Monographies de produit : Foire aux questions
Date d'entrée en vigueur : 2020/11/01
Table des matières
- 1.0 Objectif
- 2.0 Renseignements généraux
- 2.1 Qu'est-ce qu'une monographie de produit?
- 2.2 Je vois sans cesse différentes années associées à la ligne directrice et aux modèles des monographies de produit. Qu'est-ce que cela signifie?
- 2.3 À quoi sert le « numéro de contrôle » inscrit sur la première page de la monographie de produit?
- 2.4 Les fabricants doivent-ils produire des monographies de produit pour tous les médicaments?
- 2.5 Où puis-je trouver des monographies de produit approuvées par Santé Canada?
- 2.6 Pourquoi Santé Canada publie-t-il des monographies de produits?
- 2.7 La monographie de produit autorisée par Santé Canada est-elle identique à celles affichées par les fabricants de médicaments sur leurs sites Web?
- 2.8 Les monographies de produits contiennent-elles des renseignements similaires à ceux fournis par mon pharmacien?
- 2.9 Lorsque je recherche des monographies de produits à l'aide de la base de données sur les produits pharmaceutiques, pourquoi certaines sont-elles disponibles en anglais et en français et d'autres uniquement en anglais?
- 2.10 Pourquoi est-ce que je n'arrive pas à trouver la monographie de produit que je recherche dans la base de données des produits pharmaceutiques?
- 2.11 J'ai fait une recherche dans la base de données des produits pharmaceutiques par « ingrédient actif » et j'ai trouvé plusieurs produits pharmaceutiques. Pourrait-il y avoir des différences entre les monographies de ces produits?
- 2.12 Pourquoi les modifications apportées aux Renseignements sur le médicament pour le patient sont-elles importantes?
- 2.13 Comment puis-je savoir si mon texte est écrit dans un langage clair? Y-a-t-il des outils ou des références sur la rédaction en langage clair?
- 2.14 Quel lien existe-t-il entre la nouvelle section relative aux renseignements pour les consommateurs sur les médicaments et les travaux de l'initiative générale sur l'étiquetage en langage clair?
- 2.15 Quelle est la vision à long terme de Santé Canada en ce qui concerne les monographies de produit canadiennes?
- 2.16 Où puis-je obtenir de plus amples renseignements concernant les monographies de produits?
- 3.0 Mise à jour des monographies de produits
- 3.1 Quels sont les changements exacts qui ont été apportés à la mise à jour 2020 des la ligne directrice et au modèle de monographie de produit?
- 3.2 Que faire si je suis dans la file d'attente pour la date de la mise en œuvre?
- 3.3 Que se passe-t-il si ma monographie de produit n'est pas dans le format 2020?
- 3.4 Je suis tenu de déposer des demandes conformément à la ligne directrice et au format de la monographie de produit de 2016 à partir du 1er novembre 2020. Toutefois, la ligne directrice a été mise à jour dans la version 2020. Quelle version dois-je utiliser?
- 3.5 Je ne peux pas reformater la monographie de produit parce que je n'ai pas d'informations à inclure dans certaines sections de la monographie de produit. Que dois-je faire?
- 3.6 Dois-je fournir une monographie de produit annotée dans l'« ancien » format, en indiquant les sections qui ont été déplacées, le texte ajouté, etc., afin d'uniformiser la monographie de produit sur le format 2020?
- 3.7 Les soumissions administratives ou les soumissions qui comprennent une composante administrative font-elles partie du plan de mise en œuvre des monographies de produits?
- 3.8 Est-il acceptable de transférer le texte au nouveau format 2020 sans le reformater?
- 3.9 Quelle est la catégorie de dépôt et les frais associés pour une soumission uniquement pour la transition d'une monographie de produit vers le modèle 2020?
- 4.0 Monographie de produit en format XML
- 4.1 Qu'est-ce que la monographie de produit structurée?
- 4.2 Qu'est-ce que le format XML?
- 4.3 Pourquoi Santé Canada fait-elle la transition vers la structure XML?
- 4.4 Puis-je déposer une monographie de produit en XML seulement par la voie du portail commun de demandes électroniques?
- 4.5 Existe-t-il des sites pour la publication de monographies de produits XML, où le grand public peut accéder à des informations sur les médicaments? Comment inscrire ces fichiers dans le domaine public?
- 4.6 Puis-je changer le format de la monographie de produit en XML pendant son examen? Qu'en est-il des monographies de produits déjà autorisées?
- 4.7 Est-il obligatoire de soumettre la monographie de produit XML dans les deux langues ou une seule langue suffit-elle?
- 4.8 Santé Canada exigera-t-elle un format de fichier spécifique pour les monographies de produits XML à afficher sur le site Web?
- 4.9 Existe-t-il des outils d'information ou des outils de validation pour valider les fichiers de monographies de produits en format XML? La validation des monographies de produits en format XML est-elle pleinement mise en œuvre par Santé Canada?
- 4.10 Nous avons ajouté des sous-titres définis par les promoteurs en modifiant le titre du titre « Non attribué ». Comment afficher ces rubriques dans le format Word de la monographie de produit?
1.0 Objectif
Cette foire aux questions (FAQ) a pour but de créer un endroit centralisé où les Canadiens et les promoteurs de médicaments pourront trouver des renseignements sur les monographies de produit autorisées par Santé Canada.
Ce document fournit un vaste éventail de renseignements à propos des monographies de produit, notamment des informations générales, des révisions de la ligne directrice et des modèles de monographies de produits, des monographies de produits au format XML (langage de balisage extensible) et des vocabulaires contrôlés. Ce document aide, en outre, à déterminer et à expliquer les attentes de Santé Canada à l'égard des promoteurs, qui doivent suivre la dernière ligne directrice et les derniers modèles lors de la préparation ou de la révision des monographies de produit.
2.0 Renseignements généraux
2.1 Qu'est-ce qu'une monographie de produit?
Une monographie de produit est un document scientifique factuel sur un médicament qui, sans avoir recours à des documents promotionnels, décrit les propriétés, les allégations, les indications et les conditions d'utilisation du médicament, et qui contient tout autre renseignement pouvant être requis pour une utilisation optimale, efficace et sans danger de ce médicament.
Une monographie de produit doit comprendre les renseignements appropriés en ce qui concerne le nom du médicament, sa classification thérapeutique ou pharmacologique, ses effets et les données de pharmacologie clinique à son sujet, et ses indications. La monographie doit également comprendre les contre-indications, la posologie et le mode d'administration, les symptômes et le traitement du surdosage, les formes posologiques, les mises en garde, les précautions, les réactions indésirables, les interactions médicamenteuses, les effets sur les essais de laboratoire, les conditions d'entreposage et les données sur la stabilité, les instructions particulières de manutention, les renseignements pharmaceutiques, les renseignements sur les essais cliniques, la microbiologie, la toxicologie et les renseignements destinés aux patients. En outre, la monographie de produit devrait indiquer les dates de la première approbation et de la révision en vigueur, le cas échéant.
Une monographie de produit comporte de trois parties :
- Partie I : Renseignements pour le professionnel de la santé
- Partie II : Renseignements scientifiques
- Renseignements sur le médicament pour le patient (autrefois appelée Partie III : Renseignements pour le consommateur)
Les fabricants de médicaments (ou promoteurs) doivent préparer une monographie de produit détaillée conformément à la Ligne directrice : Monographies de produit. Santé Canada évalue la monographie de produit dans le cadre du processus d'examen des médicaments. Lorsqu'il faut décider du libellé, un examen minutieux du contenu, du langage et du format est nécessaire. Une fois qu'elle a été autorisée par Santé Canada, la monographie de produit est utilisée par le fabricant de médicaments ou promoteur pour informer les médecins, les pharmaciens, les dentistes, les infirmières et infirmiers, et les autres professionnels de la santé sur l'usage approprié du médicament.
2.2 Je vois sans cesse différentes années associées à la ligne directrice et aux modèles des monographies de produit. Qu'est-ce que cela signifie?
L'année renvoie à la plus récente version de la ligne directrice et du modèle de la monographie de produit. Selon ce qui est indiqué dans l'avis sur les plans de mise en œuvre des monographies de produit, Santé Canada prend actuellement des mesures en vue de l'adoption complète des mises à jour contenues dans la Ligne directrice : Monographies de produit de 2016.
Les premières lignes directrices canadiennes pour les monographies de produit ont été publiées en 1976 et révisées en 1989. Les monographies de produit ont été maintes fois modifiées depuis, mais les changements les plus importants ont été effectués en 2004, 2014 et 2016. La plus récente version de la ligne directrice et du modèle de la monographie de produit date de 2020.
Monographie de produit 2004
En 2004, la Ligne directrice à l'intention de l'industrie : Monographies de produit est entrée en vigueur pour remplacer les lignes directrices précédentes. Cette ligne directrice comprenait cinq modèles précis : un modèle standard, un modèle pour les produits ayant reçu un avis de conformité avec conditions (AC/C), un modèle pour un produit de mise en marché subséquent (bioéquivalent), un modèle pour les produits visés à l'annexe C et un autre pour les produits visés à l'annexe D. De plus, une nouvelle section s'est ajoutée à la monographie de produit afin de fournir des renseignements aux utilisateurs : la Partie III : Renseignements pour le consommateur.
Monographie de produit 2014
En 2014, la Partie III : Renseignements pour le consommateur a été remplacée par la section Renseignements sur le médicament pour le patient. La nouvelle section présentait un style de rédaction clair, conçu pour être facile à lire et à comprendre par le public visé (c.-à-d. un langage simple), avec un niveau de lecture ciblé entre la 6e à la 8e année. Cela comprend la manière dont les renseignements sont présentés sur la page : l'utilisation des espaces, de polices de caractère faciles à lire, et de la voix « active » au lieu de la voix « passive » pour les instructions. Le nouveau format a été mis en œuvre selon une approche progressive et limité aux présentations de drogue nouvelle.
Monographie de produit 2016
En 2016, la Partie I : Renseignements pour le professionnel de la santé et la Partie II : Renseignements scientifiques ont été révisées de façon à clarifier le langage, notamment par une réorganisation de l'information, afin de rendre les renseignements pour les professionnels de la santé plus faciles à lire et les renseignements essentiels sur l'innocuité plus faciles à trouver dans les monographies de produit canadiennes. Selon ce qui est indiqué dans l'Avis – Publication finale : Partie I – Renseignements pour le professionnel de la santé et Partie II – Renseignements scientifiques de la Ligne directrice – Monographies de produit, la mise en œuvre était obligatoire pour les présentations de drogue nouvelle (pdn), les présentations abrégées de drogue nouvelle (PADN) et les suppléments à une présentation abrégée de drogue nouvelle (SPADN) lorsque la monographie du produit de l'innovateur correspondant était au format 2016. Un nouveau modèle de monographie de produit, Annexe D – Médicaments biosimilaires, a été publié en 2017 afin de guider les promoteurs dans la préparation de monographies de produit pour les médicaments biosimilaires.
Situation actuelle : monographies de produit 2020
En 2020, les six modèles de monographies de produit ont été fusionnés en un seul modèle de référence. Les modifications de 2020 à la Ligne directrice : Monographies de produit s'harmonisent au modèle de référence afin de faciliter la lecture en parallèle des deux documents. De plus, des changements administratifs ont été effectués afin d'inclure les monographies de produit rédigées dans le format du langage de balisage extensible (XML) introduit pour la première fois en 2020. Des instructions ont été ajoutées ou clarifiées afin d'aider les promoteurs dans la préparation et la mise à jour des monographies de produit. Cette mise à jour aborde la mise en œuvre complète de tous les formats en langage clair et les modifications au contenu apportées en 2014 et 2016.
2.3 À quoi sert le « numéro de contrôle » inscrit sur la première page de la monographie de produit?
Un numéro de contrôle est attribué à chaque présentation que reçoit Santé Canada. Ce numéro permet une gestion efficace de la présentation, y compris des données et de la correspondance qui s'y rapportent.
Le numéro de contrôle ne doit pas être confondu avec l'identification numérique de drogue (DIN), qui doit figurer sur l'étiquette de l'emballage d'un médicament.
2.4 Les fabricants doivent-ils produire des monographies de produit pour tous les médicaments?
Non. Bien que la plupart des médicaments d'ordonnance et certains médicaments vendus sans ordonnance disposent d'une monographie de produit, les médicaments ayant un long historique de commercialisation et un profil de sécurité établi n'ont généralement pas de monographie de produit associée. Dans ce cas, d'autres renseignements, tels que les indications sur les étiquettes d'emballage, les prospectus, les renseignements d'ordonnance ou d'autres types de renseignements sur les médicaments sont produits et doivent être conformes aux conditions d'utilisation autorisées.
2.5 Où puis-je trouver des monographies de produit approuvées par Santé Canada?
À l'heure actuelle, les monographies de produit approuvées par Santé Canada sont disponibles sur le site Recherche de produits pharmaceutiques en ligne de Santé Canada.
2.6 Pourquoi Santé Canada publie-t-il des monographies de produits?
L'engagement de Santé Canada à rendre les monographies de produits disponibles dans les deux langues officielles est conforme à la Loi sur les langues officielles et aux objectifs du Ministère en matière d'ouverture et de transparence accrues. Cela répond également aux demandes des parties prenantes, y compris le public, qui souhaitent un meilleur accès aux renseignements sur les produits pharmaceutiques autorisés par Santé Canada.
En outre, en publiant les monographies de produit sur son site Web, Santé Canada rend l'accès à ces documents plus simple et plus facile.
Santé Canada croit que les professionnels de la santé, les patients, les consommateurs et les fabricants de médicaments devraient avoir accès aux renseignements canadiens autorisés afin de soutenir l'utilisation sécuritaire et efficace des médicaments. Les patients et les consommateurs peuvent obtenir des renseignements sur leurs médicaments à partir de diverses sources, notamment Internet, les publicités télévisées des États-Unis et les pharmacies. Certaines de ces sources peuvent fournir des renseignements non conformes aux renseignements autorisés par Santé Canada. En ayant accès à un emplacement central pour les monographies de produits autorisées par Santé Canada, les Canadiens peuvent compter sur des renseignements gratuits, impartiaux et précis concernant les médicaments qu'ils prennent.
Santé Canada encourage vivement les patients et les consommateurs à discuter des options de traitement et des questions relatives aux renseignements sur les médicaments avec leur professionnel de la santé (par exemple, leur médecin de famille ou leur pharmacien).
2.7 La monographie de produit autorisée par Santé Canada est-elle identique à celles affichées par les fabricants de médicaments sur leurs sites Web?
Pas toujours. Dans certains cas, les promoteurs de médicaments peuvent retirer des renseignements de leur monographie de produit pour ne mentionner que les dosages et les formulations qu'ils ont choisi d'offrir sur le marché canadien. En revanche, une version autorisée par Santé Canada devrait refléter toutes les formulations et les concentrations autorisées au Canada, indépendamment de la décision d'un fabricant d'en commercialiser la totalité ou une partie.
2.8 Les monographies de produits contiennent-elles des renseignements similaires à ceux fournis par mon pharmacien?
Le résumé d'une page imprimé et fourni aux patients canadiens dans les pharmacies du Canada peut contenir des renseignements différents de ceux qui figurent dans la monographie de produit autorisée par Santé Canada. Cela s'explique par le fait qu'en général, le contenu du résumé fourni par les pharmacies provient essentiellement de sources de renseignements sur les médicaments situées aux États-Unis et n'est pas examiné par Santé Canada. La distribution de ces fiches de renseignements est considérée comme faisant partie de la pratique pharmaceutique, qui relève des autorités provinciales.
La monographie complète du produit autorisée par Santé Canada contient toutes les informations techniques destinées aux professionnels de la santé, à savoir la Partie I – Renseignements pour le professionnel de la santé et la Partie II – Renseignements scientifiques.
Les fiches ou brochures de renseignements sur les médicaments fournies par les pharmacies canadiennes n'ont pas toujours été en conformité avec les renseignements figurant dans la monographie de produit autorisée par Santé Canada. En rendant les monographies disponibles dans un lieu central, Santé Canada s'assure que les pharmaciens et les patients/consommateurs auront accès aux informations autorisées lorsque des divergences surviendront.
2.9 Lorsque je recherche des monographies de produits à l'aide de la base de données sur les produits pharmaceutiques, pourquoi certaines sont-elles disponibles en anglais et en français et d'autres uniquement en anglais?
En date du 13 juin 2015 et du 13 juin 2017, les fabricants de médicaments (promoteurs) sont tenus de publier la monographie de produit dans les deux langues officielles pour les médicaments vendus sur ordonnance et les médicaments en vente libre, respectivement. La monographie de produit est revue dans la langue originale officielle dans le cadre du processus d'examen du médicament. Les promoteurs de médicaments sont tenus de soumettre la monographie de produit dans la langue originale de rédaction avant l'autorisation et de soumettre la monographie de produit traduite dans la deuxième langue au plus tard 20 jours après l'émission de l'avis de conformité (AC). Les promoteurs sont tenus de s'assurer que les traductions qu'ils fournissent représentent fidèlement la version originale autorisée par Santé Canada. Santé Canada affiche ensuite la monographie de produit en langue seconde pour accompagner la monographie de produit en langue originale. Si la monographie de produit n'est pas affichée dans la deuxième langue, cela signifie que le promoteur du médicament n'a pas encore soumis la monographie de produit finale dans la deuxième langue après l'autorisation, ou que la monographie de produit n'a pas été mise à jour depuis juin 2015 pour les médicaments sur ordonnance, et après juin 2017 pour les médicaments en vente libre.
2.10 Pourquoi est-ce que je n'arrive pas à trouver la monographie de produit que je recherche dans la base de données des produits pharmaceutiques?
Dans certains cas, les médicaments peuvent ne pas être accompagnés d'une monographie de produit (voir la question 2.4) ou la monographie de produit peut ne pas être disponible sur le site Web de Santé Canada; en outre, les informations sur l'ordonnance pour les produits autorisés avant janvier 2004 qui n'ont pas fait l'objet de modifications ultérieures.
2.11 J'ai fait une recherche dans la base de données des produits pharmaceutiques par « ingrédient actif » et j'ai trouvé plusieurs produits pharmaceutiques. Pourrait-il y avoir des différences entre les monographies de ces produits?
Oui. Différents médicaments peuvent contenir le même ingrédient actif. Il peut également y avoir des médicaments qui ont un nom commercial (innovateur) et des versions génériques ou biosimilaires. Des différences peuvent exister, par exemple, dans la formulation, les formes de dosage ou les posologies, les indications et le moment du dépôt et de l'autorisation des monographies de produits individuelles.
2.12 Pourquoi les modifications apportées aux Renseignements sur le médicament pour le patient sont-elles importantes?
En 2014, l'ancienne « Partie III : Renseignements pour le consommateur », maintenant intitulée « Renseignement sur le médicament pour le patient », a été révisée pour inclure des éléments en langage clair, y compris de nouvelles formulations et un nouveau formatage. Le but de ces modifications est de rendre les renseignements sur le produit pharmaceutique clairs, concis et faciles à comprendre pour les Canadiens. Lorsque les renseignements sur les médicaments ne sont pas clairs ou lorsqu'ils sont confus, il y a souvent des effets négatifs sur la santé comme des erreurs d'administration de médicament. L'amélioration de l'étiquetage représente une étape importante dans la réduction du nombre de problèmes de santé qui sont causés par une mauvaise utilisation des produits pharmaceutiques.
2.13 Comment puis-je savoir si mon texte est écrit dans un langage clair? Y-a-t-il des outils ou des références sur la rédaction en langage clair?
Le niveau de lecture visé est celui de la 6e à la 8e année. Il existe des tests et des ressources disponibles en ligne et dans les bibliothèques qui évaluent les informations textuelles. Le Flesch-Kincaid, la formule de lisibilité graphique Fry et SMOG (Simple Measure of Gobbledygook) sont quelques outils qui permettent d'évaluer la lisibilité des documents se rapportant à la santé. Les promoteurs peuvent s'en servir pour mettre à l'épreuve les renseignements qu'ils ont révisés. Certaines fonctions de lisibilité sont également proposées dans les nouvelles versions de Microsoft Word © (par exemple, le niveau de scolarité Flesch-Kincaid).
Le site de l'Association canadienne de santé publique est une bonne source de renseignements sur la lisibilité des renseignements sur la santé, y compris la rédaction en langage clair, et inclut des liens vers des documents de référence comme De bons remèdes pour les aînés : lignes directrices sur la rédaction des documents et la conception des emballages des médicaments sur ordonnance.
2.14 Quel lien existe-t-il entre la nouvelle section relative aux renseignements pour les consommateurs sur les médicaments et les travaux de l'initiative générale sur l'étiquetage en langage clair?
La révision de la monographie de produit en langage clair et simple est un exemple du travail entrepris par Santé Canada pour améliorer la compréhension des Canadiens en matière d'information sur la santé et pour réduire les erreurs de médication. Des modifications réglementaires ont également été apportées dans le but d'améliorer l'utilisation sécuritaire des médicaments en rendant les étiquettes et les emballages plus faciles à lire et à comprendre, et complètent les changements proposés aux monographies de produits. Pour plus d'informations sur l'Initiative sur l'étiquetage pour un langage clair et simple, consultez les Questions et réponses de Santé Canada : Règlements sur l'étiquetage en langage clair des médicaments d'ordonnance.
2.15 Quelle est la vision à long terme de Santé Canada en ce qui concerne les monographies de produit canadiennes?
Santé Canada se donne pour priorité d'améliorer la qualité et l'accessibilité des informations sur les produits pharmaceutiques mises à la disposition des Canadiens afin qu'ils puissent prendre des décisions éclairées sur leurs médicaments et que les professionnels de la santé puissent accéder rapidement et facilement aux informations essentielles sur les médicaments.
La monographie de produit est un élément clé de cette stratégie, car elle fournit aux Canadiens des informations factuelles et scientifiques autorisées par Santé Canada sur la façon d'utiliser leurs médicaments de manière sûre et efficace.
Le plan de mise en œuvre des monographies de produits permettra une stratégie de première numérisation qui promeut un étiquetage cohérent et fiable en utilisant un modèle unique, un format structuré, des vocabulaires ciblés et une harmonisation avec les normes internationales.
Le plan de mise en œuvre crée une nouvelle plate-forme basée sur la technologie moderne. Santé Canada est ainsi mieux outillée pour fournir des services de plus en plus avancés aux Canadiens. Pour en savoir plus, veuillez vous reporter à la question 4.3.
2.16 Où puis-je obtenir de plus amples renseignements concernant les monographies de produits?
Les questions concernant la ligne directrice doivent être adressées au :
Bureau des politiques, sciences et programmes internationaux
Direction des produits thérapeutiques
1600, rue Scott, Holland Cross, tour B, 2e étage
2e étage, indice de l'adresse 3102C1
Ottawa (Ontario)
K1Y 4N7
Courriel : hc.policy.bureau.enquiries.sc@canada.ca
Les questions concernant les soumissions doivent être envoyées au Bureau des soumissions et de la propriété intellectuelle par courriel : dppr-poste@hc-sc.gc.ca
Toute autre question concernant le contenu de la base de données des produits pharmaceutiques doit être adressée à :
Courriel : hc.DIN.sc.@canada.ca
3.0 Mise à jour des monographies de produits
3.1 Quels sont les changements exacts qui ont été apportés à la mise à jour 2020 de la ligne directrice et au modèle de monographie de produit?
Les modifications apportées en 2020 à la Ligne directrice : Monographie de produit comprennent des mises en forme et des mises à jour éditoriales ainsi que la création d'un modèle principal. Aucun changement significatif n'a été apporté au contenu.
Les mises à jour comprennent :
-
Consolidation des six modèles de monographies de produits en un modèle type de monographie de produit.
Figure 1 : Consolidation des six modèles en un modèle type
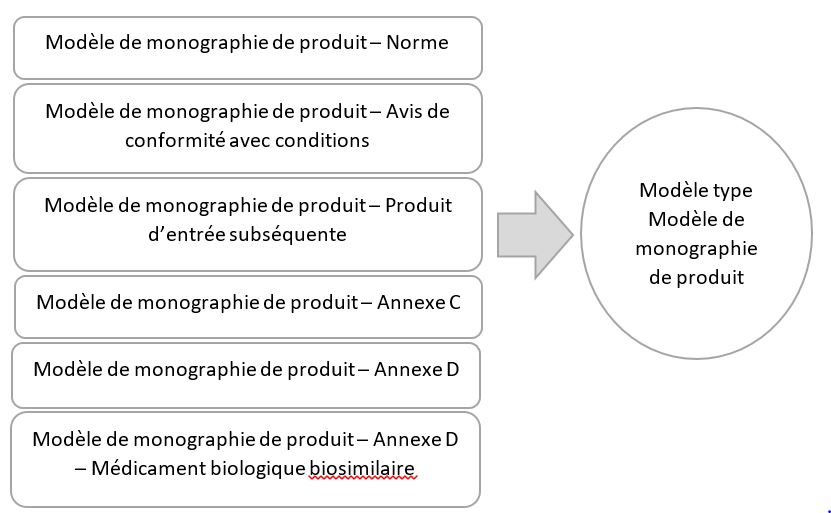
Équivalent textuel
Les six modèles de monographies de produit individuelles: Modèle de monographie de produit - Norme, Modèle de monographie de produit - Avis de conformité avec conditions, Modèle de monographie de produit - Présentation du produit de mise en marché subséquent, Modèle de monographie de produit - Annexe C, Modèle de monographie de produit – Annexe D, et Modèle de monographie de produit - Annexe D - Médicament biologique biosimilaire, ont été combinées en un modèle complet, le Modèle type de monographie de produit.
- Consolidation des informations des annexes dans le corps de la ligne directrice et uniformisation de la numérotation des sections avec le nouveau modèle type de monographie de produit pour améliorer la clarté des instructions et faciliter l'utilisation.
- Formatage pour avoir une compatibilité avec les monographies de produits préparées dans le format XML (Extensible Markup Language). Par exemple, changer l'ordre des deux sections suivantes afin que les Renseignements sur le Médicament pour le Patient apparaissent avant de Lisez ce Document pour Assurer une Utilisation Sécuritaire et Efficace de votre Médicament.
- Ajout d'instructions concernant l'omission de certaines sections. Par exemple, les titres des principales sections doivent être uniformes dans toutes les monographies de produits et ne peuvent pas être supprimés, à l'exception de l'encadré « Mises en garde et précautions importantes » et des monographies de produits à l'appui. Toutefois, les sous-sections et leurs intitulés non applicables à un produit spécifique peuvent être omis. La numérotation de tous les articles et titres de sous-sections doit rester la même, même si une sous-section est omise.
- Amélioration des instructions pour clarifier le type d'informations à inclure dans certaines sections de la monographie de produit ou la manière dont les informations doivent être présentées.
- Clarification des instructions dans la section « Récentes modifications importantes des étiquettes ».
3.2 Que faire si je suis dans la file d'attente pour la date de la mise en œuvre?
Les produits qui sont passés en revue avant le 1er novembre 2020 ne sont pas tenus de respecter le délai de mise en œuvre indiqué dans l'avis sur les plans de mise en oeuvre des monographies de produits. Toutes les soumissions ultérieures avec des propositions de changements à la monographie de produit déposées le ou après le 1er novembre 2020 devront suivre les mises à jour 2020 de la ligne directrice sur la monographie de produit et utiliser le modèle principal.
3.3 Que se passe-t-il si ma monographie de produit n'est pas dans le format 2020?
À compter du 1er novembre 2020, les promoteurs doivent mettre à jour les monographies de produits conformément à la ligne directrice et au format de 2020 si elles sont déposées auprès de Santé Canada dans le cadre d'une soumission. Toutefois, si aucun autre changement qu'un reformatage est proposé, les mises à jour proactives sont encouragées et doivent être soumises en tant que supplément d'étiquetage à une présentation de drogue nouvelle ou à une présentation abrégée de drogue nouvelle.
3.4 Je suis tenu de déposer des demandes conformément à la ligne directrice et au format de la monographie de produit de 2016 à partir du 1er novembre 2020. Toutefois, la ligne directrice a été mise à jour dans la version 2020. Quelle version dois-je utiliser?
Santé Canada a publié les mises à jour 2020 de la Ligne directrice à l'intention de l'industrie : Monographies de produits et le modèle principal de monographie de produit pour consolider les modèles qui étaient anciennement séparés, pour ajouter et clarifier les instructions et pour adapter les monographies de produits préparées en format XML (Extensible Markup Language). Si un promoteur a déjà déposé une monographie de produit en utilisant un modèle 2016, il peut lui être demandé de la refaire au format 2020 aux fins d'examen. Il est recommandé d'utiliser la dernière ligne directrice et le modèle type pour préparer toute nouvelle monographie de produit ou déposer des modifications aux monographies de produit existantes qui sont prévues en fonction du cycle de vie du produit à partir du 1er novembre 2020.
3.5 Je ne peux pas reformater la monographie de produit parce que je n'ai pas d'informations à inclure dans certaines sections de la monographie de produit. Que dois-je faire?
Dans certains cas, les promoteurs peuvent ne pas avoir les informations nécessaires pour remplir certaines sections de la monographie de produit. Toutefois, cela ne signifie pas qu'il est acceptable de conserver la monographie de produit dans un ancien format ou d'omettre des sections importantes. Le promoteur doit plutôt expliquer à Santé Canada pourquoi des informations ont été omises ou sont manquantes et, si cela est jugé acceptable, un avis doit être ajouté pour traiter les informations manquantes dans la section appropriée de la monographie de produit. Par exemple, si les données d'un essai clinique ne sont pas disponibles, le texte sous le titre de la section ESSAIS CLINIQUES peut indiquer que « les données de l'essai clinique pour lequel l'indication originale a été autorisée ne sont pas disponibles ».
3.6 Dois-je fournir une monographie de produit annotée dans l'« ancien » format, en indiquant les sections qui ont été déplacées, le texte ajouté, etc., afin d'uniformiser la monographie de produit sur le format 2020?
Oui, cela facilitera la révision s'il est clairement indiqué d'où vient le texte ou où il a été déplacé pendant le reformatage du modèle 2020.
3.7 Les soumissions administratives ou les soumissions qui comprennent une composante administrative font-elles partie du plan de mise en œuvre des monographies de produits?
Le ministère s'efforce de faire en sorte que toutes les monographies de produits autorisées aient le même format, à compter du 1er novembre 2020 (c'est-à-dire conformément à la Ligne directrice : Monographie de produit et au modèle type). Cela permettra de réduire la confusion que différents modèles peuvent créer pour le professionnel de la santé et le consommateur ou le patient et leur permettre de retrouver plus rapidement les informations essentielles sur la sécurité. Dans ce but, Santé Canada encourage les promoteurs qui déposent des soumissions comportant un volet administratif à le faire conformément aux mises à jour 2020 de la Ligne directrice : Monographie de produit et du modèle type. Il y aura des situations où cette mise à jour ne sera pas pratique, auquel cas les promoteurs devraient en discuter à l'avance avec Santé Canada afin de déterminer la meilleure voie de présentation.
Par exemple, le reformatage d'une monographie de produit nécessite un examen de son contenu pour s'assurer que les informations sont présentées correctement dans le nouveau modèle. Cette évaluation peut ne pas être pratique pour les présentations soumises à une norme de rendement de 45 jours. Ainsi, pour les soumissions administratives, la monographie de produit proposée ne doit suivre que la Ligne directrice : Monographie de produit et le modèle type lorsque ce format a été examiné et approuvé pour le produit de référence. L'exemption de dépôt en vertu de la dernière Ligne directrice : Monographie de produit et du modèle type permet de garantir que les médicaments associés à des dépôts en vrac pour les transferts de propriété des produits soient déposés en temps utile sur le site et d'éviter les retards ou les refus d'importation à la frontière.
3.8 Est-il acceptable de transférer le texte au nouveau format 2020 sans le reformater?
Non, toutes les nouvelles exigences décrites dans la mise à jour 2020 de la Ligne directrice à l'intention de l'industrie : Monographie de produit doivent être respectées au moment de faire toutes les conversions de format.
3.9 Quelle est la catégorie de dépôt et les frais associés pour une soumission uniquement pour la transition d'une monographie de produit vers le modèle 2020?
La catégorie de dépôt appropriée pour un changement de format de monographie de produit vers le nouveau modèle 2020 est la catégorie de frais « Étiquetage uniquement », pourvu qu'aucun autre changement nécessitant des données justificatives ne soit proposé. Cela signifie que si de nouvelles données sont soumises pour remplir des sections du format 2020 de la monographie de produit, la sous-classe « Étiquetage uniquement » ne sera plus applicable.
4.0 Monographie de produit en format XML
4.1 Qu'est-ce que la monographie de produit structurée?
La norme internationale d'étiquetage des produits structurés Health Level 7 est une norme de données qui définit le contenu de l'étiquetage des médicaments pour usage humain vendus sur ordonnance dans un format XML (Extensible Markup Language). Dans le contexte canadien, la monographie de produit est l'« étiquette » ou « le document » qui est structuré.
Dans ce contexte, la structure fait référence au fait que le contenu des monographies de produits a été encodé en XML. Ainsi, le texte narratif (par exemple, les titres des sections, tout le texte et les tableaux) et les informations sur les produits (par exemple, le fabricant, les ingrédients, les posologies et le conditionnement) sont structurés de manière à permettre l'indexation et la recherche.
4.2 Qu'est-ce que le format XML?
XML est un langage informatique basé sur le texte utilisé pour coder des documents électroniques dans un format structuré lisible par l'homme et par la machine. Le XML est utilisé comme format commun pour faciliter l'échange de données sur Internet.
XML est une spécification ouverte et gratuite gérée par le Consortium W3C (World Wide Web Consortium).
4.3 Pourquoi Santé Canada fait-elle la transition vers la structure XML?
Conformément à l'Avis d'intention : Transition des monographies de produits vers un format structuré, la monographie de produit XML permettra à Santé Canada et aux intervenants de fournir des fonctions et caractéristiques qui n'étaient pas offertes auparavant. Par exemple :
- Fonction de recherche : Les informations structurées augmentent le niveau de détail mis à la disposition du public. Il sera plus facile d'indexer et de rechercher des informations sur les produits pharmaceutiques, en particulier sur leurs ingrédients.
- Innovation : Les intervenants auront accès à des informations structurées sur les produits pharmaceutiques et les ordonnances. Cela peut faciliter l'utilisation à différentes fins telles que la prescription électronique, les dossiers médicaux électroniques, l'automatisation, la publication dans plusieurs canaux et les applications mobiles.
- Uniformité : Les vocabulaires uniformes permettront une utilisation cohérente de la terminologie et des définitions scientifiques pour tous les produits pharmaceutiques et les monographies de produits.
4.4 Puis-je déposer une monographie de produit en XML seulement par la voie du portail commun de demandes électroniques?
Non, la monographie de produit XML doit toujours être déposée dans le cadre d'une soumission.
4.5 Existe-t-il des sites pour la publication de monographies de produits XML, où le grand public peut accéder à des informations sur les médicaments? Comment inscrire ces fichiers dans le domaine public?
À l'heure actuelle, les monographies de produits approuvées au format PDF sont disponibles via la Base de données des produits pharmaceutiques (BDPP) en ligne. Le site Web de Santé Canada sera mis à jour pour rendre les monographies de produits XML accessibles au public. De plus amples renseignements seront disponibles dès qu'ils seront connus.
4.6 Puis-je changer le format de la monographie de produit en XML pendant son examen? Qu'en est-il des monographies de produits déjà autorisées?
À l'heure actuelle, il n'est pas possible de changer de format pendant l'examen. Les produits qui ont déjà reçu une autorisation (c'est-à-dire un avis de conformité) ne sont pas tenus de soumettre une monographie de produit en format XML. Vous pouvez toutefois vous convertir volontairement au format XML.
4.7 Est-il obligatoire de soumettre la monographie de produit XML dans les deux langues ou une seule langue suffit-elle?
Les promoteurs sont tenus de fournir les monographies de produits dans les deux langues officielles. Pour plus d'informations sur les éléments qui doivent être soumis et à quel moment, veuillez consulter le document d'orientation Questions et réponses : Règlements sur l'étiquetage en langage clair des médicaments sur ordonnance.
4.8 Santé Canada exigera-t-elle un format de fichier spécifique pour les monographies de produits XML à afficher sur le site Web?
Non. Les monographies de produits seront affichées dans le format associé à leur dépôt. Toutefois, Santé Canada a l'intention de faire la transition vers la mise en ligne des monographies de produits en format XML. Plus de renseignements seront donnés lorsqu'ils seront disponibles.
4.9 Existe-t-il des outils d'information ou des outils de validation pour valider les fichiers de monographies de produits en format XML? La validation des monographies de produits en format XML est-elle pleinement mise en œuvre par Santé Canada?
Oui, Santé Canada a la capacité interne de valider les monographies de produits en format XML. Comme pour les séquences eCTD, Santé Canada validera les monographies de produits en format XML dès leur réception et fournira aux promoteurs un rapport de validation en cas de problème. Santé Canada ne recommande ni n'approuve aucune solution unique.
4.10 Nous avons ajouté des sous-titres définis par les promoteurs en modifiant le titre du titre « Non attribué ». Comment afficher ces rubriques dans le format Word de la monographie de produit?
Les sous-sections « Non attribuées » de la monographie de produit Microsoft Word© doivent être affichées comme indiqué dans la feuille de style de la monographie de produit en format XML (c'est-à-dire du texte en gras, aligné à gauche, sur une ligne à part).
Détails de la page
- Date de modification :