ARCHIVÉ - Déclaration sur le vaccin conjugué contre le méningocoque, sérogroupes A, C, Y et W135
Relevé des maladies transmissibles au Canada
Volume 33 • DCC-3
le 1er mai 2007
Une déclaration d'un comité consultatif (DCC)
Comité consultatif national de l'immunisation (CCNI)*†
Version PDF
24 Pages -651 KB
Préambule
Le Comité consultatif national de l'immunisation (CCNI) offre constamment à l'Agence de la santé publique du Canada des conseils à jour liés à l'immunisation dans le domaine de la médecine, des sciences et de la santé publique. L'Agence de santé publique du Canada reconnaît que les conseils et les recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes et diffuse le document à des fins d'information. Les personnes qui administrent les vaccins devraient également connaître le contenu des monographies de produit pertinentes. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu des monographies de produit établies par les fabricants de vaccins au Canada. Les fabricants ont fait approuver les vaccins et démontré leur innocuité et leur efficacité uniquement lorsqu'ils sont utilisés conformément à la monographie de produit. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'Agence de santé publique du Canada régissant les conflits d'intérêts, notamment déclarer chaque année les conflits d'intérêts possibles.
Introduction
MenactraMC est un vaccin quadrivalent conjugué fabriqué par sanofi pasteur Limited qui associe une protéine et un polysaccharide et qui confère une protection contre les sérogroupes A, C, Y et W135 du méningocoque. Son utilisation a été approuvée au Canada en mai 2006 pour les personnes de 2 à 55 ans. Le polysaccharide de chaque sérogroupe méningococcique inclus dans MenactraMC est conjugué individuellement à une anatoxine diphtérique (vecteur protéique). Une dose de 0,5 mL contient 4 μg de chaque polysaccharide des sérogroupes A, C, Y et W135 ainsi que 48 μg, au total, d'anatoxine diphtérique.
MenactraMC offre une protection contre les mêmes sérogroupes que MenomuneMD , vaccin polysaccharidique quadrivalent contre le méningocoque offert actuellement, qui est lui aussi fabriqué par sanofi pasteur. De plus, trois vaccins conjugués monovalents contre le méningocoque du groupe C sont actuellement autorisés au Canada : MenjugateMD (Vaccins Novartis), NeisVac-CMCmc (GlaxoSmithkline) et MeningitecMC (Wyeth Canada).
Les recommandations contenues dans la présente déclaration seront revues à la lumière des nouveaux renseignements sur MenactraMC et des modifications de l'épidémiologie de la méningococcie invasive.
Épidémiologie de la méningococcie au Canada
Au Canada, la méningococcie invasive (MI) est endémique. Tous les 10 à 15 ans, environ, on note des périodes d'intensification de l'activité du méningocoque sans qu'aucune tendance ne puisse être dégagée. L'incidence de la MI varie considérablement, différents sérogroupes étant plus présents chez certains groupes d'âge et dans certaines régions géographiques selon les périodes. La dernière grande épidémie de méningococcie est survenue en 1940-1943 (sérogroupe A), l'incidence ayant atteint un sommet de presque 13 cas pour 100 000 habitants par année. Depuis, l'incidence globale de la maladie est demeurée ≤ 2,1 cas pour 100 000 habitants par année (intervalle de 0,5 à 2,1).
Entre 1995 et 2004, l'incidence globale de la MI au Canada s'est maintenue à 1,1 ou moins pour 100 000 par année (intervalle de 0,6 à 1,1). Globalement, le taux d'incidence annuel moyen culminait chez les enfants de < 1 an (9,2 pour 100 000) et diminuait avec l'âge, exception faite d'un léger accroissement observé dans le groupe des 15 à 19 ans (2,0 pour 100 000). En moyenne, 244 cas de méningococcie ont été signalés chaque année. La maladie frappe tout au cours de l'année, mais on observe des variations saisonnières, la majorité des cas survenant en hiver. Sur les 2 437 cas déclarés entre 1995 et 2004, les enfants de < 1 an, qui comptent pour environ 1 % de la population canadienne, représentaient 13 % des cas (moyenne de 32 cas par année). Les enfants et les adolescents de 1 à 4 ans, de 5 à 9 ans, de 10 à 14 ans et de 15 à 19 ans représentaient respectivement 15 % (moyenne de 37 cas par année), 5 % (moyenne de 13 cas par année), 6 % (moyenne de 13 cas par année) et 17 % (moyenne de 42 cas par année) des cas. Quarante‑trois pour cent des cas ont été enregistrés parmi les adultes de ≥ 20 ans. Le taux global de létalité durant cette période a été établi à 9 %.
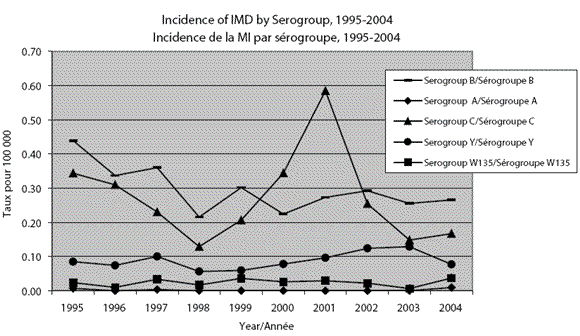
Parmi le petit nombre d'isolats de Neisseria meningitidis qui ont été caractérisés de 1971 à 1974, les sérogroupes A et C ont été le plus fréquemment identifiés. De 1975 à 1989, le sérogroupe B a prédominé1. En 1986, un nouveau clone du sérogroupe C, le sérotype 2a, caractérisé par électrophorèse enzymatique multilocus comme le type électrophorétique 15 (ET-15), a été identifié pour la première fois au Canada2. Depuis, la plupart des cas de MI endémiques au Canada ont été attribuables aux sérogroupes B et C. Toutefois, le sérogroupe C a été à l'origine de presque toutes les grappes et éclosions dans les écoles et dans les collectivités. Les infections sporadiques par le sérogroupe C sont causées par un grand nombre de souches différentes, alors que les grappes et les éclosions sont généralement provoquées par une seule souche en circulation. La figure 1 montre le taux d'incidence annuel par sérogroupe pour la période de 1995 à 2004. La proportion des cas signalés pour lesquels on possède des données sur le sérogroupe a augmenté avec le temps : de 60 % en 1985, elle est passée à 88 % en 1992 et à 94 % en 2004. Le tableau 1 présente un résumé de l'épidémiologie des sérogroupes A, B, C, Y et W135 au Canada.
Figure 1. Taux d'incidence de la méningococcie invasive par sérogroupe et année, 1995-2004
| Sérogroupe |
Nombre annuel |
Taux annuel moyen |
Âge médian |
Taux de létalité |
Commentaires |
| C |
84cas |
0,27/100000 |
19 ans |
13% |
Déclin des taux probablement attribuable aux programmes d'immunisation par le vaccin conjugué contre le sérogroupeC |
| B |
93cas |
0,30/100000 |
11 ans |
6% |
Taux relativement stables dans |
| Y |
28cas |
0,09/100000 |
45 ans |
7% |
Taux relativement stables dans |
| W135 |
9 cas |
0,03/100000 |
19 ans |
8% |
8% |
| A |
0,5cas |
0,002/100000 |
41 ans |
Aucun décès signalé |
Risque surtout pour les voyageurs qui se rendent dans une région oùla méningococcie est endémique |
*Données concernant les sérogroupes inconnus ou non typables non incluses
Épidémiologie de la méningococcie de sérogroupe C
De 1995 à 2004, on a recensé en moyenne chaque année 84 cas de méningococcie de sérogroupe C au Canada. L'incidence a atteint un sommet en 2001, avec 0,58 cas pour 100 000 habitants. Les taux d'incidence annuels moyens les plus élevés pour le sérogroupe C ont été observés chez les enfants de < 1 an (0,90 pour 100 000) et les adolescents de 15 à 19 ans (0,90 pour 100 000). La moyenne annuelle a été établie respectivement à 3,1 (1 à 8 cas) et à 18,7 (6 à 40 cas) dans ces groupes d'âge.
L'émergence du clone ET-15 du sérogroupe C a été associée à des éclosions localisées et à des périodes d'activité intense durant les années 1989 à 1993 et 2000 à 20012,3. Selon des données récentes, les taux d'incidence de la méningococcie de sérogroupe C seraient à la baisse, ce qui était prévisible en raison de la mise en œuvre de programmes d'immunisation. Les taux d'incidence moyens de la méningococcie de sérogroupe C durant les années 1995 à 2001 et 2002 à 2004 étaient respectivement de 0,31 et de 0,19 pour 100 000. Cependant, comme l'épidémiologie de la MI est imprévisible, il faudra recueillir des données pendant plus d'années encore pour déterminer si cette baisse se maintiendra.
Épidémiologie de la méningococcie de sérogroupe B
Au Canada, on a noté moins de fluctuation temporelle de l'incidence de la méningococcie causée par le sérogroupe B que de celle attribuable au sérogroupe C. De 1995 à 2004, 93 cas attribuables au sérogroupe B ont été recensés en moyenne par année, ce qui représente un taux d'incidence annuel moyen de 0,30 pour 100 000 habitants (intervalle de 0,21 à 0,44). Bien que les enfants de < 5 ans comptent pour 5,9 % de la population totale, ce groupe d'âge est celui qui a été proportionnellement le plus touché par le sérogroupe B (43,5 % des cas). C'est chez les jeunes enfants que les taux d'incidence annuels moyens (pour 100 000 habitants) ont été les plus élevés : 6,40 chez les enfants de < 1 an et 1,21 chez ceux de 1 à 4 ans.
Épidémiologie de la méningococcie de sérogroupe Y
L'incidence de la méningococcie de sérogroupe Y est demeurée relativement stable au Canada entre 1995 et 2004, la moyenne étant de 0,09 cas pour 100 000 habitants. On a enregistré en moyenne 28 cas par année. Le sérogroupe Y frappe plus souvent les personnes plus âgées (âge médian de 45 ans).
Épidémiologie de la méningococcie de sérogroupes B et W135
Rares sont les cas de méningococcie attribuables au sérogroupe A ou au sérogroupe W135 qui sont déclarés au Canada. De 1995 à 2004, cinq cas de MI dus au sérogroupe A ont été signalés (0 à 2 cas par année), ce qui représente une incidence moyenne de 0,002 pour 100 000 habitants. Aucun décès n'a été attribué au sérogroupe A. Au cours de la même période, 90 cas de MI causés par le sérogroupe W135 ont été déclarés, l'incidence moyenne étant de 0,03 pour 100 000 habitants.
Les sérogroupes A et W135 présentent un risque pour les voyageurs qui se rendent dans des régions où la méningococcie est endémique, ainsi qu'à La Mecque, en Arabie Saoudite, durant le hajj. Les régions reconnues d'endémicité ou d'hyperendémicité (la « ceinture de la méningite ») englobent les savanes d'Afrique subsaharienne, qui s'étendent de la Gambie et du Sénégal, à l'ouest, à l'Éthiopie et à l'Érythrée occidentale, à l'est.
Le risque annuel moyen de MI a été estimé au cours d'une étude menée par De Wals et coll.4 Les taux d'attaque selon l'âge et le sérogroupe ont été calculés à partir des données de surveillance de l'Agence de santé publique du Canada pour la période de 1995 à 2001 et ont été rajustés pour tenir compte du sous‑diagnostic, de la sous‑déclaration et du manque de précisions sur les sérogroupes. Le risque estimatif annual moyen de MI évitable par la vaccination durant la période qui a précédé la mise en œuvre des programmes d'immunisation contre le sérogroupe C était de 5,7 pour 1 million, et le risque par sérogroupe (pour 1 million) s'établissait comme suit : 3,9 pour le sérogroupe C, 1,4 pour le sérogroupe Y, 0,4 pour le sérogroupe W135 et près de zéro pour le sérogroupe A.
Comparaison des vaccins contre le méningocoque actuellement offerts au Canada
Deux catégories de vaccins contre le méningocoque sont actuellement offerts au Canada : les vaccins polysaccharidiques et les vaccins conjugués associant une protéine et un polysaccharide (appelés ici vaccins conjugués). Les vaccins polysaccharidiques ne sont pas reconnus par les récepteurs des lymphocytes T. La réponse immunitaire indépendante des lymphocytes T suscitée par les vaccins polysaccharidiques rend ces vaccins faiblement immunogènes chez les enfants de < 2 ans5, ce qui se traduit par une faible efficacité(6). Les vaccins polysaccharidiques n'induisent pas non plus de mémoire immunitaire et n'offrent qu'une protection de durée limitée7,8. Si le risque persiste, une réimmunisation est recommandée entre l'âge de 6 mois et 5 ans, selon l'âge au moment de la vaccination initiale9. Les vaccins polysaccharidiques ont un effet limité sur le portage asymptomatique, et leur effet sur l'immunité collective, s'il existe, semble être de courte durée10,11. Les vaccins polysaccharidiques peuvent entraîner une hyporéactivité au point où même après l'administration de doses répétées de vaccin polysaccharidique, les titres moyens géométriques (TMG) ne sont pas aussi élevés qu'après la dose initiale8,12,13. On s'inquiète par conséquent que des personnes vaccinées aient une réponse immunitaire sous-optimale si elles sont exposées à N. meningitidis, ce qui se solderait par une plus grande réceptivité à la maladie. La possibilité d'une réceptivité accrue a été observée chez des enfants de ≤ 5 ans, 3 à 5 ans après l'administration d'un vaccin polysaccharidique dans le cadre d'une campagne de vaccination de masse au Québec. Chez les enfants âgés de 2 à 5 ans au moment de la vaccination, l'efficacité du vaccin 3 à 5 ans plus tard s'établissait à –73,8 % (intervalle de confiance [IC] à 95 % : –1 956,2 % à 85,3 %); chez les enfants de < 2 ans au moment de la vaccination, l'efficacité se chiffrait à –390,5 % (IC à 95 % : –4 599,2 % à 48,8 %) 3 à 5 ans plus tard14. Toutefois, on ignore la portée clinique de l'hyporéactivité.
En revanche, les vaccins conjugués provoquent une réponse immunitaire cellulaire (lymphocytes T) et entraînent donc la production d'anticorps ayant une meilleure activité fonctionnelle15. Ces anticorps sont immunogènes chez les jeunes enfants, induisent une mémoire immunitaire8,16,17 et réduisent le portage de N. meningitidis18. Au Royaume‑Uni (R.-U.), cette réduction du portage a eu pour effet d'induire une immunité collective : on a observé une réduction de 67 % (IC à 95 % : 52 % à 77 %) de la méningococcie de sérogroupe C parmi les enfants non vaccinés après avoir comparé les périodes avant et après la mise en œuvre de la campagne de vaccination de masse, au cours de laquelle plus de 80 % de la population cible a été vaccinée19. En outre, les vaccins conjugués n'entraînent pas d'hyporéactivité et peuvent contrer l'hyporéactivité provoquée par les vaccins polysaccharidiques. Toutefois, les TMG sont généralement un peu plus faibles chez les personnes ayant reçu un vaccin conjugué après un vaccin polysaccharidique que chez celles n'ayant reçu qu'un vaccin conjugué13,20,21. Les jeunes enfants ayant déjà été immunisés au moyen d'un vaccin polysaccharidique et dont la réponse immunitaire était insatisfaisante après une dose de vaccin conjugué ont eu une réponse satisfaisante après une deuxième dose de vaccin conjugué20.
Trois différents vecteurs protéiques sont utilisés pour la fabrication des vaccins conjugués : la protéine CRM197 (MeningitecMC et MenjugateMD), l'anatoxine tétanique (NeisVac‑CMC) et l'anatoxine diphtérique (MenactraMC ). La protéine CRM197 est une toxine diphtérique mutante non toxique isolée de cultures de Corynebacterium diphtheriae22. L'anatoxine diphtérique employée dans MenactraMC est une toxine produite par C. diphtheriae qui a été détoxifiée au moyen de formaldéhyde. Le même vecteur protéique est utilisé dans d'autres vaccins tels que le DCaT-VPI, le dT et le dcaT, mais, contrairement à ces vaccins, l'anatoxine diphtérique contenue dans MenactraMC n'est pas un agent immunisant.
Avec l'homologation de MenactraMC , six différents vaccins contre le méningocoque sont maintenant approuvés au Canada. Le tableau 2 présente une comparaison des vaccins sur le marché.
Tableau 2. Comparaison des vaccins contre le méningocoque dont l'utilisation est approuvée au Canada
| Nom du produit |
Type de vaccin |
Fabricant |
Concentration du(des) polysaccharide(s) |
Vecteur protéique |
Administration |
Posologie |
| MenactraMC |
Conjugué A, C, Y, W135 |
Sanofi Pasteur |
4μg de |
48μg d'anatoxine diphtérique |
0,5 mL IM |
Personnes de 2 à 55 ans: 1 dose |
| MeningitecMC |
Conjugué C |
Wyeth Canada |
10μg |
15μg de protéine CRM197 |
0,5 mL IM |
Nourrissons: 3 doses, la première pas avant l'âge de 2 mois, les autres à au moins 1mois d'intervalle, et la troisième après l'âge de 5 mois; Nourrissons de 4 à 11 mois non vaccinés auparavant: 2 doses à au moins 1mois d'intervalle; Enfants de ≥ 1 an, adolescents et adultes: 1 dose. |
| MenjugateMD |
Conjugué C |
Vaccins Novartis |
10μg |
12,5-25μg de protéine CRM197 |
0,5 mL IM |
Nourrissons: 3 doses, la première pas avant l'âge de 2 mois, les autres à au moins 1 mois d'intervalle, et la troisième après l'âge de 5 mois; Nourrissons de 4 à 11 mois non vaccinés auparavant: 2 doses à au moins 1 mois d'intervalle; Enfants de ≥ 1 an, adolescents et adultes: 1 dose. |
| NeisVac-CMC |
Conjugué C |
GlaxoSmithKline |
10μg |
10-20μg d'anatoxine tétanique |
0,5 mL IM |
Nourrissons: 2 doses, la première pas avant l'âge de 2 mois, la deuxième à au moins 2 mois d'intervalle, après l'âge de 5mois; Enfants de ≥ 1 an, adolescents et adultes: 1 dose. |
| MenomuneMD |
Polysacchari- |
Sanofi Pasteur |
50μg de chaque sérogroupe |
Non applicable |
0,5 mL SC |
Enfants de ≥ 2 ans, adolescents et adultes: 1 dose; répéter à l'intervalle recommandé selon l'âge si le risque persiste; peut être utilisé chez les enfants de ≥ 3 mois pour une protection contre le sérogroupeA. |
| MenomuneMD |
Polysacchari- |
Sanofi Pasteur |
50μg de chaque sérogroupe |
Non applicable |
0,5 mL SC |
Enfants de ≥ 2 ans, adolescents et adultes: 1 dose; répéter à l'intervalle recommandé selon l'âge si le risque persiste; peut être utilisé chez les enfants de ≥ 3 mois pour une protection contre le sérogroupe A. |
| IM – intramuscularly |
||||||
Avant 2001, les vaccins polysaccharidiques (MenomuneMD A/C/Y/W135 et MenomuneMD A/C) étaient utilisés pour lutter contre les éclosions de méningococcie de sérogroupe C. MenomuneMD A/C/Y/W135 était administré aux voyageurs, aux personnes présentant des affections à risque élevé, au personnel militaire et à certains travailleurs de laboratoire. C'est en 2001 que le Canada a homologué pour la première fois des vaccins conjugués monovalents contre le méningocoque du sérogroupe C. Des programmes d'immunisation systématique par le vaccin conjugué contre le méningocoque du sérogroupe C ont été mis en œuvre dans l'ensemble des provinces et territoires du Canada depuis 2002. Les programmes varient selon les provinces/territoires. Pour plus d'information, prière de consulter le site http://www.phac-aspc.gc.ca/im/ptimprog-progimpt/index_f.html.
Comme le montre le tableau 2, MenactraMC renferme une concentration plus faible de polysaccharide du sérogroupe C que les trois vaccins conjugués monovalents contre le sérogroupe C (4 μg, comparativement à 10 μg) et une concentration nettement plus faible que MenomuneMD (50 μg par dose). Au cours de trois études publiées, les chercheurs ont évalué la dose optimale de polysaccharide dans un vaccin quadrivalent conjugué contre le méningocoque, comparant des doses de 1 μg, de 4 μg et de 10 μg de chaque sérogroupe. Une étude menée chez des nourrissons n'a révélé aucune différence statistique en ce qui concerne la concentration des anticorps obtenue avec les trois doses ni aucun avantage immunologique statistiquement significatif à augmenter la dose au‑delà de 4 μg. Chez ces nourrissons, des taux plus élevés de réactions locales ont été observés avec la dose de 10 μg23. Dans une étude menée chez des bambins, la dose de 4 μg s'est révélée optimale sur le plan immunitaire24. Chez les adultes, on a noté un effet proportionnel à la dose pour les sérogroupes A, C et W135, la dose de 10 μg suscitant la meilleure réponse immunitaire pour ces sérogroupes25.
Immunogénicité et efficacité des vaccins antiméningococciques
L'approbation réglementaire des vaccins conjugués contre la méningococcie repose principalement sur des études d'immunogénicité à court terme26. Il est difficile d'obtenir des données provenant d'études d'efficacité en raison de la rareté relative de la méningococcie. Les titres d'anticorps bactéricides sériques (ABS) sont le paramètre utilisé habituellement pour déterminer la réceptivité et l'immunité à l'égard de la MI. Auparavant, on utilisait du sérum humain comme source de complément pour le titrage. Lorsqu'on utilise ce type de sérum, un titre ≥ 1:4 est corrélé avec une protection contre la méningococcie de sérogroupe C27. Le sérum de lapereau, qu'il est plus facile de se procurer, a remplacé le sérum humain dans les études les plus récentes. Un titre ≥ 1:8 a été proposé comme corrélat de l'immunité à court terme lorsqu'on utilise le sérum de lapereau comme source de complément28. Aucune autre corrélation immunologique n'a été établie en ce qui concerne la protection contre les trois autres sérogroupes compris dans les vaccins. Les TMG sont également utilisés pour mesurer la réponse immunitaire au vaccin contre le méningocoque. En 1976, dans ses recommandations, le Comité d'experts sur la standardisation biologique de l'OMS a indiqué que pour qu'un vaccin polysaccharidique contre le méningocoque soit acceptable, les titres d'ABS contre les souches cibles mesurés à l'aide d'une épreuve donnée devaient être au moins quatre fois supérieurs (hausse de ≥ 2 dilutions) chez ≥ 90 % des sujets immunisés29. Les études d'immunogénicité permettent probablement d'établir l'efficacité à court terme; on ignore cependant si elles permettent de déterminer l'efficacité à long terme. Par ailleurs, on ne peut pas prévoir l'impact de la vaccination sur le portage et l'immunité collective avec ce type d'étude.
Récemment, dans le cadre de plusieurs études publiées, des chercheurs ont évalué l'efficacité des vaccins conjugués contre le méningocoque du sérogroupe C pour la lutte contre les éclosions après leur intégration aux programmes de vaccination systématique du Québec30, du R.‑U.31 et d'Espagne32. Selon toutes ces études, l'efficacité de ces vaccins durant l'année qui a suivi la mise en œuvre des programmes d'immunisation était excellente. Deux de ces études ont aussi permis d'obtenir des données concernant le suivi à plus long terme31,32. Ces études sèment le doute quant à l'efficacité à long terme du vaccin conjugué chez les enfants qui ont été vaccinés durant les premiers mois de la vie sans recevoir par la suite de dose de rappel.
Auparavant, au R.‑U., les nourrissons recevaient le vaccin conjugué contre le méningocoque du sérogroupe C à l'âge de 2, 3 et 4 mois. Trotter et coll. ont noté que chez les enfants immunisés conformément à ce calendrier, l'efficacité du vaccin plus de 1 an après la vaccination avait chuté à –81 % (IC à 95 % : –7 430 % à 71 %). Chez les enfants vaccinés entre l'âge de 5 et 11 mois et de 1 à 2 ans, la protection à long terme était meilleure, l'efficacité du vaccin à plus de 1 an étant respectivement de 82 % (IC à 95 % : –8 % à 97 %) et de 61 % (IC à 95 % : –327 % à 94 %). Même dans ces groupes plus âgés, les intervalles de confiance étaient très larges et englobaient le zéro, ce qui laisse croire que l'efficacité à long terme pourrait être faible31. En Espagne, les nourrissons recevaient le vaccin conjugué contre le méningocoque du sérogroupe C à l'âge de 2, 4 et 6 mois. Plus de 1 an après l'immunisation, l'efficacité du vaccin administré conformément à ce calendrier était de 78 % (IC à 95 % : 3,1 % à 95,0 %). Chez les enfants vaccinés entre l'âge de 7 mois et 5 ans, la protection était meilleure, l'efficacité du vaccin après 1 an s'établissant à 94,3 % (IC à 95 % : 71,2 % à 98,8 %)32.
La mémoire immunitaire conférée par les vaccins conjugués contre le méningocoque du groupe C a été démontrée par les hausses de titres observées après provocation par des vaccins polysaccharidiques ou conjugués contre le groupe C21,33. Toutefois, on ignore si la mémoire immunitaire est suffisante pour conférer une protection contre la MI, dont la période d'incubation est courte (de 2 à 10 jours, habituellement 3 ou 4 jours34). Étant donné que la période d'incubation est courte, il est possible que des anticorps circulants soient nécessaires à la protection. Il est également possible que la réduction de l'incidence des méningococcies attribuable à la vaccination diminue les occasions de rappel naturel et entraîne une baisse des taux d'anticorps circulants et une hausse de la réceptivité avec le temps. Par conséquent, des doses de rappel du vaccin conjugué contre le méningocoque du sérogroupe C pourraient s'avérer nécessaires dans l'avenir26. Selon une étude de modélisation réalisée par De Wals et coll., lorsqu'une dose de vaccin conjugué contre le méningocoque du sérogroupe C est administrée à l'âge de 12 mois, une dose de rappel serait indiquée si la protection diminue de 3 % ou plus par année. Les auteurs indiquent que l'âge optimal d'administration de cette dose de rappel serait d'environ 12 ans, vu l'épidémiologie actuelle de la méningococcie de sérogroupe C au Canada35.
Immunogénicité de MenactraMC et durée de la protection offerte par ce vaccin
L'utilisation de MenactraMC a été approuvée principalement par suite de la démonstration de la non‑infériorité immunologique de ce vaccin par rapport à MenomuneMD pour les quatre sérogroupes. Des études ont été menées chez trois groupes d'âge : enfants de 2 à 10 ans36,37, adolescents de 11 à 18 ans36,38,39 et adultes de 18 à 55 ans36,38. Des études sont aussi réalisées chez des nourrissons23, bien que le vaccin ne soit pas encore approuvé pour ce groupe d'âge. Aucune étude comparant directement MenactraMC avec les autres vaccins conjugués contre le méningocoque du sérogroupe C actuellement approuvés n'a été menée. De même, dans aucune des études susmentionnées n'a‑t‑on établi de distinction entre la réponse immunitaire chez les sujets naïfs et chez les sujets qui avaient déjà été stimulés par suite d'un portage nasopharyngé asymptomatique de N. meningitidis ou d'une infection causée par un autre microorganisme induisant une réaction croisée.
Plusieurs mesures de l'immunité ont été utilisées au cours des études sur MenactraMC . Le principal critère de jugement était le pourcentage de participants dont les titres d'ABS 28 jours après l'immunisation étaient ≥ 4 fois plus élevés qu'avant l'immunisation comparativement à MenomuneMD . D'autres critères de jugement ont été utilisés, notamment une comparaison des TMG obtenus pour chaque sérogroupe avec MenactraMC et avec MenomuneMD ; la séroconversion, définie comme le pourcentage de personnes dont les titres sont passés de < 1:8, avant la vaccination, à ≥ 1:32, 28 jours après la vaccination; les courbes de distribution cumulative inverse comparant le pourcen- tage de personnes qui ont atteint divers titres 28 jours après l'administration de MenactraMC ou de MenomuneMD ; et la mesure, par la méthode ELISA, des anticorps de types IgG et IgM spécifiques des sérogroupes36,38.
Adultes de 18 à 55 ans : MenactraMC s'est révélé immunologiquement non inférieur à MenomuneMD au cours d'un essai comparatif randomisé auquel ont participé 2 554 adultes de 18 à 55 ans. Cependant, le pourcentage de sujets qui avaient un titre au moins 4 fois plus élevé dans le sérum de lapereau 28 jours après la vaccination était plus faible (pour les quatre sérogroupes) dans le groupe MenactraMC que dans le groupe MenomuneMD : 88,5 % contre 89,7 % pour le sérogroupe C; 80,5 % contre 84,6 % pour le sérogroupe A; 73,5 % contre 79,4 % pour le sérogroupe Y; et 89,4 % contre 94,4 % pour le sérogroupe W135. Les TMG étaient eux aussi légèrement plus bas dans le groupe MenactraMC que dans le groupe MenomuneMD pour les quatre sérogroupes36,38. Une étude d'uniformité des lots menée dans ce groupe d'âge a révélé que les trois lots à l'essai étaient immunogènes, mais que les réponses contre les sérogroupes C et Y mesurées au moyen de sérum de lapereau variaient légèrement38.
Adolescents de 11 à 18 ans : MenactraMC s'est révélé immunologiquement non inférieur à MenomuneMD au cours d'un essai comparatif randomisé auquel ont participé 881 adolescents de 11 à 18 ans. Le pourcentage de sujets qui avaient un titre au moins 4 fois plus élevé dans le sérum de lapereau 28 jours après la vaccination était semblable dans les groupes MenactraMC et MenomuneMD pour tous les sérogroupes : 91,7 % contre 88,7 % pour le sérogroupe C; 92,7 % contre 92,4 % pour le sérogroupe A; 81,8 % contre 80,1 % pour le sérogroupe Y; et 96,7 % contre 95,3 % pour le sérogroupe W135, respectivement. Les TMG étaient légèrement plus élevés dans le groupe MenactraMC que dans le groupe MenomuneMD pour les sérogroupes A, C et Y et légèrement plus bas pour le sérogroupe W13536,38,39.
Trois ans après la vaccination initiale, Keyserling et coll. ont revacciné un sous‑groupe de leurs sujets avec MenactraMC (76 et 77 adolescents qui avaient auparavant reçu MenactraMC et MenomuneMD , respectivement). Avant la revaccination, le groupe qui avait déjà reçu MenactraMC affichait des TMG plus élevés pour tous les sérogroupes que le groupe qui avait reçu MenomuneMD . Aux jours 8 et 28 après la revaccination, les TMG étaient nettement plus élevés dans le groupe MenactraMC que dans le groupe MenomuneMD 39.
Enfants de 2 à 10 ans : MenactraMC s'est révélé immunologiquement non inférieur à MenomuneMD au cours d'un essai comparatif randomisé mené par Pichichero et coll., auquel ont participé 1 398 enfants de 2 à 10 ans. Le pourcentage de sujets qui avaient un titre au moins 4 fois plus élevé dans le sérum de lapereau 28 jours après la vaccination était plus haut dans le groupe MenactraMC que dans le groupe MenomuneMD pour tous les sérogroupes : 73,4 % contre 68,9 % pour le sérogroupe C; 87,7 % contre 83,8 % pour le sérogroupe A; 56,6 % contre 45,6 % pour le sérogroupe Y; et 91,0 % contre 85,4 % pour le sérogroupe W135. Vingt-huit jours et 6 mois après la vaccination, les TMG étaient plus élevés dans le groupe MenactraMC que dans le groupe MenomuneMD pour les quatre sérogroupes36,37.
Bien que cette étude donne à penser que MenactraMC présente une bonne immunogénicité comparativement à MenomuneMD chez les enfants de 2 à 10 ans, il faut souligner que l'efficacité de MenomuneMD dans ce groupe d'âge est plus faible que dans les groupes plus âgés. De Wals et coll. ont évalué l'impact d'une campagne d'immunisation de masse avec MenomuneMD en réponse à une éclosion de méningococcie causée par le sérogroupe C au Québec à l'hiver 1992-1993. L'efficacité du vaccin rajustée pour l'âge durant les 5 ans suivant la vaccination était de 41 % (IC à 95 % : –106 % à 79 %) pour les enfants de 2 à 9 ans. En comparaison, l'efficacité du vaccin atteignait 75 % chez les adolescents de 10 à 14 ans (IC à 95 % : –17 % à 93 %) et 83 % chez les personnes de 15 à 20 ans (IC à 95 % : 39 % à 96 %)6. De plus, les tableaux 3 et 4 montrent que chez les enfants de 2 à 10 ans ayant reçu MenactraMC , les TMG, tout comme le pourcentage de sujets qui avaient un titre d'anticorps au moins 4 fois plus élevé, étaient plus faibles que dans les groupes plus âgés. D'après ces données, l'efficacité du vaccin pourrait être moindre et/ou de plus courte durée chez les enfants de 2 à 10 ans que dans les groupes plus âgés.
Une série d'études visant à évaluer l'immunité et la durée de la protection conférée par MenactraMC chez des enfants de 2 ou 3 ans ont été menées auprès d'un sous-groupe d'enfants ayant participé à l'étude de Pichichero et coll. Le nombre d'enfants recrutés qui avaient reçu MenactraMC variait de 30 à 90, et, dans certaines des études, les mêmes sujets ont été inclus dans les analyses40-42.
Dans une étude, les chercheurs ont constaté que MenactraMC avait induit la formation d'anticorps bactéricides à un titre protecteur contre le sérogroupe C (défini comme un titre ≥ 1:4 avec du complément d'origine humaine) chez 50 % des 30 enfants de l'étude 1 mois après la vaccination. Après 6 mois, 40 % de ces 30 enfants avaient un titre d'anticorps bactéricides ≥ 1:440. Dans une autre étude publiée, on a mesuré les titres d'anticorps chez 48 enfants 2 à 3 ans après l'administration de MenactraMC , celle-ci ayant eu lieu lorsque les enfants étaient âgés de 4 ou 5 ans. Les résultats de cette étude ont montré que seuls 14,6 % des enfants vaccinés avaient un titre protecteur d'anticorps bactéricides contre le sérogroupe C 2 à 3 ans après l'administration de MenactraMC 41. De même, on a suivi à un intervalle moyen de 2,4 ans 40 enfants qui avaient 2 ans au moment de la vaccination par MenactraMC afin d'évaluer la persistance de l'immunité contre les sérogroupes A, Y et W135. Moins de la moitié de ces enfants avaient un titre d'anticorps bactéricides persistants ≥ 1:4. Plus précisément, 15 % avaient un titre ≥ 1:4 pour le sérogroupe A, 32,5 %, pour le sérogroupe Y et 45 %, pour le sérogroupe W13542.
Une autre étude de suivi a été menée chez 92 enfants ayant participé à l'étude de Pichichero et coll. Cette étude visait à évaluer la mémoire immunitaire chez des enfants 2 ou 3 ans après la vaccination par MenactraMC , ces enfants ayant reçu le vaccin à l'âge de 2 ou 3 ans. De très forts TMG ont été mesurés pour tous les sérogroupes 8 et 28 jours après la revaccination avec une dose de provocation consistant en un dixième de dose de MenomuneMD , ce qui laisse croire à l'induction de la mémoire immunitaire chez les jeunes enfants. Les TMG étaient beaucoup plus élevés dans le groupe qui avait déjà reçu MenactraMC , mais dans le groupe témoin n'ayant jamais été vacciné, les TMG à huit et 28 jours étaient eux aussi élevés après l'administration d'une dose de provocation de MenomuneMD 36.
Au cours d'un essai comparatif randomisé auquel ont participé 103 enfants de 2 à 4 ans, on a évalué l'immunogénicité de MenactraMC par rapport à un vaccin témoin (contre Haemophilus influenzae de type b) chez les enfants qui avaient reçu un vaccin conjugué contre le méningocoque du sérogroupe C au moins 1 an auparavant. Chez un fort pourcentage de participants qui avaient reçu MenactraMC , on a mesuré un titre d'anticorps au moins 4 fois plus élevé pour tous les sérogroupes 28 jours après la vaccination : 93,2 % pour le sérogroupe C; 97,7 % pour le sérogroupe A; 79,6 % pour le sérogroupe Y; et 97,7 % pour le sérogroupe W135. Les TMG étaient élevés pour tous les sérogroupes et étaient très élevés pour les sérogroupes C et A. Il ressort de cette étude que MenactraMC peut être utilisé pour stimuler la réponse immunitaire chez les enfants qui ont déjà reçu un vaccin conjugué contre le méningocoque du sérogroupe C36,43.
Au Canada, trois vaccins conjugués monovalents contre le méningocoque du sérogroupe C sont approuvés pour le groupe des 2 à 10 ans. Certaines données confirmant l'efficacité de ces vaccins chez ce groupe d'âge sont maintenant disponibles. Trotter et coll. ont montré que le vaccin était efficace à 93 % chez des enfants vaccinés à l'âge de 3 ou 4 ans plus de 1 an auparavant (IC à 95 % : 78 % à 98 %)31. De même, Larrauri et coll. ont conclu que le vaccin conjugué contre le méningocoque du sérogroupe C était efficace à 94,3 % (IC à 95 % : 71,2 % à 98,8 %) chez des enfants vaccinés à l'âge de 7 mois à 5 ans plus de 1 an auparavant32. Étant donné les incertitudes concernant l'immunogénicité de MenactraMC chez les enfants de 2 à 10 ans et les données à l'appui de l'efficacité des vaccins conjugués contre le méningocoque du sérogroupe C, d'autres études seront nécessaires pour garantir que MenactraMC offre une protection comparable à celle des vaccins conjugués contre le méningocoque du sérogroupe C dans ce groupe d'âge.
Tableau 3. Titres moyens géométriques selon l'âge 28 jours après l'administration d'une dose de MenactraMC
| Groupe d'âge |
2 à 10 ans36,37 |
11 à 18 ans 36,38,39 |
18 à 55 ans 36,38 |
| Sérogroupe C |
354 |
1 924 |
3 231 |
| Sérogroupe A |
1 700 |
5 483 |
3 897 |
| Sérogroupe Y |
637 |
1 322 |
1 750 |
| Sérogroupe W135 |
750 |
1 407 |
1 271 |
Tableau 4. Pourcentage de participants dont les titres d'anticorps étaient au moins 4 fois plus élevés 28 jours après l'administration d'une dose de MenactraMC
| Groupe d'âge |
2 à 10 ans36,37 |
11 à 18 ans 36,38,39 |
18 à 55 ans 36,38 |
| Sérogroupe C |
73,4 % |
91,7 % |
88,5 % |
| Sérogroupe A |
87,7 % |
92,7 % |
80,5 % |
| Sérogroupe Y |
56,6 % |
81,8 % |
73,5 % |
| Sérogroupe W135 |
91,0 % |
96,7 % |
89,4 % |
Sommaire
MenactraMC s'est révélé non inférieur à MenomuneMD dans tous les groupes d'âge, bien que la réponse immunitaire induite par MenactraMC soit plus faible dans le groupe des 2 à 10 ans que dans les groupes plus âgés. Comme l'immunogénicité de MenactraMC n'a pas été comparée à celle des vaccins conjugués contre le méningocoque du sérogroupe C, il est impossible de déterminer la non‑infériorité par rapport à ces produits. Les données sur l'immunogénicité seules sont insuffisantes pour prévoir l'efficacité du vaccin et l'immunité collective. Il faudra mener d'autres études pour évaluer l'efficacité du vaccin, son impact sur le portage nasopharyngé, ses effets indirects sur les taux de maladie dans les populations non vaccinées et sa non‑infériorité par rapport aux vaccins conjugués contre le méningocoque du sérogroupe C. On s'attend à ce que MenactraMC confère une protection plus longue que le vaccin polysaccharidique, mais, comme c'est le cas pour les vaccins conjugués contre le méningocoque du sérogroupe C, des études seront nécessaires afin de déterminer la durée de la protection conférée.
Description de MenactraMC
Une dose de 0,5 mL de MenactraMC renferme 4 μg de chacun des antigènes polysaccharidiques capsulaires des sérogroupes A, C, Y et W135, conjugués individuellement à une anatoxine diphtérique. Chaque dose contient au total 48 μg de vecteur protéique (anatoxine diphtérique). MenactraMC est un liquide stérile, clair à légèrement trouble. Avant de l'utiliser, il faut vérifier s'il a changé de couleur ou si des particules sont visibles. MenactraMC ne renferme aucun agent de conservation ni adjuvant. Il est présenté dans des seringues préremplies ou dans des fioles unidoses. Il n'y a pas de latex dans les seringues préremplies, mais il y en a dans les bouchons des fioles.
Posologie et voie d'administration
MenactraMC doit être administré en une seule injection intramusculaire (IM) de 0,5 mL, de préférence dans la région deltoïde.
Une étude a été menée auprès de 100 personnes ayant reçu par inadvertance MenactraMC par voie sous‑cutanée. Les taux de réactions indésirables étaient similaires dans ce groupe et dans le groupe témoin rétrospectif qui avait reçu le vaccin par voie IM. On a observé dans les deux groupes un pourcentage similaire de sujets dont les titres mesurés à l'aide de sérum de lapereau étaient ≥ 1:8, mais les TMG étaient plus bas pour les sérogroupes A, C et Y lorsque le vaccin avait été administré par voie sous‑cutanée. Il n'est donc pas jugé nécessaire d'administrer une autre dose de MenactraMC si le vaccin a été donné par inadvertance par voie sous‑cutanée44.
Chez les personnes ayant reçu MenactraMC , la vaccination systématique contre la diphtérie demeure nécessaire.
Conditions d'entreposage
MenactraMC doit être conservé à une température de +2 oC à +8 oC durant le transport et l'entreposage et ne doit pas être congelé. De plus, il doit être conservé à l'abri de la lumière.
Administration concomitante d'autres vaccins
Au cours d'une étude à laquelle ont participé 945 adultes âgés de 18 à 55 ans, on a évalué la réponse immunitaire à l'administration concomitante d'un vaccin contre la typhoïde et de MenactraMC , comparativement à l'administration du vaccin contre la typhoïde suivie, 1 mois plus tard, de celle de MenactraMC . Aucune différence n'a été notée en ce qui concerne la réponse immunitaire induite par l'un ou l'autre des vaccins dans les deux groupes36,38. Prière de consulter la section Réactions indésirables pour obtenir des renseignements sur l'innocuité de la coadministration du vaccin contre la typhoïde et de MenactraMC .
L'administration simultanée du vaccin dT et de MenactraMC a été comparée à l'administration du dT suivie, 1 mois plus tard, de celle de MenactraMC dans une étude à laquelle participaient 1 010 adolescents de 11 à 17 ans36,38. Selon les résultats de cette étude, les TMG des anticorps contre la diphtérie étaient beaucoup plus élevés dans le groupe ayant reçu les deux vaccins en concomitance. Dans ce groupe, les TMG étaient aussi beaucoup plus élevés pour les quatre sérogroupes du méningocoque. De même, dans ce groupe, la proportion de sujets dont les titres avaient été multipliés par 4 ou plus était plus grande pour les sérogroupes C, Y et W135, mais pas pour le sérogroupe A. Les TMG dans le groupe ayant reçu le dT suivi de MenactraMC étaient semblables pour les sérogroupes C, Y et W135 et plus élevés pour le sérogroupe A, comparativement aux titres obtenus dans une autre étude menée avec ce groupe d'âge dans laquelle MenactraMC avait été administré seul36,38,39.
Toutefois, le pourcentage de sujets ayant des titres d'anticorps au moins 4 fois plus élevés 28 jours après la vaccination était plus bas pour les sérogroupes C, Y et W135 (82,4 %, 65,1 % et 87,7 %, respectivement) dans le groupe ayant reçu le dT suivi de MenactraMC que dans le groupe ayant reçu uniquement MenactraMC . Selon ces données, il pourrait être préférable d'administrer le dT et MenactraMC simultanément si les deux produits sont nécessaires. Les TMG des anticorps contre le tétanos étaient semblables dans les deux groupes. Prière de consulter la section Réactions indésirables pour obtenir des renseignements sur l'innocuité de la coadministration du dT et de MenactraMC .
Aucune étude n'a été menée pour évaluer l'innocuité, l'efficacité ou l'immunogénicité associées à l'administration concomitante de MenactraMC et d'autres vaccins, tels le vaccin dcaT et les vaccins contre l'hépatite B, l'hépatite A et le virus du papillome humain. En général, on peut donner plus d'un vaccin en même temps si on utilise des aiguilles, des seringues et des points d'injection différents45.
Revaccination
Actuellement, on ignore s'il sera nécessaire d'administrer des doses additionnelles de MenactraMC , car on ne dispose pas d'assez de données pour prévoir la persistance de l'immunité et l'efficacité à long terme. Il faudra exercer une surveillance continue pour déterminer si la revaccination ou l'administration de doses de rappel est requise.
Les personnes ayant déjà reçu un vaccin polysaccharidique contre le méningocoque devraient recevoir MenactraMC si le risque de méningococcie persiste. La revaccination par MenactraMC des personnes à risque continu ayant reçu le vaccin polysaccharidique doit être envisagé 1 ou 2 ans plus tard si ce dernier à été reçu entre l'âge de 13 à 23 mois; 2 ou 3 ans plus tard s'il a été reçu entre l'âge de 2 et 5 ans; et 5 ans plus tard s'il a été reçu à l'âge de ≥ 6 ans. Comme il est arrivé qu'une réponse adéquate au vaccin conjugué contre le sérogroupe C ne soit observée qu'après 6 mois chez des adultes ayant reçu auparavant un vaccin polysaccharidique purifié13, il s'agit là de l'intervalle minimum recommandé pour l'administration de MenactraMC après le vaccin polysaccharidique, et ce, jusqu'à ce que d'autres données soient disponibles.
Les personnes qui ont reçu un vaccin conjugué contre le méningocoque du sérogroupe C peuvent recevoir MenactraMC ; de même, celles qui ont reçu MenactraMC peuvent recevoir un vaccin conjugué contre le méningocoque du sérogroupe C. Bien qu'il n'existe aucune donnée à ce sujet, un intervalle de 1 mois entre l'administration des produits est recommandé par les experts.
Réactions indésirables
L'innocuité de MenactraMC a été évaluée dans les trois groupes d'âge sui- vants : 2 à 10 ans36,37, 11 à 18 ans36,38,39 et 18 à 55 ans36,38. Pour ce qui est des personnes de 11 à 55 ans, six essais cliniques visant à évaluer l'innocuité de MenactraMC ont été menés auprès de 7 640 personnes36. Trois essais cliniques ont été réalisés pour évaluer l'innocuité de MenactraMC chez plus de 2 400 enfants âgés de 2 à 10 ans36. Les réactions locales et générales graves n'étaient pas fréquentes.
Réactions locales : En général, les réactions locales sont plus fréquentes après l'administration de MenactraMC que de MenomuneMD , ce qui pourrait être attribuable à l'anatoxine diphtérique que renferme MenactraMC ou encore à sa voie d'administration (IM), MenomuneMD étant administré par voie sous‑cutanée. D'après un résumé des essais cliniques, 56,3 % des personnes de 11 à 55 ans ont signalé une douleur au point d'injection dans les 7 jours suivant l'administration de MenactraMC 38. Pour ce qui est des enfants de 2 à 10 ans, 48,1 % ont ressenti une douleur après l'injection de MenactraMC dans une étude37 et 39,7 %, dans une autre étude36.
Chez les adultes, la douleur était plus courante au point d'injection du vaccin contre la typhoïde (75,2 %) qu'au point d'injection de MenactraMC (46,5 %) lorsque les deux vaccins étaient administrés simultanément36, 38. De même, lorsque MenactraMC et le dT étaient administrés en concomitance à des enfants de 11 à 17 ans, les réactions locales étaient plus nombreuses au point d'injection du dT qu'à celui de MenactraMC (70,9 % au point d'injection du dT contre 52,9 % au point d'injection de MenactraMC )36-38. Les réactions n'étaient pas plus courantes au point d'injection de MenactraMC lorsque le dT et MenactraMC étaient administrés en concomitance que lorsque MenactraMC était administré 1 mois après le dT. Aucune étude n'a été réalisée pour évaluer les conséquences de l'administration de MenactraMC suivie de celle du dT ou du dcaT. Ces combinaisons pourraient entraîner des réactions locales accrues en raison de la concentration de l'anatoxine diphtérique dans MenactraMC .
Réactions générales : Les réactions générales étaient aussi fréquentes dans le groupe MenactraMC que dans le groupe MenomuneMD 36-39. Dans un résumé des études, les réactions indésirables les plus courantes dans les 7 jours suivant la vaccination étaient les céphalées et la fatigue. Des céphalées ont été mentionnées par 40,3 % des personnes âgées de 15 à 25 ans38, 37,4 % de celles âgées de 26 à 55 ans38 et 44,8 % de celles âgées de 11 à 18 ans39qui avaient reçu MenactraMC . Dans les mêmes groupes, 34,0 %38, 29,1 %38 et 28,2 %39 des sujets, respectivement, ont fait état de fatigue. Les réactions indésirables le plus souvent constatées dans les 7 jours suivant la vaccination chez les 2 à 19 ans étaient l'irritabilité (35,2 %) et la somnolence (26,0 %)37. Aucune réaction générale grave attribuable au vaccin n'a été observée durant ces essais.
Dans une étude au cours de laquelle on a administré simultanément un vaccin contre la typhoïde et MenactraMC à des adultes, on a comparé les taux de réactions indésirables par rapport à ceux d'un groupe qui avait reçu le vaccin contre la typhoïde suivi, 1 mois plus tard, de MenactraMC 36,38. Les réactions générales telles que les céphalées et la fatigue étaient plus fréquentes dans le groupe qui avait reçu les deux vaccins en même temps, mais les taux de ces réactions indésirables étaient semblables à ceux enregistrés après l'administration du vaccin contre la typhoïde seul36. Dans une étude réalisée chez des adolescents de 11 à 17 ans, des réactions générales indésirables ont été signalées plus fréquemment après la coadministration de MenactraMC et du dT que lorsque MenactraMC avait été administré 1 mois après le dT. En général, toutefois, les taux de réactions indésirables dans le groupe MenactraMC et dT étaient similaires à ceux mesurés dans d'autres études après l'administration de MenactraMC seul38. De même, les taux de céphalées et de fatigue, réactions les plus courantes, étaient semblables dans le groupe ayant reçu simultanément les deux vaccins et dans le groupe ayant reçu le dT seul36.
Syndrome de Guillain-Barré (SGB) : La surveillance postcommercialisation effectuée par le biais du Vaccine Adverse Event Reporting System (VAERS) aux États-Unis a permis de recenser 17 cas de SGB survenus dans les 6 semaines ayant suivi l'administration de MenactraMC . Le syndrome s'est manifesté de 2 à 33 jours après la vaccination, la moyenne étant de 15,7 jours et la médiane, de 14 jours. Les cas étaient significativement concentrés autour des jours 9 à 15, et cette concentration était trop grande pour être attribuée au hasard (p = 0,012). Aucun cas n'a mentionné de symptômes compatibles avec une infection à Campylobacter jejuni, l'une des principales causes de SGB. Une culture de selles et une épreuve sérologique de détection de C. jejuni ont donné des résultats négatifs. Quinze des 17 cas étaient des adolescents âgés de 11 à 19 ans, ce groupe d'âge étant celui qui est le plus couramment vacciné par MenactraMC aux États-Unis. Les deux autres cas avaient 30 et 43 ans.
Une analyse du risque de SGB chez les 11 à 19 ans a été effectuée. Le taux de base de SGB dans ce groupe a été déterminé au moyen de deux sources, le Healthcare Cost and Utilization Project (HCUP) et le Vaccine Safety Datalink (VSD). Le VAERS a calculé le taux de SGB par personnes-mois selon le nombre de doses de vaccin distribuées dans ce groupe d'âge. Il a obtenu des taux de SGB 1,78 fois supérieurs (IC à 95 % : 1,02 à 2,85) au taux de base mesuré par le HCUP (0,11 pour 100 000 personnes‑mois dans le groupe des 11 à 19 ans). De même, il a obtenu des taux de SGB 1,77 fois supérieurs (IC à 95 % : 0,96 à 3,07) au taux de base mesuré par le VSD (0,11 pour 100 000 personnes‑mois), après ajustement en fonction des variations saisonnières.
En s'appuyant sur le risque relatif de SGB après la vaccination qui a été établi à 1,78 au moyen des données du HCUP, les Centers for Disease Control and Prevention (CDC) des États‑Unis ont estimé à 1,25 (IC à 95 % : 0,058 à 5,99) le nombre de cas excédentaires de SGB prévisibles pour chaque million de doses de vaccin distribuées dans le groupe des 11 à 19 ans. Les CDC ont indiqué que cette estimation du risque comportait un fort degré d'incertitude. En raison des limites des données indiquant un faible risque de SGB et du risque continu de méningococcie, les CDC n'ont aucunement modifié leur recommandation en faveur de l'utilisation de MenactraMC pour la vaccination des adolescents, des étudiants de collège de première année qui vivent dans des dortoirs et des autres personnes à risque élevé de méningococcie. Les CDC ont recommandé que MenactraMC ne soit pas utilisé chez les personnes ayant des antécédents de SGB, même si certaines personnes à risque particulièrement élevé de méningococcie, tels certains microbiologistes, pourraient envisager l'immunisation46. Il faut noter que les vaccins conjugués monovalents contre le méningocoque du sérogroupe C ne sont pas homologués aux États‑Unis et que MenactraMC est donc le seul vaccin conjugué contre le méningocoque autorisé dans ce pays.
Les professionnels de la santé devraient déclarer aux autorités sanitaires locales les cas de SGB temporellement associés à l'administration de MenactraMC .
Contre-indications et précautions
MenactraMC ne doit pas être donné à des personnes ayant déjà eu des réactions anaphylactiques à un vaccin contre le méningocoque ou à l'un de ses composants. Les personnes ayant des antécédents de réactions anaphylactiques à d'autres vaccins contre le méningocoque ou vaccins à composants diphtériques devraient subir un examen visant à préciser le composant responsable de la réaction allergique. Les personnes présentant une allergie anaphylactique connue au latex ne devraient pas recevoir de dose de MenactraMC provenant d'une fiole, car le capuchon renferme du latex. La seringue préremplie ne contient pas de latex.
Bien que le risque de récidive du SGB ne soit pas connu, il faut faire preuve de prudence lorsqu'on administre MenactraMC à une personne ayant déjà eu un épisode de SGB, particulièrement lorsque des produits de substitution peuvent être utilisés. Pour les personnes de ≥ 2 ans ayant des antécédents de SGB, il est préférable de donner un vaccin polysaccharidique pour une protection à court terme, car aucune association entre un vaccin polysaccharidique contre le méningocoque et le SGB n'a été décrite malgré l'utilisation massive de ce vaccin depuis plus de 30 ans. Pour une protection de plus longue durée contre la MI de sérogroupe C, un vaccin conjugué monovalent contre le sérogroupe C est privilégié. Lorsqu'on veut obtenir une protection de longue durée contre les sérogroupes A, Y et W135, il faut mettre en balance le risque de récidive du SGB et le risque de MI, et il faut bien informer le patient.
MenactraMC n'a pas été évalué chez les personnes immunodéprimées. Comme c'est le cas avec d'autres vaccins inactivés, son efficacité pourrait être réduite chez de telles personnes.
MenactraMC n'a pas été évalué chez les femmes enceintes et les femmes qui allaitent. Il ne faut donc l'utiliser chez ces femmes que lorsque les avantages l'emportent sur les risques.
Usage recommandé
Préambule : La MI est relativement rare au Canada, le taux annuel depuis 1995 s'établissant à ≤ 1.1 pour 100 000 par année. Les cas de méningococcie sont surtout attribuables aux sérogroupes C et B. Aucun vaccin n'est actuellement offert au Canada contre le sérogroupe B. Le nombre de cas de MI attribuables aux sérogroupes Y, W135 et A est très faible et est demeuré relativement stable au Canada au fil des ans. Il convient toutefois de noter que l'épidémiologie des sérogroupes de méningocoque se modifie avec le temps et à l'intérieur de certaines régions géographiques et que les sérogroupes moins courants pourraient le devenir davantage dans l'avenir. Par ailleurs, l'âge médian des personnes infectées par les sérogroupes Y et A est plus grand (44 et 45 ans, respectivement), et, par conséquent, les programmes d'immunisation systématique destinés aux enfants et aux adolescents pourraient ne pas réduire de façon importante le nombre de cas de maladie dus à ces sérogroupes. Trois vaccins conjugués monovalents très efficaces contre le méningocoque du sérogroupe C sont disponibles au Canada, bien que la durée de la protection conférée par ces vaccins demeure incertaine. Le vaccin administré dans les premiers mois de la vie semble ne conférer qu'une faible protection 1 an ou plus après la vaccination. Toutefois, chez les personnes vaccinées à un âge plus avancé, l'efficacité du vaccin est bonne après > 1 an31,32. L'efficacité de MenactraMC n'a pas été évaluée, et son immunogénicité n'a pas été comparée à celle des vaccins conjugués contre le méningocoque du sérogroupe C.
La vaccination contre les sérogroupes A, Y et W135 n'entraînera qu'une faible diminution du nombre de cas de MI étant donné que ces sérogroupes sont relativement rares. Par ailleurs, vu les inquiétudes concernant une possible association entre le SGB et MenactraMC , qui, selon les estimations, se traduirait par 1,25 cas excédentaires de SGB pour un million de doses distribuées, il convient d'utiliser avec prudence ce vaccin au Canada, particulièrement si l'on considère que l'on peut employer d'autres vaccins, tels les vaccins conjugués contre le méningocoque du sérogroupe C. Il faudra prêter une grande attention à la surveillance postcommercialisation au Canada et aux États‑Unis pour mieux comprendre la possible relation entre MenactraMC et le SGB.
Vu la rareté relative des sérogroupes A, Y et W135 dans la population et le risque d'une possible association entre le SGB et MenactraMC , l'utilisation de ce vaccin ne devrait être envisagée que pour les personnes davantage exposées aux sérogroupes A, Y ou W135 ou les situations dans lesquelles ces sérogroupes sont plus fréquents. Chez ces personnes, l'utilisation de MenomuneMD pourrait aussi être envisagée, bien que ce vaccin induise une réponse sous‑optimale chez les enfants de < 10 ans et une hyporéactivité immunologique, réponses dont la portée clinique est mal comprise. Par conséquent, MenactraMC est recommandé pour les groupes à risque élevé lorsqu'une protection de longue durée est requise et qu'une vaccination répétée par MenomuneMD aurait été nécessaire si ce produit avait été utilisé.
Personnes à risque élevé : MenactraMC est recommandé pour les personnes de 2 à 55 ans qui font partie des groupes à risque élevé suivants :
- personnes présentant une asplénie anatomique ou fonctionnelle (voir plus loin pour des renseignements concernant la splénectomie);
- personnes présentant des déficits en complément, en properdine ou en facteur D;
- voyageurs pour qui le vaccin contre le méningocoque est indiqué ou requis, notamment les pèlerins qui se rendent à La Mecque durant le hajj. Le vaccin doit être donné au moins 2 semaines avant le départ si possible (voir plus loin pour d'autres conseils aux voyageurs);
- employés de laboratoires de recherche, de laboratoires industriels et de laboratoires cliniques fréquemment exposés à N. meningitidis;
- recrues militaires.
Le CCNI estime qu'il existe des preuves acceptables pour recommander l'utilisation de MenactraMC dans les groupes susmentionnés – fermeté de la recommandation : B (tableau 5). Comme les preuves disponibles proviennent d'études d'immunogénicité menées chez des personnes en bonne santé, le niveau de preuve a été établi à II-2 pour les personnes en bonne santé et à III pour les personnes immunodéprimées. Une étude publiée semble confirmer une possible association entre le SGB et MenactraMC chez les adolescents de 11 à 19 ans. Comme le risque dans les groupes susmentionnés n'a pas été étudié, le niveau de preuve relatif à une possible association dans ces groupes a été établi à III.
Tableau 5. Qualité et fermeté des preuves
| Niveau de preuve47,48
Fermeté des recommandations
|
Voici les produits privilégiés pour le suivi des contacts et la lutte contre les éclosions :
-
Contacts étroits des personnes atteintes d'une méningococcie causée par les sérogroupes A, C, Y ou W135 (voir plus loin la définition des contacts étroits)
- Pour les contacts réceptifs des personnes atteintes d'une ménin- gococcie du sérogroupe C, le vaccin conjugué contre leméningocoque du sérogroupe C est privilégié.
- Pour les contacts réceptifs des personnes atteintes d'une ménin- gococcie des sérogroupes A, Y ou W135, MenactraMC est privilé- gié si le receveur est âgé de 2 à 10 ans. Pour les contacts plus vieux, on peut utiliser soit MenactraMC soit MenomuneMD , à moins que le contact ne nécessite probablement une pro- tection de longue durée ou doive recevoir le vaccin antiméningococcique dans l'avenir, auquel cas MenactraMC est privilégié.
Le CCNI estime qu'il existe des preuves acceptables pour recommander l'utilisation de MenactraMC chez les personnes susmentionnées – fermeté de la recommandation : B (tableau 5). Comme MenactraMC n'a pas été étudié expressément chez les contacts étroits, le niveau de preuve a été établi à III.
- Lutte contre les éclosions causées par les sérogroupes A, C, Y ou W135. Il est important de consulter les autorités sanitaires ou des experts dans le domaine des maladies transmissibles pour évaluer et maîtriser les éclosions de méningococcie dans divers milieux. De plus, il convient de se reporter aux lignes directrices publiées49.
- Pour lutter contre les éclosions causées par le sérogroupe C, le vaccin conjugué contre le méningocoque du sérogroupe C est privilégié, à moins qu'une protection contre davantage de sérogroupes ne soit indiquée.
- Pour lutter contre les éclosions causées par les sérogroupes A, Y ou W135, MenactraMC est privilégié.
Le CCNI estime qu'il existe des preuves acceptables pour recommander l'utilisation de MenactraMC dans les situations susmentionnées – fermeté de la recommandation : B (tableau 5). Comme MenactraMC n'a pas été étudié expressément pour la lutte contre les éclosions, le niveau de preuve a été établi à III.
Les personnes infectées par le virus de l'immunodéficience humaine (VIH) présentent un risque probablement plus élevé de méningococcie50. Bien que l'efficacité de MenactraMC chez les personnes infectées par le VIH ne soit pas établie, le vaccin peut être envisagé pour ce groupe.
Le CCNI estime qu'il n'existe pas de preuves suffisantes pour formuler une recommandation concernant l'utilisation de MenactraMC chez les personnes infectées par le VIH – fermeté de la recommandation : I (tableau 5). Comme MenactraMC n'a pas été étudié expressément chez les personnes positives pour le VIH, le niveau de preuve a été établi à III.
En raison de l'efficacité prouvée des vaccins conjugués contre le méningocoque du sérogroupe C chez les enfants de 2 à 10 ans et de la possibilité d'une efficacité moindre de MenactraMC , une dose de vaccin conjugué contre le méningocoque du sérogroupe C est également indiquée pour les personnes à risque élevé, comme celles mentionnées ci‑dessus, qui sont âgées de 2 à 10 ans et qui reçoivent MenactraMC . Le vaccin conjugué contre le méningocoque du sérogroupe C et MenactraMC doivent être donnés à au moins 1 mois d'intervalle. MenactraMC , qui confère une protection contre un plus grand nombre de sérogroupes, devrait être administré le premier.
Le CCNI estime qu'il existe des preuves acceptables à l'appui de la recommandation qui précède – fermeté de la recommandation : B (tableau 5). Comme aucune étude n'a été menée pour évaluer la stratégie décrite ci‑dessus, le niveau de preuve a été établi à III.
Actuellement, MenactraMC n'est pas approuvé pour les enfants de < 2 ans. Il faudra réaliser d'autres études d'immunogénicité et d'innocuité dans ce groupe d'âge. MenactraMC devrait être administré aux enfants à risque élevé conformément à ce qui précède lorsque ces enfants atteindront l'âge de 2 ans.
Le CCNI estime qu'il existe des preuves acceptables pour déconseiller l'utilisation de MenactraMC chez les enfants de < 2 ans – fermeté de la recommandation : D (tableau 5). Comme MenactraMC n'a pas été étudié expressément chez les personnes de ce groupe d'âge, le niveau de preuve a été établi à III.
MenactraMC peut être considéré comme indiqué chez les adultes de ≥ 56 ans.
Le CCNI estime qu'il n'existe pas de preuves suffisantes pour formuler une recommandation concernant l'utilisation de MenactraMC chez les adultes de ≥ 56 ans – fermeté de la recommandation : I (tableau 5). Comme MenactraMC n'a pas été étudié expressément chez les personnes de ce groupe d'âge, le niveau de preuve a été établi à III.
Splénectomie : Lorsqu'une splénectomie chirurgicale non urgente est prévue, MenactraMC et tous les autres vaccins recommandés doivent être administrés au moins 2 semaines avant l'ablation de la rate, si possible. Si c'est impossible, comme dans le cas d'une splénectomie urgente, MenactraMC et les autres vaccins doivent être donnés 2 semaines après la splénectomie. Si le patient obtient son congé avant ce délai et qu'on croit possible qu'il ne revienne pas, le vaccin devrait être donné avant le congé51.
Conseils aux voyageurs : Les professionnels de la santé qui donnent des conseils aux voyageurs canadiens devraient se tenir au courant de l'activité méningococcique dans le monde. Le Comité consultatif de la médecine tropicale et de la médecine des voyages (CCMTMV) fournit des lignes directrices aux professionnels de la santé qui donnent des conseils sur la vaccination contre le méningocoque aux voyageurs canadiens qui se rendent à l'étranger. Au moment de décider si l'immunisation est nécessaire, il faut prendre particulièrement en considération la destination du voyageur, la nature et la durée de l'exposition ainsi que l'âge et l'état de santé du voyageur. De l'information à jour sur les éclosions de méningococcie peut être obtenue auprès du Programme de médecine des voyages de l'Agence de santé publique du Canada (http://www.phac-aspc.gc.ca/tmp-pmv/index_f.html) et auprès de l'Organisation mondiale de la Santé (OMS) (http://www.who.int/csr/don/archive/disease/meningococcal_disease/en/, en anglais seulement).
Contacts étroits : Les contacts étroits des personnes infectées par le méningocoque courent un risque accru de MI; le risque est le plus élevé chez les contacts familiaux. Il convient de déterminer le statut vaccinal des contacts étroits, notamment le type de vaccin antiméningococcique, le nombre de doses et l'âge au moment de la vaccination. La vaccination des contacts étroits réceptifs en plus d'une chimioprophylaxie, devrait être envisagée lorsque l'infection par le sérogroupe en cause est évitable par la vaccination, car elle pourrait diminuer davantage le risque de méningococcie ultérieure; la vaccination devrait être réalisée le plus tôt possible. Le risque accru de maladie chez les contacts familiaux persiste jusqu'à 1 an après l'apparition de la maladie chez le cas index et subsiste plus longtemps que la protection offerte par l'antibiothérapie prophylactique. En général, ce risque de longue durée n'est pas présent chez les autres contacts non exposés de façon continue.
Les personnes suivantes sont considérées comme des contacts étroits qui devraient recevoir un traitement immunoprophylactique et chimioprophylactique :
- contacts familiaux d'un cas;
- personnes qui partagent la même chambre que le cas;
- personnes dont le nez et la bouche sont directement contaminés par les sécrétions nasales ou buccales d'un sujet atteint (p. ex., baiser sur la bouche, partage de cigarettes ou de bouteilles);
- enfants et personnel dans les garderies et les prématernelles.
Les personnes suivantes sont des contacts étroits qui devraient recevoir uniquement un traitement chimioprophylactique (et non immunoprophylactique) :
- travailleurs de la santé qui ont eu des contacts intensifs non protégés (sans masque) avec des patients infectés (p. ex., lors d'une intubation, d'une réanimation ou d'un examen de près de l'oropharynx);
- passagers aériens assis directement à côté du cas (mais non séparés par une allée) si le temps total passé à bord de l'avion est d'au moins 8 heures.
Utilisation systématique : Dans la plupart des provinces et territoires, l'épidémiologie actuelle des sérogroupes A, Y et W135 ne justifie pas l'utilisation systématique de MenactraMC . En outre, l'association possible entre le SGB et MenactraMC exige que la surveillance se poursuive, et ce, parce que le SGB est potentiellement une affection grave et que les événements indésirables associés à un vaccin en particulier pourraient miner la confiance de la population à l'égard de tous les vaccins.
Le CCNI estime qu'il n'existe pas de preuves suffisantes pour formuler une recommandation concernant l'utilisation systématique de MenactraMC - fermeté de la recommandation : I (tableau 5). Cette recommandation pourrait devoir être revue à la lumière des nouvelles données. Comme les preuves disponibles proviennent d'études d'immunogénicité menées chez des personnes en bonne santé, le niveau de preuve a été établi à II-2. Une étude publiée semble confirmer une possible association entre le SGB et MenactraMC chez les adolescents de 11 à 19 ans, et le niveau de preuve relatif à l'association dans ce groupe d'âge a donc été établi à II‑3.
Les recommandations relatives à l'utilisation de MenactraMC pourraient changer dans l'avenir en fonction des éléments suivants :
- résultats de la surveillance continue concernant l'association entre MenactraMC et le SGB;
- hausse de l'incidence de la MI de sérogroupes A, Y ou W135;
- nécessité d'administrer des doses de rappel de vaccin antiméningococcique aux adolescents qui ont reçu le vaccin conjugué contre le méningocoque du sérogroupe C durant l'enfance.
Il sera nécessaire d'exercer une surveillance attentive des paramètres susmentionnés pour déterminer adéquatement l'utilisation de MenactraMC dans l'avenir.
Un résumé des recommandations relatives au vaccin contre le méningocoque par groupe d'âge et catégorie de risque est présenté au tableau 6.
Tableau 6. Résumé des recommandations relatives au vaccin contre le méningocoque par groupe d'âge et catégorie de risque.
| Catégorie de risque |
0 à < 2 ans |
2 à 10 ans |
11 à 24 ans |
25 à 55 ans |
≥ 56 ans |
| Risque élevé |
Vaccin conjugué contre le sérogroupe |
MenactraMC suivi d'un vaccin conjugué contre le sérogroupe C 1mois plus tard |
MenactraMC |
MenactraMC |
MenactraMC ou MenomuneMD |
| Utilisation systématique |
Vaccin conjugué contre le sérogroupeC |
Vaccin conjugué contre le sérogroupeC |
Vaccin conjugué contre le sérogroupeC à moins que l'épidémiologie locale ne justifie l'utilisation de MenactraMC |
Non recommandé |
Non |
Administration simultanée d'autres vaccins
Si le dT et MenactraMC sont tous deux nécessaires, il est peut-être préférable de les administrer en concomitance, l'immunogénicité étant alors meilleure que lorsque MenactraMC est administré après le dT. Rien ne permet d'affirmer que l'immunogénicité sera également meilleure lorsque MenactraMC et d'autres vaccins renfermant le dT, comme le dcaT, seront administrés en concomitance.
Le CCNI estime qu'il n'existe pas de preuves suffisantes pour formuler une recommandation concernant l'utilisation de MenactraMC dans les situations susmentionnées – fermeté de la recommandation : I (tableau 5). Comme MenactraMC n'a pas été étudié expressément avec le dcaT, le niveau de preuve a été établi à III.
Priorités recommandées pour la recherche
Les recherches visant à trouver des réponses aux questions qui demeurent aideront à formuler d'autres recommandations concernant l'utilisation de MenactraMC , ces questions étant les suivantes :
- relation entre MenactraMC et le SGB;
- efficacité de MenactraMC et durée de la protection qu'il confère;
- comparaison entre l'immunogénicité de MenactraMC et celle des vaccins conjugués contre le méningocoque du sérogroupe C;
- impact de MenactraMC sur le portage du méningocoque et l'immunité collective;
- innocuité, immunogénicité et efficacité de MenactraMC chez les enfants de < 2 ans et les adultes de ≥ 56 ans;
- innocuité, immunogénicité et efficacité de MenactraMC dans certains groupes à risque élevé tels que les personnes immunodéprimées;
- innocuité et immunogénicité associées à l'administration concomitante de MenactraMC et d'autres vaccins tels que le dcaT et les vaccins contre le virus du papillome humain, l'hépatite A et l'hépatite B;
- innocuité et immunogénicité associées à l'administration de MenactraMC suivie de celle du dcaT ou du dT.
Références
Varughese PV, Carter AO. Maladies méningococcique au Canada. Synthèse de la surveillance jusqu'en 1987. RHMC 1989;15:89-96.
Whalen CM, Hockin JC, Ryan A et al. The changing epidemiology of invasive meningococcal disease in Canada, 1985 through 1992: Emergence of a virulent clone of Neisseria meningitidis. JAMA 1995;273:390-94.
Squires SG, Deeks SL, Tsang RSW. Surveillance accrue des méningococcies invasives au Canada: du 1er janvier 1999 au 31 décembre 2001. RMTC 2004;30:17-28.
De Wals P, Coudeville L, Trottier P et al. Vaccinating adolescents against meningococcal disease in Canada: A cost-effectiveness analysis. (Submitted for publication) 2007.
Lebel MH, Tapeiro BF, Saintonge F. Immunogenicity of bivalent AC polysaccharide meningococcal vaccine in children aged 6 through 24 months. JAMA 2001;285:1578-79.
De Wals P, De Serres G, Niyonsenga T. Effectiveness of a mass immunization campaign against serogroup C meningococcal disease in Quebec. JAMA 2001;285:177-81.
Lepow ML, Goldschneider I, Gold R et al. Persistence of antibody following immunization of children with group A and C meningococcal polysaccharide vaccines. Pediatrics 1977;60:673-80.
MacDonald NE, Halperin SA, Law BJ et al. Induction of immunologic memory by conjugated vs plain meningococcal C polysaccharide vaccine in toddlers: A randomized controlled trial. JAMA 1998;280:1685-89.
Comité consultatif national de l'immunisation (CCNI). Vaccin contre le méningocoque. Dans : Guide canadien d'immunisation, 7e éd. Ottawa : Agence de santé publique du Canada. 2007: 279-93.
Hassan-King MKA, Wall RA, Greenwood BM. Meningococcal carriage, meningococcal disease and vaccination. J Infect 1988;16:55-9.
De Wals P, Erickson L. Economic analysis of the 1992-1993 mass immuniza- tion campaign against serogroup C meningococcal disease in Quebec. Vaccine 2002;20:2840-44.
Granoff DM, Gupta RK, Belshe RB et coll. Induction of immunologic refractoriness in adults by meningococcal C polysaccharide vaccination. J Infect Dis 1998;178:870-4.
Richmond P, Kaczmarski E, Burrow R et coll. Meningococcal C polysaccharide vaccine induces immunologic hyporesponsiveness in adults that is overcome by meningococcal C conjugate vaccine. J Infect Dis 2000;181:761-4.
De Wals P, Deceuninck G, De Serres G et coll. Effectiveness of serogroup C meningococcal polysaccharide vaccine: Results from a case-control study in Quebec. Clin Infect Dis 2005;40:1116-22.
Harris S, Finn A, Granoff DM. Disparity in functional activity between serum anticapsular antibodies induced in adults by immunization with an investigational group A and C Neisseria meningitidis-diphtheria toxoid conjugate vaccine and by a polysaccharide vaccine. Infect Immun 2003;71:3402-8.
MacLennan JM, Shackley F, Heath PT et coll. Safety, immunogenicity, and induction of immunologic memory by a serogroup C meningococcal conjugate vaccine in infants: A randomized controlled. JAMA 2000;283:2795-801.
Kelly DF, Snape MD, Cutterbuck EA et coll. CRM197-conjugated serogroup C meningococcal capsular polysaccharide, but not the native polysaccharide, induces persistent antigen-specific memory B cells. Blood 2006;108:2642-7.
Maiden MCJ, Stuart JM. Carriage of serogroup C meningococci 1 year after meningococcal C conjugate polysaccharide vaccination. Lancet 2002;359:1829-30.
Ramsay ME, Andrew NJ, Trotter CL et coll. Herd immunity from meningococcal serogroup C conjugate vaccination in England: Database analysis. BMJ 2003;326:365-6.
Borrow R, Goldblatt D, Andrews N et coll. Influence of prior meningococcal C polysaccharide vaccination on the response and generation of memory after menin- gococcal C conjugate vaccination in young children. J Infect Dis 2001;184:377-80.
McVernon J, MacLennan J, Buttery J et coll. Safety and immunogenicity of meningococcus serogroup C conjugate vaccine administered as a primary or booster vaccination to healthy four-year-old children. Pediatr Infect Dis J 2002;21:747-53.
Jódar L, Griffiths E, Feavers I. Scientific challenges for the quality control and production of group C meningococcal conjugate vaccines. Vaccine 2004;22:1047-53.
Rennels M, King J, Ryall R et coll. Dosage escalation, safety and immunogenicity study of four dosages of a tetravalent meningococcal polysaccharide diphtheria toxoid conjugate vaccine in infants. Ped Infect Dis J 004;23:429-35.
Rennels M, King J, Ryall R et coll. Dose escalation, safety and immunogenicity study of a tetravalent meningococcal polysaccharide diphtheria conjugate vaccine in toddlers. Ped Infect Dis J 2002;21:978-9.
Campbell JD, Edelman R, King JC et coll. Safety, reactogenicity and immunoge- nicity of a tetravalent meningococcal polysaccharide-diphtheria toxoid conjugate vaccine given to healthy adults. J Infect Dis 2002;186:1848-51.
Snape MD, Pollard AJ. Meningococcal polysaccharide-protein conjugate vaccines. Lancet Infect Dis 2005;5:21-30.
Goldschneider I, Gotschlich EC, Artenstein MS. Human immunity to the meningococcus. I. The role of humoral antibodies. J Exp Med 1969;129:1307-26.
Borrow R, Balmer P, Miller E. Meningococcal surrogates of protection – serum bactericidal antibody activity. Vaccine 2005;23:2222-7.
World Health Organization. Requirements for meningococcal polysaccharide vaccine. Geneva: World Health Organization; 1976. Report No. 594.
De Wals P, Deceuninck G, Boulianne N et coll. Effectiveness of a mass immunization using serogroup C meningococcal conjugate vaccine. JAMA 2004;292:2491-94.
Trotter CL, Andrews NJ, Kaczmarski EB et coll. Effectiveness of meningococcal serogroup C conjugate vaccine 4 years after introduction. Lancet 2004;364:365-7.
Larrauri A, Cano R, Garcia M et coll. Impact and effectiveness of meningococcal C conjugate vaccine following its introduction in Spain. Vaccine 2005;23:4097-100.
Borrow R, Goldblatt D, Andrews N et coll. Antibody persistence and immunological memory at age 4 years after meningococcal group C conjugate vaccination in children in the United Kingdom. J Infect Dis 2002;186:1353-7.
Meningococcal infection – meningococcal meningitis. In: Heymann DL, eds. Control of communicable disease manual, 18th ed. Washington: American Public Health Association, 2004:359-66.
De Wals P, Trottier P, Pepin J. Relative efficacy of different immunization schedules for the prevention of serogroup C meningococcal disease: A model-based evaluation. Vaccine 2006;24:3500-4.
Sanofi pasteur Limited. Menactra™ product monograph. Toronto, Ont.: sanofi pasteur Limited; 2006.
Pichichero M, Casey J, Blatter M et coll. Comparative trial of the safety and immunogenicity of quadrivalent (A, C, Y, W-135) meningococcal polysaccharide- diphtheria conjugate vaccine versus quadrivalent polysaccharide vaccine in two- to ten-year-old children. Ped Infect Dis J 2005;24:57-62.
US Food and Drug Administration. Product approval information , – licensing action. URL: < http://www.fda.gov/cber/products/mpdtave011405.htm >. Rockville, MD: US Food and Drug Administration, Center for Biologics Evaluation and Research, 2005.
Keyserling H, Papa T, Koranyi K et coll. Safety, immunogenicity, and immune memory of a novel meningococcal (groups A, C, Y, and W-135) polysaccharide diphtheria toxoid conjugate vaccine (MCV-4) in healthy adolescents. Arch Pediatr Adolesc Med 2005;159:907-13.
Granoff DM, Harris SL. Protective activity of group C anticapsular antibodies elicited in two-year-olds by an investigational quadrivalent Neisseria meningitidis-diphtheria toxoid conjugate vaccine. Pediatr Infect Dis J 2004;23:490-97.
Granoff DM, Morgan A, Welsch J. Persistence of group C anticapsular antibodies two to three years after immunization with an investigational quadrivalent Neisseria meningitidis-diphtheria toxoid conjugate vaccine. Pediatr Infect Dis J 2005;24:132-36.
Granoff DM, Morgan A, Welsch J. Immunogenicity of an investigational quadrivalent Neisseria meningitidis-diphtheria toxoid conjugate vaccine in 2-year old children. Vaccine 2005;23:4307-14.
El Bashir H, Heath PT, Papa T et coll. Antibody responses to meningococcal (groups A, C, Y and W135) polysaccharide diphtheria toxoid conjugate vaccine in children who previously received meningococcal C conjugate vaccine. Vaccine 2006;24:2544-49.
Centers for Disease Prevention and Control. Inadvertent misadministration of meningococcal conjugate vaccine – United States, June-August 2005. MMWR 2006;55:1016-7.
Comité consultatif national de l'immunisation (CCNI). Méthodes d'administration des caccins. Dans : Guide canadien d'immunisation, 7e éd, Ottawa : Agence de santé publique du Canada. 2007:39-46.
Centers for Disease Prevention and Control. Update: Guillain-Barre syndrome among recipients of Menactra meningococcal conjugate vaccine – United States, June 2005-September 2006. MMWR 2006;55:1120-4.
Canadian Task Force on the Periodic Health Examination. New grades for recommendations from the Canadian Task Force on Preventive Health Care. Can Med Assoc J 2003;169:207-8.
Canadian Task Force on the Periodic Health Examination. The Canadian guide to clinical preventive health care. Ottawa: Minister of Supply and Services Canada, 1994. Cat. no. H21-117/1994E.
Agence de la santé publique du Canada. Lignes directrices pour la prévention et la lutte contre les atteintes méningococciques. RMTC 2005;31(SI):1-21.
Stephens DS, Hajjeh RA, Baughman WS et coll. Sporadic meningococcal disease in adults: Results of a 5-year population-based study. Ann Intern Med 1995;123:937-40.
Comité consultatif national de l'immunisation (CCNI). Immunisation des sujets immunodéprimés. Dans : Guide canadien d'immunisation, 7e éd. Ottawa : Agence de santé publique du Canada, 2007:127-42
* Membres : Dre M. Naus (présidente), Dre S. Deeks (secrétaire administrative), Dr K. Laupland, Dr S. Dobson, Dr B. Duval, Dre J. Embree, Mme A. Hanrahan, Dre J. Langley, Dre A. McGeer, Dre S. McNeil, Dre M.-N. Primeau, Dr B. Tan, Dre B.Warshawsky.
Représentants de liaison : Mme S. Callery (CHICA), Dr J. Carsley (ACSP), Dr J. Smith (CDC),
Dre D. Money (SOGC), Mme E. Holmes (CNCI), Dr B. Larke (CMCH), Dre B. Law (CCEC),
Dre M. Salvadori (SCP), Dre S. Rechner (CMFC), Dr J. Salzman (CCMTMV), Dr D. Scheifele (CAIRE), Dre P. Orr (AMMI Canada).
Membres d'office : Dr H. Rode (DPBTG), Dr M. Lem (DGSPNI), Dr J.W. Anderson (MDN).
††La présente déclaration a été rédigée par Bryna Warshawsky, Philippe De Wals, Shelley Deeks et Christine Navarro; elle a été approuvée par le CCNI et l'Agence de la santé publique du Canada.
Détails de la page
- Date de modification :
