Dernières nouvelles sur le CCNI : vaccins conjugués quadrivalents contre le méningocoque


Téléchargez cet article en format PDF (1,05 Mo - 43 pages)
Publié par : L'Agence de la santé publique du Canada
Numéro : Volume 39 DCC-1
Date de publication : janvier 2013
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 39 DCC-1, janvier 2013
Une déclaration d’un comité consultatif (DCC)
Comité consultatif national de l’immunisation (CCNI)†
Mise à jour sur l'utilisation des vaccins conjugués quadrivalents contre le méningocoque
Contributeurs
Membres : Dre J. Langley (présidente), Dre B. Warshawsky (vice-présidente), Dre S. Ismail (secrétaire exécutive), Dre N. Crowcroft, Mme A. Hanrahan, Dre B. Henry, Dre D. Kumar, Dre S. McNeil, Dr B. Seifert, Dre C. Quach-Thanh, Dre D. Skowronski, Dr C. Cooper, Dre W. Vaudry, Dr R. Warrington.
Représentants de liaison : Dre B. Bell (Centers for Disease Control and Prevention, U.S.), Dr J. Brophy (Association canadienne pour la recherche et l'évaluation en immunisation), Dre A. Mawle (Centers for Disease Control and Prevention), Dr H. Morrison (Conseil des médecins hygiénistes en chef), Mme S. Pelletier (Association pour la prévention des infections à l'hôpital et dans la collectivité), Mme K. Pielak (Coalition canadienne des infirmières et infirmiers pour l'immunisation), Dr P. Plourde (Comité consultatif de la médecine tropicale et de la médecine des voyages), Dre S. Rechner (Collège des médecins de famille du Canada), Dre M. Salvadori (Société canadienne de pédiatrie), Dre V. Senikas (Société des obstétriciens et gynécologues du Canada), Dre N. Sicard (Association canadienne de santé publique), Dr P. Van Buynder (Conseil des médecins hygiénistes en chef), Dre P. Orr (Association pour la microbiologie médicale et l'infectiologie).
Représentants d'office : Mme M. FarhangMehr (Centre de l'immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada), Dre S. Desai (Centre de l'immunisation et des maladies respiratoires infectieuses, ASPC), Dre B. Law (Centre de l'immunisation et des maladies respiratoires infectieuses, ASPC), Lcol (Dr) J. Anderson (Ministère de la Défense nationale), Dre E. Farzad (Direction générale de la santé des Premières nations et des Inuits, Santé Canada), Dr F. Hindieh (Direction des produits biologiques et des thérapies génétiques, Santé Canada), Dre J. A. Laroche (Centre de l'immunisation et des maladies respiratoires infectieuses, ASPC), Dr P. Varughese (Centre de l'immunisation et des maladies respiratoires infectieuses, ASPC), Dre J. Xiong (Direction des produits biologiques et des thérapies génétiques, Santé Canada), Dr R. Pless (Centre de l'immunisation et des maladies respiratoires infectieuses).
DOI
https://doi.org/10.14745/ccdr.v39i00a01f
Préambule
Le Comité consultatif national de l'immunisation (CCNI) donne à l'Agence de la santé publique du Canada (ASPC) des conseils constants et à jour liés à l'immunisation dans le domaine de la médecine, des sciences et de la santé publique. L'ASPC reconnaît que les conseils et recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes et diffuse ce document à des fins d'information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la ou des monographies pertinentes sur le produit. Les recommandations d'utilisation et autres renseignements qui figurent dans le présent document peuvent différer du contenu des monographies de produit établies par les fabricants du vaccin au Canada. Les fabricants ont fait approuver les vaccins et démontré leur innocuité et leur efficacité uniquement lorsqu'ils sont utilisés conformément à la monographie du produit. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, et notamment déclarer chaque année les conflits d'intérêts possibles.
Table des matières
- Sommaire de l'information contenue dans la présente déclaration du CCNI
- I. Introduction
- II. Méthodes
- III. Épidémiologie de la méningococcie invasive au Canada
- IV. Vaccin
- IV.1 Calendriers d'administration des vaccins conjugués contre le méningocoque utilisés au Canada
- IV.2 Description et composition de Men-C-ACYW-135-CRM (MenveoMD)
- IV.3 Efficacité théorique et réelle de Men-C-ACYW-135-CRM (MenveoMD) and Men-C-ACYW-135-D (MenactraMD)
- IV.4 Corrélats immunologiques de la protection
- IV.5 Immunogénicité de Men-C-ACYW-135-CRM (MenveoMD)
- IV.6 Calendrier, posologie et voie d'administration de Men-C-ACYW-135-CRM (MenveoMD)
- IV.7 Doses de rappel et revaccination
- IV.8 Tests sérologiques
- IV.9 Conditions d'entreposage de Men-C-ACYW-135-CRM (MenveoMD)
- IV.10 Administration simultanée d'autres vaccins
- IV.11 Innocuité et effets secondaires des vaccins
- IV.12 Contre –indications et précautions dans le cas de Men-C-ACYW-135-CRM (MenveoMD)
- IV.13 Interchangeabilité des vaccins contre le méningocoque
- V. Recommandations
- VI. Priorité en matière de recherche
- VII. Priorité en matière de surveillance
- Liste d'abréviations
- Tableaux
- Références
Sommaire de l'information contenue dans la présente déclaration du CCNI
Le tableau suivant met en relief des informations clés pour les vaccinateurs. Veuillez-vous reporter au reste de la Déclaration pour plus de détails.
Table 1: Sommaire de l'information contenue dans la présente declaration du CCNI
1. Quoi
Qu'est-ce que la méningococcie?
La méningococcie se présente habituellement comme une maladie fébrile aiguë d'apparition soudaine. Elle se caractérise par une méningite ou une septicémie (méningococcémie), ou les deux, et une éruption caractéristique qui ne blanchit pas à la pression. La mortalité globale s'élève à environ 10 %, et de 10 à 20 % des survivants souffrent de séquelles de longue durée, notamment la perte auditive, des troubles neurologiques et l'amputation de doigts ou de membres. En 2007, 229 cas de méningococcie ont été signalés au Canada, la majorité d'entre eux (131 cas) étant dus au sérogroupe B, qui est le plus répandu chez les nourrissons. Il n'existe actuellement aucun vaccin contre la maladie due au sérogroupe B au Canada. Les taux de méningococcie causée par le sérogroupe C ont diminué grâce aux programmes de vaccination; en 2007, le nombre de cas attribuables au sérogroupe Y a légèrement dépassé le nombre de cas infectés par le sérogroupe C (30 cas du sérogroupe C et 35 cas du sérogroupe Y). L'âge médian des personnes atteintes est plus élevé pour le sérogroupe Y (46 ans) que pour les sérogroupes C et W135. Il y a très peu de cas de maladie due au sérogroupe A au Canada.
En quoi consistent les vaccins conjugués contre le méningocoque?
Les vaccins conjugués monovalents contre le méningocoque du groupe C sont offerts au Canada depuis 2001. Un vaccin antiméningococcique quadrivalent (sérogroupes A, C, Y et W135) conjugué à l'anatoxine diphtérique (MenactraMD– sanofi pasteur) a été approuvé en 2006 pour les personnes âgées de 2 à 55 ans. Un deuxième vaccin conjugué quadrivalent contre le méningocoque (MenveoMD – Novartis Vaccines Inc.) a été autorisé en mai 2010 pour les personnes de 11 à 55 ans et, en juin 2011, cette autorisation a été étendue pour inclure les enfants de 2 à 10 ans. MenveoMD contient les sérogroupes A (10 μg), C (5 μg), W135 (5 μg) et Y (5 μg), chaque sérogroupe étant conjugué individuellement à CRM197, une protéine variante de l'anatoxine diphtérique, qui sert de vecteur protéique. La présente déclaration fournit des renseignements sur l'immunogénicité, l'innocuité et les indications de ce nouveau vaccin. On y met également à jour l'information sur l'efficacité et l'innocuité de MenactraMD et son usage concomitant avec d'autres vaccins chez les adolescents.
2. Qui
Personnes à vacciner?
MenveoMD est indiqué chez les personnes âgées de 2 à 55 ans. Son utilisation peut également être envisagée chez les personnes ≥ 56 ans. Les données sur l'immunogénicité et l'innocuité montrent que MenveoMD peut être utilisé chez les nourrissons dès l'âge de 2 mois, même s'il n'est pas encore approuvé pour ce groupe d'âge.
Dans la présente déclaration, le CCNI recommande l'utilisation des vaccins conjugués contre le méningocoque de la façon suivante :
1. Adolescents :
- En plus du vaccin conjugué systématique contre le méningocoque du groupe C pour les nourrissons et/ou les jeunes enfants, le CCNI recommande l'administration systématique d'un vaccin conjugué contre le méningocoque chez les adolescents vers l'âge de 12 ans. Si l'on choisit d'administrer aux adolescents un vaccin conjugué quadrivalent, MenactraMD ou MenveoMD peuvent être utilisés (Recommandation du CCNI de catégorie B).
2. Personnes à risque élevé :
- Le CCNI recommande l'administration d'un vaccin conjugué quadrivalent contre le méningocoque chez les personnes à risque élevé (Recommandation du CCNI de catégorie B)
- Personnes présentant une asplénie anatomique ou fonctionnelle (y compris une anémie falciforme);
- Personnes qui souffrent d'un déficit en complément, en properdine, en facteur D ou un déficit en anticorps primaires;
- Personnes présentant un déficit en complément acquis (p. ex. personnes recevant de l'éculizumab [SolirisMD ]) ;
- Voyageurs pour qui le vaccin contre le méningocoque est recommandé (ceinture de méningite de l'Afrique subsaharienne) ou requis (pèlerins qui se rendent à La Mecque durant le hadj);
- Employés de laboratoires de recherche, de laboratoires industriels ou de laboratoires cliniques fréquemment exposés à N. meningitidis;
- Membres du personnel militaire pendant la formation des recrues et certains déploiements. Selon le CCNI, on devrait également envisager l'administration d'un vaccin conjugué quadrivalent contre le méningocoque aux personnes infectées par le VIH.
- Pour les personnes à risque élevé âgées de 2 ans et plus, utiliser soit MenactraMD ou MenveoMD (Recommandation du CCNI de catégorie B). On recommande l'administration de deux doses à huit semaines d'intervalle pour les personnes faisant partie du groupe à risque élevé susmentionné en raison de problèmes médicaux sous-jacents (asplénie; déficit en complément, en properdine, en facteur D ou en anticorps primaires; ou VIH). Des doses de rappel sont recommandées, selon les directives de la présente déclaration, pour les personnes qui sont à risque continu en raison de problèmes médicaux sous-jacents ou d'une exposition.
- Pour les personnes à risque élevé âgées de moins de 2 ans et selon les données publiées, MenveoMD est le vaccin conjugué quadrivalent contre le méningocoque qui devrait être utilisé. (Recommandation du CCNI de catégorie B). Les calendriers possibles sont fournis dans la présente déclaration.
- Pour les personnes qui ne reçoivent qu'une dose du vaccin quadrivalent contre le méningocoque (p. ex. voyageurs) et qui sont âgées de 2 à 10 ans, le vaccin conjugué monovalent contre le méningocoque du groupe C prévu au calendrier devrait avoir déjà été administré; sinon, il devrait être administré au moins un mois après le vaccin conjugué quadrivalent.
3. Contacts étroits et éclosions :
- Sérogroupe C :
- Pour les personnes de 11 ans et plus, utiliser soit un vaccin conjugué monovalent contre le méningocoque du groupe C ou un des vaccins conjugués quadrivalents disponibles.
- Pour les enfants de moins de 11 ans, utiliser un vaccin conjugué monovalent contre le méningocoque du groupe C (Recommandation du CCNI de catégorie A).
- Sérogroupes A, W135 et Y :
- Utiliser un vaccin conjugué quadrivalent contre le méningocoque.
- Pour les personnes de 2 ans et plus, utiliser soit MenactraMD ou MenveoMD (Recommandation du CCNI de catégorie A).
- Pour les enfants de moins de 2 ans, utiliser seulement MenveoMD (Recommandation du CCNI de catégorie B). Les calendriers possibles pour les nourrissons et les jeunes enfants sont fournis dans la présente déclaration.
Pour les personnes déjà vaccinées qui sont maintenant en contact étroit ou pendant les éclosions, la revaccination selon les directives suivantes est recommandée d'après l'opinion d'experts :
- Les personnes ayant déjà été vaccinées avec un sérogroupe n'étant pas le même que le cas de référence ou la souche à l'origine de l'éclosion devraient recevoir immédiatement le vaccin approprié (comme indiqué ci-dessus);
- Les personnes ayant déjà été vaccinées avec un sérogroupe qui est le même que le cas de référence ou la souche à l'origine de l'éclosion devraient être revaccinées avec le vaccin approprié (comme indiqué ci-dessus) :
- si elles avaient moins d'un an au moment du dernier vaccin contre le méningocoque et si plus de quatre semaines se sont écoulées depuis l'administration du dernier vaccin contre le méningocoque;
- si elles présentent un problème médical sous-jacent les mettant à risque de contracter la méningococcie et si plus de quatre semaines se sont écoulées depuis l'administration du dernier vaccin contre le méningocoque;
- si plus d'une année s'est écoulée depuis le dernier vaccin contre le méningocoque si elles avaient plus d'un an au moment du dernier vaccin contre le méningocoque et aucun problème médical sous-jacent les mettant à risque de contracter une méningococcie.
3. Comment
Administration de MenveoMD :
- Chez les sujets de 2 à 55 ans, MenveoMD est administrée à raison d'une dose de 0,5 mL par voie intramusculaire.
- Le produit est reconstitué en mélangeant le liquide (contenant les sérogroupes C, W135 et Y) avec la poudre lyophilisée (renfermant le sérogroupe A). Le produit reconstitué devrait être utilisé immédiatement, mais peut se conserver à 25 ºC ou moins pendant au maximum 2 heures.
Contre‑indications de MenveoMD :
Antécédents de réaction anaphylactique à une dose antérieure du vaccin antiméningococcique, à un vaccin qui contient l'anatoxine diphtérique ou la protéine CRM197, ou à tout autre composant de MenveoMD.
Précautions dans le cas de MenveoMD : MenveoMD n'a pas été étudié chez les femmes enceintes; son emploi peut être envisagé lorsque les avantages l'emportent sur les risques. Des antécédents de SGB ne sont pas considérés comme un appel à la prudence lorsqu'on administre MenactraMDou MenveoMD. Une maladie fébrile aiguë grave justifie le report de la vaccination jusqu'à la disparition des symptômes.
Administration simultanée d'autres vaccins : MenactraMD ou MenveoMD peuvent être administrés en même temps que d'autres vaccins pour adultes et adolescents adaptés à l'âge. Une réponse immunitaire plus faible contre les antigènes coquelucheux a été observée lorsque le dcaT a été administré en même temps que MenveoMD; la réponse immunitaire la plus forte aux antigènes de la coqueluche a été obtenue lorsque le dcaT a été administré un mois après MenveoMD. MenveoMD a été étudié en association avec de nombreux vaccins administrés systématiquement aux enfants, et aucune interférence immunologique n'a été relevée. L'administration concomitante de MenveoMD avec le vaccin conjugué 13-valent contre le pneumocoque mérite d'être étudiée plus à fond.
Revaccination : En se basant sur l'opinion d'experts, le CCNI recommande le calendrier de revaccination suivant pour les personnes présentant un risque élevé en raison d'une exposition continue ou récurrente possible à la méningococcie (employés de laboratoires de recherche, de laboratoires industriels et cliniques qui peuvent être couramment exposés à N. meningitidis; pour les voyageurs qui demeurent ou retournent à des endroits où le vaccin contre le méningocoque est recommandé), et pour les personnes présentant un risque élevé en raison de problèmes médicaux sous-jacents (asplénie; déficit en complément, en properdine, en facteur D ou en anticorps primaires; ou VIH) :
- Pour les personnes ayant été vaccinées à 6 ans ou moins : donner une dose de rappel de 3 à 5 ans après la dernière dose, suivie d'une autre tous les 5 ans.
- Pour les personnes ayant été vaccinées à 7 ans ou plus : donner une dose de rappel 5 ans après la dernière dose, suivie d'une autre tous les 5 ans.
- Les voyageurs ayant l'intention de participer au hadj devraient vérifier les recommandations concernant la revaccination à l'adresse Ministry of Hajj - Kingdom of Saudi Arabia, car une revaccination plus fréquente pourrait être exigée.
Un vaccin conjugué quadrivalent contre le méningocoque devrait être utilisé pour la revaccination des groupes susmentionnés et, d'après l'opinion d'experts, tant Men-C-ACYW-135-D (MenactraMD) que Men-C-ACYW-135-CRM (MenveoMD) peuvent être administrés, peu importe le vaccin antiméningococcique reçu lors de la vaccination initiale.
Voir ci-haut pour des renseignements concernant la revaccination des personnes ayant été en contact étroit ou pendant une éclosion.
4. Pourquoi
« Conseils » sur lesquels les vaccinateurs doivent insister auprès des clients lorsqu'ils discutent des présentes recommandations
Le taux de mortalité associé à la MI est d'environ 10 %. Parmi les survivants, de 10 % à 20 % ont des séquelles à long terme, comme une perte auditive, des déficiences neurologiques et des amputations de membres ou de doigts. Par conséquent, la vaccination contre les MI appartenant à des sérogroupes évitables est importante pour les personnes présentant un risque plus élevé.
- MenactraMD et MenveoMD sont actuellement approuvés pour les personnes âgées de 2 à 55 ans. Ils se sont révélés immunogènes dans des essais cliniques auprès de sujets de 2 à 55 ans, et dans une étude sur MenveoMD, les sujets avaient jusqu'à 65 ans.
- Les études d'immunogénicité semblent indiquer que MenveoMD induit une bonne réponse chez les jeunes enfants et les nourrissons, plusieurs calendriers ayant été évalués.
- MenactraMD tout comme MenveoMD ont été étudiés en association avec plusieurs vaccins adaptés à l'âge qui ont été administrés en même temps.
Une étude menée aux É.-U. portant sur des sujets principalement âgés de 11 à 18 ans montre que MenactraMD a une efficacité d'environ 80 à 85 % dans les 3 à 4 années suivant son administration. Les résultats préliminaires d'une étude cas/témoins de MenactraMD ont révélé que celui‑ci avait un degré d'efficacité d'environ 78 %, qui diminuait avec le temps jusqu'à 5 ans suivant son administration. On ne dispose actuellement d'aucune donnée sur l'efficacité de MenveoMD, mais des données suivant l'homologation du vaccin devraient être accessibles à l'avenir.
Aucun problème important d'innocuité n'a été associé à MenactraMD ni à MenveoMD dans des essais cliniques. Deux études récentes effectuées aux États-Unis n'ont trouvé aucune association entre MenactraMD et le syndrome de Guillain-Barré.
I. Introduction
La présente déclaration vient compléter plusieurs déclarations antérieures sur les vaccins conjugués contre le méningocoqueNote en bas de page 1Note en bas de page 5, qui ont décrit l'utilisation des vaccins conjugués monovalents contre le méningocoque du groupe C et du seul vaccin conjugué quadrivalent auparavant accessible contre le méningocoque, Men‑C‑ACYW‑135‑D (MenactraMD). Dans cette déclaration, nous fournissons des renseignements et formulons des recommandations concernant l'utilisation d'un second vaccin conjugué quadrivalent contre le méningocoque, Men‑C‑ACYW‑135‑CRM (MenveoMD), produit par Novartis Vaccins Inc., qui a été approuvé au Canada en mai 2010 pour les personnes de 11 à 55 ans et dont l'usage a été étendu en juin 2011 pour inclure les enfants de 2 à 10 ans.
Dans la présente déclaration, nous :
- examinerons les recommandations existantes du Comité consultatif national de l'immunisation (CCNI) au sujet de l'utilisation des vaccins conjugués contre le méningocoque;
- mettrons à jour l'épidémiologie de la méningococcie au Canada en fournissant des données jusqu'en 2007, soit pour une année de plus que dans la déclaration antérieure du CCNINote en bas de page 5;
- offrirons une mise à jour sur les vaccins conjugués existants contre le méningocoque et les calendriers de vaccination utilisés au Canada;
- décrirons les indicateurs de l'immunogénicité à l'égard de la méningococcie invasive (MI);
- fournirons de l'information et des recommandations concernant l'utilisation du nouveau vaccin conjugué quadrivalent autorisé contre le méningocoque, Men‑C‑ACYW‑135‑CRM (MenveoMD);
- communiquerons des renseignements à jour sur l'innocuité ainsi que des données sur l'usage concomitant de Men-C-ACYW-135-D (MenactraMD) et d'autres vaccins;
- recommanderons deux doses ou plus du vaccin quadrivalent contre le méningocoque, selon l'âge, pour les personnes présentant un risque élevé de contracter une méningococcie en raison de problèmes médicaux sous-jacents;
- recommanderons la revaccination avec un vaccin conjugué quadrivalent contre le méningocoque pour les personnes présentant un risque continu en raison de problèmes médicaux sous-jacents, d'une exposition continue ou récurrente possible, ou ayant été en contact étroit avec un cas de MI ou pendant une éclosion.
I.1 Survol des recommandations antérieures du Comité consultatif national de l'immunisation relativement au vaccin conjugué contre le méningocoque
Depuis 2001, le CCNI recommande l'utilisation du vaccin conjugué contre le méningocoque du groupe C chez les nourrissons (enfants de moins de 1 an), les enfants de 1 à 4 ans, les adolescents et les jeunes adultes. Selon le CCNI, l'administration du vaccin devait aussi être envisagée chez les enfants âgés de plus de 5 ans qui n'ont pas encore atteint l'adolescence. Ce vaccin a également été recommandé pour protéger les contacts étroits de cas de MI causée par Neisseria meningitidis du groupe C et pour lutter contre les éclosions de MI due au sérogroupe C. Son administration pourrait être envisagée, en plus du vaccin quadrivalent polysaccharidique non conjugué, chez d'autres personnes à risque élevé de méningococcieNote en bas de page 1.
En mai 2007, le CCNI a recommandé l'utilisation du vaccin conjugué contre le méningocoque des groupes A, C, Y et W135 (Men‑C‑ACYW‑135‑D MenactraMD– sanofi pasteur) chez les personnes de 2 à 55 ans appartenant aux groupes à risque élevé suivants :
- personnes présentant une asplénie anatomique ou fonctionnelle;
- personnes présentant un déficit en complément, en properdine ou en facteur D;
- voyageurs pour qui le vaccin contre le méningocoque est indiqué ou requis, notamment les pèlerins qui se rendent à La Mecque durant le hadj;
- employés de laboratoires de recherche, de laboratoires industriels ou de laboratoires cliniques fréquemment exposés à N. meningitidis;
- recrues militaires.
De plus, le vaccin était recommandé pour protéger les contacts étroits des personnes atteintes d'une MI causée par les sérogroupes A, Y ou W135 et pour lutter contre les éclosions attribuables à ces sérogroupes. Le vaccin conjugué monovalent contre le méningocoque du groupe C a été recommandé pour protéger les contacts étroits de cas de MI due au sérogroupe C et pour lutter contre les éclosions de MI causée par le sérogroupe C. Le CCNI a également déclaré que le vaccin conjugué quadrivalent contre le méningocoque pourrait être envisagé chez les personnes à risque élevé, identifiées ci-dessus, qui sont âgées de 56 ans et plus, et aussi chez les personnes infectées par le VIH. Pour la vaccination systématique des adolescents âgés de 11 à 24 ans, le CCNI a recommandé le recours au vaccin conjugué contre le méningocoque du groupe C, à moins que les données épidémiologiques locales ne justifient l'utilisation du vaccin conjugué quadrivalentNote en bas de page 3.
En novembre 2007, le CCNI a recommandé qu'on administre aux bébés ayant reçu le vaccin conjugué contre le méningocoque du groupe C avant l'âge de 12 mois une dose de rappel au cours de la deuxième année de vie (à l'âge de 12 à 23 mois). Cette recommandation remplaçait l'ancienne prévoyant qu'une dose de la série primaire du vaccin conjugué contre le méningocoque du groupe C soit donnée après l'âge de 5 moisNote en bas de page 4.
Dans sa déclaration publiée en avril 2009, le CCNI a recommandé l'ajout d'une dose systématique du vaccin conjugué contre le méningocoque chez les adolescents, idéalement à l'âge de 12 ansNote en bas de page 5. Cette dose s'ajoutait à celle des vaccins conjugués contre le méningocoque administrée aux nourrissons ou aux tout-petits. On pouvait soit opter pour le vaccin conjugué monovalent contre le méningocoque du groupe C ou pour le vaccin conjugué quadrivalent. Le produit sélectionné devrait être déterminé par les provinces/territoires en fonction du fardeau de la maladie causée par les sérogroupes A, Y et W135, du coût et d'autres considérations liées aux programmes. La déclaration d'avril 2009 étendait également la liste de personnes jugées à risque élevé de MI et recommandait que les personnes atteintes d'un déficit en anticorps primaires reçoivent le vaccin conjugué quadrivalent contre le méningocoque.
II. Méthodes
Le CCNI a examiné le fardeau de la méningococcie causée par chaque sérogroupe ainsi que l'innocuité et l'immunogénicité du nouveau vaccin autorisé, Men‑C‑ACYW‑135‑CRM (MenveoMD), les calendriers vaccinaux au Canada et d'autres aspects de la stratégie globale d'immunisation. La synthèse des connaissances a été effectuée par le Groupe de travail sur le méningocoque. Après une évaluation critique de chacune des études, un tableau sommaire (Tableau 8) assorti de cotes de qualité des preuves s'inspirant de la hiérarchie méthodologique du CCNI (décrite dans les tableaux 9, 10 et 11) a été dressé, et des recommandations relatives à l'utilisation des vaccins ont été proposées. La présidente du Groupe de travail a présenté au CCNI les données probantes et les recommandations proposées le 2 février et le 2 juin 2010. Après un examen attentif des données et après consultation, les membres du CCNI se sont entendus sur certaines recommandations. Les considérations pertinentes, la justification des décisions prises et les lacunes dans les connaissances sont exposées dans le texte. L'ASPC tient à jour la mise par écrit relative à ces démarches tout au long de la synthèse des connaissances et de l'élaboration de recommandations.
III. Épidémiologie de la méningococcie au Canada
Les données épidémiologiques relatives au fardeau de la MI au Canada ont déjà été passées en revueNote en bas de page 5. Une année de données additionnelle (2007) a été incluse dans la figure et les tableaux présentés ci-dessous, qui résument les données épidémiologiques canadiennes sur la MI.
La figure 1 montre les tendances relatives à la MI au cours des dix dernières années (1998‑2007). L'introduction des programmes de vaccination des enfants contre le méningocoque du groupe C à partir de 2001 au Canada semble être associée à une diminution de l'incidence de la MI causée par le sérogroupe CNote en bas de page 6-Note en bas de page 8. Par contre, les taux de MI due aux sérogroupes A, Y et W-135 n'ont cessé d'augmenter, certaines fluctuations étant observées d'une année à l'autre. Entre 2004 et 2007, les taux de MI due au sérogroupe B ont crû progressivement. Depuis la baisse du nombre de cas dus au sérogroupe C, le sérogroupe B est devenu le principal responsable de MI chez les Canadiens. Il n'existe actuellement aucun vaccin au Canada pour prévenir la maladie causée par le sérogroupe B.
Le tableau 2 présente des données sur le nombre de cas et les taux de MI, par sérogroupe, en 2007, ainsi que les moyennes sur 10 ans; l'âge médian et les taux de létalité par sérogroupe sur une moyenne de 10 ans sont également inclus. Le nombre de cas de MI due au sérogroupe C est tombé à son plus bas niveau au cours des 10 dernières années, de sorte qu'en 2007 le nombre de cas signalés de maladie due au sérogroupe Y a légèrement dépassé celui des cas attribuables au sérogroupe C.
Le tableau 3 fournit de l'information sur le nombre de cas et les taux de MI par sérogroupe pour les provinces et territoires en 2007. Le tableau 4 contient des données similaires, dont la moyenne a été établie sur 10 ans pour la période 1998‑2007. Les tableaux indiquent que les taux de maladie due au sérogroupe B sont plus élevés au Québec qu'ailleurs au pays.
Le tableau 5 présente les nombres de cas et les taux de MI par groupe d'âge et par sérogroupe en 2007. L'incidence de la MI est la plus élevée chez les nourrissons de moins de un an (taux de 6,94 pour 100 000 en 2007), la majorité des cas étant dus au sérogroupe B. La tendance du sérogroupe Y à frapper des personnes plus âgées est également bien visible au tableau 5.
Figure 1: Taux d'incidence de la méningococcie invasive selon le sérogroupe et l'année, 1998-2007Note en bas de page 9
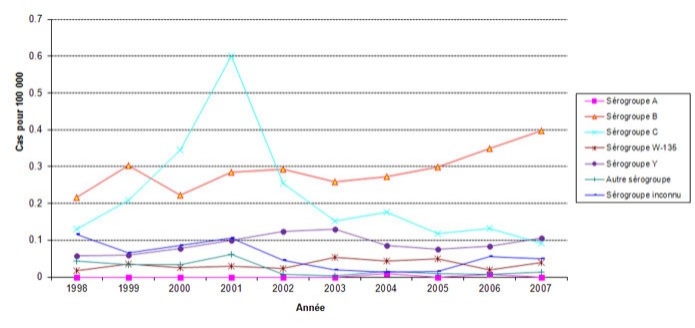
Équivalent textuel - Figure 1
| Année | Sérogroupe A | Sérogroupe B | Sérogroupe C | Sérogroupe W-135 | Sérogroupe Y | Autre sérogroupe | Sérogroupe inconnu | Tous les sérogroupes |
|---|---|---|---|---|---|---|---|---|
| 1998 | 0 | 0.21555174 | 0.129331044 | 0.016580903 | 0.05637507 | 0.043110348 | 0.116066321 | 0.577015426 |
| 1999 | 0 | 0.302618777 | 0.207228076 | 0.03618268 | 0.059208022 | 0.032893345 | 0.065786691 | 0.703917591 |
| 2000 | 0 | 0.221601376 | 0.345437439 | 0.02607075 | 0.07821225 | 0.032588438 | 0.084729938 | 0.788640192 |
| 2001 | 0 | 0.283696906 | 0.599632097 | 0.029014456 | 0.099938683 | 0.061252741 | 0.10638634 | 1.179921223 |
| 2002 | 0 | 0.293426706 | 0.255153657 | 0.022325945 | 0.124387408 | 0.006378841 | 0.04465189 | 0.746324448 |
| 2003 | 0 | 0.259168316 | 0.151708283 | 0.053730017 | 0.129584158 | 0.003160589 | 0.018963535 | 0.616314898 |
| 2004 | 0.009392412 | 0.272379958 | 0.175325031 | 0.043831258 | 0.084531711 | 0.015654021 | 0.012523216 | 0.613637607 |
| 2005 | 0 | 0.297718647 | 0.117846964 | 0.049619775 | 0.074429662 | 0.009303708 | 0.01550618 | 0.564424935 |
| 2006 | 0.006139475 | 0.349950089 | 0.131998718 | 0.018418426 | 0.082882916 | 0.006139475 | 0.055255277 | 0.650784376 |
| 2007 | 0 | 0.397816769 | 0.091103077 | 0.039478 | 0.106286923 | 0.012147077 | 0.048588308 | 0.695420154 |
| Sérogroupe | 2007 | 1998 – 2007 | ||||
|---|---|---|---|---|---|---|
| Nombre de cas | Incidence (cas de MI/100 000 habitants) | Nombre annuel moyen de cas (par an) (intervalle) |
Incidence annuelle moyenne (cas de MI/ 100 000 habitants) | Age median (ans) | Taux de létalitéTableau 2 - Note * | |
| A | 0 | 0.00 | 0.4 (0-3) | 0.00 | 62 | 0.00 |
| B | 131 | 0.40 | 91.5 (65-131) | 0.29 | 16 | 5.36 |
| C | 30 | 0.09 | 68.9 (30-182) | 0.22 | 20 | 13.79 |
| Y | 35 | 0.11 | 28.2 (17-41) | 0.09 | 46 | 5.65 |
| W135 | 13 | 0.04 | 10.6 (5-17) | 0.03 | 23 | 8.49 |
|
||||||
| Province/ territoire |
C.-B. | Alb. | Sask. | Man. | Ont. | Qc | N.-B. | N.-E. | Î.-P.-E. | T.-N.-L. | Yn | T.N.-O. | Nt | Totale |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Incidence (nombre de cas) |
0.70 (30) |
0.54 (19) |
0.70 (7) |
0.34 (4) |
0.48 (62) |
1.18 (91) |
0.54 (4) |
0.43 (4) |
0.72 (1) |
1.38 (7) |
0 (0) |
0 (0) |
0 (0) |
0.70 (229) |
| Sérogroupe A | 0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
| Sérogroupe B | 0.26 (11) |
0.31 (11) |
0.50 (5) |
0.08 (1) |
0.23 (30) |
0.86 (66) |
0.13 (1) |
0.32 (3) |
0 (0) |
0.59 (3) |
0 (0) |
0 (0) |
0 (0) |
0.40 (131) |
| Sérogroupe C | 0.16 (7) |
0 (0) |
0 (0) |
0 (0) |
0.09 (11) |
0.12 (9) |
0.27 (2) |
0 (0) |
0 (0) |
0.20 (1) |
0 (0) |
0 (0) |
0 (0) |
0.9 (30) |
| Sérogroupe Y | 0.19 (8) |
0.09 (3) |
0.2 (2) |
0.17 (2) |
0.12 (15) |
0.07 (5) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0.11 (35) |
| Sérogroupe W-135 | 0.05 (2) |
0.06 (2) |
0 (0) |
0.08 (1) |
0.02 (3) |
0.07 (5) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0.04 (13) |
| Autres Sérogroupes | 0 (0) |
0.06 (2) |
0 (0) |
0 (0) |
0.01 (1) |
0.01 (1) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
0.01 (4) |
| Sérogroupe Inconnu | 0.05 (2) |
0.03 (1) |
0 (0) |
0 (0) |
0.02 (2) |
0.05 (5) |
0.13 (1) |
0.11 (1) |
0.72 (1) |
0.59 (3) |
0 (0) |
0 (0) |
0 (0) |
0.04 (16) |
| Province/territoire | C.-B. | Alb. | Sask. | Man. | Ont. | Qc | N.-B. | N.-E. | Î.-P.-E. | T.-N.-L. | Yn | T.N.-O. | Nt | Canada |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Incidence moyenne (nombre moyen de cas) |
0.76 (31.1) |
0.95 (29.5) |
0.42 (4.2) |
0.67 (7.8) |
0.57 (68) |
0.90 (67.5) |
0.73 (5.5) |
0.49 (4.6) |
0.29 (0.4) |
0.92 (4.8) |
0.32 (0.1) |
1.17 (0.5) |
1.36 (0.4) |
0.71 (224.4) |
| Sérogroupe A | 0.01 (0.2) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.002 (0.2) |
0.001 (0.1) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.002 (0.5) |
| Sérogroupe B | 0.25 (10.4) |
0.22 (7) |
0.21 (2.1) |
0.23 (2.6) |
0.18 (22.1) |
0.52 (39.4) |
0.43 (3.2) |
0.25 (2.3) |
0.07 (0.1) |
0.35 (1.8) |
0 (0) |
0.23 (0.1) |
1.36 (0.4) |
0.29 (91.5) |
| Sérogroupe C | 0.28 (11.6) |
0.55 (16.8) |
0.08 (0.8) |
0.18 (2.1) |
0.15 (18.1) |
0.23 (17.2) |
0.12 (0.9) |
0.04 (0.4) |
0 (0) |
0.13 (0.7) |
0.32 (0.1) |
0.48 (0.2) |
0.00 (0) |
0.22 (68.9) |
| Sérogroupe Y | 0.12 (4.8) |
0.07 (2.2) |
0.08 (0.8) |
0.10 (1.2) |
0.10 (12.1) |
0.07 (4.9) |
0.09 (0.7) |
0.10 (0.9) |
0.07 (0.1) |
0.10 (0.5) |
0 (0) |
0.23 (0.1) |
0.00 (0) |
0.09 (28.3) |
| Sérogroupe W-135 | 0.04 (1.5) |
0.02 (0.7) |
0.02 (0.2) |
0.03 (0.4) |
0.05 (5.6) |
0.02 (1.8) |
0.04 (0.3) |
0.01 (0.1) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.03 (10.6) |
| Autres sérogroupes | 0.01 (0.2) |
0.02 (0.7) |
0.00 (0) |
0.01 (0.1) |
0.04 (4.9) |
0.01 (0.6) |
0.03 (0.2) |
0.00 (0) |
0.00 (0) |
0.04 (0.2) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.02 (6.9) |
| Sérogroupe inconnu | 0.06 (2.4) |
0.07 (2.1) |
0.03 (0.3) |
0.12 (1.4) |
0.04 (5) |
0.05 (3.5) |
0.03 (0.2) |
0.10 (0.9) |
0.15 (0.2) |
0.31 (1.6) |
0.00 (0) |
0.23 (0.1) |
0.00 (0) |
0.06 (17.7) |
| Sérogroupes | <1 | 1 à 4 | 5 à 9 | 10 à 14 | 15 à 19 | 20 à 24 | 25 à 29 | 30 à 39 | 40 à 59 | 60+ | Âge inconnu | Tous les âges |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Incidence (nombre de cas) |
6.94 (25) |
1.93 (27) |
0.78 (14) |
0.34 (7) |
1.30 (29) |
0.93 (21) |
0.54 (12) |
0.25 (11) |
0.45 (45) |
0.59 (36) |
0.01 (2) |
0.70 (229) |
| Sérogroupe A | 0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
| Sérogroupe B | 5.55 (20) |
1.28 (18) |
0.61 (11) |
0.20 (4) |
0.80 (18) |
0.66 (15) |
0.36 (8) |
0.13 (6) |
0.23 (23) |
0.13 (8) |
0 (0) |
0.40 (131) |
| Sérogroupe C | 0.28 (1) |
0.21 (3) |
0.06 (1) |
0.00 (0) |
0.00 (0) |
0.09 (2) |
0.09 (2) |
0.02 (1) |
0.10 (10) |
0.16 (10) |
0 (0) |
0.09 (30) |
| Sérogroupe Y | 0.28 (1) |
0.14 (2) |
0.00 (0) |
0.10 (2) |
0.31 (7) |
0.09 (2) |
0.00 (0) |
0.07 (3) |
0.06 (6) |
0.18 (11) |
0.003 (1) |
0.11 (35) |
| Sérogroupe W-135 | 0.00 (0) |
0.14 (2) |
0.00 (0) |
0.05 (1) |
0.05 (1) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.04 (4) |
0.08 (5) |
0 (0) |
0.04 (13) |
| Autres sérogroupes | 0.00 (0) |
0.00 (0) |
0.00 (0) |
0.00 (0) |
0.05 (1) |
0.04 (1) |
0.00 (0) |
0.00 (0) |
0.01 (1) |
0.02 (1) |
0 (0) |
0.01 (4) |
| Sérogroupe inconnu | 0.83 (3) |
0.14 (2) |
0.11 (2) |
0.00 (0) |
0.09 (2) |
0.04 (1) |
0.09 (2) |
0.02 (1) |
0.01 (1) |
0.02 (1) |
0.003 (1) |
0.05 (16) |
IV. Vaccin
IV.1 Calendiers d'administration des vaccins conjugués contre le méningocoque utilisés au Canada
Le tableau 6 donne un aperçu des vaccins antiméningococciques offerts au Canada. Le tableau 7 résume les calendriers de vaccination systématique des enfants utilisés dans les provinces et territoires en février 2011. Dans sa déclaration d'avril 2009, le CCNI recommandait l'inclusion d'une dose du vaccin conjugué contre le méningocoque à l'adolescence, le produit sélectionné variant selon l'épidémiologie locale. Par la suite, des provinces/territoires ont remplacé le vaccin conjugué monovalent contre le méningocoque du groupe C par le vaccin quadrivalent conjugué, Men‑C-ACYW‑135‑D (MenactraMD), dans leur programme destiné aux adolescents.
| Nom du produit | Type de vaccin | Fabricant | Concentration de polysaccharide(s) | Support protéique | Administration | Calendrier du fabricant |
|---|---|---|---|---|---|---|
| Vaccins quadrivalents contre le méningocoque (conjugués et polysaccharidiques) : | ||||||
| MenactraMD | Conjugué A, C, Y, W‑135 | sanofi pasteur | 4 μg de chaque sérogroupe | 48 μg d'anatoxine diphtérique | 0.5 ml IM | 2-55 ans – 1 dose |
| MenveoMD | Conjugué A, C, Y, W‑135 | Novartis | 10 μg du sérogroupe A 5 μg de chacun des sérogroupes C, W135 et Y |
Quantités variables de CRM197 conjuguée à chaque polysaccharide | 0.5 ml IM Doit être reconstitué |
2-55 ans – 1 dose |
| MenomuneMD A/C/Y/W-135 | Polysacchari-dique A, C, Y, W‑135 | sanofi pasteur | 50 μg de chaque sérogroupe | s.o. | 0.5 ml SC Doit être reconstitué |
Enfants de 2 ans et plus, adolescents et adultes – Une dose; répéter après un intervalle selon l'âge si le risque persiste; peut être utilisé pour protéger les enfants de 3 mois et plus contre le sérogroupe A |
| Vaccins conjugués monovalents contre le méningocoque du groupe C : | ||||||
| MeningitecMD | Conjugué C | Pfizer Canada | 10 μg | 15 μg CRM197 | 0.5 ml IM | Nourrissons de 2 à 12 mois – 2 doses pas avant l'âge de 2 mois et intervalle d'au moins deux mois, avec une dose de rappel conformément aux recommandations officielles, de préférence vers l'âge de 12 moisTableau 6 - Note *; Enfants âgés de 1 an et plus, adolescents et adultes – 1 dose |
| MenjugateMD | Conjugué C | Novartis | 10 μg | 12.5 – 25 μg CRM197 | 0.5 ml IM Doit être reconstitué |
Nourrissons : de 2 à 12 mois – 3 doses pas avant l'âge de 2 mois et séparées par un intervalle d'au moins un mois, avec une dose de rappel conformément aux recommandations du CCNITableau 6 - Note *; Enfants âgés de 1 an et plus, adolescents et adultes – 1 dose |
| Neis Vac-CMD | Conjugué C | Baxter (distribué par GlaxoSmithKline) | 10 μg | 10-20 μg d'anatoxine tétanique | 0.5 ml IM | Nourrissons de 2 à 12 mois – 2 doses pas avant l'âge de 2 mois et séparées par un intervalle d'au moins 2 mois, avec une dose après l'âge de 5 mois; si la série primaire est terminée avant l'âge de 5 mois, administrer une dose de rappel au cours de la deuxième année de vie, environ 1 an après la dernière doseTableau 6 - Note *; Enfants âgés de 1 an et plus, adolescents et adultes – 1 dose |
|
intramusculaire sous-cutané Corynebacterium diphtheriae cross reacting material 197
Il convient de noter que les recommandations du CCNI peuvent différer des recommandations du fabricant. Les recommandations du CCNI sont décrites dans le Guide canadien d'immunisation et dans les déclarations du CCNI portant sur les vaccins contre le méningocoque. |
||||||
| Province/ Territoire | Programme actuel pour les nourrissons utilisant le vaccin conjugué contre le méningocoque C | Date de mise en œuvre du programme actuel pour les nourrissons | Programme actuel pour les adolescents utilisant (C) le vaccin conjugué contre le méningocoque C ou (Q) C-ACYW-135 | Date de mise en œuvre du programme actuel pour les adolescents |
|---|---|---|---|---|
| Colombie-Britannique | 2, 12 mois | 2005 | (C) 6e année | 2003 |
| Alberta | 2, 4, et 12 mois | 2007 | (Q) 9e année | 2011 |
| Saskatchewan | 12 mois | 2004 | (Q) 6e année | 2011 |
| Manitoba | 12 mois | 2009 | (C) 4e année | 2004 |
| Ontario | 12 mois | 2004 | (Q) 7e année | 2009 |
| Québec | 12 mois | 2002 | (C) < 18 ans | 2002 |
| Nouveau-Brunswick | 12 mois | 2004 | (Q) 9e année | 2007 |
| Nouvelle-Écosse | 12 mois | 2005 | (C) 7e année | 2010 |
| Île-du-Prince-Édouard | 12 mois | 2003 | (Q) 9e année | 2006 |
| Terre-Neuve-et-Labrador | 12 mois | 2005 | (Q) 4e année | 2007 |
| Territoires du Nord-Ouest | 2, 12 mois | 2004 | (C) 9e année | 2008 |
| Yukon | 2, 12 mois | 2009 | (C) 6e année | 2006 |
| Nunavut | 12 mois | 2007 | (C) 9e année | 2006 |
IV.2 Description et composition de Men-C-ACYW-135-CRM (MenveoMD)
Men-C-ACYW-135-CRM (MenveoMD) contient des polysaccharides capsulaires des sérogroupes A (10 μg), C (5 μg), W135 (5 μg) et Y (5 μg). Chaque sérogroupe est individuellement conjugué à la protéine CRM197, une forme mutante naturelle de l'anatoxine diphtérique qui sert de vecteur protéique. Le vaccin ne renferme aucun adjuvant, aucun agent de conservation ni thimérosal. Les bouchons des flacons sont exempts de latex.
Le vaccin est emballé dans deux flacons distincts (l'un contenant le vaccin conjugué contre le méningocoque des groupes C, W135, Y sous forme liquide et l'autre renfermant le vaccin conjugué contre le méningocoque du groupe A sous forme de poudre) qui doivent être mélangés avant la vaccination. Tout le liquide du flacon contenant le vaccin contre le méningocoque des groupes C, W135 et Y est retiré et injecté dans le flacon renfermant la poudre lyophilisée (groupe A); ce dernier est agité vigoureusement jusqu'à ce que les composants se dissolvent pour donner une solution liquide claire et incolore. Par la suite, 0,5 ml de la solution reconstituée est extraite du flacon qui renfermait auparavant la poudre (méningocoque du groupe A). Il peut rester une petite quantité de vaccin reconstitué dans le flacon après le retrait de 0,5 ml.
IV.3 Efficacité théorique et réelle de Men-C-ACYW-135-CRM (MenveoMD) et Men-C-ACYW-135-D (MenactraMD)
Il n'est généralement pas possible d'effectuer des études sur l'efficacité des vaccins conjugués contre le méningocoque parce que la maladie est relativement rare et qu'il faudrait étudier des populations énormes. Les autorités réglementaires ont établi des critères d'immunogénicité comme corrélats de la protection contre la MI, et ces corrélats sont utilisés comme mesures des résultats dans les essais cliniques qui comparent les nouveaux vaccins conjugués aux anciens vaccins déjà approuvés contre le méningocoque.
IV.3.1 Men-C-ACYW-135-CRM (MenveoMD)
Il n'existe aucune donnée sur l'efficacité théorique ou réelle de Men‑C‑ACYW‑135‑CRM (MenveoMD).
IV.3.2 Men-C-ACYW-135-D (MenactraMD)
Les données sur l'efficacité de Men‑C‑ACYW‑135‑D (MenactraMD) commencent maintenant à être accessibles aux États-Unis après quatre années d'utilisation croissante du vaccin, principalement chez les personnes âgées de 11 à 18 ans. Les systèmes de surveillance Active Bacterial Core (ABC) et MeningNet (qui représentent 54 % de la population américaine) ont recensé 14 cas déclarés de MI (8 dus au sérogroupe C et 6 au sérogroupe Y) entre le 1er janvier 2005 et le 31 décembre 2008 chez des personnes qui avaient reçu le vaccin Men‑C‑ACYW‑135‑D (MenactraMD). L'âge médian des cas à l'apparition de la maladie était de 19 ans (intervalle de 15 à 21 ans) et l'intervalle médian entre la vaccination et l'apparition de la maladie était de 395 jours (intervalle de 43 à 1 021 jours). Trois cas se sont soldés par un décès, soit un taux de létalité de 21 %. D'après le nombre d'échecs vaccinaux, les estimations préliminaires de l'efficacité réelle du vaccin Men‑C‑ACYW‑135‑D (MenactraMD) dans les 3 à 4 années suivant la vaccination varient entre 80 et 85 %Note en bas de page 11.
Les résultats préliminaires d'une étude cas/témoins aux É.-U. portant sur 108 cas et 158 témoins dont l'âge variait entre 10 et 23 ans ont mis en évidence une efficacité globale de 78 % pour Men‑C‑ACYW‑135‑D (MenactraMD) (IC à 95 % : 29 à 93 %) (sérogroupe C 77 % (IC à 95 % : 14 à 94 %); sérogroupe Y 88 % (IC à 95 % : ‑23 à 99 %). Ces résultats préliminaires ont montré que l'efficacité du vaccin diminuait avec le temps lorsque l'évaluation portait sur une période de moins de 5 ans suivant la vaccinationNote en bas de page 12Note en bas de page 13.
Il convient de noter que l'efficacité réelle de chaque vaccin peut ne pas prédire l'impact du fardeau de la méningococcie dans la collectivité en raison de l'avantage additionnel conféré par l'immunité collective. Cela se vérifie notamment dans le cas de la maladie due au sérogroupe C contre lequel un grand nombre d'enfants et d'adolescents canadiens ont été vaccinés.
IV.4 Corrélats immunologiques de la protection
L'approbation réglementaire des vaccins antiméningococciques conjugués est principalement basée sur des études d'immunogénicité de courte duréeNote en bas de page 14. Il serait difficile de mener des études d'efficacité en raison de la rareté relative de la méningococcie. Les critères d'évaluation de l'immunogénicité les plus souvent employés à cette fin sont l'activité bactéricide du sérum (ABS), mesurée à l'aide de sérum humain ou de sérum de lapereau comme source de complément, et les dosages immuno-enzymatiques (ELISA).
Les titres d'ABS sont la mesure standard employée pour déterminer la réceptivité et l'immunité à l'égard de la MI. On mesure, dans un échantillon de sérum, le titre d'anticorps bactéricides qui peut tuer une partie d'une souche particulière de N. meningitidis dans une période donnée. Le titrage s'effectue in vitro en présence de complément ajouté. Dans le passé, le sérum humain était la source de complément exogène utilisée pour ce dosage, et la plupart des tests portant sur le vaccin Men‑C‑ACYW‑135‑CRM (MenveoMD) font appel à cette méthode. Lorsqu'on emploie le sérum humain comme source de complément, un titre d'activité bactéricide du sérum humain (ABSh) ≥ 1:4 est corrélé avec une protection contre la méningococcie due au sérogroupe CNote en bas de page 15, et un ABSh ≥ 1:4 a également été utilisé comme corrélat pour la méningococcie due au sérogroupe A. Il n'existe pas de corrélats immunologiques confirmés de la protection contre les sérogroupes Y et W135. Le sérum de lapereau, plus facile à se procurer, a remplacé le sérum humain dans certaines études. Un titre d'activité bactéricide du sérum de lapereau (ABSh) ≥ 1:8 a été proposé comme corrélat de l'immunité à court terme contre le sérogroupe CNote en bas de page 16. Les moyennes géométriques des titres (MGT) de l'ABS sont également utilisées pour mesurer la réponse immunitaire au vaccin contre le méningocoque. Les tests ELISA servent à déterminer les concentrations d'Ig spécifiques au polysaccharide du méningocoque du sérogroupe CNote en bas de page 17, qui peuvent être exprimées sous forme de concentrations moyennes géométriques (CMG) d'anticorps. Il existe aussi des épreuves ELISA pour mesurer l'avidité des anticorps IgG dirigés contre le méningocoque du sérogroupe CNote en bas de page 18.
Les études sur les vaccins antiméningococciques peuvent également avoir recours à la « séroréponse » comme indicateur immunologique. La séroréponse est définie comme le pourcentage de personnes qui respectent les critères suivants :
- ont un titre d'ABSh < 1:4 au départ et un titre d'ABSh post-vaccination > = 1:8;
- ont un titre d'ABSh > = 1:4 au départ et un titre post-vaccination au moins 4 fois plus élevé que leur titre de départ.
Les paramètres de la séroréponse sont fournis dans les publications auxquelles se réfère la présente déclaration mais, en général, ne seront pas résumés ici.
L'analyse statistique des données immunologiques fait appel aux notions d'infériorité, de non-infériorité et de supériorité pour les MGT, les titres d'ABSh et la séroréponse. Dans le cas des MGT, ces notions sont définies en fonction du ratio de MGT pour le vaccin étudié et le vaccin de comparaison. Les deux vaccins étaient considérés comme non inférieurs si la limite inférieure de l'intervalle de confiance bilatéral à 95 % autour du ratio était de > 0,5 et ils étaient jugés supérieurs si cette valeur était de > 1. Pour le titre d'ABSh et la séroréponse, on calcule la différence dans la proportion de sujets produisant cette réponse après avoir reçu le vaccin étudié et le vaccin de comparaison. La non-infériorité est démontrée lorsque la limite inférieure de l'intervalle de confiance bilatéral à 95 % est supérieure à -10 %, et la supériorité est définie comme une limite inférieure de plus de 0 %.
Il est bien établi que l'administration du vaccin conjugué contre le méningocoque amorce le développement d'une mémoire immunitaire et induit une bonne réponse anamnestique après une provocation par un vaccin polysaccharidique ou conjugué contre le méningocoque du groupe CNote en bas de page 19-Note en bas de page 23. Toutefois, en raison de la courte période d'incubation de la MI (intervalle de 2 à 10 jours, le plus souvent 3 à 4 jours)Note en bas de page 24, il est maintenant généralement reconnu qu'on ne peut compter sur la réponse anamnestique pour prévenir la maladie et qu'il faut des anticorps circulants pour assurer une protectionNote en bas de page 5. Les études d'immunogénicité prédisent donc probablement l'efficacité à court terme, mais on ignore si elles sont capables de déterminer l'efficacité à long terme, car les titres d'anticorps diminuent après la vaccinationNote en bas de page 25-Note en bas de page 27, même dans les 6 à 8 mois qui suivent la réception du vaccin en bas âgeNote en bas de page 23MNote en bas de page 28. On espère que plus le titre d'anticorps obtenu après la vaccination est élevé, plus les anticorps circulants persisteront longtemps et plus longue sera la durée de protection conférée par la vaccination, mais on attend actuellement des preuves pour appuyer cette hypothèse.
Les études d'immunogénicité ne permettent pas de prévoir l'impact de la vaccination sur le portage et l'immunité collective. L'immunité collective peut offrir une protection si un nombre suffisant de personnes sont vaccinées, même si la protection individuelle diminue. C'est ce que la recherche effectuée par Campbell et coll.Note en bas de page 29 a permis de constater. Le vaccin conjugué contre le méningocoque du groupe C a été introduit au Royaume-Uni en 1999, le calendrier de primovaccination prévoyant l'administration d'une dose à l'âge de 2, 3 et 4 mois et d'une seule dose de rattrapage chez les personnes de 1 à 18 ans. La dose de rattrapage a été étendue jusqu'à l'âge de 25 ans en janvier 2002. Les chercheurs ont montré que l'efficacité du vaccin chez les nourrissons s'établissait à 97 % (IC à 95 % : 91-99 %) dans la première année suivant la vaccination, mais chutait à 68 % (IC à 95 % : - 63 à 90 %) après 1 an et jusqu'à 10 ans après la vaccination. Les taux de méningococcie causée par le sérogroupe C chez les nourrissons de moins de 1 an ont cependant diminué de 99 % entre 1998-1999 et 2007-2008 (passant de 16,63 à 0,15 pour 100 000 habitants). Le déclin soutenu de la MI due au sérogroupe C, malgré l'efficacité décroissante du vaccin dans ce groupe d'âge, est attribué à l'impact de l'immunité collective induite par la vaccination des adolescents et peut-être des jeunes adultes.
IV.5 Immunogénicité of Men-C-ACYW-135-CRM (MenveoMD)
En tout, 24 essais portant sur Men‑C‑ACYW‑135‑CRM sont en cours ou sont terminés. Environ 18 500 sujets ont reçu notamment une préparation de Men‑C‑ACYW‑135‑CRM. De ce nombre, 14 000 ont reçu la préparation finale de MenveoMD dont l'usage a été approuvé (10 μg d'oligosaccharides du sérogroupe A et 5 μg d'oligosaccharides de chacun des sérogroupes C, W135 et Y sans adjuvant)Note en bas de page 30. Une préparation utilisant comme adjuvant de l'aluminium a également été testée, mais la préparation finale ne renferme pas d'adjuvant parce que ces derniers ne semblaient pas améliorer significativement l'immunogénicité du vaccin.
Dans les sections ci-dessous, nous passons en revue l'information relative à l'immunogénicité de Men‑C‑ACYW‑135‑CRM chez les nourrissons, les tout-petits, les adolescents et les adultes. Il convient de noter que dans ces études, les personnes qui administrent le vaccin ne peuvent ignorer de quel produit il s'agit à cause de l'apparence unique de Men‑C‑ACYW‑135‑CRM et de la nécessité de reconstituer le produit avant son administration. Ces études sont résumés au tableau 8.
IV.5.1 Enfants de moins de 2 ans
Deux essais comparatifs randomisés de phase II chez des nourrissons ont été effectués; les deux portaient sur des sujets du R.-U. et du Canada. Dans chaque étude, les vaccins ont été administrés en même temps que les vaccins systématiquement administrés aux nourrissons dans ces pays. Dans la première étude, menée par Snape et coll.Note en bas de page 28, 421 nourrissons ont été recrutés et ont reçu au hasard une préparation antérieure de MenveoMD qui contenait un adjuvant à base de phosphate d'aluminium (Men‑C‑ACYW‑135‑CRM avec adjuvant). Divers calendriers ont été étudiés : 2, 3, 4 mois au R.-U.; 2, 4, 6 mois au Canada; 2 et 4 mois au R.-U. et au Canada. Les résultats ont été comparés avec ceux d'un vaccin conjugué monovalent contre le méningocoque du groupe C (Menjugate® – Vaccins Novartis) administré à l'âge de 2 et de 4 mois au R.-U. L'immunité a été mesurée en se basant sur l'activité bactéricide du sérum humain (ABSh) > = 1:4. Un mois après la fin de la série vaccinale, une plus forte proportion de sujets ont atteint ce niveau d'immunité avec les calendriers à trois doses (2, 3, 4 mois ou 2, 4, 6 mois) qu'avec les calendriers à deux doses (2, 4 mois) contre les quatre sérogroupes. Les moyennes géométriques des titres (MGT) étaient également plus élevées avec les calendriers à trois doses qu'avec un calendrier à deux doses. Le calendrier canadien prévoyant une dose à l'âge de 2, 4 et 6 mois a permis à une proportion légèrement plus forte de nourrissons de développer une immunité, sauf contre le sérogroupe A, et de produire des MGT légèrement plus élevées que le calendrier du R.-U. prévoyant une dose à l'âge de 2, 3 et 4 mois. Pour le calendrier canadien avec une dose à l'âge de 2, 4 et 6 mois, le pourcentage de nourrissons qui ont obtenu un titre d'ABSh > = 1:4 un mois après la fin de la série vaccinale était le suivant :
- sérogroupe A : 81 % (IC à 95 % : 71-89 %);
- sérogroupe C : 98 % (IC à 95 % : 92-100 %);
- sérogroupe W135 : 99 % (IC à 95 % : 93-100 %);
- sérogroupe Y : 98 % (IC : 92-100 %).
Toutefois, à l'âge de 12 mois, le pourcentage de nourrissons qui présentaient ce titre avait diminué, en particulier contre les sérogroupes A et C; le pourcentage d'enfants vaccinés ayant un titre d'ABSh > 1:4 était le suivant :
- sérogroupe A : 41 % (IC à 95 % : 26-57 %);
- sérogroupe C : 70 % (IC à 95 % : 54-82 %);
- sérogroupe W135 : 95 % (IC à 95 % : 83-99 %);
- sérogroupe Y : 87 % (IC : 74-95 %).
Les MGT avaient également chuté considérablement un mois après la vaccination à l'âge de 2, 4 et 6 mois comparativement à un mois après la vaccination à l'âge de 12 mois. Par exemple, dans le cas du sérogroupe C, la MGT s'élevait à 124 (IC à 95 % : 89‑172) un mois après la vaccination et à 13 (IC à 95 % : 8,72‑18) à l'âge de 12 mois.
Administré à l'âge de 2 et de 4 mois, le vaccin conjugué monovalent contre le méningocoque du groupe C (Menjugate®), qui renferme le double de la quantité de polysaccharides du sérogroupe C comparativement au vaccin Men‑C‑ACYW‑135‑CRM avec adjuvant, a produit, en revanche, les MGT les plus élevées contre le sérogroupe C : 339 (IC à 95 % : 209‑551) à l'âge de 5 mois (un mois après la vaccination) et 26 (IC à 95 % : 17-39) à l'âge de 12 mois. Le pourcentage de nourrissons ayant un titre > = 1:4 était de 98 % (IC à 95 % : 87‑100 %) un mois après la vaccination et de 89 % (IC 95 % : 75-97 %) à l'âge de 12 mois.
Un mois après une provocation soit à l'aide d'une autre dose de Men‑C‑ACYW‑135‑CRM avec adjuvant, soit du cinquième d'une dose d'un vaccin quadrivalent polysaccharidique non conjugué (Men‑P‑ACYW‑135 – Menomune®, sanofi pasteur) à l'âge de 12 mois, tous les calendriers étaient associés à une bonne réponse anamnestique. La plus forte réponse contre le sérogroupe C un mois après la dose de Men-C-ACYW-135-CRM avec adjuvant à l'âge de 12 mois a été enregistrée chez les tout-petits qui avaient reçu le vaccin conjugué monovalent contre le méningocoque du groupe C à l'âge de 2 et de 4 mois (les MGT contre le sérogroupe C atteignaient 912 [IC à 95 % : 538-1545]). Le vaccin Men‑C‑ACYW‑135‑CRM avec adjuvant n'a pas été utilisé comme dose de rappel après la série primaire canadienne à l'âge de 2, 4 et 6 mois, mais après la série primaire au R.-U. à l'âge de 2, 3 et 4 mois, la dose de rappel à l'âge de 12 mois de Men‑C‑ACYW‑135‑CRM avec adjuvant a donné une MGT de 429 (IC à 95 % : 288-639) contre le sérogroupe C un mois suivant la vaccination.
Dans le groupe qui avait reçu le vaccin conjugué monovalent contre le méningocoque du groupe C à l'âge de 2 et 4 mois, puis une dose de Men-C-ACYW-135-CRM avec adjuvant à l'âge de 12 mois, un titre > = 1:4 contre les sérogroupes A, Y et W135 a été obtenu chez les tout-petits dans les proportions suivantes :
- sérogroupe A : 59 % (IC à 95 % : 42-75 %);
- sérogroupe W135 : 86 % (IC à 95 % : 71-95 %);
- sérogroupe Y : 86 % (IC : 71-95 %).
Il reste que les MGT étaient beaucoup plus faibles dans ce groupe contre les sérogroupes A, Y et W135 que dans les groupes qui avaient reçu la dose de rappel de Men‑C‑ACYW‑135‑CRM avec adjuvant à l'âge de 12 mois et qui avaient reçu 2 ou 3 doses du même vaccin durant la première année de vie. Cette observation semble indiquer que la durée de protection conférée chez les tout-petits par une dose de Men‑C‑ACYW‑135‑CRM avec adjuvant peut être plus courte que lorsqu'on utilise ce vaccin en primovaccination chez les nourrissons et qu'on administre une dose de rappel durant la deuxième année de vie.
La deuxième étude, menée par Perrett et coll.Note en bas de page 31, a porté sur 180 enfants au R.-U. et au Canada et a utilisé un protocole similaire à celui de Snape et coll. décrit ci-dessusNote en bas de page 28. Dans cette étude, des enfants ont reçu le vaccin Men‑C‑ACYW‑135‑CRM sans adjuvant, qui est la préparation finale de MenveoMD, à l'âge de 2 et de 4 mois en même temps que d'autres vaccins systématiques pour les nourrissons. Les réponses 1 mois après la vaccination (âge de 5 mois) étaient légèrement plus fortes dans le groupe canadien de l'étude que dans le groupe du R.-U., le pourcentage de nourrissons qui avaient obtenu un titre d'ABSh > = 1:4 dans le groupe canadien étant le suivant :
- sérogroupe A : 57 % (IC à 95 % : 45-67 %);
- sérogroupe C : 93 % (IC à 95 % : 85-97 %);
- sérogroupe W135 : 95 % (IC à 95 % : 87-99 %);
- sérogroupe Y : 91 % (IC : 82-96 %).
Comme dans l'étude de Snape et coll., le pourcentage de nourrissons qui avaient obtenu un titre d'ABSh > = 1:4 à l'âge de 12 mois avait chuté considérablement :
- sérogroupe A : 3 % (IC à 95 % : 0,067-14 %);
- sérogroupe C : 33 % (IC à 95 % : 19-49 %);
- sérogroupe W135 : 69 % (IC à 95 % : 51-83 %);
- sérogroupe Y : 63 % (IC : 46-78 %).
Les MGT ont également diminué entre le premier mois suivant la vaccination et l'âge de 12 mois. Si l'on prend comme exemple le sérogroupe C, la MGT s'élevait à 69 (IC à 95 % : 50‑95) un mois après la vaccination (âge de 5 mois) et à 4,07 (IC à 95 % : 2,73‑6,06) à l'âge de 12 mois.
L'administration à l'âge de 12 mois soit d'une dose de rappel de Men‑C‑ACYW‑135‑CRM (MenveoMD), soit du cinquième d'une dose d'un vaccin polysaccharidique quadrivalent non conjugué contre le méningocoque (Menomune®) a produit une réponse anamnestique contre tous les sérogroupes et des taux élevés de séroprotection. Un mois après la dose de rappel de Men‑C‑ACYW‑135‑CRM (MenveoMD) dans le groupe canadien de l'étude, la MGT s'établissait à 258 (IC à 95 % :156-426) contre le sérogroupe C.
Dans une étude portant sur 175 enfants, Halperin et coll.Note en bas de page 32 ont comparé l'immunogénicité dans les trois groupes suivants :
- deux doses de Men‑C‑ACYW‑135‑CRM (MenveoMD) à l'âge de 6 et de 12 mois;
- une dose de Men-C-ACYW-135-CRM (MenveoMD) à l'âge de 12 mois;
- une dose de vaccin conjugué monovalent contre le méningocoque du groupe C (MenjugateMD) à l'âge de 12 mois suivie d'une dose de Men‑C‑ACYW‑135‑CRM (MenveoMD) à l'âge de 18 mois.
D'autres vaccins ont été administrés en même temps : PentacelMD (DCaT‑VPI‑Hib) (sanofi pasteur) et Prevnar® (VCP‑7) (Pfizer).
Les deux doses de Men‑C‑ACYW‑135‑CRM (MenveoMD) administrées à l'âge de 6 et de 12 mois ont permis à 100 % des vaccinés de produire un titre d'ABSh > = 1:4 contre les sérogroupes C (IC à 95 % : 94‑100 %), W135 (IC à 95 % : 93‑100 %) et Y (IC à 95 % : 94‑100 %) et à 87 % des vaccinés (IC à 95 % : 75‑95 %) d'obtenir ce titre contre le sérogroupe A environ 28 jours après la deuxième dose. Ce calendrier a induit les MGT les plus élevées contre tous les sérogroupes sauf le sérogroupe C, alors que le calendrier comprenant une seule dose du vaccin conjugué monovalent contre le méningocoque du groupe C à l'âge de 12 mois et une dose de Men‑C‑ACYW‑135‑CRM (MenveoMD) à l'âge de 18 mois a produit une réponse plus forte. Les MGT contre le sérogroupe C 28 jours, après la dernière dose prévue dans les deux calendriers, s'établissaient comme suit :
- 314 (IC à 95 % : 234‑421) pour Men‑C‑ACYW‑135‑CRM à l'âge de 6 et de 12 mois contre
- 679 (IC à 95 % : 479‑962) pour le vaccin conjugué monovalent contre le méningocoque du groupe C à l'âge de 12 mois et pour Men‑C‑ACYW‑135‑CRM à l'âge de 18 mois.
En ce qui concerne le sérogroupe C, le vaccin Men‑C‑ACYW‑135‑CRM (MenveoMD) administré à l'âge de 12 mois et le vaccin monovalent contre le méningocoque du groupe C (MenjugateMD) à l'âge de 12 mois ont produit des MGT similaires de 40 (IC à 95 % : 29‑53 et 30‑53, respectivement) 28 jours après la vaccination, et le pourcentage d'enfants ayant obtenu un titre > = 1:4 était similaire 28 jours après la vaccination (96 % (IC à 95 % : 87‑100 %) pour le vaccin Men‑C‑ACYW‑135‑CRM et 94 % (IC à 95 % : 82‑99 %) pour le vaccin conjugué monovalent contre le méningocoque du groupe C). Contre les sérogroupes A, W135 et Y, la réponse immunitaire était similaire lorsque Men‑C‑ACYW‑135‑CRM (MenveoMD) était administré à l'âge de 12 mois ou de 18 mois. Environ 28 jours après la vaccination à l'âge de 12 mois, le pourcentage d'enfants ayant obtenu un titre d'ABSh > = 1:4 était le suivant :
- sérogroupe A : 73 % (IC à 95 % : 59-84 %);
- sérogroupe W135 : 94 % (IC à 95 % : 82-99 %);
- sérogroupe Y : 78 % (IC à 95 % : 65-88 %).
Dans une communication,Vesikari et coll.Note en bas de page 33 ont publié les résultats d'une étude d'établissement de la dose portant sur 620 tout-petits âgés de 12 à 16 mois. Ces enfants ont été classés au hasard dans un groupe recevant une ou deux doses de préparations différentes du vaccin. Lorsque la préparation vaccinale retenue pour un développement plus poussé était administrée, l'intervalle des MGT de l'ABSh contre les divers sérogroupes variait entre 5,2 et 12 après une dose et entre 28 et 76 après deux doses. Le pourcentage de sujets présentant un titre d'ABSh > = 1:4 contre les divers sérotypes variait entre 49 et 70 % après une dose et entre 91 et 96 % après deux doses.
IV.5.2 Enfants de 2 à 10 ans
Dans une étude portant sur 619 enfants âgés de 2 à 10 ans, Black et coll.Note en bas de page 27 ont comparé la réponse immunitaire au vaccin Men‑C‑ACYW‑135‑CRM (MenveoMD) avec celle au vaccin polysaccharidique quadrivalent non conjugué (Men‑P‑ACYW‑135 – Menomune®). Le pourcentage d'enfants ayant obtenu un titre d'ABSh > = 1:4 était statistiquement plus important après le vaccin Men‑C‑ACYW‑135‑CRM (MenveoMD) qu'après Men‑P‑ACYW‑135 (Menomune®) et ce, tant 1 mois que 12 mois après la vaccination. Les MGT étaient significativement plus élevées, également, chez les sujets ayant reçu Men‑C‑ACYW‑135‑CRM (MenveoMD) que chez ceux qui avaient reçu Men‑P‑ACYW‑135 (Menomune®) contre tous les sérogroupes 1 mois après la vaccination et contre les sérogroupes A, W135 et Y, 12 mois après la vaccination.
On a observé un déclin de la réponse immunitaire induite par le vaccin Men‑P‑ACYW‑135 (Menomune®) contre tous les sérogroupes 1 à 12 mois après la vaccination. Dans le cas du vaccin Men‑C‑ACYW‑135‑CRM (MenveoMD), la réponse immunitaire contre les sérogroupes A et C a faibli à partir de un mois jusqu'à 12 mois après la vaccination. Le pourcentage de sujets ayant obtenu un titre d'ABSh contre chaque sérogroupe > = 1:4 un mois et 12 mois, respectivement, après le vaccin Men‑C‑ACYW‑135‑CRM (MenveoMD) était le suivant :
- sérogroupe A : 82 % (IC à 95 % : 77‑87 %) après 1 mois et 28 % (IC à 95 % : 23‑34%) après 12 mois;
- sérogroupe C : 83 % (IC à 95 % : 78‑87 %) après 1 mois et 68 % (IC à 95 % : 62‑74%) après 12 mois;
- sérogroupe W135 : 95 % (IC à 95 % : 91‑97 %) après 1 mois et 94 % (IC à 95 % : 90‑97 %) après 12 mois;
- sérogroupe Y : 91 % (IC : 87‑94 %) après 1 mois et 86 % (IC à 95 % : 81‑90 %) après 12 mois.
Dans une étude, Halperin et coll. ont comparé Men‑C‑ACYW‑135‑CRM (MenveoMD) et Men‑C‑ACYW‑135‑D (MenactraMD) chez 2 907 enfants classés dans deux groupes d'âge : 2 à 5 ans et 6 à 10 ansNote en bas de page 30Note en bas de page 34. Certains sujets dans le groupe des 2 à 5 ans ont reçu deux doses de Men‑C‑ACYW‑135‑CRM à 60 jours d'intervalle. Après une seule dose et un mois après la vaccination, le pourcentage de sujets dans les deux groupes d'âge qui avaient obtenu un titre d'ABSh > = 1:8 était plus faible avec le vaccin Men‑C‑ACYW‑135‑CRM qu'avec Men‑C‑ACYW‑135‑D contre le sérogroupe A, non inférieur contre le sérogroupe C et statistiquement supérieur contre les sérogroupes W135 et Y. Le pourcentage d'enfants de 2 à 5 ans ayant produit un titre d'ABSh > = 1:8 un mois après avoir reçu Men‑C‑ACYW‑135‑CRM et Men‑C‑ACYW‑135‑D s'établissait respectivement comme suit :
- sérogroupe A : 72 % et 78 %;
- sérogroupe C : 68 % et 64 %;
- sérogroupe W135 : 90 % et 75 %;
- sérogroupe Y : 76 % et 57 %.
Le pourcentage d'enfants de 6 à 10 ans ayant obtenu un titre d'ABSh > = 1:8 un mois après avoir reçu Men‑C‑ACYW‑135‑CRM et Men‑C‑ACYW‑135‑-D s'établissait respectivement comme suit :
- sérogroupe A : 77 % et 83 %;
- sérogroupe C : 77 % et 74 %;
- sérogroupe W135 : 91 % et 84 %;
- sérogroupe Y : 79 % et 63 %.
Une comparaison des MGT pour les deux groupes d'âge combinés montre que Men‑C‑ACYW‑135‑CRM est non inférieur à Men‑C‑ACYW‑135‑D contre le sérogroupe A et est statistiquement supérieur contre les sérogroupes C, W135 et Y. Les sujets de 2 à 5 ans qui avaient reçu deux doses de Men‑C‑ACYW‑135‑CRM avaient des MGT beaucoup plus élevées contre tous les sérogroupes et un pourcentage plus élevé d'entre eux ont obtenu un titre > = 1:8 contre tous les sérogroupes, comparativement à ceux qui avaient reçu une seule dose de Men‑C‑ACYW‑135‑CRM.
IV.5.3 Adolescents
Une étude de phase II réalisée par Jackson et coll.Note en bas de page 35 présente des données sur 524 adolescents américains âgés de 11 à 17 ans qui ont été répartis au hasard en deux phases pour recevoir la préparation antérieure de MenveoMD avec phosphate d'aluminium comme adjuvant (Men‑C‑ACYW‑135‑CRM avec adjuvant) ou la préparation autorisée de MenveoMD sans adjuvant (Men‑C‑ACYW‑135‑CRM); les deux préparations ont été comparées avec le vaccin polysaccharidique quadrivalent non conjugué contre le méningocoque (Men‑P‑ACYW‑135 – Menomune®). Un mois après la vaccination, on a calculé les MGT et le pourcentage des sujets qui avaient obtenu un titre d'ABSh > = 1:4 et on a constaté que les préparations avec adjuvant et sans adjuvant produisaient des réponses sérologiques similaires. Selon les mesures de l'immunogénicité 1 mois après la vaccination, Men‑C‑ACYW‑135‑CRM avec ou sans adjuvant a beaucoup mieux performé que Men‑P‑ACYW‑135 (Menomune®) dans presque toutes les comparaisons des réponses aux quatre sérogroupes.
Le pourcentage d'adolescents ayant obtenu un titre d'ABSh > = 1:8 un mois après avoir reçu la préparation sans adjuvant de Men‑ACW‑CRM (la préparation autorisée de MenveoMD) s'établissait comme suit :
- sérogroupe A : 81 % (IC à 95 % : 74-87 %);
- sérogroupe C : 84 % (IC à 95 % : 77-90 %);
- sérogroupe W135 : 91 % (IC à 95 % : 84-95 %);
- sérogroupe Y : 95 % (IC : 90-98 %).
Douze mois après la vaccination, la réponse immunitaire, basée sur les MGT et/ou le pourcentage de vaccinés ayant un titre > = 1:4 et/ou 1:8, est demeurée inchangée contre le sérogroupe W135, a diminué quelque peu contre les sérogroupes C et Y, mais a chuté considérablement contre le sérogroupe A; de sorte que le pourcentage d'adolescents qui présentaient toujours un titre > = 1:8 contre le sérogroupe A, douze mois après la vaccination, n'était que de 29 % (IC à 95 % : 22-38 %). Le pourcentage d'adolescents qui possédaient toujours un titre d'ABSh > = 1:8 douze mois après la vaccination s'établissait comme suit :
- sérogroupe C : 77 % (IC à 95 % : 69-84 %);
- sérogroupe W135 (IC à 95 % :88-97 %);
- sérogroupe Y : 82 % (IC à 95 % :75-88 %).
Une étude de phase III portant sur des adolescents âgés de 11 à 18 ans a été publiéeNote en bas de page 36. Dans cet essai comparatif randomisé multicentrique aux É.-U., 2 180 adolescents ont reçu une seule dose d'un des trois lots de Men‑C‑ACYW‑135‑CRM (MenveoMD) ou une seule dose de Men‑C‑ACYW‑135‑D (MenactraMD). Comme la quantité de complément humain était limitée, l'immunogénicité n'a été évaluée que chez certains sujets (entre 288 et 501 adolescents pour Men‑C‑ACYW‑135‑D selon le sérogroupe; et entre 1 024 et 1 483 adolescents pour Men‑C‑ACYW‑135‑CRM selon le sérogroupe). Les trois lots de Men‑C‑ACYW‑135‑CRM ont été combinés pour l'analyse, car leurs résultats étaient similaires au chapitre de l'immunogénicité. Sur la base des MGT un mois après la vaccination, les auteurs ont déterminé que Men‑C‑ACYW‑135‑CRM était supérieur à Men‑C‑ACYW‑135‑D contre tous les sérogroupes. Lorsqu'un titre d'ABSh > = 1:8 un mois après la vaccination était utilisé, Men‑C‑ACYW‑135‑CRM était supérieur à Men‑C‑ACYW‑135‑D contre tous les sérogroupes, sauf le sérogroupe C; et Men‑C‑ACYW‑135‑CRM était non inférieur à Men‑C‑ACYW‑135‑D contre le sérogroupe C. La différence dans le pourcentage d'adolescents obtenant un titre d'ABSh > = 1:8 était la plus grande contre le sérogroupe Y : 88 % pour Men‑C‑ACYW‑135‑CRM (IC à 95 % : 85‑90 %) contre 69 % pour Men‑C‑ACYW‑135‑D (IC à 95 % : 63-74 %). La signification clinique des différences dans les réponses immunitaires entre les deux produits demeure obscure, notamment en ce qui concerne la durée de la protection.
Le pourcentage d'adolescents ayant obtenu un titre d'ABSh > = 1:8 un mois après avoir reçu Men‑C‑ACYW‑135‑CRM (MenveoMD) s'établissait comme suit :
- sérogroupe A : 75 % (IC à 95 % : 73-78 %);
- sérogroupe C : 84 % (IC à 95 % : 82-86 %);
- sérogroupe W135 : 96 % (IC à 95 % : 95-97 %);
- sérogroupe Y : 88 % (IC à 95 % : 85-90 %).
Gill et coll.Note en bas de page 37 ont prolongé l'étude de Jackson décrite ci‑dessusNote en bas de page 36 et étudié l'immunogénicité dans un sous-ensemble de patients. Ils ont évalué, après une période médiane de 22 mois suivant la vaccination, 278 sujets de la cohorte originale qui avaient reçu, entre l'âge de 11 et 18 ans, Men‑C‑ACYW‑135‑CRM (MenveoMD) et 191 qui avaient reçu Men‑C‑ACYW‑135‑D (MenactraMD). Leur réponse immunitaire a été comparée avec celle de 128 témoins qui n'avaient pas été vaccinés auparavant. Le pourcentage de sujets qui ont obtenu un titre d'ABSh > = 1:8 était significativement plus élevé contre les sérogroupes A, W135 et Y chez ceux qui avaient reçu Men‑C‑ACYW‑135‑CRM, comparativement à ceux qui avaient reçu Men‑C‑ACYW‑135‑D et n'était pas significativement supérieur contre le sérogroupe C. Les MGT étaient aussi significativement plus élevées contre les sérogroupes A et Y chez ceux qui avaient reçu Men-C-ACYW-135-CRM plutôt que Men-C-ACYW-135-D, et n'étaient pas significativement supérieurs contre les sérogroupes C et W135. On a avancé l'hypothèse que les taux plus élevés de persistance de la réponse immunitaire induite par Men‑C‑ACYW‑135‑CRM étaient liés aux MGT plus élevées obtenues un mois après la vaccination. Le pourcentage de sujets qui avaient obtenu un titre d'ABSh > = 1:8 après une période médiane de 22 mois suivant l'administration de Men‑C‑ACYW‑135‑CRM s'établissait comme suit :
- sérogroupe A : 36 %;
- sérogroupe C : 62 %;
- sérogroupe W135 : 84 %;
- sérogroupe Y : 67 %.
IV.5.4 Adultes
Men-C-ACYW-135-CRM (MenveoMD) a également été étudié chez des adultes âgés de 19 à 55 ans par Reisinger et coll.Note en bas de page 38, qui ont utilisé une méthodologie similaire à celle de l'étude de phase III de Jackson sur des adolescents décrite ci-dessusNote en bas de page 36. En tout, 1 359 adultes ont été classés au hasard pour recevoir soit un des trois lots de Men‑C‑ACYW‑135‑CRM (MenveoMD), soit Men‑C‑ACYW‑135‑D (MenactraMD). Vu que dans l'essai sur des adolescents, les trois lots de Men‑C‑ACYW‑135‑CRM avaient donné des résultats concordants, les trois lots ont été combinés pour cette analyse.
D'après la proportion d'adultes qui ont obtenu un titre > = 1:8 un mois après la vaccination, Men‑C‑ACYW‑135‑CRM (MenveoMD) était non inférieur à Men‑C‑ACYW‑135‑D (MenactraMD) contre les quatre sérogroupes, et était supérieur contre les sérogroupes C et Y. Selon les MGT mesurées un mois après la vaccination, Men‑C‑ACYW‑135‑CRM était non inférieur à Men‑C‑ACYW‑135‑D contre les quatre sérogroupes, et était supérieur contre les sérogroupes C, W135 et Y. Une étude plus approfondie doit être effectuée pour déterminer si ces observations signifient une protection clinique supérieure contre la MI et pour vérifier l'impact sur la durée de protection.
Le pourcentage d'adultes qui ont obtenu un titre d'ABSh > = 1:8 un mois après avoir reçu Men‑C‑ACYW‑135‑CRM (MenveoMD) s'établissait comme suit :
- sérogroupe A : 69 % (IC à 95 % : 66-72 %);
- sérogroupe C : 80 % (IC à 95 % : 77-83 %);
- sérogroupe W135 : 94 % (IC à 95 % : 91-96 %);
- sérogroupe Y : 79 % (IC : 76-83 %).
Dans deux études comparatives multicentriques, Gill et coll.Note en bas de page 39 ont étudié la réponse immunitaire induite par Men‑C‑ACYW‑135‑CRM (MenveoMD) chez des adultes. Dans le groupe des 19 à 55 ans, 3 864 sujets ont été recrutés et répartis au hasard pour recevoir soit Men‑C‑ACYW‑135‑CRM, soit Men‑C‑ACYW‑135‑D (MenactraMD). Dans le groupe des 56 à 65 ans, 326 sujets ont été recrutés et classés au hasard pour recevoir soit Men‑C‑ACYW‑135‑CRM, soit le vaccin polysaccharidique quadrivalent non conjugué (Men‑P‑ACYW‑135 – Menomune®). Men‑C‑ACYW‑135‑CRM était non inférieur au vaccin de comparaison contre tous les sérogroupes, et était statistiquement supérieur contre certains sérogroupes. Dans le groupe des 56 à 65 ans, Men‑C‑ACYW‑135‑CRM a induit des moyennes géométriques des titres (MGT) qui étaient 1,4 à 5 fois supérieures à celles produites par Men‑P‑ACYW‑135.
IV.5.5 Résumé des données sur l'immunogénicité de Men-C-ACYW-135-CRM (MenveoMD)
Treize études sur l'immunogénicité de Men‑C‑ACYW‑135‑CRM (MenveoMD) avec ou sans adjuvant ont été passées en revue; dans certaines, le vaccin avait été administré en même temps que d'autres vaccins adaptés à l'âge; les sujets étaient âgés de 2 mois à 65 ans. Ces études sont résumées au tableau 8.
Men-C-ACYW-135-CRM s'est révélé immunogène chez les nourrissons et les tout-petits; mais comme l'a souligné le CCNI, la réponse immunitaire diminue chez les nourrissons qui ont été vaccinés avant l'âge de un an – d'où la nécessité d'administrer une dose de rappel durant la deuxième année de vie (entre l'âge de 12 et 23 mois).
Men-C-ACYW-135-CRM a été comparé chez des sujets de 2 à 65 ans avec des vaccins polysaccharidiques quadrivalents non conjugués (Men‑P‑ACYW‑135 - Menomune®) et/ou l'autre vaccin conjugué quadrivalent existant contre le méningocoque, Men‑C‑ACYW‑135‑D (MenactraMD). Dans toutes les comparaisons portant sur les sérogroupes C, Y et W135 et dans la plupart des comparaisons portant sur le sérogroupe A, Men‑C‑ACYW‑135‑CRM était non inférieur à ces vaccins et, dans plusieurs cas, il produisait une réponse immunitaire statistiquement supérieure. On ignore ce que cette réponse immunitaire plus forte implique sur le plan de l'efficacité clinique, et notamment en ce qui concerne la durée de protection.
IV.6 Calendrier, posologie et voie d'administration de Men-C-ACYW-135-CRM (MenveoMD)
La dose de Men‑C‑ACYW‑135‑CRM (MenveoMD) est de 0,5 ml à injecter par voie intramusculaire (IM). L'administration d'une seule dose de Men‑C‑ACYW‑135‑CRM (MenveoMD) est approuvée chez les personnes de 2 à 55 ans. Voir la section « Recommandations » pour les autres usages possibles.
IV.7 Doses de rappel et revaccination
Les anticorps circulants sont considérés comme nécessaires pour protéger une personne contre une MI. La protection indirecte (des personnes non vaccinées) conférée par l'immunité collective contribue également à réduire la fréquence de la MI lorsque des programmes de vaccination contre le méningocoque sont offerts.
Le CCNI a déjà recommandé l'administration d'une dose pour adolescents du vaccin conjugué contre le méningocoque, même si un sujet a déjà reçu le vaccin conjugué contre le sérogroupe C durant sa première ou deuxième année de vie. On n'a pas encore déterminé s'il est nécessaire d'administrer d'autres doses de rappel après l'adolescence; cela dépendra de la durée de la protection assurée par la dose du vaccin conjugué à l'adolescence et du fardeau de la méningococcie dans les groupes plus âgés.
L'Advisory Committee on Immunization Practices, aux États-Unis, a recommandé que les sujets qui ont déjà reçu le vaccin quadrivalent contre le méningocoque à l'âge ≥ 7 ans, et qui courent un risque accru sur une longue période, soient revaccinés 5 ans après la dernière dose reçue; et que les personnes qui ont déjà été vaccinées entre 2 et 6 ans, et qui courent un risque accru sur une longue période, soient revaccinées trois ans après leur dernière doseNote en bas de page 40. En outre, ce comité a recommandé l'administration d'une dose de rappel du vaccin quadrivalent à l'âge de 16 ans aux personnes qui ont reçu le vaccin quadrivalent systématiquement administré à l'âge de 11 ou 12 ans; et la série primaire de 2 doses à 2 mois d'intervalle, dans le cas des personnes de 2 à 54 ans qui présentent certains problèmes de santé à risque élevéNote en bas de page 13. Il convient de noter qu'à la différence du Canada, les États-Unis ne disposent pas d'un programme de vaccination des nourrissons ou des tout-petits contre le méningocoque.
En se basant sur l'opinion d'experts, le CCNI recommande le calendrier de revaccination suivant pour les personnes présentant un risque élevé en raison d'une exposition continue ou récurrente possible à la méningococcie (employés de laboratoires de recherche, de laboratoires industriels et cliniques qui peuvent être couramment exposés à N. meningitidis; pour les voyageurs ou membres du personnel militaire qui demeurent ou retournent à des endroits où le vaccin contre le méningocoque est recommandé), et pour les personnes présentant un risque élevé en raison de problèmes médicaux sous-jacents (asplénie; déficit en complément, en properdine, en facteur D ou en anticorps primaires; ou VIH) :
- Pour les personnes ayant été vaccinées à 6 ans ou moins : donner une dose de rappel de 3 à 5 ans après la dernière dose, suivie d'une autre tous les 5 ans.
- Pour les personnes ayant été vaccinées à 7 ans ou plus : donner une dose de rappel 5 ans après la dernière dose, suivie d'une autre tous les 5 ans.
- Les voyageurs ayant l'intention de participer au hadj devraient vérifier les recommandations concernant la revaccination à l'adresse Ministry of Hajj - Kingdom of Saudi Arabia, car une revaccination plus fréquente pourrait être exigée.
Un vaccin conjugué quadrivalent contre le méningocoque devrait être utilisé pour la revaccination; et d'après l'opinion d'experts, tant Men‑C‑ACYW‑135‑D (MenactraMD) que Men‑C‑ACYW‑135‑CRM (MenveoMD) peuvent être administrés, peu importe le vaccin antiméningococcique reçu lors de la vaccination initiale.
Pour les personnes déjà vaccinées ayant été en contact étroit ou pendant les éclosions, la revaccination selon les directives suivantes est recommandée, d'après l'opinion d'experts :
- Les personnes ayant déjà été vaccinées avec un sérogroupe n'étant pas le même que le cas de référence ou la souche à l'origine de l'éclosion devraient recevoir immédiatement le vaccin approprié (comme l'indique la recommandation 3 ci-dessous);
- Les personnes ayant déjà été vaccinées avec un sérogroupe qui est le même que le cas de référence ou la souche à l'origine de l'éclosion devraient être revaccinées avec le vaccin approprié (comme l'indique la recommandation 3 ci-dessous) :
- si elles avaient moins d'un an au moment du dernier vaccin contre le méningocoque et si plus de quatre semaines se sont écoulées depuis l'administration du dernier vaccin contre le méningocoque;
- si elles présentent un problème médical sous-jacent les mettant à risque de contracter la méningococcie et si plus de quatre semaines se sont écoulées depuis l'administration du dernier vaccin contre le méningocoque;
- si plus d'une année s'est écoulée depuis le dernier vaccin contre le méningocoque si elles avaient plus d'un an au moment du dernier vaccin contre le méningocoque et aucun problème médical sous-jacent les mettant à risque de contracter une méningococcie.
IV.8 Test sérologiques
Une sérologie n'est pas indiquée avant ou après la vaccination systématique.
IV.9 Conditions d'entreposage de Men-C-ACYW-135-CRM (MenveoMD)
MenveoMD doit être conservé au réfrigérateur à une température entre 2 ºC et 8 ºC et demeurer à l'abri de la lumière. On ne doit pas congeler MenveoMD; le jeter s'il a été congelé par inadvertance. Une fois reconstitué, l'utiliser immédiatement, mais il peut être conservé à une température égale ou inférieure à 25 ºC durant 2 heures au maximum.
Prière de se reporter à la section « Description et composition de Men‑C‑ACYW‑135‑CRM (MenveoMD) » ci-dessus pour les instructions relatives à la reconstitution. Le composant conjugué liquide contre le méningocoque des groupes C, W135 et Y peut avoir une date de péremption différente de celle du composant conjugué en poudre contre le méningocoque du groupe A. Le produit ne devrait pas être utilisé après la date indiquée sur l'extérieur de l'emballage.
IV.10 Administration simultanée d'autres vaccins
IV.10.1 Men-C-ACYW-135-CRM (MenveoMD)
Les nourrissons recrutés dans l'essai clinique de phase II dont les résultats ont été décrits par Snape et coll.Note en bas de page 28 et Perrett et coll.Note en bas de page 31 ont reçu d'autres vaccins réguliers prévus pour les enfants en même temps que Men‑C‑ACYW‑135‑CRM avec ou sans adjuvant. Au Canada, les nourrissons ont reçu le vaccin conjugué 7-valent contre le pneumocoque (Prevnar®, Vaccins Pfizer), le vaccin contre l'hépatite B (Recombivax®, Merck and Co.) et le vaccin contre la diphtérie, le tétanos, la polio, le vaccin acellulaire contre la coqueluche et contre Haemophilus influenzae de type b (Hib) (Pentacel®, sanofi pasteur). À l'âge de 12 mois, ils ont reçu le RRO (MMR II®, Merck and Co.) avec la dose de rappel de Men‑C‑ACYW‑135‑CRM. Au R.-U., les nourrissons ont reçu le vaccin contre la diphtérie, le tétanos, la polio, le vaccin acellulaire contre la coqueluche et contre Hib (Pediacel®, sanofi pasteur), de même que le vaccin Men‑C‑ACYW‑135‑CRM avec adjuvant. Dans l'étude de Snape et coll., un mois après la fin de la série primaire de ces vaccins administrés simultanément, la réponse immunitaire s'est révélée excellente (> = 90 % ont obtenu le corrélat de protection pour les vaccins administrés simultanément). Dans le groupe canadien de l'étude de Perrett et coll., seules les deux premières doses de la série primaire de Pentacel®, de Prevnar® et de Recombivax® (doses à l'âge de 2 et de 4 mois) ont été administrées avant les tests sanguins pratiqués à l'âge de 5 mois. Les réponses immunitaires étaient néanmoins très bonnes contre la plupart des antigènes administrés simultanément, sauf la réponse à certains sérotypes pneumococciques et à Hib (où une très bonne réponse a été obtenue après les trois doses de Pediacel® à l'âge de 2, 3 et 4 mois au R.-U.).
Une étude comparative randomisée effectuée par Arguedas et coll.Note en bas de page 41 et portant sur 1 620 adolescents du Costa Rica âgés de 11 à 18 ans a examiné l'effet de l'administration concomitante de Men‑C‑ACYW‑135‑CRM (MenveoMD) et du vaccin quadrivalent contre le virus du papillome humain (VPH) (GardasilMD - Merck & Co.) et d'un vaccin contre le tétanos, la diphtérie et d'un vaccin acellulaire contre la coqueluche (dcaT) (Boostrix® - GlaxoSmithKline). D'autres groupes ont reçu Men‑C‑ACYW‑135‑CRM uniquement un mois avant le dcaT ou encore Men‑C‑ACYW‑135‑CRM un mois après le dcaT. La réponse immunitaire a été mesurée un mois après la vaccination.
Des taux similaires de réactions locales ont été obtenus lorsque les trois vaccins ont été administrés lors de la même visite ou lorsque Men‑C‑ACYW‑135‑CRM a été donné un mois avant ou après le dcaT. Le taux de réactions générales s'élevait à 58 % lorsque Men‑C‑ACYW‑135‑CRM était administré en même temps que les autres vaccins,; à 51 % lorsqu'il était administré seul, ou à 43 % lorsqu'il était administré après le dcaT. Il n'existait aucun lien possible ou probable entre un effet secondaire grave et le vaccin Men‑C‑ACYW‑135‑CRM.
L'immunogénicité du vaccin contre les types 6, 11, 16 et 18 du VPH, du vaccin contre le méningocoque A, C et Y et du vaccin contre la diphtérie et le tétanos était similaire, peu importe le calendrier d'administration. Or, les moyennes géométriques des concentrations étaient plus élevées lorsque le vaccin contre la diphtérie était administré en même temps que Men‑C‑ACYW‑135‑CRM et le vaccin contre le VPH que lorsque d'autres calendriers étaient utilisés. L'anatoxine coquelucheuse, l'hémagglutinine filamenteuse et la pertactine ont produit des réponses significativement plus fortes (d'après les moyennes géométriques des concentrations) lorsque le dcaT a été administré un mois après Men‑C‑ACYW‑135‑CRM que lorsqu'il était administré seul. Après l'administration concomitante du dcaT et de Men‑C‑ACYW‑135‑CRM et du vaccin contre le VPH, la moyenne géométrique de concentration de l'hémagglutinine filamenteuse et de la pertactine était significativement plus faible que dans le groupe qui avait reçu uniquement le dcaT. L'intérêt clinique de cette observation demeure obscur. Lorsqu'on évaluait le pourcentage de vaccinés qui avaient obtenu un titre d'ABSh > = 1:8, tous les calendriers produisaient une réponse immunitaire similaire contre les sérogroupes du méningocoque. Cependant, si la séroréponse était utilisée comme mesure de l'immunité, la réponse au sérogroupe W135 était plus faible lorsque Men‑C‑ACYW‑135‑CRM était administré un mois après le dcaT que lorsque les deux vaccins étaient donnés en même temps ou lorsque Men‑C‑ACYW‑135‑CRM était le seul à être administré. On ignore encore quel est l'intérêt clinique de ces observations.
Des résultats similaires ont été obtenus dans une étude menée par Gasparini et coll.Note en bas de page 42 chez 1 072 adolescents et jeunes adultes âgés de 11 à 25 ans qui ont été classés au hasard dans l'un des trois groupes suivants :
- Groupe 1 – Men-C-ACYW-135-CRM (MenveoMD) et dcaT (Boosterix® - GlaxoSmithKline) administrés en même temps;
- Groupe 2 – dcaT administré avec un placebo;
- Groupe 3 – Men-CACYW-135-CRM administré avec un placebo.
On n'a observé aucun effet secondaire d'intérêt clinique après l'administration de ces vaccins. Dans l'ensemble, les réactions locales et générales étaient plus fréquentes dans le groupe qui avait reçu le dcaT et Men‑C‑ACYW‑135‑CRM en même temps et dans le groupe qui avait reçu uniquement le dcaT, comparativement au groupe ayant reçu Men‑C‑ACYW‑135‑CRM.
Des réponses significativement plus fortes contre la diphtérie ont été relevées dans le groupe ayant reçu les deux vaccins en même temps. La réponse à deux des antigènes coquelucheux (anatoxine coquelucheuse et pertactine) était légèrement plus faible dans le groupe doublement vacciné que dans le groupe ayant reçu uniquement le dcaT. La réponse à l'anatoxine tétanique et aux sérogroupes du méningocoque n'a pas été modifiée par l'administration simultanée des deux vaccins.
IV.10.2 Men-C-ACYW-135-D (MenactraMD)
Dans le cadre d'une étude comparative randomisée, multicentrique et ouverte effectuée par Reisinger et coll.Note en bas de page 43, 394 garçons et 648 filles âgés de 10 à 17 ans ont été répartis au hasard dans l'un des deux groupes suivants :
- Le groupe A a reçu le vaccin quadrivalent contre le virus du papillome humain (Gardasil® – Merck and Co., Inc.) le jour 1 et les mois 2 et 6; Men‑C‑ACYW‑135‑D (MenactraMD) et le vaccin antidiphtérique, antitétanique et acellulaire contre la coqueluche (dcaT – AdacelMD – sanofi pasteur) ont également été administrés le jour 1.
- Le groupe B a reçu le vaccin contre le virus du papillome humain le jour 1 et aux mois 2 et 6; Men‑C‑ACYW‑135‑D et le dcaT ont été administrés le mois 1.
Le jour 1, le vaccin contre le VPH a été administré dans un bras des sujets du groupe A; et Men‑C‑ACYW‑135‑D et le dcaT, dans le bras opposé. Le mois 1, les sujets du groupe B ont reçu Men‑C‑ACYW‑135‑D et le dcaT dans le même bras, soit le bras opposé à celui où avait été administré le vaccin contre le VPH le jour 1. Des échantillons de sang ont été prélevés dans le groupe A le jour 1 et les mois 1 et 7; et dans le groupe B, le jour 1 et les mois 1, 2 et 7.
L'administration concomitante des trois vaccins n'a entraîné aucun problème d'innocuité, aucun effet secondaire grave n'ayant été signalé par la suite. Les seules différences significatives sur le plan statistique relevées dans l'étude étaient les suivantes : un œdème était plus fréquent dans le bras des sujets qui avaient reçu le vaccin contre le VPH le jour 1 lorsque les trois vaccins étaient administrés en même temps (groupe A) (10,9 %), que lorsque le vaccin contre le VPH était administré seul (groupe B) (6,9 %); et il y avait plus de cas de douleur dans le groupe A que dans le groupe B (81,9 % contre 75,6 %), et plus d'ecchymoses dans le groupe A que dans le groupe B (5,8 % contre 2,2 %) dans le bras dans lequel Men‑C‑ACYW‑135‑D et le dcaT avaient été injectés.
La réponse immunitaire dans le groupe A était non inférieure à celle dans le groupe B contre tous les antigènes. Il convient de noter que le groupe B a reçu Men‑C‑ACYW‑135‑D et le dcaT le même jour, de sorte qu'on ne peut comparer la réponse immunitaire de chacun de ces vaccins administrés seuls.
IV.10.3 13-valent contre la pneumocoque et vaccins conjugués contre le méningocoque contenant le protéine CRM197
Selon une étude réalisée par Diez-Domingo et coll.Note en bas de page 44, l'immunité contre le méningocoque du groupe C était moins grande lorsque le vaccin antipneumococcique 13-valent conjugué avec la protéine CRM197 était administré en même temps qu'un vaccin conjugué monovalent contre le méningocoque qui contenait la protéine CRM197 que lorsque le vaccin conjugué 7-valent contre le pneumocoque était administré en même temps que le même vaccin conjugué contre le méningocoque du groupe C. L'étude a porté sur 621 nourrissons espagnols âgés de 2 mois. Le calendrier de vaccination était le suivant : vaccins conjugués contre le pneumocoque et contre le méningocoque du groupe C à l'âge de 2 et de 4 mois; vaccin contre pneumocoque seulement à l'âge de 6 mois et vaccins contre le pneumocoque et le méningocoque du groupe C à l'âge de 15 mois. Les nourrissons ont été répartis au hasard pour recevoir soit le vaccin conjugué 7-valent, soit 13-valent contre le pneumocoque. D'autres vaccins réguliers ont été administrés simultanément. À l'âge de 5 mois, les MGT contre le méningocoque du groupe C étaient plus faibles dans le groupe qui avait reçu le vaccin 13-valent plutôt que le vaccin 7-valent (191 [IC à 95 % : 168-218] comparativement à 266 [IC à 95 % : 235-302], respectivement). La différence dans les MGT était plus marquée à l'âge de 16 mois : la MGT contre le méningocoque du groupe C s'élevait à 432 (IC à 95 % : 361-517) dans le groupe qui avait reçu le vaccin 13-valent contre le pneumocoque comparativement à 731 (IC à 95 % : 642-832) dans le groupe qui avait reçu le vaccin antipneumococcique 7-valent. Cependant, la proportion de répondants était de > 97 % dans les deux groupes. Il se peut que la plus grande quantité de CRM197 dans le vaccin 13-valent nuise à la réponse aux vaccins contre le méningocoque C contenant la protéine CRM197Note en bas de page 45. On ignore quel est l'intérêt clinique de cette observation en ce qui a trait à l'administration concomitante des vaccins conjugués à la protéine CRM197 contre le méningocoque C ou Men‑C‑ACYW‑135‑CRM (MenveoMD) avec le vaccin conjugué 13-valent contre le pneumocoque. D'autres études sur l'administration simultanée de ce vaccin s'imposent.
IV.11 Innocuité et effets secondaires des vaccins
IV.11.1 Men-C-ACYW-135-CRM (MenveoMD)
Onze études sur l'innocuité et la réactogénicité de Men‑C‑ACYW‑135‑CRM avec ou sans adjuvant ont été passées en revue; dans certaines d'entre elles, d'autres vaccins ont été administrés en même temps. Les données sur l'innocuité et sur les effets secondaires sont résumées au tableau 8. Aucun problème d'innocuité n'a été associé à l'utilisation de Men‑C‑ACYW‑135‑CRM (MenveoMD). Dans presque toutes les études où l'on a comparé ce vaccin (avec ou sans adjuvant), soit avec le vaccin conjugué monovalent contre le méningocoque du groupe C, soit avec le vaccin polysaccharidique quadrivalent non conjugué (Men‑P‑ACYW‑135 – Menomune®), soit avec l'autre vaccin conjugué quadrivalent existant contre le méningocoque (Men‑C‑ACYW‑135‑D − MenactraMD), le taux d'effets secondaires locaux et généraux était similaire. Dans toutes les études sauf une, aucun effet secondaire grave n'a été attribué par les chercheurs à Men‑C‑ACYW‑135‑CRM.
Dans l'étude où Men‑C‑ACYW‑135‑CRM avec adjuvant a été administré à des nourrissonsNote en bas de page 28, les chercheurs ont signalé deux effets secondaires graves qu'ils jugeaient liés au vaccin : purpura thrombocytopénique et tachycardie supraventriculaire. L'enfant qui a présenté un purpura thrombocytopénique avait contracté antérieurement une infection virale, et le purpura a disparu spontanément. L'enfant atteint de tachycardie supraventriculaire avait des antécédents de tachycardie supraventriculaire récurrente et a été recruté à l'encontre des critères d'exclusion de l'étude. D'après les renseignements fournis, il est possible que ces deux événements soient liés à des affections antérieures chez les sujets vaccinés.
Aucune augmentation du risque de syndrome de Guillain-Barré (SGB) n'a été relevée dans les essais cliniques portant sur Men‑C‑ACYW‑135‑CRM (MenveoMD).
IV.11.2 Men-C-ACYW-135-D (MenactraMD)
En se fondant sur les résultats de la surveillance passive aux États-Unis, le CCNI a recommandé par le passé la prudence lorsqu'on administrait Men‑C‑ACYW‑135‑D (MenactraMD) à des personnes ayant des antécédents de SGBNote en bas de page 3. Selon les recommandations actuelles du CCNI, le vaccin Men‑C‑ACYW‑135‑D (MenactraMD) peut être administré en toute sécurité aux personnes ayant des antécédents de SGB, comme l'ont montré les résultats de deux vastes études américaines sur MenactraMD, qui seront décrites ci-dessous.
La Meningococcal Vaccine Study a été coordonnée par le Harvard Pilgram Health Institute. Elle a suivi 12 589 910 sujets âgés de 11 à 21 ans participant à cinq régimes d'assurance santé américains pendant 18 322 800 personnes-année. En tout, 1,4 million de doses de Men‑C‑ACYW‑135‑D ont été administrées, et 99 cas de SGB ont été confirmés. Aucun des cas des SGB n'est survenu dans les 6 semaines suivant la réception de Men‑C‑ACYW‑135‑DNote en bas de page 46. La seconde étude se fonde sur le Vaccine Safety Datalink (VSD), une collaboration entre les Centers for Disease Control and Prevention (CDC) et huit grandes organisations de soins intégrés aux États-Unis. Depuis 2005, le VSD surveille la survenue du SGB 1 à 42 jours après la réception du vaccin Men‑C‑ACYW‑135‑D chez les adolescents de 11 à 19 ans. Au moment de l'analyse, 889 684 doses de Men‑C‑ACYW‑135‑D avaient été administrées aux huit endroits, et aucun cas vérifié de SGB n'avait été recensé dans les 42 jours suivant la vaccinationNote en bas de page 47.
IV.12 Contre-indications et precautions dans le cas de Men-C-ACYW-135-CRM (MenveoMD)
L'usage de ce produit est contre-indiqué chez tous les sujets qui ont des antécédents de réaction anaphylactique à une dose antérieure du vaccin contre le méningocoque, à tout vaccin qui contient l'anatoxine diphtérique ou la protéine CRM197, ou à tout composant de Men‑C‑ACYW‑135‑CRM (MenveoMD).
La présence d'une maladie fébrile aiguë grave justifie le report de la vaccination jusqu'à ce que les symptômes aient disparu.
Les vaccins conjugués n'ont pas été étudiés chez les femmes enceintes, et on dispose de données très limitées sur l'usage de Men‑C‑ACYW‑135‑CRM (MenveoMD) durant la grossesse; dans des circonstances où les avantages l'emportent sur les risques, l'administration de ce vaccin peut cependant être envisagée.
IV.13 Interchangeabilité des vaccins contre la méningocoque
On peut citer plusieurs exemples où plus d'un type de vaccin contre le méningocoque a été administré à la même personne. Men‑C‑ACYW‑135‑CRM avec ou sans adjuvant a été donné après des vaccins conjugués contre le méningocoque du groupe C et a produit une excellente réponse anamnestique contre le sérogroupe CNote en bas de page 28Note en bas de page 32. De même, Men‑C‑ACYW‑135‑D (MenactraMD) a induit une excellente réponse anamnestique après l'administration du vaccin conjugué contre le méningocoque du groupe CNote en bas de page 48. Les vaccins bivalents non conjugués (contre les sérogroupes A et C) ou polysaccharidiques quadrivalents sont souvent administrés après les vaccins conjugués pour simuler une exposition à la maladie et induire une bonne réponse anamnestiqueNote en bas de page 19Note en bas de page 21Note en bas de page 23Note en bas de page 28Note en bas de page 31.
Selon l'opinion d'experts, si un vaccin quadrivalent contre le méningocoque est retenu pour la dose destinée aux adolescents, Men‑C‑ACYW‑135‑CRM (MenveoMD) ou Men‑C‑ACYW‑135‑D (MenactraMD) peuvent être utilisés, peu importe le vaccin antiméningococcique qui a été administré précédemment.
On ne dispose d'aucune donnée sur l'utilisation de Men‑C‑ACYW‑135‑CRM (MenveoMD) après Men‑C‑ACYW‑135‑D (MenactraMD), ou vice versa. Selon l'opinion d'experts, s'il est nécessaire de revacciner un sujet à l'aide d'un vaccin conjugué quadrivalent, on peut utiliser l'un ou l'autre produit dans n'importe quel ordre.
V. Recommandations
V.1 Adolescents
Le CCNI continue de recommander que tous les adolescents canadiens reçoivent une dose du vaccin conjugué contre le méningocoque vers l'âge de 12 ans, même s'ils ont déjà été vaccinés durant leur première ou deuxième année de vie. On pourra opter pour un vaccin conjugué monovalent contre le méningocoque du groupe C ou un vaccin conjugué quadrivalent, selon l'épidémiologie locale ou d'autres considérations liées aux programmes. Si le choix se porte sur un vaccin conjugué quadrivalent, on peut utiliser soit Men‑C‑ACYW‑135‑D (MenactraMD), soit Men‑C‑ACYW‑135‑CRM (MenveoMD).
Recommandation du CCNI de catégorie B
V.2 Groupes à risque élevé
Comme nous l'avons recommandé précédemment, les personnes qui présentent les facteurs de risque suivants devraient recevoir le vaccin conjugué quadrivalent contre le méningocoque :
- personnes présentant une asplénie anatomique ou fonctionnelle (notamment une drépanocytose);
- personnes présentant un déficit en complément, en properdine, en facteur D ou en anticorps primaires;
- personnes présentant un déficit en complément acquis (p. ex. personnes recevant de l'éculizumab (SolirisMD);
- voyageurs pour qui le vaccin contre le méningocoque est recommandé (ceinture de méningite de l'Afrique subsaharienne) ou requis (pèlerins qui se rendent à La Mecque durant le hadj);
- employés de laboratoires de recherche, de laboratoires industriels ou de laboratoires cliniques fréquemment exposés à N. meningitidis;
- membres du personnel militaire pendant la formation des recrues et certains déploiements (les membres du personnel militaire peuvent présenter un risque accru lorsqu'ils doivent vivre dans des espaces restreints ou qu'ils sont déployés dans des pays où la maladie est endémique ou qui sont touchés par une épidémie).
Recommandation du CCNI de catégorie B
Le CCNI a déclaré précédemment que l'administration du vaccin conjugué quadrivalent contre le méningocoque pouvait être envisagée dans le cas des personnes infectées par le VIH.
Recommandation du CCNI de catégorie B
Considérations liées à l'âge s'appliquant aux groupes à risque élevé ci-dessus :
Lorsqu'on examine les considérations suivantes liées à l'âge qui s'appliquent aux groupes à risque élevé ci-dessus, il convient de rappeler que tant MenveoMD que MenactraMD ont été approuvés au Canada pour les personnes âgées de 2 à 55 ans.
-
Sujets âgés de moins de 2 ans qui présentent les facteurs de risque ci-dessus
Il a été établi que Men‑C‑ACYW‑135‑CRM (MenveoMD) était sûr et immunogène chez les enfants de moins de 2 ansNote en bas de page 28Note en bas de page 31Note en bas de page 32. Men‑C‑ACYW‑135‑D (MenactraMD) n'était que modestement immunogène chez les nourrissons, mais semblait stimuler une réponse immunitaire chez la majorité des nourrissons qui avaient reçu trois dosesNote en bas de page 49. Selon les données publiées disponibles, Men-C-ACYW-135-CRM (MenveoMD) est le produit recommandé pour ce groupe d'âge. On trouvera au tableau 12 les calendriers possibles de vaccination pour les nourrissons et les jeunes enfants à risque élevé, ces calendriers étant basés sur des essais cliniques d'immunogénicité.
-
Sujets âgés de 2 à 10 ans qui présentent les facteurs de risque ci-dessus
D'après l'opinion d'experts, on peut utiliser l'un ou l'autre vaccin conjugué quadrivalent contre le méningocoque chez les enfants dans ce groupe. On recommande l'administration de deux doses à huit semaines d'intervalle pour les personnes faisant partie du groupe à risque élevé en raison de problèmes médicaux sous-jacents (asplénie; déficit en complément, en properdine, en facteur D ou en anticorps primaires; ou VIH). Un intervalle minimal entre les doses de 4 semaines peut être suivi si l'on recherche une protection rapide. Si seule une dose a été donnée dans le passé, en donner une autre le plus tôt possible et donner des doses de rappel selon les directives ci-dessous et selon le temps écoulé depuis la deuxième dose.
Pour les personnes qui ne reçoivent qu'une dose du vaccin quadrivalent contre le méningocoque (p. ex. voyageurs), le vaccin conjugué monovalent contre le méningocoque du groupe C prévu au calendrier devrait avoir déjà été administré aux enfants âgés de 2 à 10 ans; sinon, il devrait être administré au moins un mois après le vaccin conjugué quadrivalent pour assurer une protection optimale contre le sérogroupe C.
-
Sujets âgés de 11 à 55 ans qui présentent les facteurs de risque ci-dessus
D'après l'opinion d'experts, on peut utiliser l'un ou l'autre vaccin conjugué quadrivalent contre le méningocoque dans ce groupe. On recommande l'administration de deux doses à huit semaines d'intervalle pour les personnes faisant partie du groupe à risque élevé en raison de problèmes médicaux sous-jacents (asplénie; déficit en complément, en properdine, en facteur D ou en anticorps primaires; ou VIH). Un intervalle minimal entre les doses de 4 semaines peut être suivi si l'on recherche une protection rapide. Si seule une dose a été donnée dans le passé, en donner une autre le plus tôt possible et donner des doses de rappel selon les directives ci-dessous et selon le temps écoulé depuis la deuxième dose.
-
Sujets âgés de 56 ans et plus qui présentent les facteurs de risque ci-dessus
D'après l'opinion d'experts, on peut envisager d'administrer l'un ou l'autre vaccin conjugué quadrivalent contre le méningocoque dans ce groupe. On recommande l'administration de deux doses à huit semaines d'intervalle pour les personnes faisant partie du groupe à risque élevé en raison de problèmes médicaux sous-jacents (asplénie; déficit en complément, en properdine, en facteur D ou en anticorps primaires; ou VIH). Un intervalle minimal entre les doses de 4 semaines peut être suivi si l'on recherche une protection rapide. Si seule une dose a été donnée dans le passé, en donner une autre le plus tôt possible et donner des doses de rappel selon les directives ci-dessous et selon le temps écoulé depuis la deuxième dose.
Recommandation du CCNI de catégorie B
V.3 Contacts étroits et éclosions
Sérogroupe C
Pour protéger les contacts étroits de cas de MI due au sérogroupe C qui sont âgés de 11 ans ou plus et pour lutter contre les éclosions causées par le sérogroupe C chez les personnes de 11 ans et plus, on peut utiliser soit un vaccin conjugué monovalent contre le méningocoque du groupe C, soit l'un des vaccins conjugués quadrivalents existants contre le méningocoque. Pour protéger les contacts étroits des cas de MI due au sérogroupe C qui sont âgés de moins de 11 ans ou pour lutter contre les éclosions causées par le sérogroupe C chez les enfants de moins de 11 ans, un vaccin conjugué monovalent contre le méningocoque du groupe C est recommandé, car on a accumulé plus d'expérience avec ces produits.
Recommandation du CCNI de catégorie A
Sérogroupes A, W135 et Y
L'administration d'un vaccin conjugué quadrivalent contre le méningocoque est recommandée pour protéger les contacts étroits de cas de MI due aux sérogroupes A, W135 ou Y et pour lutter contre les éclosions causées par ces sérogroupes. On peut utiliser soit Men‑C‑ACYW‑135‑CRM (MenveoMD), soit Men‑C‑ACYW‑135‑D (MenactraMD) à ces fins chez les sujets âgés de 2 ans et plus.
Recommandation du CCNI de catégorie A
Pour protéger les enfants âgés de moins de 2 ans qui sont des contacts étroits d'un cas de MI due aux sérogroupes A, W135 ou Y ou pour lutter contre les éclosions causées par ces sérogroupes, on devrait utiliser Men‑C‑ACYW‑135‑CRM (MenveoMD). La protection conférée par la vaccination après l'exposition à la MI devrait durer au moins un an, car c'est la période où les contacts familiaux courent un risque accruNote en bas de page 50. On trouvera au tableau 12 des calendriers possibles pour la vaccination des nourrissons et des jeunes enfants exposés qui doivent être protégés contre les sérogroupes A, Y ou W135 ou pour la lutte contre les éclosions causées par ces sérogroupes. On ne dispose d'aucune donnée sur l'utilisation de Men‑C‑ACYW‑135‑CRM (MenveoMD) chez les nourrissons de moins de 2 mois.
Recommandation du CCNI de catégorie B
Pour les personnes déjà vaccinées ayant été en contact étroit ou pendant les éclosions, la revaccination selon les directives suivantes est recommandée d'après l'opinion d'experts :
- Les personnes qui ont déjà été vaccinées avec un sérogroupe n'étant pas le même que le cas de référence ou la souche à l'origine de l'éclosion devraient recevoir immédiatement le vaccin approprié (comme indiqué ci-dessus);
- Les personnes ayant déjà été vaccinées avec un sérogroupe qui est le même que le cas de référence ou la souche à l'origine de l'éclosion devraient être revaccinées avec le vaccin approprié (comme indiqué ci-dessus) :
- si elles avaient moins d'un an au moment du dernier vaccin contre le méningocoque et si plus de quatre semaines se sont écoulées depuis l'administration du dernier vaccin contre le méningocoque;
- si elles présentent un problème médical sous-jacent les mettant à risque de contracter la méningococcie et si plus de quatre semaines se sont écoulées depuis l'administration du dernier vaccin contre le méningocoque;
- si plus d'une année s'est écoulée depuis le dernier vaccin contre le méningocoque si elles avaient plus d'un an au moment du dernier vaccin contre le méningocoque et n'avaient aucun problème médical sous-jacent les mettant à risque de contracter une méningococcie.
Recommandation du CCNI de catégorie B
Voir le Guide canadien d'immunisation pour obtenir plus de détails concernant la vaccination de personnes ayant été en contact étroit.
V.4 Revaccination dans certaines situations à risque élevé et pour certains groupes à risque élevé
En se basant sur l'opinion d'experts, le CCNI recommande le calendrier de revaccination suivant pour les personnes présentant un risque élevé en raison d'une exposition continue ou récurrente possible à la méningococcie (employés de laboratoires de recherche, de laboratoires industriels et cliniques qui peuvent être couramment exposés à N. meningitidis; voyageurs ou membres du personnel militaire qui demeurent ou retournent à des endroits où le vaccin contre le méningocoque est recommandé) et pour les personnes présentant un risque élevé en raison de problèmes médicaux sous-jacents (asplénie; déficit en complément, en properdine, en facteur D ou en anticorps primaires; ou VIH) :
- Pour les personnes ayant été vaccinées à 6 ans ou moins : donner une dose de rappel de 3 à 5 ans après la dernière dose, suivie d'une autre tous les 5 ans.
- Pour les personnes ayant été vaccinées à 7 ans ou plus : donner une dose de rappel 5 ans après la dernière dose, suivie d'une autre tous les 5 ans.
- Les voyageurs ayant l'intention de participer au hadj devraient vérifier les recommandations concernant la revaccination à l'adresse Ministry of Hajj - Kingdom of Saudi Arabia, car une revaccination plus fréquente pourrait être exigée.
Un vaccin conjugué quadrivalent contre le méningocoque devrait être utilisé pour la revaccination et, d'après l'opinion d'experts, tant Men‑C‑ACYW‑135‑D (MenactraMD) que Men‑C‑ACYW‑135‑CRM (MenveoMD) peuvent être administrés, peu importe le vaccin antiméningococcique reçu lors de la vaccination initiale.
Recommandation du CCNI de catégorie B
Voir la recommandation 3 susmentionnée pour obtenir les recommandations en matière de revaccination des personnes déjà vaccinées ayant été en contact étroit ou pendant une éclosion.
V.5 Administration simultanée d'autres vaccins
Men‑C‑ACYW‑135‑D (MenactraMD) ou Men‑C‑ACYW‑135‑CRM (MenveoMD) peuvent être administrés lors de la même visite en même temps que tous les vaccins pour adolescents et adultes adaptés à l'âge, mais utiliser une nouvelle seringue et une aiguille différente de même qu'un point d'injection distinct. L'administration concomitante de Men‑C‑ACYW‑135‑CRM (MenveoMD) et du dcaT peut entraîner une plus faible réponse immunitaire aux antigènes coquelucheux que l'administration exclusive du dcaT; on ignore cependant quel intérêt présente cette observation sur le plan clinique. Le dcaT donné un mois après Men-C-ACYW-135-CRM (MenveoMD) induit la plus forte réponse immunitaire aux antigènes coquelucheux.
Des études indiquent que Men-C-ACYW-135-CRM (MenveoMD) peut être administré en même temps que tous les vaccins systématiques pour enfants, mais d'autres études doivent être effectuées sur l'administration concomitante du vaccin 13-valent contre le pneumocoque, en raison de l'interférence immunologique possible avec les vaccins contenant la protéine CRM197. La signification clinique de l'administration des vaccins conjugués contre le méningocoque C CRM197 ou le Men‑C‑ACYW‑135‑CRM en concomitance avec le vaccin conjugué 13-valent contre le pneumocoque n'est pas connue.
Recommandation du CCNI de catégorie B
V.6 Usage chez les patients ayant des antécédents de syndrome de Guillain-Barré (SGB)
On peut administrer en toute sécurité soit Men‑C‑ACYW‑135‑D (MenactraMD), soit Men‑C‑ACYW‑135‑CRM (MenveoMD) aux personnes qui ont des antécédents de SGB.
Recommandation du CCNI de catégorie A
VI. Priorités en matière de recherche
Des recherches devraient être effectuées afin de régler les questions suivantes :
- L'efficacité et la durée d'immunogénicité et de protection associées à Men‑C‑ACYW‑135‑CRM (MenveoMD) et à Men‑C‑ACYW‑135‑D (MenactraMD);
- Des données supplémentaires sur l'utilisation de Men‑C‑ACYW‑135‑CRM (MenveoMD) et de Men‑C‑ACYW‑135‑D (MenactraMD) chez les nourrissons et les tout-petits;
- L'innocuité, l'immunogénicité et l'efficacité de Men‑C‑ACYW‑135‑CRM (MenveoMD) et de Men‑C‑ACYW‑135‑D (MenactraMD) dans certains groupes à risque élevé comme les sujets immunodéprimés;
- L'immunogénicité et l'innocuité de Men‑C‑ACYW‑135‑CRM (MenveoMD) et de Men‑C‑ACYW‑135‑D (MenactraMD) lorsque chacun d'entre eux est administré en même temps que d'autres vaccins adaptés à l'âge, notamment des vaccins donnés aux voyageurs. Il faut effectuer des études sur l'administration concomitante des vaccins antiméningococciques contenant la protéine CRM197 et du vaccin conjugué 13-valent contre le pneumocoque.
VII. Priorités en matière de surveillance
Il faut aussi mener de la surveillance pour répondre aux questions en suspens suivantes :
- L'impact des programmes de vaccination contre le méningocoque sur l'épidémiologie de la MI au Canada.
- Les taux de couverture par les vaccins Men‑C‑ACYW‑135‑CRM (MenveoMD) et Men‑C‑ACYW‑135‑D (MenactraMD) et l'impact de ces taux de couverture sur le portage du méningocoque et l'immunité collective, qui se reflètent dans le taux de MI chez les personnes non vaccinées.
Liste d'abréviations
- ABS
- Activité bactéricide du sérum
- ABSh
- Activité bactéricide du sérum mesurée à l'aide de sérum humain comme source de complément
- ABSl
- Activité bactéricide du sérum mesurée à l'aide de sérum de lapin lapereau comme source de complément
- ASPC
- Agence de la santé publique du Canada
- CCNI
- Comité consultatif national de l'immunisation
- CDC
- Centers for Disease Control and Prevention
- MGC
- Moyenne géométrique de la concentration
- CRM 197
- Corynebacterium diphtheriae cross reacting material 197 utilisé pour conjuguer les vaccins contre le méningocoque
- DCaT
- Vaccin antidiphtérique, acellulaire contre la coqueluche et antitétanique pour les enfants
- dcaT
- Vaccin antidiphtérique, acellulaire contre la coqueluche et antitétanique pour les adolescents et les adultes
- ELISA
- Dosage immuno-enzymatique
- Hib
- Haemophilus influenzae de type b
- Ig
- Immunoglobuline
- IgG
- Immunoglobuline G
- IM
- Intramusculaire
- Men-C-ACYW-135-CRM
- Menveo MD – Produit par Novartis Vaccins
- Men-C-ACYW-135-D
- Menactra MD – Produit par sanofi pasteur
- Men-P-ACYW-135
- Menomune ® – Produit par sanofi pasteur
- MI
- Méningococcie invasive
- RRO
- Rougeole, rubéole, oreillons
- SC
- Sous-cutané
- SGB
- Syndrome de Guillain-Barré
- MGT
- Moyenne géométrique des titres
- VCP-7
- Vaccin conjugué 7-valent contre le pneumocoque
- VPH
- Virus du papillome humain
- VSD
- Vaccine Safety Datalink
Tableaux
Tableau 8: Sommaire des preuves (en date de décembre 2009) à l'appui des recommandations du CCNI
| Étude | Vaccin | Plan d'étude | Participants | Résultats | Niveau des preuves | Qualité |
|---|---|---|---|---|---|---|
Snape et coll., 2008Note en bas de page 28 Phase II |
Men-C-ACYW-135-CRM avec adjuvant En même temps que Pediacel/ Pentacel, Recombivax, Prevnar, RRO selon les calendriers d'immunisation systématique Comparé au vaccin conjugué monovalent contre le méningocoque C (Menjugate) Men-C-ACYW-135-CRM avec adjuvant utilisé à l'âge de 12 mois dans des groupes au R.-U. et certains groupes au Canada 1/5 de la dose de vaccin polysacchari-dique quadrivalent non conjugué (Menomune®) à l'âge de 12 mois dans certains groupes au Canada |
Essai comparatif randomisé ouvert R.-U. et Canada |
N = 421 sujets recrutés et répartis au hasard entre divers calendriers/ produits R.-U. : Men-C-ACYW-135-CRM avec adjuvant à l'âge de 2, 3, 4 mois ou 2, 4 mois Canada : Men-C-ACYW-135-CRM avec adjuvant à l'âge de 2, 4, 6 mois ou 2, 4 mois R.-U. : vaccin conjugué monovalent contre le méningocoque C à l'âge de 2, 4 mois Dose à 12 mois au R.-U. : Men-C-ACYW-135-CRM Provocation à 12 mois dans certains groupes au Canada avec 1/5 de la dose de Menomune® ou Men-C-ACYW-135-CRM ou aucune provocation |
ABSh > 1:4 utilisé comme mesure de l'immunité Les calendriers à trois doses donnaient de meilleures réponses immunitaires que les calendriers à deux doses Après des doses à 2, 4, 6 mois, des taux élevés d'immunité ont été obtenus un mois suivant la réception de Men-C-ACYW-135-CRM avec adjuvant; les taux contre les sérogroupes A et C étaient en baisse à l'âge de 12 mois Les MGT étaient plus élevées contre le sérogroupe C après le vaccin conjugué monovalent contre le méningocoque C Bonne réponse anamnestique à l'âge de 12 mois MGT plus faibles contre les sérogroupes A, W135 et Y chez ceux qui avaient reçu la série primaire du vaccin conjugué contre le méningocoque C puis seulement une dose de Men-C-ACYW-135-CRM à l'âge de 12 mois comparativement à ceux ayant reçu la série primaire et une dose de rappel à 12 mois de Men-C-ACYW-135-CRM avec adjuvant Pourcentages élevés (> = 90 %) d'enfants qui ont obtenu des titres protecteurs contre les antigènes administrés simultanément |
Niveau 1 |
Bonne |
Perrett et coll., 2009Note en bas de page 31 Phase II |
Men-C-ACYW-135-CRM sans adjuvant (MenveoMD) En même temps que Pediacel/ Pentacel, Recombivax, Prevnar, RRO selon les calendriers d'immunisation systématique Men-C-ACYW-135-CRM utilisé à l'âge de 12 mois au R.-U. et chez certains Canadiens 1/5 de la dose du vaccin polysacchari-dique quadrivalent non conjugué (Menomune®) à l'âge de 12 mois chez certains Canadiens |
Essai comparatif ouvert R.-U. et Canada Canadiens répartis au hasard à l'âge de 12 mois pour recevoir Men-C-ACYW-135-CRM ou 1/5 de la dose du vaccin polysacchari-dique quadrivalent |
N = 180 recrutés Ont reçu Men-C-ACYW-135-CRM à l'âge de 2, 4 mois Dose à l'âge de 12 mois au R.-U. : Men-C-ACYW-135-CRM Administration au Canada à l'âge de 12 mois de Men-C-ACYW-135-CRM ou de 1/5 de la dose du vaccin polysacchari-dique quadrivalent |
ABSh > 1:4 utilisé pour mesurer l'immunité Taux élevés d'immunité obtenus un mois après la réception de Men-C-ACYW-135-CRM, qui étaient en baisse contre tous les sérogroupes à l'âge de 12 mois Bonne réponse anamnestique à l'âge de 12 mois Pourcentages élevés d'enfants ont obtenu des titres protecteurs contre la plupart des antigènes administrés en même temps (sauf Haemophilus influenzae de type b et certains sérotypes du pneumocoque au Canada) compte tenu du fait que seulement deux doses avaient été reçues au moment du prélèvement sanguin chez les enfants canadiens |
Niveau 1 |
Bonne |
Halperin et coll.,Note en bas de page 32 Phase II |
Men-C-ACYW-135-CRM (MenveoMD) Comparé avec le vaccin conjugué monovalent contre le méningocoque C (MenjugateMD) En même temps que Pentacel, Prevnar |
Essai comparatif partiellement randomisé, ouvert Trois centres au Canada |
N = 175 répartis entre trois calendriers Sujets âgés de 6 à 12 mois au moment du recrutement Trois groupes : Men-C-ACYW-135-CRM à l'âge de 6 mois et de 12 mois; Men-C-ACYW-135-CRM à l'âge de 12 mois; Vaccin conjugué monovalent contre le méningocoque C à l'âge de 12 mois et Men-C-ACYW-135-CRM à l'âge de 18 mois |
ABSh > 1:4 utilisée pour mesurer l'immunité Men-C-ACYW-135-CRM à 6 mois et à 12 mois a induit la meilleure réponse immunitaire contre tous les sérogroupes sauf le sérogroupe C, contre lequel la réponse était meilleure avec le vaccin conjugué monovalent contre le méningocoque C à 12 mois et Men-C-ACYW-135-CRM à 18 mois Contre le sérogroupe C, le vaccin conjugué monovalent contre le méningocoque C et Men-C-ACYW-135-CRM ont induit des réponses similaires à l'âge de 12 mois Contre les sérogroupes A, W135 et Y, les réponses à une seule dose de Men-C-ACYW-135-CRM à 12 mois ou à 18 mois étaient similaires et acceptables bien qu'inférieures à la réponse obtenue avec deux doses de Men-C-ACYW-135-CRM à 6 et 12 mois |
Niveau 1 Des enfants âgés de 6 mois lors de leur recrutement ont été répartis au hasard pour recevoir soit 2 doses de Men-C-ACYW-135-CRM à 6 et 12 mois, soit une seule dose à 12 mois Les enfants âgés de 12 mois au moment du recrutement ont tous reçu le vaccin conjugué monovalent contre le méningocoque C à 12 mois et Men-C-ACYW-135-CRM à 18 mois |
Bonne |
Vesikari, T et coll.Note en bas de page 33 |
Men-C-ACYW-135-CRM Une dose contre deux Rappel avec vaccin polysacchari-dique Men-P-ACYW-135 8 mois après la vaccination |
Étude d'établisse-ment de la dose Répartition des sujets non décrite dans le résumé Essai mené en Finlande et en Allemagne |
N = 620 recrutés Sujets âgés de 12 à 16 mois Ont reçu une ou deux doses de diverses préparations Dose de rappel du vaccin polysacchari-dique quadrivalent 8 mois après la vaccination et comparaison avec des témoins non vaccinés |
ABSh > 1:4 utilisée pour mesurer l'immunité Deux doses induisaient une meilleure réponse immunitaire qu'une seule, 49 à 70 % obtenant un titre d'ABSh > 1:4 contre les divers sérogroupes après une dose et 91 à 96 % après deux doses Bonne réponse anamnestique avec vaccin polysacchari-dique quadrivalent 8 mois après la première dose |
Pas assez d'information dans cette communication pour en évaluer la fiabilité |
Pas assez d'information dans cette communication pour en évaluer la qualité |
Black et coll.Note en bas de page 27 Phase II |
Men-C-ACYW-135-CRM (MenveoMD) Comparé avec le vaccin polysacchari-dique quadrivalent non conjugué (Men-P-ACYW-135 – Menomune®) |
Essai randomisé à simple insu Oakland, Californie |
N = 619 recrutés pour recevoir un des deux vaccins Sujets âgés de 2 à 10 ans Dose unique |
ABSh > 1:4 utilisée pour mesurer l'immunité L'immunité induite par Men-C-ACYW-135-CRM était statistiquement supérieure à celle produite par Men-P-ACYW-135 1 mois et 12 mois après la vaccination contre presque tous les sérogroupes, d'après le pourcentage de sujets obtenant une ABSh > = 1:4 et des MGT Des taux élevés d'immunité ont été obtenus un mois après la réception de Men-C-ACYW-135-CRM, mais étaient en baisse contre les sérogroupes A et C 12 mois après la vaccination |
Niveau 1 |
Bonne - un seul centre |
Halperin et coll.Note en bas de page 30Note en bas de page 34 Phase III |
Men-C-ACYW-135-CRM (MenveoMD) comparé à Men-C-ACYW-135-D (MenactraMD) Des sujets de 2 à 5 ans ont reçu une dose ou deux doses de Men-C-ACYW-135-CRM ou une dose de Men-C-ACYW-135-D Des sujets de 6 à 10 ans ont reçu une dose de Men-C-ACYW-135-CRM ou de Men-C-ACYW-135-D |
Essai randomisé partiellement à l'insu des observateurs |
N = 2 907 enfants de 2 à 10 ans |
ABSh > 1: 8 utilisée pour mesurer l'immunité Comparaison de Men-C-ACYW-135-CRM avec Men-C-ACYW-135-D en utilisant le pourcentage de sujets obtenant un titre d'ABSh > = 1:8; réponse plus faible contre le sérogroupe A, non inférieure contre le sérogroupe C et statistiquement supérieure contre les sérogroupes W135 et Y D'après les MGT, Men-C-ACYW-135-CRM était non inférieur à Men-C-ACYW-135-D contre le sérogroupe A et statistiquement supérieur contre les sérogroupes C, W135 et Y Chez les 2 à 5 ans, 2 doses de Men-C-ACYW-135-CRM données à 60 jours d'intervalle ont produit une meilleure réponse immunitaire qu'une seule dose |
Niveau 1 |
Bonne |
Jackson et coll., 2009 Phase IINote en bas de page 35 |
Men-C-ACYW-135-CRM avec adjuvant Men-C-ACYW-135-CRM sans adjuvant (MenveoMD) Comparés avec le vaccin polysacchari-dique quadrivalent non conjugué (Men-P-ACYW-135 - Menomune®) |
Essai comparatif randomisé à simple insu 3 endroits aux É.-U. |
N = 524 recrutés pour recevoir un des trois vaccins Sujets de 11 à 17 ans Une seule dose |
ABSh > 1:4 et > 1: 8 utilisée pour mesurer l'immunité Men-C-ACYW-135-CRM avec ou sans adjuvant était statistiquement supérieur à Men-P-ACYW-135 contre presque tous les sérogroupes un mois après la vaccination Men-C-ACYW-135-CRM avec et sans adjuvant induisait des réponses immunitaires similaires 1 mois après la vaccination Men-C-ACYW-135-CRM sans adjuvant (MenveoMD) était associé à une bonne persistance de l'immunité contre tous les sérogroupes sauf le sérogroupe A 12 mois après la vaccination |
Niveau 1 |
Bonne |
Jackson et coll., 2009Note en bas de page 36 Phase III |
Men-C-ACYW-135-CRM sans adjuvant (MenveoMD) Comparé avec Men-C-ACYW-135-D (MenactraMD) |
Essai comparatif randomisé à l'insu des observateurs 44 centres aux É.-U. |
N = 2180 recrutés pour recevoir un des deux vaccins, mais les sujets n'ont pas été testés pour tous les sérogroupes à cause de la quantité limitée de complément humain Sujets de 11 à 18 ans Une seule dose |
ABSh > 1: 8 utilisée pour mesurer l'immunité D'après le pourcentage ayant obtenu un titre d'ABSh > = 1:8 un mois après la vaccination, Men-C-ACYW-135-CRM était supérieur à Men-C-ACYW-135-D contre tous les sérogroupes sauf C, contre lequel il était non inférieur D'après les MGT un mois après la vaccination, Men-C-ACYW-135-CRM était supérieur à Men-C-ACYW-135-D contre tous les sérogroupes |
Niveau 1 |
Bonne |
Gill et coll.Note en bas de page 37 |
Men-C-ACYW-135-CRM sans adjuvant (MenveoMD) Comparé avec Men-C-ACYW-135-D (MenactraMD) Témoins non vaccinés appariés pour l'âge |
Médiane de 22 mois de suivi d'un sous-ensemble de sujets ayant participé à l'étude de phase III de Jackson ci-dessusNote en bas de page 36 |
278 personnes de 11 à 18 ans ont reçu Men-C-ACYW-135-CRM 191 personnes de 11 à 18 ans ont reçu Men-C-ACYW-135-D 128 témoins non vaccinés |
Après une période médiane de 22 mois suivant la vaccination, le pourcentage de sujets ayant un titre d'ABSh > 1: 8 était significativement supérieur avec Men-C-ACYW-135-CRM comparativement à Men-C-ACYW-135-D contre le sérogroupe A, W135 et Y et non significativement supérieur contre le sérogroupe C; les MGT étaient significativement plus élevées avec Men-C-ACYW-135-CRM comparativement à Men-C-ACYW-135-D contre les sérogroupes A et Y et non significativement supérieurs contre les sérogroupes C et W135 |
Niveau 1 |
Bonne |
Reisinger et coll., 2009 Phase IIINote en bas de page 38 |
Men-C-ACYW-135-CRM sans adjuvant (MenveoMD) Comparé avec Men-C-ACYW-135-D (MenactraMD) |
Essai comparatif randomisé 44 centres aux É.-U. |
N = 1359 recrutés pour recevoir un des deux vaccins Sujets de 19 à 55 ans Une seule dose |
ABSh > 1: 8 utilisée pour mesurer l'immunité Men-C-ACYW-135-CRM supérieur à Men-C-ACYW-135-D contre les sérogroupes C et Y et non inférieur contre W135 et A, d'après le pourcentage de sujets obtenant un titre d'ABSh > =1:8 un mois après la vaccination D'après les MGT un mois après la vaccination, Men-C-ACYW-135-CRM était supérieur à Men-C-ACYW-135-D contre tous les sérogroupes sauf A, contre lequel Men-C-ACYW-135-CRM était non inférieur |
Niveau 1 |
Bonne |
Gill, CJ et coll.Note en bas de page 39 |
Men-C-ACYW-135-CRM sans adjuvant (MenveoMD) chez des sujets de 19 à 65 ans Comparé avec Men-C-ACYW-135-D (MenactraMD) chez des sujets de 19 à 55 ans Comparé avec le vaccin polysacchari-dique quadrivalent non conjugué (Men-P-ACYW-135 - Menomune®) chez des sujets de 56 à 65 ans |
Deux essais comparatifs randomisés multicentriques à l'insu des observateurs Menés aux É.-U. et en Amérique latine |
N = 3864 sujets de 19 à 55 ans et 326 sujets de 56 à 65 ans |
Men-C-ACYW-135-CRM non inférieur aux deux vaccins de comparaison contre tous les sérogroupes, d'après des paramètres primaires, et statistiquement supérieur contre certains sérogroupes Dans le groupe des 56 à 65 ans, les MGT étaient 1,4 à 5 fois plus élevées avec Men-C-ACYW-135-CRM qu'avec Men-P-ACYW-135 |
Niveau 1 |
Bonne Affiche seulement, difficulté à évaluer la méthodologie complète |
Arguedas, A et coll. Phase IIINote en bas de page 41 |
Men-C-ACYW-135-CRM (MenveoMD) en même temps que le dcaT et le vaccin contre le VPH Comparé avec Men-C-ACYW-135-CRM donné un mois avant ou après le dcaT avec la série contre le VPH débutant le mois suivant |
Essai comparatif randomisé ouvert Un centre au Costa Rica |
N = 1620 répartis dans un des trois groupes Sujets de 11 à 18 ans |
La séroréponse aux sérogroupes W135 et Y était plus faible un mois après la vaccination si Men-C-ACYW-135-CRM était administré un mois après le dcaT, mais le pourcentage obtenant un titre d'ABSh > =1:8 était comparable L'hémagglutinine filamenteuse et la pertactine ont induit des réponses plus faibles lorsqu'elles ont été administrées avec le vaccin que lorsque le dcaT a été administré seul Séroréponses plus fortes contre les antigènes coquelucheux si le dcaT était administré un mois après Men-C-ACYW-135-CRM |
Niveau 1 |
Bonne |
Gasparini et coll.Note en bas de page 42 |
Men-C-ACYW-135-CRM (MenveoMD) en même temps que le dcaT Comparé avec Men-C-ACYW-135-CRM seul avec un placebo et le dcaT seul avec un placebo |
Essai comparatif randomisé à l'insu des observateurs Essai multicentrique |
N = 1072 répartis dans l'un des trois groupes Sujets de 11 à 25 ans |
Anatoxine coquelucheuse, hémagglutinine filamenteuse et pertactine induisaient des réponses légèrement plus faibles si elles étaient administrées en même temps que Men-C-ACYW-135-CRM que si le dcaT était administré seul |
Niveau 1 |
Bonne |
| Étude | Vaccin | Plan d'étude | Participants | Résultats | Niveau des preuves | Qualité |
|---|---|---|---|---|---|---|
Reisinger, KS et coll.,Note en bas de page 43 2009 |
Men-C-ACYW-135-D avec le vaccin contre le VPH et le dcaT administrés en même temps Comparaison avec le vaccin contre le VPH administré seul et Men-C-ACYW-135-D et le dcaT administrés ensemble |
Essai comparatif randomisé ouvert 21 endroits aux É.-U. |
N = 394 filles et 648 garçons répartis en deux groupes Sujets de 10 à 17 ans Groupe A a reçu le vaccin contre le VPH le jour 1 et les mois 2 et 6 ainsi que Men-C-ACYW-135-D et le dcaT le jour 1; groupe B a reçu le vaccin contre le VPH le jour 1 et les mois 2 et 6 ainsi que Men-C-ACYW-135-D et le dcaT le mois 1 |
Titres d'ABS contre les sérogroupes du méningocoque (complément humain ou de lapereau non indiqué) Non-infériorité contre tous les antigènes dans le groupe ayant reçu les trois vaccins le même jour comparativement au groupe ayant reçu le vaccin contre le VPH seul ainsi que Men-C-ACYW-135-D et le dcaT le même jour un mois après la première dose du vaccin contre le VPH |
Niveau 1 |
Assez bonne - Comparaison portant sur Men-C-ACYW-135-D et le dcaT administrés ensemble plutôt que sur chaque vaccin séparément |
| Étude | Vaccin | Plan d'étude | Participants | Résultats | Niveau des preuves | Qualité |
|---|---|---|---|---|---|---|
Domingo-Diez et coll.,Note en bas de page 44 2009 |
Vaccin conjugué monovalent contre le méningocoque contenant la protéine CRM197 administré en même temps que soit le vaccin 13-valent, soit 7-valent contre le pneumocoque et d'autres vaccins systématique-ment administrés aux enfants |
Essai comparatif randomisé 35 endroits en Espagne |
N = 621 nourrissons recrutés à l'âge de 2 mois Vaccins contre le méningocoque C et le pneumocoque (soit 13-valent ou 7-valent) administrés à l'âge de 2 et de 4 mois; vaccin contre le pneumocoque administré à l'âge de 6 mois; vaccins contre le méningocoque C et le pneumocoque administrés à l'âge de 15 mois |
Titres d'ABS (complément humain ou de lapereau non indiqué) Les MGT contre le méningocoque C étaient plus faibles dans le groupe ayant reçu le vaccin 13-valent contre le pneumocoque que dans le groupe ayant reçu le vaccin 7-valent; la différence était plus marquée à l'âge de 16 mois, mais le pourcentage de répondants était > 97 % dans les deux groupes |
Niveau 1 |
Bonne - affiche |
| Étude | Vaccin | Plan d'étude | Participants | Résultats | Niveau des preuves | Qualité |
|---|---|---|---|---|---|---|
Snape et coll., 2008Note en bas de page 28 |
Voir ci-dessus Men-C-ACYW-135-CRM avec adjuvant En même temps que Pediacel/ Pentacel, Recombivax, Prevnar, RRO selon les calendriers de vaccination systématique |
Voir ci-dessus Parents ont consigné les réactions locales et générales une semaine après chaque dose du vaccin Appels aux parents dans la semaine suivant la vaccination, tous les mois entre les doses pour nourrissons et tout-petits et 6 mois après la dernière vaccination de l'étude |
Voir ci-dessus |
Les taux de réactions locales et générales après Men-C-ACYW-135-CRM avec adjuvant étaient similaires à ceux après le vaccin conjugué monovalent contre le méningocoque C (Menjugate) Deux effets secondaires graves peut-être liés à Men-C-ACYW-135-CRM avec adjuvant : purpura thrombocytopénique idiopathique et tachycardie supraventriculaire |
Niveau 1 |
Bonne |
Perrett et coll., 2009Note en bas de page 31 |
Voir ci-dessus Men-C-ACYW-135-CRM sans adjuvant En même temps que Pediacel/ Pentacel, Recombivax, Prevnar, RRO selon les calendriers d'immunisation systématique |
Voir ci-dessus Les parents ont consigné les réactions locales et générales et les médicaments pris dans les 7 jours suivant chaque dose de vaccin Les parents ont signalé toutes les consultations médicales et effets secondaires graves Appels aux parents après la vaccination, tous les mois entre les doses pour nourrissons et tout-petits et 5 mois après la dernière visite de l'étude |
Voir ci‑dessus |
Sensibilité de catégorie 3 au point d'injection chez 2 à 4 % des sujets après au moins une dose pour nourrissons et 0 à 1 % après la dose de rappel à 12 mois de Men-C-ACYW-135-CRM sans adjuvant Aucun effet secondaire grave attribué au vaccin |
Niveau 1 |
Bonne |
Halperin et coll.Note en bas de page 32 Phase II |
Men-C-ACYW-135-CRM sans adjuvant Comparé avec le vaccin conjugué monovalent contre le méningocoque C (Menjugate®) En même temps que Pentacel, Prevnar |
Voir ci‑dessus Les parents ont consigné les réactions locales et générales pendant 7 jours après chaque dose de vaccin Hospitalisa-tions et autres effets secondaires graves consignés en tout temps durant l'étude |
Voir ci‑dessus |
Aucune différence nette dans la fréquence des effets secondaires entre le vaccin monovalent conjugué contre le méningocoque C et Men-C-ACYW-135-CRM Aucun effet secondaire grave considéré comme lié au vaccin |
Niveau 1 |
Bonne |
Black et coll.Note en bas de page 27 Phase II |
Men-C-ACYW-135-CRM (MenveoMD) Comparé avec vaccin polysacchari-dique quadrivalent non conjugué (Men-P-ACYW-135 - Menomune®) |
Voir ci‑dessus Les parents ont consigné réactions locales et générales de 1 à 7 jours après la vaccination Chercheurs ont consigné les effets secondaires nécessitant l'attention d'un médecin dans le mois qui a suivi la vaccination et les événements médicalement significatifs jusqu'à 12 mois après la vaccination |
Voir ci‑dessus |
Nombre significativement plus élevé de réactions locales et générales avec Men-C-ACYW-135-CRM qu'avec Men-P-ACYW-135 Aucune réaction indésirable grave considérée comme liée au vaccin |
Niveau 1 |
Bonne - un seul centre |
Gill, CJ et coll.Note en bas de page 51, Halperin et coll.Note en bas de page 34 |
Men-C-ACYW-135-CRM (MenveoMD) comparé à Men-C-ACYW-135-D (MenactraMD) Sujets de 2 à 5 ans ont reçu une dose ou deux doses de Men-C-ACYW-135-CRM ou une dose de Men-C-ACYW-135-D Sujets de 6 à 10 ans ont reçu une dose de Men-C-ACYW-135-CRM ou de Men-C-ACYW-135-D |
Ont consigné tous les effets secondaires dans les 7 jours suivant la vaccination |
Voir ci‑dessus Étude de phase III de Halperin et coll. portant sur des enfants de 2 à 10 ans |
Pourcentage similaire d'enfants présentant des réactions locales et générales après Men-C-ACYW-135-CRM et Men-C-ACYW-135-D Aucun effet secondaire grave considéré comme lié aux vaccins à l'étude |
Niveau 1 |
Bonne |
Jackson et coll., 2009 Phase IINote en bas de page 35 |
Men-C-ACYW-135-CRM avec et sans adjuvant Comparé avec le vaccin polysacchari-dique quadrivalent non conjugué (Men-P-ACYW-135 - Menomune®) |
Voir ci‑dessus Données sur la réactogénicité recueillies par les vaccinés pendant 7 jours suivant la vaccination Entrevue téléphonique 3e jour après la vaccination Événements graves et médicalement significatifs consignés par les chercheurs pendant 12 mois |
Voir ci‑dessus |
Après Men-C-ACYW-135-CRM sans adjuvant, les nausées étaient le seul événement sollicité significativement plus fréquent qu'après Men-P-ACYW-135 Plus grand nombre d'effets secondaires non sollicités peut‑être ou probablement liés au vaccin Men-C-ACYW-135-CRM sans adjuvant comparativement à Men-P-ACYW-135 (6,6 % de vaccinés contre 2,6 %) Aucun effet secondaire grave considéré comme lié au vaccin |
Niveau 1 |
Bonne |
Jackson et coll., 2009 Phase IIINote en bas de page 36 |
Men-C-ACYW-135-CRM sans adjuvant (MenveoMD) Comparé avec Men-C-ACYW-135-D (MenactraMD) |
Voir ci‑dessus Effets secondaires locaux et généraux consignés par les vaccinés pendant les 7 jours suivant la vaccination Rappel téléphonique le jour 3 suivant la vaccination Événements graves et médicalement significatifs consignés par les chercheurs pendant 6 mois |
Voir ci‑dessus |
Fréquence d'effets secondaires locaux et généraux sollicités similaire dans les groupes ayant reçu Men-C-ACYW-135-CRM et Men-C-ACYW-135-D, une douleur au point d'injection étant signalée chez 44 % des sujets ayant reçu Men-C-ACYW-135-CRM et chez 53 % des sujets ayant reçu Men-C-ACYW-135-D; la plupart des réactions étaient bénignes Taux similaires d'effets secondaires non sollicités dans les deux groupes Aucun effet secondaire grave considéré comme lié aux vaccins à l'étude |
Niveau 1 |
Bonne |
Reisinger et coll., 2008Note en bas de page 38 |
Men-C-ACYW-135-CRM sans adjuvant MenveoMD Comparé avec Men-C-ACYW-135-D (MenactraMD) |
Voir ci‑dessus Effets secondaires locaux et généraux consignés par les vaccinés 1 à 7 jours après la vaccination Effets secondaires nécessitant une attention médicale consignés pendant un mois suivant la vaccination, et événements indésirables et médicalement significatifs et graves consignés pendant 6 mois suivant la vaccination |
Voir ci‑dessus |
Profil de réactogénicité similaire pour Men-C-ACYW-135-CRM et Men-C-ACYW-135-D, les taux de réactions locales étant légèrement plus élevés après Men-C-ACYW-135-CRM et les taux de réactions générales étant légèrement plus élevés après Men-C-ACYW-135-D Aucun effet secondaire grave considéré comme possiblement ou probablement lié au vaccin |
Niveau 1 |
Bonne |
Gill, CJ et coll.Note en bas de page 39 |
Men-C-ACYW-135-CRM sans adjuvant (MenveoMD) chez des sujets de 19 à 65 ans Comparé avec Men-C-ACYW-135-D (MenactraMD) chez des sujets de 19 à 55 ans Comparé avec vaccin polysacchari-dique quadrivalent non conjugué (Men-P-ACYW-135 - Menomune®) chez des sujets de 56 à 65 ans |
Voir ci-dessus Réactions au point d'injection et générales sollicitées pendant les 7 jours suivant la vaccination Effets secondaires pendant les 6 mois suivant la vaccination |
Voir ci‑dessus |
Taux de réactions locales et générales sollicitées similaires dans les divers groupes |
Niveau 1 |
Bonne Affiche seulement, difficulté à évaluer la méthodologie complète |
Arguedas, A et coll.Note en bas de page 41 |
Men-C-ACYW-135-CRM (MenveoMD) en même temps que le dcaT et vaccin contre le VPH Comparé avec Men-C-ACYW-135-CRM donné un mois avant ou après le dcaT avec la série contre le VPH débutant le mois suivant |
Voir ci‑dessus Réactions locales et générales sollicitées consignées pendant 7 jours suivant la vaccination; autres effets secondaires consignés pendant un mois après la vaccination |
Voir ci‑dessus |
Taux de réactions locales similaires après l'administration concomitante ou séparée de Men-C-ACYW-135-CRM Réactions générales légèrement plus nombreuses après l'administration concomitante de Men-C-ACYW-135-CRM (58 %) que lorsque le vaccin est administré seul (51 %) ou après le dcaT (43 %) Aucun effet secondaire grave considéré comme possiblement ou probablement lié au vaccin |
Niveau 1 |
Bonne |
Gasparini et coll.Note en bas de page 42 |
Men-C-ACYW-135-CRM (MenveoMD) en même temps que le dcaT Comparé à Men-C-ACYW-135-CRM administré seul avec un placebo et au dcaT administré seul avec un placebo |
Voir ci-dessus Effets secondaires locaux et généraux et température axillaire consignés par les vaccinés ou leurs parents de 1 à 7 jours après la vaccination Effets secondaires nécessitant l'attention d'un médecin consignés pendant un mois suivant la vaccination, et effets secondaires médicalement significatifs et graves consignés pendant 6 mois après la vaccination |
Voir ci-dessus |
Aucun effet secondaire cliniquement significatif à la suite du vaccin Réactions locales et générales plus fréquentes en général dans le groupe ayant reçu les deux vaccins et dans le groupe ayant reçu seulement le dcaT, comparativement au groupe qui a reçu uniquement Men-C-ACYW-135-CRM |
Niveau 1 |
Bonne |
| Étude | Vaccin | Plan d'étude | Participants | Résultats | Niveau des preuves | Qualité |
|---|---|---|---|---|---|---|
Reisinger et coll.Note en bas de page 43 |
Men-C-ACYW-135-D avec vaccin contre le VPH et le dcaT administrés en même temps Comparés avec le vaccin contre le VPH administré seul et avec Men-C-ACYW-135-D et le dcaT administrés ensemble |
Voir ci-dessus Consignation sur une fiche, de la température et des réactions au point d'injection pendant 5 jours après chaque vaccination et des réactions générales pendant 14 jours suivant chaque vaccination 15 jours ou plus après chaque vaccination, seulement les décès ou les réactions graves considérés par le chercheur comme étant liés au vaccin ou à l'étude ont été consignés |
Voir ci-dessus |
Réactions locales plus nombreuses chez les sujets ayant reçu les vaccins simultanément, avec plus d'œdèmes au point d'injection dans le bras ayant reçu le vaccin contre le VPH, comparativement au groupe qui a reçu uniquement le vaccin contre le VPH; et plus d'ecchymoses et de douleur dans le bras des sujets ayant reçu les vaccins Men-C-ACYW-135-D et le dcaT le même jour que le vaccin contre le VPH comparativement à ceux qui ont reçu uniquement Men-C- ACYW-135-D et le dcaT le même jour. Aucune réaction grave dans l'un ou l'autre groupe après Men-C-ACYW-135-D et le dcaT |
Niveau 1 |
Assez bonne - Comparaison portant sur Men-C-ACYW-135-D et le dcaT administrés ensemble plutôt que sur chaque vaccin séparément |
Tableau 9: Niveaux de preuve fondés sur la méthodologie de la recherche
I
Données obtenues dans le cadre d'au moins un essai comparatif randomisé.
II-1
Données obtenues dans le cadre d'essais comparatifs, sans randomisation.
II-2
Données obtenues dans le cadre d'études analytiques de cohortes ou cas/témoins, réalisées de préférence dans plus d'un centre ou par plus d'un groupe de recherche utilisant des indicateurs cliniques de résultats de l'efficacité d'un vaccin.
II-3
Données provenant d'études de plusieurs séries chronologiques avec ou sans intervention. Les résultats spectaculaires obtenus dans un contexte non contrôlé (comme les résultats de l'introduction de la pénicilline dans les années 1940) pourraient aussi être considérés comme faisant partie de ce type de données probantes.
III
Opinions d'experts respectés fondées sur l'expérience clinique, des études descriptives et des études de cas ou des rapports de comités d'experts.
Tableau 10: Cote de qualité des preuves (validité interne)
Bonne
Étude (notamment les méta-analyses ou les recensions systématiques) répondant bien à tous les critères propres à la méthodologieTableau 10 - Note *.
Assez bonne
Étude (notamment les méta-analyses ou les recensions systématiques) ne répondant pas (ou du moins pas clairement) à au moins un critère propre à la méthodologieTableau 10 - Note * mais n'ayant pas de « lacune majeure » connue.
Médiocre
Étude (notamment les méta-analyses ou les recensions systématiques) ayant au moins une « lacune majeure » propre à la méthodologieTableau 10 - Note * ou une accumulation de lacunes moins importantes ne permettant pas de formuler des recommandations à partir des résultats de l'étude.
Tableau 11: Recommandations du CCNI concernant l'immunisation – Catégories
A
Les données probantes sont suffisantes pour recommander l'immunisation.
B
Les données probantes sont acceptables pour recommander l'immunisation.
C
Les données probantes existantes sont contradictoires et ne permettent pas de faire une recommandation pour ou contre l'immunisation; cependant, d'autres facteurs peuvent influer sur la prise de décisions.
D
Les données probantes sont acceptables pour déconseiller l'immunisation.
E
Les données probantes sont suffisantes pour déconseiller l'immunisation.
I
Les données probantes sont insuffisantes (en quantité ou en qualité) pour formuler une recommandation; cependant, d'autres facteurs peuvent influer sur la prise de décisions.
| Âge | Calendriers possibles |
|---|---|
| De 2 mois à moins de 12 mois | De 2 à 3 doses de Men-C-ACYW-135-CRM (MenveoMD) administrées à 8 semaines d'intervalleTableau 12 - Note * avec une autre dose entre 12 et 23 mois administrée au moins 8 semainesTableau 12 - Note * après la dernière dose |
| De 12 mois à 23 mois | 2 doses de Men-C-ACYW-135-CRM (MenveoMD) administrées à au moins 8 semaines d'intervalleTableau 12 - Note * |
Nota : Men-C-ACYW-135-CRM (MenveoMD) n'est pas encore approuvé pour les enfants de moins de 2 ans; il n'existe donc pas de calendriers autorisés pour ce groupe. Les calendriers ci-dessus sont basés sur ceux employés dans les essais cliniques et sur la recommandation antérieure du CCNI, qui est d'avis qu'une dose du vaccin conjugué contre le méningocoque devrait être administrée durant la deuxième année de vie (entre 12 et 23 mois) aux enfants qui ont été vaccinés avant l'âge de 1 an. Les calendriers pour la revaccination figurent dans la présente déclaration. |
|
Rechercher sur RMTC
Détails de la page
- Date de modification :