Effets secondaires suivant l'immunisation au Canada : 2012

 Téléchargez cet article en format PDF (886 Ko - 19 pages)
Téléchargez cet article en format PDF (886 Ko - 19 pages) Publié par : L'Agence de la santé publique du Canada
Numéro : Volume 40 S-3 : La sécurité des vaccins
Date de publication : 4 décembre 2014
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 40 S-3, le 4 décembre 2014 : La sécurité des vaccins
Surveillance
Rapport annuel du Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) pour les vaccins administrés en 2012
Law BJ1*, Laflèche J1,2, Ahmadipour N1, Anyoti H1
Affiliations
1 Centre de l'immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, Ottawa (Ontario)
2 Citoyenneté et Immigration Canada, Ottawa (Ontario)
Correspondance
DOI
https://doi.org/10.14745/ccdr.v40is3a02f
Résumé
Contexte : Décrire le profil de déclaration des effets secondaires suivant l'immunisation (ESSI) pour les vaccins administrés au Canada en 2012 ainsi que les tendances d'évolution des taux de déclaration d'effets secondaires pour les vaccins administrés de 2005 jusqu'à la fin de 2011.
Méthodologie : Analyse de données fondée sur les déclarations d'ESSI reçues par l'Agence de la santé publique du Canada en date du 30 avril 2013, pour les vaccins commercialisés au Canada et administrés entre le 1er janvier 2005 et le 31 décembre 2012.
Résultats : Le taux de déclaration des ESSI était de 10,1 pour 100 000 habitants au Canada pour les vaccins administrés en 2012; il était inversement proportionnel à l'âge des personnes vaccinées. On observe une tendance à la baisse des taux de 2005 (14, 8) à 2012 sur l'ensemble de la population et en fonction de l'âge. Dans la grande majorité des cas, les effets déclarés (94 à 95 %) n'étaient pas graves et consistaient en des réactions au point de vaccination ou à proximité, une éruption cutanée et de la fièvre.
Conclusion : Le Canada bénéficie d'un robuste système de pharmacovigilance vaccinale et jouit de l'un des taux de déclaration d'ESSI les plus élevés des pays développés. Les vaccins commercialisés au Canada possèdent un très bon profil d'innocuité. Ce rapport permet d'établir des comparaisons à l'échelle des provinces et territoires du Canada et à l'échelle mondiale.
Introduction
Le Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) est un effort collaboratif des autorités de santé publique fédérales, provinciales et territoriales qui date de 1987 Note de bas de page 1,Note de bas de page 2. À l'échelon national, le SCSESSI relève de la Section de la sécurité des vaccins du Centre de l'immunisation et des maladies respiratoires infectieuses de l'Agence de la santé publique du Canada (ASPC). Des rapports nationaux sur la sécurité des vaccins sont publiés régulièrement Note de bas de page 2,Note de bas de page 3,Note de bas de page 4,Note de bas de page 5,Note de bas de page 6,Note de bas de page 7,Note de bas de page 8,Note de bas de page 9,Note de bas de page 10,Note de bas de page 11. Le dernier rapport publié mettait l'accent sur les données de surveillance de la sécurité des vaccins administrés en 2004 et sur les tendances annuelles de déclaration remontant jusqu'en 1992 Note de bas de page 11. Le présent rapport a pour but principal de résumer les déclarations d'effets secondaires suivant l'immunisation (ESSI) reçues par l'ASPC pour les vaccins administrés en 2012 et d'offrir des données comparatives annuelles pour les vaccins administrés entre 2005 et la fin de 2011. Il inaugure également le format normalisé adopté pour les futurs rapports annuels qui facilitera la comparaison des données de déclaration d'année en année ainsi que la comparaison avec les rapports fournis par d'autres provinces et territoires du Canada Note de bas de page 12 et d'autres pays Note de bas de page 13,Note de bas de page 14.
Les objectifs du SCSESSI sont les suivants : assurer une surveillance continue de la sécurité des vaccins commercialisés au Canada; détecter l'augmentation de la fréquence ou de la gravité des réactions liées aux vaccins recensées par le passé; détecter des ESSI jusque-là inconnus susceptibles d'être liés à un vaccin; cerner les domaines nécessitant la réalisation d'investigations ou de recherches plus poussées; fournir une information opportune sur les profils de déclaration des ESSI pour les vaccins commercialisés au Canada, apte à favoriser une prise de décisions éclairée en matière d'immunisation Note de bas de page 15.
Afin de réaliser ces objectifs, le SCSESSI s'appuie sur une surveillance passive améliorée ainsi que sur une surveillance syndromique active. La première comprend tous les systèmes en place pour surveiller les cas d'ESSI et les déclarer aux programmes d'immunisation provinciaux, territoriaux et fédéraux du Canada; elle est dite « améliorée » car elle a toujours mis au premier plan la déclaration des effets secondaires reconnus comme particulièrement importants pour la santé publique, lesquels sont présentés accompagnés d'une case à cocher sur le formulaire national de déclaration des ESSI Note de bas de page 16. L'ensemble des provinces et des territoires encouragent activement la déclaration des ESSI dans leurs régions Note de bas de page 17.
La surveillance syndromique active est menée depuis 1991 dans le cadre du Programme de surveillance active de l'immunisation (IMPACT) Note de bas de page 18. Le Programme IMPACT est financé par l'Agence de la santé publique du Canada en vertu d'un contrat passé avec la Société canadienne de pédiatrie et comprend douze centres pédiatriques à l'échelle du Canada, qui représentent plus de 90 % de toutes les admissions en soins tertiaires pédiatriques au pays Note de bas de page 19,Note de bas de page 20. Le programme IMPACT examine les admissions hospitalières pour cause d'événements neurologiques (p. ex. convulsions, encéphalite, paralyse flasque aiguë, notamment syndrome de Guillain-Barré, méningite à liquide clair), de thrombocytopénie, d'abcès/cellulite au point de vaccination et d'autres complications potentiellement consécutives à l'administration de vaccins. Tout événement jugé comme étant lié de façon temporaire à l'administration d'un vaccin, pour lequel aucune explication claire n'est donnée, est déclaré en tant qu'ESSI.
Les identifiants personnels sont supprimés de toutes les déclarations d'ESSI émanant des autorités fédérales, provinciales et territoriales et du programme IMPACT avant que celles-ci ne soient transmises à l'ASPC pour être regroupées dans une base de données nationale à des fins de détection de signes et de production de rapports. À partir de 1987 et jusqu'à la fin de 2010, les détenteurs d'une autorisation de mise en marché déclaraient également les ESSI à l'ASPC. En janvier 2011, la réglementation en matière de déclarations des ESSI a été remaniée et les détenteurs d'une autorisation de mise en marché sont désormais tenus de transmettre leurs déclarations directement à Santé Canada; depuis, plusieurs d'entre eux ont cessé d'adresser leurs déclarations à l'ASPC.
Vous trouverez une explication plus détaillée des rôles et responsabilités respectifs en matière de pharmacovigilance postcommercialisation qui incombent à Santé Canada, à l'ASPC et aux autorités d'immunisation fédérales, provinciales et territoriales, à la section intitulée « Innocuité des vaccins » du Guide canadien d'immunisation Note de bas de page 21 et sur la page du site Web du SCSESSI Note de bas de page 15.
Méthodologie
Traitement des déclarations reçues par le SCSESSI
Toutes les déclarations d'ESSI sont entrées dans la base de données du SCSESSI et codées conformément à la terminologie de MedDRA (Dictionnaire médical international des activités de réglementation). Un examen systématique des dossiers médicaux est également effectué par des professionnels de la santé qualifiés afin de classer chaque déclaration en fonction de la raison unique la plus importante à son origine (principal ESSI, (tableau 1) et de la gravité des effets déclarés (tableau 2).
Principales définitions
Les effets secondaires suivant l'immunisation (ESSI) désignent généralement tout événement médical fâcheux qui se produit à la suite de l'administration d'un vaccin et qui n'a pas nécessairement de lien causal avec celle-ci. Un effet secondaire peut donc correspondre à un signe défavorable ou non intentionnel, à un résultat de laboratoire anormal, à un symptôme ou à une affection Note de bas de page 22.
En 1994, la Conférence internationale d'harmonisation sur les exigences techniques relatives à l'homologation des produits pharmaceutiques à usage humain a établi des critères de gravité pour favoriser une déclaration rapide des ESSI Note de bas de page 23. Un ESSI grave (EIG) est un ESSI qui entraîne la mort, menace le pronostic vital, exige l'hospitalisation du patient ou la prolongation de son hospitalisation, entraîne une invalidité ou une incapacité persistante ou marquée, ou une déficience ou une malformation congénitale Note de bas de page 23. On entend par déclaration rapide, une déclaration effectuée dans un délai maximal de 15 jours après la détection de l'ESSI ou plus tôt si possible, de préférence. À l'ASPC, toutes les déclarations d'EIG sont examinées par un médecin.
Un ESSI inattendu est un effet indésirable dont la nature ou la gravité ne correspondent pas aux indications portées sur l'étiquette canadienne du produit ni aux caractéristiques attendues du vaccin Note de bas de page 23.
La classification des ESSI effectuée dans le cadre de l'examen des dossiers médicaux s'est appuyée sur les définitions nationales de cas, le cas échéant, notamment les définitions publiées de Brighton Collaboration Note de bas de page 24,Note de bas de page 25,Note de bas de page 26,Note de bas de page 27,Note de bas de page 28,Note de bas de page 29,Note de bas de page 30,Note de bas de page 31,Note de bas de page 32,Note de bas de page 33,Note de bas de page 34,Note de bas de page 35,Note de bas de page 36,Note de bas de page 37 ainsi que les définitions adoptées dans le Guide de l'utilisateur du SCSESSI pour le syndrome oculo-respiratoire, la paralysie de Bell, l'arthrite, la parotidite, l'anesthésie et la paresthésie Note de bas de page 38.
Autres définitions utilisées :
- Gonflement étendu d'un membre qui touche toute la longueur d'un segment proximal ou distal du membre, le segment étant la partie d'un membre comprise entre deux articulations Note de bas de page 39.
- Ataxie cérébelleuse : apparition soudaine d'une ataxie du tronc et de troubles de la démarche Note de bas de page 40. À noter que cela suppose l'absence de tout signe cérébelleux associé à d'autres symptômes d'encéphalite ou d'encéphalomyélite disséminée aiguë, auquel cas la définition de cas de Brighton serait utilisée Note de bas de page 28.
Collecte et analyse des données
Toutes les déclarations d'ESSI reçues en date du 30 avril 2013, pour lesquelles la date d'administration des vaccins se situait entre le 1er janvier 2005 et le 31 décembre 2012, ont été extraites de la base de données du SCSESSI. Les déclarations concernant uniquement l'administration de l'un des vaccins contre la grippe pandémique H1N1 ont été exclues car ces produits ont été utilisés exclusivement en 2009 et 2010, ce qui aurait introduit un facteur de confusion dans la comparaison entre les tendances de déclaration observées pour les vaccins administrés en 2012 et celles concernant les vaccins administrés de 2005 à 2011.
Toutes les analyses de données ont été menées à l'aide du logiciel d'analyse statistique SAS 9.3. Les taux de déclaration pour 100 000 habitants ont été calculés à partir des estimations annuelles de la population par âge, sexe, province et territoire, couvrant la période de 2005 à 2012 Note de bas de page 41.
Les renseignements relatifs au total des doses de vaccin distribuées en 2011 et 2012 ont été fournis par les détenteurs d'autorisation de mise en marché et sont considérés comme étant de nature exclusive. Afin de permettre de présenter la totalité des déclarations d'ESSI et d'EIG pour les vaccins administrés en 2012 et les taux de déclaration pour 100 000 doses distribuées sans qu'il soit possible de calculer le total annuel des doses distribuées, les taux de déclaration ont été calculés à partir des données regroupées de 2011 et de 2012. Les vaccins ont été groupés en fonction de leur contenu antigénique aux fins de l'analyse.
Résultats
Nombre total d'effets et taux de déclaration
Sur les 38 364 déclarations d'ESSI extraites, 5 204 concernant uniquement le vaccin contre la grippe pandémique ont été exclues, ce vaccin n'ayant été utilisé qu'en 2009 et 2010. Sur les 33 160 déclarations incluses dans l'analyse, les déclarations d'ESSI (% EIG), par année d'administration des vaccins, étaient réparties comme suit : 2005 : 4 792 (4,5 %); 2006 : 4 417 (4,8 %); 2007 : 4 258 (5,3 %); 2008 : 4 482 (4,7 %); 2009 : 4 099 (5,8 %); 2010 : 4 046 (5,9 %); 2011 : 3 558 (5,8 %); 2012 : 3 508 (5,4 %).
Le taux de déclaration en fonction de l'âge pour 100 000 habitants par année d'administration des vaccins pour l'ensemble du Canada apparaît au tableau 3. Sur l'ensemble de la période d'administration des vaccins évaluée, les taux de déclaration les plus élevés ont été observés chez les enfants âgés entre 1 et 2 ans, suivis des nourrissons de moins de 1 an. Une forte baisse est observée chez les enfants âgés entre 2 et 7 ans, ceux âgés entre 7 et 18 ans et chez les adultes à partir de 18 ans. On observe également une tendance régulière à la baisse dans les taux de déclaration tout au long de la période étudiée, plus particulièrement chez les enfants de moins de 7 ans et pour les ESSI plus que pour les EIG.
| Groupe d'âge | Taux de déclaration des ESSI (EIG) pour 100 000 habitants | |||||||
|---|---|---|---|---|---|---|---|---|
| 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | |
| < 1 an | 176(16) | 161(16) | 169(18) | 134(12) | 152(19) | 150(20) | 136(15) | 130(12) |
| de 1 à < 2 ans | 305(22) | 290(24) | 276(22) | 283(22) | 238(18) | 217(18) | 202(17) | 152(16) |
| de 2 à < 7 ans | 47,1(1,2) | 36,7(1,1) | 31,5(1,2) | 31,0(1,2) | 27,8(1,0) | 28,7(1,0) | 28,8(1,4) | 25,2(1,2) |
| de 7 à < 18 ans | 11,9(0,5) | 11,4(0,4) | 9,5(0,4) | 15,1(0,6) | 12,3(0,5) | 12,0(0,4) | 9,7(0,6) | 11,2(0,4) |
| de 18 à < 65 ans | 6,5(0,2) | 6,0(0,1) | 6,0(0,1) | 5,6(0,1) | 4,9(0,2) | 4,7(0,1) | 4,2(0,1) | 5,0(0,1) |
| 65 ans et plus | 8,0(0,3) | 6,6(0,2) | 6,3(0,2) | 6,8(0,2) | 4,3(0,3) | 7,1(0,5) | 5,3(0,3) | 5,8(0,3) |
| Tous les âges | 14,8(0,7) | 13,5(0,6) | 12,9(0,7) | 13,4(0,6) | 12,1(0,7) | 11,9(0,7) | 10,3(0,6) | 10,1(0,6) |
|
||||||||
La baisse observée dans les déclarations de cas sur l'ensemble de la population et par groupe d'âge est probablement due à une combinaison de facteurs liés aux changements apportés aux programmes d'immunisation financés par l'État ainsi qu'aux lignes directrices régissant la déclaration des ESSI. Plusieurs provinces et territoires ont lancé des programmes de vaccination universelle contre la varicelle et par le vaccin conjugué contre le méningocoque pour les nourrissons, entre 2004 et 2006, et des programmes de vaccination contre le VPH (virus du papillome humain) pour les filles d'âge scolaire, entre 2007 et 2010. Plusieurs campagnes de rattrapage, pour divers groupes d'âge, ont également été menées, dont la plupart ont pris fin en 2011 ou 2012. En outre, un certain nombre d'autorités provinciales n'encouragent plus la déclaration des effets les plus légers, telles que la plupart des réactions au point d'administration du vaccin. Il est important de souligner également que les déclarations concernant les vaccins administrés les années antérieures à 2012 ont eu plus de temps à parvenir au système de surveillance que celles concernant les vaccins administrés en 2012. Le choix du 30 avril comme date limite d'inclusion des déclarations repose sur l'observation que plus de 80 % des déclarations relatives aux vaccins administrés au cours d'une année civile donnée ont déjà été reçues à quatre mois de la fin de l'année. Les chiffres de l'année 2012 seront mis à jour dans le cade du rapport annuel pour les vaccins administrés en 2013.
Un total de 46 481 347 doses de vaccin ont été distribuées au Canada en 2011 et 2012, ce qui donne des taux de déclaration pour 100 000 doses distribuées de 15,2 pour tous les ESSI et de 0,85 pour les EIG.
Sources de déclaration
Les figures 1A et 1B illustrent la répartition des sources de déclaration des ESSI et des EIG, stratifiées par groupe d'âge, relativement aux vaccins administrés de 2005 à 2012. En particulier, en ce qui a trait aux enfants âgés de moins de 18 ans, le réseau IMPACT a présenté, en moyenne, 4,1 % de l'ensemble des déclarations des ESSI, mais a généré 54,3 % de tous les EIG. On remarque une tendance claire dans la chute du nombre de déclarations par un détenteur d'une autorisation de mise en marché (DAMM), à la suite de la modification apportée en 2011 à la réglementation en matière de déclaration. De 2005 à 2010, les déclarations par un DAMM comptaient pour 9,8 % de toutes les déclarations d'ESSI et pour 7,1 % de celles d'EIG. En 2011 et 2012, la contribution relative est descendue à 6,0 % de toutes les déclarations d'ESSI et à 4,3 % de celles d'EIG. Étant donné le volume de déclarations des programmes fédéraux, provinciaux et territoriaux et du réseau IMPACT, ce changement n'a pas eu d'effet important sur les tendances en matière de déclaration du Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI); en outre, les déclarations sont recueillies et étudiées par la Direction des produits de santé commercialisés de Santé Canada et les renseignements ne sont donc pas perdus.
Figure 1A : Sources de déclaration des ESSIFigure 1A - Annotation 1 pour les enfants et les adultes par année d'administration des vaccins, de 2005 à 2012
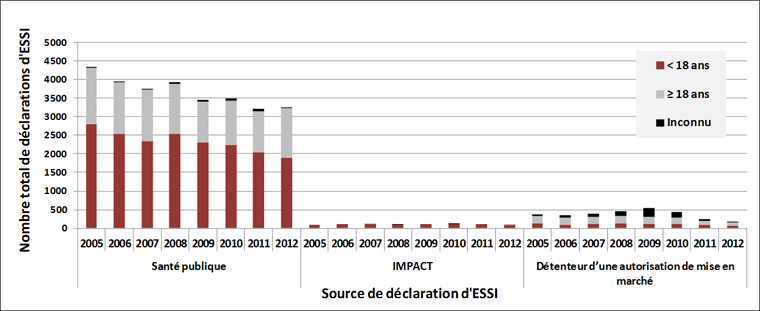
- Note de bas de page 1
-
Effet secondaire suivant l'immunisation (ESSI)
Équivalent textuel - Figure 1A
Cette figure est un histogramme montrant la contribution relative des trois sources de déclaration d'effets secondaires suivant l'immunisation (ESSI) pour les enfants et les adultes par année d'administration du vaccin. Les trois sources sont les suivantes : l'Agence de la santé publique du Canada, IMPACT et les détenteurs d'une autorisation de mise en marché. Chaque barre possède trois couleurs : une couleur correspond aux personnes âgées de moins de dix-huit ans, une autre correspond aux personnes âgées de plus de dix-huit ans et une dernière correspond aux personnes dont l'âge est inconnu. L'axe y représente le nombre total de déclarations d'ESSI et varie de 0 à 5 000. L'axe x représente les années de 2005 à 2012 pour chacune des trois sources. La source la plus importante était de loin l'Agence de la santé publique du Canada qui comptait 4 339 déclarations en 2005, et qui a connu une diminution irrégulière pour obtenir 3 240 déclarations en 2012; environ deux tiers des déclarations provenaient des enfants, un tiers provenait des adultes et seulement un petit nombre d'entre elles étaient inconnues. La deuxième plus importante source était les détenteurs d'une autorisation de mise en marché qui comptait 363 déclarations en 2005; ce nombre a augmenté pour atteindre un maximum de 545 déclarations en 2009 et a ensuite diminué pour atteindre 180 déclarations en 2012; près de la moitié des déclarations concernaient les adultes âgés de 18 ans et plus au cours de la plupart des années, à l'exception de 2009, où 46 % des déclarations concernaient un groupe d'âge inconnu. Le nombre de déclarations IMPACT variait de 87 à 126 par année et elles concernaient tous les enfants âgés de moins de 18 ans.
Figure 1B : Sources de déclaration des ESSIFigure 1B - Annotation 1 graves (EIG)Figure 1B - Annotation 2 pour les enfants et les adultes par année d'administration des vaccins, de 2005 à 2012
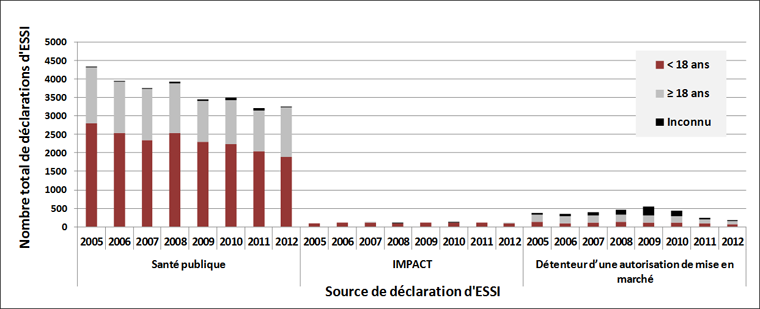
- Note de bas de page 1
-
Effet secondaire suivant l'immunisation (ESSI)
- Note de bas de page 2
-
Effet indésirable grave (EIG)
Équivalent textuel - Figure 1B
Cette figure est un histogramme montrant la contribution relative des trois sources de déclaration d'effet indésirable grave (EIG) suivant l'immunisation pour les enfants et les adultes par année d'administration du vaccin. Les trois sources sont les suivantes : l'Agence de la santé publique du Canada, IMPACT et les détenteurs d'une autorisation de mise en marché. Chaque barre possède trois couleurs : une couleur correspond aux personnes âgées de moins de deux ans, une autre correspond aux personnes âgées de deux ans à dix-sept ans, et une dernière correspond aux personnes âgées de dix-huit ans et plus. L'axe y représente le nombre total de déclarations d'ESSI et varie de 0 à 140. L'axe x représente les années de 2005 à 2012 pour chacune des trois sources. Le nombre total de déclarations soumises par l'Agence de la santé publique du Canada et IMPACT étaient semblables chaque année : l'Agence de la santé publique du Canada y a contribué le plus en 2005, 2008, 2010 et 2012 (129, 125, 128 et 96 déclarations d'EIG respectivement) et IMPACT y a contribué le plus en 2006, 2007, 2009 et 2011 (103, 107, 109 et 109 déclarations d'EIG respectivement). La différence importante entre les deux sources de déclaration était la répartition annuelle selon l'âge. Les déclarations de l'Agence de la santé publique du Canada concernaient tous les groupes d'âge : de 50 à 75 % environ des déclarations concernaient les enfants âgés de 0 à moins de 2 ans, de 10 à 30 % concernaient les enfants âgés de 2 à moins de 18 ans et de 24 à 40 % des déclarations concernaient les adultes. Toutes les déclarations d'IMPACT concernaient les enfants de moins de 18 ans, dont près de 80 % concernaient les enfants âgés de 0 à moins de deux ans. Les détenteurs d'une autorisation de mise en marché ont contribué à la production de 7 à 21 déclarations d'EIG chaque année comprenant d'importants écarts annuels dans la répartition selon l'âge, de 23 à 71 % des déclarations concernaient les adultes, de 0 à 62 % des déclarations concernaient les enfants âgés de 2 à moins de 18 ans et de 15 à 44 % des déclarations concernaient les enfants âgés de 0 à moins de 2 ans.
Répartition par âge et par sexe
En ce qui concerne les vaccins administrés en 2012, la répartition par âge parmi les déclarations d'ESSI (EIG) était : < 1 an : 14 % de tous les ESSI (24 % de tous les EIG); de 1 à < 2 ans : 16 % (32 %); de 2 à < 7 ans : 14 % (12 %); de 7 à < 18 ans : 14 % (9 %); de 18 à < 65 ans : 32 % (14 %); 65 ans et plus : 9 % (8 %); âge inconnu : 1 % (1 %). La répartition est demeurée assez constante avec le temps (données non représentées). La plus grande proportion de cas graves signalés parmi les jeunes enfants reflète la contribution de la surveillance syndromique active par IMPACT.
En ce qui concerne le sexe, le rapport femmes-hommes est demeuré assez constant, relativement aux vaccins administrés de 2005 à 2012, chez les enfants âgés de moins de 7 ans (intervalle de 0,8 à 0,9) et chez tous les adultes (intervalle de 3,4 à 4,1). En revanche, ce rapport a constamment augmenté chez les enfants âgés de 7 à < 18 ans, pour passer de 1,1 en 2005 à 1,6 en 2007; il a atteint un sommet de 2,3 en 2011, avant de chuter à 1,8 en 2012. Les changements correspondaient au lancement des programmes universels de vaccination des femmes contre le virus du papillome humain (VPH), ayant commencé en Ontario en 2007, puis s'étant étendu dans toutes les autres provinces en 2008, ainsi que dans les territoires en 2010, en plus des programmes de rattrapage destinés aux filles d'âge scolaire plus âgées, qui se sont terminés avant 2012.
Soins de santé utilisés et résultats relatifs aux ESSI des vaccins administrés en 2012
La répartition des soins de santé associés utilisés était : aucun dans 24,5 % des cas; conseil d'un professionnel de la santé dans 5 % des cas; examen médical non urgent dans 35,9 % des cas; examen médical urgent dans 17,9 % des cas; hospitalisation dans 5,2 % des cas; prolongation d'une hospitalisation déjà en cours dans 0,1 % des cas et soin inconnu dans 11,4 % des cas signalés. La seule tendance temporelle observée en matière de déclaration était le fait que l'utilisation était précisée dans une proportion croissante de déclarations avec le temps, avec de légères hausses des proportions d'examens médicaux urgents et non urgents (données non représentées).
La répartition de l'issue était : 67,8 % des cas signalés étaient complètement rétablis; 16,2 % n'étaient pas encore rétablis; 0 % souffraient d'une incapacité permanente; 0,1 % des cas s'était soldé par un décès; enfin, on ignorait l'issue de 15,8 % des cas signalés. On n'a observé aucune tendance temporelle notable, relativement aux vaccins administrés de 2005 à 2012 (données non représentées). Des issues mortelles et des cas d'incapacité permanente sont rarement signalés (intervalle annuel de 5 à 14 et de 0 à 11 du nombre total de déclarations, respectivement).
Effets indésirables signalés
Le tableau 4 montre la distribution par classification par système et organe de MedDRA pour tous les ESSI signalés, relativement à tous les vaccins administrés en 2012, ainsi que les répartitions comparatives relatives aux vaccins administrés en 2011 et de 2005 à 2010. La seule classification pour laquelle on observe une augmentation temporelle constante mesurable du nombre de cas est celle du système immunitaire, dont la proportion est passée de 5,8 % des vaccins administrés de 2005 à 2010, à 8,9 % en 2011, puis à 14,0 % en 2012. Les 490 cas signalés à la suite de vaccins administrés en 2012 étaient tous associés à des termes privilégiés relatifs à des ESSI allergiques (essentiellement l'hypersensibilité, certaines réactions anaphylactiques et deux réactions immunitaires de type III); seulement 11 (2,2 %) étaient graves. Lors d'une comparaison croisée avec la classification des principaux ESSI, la majorité des cas tombait sous les catégories : autre réaction allergique (198), éruption cutanée seule (153), réaction anaphylactique (50) ou réaction au point de vaccination (43). On a signalé un seul cas d'arthrite, un d'érythème polymorphe, un de maladie sérique et aucun de troubles immuns sujets de préoccupations. Les déclarations de réactions anaphylactiques se répartissaient dans plusieurs groupes d'âge et vaccins, sans grappe liée à un lot.
| Classification par système et organe | % des ESSI signalés mentionnant au moins 1 terme de CSOTableau 4 - Annotation 3 | ||
|---|---|---|---|
| 2005-2010 | 2011 | 2012 | |
| Affections hématologiques et du système lymphatique | 2,1 | 2,7 | 1,9 |
| Affections cardiaques | 1 | 1,4 | 1,6 |
| Affections congénitales, familiales et génétiques | 0 | 0 | 0 |
| Affections de l'oreille et du labyrinthe | 0,6 | 0,9 | 1,1 |
| Affections endocriniennes | 0 | 0 | 0,1 |
| Affections oculaires | 5,7 | 6,7 | 6,6 |
| Affections gastro-intestinales | 14,9 | 19,3 | 20,2 |
| Troubles généraux et anomalies au site d'administration | 61,2 | 66,6 | 66,7 |
| Affections hépatobiliaires | 0,1 | 0,1 | 0,1 |
| Affections du système immunitaire | 5,8 | 8,9 | 14,0 |
| Infections et infestations | 7,0 | 10,1 | 11,5 |
| Lésions, intoxications et complications liées aux procédures | 1,8 | 3,3 | 3,1 |
| Investigations | 6,9 | 4,6 | 2,9 |
| Troubles du métabolisme et de la nutrition | 3,4 | 3,9 | 3,9 |
| Affections musculo-squelettiques et du tissu conjonctif | 8,4 | 10,6 | 10,3 |
| Tumeurs bénignes, malignes et non précisées (y compris les kystes et polypes) | 0 | 0 | 0 |
| Affections du système nerveux | 19,5 | 20,4 | 21,6 |
| Affections gravidiques, puerpérales et périnatales | 0,1 | 0 | 0 |
| Troubles psychiatriques | 2,6 | 2,2 | 2,1 |
| Affections du rein et des voies urinaires | 0,2 | 0,3 | 0,4 |
| Affections des organes de reproduction et du sein | 0,2 | 0,1 | 0,3 |
| Affections respiratoires, thoraciques et médiastinales | 9,3 | 11,8 | 11,4 |
| Affections de la peau et du tissu sous-cutané | 35,2 | 40,0 | 37,6 |
| Caractéristiques socio-environnementales | 0,2 | 0,1 | 0,1 |
| Actes médicaux et chirurgicaux | 0,1 | 0,1 | 0 |
| Affections vasculaires | 3,1 | 3,4 | 4,2 |
|
|||
Principale raison de déclaration
Le tableau 5 montre les résultats de la classification de l'examen du dossier médical des 3 508 cas d'ESSI signalés après l'administration de vaccins effectuée en 2012, y compris, pour chaque catégorie principale, les taux d'ESSI et d'EIG signalés pour 100 000 doses distribuées et la proportion des types précis d'ESSI.
| Catégorie d'effets secondaires suivant l'immunisation (ESSI) | Total des ESSI/Effets indésirables graves (EIG) | Taux de déclaration pour 100 000 doses distribuées | Répartition par catégorie selon le type précis d'ESSI |
% type d'EIG | ||
|---|---|---|---|---|---|---|
| Tous les cas | EIG | |||||
| Réactions au site de vaccination ou à proximité | 1 238/20 | 5,25 | 0,08 | Abcès : 1,5 % | 5 | |
| Cellulite : 17 % | 7 | |||||
| Œdème sévère d'un membre : 14 % | 2 | |||||
| Douleur au membre vacciné d'une durée > 7 jours : 1,5 % | 0 | |||||
| Autre réaction locale : 66 % | 0,1 | |||||
| Événements allergiques ou de type allergique | 443/10 | 1,88 | 0,04 | Réaction anaphylactique : 11,7 % | 12 | |
| Syndrome oculo-respiratoire : 8,6 % | 3 | |||||
| Autre manifestation allergique : 79,7 % | 0,5 | |||||
| Événements neurologiques | 147/64 | 0,62 | 0,27 | Encéphalomyélite : 6,1 % | 67 | |
| Ataxie/cérébellite : 0,7 % | 100 | |||||
| Méningite à liquide clair : 1,4 % | 100 | |||||
| Syndrome de Guillain-Barré : 3,4 % | 80 | |||||
| Paralysie de Bell : 9,5 % | 7 | |||||
| Autre paralysie d'une durée > 1 jour : 1,4 % | 50 | |||||
| Convulsions : 67,3 % | 43 | |||||
| Autre manifestation neurologique : 10,2 % | 40 | |||||
| Éruption cutanée seulement | 694/0 | 2,94 | 0 | |||
| Autres événements indiqués sur le formulaire de déclaration du SCSESSI | 153/21 | 0,65 | 0,09 | Arthrite : 11,8 % | 0 | |
| Épisode hypotonique-hyporéactif : 19,6 % | 33 | |||||
| Intussusception : 2,6 % | 50 | |||||
| Paresthésie : 41,8 % | 0 | |||||
| Parotidite : 5,2 % | 0 | |||||
| Pleurs persistants : 11,1 % | 0 | |||||
| Thrombocytopénie : 7,8 % | 75 | |||||
| Autres effets généraux non précisés sur le formulaire de déclaration du SCSESSI | 390/52 | 1,65 | 0,22 | Fièvre uniquement : 14,9 % | 7 | |
| Infection : 22,9 % | 20 | |||||
| Syndrome pseudogrippal : 7,7 % | 3 | |||||
| Autres symptômes généraux : 28 % | 7 | |||||
| Éruption cutanée accompagnée de fièvre/autres symptômes – ajouter 1 EIG : 21,8 % | 11 | |||||
| Syndrome : 4,7 % | 61 | |||||
| Anxiété due à l'immunisation | 38/2 | 0,16 | <0,01 | |||
| Autres événements divers | 337/20 | 1,43 | 0,08 | Troubles gastro-intestinaux (à l'exclusion d'une intussusception) : 50,7 % | 3,5 | |
| Échec de l'immunisation : 1,2 % | 50 | |||||
| Autre : 48,1 % | 7 | |||||
| Erreur de vaccination sans ESSI | 68/0 | 0,29 | 0 | |||
|
||||||
Le tableau 6 montre la répartition en fonction de la gravité et du groupe d'âge dans les catégories des principaux ESSI. Les réactions au point de vaccination ou près de celui-ci et les éruptions cutanées seules comptaient pour 55,1 % de toutes les déclarations reçues, relativement aux vaccins administrés en 2012, mais seulement pour 11,2 % des EIG signalés. En revanche, les manifestations neurologiques comptaient pour seulement 4,2 % de toutes les déclarations de 2012, mais pour 43,5 % des EIG signalés. Le réseau IMPACT, qui recherche activement les manifestations neurologiques, a signalé 45 (70 %) des 64 manifestations neurologiques graves.
| Catégorie des principaux ESSI (total des cas signalés dans la catégorie) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Site de vaccination (1 238) | Réaction allergique (443) | Neurologique (147) |
Éruption cutanée seulement (694) |
Autre précisé (153) |
Général (390) | Anxiété (38) | Divers autres (337) |
Erreur de vaccination (pas d'ESSI) (68) |
||
| Répartition de la gravité par catégorie d'ESSITableau 6 - Annotation 1 | Graves | 1,6 | 2,2 | 43,5 | 0 | 13,7 | 13,3 | 5,3 | 5,6 | 0 |
| Répercussions élevées | 1,1 | 3,6 | 4,1 | 0,7 | 4,6 | 4,4 | 10,5 | 2,7 | 0 | |
| Répercussions modérées | 57,2 | 50,8 | 40,8 | 47,6 | 41,8 | 45,1 | 63,2 | 39,8 | 0 | |
| Répercussions faibles | 28,2 | 32,3 | 5,4 | 40,9 | 31,4 | 25,6 | 21,1 | 30,9 | 55,9 | |
| Non précisée | 11,9 | 11,3 | 6,1 | 10,8 | 8,5 | 11,5 | 0 | 21,1 | 44,1 | |
| Répartition par catégorie d'ESSI selon le degré de gravitéTableau 6 - Annotation 2 | Graves | 10,7 | 4,8 | 34,2 | 0,5 | 11,2 | 27,3 | 1,1 | 10,2 | 0 |
| Répercussions élevées | 17,9 | 20,5 | 7,7 | 6,4 | 9,0 | 21,8 | 5,1 | 11,5 | 0 | |
| Répercussions modérées | 41,1 | 13,1 | 3,5 | 19,2 | 3,7 | 10,2 | 1,4 | 7,8 | 0 | |
| Répercussions faibles | 32,3 | 13,2 | 0,7 | 26,2 | 4,4 | 9,2 | 0,7 | 9,6 | 3,5 | |
| Non précisée | 33,4 | 11,4 | 2,0 | 17,0 | 3,0 | 10,2 | 0 | 16,1 | 6,8 | |
| Répartition par groupe d'âge selon la catégorie d'ESSITableau 6 - Annotation 1 | < 1 an | 3,9 | 7,7 | 17,7 | 18,4 | 35,3 | 23,6 | 0 | 30,6 | 20,6 |
| de 1 à < 2 ans | 11,4 | 6,8 | 40,1 | 28,8 | 4,6 | 28,2 | 0 | 5,3 | 19,1 | |
| de 2 à < 7 ans | 23,6 | 7,2 | 8,2 | 11,5 | 0,7 | 11,5 | 7,9 | 4,5 | 2,9 | |
| de 7 à < 18 ans | 12,0 | 20,8 | 9,5 | 15,3 | 7,8 | 8,5 | 55,3 | 12,8 | 11,8 | |
| de 18 à < 65 ans | 34,2 | 48,8 | 19,7 | 22,5 | 46,4 | 22,1 | 28,9 | 35,0 | 20,6 | |
| 65 ans et plus | 14,5 | 8,1 | 4,1 | 3,2 | 4,6 | 5,4 | 7,9 | 8,9 | 1,5 | |
| Inconnu | 0,4 | 0,7 | 0,7 | 0,3 | 0,7 | 0,8 | 0 | 3,0 | 23,5 | |
| Répartition par catégorie d'ESSI selon le groupe d'âgeTableau 6 - Annotation 2 | < 1 an | 9,6 | 6,8 | 5,2 | 25,7 | 10,8 | 18,4 | 0 | 20,6 | 2,8 |
| de 1 à < 2 ans | 24,4 | 5,2 | 10,2 | 34,6 | 1,2 | 19,0 | 0 | 3,1 | 2,2 | |
| de 2 à < 7 ans | 60,6 | 6,6 | 2,5 | 16,6 | 0,2 | 9,3 | 0,6 | 3,1 | 0,4 | |
| de 7 à < 18 ans | 31,2 | 19,2 | 2,9 | 22,2 | 2,5 | 6,9 | 4,4 | 9,0 | 1,7 | |
| de 18 à < 65 ans | 37,7 | 19,2 | 2,6 | 13,9 | 6,3 | 7,6 | 1,0 | 10,5 | 1,2 | |
| 65 ans et plus | 58,7 | 11,8 | 2,0 | 7,2 | 2,3 | 6,9 | 1,0 | 9,8 | 0,3 | |
| Inconnu | 35,3 | 12,6 | 4,2 | 19,8 | 4,4 | 11,1 | 1,1 | 9,6 | 1,9 | |
|
||||||||||
Les enfants âgés de 1 à < 2 ans comptaient pour la plus grande proportion des déclarations dans les catégories des principaux ESSI que sont les réactions neurologiques, les éruptions cutanées seules et les réactions générales. Les enfants âgés de 7 à < 18 ans comptaient pour 55,3 % des réactions d'anxiété due à la vaccination. Les adultes âgés de 18 à < 65 ans formaient le groupe d'âge le plus important, relativement aux catégories des principaux ESSI que sont les réactions allergiques, au site de vaccination, autres précisées et diverses. Dans chaque catégorie d'âge, les groupes des principaux ESSI les plus souvent signalés étaient les réactions au site de vaccination, chez tous les cas âgés de 2 ans et plus, et les éruptions cutanées seules, chez les cas âgés de moins de 2 ans.
Vaccins administrés en 2012
Le tableau 7 comporte la liste des vaccins pour lesquels au moins une déclaration d'ESSI a été reçue, en ce qui concerne les vaccins administrés au cours de l'année civile 2012, regroupés par contenu antigénique, ainsi qu'en fonction du fait qu'ils étaient inclus ou non dans des programmes d'immunisation du Canada financés par l'État pour administration systématique ou limitée ou qu'ils étaient vendus principalement dans le marché privé. Le tableau fournit des données sur chaque groupe antigénique à propos de la proportion des déclarations si un seul vaccin avait été administré, du nombre total de déclarations d'ESSI et d'EIG à la suite de vaccins administrés en 2012, ainsi que du taux de déclaration combiné de 2011 et 2012 pour 100 000 doses distribuées. On doit interpréter avec prudence la variation des taux de déclaration. Par exemple, le taux observé avec le vaccin DCat-VPI-HB-Hib est presque quatre fois celui observé avec le vaccin DCat-VPI-Hib, tous les deux administrés aux nourrissons aux âges de 2, 4 et 6 mois. Le produit contenant le HB est administré principalement en Colombie-Britannique, dont le taux de déclaration est considérablement plus élevé que celui des autres provinces (données non représentées). En outre, les renseignements concernant les doses distribuées ne tiennent pas compte des doses retournées ou gaspillées et, au mieux, il s'agit d'une mauvaise valeur de substitution pour les taux de déclaration relatifs aux vaccins administrés, taux qui ne sont actuellement pas disponibles partout au Canada.
| Infections ciblées | Nom sous lequel le vaccin est commercialisé au Canada (DAMMTableau 7 - Annotation 2) | Abréviation du groupe de vaccins | % seul vaccin administré | 2012 ESSI |
2012 EIG (% ESSI) |
Taux de déclaration d'ESSI combinés de 2011-2012 pour 100 000 doses distribuées | |
|---|---|---|---|---|---|---|---|
| Vaccins administrés en vertu de programmes d'immunisation financés par l'État | |||||||
| Diphtérie, tétanos, coqueluche | Adacel® (SP) Boostrix™ (GSK) | DCat | 67 | 334 | 3(0.9) | 20.0 | |
| Diphtérie, tétanos, coqueluche, Polio | Quadracel® (SP), Infanrix™-IPV (GSK) | DCaT-VPI | 53 | 176 | 6(3.4) | 101.0 | |
| Adacel®-Polio (SP), Boostrix®-Polio (GSK) | DCat-VPI | 57 | 60 | 1(1.7) | 15.2 | ||
| Diphtérie, tétanos, coqueluche, Polio, H. influenzae de type b |
Pediacel® (SP), Infanrix™-IPV/Hib (GSK) | DCaT-VPI-Hib | 42 | 498 | 38(7.6) | 37.6 | |
| Diphtérie, tétanos, coqueluche, Polio, H. influenzae de type b, hépatite B |
Infanrix hexa™ (GSK) | DCaT-HB-VPI-Hib | 16 | 214 | 12(5.6) | 148.2 | |
| Diphtérie, tétanos, polio | Td Polio Adsorbées (SP) | Td-VPI | 47 | 15 | 1(6.7) | 22.1 | |
| Diphtérie, tétanos | Td Adsorbées (SP) | Td | 54 | 80 | 2(2.5) | 10.3 | |
| Pneumococcie invasive | Prevnar® (Pfiz), Synflorix™ (GSK), Prevnar®13 (Pfiz) | Pneu-C | 6 | 682 | 78(11.4) | 56.8 | |
| Pneumo® 23 (SP), Pneumovax® 23 (MF) | Pneu-P-23 | 50 | 228 | 18(7.9) | 38.0 | ||
| Méningococcie invasive | Meningitec® (Pfiz), Menjugate® (NP), Neis Vac-C® (GSK) | Men-C-C | 6 | 468 | 61(13.0) | 85.2 | |
| Menactra® (SP), Menveo™ (NVD), Nimenrix™ (GSK) | Men-C-ACYW-135 | 48 | 84 | 2(2.4) | 23.7 | ||
| Menomune® - A/C/Y/W-135 (SP) | Men-P-ACYW-135 | 0 | 2 | 0 | NCTableau 7 - Annotation 3 | ||
| Hépatite B | Engerix® -B (GSK), Recombivax HB® (MF) | HB | 38 | 213 | 11(5.2) | 22.0 | |
| Hépatite A, hépatite B | Twinrix® et Twinrix® Junior (GSK) | HAHB | 56 | 90 | 3(3.3) | 10.1 | |
| Hépatite A | Avaxim® et Avaxim®-Pediatric (SP), Havrix®1440 & Havrix®720Junior (GSK), Vaqta® (MF) |
HA | 24 | 70 | 2(2.9) | 14.1 | |
| Hépatite A, typhoïde | ViVAXIM™ (SP) | HA-Typh-I | 46 | 11 | 0 | 20.8 | |
| Rougeole, oreillons, rubéole | M-M-R® II (MF), Priorix® (GSK) | ROR | 20 | 393 | 29(7.4) | 68.2 | |
| Rougeole, oreillons, rubéole + Varicelle | Priorix-Tetra™ (GSK) | RORV | 17 | 163 | 42(25.8) | 53.7 | |
| Varicelle | Varilrix® (GSK), Varivax® III (MF) | Var | 22 | 358 | 16(4.5) | 74.0 | |
| Grippe | Fluviral® (GSK), Vaxigrip® et Intanza™ (SP), Agriflu® (NVD), Fluad® (NP), DInfluvac® (API) Flumist® (AZC) |
Inf | 82 | 913 | 36(3.9) | 8.5 | |
| Virus du papillome humain | Gardasil® (MF), Cervarix™ (GSK) | VPH | 65 | 185 | 9(4.9) | 29.8 | |
| Rotavirus | Rotarix™ (GSK), RotaTeq® (MF) | Rota | 11 | 228 | 21(9.2) | 30.5 | |
| Vaccins à usage particulier (financés par l'État dans certaines situations) | |||||||
| Tuberculose | BCG (SP) | Bacille de Calmette-Guérin (BCG) | 100 | 5 | 0 | NCTableau 7 - Annotation 3 | |
| Rage | Imovax® Rabies(SP), RabAvert® (NP) | Rage | 85 | 39 | 0 | 135.1 | |
| Vaccins non financés par l'État | |||||||
| Zona | Zostavax® (MF) | Zona | 91 | 80 | 2(2.5) | 27.7 | |
| H. influenzae de type b | ACT-HIB® (SP), Hiberix® (GSK), Liquid PedvaxHib®(MF) | Hib | 6 | 16 | 3(18.8) | 63.8 | |
| Polio | Imovax® Polio (SP) | VPI | 3 | 29 | 0 | 28.2 | |
| Choléra | Dukoral® (CV) | Chol-Ecol-O | 77 | 26 | 1(3.8) | 10.5 | |
| Encéphalite japonaise | IXIARO® (NP) | EJ | 57 | 7 | 1(14.3) | NCTableau 7 - Annotation 3 | |
| Encéphalite transmise par les tiques | FSME-IMMUN™ (Bax) | ETT | 100 | 1 | 0 | NCTableau 7 - Annotation 3 | |
| Typhoïde | Typherix™ (GSK), Typhim Vi® (SP), Vivotif ® (CV) | Typh-I/O | 42 | 43 | 1(2.3) | 18.4 | |
| Fièvre jaune | YF-Vax® (SP) | FJ | 24 | 25 | 0 | 33.5 | |
|
|||||||
La figure 2 montre la répartition totale des principaux ESSI par groupe de vaccins. Les réactions au site d'injection ou près de celui-ci comptaient pour plus de 50 % des ESSI signalés relatifs aux vaccins DCat-VPI, DCat-VPI, Td, Pneu-P-23 et Zona. Les manifestations neurologiques comptaient pour 24 % de l'ensemble des déclarations relatives au vaccin contre la rougeole, la rubéole, les oreillons et la varicelle (RORV), mais pour une proportion beaucoup plus petite des déclarations relatives aux autres vaccins, notamment le vaccin contre la rougeole, la rubéole et les oreillons (ROR).
Figure 2 : Répartition des principaux effets secondaires suivant l'immunisation (ESSI) par groupe de vaccins
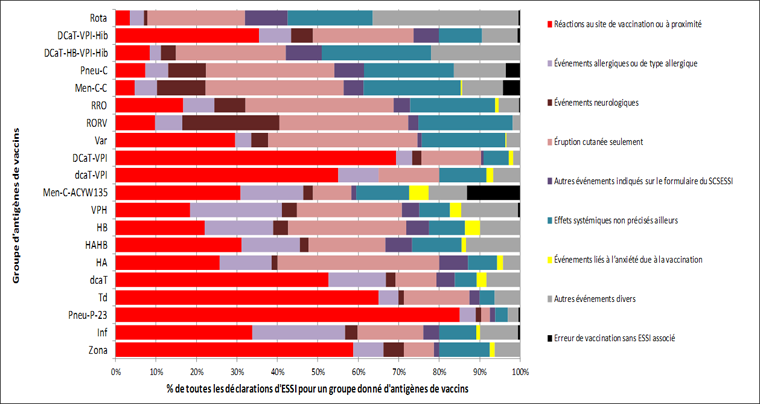
Équivalent textuel - Figure 2
Cette figure est un graphique à barres illustrant la répartition des principaux effets secondaires par groupe du vaccin. L'axe y indique vingt groupes antigéniques de vaccin accessibles au Canada. L'axe x représente le pourcentage de toutes les déclarations d'ESSI pour un groupe donné d'antigènes vaccinaux et varie de 0 à 100 %. Les barres horizontales sont codées en différentes couleurs pour les principaux ESSI. En général, l'ESSI le plus souvent déclaré était les réactions au site de vaccination ou à proximité. Il variait de plus de 85 % pour les déclarations concernant le vaccin polysaccharidique 23-valent contre le pneumocoque (Pneu-P-23) à moins de 5 % pour les déclarations concernant les vaccins antirotavirus. L'éruption cutanée variait de 40 % des déclarations d'ESSI pour le vaccin contre l'hépatite A à moins de 5 % des déclarations pour le vaccin polysaccharidique 23-valent contre le pneumocoque. Les événements allergiques ou de type allergique variaient de 25 % des déclarations d'ESSI pour le vaccin contre le virus du papillome humain (VPH) à moins de 5 % des déclarations pour un vaccin combiné contre la diphtérie, le tétanos, la coqueluche acellulaire, l'hépatite B, le virus de la polio inactivé et l'Haemophilus influenzae de type b (DTaP-HB-IPV-Hib). L'ESSI le moins souvent déclaré était les événements liés à l'anxiété due à la vaccination qui variaient de 0-1 % parmi les déclarations pour la plupart des vaccins à 2,4-4,8 % pour les déclarations concernant les vaccins principalement administrés aux enfants d'âge scolaire, à savoir le vaccin Tdap, le vaccin contre le VPH, le vaccin HB et le vaccin méningococcique conjugué quadrivalent (Men-C-ACYW-135).
Effets indésirables graves par raison principale de la déclaration
Parmi les 188 ESSI graves signalés, relativement à des vaccins administrés en 2012, la raison pour laquelle les effets ont été jugés graves était une hospitalisation dans 183 cas et le décès dans cinq cas. Aucun des décès n'a été imputé à un vaccin, comme on l'explique plus bas.
Trois décès sont survenus chez des adultes, trois minutes, 35 minutes et cinq jours après l'administration d'un vaccin antigrippal inactivé (deux fabricants différents et un produit non identifié), pour un taux total de déclaration de 0,3 pour 1 million de doses de vaccin antigrippal distribuées. Tous les décès ont été soudains et dus à un arrêt cardiaque; dans tous les cas, on a jugé qu'une cardiopathie préexistante était probablement la cause du décès.
Un décès a suivi l'administration d'une deuxième dose d'un vaccin ROR à un enfant d'âge scolaire (taux de déclaration de 1,45 pour 1 million de doses distribuées). Aucun autre vaccin n'avait été administré. Il y a eu apparition d'une fièvre aiguë dans les 24 heures suivant la vaccination puis, trois jours plus tard, de convulsions fébriles, qui ont progressé vers un état de mal épileptique entraînant un coma résistant. Le décès est survenu plusieurs semaines plus tard. La neuro-imagerie a révélé une anomalie temporale droite en foyer, mais aucune cause n'a été trouvée, malgré des examens approfondis. Le moment de l'apparition de la maladie n'étaye pas un rapport de causalité avec la vaccination.
Enfin, un tout-petit est décédé dans les 24 heures suivant son immunisation avec le vaccin DCat-VPI-Hib seul (taux de déclaration de 0,7 pour 1 million de doses distribuées). L'enquête du coroner a révélé que le décès était attribuable à une infection respiratoire aiguë.
On a signalé 64 manifestations neurologiques graves, dont 43 cas de convulsions, la plupart fébriles. Dans les 42 cas dont l'issue est connue, 41 personnes se sont complètement rétablies; l'exception était un cas connu de sclérose tubéreuse de Bourneville accompagnée de spasmes infantiles. Six cas ont été déclarés après l'administration d'un seul vaccin (ROR, VPH, antigrippal inactivé, DCat-VPI-HB-Hib, Var, vaccin combiné hépatite A/hépatite B [HAHB]), et les autres cas se sont déclarés après l'administration de deux vaccins ou plus. Tous les cas, sauf huit, étaient associés aux vaccins ROR ou RORV, habituellement administrés avec des vaccins conjugués contre le pneumocoque ou le méningocoque ou les deux. Le taux de déclaration de cas chez qui l'apparition des effets secondaires est survenue dans l'intervalle de risque attendu de 5 à 12 jours était de 1,08 pour 100 000 doses distribuées de vaccins contenant la rougeole avec les vaccins ROR et de 4,83 avec les vaccins RORV. Le risque accru de convulsion fébrile à la suite de l'administration d'un vaccin RORV, par rapport à un vaccin ROR, est désormais bien connu et a été récemment documenté au Canada Note de bas de page 42.
Les 21 autres manifestations neurologiques graves portent sur plusieurs affections. On a recensé 11 cas possibles de maladie de démyélinisation. On a signalé quatre cas de syndrome de Guillain-Barré, dont trois étant apparu 10, 11 et un nombre inconnu de jours après l'administration de vaccins contre la diphtérie et le tétanos, et un cas apparu 24 heures après l'administration d'un vaccin polysaccharidique contre le pneumocoque. On a signalé deux cas d'encéphalite aiguë : un apparu 11 jours après l'administration d'un vaccin RORV seul et l'autre, 22 jours après l'administration d'un vaccin RORV et de vaccins conjugués contre le pneumocoque et le méningocoque. La causalité n'a été prouvée dans aucun des cas, mais le vaccin vivant atténué du virus aurait pu causer la maladie. Les deux personnes se sont complètement rétablies. On a signalé deux cas d'encéphalomyélite aiguë disséminée : un premier cas s'est manifesté 1 jour après l'administration de la deuxième dose et 29 jours après l'administration de la première dose d'un vaccin contre l'encéphalite japonaise; l'autre est apparu 13 jours après l'administration de la première dose de vaccins contre le VPH et contre l'hépatite B. Aucun cas ne répondait aux critères de Brighton relatifs à la certitude liée au diagnostic; la causalité n'a donc pas pu être évaluée. Un cas de myélite transverse est apparu cinq jours après l'administration d'un vaccin ROR, mais une infection virale concomitante en était probablement la cause. On a en outre signalé un cas de névrite optique, apparue sept jours après l'administration de la deuxième dose d'un vaccin contre le VPH. Aucune autre explication n'était apparente et le vaccin a pu être en cause. Enfin, on a signalé un seul cas d'encéphalomyélite, apparue dans les 24 heures suivant l'administration de vaccins DCat-VPI-Hib et Pneu-C. Le moment de l'apparition de l'encéphalomyélite ne correspondait pas à la possibilité qu'elle puisse avoir été causée par un vaccin; on a présumé qu'une infection à entérovirus en était la cause. Les autres cas de troubles neurologiques graves sont apparus à la suite de l'administration de divers vaccins, dont aucun n'a été jugé susceptible d'avoir causé les manifestations déclarées, qui comprenaient : deux méningites à liquide clair, une paralysie de Bell, une autre paralysie d'une durée supérieure à un jour, une ataxie cérébelleuse, un AVC, deux cas de confusion temporaire, et un de trouble de conversion.
Vingt EIG ont été déclarés en rapport à des réactions au point d'injection ou près de celui-ci, notamment : 15 cas de cellulite, trois cas d'œdème sévère d'un membre, un cas d'abcès et un cas ne pouvant pas être placé dans une sous-classe. Dans tous les cas, la raison pour laquelle le cas a été jugé grave a été l'hospitalisation, principalement administration d'un antibiotique par voie intraveineuse. Les vaccins en cause incluaient : le vaccin polysaccharidique contre le pneumocoque (14 déclarations, dont sept sans autre vaccin), le vaccin antigrippal inactivé (neuf déclarations, dont trois sans autre vaccin) et deux cas associés au vaccin DCat-VPI-Hib (un sans autre vaccin). Les symptômes sont apparus dans les 24 heures après l'immunisation dans 16 des cas, et deux jours après dans quatre des cas.
Parmi 10 manifestations allergiques graves, on comptait six déclarations de réaction anaphylactique (une de niveau 1, deux de niveau 2 et trois de niveau 4 en vertu des critères de Brighton), une de syndrome oculo-respiratoire et trois de réaction allergique autre. L'apparition est survenue dans les 30 minutes dans six cas, dans un délai de 1 à < 24 heures dans deux cas, après 17 jours dans un cas et dans un délai inconnu pour un autre cas. Les vaccins associés aux réactions anaphylactiques comprenaient deux vaccins HB administrés seuls, deux vaccins antigrippaux inactivés administrés seuls et deux vaccins DCat-VPI-Hib, un administré seul et l'autre administré avec des vaccins Men-C-C et Pneu-C. La seule manifestation inhabituelle était un cas diagnostiqué comme étant une hypersensibilité de type IV accompagnée d'une hépatite secondaire, apparue chez un adulte d'âge moyen, 17 jours après l'administration d'une deuxième dose d'un vaccin Chol-Ecol-O et 39 jours après l'administration de vaccins HAHB et Typh-I/O. La causalité n'a pas pu être évaluée de façon approfondie, en raison d'une insuffisance de renseignements, mais la personne s'est complètement rétablie.
Parmi les autres manifestations précisées dans le formulaire du SCSESSI, les déclarations d'EIG comprenaient 10 cas d'épisode hypotonique-hyporéactif, neuf de thrombocytopénie et deux d'intussusception. Aucun de ces cas n'était inattendu, étant donné les relations connues, mais plusieurs étaient explicables par d'autres raisons.
Les autres déclarations d'EIG se classaient, selon l'examen des dossiers médicaux, parmi les événements d'ordre général (52 cas), divers (20 cas) ou liés à l'anxiété due à la vaccination (deux cas), dont les manifestations touchaient une vaste gamme de diagnostics, de vaccins et de groupes d'âge particuliers. On n'a observé aucune concentration notable de cas de tout type de manifestations ou de groupe de vaccins, ni aucun fait soulevant une préoccupation.
Discussion
Le présent rapport est le premier rapport annuel sur la sécurité des vaccins administrés au Canada au cours d'une année civile présenté conformément à un modèle uniforme. L'interprétation des données du SCSESSI doit tenir compte de plusieurs mises en garde. La surveillance ne permet pas de consigner tous les événements et il n'existe par de dénominateurs fiables, relativement aux vaccins administrés; l'incidence des ESSI ne doit donc pas être calculée ni extrapolée à partir de ces données. L'exhaustivité des déclarations et leur conformité, par rapport aux définitions nationales de cas, varient. Les taux de déclaration dépendent de nombreux facteurs, notamment l'âge, le territoire de compétence, la nouveauté d'un programme de vaccination donné et le degré de controverse, au sein du public, concernant les préoccupations, réelles ou perçues, en matière d'innocuité. Alors que le présent rapport résume notre expérience des huit dernières années, les renseignements fournis au SCSESSI sont régulièrement examinés, au cours de l'année, en vue de déceler toute augmentation inhabituelle ou imprévue des EIG, et d'y réagir.
Le principal objectif de la surveillance après commercialisation est de détecter toute préoccupation nouvelle ou inhabituelle concernant l'innocuité pouvant signaler des liens auparavant inconnus entre un vaccin donné et un événement, ou des changements des profils prévus d'innocuité, en ce qui a trait à la fréquence ou à la gravité de certains effets indésirables. Ainsi, bien que la déclaration de liens présumés soit encouragée, il ne faut pas oublier qu'une déclaration n'est pas la preuve qu'un ou des vaccins causent un effet donné. De par leur nom même, les ESSI représentent une relation temporelle d'un effet qui suit une immunisation. La cause de cet effet peut être attribuable à une propriété intrinsèque du vaccin, à un problème de qualité de fabrication, à une erreur lors d'une étape du processus d'immunisation, à une anxiété associée à l'immunisation ou à une manifestation qui coïncide avec la vaccination, mais qui n'a aucun lien avec elle Note de bas de page 22. Il est rarement possible de déterminer une cause précise en fonction de ce qui est déclaré dans un système national comme le SCSESSI. Il faut toujours effectuer une enquête plus approfondie à propos d'un signal détecté afin d'en déterminer la cause, tant au niveau de la personne que de la population. Néanmoins, les données présentées dans le présent rapport fournissent un profil au fil du temps qui peut servir à tirer des conclusions générales, en ce qui a trait au SCSESSI en tant que système de surveillance et à l'innocuité des vaccins administrés au Canada.
D'une part, le Canada dispose d'un solide système de surveillance des vaccins fondé sur des décennies de collaboration synergique avec les autorités sanitaires publiques régionales et fédérales, ainsi qu'avec des partenaires clés, décrits plus en détail ailleurs dans le présent supplément. Au Canada, le taux de déclaration total annuel d'ESSI de 10,1 pour 100 000 habitants est élevé, si on le compare à la plupart des autres pays dont le calendrier d'immunisation est similaire, notamment les États-Unis (taux de 4,4 pour les vaccins administrés de 1991 à 2001) Note de bas de page 13, l'Europe (taux de 2005 inférieur à 5 en France, en Allemagne, en Grande-Bretagne, en Italie et en Espagne, de 6 ou 7 aux Pays-Bas et en Norvège, de 9,8 en Suède et de 18,5 en Finlande) Note de bas de page 43, et semble comparable à celui de l'Australie (10,4 en 2011), mais est probablement supérieur Note de bas de page 14. Le Canada et la plupart des autres pays utilisent les déclarations de cas individuels comme le numérateur des taux représentatifs de la population, alors que l'Australie se sert des effets indésirables individuels, qui excèdent souvent le nombre de un par cas déclaré. En fonction de programmes d'immunisation similaires, les taux de déclaration d'ESSI supérieurs du Canada reflètent le haut niveau de vigilance des autorités sanitaires publiques qui déclarent les ESSI, ainsi que du volet de surveillance active du réseau IMPACT.
D'autre part, le profil des vaccins administrés au Canada est très bon. La vaste majorité des ESSI signalés sont de faible gravité et se résorbent complètement. La seule concentration notable de cas d'effets graves associés à des vaccins administrés en 2012 concernait des convulsions fébriles au cours de la deuxième année de vie, probablement attribuables à des vaccins contenant le virus de la rougeole, et dont le taux le plus élevé était lié au vaccin RORV. Bien qu'il s'agisse d'un effet attendu, il effraie les personnes concernées. Il est essentiel que des renseignements réalistes à propos du rapport entre les risques et les avantages, ainsi que des mesures à prendre le cas échéant, soient communiqués aux parents et aux personnes soignantes.
Enfin, la classification de l'examen du dossier médical, entreprise à l'échelle nationale en 2011 par la Section de la sécurité des vaccins de l'Agence de la santé publique du Canada (ASPC), offre un cadre additionnel en vue de soumettre les données relatives aux ESSI et qui sera, espère-t-on, plus utile aux intervenants cliniques, publics et des autorités sanitaires que les rapports sommaires précédents fondés sur des cadres réglementaires de codage comme MedDRA. Les deux cadres sont utiles et c'est pourquoi ils sont inclus dans le présent rapport. Les données de la classification par système et organe procurent un moyen de comparaison entre le présent rapport et ceux publiés par les organismes nationaux de réglementation et les détenteurs d'une autorisation de mise en marché. La classification de l'examen du dossier médical est étroitement liée avec le formulaire de déclaration du SCSESSI et sert également à la rédaction des résumés des ESSI signalés que l'ASPC publiée trimestriellement en ligne Note de bas de page 44. La classification de l'examen du dossier médical constitue aussi un outil additionnel important en vue de permettre aux spécialistes d'effectuer un examen opportun de tous les EIG signalés à l'ASPC et de faciliter les activités d'assurance de la qualité.
Remerciements
Le présent rapport n'aurait pu être réalisé sans la contribution de tous les participants au SCSESSI, notamment les autorités fédérales, provinciales et territoriales d'immunisation, particulièrement celles qui font partie du Groupe de travail sur la vaccinovigilance, le réseau IMPACT et tout le personnel de la Section de la sécurité des vaccins de l'ASPC. Nous aimerions également remercier toutes les personnes ayant pris le temps de déclarer des ESSI pour leur contribution à la sécurité des vaccins au Canada.
Conflit d'intérêts
Aucun
Financement
Ce travail a été entièrement financé par l'Agence de la santé publique du Canada.
Détails de la page
- Date de modification :