Directives provisoires concernant la détection du SRAS-CoV-2 grâce au test de dépistage rapide des antigènes de la COVID-19 de Panbio

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 47-01 : Éclosions de maladies d'origine alimentaire et de contact avec des animaux
Date de publication : janvier 2021
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 47 Numéro 1, Janvier 2021 : Éclosions de maladies d'origine alimentaire et de contact avec des animaux
Science de l'application des connaissances
Orientations provisoires sur l'utilisation du test antigénique rapide pour la COVID-19 d'Abbott Panbio™
au nom du Conseil des directeurs de laboratoire du Réseau des laboratoires de santé publique du Canada et du Groupe de travail sur les infections par les virus respiratoires du Réseau des laboratoires de santé publique du Canada
Correspondance
Citation proposée
Conseil des directeurs de laboratoire du Réseau des laboratoires de santé publique du Canada et Groupe de travail sur les infections par les virus respiratoires du Réseau des laboratoires de santé publique du Canada. Orientations provisoires sur l’utilisation du test antigénique rapide pour la COVID-19 d’Abbott Panbio™. Relevé des maladies transmissibles au Canada 2021;47(1):20–6. https://doi.org/10.14745/ccdr.v47i01a04f
Mots-clés : Abbott Panbio, COVID-19, antigène, test rapide, SRAS-CoV-2, Canada, santé publique, orientation
Introduction
Ce document, préparé le 12 décembre 2020, fournit des orientations provisoires sur l’utilisation du test antigénique rapide pour la COVID-19 Panbio d’Abbott™ dans le contexte du système de santé publique canadien et d’une réponse nationale coordonnée à la maladie du coronavirus 2019 (COVID-19).
Le test antigénique rapide pour la COVID-19 Panbio est utilisé pour la détection qualitative de l’antigène du coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) dans les échantillons de frottis nasopharyngés humains prélevés des personnes suspectées de COVID-19 par leur prestataire de soins. Le dispositif de test antigénique rapide pour la COVID-19 Panbio fonctionne comme un test à flux latéral comprenant à la fois une ligne de test témoin et une ligne de test spécifique COVID-19 dans une fenêtre de résultats. Après l’application d’un échantillon d’un patient sur le dispositif de test, la présence d’une ligne de contrôle dans la fenêtre de résultats confirme la validité du résultat du test, tandis que la présence d’une ligne de test est interprétée comme un résultat positif pour la COVID-19.
Il convient de noter que si Abbott commercialise déjà un test antigénique rapide qui est largement utilisé aux États-Unis (BinaxNOW™ COVID-19 Antigen Card), le test antigénique, dont l’utilisation a été approuvée et qui est commercialisé au Canada (Test antigénique rapide pour la COVID-19 Panbio), est fabriqué dans un autre établissement. En outre, les deux versions du test Abbott de capture d’antigènes pour la COVID-19 diffèrent considérablement dans leurs caractéristiques de conception. En tant que telles, les caractéristiques de rendement peuvent ne pas être les mêmes. Des données cliniques canadiennes sont nécessaires pour valider le test qui est en cours de distribution à l’échelle nationale et, au moment de la rédaction du présent document, ces données n’ont pas encore été recueillies de manière adéquate. Avant l’autorisation du test antigénique rapide pour la COVID-19 Panbio par Santé Canada, le Réseau des laboratoires de santé publique du Canada a formé un groupe de travail pour vérifier les caractéristiques de rendement des diverses technologies de capture d’antigènes mises sur le marché. Au moment de la rédaction du présent document, l’évaluation et la vérification de la sensibilité clinique du test antigénique rapide pour la COVID-19 Panbio sont en cours. Cependant, les données préliminaires de sensibilité analytique suggèrent que le test antigénique rapide pour la COVID-19 Panbio aura probablement une sensibilité moindre par rapport aux tests d’amplification des acides nucléiques, notamment l’Abbott ID NOW™ (tableau 1).
| Identification des patientsTableau 1 Note de bas de page b | Lieu du test qPCR | Ct gene E | Ct ajusté pour l’entréeTableau 1 Note de bas de page c | Nombre approximatif de copies d’entréeTableau 1 Note de bas de page dTableau 1 Note de bas de page e | Résultat ID NOW | Résultat Panbio |
|---|---|---|---|---|---|---|
| Patient 1 | LPC | 16 | 22,6 | 1 294 497 | Positif | Positif |
| Patient 2 | LPC | 19 | 25,6 | 271 908 | Positif | Positif |
| Patient 3 | LPC | 19 | 25,6 | 383 421 | Positif | Positif |
| Patient 4 | LPC | 20 | 26,6 | 586 124 | Positif | Positif |
| Patient 5 | LNM | 20,4 | 27 | ND | Positif | Positif |
| Patient 6 | LNM | 22,2 | 28,8 | ND | Positif | Positif |
| Patient 7 | LNM | 22,3 | 28,9 | ND | Positif | Positif |
| Patient 8 | LNM | 24,6 | 31,2 | ND | Positif | Négatif |
| Patient 9 | LPC | 25 | 31,6 | 16 116 | Positif | Négatif |
| Patient 10 | LNM | 25,2 | 31,8 | ND | Positif | Négatif |
| Patient 11 | LPC | 26 | 32,6 | 1 547 | Positif | Négatif |
| Patient 12 | LPC | 26 | 32,6 | 2 428 | Positif | Négatif |
| Patient 13 | LNM | 27,9 | 34,5 | 3 681 | Positif | Négatif |
| Patient 14 | LPC | 30 | 36,6 | 164 | Positif | Négatif |
| Patient 15 | LNM | 30 | 36,6 | ND | Positif | Négatif |
| Patient 16 | LNM | 31,6 | 38,2 | 272 | Positif | Négatif |
| Patient 17 | LPC | Négatif | 0 | 0 | Négatif | Négatif |
| Patient 18 | LPC | Négatif | 0 | 0 | Négatif | Négatif |
| Patient 19 | LPC | Négatif | 0 | 0 | Négatif | Négatif |
| Mise en commun | LNM | Négatif | 0 | 0 | Négatif | Négatif |
L’utilisation d’un test moins sensible comporte des risques pour la prise de décision clinique et de santé publique qui ne peuvent être compensés que par l’ampleur des avantages possibles. Il convient d’examiner attentivement où et comment le test antigénique rapide pour la COVID-19 Panbio est utilisé afin d’atténuer le degré accru d’incertitude diagnostique associé à cette technologie par rapport au test de diagnostic conventionnel « étalon de référence » du SRAS-CoV-2 au Canada.
Ces lignes directrices sont destinées à être mises à jour périodiquement, à mesure que de plus amples informations sont disponibles concernant la sensibilité et la spécificité des tests dans le contexte général de l’infection par le SRAS-CoV-2.
Bien que ce document, tel qu’il est actuellement rédigé, soit spécifique à Abbott Panbio, un nombre de ces lignes directrices peuvent également s’appliquer à tout test moléculaire moins sensible ainsi que tout test rapide fondé sur l’antigène dont l’utilisation sera approuvée à l’avenir.
Messages clés
-
Santé Canada a approuvé l’utilisation du test antigénique rapide pour la COVID-19 Panbio (octobre 2020)
-
L’utilisation prévue pour ce test est décrite dans la notice du kit de test antigénique rapide pour la COVID-19 Panbio et indique ce qui suit :
« Panbio™ COVID-19 Ag Rapid Test Device est un test de diagnostic rapide in vitro pour la détection qualitative de l'antigène SRAS-CoV-2 (Ag) dans des échantillons sur écouvillons nasopharyngés humains provenant de personnes répondant aux critères cliniques ou épidémiologiques de la COVID-19. Panbio™ COVID-19 Ag Rapid Test Device est destiné à un usage professionnel uniquement et est destiné à être utilisé comme une aide au diagnostic de l'infection par le SRAS-CoV-2. Le produit peut être utilisé dans tout environnement de laboratoire et hors laboratoire qui répond aux exigences spécifiées dans le mode d'emploi et dans la réglementation locale. Le test fournit des résultats de test préliminaires. Les résultats négatifs n'empêchent pas l'infection par le SRAS-CoV-2 et ils ne peuvent pas être utilisés comme seule base de traitement ou d'autres décisions de prise en charge. Les résultats négatifs doivent être associés aux observations cliniques, aux antécédents du patient et aux informations épidémiologiques. Le test n'est pas destiné à être utilisé comme test de dépistage des donneurs pour le SRAS-CoV-2. »
-
Les rendements cliniques du test antigénique rapide pour la COVID-19 Panbio doivent continuer à être soigneusement surveillées en raison de la faible sensibilité prévue du test.
-
Le rendement du test doit être vérifié sur le terrain avant de recommander son utilisation. Cela est essentiel, car les données obtenues à partir des évaluations avant commercialisation ne peuvent pas tenir compte de la variabilité prévue de la formation ou de la qualité de la collecte de l’échantillon qui suit son utilisation dans une population plus large, et en particulier, dans les situations au point d’intervention.
-
Le test antigénique rapide pour la COVID-19 Panbio nécessite le prélèvement d’un échantillon prélevé par écouvillonnage du nasopharynx. Ce test peut être moins acceptable pour les tests en série de populations, en particulier chez les individus à faible risque et asymptomatiques, par rapport à d’autres tests (e.g. Abbott ID NOW, qui, en plus des échantillons prélevés par écouvillonnage du nasopharynx, peut également être utilisé avec des écouvillons de gorge ou nasaux).
-
Les caractéristiques de rendement « sur le terrain » du test antigénique rapide pour la COVID-19 Panbio sont encore en cours d’évaluation au Canada; cependant, les données concernant le rendement du test antigénique rapide pour la COVID-19 Panbio aux États-Unis suggèrent que les tests ont une sensibilité plus faible, mais une spécificité comparable aux tests développés en laboratoire et aux tests commerciaux d’amplification des acides nucléiques.
-
Bien que la nature rapide et la facilité d’utilisation du test antigénique rapide pour la COVID-19 le rend adapté aux applications au point d’intervention, les caractéristiques de rendement décrites ci-dessus combinées à l’incidence de l’infection au sein de la population testée doivent être prises en compte lors de l’interprétation des résultats.
- Les indications des tests (e.g. symptomatiques ou asymptomatiques, avec ou sans éclosion, dans des lieux d’hébergement collectif contre la population générale) sont également un élément important à prendre en compte dans l’utilisation de cette technologie.
-
En concertation avec les directeurs de laboratoires provinciaux et territoriaux, il faut réfléchir soigneusement à l’utilisation de ce test.
- Pour l’instant, en attendant que d’autres données soient recueillies, en raison de la sensibilité réduite, tous les négatifs doivent être considérés comme des négatifs préliminaires.
- En raison d’un taux de faux négatifs plus élevé que prévu (par rapport aux tests d’amplitude d’acide nucléique classiques), il est reconnu que les tests réflexifs en laboratoire des négatifs préliminaires du test antigénique rapide pour la COVID-19 Panbio (en fonction de son utilisation proposée) introduiront probablement une charge supplémentaire pour les laboratoires de référence déjà confrontés à d’énormes volumes de tests. L’utilité d’un nouveau test de laboratoire utilisant une méthode plus sensible doit tenir compte de l’indication initiale du test.
-
Ce document décrit les scénarios dans lesquels les tests antigéniques rapides pour la COVID-19 Panbio peuvent s’avérer utiles, si les caractéristiques de rendement attendues sont confirmées.
Approche actuelle du dépistage du SRAS-CoV-2 au Canada
Depuis l’apparition du SRAS-CoV-2, le dépistage a été un pilier essentiel de la réponse du Canada à la pandémie. Le large recours aux tests, dans le cadre d’un ensemble de mesures de santé publique, a contribué à un aplatissement de la courbe épidémique au printemps 2020, ce qui démontre la valeur des tests dans le cadre de la réponse à la COVID-19. Jusqu’à présent, les tests ont reposé sur des tests moléculaires (i.e. l’amplification en chaîne par polymérase à transcription inverse) effectués sur un échantillon prélevé par écouvillonnage du nasopharynx ou un autre échantillon respiratoire prélevé par un professionnel de la santé. Cette méthode de dépistage demeure l’étalon de référence pour la détection de l’infection par le SRAS-CoV-2 au Canada.
Considérations aux fins de l’utilisation du test antigénique rapide pour la COVID-19 Panbio
Malgré la différence de profil de rendement, d’autres caractéristiques du test antigénique rapide pour la COVID-19 Panbio (notamment, mais pas exclusivement, un délai d’exécution plus rapide, un coût par test inférieur, la possibilité de faire réaliser les tests dans certaines juridictions par des individus qui ne sont pas des professionnels de la santé plus fréquemment) suggèrent qu’il pourrait avoir un rôle important à jouer dans la prochaine phase de la réponse à la pandémie.
Il est essentiel de comprendre le moment du prélèvement des échantillons par rapport à l’apparition des symptômes, car la faible sensibilité du test ne devrait pas être uniforme au cours de l’infection. Les données suggèrent que l’excrétion virale peut commencer deux à trois jours avant l’apparition des symptômes, culminant vers le moment de l’apparition des symptômes puis diminuant progressivement au fil du temps Note de bas de page 1 Note de bas de page 2. Au cours des cinq premiers jours de l’apparition des symptômes, les charges virales sont très probablement supérieures à la limite de détection du test antigénique rapide pour la COVID-19 Panbio, bien que le moment suivant l’apparition des symptômes doit encore être soigneusement examiné. Il est également important de comprendre le rendement du test par rapport au temps écoulé depuis une exposition potentielle (i.e. le nombre de jours après l’exposition pendant lesquels on peut s’attendre à avoir des charges virales pouvant être détectées de manière optimale avec le test antigénique rapide pour la COVID-19 Panbio) lorsqu’il est utilisé pour la recherche rapide des contacts.
Il est important pour les experts en santé publique, en microbiologie et en maladies infectieuses d’identifier les scénarios selon lesquels l’utilisation du test antigénique rapide pour la COVID-19 Panbio pourrait renforcer la réponse de la santé publique en 1) élargissant l’accès aux tests au-delà des indications existantes et 2) augmentant la capacité de détection du SRAS-CoV-2. En outre, il est essentiel de mettre en place des mécanismes permettant d’intégrer efficacement les résultats d’un nouveau test au point d’intervention dans le système de santé publique (voir la section « Communication des résultats et contrôle de la qualité » ci-dessous).
Mise en balance de la sensibilité des tests avec d’autres considérations
Les caractéristiques de rendement intrinsèques du test antigénique rapide pour la COVID-19 Panbio ne sont pas les seuls facteurs qui déterminent son utilité. L’interprétation finale d’un test doit tenir compte des paramètres de rendement, de la prévalence de l’infection, des valeurs prédictives et de l’utilisation prévue du résultat du test. Par conséquent, la tolérance des seuils de sensibilité et de spécificité variera en fonction de la raison du test et de l’action attendue à la suite d’un résultat positif ou négatif.
Dans les scénarios où des décisions et des actions critiques reposent sur un résultat de test (e.g. un résident symptomatique dans une maison de soins de longue durée ou un patient dans l’unité de soins intensifs qui a besoin d’un traitement immédiat), le test recommandé serait le plus précis. Au moment de la rédaction du présent document, le test indiqué (le meilleur) serait l’amplification en chaîne par polymérase à transcription inverse effectuée sur un échantillon prélevé par écouvillonnage du nasopharynx ou sur des échantillons des voies respiratoires inférieures dans les cas où l’on constate une pneumonie. Toutefois, il peut y avoir des circonstances dans lesquelles un test rapide au point d’intervention serait autorisé et renforcerait la capacité de test pour soutenir la réponse de santé publique, en particulier lorsque la demande de test d’amplification en chaîne par polymérase à transcription inverse dépasse la capacité du laboratoire, est indisponible ou dans des situations où un individu symptomatique pourrait être perdu au suivi.
Utilisation proposée du test antigénique rapide pour la COVID-19 Panbio
Une stratégie pour réduire l’écart de sensibilité d’une technologie consisterait à utiliser des tests répétés en série. Cependant, cela peut ne pas être possible avec le test antigénique rapide pour la COVID-19 Panbio. Cette technologie nécessite spécifiquement l’utilisation d’un échantillon prélevé par écouvillonnage du nasopharynx, ce qui peut limiter son utilité et son utilisation en raison de la nature inconfortable du prélèvement des échantillons du patient et de l’obligation de prélèvement par un professionnel de la santé. Dans les milieux à faible prévalence et à faible risque, les tests répétés en série avec le test antigénique rapide pour la COVID-19 Panbio peuvent ne pas être l’idéal. Cela peut être particulièrement pertinent dans les milieux impliquant une population pédiatrique (garderies, écoles, équipes sportives).
Il existe cependant des situations précises pour lesquelles le test antigénique rapide pour la COVID-19 Panbio peut être considéré comme une option appropriée : lorsque l’infection est présente (qu’elle soit symptomatique ou asymptomatique) au sein d’une communauté; test symptomatique dans des lieux d’hébergement collectif; test symptomatique dans les communautés nordiques, éloignées et isolées; et surveillance communautaire asymptomatique dans la population générale.
L’infection est répandue au sein d’une communauté
Le test antigénique rapide pour la COVID-19 Panbio pourrait être utilisé pour tester des individus lorsque la prévalence de l’infection est élevée au sein d’une communauté et que l’accès à un test d’amplification en chaîne par polymérase à transcription inverse en temps utile est considérablement limité (figure 1). Les résultats positifs pourraient être considérés comme positifs préliminaires (présumés) et faire l’objet d’une action immédiate en raison de la valeur prédictive positive accrue dans ces contextes. Des mesures de santé publique (isolement, recherche des contacts) doivent être mises en œuvre immédiatement, tandis que des tests d’amplification en chaîne par polymérase en laboratoire sont effectués pour confirmer les résultats.
Figure 1 : Scénario 1 - Test symptomatique lorsque l'infection est répandue dans une communauté
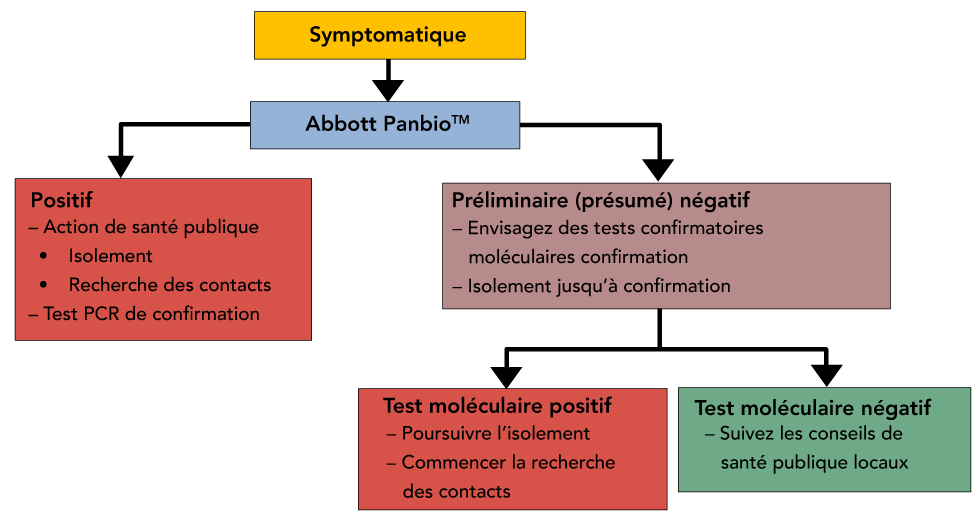
Description textuelle : Figure 1
Figure 1 : Scénario 1 - Test symptomatique lorsque l'infection est répandue dans une communauté
Arbre de décision représentant les actions de santé publique suggérées, le signalement et l'obligation de répéter les tests des patients symptomatiques lorsque l'infection est prévalente au sein d'une communauté (e.g. lors d'une éclosion). En raison de la valeur prédictive positive plus élevée lors d'une éclosion, un résultat positif pourrait être considéré comme un vrai positif, bien que la nécessité de refaire les tests soit laissée à l'appréciation des provinces et territoires.
Il faut prendre en considération si une personne qui reçoit un résultat négatif du test antigénique rapide pour la COVID-19 Panbio est symptomatique ou asymptomatique, car tous les résultats négatifs sont considérés comme « négatifs préliminaires (présumés) ».
Scénario 1 - Dépistage symptomatique au sein d’une communauté : Il est recommandé que les personnes symptomatiques qui reçoivent des résultats négatifs préliminaires (présumés) soient testées à nouveau et maintenues en isolement jusqu’à ce que les résultats des tests d’amplification en chaîne par polymérase à transcription inverse de confirmation en laboratoire soient disponibles. L’organigramme de la figure 1 illustre une approche possible du dépistage; toutefois, les algorithmes sont susceptibles de varier d’une province/territoire à l’autre en fonction de facteurs locaux, notamment le stade de la vague pandémique et l’expérience du système de santé avec le test Panbio.
Les communautés nordiques, éloignées et isolées sont confrontées à des obstacles supplémentaires pour accéder aux résultats des tests en temps opportun, en raison du temps de transport nécessaire pour livrer un échantillon à un laboratoire de dépistage. Étant donné l’importance d’identifier avec précision les nouveaux cas dans les communautés nordiques, éloignées et isolées afin de prévenir la propagation face aux ressources limitées en matière de soins de santé, le test d’amplification en chaîne par polymérase à transcription inverse est le test recommandé pour ces milieux. L’utilisation du test antigénique rapide pour la COVID-19 Panbio peut être utile dans les communautés nordiques, éloignées et isolées où l’accès aux services de dépistage en laboratoire et aux résultats rapides est inexistant ou difficile.
Scénario 2 - Dépistage asymptomatique au sein d’une communauté : Le dépistage réflexif répété des personnes asymptomatiques qui reçoivent des résultats négatifs préliminaires (présumés) doit prendre en considération la charge qui sera imposée aux systèmes de tests en laboratoire déjà surchargés (figure 2).
Figure 2 : Scénario 2 - Dépistage asymptomatique lorsque l'infection est répandue dans une communauté
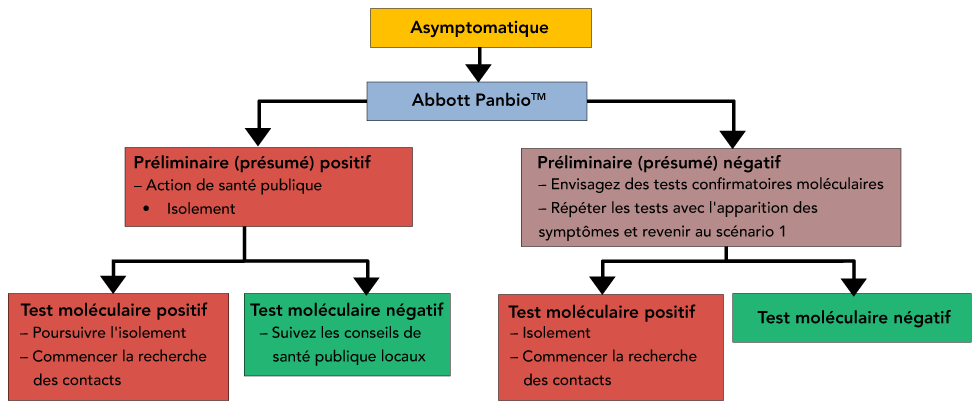
Description textuelle : Figure 2
Figure 2 : Scénario 2 - Dépistage asymptomatique lorsque l'infection est répandue dans une communauté
Arbre de décision représentant les actions de santé publique suggérées, le signalement et le test répété des patients asymptomatiques lorsque l'infection est prévalente au sein d'une communauté. Dans ce scénario, un résultat positif Panbio nécessiterait un nouveau dépistage par une méthode moléculaire plus sensible.
Dépistage dans le cadre des lieux d’hébergement collectif
Scénario 1 - dépistage symptomatique dans des lieux d’hébergement collectif : Bien que l’utilisation d’un test moins sensible ne soit pas recommandée pour la gestion exclusive d’une épidémie, le dépistage des individus symptomatiques et des contacts directs avec le test antigénique rapide pour la COVID-19 Panbio peut être un outil utile pour l’identification précoce d’éventuelles épidémies dans des environnements regroupés (e.g. les établissements de soins de longue durée et les établissements correctionnels, les grandes usines de traitement, les travailleurs dans les mines éloignées, les refuges pour sans-abri) (figure 3). Les tests peuvent faire partie de l’identification et de l’enquête sur les éclosions suspectées où les patients peuvent être testés rapidement sur place si des résultats préliminaires plus rapides permettent d’informer et d’accélérer l’action de santé publique (triage des patients et recherche des contacts). Tous les tests antigéniques au point d’intervention doivent être suivis d’un test d’amplification en chaîne par polymérase en laboratoire lorsqu’ils sont effectués dans le cadre d’une éclosion. Cela peut être particulièrement pertinent dans les situations où une personne symptomatique pourrait autrement être perdue au suivi (e.g. un refuge pour sans-abri).
Figure 3 : Scénario 1 - Dépistage symptomatique dans le cadre des lieux d'hébergement collectif
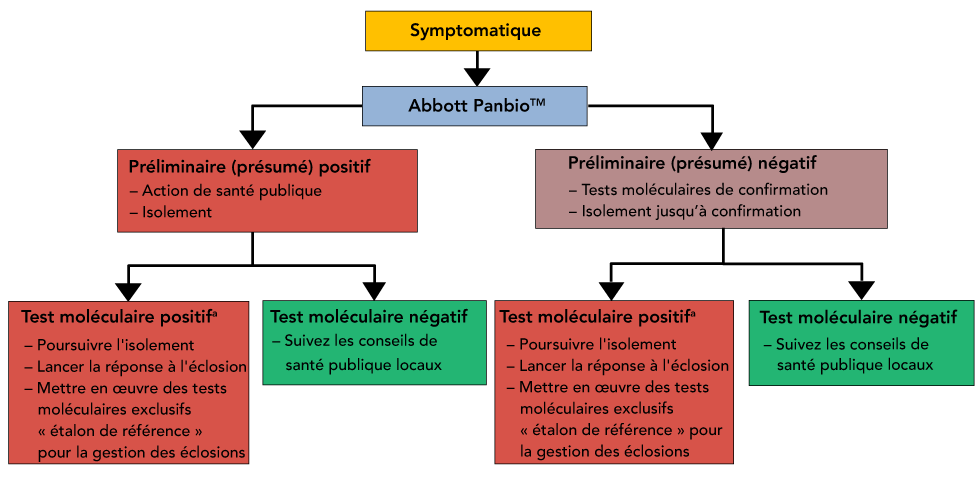
a Un seul cas positif confirmé au niveau moléculaire chez les résidents ou le personnel déclenche l’intervention en cas d’éclosion
Description textuelle : Figure 3
Figure 3 : Scénario 1 - Dépistage symptomatique dans le cadre des lieux d'hébergement collectif
Arbre de décision représentant les actions de santé publique suggérées, la déclaration et le test répété des patients symptomatiques dans un environnement d'hébergement collectif/à haut risque. Dans ce scénario, les résultats positifs et négatifs Panbio nécessiteraient un nouveau test réflexif en raison des conséquences accrues des résultats faux négatifs et faux positifs.
Dans ce cas, l’utilisation prévue d’un test au point d’intervention est de surveiller l’infection chez des personnes qui ne pourraient pas être testées à la même fréquence en raison de difficultés liées à la capacité de dépistage. En raison de la réduction potentielle de la probabilité d’un résultat positif avant le test, le test devrait être confirmé par un test d’amplification des acides nucléiques en laboratoire. Cette exigence de confirmation vise à réduire le risque de facteurs négatifs associés à un test faussement positif (e.g. retrait inutile du travail, stigmatisation pouvant être associée à l’infection).
Scénario 1A - Dépistage symptomatique dans les communautés isolées du Nord : Les tests rapides pour la COVID-19 Panbio pourraient être utilisés pour dépister tous les individus des communautés nordiques, éloignées et isolées présentant un ou plusieurs symptômes de la COVID-19 (dans les cinq jours suivant l’apparition des symptômes) afin d’assurer une surveillance en temps réel d’une éventuelle éclosion de COVID-19 et d’accélérer les actions de santé publique. En raison des retards prévus dans le retour des résultats de laboratoire, deux écouvillons nasopharyngés seraient toujours prélevés lorsqu’un patient se présenterait pour la première fois pour des soins. Un échantillon prélevé par écouvillonnage du nasopharynx serait ensuite testé par le test antigénique rapide pour la COVID-19 Panbio tandis que le second échantillon prélevé par écouvillonnage du nasopharynx serait envoyé par réflexe pour être testé par une méthode moléculaire de référence (dans un laboratoire de référence ou sur un site utilisant le test moléculaire GeneXpert™ Xpress SRAS-CoV-2). Dans ce scénario, tous les résultats (positifs et négatifs) du test antigénique rapide pour la COVID-19 Panbio seraient considérés comme préliminaires/présumés jusqu’à ce qu’ils soient confirmés au niveau moléculaire. Un résultat négatif présumé exigerait que les personnes symptomatiques continuent à s’isoler jusqu’à ce que les résultats soient confirmés négatifs par un test de référence, tandis qu’un résultat positif présumé permettrait de prendre des mesures immédiates de santé publique qui pourraient bénéficier de manière significative aux membres de la communauté exposés à un risque accru de maladie grave du fait de la COVID-19 (i.e. les personnes de plus de 65 ans ou les personnes souffrant de troubles médicaux sous-jacents). Si un test antigénique rapide pour la COVID-19 Panbio est confirmé comme positif par une méthode de référence moléculaire, la communauté nordique, éloignée et isolée lancerait une réponse à l’éclosion qui pourrait inclure un dépistage Panbio en cours, mais devrait également intégrer un test moléculaire de référence pour une gestion efficace de l’éclosion.
Scénario 2 - dépistage asymptomatique dans le cadre des lieux d’hébergement collectif : On pourrait envisager de surveiller les personnes asymptomatiques qui risquent d’introduire l’infection dans des milieux à haut risque. Les données de modélisation suggèrent que les protocoles de dépistage qui incorporent des tests répétés et fréquents sur des individus asymptomatiques pourraient être efficaces Note de bas de page 3. La seule mise en garde est qu’il peut y avoir une résistance des individus à subir des prélèvements d’échantillon par écouvillonnage du nasopharynx répétés en raison de leur inconfort. La nécessité pour un professionnel de la santé d’obtenir des échantillons prélevés par écouvillonnage du nasopharynx, combinée avec la sensibilité réduite du test antigénique rapide pour la COVID-19 Panbio, suggère que cette technologie pourrait avoir moins d’utilité pour la répétition de tests en série sur des individus asymptomatiques en l’absence d’une éclosion connue ou dans un contexte de forte prévalence. À l’heure actuelle, l’autorisation de mise sur le marché du test antigénique rapide pour la COVID-19 Panbio par le Bureau des dispositifs médicaux de Santé Canada est exclusivement axée sur les dépistages symptomatiques dans la phase précoce de la maladie, de sorte que l’utilisation du test dans un contexte de surveillance nécessitera une validation clinique minutieuse. La fréquence des tests répétés n’a pas encore été définie.
Surveillance communautaire asymptomatique dans la population générale
Il existe une abondance de données mettant en évidence la propagation asymptomatique du SRAS-CoV-2. Jusqu’à 40 % de toutes les transmissions survenant dans la population générale, même avec l’hygiène des mains, le port de masque et la distanciation sociale, semblent être dues à des événements de transmission silencieux ou asymptomatiques. La généralisation des tests sur les individus dans la population générale permettra de mieux comprendre l’étendue de la propagation asymptomatique ainsi que la prévalence de l’infection dans la population générale et pourrait également contribuer à déstigmatiser les tests pour la COVID-19. Tout comme les récents programmes « Connaissez votre statut » pour les infections sexuellement transmissibles par le sang, le dépistage généralisé et les connaissances qui en découlent peuvent aider à normaliser le test de la COVID-19 et contribuer à informer et à réduire les comportements associés à la transmission. La généralisation des dépistages communautaires sur les personnes asymptomatiques doit prendre en considération l’impact que ces dépistages peuvent avoir sur les systèmes de soins de santé et de laboratoire, en veillant à ce que les ressources des soins de santé et des laboratoires puissent rester concentrées sur les besoins des personnes à haut risque et symptomatiques. En tant que tel, le dépistage communautaire de la COVID-19 nécessitera probablement de nouvelles approches pour la collecte d’échantillons, comme le recours à des professionnels non réglementés et non spécialisés dans les soins de santé qui sont formés pour effectuer des tests sur place. Les personnes testées pourraient soit recevoir les résultats sur place, soit les recevoir par message texte ou par courrier électronique dans les meilleurs délais.
La figure 4 résume les mesures à prendre pour une surveillance communautaire asymptomatique dans la population générale.
Figure 4 : Surveillance communautaire asymptomatique dans la population générale
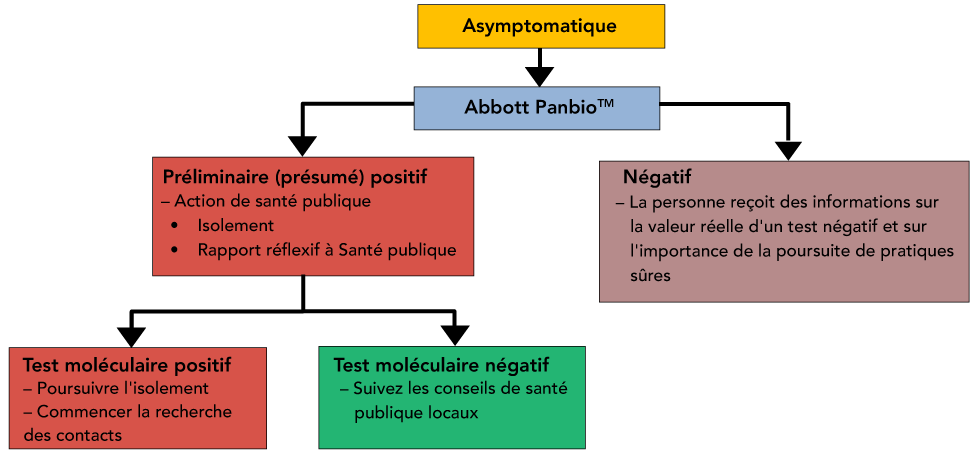
Description textuelle : Figure 4
Figure 4 : Surveillance communautaire asymptomatique dans la population générale
Arbre de décision représentant les actions de santé publique suggérées, la déclaration et le test répété des patients asymptomatiques pour la surveillance de la population générale. Dans ce scénario, un résultat Panbio négatif ne nécessiterait pas de tests réflexifs en raison de la probabilité de surcharger un programme de tests de laboratoire déjà bien chargé.
En cas de résultat négatif, les messages textes peuvent également inclure des informations sur les limites d’un résultat négatif et renforcer les mesures de santé publique telles que la vigilance continue/attention aux symptômes. Des résultats négatifs ne nécessiteraient pas de tests réflexifs, car cela risquerait de submerger un programme de tests en laboratoire déjà bien chargé.
En cas de résultat positif, la personne sera informée du devoir de s’isoler et d’être reliée de manière appropriée aux systèmes de santé publique provinciaux/territoriaux pour les tests de confirmation et le suivi (i.e. la recherche des contacts). Des informations peuvent être fournies parallèlement à la santé publique pour accélérer les interventions efficaces.
Communication des résultats et assurance de la qualité
L’utilisation du test antigénique rapide pour la COVID-19 Panbio se fera très probablement en dehors d’un environnement de laboratoire. Les autorisations de mise sur le marché actuellement prévues devraient exiger la supervision de la procédure de dépistage par un professionnel de la santé qualifié. Il sera essentiel d’établir un mécanisme et des orientations pour la communication des résultats (en particulier les résultats positifs) au système de santé publique ou au système de laboratoire afin de garantir une saisie des données et un contrôle de qualité appropriés, et de soutenir l’action de santé publique.
Il est essentiel que les pratiques d’assurance de la qualité soient prises en compte lors de la mise en œuvre des tests au point d’intervention, quelle que soit la simplicité perçue du test. Lorsque les tests au point d’intervention sont mis en œuvre en dehors d’un environnement hospitalier, il est recommandé aux sites de s’associer à des laboratoires locaux accrédités pour une orientation et une surveillance continues. Le directeur du laboratoire et les laboratoires partenaires guideront les sites pour s’assurer que les pratiques importantes d’assurance de la qualité sont en place.
Exemples de pratiques d’assurance de la qualité à prendre en compte :
- Formation et autorisation permanente du personnel qui effectuera les tests au point d’intervention
- Validation initiale et continue des réactifs avant l’utilisation clinique
- Pratiques de contrôle de la qualité pour une surveillance régulière des rendements des tests
- Tests d’aptitudes pour contrôler les pratiques générales de dépistage sur un site
- Dépannage des problèmes liés aux tests ou aux appareils
- Communication des résultats
Des questions scientifiques cruciales
L’état de la science continue d’évoluer chaque jour alors que des investissements mondiaux sans précédent dans la recherche et le développement se poursuivent. Malgré cela, il reste un certain nombre de questions essentielles pour éclairer l’utilisation de nouveaux tests tels que le test antigénique rapide pour la COVID-19 Panbio et les types d’échantillons.
- Comment ces tests fonctionnent-ils dans des situations « réelles »?
- De nombreuses demandes d’approbation réglementaire ont utilisé des échantillons simulés pour évaluer les tests. Cela crée une incertitude quant au véritable rendement lorsqu’il est appliqué à des patients réels. Il doit y avoir une vérification du rendement en comparant le rendement réel de l’utilisation prévue sur le terrain par rapport à la méthode traditionnelle d’amplification des acides nucléiques.
- Quelle est la fréquence des tests nécessaires pour combler l’écart de sensibilité?
- Il faut pour cela comprendre la dynamique du test au fil du temps. Il sera important de déterminer la fréquence des tests afin de mieux atténuer le risque de manquer des cas en raison de la sensibilité réduite du test antigénique rapide pour la COVID-19 Panbio.
- À quel seuil de transmission communautaire est-il bénéfique de répéter les tests dans des environnements précis?
Conclusion
Ce document fournit des lignes directrices provisoires sur l’utilisation du test rapide d’antigène Abbott Panbio COVID-19 dans le contexte du système canadien de santé publique et une réponse nationale coordonnée à la maladie du coronavirus. Ces lignes directrices sont censées être mises à jour périodiquement au fur et à mesure que de plus amples renseignements sont disponibles sur la sensibilité et la spécificité des tests dans le contexte global de l’infection pandémique 2019 par le SRAS-CoV-2 (COVID-19).
Intérêts concurrents
Aucun.
Remerciements
La contribution du Réseau des laboratoires de santé publique du Canada provient du Conseil des directeurs de laboratoire du Réseau des Laboratoires de Santé Publique du Canada et du Groupe de travail sur les infections respiratoires virales. Nous tenons à remercier les membres du secrétariat du RLSPC, notamment A. MacKeen et T. Kuschak, qui ont coordonné la synthèse du document.
Financement
Aucun.
Références
- Note de bas de page 1
-
Bullard J, Dust K, Funk D, Strong JE, Alexander D, Garnett L, Boodman C, Bello A, Hedley A, Schiffman Z, Doan K, Bastien N, Li Y, Van Caseseele PG, Poliquin G. Predicting infectious SARS-CoV-2 from diagnostic samples. Clin Infect Dis. 2020 May 22:ciaa638. Publié en ligne, avant la version imprimée. https://doi.org/10.1093/cid/ciaa638.
- Note de bas de page 2
-
He X, Lau EH, Wu P, Deng X, Wang J, Hao X, Lau YC, Wong JY, Guan Y, Tan X, Mo X, Chen Y, Liao B, Chen W, Hu F, Zhang Q, Zhong M, Wu Y, Zhao L, Zhang F, Cowling BJ, Li F, Leung GM. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nat Med 2020;26(5):672–5. https://doi.org/10.1038/s41591-020-0869-5
- Note de bas de page 3
-
Mina MJ, Parker R, Larremore DB. Rethinking Covid-19 Test Sensitivity - A Strategy for Containment. N Engl J Med 2020;383(22):e120. https://doi.org/10.1056/NEJMp2025631

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International
Détails de la page
- Date de modification :