Guide pour la préparation des demandes préalables à la mise en marché de préparations pour nourrissons et de fortifiants pour lait humain
2021
Table des matières
- 1.0 Introduction
- 2.0 Contexte réglementaire
- 3.0 Considérations administratives
- 4.0 Exigences relatives aux demandes préalables à la mise en marché visant les préparations pour nourrissons et les fortifiants pour lait humain
- 4.1 Marque et nom du produit
- 4.2 Nom et adresse
- 4.3 Description du changement majeur
- 4.4 Liste de tous les ingrédients
- 4.5 Spécifications des ingrédients
- 4.6 Procédure de contrôle de la qualité pour l'analyse des éléments nutritifs
- 4.7 Processus de fabrication et procédures de contrôle de la qualité
- 4.8 Date limite d'utilisation et données de stabilité
- 4.9 Valeur nutritive adéquate
- 4.10 Données probantes à l'appui de changements majeurs
- 4.11 Emballage
- 4.12 Instructions sur la préparation, l'emploi et la conservation
- 4.13 Texte de l'étiquette
- 4.14 Demande signée
- 4.15 Justification scientifique pour un nouveau fortifiant pour lait humain ou pour un changement majeur
- 5.0 Examens faits à l'étranger
- 6.0 Références au lait maternel
- 7.0 Glossaire et abréviations
- Appendice 1a. Liste de vérification des demandes visant les préparations pour nourrissons: nouvelle demande
- Appendice 1b. Liste de vérification des demandes visant les préparations pour nourrissons: changement majeur
- Appendice 2a. Liste de vérification des demandes visant les fortifiants pour lait humain: nouvelle demande
- Appendice 2b. Liste de vérification des demandes visant les fortifiants pour lait humain: changement majeur
- Appendice 3. Organigramme d'approbation d'un aliment nouveau ou d'un nouvel ingrédient d'aliment pour bébés (NIAB)
- Appendice 4. Modèle de comparaison du profil nutritionnel d'une préparation pour nourrissons prématurés ou d'un fortifiant de lait humain (tel qu'il est donné) avec les recommandations nutritionnelles pour prématurés pour 100 kcal
- Appendice 5. Modèle suggéré pour les données de spécification du produit fini, préparation pour nourrissons
- Appendice 6. Modèle suggéré pour les données de stabilité, préparation pour nourrissons
1.0 Introduction
Une préparation pour nourrissons est un succédané de lait humain qui est donné aux nourrissons généralement pendant la première année de leur vie. Une préparation pour nourrissons est vendue soit sous forme de liquide prêt à servir, soit sous forme de concentré à diluer dans l'eau, soit sous forme de poudre à mélanger à de l'eau avant de nourrir les nourrissons. Pour certains nourrissons, une préparation pour nourrissons est la seule source d'alimentation reçue de la naissance à environ six mois de vie, lorsque d'autres aliments sont généralement introduits. Les six premiers mois sont cruciaux pour les nourrissons, car ils connaissent une croissance et un développement rapides au cours de cette période. Ainsi, des garanties strictes doivent être mises en place pour protéger cette population vulnérable afin de s'assurer que les préparations pour nourrissons sont bien tolérées, qu'elles peuvent être utilisées en toute sécurité et qu'elles favorisent la croissance et le développement. Le terme « préparation pour nourrissons » comprend les préparations pour nourrissons prématurés ainsi que les préparations spécialisées pour nourrissons, telles que celles qui sont hypoallergéniques ou destinées aux nourrissons présentant des erreurs innées du métabolisme.
Les fortifiants pour lait humain sont des aliments dont la composition comprend au moins l'ajout de vitamines, de minéraux ou d'acides aminés, qui sont destinés à être ajoutés au lait humain (lait maternel) pour en augmenter la valeur nutritionnelle. Les fortifiants pour lait humain sont administrés à certains nourrissons prématurés ou à d'autres nourrissons (par exemple, les nourrissons de faible poids à la naissance) lorsqu'ils sont médicalement requis pour répondre à des besoins nutritionnels particuliers. Les fortifiants pour lait humain n'ont pas une valeur nutritive adéquate s'ils ne sont pas ajoutés au lait humain.
Au Canada, les préparations pour nourrissons et les fortifiants pour lait humain sont assujettis à la Règlement sur les aliments et drogues (RAD). Plus spécifiquement, en vertu du titre 25 du RAD, les fabricants doivent présenter une demande préalable à la mise en marché avant de vendre ou d'annoncer toute nouvelle préparation pour nourrissons ou tout nouveau fortifiant pour lait humain, ou un qui a subi un changement majeur. La demande préalable à la mise en marché doit contenir des renseignements détaillés sur la composition et la fabrication de la préparation pour nourrissons ou du fortifiant pour lait humain, son emballage et son étiquetage, ainsi que des données probantes permettant d'établir que la préparation pour nourrissons nouvelle ou modifiée ou le fortifiant pour lait humain nouveau ou modifié est sûr et a une valeur nutritionnelle adéquate pour favoriser une croissance et un développement acceptables chez les nourrissons auxquels il est destiné. Dans les cas où seuls des changements mineurs sont apportés à la préparation pour nourrissons ou au fortifiant pour lait humain existant, des demandes volontaires peuvent être considérées comme appropriées.
Ce guide a pour but d'aider les fabricants de préparations pour nourrissons ou de fortifiants pour lait humain à préparer une demande préalable à la mise en marché pour une préparation pour nourrissons ou un fortifiant pour lait humain. Les sections 4.6, 4.7 et 4.8 du présent guide renvoient aux Bonnes pratiques de fabrication des préparations pour nourrissons de Santé Canada (appelées « les BPF » dans le présent document), qui s'appliquent aussi généralement aux fortifiants pour lait humain, et qui établissent les exigences générales d'un contrôle efficace des ingrédients, des formulations, des procédés, des installations et de l'équipement utilisés pour la production de toutes les préparations pour nourrissons et de tous les fortifiants pour lait humain devant être vendus, distribués ou commercialisés au Canada. Ces exigences s'appliquent indépendamment du fait que la préparation pour nourrissons ou le fortifiant pour lait humain soit fabriqué au Canada ou dans un autre pays dont la réglementation relative à la fabrication peut différer de celle du Canada. Les BPF s'appliquent aux préparations pour nourrissons et aux fortifiants pour lait humain nouveaux ou modifiés ainsi qu'aux installations de sous-traitants tiers qui servent à la fabrication ou à l'emballage de ces produits.
À la fin de l'examen préalable à la mise en marché d'une nouvelle préparation pour nourrissons ou d'un nouveau fortifiant pour lait humain, et si Santé Canada n'a pas d'autres questions ou objections, une lettre sera émise pour la vente de la préparation pour nourrissons ou du fortifiant pour lait humain au Canada.
Tous les fabricants de préparations pour nourrissons et de fortifiants pour lait humain doivent obtenir une licence en vertu de la Loi sur la salubrité des aliments au Canada et du Règlement sur la salubrité des aliments au Canada pour mener des activités, notamment la fabrication, l'étiquetage, l'emballage, l'exportation, l'importation ou l'envoi de préparations pour nourrissons ou de fortifiants pour lait humain au-delà des frontières provinciales ou territoriales. Après avoir obtenu votre lettre de Santé Canada, veuillez consulter Mon ACIA et le site web Ce qu'il faut savoir avant de présenter une demande de licence pour la salubrité des aliments au Canada pour obtenir une licence pour la salubrité des aliments au Canada.
2.0 Contexte réglementaire
2.1 Définitions réglementaires
Le terme suivant est défini à l'article 2 de la LAD:
- Vente – est assimilé au fait de mettre en vente, ou d'exposer ou d'avoir en sa possession pour la vente, ou de distribuer, que la distribution soit faite ou non pour une contrepartie.
Le terme suivant est défini à l'article A.01.010 du RAD:
- Fabricant ou distributeur - désigne toute personne, y compris une association ou une société de personnes, qui, sous son propre nom ou sous une marque de commerce, un dessin-marque, un logo, un nom commercial ou un autre nom, dessin ou marque soumis à son contrôle, vend un aliment ou une drogue.
Les termes suivants sont définis à l'article B.25.001 du RAD:
- Bébé - désigne une personne de moins d'un an.
- Changement majeur - relativement à un fortifiant pour lait humain ou à un succédané de lait humain, un changement d'ingrédient ou de la quantité d'un ingrédient, ou la modification du traitement ou de l'emballage du fortifiant pour lait humain ou du succédané de lait humain, qui pourrait, selon l'expérience du fabricant ou la théorie généralement admise, altérer les concentrations ou compromettre la disponibilité des éléments nutritifs du fortifiant pour lait humain ou du succédané de lait humain, ou l'innocuité microbiologique ou chimique de ceux-ci;
- Date limite d'utilisation - s'entend, dans le cas d'un succédané de lait humain (préparation pour nourrissons), de la date :
- après laquelle le fabricant recommande de ne pas consommer le succédané de lait humain,
- jusqu'à laquelle le succédané de lait humain conserve sa stabilité physique et microbiologique, et
- la valeur nutritive indiquée sur l'étiquette.
- Fortifiant pour lait humain - désigne un aliment dont la composition comprend une vitamine, un minéral nutritif ou un acide aminé ajouté, et qui est étiqueté ou annoncé comme devant être ajouté au lait humain pour augmenter sa valeur nutritive afin de satisfaire aux besoins alimentaires particuliers d'un bébé qui manifeste un état physique ou physiologique particulier en raison d'une maladie, d'un désordre ou d'un état physique anormal.
- Succédané de lait humain nouveau - désigne une préparation pour nourrissons
- soit qui est fabriquée pour la première fois,
- soit qui est vendue au Canada pour la première fois,
- soit qu'une personne fabrique pour la première fois.
- Succédané de lait humain - désigne tout aliment présenté
- comme un remplacement partiel ou total du lait humain et destiné à être consommé par des bébés, ou
- comme pouvant être utilisé comme ingrédient d'un aliment visé à l'alinéa a).
Le terme suivant est défini à l'article B.27.001 du RAD:
- Aliment peu acide - désigne un aliment, à l'exception des boissons alcooliques, dont l'un des constituants a un pH supérieur à 4,6 et une activité de l'eau supérieure à 0,85.
2.2 Réglementation des préparations pour nourrissons et des fortifiants pour lait humain au Canada
En vertu des articles B.25.046 et B.25.048 (pour les préparations pour nourrissons) et des articles B.25.011 et B.25.015 (pour les fortifiants pour lait humain) du RAD, les fabricants sont tenus d'envoyer une demande préalable à la mise en marché avant de vendre ou d'annoncer toute nouvelle préparation pour nourrissons ou une préparation qui a fait l'objet d'un changement majeur. La demande doit contenir des renseignements détaillés sur :
- La composition et la fabrication de la préparation pour nourrissons ou du fortifiant pour lait humain;
- Son emballage et étiquetage;
- Les données probantes établissant que la préparation pour nourrissons nouvelle ou modifiée ou le fortifiant pour lait humain nouveau ou modifié est sûr et a une valeur nutritive adéquate pour favoriser une croissance et un développement acceptables chez les nourrissons auxquels il est destiné.
Les exigences propres à une nouvelle préparation pour nourrissons sont fournies au paragraphe B.25.046 (2), alinéas a) à m) du RAD, et celles relatives à une préparation pour nourrissons qui a fait l'objet d'un changement majeur se trouvent au paragraphe B.25.048 (2), alinéas a) à g) du RAD. Les exigences propres à un nouveau fortifiant pour lait humain sont fournies au paragraphe B.25.011, alinéas a) à n) du RAD, et celles relatives à un fortifiant pour lait humain qui a fait l'objet d'un changement majeur se trouvent au paragraphe B.25.015 (2), alinéas a) à g), du RAD.
2.3 Quand une demande préalable à la mise en marché est-elle requise?
Une demande préalable à la mise en marché est requise pour 1) toute nouvelle préparation pour nourrissons ou tout nouveau fortifiant pour lait humain, 2) toute préparation pour nourrissons ou tout fortifiant pour lait humain qui a fait l'objet d'un changement majeur.
Les exigences réglementaires propres aux préparations pour nourrissons se trouvent aux articles B.25.046 et B.25.048, et celles propres aux fortifiants pour lait humain se trouvent aux articles B.25.011 et B.25.015 du RAD.
Les fabricants sont fortement encouragés à utiliser les listes de vérification fournies dans le présent document : l'appendice 1 pour les demandes relatives aux préparations pour nourrissons, et l'appendice 2 pour les demandes relatives aux fortifiants pour lait humain, afin de s'assurer que tous les renseignements requis sont inclus dans le dossier de demande.
Les fabricants sont fortement encouragés à demander une réunion préalable à la demande d'approbation avec Santé Canada pendant la préparation d'une demande préalable à la mise en marché pour une nouvelle préparation pour nourrissons ou un nouveau fortifiant pour lait humain ou lorsqu'ils prévoient un changement de formulation, d'emballage ou de traitement. Une demande de réunion préalable à la demande d'approbation doit être envoyée à l'Unité de la gestion des demandes et de l'information de la Direction des aliments de Santé Canada à l'adresse suivante : smiu-ugdi@hc-sc.gc.ca.
2.3.1 Nouvelle préparation pour nourrissons ou nouveau fortifiant pour lait humain
Les fabricants doivent fournir à Santé Canada une demande préalable à la mise en marché d'une nouvelle préparation pour nourrissons ou d'un nouveau fortifiant pour lait humain ou lorsqu'il est fabriqué pour la première fois, vendu pour la première fois au Canada ou fabriqué par une personne qui le fabrique pour la première fois.
Les alinéas a) à m) du paragraphe B.25.046 (2) du RAD précisent les exigences réglementaires pour une nouvelle préparation pour nourrissons, tandis que les alinéas a) à n) de l'article B.25.011 précisent les exigences réglementaires pour un nouveau fortifiant pour lait humain.
2.3.2 Préparation pour nourrissons ou fortifiant pour lait humain ayant fait l'objet d'un changement majeur
Les fabricants doivent aviser Santé Canada avant la vente de toute préparation pour nourrissons ou de tout fortifiant pour lait humain qui a fait l'objet d'un changement majeur d'ingrédients, d'emballage ou de procédé de fabrication et dont on peut s'attendre à ce qu'il ait une incidence négative sur l'innocuité, les concentrations ou la disponibilité des éléments nutritifs. Voici des exemples de changements majeurs pour lesquels une demande préalable à la mise en marché est nécessaire :
- Tout changement du traitement ou de l'emballage;
- Changement apporté à l'installation de fabrication ou nouvelle installation de fabrication;
- Ajout d'une nouvelle source de macronutriments (protéines, lipides ou glucides);
- Changement important de la quantité de protéines, de lipides ou de glucides;
- Ajout d'un nouvel ingrédient ou d'un aliment nouveau;
- Changement de la quantité ou des sources de vitamines ou de minéraux qui pourrait, selon l'expérience du fabricant ou la théorie généralement admise, altérer les concentrations ou compromettre la disponibilité des éléments nutritifs, ou l'innocuité microbiologique ou chimique.
Les alinéas a) à g) du paragraphe B.25.048 (2) du RAD précisent les exigences réglementaires pour une préparation pour nourrissons ayant fait l'objet d'un changement majeur, tandis que les alinéas a) à g) du paragraphe B.25.015 (2) précisent les exigences réglementaires pour un fortifiant pour lait humain ayant fait l'objet d'un changement majeur.
Les fabricants qui prévoient un changement de formulation, d'emballage ou de traitement doivent communiquer avec l'Unité de la gestion des demandes et de l'information (UGDI) de la Direction des aliments de Santé Canada pour organiser une réunion préalable à la demande d'approbation, à l'adresse : smiu-ugdi@hc-sc.gc.ca.
2.3.3 Nouvel ingrédient d'aliment pour bébés
Le fabricant d'un nouvel ingrédient qui n'a jamais été utilisé dans une préparation pour nourrissons ou un fortifiant pour lait humain au Canada doit présenter une demande d'évaluation d'un aliment nouveau ou d'un nouvel ingrédient d'aliment pour bébés (NIAB). Le fabricant doit recevoir l'approbation de l'ingrédient en tant qu'aliment nouveau ou en tant que NIAB avant qu'une demande préalable à la mise en marché soit faite pour une préparation pour nourrissons ou un fortifiant pour lait humain contenant l'ingrédient. Le processus est décrit à l'appendice 3, Organigramme d'approbation d'un aliment nouveau ou d'un nouvel ingrédient d'aliment pour bébés.
Aliment nouveau
Si l'ingrédient est nouveau (par exemple, parce qu'il n'a pas d'antécédents d'utilisation sécuritaire comme aliment au Canada), son innocuité doit d'abord être évaluée par Santé Canada, comme l'exige titre 28 du RAD. Le demandeur doit consulter les Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux de Santé Canada.
Nouvel ingrédient d'aliment pour bébés (NIAB)
Si le nouvel ingrédient n'est pas nouveau pour la population générale, ou si son innocuité a été évaluée uniquement pour la population générale, à l'exclusion des nourrissons, son innocuité doit être évaluée pour la population des nourrissons. Les exigences à l'appui d'une demande de NIAB sont les suivantes :
- Description du nouvel ingrédient, du procédé de fabrication et de la monographie du produit
- Historique de l'utilisation, y compris le statut réglementaire dans d'autres administrations
- Exposition alimentaire proposée pour les nourrissons
- Considérations nutritionnelles
- Toxicologie
- Biodisponibilité et fonction chez l'adulte et le nourrisson
- Efficacité physiologique, effets gastro-intestinaux et considérations d'innocuité dans la population des nourrissons – Cela peut comprendre des études cliniques menées chez les nourrissons nés à terme ou prématurés, selon la population cible proposée et utilisant le nouvel ingrédient en question (ou un ingrédient similaire, à condition que l'équivalence avec l'objet de la demande du NIAB soit démontrée).
- Allergénicité
- Considérations chimiques, notamment les additifs alimentaires utilisés, les niveaux de contaminants tels que les métaux lourds
- Microbiologie
S'il n'est pas démontré que le nouvel ingrédient est sans danger pour les nourrissons, il sera rejeté.
Demande préalable à la mise en marché pour une préparation pour nourrissons ou un fortifiant pour lait humain
Si le NIAB ou l'aliment nouveau est jugé sans danger pour les nourrissons, les demandeurs sont invités à envoyer une demande préalable à la mise en marché de la préparation pour nourrissons ou du fortifiant pour lait humain contenant le nouvel ingrédient en suivant les lignes directrices du présent document.
3.0 Considérations administratives
3.1 Renseignements de nature administrative
Les demandes présentées à Santé Canada doivent répondre aux exigences ci-dessous :
- La pagination de chaque fichier de document présenté doit être séquentielle;
- L'identification du demandeur (par exemple, le nom de la société) doit figurer au moins une fois sur chaque fichier de document présenté;
- Les demandeurs sont tenus d'indiquer clairement les parties de la demande qui contiennent des données exclusives ou confidentielles (par exemple, les résultats d'un essai clinique non publié, des détails sur la fabrication);
- Les demandeurs sont responsables de l'exactitude de toutes les références citées, publiées ou non. Un style établi pour citer les références doit être utilisé.
- Si une tierce partie présente une demande au nom du fabricant/demandeur, le formulaire de la partie autorisée désignée doit être inclus dans la demande.
Important : Toutes les données et informations contenues dans la demande doivent être fournies en anglais ou en français. Les documents rédigés dans d'autres langues doivent être traduits en anglais ou en français pour être acceptés et examinés par Santé Canada.
3.2 Lettre d'accompagnement
Une lettre d'accompagnement doit être jointe à la demande préalable à la mise en marché du demandeur. La lettre doit être datée et fournir les coordonnées complètes, notamment le nom, le titre, l'adresse complète et le numéro de téléphone du demandeur et de toutes les parties, y compris les tiers autorisés par le demandeur à communiquer avec Santé Canada au sujet de la demande.
La lettre doit décrire brièvement le produit et contenir la marque et le nom du produit. La référence à toute demande connexe ou antérieure doit être mentionnée dans la lettre d'accompagnement, et doit porter le numéro de la demande, les dates clés, le nom de la marque, etc.
Il est courant que les entreprises utilisent les installations d'un fabricant distinct et confient certains des aspects techniques de la demande au personnel qualifié de l'installation de fabrication. Ces dispositions et toutes les coordonnées pertinentes doivent être indiquées dans la lettre d'accompagnement.
3.3 Listes de vérification
Des listes de vérification (appendices 1 et 2) ont été élaborées pour aider les demandeurs à assembler leur demande d'approbation d'une préparation pour nourrissons ou d'un fortifiant pour lait humain. La liste de vérification résume les renseignements administratifs et scientifiques ou techniques qui sont censés aider le demandeur à préparer une demande et l'évaluateur scientifique à vérifier que les renseignements requis ont été présentés. Bien qu'il ne s'agisse pas d'une exigence légale, il est demandé que la liste de vérification remplie soit envoyée avec la demande et la lettre d'accompagnement.
3.4 Comment présenter une demande
Les demandes relatives aux préparations pour nourrissons, fortifiants pour lait humain et aux NIAB doivent être envoyées par courriel à l'Unité de gestion des demandes et de l'information de la Direction des aliments de Santé Canada, à l'adresse : smiu-ugdi@hc-sc.gc.ca.
3.5 Processus de gestion des demandes préalables à la mise en marché visant les préparations pour nourrissons de la Direction des aliments
Les fabricants sont vivement encouragés à consulter Le processus de gestion des demandes visant les additifs alimentaires, les préparations pour nourrissons et les aliments nouveaux de la Direction des aliments pour obtenir de l'information sur les réunions préalable à la demande d'approbation, la vérification administrative, l'évaluation scientifique des demandes et les décisions.
3.5.1 Échéancier de traitement des demandes
Santé Canada s'engage à améliorer la rapidité de l'examen des demandes visant les préparations pour nourrissons et les fortifiants pour lait humain. Après avoir reçu un dossier de demande complet, Santé Canada applique une norme de service de 90 jours d'examen actif pour la grande majorité des préparations pour nourrissons et des fortifiants pour lait humain. Le temps d'examen actif correspond au temps que les évaluateurs de Santé Canada passent à examiner la demande. Si le dossier est incomplet ou si les renseignements reçus ne sont pas suffisants pour établir l'innocuité du produit, Santé Canada en avisera le demandeur par écrit et pourra demander des renseignements supplémentaires. Le temps écoulé entre la demande de renseignements supplémentaires de Santé Canada et la réception de ces renseignements n'est pas considéré comme un temps d'examen actif.
4.0 Exigences relatives aux demandes préalables à la mise en marché visant les préparations pour nourrissons et les fortifiants pour lait humain
Cette section décrit les renseignements précis requis dans le cadre d'une demande visant une préparation pour nourrissons ou un fortifiant pour lait humain en vertu du RAD.
4.1 Marque et nom du produit
Conformément aux alinéas B.25.046(2)a) et B.25.048(2)a) du RAD (pour les préparations pour nourrissons) et B.25.011a) et B.25.015(2)a) (pour les fortifiants pour lait humain), une demande préalable à la mise en marché doit préciser la marque et le nom du produit sous lesquels la préparation pour nourrissons ou le fortifiant pour lait humain sera vendu ou annoncé pour la vente.
Le nom du produit pourrait inclure des caractéristiques telles que :
- La source de protéines utilisée (par exemple, à base de lait de vache, à base de soja);
- La forme (par exemple, poudre, concentré liquide ou, pour les préparations pour nourrissons uniquement, liquide prêt à l'emploi);
- La population de nourrissons visée par la préparation (par exemple, les nourrissons nés à terme, les nourrissons en phase de transition, les prématurés, les nourrissons présentant une allergie aux protéines du lait de vache, etc.);
- Le type d'emballage (par exemple, sachet, boîte composite) et le volume ou le poids (par exemple, 120 mL ou 120 g).
4.2 Nom et adresse
Conformément aux alinéas B.25.046(2)b), c) et B.25.048(2)b) du RAD (pour les préparations pour nourrissons) et B.25.011b), c) et B.25.015(2)b) (pour les fortifiants pour lait humain), une demande préalable à la mise en marché doit contenir le nom et l'adresse du principal établissement du fabricant et les noms et adresses de chaque établissement dans lequel la préparation pour nourrissons ou le fortifiant pour lait humain doit être fabriqué.
Si une partie de la fabrication de la nouvelle préparation pour nourrissons ou du nouveau fortifiant pour lait humain est confiée à une entreprise tierce, le nom et l'adresse de l'entrepreneur doivent également être soumis. Il peut s'agir, par exemple, des ingrédients en vrac tels que la poudre de base, les mélanges de protéines ou les poudres de glucides fabriqués par une société tierce.
4.3 Description du changement majeur
Conformément à l'alinéa B.25.048(2)c) (pour les préparations pour nourrissons) et B.25.015(2)c) (pour les fortifiants pour lait humain) du RAD, la description du changement majeur proposé à une préparation pour nourrissons existante ou à un fortifiant pour lait humain existant doit être fournie. La description du changement majeur doit être accompagnée d'une description de tout autre changement (comme les ingrédients, la transformation, l'emballage) qui a été nécessaire pour s'adapter au changement majeur.
En cas de modification du mode de préparation, il convient de fournir un tableau comparant le mode actuel de préparation au mode proposé.
4.4 Liste de tous les ingrédients
Conformément à l'article B.25.046(2)d) (pour les préparations pour nourrissons) et à l'article B.25.011d) (pour les fortifiants pour lait humain) du RAD, la liste de tous les ingrédients doit être fournie avec les quantités spécifiées. La nomenclature d'un lot de préparation pour nourrissons doit être présentée pour répondre à cette exigence.
Pour la préparation pour nourrissons, les quantités d'éléments nutritifs doivent se situer dans la fourchette indiquée au tableau II du titre 25 du RAD, lorsqu'elles sont disponibles. Pour les éléments nutritifs qui ne figurent pas dans le tableau II, les normes du Codex appropriées et les fourchettes d'éléments nutritifs du rapport « Assessment of Nutrient Requirements for Infant Formulas (LSRO Report, 1998) du Life Sciences Research Office » doivent être utilisées à titre indicatif.
Les besoins nutritifs des prématurés selon les recommandations internationales d'experts les plus récentes sont résumés à l'appendice 4, qui se présente sous la forme d'un modèle permettant aux fabricants de comparer le profil nutritionnel de leurs produits aux besoins. L'évaluation de la préparation pour nourrissons prématurés est basée sur la préparation prête à l'emploi, et celle du fortifiant pour lait humain est basée sur la composition du fortifiant pour lait humain ajouté au lait humain pour prématurés (et non pas le fortifiant seul) conformément au mode d'emploi. Les quantités d'éléments nutritifs ajoutés à un nouveau fortifiant pour lait humain ou à un fortifiant qui a subi un changement majeur seront examinées et évaluées au cas par cas dans le cadre du processus d'examen préalable à la mise en marché.
Tout additif alimentaire présent dans la préparation pour nourrissons, le fortifiant pour lait humain ou la fabrication d'un ingrédient doit être décrit et son niveau d'utilisation doit être indiqué en pourcentage du poids de la préparation pour nourrissons ou du fortifiant pour lait humain, tel qu'il est consommé.
4.5 Spécifications des ingrédients
Conformément à l'article B.25.046 (2) (e) (pour les préparations pour nourrissons) et à l'article B.25.011 (f) (pour les fortifiants pour lait humain) du RAD, les spécifications relatives à la qualité nutritionnelle, microbiologique et physique de tous les ingrédients et de la nouvelle préparation pour nourrissons ou du nouveau fortifiant pour lait humain doivent être fournies dans la demande préalable à la mise en marché. Elles sont nécessaires pour permettre à Santé Canada de déterminer si une préparation répond aux exigences canadiennes en matière de composition et pour définir les dangers microbiens, physiques, nutritionnels et chimiques potentiels, y compris les allergènes. Les renseignements requis comprennent, entre autres, les certificats d'analyse et les fiches techniques des matières premières des fournisseurs.
Les spécifications du produit fini, avec les minimums et les maximums, doivent également être fournies pour la préparation pour nourrissons ou le fortifiant pour lait humain, préparé selon le mode d'emploi, les quantités étant exprimées pour 100 kcal. La préparation pour nourrissons préparée selon le mode d'emploi doit être conforme aux dispositions des articles B.25.054, B.25.055 et B.25.056 du RAD, outre toutes les autres exigences réglementaires du titre 25. Plus précisément, les quantités d'éléments nutritifs déclarées dans les spécifications du produit fini doivent se situer dans les limites des quantités minimales et maximales autorisées prévues pour chaque nutriment dans le tableau II du titre 25 du RAD ou dans les normes appropriées (voir la section 4.4 du présent guide). Les quantités d'éléments nutritifs minimales et maximales ajoutées à un nouveau fortifiant pour lait humain ou à un fortifiant qui a subi un changement majeur seront examinées et évaluées au cas par cas dans le cadre du processus d'examen préalable à la mise en marché.
Un modèle de spécification du produit fini est disponible pour les préparations pour nourrissons à l'appendice 5.
4.6 Procédure de contrôle de la qualité pour l'analyse des éléments nutritifs
Conformément à l'article B.25.046 (2) f) (pour les préparations pour nourrissons) et à l'article B.25.011 (g) (pour les fortifiants pour lait humain) du RAD, les fabricants doivent fournir des détails sur la procédure de contrôle de la qualité concernant l'analyse des ingrédients et de la nouvelle préparation pour nourrissons ou du nouveau fortifiant pour lait humain. Il s'agit notamment de fournir des documents démontrant que le fabricant possède des laboratoires convenablement équipés pour contrôler la production et l'acceptation des ingrédients bruts, des matériaux d'emballage, des produits semi-finis et des produits finis, ou qu'il a accès auxdits laboratoires. Des capacités de validation de méthodes et de processus et de stabilité peuvent également être requises. Consultez la section 3.6 des Bonnes pratiques de fabrication des préparations pour nourrissons.
Comme indiqué dans les sections 3.6, 3.9.2 et 3.10 des BPF, les fabricants sont tenus de mettre en œuvre une procédure de contrôle de la qualité pour tester chaque élément nutritif de chaque prémélange d'éléments nutritifs utilisé au cours de la fabrication, et de réaliser des tests d'éléments nutritifs appropriés dans les produits semi-finis et finis (avant la mise en circulation du produit). Les résultats fournis doivent permettre de vérifier que tous les éléments nutritifs requis par la réglementation et que tout élément nutritif ajouté par le fabricant sont présents aux niveaux appropriés dans chaque lot de préparations pour nourrissons ou de fortifiants pour lait humain.
Chaque lot de préparations en poudre pour nourrissons et de fortifiants pour lait humain doit répondre, au minimum, aux critères microbiologiques pour les préparations en poudre pour nourrissons adoptés par Santé Canada, tels que décrits dans le tableau 1 de la section 3.10 des BPF. Ces recommandations sont conformes au Code d'usages en matière d'hygiène pour les préparations en poudre pour nourrissons et jeunes enfants (Commission du Codex Alimentarius, CAC/RCP 66-2008).
Pour les préparations liquides pour nourrissons et les fortifiants pour lait humain, qui sont considérés comme des aliments peu acides emballés dans des récipients hermétiquement fermés (voir la section 3.9 des BPF et le titre 27 du RAD), la partie 4 du Règlement sur la salubrité des aliments au Canada (RSAC) fournit les exigences pour chaque application du traitement programmé aux aliments peu acides. Plus précisément, chaque application du traitement programmé aux aliments peu acides en conserve nécessite un enregistrement des résultats de l'incubation.
Des directives générales sur les tests d'incubation se trouvent dans le Code d'usages en matière d'hygiène pour les conserves non acidifiées ou acidifiées, de produits alimentaires naturellement peu acides, CAC/RCP 23-1979. Section 3.10 des BPF pour le contrôle des produits finis des préparations liquides et en poudre.
4.7 Processus de fabrication et procédures de contrôle de la qualité
Conformément à l'article B.25.046 (2) (g) (pour les préparations pour nourrissons) et à l'article B.25.011 (h) (pour les fortifiants pour lait humain) du RAD, une demande préalable à la mise en marché doit inclure les détails du processus de fabrication et de la procédure de contrôle de la qualité utilisée tout au long de la transformation. Cela signifie qu'il faut fournir les renseignements montrant le contrôle efficace des ingrédients, des modes de préparation, des procédés, des installations et de l'équipement utilisés dans la production de préparations pour nourrissons ou de fortifiants pour lait humain destinés à être vendus, distribués ou commercialisés au Canada. Consultez le site de Santé Canada pour connaître les Bonnes pratiques de fabrication des préparations pour nourrissons.
Le fabricant doit fournir les renseignements suivants pour l'examen de Santé Canada :
- Mode de préparation, conception du procédé, matières entrantes (ingrédients, additifs alimentaires, matériaux d'emballage et adjuvants de fabrication), équipement de transformation, contrôle du procédé, contrôle avant et après le procédé, préparation du produit et malaxage/mélange/conservation intermédiaire, traitement et conditions de traitement thermique (comme la pasteurisation ou la stérilisation/l'exigence de stérilité commerciale), homogénéisation, emballage et remplissage, séchage, fermeture du récipient et registres d'examen, conservation, produit semi-fini, produit fini, code ou identification du numéro de lot, tests relatifs à la stabilité du produit et à sa mise en circulation, et transport;
- Un plan complet d'analyse des risques et de maîtrise des points critiques (HACCP) ou un plan de BPF fondé sur le HACCP pour évaluer les contrôles que le fabricant a mis en place pour la production des préparations pour nourrissons ou des fortifiants pour lait humain;
- Diagramme de fabrication ou organigramme (de la réception des matières premières à la conservation et à la distribution du produit final), montrant la séquence et l'interaction de toutes les étapes de transformation de l'opération, y compris l'endroit où les matières premières, les ingrédients et les produits intermédiaires entrent dans le flux et où les produits intermédiaires, les sous-produits et les déchets sont rejetés ou éliminés;
- Texte détaillé décrivant le diagramme ou le flux du processus/la procédure de production.
Il incombe au fabricant d'informer Santé Canada des nouvelles installations de fabrication. Consultez les Exigences relatives aux nouvelles installations de fabrication de préparations pour nourrissons et de fortifiants pour lait humain.
4.8 Date limite d'utilisation et données de stabilité
Conformément à l'article B.25.046(2)h) (pour les préparations pour nourrissons) et à l'article B.25.011i) (pour les fortifiants pour lait humain) du RAD, la section 3.13 des Bonnes pratiques de fabrication des préparations pour nourrissons fournit des exigences générales sur le programme de stabilité et le contrôle de la date limite d'utilisation, qui s'appliquent également aux fortifiants pour lait humain.
Le fabricant doit fournir les renseignements suivants à Santé Canada :
- La période limite d'utilisation proposés pour le produit;
- Données de stabilité pour tous les éléments nutritifs afin de justifier la période limite d'utilisation proposée pour le produit;
- Les données de stabilité doivent porter sur un nombre suffisant de lots de chaque produit pendant la durée de conservation indiquée sur l'étiquette pour étayer les conclusions générales concernant la stabilité et les propriétés physiques de tous les ingrédients, en particulier les ingrédients labiles, ainsi qu'à la date limite d'utilisation;
- Données de stabilité pour au moins deux à trois lots commerciaux du produit proposé ou d'un produit similaire au produit proposé;
- Si le requérant choisit de fournir des données de stabilité pour un produit similaire commercialisé ailleurs (par exemple, aux États-Unis) ou de fournir des données provenant de lots de recherche portant un nom de produit différent, le nom du produit qui correspond au produit proposé doit également être fourni;
- Données de stabilité pour le produit proposé dans tous les formats d'emballage applicables (bouteilles en verre, boîtes métalliques, boîtes composites);
- Les données de stabilité pour les liquides doivent être fournies jusqu'à la durée de conservation proposée, et pour les poudres, elles peuvent être fournies jusqu'à un minimum de la moitié de la durée de conservation proposée;
- Des données sur la stabilité à plus de deux points dans le temps sont nécessaires pour les nouveaux produits. Le nombre de lots et la fréquence des tests de stabilité peuvent être réduits une fois que le fabricant a constitué une base de données suffisante.
L'appendice 6 fournit un modèle de données sur la stabilité des préparations pour nourrissons. En outre, la section 3.13 des Bonnes pratiques de fabrication des préparations pour nourrissons fournit des exigences générales sur le contrôle du programme de stabilité et de la date limite d'utilisation, qui s'appliquent également aux fortifiants pour lait humain.
4.9 Valeur nutritive adéquate
Conformément aux articles B.25.046(2)i) et B.25.048(2)d) du RAD (pour les préparations pour nourrissons) et aux articles B.25.011j) et B.25.015(2)d) (pour les fortifiants pour lait humain), les données probantes sur lesquelles on se fonde pour établir qu'une préparation pour nourrissons ou un fortifiant pour lait humain est adéquate sur le plan nutritionnel pour favoriser une croissance et un développement acceptables chez les nourrissons doivent être soumises à l'examen de Santé Canada.
Consultez les documents d'orientation suivants pour aider à la préparation des études visant à soutenir que la valeur nutritive est adéquate:
- Guide pour démontrer que la valeur nutritive est adéquate– Préparations pour nourrissons nés à terme
- Guide pour démontrer que la valeur nutritive est adéquate – Préparations pour prématurés et fortifiants pour lait humain
- Protocole d'essai clinique sur la croissance et la tolérance – Nouveau nés à terme en santé
- Protocole d'essai clinique sur la croissance et la tolérance – Prématurés
4.10 Données probantes à l'appui de changements majeurs
Conformément à l'article B.25.048 (2) (e) (pour les préparations pour nourrissons) et à l'article B.25.015(2)e) (pour les fortifiants pour lait humain) du RAD, un essai clinique sur la croissance et la tolérance et une étude du coefficient d'efficacité protéique (CEP) peuvent être exigés pour les préparations pour nourrissons ou les fortifiants pour lait humain qui ont subi un changement majeur.
Santé Canada encourage les requérants à avoir une réunion préalable à la demande d'approbation avec Santé Canada concernant les exigences du règlement, puisque les exigences varient au cas par cas.
4.11 Emballage
Conformément à l'article B.25.046 (2) (j) (pour les préparations pour nourrissons) et à l'article B.25.011k) du RAD (pour les fortifiants pour lait humain), le matériau d'emballage utilisé pour les préparations pour nourrissons ou les fortifiants pour lait humain doit être approuvé comme étant de qualité alimentaire et doit être conforme au titre 23 du RAD. Le fabricant doit fournir une lettre de non-objection émise par le Bureau d'innocuité des produits chimiques de Santé Canada pour confirmer l'acceptabilité. Les Bonnes pratiques de fabrication des préparations pour nourrissons doivent être consultées pour de plus amples renseignements sur les exigences de fabrication pour l'emballage des préparations pour nourrissons. Des renseignements supplémentaires sur le processus de demande préalable à la mise en marché pour les emballages alimentaires sont également disponibles dans le document d'orientation sur les matériaux d'emballage du Bureau d'innocuité des produits chimiques de la Direction des aliments de Santé Canada.
4.12 Instructions sur la préparation, l'emploi et la conservation
Conformément aux articles B.25.046 (2) (k), B.25.057 (1) (e) et (2) (e) du RAD (pour les préparations pour nourrissons) et aux articles B.25.011(l), B.25.020 (e) et (f) (pour les fortifiants pour lait humain), les instructions sur la préparation, l'emploi et la conservation d'une préparation pour nourrissons ou d'un fortifiant pour lait humain doivent figurer dans le texte de l'étiquette fourni dans le dossier de demande préalable à la mise en marché, comme précisé ci-dessous.
4.12.1 Mode de reconstitution et d'utilisation
L'objectif de fournir des instructions appropriées dans le texte de l'étiquette est de réduire le risque de maladie d'origine alimentaire chez les nourrissons. Le mode d'emploi pour la préparation et l'utilisation de la préparation pour nourrissons ou du fortifiant pour lait humain peut comprendre des diagrammes ou des pictogrammes. Pour les préparations en poudre pour nourrissons, ces instructions doivent être conformes au guide de Santé Canada sur la Reconstitution et manipulation d'une préparation en poudre pour nourrissons.
Pour les préparations en poudre pour nourrissons et les fortifiants pour lait humain, consultez le Codex Alimentarius Commission dans le CXC 66-2008 Code d'usages en matière d'hygiène pour les préparations en poudre pour nourrissons et jeunes enfants. Le mode d'emploi pour la reconstitution et l'utilisation des préparations pour nourrissons doit comprendre ce qui suit :
- Une déclaration générale sur la façon de reconstituer une préparation en toute sécurité, telle que « La santé de votre bébé dépend du respect minutieux des instructions de reconstitution. Il est important de respecter les règles d'hygiène, de préparation, de dilution, de manipulation (ou d'utilisation) et de conservation lors de la reconstitution des préparations pour nourrissons »;
- Des instructions sur la préparation initiale, y compris le lavage des mains adéquat et la garantie que la préparation est reconstituée dans un environnement propre. Parmi les formulations possibles, citons : « Lavez-vous soigneusement les mains et nettoyez les comptoirs à fond à l'eau et au savon avant de reconstituer une préparation pour nourrissons »;
- Instructions sur la stérilisation des biberons et des ustensiles de préparation telles que « Lavez les biberons, les tétines, les bouchons, les anneaux, l'ouvre-boîte et tous les ustensiles de préparation, puis faites bouillir pendant au moins cinq minutes à gros bouillons ». Pour les préparations en poudre pour nourrissons, des instructions sur l'eau supplémentaire utilisée pour reconstituer la préparation doivent être incluses. Par exemple, « Faites bouillir de l'eau supplémentaire pour formule pour nourrissons à gros bouillons pendant au moins deux minutes. Après avoir refroidi l'eau à 70 °C, la quantité d'eau requise peut être ajoutée dans une bouteille stérilisée »;
- Un énoncé sur la nécessité de vérifier la température des préparations pour nourrissons avant de nourrir l'enfant, afin d'éviter de lui ébouillanter la bouche. La préparation doit être refroidie à la température ambiante ou corporelle. Une façon de s'assurer que la température est adéquate est de tester la température de la préparation sur le poignet de l'aidant. Voici quelques exemples de formulations possibles : « Placez une goutte de formule pour nourrissons dans l'intérieur de votre poignet. Si vous ne sentez pas de différence de température, la température de la préparation est parfaite ».
Pour les fortifiants pour lait humain, les précautions de sécurité suivantes doivent être prises :
- À n'utiliser que sous contrôle médical;
- N'est pas destiné à l'alimentation des nourrissons ayant un faible poids à la naissance après qu'ils ont atteint un poids de 3 600 g (environ huit livres), sauf avis contraire d'un professionnel de la santé;
- Une dose de fer supplémentaire peut être nécessaire.
Pour les fortifiants pour lait humain, il convient d'inclure une déclaration semblable à la suivante : « La tolérance à l'alimentation entérale doit être confirmée en offrant de petits volumes de lait humain non fortifié. Une fois que l'alimentation entérale est bien établie, (nom du produit) peut être ajouté au lait humain. Un tableau semblable au suivant doit également être inclus :
| Calories supplémentaires souhaitées | Lait humain | Fortifiant pour lait humain | Rendement approximatif |
|---|---|---|---|
x calories/y mL |
z mL |
Type d'emballage (p. ex., un sachet) |
w mL |
Exemples |
|||
2 calories/30 mL |
50 mL |
1 sachet |
55 mL |
4 calories/30 mL |
25 mL |
1 sachet |
30 mL |
4.12.2 Conservation
Les instructions sur la conservation adéquate des préparations pour nourrissons ou des fortifiants pour lait humain avant et après l'ouverture des récipients/emballages doivent comprendre des renseignements sur la température, l'exposition à la lumière ou à la chaleur et la durée pendant laquelle les récipients peuvent être conservés en toute sécurité. Des mentions telles que « Ne pas congeler » ou « conserver au congélateur » et « Éviter la chaleur excessive » doivent également être incluses, le cas échéant.
Une fois reconstitués, les préparations pour nourrissons ou les fortifiants pour lait humain peuvent se détériorer rapidement. La durée d'utilisation de ces produits après leur reconstitution doit être indiquée. Les formulations possibles sont les suivantes : « Nourrir le nourrisson immédiatement, ou couvrir et conserver au réfrigérateur entre 2 et 4 °C (35 et 40 °F) pendant 24 heures au maximum. N'utilisez pas de préparation reconstituée si elle est restée plus d'une heure sans réfrigération ».
4.13 Texte de l'étiquette
Conformément aux articles B.25.046(2) (l) et B.25.048(2) (f) (pour les préparations pour nourrissons) et aux articles B.25.011 (m) et B.25.015(2) (f) (pour les fortifiants pour lait humain) du RAD, le texte écrit de toutes les étiquettes, y compris les notices d'accompagnement, qui sera utilisé en rapport avec la préparation pour nourrissons ou le fortifiant pour lait humain doit être fourni à Santé Canada dans le cadre de la demande préalable à la mise en marché.
Les articles B.25.057 et B.25.020 du RAD énoncent les exigences en matière d'étiquetage des préparations respectivement pour nourrissons et des fortifiants pour lait humain. La préparation pour nourrissons doit également être conforme à la réglementation générale sur l'étiquetage des aliments. Le document d'orientation L'étiquetage des aliments pour l'industrie de l'ACIA doit être consulté pour plus de renseignements sur les exigences générales en matière d'étiquetage des aliments.
Les paragraphes B.25.020 (1), (2) et (3) du RAD énumèrent les renseignements précis requis pour les étiquettes intérieure et extérieure des fortifiants pour lait humain :
- Les renseignements figurant aux alinéas B.25.020(1) (a) à (i) doivent figurer sur l'étiquette extérieure du fortifiant pour lait humain.
- Les renseignements figurant aux alinéas B.25.020 (1) (h) et (i) doivent figurer sur l'étiquette intérieure du fortifiant pour lait humain.
- Si le fortifiant pour lait humain n'a pas d'étiquette extérieure, les renseignements prévus aux alinéas B.25.020 (1) (a) à (i) doivent figurer sur l'étiquette intérieure. Dans ce scénario, les renseignements des alinéas B.25.020 (1) (e) et (f) [le mode de conservation, d'emploi et de préparation] peuvent se trouver dans un dépliant qui est apposée/attachée au contenant immédiat.
Le texte écrit de toutes les étiquettes, y compris les notices d'accompagnement, à utiliser en relation avec la préparation pour nourrissons ou le fortifiant pour lait humain, doit être fourni dans le cadre de la demande préalable à la mise en marché. Les copies électroniques doivent être envoyées à l'Unité de la gestion des demandes et de l'information (UGDI) de la Direction des aliments de Santé Canada à l'adresse smiu-ugdi@hc-sc.gc.ca dès qu'elles sont disponibles après l'envoi d'une demande préalable à la mise en marché. Les copies électroniques fournies doivent permettre un agrandissement, de sorte que tout le texte soit lisible.
Énoncés de mise en garde
Les renseignements importants relatifs à la sécurité doivent être clairement indiqués sous un titre d'avertissement en gras et en majuscules, MISE EN GARDE. Il devrait y avoir une mise en garde de sécurité sur les risques lorsqu'on chauffe et réchauffe des préparations pour nourrissons dans le four à micro-ondes, telle que « Ne jamais chauffer une préparation pour nourrissons dans un four à micro-ondes. De graves brûlures peuvent en résulter. ». Le texte de l'étiquette doit inclure un avertissement sur les allergènes alimentaires prioritaires qui peuvent être entrés en contact avec la préparation pour nourrissons ou le fortifiant pour lait humain.
Pour garantir la sécurité d'utilisation des fortifiants pour lait humain, l'étiquette du produit doit également comporter les éléments suivants :
- La charge potentielle rénale en solutés (CPRS) du lait humain enrichi (tel que consommé);
- L'osmolalité du lait humain enrichi (tel que consommé).
Avis sur les préparations pour nourrissons
Il est fortement recommandé que l'étiquetage comporte la mention « Avis important » suivie d'une déclaration sur la supériorité de l'allaitement maternel. Cette directive est conforme au Code international de commercialisation des substituts du lait maternel, dont le Canada est signataire.
Indications d'utilisation des préparations pour nourrissons
Certaines préparations spécialisées pour nourrissons sont indiquées pour les nourrissons présentant certaines affections. Les indications d'utilisation définissent les produits destinés à la prise en charge diététique de certaines affections. Voici des exemples d'indications d'utilisation appropriées qui ont été acceptées pour les préparations pour nourrissons :
- Pour la prise en charge diététique des coliques dues à une allergie aux protéines du lait de vache;
- Hypoallergénique, pour la prise en charge diététique des nourrissons allergiques au lait de vache;
- Épaissie avec de l'amidon de riz, pour l'alimentation des nourrissons qui régurgitent fréquemment.
Toute nouvelle indication proposée pour l'utilisation d'une préparation pour nourrissons doit être étayée par des études cliniques réalisées avec la préparation pour nourrissons particulière visée par l'avis. Ces préparations spécialisées et les indications qui les accompagnent sont examinées par Santé Canada au cours du processus d'examen de la demande préalable à la mise en marché.
Les allégations relatives aux préparations pour nourrissons sans lactose doivent être accompagnées de renseignements sur la spécification du produit fini concernant le lactose, qui doit être inférieur ou égal à 10 mg/100 kcal. Au Canada, toutes les préparations pour nourrissons sans lactose à base de lait sont étiquetées avec une mention de contre-indication à l'utilisation de ces préparations chez les nourrissons atteints de galactosémie.
Indications concernant les fortifiants pour lait humain
Voici des exemples d'indications appropriées qui ont été acceptées pour les fortifiants pour lait humain :
- Conçus pour les nourrissons prématurés en tant que supplément nutritif à ajouter au lait humain;
- Pour les nourrissons prématurés et ayant un faible poids à la naissance nourris au lait humain;
- Ce fortifiant pour lait humain est élaboré pour les nourrissons prématurés et ayant un faible poids à la naissance en tant que supplément nutritionnel à ajouter au lait humain.
Comme c'est le cas pour les préparations spécialisées, toute nouvelle indication proposée doit être étayée par des études cliniques réalisées avec le fortifiant pour lait humain visé par l'avis. La nouvelle indication fera par la suite l'objet d'une évaluation par Santé Canada dans le cadre du processus d'examen de la demande préalable à la mise en marché.
4.14 Demande signée
Conformément aux alinéas B.25.046 (2) (m) et B.25.048 (2) (g) du RAD (pour les préparations pour nourrissons) et aux alinéas B.25.011 (n) et B.25.15 (2) (g) (pour les fortifiants pour lait humain), le nom, le titre et la signature datée de la personne-ressource responsable de la demande préalable à la mise en marché de la préparation pour nourrissons ou du fortifiant pour lait humain doivent être inclus.
4.15 Justification scientifique pour un nouveau fortifiant pour lait humain ou pour un changement majeur
Conformément aux alinéas B.25.011 (e) et B.25.15(2) (c) du RAD, une justification du but et de l'utilisation du nouveau fortifiant pour lait humain ou du fortifiant ayant subi un changement majeur doit être présentée.
5.0 Examens faits à l'étranger
Lors de son évaluation préalable à la mise en marché d'une nouvelle préparation pour nourrissons ou d'un fortifiant pour lait humain nouveau ou ayant subi un changement majeur, Santé Canada pourrait également tenir compte d'autres renseignements pertinents, comme les renseignements fournis à un organisme de réglementation étranger ou obtenus de celui-ci, ou les données après la mise sur le marché provenant d'un autre pays. Bien que de tels renseignements ne soient pas exigés dans le cadre de la présentation préalable à la mise en marché, les renseignements provenant d'un autre organisme de réglementation et concernant l'approbation dans un autre pays d'une nouvelle préparation pour nourrissons ou d'un fortifiant pour lait humain nouveau ou ayant subi un changement majeur pourraient aider à simplifier le processus d'évaluation de Santé Canada.
Pour toute question sur l'utilisation de l'information provenant d'un organisme de réglementation étranger ou de données après la mise sur le marché, les fabricants sont invités à communiquer avec Santé Canada à l'adresse suivante : bns-bsn@hc-sc.gc.ca.
6.0 Références au lait maternel
Le Code international de commercialisation des substituts du lait maternel (Code), dont le Canada est signataire, énonce des principes d'étiquetage qui favorisent un étiquetage clair concernant l'utilisation appropriée d'une préparation pour nourrissons tout en favorisant l'allaitement maternel. Comparer les préparations pour nourrissons au lait maternel, y compris les comparaisons de la teneur d'un nutriment entre les préparations pour nourrissons et le lait maternel, est contraire au message véhiculé par le Code.
Santé Canada incite fortement l'industrie des préparations pour nourrissons à soutenir et à appliquer les principes du Code. De plus, le guide de l'ACIA Exigences en matière d'étiquetage des aliments pour bébés, des préparations pour nourrissons et du lait maternel fournit des renseignements sur les allégations acceptables et s'aligne sur certains principes énoncés dans le Code. Par exemple, la présentation d'un ingrédient dans une préparation pour nourrissons comme étant un composant clé du lait maternel est considérée comme trompeuse puisque plusieurs composants du lait maternel sont d'importance égale.
7.0 Glossaire et abréviations
Cette section fournit un glossaire des principaux termes et abréviations utilisés dans ce guide.
7.1 Glossaire
Lot de fabrication
Quantité précise de préparation pour nourrissons devant avoir des caractéristiques et une qualité uniformes à l'intérieur de limites déterminées, qui est fabriquée conformément à une commande unique de production et qui peut constituer la totalité ou une partie d'un lot.
Lot
Quantité de préparation pour nourrissons produite dans des conditions identiques, dont tous les emballages portent un numéro de lot qui indique que la production s'est faite dans un intervalle donné sur une « chaîne » précise ou dans une autre unité de transformation critique. Il peut être défini par une période (par exemple, entre deux assainissements) ou par toute autre mesure de traitement. Il est souvent associé à un numéro permettant de retracer les parties constitutives ou les ingrédients ainsi que les registres de la main-d'œuvre et des équipements impliqués dans la fabrication d'une préparation pour nourrissons. Cela permet aux fabricants et à d'autres entités de réaliser des contrôles de qualité, de calculer les dates limites d'utilisation et de publier des corrections ou des renseignements sur les rappels pour des sous-ensembles de la production.
Valeur nutritive adéquate
Une préparation pour nourrissons est adéquate sur le plan nutritionnel si elle favorise une croissance et un développement acceptables chez le nourrisson lorsqu'elle est consommée conformément au mode d'emploi. Les résultats des essais cliniques sont souvent utilisés pour déterminer si une préparation pour nourrissons donnée est adéquate sur le plan nutritionnel.
Présentation préalable à la mise en marché
Le RAD exige que les fabricants avisent Santé Canada avant la mise en marché de toute nouvelle préparation pour nourrissons ou tout nouveau fortifiant pour lait humain, ou de toute préparation pour nourrissons ou tout fortifiant pour lait humain ayant subi un changement majeur de formulation, de fabrication ou d'emballage. Les articles B.25.046 et B.25.048 du RAD précisent les renseignements devant être fournis dans la demande préalable à la mise en marché pour les préparations pour nourrissons. Les renseignements à fournir pour les fortifiants pour lait humain se trouvent dans les sections B.25.011 et B.25.015.
Prémélange
Mélange d'ingrédients contenant deux éléments nutritifs ou plus inscrits sur l'étiquette et qui est préparé dans une installation de fabrication distincte de celle où s'effectue la transformation du produit fini.
Sécurité
Une certitude raisonnable de l'innocuité (article 409 de la Federal Food, Drug, and Cosmetic Act de la Food and Drug Administration des États-Unis).
7.2 Abréviations
- BPF
- Bonnes pratiques de fabrication
- CPRS
- Charge potentielle rénale en solutés
- FLH
- Fortifiant pour lait humain
- HACCP
- Analyse des risques et de la maîtrise des points critiques
- LSAC
- Loi sur la salubrité des aliments au Canada
- LSRO
- Life Sciences Research Office
- NIAB
- Nouvel ingrédient d'aliment pour bébés
- PCP
- Plan de contrôle préventif
- RAD
- Règlement sur les aliments et drogues
- RSAC
- Règlement sur la salubrité des aliments au Canada
- UGDI
- Unité de la gestion des demandes et de l'information
Appendice 1a. Liste de vérification des demandes visant les préparations pour nourrissons: nouvelle demande
Renseignements de nature administrative |
||
|---|---|---|
Contenu de la demande |
Oui (√) |
Justification de l'omission |
Lettre d'accompagnement fournie |
||
Titre de la présentation indiqué |
||
Liste de vérification remplie jointe |
||
Coordonnées fournies (nom de l'entreprise, adresse postale complète, nom de la personne-ressource, numéro de téléphone, adresse électronique) |
||
Version électronique de la demande |
||
S'il y a lieu, le numéro de référence de la demande précédente et la date sur la lettre : |
||
Informations requises en vertu de la partie B du Règlement sur les aliments et drogues |
|||
|---|---|---|---|
Demande visant une nouvelle préparation pour nourrissons |
Oui (√) |
Justification de l'omission |
|
Nom sous lequel elle sera vendue ou annoncée pour la vente (B.25.046.2a) |
|||
Nom et adresse du principal établissement du fabricant (B.25.046.2b) |
|||
Noms et adresses de chaque établissement dans lequel le produit est fabriqué (B.25.046.2c) |
|||
Liste de tous les ingrédients, indiqués de manière quantitative (B.25.046.2d) |
|||
Caractéristiques relatives à la qualité nutritive, microbiologique et physique des ingrédients et de la nouvelle préparation pour nourrissons (B.25.046.2e) |
|||
Détail des techniques de contrôle de la qualité appliquées à l'examen des ingrédients et de la nouvelle préparation pour nourrissons (B.25.046.2f) |
|||
Détail du procédé de fabrication et des techniques de contrôle de la qualité appliquées au cours de la fabrication (B.25.046.2g) |
|||
Résultats des examens effectués pour déterminer la date limite d'utilisation de la nouvelle préparation pour nourrissons (B.25.046.2h) |
|||
Preuves établissant que la nouvelle préparation pour nourrissons a une valeur nutritive adéquate pour favoriser une croissance et un développement acceptables chez les nourrissons lorsqu'elle est consommée suivant le mode d'emploi (B.25.046.2i) |
|||
Description du type d'emballage qui sera utilisé (B.25.046.2j) |
|||
Mode d'emploi (B.25.046.2k) |
|||
Texte écrit de toutes les étiquettes (des maquettes bilingues et en couleur sont privilégiées), y compris les notices d'accompagnement, qui seront utilisées avec la nouvelle préparation pour nourrissons (B.25.046.2l) |
|||
Nom et titre du signataire de la présentation et date de la signature (B.25.046.2m) | |||
Appendice 1b. Liste de vérification des demandes visant les préparations pour nourrissons: changement majeur
Renseignements de nature administrative |
||
|---|---|---|
Contenu de la demande |
Oui (√) |
Justification de l'omission |
Lettre d'accompagnement fournie |
||
Titre de la présentation indiqué |
||
Liste de vérification remplie jointe |
||
Coordonnées fournies (nom de l'entreprise, adresse postale complète, nom de la personne-ressource, numéro de téléphone, adresse électronique) |
||
Version électronique de la demande |
||
Informations requises en vertu de la partie B du Règlement sur les aliments et drogues |
||
|---|---|---|
Demandes visant une préparation pour nourrissons existante ayant subi un changement majeur |
Oui (√) |
Justification de l'omission |
Nom sous lequel elle sera vendue ou annoncée pour la vente (B.25.048.2a du RAD) |
||
Nom et adresse du principal établissement du fabricant (B.25.048.2b du RAD) |
||
Description du changement majeur (B.25.048.2c du RAD) |
||
Preuves établissant que la préparation pour nourrissons a une valeur nutritive adéquate pour favoriser une croissance et un développement acceptables chez les nourrissons lorsqu'elle est consommée suivant le mode d'emploi (B.25.048.2d du RAD) |
||
Preuves établissant que le changement majeur n'a pas d'effet négatif sur la préparation pour nourrissons (B.25.048.2 e du RAD) |
||
Texte écrit de toutes les étiquettes, y compris les notices d'accompagnement, qui seront utilisées avec la nouvelle préparation pour nourrissons (des maquettes bilingues et en couleur sont privilégiées) (B.25.048.2f du RAD) |
||
Nom et titre du signataire de la présentation et date de la signature (B.25.048.2g du RAD) |
||
Appendice 2a. Liste de vérification des demandes visant les fortifiants pour lait humain: nouvelle demande
Renseignements de nature administrative |
||
|---|---|---|
Contenu de la demande |
Oui (√) |
Justification de l'omission |
Lettre d'accompagnement fournie |
||
Titre de la présentation indiqué |
||
Liste de vérification remplie jointe |
||
Coordonnées fournies (nom de l'entreprise, adresse postale complète, nom de la personne-ressource, numéro de téléphone, adresse électronique) |
||
Version électronique de la demande |
||
S'il y a lieu, le numéro de référence de la demande précédente et la date sur la lettre : |
||
Informations requises en vertu de la partie B du Règlement sur les aliments et drogues |
||
|---|---|---|
Contenu de la demande |
Oui (√) |
Justification de l'omission |
Nom sous lequel il sera vendu ou annoncé pour la vente (B.25.011a du RAD) |
||
Nom et adresse du principal établissement du fabricant (B.25.011b du RAD) |
||
Noms et adresses de chaque établissement dans lequel le produit est fabriqué (B.25.011c du RAD) |
||
Liste de tous les ingrédients, indiqués de manière quantitative (B.25.011d du RAD) |
||
Justification scientifique pour la formulation (B.25.011Remarque e du RAD) |
||
Caractéristiques relatives à la qualité nutritive, microbiologique et physique des ingrédients et du nouveau fortifiant pour lait humain (B.25.011f du RAD) |
||
Détail des techniques de contrôle de la qualité appliquées à l'examen des ingrédients et du nouveau fortifiant pour lait humain (B.25.011g du RAD) |
||
Détail du procédé de fabrication et des techniques de contrôle de la qualité appliquées au cours de la fabrication (B.25.011h du RAD) |
||
Résultats des examens effectués pour déterminer la date limite d'utilisation du nouveau fortifiant pour lait humain (B.25.011i du RAD) |
||
Preuves établissant que le nouveau fortifiant pour lait humain a une valeur nutritive adéquate pour favoriser une croissance et un développement acceptables chez les nourrissons lorsqu'il est consommé suivant le mode d'emploi (B.25.011j du RAD) |
||
Description du type d'emballage qui sera utilisé (B.25.011k du RAD) |
||
Mode d'emploi (B.25.011l du RAD) |
||
Texte écrit de toutes les étiquettes (des maquettes bilingues et en couleur sont privilégiées), y compris les notices d'accompagnement, qui seront utilisées avec le nouveau fortifiant pour lait humain (B.25.011m du RAD) |
||
Nom et titre du signataire de la présentation et date de la signature (B.25.011n du RAD) |
||
Appendice 2b. Liste de vérification des demandes visant les fortifiants pour lait humain: changement majeur
Renseignements de nature administrative |
||
|---|---|---|
Contenu de la demande |
Oui (√) |
Justification de l'omission |
Lettre d'accompagnement fournie |
||
Titre de la présentation indiqué |
||
Liste de vérification remplie jointe |
||
Coordonnées fournies (nom de l'entreprise, adresse postale complète, nom de la personne-ressource, numéro de téléphone, adresse électronique) |
||
Version électronique de la demande |
||
Informations requises en vertu de la partie B du Règlement sur les aliments et drogues |
||
Demandes visant un fortifiant pour lait humain existant ayant subi un changement majeur |
Oui (√) |
Justification de l'omission |
Nom sous lequel il sera vendu ou annoncé pour la vente (B.25.015.2a du RAD) |
||
Nom et adresse du principal établissement du fabricant (B.25.015.2b du RAD) |
||
Description du changement majeur (B.25.015.2c du RAD) |
||
Preuves établissant que le fortifiant pour lait humain a une valeur nutritive adéquate pour favoriser une croissance et un développement acceptables chez les nourrissons lorsqu'il est consommé suivant le mode d'emploi (B.25.015.2d du RAD) |
||
Preuves établissant que le changement majeur n'a pas d'effet négatif sur le fortifiant pour lait humain (B.25.015.2e du RAD) |
||
Texte écrit de toutes les étiquettes, y compris les notices d'accompagnement, qui seront utilisées avec le nouveau fortifiant pour lait humain (des maquettes bilingues et en couleur sont privilégiées) (B.25.015.2f du RAD) |
||
Nom et titre du signataire de la présentation et date de la signature (B.25.015.2g du RAD) |
||
Appendice 3. Organigramme d'approbation d'un aliment nouveau ou d'un nouvel ingrédient d'aliment pour bébés (NIAB)
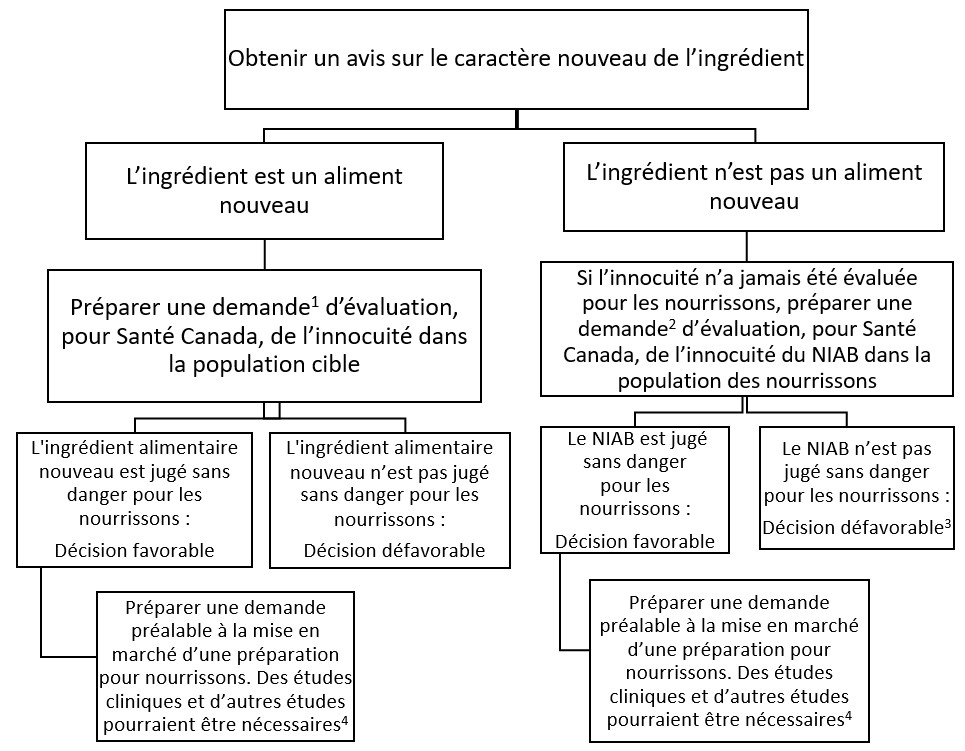
Figure 1 - Équivalent textuel
A VENIR
Référence 1 Pour obtenir des renseignements sur les exigences relatives à la demande d'approbation d'un aliment nouveau, consultez les Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux de Santé Canada.
Référence 2Pour de plus amples informations sur les exigences relatives à la demande visant un NIAB, consulter la section 2.3.3 du présent guide.
Référence 3 Une décision défavorable entraînerait la clôture de la demande. Une nouvelle demande serait nécessaire.
Référence 4Pour de plus amples informations sur les essais cliniques, consultez le Protocole d'essai clinique sur la croissance et la tolérance – Nouveau-nés à terme et en santé de Santé Canada.
Appendice 4. Modèle de comparaison du profil nutritionnel d'une préparation pour nourrissons prématurés ou d'un fortifiant de lait humain (tel qu'il est donné) avec les recommandations nutritionnelles pour prématurés pour 100 kcal
NOTE: Une valeur unique représente une recommandation minimale. Une valeur entre crochets a été rapportée comme la valeur calculée dans la citation indiquée.
- MACRONUTRIMENTS
Éléments nutritifs (unité) |
Exigences du RAD |
Recommandations des experts internationaux |
Profil nutritionnel |
Spécification |
||||||
|---|---|---|---|---|---|---|---|---|---|---|
Nom de l'élément nutritif |
Unité |
ESPGHAN (2010)Référence 1 |
Tsang, et. al. (2005)Référence 2 >1000 g P.C. |
LSRO (2002)Référence 3 |
OMSRéférence 4 >1000 g P.C. (stabilisation à terme)Remarque a |
Koletzko, et. al. (2014)Référence 5 |
Min |
Max |
||
Protéines |
g |
1,8 – 4 |
3,2 – 4,1Remarque b |
2,6 – 3,8 |
2,5 – 3,6 |
[2,5 – 3,0] |
3,2 – 4,1 |
|||
Lipides |
g |
3,3 – 6 |
4,4 – 6,0 |
4,1 – 6,5 |
4,4 – 5,7 |
[3,8 – 5,7] |
4,4 – 6,0 |
|||
- AL |
g |
0,5 |
0,350 – 1,400 |
0,462 – 1,309 |
[0,350 – 1,425]Remarque c |
AP |
0,350 – 1,400 |
|||
- AAL |
g |
AP |
>0,050 |
AP (1 – 4 E% par kg/jour) |
0,077 – 0,228 (1,75 – 4% des acids gras totaux) |
AP |
0.050 |
|||
- AL:AAL |
- |
AP |
5 – 15 |
5 – 15 |
6 – 16 |
AP |
AP |
|||
- AA |
g |
AP |
0,016 – 0,039 |
0,022 |
[0 – 0,034] Remarque d |
AP |
0,032 – 0,041 |
|||
- ADH |
g |
AP |
0,011 – 0,027 |
0,016 |
[0 – 0,020]Remarque e |
AP |
0,050 – 0,055 |
|||
Glucides |
g |
AP |
10,5 – 12 |
5,4 – 15.5 |
9,6 – 12.5 |
[6,3 – 12.9] |
10,5 – 12 |
|||
- VITAMINES ET MINÉRAUX
Éléments nutritifs (unité) |
Exigences du RAD |
Recommandations des experts internationaux |
Profil nutritionnel |
Spécification |
||||||
|---|---|---|---|---|---|---|---|---|---|---|
Nom de l'élément nutritif |
Unité |
ESPGHAN (2010)Référence 1 |
Tsang, et. al. (2005)Référence 2 >1000 g P.C. |
LSRO (2002)Référence 3 |
OMSRéférence 4 >1000 g P.C. (stabilisation à terme)Remarque a |
Koletzko, et. al. (2014)Référence 5 |
Min |
Max |
||
Vitamine A |
UI |
250 – 500 |
1200 – 2467 |
538 – 1364 |
680 – 1267 |
583 – 1250 |
1217 – 3333 |
|||
mcg RE |
-- |
[360 – 740] |
[162 – 410] |
[204 – 380] |
[175 – 375] |
[365 – 1000] |
||||
Vitamine D |
UI |
40 – 100 |
800 – 1000Remarque f par jour |
115 – 364 |
75 – 270 |
[400 – 800]Remarque f par jour |
100 – 350 provenant seulement du lait |
|||
Vitamine E |
UI |
0.6 |
[3,0 – 15] |
4,6 – 10,9 |
[3,0 – 12] |
[5,0 – 10,0] |
[3,0 – 15] |
|||
mg α-TE |
-- |
2 – 10 |
[3,1 – 7,3] |
2 – 8 Remarque g |
[3,4 – 6,7] |
2 – 10 |
||||
Vitamine K |
mcg |
8 |
4 – 25 |
6,2 – 9,1 |
4 – 25 |
[6.7 – 8.3] |
4 – 25 |
|||
Vitamine C |
mg |
8 |
10 – 42 |
13,8 – 21,8 |
8,3 – 37 |
[5 – 8] |
18 – 50 |
|||
Thiamine |
mcg |
40 |
125 – 275 |
138 – 218 |
30 – 250 |
[33 – 42] |
127 – 273 |
|||
Riboflavine |
mcg |
60 |
180 – 365 |
192 – 327 |
80 – 620 |
[300 – 383] |
181 – 364 |
|||
Vitamine B6 |
mcg |
35 |
41 – 273 |
115 – 191 |
30 – 250 |
[15]Remarque h |
45 – 273 |
|||
Vitamine B12 |
mcg |
0,15 |
0,08 – 0,7 |
0,23 – 0,27 |
0,08 – 0,7 |
[0,15]Remarque f |
0,09 – 0,73 |
|||
Niacine |
mcg |
250 |
345 – 5000 |
2800 – 4400 |
550 – 5000 |
[720] |
900 – 5000 |
|||
Acide pantothénique |
mcg |
300 |
300 – 1900 |
900 – 1500 |
300 – 1900 |
[667 – 1083] |
450 – 1900 |
|||
Acide folique |
mcg |
4 |
32 – 90 |
19 – 45 |
30 – 45 |
[50]Remarque f |
32 – 91 |
|||
Biotine |
mcg |
2 |
1,5 – 15 |
2,8 – 5,5 |
1,0 – 37 |
[1,3] |
1.5 – 15 |
|||
Choline |
mg |
12 |
7 – 50 |
11,1 – 25,5 |
7 – 23 |
AP |
7,3 – 50 |
|||
Inositol |
mg |
AP |
4 – 48 |
25 – 74 |
4 – 44 |
AP |
4 – 48 |
|||
Taurine |
mg |
AP |
AP |
3,5 – 8,2 |
5 – 12 |
AP |
AP |
|||
Carnitine |
mg |
AP |
AP |
2,2 – 2,6 |
2 – 5,9 |
AP |
AP |
|||
Calcium (Ca) |
mg |
50 |
110 – 130 |
77 – 200 |
123 – 185 |
[134 – 200] |
109 – 182 |
|||
Phosphore(P) |
mg |
25 |
55 – 80 |
46 – 127 |
82 – 109 |
[65 – 98] |
55 – 127 |
|||
Ca:P |
-- |
1,2 – 2 |
AP |
AP |
1,7 – 2,0:1 |
AP |
AP |
|||
Magnésium |
mg |
6 |
7,5 – 13,6 |
AP |
6,8 – 17 |
[4,1 – 8,1] |
7,5 – 13.6 |
|||
Sodium |
mg |
20 – 60 |
63 – 105 |
53 – 105 |
39 – 63 |
[48 – 77] |
63 – 105 |
|||
Potassium |
mg |
80 – 200 |
60 – 120 |
60 – 106 |
60 – 160 |
[81 – 114] |
71 – 177 |
|||
Chlorure |
mg |
55 – 150 |
95 – 161 |
82 – 226 |
60 – 160 |
[74 – 118] |
95 – 161 |
|||
Fer |
mg |
0.15 |
1,8 – 2,7 |
1,538 – 3,636 |
1,7 – 3,0 |
[1.7 – 2.5] |
1,8 – 2,7 |
|||
Zinc |
mg |
0.5 |
1,0 – 1,8 |
0,769 – 2,727 |
1,1 – 1,5 |
[0,42 – 0,67] |
1,3 – 2,3 |
|||
Cuivre |
mcg |
60 |
90 – 120 |
92 – 136 |
100 – 250 |
[58 – 101] |
90 – 210 |
|||
Manganèse |
mcg |
5 |
6,3 – 25 |
0,5 – 6,8 |
6,3 – 25 |
[0,5 – 0,9] |
0,9 – 13,6 |
|||
Iode |
mcg |
5 |
10 – 50 |
7,7 – 54,5 |
6 – 35 |
[26 – 53] |
9 – 50 |
|||
Sélénium |
mcg |
AP |
4,5 – 9 |
1,0 – 4,1 |
1,8 – 5,0 |
[2,6 – 3,9] |
4,5 – 9 |
|||
Chrome |
mcg |
AP |
0,027 – 1,12 |
0,08 – 2,05 |
AP |
0,04 – 0,08 |
0,027 – 2,045 |
|||
Molybdène |
mcg |
AP |
0,27 – 4,5 |
0,23 – 0,27 |
AP |
0,16 – 0,32 |
0,27 – 4,5 |
|||
Fluorure |
mcg |
AP |
1,4 – 55 |
NS |
0 – 25 |
AP |
1,4 – 55 |
|||
- NUCLÉOTIDES
Éléments nutritifs (unité) |
Exigences du RAD |
Recommandations des experts internationaux |
Profil nutritionnel |
Spécification |
||||||
|---|---|---|---|---|---|---|---|---|---|---|
Nom de l'élément nutritif |
Unité |
ESPGHAN (2010)Référence 1 |
Tsang, et. al. (2005)Référence 2 >1000 g P.C. |
LSRO (2002)Référence 3 |
OMSRéférence 4 >1000 g P.C. (stabilisation à terme)Remarque a |
Koletzko, et. al. (2014)Référence 5 |
Min |
Max |
||
Nucléotides totaux |
mg |
AP |
AP |
AP |
AP |
AP |
AP |
|||
AMP |
mg |
AP |
AP |
0,27 – 0,73 |
AP |
AP |
AP |
|||
CMP |
mg |
AP |
AP |
1,6 – 3,7 |
AP |
AP |
AP |
|||
GMP |
mg |
AP |
AP |
0,03 – 0,54 |
AP |
AP |
AP |
|||
UMP |
mg |
AP |
AP |
0,69 – 0,9 |
AP |
AP |
AP |
|||
Abréviations
- AAL
- acide alpha-linolénique;
- AGPI
- acides gras polyinsaturés
- AL
- acide linoléique
- AMP
- adénosine monophosphate
- AP
- aucune précision
- Ca:P
- calcium/phosphore
- CMP
- cytosine monophosphate
- Eα-T
- équivalents α-tocophérol
- ER
- équivalents rétinol
- GMP
- guanosine monophosphate
- LSRO
- Life Sciences Research Office
- Max
- maximum
- mcg
- microgramme
- mg
- milligramme
- Min
- minimum
- OMS
- Organisation mondiale de la Santé
- UMP
- uridine monophosphate
Références
- Référence 1
-
Agostoni C, Buonocore G, Carnielli VP, De Curtis M, Darmaun D, Decsi T, et al. Enteral nutrient supply for preterm infants: commentary from the European Society of Paediatric Gastroenterology, Hepatology, and Nutrition Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2010:50. 85-91.
- Référence 2
-
Tsang RC, Uauy R, Koletzko B, Zlotkin S. Nutrition of the preterm infant, Scientific basic and practical guidelines. Cincinnati, OH: Digital Educational Publishing Inc. 2005.
- Référence 3
-
Klein CJ. Nutrient requirements for preterm infant formulas. J Nutr 2002;132:1395S-577S.
- Référence 4
-
Tudehope D. et al. Nutritional Needs of the Micropreterm Infant March 2013, Volume 162, Issue 3, Supplement, Pages S72–S80
- Référence 5
-
Koletzko B, Poindexter B, Uauy R. Nutritional Care of Preterm Infants: Scientific Basis and Practical Guidelines. Karger, 2014:99-120
Remarques
- Remarque a
-
Calculé sur la base de la moyenne des recommandations énergétiques maximales et minimales pour la population indiquée; 120 kcal/kg/j pour une stabilisation à terme.
- Remarque b
-
3,6 – 4,1 g / 100 kcal pour les nourrissons dont le poids corporel est inférieur à 1 kg; 3,2-3,6 g/100 kcal pour les nourrissons dont le poids corporel se situe entre 1 et 1,8 kg.
- Remarque c
-
Acides gras totaux : 8% (minimum) and 25% (maximum)
- Remarque d
-
La recommandation minimale pour l'AA n'a pas été établie. Maximum : 0,6 % des acides gras totaux, avec la condition supplémentaire que le ratio AA:ADH se situe dans la plage 1,5-2,0:1.
- Remarque e
-
La recommandation minimale pour l'ADH n'a pas été établie. Maximum : 0,35 % des acides gras totaux, avec la condition supplémentaire que le ratio AA:ADH se situe dans la plage 1,5-2,0:1.
- Remarque f
-
Recommandation donnée par jour, indépendamment du poids corporel et de l'apport énergétique.
- Remarque g
-
Le ratio vitamine E:AGPI (mg d'Eα-T par g d'AGPI) devrait être supérieur à 1,5 mg/g.
- Remarque h
-
Recommandation par gramme de protéines consommé.
Appendice 5. Modèle suggéré pour les données de spécification du produit fini, préparation pour nourrissons
Éléments nutritifs (unité) |
Allégation sur l'étiquette |
Limites tolérées |
RAD (1990) |
LSRO 1998 |
Norme Codex 72-1981 |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
par 100 mL |
par 100 kcal |
Min. par 100 kcal |
% min. pour l'allégation sur l'étiquette |
Max. par 100 kcal |
% max. pour l'allégation sur l'étiquette |
MIN. par 100 kcal |
MAX. par 100 kcal |
MIN. par 100 kcal |
MAX. par 100 kcal |
MIN. par 100 kcal |
MAX. par 100 kcal |
|
Énergie (kcal) |
--- |
--- |
63 |
71 |
60 |
70 |
||||||
Protéines (g) |
1,8 |
4 |
1,7 |
3,4 |
1,8 |
3 |
||||||
Glucides totaux (g) |
--- |
--- |
9 |
13 |
9 |
14 |
||||||
Matières grasses totales (g) |
3,3 |
6 |
4,4 |
6,4 |
4,4 |
6 |
||||||
Acide linoléique (AL) (mg, % de matières grasses) |
500 |
--- |
350 |
2240 |
300 |
1400* |
||||||
Acide alpha-linolénique (AAL) (mg, % de matières grasses) |
--- |
--- |
77 |
256 |
50 |
--- |
||||||
Acide arachidonique (AA) (mg/100 kcal) |
--- |
--- |
--- |
--- |
--- |
--- |
||||||
Acide docosahexaénoïque (ADH) (mg, % de matières grasses) |
--- |
--- |
--- |
--- |
--- |
0,5%* |
||||||
Carnitine (mg) |
--- |
--- |
1,2 |
2 |
1,2 |
--- |
||||||
Taurine (mg) |
--- |
--- |
0 |
12 |
--- |
12 |
||||||
Nucléotides (mg) |
--- |
--- |
0 |
16 |
--- |
--- |
||||||
Choline (mg) |
12 |
--- |
7 |
30 |
7 |
50* |
||||||
Inositol (mg) |
--- |
--- |
4 |
40 |
4 |
40* |
||||||
Vitamine A (UI) |
250 |
500 |
200 |
500 |
200 |
600 |
||||||
Vitamine D (UI) |
40 |
100 |
40 |
100 |
40 |
100 |
||||||
Vitamine E (UI) |
0,6 |
--- |
0,7 |
7,5 |
0,7 |
5* |
||||||
Vitamine K (mcg) |
8 |
--- |
1 |
25 |
4 |
27* |
||||||
Vitamine B1 – Thiamine (mcg) |
40 |
--- |
30 |
200 |
60 |
300* |
||||||
Vitamine B2 – Riboflavine (mcg) |
60 |
--- |
80 |
300 |
80 |
500* |
||||||
Vitamine B3 – Niacine (mcg) |
250 |
--- |
550 |
2000 |
300 |
1500* |
||||||
Vitamine B5 – Acide pantothénique (mcg) |
300 |
--- |
300 |
1200 |
400 |
2000* |
||||||
Vitamine B6 – Pyridoxine (mcg) |
35 |
--- |
30 |
130 |
35 |
175* |
||||||
Vitamine B12 - Cobalamine (mcg) |
0,15 |
--- |
0,08 |
0,7 |
0,1 |
1,5* |
||||||
Acide folique (mcg) |
4 |
--- |
11 |
40 |
10 |
50* |
||||||
Biotine (mcg) |
2 |
--- |
1 |
15 |
1.5 |
10* |
||||||
Vitamine C (mcg) |
8 |
--- |
6 |
15 |
10 |
70* |
||||||
Calcium (mg) |
50 |
--- |
50 |
140 |
50 |
140* |
||||||
Phosphore (mg) |
25 |
--- |
20 |
70 |
25 |
100* |
||||||
Magnésium (mg) |
6 |
--- |
4 |
17 |
5 |
15* |
||||||
Fer (mg) |
0,15 |
--- |
0,2 |
1,65 |
0,45 |
--- |
||||||
Zinc (mg) |
0,5 |
--- |
0,4 |
1 |
0,5 |
1,5* |
||||||
Manganèse (mcg) |
5 |
--- |
1 |
100 |
1 |
100* |
||||||
Cuivre (mcg) |
60 |
--- |
60 |
160 |
35 |
120* |
||||||
Iode (mcg) |
5 |
--- |
8 |
35 |
10 |
60* |
||||||
Sodium (mg) |
20 |
60 |
25 |
50 |
20 |
60 |
||||||
Potassium (mg) |
80 |
200 |
60 |
160 |
60 |
180 |
||||||
Chlorure (mg) |
55 |
150 |
50 |
160 |
50 |
160 |
||||||
Sélénium (mcg) |
--- |
--- |
1,5 |
5 |
1 |
9* |
||||||
Ratio AL:AAL |
--- |
--- |
6 |
16 |
5 |
15 |
||||||
Ratio calcium:phosphore |
1,2 |
2 |
1,1 |
2 |
1 |
2 |
||||||
Ratio vitamine B6:protéines (mcg/g) |
15 |
--- |
--- |
--- |
--- |
--- |
||||||
Ratio alpha-tocophérol/acide linoléique |
0,6 |
--- |
--- |
--- |
--- |
--- |
||||||
* Niveau supérieur, selon les lignes directrices
Appendice 6. Modèle suggéré pour les données de stabilité, préparation pour nourrissons
NOM DU PRODUIT : |
Lot de recherche ou commercial : |
Température : |
||||||||||||||||||
Autre nom du produit (le cas échéant) : |
Numéro de lot de fabrication : |
Durée de conservation proposée : |
||||||||||||||||||
Type d'emballage : |
||||||||||||||||||||
0 mois (point du début de la période) |
X mois (point médian de la période) |
X mois (point de la fin de la période) |
||||||||||||||||||
| Allégation sur l'étiquette | Points de données | Points de données | Points de données | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Éléments nutritifs(unité) | par 100 mL | par 100 kcal | par 100 kcal | MOY | % de l'allégation sur l'étiquette | par 100 kcal | MOY. | % de l'allégation sur l'étiquette | par 100 kcal | MOYENNE | % de l'allégation sur l'étiquette | par 100 kcal | MOY. | % de l'allégation sur l'étiquette | par 100 kcal | MOY. | % de l'allégation sur l'étiquette | par 100 kcal | MOY. | % de l'allégation sur l'étiquette |
| Énergie (kcal) | ||||||||||||||||||||
| Protéines (g) | ||||||||||||||||||||
| Glucides totaux (g) | ||||||||||||||||||||
| Matières grasses totales (g) | ||||||||||||||||||||
| Acide linoléique (AL) (mg, % de matières grasses) | ||||||||||||||||||||
| Acide alpha-linolénique (AAL) (mg, % de matières grasses) | ||||||||||||||||||||
| Acide arachidonique (AA) (mg) | ||||||||||||||||||||
| Acide docosahexaénoïque (ADH) (mg, % de matières grasses) | ||||||||||||||||||||
| Carnitine (mg) | ||||||||||||||||||||
| Taurine (mg) | ||||||||||||||||||||
| Nucléotides (mg) | ||||||||||||||||||||
| Choline (mg) | ||||||||||||||||||||
| Inositol (mg) | ||||||||||||||||||||
| Vitamine A (UI) | ||||||||||||||||||||
| Vitamine D (UI) | ||||||||||||||||||||
| Vitamine E (UI) | ||||||||||||||||||||
| Vitamine K (mcg) | ||||||||||||||||||||
| Vitamine B1 – Thiamine (mcg) | ||||||||||||||||||||
| Vitamine B2 – Riboflavine (mcg) | ||||||||||||||||||||
| Vitamine B3 – Niacine (mcg) | ||||||||||||||||||||
| Vitamine B5 – Acide pantothénique (mcg) | ||||||||||||||||||||
| Vitamine B6 – Pyridoxine (mcg) | ||||||||||||||||||||
| Vitamin B12 - Cobalamine (mcg) | ||||||||||||||||||||
| Acide folique (mcg) | ||||||||||||||||||||
| Biotine (mcg) | ||||||||||||||||||||
| Vitamine C (mcg) | ||||||||||||||||||||
| Calcium (mg) | ||||||||||||||||||||
| Phosphore (mg) | ||||||||||||||||||||
| Magnésium (mg) | ||||||||||||||||||||
| Fer (mg) | ||||||||||||||||||||
| Zinc (mg) | ||||||||||||||||||||
| Manganèse (mcg) | ||||||||||||||||||||
| Cuivre (mcg) | ||||||||||||||||||||
| Iode (mcg) | ||||||||||||||||||||
| Sodium (mg) | ||||||||||||||||||||
| Potassium (mg) | ||||||||||||||||||||
| Chlorure (mg) | ||||||||||||||||||||
| Sélénium (mcg) | ||||||||||||||||||||
Détails de la page
- Date de modification :