Valeur préliminaire pour l’acide perfluorononanoïque (APFN) dans l’eau potable – Résumé technique

Télécharger le format de rechange
(Format PDF, 560 Ko, 5 pages)
Organisation : Santé Canada
Publiée : Novembre 2020
Une valeur préliminaire de 20 ng/L (0,000020 mg/L) a été établie pour l’acide perfluorononanoïque (APFN) dans l’eau potable.
Valeurs préliminaires
Les valeurs préliminaires de Santé Canada représentent des valeurs seuil pour les contaminants présents dans l’eau qui pourrait servir comme source d’eau potable. Une exposition à vie à ces contaminants pouvant aller jusqu’à la valeur préliminaire, à la fois par la consommation d’eau potable et son utilisation durant la douche ou le bain, ne devrait pas augmenter les risques pour la santé des Canadiens, y compris des enfants.
Une valeur préliminaire est établie pour les contaminants qui ne sont pas fréquemment présents dans l’eau potable (qu’elle provienne d’une source ou qu’elle ait été traitée au préalable) au Canada, et donc des recommandations pour la qualité de l’eau potable au Canada ne sont pas instaurées. Santé Canada établit des valeurs préliminaires pour les contaminants à la demande des ministères fédéraux, des provinces ou des territoires. Ces autorités compétentes en font généralement la demande lorsqu’il existe des préoccupations pour la santé humaine attribuables à la présence soupçonnée d’un contaminant dans une source locale d’approvisionnement en eau ou à sa détection et qu’on n’a pas établi de valeur seuil dans l’eau potable pour cette substance. Depuis 2020, les résumés techniques pour les valeurs préliminaires sont publiés en ligne lorsque Santé Canada prévoit que ces valeurs préliminaires pourraient être nécessaires pour plus d’un partie intéressé ou d’une autorité compétente.
Les valeurs préliminaires ne remplacent pas les valeurs de la réglementation existante ou ne prévalent pas sur ces dernières. Toutefois, elles peuvent aider les autorités et la population à connaître les effets potentiels d’un contaminant sur la santé.
Les valeurs préliminaires ont été établies à la suite d’une recension des publications sur la recherche scientifique et des données réglementaires d’autres pays accessibles au moment de leur établissement. En outre, ces valeurs font l’objet d’un examen à l’externe par des pairs pour garantir l’intégrité scientifique.
Santé Canada s’engage à demeurer à l’affût des dernières connaissances scientifiques, dont celles portant sur les risques pour la santé associés aux contaminants n’étant pas habituellement présents dans l’eau potable et ne faisant pas partie des recommandations pour la qualité de l’eau potable au Canada. À cette fin, Santé Canada intègre les contaminants assortis d’une valeur préliminaire dans l’établissement périodique des priorités visant les contaminants dans le but d’élaborer des recommandations complètes.
Considérations liées à l’exposition
Propriétés et sources
L’acide perfluorononanoïque (APFN) appartient à un groupe de substances chimiques appelé les substances perfluoroalkylées. Ces substances ont servi à fabriquer des tapis, des vêtements, des tissus pour le mobilier, des emballages en papier pour les aliments et d’autres matériaux. Elles servent aussi à la lutte contre les incendies sur les terrains d’aviation et dans un certain nombre de procédés industriels. L’APFN n’est pas fabriqué au Canada, mais comme cette substance a été largement utilisée dans le passé et comme elle est résistante à une dégradation dans l’environnement, on la détecte dans l’environnement ainsi que dans des échantillons de sang humain.
Exposition
On s’attend à ce que les principales sources d’APFN soient les aliments et les produits de consommation. Toutefois, l’eau potable peut représenter une source importante d’exposition à proximité de sources ponctuelles comme les installations de lutte contre les incendies où ont lieu de façon répétée des exercices de formation de lutte contre les incendies ou dans les endroits où de grandes quantités de mousse à formation de pellicules aqueuses sont utilisées pour éteindre des incendies entretenus par des liquides combustibles ou inflammables. Les installations où des substances perfluoroalkylées (SPFA) ou des précurseurs des SPFA (p. ex., alcools fluorotélomères) sont entreposés et manipulés peuvent représenter des sources ponctuelles additionnelles. L’exposition à l’APFN par l’eau potable durant un bain ou une douche devrait être négligeable en raison des propriétés physicochimiques de la substance.
L’APFN n’a pas été détecté dans l’eau potable traitée au Canada, mais a été mesuré dans des échantillons d’eau de surface (< 2,0 ng/L) et d’eau potable brute (< 68 ng/L) au Canada (De Silva et coll., 2009; Ministère du développement durable, de l’environnement, de la faune et des parcs, 2012).
Éléments sanitaires à considérer
L’APFN est rapidement absorbé après une exposition par voie orale et est distribué dans le sang et le foie. À l’instar d’autres SPFA, l’APFN est chimiquement non réactif et n’est pas métabolisé. L’élimination est lente et se fait par les urines et les excréments. Il existe de grandes différences entre les humains et d’autres espèces : des demi‑vies de l’APFN de l’ordre de quelques semaines ont été mesurées chez des rongeurs, tandis que l’estimation de la demi‑vie d’élimination chez l’humain varie de 2,1 à 4,3 années (Olsen et coll., 2007; Bartell et coll., 2010; Seals et coll., 2011).
Dans plus de 40 études épidémiologiques, on a examiné les associations entre les concentrations d’APFN sériques et les effets nocifs sur la santé dont les effets sur le foie, les reins et la thyroïde, les effets immunologiques et métaboliques, ainsi que les effets sur la reproduction et le développement. On a observé des associations positives pour certains effets dont une fonction hépatique et rénale réduite, et une baisse de la lipidémie et des fonctions immunitaires. En raison du plan d’études, de la présence de biais et de facteurs de confusion, les études épidémiologiques n’ont pas pu servir à évaluer la relation dose‑effet.
Aucune étude n’a porté sur la toxicité chronique ou le risque cancérogène de l’APFN.
Sélection de l’étude clé
Dans les études menées avec des animaux, l’exposition par voie orale à l’APFN a été associée à des effets nocifs sur la santé du foie et des reins ainsi que des effets nocifs sur l’appareil reproducteur. La toxicité hépatique chez le rat a été l’effet observé associé au plus faible niveau d’exposition, a été observé aux faibles doses administrées dans plusieurs études (Stump et coll., 2008; Mertens et coll., 2010; Wolf et coll., 2010; Das et coll., 2015) et sert d’effet critique (clé) dans l’établissement de l’apport quotidien tolérable. Stump et coll. 2008 a été choisie comme étude clé parce qu’elle a fait état du plus faible niveau d’exposition où des effets toxiques sur le foie sont observés.
Calcul de la valeur préliminaire
Une valeur préliminaire de 20 ng/L a été calculée après avoir considéré les éléments suivants.
Nous avons modélisé une dose repère (benchmark dose ou BMD) à l’aide des données sur la relation dose‑effet tirées de la publication de Stump et coll. (2008) qui a établi un point de départ de 0,012 mg/kg p.c. par jour. Ce chiffre a été corrigé par la suite à l’aide d’un facteur d’ajustement propre à la substance chimique de 73 pour tenir compte des différences de toxicocinétique entre l’humain et le rat, d’après des données publiées par Ohmori et coll. (2003) et Zhang et coll. (2013), ce qui a donné un point de départ équivalent chez l’humain (PODHED) de 1,64 × 10 ‑4 mg/kg p.c. par jour.
L’équation standard suivante a servi à calculer la valeur préliminaire de 20 ng/L (valeur arrondie) :
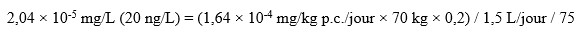
Équivalent textuel
Cette équation permet de calculer la valeur de dépistage de la PFNA. La valeur de dépistage est calculée en multipliant le point de départ de la dose équivalente humaine de 0,164 microgramme par kilogramme de poids corporel par jour par un poids corporel de 70 kilogrammes et par un facteur d'attribution de 0,20, puis en divisant par un volume d'eau ingéré par jour de 1,5 litre et par le facteur de sécurité appliqué au point de départ de la dose équivalente humaine de 75. Cela équivaut à une valeur de dépistage de 20 nanogrammes par litre pour les SPFA.
Où :
- 1,64 × 10-4 mg/kg p.c. par jour est le PODHED associé à une augmentation de l’hypertrophie hépatocellulaire d’après une étude sur deux générations menée chez le rat par Stump et al. (2008).
- 70 kg représente le poids corporel moyen estimé pour un adulte au Canada.
- 0,2 est le facteur d’attribution par défaut pour l’eau potable; la proportion de l’exposition à l’APFN provenant de l’eau potable par opposition à l’exposition provenant d’autres milieux de l’environnement (c.‑à‑d., aliments, air, sol, produits de consommation, etc.) en l’absence d’autres données sur l’exposition, la valeur minimale par défaut utilisée est 20 % (Krishnan et Carrier, 2013).
- 1,5 L par jour est le volume quotidien estimé d’eau du robinet consommé par un adulte.
- 75 est le facteur d’incertitude appliqué au PODHED (2,5 pour la variation interespèces de la toxicodynamique; 10 pour la variabilité intraespèces; 3 pour les lacunes de la base de données).
Considérations internationales
Les lignes directrices, les normes et/ou les valeurs recommandées pour la qualité de l’eau potable établies par des gouvernements étrangers ou des organisations internationales peuvent varier en raison des données scientifiques disponibles au moment de l’évaluation, ainsi que du recours à différentes politiques et approches, tels que le choix de la principale étude, et l’utilisation de taux de consommation, poids corporels et facteurs d’attribution différents.
Le New Jersey a établi une concentration maximale de contaminant basée sur la santé pour le APFN dans l’eau potable de 13 ng/L en se basant sur une augmentation du poids du foie chez des souris gravides exposées à l’APFN et sur un facteur d’incertitude cumulatif de 1 000 (New Jersey Water Quality Institute, 2015). La Texas Commission on Environmental Quality a établi un niveau de concentration protecteur de niveau 1 en milieu résidentiel de 290 ng/L pour l’APFN (TCEQ, 2016). Cette valeur est basée sur une dose sans effet nocif observé (NOAEL) de 1 mg/kg p.c. par jour pour ce qui est de l’apoptose de la rate et sur un facteur d’incertitude cumulatif de 1 000 en plus d’un facteur de 81 pour tenir compte de la toxicocinétique (c’est‑à‑dire, les taux d’élimination) entre le rat et l’humain.
Coordonnées
Si vous souhaitez recevoir plus d’information, veuillez nous contacter à hc.water-eau.sc@canada.ca.
Références
Bartell, S.M., Calafat, A.M., Lyu, C., Kato, K., Ryan, P.B. and Steenland, K. (2010). Rate of decline in serum PFOA concentrations after granular activated carbon filtration at two public water systems in Ohio and West Virginia. Environ. Health Perspect., 118(2): 222-228.
Das, K.P., Grey, B.E., Rosen, M.B., Wood, C.R., Tatum-Gibbs, K.R., Zehr, R.D., Strynar, M.J., Lindstrom, A.B. and Lau, C. (2015). Developmental toxicity of perfluorononanoic acid in mice. Reproductive Toxicology, 51: 133-144.
De Silva, A.O., Muir, D.C.G. and Mabury, S.A. (2009). Distribution of perfluorocarboxylate isomers in select samples from the North American environment. Environmental Toxicology and Chemistry, 28(9): 1801-1814.
Krishnan, K. and Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health, Part B: Crit. Rev., 16 (1): 39-51.
Lide, D.R. (Eds.) (1996). CRC Handbook of Chemistry and Physics, 77 e édition.
Mertens, J.J.W.M., Sved, D.W., Marit, G.B., Myers, N.R., Stetson, P.L., Murphy, S.R., Schmit, B., Shinohara, M. and Farr, C.H. (2010). Subchronic toxicity of S-111-S-WB in Sprague Dawley rats. Int. J. Toxicol., 29(4): 358-371.
Ministère du Développement durable, de l’Environnement, de la Faune et des Parcs. (2012). Les composés perfluorés dans les cours d’eau et l’eau potable du Québec méridional. Ministère du Développement durable, de l’Environnement, de la Faune et des Parcs, Direction du suivi de l’état de l’environnement.
New Jersey Water Quality Institute. (2018). Health-based maximum contaminant level support document: Perfluorononanoic acid (PFNA). New Jersey Water Quality Institute Health Effects Subcommittee.
Ohmori, K., Kudo, N., Katayama, K. and Kawashima, Y. (2003). Comparison of the toxicokinetics between perfluorocarboxylic acids with different carbon chain length. Toxicology. Toxicology, 184(2-3): 135-140.
Olsen, G.W., Burris, J.M., Ehresman, D.J., Froelich, J.W., Seacat, A.M., Butenhoff, J.L. and Zobel, L.R. (2007). Half-life of serum elimination of perfluorooctanesulfonate, perfluorohexanesulfonate, and perfluorooctanoate in retired fluorochemical production workers. Environ. Health Perspect., 115(9): 1298-1305.
Seals, R., Bartell, S.M. and Steenland, K. (2011). Accumulation and clearance of perfluorooctanoic acid (PFOA) in current and former residents of an exposed community. Environ. Health Perspect., 119(1): 119-124.
Stump, D.G., Holson, J.F., Murphy, S.R., Farr, C.H., Schmit, B. and Shinohara, M. (2008). An oral two-generation reproductive toxicity study of S-111-S-WB in rats. Reproductive Toxicology, 25(1): 7-20.
TCEQ. (2016). Toxicological evaluation of perfluoro compounds (e.g., PFOS, PFOA). Texas Commission on Environmental Quality. Accès à https://www.tceq.texas.gov/toxicology#pfcs
Wolf, C.J., Zehr, R.D., Schmid, J.E., Lau, C. and Abbott, B.D. (2010). Developmental effects of perfluorononanoic acid in the mouse are dependent on peroxisome proliferator-activated receptor-alpha. PPAR Research, Article number 282896.
Zhang, T., Sun, H., Lin, Y., Qin, X., Zhang, Y., Geng, X. and Kannan, K. (2013a). Distribution of poly- and perfluoroalkyl substances in matched samples from pregnant women and carbon chain length related maternal transfer. Environ. Sci. Technol., 47(14): 7974-7981.
Zhang, Y., Beesoon, S., Zhu, L. and Martin, J.W. (2013b). Biomonitoring of perfluoroalkyl acids in human urine and estimates of biological half-life. Environmental science and technology. Environ. Sci. Technol., 47(18): 10619-10627.
Détails de la page
- Date de modification :