Recommandations pour la qualité de l’eau potable au Canada : Document technique - Le strontium
Table des matières
Partie I. Vue d'ensemble et application
Partie II. Science et considérations techniques
- 4.0 Propriétés, utilisation et sources dans l'environnement
- 4.1 Devenir dans l'environnement
- 5.0 Exposition
- 5.1 Eau
- 5.2 Aliments
- 5.3 Air
- 5.4 Produits de consommation
- 5.5 Sol
- 5.6 Exposition multi-voies par l'eau potable
- 5.7 Apport quotidien total
- 6.0 Méthodes d'analyse
- 6.1 Méthode recommandée
- 6.2 Autres méthodes
- 6.3 Préparation des échantillons
- 7.0 Techniques de traitement et considérations liées aux réseaux de distribution
- 7.1 Traitement à l'échelle municipale
- 7.2 Réseau de distribution
- 7.3 Échelle résidentielle
- 8.0 Cinétique et métabolisme
- 8.1 Absorption
- 8.2 Distribution
- 8.3 Métabolisme
- 8.4 Excrétion
- 8.5 Modèles pharmacocinétiques à base physiologique
- 9.0 Effets sur la santé
- 9.1 Effets sur la santé humaine
- 9.2 Effets sur les animaux de laboratoire
- 9.3 Mode d'action
- 10.0 Classification et évaluation
- 10.1 Évaluation des risques d'effets autres que le cancer
- 10.2 Considérations internationales
- 11.0 Justification
- 12.0 Références
- Annexe A : Liste des acronymes
Partie I. Vue d'ensemble et application
1.0 Recommandation
La concentration maximale acceptable (CMA) pour le strontium total dans l'eau potable est de 7,0 mg/L.
2.0 Sommaire
Le strontium est largement répandu dans la nature et a été détecté dans de nombreux minéraux différents. Il peut être présent dans l'eau que l'on trouve dans la nature; il peut provenir de sources naturelles (météorisation des sols et des roches) ou du fait de l'activité humaine. Bien qu'il ne soit pas activement exploité au Canada, le strontium peut être libéré dans l'environnement comme sous-produit d'autres opérations minières ou en raison de son utilisation par de nombreuses industries. Le strontium est utilisé dans les applications électriques et la peinture, il sert à retirer le plomb de solutions électrolytiques de zinc, il est employé dans des pièces pyrotechniques et du matériel de signalisation, et il sert également à la fabrication de divers autres produits (verre, aimants permanents en céramique et glaçure, alliages d'aluminium, etc.). Les sels de strontium sont utilisés au Canada en raison de leurs effets bénéfiques sur la santé, soit comme produits de santé naturels (homologués principalement pour favoriser la santé des os), ou dans le cadre du traitement contre le cancer. Les formes radioactives de strontium sont utilisées à des fins médicales, comme pour l'imagerie osseuse. Le strontium est naturellement présent dans l'environnement sous forme d'un mélange de quatre radio-isotopes, lesquels sont considérés comme stables. Le présent document met uniquement l'accent sur les propriétés chimiques du strontium. Les formes radiologiques et les isotopes radioactifs du strontium sont traités dans un document distinct (Santé Canada, 2009).
Ce document technique passe en revue et évalue tous les risques connus pour la santé qui sont associés à la présence de strontium dans l'eau potable. Il évalue les nouvelles études et approches et tient compte des techniques de traitement appropriées disponibles. D'après cet examen, la recommandation pour le strontium dans l'eau potable est une concentration maximale acceptable de 7,0 mg/L.

Télécharger le rapport complet
(PDF format, 704 Ko, 73 page)
Organisation: Santé Canada
Date publiée: 24 mai, 2019
2.1 Effets sur la santé
Bien que seules quelques études menées sur des humains aient fait état d'un effet nocif sur les os, de nombreuses études animales ont révélé des effets nocifs sur les os à la suite de l'ingestion de fortes doses de strontium. Étant donné que c'est durant la première année de vie que la sensibilité aux effets nocifs sur les os est la plus élevée, les nourrissons sont considérés comme la sous-population sensible à la toxicité du strontium. Par conséquent, la CMA de 7,0 mg/L a été établie en fonction d'études sur les effets osseux chez les jeunes rats.
2.2 Exposition
Les Canadiens sont principalement exposés au strontium dans les aliments et l'eau potable. La concentration de strontium dans les produits alimentaires au Canada varie selon les municipalités et les années, et dépend de l'aliment en question et des conditions du sol. Les concentrations de strontium dans l'eau potable au Canada peuvent varier grandement selon les formations géologiques et les activités anthropiques à proximité de l'eau non traitée, l'eau souterraine présentant généralement des concentrations plus élevées que l'eau de surface. On ne s'attend pas à ce que l'apport en strontium présent dans l'eau potable se fasse par contact cutané ou par inhalation.
2.3 Analyse et traitement
Il existe plusieurs méthodes d'analyse permettant de mesurer le strontium total présent dans l'eau potable à des concentrations bien inférieures à la CMA. Les mesures devraient être pour le strontium total, ce qui inclut sa forme dissoute et sa forme particulaire dans un échantillon d'eau.
La précipitation chimique et l'échange d'ions constituent les deux meilleures techniques pour l'enlèvement du strontium naturellement présent dans l'eau potable. À l'échelle municipale, les techniques disponibles pour le traitement du strontium total comprennent la précipitation chimique, l'échange d'ions et l'osmose inverse. Parmi les autres stratégies pour diminuer l'exposition au strontium, il y a le fait de se relier à une nouvelle source d'eau, de mélanger différentes sources d'eau permettant de diminuer la concentration de strontium sous la CMA ou de se raccorder à un autre système d'approvisionnement en eau.
À l'échelle résidentielle, les dispositifs de traitement utilisant les techniques d'échange d'ions ou d'osmose inverse seraient efficaces pour enlever le strontium de l'eau potable, bien qu'aucun de ces dispositifs de traitement ne soit actuellement certifié à cette fin. Il est important de noter que les systèmes d'osmose inverse doivent être installés uniquement au point d'utilisation, étant donné que l'eau traitée pourrait être corrosive pour les composants de plomberie interne.
2.4 Considérations internationales
L'Organisation mondiale de la Santé (OMS), l'United States Environmental Protection Agency (U.S. EPA), l'Union européenne et le National Health and Medical Research Council de l'Australie n'ont pas établi de limites réglementaires fondées sur la santé quant à la concentration de l'élément chimique strontium dans l'eau potable.
3.0 Application de la recommandation
Remarque : Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité appropriée en matière d'eau potable dans le secteur de compétence concerné.
En ce qui concerne les systèmes d'approvisionnement en eau potable qui connaissent à l'occasion de courts épisodes de dépassement des concentrations de strontium au-delà de la valeur de la recommandation, il est suggéré d'élaborer un plan et de le mettre en œuvre pour remédier à ces situations. Le traitement de l'eau à la source, le mélange avec de l'eau provenant d'un autre réseau, l'interconnexion avec un tel réseau et l'achat d'eau auprès d'un tel réseau pourraient constituer des stratégies de diminution de l'exposition au strontium qui se trouve dans l'eau potable. Quant aux longs épisodes de dépassement plus importants qui ne peuvent pas être résolus grâce au traitement, il est suggéré d'envisager d'autres sources d'eau potable.
Il se pourrait que le protocole d'analyse actuel sous-évalue la concentration de strontium total dans l'eau potable dans les cas où le strontium particulaire n'est pas solubilisé (voir la section 6.3). Les installations de traitement doivent consulter les autorités responsables de l'eau potable afin de connaître les exigences de traitement, telles que la digestion des échantillons.
3.1 Surveillance
3.1.1 Caractérisation des sources
Le strontium se trouve dans les eaux de surface et souterraines présentant des dépôts calcaires riches en célestine. Il faut caractériser toutes les sources d'eau (de surface et souterraines) pour déterminer s'il y a présence de strontium. La fréquence de la caractérisation dépendra de variations potentielles :
- En ce qui concerne les eaux de surface, il peut y avoir des concentrations élevées de strontium dans les secteurs présentant de faibles précipitations et des taux d'évaporation élevés. Ces conditions peuvent mener à une présence accrue de matières dissoutes dans les cours d'eau, et donc se traduire par proportionnellement plus de strontium dans ces eaux de surface à salinité élevée.
- Dans les eaux souterraines, bien que la concentration de strontium soit moins susceptible de fluctuer, des variations ont été observées entre des puits de zones humides et de zones sèches.
Si la concentration de strontium total dans une source d'eau avoisine la CMA et qu'il est prévu ou connu que la concentration varie avec le temps (p. ex. si des activités anthropiques sont instaurées), une surveillance de la source devrait être faite chaque année. Les autorités peuvent envisager de réduire la surveillance s'il est démontré que la concentration de strontium dans la source d'eau est inférieure à la CMA et si un traitement approprié est en place.
La qualité de l'eau des nouvelles sources d'eau utilisées aux fins de consommation devraient être évaluée par ceux qui exercent des mesures de contrôle pour gérer la présence de strontium afin de s'assurer que cela ne gêne pas les procédés de traitement existants, ne se répercute pas sur le réseau de distribution et ne crée pas d'autres enjeux liés à la qualité de l'eau.
3.1.2 Surveillance opérationelle
Une surveillance régulière de l'eau traitée doit être exercée lors du traitement de l'eau pour éliminer le strontium afin d'effectuer les rajustements de procédés nécessaires, et de s'assurer que les procédés de traitement continuent d'être efficaces pour maintenir les concentrations de strontium sous la CMA. Une surveillance du pH de l'eau dans le contexte de l'exploitation doit être assurée par les installations de traitement qui ont recours à l'adoucissement à la chaux et au carbonate de sodium. Étant donné que le calcium joue un rôle important et nécessaire dans l'enlèvement du strontium, une concentration suffisante de calcium est requise pour assurer un enlèvement optimal du strontium. Les installations de traitement qui utilisent des résines échangeuses de cations fortement acides sous forme de sodium doivent être conscientes que ce procédé pourrait introduire des quantités indésirables de sodium dans l'eau traitée.
3.1.3 Surveillance de la conformité
Lorsqu'un système de traitement est en place pour l'enlèvement du strontium, il est recommandé de mener une surveillance de conformité du strontium total, à tout le moins chaque année, afin de confirmer que la CMA n'est pas dépassée. Les échantillons devraient être prélevés après le traitement, mais avant la distribution (généralement au point d'entrée du réseau de distribution), puis analysés par un laboratoire accrédité.
3.1.4 Réseau de distribution
Comme toute substance inorganique, le strontium peut s'accumuler dans les réseaux de distribution et être libéré par la suite. Par conséquent, il faut aussi exercer une surveillance tout le long des réseaux de distribution où la présence de strontium a été ou est habituellement observée dans l'eau non traitée et distribuée. Les programmes de surveillance doivent être conçus en fonction de chaque réseau d'eau potable particulier, afin qu'il soit possible de vérifier que les stratégies de contrôle fonctionnent comme prévu et d'examiner les facteurs de risque de concentration élevée de strontium dans le réseau d'eau potable. Les facteurs qui influencent l'accumulation (p. ex. produits de corrosion du fer, dépôts de manganèse et incrustations de carbonate de calcium) et la mobilisation du strontium, comme des changements dans la chimie de l'eau et des perturbations physiques/hydrauliques dans le réseau de distribution, pourraient servir d'indicateurs de la fréquence de surveillance des rejets de strontium, ainsi que des endroits où exercer une telle surveillance.
Il faut exercer une surveillance à l'égard du strontium total et des autres contaminants (p. ex. fer, manganèse, arsenic, plomb) lorsque la qualité de l'eau change ou que des perturbations physiques se produisent dans le réseau. Le rejet de strontium et d'autres contaminants peut être indiqué par un changement de couleur de l'eau ou une augmentation de la turbidité résultant de la libération de dépôts ou d'incrustations présents sur les parois des tuyaux. La fréquence et le lieu des sites de surveillance du strontium dans le réseau de distribution doivent tenir compte de l'accumulation propre au site et des facteurs de risques de rejet. Cependant, même si l'eau ne change pas de couleur, il ne faut pas l'interpréter comme une absence de rejet de métaux.
La fréquence des activités de surveillance peut être moindre dans les services d'eau potable dont les données de référence indiquent l'absence de strontium dans le réseau de distribution.
3.1.5 Puits privés
Les propriétaires qui possèdent des puits privés sont encouragés à faire vérifier la présence de strontium total dans leur eau, afin de s'assurer que la concentration dans leur source d'approvisionnement est inférieure à la CMA. De plus, les propriétaires de puits privés qui utilisent des dispositifs de traitement résidentiel doivent régulièrement faire vérifier l'eau qui entre dans le dispositif ainsi que l'eau traitée pour s'assurer de l'efficacité du dispositif. Les propriétaires qui utilisent des adoucisseurs à échange d'ions doivent être conscients qu'un tel système de traitement peut introduire des quantités indésirables de sodium dans l'eau traitée.
Partie II. Science et considérations techniques
4.0 Propriétés, utilisation et sources dans l'environnement
Le strontium élémentaire (numéro de registre du Chemical Abstracts Service [CAS] : 7440-24-6) a un poids moléculaire de 87,62 g/mol. Il se situe entre le calcium et le baryum dans le groupe des métaux alcalino-terreux. Le strontium (Sr) se trouve uniquement à un état de valence de +2 dans l'environnement (OMS, 2010; ANSES, 2013). Parmi les nombreux isotopes de strontium qui peuvent exister, on en trouve seulement quatre (84 Sr, 86Sr, 87Sr, 88Sr) à l'état naturel; ces isotopes sont considérés comme stables (MacMillan et coll., 2000). Lesisotopes radioactifs de strontium, en particulier82Sr, 85Sr, 89Sr et 90Sr, se forment lors de la fission nucléaire (ATSDR, 2004) ou sont produits à des fins médicales. Le strontium est présent naturellement dans la croûte terrestre à une concentration de 0,04 % (au 15e rang des éléments les plus abondants), et dans l'eau de mer à une concentration de 0,0008 % (8 ppm) (MacMillan et coll., 2000). Il réagit facilement au contact de l'eau et de l'oxygène, et se retrouve généralement sous forme de carbonate de strontium (SrCO3) et de sulfate de strontium (SrSO4) dans les minéraux, mais peut également être présent dans d'autres composants, comme le phosphate de strontium [Sr3(PO4)2], et en association avec des formations de roches sédimentaires (Skoryna, 1981; ANSES, 2013). Il est présent dans l'eau en tant que cation hydraté, et peut créer des complexes avec des carbonates et des silicates selon la minéralisation de l'eau (Malina, 2004; OMS, 2010). Le strontium a un point d'ébullition de 375 °C, un point de fusion de 122 °C et une pression de vapeur de 0,0005 Pa (basse) (U.S. EPA, 1996). La solubilité des sels de strontium varie. Le nitrate de strontium (Sr(NO3)2, 538-790 g/L à 18 °C), le chlorure de strontium (SrCl2, 345-538 g/L à 20 °C) et le SrSO4 (0,14 g/L à 30 ºC) sont modérément solubles dans l'eau, tandis que le SrCO3 (0,01 mg/L à 25 °C) est faiblement soluble (MacMillan et coll., 2000; ATSDR, 2004). Il n'existe pas de données relatives à la constante de la loi d'Henry.
Les espèces géochimiques de strontium les plus importantes sur le planéconomique sont le SrSO4 (célestine ou célestite) et le SrCO3 (strontianite) (MacMillan et coll., 2000; Ober, 2006). Le SrSO4 est la principale source géochimique de strontium; elle estconvertie en d'autres formes à des fins commerciales, surtout en SrCO3 et en Sr(NO3)2 (Fowler, 1991). Le SrCO3 est utilisé dans les procédés de fabrication d'aimants permanents en céramique et de glaçure, en remplacement du plomb (Fowler, 1991; ATSDR, 2004; Ober, 2014). Il sert également à accroître la résistance et la dureté du verre, à améliorer des propriétés optiques, et à absorber les radiations (Ober, 2006). On l'emploie pour enlever le plomb des solutions électrolytiques au zinc et pour fabriquer des alliages d'aluminium utilisés dans les industries de l'aérospatiale et de l'automobile. Son utilisation répandue pour les applications électriques et la peinture s'explique par ses propriétés physiques, qui permettent la conduction à température élevée ainsi qu'une démagnétisation et offrent une résistance à la corrosion (Ober, 2006). Le nitrate de strontium et, dans une moindre mesure, le sulfate de strontium, le chlorure de strontium et l'oxalate de strontium servent principalement à fabriquer des pièces pyrotechniques et des dispositifs de signalisation qui produisent une vive couleur rouge. Le chromate de strontium est utilisé comme pigment de peinture. Les formes radioactives de strontium sont utilisées dans le cas d'applications médicales comme l'imagerie osseuse (ATSDR, 2004).
Certains sels de strontium sont classés comme des produits de santé naturels en vertu de l'article 7 de l'Annexe 1 (minéral) du Règlement sur les produits de santé naturels (gouvernement du Canada, 2003). Le citrate, le lactate et le gluconate de strontium, souvent en combinaison avec d'autres ingrédients, sont les sels principalement utilisés dans les produits de santé naturels pour favoriser la santé des os. Ils sont également utilisés dans le dentifrice pour soulager la sensibilité dentaire.
Le ranélate de strontium (SrR) est un médicament d'ordonnance commercialisé en Europe pour le traitement de l'ostéoporose. Il se dissocie en deux atomes stables de Sr2+ et en une molécule d'acide ranélique dans le tractus gastrointestinal. Son effet pharmacologique d'augmenter la densité minérale osseuse est attribué à la fraction du strontium (EMA, 2012, 2013; Yamaguchi et Weitzmann, 2012; Santé Canada, 2015a). L'acide ranélique est très peu absorbé et essentiellement excrété. La base de données sur les produits pharmaceutiques de Santé Canada n'identifie actuellement aucun produit contenant du strontium comme ingrédient actif pour le traitement de l'ostéoporose.
Bien que l'utilisation du SrR ait été approuvée en 2004 dans l'ensemble des pays de l'Union européenne pour le traitement de l'ostéoporose pour les personnes âgées, cette utilisation a par la suite été restreinte. L'Agence européenne des médicaments (EMA, 2014) considérait que le rapport avantages/risques était favorable à l'emploi du SrR. L'agence a cependant recommandé que son utilisation soit limitée aux patients ne pouvant recourir à aucune autre option et à ceux sans antécédents de problèmes cardiaques ou circulatoires, et de cesser le traitement en cas d'éruption cutanée, en raison des effets nocifs possibles. Le fabricant a cessé de commercialiser et de distribuer le SrR en 2017 (Drug and Therapeutics Bulletin, 2017). Santé Canada a adopté une approche préventive en recommandant l'ajout d'avertissements sur les étiquettes des produits contenant entre 4 et 682 mg de strontium à l'intention des personnes atteintes, ou qui sont très susceptibles d'être atteintes, de maladies cardiaques, de troubles circulatoires ou de caillots sanguins. Il est également conseillé aux utilisateurs de consulter un professionnel de la santé avant d'utiliser le produit pendant plus de 6 mois (Santé Canada, 2015b). Le groupement ranélate polaire du SrR est faiblement absorbé et non métabolisé, et il est rapidement excrété; ainsi, le strontium lui-même est considéré comme responsable des effets bénéfiques sur les os observés au cours d'essais cliniques (Laboratoires Servier, 2016). Il n'est pas certain que le mécanisme de toxicité du SrR soit complètement indépendant du groupement de l'acide ranélique. En outre, une seule dose élevée de SrR peut ne pas représenter une exposition environnementale à différents composés de Sr dans l'eau potable.
Certains sels de strontium (iodure, carbonate) sont utilisés dans le cadre du traitement contre le cancer au Canada. Seul le strontium-89 radiopharmaceutique est approuvé au Canada pour un usage intraveineux dans le cadre du traitement contre le cancer (Société canadienne du cancer, 2017).
D'importants dépôts de strontium ont été découverts en Nouvelle-Écosse, en grande partie sous forme de SrSO4 dans des roches sédimentaires du comté de Cap-Breton. Cependant, le minerai est de faible qualité et la seule mine a commencé ses activités en 1971 pour fermer ses portes en 1976 (Fowler, 1991; Ober, 2006; Environnement Canada, 2012; Marshall, 2013).
Seules les formes non radiologiques du strontium seront évaluées dans le présent document, puisqu'il existe déjà une recommandation à l'égard des formes radioactives (Santé Canada, 2009). Le chromate de strontium ne sera pas évalué, étant donné que le chromate est considéré comme responsable des effets toxiques.
4.1 Devenir dans l'environnement
Le strontium sous forme ionique (Sr2+) représente la fraction échangeable soluble dans l'eau (labile dans le sol) (Lee, 2008; Heuel-Fabianek, 2014). Il pénètre principalement dans l'eau par lessivage à partir du calcaire (présent dans les roches ignées et métamorphiques,notamment dans les granites et les roches sédimentaires) sous forme de Sr2+ hydraté, et peut descendre dans les eaux souterraines (Malina, 2004). Bien qu'il ne soit pas activement exploité au Canada, le strontium peut être libéré dans l'environnement comme sous-produit d'autres opérations minières, comme dans le cas de l'extraction de diamants au Yukon (De Beers Canada, 2013). Les dépôts atmosphériques attribuables à la combustion du charbon et aux engrais phosphatés peuvent également contribuer, dans une moindre mesure (OMS, 2010; De Beers Canada, 2013). La mobilité du strontium dans le sol est modérée et dépend de la capacité d'échange cationique du sol, de la teneur en ions de l'eau en circulation et du pH (Kaplan et Kellum, 2010). Les sols ayant une faible teneur en ions calcium échangeable (faible capacité d'échange cationique) ou qui sont pauvres en humus favorisent la mobilité du strontium (faible coefficient de partage sol-eau, Kd), étant donné que le Sr2+ précipite lorsqu'il réagit avec de la matière organique (ATSDR, 2004; Heuel-Fabianek, 2014). Une petite partie adhère aux particules de métal et d'argile du sol. En fait, dans les sols légèrement acides à basiques, le strontium formera en majorité des composés insolubles (SrSO4 lorsque le pH se situe entre 4 et 8; SrCO3 lorsque le pH est supérieur à 8). L'eau en circulation riche en minéraux augmente également la mobilité du strontium. La majeure partie du strontium présent dans l'eau existe sous forme d'ions hydratés et peut réagir avec différents éléments, comme l'azote (N2), le fluor (F2) et le souffre (S) (Skoryna, 1981).
Le strontium se retrouve souvent dans les minéraux du calcium; cependant, il n'existe généralement pas de corrélation directe entre les concentrations des deux éléments. Un rapport récent n'a démontré aucune corrélation entre les concentrations de strontium et de calcium dans les eaux souterraines de l'Indiana aux États-Unis (n = 1 832) (Najm, 2016); 95 % des échantillons d'eau affichaient un rapport strontium/calcium inférieur à 0,1 (mg/mg). On a observé dans des cours d'eau aux États-Unis des rapports strontium/calcium (atomes de strontium pour 1 000 atomes de calcium) allant de 0,4 à 16. Des rapports strontium/calcium plus élevés sont observés lorsque l'eau circule dans des dépôts de SrSO4 ou de SrCO3, tandis que des rapports inférieurs sont relevés dans l'eau circulant dans des roches sédimentaires et basaltiques (Skougstad et Horr, 1963).
5.0 Exposition
Les aliments et l'eau représentent les principales sources d'exposition au strontium, mais leur apport est extrêmement variable, et les eaux souterraines présentent habituellement des concentrations supérieures à celles des eaux de surface. La teneur en strontium de l'eau potable canadienne peut varier considérablement selon les formations géologiques et les activités anthropiques à proximité de la source d'approvisionnement en eau. Il semble approprié que la contribution de l'eau potable en tant que source soit de 50 %, étant donné que seules deux sources principales d'exposition ont été recensées (Krishnan et Carrier, 2013) et que les données relatives à ces sources (voir le tableau 1 plus bas) appuient le choix du facteur d'attribution.
5.1 Eau
Entre 2000 et 2016, Environnement et Changement climatique Canada (2017) a recueilli des données sur la qualité de l'eau douce dans plus de 200 sites d'échantillonnage fédéraux et fédéraux-provinciaux à divers endroits et à diverses fréquences dans l'ensemble des écosystèmes aquatiques du Canada. Sur 18 821 échantillons, 5 se situaient sous la limite de détection (LD) de 0,005-4,0 µg/L (< 0,1 %); la valeur moyenne était de 154,2 µg/L, la valeur médiane, de 114 µg/L, et la valeur correspondant au 75e percentile, de 192 µg/L; 3 % des échantillons dépassaient 500 µg/L et la valeur maximale était de 2 900 µg/L.
Les concentrations de strontium dans l'eau potable ont été mesurées dans divers endroits au Canada dans le cadre de l'Étude nationale sur les sous-produits de désinfection et certains contaminants émergents dans l'eau potable au Canada (n = 124; 41 échantillons provenaient de lacs, 48 de rivières et 35 de puits) (Santé Canada, 2015c). Dans l'eau brute, la valeur moyenne était de 185 µg/L, la valeur médiane, de 115 µg/L, et la valeur correspondant au 75e percentile, de 250 µg/L; 11 mesures dépassaient 500 µg/L et la valeur maximale était de 1 600 µg/L. Dans l'eau traitée, la valeur moyenne était de 185 µg/L, la valeur médiane, de 130 µg/L, et la valeur correspondant au 75e percentile, de 235 µg/L; 13 mesures dépassaient 500 µg/L et la valeur maximale était de 1 500 µg/L. L'eau potable provenant d'un lac présentait les concentrations les plus basses (valeur médiane de 43 µg/L), suivie de l'eau provenant d'une rivière (valeur médiane de 150 µg/L) et d'un puits (valeur médiane de 210 µg/L).
L'Étude canadienne sur l'alimentation totale (ECAT) est une initiative de Santé Canada qui mesure les concentrations de différentes substances chimiques dans les aliments et qui utilise les données recueillies pour estimer les apports alimentaires de différents groupes d'âge et de sexe de la population canadienne (Santé Canada, 2007a). Les concentrations de strontium ont été mesurées dans l'eau du robinet de six municipalités entre 2001 et 2007. À St. John's, la concentration moyenne était de 10 µg/L; à Halifax, de 12 µg/L; à Montréal, de 150 µg/L; à Toronto, de 138 µg/L; à Winnipeg, de 36 µg/L; et à Vancouver, de 5 à 7 µg/L.
À Terre-Neuve-et-Labrador, les concentrations de strontium ont été mesurées dans l'eau brute et dans l'eau traitée des systèmes publics d'eau potable entre 2010 et 2015 (Newfoundland and Labrador Department of Environment and Conservation, 2015). Pour les 1 184 échantillons d'eau brute analysés, la valeur moyenne était de 82 µg/L, la valeur médiane, de 14 µg/L et la valeur correspondant au 75e percentile, de 59 µg/L; la valeur maximale détectée était de 2 990 µg/L; 204 échantillons (17 % d'entre eux) affichaient une concentration de strontium supérieure à 100 µg/L. Au total, 4 968 échantillons d'eau traitée ont été analysés; la valeur moyenne étaitde 116 µg/L, la valeur médiane, de 19 µg/L, la valeur correspondant au 75e percentile, de 91 µg/L et la valeur maximale, de 6 320 µg/L; 1 149 échantillons (23 %) affichaient une concentration de strontium supérieure à 100 µg/L.
La Nouvelle-Écosse a fait rapport des échantillons municipaux prélevés dans 90 installations entre 1999 et 2014 (Nova Scotia Environment, 2016). Les échantillons d'eau brute (n = 191) présentaient une valeur moyenne de 98µg/L, une valeur médiane de 17 µg/L et une valeur correspondant au 75e percentile de 53 µg/L; 36 échantillons (19 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 2 200 µg/L. Les échantillons d'eau traitée (n = 483) présentaient une valeur moyenne de 55 µg/L, une valeur médiane de 19 µg/L et une valeur correspondant au 75e percentile de 29 µg/L; 58 échantillons (12 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 690 µg/L. Au total, 28 échantillons affichaient une concentration égale ou inférieure à la LD de 2 à 5 µg/L.
Au Nouveau-Brunswick pour 2008-2016, les échantillons d'eau brute (n = 442) présentaient une valeur moyenne de 297 µg/L, une valeur médiane de 185 µg/L et une valeur correspondant au 75e percentile de 281 µg/L; 350 échantillons (79 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 3 500 µg/L (ministère de la Santé du Nouveau-Brunswick, 2016). Les échantillons d'eau traitée distribuée (n = 523) présentaient une valeur moyenne de 187 µg/L, une valeur médiane de 82 µg/L et une valeur correspondant au 75e percentile de 189 µg/L; 248 échantillons (47 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 2 600 µg/L.
Un programme de surveillance des eaux souterraines au Québec a fait rapport des analyses de la présence de strontium dans les eaux souterraines dans des régions de l'ensemble de la province entre 1941 et 2012 (ministère du Développement durable, de l'Environnement et de la Lutte contre les changements climatiques, 2016). Une valeur moyenne de 857 µg/L, une valeur médiane de 210 µg/L, une valeur correspondant au 75e percentile de 580 µg/L et une valeur maximale de 47 000 µg/L ont été signalés; 10,5 % des échantillons affichaient une concentration supérieure à 1 500 µg/L et 4 % d'entre eux dépassaient 4 000 µg/L (n = 1 261 pour les puits, LD = 2 µg/L) (Brisson, 2014). De plus, le Programme de surveillance de la qualité de l'eau potable a signalé trois mesures supérieures à 1 500 µg/L et une mesure supérieure à 4 000 µg/L (LD = 0,2 µg/L) parmi les échantillons d'eau souterraine traitée prélevés dans 50 installations entre 2012 et 2014.
Le projet Géochimie des eaux souterraines ambiantes caractérise l'étatchimique des eaux souterraines du sud de l'Ontario (une région de 96 000 km2); dans le cadre de ce projet, environ 2 300 échantillons ont été prélevés entre 2007 et 2014 (Hamilton, 2015). Au total, 31 échantillons de strontium sur 2 287 (1,3 %) affichaient une concentration inférieure à la LD de 0,1 µg/L; la valeur moyenne était de 3 528 µg/L, la valeur médiane, de 625 µg/L et la valeur correspondant au 75e percentile, de 2 436 µg/L; 11,2 % des échantillons affichaient une concentration supérieure à 10 000 µg/L et la valeur maximale était de 87 832 µg/L. Il existait une faible corrélation (0,27) entre les concentrations de calcium et de strontium dans l'eau brute.
Au Manitoba, les échantillons d'eau souterraine brute (n = 736) présentaient une valeur moyenne de 454 µg/L, une valeur médiane de 454 µg/L et une valeur correspondant au 75e percentile de 551 µg/L; 664 échantillons (90 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 7 750 µg/L pour 2009-2016 (Conservation et Gestion des ressources hydriques du Manitoba, 2016). Les échantillons d'eau souterraine traitée (n = 976) présentaient une valeur moyenne de 346 µg/L,une valeur médiane de 275 µg/L et une valeur correspondant au 75e percentile de 462 µg/L; 746 échantillons (76 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 7 940 µg/L. Les échantillons d'eau de surface brute (n = 466) présentaient une valeur moyenne de 124 µg/L, une valeur médiane de 44 µg/L et une valeur correspondant au 75e percentile de 214 µg/L; 170 échantillons (37 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 1 010 µg/L. Les échantillons d'eau de surface traitée (n = 499) présentaient une valeur moyenne de 84 µg/L, une valeur médiane de 42 µg/L et une valeur correspondant au 75e percentile de 124 µg/L; 155 échantillons (31 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 653 µg/L. Au total, 24 échantillons affichaient une concentration égale ou inférieure à 1 µg/L.
En Saskatchewan, l'eau souterraine présentait une valeur moyenne de 570µg/L, une valeur médiane de 630 µg/L, une valeur correspondant au 75e percentile de 730 µg/L et une valeur maximale de 2 100 µg/L (n = 67); l'eau de surface présentait une valeur moyenne de 310 µg/L, une valeur médiane de 250 µg/L, une valeur correspondant au 75e percentile de 290 µg/L et une valeur maximale de 1 000 µg/L (n = 156) (Water Security Agency [Saskatchewan], 2015). Globalement, 212 échantillons (95 %) affichaient une concentration supérieure à 100 µg/L et 7 échantillons présentaient une concentration égale ou inférieure à 1 µg/L.
En Alberta, les concentrations de strontium ont été mesurées entre 1999 et 2015 dans les systèmes d'approvisionnement en eau potable traitée (Alberta Environment and Sustainable Resource Development, 2016). La concentration moyenne de strontium dissous (eau filtrée, aucune particule < 0,45 µm) était de 372 µg/L; tous les échantillons présentaient une concentration supérieure à 100 µg/L et la valeur maximale était de 482 µg/L (n = 6). Le strontium extractible présentait une valeur moyenne de 308 µg/L, une valeur médiane de 257 µg/L et une valeur correspondant au 75e percentile de 385 µg/L; 919 échantillons (88 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 2 820 µg/L (n = 1 042). Le strontium total présentait une valeur moyenne de 276µg/L, une valeur médiane de 234 µg/L et une valeur correspondant au 75e percentile de 315 µg/L; 202 échantillons (94 %) affichaient une concentration supérieure à 100 µg/L et la valeur maximale observée était de 1 170 µg/L (n = 214).
5.2 Aliments
Les apports alimentaires moyens de strontium ont été estimés entre 1993 et 2007 pour les Canadiens de tous les groupes d'âge dans sept municipalités (St. John's, Halifax, Montréal, Ottawa, Toronto, Winnipeg et Vancouver) dans le cadre de l'ECAT (Santé Canada, 2007b). Les apports moyens estimés par catégorie d'âge (en µg/kg poids corporel [p.c.] par jour) étaient les suivants : de 75,5 à 83,9 pour les 0 à 6 mois; de 64,9 à 69,6 pour les 6 mois à 4 ans; 44,7 pour les 5 à 11 ans; 28,4 pour les 12 à 19 ans; de 19,1 à 26,7 pour les personnes d'un âge égal ou supérieur à 20 ans (voir le tableau 1). Selon cette étude, l'exposition au strontium par voie alimentaire peut être estimée entre 1 337 et 1 869 µg par jour pour les Canadiens adultes (19,1-26,7 µg/kg p.c. par jour).
Les concentrations de strontium dans les aliments varient selon les pays et les régions et dépendent de l'aliment lui-même et des conditions du sol (Chang et coll., 2015). Selon l'ECAT menée de 1993 à 2012, les concentrations de strontium observées dans des aliments courants variaient d'une année à l'autre et d'une ville à l'autre au Canada (Santé Canada, 2007b). Par exemple, les concentrations de strontium variaient de 40 à 500 µg/kg dans le jus de pomme, de 200 à 11 000 µg/kg dans le fromage, de 100 à 1 800 µg/kg dans les œufs, de 100 à 2 500 µg/kg dans les tomates, de 200 à 800 µg/kg dans le lait entier et de 50 à 678 µg/kg dans le thé, pour atteindre jusqu'à 100 000 µg/kg dans les herbes et les épices.
Entre 2008 et 2011, l'étude MIREC a recueilli des données de biosurveillance auprès de nourrissons et de leurs mères dans 10 villes canadiennes (Arbuckle et coll., 2013). Les échantillons de lait maternel (n = 845) présentaient une valeur moyenne de strontium de 41 µg/L, une valeur médiane de 37 µg/L, une valeur correspondant au 75e percentile de 48 µg/L et une valeur correspondant au 90e percentile de 62 µg/L; 11 échantillons affichaient une concentration supérieure à 100 µg/L et la valeur maximale était de 282 µg/L (Dabeka et coll., 2016). Les concentrations de strontium dans la préparation pour nourrissons reconstituée (y compris avec l'eau du robinet) qui ont été mesurées lors de l'ECAT entre 1993 et 2007 variaient de 247 à 844 µg/kg (Santé Canada, 2007a). Les valeurs de la concentration de strontium dans la préparation pour nourrissons seule (en soustrayant la contribution de l'eau du robinet) servent à calculer l'apport quotidien provenant des aliments pour les nourrissons de 0 à 6 mois nourris d'une préparation pour nourrissons, présenté dans le tableau 1.
5.3 Air
Le Réseau national de surveillance de la pollution de l'air (RNSPA) du Canada recueille des données sur plus de 300 polluants de l'air ambiant partout au Canada (Environnement Canada, 2014). Des données ont étésignalées sur la concentration de strontium dans des particules fines (MP2,5) et grossières (MP10). En ce qui concerne les particules fines, 100 échantillons sur 453 (22,1 %) affichaient une concentration supérieure à la LD de 0,28 ng/m3; la valeurmoyenne était de 0,61 ng/m3, la valeur médiane, de 0,39 ng/m3 et la valeur correspondant au 75e percentile, de 0,63 ng/m3; quatre échantillons présentaient une concentrationsupérieure à 5 ng/m3 et la valeur maximale était de 15,7 ng/m3. En ce qui concerne les particules grossières, seuls 21 des 1 924 échantillons (1,1 %) affichaient des concentrations supérieures à la LD de 5 ng/m3, et la valeur maximale était de 17 ng/m3.
5.4 Produits de consommation
Tel qu'il est expliqué à la section 4.0, les composés de strontium font partie de différents produits médicinaux offerts au Canada; ils peuvent être consommés par voie orale en tant que produits naturels à une dose pouvant atteindre 680 mg par jour, pour le maintien de la densité minérale osseuse (Santé Canada, 2015b). Les étiquettes des produits renfermant entre 4 et 682 mg de strontium portent des avertissements destinés aux individus atteints ou présentant un risque élevé d'être atteints de maladies cardiaques, de troubles circulatoires ou de caillots sanguins, leur indiquant de consulter un professionnel de la santé en cas d'une utilisation au-delà de 6 mois (Santé Canada, 2015b). Cependant, aucune estimation de l'exposition des Canadiens à ces produits n'a été recensée. Le strontium entre également dans la fabrication de produits comme les vitraux et les composants électriques, mais les propriétés physicochimiques de ces produits font que l'exposition et l'absorption associées sont considérées comme minimales.
5.5 Sol
Les concentrations de strontium variaient de 20 à 605 mg/kg dans 162 échantillons de sol (moyenne de 207 mg/kg) prélevés au Canada (Agriculture Canada, 1979). Ces résultats sont similaires à d'autres concentrations moyennes de strontium mesurées dans le sol partout dans le monde, moyenne qui est d'environ 240 mg/kg selon l'Organisation mondiale de la Santé (OMS, 2010). Les concentrations de strontium dans la poussière domestique, la poussière de rue et le sol de jardin ont été déterminées au cours d'une enquête portant sur 50 résidences dans 10 secteurs d'Ottawa en 1992 (Rasmussen et coll., 2001). Les concentrations moyennes de strontium dans le sol de jardin, la poussière domestique et la poussière de rue étaient respectivement de 359, 242 et 446 mg/kg; les concentrations médianes étaient respectivement de 356, 249 et 445 mg/kg; les concentrations correspondant au 90e percentile étaient respectivement de 401, 369 et 539 mg/kg; et les concentrations maximales étaient de 437, 410 et 735 mg/kg (LD minimale : 0,1 mg/kg).
5.6 Exposition multivoies par l'eau potable
Il n'est pas prévu qu'une exposition aux vapeurs de strontium survienne pendant une douche, étant donné que le strontium n'est pas volatil. Bien que la formation de fines gouttelettes durant une douche pourrait permettre l'inhalation de strontium sous forme d'aérosols, l'évaluation type de l'exposition par voies multiples, qui mesure l'exposition par inhalation à des substances chimiques volatiles pendant la douche ou le bain, ne représenterait pas avec précision l'inhalation d'aérosols de strontium au cours d'une douche. En outre, l'absorption du strontium par voie cutanée est négligeable. Ilyin et coll. (1975) ont mesuré l'absorption de strontium par la peau intacte pour trois sujets masculins ayant été exposés par voie topique à 0,15 mL d'une solution de chlorure de strontium pendant 6 heures. L'absorption cutanée moyenne du strontium était très faible (0,26 % de la quantité appliquée). Par conséquent, les expositions par voie cutanée et par inhalation pendant la douche sont peu susceptibles de contribuer de façon importante à l'exposition totale.
5.7 Apport quotidien total
On trouvera dans le tableau 1 une estimation des apports quotidiens totaux de strontium provenant de l'eau potable, de l'air, du sol et des aliments pour les groupes d'âge suivants de la population canadienne : 0 à 6 mois, 7 mois à 4 ans, 5 à 11 ans, 12 à 19 ans et âge égal ou supérieur à 20 ans. Les apports quotidiens de strontium provenant de suppléments alimentaires et d'autres produits de consommation n'ont pas été estimés, compte tenu de l'absence de données sur la proportion de la population générale qui utilise ces produits. Une variabilité individuelle des apports en strontium est possible pour chaque source. Si l'on se fie aux données du tableau 1, il semble approprié que la contribution de l'eau potable en tant que source soit de 50 %, étant donné que les aliments et l'eau potable constituent les deux principales sources d'exposition au strontium.
| Groupe d'âge | Apport quotidien en strontium provenant de diverses sources en µg/kg p.c. par jour | ||||
|---|---|---|---|---|---|
| Eau potableNote de bas de page a | AirNote de bas de page b | SolNote de bas de page c | AlimentsNote de bas de page d | Total | |
| Enfants de 0 à 6 mois allaités | 0,0 (0) | < 0,001 | 2,2 | 4,4 | 6,6 |
| Enfants de 0 à 6 mois nourris d'une préparation pour nourrissons | 115,2 (50) | < 0,001 | 2,2 | 103,8 | 221,2 |
| 7 mois à 4 ans | 66,2 (50) | < 0,001 | 1,7 | 67,3 | 135,2 |
| 5 à 11 ans | 35,8 (40) | < 0,001 | 0,6 | 44,7 | 81,1 |
| 12 à 19 ans | 24,5 (50) | < 0,001 | 0,2 | 28,4 | 53,1 |
| Âge égal ou supérieur à 20 ans | 23,0 (50) | < 0,001 | 0,1 | 22,9 | 46,0 |
|
|||||
6.0 Méthodes d'analyse
Les sources qui figurent plus bas abordent le traitement des échantillons destinés aux analyses du strontium dans l'eau potable (c.-à-d., notamment, la conservation, l'entreposage et la digestion des échantillons). Il faut effectuer les analyses de strontium conformément aux instructions de l'autorité responsable de la qualité de l'eau potable. Il est recommandé aux services d'eau potable d'aborder les exigences en matière d'échantillons avec le laboratoire accrédité menant les analyses, afin de s'assurer du respect des procédures de contrôle de la qualité et du maintien rigoureux du strontium total à une concentration inférieure à la CMA.
6.1 Méthode recommandée
Les méthodes indiquées ci-dessous, et recommandées par l'United States Environmental Protection Agency (U.S. EPA) dans la troisième règle de surveillance des contaminants non réglementés (Third Unregulated Contaminant Monitoring Rule, UCMR 3), permettent d'analyser le strontium naturel qui se trouve dans l'eau potable. Trois méthodes d'analyse, la méthode EPA 200.8 révision 5.4 (U.S. EPA, 1994a), la méthode SM 3125B (APHA, 2005; 2012) et la méthode ASTM 5673-10 (ASTM, 2010) à l'égard du strontium dans l'eau potable, utilisent une technique de spectrométrie de masse avec plasma induit (ICP-MS). Elles s'appliquent aux métaux dissous et aux métaux récupérables totaux dans l'eau potable. La concentration de métaux récupérables totaux se définit comme la somme de la concentration des métaux dissous et de la concentration des métaux particulaires (en suspension) d'un échantillon d'eau.
La méthode ICP-MS est une technique de détection hautement sensible. Selon cette méthode, une source de plasma à couplage inductif sert à ioniser et à atomiser l'analyte, lequel est ensuite séparé par un spectromètre de masse en fonction du ratio masse/charge (m/z). Un multiplicateur d'électrons ou un détecteur Faraday détecte les ions séparés. Bien que l'U.S. EPA recommande les méthodes 200.8 et ASTM D5673-10 pour surveiller le strontium en vertu de la UCMR3, le strontium n'a pas été inclus comme analyte dans le cadre de ces deux méthodes et les limites de détection de la méthode (LDM) ne sont pas énumérées (U.S. EPA, 2012). La méthode SM 3125 B présente une limite d'instrument de détection (LID) de 0,001 µg/L (APHA, 2005, 2012). La UCMR 3 stipule que, dans le cas des trois méthodes, les installations de traitement doivent viser pour le strontium à déclarer pendant la surveillance un seuil minimal de 0,3 μg/L (U.S. EPA, 2012).
L'ICP-MS peut être touchée par un certain nombre de sources d'interférences comme les interférences élémentaires isobares, lorsque des isotopes de différents éléments forment des ions à simple ou double charge du même ratio nominal m/z et ne peuvent être différenciés de l'analyte étudié; les interférences attribuables aux ions polyatomiques, lorsque des ions comportant plus d'un atome ont le même ratio m/z que l'analyte étudié; et les interférences physiques associées aux processus physiques tels que le transport de l'échantillon et les processus de conversion des échantillons dans le plasma. Généralement, la présence de fortes concentrations de solides dissous dans un échantillon peut nuire à la transmission ionique, et des interférences physiques peuvent survenir lorsque les concentrations de solides dissous dépassent 0,2% (p/v) (U.S. EPA, 1994a) et 0,5 % (p/v) (APHA, 2005; 2012).
6.2 Autres méthodes
En plus des méthodes recommandées par l'U.S. EPA, on peut analyser le strontium à l'aide des techniques instrumentales suivantes :
6.2.1 Spectrométrie d'émission atomique à plasma induit (ICP-AES)
Les méthodes 200.7 rév. 4.4 de l'U.S. EPA (U.S. EPA, 1994b) et SM 3120B (APHA et coll., 2012) sont fondées sur des analyses multiélémentaires réalisées par ICP-AES, à l'aide d'instruments séquentiels ou simultanés. Les méthodes présentent des LDM de 0,3 µg/L et 0,5 µg/L, respectivement, pour le strontium total. Les instruments mesurent les spectres linéaires d'émission atomique par spectrométrie optique. Après qu'une solution d'échantillon a été nébulisée et que l'aérosol qui en a résulté est transporté vers une torche à plasma, des spectres d'émission propres aux éléments sont produits. Les spectres sont dispersés par un spectromètre à réseau et l'intensité des spectres linéaires (ou émissions lumineuses) est vérifiée à des longueurs d'onde précises par un appareil photosensible. Les méthodes sont sujettes à des interférences spectrales (émissions lumineuses provenant de sources spectrales autres que l'élément à analyser) et, dans une moindre mesure, à des interférences chimiques (en raison de la formation d'un composé moléculaire, des effets de l'ionisation et des effets de la vaporisation du soluté). Des interférences physiques peuvent survenir avec la méthode 200.7 de l'U.S. EPA et la méthode SM3120B lorsque la concentration de solides dissous totaux est supérieure à 0,2 % (p/v) ou à 1 500 mg/L, respectivement (U.S. EPA, 1994b; APHA et coll., 2012).
À l'instar des méthodes expliquées plus haut, la méthode USGS I-4471-97 utilisant des techniques d'ICP-AES a été élaborée pour la détermination de 21 métaux totaux récupérables dans de l'eau contenant des particules non dissoutes. Une digestion acide préliminaire est utilisée pour désorber et solubiliser les métaux-traces associés à la phase des sédiments en suspension de l'échantillon, et la méthode présente une LDM de 0,5 µg/L pour le strontium (USGS, 1998).
6.2.2 Spectrométrie d'absorption atomique par flamme
La méthode SM 3111B (APHA et coll., 2012) et les méthodes USGS I-1800 et I-3800 (U.S.G.S., 1989) ont recours à la spectrométrie d'absorption atomique.
Contrairement à l'ICP-MS et l'ICP-AES, les méthodes d'absorption atomique permettent habituellement d'analyser un seul élément. La méthode SM 3111B est une méthode d'absorption atomique directe par flamme air-acétylène, dans laquelle l'échantillon est aspiré dans la flamme et atomisé. Elle consiste à envoyer un faisceau de lumière vers un détecteur en le faisant passer d'abord à travers une flamme puis dans un monochromateur. Le détecteur mesure alors la quantité de lumière absorbée par l'élément atomisé dans la flamme. Comme chaque métal possède une longueur d'onde d'absorption qui lui est propre, une lampe source composée de l'élément concerné est utilisée. La méthode SM 3111B présente une LDM de 0,03 mg/L. Aucune interférence propre à un élément n'a été recensée pour cette méthode (APHA et coll., 2012).
Les méthodes USGS I-1800 et I-3800 ont été élaborées pour l'analyse du strontium dissous et du strontium total récupérable, respectivement. Les méthodes conviennent à des concentrations de strontium variant de 10 µg/L à 5 000 µg/L. Du chlorure de lanthane et un surplus de chlorure de potassium sont ajoutés aux échantillons afin de masquer les interférences potentielles attribuables au sodium, à l'aluminium, au phosphate et à la silice, et de contrôler une ionisation du strontium dans la flamme (U.S.G.S., 1989).
6.3 Préparation des échantillons
Bien que les méthodes énoncées ci-dessus ne requièrent pas de digestion thermique en milieu acide pour l'analyse des métaux totaux récupérables à moins que la turbidité dépasse 1 unité de turbidité néphélémétrique (UTN), des recherches menées sur d'autres métaux comme le plomb et le chrome ont indiqué que cela ne permettait pas de quantifier avec précision la concentration totale d'un métal dans un échantillon. Par conséquent, le protocole actuel peut sous-estimer le strontium total dans l'eau potable en présence de strontium particulaire. Les exigences en matière d'analyse de l'UCMR3 prescrivent notamment de solubiliser l'échantillon préservé dans l'acide par chauffage léger à l'aide d'acide nitrique, peu importe la turbidité de l'échantillon ou la méthode utilisée (U.S. EPA, 2012). De même, APHA et coll. (2012) recommandent de vérifier si les métaux ont été récupérés de manière adéquate dans les différentes matrices d'échantillon, en comparant les résultats obtenus avec et sans la digestion. Il est recommandé d'effectuer une digestion par micro-ondes (SM 3030 K) lorsque l'analyse des métaux totaux récupérables est effectuée à l'aide d'une méthode SM qui fait appel à l'ICP-MS.
On a analysé des échantillons d'eau traitée provenant de deux usines différentes d'adoucissement à la chaux traitant un mélange d'eau souterraine et d'eau de surface afin de détecter la présence de strontium et d'évaluer la qualité générale de l'eau (pH, alcalinité, dureté, présence de sulfate et conductivité). Étant donné qu'aucune différence n'a été observée entre les échantillons d'eau brute filtrée et non filtrée à l'égard de leur concentration en strontium (diamètre des pores de 0,2 µm à 1,2 µm), il a été conclu que le strontium était présent sous forme dissoute (< 0,1 µm) dans tous les échantillons analysés (Najm, 2016).
La détection des fractions particulaires et dissoutes du strontium est considérée comme une pratique exemplaire dans l'analyse du strontium.
7.0 Techniques de traitement et considérations liées aux réseaux de distribution
En tant que métal alcalino-terreux, le strontium a une composition chimique qui ressemble à celle du calcium. Le strontium peut exister sous les états d'oxydation Sr0 ou Sr2+; cependant, il se retrouve dans l'environnement que sous forme de Sr2+. Dans l'eau, le strontium forme une sphère d'hydratation et est coordonné avec au moins six molécules d'eau (U.S. EPA, 1999; Alfredo et coll., 2014). Le strontium a peu tendance à former des complexes avec des ligands organiques et inorganiques. Le strontium dissous ne forme que des complexes aqueux faibles avec le carbonate, le sulfate, le chlorure et le nitrate (U.S. EPA, 1999). Selon les hypothèses que la stabilité du strontium avec les ligands organiques est similaire à celle du calcium, que le strontium est présent à des concentrations très inférieures à celles du calcium, et qu'il ne peut pas entrer en compétition avec le calcium, Stevenson et Fitch (1986) ont conclu que le strontium ne formerait pas de complexes forts avec les acides fulvique et humique.
Peu de données existent sur l'enlèvement du strontium présent naturellement dans l'eau potable. Les techniques conventionnelles de coagulation/filtration ont démontré un faible taux d'enlèvement du strontium de l'eau potable (jusqu'à 30 %) (Gäfvert et coll., 2002; Lytle et coll., 2015; O'Donnell et coll., 2016). Lors d'un examen récent des options de traitement pour l'enlèvement du strontium naturellement présent dans l'eau potable, Najm (2016) a conclu que la précipitation chimique et l'échange ionique étaient les deux techniques les plus viables pour éliminer le strontium de l'eau potable. Une étude antérieure sur l'enlèvement du strontium à grande échelle a indiqué que les taux d'enlèvement du strontium et du calcium étaient à peu près équivalents et variaient de 50 % à 85 % poour huit usines municipales d'adoucissement à la chaux (Alexander et coll., 1954). Une étude récente portant sur des usines de traitement à grande échelle ayant recours à la précipitation à la chaux/soude et à l'échange ionique (EI) pour adoucir l'eau a fait état d'un enlèvement efficace du strontium, respectivement de l'ordre de 73,5 %, et de 89,3 % à 99,9 % (Lytle et coll., 2015; O'Donnell et coll., 2016). Une évaluation de quatre dispositifs commerciaux d'osmose inverse utilisés au point d'utilisation (OI-PdU) a trouvé qu'ils avaient permis d'éliminer entre 96,6 % et 99,9 % du strontium de l'eau potable (Lytle et coll., 2015).
La majorité des études existantes sur le traitement du strontium abordent l'enlèvement du strontium radioactif des déchets radioactifs ou de sites contaminés par de tels déchets. Diverses techniques de traitement ont été évaluées, notamment l'adoucissement à la chaux (McCauley et Eliassen, 1955), la sorption (Bortun et coll., 1997; Bostick et coll., 1997; Marinin et Brown, 2000; Kulyukhin et coll., 2005; Rabideau et coll., 2005; Sato et coll., 2011), l'échange ionique (Sivaiah et coll., 2005; Marinin et Brown, 2000), la nanofiltration (Gaubert et coll., 1997; Hwang et coll., 2002; Liang et coll., 2011; Richards et coll., 2011; Ding et coll., 2015) et le traitement biologique (Achal et coll., 2012; Trope et coll., 2012). Plusieurs de ces études ont utilisé le strontium naturel comme substitut dans le but de refléter l'efficacité potentielle de certains procédés de traitement pour l'enlèvement du strontium radioactif. De plus, le strontium naturel était une cible dans quelques études qui évaluaient son enlèvement des eaux résiduaires industrielles, par adsorption et par EI.
Bien que les caractéristiques chimiques de l'enlèvement du strontium de l'eau soient indépendantes des isotopes du strontium (ASTDR, 2004), Najm (2016) a établi que la nature des études qui évaluaient l'enlèvement du strontium radioactif des eaux usées différait de celle des études qui portaient sur l'enlèvement du strontium naturel. Étant donné que les résines échangeuses d'ions organiques tolèrent mal une exposition aux radiations, les résines échangeuses d'ions/adsorbants inorganiques naturels et synthétiques sont préconisés pour l'enlèvement du strontium radioactif. Les adsorbants inorganiques tels que les zéolites, les titanates de sodium et les titanosilicates sont chimiquement inertes et stables à l'égard du rayonnement ionisant (Sivaiah et coll., 2005; El-Kamash, 2008). De plus, étant donné que les études ont été menées dans le contexte de l'enlèvement du strontium radioactif, la régénération des adsorbants/résines échangeuses d'ions n'a pas été prise en compte. Malgré ces limitations, les études ont fourni des renseignements précieux sur la capacité et les enjeux relatifs aux adsorbants/résines échangeuses d'ions inorganiques servant à éliminer le strontium.
7.1 Traitement à l'échelle municipale
Parmi les stratégies de gestion du strontium qui peuvent être mises en place à l'échelle municipale, il y a le traitement de l'eau à la source et des pratiques telles que le passage à une autre source d'approvisionnement, le mélange avec de l'eau provenant d'un autre réseau, l'interconnexion avec un tel réseau et l'achat d'eau auprès d'un tel réseau. Il faut effectuer la caractérisation de la qualité de l'eau de façon à s'assurer d'évaluer les changements de qualité de l'eau à la suite du contrôle ou du traitement et de définir les répercussions potentielles pour le réseau de distribution. Une modification de la qualité de l'eau ne doit pas entraîner d'autres problèmes de conformité. L'essai pilote de la méthode de traitement ou de l'option de contrôle choisie pour le strontium constitue aussi une importante étape dans l'évaluation d'éventuelles conséquences imprévues, telles que la modification de la qualité de l'eau.
7.1.1 Options de contrôle
Parmi les options de contrôle types pour diminuer les concentrations excessives de strontium dans l'eau potable, mentionnons la transition à une nouvelle source, le mélange de différentes sources d'eau permettant de diminuer la concentration de strontium sous la CMA ou le raccordement à un autre système d'approvisionnement et l'achat d'eau auprès d'un autre système. Il faut accorder une attention particulière à la qualité de l'eau provenant d'une nouvelle source avant d'apporter tout changement (passage à une autre source, mélange ou raccordement) à une source d'approvisionnement existante. Par exemple, si la nouvelle source d'eau est plus corrosive, cela pourrait entraîner un lessivage de plomb ou de cuivre dans le réseau de distribution.
La transition à une autre source peut nécessiter le creusage d'un nouveau puits dans un aquifère renfermant de faibles concentrations de strontium ou le scellement de zones de production d'eau contenant de fortes concentrations de strontium, ou peut mener à la découverte d'une source d'eau de surface non contaminée. Le passage à une autre source peut aussi être limité par la disponibilité de nouvelles sources, les droits existants relatifs à l'eau et les coûts liés au transport de l'eau de la nouvelle source d'approvisionnement en eau vers l'usine de traitement.
Le mélange comprend la dilution des concentrations de strontium d'une source contaminée avec une autre source contenant peu ou pas de strontium. Pour minimiser la tuyauterie requise pour transporter les eaux vers un point de mélange commun, les sources devraient idéalement être rapprochées. Le mélange a lieu habituellement dans un réservoir de stockage ou un collecteur commun, et il en résulte des concentrations de strontium inférieures à la CMA.
Lors d'un raccordement à un autre système d'approvisionnement en eau, le système récepteur doit prendre en compte un certain nombre de facteurs, notamment s'il y a un approvisionnement en eau à proximité qui présente la CMA requise en matière de strontium, s'il est disposé à se raccorder à un autre système ou à se regrouper, et si le système de raccordement peut répondre à la demande accrue qui résultera des clients supplémentaires. Les coûts sont également à prendre en considération lors d'une prise de décision relative à un raccordement.
7.1.2 Procédés conventionnels de coagulation et de filtration
Les procédés conventionnels de coagulation/filtration comptent parmi les procédés de traitement de l'eau les plus couramment utilisés par les grands systèmes d'eau pour enlever les particules et la turbidité des sources d'eau. Cependant, ce traitement n'enlève pas le strontium de l'eau potable de manière efficace (Gäfvert et coll., 2002; Brown et coll., 2008; Lytle et coll., 2015; O'Donnell et coll., 2016). L'efficacité des usines de traitement de l'eau à grande échelle à l'égard de l'enlèvement du strontium et du calcium naturels a été étudiée au début des années 1950. Des échantillons provenant de 50 usines de traitement de l'eau et présentant diverses concentrations de strontium naturel (maximum de 1,9 mg/L) ont été analysés. Sept de ces usines, qui avaient recours à la coagulation/filtration avec du sulfate d'aluminium ou ferreux comme coagulant, ont réussi à enlever le strontium de l'eau de surface et de l'eau souterraine dans des proportions allant de 10 % à 30 % (Alexander et coll., 1954). Jiménez et De La Montaña Rufo (2002) ont découvert que le pourcentage d'enlèvement du strontium dans 17 usines de traitement de l'eau utilisant la coagulation/floculation ne dépassait pas 15 %. Lytle et coll. (2015) et O'Donnell et coll. (2016) ont signalé des résultats d'essais en laboratoire similaires et ont confirmé que l'inefficacité de l'enlèvement du strontium par procédé de coagulation/filtration conventionnel pour le traitement de l'eau de surface atteignait un pic lorsque la concentration de strontium était de 5 mg/L. Les taux d'enlèvement de strontium étaient inférieurs à 5,0 % lorsqu'on utilisait des doses de chlorure de fer(III) ou d'aluminium jusqu'à concurrence de 50 mg/L. De plus, O'Donnell et coll. (2016) ont indiqué que la dose de coagulant, la concentration initiale de strontium et le pH n'avaient aucun impact sur l'enlèvement du strontium durant les essais en laboratoire pour les procédés de coagulation/filtration. Par contre, les auteurs ont relevé que la turbidité initiale avait une très faible incidence sur l'enlèvement du strontium. Des taux d'enlèvement du strontium allant jusqu'à 18 % (coagulant d'alun) et 5,9 % (coagulant ferrique) ont été observés pour les échantillons filtrés lorsque les turbidités initiales étaient de 246 UTN et de 89,6 UTN, respectivement. Les auteurs ont conclu que le traitement par coagulation/filtration ne constituait pas une stratégie viable pour l'enlèvement du strontium de l'eau potable (O'Donnell et coll., 2016).
7.1.3 Précipitation chimique
L'adoucissement à la chaux est un processus de précipitation qui enlève entre autres les ions de calcium et de magnésium de l'eau dure. On ajoute de la chaux (Ca(OH)2) pour faire monter le pH de l'eau à 9,5, ce qui provoque une modification de l'équilibre carbonique se traduisant par une précipitation de carbonate de calcium (CaCO3). Du carbonate de sodium (Na2CO3) est ajouté afin de précipiter duCaCO3 à partir de la dureté non carbonatée. La Ca(OH)2 et le Na2CO3 peuvent être ajoutés au-delà du point de précipitation du CaCO3, ce qui se traduira par une précipitation d'hydroxyde de magnésium [Mg(OH)2].
À l'instar du calcium, le strontium peut précipiter dans l'eau sous forme de carbonate (SrCO3; constante de solubilité Ksp = 10-9,25), de sulfate (SrSO4; Ksp = 10-6,46) et de phosphate (Sr3(PO4)2; Ksp = 10-27,4) (Dean, 1992; Najm, 2016).
Des études antérieures ont observé la co-précipitation du SrCO3 avec le CaCO3 lors des procédés d'adoucissement à la chaux. Alexander et coll. (1954) ont comparé les taux d'enlèvement du strontium d'eaux non traitées à l'aide de diverses méthodes de traitement, et ont signalé qu'un procédé d'adoucissement à la chaux constituait le traitement le plus efficace pour réduire le strontium présentant des concentrations dans l'influent jusqu'à 1,9 mg/L; il permettait d'atteindre un équivalent d'enlèvement de l'ordre de 50 % à 85 %. Une autre étude a observé que l'enlèvement de la dureté calcique était essentiel à un enlèvement maximal du strontium (McCauley et Eliassen, 1955).
La chimie des précipitations de SrCO3 et de CaCO3 aindiqué que lorsque les concentrations de SrCO3 et de CaCO3 se situaient toutes deux sur leur courbe de saturation respective dans des conditions d'exploitation identiques (diagramme pC-pH), le rapport massique Sr/Ca (mg/mg) était de 0,256:1. Ainsi, il est seulement possible de précipiter le SrCO3 sans également précipiter le CaCO3 lorsque le rapport de masse strontium/calcium est supérieur à 0,256:1 (Najm, 2016). L'analyse statistique du rapport de masse strontium/calcium dans des échantillons d'eau souterraine de l'Indiana (n = 1 839) a démontré que moins de 1,0 % des échantillons analysés présentait un rapport massique supérieur à 0,256:1 et que, par conséquent, dans plusde 99,0 % des échantillons d'eau souterraine, le SrCO3 ne pouvait pas précipiter sans que le CaCO3 précipite aussi. Cependant, ces analyses sont liées à l'ensemble de données de l'Indiana, et pourraient ne pas s'appliquer à d'autres sources d'eau. Par exemple, O'Donnell et coll. (2016) n'ont observé aucun enlèvement de SrCO3 en l'absence de calcium dans un échantillon d'eau d'un pH aussi élevé que 11,0 et renfermant 4,89 mg/L de strontium ainsi que 85 mg/L de carbone inorganique dissous. En dépit du fait que le rapport de masse strontium/calcium était supérieur à 0,256:1 dans cet échantillon, les résultats ont démontré que la précipitation du calcium était nécessaire à l'enlèvement du strontium (O'Donnell et coll., 2016).
À la lumière de ce qui précède, les installations de traitement ayant recours à l'adoucissement à la chaux pour enlever le CaCO3 de l'eau brute pourraient peut-être également enlever le strontium avec ce procédé. La précipitation chimique constitue une technique de traitement viable pour l'enlèvement du strontium; néanmoins, il faut entreprendre une évaluation des conditions d'exploitation afin de maximiser l'enlèvement du strontium (Najm, 2016).
Une étude concernant plusieurs usines de traitement à grande échelle a porté notamment sur un système d'adoucissement à la chaux, cinq systèmes d'adoucissement d'eau par EI, plusieurs systèmes de filtration et deux milieux d'adsorption à base de fer. Situés dans cinq États voisins aux abords des Grands Lacs, ces systèmes traitaient des eaux souterraines contenant de 0,25 mg/L à 36,3 mg/L de strontium. L'usine d'adoucissement à la chaux présentait dans l'eau brute une concentration de strontium de 3,5 mg/L, une concentration de calcium de 121,6 mg/L et une concentration de magnésium de 44,8 mg/L, et des taux d'enlèvement de 73,5 %, 82,4 % et 73,2 % ont été atteints pour le strontium, le calcium et le manganèse, respectivement. Aucune donnée d'exploitation n'était disponible pour cette usine de traitement (Lytle et coll., 2015).
Une étude portant sur l'adoucissement à la chaux a observé que l'enlèvement du strontium était lié à l'enlèvement du calcium dans l'eau potable (Lytle et coll., 2015; O'Donnell, 2016). Ce lien a été observé lors d'essais en laboratoire sur l'enlèvement du strontium de trois eaux souterraines présentant initialement des concentrations de strontium de 4,2, 10,9 et 21,8 mg/L; des concentrations de calcium de 126, 112,0 et 102,0 mg/L; des concentrations de magnésium de 32, 32,5 et 43,7 mg/L; ainsi que des pH de 7,2, 7,3 et 7,3, respectivement. L'ajout d'une quantité de chaux allant de 0 à 450 mg/L a fait grimper les pH jusqu'à 12,0. Du carbonate de sodium (soude) à une concentration de 45 mg/L a été utilisé pour l'enlèvement de la dureté non carbonatée. L'étude a observé que les taux d'enlèvement du strontium et du calcium augmentaient avec l'augmentation de la dose de chaux jusqu'à ce que les pH atteignent 10,0-11,0, puis que les taux d'enlèvement du strontium et du calcium descendaient lorsqu'on augmentait encore la dose de chaux. La diminution du magnésium, en revanche, s'est rapidement accrue lorsque le pH a dépassé 11,0. En ce qui concerne les eaux souterraines testées, des taux d'enlèvement maximaux de 78,2 %, 78,5 % et 77,7 % pour le strontium et de 86,4 %, 83,2 % et 82,4 % pour le calcium ont été obtenus à un pH de 10,7. Les concentrations minimales de strontium obtenues dans les eaux traitées (0,9, 2,3 et 4,8 mg/L) dépendaient de la concentration en strontium de l'eau brute (c.-à-d. que la concentration finale de strontium dans l'eau traitée augmentait en fonction de l'augmentation de la concentration de strontium dans l'eau brute). Cependant, les taux d'enlèvement maximaux du strontium, exprimés en pourcentages, étaient à peu près les mêmes pour ces trois concentrations différentes de strontium dans l'eau brute. Étant donné qu'on n'avait pas observé d'enlèvement du strontium en l'absence de calcium dans les échantillons témoins, l'étude a suggéré que le calcium jouait un rôle important et nécessaire dans le mécanisme de l'enlèvement du strontium. Le taux d'enlèvement maximal du strontium correspondait au taux optimal d'enlèvement du calcium. Les auteurs ont conclu que le strontium co-précipitait avec le CaCO3, que la technique d'adoucissement à la chaux l'éliminait de manière efficace et que l'enlèvement était associé au pH, à la dose de chaux ainsi qu'aux concentrations de calcium et de carbone inorganique dissous. Une analyse des précipités par diffraction aux rayons X a suggéré que le strontium était incorporé au réseau cristallin du calcium (O'Donnell et coll., 2016). Ces constatations sont en accord aveccelles de McCauley et Eliassen (1955), qui ont signalé que le SrCO3 co-précipitait avec le CaCO3 et formait des cristaux mixtes de calcite et de strontianite (certains ions de calcium dans le cristal de CaCO3 étaient remplacés par des ions de strontium). Les auteurs ont fait état d'un procédé d'adoucissement modifié (procédé de précipitation répétée) conçu à l'origine pour le traitement du strontium radioactif dans l'eau potable et nécessitant une diminution de plus de 99,0 % de la radioactivité du strontium. À la suite de l'adoucissement initial (enlèvement de 80 à 90 %), des portions de chlorure de calcium en présence d'un surplus de soude ont réussi à enlever le strontium radioactif dans une proportion supérieure à 99,9 % (McCauley et Eliassen, 1955).
Une solution de rechange à l'adoucissement conventionnel par précipitation est le procédé d'adoucissement par granules. Dans ce procédé, on injecte de la chaux, de la soude caustique ou du carbonate de sodium dans l'eau pour accroître la concentration d'ions carbonate et donc déclencher la précipitation de CaCO3 et de SrCO3. L'eau circule dans un contacteur renfermant du sable fluidisé. Le CaCO3 et le SrCO3 précipitent et forment de gros granules sur les grains de sable, lesquels sont ensuite retirés du contacteur. Lors d'une étude pilote, un procédé d'adoucissement par granules a été utilisé pour enlever le calcium du concentrat généré par le traitement d'OI d'une eau souterraine saumâtre. Le concentrat d'OI contenait 652,0 mg/L de calcium et 5,0 mg/L de strontium. L'augmentation du pH de l'eau jusqu'à 10,5 par l'ajout d'un mélange de chaux et de soude caustique a fait baisser la concentration en calcium dans l'eau traitée à 19,0 mg/L et la concentration de strontium, à < 0,05 mg/L. Ce procédé permet une déshydratation et un transport faciles des matières précipitées formées (Najm, 2016).
Une des restrictions du procédé d'adoucissement à la chaux/soude est qu'il faut porter le pH de l'eau à 10,6 pour obtenir un enlèvement optimal du strontium et du calcium. Il peut être nécessaire de recarbonater l'eau traitée pour faire baisser le pH et d'ajouter des inhibiteurs de corrosion pour protéger le réseau de distribution (pour parer à la corrosivité potentiellement altérée de l'eau traitée en raison de l'enlèvement de la dureté et de l'alcalinité). En outre, le grand volume de boues générées au cours du procédé conventionnel d'adoucissement par précipitation requiert des dispositions spéciales en termes de manutention (stockage en citerne), de traitement (déshydratation mécanique) et d'enlèvement hors site.
7.1.4 Échange d'ions
L'U.S. EPA (2011) a déterminé que l'échange d'ions était une des meilleures techniques existantes pour l'enlèvement du strontium radioactif. Étant donné que les isotopes stables et radioactifs de strontium se comportent de la même façon sur le plan chimique (ATSDR, 2004), ce procédé doit enlever efficacement le strontium naturel de l'eau potable (Sorg et Logsdon, 1980; El-Kamash, 2008; Sato et coll., 2011).
L'application la plus courante de l'échange d'ions dans le traitement de l'eau potable est l'adoucissement de l'eau. Des recherches approfondies ont été effectuées sur l'applicabilité des résines échangeuses de cations (REC) fortement acides et faiblement acides à l'égard de l'enlèvement de cations de calcium (Ca2+) et de magnésium (Mg2+) formant des dépôts, d'autres éléments alcalino-terreux comme le baryum (Ba2+) et le radium (Ra2+) et, dans une moindre mesure, de Sr2+ dans l'eau potable (Myers et coll., 1985; Snoeyink et coll., 1987; Subramonian et coll., 1990; Clifford, 1999; Clifford et coll., 2011). Les REC fortement acides comportent des sites d'échange fortement acides et peuvent échanger des ions dans une vaste gamme de valeurs de pH, soit de 2 à 11, tandis que les REC faiblement acides présentent un groupement fonctionnel faiblement acide et peuvent échanger des ions seulement lorsque le pH est neutre ou alcalin. Les REC fortement acides sous forme de sodium(Na+) ou d'hydrogène (H+) échangent des cations Na+ ou H+ contre des ions Ca2+, Mg2+, Ba2+ et Sr2+ dans l'eau, en tant que dureté carbonatée ou non carbonatée. De façon générale, le pH et l'alcalinité de l'eau traitée par les REC fortement acides (Na+) demeuraient à peu près inchangés durant le cycle de production. Cependant, l'utilisation de telles résines sous forme de Na+ peut se traduire par des quantités non souhaitées de sodium dans l'eau traitée. Les REC fortement et faiblement acides sous forme de H+ sont d'autres résines pouvant servir à la production d'eau traitée sans sodium. Néanmoins, les REC fortement acides sous forme H+ sont rarement utilisées pour adoucir l'eau en raison de l'acidité de l'eau traitée et de l'inefficacité de l'acide à régénérer les résines. Les REC faiblement acides sous forme de H+ enlèvent efficacement la dureté carbonatée (seulement) et les cations métalliques divalents dans l'eau. Le procédé se traduit par un adoucissement partiel et produit une eau traitée présentant une faible alcalinité et de faibles concentrations de matières dissoutes totales. Il faut extraire le CO2 présent dans l'eau traitée et ajuster son pH (augmentation) afin de produire une eau non corrosive (Clifford, 1999; Clifford et coll., 2011).
Les résines échangeuses d'ions présentent un degré de sélectivité pour divers ions, selon la concentration ionique de la solution et le type de résine choisi (Clifford, 1999). La capacité d'échange ionique et la sélectivité de la résine sont des éléments importants à considérer dans le choix d'une résine. Clifford et coll. (2011) ont comparé les facteurs de séparation d'un certain nombre de cations dans des REC fortement acides (matrice de divinylbenzène de polystyrène avec groupement fonctionnel de sulfonate) et ont produit la séquence suivante de sélectivité ionique (en ordre de préférence d'échange) pour dix cations divalents :
Figure 1 - Strontium dans l'eau potable
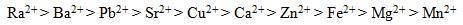
Figure 1 - Équivalent textuel
L'ordre de préférence d'échange est: Ra2+, Ba2+, Pb2+, Sr2+, Cu2+, Ca2+, Zn2+, Fe2+, Mg2+, Mn2+.
La séquence ci-dessus suggère que les cations Ra2+, Ba2+ et Sr2+ sont préférentiellement enlevés par rapport aux cations Ca2+ et Mg2+ lors de l'adoucissement de l'eau. Les REC faiblement acides affichent la mêmeséquence de sélectivité que les REC fortement acides, sauf que l'ion H+ est le cation le plus privilégié (Clifford et coll., 2011). En raison de l'abondance de calcium et de magnésium dans les eaux naturelles à des concentrations qui dépassent de loin celles du strontium, la présence de ces ions peut nuire à l'efficacité de l'enlèvement du strontium (Bortun et coll., 1997; Marinin et Brown, 2000; Najm, 2016), et peut réduire la durée d'utilisation de la colonne jusqu'à la percée du strontium (Clifford et coll., 2011).
La régénérabilité est un autre élément à considérer lors du choix d'une résine. En général, une résine présentant une forte affinité pour un contaminant et qui peut être utilisée intacte longtemps est difficile à régénérer (Clifford, 1999). Snoeyink et coll. (1987) ont démontré que le baryum, dont les propriétés chimiques et physiques sont similaires à celles du strontium, s'accumulait dans une REC fortement acide lors de chaque cycle de régénération, et qu'il réduisait la capacité de la résine durant le processus d'adoucissement de l'eau.
Des résines sélectives présentant une forte affinité pour des contaminants spécifiques ont été fabriquées pour des applications de traitement de l'eau. Les résines dont le groupement fonctionnel est chélatant ont démontré de fortes affinités pour des ions de dureté et pour plusieurs métaux dont le zinc, le chrome et le plomb. Charizia et coll. (1998) ont fait état de l'élaboration d'une résine sélective pour l'enlèvement du strontium radioactif des déchets nucléaires; cependant, Najm (2016) a indiqué que rien ne prouvait que cette résine ou que d'autres résines échangeuses de cations à usage unique présentant une capacité élevée d'enlèvement du strontium aient déjà été mises sur le marché.
Une étude a évalué l'efficacité de cinq systèmes d'adoucissement par EI à grande échelle et a constaté que quatre d'entre eux présentaient des taux d'enlèvement de strontium variant de 89,3 % à 99,9 %, alors que le taux du cinquième était de 33,3 % (Lytle et coll., 2015). Les concentrations de strontium dans l'eau brute variaient entre 0,27 et 36,3 mg/L. Le taux d'enlèvement le plus élevé (99,9 %) a été atteint par un système traitant une eau brute affichant une concentration de strontium de 36,3 mg/L. Une évaluation de l'efficacité du système d'EI requiert l'établissement d'une onde de percée pour aider à la détermination de la durée de vie du lit de la résine et des délais de régénération. Compte tenu qu'il n'était pas indiqué à combien de volumes de lit (VL) les échantillons d'eau avaient été recueillis, le rendement de ces cinq systèmes d'EI n'a pas pu être évalué de façon exhaustive.
Une étude en laboratoire, qui a utilisé du nitrate de strontium [Sr(NO3)2] en remplacement du strontium radioactif et de l'eau souterraine simulée (préparée selon la composition d'un bassin connu sous-jacent à un site nucléaire), a évalué la capacité de deux résines échangeuses de cations disponibles sur le marché et de plusieurs matériaux adsorptifs inorganiques (zéolites naturelles et synthétiques et cinq nouveaux matériaux cristallins synthétiques ou composites) à l'égard de l'enlèvement du strontium radioactif (Marinin et Brown, 2000). Selon les valeurs du coefficient de distribution (Kd) obtenues au moyen d'expériences en batch en laboratoire, les deux résines échangeuses de cations disponibles sur le marché ont démontré le potentiel d'enlèvement du strontium le plus élevé, leurs valeurs de Kd (> 200 000 et 150 000 mL/g, respectivement) dépassant de loin celles des zéolites naturelles et synthétiques, qui étaient de 680 et 1 360 mL/g, respectivement. En présence d'ions concurrents comme le calcium, le magnésium et le baryum, il a été observé que les valeurs de Kddes résines concernant le strontium diminuaient. Le coefficient de Kd est un terme utilisé pour caractériser l'aptitude d'un adsorbant en phase solide ou d'une résine à adsorber les contaminants radioactifs d'un liquide contaminé. Le coefficient décrit le volume d'eau pouvant être traité par une masse donnée d'adsorbant lorsque les concentrations de contaminant dans le liquide et sur l'adsorbant atteignent un point d'équilibre.
Le traitement par échange d'ions présente quelques limitations. La contamination de la résine peut devenir une préoccupation si la source d'approvisionnement en eau renferme de fortes concentrations de particules, de métaux (comme le fer et le manganèse) et de matière organique dissoute. Pour préserver la durée de vie du lit, il peut être nécessaire de faire un prétraitement pour enlever ces contaminants inorganiques et organiques. Le recours à un prétraitement peut complexifier le système, augmenter les coûts et compliquer l'élimination des matières résiduelles. Le traitement par échange d'ions génère des eaux résiduaires saumâtres dont il faut disposer et qui peuvent contenir divers contaminants en concentrations importantes selon la qualité de l'eau brute à traiter. La nature et la quantité des contaminants qui se retrouvent dans la saumure, de même que les volumes de saumures qui seront générés par le traitement sont des éléments à prendre en compte dans le choix de gestion de ce type de rejet. La gestion des résines épuisées peut également devenir une contrainte si jamais des composés radioactifs sont présents à l'eau brute et enlevés par EI. Tous ces éléments doivent être pris en considération lors de l'évaluation d'un projet impliquant l'EI par les autorités.
7.1.5 Technologies des membranes
Les procédés de séparation par membrane sous haute pression tels que l'OI et la nanofiltration sont des techniques éprouvées pour l'enlèvement des ions de l'eau potable. Étant donné que le strontium existe sous forme d'ion divalent (Sr2+) dans l'eau, son enlèvement au moyen de membranes d'OI ou de nanofiltration doit dépasser 95 % dans la plupart des conditions (Najm, 2016).
Les procédés d'OI et de nanofiltration emploient divers mécanismes pour rejeter les constituants inorganiques dans l'eau potable (Nghiem et coll., 2004). L'exclusion par la taille est un important mécanisme de rejet des contaminants par les membranes. Dans une solution aqueuse, les ions se lient fortement à un certain nombre de molécules d'eau au moyen d'interactions électrostatiques. L'hydratation d'un composé ionique peut être considérée comme une complexation, dans laquelle l'eau joue le rôle du ligand. La complexation peut améliorer le rejet des constituants de manière significative en raison d'une augmentation de la taille de l'ion (Richards et coll., 2011). En plus de l'effet de la taille, une répulsion électrostatique peut accroître le rejet des ions chargés par la membrane de charge identique. À l'opposé, une attraction électrostatique entre des ions de charges opposées et la surface des membranes peut réduire le rejet en raison du fait que les ions sont attirés par cette surface, ce qui augmente la probabilité que ces ions traversent les pores de la membrane (Schaep et coll., 1998; Nghiem et coll., 2004; Van der Bruggen et coll., 2004; Verliefde et coll., 2008). Les effets de surface des membranes (attraction ou répulsion électrostatique) ont une durée limitée et sont rapidement atténués par le colmatage.
Quatre études pilotes portant sur des membranes de nanofiltration/OI ont évalué les effets de la fluctuation énergétique et des valeurs de pH de l'eau sur le rejet de contaminants inorganiques, dont le strontium dans les eaux souterraines (Richards et coll. 2011). Deux sources d'eau souterraine saumâtre affichant une concentration de strontium de 1,3 mg/L et d'environ 0,5 mg/L ont été utilisées pour les essais. En raison de l'exclusion par la taille, une membrane sélectionnée a atteint un taux d'enlèvement du strontium supérieur à 99,0 % pour les deux eaux souterraines testées. Aucun impact découlant des conditions d'exploitation n'a été observé (Richards et coll., 2011).
Une membrane d'OI en polyamide, spiralée et sous basse pression (< 1,0 MPa) a fait l'objet d'un essai pour le traitement du strontium et du césium radioactifs (Ding et coll., 2015). Pour la préparation des solutions d'essai, du Sr(NO3)2 a été dissous en remplacement du strontium radioactif dans de l'eau ultrapure contenant 1 mM de quelques cations courants (Na+, Mg2+et Ca2+) sousforme de sels de chlorure et 1 mM de quelques anions courants (Cl-, F-, NO3- et SO42-) sous forme de sels de sodium. Les caractéristiques techniques de la membrane d'OI pilote étaient les suivantes : seuil de coupure de 100 Da, efficacité de rejet du sel de 98 %, et taux de récupération d'eau de 37,5 %. L'eau de perméation et l'eau rejetée ont été retournées au réservoir d'alimentation afin que le débit d'alimentation en strontium reste dans une plage de 100 à 1 000 µg/L. Il a été constaté que les interactions électrostatiques favorisaient le rejet du strontium, commele démontre le taux de rejet minimal (environ 97,2 %) survenu à un pHIEP de 5,0 (point isoélectrique de la membrane). À des pH inférieurs à 5, la membrane d'OI était chargée positivement, et les rejets de strontium supérieurs à 99,0 % ont été obtenus en raison de la répulsion électrostatique. Des taux de rejet supérieurs à 99,0 % ont également été observés à un pH de 9,0, en raison du potentiel de membrane créé à la frontière entre la surface de la membrane et la solution. La membrane d'OI a également été testée avec de l'eau de surface à laquelle 1 000 µg/L de strontium avaient été ajoutés. Un taux de rejet du strontium supérieur à 97,5 % a été observé, le flux n'ayant que légèrement baissé après une période opérationnelle de 24 heures (Ding et coll., 2015).
Deux chaînes de traitement pilotes ont été exploitées pour déterminer la faisabilité de recycler l'eau traitée secondaire provenant d'une usine de traitement des eaux usées en vue du remplissage potentiel des nappes souterraines et de l'augmentation de l'eau de surface (Liang et coll., 2011). La chaîne no 1 comprenait une unité d'ultrafiltration,une unité d'OI et un procédé d'oxydation avancé (POA); quant à la chaîne no 2, elle se composait d'un bioréacteur à membrane (BRM), d'une unité d'OI et d'un POA. L'unité d'ultrafiltration testée était un système de filtration en continu de 60 gpm (3,8 L/s) équipé de 12 éléments de membrane d'ultrafiltration à fibres creuses et dont les pores de membrane présentaient une taille nominale de 0,04 µm. Le BRM évalué était une unité de 60 gpm (3,8 L/s) comportant deux ensembles de dix modules de membranes à fibres creuses et dont la taille nominale des pores de membranes était de 0,04 µm. Les systèmes d'OI étaient identiques, chacun se composant d'un filtre à cartouche et d'un appareil sous pression à deux phases comportant un total de 21 éléments spiralés de membrane. Aucun enlèvement de strontium n'a été observé de la part de l'unité d'ultrafiltration ni du BRM. Un enlèvement presque complet (99,9 %) a été obtenu avec les deux unités d'OI pilotes, les concentrations médianes ayant descendu de 726 µg/L dans l'eau d'alimentation à moins de 0,5 µg/L dans le perméat d'OI. Les deux unités d'OI ont fonctionné à un flux moyen de 12 gfd (20,4 L/m2 h) et ont présenté un taux de récupération moyen d'environ 85 % (Liang et coll., 2011). De même, afin de rehausser les exigences relatives à l'approvisionnement en eau potable, Subramani et coll. (2010) ont fait rapport au sujet de l'utilisation de membranes d'OI pour la déminéralisation de l'eau de surface. Les concentrations de strontium ont systématiquement baissé de 1,2 à 1,3 mg/L dans le débit prétraité et sous la LD de la méthode de 0,01 mg/L dans le perméat (Subramani et coll., 2010).
Les limitations du procédé d'OI comprennent une possibilité d'entartrage, d'encrassement ou de défaillance de la membrane, ainsi que des coûts en énergie et en capital accrus. Le calcium, le baryum et la silice peuvent entartrer la membrane et diminuer son efficacité. Des colloïdes et des bactéries peuvent aussi causer un encrassement. L'entartrage et l'encrassement vont tous deux augmenter la chute de pression, ce qui réduira la durée de vie de la membrane et fera monter les coûts énergétiques. Des prétraitements comme l'adoucissement, la filtration par cartouche et le nettoyage de la membrane peuvent aider à obtenir des durées de fonctionnement acceptables pour la membrane. Le chlore peut endommager les membranes d'OI; il faut l'inactiver au moyen d'agents chimiques de déchloration ou de charbon actif en grains. Étant donné que l'OI enlève l'alcalinité de l'eau, elle abaisse le pH de l'eau produite et accroît sa corrosivité. Par conséquent, il faut ajuster le pH et l'alcalinité de l'eau produite pour éviter des problèmes de corrosion dans le réseau de distribution tels que le lessivage du plomb et du cuivre (Schock et Lytle, 2011).
7.1.6 Autres techniques - adsorbants inorganiques/résines échangeuses d'ions
De nombreuses études se sont penchées sur l'utilisation d'adsorbants inorganiques naturels et synthétiques pour l'enlèvement du strontium des déchets liquides générés par les centrales nucléaires, ou de l'eau souterraine contaminée par des déchets nucléaires. Ces études ont considéré ces matériaux inorganiques comme des adsorbants, bien que le mécanisme d'enlèvement du strontium soit principalement considéré comme un processus d'échange d'ions. Malgré l'observation d'une forte capacité d'échange et d'une sélectivité élevée pour le strontium (Bortun et coll., 1997; Marinin et Brown, 2000; Kulyukhin et coll., 2005; El- Kamash, 2008; Sato et coll., 2011; Ivanets et coll., 2014), ces adsorbants inorganiques/résines échangeuses d'ions ont semblé être moins efficaces comparativement aux résines échangeuses de cations régénérables conventionnelles, et il est présumé qu'elles sont plus coûteuses (Marinin et Brown, 2000; Najm, 2016). Il convient de noter que plusieurs adsorbants inorganiques ont été préparés en laboratoire et qu'ils ne sont pas disponibles sur le marché. Des essais en laboratoire et pilotes sont recommandés pour les adsorbants les plus prometteurs (Najm, 2016).
7.1.6.1 Zéolites et adsorbants à base de phosphate
Des études ont été menées sur l'utilisation de zéolites et d'adsorbants à base de phosphate pour l'enlèvement du strontium présent dans l'eau. Les zéolites (des aluminosilicates comme la clinoptilolite et la mordénite) se retrouvent en abondance dans l'environnement, et ont largement été utilisées comme adsorbants et milieux d'échange d'ions dans les systèmes de traitement des eaux usées (Kulyukhin et coll., 2005; El-Rahman et coll., 2006; El-Kamash, 2008; Yusan et Erenturk, 2011; Ivanets et coll., 2014; Araissi et coll., 2016).
El-Kamash (2008) a fait rapport sur la possibilité qu'une zéolite synthétique A (sous forme de Na+) adsorbe le strontium présent dans des solutions aqueuses lors d'essais en batch et en colonne à lit fixe. Cette étude constituait un autre exemple de l'utilisation d'un substitut stable (du SrCl2∙6H2O dans de l'eau distillée) pour obtenir des renseignements utiles sur le traitement requis pour éliminer les isotopes radioactifs de courants aqueux et de déchets nucléaires. Des expériences en batch ont été effectuées pour déterminer la gamme de pH optimale pour l'enlèvement, laquelle se situait entre 6,0 et 8,0. Lors des expériences en colonne à lit fixe, l'effet de la concentration initiale de strontium (50, 100 et 150 mg/L), la hauteur du lit (3,0, 4,5 et 6,0 cm), ainsi que le débit d'alimentation (3,12 et 5,00 mL/min) ont été examinés. Ces concentrations initiales de strontium étaient beaucoup plus élevées que celles présentes dans les usines de traitement de l'eau. Globalement, le taux d'enlèvement du strontium se situait entre 64,5 % et 86,4 %. Le taux d'enlèvement le plus élevé (86,4 %) a été obtenu avec une concentration initiale de strontium de 100 mg/L, dans un lit de 6,0 cm de profondeur, à un débit d'alimentation de 3,12 mL/min [l'équivalent d'un temps de contact en fût vide (TCFV) de 1,5 min]. De façon générale, les taux d'enlèvement élevés ont été observés à des débits d'alimentation plus faibles et dans des lits plus profonds, ce qui laisse entendre des temps de contact plus longs (El-Kamash, 2008). De même, Sato et coll. (2011) et Araissi et coll. (2016) ont indiqué que la zéolite synthétique « 4A » était une matière échangeuse d'ions efficace pour l'enlèvement du strontium et dubaryum de solutions aqueuses. Une solution d'essai a été préparée : du SrCl2 (comme substitut radioactif) a été dissous dans de l'eau du robinet en vue d'obtenir une concentration cible variant entre 40 µg/L et 50 µg/L (Sato et coll., 2011). La zéolite A4 (capacité d'échange cationique de 5,5 meq/g) a été ajoutée à la solution d'essai à une concentration allant de 0,001 % à 1,0 % (p/v), puis la solution a été agitée pendant 30 min. On a constaté que les taux d'enlèvement du strontium dépassaient 90 % lorsque la zéolite A4 était ajoutée à une concentration d'au moins 0,01 % et que le pH se situait entre 5,8 et 8,6. Étant donné que des essais en colonne n'ont pas été effectués, l'efficacité de ce matériau n'a pu être véritablement évaluée (Sato et coll., 2011).
Kulyukhin et coll. (2005) et Ivanets et coll. (2014) se sont penchés sur l'enlèvement du strontium de l'eau réalisé au moyen de plusieurs adsorbants synthétiques de phosphate de magnésium et de calcium. Ivanets et coll. (2014) ont constaté que l'hydrogénophosphate de calcium, l'hydroxyapatite et l'hydrogénophosphate de magnésium pouvaient adsorber le strontium à des concentrations de 10,9 mg/g, 25,7 mg/g et 280,0 mg/g, respectivement. Lesessais ont été effectués avec un substitut stable [le Sr(NO3)2] présentant des concentrations qui variaient entre 10 mg/L et 5 000 mg/L. Les différents mécanismes d'interaction entre les ions de strontium et les adsorbants inorganiques étudiés ont expliqué les différences de rendement des adsorbants (Ivanets et coll., 2014).
7.1.6.2 Titanosilicates
Bortun et coll. (1997) ont étudié en profondeur divers phosphates et silicates métalliques polyvalents inorganiques synthétiques aux fins de l'enlèvement du strontium. Lors d'expériences en batch, deuxtitanosilicates de sodium (Na2Ti2SiO7.2H2O et Na2TiSi2O7.2H2O) et un titanate de sodium (Na4Ti9O20) affichaient une forte affinité pour le strontium. Les expériences ont été menées avec une concentration de strontium [sous forme de SrCl2] de 87,6 mg/L, avec et sans la présence d'ions concurrents (sodium et calcium). Les taux d'absorption maximaux du strontium de 2,0-2,5 meq de Sr/g pour les deux titanosilicates de sodium, et de 2,0 meq de Sr/g pour le titanate de sodium, ont été observés à des pH variant entre 5,5 et 8,0 et entre 6,5 et 7,5, respectivement. Alors que les ions de calcium étaient les concurrents principaux pour l'enlèvement sélectif du strontium, les ions de sodium n'ont montré aucune influence (Bortun et coll., 1997). De même, Marinin et Brown (2000) ont indiqué que parmi plusieurs matériaux adsorbants inorganiques testés, le titanosilicate de sodium synthétique et le titanate de sodium présentaient des coefficients de distribution élevés pour le strontium, mais une faible sélectivité.
Les deux formes de titanosilicate cristallin (CSTs) (en poudre et en granules) ont démontré la capacité d'enlever le strontium et le césium naturels des eaux usées à des valeurs de pH neutres et en présence d'autres ions concurrents (Bostick et coll., 1997; Spencer et coll., 2000). Lors d'essais en colonne en laboratoire (Bostick et coll., 1997) utilisant l'IONSIV® IE-911 sous forme d'hydrogène, une percée de strontium de 1,0 % s'est produite à 14 000 VL et une percée de 15,0 % est survenue à 120 000 VL après 10 mois de fonctionnement de la colonne. Les concentrations initiales étaient de 0,1 mg/L pour le strontium, de 45,0 mg/L pour le calcium, de 18,0 mg/L pour le sodium et de 9,0 mg/L pour le magnésium, et le pH variait entre 7,0 et 8,0. Tous les autres cations ont obtenu une fuite de 50 % en dessous de 1 300 VL. À titre comparatif, une zéolite à l'essai a éliminé le strontium de manière moins efficace, une percée de 1,0 % ayant été observée à 3 000 VL et une percée de 50,0 % étant survenue à 15 000 VL (Bostick et coll., 1997).
7.2 Réseau de distribution
La tuyauterie du réseau de distribution d'eau est vulnérable à la corrosion et à l'accumulation de dépôts de calcaire sur l'intérieur de la surface des conduites. Les produits de corrosion et les incrustations de calcaire qui se forment dans les réseaux de distribution d'eau potable servent de puits réactifs aux ions de métaux comme le plomb, le cuivre, l'arsenic, ainsi que le vanadium, et il est raisonnable de supposer que les ions de strontium se concentrent également dans les produits de corrosion (Gerke et coll., 2013). Ces dépôts peuvent parfois se déloger à la suite de perturbations physiques/hydrauliques ou d'une instabilité chimique de l'eau, ce qui permet aux contaminants d'être mobilisés de nouveau dans l'eau et de créer des risques potentiels pour la santé (Ouvrard et coll., 2002; Dong et coll., 2003; Schock et Holm, 2003; Lytle et coll., 2004; Schock, 2005; Friedman et coll., 2010; Gerke et coll., 2013, 2014, 2016; Schock et coll., 2014).
La stabilité des conditions de la qualité de l'eau est un facteur important pour réduire au minimum l'accumulation et la libération de contaminants inorganiques traces dans les réseaux de distribution. Friedman et coll. (2010) ont relevé plusieurs paramètres clés liés à la qualité de l'eau qui doivent être contrôlés afin de maintenir la stabilité de l'eau pour les dépôts de matière inorganique, dont le pH, le potentiel d'oxydoréduction et la corrosion, et d'éviter le mélange non contrôlé des eaux de surface et souterraines.
On dispose de peu de renseignements sur l'accumulation de strontium dans les réseaux de distribution d'eau et sur les facteurs qui contribuent aux événements de rejet du strontium. Gerke et coll. (2014) ont évalué les mécanismes d'adsorption/désorption vers/depuis les produits de corrosion du fer à l'égard des désinfectants (chlore et chloramines) et des conditions d'écoulement de l'eau (écoulement continu et temps de séjour maximum) dans des réseaux modèles de distribution d'eau potable. Les produits de corrosion qui se sont formés dans des échantillons d'eau désinfectés au chlore et aux chloramines se composaient essentiellement d'oxyhydroxydes defer γ-FeOOH et, dans une moindre mesure, de α-FeOOH et de Fe3O4. Les produits de corrosion qui se sont formés dans des échantillons simulant un écoulement continu d'eau désinfectée au chlore et aux chloramines contenaient des concentrations de strontium de 22 mg/kg (0,002 % pds) et de 47 mg/kg (0,005 % pds), respectivement. En particulier, dans les échantillons simulant la durée de stagnation dans le réseau de distribution, les concentrations de strontium qu'affichaient les produits de corrosion étaient semblables et se sont élevées à 215 mg/kg (0,02 % pds) et 217 mg/kg (0,02 % pds) pour les échantillons d'eau désinfectés au chlore et aux chloramines, respectivement. Lorsque l'eau s'est remise à circuler, les concentrations de strontium dans les dépôts de calcaire sont descendues à 30 mg/kg (0,003 % pds) dans l'échantillon désinfecté au chlore et à 40 mg/kg (0,004 % pds) dans l'échantillon désinfecté aux chloramines. Les concentrations de strontium ainsi que les taux d'adsorption et de désorption ont différé légèrement selon les désinfectants utilisés. L'auteur a indiqué que les oxyhydroxydes de fer constituaient une phase importante de l'accumulation du strontium dans les eaux désinfectées au chlore et aux chloramines (Gerke et coll., 2014). De même, Gerke et coll. (2013) ont fait état de concentrations moyennes de strontium de 3 à 54 mg/kg (jusqu'à 0,005 % pds) dans la couche de surface de produits de corrosion du fer recueillis dans quatre réseaux de distribution en exploitation (trois conduites maîtresses en fonte sans revêtement et un tuyau en fer galvanisé). L'eau potable traitée avait dans tous les cas une concentration de strontium inférieure à 0,5 mg/L. De plus, une concentration en strontium de 40,3 mg/kg (0,004 % pds) a été mesurée dans des particules prélevées d'un filtre à sédiments en polypropylène (installation résidentielle, quatre années de fonctionnement). La concentration en strontium détectée était à peu près la même que la concentration en strontium moyenne de 38,0 mg/kg (0,004 % pds) mesurée dans la couche de surface des produits de corrosion du fer présents dans le réseau de distribution. Il a été suggéré que le strontium lié aux particules s'était détaché de la surface des tuyaux et avait été transporté jusqu'à la résidence (Gerke et coll., 2013).
Des études ont également observé que le strontium était adsorbé et incorporé dans des précipités de CaCO3 et dans des dépôts de manganèse accumulés dans les réseaux de distribution (Gerke et coll., 2014; 2016). Gerke et coll. (2016) ont constaté que le fer, le chrome et le strontium s'étaient accumulés dans les dépôts de manganèse qui se formaient dans les tuyaux de plomb et les raccords en laiton de deux réseaux de distribution d'eau. L'auteur a suggéré que la déstabilisation des dépôts de manganèse pouvait accroître la concentration de métaux aux robinets des consommateurs (Gerke et coll., 2016). Des dépôts de calcaire provenant de matériaux de fabrication de canalisations des réseaux de distribution (polyéthylène et fonte) ont été prélevés dans 16 réseaux de distribution d'eau potable en Finlande, dans le cadre d'un programme de nettoyage des conduites maîtresses (Zaheus et coll., 2001). Ce programme comportait le nettoyage des conduites maîtresses en 1996, le prélèvement d'échantillons, puis une évaluation des changements après un an. Les concentrations moyennes de strontium, de fer et de calcium mesurées dans les échantillons de dépôts prélevés en 1996 étaient de 85 mg/kg (0,008 % pds), 18 % (par poids) et 3,0 % (par poids), respectivement. Après un an, des tendances à l'accroissement des concentrations de chacun des métaux ont été observées. La concentration moyenne en strontium est montée à 253 mg/kg (0,02 % pds), et les concentrations en fer et en calcium se sont élevées à 31 % et 5,4 %, respectivement, dans les dépôts nouvellement formés. Cependant, l'étude avait été menée à l'origine pour évaluer la croissance microbienne dans les réseaux de distribution, et aucune conclusion n'a été tirée au sujet de l'accumulation de matières inorganiques dans les dépôts (Zaheus et coll., 2001).
Les résultats de l'étude indiquent une accumulation de strontium négligeable dans les réseaux de distribution. Cependant, l'accumulation pourrait être plus importante en cas de concentration plus élevée (p. ex. proche de la CMA ou supérieure à celle-ci).
7.3 Échelle résidentielle
Dans les cas où l'on souhaite éliminer le strontium à l'échelle résidentielle, par exemple lorsque l'eau potable d'une résidence provient d'un puits privé, un dispositif de traitement résidentiel peut être employé pour abaisser les concentrations de strontium dans l'eau potable. Avant d'installer un appareil de traitement, il faut faire analyser l'eau pour en établir la chimie générale et vérifier la présence de strontium dans la source d'approvisionnement en eau, ainsi que sa concentration. L'eau qui entre dans le dispositif de traitement et l'eau traitée doivent être analysées régulièrement par un laboratoire accrédité pour vérifier l'efficacité du dispositif. Comme les dispositifs de traitement perdent leur capacité d'enlèvement avec l'usage et le temps, ils doivent faire l'objet d'un entretien et être remplacés à l'occasion. Les consommateurs doivent vérifier la durée de vie prévue des composantes de leur dispositif de traitement selon les recommandations du fabricant, et veiller à leur entretien au besoin.
Santé Canada ne recommande aucune marque particulière de dispositif de traitement de l'eau potable, mais conseille fortement aux consommateurs d'utiliser des dispositifs dont la conformité aux normes pertinentes de NSF International (NSF) et de l'American National Standards Institute (ANSI) est certifiée par un organisme de certification agréé. Ces normes visent à préserver la qualité de l'eau potable en assurant la sûreté des matériaux et l'efficacité des produits qui entrent en contact avec l'eau potable. Les organismes de certification, qui doivent être accrédités par le Conseil canadien des normes (CCN), garantissent qu'un produit est conforme aux normes en vigueur. Au Canada, le CCN a accrédité les organismes suivants pour la certification de la conformité aux normes NSF/ANSI des matériaux et dispositifs de traitement de l'eau potable (CCN, 2019) :
- Groupe CSA (www.csagroup.org - disponible en anglais seulement);
- NSF International (www.nsf.org - disponible en anglais seulement);
- Water Quality Association (www.wqa.org - disponible en anglais seulement);
- UL LLC (www.ul.com - disponible en anglais seulement);
- Bureau de normalisation du Québec (www.bnq.qc.ca);
- International Association of Plumbing & Mechanical Officials (www.iapmo.org - disponible en anglais seulement).
Une liste à jour des organismes de certification accrédités peut être obtenue auprès du CCN (www.scc.ca/fr).
Bien qu'aucun dispositif de traitement résidentiel ne soit certifié pour enlever le strontium de l'eau potable, des dispositifs utilisant l'OI ou l'EI peuvent enlever le strontium de l'eau potable à l'échelle résidentielle. On recommande l'utilisation de dispositifs de traitement qui ont été certifiés conformes à la norme 58 de NSF/ANSI (Reverse Osmosis Drinking Water Treatment Systems, à la norme NSF/ANSI 44 (Cation exchange water softeners) ou à la norme NSF/ANSI 53 (Drinking Water Treatment Units - Health Effects). L'eau qui a été traitée par osmose inverse peut être corrosive pour l'intérieur des éléments de plomberie. Ces dispositifs devraient donc être installés uniquement au point d'utilisation. En outre, ces systèmes de traitement de l'eau potable sont conçus pour être installés uniquement au point d'utilisation, car il faut de grandes quantités d'eau pour obtenir le volume requis d'eau traitée, ce qui n'est généralement pas pratique si on les installe au point d'entrée de l'eau d'une résidence. En outre, un prétraitement peut être nécessaire pour diminuer l'encrassement et prolonger la durée de vie de la membrane d'OI.
Dans le cadre du programme de vérification des technologies environnementales (ETV) de l'EPA, NSF International (NSF), un centre des réseaux de distribution de l'eau potable de l'ETV parrainé par l'EPA pour la vérification des technologies, a évalué quatre dispositifs commerciaux d'OI-PdU fabriqués par Watts Premier Inc. (NSF, 2006a; NSF, 2006b), EcoWater Systems, Inc. (NSF, 2005a) et Kinetico, Inc. (NSF, 2005b). Les dispositifs ont été confrontés à des contaminants individuels ou combinés, notamment des produits chimiques organiques et inorganiques et des microorganismes.
Le système d'OI Watts Premier M-2400 pour PdE monté sur patins était équipéd'une cartouche à membrane d'OI de 4 po × 40 po (d'une superficie de 82 pi2 [7,6 m2]), d'un filtre à charbon actif ou à sédiment prémembrane, d'un filtre à charbon actif post-membrane optionnel, et d'un réservoir optionnel pour l'eau produite. Le strontium naturel était l'un des 17 produits chimiques et microorganismes problématiques testés. Contrairement aux autres produits chimiques et microorganismes problématiques, le strontium, le césium et le cadmium ont été combinés aux fins de l'essai avec les échantillons de perméat et d'influent prélevés au début et à la fin de l'opération de 30 minutes. Les mesures des triplicats d'influent et d'eau traitée ont indiqué que les concentrations de strontium étaient tombées de 990 à 2 µg/L, soit l'équivalent d'un taux d'enlèvement > 99 % (NSF, 2006a).
Le dispositif d'OI Watts Premier WP-4V pour PdU était composé d'une membrane d'OI, d'un filtre à sédiments (pour l'enlèvement des matières particulaires), d'un filtre à charbon préactivé (pour l'enlèvement du chlore), d'un filtre à charbon postactivé, et d'un réservoir de stockage de 3 gallons. En ce qui concerne le strontium et les trois autres produits chimiques inorganiques, l'essai individuel a été mené avec uniquement la membrane d'OI en place. Une fois de plus, les analyses chimiques ont indiqué un enlèvement quasi complet du strontium, ses concentrations ayant été réduites de 920 à 1 µg/L (NSF, 2006b).
L'unité d'OI EcoWater Systems ERO-R450E pour PdU était également équipée d'une membrane d'OI, de filtres à charbon pré- et postactivés, et d'un réservoir de stockage de 3,1 gallons. Avant l'essai, la membrane d'OI a été mise en condition de fonctionnement avec de l'eau pendant sept jours. À l'instar du dispositif Watts Premier WP-4V pour PdU, le dispositif ERO-R450E pour PdU a été testé avec seulement la membrane d'OI en place ainsi qu'avec une seule substance chimique inorganique problématique. Un enlèvement du strontium de plus de 96 % a été observé, et les concentrations ont été réduites d'une moyenne de 960 µg/L à une moyenne de 33 µg/L (NSF, 2005a).
Le dispositif d'OI Pall/Kinetico PurefectaMC pour PdU était composé d'une membrane d'OI, d'un filtre à charbon préactivé ou à sédiments, d'un filtre biologique à bactéries/virus Pall, et d'un réservoir sous pression à parois souples de 3 gallons pour le stockage du perméat. Après avoir été mis en condition de fonctionnement pendant sept jours, le dispositif équipé uniquement de la membrane d'OI a été testé avec un seul produit chimique problématique pendant une journée. Un enlèvement quasi complet (99 %) a été observé; les concentrations de strontium ont été réduites de 850 à 2 µg/L (NSF, 2005b).
Plusieurs systèmes d'adoucissement par EI pour PdE, sans description des composants des systèmes ni des conditions de fonctionnement, ont permis d'obtenir un enlèvement variant de 96,3 % à 100 % pour le traitement de concentrations de strontium variant de 0,27 à 8,22 mg/L (O'Donnell et Lytle, 2014). Les particuliers qui possèdent un puits privé doivent être conscients que l'utilisation d'adoucisseurs par échange d'ions sous forme de sodium peut entraîner une quantité non souhaitée de sodium dans l'eau traitée. La contribution dans l'eau du sodium provenant d'un adoucisseur d'eau variera en fonction du taux de dureté de l'eau.
8.0 Cinétique et métabolisme
8.1 Absorption
Lorsqu'elles sont ingérées, les formes de strontium solubles ou présentes dans les aliments sont rapidement absorbées par l'estomac et l'intestin grêle, avec un pic du taux d'absorption 1 à 2 heures après l'ingestion (Skoryna, 1981; Leeuwenkamp et coll., 1990). Un taux moyen d'absorption orale de 22-25 % a été signalé, qui variait principalement selon la dose et l'âge du sujet, mais aucune différence majeure entre les sexes et les espèces n'a été relevée (Kahn et coll., 1969; Kostial et coll., 1969; CIPR, 1993; Sips et coll., 1996; Apostoaei, 2002; Li et coll., 2006). À faibles doses, l'absorption est proportionnelle à la dose orale; cependant, cette proportion diminue à mesure que les doses augmentent ou lorsque l'ingestion a lieu avec des aliments ou du calcium (Skoryna, 1981; Sips et coll., 1996; Nielsen, 2004).
Chez les humains, les taux d'absorption observés étaient plus élevés pour l'eau potable (moyenne de 57 % et maximum de 97 %) que pour la laitue, le lait, les aliments pour bébé ou les solutions de calcium (moyennes de 27 à 45 %; Li et coll., 2006). Il a également été observé que les polysaccharides, les alginates et la pectine présents dans les aliments diminuaient l'absorption du strontium, comparativement à l'absorption de strontium administré dans de l'eau potable à 10 volontaires adultes (Höllriegl et coll., 2004). L'absorption de strontium est augmentée par un faible apport en calcium (augmentation de 20 % à 40 %) et par le jeûne (augmentation de 25 % à 55 %) (CIPR, 1993). Wellman et coll. (1966) ont démontré que le taux de rétention du strontium était plus élevé pour les nourrissons que pour les enfants de 6 à 9 ans, bien qu'aucun détail n'ait été donné sur la dose et la durée de l'exposition. Des variations (de -47 à 59 µg de strontium) du taux d'absorption (apport provenant du lait maternel moins l'excrétion fécale) ont été observées chez 12 nourrissons âgés de 6 à 8 jours (Harrison et coll., 1965).
Les jeunes rats absorbent une proportion plus élevée de strontium que les rats plus âgés, possiblement en raison d'une formation osseuse accrue (Kshirsagar, 1985; Apostoaei, 2002). L'absorption de 1 µCi de 85SrCl était plus élevée chez les rats âgés de 14 à 18 jours (95 % ± 0,4; n = 31 rats) que chez les rats âgés de 22 jours (74 % ± 2,4; n = 5 rats), ceux âgés de 6 à 8 semaines (25 % ± 1,0; n = 45 rats) et ceux âgés de 60 à 70 semaines (11 % ± 0,8; n = 24 rats) (Taylor et coll., 1962). Selon une autre étude, des rats âgés de 22 jours à qui on a administré diverses concentrations de calcium (0,1-2 %) et une concentration fixe de strontium (0,04 µCi/g d'aliments) absorbaient plus de strontium que des rats âgés de 200 jours (Palmer et Thompson, 1964). Les jeunes rats commencent à absorber du calcium de manière préférentielle (concurrence avec le strontium) lorsqu'ils atteignent l'âge d'un an environ (Kshirsagar, 1985).
Une baisse des concentrations de calcium dans le plasma stimule la sécrétion de parathormones, ce qui se traduit par une augmentation de l'absorption du strontium, des taux de remodelage osseux, et du nombre de transporteurs du calcium dans l'intestin (MacDonald et coll., 1951; Shorr et Carter, 1952; Eisenberg et Gordan, 1961; Sips et coll., 1996; Sairanen et coll., 2000; Apostoaei, 2002; Llinas et coll., 2006). Le strontium rivalise avec le calcium pour l'absorption dans le duodénum, bien que le strontium affiche une affinité inférieure pour les transporteurs intestinaux (Kahn et coll., 1969; Schrooten et coll., 1999). Les rats à qui on a administré des concentrations plus basses de calcium (0,1 %) présentaient des taux de rétention osseuse du90Sr plus élevés que ceux des rats ayant reçu des concentrations plus fortes de calcium (2 %) (Palmer et Thompson, 1964). Lors d'expériences ex vivo menées sur des tissus duodénaux, le calcium réduisait plus l'absorption du strontium que le strontium ne réduisait l'absorption du calcium (Hendrix et coll., 1963). D'autres facteurs peuvent également influer sur les taux d'absorption du strontium, comme le polymorphisme de la vitamine D, les concentrations de vitamine D et l'apport en magnésium (Hendrix et coll., 1963; Vezzoli et coll., 2002).
L'administration d'une dose orale unique de 500 mg de gluconate de strontium à un patient humain a entraîné une absorption rapide avec un pic de concentration sérique (Cmax) à 4 heures (Skoryna, 1981). L'absorption du strontium est devenue biphasique à la suite de l'administration de 2,5 mmol de strontium (667 mg de SrCl2) à 6 hommes en bonne santé (Leeuwenkamp et coll., 1990). Le Cmax moyen était de 3,55 µg/mL et la surface sous la courbe était de 9 138 µg mL/min (Leeuwenkamp et coll., 1990). Dans une autre étude portant sur 16 hommes ayant reçu une dose orale de 2,5 à 5,0 mmol de SrCl2, la concentration plasmatique maximale du strontium a été atteinte après 2,9 h (Sips et coll., 1996). Après une exposition orale unique à 2 g de SrR (contenant 680 mg de strontium), le Cmax était de 6 mg/L et le volume de distribution du strontium était de 64 L (EMA, 2005). Des patients ayant reçu quotidiennement, pendant au moins 3 mois, entre 183 et 274 mg de strontium provenant du gluconate de strontium affichaient une concentration sérique moyenne de 5,13 mg/L (Skoryna, 1981). La concentration plasmatique maximale était atteinte 3 à 6 heures après l'administration d'une dose orale unique de SrR (2 g) (EMA, 2005). Le SrR n'est pas présent dans l'environnement, mais il se dissocie in vivo en deux atomes Sr2+ et une fraction organique (acide ranélique) (Meunier et coll., 2004; EMA, 2013; Querido et coll., 2016).
Des rats à capuchon exposés à des concentrations de 0,09 %, de 0,19 % ou de 0,34 % de chlorure de strontium dans l'eau potable affichaient des concentrations sériques moyennes respectives de strontium de 1,92 mg/L, de 3,8 mg/L et de 8,68 mg/L après 3 mois (Skoryna, 1981). L'absorption diminuait après 2 ans. Il a été démontré que des rats en lactation absorbaient le double de la quantité de strontium absorbée par des rats qui n'étaient pas en lactation (Kostial et coll., 1969).
8.2 Distribution
À l'instar du calcium, le strontium parvient à la plupart des organes du corps et peut former des complexes avec le carbonate, le phosphate, le citrate, le lactate et l'hydroxyapatite, ce qui mène à sa distribution rapide et à son accumulation dans les os et les dents; 99 % de sa charge corporelle se situe dans le squelette (Storey, 1968; El et Rousselet, 1981; Humphrey et coll., 2008). Après les os, les tissus dans lesquels figurent les concentrations les plus élevées de strontium sont les tissus rénaux, pulmonaires, surrénaliens, cérébraux, cardiaques, musculaires et hépatiques chez l'animal, et les tissus musculaires, adipeux et cutanés chez l'humain (Schroeder et coll., 1972; Skoryna, 1981). Des rats à capuchon exposés à des taux de 0,09 %, de 0,19 % ou de 0,34 % de chlorure de strontium dans l'eau potable présentaient des rapports respectifs de strontium/calcium dans les os de 1/50, de 1/27 et de 1/12 (Skoryna, 1981). À l'intérieur des cellules, le strontium est principalement lié à des protéines liant le calcium (Ca2+ATPases, antiport Na+/Ca+, etc.) et les concentrations les plus élevées s'observent dans les mitochondries, dans le réticulum sarcoplasmique, dans les lysosomes et dans les microsomes (Skoryna, 1981). Il se distribue dans les os de façon hétérogène et remplace le calcium dans les cristaux d'hydroxyapatite par échange de surface ou substitution ionique (Skoryna, 1981).
Avec le temps, la concentration de strontium dans les os peut varier selon les personnes, selon différents facteurs (exposition, absorption, âge, alimentation, prise de médicaments, sexe, site squelettique, moment de la journée, etc.). On ne sait pas si la concentration de strontium dans les os plafonne avec le temps chez l'humain (Bärenholdt et coll., 2009; Doublier et coll., 2011; Moise et coll., 2012).,Pendant la période très active d'essais nucléaires de 1959-1968 au Royaume-Uni, il a été constaté que le rapport strontium 90/calcium dans les os augmentait plus rapidement chez les bébés de moins d'un an que chez les enfants plus âgés et les adultes (Papworth et Vennart, 1984). Les auteurs ont estimé que 10 % du strontium alimentaire était intégré aux os des nouveau-nés. Cette proportion descendait à 4,5 % à 5 ans, puis montait à 9,5 % à 15 ans avant de tomber à 4,5 %, ce qui correspond à la moyenne chez l'adulte. Chez les adultes, on a constaté que les concentrations de strontium dans les os augmentaient avec l'âge, et qu'elles étaient plus élevées dans le tissu trabéculaire que dans les tissus osseux corticaux et ostéoïdiens (Bärenholdt et coll., 2009; Roschger et coll., 2010; Moise et coll., 2012).
Parmi 32 femmes atteintes d'ostéoporose, les concentrations les plus élevées de strontium dans les os (moyenne de 1,1 %) ont été observées chez celles ayant reçu le supplément de SrR pendant la plus longue période (7-8 ans). La capture osseuse du strontium variait fortement selon les patientes (Bärenholdt et coll., 2009). Dans les fémurs de 14 femmes ménopausées, le strontium avait tendance à se répartir entre les matrices osseuses et les lignes cémentantes, et était associé de façon significative à la concentration de calcium et au degré de minéralisation (Pemmer et coll., 2013). Le volume de distribution du strontium était de 71 L sur une période de 20 jours pour 10 hommes volontaires ayant reçu une injection de 5 mmol de gluconate de strontium par voie intraveineuse (Moroas et coll., 1991).
Le passage transplacentaire est probable, étant donné que la charge fœtale de strontium s'est avérée plus élevée chez des rats ayant reçu une injection de strontium au cours des périodes de gestation à ossification élevée (Rönnbäck 1986). Le strontium est transféré dans le lait maternel, et des ratons F1 présentaient une concentration plasmatique de strontium deux fois plus élevée après l'allaitement comparativement à leurs mères (EMA, 2014). D'ailleurs, de fortes doses orales de SrR données à des rats (750 mg/kg p.c. par jour) se sont traduites par un rapport lait maternel/plasma de 73 et par des concentrations plasmatiques élevées chez les nouveau-nés (Laboratoires Servier, 2016).
8.3 Métabolisme
Le strontium n'est pas métabolisé, mais il interagit avec les protéines et les anions inorganiques, tels que le carbonate et le citrate (EMA, 2005).
8.4 Excrétion
Le strontium est principalement éliminé dans l'urine et les selles chez l'humain et chez l'animal (Harrison et coll., 1965; Skoryna, 1981; Schrooten et coll., 1999; Cohen-Sohal, 2002; EMA, 2005). Une étude menée auprès de 25 nourrissons a constaté que le strontium était surtout éliminé dans les selles et que l'élimination augmentait de façon linéaire avec l'apport en strontium (Kahn et coll., 1969). L'élimination corporelle du strontium est lente, et il a été démontré qu'il subissait une réabsorption dans les tubes rénaux (ATSDR, 2004). Après l'exposition, la phase rapide d'élimination est suivie d'une phase lente reflétant l'élimination lente du squelette (OMS, 2010). Les mécanismes responsables de l'élimination du strontium des os sont l'élimination des réserves osseuses échangeables, le remplacement par le calcium et l'élimination par les ostéoclastes (Cohen-Sohal, 2002).
Pour 6 hommes en bonne santé ayant reçu 667 mg de SrCl2 6H2O par voie orale, les demi-vies d'élimination plasmatique étaient de 5,2 heures pour la première phase et de 47,3 heures pour la deuxième phase, et la clairance était de 100 mL/min/1,74 m2 (Leeuwenkamp et coll., 1990). Dans cette étude, il a été démontré que le strontium était excrété dans l'urine de manière plus efficace que le calcium. Chez 10 hommes volontaires ayant reçu une injection de 5 mmol de gluconate de strontium par voie intraveineuse, on a observé une clairance totale de 13,5 L par jour, une clairance rénale de 7,8 L par jour, ainsi qu'une demi-vie de 5,4 jours sur une période de 20 jours (Moroas et coll., 1991). Les concentrations plasmatiques de strontium avoisinaient la limite de détection après 20 jours. Dans une autre étude, la clairance moyenne du strontium était de 4 L par jour (intervalle : 0,7 à 9,2 L) pour des enfants de 4 à 14 ans (n = 12) et de 9,7 L par jour (intervalle : 7,4 à 12,7 L) pour des adultes de 35 à 63 ans ayant reçu une dose de 5 mg de strontium par voie orale (Sutton et coll., 1971). Des humains exposés à du strontium radioactif pendant des décennies en Russie présentaient des demi-vies corporelles (clairance du strontium) de 16 ans pour les femmes et de 28 ans pour les hommes (Tolstykh et coll., 2014). En ce qui concerne la demi-vie plus courte chez les femmes, on a avancé l'hypothèse qu'elle reflétait les plus grands taux de perte osseuse chez les personnes ménopausées. Après une exposition à une dose orale unique de 2 g de SrR (renfermant 680 mg de strontium), les clairances plasmatique et rénale ont été estimées respectivement à 17,3 L et à 10,1 L par jour, et la demi-vie a été estimée à 50 à 60 heures (EMA, 2005; Laboratoires Servier, 2016). Chez des rats Sprague-Dawley ayant reçu une injection de 20 µCi de SrCl2 par voie intrapéritonéale, la demi-vie du strontium était de 113,7 jours (Cohn et Gusmano, 1967). Chez les rats et les singes, des demi-vies de 78 jours et de 23 jours et des volumes de distribution de 71 L et de 15 L ont été observés après l'administration respective par voie orale de doses de 75-1 150 mg de SrR/kg p.c. et de 9-940 mg de SrR/kg p.c. (EMA, 2005).
8.5 Modèles pharmacocinétiques à base physiologique
La Commission internationale de protection radiologique (CIPR, 1993) a élaboré un modèle compartimental de la cinétique des éléments alcalino-terreux, dont le strontium radioactif, chez l'humain, qui s'applique aux nourrissons, aux enfants, aux adolescents et aux adultes (Shagina et coll., 2015a, b, c). Cependant, ce modèle met l'accent sur la dosimétrie humaine et les coefficients de dose en fonction de l'âge, et ne caractérise pas la variabilité au sein des groupes d'âge. Le modèle a démontré des variations d'un groupe d'âge à un autre; il a estimé que les nourrissons absorbaient 60 % du strontium ingéré et que cette proportion descendait à 30 % à l'âge adulte.
Un modèle pharmacocinétique à base physiologique a été mis au point pour estimer l'exposition osseuse de rats femelles Sprague-Dawley adultes ovariectomisées ayant reçu du SrR (250 mg/kg par jour) pendant 6 mois (Pertinez et coll., 2013). Cependant, la forme de strontium et le modèle animal ostéoporotique ne sont pas représentatifs de l'exposition environnementale au strontium de la population générale.
9.0 Effets sur la santé
9.1 Effets sur la santé humaine
En résumé, il a été démontré que la supplémentation en strontium était bénéfique pour les os; par contre, le rachitisme, l'ostéomalacie et des effets sans gravité (p. ex. des dérangements gastrointestinaux) ont été associés à une exposition environnementale. Des effets secondaires graves, comme des effets cardiovasculaires, ont été associés à une supplémentation clinique de SrR à des participants atteints d'ostéoporose (tous les patients ont également reçu des suppléments de vitamine D et de calcium). L'importance des effets signalés sur la santé humaine est limitée quant à l'évaluation des risques associés au strontium dans l'eau potable. Il est difficile d'utiliser la base de données épidémiologiques en vue du calcul d'un PDD en raison de la qualité médiocre de la base de données sur l'environnement, du manque de cohérence entre les essais cliniques, de la conception des essais mettant l'accent sur les effets bénéfiques pour les os, de la faible amplitude des effets secondaires et de la faible pertinence des essais médicamenteux dans le contexte de l'eau potable (en raison des différences dans les sous-populations étudiées). En outre, l'augmentation du risque d'effets cardiovasculaires n'a été observée que pour des patients atteints d'ostéoporose et ayant des antécédents de maladies cardiovasculaires. De plus, les taux d'effets cardiovasculaires étaient similaires à ceux observés dans la population générale; ils n'ont pas été observés dans des études individuelles ou dans d'autres essais cliniques à grande échelle, et aucun mécanisme d'action n'a été suggéré.
9.1.1 Effets bénéfiques
Le strontium est vraisemblablement un élément trace non essentiel (son rôle dans le renouvellement des cellules osseuses n'est pas entièrement compris). La prise de suppléments de sels de strontium (SrR, citrate de strontium, etc.) s'est avérée bénéfique pour les os de modèles animaux d'ostéoporose à des doses de 600 mg/kg p.c. par jour (Bain et coll., 2009; Zhao et coll., 2015). De nombreux essais cliniques à double insu ont également démontré que la densité osseuse de patients atteints d'ostéoporose s'améliorait après la prise de suppléments quotidiens de 680-1 360 mg de strontium provenant du SrR (Roschger et coll., 2010; Doublier et coll., 2011; Genuis et Bouchard, 2012; Reginster et coll., 2010, 2014, 2015). La concentration de strontium dans l'eau potable a été associée négativement à l'apparition de caries; cependant, la nature de ce lien n'a pas encore été définie (Athanassouli et coll., 1983; Curzon, 1985; Li et coll., 2013; Lippert et Hara, 2013).
9.1.2 Exposition aiguë
Très peu d'études ont fait état de la toxicité aiguë du strontium. Des doses orales uniques pouvant aller jusqu'à 7,5 g de strontium (provenant de 11 g de SrR) ont été bien tolérées et n'ont pas provoqué de symptômes chez de jeunes hommes volontaires en bonne santé (Laboratoires Servier, 2016).
9.1.3 Exposition chronique
9.1.3.1 Toxicité squelettique
Malgré de très nombreuses preuves des effets sur les animaux, peu d'études épidémiologiques ont fait état des effets de l'exposition environnementale du strontium sur les humains. L'ATSDR (2004) a signalé que les effets osseux pouvaient se produire lorsque les enfants étaient exposés à des concentrations élevées (les doses n'ont pas été spécifiées) de strontium et qu'ils présentaient des carences en vitamine D et en calcium.
En Turquie, il a été constaté que les enfants âgés de 6 à 60 mois (n = 2 140) vivant dans une région où le sol renferme une concentration élevée de strontium (> 350 ppm) et où les céréales forment la base principale de l'alimentation présentaient plus fréquemment un ou plusieurs symptômes de rachitisme (c.-à-d. défaut de minéralisation de l'ostéoïde chez l'enfant, caractérisé par des bourrelets des poignets, des malformations osseuses, un craniotabès [ramollissement des os du crâne], un chapelet costal [expansion des extrémités des côtes antérieures aux articulations costo-chondrales], une taille et un poids anormaux) comparativement aux enfants vivant dans des régions à faible concentration de strontium (< 350 ppm) (Ozgür et coll., 1996). Bien que les auteurs ne se soient pas penchés sur la quantité de minéraux ostéoformateurs dans l'alimentation locale, ils ont constaté que les nourrissons allaités bénéficiaient d'un effet protecteur.
L'analyse des os de 100 patients sous dialyse provenant de divers pays a révélé que la concentration de strontium était supérieure chez les patients atteints d'ostéomalacie (trouble de minéralisation des os chez l'adulte équivalant au rachitisme chez l'enfant) comparativement à ceux atteints d'ostéodystrophie rénale (D'Haese et coll., 2000). Néanmoins, les auteurs ont indiqué que le rôle joué par le strontium dans l'ostéomalacie restait à définir, que les patients atteints de dysfonctionnements rénaux ne représentaient pas nécessairement la population canadienne en général, et que les os des patients atteints d'ostéomalacie affichaient également des concentrations élevées d'aluminium.
9.1.3.2 Toxicité cardiovasculaire et réactions d'hypersensibilité
Les preuves relatives aux risques d'effets cardiovasculaires à la suite d'une exposition environnementale au strontium sont limitées, et les résultats n'ont démontré aucun effet indésirable. Une étude menée auprès de personnes de plus de 45 ans résidant au Texas a révélé l'existence d'une corrélation inverse entre la concentration du strontium dans l'eau potable (0,4 à 37,8 mg/L) et dans l'urine, et la mortalité cardiovasculaire (c.-à-d. que le strontium aurait un effet protecteur) (Dawson et coll., 1978). Cependant, l'exposition concomitante au calcium, au magnésium, au lithium et au silicone limite l'interprétation que l'on peut faire de l'association observée. On a démontré une association entre l'utilisation de doses thérapeutiques de strontium (680 mg de strontium par jour, donné sous forme de SrR) pour le traitement de l'ostéoporose et l'apparition d'effets cardiovasculaires nocifs chez des patients de populations particulières, tels que ceux ayant des antécédents de cardiopathie ou de trouble circulatoire; toutefois, aucune donnée n'a permis d'associer des effets cardiovasculaires à une exposition au strontium en deçà des doses thérapeutiques.
De fortes doses orales de strontium (680-1 360 mg par jour provenant du SrR) ont été associées à de graves effets secondaires, comme des effets cardiovasculaires, dans certains essais cliniques portant sur l'ostéoporose. Un risque légèrement plus élevé de thrombo-embolie veineuse (TEV) (risque relatif [RR] = 1,6; intervalle de confiance [IC] à 95 % : 1,0; 2,0) a été observé chez les utilisateurs de SrR lorsqu'on combine deux vastes études européennes à double insu et contrôlées par placebo (une étude de l'intervention thérapeutique à l'égard de l'ostéoporose touchant la colonne vertébrale [SOTI] et une étude du traitement de l'ostéoporose périphérique [TROPOS]). La mise en commun des études s'est traduite par un risque fortement accru (RR = 1,6; IC à 95 % = 1,07; 2,38) d'infarctus du myocarde pour les groupes prenant du SrR comparativement aux groupes prenant le placebo (EMA, 2014; Laboratoires Servier, 2016). Cependant, les taux étaient similaires à ceux observés dans la population générale et n'ont pas été observés par les études individuelles incluses dans le calcul du RR (Cianferotti et coll., 2013; Reginster et coll., 2014; Laboratoires Servier, 2016). De plus, aucun mécanisme d'action à l'origine de ces effets hypothétiques n'a été élucidé, et les patients atteints de TEV présentaient déjà divers facteurs de risque (âge, immobilité, antécédents médicaux, etc.; Reginster et coll., 2013).
Aucune différence n'a été observée dans les biomarqueurs de l'hémostase ni dans les indices de biochimie cardiovasculaire chez des femmes atteintes d'ostéoporose ayant reçu 2 g de SrR par jour (n = 40) pendant 12 mois, comparativement aux valeurs de base ou au groupe placebo (n = 40), et il n'y a eu aucun cas de TEV (Atteritano et coll., 2015). Cette situation a également été observée dans une étude menée par Ulger et coll. (2012), au cours de laquelle les paramètres hémorhéologiques (morphologie des érythrocytes et viscosité sanguine) n'avaient pas changé après 2 mois de traitement (2 g de SrR par jour) administré à 22 femmes atteintes d'ostéoporose. Une étude de cohortes menée dans un contexte de médecine générale en Angleterre a révélé que les patients (n = 10 865, moyenne de 73 ans, 91 % de femmes) prenant 2 g de SrR par jour ne présentaient pas de risque accru de TEV comparativement aux autres groupes de patients (Osborne et coll., 2010).
Un autre effet secondaire, rare mais grave, a été observé lors de la surveillance après la mise en marché du SrR (< 20 cas pour 570 000 patients-années d'exposition) : il s'agit d'un syndrome de réaction d'hypersensibilité grave caractérisé par une éruption cutanée d'origine médicamenteuse et par des symptômes d'éosinophilie et généralisés (DRESS); ce syndrome avait également été auparavant associé à l'administration d'autres médicaments (Meunier et coll., 2009; Cianferotti et coll., 2013). Cependant, une étude de cohortes menée en Angleterre (n = 10 865) n'a révélé aucun cas de DRESS chez des patients prenant 2 g de SrR par jour (Osborne et coll., 2010). L'absence d'un tel effet a été appuyée par une étude rétrospective menée auprès de femmes ménopausées traitées au SrR (n = 12 702) dans 7 pays d'Europe (Audran et coll., 2013). Une publication sur la pharmacovigilance et l'innocuité des médicaments en France a fait état d'effets similaires sur la santé (cardiovasculaires, digestifs, cutanés, etc.) signalés par des utilisateurs de SrR entre 2006 et 2009 (Jonville-Bera et Autret-Leca, 2011). Néanmoins, la causalité n'a pu être déterminée avec ce type de rapport, puisqu'il n'existait aucune comparaison avec les groupes témoins ou aucun taux de référence des effets sur la santé (association seulement, aucune information sur un risque potentiel).
Dans le cadre de trois autres études à double insu et contrôlées par placebo (prévention de la perte osseuse ménopausique précoce par l'administration de SrR [PREVOS], administration de strontium pour le traitement de l'ostéoporose [STRATOS] et essai de l'efficacité du SrR dans le traitement de l'arthrose du genou [SEKOIA]), entre 0,5 et 2 g de SrR par jour ont été administrés à des centaines de patients pendant 2 ans, dans environ 100 centres européens. Aucune différence en termes d'effets nocifs du traitement n'a été observée comparativement aux groupes placebos après 2 ans de traitement, et aucun cas de TEV ou de DRESS n'est survenu (Reginster et Meunier, 2003). Des doses allant jusqu'à 4 g de SrR par jour pendant 25 à 147 jours ont également été bien tolérées par des femmes ménopausées incluses dans les sous-groupes de sécurité de ces essais (Laboratoires Servier, 2016). En 2004, le SrR a été approuvé pour le traitement de l'ostéoporose pour les personnes âgées dans toute l'Union européenne. Cependant, son utilisation a été restreinte par la suite (EMA, 2014), car des études cliniques avec répartition aléatoire et contrôlées contre placebo, menées auprès d'environ 7 500 femmes ménopausées, ont révélé un risque accru d'infarctus du myocarde (1,7 %) comparativement aux témoins (1,1 %) (RR : 1,6; IC à 95 % : 1,07-2,38). L'analyse a également révélé un déséquilibre du nombre de troubles cardiaques graves (angine de poitrine, coronaropathie) chez les hommes atteints d'ostéoporose grave qui ont pris le médicament, comparativement à ceux qui ont pris le placebo (8,7 % comparativement à 4,6 %).
Aucun effet nocif n'a été observé après l'administration de suppléments contenant du strontium provenant du citrate de strontium (de 6 mois à 1 an), du gluconate de strontium (au moins 3 mois) ou du lactate de strontium (de 3 mois jusqu'à 4 ans) à des patients de quatre différentes études (Shorr et Carter, 1952; Skoryna, 1981; Kaats et coll., 2011; Michalek et coll., 2011). Les résultats de deux études danoises rétrospectives (Abrahamsen et coll., 2014; Svanstrom et coll., 2014) et d'une étude cas/témoins nichée de cohorte menée au Royaume-Uni (Cooper et coll., 2014) n'ont pas mis en évidence d'augmentation du risque d'effets cardiovasculaires pour les utilisateurs de SrR. Cependant, une analyse plus récente des données cliniques des essais à grande échelle SOTI (mené auprès de 1 649 femmes ménopausées âgées en moyenne de 70 ans) et TROPOS (mené auprès de 5 091 femmes ménopausées), dans lesquels le SrR a été administré en vue de réduire le risque de fractures vertébrales (SOTI) et non vertébrales (TROPOS), a trouvé que le SrR augmente de 2 % le risque absolu d'infarctus du myocarde et d'insuffisance cardiaque congestive (Bolland et Grey, 2016).
9.1.3.3 Toxicité gastrointestinale et autres effets
Selon quelques auteurs, l'administration de SrR a été bien tolérée dans de nombreux essais cliniques, la plupart des effets nocifs ayant semblé légers et transitoires (Kaufman et coll., 2013; Laboratoires Servier, 2016). Cependant, l'administration de 2 g de SrR par jour, en association avec du calcium et de la vitamine D, à des femmes atteintes d'ostéoporose de plus de 50 ans a été associée à une fréquence accrue de nausées, de diarrhées et de maux de tête en début de traitement lors d'essais à grande échelle (SOTI et TROPOS), mais aucune différence ne s'est maintenue avec le temps (Reginster et Meunier, 2003; Meunier et coll., 2004; Roux, 2007; Compston, 2014; Reginster et coll., 2014). Au cours de ces essais, la concentration de créatine kinase était légèrement élevée, mais demeurait dans les limites normales; un tel effet pourrait s'avérer préoccupant pour les personnes atteints d'un trouble du fonctionnement rénal, car une concentration élevée de créatine kinase peut indiquer une atteinte rénale.
9.1.4 Cancérogénicité
Quelques études épidémiologiques ont observé des associations entre l'exposition au strontium et le cancer, notamment le cancer du sein (Chen et coll., 2012), du côlon (Kikuchi et coll., 1999) et de l'estomac (Nakaji et coll., 2001). Cependant, ces études préliminaires ont été menées rétrospectivement, et on ne sait pas comment les covariables ont été intégrées à l'évaluation (Helicobacter pylori, régimes alimentaires en Asie, etc.). Étant donné la quantité très limitée de données sur les effets cancérogènes chez l'humain, il est impossible de déterminer le potentiel cancérogène du strontium pour les humains.
9.1.5 Toxicité pour le développement et la reproduction
Une étude rétrospective a comparé l'exposition au strontium provenant de l'eau potable, des cultures et du sol dans deux régions de la Chine, l'une présentant une prévalence élevée d'anomalies congénitales, comme un raccourcissement des membres, et l'autre présentant une prévalence faible de telles anomalies (Yu et coll., 2011). Les concentrations de strontium dans l'eau fluviale, l'eau des puits, les terres cultivées et le maïs étaient inversement associées aux taux d'anomalies congénitales (concentration de strontium plus élevée dans la région où la prévalence d'anomalies congénitales était faible). Une étude écologique n'a observé aucune association entre la concentration de strontium dans le sol et les anomalies du tube neural observées au cours des naissances survenues entre 2002 et 2004 dans la région de Luliang en Chine (Huang et coll., 2011). Une étude transversale fondée sur les données de 2011 à 2012 de la National Health and Nutrition Examination Survey des États-Unis (enquête menée auprès de 5 107 individus) a révélé que la probabilité de présenter de faibles niveaux de testostérone augmentait avec la concentration en strontium de l'urine (Xu et coll., 2015). Cependant, les auteurs ont affirmé que la nature transversale de l'étude ne leur permettait pas d'affirmer ou d'infirmer l'influence du strontium sur les taux de testostérone, et que des recherches supplémentaires étaient nécessaires pour évaluer la relation entre une exposition à long terme à des concentrations physiologiques de strontium dans l'urine et un faible taux de testostérone chez l'homme adulte.
9.2 Effets sur les animaux de laboratoire
De fortes doses de composés renfermant du Sr2+ dans l'eau potable, les aliments ou des suppléments ont été associées à des troubles osseux (rachitisme et ostéomalacie, minéralisation osseuse anormale et diminuée en plus d'une accumulation ostéoïde) dans des études animales (concentrations ≥ 0,3 -0,4 % dans l'alimentation, ou doses ≥ 525 mg/kg p.c. par jour, avec une dose sans effet nocif observé [NOAEL] de 425 mg/kg p.c. par jour pour la calcification osseuse). Bien que la dose indiquée dans la majorité des études s'est avérée faire référence au strontium ionique, de nombreuses études animales utilisant des sels de strontium ne précisent pas clairement si la dose indiquée fait référence au strontium ou à un complexe du strontium. La dose a donc été exprimée en utilisant les mêmes mots que les auteurs de ces études. Lorsque cela était possible, on a communiqué avec les auteurs d'études faisant état de données clés afin de confirmer que les doses avaient été correctement interprétées.
9.2.1 Toxicité aiguë
Les valeurs de la dose létale moyenne (DL50) par voie orale pour les souris sont de 1 800 mg de Sr(NO3)2/kg p.c. et de 2 700-2 900 mg de SrCl2/kg p.c. (ATSDR, 2004), tandis que lesvaleurs de la DL50 pour les rats sont > 2 000 mg de SrCO3 et de Sr(NO3)2/kg p.c. Des doses uniques de SrR allant jusqu'à 2 500 mg/kg p.c. administrées par voie orale à des rongeurs, à des chiens et à des singes n'ont montré aucune toxicité, à l'exception de vomissements chez des singes (EMA, 2005).
9.2.2 Exposition de courte durée et subchronique
9.2.2.1 Effets bénéfiques
Des animaux (des rats adultes, des souris de 21 jours et de 6 semaines, ainsi que des chèvres de 6 à 8 ans ovariectomisées) ayant reçu de faibles concentrations quotidiennes de strontium (0,27-0,3 % de strontium, donné sous forme de chlorure de Sr ou de phosphate de Sr, ou 68-612 mg de Sr/kg p.c., donné sous forme de SrR) dans des aliments ou de l'eau potable ont vu leurs paramètres squelettiques s'améliorer; par exemple, la densité minérale osseuse et les taux de formation osseuse trabéculaire du fémur et des vertèbres ont augmenté après 8 à 104 semaines (Marie et Hott, 1986; Grynpas et coll., 1996; Delannoy et coll., 2002; Li et coll., 2012). Plus particulièrement, des rats de 28 jours ayant reçu 168 mg de Sr/kg p.c. par jour (en plus de 77 mg de calcium/kg p.c. par jour, ce qui est considéré comme un apport faible en calcium) ont affiché, après 8 semaines, une augmentation de 17 % du volume osseux minéralisé ainsi que des surfaces ostéoïdes et ostéoblastiques, comparativement aux témoins qui ne recevaient aucun supplément de strontium (Grynpas et coll., 1996). Le taux d'apposition minérale, l'épaisseur ostéoïde et le délai de minéralisation étaient similaires d'un groupe à l'autre, ce qui appuie une absence d'effets nocifs pour les os.
9.2.2.2 Toxicité squelettique
Il a été démontré que de fortes doses de strontium entraînaient des anomalies du cartilage de conjugaison (surtout en raison de l'élargissement excessif de la zone hypertrophique) et empêchaient la calcification, ce qui entraînait une surproduction de tissu osseux ostéoïde non minéralisé. Des anomalies osseuses ont été observées à répétition chez de jeunes animaux de laboratoire (différentes souches de rats et de souris) des deux sexes ayant reçu différentes formes de strontium (dans l'eau potable, les aliments ou des suppléments) à des concentrations ≥ 0,3 % (équivalant à une concentration ≥ 525 mg/kg p.c. par jour). Par exemple, on a observé des cas de rachitisme, de diminution du poids corporel, d'inhibition de la minéralisation et de la croissance osseuse, de dos rond et de perturbation de l'activité de la phosphatase alcaline des os après avoir administré à de jeunes rats des deux sexes ≤ 1 % de strontium dans l'alimentation (renfermant entre 0,4 et 1,6 % de Ca2+) pour des périodes courtes à intermédiaires (de 3 semaines à 9 mois) (Storey, 1961; Johnson et coll., 1968; Kshirsagar, 1976; Marie et coll., 1985; Morohashi et coll., 1994).
Exposition à l'eau potable
De jeunes rats mâles SD sevrés (n = 8 rats par groupe) ont ingéré 0 %, 0,19 %, 0,27 %, 0,34 % ou 0,4 % de strontium (ce qui correspond à une concentration de strontium de 316 ± 97,4, de 425 ± 149, de 525 ± 194 ou de 634 ± 264 mg/kg p.c. par jour, respectivement, telle que calculée par les auteurs) sous forme de SrCl2 dans de l'eau potable, ainsi qu'une alimentation semi-synthétique contenant 0,5 % de calcium Note de bas de page [1], 0,5 % de phosphore, 0,16 % de magnésium et 2 000 UI/kg de vitamine D pendant 9 semaines (Marie et coll., 1985). Une histomorphométrie des septième et huitième vertèbres caudales a été effectuée au moyen d'un oculaire intégrateur de Zeiss de 100 points et d'un analyseur d'images semi-automatique. On a mesuré la teneur en minéraux après avoir séché et dissous le fémur et le tibia droits dans de l'acide chlorhydrique. Le taux de calcification endostéale (en µm par jour) a été mesuré comme étant la distance entre les deux marquages à la tétracycline divisée par le temps écoulé entre les marquages. Un accroissement du tissu ostéoïde (volume, surface et épaisseur) a été observé à toutes les doses de strontium. Le strontium à des concentrations de 0,19 %, 0,27 % et 0,34 % a fait augmenter la densité et le volume de l'os trabéculaire, et une augmentation considérable de la taille des ostéoïdes (volume et surface) a été observée dans tous les groupes exposés au strontium. Le rapport ostéoblaste/ostéoïde n'a été réduit qu'à la concentration de 0,4 % de strontium.
Le volume osseux calcifié a été augmenté aux concentrations de 0,19 % et de 0,34 % de strontium; cependant, on a observé une diminution du taux de calcification et du poids des os réduits en cendres, ainsi qu'un accroissement de l'épaisseur ostéoïde aux concentrations de 0,34 % et 0,4 % de strontium. Aucune différence en matière de consommation d'aliments ou d'eau, de taux de croissance, des concentrations sériques de vitamine D, de concentration osseuse de calcium ou de phosphate, ou encore de croissance des tibias n'a été observée entre les groupes prenant du strontium et les témoins. Étant donné que l'accroissement de la formation ostéoïde n'a pas été accompagné d'une diminution de la calcification ou des taux de résorption à des doses de 0,19 % et de 0,27 % de strontium, les auteurs ont conclu que cela était associé à une augmentation des centres actifs de formation osseuse et que des doses de strontium inférieures à 0,34 % n'étaient pas associées à une inhibition des taux de minéralisation osseuse. Parmi les anomalies osseuses observées à une concentration de strontium de 0,4 % (ou 634 mg/kg p.c. par jour), mentionnons une diminution de la minéralisation, une diminution de la surface ostéoïde doublement marquée et une prolongation du délai de minéralisation. La diminution significative du taux de minéralisation osseuse combinée à l'augmentation de la formation ostéoïde observées aux doses de 0,34 % et de 0,4 % de strontium est considérée comme une anomalie osseuse. Le taux de croissance et la consommation d'eau et d'aliments n'étaient pas différents d'un groupe de dose à l'autre à 9 semaines. La vitamine D présente dans le sérum n'était pas différente dans le groupe ayant reçu du strontium comparativement au groupe témoin, tandis que le calcium sérique a diminué temporairement à 4 semaines dans le groupe ayant reçu du strontium comparativement au groupe témoin. La concentration urinaire de phosphate à 4 semaines était considérablement plus basse dans le groupe recevant une dose de 0,27 % de strontium que dans le groupe témoin, et la concentration urinaire de magnésium à 9 semaines était considérablement plus basse dans les deux groupes recevant les doses les plus élevées de strontium que dans le groupe témoin. Le point de santé le plus sensible et le plus complet est la diminution de la minéralisation osseuse à une concentration de strontium de 0,34 % (525 mg/kg p.c. par jour), et cette dose peut également être désignée comme la dose minimale avec effet nocif observé (LOAEL), la NOAEL correspondant à 0,27 % de strontium (425 mg/kg p.c. par jour).
Exposition alimentaire
Les études comportant un seul groupe de dose à des concentrations légèrement supérieures (variant entre 1,5 et 1,6 %; doses en mg/kg non indiquées) de différentes formes de strontium dans l'alimentation (contenant de 0,04 à 1,2 % de Ca2+), administrées pour de courtes périodes (3 à 4 semaines), ont entraîné des symptômes osseux similaires ou plus graves chez de jeunes rats mâles sevrés âgés de moins de 4 semaines. Les symptômes étaient notamment des troubles de la calcification et de la résorption osseuses, une prolongation du délai de minéralisation, une diminution du taux d'apposition minérale, des malformations rachitiques accompagnées d'une baisse de la densité et de la croissance des tibias, une diminution du poids corporel, le remplacement de l'os trabéculaire par du tissu ostéoïde (os non minéralisé) avec élargissement des cartilages de conjugaison de la métaphyse et de l'épiphyse, ainsi que des perturbations dans les agencements de cellules osseuses avec de volumineuses lacunes extracellulaires (Storey, 1968; Matsumoto, 1976; Reinholt et coll., 1984; Svensson et coll., 1985, 1987; Neufeld et Boskey, 1994). Aucune de ces études n'a indiqué de doses en mg/kg ou la quantité de l'apport alimentaire, et la plupart n'ont utilisé qu'une seule concentration de strontium. Les études les plus pertinentes et exhaustives sont décrites ci-dessous.
Dans une étude de Storey (1961), des rats femelles juvéniles et adultes (n = 3 à 5 rats par groupe, souche non spécifiée) ont ingéré 1,6 % de calcium et de strontium (provenant du SrCO3) par voie alimentaire pendant 20 jours à des concentrations de 0 %, 0,19 %, 0,38 %, 0,75 %, 1 % (seulement pour les jeunes rats), 1,5 % et 3 %; les auteurs n'ont pas précisé les doses en mg/kg ni la quantité de l'apport alimentaire; cependant, l'ATSDR (2004) a estimé les doses de 140 à 4 975 mg/kg p.c. par jour. Pour les jeunes rats, des expositions à ≥ 0,38 % de strontium se sont traduites par des irrégularités des plaques cartilagineuses, l'existence de zones non calcifiées dans les travées métaphysaires et la diaphyse, une inhibition de la calcification et une diminution de la teneur en minéraux des os, des modifications de la configuration des colonnes matricielles intercellulaires et des anomalies dans l'organisation de la plaque cartilagineuse. Les effets étaient plus prononcés lorsque les doses de strontium étaient plus élevées; on a constaté un élargissement de la plaque épiphysaire et des irrégularités de la zone hypertrophique à une dose de 0,75 %; une croissance diminuée, une croissance anormale du cartilage, une mauvaise calcification et une teneur en cendres réduite dans les os à une dose de 1,5 %; et, enfin, des prolongements de cartilage non calcifié au sein de régions de tissu ostéoïde et une zone hypertrophique encore plus irrégulière à une dose de 3 %. Des changements similaires ont été observés chez les rats adultes, mais dans une moindre mesure. Aucun effet nocif n'a été observé à une dose de 0,19 % de strontium.
Dans une autre étude, Storey (1962) a exposé des rats adultes et juvéniles des deux sexes (n = 50 au total) à une concentration de 1,8 % de strontium (provenant du SrCO3, accompagné de 1,5 % de calcium) dans leur alimentation pendant une période allant jusqu'à 9 mois, et des nécropsies en série ont été effectuées tout au long de l'étude (les doses en mg/kg et la quantité de l'apport alimentaire n'ont pas été indiquées). Les jeunes rats présentaient une démarche rachitique, des irrégularités dans la plaque cartilagineuse épiphysaire, dans la calcification et dans les matrices osseuses extracellulaires, ainsi qu'un poids corporel réduit au cours du mois suivant le début de l'administration des doses. Des anomalies structurelles osseuses, des perturbations des agencements de cellules, ainsi que des perturbations des plaques épiphysaires du tibia et du fémur (avec des fragments isolés de cartilage remplaçant en partie des tissus ostéoïdes) ont été observées dans les mois suivants, jusqu'à 7 mois. La plupart de ces changements ont également été observés chez les rats adultes à partir de 3 mois, mais ils étaient moins graves.
De jeunes rats Wistar femelles (n = 6 à 8 rats par groupe) ont reçu par voie alimentaire des concentrations de strontium de 0,05 %, 0,1 % ou 0,5 %(respectivement 87,5, 175 ou 875 µmol par jour) provenant du SrCO3 pendant 27 jours durant les 36 à 63 jours de l'étude (Morohashi et coll., 1994). Aucun effet sur la santé n'a été observé aux doses de 0,05 % et de 0,1 %, et aucune dose n'a influé sur le poids corporel ou la longueur du fémur (critères d'évaluation). Une diminution de la résorption et des taux de formation des os ainsi qu'un accroissement de l'os trabéculaire ont été observés dans le fémur à une concentration de strontium de 0,5 %.
De jeunes rats SD mâles sevrés (n = 5 rats par groupe) ont reçu 0 %, 0,19 % ou 0,4 % de SrCl2 dans l'eau potable, ainsi qu'une alimentation semi-synthétique contenant 0,5 % de calcium pendant 4 et 8 semaines (Grynpas et Marie, 1990). On a observé un accroissement du tissu osseux trabéculaire (volume ostéoïde) après 8 semaines d'administration de la dose de 0,19 %. Un accroissement de l'épaisseur ostéoïde et une prolongation du temps de minéralisation ont été observés après 8 semaines d'administration de la dose de 0,4 %. Une tendance à la baisse de la densité et de la minéralisation a été observée lors de l'augmentation des doses, qui s'accompagnait d'une diminution de la longueur des cristaux et d'un remplacement du calcium par le strontium dans les minéraux contenus dans les os.
Des rats Wistar mâles sevrés (n = 5 à 6 par groupe) ont reçu du Sr3(PO4)2 par voie alimentaire à des concentrations de 0,5 %, 1 % ou 2 % de strontium (les doses en mg/kg n'ont pas été indiquées) pendant 2, 4 ou 6 semaines (Kshirsagar, 1976). Un retard de croissance et une augmentation de l'activité de la phosphatase alcaline osseuse ont été observés à la dose de 2 %. Aucune déformation osseuse n'a été observée à une concentration de strontium de 0,5 % ou de 1 %, mais d'importantes modifications des activités enzymatiques (phosphatase alcaline des os, ainsi que phosphatase acide du foie, des intestins et des reins) ont été constatées à la dose de 1 %.
Un rapport de l'EMA (2005) effectue la synthèse des effets toxicologiques observés dans des études utilisant une supplémentation de SrR, mais la source des données n'y est pas précisée. Une ostéomalacie, une minéralisation osseuse anormale et une accumulation ostéoïde ont été induites chez des rates ovariectomisées à qui on a administré par voie alimentaire 425 mg de Sr/kg p.c. par jour provenant du SrR, pendant 41 semaines. De plus, une ostéomalacie et des déformations des os longs ont été observées chez des souris ayant été exposées à 5 000 mg de SrR/kg p.c. par jour pendant 52 semaines ou à 600 mg de SrR/kg p.c. par jour pendant 104 semaines (aucune anomalie osseuse n'a été observée à la suite d'une administration de 2 500 mg/kg p.c. par jour pendant 52 semaines). Enfin, des guenons ovariectomisées affichaient un retard de minéralisation après avoir reçu deux doses de 625 mg de SrR/kg p.c. par jour pendant 52 semaines (aucune anomalie osseuse n'a été observée à la suite d'une administration de 750 mg/kg p.c. par jour pendant 26 semaines ou de deux doses de 250 mg/kg p.c. par jour pendant 52 semaines).
9.2.3 Génotoxicité
La plupart des études ont mis l'accent sur la génotoxicité du strontium radioactif, et les données probantes sur le strontium stable ont généralement démontré une absence de génotoxicité de l'élément. Par exemple, il a été démontré que le SrCl2 n'était pas génotoxique (aucune inhibition de la croissance des cellules déficientes en système de recombinaison comparativement à celles d'une souche sauvage) lors d'un essai de recombinaison utilisant deux souches de la bactérie B. subtilis H17 et M45 (Kanematsu et coll., 1980). La concentration de SrCl2 qui inhibait de 50 % l'efficacité de clonage des cellules ovariennes de hamsters chinois était élevée comparativement à celle d'autres composés (87 000 µM, comparativement à 240 µM pour le chlorure de manganèse et à 1,3 µM pour le chlorure de cadmium, par exemple) (Tan et coll., 1984). Le strontium (sous forme de Sr2+) n'a pas altéré la fidélité de la réplication de l'ADN des ADN polymérases purifiées à partir de matrices polynucléotidiques synthétiques (Loeb et coll., 1977). Au cours d'essais menés in vitro sur des cellules bactériennes (Salmonella typhimurium et Escherichia coli) et de mammifères (fibroblastes de hamsters chinois et lymphocytes humains) et in vivo chez les rats, aucune mutagénicité, génotoxicité ou toxicité chromosomique du SrR n'a été mise en évidence (EMA, 2005; Laboratoires Servier, 2016). Le SrCl2 dans l'eau potable (240-2 600 mg/kg p.c.) a entraîné des anomalies chromosomiques (lacunes, bris, non-disjonction et polyploïdie) in vivo dans les cellules de la moelle osseuse de jeunes souris albinos suisses (âgées de 6 à 8 semaines) (n = 5 par ensemble); cependant, certaines de ces concentrations dépassaient la valeur énoncée dans la ligne directrice no 475 de l'Organisation de coopération et de développement économiques, et l'isotope de strontium n'a pas été mentionné (Ghosh et coll., 1990; OCDE, 1997).
9.2.4 Cancérogénicité
Peu d'enquêtes ont été menées au sujet des effets cancérogènes du strontium. Bien que les formes radioactives du strontium (comme le strontium-90) soient génotoxiques et provoquent un cancer chez les animaux, les formes stables de strontium n'ont pas entraîné d'augmentation du développement de tumeurs chez les animaux. Le Centre international de recherche sur le cancer (CIRC), l'U.S. EPA et le National Toxicology Program (NTP) n'ont pas évalué la cancérogénicité des formes de strontium.
L'EMA (2005) a fait état d'un plus grand nombre de tumeurs des cellules thyroïdiennes C chez 344 rats Fischer mâles ayant reçu par voie orale des doses de SrR de 200, de 600 ou de 1 800 mg/kg p.c. par jour (le nombre d'animaux par groupe n'était pas précisé). Les augmentations n'étaient pas reliées aux doses (seules la plus faible et la plus élevée des doses étaient significatives); les augmentations restaient dans la gamme des données historiques, et celles observées chez les femelles n'étaient pas significatives. Cependant, les auteurs ont indiqué que les tumeurs des cellules thyroïdiennes C pourraient être plausibles; ils ont émis l'hypothèse d'un mécanisme mettant en cause une hypercalcémie à long terme, une sécrétion accrue de calcitonine et une hypertrophie des cellules C.
L'EMA (2005) a également fait état d'un plus grand nombre de lymphomes lymphocytaires, d'adénomes hépatocellulaires et d'adénomes ovariens, ainsi que d'une combinaison d'adénomes et de carcinomes bronchioloalvéolaires chez des souris B6C3F1 ayant reçu par voie orale dans l'alimentation des doses de SrR de 150, 225, 300, 450, 625 ou 900 mg/kg p.c. par jour pendant 104 semaines; cependant, aucun de ces cancers n'a été considéré comme étant relié au traitement (aucun détail sur l'étude n'a été fourni).
En conclusion, étant donné la quantité très limitée de données sur les effets cancérogènes, il est impossible de déterminer le potentiel cancérogène du strontium pour les animaux.
9.2.5 Toxicité pour la reproduction et le développement
Il n'existe aucune étude standard sur la reproduction ou le développement utilisant des voies d'exposition pertinentes sur le plan environnemental, et la taille des échantillons de l'étude sur l'exposition sous-cutanée était très petite. Il semblerait que le strontium ait un effet nocif sur l'organogénèse osseuse, qui se poursuit après la naissance, pour les rongeurs sevrés et juvéniles, tel qu'il est décrit ci-dessus. L'OMS (2010) a présenté les résultats d'une étude de l'Institut national de la recherche environnementale (NIER, Corée du Sud, 2006) qui ne montrait aucun effet sur le développement fœtal de rats (16 rats de chaque sexe par groupe de dose) dont la mère recevait par gavage du sulfate de strontium (jusqu'à 2 g de sulfate de Sr/kg p.c. par jour) à partir de 2 semaines avant l'accouplement, jusqu'au 4e jour de lactation. Dans une autre étude de Shibata et Yamashita (2001), telle que mentionnée par l'OMS (2010), une inhibition de la calcification de l'os et du cartilage mandibulaires a été observée chez les souris nouveau-nées de mères (n = 4) ayant reçu 2 % de carbonate de strontium (il n'est pas clair à quoi cette dose fait référence) tout au long de la gestation; cependant, aucun effet sur le nombre de fœtus ni sur leur viabilité n'a été observé. Skoryna (1981) a évoqué une étude qui ne démontrait aucun effet toxique chez des rats ayant reçu du strontium sur trois générations (aucun détail sur l'étude n'a été fourni). De fortes doses de SrR (1 000 mg/kg p.c. par jour) administrées à des rats mâles et femelles n'ont pas eu d'effet sur la fertilité (aucun détail n'a été fourni, Laboratoires Servier, 2016). Cependant, il a été constaté que le SrR retardait l'apparition des incisives chez les petits des rats lorsque de fortes doses orales étaient données (750 mg de SrR/kg p.c. par jour). Les retards de minéralisation osseuse observés chez des rats Wistar mâles atteints d'insuffisance rénale chronique ayant reçu du strontium (2 g de Sr/L dans l'eau potable pendant 2 à 12 semaines) se sont avérés réversibles après l'arrêt de cette administration (Oste et coll., 2005). Aucun effet sur le poids corporel, la taille des portées, les anomalies ou la teratogénicité n'a été observé chez la progéniture de rats Wistar femelles (n = 3 rats par groupe) ayant reçudes doses sous-cutanées de 25, 50, 100 ou 200 mg/kg p.c. de Sr(NO3)2 entre les jours 9 et 19 de la gestation (Lansdown et coll., 1972).
9.2.6 Autres effets
Les autres effets observés chez les animaux étaient des difficultés respiratoires, une paralysie des pattes arrière ainsi que la mort pour des rats exposés à une concentration de 0,49 % de strontium (forme non spécifiée) du 21e au 64e jour suivant leur naissance (Johnson et coll., 1968). Cependant, il est difficile de tirer des conclusions basées sur cette étude, car les auteurs ont indiqué que certains effets étaient réversibles, aucun examen histologique n'a été effectué sur les cadavres d'animaux, la forme de strontium était inconnue, aucune donnée ou statistique sur les effets sur la santé n'a été présentée, et les régimes alimentaires étaient carencés en calcium.
Une modification de l'activité des phosphatases alcaline et acide a été observée dans le foie et l'intestin grêle de jeunes rats à la suite de l'administration par voie alimentaire de 1 % et de 2 % de phosphate de strontium pendant 2 à 6 semaines (Kshirsagar, 1976). Les auteurs ont mentionné que l'importance biologique de ces effets était incertaine.
Des rats Wistar adultes exempts d'organismes pathogènes spécifiques (n = 6 par groupe de dose) ayant reçu 3 000 ppm de SrCl2·6H2O par voie alimentaire (il n'est pas clair à quoi cette dose faisait référence) et 0,85 % de calcium ont affiché une faible augmentation du nombre d'érythrocytes et de globules blancs après 2 semaines, des changements histologiques mineurs de la thyroïde, ainsi qu'une baisse du poids de l'hypophyse et des concentrations de glycogène hépatique après 90 jours chez les femelles (Kroes et coll., 1977). Cependant, il n'y a eu aucune relation dose-réponse.
9.3 Mode d'action
9.3.1 Effets toxiques
Bien que les mécanismes de toxicité demeurent incertains, les effets nocifs induits par le strontium sur la formation osseuse sont liés à la similitude de ce dernier avec le calcium en termes de propriétés chimiques, les deux éléments partageant des voies métaboliques et interagissant avec des composants cellulaires et moléculaires semblables de l'organisme (Skoryna, 1981; Fischer et coll., 2011). Les effets sur les os sont accentués lorsque le régime alimentaire est faible en calcium; cependant, des anomalies osseuses ont également été observées à des concentrations normales de calcium (jusqu'à 1,6 %). Étant donné que le strontium influe sur la croissance osseuse et que les nourrissons en reçoivent un apport plus élevé par kilogramme de poids corporel que les membres des autres groupes d'âge, ils sont particulièrement sensibles aux effets du strontium sur les os; chez l'animal, il a été démontré que les effets sur les os sont plus évidents chez le jeune rat que chez l'adulte, ce qui appuie le choix de la sous-population sensible (Storey, 1961, 1962; Svensson et coll., 1985, 1987; Neufeld et Boskey, 1994).
Le principal mécanisme de la toxicité du strontium est la compétition directe avec le calcium pour la liaison des cristaux d'hydroxyapatite qui se forment par interférence physiochimique (Neufeld et Boskey, 1994; Boivin et coll., 1996; Cabrera et coll., 1999; Verberckmoes et coll., 2003; Fischer et coll., 2011; Hendrych et coll., 2016). Il a été démontré que le strontium abaissait les taux sériques de calcium et qu'il se concentrait au plan de la calcification ostéoïde (Schrooten et coll., 1998; Shibata et Yamashita, 2001). La liaison du strontium, un atome plus gros que le calcium, et la teneur en carbonate supérieure du minéral peuvent augmenter et modifier la structure des réseaux d'apatite, réduire la formation et la croissance des cristaux, et accroître la solubilité de l'hydroxyapatite - et possiblement réduire la stabilité de la matrice osseuse durant les processus de résorption des os et accroître la dissolution (Skoryna, 1981; Christoffersen et coll., 1997; Cabrera et coll., 1999; Verberckmoes et coll., 2004; Oste et coll., 2005). Par exemple, des études morphologiques ont révélé que les molécules d'hydroxyapatite présentant des concentrations élevées de strontium affichaient une taille de cristaux et une cristallinité réduites, ainsi qu'une agrégation accrue in vitro (Querido et coll., 2016). L'agrégation pourrait mener à des interactions accrues avec les composants organiques et cellulaires des matrices. En outre, des changements dans la structure des réseaux ont été observés; ils influaient sur les distances et les angles de liaison. Cette voie potentielle de toxicité mettant en cause une compétition avec le calcium est appuyée par le retour rapide à la normale de la minéralisation chez les rats après l'arrêt du traitement.
Un autre mécanisme de la toxicité du strontium est l'interaction avec les différentes protéines liant le calcium, les messagers des cellules secondaires, et les récepteurs des protéines G sensibles au calcium exprimés dans les os et d'autres cellules (la glande parathyroïde et les reins, par exemple, bien que des effets dans ces organes n'aient pas été signalés) (Chang et coll., 1999; Pi et Quarles, 2004; Caudarella et coll., 2011). Ces interactions peuvent altérer la morphologie, l'agencement et la maturation des cellules osseuses (p. ex. les ostéoblastes), tel qu'il a été observé in vitro et in vivo chez des rats ayant un régime riche en strontium (Matsumoto, 1976; Verberckmoes et coll., 2003; Oste et coll., 2005; Fischer et coll., 2011), ainsi que se répercuter sur les fonctions des cellules osseuses comme la synthèse du collagène et la libération de cristaux par les vésicules matricielles (Anderson, 1995; Kirsch et coll., 2003; Oste et coll., 2005). De plus, le strontium pourrait remplacer le calcium au sein du site actif de la phosphatase alcaline non spécifique du tissu enzymatique humain (une phosphatase alcaline intervenant dans le contrôle de la formation de l'hydroxyapatite et de la minéralisation osseuse) et modifier sa configuration, tel qu'il est illustré dans une étude sur la structure des cristaux (Llinas et coll., 2006).
En outre, le strontium peut abaisser les concentrations sériques de calcium et de parathormones par le biais d'une contre-réaction négative à la suite de l'activation du récepteur de calcium de la glande parathyroïde, tel qu'il a été constaté chez des rats ayant un régime riche en strontium (Kshirsagar, 1976; El et Rousselet, 1981; Morohashi et coll., 1994; Schrooten et coll., 1998; Oste et coll., 2005; Fischer et coll., 2011). La diminution des concentrations de calcium est liée à l'inhibition de la minéralisation et à un accroissement de la résorption osseuse pour augmenter les concentrations sériques. L'histopathologie de la thyroïde observée à la dose élevée lors de l'étude menée par Kroes et coll. (1977) pourrait être attribuable à la stimulation par le strontium du CaSR dans les cellules C de la thyroïde, bien que cette hypothèse n'ait pas été mise à l'épreuve.
Les parathormones jouent un rôle clé dans le remodelage osseux en stimulant à la fois la formation et la résorption osseuses par le biais de la maturation des ostéoblastes et des ostéoclastes. Il a été démontré que le strontium réduisait l'absorption du calcium en inhibant indirectement l'expression de l'ARN codant pour la calbindine D et l'activation rénale de la vitamine D, effets qui sont possiblement liés à l'altération de l'activité des parathormones (El et Rousselet, 1981; Vezzoli et coll., 1998).
Parmi les autres mécanismes de toxicité, mentionnons le retard de l'apoptose des chondrocytes, ce qui mène à une surproduction d'ostéoïdes (Fisher et coll., 2011), le sous-développement des bordures plissées des ostéoclastes, la non-calcification des fibrilles de collagène des fœtus de souris gravides recevant 2 % de carbonate de strontium dans de l'eau (Shibata et Yamashita, 2001), l'augmentation du nombre de protéines non collagéniques (ce qui peut altérer la minéralisation osseuse) et l'altération du métabolisme des phospholipides acides complexés menant à leur accumulation chez de jeunes rats ayant un régime riche en strontium (Neufeld et Boskey, 1994). Finalement, les rats traités au strontium présentaient une quantité moindre de parathormones sériques, ce qui pouvait potentiellement réduire le remodelage osseux et diminuer la réabsorption rénale du calcium (Oste et coll., 2005).
9.3.2 Effets bénéfiques
Il a été suggéré que différentes formes de strontium inhibaient la résorption osseuse tout en stimulant la formation osseuse à de faibles doses chez l'animal (Ferraro et coll., 1983; Marie et Hott, 1986; Marie et coll., 1993; Grynpas et coll., 1996) et l'humain (EMA, 2005), et que les effets étaient susceptibles de varier selon l'âge de l'individu. On a constaté que le strontium stimulait la prolifération et la différenciation des ostéoblastes in vitro par le biais de l'activation du récepteur sensible au calcium et pour signaler la transcription de gènes associés à la croissance à de faibles doses (Cabrera et coll., 1999; Brennan et coll., 2009; Rybchyn et coll., 2011; Querido et coll., 2016). En outre, on a observé après l'administration de SrR des améliorations dans les déterminants de la résistance osseuse chez les rats ainsi que dans la microarchitecture et la densité minérale des os de patients atteints d'ostéoporose (Hamdy, 2009). Il a aussi été démontré que le SrR augmentait et réduisait l'expression de régulateurs positifs et négatifs de la synthèse des os par les cellules osseuses, respectivement (Hamdy, 2009; Hurtel et coll., 2009). Enfin, le strontium est incorporé à l'apatite osseuse par un échange ionique réversible et une substitution ionique du calcium, ce qui accroît la densité osseuse (Querido et coll., 2016).
10.0 Classification et évaluation
Peu d'enquêtes ont été faites au sujet des effets cancérogènes du strontium. En termes de classification du cancer, l'Integrated Risk Information System de l'U.S. EPA a indiqué qu'il n'y avait pas suffisamment d'information pour évaluer le potentiel cancérogène du strontium en raison du manque d'études chroniques valables (U.S. EPA, 2014). La cancérogénicité du strontium n'a pas été évaluée par le CIRC ou le NTP.
10.1 Évaluation des risques d'effets autres que le cancer
Il a été démontré que le strontium était à la fois bénéfique et toxique pour le squelette humain et animal. Le mode d'action des effets du strontium sur les os vient appuyer le choix de ce critère d'évaluation clé comme fondement de définition de la valeur basée sur la santé (VBS) du strontium dans l'eau potable. Seules quelques études épidémiologiques ont décrit les effets nocifs du strontium élémentaire sur les os : une étude d'Özgür et coll. (1996) indique un lien potentiel entre une exposition élevée au strontium et le rachitisme chez les enfants turcs; cependant, les données sont insuffisantes pour définir les doses associées à cet effet. Au cours d'études animales, des anomalies osseuses (rachitisme, avec minéralisation osseuse réduite et accumulation ostéoïde) ont été observées à la suite d'une exposition à de fortes doses de strontium (concentrations ≥ 0,3-0,4 % dans l'alimentation ou doses de ≥ 525 mg/kg p.c. par jour), alors que l'exposition à de faibles doses réduisait la résorption osseuse, améliorait la formation osseuse et n'avait aucun effet sur la minéralisation des os. Étant donné que les taux les plus élevés de remodelage osseux surviennent durant la première année de vie (une bonne partie du squelette étant remplacée au cours de cette période), l'apport calcique est particulièrement élevé chez le nourrisson, de même que l'absorption du strontium et son intégration dans les os, ce qui appuie la définition de ce groupe d'âge comme le plus sensible aux effets du strontium sur les os (ICRP, 1993; ATSDR, 2004; Hood, 2006; Wheeless, 2011).
L'étude choisie pour déterminer la VBS du strontium dans l'eau potable est celle de Marie et coll. (1985). Cette étude convenait au calcul de la VBS, car le strontium était administré dans de l'eau potable (absorption supérieure du strontium comparativement aux aliments), de multiples doses ont été testées, les paramètres osseux touchés ont été quantifiés, et l'étude a été menée chez des rats sevrés, qui présentent des taux plus élevés d'absorption du strontium et de remodelage osseux que les rats adultes. Les auteurs ont fourni les renseignements posologiques en mg/kg p.c. par jour, et les effets sur les os ont été détaillés en fonction des différents biomarqueurs et des mesures osseuses directes. Ils ont fait état des valeurs de la croissance des tissus osseux et de la minéralisation du tissu nouvellement formé. Les effets sur la santé les plus sensibles et les plus complets sont la diminution du taux de calcification osseuse et une augmentation de la surface ostéoïde aux deux doses les plus élevées (0,34 et 0,4 % de chlorure de Sr); si l'on se fie à la quantité de calcium et de strontium dans les aliments et l'eau potable consommés, les animaux des groupes ayant reçu ces doses ont été exposés à un rapport calcium/strontium d'environ 3:1. Un délai de minéralisation prolongé a aussi été observé à la dose de 0,4 % de chlorure de sodium. Comme il en a été question à la section 9.2, le choix des effets osseux comme effet critique est appuyé par d'autres études animales (Storey, 1961; Johnson et coll., 1968; Kshirsagar, 1976; Morohashi et coll., 1994). Des anomalies osseuses similaires ont également été observées dans une étude portant sur des rats adultes (Storey, 1961); cependant, l'étude est limitée quant à l'évaluation des risques, en raison de la faible taille du groupe d'échantillons, de la courte durée d'exposition, du manque d'information sur l'âge/la souche des animaux et de la détermination expérimentale des doses, ainsi que du fait qu'une forme de strontium à faible solubilité (le carbonate de strontium) a été administrée par voie alimentaire, ce qui pourrait expliquer que les effets constatés ont été retardés et moins prononcés.
La quantité de calcium dans l'alimentation était adéquate (0,5 %), mais inférieure à celle d'autres études sur les effets du strontium sur les os. Selon les études pertinentes, un apport calcique normal chez le rat serait de 1,19 à 3,5 % (Conseil national de recherches du Canada, 1995; Bollen et Bai, 2005; Fuchs et coll., 2008); par conséquent, l'apport calcique de cette étude (0,5 %) devrait produire une VBS conservatrice, étant donné que les animaux présentant une carence en calcium ont affiché une sensibilité accrue aux effets du strontium sur les os. Le rapport calcium/strontium dans l'eau peut varier, selon le type de roches présentes dans l'eau (voir la section 4.0); les situations au cours desquelles les humains sont exposés à une concentration de strontium plus élevée que la concentration de calcium peuvent être une source de préoccupation. Il a été démontré que d'autres facteurs modifiaient le taux d'absorption du strontium (voir la section 8.1). La sensibilité peut être augmentée dans les cas de carence en vitamine D, qui réduit l'absorption du calcium par les intestins (Holick, 2010). Des concentrations suffisantes de calcium et de vitamine D dans le corps peuvent diminuer la quantité de strontium incorporée aux os, ce qui diminue la probabilité d'effets nocifs sur les os des enfants dont les concentrations de calcium et de vitamine D sont adéquates. Ainsi, la coexistence de fortes concentrations de calcium, ou même de doses alimentaires normales, comme le rapportent Harrison et coll. (1966) et Kostial et coll. (1972), pourrait protéger des effets nocifs du strontium sur les os; cependant, il est impossible d'ajuster avec certitude la VBS du strontium en fonction de l'apport en calcium ou de la concentration dans l'eau. Les carences en calcium sont rares chez les jeunes enfants canadiens (< 2,6 % de 1 à 3 ans); par contre, il a été signalé qu'une proportion élevée d'adolescents canadiens présentait une déficience en calcium (> 60 % de 9 à 18 ans) (Statistique Canada, 2004).
La modélisation de la dose de référence (BMD) a été effectuée à l'aide de la version 2.6.0.1 du logiciel de BMD de l'U.S. EPA afin d'estimer la limite de confiance inférieure de 95 % en fonction d'une diminution d'un écart-type de la BMD (BMDL) pour les anomalies de minéralisation osseuse (réponse continue) (U.S. EPA, 2015). Les modèles de Hill, exponentiel, linéaire, polynomial et de puissance s'ajustent tous bien aux données, produisant (visuellement) une BMD de 328 mg/kg par jour (moyenne des modèles); néanmoins, l'approche de la BMD n'a pas été retenue pour plusieurs raisons. Si on examine les différents effets, les données de l'étude sont plus solides seulement en ce qui concerne les effets survenant à 525 mg/kg p.c. par jour ou plus; en fait, les auteurs ont affirmé qu'ils avaient documenté la déficience de minéralisation osseuse, que le strontium nuisait clairement à la minéralisation à la dose la plus élevée (634 mg/kg par jour) et qu'aucun effet n'avait été observé à une dose de 425 mg/kg par jour. Ensuite, la BDML se rapproche davantage de la plus faible dose à l'étude, ce qui ne correspond pas aux observations rapportées par Marie et coll. (1985). Enfin, les modèles de BMD présentaient un écart faible (valeur p de 0,02 pour l'adéquation de l'écart), qui pourrait être attribuable à l'IC à 95 % relativement large du groupe de 425 mg/kg p.c. par jour comparativement à celui des autres, ce qui réduit la confiance envers les résultats de la BMDL.
Pour les raisons tout juste évoquées, l'approche de la NOAEL est choisie pour le calcul du PDD en fonction de l'effet sur la santé le plus sensible et le plus complet, soit la diminution de la minéralisation osseuse chez les jeunes rats (Marie et coll., 1985).
Figure 2 - Strontium dans l'eau potable
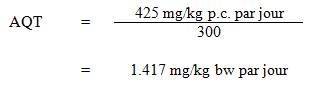
Figure 2 - Équivalent textuel
L'AQT est 1,417 mg/kg p.c. par jour. Ceci est calculé par divisant 425 mg/kg p.c. par jour par le facteur d'incertitude de 300.
Où :
- 425 mg/kg p.c. par jour est la NOAEL pour les anomalies de calcification (Marie et coll., 1985);
- 300 est le facteur d'incertitude (FI) : ×10 pour la variabilité interspécifique, ×10 pour la variabilité intraspécifique (y compris les vulnérabilités chez les femmes enceintes et les adolescents) et ×3 pour les lacunes de la base de données (absence d'études complètes sur la toxicité pour le développement chez aucune espèce).
Figure 3 - Strontium dans l'eau potable
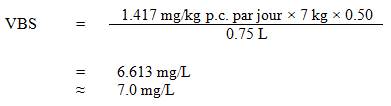
Figure 3 - Équivalent textuel
La VBS est 6,613 mg/L, arrondi à 7,0. Ceci est calculé par mutlipliant 1,417 mg/kg p.c. par jour par 7 kg, ensuite par 0,50. Ce produit est ensuite divisé par 0,75 L.
Où :
- 1,417 mg/kg p.c. par jour est l'AQT, tel que calculé plus haut;
- 7 kg est le poids corporel moyen des nourrissons âgés de 0 à 6 mois (Santé Canada, 1994);
- 0,5 est le facteur d'attribution estimé pour l'eau potable. Les préparations en poudre pour nourrissons et l'eau ayant servi à leur préparation sont considérées comme les principales sources d'exposition au strontium chez les nourrissons nourris d'une préparation pour nourrissons pendant les premiers mois de vie. Il est présumé que l'attribution provenant de l'eau potable représente la moitié de l'exposition potentielle totale, et l'autre moitié provient de la préparation elle-même, comme le soutiennent les données d'exposition de la section 5. Il n'est pas prévu que les contributions d'autres sources soient significatives pour ce groupe d'âge; et
- 0,75 L est l'apport en eau quotidien moyen des nourrissons de 0 à 6 mois (Santé Canada, 1994).
10.2 Considérations internationales
La présente section expose les recommandations, les normes et les directives émises par des organisations étrangères et internationales en matière de qualité de l'eau potable. L'ancienneté des évaluations ou des divergences de politiques ou d'approches, notamment dans le choix de l'étude clé et dans les divers taux de consommation, masses corporelles et facteurs d'attribution employés, peuvent expliquer les écarts de valeurs.
Ni l'Organisation mondiale de la Santé (OMS), ni l'United States Environmental Protection Agency (U.S. EPA), l'Union Européenne ou l'Australian National Health and Medical Research Council n'ont établi de limites réglementaires fondées sur la santé pour l'élément chimique strontium dans l'eau potable.
L'U.S. EPA a établi, dans un avis sanitaire, une valeur à vie de 4 mg/L pour le strontium dans l'eau potable, en fonction d'une dose de référence de 0,6 mg/kg/jour (U.S. EPA, 2018). Les avis sanitaires constituent des limites non réglementaires : elles servent d'indicateur d'une concentration acceptable dans l'eau potable.
11.0 Justification
Le strontium est présent dans de nombreuses sources d'eau potable, de façon naturelle et par suite d'activités humaines. Les concentrations de strontium dans l'eau potable canadienne varieront grandement selon les formations géologiques et les activités anthropiques, notamment les opérations minières et manufacturières. Le strontium existe sous la forme d'un mélange de quatre radio-isotopes d'origine naturelle considérés comme étant stables. L'objet du présent document se limite aux propriétés chimiques du strontium. Selon les propriétés chimiques de cet élément, l'exposition au strontium dans l'eau potable ne serait préoccupante qu'en cas d'ingestion - l'exposition par inhalation ou absorption cutanée ne devrait pas être source de préoccupation.
Les données actuelles ne permettent pas d'évaluer le potentiel cancérogène de l'exposition orale au strontium chez l'humain ou l'animal, étant donné la non-disponibilité d'études spécifiques sur le cancer chez les animaux ayant recours à l'exposition orale. La cancérogénicité du strontium n'a pas été évaluée par le CIRC ou le NTP.
Les os sont généralement considérés comme la cible principale de la toxicité du strontium tant chez l'humain que chez l'animal. Il a été démontré que le strontium était bénéfique pour le squelette des animaux et des humains, et seules quelques études épidémiologiques ont documenté les effets nocifs du strontium élémentaire sur les os. Cependant, de nombreuses études animales ont révélé des anomalies osseuses (rachitisme, diminution de la minéralisation osseuse et accumulation ostéoïde) à la suite d'expositions à de fortes doses de strontium. Étant donné que les taux de remodelage osseux les plus élevés surviennent au cours de la première année de vie (presque 100 % du squelette étant remplacé au cours de cette période), l'apport en calcium est plus élevé chez les nourrissons (tout comme l'est l'apport potentiel en strontium), ce qui vient appuyer la définition de ce groupe d'âge comme étant le plus sensible aux effets du strontium sur les os. Pour toutes ces raisons, une CMA de 7,0 mg/L a été établie afin de protéger la population la plus sensible que forment les nourrissons, en fonction de la diminution de la minéralisation osseuse observée chez les jeunes rats lors d'une étude.
Une CMA de 7,0 mg/L est établie pour le strontium total dans l'eau potable. La CMA protège contre les effets potentiels sur la santé, peut être mesurée de façon fiable à l'aide des méthodes d'analyse existantes et peut être atteinte par les techniques de traitement existantes à l'échelle municipale et résidentielle. Cette recommandation s'appuie sur la toxicité chimique du strontium naturel. Les formes radiologiques et les isotopes radioactifs du strontium sont abordés dans un autre document (Santé Canada, 2009). Les effets toxiques du strontium peuvent diminuer en présence d'une concentration élevée de calcium dans les sources d'eau potable ou simplement d'une quantité suffisante de calcium dans l'alimentation, étant donné que les os absorbent et intègrent mieux le calcium que le strontium
Santé Canada continuera, dans le cadre de son processus continu de révision des recommandations, de suivre les nouvelles recherches à ce sujet, et recommandera au besoin toute modification jugée appropriée.
12.0 Références
- Abrahamsen, B., Grove, E.L. et Vestergaard, P. (2014). Nationwide registry-based analysis of cardiovascular risk factors and adverse outcomes in patients treated with strontium ranelate. Osteoporos. Int., 25(2): 757-762.
- Achal, V., Pan, X. et Zhang, D. (2012). Bioremediation of strontium (Sr) contaminated aquifer quartz sand based on carbonate precipitation induced by Sr resistant halomonas sp. Chemosphere, 89: 764-768.
- Agriculture Canada (1979). Minor elements in Canadian soils. Research Branch. Land Resource Research Institute Contribution No. LRRI 27 Engineering and Statistical Research Institute Contribution No. I-71 Ottawa. Disponible à l'adresse : http://sis.agr.gc.ca/cansis/publications/miscellaneous/1979-minor/1979-minor-elements.pdf
- Alberta Environment and Sustainable Resource Development (2016). Communication personnelle avec D. Reid et K. Pongar.
- Alexander, G.V., Nusbaum, R.E. et MacDonald, N.S. (1954). Strontium and calcium in municipal water supplies. J. Am. Water Works Assoc., 46(7): 643-654.
- Alfredo, K., Adams, C., Eaton, A., Roberson, A. et Stannford, B. ( 2014). The potential regulation implications of strontium. American Water Works Association. Disponible à l'adresse : www.awwa.org/Portals/0/files/legreg/ documents/2014AWWAStrontiumBriefingPaper.pdf
- Anderson, H.C. (1995). Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. (314)(314): 266-280.
- ANSES (2013). Avis relatif à une évaluation des risques sanitaires liés à la présence de strontium dans les eaux destinées à la consommation humaine. Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail. Saisie no 2012-SA-0262. Maisons-Alfort (ed.). France. 28 p.
- APHA, AWWA et WEF (2005). Standard methods for the examination of water and wastewater, 21e édition. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, DC.
- APHA, AWWA et WEF (2012). Standard methods for the examination of water and wastewater, 22e édition. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, DC.
- Apostoaei, A.I. (2002). Absorption of strontium from the gastrointestinal tract into plasma in healthy human adults. Health Phys., 83(1): 56-65.
- Araissi, M., Ayed, I., Elaloui, E. et Moussaoui, Y. (2016). Removal of barium and strontium from aqueous solution using zeolite 4A. Water Sci. Technol., 73(7): 1628-1636.
- Arbuckle, T.E., Fraser, W.D., Fisher, M., Davis, K., Liang, C.L., Lupien, N. et coll. (2013). Cohort profile: the maternal-infant research on environmental chemicals research platform. Paediatr. Perinat. Epidemiol., 27(4): 415-425.
- ASTM (2010). ASTM D5673-10 Standard test method for elements in water by inductively coupled plasma-mass spectrometry. ASTM International, West Conshohocken, Pennsylvania.
- Athanassouli, T.M., Papastathopoulos, D.S. et Apostolopoulos, A.X. (1983). Dental caries and strontium concentration in drinking water and surface enamel. J. Dent. Res., 62(9): 989-991.
- ATSDR (2004). Toxicological profile for strontium. Agency for Toxic Substances and Disease Registry, U.S. Department of Health and Human Services, Atlanta, Georgia.
- Atteritano, M., Catalano, A., Santoro, D., Lasco, A. et Benvenga, S. (2015). Effects of strontium ranelate on markers of cardiovascular risk in postmenopausal osteoporotic women. Endocrine, 53(1): 305-312
- AWWA (2014). The potential regulatory implications of strontium. American Water Works Association. Government Affairs Office. Washington, DC.
- Bain, S.D., Jerome, C., Shen, V., Dupin-Roger, I. et Ammann, P. (2009). Strontium ranelate improves bone strength in ovariectomized rat by positively influencing bone resistance determinants. Osteoporos. Int., 20(8): 1417-1428.
- Bärenholdt, O., Kolthoff, N. et Nielsen, S.P. (2009). Effect of long-term treatment with strontium ranelate on bone strontium content. Bone, 45(2) : 200-206.
- Boivin, G., Deloffre, P., Perrat, B., Panczer, G., Boudeulle, M., Mauras, Y., Allain, P., Tsouderos, Y. et Meunier, P.J. (1996). Strontium distribution and interactions with bone mineral in monkey iliac bone after strontium salt (S 12911) administration. J. Bone Miner. Res., 11(9): 1302-1311.
- Bolland, M. and Grey, A. (2016). Ten years too long: strontium ranelate, cardiac events, and the European Medicines Agency. BMJ 354:i5109. Disponible à l'adresse : https://www.bmj.com/content/354/bmj.i5109
- Bollen, A.M. et Bai, X.Q. (2005). Effects of long-term calcium intake on body weight, body fat and bone in growing rats. Osteoporos. Int., 16(12): 1864-1870
- Bortun, A.I., Bortun, L.N. et Clearfield, A. (1997). Evaluation of synthetic inorganic ion exchangers for cesium and strontium removal from contaminated groundwater and wastewater. Solvent Extr. Ion Exch., 15(5): 909-929.
- Bostick, D.T., DePaoli, S.M. et Guo, B. (1997). A comparative evaluation of ionsiv®ie-911 and chabazite zeolite for the removal of radiostrontium and cesium from wastewater. Chemical technology division, Oak Ridge National Laboratory, Tennessee.
- Brennan, T.C., Rybchyn, M.S., Green, W., Atwa, S., Conigrave, A.D. et Mason, R.S. (2009). Osteoblasts play key roles in the mechanisms of action of strontium ranelate. Br. J. Pharmacol., 157(7) : 1291-1300.
- Brisson, I.J. (2014). Strontium stable dans l'eau potable - revue des connaissances et soutien aux directions de santé publique. Institut national de santé publique du Québec (INSPQ) (ed.). Gouvernement du Québec, 7 p. Disponible à l'adresse : www.inspq.qc.ca/bise/article-secondaire-strontium-stable-dans-l-eau-potable-revue-des-connaissances-et-soutien-aux-directions-de-sante-publique
- Brown, J., Hammond, D., et Wilkins, T.Y. (2008). Handbook of assessing the impact of a radiological incident on levels of radioactivity in drinking water and risk to operatives at water treatment works: Supporting scientific report. Health Protection Agency. Center for Radiation, Chemical and Environmental Hazards. Chilton, Didcot, Oxfordshire. ISBN-978-0-85951-621-1.
- Cabrera, W.E., Schrooten, I., De Broe, M.E. et D'Haese, P.C. (1999). Strontium and bone. J. Bone Miner. Res., 14(5): 661-668.
- Caudarella, R., Vescini, F., Buffa, A., Rizzoli, E., Ceccoli, L. et Francucci, C.M. (2011). Role of calcium-sensing receptor in bone biology. J. Endocrinol. Invest., 34(7 Suppl): 13-17.
- CCN (2015). Répertoire des organismes de certification accrédités de produits, de processus et de services. Conseil canadien des normes, Ottawa, Ontario. Disponible à l'adresse : www.scc.ca/fr/accreditation/certification-de-produits-procedes-et-services/repertoire-des-organismes-de-certification-accredites
- Chang, C.T., You, C.F., Aggarwal, S.K., Chung, C.H., Chao, H.C. et Liu, H.C. (2015). Boron and strontium isotope ratios and major/trace elements concentrations in tea leaves at four major tea growing gardens in Taiwan. Environ. Geochem. Health, 38(3): 737-748
- Chang, W., Tu, C., Chen, T.H., Komuves, L., Oda, Y., Pratt, S.A., Miller, S. et Shoback, D. (1999). Expression and signal transduction of calcium-sensing receptors in cartilage and bone. Endocrinology, 140(12): 5883-5893.
- Chen, L.J., Tang, L.Y., He, J.R., Su, Y., Cen, Y.L., Yu, D.D., Wu, B.H., Lin, Y., Chen, W.Q., Song, E.W. et Ren, Z.F. (2012). Urinary strontium and the risk of breast cancer: a case-control study in Guangzhou, China. Environ. Res., 112: 212-217.
- Christoffersen, J., Christoffersen, M.R., Kolthoff, N. et Bärenholdt, O. (1997). Effects of strontium ions on growth and dissolution of hydroxyapatite and on bone mineral detection. Bone, 20(1): 47-54.
- Cianferotti, L., D'Asta, F. et Brandi, M.L. (2013). A review on strontium ranelate long-term antifracture efficacy in the treatment of postmenopausal osteoporosis. Ther. Adv. Musculoskelet. Dis., 5(3): 127-139.
- CIPR (1993). Age-dependent doses to members of the public from intake of radionuclides - Part 2 ingestion dose coefficients. CIPR Publication 67. Ann. CIPR 23 (3-4). Commission Internationale de Protection Radiologique. Disponible à l'adresse : www.icrp.org/publication.asp?id=ICRP%20Publication%2067
- Clifford, D.A. (1999). Ion exchange and inorganic adsorption. Chapitre 9 dans : Letterman, R.D.(ed). Water quality and treatment: a handbook of community water supplies, 5th edition American Water Works Association. Denver, Colorado. McGraw-Hill, New York, New York.
- Clifford, D., Sorg, T. et Ghurye, G. (2011). Ion exchange and adsorption of inorganic contaminants. Chapitre 12 dans : Water quality and treatment: a handbook of community water supplies. 6th edition. American Water Works Association, Denver, Colorado.
- Cohen-Solal, M. (2002). Strontium overload and toxicity: impact on renal osteodystrophy. Nephrol. Dial. Transplant., 17 (Suppl 2): 30-34.
- Cohn, S.H. et Gusmano, E.A. (1967). Kinetics of strontium and calcium skeletal metabolism in the rat. Exp. Biol. Med., 126(1): 79-83.
- Compston, J. (2014). Strontium ranelate lives to fight another day. Maturitas, 78(2): 75-76.
- Cooper, C., Fox, K.M. et Borer, J.S. (2014). Ischaemic cardiac events and use of strontium ranelate in postmenopausal osteoporosis: a nested case-control study in the CPRD. Osteoporos. Int., 25(2): 737-745.
- Curzon, M.E. (1985). The relation between caries prevalence and strontium concentrations in drinking water, plaque, and surface enamel. J. Dent. Res., 64(12): 1386-1388.
- Dabeka, R.W., Huang, R., Pepper, K., Gauthier, B.R., Arbuckle, T., Fraser, W. et Rawn, D.F.K. (2016). Trace element levels in human milk. MIREC Study. Données non publiées. Santé Canada (disponible sur demande)
- Dawson, E.B., Frey, M.J., Moore, T.D. et McGanity, W.J. (1978). Relationship of metal metabolism to vascular disease mortality rates in Texas. Am. J. Clin. Nutr., 31(7): 1188-1197.
- Dean, J. A. (1992). Electrolytes, electromotive force, and chemicalequilibrium. Chapitre 8 dans : Lange's Handbook of Chemistry, 14 th Ed,. McGraw-Hill, New York, New York.
- De Beers Canada (2013). Snap Lake Mine: Strontium response plan. Report No. MV2011L2-0004. File: L020. Disponible à l'adresse : https://mvlwb.com/content/mv2011l2-0004-snap-lake-strontium-response-plan
- Delannoy, P., Bazot, D. et Marie, P.J. (2002). Long-term treatment with strontium ranelate increases vertebral bone mass without deleterious effect in mice. Metab. Clin. Exp., 51(7): 906-911.
- D'Haese, P.C., Schrooten, I., Goodman, W.G., Cabrera, W.E., Lamberts, L.V., Elseviers, M.M., Couttenye, M.M. et De Broe, M.E. (2000). Increased bone strontium levels in hemodialysis patients with osteomalacia. Kidney Int., 57(3): 1107-1114.
- Ding, S., Yang, Y., Huang, H., Liu, H. et Hou, L. (2015). Effects of feed solution chemistry on low pressure reverse osmosis filtration of cesium and strontium. J. Hazard. Mater., 294: 27.
- Dong, D., Derry, L.A. et Lion, L.W. (2003). Pb scavenging from a freshwater lake by Mn oxides in heterogeneous surface coating materials. Water Res., 37, 1662-1666.
- Doublier, A., Farlay, D., Khebbab, M.T., Jaurand, X., Meunier, P.J. et Boivin, G. (2011). Distribution of strontium and mineralization in iliac bone biopsies from osteoporotic women treated long-term with strontium ranelate. Eur. J. Endocrinol., 165(3): 469-476.
- Drug and Therapeutics Bulletin (2017). Strontium ranelate discontinued. BMJ Publishing Group Ltd. Disponible à l'adresse : https://dtb.bmj.com/content/55/8/86.1
- Eisenberg, E. et Gordan, G.S. (1961). Skeletal dynamics in man measured by nonradioactive strontium. J. Clin. Invest., 40: 1809-1825.
- El, S.N. et Rousselet, F. (1981). Effects of stable strontium administration on calcium metabolism with particular reference to low calcium diet. Dans : Handbook of Stable Strontium. Skoryna, S.C. (ed.). Plenum Press, New York. p. 515-544.
- El-Kamash, A.M. (2008). Evaluation of zeolite A for the sorptive removal of Cs+ and Sr2+ ions from aqueous solutions using batch and fixed bed column operations. J. Hazard. Mater., 151(2-3): 432-445.
- El-Rahman, K.M., El-Kamash, A.M., El-Sourougy, M.R. et Abdel-Moniem, N.M. (2006). Thermodynamic modeling for the removal of Cs+, Sr2+, Ca2+ and Mg2+ ions from aqueous waste solutions using zeolite A. J. Radioanal. Nucl. Chem., 268(2): 221-230.
- EMA (2005). Protelos : EPAR - Scientific discussion. European Medicines Agency, non-publié, Londres, Royaume Uni.
- EMA (2012). CHMP Type II variation assessment report. Invented name Protelos. European Medicines Agency, EMEA/H/C/000560/II/0031, Londres, Royaume Uni.
- EMA (2013). PSUR assessment report. Strontium ranelate. European Medicines Agency, EMA/PRAC/136656/2013, Londres, Royaume Uni.
- EMA (2014). Protelos/Osseor to remain available but with further restrictions. European Medicines Agency, EMA/235924/2014, Londres, Royaume Uni.
- Environnement Canada (2012). Évaluation sommaire de la performance des mines de métaux assujetties au Règlement sur les effluents des mines de métaux en 2012. En49-15F-PDF.
- Environnement Canada (2014). Résultats de surveillance du Réseau national de surveillance de la pollution atmosphérique (RNSPA) : Produits de données finales du RNSPA.
- Environnement et Changement climatique Canada (2017). Données nationales de monitoring de la qualité de l'eau à long terme.
- Ferraro, E.F., Carr, R. et Zimmerman, K. (1983). A comparison of the effects of strontium chloride and calcium chloride on alveolar bone. Calcif. Tissue Int., 35(2): 258-260.
- Fischer, D.C., Jensen, C., Rahn, A., Salewski, B., Kundt,,G., D'Haese, P.C., Haffner, D. et Behets, G.J. (2011). Moderate strontium loading induces rickets in rats with mild chronic renal failure. Kidney Blood Press Res., 34(6): 375-381.
- Fowler, J.H. (1991). Barite, celestite and fluorite in Nova Scotia. Information Circular 15. Nova Scotia Department of Natural Resources, Halifax. Disponible à l'adresse : http://novascotia.ca/natr/meb/data/pubs/ic/ic15.pdf
- Friedman, M.J., Hill, A.S., Reiber, S.H., Valentine, R.L., Larsen, G., Young, A., Korshin, G.V. et Peng, C-Y. (2010). Assessment of inorganics accumulation in drinking water system scales and sediments. Water Research Foundation and United States Environmental Protection Agency, Denver, Colorado. Disponible à l'adresse : www.waterrf.org/PublicReportLibrary/3118.pdf
- Fuchs, R. K., Allen, M. R., Condon, K.W., Reinwald, S.,Miller, L. M., McClenathan, D., Keck, B., Phipps, R. J. and Burr, D. B. (2008). Strontium ranelate does not stimulate bone formation in ovariectomized rats. Osteoporosis Intl, 19, 1331-1341.
- Gäfvert, T., Ellmark, C. et Holm, E. (2002). Removal of radionuclides at a waterworks. J. Environ. Radioact., 63(2): 105-115.
- Gaubert, E., Barnier, H., Maurel, A., Foos, J., Guy, A., Bardot, C. et Lemaire, M. (1997). Selective strontium removal from a sodium nitrate aqueous medium by nanofiltration - complexation. Sep. Sci. Technol., 32(1-4): 585-597.
- Genuis, S.J. et Bouchard, T.P. (2012). Combination of micronutrients for bone (COMB) study: bone density after micronutrient intervention. J. Environ. Public. Health., 2012: 354151.
- Gerke, T.L., Little, B.J., Luxton, T.P., Scheckel, K.G. et Maynard, L. (2013). Strontium concentrations in corrosion products from residential drinking water distribution systems. Environ. Sci. Technol, 47: 5171.
- Gerke, T.L., Little, B.J., Luxton, T.P., Scheckel, K.G., Maynard, J.B. et Szabo, J. (2014). Strontium adsorption and desorption reactions in model drinking water distribution system. J. Water Supply: Res. Tech.-AQUA, 63(6): 449.
- Gerke, T.L., Little, B.J. et Barry Maynard, J. (2016). Manganese deposition in drinking water distribution systems. Sci. Total Environ., 541: 184-193.
- Ghosh, S., Talukder, G. et Sharma, A. (1990). Clastogenic activity of strontium chloride on bone marrow cells in vivo. Biol. Trace Elem. Res., 25(1): 51-56.
- Gouvernement du Canada (2003). Règlement sur les produits de santé naturels. DORS/2003-196. Disponible à l'adresse : http://laws-lois.justice.gc.ca/fra/reglements/DORS-2003-196/
- Grynpas, M.D., Marie, P.J. (1990) Effects of low doses of strontium on bone quality and quantity in rats. Bone. 11(5): 313-319.
- Grynpas, M.D., Hamilton, E., Cheung, R., Tsouderos, Y., Deloffre, P., Hott, M. et Marie, P.J. (1996). Strontium increases vertebral bone volume in rats at a low dose that does not induce detectable mineralization defect. Bone, 18(3): 253-259.
- Hamdy, N.A. (2009). Strontium ranelate improves bone microarchitecture in osteoporosis. Rheumatology (Oxford), 48 Suppl 4: iv9-13.
- Hamilton, S.M. (2015). Ambient groundwater geochemistry data for southern Ontario, 2007-2014. Ontario Geological Survey, Miscellaneous Release-Data 283-Revised Queen's Printer for Ontario. Disponible à l'adresse : www.geologyontario.mndm.gov.on.ca/mndmfiles/pub/data/imaging/MRD283-REV//MRD283-REV.pdf
- Harrison, G.E., Sutton, A., Shepherd, H. et Widdowson, E.M. (1965). Strontium balance in breast-fed babies. Br. J. Nutr., 19: 111-117.
- Harrison, G., Howells, G., Pollard, J., Kostial, K., and Manitaševi´c, R. (1966). Effect of dietary phosphorus supplementation on the uptake of radioactive strontium in rats. Br. J. Nutr., 20(3): 561-569.
- Hendrix, Z.J., Alcock, N.W. et Archibald, R.M. (1963). Competition between calcium, strontium, and magnesium for absorption in the isolated rat intestine. Clin. Chem., 12: 734-744.
- Hendrych, M., Olejnickova, V. et Novakova, M. (2016). Calcium versus strontium handling by the heart muscle. Gen. Physiol. Biophys., 35(1): 13-23.
- Heuel-Fabianek, B. (2014). Partition coefficients (Kd) for the modelling of transport processes of radionuclides in groundwater. Division of Safety and Radiation Protection, Berichte des Forschungszentrums Jülich (ed.). Helmholtz Association of German Research Centres, 51 p. Disponible à l'adresse : www.researchgate.net/publication/303250933 _Partition_Coefficients_Kd_for_the_Modelling_of_Transport_Processes_of_Radionuclides_in_Groundwater
- Holick, M.F. (2010). The vitamin D deficiency pandemic: a forgotten hormone important for health. Public Health Rev., 32: 267-283.
- Höllriegl, V., Röhmu, M., Oeh, J., Werner, E. et Roth, P. (2004). Reduction in the absorption of dietary strontium in man by nutritional factors. GSF-National Research Center for Environment and Health, Institute of Radiation Protection, In: Proceedings of the 11th International Congress of the International Radiation Protection Association, Madrid, Spain, May 23-28, 2004). International Radiation Protection Association, Neuherberg, Germany. Disponible à l'adresse : www.ipen.br/biblioteca/cd/irpa/2004/files/6d6.pdf
- Hood (ed.). (2006). Developmental and reproductive toxicology: A practical approach. Taylor & Francis. CRC, Florida.
- Huang, J., Wu, J., Li, T., Song, X., Zhang, B., Zhang, P. et Zheng, X. (2011). Effect of exposure to trace elements in the soil on the prevalence of neural tube defects in a high-risk area of China. Biomed. Environ. Sci., 24(2): 94-101.
- Humphrey, L.T., Dean, M.C., Jeffries, T.E. et Penn, M. (2008). Unlocking evidence of early diet from tooth enamel. Proc. Natl. Acad. Sci. U. S. A., 105(19): 6834-6839.
- Hunt, J.R., Hunt, C.D., Zito, C.A., Idso, J.P. et Johnson, L.K. (2008). Calcium requirements of growing rats based on bone mass, structure, or biomechanical strength are similar. J. Nutr., 138(8): 1462-1468.
- Hurtel-Lemaire, A.S., Mentaverri, R., Caudrillier, A., Cournarie, F., Wattel, A., Kamel, S., Terwilliger, E.F., Brown, E.M. et Brazier, M. (2009). The calcium-sensing receptor is involved in strontium ranelate-induced osteoclast apoptosis. New insights into the associated signaling pathways. J. Biol. Chem., 284(1): 575-584.
- Hwang, E., Lee, K., Choo, K., Choi, S., Kim, S., Yoon, C. et Lee, C. (2002). Effect of precipitation and complexation on nanofiltration of strontium-containing nuclear wastewater. Desalination, 147(1-3): 289-294.
- Ilyin, L.A., Ivannikov, A.T., Parfenov, Y.D. et Stolyarov, V.P. (1975). Strontium absorption through damaged and undamaged human skin. Health Phys., 29(1): 75-80.
- Ivanets, A.I., Shashkova, I.L., Kitikova, N.V., Drozdova, N.V., Saprunova, N.A., Radkevich, A.V. et Kulbitskaya, L.V. (2014). Sorption of strontium ions from solutions onto calcium and magnesium phosphates. Radiochemistry, 56(1): 32-37.
- Jiménez, A. et De La Montaña Rufo, M. (2002). Effect of water purification on its radioactive content. Water Res., 36(7): 1715-1724.
- Johnson, A.R., Armstrong, W.D. et Singer, L. (1968). The incorporation and removal of large amounts of strontium by physiologic mechanisms in mineralized tissues. Calcif. Tissue Res., 2(3): 242-252.
- Jonville-Bera, A.P. et Autret-Leca, E. (2011). Adverse drug reactions of strontium ranelate (Protelos((R)) in France. Presse Med., 40(10): e453-e462.
- Kaats, G.R., Preuss, H.G., Croft, H.A., Keith, S.C. et Keith, P.L. (2011). A comparative effectiveness study of bone density changes in women over 40 following three bone health plans containing variations of the same novel plant-sourced calcium. Int. J. Med. Sci., 8(3): 180-191.
- Kahn, B., Straub, C.P., Robbins, P.J., Wellman, H.N., Seltzer, R.A. et Telles, N.C. (1969). Intake, excretion, and retention of stable strontium. Pediatrics, 43(4): 687-705.
- Kanematsu, N., Hara, M. et Kada, T. (1980). Rec assay and mutagenicity studies on metal compounds. Mutat. Res., 77(2): 109-116.
- Kaplan, L.J. et Kellum, J.A. (2010). Fluids, pH, ions and electrolytes. Current Opinion in Critical Care. Curr. Opin. Crit. Care, 16(4): 323-331.
- Kaufman, J.M., Audran, M., Bianchi, G., Braga, V., Diaz-Curiel, M., Francis, R.M., Goemaere, S., Josse, R., Palacios, S., Ringe, J.D., Felsenberg, D. et Boonen, S. (2013). Efficacy and safety of strontium ranelate in the treatment of osteoporosis in men. J. Clin. Endocrinol. Metab., 98(2): 592-601.
- Kikuchi, H., Iwane, S., Munakata, A., Tamura, K., Nakaji, S. et Sugawara, K. (1999). Trace element levels in drinking water and the incidence of colorectal cancer. Tohoku J. Exp. Med., 188(3): 217-225.
- Kirsch, T., Wang, W. et Pfander, D. (2003). Functional differences between growth plate apoptotic bodies and matrix vesicles. J. Bone Miner. Res., 18(10): 1872-1881.
- Kostial, K., Gruden, N. et Durakovic, A. (1969). Intestinal absorption of calcium-47 and strontium-85 in lactating rats. Calcif. Tissue Res., 4(1): 13-19.
- Kostial, K., Gruden, N., Duraković, A., Juvancic, V. and Simonović, I. (1972). Reduction in strontium absorption in pregnant, lactating and suckling rats. Acta Radiol Ther Phys Biol. 11(3): 277-87.
- Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39-51.
- Kroes, R., den Tonkelaar, E.M., Minderhoud, A., Speijers, G.J., Vonk-Visser, D.M., Berkvens, J.M. et van Esch, G.J. (1977). Short-term toxicity of strontium chloride in rats. Toxicology, 7(1): 11-21.
- Kshirsagar, S.G. (1976). Effect of stable strontium on the tissue alkaline and acid phosphatase activities of rat: feeding studies. J. Nutr., 106(10): 1475-1483.
- Kshirsagar, S.G. (1985). Effect of age on strontium-calcium discrimination by rat tissues. Indian. J. Exp. Biol., 23(7): 366-369.
- Kulyukhin, S.A., Krasavina, E.P., Mizina, L.V., Rumer, I.A., Tanashchuk, N.V. et Konovalova, N.A. (2005). Sorption of iodine, cesium, and strontium radionuclides on alkaline-earth hydroxyphosphates from aqueous solutions. Radiochemistry, 47(1): 84-88.
- Lansdown, A.B., Longland, R.C. et Grasso, P. (1972). Reduced foetal calcium without skeletal malformations in rats following high maternal doses of a strontium salt. Experientia, 28(5): 558-560.
- Lee, S.S. (2008). The effect of dissolved organic matter on distribution of heavy metals at the mica-water interface. ProQuest, Chicago, Illinois. 111 pp.
- Leeuwenkamp, O.R., van der Vijgh, W.J., Husken, B.C., Lips, P. et Netelenbos, J.C. (1990). Human pharmacokinetics of orally administered strontium. Calcif. Tissue Int., 47(3): 136-141.
- Li, W.B., Höllriegl, V., Roth, P. et Oeh, U. (2006). Human biokinetics of strontium. Part I: Intestinal absorption rate and its impact on the dose coefficient of 90Sr after ingestion. Radiat. Environ. Biophys., 45(2): 115-124.
- Li, Z., Peng, S., Pan, H., Tang, B., Lam, R.W. et Lu, W.W. (2012). Microarchitecture and nanomechanical properties of trabecular bone after strontium administration in osteoporotic goats. Biol. Trace Elem. Res., 145(1): 39-46.
- Li, Z., He, M., Peng, B. et Jin, Z. (2013). Strontium concentrations and isotope ratios in enamel of healthy and carious teeth in southern Shaanxi, China. Rapid Commun. Mass Spectrom., 27(17): 1919-1924.
- Liang, S., Morton, R., Tang, C., Barry, J., Knapp, T. et Smal, N. (2011). Pilot study of advanced water treatment processes to purify secondary effluent. Proceedings of the American Water Works Association Water Quality Technology Conference & Exposure. Phoenix, Arizona. Disponible à l'adresse : www.ingentaconnect.com/content/wef/ wefproc/2011/00002011/00000014/art00046?crawler=true
- Lippert, F. et Hara, A.T. (2013). Strontium and caries: a long and complicated relationship. Caries Res., 47(1): 34-49.
- Llinas, P., Masella, M., Stigbrand, T., Menez, A., Stura, E.A. et Le Du, M.H. (2006). Structural studies of human alkaline phosphatase in complex with strontium: implication for its secondary effect in bones. Protein Sci., 15(7): 1691-1700.
- Loeb, L.A., Sirover, M.A., Weymouth, L.A., Dube, D.K., Seal, G., Agarwal, S.S. et Katz, E. (1977). Infidelity of DNA synthesis as related to mutagenesis and carcinogenesis. J. Toxicol. Environ. Health, 2(6): 1297-1304.
- Lytle, D.A., Sorg, T.J and Frietch, C. (2004). Accumulation of arsenic in drinking water distribution systems. Environ. Sci. Technol. 38(20): 5365-5372.
- Lytle, D., Chait, H., Vu, K et O'Donnell, A. (2015). Removal of strontium from drinking water: pilot and full scale studies. Proceedings of the American Water Works Association Water Quality Technology Conference, Salt Lake City, Utah
- MacDonald, N.S., Nusbaum, R.E., Stearns, R., Ezmislian, F., McArthur, C. et Spain, P. (1951). The skeletal deposition of non-radioactive strontium. J. Biol. Chem., 188(1): 137-143.
- MacMillan, J.P., Park, J.W., Gerstenberg, R., Wagner, H., Köhler, K. et Wallbrecht, P. (2000). Strontium and strontium compounds. Dans : Ullmann's encyclopedia of industrial chemistry. Wiley-VCH. (ed.). p. 473-480.
- Malina, G. (2004). Ecotoxicological and environmental problems associated with the former chemical plant in Tarnowskie Gory, Poland. Dans : Challenges for toxicology from large contamination sites. Toxicology, 205(3): 157-172.
- Manitoba Conservation and Water Stewardship (2016). Communication personnelle avec J. Muenster et K. Philip.
- Marie, P.J. et Hott, M. (1986). Short-term effects of fluoride and strontium on bone formation and resorption in the mouse. Metabolism, 35(6): 547-551.
- Marie, P.J., Garba, M.T., Hott, M. et Miravet, L. (1985). Effect of low doses of stable strontium on bone metabolism in rats. Miner. Electrolyte Metab., 11(1): 5-13.
- Marie, P.J., Hott, M., Modrowski, D., De Pollak, C., Guillemain, J., Deloffre, P. et Tsouderos, Y. (1993). An uncoupling agent containing strontium prevents bone loss by depressing bone resorption and maintaining bone formation in estrogen-deficient rats. J. Bone Miner. Res., 8(5): 607-615.
- Marinin, D. et Brown, G. (2000). Studies of sorbent/ion exchange material for the removal of radioactive strontium from liquid radioactive waste and high hardness groundwater. Waste Manag., 20: 545.
- Marshall, B. (2013). Facts and figures of the Canadian mining industry. The Mining Association of Canada. West Coast Editorial Associates / Wet Frog Studios. Disponible à l'adresse : http://mining.ca/sites/default/files/documents/ FactsandFigures2013.pdf
- Matsumoto, A. (1976). Effect of strontium on the epiphyseal cartilage plate of rat tibiae-histological and radiographic studies. Jpn. J. Pharmacol., 26(6): 675-681.
- McCauley, R.F., et Eliassen, R. (1955). Radioactive -strontium removal by lime-soda softening. J. Am. Water Works Assoc. 47(5): 494-502.
- Meunier, P.J., Roux, C., Seeman, E., Ortolani, S., Badurski, J.E., Spector, T.D., Cannata, J., Balogh, A., Lemmel, E.M., Pors-Nielsen, S., Rizzoli, R., Genant, H.K. et Reginster, J.Y. (2004). The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N. Engl. J. Med., 350(5): 459-468.
- Meunier, P.J., Roux, C., Ortolani, S., Diaz-Curiel, M., Compston, J., Marquis, P., Cormier, C., Isaia, G., Badurski, J., Wark, J.D., Collette, J. et Reginster, J.Y. (2009). Effects of long-term strontium ranelate treatment on vertebral fracture risk in postmenopausal women with osteoporosis. Osteoporos. Int., 20(10): 1663-1673.
- Michalek, J.E., Preuss, H.G., Croft, H.A., Keith, P.L., Keith, S.C., Dapilmoto, M., Perricone, N.V., Leckie, R.B. et Kaats, G.R. (2011). Changes in total body bone mineral density following a common bone health plan with two versions of a unique bone health supplement: a comparative effectiveness research study. Nutr. J., 10(1): 32.
- Ministère du Développement durable, de l'Environnement et de la Lutte contre les changements climatiques (2016). Communication personnelle avec C. Robert et A. Bolduc.
- Moise, H., Adachi, J.D., Chettle, D.R. et Pejović-Milić, A. (2012). Monitoring bone strontium levels of an osteoporotic subject due to self-administration of strontium citrate with a novel diagnostic tool, in vivo XRF: A case study. Bone, 51(1): 93-97.
- Moroas, M.E., Aronson, J.K. et Grahame-Smith, D.G. (1991). Intravenous strontium gluconate as a kinetic marker for calcium in healthy volunteers. Br. J. Clin. Pharmacol., 31(4): 423-427.
- Morohashi, T., Sano, T. et Yamada, S. (1994). Effects of strontium on calcium metabolism in rats. I. A distinction between the pharmacological and toxic doses. Jpn. J. Pharmacol., 64(3): 155-162.
- Myers, A.G., Snoeyink, V.L. et Snyder, D.W. (1985). Removing barium and radium through calcium cation exchange. J. Am. Water Works Assoc., 77(5): 60-66.
- Najm, I. (2016). Strontium in water: Critical review of its treatment options and considerations for its removal. Water Research Foundation. ISBN 978-1-60573-239-8. Disponible à l'adresse : www.waterrf.org/Pages/Projects.aspx? PID=4604
- Nakaji, S., Fukuda, S., Sakamoto, J., Sugawara, K., Shimoyama, T., Umeda, T. et Baxter, D. (2001). Relationship between mineral and trace element concentrations in drinking water and gastric cancer mortality in Japan. Nutr. Cancer, 40(2): 99-102.
- National Research Council (U.S.) (1995). Nutrient requirements of laboratory animals. Fourth Revised Edition. Committee on Animal Nutrition. National Academy of Sciences, National Research Council, Washington, D.C. Disponible à l'adresse : www.nap.edu/catalog/4758/nutrient-requirements-of-laboratory-animals-fourth-revised-edition-1995
- Neufeld, E.B. et Boskey, A.L. (1994). Strontium alters the complexed acidic phospholipid content of mineralizing tissues. Bone, 15(4): 425-430.
- New Brunswick Department of Health (2016). Communication personnelle avec K. Gould.
- Newfoundland and Labrador Department of Environment and Conservation (2015). Communication personnelle avec H. Khan.
- Nghiem, L. D. et Schafer, A. I. (2004). Trace contaminant removal with nanofiltration. Chapitre 20 dans : Nanofiltration-principals and applications. Schafer, A. I., Waite, T. D., et Fane, A. G (Eds).
- Nielsen, S.P. (2004). The biological role of strontium. Bone, 35(3): 583-588.
- NIER (2006). Combined repeated dose toxicity study with the reproduction/developmental toxicity screening test of strontium sulfate in rats (Report No. R06139), tested by Biotoxtech. Incheon, National Institute of Environmental Research [cité par l'OCDE, 2007].
- Nova Scotia Environment (2016). Communication personnelle avec C. Mosher.
- NSF (2005a). ETV report: Removal of chemical contaminants in drinking water - EcoWater systems incorporated ERO-R450E Drinking Water Treatment System. NSF 05/14b/EPADWCTR (EPA/600/R-05/122), NSF International for the U.S. Environmental Protection Agency, Washington, DC.
- NSF (2005b). ETV report: Removal of chemical contaminants in drinking water - Pall/Kinetico Purefecta™ Drinking Water Treatment System. NSF 05/13b/EPADWCTR, NSF International for the U.S. Environmental Protection Agency, Washington, DC.
- NSF (2006a). ETV report: Removal of chemical and microbial contaminants in drinking water Watts Premier, Inc. M-2400 Point-of-Entry Reverse Osmosis Drinking Water Treatment System. NSF 06/23/EPADWCTR (EPA/600/R-06/101), NSF International for the U.S. Environmental Protection Agency, Washington, DC.
- NSF (2006b). ETV report: removal of chemical contaminants in drinking water - Watts Premier, Inc. WP-4V Drinking Water Treatment System. EPA/600/R-06/005), NSF International for the U.S. Environmental Protection Agency, Washington, DC.
- O'Donnell, A.J. et Lytle, D.A. (2014). Full scale and bench scale studies on the removal of strontium from water. Proceedings of the American Water Works Association Annual Conference & Exposure. Cincinnati, Ohio.
- O'Donnell, A.J., Lytle, D.A., Harmon, S., Vu, K., Chait, H. et Dionysiou, D. (2016). Removal of strontium from drinking water by conventional treatment and lime softening in bench-scale study. Water Res. 103:319-333.
- Ober, J.A. (2006). Strontium minerals. Dans : Industrial minerals & rocks: commodities, markets, and uses. Kogel, J.E. (ed.). Society for Mining, Metallurgy, and Exploration, Inc., U.S., p. 925-934.
- Ober, J.A. (2014). Strontium. Dans : 2012 Minerals yearbook, volume I. Metals and minerals. U.S. Geological Survey. Strontium. Advance Release.
- OCDE (1997). Test No. 475: Mammalian bone marrow chromosome aberration test. Organisation de coopération et de développement économiques.
- OCDE (2007). SIDS initial assessment report for SIAM 24 (Paris, France, 17-20 April 2007). Paris, Organisation de coopération et de développement économiques, Direction de l'environnement.
- OMS (2010). Strontium and strontium compounds. Concise international chemical assessment document 77. Programme international sur la sécurité des substances chimiques, Organisation mondiale de la Santé.
- Osborne, V., Layton, D., Perrio, M., Wilton, L. et Shakir, S.A. (2010). Incidence of venous thromboembolism in users of strontium ranelate: an analysis of data from a prescription-event monitoring study in England. Drug Saf., 33(7): 579-591.
- Oste, L., Bervoets, A.R., Behets, G.J., Dams, G., Marijnissen, R.L., Geryl, H., Lamberts, L.V., Verberckmoes, S.C., Van Hoof, V.O., De Broe, M.E. et D'Haese, P.C. (2005). Time-evolution and reversibility of strontium-induced osteomalacia in chronic renal failure rats. Kidney Int., 67(3): 920-930.
- Ouvrard, S., Simonnot, M-O. et Sardin, M. (2002). Reactive behavior of natural manganese oxides toward the adsorption of phosphate and arsenate. Ind. Eng. Chem. Res., 41, 2785-2791.
- Ozgur, S., Sumer, H. et Kocoglu, G. (1996). Rickets and soil strontium. Arch. Dis. Child., 75(6): 524-526.
- Palmer, R.F. et Thompson, R.C. (1964). Strontium-calcium interrelationships in the growing rat. Am. J. Physiol., 207: 561-566.
- Papworth, D.G. et Vennart, J. (1984). The uptake and turnover of 90Sr in the human skeleton. Phys. Med. Biol., 29(9): 1045-1061.
- Pemmer, B., Roschger, A., Wastl, A., Hofstaetter, J.G., Wobrauschek, P., Simon, R., Thaler, H.W., Roschger, P., Klaushofer, K. et Streli, C. (2013). Spatial distribution of the trace elements zinc, strontium and lead in human bone tissue. Bone, 57(1): 184-193.
- Pertinez, H., Chenel, M. et Aarons, L. (2013). A physiologically based pharmacokinetic model for strontium exposure in rat. Pharm. Res., 30(6): 1536-1552.
- Pi, M. et Quarles, L.D. (2004). A novel cation-sensing mechanism in osteoblasts is a molecular target for strontium. J. Bone Miner. Res., 19(5): 862-869.
- Querido, W., Rossi, A.L. et Farina, M. (2016). The effects of strontium on bone mineral: A review on current knowledge and microanalytical approaches. Micron, 80: 122-134.
- Rabideau, A. J., van Benschoten, J., Patel, A. et Bandilla, K (2005). Performance assessment of a zeolite treatment wall for removing Sr-90 from groundwater. J. Contam. Hydrol., 79: 1-24.
- Rasmussen, P.E., Subramanian, K.S. et Jessiman, B.J. (2001). A multi-element profile of housedust in relation to exterior dust and soils in the city of Ottawa, Canada. Sci. Total Environ., 267(1-3): 125-140.
- Reginster, J.Y. (2014). Cardiac concerns associated with strontium ranelate. Expert Opin. Drug Saf., 13(9): 1209-1213.
- Reginster, J.Y. et Meunier, P.J. (2003). Strontium ranelate phase 2 dose-ranging studies: PREVOS and STRATOS studies. Osteoporos. Int., 14 Suppl 3: S56-65.
- Reginster, J.Y., Hiligsmann, M. et Bruyere, O. (2010). Strontium ranelate: long-term efficacy against vertebral, nonvertebral and hip fractures in patients with postmenopausal osteoporosis. Ther. Adv. Musculoskelet. Dis., 2(3): 133-143.
- Reginster, J.Y., Pelousse, F. et Bruyere, O. (2013). Safety concerns with the long-term management of osteoporosis. Expert Opin. Drug Saf., 12(4): 507-522.
- Reginster, J.Y., Neuprez, A., Dardenne, N., Beaudart, C., Emonts, P. et Bruyere, O. (2014). Efficacy and safety of currently marketed anti-osteoporosis medications. Best Pract. Res. Clin. Endocrinol. Metab., 28(6): 809-834.
- Reginster, J.Y., Brandi, M.L., Cannata-Andia, J., Cooper, C., Cortet, B., Feron, J.M., Genant, H., Palacios, S., Ringe, J.D. et Rizzoli, R. (2015). The position of strontium ranelate in today's management of osteoporosis. Osteoporos. Int., 26(6): 1667-1671.
- Reinholt, F.P., Hjerpe, A., Jansson, K. et Engfeldt, B. (1984). Stereological studies on the epiphyseal growth plate in strontium-induced rickets. With special reference to the distribution of matrix vesicles. J. Bone Joint Surg. Am., 66(8): 1274-1280.
- Richards, L., Richards, B. et Schäfer, A. (2011). Salt and inorganic contaminant removal by renewable energy powered nanofiltration/reverse osmosis J. Membr. Sci., 369(1-2): 188.
- Roschger, P., Manjubala, I., Zoeger, N., Meirer, F., Simon, R., Li, C., Fratzl-Zelman, N., Misof, B.M., Paschalis, E.P., Streli, C., Fratzl, P. et Klaushofer, K. (2010). Bone material quality in transiliac bone biopsies of postmenopausal osteoporotic women after 3 years of strontium ranelate treatment. J. Bone Miner. Res., 25(4): 891-900.
- Roux, C., Fechtenbaum, J., Kolta, S., Isaia, G., Andia, J.B. et Devogelaer, J.P. (2007). Strontium ranelate reduces the risk of vertebral fracture in young postmenopausal women with severe osteoporosis. Ann. Rheum. Dis., 67(12): 1736-1738.
- Rybchyn, M.S., Slater, M., Conigrave, A.D. et Mason, R.S. (2011). An Akt-dependent increase in canonical Wnt signaling and a decrease in sclerostin protein levels are involved in strontium ranelate-induced osteogenic effects in human osteoblasts. J. Biol. Chem., 286(27): 23771-23779.
- Sairanen, S., Karkkainen, M., Tahtela, R., Laitinen, K., Makela, P., Lamberg-Allardt, C. et Valimaki, M.J. (2000). Bone mass and markers of bone and calcium metabolism in postmenopausal women treated with 1,25-dihydroxyvitamin D (Calcitriol) for four years. Calcif. Tissue Int., 67(2): 122-127.
- Santé Canada (1994). Loi canadienne sur la protection de l'environnement. L'évaluation du risque à la santé humaine des substances d'intérêt prioritaire. Ministre des Approvisionnements et Services Canada, Ottawa, Ontario.
- Santé Canada (2007a). Apports alimentaires moyens (µg/kg poids corporel/jour) de microéléments chez les Canadiens de différents groupes d'âge-sexe, Étude de la diète totale menée entre 1993 et 1996. Bureau d'innocuité des produits chimiques, Direction générale des produits de santé et des aliments, Ottawa, Ontario. Disponible à l'adresse : www.canada.ca/fr/sante-canada/services/aliments-nutrition/surveillance-aliments-nutrition/etude-canadienne-alimentation-totale/apports-alimentaires-contaminants-autres-produits-chimiques-chez-canadiens-selon-groupes-sexe/apports-alimentaires-moyens-poids-corporel-jour-microelements-chez-canadiens-differents-groupes-sexe-etude-diete-totale-menee-entre-1993.html
- Santé Canada (2007b). Tableaux des apports nutritionnels de référence. Bureau d'innocuité des produits chimiques, Direction générale des produits de santé et des aliments, Ottawa, Ontario.
- Santé Canada (2009). Recommandations pour la qualité de l'eau potable au Canada : Document technique - Paramètres radiologiques, Bureau de la radioprotection, Direction générale de la santé environnementale et de la sécurité des consommateurs, Ottawa, Ontario. Disponible à l'adresse : www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-parametres-radiologiques.html
- Santé Canada (2015a). Résumé de l'examen de l'innocuité - strontium - risque d'effets secondaires de nature cardiaque et circulatoire. Direction générale des produits de santé et des aliments, Ottawa, Ontario. Disponible à l'adresse : www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/medeffet-canada/examens-innocuite/resume-examen-innocuite-strontium-risque-nature-cardiaque-circulatoire.html
- Santé Canada (2015b). Produits de santé contenant du strontium - Nouvelles restrictions en raison d'un possible risque de troubles cardiaques et circulatoires. RA-55524. Disponible à l'adresse : http://canadiensensante.gc.ca/recall-alert-rappel-avis/hc-sc/2015/55524a-fra.php
- Santé Canada (2015c). Communication personnelle avec A.-M. Tugulea.
- Saskatchewan Water Security Agency (2015). Communication personnelle avec S. Ferris.
- Sato, I., Kudo, H. et Tsuda, S. (2011). Removal efficiency of water purifier and adsorbent for iodine, cesium, strontium, barium, and zirconium in drinking water. J. Toxicol. Sci., 36(6): 829-834.
- Schaep, J., Van der Bruggen, B., Vandecasteele, C. et Wilms, D. (1998). Influence of ion size and charge in nanofiltration. Sep. Purif. Technol., 14(1-3): 155-162.
- Schock, M.R. (2005). Distribution systems and reservoirs and reactors for inorganic contaminants. Chapitre 6 dans : Distribution water quality challenges in the 21st century, 1e édition. American Water Works Association, Denver, Colorado.
- Schock, M.R. et Holm, T.R. (2003). Are we monitoring in the right places for metals and radionuclides? Journal of the New England Water Works Association, 141(2):102.
- Schock, M. et Lytle, D. (2011). Internal corrosion and deposition control. Chapitre 20 dans : Water quality and treatment: a handbook on drinking water. American Water Works Association, Denver, Colorado.
- Schock, M.R., Cantor, A.F., Triantafyllidou, S., Desantis, M.K. et Scheckel, K.G. (2014). Importance of pipe deposits to Lead and Copper Rule compliance. J. Am. Water Works Assoc., 106(7), E336-E349.
- Schroeder, H.A., Tipton, I.H. et Nason, A.P. (1972). Trace metals in man: strontium and barium. J. Chronic Dis., 25(9): 491-517.
- Schrooten, I., Cabrera, W., Goodman, W.G., Dauwe, S., Lamberts, L.V., Marynissen, R., Dorrine, W., De Broe, M.E. et D'Haese, P.C. (1998). Strontium causes osteomalacia in chronic renal failure rats. Kidney Int., 54(2): 448-456.
- Schrooten, I., Elseviers, M.M., Lamberts, L.V., De Broe, M.E. et D'Haese, P.C. (1999). Increased serum strontium levels in dialysis patients: an epidemiological survey. Kidney Int., 56(5): 1886-1892.
- Servier laboratories (2016). Protelos: summary of product characteristics. Disponible à l'adresse : https://www.medicines.org.uk/emc/product/5598/smpc
- Shagina, N.B., Fell, T.P., Tolstykh, E.I., Harrison, J.D. et Degteva, M.O. (2015a). Strontium biokinetic model for the pregnant woman and fetus: application to Techa River studies. J. Radiol. Prot., 35(3): 659-676.
- Shagina, N.B., Tolstykh, E.I., Degteva, M.O., Anspaugh, L.R. et Napier, B.A. (2015b). Age and gender specific biokinetic model for strontium in humans. J. Radiol. Prot., 35(1): 87-127.
- Shagina, N.B., Tolstykh, E.I., Fell, T.P., Smith, T.J., Harrison, J.D. et Degteva, M.O. (2015c). Strontium biokinetic model for the lactating woman and transfer to breast milk: application to Techa River studies. J. Radiol. Prot., 35(3): 677-694.
- Shibata, S. et Yamashita, Y. (2001). An ultrastructural study of osteoclasts and chondroclasts in poorly calcified mandible induced by high doses of strontium diet to fetal mice. Ann. Anat., 183(4): 357-361.
- Shorr, E. et Carter, A.C. (1952). The usefulness of strontium as an adjuvant to calcium in the remineralization of the skeleton in man. Bull. Hosp. Joint Dis., 13(1): 59-66.
- Sips, A.J., van der Vijgh, W.J., Barto, R. et Netelenbos, J.C. (1996). Intestinal absorption of strontium chloride in healthy volunteers: pharmacokinetics and reproducibility. Br. J. Clin. Pharmacol., 41(6): 543-549.
- Sivaiah, M.V., Venkatesan, K.A., Krishna, R.M., Sasidhar, P. et Murthy, G.S. (2005). Ion exchange properties of strontium on in situ precipitated polyantimonic acid in amberlite XAD-7. Sep. Purif. Technol., 44(1): 1-9.
- Skoryna, S.C. (1981). Effects of oral supplementation with stable strontium. Can. Med. Assoc. J., 125(7): 703-712.
- Skougstad, M.W. et Horr, C.A. (1963). Occurrence and distribution of strontium in natural water. Geological Survey Water-Supply Paper 1496-D. U.S. Atomic Energy Commission. U.S. Dept. of the Interior, Washington. Disponible à l'adresse : https://pubs.usgs.gov/wsp/1496d/report.pdf
- Snoeyink, V.L., Cairns-Chambers, C. et Pfeffer, J.L. (1987). Strong-acid ion exchange for removing barium, radium, and hardness. J. Am. Water Works Assoc., 79(8): 66-72.
- Société canadienne du cancer (2017). Metastases osseuses. Disponible à l'adresse : www.cancer.ca/fr-ca/cancer-information/cancer-type/metastatic-cancer/bone-metastases
- Sorg, T. J. et Logsdon, G. S. (1980). Treatment technology to meet the interim primary drinking water regulations for inorganics: Part 5. J. Am. Water Works Assoc., 72 (7):411-422.
- Spencer, B.B., Wang, H. et Anderson, K.K. (2000). Thermal conductivity of IONSIV IE-911 crystalline silicotitanate and Savannah River waste simulant solutions, ORNL/TM-2000/285, Oak Ridge National Laboratory, Tennessee. Disponible à l'adresse : https://info.ornl.gov/sites/publications/Files/Pub57520.pdf
- Statistique Canada (2004). Enquête sur la santé dans les collectivités canadiennes cycle 2.2, nutrition. Apports nutritionnels provenant des aliments. Tableaux de données sommaires provinciales, régionales et nationales.
- Stevenson, F.J. et Fitch, A. (1986). Chemistry of complexation of metal ions with soil solution organics. Chapitre 2 dans : Huang P.M. et Schnitzer, M. (éd.). Interaction of soil, minerals with natural organics and microbes. Soil Science Society of America. Madison, Wisconsin, p.29-58
- Storey, E. (1961). Strontium "rickets": bone, calcium and strontium changes. Australas. Ann. Med., 10: 213-222.
- Storey, E. (1962). Intermittent bone changes and multiple cartilage defects in chronic strontium rickets in rats. J. Bone Joint Surg. Br., 44-B: 194-208.
- Storey, E. (1968). Calcium and strontium changes in bone associated with continuous administration of stable strontium to rats. Arch. Biochem. Biophys., 124(1): 575-581.
- Subramani, A., Liu, L., Balbis, E., Schers, G., Lehman, G. et Jacangelo, J. (2010). Application of new generation reverse osmosis membranes for treatment of surface water with high organic content. Proceedings of the American Water Works Association Water Quality Technology Conference, Savannah, Georgia.
- Subramonian, S., Clifford, D. et Vijjeswarapu, W. (1990). Evaluating ion exchange for removing radium from groundwater. J. Am. Water Works Assoc., 82(5): 61-70.
- Sutton, A., Shepherd, H., Harrison, G.E. et Barltrop, D. (1971). Excretion and retention of stable strontium in children. Nature, 230(5293): 396-397.
- Svanstrom, H., Pasternak, B. et Hviid, A. (2014). Use of strontium ranelate and risk of acute coronary syndrome: cohort study. Ann. Rheum. Dis., 73(6): 1037-1043.
- Svensson, O., Hjerpe, A., Reinholt, F.P., Wikstrom, B. et Engfeldt, B. (1985). The effect of strontium and manganese on freshly isolated chondrocytes. Acta Pathol. Microbiol. Immunol. Scand. A., 93(3): 115-120.
- Svensson, O., Reinholt, F.P. et Engfeldt, B. (1987). The parathyroid gland in metal rickets. A stereological study. Acta Pathol. Microbiol. Immunol. Scand. A., 95(6): 309-314.
- Tan, E.L., Williams, M.W., Schenley, R.L., Perdue, S.W., Hayden, T.L., Turner, J.E. et Hsie, A.W. (1984). The toxicity of sixteen metallic compounds in Chinese hamster ovary cells. Toxicol. Appl. Pharmacol., 74(3): 330-336.
- Taylor, D.M., Bligh, P.H. et Duggan, M.H. (1962). The absorption of calcium, strontium, barium and radium from the gastrointestinal tract of the rat. Biochem. J., 83: 25-29.
- Tolstykh, E.I., Shagina, N.B. et Degteva, M.O. (2014). Increase in accumulation of strontium-90 in the maternal skeleton during pregnancy and lactation: analysis of the Techa River data. Radiat. Environ. Biophys., 53(3): 551-557.
- U.S. EPA (1994a). Method 200.8 Rev. 5.4. Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. Environmental Monitoring Systems Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio 45268.
- U.S. EPA (1994b). Method 200.7 Rev. 4.4. Determination of metals and trace elements in water and wastes by inductively coupled plasma-atomic emission spectrometry. Environmental Monitoring Systems Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio 45268.
- U.S. EPA (1996). Strontium (CASRN 7440-24-6). I.A. reference dose for chronic oral exposure (RfD). U.S. Environmental Protection Agency.
- U.S. EPA (1999). Understanding variation in partition coefficient, Kd Values. Volume II: Review of geochemistry and available Kd values for cadmium, cesium, chromium, lead, plutonium, radon, strontium, thorium, titanium and uranium. Office of Air and Radiation. U.S. Environmental Protection Agency. EPA 402-R-99-004B.
- U.S. EPA (2011). Drinking water treatability database: Strontium. U.S. Environmental Protection Agency. Disponible à: iaspub.epa.gov/tdb/pages/contaminant/contaminantOverview.do?contaminantId=10600
- U.S. EPA (2012). UCMR 3 laboratory approval requirements and information document. Version 2. Technical support center. Standards and risk management division. Office of Groundwater and Drinking water, U.S. Environmental Protection Agency, Cincinnati, Ohio 45268.
- U.S. EPA (2014). Federal Register Part II, 40 CRF Part 141, Announcement of preliminary regulatory determinations for contaminants on the third drinking water contaminant candidate list; Proposed rule, 79 (202).
- U.S. EPA (2015). Benchmark dose software (BMDS) version 2.6.0.1. Software available for download from the U.S. Environmental Protection Agency. Disponible à l'adresse : www.epa.gov/NCEA/bmds/index.html
- U.S. EPA (2018). 2018 edition of the drinking water standards and health advisories tables. Disponible à l'adresse : https://www.epa.gov/sites/production/files/2018-03/documents/dwtable2018.pdf
- Ulger, Z., Gurel, E.I., Halil, M., Oozen, G., Kalan, I., Seringec, N., Yavuz, B.B., Yesil, Y., Cankurtaran, M., Dikmenoglu, N. et Ariogul, S. (2012). Hemorheological changes with strontium ranelate treatment do not seem to be related to its claimed prothrombotic effects. Arch. Gerontol. Geriatr., 54(1): 218-221.
- Van der Bruggen, B., Koninckx, A. et Vandecasteele, C. (2004). Separation of monovalent and divalent ions from aqueous solution by electrodialysis and nanofiltration. Water Res., 38(5): 1347-1353.
- Verberckmoes, S.C., De Broe, M.E. et D'Haese, P.C. (2003). Dose-dependent effects of strontium on osteoblast function and mineralization. Kidney Int., 64(2): 534-543.
- Verberckmoes, S.C., Behets, G.J., Oste, L., Bervoets, A.R., Lamberts, L.V., Drakopoulos, M., Somogyi, A., Cool, P., Dorrine, W., De Broe, M.E. et D'Haese, P.C. (2004). Effects of strontium on the physicochemical characteristics of hydroxyapatite. Calcif. Tissue Int., 75(5): 405-415.
- Verliefde, A.R.D., Cornelissen, E.R., Heijman, S.G.J., Verberk, J.Q.J.C., Amy, G.L., Van Der Bruggen, B. et Van Dijk, J.C. (2008). The role of electrostatic interactions on the rejection of organic solutes in aqueous solutions with nanofiltration. J. Membr. Sci., 322(1): 52-66.
- Vezzoli, G., Baragetti, I., Zerbi, S., Caumo, A., Soldati, L., Bellinzoni, P., Centemero, A., Rubinacci, A., Moro, G. et Bianchi, G. (1998). Strontium absorption and excretion in normocalciuric subjects: relation to calcium metabolism. Clin. Chem., 44(3): 586-590.
- Vezzoli, G., Soldati, L., Proverbio, M.C., Adamo, D., Rubinacci, A., Bianchi, G. et Mora, S. (2002). Polymorphism of vitamin D receptor gene start codon in patients with calcium kidney stones. J. Nephrol., 15(2): 158-164.
- Wellman, H.N., Kahn, B., Salem, A. et Robbins, P.J. (1966). Strontium and calcium metabolism in children of various ages. (IRPA 1 Rome).
- Wheeless, C.R. (ed.). (2011). Wheeless' Textbook of Orthopaedics. Bone remodelling.
- Whitaker, M. et Kuijpers, G. (2013). NDA 202342 esomeprazole strontium - 505(b)(2). Memorandum of Consultation. Medical review(s). Center for Drug Evaluation and Research, FDA, Application number: 202342Orig1s000.
- Xu, C., Liu, Q., Liu, H., Heroux, P., Zhang, Q., Jiang, Z.Y. et Gu, A. (2015). Low serum testosterone levels are associated with elevated urinary mandelic acid, and strontium levels in adult men according to the US 2011-2012 National Health and Nutrition Examination Survey. PLoS One, 10(5): e0127451.
- Yamaguchi, M. et Weitzmann, M.N. (2012). The intact strontium ranelate complex stimulates osteoblastogenesis and suppresses osteoclastogenesis by antagonizing NF-kappaB activation. Mol. Cell. Biochem., 359(1-2): 399-407.
- Yu, H.Y. et Zhang, K.L. (2011). Links between environmental geochemistry and rate of birth defects: Shanxi Province, China. Sci. Total Environ., 409(3): 447-451.
- Yusan, S. et Erenturk, S. (2011). Adsorption characterization of strontium on PAN/Zeolite composite adsorbent. World J Nucl Sci Technol., 1: 6-12.
- Zhao, S., Wang, X., Li, N., Chen, Y., Su, Y. et Zhang, J. (2015). Effects of strontium ranelate on bone formation in the mid-palatal suture after rapid maxillary expansion. Drug Des. Devel. Ther., 9: 2725-2734.
Annexe A : Liste des acronymes
- ADN
- acide désoxyribonucléique
- ANSI
- American National Standards Institute
- AQT
- apport quotidien tolérable
- BMD
- dose de référence
- BMDL
- limite inférieure de l'intervalle de confiance de la dose de référence
- Ca
- calcium
- CIRC
- Centre international de recherche sur le cancer
- CCN
- Conseil canadien des normes
- CMA
- concentration maximale acceptable
- ECAT
- Étude canadienne sur l'alimentation totale
- EI
- échange d'ions
- IC
- intervalle de confiance
- ICP-AES
- spectrométrie d'émission atomique à plasma induit
- ICP-MS
- spectrométrie de masse avec plasma induit
- LD
- limite de détection
- LDM
- limite de détection de la méthode
- LOAEL
- dose minimale avec effet nocif observé
- MIREC
- maternal-infant research on environmental chemical (étude)
- NHANES
- national health and nutrition examination survey (États-Unis)
- NOAEL
- dose sans effet nocif observé
- NSF
- NSF International
- NTP
- National Toxicology Program (États-Unis)
- OI
- osmose inverse
- OMS
- Organisation mondiale de la Santé
- p.c.
- poids corporel
- PdE
- point d'entrée
- PdU
- point d'utilisation
- REC
- résines échangeuses de cations
- RI
- ratio d'incidence
- RNSPA
- réseau national de surveillance de la pollution de l'air
- RR
- risque relatif
- SM
- méthode normalisée
- Sr
- strontium
- SrR
- ranélate de strontium
- UCMR 3
- Unregulated Contaminant Monitoring Rule 3
- U.S. EPA
- United States Environmental Protection Agency
- UTN
- unité de turbidité néphélémétrique
- VBS
- valeur basée sur la santé
- VL
- volumes de lit
Notes de bas de page
- Note de bas de page 1
Le Conseil national de recherches des États-Unis a indiqué que 0,5 % de calcium constituait la concentration minimale pour optimiser au maximum la minéralisation osseuse des rats pendant leur croissance, qu'une concentration de 3,5 % de calcium (avec un rapport calcium/phosphore de 0,9) pouvait suffir à la croissance normale des rats, et que des signes de carence pouvaient être observés à des concentrations inférieures à 0,3 % (National Research Council, 1995; Bollen et Bai, 2005). Une étude récente a révélé qu'une concentration de 0,3 % de calcium (apport en strontium non spécifié) était adéquate, et qu'une augmentation de la structure, de la densité et des paramètres de résistance des os avait été observée chez des rats SD de 4 semaines ayant reçu dans leur alimentation jusqu'à 0,3 % de calcium, avant l'atteinte d'un plateau (Hunt et coll., 2008).
Détails de la page
- Date de modification :