Faits saillants de 2018 sur les médicaments et les instruments médicaux : Pour maintenir et améliorer votre santé

Télécharger le format de rechange
(Format PDF, 8 Mo, 88 pages)
Organisation : Santé Canada
Publiée : 2019-06-27
Découvrez les nouveaux médicaments et instruments médicaux dont Santé Canada a approuvé la vente au Canada, ainsi que l'information que nous avons publiée sur les problèmes d'innocuité potentiels et nos autres réalisations de 2018.
Table des matières
- Bienvenue au rapport annuel sur les faits saillants de Santé Canada
- Message de la Conseillère Médicale en Chef
- Message du Chef Principal de la réglementation
- Médicamentsà usage humain
- Instruments médicaux
- Médicaments à usage vétérinaire
Bienvenue au rapport annuel sur les faits saillants de Santé Canada
Le rapport fournit de l'information sur les nouveaux médicaments et instruments médicaux dont Santé Canada a approuvé la vente au Canada, de l'information que nous avons publiée sur les problèmes d'innocuité potentiels et sur nos autres réalisations en 2018.
Cette année, le rapport comprend une section augmentée sur les instruments médicaux et une nouvelle section sur les médicaments vétérinaires. Nous avons également ajouté les médicaments vendus sans ordonnance, plus communément appelés produits en vente libre. Le rapport de cette année est divisé en sections sur les médicaments à usage humain, les instruments médicaux et les médicaments à usage vétérinaire afin de mieux représenter l'information sur ces produits thérapeutiques.
Lorsque Santé Canada approuve de nouveaux produits, nous continuons à surveiller leur utilisation en situation réelle et à prendre des mesures lorsque des problèmes se présentent. Le rapport de cette année fournit de l'information sur la manière de déclarer un effet indésirable à un médicament ou un incident lié à un instrument médical. Nous fournissons également plus de détails sur les communications des risques que nous avons publiées concernant les produits sur le marché canadien, c'est-à-dire l'information que nous avons publiée pour aviser les professionnels de la santé et le public des problèmes d'innocuité nouvellement déterminés.
Santé Canada publie beaucoup d'information en ligne pour ceux qui recherchent de l'information à jour sur les médicaments et les instruments médicaux. D'après les commentaires reçus sur le rapport de l'année dernière, nous avons agrandi les sections « Clics santé » pour que vous puissez trouver des informations à jour sur nos activités. Nous vous invitons également à suivre @GouvCanSanté sur Twitter pour recevoir des mises à jour sur les médicaments et les instruments médicaux nouvellement approuvés.
Nous espérons que le rapport sur les faits saillants de 2018 vous fournira de l'information pertinente sur notre travail, et soulignera comment les nouveaux médicaments et instruments médicaux que nous avons approuvés en 2018 contribuent de façon importante à l'amélioration des résultats liés à la santé des Canadiens.

Pierre Sabourin,
Sous-ministre adjoint,
Santé Canada

Kendal Weber,
Sous-ministre adjointe déléguée,
Santé Canada
Message de la Conseillère Médicale en Chef
Santé Canada joue un rôle essentiel en permettant l'accès aux thérapies nécessaires. En raison de notre rôle unique dans la réglementation de l'innocuité, de l'efficacité et de la qualité des nouveaux médicaments et instruments médicaux, nous avons également la responsabilité de fournir aux Canadiens de l'information crédible sur ces produits.
Aujourd'hui plus que jamais, les gens recherchent de nouvelles sources, en particulier en ligne, pour les aider à prendre des décisions au sujet de leurs soins de santé et de ceux de leurs familles. Aider les patients et leurs équipes des soins de santé à accéder à de l'information crédible sur la santé et l'innocuité des produits thérapeutiques est un rôle que nous prenons très au sérieux.
En 2018, Santé Canada a poursuivi la mise en œuvre de ses plans visant à mettre à la disposition des Canadiens davantage d'information concernant les médicaments et les instruments médicaux. Par exemple, nous avons publié :
- les raisons étayant nos décisions concernant les nouveaux médicaments et instruments médicaux
- les résumés de nos examens de l'innocuité des thérapies utilisées au Canada
- l'information sur les pénuries de médicaments et les autres facteurs qui ont une incidence sur leur accès
- les listes des présentations de médicaments en cours d'examen, y compris une liste de présentations de médicament générique que Santé Canada examine à l'heure actuelle
Cette information aidera les patients, les soignants et les fournisseurs de soins de santé à tenir des conversations plus éclairées sur les avantages et les risques possibles associés aux médicaments et aux instruments médicaux.
Au Canada, l'accès aux médicaments et aux instruments médicaux est un processus complexe : le continuum des soins de santé compte de nombreux partenaires. De nombreux facteurs interviennent également tout au long du cycle de vie d'un produit, de son développement à son approbation, puis à son utilisation dans le système de santé. En 2018, Santé Canada a fait des progrès considérables dans la collaboration avec ses partenaires, au Canada et à l'étranger, pour accélérer ces processus et, par conséquent, mettre en marché plus de produits au Canada, plus rapidement.
Par exemple, nous avons harmonisé nos processus d'examen des médicaments à usage humain afin que les recommandations concernant le financement puissent être formulées plus tôt et que les médicaments puissent être mis à la disposition des patients plus rapidement. Nous avons également continué à travailler avec nos partenaires internationaux pour faire en sorte que les médicaments à usage humain et à usage vétérinaire et les instruments médicaux deviennent disponibles plus rapidement et de façon plus efficace.
Notre priorité est de protéger et de favoriser la santé et la sécurité des Canadiens. L'amélioration de l'accès aux médicaments et aux instruments médicaux et la fourniture d'une information pertinente sur ces produits sont des éléments importants de ce travail et nous continueront de nous concentrer sur ces objectifs au cours des prochaines années.

Supriya Sharma,
Conseillère médicale en chef,
Santé Canada
Message du Chef Principal de la Réglementation
Santé Canada s'emploie à protéger et à favoriser la santé et la sécurité des Canadiens. Notre travail repose sur les lois et les règlements canadiens. Nous avons la responsabilité d'appliquer la réglementation qui met à votre disposition d'importants médicaments, à usage humain et à usage vétérinaire, et instruments médicaux.
Nous avons besoin d'instruments réglementaires consolidés, modernes et flexibles afin de pouvoir :
- prendre des décisions fondées sur des données scientifiques, en temps opportun, et d'une façon qui corresponde au processus décisionnel le plus rigoureux de toutes les autorités de réglementation
- réglementer les technologies avancées de manière appropriée
- maintenir une surveillance appropriée de l'innocuité des médicaments et des instruments médicaux au Canada
En 2018, Santé Canada a réalisé des progrès importants pour moderniser la réglementation qui sous-tend notre travail. Par exemple, nous continuons de mettre en œuvre des règlements importants en vertu de la Loi de Vanessa, ainsi qu'une mise à jour exhaustive de la Loi sur les aliments et les drogues portant sur l'innocuité. Notamment, nous avons :
- finalisé la réglementation exigeant un fabricant d'effectuer des essais, des études et des évaluations et de demander que les fabricants nous fournissent les communications sur les risques parues dans d'autres pays
- proposé une réglementation visant à améliorer la déclaration des effets indésirables graves des médicaments (également connu sous le nom d'effets secondaires) et des incidents liés aux instruments médicaux par les hôpitaux
- proposé une réglementation visant à mettre à la disposition du public de l'information clinique sur l'innocuité et l'efficacité des médicaments et des instruments médicaux
En 2018, nous avons élargi notre réglementation afin de créer une nouvelle voie pour les produits de santé vétérinaires à faible risque. De plus, nous avons aussi finalisé les règlements pour restreindre le marketing et la publicité des opioïdes dans le cadre de la réponse du Canada à la crise des opioïdes.
Nous continuerons à veiller à ce que nos règlements soient à jour et orientés vers l'avenir. Nous allons de l'avant avec une modernisation complète de notre réglementation sur les produits thérapeutiques. Nous avons analysé les tendances à venir, la technologie de pointe et l'innovation, et nous menons des consultations sur ces résultats dans les domaines de l'intelligence artificielle, de l'impression 3D, des thérapies cellulaires, et encore plus.
Ces travaux, ainsi que d'autres projets en cours au sein du Ministère, permettront d'améliorer les résultats en matière de santé des patients, notamment des populations spéciales telles que les enfants, les personnes âgées et les femmes enceintes ou qui allaitent.

David K. Lee,
Chef principal de la réglementation,
Santé Canada
Médicaments à usage humain
Médicaments à usage humain : 2018 En bref
Les médicaments à usage humain, y compris les médicaments pharmaceutiques sur ordonnance et les médicaments biologiques, les vaccins et les médicaments en vente libre (vendus sans ordonnance), jouent un rôle important en aidant les Canadiens à mener une vie saine. Nous examinons et surveillons les médicaments afin de s'assurer que les avantages l'emportent sur les risques potentiels associés à ces produits tout au long de leur cycle de vie.
Nous réglementons une vaste gamme de médicaments, des analgésiques en vente libre aux médicaments personnalisés administrés dans des unités de soins intensifs dans les hôpitaux. Nos examens scientifiques sont à la base de notre travail de réglementation pour tous les médicaments que nous réglementons.
En 2018, nous avons embauché du personnel scientifique supplémentaire pour accroître notre capacité à :
- examiner les nouveaux médicaments
- examiner les médicaments génériques et biosimilaires, qui sont plus rentables pour le système de santé
- surveiller l'innocuité des médicaments après leur arrivée sur le marché canadien
- mettre en place de nouvelles exigences en langage clair pour les médicaments sans ordonnance
En plus d'acquérir ces nouvelles capacités, nous avons renforcé nos connaissances scientifiques grâce à nos partenariats avec des organismes de réglementation de confiance d'autres pays. Ces interactions nous aident à mieux connaître certains produits complexes et à prendre des décisions qui amélioreront l'innocuité des médicaments mis en marché au Canada.
Le cœur de notre travail consiste à faire en sorte que des médicaments sûrs et efficaces soient disponibles en temps opportun. L'utilisation efficace de nos ressources aide les Canadiens à accéder plus rapidement aux médicaments dont ils ont besoin. En 2018, nous avons atteint et dépassé nos objectifs de rendement en matière d'examen des médicaments.
Nouveaux médicaments approuvés
En 2018, Santé Canada a approuvé 78 nouveaux médicaments, ce qui vous permet de disposer de nouvelles options innovantes pour le traitement, la prévention et le diagnostic de divers problèmes de santé.
Quarante des nouveaux médicaments approuvés en 2018 portent sur de nouvelles substances actives : des ingrédients médicinaux dont la vente n'a jamais été approuvée au Canada. Trente-cinq pour cent de ceux-ci ont été approuvés dans le cadre d'un examen prioritaire afin de répondre aux besoins médicaux n'aillant pas de solution satisfaisante, y compris la première thérapie génique approuvée au Canada (Kymriah) et un nouveau traitement destiné à certains patients atteints de fibrose kystique (Symdeko).
Nous avons également approuvé 135 nouveaux médicaments génériques et 4 nouveaux médicaments biosimilaires, qui permettent d'offrir un choix d'options plus vaste et plus abordable.
Pour obtenir la liste et la description des nouveaux médicaments que nous avons approuvés en 2018, voyez « Médicaments à usage humain : Approuvés en 2018 ».
Essais cliniques et programme d'accès spécial
Dans le cadre de notre rôle visant à faciliter l'accès à des thérapies clés, nous approuvons les demandes pour permettre aux entreprises et aux chercheurs de mener des essais cliniques sur les médicaments au Canada. Les nouveaux essais cliniques permettent d'accéder à des options plus innovantes. En 2018, 1 209 nouvelles demandes d'essais cliniques ont été approuvées pour des médicaments, dont plusieurs pour des thérapies cellulaires et géniques de pointe ainsi que des thérapies ciblées en oncologie.
Il existe également des moyens par lesquels nous offrons un accès aux médicaments qui ne sont pas accessibles au Canada grâce à notre Programme d'accès spécial. Le programme offre aux médecins un moyen de demander pour leurs patients des traitements qui ne seraient pas disponibles autrement. L'accès à des médicaments non approuvés peut être accordé pour une utilisation d'urgence ou pour le traitement de conditions graves ou potentiellement mortelles. En 2018, 13 125 demandes d'accès spécial aux médicaments ont été approuvées, y compris l'accès au triamcinolone pour le traitement de l'arthrite juvénile.
Surveillance après la mise en marché
Une fois que les médicaments sont disponibles au Canada, Santé Canada continue de surveiller et d'évaluer les déclarations d'effets indésirables des médicaments. Nous appelons cela la « surveillance après la mise en marché ». Il n'est pas possible de connaître ou de prédire tous les effets indésirables possibles d'un médicament grâce aux études cliniques au moment de l'approbation de la mise en marché.
En 2018, Santé Canada a reçu de sources nationales et internationales 1 091 696 déclarations d'effets indésirables de médicaments à usage humain après leur mise en marché. Nous avons pris 620 mesures liées aux médicaments à usage humain après leurs mises en marché. Ces mesures peuvent consister à fournir au public et aux professionnels de la santé de nouvelles informations sur l'innocuité, à recommander des modifications à apporter à l'étiquetage et même à retirer un médicament du marché dans les situations les plus graves.
La section « Médicaments à usage humain » du rapport fournit de plus amples renseignements sur nos activités en 2018. Vous trouverez un aperçu des progrès que nous avons accomplis en 2018 relativement à nos priorités principales. Vous découvrirez le cycle de vie d'un médicament et notre rôle qui consiste à nous assurer que les avantages d'un médicament continuent de l'emporter sur les risques potentiels associés à leur utilisation. Vous y trouverez également des renseignements sur les nouveaux médicaments que nous avons approuvés en 2018 ainsi que les mesures que nous avons prises pour résoudre les problèmes d'innocuité des produits qui sont déjà sur le marché canadien. Voyez également la nouvelle section « Clics santé » pour suivre des informations à jour sur nos activités.

John Patrick Stewart,
Directeur général,
Produits thérapeutiques,
Santé Canada

Celia Lourenco,
Directrice générale,
Produits biologiques et thérapies génétiques,
Santé Canada

Rhonda Kropp,
Directrice générale,
Produits de santé commercialisés,
Santé Canada

Manon Bombardier,
Directrice générale,
Produits sans-ordonnance,
Santé Canada
Médicaments à Usage Humain : Réalisations de 2018
Examen réglementaire
Le système de santé canadien évolue rapidement. Nous avons besoin d'un système de réglementation capable de continuer à s'adapter aux changements dans la prestation des soins de santé et qui permet également aux gens d’accéder plus rapidement aux médicaments dont ils ont besoin. Nous devons également continuer à nous assurer que tous les médicaments que nous approuvons sont sûrs, efficaces et de bonne qualité.
Santé Canada a élaboré l'initiative « Améliorer l'examen réglementaire des médicaments et des instruments » en 2017 afin de permettre aux patients d’accéder plus rapidement aux médicaments et aux instruments médicaux. Nous avons également pour objectif de travailler davantage avec nos partenaires du système de santé au Canada et avec d’autres pays et de mieux utiliser les données probantes du monde réel (des données recueillies en dehors des essais cliniques) tout au long du cycle de vie d’un produit.
En 2018, nous avons réalisé des progrès importants pour améliorer l'accès aux médicaments. Par exemple, nous avons :
- renforcé nos partenariats internationaux pour mieux faire en sorte que les médicaments essentiels soient mis à la disposition des patients plus rapidement
- travaillé avec nos partenaires du système de santé au Canada pour harmoniser notre travail d’examen en accélérant l'accès aux médicaments
- mis à la disposition des patients, des soignants et des professionnels de la santé davantage d'information sur les présentations de médicaments et nos décisions en matière d'homologation des médicaments
Nous avons également embauché du personnel scientifique supplémentaire pour accroître notre capacité à examiner les médicaments innovants ainsi que les médicaments génériques et biosimilaires qui permettent de réduire les coûts, et à surveiller l'innocuité et l'efficacité des médicaments après que leur vente ait été approuvée au Canada.
La présente section du rapport vous fournira de l’information plus détaillée sur ces projets importants, ainsi que sur certaines de nos autres priorités en 2018.
Établir des partenariats internationaux
Santé Canada participe activement à plusieurs initiatives avec d’autres organismes de réglementation internationaux. Ces initiatives varient de réunions spéciales pour aborder les problèmes mondiaux d‘innocuité des médicaments aux échanges de renseignements prévus régulièrement sur des sujets liés à l’innocuité, à l’efficacité et à la qualité des médicaments. La collaboration de Santé Canada avec des partenaires de confiance internationaux nous permet d’échanger des connaissances scientifiques, d’apporter de plus importants gains d’efficacité à nos processus et de réduire le fardeau réglementaire inutile. Nous nous associons pour mettre en commun notre expertise, élaborer des politiques et établir des normes.
Voici des exemples de nos collaborations avec d’autres organismes de réglementation internationaux en 2018 :
- International Coalition of Medicines Regulatory Authorities (ICMRA) – Santé Canada est un membre fondateur de l’ICMRA, qui mobilise 30 organismes de réglementation du monde entier. Cet organisme met l’accent sur l’élaboration de stratégies visant à régler des problèmes de santé à l’échelle mondiale, par exemple, l’adaptation à des technologies innovantes en matière de santé qui ne s’harmonisent pas bien avec les cadres réglementaires actuels. En 2018, le « Increasing Adverse Event Reporting Working Group” (groupe de travail sur l'augmentation de la déclaration des effets indésirables) de l’ICMRA a rempli un sondage et publié un rapport sur l’augmentation de la déclaration des réactions présumées aux effets indésirables et l’amélioration de la qualité des déclarations d’évènements indésirables. Onze membres de l’ICMRA ont pris part à ce sondage et le rapport a été publié sur le site Web public de l’IMCRA.
- International Council for Harmonisation (ICH) – Santé Canada est aussi un membre de l’ICH. Par l’entremise de cet organisme, des experts scientifiques du monde entier travaillent ensemble pour élaborer des lignes directrices harmonisées qui aident les organismes de réglementation à s’assurer que les médicaments sont sûrs, efficaces et de haute qualité. En 2018, le travail a commencé sur trois nouvelles lignes directrices, y compris la ligne directrice M11: Clinical Electronic Structured Harmonized Protocol (CeSHarP) (M11 : protocole électronique harmonisé structuré clinique). La ligne directrice M11 fournira un gabarit normalisé pour le protocole d’essais cliniques, lequel décrit le processus et la procédure qui régit la réalisation et l’analyse d’un essai clinique.
- Consortium Australie-Canada-Singapour-Suisse (ACSS) – Par l’entremise du Consortium ACSS, nous travaillons avec des partenaires de confiance pour examiner ensemble les nouveaux médicaments, afin de les mettre sur le marché rapidement et efficacement. En 2018, Santé Canada, avec l’Australie, a approuvé le premier médicament (Erleada) devant être examiné dans le cadre de cet essai de partage des tâches, ou « examen conjoint ». Pour obtenir plus de renseignements sur Erleada, consultez les « Médicaments destinés à l’usage humain : Approuvés en 2018 ».
Alignement avec les partenaires du système de santé canadien
Mettre les médicaments à la disposition des patients est un processus complexe. Une fois que Santé Canada a décidé d’approuver la vente d’un produit au Canada, les organisations suivantes peuvent jouer un rôle avant que le médicament ne soit mis à la disposition des patients :
- Les organismes d'évaluation des technologies de la santé (L’Agence canadienne des médicaments et des technologies de la santé [ACMTS], et l’Institut national d’excellence en santé et services sociaux [INESSS]) qui vérifient si les avantages d'un médicament l'emportent sur son coût. Ils font des recommandations aux régimes publics d'assurance-maladie concernant le financement d’un médicament, c'est-à-dire qu'ils recommandent qu’il soit remboursé ou non par ces régimes.
- L’Alliance pancanadienne pharmaceutique agit au nom des gouvernements fédéral, provinciaux et territoriaux pour négocier avec les entreprises de médicaments les prix que les gouvernements paieront pour certains médicaments.
- Les gouvernements fédéral, provinciaux et territoriaux décident d’accepter ou non que leur gouvernement paie les médicaments dans le cadre de leurs régimes publics d'assurance-maladie.
Dans le cadre de son initiative « Améliorer l'examen réglementaire des médicaments et des instruments », Santé Canada a continué en 2018 à aligner ses processus d'examen avec ceux des organismes d'évaluation des technologies de la santé. Cette harmonisation contribue à fournir aux patients des médicaments sont mis à la disposition des patients plus rapidement. Nous avons approuvé huit nouveaux médicaments dans le cadre de ce processus d’« examen aligné » en 2018. Pour de plus amples informations, voyez « Médicaments à usage humain : Approuvés en 2018 ».
Utiliser des données probantes du monde réel
Pendant la mise au point de médicaments, les promoteurs (chercheurs et fabricants) mènent des essais cliniques afin de démontrer qu’un médicament est sûr et efficace. Dans certains cas, il peut être plus difficile de recueillir des données probantes dans le cadre d’essais cliniques. Par exemple, il se peut que très peu de patients puissent participer à un essai clinique pour une maladie rare.
Dans ces cas, les renseignements au sujet de la façon dont les médicaments sont utilisés dans des contextes réels (c’est-à-dire en dehors d’un essai clinique) peuvent nous aider à comprendre comment utiliser les médicaments de façon sûre et efficace. Par voie de conséquence, cela peut déboucher sur plus d’options de traitement.
Santé Canada prend déjà en considération les données probantes recueillies dans des contextes réels pour la prise de décisions tout au long du cycle de vie d’un médicament. Ces données probantes servent à l’examen des présentations de médicaments, de même qu’à la surveillance de l’innocuité et de l’efficacité des médicaments une fois qu’ils sont disponibles pour la vente au Canada.
Nous étoffons la façon dont nous utilisons les données probantes tirées des contextes réels. Nous pourrons ainsi augmenter le nombre d’options de traitement et rendre notre système réglementaire mieux adapté aux besoins des Canadiens. En 2018, nous avons tenu des discussions avec nos partenaires du système de soins de santé au sujet de la façon d’améliorer l’utilisation de données probantes du monde réel au cours du cycle de vie d’un médicament. Ces discussions formeront la base d’approches collectives visant à mieux tirer parti des données probantes recueillies dans des contextes réels. Elles influeront aussi sur les directives que nous donnerons aux entreprises de médicaments au sujet de la qualité des données probantes du monde réel qu’elles doivent soumettre à Santé Canada.
Communiquer les risques de l'usage des opioïdes
Santé Canada s'est engagé à s’attaquer à la crise nationale des opioïdes et a pris plusieurs mesures en 2018. Le nombre croissant de surdoses et de décès causés par les opioïdes, y compris le fentanyl, est une crise nationale en santé publique. Il s’agit d’un problème complexe pour la santé et la société qui requiert une intervention exhaustive, collaborative, compassionnelle et fondée sur des données probantes.
De nouveaux règlements pour vous donner une meilleure information
Les opioïdes doivent maintenant être fournis avec un autocollant de mise en garde et une fiche de renseignements pour les patients. Ensemble, ces documents fournissent aux patients une information claire sur l'utilisation sécuritaire et les risques associés à ces produits.
Figure 1 : Autocollant de mise en garde et fiche de renseignements pour les patients

Équivalent textuel
Cette figure montre l'étiquette de mise en garde opioïdes autocollant. Il y a une boîte rectangulaire jaune. Justifié à gauche à l'intérieur du rectangle est un triangle blanc de prudence, tête en bas, avec un point d'exclamation en caractères gras. À la droite du triangle de prudence sont trois lignes de texte. Les deux premières lignes renferment les mots « Les opioïdes peuvent causer une dépendance », la troisième ligne contient les mots « toxicomanie et une surdose ».
Nous exigeons également que les entreprises de médicaments élaborent et mettent en œuvre des plans de gestion des risques pour surveiller, prévenir et atténuer les risques associés à l'utilisation de leurs produits opioïdes au Canada.
Pour de plus amples informations, allez à Autocollant de mise en garde et fiche de renseignements pour les patients, et Plans de gestion des risques au sujet des opioïdes.
Améliorer l'accès aux nouveaux traitements
En 2018, nous avons approuvé l'utilisation au Canada de deux nouveaux médicaments pour le traitement des troubles liés à l'usage des opioïdes, la Probuphine et le Sublocade. Pour de plus amples informations sur ces produits, voyez « Médicaments à usage humain : Approuvés en 2018 ».
Nous fournissons également un accès aux médicaments qui servent à répondre à des besoins urgents en matière de santé publique. Ce sont des médicaments qui ont été approuvés par les États-Unis, l'Union européenne ou la Suisse, mais dont la vente n'est pas approuvée au Canada, comme l'indique notre Liste des drogues utilisées pour des besoins urgents en matière de santé publique. Dans le cadre de ce système, nous avons donné accès au Diaphin et au film de Suboxone pour aider les responsables de la santé publique fédéraux, provinciaux et territoriaux à faire face à la crise des opioïdes.
Restreindre le marketing et la publicité relatifs aux opioïdes et appliquer la réglementation à cet égard
En juin 2018, la ministre de la Santé a demandé aux sociétés pharmaceutiques de mettre fin volontairement au marketing et à la publicité des opioïdes. Les réponses de l'industrie sont mises à la disposition du public.
Parallèlement, Santé Canada a publié un Avis d'intention visant à restreindre davantage le marketing et la publicité des opioïdes. Les commentaires issus de cette consultation éclairent la façon d'imposer de nouvelles restrictions de la publicité et du marketing des opioïdes.
En 2018, nous avons mis en place une équipe spécialisée de la conformité du marketing et de l'application de la réglementation pour surveiller le marketing des opioïdes et appliquer les règles existantes concernant le marketing inapproprié.
Réglementer les médicaments vendus sans ordonnance
Chaque année, Santé Canada examine des centaines de médicaments vendus sans ordonnance, également appelés produits en vente libre, qui peuvent être achetés sans l'ordonnance d'un médecin. Ces produits peuvent apporter une contribution importante au maintien de la santé des Canadiens. Ils comprennent des :
- antiseptiques
- lotions solaires
- analgésiques
- médicaments contre la toux et le rhume
Santé Canada réglemente les médicaments vendus sans ordonnance pour s'assurer de leur innocuité, de leur efficacité et de leur grande qualité. Le numéro d'identification du médicament (DIN) sur l'étiquette du produit indique que le médicament a satisfait à nos exigences. Comme pour tous les médicaments, Santé Canada surveille les médicaments vendus sans ordonnance sur le marché et prendra des mesures correctives si un problème se pose.
De l'information pour vous aider à faire un choix éclairé
Nous avons adopté de nouvelles exigences relatives à l'étiquetage afin que l'information sur vos médicaments soit plus facile à lire, à comprendre et à trouver sur l'emballage. En 2018, Santé Canada a approuvé 400 étiquettes révisées de médicaments vendus sans ordonnance.
Pour de plus amples informations sur les nouvelles exigences en matière d'étiquetage, allez à Étiquettes des médicaments vendus sans ordonnance.
Lutter contre la résistance aux antimicrobiens
Pourquoi la résistance aux antimicrobiens est-elle un problème grave ?
Les bactéries, les virus, les champignons et les parasites peuvent résister aux antimicrobiens, tels que les antibiotiques et les antiviraux, qui sont utilisés pour soigner les personnes malades. C'est ce qu'on appelle la résistance aux antimicrobiens (RAM). Étant donné que les antimicrobiens ont mal été utilisés, et surutilisés, la RAM s'est répandue au Canada et dans le monde entier.
La RAM est une menace sérieuse pour la santé publique. Lorsque les antimicrobiens standards utilisés pour traiter les infections ne fonctionnent pas aussi bien qu'ils le devraient, nous traitons moins efficacement les maladies infectieuses courantes. Les risques des infections persistantes comprennent la prolongation des maladies, l'invalidité et même la mort.
Santé Canada continue de prendre des mesures importantes pour protéger l'utilisation des médicaments antimicrobiens à usage humain et encourager la mise au point de produits thérapeutiques nouveaux et innovants. Santé Canada contribue au Plan d'action fédéral sur la résistance et le recours aux antimicrobiens au Canada et à Lutter contre la résistance aux antimicrobiens et optimiser leur utilisation : un cadre d'action pancanadien. Nous travaillons en étroite collaboration avec des experts de premier plan et des partenaires internationaux.
Les fabricants de tous les antibiotiques doivent maintenant fournir de l'information sur l'utilisation appropriée d'un médicament sur son étiquette. Ceci contribue à la sensibilisation et encourage une utilisation prudente.
Nous nous penchons également sur la façon d'accélérer le processus d'examen des nouveaux médicaments et des nouveaux instruments de diagnostic. Nous informerons les entreprises concernant les produits dont nous avons un besoin urgent au Canada pour lutter contre la résistance aux antimicrobiens. Nous travaillerons également avec les entreprises, ainsi qu'avec le milieu de la recherche, pour mettre sur pied des essais cliniques qui amélioreront l'accès aux nouvelles thérapies ciblant les bactéries résistantes aux autres traitements offerts.
Pour des informations sur la résistance aux antimicrobiens chez les animaux et les médicaments vétérinaires, voyez « Médicaments à usage vétérinaire : Réalisations de 2018 ».
Médicaments à usage humain : Cycle de vie des médicaments
Dans le cadre de la mission de Santé Canada qui consiste à aider les Canadiens à maintenir et à améliorer leur santé, nous examinons les médicaments avant et après leur arrivée sur le marché canadien. Santé Canada s'investit tout au long du cycle de vie d'un médicament à usage humain, y compris durant les essais cliniques et les analyses du médicament, par l'intermédiaire de l'examen pour l'autorisation, ainsi qu'une fois que le médicament a été commercialisé sur le marché et rendu accessible aux Canadiens. Par exemple, nous:
- examinons les demandes d'essais cliniques
- évaluons les demandes d'accès spécial
- examinons les présentations pour la vente du médicament au Canada
- surveillons l'innocuité et l'efficacité des médicaments en situation réelle une fois leur vente autorisée au Canada
Essais cliniques
Les essais cliniques sont réalisés par les promoteurs (fabricants ou chercheurs) afin de recueillir de l'information sur l'innocuité et l'efficacité d'un médicament chez l'être humain. Les essais cliniques des médicaments représentent de nouvelles thérapies potentielles de soins en santé susceptibles de répondre aux besoins des Canadiens. Les entreprises peuvent soumettre les résultats de ces essais à Santé Canada dans le cadre de la présentation d'un médicament. Nous passerons alors en revue les résultats afin de décider si le médicament sera approuvé pour la vente au Canada.
Les promoteurs des essais cliniques (y compris les fabricants et les chercheurs) soumettent leurs demandes afin de réaliser un essai clinique avec un médicament au Canada. Nous examinons ces demandes et décidons d'autoriser ou non la tenue de l'essai au Canada. La Ligne directrice à l'intention des promoteurs d'essais cliniques : Demandes d'essais cliniques fournit de l'information détaillée sur les échéanciers et les processus de l'examen des demandes d'essais cliniques.
En 2018, Santé Canada a autorisé 1 209 nouvelles demandes d'essais cliniques de médicaments.
Vous pouvez découvrir quelles demandes d'essais cliniques ont été approuvées pour des médicaments au Canada en faisant une recherche dans la Base de données sur les essais cliniques de Santé Canada.
Présentation et examen des médicaments
Lorsqu'une entreprise décide de commercialiser un médicament au Canada, elle nous soumet une demande de présentation d'un nouveau médicament. Une présentation d'un nouveau médicament contient des données scientifiques sur le nombre d'années d'analyse du médicament en laboratoires et sur les animaux, ainsi que dans le cadre d'essais cliniques chez des humains.
Nos scientifiques et professionnels de la médecine effectuent un examen rigoureux de l'information soumise, en faisant parfois appel à des experts-conseils et à des comités consultatifs externes. Les évaluateurs examinent les données sur l'innocuité, l'efficacité et la qualité afin de déterminer les avantages et les risques potentiels associés aux médicaments. Ils passent également en revue l'information sur le médicament à fournir aux praticiens de la santé et aux consommateurs.
Nous publions des listes des présentations de nouveaux médicaments qui sont en train d'être examinés par Santé Canada. Les listes sont mises à jour mensuellement, et pour les présentations qui ont débouché sur une conclusion, elles comprennent le résultat de l'examen. En 2018, nous avons également commencé à publier une liste de présentations de médicament générique en cours d'examen. Les listes aideront les Canadiens à savoir quels sont les médicaments qui ont été acceptés pour un examen au Canada, et par conséquent, quels traitements pourraient être accessibles dans l'avenir.
Les délais d'exécution cibles des examens de Santé Canada varient d'un type de présentations de médicaments à l'autre. Il est important que nous réalisions les examens dans les délais d'exécution cibles de manière à ce que tout le monde (les patients, les professionnels de la santé et les entreprises pharmaceutiques) puisse prévoir quand une décision sera rendue. La Ligne directrice de l'industrie : gestion des présentations de drogues fournit des renseignements détaillés sur les échéanciers et les processus de l'examen des présentations de médicaments.
Voies d'examen accéléré
Nous offrons différents processus d'examen qui permettent d'accélérer la prise de la décision finale pour certains médicaments, y compris ceux qui sont conçus pour combler des besoins de soins particuliers, c'est-à-dire que plusieurs voies d'examen des médicaments à usage humain ont des délais d'exécution abrégés. Les produits approuvés par les voies d'examen accéléré peuvent être rendus accessibles aux patients plus tôt.
En 2018, 35 % des présentations de nouveaux médicaments qui concernaient des substances actives nouvelles ont été approuvées dans le cadre d'un examen accéléré.
Deux exemples d'examen accéléré sont l'Évaluation prioritaire et l'Avis de conformité avec conditions.
Examen prioritaire
Les médicaments pour les maladies ou les conditions graves, potentiellement mortelles ou très débilitantes peuvent bénéficier d'un statut d'examen prioritaire. Les présentations de médicament qui obtiennent le statut d'évaluation prioritaire sont soumises à un processus d'examen accéléré.
La Ligne directrice à l'intention de l'industrie : Évaluation prioritaire des présentations de drogues fournit de l'information détaillée sur les échéanciers et les processus d'examen des présentations de médicaments dans le cadre de ce processus accéléré.
Avis de conformité avec conditions
Lorsqu'un nouveau médicament est approuvé, Santé Canada émet un avis de conformité (AC). Pour un médicament qui présente des avantages cliniques prometteurs, visant une maladie ou une condition grave, potentiellement mortelle ou très débilitante, un AC peut être émis avec conditions (AC-C). Le fabricant doit quand même montrer que le médicament présente un profil d'innocuité acceptable et est d'excellente qualité.
Les présentations qui sont examinées selon cette voie sont également soumises à un processus d'examen accéléré.
La Ligne directrice : Avis de conformité avec conditions fournit de l'information détaillée sur les échéanciers et les processus d'examen des présentations de médicaments dans le cadre de ce processus accéléré.
Approbation des médicaments
Après avoir examiné une présentation de médicament, Santé Canada peut conclure que les avantages l'emportent sur les risques potentiels associés au produit et approuver sa vente au Canada. Lorsqu'un nouveau médicament est approuvé, un avis de conformité (AC) et un numéro d'identification du médicament (DIN) sont émis à son égard.
Cela ne signifie pas que le médicament sera immédiatement mis à la disposition des patients, car de nombreux autres facteurs peuvent influencer ce délai.
En 2018, Santé Canada a approuvé 78 nouveaux médicaments, dont 40 nouvelles substances actives. Nous avons approuvé 135 nouveaux médicaments génériques et 4 médicaments biosimilaires.
Pour obtenir une liste de ce qui a été approuvé en 2018, voyez « Médicaments à usage humain : Approuvés en 2018 ». Vous pouvez également consulter la « Mise à jour sur les nouvelles homologations de médicaments et d'instruments médicaux » qui est publiée trimestriellement.
Pour demander les Rapports de rendement sur les présentations de médicaments trimestriels et annuels, allez à Rapports et publications – Médicaments.
Programme d'accès spécial
Les médicaments qui ne sont pas approuvés au Canada peuvent être disponibles dans le cadre de notre Programme d'accès spécial. Le Programme d'accès spécial aux médicaments donne accès à des médicaments qui ne peuvent être vendus ou distribués au Canada autrement, si certains critères sont satisfaits.
Dans le cadre de ce programme, l'accès est fourni à un professionnel de la santé donné pour le traitement d'un patient en particulier. L'accès peut être accordé pour une utilisation d'urgence ou pour les patients atteints d'une condition grave ou potentiellement mortelle lorsque les thérapies conventionnelles ne fonctionnent pas, ne sont pas disponibles ou ne conviennent pas. Notre Programme d'accès spécial fonctionne 24 heures par jour et 365 jours par année.
En 2018, Santé Canada a approuvé 13 125 demandes d'accès spécial à des médicaments.
Surveillance après la mise en marché
Il n'est pas possible de savoir ni de prédire quels seront tous les effets indésirables possibles d'un médicament dans le cadre d'études cliniques. Après qu'un produit est rendu accessible à la vente au Canada, nous continuons d'assurer la surveillance de son utilisation en situation réelle, c.-à-d. dans une population élargie prenant possiblement d'autres médicaments. Nous appelons cela la « surveillance après la mise en marché ». Nous évaluons les problèmes d'innocuité et d'efficacité potentiels et prenons des mesures lorsque des problèmes sont identifiés.
Santé Canada examine fréquemment des documents nommés plans de gestion des risques (PGR) qui sont soumis par les fabricants de médicaments dans le cadre de leurs présentations de médicaments. Un PGR comprend des renseignements sur le profil d'innocuité d'un médicament ainsi que sur la prévention et la réduction des risques qui y sont associés. Il contient aussi des plans d'études et d'autres activités pour en apprendre davantage à propos de l'innocuité et l'efficacité du médicament. Les PGR servent à améliorer la qualité de l'évaluation des risques pour la santé.
En 2018, Santé Canada a examiné 166 plans de gestion des risques liés aux médicaments à usage humain.
Collecte de renseignements
Santé Canada recueille des renseignements après la mise en marché (c'est-à-dire des renseignements sur un produit qui sont recueillis après son homologation) à partir de diverses sources.
Les réactions indésirables soupçonnées qui sont déclarées après que la vente des produits ait été autorisée sont l'une des sources d'information de Santé Canada. Les réactions indésirables sont des effets indésirables qui peuvent être causés par des médicaments.
En 2018, nous avons reçu 1 091 696 déclarations d'effets indésirables après la mise en marché liées à des médicaments à usage humain (117 153 au Canada et 914 543 dans le reste du monde).
Vous pouvez déclarer les effets indésirables des médicaments et les incidents liés aux instruments médicaux à votre professionnel de la santé, à un hôpital ou à l'entreprise qui a fabriqué le produit. Vous pouvez également les déclarer à Santé Canada par l'entremise de MedEffet Canada ou par téléphone au 1-866-234-2345.
Vous pouvez trouver de l'information sur les nombres et les tendances annuels des déclarations de cas d'effets indésirables des médicaments et les déclarations des incidents liés aux instruments médicaux faites à Santé Canada entre 2008 et 2017 dans les Tendances annuelles dans les déclarations de cas d'effets indésirables des produits de santé et des incidents liés aux matériels médicaux à Santé Canada (2008-2017).
Évaluer les signaux d'innocuité
Nous évaluons les données que nous recueillons pour détecter de nouveaux signaux d'innocuité sur lesquels nous menons ensuite des enquêtes plus approfondies. Un « signal lié à l'innocuité » peut être défini comme étant un renseignement à propos d'un nouvel effet indésirable ou d'un effet indésirable connu qui peut être associé à un médicament. Ces enquêtes sont appelées évaluations des signaux et peuvent donner lieu à des recommandations concernant les mesures que l'entreprise, Santé Canada ou les deux doivent prendre. Ces mesures peuvent consister à fournir au public et aux professionnels de la santé de nouvelles informations sur l'innocuité, à recommander des modifications à apporter à l'étiquetage et même à retirer un médicament du marché dans les situations les plus graves.
Par exemple, nous avons évalué en 2018 un signal pour Fibristal, un médicament utilisé pour traiter les fibromes utérins, et le risque de lésions au foie. L'évaluation du signal comprenait un examen approfondi de la documentation scientifique et des renseignements provenant d'organismes de réglementation étrangers, ainsi qu'une évaluation des déclarations d'effets indésirables. Après l'évaluation, l'étiquette canadienne de Fibristal a été mise à jour relativement à la gestion du risque de lésions au foie, et des communiqués concernant le risque ont été publiés dans le but d'informer le public et les professionnels de la santé à propos de la gestion du risque.
Nous publions des résumés de l'examen de l'innocuité (REI) afin d'informer les Canadiens à propos des résultats de toute enquête sur l'innocuité susceptible de se répercuter sur l'utilisation de ces produits thérapeutiques.
En 2018, Santé Canada a examiné 102 problèmes d'innocuité et d'efficacité liés aux médicaments à usage humain. À la suite de ces examens, Santé Canada a publié 22 résumés de l'examen de l'innocuité et a demandé aux entreprises de procéder à 308 mises à jour d'innocuité.
En 2018, Santé Canada a publié 65 communications sur les risques concernant les médicaments à usage humain, destinées aux professionnels de la santé et aux Canadiens.
Vous trouverez ces communications sur les risques dans la Base de données des rappels et des avis de sécurité. Nous publions également des éditions mensuelles d'InfoVigilance sur les produits de santé. Cette publication fournit aux professionnels de la santé de l'information sur les risques émergents liés à l'innocuité des produits de santé à utiliser avec leurs patients.
Plans de gestion des risques
En plus des plans de gestion des risques (PGR) associés à la présentation d'un médicament, Santé Canada examine les PGR soumis par les entreprises après qu'un médicament a été rendu accessible à la vente au Canada.
Par exemple, dans le cadre du Plan d'action sur les opioïdes de Santé Canada, les entreprises de médicaments ont été tenues d'élaborer et de mettre en place des PGR pour les produits opioïdes afin d'assurer la surveillance, la prévention et l'atténuation des risques associés à l'utilisation des opioïdes. Nous avons reçu ces plans et sommes en train de les examiner et de fournir une rétroaction aux entreprises de médicaments.
Environ 120 PGR ont été reçus de la part de diverses entreprises offrant des produits opioïdes sur le marché.
Plaintes relatives à la publicité
Dans le cadre du travail réalisé après la mise en marché, Santé Canada réglemente également la publicité des médicaments vendus au Canada afin de s'assurer que les entreprises ne font pas de fausses allégations concernant leurs produits. Nous examinons les plaintes relatives à la publicité afin de déterminer si une entreprise se conforme ou non à nos exigences.
En 2018, Santé Canada a examiné 131 plaintes relative à la publicité concernant des médicaments à usage humain.
Par exemple, Santé Canada a découvert en 2018 qu'un guide de Trelegy Ellipta contenait plusieurs déclarations et énoncés qui étaient trompeurs et pouvaient poser des risques pour la santé des patients canadiens. Bien que rien n'indiquait que ces déclarations étaient destinées aux professionnels de la santé, Santé Canada a immédiatement demandé, par mesure de précaution, à l'entreprise pharmaceutique de cesser d'utiliser les déclarations trompeuses en matière de santé dans le document. Santé Canada a également publié un article sur l'InfoVigilance sur les produits de santé afin de rappeler aux professionnels de la santé l'indication approuvée pour le produit.
Après avoir examiné une plainte, nous prenons les mesures appropriées lorsqu'il est déterminé que les exigences ne sont pas respectées. Ceci peut consister à demander à une entreprise de cesser de diffuser une publicité non conforme et à prendre des mesures pour éviter tout problème futur.
En plus d'examiner les plaintes, Santé Canada a mis en place récemment une équipe spécialisée chargée d'identifier les problèmes relatifs à la publicité avant même qu'une plainte ne soit déposée. Cette équipe appliquera les règles existantes en matière de publicité et prendra les mesures qui s'imposent, notamment en recommandant, le cas échéant, que des accusations criminelles soient portées. Santé Canada communiquera tous les cas de publicité non conforme sur son site Web.
Cette initiative renforce la capacité du Ministère à détecter les tendances et les problèmes susceptibles de devenir des crises graves en matière de santé publique ou d'y contribuer.
Médicaments à usage humain : Approuvés en 2018
Cette section présente les nouveaux médicaments, les médicaments génériques et les médicaments biosimilaires approuvés pour la vente au Canada en 2018, ainsi que les mises à jour sur l'innocuité qui ont été publiées.
Vous pouvez déclarer les effets indésirables des médicaments et les incidents liés aux instruments médicaux à votre professionnel de la santé, à un hôpital ou au fabricant du produit visé. Vous pouvez aussi les déclarer à Santé Canada par l'entremise de MedEffet Canada ou par téléphone en composant le 1-866-234-2345.
Catégories de santé
Les médicaments de la liste ont été répartis en catégories selon le Système de classification anatomique thérapeutique chimique (système ATC), système de codes mis au point par l'Organisation mondiale de la santé. Les codes ATC sont souvent attribués d'après le mécanisme d'action (c'est-à-dire la façon dont le médicament fonctionne) plutôt qu'en fonction de la maladie ou de la pathologie à traiter.
Nous avons donné l'indication de chaque nouveau médicament afin de vous offrir quelques renseignements supplémentaires. De plus, chaque nouveau médicament a un hyperlien vers les Sommaires des décisions, si disponibles. Ces documents offrent un bref aperçu de la justification de notre décision d'approuver le médicament.
Voici les catégories :
- Système digestif et métabolisme
- par exemple, les médicaments visant le tube digestif, les médicaments contre l'obésité, les médicaments contre le diabète, et les vitamines
- Anti-infectieux à usage systémique
- par exemple, les antibactériens, antifongiques, antiviraux, et vaccins
- Agents antinéoplasiques et immunomodulateurs
- par exemple, les médicaments pour le traitement du cancer et les médicaments qui stimulent ou suppriment les réponses immunitaires
- Produits antiparasitaires, insecticides et répulsifs
- par exemple, les médicaments pour traiter les infestations parasitaires
- Sang et organes sanguinoformateurs
- par exemple, les médicaments comme les anticoagulants et les antihémorragiques
- Système cardiovasculaire
- par exemple, les médicaments contre l'hypertension artérielle et les hypocholestérolémiants
- Médicaments dermatologiques
- par exemple, les médicaments pour la peau, tel que les médicaments contre le psoriasis
- Système génito-urinaire et hormones sexuelles
- par exemple, les contraceptifs hormonaux, agents de fertilité, et hormones sexuelles
- Système musculo-squelettique
- par exemple, les médicaments qui ont un effet sur les muscles, les os, et les articulations, notamment les anti-inflammatoires et les relaxants musculaires
- Système nerveux
- par exemple, les médicaments qui ont un effet sur le cerveau et le système nerveux, notamment les anesthésiques chirurgicaux, les médicaments pour traiter les toxicomanies, les antidépresseurs, et les anticonvulsifs
- Système respiratoire
- par exemple, les médicaments qui ont un effet sur le système respiratoire, notamment les bronchodilatateurs et les médicaments contre la toux
- Organes sensoriels
- par exemple, les médicaments pour les yeux et les oreilles
- Préparations hormonales systémiques excluant les hormones sexuelles et insulines
- par exemple, les médicaments qui ont un effet sur le système endocrinien, notamment les corticostéroïdes et les hormones thyroïdiennes
- Divers
- par exemple, les médicaments non classifiables dans d'autres catégories, tel que les agents de diagnostic et les médicaments pour traiter les concentrations sanguines élevées de potassium ou de phosphate
Définitions importantes
- Examen aligné
- L'examen aligné est un examen où la société pharmaceutique a permis que l'information soit communiquée par Santé Canada à des organismes d'évaluation des technologies de santé. Pour en savoir plus, allez à la rubrique « Médicaments pour utilisation humaine : Réalisations de 2018 ».
- Médicaments biologiques
- Les médicaments biologiques sont des produits d'origine biologique tels que les vaccins, les produits dérivés du sang et les produits issus de la biotechnologie.
- Produits biosimilaires
- Il s'agit de médicament biologique mis en marché à la suite d'un médicament biologique homologué précédemment au Canada, et qui présente une similitude démontrée avec ce médicament biologique homologué précédemment.
- Drogues nouvelles pour usage exceptionnel
- Santé Canada reconnaît qu'il y a des circonstances dans lesquelles les fabricants ne peuvent pas raisonnablement fournir de données probantes substantielles pour montrer l'innocuité et l'efficacité d'un produit thérapeutique parce qu'il est difficile, du point de vue logistique ou éthique, de réaliser des essais cliniques appropriés sur l'être humain. Pour ces types de produits qui peuvent être nécessaires dans le cadre de la préparation aux situations d'urgence au Canada, la réglementation sur les drogues nouvelles pour usage exceptionnel (DNUE) permet d'accorder une autorisation de mise en marché en s'appuyant principalement sur des données obtenues dans le cadre d'essais sur des animaux. Une fois qu'une autorisation de mise en marché d'un produit en tant que DNUE a été délivrée, la vente du produit pour cette indication est limitée aux gouvernements fédéral, provinciaux et territoriaux et aux administrations municipales.
- Médicaments génériques
- Copie d'un produit de marque. Les médicaments génériques contiennent les mêmes ingrédients médicinaux que les produits de marque et sont considérés comme biologiquement équivalents aux médicaments de marque. Il peut y avoir de nombreuses versions génériques d'un médicament de marque. Comme les médicaments génériques coûtent moins cher que les médicaments de marque, l'approbation des médicaments génériques peut entraîner des économies considérables pour le système de santé.
- Examen conjoint
- Il faut entendre par examen conjoint les examens lors desquels Santé Canada a œuvré de concert avec d'autres partenaires de confiance pour partager le travail d'examen des médicaments. Pour en savoir plus, voir la rubrique « Médicaments pour utilisation humaine : Réalisations de 2018 ».
- Nouveaux médicaments
- Les nouveaux médicaments vous donnent des choix nouveaux et innovateurs de traitement, de prévention et de diagnostic de différents problèmes de santé.
- Nouvelle substance active
- Un nouveau médicament qui contient un ingrédient médicinal qui n'avait pas encore été approuvé dans un médicament au Canada et qui n'est pas une variante d'un ingrédient médicinal déjà approuvé.
- Avis de conformité avec conditions
- Pour un médicament qui présente un avantage clinique prometteur, visant une maladie ou une condition grave, potentiellement mortelle ou très débilitante, un avis de conformité peut être délivré avec conditions (AC-C). Le fabricant doit quand même montrer que le médicament a un profil d'innocuité acceptable fondé sur une évaluation des avantages et des risques associés à l'usage du médicament et qu'il est d'excellente qualité. Les présentations qui sont examinées dans le cadre de ce volet sont également assujetties à des délais d'examen abrégé.
- Médicaments orphelins
- Les médicaments orphelins sont utilisés pour soigner des maladies rares, et ont reçu une désignation de médicaments orphelins aux États-Unis ou dans l'Union européenne.
- Médicaments en vente libre (sans ordonnance)
- Les médicaments sans ordonnance, aussi appelés médicaments en vente libre, sont des produits qui peuvent être achetés sans l'ordonnance d'un médecin.
- Examen prioritaire
- Peuvent bénéficier d'un examen prioritaire les présentations de médicaments à l'égard d'un produit visant une maladie ou une condition grave, potentiellement mortelle ou très débilitante. Les présentations qui obtiennent le statut d'examen prioritaire sont assujetties à des délais d'examen plus courts.
- Mises à jour sur l'innocuité
- Les mises à jour sur l'innocuité sont conçues pour diffuser de l'information sur les risques de santé éventuels afin que les patients et les professionnels de la santé puissent prendre des décisions éclairées sur la santé. Pour en savoir plus sur les types de communication des risques que l'on peut trouver sur le site Web du gouvernement du Canada, voir la rubrique « Clics santé – Aperçu des médicaments à usage humain ».
Figure 2: Nombre de nouveaux médicaments, nouveaux médicaments génériques, et nouveaux médicaments biosimilaires approuvés en 2018, par catégorie ATC (le Système de classification anatomique thérapeutique chimique [système ATC], système de codes mis au point par l'Organisation mondiale de la santé).
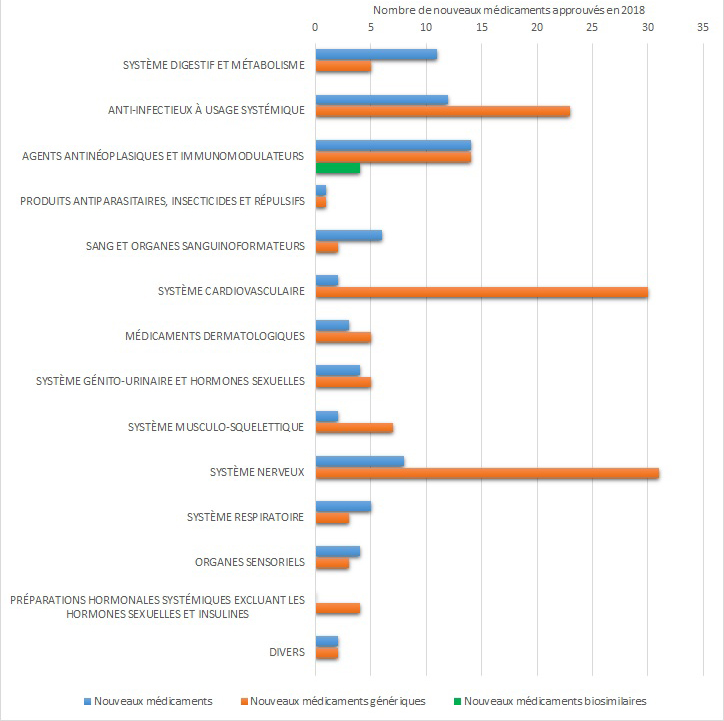
Équivalent texuel
| Catégorie ATC | Nombre de nouveaux médicaments approuvés | Nombre de nouveaux médicaments génériques approuvés | Nombre de nouveaux médicaments biosimilaires approuvés |
|---|---|---|---|
| Système digestif et métabolisme | 11 | 5 | 0 |
| Anti-infectieux à usage systémique | 12 | 23 | 0 |
| Agents antinéoplasiques et immunomodulateurs | 14 | 14 | 4 |
| Produits antiparasitaires, insecticides et répulsifs | 1 | 1 | 0 |
| Sang et organes sanguinoformateurs | 6 | 2 | 0 |
| Système cardiovasculaire | 2 | 30 | 0 |
| Médicaments dermatologiques | 3 | 5 | 0 |
| Système génito-urinaire et hormones sexuelles | 4 | 5 | 0 |
| Système musculo-squelettique | 2 | 7 | 0 |
| Système nerveux | 8 | 31 | 0 |
| Système respiratoire | 5 | 3 | 0 |
| Organes sensoriels | 4 | 3 | 0 |
| Préparations hormonales systémiques excluant les hormones sexuelles et insulines | 0 | 4 | 0 |
| Divers | 2 | 2 | 0 |
| Total des nouveaux médicaments approuvés en 2018 | 74 | 135 | 4 |
Système digestif et métabolisme
Par exemple, les médicaments visant le tube digestif, les médicaments contre l'obésité, les médicaments contre le diabète, et les vitamines.
11 Nouveaux médicaments ont été approuvés dans cette catégorie
Brineura
- Médicament biologique
- Nouvelle substance active
- Médicament orphelin
- Examen prioritaire
- Ingrédient médicinal
- Cerliponase Alfa
- Indication
- Le Brineura contient la substance active Cerliponase Alfa qui appartient à un groupe de médicaments connus sous le nom d'enzymothérapies substitutives. Il sert à traiter les patients atteints de la céroïde-lipofuscinose neuronale de type 2 (CLN2), également appelée déficit en tripeptidyl peptidase-1 (TPP1).
Contrave
- Ingrédient médicinal
- Chlorhydrate de bupropion, chlorhydrate de naltréxone
- Indication
- Contrave devrait être pris en association avec un régime alimentaire à calories réduites et une activité physique accrue. Il est destiné à la gestion du poids pour :
- les patients obèses
- les patients en surpoids qui ont au moins une affection liée au poids, comme :
- une hypertension artérielle contrôlée avec un médicament
- du diabète de type 2
- une grande quantité de lipides (cholestérol ou d'autres types de gras) dans le sang
Mezera
- Ingrédient médicinal
- Mésalazine
- Indication
- Traitement de la rectite ulcéreuse active d'intensité légère à modérée.
Ozempic
- Médicament biologique
- Nouvelle substance active
- Ingrédient médicinal
- Sémaglutide
- Indication
- L'Ozempic contient la substance active sémaglutide. Il sert à abaisser le taux de sucre sanguin (glucose) chez les adultes atteints de diabète de type 2. Ozempic est utilisé comme seul médicament si le taux de sucre sanguin n'est pas bien contrôlé par le régime et l'exercice uniquement et que vous ne pouvez utiliser la metformine. Ozempic est utilisé conjointement avec un ou plusieurs autres médicaments contre le diabète s'ils ne suffisent pas à contrôler les taux de sucre sanguin. Ces autres médicaments peuvent être : antidiabétiques oraux (par exemple, metformine, sulfonylurée) ou insuline.
Rayaldee
- Nouvelle substance active
- Ingrédient médicinal
- Calcifédiol
- Indication
- Rayaldee est utilisé pour traiter l'hyperparathyroïdie secondaire (SHPT) chez les adultes atteints d'insuffisance rénale chronique de stade 3 ou 4, qui n'ont pas assez de vitamine D.
Segluromet
Segluromet Sommaire de décision
- Ingrédient médicinal
- Pidolate d'ertugliflozin, chlorhydrate de metformine
- Indication
- Segluromet est utilisé en combinaison avec un régime alimentaire et de l'exercice. Il est utilisé pour améliorer les taux de glycémie des adultes avec un diabète de type 2.
Soliqua
Segluromet Sommaire de décision
- Ingrédient médicinal
- Insuline glargine, lixisénatide
- Indication
- Soliqua est utilisé en combinaison avec un régime alimentaire et de l'exercice pour améliorer les taux de glycémie des adultes avec un diabète de type 2. Il est généralement prescrit quand l'insuline avec ou sans metformine ne suffit pas à contrôler vos taux de glycémie.
Steglatro
- Nouvelle substance active
Steglatro Sommaire de décision
- Ingrédient médicinal
- Ertugliflozin
- Indication
- Steglatro est utilisé en combinaison avec un régime alimentaire et de l'exercice pour améliorer les taux de glycémie des adultes avec un diabète de type 2 dans les cas où prescrire de la metformine n'est pas une option (en raison de contre-indications ou d'intolérance).
Steglujan
Steglujan Sommaire de décision
- Ingrédient médicinal
- Pidolate d'ertugliflozin, phosphate de sitagliptine monohydraté
- Indication
- Steglujan est utilisé en combinaison avec de la metformine, un régime alimentaire et de l'exercice. Il est utilisé pour améliorer les taux de glycémie des adultes avec un diabète de type 2.
Xermelo
- Examen aligné
- Nouvelle substance active
- Médicament orphelin
- Ingrédient médicinal
- Étiprate de télotristat
- Indication
- Ce médicament est utilisé chez les adultes pour traiter la diarrhée causée par un trouble appelé « syndrome carcinoïde ».
- Xermelo est utilisé si la diarrhée n'est pas bien maîtrisée par l'injection d'autres médicaments appelés « analogues de la somatostatine » (lanréotide ou octréotide). Vous devez continuer de recevoir des injections de ces médicaments lorsque vous prenez Xermelo.
Xultophy
- Médicament biologique
- Ingrédient médicinal
- Insuline dégludec, liraglutide
- Indication
- Le Xultophy est utilisé combiné à la metformine, avec ou sans sulfonylurée, pour améliorer les taux sanguin (de sucre) chez les patients adultes atteints de diabète de type 2.
5 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant de l'ésoméprazole magnésien trihydraté
- 1 produit contenant du glycopyrrolate
- 1 produit contenant du chlorhydrate de granisétron
- 1 produit contenant du chlorhydrate d'ondansétron dihydraté
- 1 produit contenant de l'ursodiol
Mises à jour sur l'innocuité publiées dans cette catégorie
- Inhibiteurs Dipeptidylpeptidase-4 (DPP-4) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de réaction de la peau (pemphigoïde bulleuse)
- Ocaliva (acide obéticholique) : InfoVigilance sur les produits de santé : Problèmes hépatiques (y compris défaillance hépatique) liés à des erreurs d'ordonnance de dosage.
- Inhibiteurs de SGLT2 (canagliflozine, dapagliflozine, empagliflozine) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'une affectation cérébrale rare (syndrome d'encéphalopathie postérieure réversible) chez les patients résentant des taux élevés d'acides dans le sang (acidocétose diabétique) et Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'inflammation du pancréas (pancréatite aiguë et chronique)
Anti-infectieux à usage systémique
Par exemple, les antibactériens, antifongiques, antiviraux, et vaccins.
12 Nouveaux médicaments ont été approuvés dans cette catégorie
Afluria Tetra
- Médicament biologique
Afluria Tetra Sommaire de décision
- Ingrédient médicinal
- Hémagglutinine-souche A (H1N1), hémagglutinine-souche A (H3N2), hémagglutinine-souche B (Victoria), hémagglutinine-souche B (Yamagata)
- Indication
- Afluria Tetra est indiqué pour l'immunisation active des personnes de cinq ans et plus contre la grippe causée par les virus de l'influenza des types A et B contenus dans le vaccin.
Biktarvy
- Nouvelle substance active
- Ingrédient médicinal
- Bictégravir de sodium, emtricitabine, hémifurate de ténofovir alafénamide
- Indication
- Biktarvy est un comprimé pour le traitement de l'infection par le virus de l'immunodéficience humaine (VIH-1) chez les adultes. Biktarvy est pour les individus qui n'ont pas un virus VIH résistant aux composants de Biktarvy.
Biothrax
- Drogue nouvelle pour usage exceptionnel
- Nouvelle substance active
- Médicament orphelin
- Ingrédient médicinal
- Filtrat d'antigène de l'Anthrax
- Indication
- Le vaccin BioThrax Anthrax adsorbé est un vaccin utilisé pour prévenir l'infection due au Bacillus anthracis.
Cresemba
- Examen harmonisé
- Nouvelle substance active
- Médicament orphelin
- Ingrédient médicinal
- Sulfate d'isavuconazonium
- Indication
- Cresemba est utilisé chez les adultes pour traiter :
- l'aspergillose
- la mucormycose (également appelée zygomycose)
- Il s'agit d'infections fongiques qui peuvent se retrouver dans votre sang ou vos tissus.
- Cresemba est utilisé chez les adultes pour traiter :
Cutaquig
- Médicament biologique
- Ingrédient médicinal
- Immunoglobuline G (humaine)
- Indication
- Le Cutaquig sert à traiter l'immunodéficience primaire (IDP) et l'immunodéficience secondaire (IDS) chez les personnes ayant besoin d'une thérapie de remplacement de l'immunoglobuline.
Delstrigo
Delstrigo Sommaire de décision
- Ingrédient médicinal
- Doravirine, lamivudine, fumarate de ténofovir disoproxil
- Indication
- Delstrigo est utilisé pour le traitement de l'infection au virus de l'immunodéficience humaine-1 (VIH-1) chez l'adulte. Le VIH est le virus qui cause le sida (syndrome d'immunodéficience acquise). Delstrigo s'adresse aux personnes dont le VIH n'est pas résistant à la doravirine, à la lamivudine ou au ténofovir.
Juluca
- Ingrédient médicinal
- Dolutégravir de sodium, chlorydrate de rilpivirine
- Indication
- Juluca est utilisé pour traiter l'infection par le VIH (virus de l'immunodéficience humaine) chez les adultes.
Kamrab
- Médicament biologique
- Ingrédient médicinal
- Immunoglobuline antirabique (humaine)
- Indication
- Kamrab est utilisé pour traiter l'infection au virus de la rage. C'est un traitement monodose utilisé avec une série vaccinale antirabique complète.
Mar-Cidofovir
Mar-Cidofovir Sommaire de décision
- Ingrédient médicinal
- Cidofovir
- Indication
- Mar-Cidofovir est utilisé pour traiter une infection oculaire appelée rétinite à CMV (cytomégalovirus) chez les patients atteints du SIDA (syndrome d'immunodéficience acquise).
Pifeltro
- Nouvelle substance active
- Ingrédient médicinal
- Doravirine
- Indication
- Pifeltro est utilisé pour le traitement de l'infection au virus de l'immunodéficience humaine-1 (VIH-1) chez l'adulte. Le VIH est le virus qui cause le sida (syndrome d'immunodéficience humaine). Pifeltro est utilisé en même temps que d'autres médicaments pour traiter l'infection au VIH. Pifeltro s'adresse aux personnes qui ne sont pas atteintes d'un virus du VIH résistant à la doravirine.
Symtuza
- Ingrédient médicinal
- Cobistat, éthanolate de darunavir, emtricitabine, hémifumarate de ténofovir alafénamide
- Indication
- Symtuza est un régime d'un comprimé qui contient des médicaments antirétroviraux pour traiter le virus de l'immunodéficience humaine (VIH). Le VIH est le virus responsable du SIDA (syndrome d'immunodéficience acquise).
Xydalba
- Nouvelle substance active
- Examen prioritaire
- Ingrédient médicinal
- Dalbavancine
- Indication
- Xydalba est utilisé pour traiter les adultes avec des infections cutanées ou des infections dans les couches de chair sous l'épiderme.
23 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant du sulfate d'abacavir
- 1 produit contenant du sulfate d'amikacine
- 1 produit contenant de l'amoxicilline et de l'acide clavulanique
- 1 produit contenant de l'amoxicilline trihydratée
- 1 produit contenant de l'amoxicilline trihydratée et du potassium de clavulanate
- 1 produit contenant du sulfate d'atazanavir
- 2 produits contenant du dihydrate d'azithromycine
- 1 produit contenant de la clarithromycine
- 1 produit contenant de l'éfavirenz, de l'emtricitabine et du fumarate de ténofovir disoproxil
- 1 produit contenant de la fosfomycine trométhamine
- 1 produit contenant du ganciclovir
- 1 produit contenant du sodium de ganciclovir
- 1 produit contenant de l'itraconazole
- 1 produit contenant de la lamivudine
- 1 produit contenant du linézolide
- 1 produit contenant du phosphate d'oseltamivir
- 2 produits contenant du fumarate de ténofovir disoproxil
- 1 produit contenant du chlorhydrate de vancomycine
- 3 produits contenant du voriconazole
Mises à jour sur l'innocuité publiées dans cette catégorie
- Azithromycine : Mise à jour : Risque possible de récidive du cancer
- Antibiotiques bêta-lactamines : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'effets indésirables graves touchant la peau (réactions indésirables cutanée graves – SCAR)
- Isoniazide : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'inflammation du pancréas (pancréatite)
- Prezcobix (darunavir et cobicistat) et Symtuza (darunavir, cobicistat, emtracitabine et ténofovir alafénamide) : InfoVigilance sur les produits de santé : Risque de diminution significative de l'exposition au darunavir et au cobicistat pendant la grossesse
- Rifadin (rifampine) : InfoVigilance sur les produits de santé : Risque de coagulopathie dépendante de la vitamine K
- Tivicay, Triumeq et Juluca (médicaments contenant du dolutégravir) : Avis aux professionnels de la santé : Risque de malformations touchant le cerveau, la colonne vertébrale et la moelle épinière
- Vaccins de GlaxoSmithKline Inc. : Avis aux professionnels de la santé : Risque potentiel d'administration de doses insuffisantes
Agents antinéoplasiques et immunomodulateurs
Par exemple, les médicaments pour le traitement du cancer et les médicaments qui stimulent ou suppriment les réponses immunitaires.
14 Nouveaux médicaments ont été approuvés dans cette catégorie
Alunbrig
- Nouvelle substance active
- Avis de conformité avec conditions
- Médicament orphelin
- Ingrédient médicinal
- Brigatinib
- Indication
- Alunbrig est utilisé pour traiter un type de cancer du poumon appelé cancer du poumon non à petites cellules (CPNPC). Il est utilisé quand le cancer s'est propagé à d'autres parties du corps (métastatique). Il est uniquement utilisé chez les patients dont le cancer s'est aggravé après avoir pris du crizotinib ou chez les patients qui ne sont pas en mesure de prendre du crizotinib.
Bavencio
- Avis de conformité avec conditions
- Ingrédient médicinal
- Avelumab
- Indication
- Bavencio est un médicament utilisé pour traiter un type rare de cancer de la peau qui s'est propagé, appelé carcinome à cellules de Merkel métastatique, chez les adultes précédemment traités. Bavencio est aussi utilisé pour traiter un cancer de la vessie qui ne peut être retiré par une chirurgie ou qui s'est propagé et qui a déjà été traité à l'aide d'un certain type de chimiothérapie qui n'a pas fonctionné ou qui a cessé de fonctionner.
Besponsa
- Nouvelle substance active
- Médicament biologique
- Ingrédient médicinal
- Inotuzumab ozogamicine
- Indication
- Besponsa est utilisé pour traiter un type particulier de leucémie, la leucémie aiguë lymphoblastique (LAL). La LAL est un cancer du sang. Chez la personne qui en est atteinte, on observe un nombre trop élevé de globules blancs. Besponsa est utilisé dans le traitement de la LAL chez les adultes dont la LAL est réapparu après un traitement (récidivante) ou n'a pas répondu au premier traitement (réfractaire).
Cabometyx
- Nouvelle substance active
- Examen prioritaire
Cabometyx Sommaire de décision
- Ingrédient médicinal
- Cabozantinib
- Indication
- Cabometyx est utilisé pour traiter les adultes ayant un type de cancer avancé du rein appelé hypernéphrome et qui ont déjà reçu un traitement avec un médicament spécifique contre le cancer.
Erleada
- Examen conjoint
- Nouvelle substance active
- Examen prioritaire
- Ingrédient médicinal
- Apalutamide
- Indication
- Erleada est utilisé pour traiter le cancer de la prostate qui :
- ne s'est pas propagé à d'autres parties du corps, et
- ne répond plus à un médicament ou à une intervention chirurgicale qui permet de réduire la testostérone
- Erleada est utilisé pour traiter le cancer de la prostate qui :
Folotyn
- Examen aligné
- Nouvelle substance active
- Médicament orphelin
- Ingrédient médicinal
- Pralatrexate
- Indication
- Folotyn est utilisé pour traiter un type de cancer appelé lymphome périphérique à cellules T (LPCT) qui ne disparaît pas, qui s'aggrave ou réapparait après un traitement avec un autre agent anticancéreux.
Imfinzi
- Médicament biologique
- Avis de conformité avec conditions
- Ingrédient médicinal
- Durvalumab
- Indication
- Imfinzi (durvalumab) est un médicament utilisé pour traiter les adultes atteints d'un cancer de la vessie, de l'uretère, de l'urètre ou du bassinet du rein (appelé carcinome urothélial). Il est utilisé lorsque :
- votre cancer s'est propagé et ne peut être retiré par chirurgie, et que
- vous avez reçu une chimiothérapie qui n'a pas fonctionné ou qui a cessé de fonctionner
- Imfinzi est également utilisé pour traiter les adultes atteints d'un type de cancer du poumon appelé cancer du poumon non à petites cellules. Il est utilisé lorsque :
- votre tumeur a augmenté de volume et ne peut pas être retiré par chirurgie, et que
- votre cancer a répondu à un traitement par une chimiothérapie et une radiothérapie ou s'est stabilisé à la suite de ces traitements
Kisqali
- Nouvelle substance active
- Ingrédient médicinal
- Succinate de ribociclib
- Indication
- Kisqali est utilisé pour traiter la femme ménopausée avec un certain type de cancer du sein qui est avancé et qu'il n'est peut-être pas possible de retirer par une intervention chirurgicale ou qui s'est propagé à d'autres parties du corps. Kisqali doit être utilisé en association avec un autre médicament contre le cancer du sein, appelé létrozole.
Kymriah
- Médicament biologique
- Nouvelle substance active
- Médicament orphelin
- Examen prioritaire
Kymriah Sommaire de décision (LDGCB) et Kymriah Sommaire de décision (LAL à cellules B)
- Ingrédient médicinal
- Tisagenlecleucel
- Indication
- Kymriah est utilisé pour traiter :
- La leucémie lymphoblastique aiguë à cellules B (LAL à cellules B), une forme de cancer composé de certains types de globules blancs qui sont devenus cancéreux. Kymriah peut être administré aux enfants et aux jeunes adultes âgés de trois à 25 ans qui sont atteints de cette forme de cancer.
- Le lymphome diffus à grandes cellules B (LDGCB), une forme de cancer composé de certains types de globules blancs qui sont devenus cancéreux, principalement dans les ganglions lymphatiques. Kymriah peut être administré aux adultes (âgés de 18 ans ou plus) chez lesquels le LDGCB est réapparu après d'autres traitements ou lorsque les autres traitements ont échoué.
- Kymriah est utilisé pour traiter :
Lonsurf
- Nouvelle substance active
- Examen prioritaire
- Ingrédient médicinal
- Chlorhydrate de tipiracil, trifluridine
- Indication
- Lonsurf est utilisé pour traiter les adultes ayant un cancer du côlon ou un cancer du rectum – parfois appelé cancer « colorectal ». Il est utilisé quand le cancer s'est propagé à d'autres parties du corps. Il est utilisé quand d'autres traitements n'ont pas fonctionné ou quand d'autres traitements ne vous conviennent pas.
Ocrevus
- Médicament biologique
- Examen prioritaire
- Ingrédient médicinal
- Ocrélizumab
- Indication
- Ocrevus est un médicament d'ordonnance utilisé dans le traitement de la sclérose en plaques récurrente rémittente (SPRR) évolutive et de la sclérose en plaques progressive primaire (SPPP) chez les adultes.
Olumiant
- Nouvelle substance active
- Ingrédient médicinal
- Baricitinib
- Indication
- Oluminant, en association avec la méthotrexate, est indiqué pour réduire les signes et symptômes de la polyarthrite rhumatoïde chez les adultes atteints d'une polyarthrite rhumatoïde évolutive d'intensité modérée à grave qui ont montré une réponse inadéquate à un ou plusieurs autres médicaments appelés médicaments anti-rhumatoïdes modifiant la maladie (DMARD).
Siliq
- Médicament biologique
- Nouvelle substance active
- Ingrédient médicinal
- Brodalumab
- Indication
- Siliq est utilisé pour traiter une maladie de la peau appelé « psoriasis en plaques », qui provoque une inflammation de la peau et la formation de plaques écailleuses sur la peau. Siliq réduit l'inflammation et les autres symptômes de la maladie. Siliq est utilisé chez les adultes atteints de psoriasis en plaques modéré à sévère touchant de grandes surfaces du corps qui pourraient bénéficier de la prise d'injections, de pilules ou de la photothérapie.
Unituxin
- Médicament biologique
- Nouvelle substance active
- Médicament orphelin
- Ingrédient médicinal
- Dinutuximab
- Indication
- Unituxin est utilisé pour traiter les neuroblastomes à haut risque chez les bébés, les enfants et les adolescents. Le neuroblastome est un cancer qui débute dans les cellules nerveuses précoces du corps.
4 Nouveaux produits biosimilaires ont été approuvés dans cette catégorie
Fulphila
- Examen aligné
- Médicament biologique
- Ingrédient médicinal
- Pegfilgrastim
- Indication
- Fulphila est utilisé dans le traitement de la neutropénie. Cette affection qui empêche l'organisme de produire des quantités suffisantes de globules blancs peut être causée par les médicaments anticancéreux. La neutropénie est l'effets indésirable le plus commun de la chimiothérapie. Elle prédispose l'organisme aux infections et l'empêche de les combattre. Fulphila augmente le nombre de neutrophiles qui combattent les infections.
Hadlima, Hadlima PushTouch
- Médicament biologique
Hadlima, Hadlima PushTouch Sommaire de décision
- Ingrédient médicinal
- Adalimumab
- Indication
- Hadlima (ou Hadlima PushTouch) est un médicament qu'on emploie pour traiter :
- Les adultes atteints de polyarthrite rhumatoïde, une maladie inflammatoire qui s'attaque aux articulations.
- Les adultes atteints de rhumatisme psoriasique, une maladie inflammatoire qui s'attaque aux articulations et à la peau.
- Les adultes atteints de spondylarthrite ankylosante, une forme d'arthrite.
- Les adultes atteints de la maladie de Crohn, une maladie inflammatoire qui s'attaque au tube digestif.
- Les enfants atteints d'arthrite juvénile idiopathique polyarticulaire âgés d'au moins quatre ans qui doivent recevoir la pleine dose de 40 mg selon leur poids et leur taille.
- Les adultes atteints de colite ulcéreuse, une maladie inflammatoire de l'intestin (côlon).
- Les adultes atteints d'hidradénite suppurée modérément à fortement évolutive qui n'ont pas répondu à un traitement antibiotique. L'hidradénite suppurée est une maladie inflammatoire de la peau chronique, douloureuse et évolutive, qui provoque l'apparition de nodules, d'abcès, de voies de sinus et de fistules sous les seins, aux aisselles, sur les fesses et dans l'aine.
- Les adultes atteints de psoriasis, une maladie inflammatoire de la peau. Le médecin vous a prescrit Hadlima (ou Hadlima PushTouch) pour atténuer les signes et les symptômes de votre psoriasis en plaques.
- Les adultes atteints d'uvéite, une maladie inflammatoire de l'œil.
- Hadlima (ou Hadlima PushTouch) est un médicament qu'on emploie pour traiter :
Lapelga
- Médicament biologique
- Ingrédient médicinal
- Pegfilgrastim
- Indication
- Lapelga est utilisé pour traiter la neutropénie. La neutropénie est la condition d'un corps qui produit trop peu de globules blancs. Elle peut être causée par des drogues utilisées pour traiter le cancer. La neutropénie est l'effet indésirable grave le plus commun de la chimiothérapie. La neutropénie rend votre corps vulnérable aux infections et vous empêche de les combattre. Lapelga augmente le nombre de neutrophiles, qui combattent les infections.
Mvasi
- Médicament biologique
- Ingrédient médicinal
- Bévacizumab
- Indication
- Mvasi est utilisé en association avec une chimiothérapie spécifique (chimiothérapie à base de 5-fluorouracil [5-FU] administrée par voie intraveineuse) pour le traitement des personnes qui ont reçu pour la première fois un diagnostic de cancer colorectal métastatique. Mvasi est également utilisé avec un autre type de chimiothérapie (carboplatine et paclitaxel) pour le traitement du cancer du poumon non à petites cellules métastatique.
14 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant de l'azacitidine
- 2 produits contenant une solution tampon et du chlorhydrate de melphalan
- 3 produits contenant du busulfan
- 1 produit contenant du chlorhydrate d'erlotinib
- 2 produits contenant du fluorouracil
- 1 produit contenant de la leflunomide
- 1 produit contenant du mofétilmycophénolate
- 2 produits contenant du pemetrexed hémipentahydrate disodique
- 1 produit contenant du tacrolimus
Mises à jour sur l'innocuité publiées dans cette catégorie
- Avonex (interféron bêta-1a) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de maladie inflammatoire touchant un ou plusieurs organes (sarcoïdose)
- Blincyto (blinatumomab) : Avis aux professionnels de la santé : Risque de toxicité de l'alcool benzylique chez l'enfant
- Erwinase (L- Asparaginase) : Avis aux professionnels de la santé : Flacons contenant des particules pour aider à la gestion des impacts de la pénurie actuelle
- Gilenya (fingolimod) : InfoVigilance sur les produits de santé : Risque d'effets indésirables graves chez les patients atteints de troubles cardiaques
- Gleevec et génériques (mésylate d'imatinib) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de troubles affectant les tendons
- Halaven (mésylate d'eribuline) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'effets indésirables graves au niveau de la peau (SCAR)
- Imbruvica (ibrutinib) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'une anomalie du rythme cardiaque grave et mortelle (tachyarythmie ventriculaire)
- Imuran (azathioprine) : InfoVigilance sur les produits de santé : Risque d'activation macrofagique excessive surtout chez les personnes atteintes d'arthrite
- Jakavi (ruxolitinib) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'interaction médicamenteuse avec les substrats de la P-glycoprotéine (P-gp) (y compris la rosuvastatine)
- Lenvima (lenvatinib) : InfoVigilance sur les produits de santé : Risque de pneumothorax
- Ofev (nintedanib) : Avis aux professionnels de la santé : Risque de lésions hépatiques induites par le médicament et InfoVigilance sur les produits de santé : Risque de perforation gastro-intestinale
- Remicade (infliximab) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'une affection vésiculeuse de la peau appelée dermatose bulleuse à IgA linéaire
- Revlimid (lénalidomide) : InfoVigilance sur les produits de santé : Risque de rejet de transplantation d'organe solide
- Ruxolitinib : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de lésions du foie
- Tecentriq (atézolizumab) : Avis aux professionnels de la santé : risque de néphrite à médiation immunitaire et Avis aux professionnels de la santé : Risque d'inflammation du muscle cardiaque (myocardite)
- Inhibiteurs de la tyrosine kinase du récepteur du facteur de croissance de l'endothélium vasculaire (ITK du récepteur du FCEV) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de changements structurels anormaux aux parois artérielles y compris la rupture (dissections artérielles et anévrismes artériels)
- Zinbryta (daclizumab bêta) : Avis aux professionnels de la santé : Retrait volontaire du marché au Canada en raison du risque d'encéphalite
- Zydelig (idelalisib) : InfoVigilance sur les produits de santé : Risque d'infection grave du cerveau
Produits antiparasitaires, insecticides et répulsifs
Par exemple, les médicaments pour traiter les infestations parasitaires.
1 Nouveau médicament a été approuvé dans cette catégorie
Stromectol
Stromectol Sommaire de décision
- Ingrédient médicinal
- Ivermectine
- Indication
- Stromectol est utilisé pour traiter les infections provoquées par certains parasites (vers).
1 Nouveau médicament générique a été approuvé dans cette catégorie
- 1 produit contenant de l'atovaquone
Sang et organes sanguinoformateurs
Par exemple, les médicaments comme les anticoagulants et les antihémorragiques.
6 Nouveaux médicaments ont été approuvés dans cette catégorie
Alphanate
- Médicament biologique
Alphanate Sommaire de décision
- Ingrédient médicinal
- Facteur antihémophilique (humain), facteur de Von Willebrand (humain)
- Indication
- Alphanate (complexe du facteur antihémophilique/facteur de von Willebrand [humain]) est indiqué pour la prévention et le traitement d'épisodes de saignement mineur ou ne menaçant pas le pronostic vital et des saignements d'origine chirurgicale chez les adultes et les enfants atteints de la maladie de von Willebrand, lorsque les autres médicaments semblent inefficaces ou est contre-indiqués.
Hemlibra
- Médicament biologique
- Nouvelle substance active
- Médicament orphelin
- Examen prioritaire
- Ingrédient médicinal
- Emicizumab
- Indication
- Emicizumab est un médicament pouvant être utilisé par tous les groupes d'âge. Il est utilisé pour traiter les personnes :
- qui sont atteintes d'hémophilie A (un trouble hémorragique avec lequel peuvent naître certaines personnes ou qui peut se manifester au cours de la vie), une maladie causée par l'absence ou le mauvais fonctionnement d'une protéine (le facteur VIII), ce qui peut empêcher le sang de coaguler normalement
- qui ont aussi développé des « inhibiteurs du facteur VIII », lesquels empêchent le facteur VIII de remplacement de fonctionner correctement
- Emicizumab est un médicament pouvant être utilisé par tous les groupes d'âge. Il est utilisé pour traiter les personnes :
Jivi
- Médicament biologique
- Nouvelle substance active
- Ingrédient médicinal
- Facteur antihémophilique (recombinant pégylé à domaine B tronqué)
- Indication
- JIVI est destiné au traitement de l'hémophilie A chez les patients de 12 ans ou plus ayant été traités antérieurement. JIVI peut être utilisé pour :
- prévenir les hémorragies
- faire cesser les hémorragies
- JIVI est destiné au traitement de l'hémophilie A chez les patients de 12 ans ou plus ayant été traités antérieurement. JIVI peut être utilisé pour :
Monoferric
- Nouvelle substance active
Monoferric Sommaire de décision
- Ingrédient médicinal
- Fer-isomaltoside 1000
- Indication
- Monoferric est utilisé pour augmenter votre teneur en fer (parfois appelée « anémie ferriprive » quand :
- vous ne tolérez pas l'administration de fer par voie orale ou
- les traitements ferriques par voie orale ne fonctionnent pas pour vous
- Monoferric est utilisé pour augmenter votre teneur en fer (parfois appelée « anémie ferriprive » quand :
Panhematin
- Médicament biologique
- Nouvelle substance active
- Examen prioritaire
Panhematin Sommaire de décision
- Ingrédient médicinal
- Hémine
- Indication
- Panhematin est un médicament d'ordonnance à base d'hémine pour injection. Il est utilisé pour soulager les crises de porphyrie aiguë intermittente (PAI) liées au cycle menstruel chez les femmes qui en souffrent, lorsqu'on observe ou qu'on soupçonne que le traitement initial par des glucides est inadéquat. Panhematin ne devrait pas être utilisé pour prévenir les crises de porphyrie.
Takhzyro
- Médicament biologique
- Nouvelle substance active
- Examen prioritaire
- Ingrédient médicinal
- Lanadélumab
- Indication
- Takhzyro est un médicament utilisé pour prévenir de crises d'angio-œdème héréditaire (AOH) chez les adultes et les adolescents (âgés de 12 ans et plus). Takhzyro ne doit pas être utilisé pour traiter une crise d'AOH aiguë. En cas de crise aiguë, consulter un médecin.
2 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant du dabigatran étexilate
- 1 produit contenant du dabigatran étexilate mésilate
Mises à jour sur l'innocuité publiées dans cette catégorie
- Solution pour dialyse péritonéale Dianeal : Avis : Présence possible de matière particulaire
- Pradaxa (dabigatran étexilate) : Résumé de l'examen de l'innocuité – Évaluation du risque potentiel de lésions du foie
Système cardiovasculaire
Par exemple, les médicaments contre l'hypertension artérielle et les hypocholestérolémiants.
2 Nouveaux médicaments ont été approuvés dans cette catégorie
Apo-Perindopril Arginine
Apo-Perindopril Arginine Sommaire de décision
- Ingrédient médicinal
- Périndopril arginine
- Indication
- Votre médecin peut prescrire l'Apo-Perindopril Arginine pour :
- traiter l'hypertension artérielle d'intensité légère à modérée
- traiter l'insuffisance cardiaque congestive d'intensité légère à modérée en association avec d'autres médicaments
- réduire le risque cardiovasculaire chez les patients atteints d'hypertension artérielle et/ou ceux qui ont eu une crise cardiaque et ont une coronaropathie stable
- Votre médecin peut prescrire l'Apo-Perindopril Arginine pour :
Mylan-Perindopril Arginine
- Ingrédient médicinal
- Périndopril arginine
- Indication
- Mylan-Perindopril Arginine est utilisé chez les adultes pour :
- traiter l'hypertension artérielle d'intensité légère à modérée
- traiter l'insuffisance cardiaque congestive d'intensité légère à modérée en association avec d'autres médicaments
- réduire le risque cardiovasculaire chez les patients atteints d'hypertension artérielle et/ou ceux qui ont eu une crise cardiaque et ont une coronaropathie stable
- Mylan-Perindopril Arginine est utilisé chez les adultes pour :
30 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant de l'ambrisentan
- 1 produit contenant de l'amlodipine besylate et du telmisartan
- 2 produits contenant de l'atorvastatine calcique
- 1 produit contenant du monohydrate de bosentan
- 1 produit contenant de la résine de cholestyramine
- 1 produit contenant du chlorhydrate de diltiazem
- 1 produit contenant de l'éplérénone
- 1 produit contenant de l'ethacrynate de sodium
- 1 produit contenant de l'acétate de flécaïnide
- 1 produit contenant du furosémide
- 2 produits contenant de l'hydrochlorothiazide et de l'olmésartan médoxomil
- 3 produits contenant de l'indapamide et du périndropril erbumine
- 2 produits contenant du tartrate de métoprolol
- 1 produit contenant du chlorhydrate de midodrine
- 5 produits contenant périndopril erbumine
- 1 produit contenant citrate de sildénafil
- 1 produit contenant du nitroprussiate de sodium
- 4 produits contenant du trandolapril
Mises à jour sur l'innocuité publiées dans cette catégorie
- Avapro (irbesartan) et Avalide (irbesartan et hydrochlorothiazide) : InfoVigilance sur les produits de santé : Risque d'exacerbation d'une pathologie cutanée auto-immunitaire caractérisée par des plaques rouges écailleuses (psoriasis)
- Cardizem CD (chlorhydrate de diltiazem) : InfoVigilance sur les produits de santé : Risque de bronchospasme, incluant l'aggravation de l'asthme
- EpiPens :
- Mise à jour : Pénurie d'auto-injecteurs EpiPen (0,3 mg) au Canada
- Mise à jour : Mise à jour sur la pénurie d'auto-injecteurs EpiPen (0,3 mg) et EpiPen Jr (0,15 mg) au Canada
- Mise à jour : Mise à jour de Santé Canada à l'intention de la population canadienne au sujet de la pénurie d'auto-injecteurs EpiPen (0,3 mg)
- Avis aux professionnels de la santé : Arrêté d'urgence permettant l'importation d'AUVI-Q en réponse aux pénuries d'EpiPen et EpiPen Jr
- Avis : Les auto-injecteurs EpiPen et EpiPen Jr pourraient coller à l'intérieur de leurs tubes de rangement.
- Tromboject 1 % et 3 % (tétradécyl sulfate de sodium) : Avis aux professionnels de la santé : Les fioles peuvent contenir des particules visibles et insolubles et Avis aux professionnels de la santé : Mise à jour sur l'utilisation de filtres de grade médical
- Plusieurs médicaments contenant du valsartan :
- Avis : Rappel en raison d'une contamination potentiellement cancérogène
- Mise à jour : Élargissement du rappel de médicaments contenant du valsartan pour inclure des lots supplémentaires
- Mise à jour : Seconde impureté liée aux médicaments renfermant du valsartan déjà rappelés
- Mise à jour : Santé Canada communique aux Canadiens les plus récentes estimations des risques pour la santé des médicaments renfermant du valsartan rappelés, qui contiennent de la NDMA
- Mise à jour : Rappel volontaire de médicaments Mylan-Valsartan par mesure de précaution en raison de la présence d'une impureté
- Mise à jour : Santé Canada constate que le site Zhejiang Huahai Pharmaceuticals (fabricant des ingrédients pharmaceutiques actifs du valsartan) ne respecte pas les exigences relatives à la fabrication d'ingrédients médicamenteux
Médicaments dermatologiques
Par exemple, les médicaments pour la peau, tel que les médicaments contre le psoriasis.
3 Nouveaux médicaments ont été approuvés dans cette catégorie
Eucrisa
- Nouvelle substance active
- Ingrédient médicinal
- Crisaborole
- Indication
- Eucrisa est un médicament non stéroïdien sur ordonnance utilisé sur la peau pour traiter l'eczéma d'intensité légère à modérée (dermatite atopique).
Fucibet
- Ingrédient médicinal
- Bétaméthasone, acide fusidique
- Indication
- Fucibet est utilisé pour traiter l'eczéma qui est infecté par des bactéries ou qui semble être infecté.
Stramucin
- Médicament en vente libre
- Ingrédient médicinal
- Mupirocine
- Indication
- Stramucin est utilisé pour le traitement topique des infections cutanées bactériennes mineures et des infections mineures dans les petites coupures, plaies ou éraflures.
5 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant de l'acyclovir
- 1 produit contenant de l'alitrétinoïne
- 1 produit contenant du phosphate de clindamycine
- 1 produit contenant du propionate de clobétasol
- 1 produit contenant de l'imiquimod
Mises à jour sur l'innocuité publiées dans cette catégorie
- Hydroquinone : Mise à jour : Santé Canada rappelle aux Canadiens de consulter un professionnel de la santé avant d'utiliser des produits à concentration élevée en hydroquinone
- Écrans solaires Option+ et Personelle : Avis : Rappelés en raison en raison d'une contamination bactérienne
- Propecia (finastéride) : InfoVigilance sur les produits de santé : Risque de troubles musculaires
- Écrans solaires au Canada : Mise à jour : Conseils de sécurité importants sur les écrans solaires et Mise à jour : Les tests effectués par Santé Canada n'ont révélé aucun problème important en ce qui concerne la qualité des produits et Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de réactions cutanées
- Tactupump et Tactupump Forte (adapalène et peroxyde de benzoyle) : InfoVigilance sur les produits de santé : Risque d'anomalies congénitales chez les femmes enceintes ou prévoyant le devenir
Système génito-urinaire et hormones sexuelles
Par exemple, les contraceptifs hormonaux, agents de fertilité, et hormones sexuelles.
4 Nouveaux médicaments ont été approuvés dans cette catégorie
Addyi
- Nouvelle substance active
- Ingrédient médicinal
- Flibansérine
- Indication
- Addyi est utilisé pour traiter une affection chez la femme appelée trouble lié à la baisse du désir sexuel. Cela signifie que pour un minimum de 6 mois, de 75 à 100 % du temps, vous avez éprouvé un faible désir sexuel et que cela provoque chez vous de la détresse ou des difficultés dans vos relations.
Orilissa
- Nouvelle substance active
- Ingrédient médicinal
- Élagolix
- Indication
- Orilissa est utilisé pour le traitement des symptômes douloureux de l'endométriose.
pms-Progesterone
pms-Progesterone Sommaire de décision
- Ingrédient médicinal
- Progestérone
- Indication
- pms-Progesterone est approuvé chez les femmes avec un utérus intact (n'ayant pas subi d'hystérectomie) qui ont recours à l'œstrogénothérapie substitutive pour la ménopause.
Rekovelle
- Médicament biologique
- Nouvelle substance active
Rekovelle Sommaire de décision
- Ingrédient médicinal
- Follitropine delta
- Indication
- Rekovelle est utilisée pour traiter l'infertilité chez la femme et on l'utilise chez les femmes qui participent à un programme de reproduction assistée comme la fécondation in vitro (FIV) et l'injection intracytoplasmique du spermatozoïde (ICSI).
5 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant de la progestérone
- 1 produit contenant du citrate de sildénafil
- 3 produits contenant du chlorhydrate de vardénafil
Mises à jour sur l'innocuité publiées dans cette catégorie
- Pilule anticonceptionnelle Alysena 28 : Avis : rappel d'un lot en raison de comprimés ébréchés qui peuvent réduire l'efficacité de la prévention des grossesses
- Alysena (comprimés de lévonorgestrel et éthinyl estradiol) 28 et 21 : Avis : Autres lots découverts de comprimés brisés ou ébréchés
- Pilules anticonceptionnelles : Avis : Les femmes qui prennent des pilules anticonceptionnelles doivent retourner les emballages pour les faire remplacer s'il manque des comprimés ou s'ils ont un aspect inhabituel
- Pilules anticonceptionnelles Demulen 30 : Avis : Emballages contenant des comprimés cassés ou ébréchés
- Fibristal (acétate d'ulipristal) : Mise à jour : Signalement, au Canada et en Europe, de graves effets indésirables touchant le foie et Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de lésions du foie rares, mais graves
- Pilules anticonceptionnelles Marvelon 28 : Avis : Absence d'autocollants pour les jours de la semaine dans certains emballages
- Proscar (finastéride) : InfoVigilance sur les produits de santé : Risque de troubles musculaires
Système musculo-squelettique
Par exemple, les médicaments qui ont un effet sur les muscles, les os, et les articulations, notamment les anti-inflammatoires et les relaxants musculaires.
2 Nouveaux médicaments ont été approuvés dans cette catégorie
Crysvita
- Médicament biologique
- Nouvelle substance active
- Médicament orphelin
- Examen prioritaire
- Ingrédient médicinal
- Burosumab
- Indication
- Crysvita contient la substance active burosumab. Il s'agit d'un type de médicament que l'on appelle un anticorps monoclonal humain. Crysvita est utilisé pour traiter l'hypophosphatémie liée au chromosome X (XLH). Il est utilisé chez les enfants âgés d'au moins un an ainsi que chez les adultes. XLH est une maladie génétique. Les personnes atteintes de XLH présentent des taux plus élevés d'une hormone appelée le facteur de croissance des fibroblastes 23 (FGF23). Le FGF23 abaisse la quantité de phosphate dans le sang. Le faible taux de phosphate peut générer des os qui ne peuvent pas grandir et durcir correctement.
Nuceiva
- Médicament biologique
- Ingrédient médicinal
- PrabotulinumtoxinA
- Indication
- Nuceiva est indiqué pour l'amélioration temporaire de l'apparence des sillons intersourciliers (aussi appelés rides glabellaires) modérés à sévères chez les adultes < 65 ans.
7 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant de l'allopurinol
- 1 produit contenant du carbonate de calcium et du risédronate sodique
- 1 produit contenant du célécoxib
- 1 produit contenant du diclofénac sodique
- 1 produit contenant du naproxène sodique
- 2 produits contenant de l'acide zolédronique
Système nerveux
Par exemple, les médicaments qui ont un effet sur le cerveau et le système nerveux, notamment les anesthésiques chirurgicaux, les médicaments pour traiter les toxicomanies, les antidépresseurs, et les anticonvulsifs.
8 Nouveaux médicaments ont été approuvés dans cette catégorie
Acétaminophène injectable
- Ingrédient médicamenteux
- Acétaminophène
- Indication
- Le produit soulage la douleur et la fièvre.
Aimovig
- Médicament biologique
- Nouvelle substance active
- Ingrédient médicinal
- Érénumab
- Indication
- Aimovig est indiqué pour la prévention de la migraine chez l'adulte qui souffre de migraines au moins quatre jours par mois.
Belsomra
- Nouvelle substance active
- Ingrédient médicinal
- Suvorexant
- Indication
- Belsomra (suvorexant) est un somnifère utilisé pour le traitement de l'insomnie chez les adultes qui ont des difficultés à :
- s'endormir, et/ou à
- rester endormis (réveils trop fréquents ou périodes d'éveil trop longues durant la nuit, ou encore réveils trop tôt et incapacité à se rendormir)
- Belsomra (suvorexant) est un somnifère utilisé pour le traitement de l'insomnie chez les adultes qui ont des difficultés à :
Penthrox
- Ingrédient médicinal
- Méthoxyflurane
- Indication
- Penthrox est utilisé pour le soulagement à court terme de douleurs légères à intenses après un traumatisme ou au cours d'actes médicaux.
Probuphine
Probuphine Sommaire de décision
- Ingrédient médicinal
- Chlorhydrate de buprénorphine
- Indication
- Probuphine est :
- utilisé pour traiter les adultes (18 ans et plus) qui ont une dépendance aux opioïdes
- pour les adultes qui à l'heure actuelle ne prennent pas plus de 8 mg de buprénorphine par voie orale
- un programme de médicaments en association avec des services de conseil et d'appui psychosocial
- Probuphine est :
Radicava
- Examen aligné
- Nouvelle substance active
- Examen prioritaire
- Ingrédient médicinal
- Édaravone
- Indication
- Radicava est un médicament sur ordonnance utilisé pour traiter la sclérose latérale amyotrophique (SLA).
Sublocade
- Examen prioritaire
Sublocade Sommaire de décision
- Ingrédient médicinal
- Buprénorphine
- Indication
- Sublocade est utilisé pour traiter les patients adultes (18 ans et plus) qui ont des problèmes modérés ou graves d'utilisation d'opioïdes.
Tegsedi
- Nouvelle substance active
- Examen prioritaire
- Ingrédient médicinal
- Sodium d'inotersen
- Indication
- Tegsedi est utilisé pour le traitement de la polyneuropathie de stade 1 ou 2 chez des patients adultes atteints d'amylose de la transthyrétine héréditaire (ATTR héréditaire).
31 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 6 produits contenant de l'aripiprazole
- 1 produit contenant de l'atomoxétine
- 1 produit contenant du chlorhydrate de bupropion
- 1 produit contenant du sulfate de dextroamphétamine
- 1 produit contenant du bromhydrate d'élétriptan
- 1 produit contenant du chlorhydrate d'hydromorphone
- 5 produits contenant du lacosamide
- 1 produit contenant du lévétiracétam
- 1 produit contenant du modafinil
- 1 produit contenant de la prégabaline
- 1 produit contenant de la rivastigmine
- 1 produit contenant du benzoate de rizatriptan
- 1 produit contenant du citrate de sufentanil
- 2 produits contenant du chlorhydrate de tramadol
- 3 produits contenant du tartrate de varénicline
- 2 produits contenant du chlorhydrate de ziprasidone
- 1 produit contenant du chlorhydrate de ziprasidone monohydrate
- 1 produit contenant du zolmitriptan
Mises à jour sur l'innocuité publiées dans cette catégorie
- Antipsychotiques atypiques : Résumé de l'examen de l'innocuité : Évaluation du risque de syndrome d'hypersensibilité médicamenteuse avec éosinophilie et symptômes généraux (syndrome DRESS)
- Biomedic, Option+, Laboratoires Trianon Inc. : solutions orales d'acétaminophène à saveur de fraise : Avis : Rappel de plusieurs lots en raison de la défectuosité des bouchons de sécurité à l'épreuve des enfants et Avis : Élargissement de l'appel à tous les lots
- Clozapine : Résumé de l'examen de l'innocuité : Évaluation de l'efficacité de la surveillance d'un faible taux de globules blancs (agranulocytose)
- Concerta (chlorhydrate de méthylphénidate) : InfoVigilance sur les produits de santé : Risque de troubles vasculaires cérébraux, p. ex. AVC
- Elavil (chlorhydrate d'amitriptyline) : InfoVigilance sur les produits de santé : Risque de troubles du rythme cardiaque
- Imitrex solution injectable (succinate de sumatriptan) : InfoVigilance sur les produits de santé : Risque de réactions allergiques chez les personnes qui sont sensibles au latex
- Lamotrigine (Lamictal et génériques) : InfoVigilance sur les produits de santé : Déclarations internationales de troubles sanguins, à savoir augmentation de la numération de phagocytes
- Méthadose et Métadol-D (chlorhydrate de méthadone) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de préjudice grave chez les enfants exposés à la méthadone à travers le lait maternel
- Primidone : Avis : Rappel en raison de taux élevés de plomb
- Sévoflurane : Résumé de l'examen de l'innocuité : Réévaluation du risque potentiel de rythme cardiaque lent (bradycardie) chez les enfants atteints du syndrome de Down
- Gouttes orales d'acétaminophène à saveur de fraise pour nourrissons : Avis : Rappel en raison de défectuosité des bouchons de sécurité à l'épreuve des enfants
- Vimpat (lacosamide) : InfoVigilance sur les produits de santé : Risque de tachyarythmie ventriculaire
- Vita Health Products : Avis : Rappel parce que les consommateurs peuvent être incapables d'accéder à d'importants renseignements sur l'innocuité sur les étiquettes
- Zoloft (chlorhydrate de sertraline) : InfoVigilance sur les produits de santé : Risque de troubles du rythme cardiaque
Système respiratoire
Par exemple, les médicaments qui ont un effet sur le système respiratoire, notamment les bronchodilatateurs et les médicaments contre la toux.
5 Nouveaux médicaments ont été approuvés dans cette catégorie
Arbesda Respiclick
Arbesda Respiclick Sommaire de décision
- Ingrédient médicinal
- Propionate de fluticasone, xinafoate de salmétérol
- Indication
- Arbesda Respiclick est utilisé pour le traitement de l'asthme. Il est utilisé chez les individus de 12 ans et plus.
Bevespi Aerosphere
Bevespi Aerosphere Sommaire de décision
- Ingrédient médicinal
- Fumarate de formotérol dihydraté, bromure de glycopyrronium
- Indication
- Bevespi Aerosphere est utilisé chez les adultes qui ont de la difficulté à respirer en raison d'une maladie pulmonaire appelée bronchopneumopathie chronique obstructive (BPCO). Cela comprend la bronchite chronique et l'emphysème.
Fasenra
- Médicament biologique
- Nouvelle substance active
- Médicament orphelin
- Ingrédient médicinal
- Benralizumab
- Indication
- Fasenra est un médicament d'ordonnance utilisé en plus d'autres médicaments contre l'asthme pour le traitement d'entretien des patients adultes atteints d'asthme éosinophilique sévère, lorsque leur asthme n'est pas maîtrisé par leurs médicaments actuels contre l'asthme. L'asthme éosinophilique sévère est un type d'asthme caractérisé par une hausse des éosinophiles dans le sang ou les poumons. Les éosinophiles sont un type de globules blancs associés à une inflammation des voies respiratoires pouvant aggraver l'asthme ou augmenter le nombre de crises d'asthme.
Symdeko
- Nouvelle substance active
- Examen prioritaire
- Ingrédient médicinal
- Ivacaftor, tezacaftor
- Indication
- Symdeko est utilisé pour le traitement des patients atteints de fibrose kystique (FK) âgés de 12 ans et plus qui :
- sont homozygotes pour la mutation F508del du gène régulateur de la conductance transmembranaire de la fibrose kystique (CFTR) ou
- sont hétérozygotes pour la mutation F508del et ont une des mutations du gène CFTR suivantes : P67L, D110H, R117C, L206W, R352Q, A455E, D579G, 711+3A→G, S945L, S977F, R1070W, D1152H, 2789+5G→A, 3272-26A→G, et 3849+10kbC→T
- Symdeko est utilisé pour le traitement des patients atteints de fibrose kystique (FK) âgés de 12 ans et plus qui :
Trelegy Ellipta
Trelegy Ellipta Sommaire de décision
- Ingrédient médicinal
- Furoate de fluticason, bromure d'umeclidinium, vilantérol trifénatate
- Indication
- Trelegy Ellipta est utilisé chez les adultes pour le traitement à long terme d'une maladie pulmonaire appelée bronchopneumopathie chronique obstructive (BPCO). Cela comprend la bronchite chronique et l'emphysème. Trelegy Ellipta est utilisé chez les patients dont la BPCO n'est pas traitée de façon adéquate avec une autre combinaison de médicaments (corticostéroïdes inhalés/BALA).
3 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant du chlorhydrate de cétirizine
- 1 produit contenant du bromure d'ipratropium, salbutamol
- 1 produit contenant du furoate de mométasone
Mise à jour sur l'innocuité publiée dans cette catégorie
- Ventolin Diskus : Avis : Rappel d'un lot parce que les inhalateurs pourraient ne pas délivrer la dose prévue
Organes sensoriels
Par exemple, les médicaments pour les yeux et les oreilles.
4 Nouveaux médicaments ont été approuvés dans cette catégorie
Iluvien
- Ingrédient médicinal
- Acétonide de fluocinolone
- Indication
- Iluvien sert à traiter la perte de vision due à l'œdème maculaire diabétique. Iluvien convient aux patients atteints d'œdème maculaire diabétique qui étaient préalablement traités aux corticostéroïdes.
Restasis MultiDose
Restasis MultiDose Sommaire de décision
- Ingrédient médicinal
- Cyclosporine
- Indication
- Restasis MultiDose est utilisé pour traiter certains patients qui ont une affection appelée sécheresse oculaire avec insuffisance lacrymale.
Verkazia
- Examen prioritaire
- Ingrédient médicinal
- Cyclosporine
- Indication
- Verkazia sert à traiter les enfants (quatre ans à l'adolescence [12 à 18 ans]) d'une forme sévère d'allergie oculaire nommée « kératoconjonctivite vernale ».
Vyzulta
- Examen aligné
- Nouvelle substance active
- Ingrédient médicinal
- Latanoprostène bunod
- Indication
- Vyzulta est utilisé pour réduire la pression élevée dans l'œil chez les patients atteints de glaucome à angle ouvert ou hypertension oculaire
3 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 2 produits contenant du diclofénac sodique
- 1 produit contenant du chlorhydrate de moxifloxacine
Mises à jour sur l'innocuité publiées dans cette catégorie
- Alcaine (chlorhydrate de proparacaïne) : InfoVigilance sur les produits de santé : Risque de dommages oculaires en raison d'utilisation répétée ou abusive
- Flarex (suspension ophtalmique d'acétate de fluorométholone) : InfoVigilance sur les produits de santé : Risque de toxicité systémique liée aux corticostéroïdes
Préparations hormonales systémiques excluant les hormones sexuelles et insulines
Par exemple, les médicaments qui ont un effet sur le système endocrinien, notamment les corticostéroïdes et les hormones thyroïdienne.
4 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 3 produits contenant du chlorhydrate de cinacalcet
- 1 produit contenant du thiamazole
Mises à jour sur l'innocuité publiées dans cette catégorie
- Orgalutran (injection d'acétate de ganirelix) : InfoVigilance sur les produits de santé : Risque de réactions allergiques chez les patients ayant une hypersensibilité connue au caoutchouc/latex
- Prednisone et prednisolone (glucocorticoïdes) : Résumé de l'examen de l'innocuité : Évaluer le risque potentiel d'une complication grave appelée crise rénale sclérodermique chez les patients atteints d'une sclérose systémique
Divers
Par exemple, les médicaments non classifiables dans d'autres catégories, tel que les agents de diagnostic et les médicaments pour traiter les concentrations sanguines élevées de potassium ou de phosphate.
2 Nouveaux médicaments ont été approuvés dans cette catégorie
Velphoro
- Nouvelle substance active
- Ingrédient médicinal
- Sucroferric oxyhydroxide
- Indication
- Pour contrôler des taux élevés de phosphore chez les adultes qui ont une maladie rénale au stade terminal et sont en dialyse.
Veltassa
- Nouvelle substance active
- Ingrédient médicinal
- Calcium de sorbitex de patiromer
- Indication
- Veltassa est utilisé pour traiter les taux élevés de potassium dans le sang. Veltassa est conçu uniquement pour une utilisation chez les patients atteints de néphropathie chronique, à l'exception de la néphropathie au stade terminal.
2 Nouveaux médicaments génériques ont été approuvés dans cette catégorie
- 1 produit contenant du déférasirox
- 1 produit contenant de la leucovorine calcique
Mises à jour sur l'innocuité publiées dans cette catégorie
- Agents de contraste à base de gadolinium : Résumé de l'examen de l'innocuité : Évaluation des risques de dépôts de gadolinium dans le cerveau et d'effets secondaires potentiels sur le cerveau et le système nerveux (neurologiques)
- Jamp-Glucose 50 et Jamp-Glucose 75 : Avis aux professionnels de la santé : risque de résultats faussement négatifs lors du test de dépistage du diabète ou du test d'hyperglycémie orale provoquée
- Kayexalate (sulfonate de polystyrène sodique) et Resonium Calcium (sulfonate de polystyrène calcique) : InfoVigilance sur les produits de santé : Risque de diminution de l'efficacité d'autres médicaments à prise orale
- Xofigo (solution injectable de dichlorure de radium Ra 223) : Avis aux professionnels de la santé : Risque de fractures et d'augmentation des décès
Clics santé – Aperçu des médicaments à usage humain
Pour demeurer au courant de nos activités :
- Suivez-nous sur Facebook
- Suivez-nous sur Twitter
- Suivez-nous sur YouTube
- Voyez les dernières nouvelles de Santé Canada sur notre site Web
- Trouvez d'autres informations sur la santé sur le site Web du gouvernement du Canada
Vous pouvez également trouver des informations particulières sur les médicaments en suivant les liens ci-dessous.
Nouveaux médicaments approuvés
- Nouveau Santé Canada publie régulièrement des gazouillis sur les nouveaux médicaments approuvés.
- Twitter #Medicamentsetinstrumentsmedicaux
- Nouveau Santé Canada publie une mise à jour trimestrielle qui présente les médicaments et les instruments médicaux homologués au cours des trois derniers mois.
- Twitter #Medicamentsetinstrumentsmedicaux
- Le Registre des médicaments et des produits de santé fournit aux consommateurs de l'information sur les médicaments commercialisés à l'heure actuelle au Canada.
- La Base de données sur les produits pharmaceutiques est une liste de tous les médicaments dont la vente est approuvée au Canada. Dans la base de données, de nombreux médicaments sont accompagnés de leur monographie de produit qui décrit les conditions d'utilisation du produit.
- Les Listes de présentations en cours d'examen montrent les médicaments évalués à l'heure actuelle par Santé Canada.
- Nouveau La liste des présentations de médicament générique en cours d'examen montre les médicaments génériques évalués à l'heure actuelle par Santé Canada.
- La Base de données des avis de conformité présente les approbations (avis de conformité ou AC) délivrées pour les nouveaux médicaments.
- Les sommaires des décisions réglementaires décrivent l'objet d'une présentation de médicament, et les motifs expliquant la décision prise par Santé Canada de l'approuver ou de la rejeter.
- Les sommaires des motifs de décision détaillent les considérations réglementaires, sécuritaires, et reliées à l'efficacité et la qualité du produit prises en compte par Santé Canada lors de sa décision d'approuver certaines présentations de médicament.
Pénuries de médicaments
- Le site des Pénuries de drogues au Canada fournit de l'information sur les pénuries de médicaments réelles et prévues.
Essais cliniques des médicaments
- La Base de données sur les essais cliniques répertorie les demandes d'essais cliniques qui ont été approuvées pour des médicaments au Canada.
Surveillance des médicaments après la mise en marché
Vous pouvez déclarer les effets indésirables à un médicament et les incidents liés à un instrument médical à votre professionnel de la santé, à un hôpital ou à l'entreprise qui a fabriqué le produit. Vous pouvez également les déclarer à Santé Canada par l'entremise de MedEffet Canada ou par téléphone au 1-866-234-2345.
- La Base de données des rappels et des avis de sécurité comprend les rappels, les avis, les alertes de sécurité et les autres publications de Santé Canada.
- Les résumés de l'examen de l'innocuité sont des résumés des examens des problèmes d'innocuité potentiels des médicaments que nous avons réalisés.
- Les nouveaux examens de l'innocuité et de l'efficacité sont des tableaux qui présentent les examens en cours à l'heure actuelle à Santé Canada.
- « InfoVigilance sur les produits de santé » est une publication mensuelle destinée principalement aux professionnels de la santé. InfoVigilance sur les produits de santé fournit de l'information clinique pertinente sur les produits de santé et leur innocuité.
- Les tableaux récapitulatifs des plaintes relatives à la publicité présentent les plaintes relatives à la publicité sur les produits de santé qui ont été portées auprès de Santé Canada et les mesures que nous avons prises.
- La Base de données en ligne des effets indésirables de Canada Vigilance contient de l'information sur les effets indésirables soupçonnés des produits de santé et sur les incidents liés aux instruments médicaux. Ces déclarations ont été soumises par des consommateurs et des professionnels de la santé ainsi que par des fabricants et des distributeurs de médicaments.
Instruments médicaux
Instruments médicaux : 2018 En bref
Les Canadiens dépendent des instruments médicaux pour maintenir et améliorer leur santé et leur bien-être. Nous adoptons une approche axée sur le risque en matière de réglementation des instruments médicaux. En d'autres termes, l'ampleur de l'évaluation à laquelle nous procédons avant l'homologation dépend des risques qui pourraient être associés à l'utilisation de l'instrument médical.
Au Canada, nous classons les instruments médicaux en quatre classes en fonction du risque potentiel. Celles-ci vont de la Classe I, celle des instruments qui présentent le risque potentiel le plus faible (p. ex., un abaisse-langue) à la Classe IV, celle des instruments qui présentent le risque potentiel le plus élevé (p. ex., un stimulateur cardiaque).
En 2018, nous avons publié le Plan d'action sur les instruments médicaux, qui décrit une stratégie en trois parties visant à améliorer l'innocuité et l'efficacité des instruments médicaux et à optimiser les résultats en matière de santé pour les patients :
- améliorer la façon dont les instruments sont mis en marché au Canada
- renforcer la surveillance et le suivi des instruments une fois qu'ils sont utilisés par les Canadiens
- fournir aux Canadiens de plus amples informations sur les instruments médicaux qu'ils utilisent
Les produits que nous réglementons sont très divers et nécessitent un vaste éventail de compétences scientifiques et techniques. Le rythme du changement est de plus en plus rapide et un domaine qui connaît une croissance particulièrement rapide est celui des technologies numériques de la santé. Nous voulons répondre à la demande croissante des patients, des partenaires du secteur de la santé et de l'industrie pour les technologies de pointe. Cependant, il est essentiel de nous assurer que les instruments médicaux qui incorporent ces technologies sont sûrs et efficaces.
En 2018, nous avons créé une nouvelle division chargée d'examiner les instruments médicaux qui font appel aux technologies numériques de la santé. Cette division se concentrera sur les problèmes de sécurité liés aux technologies numériques de la santé, tels que la protection des renseignements confidentiels sur la santé et la prévention du piratage et des menaces pour la cybersécurité.
Le cœur de notre travail consiste à faire en sorte que des instruments médicaux sûrs et efficaces soient mis à la disposition des utilisateurs le plus rapidement possible. L'utilisation efficace de nos ressources aide les Canadiens à accéder plus rapidement aux produits de santé dont ils ont besoin. En 2018, nous avons atteint et dépassé nos objectifs de rendement concernant les examens des instruments médicaux.
Nouveaux instruments médicaux approuvés
En 2018, nous avons approuvé 355 nouveaux instruments médicaux de classe III et 80 nouveaux instruments médicaux de classe IV. Ceux-ci fournissent un large éventail d'options pour traiter, gérer, diagnostiquer ou prévenir une maladie ou un problème de santé physique.
Quatre des nouveaux instruments médicaux de classe IV font appel à une technologie nouvelle : un nouveau dispositif, appareil, logiciel ou matériel doté d'une technologie nouvelle dont la vente n'avait encore jamais été approuvée au Canada.
Pour obtenir une liste et une description des nouveaux instruments médicaux que nous avons approuvés en 2018, voyez « Instruments médicaux : Approuvés en 2018 ».
Essais cliniques et programme d'accès spécial
Dans le cadre de notre rôle visant à faciliter l'accès à des thérapies clés, nous approuvons les demandes pour permettre aux entreprises et aux chercheurs de procéder à des essais cliniques (appelés essais expérimentaux) sur des instruments médicaux au Canada. Les nouveaux essais cliniques permettent d'élargir le choix d'options innovantes. En 2018, 199 nouvelles demandes d'essais expérimentaux ont été approuvées pour des instruments médicaux.
Il existe également des moyens par lesquels nous offrons un accès aux instruments médicaux qui n'ont pas encore été approuvés pour la vente au Canada grâce au Programme d'accès spécial. Le Programme donne aux médecins un moyen de demander pour leurs patients des traitements qui ne seraient pas disponibles autrement. L'accès à des instruments médicaux non approuvés peut être accordé pour une utilisation d'urgence ou pour des patients atteints de conditions graves ou potentiellement mortelles. En 2018, 2 619 demandes d'accès spécial à des instruments médicaux ont été approuvées.
Surveillance après la mise en marché
Une fois que les instruments médicaux sont disponibles au Canada, Santé Canada continue de surveiller et d'évaluer les déclarations d'incidents soupçonnés d'être liés aux instruments médicaux. Nous appelons cela la « surveillance après la mise en marché ». Il n'est pas possible de connaître ou de prédire tous les effets indésirables ou les incidents liés à un instrument médical au moyen des études cliniques réalisées au moment de l'approbation pour la mise en marché.
En 2018, nous avons reçu 28 176 déclarations d'incidents liés à des instruments médicaux après la mise en marché provenant de sources nationales et internationales. Nous avons pris 54 mesures après la mise en marché concernant des instruments médicaux. Ces mesures peuvent consister à fournir au public et aux professionnels de la santé les nouvelles informations sur l'innocuité, à recommander des modifications à apporter à l'étiquetage et même à retirer un instrument médical du marché dans les cas les plus graves.
La section « Instruments médicaux » du rapport fournit de plus amples renseignements sur nos activités en 2018. Vous trouverez un aperçu des progrès que nous avons accomplis en 2018 relativement à nos priorités principales. Vous découvrirez le cycle de vie d'un instrument médical et le rôle que nous jouons pour faire en sorte que les avantages continuent de l'emporter sur les risques potentiels associés à l'utilisation d'un instrument. Vous y trouverez également des renseignements sur les nouveaux instruments médicaux que nous avons approuvés en 2018 ainsi que les mesures que nous avons prises pour résoudre les problèmes d'innocuité des produits qui se trouvent déjà sur le marché canadien. Voyez également la nouvelle section « Clics santé » pour suivre l'information à jour sur nos activités.

John Patrick Stewart,
Directeur général,
Produits thérapeutiques,
Santé Canada

Rhonda Kropp,
Directrice générale,
Produits de santé commercialisés,
Santé Canada
Instruments médicaux : Réalisations de 2018
Examen réglementaire
Le système de santé canadien évolue rapidement. Nous avons besoin d'un système de réglementation capable de continuer à s'adapter aux changements dans la prestation des soins de santé et qui permette également aux gens d'accéder plus rapidement aux instruments médicaux dont ils ont besoin. Nous devons également continuer à nous assurer que tous les instruments que nous approuvons sont sûrs, efficaces et d'excellente qualité.
Santé Canada a élaboré l'initiative « Améliorer l'examen réglementaire des médicaments et des instruments » en 2017 afin de permettre aux patients d'accéder plus rapidement aux médicaments et aux instruments. Nous avons également pour objectif de travailler davantage avec nos partenaires du système de soins de santé au Canada et avec d'autres pays et de mieux utiliser les données probantes du monde réel (des données recueillies en dehors des essais cliniques) tout au long du cycle de vie d'un produit.
En 2018, nous avons réalisé des progrès importants en vue d'améliorer l'accès aux instruments médicaux. Par exemple, nous avons :
- Travaillé avec nos partenaires du système de soins de santé du Canada pour aligner notre travail d'examen et accélérer l'accès aux instruments médicaux.
- Créé une unité de l'examen des technologies numériques de la santé qui se concentrera sur les technologies telles que les instruments médicaux sans fil, la télémédecine et l'intelligence artificielle.
- Mis à la disposition des patients, des soignants et des professionnels de la santé davantage d'information sur les instruments médicaux. Par exemple, Santé Canada publie régulièrement des gazouillis sur les nouveaux instruments médicaux approuvés.
Nous avons également embauché du personnel scientifique supplémentaire pour accroître notre capacité à examiner les instruments médicaux innovants et à aider à surveiller l'innocuité et l'efficacité des instruments après que leur vente ait été approuvée au Canada.
La présente section du rapport vous fournira de l'information plus détaillée sur ces projets importants ainsi que sur certaines de nos autres priorités en 2018.
Plan d'action sur les instruments médicaux
Le Plan d'action de Santé Canada sur les instruments médicaux est une stratégie visant à renforcer le système de réglementation des instruments médicaux au Canada. Cette stratégie est axée sur les patients canadiens, améliorera continuellement l'innocuité, l'efficacité et la qualité des instruments au Canada et optimisera les résultats en matière de santé pour les patients.
Ce plan d'action en trois parties, réalisé avec nos partenaires, accélérera le travail visant à :
- Améliorer la façon dont les instruments sont mis en marché en intensifiant la recherche effectuée par des professionnels de la santé, en examinant les exigences en matière de données probantes à respecter pour l'homologation des instruments médicaux et en élargissant le recours à des experts externes et au point de vue des patients tout en renforçant notre expertise interne.
- Renforcer la surveillance et le suivi en élargissant et en améliorant la déclaration des incidents par les établissements de santé, en mettant en œuvre des moyens d'action réglementaires pour identifier les problèmes d'innocuité et y répondre et en augmentant le nombre d'inspections pour assurer la qualité des instruments médicaux.
- Fournir plus d'information aux Canadiens en améliorant l'accès aux données cliniques, en publiant les décisions prises suite aux examens concernant les instruments médicaux à risque élevé, en publiant l'information sur les incidents liés aux instruments médicaux et en améliorant l'accès aux résultats des inspections.
En favorisant une communication et une consultation ouvertes avec les Canadiens tout au long de ce plan d'action, Santé Canada veille à ce que tous les points de vue soient pris en compte lors de l'élaboration des politiques et des règlements. Nous tiendrons également les Canadiens au courant des progrès réalisés dans la mise en œuvre du plan d'action afin qu'ils sachent ce que Santé Canada fait pour améliorer l'innocuité et l'efficacité des instruments qu'ils utilisent.
Pour de plus amples informations, allez à Plan d'action de Santé Canada sur les instruments médicaux : Amélioration continue de la sécurité, de l'efficacité et de la qualité.
Technologies numériques de la santé
Les technologies numériques de la santé joueront un rôle essentiel dans la prestation des soins futurs aux patients. Leur adoption et leur utilisation rendront probablement la prestation des soins de santé plus accessible, pratique et rentable. Nous voulons répondre à la demande croissante des patients, des systèmes de soins de santé et de l'industrie pour des technologies de pointe. Cependant, nous devons également veiller à ce que les instruments médicaux restent sûrs et efficaces pour les Canadiens.
En 2018, nous avons créé une nouvelle Division de la santé numérique. Ce groupe de scientifiques et d'ingénieurs examine les demandes d'homologation des instruments médicaux comportant des technologies numériques de la santé. Ils s'acharnent également à résoudre les problèmes de sécurité tels que la protection des renseignements confidentiels sur la santé et la prévention du piratage et des menaces pour la cybersécurité.
Santé Canada cherche également à obtenir des conseils éclairés sur les technologies numériques de la santé afin d'éclairer ses décisions concernant ces demandes d'homologation d'instruments médicaux. En 2018, nous avons créé un Comité consultatif scientifique sur les technologies numériques de la santé (CCS-TNS). Ce comité nous aidera à accroître et à diversifier nos connaissances sur les avantages et les risques potentiels associés à l'utilisation de ces produits. Pour de plus amples informations, allez à Comités consultatifs d'experts/scientifiques – Technologies numériques de la santé.
Innocuité, efficacité et qualité des instruments médicaux
En 2018, Santé Canada a réalisé des progrès importants qui continueront à assurer le respect de nos normes rigoureuses en matière d'innocuité, d'efficacité et de qualité des instruments médicaux.
Par exemple, nous avons publié pour l'industrie deux ébauches de lignes directrices qui contribueront à clarifier nos normes relatives à la cybersécurité et à l'impression 3D. Ces nouvelles technologies pourraient profiter aux Canadiens. Cependant, elles présentent des défis particuliers pour Santé Canada et les fabricants. Nos lignes directrices feront en sorte que les instruments médicaux dotés de technologies nouvelles demeurent conformes à nos normes en matière de sécurité et d'efficacité et que les risques cybersécuritaires potentiels soient pris en compte.
L'excellente qualité d'un instrument médical contribue à faire en sorte qu'il fonctionne comme prévu. Ceci est particulièrement important pour les instruments à longue durée de vie et ceux qui sont implantés dans le corps. En 2018, nous avons poursuivi notre transition vers un système d'audit appelé Programme d'audit unique des matériels médicaux (PAUMM). Ce programme est aligné avec ceux de nos partenaires dans d'autres pays et continue à assurer la qualité des instruments médicaux vendus au Canada.
Instruments médicaux : Cycle de vie des instruments médicaux
Dans le cadre de la mission de Santé Canada qui consiste à aider les Canadiens à maintenir et à améliorer leur santé, nous évaluons les instruments médicaux avant et après leur arrivée sur le marché canadien. Santé Canada s'investit tout au long du cycle de vie d'un instrument médical, y compris durant les essais expérimentaux de l'instrument, par l'intermédiaire de l'évaluation pour l'autorisation, ainsi qu'une fois que l'instrument a été lancé sur le marché et rendu accessible aux Canadiens. Par exemple, nous :
- évaluons les demandes d'essais expérimentaux (essais cliniques)
- évaluons les demandes d'accès spécial
- examinons les demandes d'autorisation de vente d'instrument au Canada
- surveillons l'innocuité et l'efficacité des instruments médicaux en situation réelle une fois leur vente autorisée au Canada
Essais cliniques (essais expérimentaux)
Les essais cliniques sont réalisés par les promoteurs (fabricants ou chercheurs) afin de recueillir de l'information sur l'innocuité et l'efficacité d'un instrument médical chez l'être humain. Les essais cliniques (essais expérimentaux) sur les instruments médicaux représentent de nouvelles thérapies de santé possibles qui pourraient éventuellement répondre aux besoins des Canadiens.
Les promoteurs des essais expérimentaux soumettent leurs demandes afin de réaliser un essai clinique sur un instrument médical au Canada. Nous examinons ces demandes et décidons d'autoriser ou non la réalisation de l'essai au Canada. La ligne directrice Demandes d'autorisation d'essai expérimental pour les instruments médicaux ligne directrice – Sommaire fournit de l'information détaillée sur les échéanciers et les processus d'examen des demandes d'essais expérimentaux.
En 2018, Santé Canada a approuvé 199 nouvelles demandes d'essais expérimentaux sur des instruments médicaux.
Programme d'accès spécial
Les instruments médicaux qui ne sont pas approuvés au Canada peuvent être disponibles dans le cadre de notre Programme d'accès spécial. Le Programme d'accès spécial – Instruments médicaux permet d'accéder à des instruments médicaux personnalisés ou non homologués, si certains critères sont satisfaits.
Dans le cadre de ce programme, l'accès est accordé à un professionnel de la santé donné pour le traitement d'un patient en particulier. L'accès peut être accordé pour une utilisation d'urgence ou pour les patients atteints d'une condition grave ou potentiellement mortelle lorsque les thérapies conventionnelles ne fonctionnent pas, ne sont pas disponibles ou ne conviennent pas. La décision d'autoriser ou de rejeter une demande est prise au cas par cas. Nous tenons compte de l'utilisation prévue de l'instrument médical, de la condition du patient, des instruments de rechange offerts et de l'information fournie pour soutenir la demande.
Notre Programme d'accès spécial fonctionne 24 heures par jour, 365 jours par année.
En 2018, Santé Canada a approuvé 2 619 demandes d'accès spécial à des instruments médicaux.
Demandes d'homologation et évaluation des instruments médicaux
Il existe différentes classes d'instruments médicaux qui vont de la classe I à la classe IV. Les instruments de la classe I sont considérés des instruments à faible risque – par exemple, un abaisse-langue. Les appareils de la classe IV présentent le risque potentiel le plus élevé – par exemple, un stimulateur cardiaque.
Lorsqu'une entreprise décide de commercialiser un instrument médical de classe II, III ou IV au Canada, elle nous présente une demande d'homologation d'un nouvel instrument médical. La demande contient des données scientifiques sur l'innocuité, l'efficacité et la qualité de l'instrument médical. Les instruments de classe I ne nécessitent pas d'homologation, mais sont surveillés par l'intermédiaire de licences d'établissement.
Les demandes d'homologation des instruments médicaux à risque élevé sont examinées par nos scientifiques et nos ingénieurs. Ils procèdent à un examen approfondi des données soumises en faisant parfois appel à des experts-conseils et à des comités consultatifs externes.
Les examinateurs évaluent les données sur l'innocuité, l'efficacité et la qualité afin d'évaluer les avantages et les risques potentiels associés à l'utilisation des instruments médicaux. Ils examinent également l'information à fournir aux professionnels de la santé et aux consommateurs sur l'instrument médical.
Les délais d'exécution cibles des examens de Santé Canada varient d'une classe d'instruments médicaux à l'autre. La ligne directrice intitulée Gestion des demandes d'homologation d'instruments médicaux et d'autorisation d'essais expérimentaux fournit des renseignements détaillés sur les échéanciers et les processus d'examen des demandes d'homologation des instruments médicaux.
Voie d'examen accéléré : examen prioritaire
La procédure d'examen prioritaire est une procédure accélérée de prise de décision, disponible pour certains instruments médicaux, y compris ceux qui servent à combler des besoins de soins de santé particuliers. Les instruments médicaux qui servent au traitement des maladies ou des affections graves, potentiellement mortelles ou très débilitantes peuvent bénéficier d'un statut d'examen prioritaire. Les produits approuvés par les voies d'examen accéléré peuvent être rendus accessibles aux patients plus tôt.
En 2018, trois des 80 nouveaux instruments médicaux de classe IV ont été approuvés dans le cadre d'une procédure d'examen prioritaire.
Approbation des instruments médicaux
Après avoir examiné une demande d'homologation d'un instrument médical, Santé Canada peut conclure que les avantages l'emportent sur les risques potentiels associés à l'utilisation du produit et approuver la vente de l'instrument au Canada. Lorsqu'un nouvel instrument médical est homologué, une homologation d'instrument médical est émise.
Cela ne signifie pas que l'instrument médical sera disponible immédiatement pour les patients, car de nombreux autres facteurs peuvent influencer la mise en marché.
En 2018, Santé Canada a approuvé 355 nouveaux instruments médicaux de classe III et 80 nouveaux instruments médicaux de classe IV, y compris quatre instruments médicaux de classe IV dotés d'une technologie nouvelle.
Pour obtenir la liste de ce qui a été approuvé en 2018, voyez « Instruments médicaux : Approuvés en 2018 ». Vous pouvez également consulter la Mise à jour sur les nouvelles homologations de médicaments et d'instruments médicaux publiée trimestriellement.
Pour demander les Rapports sur le rendement du Bureau des matériels médicaux trimestriels et annuels, allez à Rapports et publications – Instruments médicaux.
Surveillance après la mise en marché
Il n'est pas possible de savoir ni de prédire quels seront tous les effets indésirables possibles d'un instrument médical dans le cadre d'études cliniques. Après qu'un produit est rendu accessible à la vente au Canada, nous continuons d'assurer la surveillance de son utilisation en situation réelle, c.-à-d. dans une population élargie. Nous appelons cela la « surveillance après la mise en marché ». Nous évaluons les problèmes d'innocuité et d'efficacité potentiels et prenons les mesures qui s'imposent.
Collecte d'information
Santé Canada recueille de l'information après la mise en marché (c'est-à-dire de l'information sur un produit recueilli après son homologation) à partir de diverses sources.
Les incidents soupçonnés d'être liés aux instruments médicaux qui sont déclarés après l'approbation de la vente des produits constituent l'une des sources d'information utilisées par Santé Canada. Il s'agit des effets indésirables dont des instruments médicaux pourraient être la cause.
En 2018, nous avons reçu 28 176 déclarations d'incidents liés à des instruments médicaux (27 125 au Canada et 1 051 dans le reste du monde).
Vous pouvez déclarer les effets indésirables des médicaments et les incidents liés aux instruments médicaux à votre professionnel de la santé, à un hôpital ou à l'entreprise qui a fabriqué le produit. Vous pouvez également les déclarer à Santé Canada par l'entremise de MedEffet Canada ou par téléphone au 1-866-234-2345.
Vous trouverez de l'information sur les nombres et les tendances annuels des déclarations de cas d'effets indésirables des médicaments et des déclarations d'incidents liés aux instruments médicaux faites à Santé Canada entre 2008 et 2017 dans les Tendances annuelles dans les déclarations de cas d'effets indésirables des produits de santé et des incidents liés aux matériels médicaux à Santé Canada (2008-2017).
Évaluer les signaux d'innocuité
Nous évaluons les données que nous recueillons pour détecter de nouveaux signaux d'innocuité sur lesquels nous faisons ensuite une enquête plus approfondie. Un « signal lié à l'innocuité » peut être défini comme étant un renseignement à propos d'un nouvel effet indésirable ou d'un effet indésirable connu qui peut être associé à un instrument médical. Ces enquêtes sont appelées évaluations des signaux et peuvent donner lieu à des recommandations concernant les mesures que l'entreprise, Santé Canada ou les deux devraient prendre. Ces mesures peuvent consister à fournir au public et aux professionnels de la santé les nouvelles informations sur l'innocuité, à recommander des modifications à apporter à l'étiquetage et même à retirer un instrument médical du marché dans les cas les plus graves.
Par exemple, nous avons évalué en 2018 un signal pour des cathéters d'ablation par radiofréquence, employés dans le cadre d'interventions cardiaques visant à traiter les patients présentant des battements de cœur irréguliers, et le risque de communication anormale entre le cœur et le tube digestif. L'évaluation du signal comprenait un examen de l'information soumise par le fabricant de l'instrument médical et de la documentation scientifique, ainsi qu'une évaluation des déclarations d'incidents liés à l'instrument médical (aux niveaux national et international). Après l'examen de l'innocuité, un communiqué sur le risque a été publié dans le but d'informer les professionnels de la santé et les patients à propos de ce risque puis l'étiquette canadienne a été mise à jour.
Nous publions des résumés de l'examen de l'innocuité (REI) afin d'informer les Canadiens à propos des résultats de toute enquête sur l'innocuité susceptible de se répercuter sur l'utilisation de ces produits thérapeutiques.
En 2018, Santé Canada a examiné 26 problèmes de l'innocuité et de l'efficacité liés aux instruments médicaux, ce qui a entraîné la publication de 6 résumés de l'examen de l'innocuité.
En 2018, Santé Canada a publié 5 communications des risques destinées aux professionnels de la santé et aux Canadiens concernant les instruments médicaux.
Vous pouvez trouver ces communications des risques dans la Base de données des rappels et des avis de sécurité. Nous publions également des éditions mensuelles d'InfoVigilance sur les produits de santé. Cette publication fournit aux professionnels de la santé de l'information sur les risques émergents liés à l'innocuité des produits de santé, à utiliser avec leurs patients.
Plaintes relatives à la publicité
Dans le cadre du travail effectué après la mise en marché, Santé Canada réglemente également la publicité des instruments médicaux vendus au Canada pour s'assurer que les entreprises ne fassent pas d'allégations trompeuses concernant leurs produits. Nous examinons les plaintes relatives à la publicité afin de déterminer si une entreprise se conforme ou non à nos exigences.
En 2018, Santé Canada a examiné 18 plaintes relatives à la publicité concernant des instruments médicaux.
Par exemple, Santé Canada a communiqué avec plusieurs centres de santé et cliniques de chirurgie en 2018 dans l'ensemble du pays pour faire part de ses préoccupations concernant les publicités sur des instruments médicaux tels que Juvéderm, un produit de comblement facial. Santé Canada a déterminé que les déclarations dans ces publicités n'étaient pas autorisées, et nous avons demandé à ces cliniques de cesser immédiatement ces pratiques illégales. Santé Canada s'active encore à informer quelques-unes de ces cliniques et travaille en collaboration avec celles-ci afin d'arriver à une conformité volontaire.
Après avoir examiné une plainte, nous prenons des mesures appropriées en cas de non-conformité. Ceci peut consister à demander à une entreprise de cesser de diffuser de la publicité non conforme et à prendre des mesures pour éviter tout problème futur.
En plus d'examiner les plaintes, Santé Canada a mis en place récemment une équipe spécialisée chargée d'identifier les problèmes relatifs à la publicité avant même qu'une plainte ne soit déposée. Cette équipe appliquera les règles existantes en matière de publicité et prendra les mesures qui s'imposent, y compris en recommandant de porter des accusations criminelles s'il y a lieu. Santé Canada communiquera tous les cas de publicité non conforme sur son site Web.
Cette initiative renforce la capacité du Ministère à détecter les tendances et les problèmes susceptibles de devenir de graves crises de santé publique ou d'y contribuer.
Instruments médicaux : Approuvés en 2018
Les instruments médicaux sont répartis en quatre classes : I, II, III et IV. Les instruments de classe I présentent un faible risque, par exemple un abaisse-langue. Les instruments de classe IV présentent le risque le plus élevé, par exemple un stimulateur cardiaque.
Cette section présente les nouveaux instruments médicaux de classe IV, notamment ceux avec des technologies nouvelles, approuvés pour la vente au Canada en 2018, ainsi que les mises à jour publiées sur l'innocuité.
Vous pouvez déclarer les effets indésirables des médicaments et les incidents liés aux instruments médicaux à votre professionnel de la santé, à un hôpital ou au fabricant du produit visé. Vous pouvez aussi les déclarer à Santé Canada par l'entremise de MedEffet Canada ou par téléphone en composant le 1-866-234-2345.
Catégories de santé
- Cerveau et moelle épinière
- Implants mammaires
- Santé dentaire
- Santé liée au diabète
- Tests diagnostiques
- Santé digestive
- Santé oculaire
- Santé cardiovasculaire
- Imagerie médicale
- Utilisation d'opioïdes
- Don d'organes
- Orthopédie
- Prise en charge de la douleur
- Chirurgie
- Santé vasculaire
- Gestion des blessures
- Autre
Définitions importantes
- Instruments médicaux
- Les instruments médicaux sont des produits servant à établir un diagnostic ou qui sont utilisés pour des fins thérapeutiques. L'autorisation de nouveaux instruments médicaux nous donne accès à un plus large éventail d'options indiquées pour le traitement, la prise en charge, le diagnostic et la prévention des maladies et des problèmes de santé.
- Technologie nouvelle
- Les instruments médicaux ayant une technologie nouvelle introduisent un nouvel appareil, logiciel ou matériel d'une technologie nouvelle dont la commercialisation au Canada n'a jamais été autorisée auparavant.
- Examen prioritaire
- La priorité d'examen peut être accordée à une demande d'instrument médical visant un produit destiné à soigner des maladies ou des conditions graves, potentiellement mortelles ou gravement débilitantes. Les demandes qui bénéficient d'un examen prioritaire sont soumises à un processus d'examen abrégé.
- Mises à jour sur l'innocuité
- Les mises à jour sur l'innocuité visent à communiquer de l'information sur les risques potentiels pour la santé afin que les patients et les professionnels de la santé puissent prendre des décisions éclairées en matière de santé. Pour en savoir plus sur les types de communication de risque présents sur le site Web du gouvernement du Canada, allez à « Clics santé – Aperçu des instruments médicaux ».
Figure 3: Nombre de nouveaux instruments médicaux de classe IV approuvés en 2018, par catégorie de santé.
Équivalent textuel
| Catégorie de santé | Nombre de nouveaux instruments médicaux de classe IV approuvés |
|---|---|
| Cerveau et moelle épinière | 6 |
| Implants mammaires | 4 |
| Santé dentaire | 7 |
| Santé liée au diabète | 3 |
| Tests diagnostiques | 13 |
| Santé cardiovasculaire | 16 |
| Imagerie médicale | 5 |
| Don d'organes | 1 |
| Orthopédie | 1 |
| Prise en charge de la douleur | 3 |
| Chirurgie | 4 |
| Santé vasculaire | 13 |
| Gestion des blessures | 4 |
| Total des nouveaux instruments médicaux de classe IV approuvés en 2018 | 80 |
Cerveau et moelle épinière
6 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Trousses de stimulation cérébrale profonde (SCP) (DBS [Deep brain stimulation] packs)
Trousses de stimulation cérébrale profonde Sommaire de décision
- Indication
- Les trousses de stimulation cérébrale profonde comprennent des composants stériles vendus aux professionnels de la santé afin de faciliter la procédure neurologique médico-chirurgicale d'insertion d'une électrode de stimulation cérébrale profonde (SCP) dans le cerveau.
Système de recouvrement du trou de trépan Guardian (Guardian cranial burr hole cover system)
Système de recouvrement du trou de trépan Guardian Sommaire de décision
- Indication
- Le système de recouvrement du trou de trépan Guardian est un dispositif permettant de fixer des électrodes de façon temporaire ou permanente. Il est conçu pour fixer une électrode de stimulation cérébrale profonde (SCP) compatible fabriquée par St. Jude Medical.
Générateur d'impulsions implantable Infinity (Infinity implantable pulse generator)
Générateur d'impulsions implantable Infinity Sommaire de décision
- Indication
- Ce système de neurostimulation est conçu pour assurer une stimulation unilatérale ou bilatérale du thalamus, du globus pallidus interne ou du noyau subthalamique chez des patients atteints d'une forme de la maladie de Parkinson sensible à la lévodopa.
Système de neurostimulation Intellis (Intellis neurostimulation system)
Système de neurostimulation Intellis Sommaire de décision
- Indication
- Le système de neurostimulation Intellis est un dispositif implantable de stimulation de la moelle épinière ou des nerfs périphériques qui est fondé sur le dispositif RestoreSensor actuellement homologué (nos d'homologation 83770, 91421). Le stimulateur génère et émet de faibles impulsions électriques dans la région concernée pour modifier la génération, la transmission ou l'interprétation du potentiel d'action. Le stimulateur est relié à des électrodes homologuées et, selon le type d'électrodes utilisées, le système peut être considéré compatible avec la résonance magnétique (RM) sous conditions.
Trousses d'électrodes et de rallonges pour les systèmes de stimulation cérébrale profonde (SCP) (Lead and extension kits for deep brain stimulation [DBS] systems)
- Indication
- Les électrodes de SCP conçues par St. Jude Medical sont destinées à acheminer une impulsion électrique vers des zones cibles dans le cerveau. Les rallonges de SCP sont destinées à raccorder les électrodes à un générateur d'impulsions implantable.
Trousses de dérivation ventriculopéritonéale (VP Shunt procedure packs)
Trousses de dérivation ventriculopéritonéale Sommaire de décision
- Indication
- Cette trousse est conçue pour réduire la pression exercée sur le cerveau par l'accumulation de liquide. La dérivation ventriculopéritonéale (DVP) est une intervention chirurgicale qui sert principalement à traiter une affection appelée hydrocéphalie. Cette affection consiste en une accumulation excessive de liquide céphalorachidien (LCR) dans les ventricules du cerveau.
Implants mammaires
4 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Expanseur tissulaire Natrelle 133 Plus (Natrelle 133 Plus tissue expander)
Expanseur tissulaire Natrelle 133 Plus Sommaire de décision
- Indication
- Les expanseurs tissulaires Natrelle 133 Plus Microcell sont utilisables pour la reconstruction mammaire après une mastectomie, la correction d'un sein sous-développé, l'élimination de cicatrices et les procédures de défaut tissulaire. L'expanseur est destiné à une implantation sous-cutanée ou sous-musculaire temporaire et ne devrait pas demeurer implanté pendant plus de six mois.
Implants mammaires Natrelle 410 Microcell remplis de gel de silicone Truform (Natrelle 410 Truform Microcell silicone-filled breast implants)
Implants mammaires Natrelle 410 Microcell remplis de gel de silicone Truform Sommaire de décision
- Indication
- Les implants mammaires Natrelle 410 Truform Microcell remplis de gel de silicone sont indiqués pour l'augmentation mammaire chez les femmes d'au moins 22 ans et la révision ou la reconstruction d'une augmentation mammaire antérieure afin de corriger ou d'améliorer les résultats de la chirurgie précédente.
Implants mammaires Natrelle Inspira Microcell Truform 1 (Natrelle Inspira Truform 1 Microcell breast implants)
Implants mammaires Natrelle Inspira Microcell Truform 1 Sommaire de décision
- Indication
- Les implants mammaires Natrelle Inspira Truform Microcell sont indiqués pour l'augmentation mammaire chez les femmes d'au moins 22 ans et la révision ou la reconstruction d'une augmentation mammaire antérieure afin de corriger ou d'améliorer les résultats de la chirurgie précédente.
Implants mammaires Natrelle Inspira Microcell remplis de gel Truform 2 (Natrelle Inspira Truform 2 Microcell breast implants)
Implants mammaires Natrelle Inspira Microcell remplis de gel Truform 2 Sommaire de décision
- Indication
- Les implants mammaires Natrelle Inspira Microcell remplis de gel Truform 2 sont indiqués pour l'augmentation mammaire chez les femmes de 22 ans ou plus et la révision d'une augmentation ou reconstruction mammaire antérieure pour corriger ou améliorer les résultats de la chirurgie précédente.
Santé dentaire
7 Nouveaux instruments ont été approuvés dans cette catégorie
Substitut osseux A-Oss (A-Oss bone substitute)
Substitut osseux A-Oss Sommaire de décision
- Indication
- A-Oss est à utiliser pour le traitement et la prévention des déficiences osseuses dans les domaines dentaires suivants :
- obturation d'une partie manquante d'un os en raison d'une maladie périodontale, cystectomie ou extraction dentaire
- obturation de la partie manquante d'un os entourant un implant
- relèvement du sinus maxillaire pour implantation
- augmentation/restauration osseuse alvéolaire
- A-Oss est à utiliser pour le traitement et la prévention des déficiences osseuses dans les domaines dentaires suivants :
Matrice de collagène Geistlich Fibro-Gide (Geistlich Fibro-Gide collagen matrix)
Matrice de collagène Geistlich Fibro-Gide Sommaire de décision
- Indication
- Geistlich Fibro-Gide est destiné à l'utilisation pour l'augmentation des tissus mous.
Matrice de reconstruction tissulaire NovoMatrix (NovoMatrix reconstructive tissue matrix)
Matrice de reconstruction tissulaire NovoMatrix Sommaire de décision
- Indication
- La matrice de reconstruction tissulaire NovoMatrix est indiquée pour :
- la greffe gingivale localisée visant à augmenter le tissu kératinisé autour des dents
- la reconstruction de la crête alvéolaire dans le cadre d'un traitement prothétique
- les interventions de régénération tissulaire guidée visant le recouvrement radiculaire dans le cadre du traitement des défauts de récession
- La matrice de reconstruction tissulaire NovoMatrix est indiquée pour :
Substitut osseux spongieux de collagène OCS-B (bovin) avec collagène (OCS-B collagen spongious bone substitute [bovine] with collagen)
Substitut osseux spongieux de collagène OCS-B (bovin) avec collagène Sommaire de décision
- Indication
- OCS-B, une matrice minérale osseuse contenant du collagène destiné aux greffes osseuses pratiquées lors des chirurgies parodontales, buccales et maxillo-faciales.
Ossix Bone
Ossix Bone Sommaire de décision
- Indication
- Ossix Bone est un matériau pour greffe osseuse ostéoconducteur et biodégradable. Il est destiné aux interventions de régénération osseuse guidée (ROG) traitant les défauts parodontaux.
Straumann Cerabone
Straumann Cerabone Sommaire de décision
- Indication
- Straumann Cerabone est indiqué pour le comblement ou la reconstruction des défauts osseux en chirurgie buccale.
Membrane Jason de Straumann (Straumann Jason membrane)
Membrane Jason de Straumann Sommaire de décision
- Indication
- La membrane Jason de Straumann, utilisée seule ou en association avec des matériaux de comblement appropriés (p. ex. os autogène, matériaux de régénération osseuse allogène, xénogène ou alloplastique), est indiquée pour la régénération tissulaire et osseuse guidée, qu'elle soit immédiate ou différée.
Santé liée au diabète
3 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Système de mesure du glucose en continu Guardian Connect (Guardian Connect continuous glucose monitoring system)
- Technologie nouvelle
Système de mesure du glucose en continu Guardian Connect Sommaire de décision
- Indication
- L'application Guardian Connect peut être intégrée avec les capteurs de glucose Guardian 3 pour assurer une surveillance continue du taux de glucose dans le liquide interstitiel sous-cutané chez les personnes âgées de 3 ans ou plus atteintes du diabète sucré.
Capteur Guardian (3) (Guardian sensor [3])
- Examen prioritaire
Capteur Guardian Sommaire de décision
- Indication
- Le capteur Guardian (3) est un capteur de glucose interstitiel qui se porte sur le corps et qui utilise un petit embout de capteur inséré sous la peau pour mesurer le taux de glucose dans le liquide interstitiel. Le capteur doit être utilisé avec les systèmes de surveillance du glucose en continu de Medtronic pour la surveillance en continu du taux de glucose chez les personnes diabétiques.
MiniMed 670G
- Technologie nouvelle
- Examen prioritaire
MiniMed 670G Sommaire de décision
- Indication
- Le système MiniMed 670G est destiné à l'administration continue d'insuline basale (à des taux déterminés par l'utilisateur) et à l'administration de bolus d'insuline (en quantités déterminées par l'utilisateur) pour la prise en charge du diabète sucré de type 1 chez les personnes de 7 ans et plus ainsi que pour la surveillance du glucose dans le liquide interstitiel sous-cutané et l'établissement de tendances en continu. Le système 670G peut être programmé afin d'ajuster automatiquement l'administration d'insuline basale en fonction des mesures prises par les capteurs de glucose Guardian 3.
Mise à jour sur l'innocuité publiée dans cette catégorie
- Système Omnipod de gestion de l'insuline : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de mauvais fonctionnement de l'instrument
Tests diagnostiques
13 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Épreuve IgM anti-HBc Alinity i (Alinity i anti-HBc IgM assay)
Épreuve IgM anti-HBc Alinity i Sommaire de décision
- Indication
- L'épreuve IgM anti-HBc Alinity i est indiquée pour faciliter le diagnostic de l'infection aiguë ou récente par le virus de l'hépatite B.
Épreuve anti-HBc II Alinity i (Alinity i anti-HBc II assay)
Épreuve anti-HBc II Alinity i Sommaire de décision
- Indication
- L'épreuve Anti-HBc II Alinity i est destinée à être utilisée comme aide au diagnostic de l'infection par le virus de l'hépatite B et comme test de dépistage pour prévenir la transmission du virus de l'hépatite B (VHB) aux receveurs de sang, de composants sanguins, de cellules, de tissus et d'organes.
Épreuve anti-HBe Alinity i (Alinity i Anti-HBe assay)
Épreuve anti-HBe Alinity i Sommaire de décision
- Indication
- L'épreuve Anti-HBe Alinity i est utilisée pour la détection qualitative des anticorps dirigés contre l'antigène e du virus de l'hépatite B (anti-HBe) dans le sérum et le plasma humains, conçu pour être utilisé avec l'analyseur Alinity i. L'épreuve Anti-HBe Alinity i est destinée à être utilisée comme aide au diagnostic et à la surveillance de l'infection par le virus de l'hépatite B.
Épreuve Anti-HBs Alinity i (Alinity i Anti-HBs assay)
Épreuve Anti-HBs Alinity i Sommaire de décision
- Indication
- L'épreuve Anti-HBs Alinity i est utilisée pour la détermination quantitative des anticorps dirigés contre l'antigène de surface du virus de l'hépatite B (anti-HBs) dans le sérum et le plasma humains, au moyen de l'analyseur Alinity i.
Épreuve Alinity i Anti-HCV (Alinity i Anti-HCV assay)
Épreuve Alinity i Anti-HCV Sommaire de décision
- Indication
- Le test Alinity i Anti-HCV est destiné à être utilisé comme aide au diagnostic de l'infection par le virus de l'hépatite C et comme test de dépistage pour prévenir la transmission du virus de l'hépatite C aux receveurs de sang, de composants sanguins, de cellules, de tissus et d'organes.
Épreuve Chagas Alinity i (Dépistage de maladie chez les donneurs et les cadavres) (Alinity i Chagas assay [donor screening/cadaveric])
Épreuve Chagas Alinity i Sommaire de décision
- Indication
- L'épreuve Chagas Alinity i sert à faciliter le diagnostic de l'infection à T. cruzi (Chagas) et aux épreuves de dépistage pour éviter la transmission de T. cruzi (Chagas) aux receveurs de sang, composants sanguins, cellules, tissus et organes.
Épreuve HBeAg Alinity i (Alinity i HBeAg assay)
Épreuve HBeAg Alinity i Sommaire de décision
- Indication
- L'épreuve HBeAg Alinity i peut être utilisée comme aide au diagnostic et à la surveillance de l'infection par le virus de l'hépatite B.
Épreuve HBsAg Alinity i (Alinity i HBsAg assay)
Épreuve HBsAg Alinity i Sommaire des décision
- Indication
- L'épreuve HBsAg Alinity i est un dosage immunologique microparticulaire par chimiluminescence utilisé pour la détermination quantitative de l'antigène de surface du virus de l'hépatite B (AgHBs) dans le sérum et le plasma humains, au moyen de l'analyseur Alinity i.
Épreuve Alinity i HIV AG/AB Combo (Dépistage de maladie chez les donneurs et les cadavres) (Alinity i HIV AG/AB Combo assay [Donor screening and cadaveric testing])
Épreuve Alinity i HIV AG/AB Combo Sommaire de décision
- Indication
- Le test Alinity i HIV AG/AB Combo doit être utilisé comme un outil permettant de diagnostiquer l'infection par le VIH-1 ou le VIH-2 et comme un test de dépistage pour prévenir la transmission du VIH-1 ou du VIH-2 aux receveurs de sang, de composantes sanguines, de cellules, de tissus et d'organes.
Alinity I rHTLV-I/II
Alinity I rHTLV-I/II Sommaire de décision
- Indication
- L'épreuve rHTLV-I/II Alinity i est destiné à faciliter le diagnostic des infections à HTLV-I et HTLV-II et comme test de dépistage pour éviter la transmission du HTLV-I et HTLV-II aux receveurs de sang, composantes du sang, cellules, tissus et organes.
Épreuve Syphilis TP Alinity i (Dépistage de maladie chez les donneurs et les cadavres) (Alinity i Syphilis TP assay [Donor screening & cadaveric testing])
Épreuve Syphilis TP Alinity i Sommaire de décision
- Indication
- L'épreuve Syphilis TP Alinity i est conçue pour faciliter le diagnostic de l'infection syphilitique et comme outil de dépistage pour prévenir la transmission de Treponema pallidum aux receveurs de sang, de composantes sanguines, de cellules, de tissus ou d'organes.
Elecsys HIV duo dépistage de maladie chez les donneurs (Elecsys HIV duo donor screening)
Elecsys HIV duo dépistage de maladie chez les donneurs Sommaire de décision
- Indication
- Test de dosage immunologique pour la détermination qualitative in vitro de l'antigène p24 du VIH-1 ainsi que des anticorps anti-VIH-1, groupe O inclus, et anti-VIH-2 dans le sérum et le plasma humains. Le test est indiqué pour faciliter le diagnostic de l'infection à VIH-1 et/ou de l'infection à VIH-2. Il est également indiqué comme test de dépistage de l'antigène p24 du VIH-1 et des anticorps dirigés contre le VIH-1 et le VIH-2 dans les échantillons individuels de sérum ou de plasma de donneurs de sang humains.
Virotrol HIV-1 gO
Virotrol HIV-1 gO Sommaire de décision
- Indication
- Virotrol HIV-1 gO est conçu pour être utilisé comme réactif non titré de contrôle de la qualité avec des méthodes d'analyse in vitro pour la détermination des anticorps dirigés contre le virus de l'immunodéficience humaine de type 1 (VIH-1 du groupe O) dans le sérum ou le plasma humains. Il permet d'estimer la précision et de détecter les écarts systématiques par rapport aux méthodes d'analyse en laboratoire spécifiques.
Santé digestive
Mise à jour sur l'innocuité publiée dans cette catégorie
- Système thérapeutique Enterra : Résumé de l'examen de l'innocuité : Évaluation de l'absence potentielle d'effet
Santé oculaire
Mises à jour sur l'innocuité publiées dans cette catégorie
- Lentilles cornéennes à but esthétique : Mise à jour : Rappel aux Canadiens des risques liés à l'utilisation
- Dispositifs viscochirurgicaux ophtalmiques (DVO) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'inflammation de la partie avant de l'œil (syndrome de toxicité dans le segment antérieur)
Santé cardiovasculaire
16 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Bioprothèse aortique Acurate neo et système d'implantation par voie transfémorale Acurate TF (Acurate neo aortic bioprosthesis and Acurate TF transfemoral delivery system)
- Indication
- La bioprothèse aortique Acurate neo et le système d'implantation par voie transfémorale Acurate TF est un dispositif de remplacement de la valve aortique par cathéter indiqué chez les patients âgés de 75 ans et plus présentant une sténose aortique grave pour qui les risques de décès liés au remplacement de la valve aortique par une intervention chirurgicale classique sont jugés très élevés, et chez les patients inopérables.
Système de stimulation cardiaque Astra/Azure MRI SureScan (Astra/Azure MRI SureScan pacing system)
Système de stimulation cardiaque Astra/Azure MRI SureScan Sommaire de décision
- Indication
- Les systèmes Astra/Azure S/XT SR/DR MRI SureScan sont des stimulateurs cardiaques implantables indiqués chez les patients qui peuvent bénéficier d'une stimulation à fréquence asservie ou non asservie pour rétablir la fréquence cardiaque physiologique, améliorer le débit cardiaque, prévenir les symptômes ou protéger contre les arythmies liées à la formation d'impulsions cardiaques ou à des troubles de la conduction cardiaque.
Valve aortique transcathéter CoreValve Evolut PRO (CoreValve Evolut PRO transcatheter aortic valve)
Valve aortique transcathéter CoreValve Evolut PRO Sommaire de décision
- Indication
- Le système CoreValve Evolut PRO est un système de valve aortique transcathéter indiqué pour les patients ayant une sténose symptomatique grave de la valve aortique native ou ayant une sténose et/ou une insuffisance aortique induite par la dégénérescence de la bioprothèse valvulaire chirurgicale, laquelle doit être remplacée.
CRT-P MRI SureScan
CRT-P MRI SureScan Sommaire de décision
- Indication
- Les instruments CRT-P MRI SureScan sont des stimulateurs cardiaques de resynchronisation.
Defigard Touch 7
Defigard Touch 7 Sommaire de décision
- Indication
- Le Defigard Touch 7 est un défibrillateur externe utilisé pour le traitement de la fibrillation ventriculaire (FV) et de la tachycardie ventriculaire (TV).
Stimulateur cardiaque implantable Edora 8 (Edora 8 implantable pulse generator)
Stimulateur cardiaque implantable Edora 8 Sommaire de décision
- Indication
- Edora est une famille de stimulateurs cardiaques implantables indiqués pour tous les cas de bradycardie ou d'arythmie.
FRED PA-1
FRED PA-1 Sommaire de décision
- Indication
- Le FRED PA-1 est un défibrillateur automatique externe utilisé pour le traitement de la fibrillation ventriculaire (FV) et la tachycardie ventriculaire (TV).
Système d'assistance ventriculaire gauche Heartmate 3 (Heartmate 3 left ventricular assist system [LVAS])
- Technologie nouvelle
Système d'assistance ventriculaire gauche Heartmate 3 Sommaire de décision
- Indication
- Le système d'assistance ventriculaire gauche Heartmate 3 est un petit dispositif implantable qui aide le ventricule gauche du cœur (la chambre de pompage principale du cœur) à acheminer le sang dans toutes les parties du corps en assumant une partie ou la totalité de la charge de travail de la circulation sanguine. Le système d'assistance ventriculaire gauche Heartmate 3 est destiné aux patients atteints d'insuffisance cardiaque dont le cœur est incapable de pomper efficacement.
Ilivia 7 CRT-D
Ilivia 7 CRT-D Sommaire de décision
- Indication
- L'instrument Ilivia 7 CRT-D est un défibrillateur implantable qui peut être utilisé pour traiter l'arythmie ventriculaire potentiellement mortelle par stimulation antitachycardique et défibrillation.
Ilivia 7 ICD (ProMRI)
Ilivia 7 ICD (ProMRI) Sommaire de décision
- Indication
- L'instrument Ilivia 7 ICD ProMRI est un défibrillateur implantable qui peut être utilisé pour traiter l'arythmie ventriculaire potentiellement mortelle par stimulation antitachycardique et défibrillation.
Système de programmation Latitude (Latitude programming system)
Système de programmation Latitude Sommaire de décision
- Indication
- Le système de programmation Latitude modèle 3300 sert à interroger et programmer les générateurs d'impulsion de BSC, à afficher, enregistrer et transférer les données sur le patient et le dispositif, à évaluer l'emplacement des électrodes pendant l'implantation du dispositif, à imprimer des rapports sur des imprimantes externes filaires ou sans fil, et prend en charge le téléchargement par Internet des mises à niveau du logiciel de programmation.
Système de réparation mitrale MitraClip (MitraClip delivery system)
Système de réparation mitrale MitraClip Sommaire de décision
- Indication
- Le système de réparation mitrale MitraClip NTR et le système de réparation mitrale MitraClip XTR sont conçus pour la réparation percutanée de la valve mitrale à cœur battant.
Cathéters électrophysiologiques de diagnostic retraités (Reprocessed electrophysiology diagnostic catheters)
Cathéters électrophysiologiques de diagnostic retraités Sommaire de décision
- Indication
- Les cathéters de diagnostic électrophysiologique retraités sont utilisés pour faciliter la cartographie électrophysiologique des structures cardiaques et obtenir des électrogrammes dans les régions auriculaires.
Cathéters d'électrophysiologie Lasso retraités (Reprocessed Lasso electrophysiology catheters)
Cathéters d'électrophysiologie Lasso retraités Sommaire de décision
- Indication
- Les cathéters d'électrophysiologie Lasso retraités sont utilisés pour faciliter la cartographie électrophysiologique des structures cardiaques et obtenir des électrogrammes des régions auriculaires.
Cathéters électrophysiologiques de diagnostic retraités et scellés (Reprocessed sealed electrophysiology diagnostic catheters)
Cathéters électrophysiologiques de diagnostic retraités et scellés Sommaire de décision
- Indication
- Les cathéters électrophysiologiques de diagnostic retraités et scellés servent à évaluer divers types d'arythmies cardiaques sur des sites endocardiaques et intravasculaires.
Cathéter d'ablation à capteur de force de contact TactiCath, avec capteur (TactiCath contact force ablation catheter, Sensor Enabled)
Cathéter d'ablation à capteur de force de contact TactiCath, avec capteur Sommaire de décision
- Indication
- Le cathéter d'ablation à capteur de force de contact TactiCath, Sensor Enabled est indiqué pour la cartographie électrophysiologique du cœur (stimulation et enregistrement), ainsi que pour l'ablation cardiaque des arythmies supraventriculaires dans l'oreillette droite et l'oreillette gauche, y compris la fibrillation auriculaire, lorsqu'il est utilisé avec un générateur de radiofréquences.
Mise à jour sur l'innocuité publiée dans cette catégorie
- Cathéters percutanés d'ablation par radiofréquence : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'une communication anormale entre le cœur et le tractus digestif (fistule atrio-œsesophagienne)
Imagerie médicale
5 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Cathéter de cartographie haute densité à grille Advisor, avec capteur (Advisor HD grid mapping catheter, Sensor Enabled)
Cathéter de cartographie haute densité à grille Advisor, avec capteur Sommaire de décision
- Indication
- Le cathéter de cartographie haute densité à grille Advisor, Sensor Enabled est un cathéter de cartographie électrophysiologique indiqué pour la cartographie électrophysiologique à électrodes multiples des structures du cœur, c'est-à-dire pour l'enregistrement ou la stimulation seulement.
Cathéter d'imagerie périphérique OptiCross 18 (OptiCross 18 peripheral imaging catheter)
Cathéter d'imagerie périphérique OptiCross 18 Sommaire de décision
- Indication
- Le cathéter d'imagerie périphérique OptiCross 18, 30 MHz, est un cathéter d'imagerie intravasculaire par ultrasons conçu pour fournir aux médecins une image à 360 degrés de l'intérieur des vaisseaux périphériques pour examiner les maladies vasculaires et observer les effets de l'intervention.
Cathéter intravasculaire à ultrasons (IVUS) rotatoire Refinity (Refinity rotational intravascular ultrasound [IVUS] catheter)
Cathéter intravasculaire à ultrasons (IVUS) rotatoire Refinity Sommaire de décision
- Indication
- Le cathéter intravasculaire à ultrasons (IVUS) rotatoire Refinity est destiné à l'examen intravasculaire par ultrasons des artères coronaires.
Cathéter IVUS numérique Visions PV.014P RX (Visions PV.014P RX Digital IVUS catheter)
Cathéter IVUS numérique Visions PV.014P RX Sommaire de décision
- Indication
- Le cathéter IVUS numérique Visions PV.014P RX est conçu pour l'évaluation de la morphologie vasculaire des vaisseaux sanguins coronaires et périphériques en fournissant une image transversale de ces vaisseaux.
Transducteur 14L5 SP (14L5 SP TRANSDUCER)
Transducteur 14L5 SP Sommaire de décision
- Indication
- Le dispositif 14L5 SP est un transducteur échographique chirurgical en réseau linéaire utilisé avec des échographes pour des applications periopératoires et de surface corporelle.
Utilisation d'opioïdes
Mise à jour sur l'innocuité publiée dans cette catégorie
- Bandelettes de test du fentanyl : Mise à jour : Limites des bandelettes de test du fentanyl utilisées avant la consommation de drogues de rue
Don d'organes
1 Nouveau instrument médical a été approuvé dans cette catégorie
Trousses de transplantation pulmonaire (Lung transplant procedure packs)
Trousses de transplantation pulmonaire Sommaire de décision
- Indication
- Les trousses de transplantation pulmonaire sont destinées à être utilisées dans la transplantation pulmonaire, une intervention chirurgicale consistant à retirer un poumon du corps d'une personne (donneur) et à le placer dans le corps d'une autre personne (receveur) afin de remplacer un poumon endommagé ou manquant.
Orthopédie
1 Nouvel instrument médical a été approuvé dans cette catégorie
Implant injectable JointRep (JointRep injectable implant)
Implant injectable JointRep Sommaire de décision
- Indication
- L'implant injectable JointRep est indiqué pour le traitement des déficiences cartilagineuses de l'articulation du genou chez l'adulte, en conjonction avec une technique de stimulation de la moelle osseuse (SMO) pour la réduction des douleurs articulaires et l'amélioration des fonctions articulaires et des activités du patient.
Prise en charge de la douleur
3 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Électrodes et accessoires de stimulation du GRD (DRG leads and accessories)
Électrodes et accessoires de stimulation du GRD Sommaire de décision
- Indication
- Les électrodes et les accessoires de stimulation du ganglion de la racine dorsale (GRD) sont destinés à être utilisés avec un neurostimulateur de GRD.
Système de neurostimulation Intellis avec neurostimulateur externe sans fil (Intellis neurostimulation system with wireless external neurostimulator)
Système de neurostimulation Intellis avec neurostimulateur externe sans fil Sommaire de décision
- Indication
- Le système de neurostimulation Intellis est un dispositif implantable de stimulation de la moelle épinière ou des nerfs périphériques. Le stimulateur génère et émet de faibles impulsions électriques dans la région concernée pour modifier la génération, la transmission ou l'interprétation du potentiel d'action.
Générateur d'impulsions implantable Proclaim DRG (Proclaim DRG implantable pulse generator)
Générateur d'impulsions implantable Proclaim DRG Sommaire de décision
- Indication
- Le Générateur d'impulsions implantable Proclaim DRG est un dispositif de stimulation de la moelle épinière. Ce dispositif, lorsqu'il est utilisé avec d'autres composantes (sondes électrodes/prolongateurs), applique des impulsions électriques de faible intensité sur le ganglion de la racine dorsale pour aider à soulager la douleur.
Chirurgie
4 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Dispositif d'évacuation neurochirurgicale Artemis (Artemis neuro evacuation device)
Dispositif d'évacuation neurochirurgicale Artemis Sommaire de décision
- Indication
- Le dispositif d'évacuation neurochirurgicale Artemis est utilisé pour l'aspiration contrôlée des tissus ou des liquides au cours d'une intervention chirurgicale du système ventriculaire ou du cerveau en association avec une pompe d'aspiration Penumbra.
Fils de suture chirurgicale Filaprop stérilisés (Filaprop sterilised surgical needled suture)
Fils de suture chirurgicale Filaprop stérilisés Sommaire de décision
- Indication
- Les sutures au Filaprop sont destinées au rapprochement et à la ligature des tissus mous, notamment dans le cadre d'intervention cardiovasculaires, ophtalmiques et neurologiques.
Suture chirurgicale résorbable en catgut normal et en catgut chromé (Plain and chromic gut absorbable surgical sutures)
Suture chirurgicale résorbable en catgut normal et en catgut chromé Sommaire de décision
- Indication
- Les fils de suture en catgut normal et en catgut chromé sont indiqués pour la suture ou la ligature de tissus mous dans le cadre d'interventions chirurgicales générales, notamment ophtalmiques, mais non pour la suture ou la ligature de tissus cardiovasculaires ou nerveux.
Système d'ablation au laser guidé par l'imagerie par résonance magnétique Visualase (Visualase MRI-guided laser ablation system)
- Indication
- Le système d'ablation au laser guidé par l'imagerie par résonance magnétique (IRM) Visualase est indiqué dans les interventions à effraction minimale pour l'ablation, la nécrotisation ou la coagulation des tissus mous par une irradiation interstitielle ou une thermothérapie guidée par l'IRM pour des longueurs d'ondes situées entre 800 et 1 064 nm en neurochirurgie du crâne.
Mises à jour sur l'innocuité publiées dans cette catégorie
- Fils de suture crantés (sans nœud) : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel d'obstruction intestinale (occlusion de l'intestin grêle)
- Barrière anti-adhérences SurgiWrap : Résumé de l'examen de l'innocuité : Évaluation du risque potentiel de réaction à un corps étranger simulant la réapparition locale d'un cancer
Santé vasculaire
13 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Endoprothèse Ascyrus Medical pour dissection aortique (AMDS) (Ascyrus Medical dissection stent [AMDS])
- Technologie nouvelle
- Examen prioritaire
Endoprothèse Ascyrus Medical pour dissection aortique Sommaire de décision
- Indication
- L'endoprothèse Ascyrus Medical pour dissection aortique est conçue pour la réparation aortique, le remodelage aortique et la réexpansion du lambeau intimal dans l'aorte ascendante, la crosse de l'aorte et l'aorte descendante chez les patients ayant subi une dissection aortique aiguë de type I selon la classification DeBakey et/ou des hématomes intramuraux (HIM) ainsi qu'une malperfusion clinique préopératoire et/ou radiographique et qui ont subi une réparation chirurgicale ouverte dans les 14 jours suivant le diagnostic.
Dispositif de Reconstruction Vasculaire Codman Enterprise 2 (Codman Enterprise 2 Vascular Reconstruction Device)
Dispositif de Reconstruction Vasculaire Codman Enterprise 2 Sommaire de décision
- Indication
- Le Dispositif de Reconstruction Vasculaire Codman Enterprise 2 est destiné à une utilisation en association avec des spires d'embolisation pour le traitement des anévrismes intracrâniens sacculaires ou fusiformes à collet large.
Dispositif de revascularisation Embotrap II (Embotrap II revascularization device)
Dispositif de revascularisation Embotrap II Sommaire de décision
- Indication
- Le dispositif de revascularisation Embotrap/Embotrap II est conçu pour rétablir la circulation sanguine dans le système neurovasculaire en retirant les caillots chez les personnes ayant subi un accident ischémique cérébral dans les 8 heures suivant l'apparition des symptômes.
Système Heli-FX EndoAnchor (Heli-FX EndoAnchor system)
Système Heli-FX EndoAnchor Sommaire de décision
- Indication
- Le système Heli-FX EndoAnchor vise à fixer et à sceller les prothèses aortiques endovasculaires à l'artère native. Le système Heli-FX EndoAnchor est indiqué chez les patients dont la prothèse endovasculaire présente une migration ou une endofuite, ou qui sont à risque de telles complications, et qui ont besoin d'une meilleure fixation radiale ou d'un scellement pour retrouver ou maintenir une bonne exclusion anévrysmale.
Cathéter d'extraction de thrombus Capturer d'iVascular (iVascular Capturer, thrombus extraction catheter)
Cathéter d'extraction de thrombus Capturer d'iVascular Sommaire de décision
- Indication
- Le cathéter d'extraction de thrombus Capturer d'iVascular est un cathéter utilisé pour extraire les thrombus frais. Le cathéter d'extraction de thrombus est spécialement indiqué pour l'extraction d'emboles et de thrombus mous et frais des vaisseaux coronaires et périphériques.
Système d'endoprothèse Neuroform Atlas (Neuroform Atlas stent system)
Système d'endoprothèse Neuroform Atlas Sommaire de décision
- Indication
- Le système d'endoprothèse Neuroform Atlas est destiné à être utilisé avec des spirales d'embolisation neurovasculaire chez des patients âgés de 18 ans ou plus pour le traitement des anévrismes intracrâniens sacculaires à large collet.
Microsphères d'embolisation Occlusin (Occlusin embolization microspheres)
Microsphères d'embolisation Occlusin Sommaire de décision
- Indication
- Les microsphères Occlusin 500 sont destinées à être utilisées pour l'embolisation des tissus cibles, notamment en cas de tumeur hypervasculaire et d'hypertrophie (ou hyperplasie) bénigne de la prostate.
Spire métallique Optima (Optima coil system)
Spire métallique Optima Sommaire de décision
- Indication
- La spire métallique Optima est conçue pour l'embolisation endovasculaire d'anévrismes intracrâniens sacciformes, fusiformes ou disséquants, qu'ils soient rompus ou non, et pour l'embolisation d'autres anomalies neurovasculaires, comme des malformations artérioveineuses et des fistules artérioveineuses. La spire métallique Optima est également conçue pour l'occlusion vasculaire des vaisseaux sanguins au sein du système neurovasculaire, afin d'obstruer de façon permanente la circulation du sang vers un anévrisme ou une autre malformation vasculaire, ainsi que pour l'embolisation artérielle et veineuse dans le système vasculaire périphérique.
Système d'athérectomie Phoenix (Phoenix atherectomy system)
Système d'athérectomie Phoenix Sommaire de décision
- Indication
- Le système d'athérectomie Phoenix est indiqué pour l'athérectomie des vaisseaux périphériques. Il ne doit pas être utilisé dans le système vasculaire coronarien, carotidien, iliaque ou rénal.
Dispositif d'embolisation Pipeline Flex avec Technologie Bouclier (Pipeline Flex embolization device with shield technology)
Dispositif d'embolisation Pipeline Flex avec Technologie Bouclier Sommaire de décision
- Indication
- Le dispositif d'embolisation Pipeline Flex avec Technologie Bouclier est conçu pour être utilisé avec ou sans spirales emboliques pour le traitement des anévrismes intracrâniens à collet large ne se prêtant pas au traitement par clippage chirurgical.
Stent périphérique auto-expansible en nitinol Pulsar-18 (Pulsar-18 peripheral self-expanding nitinol stent system)
Stent périphérique auto-expansible en nitinol Pulsar-18 Sommaire de décision
- Indication
- Le stent périphérique auto-expansible en nitinol Pulsar-18 est une endoprothèse auto-expansible qui est indiquée pour améliorer le diamètre luminal chez les patients symptomatiques présentant des lésions de novo, resténotiques ou occlusives dans les artères fémorale et poplitée proximale.
Dispositif de revascularisation Tigertriever (Tigertriever revascularization device)
Dispositif de revascularisation Tigertriever Sommaire de décision
- Indication
- Le dispositif Tigertriever est conçu pour rétablir la circulation sanguine chez les personnes ayant subi un accident ischémique cérébral causé par l'occlusion de gros vaisseaux intracrâniens. Il est indiqué pour les personnes qui sont inadmissibles à une administration d'activateur tissulaire du plasminogène (t-PA) par voie intraveineuse ou chez qui ce traitement a échoué.
Système d'embolisation d'anévrisme WEB (WEB aneurysm embolization system)
Système d'embolisation d'anévrisme WEB Sommaire de décision
- Indication
- Le système d'embolisation d'anévrisme WEB est conçu pour l'embolisation endovasculaire d'anévrismes intracrâniens rompus ou non rompus.
Gestion des blessures
4 Nouveaux instruments médicaux ont été approuvés dans cette catégorie
Cytal
- Indication
- La famille d'instruments médicaux Cytal consiste en des pansements résorbables composés de matrice extracellulaire d'origine porcine pour diverses utilisations.
Matrice dermique Endoform (Endoform dermal template)
Matrice dermique Endoform Sommaire de décision
- Indication
- La matrice dermique Endoform est indiquée pour la prise en charge des plaies.
Matrice dermique MatriDerm (MatriDerm dermal matrix)
Matrice dermique MatriDerm Sommaire de décision
- Indication
- La matrice MatriDerm est utilisée conjointement avec des greffes de peau autologues de demi-épaisseur pour la reconstruction d'anomalies du derme profond et des plaies cutanées de pleine épaisseur en chirurgie plastique de reconstruction et dans le traitement chirurgical des brûlures, des traumas et des maladies dermatologiques. Elle est également utilisée dans le traitement des plaies qui cicatrisent mal et qui nécessitent une greffe.
MicroMatrix
MicroMatrix Sommaire de décision
- Indication
- MicroMatrix est destiné aux soins des plaies.
Autre
Mise à jour sur l'innocuité publiée dans cette catégorie
- Lit d'hôpital EasyCare : InfoVigilance sur les produits de santé : Risque de piégeage du patient
Clics santé – Aperçu des instruments médicaux
Pour demeurer au courant de nos activités :
- Suivez-nous sur Facebook
- Suivez-nous sur Twitter
- Suivez-nous sur YouTube
- Voyez les dernières nouvelles de Santé Canada sur notre site Web
- Trouvez d'autres informations sur la santé sur le site Web du gouvernement du Canada
Vous pouvez également trouver des informations sur des instruments médicaux en particulier en suivant les liens ci-dessous.
Nouveaux instruments médicaux approuvés
- Nouveau Santé Canada publie régulièrement des gazouillis sur les nouveaux instruments médicaux approuvés.
- Twitter #Medicamentsetinstrumentsmedicaux
- Nouveau Santé Canada publie une mise à jour trimestrielle qui présente les médicaments et les instruments médicaux homologués au cours des trois derniers mois.
- Twitter #Medicamentsetinstrumentsmedicaux
- La Liste des instruments médicaux homologués en vigueur (MDALL) est une liste de toutes les homologations (licences) délivrées pour les instruments médicaux.
- Les sommaires des décisions réglementaires décrivent l'objet d'une demande d'homologation d'instrument médical, et les motifs expliquant la décision prise par Santé Canada de l'approuver ou de la rejeter.
- Les sommaires des motifs de décision détaillent les considérations réglementaires, sécuritaires, et reliées à l'efficacité et la qualité du produit prises en compte par Santé Canada lors de sa décision d'approuver certains instruments médicaux.
Surveillance des instruments médicaux après la mise en marché
Vous pouvez déclarer les effets indésirables aux médicaments et les incidents liés aux instruments médicaux à votre professionnel de la santé, à un hôpital ou à l'entreprise qui a fabriqué le produit. Vous pouvez également les déclarer à Santé Canada par l'entremise de MedEffet Canada ou par téléphone au 1-866-234-2345.
- La Base de données des rappels et des avis de sécurité comprend les rappels, les avis, les alertes de sécurité et les autres publications de Santé Canada.
- Les résumés de l'examen de l'innocuité résument les examens des problèmes d'innocuité potentiels des instruments médicaux que nous avons réalisés.
- Les nouveaux examens de l'innocuité et de l'efficacité sont des tableaux qui présentent les examens en cours à Santé Canada.
- « InfoVigilance sur les produits de santé » est une publication mensuelle destinée principalement aux professionnels de la santé. InfoVigilance sur les produits de santé fournit de l'information pertinente du point de vue clinique sur les produits de santé et leur innocuité.
- Les tableaux récapitulatifs des plaintes en matière de publicité présentent les plaintes relatives à la publicité sur les produits de santé qui ont été déposées auprès de Santé Canada et les mesures que nous avons prises.
- Nouveau La base de données des incidents liés aux matériels médicaux comprend les incidents soupçonnés d'être liés à des instruments médicaux qui sont déclarés à Santé Canada. Ces déclarations ont été soumises par des consommateurs et des professionnels de la santé ainsi que par des fabricants d'instruments médicaux.
Médicaments à usage vétérinaire
Médicaments à usage vétérinaire : 2018 En bref
Les nouveaux médicaments à usage vétérinaire fournissent de nouveaux moyens de contribuer à maintenir et à améliorer la santé des animaux. Nous évaluons et surveillons l'innocuité, la qualité et l'efficacité des médicaments vétérinaires. Nous établissons des normes, encourageons l'utilisation prudente des médicaments vétérinaires chez les animaux destinés à la production d'aliments et les animaux de compagnie et travaillons ainsi à protéger l'approvisionnement en nourriture du Canada.
Les médicaments que nous réglementons vont de ceux médicaments qui préviennent et/ou traitent des maladies graves chez les animaux aux produits de santé vétérinaires destinés à maintenir leur santé et leur bien-être. Nos examens scientifiques sont à la base de notre travail de réglementation pour les médicaments que nous réglementons.
En 2018, nous avons réalisé des progrès importants relativement à nos priorités principales, notamment :
- prendre des mesures pour lutter contre la résistance aux antimicrobiens
- travailler avec nos partenaires étrangers pour faciliter l'accès rapide aux médicaments vétérinaires au Canada
Nouveaux médicaments approuvés
En 2018, nous avons contribué à assurer la disponibilité de plus de 1 300 produits de santé vétérinaires et avons élargi ainsi l'éventail des options à faible risque disponibles pour maintenir ou favoriser la santé et le bien-être des animaux.
Nous avons approuvé 8 nouveaux médicaments vétérinaires destinés aux animaux de compagnie et aux animaux destinés à la production d'aliments. De nouveaux produits et thérapies innovants à utiliser pour gérer la santé et le bien-être des animaux sont ainsi devenus disponibles. Nous avons également approuvé 7 nouveaux médicaments vétérinaires génériques afin d'offrir des options supplémentaires pour assurer une prévention et un traitement plus économiques.
Pour obtenir la liste et la description des nouveaux médicaments que nous avons approuvés en 2018, voyez « Médicaments à usage vétérinaire : Approuvés en 2018 ».
Essais cliniques et programme de distribution de médicament d'urgence
Nous approuvons les demandes pour permettre aux entreprises et aux chercheurs de réaliser des essais cliniques sur les médicaments vétérinaires au Canada. Les nouveaux essais sur les médicaments vétérinaires nous permettront de disposer de nouveaux produits dans l'avenir. En 2018, 86 nouveaux certificats d'études expérimentales (CEE) ont été autorisés à l'appui d'essais cliniques ou d'activités de recherche.
Notre Programme de distribution de médicaments d'urgence donne accès à des médicaments à usage vétérinaire qui n'ont pas encore été autorisés pour la vente au Canada. Le programme permet aux vétérinaires de demander des traitements qui ne sont pas disponibles autrement. L'accès à des médicaments à usage vétérinaire non approuvés peut être accordé en cas d'urgence médicale chez un animal confié aux soins d'un vétérinaire. En 2018, 644 demandes ont été approuvées dans le cadre du Programme de distribution de médicament d'urgence.
Surveiller les médicaments après l'approbation
Une fois que les médicaments sont disponibles pour être utilisés au Canada, Santé Canada continue de surveiller et d'évaluer les déclarations d'effets indésirables soupçonnés d'être associés aux médicaments vétérinaires. Il n'est pas possible de connaître ou de prédire tous les effets indésirables possibles d'un médicament vétérinaire au moyen des études cliniques au moment de l'approbation de la mise en marché.
Pour la première fois, les médicaments à usage vétérinaire ont été incorporés dans ce rapport « Faits saillants ». La section « Médicaments à usage vétérinaire » du rapport fournit de plus amples renseignements sur nos activités en 2018. Vous trouverez un aperçu des progrès que nous avons accomplis en 2018 relativement à nos priorités principales. Vous découvrirez le cycle de vie du produit d'un médicament vétérinaire et de notre rôle, qui consiste à nous assurer que les avantages l'emportent sur les risques potentiels associés à l'utilisation d'un médicament, tout en protégeant la salubrité des aliments. Vous y trouverez également des renseignements à propos des nouveaux médicaments vétérinaires que nous avons approuvés en 2018. Voyez également la nouvelle section « Clics santé » pour obtenir de l'information à jour sur nos activités.

Mary Jane Ireland,
Directrice générale,
Médicaments vétérinaires,
Santé Canada
Médicaments à usage vétérinaire : Réalisations de 2018
Combattre la résistance aux antimicrobiens liée aux animaux
L'utilisation des antimicrobiens chez les animaux peut se répercuter sur la façon dont les êtres humains et les animaux réagissent au traitement
Les antibiotiques sont utilisés chez les animaux pour prévenir ou traiter des maladies. Une grande partie des antibiotiques utilisés au Canada sont utilisés chez les animaux destinés à la production d'aliments.
Les bactéries, virus, champignons et parasites peuvent résister aux antimicrobiens, tels que les antibiotiques et les antiviraux, qui sont utilisés pour soigner les personnes et les animaux malades. Ceci est connu sous le nom de résistance aux antimicrobiens (RAM). L'impact de la RAM sur la santé humaine et animale est une préoccupation au Canada et dans le monde entier.
Chez les animaux, l'utilisation des antimicrobiens contribue au développement et à la propagation des bactéries résistantes. Ces bactéries peuvent être transférées à l'être humain par l'entremise des aliments que nous mangeons (produits d'origine animale) et par le contact direct.
Prendre des mesures pour combattre la résistance aux antimicrobiens
Depuis décembre 2018, de nombreux antimicrobiens utilisés chez les animaux qui étaient disponibles « en vente libre » (c'est-à-dire sans ordonnance) autrefois ne sont disponibles que sur ordonnance. La supervision par un vétérinaire agréé pour la prise de décisions relatives au traitement est une partie importante de la surveillance antimicrobienne. Pour de plus amples informations, voyez Utilisation responsable des antimicrobiens importants sur le plan médical chez les animaux.
Comprendre le nombre et le type d'antimicrobiens disponibles aux fins de leur utilisation chez les animaux nous aide à mieux comprendre les modes d'action et les tendances de la résistance aux antimicrobiens chez les bactéries préoccupantes. Les entreprises qui fabriquent, importent et préparent ces antimicrobiens à usage vétérinaire doivent maintenant déclarer chaque année à Santé Canada les ventes d'antimicrobiens importants sur le plan médical. Pour aider les entreprises à faire leurs déclarations, nous avons lancé un outil de déclaration des ventes en ligne. Pour de plus amples informations, voyez Rapports sur les ventes de médicaments vétérinaires antimicrobiens.
Nous avons renforcé la surveillance des ingrédients actifs dans les produits à usage vétérinaire afin de continuer à faire en sorte qu'ils soient fabriqués en respectant des normes de qualité et d'innocuité strictes. Consultez la page, Surveillance de la qualité des ingrédients pharmaceutiques actifs à usage vétérinaire au Canada pour de plus amples informations.
Nous participons également aux activités de groupes internationaux qui nous aident dans notre travail sur la RAM, tels que le Codex Alimentarius.
Notre travail visant à favoriser une gestion efficace des antimicrobiens à usage vétérinaire fait partie du Plan d'action fédéral sur la résistance et le recours aux antimicrobiens au Canada et de Lutter contre la résistance aux antimicrobiens et optimiser leur utilisation : un cadre d'action pancanadien.
Pour en savoir plus sur la résistance aux antimicrobiens chez l'être humain, voyez « Médicaments à usage humain : Réalisations de 2018 ».
Offrir plus d'options pour améliorer la santé et le bien-être des animaux
Nous avons contribué à assurer la disponibilité de plus de 1 300 produits de santé vétérinaires et à offrir davantage d'options à faible risque pour maintenir ou favoriser la santé et le bien-être des animaux. Les produits de santé vétérinaires comprennent des ingrédients tels que les vitamines et les minéraux et des médicaments traditionnels. En gardant les animaux en bonne santé, on peut réduire la dépendance à l'égard des médicaments comme les antimicrobiens.
Nous avons créé le Programme de notification pour les produits de santé animale, qui permet d'accéder en temps opportun aux produits de santé animale utilisés pour maintenir ou améliorer la santé des animaux de compagnie et des animaux destinés à la production d'aliments. Pour de plus amples informations, voyez Produits de santé animale.
De nombreux propriétaires d'animaux recherchent de nouvelles options, telles que les probiotiques, pour améliorer la santé des animaux et réduire le besoin d'antimicrobiens. Connus sous le nom de « produits microbiens viables », ces produits sont donnés au bétail afin d'améliorer la digestion et la production pour favoriser la santé en général et soigner ou prévenir certaines conditions ou maladies. Nous avons collaboré avec l'Agence canadienne d'inspection des aliments (ACIA) et les intervenants pour clarifier le processus de mise en marché de ces produits en assurant une surveillance appropriée afin d'accroître leur disponibilité dans le cadre des plans de gestion de la santé des animaux en général. Pour de plus amples informations, voyez Produits microbiens viables.
Pour aider les producteurs laitiers à améliorer la santé de leurs bovins, nous avons également mis en place un processus d'homologation accélérée pour les solutions antiseptiques pour trayons. Celles-ci sont utilisées par les producteurs laitiers pour aider à réduire la propagation des organismes susceptibles de causer des mammites chez les bovins laitiers. Ce nouveau processus permet d'offrir plus rapidement aux producteurs laitiers un plus vaste éventail de produits. Pour de plus amples informations, allez à la Monographie de solutions antiseptiques pour trayons.
Collaborer à l'échelle internationale
Nous participons activement à plusieurs initiatives internationales importantes. La collaboration avec nos partenaires étrangers de confiance :
- contribue à l'atteinte d'importants objectifs de santé publique
- favorise l'harmonisation de la réglementation
- encourage l'innovation
- améliore en fin de compte l'accès simultané à des médicaments vétérinaires sûrs et efficaces dans le monde entier
Les organisations internationales permettent aux organismes de réglementation d'échanger des pratiques exemplaires, de discuter des défis émergents et d'établir des normes. Par exemple, Santé Canada est un observateur de la Coopération internationale pour l'harmonisation des exigences techniques pour l'enregistrement des produits médicaux vétérinaires (VICH). Dans le cadre du VICH, des experts scientifiques du monde entier travaillent ensemble à l'élaboration de lignes directrices qui aident les organismes de réglementation à s'assurer que les médicaments vétérinaires sont sûrs, efficaces et d'excellente qualité.
Santé Canada participe également à l'établissement de normes internationales sur les résidus de médicaments vétérinaires dans les aliments dans le cadre du Codex Alimentarius par l'entremise du Comité du Codex sur les résidus de médicaments vétérinaires dans les aliments.
Pour de plus amples informations, allez à Médicaments vétérinaires – Collaboration internationale.
Médicaments à usage vétérinaire : Cycle de vie des médicaments
Chaque année, nous approuvons de nouveaux médicaments vétérinaires au Canada et élargissons ainsi l'éventail des options disponibles pour contribuer à maintenir et à améliorer la santé et le bien-être des animaux. Nous travaillons à protéger la santé humaine et animale ainsi que la sécurité de l'approvisionnement alimentaire du Canada.
Dans le cadre de notre travail visant à protéger la santé humaine et animale et la sécurité de l'approvisionnement alimentaire du Canada, nous évaluons les médicaments vétérinaires avant et après leur arrivée sur le marché canadien. Tout au long du cycle de vie d'un médicament à usage vétérinaire, nous évaluons :
- les demandes d'essais cliniques
- les demandes de distribution de médicament d'urgence
- les présentations faites pour obtenir l'autorisation de vendre le médicament au Canada
Une fois que la vente d'un médicament a été approuvée au Canada, nous continuons à surveiller son innocuité en situation réelle.
Essais cliniques
Les certificats d'études expérimentales pour les demandes relatives aux médicaments vétérinaires et aux drogues nouvelles de recherche contribuent à la mise au point de nouveaux médicaments vétérinaires potentiels ou de nouvelles utilisations de produits déjà approuvés qui ont pour but de répondre aux besoins de santé des animaux destinés à la production d'aliments et des animaux de compagnie.
Les promoteurs d'essais cliniques (y compris les fabricants et les chercheurs) soumettent leurs demandes afin de réaliser un essai sur un médicament vétérinaire au Canada. Nous examinons ces demandes et décidons d'accorder ou non une approbation pour le médicament à utiliser dans le cadre de l'essai.
En 2018, Santé Canada a approuvé 86 nouvelles demandes de certificat d'études expérimentales pour des médicaments vétérinaires.
Programme de distribution de médicament d'urgence
Les médicaments qui ne sont pas approuvés au Canada peuvent être disponibles dans le cadre de notre Programme de distribution de médicament d'urgence.
Le Programme de distribution de médicament d'urgence donne accès à des médicaments vétérinaires aux fins du diagnostic ou du traitement d'une urgence médicale. Les animaux qui reçoivent des médicaments dans le cadre de ce programme doivent être soignés par un vétérinaire.
En 2018, Santé Canada a approuvé 644 demandes d'accès d'urgence à des médicaments vétérinaires.
Présentation et examen des médicaments
Lorsqu'une entreprise décide de commercialiser un médicament vétérinaire au Canada, elle nous présente une demande. Une présentation de drogue nouvelle contient des données scientifiques détaillées sur l'innocuité, l'efficacité et la qualité du médicament.
Nos scientifiques examinent les demandes relatives aux médicaments afin d'évaluer les avantages et les risques potentiels associés à leur utilisation pour la santé humaine et animale. Ils contribuent également à faire en sorte qu'un mode d'emploi et des mises en garde clairs soient apposés sur les étiquettes des médicaments vétérinaires.
De nombreux médicaments vétérinaires sont conçus pour être utilisés chez des animaux destinés à la production d'aliments tels que les bovins, les volailles et les porcs. Nous travaillons à assurer la salubrité des aliments qui proviennent d'animaux traités avec des médicaments vétérinaires. Pour ce faire, nous fixons des normes telles que les limites maximales de résidus pour la présence des médicaments vétérinaires dans les aliments ainsi que des délais d'attente.
Les délais de réalisation cibles de l'examen de Santé Canada varie d'une classe de présentations de drogue à l'autre. Le Document d'orientation à l'intention de l'industrie sur la gestion des présentations réglementaires fournit de l'information détaillée sur les échéanciers et les processus de l'examen des présentations de drogue à usage vétérinaire.
Examens innovateurs (Coopération internationale des autorités de réglementation)
Grâce à la coopération internationale, nous examinons les présentations de médicaments vétérinaires avec des partenaires de confiance, comme le Center for Veterinary Medicines de la Food and Drug Administration des États-Unis, l'Australia Pesticide and Veterinary Medicine Authority, et le New Zealand Ministry of Primary Industries.
Ces examens concertés permettent d'intégrer des médicaments vétérinaires sur le marché au Canada en même temps que dans d'autres pays, ce qui serait autrement impossible. Par conséquent, les propriétaires d'animaux de compagnie, les vétérinaires et les producteurs ont accès plus rapidement à des médicaments vétérinaires sécuritaires, efficaces et de grande qualité. Les producteurs alimentaires canadiens demeurent également compétitifs sur la scène mondiale.
En 2018, 22 médicaments vétérinaires ont été soumis à l'examen avec un partenaire par le biais du mécanisme de coopération internationale. À la fin de 2018, huit produits ont ainsi été homologués simultanément. Nous continuons d'examiner d'autres possibilités d'améliorer et d'élargir cette importante initiative.
Approbation des médicaments vétérinaires
Après avoir examiné une présentation de drogue, Santé Canada peut conclure que les avantages l'emportent sur les risques potentiels associés à l'utilisation du produit, et approuver la vente du médicament vétérinaire au Canada. Lorsqu'un nouveau médicament vétérinaire est approuvé, un avis de conformité et un numéro d'identification du médicament (DIN) sont émis.
Cela ne signifie pas que le médicament sera disponible immédiatement au Canada, car de nombreux autres facteurs peuvent influencer la mise en marché.
En 2018, Santé Canada a approuvé huit nouveaux médicaments vétérinaires et sept nouveaux médicaments génériques. Nous avons également contribué à mettre plus de 1 300 produits de santé vétérinaires à la disposition des utilisateurs.
Pour obtenir la liste de ce qui a été approuvé en 2018, voyez « Médicaments à usage vétérinaire : Approuvés en 2018 ».
Surveillance après la mise en marché
Une fois que Santé Canada a homologué un médicament vétérinaire, nous continuons de surveiller son utilisation en situation réelle. Nous appelons cela la « surveillance après la mise en marché ». Nous évaluons les problèmes d'innocuité et d'efficacité potentiels et prenons les mesures qui s'imposent.
Collecte d'information
Santé Canada recueille de l'information après la mise en marché (c'est-à-dire de l'information recueillie sur un produit après son homologation) de diverses sources.
Les événements indésirables soupçonnés qui sont déclarés après que la vente des produits ait été autorisée sont l'une des sources d'information de Santé Canada. Les événements indésirables sont des événements indésirables ou néfastes qui surviennent après l'administration d'un médicament vétérinaire. Sont inclus :
- les réactions ou les événements indésirables chez les animaux
- les réactions ou les événements indésirables chez les êtres humains qui participent à l'administration d'un médicament vétérinaire à un animal
- les événements qui résultent d'un manque d'effet soupçonné
Évaluer les signaux de sécurité
Nous évaluons les déclarations d'événements indésirables soumises par les fabricants et le public (y compris les propriétaires d'animaux et les vétérinaires) afin de déterminer si elles sont liées aux médicaments administrés. Nous travaillons avec les fabricants et les vétérinaires pour nous assurer que toute information importante sur la sécurité est communiquée.
Vous pouvez déclarer une réaction indésirable à un médicament vétérinaire à Santé Canada.Médicaments à usage vétérinaire : Approuvés en 2018
Vous pouvez déclarer les réactions indésirables aux médicaments vétérinaires à Santé Canada.
Définitions importantes
- Médicaments génériques
- Une copie d'un produit de marque. Les médicaments génériques contiennent les mêmes ingrédients médicinaux que les médicaments de marque et sont considérés comme des médicaments équivalents des médicaments de marque. Il peut y avoir de nombreuses versions génériques d'un médicament de marque.
- Examen innovateur (coopération internationale des autorités de réglementation)
- Grâce aux mécanismes de coopération internationale des autorités de réglementation, nous examinons les présentations de médicaments vétérinaires avec des partenaires de confiance, comme le Center for Veterinary Medicines de la Food and Drug Administration des États-Unis, l'Australian Pesticide and Veterinary Medicines Authority, et le New Zealand Ministry of Primary Industries.
- Nouveaux médicaments
- Les nouveaux médicaments donnent de nouvelles options innovantes de traitement, de prévention et de diagnostic de différents problèmes de santé.
- Nouvelle substance active
- Un nouveau médicament qui contient un ingrédient médicinal qui n'avait pas encore été approuvé dans un médicament au Canada et qui n'est pas une variante d'un ingrédient médicinal déjà approuvé à usage vétérinaire.
8 Nouveaux médicaments ont été approuvés à usage vétérinaire
Claro
- Ingrédient médicinal
- Florfénicol, furoate de mométasone, chlorhydrate de terbinafine
- Indication
- Pour le traitement des infections de l'oreille chez les chiens.
Euthansol-D
- Ingrédient médicinal
- Pentobarbital sodique, phénytoïne sodique
- Indication
- Pour l'euthanasie sans cruauté des animaux.
Experior
- Examen innovateur (coopération internationale des autorités de réglementation)
- Nouvelle substance active
- Ingrédient médicinal
- Lubabégron
- Indication
- Pour réduire les émissions d'ammoniac chez le bovin de boucherie.
Forcyl
- Ingrédient médicinal
- Marbofloxacine
- Indication
- Pour le traitement des infections respiratoires chez le bovin.
Nexgard spectra
- Ingrédient médicinal
- Afoxolaner, oxime de milbemycine
- Indication
- Pour le traitement et le contrôle des parasites externes et internes chez les chiens.
Oceanblu
- Ingrédient médicinal
- Acide glycolique
- Indication
- Une trempette antiseptique des trayons pour les vaches laitières.
Ractopamine 4
- Ingrédient médicinal
- Chlorhydrate de ractopamine
- Indication
- Pour l'augmentation de la maigreur de la carcasse et de la prise de masse chez le bovin de boucherie.
Revolution plus
- Examen innovateur (coopération internationale des autorités de réglementation)
- Ingrédient médicinal
- Sarolaner, sélamectine
- Indication
- Pour le traitement et le contrôle des parasites externes et internes chez les chats.
7 Nouveaux médicaments génériques ont été approuvés à usage vétérinaire
- 1 produit contenant chlorhydrate de dexmédétomidine
- 1 produit contenant du dinoprost trométhamine
- 1 produit contenant de l'enrofloxacine
- 1 produit contenant du lactate d'halofuginone
- 1 produit contenant du méloxicam
- 1 produit contenant du chlorhydrate de ractopamine
- 1 produit contenant du phosphate de timlicosine
Clics santé – Aperçu des médicaments à usage vétérinaire
Pour demeurer au courant de nos activités :
- Suivez-nous sur Facebook
- Suivez-nous sur Twitter
- Suivez-nous sur YouTube
- Voyez les dernières nouvelles de Santé Canada sur notre site Web
- Trouvez d'autres informations sur la santé sur le site Web du gouvernement du Canada
Vous pouvez également trouver des renseignements précis sur les médicaments vétérinaires en suivant les liens ci-dessous.
Nouveaux médicaments approuvés
- La Base de données sur les produits pharmaceutiques est une liste de tous les médicaments dont la vente est approuvée au Canada. Dans la base de données, de nombreux médicaments sont accompagnés de leur étiquetage vétérinaire qui décrit les conditions d'utilisation du produit.
- La Base de données des avis de conformité répertorie les homologations (avis de conformité ou AC) délivrées pour les nouveaux médicaments.
Surveillance après la mise en marché des médicaments vétérinaires
Déclarer un effet indésirable d'un médicament vétérinaire.
Détails de la page
- Date de modification :