Ébauche d’évaluation pour les terpènes et terpénoïdes - Groupe des phénylpropanoïdes et des aldéhydes
Titre officiel : Ébauche d’évaluation - Terpènes et terpénoïdes - Groupe des phénylpropanoïdes et des aldéhydes
Environnement et Changement climatique Canada
Santé Canada
Février 2024
Résumé
En vertu de l'article 68 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], les ministres de l’Environnement et de la Santé ont réalisé une évaluation de 12 substances désignées sous le nom « Groupe des phénylpropanoïdes et des aldéhydes », dans le cadre du Plan de gestion des produits chimiques. Le tableau ci-dessous présente, pour chaque substance, son numéro au registre du Chemical Abstracts Service (no CASNote de bas de page 1), son nom sur la Liste intérieure (LI), son nom commun et le sous-groupe auquel il appartient dans la présente évaluation.
| N° CAS | Sous-groupe | Nom chimique | Nom commun |
|---|---|---|---|
| 8006-78-8a | Substance distincte (phénylpropanoïdes) | Essences de feuille de laurier | Essences de feuille de laurier |
| 8016-88-4a | Substance distincte (phénylpropanoïdes) | Essences d’estragon | Essences d’estragon |
| 8022-96-6a | Sous-groupe 1 des phénylpropanoïdes (phénylpropanoïdes) | Essences de jasmin | Essences de jasmin |
| 8024-43-9a | Sous-groupe 1 des phénylpropanoïdes (phénylpropanoïdes) | Parfums et essences de jasmin | Parfums et essences de jasmin |
| 8024-08-6a | Substance distincte (aldéhydes) | Essences de violette | Essences de violette |
| 80-54-6 | Sous-groupe 2 des aldéhydes (aldéhydes) | 2-(4-tert-Butylbenzyl)propionaldéhyde | Lilial |
| 91-51-0 | Sous-groupe 2 des aldéhydes (aldéhydes) | 2-{[3-(4-t-Butylphényl)-2‑méthylpropylidène]amino} benzoate de méthyle | Verdantiol |
| 37677-14-8 | Sous-groupe 2 des aldéhydes (aldéhydes) | 4-(4-Méthyl-3‑pentényl)cyclohex-3-ène-1‑carbaldéhyde | Myrac-aldéhyde |
| 52474-60-9 | Sous-groupe 2 des aldéhydes (aldéhydes) | 1-Méthyl-3-(4-méthyl-3‑pentényl)cyclohex-3-ène-1‑carbaldéhyde | Myrmac-aldéhyde |
| 52475-86-2 | Sous-groupe 2 des aldéhydes (aldéhydes) | 1-Méthyl-4-(4-méthyl-3‑pentényl)cyclohex-3-ène-1‑carbaldéhyde | Myrmac-carboxaldéhyde |
| 65405-84-7 | Sous-groupe 2 des aldéhydes (aldéhydes) | α,2,2,6-Tétraméthylcyclohexène-1‑butyraldéhyde | Cétonal |
| 66327-54-6 | Sous-groupe 2 des aldéhydes (aldéhydes) | 1-Méthyl-4-(4-méthylpentyl)cyclohex-3-ène-1-carbaldéhyde | Vernaldéhyde |
a La substance de ce n° CAS est une substance UVCB (substance de composition inconnue ou variable, produit de réaction complexe ou matière biologique).
Toutes les substances du groupe des phénylpropanoïdes et des aldéhydes ont été visées par une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2012). À l’exception du lilial, aucune des substances de ce groupe n’a été fabriquée ou importée au Canada en quantités supérieures au seuil de déclaration de 100 kg au cours de l’année de déclaration 2011 (Environnement Canada, 2013). En ce qui concerne le lilial, la quantité fabriquée au Canada et déclarée en 2008 était de 910 kg, et la quantité importée au Canada et déclarée au cours de la même année civile était de 24 460 kg (Environnement Canada, 2013).
Les substances du groupe des phénylpropanoïdes et des aldéhydes sont généralement utilisées dans divers produits comme ingrédients parfumants dans les cosmétiques, les médicaments qui comprennent les produits de santé naturels (PSN), produits de nettoyage et assainisseurs d’air, et dans les utilisations de ces substances pour fabriquer certains de ces produits faits soi-même. Certaines de ces substances sont également présentes dans des produits antiparasitaires en tant que produits de formulation. En outre, certaines d’entre elles sont naturellement présentes dans des aliments et peuvent être utilisées comme aromatisants alimentaires.
Les risques pour l’environnement associés aux substances du groupe des phénylpropanoïdes et des aldéhydes ont été caractérisés selon l’Approche de classification du risque écologique (CRE) des substances organiques, qui est fondée sur le risque et fait appel à plusieurs paramètres pour déterminer le danger et l’exposition, ainsi que plusieurs sources de données pondérées pour classifier le risque. Les profils de danger reposent principalement sur des paramètres concernant le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne établis d’après le réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les paramètres pris en compte pour établir les profils d’exposition sont le débit d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. On emploie une matrice de risque pour attribuer aux substances un degré faible, moyen ou élevé de préoccupation potentielle, selon leurs profils de danger et d’exposition. À la lumière des résultats de l’analyse selon la CRE, il est peu probable que les substances du groupe des phénylpropanoïdes et des aldéhydes causent des effets nocifs pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation, les substances du groupe des phénylpropanoïdes et des aldéhydes présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que les 12 substances du groupe des phénylpropanoïdes et des aldéhydes ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Aux fins de l’évaluation des risques pour la santé humaine, 9 des 12 substances de ce groupe ont été divisées en deux sous‑groupes, en raison de similarités sur le plan de la structure chimique, des propriétés et/ou de la toxicité, et les 3 substances restantes ont été examinées séparément. L’exposition à ces substances dans l’environnement ne devrait pas avoir de répercussions sur la santé humaine, en raison des faibles quantités déclarées lors d’une enquête menée en vertu de l’article 71 de la LCPE ou des expositions estimatives provenant de la surveillance et de la modélisation environnementales. Le cas échéant, on a caractérisé l’exposition pour l’utilisation de produits cosmétiques et de médicaments qui comprennent les PSN, et pour l’utilisation possible comme aromatisants alimentaires, produits de nettoyage, assainisseurs d’air et produits faits soi-même contenant des phénylpropanoïdes et des aldéhydes, cette exposition devant se produire principalement par voie cutanée et par inhalation.
Pour les essences de feuille de laurier, la caractérisation des risques a été basée sur le méthyleugénol, un composant des essences de feuille de laurier. L’effet critique sur la santé était la cancérogénicité génotoxique chez les animaux de laboratoire. Le méthyleugénol est un ingrédient à usage restreint inscrit sur la Liste critique des ingrédients de cosmétiques. Selon cette Liste, le méthyleugénol est permis seulement lorsqu’il est présent de façon naturelle dans des extraits végétaux, selon les concentrations maximales autorisées dans le produit final énumérées pour différents types de produits. Aux fins de la présente évaluation, on a présumé que ces restrictions étaient respectées et que les essences de feuille de laurier étaient les seules à contenir du méthyleugénol. Les marges d’exposition (ME) des essences de feuille de laurier dans des aliments, des cosmétiques ainsi que des aérosols inhalables ou des bâtonnets d’inhalation (PSN) sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et sur les effets sur la santé utilisées pour caractériser le risque. La comparaison entre la concentration entraînant un effet critique sur la santé et la concentration estimative d’exposition aux essences de feuille de laurier découlant de leur utilisation pour la fabrication d’huiles de bain faites soi-même est jugée suffisante pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque. Les ME des essences de feuille de laurier résultant de leur utilisation dans des produits faits soi-même, comme ceux utilisés dans les diffuseurs aromatiques et les hydratants corporels, ainsi que l’effet critique sur la santé, pourraient être insuffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
Pour ce qui est des essences d’estragon, la caractérisation des risques a été basée sur l’un de ses principaux composants, le méthyleugénol, et sur deux composés similaires sur le plan structural, l’estragol et l’élémicine, dont on a supposé, aux fins de la présente évaluation, qu’ils avaient le même pouvoir cancérogène que le méthyleugénol. L’effet critique sur la santé était la cancérogénicité génotoxique chez les animaux de laboratoire. Les ME des essences d’estragon dans les aliments (en raison de leur utilisation potentielle comme aromatisant), les capsules pour la digestion (PSN), les nettoyants pour le visage et les savons sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et sur les effets sur la santé utilisées pour caractériser le risque. Toutefois, les ME comprises entre les concentrations entraînant un effet critique et celle de l’exposition journalière estimative aux hydratants corporels, aux parfums corporels et aux hydratants pour le visage pourraient être insuffisantes pour tenir compte des incertitudes dans les données sur l’exposition et sur les effets sur la santé utilisées pour caractériser le risque. En outre, pour ce qui est de l’exposition aux essences d’estragon utilisées dans des produits faits soi-même comme pour les diffuseurs aromatiques, les huiles de massage, les huiles de bain ou les hydratants corporels, les ME pourraient être insuffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
En ce qui concerne les substances du sous-groupe 1 des phénylpropanoïdes (essences de jasmin, parfums et essences de jasmin), les données sur le danger ont été basées sur des extraits de jasmin. L’effet critique sur la santé était la toxicité pour la reproduction chez les animaux de laboratoire de sexe féminin. Une comparaison des concentrations entraînant des effets critiques sur la santé avec les concentrations estimatives d’exposition aux substances du sous-groupe 1 des phénylpropanoïdes de différents aliments (d’après leur utilisation potentielle comme aromatisant), après‑shampooings, nettoyants corporels, traitement topique en crème (PSN), écran solaire en poudre pour le visage (PSN), en applicateur à bille pour la détente (PSN), rouges à lèvres, produits coiffants, antisudorifiques/déodorants, colorants capillaires temporaires et écrans solaires (pour les enfants de 2 ans et plus) (PSN) ont donné des ME jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque. En outre, les ME des essences de jasmin pour la fabrication d’huiles de bain faites soi-même sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque. Les ME établies pour l’utilisation des essences de jasmin dans un nettoyant tout usage en aérosol, un nettoyant tout usage pour les planchers, un assouplisseur de tissus pour la lessive en aérosol ou un détergent à lessive liquide sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque. Toutefois, les ME comprises entre les concentrations entraînant un effet critique et celles de l’exposition journalière estimée à des hydratants corporels, des parfums corporels, des produits hydratants pour le visage ou le traitement de l’acné (PSN), des écrans solaires (enfants de 6 à 12 mois) (PSN) ou des nettoyants antiseptiques pour la peau (PSN) pourraient être insuffisantes pour tenir compte des incertitudes dans les données sur l’exposition et sur les effets sur la santé utilisées pour caractériser le risque. En outre, les ME établies d’après l’utilisation des essences de jasmin dans des produits faits soi-même tels que ceux utilisés dans les diffuseurs aromatiques, les huiles de massage, les hydratants corporels ou les brumisateurs faciaux pourraient être insuffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
Les données sur le danger associé au 2,4-hexadiénal, l’analogue du 2,6-nonadiénal, l’un des principaux composants des essences de violette, ont été utilisées pour l’évaluation des essences de violette par l’extrapolation. Pour caractériser le risque, on s’est fondé sur les effets critiques sur la santé observés chez des animaux de laboratoire, à savoir une hyperplasie épithéliale légère à modérée du secteur gastrique antérieur. Les ME des essences de violette dans les aliments (car elles peuvent être utilisées comme aromatisants), les hydratants pour les yeux, les après-shampooings, les nettoyants pour le visage, les hydratants corporels, les huiles de massage (personnes de 9 ans et plus), les rouges à lèvres et les parfums corporels, ainsi que dans les produits faits soi-même comme les huiles de bain ou les hydratants corporels, ont été jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque. Toutefois, les ME établies d’après l’utilisation des essences de violette dans des huiles de massage (enfants de 8 ans et moins) et dans des produits faits soi-même, comme ceux utilisés dans les diffuseurs aromatiques et les brumisateurs faciaux, pourraient être insuffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
En ce qui concerne les substances du sous-groupe 2 des aldéhydes (lilial, verdantiol, myrac-aldéhyde, myrmac-aldéhyde, myrmac-carboxaldéhyde, cétonal, vernaldéhyde), les données sur les dangers du lilial, un analogue, ont été utilisées pour l’extrapolation, pour évaluer le danger associé à toutes les autres substances du sous‑groupe des aldéhydes. Les effets critiques sur la santé de la toxicité pour le développement, chez les animaux de laboratoire, ont servi à caractériser le risque. Les ME comprises entre les concentrations entraînant un effet critique et celles, estimées, de l’exposition au lilial provenant des milieux environnementaux, des nettoyants corporels, des après-shampooings (à rincer), des maquillages pour le visage, des vernis à ongles, des dissolvants pour vernis à ongles, des produits dépilatoires, des antisudorifiques et des déodorants en atomiseur, des produits pour le bain, des produits de traitement de l’acné (PSN), des nettoyants antiseptiques pour la peau (PSN), des colorants capillaires temporaires ou des produits bronzants sans soleil pour le visage sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque. En outre, les ME comprises entre les concentrations entraînant un effet critique et celles, estimatives, de l’exposition au lilial présent dans un désodorisant pour tapis, sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque. Cependant, les ME comprises entre les concentrations entraînant un effet critique et l’exposition journalière estimée au lilial présent dans des cosmétiques, un assainisseur d’air en gel solide ou un assainisseur d’air, sous forme liquide, à brancher (enfants de 1 an) pourraient être insuffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
En ce qui concerne le myrac-aldéhyde, le myrmac-aldéhyde, le myrmac‑carboxaldéhyde, le cétonal et le vernaldéhyde, les ME comprises entre les concentrations entraînant un effet critique et celles de l’exposition journalière estimée à des cosmétiques, à des assainisseurs d’air et à des produits de nettoyage sont jugées suffisantes pour tenir compte des incertitudes.
Comme aucune source d’exposition de la population générale au verdantiol n’a été relevée, une approche qualitative a été appliquée pour caractériser les risques pour la santé humaine associés à cette substance, qui ont été jugés faibles.
L’évaluation des effets de chaque substance sur la santé humaine prenait en compte les groupes de personnes de la population canadienne qui, en raison d’une plus grande sensibilité ou d’une exposition plus importante, pourraient être plus vulnérables et subir des effets nocifs pour leur santé. Certains sous-groupes de la population, comme les nourrissons, les enfants ainsi que les personnes en âge de procréer, sont régulièrement pris en compte tout au long du processus d’évaluation. Par exemple, les expositions en fonction de l’âge sont régulièrement estimées, et des études pour le développement et la reproduction sont examinées afin de déterminer les effets nocifs pour la santé, le cas échéant. Ces sous-groupes de la population pouvant être plus exposés ou plus sensibles ont été pris en compte dans les conclusions de l’évaluation des risques.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation, il est proposé de conclure que les essences de feuille de laurier, les essences d’estragon, les essences de jasmin, les parfums et essences de jasmin, les essences de violette et le lilial satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines et que le verdantiol, le myrac-aldéhyde, le myrmac‑aldéhyde, le myrmac-carboxaldéhyde, le cétonal et le vernaldéhyde ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est proposé de conclure que les essences de feuille de laurier, les essences d’estragon, les essences de jasmin, les parfums et essences de jasmin, les essences de violette et le lilial satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE, et que le verdantiol, le myrac-aldéhyde, le myrmac-aldéhyde, le myrmac-carboxaldéhyde, le cétonal et le vernaldéhyde ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que le lilial répond aux critères de persistance, mais pas à ceux de bioaccumulation, énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu de l'article 68 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] (Canada, 1999), les ministres de l’Environnement et de la Santé ont procédé à une évaluation de 12 des 76 substances désignées collectivement dans le Plan de gestion des produits chimiques (PGPC) par « Groupe des terpènes et des terpénoïdes », afin de déterminer si ces 12 substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Ces 12 substances ont été jugées d’intérêt prioritaire aux fins de l’évaluation, car elles répondent aux critères de catégorisation ou ont été jugées d’intérêt prioritaire selon d’autres mécanismes (ECCC, SC [modifié en 2017]).
Parmi les autres substances du groupe des terpènes et des terpénoïdes, 33 ont été évaluées sur le plan des risques pour l’environnement et la santé humaine, et les décisions prises concernant ces substances sont présentées dans des rapports distinctsNote de bas de page 2. La substance de numéro 91-51-0 au registre du Chemical Abstracts Service (no CAS) a été jugée d’intérêt prioritaire aux fins de l’évaluation, car elle répond aux critères de catégorisation. Elle est incluse dans la présente évaluation parce que ses propriétés chimiques sont semblables à celles d’autres substances jugées d’intérêt prioritaire et visées par le présent document. Les décisions concernant les autres substances seront communiquées dans des rapports d’évaluation distincts.
Les 12 substances examinées dans la présente évaluation sont nommées ci‑après « Groupe des phénylpropanoïdes et des aldéhydes ». Certaines substances sont évaluées dans des sous-groupes en raison de leurs similarités sur le plan de la structure chimique, des propriétés et/ou de la toxicité. Étant donné que ces substances pourraient avoir des utilisations et des applications semblables, nous avons évalué les risques pour la santé humaine en posant des hypothèses d’exposition similaires pour l’ensemble du groupe.
Les risques pour l’environnement dus aux substances du groupe des phénylpropanoïdes et des aldéhydes ont été caractérisés selon l’approche de la Classification du risque écologique (CRE) des substances organiques (ECCC, 2016a). La CRE décrit les dangers d’une substance à l’aide de paramètres clés, dont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne établis à partir du réseau trophique, la biodisponibilité, ainsi que l’activité chimique et biologique, et elle tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres d’après des facteurs comme les taux d’émission potentiels, la persistance globale et le potentiel de transport à grande distance dans l’atmosphère. On a combiné les divers éléments de preuve pour déterminer quelles substances nécessitent une évaluation poussée de leur potentiel de causer des effets nocifs sur l’environnement, et lesquelles présentent une faible probabilité de causer des effets nocifs sur l’environnement.
Certaines substances du groupe des phénylpropanoïdes et des aldéhydes ou les analogues utilisés en lecture croisée dans la présente évaluation ont été examinés par l’Environnemental Protection Agency des États‑Unis (US EPA), l’Australian National Industrial Chemicals Notification and Assessment Scheme (NICNAS), l’Agence européenne des produits chimiques (ECHA), l’Autorité européenne de sécurité des aliments (EFSA), le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA), l’European Scientific Committee on Consumer Safety (SCCS) ou l’Organisation mondiale de la santé (OMS). Les examens réalisés par ces autorités ont été utilisés dans le cadre de la présente évaluation pour étayer la caractérisation des effets sur la santé.
Le sabinène et le phytol, qui sont les principaux composants des essences d’estragon et des essences de jasmin, respectivement, sont des ingrédients pouvant être présents dans les produits de vapotage (US EPA, 2019), et représenter une source supplémentaire d’exposition aux essences d’estragon et aux essences de jasmin. Les produits de vapotage (comme les cigarettes électroniques et les dispositifs de vapotage contenant du cannabis) sont visés par des cadres législatifs distincts (SC [modifié en 2020]).
La présente ébauche d’évaluation tient compte des renseignements sur les propriétés chimiques des substances, leur devenir dans l’environnement, les dangers qu’elles peuvent présenter, leurs utilisations et leur potentiel d’exposition, dont des renseignements supplémentaires présentés par les intervenants. Nous avons relevé des données pertinentes jusqu’en septembre 2020. Les données empiriques obtenues d’études clés ainsi que quelques résultats provenant de modélisations ont servi à formuler les conclusions proposées.
La présente ébauche d’évaluation a été préparée par le personnel du Programme conjoint d’évaluation des risques en vertu de la LCPE de Santé Canada (SC) et d’Environnement et Changement climatique Canada (ECCC) et prend en compte les données provenant d’autres programmes de ces ministères. Le volet de l’évaluation concernant la santé humaine a fait l’objet d’un examen par des pairs ou d’une consultation externes. Les commentaires sur les parties techniques du volet Santé humaine ont été formulés par Jennifer Flippin, Theresa Lopez et Joan Garey, toutes affiliées à Tetra Tech. L’évaluation des risques pour l’environnement repose sur le document de la CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe par des pairs et d’une consultation publique de 60 jours. Bien que les commentaires externes aient été pris en considération, le contenu final et les conclusions de la présente ébauche d’évaluation demeurent la responsabilité de SC et d’ECCC.
Pour la détermination de la conformité des substances aux critères énoncés à l’article 64 de la LCPE, les évaluations s’appuient sur des renseignements scientifiques essentiels, dont des informations, si elles sont disponibles, sur les sous-populations susceptibles d’être plus sensibles ou plus exposées, les environnements vulnérables et les effets cumulatifsNote de bas de page 3, et en utilisent une approche fondée sur le poids des preuves et sur le principe de précautionNote de bas de page 4. Dans le présent document, nous exposons ces renseignements et éléments de preuve essentiels sur lesquels sont fondées les conclusions proposées.
2. Identité des substances
Les tableaux 2‑1 et 2‑2 présentent, respectivement, les nos CAS et les noms figurant sur la Liste intérieure (LI) des substances distinctes et des substances représentatives des UVCB (substances de composition inconnue ou variable, produits de réaction complexe ou matières biologiques) du groupe des phénylpropanoïdes et des aldéhydes qui ont été utilisées aux fins de l’évaluation des effets sur la santé humaine. Dans la présente évaluation, les substances ont été divisées en deux sous‑groupes, selon leur structure chimique, leurs propriétés et/ou leur toxicité, et en trois substances distinctes.
Les terpènes sont des hydrocarbures simples consistant en unités isopréniques répétitives de cinq atomes de carbone (figure 2-1).
Les terpénoïdes constituent une classe modifiée de terpènes avec différents groupes fonctionnels et des groupes méthyles oxydés en diverses positions, déplacés ou éliminés. Les terpènes et les terpénoïdes sont classés en fonction du nombre d’unités d’isoprènes qu’ils contiennent (Caputi et Aprea, 2011; Perveen, 2018). Les monoterpènes contiennent deux unités d’isoprènes. Les préfixes di-, tri- et tétra- désignent respectivement deux, trois et quatre unités de monoterpènes. De plus, les sesquiterpènes et les sesterpènes contiennent respectivement trois et cinq unités d’isoprènes. Les phénylpropanoïdes sont caractérisés par une chaîne de trois atomes de carbone liés à un noyau benzénique. Les aldéhydes contiennent le groupe fonctionnel –CHO et sont considérés comme des alcools primaires partiellement oxydés (Tisserand et Young, 2014).

Description longue
La figure 2-1 présente la formule développée de l’unité moléculaire de l’isoprène (2-méthyl-1,3-butadiène) à gauche (en noir) et la formule linéaire (squelette) à droite (en bleu). Les deux représentations montrent une double liaison entre les deux premiers carbones (C1 et C2) et une seconde double liaison entre les deux derniers carbones (C3 et C4).
Ces substances sont les composants des huiles essentielles que l’on trouve dans de nombreuses plantes. Les huiles essentielles sont des mélanges de composés organiques volatils provenant d’une seule source botanique et contribuant à la saveur et au parfum d’une plante. Ces huiles essentielles d’origine végétale ont de nombreux composants qui peuvent être extraits de différentes parties de la plante (par exemple, feuilles, graines, tiges, fleurs, racines, fruits, bois, écorces, herbe, gomme, fleurs d’arbre, bulbes et boutons de fleur) (Tisserand et Young, 2014). De plus, la concentration de ces principaux composants peut varier en fonction de différents facteurs, dont l’origine de la plante, l’espèce, la température, le sol et le lieu géographique. Les huiles essentielles extraites de plantes du même genre et de la même espèce peuvent être chimiquement différentes même si leur origine est la même.
| Sous-groupea | No CAS | Nom sur la LI (nom commun) | Structure chimique ou nom chimique représentatif, structure et plage de concentrations dans les huiles essentielles, et formule moléculaire |
|---|---|---|---|
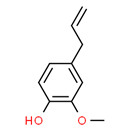
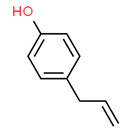
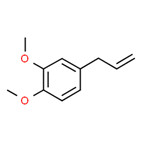
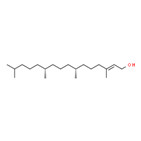
| Substance distincte | 8006-78-8 | Essences de feuille de laurierb |
|
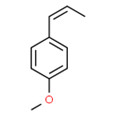
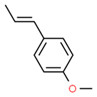
| Substance distincte | 8016-88-4 | Essences d’estragonb |
|
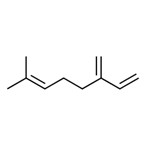
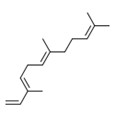
| 1 |
8022-96-6 8024-43-9 |
Essences de jasminb Parfums et essences de jasminb |
|
« Trace » signifie une concentration inférieure à 1 %.
a Aux fins de l’évaluation, le groupe des phénylpropanoïdes a été divisé en un sous-groupe et deux substances distinctes. Le sous-groupe 1 des phénylpropanoïdes comprend les essences de jasmin et les parfums et essences de jasmin en raison de leur composition similaire.
b Cette substance est un UVCB. Ces UVCB sont des substances de sources naturelles ou le résultat de réactions complexes et ne peuvent être caractérisées par leurs constituants chimiques en raison de leur composition trop complexe ou variable. Les UVCB ne sont pas des mélanges intentionnels de substances distinctes et sont considérées comme des substances simples.
c Plage de concentrations du ou des composants principaux des huiles essentielles de Pimenta racemosa, d’après Kim et al. (2008) et Bowles (2003).
d Plage de concentrations du ou des composants principaux des huiles essentielles de Pimenta racemosa, d’après McHale et al. (1977), Tucker et al. (1991), Jirovetz et al. (2007a) et Kim et al. (2008).
e Plage de concentrations du ou des composants principaux des huiles essentielles de Pimenta racemosa, d’après McHale et al. (1977), Tucker et al. (1991), Jirovetz et al. (2007a) et Kim et al. (2008).
f Plage de concentrations du ou des composants principaux des huiles essentielles de Pimenta racemosa, d’après Tucker et al. (1991), Abaul et al. (1995), Kim et al. (2008) et Jirovetz et al. (2007a).
g Plage de concentrations du ou des composants principaux des huiles essentielles d’Artemisia dracunculus, d’après Kordali et al. (2005), Lopes-Lutz et al. (2008) et Obolskiy et al. (2011).
h Plage de concentrations du ou des composants principaux des huiles essentielles d’Artemisia dracunculus, d’après Kordali et al. (2005) et Obolskiy et al. (2011).
i Plage de concentrations du ou des composants principaux des huiles essentielles d’Artemisia dracunculus, d’après Sayyah et al. (2004) et Obolskiy et al. (2011).
j Plage de concentrations du ou des composants principaux des huiles essentielles d’Artemisia dracunculus, d’après Obolskiy et al. (2011).
k Plage de concentrations du ou des composants principaux des huiles essentielles d’Artemisia dracunculus, d’après Ayoughi et al. (2011) et Obolskiy et al. (2011).
l Plage de concentrations du ou des composants principaux des huiles essentielles de Jasminium grandiflorum, d’après Jirovetz et al. (2007b), Bera et al. (2015) et Wei et al. (2015).
m Plage de concentrations du ou des composants principaux des huiles essentielles de Jasminium grandiflorum, d’après Braun et al. (2009), Prakash et al. (2012), Bera et al. (2015) et Wei et al. (2015).
n Plage de concentrations du ou des composants principaux des huiles essentielles de Jasminium grandiflorum, d’après Prakash et al. (2012) et Bera et al. (2015).
o Plage de concentrations du ou des composants principaux des huiles essentielles de Jasminium grandiflorum, d’après Jirovetz et al. (2007b) et Wei et al. (2015).
p Plage de concentrations du ou des composants principaux des huiles essentielles de Jasminium grandiflorum, d’après Tisserand et Young (2014) et Wei et al. (2015).
q Plage de concentrations du ou des composants principaux des huiles essentielles de Jasminium grandiflorum, d’après Bera et al. (2015) et Wei et al. (2015).
r Plage de concentrations du ou des composants principaux des huiles essentielles de Jasminium grandiflorum, d’après Prakash et al. (2012) et Bera et al. (2015).
| Sous-groupea | No CAS | Nom sur la LI (nom commun) | Structure chimique ou nom chimique représentatif, structure et plage de concentrations dans les huiles essentielles, et formule moléculaire |
|---|---|---|---|
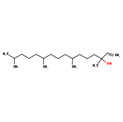
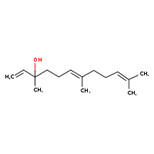
| Substance distincte | 8024-08-6 | Essences de violetteb |
|
| 2 | 80-54-6 | 2-(4-tert-Butylbenzyl)-propionaldéhyde (Lilial) |
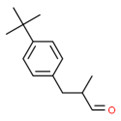 C14H20O |
| 2 | 91-51-0 | 2-{[3-(4-t-butylphényl)-2 méthylpropy-lidène]amino}-benzoate de méthyle (Verdantiol) |
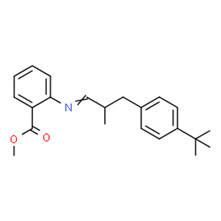 C22H27 |
| 2 | 37677-14-8 | 4-(4-Méthyl-3 pentényl)cyclo-hex-3-ène-1 carbaldéhyde (myrac-aldéhyde) |
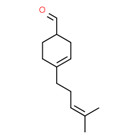 C13H20O |
| 2 | 52474-60-9 | 1-Méthyl-3-(4 méthyl-3 pentényl)cyclo-hex-3-ène-1 carbaldéhyde (myrmac-aldéhyde) |
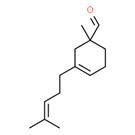 C14H22O |
| 2 | 52475-86-2 | 1-Méthyl-4 (4 méthyl-3 pentényl)-cyclohex-3-ène-1 carbaldéhyde (myrmac-carboxaldéhyde) |
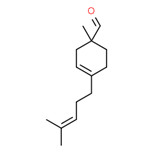 C14H22O |
| 2 | 65405-84-7 | Cyclohexène-butanal, α,2,2,6 tétraméthyl-(cétonal) |
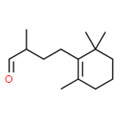 C14H24O |
| 2 | 66327-54-6 | 1-Méthyl-4 (4 méthylpentyl)cyclohex-3-ène-1 carbaldéhyde- (vernaldéhyde) |
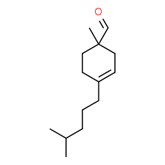 C14H24O |
a Aux fins de l’évaluation, le groupe des aldéhydes a été divisé en un sous-groupe et une substance distincte. Le sous-groupe 2 des aldéhydes comprend des données sur le danger associées au Lilial, qui ont été utilisées pour la caractérisation des risques. Le Lilial est une substance distincte du sous-groupe 2 des aldéhydes et a été utilisé comme analogue pour la lecture croisée du Verdantiol, du myrac-aldéhyde, du myrmac-aldéhyde, du myrmac-carboxaldéhyde, du cétonal et du vernaldéhyde. Le Verdantiol semble être une impureté et un métabolite possible du Lilial, car le Verdantiol peut être hydrolysé en Lilial.
b Cette substance est un UVCB.
c Plage de concentrations du ou des composants principaux des huiles essentielles de Viola odorata, d’après Cu et al. (1992) et Saint-Lary et al. (2014).
2.1 Sélection d’analogues et utilisation de modèles QSAR
Une méthode de lecture croisée faisant appel à des données d’analogues ou de composants des substances ciblées, le cas échéant, a été utilisée pour l’évaluation des effets sur la santé humaine. Les analogues ont été sélectionnés parmi une longue liste de substances similaires sur le plan de la structure ou des caractéristiques (par exemple, les propriétés physico‑chimiques et la toxicocinétique). Toutefois, comme il y avait peu de données sur la majorité des substances visées, le choix des analogues a été guidé par la présence de données empiriques pertinentes sur les effets sur la santé humaine.
Pour le choix des analogues, on s’est appuyé sur des évaluations réalisées à l’aide de la boîte à outils sur les relations quantitatives structure-activité (QSAR), version 4.3, de l’Organisation de coopération et de développement économiques (OCDE, 2019). Les données de lecture croisée sélectionnées pour étayer l’évaluation des effets des phénylpropanoïdes et des aldéhydes sur la santé humaine sont examinées plus en détail dans les sections correspondantes du présent document. Le tableau 2.3 présente des renseignements sur l’identité et la structure chimique des analogues utilisés pour l’évaluation des risques pour la santé humaine associés aux phénylpropanoïdes et aux aldéhydes (en l’occurrence, les essences de violette).
| Substance ou sous-groupe évalué | No CAS de l’analogue | Nom commun | Structure chimique, formule moléculaire et forme SMILES | Masse moléculaire (g/mol) |
|---|---|---|---|---|
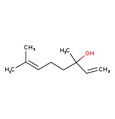
| Essences de violette | 142-83-6 | 2,4-Hexadiénal |
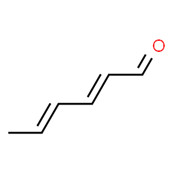 C6H8O |
96.13 |
3. Propriétés physiques et chimiques
Le tableau 3-1 présente un résumé des propriétés physiques et chimiques des substances du groupe des phénylpropanoïdes et des aldéhydes. Lorsque les données expérimentales d’une propriété étaient limitées ou inexistantes, des données provenant d’analogues ont été utilisées pour la lecture croisée ou la modélisation à l’aide de QSAR (OCDE, 2019) afin de générer des valeurs prédictives pour la substance. Les valeurs d’autres propriétés physiques et chimiques sont présentées dans le document d’ECCC de 2016 (b).
| Substance | Nom commun (no CAS) des constituants représentatifs | Masse moléculaire (g/mol)a | Hydro-solubilité (mg/L)a | Pression de vapeur (Pa)a | log Koea |
|---|---|---|---|---|---|
| Essences de feuille de laurier | Eugénol (97-53-0) | 164,21 | 2 460 | 1,26(M) | 2,27 |
| Essences de feuille de laurier | Chavicol (501-92-8) | 134,18 | 1 110(M) | 3,04(M) | 2,91(M) |
| Essences de feuille de laurier | bêta-myrcène (123-35-3) | 136,24 | 5,6 | 268 | 4,17 |
| Essences de feuille de laurier | Méthyleugénol (93-15-2) | 178,23 | 500 | 4,46 | 3,03(M) |
| Essences d’estragon | Méthyleugénol (93-15-2) | 178,23 | 500 | 4,46 | 3,03(M) |
| Essences d’estragon | Estragol (140-67-0) | 148,21 | 178 | 22 (M) | 3,47(M) |
| Essences d’estragon | Sabinène (3387-41-5) | 136,24 | 2,49(M) | 981(M) | 4,69(M) |
| Essences d’estragon | Terpinolène (586-62-9) | 136,24 | 9,5 | 99 | 4,47 |
| Essences d’estragon | Élémicine (487-11-6) | 208,26 | 133,2(M) | 0,28(M) | 2,90(M) |
| Essences d’estragon | cis-anéthol (25679-28-1) | 148,21 | 111 | 8,46(M) | 3,39(M) |
| Essences d’estragon | trans-anéthol (4180-23-8) | 148,21 | 111 | 8,46(M) | 3,39(M) |
|
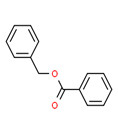
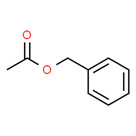
Essences de jasmin Parfums et essences de jasmin |
Acétate de benzyle (140-11-4) | 150,18 | 3 100(E) | 23,6(E) | 1,96(E) |
|
Essences de jasmin Parfums et essences de jasmin |
Benzoate de benzyle (120-51-4) | 212,25 | 15,39(M) | 0,03(E) | 3,97(E) |
|
Essences de jasmin Parfums et essences de jasmin |
alpha-farnesène (502-61-4) | 204,36 | 1,05 x 10-2 (M) | 3,33(M) | 7,10(M) |
|
Essences de jasmin Parfums et essences de jasmin |
Phytol (150-86-7) | 296,54 | 3,27 x 10-3(M) | 4,30 x 10-4 (M) | 8,32(M) |
|
Essences de jasmin Parfums et essences de jasmin |
Isophytol (505-32-8) | 296,54 | 7,53 x 10-3(M) | 1,88 x 10-3 (M) | 8,23(M) |
|
Essences de jasmin Parfums et essences de jasmin |
Nérolidol (7212-44-4) | 222,37 | 7,67(M) | 0,08(M) | 5,68(M) |
|
Essences de jasmin Parfums et essences de jasmin |
Linalol (78-70-6) | 154,25 | 1 590(E) | 21(E) | 2,9(E) |
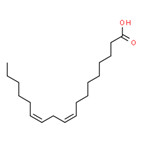
| Essences de violette | Acide linoléïque (2197-37-7) | 280,45 | 3,77 x 10-2(M) | 1,16 x 10-4 | 7,05 |
| Essences de violette | 2,6-Nonadiénal (557-48-2) | 138,21 | 318,8(M) | 31,1(M) | 2,84(M) |
| Essences de violette | Acide palmitique (57-10-3) | 256,43 | 0,04 | 5,07 x 10-5 | 7,17 |
| Essences de violette | 1-Octadécène (112-88-9) | 252,48 | 1,26 x 10-4(M) | 8,99 x 10-3(M) | 9,04(M) |
| Lilial | N.D. | 204,31 | 7,86(M) | 0,477(M) | 4,36(M) |
| Verdantiol | N.D. | 337,46 | 0,028(M) | 4,0 x 10-5(M) | 6,35(M) |
| Myrac-aldéhyde | N.D. | 192,30 | 4,35(M) | 0,783(M) | 4,73(M) |
| Myrmac-aldéhyde | N.D. | 206,33 | 1,51(M) | 0,349(M) | 5,19(M) |
| Myrmac-carboxaldéhyde | N.D. | 206,33 | 1,51(M) | 0,349(M) | 5,19(M) |
| Cétonal | N.D. | 208,35 | 1,44(M) | 0,834(M) | 5,20(M) |
| Vernaldéhyde | N.D. | 208,35 | 1,25(M) | 0,605(M) | 5,27(M) |
Abréviations : N.D. = non disponible; Koe = coefficient de partage octanol-eau; (M) = valeur modélisée; (E) = valeur expérimentale.
a US EPA (2012a).
4. Sources et utilisations
Toutes les substances du groupe des phénylpropanoïdes et des aldéhydes ont été visées par une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2012). À l’exception du Lilial, aucune des substances de ce groupe n’a été fabriquée ou importée au Canada en quantités supérieures au seuil de 100 kg au cours de l’année de déclaration 2011 (Environnement Canada, 2013).
En ce qui concerne le Lilial, la quantité fabriquée au Canada et déclarée en 2008 était de 910 kg, et la quantité importée au Canada et déclarée au cours de la même année civile était de 24 460 kg (Environnement Canada, 2013). Le tableau 4-1 présente un résumé des renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE.
| Substance | Quantité fabriquée totale (kg)a | Quantité importée totale (kg)a | Année de déclaration |
|---|---|---|---|
| Essences de feuille de laurier | A.D. | A.D. | 2011 |
| Essences d’estragon | A.D. | A.D. | 2011 |
| Essences de jasmin | A.D. | A.D. | 2011 |
| Parfums et essences de jasmin | A.D. | A.D. | 2011 |
| Essences de violette | A.D. | A.D. | 2011 |
| Lilial | 910 | 24 460 | 2008 |
| Verdantiol | A.D. | A.D. | 2011 |
| Myrac-aldéhyde | A.D. | A.D. | 2011 |
| Myrmac-aldéhyde | A.D. | A.D. | 2011 |
| Myrmac-carboxaldéhyde | A.D. | A.D. | 2011 |
| Cétonal | A.D. | A.D. | S.O. |
| Vernaldéhyde | A.D. | A.D. | 2011 |
Abréviations : A.D. = aucune déclaration de quantité supérieure au seuil de 100 kg; S.O. = sans objet, et cette substance n’était pas visée par les enquêtes menées en vertu de l’article 71.
a Les valeurs reflètent les quantités déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2012). Voir les enquêtes pour connaître les inclusions ou les exclusions particulières (annexes 2 et 3).
Les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE indiquent que le Lilial est utilisé comme agent aromatisant dans des produits de nettoyage, des produits d’entretien du mobilier, des automobiles, des vêtements et des chaussures, des produits de soins personnels, des assainisseurs d’air, des produits de soins pour animaux de compagnie, des lubrifiants, des graisses, ainsi que dans les détergents pour la lessive et la vaisselle (Environnement Canada 2013). Les renseignements fournis en réponse à l’enquête menée en vertu de l’article 71 de la LCPE indiquent également que les essences de violette, le myrac‑aldéhyde et le vernaldéhyde ont été employés dans des produits de soins personnels importésNote de bas de page 5 (Environnement Canada, 2013).
En outre, en ce qui concerne le myrac-aldéhyde, le myrmac-aldéhyde, le myrmac-carboxaldéhyde, le cétonal et le vernaldéhyde, une entreprise a déclaré que ces substances sont employées en faibles concentrations comme parfums dans les cosmétiques, les assainisseurs d’air et les produits de nettoyage.
Le tableau 4-2 présente d’autres utilisations du groupe des phénylpropanoïdes et des aldéhydes.
| Substance | Aromatisantsa | Additifs indirectsFootnote 5,a | Base de données d’ingrédients de produits de santé naturels (BDIPSN) | Base de données sur les produits de santé naturels homologués (BDPSNH)b | Cosmétiquesc | Formulants dans les produits anti-parasitairesd |
|---|---|---|---|---|---|---|
| Essences de feuille de laurier | O | N | O | O (IM, INM) | O | O |
| Essences d’estragon | O | N | O | O (IM, INM) | O | O |
| Essences de jasmin | O | N | O | O (IM, INM) | O | N |
| Parfums et essences de jasmin | N | N | O | O (IM, INM) | N | N |
| Essences de violette | O | N | O | O (IM, INM) | O | N |
| Lilial | N | O (Composant de savons pour les mains; pas de contact direct avec les aliments) | O | O (INM) | O | O |
| Verdantiol | N | N | N | N | N | N |
| Myrac-aldéhyde | N | N | N | N | N | O |
| Myrmac-aldéhyde | N | N | N | N | O | O |
| Myrmac-carboxaldéhyde | N | N | N | N | N | N |
| Cétonal | N | N | N | N | N | N |
| Vernaldéhyde | N | N | N | N | N | O |
Abréviations : O = oui, cette utilisation a été déclarée pour cette substance; N = non, cette utilisation n’a pas été déclarée pour cette substance; IM = ingrédient médicinal; INM = ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada, au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2015, 2017 et 2020, sans référence.
b Dans la Base de données sur les produits de santé naturels homologués, cette substance est présente comme ingrédient médicinal ou non médicinal dans des produits de santé naturels (PSN) au Canada. Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 2021; sans référence.
c Substance déclarée présente dans des cosmétiques, d’après des déclarations soumises à Santé Canada conformément au Règlement sur les cosmétiques. Communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2017 et 2020, sans référence.
d Formulant dans des produits antiparasitaires homologués au Canada. Communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2015 et 2020, sans référence.
Produits faits soi-même
Certains terpènes et terpénoïdes à propriétés aromatiques du groupe des phénylpropanoïdes et des aldéhydes sont commercialisés au Canada sous forme d’« huiles essentielles » en concentrations pouvant atteindre 100 %. Les consommateurs peuvent donc acheter ces substances non diluées et les utiliser pour fabriquer des produits faits soi-même. Les produits faits soi-même pouvant entraîner une forte exposition des consommateurs comprennent les diffuseurs aromatiques (utilisés en aromathérapie), les huiles de massage, les huiles pour le bain, les hydratants corporels et les brumisateurs faciaux. Par conséquent, la présente évaluation englobe également les utilisations de substances non diluées dans les produits faits soi-même. Les paramètres permettant d’estimer l’exposition par voie cutanée et par inhalation aux produits faits soi-même sont présentés à l’annexe B.
Essences de feuille de laurier
Les essences de feuille de laurier sont des UVCB extraits d’une distillation à la vapeur de Pimenta racemosa, un arbre qui appartient à la famille des myrtacées (Myrtaceaes). Cet arbre est également connu sous le nom de bois d’Inde. Bien qu’il soit originaire des Antilles, il est également cultivé dans de nombreuses régions chaudes du globe (Moharram et al., 2018). Autrement dit, tout extrait de Pimenta racemosa de la famille des myrtacées est considéré comme répondant à cette définition.
Les essences de feuille de laurier sont utilisées dans plusieurs produits disponibles aux consommateurs, notamment des hydratants, des après-shampooings, des produits pour le bain et des nettoyants corporels. D’après les déclarations présentées à Santé Canada conformément au Règlement sur les cosmétiques, les essences de feuille de laurierNote de bas de page 7 sont utilisées dans plus de 90 produits au Canada, la majorité d’entre eux (environ 94 %) ayant des concentrations inférieures ou égales à 3 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence). Il existe également des PSN qui contiennent des essences de feuille de laurier comme ingrédient médicinal ou non médicinal et qui sont utilisées comme ingrédients parfumants (BDPSNH [modifiée en 2021]; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2021; sans référence).
Au Canada, les essences de feuille de laurier sont également utilisées comme formulants dans des produits antiparasitaires (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
Les essences de feuille de laurier (essences de Bay de Saint-Thomas) sont généralement reconnues comme sûres (désignées par l’acronyme GRAS, de l’anglais Generally Recognized as Safe), et figurent dans le Titre 21 de la Partie 182 du Code of Federal Regulations (21CFR182.20) des États-Unis. Les essences de feuilles du bois d’Inde (Pimenta acris [Sw.] Kostel; P. racemosa) sont inscrites au numéro 2122 dans la Bibliothèque des ingrédients aromatiques de la Flavor and Extract Manufacturers Association (FEMA, 2020).
Selon l’International Fragrance Association (IFRA, 2017), les essences de feuille de laurier seraient également un ingrédient parfumant utilisé dans des biens de consommation.
Les essences de feuille de laurier sont utilisées partout dans le monde comme aromatisants dans une vaste gamme d’aliments (COE, 2000; Burdock, 2010). Elles n’ont pas d’état particulier sur le plan alimentaire en Europe. Cependant, elles figurent dans l’Inventaire des substances ajoutées aux aliments (Substances Added to Food Inventory) de la Food and Drug Administration des États-Unis (US FDA) comme aromatisant ou adjuvant (CE, 2008; US FDA, 2018). On ne dispose d’aucune donnée de référence concernant l’utilisation possible des essences de feuille de laurier comme aromatisants alimentaires au Canada. Toutefois, étant donné que la substance est connue comme aromatisants alimentaires à l’échelle mondiale, il est possible qu’elle soit présente comme aromatisant dans des aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
Essences d’estragon
Les essences d’estragon sont des UVCB extraits d’une distillation à la vapeur d’Artemisia dracunculus, un végétal appartenant à la famille des astéracées (Asteraceae). La plante est connue sous plusieurs noms, par exemple estragon français, herbe aux dragons et armoise âcre. Elle est cultivée dans de nombreux pays, dont l’Iran (Raeisi et al., 2012). Sans mention explicite, tout extrait d’Artemisia dracunculus de la famille des astéracées est considéré comme répondant à cette définition.
Les essences d’estragon sont utilisées dans certains produits disponibles aux consommateurs, tels que les hydratants, les parfums, les huiles de massage, les antisudorifiques et les déodorants. D’après les déclarations présentées à Santé Canada conformément au Règlement sur les cosmétiques, les essences d’estragon ou d’Artemisia dracunculus sont utilisées dans environ 30 produits, la majorité (environ 80 %) ayant des concentrations inférieures ou égales à 3 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence). Il existe également des PSN qui contiennent des essences d’estragon en tant qu’ingrédient médicinal ou non médicinal comme exhausteur de goût, ingrédient parfumant ou agent de conditionnement de la peau (BDPSNH, 2021; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2021; sans référence).
Au Canada, les essences d’estragon sont également utilisées comme formulant dans des produits antiparasitaires (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
L’estragol et l’estragon figurent sur la liste GRAS du Titre 21 de la Partie 182 du 21CFR182.20 des États-Unis. L’estragon (Artemesia dracunculus L.) est inscrit au numéro 3043 de la Bibliothèque des ingrédients aromatiques (Flavor Ingredient Library) de la FEMA (FEMA, 2020). Les essences d’estragon (Artemisia dracunculus L.) figurent au numéro 2412 (FEMA, 2020).
L’annexe III du Règlement no 1334/2008 (CE) présente les substances qui ne doivent pas être ajoutées aux aliments ainsi que les concentrations maximales de certaines substances en Union européenne (UE), qui sont naturellement présentes dans des aromatisants et des ingrédients d’aliments possédant des propriétés aromatisantes. En raison de l’utilisation d’aromatisants ou d’ingrédients d’aliments possédant des propriétés aromatisantes dans et sur ces aliments en UE, il ne faut pas dépasser les concentrations maximales. L’annexe III interdit l’ajout d’estragol dans les aliments, en tant que tel, et fixe les concentrations maximales d’estragol dans certains produits alimentaires combinésNote de bas de page 8, en raison de la présence de cette substance naturelle dans des arômes ou des ingrédients alimentaires possédant des propriétés aromatisantes, utilisés dans des produits alimentaires. Les essences d’estragon sont contiennent environ 0 % à 82 % d’estragol, et la quantité d’estragol dans des produits alimentaires découlant de l’ajout d’essences d’estragon ou d’autres préparations aromatisantes serait soumise aux concentrations maximales fixées par le Règlement no 1334/2008 (CE) de l’Union européenne.
Les essences d’estragon sont répertoriées par l’IFRA (2017) comme ingrédient parfumant utilisé dans des biens de consommation.
Les essences d’estragon sont utilisées partout dans le monde comme aromatisants dans une vaste gamme d’aliments (COE, 2000; Burdock, 2010). Les essences d’estragon n’ont pas d’état particulier sur le plan alimentaire en Europe. Cependant, elles figurent dans l’inventaire des substances ajoutées aux aliments comme aromatisant ou adjuvant (Substances Added to Food Inventory) de la FDA (CE, 2008; US FDA, 2018). On ne dispose d’aucune donnée de référence concernant l’utilisation possible des essences d’estragon comme aromatisants alimentaires au Canada. Toutefois, étant donné que cette substance est connue comme aromatisants alimentaires partout dans le monde, il est possible qu’elle soit présente comme aromatisant dans des aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
En outre, le sabinène, l’un des principaux composants des essences d’estragon, a été trouvée dans des produits de vapotage aux États-Unis (US EPA, 2019).
Sous-groupe 1 des phénylpropanoïdes (essences de jasmin, et parfums et essences de jasmin)
Le sous-groupe 1 des phénylpropanoïdes comprend deux UVCB : les essences de jasmin d’une part, et les parfums et essences de jasmin d’autre part. Les deux substances sont produites à partir de fleurs fraîches de plusieurs espèces de jasmin (Jasminum spp.) de la famille des oléacées (Oleaceae). Il existe plus de 2 000 espèces de jasmin connues. Les espèces les plus courantes sont Jasminum officinale, J. grandiflorum, J. floribundum, J. humile, J. odoratissimum, J. paniculatum et J. sambac. Originaires de l’Inde, les variétés de jasmin sont également bien connues dans les pays méditerranéens d’Europe, en Asie, en Afrique, aux îles Comores et en Chine. Les principaux fournisseurs de produits aromatiques tirés du jasmin sont l’Égypte, le Maroc, l’Algérie, l’Italie et la France (Jirovetz et al., 2007b). Sauf mention explicite, tout extrait de Jasminum spp. de la famille des oléacées est considéré comme répondant à cette définition.
Les essences de jasmin et les parfums et essences de jasmin portent deux nos CAS différents. Cependant, l’inventaire des substances chimiques établi en vertu de la Toxic Substances Control Act les définit toutes deux comme des « extraits et leurs dérivés physiquement modifiés de Jasminum officinale, Oleaceae » (ChemIDPlus, 2019). Elles partagent également des synonymes similaires, comme l’essence absolue de jasmin ou l’essence de jasmin (ChemIDPlus, 2019). L’IFRA a déterminé que les substances des deux nos CAS différents sont des substances identiques (IFRA, 2013). Par conséquent, dans le présent document, les essences de jasmin et les parfums et essences de jasmin sont évalués comme une seule et même substance. L’IFRA a également déterminé que la substance de no CAS 90045-94-6, appelée essences de Jasmin officinale var. grandiflorum, est identique aux essences de jasmin et aux parfums et essences de jasmin (IFRA 2013). Les deux substances seront désignées ci‑après sous le nom d’essences de jasmin.
Les essences de jasmin sont présentes dans plusieurs produits disponibles aux consommateurs, notamment les hydratants corporels, les parfums corporels, les huiles de massage, le maquillage et les nettoyants pour le visage. D’après les déclarations présentées à Santé Canada conformément au Règlement sur les cosmétiques, les essences de jasminNote de bas de page 9 sont utilisées dans environ 550 produits au Canada, la majorité (environ 78 %) ayant des concentrations inférieures ou égales à 1 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence). Il existe aussi des PSN qui contiennent des essences de jasmin comme ingrédient médicinal ou non médicinal jouant le rôle de parfumant ou d’agent de conditionnement de la peau (BDPSNH, 2021; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2021; sans référence).
Les essences de jasmin peuvent être présentes dans des produits de nettoyage, par exemple des nettoyants tout usage en liquide ou en gel dans des flacons à bec verseur, en vaporisateurs à pompe ou en aérosols à des concentrations pouvant atteindre 1 %, des détergents liquides ou en gel pour la vaisselle dans des flacons à bec verseur pour le lavage à la main ou dans un lave-vaisselle automatique à des concentrations pouvant atteindre 1 %, dans les assouplisseurs de tissus liquides offerts en flacons à bec verseur pour utilisation dans une machine à laver ou application directe sur le tissu en pulvérisateur ou en aérosol à des concentrations pouvant atteindre 5 % et des détergents à lessive et renforçateurs pour détergents liquides disponibles en flacons à bec verseur pour utilisation dans la machine à laver à des concentrations pouvant atteindre 5 % (ACI, 2020). Les essences de jasmin sont également présentes dans les brûleurs d’huile parfumée (MSDS, 2006).
Les huiles essentielles, les oléorésines (sans solvant) et les extraits naturels (y compris les distillats) de jasmin (Jasminum officinale L. et autres Jasminum spp.) sont considérés comme des substances GRAS dans le Titre 21 de la Partie 182 du 21CFR182.20 des États-Unis.
Les essences de jasmin (Jasminium grandiflorum L.) sont inscrites au numéro 2600 de la Bibliothèque des ingrédients aromatiques de la FEMA (FEMA, 2020).
L’IFRA (2017) a déterminé que les essences de jasmin sont un ingrédient parfumant utilisé dans des biens de consommation.
Les essences de jasmin sont utilisées partout dans le monde comme aromatisant dans une vaste gamme d’aliments (COE, 2000; Burdock, 2010). Les essences de jasmin n’ont pas d’état particulier sur le plan alimentaire en Europe. Cependant, elles figurent dans l’Inventaire de la FDA des substances ajoutées aux aliments comme aromatisant ou adjuvant (CE, 2008; US FDA, 2018). On ne dispose d’aucune donnée de référence concernant l’utilisation possible des essences de jasmin comme aromatisants alimentaires au Canada. Toutefois, étant donné que cette substance est utilisée comme aromatisant alimentaire à l’échelle mondiale, il est possible qu’elle soit présente comme aromatisant dans des aliments vendus au Canada. Aucune des données disponibles n’indique que les parfums et essences de jasmin ont des utilisations alimentaires directes ou indirectes au Canada ou à l’étranger (communication personnelle, courriel de la Direction des aliments de Santé Canada, au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
De plus, le phytol, l’un des principaux composants des essences de jasmin, a été trouvé dans des produits de vapotage aux États-Unis (US EPA, 2019).
Essences de violette
Les essences de violette sont des substances UVCB obtenues à partir de Viola odorata, une plante appartenant à la famille des violacées (Violaceae). Cette plante est originaire d’Asie, d’Afrique du Nord et d’Europe. Sauf mention expresse, tout extrait de Viola odorata est considéré comme répondant à cette définition.
Les essences de violette sont utilisées dans plusieurs produits disponibles aux consommateurs, tels que les hydratants corporels, les parfums, les nettoyants pour le visage, les produits coiffants et les rouges à lèvres. D’après les déclarations présentées à Santé Canada conformément au Règlement sur les cosmétiques, les essences de violetteNote de bas de page 10 sont utilisées dans plus de 400 produits, la majorité (90 %) étant en concentration inférieure ou égale à 1 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes, mars 2017; sans référence). Il existe également des PSN qui contiennent des essences de violette en tant qu’ingrédient médicinal ou non médicinal utilisé comme ingrédient parfumant (BDPSNH, 2021; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2021; sans référence).
Les huiles essentielles, les oléorésines (sans solvant) et les extraits naturels (y compris les distillats) des fleurs, des feuilles et de l’essence absolue de violette sont généralement reconnus comme sûrs (GRAS) dans le Titre 21 de la Partie 182 du 21CFR182.20 des États-Unis. L’essence absolue des feuilles de violette (Viola odorata L.) est inscrite au numéro 3110 de la Bibliothèque des ingrédients aromatiques de la FEMA (FEMA, 2020).
L’IFRA (2017) a déterminé que les essences de violette sont un ingrédient parfumant utilisé dans des biens de consommation.
Les essences de violette sont utilisées partout dans le monde comme agent aromatisant dans une vaste gamme d’aliments (Burdock, 2010; COE, 2000). Les essences de violette n’ont pas d’état particulier sur le plan alimentaire en Europe. Cependant, elles figurent dans l’Inventaire de la FDA des substances ajoutées aux aliments comme aromatisant ou adjuvant (CE, 2008; US FDA, 2018). On ne dispose d’aucune donnée de référence concernant l’utilisation possible des essences de violette comme aromatisants alimentaires au Canada. Toutefois, étant donné que cette substance est utilisée comme aromatisant alimentaire à l’échelle mondiale, il est possible qu’elle soit présente comme aromatisant dans des aliments vendus au Canada (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
Sous-groupe 2 des aldéhydes (Lilial, Verdantiol, myrac-aldéhyde, myrmac‑aldéhyde, myrmac-carboxaldéhyde, cétonal, vernaldéhyde)
Le sous-groupe 2 des aldéhydes compte sept substances distinctes, à savoir : Lilial, Verdantiol, myrac-aldéhyde, myrmac-aldéhyde, myrmac‑carboxaldéhyde, cétonal et vernaldéhyde.
Le Lilial est utilisé dans plusieurs produits disponibles aux consommateurs comme des hydratants corporels, des huiles de massage, des parfums, des après-shampooings, des colorants capillaires et des vernis à ongles. À la lumière des déclarations présentées à Santé Canada conformément au Règlement sur les cosmétiques, le Lilial est utilisé dans environ 6 500 produits, la majorité (90 %) ayant des concentrations inférieures ou égales à 0,3 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence). Il existe également des PSN qui contiennent du Lilial comme ingrédient non médicinal utilisé comme ingrédient parfumant, outre comme médicament sans ordonnance, comme les écrans solaires et les produits de maquillage avec protection solaire (BDPSNH, 2021; communication personnelle, courriel de la Direction des médicaments pharmaceutiques de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2021; sans référence).
Au Canada, selon les déclarations, le Lilial, le myrac-aldéhyde, le myrmac‑aldéhyde et le vernaldéhyde ont également été utilisés comme formulants dans des produits antiparasitaires (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
En outre, le Lilial peut être présent dans les produits de nettoyage (ACI, 2020). Il peut aussi être présent dans des assainisseurs d’air et des désodorisants pour tapis (SDS, 2016, 2017a, 2017b). Le myrac-aldéhyde, le myrmac-aldéhyde et le myrmac‑carboxaldéhyde sont également utilisés comme assainisseurs d’air (CPID, 2021).
Le Lilial est utilisé comme composant d’additifs indirects (par exemple, dans des savons pour les mains) dans des établissements de transformation des aliments sans contact direct avec les aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence). On ne dispose d’aucune donnée indiquant que d’autres substances du sous-groupe 2 des aldéhydes ont des utilisations directes ou indirectes avec des aliments au Canada ou à l’étranger (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
Le Lilial, le myrac-aldéhyde, le myrmac-aldéhyde, le myrmac carboxaldéhyde, le cétonal et le vernaldéhyde sont principalement utilisés comme ingrédients parfumants dans des produits disponibles aux consommateurs au Canada et sont généralement présents dans des mélanges de parfums en faibles concentrations (Environnement Canada, 2013).
Selon la déclaration d’une entreprise, des substances du sous-groupe 2 des aldéhydes sont utilisées comme ingrédients parfumants en faibles concentrations et peuvent être présentes dans certaines catégories de produits, dont les cosmétiques, les assainisseurs d’air et les produits de nettoyage.
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
Selon les modèles utilisés dans la CRE, le Lilial et les parfums et essences de jasmin devraient persister dans l’eau, les sédiments et le sol, mais ne devraient pas persister dans l’air (ECCC, 2016b).
Selon les modèles utilisés dans la CRE, les essences de violette, le myrmac‑carboxaldéhyde et le vernaldéhyde devraient persister dans les sédiments, mais ne devraient pas persister dans l’eau, le sol ou l’air (ECCC, 2016b).
Selon les modèles utilisés dans la CRE, les essences de jasmin devraient persister dans l’air, mais ne devraient pas persister dans l’eau, les sédiments ou le sol (ECCC, 2016b).
Selon les modèles utilisés dans la CRE, les essences de feuille de laurier, les essences d’estragon, le Verdantiol, le myrac-aldéhyde, le myrmac-aldéhyde et le cétonal ne devraient pas persister dans l’air, l’eau, les sédiments ou le sol (ECCC, 2016b).
5.2 Potentiel de bioaccumulation
Bien que les valeurs log Koe du Verdantiol, du myrmac-aldéhyde, du myrmac‑carboxaldéhyde, du cétonal et du vernaldéhyde soient modérées à élevées, les facteurs de bioconcentration de ces substances sont faibles. Par conséquent, le Verdantiol, le myrmac-aldéhyde, le myrmac-carboxaldéhyde, le cétonal et le vernaldéhyde ne devraient pas s’accumuler de manière importante dans les organismes (ECCC 2016b).
Compte tenu de leurs faibles valeurs Koe et de leurs faibles facteurs de bioconcentration, les essences de feuille de laurier, les essences d’estragon, les essences de jasmin, les parfums et essences de jasmin, les essences de violette, le Lilial et le myrac-aldéhyde ne devraient pas s’accumuler de manière significative dans les organismes (ECCC, 2016b).
6. Potentiel de causer des effets nocifs pour l’environnement
6.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés aux substances du groupe des phénylpropanoïdes et des aldéhydes ont été caractérisés selon l’approche de CRE (ECCC, 2016a). La CRE est une méthode fondée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et qui pondère plusieurs éléments de preuve pour classer les risques. On combine les divers éléments de preuve pour classer les risques associés à une substance selon son potentiel de toxicité et son potentiel d’exposition dans différents milieux. On peut ainsi réduire l’incertitude globale liée à la caractérisation des risques, contrairement à une approche reposant sur un seul paramètre mesuré dans un seul milieu (par exemple, concentration létale médiane [CL50]). Puisque les essences de violette sont une substance UVCB et qu’on ne peut la représenter convenablement par une seule structure chimique, on a classé les risques au moyen d’une approche manuelle fondée sur le jugement. L’approche, décrite en détail dans le document d’ECCC de 2016 (a), est résumée ci-dessous.
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans le poisson), l’écotoxicité aiguë pour le poisson et les volumes de produits chimiques importés et fabriqués au Canada ont été tirées de la littérature scientifique, de bases de données empiriques accessibles (par exemple, la boîte à outils QSAR de l’OCDE, 2014) et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE, ou ont été produites à l’aide de modèles QSAR (relation quantitative structure-activité) ou de modèles de devenir du bilan massique ou de bioaccumulation. Ces données ont servi à alimenter d’autres modèles de bilan massique ou à achever d’établir les profils de risques et d’exposition des substances.
Les profils de danger reposent principalement sur des paramètres tels que le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dans le réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition sont également fondés sur de nombreux paramètres, dont les taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. On a comparé les profils de danger et d’exposition avec les critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique selon trois paliers : faible, modéré, élevé. On a appliqué d’autres règles (par exemple, cohérence du classement et marge d’exposition) pour préciser les classements préliminaires de danger et d’exposition. Toutefois, dans le cas des essences de violette, les profils de danger et d’exposition n’ont pu être pleinement caractérisés, en raison de l’absence d’une structure représentative permettant d’estimer les propriétés nécessaires et du manque de données empiriques pour ces propriétés. Par conséquent, on a classé manuellement le danger et l’exposition en examinant les constituants de l’UVCB, en analysant les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE et en prenant des décisions basées sur les données de substances similaires et/ou en appliquant son jugement.
Une matrice de risques a permis d’attribuer à chaque substance un risque faible, modéré ou élevé, en fonction du classement de son profil de danger et d’exposition. On a vérifié le classement des risques établi au moyen de la CRE en suivant une approche en deux étapes. La première étape servait à ajuster le classement des risques de moyen ou élevé à faible pour les substances affichant un faible taux d’émission estimé dans l’eau après le traitement des eaux usées, ce qui indique un faible potentiel d’exposition. La deuxième étape consistait à revoir le classement du potentiel de risque faible selon des scénarios de risque relativement prudents, à l’échelle locale (c’est-à-dire dans la zone située à proximité immédiate d’une source ponctuelle de rejet), scénarios conçus pour protéger l’environnement, afin de déterminer si le classement du risque devrait être haussé.
La méthode de la CRE est une approche pondérée visant à réduire au minimum le potentiel de surclassement ou de sous-classement du danger et de l’exposition, et du risque subséquent. Une description plus détaillée des approches équilibrées de traitement des incertitudes est présentée dans le document d’ECCC de 2016 (a). Les paragraphes suivants décrivent deux des domaines d’incertitude plus importants. Des valeurs empiriques ou modélisées erronées de toxicité aiguë pourraient mener à une modification du classement du danger, surtout dans le cas des paramètres liés à des valeurs de résidus dans les tissus (c’est-à-dire le mode d’action toxique), dont un grand nombre sont des valeurs issues de modèles QSAR (OCDE, QSAR Toolbox, 2014). Toutefois, les conséquences de ce type d’erreur sont atténuées par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) de résidus présents dans les tissus qui sert à l’analyse des résidus corporels critiques. L’erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger comme le profil structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Comme la classification de l’exposition et du risque est très sensible au taux d’émission et à la quantité utilisée, les modifications ou les erreurs dans les quantités de composés chimiques pourraient se traduire par un classement différent de l’exposition. Les classements obtenus au moyen de la CRE représentent donc l’exposition et le risque au Canada, compte tenu de l’estimation des quantités actuellement utilisées, mais pourraient ne pas rendre compte des tendances futures.
Les données et les considérations critiques utilisées pour élaborer les profils propres à une substance du groupe des phénylpropanoïdes et des aldéhydes, ainsi que le classement du danger, de l’exposition et des risques, sont présentées dans le document d’ECCC de 2016 (b).
Le tableau 6-1 présente un résumé du classement du danger et de l’exposition des 12 substances du groupe des phénylpropanoïdes et des aldéhydes.
| Substance | Classement du danger selon la CRE | Classement de l’exposition selon la CRE | Classement du risque selon la CRE |
|---|---|---|---|
| Essences de feuille de laurier | Faible | Faible | Faible |
| Essences d’estragon | Faible | Faible | Faible |
| Essences de jasmin | Faible | Élevée | Faible |
| Parfums et essences de jasmin | Faible | Faible | Faible |
| Essences de violette | Faible | Faible | Faible |
| Lilial | Faible | Faible | Faible |
| Verdantiol | Faible | Faible | Faible |
| Myrac-aldéhyde | Faible | Faible | Faible |
| Myrmac-aldéhyde | Faible | Faible | Faible |
| Myrmac-carboxaldéhyde | Faible | Faible | Faible |
| Cétonal | Faible | Faible | Faible |
| Vernaldéhyde | Faible | Faible | Faible |
Étant donné le classement « faible » pour le danger et « faible » pour l’exposition, selon les données prises en compte dans la CRE, les essences de feuille de laurier, les essences d’estragon, les parfums et essences de jasmin, les essences de violette, le Lilial, le Verdantiol, le myrac-aldéhyde, le myrmac-aldéhyde, le myrmac‑carboxaldéhyde, le cétonal et le vernaldéhyde présentent un faible potentiel de risque pour l’environnement. Il est peu probable que ces substances soient préoccupantes pour l’environnement au Canada.
D’après les données prises en compte dans le la CRE, les essences de jasmin présentent un potentiel d’exposition élevé en raison de leur demi‑vie extrêmement longue dans l’air. Bien que les profils d’emploi actuels des essences de jasmin entraînent un potentiel d’exposition élevé, il est peu probable que ces essences soient préoccupantes pour l’environnement au Canada, compte tenu de leur faible potentiel de danger.
7. Potentiel d’effets nocifs sur la santé humaine
Pour caractériser les effets des substances du groupe des phénylpropanoïdes et des aldéhydes sur la santé, il a été jugé préférable d’utiliser les données sur le danger associées aux substances elles‑mêmes. Faute de données sur les effets des essences sur la santé, les données sur les effets sur la santé des principaux composants présents dans ces essences ont été prises en compte pour alimenter l’évaluation des risques. Faute de données sur les effets sur la santé de la substance ou des principaux composants présents dans les essences, l’approche de lecture croisée a été appliquée.
Certains sous-groupes de la population pourraient être davantage exposés en raison de leurs caractéristiques physiques (par exemple, le poids corporel, la fréquence respiratoire, la superficie de la peau). En raison de ces différences d’exposition, les risques de causer des effets nocifs pour la santé pourraient être accrus dans ces populations vulnérables. Dans la présente évaluation, on a estimé l’exposition des nourrissons, des tout-petits et des enfants, qui peuvent être davantage exposés par kilogramme (kg) de poids corporel (p.c.) que les adultes à certains produits disponibles aux consommateurs, notamment les lotions corporelles, les écrans solaires et les désinfectants pour les mains. En outre, lorsqu’elles étaient disponibles et appropriées, les études sur la reproduction et le développement ont été prises en compte pour garantir la protection des femmes enceintes et de leurs fœtus en développement.
7.1 Essences de feuille de laurier
7.1.1 Évaluation de l’exposition
Milieux environnementaux
Les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE ne contenaient aucune donnée sur l’utilisation des essences de feuille de laurier. Aucune donnée de surveillance pour les essences de feuille de laurier dans les milieux environnementaux au Canada ou ailleurs n’a été trouvée. D’après les renseignements examinés dans le cadre de la CRE, les essences de feuille de laurier ont été classées comme substances présentant un faible potentiel d’exposition de l’environnement (voir la section 6.1).
Aliments
On ne dispose d’aucune donnée de référence concernant l’utilisation possible des essences de feuille de laurier comme aromatisants dans des aliments vendus au Canada. Toutefois, comme les essences de feuille de laurier sont utilisées en tant qu’aromatisants alimentaires partout dans le monde, il est possible que cette substance soit présente comme aromatisant dans des aliments vendus au Canada.
Selon le Handbook of Flavour Ingredients de Fenaroli, la dose estimée par personne (par habitant) d’essences de feuille de laurier, découlant de leur utilisation comme aromatisants alimentaires, est de 3,39 × 10-1 μg/kg p.c./j, d’après la méthode de calcul de la dose maximale journalière basée sur des données d’enquête (MSDI, de l’anglais Maximized survey-derived daily intake) pour la population des États-Unis (Burdock, 2010). Faute de donner sur l’utilisation réelle, le cas échéant, des essences de feuille de laurier comme aromatisants dans des aliments vendus au Canada, la dose journalière estimée par habitant pour la population des États-Unis (Burdock, 2010) est jugée acceptable pour l’exposition alimentaire possible de la population générale au Canada âgée de 1 an et plus à cette substance en raison de son utilisation possible comme aromatisants alimentaires (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
Exposition à la substance présente naturellement dans des aliments :
On ne dispose d’aucune donnée de référence concernant la présence naturelle des essences de feuille de laurier dans des aliments. Toutefois, l’exposition à cette substance par voie alimentaire, le cas échéant, devrait être limitée à sa présence naturelle dans des aliments (Nijssen et al., 2018).
Produits disponibles aux consommateurs
Selon la source, les essences de feuille de laurier peuvent contenir du méthyleugénol à des concentrations de 0 % à 2 %. Dans les cosmétiques au Canada, le méthyleugénol est un ingrédient à usage restreint inscrit sur la Liste critique des ingrédients des cosmétiquesNote de bas de page 11. La Liste critique des ingrédients des cosmétiques indique que le méthyleugénol est une substance autorisée seulement lorsqu’elle est un composant naturellement présent dans des extraits botaniques et ne dépasse pas la concentration maximale de 0,01 % dans les parfums fins, de 0,004 % dans l’eau de toilette, de 0,002 % dans les crèmes parfumées, de 0,0002 % dans d’autres produits sans rinçage et produits d’hygiène buccale, et de 0,001 % dans les produits à rincer (SC, 2019a).
Les essences de feuille de laurier sont présentes dans des produits disponibles aux consommateurs. Afin d’évaluer l’exposition possible par voie cutanée et par inhalation aux essences de feuille de laurier présentes dans des cosmétiques et des PSN, des scénarios sentinelles ont été sélectionnés d’après une combinaison de fréquences d’utilisation et de concentrations déclarées d’essences de feuille de laurier dans ces produits. Les scénarios sentinelles retenus ci‑dessous sont ceux dont les valeurs d’exposition sont les plus élevées par rapport à d’autres produits cosmétiques et groupes d’âge, ainsi qu’à des PSN auxquels des essences de feuille de laurier sont ajoutées comme ingrédient non médicinal, selon les produits trouvés qui contenaient cette substance. Étant donné que le méthyleugénol figure sur la Liste critique des ingrédients des cosmétiques comme substance dont l’utilisation est restreinte à ces seuls produits, on a supposé que les conditions indiquées sur cette liste sont respectées et que l’exposition aux essences de feuille de laurier est basée sur l’hypothèse que les concentrations maximales autorisées de méthyleugénol indiquées dans cette liste pour chacun de ces produits sont utilisées.
L’utilisation d’essences de feuille de laurier pures dans les produits faits soi-même comme ceux utilisés dans les diffuseurs aromatiques, les huiles de massage, les huiles pour le bain et les hydratants corporels a été évaluée. Même si la concentration maximale déclarée pour les huiles de massage contenant des essences de feuille de laurier est de 100 %, les huiles de massage sont généralement diluées avant d’être utilisées. Par conséquent, on a supposé que la concentration maximale d’essences de feuille de laurier dans les huiles de massage faites soi-même était de 3 % (RIVM, 2006). D’après l’information disponible, les produits pour le corps seraient généralement dilués à une concentration variant de 1 à 4 % (Tisserand Institute, 2021). À la lumière de ces renseignements, on a supposé que la concentration maximale d’essences de feuille de laurier dans les hydratants corporels faits soi-même est de 3 %.
Faute de données sur l’absorption cutanée propre à chaque substance chimique, on a utilisé une valeur d’absorption cutanée de 40 % pour le méthyleugénol afin d’estimer l’exposition générale par voie cutanée (EC et SC, 2010). Pour tenir compte de la quantité de produit absorbée par voie cutanée, la quantité de produit pouvant être inhalée a été réduite à 60 %, sauf pour les hydratants corporels. Dans le cas des hydratants corporels, puisque la quantité de produit inhalable a été réduite pour tenir compte de la superficie exposée, et comme cette valeur était inférieure à 60 % de la quantité de produit, aucune autre modification n’a été apportée à la quantité de produit.
Les tableaux 7-1 et 7-2 présentent les valeurs estimatives de l’exposition générale quotidienne les plus faibles et les plus élevées (somme de l’exposition par inhalation et de l’exposition par voie cutanée), ainsi que les doses journalières moyennes pour la durée de la vie (DJMDV) calculées pour le méthyleugénol dans les essences de feuille de laurier présentes dans des produits cosmétiques et des PSN, respectivement. Le tableau 7-3 présente les valeurs estimatives de l’exposition générale quotidienne les plus faibles et les plus élevées, ainsi que les DJMDV de méthyleugénol dans les produits faits soi-même contenant des essences de feuille de laurier.
| Scénario de type de produit | Pourcentage de méthyleugénol dans le produit | Exposition journalière généralea (mg/kg p.c./j) | DJMDVb (mg/kg p.c./j) |
|---|---|---|---|
| Parfum fin (aérosol) | 0,01 % | 2,66 × 10-4 (14–18 ans) à 4,15 × 10-4 (4–8 ans) | 2,94 × 10-4 |
| Eau de toilette | 0,004 % | 1,24 × 10-4 (14–18 ans) à 1,90 × 10-4 (4–8 ans) | 1,31 × 10-4 |
| Crèmes parfumées | 0,002 % | 1,06 × 10-3 (14-18 ans) à 2,05 × 10-3 (0-5 mois) | 1,17 × 10-3 |
| Après-shampooing (sans rinçage) | 0,0002 % | 1,39 × 10-5 (14–18 ans) à 2,34 × 10-5 (adultes) | 2,12 × 10-5 |
| Nettoyant corporel | 0,001 % | 9,35 × 10-6 (adultes) à 3,47 × 10-5 (0–5 mois) | 1,08 × 10-5 |
a Seuls les groupes d’âge des moins exposés aux plus exposés sont présentés. Les estimations de l’exposition aux essences de feuille de laurier ont été modifiées en supposant que le méthyleugénol est présent à la concentration maximale permise indiquée dans la Liste critique des cosmétiques.
b DJMDV = dose journalière moyenne pour la durée de la vie. Voir l’annexe A pour les calculs détaillés.
| Scénario de type de produit | Pourcentage d’essences de feuille de laurier dans le produit | Exposition journalière généralea (mg/kg p.c./j) | DJMDVb (mg/kg p.c./j) |
|---|---|---|---|
| Bâtonnet d’inhalation | 0,06 % | 1,33 × 10-5 (adultes) | 1,01 × 10-5 |
| Aérosols inhalables | 2 % | 8,48 × 10-6 (adultes) | 6,41 × 10-6 |
a Seuls les groupes d’âge les moins exposés et les plus exposés sont représentés. Les estimations de l’exposition aux essences de feuille de laurier ont été modifiées pour une concentration maximale de 2 % de méthyleugénol.
b DJMDV = dose journalière moyenne pour la durée de la vie. Voir l’annexe A pour les calculs détaillés.
| Scénario de type de produit | Pourcentage d’essences de feuille de laurier dans le produit final | Exposition journalière généralea (mg/kg p.c./j) | DJMDVb (mg/kg p.c./j) |
|---|---|---|---|
| Diffuseurs aromatiques | 100 % | 2,07 × 10-2 (adultes) à 3,93 × 10-2 (1 an) | 2,3 × 10-2 |
| Huiles de massage | 3 % | 1,25 × 10-3 (adultes) à 9,13 × 10-3 (0–5 mois) | 1,37 × 10-2 |
| Huiles pour le bain | 100 % | 8,37 × 10-4 (adultes) à 1,35 × 10-5 (9–13 ans) | 7,87 × 10-4 |
| Hydratants corporels | 3 % | 3,18 × 10-2 (adultes) à 6,13 × 10-2 (0–6 mois) | 3,5 × 10-2 |
a Seuls les groupes d’âge les moins exposés et les plus exposés sont représentés. Les estimations de l’exposition aux essences de feuille de laurier ont été modifiées pour une concentration maximale de 2 % de méthyleugénol.
b DJMDV = dose journalière moyenne pour la durée de la vie. Voir l’annexe B pour les calculs détaillés.
7.1.2 Évaluation des effets sur la santé
Aucune donnée empirique sur les effets sur la santé ni évaluation internationale n’a été trouvée pour les essences de feuille de laurier.
Afin d’alimenter l’évaluation des effets sur la santé, les données disponibles sur les dangers des principaux composants des essences de feuille de laurier, à savoir l’eugénol (46 %–56 %), le chavicol (9 %–22 %), le bêta-myrcène (13 %–26 %) et le méthyleugénol (0 %–2 %), ont été prises en compte.
L’eugénol a été considéré comme une substance présentant un faible potentiel de danger. Par conséquent, le risque pour la santé humaine découlant de l’exposition à l’eugénol a été jugé faible par ECCC et SC dans une évaluation préalable (ECCC, SC, 2018d).
Aucune donnée empirique sur les effets sur la santé ni évaluation internationale n’a été trouvée pour le chavicol.
Le Centre international de recherche sur le cancer (CIRC) considère le bêta-myrcène comme un agent d’intérêt prioritaire moyen et le classe dans le groupe 2B : cancérogène possible pour les humains (CIRC, 2014). En Californie, l’Office of Environmental Health Danger Assessment (OEHHA) a ajouté le bêta-myrcène à la liste des produits chimiques reconnus par l’État comme substance cancérogène chez les animaux de laboratoire aux fins de la Proposition 65 (OEHHA, 2018). Le bêta-myrcène n’est pas non plus considéré comme génotoxique (CIRC, 2014; US FDA, 2018; OEHHA, 2018; ECCC, SC, 2020). Une dose sans effet nocif observé (DSENO) de 250 mg/kg p.c./j de bêta-myrcène a été déterminée comme toxique pour la reproduction et le développement, d’après une diminution du nombre de sites d’implantation des fœtus vivants et une augmentation de la fréquence des malformations squelettiques, comme la fusion de l’os zygomatique, la dislocation du sternum et la formation de côtes lombaires supplémentaires à 500 mg/kg p.c./j chez le rat, selon ECCC et SC (2020).
Le National Toxicology Program (NTP) des États‑Unis a classé le méthyleugénol dans la catégorie des substances dont on peut raisonnablement penser qu’elles sont cancérogènes pour l’humain, d’après des preuves suffisantes de leur cancérogénicité observée chez les animaux de laboratoire (NTP, 2000). Le CIRC a également évalué le méthyleugénol et a conclu qu’il existe des preuves suffisantes de cancérogénicité chez les animaux de laboratoire (CIRC, 2013). Le CIRC a donc rangé le méthyleugénol parmi les agents qui sont peut-être cancérogènes pour l’Homme (groupe 2B) (CIRC, 2013).
Conformément aux résultats de l’essai biologique de 2 ans réalisé dans le cadre du NTP en 2005, le gouvernement du Canada a conclu que le méthyleugénol est génotoxique et cancérogène et a déterminé que la dose minimale entraînant un effet nocif observé (DMENO) est de 37 mg/kg p.c./j, soit la plus faible dose d’essai, d’après l’observation de tumeurs au foie et de tumeurs à l’estomac glandulaire chez les rats ainsi que chez les souris des deux sexes (NTP, 2000; EC, SC, 2010).
Pour le méthyleugénol, on ne dispose pas de dose repère (DR) déterminée par un organisme international. Cependant, on trouve dans la littérature scientifique plusieurs doses repères, basées sur la même étude standard de cancérogénicité de 2 ans du NTP (2000) et utilisées par le gouvernement du Canada pour évaluer les risques associés au méthyleugénol (EC, SC, 2010).
Dans une première étude d’évaluation de la génotoxicité et de la cancérogénicité de composés pouvant être présents dans des aliments et des compléments alimentaires à base de végétaux, les valeurs de la BMDL10 (limite de confiance inférieure de la dose qui produit une variation de 10 % de l’effet nocif par rapport à la réponse de fond) ont été obtenues à l’aide de la version 2.1.2 du logiciel BMD de l’EPA des États-Unis, selon différents modèles (Gamma, Logistic, Log-logistic, Probit, Log-Probit, Multistage, Weibull et Quantal, modèle linéaire). Le logiciel BMD a été appliqué avec les réglages par défaut pour les restrictions du modèle, le type de risques (supplémentaires), le niveau de confiance (95 %) et le métabolisme de base (10 %). Les valeurs de la relation dose-réponse déclenchant la formation de carcinomes hépatocellulaires chez les rats F344/N mâles et femelles ont été calculées et ajustées pour tenir compte de la durée d’exposition (exposition de 5 jours au lieu de 7 jours par semaine) (Van den Berg et al., 2011). Pour le méthyleugénol, on a obtenu des valeurs de DR10 de 15,3 à 34 mg/kg p.c./j chez les rats mâles et de 48,8 à 73,6 mg/kg p.c./j chez les rats femelles (Van den Berg et al., 2011).
Dans une deuxième étude d’évaluation des risques, les auteurs ont estimé les valeurs de DR pour déterminer les ME dans différentes boissons à base de plantes (Suparmi et al., 2019). Afin de déterminer les valeurs de BMDL10, les valeurs de la relation dose‑réponse déclenchant la formation de carcinomes hépatocellulaires chez les rats F344/N mâles et femelles ont été calculées et ajustées pour tenir compte de la durée de l’exposition (exposition de 5 jours au lieu de 7 jours par semaine) (Suparmi et al., 2019). Les valeurs de BMDL10 ont été obtenues selon les recommandations du comité scientifique de l’EFSA, c’est‑à‑dire par calcul de la moyenne des résultats des modèles plutôt que par la sélection ou le rejet d’un modèle particulier (EFSA, 2017). Selon cette approche, on a également utilisé l’outil de l’EFSA, qui met en application des méthodes statistiques pour le progiciel PROAST écrit en R. La moyenne des BMDL10 modélisées a été calculée d’après les paramètres par défaut. La valeur de BMDL10 chez les rats mâles a été établie à 22,2 mg/kg p.c./j et chez les rats femelles à 66,5 mg/kg p.c./j (Suparmi et al., 2019). Ces deux valeurs se situent dans la fourchette des valeurs BMDL10 déterminées dans l’étude précédente.
D’autres études ont également été prises en compte, mais elles n’avaient pas suivi les lignes directrices de l’EPA des États‑Unis ou de l’EFSA pour ce qui est de l’analyse de la cancérogénicité (Rietjens et al., 2008; Smith et al., 2010).
En général, la souris s’est avérée être l’espèce la plus sensible et chez laquelle les doses minimales ayant entraîné un effet observé dans les paramètres tumoraux ont été déterminées. Toutefois, la modélisation des données sur la souris a été difficile en raison de l’absence de tendance pour la relation dose-réponse. Par conséquent, aucun modèle statistique n’a permis d’ajuster les données correctement. En raison de ces difficultés liées aux données pour les souris, de nombreux auteurs ont sélectionné des valeurs de la relation dose-réponse basées sur l’apparition d’adénomes hépatiques observée chez des rats mâles pour calculer la DR du méthyleugénol (Rietjens et al., 2008; Smith et al., 2010; Van den Berg et al., 2011; Suparmi et al., 2019).
7.1.3 Caractérisation des risques pour la santé humaine
Le critère d’effet préoccupant relevé pour les essences de feuille de laurier est la cancérogénicité génotoxique du méthyleugénol dont la BMDL10 est de 22,2 mg/kg p.c./j d’après la fréquence significativement accrue d’apparition de carcinomes hépatocellulaires chez les rats mâles, d’une manière liée à la dose, dans une étude de cancérogénicité de 2 ans dans le cadre du NTP (2000) (Suparmi et al., 2019). Pour déterminer le risque associé aux essences de feuille de laurier contenant du méthyleugénol, on a déterminé les ME par comparaison des DJMDV estimées résultant de l’utilisation du produit avec les valeurs de BMDL10 du méthyleugénol.
Le tableau 7-4 présente un résumé des valeurs de DJMDV et de ME pour le méthyleugénol dans les essences de feuille de laurier et les cosmétiques qui en contiennent. Le tableau 7-5 présente ces valeurs pour les aliments et les PSN. Le tableau 7-6 présente ces valeurs pour les produits faits soi-même contenant des essences de feuille de laurier.
| Scénario d’exposition | DJMDVa (mg/kg p.c./j) | MEb |
|---|---|---|
| Exposition générale par voie cutanée et par inhalation de la substance présente dans des parfums fins (0,01 %) | 2,94 × 10-4 | > 75 000 |
| Exposition générale par voie cutanée et par inhalation de la substance présente dans des eaux de toilette (0,004 %) | 1,31 × 10-4 | > 169 000 |
| Exposition générale par inhalation de la substance présente dans des crèmes parfumées (0,002 %) | 1,17 × 10-3 | > 19 000 |
| Exposition générale par voie cutanée et par inhalation de la substance présente dans des après-shampooings (sans rinçage) (0,0002 %) | 2,12 × 10-5 | > 1 000 000 |
| Exposition générale par voie cutanée et par inhalation de la substance présente dans des nettoyants corporels (0,001 %) | 1,08 × 10-5 | > 2 000 000 |
a Les DJMDV ont été ajustées pour tenir compte des concentrations maximales de méthyleugénol autorisées selon la Liste critique des ingrédients des cosmétiques.
b Les ME ont été calculées d’après une BMDL10 de 22,2 mg/kg p.c./j pour la cancérogénicité du méthyleugénol.
| Scénario d’exposition | DJMDVa (mg/kg p.c./j) | MEb |
|---|---|---|
| Aromatisant alimentaire (1 an et plus) | 6,78 × 10-6 | > 3 000 000 |
| Exposition générale par inhalation à des bâtonnets d’inhalation (0,06 %) | 1,01 × 10-5 | > 2 000 000 |
| Exposition générale par inhalation à des aérosols inhalables (2 %) | 6,41 × 10-6 | > 3 000 000 |
a Pour les essences de feuille de laurier utilisées comme aromatisants alimentaires, ainsi que dans les bâtonnets d’inhalation et les aérosols inhalables, les DJMDV ont été ajustées pour tenir compte de la concentration maximale de 2 % de méthyleugénol.
b Les ME ont été calculées d’après une BMDL10 de 22,2 mg/kg p.c./j déterminée d’après la cancérogénicité du méthyleugénol.
| Scénario d’exposition | DJMDVa (mg/kg p.c./j) | MEb |
|---|---|---|
| Exposition générale par voie cutanée et par inhalation à des produits faits soi-même – diffuseurs aromatiques (100 %) | 2,3 × 10-2 | 965 |
| Exposition générale par voie cutanée et par inhalation à des produits faits soi-même – huiles de massage (3 %) | 1,6 × 10-3 | 13 891 |
| Exposition générale par voie cutanée et par inhalation à des produits faits soi-même – huiles pour le bain (100 %) | 7,88 × 10-4 | 28 000 |
| Exposition générale par voie cutanée et par inhalation à des produits faits soi-même – hydratants corporels (3 %) | 3,5 × 10-2 | 633 |
a Pour les essences de feuille de laurier utilisées dans les diffuseurs aromatiques, les huiles de massage, les huiles pour le bain et les hydratants corporels, les DJMDV ont été ajustées pour tenir compte de la concentration maximale de 2 % de méthyleugénol.
b Les ME ont été calculées d’après une BMDL10 de 22,2 mg/kg p.c./j déterminée d’après la cancérogénicité du méthyleugénol.
Les ME pour les essences de feuille de laurier présentes dans les cosmétiques, les aromatisants alimentaires, les bâtonnets d’inhalation et les aérosols inhalables (PSN) sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé, utilisées pour caractériser le risque.
Les ME pour les essences de feuille de laurier contenues dans les huiles pour le bain et les huiles de massage faites soi-même sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé, utilisées pour caractériser le risque.
Pour ce qui est de l’exposition aux essences de feuille de laurier contenues dans les produits faits soi-même utilisés dans les diffuseurs aromatiques et les hydratants corporels faits soi-même, les ME comprises entre les concentrations entraînant un effet critique et celles de l’exposition estimée, indiquées dans le tableau 7-6, sont inférieures à 10 000, ce qui tient compte des incertitudes relatives à l’extrapolation interspécifique, à la variabilité intraspécifique, au point de départ (PdD) et au caractère exhaustif de la base de données, mais elles pourraient être insuffisantes.
7.1.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitudes | Incidence |
|---|---|
| Lors du calcul des risques associés au méthyleugénol dans les essences de feuille de laurier utilisées dans des diffuseurs aromatiques, des huiles de massage, des hydratants corporels et des huiles pour le bain, on a supposé que la source des essences de feuille de laurier contenait 2 % de méthyleugénol. Les concentrations déclarées de méthyleugénol dans les essences de feuille de laurier peuvent varier de 0 % à 2 %, selon la source. | + |
| Aucune étude de toxicité à court terme, de toxicité chronique, de toxicité pour la reproduction ou le développement ou de cancérogénicité n’a été trouvée pour les essences de feuille de laurier. | +/- |
| L’extrapolation de voie à voie pour les essences de feuille de laurier a été réalisée dans des scénarios d’exposition cutanée et par inhalation, par comparaison avec une concentration entraînant un effet provenant d’une étude d’exposition par voie orale. | +/- |
+ = incertitude associée à une possibilité de surestimation de l’exposition ou du risque; - = incertitude associée à une possibilité de sous‑estimation de l’exposition ou du risque; +/- = possibilité inconnue de surestimation ou de sous‑estimation du risque.
7.2 Essences d’estragon
7.2.1 Évaluation de l’exposition
Milieux environnementaux
Aucune utilisation d’essences d’estragon n’a été déclarée dans l’enquête menée en vertu de l’article 71 de la LCPE. Aucun rapport de surveillance des essences d’estragon dans les milieux environnementaux au Canada ou ailleurs n’a été trouvé. D’après les renseignements examinés dans le cadre de la CRE, les essences d’estragon ont été classées comme substances présentant un faible potentiel d’exposition environnementale (voir la section 6.1).
Aliments
On ne dispose d’aucune donnée de référence concernant l’utilisation possible des essences d’estragon comme aromatisants alimentaires dans les aliments vendus au Canada. Toutefois, sachant que les essences d’estragon sont utilisées comme aromatisants alimentaires partout dans le monde, il est possible que cette substance soit présente comme aromatisant dans des aliments vendus au Canada.
La dose estimée d’essences d’estragon comme aromatisants alimentaires par personne (par habitant) est de 5,37 × 10-1 μg/kg p.c./j (Burdock, 2010). Cette estimation était basée sur les volumes de production annuels déclarés par l’industrie alimentaire (NAS, 1989, cité dans Burdock, 2010), et on présume que seulement 60 % du volume réel produit a été déclaré et que la totalité de la quantité produite a été consommée par seulement 10 % de la population américaine.
Faute de données sur l’utilisation réelle, le cas échéant, d’essences d’estragon, comme aromatisants dans des aliments vendus au Canada, les doses estimées par habitant pour la population des États-Unis (Burdock, 2010) sont jugées acceptables pour l’estimation de l’exposition possible par le régime alimentaire des Canadiens de 1 an et plus exposés à cette substance de par leur utilisation comme aromatisants alimentaires.
Le trans-anéthol dans le lait maternel a été détecté après l’ingestion de capsules contenant 100 mg de trans-anéthol par 15 femmes allaitantes (Hausner et al., 2008). La concentration de trans-anéthol atteignait un pic ~2 à 6 heures après l’ingestion (23,2 µg/L) et revenait à sa valeur normale dans les 8 heures suivant l’ingestion.
Exposition à la substance présente naturellement dans les aliments :
On ne dispose d’aucune donnée de référence concernant la présence naturelle des essences d’estragon dans les aliments. Les essences d’estragon sont tirées de la plante du même nom (Burdock, 2010; VCF, 2020). L’exposition à cette substance par le régime alimentaire, le cas échéant, devrait être limitée à sa présence naturelle dans des aliments (Nijssen et al., 2018).
Produits disponibles aux consommateurs
Les essences d’estragon sont présentes dans des produits disponibles aux consommateurs. Afin d’évaluer le potentiel d’exposition aux essences d’estragon présentes dans les cosmétiques et les PSN appliqués sur la peau, on a choisi des scénarios sentinelles en se fondant sur une combinaison de fréquences d’utilisation et de concentrations déclarées d’essences d’estragon dans ces produits. Les scénarios sentinelles sélectionnés pour les cosmétiques représentaient l’exposition maximale par rapport aux autres cosmétiques appliqués sur la peau, comme les PSN dans lesquels les essences d’estragon sont utilisées comme ingrédient non médicinal, d’après les produits déclarés contenant cette substance. Les scénarios d’exposition aux essences d’estragon par l’utilisation d’hydratants corporels, de parfums corporels, d’hydratants pour le visage, de nettoyants pour le visage et de savon ont été considérés comme des scénarios sentinelles pour les applications cutanées (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
En ce qui concerne l’utilisation d’essences d’estragon à 100 % dans des produits faits soi-même, on devrait atteindre l’exposition journalière la plus élevée avec un diffuseur aromatique à une concentration maximale de 100 % ou un hydratant corporel dilué à une concentration de 3 % (Tisserand Institute, 2021), ainsi qu’avec des huiles de massage diluées à une concentration de 3 % (RIVM, 2006) et des huiles pour le bain faites soi-même à une concentration maximale déclarée de 100 %.
Les essences d’estragon sont également présentes comme ingrédient non médicinal dans le but de rehausser la saveur de PSN administrés par voie orale. L’exposition aux essences d’estragon par voie orale a donc été quantifiée pour ces produits (BDPSNH, 2021). Le rôle non médicinal des essences d’estragon, lorsqu’elles sont utilisées comme exhausteur de goût, est associé à une limite maximale de consommation par voie orale de 0,05 mg/kg p.c./j (BDIPSN [modifié en 2021]). Cette limite est recommandée par Tisserand et Young (2014) en raison de la teneur en estragol et en méthyleugénol des essences d’estragon et des effets génotoxiques et cancérogènes possibles de ces substances. Lorsque les essences d’estragon sont utilisées de manière topique, cette limite maximale est de 0,12 % (Tisserand et Young, 2014).
Faute de données sur l’absorption cutanée propre à chaque substance chimique, on a utilisé une valeur d’absorption cutanée de 40 % du méthyleugénol afin d’estimer l’exposition générale par voie cutanée (EC, SC, 2010). Pour tenir compte de la quantité de produit absorbée par voie cutanée, la quantité de produit pouvant être inhalée a été multipliée par 60 %, sauf pour les hydratants corporels. Dans le cas des hydratants corporels, comme la quantité de produit inhalable a été réduite pour tenir compte de la superficie exposée et comme cette valeur était inférieure à 60 % de la quantité de produit, aucun autre ajustement n’a été apporté à la quantité de produit.
On a estimé l’exposition générale quotidienne en additionnant les valeurs d’exposition par toutes les voies pertinentes pour le scénario (voie orale, voie cutanée, inhalation). Les estimations de l’exposition pour les groupes d’âge les moins exposés et les plus exposés aux produits, ainsi que les DJMDV calculées, sont présentées dans le tableau 7-8.
En outre, les estimations de l’exposition générale journalière des groupes d’âge les moins exposés et les plus exposés, ainsi que les DJMDV pour les essences d’estragon présentes dans des produits faits soi-même, sont présentées dans le tableau 7-9.
| Scénario de produit | Pourcentage dans le produit | Exposition générale journalière (mg/kg p.c./j)a | DJMDVb (mg/kg p.c./j) |
|---|---|---|---|
| Hydratants corporels | 0,3 % |
1,59 × 10-1 (14–18 ans) à 3,07 × 10-1 (0–5 mois) |
1,75 × 10-1 |
| Parfums corporels | 100 % | 3,12 (14-18 ans) à 4,68 (4–8 ans) | 3,44 |
| Hydratants pour le visage | 0,1 % |
1,05 × 10-2 (14–18 ans) à 1,75 × 10-2 (adultes) |
1,46 × 10-2 |
| Nettoyants pour le visage | 0,1 % |
2,68 × 10-4 (14–18 ans) à 3,70 × 10-4 (9–13 ans) |
2,73 × 10-4 |
| Savons | 0,3 % | 3,64 × 10-4 (adultes) à 4,78 × 10-4 (1 an) | 3,86 × 10-4 |
| Capsules d’aide à la digestion (PSN) | 0,0026 % | 1,26 × 10-4 (adultes) | 9,57 × 10-5 |
a Seules les valeurs pour les groupes les moins exposés et les plus exposés sont présentées.
b Pour les calculs, veuillez consulter l’annexe A.
| Scénario de produit | Pourcentage dans le produit | Exposition générale journalière (mg/kg p.c./j)a | DJMDVb (mg/kg p.c./j) |
|---|---|---|---|
| Diffuseurs aromatiques | 100 % | 1,09 (adultes) à 1,96 (1 an) | 1,20 |
| Huiles de massage | 3 % |
6,25 × 10-22 (adultes) à 4,56 × 10-1 (0–5 mois) |
8 × 10-2 |
| Huiles pour le bain | 100 % |
4,30 × 10-2 (adultes) à 6,95 × 10-2 (9–13 ans) |
4,05 × 10-2 |
| Hydratants corporels | 3 % | 1,59 (14–18 ans) à 3,07 (0‑5 mois) | 1,75 |
7.2.2 Évaluation des effets sur la santé
On n’a trouvé aucune donnée empirique sur les effets sur la santé ni aucune évaluation internationale pour les essences d’estragon, sauf celles d’un test de synthèse non programmée de l’ADN dans le foie de rats (Nesslany et al., 2010) et d’un test d’Ames in vitro réalisé avec Saccharomyces cerevisiae (Tateo et al., 1989). Les résultats à ces deux tests ont été positifs.
Afin d’éclairer l’évaluation des effets sur la santé, on a pris en compte les données sur le danger des principaux composants des essences d’estragon : le méthyleugénol (2 %–39 %), l’estragol (0 %–82 %), le sabinène (trace–39 %), la terpinolène (0,5 %–25 %), le cis-anéthol (51 %–81 %), le trans-anéthol (21,1 %–53 %) et l’élémicine (trace–57 %).
Méthyleugénol
Le méthyleugénol est considéré comme un cancérogène génotoxique, et sa valeur de BMDL10 est de 22,2 mg/kg p.c./j. Pour de plus amples renseignements sur les effets du méthyleugénol sur la santé, veuillez consulter la section traitant de l’évaluation des effets des essences de feuille de laurier sur la santé (section 7.1.2).
Estragol
L’OEHHA, l’EFSA, l’IFRA et l’Agence européenne des médicaments (EMA) ont déterminé que l’estragol est un cancérogène génotoxique semblable au méthyleugénol (OEHHA, 1999; EFSA, 2009; IFRA, 2015; EMA, 2020). L’IFRA a calculé une dose de référence de 0,04 mg/kg p.c./j pour une exposition à long terme aux parfums (IFRA, 2015). L’EFSA a calculé des valeurs de BMDL10 comprises entre 9,2 et 32,7 mg/kg p.c./j d’après les données de l’étude de cancérogénicité de 12 mois de Miller et al. (1983) et l’EMA a utilisé ces mêmes valeurs pour son évaluation des risques associés à l’estragol (EMA, 2015). Toutefois, dans l’étude de cancérogénicité, les animaux ont été exposés par le régime alimentaire, et les auteurs de l’étude n’ont pas indiqué la quantité d’aliments traités consommés par les animaux. En outre, l’EFSA n’a pas présenté de justification ni de calcul de la dose journalière estimée d’estragol qu’elle a utilisée pour déterminer les valeurs de BMDL10.
Dans des études de cancérogénicité par voie orale, des souris CD-1 mâles et femelles en présevrage ont reçu 2,5 mmol d’estragol/kg p.c. (équivalant à 370 mg/kg p.c.), par gavage, 2 fois par semaine pendant 5 semaines (Miller et al., 1983). Dans les 11 à 14 mois suivant le dernier jour d’exposition, on a observé une augmentation significative des hépatomes chez les souris mâles, mais pas chez les souris femelles (Miller et al., 1983).
Dans une autre étude de cancérogénicité réalisée par les mêmes auteurs, des souris CD-1 femelles adultes (50/dose) ont reçu 0, 2 300 ou 4 600 mg/kg de nourriture, 3 fois par semaine pendant 12 mois. Un sous-ensemble de ces animaux a bénéficié d’une période de récupération de 6 mois sans traitement (Miller et al., 1983). Tous les animaux ayant été exposés à l’estragol ont présenté un nombre significativement plus élevé d’angiosarcomes hépatiques, d’hémangio-endothélio-sarcomes et d’hépatomes (Miller et al., 1983). En outre, ils ont observé des nodules dans le foie des animaux des deux groupes ayant reçu de l’estragol à 12 mois, mais les nodules ont progressivement régressé après l’administration, car leur taille avait diminué à 18 mois (Miller et al., 1983). Les foies présentaient divers degrés d’inflammation chronique, une fibrose, une prolifération dans les voies biliaires, plusieurs histiocytes chargés de céroïdes, de l’hyperplasie cellulaire et une mégalocytose (Miller et al., 1983). Les auteurs de l’étude n’ont pas indiqué la consommation d’estragol des animaux pendant le traitement, ce qui a empêché d’estimer leur exposition journalière.
Dans une étude de cancérogénicité, des souris CD-1 mâles en présevrage (50/dose) ont été exposées à 0, 4,4 ou 5,2 µmol/kg p.c. (équivalant à 0, 651 ou 769,6 µg/kg p.c., respectivement) en tout, après 4 injections sous-cutanées aux jours postnataux (JPN) 1, 8, 15, et 22 (Drinkwater et al., 1976). Après 15 mois, le nombre de carcinomes hépatocellulaires chez les animaux traités était plus élevé que chez les animaux du groupe témoin (Drinkwater et al., 1976).
Dans l’ensemble, les études réalisées avec des animaux de laboratoire ont montré clairement le potentiel cancérogène de l’estragol.
Dans une étude de 90 jours, des rats F344/N mâles et femelles ont reçu, par voie orale (gavage), 0, 37,5, 75, 150, 300 ou 600 mg/kg p.c./j d’estragol pendant 5 jours chaque semaine (NTP, 2011a). Aucune mortalité n’a été observée, mais on a constaté une diminution significative du poids corporel moyen ou un ralentissement de la prise de poids corporel à 300 et à 600 mg/kg p.c./j chez les rats des deux sexes. Dans les paramètres hématologiques, des variations statistiquement significatives et liées à la dose ont été observées chez les rats mâles et femelles, notamment une anémie microcytaire, normochrome et arégénérative. Les variations constatées dans les paramètres hématologiques se sont intensifiées avec la durée et la dose, allant de modifications subtiles lors d’une exposition à de faibles doses à des changements statistiquement significatifs observés dans les groupes exposés à 300 ou 600 mg/kg p.c./j à la fin de l’étude (semaine 14 de l’exposition). Les auteurs de l’étude semblent indiquer que les variations hématologiques sont des indicateurs d’une érythropoïèse inefficace (NTP, 2011a). Ils ont également signalé une hyperplasie de la moelle osseuse, une augmentation du poids des reins, des changements dans l’histologie tubulaire, une dégénérescence de l’épithélium olfactif, une hypertrophie des cellules chromophobes dans le lobe antérieur de l’hypophyse, une atrophie des glandes gastriques et des testicules, et une augmentation de la fréquence de la dégénérescence de l’épithélium germinal des testicules et de l’hypospermie bilatérale à 300 et 600 mg/kg p.c./j chez les deux sexes (NTP, 2011a). La concentration d’enzymes, dont l’alanine aminotransférase sérique, la sorbitol déshydrogénase et les sels biliaires, a augmenté de manière significative, et ces changements correspondaient aux lésions histopathologiques observées à 300 et 600 mg/kg p.c./j dans le foie chez les animaux des deux sexes. Les changements macroscopiques consistaient en une augmentation significative du poids absolu et du poids relatif du foie et en une coloration anormale du foie, et ces changements ont été suivis par une évaluation histopathologique du foie qui a montré une augmentation liée à la dose de l’hypertrophie des hépatocytes, de l’hyperplasie des cellules ovales, de l’hyperplasie des voies biliaires et des signes d’inflammation chronique chez les animaux des deux sexes de tous les groupes exposés à des doses (NTP, 2011a). À la dose de 600 mg/kg p.c./j, on a observé un adénome hépatocellulaire chez 1 rat mâle sur 10 et un cholangiocarcinome (cancer des voies biliaires) chez 2 rats mâles sur 10. Les auteurs de l’étude ont conclu que le foie était le principal organe ciblé par l’estragol chez le rat (NTP, 2011a).
Dans une étude de 90 jours, des souris B6C3F1 mâles et femelles ont reçu par gavage 0, 37,5, 75, 150, 300 ou 600 mg/kg p.c./j d’estragol 5 jours par semaine (NTP, 2011a). Le traitement à l’estragol a entraîné la mort d’une souris mâle à la dose de 600 mg/kg p.c./j pendant la semaine 9. Toutes les souris femelles sont mortes au cours de la semaine 1 après une exposition à 600 mg/kg p.c./j, ce que les auteurs de l’étude ont associé à une nécrose du foie causée par l’estragol (NTP 2011a). Tout comme chez les rats, les auteurs de l’étude ont indiqué que le foie était l’organe cible chez les souris en raison de l’augmentation du poids du foie, de l’hypertrophie hépatocytaire, de la dégénérescence hépatocellulaire, de l’hyperplasie des cellules ovales et de la nécrose dans tous les groupes de doses, à l’exception du groupe ayant reçu 37,5 mg/kg p.c./j (NTP, 2011a). On a observé, principalement à 300 et 600 mg/kg p.c./j, une dégénérescence statistiquement significative des glandes gastriques de l’estomac glandulaire, une hyperplasie squameuse, une minéralisation et un ulcère du préestomac, ainsi qu’une dégénérescence de l’épithélium olfactif (NTP, 2011a).
Dans l’ensemble, les auteurs de l’étude ont conclu que le foie était le principal organe cible chez les rats et les souris mâles et femelles après une exposition subchronique de 90 jours à l’estragol. Cette substance présentait également une activité cancérogène. Toutefois, il a été reconnu que cette étude d’exposition de 90 jours ne permettait pas d’évaluer entièrement le potentiel cancérogène de l’estragol (NTP, 2011a). Les auteurs de l’étude du NTP (2011a) ont reconnu également que de nombreuses études ont révélé le potentiel hépatocancérogène de l’estragol ou de substances de structure apparentée (safrole ou méthyleugénol) chez les rats et les souris après une exposition à long terme.
Cependant, la littérature scientifique disponible ne permet pas de calculer une BMDL10. Faute d’études suffisantes sur la relation dose-réponse avec l’estragol, on a adopté une approche de lecture croisée, et utilisé les données sur le danger obtenues par lecture avec l’analogue, en l’occurrence le méthyleugénol, pour caractériser le risque cancérogène.
Les résultats des essais de génotoxicité avec l’estragol étaient généralement négatifs chez Salmonella typhimurium (S. typhimurium) (Drinkwater et al., 1976; Swanson et al., 1979; Sekizawa et Shibamoto, 1982; NTP, 2011a), de même que dans le test de recombinaison avec Bacillus subtilis (Sekizawa et Shibamoto 1982), mais aussi avec des cellules V79 de hamster, probablement en raison du métabolisme complexe nécessaire à la bioactivation in vivo. Des résultats positifs ont été rapportés pour l’estragol lorsque les résultats relatifs aux métabolites toxiques présumés, à savoir le 1’-hydroxyestragol et les époxydes d’allyle, étaient positifs dans les essais de mutagénicité avec ou sans activation exogène (EMA 2020).
L’estragol s’est révélé positif dans les cellules V79 lors du test d’échange de chromatides sœurs et du test des comètes en conditions alcalines, ainsi que dans deux lignées de cellules CHO lors du test des comètes (Martins et al., 2012). Les résultats de tous les tests ont été positifs sans activation métabolique, ce qui semble indiquer que l’estragol, en plus d’être métabolisé en métabolites génotoxiques, peut également être un agent génotoxique à action directe formant des adduits à l’ADN. Plusieurs études in vivo réalisées chez des rongeurs adultes ont montré que la génotoxicité de l’estragol lui‑même est causée par des adduits à l’ADN détectés par l’test de synthèse non programmée de l’ADN dans le foie (Phillips et al., 1984; Randerath et al., 1984; Nesslany et al., 2010; Paini et al., 2012; Suzuki et al., 2012), dans les poumons et les reins (Paini et al., 2012), et in vitro dans des cellules d’hépatomes humains (HepG2; Zhou et al., 2007). L’estragol est considéré comme génotoxique, car il produit spécifiquement des adduits à l’ADN dans des modèles animaux et des cellules hépatiques humaines, et comme cancérogène dans des modèles animaux.
L’estragol est un alkylbenzène dont la structure est apparentée à celle du méthyleugénol (CIRC, 2014). Sur le plan chimique, l’estragol est un 4‑méthoxyallylbenzène et le méthyleugénol est un 3,4-diméthoxyallylbenzène. La seule différence structurale entre l’estragol et le méthyleugénol est que ce dernier contient un deuxième groupe méthoxy. Comme ces deux substances ont le même squelette et les mêmes substituants cycliques, elles devraient être similaires en ce qui concerne leur devenir métabolique, leur pharmacocinétique et leur potentiel toxicologique. Elles présentent toutes deux des propriétés physico-chimiques et des profils mécanistiques comparables, sont biodisponibles et donnent des résultats positifs aux tests de cancérogénicité (génotoxicité) avec la boîte à outils QSAR de l’OCDE (OECD QSAR Toolbox, 2016). Le méthyleugénol et l’estragol sont métabolisés principalement par le CYP1A2 qui produit des métabolites génotoxiques et cancérogènes similaires (CIRC, 2014). Le méthyleugénol, tout comme l’estragol, n’est pas mutagène chez les bactéries, mais cause des aberrations chromosomiques in vitro et forme des adduits à l’ADN in vivo dans le foie des rongeurs et in vitro dans des cellules hépatiques humaines (CIRC, 2014).
Sabinène
La seule information dont on dispose sur les effets du sabinène sur la santé est le résultat positif d’un essai de mutation inverse sur bactéries faisant appel à la souche TA 1535 de S. typhimurium, en l’absence ou en présence d’activation métabolique (Dossier d’enregistrement de l’ECHA, 2017). Faute de données sur le sabinène concernant sa génotoxicité, sa cancérogénicité ou sa toxicité pour la reproduction et le développement, l’EFSA a utilisé une DSENO de 222 mg/kg p.c./j pour le bêta‑caryophyllène (substance bicyclique, groupe des hydrocarbures non aromatiques) comme substance justificative pour son évaluation du sabinène (EFSA, 2015).
Terpinolène
On n’a trouvé aucune étude de cancérogénicité portant sur le terpinolène.
Dans un test épicutané, le terpinolène n’était ni un irritant ni un sensibilisant cutané chez les humains exposés à une concentration de 20 % dans du pétrolatum (gelée de pétrole) pendant 48 heures (Opdyke 1988).
Dans une étude de toxicité pour la reproduction et le développement menée conformément à la ligne directrice 422 de l’OCDE, des rats Sprague-Dawley mâles et femelles (10/dose/sexe) ont reçu par voie orale 0, 800, 2 500 ou 5 000 ppm (équivalant à 0, 54,1, 154,6 ou 300,8 mg/kg p.c./j, respectivement) de terpinolène dans leur régime alimentaire avant et pendant la période d'accouplement des deux sexes (jusqu’à 42 jours pour les mâles) et pendant la gestation et le début de la lactation des femelles uniquement (environ 100 jours pour les femelles) (dossier d’enregistrement de l’ECHA, 2020a). Certains mâles ont eu une période de récupération de 2 semaines. Les auteurs de l’étude n’ont observé ni mortalité ni signe clinique. Ils ont cependant observé une réduction significative du poids corporel et de la quantité ingérée par le régime alimentaire chez les mâles et les femelles du groupe ayant reçu 5 000 ppm et chez les femelles du groupe ayant reçu 2 500 ppm. Une diminution du poids corporel a également été observée chez les femelles du groupe ayant reçu 800 ppm. Les auteurs de l’étude ont conclu que les effets sur le poids corporel découlaient de la faible sapidité du régime alimentaire (dossier d’enregistrement de l’ECHA, 2020a). Ils n’ont détecté aucun effet lié au traitement sur la performance de l’accouplement, la fertilité ou la durée de la gestation. Seuls les mâles du groupe ayant reçu 5 000 ppm ont présenté une augmentation du poids du foie (poids absolu et poids relatif au poids corporel). Chez les mâles des groupes ayant reçu 2 500 ou 5 000 ppm, une hypertrophie des cellules centrolobulaires du foie, réversible après 2 semaines sans traitement, a été constatée. Une réduction du poids corporel des petits a été détectée au JPN 7 dans le groupe des portées dont les mères avaient reçu 5 000 ppm. À la lumière de ces résultats, les auteurs de l’étude ont déterminé une DSENO pour la toxicité générale de 151,5 et 294,6 mg/kg p.c./j (2 500 et 5 000 ppm) pour les femelles et les mâles, respectivement, une DSENO pour la toxicité maternelle et pour le développement de 2 500 ppm (correspondant à 356 mg/kg p.c./j), et une DSENO pour la toxicité pour la reproduction de 5 000 ppm, représentant la dose d’essai la plus élevée dans cette étude (correspondant à 294,6 mg/kg p.c./j) (dossier d’enregistrement de l’ECHA, 2020a).
Le terpinolène n’a pas été génotoxique dans l’essai des micronoyaux ou l’essai d’échange de chromatides sœurs et n’a eu aucun effet sur la concentration de la 8‑oxo‑2’-désoxyguanosine dans les cellules du sang humain en culture (Turkez et al., 2014). Le terpinolène n’était pas non plus génotoxique dans l’essai de mutation génétique, le test d’Ames, l’essai d’aberration chromosomique et l’essai des micronoyaux dans les lymphocytes humains avec ou sans activation métabolique (dossier d’enregistrement de l’ECHA, 2020a).
cis-Anéthol et trans-anéthol
Les deux anéthols sont distribués et métabolisés de manière similaire chez le rat, le lapin, l’humain et la souris (Tisserand et Young, 2014). Le trans-anéthol subit une biotransformation par trois voies principales : l'O-déméthylation, la N-oxydation et l’époxydation. La troisième voie peut produire des métabolites toxiques et est considérée comme une voie mineure (3 %) chez l’humain (Tisserand et Young, 2014). Chez les rongeurs, le trans-anéthol est métabolisé différemment en fonction de la dose, ce qui n’est pas le cas chez l’humain (Tisserand et Young, 2014).
Le cis-anéthol est également appelé (Z)-anéthol et est nettement plus toxique que le (E)-anéthol commun (trans-anéthol) (Tisserand et Young, 2014). Le cis- et le trans-anéthol sont tous deux considérés comme des isomères de l’estragol (US NLM, 2014). La DL50 de la voie orale a été établie à 150 mg/kg pour le cis-anéthol chez les rats (RTECS, 2019). On ne dispose d’aucune autre donnée empirique sur les effets du cis‑anéthol sur la santé.
En Australie, le trans-anéthol a déjà été examiné par le NICNAS dans le cadre d’une évaluation des produits chimiques existants d’intérêt prioritaire réalisée en 2016, et le seul effet sur la santé signalé était une sensibilisation cutanée (NICNAS 2016a). L’OMS a évalué l’innocuité du trans-anéthol et a conclu qu’il était peu probable que cette substance soit génotoxique, mais a ajouté que les données disponibles étaient insuffisantes pour permettre une évaluation définitive de la signification des tumeurs hépatiques malignes observées chez les rongeurs (OMS, 1991). L’Organisation a calculé une DSENO de 300 mg/kg p.c./j d’après une hypertrophie des cellules hépatiques chez le rat à 600 mg/kg p.c./j, après une exposition par voie orale de 90 jours (OMS, 1999).
Des souris CD-1 mâles et femelles (5/sexe/dose) ont reçu par voie orale une dose de 0, 60, 120, 240, 360 ou 500 mg/kg p.c./j de trans-anéthol ajouté dans leur régime alimentaire, pendant 28 jours (Newberne et al., 1999). Les auteurs de l’étude ont observé que l’ajout de trans-anéthol au régime alimentaire rendait les aliments très peu sapides pour les souris aux doses élevées, ce qui se traduisait par une diminution de la prise alimentaire et de la prise de poids corporel (Newberne et al., 1999). Aucun changement biochimique macroscopique ou histopathologique n’a été observé (Newberne et al., 1999).
Les mêmes auteurs ont ensuite utilisé l’étude précédente pour déterminer la plage de doses pour une étude de 90 jours. Des souris CD-1 mâles et femelles (20/sexe/dose) ont reçu par voie orale 0, 30, 60, 120 ou 240 mg/kg p.c./j de trans-anéthol ajouté dans leur régime alimentaire pendant 90 jours (Newberne et al., 1999). Les auteurs ont observé une mortalité accrue aux doses de 60 mg/kg p.c./j et plus chez les mâles et aux doses de 120 mg/kg p.c./j et plus chez les femelles. Ils ont attribué cette mortalité au « syndrome d’inanition », caractérisé par une diminution de la consommation d’aliments, de l’ingestion d’eau et de l’activité physique, probablement associée à la faible sapidité des aliments (Newberne et al., 1999). Le poids corporel a diminué chaque semaine aux doses de 120 mg/kg p.c./j et plus chez les mâles et à celle de 240 mg/kg p.c./j chez les femelles, diminution qui était accompagnée d’une diminution de la consommation quotidienne d’aliments. L’examen macroscopique et histopathologique a montré une réduction du glycogène hépatique aux doses de 30 mg/kg p.c./j et plus chez les mâles et aux doses de 60 mg/kg p.c./j et plus chez les femelles. Une réduction du poids des reins, du cerveau et de la rate a été observée chez les mâles à la dose maximale et a été corrélée avec une diminution de la cellularité dans ces organes (Newberne et al., 1999). Les auteurs de l’étude ont également observé une augmentation de l’hypertrophie des cellules hépatiques chez les mâles exposés aux doses de 60 mg/kg p.c./j et plus, ainsi qu’une hypertrophie du foie et une augmentation, liée à la dose, du poids relatif du foie dans tous les groupes de mâles traités. Ils ont estimé que ces effets sont des réponses physiologiques adaptatives aux voies métaboliques connues du trans-anéthol chez les rongeurs (Newberne et al., 1999). Ils n’ont observé aucune autre différence, notamment sur le plan histopathologique, entre les groupes de femelles traitées et les groupes témoins. L’analyse chimique du sang a révélé une augmentation des concentrations de l’alanine et de l’aspartate transaminase aux doses de 120 mg/kg p.c./j et plus, qui, conjuguée à l’hypertrophie des cellules du foie, semble indiquer une induction enzymatique, selon la conclusion des auteurs de l’étude (Newberne et al., 1999). Une augmentation de la phosphatase alcaline aux doses de 120 mg/kg p.c./j et plus a également été observée chez tous les animaux traités. À l’exception de la diminution du glycogène hépatocellulaire, aucun effet nocif n’a été observé dans le foie des souris femelles (Newberne et al., 1999). Vu l’absence de tout signe histopathologique, une variation minime dans le sérum sanguin et une forte diminution de la quantité de nourriture ingérée, en raison de la faible sapidité de la nourriture, chez les deux sexes, les auteurs de l’étude ont calculé une DSENO supérieure à 240 mg/kg p.c./j (Newberne et al., 1999). Comme il n’y avait pas de période de récupération pour confirmer que les effets observés dans le foie, les reins, le cerveau et la rate des mâles étaient de nature adaptative, la DMENO de 30 mg/kg p.c./j a été établie d’après la toxicité hépatique liée à la dose chez les souris mâles.
Dans une étude sur la toxicité pour la reproduction, des rats Wistar mâles et femelles ont reçu par voie orale 0 % ou 1 % de trans-anéthol (la dose réelle de trans-anéthol variant de 1 400 mg/kg p.c./j pendant les premières semaines de traitement à 700 mg/kg p.c./j à la fin de la période précopulatoire) ajouté au régime alimentaire pendant 70 jours (OMS, 1999; dossier d’enregistrement de l’ECHA, 2020b). Les rats ont été appariés un à un pendant au plus 15 jours, où 9 couples de rats avaient un régime alimentaire témoin (groupe I), 9 couples de rats un régime alimentaire avec traitement (groupe IV), les mâles de 10 couples recevant un régime alimentaire témoin et les femelles de 10 couples de femelles recevant un régime alimentaire avec traitement (groupe II), et les mâles de 10 couples recevant un régime alimentaire avec traitement et les femelles de 10 couples recevant un régime alimentaire témoin (groupe III). Après le sevrage, les petits ont reçu le même traitement alimentaire que leurs deux parents. Une alimentation appropriée a été maintenue avant et pendant la période de reproduction, et pendant la gestation et la lactation. Quatre générations ont été ainsi produites selon le même schéma. En outre, on a mené une expérience d’adoption croisée en accouplant six femelles témoins et six femelles traitées de la génération F1 avec un nombre égal de mâles de la génération F1 du groupe témoin. À la naissance, on a échangé les portées des mères témoins et traitées, et les portées ont été élevées par une mère de l’autre groupe (OMS, 1999; dossier d’enregistrement de l’ECHA, 2020b). Tous les groupes de rats traités au trans-anéthol ont présenté un ralentissement de la prise de poids corporel. La consommation d’aliments a diminué chez les rats traités au cours des premières semaines de l’étude, mais elle était généralement comparable à celle du groupe témoin pendant le reste de la période de traitement, sauf chez les mâles et les femelles F2, dont la quantité de nourriture consommée était significativement inférieure à celle des animaux témoins pendant toute la période de reproduction. On n’a observé aucune différence dans les paramètres de reproduction tels que l’indice de fertilité, l’indice de gestation, la viabilité des petits ou la taille de la portée (OMS, 1999; dossier d’enregistrement de l’ECHA, 2020b). Les auteurs de l’étude n’ont observé aucun signe clinique. Le poids corporel des petits, par portée, avait diminué chez tous les jeunes élevés par des mères traitées, quel que soit le régime alimentaire des mâles ou des mères pendant la gestation. Ainsi, la croissance postnatale était associée à l’exposition des mères au trans-anéthol pendant la lactation, mais pas pendant la gestation. Les auteurs de l’étude semblent indiquer que la substance à l’essai aurait pu être directement toxique par le lait plutôt que par un effet sur la qualité de l’alimentation (OMS, 1999; dossier d’enregistrement de l’ECHA, 2020b).
Dans une étude sur la toxicité pour la reproduction dans une génération, des rats Sprague-Dawley femelles (10/dose) ont reçu, par gavage, 0, 35, 175 ou 350 mg/kg p.c./j de trans‑anéthol pendant 7 jours avant l’accouplement, 7 jours lors de la période d’accouplement avec des mâles non traités, 21 jours lors de la gestation et de la mise bas, et jusqu’au jour 4 de la lactation (environ 40 jours en tout) (OMS, 1999). Le poids corporel et la consommation d’aliments des femelles du groupe ayant reçu la dose élevée étaient significativement plus faibles pendant la période précopulatoire, la gestation et la lactation (OMS, 1999). La même tendance a été observée dans le groupe ayant reçu la dose intermédiaire, mais elle n’était pas significative. Pendant la lactation, certains animaux du groupe ayant reçu la dose élevée semblaient être en mauvais état, comme l’ont indiqué les observations cliniques, notamment une émaciation, un mauvais entretien de la fourrure pâle et la présence de taches sur la fourrure (OMS, 1999). Le traitement n’a pas modifié la performance de l’accouplement ni la fertilité. Cependant, on a observé une augmentation du nombre de petits mort-nés, une diminution du nombre de petits vivants à la naissance (indice de viabilité) et une diminution du poids des petits dans le groupe ayant reçu la dose élevée (OMS, 1999). Aucun effet de ce type n’a été observé dans les groupes exposés aux doses faibles et intermédiaires. La DSENO a été établie à 175 mg/kg p.c./j (OMS, 1999).
Dans une étude de cancérogénicité, des rats Sprague-Dawley mâles et femelles (26 à 78/dose) ont reçu par voie orale 0, 0,25, 0,5 ou 1 % de trans-anéthol (équivalant à 0, 100, 200 ou 400 mg/kg p.c./j pour les femelles et à 0, 120, 250 ou 550 mg/kg p.c./j pour les mâles, respectivement) dans leur régime alimentaire pendant 2 ans (Truhaut et al., 1989). Aucune mortalité ni aucun signe clinique lié au traitement n’a été observé. Toutefois, on a remarqué, chez les deux sexes, un retard passager dans la prise de poids corporel découlant d’une diminution de la quantité d’aliments ingérés au cours des premières semaines de traitement (Truhaut et al., 1989). Aucun effet toxicologique n’a été observé. Certaines lésions néoplasiques ont été constatées, notamment des adénomes et des carcinomes hépatocellulaires, dans le groupe de femelles ayant reçu la dose élevée, ainsi que des lésions non néoplasiques chez les animaux des deux sexes du groupe ayant reçu la dose élevée, tandis qu’une hyperplasie nodulaire a été signalée chez les mâles du groupe ayant reçu la dose intermédiaire (Truhaut et al., 1989). Des pathologistes indépendants ont examiné les résultats de cette étude et tous ont convenu qu’il y avait eu une nette augmentation des adénomes ou des carcinomes hépatocellulaires chez les femelles du groupe ayant reçu la dose élevée (1 %), mais non chez les mâles, quelle que soit la dose (OMS, 1991).
Plusieurs études in vitro ont montré que le trans-anéthol n’était pas génotoxique : test d’Ames ayant fait appel aux souches TA98, TA100, TA1535, TA1537 ou TA1538 de S. typhimurium (Hsia et al., 1979; Swanson et al., 1979; Nestmann et al., 1980; Sekizawa et Shibamoto, 1982; Mortelmans et al., 1986; Heck et al., 1989 et Gorelick, 1995), essai d’aberration chromosomique (Gorelick, 1995) et test de synthèse non programmée de l’ADN (Heck et al., 1989; Marshall et al., 1989; Howes et al., 1990 et Müller et al., 1994). Le trans-anéthol n’était pas non plus génotoxique dans l’essai des micronoyaux in vivo chez des souris Swiss mâles (Abraham, 2001) ni dans le test in vivo de synthèse non programmée de l’ADN (Marshall et Caldwell, 1996). Le trans-anéthol ne s’est avéré positif que dans le test du lymphome de souris avec activation métabolique (Heck et al., 1989 et Gorelick, 1995).
Élémicine
L’élémicine est un alkylbenzène dont la structure s’apparente à celle du méthyleugénol. Elle s’en distingue par la présence d’un groupe méthoxy supplémentaire sur le cinquième carbone du cycle phényle. Une recherche effectuée dans les bases de données toxicologiques a révélé des lacunes dans les données sur les dangers de l’élémicine. De plus, on n’a trouvé aucune étude de toxicité chronique, à court terme, pour le développement ni d’études sur d’autres animaux.
Dans un test in vitro de synthèse non programmée de l’ADN, la métabolisation de l’élémicine par la voie de la 1’‑hydroxylation a entraîné la formation d’adduits à l’ADN par le même mécanisme que pour le méthyleugénol (Hasheminejad et Caldwell, 1994). En outre, il a été montré que l’élémicine provoque des cassures des brins d’ADN dans un test de synthèse non programmée de l’ADN sur le foie de fœtus de dinde (Kobets et al., 2016) et dans une étude in vitro sur des hépatocytes de rats en culture (Hasheminejad et Caldwell, 1994). Il n’existe pas d’autres données sur les dangers de l’élémicine.
Une comparaison entre l’élémicine et le méthyleugénol montre que tous deux ont des propriétés physico-chimiques et des profils mécanistiques comparables, qu’ils sont biodisponibles et qu’ils présentent des alertes dans une étude de liaison à l’ADN de l’OCDE pour la mutagénicité in vivo et la cancérogénicité (génotoxicité), alertes obtenues à l’aide de la boîte à outils QSAR de l’OCDE (OECD QSAR Toolbox, 2016). Le méthyleugénol était l’analogue le plus similaire (78,57 %) des analogues proposés par la boîte à outils QSAR de l’OCDE. Étant donné ces similarités, le méthyleugénol est considéré, dans la présente évaluation, comme un analogue approprié de l’élémicine.
7.2.3 Caractérisation des risques pour la santé humaine
Le méthyleugénol, l’estragol et l’élémicine sont les principaux composants des essences d’estragon. Ces trois composants sont considérés comme des substances génotoxiques et cancérogènes, similaires sur le plan du mode d’action et de la puissance. Une BMDL10 de 22,2 mg/kg p.c./j pour le méthyleugénol (Suparmi et al., 2019) a été sélectionnée pour caractériser le risque découlant de l’exposition au méthyleugénol, à l’élémicine et à l’estragol présents dans les essences d’estragon.
Compte tenu des concentrations déclarées de méthyleugénol (2 % à 39 %), d’estragol (0 % à 82 %) et d’élémicine (0 % à 57 %) dans les essences d’estragon, on a supposé que la somme des concentrations du méthyleugénol, de l’estragol et de l’élémicine dans les essences d’estragon était de 100 %.
Les DJMDV ainsi que les ME résultantes pour les essences d’estragon utilisées comme aromatisants alimentaires et dans les produits disponibles aux consommateurs sont présentées dans le tableau 7-10. En outre, les DJMDV ainsi que les ME résultantes pour les produits faits soi-même ont été calculées et sont présentées dans le tableau 7‑11.
| Scénario d’exposition | DJMDVa (mg/kg p.c./j) | MEb |
|---|---|---|
| Aromatisant alimentaire (1 an et plus) | 5,37 × 10-4 | > 41 000 |
| Exposition générale par voie cutanée et par inhalation dans les hydratants corporels (0,3 %) | 1,75 × 10-1 | 127 |
| Exposition générale par voie cutanée et par inhalation dans les parfums corporels (100 %) | 3,44 | 6 |
| Exposition générale par voie cutanée et par inhalation dans les hydratants pour le visage (0,1 %) | 1,46 × 10-2 | 1 563 |
| Exposition générale par voie cutanée et par inhalation dans les nettoyants pour le visage (0,1 %) | 2,73 × 10-4 | > 80 000 |
| Exposition générale par voie cutanée et par inhalation dans les savons (0,3 %) | 3,85 × 10-4 | > 57 000 |
| Exposition générale par voie orale découlant de l’ingestion de capsules d’aide à la digestion (PSN) (0,0026 %) | 9,57 × 10-5 | > 200 000 |
a Les calculs sont présentés à l’annexe A.
b Les ME ont été calculées à l’aide d’une BMDL10 de 22,2 mg/kg p.c./j établie d’après la cancérogénicité du méthyleugénol.
| Scénario d’exposition | DJMDVa (mg/kg p.c./j) | MEb |
|---|---|---|
| Exposition générale par voie cutanée et par inhalation par des produits faits soi-même – diffuseurs aromatiques (100 %) | 1,20 | 18 |
| Exposition générale par voie cutanée et par inhalation par des produits faits soi-même – huiles de massage (3 %) | 8 × 10-2 | 278 |
| Exposition générale par voie cutanée et par inhalation par des produits faits soi-même – huiles pour le bain (100 %) | 4,05 × 10-2 | 549 |
| Exposition générale par voie cutanée et par inhalation par des produits faits soi-même – hydratants corporels (3 %) | 1,75 | 13 |
a Les calculs sont présentés à l’annexe B.
b Les ME ont été calculées à l’aide d’une BMDL10 de 22,2 mg/kg p.c./j établie d’après la cancérogénicité du méthyleugénol.
Les ME pour les essences d’estragon dans les aliments (d’après l’utilisation possible des essences d’estragon comme aromatisants), les capsules d’aide à la digestion (PSN), les nettoyants pour le visage et les savons sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
Toutefois, les ME comprises entre les concentrations entraînant un effet critique et celles de l’exposition journalière estimée pour les hydratants corporels, les parfums corporels et les hydratants pour le visage sont inférieures à 10 000. Ces valeurs tiennent compte des incertitudes découlant de l’extrapolation interspécifique, de l’extrapolation intraspécifique, du point de départ (PdD) et du caractère exhaustif de la base de données, et on considère qu’elles pourraient être insuffisantes. En outre, en ce qui concerne l’exposition aux essences d’estragon qui sont présentes dans des diffuseurs aromatiques, des huiles de massage, des huiles pour le bain et des hydratants corporels faits soi-même, les ME comprises entre les concentrations entraînant un effet critique et celles de l’exposition estimée, présentées dans le tableau 7-11, sont inférieures à 10 000, valeurs qui tiennent compte des incertitudes liées à l’extrapolation interspécifique, à l’extrapolation intraspécifique, au PdD et au caractère exhaustif de la base de données, et on considère qu’elles pourraient être insuffisantes.
7.2.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Incidence |
|---|---|
| Les essences d’estragon sont considérées comme étant composées uniquement d’estragol, d’élémicine et de méthyleugénol. | + |
| On n’a trouvé aucune étude de toxicité à court terme, de toxicité chronique, de toxicité pour la reproduction et le développement et de cancérogénicité pour les essences d’estragon. | +/- |
| Une BMDL10 pour le méthyleugénol a été sélectionnée pour représenter le pouvoir cancérogène du méthyleugénol, de l’estragol et de l’élémicine pris ensemble. | +/- |
| On n’a trouvé aucune étude appropriée pour déterminer l’exposition par voie cutanée ou par inhalation. Par conséquent, on a procédé à une extrapolation de voie à voie pour les essences d’estragon en faisant appel à des scénarios d’exposition par voie cutanée et par inhalation et en comparant les concentrations obtenues à celles entraînant un effet d’une étude de toxicité par voie orale. | +/- |
+ = incertitude pouvant causer une surestimation de l’exposition ou du risque; - = incertitude pouvant causer une sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu de surestimation ou de sous-estimation du risque.
7.3 Sous-groupe 1 des phénylpropanoïdes (essences de jasmin, et parfums et essences de jasmin)
7.3.1 Évaluation de l’exposition
Milieux environnementaux
Compte tenu de la faible quantité (< 100 kg) déclarée en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), on ne s’attend pas à ce qu’il y ait une exposition à ces substances dans les milieux environnementaux. Aucun rapport de surveillance des essences de jasmin dans les milieux environnementaux au Canada ou ailleurs n’a été trouvé.
Aliments
On n’a trouvé aucun renseignement définitif concernant l’utilisation possible des essences de jasmin comme aromatisants dans des aliments vendus au Canada. Toutefois, comme cette substance est utilisée comme aromatisant alimentaire partout dans le monde, il est possible qu’elle soit présente comme aromatisant dans des aliments vendus au Canada.
Selon le Handbook of Flavour Ingredients de Fenaroli, l’absorption estimée par personne (par habitant) d’essences de jasmin utilisées comme aromatisants alimentaires est de 9,88 × 10-3 μg/kg p.c./j, d’après la méthode de calcul de la dose maximale journalière basée sur des données d’enquête utilisée pour la population des États-Unis (Burdock, 2010).
Faute de données sur l’utilisation réelle, le cas échéant, des essences de jasmin comme aromatisants dans des aliments vendus au Canada, l’estimation de la dose journalière par habitant pour la population des États-Unis (Burdock, 2010) est jugée acceptable pour l’exposition par le régime alimentaire de la population générale âgée de 1 an et plus au Canada, à cette substance découlant de son utilisation possible comme aromatisant alimentaire (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
Exposition à la substance présente naturellement dans les aliments :
On ne dispose d’aucune donnée de référence concernant la présence naturelle d’essences de jasmin dans les aliments. L’exposition alimentaire à cette substance dans les aliments dans lesquels elle est présente naturellement, le cas échéant, devrait être faible (Nijssen et al., 2018).
Produits disponibles aux consommateurs
Les essences de jasmin sont présentes dans des produits disponibles aux consommateurs. Afin d’évaluer le potentiel d’exposition aux essences de jasmin présentes dans des cosmétiques et des PSN appliqués, par voie cutanée et par inhalation, des scénarios sentinelles ont été sélectionnés d’après une combinaison de fréquence d’utilisation et de concentrations rapportées d’essences de jasmin dans ces produits. Les scénarios sentinelles sélectionnés sont ceux dont les valeurs d’exposition sont les plus élevées par rapport à d’autres cosmétiques et PSN dans lesquels les essences de jasmin sont utilisées comme ingrédient non médicinal, d’après les produits dans lesquels ces substances seraient présentes, selon les déclarations. L’exposition aux essences de jasmin découlant de leur utilisation dans divers produits : après-shampooings, nettoyants corporels, hydratants corporels, produits hydratants pour le visage ou produits pour le traitement de l’acné faciale (PSN), crèmes de traitement à application topique (PSN), parfums corporels, produits coiffants en aérosol, antisudorifiques, déodorants, colorants capillaires temporaires, écrans solaires (PSN) et nettoyants antiseptiques pour la peau (PSN). Les expositions à ces produits ont été considérées comme des scénarios sentinelles pour les applications cutanées (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020 et 2021; sans référence).
Les essences de jasmin sont également présentes dans un rouge à lèvres. L’exposition par voie orale découlant de l’utilisation du rouge à lèvres a été quantifiée (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
En ce qui concerne l’utilisation d’essences de jasmin pures dans des produits faits soi-même, l’exposition journalière devrait être la plus élevée lors de l’utilisation des essences dans un diffuseur aromatique, des huiles de massage, des huiles pour le bain, des hydratants corporels et des brumisateurs faciaux, avec une concentration maximale déclarée de 100 %. Bien que la concentration maximale des essences de jasmin déclarée dans les huiles de massage soit de 100 %, les huiles de massage sont généralement diluées avant utilisation. Ainsi, la concentration maximale d’essences de jasmin dans les huiles de massage faites soi-même est présumée être de 3 % par le RIVM (2006). Il a été déclaré que les essences pour produits corporels sont habituellement diluées pour obtenir une concentration finale de 1 % à 4 % (Tisserand Institute, 2021). À la lumière de ces renseignements, la concentration maximale d’essences de jasmin dans les hydratants corporels faits soi-même a été estimée à 3 %.
Selon les données tirées du site Web de l’American Cleaning Institute, les essences de jasmin peuvent être utilisées comme ingrédients parfumants dans les nettoyants tout usage, les détergents à vaisselle, les assouplisseurs de tissus et les détergents liquides pour le linge (ACI, 2020). Afin d’évaluer l’exposition possible aux essences de jasmin découlant de leur utilisation dans des produits domestiques de nettoyage, on a quantifié l’exposition due à leur utilisation dans des nettoyants tout usage liquides et en aérosol à une concentration maximale de 1 %, dans un assouplisseur de tissus en aérosol à 5 % et dans un détergent liquide pour le linge à 5 % pour le lavage à la machine (ACI, 2020).
Pour calculer l’exposition générale à partir de l’exposition cutanée aux essences de jasmin, on a sélectionné une valeur d’absorption cutanée de 50 % d’après les considérations qui suivent. L’absorption cutanée du benzoate de benzyle et de l’acétate de benzyle, qui sont deux des principaux composants des essences de jasmin, a été déterminée dans une étude in vivo réalisée chez des singes rhésus. Les valeurs ont été obtenues lors d’un test épicutané recouvert et non recouvert. Les valeurs d’absorption cutanée sur les sites non recouverts étaient de 34,6 % et 57 % pour l’acétate de benzyle et le benzoate de benzyle, respectivement, les substances ayant été absorbées surtout au cours des 24 premières heures suivant l’administration topique. L’absorption du benzoate de benzyle et de l’acétate de benzyle peut être un indicateur de la capacité de ces composés à être absorbés lorsqu’ils sont appliqués sur la peau humaine (Bronaugh et al., 1990).
Afin d’estimer l’exposition générale aux essences de jasmin, les valeurs estimées de l’exposition par voie orale, par inhalation et par voie cutanée ont été additionnées, le cas échéant. Pour tenir compte de la quantité de produit absorbée par voie cutanée, la quantité de produit pouvant être inhalée a été ajustée par un facteur de 50 %, sauf pour les hydratants corporels. Dans le cas des hydratants corporels, comme la quantité de produit absorbée par inhalation a été ajustée pour tenir compte de la superficie exposée et que cette valeur était inférieure à 50 % de la quantité de produit administré, aucun autre ajustement n’a été apporté à la quantité de produit.
Les valeurs estimatives de l’exposition des personnes des groupes d’âge les moins et les plus exposés à ces produits disponibles aux consommateurs est présentée dans le tableau 7-13. Les valeurs estimatives de l’exposition générale journalière (somme de l’exposition par inhalation et par voie cutanée) aux produits faits soi-même contenant des essences de jasmin sont présentées dans le tableau 7‑14.
| Scénario de produit | Pourcentage dans le produit | Voie(s) d’exposition | Plage d’exposition (mg/kg p.c./j)a |
|---|---|---|---|
| Après-shampooings (avec rinçage) | 30 % | Cutanée et inhalation | 5,68 × 10-2 (adultes) à 6,44 × 10-2 (9–13 ans) |
| Nettoyants corporels (liquides) | 3 % | Cutanée et inhalation | 3,71 × 10-2 (adultes) à 0,13 (0–5 mois) |
| Hydratants corporels | 3 % | Cutanée et inhalation | 2,07 (adultes) à 4,78 (0–5 mois) |
| Produits hydratants pour le visage ou le traitement de l’acné (PSN) | 1 % | Cutanée et inhalation | 0,32 (adultes) à 0,40 (9–13 ans) |
| Crèmes de traitement à application topique (PSN) | 1 % | Cutanée et inhalation | 0,11 (adultes) à 0,14 (9–13 ans) |
| Écrans solaires en poudre pour le visage (PSN) | 0,07 % | Cutanée et inhalation | 2,2 × 10-3 (adultes) |
| Huiles essentielles en applicateur à bille pour la détente (PSN) | 0,01 % | Cutanée et inhalation | 3 × 10-4 (adultes) |
| Rouges à lèvres | 3 % | Orale | 1,78 × 10-2 (adultes) à 4,40 × 10-2 (2‑3 ans) |
| Parfums corporels | 82 % | Cutanée et inhalation | 3,12 (14-18 ans) à 9,14 (2–3 ans) |
| Produits coiffants en aérosol | 0,1 % | Cutanée et inhalation | 1,58 × 10-3 (14‑18 ans) à 4,26 × 10-3 (4–8 ans) |
| Antisudorifiques et déodorants | 2 % | Cutanée et inhalation | 0,11 (9–13 ans) à 0,18 (14–18 ans) |
| Colorants capillaires temporaires | 0,1 % | Cutanée et inhalation | 2,42 × 10-2 (adultes) à 7,73 × 10-2 (4‑8 ans) |
| Écrans solaires (PSN) | 0,07 % | Cutanée | 7,35 × 10-2 (9‑13 ans) à 3,32 × 10-1 (6‑11 mois) |
| Nettoyants antiseptiques pour la peau (PSN) | 2 % | Cutanée et inhalation | 0,38 (14–18 ans) à 1,1 (2–3 ans) |
| Nettoyants antiseptiques pour la peau (PSN)b | 2 % | Cutanée et inhalation | 5,67 (adultes) à 27,2 (2–3 ans) |
| Nettoyants tout usage en aérosol (par application et par essuyage) | 1 % | Cutanée et inhalation | 7 × 10-2 (adultes) |
| Nettoyants liquides tout usage pour plancher (mélange et chargement, et application) | 1 % | Cutanée et inhalation | 2,53 × 10-2 (adultes) |
| Exposition après le lavage des planchers | 1 % | Cutanée, inhalation et voie orale fortuite (contact main-bouche) | 1,16 × 10-2 (1 an) |
| Assouplisseurs de tissus en aérosol pour la lessive | 5 % | Inhalation | 2,45 × 10-2 (adultes) |
| Détergents liquides pour le linge (lavage à la machine; mélange et chargement, suspension des vêtements pour séchage et port de vêtements récemment lavés) | 5 % | Cutanée et inhalation | 1,86 × 10-1 (adultes) |
| Détergents liquides pour le linge (lavage à la machine, transfert depuis les tissus lavés) (tous les sous‑groupes de la population, à l’exception des adultes) | 5 % | Cutanée, inhalation et voie orale fortuite (contact objet-bouche) (1 an seulement) | 5,54 × 10-3 (14–18 ans) à 9,28 × 10-3 (0-6 mois) |
a Seules les valeurs pour les groupes d’âge les moins exposés et les plus exposés sont présentées. Les détails des calculs figurent à l’annexe A.
b Pour ce qui est des situations préoccupantes en matière de santé publique, la fréquence d’utilisation des désinfectants pour les mains dans la population générale peut augmenter jusqu’à 25 fois par jour (utilisation personnelle par les adultes, augmentation de la fréquence d’utilisation par les enfants dans les écoles et les garderies) (RIVM, 2021a).
| Scénario de produit | Pourcentage dans le produit | Voie(s) d’exposition | Plage d’exposition (mg/kg p.c./j)a |
|---|---|---|---|
| Diffuseurs aromatiques | 100 % | Cutanée et inhalation | 1,16 (adultes) à 1,97 (9–13 ans) |
| Huiles de massage | 3 % | Cutanée et inhalation | 6,89 × 10-1 (adultes) à 4,35 (0–5 mois) |
| Huiles pour le bain | 100 % | Cutanée et inhalation | 1,56 × 10-1 (adultes) à 2,51 × 10-1 (9–13 ans) |
| Hydratants corporels | 3 % | Cutanée et inhalation | 2,07 (adultes) à 4,78 (0–5 mois) |
| Brumisateurs faciaux | 100 % | Cutanée et inhalation |
1,05 à 1,19b (adultes) 3,13 à 3,47b (4–8 ans) |
| Brumisateurs faciaux – exposition des non‑utilisateurs (1 an seulement) | 100 % | Cutanée et inhalation | 5,26 × 10-1 |
a Seules les valeurs pour les groupes d’âge les moins exposés et les plus exposés sont présentées. Les détails des calculs figurent à l’annexe A.
b Après 4 heures d’exposition au total; lorsque l’appareil est fermé après 20 minutes d’utilisation, on suppose que la personne reste dans la pièce pendant 3 heures et 40 minutes après l’utilisation.
7.3.2 Évaluation des effets sur la santé
Il existe peu de données empiriques sur les effets sur la santé et il n’y a aucune évaluation internationale concernant les essences de jasmin.
Dans une étude sur la toxicité pour la reproduction, des rates (10/dose) ont reçu 0 ou 500 mg/kg p.c./j d’essences de Jasmine officinale var. grandiflorum par gavage pendant 3 phases œstrales (environ 15 jours), ce qui a causé une prolongation importante de la phase diœstrale chez les rates traitées (Iqbal et al., 1993). Les auteurs de l’étude n’ont pas donné de précisions sur les signes cliniques ou les effets du traitement.
Dans une autre étude des mêmes auteurs sur la toxicité pour la reproduction, des rates ont reçu 0, 250 ou 500 mg/kg p.c./j d’extrait de Jasmine officinale var. grandiflorum (extrait de jasmin) ajouté dans leur eau potable du jour de gestation (JG) 1 à JG 5 (15 rates/dose), du JG 8 à 12 (8 rates/dose) ou du JG 12 à 20 (6 rates/dose) (Iqbal et al., 1993). Les rates traitées pendant les JG 1 à 5 ont été euthanasiées au JG 10, tandis que les autres rates l’ont été au JG 20. Les auteurs de l’étude n’ont donné aucun détail au sujet de l’état clinique des rates traitées. Une augmentation des pertes après implantation liée à la dose (groupe témoin : 1,42 %, dose faible : 48,8 %, dose élevée : 75 %) et une diminution de la fertilité liée à la dose (groupe témoin : 100 %, dose faible : 92 %, dose élevée : 60 %) ont été observées du JG 1 à 5. Une mortalité fœtale plus élevée a été observée à la dose maximale (12,8 %) par rapport à celle du groupe témoin (1,2 %). Une augmentation de la résorption liée à la dose (groupe témoin : 3,44 %, dose faible : 7,89 %, dose élevée : 15,35 %) a été constatée du JG 8 au JG 12. On n’a remarqué aucun changement significatif dans le poids et la taille (longueur) des fœtus, ni aucune anomalie macroscopique du JG 12 à 20. Toutefois, les auteurs de l’étude n’ont pas examiné le squelette ni les organes des fœtus. Ils ont observé, chez toutes les rates traitées, une diminution de la progestérone au JG 5, mais pas aux JG 12 et 20, ce qui indique que les essences de jasmin peuvent avoir un effet perturbateur sur le système endocrinien au début de la gestation. Les auteurs de l’étude ont conclu que la diminution des concentrations de progestérone au JG 5 pouvait être responsable de l’effet anti-implantatoire chez les rates (Iqbal et al., 1993). D’après les résultats de l’étude, une DMENO de 250 mg/kg p.c./j, soit la plus faible dose à l’essai, a été calculée pour la toxicité pour la reproduction et le développement.
Afin d’éclairer l’évaluation des effets sur la santé, on a pris en compte les données sur les dangers disponibles pour les principaux composants des essences de jasmin, à savoir l’acétate de benzyle (0 % à 31 %), le benzoate de benzyle (3 % à 21 %), le (E,E)‑alpha-farnesène (1 % à 6 %), le linalol (7 % à 13 %), le phytol (11 % à 26 %), l’isophytol (5 % à 12 %) et le nérolidol (trace à 13 %).
Acétate de benzyle et benzoate de benzyle
On ne dispose d’aucune donnée empirique sur les effets de l’acétate de benzyle sur la santé, et seules deux études sur la toxicité pour la reproduction et le développement ont été trouvées pour le benzoate de benzyle.
L’acétate de benzyle et le benzoate de benzyle ont été ajoutés par l’EPA en tant qu’esters de benzyle dans la catégorie chimique des « dérivés du benzyle » (US EPA, 2010). L’acétate de benzyle et le benzoate de benzyle sont hydrolysés pour donner de l’alcool benzylique, qui est ensuite oxydé en acide benzoïque, un métabolite stable (US EPA, 2010). Comme ces molécules contiennent un cycle benzénique auquel est directement lié un groupe fonctionnel oxygéné qui est hydrolysé et/ou oxydé en acide benzoïque, ces substances et autres dérivés du benzyle ont été placés dans la même catégorie (US EPA, 2010). Après un examen exhaustif de la toxicocinétique de l’acétate de benzyle et du benzoate de benzyle, d’autres organismes internationaux tels que l’EFSA, le Research Institute for Fragrance Materials (RIFM) ou le Cosmetic Ingredient Review (CIR) ont corroboré la métabolisation rapide et importante des deux substances en acide benzoïque (EFSA, 2012; McGinty et al., 2012 et Johnson et al., 2017).
En 2019, ECCC et SC ont évalué plusieurs substances appartenant au groupe des benzoates, et toutes étaient des esters de l’acide benzoïque (ECCC, SC, 2019). La caractérisation du danger pour les trois sous-groupes dans l’évaluation préalable du groupe des benzoates (c’est-à-dire les benzoates d’alkyle simples, les dibenzoates et les tribenzoates) s’appuyait solidement sur des preuves empiriques voulant que ces substances s’hydrolysent facilement en acide benzoïque, qui est ensuite métabolisé en acide hippurique, puis excrété (ECCC, SC, 2019). Par conséquent, et conformément aux évaluations réalisées ailleurs dans le monde, l’évaluation préalable du groupe des benzoates a conclu que ces substances sont peu dangereuses et que le risque pour la santé humaine est faible (ECCC, SC, 2019).
Toutefois, le benzoate de benzyle semble pouvoir causer des effets nocifs pour le développement. Des rates Wistar gravides (5/dose) ont reçu par gavage 0, 25 ou 100 mg/kg p.c./j de benzoate de benzyle du JG 0 à 20 (Koçkaya et Kιlιç, 2011). On a déterminé la diminution de la quantité d’aliments consommés et d’eau ingérée chez les animaux du groupe ayant reçu la dose élevée, mais aucune variation du poids corporel ou de la prise de poids corporel n’a été observée. Dans le groupe ayant reçu la dose élevée, un pourcentage significativement plus élevé de lymphocytes et un pourcentage plus faible de monocytes, ainsi qu’une diminution des taux de créatinine ont été constatés. Une augmentation de l’aspartate aminotransférase a été mesurée dans les deux groupes traités. Le poids absolu du cœur chez les mères était plus élevé dans le groupe ayant reçu la dose élevée, mais aucun changement histopathologique n’a été remarqué. On a observé, à toutes les doses, chez les mères, un nombre significativement plus élevé d’œdèmes dans la région périvasculaire du cerveau et une vacuolisation dans le cortex. Certaines variations significatives dans les deux groupes traités ont été trouvées au niveau du squelette des fœtus, comme un radius plus court et un cubitus plus long. Un nombre significativement plus élevé de fœtus a présenté un élargissement de l’espace intermyofibrillaire du cœur des fœtus dans les deux groupes traités. À la dose de 100 mg/kg p.c./j, le poids et la longueur des fœtus étaient significativement plus élevés et le placenta (diamètre, épaisseur et poids) était plus imposant. Par contre, à la dose de 25 mg/kg p.c./j, le placenta était significativement plus petit. À la dose de 100 mg/kg p.c./j, le nombre d’implantations était moins élevé et on a observé une augmentation des résorptions liée à la dose, passant du groupe témoin (4 %) au groupe ayant reçu la dose faible (12 %), et cette augmentation était importante dans le groupe exposé à la dose élevée (20 %). Une DMENO de 25 mg/kg p.c./j a été estimée d’après l’augmentation liée à la dose du nombre de résorptions fœtales et d’œdèmes cérébraux chez les mères et des variations au niveau du squelette des fœtus.
Dans une autre étude de toxicité pour le développement, des rates Wistar gravides (21/dose) ont reçu par voie orale 0 %, 0,4 % ou 1 % de benzoate de benzyle (équivalant à 0, 26 ou 646 mg/kg p.c./j, valeurs déterminées par les auteurs, respectivement), dans leur régime alimentaire, du JG 1 au JPN 20 (dossier d’enregistrement de l’ECHA, 2020c). Un groupe de 14 animaux dans chaque groupe de dose a été sacrifié au JG 20, tandis qu’un autre groupe de 7 animaux par groupe de doses a été conservé jusqu’au JPN 21. Aucun signe clinique de toxicité ni changement du poids corporel n’ont été observés chez les mères. On a constaté une diminution des pertes après implantation uniquement dans le groupe ayant reçu la dose élevée, mais elle n’était pas statistiquement significative. Une augmentation non significative, liée à la dose, des malformations, comme la dilatation du bassinet du rein, un apex bifide du cœur, une anomalie du sous-maxillaire, une anomalie de la langue, une fente palatine ou une hétérotaxie a été observée dans le groupe témoin (1 %), le groupe à faible dose (1,2 %) et le groupe à dose élevée (8,8 %). Les auteurs de l’étude ont constaté un poids corporel plus faible chez les petits nés de mères traitées, mais ce phénomène n’a pas été jugé nocif par les auteurs, car il n’était pas statistiquement significatif et ne suivait pas un schéma de relation dose-réponse. Les auteurs n’ont observé aucun autre changement clinique. Ils ont calculé une DSENO de 646 mg/kg p.c./j, soit la dose d’essai la plus élevée (dossier d’enregistrement de l’ECHA, 2020c). Dans la présente évaluation, on recommande une DMENO de 26 mg/kg p.c./j, établie d’après la diminution du poids corporel des petits après leur naissance aux deux doses, en l’absence de toxicité maternelle, et l’augmentation des malformations chez les fœtus en l’absence de toxicité maternelle à 646 mg/kg p.c./j. En comparaison avec l’étude précédente (Koçkaya et Kιlιç, 2011), les différences dans les résultats peuvent être associées à la voie d’administration.
Dans un essai in vitro, le benzoate de benzyle est un compétiteur œstrogénique faible de l’œstradiol, mais il est capable de se lier aux récepteurs œstrogéniques humains ERα et ERβ, et d’augmenter le nombre de gènes rapporteurs sensibles aux œstrogènes (ERE-CAT) et de gènes pS2 sensibles aux œstrogènes endogènes dans les cellules MCF7 (Charles et Darbre, 2009). On a également obtenu des résultats positifs dans l’essai de prolifération des cellules MCF7 avec le benzoate de benzyle (Charles et Darbre, 2009). Les auteurs de l’étude ont conclu que le benzoate de benzyle a un effet œstrogénique sur les cellules humaines (Charles et Darbre, 2009).
Linalol
ECCC et SC ont évalué le linalol en tant que composant majeur des essences de bois de rose, et aucun effet préoccupant sur la santé n’a été relevé. L’exposition aux essences de bois de rose a donc été considérée comme présentant un faible risque pour la santé humaine (ECCC, SC, 2020).
(3E,6E)-alpha-Farnesène
On ne dispose d’aucune autre donnée empirique sur les effets du (3E,6E)-alpha-farnesène sur la santé.
L’EFSA a utilisé le bêta-myrcène comme substance représentative pour évaluer l’innocuité des hydrocarbures terpéniques acycliques, dont l’alpha-farnesène fait partie (EFSA, 2015). ECCC et SC ont déterminé une DSENO de 300 mg/kg p.c./j de bêta‑myrcène pour la toxicité pour la reproduction et le développement, d’après l’augmentation du taux de résorption, la diminution du nombre de fœtus vivants et l’augmentation de la fréquence des malformations squelettiques, comme la fusion des os zygomatiques, la dislocation du sternum et la formation de côtes lombaires supplémentaires à 500 mg/kg p.c./j chez le rat (ECCC, SC, 2020).
Phytol
Il existe peu de données empiriques sur les effets du phytol sur la santé. Le phytol est un alcool diterpénique acyclique qui peut être utilisé comme précurseur pour la fabrication de formes synthétiques de la vitamine E et de la vitamine K1 (NCBI, 2019).
Le phytol est classé comme promoteur de tumeurs par le Chemical Carcinogenesis Research Information System, dont le mode d’action inscrit dans la base de données PubChem est non spécifié (NCBI, 2019). Dans la base de données toxicogénomiques comparatives, le phytol nuirait aux gènes liés à la nécrose, à l’hypertrophie et aux lésions hépatiques et aux néoplasmes présents dans le foie, ainsi qu'aux gènes liés à l’hyperplasie et aux maladies pulmonaires, et aux tumeurs interstitielles et aux néoplasmes présents dans les poumons (CTD, 2019).
Un groupe de rats (6/dose) a reçu, dans le régime alimentaire, 2 % de phytol (équivalant environ à 1 000 mg/kg p.c./j) pendant 40 semaines (Steinberg et al., 1966). Un seul animal est mort à la fin de la période d’exposition. Tous les rats traités présentaient un poids corporel plus faible. Les auteurs n’ont décrit aucun résultat.
Dans plusieurs études, des souris et des rats, mâles et femelles, ont reçu, dans le régime alimentaire, 0 %, 0,5 % ou 1 % de phytol (ce qui équivaut environ à 0, 250 et 750 mg/kg p.c./j, respectivement) pendant des périodes variables (variant de 19 jours à 15 mois) (Steinberg et al., 1966; Atshaves et al., 2004, et Mackie et al., 2009). Aucun des animaux n’est mort, mais beaucoup ont présenté des signes d’hépatotoxicité accompagnés d’une hypertrophie et d’une hyperplasie ou d’une nécrose hépatocytaire accompagnée d’une inflammation dès le début du traitement chez tous les animaux traités.
Dans une étude de toxicité par inhalation à court terme, des rats Sprague-Dawley (5/sexe/dose) ont été exposés, par voie nasale uniquement, à une concentration moyenne de phytol en aérosol de 5,5 mg/L pendant 0 ou 30 minutes ou 1, 2, 4 ou 6 heures par jour pendant 14 jours consécutifs (Schwotzer et al., 2021). Les auteurs de l’étude ont estimé la plage de doses à 12,9 à 155,0 mg/kg p.c. à l’aide d’une fraction du dépôt de 10 % établie d’après la taille des particules d’aérosol. L’étude a pris fin de manière inattendue au jour 2 en raison de l’apparition de signes cliniques graves à toutes les durées de l’exposition et de mortalité après l’exposition dans les groupes exposés pendant 4 et 6 heures. Tous les animaux ont présenté une horripilation, une posture voûtée et une respiration rapide au cours des deux premiers jours. Les animaux exposés au phytol pendant 4 et 6 heures ont montré, à l’examen macroscopique, des poumons d’une coloration violette très anormale. Les poids absolu et relatif des poumons ont augmenté de manière significative après les expositions de 4 et 6 heures. De plus, les augmentations étaient liées à la dose. Les voies respiratoires ont montré une dégénérescence et une nécrose de l’épithélium du nez, des cornets nasaux, du larynx et de la trachée qui sont liées à la dose. Un œdème pulmonaire accompagné de fibrine et d’une inflammation généralisée des cellules mixtes, et une grande abondance de macrophages, de lymphocytes et de neutrophiles ont été observés dans les poumons après une exposition de 4 ou 6 heures. Chez les animaux ayant été exposés à 0,5, 1 et 2 heures, on a constaté une inflammation à cellules mixtes dans les poumons et une distribution centrolobulaire distincte. Les auteurs de l’étude n’ont trouvé aucun autre effet général. Cependant, ils ont calculé une DMENO de 10,8 mg/kg p.c./j pour le phytol, établie d’après le degré élevé de toxicité observé dans les poumons et la mortalité aux longues durées d’exposition après 2 jours (Shwotzer et al., 2021). Ils ont recommandé une évaluation plus poussée de l’exposition au phytol par inhalation, en raison du petit diamètre aérodynamique des particules (0,99 µm), indication d’une pénétration profonde dans les poumons, et parce que le plan expérimental de l’étude reposait sur l’hypothèse que la substance était peu toxique.
Le phytol ne s’est pas avéré mutagène aux tests d’Ames réalisés avec la souche TA100 de S. typhimurium, avec et sans activation métabolique, et dans l’essai de recombinaison et de mutation somatique (SMART, de l’anglais Somatic mutation and recombination test) sur la drosophile (Choi et al., 1993). Cependant, le phytol a présenté des effets clastogènes dans le test des comètes effectué avec Allium cepa (Islam et., 2017).
Plusieurs études in vitro ont montré que non seulement le phytol a un potentiel anti‑angiogénique et antiprolifératif, mais il arrête également le cycle cellulaire (la mitose) des cellules d’adénocarcinomes pulmonaires (Itoh et al., 2018, et Sakthivel et al., 2018).
Faute d’autres données, le phytol est jugé clastogène.
Isophytol
L’isophytol a fait l’objet d’un examen international dans le cadre d’un rapport d’évaluation initial (SIAR) de l’ensemble de données de dépistage (EDD) de l’OCDE, qui, d’après des données sur les animaux, a jugé l’isophytol comme étant faiblement toxique pour les mammifères (OCDE, 2003).
Dans une étude à court terme, des rats mâles et femelles (12/dose/sexe) ont reçu 0, 250, 500 ou 1 000 mg/kg p.c./j d’isophytol pendant 28 jours, au terme desquels ils ont bénéficié d’une période de récupération de 14 jours (OCDE, 2003). Aucun signe ou effet clinique n’a été observé aux doses faibles et moyennes. À la dose maximale, on a constaté des taches sur la fourrure, une augmentation du poids des reins et de la rate chez les femelles, une posture voûtée, une perte de poids, une pâleur et une augmentation du poids corporel chez les mâles, ainsi que certains changements dans l’hématologie et une augmentation du poids du foie chez les mâles et les femelles (OCDE, 2003). Aucun changement histopathologique n’a été observé, et la plupart des changements n’étaient plus apparents après la période de récupération (OCDE, 2003). D’après ces résultats, une DSENO de 500 mg/kg p.c./j et une DMENO de 1 000 mg/kg p.c./j ont été établies pour l’isophytol (OCDE, 2003).
Dans une étude de toxicité pour la reproduction et le développement, des rats mâles et femelles ont reçu par voie orale (gavage) 0, 250, 500 ou 1 000 mg/kg p.c./j d’isophytol pendant les 10 semaines précédant l’accouplement chez les mâles, et pendant au moins 8 semaines chez les femelles (les 2 semaines précédant l’accouplement, 3 semaines pendant la gestation, 3 semaines pendant la lactation) (OCDE, 2003). À la dose maximale, les femelles ont présenté une augmentation de la fréquence du comportement léthargique, une posture voûtée et une horripilation. Aucun changement significatif du poids corporel n’a été observé. La consommation alimentaire absolue et relative des femelles des groupes exposés à la dose intermédiaire et à la dose élevée a augmenté pendant une partie des périodes précédant et suivant l’accouplement, mais la consommation alimentaire absolue a diminué pendant toute la période de lactation. Le poids absolu et relatif des reins a augmenté de manière significative chez les femelles des groupes exposés aux doses intermédiaire et élevée, et seulement à la dose maximale chez les mâles, avec la présence d’agrégats basophiles et une augmentation de la présence de cellules tubulaires basophiles. Une dilatation des tubules rénaux et une minéralisation générale ont été observées chez tous les animaux traités. Dans le groupe exposé à la dose maximale, les femelles ont présenté une diminution de l’indice de fertilité et du taux de conception, ainsi qu’une augmentation du nombre de petits morts par portée, des pertes postnatales et des pertes pendant l’élevage. Les pertes postnatales ont également augmenté dans les groupes exposés aux doses faible et intermédiaire (OCDE, 2003). Comme ces valeurs, à l’exception de celles obtenues dans le groupe ayant reçu la dose maximale, se situaient dans la plage des valeurs historiques du groupe témoin, l’OCDE a estimé que cette observation était fortuite et n’était pas liée au traitement administré (OCDE, 2003). Toutefois, ces valeurs n’ont pas été fournies dans le rapport de l’OCDE pour un examen plus approfondi. La survie et la condition physique générale des petits étaient diminuées dans le groupe exposé à la dose maximale. Les petits présentaient des signes cliniques prononcés, tels qu’un corps très petit ou froid, une absorption de lait faible ou nulle, et la mort. Selon ces résultats, l’OCDE a calculé une DMENO de 250 mg/kg p.c./j, soit la plus faible dose à l’essai, établie d’après la toxicité générale pour les reins chez les deux sexes, et une DSENO de 500 mg/kg p.c./j établie d’après les effets sur la reproduction et le développement chez les mères (OCDE, 2003).
L’isophytol ne s’est pas révélé génotoxique dans les tests d’Ames réalisés avec les souches TA97, TA98, TA100, TA102, TA103, TA1535 et TA1537 de S. typhimurium, avec ou sans activation métabolique (OCDE, 2003). L’essai des micronoyaux chez la souris s’est également avéré négatif pour l’isophytol (OCDE, 2003).
Nérolidol
Le JECFA a évalué le nérolidol comme aromatisant alimentaire (OMS, 2008) et a conclu que, vu les faibles valeurs d’exposition, cette substance ne causait « aucune préoccupation sur le plan de l’innocuité aux concentrations actuelles d’ingestion lorsqu’elle est utilisée comme aromatisant » [traduction]. De même, l’EFSA a conclu que la faible concentration ingérée estimée du nérolidol comme aromatisant ne posait pas de préoccupation sur le plan de l’innocuité (EFSA, 2010). Il existe peu de données empiriques sur les effets du nérolidol sur la santé.
Dans une étude menée conformément à la ligne directrice 422 de l’OCDE, des rats Wistar mâles et femelles (10/sexe/dose) ont reçu par voie orale 0, 1 500, 4 000 ou 12 000 ppm (équivalant à 0, 100, 300 ou 1 000 mg/kg p.c./j, respectivement) de nérolidol dans leur régime alimentaire pendant 37 jours (avant et pendant la période d’accouplement) pour les mâles et 58 jours pour les femelles (avant et pendant la période d’accouplement, et pendant la gestation et la période de lactation) (dossier d’enregistrement de l’ECHA, 2020d). On a observé une diminution de la consommation alimentaire et du poids corporel chez les femelles aux doses de 4 000 et 12 000 ppm. Le poids du foie a augmenté chez les deux sexes dans le groupe exposé à la dose élevée et chez les femelles dans le groupe exposé à la dose intermédiaire. Les femelles présentaient également une hypertrophie des cellules centrolobulaires du foie, et des changements dans les graisses accumulées au centre de l’organe dans les groupes ayant reçu les doses moyennes et élevées (dossier d’enregistrement de l’ECHA, 2020d). On n’a observé aucun effet sur la fertilité des parents et leurs paramètres de reproduction. Une diminution du poids corporel des petits a été observée uniquement dans le groupe exposé à la dose élevée et était un effet secondaire de la toxicité maternelle (dossier d’enregistrement de l’ECHA, 2020d). D’après ces résultats, une DSENO de 1 500 ppm (100 mg/kg p.c./j) a été établie pour la toxicité hépatique chez les femelles à 4 000 ppm (300 mg/kg p.c./j) (dossier d’enregistrement de l’ECHA, 2020d).
Dans une étude in vivo, le nérolidol s’est révélé clastogène dans le sang périphérique et les cellules hépatiques lors du test des comètes et de l’essai des micronoyaux chez des souris Swiss exposées (Pículo et al., 2010). Dans une étude in vitro conforme à la ligne directrice 480 de l’OCDE, le nérolidol n’a pas été mutagène lors d’un essai de mutation génique réalisé avec Saccharomyces cerevisiae, mais il s’est révélé très cytotoxique (Sperotto et al., 2013).
7.3.3 Caractérisation des risques pour la santé humaine
La caractérisation des risques associés aux essences de jasmin tient compte des effets généraux découlant de l’ensemble des voies d’exposition pertinentes (voies orale et cutanée, inhalation), ainsi que des risques propres à l’exposition par inhalation.
En ce qui concerne l’exposition générale, le critère d’effet relevé était une DMENO établie d’après la toxicité pour la reproduction suivant une exposition par voie orale de 250 mg/kg p.c./j d’extrait de jasmin (la dose minimale d’essai) chez le rat (Iqbal et al., 1993). On a observé une augmentation des pertes post-implantatoires, de la mortalité des fœtus et des résorptions fœtales, et une diminution de la fertilité et de la concentration de la progestérone aux doses de 250 mg/kg p.c./j et plus. Ce PdD a été jugé pertinent pour tous les groupes d’âge. D’après l’étude visant à déterminer les effets critiques qui est mentionnée ci‑dessus, les essences de jasmin peuvent modifier la concentration de certaines hormones de la reproduction chez les rates adultes à la suite d’une exposition de courte durée (par exemple, 5 jours). Un facteur d’absorption cutanée de 50 % a été appliqué aux valeurs d’exposition cutanée.
Pour ce qui est de l’exposition par inhalation, les risques ont également été caractérisés d’après les effets d’un composant des essences de jasmin (le phytol) au point de contact, effets qui ont été comparés à ceux observés à la concentration de phytol estimée dans l’air de 5,5 mg/L, soit la DMENO, par exposition, concentration qui a entraîné une inflammation des poumons causée par le phytol, ainsi qu’une dégénérescence et une nécrose des voies respiratoires liées à la dose (Schwotzer et al., 2021).
On estime que l’approche combinée protège à la fois des effets généraux à court et à long terme, ainsi que des effets localisés pendant l’exposition en question. Le tableau 7‑15 présente les valeurs estimées de l’exposition générale journalière des groupes d’âge les plus et les moins exposés aux essences de jasmin, ainsi que les ME résultantes de l’exposition aux aromatisants alimentaires, aux cosmétiques et à d’autres produits disponibles aux consommateurs. Le tableau 7-16 présente les valeurs estimées de l’exposition générale journalière aux essences de jasmin, ainsi que les ME résultantes de l’exposition à des produits faits soi-même. Enfin, le tableau 7‑17 présente les valeurs estimées des concentrations de phytol présentes dans les essences de jasmin, dans l’air et par exposition, ainsi que les ME résultantes.
| Scénario d’exposition | Exposition générale (mg/kg p.c./j)a | MEb |
|---|---|---|
|
Aromatisant alimentaire (1 an et plus) |
4,94 x 10-6 | > 2 000 000 |
|
Exposition par voie cutanée et par inhalation aux après-shampooings (à rincer) (30 %) (9–13 ans à adultes) |
5,68 x 10-2 (adultes) à 6,44 x 10-2 (9–13 ans) |
3 885 (9–13 ans) à 4 400 (adultes) |
|
Exposition par voie cutanée et par inhalation aux nettoyants corporels liquides (3 %) (tous les sous-groupes de la population) |
3,71 x 10-2 (adultes) à 0,13 (0–5 mois) | 1 882 (0–5 mois) à 6 736 (adultes) |
|
Exposition par voie cutanée et par inhalation aux hydratants corporels (3 %) (tous les sous-groupes de la population) |
2,07 (adultes) à 4,78 (0–5 mois) |
52 (0–5 mois) à 121 (adultes) |
| Exposition par voie cutanée et par inhalation aux produits hydratants pour le visage ou au traitement de l’acné (PSN) (1 %) (9–13 ans à adultes) |
0,32 (adultes) à 0,40 (9–13 ans) |
626 (9–13 ans) à 782 (adultes) |
| Exposition par voie cutanée et par inhalation aux crèmes de traitement (PSN) à usage topique (1 %) (9–13 ans à adultes) |
0,11 (adultes) à 0,14 (9–13 ans) |
1 822 (9–13 ans) à 2 344 (adultes) |
| Exposition par voie cutanée et par inhalation aux écrans solaires pour le visage en poudre (PSN) (0,07 %) (adultes) | 2,2 x 10-3 (adultes) | 114 000 |
| Exposition par voie cutanée et par inhalation aux huiles essentielles en applicateur à bille pour la détente (PSN) (0,01 %) (adultes) | 3 x 10-4 (adultes) | > 800 000 |
|
Exposition par voie orale aux rouges à lèvres (3 %) (2–3 ans à adultes) |
1,78 x 10-2 (adultes) à 4,40 x 10-2 (2–3 ans) |
5 682 (2–3 ans) à 14 015 (adultes) |
|
Exposition par voie cutanée et par inhalation aux parfums corporels (82 %) (2–3 ans à adultes) |
3,12 (14–18 ans) à 9,14 (2–3 ans) |
27 (2–3 ans) à 80 (14–18 ans) |
|
Exposition par voie cutanée et par inhalation aux produits coiffants en aérosol (0,1 %) (4–8 ans à adultes) |
1,58 x 10-3 (14–18 ans) à 4,26 x 10-3 (4–8 ans) | 58 697 (4–8 ans) à 158 079 (14–18 ans) |
|
Exposition par voie cutanée et par inhalation aux antisudorifiques et aux déodorants (2 %) (9–13 ans à adultes) |
0,11 (9–13 ans) à 0,18 (14–18 ans) | 1 377 (14–18 ans) à 2 341 (9–13 ans) |
|
Exposition par voie cutanée et par inhalation aux colorants capillaires temporaires (0,1 %) (4–8 ans à adultes) |
2,42 x 10-2 (adultes) à 7,73 x 10-2 (4–8 ans) |
3 234 (4–8 ans) à 10 348 (adultes) |
|
Exposition cutanée aux écrans solaires (PSN) (0,07 %) (6–11 mois à adultes) |
7,35 x 10-2 (9–13 ans) à 3,32 x 10-1 (6–11 mois) |
752 (6–11 mois) à 3 401 (9–13 ans) |
| Exposition par voie cutanée et par inhalation aux nettoyants antiseptiques pour la peau (PSN) (2 %) (2–3 ans à adultes) | 0,38 (14–18 ans) à 1,09 (2–3 ans) | 230 (2–3 ans) à 657 (14–18 ans) |
| Exposition par voie cutanée et par inhalation aux nettoyants antiseptiques pour la peau (PSN) (2 %) (2–3 ans à adultes)c |
5,67 (adultes) à 27,2 (2–3 ans) |
9 (2–3 ans) à 44 (adultes) |
| Exposition par voie cutanée et par inhalation aux nettoyants tout usage en aérosol (1 %) (adultes) | 7 x 10-2 (adultes) | 3 576 (adultes) |
| Exposition par voie cutanée et par inhalation aux nettoyants tout usage liquides pour les planchers (1 %) (adultes) | 2,53 x 10-2 (adultes) | 9 896 (adultes) |
| Exposition fortuite par voie cutanée, par inhalation et par voie orale (contact main-bouche) après le lavage des planchers (1 an) | 1,16 x 10-2 (1 an) | 21 567 (1 an) |
| Exposition par inhalation aux assouplisseurs de tissus en aérosol pour la lessive (5 %) (adultes) | 2,45 x 10-2 (adultes) | 10 210 (adultes) |
| Exposition par voie cutanée et par inhalation aux détergents liquides pour le lavage à la machine (mélange et chargement, suspension du linge et émission par les vêtements) (5 %) (adultes) | 1,86 x 10-1 (adultes) | 1 341 (adultes) |
|
Exposition par voie cutanée et exposition fortuite par voie orale (1 an seulement) découlant de l’émission par les tissus lavés (5 %) (tous les sous-groupes de la population, sauf les adultes) |
5,54 x 10-3 (14–18 ans) à 9,28 x 10-3 (0–6 mois) |
26 950 (0–6 mois) à 45 134 (14–18 ans) |
a Les paramètres utilisés pour les essences de jasmin dans les scénarios d’exposition et les calculs figurent à l’annexe A. On a supposé une absorption cutanée de 50 %.
b Les ME ont été calculées à l’aide de la concentration entraînant un effet critique (DMENO = 250 mg/kg p.c./j), établie d’après la toxicité pour la reproduction observée chez les femelles.
c En ce qui concerne les préoccupations pour la santé publique, le nombre d’utilisations de désinfectants pour les mains dans la population générale peut augmenter jusqu’à 25 fois par jour (utilisation personnelle par les adultes, utilisation accrue chez les enfants dans les écoles et les garderies) (RIVM, 2021a).
| Scénario d’exposition | Exposition générale (mg/kg p.c./j)a | MEb |
|---|---|---|
| Exposition générale par voie cutanée (pour les 9–13 ans à adultes, seulement) et par inhalation aux diffuseurs aromatiques contenant des produits faits soi-même (100 %) (tous les sous-groupes de la population) | 1,16 (adultes) à 1,97 (14–18 ans) | 127 (9–13 ans) à 216 (adultes) |
| Exposition par voie cutanée et par inhalation aux huiles de massage faites soi-même (3 %) (tous les sous-groupes de la population) | 6,89 x 10-1 (adultes) à 4,35 (0–5 mois) | 57 (0–5 mois) à 363 (adultes) |
| Exposition par voie cutanée et par inhalation aux huiles faites soi-même pour le bain (100 %) (9–13 ans à adultes) | 1,56 x 10-1 (adultes) à 2,51 x 10-1 (9–13 ans) | 997 (9–13 ans) à 1 606 (adultes) |
| Exposition par voie cutanée et par inhalation aux hydratants corporels faits soi-même (3 %) (tous les sous-groupes de la population) | 2,07 (adultes) à 4,78 (0–5 mois) | 52 (0–5 mois) à 121 (adultes) |
| Exposition par voie cutanée et par inhalation aux huiles essentielles pour brumisateurs faciaux contenant des produits faits soi-mêmec (100 %) (4–8 ans à adultes) | 1,19 (adultes) à 3,47 (4–8 ans) | 72 (4–8 ans) à 210 (adultes) |
| Exposition des non-utilisateurs par voie cutanée et par inhalation aux huiles essentielles pour brumisateurs faciaux contenant des produits faits soi-même (1 an seulement) (100 %) | 5,26 × 10-1 | 475 |
a Les paramètres utilisés pour les essences de jasmin dans les scénarios d’exposition et les calculs figurent à l’annexe A. On a supposé une absorption cutanée de 50 %.
b Les ME ont été calculées à l’aide de la concentration entraînant un effet critique (DMENO = 250 mg/kg p.c./j), établie d’après la toxicité pour la reproduction observée chez les femelles.
c Après 4 heures d’exposition; lorsque l’appareil est fermé après 20 minutes d’utilisation, on suppose que la personne exposée reste ensuite dans la pièce pendant 3 heures et 40 minutes.
| Scénario de produit | Concentration atmosphérique par exposition (mg/m3)a | MEb thtd> |
|---|---|---|
| Assainisseurs d’air (100 %) (tous les sous-groupes de la population) | 3,2 | > 1 700 (tous les sous-groupes de la population) |
| Produits coiffants en aérosol (0,1 %) (4–8 ans à adultes) | 2,70 x 10-3 (18 ans et moins) à 3,10 x 10-3 (adultes) |
> 1 700 000 (adultes) > 2 000 000 (18 ans et moins) |
| Assouplisseurs de tissus en aérosol pour la lessive (5 %) (adultes) | 5,50 x 10-3 | > 1 000 000 (adultes) |
| Nettoyants tout usage en aérosol (1 %) (adultes) | 1,50 x 10-3 | > 3 000 000 (adultes) |
| Nettoyants tout usage liquides (1 %) (adultes) | 1,72 x 10-7 | > 32 100 000 000 (adultes) |
a Les concentrations atmosphériques par exposition ont été réduites à 50 % pour tenir compte de la quantité maximale de composants des essences de jasmin présentant une toxicité.
b Les ME ont été calculées à l’aide de la concentration entraînant un effet critique (DMENO = 5,5 mg/L) établie d’après la toxicité pulmonaire observée chez le rat après deux jours d’exposition au phytol.
Les ME calculées pour les essences de jasmin présentes dans des aliments (en raison de leur utilisation possible comme aromatisants), les après-shampooings, les nettoyants corporels, les crèmes de traitement (PSN) à usage topique, les écrans solaires en poudre pour le visage (PSN), les huiles essentielles en applicateur à bille pour la détente (PSN), les rouges à lèvres, les produits coiffants, les antisudorifiques, les déodorants, les colorants capillaires temporaires et les écrans solaires (PSN; 2 ans et plus) sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
Les ME calculées pour les essences de jasmin présentes dans des nettoyants tout usage en aérosol, des nettoyants tout usage pour les planchers et des détergents liquides pour la lessive sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
En outre, les ME calculées pour les essences de jasmin lorsqu’elles sont employées dans des huiles faites soi-même pour le bain, sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
Les ME comprises entre les concentrations entraînant un effet critique et celles de l’exposition journalière estimée aux hydratants corporels, aux parfums corporels, aux produits hydratants pour le visage (PSN), au traitement de l’acné (PSN), aux écrans solaires (PSN; 1 an et 6 à 11 mois) et aux nettoyants antiseptiques pour la peau (PSN) sont inférieures à 1 000, ce qui tient compte des incertitudes relatives à l’extrapolation interspécifique, à l’extrapolation intraspécifique, au PdD et à la pertinence de la base de données, et pourraient être insuffisantes.
De plus, les ME pour les essences de jasmin dans des produits faits soi-même tels que les diffuseurs aromatiques, les huiles de massage, les hydratants corporels et les brumisateurs faciaux sont inférieures à 1 000, ce qui tient compte des incertitudes relatives à l’extrapolation interspécifique, à l’extrapolation intraspécifique, au PdD et à la pertinence de la base de données, et pourraient être insuffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets pour la santé utilisées pour caractériser les risques.
Il convient de noter qu’un composant des essences de jasmin, le benzoate de benzyle, a été associé à des effets sur le développement chez le rat, notamment une augmentation de la zone intermyofibrillaire du cœur des fœtus et des variations squelettiques à la dose minimale d’essai (25 mg/kg/j). Ce composant a été classé comme substance œstrogénique potentielle pour les cellules humaines, dans une étude in vitro (Charles et Darbre, 2009). Si les essences de jasmin présentes dans des produits disponibles aux consommateurs contiennent plus de 10 % de benzoate de benzyle, la présente évaluation pourrait ne pas protéger suffisamment.
Les ME comprises entre les concentrations entraînant un effet critique et les concentrations atmosphériques estimatives, par exposition, associées aux assainisseurs d’air, aux produits coiffants en aérosol, aux assouplisseurs de tissus en aérosol pour la lessive, aux nettoyants tout usage en aérosol et aux nettoyants liquides tout usage, sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
7.3.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principales sources d’incertitudes | Incidence |
|---|---|
| Le facteur d’absorption cutanée utilisé pour les essences de jasmin présente un certain degré d’incertitude, compte tenu de l’absorption cutanée in vivo du benzoate de benzyle et de l’acétate de benzyle. | +/- |
| La concentration maximale d’essences de jasmin dans les écrans solaires et les nettoyants antiseptiques pour la peau est une estimation prudente. Faute de disposer de renseignements suffisants, nous avons déterminé leur concentration dans les écrans solaires d’après la quantité maximale d’essences de jasmin diluées dans l’eau, et leur concentration dans les nettoyants antiseptiques pour la peau d’après la concentration maximale des autres ingrédients dans le produit (SDS, 2014b). | + |
| Les essences de jasmin peuvent être utilisées dans des désinfectants pour les mains. Il existe des incertitudes quant à la durée de l’utilisation de désinfectants pour les mains qui pourrait augmenter dans des situations préoccupantes pour la santé publique. | +/- |
| Aucune étude n’a été réalisée sur l’exposition par voie cutanée et par inhalation. | +/- |
| Aucune étude appropriée n’a été trouvée sur l’exposition par voie cutanée et par inhalation. Par conséquent, pour déterminer l’exposition générale, nous avons procédé par une extrapolation de voie à voie d’après les données d’une étude de toxicité par voie orale. | +/- |
| Les essences de jasmin ont été jugées représentatives des parfums et essences de jasmin, faute de disposer de renseignements sur leur composition. | +/- |
| Un composant des essences de jasmin, le benzoate de benzyle, présentait des effets sur le développement chez le rat à la dose minimale d’essai (25 mg/kg p.c./j). Si les essences de jasmin présentes dans des produits disponibles aux consommateurs contiennent plus de 10 % de benzoate de benzyle, la présente évaluation pourrait ne pas protéger suffisamment. | - |
+ = incertitude pouvant causer une surestimation de l’exposition ou du risque; - = incertitude pouvant causer une sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu de surestimation ou de sous-estimation du risque. Les marges d’exposition obtenues ont été jugées suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les dangers.
7.4 Essences de violette
7.4.1 Évaluation de l’exposition
Milieux environnementaux
Étant donné que les essences de violette n’ont pas été fabriquées ou importées au Canada en quantité supérieure au seuil de déclaration de 100 kg (Environnement Canada, 2013), il ne devrait y avoir aucune exposition des milieux environnementaux à ces substances. Aucun rapport de surveillance des essences de violette dans les milieux environnementaux au Canada ou ailleurs n’a été trouvé.
Aliments
On ne dispose d’aucune donnée définitive concernant l’utilisation des essences de violette comme aromatisants dans des aliments vendus au Canada. Toutefois, comme les essences de violette sont présentes en tant qu’aromatisants alimentaires partout dans le monde, il est possible que cette substance soit présente comme aromatisant dans des aliments vendus au Canada.
Selon le Handbook of Flavour Ingredients de Fenaroli, la consommation « personnelle » de cette substance est due à son utilisation comme aromatisant alimentaire. La consommation personnelle par habitant de cette substance est estimée d’après une enquête sur la MSDI basée sur les volumes de production déclarés par l’industrie alimentaire du pays (NAS, 1989, cité dans Burdock, 2010).
Faute de disposer de données sur l’utilisation réelle des essences de violette comme aromatisant alimentaire au Canada, le cas échéant, la dose journalière estimative par habitant pour la population des États-Unis de 1,33 × 10-1 μg/kg p.c./j, d’après le Handbook of Flavour Ingredients de Fenaroli (Burdock, 2010), est une estimation acceptable de l’exposition possible par le régime alimentaire de la population canadienne générale de 1 an et plus à cette substance, qui pourrait être utilisée comme aromatisant alimentaire (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence).
Exposition à la substance présente naturellement dans des aliments :
On ne dispose d’aucune donnée définitive concernant la présence naturelle des essences de violette dans les aliments. Toutefois, il devrait y avoir une exposition à cette substance par le régime alimentaire, en raison de sa présence naturelle dans des aliments (Nijssen et al., 2018).
Produits disponibles aux consommateurs
Les essences de violette sont présentes dans des produits disponibles aux consommateurs. D’après l’évaluation des effets des essences de violette sur la santé (section 7.4.2), les expositions par inhalation et par voie orale sont les voies jugées les plus pertinentes pour la caractérisation des risques, y compris pour ce qui est des produits disponibles aux consommateurs appliqués sur la peau. Les scénarios sentinelles sélectionnés pour les cosmétiques représentaient l’exposition la plus élevée par rapport aux autres cosmétiques et PSN dans lesquels les essences de violette sont utilisées comme ingrédients non médicinaux, d’après les produits déclarés contenant cette substance. Afin d’évaluer le potentiel d’exposition aux essences de violette dans les cosmétiques appliqués par voie cutanée, des scénarios sentinelles ont été choisis d’après une combinaison de la fréquence d’utilisation et des concentrations déclarées d’essences de violette dans ces produits. Les scénarios sentinelles choisis représentaient les valeurs d’exposition les plus élevées par rapport à d’autres cosmétiques appliqués sur la peau et à d’autres produits dans lesquels cette substance a été déclarée. Les expositions aux essences de violette présentes dans les hydratants pour les yeux, les après-shampooings, les nettoyants pour le visage, les hydratants corporels, les huiles de massage et les parfums corporels ont été considérées comme des scénarios sentinelles pour ce qui est des applications par voie cutanée (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2017; sans référence).
En outre, les essences de violette pures à 100 % ajoutées à des produits faits soi-même tels que ceux utilisés dans les diffuseurs aromatiques, les huiles pour le bain, les hydratants corporels et les brumisateurs faciaux ont également été évaluées. Les huiles utilisées dans les produits corporels sont habituellement diluées en concentrations de 1 % à 4 % (Tisserand Institute, 2021). D’après ces renseignements, la concentration maximale d’essences de violette dans les hydratants corporels faits soi-même a été estimée à 3 %. Bien que la concentration maximale déclarée pour les huiles de massage contenant des essences de violette était de 100 %, les huiles de massage sont habituellement diluées avant leur utilisation. Par conséquent, le RIVM (2006) a supposé la concentration maximale d’essences de violette dans les huiles de massage faites soi-même à 3 %, mais ce scénario englobe une huile de massage disponible aux consommateurs contenant une concentration de 10 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2017; sans référence).
De plus, les essences de violette sont présentes dans les rouges à lèvres. L’exposition par voie orale due à leur utilisation dans les rouges à lèvres a été quantifiée (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2017; sans référence).
La quantité de produit disponible par inhalation, à la suite de son évaporation, a été réduite à 80 % pour tenir compte d’une quantité estimée de 20 % retenue par la peau. Ce facteur de 20 % repose sur des études d’absorption cutanée in vitro chez l’humain du géraniol, du citronellol, du linalol et du citral (Gilpin et al., 2010; dossier d’enregistrement de l’ECHA, 2018; Charles River, 2019). Les propriétés physico‑chimiques du 2,6-nonadiénal, l’un des principaux composants des essences de violette, sont semblables à celles des monoterpènes acycliques, monocycliques et bicycliques, qui font partie des terpènes et des terpénoïdes. La masse moléculaire, la pression de vapeur et le log Koe du 2,6-nonadiénal sont de 138,21 g/mol, 31 Pa et 2,84, respectivement. Ces valeurs sont semblables à celles obtenues pour le géraniol, le citronellol, le linalol et le citral, dont les masses moléculaires varient de 152 à 156,27 g/mol, les pressions de vapeur de 4 à 21 Pa, et les valeurs log Koe de 2,9 à 3,5. Dans le cas des hydratants corporels, comme la quantité de produit inhalable a été réduite en fonction de la superficie exposée et que cette valeur était inférieure à 80 % de la quantité de produit, aucune autre modification n’a été apportée à la quantité de produit. Dans le cas des après-shampooings (à rincer), nous avons estimé que seule la quantité de produit en contact avec le cuir chevelu pouvait être retenue par la peau, et jugé que la quantité de produit appliqué sur les cheveux pouvait s’évaporer.
Le tableau 7-19 présente les valeurs estimées de l’exposition des groupes d’âge les moins et les plus exposés à des produits disponibles aux consommateurs. Le tableau 7‑20 présente les valeurs estimées de l’exposition des groupes d’âge les moins et les plus exposés à des produits faits soi-même.
| Scénario de produit | Pourcentage dans le produit | Voie d’exposition |
Plage d’exposition (mg/kg p.c./j)a |
|---|---|---|---|
| Hydratants pour les yeux | 100 % | Inhalation | 6,98 x 10-3 (adultes) à 8,78 x 10-3 (14–18 ans) |
| Après-shampooing (à rincer) | 100 % | Inhalation | 1,82 x 10-2 (adultes) à 4,89 10-2 (2–3 ans) |
| Nettoyants pour le visage | 30 % | Inhalation | 9,12 x 10-3 (14–18 ans) à 1,52 x 10-3 (adultes) |
| Hydratants corporels | 10 % | Inhalation | 1,45 x 10-2 (0–5 mois) à 3,14 x 10-2 (9–13 ans) |
| Huiles de massage | 10 % | Inhalation | 4,26 x 10-2 (adultes) à 88,43 x 10-2 (1 an) |
| Rouges à lèvres | 10 % | Orale | 1,13 x 10-2 (adultes) à 2,79 x 10-2 (2–3 ans) |
| Parfums corporels | 10 % | Inhalation | 2,44 x 10-3 (adultes) à 4,31 x 10-3 (2–3 ans) |
a Seules les valeurs des groupes d’âge les moins et les plus exposés sont présentées. Les valeurs d’exposition ont été réduites de 19 % pour tenir compte de la quantité maximale de 2,6-nonadiénal dans les essences de violette, en supposant que 80 % de la dose appliquée pouvait s’évaporer. Les calculs sont présentés à l’annexe A.
| Scénario de produit | Pourcentage dans le produit | Voie d’exposition | Plage d’exposition (mg/kg p.c./j)a |
|---|---|---|---|
| Diffuseurs aromatiques | 100 % | Inhalation | 1,56 x 10-1 (adultes) à 3,73 x 10-1 (1 an) |
| Huiles pour le bain | 100 % | Inhalation | 2,85 x 10-2 (adultes) à 4,56 x 10-2 (9–13 ans) |
| Hydratants corporels | 3 % | Inhalation | 4,84 x 10-3 (0-5 mois) à 1,05 x 10-3 (9–13 ans) |
| Brumisateurs faciaux | 100 % | Inhalation | 0,05–0,02b (adultes) à 0,13–0,06b (4–8 ans) |
| Brumisateurs faciaux – exposition des non-utilisateurs (1 an seulement) | 100 % | Inhalation | 0,10 |
a Seules les valeurs pour les groupes d’âge les moins et les plus exposés sont présentées. Les valeurs d’exposition ont été réduites de 19 % pour tenir compte de la quantité maximale de 2,6-nonadiénal dans les essences de violette, en supposant que 80 % de la dose appliquée pouvait s’évaporer. Les calculs sont présentés à l’annexe B.
b Après 4 heures d’exposition; lorsque le dispositif est fermé, après 20 minutes d’utilisation, on suppose que la personne reste dans la pièce pendant 3 heures et 40 minutes.
7.4.2 Évaluation des effets sur la santé
Il n’existe aucune évaluation faite à l’étranger ni de données disponibles sur les effets des essences de violette sur la santé.
Selon les seules études disponibles sur les effets des essences de feuille de violette sur la santé, il n’y aurait aucune irritation, sensibilisation ou phototoxicité lorsque la substance est appliquée par voie cutanée sur des animaux et des volontaires humains à raison de 2 % dans du pétrolatum. Ces études ont également rapporté des effets anti‑inflammatoires dans des essais de toxicité aiguë et subaiguë (Opdyke, 1976).
Afin d’éclairer l’évaluation des effets sur la santé, nous avons pris en compte les données disponibles sur les dangers associés aux principaux composants des essences de violette, à savoir le 2,6-nonadiénal (5 % à 19 %), l’acide linoléique (0 % à 58 %), l’acide palmitique (0 % à 17 %) et le 1-octadécène (0 % à 11 %).
2,6-Nonadiénal
La littérature scientifique ne contenait aucune étude sur le 2-trans-6-cis-nonadiénal concernant sa toxicité subchronique et chronique, sa toxicité pour la reproduction ou le développement, et sa cancérogénicité chez les animaux.
Dans le test d’Ames réalisé avec la souche TA100 de S. typhimurium, aucune augmentation des révertants n’a été observée, que ce soit avec ou sans activation métabolique (Eder et al., 1992). Toutefois, le 2,6-nonadiénal avait augmenté de façon significative le nombre d’échanges de chromatides sœurs dans les lymphocytes de sang humain et les cellules Namalwa en culture (Dittberner et al., 1995), et avait causé des aberrations chromosomiques dans les cellules Namalwa, mais non dans les lymphocytes (Dittberner et al., 1995). Une augmentation significative du nombre de métaphases aneuploïdes a été constatée après un traitement au 2,6-nonadiénal (Dittberner et al., 1995). En outre, le 2,6-nonadiénal a causé une augmentation de l’abondance des micronoyaux dans les lymphocytes de sang humain et les cellules Namalwa, liée à la concentration (Dittberner et al., 1995). Après une hybridation in situ en fluorescence, les cellules Namalwa et les lymphocytes humains ont présenté une augmentation significative de l’abondance des micronoyaux centromères-positifs, ce qui découle généralement d’une altération de la fonction du fuseau mitotique, altération qui peut donc être classée comme un effet aneugénique (Dittberner et al., 1995). Faute de disposer d’autres renseignements, le 2,6-nonadiénal pourrait être considéré comme aneugénique.
Comme nous ne disposions d’aucune données sur le danger pour le 2,6-nonadiénal, nous avons adopté une approche par lecture croisée et employé les données sur les dangers de l’analogue utilisé dans la lecture croisée, en l’occurrence le 2,4-hexadiénal, pour éclairer l’évaluation des effets sur la santé.
Le 2,6-nonadiénal et le 2,4-hexadiénal sont des aldéhydes alpha et bêta insaturés. Ils ont une structure similaire, composée d’une chaîne aliphatique d’hydrocarbures comportant trois liaisons doubles et un groupe carbonyle. La seule différence structurale entre les deux substances est que le 2,6-nonadiénal (formule moléculaire : C9H14O) a une chaîne plus longue que le 2,4-hexadiénal (formule moléculaire : C6H8O). La cible et l’analogue sont tous deux des substances naturellement présentes dans des aliments et sont utilisés comme ingrédients aromatisants dans l’industrie alimentaire et produits de manière endogène à partir de produits de peroxydation lipidique dans l’organisme (Adams et al., 2008). Le 2,6-nonadiénal et le 2,4-hexadiénal ont des propriétés physico-chimiques comparables et présentent tous deux des caractéristiques structurales associées à un potentiel de réactivité forte et interagissent avec des macromolécules biologiques comme l’ADN. Ils donnent les mêmes alertes de structure avec la boîte à outils QSAR version 4.2 (OCDE, 2016), y compris des alertes de liaison à l’ADN et aux protéines, de mutagénicité in vitro et in vivo, et de sensibilisation cutanée, ce qui les rend potentiellement toxiques et capables de modifier des processus cellulaires.
Dans un rapport du NTP américain, les auteurs ont conclu que le 2,4-hexadiénal présentait chez les rats F344/N mâles et femelles et les souris B6C3F1 mâles et femelles, des signes probants d’activité cancérogène, soit une augmentation de l’incidence des néoplasmes à cellules squameuses dans le pré-estomac (NTP, 2003). Le CIRC a classé cette substance comme peut-être cancérogène pour l’Homme (groupe 2B) d’après les données probantes suffisantes de cancérogénicité chez les animaux de laboratoire et compte tenu de l’absence de données sur le danger chez l’humain (CIRC, 2013). L’évaluation par le groupe d’experts de l’EFSA (EFSA, 2018) de la génotoxicité du 2,4-hexadiénal a montré que la substance n’était pas mutagène. Le JECFA a conclu que les néoplasmes du préestomac étaient causés par des mécanismes non génotoxiques tels qu’une irritation découlant d’une exposition prolongée au 2,4-hexadiénal administré quotidiennement au site du premier contact (préestomac), par gavage, et n’étaient pas un effet général causé par le produit chimique (Nyska et al., 2001; Chan et al., 2003 et OMS, 2004). Le JECFA a également mis en doute la pertinence d’associer la formation de ces tumeurs chez les rongeurs à celle du cancer chez l’humain, compte tenu des conditions d’exposition employées dans les études du NTP (NTP, 2003; OMS, 2004). De plus, l’effet cancérogène a été observé uniquement chez les animaux exposés à de fortes doses de 2,4-hexadiénal pendant deux ans (NTP, 2003).
Des rats (5/sexe/dose) ont reçu, par gavage, de 2,4‑hexadiénal à des doses de 0, 0,75 ou 7,5 mg/kg p.c./j dans de l’huile de maïs, à raison de 6 jours par semaine, pendant 14 jours (OMS, 2004; Adams et al., 2008). Aucun effet lié au traitement n’a été constaté : aucun signe clinique ni observation aux examens hématologique et histopathologique. Les auteurs de l’étude ont établi une dose sans effet observé (DSEO) de 7,5 mg/kg p.c./j, soit la dose la plus élevée d’essai (OMS, 2004; Adams et al., 2008).
Des rats F344/N (24/sexe/dose) ont reçu, par voie orale, du 2,4‑hexadiénal à des doses de 0 ou 2,23 mg/kg p.c./j dans leur régime alimentaire, à raison de 7 jours par semaine, pendant 13 semaines (OMS, 2004; Adams et al., 2008). On n’a observé aucun effet lié au traitement sur le poids corporel ou à l’examen histopathologique lors de l’autopsie. Les auteurs ont rapporté une DSEO de 2,23 mg/kg p.c./j, soit la dose la plus élevée d’essai (OMS, 2004; Adams et al., 2008).
Dans une étude de détermination des doses, des groupes de rats Fischer 344/N mâles et femelles et des souris B6C3F1 (5/sexe/dose) ont reçu, par gavage, du 2,4‑hexadiénal à des doses de 0, 3, 9, 27, 80 ou 240 mg/kg p.c./j dans de l’huile de maïs, à raison de 5 jours par semaine, pendant 16 jours (NTP, 2003). Chez les rats ayant reçu la dose la plus élevée, trois rats mâles et trois rats femelles sont morts avant la fin de l’étude. Les rats exposés à la dose de 240 mg/kg p.c./j ont présenté un ralentissement significatif de la prise de poids corporel par rapport aux animaux du groupe témoin. Le poids du foie des rats femelles ayant reçu la dose élevée était significativement plus élevé que celui des animaux du groupe témoin (les auteurs de l’étude n’ont mentionné aucun corrélat histopathologique). Les signes cliniques observés à la dose la plus élevée comprenaient une diarrhée, une ataxie, une léthargie et un écoulement nasal et/ou oculaire chez les rats mâles, et une léthargie, une pâleur et une respiration anormale chez les femelles (NTP, 2003). À l’examen macroscopique clinique, on a constaté une nécrose et une ulcération du préestomac chez la plupart des rats des deux sexes, à la dose de 240 mg/kg p.c./j, ainsi qu’une hyperplasie épithéliale légère à modérée du préestomac à la dose de 80 mg/kg p.c./j (NTP, 2003). Aucun effet sur le préestomac n’a été observé au microscope à la dose de 27 mg/kg p.c./j. Chez la souris, un mâle et une femelle exposés à la dose la plus élevée sont morts avant la fin de l’étude, et parmi les signes cliniques, on compte une léthargie et des poils ébouriffés. On a rapporté une ulcération et une nécrose marquées du préestomac chez toutes les souris exposées à la dose de 240 mg/kg p.c./j. À la dose de 80 mg/kg p.c./j, l’étude a révélé une hyperplasie épithéliale minime à légère, ainsi qu’une hyperkératose, mais aucun effet sur le préestomac n'a été observé à des doses plus faibles chez les souris (NTP, 2003).
Dans une étude à court terme, des groupes de rats F344/N (10/sexe/dose) ont reçu, par gavage, du 2,4-hexadiénal à des doses de 0, 7,5, 15, 30, 60 ou 120 mg/kg p.c./j dans de l’huile de maïs, à raison de 5 jours par semaine pendant 14 semaines (NTP, 2003). Tous les animaux sont restés vivants jusqu’à la fin du traitement. Le poids corporel moyen final et la prise de poids corporel ont diminué aux doses administrées de 30, 60 et 120 mg/kg p.c./j chez les mâles uniquement, par rapport aux animaux du groupe témoin (NTP, 2003). À la dose la plus élevée, on a constaté une augmentation significative de l’incidence de l’hyperplasie épithéliale, de la dégénérescence et de l’inflammation chronique active du préestomac chez les mâles et les femelles, ainsi que de l’incidence de l’atrophie nasale, de l’ostéofibrose et des exsudats chez les mâles (NTP, 2003). Contrairement aux rats mâles, les lésions nasales chez les femelles se limitaient à une nécrose aiguë présente chez un animal exposé à la dose de 60 mg/kg p.c./j et chez deux animaux exposés à celle de 120 mg/kg p.c./j (NTP, 2003).
Dans une autre étude à court terme, des souris B6C3F1 mâles et femelles (10/sexe/dose) ont reçu, par voie orale (gavage), du 2,4-hexadiénal dans de l’huile de maïs à des doses de 0, 7,5, 15, 30, 60 ou 120 mg/kg p.c./j, à raison de 5 jours par semaine pendant 14 semaines (NTP, 2003). Le traitement n’a pas réduit la longévité ni ralenti la prise de poids corporel chez les deux sexes, quelle que soit la dose. Les poids absolu et relatif des reins ont augmenté à la dose de 60 et 120 mg/kg p.c./j (chez les mâles, uniquement), les poids absolu et relatif du foie ont augmenté à la dose de 60 mg/kg p.c./j (chez les deux sexes), et le poids relatif du foie chez les femelles de tous les groupes exposés à des doses a augmenté par rapport aux animaux du groupe témoin. Une augmentation de l’incidence de l’hyperplasie épithéliale minime à légère du préestomac (sans inflammation ni prolifération des cellules basales) n'a été observée que chez les femelles exposées à la dose de 120 mg/kg p.c./j. L’incidence d’une nécrose minime à légère de l’épithélium olfactif a augmenté de manière significative chez les deux sexes exposés à la dose de 120 mg/kg p.c./j, tandis que celle de l’atrophie de l’épithélium olfactif n’a augmenté de manière significative que chez les mâles, à cette même dose (NTP, 2003).
Dans une étude de cancérogénicité, des groupes de rats F344/N mâles et femelles (50/sexe/dose) ont reçu, par gavage, du 2,4-hexadiénal dans de l’huile de maïs à des doses de 0, 22,5, 45 ou 90 mg/kg p.c./j, à raison de 5 jours par semaine, pendant deux ans (NTP, 2003). Le traitement n’a pas eu d’effet sur le taux de survie. La substance chimique a provoqué une augmentation importante de l’incidence des papillomes épidermoïdes du préestomac chez les rats des deux sexes des groupes ayant reçu 45 et 90 mg/kg p.c./j. Aucune autre tumeur significative liée au traitement n’a été observée chez les animaux traités. L’incidence de l’hyperplasie épithéliale du préestomac (épaississement localisé, étendu à diffus, de toutes les couches de l’épithélium pavimenteux, qui est considéré comme une lésion pouvant être le précurseur de néoplasies dans le préestomac) a augmenté de manière significative dans tous les groupes de traitement, chez les deux sexes, la gravité variant de légère à modérée aux doses de 45 et 90 mg/kg p.c./j, respectivement. À la dose la plus élevée, les mâles ont présenté une aggravation de l’inflammation et une augmentation du nombre de kystes dans le préestomac. Les auteurs ont interprété cet effet comme étant le résultat de l’invasion d’un épithélium hyperplasique bénin (NTP, 2003). On a calculé une DMENO de 22,5 mg/kg p.c./j d’après une relation dose-réponse d’hyperplasie épithéliale dans le préestomac à toutes les doses chez les rats des deux sexes. On a adapté cette concentration entraînant un effet critique en la multipliant par 5/7 pour tenir compte de la fréquence d’exposition (les animaux ont été exposés 5 jours par semaine), d’où une DMENO de 16,1 mg/kg p.c./j.
Dans une étude de cancérogénicité, des groupes de souris B6C3F1 mâles et femelles (50/sexe/dose) ont reçu, par gavage, du 2,4-hexadiénal dans de l’huile de maïs à des doses de 0, 30, 60 ou 120 mg/kg p.c./j, à raison de 5 jours par semaine pendant 2 ans (NTP, 2003). Le traitement n’a pas eu d’effet sur le taux de survie. L’incidence des papillomes épidermoïdes ou des papillomes et carcinomes épidermoïdes dans le préestomac était significativement plus élevée chez les mâles à la dose de 120 mg/kg p.c./j et chez les femelles aux doses de 60 et 120 mg/kg p.c./j. L’incidence des carcinomes épidermoïdes du préestomac, pris isolément, a augmenté de manière significative chez les femelles, uniquement à la dose élevée. Le nombre de lésions non néoplasiques du préestomac, consistant en une hyperplasie de l’épithélium pavimenteux, a augmenté chez les femelles, à la dose de 60 mg/kg p.c./j, et chez les deux sexes, à la dose de 120 mg/kg p.c./j. De même, l’incidence des ulcères a augmenté chez les mâles à la dose de 120 mg/kg p.c./j. Deux souris mâles du groupe exposé à la dose élevée ont présenté des carcinomes épidermoïdes de la langue. Les auteurs de l’étude ont justifié ce résultat en expliquant que la substance chimique se trouvant à l’extrémité de l’aiguille de gavage a pu être déposée dans la cavité buccale pendant le gavage ou une certaine partie du produit ingéré a pu être régurgitée (NTP, 2003).
L’évaluation de la génotoxicité du 2,4-hexadiénal a montré que la substance n’était pas mutagène, selon le test d’Ames réalisé avec plusieurs souches de S. typhimurium, à savoir TA102 (Marnett et al., 1985), TA98, TA1535 (Florin et al., 1980; NTP, 2003), TA100, et TA1537 (Florin et al., 1980), avec ou sans activation métabolique. Toutefois, d’autres études où le test d’Ames a été utilisé ont montré que le résultat du 2,4‑hexadiénal était positif avec les souches TA100 (Eder et al., 1992; NTP, 2003) et TA104 (Marnett et al., 1985) de S. typhimurium. Les résultats positifs avec le 2,4‑hexadiénal étaient faibles, mais statistiquement significatifs, dans un essai de mutation génique in vitro au locus de l’hypoxanthine-guanine-phosphoribosyl-transférase dans la lignée cellulaire de lymphomes de souris L5178Y, avec activation métabolique (EFSA, 2018). Toutefois, les auteurs de l’étude considèrent que le 2,4‑hexadiénal n’est pas mutagène, car les résultats n’ont pas pu être comparés aux données d’anciennes lignées témoin ni être validés par d’autres expériences (EFSA, 2018). Aucune mutagénicité n’a été signalée dans le chromotest SOS réalisé avec les souches PQ37 et PQ243 d’Escherichia coli (E. coli) incubées avec du 2,4‑hexadiénal (Eder et al., 1992). Cependant, le 2,4-hexadiénal a causé des cassures de brins d’ADN dans un essai d’élution alcaline faisant appel à des cellules leucémiques de souris L1210 (Eder et al., 1993). Les résultats ont été non concluants dans les essais in vivo de micronoyau sur les érythrocytes polychromatiques de la moelle osseuse de souris et de rats mâles auxquels on a administré du 2,4-hexadiénal par voie intrapéritonéale à des doses variant de 40 mg/kg p.c./j à 160 mg/kg p.c./j (chez la souris) et de 50 mg/kg p.c./j à 200 mg/kg p.c./j (chez le rat) (NTP, 2003). Dans ces essais, la tendance de la réponse pour les plages de doses était significative. Toutefois, aucune des valeurs moyennes de chacun des groupes d’animaux traités ne différait significativement des valeurs obtenues dans le groupe témoin (NTP, 2003). Des résultats négatifs ont été rapportés pour les tests de micronoyaux sur érythrocytes normochromatiques (matures) de sang périphérique de souris mâles et femelles exposées au 2,4-hexadiénal (7,5 mg/kg p.c./j à 120 mg/kg p.c./j), par gavage, pendant 14 semaines (NTP, 2003). De même, le 2,4-hexadiénal a donné des résultats négatifs pour un effet clastogène ou aneugénique à un test du micronoyau in vivo avec analyse automatisée réalisé sur des cellules de moelle osseuse et des réticulocytes de sang périphérique de rats mâles exposés par gavage (voie orale) ou par voie intrapéritonéale (EFSA, 2018). On n’a constaté aucune augmentation significative de la fréquence des mutants cII lorsque du 2,4-hexadiénal a été administré dans un essai de mutation génique à des rongeurs transgéniques visant à déterminer le potentiel de la substance à causer des mutations géniques chez la souris (EFSA, 2018). Conformément aux conclusions du groupe d’experts de l’EFSA, les préoccupations en matière de génotoxicité peuvent être éliminées grâce aux résultats de la batterie complète de tests in vitro et in vivo réalisés sur le 2,4-hexadiénal.
Acide linoléique
L’acide 9,12-octadécadiénoïque, un acide gras oméga 6 également connu sous le nom d’acide linoléique, est un acide gras polyinsaturé naturellement présent dans les huiles végétales (Whelan et Fritsche, 2013). L’acide linoléique est le principal composant de l’huile d’onagre (70 % à 77 % de l’huile) et il a été évalué par ECCC et SC en tant que substance du groupe des acides gras et dérivés (ECCC et SC, 2018c). Selon les données disponibles, on estime que l’huile d’onagre présente un faible potentiel de danger et un faible risque pour la santé humaine (ECCC et SC, 2018c). La FDA américaine a confirmé que l’acide linoléique est une substance généralement reconnue comme sûre (GRAS) en tant que substance alimentaire utilisée directement comme aromatisant alimentaire ou adjuvant (US FDA, 2018). En 1998 et en 2002, le JECFA a évalué l’acide linoléique en tant que substance isolée et en tant que mélange contenant de l’acide linoléique et a conclu que l’acide ne présentait aucun danger aux concentrations actuellement ingérées lorsqu’il est utilisé comme aromatisant alimentaire (OMS, 2019). Le NICNAS a jugé l’acide linoléique peu préoccupant pour la santé humaine (NICNAS, 2017a).
On dispose de peu de données sur la toxicité de l’acide linoléique. Dans un profil d’évaluation initiale de l’Ensemble de données de dépistage (EDD) de l’OCDE, l’acide linoléique a été évalué parmi d’autres acides gras, dont l’acide palmitique, un autre composant important des essences de violette (OCDE, 2014). Les propriétés de l’acide linoléique et de l’acide palmitique n’indiquent pas que ces substances pourraient avoir des effets généraux présentant un danger pour la santé humaine (OCDE, 2014).
Dans une étude sur la toxicité pour le développement selon Chernoff‑Kavlock, des groupes de souris femelles (26-30/dose) ont reçu, par gavage (voie orale), 10 g/kg p.c./j d’acide linoléique du JG 8 au JG12 (OCDE, 2014). Aucun effet sur la reproduction ou le développement n’a été observé à cette dose (OCDE, 2014).
De même, on n’a constaté aucun effet nocif dans une étude de toxicité par voie orale à doses répétées, dans laquelle un groupe de 20 rats mâles ont reçu, dans leur alimentation, de l’acide linoléique à une dose de 1,5 % (~467 à 1970 mg/kg p.c./j) pendant 36 semaines (OCDE, 2014).
L’acide linoléique n’a pas été mutagène lors d’un essai de mutation génique sur les souches TA98, TA100, TA1535, TA1537 et TA97 de S. typhimurium, en présence et en l’absence d’activation métabolique (OCDE, 2014).
Acide palmitique
Le JECFA a évalué l’acide palmitique et a conclu qu’il ne présentait aucune préoccupation en matière de sécurité, aux concentrations ingérées actuellement, lorsqu’il est utilisé comme aromatisant alimentaire (OMS, 1999). Le NICNAS a jugé l’acide palmitique comme peu préoccupant pour la santé humaine (NICNAS, 2017b).
Le groupe d’experts du CIR a publié en 1987 son évaluation de l’innocuité des substances du groupe des acides oléiques, comprenant l’acide palmitique, dans laquelle il a conclu que ces substances sont sans danger selon les utilisations actuelles et aux concentrations dans les produits cosmétiques (CIR, 1987). Une réévaluation de ce groupe de substances n’a montré aucune toxicité de l’acide palmitique pour la physiologie de la reproduction et du développement (CIR, 2006). L’acide palmitique a été évalué par le RIFM dans le cadre d’une évaluation de l’innocuité des ingrédients de parfumerie à l’aide d’une approche de seuil de préoccupation toxicologique (SPT) pour les doses répétées et les critères d’effet toxique pour la reproduction. Le groupe d’experts a conclu que l’acide palmitique pouvait être utilisé en toute sécurité aux concentrations d’exposition actuelles (Api et al., 2019).
1-Octadécène
L’Ensemble de données de dépistage (EDD) de l’OCDE a publié un profil d’évaluation initiale sur les oléfines supérieures, dont le 1-octadécène, et a utilisé une approche par catégorie ou par analogue (OCDE, 2004).
Dans une évaluation préalable de la toxicité pour la reproduction et le développement, des rats mâles et femelles (12/sexe/dose) ont reçu, par gavage (voie orale), une dose de 0, 100, 500 ou 1 000 mg/kg p.c./j d’une substance à l’essai contenant un mélange d’isomères d’octadécène (le pourcentage de la substance à l’essai dans le mélange n’est pas connu), pendant les deux semaines précédant la période de reproduction et pendant la période de reproduction (mâles et femelles), puis pendant les quatre semaines suivant la période de reproduction pour les mâles et pendant la période de gestation et la période suivant la mise bas pour les femelles (OCDE, 2004). En raison de l’absence d’effets sur le plan clinique, sur la reproduction et sur le développement, les auteurs de l’étude ont déterminé la DSENO à 1 000 mg/kg p.c./j, soit la dose d’essai la plus élevée (OCDE, 2004).
D’après le poids de la preuve amassée par l’examen d’études sur la toxicité des oléfines, le groupe d’experts chargés de cette évaluation a conclu que les substances de cette catégorie, dont le 1-octadécène, sont actuellement d’intérêt peu prioritaire pour subir une évaluation approfondie (OCDE, 2004).
7.4.3 Caractérisation des risques pour la santé humaine
Il a été établi que le 2,6-nonadiénal est le principal composant d’importance toxicologique dans les essences de violette. On a déterminé une DMENO (adaptée) à 16,1 mg/kg p.c./j pour le 2,4-hexadiénal (un analogue du 2,6-nonadiénal) en raison d’une hyperplasie épithéliale du préestomac, liée à la dose, à toutes les doses, chez les deux sexes, dans l’étude de cancérogénicité de 2 ans chez le rat (NTP, 2003). Ces effets ont été considérés comme applicables aux voies d’exposition par voie cutanée et par inhalation. Toutefois, ces effets n’ont pas été jugés pertinents pour la caractérisation des risques découlant de l’exposition par voie cutanée. Faute de disposer d'un PdD satisfaisant, l’exposition par voie cutanée n’a pas été examinée plus en profondeur dans le cadre de la présente évaluation.
L’EFSA (2018) et l’OMS (2004) ont rapporté que des mécanismes non génotoxiques ont été proposés pour expliquer la cancérogénicité possible du 2,4-hexadiénal. Selon le NTP (2003), la formation de tumeurs suivant l’administration de 2,4‑hexadiénal a été observée chez des rats exposés à des doses égales ou supérieures à 45 mg/kg p.c./j (femelles) et chez des souris exposées à des doses égales ou supérieures à 60 mg/kg p.c./j (femelles) et à 120 mg/kg p.c./j (mâles). Aucune différence n’a été constatée dans les effets néoplasiques entre le groupe témoin et le groupe exposé à la dose la plus faible, soit 22,5 mg/kg p.c./j (NTP, 2003). Par conséquent, la DMENO établie d’après les effets non cancérogènes, qui est de 16,1 mg/kg p.c./j pour le 2,4‑hexadiénal et est utilisée pour caractériser les risques associés aux essences de violette, est jugée suffisante pour protéger la santé humaine.
Le tableau 7-21 présente les valeurs de l’exposition journalière estimée chez les personnes des groupes d’âge les plus et les moins exposés et les ME qui en découlent, par les aromatisants alimentaires et les produits disponibles aux consommateurs. De même, le tableau 7-22 présente l’exposition journalière estimée chez les personnes des groupes d’âge les plus et les moins exposés et les ME qui en découlent par les produits faits soi-même.
| Scénario d’exposition | Plage d’exposition (mg/kg p.c./j)a | Plage des MEb |
|---|---|---|
| Aromatisant alimentaire (1 an et plus) | 2,52 x 10-5 | > 630 000 |
| Exposition par inhalation aux hydratants pour les yeux (100 %) (14–18 ans à adultes) | 6,98 x 10-3 (adultes) à 8,78 x 10-3 (14–18 ans) | 1 836 (14-18 ans) à 2 307 (adultes) |
|
Exposition par inhalation aux après-shampooings (à rincer) (100 %) (2–3 ans à adultes) |
1,82 x 10-2 (adultes) à 4,89 x 10-2 (2–3 ans) | 329 (2–3 ans) à 884 (adultes) |
| Exposition par inhalation aux nettoyants pour le visage (30 %) (9–13 ans à adultes) | 9,12 x 10-3 (14–18 ans) à 1,52 x 10-3 (adultes) | 1 060 (adultes) à 1 756 (14‑18 ans) |
|
Exposition par inhalation aux hydratants corporels (10 %) (tous les sous-groupes de la population) |
1,45 x 10-2 (0–5 mois) à 3,14 x 10-2 (9–13 ans) | 512 (9–13 ans) à 1 110 (0–5 mois) |
| Exposition par inhalation aux huiles de massage (10 %) (tous les sous-groupes de la population) | 44,26 x 10-2 (adultes) à 88,43 x 10-2 (1 an) | 191 (1 an) à 378 (adultes) |
| Exposition par voie orale aux rouges à lèvres (10 %) (2–3 ans à adultes) | 1,13 x 10-2 (adulte) à 2,79 x 10-2 (2–3 ans) | 578 (2–3 ans) à 1 425 (adultes) |
|
Exposition par inhalation aux parfums corporels (10 %) (2–3 ans à adultes) |
2,44 x 10-3 (adultes) à 4,31 x 10-3 (2–3 ans) | 3 734 (2–3 ans) à 6 592 (adultes) |
a Les valeurs estimatives de l’exposition ont été réduites à 19 % pour tenir compte de la quantité maximale de 2,6‑nonadiénal présente dans les essences de violette, en supposant que 80 % de la dose appliquée était évaporable (à l’exception de l’exposition aux aromatisants alimentaires). Les calculs figurent à l’annexe A.
b Les ME ont été calculées d’après une DMENO ajustée, établie sur des effets non cancérogènes, de 16,1 mg/kg p.c./j pour le 2,4-hexadiénal, un analogue, en raison d’une hyperplasie épithéliale légère à modérée du préestomac à toutes les doses, chez les deux sexes, dans l’étude de cancérogénicité de 2 ans chez le rat.
| Scénario d’exposition | Plage d’exposition (mg/kg p.c./j)a | Plage des MEb |
|---|---|---|
| Exposition par inhalation aux diffuseurs aromatiques contenant des produits faits soi-même (100 %) (tous les sous-groupes de la population) | 1,56 x 10-1 (adultes) à 3,73 x 10-1 (1 an) | 43 (1 an) à 154 (adultes) |
|
Exposition par inhalation aux huiles pour le bain faites soi-même (100 %) (9–13 ans à adultes) |
2,85 x 10-2 (adultes) à 4,56 x 10-2 (9–13 ans) | 353 (9–13 ans) à 565 (adultes) |
|
Exposition par inhalation aux hydratants corporels faits soi-même (3 %) (tous les sous-groupes de la population) |
4,84 x 10-3 (0–5 mois) à 1,05 x 10-3 (9–13 ans) | 1 536 (9–13 ans) à 3 330 (0–5 mois) |
|
Exposition par inhalation aux brumisateurs faciaux contenant des produits faits soi-mêmec (100 %) (4–8 ans à adultes) |
0,08 (adultes) à 0,2 (4–8 ans) | 82 (4–8 ans) à 198 (adultes) |
| Exposition des non-utilisateurs par inhalation aux brumisateurs faciaux contenant des produits faits soi-même (100 %) (1 an seulement) | 0,10 | 168 |
a Les estimations de l’exposition ont été réduites à 19 % pour tenir compte de la quantité maximale d’aldéhyde présent dans les essences de violette, en supposant que 80 % de la dose appliquée était évaporable (à l’exception de l’exposition aux aromatisants alimentaires). Les calculs figurent à l’annexe B.
b Les ME ont été calculées d’après une DMENO ajustée, établie sur les effets non cancérogènes, de 16,1 mg/kg p.c./j pour le 2,4-hexadiénal, un analogue, en raison d’une hyperplasie épithéliale légère à modérée du préestomac à toutes les doses, chez les deux sexes, dans l’étude de cancérogénicité de 2 ans chez le rat.
c Après 4 heures d’exposition au total; lorsque l’appareil est fermé après 20 minutes d’utilisation, on suppose que la personne reste dans la pièce pendant encore 3 heures et 40 minutes.
Les ME pour les essences de violette dans les aliments (pour leur utilisation possible comme aromatisants), les hydratants pour les yeux, les après-shampooings à rincer, les nettoyants pour le visage, les hydratants corporels, les huiles de massage (9 ans et plus), les rouges à lèvres et les parfums corporels sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
En outre, les ME pour l’utilisation des essences de violette dans les huiles de massage (8 ans et moins) sont inférieures à 300, ce qui tient compte des incertitudes concernant l’extrapolation interspécifique, l’extrapolation intraspécifique, le PdD et la pertinence de la base de données, et pourraient être insuffisantes.
Les ME pour l’utilisation des essences de violette comme huiles faites soi-même pour le bain et hydratants corporels faits soi-même sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
Les ME comprises entre les concentrations entraînant un effet critique et celles de l’exposition journalière estimée associée à l’utilisation des essences de violette dans les diffuseurs aromatiques et brumisateurs faciaux contenant des produits faits soi-même (pendant l’utilisation du dispositif), et lorsque le dispositif est arrêté après 20 minutes d’utilisation, sont inférieures à 300, ce qui tient compte des incertitudes relatives à l’extrapolation interspécifique, à l’extrapolation intraspécifique, au PdD et à la pertinence de la base de données, et pourraient être insuffisantes.
7.4.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| Il existe peu de données disponibles sur les dangers des essences de violette et de leur principal composant, le 2,6-nonadiénal. L’analogue, le 2,4-hexadiénal, a été utilisé en lecture croisée pour l’évaluation des risques. | +/- |
| Il n’existe pas d’étude appropriée sur la toxicité par voie cutanée ou par inhalation associée au 2,4-hexadiénal. Par conséquent, on a effectué une extrapolation de voie à voie pour les essences de violette dans les scénarios d’exposition par inhalation, avec une concentration entraînant un effet critique dans une étude sur la toxicité par voie orale, et aucun PdD pour la voie cutanée n’a été déterminé. | +/- |
+ = incertitude pouvant causer une surestimation de l’exposition ou du risque; - = incertitude pouvant causer une sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu de surestimation ou de sous-estimation du risque.
7.5 Sous-groupe 2 des aldéhydes (Lilial, Verdantiol, myrac-aldéhyde, myrmac-aldéhyde, myrmac-carboxaldéhyde, cétonal, vernaldéhyde)
7.5.1 Évaluation de l’exposition
Milieux environnementaux
Compte tenu de la faible quantité (< 100 kg) de substance déclarée en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), il ne devrait y avoir aucune exposition au Verdantiol, au myrac-aldéhyde, au myrmac‑aldéhyde, au myrmac-carboxaldéhyde ou au vernaldéhyde par les milieux environnementaux.
En 2011, le Conseil national de recherches du Canada (CNRC) a examiné la présence de 954 produits chimiques organiques inscrits dans quatre bases de données dans des échantillons de matériaux de construction, d’air intérieur et de poussière. On a analysé un sous‑ensemble de données d’une étude du CNRC réalisée en 2010 examinant des échantillons de poussière et d’air intérieur prélevés dans 115 maisons de la ville de Québec, afin de détecter certains produits chimiques, dont le Lilial. Les concentrations maximales rapportées étaient de 28,99 μg de Lilial/g de poussière et de 3,76 μg/m3 d’air intérieur (CNRC, 2011). Le Lilial a également été quantifié dans l’air intérieur par une chromatographie en phase gazeuse d’échantillons d’air intérieur prélevés dans le cadre de deux études de surveillance sur le terrain visant à mesurer les composés organiques volatils dans l’air intérieur de 36 maisons à Ottawa, en 2014 (c’est-à-dire l’étude dite des garages), et de 54 maisons au Nunavik, en 2018 (c’est-à-dire l’étude du Nunavik). Le Lilial n’a pas été détecté à des concentrations supérieures au seuil de détection de la méthode (c’est-à-dire 2 ng) à Ottawa, mais l’a été dans 9 % des échantillons prélevés au Nunavik. Les concentrations de Lilial dans l’air provenant d’échantillons dont les concentrations étaient supérieures au seuil de détection de la méthode variaient de 0,4 à 0,7 μg/m3 (n = 5) (CNRC, 2019). Comme les concentrations dans l’air intérieur étaient plus élevées dans l’étude de la ville de Québec, c’est cette étude qui a été utilisée pour calculer l’exposition possible au Lilial dans l’air intérieur.
Aucune valeur mesurée des concentrations de Lilial dans l’air ambiant, l’eau ou le sol au Canada n’a été trouvée. À l’aide des déclarations de 2011 sur les quantités dans le commerce canadien, on a utilisé le modèle de fugacité de niveau III, connu sous le nom de ChemCAN (2003), pour calculer les concentrations du Lilial estimées dans l’environnement (Environnement Canada, 2013), soit 25 370,22 kg (quantités fabriquées et importées). Les concentrations estimées dans l’air, l’eau et le sol étaient respectivement de 5,50 × 10-5 μg/m3, 3,34 × 10-3 μg/L et 0,32 ng/g.
On a estimé l’exposition au Lilial par les milieux environnementaux à l’aide des concentrations estimées dans l’air ambiant, l’eau et le sol, ainsi que des concentrations maximales de Lilial mesurées dans les échantillons de poussière et d’air intérieur, extraites de l’étude de Québec (CNRC, 2011). Les valeurs estimatives de l’exposition des adultes et des enfants de 1 an variaient de 6,70 × 10-4 mg/kg p.c./j à 2,49 × 10-3 mg/kg p.c./j, respectivement.
Produits disponibles aux consommateurs
Le Lilial est présent dans des produits disponibles aux consommateurs. Pour évaluer le potentiel d’exposition au Lilial présent dans des cosmétiques et des PSN appliqués sur la peau (voie cutanée), des scénarios sentinelles ont été choisis d’après une combinaison de fréquences d’utilisation et de concentrations déclarées de Lilial dans ces produits. Les scénarios sentinelles choisis comprenaient les valeurs d’exposition les plus élevées par rapport à d’autres cosmétiques et PSN appliqués sur la peau, connus pour contenir ces substances. Pour l’application cutanée, on a employé des scénarios sentinelles pour l’utilisation des produits suivants : parfums corporels; nettoyants corporels liquides; après-shampooing à rincer; huiles de massage; hydratants corporels; produits de maquillage pour le visage; vernis à ongles; dissolvants pour vernis à ongles; crèmes dépilatoires; antisudorifiques et déodorants; produits pour le bain; hydratants pour le visage; traitements de l’acné (PSN); nettoyants antiseptiques pour la peau (PSN); colorants capillaires; produits de défrisage, d’ondulation et de bouclage des cheveux; et produits autobronzants pour le visage (ne sont pas un PSN) (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2020; sans référence; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada, au Bureau d’évaluation du risque des substances existantes de Santé Canada, 2021; sans référence).
Vu l’utilisation répandue du Lilial dans les produits disponibles aux consommateurs, cette substance a été sélectionnée comme produit chimique utile pour la biosurveillance humaine (HBM) en Allemagne. Dans la première étude de biosurveillance humaine effectuée sur le Lilial, 2 133 enfants et adolescents (des deux sexes) âgés de 3 à 17 ans ont fourni des échantillons d’urine qui ont été analysés (Murawski et al., 2020). Quatre métabolites principaux, à savoir l’acide tert-butyle benzoïque (TBBA), le lysmérol, l’acide lysmérylique et l’acide hydroxylysmérylique, ont été trouvés en quantités quantifiables aux concentrations maximales de 315, 91,1, 8,97 et 39,7 μg/L, respectivement; aux concentrations moyennes de 10,21 μg/L pour le TBBA, de 1,528 μg/L pour le lysmérol; et aux concentrations inférieures au seuil de quantification de 0,2 μg/L pour l’acide lysmérylique et de 0,4 μg/L l’acide hydroxylysmérylique (Murawski et al., 2020). En outre, on a mesuré les mêmes métabolites dans les échantillons d’urine provenant de 329 jeunes adultes âgés de 20 à 29 ans. Ces échantillons ont été fournis par l’agence allemande de l’environnement dans le but d’étudier l’exposition au Lilial entre 2000 et 2018 (Scherer et al., 2021). Pour le TBBA, le lysmérol, l’acide lysmérylique et l’acide hydroxylysmérylique, les concentrations maximales étaient de 84,72, 14,02, 31,32 et 29,23 μg/24 heures et les concentrations moyennes de 13,73, 1,78, 0,99 et 3,41 μg/24 heures, respectivement. Une baisse significative de ces métabolites a été observée au cours des années d’échantillonnage (Scherer et al., 2021).
Le Lilial a été trouvé dans un produit désodorisant pour tapis (SDS, 2017a). On a également trouvé le Lilial dans divers assainisseurs d’air (en gel solide, sous forme liquide à brancher et en aérosol) (SDS, 2016; 2017a; 2019) à des concentrations variant de 0,1 % à 5 %. L’exposition par un assainisseur d’air en gel solide (SDS, 2016) et un assainisseur d’air, sous forme liquide, à brancher (SDS, 2017a) a été quantifiée.
Après une application cutanée de Lilial sous occlusion (6,8 mg/kg p.c./j dans de l’éthanol à 70 %) sur le dos de rats, une proportion totale cumulée moyenne de 14,6 % de la dose a été excrétée dans l’urine, et 0,8 % de la dose a été trouvée dans l’eau de lavage des cages et 2,0 % dans les matières fécales (les concentrations dans les pièges à air expiré n’étaient pas détectables). La radioactivité restante dans tous les tissus étudiés était de 1,2 % de la dose initiale (site d’application). La proportion totale moyenne de la dose appliquée était d’environ 19 % dans les matières fécales et les tissus, jusqu’à 120 heures après l’application (SCCS, 2016; RIFM, 2020).
Afin d’estimer l’exposition générale aux substances du sous-groupe 2 des aldéhydes, on a additionné les valeurs estimées de l’exposition par voie orale, par inhalation et par voie cutanée, le cas échéant. Un facteur d’absorption cutanée de 15 %, basé sur une étude in vitro chez les humains et portant spécifiquement sur le Lilial, a été utilisé (SCCS, 2019). La valeur de l’absorption cutanée était une estimation dans la partie supérieure de la fourchette provenant de quatre groupes de formulation différents dont les valeurs d’absorption cutanée observées variaient de 8,5 % à 13,5 % (comprenant les résidus fixés à la peau et l’ajout de deux écarts-types pour deux groupes de doses et d’un écart-type pour les deux autres groupes de doses). Pour tenir compte de la quantité de produit absorbée par voie cutanée, la quantité de produit disponible par inhalation a été ajustée à 85 %, sauf dans le cas des hydratants corporels. Dans le cas des hydratants corporels, comme la quantité de produit inhalable a été ajustée pour tenir compte de la superficie exposée et comme cette valeur était inférieure à 85 % de la quantité de produit, aucun autre ajustement n’a été apporté à la quantité de produit.
Le tableau 7-24 présente un résumé des valeurs estimées de l’exposition générale au Lilial pour les groupes d’âge les moins et les plus exposés.
| Scénario de produit | Pourcentage dans le produit | Voie(s) d’exposition | Plage d’exposition (mg/kg p.c./j)a |
|---|---|---|---|
| Parfums corporels | 44 % | Cutanée et inhalation | 0,54 (adultes) à 1,52 (2–3 ans) |
| Nettoyants corporels liquides | 1 % | Cutanée et inhalation |
3,24 x 10-3 (adultes) à 1,3 x 10-2 (0–5 mois) |
| Après-shampooings (à rincer) | 2 % | Cutanée et inhalation | 5,06 x 10-3 (14–18 ans) à 1,06 x 10-2 (2–3 ans) |
| Huiles de massage | 0,3 % | Cutanée et inhalation |
2,58 x 10-2 (adultes) à 1,38 x 10-1 (0–5 mois) |
| Hydratants corporels | 1 % | Cutanée et inhalation |
2,17 x 10-1 (adultes) à 4,84 x 10-1 (0–5 mois) |
| Produits de maquillage liquides pour le visage | 1 % | Cutanée et inhalation | 1,30 x 10-2 (14–18 ans) à 2,69 x 10-2 (4–8 ans) |
| Vernis à ongles | 3 % | Cutanée et inhalation | 9,73 x 10-3 (adultes) à 1,80 x 10-2 (2–3 ans) |
| Dissolvant pour vernis à ongles | 0,1 % | Cutanée et inhalation | 5,86 x 10-2 (adultes) à 1 x 10-2 (9–13 ans) |
| Produits dépilatoires | 0,1 % | Cutanée et inhalation |
3,67 x 10-3 (14–18 ans) à 4,46 x 10-3 (adultes) |
| Antisudorifiques et déodorants (solides) | 3 % | Cutanée et inhalation | 5,18 x10-2 (9–13 ans) à 8,63 x 10-2 (14-18 ans) |
| Antisudorifiques et déodorants (aérosol) | 0,3 % | Cutanée et inhalation | 1,01 x 10-2 (9–13 ans) à 2,67 x 10-2 (14–18 ans) |
| Produit pour le bain | 3 % | Cutanée et inhalation | 9,18 x 10-4 (9–13 ans) à 2,83 x 10-3 (14–18 ans) |
| Hydratants pour le visage | 3 % | Cutanée et inhalation | 1,32 x 10-1 (14–18 ans) à 2,11 x 10-1 (adultes) |
| Colorants capillaires permanents | 1 % | Cutanée et inhalation | 2,69 x 10-1 (adultes) à 3,21 x 10-1 (14–18 ans) |
| Colorants capillaires temporaires | 0,11 % | Cutanée et inhalation | 8,33 x 10 -3 (adultes) à 2,59 x 10-2 (4–8 ans) |
| Produits de défrisage, d’ondulation et de bouclage des cheveux | 11 % | Cutanée et inhalation | 1,62 x 10-1 (adultes) à 4,31 x 10-1 (4–8 ans) |
| Produits autobronzants pour le visage (lotion) | 1 % | Cutanée et inhalation | 3,35 x 10-2 (adultes) à 3,94 x 10-2 (14–18 ans) |
| Produits pour le traitement de l’acné (PSN) | 0,1 % | Cutanée et inhalation | 2,23 x 10-4 (adultes) à 3,53 x 10-4 (9–13 ans) |
| Nettoyants antiseptiques pour la peau (PSN) | 0,007 % | Cutanée et inhalation | 3,56 x 10-4 (14–18 ans) à 1,05 x 10-3 (2–3 ans) |
| Nettoyants antiseptiques pour la peau (PSN)b | 0,007 % | Cutanée et inhalation | 5,33 x 10-3 (adultes) à 2,63 x 10-2 (2–3 ans) |
| Désodorisant pour tapis (application) | 1 % | Cutanée et inhalation | 7,71 x 10-4 (adultes) |
| Exposition aux tapis après leur nettoyage | 1 % | Cutanée, inhalation et voie orale (exposition fortuite) | 1,31 x 10-2 (1 an) |
| Assainisseur d’air en gel solide | 5 % | Inhalation | 5,31 x 10-2 (adultes) à 2,11 x 10-1 (1 an) |
| Assainisseur d’air, sous forme liquide, à brancher | 3 % | Inhalation | 1,37 x 10-2 (adultes) à 4,87 x 10-2 (1 an) |
a Seuls les groupes d’âge les moins et les plus exposés sont présentés. Les calculs détaillés figurent à l’annexe A.
b En ce qui concerne les préoccupations pour la santé publique, l’utilisation de désinfectants pour les mains au sein de la population générale peut augmenter jusqu’à 25 utilisations par jour (utilisation personnelle par les adultes, utilisation accrue par les enfants dans les écoles et les garderies) (RIVM, 2021a).
Aucune utilisation au Canada du myrac-aldéhyde, du myrmac-aldéhyde, du myrmac‑carboxaldéhyde, du cétonal, du vernaldéhyde et du Verdantiol n’a été trouvée dans les produits disponibles aux consommateurs, les matériaux d’emballage alimentaire et les additifs indirects.
Selon une déclaration présentée par l’industrie, le Lilial, le myrac-aldéhyde, le myrmac‑aldéhyde, le myrmac-carboxaldéhyde, le cétonal et le vernaldéhyde peuvent être présents comme ingrédients parfumants dans les produits disponibles aux consommateurs des catégories suivantes : cosmétiques sans rinçage (c’est-à-dire moins de 0,05 %), cosmétiques à rincer (c’est-à-dire moins de 0,1 %), les assainisseurs d’air (c’est-à-dire moins de 2,5 %) et les produits de nettoyage (c’est-à-dire moins de 0,05 %). Afin d’évaluer l’exposition possible de la population générale à ces substances, en raison de l’utilisation de ces catégories de produits, des scénarios sentinelles représentatifs de l’exposition ont été choisis. Ces scénarios décrivent l’exposition maximale à ces substances, associée à l’utilisation de ces produits, compte tenu de la fréquence d’utilisation et de leurs concentrations. Par conséquent, l’utilisation d’un hydratant corporel à 0,05 %, d’un nettoyant corporel à 0,1 %, d’un assainisseur d’air, liquide, à 2,5 % et d’un détergent liquide pour la machine à laver à 0,05 % représente les scénarios sentinelles pour, respectivement, les cosmétiques sans rinçage, les cosmétiques à rincer, les assainisseurs d’air et les produits de nettoyage. Le tableau 7‑25 présente un résumé des valeurs estimées de l’exposition générale pour les groupes d’âge les moins et les plus exposés.
| Scénario de produit | Pourcentage dans le produit | Voie(s) d’exposition | Plage d’exposition (mg/kg p.c./j)a |
|---|---|---|---|
| Cosmétiques sans rinçage | 0,05 % | Cutanée et inhalation | 1,08 x 10-1 (adultes) à 2,42 x 10-2 (0–5 mois) |
| Cosmétiques à rincer | 0,1 % | Cutanée et inhalation | 1,71 x 10-3 (adultes) à 4,37 x 10-3 (0–5 mois) |
| Assainisseurs d’air | 2,5 % | Inhalation | 1,14 x 10-3 (adultes) à 4,07 x 10-3 (1 an) |
| Produits de nettoyage | 0,05 % | Cutanée et inhalation | 1,66 x 10-5 (14–18 ans) à 5,6 x 10-4 (adultes) |
a Seuls les groupes d’âge les moins et les plus exposés sont présentés. Les calculs détaillés figurent à l’annexe A.
7.5.2 Évaluation des effets sur la santé
Le sous-groupe 2 des aldéhydes compte sept substances distinctes, à savoir : le Lilial, le Verdantiol, le myrac-aldéhyde, le myrmac-aldéhyde, le myrmac-carboxaldéhyde, le cétonal et le vernaldéhyde.
On ne dispose d’aucune donnée sur les dangers du Verdantiol, du myrmac-aldéhyde et du myrmac-carboxaldéhyde. En ce qui concerne le myrac-aldéhyde et le vernaldéhyde, on possède peu de données, si ce n’est des données sur la sensibilisation cutanée. Le cétonal a été évalué par le NICNAS d’après les quelques données sur la sensibilisation cutanée et la génotoxicité (NICNAS, 2016b).
Le myrac-aldéhyde n’est pas considéré comme un sensibilisant cutané, d’après les résultats d’un test de maximisation dans lequel 23 volontaires humains n’ont pas eu de réaction de sensibilisation après avoir été exposés au myrac-aldéhyde à 3 % dans du pétrolatum (Fragrance Raw Materials Monographs, 1976).
Le vernaldéhyde n’est pas considéré comme un sensibilisant cutané, d’après les résultats d’un test épicutané à provocations répétées (HRIPT) dans lequel des volontaires humains (n = 52) n’ont pas eu de réaction de sensibilisation après avoir été exposés au vernaldéhyde à 2 % dans du phtalate de diméthyle (Ford et al., 1992).
Le cétonal est considéré comme un sensibilisant cutané chez les souris femelles, d’après un test des ganglions lymphatiques locaux réalisé selon la Ligne directrice 429 de l’OCDE (NICNAS, 2016b). Le cétonal a été considéré comme non sensibilisant dans l’essai KeratinoSen, car le gène de la luciférase a été induit à des concentrations cytotoxiques (Dossier d’enregistrement de l’ECHA, 2020d).
Le cétonal a obtenu des résultats négatifs à un essai de mutation ponctuel in vitro (test d’Ames) sur les souches TA98, TA100, TA102, TA1535 et TA1537 de S. typhimurium, avec ou sans activation métabolique (NICNAS, 2016b; dossier d’enregistrement de l’ECHA, 2020d).
Faute de disposer de données sur les dangers associés à ces substances, une approche de lecture croisée a été adoptée. On a donc utilisé les renseignements sur les dangers de l’analogue, soit le Lilial, pour éclairer l’évaluation des effets sur la santé.
Le Lilial est une substance synthétique qui n’est pas présente dans la nature (Arnau et al., 2000), alors que les cinq autres substances du sous-groupe 2 des aldéhydes sont présentes dans la nature et appartiennent à la catégorie des terpènes. Le Lilial est un mélange racémique englobant deux énantiomères, à savoir le (2S)-3-(4-tert-butylphényl)-2-méthylpropanal et le (2R)-3-(4-tert-butylphényl)-2-méthylpropanal (SCCS, 2019). Les sept substances du sous-groupe 2 des aldéhydes sont toutes des aldéhydes aromatiques, caractérisés par un cycle à six carbones et possédant plusieurs groupes méthyle et un groupe carbonyle sur la chaîne latérale. Cependant, le Lilial possède trois doubles liaisons dans la structure du cycle (benzène), alors que les deux autres aldéhydes du sous-groupe 2 des aldéhydes n’en ont qu’une. En outre, la position du groupe carbonyle diffère pour chaque substance. Par exemple, le groupe carbonyle est présent sur la chaîne latérale la plus éloignée du cycle pour le Lilial et le cétonal, alors que pour les autres substances, ce groupe se trouve plus proche de la structure du cycle. Enfin, le myrac-aldéhyde et le myrmac-aldéhyde possèdent tous deux une double liaison sur la chaîne latérale, contrairement aux autres substances du sous‑groupe, qui ne possèdent pas de doubles liaisons (à l’exception du groupe carbonyle). Les études réalisées chez les humains et les animaux montrent clairement l’absorption générale du Lilial par les voies orale et cutanée, ainsi qu’une biodisponibilité élevée par voie orale (SCCS, 2016). Il n’existe pas de données toxicocinétiques sur les analogues, mais il est probable que ces derniers présentent également une biodisponibilité élevée par voie orale, car leurs propriétés physiques et chimiques sont très semblables à celles du Lilial. La cible et les analogues sont des aldéhydes simples et, par conséquent, tous ont donné des alertes structurales pour ce qui est de la génotoxicité, ainsi que pour la mutagénicité in vitro et in vivo avec la boîte à outils QSAR, version 4.2 (OCDE, 2016).
Le Verdantiol est une base de Schiff préparée synthétiquement à partir d’un aldéhyde (le Lilial) et d’une amine (l’anthranilate de méthyle). La préparation des bases de Schiff est une réaction réversible, ce qui signifie que le Verdantiol est instable et pourrait être hydrolysé pour régénérer l’aldéhyde d’origine, en l’occurrence le Lilial. La présence stœchiométrique du Lilial dans le Verdantiol est prise en compte, si on suppose une dissociation de 100 % par défaut, en raison de l’absence de données sur le Verdantiol.
Une modification au Règlement CLP (règlement relatif à la classification, à l’étiquetage et à l’emballage) a été apportée en août 2020 pour classifier le Lilial dans la catégorie 1B des substances toxiques pour la reproduction (présumées toxiques pour la reproduction humaine, d’après des études réalisées sur des animaux), en raison de signes de toxicité pour la reproduction. Le Lilial est interdit dans les cosmétiques en Europe depuis mars 2022. De plus, l’ECHA procède actuellement à l’évaluation du Lilial, car il serait peut-être un perturbateur endocrinien. Enfin, le Lilial est classé comme substance toxique pour la reproduction, selon les normes harmonisées de classification et d’étiquetage approuvées par l’UE, et il figure sur la liste candidate des substances extrêmement préoccupantes.
Toxicocinétique
Après une application cutanée semi-occlusive de 14C-Lilial (11,37 mg de Lilial dans 70 % d’éthanol sur 10 cm2 de la peau du dos) sur trois volontaires humains pendant 6 heures, 1,4 % de la dose appliquée a été excrétée en moyenne dans l’urine en 24 heures et, ultérieurement, la radioactivité a été inférieure à la limite de détection dans les échantillons d’urine et dans tous les échantillons de matières fécales et de plasma sanguin (SCCS, 2016).
D’après plusieurs sources de données (Hunter et al., 1965; Cagen et al., 1989), la toxicité du Lilial pour l’appareil reproducteur mâle du rat est présumée être due à la formation du métabolite acide p-tert-butyle benzoïque (TBBA), plus particulièrement le conjugué de la coenzyme A (CoA) du TBBA qui a été formé (McCune et al., 1982). Le Lilial et le métabolite TBBA sont rapidement transformés en TBBA-CoA dans les hépatocytes de rats, ce qui a mené à une accumulation en concentrations stables de ce conjugué, qui n’était pas détectable dans les hépatocytes humains. Cela indique que le mécanisme de toxicité du Lilial est propre à l’espèce, les rats semblant plus sensibles que les humains (Laue et al., 2017).
L’activité œstrogénique possible du Lilial a été étudiée dans un essai in vitro avec des cellules humaines de cancer du sein de la lignée MCF7 (Charles et al., 2009). Le Lilial a partiellement déplacé le [3H]-estradiol des récepteurs œstrogéniques humains recombinants ERα et ERβ et des récepteurs cytosoliques des œstrogènes des cellules MCF7 (Charles et al., 2009). En outre, le Lilial a augmenté l’expression d’un gène rapporteur intégré stable, réactif aux œstrogènes, et du gène pS2 endogène répondant aux œstrogènes dans les cellules MCF7 (Charles et al., 2009). À la lumière de ces observations, les auteurs ont conclu que le Lilial peut induire des réponses œstrogéniques dans la lignée MCF7 des cellules humaines du cancer du sein in vitro. Toutefois, on ne dispose d’aucune étude sur l’activité œstrogénique potentielle du Lilial in vivo.
Études de toxicité à doses répétées
Dans une étude conforme à la Ligne directrice 408 de l’OCDE, le Lilial a été administré par voie orale (gavage) à des rats albinos femelles et mâles (14/sexe/dose) à des doses de 0, 2, 5, 25 ou 50 mg/kg p.c./j, 5 jours par semaine pendant 13 semaines (SCCS, 2016; dossier d’enregistrement de l’ECHA, 2020e). Les animaux du groupe témoin et du groupe ayant reçu une dose élevée ont bénéficié d’une récupération de 4 semaines après le traitement. À une dose égale ou supérieure à 25 mg/kg p.c./j, on a observé une augmentation, liée à la dose, du poids absolu et du poids relatif du foie et des surrénales chez les deux sexes, mais ces changements ont été réversibles dans le groupe qui a profité d’une récupération (groupe ayant reçu une dose élevée). De plus, on a constaté une diminution significative de l’activité de la cholinestérase plasmatique (30 % et 70 % par rapport aux animaux du groupe témoin) et une baisse du taux de cholestérol plasmatique à 25 et 50 mg/kg p.c./j chez les deux sexes, mais ces changements ont également été réversibles dans le groupe ayant bénéficié d’une période de récupération. La fréquence de l’atrophie testiculaire et de la formation de spermatocèles dans les épididymes a augmenté chez les mâles à la dose de 50 mg/kg p.c./j. Une perturbation de la spermatogenèse et de la spermiogenèse, une augmentation testiculaire des tubules ne contenant que des cellules de Sertoli et une augmentation de la densité de surface des cellules de Leydig ont été décrites. On a aussi observé une diminution de la densité en spermatozoïdes, en cellules nucléées et en spermatocèles dans les épididymes à la dose de 50 mg/kg p.c./j. Dans le groupe ayant récupéré pendant 4 semaines, les effets sur les organes reproducteurs mâles ont persisté après le traitement. Les auteurs de l’étude ont calculé une DSENO de 25 mg/kg p.c./j pour la toxicité testiculaire (SCCS, 2016; dossier d’enregistrement de l’ECHA, 2020e).
Dans une étude de toxicité subchronique, des chiens beagle (3/sexe/dose) ont reçu quotidiennement par voie orale des capsules contenant 0, 4,4, 22,3 ou 44,6 mg/kg p.c./j de Lilial, 7 jours par semaine, pendant 13 semaines (SCCS, 2016). Aucune mortalité n’est survenue, et aucune différence significative dans la prise de poids corporel n’a été observée. De plus, aucun effet lié au traitement n’a été rapporté en ce qui concerne les signes cliniques et les paramètres chimiques. La pathologie clinique et l’histopathologie n’ont révélé aucun résultat spécifique lié à la substance. En particulier, il n’y a eu aucune modification des organes reproducteurs chez les mâles ou les femelles (SCCS, 2016). Dans une étude ultérieure menée par les mêmes auteurs, dans laquelle trois chiens beagle femelles ont reçu par voie orale 200 mg/kg p.c./j de Lilial sous forme de gélules pendant 13 semaines, aucun effet lié au traitement n’a été constaté, comme dans l’étude précédente (SCCS, 2016; CLH, 2017).
Dans une étude exploratoire avec augmentation progressive des doses, deux chiens mâles ont été traités par du Lilial à des doses croissantes de 50 µL/kg p.c./j du jour 1 au jour 7; de 100 µL/kg p.c./j du jour 8 au jour 14; de 200 µL/kg p.c./j du jour 15 au jour 21; de 400 µL/kg p.c./j du jour 22 au jour 50 et de 600 µL/kg p.c./j du jour 51 au jour 64 (ce qui correspondait à 47 mg/kg p.c./j jusqu’à 564 mg/kg p.c./j) (SCCS, 2016; CLH, 2017). Dans cette étude, on a observé des vomissements occasionnels chez les deux animaux, une diarrhée chez un animal et une réduction du poids corporel en même temps qu’une augmentation des taux de glutamate déshydrogénase et d’alanine aminotransférase. Les examens histologiques ont montré une inflammation multifocale dans le foie et une légère atrophie des tubules séminifères chez les deux animaux (nécrose des cellules germinales, présence de cellules géantes multinucléées dans la lumière tubulaire) (SCCS, 2016; CLH, 2017).
Dans une étude de détermination des doses toxiques pour la reproduction chez une génération, des rats Wistar mâles et femelles (10/sexe/dose) ont reçu par voie orale 0, 400, 800, 1 700 ou 3 400 ppm (équivalant à 14,5, 28,7, 62,6 ou 119,7 mg/kg p.c./j, respectivement) de Lilial microencapsulé ajouté dans la nourriture pendant les périodes de préaccouplement (six semaines) et d’accouplement, pour les deux sexes, et tout au long de la gestation et de la lactation (14 semaines), pour les mères F0 uniquement (SCCS, 2016; NICNAS, 2016c; CLH, 2017). Les mâles F0 ont présenté une diminution liée à la dose du poids corporel et de la prise de poids corporel, ainsi qu’une réduction de la consommation alimentaire chez ceux ayant reçu 3 400 ppm. Une augmentation du poids relatif du foie à partir de la dose de 800 ppm et une diminution du poids relatif des reins à la dose de 3 400 ppm ont été observées chez les mâles F0 uniquement. Chez les mâles F0, une augmentation des taux plasmatiques d’alanine aminotransférase, de phosphatase alcaline et de glutamate déshydrogénase a été observée à 1 700 et 3 400 ppm, et une augmentation des taux plasmatiques de γ-glutamyl transférase n’a été observée qu’à la dose de 3 400 ppm. Des effets sur les organes reproducteurs mâles ont été constatés aux doses de 1 700 et 3 400 ppm, notamment une diminution du poids relatif des testicules et de la queue de l’épididyme, une dégénérescence diffuse des testicules et une aspermie dans l’épididyme. Dans le groupe de mâles exposés à 3 400 ppm, on a noté une diminution du poids des vésicules séminales et de la prostate, ainsi qu’une hyperplasie des cellules de Leydig. Les mères F0 ont présenté une diminution du poids corporel et de la prise de poids corporel dans le groupe ayant reçu la dose de 800 ppm et des doses plus élevées avant et après la période d’accouplement. Pendant la gestation et la lactation, le poids corporel moyen des mères a diminué et la prise de poids corporel a ralenti dans le groupe ayant reçu 800 ppm, et la consommation alimentaire a diminué pendant la lactation par rapport aux animaux du groupe témoin. Une augmentation de 2 à 8 fois des taux sériques de γ-glutamyl transférase et une diminution de 50 % à 65 % des taux sériques de cholinestérase par rapport aux animaux du groupe témoin ont été observées dans tous les groupes de doses chez les mères F0. Aucune progéniture viable n’a été produite par les animaux des groupes ayant reçu 1 700 et 3 400 ppm. À 1 700 ppm, une seule des huit femelles accouplées est devenue gravide et celle-ci n’a eu qu’une seule implantation, qui s’est finalement résorbée (pertes post-implantatoires). Dans les groupes ayant reçu 400 et 800 ppm, on a noté une augmentation non significative des pertes post-implantatoires moyennes et une diminution du nombre moyen de petits par mère. La survie postnatale a diminué de manière non significative entre les jours 0 et 4 dans les groupes ayant reçu 400 et 800 ppm, et aucune mortalité des petits n’a été constatée entre les JPN 4 et 21. Le poids des petits à la naissance et au sevrage était également réduit, et la prise de poids corporel ralentie, chez les petits des groupes ayant reçu 400 et 800 ppm. D’après ces résultats, les auteurs ont suggéré que la dose de 400 ppm (~14,5 mg/kg p.c./j) soit retenue comme DSENO chez les mâles et comme DMENO chez les mères pour la toxicité générale, et ont calculé une DSENO de 800 ppm (~28,7 mg/kg p.c./j) pour la toxicité pour la reproduction chez les mâles (SCCS, 2016; NICNAS, 2016c; CLH, 2017).
Dans une étude de toxicité pour le développement réalisée conformément à la Ligne directrice 414 de l’OCDE, des rates gravides (25/dose) ont reçu par voie orale (gavage) 0, 5, 15 ou 45 mg/kg p.c./j (doses efficaces : 0, 4,1, 12,7 ou 40,7 mg/kg p.c./j, respectivement) de Lilial dans de l’huile d’olive entre les JG 6 et 20 (SCCS, 2016; NICNAS, 2016c; CLH, 2017). Aucune mortalité n’est survenue, mais des signes de toxicité maternelle ont été observés à 15 et 45 mg/kg p.c./j. On a constaté une augmentation des taux moyens d’alanine aminotransférase (20 % à 30 % au‑dessus des valeurs du groupe témoin) et une diminution des taux sériques de cholinestérase (20 % à 45 % de moins par rapport aux animaux du groupe témoin) dans les groupes ayant reçu 15 et 45 mg/kg p.c./j, et les taux moyens de glutamate déshydrogénase ont augmenté (79 % de plus par rapport aux animaux du groupe témoin) dans le groupe ayant reçu la dose de 45 mg/kg p.c./j. Une augmentation du poids absolu et relatif du foie a été notée à toutes les doses, avec des modifications histopathologiques aux doses de 15 et 45 mg/kg p.c./j. Le poids de l’utérus a diminué (de 20 % par rapport aux animaux du groupe témoin) à 45 mg/kg p.c./j, mais pas de manière significative. La consommation moyenne de nourriture a diminué (de 18 % par rapport au groupe témoin) dans le groupe ayant reçu la dose élevée entre les jours 6 et 8 après la période d’accouplement, mais elle était comparable à celle qui a été observée chez les animaux du groupe témoin à la fin de l’étude. Bien qu’aucune diminution de la consommation alimentaire n’ait été observée chez les animaux ayant reçu la dose médiane, la prise de poids moyenne chez les mères a ralenti entre les jours 6 et 8 après la mise bas (de 56 % par rapport au groupe témoin), mais elle s’est rétablie au cours de la période à l’étude. À la dose de 45 mg/kg p.c./j, on a constaté une perte de poids corporel moyenne chez les mères aux jours 6 à 8 après la période d’accouplement, et la prise de poids corporel moyenne a ralenti (de 25 % par rapport au groupe témoin) pendant toute la durée du traitement. Les pertes post-implantatoires moyennes ont augmenté dans le groupe ayant reçu la dose élevée, dans lequel on a noté une résorption de 15,1 % par mère, contre 4,4 %, 4,7 % et 4,9 % aux doses de 0, 5 et 15 mg/kg p.c./j, respectivement. Des signes de toxicité pour le développement prénatal ont été observés aux doses de 15 et 45 mg/kg p.c./j, et consistaient en une réduction du poids corporel moyen des fœtus et une augmentation du pourcentage moyen de variations squelettiques par portée (retards et perturbations de l’ossification du crâne, des sternèbres et de la ceinture pubienne). Des malformations ont été notées chez 3 des 170 fœtus du groupe exposé à la dose élevée (1,8 % de tous les fœtus du groupe exposé à la dose élevée; 3 des 23 portées touchées), notamment une anasarque, une polydactylie et une hémivertèbre cervicale. Les auteurs ont calculé une DSENO de 4,1 mg/kg p.c./j pour la toxicité maternelle et la toxicité prénatale pour le développement aux doses élevées (SCCS, 2016; NICNAS, 2016c; CLH, 2017).
Dans une étude modifiée sur la toxicité pour la reproduction sur une génération, réalisée conformément à la Ligne directrice 443 de l’OCDE, on a administré du Lilial en capsules à des rats Wistar mâles et femelles (35-40/sexe/dose) à des doses nominales de 0, 1, 3 ou 10 mg/kg p.c./j (équivalant à 0, 1,4, 4,5 ou 15,1 mg/kg p.c./j, respectivement) dans leur nourriture (CLH, 2017; SCCS, 2019; RIFM, 2020). Les animaux F0 ont été traités par le Lilial pendant environ deux semaines avant la période d’accouplement, pendant la période d’accouplement (jusqu’à deux semaines) et pendant au plus six semaines après la période d’accouplement (mâles) ou pendant la gestation (trois semaines) et la lactation (trois semaines) pour les femelles. Les petits de la portée F1 ont été répartis en sept cohortes différentes (cohortes 1A, 1B, 2A, 2B, 3, 4A et 4B) pour faire l’objet d’examens histopathologiques spécifiques et ont été soumis au régime alimentaire d’essai jusqu’à leur sacrifice. La cohorte 1B a été choisie pour produire des petits F2. Les cohortes ont été examinées pour déterminer ce qui suit : les cohortes 1 (A/B) pour la toxicité pour la reproduction, les cohortes 2 (A/B) pour la neurotoxicité pour le développement, la cohorte 3 pour l’immunotoxicité pour le développement et la cohorte 4 (A/B) pour l’activité de l’acétylcholinestérase chez les animaux F0, les petits excédentaires au JPN 4 et les petits de la génération F1 au JPN 22 et au stade de l’adolescence. L’étude s’est terminée par le sacrifice des animaux F2 sevrés et des animaux parents de la cohorte 1B de la génération F1. On n’a constaté aucune mortalité liée à la substance à l’essai. Le poids corporel des mères était significativement réduit par rapport aux animaux du groupe témoin chez les femelles F0 et F1 ayant reçu des doses élevées pendant la gestation et la lactation. Le poids des ovaires, tant absolu (100, 99, 94 et 88 mg aux doses de 0, 1, 3 et 10 mg/kg p.c./j, respectivement) que relatif (100, 96, 93 et 89 mg aux doses de 0, 1, 3 et 10 mg/kg p.c./j, respectivement) a diminué. On a observé certains changements dans les paramètres sanguins et enzymatiques à la dose de 10 mg/kg p.c./j, par exemple un allongement du temps de Quick chez les deux sexes des générations F0 et F1 ainsi qu’une augmentation de l’activité de la γ-glutamyl transférase et une réduction des taux d’albumine chez les femelles F0 et F1. À la dose de 10 mg/kg p.c./j, on a noté une numération des globules rouges et des taux d’hémoglobine plus élevés chez les femelles F0 et chez les mâles et femelles F1. Des taux d’hématocrite plus élevés ont également été observés chez les femelles F0 à cette dose. On a constaté une diminution de l’activité sérique moyenne de l’acétylcholinestérase chez les femelles F0 (de 16 % chez les animaux ayant reçu la dose intermédiaire et de 21 % chez les animaux ayant reçu la dose élevée, par rapport aux animaux du groupe témoin) et dans d’autres tissus périphériques, dont les érythrocytes. Chez les mâles F0 ayant reçu la dose élevée, on a observé une diminution de l’activité moyenne de l’acétylcholinestérase du muscle gastrocnémien (musculus gastrocnemius, soit de 18 % par rapport au groupe témoin). Chez les femelles F0 et F1 (cohortes 1A et 1B) ayant reçu la dose élevée, on a observé une augmentation des poids absolu et relatif du foie (de 119 % et 120 % par rapport au groupe témoin, respectivement), associée à une hypertrophie centrolobulaire minime ou légère et accompagnée d’une apoptose/nécrose unicellulaire minime ou légère des hépatocytes. Les seuls résultats notables concernant les paramètres de la reproduction étaient des pourcentages moyens légèrement et non significativement plus élevés de spermatozoïdes anormaux (augmentation de 3,5 % par rapport au groupe témoin) dans la queue épididymaire chez les mâles F0 ayant reçu la dose élevée. Le poids corporel des petits F1 et F2 exposés à la dose élevée était inférieur de 14 % à 16 % à celui des animaux du groupe témoin après la naissance et ne s’était pas rétabli avant le sevrage. Chez les femelles F1 ayant reçu la dose élevée, on a constaté une diminution du nombre moyen de sites d’implantation ainsi qu’une diminution du nombre moyen de petits F2 auxquels elles ont mis bas. L’activité périphérique de l’acétylcholinestérase dans les érythrocytes sériques et le tissu du diaphragme a été plus faible chez les petits de la génération F1, c’est-à-dire chez les mâles au JPN 4 et chez les femelles au JPN 76, du groupe ayant reçu la dose élevée (jusqu’à 50 % des valeurs moyennes chez les animaux du groupe témoin). Aucun signe clinique correspondant de neurotoxicité pour le développement n’a été remarqué chez les petits F1 mâles et femelles, quelle que soit la dose. Le traitement n’a pas eu d’effet sur l’activité motrice, l’habituation au réflexe de sursaut auditif ou la batterie d’observations fonctionnelles chez ces animaux après l’exposition à la substance à l’essai. Les seuls résultats notables dans les essais neurocomportementaux ont été des amplitudes maximales plus faibles dans le test de réponse au réflexe de sursaut auditif chez les mâles F1 exposés à la dose élevée uniquement, et aucun effet correspondant n'a été observé pour ce qui est de la latence du réflexe de sursaut. La neuropathologie, la pesée du cerveau, la mesure de la longueur et de la largeur du cerveau, la morphométrie du cerveau et l’examen neuropathologique au microscope optique n’ont révélé aucun résultat neurotoxicologique lié au traitement. Ni la réponse des anticorps IgM anti-SRBC dépendants des cellules T, ni les nombres absolu et relatif de cellules lymphocytaires dans le tissu de la rate n’ont présenté de changement lié au traitement, ce qui indique qu’il n’y a aucun signe de DIT (thermogenèse postprandiale) causé par le Lilial. À la lumière de ces résultats, les auteurs ont déterminé une DSENO pour la toxicité générale de 3 mg/kg p.c./j (dose efficace : 4,5 mg/kg p.c./j) chez les parents F0 et F1 ainsi que chez les animaux adolescents; une DSENO pour la toxicité pour le développement de 3 mg/kg p.c./j (dose efficace : 4,5 mg/kg p.c./j) chez les descendants F1 et F2; et une DSENO pour la performance de la reproduction de 10 mg/kg p.c./j (dose efficace : 15,1 mg/kg p.c./j), soit la plus forte dose d’essai, chez les parents F0 et F1 (CLH, 2017; SCCS, 2019; RIFM, 2020).
Dans la seule étude de toxicité cutanée, du Lilial non dilué a été appliqué en tests épicutanés sous occlusion sur le dos de rats albinos (5 mâles/groupe) pendant six heures, à des doses de 0, 250, 500, 1 000 ou 2 000 mg/kg p.c./j pendant 5 jours consécutifs (SCCS, 2016; NICNAS, 2016c; CLH, 2017). On a observé une légère diminution du poids corporel et une atrophie testiculaire marquée à la dose de 2 000 mg/kg p.c./j. Les auteurs ont observé des tubules séminifères présentant une désorganisation de la structure épithéliale, une diminution du nombre de cellules germinales et une augmentation du nombre de cellules germinales en dégénérescence (y compris des cellules géantes), en lien avec des cellules germinales immatures et/ou en dégénérescence dans les épididymes, ainsi que la présence de spermatocèles à la dose de 2 000 mg/kg p.c./j. Aucune autre observation n’a été effectuée pour évaluer les effets nocifs autres que la toxicité testiculaire. Les auteurs de l’étude ont établi la DSENO à 1 000 mg/kg p.c./j d’après les effets observés sur les organes reproducteurs à la dose la plus élevée d’essai (NICNAS, 2016c; SCCS, 2016; CLH, 2017).
Des rats et des souris (5 mâles/groupe) ont reçu 50 mg/kg p.c./j de Lilial et d’acide lysmérylique (métabolite du Lilial) dans de l’huile d’olive par gavage pendant 1, 2, 3, 4 ou 14 jours, et ont étudié principalement la toxicité pour les organes reproducteurs (SCCS, 2016; CLH, 2017). Aucune mortalité n’est survenue et aucun signe clinique n’a été rapporté chez les rats et les souris. Chez les rats, on a observé une atrophie testiculaire légère à grave, 2 animaux sur 5 ayant été touchés après une seule application de Lilial, et tous les animaux l’ayant été après des périodes d’application plus longues. Chez les souris, une réduction du ratio spermatozoïdes normaux/spermatozoïdes anormaux a été observée après une exposition au Lilial pendant trois et quatre jours seulement, mais on n’a observé aucune modification histopathologique des testicules. Cependant, des périodes de traitement plus longues n'ont pas eu d’effet sur ce paramètre ou sur d’autres paramètres du sperme, tels que la motilité des spermatozoïdes et le nombre de spermatides dans les testicules ou la queue de l’épididyme (SCCS, 2016; CLH, 2017).
Plusieurs études exploratoires réalisées par gavage oral pendant 5 jours consécutifs chez le rat à des doses allant de 25 à 400 mg/kg p.c./j ont montré des signes cliniques de toxicité, une perte de poids corporel et des changements macroscopiques dans le foie à partir de 50 mg/kg p.c./j (SCCS, 2016; NICNAS, 2016c; CLH, 2017). À la même dose, on a constaté une dégénérescence et une perte de cellules germinales dans l’épithélium séminifère. Cependant, une diminution du poids des testicules et des reins ainsi qu’une diminution de la taille de la prostate et des vésicules séminales sont apparues à des doses plus élevées, qui n’ont pas été indiquées dans l’étude (SCCS, 2016; NICNAS, 2016c; CLH, 2017).
Cinq souris mâles et cinq cobayes mâles ont reçu une dose journalière par voie orale de 100 mg/kg p.c./j de Lilial pendant 5 jours consécutifs, et n’ont présenté aucun signe de toxicité générale, y compris la toxicité pour les testicules (SCCS, 2016; NICNAS, 2016c; CLH, 2017).
Cinq lapins mâles traités pendant 15 jours par gavage avec du Lilial à 30, 100 ou 300 mg/kg p.c./j n’ont présenté aucun effet lié au traitement en termes d’observations cliniques, de poids corporel et de consommation alimentaire (SCCS, 2016; NICNAS, 2016c; CLH, 2017). À 30 mg/kg p.c./j, un animal a présenté une dégénérescence modérée des tubules séminifères, une oligospermie modérée et une inflammation modérée de l’épididyme. À la dose de 100 mg/kg p.c./j, on a observé une réduction de la taille des testicules et des épididymes avec une dégénérescence diffuse grave des tubules séminifères et une atrophie grave accompagnée d’une aspermie dans l’épididyme gauche. Cependant, l’évaluation du sperme n’a révélé aucun effet lié au traitement chez cet animal ou chez tout autre animal traité, et aucune relation dose-effet n'a été observée. Les auteurs de l’étude n’ont pas jugé ces effets comme étant liés au traitement (SCCS, 2016; NICNAS, 2016c; CLH, 2017).
Des chiens Beagle (4 mâles/groupe) ont reçu par voie orale des doses de Lilial sous forme de capsules de gélatine de 0, 40, 200 ou 1 000 mg/kg p.c./j pendant deux semaines (SCCS, 2016; NICNAS, 2016c; CLH, 2017). En raison de l’apparition de vomissements et de diarrhées à 1 000 mg/kg p.c./j, la dose élevée a été abaissée à 500 mg/kg p.c./j à partir du jour 3. Dans les groupes ayant reçu les doses moyenne et élevée, on a observé une augmentation du poids du foie et une hypertrophie centrolobulaire des hépatocytes. À 200 mg/kg p.c./j, un chien a présenté une dégénérescence des tubules séminifères, une hyperplasie des cellules de Leydig, ainsi qu’une aspermie et une vacuolisation épithéliale dans les épididymes (SCCS, 2016; NICNAS, 2016c; CLH, 2017). Dans une étude de suivi chez 10 chiens mâles ayant reçu 200 mg/kg p.c./j de Lilial pendant deux semaines, on a constaté une perte grave du poids corporel, une anémie, une augmentation du poids du foie et une diminution du poids de la prostate et des testicules avec des corrélats histomorphologiques. On a également observé une altération de la qualité du sperme et une réduction de la motilité des spermatozoïdes (SCCS, 2016; NICNAS, 2016c; CLH, 2017).
Deux singes rhésus mâles ont reçu par voie orale du Lilial dans la nourriture à raison de 0 ou 100 mg/kg p.c./j pendant 5 jours (SCCS, 2016; NICNAS, 2016c; CLH, 2017). On a observé uniquement de petits foyers dans un épididyme d’un animal et de petits espaces creux dans l’épithélium d’un épididyme de l’autre animal. Les testicules des deux animaux ne présentaient aucune lésion. Selon les auteurs de l’étude, les observations dans un épididyme de chaque animal ne représentent pas un effet lié à la substance à l’essai, car les autres tissus reproducteurs mâles n’ont pas été affectés (SCCS, 2016; NICNAS, 2016c; CLH, 2017).
Les études de toxicité du Lilial montrent que celui‑ci a des effets nocifs sur la reproduction chez la plupart des espèces animales examinées (rats, souris, chiens, lapins, singes), le rat étant le plus sensible et les organes reproducteurs mâles présentant des effets indésirables à des doses plus faibles que chez les autres espèces.
Génotoxicité
On a obtenu des résultats négatifs dans un test d’Ames avec les souches TA1535, TA1537, TA1538, TA97, TA98, TA100 et TA102 de S. typhimurium, avec ou sans activation métabolique (Di Sotto et al., 2014; SCCS, 2016; NICNAS, 2016c). De même, un autre essai de mutation inverse sur bactéries avec les souches TA98, TA100 et TA1537 de S. typhimurium et la souche WP2 uvrA d’E. coli a donné des résultats négatifs avec et sans S9 Mix (SCCS, 2019). Cependant, une augmentation du nombre de révertants sans S9 Mix a été observée dans cet essai de mutation inverse pour la souche TA1535 de S. typhimurium, dans l’essai d’incorporation sur plaque (mais non dans l’essai de suivi avant incubation), bien que les auteurs aient estimé que le Lilial n’était pas mutagène dans cet essai, car les augmentations observées n’étaient pas reproductibles, étaient associées à une cytotoxicité et ne présentaient pas de tendance en fonction de la dose (SCCS, 2019). Un essai de mutation génique sur cellules de mammifères utilisant des fibroblastes de poumon de hamster chinois (V79) a présenté des augmentations significatives de la fréquence des mutants. Cependant, les auteurs ont conclu que le Lilial n’était pas mutagène dans les conditions de l’étude, car les augmentations observées n’étaient pas dépendantes de la dose ni reproductibles (Dossier d’enregistrement de l’ECHA 2020e; SCCS, 2016; NICNAS, 2016c). Le Lilial n’a pas induit d’augmentation significative de la fréquence des mutants au locus TK +/- dans les cellules L5178Y dans un autre essai de mutation génique utilisant un essai avec cellules de lymphome de souris (Dossier d’enregistrement de l’ECHA 2020e). Le Lilial n’a pas induit de cassures de brins simples de l’ADN dans un essai des comètes en milieu alcalin sur des cellules épithéliales humaines en colonies (Di Sotto et al., 2014). Dans une étude non exigée sur des micronoyaux de lymphocytes humains, le Lilial n’a pas montré d’augmentation de la fréquence des micronoyaux par rapport aux animaux du groupe témoin (Di Sotto et al., 2014). En revanche, il a induit des aberrations chromosomiques numériques et structurales en l’absence du S9 Mix, dépendantes de la concentration, des aberrations structurales en présence du S Mix dans un essai d’aberration chromosomique sur des cellules ovariennes de hamster chinois (SCCS, 2016; NICNAS, 2016c).
Dans un test du micronoyau in vivo, on a injecté du Lilial par voie intrapéritonéale à des souris (5/sexe/dose) à raison de 150, 300 ou 600 mg/kg p.c./j. Une augmentation des érythrocytes polychromatiques micronucléés totaux dans le groupe ayant reçu la dose élevée n’a été observée que chez les mâles 48 heures après le traitement (mais pas après 24 heures). Cependant, les auteurs de l’étude ont conclu que le Lilial ne présentait pas de potentiel clastogène, car les augmentations observées se situaient dans la fourchette des données obtenues chez les animaux de l’ancien groupe témoin, n’étaient pas dépendantes de la dose et n’ont été observées dans aucun autre groupe de doses (Dossier d’enregistrement de l’ECHA 2020e; SCCS, 2016; NICNAS, 2016c).
7.5.3 Caractérisation des risques pour la santé humaine
Pour les substances du sous-groupe 2 des aldéhydes, la concentration entraînant un effet critique est une DSENO par voie orale de 4,1 mg/kg p.c./j, d’après une étude de toxicité pour le développement chez le rat exposé au Lilial, et d’après les effets nocifs observés chez les mères et les fœtus à des concentrations plus élevées. Cette concentration produisant un effet est basée sur des modifications pathologiques dans le foie et une diminution des concentrations d’acétylcholinestérase chez les mères à 12,7 mg/kg p.c./j, une diminution du poids corporel des fœtus et une fréquence accrue des variations squelettiques chez les fœtus à 12,7 mg/kg p.c./j, ainsi qu’une diminution du poids corporel des mères et une augmentation des pertes post-implantatoires à 40,7 mg/kg p.c./j (SCCS, 2016). Cette concentration de 4,1 mg/kg p.c./j entraînant un effet critique est étayée par d’autres études utilisant des critères d’effet similaires, par exemple une étude de toxicité pour la reproduction sur une génération dans laquelle la DSENO était de 4,5 mg/kg p.c./j, d’après une toxicité hépatique, une diminution de la consommation alimentaire chez les femelles F0 et du poids corporel des mères, une réduction du poids des petits et une activité moindre de l’acétylcholinestérase chez les ratons et les rats adolescents à la dose suivante de 15,1 mg/kg p.c./j (SCCS, 2019).
On n’a pas trouvé de données adéquates sur les dangers par la voie cutanée et l’inhalation. Par conséquent, on a utilisé la DSENO par voie orale de 4,1 mg/kg p.c./j pour caractériser les risques, ainsi que l’extrapolation de voie à voie pour les substances du sous-groupe 2 des aldéhydes. Le tableau 7-26 présente un résumé des valeurs estimées de l’exposition journalière pour les groupes d’âge les plus et les moins exposés, et les ME calculées pour le Lilial.
| Scénario d’exposition | Exposition générale (mg/kg p.c./j)a | MEb |
|---|---|---|
| Inhalation et exposition par voie orale par les milieux environnementaux (c’est-à-dire air, eau, poussière et sol) (tous les sous-groupes de la population) | 6,70 x 10-4 (adultes) à 2,49 x 10-3 (1 an) | 1 647 (1 an) à 6 119 (adultes) |
| Exposition par voie cutanée et par inhalation aux parfums corporels (44 %) (2–3 ans à adultes) | 0,54 (adultes) à 1,52 (2–3 ans) | 3 (2–3 ans) à 8 (adultes) |
| Exposition par voie cutanée et par inhalation aux nettoyants corporels liquides (1 %) (tous les sous-groupes de la population) | 3,24 x 10-3 (adultes) à 1,3 x 10-2 (0–5 mois) | 318 (0–5 mois) à 1 265 (adultes) |
| Exposition par voie cutanée et par inhalation aux après-shampooings (à rincer) (2 %) (2–3 ans à adultes) | 5,06 x 10-3 (14–18 ans) à 1,06 x 10-2 (2–3 ans) | 387 (2–3 ans) à 810 (14–18 ans) |
| Exposition par voie cutanée et par inhalation aux huiles de massage (0,3 %) (tous les sous-groupes de la population) | 2,58 x 10-2 (adultes) à 1,38 x 10-1 (0–5 mois) | 30 (0–5 mois) à 159 (adultes) |
| Exposition par voie cutanée et par inhalation aux hydratants corporels (1 %) (tous les sous-groupes de la population) | 2,17 x 10-1 (adultes) à 4,84 10-1 (0–5 mois) | 8 (0–5 mois) à 19 (adultes) |
| Exposition par voie cutanée et par inhalation aux produits de maquillage liquides pour le visage (1 %) (4–8 ans à adultes) | 1,30 x 10-2 (14–18 ans) à 2,69 x 10-2 (4–8 ans) | 152 (4–8 ans) à 315 (14–18 ans) |
| Exposition par voie cutanée et par inhalation aux vernis à ongles (3 %) (2–3 ans à adultes) | 9,73 x 10-3 (adultes) à 1,80 x 10-2 (2–3 ans) | 228 (2–3 ans) à 421 (adultes) |
| Exposition par voie cutanée et par inhalation aux dissolvants pour vernis à ongles (0,1 %) (2–3 ans à adultes) | 5,86 x 10-3 (adultes) à 1 x 10-2 (9–13 ans) | 405 (9–13 ans) à 700 (adultes) |
| Exposition par voie cutanée et par inhalation aux produits dépilatoires (0,1 %) (9–13 ans à adultes) | 3,67 x 10-3 (14–18 ans) à 4,46, x 10-3 (adultes) | 920 (adultes) à 1 117 (14–18 ans) |
|
Exposition par voie cutanée et par inhalation aux antisudorifiques et déodorants solides (3 %) (9–13 ans à adultes) |
5,18 x 10-2 (9–13 ans) à 8,63 x 10-2 (14–18 ans) | 48 (14–18 ans) à 79 (9–13 ans) |
| Exposition par voie cutanée et par inhalation aux antisudorifiques et déodorants en aérosol (0,3 %) (9–13 ans à adultes) | 1,01 x 10-2 (9–13 ans) à 2,67 x 10-2 (14–18 ans) | 153 (14–18 ans) à 406 (9–13 ans) |
| Exposition par voie cutanée et par inhalation aux produits pour le bain (3 %) (tous les sous-groupes de la population) | 9,18 x 10-4 (9–13 ans) à 2,83 x 10-3 (14–18 ans) | 1 451 (14–18 ans) à 4 464 (9–13 ans) |
| Exposition par voie cutanée et par inhalation aux hydratants pour le visage (3 %) (9–13 ans à adultes) | 1,32 x 10-1 (14–18 ans) à 2,11 x 10-1 (adultes) | 19 (adultes) à 31 (14–18 ans) |
| Exposition par voie cutanée et par inhalation aux colorants capillaires permanents (1 %) (14–18 ans à adultes) | 2,69 x 10-1 (adultes) à 3,21 x 10-1 (14–18 ans) | 13 (14–18 ans) à 15 (adultes) |
| Exposition par voie cutanée et par inhalation aux colorants capillaires temporaires (0,11 %) (4–8 ans à adultes) | 8,33 x 10-3 (adultes) à 2,59 x 10-2 (4–8 ans) | 158 (4–8 ans) à 492 (adultes) |
| Exposition par voie cutanée et par inhalation aux produits de défrisage, d’ondulation et de bouclage des cheveux (1 %) (4–8 ans à adultes) | 1,62 x 10-1 (adultes) à 4,31 x 10-1 (4–8 ans) | 10 (4–8 ans) à 25 (adultes) |
| Exposition par voie cutanée et par inhalation aux lotions autobronzantes pour le visage (ce produit n’est pas un PSN) (1 %) (14–18 ans à adultes) | 3,35 x 10-2 (adultes) à 3,94 x 10-2 (14–18 ans) | 104 (14–18 ans) à 123 (adultes) |
| Exposition par voie cutanée et par inhalation aux produits pour le traitement de l’acné (0,11 %) (PSN) (9–13 ans à adultes) | 2,23 x 10-4 (adultes) à 3,53 x 10-4 (9–13 ans) | 11 610 (9–13 ans) à 18 412 (adultes) |
| Exposition par voie cutanée et par inhalation aux nettoyants antiseptiques pour la peau (0,007 %) (PSN) (2–3 ans à adultes) | 3,56 x 10-4 (14–18 ans) à 1,05 x 10-3 (2–3 ans) | 3 904 (2–3 ans) à 11 516 (14–18 ans) |
| Exposition par voie cutanée et par inhalation aux nettoyants antiseptiques pour la peauc (0,007 %) (PSN) (2—3 ans à adultes) | 5,33 x 10-3 (adultes)à 2,63 x 10-2 (2–3 ans) | 156 (2–3 ans) à 770 (adultes) |
| Exposition par voie cutanée et par inhalation aux désodorisants pour tapis (application) (1 %) (adultes) | 7,71 x 10-4 (adultes) | 5 316 (adultes) |
| Exposition fortuite par voie cutanée, par inhalation et par voie orale aux désodorisants pour tapis après l’application (1 %) (1 an) | 1,31 x 10-2 (1 an) | 312 (1 an) |
| Exposition par inhalation aux assainisseurs d’air en gel solide (5 %) (tous les sous-groupes de la population) | 5,31 x 10-2 (adultes) à 2,11 x 10-1 (1 an) | 19 (1 an) à 77 (adultes) |
| Exposition par inhalation aux assainisseurs d’air (sous forme liquide) à brancher (3 %) (tous les sous‑groupes de la population) | 1,37 x 10-2 (adultes) à 4,87 x 10-2 (1 an) | 84 (1 an) à 300 (adultes) |
a Les paramètres et calculs des scénarios d’exposition pour les substances du sous-groupe 2 des aldéhydes sont présentés à l’annexe A. On a supposé une absorption cutanée de 15 %.
b Les ME ont été calculées selon la concentration entraînant un effet critique (DSENO = 4,1 mg/kg p.c./j), d’après une étude de toxicité pour le développement chez le rat.
c En ce qui concerne les préoccupations pour la santé publique, l’utilisation de désinfectants pour les mains au sein de la population générale peut augmenter jusqu’à 25 utilisations par jour (utilisation personnelle par les adultes, utilisation accrue par les enfants dans les écoles et les garderies) (RIVM, 2021a).
Pour ce qui est de tenir compte des incertitudes dans les données sur l’exposition au Lilial et sur ses effets sur la santé, utilisées pour caractériser le risque, on a jugé suffisantes les ME comprises entre les concentrations entraînant un effet critique et l’exposition estimée au Lilial présent dans les milieux naturels, les nettoyants corporels, les après-shampooings, les huiles de massage (9 ans et plus), les produits de maquillage liquides pour le visage, les vernis à ongles, les dissolvants pour vernis à ongles, les produits dépilatoires, les antisudorifiques et les déodorants en aérosol, les produits pour le bain, les produits pour le traitement de l’acné en crème (PSN), les nettoyants antiseptiques pour la peau (PSN), les colorants capillaires temporaires, les produits autobronzants pour le visage et les désodorisants pour tapis.
Les ME comprises entre les concentrations entraînant un effet critique et la celle de l’exposition journalière estimée au Lilial présent dans les cosmétiquesNote de bas de page 11, les assainisseurs d’air gel solide et les assainisseurs d’air, sous forme liquide, à brancher (enfants de 1 an) sont inférieures à 100, ce qui tient compte des incertitudes relatives à l’extrapolation interspécifique, l’extrapolation intraspécifique, le PdD et la pertinence de la base de données, et pourraient être insuffisantes.
En outre, le tableau 7-27 présente un résumé des valeurs estimées de l’exposition journalière des groupes d’âge les plus et les moins exposés, ainsi que les ME calculées, pour le Lilial, le myrac-aldéhyde, le myrmac-aldéhyde, le myrmac-carboxaldéhyde, le cétonal et le vernaldéhyde.
| Scénario d’exposition | Exposition générale (mg/kg p.c./j)a | MEb |
|---|---|---|
| Exposition par voie cutanée et par inhalation aux cosmétiques sans rinçage (0,05 %) (tous les sous-groupes de la population) | 1,08 x 10-1 (adultes) à 2,42 x 10-2 (0–5 mois) | 169–379 |
| Exposition par voie cutanée et par inhalation aux cosmétiques à rincer (0,1 %) (tous les sous-groupes de la population) | 1,71 x 10-3 (adultes) à 4,37 x 10-3 (0–5 mois) | 938–2 400 |
| Exposition par inhalation aux assainisseurs d’air (2,5 %) (tous les sous-groupes de la population) | 1,14 x 10-2 (adultes) à 4,07 x 10-2 (1 an) | 101 |
| Exposition par voie cutanée et par inhalation aux produits de nettoyage (0,05 %) (tous les sous-groupes de la population) | 1,66 x 10-5 (14–18 ans) à 5,6 x 10-4 (adultes) | 7 300–200 000 |
a Les paramètres et calculs des scénarios d’exposition pour les substances du sous-groupe 2 des aldéhydes sont présentés à l’annexe A. On a supposé une absorption cutanée de 15 %.
b Les ME ont été calculées selon la concentration entraînant un effet critique (DSENO = 4,1 mg/kg p.c./j), d’après une étude de toxicité pour le développement chez le rat.
Les ME comprises entre les concentrations entraînant un effet critique et l’exposition estimée au Lilial, au myrac-aldéhyde, au myrmac-aldéhyde, au myrmac-carboxaldéhyde, au cétonal et au vernaldéhyde par les cosmétiques, les assainisseurs d’air et les produits de nettoyage sont jugées suffisantes pour tenir compte des incertitudes dans les données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
Comme aucune source d’exposition de la population générale au Verdantiol n’a été trouvée, on a utilisé une approche qualitative pour caractériser les risques du Verdantiol pour la santé humaine, et ils ont été jugés faibles.
Bien que l’exposition de la population générale au myrac-aldéhyde, au myrmac‑aldéhyde, au myrmac-carboxaldéhyde, au cétonal, au vernaldéhyde et au Verdantiol ne soit pas jugée préoccupante aux concentrations actuelles, ces substances pourraient néanmoins être préoccupantes pour la santé d’après leur toxicité potentielle pour la reproduction et le développement. L’exposition à cette substance pourrait donc être préoccupante si elle devait augmenter.
7.5.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| L’utilisation possible de plus d’un produit par une même personne au cours d’une même journée (c’est-à-dire une exposition cumulée) n’a pas été examinée. L’exposition de certaines personnes pourrait ainsi être sous-estimée. | - |
| L’utilisation de plusieurs substances du sous-groupe 2 des aldéhydes dans un même produit n’a pas été examinée. Toutefois, les concentrations maximales ont été utilisées dans l’évaluation des risques, ce qui pourrait représenter la somme de plusieurs substances. | - |
| On ne dispose d’aucune donnée sur les dangers du myrac-aldéhyde, du myrmac-aldéhyde, du myrmac-carboxaldéhyde, du cétonal ou du vernaldéhyde. On a utilisé un analogue en lecture croisée et un membre du sous-groupe 2 des aldéhydes, en l’occurrence le Lilial, pour éclairer l’évaluation des risques. | +/- |
| L’extrapolation de voie à voie des substances du sous-groupe 2 des aldéhydes a été utilisée pour les scénarios d’exposition par voie cutanée et par inhalation d’après une concentration entraînant un effet critique dans une étude de toxicité par voie orale. | +/- |
+ = incertitude pouvant causer une surestimation de l’exposition ou du risque; - = incertitude pouvant causer une sous-estimation de l’exposition ou du risque; +/- = potentiel inconnu de surestimation ou de sous-estimation du risque.
8. Prise en compte des sous-populations susceptibles d’être plus sensibles ou plus exposées
Certains groupes de personnes au sein de la population canadienne pourraient, en raison d’une susceptibilité ou d’une exposition accrues, courir un risque plus grand que la population générale de subir des effets nocifs pour la santé dus à l’exposition à certaines substances. Certains sous-groupes de la population, comme les nourrissons, les enfants ainsi que les adolescentes et femmes en âge de procréer, sont régulièrement étudiés tout au long du processus d’évaluation. Par exemple, les valeurs d’exposition en fonction de l’âge sont régulièrement estimées, et des études de toxicité pour le développement et la reproduction sont examinées afin de trouver les effets nocifs potentiels sur la santé. Certains sous-groupes de la population sont systématiquement pris en compte tout au long du processus d’évaluation, comme les nourrissons, les enfants ainsi que les adolescentes et femmes en âge de procréer.
9. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation, les substances du groupe des phénylpropanoïdes et des aldéhydes présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que les 12 substances du groupe des phénylpropanoïdes et des aldéhydes ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation, il est proposé de conclure que les essences de feuille de laurier, les essences d’estragon, les essences de jasmin, les parfums et essences de jasmin, les essences de violette et le Lilial satisfont au critère énoncé à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines et que le Verdantiol, le myrac-aldéhyde, le myrmac-aldéhyde, le myrmac-carboxaldéhyde, le cétonal et le vernaldéhyde ne satisfont pas au critère énoncé à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est proposé de conclure que les essences de feuille de laurier, les essences d’estragon, les essences de jasmin, les parfums et essences de jasmin, les essences de violette et le Lilial satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE, et que le Verdantiol, le myrac-aldéhyde, le myrmac-aldéhyde, le myrmac-carboxaldéhyde, le cétonal et le vernaldéhyde ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que le Lilial répond aux critères de persistance, mais pas à ceux de bioaccumulation, énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Bibliographie
[21CFR182.20] Code of Federal Regulations, Title 21 – Food and Drugs, Part 182 Substances Generally Recognized as Safe, Section 182.20 Essential oils, oleoresins (solvent-free), and natural extractives (including distillates). [Disponible en anglais seulement.]
Abaul J, Bourgeois P, Bessiere JM. 1995. Chemical composition of the essential oils of chemotypes of Pimenta racemosa var. racemosa (P. Miller) JW Moore (Bois d'Inde) of Guadeloupe (FWI). Flavour Fragr J. 10(5):319-321. [Disponible en anglais seulement.]
Abraham SK. 2001. Anti-genotoxicity of trans-anethole and eugenol in mice. Food Chem Toxicol. 39(5):493-498. [Disponible en anglais seulement.]
[ACI] American Cleaning Institute. 2018. [database] [consulté en 2018]. [Disponible en anglais seulement.]
[ACI] American Cleaning Institute. 2020. [database] [consulté en juin 2020]. [Disponible en anglais seulement.]
Adams TB, Gavin CL, Taylor SV, Waddell WJ, Cohen SM, Feron VJ, Goodman J, Rietjens IMCM, Marnett LJ, Portoghese PS, et al. 2008. The FEMA GRAS assessment of α, β-unsaturated aldehydes and related substances used as flavor ingredients. Food Chem Toxicol. 46(9):2935-2967. [Disponible en anglais seulement.]
Api AM, Belmonte F, Belsito D, Biserta S, Botelho D, Bruze M, Burton Jr GA, Buschmann J, Cancellieri MA, Dagli ML, et al. 2019. RIFM fragrance ingredient safety assessment, palmitic acid, CAS Registry Number 57-10-3. Food Chem Toxicol. 134 Suppl:110980. [Disponible en anglais seulement.]
Arnau EG, Andersen KE, Bruze M, Frosch PJ, Johansen JD, Menne T, Rastogi SC, White IR, Lepoittevin JP. 2000. Identification of Lilial as a fragrance sensitizer in a perfume by bioassay-guided chemical fractionation and structure-activity relationships. Contact Derm. 43(6):351-358. [Disponible en anglais seulement.]
Atshaves BP, Payne HR, McIntosh AL, Tichy SE, Russell D, Kier AB, Schroeder F. 2004. Sexually dimorphic metabolism of branched-chain lipids in C57BL/6J mice. J Lipid Res. 45(5):812-830. [Disponible en anglais seulement.]
Ayoughi F, Barzegar M, Sahari MA, Naghdibadi H. 2011. Chemical compositions of essential oils of Artemisia dracunculus L. and endemic Matricaria chamomilla L. and an evaluation of their antioxidative effects. J Agric Sci Tech. 13(1):79-88. [Disponible en anglais seulement.]
Bánsághi S, Soule H, Guitart C, Pittet D, Haidegger T. 2020. Critical reliability issues of common type alcohol-based handrub dispensers. Antimicrob Resist Infect Control. 9(90). [Disponible en anglais seulement.]
[BDIPSN] Base de données d'ingrédients de produits de santé naturels [base de données]. [Modifié le 13 oct. 2021]. Ottawa (Ont.), gouvernement du Canada. [Consulté le 9 nov. 2021].
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. [Modifié le 8 sept. 2021]. Ottawa (Ont.), gouvernement du Canada. [Consulté le 9 nov. 2021].
Bera P, Kotamreddy JNR, Samanta T, Maiti S, Mitra A. 2015. Inter-specific variation in headspace scent volatiles composition of four commercially cultivated jasmine flowers. Nat Prod Res. 29(14):1328-1335. [Disponible en anglais seulement.]
Beyer J, Ehlers D, Maurer HH. 2006. Abuse of nutmeg (Myristica fragrans Houtt.): Studies on the metabolism and the toxicologic detection of its ingredients elemicin, myristicin, and safrole in rat and human urine using gas chromatography/mass spectrometry. Ther Drug Monit. 28(4):568-575. [Disponible en anglais seulement.]
Bowles EJ. 2003. The chemistry of aromatherapeutic oils. 3rd ed. Online version. Crows Nest (AU) : Allen & Unwin. [Disponible en anglais seulement.]
Braun NA, Kohlenberg B, Sim S, Meier M, Hammerschmidt F-J. 2009. Jasminum flexile flower absolute from India - a detailed comparison with three other jasmine absolutes. Nat Prod Commun. 4(9):1239-1250. [Disponible en anglais seulement.]
Bremmer HF, Prud’homme de Lodder LCH, van Engelen JGM. 2006. Cosmetics Fact Sheet. RIVM report 320104001/2006. [Disponible en anglais seulement.]
Bronaugh RL, Wester RC, Bucks D, Maibach HI, Sarason R. 1990. In vivo percutaneous absorption of fragrance ingredients in rhesus monkeys and humans. Food Chem Toxicol. 28(5):369-373. [Disponible en anglais seulement.]
Burdock GA. 2010. Fenaroli’s handbook of flavor ingredients. 6th ed. Boca Raton (FL): CRC Press. [Disponible en anglais seulement.]
Cagen SZ, Patterson DR, Wimberly HC, Lu CC, Gardiner TH. 1989. Toxicity induced by subchronic dermal exposure to paratertiary butyl benzoic acid (pt BBA) in Fischer 344 rats. J Am Coll Toxicol. 8(5):1027-1038. [Disponible en anglais seulement.]
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, nº 3.
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF], Gazette du Canada, Partie I, vol. 146, nº 48, supplément.
Caputi L, Aprea E. 2011. Use of terpenoids as natural flavouring compounds in food industry. Recent Pat Food Nutr Agric. 3(1):9-16. [Disponible en anglais seulement.]
[CE] Commission européenne. 2008. RÈGLEMENT (CE) Nº 1334/2008 DU PARLEMENT EUROPÉEN ET DU CONSEIL du 16 décembre 2008 relatif aux arômes et à certains ingrédients alimentaires possédant des propriétés aromatisantes qui sont destinés à être utilisés dans et sur les denrées alimentaires et modifiant le règlement (CEE) nº 1601/91 du Conseil, les règlements (CE) nº 2232/96 et (CE) nº 110/2008 et la directive 2000/13/CE.
Chan PC, Mahler J, Peddada S, Lomnitski L, Nyska A. 2003. Forestomach tumor induction by 2,4-hexadienal in F344N rats and B6C3F1 mice. Arch Toxicol. 77(9):511-520. [Disponible en anglais seulement.]
Charles AK, Darbre PD. 2009. Oestrogenic activity of benzyl salicylate, benzyl benzoate and butylphenylmethylpropional (Lilial) in MCF7 human breast cancer cells in vitro. J Appl Toxicol. 29(5):422‑434. [Disponible en anglais seulement.]
Charles River. 2019. The in vitro percutaneous absorption of radiolabelled alpha-pinene and radiolabelled citral in two test preparations through human skin (OECD 428 and SCCS). Tranent, East Lothian, United Kingdom. 109 p. Report No. 40807. Rapport inédit. [Disponible en anglais seulement.]
ChemCAN [level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (ON) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. [Disponible en anglais seulement.]
ChemID Plus [database]. 2019. Bethesda (MD): US National Library of Medicine. Search results for CAS RN [8022-96-6] and [8024-43-9]. [Consulté en mai 2020]. [Disponible en anglais seulement.]
Choi Y-H, Ahn S-J, Park K-Y, Yoo M-A, Lee W-H. 1993. Effects of phytol on the mutagenicity of UV and EMS in salmonella and drosophila mutation assaying systems. Environ Mut Carc. 13(2):92-100. [Disponible en anglais seulement.]
[CIR] Cosmetic Ingredient Review. 1987. Final report on the safety assessment of oleic acid, lauric acid, palmitic acid, myristic acid, and stearic acid. J Am Coll Toxicol. 6(3). [Disponible en anglais seulement.]
[CIR] Cosmetic Ingredient Review. 2006. Annual review of cosmetic ingredient safety assessments—2004/2005. Int J Toxicol. 25 Suppl 2:1-89. [Disponible en anglais seulement.]
[CIRC] Centre International de recherche sur le Cancer. 2013 IARC monographs on the evaluation of carcinogenic risks to humans: some chemicals present in industrial and consumer products, food and drinking-water [PDF]. Lyon (FR) : Centre International de recherche sur le Cancer. [Disponible en anglais seulement.]
[CIRC] Centre International de recherche sur le Cancer. 2014. IARC monographs on the evaluation of carcinogenic risks to humans [PDF]. Report of the Advisory Group to Recommend Priorities for IARC Monographs during 2015-2019. Lyon (FR) : Centre International de recherche sur le Cancer. [Disponible en anglais seulement.]
CLH. 2017. CLP Report for 2-(4-tert-butylbenzyl)propionaldehyde. [Disponible en anglais seulement.]
[CNRC] Conseil national de recherches Canada. 2011. Data gathering on chemicals released to indoor air of residences of building materials and furnishings. Institut de recherche en construction du CNRC. Report No. B3332.2. Préparé pour Santé Canada, Ottawa (Ont.). [Disponible en anglais seulement.]
[CNRC] Conseil national de recherches Canada. 2019. Investigation of sources and indoor levels of CMP3 chemicals. Phase 1 – analysis of indoor air samples from two field studies. Report No. A1-014282.1. Préparé pour Santé Canada, Ottawa (Ont.). [Disponible en anglais seulement.]
[CoE] Council of Europe. 2000. Natural sources of flavourings - report no. 1. [Disponible en anglais seulement.]
[CPID] Consumer Product Ingredients Database [base de données]. c2021. McLean(VA) : DeLima Associates. [Consulté en juillet 2021]. [Disponible en anglais seulement.]
[CTD] The Comparative Toxicogenomics Database. 2019. Phytol [base de données]. [Consulté en décembre 2019]. [Disponible en anglais seulement.]
Cu JQ, Perineau F, Gaset A. 1992. Volatile components of violet leaves. Phytochemistry. 31(2):571-573. [Disponible en anglais seulement.]
Di Sotto A, Maffei F, Hrelia P, Di Giacomo S, Pagano E, Borrelli F, Mazzanti G. 2014. Genotoxicity assessment of some cosmetic and food additives. Regul Toxicol Pharmacol. 68(1):16-22. [Disponible en anglais seulement.]
Dittberner U, Eisenbrand G, Zankl H. 1995. Genotoxic effects of the α, β-unsaturated aldehydes 2-trans-butenal, 2-trans-hexenal and 2-trans, 6-cis-rmnonadienal. Mut Res/Environ Mutagen Relat Subj. 335(3):259-265. [Disponible en anglais seulement.]
Drinkwater NR, Miller EC, Miller JA, Pitot HC. 1976. Hepatocarcinogenicity of estragole (1-allyl-4-methoxybenzene) and 1’-hydroxyestragole in the mouse and mutagenicity of 1’-acetoxyestragole in bacteria. J Natl Cancer Inst. 57(6):1323-1331. [Disponible en anglais seulement.]
[EC, SC] Environnement Canada, Santé Canada. 2010. Évaluation préalable pour le Défi concernant le 4-Allylvératrole (méthyleugénol), Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l'approche scientifique : Classification du risque écologique des substances organiques, Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC) : ECCC. Information en appui au document d’approche scientifique : Classification du risque écologique des substances organiques. Disponible sur demande à : substances@ec.gc.ca. [Disponible en anglais seulement.]
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2017]. Catégorisation de substances chimiques, Ottawa (Ont.), gouvernement du Canada. [Consulté en mars 2018].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018a. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018b. Évaluation préalable : Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018c. Ébauche d’évaluation préalable du groupe des acides gras et dérivés. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018d. Évaluation préalable 2-Méthoxy-4-(prop-2-ènyl)phénol (eugénol) et Rose, extrait de Rosa canina, Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2019. Évaluation préalable benzoates, Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2020. Ébauche d’évaluation préalable – Terpènes et terpénoïdes – Groupe des monoterpènes acycliques, monocycliques et bicycliques. Ottawa (Ont.), gouvernement du Canada.
[ECHA] European Chemicals Agency. 2015. Biocides human health exposure methodology. First edition, October, version 1. [Disponible en anglais seulement.]
[ECHA Registration dossier] Europe Chemicals Agency. 2017. Registration dossier for thuj-4(10)-ene (Sabinene). [Disponible en anglais seulement.]
[ECHA Registration dossier] European Chemicals Agency. 2018. Registration dossier for linalool. [Disponible en anglais seulement.]
[ECHA Registration dossier] Europe Chemicals Agency. 2020a. Registration dossier for p-mentha-1,4(8)-diene (Terpinolene). [Disponible en anglais seulement.]
[ECHA Registration dossier] Europe Chemicals Agency. 2020b. Registration dossier for (E)-anethole. [Disponible en anglais seulement.]
[ECHA Registration dossier] Europe Chemicals Agency. 2020c. Registration dossier for benzyl benzoate. [Disponible en anglais seulement.]
[ECHA Registration dossier] Europe Chemicals Agency. 2020d. Registration dossier for nerolidol. [Disponible en anglais seulement.]
[ECHA Registration dossier] European Chemicals Agency. 2020d. Registration dossier for α,2,2,6-tetramethylcyclohexene-1-butyraldehyde (CAS No. 65405-84-7). [Disponible en anglais seulement.]
[ECHA Registration dossier] European Chemicals Agency. 2020e. Registration dossier for 2-(4-tert-butylbenzyl)propionaldehyde (CAS No. 80-54-6). [Disponible en anglais seulement.]
Eder E, Deininger C, Neudecker T, Deininger D. 1992. Mutagenicity of β‐alkyl substituted acrolein congeners in the Salmonella typhimurium strain TA100 and genotoxicity testing in the SOS chromotest. Environ Mol Mutagen. 19(4):338-345. [Disponible en anglais seulement.]
Eder E, Scheckenbach S, Deininger C, Huffman C. 1993. The possible role of α, β-unsaturated carbonyl compounds in mutagenesis and carcinogenesis. Toxicol Lett. 67(1-3):87-103. [Disponible en anglais seulement.]
[EFSA] European Food Safety Authority. 2009. Scientific Cooperation Report: Advice on the EFSA guidance document for the safety assessment of botanicals and botanical preparations intended for use as food supplements, based on real case studies [EPDF]. EFSA Journal. 7(9):2080. [Disponible en anglais seulement.]
[EFSA] European Food Safety Authority. 2010. Scientific opinion on flavouring group evaluation 90 (FGE.90): Consideration of aliphatic, acyclic and alicyclic terpenoid tertiary alcohols and structurally related substances evaluated by JECFA (68th meeting) structurally related to aliphatic, alicyclic and aromatic saturated and unsaturated tertiary alcohols, aromatic tertiary alcohols and their esters evaluated by EFSA in FGE.18Rev1 (2009). EFSA Journal. 8(2):1336. [Disponible en anglais seulement.]
[EFSA] European Food Safety Authority. 2012. Scientific opinion on the safety and efficacy of benzyl alcohols, aldehydes, acids, esters and acetals (chemical group 23) when used as flavourings for all animal species. EFSA Journal. 10(7):2785. [Disponible en anglais seulement.]
[EFSA] European Food Safety Authority. 2015. Scientific Opinion on flavouring Group Evaluation 78, Revision 2 (FGE.78Rev2): consideration of aliphatic and alicyclic and aromatic hydrocarbons evaluated by JECFA (63rd meeting) structurally related to aliphatic hydrocarbons evaluated by EFSA in FGE.25Rev3 [EPDF]. EFSA Journal. 13(4):4067. [Disponible en anglais seulement.]
[EFSA] European Food Safety Authority. 2017. Update: use of the benchmark dose approach in risk assessment. EFSA Journal. 15(1):4658. [Disponible en anglais seulement.]
[EFSA] European Food Safety Authority. 2018. Scientific Opinion on Flavouring Group Evaluation 203, Revision 2 (FGE.203Rev2): α, β‐unsaturated aliphatic aldehydes and precursors from chemical subgroup 1.1.4 of FGE.19 with two or more conjugated double‐bonds and with or without additional non‐conjugated double‐bonds. EFSA Journal. 16(7):e05322. [Disponible en anglais seulement.]
[EMA] European Medicines Agency. 2015. Public statement on the use of herbal medicinal products containing estragole [PDF]. European Medicines Agency/Committee on Herbal Medicinal Products. 137212. Amsterdam (NL): European Medicines Agency. [Disponible en anglais seulement.]
[EMA] European Medicines Agency. 2020. Public statement on the use of herbal medicinal products containing estragole [PDF]. European Medicines Agency/Committee on Herbal Medicinal Products. 137212. Amsterdam (NL): European Medicines Agency. [Disponible en anglais seulement.]
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LI recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances de la Liste intérieure. Données préparées par Environnement Canada, Santé Canada; Programme des substances existantes.
[FEMA] Flavor and Extract Manufacturers Association. 2020. Flavor Ingredient Library. [Disponible en anglais seulement.]
Ficheux AS, Morriset T, Chevillotte G, Postic C, Roudot AC. 2014. Probabilistic assessment of exposure to nail cosmetics in French consumers. Food and Chemical Toxicology. 66:36-43. [Disponible en anglais seulement.]
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, et al. 2016. Consumption of cosmetic products by the French population. Second part: amount data. Food Chem Toxicol. 90:130-141. [Disponible en anglais seulement.]
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. Consumption of cosmetic products by the French population. First part: frequency data. Food Chem Toxicol. 78:159-169. [Disponible en anglais seulement.]
Florin I, Rutberg L, Curvall M, Enzell CR. 1980. Screening of tobacco smoke constituents for mutagenicity using the Ames' test. Toxicology. 15(3):219-232. [Disponible en anglais seulement.]
Ford RA, Api AM, Letizia CS. 1992. Fragrance raw materials monographs: 1-Formyl-1-methyl-4-(4-methylpentyl)-3-cyclohexene. Food Chem Toxicol. 30:37S. [Disponible en anglais seulement.]
Fragrance raw materials monographs. 1976. Fragrance raw materials monographs: Isohexenyl cyclohexenyl carboxaldehyde. Food Cosmet Toxicol. 14:803. [Disponible en anglais seulement.]
Garcia-Hidalgo E, von Goetz N, Siegrist M, Hungerbühler K. 2017. Use-patterns of personal care and household cleaning products in Switzerland. Food Chem Toxicol. 99:24-39. [Disponible en anglais seulement.]
Gilpin S, Hui X, Maibach H. 2010. In vitro human skin penetration of geraniol and citronellol. Dermatitis. 21(1):41-48. [Disponible en anglais seulement.]
Gomez-Berrada M-P, Gautier F, Parent-Massin D, Ferret P-J. 2013. Retrospective exposure data for baby and children care products: an analysis of 48 clinical studies. Food Chem Toxicol. 57:185-194. [Disponible en anglais seulement.]
Gorelick NJ. 1995. Genotoxicity of trans-anethole in vitro. Mutat Res. 326(2):199-209. [Disponible en anglais seulement.]
Greenaway RE, Ormandy K, Fellows C, Hollowood T. 2018. Impact of hand sanitizer format (gel/foam/liquid) and dose amount on its sensory properties and acceptability for improving hand hygiene compliance. J Hosp Infect. 100(2):195-201. [Disponible en anglais seulement.]
Hall B, Tozer S, Safford B, Coroama M, Steiling W, Leneveu-Duchemin MC, McNamara C, Gibney M. 2007. European consumer exposure to cosmetic products, a framework for conducting population exposure assessments. Food Chem Toxicol. 45(11):2097-2108. [Disponible en anglais seulement.]
Hasheminejad G, Caldwell J. 1994. Genotoxicity of the alkenylbenzenes α− and β-asarone, myristicin and elemicin as determined by the UDS assay in cultured rat hepatocytes. Food Chem Toxicol. 32(3):223‑231. [Disponible en anglais seulement.]
Hausner H, Bredie WLP, Mølgaard C, Petersen MA, Møller P. 2008. Differential transfer of dietary flavour compounds into human breast milk. Physiol Behav. 95(1-2):118-124. [Disponible en anglais seulement.]
Heck JD, Vollmuth TA, Cifone MA, Jagannath DR, Myhr B, Curren RD. 1989. An evaluation of food flavoring ingredients in a genetic toxicity screening battery. Toxicologist. 9(1):257-272. [Disponible en anglais seulement.]
Howes AJ, Chan VSW, Caldwell J. 1990. Structure-specificity of the genotoxicity of some naturally occurring alkenylbenzenes determined by the unscheduled DNA synthesis assay in rat hepatocytes. Food Chem Toxicol. 28(8):537-542. [Disponible en anglais seulement.]
Hsia MTS, Adamovics JA, Kreamer BL. 1979. Microbial mutagenicity studies of insect growth regulators and other potential insecticidal compounds in Salmonella typhimurium. Chemosphere. 8(8):521-529. [Disponible en anglais seulement.]
Hunter CG, Chambers PL, Stevenson DE. 1965. Studies on the oral toxicity of p-tert-butyl benzoic acid in rats. Food Cosmet Toxicol. 3(2):289-298. [Disponible en anglais seulement.]
[IFRA] International Fragrance Association. 2013. International Fragrance Association Standard, 43rd Amendment [PDF]. Brussels (BE): International Fragrance Association. [Consulté en mai 2020]. [Disponible en anglais seulement.]
[IFRA] International Fragrance Association. 2015. International Fragrance Association Standard, 48th Amendment [PDF]. Brussels (BE): International Fragrance Association. [Consulté en avril 2020]. [Disponible en anglais seulement.]
[IFRA] International Fragrance Association. 2017. Volume of Use Survey 2017: Transparency List. Geneva (CH) : International Fragrance Association. [Consulté en décembre 2018]. [Disponible en anglais seulement.]
Iqbal M, Ghosh AKM, Saluja AK. 1993. Antifertility activity of the floral buds of Jasminum officinale var. grandiflorum in rats. Phytother Res. 7(1):5-8. [Disponible en anglais seulement.]
Islam MT, Streck L, Barros de Alencar MVO, Cardoso Silva SW, da Conceição Machado K, da Conceição Machado K, Júnior ALG, Jardim Paz MFC, Ferreira da Mata AMO, de Castro e Sousa JM, et al. 2017. Evaluation of toxic, cytotoxic and genotoxic effects of phytol and its nanoemulsion. Chemosphere. 177:93-101. [Disponible en anglais seulement.]
Itoh T, Ono A, Kawaguchi K, Teraoka S, Harada M, Sumi K, Ando M, Tsukamasa Y, Ninomiya M, Koketsu M, et al. 2018. Phytol isolated from watermelon (Citrullus lanatus) sprouts induces cell death in human T-lymphoid cell line Jurkat cells via S-phase cell cycle arrest. Food Chem Toxicol. 115:425-435. [Disponible en anglais seulement.]
Jirovetz L, Buchbauer G, Stoilova I, Krastanov A, Stoyanova A, Schmidt E. 2007a. Spice plants: chemical composition and antioxidant properties of Pimenta lindl. Essential oils, part: 2 Pimenta racemosa (Mill.) J.W Moore leaf oil from Jamaica. Ernahhrung/Nutrition. 31(7/8):293-300. [Disponible en anglais seulement.]
Jirovetz L, Buchbauer G, Schweiger T, Denkova Z, Slavchev A, Stoyanova A, Schmidt E, Geissler M. 2007b. Chemical composition, olfactory evaluation and antimicrobial activities of Jasminum grandiflorum L. absolute from India. Nat Prod Commun. 2(4):407-412. [Disponible en anglais seulement.]
Johnson Jr W, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Liebler DC, Marks Jr JG, Shank RC, Slaga TJ, Snyder PW, et al. 2017. Safety assessment of benzyl alcohol, benzoic acid and its salts, and benzyl benzoate. Int J Toxicol. 36(3 Suppl):5S-30S. [Disponible en anglais seulement.]
Kampf G, Ruselack S, Eggerstedt S, Nowak N, Bashir M. 2013. Less and less–influence of volume on hand coverage and bactericidal efficacy in hand disinfection. BMC Infect Dis. 13:472. [Disponible en anglais seulement.]
Kenters N, Eikelenboom-Boskamp A, Hines J, McGreer A, Huijskens EGW, Voss A. 2020. Product dose considerations for real-world hand sanitiser efficacy. Am J Infect Control. 48(5):503-506. [Disponible en anglais seulement.]
Kim J, Lee Y-S, Lee S-G, Shin S-C, Park I-K. 2008. Fumigant antifungal activity of plant essential oils and components from west Indian bay (Pimenta racemosa) and thyme (Thymus vulgaris) oils against two phytopathogenic fungi. Flavour Fragr J. 23(4):272-277. [Disponible en anglais seulement.]
Kobets T, Duan J-D, Brunnemann KD, Etter S, Smith B, Williams GM. 2016. Structure-activity relationships for DNA damage by alkenylbenzenes in turkey egg fetal liver. Toxicol Sci. 150(2):301-311. [Disponible en anglais seulement.]
Koçkaya EA, Kιlιç A. 2011. Developmental toxicity of benzyl benzoate in rats after maternal exposure throughout pregnancy. Environ Toxicol. 29(1):40-53. [Disponible en anglais seulement.]
Kordali S, Kotan R, Mavi A, Cakir A, Ala A, Yildirim A. 2005. Determination of the chemical composition and antioxidant activity of the essential oil of Artemisia dracunculus and of the antifungal and antibacterial activities of Turkish Artemisia absinthium, A. dracunculus, Artemisia santonicum, and Artemisia spicigera essential oils. J Agric Food Chem. 53(24):9452-9458. [Disponible en anglais seulement.]
Laue H, Kern S, Badertscher RP, Ellis G, Natsch A. 2017. p-Alkyl-benzoyl-CoA conjugates as relevant metabolites of aromatic aldehydes with rat testicular toxicity—studies leading to the design of a safer new fragrance chemical. Toxicol Sci. 160(2):244-255. [Disponible en anglais seulement.]
Lopes-Lutz D, Alviano DS, Alviano CS, Kolodziejczyk P. 2008. Screening of chemical composition, antimicrobial and antioxidant activities of Artemisia essential oils. Phytochemistry. 69(8):1732-1738. [Disponible en anglais seulement.]
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, Sewall C. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol 43: 279-291. [Disponible en anglais seulement.]
Loretz L, Api AM, Barraj L, Burdick J, Davis DA, Dressler W, Gilberti E, Jarrett G, Mann S, Pan YHL, et al. 2006. Exposure data for personal care products: hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. Food Chem Toxicol. 44(12):2008-2018. [Disponible en anglais seulement.]
Loretz LJ, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA, et al. 2008. Exposure data for cosmetic products: facial cleanser, hair conditioner, and eye shadow. Food Chem Toxicol. 46(5):1516-1524. [Disponible en anglais seulement.]
Macinga DR, Edmonds SL, Campbell E, Shumaker DJ, Arbogast JW. 2013. Efficacy of novel alcohol-based hand rub products at typical in-use volumes. Infect Control Hosp Epidemiol. 34(3):299-301. [Disponible en anglais seulement.]
Mackie JT, Atshaves BP, Payne HR, McIntosh AL, Schroeder F, Kier AB. 2009. Phytol-induced hepatotoxicity in mice. Toxicol Pathol. 37(2):201-208. [Disponible en anglais seulement.]
Marnett LJ, Hurd HK, Hollstein MC, Levin DE, Esterbauer H, Ames BN. 1985. Naturally occurring carbonyl compounds are mutagens Salmonella tester strain TA104. Mutat Res/Fund Molec Mech Mutagen. 148(1-2):25-34. [Disponible en anglais seulement.]
Marshall AD, Caldwell J. 1996. Lack of influence of modulators of epoxide metabolism on the genotoxicity of trans-anethole in freshly isolated rat hepatocytes assessed with the unscheduled DNA synthesis assay. Food Chem Toxicol. 34(4):337-345. [Disponible en anglais seulement.]
Marshall AD, Howes AJ, Caldwell J. 1989. Cytotoxicity and genotoxicity of the food flavour anethole in cultured rat hepatocytes. Hum Toxicol. 8:404. [Disponible en anglais seulement.]
Martins C, Cação R, Cole KJ, Phillips DH, Laires A, Rueff J, Rodrigues AS. 2012. Estragole: a weak direct-acting food-borne genotoxin and potential carcinogen. Mutat Res/Genet Toxicol Environ Mutagen. 747(1):86-92. [Disponible en anglais seulement.]
McCune SA, Durant PJ, Flanders LE, Harris RA. 1982. Inhibition of hepatic gluconeogenesis and lipogenesis by benzoic acid, p-tert.-butylbenzoic acid, and a structurally related hypolipidemic agent SC-33459. Arch Biochem Biophys. 214(1):124-133. [Disponible en anglais seulement.]
McGinty D, Vitale D, Letizia CS, Api AM. 2012. Fragrance material review on benzyl acetate. Food Chem Toxicol. 50 Suppl 2:S 363-384. [Disponible en anglais seulement.]
McHale D, Laurie WA, Woof MA. 1977. Composition of West Indian bay oils. Food Chem. 2(1):19-25. [Disponible en anglais seulement.]
Miller EC, Swanson AB, Phillips DH, Fletcher TL, Liem A, Miller JA. 1983. Structure-activity studies of the carcinogenicities in the mouse and rat of some naturally occurring and synthetic alkenylbenzene derivatives related to safrole and estragole. Cancer Res. 43(3):1124-1134. [Disponible en anglais seulement.]
Moharram FA-E, Al-Gendy AA, El-Shenawy SM, Ibrahim BM, Zarka MA. 2018. Phenolic profile, anti-inflammatory, antinociceptive, anti-ulcerogenic and hepatoprotective activities of Pimenta racemosa leaves. BMC Complement Altern Med. 18(1):208. [Disponible en anglais seulement.]
Mortelmans K, Haworth S, Lawlor T, Speck W, Tainer B, Zeiger E. 1986. Salmonella mutagenicity tests: II. Results from the testing of 270 chemicals. Environ Mutagen. 8 Suppl 7:1-119. [Disponible en anglais seulement.]
[MSDS] Material Safety Data Sheet. 2006. Angel oil burner. Lynwood (IL) : Hosley International. [Disponible en anglais seulement.]
Müller L, Kasper P, Müller-Tegethoff K, Petr T. 1994. The genotoxic potential in vitro and in vivo of the allyl benzene etheric oils estragole, basil oil and trans-anethole. Mutat Res. 325(4):129-136. [Disponible en anglais seulement.]
Murawski A, Fiedler N, Schmied-Tobies MIH, Rucic E, Schwedler G, Stoeckelhuber M, Scherer G, Pluym N, Scherer M, Kolossa-Gehring M. 2020. Metabolites of the fragrance 2-(4-tert-butylbenzyl) propionaldehyde (lysmeral) in urine of children and adolescents in Germany–Human biomonitoring results of the German Environmental Survey 2014–2017 (GerES V). Int J Hyg Environ Health. 229:113594. [Disponible en anglais seulement.]
[NCBI] US National Library of Medicine National Center for Biotechnology Information. 2019. Substance Record on PubChem : Phytol CAS Number 150-86-7 [base de données]. [consulté en décembre 2019]. [Disponible en anglais seulement.]
Nesslany F, Parent-Massin D, Marzin D. 2010. Risk assessment of consumption of methylchavicol and tarragon: the genotoxic potential in vivo and in vitro. Mutat Res/Genet Toxicol Environ Mutagen. 696(1):1‑9. [Disponible en anglais seulement.]
Nestmann ER, Lee EGH, Matula TI, Douglas GR, Mueller JC.1980. Mutagenicity of constituents identified in pulp and paper mill effluents using the Salmonella/mammalian-microsome assay. Mutat Res. 79(3):203-212. [Disponible en anglais seulement.]
Newberne P, Smith RL, Doull J, Goodman JI, Munro IC, Portoghese PS, Wagner BM, Weil CS, Woods LA, Adams TB, et al. 1999. The FEMA GRAS assessment of trans-anethole used as a flavouring substance. Food Chem Toxicol. 37(7):789-811. [Disponible en anglais seulement.]
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2016a. Benzene, 1-methoxy-4-(1-propenyl)-, (E)-: Human health tier II assessment [PDF]. [Disponible en anglais seulement.]
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2016b. Cyclohexenebutanal, alpha-2,2,6-tetramethyl-: human health tier II assessment. [Disponible en anglais seulement.]
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2016c. Benzenepropanal, 4(1,1dimethylethyl).alpha.methyl: human health tier II assessment. [Disponible en anglais seulement.]
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2017a. Search assessment: 9,12-Octadecadienoic acid, (Z,Z)-. [Consulté le 10 sept. 2020]. [Disponible en anglais seulement.]
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2017b. Search assessment: Hexadecanoic acid. [Consulté le 10 sept. 2020]. [Disponible en anglais seulement.]
Nijssen LM, Ingen-Visscher CA van, Donders JJH, editors. 1963-2018. VCF (Volatile Compounds in Food): database, version 16.6.1, 2018. Zeist (NL): Triskelion B.V. [Disponible en anglais seulement.]
[NTP] National Toxicology Program. 2000. NTP technical report on the toxicology and carcinogenesis studies of methyleugenol (CAS NO. 93-15-2) in F344/N rats and B6C3F1 mice (gavage studies). Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. NTP Toxicity Report 491. [Disponible en anglais seulement.]
[NTP] National Toxicology Program. 2003. NTP technical report on the toxicology and carcinogenesis studies of 2,4-hexadienal (89% trans,trans isomer, CAS No. 142-83-6; 11% cis,trans isomer) in F344/N rats and B6C3F1 mice (gavage studies). Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. NTP Toxicity Report 509. [Disponible en anglais seulement.]
[NTP] National Toxicology Program. 2011a. NTP technical report on the 3-month toxicity studies of estragole (CAS No. 140-67-0) administered by gavage to F344/N rats and B6C3F1 mice [PDF]. Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. NTP Toxicity Report 82. [Disponible en anglais seulement.]
Nyska A, Moomaw CR, Lomnitski L, Chan P. 2001. Glutathione S-transferase Pi expression in forestomach carcinogenesis process induced by gavage-administered 2,4-hexadienal in the F344 rat. Arch Toxicol. 75(10):618-624. [Disponible en anglais seulement.]
O.Berk Leaders in Packaging Solutions. [date inconnue]. O.Berk online product catalog – fine mist sprayers. [Consulté en sept. 2018]. [Disponible en anglais seulement.]
Obolskiy D, Pischel I, Feistel B, Glotov N, Heinrich M. 2011. Artemisia dracunculus L. (tarragon): a critical review of its traditional use, chemical composition, pharmacology, and safety. J Agric Food Chem. 59(21):11367-11384. [Disponible en anglais seulement.]
[OCDE] Organisation de coopération et de développement économiques. 2003. OECD SIDS Initial Assessment Report for SIAM 16: Isophytol. OCDE Paris. [Disponible en anglais seulement.]
[OCDE] Organisation de coopération et de développement économiques. 2004. SIDS Initial Assessment Profile (SIAP): Higher Olefins Category. [Consulté le 11 août 2020]. [Disponible en anglais seulement.]
[OCDE] Organisation de coopération et de développement économiques. 2014. SIDS Initial Assessment Profile (SIAP): Aliphatic Acids Category. CoCAM [Cooperative Chemicals Assessment Meeting] 6, du 30 sept. au 3 oct. 2014. [consulté le 11 août 2020]. [Disponible en anglais seulement.]
[OCDE] QSAR Toolbox [outil d’extrapolation]. 2014. Version 3.3. Paris (FR) : Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement.]
[OCDE] QSAR Toolbox [outil d’extrapolation]. 2016. Paris (FR) : Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement.]
[OCDE] QSAR Toolbox [outil d’extrapolation]. 2019. Version 4.3. Paris (FR) : Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement.]
[OEHHA] Office of Environmental Health Hazard Assessment, Reproductive and Cancer Hazard Assessment Section. 1999. Evidence on the carcinogenicity of estragole [PDF]. [Consulté en avril 2020]. [Disponible en anglais seulement.]
[OEHHA] Office of Environmental Health Hazard Assessment. 2018. Chemical listed effective March 27, 2015 as known to the State of California to cause cancer: beta-myrcene. [Consulté en avril 2020]. [Disponible en anglais seulement.]
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA). 1991. First draft for safety evaluation of certain food additives: trans-anethole. WHO Food Additives Series: 28. Geneva (CH): World Health Organization. [Disponible en anglais seulement.]
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA). 1999. Safety evaluation of certain food additives: trans-anethole. WHO Food Additives Series: 42. Geneva (CH): World Health Organization. [Disponible en anglais seulement.]
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA). 2004. Safety evaluation of certain food additives and contaminants: aliphatic, alicyclic, linear, a,b-unsaturated, di- and trienals and related alcohols, acids and esters. WHO Food Additives Series: 52. Geneva (CH): World Health Organization. [Disponible en anglais seulement.]
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA). 2008. Safety evaluation of certain food additives and contaminants [PDF]. Sixty-eighth meeting of the Joint FAO/WHO Expert Committee on Food additives (JECFA). WHO Food Additives Series: 59. Geneva (CH): World Health Organization. [Disponible en anglais seulement.]
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA). 2019. Linoleic and linolenic acid (mixture). [consulté le 10 sept. 2020]. [Disponible en anglais seulement.]
Opdyke DLJ. 1976. Monographs on fragrance raw materials: violet leaf absolute. Food Cosmet Toxicol. 14:729. [Disponible en anglais seulement.]
Opdyke DLJ. 1988. Fragrance raw materials monographs: terpinolene. Food Cosmet Toxicol. 14 Suppl:877-878. [Disponible en anglais seulement.]
Paini A, Punt A, Scholz G, Gremaud E, Spenkelink B, Alink G, Schilter B, van Bladeren PJ, Rietjens IMCM. 2012. In vivo validation of DNA adduct formation by estragole in rats predicted by physiologically based biodynamic modelling. Mutagenesis. 27(6):653-663. [Disponible en anglais seulement.]
Perveen S. 2018. Introductory chapter: terpenes and terpenoids. In: Perveen S, Al-Taweel A, editors. Terpenes and terpenoids. London (UK): IntechOpen. [Consulté le 18 décembre 2019]. [Disponible en anglais seulement.]
Phillips DH, Reddy MV, Randerath K. 1984. 32P-post labelling analysis of DNA adducts formed in the livers of animals treated with safrole, estragole and other naturally-occurring alkenylbenzenes. II. Newborn male B6C3F1 mice. Carcinogenesis. 5(12):1623-1628. [Disponible en anglais seulement.]
Pículo F, Macedo CG, de Andrade SF, Maistro EL. 2010. In vivo genotoxicity assessment of nerolidol. J Appl Toxicol. 31(17):633-639. [Disponible en anglais seulement.]
Prakash O, Sahoo D, Rout PK. 2012. Liquid CO2 extraction of Jasminum grandiflorum and comparison with conventional process. Nat Prod Commun. 7(1):89-92. [Disponible en anglais seulement.]
Raeisi M, Tajik H, Razavi RS, Maham M, Moradi M, Hajimohammadi B, Naghili H, Hashemi M, Mehdizadeh T. 2012. Essential oil of tarragon (Artemisia dracunculus) antibacterial activity on Staphylococcus aureus and Escherichia coli in culture media and Iranian white cheese. Iran J Microbiol. 4(1):30-34. [Disponible en anglais seulement.]
Randerath K, Haglund RE, Phillips DH, Reddy MV. 1984. 32P-post-labelling analysis of DNA adducts formed in the livers of animals treated with safrole, estragole and other naturally-occurring alkenylbenzenes. I. Adult female CD-1 mice. Carcinogenesis. 5(12):1613-1622. [Disponible en anglais seulement.]
Rietjens IMCM, Slob W, Galli C, Silano V. 2008. Risk assessment of botanicals and botanical preparations intended for use in food and food supplements: emerging issues. Toxicol Lett. 180(2):131‑136. [Disponible en anglais seulement.]
[RIFM] Research Institute for Fragrance Materials, Inc. 2020. RIFM fragrance ingredient safety assessment, p-t-butyl-α-methylhydrocinnamic aldehyde, CAS Registry Number 80-54-6. Food Chem Toxicol. 141(Suppl 1):111430. [Disponible en anglais seulement.]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement (NL)]. 2006. Cosmetics fact sheet: to assess the risks for the consumer: updated version for ConsExpo 4. Bilthoven (NL): RIVM. Report No.: 320104001/2006. [Disponible en anglais seulement.]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement (NL)]. 2018. ConsExpo. 2016. ConsExpo Web consumer exposure models. Bilthoven (NL) : RIVM. [Disponible en anglais seulement.]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu (Institut national pour la santé publique et l’environnement). 2018. Cleaning Products Factsheet: Default parameters for estimating consumer exposure - updated version 2018 [PDF]. Bilthoven (NL): RIVM. Report No. 2016-0179. Contains erratum d.d. 13-9-2018. [Disponible en anglais seulement.]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement (NL)]. 2021a. Health risk assessment of ethanol-containing hand sanitizer [PDF]. Bilthoven (NL) : RIVM. Report No.: 2021-0026. [Disponible en anglais seulement.]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement (NL)]. 2021b. Air Fresheners Fact Sheet [PDF]. Bilthoven (NL) : RIVM. Report No.: 2021-0233. [Disponible en anglais seulement.]
[RTECS] Registry of Toxic Effects of Chemical Substances. 2019. Record for anisole, p-propenyl-, cis- (25679-28-1). Hamilton (ON): Canadian Centre for Occupational Health and Safety, National Institute for Occupational Safety and Health. [Mis à jour en novembre 2019; consulté en mai 2020]. [Disponible en anglais seulement.]
Saint-Lary L, Roy C, Paris J-P, Tournayre P, Berdagué J-L, Thomas OP, Fernandez X. 2014. Volatile compounds of Viola odorata absolutes: identification of odorant active markers to distinguish plants originating from France and Egypt. Chem Biodivers. 11(6):843-860. [Disponible en anglais seulement.]
Sakthivel R, Mala DS, Devi KP. 2018. Phytol shows anti-angiogenic activity and induces apoptosis in A549 cells by depolarizing the mitochondrial membrane potential. Biomed Pharmacother. 105:742-752. [Disponible en anglais seulement.]
Sayyah M, Nadjafnia L, Kamalinejad M. 2004. Anticonvulsant activity and chemical composition of Artemisia dracunculus L. essential oil. J Ethnopharmacol. 94(2-3):282-287. [Disponible en anglais seulement.]
[SC] Santé Canada. 2013. Document d’orientation provisoire sur l’évaluation des risques pour la santé humaine associés à une exposition de courte durée aux substances cancérogènes présentes dans les sites contaminés [PDF], Ottawa (Ont.), Santé Canada.
[SC] Santé Canada. 2016. Document sur l'approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances, Ottawa (Ont.), gouvernement du Canada.
[SC] Santé Canada. 2019a. Liste critique des ingrédients de cosmétiques [Internet], Ottawa (Ont.), Santé Canada, Sécurité des produits de consommation.
[SC] Santé Canada. 2019b. Canadian exposure factors used in human health risk assessment. Rapport inédit. Ottawa (Ont.), gouvernement du Canada. [Disponible en anglais seulement.]
[SC] Santé Canada. 2019c. Les produits d’autosoins et Santé Canada [Internet], Ottawa (Ont.), Santé Canada, gouvernement du Canada.
[SC] Santé Canada. 2020. [Modifié le 14 juillet 2020]. Règlements sur les produits de vapotage, Ottawa (Ont.), gouvernement du Canada. [Consulté le 22 avril 2021].
[SCCS] Scientific Committee on Consumer Safety. 2015. The SCCS notes of guidance for the testing of cosmetic ingredients and their safety evaluation [PDF]. 9th Revision. European Commission. Report No. SCCS/1564/15, révision du 25 avril 2016. [Consulté en avril 2020]. [Disponible en anglais seulement.]
[SCCS] Scientific Committee on Consumer Safety. 2016. Opinion on butylphenyl methylpropional (BMHCA). 12 August 2015, SCCS/1540/14, révision du 16 mars 2016. [Disponible en anglais seulement.]
[SCCS] Scientific Committee on Consumer Safety. 2019. Opinion on the safety of butylphenyl methylpropional (p-BMHCA) in cosmetic products - submission II, version provisoire le 14 décembre 2017, version finale le 10 mai 2019, SCCS/1591/2017. [Disponible en anglais seulement.]
[SCF] European Commission, Scientific Committee on Food. 2001. Opinion of the Scientific Committee on Food on estragole (1-allyl-4-methoxybenzene) [PDF]. [Disponible en anglais seulement.]
Scherer M, Petreanu W, Weber T, Scherer G, Pluym N, Kolossa-Gehring M. 2021. Human biomonitoring in urine samples from the Environmental Specimen Bank reveals a decreasing trend over time in the exposure to the fragrance chemical lysmeral from 2000 to 2018. Chemosphere. 265:128955. [Disponible en anglais seulement.]
Schwotzer D, Gigliotti A, Irshad H, Dye W, McDonald J. 2021. Phytol, not propylene glycol, causes severe pulmonary injury after inhalation dosing in Sprague-Dawley rats. Inhal Toxicol. 33(1):33-40. [Disponible en anglais seulement.]
[SDS] Safety Data Sheet. 2014a. Oil Essentials Soothe Lavender & Rose Hip. Yokneam (IL) : Emilia Cosmetics Ltd. [Disponible en anglais seulement.]
[SDS] Safety Data Sheet. 2014b. Hand Sanitizer -Vitamin E. Toronto (CA): Apollo Health and beauty care. [Disponible en anglais seulement.]
[SDS] Safety Data Sheet. 2016. Fresh Products Curve Air Freshener Cucumber Melon. Toledo (OH) : Fresh Products. [accès restreint]. [Disponible en anglais seulement.]
[SDS] Safety Data Sheet. 2017a. Glade® PlugIns® Scented Oil Delicate Vanilla Embrace™. Bradford (ON) : S.C. Johnson and Son, Limited. [accès restreint]. [Disponible en anglais seulement.]
[SDS] Safety Data Sheet. 2017b. Air Wick Carpet Powder – Country Vanilla – 2 in 1. Sydney (AU) : Reckitt Benckiser Pty Limited. [Disponible en anglais seulement.]
[SDS] Safety Data Sheet. 2019. AIRLIFT TROPICAL AIR FRESHENER (AEROSOL) [PDF]. Maumee (OH): Spartan Chemical Company, Inc. [Disponible en anglais seulement.]
[SDS] Safety Data Sheet. 2020. Febreze LIGHT PLUGS Bamboo [PDF]. Cincinnati (OH): Procter & Gamble Inc. [Disponible en anglais seulement.]
Sekizawa J, Shibamoto T. 1982. Genotoxicity of safrole-related chemicals in microbial test systems. Mutat Res. 101(2):127-140. [Disponible en anglais seulement.]
Smith B, Cadby P, Leblanc J-C, Setzer RW. 2010. Application of the margin of exposure (MoE) approach to substances in food that are genotoxic and carcinogenic: example: methyleugenol, CASRN: 93-15-2. Food Chem Toxicol. 48 Suppl 1:S89-S97. [Disponible en anglais seulement.]
Sperotto ARM, Moura DJ, Péres VF, Damasceno FC, Caramão EB, Henriques JAP, Saffi J. 2013. Cytotoxic mechanism of Piper gaudichaudianum Kunth essential oil and its major compound nerolidol. Food Chem Toxicol. 57:57-68. [Disponible en anglais seulement.]
Statistics Canada. 2017. Custom tabulation of grooming products data from the Canadian Health Measures Survey Cycle 2 (2010-2011). Prepared for Existing Substances Risk Assessment Bureau, Health Canada by Statistics Canada. Document inédit. [Disponible en anglais seulement.]
Steinberg D, Avigan J, Mize CE, Baxter JH, Cammermeyer J, Fales HM, Highet PF. 1966. Effects of dietary phytol and phytanic acid in animals. J Lipid Res. 7(5):684-691. [Disponible en anglais seulement.]
Suparmi S, Ginting AJ, Mariyam S, Wesseling S, Rietjens IMCM. 2019. Levels of methyleugenol and eugenol in instant herbal beverages available on the Indonesian market and related risk assessment. Food Chem Toxicol. 125:467-478. [Disponible en anglais seulement.]
Suzuki Y, Umemura T, Hibi D, Inoue T, Jin M, Ishii Y, Sakai H, Nohmi T, Yanai T, Nishikawa A, et al. 2012. Possible involvement of genotoxic mechanisms in estragole-induced hepatocarcinogenesis in rats. Arch Toxicol. 86(10):1593-1601. [Disponible en anglais seulement.]
Swanson AB, Chambliss DD, Blomquist JC, Miller EC, Miller JA. 1979. The mutagenicities of safrole, estragole, eugenol, trans-anethole, and some of their known or possible metabolites for Salmonella typhimurium mutants. Mutat Res. 60(2):143-153. [Disponible en anglais seulement.]
Tateo F, Santamaria L, Bianchi L, Bianchi A. 1989. Basil oil and tarragon oil: composition and genotoxicity evaluation. J Essent Oil Res. 1(3):111-118. [Disponible en anglais seulement.]
Tisserand R, Young R. 2014. Essential oil safety. 2nd ed. London (UK): Churchill Livingstone. [Disponible en anglais seulement.]
Tisserand Institute. 2021. How to use essential oils safely. [Consulté en juillet 2021]. [Disponible en anglais seulement.]
Truhaut R, Le Bourhis B, Attia M, Glomot R, Newman J, Caldwell J. 1989. Chronic toxicity/carcinogenicity study of trans-anethole in rats. Food Chem Toxicol. 27(1):11-20. [Disponible en anglais seulement.]
Tucker AO, Maciarello MJ, Adams RP, Landrum LR, Zanoni TA. 1991. Volatile leaf oils of Caribbean Myrtaceae. I. Three varieties of Pimenta racemosa (Miller) J. Moore of the Dominican Republic and the commercial bay oil. J Essent Oil Res. 3(5):323-329. [Disponible en anglais seulement.]
Turkez H, Aydin E, Geyikoglu F, Cetin D. 2014. Genotoxic and oxidative damage potentials in human lymphocytes after exposure to terpinolene in vitro. Cytotechnology. 67(3):409-418. [Disponible en anglais seulement.]
[US EPA] United States Environmental Protection Agency. 2010. Screening-level hazard characterization: Benzyl Derivatives Category [PDF]. Hazard Characterization Document. US Environmental Protection Agency. [Disponible en anglais seulement.]
[US EPA] United States Environmental Protection Agency. 2012a. EPI Suite- Estimation Program Interface Suite for Microsoft Windows [estimation model]. C2000-2012. Version 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Disponible en anglais seulement.]
[US EPA] United States Environmental Protection Agency. 2012b. Standard Operating Procedures for Residential Pesticide Exposure Assessment [PDF]. October 2012 Washington (DC): Health Effects Division, Office of Pesticide Programs, Office of Chemical Safety and Pollution Prevention. [Disponible en anglais seulement.]
[US EPA] United States Environmental Protection Agency. 2019. The Chemistry Dashboard. LIST: Terpenes in vape. Research Triangle Park (NC): US Environmental Protection Agency, Chemical Safety for Sustainability Research Program. [Disponible en anglais seulement.]
[US FDA] United States Food and Drug Administration. 2018. Substances Added to Food (formerly EAFUS). [Disponible en anglais seulement.]
[US NLM] United States National Library of Medicine. 2014. Record on anethole. [updated 2014 Nov; consulté le 2020 May]. Bethesda (MD): National Institutes of Health of United States. [Disponible en anglais seulement.]
Van den Berg SJPL, Restani P, Boersma MG, Delmulle L, Rietjens IMCM. 2011. Levels of genotoxic and carcinogenic compounds in plant food supplements and associated risk assessment. Food Nutr Sci. 2(9):989-1010. [Disponible en anglais seulement.]
[VCF] Volatile Compounds in Food: database. 2020. Van Dongen WD, Donders JJH, editors. Version 16.7. Reeuwijk (NL): BeWiDo B.V., 1963-2020. [Disponible en anglais seulement.]
Wei FH, Chen FL, Tan XM. 2015. Gas chromatographic-mass spectrometric analysis of essential oil of Jasminum officinale L var Grandiflorum flower. Trop J Pharm Res. 14(1):149-152. [Disponible en anglais seulement.]
Whelan J, Fritsche K. 2013. Linoleic acid. Adv Nutr. 4(3):311-312. [Disponible en anglais seulement.]
Wilkinson MAC, Ormandy K, Bradley CR, Fraise AP, Hines J. 2017. Dose considerations for alcohol-based hand rubs. J Hosp Infect. 95(2):175-182. [Disponible en anglais seulement.]
Wu XM, Bennett DH, Ritz B, Cassady DL, Lee K, Hertz-Picciotto I. 2010. Usage pattern of personal care products in California households. Food Chem Toxicol. 48(11):3109-3119. [Disponible en anglais seulement.]
Yang X-N, Wang Y-K, Zhu X, Xiao X-R, Dai M-Y, Zhang T, Qu Y, Yang X-W, Qin H-B, Gonzalez FJ, et al. 2019. Metabolic Activation of Elemicin Leads to the Inhibition of Stearoyl-CoA Desaturase 1. Chem Res Toxicol. 32(10):1965-1976. [Disponible en anglais seulement.]
Zhou G-D, Moorthy B, Bi J, Donnelly KC, Randerath K. 2007. DNA adducts from alkoxyallylbenzene herb and spice constituents in cultured human (HepG2) cells. Environ Mol Mutagen. 48(9):715-721. [Disponible en anglais seulement.]
Annexe A. Paramètres d’estimation de l’exposition par les voies orale et cutanée et par inhalation aux produits disponibles aux consommateurs
Les valeurs de l’exposition des produits disponibles aux consommateurs ont été estimées à l’aide de ConsExpo Web (RIVM, 2018). Ces valeurs ont été calculées en utilisant les poids corporels et les doses d’inhalation par défaut, soit : 74 kg/15,1 m³/j pour les adultes (19 ans et plus); 62 kg/15,9 m 3/j pour les 14 à 18 ans; 42 kg/13m9 m 3/j pour les 9 à 13 ans; 23 kg/11,1 m 3/j pour les 4 à 8 ans; 15 kg/9,2 m 3/j pour les 2 à 3 ans; 11 kg/8,0 m³/j pour les enfants de 1 an; 9,1 kg/5,4 m 3/j pour les 6 à 11 mois et 6,3 kg/3,7 m 3/j pour les 0 à 5 mois (SC, 2019b).
On a utilisé un facteur d’absorption cutanée de 20 % pour les essences de violette, de 50 % pour les substances du sous-groupe 1 des phénylpropanoïdes (essences de jasmin, parfums et essences de jasmin), de 40 % pour les essences de feuille de laurier et les essences d’estragon, et de 15 % pour les substances du sous-groupe 2 des aldéhydes (Lilial, myrac-aldéhyde, myrmac-aldéhyde, myrmac-carboxaldéhyde, cétonal, vernaldéhyde). Les valeurs estimatives calculées de l’exposition aux essences de violette et aux essences de feuille de laurier ont été ajustées de 19 % et 2 % pour la quantité maximale de 2,6-nonadiénal et de méthyleugénol dans les essences de violette et les essences de feuille de laurier, respectivement.
Pour le calcul des valeurs DJMDV, on a utilisé une durée de vie moyenne de 78 ans (SC, 2013).
| Scénario d’exposition | Hypothèses |
|---|---|
| Hydratants pour les yeux (essences de violette) |
Concentration : 100 % d’essences de violette Quantité de produit : 0,16 g (adultes et 14–18 ans) (Ficheux et al., 2016). Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Après-shampooing (à rincer) (essences de violette, essences de feuille de laurier) |
Concentration : 100 % d’essences de violette, 3 % d’essences de feuille de laurier (en supposant la concentration maximale de 0,0002 % de méthyleugénol autorisée selon la Liste critique des ingrédients des cosmétiques) Quantité de produit (essences de violette) : 1,5 g, en supposant que tous les sous-groupes de la population sont exposés (selon les instructions du fabricant) Quantité de produit (essences de feuille de laurier) : 13,1 g (adultes); 10 g (14–18 ans); 7,8 g (9–13 ans et 4–8 ans); 5,2 g (2–3 ans) (Ficheux et al., 2016; Garcia-Hidalgo et al., 2017) Fréquence : 1,1 (adultes) (Loretz et al., 2008). Pour tous les autres sous-groupes de la population, la fréquence moyenne avait une valeur présumée de 1. Facteur de rétention : 0,1 L’exposition cutanée aux essences de feuille de laurier (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Essences de feuille de laurier : exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Une dose journalière moyenne pour la durée de la vie (DJMDV) a également été calculée pour les essences de feuille de laurier, selon la formule suivante : DJMDV (mg/kg p.c./j) = ((exposition combinée (mg/kg p.c./j) 0–5 mois * durée du stade de vie (0,5 an)) + (exposition combinée (mg/kg p.c./j) 6–12 mois * durée du stade de vie (0,5 an)) + (exposition combinée (mg/kg p.c./j) 1 an * durée du stade de vie (1 an)) + (exposition combinée (mg/kg p.c./j) 2–3 ans * durée du stade de vie (2 ans)) + (exposition combinée (mg/kg p.c./j) 4–8 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j 9–13 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)) / durée de vie moyenne (78 ans) |
| Après-shampooings (à rincer) (essences de jasmin, Lilial) |
Concentration : 30 % d’essences de jasmin, 2 % de Lilial. Quantité de produit (essences de jasmin) : 0,71 g, en supposant que tous les sous-groupes de la population sont exposés (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, au Bureau d’évaluation du risque des substances existantes, février 2021; sans référence) Quantité de produit (Lilial) : 13,1 g (adultes); 10 g (14–18 ans); 7,8 g (9–13 ans et 4–8 ans); 5,2 g (2–3 ans) (Ficheux et al., 2016; Garcia-Hidalgo et al., 2017) Fréquence : 1,1 (adultes) (Loretz et al., 2008). Pour tous les autres sous-groupes de la population, la fréquence moyenne avait une valeur présumée de 1. L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Nettoyants pour le visage (essences de violette, essences d’estragon) |
Concentration : 30 % d’essences de violette, 0,1 % d’essences d’estragon Quantité de produit : 3,3 g (adultes et 14–18 ans); 3,1 g (9–13 ans) (Ficheux et al., 2016) Fréquence : 1,6/j (adultes) (Loretz et al., 2008); 1,2/j (14–18 ans et 9–13 ans) (Ficheux et al., 2015) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Pour les essences d’estragon, on a également calculé une DJMDV selon la formule suivante : DJMDV (mg/kg p.c./j) = {[exposition combinée (mg/kg p.c./j) 9–13 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)]} / durée de vie moyenne (78 ans) |
| Produits pour le traitement de l’acné (PSN) (Lilial) |
Concentration : 0,1 % de Lilial Quantité de produit : 3,3 g (adultes et 14–18 ans); 3,1 g (9–13 ans) (Ficheux et al., 2016)
Fréquence : 3/j (tous les sous-groupes de la population) (selon les recommandations du fabricant) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Hydratants corporels (essences de violette, essences de feuille de laurier, essences d’estragon, essences de jasmin et Lilial) |
Concentration : 10 % d’essences de violette, 0,3 % d’essences de feuille de laurier (en supposant la concentration maximale de 0,002 % de méthyleugénol autorisée selon la Liste critique des ingrédients des cosmétiques), 0,3 % d’essences d’estragon, 3 % d’essences de jasmin, 1 % de Lilial, 0,1 % d’ingrédients parfumants Quantité de produit : 10 g (adultes et 14–18 ans); 7,7 g (9–13 ans); 5 g (4–8 ans); 4,1 g (2–3 ans); 3,1 g (1 an); 2,5 g (6–11 mois); 2 g (0–5 mois) (Ficheux et al., 2016) Pour tous les autres sous-groupes de la population, la fréquence moyenne avait une valeur présumée de 1. Pour les essences de feuille de laurier et les essences d’estragon (calcul de la DJMDV), on a utilisé une fréquence de 0,8/j pour tous les autres sous-groupes de la population (Wu et al., 2010; Ficheux et al., 2015). Pour les essences de feuille de laurier, les essences d’estragon, les essences de jasmin et le Lilial, l’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne (1/j) * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Quantité de produit : valeurs ajustées pour la surface découverte d’une personne portant un vêtement à manches courtes et un short : 4,87 g (adultes); 4,65 g (14–18 ans); 3,61 g (9–13 ans); 2,3 g (4–8 ans); 1,85 g (2–3 ans); 1,45 g (1 an); 1,16 g (0–5 mois); 0,93 g (0–5 mois). Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j) * fréquence (calcul de la DJMDV seulement)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Pour les essences de feuille de laurier et les essences d’estragon, les valeurs DJMDV ont également été calculées selon la formule suivante (SC, 2013) : DJMDV (mg/kg p.c./j) = ((exposition combinée (mg/kg p.c./j) 0–5 mois * durée du stade de vie (0,5 an)) + (exposition combinée (mg/kg p.c./j) 6–12 mois * durée du stade de vie (0,5 an)) + (exposition combinée (mg/kg p.c./j) 1 an * durée du stade de vie (1 an)) + (exposition combinée (mg/kg p.c./j) 2-3 ans * durée du stade de vie (2 ans)) + (exposition combinée (mg/kg p.c./j) 4–8 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j 9–13 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)) / durée de vie moyenne (78 ans) |
| Huiles de massage (essences de violette, Lilial) |
Concentration : 10 % d’essences de violette, 0,3 % de Lilial. Quantité de produit : 3,2 g (adultes); 2,9 g (14–18 ans); 2,3 g (9–13 ans); 1,9 g (4–8 ans); 1,8 g (2–3 ans, 1 an, 6–11 mois, 0–5 mois) (Ficheux et al., 2016) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Rouges à lèvres (essences de violette, essences de jasmin) |
Concentration : 10 % d’essences de violette, 3 % d’essences de jasmin Quantité de produit : 0,022 g (tous les sous-groupes de la population) (Ficheux et al., 2016) L’exposition par voie orale (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne (1/j) * concentration de produit * facteur de conversion (mg/g)] ÷ poids corporel |
| Parfums corporels (essences de violette, essences de feuille de laurier, essences d’estragon, essences de jasmin, Lilial) |
Concentration : 10 % d’essences de violette, 10 % d’essences de feuille de laurier (en supposant une concentration de 0,004 % pour l’eau de toilette et de 0,01 % pour les parfums fins, d’après la concentration maximale de méthyleugénol autorisée selon la Liste critique des ingrédients des cosmétiques), 100 % d’essences d’estragon, 82 % d’essences de jasmin, 44 % de Lilial Quantité de produit : basée sur la concentration dans les eaux de toilette, 0,33 g (adultes, 14–18 ans, et 9–13 ans) (Ficheux et al., 2016) Fréquence : 1,7/j (adultes) (Loretz et al., 2006); 1.4/j (14–18 ans et 9–13 ans) (Statistique Canada 2017) Pour les essences de feuille de laurier, les essences d’estragon, les essences de jasmin et le Lilial, l’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Pour les produits à pulvériser, les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « pulvérisation-évaporation-surface de libération constante ». Pour les produits en applicateur à bille, les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Pour les essences de feuille de laurier et les essences d’estragon, les valeurs DJMDV ont également été calculées selon la formule suivante (SC, 2013) : DJMDV (mg/kg p.c./j) = ((exposition combinée (mg/kg p.c./j) 9–13 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)) / durée de vie moyenne (78 ans)) |
| Huiles essentielles en applicateur à bille pour la détente (PSN) (essences de jasmin) |
Concentration : 0,01 % Quantité de produit : 0,14 g [selon les instructions du fabricant, 0,15 mL * masse volumique des essences de jasmin (0,947 g/mL)) Fréquence : 3/j (selon les instructions du fabricant) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Quantité de produit : comme ci-dessus, valeur ajustée pour tenir compte de la quantité restante sur la surface de la peau après l’absorption cutanée de la substance et de la fréquence journalière. Durée d’exposition et de libération : 24 h Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Produits pour le bain (Lilial) |
Concentration : 3 % de Lilial Quantité de produit : Pour le Lilial, 0,0394 g (adultes), 0,0370 g (14–18 ans), 0,0078 g (9–13 ans) (Ficheux et al.2016), 0,051 g (4–8 ans), 0,0055 g (2–3 ans), 0,0041 g (1 an), 0,0034 g (6–11 mois) (Garcia-Hidalgo et al., 2017), 0,0026 g (0–5 mois) (Garcia-Hidalgo et al., 2017) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Hydratants pour le visage (essences d’estragon, Lilial) |
Concentration : 0,1 % d’essences d’estragon, 3 % de Lilial Quantité de produit : 1,5 g (adultes et 14–18 ans); 1,1 g (9–13 ans) (Ficheux et al., 2016) Fréquence : 2/j (adultes) (Loretz et al., 2005); 1/j (14–18 ans et 9–13 ans) (Ficheux et al., 2015) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Pour les essences d’estragon, on a également calculé une DJMDV selon la formule suivante : DJMDV (mg/kg p.c./j) = {[exposition combinée (mg/kg p.c./j) 9–13 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)]} / durée de vie moyenne (78 ans) |
| Produit hydratant pour le visage ou le traitement de l’acné (PSN) (essences de jasmin) |
Concentration : 1 % d’essences de jasmin Quantité de produit : 1,5 g (adultes) (Ficheux et al., 2016) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Écran solaire en poudre pour le visage (PSN) (essences de jasmin) |
Concentration : 0,07 % Quantité de produit : 0,073 g (adultes) (Ficheux et al., 2016) Fréquence : 6/j (selon les recommandations du fabricant) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Crèmes de traitement (PSN) à usage topique (essences de jasmin) |
Concentration : 1 % d’essences de jasmin Quantité de produit : 1,5 g (adultes) (Ficheux et al., 2016) Fréquence : 1/j (selon les recommandations du fabricant) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Savons (essences d’estragon) |
Concentration : 0,3 % d’essences d’estragon Quantité de produit : 1,1 g (adultes et 14–18 ans), 0,82 g (9–13 ans), 0,53 g (4–8 ans), 0,38 g (2–3 ans), 0,29 g (1 an), 0,24 g (6–11 mois), 0,18 g (0–5 mois) (Ficheux et al., 2016) Fréquence : 1,2 (adultes et 14–18 ans), 1,15 (9–13 ans et 4–8 ans), 1,1 (2–3 ans, 1 an, 6–11 mois et 0–5 mois) (Ficheux et al., 2015) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * facteur de rétention * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel La DJMDV a également été calculée selon la formule suivante : DJMDV (mg/kg p.c./j) = {[exposition combinée (mg/kg p.c./j) 0–5 mois * durée du stade de vie (0,5 an)] + [exposition combinée (mg/kg p.c./j) 6–12 mois * durée du stade de vie (0,5 an)] + [exposition combinée (mg/kg p.c./j) 1 an * durée du stade de vie (1 an)] + [exposition combinée (mg/kg p.c./j) 2–3 ans * durée du stade de vie (2 ans)] + [exposition combinée (mg/kg p.c./j) 4–8 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) 9–13 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)]} / durée de vie moyenne (78 ans) |
| Capsule d’aide à la digestion (PSN) (essences d’estragon) |
Essences d’estragon : 0,0026 % La DJMDV a également été calculée selon la formule suivante (SC, 2013) : DJMDV (mg/kg p.c./j) = [exposition par voie orale (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)] / durée de vie moyenne (78 ans) |
| Bâtonnet d’inhalation (PSN) (essences de feuille de laurier) |
Concentration : 0,06 % d’essences de feuille de laurier Quantité de produit : 1 g (adultes) (valeur calculée en supposant que toute la quantité de produit, soit 1 mL, est utilisée en une journée, avec une masse volumique présumée de 1 g/mL (1 mL * 1 g/mL) Fréquence : on présume que l’utilisateur emploierait le produit 30 jours par année (jugement professionnel) L’exposition par inhalation (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * facteur de composition ajusté (2 %) * facteur de conversion (1 000 mg/g)] ÷ poids corporel Pour les essences de feuille de laurier, une DJMDV a également été calculée selon la formule suivante : DJMDV (mg/kg p.c./j) = [exposition par inhalation (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)] / durée de vie moyenne (78 ans) |
| Aérosol respiratoire (PSN) (essences de feuille de laurier) |
Concentration : 2 % d’essences de feuille de laurier Les concentrations atmosphériques ont été modélisées à l’aide du modèle « exposition à la pulvérisation-libération instantanée ». Quantité de produit : 1,3 g, calculée d’après la plage supérieure de volume par pulvérisation de 0,16 mL, et l’hypothèse que le nombre maximal de pulvérisations par jour serait de 9. Durée d’exposition : 5 min (RIVM, 2006) Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j) * fréquence (calcul de la DJMDV seulement) (168 fois/365 (année), d’après une fréquence de 14 fois par mois) (RIVM, 2006)] ÷ poids corporel La DJMDV a également été calculée selon la formule suivante : DJMDV (mg/kg p.c./j) = [exposition par inhalation (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)] / durée de vie moyenne (78 ans) |
| Antisudorifiques et déodorants (solides) (essences d’estragon, essences de jasmin, Lilial) |
Concentration : 1 % d’essences d’estragon, 2 % d’essences de jasmin, 3 % de Lilial Quantité de produit : 1 g (adultes et 14–18 ans); 0,4 g (9–13 ans) (Ficheux et al., 2016) Fréquence : 1,3 (adultes) (Loretz et al., 2006); 1,1 (14–18 ans et 9–13 ans) (Wu et al., 2010; Ficheux et al., 2015) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Durée d’exposition et de libération : 18 h (adultes); 22 h (14–18 ans et 9–13 ans) Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Pour les essences d’estragon, on a également calculé une DJMDV selon la formule suivante : DJMDV (mg/kg p.c./j) = {[exposition combinée (mg/kg p.c./j) 9–13 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)]} / durée de vie moyenne (78 ans) |
| Antisudorifiques et déodorants (aérosol) (Lilial) |
Concentration : 0,3 % de Lilial Quantité de produit : 3,48 g (adultes et 14–18 ans) (Hall et al., 2007); 0,98 g (9–13 ans) (Ficheux et al., 2016) Fréquence : 1,3 (adultes) (Loretz et al., 2006); 1,2 (14–18 ans) (Ficheux et al., 2015); 1,1 (9–13 ans) (Wu et al., 2010) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel L’exposition par inhalation de la substance pulvérisée a été quantifiée selon le modèle « exposition-pulvérisation-libération instantanée » et les paramètres suivants : Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Nettoyants antiseptiques pour la peau (PSN) (essences de jasmin, Lilial) |
Concentration : 2 % d’essences de jasmin, 0,07 % de Lilial Quantité de produit : 1,5 g (tous les groupes d’âge, Kampf et al., 2013; Macinga et al., 2013; Bánsághi et al., 2020) Fréquence : 2,9 (adultes); 1,4 (14–18 ans, 9–13 ans, 4–8 ans), 0,8 (ajustée à 1) (2– 3 ans) (Wu et al., 2010) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-libération constante ». Durée d’exposition et de libération : 20 min (tous les groupes d’âge) Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Nettoyants corporels (liquides) (essences de feuille de laurier, essences de jasmin, Lilial) |
Concentration : 3 % d’essences de feuille de laurier (en supposant une concentration maximale de méthyleugénol de 0,001 %, autorisée selon la Liste critique des ingrédients des cosmétiques), 3 % d’essences de jasmin, 1 % de Lilial Quantité de produit : 11 g (adultes et 14–18 ans); 10,9 (9–13 ans et 4–8 ans); 6,7 g (2–3 ans); 5,4 g (1 an); 4,9 g (6–11 mois); 4,5 g (0–5 mois) (Loretz et al., 2006; Ficheux et al., 2016; Garcia-Hidalgo et al., 2017) Fréquence : 1,4 (adultes); 1,2 (14–18 ans, 2–3 ans, 1 an, 6–11 mois, et 0–5 mois); 1 (9–13 ans et 4–8 ans) (Loretz et al., 2006; Ficheux et al., 2015). Une fréquence de 1 a été assignée aux fréquences inférieures à 1. L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Colorants capillaires permanents (Lilial) |
Concentration : 1 % de Lilial Quantité de produit : 132,6 g (adultes et 14–18 ans) (Ramirez-Martinez et al., (2015) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Colorants capillaires temporaires (essences de jasmin, Lilial) |
Concentration : 0,1 % d’essences de jasmin, 0,11 % de Lilial Quantité de produit : 35 g (adultes, 14–18 ans, 9–13 ans, et 4–8 ans) (SCCS, 2015) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Produits coiffants en aérosol (essences de jasmin) |
Concentration : 0,1 % d’essences de jasmin Quantité de produit : 2,6 g (adultes) (Loretz et al., 2008); 2,3 g (14–18 ans, 9–13 ans, et 4–8 ans) (Ficheux et al., 2016) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel L’exposition par inhalation à la quantité pulvérisée a été quantifiée à l’aide du modèle « exposition-pulvérisation, avec pulvérisation vers la personne exposée », et les paramètres suivants : Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Produits de défrisage, d’ondulation et de bouclage des cheveux (Lilial) |
Concentration : 11 % de Lilial Quantité de produit : 80 g (adultes et 14–18 ans) (Bremmer et al., 2006), 76 g (9–13 ans) (ajustement SA), 66 g (4–8 ans) (ajustement SA) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Produits dépilatoires (Lilial) |
Concentration : 0,1 % de Lilial Quantité de produit : 9,7 g (adultes, 14–18 ans et 9–13 ans); les valeurs pour un masque facial ont été utilisées comme données de substitution, et la quantité a été ajustée en fonction de la superficie (Ficheux et al., 2016). L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de rétention * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Écrans solaires (PSN) (essences de jasmin, Lilial) |
Concentration : 0,07 % d’essences de jasmin, 0,01 % de Lilial Quantité de produit : 18,2 g (adultes et 14–18 ans); 6,3 g (9–13 ans et 4–8 ans); 5,4 g (2–3 ans, 1 an et 6–11 mois) (Ficheux et al., 2016) L’exposition par inhalation d’essences de jasmin et de Lilial n’a pas été quantifiée, car le produit est censé être utilisé à l’extérieur. L’exposition par inhalation devrait donc être minime. L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel |
| Produits de maquillage liquides pour le visage (Lilial) |
Concentration : 1 % de Lilial Quantité de produit : 0,54 g (adultes) (Loretz et al., 2016); 0,41 g (14–18 ans) (Ficheux et al., 2016); 0,39 g (9–13 ans) (ajustement SA); 0,34 g (ajustement SA) Fréquence : fréquence minimale présumée de 1 L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Vernis à ongles (Lilial) |
Concentration : 3 % de Lilial Quantité de produit : 0,16 g (adultes,14–18 ans et 9–13 ans); 0,06 g (4–8 ans et 2–3 ans) (Ficheux et al., 2014) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Dissolvants pour vernis à ongles (Lilial) |
Concentration : 0,1 % de Lilial Quantité de produit : 2,25 g (adultes,14–18 ans et 9–13 ans); 0,76 g (4–8 ans et 2–3 ans) (Ficheux et al., 2014) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg) |
| Produits autobronzants pour le visage (lotion) (Lilial) |
Concentration : 1 % de Lilial Quantité de produit : 1,5 g (adultes et 1–18 ans) (Ficheux et al., 2016) L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Assainisseur d’air (gel solide) (Lilial) |
Concentration : 5 % de Lilial (SDS 2016) Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-surface à libération instantanée ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel |
| Assainisseur d’air (liquide, à brancher) (sous-groupe 2) |
Concentration : 3 % de Lilial (SDS 2017a), 1 % de myrac-aldéhyde (SDS 2020) Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-libération constante ». Quantité de produit : 0,5 g/j (d’après un contenant d’environ 26 g et 50 jours d’utilisation, en supposant une masse volumique de 1 g/mL)) Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel |
| Scénario d’exposition | Hypothèses |
|---|---|
| Mélange, chargement et application d’un nettoyant tout usage pour les planchers (liquides) (adultes) (essences de jasmin, Lilial) |
Concentration : 1 % d’essences de jasmin (ACI, 2018), 1 % de Lilial Mélange et chargement (exposition cutanée) Application (voie cutanée) Exposition totale par voie cutanée : mélange et chargement + application Mélange et chargement (inhalation) Application (inhalation) Concentration dans l’air (moyenne pondérée dans le temps) = {[concentration moyenne par événement (mélange/chargement) (mg/m³) * 0,75 min] + [concentration moyenne par événement (application) (mg/m³) * 240 min]} ÷ [total time 240,75 min / (24 h * 60 min)] Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition totale par voie cutanée (mg/kg p.c./j) + exposition totale par inhalation (mg/kg p.c./j) |
| Exposition due au contact avec les planchers nettoyés (tout-petits) (essences de jasmin, Lilial) |
Concentration : 1 % d’essences de jasmin (ACI, 2018), 1 % de Lilial Les calculs sont basés sur le document Residential SOPs de l’EPA (2012b), section 7. Voie cutanée Résidu déposé (mg/cm²) : calculé en partant de l’hypothèse de 14 g de produit pour 22 m² de sol (fiche de renseignements de ConsExpo (RIVM, 2018) sur les produits de nettoyage) * 1 000 mg/g * 1 m²/10 000 cm² Exposition fortuite par voie orale (c’est-à-dire exposition par contact main-bouche) RM : charge de résidus dans les mains (mg/cm²); calculée à l’aide de la formule suivante : Fpamains = 0,15 (sans unité); fraction du principe actif sur les mains par rapport au résidu total de surface selon une étude sur le jazzercise FM : 0,13 (sans unité); fraction d’utilisation de la main Exposition combinée = exposition cutanée + exposition par inhalation + exposition fortuite par voie orale |
| Mélange, chargement et application d’un nettoyant tout usage (aérosol) (adultes) (essences de jasmin) |
Concentration : 1 % d’essences de jasmin (ACI, 2018) Inhalation-exposition à la pulvérisation-pulvérisation L’inhalation lors de l’application à rincer et de l’essuyage devrait être minime, en raison de la faible pression de vapeur des essences de jasmin. Essuyage (voie cutanée) Exposition combinée totale : inhalation lors de l’application + voie cutanée lors de l’application + voie cutanée lors du nettoyage |
| Mélange et chargement d’un détergent liquide pour le lavage du linge à la main, et suspension des vêtements lavés à la main (adultes) (Lilial) |
Concentration : 1 % de Lilial Mélange et chargement (exposition cutanée) Lavage (voie cutanée) Suspension du linge (voie cutanée) : 80,08 mg [valeur calculée selon une épaisseur de couche présumée de 8,8 mg/mL (concentration d’un détergent liquide régulier dans l’eau de lavage) * 910 cm² (superficie des mains) * 0,01 cm] Exposition totale par voie cutanée (mg/kg p.c./j) = [voie cutanée (mélange/chargement) (mg) + voie cutanée (lavage) (mg) + voie cutanée (suspension) (mg)] * absorption cutanée/poids corporel Mélange et chargement (exposition par inhalation) Lavage (exposition par inhalation) Suspension du linge (exposition par inhalation) Concentration dans l’air (moyenne pondérée sur 24 heures) = {[concentration moyenne dans l’air – mélange et chargement (mg/m³) * durée (0,75 min)] + [concentration moyenne dans l’air – lavage (mg/m³) * durée (10 min)] + [concentration moyenne dans l’air – suspension (mg/m³) * durée (240 min)]} / {[durée totale (250,75 min)] * [250,75 min * (24 h/60 min)]} Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air, moyenne pondérée sur 24 heures(mg/m³) * dose journalière inhalée (m³/j)] / poids corporel (kg) Exposition combinée totale (mg/kg p.c./j) = exposition totale par voie cutanée (mg/kg p.c./j) + exposition totale par inhalation (mg/kg p.c./j) |
| Mélange et chargement d’un liquide pour le lavage à la machine, la suspension du linge lavé à la machine et migration depuis les vêtements lavés (adultes) (essences de jasmin) |
Concentration : 5 % d’essences de jasmin (ACI, 2018) Mélange et chargement (exposition cutanée) Suspension de la lessive (voie cutanée) Mélange et chargement (exposition par inhalation) Suspension du linge (exposition par inhalation) Concentration dans l’air (moyenne pondérée sur 24 heures) = {[concentration moyenne dans l’air – mélange et chargement (mg/m³) * durée (0,75 min)] + [concentration moyenne dans l’air – suspension (mg/m³) * durée (240 min)]} / {[durée totale (250,75 min)] * [250,75 min * (24 h/60 min)]} Exposition par inhalation (mg/kg p.c./j) = (concentration dans l’air, moyenne pondérée sur 24 heures(mg/m³) * dose journalière inhalée (m³/j) / poids corporel (kg) Migration depuis les vêtements lavés à la machine (exposition cutanée) Fraction pondérale du produit sur le tissu : 7,6 x 10-4 (détergent liquide régulier) (RIVM, 2018) Exposition totale par voie cutanée = exposition cutanée due au mélange et au chargement + exposition cutanée due à la suspension des vêtements lavés + migration cutanée depuis les vêtements Exposition combinée totale (mg/kg p.c./j) = exposition totale par voie cutanée (mg/kg p.c./j) + exposition totale par inhalation (mg/kg p.c./j) |
| Migration depuis les vêtements lavés (tous les sous-groupes de la population sauf les adultes) (voir ci-dessus) (essences de jasmin) |
Concentration : 5 % d’essences de jasmin (ACI, 2018) Migration depuis les vêtements lavés à la machine (voie cutanée) : Fraction pondérale du produit sur le tissu : 7,6 x 10-4 (détergent liquide régulier) (RIVM, 2018) Exposition fortuite par voie orale (mise à la bouche de tissus lavés) (1–2 ans seulement) Résidus à la surface (mg/cm²) : voir le calcul ci-dessus Exposition combinée (1–2 ans seulement) = migration des vêtements lavés à la peau + exposition fortuite par voie orale, mise à la bouche des vêtements ou des tissus lavés |
| Nettoyant de cuvette de toilette (adultes) (Lilial) |
Concentration : 1 % de Lilial Application (voie cutanée) Exposition cutanée (mg/kg p.c./j) = [quantité de produit (mg) * absorption cutanée] / poids corporel Application (inhalation) Exposition par inhalation (mg/kg p.c./j) : [concentration journalière dans l’air (mg/m³) * dose journalière inhalée (m³/j)] / poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Désodorisant pour tapis (adultes) (Lilial) |
Concentration : 1 % de Lilial Produit évalué comme nettoyant à tapis Application (voie cutanée) Exposition cutanée (mg/kg p.c./j) = [quantité de produit (mg) * absorption cutanée] / poids corporel Inhalation Exposition par inhalation (mg/kg p.c./j) = [concentration journalière dans l’air (mg/m³) * dose journalière inhalée (m³/j)] / poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) |
| Exposition par contact avec le tapis nettoyé (désodorisant pour tapis) (tout‑petits) (Lilial) |
Concentration : 1 % de Lilial Les calculs sont basés sur le document Residential SOPs de l’US EPA (2012b), section 7. Exposition cutanée Résidus déposés (mg/cm²) : valeur calculée en supposant l’application de 2 200 g de produit sur 22 m² de plancher * 10 % pour tenir compte du passage à l’aspirateur (ConsExpo Cleaning Fact Sheet, RIVM, 2018) * 1 000 mg/g * 1 m²/10 000 cm² Exposition fortuite par voie orale (c’est-à-dire exposition par contact main-bouche) RM : charge de résidus dans les mains (mg/cm²); calculée à l’aide de la formule suivante : Fpamains = 0,15 (sans unité); fraction du principe actif sur les mains par rapport au résidu total de surface selon une étude sur le jazzercise FM : 0,13 (sans unité); fraction d’utilisation de la main Exposition combinée = exposition cutanée + exposition par inhalation + exposition fortuite par voie orale Exposition combinée = exposition cutanée + exposition fortuite par voie orale + exposition par inhalation (valeur calculée d’après la concentration dans l’air après l’application du produit) |
Annexe B. Paramètres d’estimation de l’exposition par voie cutanée et par inhalation aux produits faits soi-même
| Scénario d’exposition | Hypothèses |
|---|---|
| Diffuseurs aromatiques (essences de violette, essences de feuille de laurier, essences d’estragon, essences de jasmin) |
Concentration : 100 % d’essences de violette,100 % d’essences de feuille de laurier, 100 % d’essences d’estragon, 100 % d’essences de jasmin La quantité de produit pour évaluer l’exposition cutanée est d’environ 2 gouttes d’huile essentielle (jugement professionnel), ajoutées au dispositif fixe (1 goutte équivaut à 0,05 mL) * masse volumique de l’essence Les concentrations atmosphériques ont été modélisées à l’aide du modèle « évaporation-libération constante » (RIVM, 2021b). Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j) * fréquence (365 fois/365 (an))] ÷ poids corporel Pour les essences de feuille de laurier et les essences d’estragon, les valeurs DJMDV ont également été calculées selon la formule suivante (SC, 2013) : DJMDV (mg/kg p.c./j) = ((exposition (mg/kg p.c./j) 0–5 mois * durée du stade de vie (0,5 an)) + (exposition (mg/kg p.c./j) 6–12 mois * durée du stade de vie (0,5 an)) + (exposition (mg/kg p.c./j) 1 an * durée du stade de vie (1 an)) + (exposition (mg/kg p.c./j) 2–3 ans * durée du stade de vie (2 ans)) + (exposition (mg/kg p.c./j) 4–8 ans * durée du stade de vie (5 ans)) + (exposition (mg/kg p.c./j 9–13 ans * durée du stade de vie (5 ans)) + (exposition (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)) + (exposition (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)) / durée de vie moyenne (78 ans) |
| Huiles de massage faites soi-même (essences de feuille de laurier, essences d’estragon, essences de jasmin) |
Concentration : 3 % d’essences de feuille de laurier, 3 % d’essences d’estragon, 3 % d’essences de jasmin Quantité de produit : 3,2 g (adultes); 2,9 g (14–18 ans); 2,3 g (9–13 ans); 1,9 g (4–8 ans); 1,8 g (2–3 ans, 1 an, 6–11 mois, 0–5 mois) (Ficheux et al., 2016) Fréquence : essences de jasmin, 1 pour tous les sous‑groupes de la population. L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j) * fréquence (comme ci-dessus, pour le calcul de la DJMDV seulement)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Pour les essences de feuille de laurier et les essences d’estragon, les valeurs DJMDV ont également été calculées selon la formule suivante (SC, 2013) : DJMDV (mg/kg p.c./j) = ((exposition combinée (mg/kg p.c./j) 0–5 mois * durée du stade de vie (0,5 an)) + (exposition combinée (mg/kg p.c./j) 6–12 mois * durée du stade de vie (0,5 an)) + (exposition combinée (mg/kg p.c./j) 1 an * durée du stade de vie (1 an)) + (exposition combinée (mg/kg p.c./j) 2–3 ans * durée du stade de vie (2 ans)) + (exposition combinée (mg/kg p.c./j) 4–8 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j 9–13 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)) + (exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)) / durée de vie moyenne (78 ans) |
| Huiles faites soi-même pour le bain (essences de violette, essences de feuille de laurier, essences d’estragon, essences de jasmin) |
Concentration : 100 % d’essences de violette, 100 % d’essences de feuille de laurier, 100 % d’essences d’estragon, 100 % d’essences de jasmin La quantité de produit est basée sur environ 10 gouttes d’huiles essentielles pures ajoutées à un bain rempli de 120 L d’eau (1 goutte équivaut à 0,05 mL), multipliée par la masse volumique de l’essence (RIVM, 2006). La quantité de produit déposée sur la peau a été calculée d’après une épaisseur présumée de la couche, dans laquelle le volume d’eau qui entre en contact avec la peau est égal à la superficie du corps entier, sauf la tête, multipliée par l’épaisseur de la couche liquide sur la peau (0,01 cm; ECHA 2015). Fréquence : 0,29 (tous les sous-groupes de la population) (calcul de la DJMDV seulement) (Bremmer et al., 2006) Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j) * fréquence (calcul de la DJMDV seulement)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Pour les essences de feuille de laurier et les essences d’estragon, on a également calculé une DJMDV selon la formule suivante (SC, 2013) : DJMDV (mg/kg p.c./j) = {[exposition combinée (mg/kg p.c./j) 9–13 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)]} / durée de vie moyenne (78 ans) |
| Hydratants corporels faits soi-même (essences de violette, essences de feuille de laurier, essences d’estragon, essences de jasmin) |
Concentration : 3 % d’essences de violette, 3 % d’essences de feuille de laurier (en supposant la concentration maximale de 0,002 % de méthyleugénol autorisée selon la Liste critique des ingrédients des cosmétiques), 3 % d’essences d’estragon, 3 % d’essences de jasmin Quantité de produit : 10 g (adultes et 14–18 ans); 7,7 g (9–13 ans); 5 g (4–8 ans); 4,1 g (2–3 ans); 3,1 g (1 an); 2,5 g (6–11 mois); 2 g (0–5 mois) (Ficheux et al., 2016) Pour les essences de feuille de laurier, les essences d’estragon et les essences de jasmin, l’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit (g/application) * fréquence journalière moyenne * concentration de produit * absorption cutanée * facteur de conversion (1 000 mg/g)] ÷ poids corporel Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-évaporation-surface de libération constante ». Exposition par inhalation (mg/kg p.c./j) = [concentration dans l’air (mg/m³) (moyenne pondérée sur 24 h) * dose inhalée (m³/j) * fréquence (calcul de la DJMDV seulement)] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Pour les essences de feuille de laurier et les essences d’estragon, la DJMDV a également été calculée selon la formule suivante (SC, 2013) : DJMDV (mg/kg p.c./j) = {[exposition combinée (mg/kg p.c./j) 0–5 mois * durée du stade de vie (0,5 an)] + [exposition combinée (mg/kg p.c./j) 6–12 mois * durée du stade de vie (0,5 an)] + [exposition combinée (mg/kg p.c./j) 1 an * durée du stade de vie (1 an)] + [exposition combinée (mg/kg p.c./j) 2–3 ans * durée du stade de vie (2 ans)] + [exposition combinée (mg/kg p.c./j) 4–8 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j 9–13 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) 14–18 ans * durée du stade de vie (5 ans)] + [exposition combinée (mg/kg p.c./j) adulte (19 ans et +) * durée du stade de vie (59 ans)]} / durée de vie moyenne (78 ans) |
| Brumisateurs faciaux (essences de violette, essences de jasmin) |
Concentration : 100 % d’essences de violette, 100 % d’essences de jasmin La quantité de produit représente environ 10 gouttes d’huile essentielle ajoutées au dispositif stationnaire (1 goutte équivaut à 0,05 mL) * masse volumique (RIVM, 2006; SC, 2015). Fréquence : on présume que la fréquence est de 1 (adultes, 14–18 ans, 9–13 ans, 4–8 ans) Les concentrations atmosphériques ont été modélisées à l’aide du modèle de ConsExpo « exposition à la vapeur-libération constante ». On suppose que 50 % de la concentration moyenne par événement sera inhalé, et que la personne sera exposée par voie cutanée à 50 % de la concentration moyenne par événement. Pour l’exposition par inhalation, après 20 minutes de brumisation faciale, on suppose que la personne demeure dans une pièce de 20 m³ pendant 3 heures et 40 minutes. On suppose également qu’un enfant de 1 an est présent dans la pièce pendant 4 heures. Exposition par inhalation pendant 20 min (mg/kg p.c./j) = {concentration moyenne par événement (mg/m³) * 0,5 * [dose inhalée (m³/j) * durée d’exposition (20 min) ÷ (60*24)]* volume de la pièce} ÷ poids corporel Quantité de produit sur la peau : concentration moyenne par événement (mg/m³) * volume de la pièce (1 m³) * 0,5 L’exposition cutanée (mg/kg p.c./j) a été calculée selon la formule suivante : [quantité moyenne de produit dans l’air (mg/application) * fréquence journalière moyenne * absorption cutanée] ÷ poids corporel Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j) Exposition secondaire par inhalation pendant 3 heures et 40 minutes : Quantité totale inhalée pendant 20 min (mg) = concentration moyenne par événement (mg/m³) * 0,5 * air inhalé en 20 min (m³) Exposition des non-utilisateurs (enfants de 1 an seulement) par inhalation (mg/kg p.c./j) = quantité de produit dans l’air après 20 min de diffusion dans la pièce de 20 m³ (mg/m³) * dose inhalée (m³/j) * [220 min ÷ (60 min/h * 24 h/j)] ÷ poids corporel |