Archivée - Détection d’E. coli O157 et non-O157

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 44-11 : Infections liées aux soins de santé et résistance aux antimicrobiens
Date de publication : 1er novembre 2018
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 44-11, le 1er novembre 2018 : Infections liées aux soins de santé et résistance aux antimicrobiens
Orientation
Recommandations du Réseau des laboratoires de santé publique du Canada (RLSPC) pour la détection en laboratoire d’Escherichia coli producteurs de Shiga-toxines (O157 et non-O157)
L Chui1, S Christianson2, DC Alexander3, V Arseneau4, S Bekal5, B Berenger1, Y Chen6, R Davidson7, DJ Farrell8, GJ German4, L Gilbert9, LMN Hoang10, RP Johnson2, A MacKeen11, A Maki6, C Nadon2, E Nickerson12, A Peralta6, SM Radons Arneson11, Y Yu6, K Ziebell2 au nom du Réseau des laboratoires de santé publique du Canada (RLSPC)
Affiliations
1 Provincial Laboratory for Public Health, Alberta Public Laboratories (Alberta)
2 Laboratoire national de microbiologie (Manitoba et Ontario)
3 Cadham Provincial Laboratory (Manitoba)
4 Santé Île-du-Prince-Édouard (Île-du-Prince-Édouard)
5 Laboratoire de santé publique du Québec (Québec)
6 Santé publique Ontario (Ontario)
7 Centre des sciences de la santé Queen Elizabeth II (Nouvelle-Écosse)
8 Roy Romanow Provincial Laboratory (Saskatchewan)
9 Provincial Public Health and Microbiology Laboratory, Eastern Health (Terre-Neuve-et-Labrador)
10 BC Centre for Disease Control Public Health Laboratory (Colombie-Britannique)
11 Réseau des laboratoires de santé publique du Canada (Manitoba)
12 The New Brunswick Enteric Reference Centre (Nouveau-Brunswick)
Correspondance
Citation proposée
Chui L, Christianson S, Alexander DC, Arseneau V, Bekal S, Berenger B, Davidson R, Farrell DJ, German GJ, Gilbert L, Hoang LMN, Johnson RP, MacKeen A, Maki A, Nadon C, Nickerson E, Peralta A, Radons Arneson SM, Yu Y, Ziebell K, au nom du Réseau des laboratoires de santé publique du Canada (RLSPC). Recommandations du Réseau des laboratoires de santé publique du Canada (RLSPC) pour la détection en laboratoire d’Escherichia coli producteurs de Shiga‑toxines (O157 et non‑O157). Relevé des maladies transmissibles au Canada 2018;44(11):268-72. https://doi.org/10.14745/ccdr.v44i11a06f
Mots-clés : recommandations pour les analyses de laboratoire, Escherichia coli producteur de Shiga‑toxines, STEC O157, STEC non‑O157, tests diagnostiques sans culture, tests d’amplification des acides nucléiques (TAAN), dosage immuno‑enzymatique, milieu de culture chromogène
Résumé
Les Escherichia coli producteurs de Shiga‑toxines (STEC) sont d’importants agents pathogènes entériques qui sont à l’origine de cas sporadiques et d’éclosions de gastro-entérite. Les souches E. coli O157:H7/NM (STEC O157) sont les sérotypes de STEC les plus connus, mais il devient de plus en plus évident que les sérotypes de STEC non‑O157 ont été sous-déclarés par le passé, car ils n’étaient pas ciblés par les analyses de dépistages courantes de la plupart des laboratoires de première ligne. Le Réseau des laboratoires de santé publique du Canada (RLSPC) estime que la détection et la surveillance des sérotypes de STEC non‑O157 doivent être améliorées, et a donc élaboré les recommandations suivantes afin de faciliter le processus décisionnel des laboratoires de microbiologie cliniques et de référence. Ces recommandations devraient être suivies par les laboratoires, au mieux de leurs capacités, en fonction de la technologie et des ressources dont ils disposent.
Le RLSPC recommande aux laboratoires de première ligne d’utiliser un milieu de culture chromogène ou de réaliser un test diagnostique sans culture (TDSC) lors du dépistage d’agents infectieux responsables d’une gastro-entérite bactérienne effectué à partir d’un échantillon de selles. Parmi les TDSC possibles, on compte les tests d’amplification des acides nucléiques (TAAN), qui permettent de détecter les gènes des Shiga‑toxines, ou les dosages immuno-enzymatiques, qui détectent les Shiga‑toxines. Si l’un ou l’autre TDSC produit des résultats positifs indiquant la présence possible de STEC, les laboratoires doivent disposer de méthodes pour mettre en culture et isoler les STEC, afin d’appuyer les activités de surveillance à l’échelle nationale et provinciale ainsi que les enquêtes et les interventions en matière d’éclosion. Les recommandations du RLSPC devraient améliorer le dépistage de STEC chez les patients présentant une diarrhée, en particulier lorsqu’elle est attribuable à des sérotypes non‑O157. Ces mesures devraient également améliorer la qualité globale des soins de santé ainsi que la salubrité des aliments, et mieux protéger le public grâce à des stratégies de surveillance, de détection des éclosions et d’intervention plus efficaces.
Introduction
La bactérie Escherichia coli est naturellement présente dans la flore intestinale. Toutefois, les sérotypes d’Escherichia coli producteurs de Shiga‑toxines (STEC) sont des agents pathogènes intestinaux. Bien qu’ils ne causent généralement que des symptômes spontanément résolutifs de diarrhée et de douleur abdominale, ils peuvent dans de rares cas entraîner des séquelles graves et potentiellement mortelles, comme un syndrome hémolytique et urémique Note de bas de page 1.
Les sérotypes d’E. coli O157:H7/NM (STEC O157) sont les agents le plus souvent responsables des infections chez l’être humain. Toutefois, de nombreux sérotypes de STEC non‑O157 ont été associés à des cas graves de gastro-entérite ainsi qu’à des éclosions importantes Note de bas de page 2. En effet, on a observé en 2011 une éclosion d’E. coli O104:H4 en Europe Note de bas de page 3. En 2016, on a également signalé une éclosion de STEC O121 liée à de la farine au Canada et aux États-Unis Note de bas de page 4. Ces éclosions récentes de sérotypes non‑O157 ont souligné l’importance clinique de mettre en place des mesures opportunes et fiables de détection et de surveillance de ces organismes Note de bas de page 5Note de bas de page 6Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10.
En 2016, 642 cas d’infection à STEC ont été rapportés dans le cadre du Programme national de surveillance des maladies entériques (PNSME); environ 35 % des cas étaient attribuables à des sérotypes de STEC non‑O157 Note de bas de page 11. Au Canada, il est probable que les données actuelles concernant les infections à STEC non‑O157 soient sous-estimées, car les tests de dépistage couramment utilisés par de nombreux laboratoires ne ciblent pas ces sérotypes Note de bas de page 11Note de bas de page 12. Plusieurs raisons expliquent ce problème. Il est facile de déceler les STEC O157 en utilisant un milieu de culture différentiel et sélectif comme une gélose MacConkey-sorbitol ou un milieu de culture chromogène O157. Toutefois, contrairement aux STEC 0157, les STEC non‑O157 ne possèdent pas les caractéristiques phénotypiques qui permettent de les distinguer aisément d’une bactérie E. coli de type générique et, par conséquent, ils sont difficiles à isoler dans un milieu de culture.
Détection des sous-types de STEC non-O157
L’amélioration de la capacité des laboratoires à identifier les STEC non‑O157 repose sur l’utilisation de milieux de culture chromogènes ou sélectifs et de tests diagnostiques sans culture (TDSC). Les deux TDSC les plus fréquemment utilisés sont les tests d’amplification des acides nucléiques (TAAN), qui permettent de détecter les gènes des Shiga‑toxines, et les dosages immuno-enzymatiques, qui détectent les Shiga‑toxines. Les TDSC les moins courants comprennent la détection des Shiga‑toxines par un test de cytotoxicité à partir d’une culture de cellules ou fondé sur la méthode d’agglutination passive au latex, et l’isolement des sérogroupes choisis par capture de l’antigène O au moyen de billes immunomagnétiques. Cependant, ces méthodes sont difficiles à appliquer par la plupart des laboratoires de microbiologie de première ligne. Non seulement il est important d’identifier le sous-type de STEC, mais il est également essentiel d’obtenir des isolats afin d’effectuer une caractérisation plus poussée (p. ex. sérotype, génotype moléculaire et séquençage du génome entier).
Chaque méthode de dépistage a ses avantages et ses inconvénients. Par exemple, les géloses chromogènes ont une sensibilité supérieure à 85 % Note de bas de page 13. Elles sont moins coûteuses que les autres méthodes, et il est facile pour les laboratoires de les intégrer à leur processus d’analyse en les substituant aux plaques spécifiques de O157 actuellement utilisées. Ces géloses peuvent toutefois inhiber certains sérotypes de STEC Note de bas de page 14. Quant au dosage immuno-enzymatique des Shiga‑toxines, il existe des micropuits et des dispositifs à écoulement latéral pouvant être utilisés à cette fin. La sensibilité du dosage immuno-enzymatique est inférieure à celle des méthodes d’analyse directe des selles; toutefois, l’utilisation durant la nuit d’un bouillon d’enrichissement MacConkey Note de bas de page 15 ou d’un autre bouillon approprié permettrait d’atteindre une sensibilité comparable à celle des TAAN Note de bas de page 13Note de bas de page 16. Les TAAN maison et commerciaux ont une sensibilité équivalente, et il s’agit des méthodes les plus sensibles qui existent actuellement Note de bas de page 15Note de bas de page 17. De nombreux TAAN peuvent être effectués directement à partir d’échantillons de selles Note de bas de page 18, ce qui améliore le délai d’exécution comparativement aux cultures et aux dosages immuno-enzymatiques. Les TAAN multiplex ont l’avantage supplémentaire de déceler plusieurs agents pathogènes simultanément. Les méthodes de dosage immuno-enzymatique et les TAAN permettent de distinguer les Shiga‑toxines et les gènes des Shiga‑toxines, respectivement, de tout autre sérotype de STEC. Cependant, ces analyses sont plus coûteuses que les géloses. Les TAAN exigent également de se procurer de l’équipement supplémentaire, de désigner un endroit pour la configuration moléculaire et d’offrir aux membres du personnel une formation spécialisée, ce qui peut être difficilement applicable pour bon nombre de laboratoires de première ligne.
Répercussions sur la santé publique
L’isolement et le sous-typage plus poussé des souches de STEC permettent de les comparer afin de cibler les éclosions ainsi que les sources potentielles d’infection. Une fois que la source soupçonnée d’une éclosion est établie, les activités de suivi et de prise en charge mises en place par les organismes de santé publique permettent de prévenir la propagation de l’agent infectieux et de sensibiliser le public à son égard.
Les recommandations suivantes visent à déterminer les tests et analyses à intégrer aux méthodes d’analyse utilisées par un laboratoire pour détecter et confirmer la présence de STEC dans un échantillon de selles, et pour obtenir des isolats positifs à des fins de caractérisation plus poussée.
Recommandations
Le Réseau des laboratoires de santé publique du Canada (RLSPC) recommande aux laboratoires de première ligne effectuant des tests de dépistage des agents infectieux responsables d’une gastro-entérite bactérienne d’utiliser au moins une des trois options suivantes pour le dépistage de STEC : TAAN, culture dans une gélose sélective ou dosage immuno-enzymatique avec utilisation d’un bouillon d’enrichissement (Figure 1). Les échantillons de selles utilisés aux fins de la détection des STEC doivent satisfaire aux lignes directrices locales en matière de présentation et d’analyse. Les laboratoires qui utilisent une gélose chromogène comme principale méthode de détection peuvent envisager l’adoption d’une méthode de dosage immuno-enzymatique avec bouillon d’enrichissement ou la réalisation d’un TAAN dans les cas où l’on soupçonne fortement la présence d’une infection à STEC, quand les résultats de la culture en milieu chromogène sont négatifs.
Si des TDSC sont utilisés pour le dépistage de STEC, il est toujours recommandé d’obtenir des isolats à des fins de caractérisation plus poussée lorsque des Shiga‑toxines et des gènes de Shiga‑toxines sont identifiés. Les recommandations du RLSPC en matière de cultures figurent dans l’article de Berenger et de ses collaborateurs Note de bas de page 19. Il est essentiel que les laboratoires de première ligne communiquent avec le laboratoire de santé publique de référence de leur région pour déterminer la marche à suivre pour la mise en culture, l’isolement et la caractérisation des isolats avant la présentation des échantillons.
Figure 1 : Recommandations pour la détection d’Escherichia coli producteurs de Shiga-toxines dans des échantillons de selles
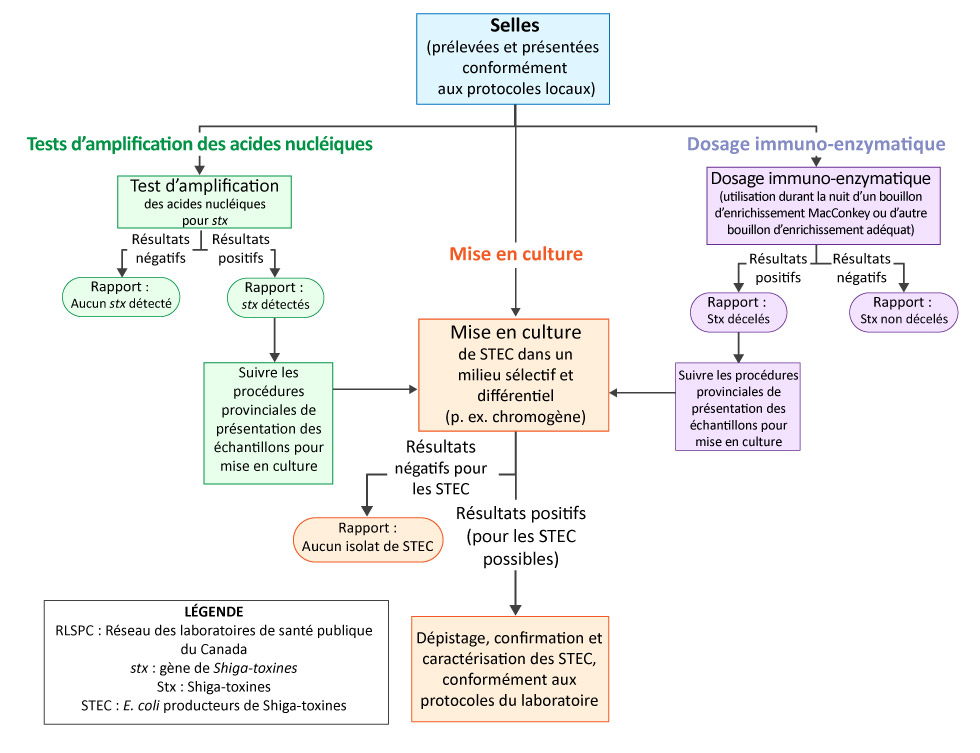
Description textuelle : Figure 1
Figure 1 : Recommandations pour la détection d’Escherichia coli producteurs de Shiga‑toxines dans des échantillons de selles
Ceci est un diagramme illustrant les processus recommandés pour la détection en laboratoire d’Escherichia coli producteurs de Shiga‑toxines dans les échantillons de selles. Trois processus sont illustrés : tests d’amplification des acides nucléiques, dosage immuno-enzymatique et mise en culture.
La branche intitulée Tests d'amplification des acides nucléiques pour la détection du gène de la shigatoxine montre que, pour les tests d'acides nucléiques négatifs pour le gène de la toxine Shiga, un rapport doit être complété et aucune autre action n'est requise au laboratoire. Pour les tests d’acides nucléiques positifs, le rapport devrait indiquer qu’aucune Shiga‑toxine n’a été dépistée et l’étape suivante est de suivre les procédures provinciales pour la soumission de cultures. Le processus pour les cultures est abordé plus loin dans cette description textuelle.
Le processus du dosage immuno-enzymatique pour la détection de s Shiga‑toxine est la suivante. Le dosage immuno-enzymatique est effectué en utilisant un bouillon d’enrichissement MacConkey durant la nuit ou un autre bouillon adéquat. Lorsque les résultats des tests immunologiques sont négatifs pour les Shiga‑toxines , un rapport doit être rempli et aucune autre action n'est requise au laboratoire. Pour les dosages immuno-enzymatiques positifs, le rapport devrait noter que la Shiga‑toxines a été dépistée et l'étape suivante consiste à suivre les procédures provinciales pour les soumissions de cultures.
Le processus de culture peut être suivi à la suite des tests d’amplification des acides nucléiques négatifs ou des dosages immuno-enzymatiques positifs. Si la culture est négative pour les Escherichia coli producteurs de Shiga‑toxines ( Shiga toxin-producing Escherichia Coli [STEC]), un rapport doit être complété et aucune autre action n'est requise au laboratoire. Si la culture est positive, indiquant une STEC possible, le protocole du laboratoire devrait être suivi pour la détection, la confirmation et la caractérisation de STEC.
Discussion
Pour diagnostiquer avec précision tous les cas de gastro-entérite liés aux STEC pouvant mener à une éclosion et nuire à la santé publique, il est important d’identifier tant les sérotypes O157 que les sérotypes non‑O157. À cette fin, le dépistage doit être effectué au moyen d’une culture ou d’un TDSC (TAAN ou dosage immuno-enzymatique). Si les résultats du TDSC sont positifs, une mise en culture doit être réalisée pour confirmer la présence de STEC et caractériser l’organisme en cause.
Les laboratoires devraient suivre les recommandations du RLSPC, au mieux de leurs capacités, en fonction de la technologie et des ressources dont ils disposent. Il faut souligner qu’en cas de présence confirmée de STEC, il est primordial de mettre l’organisme en culture à des fins de caractérisation plus poussée (typage et sous-typage). En cas d’éclosion, cela permet également d’intervenir de façon plus efficace et de soutenir les programmes de surveillance, dont PulseNet Canada et le Programme de surveillance des maladies entériques.
Le rôle des laboratoires provinciaux et fédéraux consiste à appuyer les laboratoires de première ligne dans la réalisation de tests de confirmation, au besoin, ainsi que dans le sérotypage et la prestation d’autres services offerts par des laboratoires de référence en lien avec les isolats de STEC. Ces laboratoires doivent également favoriser la mise en place de nouveaux algorithmes d’analyse pour STEC non‑O157. Le réseau de laboratoires de santé publique varie d’une province à l’autre. Par conséquent, tout changement dans les protocoles des laboratoires de santé publique pouvant avoir une incidence sur la capacité des laboratoires de première ligne à suivre ces recommandations doit être abordé avec les laboratoires de première ligne et les autres intervenants avant d’être instauré.
Conclusion
Le respect de ces recommandations du RLSPC devrait améliorer la détection de STEC chez les patients qui présentent une diarrhée, en particulier lorsqu’elle est attribuable aux sérotypes non‑O157. Ces mesures devraient également permettre d’améliorer la qualité globale des soins de santé ainsi que la salubrité des aliments, et mieux protéger le public grâce à des stratégies de surveillance, de détection des éclosions et d’intervention plus efficaces.
Déclaration des auteurs
Tous les auteurs sont membres du groupe de travail sur les sérotypes d’Escherichia coli producteurs de Shiga‑toxines du Réseau des laboratoires de santé publique du Canada. Ce groupe était présidé par L Chui (coprésidente provinciale) et S Christianson (coprésidente fédérale).
Conflit d’intérêts
Aucun.
Remerciements
Les auteurs souhaitent remercier le Réseau des laboratoires de santé publique du Canada ainsi que les membres du conseil des directeurs de laboratoire et du secrétariat pour les conseils fournis lors de l’élaboration de ces recommandations.
Financement
Le financement du secrétariat du Réseau des laboratoires de santé publique du Canada est assuré par le Laboratoire national de microbiologie et par l’Agence de santé publique du Canada.