Archivée : Mise à jour sur l’évaluation rapide des risques : Influenza aviaire A(H5N1) de clade 2.3.4.4b chez le bétail, répercussions pour la santé publique au Canada
Télécharger en format PDF
(594 Ko, 11 pages)
Organisation : Agence de la santé publique du Canada
Date de publication : 2024-04-26
Date de cette évaluation : 19 avril 2024 (données en date du 11 avril 2024)
Sur cette page
- Raison de l'évaluation
- Questions sur le risque
- Énoncé de risque
- Mesures proposées pour les autorités de santé publique
- Annexe technique
- Annexe A : Remerciements
- Notes de bas de page
- Références
Raison de l'évaluation
Détection de l'influenza aviaire A(H5N1) de clade 2.3.4.4b chez les bovins et les chèvres aux États-Unis.
Questions sur le risque
1. Question relative au risque : Quelle est la probabilité et l'impact d'une infection humaine par l'influenza aviaire A(H5N1) de clade 2.3.4.4b attribuable à une exposition au bétail (p. ex. bovins, chèvres, porcs)Note de bas de page a au Canada au cours des trois prochains mois?
2. Autre question sur le risque futur : Comment la situation actuelle influe-t-elle sur les risques éventuels pour la santé publique au Canada?
Énoncé de risque
Pour l'ensemble de la population canadienne, la probabilité d'infection humaine par l'influenza aviaire A(H5N1) de clade 2.3.4.4b acquis par du bétail (p. ex. bovins, chèvres, porcs) au cours des trois prochains mois est très faible en raison de la très faible probabilité et du très faible niveau d'exposition au virus infectieux. Compte tenu du petit nombre de cas humains signalés à ce jour à l'échelle mondiale, malgré des expositions fréquentes à des contacts élevés pour certaines personnes, le virus semble avoir une capacité limitée d'infecter les humains. Par conséquent, la probabilité est tout au plus faible pour les personnes ayant une exposition plus fréquente à du bétail infectieux. Le niveau d'incertitude est élevé pour ces estimations en raison de la surveillance et des tests limités sur les espèces de mammifères, et des renseignements limités sur la proportion de bétail infecté, ainsi que de la nature de l'infection et de la dynamique de transmission chez ces espèces, et le potentiel de transmission de ce clade des mammifères infectés aux humains.
Il n'y a eu aucun changement dans l'ampleur estimée de l'impact par rapport à l'évaluation rapide des risques précédente sur les personnes infectées ou la population canadienne. Rien n'indique que le virus ait acquis la capacité de transmission soutenue entre humains.
Il demeure inconnu dans quelle mesure la situation actuelle influera sur le risque futur pour la santé publique au Canada. Cependant, la transmission continue des virus de l'influenza aviaire A(H5N1) de clade 2.3.4.4b chez les populations d'oiseaux sauvages et domestiques, ainsi que les déversements répétés dans les espèces de mammifères sauvages et domestiques, augmentent la probabilité d'un réassortiment ou d'une adaptation virale qui pourraient permettre une transmission durable chez les espèces de mammifères, notamment les humains, comme indiqué dans l'évaluation rapide des risques précédente et l'analyse du scénario de risque de pandémie. Les déversements sur le bétail augmentent les possibilités de changement génétique qui pourrait entraîner une adaptation du virus chez les hôtes mammifères, surtout si les infections sont légères ou asymptomatiques chez le bétail et qu'elles passent inaperçues et que les précautions prises contre l'infection sont minimes.
On soupçonne fortement que la transmission de ce clade se produit à l'échelle mondiale entre des mammifères ayant suffisamment de contacts, toutefois le degré de transmission n'est pas clair à l'heure actuelle. Le contact entre les porcs et tout animal infecté, notamment le bétail, peut accroître la probabilité de changements génétiques importants dans le virus, puisque les porcs sont reconnus comme étant un hôte pour de multiples virus de l'influenza A.Reference 1
Il est très difficile de prédire comment le virus évoluera, mais cette incertitude souligne l'importance des activités de surveillance et de préparation autant pour la santé humaine que la santé animale.
Mesures proposées à l'intention des autorités de santé publique et des partenaires une seule santé
La coordination conforme à l'approche Une seule santé sur cette question demeure essentielle. Les mesures proposées dans le cadre de l'évaluation rapide des risques précédente demeurent importantes. L'ASPC continuera de mobiliser les partenaires Une seule santé (organismes fédéraux, provinciaux, territoriaux et autres organismes non gouvernementaux) au pays et de collaborer avec des partenaires internationaux pour évaluer les risques pour la santé publique associés aux souches actuelles et futures de l'influenza aviaire A.
Les recommandations proposées ci-dessous sont fondées sur les lacunes en matière de connaissances cernées au cours de cette mise à jour.
Surveillance et établissement de rapports
- Poursuivre les efforts visant à améliorer et à intégrer davantage les activités de surveillance de l'influenza aviaire dans l'ensemble du spectre d'Une seule santé pour :
- surveiller les changements dans l'évolution des virus et dans son adaptation chez différentes espèces ainsi que la résistance aux antiviraux chez toute espèce de mammifères infectée;
- détecter rapidement et réagir à une infection humaine potentielle, en particulier chez les personnes exposées au bétail infecté; élaborer des protocoles a priori pour faciliter les enquêtes, notamment pour la fréquence sérologique;
- comprendre le risque d'infection dans les groupes de population humaine à une exposition au bétail, comme dans le cadre d'études séro-épidémiologiques chez les animaux et les humains.
Communication des risques
- Poursuivre la communication régulière sur l'influenza aviaire A(H5N1) de clade 2.3.4.4b avec le public et les personnes qui travaillent avec du bétail, notamment les personnes qui travaillent avec de la volaille et du bétail sur les lieux. Communiquer les lignes directrices du document La faune sauvage et la grippe aviaire : Conseils généraux sur la manipulation pour protéger votre santé.
- Continuer de sensibiliser les professionnels de la santé à la détection et à la prise en charge précoces de l'infection par le virus A(H5N1) de clade 2.3.4.4b chez les personnes qui présentent des signes ou des symptômes de maladie respiratoire aiguë ou de conjonctivite et qui ont des antécédents d'exposition pertinents. Diffuser les Orientations sur les problèmes de santé humaine liés à l'influenza aviaire au Canada.
Recherche
- Envisager de mener des activités de recherche selon les lacunes identifiées en matière de connaissances (2.4)
Mise en garde : La méthodologie qualitative et fondée sur l'opinion d'experts est destinée à être utilisée dans les situations où des décisions stratégiques doivent être prises face à une grande incertitude. L'évaluation s'est principalement appuyée sur les connaissances professionnelles collectives de l'équipe sur des sujets tels que les maladies infectieuses, la virologie, l'épidémiologie, le système de santé, les pratiques de l'industrie et les interactions humain-animal. Le cas échéant, certaines références ont été fournies, mais il ne s'agit pas d'une analyse documentaire. Les estimations représentent les opinions consensuelles, mais pas nécessairement unanimes, des participants et ne doivent pas être interprétées comme représentant les vues de tous les participants et de leurs organisations respectives.
Annexe technique
Contexte de l'événement: situation actuelle (en date du 11 avril 2024)
Bétail (chèvres et bovins laitiers)
Au début de mars 2024, des décès inhabituels de chevreaux ont été signalés dans une ferme du Minnesota où un troupeau de volailles de basse-cour a été abattu en février en raison du clade 2.3.4.4b de la grippe aviaire A(H5N1).Reference 2 Les chèvres et la volaille de la ferme avaient accès aux mêmes espaces et ils utilisaient des sources d'eau communes.Reference 2 Dix chevreaux sont morts, âgés de 5 à 9 ours. Sur les dix chevreaux qui sont morts, cinq ont obtenu des résultats positifs sur des échantillons de cerveau et de tissus pour le virus. De plus, le séquençage génomique a montré que les virus dans des échantillons prélevés chez les chevreaux et la volaille à la ferme étaient hautement corrélés.Reference 2Reference 3 En date du 11 mars, aucune autre maladie n'avait été signalée.Reference 2
Le 11 mars 2024, une maladie d'étiologie inconnue a été signalée chez les bovins laitiers au Texas, aux États-Unis.Reference 4 Des premiers signes de faible consommation de matières sèches avaient été observés le 9 mars 2024. Deux jours plus tard, 17 vaches présentaient divers signes de maladie, notamment une baisse du rendement du lait, un lait avec une consistance plus épaisse et une couleur anormale semblable au colostrum, des matières fécales sèches et collantes et de l'anorexie.Reference 5 Certaines vaches souffraient de maladies secondaires comme la mammite et la pneumonie.Reference 5 Le 25 mars, des échantillons oropharyngés et de lait de vaches du Texas et du Kansas ont été confirmés comme étant positifs pour l'influenza aviaire A(H5N1) de clade 2.3.4.4b par test de PCR et d'immunohistochimie.Reference 5 En date du 8 avril 2024, l'influenza aviaire A (H5N1) de clade 2.3.4.4b a été confirmé chez les bovins laitiers de 16 troupeaux dans 7 États américains : Texas (9), Kansas (3), Michigan (1), Nouveau-Mexique (2), Idaho (1), Ohio (1) et Caroline du Nord (1).Reference 6 La morbidité a été observée chez environ 10 % des animaux des troupeaux touchés. Les bovins touchés se sont rétablis et il n'y a pas eu de décès jusqu'à maintenant. On croit que les oiseaux migrateurs sauvages sont la source de l'infection pour les fermes initialement touchées, car des oiseaux sauvages morts ont été trouvés près des piscicultures.Reference 6Reference 7
Le troupeau touché au Michigan avait reçu des vaches d'une ferme touchée au Texas. Les troupeaux touchés en Idaho et en Ohio avaient également reçu des vaches laitières du Texas, mais on ne sait pas s'il y en a eu dans d'autres troupeaux. Les preuves d'une transmission entre bovins ne peuvent être exclues. Il est possible qu'elle se soit produite par l'intermédiaire d'équipements de traite contaminés, car des niveaux élevés de virus ont été trouvés dans le lait de vaches infectées, et il n'y avait pas de traces d'infection dans les écouvillons nasaux et les excréments, autrement les traces étaient faibles. Les observations pathogéniques précoces indiquent un tropisme tissulaire apparent pour la glande mammaire chez les bovins domestiques en lactation.Reference 8 Cependant, jusqu'à présent, il n'y a pas eu de preuve d'adaptations mammaliennes des virus détectés chez les animaux.Reference 7Reference 9 Les pigeons morts et les mainates religieux morts, qui n'ont pas été reconnus comme porteurs ou sensibles à l'influenza aviaire hautement pathogène (IAHP), ainsi qu'un chat vivant à la ferme bovine initialement touchée au Texas ont fait l'objet de tests et l'influenza aviaire A(H5N1) de clade 2.3.4.4b de a été isolé.Reference 4Reference 10
Humains
Depuis décembre 2021 (en date du 10 avril 2024), des détections de virus de l'influenza aviaire A(H5N1) de clade 2.3.4.4b chez l'humain ont été signalées en Chine (n=2).Reference 11Reference 12, au Royaume-Uni (n=5)Reference 13Reference 14Reference 15, aux États-Unis (n=2)Reference 16Reference 17, en Espagne (n=2)Reference 18, au Viet Nam (n=2; clade non confirmé au moment de la rédaction)Reference 12Reference 19Reference 20, en Équateur (n=)Reference 10 et au Chili (n=1)Reference 21. Le cas le plus récent a été détecté aux États-Unis le 1er avril 2024. Cette personne avait été exposée à des bovins laitiers infectés dans l'une des fermes susmentionnées. La rougeur oculaire (conjonctivite) était le seul signe clinique du patient. Les échantillons respiratoires et des conjonctives ont donné des résultats positifs. La personne a été traitée à l'oseltamivir et a été isolée pendant son rétablissement. Le patient n'a pas eu besoin d'être hospitalisé. L'analyse génomique a confirmé que la séquence du virus était celle de l'influenza aviaire A (H5N1) de clade 2.3.4.4b, chaque segment génétique étant étroitement lié aux virus détectés chez les bovins laitiers au Texas. Contrairement aux virus trouvés chez les bovins infectés et à ceux détectés chez les oiseaux sauvages de la région, le virus détecté chez l'humain présentait la mutation PB2 E627K.Reference 22 Cette mutation peut s'être produite après l'infection par réplication virale dans le cas humain. Il s'agit de l'un des changements génétiques connus associés à l'adaptation des mammifères, mais il n'y a pas eu de propagation à partir des personnes infectées par un virus avec cette mutation.Reference 23Reference 24
Oiseaux
Le virus de l'influenza aviaire A(H5N1) de clade 2.3.4.4b a entraîné une transmission mondiale sans précédent chez les oiseaux, incluant un nombre important de détections chez les volailles domestiques (volailles de basse-cour et volailles commerciales) et les oiseaux sauvages. Depuis 2021, l'influenza aviaire A(H5N1) de clade 2.3.4.4b a été détecté chez 11 030 500 oiseaux avicoles (en date du 5 mars 2024)Reference 25 et 2 824 oiseaux sauvages (en date du 8 avril 2024)Reference 26 au Canada. Dans l'ensemble, des détections ont été effectuées chez plus de 80 espèces d'oiseaux sauvages (on peut les trouver dans le tableau de bord des résultats positifs des espèces sauvages de l'ACIAReference 26), dont bon nombre sont des espèces migratrices qui passent au moins une partie de leur cycle annuel au Canada, qui migrent vers le nord au printemps vers des aires de reproduction, et vers le sud à l'automne dans les zones d'hivernage.
Mammifères non humains
En Amérique du Nord, des infections par l'influenza aviaire A(H5N1) de clade 2.3.4.4b se sont produites chez de nombreux mammifères sauvages, notamment des mésocarnivores, de grands carnivores, des mammifères marins, des marsupiaux et des rongeurs.Reference 27 En Amérique du Sud, des infections généralisées sont survenues chez les mammifères marins, notamment un événement de mortalité massive chez des milliers d'otaries à crinière d'Amérique du Sud, où la transmission entre mammifères n'a pas été exclue.Reference 27Reference 28Reference 29 En Amérique du Nord, on n'a relevé des détections chez les mammifères domestiques que chez des chats et des chiens.
Définitions
Les définitions de l'exposition sont les mêmes que dans l'évaluation rapide des risques précédente, en plus de ces définitions :
- On suppose que l'exposition de la population générale (humaine) est soit négligeable, soit d'un faible niveau d'exposition au bétail.
Les ajouts à la liste des groupes professionnels et récréatifs présentant une exposition potentiellement pertinente dans l'évaluation rapide des risques précédente (annexe B) comprennent :
- Travailleur de l'élevage de bétail et propriétaire d'un petit troupeau
- Travailleur dans une usine de transformation de la viande ou du lait
Résultats détaillés de l'évaluation des risques pour la question 1
Voie de risque
Voie de risque décrivant une exposition au bétail infecté menant à une infection humaine par l'influenza aviaire A(H5N1) de clade 2.3.4.4b au Canada au cours des trois prochains mois. La propagation interhumaine (question 4) et les répercussions sur la santé humaine (questions 5 et 6) ont été évaluées dans l'évaluation rapide précédente.
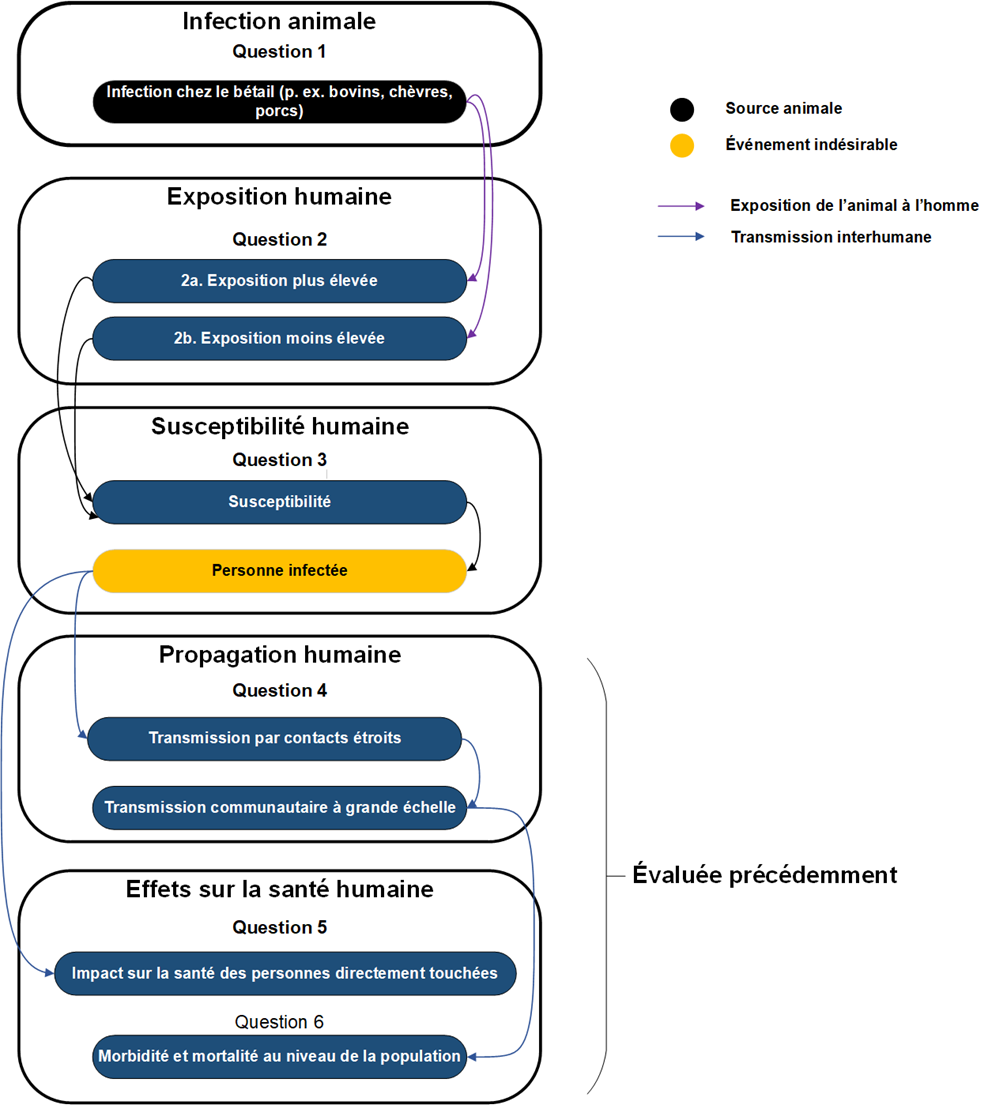
Figure 1: Texte descriptif
La probabilité d'une telle infection dépend de la prévalence de l'infection chez le bétail (question 1), combinée à la probabilité d'exposition à une quantité suffisante de virus pour potentiellement causer une infection à la suite de différents types de contact avec les animaux (questions 2a-2b), puis combinée à la probabilité qu'une personne exposée à une quantité suffisante de virus développe effectivement une infection (question 3). Les estimations d'impact (questions 4 à 6) ne sont pas incluses dans la présente évaluation, car elles ont été évaluées précédemment.
Sous-questions sur l'estimation de la probabilité
1. Quelle est la probabilité qu'un animal d'un troupeau de bétail au Canada soit infecté par l'influenza aviaire type A(H5N1) de clade 2.3.4.4b pendant la période d'évaluation?
La probabilité qu'un animal d'un troupeau de bétail au Canada soit infecté par l'influenza aviaire type A(H5N1) de clade 2.3.4.4b est trop incertain pour être évalué.
Par le passé, les bovins ont généralement été épargnés par l'influenza A. Cependant, des recherches antérieures laissent entendre qu'ils sont vulnérables aux virus humains de l'influenza A H1N1 et H3N2 et que ces virus jouent un rôle dans les maladies respiratoires et le syndrome de chute de lait chez les bovins.Reference 30Reference 31Reference 32 Des expériences ont également révélé que les bovins étaient sensibles à un sous-type H5N1 de l'IAHP (lignée asiatique) et que des virus infectieux avaient été détectés dans des écouvillons nasaux d'animaux sous-infectésReference 33. Jusqu'aux récentes découvertes aux États-Unis, on n'avait signalé aucun cas de bovins ou de chèvres infectés par le clade actuel du sous-type H5N1, malgré l'importante circulation chez les oiseaux dans le monde entier. On sait que les porcs sont sensibles aux virus de la grippe aviaire, une étude récente menée en Italie ayant rapporté des preuves de séroconversion d'un troupeau de porcs à un virus H5N1 semblable à la souche détectée chez les pondeuses de la même fermeReference 34.
Compte tenu des constatations actuelles concernant les bovins et les chèvres aux États-Unis, il est raisonnable de supposer que le bétail qui est en contact direct avec des oiseaux infectés ou leur environnement contaminé (comme les sources d'alimentation et d'eau) puisse être infecté. Toutefois, on ne connaît pas l'étendue des infections qui ont peut-être déjà eu lieu ou qui pourraient se produire à l'avenir. Aucune surveillance de l'infection subclinique ou des symptômes légers par l'influenza aviaire A(H5N1) de clade 2.3.4.4b n'a été effectuée au Canada. À ce jour, aucun cas présumé d'infection par l'influenza aviaire A(H5N1) de clade 2.3.4.4b (en raison de signes cliniques) n'a été signalé chez des bovins ou d'autres animaux d'élevage au Canada. Cependant, il est possible qu'une infection ait eu lieu chez les bovins canadiens par le mouvement des bovins laitiers infectés en provenance des États-Unis.
Les bovins laitiers du Canada ont probablement moins de contacts avec les oiseaux sauvages que les bovins laitiers du sud des États-Unis, puisqu'ils vivent partiellement dans des établissements fermés. Cependant, il existe un degré de biosûreté moins élevé (p. ex. plus grand potentiel pour les humains d'introduire du sol contaminé) avec les étables laitières qu'avec les étables de volailles. Les bovins de boucherie et les autres petits ruminants passent plus de temps à l'extérieur et sont plus susceptibles d'être en contact avec des oiseaux sauvages que les bovins laitiers. Comparativement aux infections chez les bovins laitiers, qui font l'objet de manipulations quotidiennes (p. ex. pour la traite), les infections chez les animaux élevés pour la production de viande, comme les bovins de boucherie, pourraient être plus difficiles à détecter, puisqu'elles ne sont pas surveillées aussi étroitement.
Certaines espèces d'oiseaux sauvages, en particulier la sauvagine, commencent leur migration printanière au Canada dès février; les périodes migratoires principales pour la plupart des espèces ont lieu entre avril et juin. Au Canada, les tendances saisonnières de la prévalence de l'infection coïncident avec les périodes d'augmentation des rassemblements d'oiseaux sauvages au printemps et à l'automne.Reference 35Reference 36 Des infections sporadiques chez le bétail au Canada pourraient se produire pendant la période d'évaluation, comme on l'a observé aux États-Unis; toutefois, l'étendue est incertaine. Il peut y avoir une variation géographique de la prévalence de l'infection, selon l'épidémiologie locale de l'influenza aviaire A(H5N1) de clade 2.3.4.4b et la densité des populations d'oiseaux sauvages et de bétail.
L'incertitude est trop élevée pour permettre une estimation de l'infection du bétail à l'heure actuelle, car la surveillance du bétail est limitée, de même que l'information sur la susceptibilité du bétail et la possibilité d'infections asymptomatiques ou légères.
2a. Quelle est la probabilité qu'une exposition plus élevée implique une quantité suffisante de virus pour causer une infection (pour une personne dans une situation régulière)?
La probabilité qu'une exposition plus élevée implique une quantité suffisante de virus pour causer une infection est trop incertaine pour être évalué.
La détection de ce virus chez un être humain exposé à des bovins laitiers infectés aux États-Unis suggère qu'il pourrait y avoir une transmission à des personnes en contact étroit avec du bétail infecté ou avec des environnements très contaminés. Toutefois, l'étendue et la voie de l'excrétion du virus par le bétail et la voie de transmission au cas humain sont incertaines, ce qui entrave l'évaluation de la probabilité de cet événement au fil du temps. Le patient des États-Unis a déclaré un seul signe clinique, soit une légère rougeur oculaire. Par conséquent, même s'il s'agissait du résultat d'une transmission provenant du bétail ou de l'environnement contaminé, on ne sait pas si la quantité de virus excrété par le bétail serait suffisante pour provoquer une infection plus grave. De plus, les renseignements actuels sur l'infection chez les bovins des États-Unis indiquent une forte détection du virus dans le lait, une détection faible ou négligeable dans les écouvillons nasaux et aucune détection dans les échantillons de sang, ce qui laisse supposer une maladie non systémique. Comme il a été mentionné dans l'évaluation rapide des risques précédente, la plupart des cas humains signalés à ce jour impliquaient une exposition à un niveau plus élevé avec des volailles infectées ou dans des environnements très contaminés.
L'incertitude est trop élevée pour pouvoir estimer la probabilité, notamment en raison des renseignements limités sur la période d'incubation et l'excrétion du bétail, ainsi que sur le mode de transmission connexe.
2b. Quelle est la probabilité qu'une exposition moins élevée implique une quantité suffisante de virus pour causer une infection (pour une personne dans une situation régulière)?
La probabilité qu'une exposition moins élevée implique une quantité suffisante de virus pour causer une infection est très faible. L'estimation de l'incertitude est élevée.
Cette estimation est la même que celle de l'évaluation rapide des risques précédente pour les personnes exposées à d'autres animaux (autres que du bétail). À l'échelle mondiale, aucun cas humain connu n'est associé à une faible exposition du grand public. En raison du volume élevé d'infections par ce virus chez les animaux sauvages et la volaille au Canada, il y a probablement eu de nombreux contacts faibles qui n'ont pas entraîné d'exposition à une quantité suffisante du virus pour causer une maladie importante chez une personne.
L'estimation de l'incertitude est élevée en raison du manque d'information sur la dose infectieuse potentielle dans les situations de faible exposition et du risque de sous-détection d'infections asymptomatiques ou légères chez les humains à la suite d'une faible exposition.
3. Quelle est la probabilité qu'une personne qui a été exposée à une quantité suffisante de virus contracte une infection?
La probabilité qu'une personne qui a été exposée à une quantité suffisante de virus contracte une infection est faible. L'estimation de l'incertitude est modérée.
Cette estimation est la même que celle de l'évaluation rapide des risques précédente pour les personnes exposées à d'autres animaux (autres que du bétail). Bien que l'on s'attende à ce que les humains aient très peu de protection immunologique contre les virus de l'influenza aviaire A(H5N1) de clade 2.3.4.4b, seuls quelques cas humains ont été signalés à ce jour dans le monde, malgré les expositions élevées fréquentes chez certaines personnes, en particulier celles qui sont en contact avec la volaille. L'analyse génétique du virus isolé chez les bovins n'a révélé aucun changement majeur au virus par rapport à ce qui avait été découvert précédemment.Reference 37
L'estimation de l'incertitude est modérée en raison du manque d'information sur ce clade particulier, du petit nombre de détections chez les humains et des activités de surveillance limitées chez les personnes exposées aux animaux infectés.
Estimations combinées des probabilités
Quelle est la probabilité d'infection humaine par l'influenza aviaire A(H5N1) de clade 2.3.4.4b en raison d'une exposition au bétail au Canada au cours des trois prochains mois?
La probabilité d'infection par l'influenza aviaire A(H5N1) de clade 2.3.4.4b est très faible pour la population générale dans le cadre d'une exposition négligeable ou faible au bétail (p. ex. bovins, chèvres, porcs), en raison de la très faible probabilité d'exposition au virus. Cette estimation est très incertaine en raison du manque d'information sur la dose infectieuse potentielle pour les expositions de faible niveau.
Logique permettant de calculer la probabilité globaleNote de bas de page b = 1 et 2b et 3:
- Infection du bétail : Trop incertaine pour être évaluée
- Quantité suffisante de virus provenant d'une exposition moins élevée : Très faible (incertitude élevée)
- Infection à la suite d'une exposition à une quantité suffisante de virus : Faible (incertitude modérée)
- Probabilité combinée : très faible (incertitude élevée)
La probabilité d'infection par l'influenza aviaire A(H5N1) de clade 2.3.4.4b pour les personnes qui sont plus fréquemment exposées au bétail (p. ex. bovins, chèvres, porcs) est tout au plus faible en raison de la capacité limitée du virus à infecter les humains. L'incertitude est élevée pour cette estimation en raison du manque d'information sur le caractère infectieux de ce clade pour les humains, du petit nombre d'infections chez les humains, et de la surveillance et des tests limités pour le bétail et les personnes exposées au bétail.
Logique permettant de calculer la probabilité globaleNote de bas de page b = 1 et 2a et 3 :
- Infection du bétail : Trop incertaine pour être évaluée
- Quantité suffisante de virus provenant d'une exposition plus élevée : Trop incertain pour être évalué
- Infection à la suite d'une exposition à une quantité suffisante de virus : Faible (incertitude modérée)
- Probabilité combinée : faible (incertitude élevée)
Lacunes dans les connaissances
La majorité des principales incertitudes scientifiques et lacunes dans les connaissances découlant de l'évaluation rapide précédente demeurent en vigueur. Les éléments propres à cette évaluation sont inclus ci-dessous (voir le tableau 1).
| Sous-section de voie de risque d'infection | Inconnu ou plus de renseignements nécessaires |
|---|---|
| Infection animale Par exemple, les voies d'introduction |
|
| Exposition et infection chez les humains Par exemple l'incidence et la prévalence |
|
Annexe A : Remerciements
Équipe de l'Évaluation rapide des risques de l'influenza aviaire A(H5N1) de clade 2.3.4.4b
Agence de la santé publique du Canada: Rukshanda Ahmad, Dima Ayache, Sharon Calvin, Oluwafemi Oluwole, Sandra Radons Arneson, Shelley Veilleux
Nous remercions tout particulièrement les membres du Comité directeur multi-organismes sur les risques pour la santé publique associés à l'influenza aviaire A(H5N1) au Canada. Veuillez consulter l'évaluation rapide des risques précédente pour obtenir la liste complète des membres.
Notes de bas de page
- Note de bas de page a
-
Santé Canada évalue les risques pour la salubrité des aliments associés aux produits d'origine animale.
- Note de bas de page b
-
Étant donné que la probabilité de chaque étape de la voie de risque dépend de la probabilité des étapes précédentes, la probabilité de la question combinée est donc déterminée par la plus faible probabilité estimée pendant des étapes précises de la voie de risque (c.-à-d. les questions séparées par des énoncés « et »).
Références
- Reference 1
-
Ma W., Kahn R.E., Richt J. A. The pig as a mixing vessel for influenza viruses: Human and veterinary implications. J Mol Genet Med. 2008;3(1):158-166. Publié le 27 novembre 2008.
- Reference 2
-
Stevens County goat tests positive for same influenza virus affecting poultry. https://www.bah.state.mn.us/news_release/stevens-county-goat-tests-positive-for-same-influenza-virus-affecting-poultry/. Publié le 20 mars 2024.
- Reference 3
-
États-Unis d'Amérique – Influenza A de haute pathogénicité (Inf. par les virus de l') (autres que les volailles, y compris les oiseaux sauvages) (2017 –) – Rapport de suivi 43 Système mondial d'information zoosanitaire. https://wahis.woah.org/#/in-review/4451?reportId=166488
- Reference 4
-
What dairy industry/consumers should know about the highly pathogenic avian influenza virus (HPAIV). YouTube. https://www.youtube.com/watch?app=desktop&v=WnWeh_zafV4. Publié le 4 avril 2024.
- Reference 5
-
Avian flu detections in dairy cows raise more key questions. CIDRAP. https://www.cidrap.umn.edu/avian-influenza-bird-flu/avian-flu-detections-dairy-cows-raise-more-key-questions. Publié le 27 mars 2024.
- Reference 6
-
Service d'inspection de la santé des animaux et des végétaux des États-Unis. Highly pathogenic avian influenza (HPAI) detections in Livestock. https://www.aphis.usda.gov/livestock-poultry-disease/avian/avian-influenza/hpai-detections/livestock. Publié le 15 avril 2024.
- Reference 7
-
Cohen J. Bird flu may be spreading in cows via milking and Herd Transport | Science | AAAS. Science. https://www.science.org/content/article/bird-flu-may-be-spreading-cows-milking-and-herd-transport. Publié le 4 avril 2024.
- Reference 8
-
Hu X., Saxena A., Magstadt D. R., et coll. Highly Pathogenic Avian Influenza A (H5N1) clade 2.3.4.4b Virus detected in dairy cattle. bioRxiv; 2024. DOI: 10.1101/2024.04.16.588916.
- Reference 9
-
Clayton C. Bird flu outbreak in dairy cows spreads to Michigan, Idaho and New Mexico. DTN Progressive Farmer. https://www.dtnpf.com/agriculture/web/ag/news/article/2024/03/30/bird-flu-outbreak-dairy-cows-spreads. Publié le 30 mars 2024.
- Reference 10
-
Schnirring L. Tests confirm avian flu on New Mexico dairy farm; probe finds cats positive. CIDRAP. https://www.cidrap.umn.edu/avian-influenza-bird-flu/tests-confirm-avian-flu-new-mexico-dairy-farm-probe-finds-cats-positive. Publié le 2 avril 2024.
- Reference 11
-
Organisation mondiale de la Santé. Influenza at the human-animal interface. Summary and risk assessment, from 6 October to 11 November 2022. https://cdn.who.int/media/docs/default-source/influenza/human-animal-interface-risk-assessments/influenza-at-the-human-animal-interface-summary-and-assessment--from-6-october-to-11-november-2022.pdf?sfvrsn=db9a4370_1&download=true
- Reference 12
-
Organisation mondiale de la Santé. Influenza at the human-animal interface. Summary and risk assessment, from 27 January to 3 March 2023. https://cdn.who.int/media/docs/default-source/global-influenza-programme/influenza-at-the-human-animal-interface-summary-and-assessment--from-27-january-to-3-march-2023.pdf?sfvrsn=6065458a_1&download=true
- Reference 13
-
Oliver I., Roberts J., Brown C. S., et coll. A case of avian influenza A(H5N1) in England, January 2022. Euro Surveill. 2022;27(5):2200061. doi:10.2807/1560-7917.ES.2022.27.5.2200061
- Reference 14
-
Agence britannique de la sécurité sanitaire. Avian flu detected in 2 individuals taking part in testing programme. GOV.UK. 16 mai 2023. https://www.gov.uk/government/news/avian-flu-detected-in-2-individuals-taking-part-in-testing-programme.
- Reference 15
-
Agence britannique de la sécurité sanitaire. Investigation into the risk to human health of avian influenza (influenza A H5N1) in england: Technical briefing 5. GOV.UK. https://www.gov.uk/government/publications/avian-influenza-influenza-a-h5n1-technical-briefings/investigation-into-the-risk-to-human-health-of-avian-influenza-influenza-a-h5n1-in-england-technical-briefing-5. Publié le 14 juillet 2023.
- Reference 16
-
Centers for Disease Control. U.S. case of human avian influenza A(H5) virus reported. Site Web des CDC. Mise à jour en 2022. https://www.cdc.gov/media/releases/2022/s0428-avian-flu.html.
- Reference 17
-
Centers for Disease Control. Highly pathogenic avian influenza A (H5N1) virus infection reported in a person in the U.S. https://www.cdc.gov/media/releases/2024/p0401-avian-flu.html. Publié le 1er avril 2024.
- Reference 18
-
Aznar E., Casas I., González Praetorius A., et coll. Influenza A(H5N1) detection in two asymptomatic poultry farm workers in Spain, September to October 2022: suspected environmental contamination. Euro Surveill. 2023;28(8):2300107. doi:10.2807/1560-7917.ES.2023.28.8.2300107
- Reference 19
-
Organisation mondiale de la Santé Assessment of risk associated with recent influenza A(H5N1) clade 2.3.4.4b viruses. Publié le 21 décembre 2022. https://www.who.int/publications/m/item/assessment-of-risk-associated-with-recent-influenza-a(h5n1)– clade-2.3.4.4b-viruses
- Reference 20
-
Avian influenza A(H5N1) – Viet Nam. Organisation mondiale de la Santé. https://www.who.int/emergencies/disease-outbreak-news/item/2024-DON511. Publié le 2 avril 2024.
- Reference 21
-
Organisation mondiale de la Santé. Influenza at the human-animal interface. Summary and risk assessment, 24 April 2023.https://cdn.who.int/media/docs/default-source/influenza/human-animal-interface-risk-assessments/influenza-at-the-human-animal-interface-summary-and-assessment--from-4-march-to-24-april-2023.pdf?sfvrsn=e667a5dc_1&download=true
- Reference 22
-
Centers for Disease Control. Technical Update: Summary Analysis of Genetic Sequences of Highly Pathogenic Avian Influenza A(H5N1) Viruses in Texas. Publié le 2 avril 2024. https://www.cdc.gov/flu/avianflu/spotlights/2023-2024/h5n1-analysis-texas.htm
- Reference 23
-
Jonges M., Welkers M.R., Jeeninga R. E., et coll. Emergence of the virulence-associated PB2 E627K substitution in a fatal human case of highly pathogenic avian influenza virus A(H7N7) infection as determined by Illumina ultra-deep sequencing. J Virol. 2014;88(3):1694-1702. doi:10.1128/JVI.02044-13
- Reference 24
-
Lee C.Y., An S.H., Choi J.G., Lee Y.J., Kim J.H., Kwon H.J. Rank orders of mammalian pathogenicity-related PB2 mutations of avian influenza A viruses. Sci Rep. 2020;10(1):5359. Publié le 24 mars 2020. doi:10.1038/s41598-020-62036-5
- Reference 25
-
Gouvernement du Canada. Agence canadienne d'inspection des aliments. https://inspection.canada.ca/sante-des-animaux/animaux-terrestres/maladies/declaration-obligatoire/influenza-aviaire/situation-actuelle-de-la-grippe-aviaire/etat-de-reponse-en-cours-aux-detections-d-iahp/fra/1640207916497/1640207916934. Publié le 12 avril 2024.
- Reference 26
-
Agence canadienne d'inspection des aliments. Influenza aviaire hautement pathogène – Animaux sauvages. https://cfia-ncr.maps.arcgis.com/apps/dashboards/89c779e98cdf492c899df23e1c38fdbc
- Reference 27
-
Système mondial d'information zoosanitaire. Gestion des événements. https://wahis.woah.org/#/event-management.
- Reference 28
-
Ulloa M., Fernández A., Ariyama N., et coll. Mass mortality event in South American sea lions (Otaria flavescens) correlated to highly pathogenic avian influenza (HPAI) H5N1 outbreak in Chile. Vet Q. 2023;43(1):1-10. doi:10.1080/01652176.2023.2265173
- Reference 29
-
Leguia M., Garcia-Glaessner A., Muñoz-Saavedra B., et coll. Highly pathogenic avian influenza A (H5N1) in marine mammals and seabirds in Peru. Nat Commun. 2023;14(1):5489. Publié le 7 septembre 2023. doi:10.1038/s41467-023-41182-0
- Reference 30
-
Graham, D.A., Calvert, V., McLaren, E. Retrospective analysis of serum and nasal mucus from cattle in Northern Ireland for evidence of infection with influenza A virus. Vet Rec. 2002;150(7):201-204. doi:10.1136/vr.150.7.201
- Reference 31
-
Crawshaw T.R., Brown I.H., Essen S.C., Young S.C. Significant rising antibody titres to influenza A are associated with an acute reduction in milk yield in cattle. Vet J. 2008;178(1):98-102. doi:10.1016/j.tvjl.2007.07.022
- Reference 32
-
Brown I.H., Crawshaw T.R., Harris P.A., Alexander D.J. Detection of antibodies to influenza A virus in cattle in association with respiratory disease and reduced milk yield. Vet Rec. 1998;143(23):637-638.
- Reference 33
-
Kalthoff D, Hoffmann B, Harder T, Durban M, Beer M. Experimental infection of cattle with highly pathogenic avian influenza virus (H5N1). Emerg Infect Dis. 2008;14(7):1132-1134. doi:10.3201/eid1407.071468
- Reference 34
-
Rosone F., Bonfante F., Sala M.G., et coll. Seroconversion of a Swine Herd in a Free-Range Rural Multi-Species Farm against HPAI H5N1 2.3.4.4b Clade Virus. Microorganisms. 2023;11(5):1162. Publié le 28 avril 2023. doi:10.3390/microorganisms11051162
- Reference 35
-
Giacinti, J. A., Signore, A. V., Jones, M. E. B., et coll. Avian influenza viruses in wild birds in Canada following incursions of highly pathogenic H5N1 virus from Eurasia in 2021/2022. BioRxiv. 2023. doi:10.1101/2023.11.23.565566.
- Reference 36
-
Papp Z., Clark R.G., Parmley E.J., Leighton F.A., Waldner C., Soos C. The ecology of avian influenza viruses in wild dabbling ducks (Anas spp.) in Canada. PLoS One. 2017;12(5):e0176297. Publié le 5 mai 2017. doi:10.1371/journal.pone.0176297
- Reference 37
-
Service d'inspection de la santé des animaux et des végétaux des États-Unis. Federal and State Veterinary, Public Health Agencies Share Update on HPAI Detection in Kansas, Texas Dairy Herds. https://www.aphis.usda.gov/news/agency-announcements/federal-state-veterinary-public-health-agencies-share-update-hpai. Publié le 25 mars 2024.
