Système canadien de surveillance de la résistance aux antimicrobiens : Rapport de 2022
Télécharger en format PDF
(14,3 Mo, 116 pages)
https://doi.org//10.58333/f241022
Organisation : Agence de la santé publique du Canada
Publiée : 2022-11-28
Tableau des matières
- Résumé
- La résistance aux antimicrobiens (RAM) chez les humains
- Bactériémies au Staphylococcus aureus résistant à la méthicille
- Bactériémis à entérocoques résistants à la vancomycine
- Les entérobactéries productrices de carbapénémase
- Infections au Clostridioides difficile1
- Infections à Neisseria gonorrhoeae
- Infections à Mycobacterium tuberculosis résistantes aux médicaments
- Infections invasives à Streptococcus pneumoniae
- Infections invasives à Streptococcus pyogenes (streptocoque du groupe A)
- La Salmonella enterica typhoïdique et non typhoïdique
- Résultats de la sensibilité aux antimicrobiens des échantillons d’urine et de sang, réseau de la résistance aux antimicrobiens (RésRAM)
- Utilisation des antimicrobiens (UAM) chez les humains
- Consommation d’antimicrobiens chez les humains au Canada, 2017 à 2021
- Consommation d’antimicrobiens par l’humain dans le secteur communautaire.
- Enquête nationale canadienne sur la prescription d’antimicrobiens, 2018 à 2021
- Surveillance de l’utilisation des antimicrobiens chez l’humain dans le secteur communautaire avant8 et pendant9 la pandémie de la COVID-19, Canada
- Tendances nationales générales
- Prescriptions d’antimicrobiens avant et pendant la COVID-19 dans la communauté, selon la catégorisation « AWaRe » de l’OMS, Canada, 2016 à 2022
- Prescriptions d’antimicrobiens dans la communauté avant et pendant la pandémie de la COVID-19, stratifiées par sexe, Canada, 2016 à 2022
- Prescriptions mensuelles d’antimicrobiens avant et pendant la COVID-19 dans la communauté stratifées par âge, Canada, 2016 à 2022
- Utilisation des antimicrobiens (UAM), résistance aux antimicrobiens (RAM) et RAM et UAM intégrée chez les animaux/aliments et les personnes au Canada
- Antimicrobiens vendus pour être utilisés chez tous les animaux au Canada
- Surveillance de l’utilisation des antimicrobiens et de la résistance aux antimicrobiens à l’échelle des exploitations agricoles dans le cadre du PICRA : poulets de chair, dindes et porcs croissance-finition
- Utilisation intégrée des antimicrobiens et résistance aux antimicrobiens le long de la chaîne alimentaire : Salmonella résistante aux céphalosporines de troisième génération
- Informations intégrées sur les antimicrobiens destinés à être utilisés dans tous les secteurs (humains, animaux et cultures)
- Antimicrobiens vendus pour être utilises chez les animaux au Canada
- Antimicrobiens vendus pour être utilisés chez les animaux — perspective internationale
- Surveillance au niveau de l’exploitation de l’utilisation des antimicrobiens et de la résistance aux antimicrobiens
- Résistance aux antimicrobiens et utilisation des antimicrobiens intégrées à partir de la surveillance des exploitations agricoles — PICRA
- L’UAM et la RAM intégrées tout au long de la chaîne alimentaire
- Informations intégrées sur les antimicrobiens destinés à être utilisés dans tous les secteurs (humains, animaux et cultures)
- Auteurs
- Annexes
- Notes de bas de page
- Références
Résumé
Introduction
L’Organisation mondiale de la santé (OMS) a déclaré que la résistance aux antimicrobiens (RAM) était l’une des principales menaces pour la santé publique de l’humanité. À l’échelle mondiale, on estime que 4,95 millions de décès en 2019 étaient associés à des infections bactériennes résistantes aux antimicrobiens, dont 1,27 million de décès directement attribuables à la RAM (1). Avant le début de la pandémie de la COVID, on estimait qu’en 2018 plus d’un quart des infections bactériennes au Canada étaient résistantes à au moins un antimicrobien de première ligne et que 14 000 décès canadiens étaient associés à la RAM, dont 5 400 étaient directement attribuables à la RAM. On estime qu’en 2018 la RAM a coûté environ 1,4 milliard de dollars au système de santé canadien et a provoqué une baisse du PIB du Canada de 2,0 milliards de dollars (2).
De nombreux médicaments antimicrobiens existants sont de moins en moins efficaces pour traiter les infections, et des agents pathogènes résistants aux médicaments continuent d’émerger. La situation est aggravée par le manque de nouveaux antimicrobiens dans les recherches et de développement en cours. Si rien n’est fait, le risque de développer une infection résistante empêchera de nombreux Canadiens d’avoir accès à des procédures médicales courantes, y compris les opérations chirurgicales de routine (comme les remplacements de hanche) et la chimiothérapie pour le cancer. En outre, les infections courantes (comme l’angine à streptocoques) peuvent devenir plus difficiles à traiter, entraîner davantage de complications et, dans certains cas, mettre la vie en danger. Si le taux de résistance aux antimicrobiens atteint 40% d’ici à 2050, on prévoit que les coûts annuels pour le système de santé canadiens s’élèveraient à 7,6 milliards de dollars (2).
La lutte contre la RAM au Canada exige une intervention multisectorielle coordonnée de type « Une seule santé » qui inclut des partenaires du gouvernement, de la santé humaine, de la santé animale, de l’agroalimentaire, de l’industrie, du milieu universitaire et des associations professionnelles. Une meilleure collaboration entre ces partenaires et le public sera nécessaire pour améliorer la connaissance et la compréhension de la RAM et de l’utilisation appropriée des antimicrobiens. D’après les résultats d’une recherche nationale sur l’opinion publique menée par l’Agence de la santé publique du Canada (ASPC) entre décembre 2021 et janvier 2022, la majorité (57,0 %) des répondants étaient préoccupés par la résistance aux antimicrobiens. Toutefois, ce niveau est beaucoup plus bas que ceux rapportés dans d’autres pays tels le Royaume-Uni ou les États-Unis (3)(4). Alors que 34 % ont déclaré avoir utilisé des antibiotiques au moins une fois au cours des 12 mois précédents, près du tiers des répondants croyaient erronément que les antibiotiques étaient efficaces contre le rhume et la grippe (5).
Renforcer la surveillance pour détecter, comprendre et agir contre la RAM et en matière d’utilisation des antimicrobiens (UAM)
Le rapport de 2022 du Système canadien de surveillance de la résistance aux antimicrobiens (SCSRA) fournit un aperçu des tendances quinquennales jusqu’en 2021 et présente une vision intégrée des données nationales disponibles sur la RAM et de l’utilisation des antimicrobiens (UAM) dans les populations humaines et animales générées par l’ASPC et ses partenaires. Le rapport du SCSRA est une partie fondamentale des efforts pour atteindre les objectifs visés par l’ASPC en matière de surveillance de la RAM et de l’UAM (détecter, comprendre et agir), en fournissant des informations pertinentes, précises et complètes aux intervenants, aux chercheurs, aux professionnels de la santé, aux producteurs et aux décideurs afin d’orienter la recherche, les politiques et les actions relatives aux nouvelles tendances en matière de la RAM et de l’UAM.
Les efforts pour atteindre ces objectifs ont récemment été accélérés, grâce au nouveau financement annoncé en 2021, qui a permis à l’ASPC des progresser dans plusieurs domaines prioritaires.
- Détecter – Identification et surveillance en temps opportun des menaces liées à la RAM et des tendances de l’UAM dans l’ensemble du spectre « Une seule santé »
- Les résultats du programme RésRAM de l'ASPC, basé sur l'intégration des données diagnostique de laboratoire qui représentent maintenant environ 40 % de la population, sont utilisés pour détecter des changements dans les tendances de la RAM.
- L’information sur les taux de RAM chez certains animaux/aliments de la chaîne alimentaire canadienne est utilisée pour détecter les menaces émergentes pour la santé, une étape importante dan l’élargissement d’une approache « Une seule santé » à la RAM.
- Comprendre – L’analyse des données sur la RAM et l’UAM chez les humains et les animaux, y compris les tendances, la morbidité, la mortalité et l’impact économique, menant à une gestion des risques et à une prise de décisions éclairées
- Les résultats de l’Enquête nationale sur les prescriptions d’antimicrobiens (ENPA) sont utilisés pour élargir notre compréhension de la pertinence des prescriptions délivrées dans les milieux de soins de santé au Canada.
- Le Canada accroît ses contributions de données de systèmes de surveillance internationaux (p. ex. le Système mondial de surveillance de l’utilisation et de la résistance aux antimicrobiens de l’Organization mondiale de la santé) afin de mieux comprendre comment la RAM se propage entre les pays.
- Agir – Amélioration de l’efficacité de la gestion des antimicrobiens et des interventions de prévention et contrôle des infections grâce à des données rigoureuses
- Plusieurs des résultats et analyses des tendances de la RAM et de l’UAM dans ce rapport ont déjà été utilisés par des partenaires en surveillance, tels que des hôpitaux et des fermes, pour évaluer l’efficacité de leur gestion courante des antimicrobiens et de leurs stratégies de prévention et de contrôle des infections pour combattre la RAM.
Vers l’avenir
Au-delà de ces progrès, l’ASPC a entamé des nouvelles activités de surveillance dans le but d’appuyer l’action contre la RAM en améliorant la détection et la compréhension des menaces de la RAM et des tendance d’UAM dans l’ensemble du « Une seule santé ». Les données résultant de ces activités seront disponibles dans le prochain rapport :
- En partenariat avec Santé Canada, l’ASPC a commencé à surveiller la quantité de certains antimicrobiens dans les échantillons d’eaux usées dans certaines villes canadiennes. Ces travaux contribueront à former la base de la surveillance environnementale des antimicrobiens déversés dans les eaux douces.
- La surveillance sentinelle des infections RAM chez les patients hospitalisés a été élargie afin d’améliorer la représentation à travers l’échelle du Canada, et le lancement de la surveillance des infections RAM chez les résidents des établissements de soins de longue durée est en cours.
- La surveillance des infections de gonorrhée résistantes aux antimicrobiens au Canada a pris de l’ampleur avec l’amélioration des méthodes de laboratoire permettant de prédire la présence d’une infection RAM, et un nombre accru de partenariats de partage de données avec les gouvernements provinciaux.
- En utilisant une approche « Une seule santé », l’ASPC élargit la couverture de la surveillance des différents secteurs de la chaîne alimentaire, y compris l’expansion des activités à la ferme pour les bovins de boucherie et les bovins laitiers. De plus, l’ASPC renforce la surveillance de la viande et de fruits de mer vendus au détail, car cette viande constitue une voie de transmission des bactéries résistantes des animaux aux humains.
SCSRA 2022 : Le RAM et la COVID-19 – Enjeux émergents
Les résultats de la surveillance présentés dans ce rapport correspondent à la première année complète de la pandémie de la COVID-19, dont les effets commencent seulement à se faire sentir. Le Canada, en concert avec de nombreux partenaires internationaux, a observé une diminution de la consommation d’antimicrobiens, principalement en raison de la réduction de l’utilisation communautaire d’antibiotiques. Toutefois, des rapports provinciaux indiquent une augmentation de l'utilisation d’antimicrobiens chez les patients hospitalisés pour la COVID-19 (6). Bien que les hospitalisations pour la COVID-19 peuvent avoir conduit à des taux plus élevés d’infections bactériennes associées aux soins de santé, d’après des rapports internationaux, les complications respiratoires associées à la COVID-19 et les défis cliniques liées au diagnostic des co-infections ont augmenté le risque de prescriptions inappropriées en milieu hospitalier (7). En outre, la diminution globale du nombre de Canadiens admis dans les hôpitaux peut avoir réduit la fréquence des infections nosocomiales. En dernier lieu, les contraintes quasi universelles en matière de ressources de soins de santé (p. ex. personnel réaffecté ou insuffisant) peuvent réduire la capacité de la santé publique à produire des données de surveillance cohérentes relative à la RAM. L’effet global des facteurs liés à la pandémie sur le fardeau de la RAM au Canada reste à déterminer. L’ASPC et ses partenaires continuent de surveiller les répercussions que ces facteurs ont pu avoir sur la RAM.
SCSRA 2022 principales conclusions
De 2016 à 2020, la résistance aux antimicrobiens a continué à augmenter pour la plupart des organismes prioritaires, avec quelques changements de tendances suite au début de la pandémie de la COVID-19
- Le taux global de bactériémies au Staphylococcus aureus résistant à la méthicilline (SARM) a augmenté, sous l’effet d’une hausse des bactériémies au SARM d’origine communautaire (SARM-OC) depuis 2017. Cette tendance pourrait être due à une augmentation de la fréquence de certains comportements à risque au Canada, tels que l’utilisation de drogues par injection et la crise persistante des opiacés. Une meilleure compréhension de la situation aidera à cerner des objectifs d’intervention.
- Le taux global de bactériémies à entérocoques résistants à la vancomycine (ERV) a augmenté entre 2016 and 2020; cependant, depuis 2018, le taux a légèrement baissé. Ces changements peuvent être liés à l’émergence d’une nouvelle séquence type, la modification de protocoles de contrôle des infections, une baisse des cas liés aux éclosions dans les hôpitaux soignant des patients à haut risque et la pandémie de la COVID-19.
- Le taux global des infections par des Enterobactéries productrices de carbapénémase (EPC) a augmenté, toutefois il y a eu une diminution des cas entre 2019 et 2020. Cette baisse récente pourrait être due à une baisse des hospitalisations et à une augmentation des mesures de prévention et de contrôle des infections liée la pandémie de la COVID-19.
- Le taux global des infections à Clostridioides difficile (ICD) a diminué cependant le taux a augmenté entre 2019 and 2020. Les causes de cette tendance sont actuellement à l’étude, elle pourrait être liée à l’augmentation de la consommation des antibiotiques chez les patients hospitalisés pendant les premières phases de la pandémie de la COVID-19.
L’utilisation des antimicrobiens chez les humains continue à diminuer, cependant les prescriptions inappropriées sont fréquentes
- Entre 2017 et 2021, la consommation globale des antimicrobiens a diminué dans toutes les provinces canadiennes, avec une baisse marquée au début de la pandémie de la COVID-19 (2020 à 2021).
- De 2018 à 2019, presqu’un quart des prescriptions dans les établissements de santé canadiens ont été jugées inappropriées ou suboptimales.
Diminuation de la résistance aux antimicrobiens chez les animaux sains pour les espèces animales sous surveillance
- Entre 2016 et 2020, une mesure clé de la résistance aux antimicrobiens a indiqué une diminution de la résistance aux antimicrobiens dans les bactéries provenant de poulets de chair, de dindes et de porc en croissance-finition en santé. L’utilisation d’antimicrobiens rapportée dans ces exploitations a également diminué.
Les ventes d’antimicrobiens destinés à être utilisés chez les animaux ont augmenté
- Entre 2019 et 2020, la quantité d’antibiotiques importants sur le plan médical (AIM) vendus pour être utilisés chez les animaux au Canada a augmenté légèrement. Les ventes d’antimicrobiens destinés à être utilisés chez les volailles et les poissons ont diminué, tandis que les ventes destinées aux porcs, aux bovins et aux petits ruminants ont augmenté.
- En 2020, l’utilisation des AIM chez les animaux représentait 82 % des AIMs (kg) distribués pour l’utilisation chez les humains, les animaux et les cultures.
- La quantité d’AIMs vendus pour être utilisés chez les animaux de production au Canada demeure trois fois plus élevée que la quantité moyenne rapportée par les pays européens.
Résumé des tendances
Ce résumé des tendances fournit une interprétation de haut niveau tirée des informations cliniques, épidémiologiques et/ou de résistance disponibles au moment de la publication.
| Sujet | Années de rapport | Tendance |
|---|---|---|
| Bactériémies au Staphylococcus aureus résistant à la méthicilline (SARM) associées aux soins de santé | 2016 à 2020 | Amélioration |
| Bactériémies au Staphylococcus aureus résistant à la méthicilline (SARM) d’origine communautaire | 2016 à 2020 | Aggravation |
| Bactériémies à entérocoques résistants à la vancomycine (ERV) | 2016 à 2020 | Aggravation |
| Infections par des enterobactéries productrices de carbapénémase (EPC) | 2016 à 2020 | Aggravation |
| Infections à Clostridioides difficile (ICD) | 2016 à 2020 | Amélioration |
| Infections au Neisseria gonorrhoeae (GC) résistant aux médicaments | 2016 à 2020 | Aggravation |
| Infections au Mycobacterium tuberculosis (TB) résistant aux médicaments | 2016 à 2020 | Stable |
| Infections au Streptococcus pneumoniae invasif (PI) multirésistant aux médicaments évitables par la vaccination | 2016 à 2020 | Aggravation |
| Infections à Salmonella enterica typhique et non typhique* | 2016 à 2019 | Aggravation |
| *Inclut seulement quatre années de données. | ||
Bactériémies au Staphylococcus aureus résistant à la méthicilline (SARM) : 2016 à 2020
- L’incidence des bactériémies au SARM détectées en milieu hospitalier continue à évoluer des bactériémies SARM associées aux soins de santé (baisse de 2,3 %) vers des bactériémies SARM d’origine communautaire (SARM-OC) (augmentation de 75,0 %).
- Plus de 1 patient sur 6 (17,5%) atteint d’une bactériémie au SARM est décédé dans les 30 jours suivant le diagnostic (mortalité toutes causes confondues).
- Dans les résultats de ResRAM de 2020, le SARM représentait 16,1 % des isolats sanguins du Staphylococcus aureus.
Bactériémies à entérocoques résistants à la vancomycine (ERV) : 2016 à 2020
- Le taux d’incidence global des bactériémies à ERV a augmenté de 72,2 % entre 2016 et 2020.
- Après une augmentation soutenue, le taux global de bactériémie ERV chez les patients hospitalisés semble s'être stabilisé pour les infections d'origine communautaire et associés aux soins de santé pendant la pandémie de la COVID-19 (2019 et 2020)
- Près de 1 patient sur 3 (32,7%) atteint d’une bactériémie ERV est décédé dans les 30 jours suivant le diagnostic (mortalité toutes causes confondues).
Infections par des enterobactéries productrices de carbapénémase (EPC) : 2016 à 2020
- L’incidence des infections à CPE liées aux soins de santé demeure basse et semble avoir diminué pendant la pandémie de la COVID-19 (2019 et 2020).
- Plus de 1 patient sur 5 (21,0 %) atteint d’une infection à CPE liée aux soins de santé est décédé dans les 30 jours suivant le diagnostic (mortalité toutes causes confondues).
Infections à Clostridioides difficile (ICD) : 2016 à 2020
- Après une baisse soutenue de 2016 à 2019, les taux d'ICD associés aux soins de santé ont augmenté en 2020 pendant la pandémie de la COVID-19.
- La mortalité attribuable à 30 jours était de 2,2 % pour les patients ayant reçu un diagnostic d'ICD.
Infections au Neisseria gonorrhoeae résistant aux médicaments : 2016 à 2019
- L’incidence de la GC continue à augmenter au Canada, avec des taux plus élevés chez les hommes.
- L’efficacité continue de l’azithromycine pour le traitement de la gonorrhée est en péril avec une proportion des infections qui sont résistantes qui continue de dépasser le seuil de 5 % recommandé par l’OMS.
Infections à Mycobacterium Tuberculosis (TB) résistant aux médicaments : 2016 à 2020
- Entre 2016 et 2020, les taux d’incidence de l’infection à Mycobactérium Tuberculosis sont restés relativement stables.
- Le plus récent cas d’ultrarésistance aux médicaments (URM) a été signalé en 2018.
Infections au Streptococcus pneumoniae invasif multirésistant évitables par la vaccination (PI) : 2014 à 2018
- Le taux de maladies pneumococciques invasives (PI), dont les PI multirésistantes, continue a augmenté.
- En dépit de la disponibilité de vaccins contre le pneumocoque, le taux d’infection avec des sérotypes de PI évitables par la vaccination a augmenté de 45,0 %.
Infections à Salmonella enterica typhique et non typhique : 2016 à 2019
- En 2019, 12,0 % des infections à Salmonella enterica typhoïques et 16,6 % des infections à Salmonella enterica non typhoïques étaient résistantes à trois classes d'antimicrobiens ou plus.
Utilisation d’antimicrobiens chez l’humain : 2017 à 2021
- Entre 2017 et 2021, la consommation d’antimicrobiens au Canada a diminué dans toutes les provinces, avec une diminution marquée pendant la pandémie de la COVID-19 (2019 à 2021). En 2021, les prescriptions d’antimicrobiens dans la communauté étaient en-dessous des niveaux rapportés avant la pandémie.
- La consommation d’antimicrobiens des médicaments de la catégorie « Accès » de l’outil AWaRe au Canada continue de dépasser la référence de l’OMS de 60 % de la consommation totale de médicaments, près de 74 % provenant de ce groupe.
- D’après les données du l’Enquête nationale sur la prescription d’antimicrobiens (ENPA), presqu’un quart des prescriptions dans les établissements de santé canadiens peuvent être jugées inappropriées ou sous-optimales.
Résistance aux antimicrobiens dans les bactéries provenant de poulets de chair, de porcs en croissance-finition et de dindes sains : 2016-2020
- Entre 2016 et 2020, la résistance aux antimicrobiens (exprimée en pourcentage d’isolats d’E. coli résistants à trois classes d’antimicrobiens ou plus) a diminué dans les échantillons provenant de poulets de chair, de dindes et les porcs en croissance-finition. Les rapports du PICRA contiennent des données sur la RAM chez les bactéries provenant d’autres espèces animales et à d’autres stades de la chaîne alimentaire.
Utilisation d’antimicrobiens chez les animaux : 2019 à 2020
- Selon la surveillance des exploitations sentinelles volontaires, entre 2019 et 2020, la quantité d’antibiotiques importants sur le plan médical (AIM) vendus pour être utilisés chez les animaux au Canada a augmenté légèrement de 0,98 million à 1,05 million kilogrammes (kg), ce qui représente 82 % des AIMs (kg) distribués au Canada pour l’utilisation chez les humains, les animaux et les cultures.
- Entre 2019 et 2020, les ventes d’antimicrobiens (en kg) destinés à être utilisés chez les volailles et les poissons ont diminué, tandis que les ventes destinées aux porcs, aux bovins et aux petits ruminants ont augmenté. Les ventes destinées aux chevaux, aux chiens et aux chats sont restées stables (changement de moins que 1%).
- La quantité d’antibiotiques importants sur le plan médical (AIM) vendus pour être utilisés chez les animaux de production au Canada demeure trois fois plus élevée que la quantité moyenne rapportée par les pays européens qui participent à la Surveillance européenne de la consommation d'antibiotiques à usage vétérinaire (ESVAC).
La résistance aux antimicrobiens (RAM) chez les humains
Bactériémies au Staphylococcus aureus résistant à la méthicilline
Le Staphylococcus aureus (S. aureus) est une bactérie commensale que l’on trouve sur la peau et la muqueuse nasale des humains et sur la peau des animaux à sang chaud. Près d’un tiers des adultes en bonne santé sont colonisés par le S. aureus, et 10 à 20 % peuvent présenter une colonisation persistante (8). S. aureus peut être à l’origine d’un large éventail d’infections invasives, notamment des infections de la peau et des tissus mous, des bactériémies et des pneumonies sous ventilation assistée (9). Le S. aureus se propage par contact direct avec la peau ou par contact avec des équipements et des surfaces contaminées.
Le S. aureus résistant à la méthicilline (SARM) est causé par des souches de la bactérie qui sont résistantes aux bêta-lactames, une classe d’antibiotiques qui constituent le traitement de première intention le plus courant pour les infections au S. aureus. Au Canada, la première éclosion de SARM a été signalée en 1978 (10). Alors qu’à l’origine, les infections à SARM étaient principalement associées aux soins de santé, les infections à SARM associées à la communauté sont en augmentation depuis les années 2000 (11). Les infections invasives au SARM sont le plus souvent traitées par la vancomycine ou par des agents plus récents comme la daptomycine, le linézolide ou la tigécycline.
Les données présentées étaient limitées aux cas signalés au Programme canadien de surveillance des infections nosocomiales (PCSIN) dans 10 provinces et un territoire par 62 à 80 hôpitaux entre 2016 et 2020. Les résultats ont été stratifiés par source d’acquisition (c.-à-d. associée aux soins de santé et d’origine communautaire.
La bactériémie au SARM a été définie comme présentant de nouveaux symptômes survenant plus de trois jours suivants l’hospitalisation ou si le patient a été hospitalisé dans les 7 derniers jours ou jusqu’à 90 jours (utilise le meilleur jugement clinique) selon la source ou l’infection ou le patient a eu une exposition à des soins de santé dans l'établissement déclarant qui aurait entraîné cette bactériémie.
Les bactériémies au SARM d’origine communautaire ont été définies comme présentant des symptômes apparaissant moins de 3 jours (< 72 heures) après l’admission, sans antécédents d’hospitalisation ou de toute autre exposition aux soins de santé qui aurait pu entraîner ces bactériémies. Les calculs de mortalité ont exclu les cas où la source d’acquisition était inconnue. Une méthode plus détaillée (y compris les définitions de SARM lié aux soins de santé et d’origine communautaire) se trouve dans le rapport 2022 du PCSIN (12).
Pour de plus amples informations sur les infections associées aux soins de santé, les organismes résistants aux antimicrobiens, les caractéristiques moléculaires (par exemple, les types de spa) et les tendances en matière de résistance aux antimicrobiens dans les hôpitaux participant au PCSIN, veuillez consulter la page de données interactives du PCSIN.
Principales conclusions
- Entre 2016 et 2020, l’incidence globale des bactériémies au SARM a augmenté de 33,3 %, sous l’effet d’une hausse de 75,0 % des bactériémies au SARM-OC.
- La résistance à la ciprofloxacine a diminué lentement dans les bactériémies à SARM liées aux soins de santé et d’origine communautaire.
- Pour la première fois, la non-susceptibilité à la daptomycine a été identifiée dans le cadre de la surveillance des bactériémies au SARM dans le PCSIN (quatre isolats en 2020).
- Tous les isolats testés sont restés sensibles au linézolide, à la tigécycline et à la vancomycine de 2016 à 2020.
Resultats
De 2016 à 2020, l’incidence globale des bactériémies au SARM a augmenté de 33,3 %, passant de 0,84 à 1,12 par 10 000 jours-patients, sous l’effet d’une augmentation du taux de bactériémies au SARM-OC.
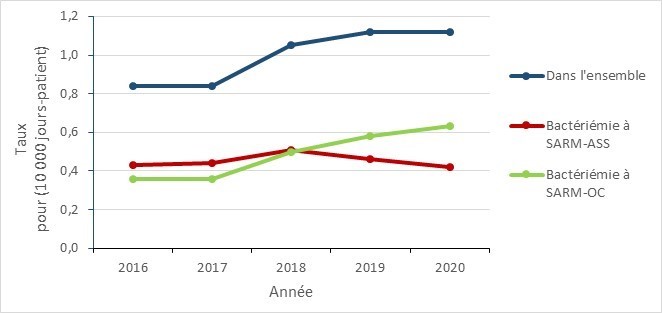
Figure 1 - Équivalent textuel
| SARM | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Dans l’ensemble | 0,84 | 0,84 | 1,05 | 1,12 | 1,12 |
| Bactériemie à SARM-ASS | 0,43 | 0,44 | 0,51 | 0,46 | 0,42 |
| Bactériémie à SARM-OC | 0,36 | 0,36 | 0,50 | 0,58 | 0,63 |
Le taux d’incidence des bactériémies au SARM liées à la communauté est resté stable dans les hôpitaux pour adultes et mixtes au cours de cette période de cinq ans. Les taux dans les hôpitaux pédiatriques ont été relativement stables de 2016 à 2018 (0,42 à 0,30 cas pour 10 000 jours-patients), puis ont augmenté de 63,3 % en 2019 (0,49 cas par 10 000 jours-patients), avant de revenir à un taux pré-pic de 0,29 en 2020.
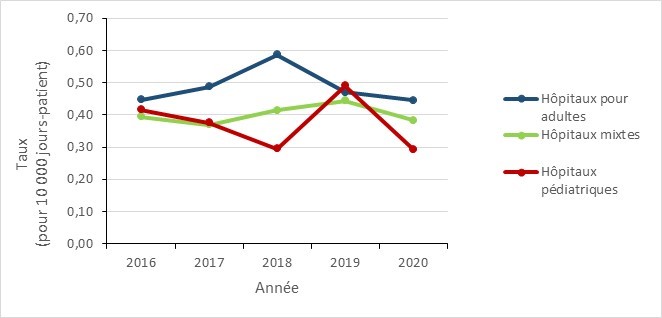
Figure 2 - Équivalent textuel
| Type d’hôpitaux | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Hôpitaux pour adultes | 0,45 | 0,49 | 0,59 | 0,47 | 0,45 |
| Hôpitaux mixtes | 0,39 | 0,37 | 0,41 | 0,44 | 0,38 |
| Hôpitaux pédiatriques | 0,42 | 0,38 | 0,30 | 0,49 | 0,29 |
Taux de mortalité
De 2016 à 2020 :
- La mortalité toutes causes confondues due aux bactériémies dans l'ensemble a diminué de 8,9%, passant de 19,1 à 17,4 par 100 cas de bactériémies au SARM.
- La mortalité toutes causes confondues due aux bactériémies au SARM-ASS a diminué de 8,3 %, passant de 21,7 à 19,9 par 100 cas de bactériémies à SARM-ASS.
- La mortalité toutes causes confondues liée aux bactériémies au SARM-OC est restée stable avec des valeurs variant entre 12,3 et 16,0 par 100 cas de bactériémies à SARM-OC
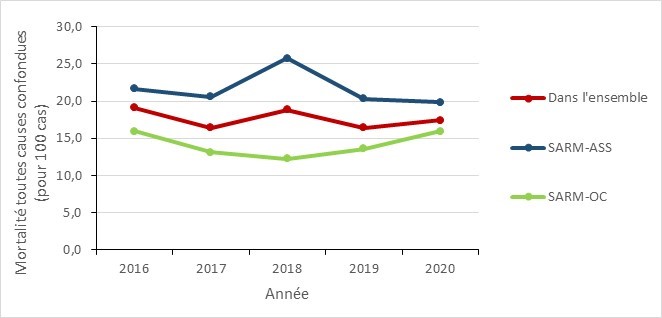
Figure 3 - Équivalent textuel
| SARM | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Dans l’ensemble | 19,1 | 16,4 | 18,8 | 16,4 | 17,24 |
| SARM-ASS | 21,7 | 20,6 | 25,7 | 20,3 | 19,9 |
| SARM-OC | 16,0 | 13,1 | 12,3 | 13,6 | 15,9 |
Tendances de la résistance aux antimicrobiens de 2016 à 2020
Parmi les isolats testés où la bactériémie a été déterminée comme ayant été acquise dans un établissement de soins de santé (bactériémies au SARM-ASS) :
- La proportion résistante à la ciprofloxacine a diminué, passant de 78,4 % à 65,3 % (soit une diminution absolue de 13,1 % entre 2016 et 2020).
- La résistance à la clindamycine et à l’érythromycine est restée relativement stable entre 34,2 % et 50,3 % pour la clindamycine et entre 71,2 % et 80,7 % pour l’érythromycine.
- La résistance à la rifampicine, à la tétracycline et au triméthoprime-sulfaméthoxazole sont tous restés inférieurs à 7,0 % au cours de la période de cinq ans.
- Tous les isolats testés sont restés sensibles à la daptomycine entre 2016 et 2019 (la daptomycine est l’un des traitements de choix de première ligne avec la vancomycine). Cependant, en 2020, deux isolats ont été déterminés comme non sensibles pour la première fois dans le système de surveillance du PCSIN. De 2016 à 2020, tous les isolats testés sont restés sensibles au linézolide, à la tigécycline et à la vancomycine.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés | 273 | 296 | 334 | 261 | 222 |
| Ciprofloxacine | 78,4 % | 77,0 % | 74,6 % | 72,0 % | 65,3 % |
| Clindamycine | 48,0 % | 47,6 % | 50,3 % | 49,0 % | 34,2 % |
| Daptomycinea | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,9 % |
| Érythromycine | 79,9 % | 80,7 % | 76,9 % | 75,1 % | 71,2 % |
| Rifampicine | 2,6 % | 1,0 % | 0,9 % | 2,3 % | 0,9 % |
| Tétracycline | 4,8 % | 5,4 % | 4,5 % | 6,9 % | 6,3 % |
| Triméthoprime-sulfaméthoxazole | 1,5 % | 1,4 % | 0,9 % | 1,1 % | 1,8 % |
|
a *Pour la Daptomycine, seuls les « résultats non sensibles sont rapportés ». Il n’y a pas d’interprétations intermédiaires ou résistantes pour la daptomycine dans le Clinical and Laboratory Standards Institute (CLSI). Les antimicrobiens inclus faisaient partie du groupe d’antibiogrammes de laboratoire qui peut inclure ceux qui ne font pas partie des directives de traitement. Par conséquent, certains antimicrobiens sont présentés uniquement à des fins épidémiologiques. |
|||||
Parmi les isolats testés où la bactériémie a été identifiée comme d’origine communautaire (bactériémies au SARM-OC) :
- La proportion d’isolats résistants à la ciprofloxacine est passée de 75,4 % à 63,0 % (soit une diminution absolue de 12,4 % entre 2016 et 2020).
- La résistance à la clindamycine et à l’érythromycine est restée relativement stable entre 29,4 % et 39,5 % pour la clindamycine et entre 71,7 % et 81,0 % pour l’érythromycine.
- La résistance antimicrobienne est restée faible (< 11 %) pour la rifampicine, la tétracycline et le triméthoprime-sulfaméthoxazole.
- Tous les isolats testés sont restés sensibles à la daptomycine de 2016 à 2019 (l’un des traitements de choix de première ligne avec la vancomycine). Cependant, en 2020, deux isolats ont été déterminés comme non sensibles pour la première fois dans le système de surveillance du PCSIN.
- De 2016 à 2020, tous les isolats testés sont restés sensibles au linézolide, à la tigécycline et à la vancomycine.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 228 | 232 | 334 | 320 | 346 |
| Ciprofloxacine | 75,4 % | 76,3 % | 69,2 % | 68,1 % | 63,0 % |
| Clindamycine | 39,5 % | 36,6 % | 33,2 % | 29,4 % | 31,8 % |
| Daptomycinea | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,6 % |
| Érythromycine | 75,9 % | 81,0 % | 73,4 % | 76,3 % | 71,7 % |
| Rifampicine | 1,3 % | 2,6 % | 0,9 % | 0,0 % | 0,6 % |
| Tétracycline | 7,5 % | 7,8 % | 9,9 % | 6,6 % | 5,8 % |
| Triméthoprim-sulfaméthoxazole | 2,6 % | 1,3 % | 3,3 % | 1,6 % | 2,9 % |
|
aPour la Daptomycine, seuls les « résultats non sensibles sont rapportés ». Il n’y a pas d’interprétations intermédiaires ou résistantes pour la daptomycine dans le Clinical and Laboratory Standards Institute (CLSI). Les antimicrobiens inclus faisaient partie du panel d’antibiogrammes du laboratoire, ce qui peut inclure ceux qui ne font pas partie des directives de traitement. Par conséquent, certains antimicrobiens sont présentés uniquement à des fins épidémiologiques. |
|||||
Les types de souches et les données de résistance pour les bactériémies au SARM-ASS et SARM-OC sont basés sur la définition de cas épidémiologique pour le « lieu d’acquisition ».
Bien que les infections à SARM-ASS et SARM-OC existent depuis longtemps, les tendances actuelles montrent une augmentation constante des infections au SARM-OC depuis 2015 environ.
Les données sur le type de souche et la proportion de résistance des isolats de bactérie SARM-ASS ont été limitées aux infections attribuées à l'hôpital déclarant.
- Depuis 2018, le PCSIN collecte des données épidémiologiques sur les bactériémies au SARM et au Staphyloccus aureus sensible à la méthicilline déterminées comme acquises dans l’hôpital déclarant. La proportion de SARM est restée stable, allant de 23 % en 2018 à 21 % en 2020.
- En outre, de 2018 à 2020, le PCSIN a collecté des données agrégées à l’échelle de l’hôpital sur les isolats récupérés chez les patients hospitalisés et les patients externes dans le cadre de son projet de surveillance des antibiogrammes. La proportion d’isolats de S. aureus déterminés comme SARM a fluctué entre 23 % et 26 % au cours de cette période.
- Parmi les types de souches épidémiques à l’hôpital signalés entre 2016 et 2020 :
- Le SARMC 2 lié à la communauté, un type de souche épidémique historiquement associé au SARM lié aux soins de santé a diminué de 45,1 % en 2016 à 30,5 % en 2020. Les types de souches épidémiques SARMC 7 et SARMC 10 sont traditionnellement d’origine communautaire, et entre 2016 et 2020, le pourcentage de SARM 7 ayant presque doublé, passant de 7 % à 13 %, et celui de SARM 10 étant passé de 35 % à 40 %.
| Type de souche épidémique | 2016 N (%) |
2017 N (%) |
2018 N (%) |
2019 N (%) |
2020 N (%) |
|---|---|---|---|---|---|
| Tous les types de souches épidémiquesa (n) | 562 | 564 | 702 | 664 | 618 |
| SARMC 2 | 189 (33,6 %) | 173 (30,7 %) | 196 (27,9 %) | 163 (24,5 %) | 131 (21,2 %) |
| SARMC 7 | 39 (6,9 %) | 48 (8,5 %) | 57 (8,1 %) | 66 (9,9 %) | 84 (13,6 %) |
| SARMC 10 | 258 (45,9 %) | 253 (44,9 %) | 327 (46,6 %) | 330 (49,7 %) | 310 (50,2 %) |
| Autreb | 76 (13,5 %) | 90 (16,0 %) | 122 (17,4 %) | 105 (15,8 %) | 93 (15,0 %) |
| Types de souches épidémiques – ASS (n) | 284 | 298 | 334 | 280 | 223 |
| SARMC 2 | 128 (45,1 %) | 119 (39,9 %) | 127 (38,0 %) | 101 (36,1 %) | 68 (30,5 %) |
| SARMC 7 | 20 (7,0 %) | 19 (6,4 %) | 25 (7,5 %) | 17 (6,1 %) | 29 (13,0 %) |
| SARMC 10 | 98 (34,5 %) | 105 (35,2 %) | 119 (35,6 %) | 105 (37,5 %) | 89 (39,9 %) |
| Autreb | 38 (13,4 %) | 55 (18,5 %) | 63 (18,9 %) | 57 (20,4 %) | 37 (16,6 %) |
| Types de souches épidémiques – OC (n) | 248 | 232 | 334 | 341 | 346 |
| SARMC 2 | 53 (21,4 %) | 40 (17,2 %) | 59 (17,7 %) | 52 (15,2 %) | 50 (14,5 %) |
| SARMC 7 | 18 (7,3 %) | 28 (12,1 %) | 31 (9,3 %) | 49 (14,4 %) | 55 (15,9 %) |
| SARMC 10 | 141 (56,9 %) | 132 (56,9 %) | 190 (56,9 %) | 202 (59,2 %) | 196 (56,6 %) |
| Autreb | 36 (14,5 %) | 32 (13,8 %) | 54 (16,2 %) | 38 (11,1 %) | 45 (13,0 %) |
|
aLes types de souches et la résistance pour ASS et OC sont basés sur la définition épidémiologique des cas. Les isolats dont la source d'acquisition est inconnue ou manquante ont été exclus. bAutres types de souches épidémiques = SARMC 1, SARMC 3/6, SARMC 4, SARMC 5, SARMC 8, Européen, ST398, ST772, ST88, ST97, USA 1000 Chine/Taiwan, USA1100 SWP/Oceania, USA 700 ainsi que les types de souches épidémiques non attribués. |
|||||
Bactériémies à entérocoques résistants à la vancomycine
Les entérocoques sont des bactéries facultatives commensales de la microflore intestinale et sont excrétés dans les selles humaines (13). Environ 30 % de toutes les infections à Enterococci associées aux soins de santé sont résistantes à la vancomycine (14). Les entérocoques sont associés à des infections graves et potentiellement mortelles chez l’humain, comme les infections urinaires, les septicémies et les endocardites (15).
Les entérocoques résistants à la vancomycine (ERV) se transmettent généralement d’une personne à l’autre par contact direct ou par contact avec des surfaces contaminées. Les infections à ERV surviennent le plus souvent chez les personnes hospitalisées dont le système immunitaire est affaibli, chez celles qui ont déjà été traitées à la vancomycine (ou à d’autres antibiotiques pendant de longues périodes), chez celles qui ont subi des interventions chirurgicales et chez celles qui portent des dispositifs médicaux comme des cathéters urinaires (16).
Alors que le traitement des infections à entérocoques comprenait traditionnellement un régime à base de pénicilline semi-synthétique ou d’aminoglycopeptides (c.-à-d. la vancomycine), avec l’augmentation des schémas de résistance, d’autres options thérapeutiques telles que le linézolide, la daptomycine et la tigécycline ont été introduites pour le traitement des bactériémies à ERV (13).
Les données présentées ont été limitées aux cas signalés au Programme canadien de surveillance des infections nosocomiales (PCSIN) par 59 à 68 des 89 hôpitaux déclarants entre 2016 et 2020. Les résultats ont été stratifiés par type d’établissement (c.-à-d. hôpital ou établissement mixte). Un cas de bactériémie à ERV associée aux soins de santé (bactériémie ERV-ASS) a été défini comme un patient ayant été hospitalisé pendant 3 jours ou plus (≥ 72 heures) ou ayant des antécédents d’hospitalisation (jour 1 est le jour de l’admission hospitalière) ou toute autre exposition aux soins de santé dans l’établissement au cours des 7 derniers jours (ou jusqu’à 90 jours, dépendamment de la source de l’infection) qui aurait pu entraîner cette bactériémie selon l’évaluation d’un praticien de la prévention et du contrôle des infections. Les calculs de mortalité excluent les cas où la source d’acquisition était inconnue. D’autres détails méthodologiques peuvent être trouvés dans la publication 2022 du PCSIN (12).
Pour de plus amples informations sur les infections associées aux soins de santé, les organismes résistants aux antimicrobiens, les caractéristiques moléculaires (par exemple, les types de spa) et les tendances en matière de résistance aux antimicrobiens dans les hôpitaux participant au PCSIN, veuillez consulter la page de données interactives du PCSIN.
Principales conclusions
- Le taux d’incidence global des bactériémies à ERV a augmenté de 72,2 %, passant de 0,18 par 10 000 jours-patients en 2016 à 0,31 par 10 000 jours-patients en 2020.
- Parmi les bactériémies à ERV identifiées entre 2016 et 2020, la mortalité toutes causes confondues à trente jours était de 32,7 %.
- La résistance à la gentamicine de niveau élevé a augmenté entre 2016 (13,2 %) et 2018 (42,5 %). Toutefois, une diminution a été observée entre 2019 (33,1 %) et 2020 (26,1 %).
- Entre 2016 et 2020, dans les isolats des bactériémies à ERV, de faibles niveaux de résistance ont été détectés à la tigécycline (< 1 %), au linézolide (< 2 %) et à la daptomycine (< 9 %).
Résultats
Le taux d’incidence nationale des infections à ERV par 10 000 jours-patients est passé de 0,18 en 2016 à un pic de 0,35 en 2018, avant de diminuer légèrement pour atteindre 0,31 en 2020. Les bactériémies à ERV sont principalement associées aux soins de santé : 93,2 % des bactériémie à ERV signalées entre 2016 et 2020 ont été acquises dans un établissement de santé. La mortalité globale, toutes causes confondues, des infections sanguines à ERV était de 32,7 %.
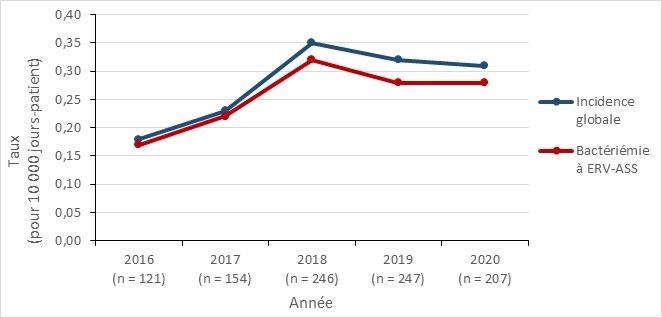
Figure 4 - Équivalent textuel
| ERV | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Incidence globale | 0,18 | 0,23 | 0,35 | 0,32 | 0,31 |
| Bactériémie à ERV-ASS | 0,17 | 0,22 | 0,32 | 0,28 | 0,28 |
Incidence des bactériémies à ERV par type d’établissement
Entre 2016 et 2020, le taux d’incidence des bactériémies à ERV dans les établissements pour adultes a augmenté de 72,7 %; toutefois, depuis le pic atteint en 2018, une baisse a été observée (de 0,48 par 10 000 jours-patients en 2018 à 0,38 par 10 000 jours-patients en 2020).
L’incidence des bactériémies à ERV dans les établissements mixtes a été relativement stable entre 2016 et 2019, avec des taux d’incidence fluctuant entre 0,12 et 0,20 par 10 000 patients-jours. Les bactériémies à ERV ont rarement été trouvées dans les établissements pédiatriques, 2,2 % (n = 21/975) des infections signalées entre 2016 et 2020 ont été acquises dans un établissement de santé pédiatrique.
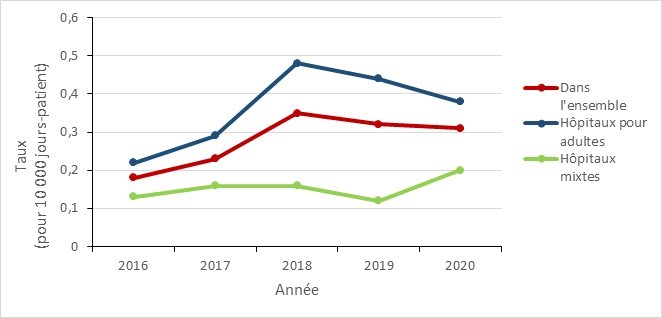
Figure 5 - Équivalent textuel
| Type d’hôpitaux | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Dans l’ensemble | 0,18 | 0,23 | 0,35 | 0,32 | 0,31 |
| Hôpitaux pour adultes | 0,22 | 0,29 | 0,48 | 0,44 | 0,38 |
| Hôpitaux mixtes | 0,13 | 0,16 | 0,16 | 0,12 | 0,20 |
Proportion d’isolats de bactériémies à ERV déterminées comme Enterococcus fæcium et Enterococcus faecalis entre 2016 et 2020 :
- Enterococcus fæcium : 679/683 (99,4 %)
- Enterococcus faecalis : 4/683 (0,6 %)
Typage de séquence multilocus et profils de résistance antimicrobienne
En 2020, les trois types de séquence les plus courants étaient ST17 (36,1 %), ST1478 (17,6 %) et ST80 (17,6 %). Cependant, la distribution des types de séquences les plus importantes des bactériémies à ERV (E. fæcium) a changé au fil du temps. La plus forte augmentation a été observée chez les ST17 (3,3 % en 2016 à 36,1 % en 2020). ST1478 est passé de 11,0 % en 2016 à 38,7 % en 2018, suivi d’une baisse à 17,6 % en 2020.
| Proportion du type de séquence par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 91 | 116 | 181 | 165 | 119 |
| ST17 | 3,3 % | 5,2 % | 5,0 % | 21,2 % | 36,1 % |
| ST18 | 15,4 % | 5,2 % | 1,7 % | 1,8 % | 1,7 % |
| ST80 | 12,1 % | 9,5 % | 11,6 % | 12,7 % | 17,6 % |
| ST117 | 23,1 % | 14,7 % | 13,3 % | 9,7 % | 11,8 % |
| ST412 | 14,3 % | 6,9 % | 4,2 % | 0,6 % | 0,8 % |
| ST734 | 4,4 % | 13,0 % | 11,6 % | 11,5 % | 8,4 % |
| ST1478 | 11,0 % | 27,6 % | 38,7 % | 32,7 % | 17,6 % |
| Autrea | 16,5 % | 18,1 % | 13,8 % | 8,5 % | 5,9 % |
| a « Autres » incluent ST16, ST56, ST78, ST132, ST154, ST192, ST203, ST233, ST252, ST262, ST280, ST282, ST323, ST375, ST414, ST494, ST584, ST612,ST662, ST663, ST664, ST665, ST721, ST736, ST750, ST761, ST772, ST786, ST787, ST802, ST835, ST836, ST912, ST982, ST983, ST984, ST992, ST1032, ST1112, ST1113, ST1201, ST1265, ST1421, ST1424, ST1497, ST1587, ST1612, ST1692, ST1821, ST1824. | |||||
Entre 2016 et 2020, presque tous les isolats de bactériémies à ERV étaient résistants à la ciprofloxacine et à la pénicilline. La résistance à la gentamicine de niveau élevé a augmenté de 2016 (13,2 %) à 2018 (42,5 %). Toutefois, une diminution de 7,0 % a été observée plus récemment entre 2019 (33,1 %) et 2020 (26,1 %). Les isolats de bactériémies à ERV sont restés largement sensibles à la tigécycline (résistance < 1 %), au linézolide (résistance < 2 %) et à la daptomycine (résistance < 9 %) pendant toutes les années de surveillance. La résistance à la daptomycine a atteint un pic de 8,6 % (n = 10) en 2017 et a diminué à 3,5 % (n = 4) en 2020. Toutefois, ces chiffres doivent être interprétés avec prudence en raison du petit nombre d’isolats résistants identifiés chaque année. La résistance à la quinupristine-dalfopristine est restée relativement stable au Canada, la résistance fluctuant entre 6,9 % et 10,7 % au cours de la période de cinq ans.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n)a | 91 | 116 | 181 | 169 | 115 |
| Ampicilline | 100,0 % | 100,0 % | 100,0 % | 100,0 % | 97,4 % |
| Chloramphénicol | 2,2 % | 9,5 % | 2,2 % | 16,6 % | 19,1 % |
| Ciprofloxacine | 100,0 % | 100,0 % | 100,0 % | 100,0 % | 98,3 % |
| Daptomycineb | 7,7 % | 8,6 % | 6,6 % | 4,1 % | 3,5 % |
| Érythromycine | 91,2 % | 93,1 % | 95,6 % | 95,9 % | 93,9 % |
| Gentamicine (niveau éléve) | 13,2 % | 38,8 % | 42,5 % | 33,1 % | 26,1 % |
| Lévofloxacine | 100,0 % | 100,0 % | 98,9 % | 100,0 % | 97,4 % |
| Linézolide | 1,1 % | 0,0 % | 1,1 % | 1,8 % | 0,0 % |
| Nitrofurantoïne | 38,5 % | 44,8 % | 30,4 % | 40,2 % | 34,8 % |
| Pénicilline | 100,0 % | 100,0 % | 100,0 % | 100,0 % | 98,3 % |
| Quinupristin-dalfopristine | 9,9 % | 6,9 % | 9,9 % | 10,7 % | 7,0 % |
| Rifampicine | 93,4 % | 94,8 % | 90,1 % | 91,7 % | 85,2 % |
| Streptomycine (niveau éléve) | 35,2 % | 33,6 % | 33,1 % | 25,4 % | 20,0 % |
| Tétracycline | 50,5 % | 56,9 % | 59,7 % | 70,4 % | 62,6 % |
| Tigécyclinec | 0,0 % | 0,0 % | 0,6 % | 0,0 % | 0,0 % |
| Vancomycine | 96,7 % | 95,7 % | 97,2 % | 98,2 % | 95,7 % |
|
a Le nombre total reflète le nombre d’isolats testés pour chacun des antibiotiques énumérés ci-dessus. bDepuis 2020, le Clinical and Laboratory Standards Institute (CLSI) dispose de points de rupture de résistance pour la daptomycine. Toutes les données de 2016 à aujourd’hui ont été analysées avec ces points d’arrêt. Les résultats de la résistance à la tigécycline ont été interprétés selon les points de rupture de l’European Committee on Animicrobial Susceptibility Testing (EUCAST), car il n’y en a pas selon le CLSI. Les antimicrobiens inclus faisaient partie du panel d’antibiogrammes du laboratoire, ce qui peut inclure ceux qui ne font pas partie des directives de traitement. Par conséquent, certains antimicrobiens sont présentés uniquement à des fins épidémiologiques. |
|||||
Les entérobactéries productrices de carbapénémase
Les entérobactéries constituent un vaste groupe de bactéries en forme de bâtonnets et facultativement anaérobies, commensales du microbiote intestinal humain et de différentes espèces animales (17). L’agent pathogène peut provoquer différents types d’infections telles que les infections des voies urinaires, la pyélonéphrite, la septicémie, la pneumonie et la méningite (18).
Les entérobactéries productrices de carbapénémase (EPC) sont des bactéries à Gram négatif qui ont la capacité d’hydrolyser les carbapénèmes par la production d’enzymes carbapénémases. La plupart des carbapénémases hydrolysent les pénicillines, les céphalosporines et les carbapénèmes. De plus, les carbapénémases sont souvent associées à la multirésistance, car elles se trouvent généralement sur des plasmides contenant de multiples déterminants de la résistance à d’autres classes d’antimicrobiens, ce qui limite les options de traitement (19). Des carbapénémases bien décrites, comme la Klebsiella pneumoniae carbapénémase (KPC), la métallo-β-lactamase de New Delhi (NDM) et l’oxacillinase 48 (OXA-48), sont signalées dans le monde entier et le sont de plus en plus au Canada (20) (21) (22).
L’EPC peut se répandre dans les secteurs des soins de santé et des communautés. À l’échelle mondiale, l’incidence de l’EPC augmente depuis près de deux décennies, ce qui a incité l’Organisation mondiale de la santé (OMS) à désigner l’EPC comme un agent pathogène résistant aux antimicrobiens (RAM) prioritaire en 2017 (23). Au Canada, les premiers cas d’EPC ont été détectés en 2008 (24); de 2010 à 2014, l’incidence sur cinq ans a été estimée à 0,09 par 10 000 jours-patients et la mortalité toutes causes confondues à 17,1 par 100 cas d’EPC pour la même période (20).
Le traitement des infections causées par l’ECP comprend les aminoglycosides, les fluoroquinolones et le triméthoprime-sulfaméthoxazole. Les traitements à base de tigécycline et de polymyxines (colistine) peuvent être envisagés, mais uniquement en cas de résistance à toutes les autres classes d’antimicrobiens. Cependant, l’émergence d’une résistance contre un grand nombre de ces médicaments est devenue un défi clinique croissant (25).
Les données présentées ont été limitées aux cas signalés au Programme canadien de surveillance des infections nosocomiales (PCSIN) par 55 à 72 des 89 hôpitaux déclarants entre 2016 et 2020. Les données sur les isolats présentés incluent à la fois l’infection et la colonisation. En raison du faible nombre d’infections annuelles, les données régionales proviennent à la fois d’infections à EPC associées aux soins de santé (EPC-ASS) et d’infections EPC d’origine communautaire (EPC-OC), données combinées. On a émis l’hypothèse que la légère diminution observée en 2020 était le résultat de la pandémie de COVID-19, peut-être en raison de changements dans les pratiques de dépistage et de test et de la réduction des voyages internationaux. Les calculs de mortalité ont exclu les cas où la source d'acquisition était inconnue. Une méthodologie plus détaillée (y compris les définitions de ASS- et OC) peut être trouvée dans le rapport 2022 du PCSIN (12).
Pour de plus amples informations sur les infections associées aux soins de santé, les organismes résistants aux antimicrobiens, les caractéristiques moléculaires (par exemple, les types de spa) et les tendances en matière de résistance aux antimicrobiens dans les hôpitaux participant au PCSIN, veuillez consulter la page de données interactives du PCSIN.
Principales conclusions
Entre 2016 et 2020 :
- L’incidence des infections à CPE-ASS est passée de 0,02 pour 10 000 jours-patients en 2016 à 0,05 par 10 000 jours en 2019, suivie d’une diminution en 2020 (0,03 par 10 000 jours-patients).
- Entre 2016 et 2020, la KPC, la NDM et l’OXA-48 étaient les carbapénémases les plus répandues.
- De 2016 à 2020, la prévalence de la résistance à l’amikacine et à la gentamicine parmi tous les isolats d’EPC a diminué de 18,5 % et 9,4 %, respectivement, tandis que la résistance au triméthoprime-sulfaméthoxazole a augmenté de 12,8 %.
Résultats
- Bien que l’incidence des infections à EPC liées aux soins de santé reste faible dans les hôpitaux canadiens pour les soins aigus, une augmentation a été observée de 2016 (0,02 par 10 000 jours-patients) à 2019 (0,05 par 10 000 jours-patients), suivie d’une diminution en 2020 (0,03 par 10 000 jours-patients).
- De 2016 à 2020, la mortalité toutes causes confondues par 100 patients infectés par EPC en installation hospitalière était de 18,02 % (n=20).
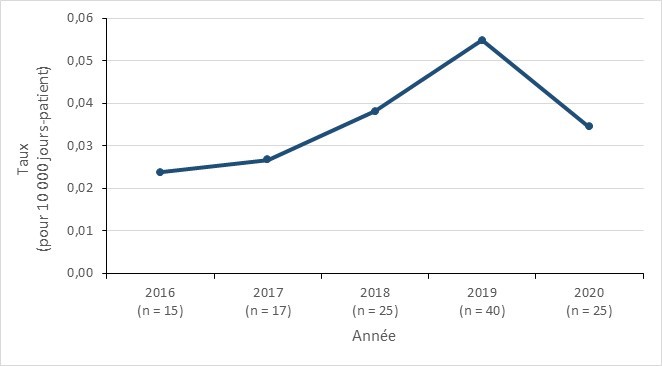
Figure 6 - Équivalent textuel
| EPC | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Infection à EPC-ASS | 0,02 | 0,03 | 0,04 | 0,05 | 0,03 |
Tendances régionale
Les données régionales sur l’EPC ne comprennent que les infections provenant de toutes les sources d’acquisition. Entre 2016 et 2020, les taux d’infection par l’ECP étaient les plus élevés dans le centre et l’ouest du Canada et sont restés faibles dans l’est du pays. La variabilité des taux d’incidence régionaux est due au petit nombre d’infections signalées.
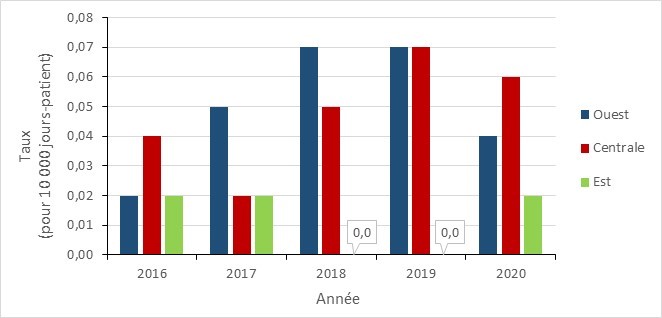
Figure 7 - Équivalent textuel
| Région | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Ouest | 0,02 | 0,05 | 0,07 | 0,07 | 0,04 |
| Centrale | 0,04 | 0,02 | 0,05 | 0,07 | 0,06 |
| Est | 0,02 | 0,02 | 0,00 | 0,00 | 0,02 |
*Ouest : Colombie-Britannique, Alberta, Saskatchewan et Manitoba; Centrale : Ontario et Québec; Est : Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve.
Les carbapénémases identifiés
Les résultats suivants reflètent tous les isolats d’EPC (infections et colonisations) soumis. Certains isolats contiennent plusieurs carbapénémases. Par conséquent, le nombre total d’isolats testés et le nombre de carbapénémases indiqué peuvent différer.
Klebsiella pneumoniae (KPC), la métallo-β-lactamase de New Delhi (NDM) et l’oxacillinase-48 (OXA-48) ont été les carbapénémases les plus fréquemment identifiées entre 2016 et 2020. Dans l’ensemble, les proportions de ces types de carbapénémase sont restées relativement stables avec des variations minimes au cours de cette période. Les types de KPC étaient systématiquement plus répandus que les autres, suivis par le type d’enzyme de NDM.
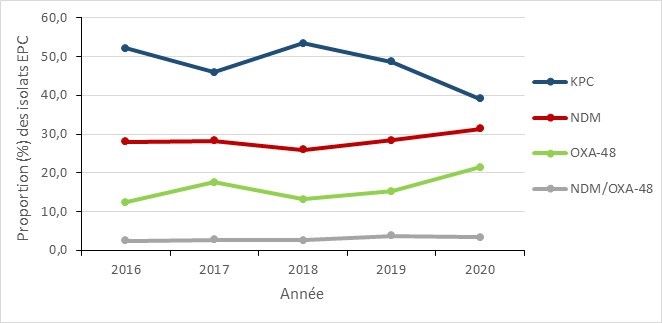
Figure 8 - Équivalent textuel
| Carbapénémase | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| KPC | 52,2 % | 46,0 % | 53,5 % | 48,7 % | 39,1 % |
| NDM | 28,0 % | 28,3 % | 25,9 % | 28,4 % | 31,4 % |
| OXA-48 | 12,4 % | 17,6 % | 13,2 % | 15,3 % | 21,4 % |
| NDM/OXA-48 | 2,5 % | 2,7 % | 2,6 % | 3,8 % | 3,3 % |
Résultats de la résistance à l’EPC
- Plus de 60 % des isolats d’ECP étaient résistants à la ceftazidime, à la ciprofloxacine, au méropénème, à la pipéracilline-tazobactam et au triméthoprime-sulfaméthoxazole.
- Entre 2016 et 2020, la tigécycline et l’amikacine ont présenté les niveaux de résistance les plus faibles parmi les antimicrobiens testés, les niveaux correspondants variant respectivement entre 0,0 et 20,0 %, et 7,0 à 27,0 %.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 161 | 187 | 228 | 261 | 210 |
| Amikacin | 26,1 % | 17,1 % | 19,3 % | 8,8 % | 7,6 % |
| Ceftazidime | 86,3 % | 85,6 % | 84,2 % | 89,3 % | 82,4 % |
| Ciprofloxacine | 82,6 % | 73,8 % | 69,3 % | 70,1 % | 71,4 % |
| Gentamicine | 38,5 % | 34,2 % | 35,1 % | 33,0 % | 29,0 % |
| Meropénem | 87,0 % | 85,0 % | 86,8 % | 72,8 % | 61,9 % |
| Pipéracilline-tazobactam | 72,0 % | 85,0 % | 92,1 % | 90,8 % | 87,6 % |
| Tigécycline | 19,9 % | 9,6 % | 13,2 % | 13,8 % | 0,0 % |
| Tobramycine | 46,6 % | 38,0 % | 44,3 % | 46,4 % | 37,1 % |
| Triméthoprim-sulfaméthoxazole | 63,4 % | 60,4 % | 62,7 % | 73,9 % | 76,2 % |
| Les antimicrobiens inclus faisaient partie du panel d’antibiogrammes du laboratoire, ce qui peut inclure ceux qui ne font pas partie des directives de traitement. Par conséquent, certains antimicrobiens sont présentés uniquement à des fins épidémiologiques. | |||||
Infections au Clostridioides difficile1
La bactérie Clostridioides difficile (C. difficile) provoque des diarrhées infectieuses et des colites pseudo-membraneuses. L’infection à C. difficile (ICD) découle de l’utilisation d’antibiotiques à large spectre, qui perturbent le microbiote intestinal, permettant sa prolifération (26) et constitue la cause la plus fréquente de diarrhée infectieuse associée aux soins (27). C. difficile produit deux toxines majeures considérées comme étant principalement responsables de sa virulence et les principaux contributeurs à sa pathogenèse (28). Il se dissémine par contact direct entre les personnes et les surfaces contaminées à fort pouvoir de contact, tant dans les établissements de santé que dans la communauté (29) (30) (31).
L’ICD est généralement traitée par la vancomycine, le métronidazole ou la fidaxomicine en deuxième intention (32). Le C. difficile est résistant à de nombreux antibiotiques tels que les tétracyclines, l’érythromycine, la clindamycine, les pénicillines, les céphalosporines et les fluoroquinolones qui sont couramment utilisés dans le traitement des infections bactériennes en milieu clinique (33) (34). Le génome du C. difficile contient une pléthore d’éléments génétiques mobiles, qui sont transférables entre les souches de C. difficile ou entre C. difficile et d’autres espèces bactériennes, facilitant ainsi la propagation de la résistance aux antimicrobiens (35).
Les données présentées ont été limitées aux cas signalés au Programme canadien de surveillance des infections nosocomiales (PCSIN) par 55 à 82 des 89 hôpitaux déclarants entre 2016 et 2020. Les résultats ont été stratifiés par source d’acquisition (c.-à-d. associée aux soins de santé (ASS) et d’origine communautaire (OC)). L’ICD liée à la communauté est définie comme des symptômes apparaissant moins de 3 jours (< 72 heures) après l’admission sans antécédents d’hospitalisation ou de toute autre exposition aux soins dans les 12 semaines précédentes. Les calculs de mortalité ont exclu les cas où la source d’acquisition était inconnue. La méthodologie et les définitions de cas ont été décrites précédemment par le PCSIN.
Pour de plus amples informations sur les infections associées aux soins de santé, les organismes résistants aux antimicrobiens, les caractéristiques moléculaires (par exemple, les types de spa) et les tendances en matière de résistance aux antimicrobiens dans les hôpitaux participant au PCSIN, veuillez consulter la page de données interactives du PCSIN.
Principales conclusions
- Entre 2016 et 2019, les taux d’incidence des ICD associées aux soins de santé (ICD-ASS) ont diminué, une légère augmentation étant signalée en 2020. L’incidence des ICD d’origine communautaire (ICD-OC) est restée relativement stable.
- Parmi tous les cas d’ICD (ICD-ASS et ICD-OC confondus), la mortalité y étant attribuable à 30 jours était de 2,2 %.
- Au cours de cette période, un isolat d’IDC-ASS s’est révélé résistant au métronidazole, et aucun isolat résistant à la vancomycine n’a été identifié.
Résultats
Tendances de l’incidence et de la mortalité des infections à Clostridioides difficile
Le taux d’incidence des ICD-ASS a diminué de 18,2 % entre 2016 et 2019 (passant de 4,4 à 3,6 cas par 10 000 jours-patients), suivi d’une légère augmentation en 2020 à 3,8 cas par 10 000 jours-patients. La mortalité attribuable à l’ICD liée aux soins de santé dans les 30 jours suivant le diagnostic a diminué passant de 2,5 % en 2016 à 2,0 % en 2020.
Entre 2016 et 2020, l’incidence de l’ICD-OC est restée globalement stable, avec des taux fluctuant entre 1,2 et 1,4 cas par 1 000 patients-admissions. Le taux de mortalité de l’ICD-OC a varié entre 2,1 % et 4,5 % entre 2016 et 2020. Globalement, la mortalité attribuable à 30 jours pour tous les cas d’ICD a fluctué entre 2016 et 2020 (1,3 % à 2,7 %), mais est restée faible à 2,2 %.
La mortalité attribuable fait référence aux décès où l’ICD est la cause directe du décès ou a contribué au décès dans les 30 jours suivant la date du premier spécimen de laboratoire positif ou du premier spécimen histopathologique positif.
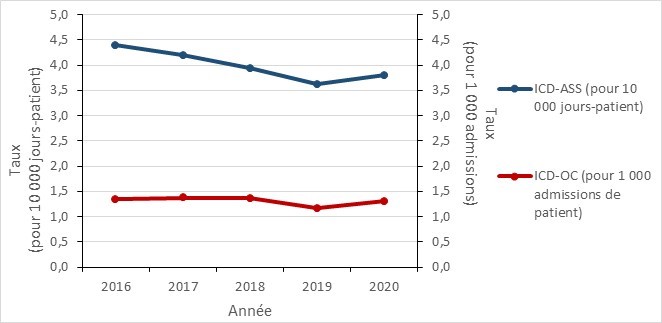
Figure 9 - Équivalent textuel
| Origine | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| ICD-ASS (pour 10 000 jours-patient) | 4,39 | 4,19 | 3,94 | 3,62 | 3,80 |
| ICD-OC (pour 1 000 admission de patient) | 1,34 | 1,37 | 1,36 | 1,17 | 1,30 |
Prévalence des ribotypes de l’ICD
Les ribotypes (RT) suivants ont été sélectionnés et signalés en raison de leur incidence élevée, de leur potentiel épidémique et de leur risque d’être associés à une résistance aux antimicrobiens.
- Le RT106 est le ribotype le plus répandu et est hautement résistant à de nombreux antimicrobiens (c.-à-d. la clindamycine, l’érythromycine, les fluoroquinolones et les céphalosporines de troisième génération) (36).
- Les RT106, le RT020 et le RT014 sont en train de devenir les courants dans les secteurs des soins de santé et dans la communauté (36) (37).
- La prévalence de la RT027 au Canada a diminué depuis 2016. Cette diminution de la prévalence a également coïncidé avec une diminution de la résistance aux fluoroquinolones.
Parmi les 339 isolats testés en 2020, le RT106 était le plus fréquent (14,7 %, n = 50), suivi du RT014 (8,0 %, n = 27) et du RT020 (7,7 %, n = 26). Les ribotypes d’ICD liées aux soins de santé prédominants étaient respectivement RT106 (15,0 %, n = 41), RT020 (8,4 %, n = 23) et RT014 (8,1 %, n = 22). Les ribotypes d’ICD liées aux soins de santé prédominants étaient respectivement RT106 (13,6 %, n = 9), RT015 (9,1 %, n = 6) et RT014 (7,6 %, n = 5).
Le RT078/126 associée au bétail qui a démontré un potentiel épidémique dans d’autres pays semble être peu fréquent parmi les patients hospitalisés atteints d’ICD au Canada (3,9 % en 2020).
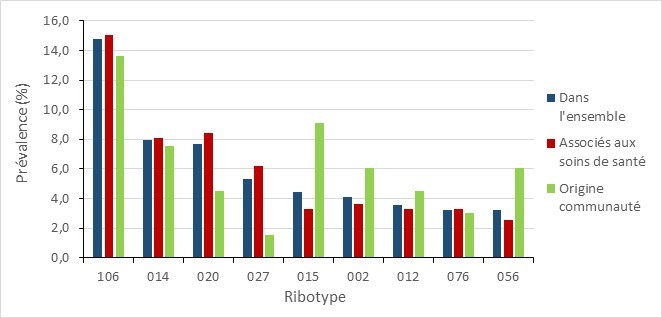
Figure 10 - Équivalent textuel
| Ribotype | Dans l’ensemble | Associés aux soins de santé | Origine communauté |
|---|---|---|---|
| 106 | 14,7 % | 15,0 % | 13,6 % |
| 014 | 8,0 % | 8,1 % | 7,6 % |
| 020 | 7,7 % | 8,4 % | 4,5 % |
| 027 | 5,3 % | 6,2 % | 1,5 % |
| 015 | 4,4 % | 3,3 % | 9,1 % |
| 002 | 4,1 % | 3,7 % | 6,1 % |
| 012 | 3,5 % | 3,3 % | 4,5 % |
| 076 | 3,2 % | 3,3 % | 3,0 % |
| 056 | 3,2 % | 2,6 % | 6,1 % |
a En raison de la COVID-19, les soumissions d’échantillons sont incomplètes. Les données présentées sont préliminaires et il convient de faire preuve de prudence lors de l’interprétation des tendances.
Test de sensibilité antimicrobienne de l’ICD
Des tests de résistance aux antimicrobiens ont été réalisés pour les isolats de C. difficile collectés entre 2016 et 2020.
La résistance aux ICD-ASS à la clindamycine a atteint un pic de 47,5 % en 2018 et a diminué de 67.6% entre 2019 et 2020. À l’exception d’un seul isolat résistant signalé en 2018, l’ICD-ASS est restée sensible au métronidazole au cours de la période de cinq ans. Aucune résistance à la vancomycine n’a été trouvée pour les isolats d’ICD-ASS. La résistance à la rifampicine a fluctué entre 0,9 % et 2,5 %, avec une moyenne de 1,6 % entre 2016 et 2020. La résistance de l’ICD-ASS à la moxifloxacine a diminué de 17,2 % en 2016 à 6,2 % en 2020.
La proportion d’isolats de l’ICD-OC résistants à la clindamycine a plus que doublé entre 2017 et 2018 (22,7 % à 52,6 %), suivie d’une diminution de 34,4 % entre 2018 et 2020. La résistance à la rifampicine est restée faible et a fluctué entre 0 % et 1,6 %. Aucune résistance à la vancomycine ou au métronidazole n’a été trouvée dans les isolats d’ICD-OC.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 494 | 526 | 474 | 440 | 273 |
| Clindamycine | 22,1 % | 21,9 % | 47,5 % | 39,3 % | 15,4 % |
| Métronidazole | 0,0 % | 0,0 % | 0,2 % | 0,0 % | 0,0 % |
| Moxifloxacine | 17,2 % | 18,6 % | 12,5 % | 11,6 % | 6,2 % |
| Rifampicine | 1,6 % | 2,5 % | 1,7 % | 0,9 % | 1,1 % |
| Tigécycline | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
| Vancomycine | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
|
aEn raison de la COVID-19, les soumissions d’échantillons pour 2020 sont incomplètes. Les données présentées sont préliminaires et il convient de faire preuve de prudence lors de l’interprétation des tendances. Les antimicrobiens inclus faisaient partie du panel d’antibiogrammes du laboratoire, ce qui peut inclure ceux qui ne font pas partie des directives de traitement. Par conséquent, certains antimicrobiens sont présentés uniquement à des fins épidémiologiques. |
|||||
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 163 | 150 | 156 | 128 | 66 |
| Clindamycine | 22,1 % | 22,7 % | 52,6 % | 37,5 % | 18,2 % |
| Métronidazole | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
| Moxifloxacine | 11,0 % | 10,7 % | 7,1 % | 11,7 % | 7,6 % |
| Rifampicine | 0,6 % | 0,7 % | 1,3 % | 1,6 % | 0,0 % |
| Tigécycline | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
| Vancomycine | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
|
aEn raison de la COVID-19, les soumissions d’échantillons pour 2020 sont incomplètes. Les données présentées sont préliminaires et il convient de faire preuve de prudence lors de l’interprétation des tendances. Les antimicrobiens inclus faisaient partie du panel d’antibiogrammes du laboratoire, ce qui peut inclure ceux qui ne font pas partie des directives de traitement. Par conséquent, certains antimicrobiens sont présentés uniquement à des fins épidémiologiques. |
|||||
Infections à Neisseria gonorrhoeae
Neisseria gonorrhoeae est un agent pathogène strictement humain qui provoque une infection sexuellement transmissible (IST) connue sous le nom de gonorrhée (38). La gonorrhée se manifeste généralement par une urétrite et une cervicite, mais peut également se présenter sous la forme d’infections rectales et pharyngées. En l’absence de traitement, la gonorrhée peut entraîner des complications graves, notamment une maladie inflammatoire pelvienne, une grossesse extra-utérine, une infertilité, une épididymite et, dans de rares cas, peut pénétrer dans des sites stériles pour devenir une infection gonococcique disséminée (39). La présence de gonorrhée peut également augmenter le risque d’acquisition et de transmission du VIH (40).
Au Canada, la gonorrhée fait l’objet d’une déclaration nationale depuis 1924 et est la deuxième infection bactérienne transmise sexuellement (ITS) la plus souvent déclarée, les taux augmentant depuis presque deux décennies (41) (42). Une résistance croissante aux antimicrobiens a été documentée dans les isolats de N. gonorrhoeae, y compris le développement de la multirésistance (MR) et d’ultrarésistance aux médicaments (UR) (43) (44). À l’échelle mondiale et au Canada, des isolats de N. gonorrhoeae présentant une sensibilité réduite aux céphalosporines à spectre étendu et une résistance accrue à l’azithromycine ont été signalés. L’identification d’isolats URM a conduit l’Organisation mondiale de la santé (OMS) à donner un avertissement voulant que la gonorrhée puisse devenir impossible à traiter en raison de la résistance à toutes les classes d’antimicrobiens disponibles (39) (40).
Les données présentées ont été limitées aux isolats de Neisseria gonorrhoeae signalés au Programme de surveillance antimicrobienne du gonocoque (GASP-Canada) de 2016 à 2020 pour les résultats de résistance aux antimicrobiens et au Système canadien de surveillance des maladies à déclaration obligatoire (SCMDO) de 2016 à 2019 pour les données d’incidence. Les isolats en double ont été supprimés lors du calcul des proportions de résistance.
La Neisseria gonorrhoeae multirésistante (MR) est défini comme une diminution de la sensibilité/résistance à un traitement actuellement recommandé (céphalosporine et azithromycine) plus une résistance à au moins deux autres antimicrobiens.
Les gonocoques ultrarésistants aux médicaments (UR) sont définis par une diminution de la sensibilité/résistance à deux traitements actuellement recommandés (céphalosporine et azithromycine) plus une résistance à au moins deux autres antimicrobiens.
D’autres détails méthodologiques se trouvent dans le rapport 2020 du Système canadien de surveillance de la résistance aux antimicrobiens (SCSRA) (45).
Principales conclusions
- Le taux d’infection de gonorrhée déclaré a augmenté de 43,9 %, passant de 65,7 à 94,3 cas par 100 000 habitants entre 2016 et 2019.
- Entre 2016 et 2020, la proportion d’isolats de N. gonorrhoeae MR cultivés a fluctué entre 6,3 % et 12,4 %, la valeur la plus faible de 6,3 % étant signalée en 2020.
- Entre 2016 et 2020, la proportion d’isolats de N. gonorrhoeae cultivés résistants à l’azithromycine variait de 6,1 % à 11,7 %, avec une médiane de 7,6 %.
- Onze cas de N. gonorrhoeae UR ont été déterminés au Canada entre 2016 et 2020. Bien que ces chiffres restent faibles, une surveillance accrue s’impose, car ces organismes peuvent menacer le succès des recommandations actuelles en matière de traitement de la gonorrhée.
Résultats
Entre 2016 et 2019, le taux de cas de gonorrhée diagnostiqués au Canada a augmenté de 43,5 %, passant de 65,7 à 94,3 cas par 100 000 habitants. Les taux d’infection par N. gonorrhoeae continuent d’être plus élevés chez les hommes.
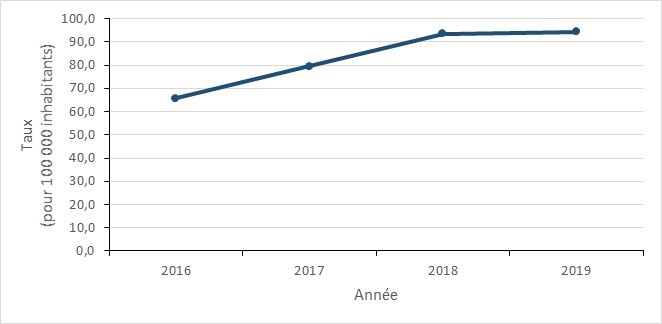
Figure 11 - Équivalent textuel
| 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|
| Taux d’incidence | 65,65 | 79,42 | 93,47 | 94,28 |
La proportion d’isolats de N. gonorrhoeae présentant une résistance à au moins un antibiotique a augmenté de 14,2 % entre 2016 et 2020; l’augmentation la plus importante a été observée entre 2019 et 2020 avec une hausse de 16,0 %, passant de 63,7 % à 73,9 %. Cependant, la proportion d’isolats de MR a montré une variabilité marquée (entre 6,3 % et 12,4 %) au cours de la période de cinq ans, avec une diminution globale de 29,2 %. Onze cas de N. gonorrhoeae UR ont été déterminés de 2016 à 2020, la majorité (63,6 %, n = 7) ayant été signalée en 2018
| Proportion d’isolats résistants par année | 2016 N (%) |
2017 N (%) |
2018 N (%) |
2019 N (%) |
2020 N (%) |
|---|---|---|---|---|---|
| Isolats testés (n) | 4 538 | 5,290 | 5,607 | 4,859 | 3,130 |
| Résistant à plusieurs médicaments (MR) | 406 (8,9 %) | 645 (12.2%) | 446 (8.0%) | 601 (12.4%) | 198 (6.3%) |
| L’ultrarésistant aux médicaments (UR) | 1 (0,02 %) | 0 (0.00%) | 7 (0.12%) | 1 (0.02%) | 2 (0.06%) |
| Résistant à au moins un antimicrobien | 2 936 (64,7 %) | 3,316 (62.7%) | 3,369 (60.1%) | 3,097 (63.7%) | 2,312 (73.9%) |
| a En raison de la pandémie de la COVID-19, moins d’isolats ont été testés en 2020. Il convient donc de faire preuve de prudence lors de l’interprétation des tendances ou des comparaisons d’une année à l’autre. | |||||
En 2020, pour la troisième année consécutive, la proportion de résistance était la plus élevée pour la ciprofloxacine (56.5 % en 2019). En conséquence, les augmentations de la résistance à l’azithromycine étaient à l’origine de l’augmentation de la gonorrhée MR. Une diminution rapide de la gonorrhée MR entre 2019 et 2020 devrait être interprétée avec précaution à cause de la COVID-19. Bien que les chiffres absolus soient faibles, la proportion d’isolats présentant une sensibilité réduite au céfixime est passée de 0,3 % (n = 14) en 2016 à 2,8 % (n = 87) en 2020. Parallèlement, la proportion d’isolats présentant une sensibilité réduite à la ceftriaxone a également diminué, passant de 1,8 % (n = 80) en 2016 à 0,9 % (n = 29) en 2020.
| Proportion d’isolats (R) et (SR) par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 4 538 | 5 290 | 5 607 | 4 859 | 3 130 |
| Azithromycine (R) | 7,2 % | 11,6 % | 7,6 % | 11,7 % | 6,1 % |
| Céfixime (SR) | 0,3 % | 0,6 % | 0,5 % | 1,5 % | 2,8 % |
| Ceftriaxone (SR) | 1,8 % | 0,6 % | 0,6 % | 0,8 % | 0,9 % |
| Ciprofloxacine (R) | 47,1 % | 50,1 % | 57,3 % | 57,0 % | 56,5 % |
| Érythromycine (R) | 31,7 % | 57,0 % | 56,0 % | 37,7 % | 32,6 % |
| Pénicilline (R) | 17,4 % | 18,9 % | 9,2 % | 7,1 % | 7,0 % |
| Tétracycline (R) | 53,3 % | 45,9 % | 47,1 % | 44,2 % | 43,1 % |
| Les antimicrobiens inclus faisaient partie du panel d’antibiogrammes du laboratoire, ce qui peut inclure ceux qui ne font pas partie des directives de traitement. Par conséquent, certains antimicrobiens sont présentés uniquement à des fins épidémiologiques. | |||||
Neisseria gonorrhoeae résistant à la ceftriaxone :
À ce jour, trois cas de Neisseria gonorrhoeae résistant à la ceftriaxone ont été signalés au Canada. Le premier cas (une femme) et le deuxième cas (un homme) ont été signalés en 2017 (46) et 2018 (47), et ont tous deux été associés à un historique de voyage. Le troisième cas (une femme) a été signalé en décembre 2021 et n’était pas lié à un voyage international (non publié, Laboratoire National de Microbiology).
Adhésion des prescripteurs aux régimes de traitement de la gonorrhée recommandés2 par l’ASPC parmi les cas de la SARGA3 : 2015 à 2020
Établi en 2013, le Système de surveillance accrue de la résistance de la gonorrhée aux antimicrobiens (SARGA) relie les données épidémiologiques, cliniques et de laboratoire sur les cas de N. gonorrhoeae au Canada. L’objectif du SARGA est de mieux comprendre les tendances actuelles de la résistance aux antimicrobiens (RAM) de N. gonorrhoeae et de soutenir le développement de lignes directrices pour le traitement de la gonorrhée et d’interventions de santé publique afin de minimiser la propagation de la gonorrhée RAM. Actuellement, quatre provinces et territoires fournissent des données au SARGA (Alberta, Manitoba, Territoires du Nord-Ouest et Nouvelle-Écosse) et le recrutement de provinces et territoires supplémentaires est en cours.
En comparant les traitements et les doses de gonorrhée prescrits pour les cas de RAM aux régimes de traitement de la gonorrhée recommandés par l’ASPC pour les années 2015 à 2020, la proportion annuelle moyenne de cas de gonorrhée RAM auxquels on a prescrit un traitement de la gonorrhée « préféré » ou « alternatif » pour les infections anogénitales et pharyngées chez les gbHARSAH, était de 94,2 % (plage : 89,1 % à 97,7 %) et 92,9 % (plage : 88,9 % à 95,8 %), respectivement. Parmi les « autres adultes » (hommes, femmes, transsexuels non gbHARSAH) atteints d’infections anogénitales et pharyngées, la proportion annuelle moyenne de ceux qui se sont vus prescrire les schémas thérapeutiques « préférés » ou « alternatifs » était de 93,6 % (plage : 91,1 % à 96,1 %) et 88,4 % (plage : 76,8 % à 96,8 %), respectivement.
Infections à Mycobacterium tuberculosis résistant aux médicaments
La tuberculose est une infection causée par la bactérie intracellulaire Mycobacterium tuberculosis (MTB) (49). Le MTB se transmet de personne à personne par des gouttelettes aérosolisées et non par contact de surface. Le MTB infecte le plus souvent les poumons, mais peut également provoquer des infections extrapulmonaires telles que la lymphadénite, la méningite et l’ostéomyélite (50) (51).
À l’échelle mondiale, malgré les progrès réalisés dans la lutte contre les principaux facteurs de la tuberculose (TB) (tels que la sous-nutrition, le tabagisme, la pollution de l’air intérieur, le diabète et la pauvreté), les infections par cet organisme restent prévalentes et constituent la première cause de décès due à un seul agent pathogène dans le monde, à l’exception de l’année 2020, où cela a été la COVID-19 (52). Pour la seule année 2019, environ 10 millions de cas de tuberculose active ont été signalés par l’Organisation mondiale de la santé (OMS), et 1,4 million de personnes sont décédées au cours de la même année (52). Au Canada, l’incidence de la tuberculose active demeure faible et relativement stable, les taux fluctuant entre 4,6 et 5,1 par 100 000 habitants entre 2010 et 2020 (53).
Le traitement de première intention de la tuberculose consiste en des thérapies combinées comprenant des antibiotiques tels que l’isoniazide, la rifampicine, le pyrazinamide et l’éthambutol (54). Cependant, les souches de MTB ont développé une résistance aux antimicrobiens, y compris une multirésistance (MR) et même une ultrarésistance aux médicaments (UR). Au Canada, la proportion de monorésistance dans les isolats récupérés de la tuberculose active a fluctué entre 6,6 et 9,1 % entre 2010 et 2020 (53).
Les données présentées sur la résistance du M. tuberculosis aux antituberculeux de première et de deuxième intention par toutes les compétences canadiennes ont été fournies par le Système canadien de surveillance des laboratoires de tuberculose (SCSLT). Des isolats provenant de cas de tuberculose déclarés positifs à la culture ont été testés pour leur sensibilité. Les résultats des cultures positives du complexe M. tuberculosis (M. tuberculosis, M. africanum, M. canetti, M. caprae, M. microti, M. pinnipedii ou M. bovis) ont été inclus dans les analyses. Les isolats de M. bovis Bacillus Calmette-Guérin (BCG) ont été exclus, car ils représentent une complication non infectieuse de la vaccination antituberculeuse souvent rencontrée chez les patients immunodéprimés. Les types de résistance aux médicaments ont été répertoriés et une tendance sur cinq ans a été évaluée :
- Monorésistance (c.-à-d. résistance à un seul médicament antituberculeux de première intention);
- Polyrésistance (c.-à-d. résistance à plus d’un médicament antituberculeux, autre que l’isoniazide et la rifampicine);
- Multirésistance (MR) (c.-à-d. résistance à au moins l’isoniazide et la rifampicine);
- Ultrarésistance aux médicaments (UR) (c.-à-d. résistance à toute fluoroquinolone, comme la ciprofloxacine et la moxifloxacine), et à au moins un des trois médicaments injectables de deuxième intention (capréomycine, kanamycine et amikacine), en plus de la multirésistance
Principales conclusions
- Entre 2016 et 2020, les taux d’incidence de l’infection à Mycobactérium tuberculosis sont restés relativement stables entre 4,7 et 5,1 cas par 100 000 habitants.
- La résistance de la tuberculose est également restée relativement stable, les MR fluctuant entre 0,9 et 1,5 % et un seul isolat de tuberculose UR ayant été signalé au cours de la période de cinq ans.
- En 2020, sur les 1 538 isolats de tuberculosis testés, les taux de résistance étaient : Résistant à 1 médicament 8,3 % (n = 128), polyrésistants 0,5 % (n = 7); et multirésistant 0,9 % (n = 14).
- Entre 2016 et 2020, un seul cas de tuberculose UR a été signalé (en 2018)
Résultats
En 2020, 1 563 cas incidents de tuberculose ont été signalés au Canada. Parmi ceux-ci, 98,4 % (n = 1 538) des isolats provenaient du complexe M. tuberculosis, avec Mycobacterium bovis représentant le 1,6 % restant (n = 25). La résistance à au moins un médicament antituberculeux a été détectée chez 9,7 % (n = 149) des isolats du complexe M. tuberculosis à culture positive, ce qui était presque entièrement lié à la monorésistance (85,9 %, n = 128). Parmi ces isolats, 79,7 % (n = 102) étaient résistants à l’isoniazide, 16,4 % (n = 21) étaient résistants au pyrazinamide et 3,9 % (n = 5) étaient résistants à la rifampicine. En 2020, 9,4 % (n = 14) et 4,7 % (n = 7) des isolats du complexe M. tuberculosis résistants étaient respectivement résistant à plusieurs médicaments et polyrésistants, et aucun isolat du complexe de M. tuberculosis n’était une tuberculose UR.
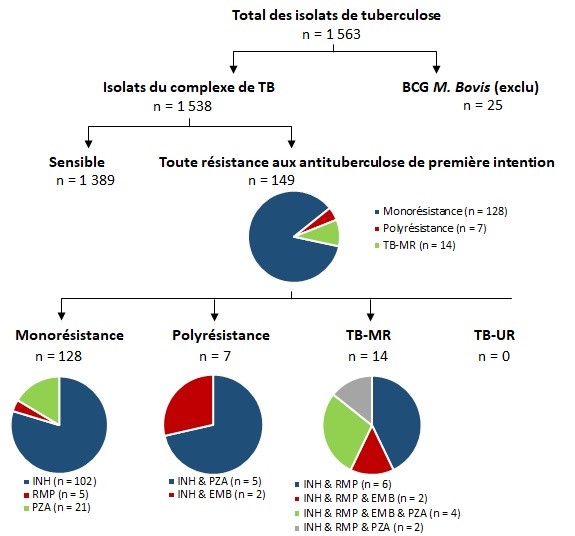
Figure 12 - Équivalent textuel
Graphiques à secteurs pour les isolats de tuberculose testés pour la résistance aux médicaments antituberculeux au Canada, en 2020. Au total, 1 563 isolats ont été testés. 25 d’entre eux étaient des isolats de bacille de Calmette-Guérin (BCG) M. Bovis; les 1 538 autres étaient des isolats du complexe Mycobacterium tuberculosis (TB). Sur les 1 538 isolats du complexe Mycobacterium tuberculosis, 1 389 étaient sensibles, tandis que les 149 restants étaient résistants aux antituberculeux de première intention. Parmi les 143 isolats résistants, 128 étaient monorésistants, 7 étaient polyrésistants et 14 étaient multirésistants. Sur les 128 isolats monorésistants, 102 étaient résistants à l’isoniazide (INH), 5 étaient résistants à la rifampicine (RMP), et 21 étaient résistants au pyrazinamide (PZA). Parmi les 14 isolats multirésistants, 6 étaient résistants à l’isoniazide et à la rifampicine; 2 était résistant à l’isoniazide, à la rifampicine et à l’éthambutol (EMB); 4 étaient résistants à l’isoniazide, à la rifampicine, à l’éthambutol et au pyrazinamide; et 2 étaient résistants à l’isoniazide, à la rifampicine et au pyrazinamide. Parmi les 7 isolats polyrésistants, 2 étaient résistants à l’isoniazide et au pyrazinamide et 2 étaient résistant à l’isoniazide et à l’éthambutol. Aucun isolat n’était ultrarésistant.
Abréviations : MTB (Mycobacterium Tuberculosis); BCG (Mycobacterium bovis); RPM (résistant à plusieurs médicaments); URM (ultrarésistant aux médicaments); INH (Isoniazide); RMP (Rifampicine); PZA (Pyrazinamide); EMB (Éthambutol).
Entre 2016 et 2020, la différence de prévalence des isolats de tuberculose résistants aux médicaments était minime pour chaque type de résistance. La résistance à l’isoniazide était la forme la plus courante de monorésistance, détectée chez 6,4 % (n = 485) des cas de tuberculose confirmés. Cette résistance a été suivie par une résistance au pyrazinamide dans 1,3 % des cas (n = 102). Cette distribution des schémas de résistance a peu changé au cours de la période de cinq ans allant de 2016 à 2020.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 1 451 | 1 522 | 1 465 | 1 630 | 1 538 |
| Monorésistant | 7,4 % | 6,6 % | 8,3 % | 9,0 % | 8,3 % |
| Polyrésistant | 0,3 % | 0,4 % | 0,3 % | 0,3 % | 0,5 % |
| Multirésistant | 1,2 % | 0,9 % | 1,5 % | 1,2 % | 0,9 % |
| Ultrarésistant | 0,0 % | 0,0 % | 0,1 % | 0,0 % | 0,0 % |
| Résistant à au moins un antimicrobien | 9,0 % | 8,0 % | 10,2 % | 10,5 % | 9,7 % |
Un seul isolat a présenté une ultrarésistance aux médicaments au cours de cette période (en 2018). La prévalence annuelle de la MR varie entre 0,9 % et 1,5 % entre 2016 et 2020.
Alors que les différences de taux de résistance entre les groupes d’âge étaient minimes en 2020, les souches du complexe de M. tuberculosis isolées chez les personnes âgées (> 65 ans) étaient relativement moins résistantes aux médicaments antituberculeux que celles isolées dans les groupes d’âge plus jeunes. Les taux de résistance par âge étaient similaires parmi les souches récupérées dans les groupes d'âge plus jeunes (0,6 cas/100 000 chez les 25-34 ans contre 0,3 cas/100 000 chez les 65-74 ans).
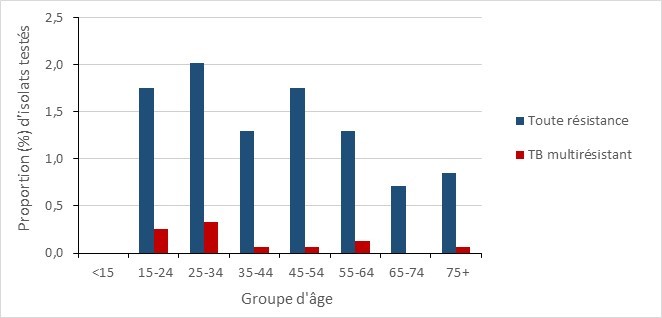
Figure 13 - Équivalent textuel
| Groupe d’âge | Toute résistance | TB multirésistant |
|---|---|---|
| <15 | 0,0 % | 0,0 % |
| 15-24 | 1,8 % | 0,3 % |
| 25-34 | 2,0 % | 0,3 % |
| 35-44 | 1,3 % | 0,1 % |
| 45-54 | 1,8 % | 0,1 % |
| 55-64 | 1,3 % | 0,1 % |
| 65-74 | 0,7 % | 0,0 % |
| 75+ | 0,8 % | 0,1 % |
La stratification par sexe a montré des proportions de résistance similaires parmi les isolats récupérés chez les femmes (9,5 % à 10,5 %) et les hommes (6,8 % à 10,5 %).
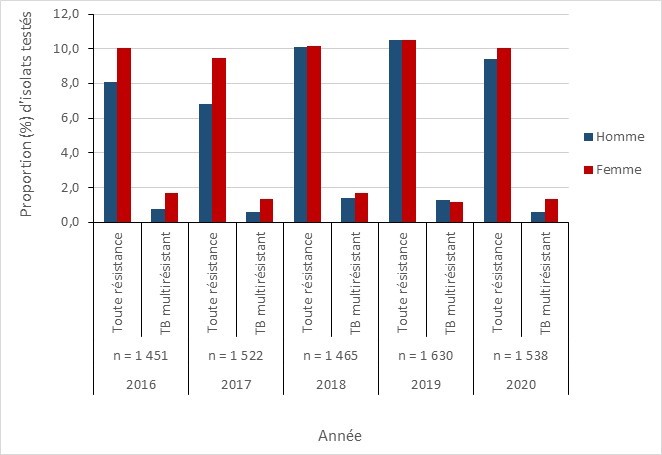
Figure 14 - Équivalent textuel
| Toute résistance | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Homme | 8,1 % | 6,8 % | 10,1 % | 10,5 % | 9,4 % |
| Femme | 10,0 % | 9,5 % | 10,1 % | 10,5 % | 10,0 % |
| TB multirésistant | 2016 | 2017 | 2018 | 2019 | 2020 |
| Homme | 0,8 % | 0,6 % | 1,4 % | 1,3 % | 0,6 % |
| Femme | 1,7 % | 1,4 % | 1,7 % | 1,1 % | 1,3 % |
Infections invasives à Streptococcus pneumoniae
Les Streptococcus pneumoniae (pneumocoques) sont des bactéries à Gram positif qui peuvent provoquer toute une série de maladies invasives. Les maladies invasives à pneumocoques (MIP) peuvent inclure la pneumonie, la septicémie et même la méningite. La MIP peut être contractée dans la communauté ou dans le secteur des soins de santé et est associée à une mortalité importante (environ 2 millions de décès annuels dans le monde) et à de graves séquelles à long terme (55). S. pneumoniae se trouve dans le nasopharynx et est transmis par les gouttelettes respiratoires. La prévalence de la colonisation asymptomatique est estimée à 5 à 10 % chez les adultes (56), avec un pic signalé chez les enfants (55). L’organisme se propage par contact direct ou indirect entre individus et peut provoquer des éclosions dans des environnements surpeuplés. Bien que la MIP puisse être prévenue par l’immunisation avec le vaccin VPC13 dans les groupes d’âge cibles, 26 % des cas d’IIP au Canada ont été causés par des sérotypes VPC13 évitables par la vaccination en 2014 (57). Les options de traitement des IIP comprennent les pénicillines (c.-à-d. l’amoxicilline-clavulanate), les céphalosporines de deuxième génération, les fluoroquinolones et les macrolides (58). Une résistance à chacun de ces agents a été signalée, y compris l’émergence de souches multirésistantes susceptibles d’accroître le risque d’échec du traitement dans certaines populations (59) (60).
Les données présentées ont été limitées aux isolats invasifs de S. pneumoniae signalés par la Surveillance nationale en laboratoire de la maladie invasive due au streptocoque (eSTREP) du Laboratoire national de microbiologie (LNM) et le Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO). Ces données sont basées sur les résultats des tests d’isolats invasifs de S. pneumoniae fournis par toutes les compétences provinciales et territoriales canadiennes au LNM.
Les points de rupture du Clinical and Laboratory Standards Institute (CLSI) ont été utilisés pour tous les isolats (CLSI M100). La ceftriaxone et la pénicilline ont été interprétées en utilisant les points de rupture du CLSI pour la méningite parentérale.
Les susceptibilités à la pénicilline et à la ceftriaxone ont été déterminées à l’aide des points de rupture du CLSI pour la méningite et la susceptibilité au céfuroxime était basée sur le point de rupture parental. Des points d’arrêt interprétatifs normalisés ont été appliqués à toutes les autres analyses de sensibilité aux antimicrobiens. Les analyses incluent la stratification par sérotypes évitables par la vaccination (VPC13) et non évitables par la vaccination (non-VPC13), mais pas la source d’acquisition.
Certaines des données peuvent être incomplètes, car certaines compétences soumettent des sous-ensembles d’isolats. En outre, les données pour l’année 2020 peuvent avoir été affectées par l’émergence de la pandémie de la COVID-19.
Une méthodologie détaillée a été publiée récemment (45) (61).
Principales conclusions
- Entre 2015 et 2019, le taux de maladies invasives à pneumocoques (MIP) a augmenté de 11,0 %, passant de 9,0 à 10,1 cas par 100 000 habitants.
- Entre 2016 et 2020, la proportion de la multirésistance a augmenté de 8,4 % à 12,3 % et de 2,8 % à 8,0 % dans les sérotypes VPC134 et non VPC13, respectivement.
- Alors que le nombre de cas reste petit (n=11), la proportion de résistance dans les isolats MIP dans le groupe âgé d'un an ou moins a augmenté de 24,6 % entre 2016 et 2020 (de 3,2 %à 27,8 %).
Résultats
Résultats de l’incidence
Entre 2015 et 2019, le taux de maladies invasives à pneumocoques (MIP) a augmenté de 11,0 %, passant de 9,0 à 10,1 cas par 100 000 habitants entre 2015 et 2019, ce qui souligne la nécessité d’améliorer l’adoption du vaccin dans le cadre des solutions visant à atténuer le fardeau épidémiologique des MIP sur les groupes vulnérables (c.-à-d. chez les enfants).
Le nombre annuel d’isolats invasifs de S. pneumoniae reçus par le LNM entre 2016 et 2020 a varié entre 2 108 et 3 673, dont un tiers (30,2 % à 34,9 % des isolats chaque année) étaient des isolats VPC13 et deux tiers des isolats non VPC13.
En 2020, les sensibilités aux antimicrobiens étaient disponibles pour 48,5 % (n = 1 022/2 108) des isolats collectés.
Résultats de la résistance
Entre 2016 et 2020, la proportion de résistance des isolats de S. pneumoniae ont augmenté pour plusieurs antimicrobiens, notamment la doxycycline (augmentation de 2,9 %) et le triméthoprime-sulfaméthoxazole (augmentation de 2,3 %). La clarithromycine a montré les niveaux de résistance les plus élevés entre 21,5 % et 25,9 %, suivie par la pénicilline avec des proportions fluctuant entre 9,9 % et 15,0 %. La résistance à la clindamycine a initialement augmenté de 4,2 % à 7,9 % entre 2016 et 2017, mais a légèrement diminué par la suite pour atteindre 7,0 % en 2020.
La résistance à la ceftriaxone est restée faible et stable (0,2 % à 0,7 %) de 2016 à 2020. La résistance aux antimicrobiens carbapénèmes est restée faible, même si de légères augmentations de la résistance à l’imipénème (0,3 % à 1,2 %) et au méropénème (0,7 % à 2,0 %) ont été constatées entre 2016 et 2020. Tous les isolats de S. pneumoniae étaient sensibles au linézolide et à la vancomycine.
La multirésistance a augmenté pour tous les groupes d’âge entre 2016 et 2020. Les proportions de résistance ont augmenté chez les personnes âgées de moins d’un an (de 3,2 % à 27,8 %). Dans les autres groupes d’âge, les proportions de résistance ont augmenté de 3,2 % à 5,6 % chez les personnes âgées d’un à quatre ans, de 4,7 % à 7,6 % chez les personnes âgées de cinq à 39 ans, de 3,8 % à 11,5 % chez les personnes âgées de 40 à 59 ans et de 4,3 % à 7,8 % chez les personnes âgées de 60 ans et plus. Ces augmentations soulignent l’importance d’une couverture vaccinale élevée et durable parmi les groupes éligibles.
En 2020, les proportions les plus élevés de multirésistance ont été identifiés dans les sérotypes 15A (non-VPC13), 19A (VPC13), 19F (VPC13) et 12F (nVPC13), soit 66,7 % (n = 18), 34,3 % (n = 12), 27,3 % (n = 6) et 25,9 % (n = 14), respectivement.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 1 114 | 1 130 | 1 784 | 1 815 | 1 022 |
| Amoxicilline/Acide clavulanique | 0,1 % | 0,4 % | 1,2 % | 0,4 % | 1,4 % |
| Ceftriaxone | 0,4 % | 0,7 % | 0,7 % | 0,2 % | 0,4 % |
| Chloramphénicol | 1,2 % | 2,0 % | 5,6 % | 3,1 % | 4,1 % |
| Clarithromycine | 21,5 % | 25,8 % | 25,9 % | 25,0 % | 23,0 % |
| Clindamycine | 4,2 % | 7,9 % | 6,8 % | 7,3 % | 7,0 % |
| Doxycycline | 8,5 % | 10,7 % | 8,5 % | 10,5 % | 11,4 % |
| Imipenem | 0,3 % | 1,4 % | 1,4 % | 0,2 % | 1,2 % |
| Lévofloxacine | 0,3 % | 0,4 % | 0,3 % | 0,6 % | 0,1 % |
| Meropénem | 0,7 % | 1,6 % | 2,0 % | 0,9 % | 2,0 % |
| Pénicilline | 12,2 % | 15,0 % | 11,2 % | 10,7 % | 9,9 % |
| Triméthoprim-Sulfaméthoxazole | 8,8 % | 10,6 % | 7,7 % | 9,5 % | 11,1 % |
| Les antimicrobiens inclus faisaient partie du panel d’antibiogrammes du laboratoire, ce qui peut inclure ceux qui ne font pas partie des directives de traitement. Par conséquent, certains antimicrobiens sont présentés uniquement à des fins épidémiologiques. | |||||
Résistance aux antimicrobiens dans les sérotypes VPC13 de S. pneumoniae
- Parmi les sérotypes du VPC13, les taux de résistance à la clarithromycine et à la doxycycline étaient les plus élevés, allant de 16,5 % à 24,1 % et de 13,9 % à 17,6 %, respectivement.
- Les taux de résistance à la pénicilline dans les sérotypes VPC13 ont augmenté de 3,2 % entre 2016 et 2017 avant de diminuer de près de 10 % de 2017 à 2020. Les taux de résistance à l’amoxicilline/acide clavulanique ont fluctué entre 0,4 % et 3,7 % entre 2016 et 2020. La résistance à la ceftriaxone est restée faible, multipliée par six entre 2016 et 2017 (de 0,4 % à 2,4 %) avant de continuer à diminuer.
- Dans l’ensemble, les sérotypes VPC13 sont restés relativement sensibles à l’imipénème et au méropénème, avec de faibles taux de résistance entre 2016 et 2020 (0,7 % et 4,4 %).
- Par catégorie de résistance, entre 2016 et 2020 :
- la proportion de sérotypes VPC13 présentant une résistance à une classe d’antimicrobiens a montré une nette tendance à la baisse (diminution de 57,1 %), passant de 14,7 % à 6,3 %;
- la résistance à deux classes d’antimicrobiens, après avoir initialement augmenté de 5,3 % à 8,5 % entre 2016 et 2017, a diminué de 58,7 % % entre 2017 et 2020;
- à l’inverse, la résistance à plusieurs médicaments (résistance à trois classes d’antimicrobiens ou plus) est restée relativement stable de 2016 à 2019, pour augmenter légèrement en 2020.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 285 | 295 | 519 | 503 | 350 |
| Amoxicilline/Acide clavulanique | 0,4 % | 1,4 % | 3,7 % | 1,4 % | 3,4 % |
| Ceftriaxone | 0,4 % | 2,4 % | 1,7 % | 0,8 % | 1,0 % |
| Chloramphénicol | 2,8 % | 5,4 % | 7,9 % | 6,6 % | 7,1 % |
| Clarithromycine | 21,1 % | 24,1 % | 22,5 % | 16,5 % | 18,6 % |
| Clindamycine | 7,0 % | 12,9 % | 11,0 % | 8,5 % | 10,9 % |
| Doxycycline | 14,7 % | 17,6 % | 13,9 % | 14,3 % | 14,6 % |
| Imipenem | 0,7 % | 4,4 % | 4,0 % | 0,8 % | 3,1 % |
| Lévofloxacine | 0,4 % | 1,0 % | 0,8 % | 0,0 % | 0,0 % |
| Meropénem | 1,4 % | 2,7 % | 4,4 % | 1,8 % | 3,7 % |
| Pénicilline | 13,7 % | 16,9 % | 10,6 % | 7,8 % | 7,1 % |
| Triméthoprim-Sulfaméthoxazole | 8,4 % | 12,5 % | 7,9 % | 5,6 % | 7,4 % |
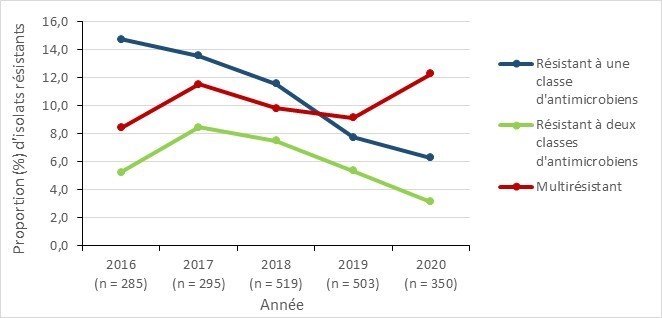
Figure 15 - Équivalent textuel
| Résistance | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Résistant à une classe d’antimicrobiens | 14,7 % | 13,6 % | 11,6 % | 7,8 % | 6,3 % |
| Résistant à deux classes d’antimicrobiens | 5,3 % | 8,5 % | 7,5 % | 5,4 % | 3,1 % |
| Multirésistant | 8,4 % | 11,5 % | 9,8 % | 9,1 % | 12,3 % |
Résistance aux antimicrobiens dans les sérotypes non VPC13 de S. pneumoniae
- Parmi les sérotypes du non VPC13, les taux de résistance à la clarithromycine et à la doxycycline étaient les plus élevés, allant de 21,7 % à 28,2 % et de 11,3 % à 14,3 %, respectivement.
- Les proportions de résistance à l’amoxicilline/acide clavulanique sont restées faibles (de non détectés en 2016 à 0,3 % en 2020).
- La résistance à la ceftriaxone, à l’imipénème et au méropénème est restée stable.
- Par catégorie de résistance, entre 2016 et 2020 :
- la proportion de multirésistance dans les sérotypes non VPC13 a augmenté de 185,7 %, passant de 2,8 % à 8,0 %;
- la résistance à deux classes d’antimicrobiens est restée stable au cours de la période de cinq ans;
- après avoir atteint un pic en 2018 à 24,6 %, la résistance à une classe d’antimicrobiens a diminué par la suite, pour atteindre 16,5 % en 2020 (diminution de 32,9 %).
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 829 | 835 | 1 265 | 1 312 | 672 |
| Amoxicilline/Acide clavulanique | 0,0 % | 0,1 % | 0,2 % | 0,0 % | 0,3 % |
| Ceftriaxone | 0,4 % | 0,1 % | 0,3 % | 0,0 % | 0,1 % |
| Chloramphénicol | 0,6 % | 0,8 % | 4,7 % | 1,8 % | 2,5 % |
| Clarithromycine | 21,7 % | 26,3 % | 27,3 % | 28,2 % | 25,3 % |
| Clindamycine | 3,3 % | 6,1 % | 5,1 % | 6,9 % | 5,1 % |
| Doxycycline | 6,4 % | 8,3 % | 6,2 % | 9,1 % | 9,8 % |
| Imipenem | 0,2 % | 0,2 % | 0,3 % | 0,0 % | 0,1 % |
| Lévofloxacine | 0,2 % | 0,2 % | 0,1 % | 0,8 % | 0,1 % |
| Meropénem | 0,5 % | 1,2 % | 1,0 % | 0,6 % | 1,0 % |
| Pénicilline | 11,7 % | 14,3 % | 11,4 % | 11,8 % | 11,3 % |
| Triméthoprim-Sulfaméthoxazole | 8,9 % | 9,9 % | 7,6 % | 11,0 % | 12,9 % |
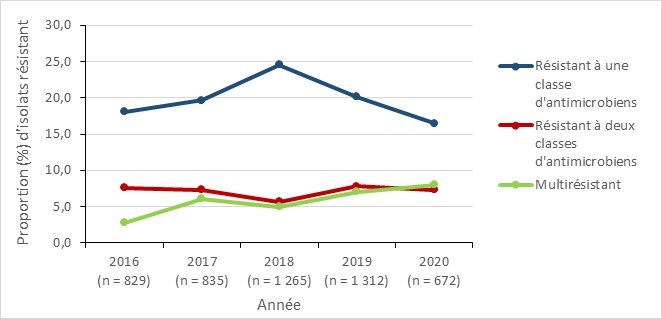
Figure 16 - Équivalent textuel
| Résistance | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Résistant à une classe d’antimicrobiens | 18,1 % | 19,6 % | 24,6 % | 20,1 % | 16,5 % |
| Résistant à deux classes d’antimicrobiens | 7,6 % | 7,3 % | 5,7 % | 7,8 % | 7,3 % |
| Multirésistant | 2,8 % | 6,1 % | 5,0 % | 7,0 % | 8,0 % |
Infections invasives à Streptococcus pyogenes (streptocoque du groupe A)
Streptococcus pyogenes ou Streptococcus du groupe A (SGA) sont des bactéries à Gram positif spécifique à l’humain et capables de coloniser la peau et la gorge (62). Le SGA se propage par les gouttelettes respiratoires, le contact direct avec les lésions cutanées ainsi que par les surfaces et équipements contaminés. Dans le monde, on estime que cet agent pathogène infecte 18,1 millions de personnes par an, entraînant un demi-million de décès chaque année (63). Au Canada, l’incidence de la maladie invasive à streptocoque du groupe A (iSGA) est passée de 4,1 à 6,7 cas par 100 000 habitants entre 2010 et 2017 (soit une hausse de 63 %), ce qui a incité l’Agence de la santé publique du Canada à renforcer sa surveillance existante de l’iGAS en 2017 (64). Les infections à streptocoques du groupe A (SGA) se présentent couramment sous la forme de pharyngites, d’impétigo et de scarlatine, mais aussi d’infections invasives plus graves, potentiellement mortelles, comme le syndrome du choc septique streptococcique, la fasciite nécrosante et la méningite. Les infections à streptocoques du groupe A peuvent également être associées à des complications post-infectieuses à médiation immunitaire telles que la glomérulonéphrite et le rhumatisme articulaire aigu (65) (66)
Les infections à iSGA sont généralement traitées par des antibiotiques à base de pénicilline et de céphalosporines ou de macrolides pour les patients allergiques aux pénicillines (67). Bien que le SGA reste largement sensible aux pénicillines et aux céphalosporines, une résistance croissante aux macrolides a été signalée (68).
Les données présentées ont été fournies par la Surveillance nationale en laboratoire de la maladie invasive due au streptocoque (eSTREP) du Laboratoire national de microbiologie (LNM) et le Système canadien de surveillance des maladies à déclaration obligatoire (SCSDO). Ces données sont basées sur les résultats des tests d’isolats fournis par toutes les compétences provinciales et territoriales canadiennes qui soumettent des données au LNM. Certaines des données peuvent être incomplètes, car certaines compétences soumettent des sous-ensembles d’isolats. En outre, les données pour l’année 2020 peuvent avoir été affectées par l’émergence de la pandémie de la COVID-19. Une méthodologie détaillée a été publiée récemment (45).
Principales conclusions
- Entre 2015 et 2019, le taux d’incidence des infections invasives à Streptococcus pyogenes a augmenté de 52,8 %, passant de 5,3 à 8,1 cas par 100 000 habitants, sous l’effet d’une hausse de 62,3 % entre 2015 et 2018.
- Parmi tous les antimicrobiens testés entre 2016 et 2020, la résistance à l’érythromycine était la plus élevée avec des niveaux compris entre 8,5 % et 11,5 % sur la période de cinq ans.
- De 2016 à 2020, Streptococcus pyogenes est resté sensible à la pénicilline et à la vancomycine.
Résultats
Entre 2015 et 2019, les données agrégées des treize provinces et territoires canadiens ont montré une augmentation de 52,8 % du taux d’incidence du Streptococcus pyogenes invasif (streptocoque du groupe A, iSGA), passant de 5,3 à 8,1 cas par 100 000 habitants. Ceci a été portée par une hausse entre 2015 et 2018 (de 5,3 à 8,6 cas par 100 000 habitants), suivie d’une baisse de 5,8 % en 2019 (8,6 à 8,1 cas par 100 000 habitants).
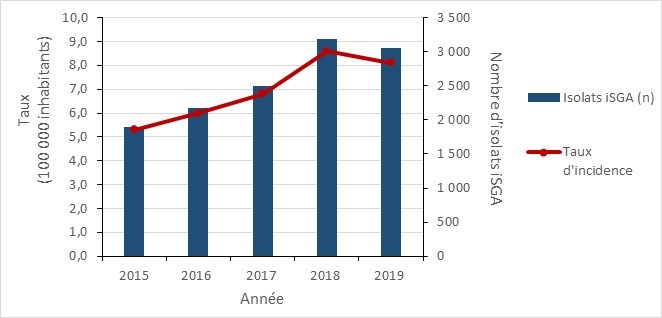
Figure 17 - Équivalent textuel
| Year | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Taux d’incidence | 5,3 | 6,0 | 6,8 | 8,6 | 8,1 |
| Isolats iSGA | 1 894 | 2 168 | 2 492 | 3 187 | 3 054 |
Entre 2016 et 2020, parmi les isolats testés pour la résistance, les proportions les plus élevés de résistance antimicrobienne ont été observés pour l’érythromycine. Bien que la résistance constitutive à la clindamycine ait augmenté initialement de 4,0 % à 6,8 % entre 2016 et 2017, une forte diminution a suivi en 2018 (à 3,4 %), et est restée stable.
Le Streptococcus pyogenes invasif est resté sensible à la pénicilline et à la vancomycine, aucun isolat résistant n’ayant été identifié au cours de la période de cinq ans.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Isolats testés (n) | 1 771 | 2 055 | 2 764 | 2 773 | 2 375 |
| Clindamycinea | 4,0 % | 6,8 % | 3,4 % | 3,0 % | 3,2 % |
| Érythromycine | 8,8 % | 10,0 % | 9,6 % | 8,5 % | 11,5 % |
| Pénicilline | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
| Vancomycine | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
|
aRésistance constitutive Les antimicrobiens inclus faisaient partie du panel d’antibiogrammes du laboratoire, ce qui peut inclure ceux qui ne font pas partie des directives de traitement. Par conséquent, certains antimicrobiens sont présentés uniquement à des fins épidémiologiques. |
|||||
La Salmonella enterica typhoïdique et non typhoïdique
Salmonella enterica est une bactérie qui provoque des gastro-entérites et la fièvre entérique (typhoïde). La gastro-entérite ou « intoxication alimentaire » peut provoquer des nausées, des vomissements, de la diarrhée et de la fièvre. La fièvre entérique ou typhoïde provoque une forte fièvre, des douleurs abdominales et des maux de tête. L’infection se produit généralement par la consommation d’aliments contaminés, le contact avec des excréments infectés ou des animaux infectés, des aliments pour animaux ou des humains. Cette bactérie a développé une résistance à de multiples antibiotiques, dont l’ampicilline, le chloramphénicol, la streptomycine, les sulfamides, la tétracycline, les fluoroquinolones et les céphalosporines à spectre étendu (69) (70).
Les données présentées ont été limitées aux isolats de Salmonella enterica (sérovars typhi, paratyphi et non typhoïdique) associés à une infection humaine soumis au Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA) entre 2016 et 2019. Une méthodologie plus poussée a déjà été publiée par le Programme intégré canadien de surveillance de la résistance aux antimicrobiens (71).
Principales conclusions
- Depuis 2016, la fréquence de la résistance à plusieurs antimicrobiens importants a augmenté dans les isolats de Salmonella récupérés lors d’une infection humaine.
- Entre 2016 et 2019, la fréquence des Salmonella typhoïdiques résistantes à la ceftriaxone est passée de moins de 0,5 % à 4,5 %.
- Entre 2016 et 2019, la fréquence des Salmonella typhoïdiques résistantes à la ceftriaxone est passée de moins de 0,5 % à 2,3 %.
- La fréquence des Salmonella non typhoïdiques résistantes à la ciprofloxacine est restée stable à 2,2 % en 2018 et 2019.
- En 2019, 12,0 % des salmonella typhoïdiques et 16,6 % des salmonelles non typhoïdiques étaient résistantes à trois classes d’antimicrobiens ou plus.
Résultats de l’antibiogramme - Salmonella enterica sérovars Typhi & Paratyphi (Typhoïde)
Le nombre d’isolats de Salmonella enterica typhoïdique soumis à des tests de laboratoire a augmenté de 162 à 308 entre 2016 et 2019. En 2019, 77,6 % (n = 239) des sérovars de Salmonella enterica typhoïdique soumis étaient Typhi, 21,1 %, (n = 65) étaient Paratyphi A, et 1,3 % étaient Paratyphi B (n = 4). La majorité a été cultivée à partir du sang (80,5 %, n = 248). Parmi les isolats soumis, la majorité provenait de l’Ontario (50,7 %, n = 156), de la Colombie-Britannique (19,8 %, n = 61) et de l’Alberta (14,0 %, n = 43).
Les fréquences relatives de résistance parmi les isolats de Salmonella enterica typhoïdique soumis sont généralement restées stables en 2019, à l’exception de la résistance croissante à la ceftriaxone. Depuis 2017, la résistance à la ceftriaxone est passée de 0,4 % (n = 1) à 2,9 % (n = 8) en 2018, puis à 4,5 % (14) en 2019. En 2019, 88,0 % (n = 271) des isolats étaient résistants à l’acide nalidixique et 20,1 % (n = 62) étaient résistants à la ciprofloxacine. Aucune résistance à l’azithromycine ou au méropénème n’a été déterminée. En 2019, 10,7 % (n = 33) des isolats de Salmonella enterica typhoïdiques étaient sensibles à tous les antimicrobiens testés; 12,0 % (n = 37) étaient résistants à trois classes d’antimicrobiens ou plus. Sur les sept classes d’antimicrobiens testées, aucun isolat de Salmonella enterica typhoïdique n’était résistant à six ou sept classes.
| Proportion d’isolats résistant par année | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|
| Isolats testés (n) | 162 | 235 | 278 | 308 |
| Ampicilline | 16,7 % | 9,8 % | 11,2 % | 11,7 % |
| Azithromycine | 0,0 % | 0,4 % | 0,0 % | 0,0 % |
| Ceftriaxone | 0,0 % | 0,4 % | 2,9 % | 4,5 % |
| Chloramphénicol | 17,9 % | 8,1 % | 10,8 % | 9,7 % |
| Ciprofloxacine | 14,2 % | 22,1 % | 18,3 % | 20,1 % |
| Gentamicine | 0,0 % | 0,0 % | 0,4 % | 0,0 % |
| Meropénem | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
| Acide nalidixique | 84,0 % | 87,2 % | 87,8 % | 88,0 % |
| Streptomycine | 22,8 % | 16,2 % | 18,7 % | 14,3 % |
| Tétracycline | 2,5 % | 3,4 % | 1,4 % | 1,9 % |
| Triméthoprim-sulfaméthoxazole | 18,5 % | 8,9 % | 10,4 % | 10,4 % |
Salmonella enterica non typhoïque
Le nombre d’isolats de Salmonella enterica typhoïdique soumis à des tests de laboratoire a augmenté de 2 371 à 1 800 entre 2016 et 2019. En 2019, 47,8 % (n = 860) des sérovars de Salmonella enterica non typhoïdiques soumis étaient Enteritidis, 16,6 % (n = 298) étaient Typhimurium et 10,2 % (n = 184) étaient Newport. La majorité a été récupérée dans des échantillons de selles (81,4 %, n = 1 465), suivis par le sang (7,6 %, n = 136) et l’urine (6,0 %, n = 108).
Les fréquences relatives de résistance parmi les isolats de Salmonella enterica non typhoïdiques soumis sont généralement restées stables en 2019, mais avec quelques exceptions. En 2019, la résistance à l’acide nalidixique a augmenté à 21,8 % (n = 392/1800). Cependant, la résistance à la ciprofloxacine, n’a que légèrement augmenté de 1,7 % (n = 40) en 2016 à 2,2 % (n = 48) en 2018 et en 2019 (2,2 %; n = 40). Depuis 2016, la résistance à l’azithromycine est passée de 0,4 % (n = 10) à 2,3 % (n = 42) en 2019. Aucune résistance au méropénem n’a été observée au cours de cette période de quatre ans. En 2019, 60,3 % (n = 1 086) des isolats de Salmonella enterica typhoïdiques étaient sensibles à tous les antimicrobiens testés; 16,6 % (n = 298) étaient résistants à trois classes d’antimicrobiens ou plus.
| Proportion d’isolats résistants par année | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|
| Isolats testés (n) | 2 371 | 2 057 | 2 190 | 1 800 |
| Ampicilline | 13.1% | 13.4% | 13.4% | 15.8% |
| Azithromycine | 0.4% | 0.8% | 1.5% | 2.3% |
| Ceftriaxone | 4.0% | 3.5% | 2.8% | 3.5% |
| Chloramphénicol | 4.7% | 7.4% | 7.8% | 9.8% |
| Ciprofloxacine | 1.7% | 1.8% | 2.2% | 2.2% |
| Gentamicine | 2.5% | 1.8% | 2.4% | 2.9% |
| Meropénem | 0.0% | 0.0% | 0.0% | 0.0% |
| Acide nalidixique | 16.2% | 19.1% | 15.2% | 21.8% |
| Streptomycine | 13.4% | 18.3% | 14.7% | 17.2% |
| Tétracycline | 12.6% | 13.8% | 16.2% | 18.2% |
| Triméthoprim-sulfaméthoxazole | 3.0% | 3.3% | 4.6% | 5.5% |
Résultats de la sensibilité aux antimicrobiens des échantillons d’urine et de sang, Réseau de la résistance aux antimicrobiens (RésRAM)
Le Réseau de la résistance aux antimicrobiens (RésRAM) est un système de surveillance de la résistance aux antimicrobiens (RAM) en laboratoire, en cours de développement au Laboratoire national de microbiologie de l’Agence de santé publique du Canada. RésRAM recueille des renseignements sur les tests de sensibilité aux antimicrobiens provenant de laboratoires cliniques et vétérinaires publics et privés, ainsi que des systèmes de surveillance de la RAM de l’ASPC. RésRAM utilise une approche intégrée « Une seule santé » qui permet une évaluation multidimensionnelle de la RAM en santé humaine et animale.
Escherichia coli (E. coli)
Les E. coli sont des bactéries à Gram négatif et font partie de l’ordre des Enterobacterales. Il s’agit d’un commensal du tractus gastro-intestinal des humains et des animaux. Les souches associées à l’environnement peuvent être trouvées dans les eaux usées et les sédiments (72).
Les souches pathogènes d’E coli peuvent provoquer des maladies diarrhéiques, des infections des voies urinaires et des septicémies intra-abdominales. Les souches productrices de toxines peuvent entraîner des pathologies graves chez l’humain, notamment la colite hémorragique et le syndrome hémolytique et urémique (73). Les souches hautement pathogènes peuvent provoquer de graves bactériémies et des méningites chez les nouveau-nés (74).
Les options thérapeutiques pour E. coli, guidées par les résultats des antibiogrammes, comprennent les quinolones, le triméthoprime-sulfaméthoxazole, les aminoglycosides, les céphalosporines et les carbapénèmes (75). L’augmentation des taux de résistance à plusieurs de ces agents peut compliquer le traitement des infections à E. coli (76) (77).
Klebsiella pneumoniae (K. pneumoniae)
Les K. pneumoniae sont des bactéries anaérobies facultatives à Gram négatif de l’ordre des Enterobacterales. Chez l’humain, la K. pneumoniae peut coloniser le tractus gastro-intestinal et les surfaces muqueuses, et on peut également le trouver sur les dispositifs médicaux et les eaux de surface (78).
La K. pneumoniae peut provoquer des pneumonies, des infections des voies urinaires, des abcès du foie, des méningites et des fasciites nécrosantes (79). La K. pneumoniae productrice de carbapénémase est capable d’hydrolyser les céphalosporines, les monobactames, les pénicillines et les carbapénèmes, ce qui rend le micro-organisme résistant à de multiples classes d’antibactériens.
Le traitement des infections à K. pneumoniae comprend les aminoglycosides, les céphalosporines, les fluoroquinolones et les carbapénèmes, et a récemment inclus les polymyximes (colistine) et la tigécycline comme traitements de dernière ligne pour les infections résistantes (80).
Staphylococcus aureus (S. aureus)
Les S. aureus sont des bactéries à Gram positif qui sont fréquemment membres du microbiote de la peau, du nez et de la gorge (81). Cet agent pathogène peut causer des infections dans n’importe quel système organique et est l’une des causes les plus fréquentes d’infections (82); causant des infections de la peau et des tissus mous, des pneumonies sous ventilation, des infections sanguines et le syndrome du choc toxique (83) (84).
Les bêta-lactamines telles que la cloxacilline ou les céphalosporines de première génération sont les traitements de première intention les plus courants pour les infections à S. aureus. Les S. aureus résistants à la méthicilline (SARM) sont des souches qui sont hautement résistantes aux bêta-lactamines et qui nécessitent un traitement avec d’autres agents comme la vancomycine, la daptomycine, le linézolide ou la tigécycline (85).
Streptococcus pneumoniae (S. pneumoniae)
Les S. pneumoniae sont des bactéries à Gram positif qui sont commensales au nasopharynx mais peuvent également provoquer des infections invasives telles que la pneumonie, la septicémie et la méningite (55).
Le traitement de S. pneumoniae invasif comprend les pénicillines, les céphalosporines, les fluoroquinolones et les macrolides (86). La résistance à la pénicilline et, dans une moindre mesure, à d’autres agents antimicrobiens, est apparue dans les isolats de S. pneumoniae, ce qui limite potentiellement leur utilité comme thérapeutique pour les infections causées par cet organisme.
Les données présentées incluent des isolats cliniques humains. Les patients hospitalisés et les patients externes sont inclus. Les isolats en double provenant des mêmes patients ont été exclus conformément aux directives du Clinical and Laboratory Standards Institute (CLSI). Les données comprennent les sites participants de l’Ontario, de l’Île-du-Prince-Édouard et de la Saskatchewan. Certaines valeurs ont été estimées en raison de la suppression de données parmi les petites cellules dans certaines régions. Les isolats non-susceptibles comprenaient ceux qui étaient résistants ainsi que les isolats qui n’étaient pas complètement susceptibles (intermédiaires), lors que pertinent.
Principales conclusions
- E. coli a montré une très faible non-sensibilité à l’ertapénème (0,5 %) dans les échantillons d’urine
- Dans l’ensemble, la K. pneumoniae isolée des échantillons de sang présentait une faible non-sensibilité aux antimicrobiens sélectionnés.
- 16,1 % des S. aureus isolés du sang étaient des SARM. La non-susceptibilité pour la clindamycine était de 34,6 %. Tous les isolats de S. aureus provenant du sang étaient sensibles à la vancomycine.
- La non-sensibilité à la clindamycine était de 34,6 %. Tous les isolats sanguins de S. aureus était sensibles à la vancomycine.
- S. pneumoniae est resté sensible à la moxifloxacine et à la vancomycine et a montré une très faible non-susceptibilité aux autres antimicrobiens (<2%), à l’exception de la pénicilline (6,6 %).
Résultats
Résultats de la sensibilité aux antimicrobiens des urines : E. coli et K. pneumoniae
En 2020, les proportions les plus élevées de non-susceptibilité dans les isolats d’E. coli étaient : ampicilline (40,4 %), amoxicilline-clavulanate (31,6 %), et ciprofloxacine (23,5 %) et triméthoprime-sulfaméthoxazole (19,9 %). Les proportions de non-susceptibilité étaient plus faibles pour l’ertapénème (0,5 %), la gentamicine (6,8 %) et la tobramycine (13,7 %).
Parmi les isolats de K. pneumoniae testés en 2020, les proportions de résistance étaient inférieures à celles observées pour les isolats d’E. coli : ciprofloxacine (9,5 %), triméthoprime-fulfaméthoxazole (7,2 %), gentamicine (1,8 %) et ertapénème (2,7 %). Comme prévu, étant donné la résistance intrinsèque de K. pneumoniae à l’ampicilline, la non-susceptibilité était très élevée (99,9 %).
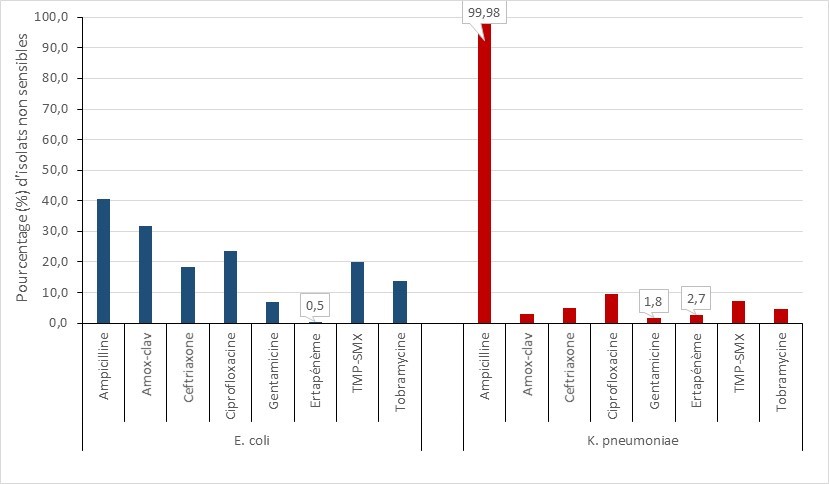
Figure 18 - Équivalent textuel
| Antibiotiques | E. coli | K. pneumoniae |
|---|---|---|
| Ampicilline | 40,4 % | 99,9 % |
| Amoxicilline/Acide Clavulanique | 31,6 % | 3,0 % |
| Ceftriaxone | 18,5 % | 5,1 % |
| Ciprofloxacine | 23,5 % | 9,5 % |
| Gentamicine | 6,8 % | 1,8 % |
| Ertapénème | 0,5 % | 2,7 % |
| Sulfaméthoxazole/triméthoprime | 19,9 % | 7,2 % |
| Tobramycine | 13,7 % | 4,6 % |
aParmi les carbapénèmes, seul l’ertapénème est présenté pour 2020 en raison des limites de l’estimation des autres carbapénèmes dans les extraits de données initiaux.
Sensibilité aux antimicrobiens à partir du sang : E. coli, K. pneumoniae, S. aureus, et S. pneumoniae
Parmi les échantillons de sang collectés en 2020, les proportions de non-susceptibilité pour l’E. coli étaient : ciprofloxacine (30,2 %), pipéracilline-tazobactam (25,1 %) et triméthoprime/sulfaméthoxazole (TMP-SMX) (25,1 %). Les proportions de non-susceptibilité étaient plus faibles pour la ceftriaxone (21,3 %), la tobramycine (10,0 %) et la gentamicine (8,8 %).
Parmi les S. aureus isolés du sang, 16,1 % étaient des SARM (non sensibles à la cloxacilline/oxacilline). La proportion de non-susceptibilité à la clindamycine était de 34,6 % parmi les isolats de S. aureus. Les proportions de non-susceptibilité pour l’érythromycine et le TMP-SMX étaient de 28,7 %. Tous les isolats de S. aureus étaient sensibles à la vancomycine.
Pour les isolats de S. pneumoniae provenant d’échantillons de sang, les taux de non-susceptibilité étaient globalement faibles. Le taux de non-susceptibilité à la pénicilline était de 6,6 %, suivi par la ceftriaxone (1,8 %) et la lévofloxacine (0,8 %). Tous les isolats de S. pneumoniae étaient sensibles au linézolide et à la vancomycine. Ces résultats semblent comparables aux résultats de résistance trouvés dans la littérature scientifique; la résistance de S. aureus a été trouvée à 13,4 % pour l’oxacilline, et plus élevée pour la SMX-TMP et pour l’érythromycine, à 15,5 % et 65,9 %, respectivement.
Pour les isolats sanguins de S. pneumoniae, les proportions de non-susceptibilité étaient faibles en général. Le taux de non-susceptibilité à la pénicilline était de 6,6 %, suivi par la ceftriaxone (1,8 %) et la lévofloxacine (0,8 %). Tous les isolats de S. pneumoniae étaient sensibles à la moxifloxacine et à la vancomycine.
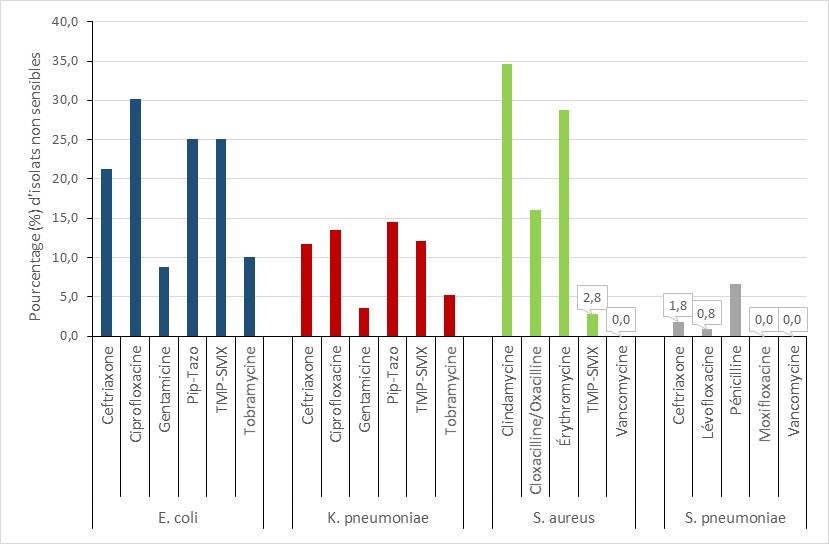
Figure 19 - Équivalent textuel
| Antibiotique | E. coli | K. pneumoniae | S. aureus | S. pneumoniae |
|---|---|---|---|---|
| Ceftriaxone | 21,2 % | 11,8 % | n/a | 1,8 % |
| Ciprofloxacine | 30,2 % | 13,4 % | n/a | n/a |
| Clindamycine | n/a | n/a | 34,6 % | n/a |
| Cloxacilline/Oxacilline | n/a | n/a | 16,0 % | n/a |
| Érythromycine | n/a | n/a | 28,7 % | n/a |
| Gentamicine | 8,8 % | 3,6 % | n/a | n/a |
| Lévofloxacine | n/a | n/a | n/a | 0,8 % |
| Pénicilline | n/a | n/a | n/a | 6,6 % |
| Moxifloxacine | n/a | n/a | n/a | 0,0 % |
| Pipéracilline/tazobactam | 25,1 % | 14,5 % | n/a | n/a |
| Sulfaméthoxazole/Triméthoprime | 25,1 % | 12,1 % | 2,8 % | n/a |
| Tobramycine | 10,0 % | 5,3 % | n/a | n/a |
| Vancomycine | n/a | n/a | 0,0 % | 0,0 % |
Utilisation des antimicrobiens (UAM) chez les humains
Consommation d’antimicrobiens chez les humains au Canada, 2017 à 2021
La mauvaise utilisation et la surutilisation des antibiotiques est un facteur bien connu d'accélération du taux de RAM. L'Agence de la santé publique du Canada utilise les achats d'antibiotiques pour utilisation chez les humains dans les secteurs de la santé et les antibiotiques délivrés par les pharmacies de détail comme indicateur de la consommation humaine d'antimicrobiens afin de surveiller les tendances de l'utilisation des antimicrobiens à l'échelle nationale et régionale
La consommation humaine d’antimicrobiens au Canada est estimée à partir de deux sources IQVIA : Canadian Drugstore & Hospital Purchases (CDH) et le Canadian Compuscript (CS). Le CDH fournit des projections du volume en dollars et en unités des produits pharmaceutiques et diagnostiques achetés par les pharmacies de détail et les établissements de soins de santé canadiens à l’échelle provinciale. Les données du CDH sont des estimations et non des données de recensement et les antibiotiques retournés sont reflétés dans les données. CS assure la projection des prescriptions de produits pharmaceutiques dans les pharmacies du Canada à l’échelle provinciale. Dans la section suivante, bien que tous les antibiotiques vendus ne soient pas consommés, les achats des secteurs de la santé et les prescriptions d’antibiotiques délivrées dans la communauté seront utilisés comme une approximation de la consommation humaine nationale d’antimicrobiens. L’achat d’antibiotiques par les hôpitaux reflétera la consommation d’antimicrobiens dans le secteur des soins de santé, tandis que les antibiotiques délivrés dans les pharmacies de détail refléteront la consommation d’antimicrobiens dans le secteur communautaire.
Clause de non-responsabilité : Les déclarations, constatations, conclusions, points de vue et opinions exprimés dans ce rapport sont fondés en partie sur des données obtenues sous licence d’IQVIA Solutions Canada Inc. concernant le ou les services d’information suivants : Compuscrit, [de : Janvier, 2017 à : Avril 2022]. Tous droits réservés. Les déclarations, constatations, conclusions, points de vue et opinions exprimés dans ce document ne sont pas nécessairement ceux d’IQVIA Inc. ou de l’une de ses entités affiliées ou filiales.
Principales conclusions
Entre 2017 et 2021 :
- La consommation globale d’antimicrobiens au Canada a diminué de 26,9 % lorsqu'elle est mesurée en doses thérapeutiques quotidiennes (DDD) avec des tendances à la baisse dans toutes les compétences.
- La consommation d’antimicrobiens dans les secteurs communautaires et des soins de santé a diminué de 25,3 % et 27,0 %, respectivement.
- La consommation de médicaments antimicrobiens dans la catégorie « Accès » de l’AWaRe au Canada continue de dépasser le point de référence de l’OMS selon lequel 60 % de la consommation totale de médicaments proviennent du groupe « Accès ». En 2021, près de 73,6 % de la consommation totale d’antimicrobiens au Canada provenait du groupe « Accès ».
- Les médicaments « Accès » représentaient 75,8 % de l’utilisation dans le secteur communautaire, mais seulement 49,3 % de l’utilisation dans le secteur des soins de santé.
- La consommation antimicrobienne des médicaments de la catégorie AWaRe « À surveiller » a diminué de 45,1 % entre 2017 et 2021. Les secteurs des collectivités et des soins de santé ont tous deux connu une baisse de l’utilisation de la fonction « À surveiller », respectivement de 47,8 % et 23,8 %.
- La consommation de médicaments dans la catégorie « De réserve » de l’AWaRe a augmenté de 24,5 %, grâce à une hausse de 43,1 % dans le secteur des soins de santé. Le secteur communautaire a connu une baisse de la consommation de 4,1 %. Malgré cette augmentation, la proportion totale d’antimicrobiens consommés dans la catégorie « De réserve » reste à 0,2 %.
- La consommation de daptomycine a été le moteur de l’augmentation des médicaments de « De réserve », avec une hausse de 68,3 % dans le secteur des soins de santé et de 38,0 % dans la communauté.
- La consommation globale de carbapénèmes a diminué de 32,8 %, en raison d’une baisse de 50,6 % dans le secteur des soins de santé. En revanche, le secteur communautaire a connu une augmentation de 21,4 %.
Perspective nationales
Consommation humaine nationale d’antimicrobiens, achetés par le secteur des soins de santé et délivrés par les pharmacies de détail (DDD par 1 000 jours-habitants)
Entre 2017 et 2021, la consommation nationale d’antimicrobiens a diminué de 26,9 %, passant de 17,0 à 12,5 DDD par 1 000 jours- habitants. Entre 2017 et 2021, le secteur des soins de santé et le secteur communautaire ont connu des baisses respectives de 25,3 % (1,4 à 1,0 DDD par 1 000 jours-habitants) et 27,0 % (15,7 à 11,4 DDD par 1 000 jours-habitants). Au cours de cette période de cinq ans, au moins 90,0 % des antimicrobiens (DDD par 1 000 jours-habitants) ont été délivrés dans la communauté.
Entre 2017 et 2021, le montant annuel national dépensé pour les antibiotiques, les soins de santé et les secteurs communautaires combinés, (dollars ajustés selon l’inflation) a diminué de 32,0 %, passant de 883,2 millions $ en 2017 à 600,3 millions $ en 2021.
- Les dépenses en antimicrobiens dans la communauté ont diminué de 34,4 % et avec une baisse progressive et continue entre 2017 et 2021.
- Le montant annuel dépensé en antibiotiques dans le secteur de la santé a diminué de 14,4 % entre 2017 et 2021, principalement sous l’effet d’une baisse de 19,2 % entre 2019 et 2021.
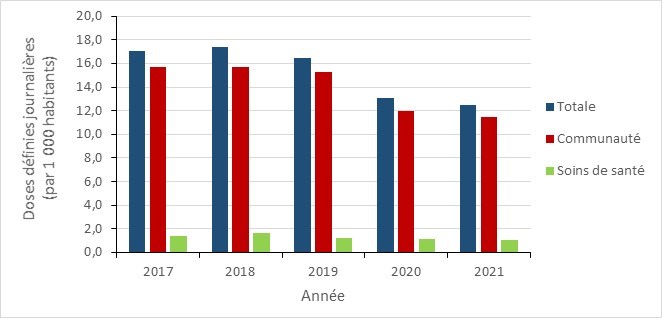
Figure 20 - Équivalent textuel
| Sector | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| Communauté | 15,7 | 15,7 | 15,2 | 12,0 | 11,4 |
| Soins de santé | 1,4 | 1,7 | 1,2 | 1,1 | 1,0 |
| Total | 17,0 | 17,4 | 16,4 | 13,1 | 12,5 |
Juridiction Canadienne – provinces
Entre 2017 et 2021, toutes les compétences canadiennes ont connu une diminution de leur consommation d’antimicrobiens. Alors que le Canada atlantique avait la consommation d’antimicrobiens la plus élevée en 2021 (5 794,1 DDD par 1 000 habitants), cette région a connu la deuxième plus forte diminution au cours de la période de cinq ans (de 28,7 %) après les Prairies qui ont connu une diminution de 28,9 %. À l’inverse, l’Ontario affiche la plus faible diminution de la consommation d’antimicrobiens, à 24,8 % entre 2017 et 2021. Parmi toutes les juridictions canadiennes, le Québec a enregistré la plus faible consommation d’antimicrobiens au cours de la période de cinq ans, avec une moyenne de 5 048,5 DDD par 1 000 habitants.
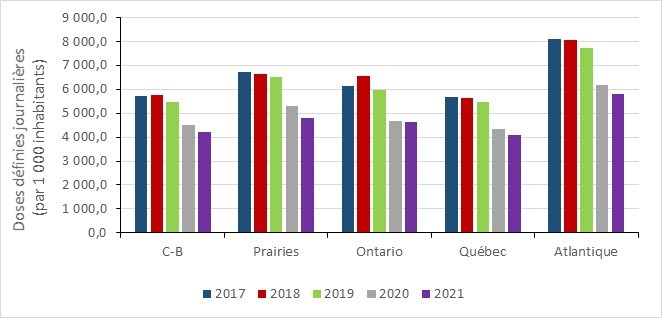
Figure 21 - Équivalent textuel
| Jurisdiction | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| C-B | 5 722,8 | 5 745,9 | 5 454,3 | 4 505,3 | 4 208,0 |
| Prairies | 6 727,5 | 6 661,5 | 6 534,9 | 5 292,0 | 4 783,6 |
| Ont | 6 144,2 | 6 557,8 | 5 963,8 | 4 692,1 | 4 620,9 |
| Qc | 5 676,1 | 5 653,8 | 5 483,3 | 4 357,5 | 4 072,0 |
| Atlantique | 8 122,5 | 8 057,6 | 7 722,1 | 6 183,5 | 5 794,1 |
Prairies : Alberta, Saskatchewan et Manitoba
Atlantique : Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard et Terre-Neuve-et-Labrador.
Améliorer l'utilisation des antimicrobiens au Canada - Utiliser les données pour éclairer l'action
L’Agence de la Santé publique du Canada (ASPC) estime la quantité d’antimicrobiens utilisée par les humains au Canada grâce aux données fournies par IQVIA, un fournisseur d’informations sur la vente et la distribution de produits pharmaceutiques dans plus de 100 pays. Ces résultats, récemment publiés par le Système Canadien de Surveillance de la Résistance aux Antimicrobiens (SCSRA), ont régulièrement identifié certaines provinces de l’Atlantique comme étant les plus grands consommateurs d’antimicrobiens par habitant au Canada. Ces tendances, complétées par un nombre croissant de données probantes, ont poussé les représentants de Terre-Neuve-et-Labrador (T.-N.’L.) à passer à l’action.
Par l’intermédiaire du Centre d’information sur la Santé de Terre-Neuve-et-Labrador (NLCHI), un système qui rassemble des données à l’échelle de la province sur chaque prescription de patient externe délivrée par les pharmacies communautaires, une enquête a aidé à identifier les pratiques de prescription spécifiques qui contribuaient à la surutilisation des antimicrobiens – notamment les prescriptions de longue durée, les prescripteurs à taux élevés et habitants à taux élevés de prescriptions. Alors que les travaux se poursuivent pour développer les méthodes nécessaires pour identifier d’autres pratiques de prescription inappropriées d’antimicrobiens, les résultats récents du NLCHI montrent que l’utilisation d’antimicrobiens à T.-N.-L. a diminué de 34 % entre 2017 et 2021*. Cela complète les résultats récents du SCSRA, qui montrent que l’utilisation d’antimicrobiens dans les provinces de l’Atlantique a diminué de 29 % au cours de la même période. Ces résultats démontrent comment l’utilisation des données de prescriptions peut servir de modèle pour réduire l’utilisation d’antimicrobiens dans d’autres juridictions canadiennes.
Les estimations nationales continuent d’identifier la région de l’Atlantique comme étant la plus grande consommatrice d’antimicrobiens par habitant au Canada; cependant, on attribue à ces provinces l’une des plus importantes diminutions de l’utilisation d’antimicrobiens au cours de la période de cinq ans.
*Résultats partagés avec l’ASPC par communication personnelle et non publiés au moment de la publication du rapport SCSRA 2022.
Les cinq principales classes d’antimicrobiens
Consommation nationale des cinq principales classes d’antimicrobiens, achetés par les services de santé et délivrés par les pharmacies de détail, 2017 à 2021
- Au cours de la période de cinq ans allant de 2017 à 2021, les cinq principaux antimicrobiens consommés au niveau national sont restés les mêmes et similaires à ceux consommés dans le secteur communautaire. Il s’agit (de la consommation la plus élevée à la plus faible en DDD par 1 000 habitants) des tétracyclines, des pénicillines, des céphalosporines de première génération, des macrolides et des inhibiteurs de bêta-lactamase.
- Cependant, les cinq antimicrobiens les plus consommés entre 2017 et 2021 étaient différents dans le secteur de la santé. Il s’agissait (de la consommation la plus élevée à la plus faible en DDD par 1 000 habitants) : des céphalosporines de deuxième et troisième générations (données combinées), des céphalosporines de première génération, des macrolides et des inhibiteurs de bêta-lactamase.
- Aux trois niveaux (national, communautaire et soins de santé), à l’exception des tétracyclines dont la consommation a augmenté, tous les autres antimicrobiens du top 5 ont vu leur consommation diminuer entre 2017 et 2021.
- En 2021, les cinq principales classes d’antimicrobiens consommées au Canada étaient les tétracyclines (1 149,5 DDD par 1 000 habitants), les pénicillines (839,3 DDD par 1 000 habitants), les céphalosporines de première génération (425,1 DDD par 1 000 habitants), les macrolides (372,5 DDD par 1 000 habitants) et les inhibiteurs de bêta-lactamase (356,6 DDD par 1 000 habitants). Alors que la consommation de quatre de ces classes d’antimicrobiens a diminué entre 2017 et 2021, celle des tétracyclines a augmenté de 8,3 %, passant de 1 061,8 en 2017 à 1 149,5 DTQ par 1 000 habitants en 2021.
- Les cinq principales classes d’antimicrobiens délivrées dans le secteur communautaire au Canada en 2021 étaient les tétracyclines (1 094,5 DDD par 1 000 habitants), les pénicillines (812,9 DDD par 1 000 habitants), les céphalosporines de première génération (388,1 DDD par 1 000 habitants), les macrolides (334,4 DDD par 1 000 habitants) et les fluoroquinolones (318,0 DDD par 1 000 habitants).
- En raison de la nature des rendements dans les données du secteur de la santé, les classements sont déterminés sur la base des données de 2019, mais les achats présentés sont de 2021. Les cinq principales classes d’antimicrobiens achetés dans le secteur de la santé en étaient les céphalosporines de première génération (36,9 DDD par 1 000 habitants), les céphalosporines de deuxième et troisième génération (53,4 DDD par 1 000 habitants), les macrolides (38,1 DDD par 1 000 habitants), les inhibiteurs de la bêta-lactamase (44,9 DDD par 1 000 habitants) et les tétracyclines (54,9 DDD par 1 000 habitants).
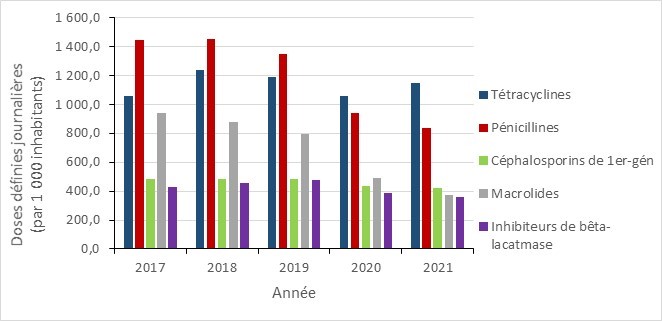
Figure 22 - Équivalent textuel
| Catégories d’antimicrobiens | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| Tétracyclines | 1 061,6 | 1 238,2 | 1 186,7 | 1 058,4 | 1 149,3 |
| Pénicillines | 1 444,1 | 1 451,9 | 1 349,1 | 937,6 | 839,3 |
| Céphalosporines de première génération | 482,8 | 483,3 | 482,8 | 437,7 | 425,1 |
| Macrolides | 941,2 | 875,8 | 795,4 | 493,9 | 372,5 |
| Inhibiteurs de bêta-lactamase | 428,6 | 454,8 | 479,2 | 385,4 | 356,6 |
Les antimicrobiens AWaRe
En 2017, l’organisation mondiale de la santé (OMS) a introduit un système de classification par paliers pour les antibiotiques. Le système classe les antibiotiques en trois groupes de gestion : « Accès », « À surveiller » et « De réserve », pour souligner l’importance de leurs utilisations optimales en médecine humaine et le potentiel de résistance aux antimicrobiens (OMS, 2021).
Accès
- Les antibiotiques du groupe « Access » sont généralement utilisés pour traiter les infections causées par des organismes couramment sensibles et présentant un risque de résistance plus faible que ceux des catégories « À surveiller » et « De réserve ».
- Au cours de la période de cinq ans de 2017 à 2021, de tous les médicaments antimicrobiens consommés par les humains dans le groupe « Accès » ont représenté 68,7 %. Alors que la consommation globale d’antimicrobiens a diminué entre 2017 et 2021, la consommation d’antimicrobiens dans le groupe « Accès » a présenté une baisse de 17,2 % (4 041,4 à 3 346,1 DDD par 1 000 habitants) sur cette période. Cependant, le Canada continue d’enregistrer une augmentation de la proportion de médicaments consommés dans le groupe « Accès ». En 2017, 65 % du total des antimicrobiens consommés appartenaient au groupe « Accès ». Cette proportion passera à 74 % en 2021.
- Ces tendances se reflètent dans le secteur communautaire avec une diminution de 16,5 % (3 787,8 à 3 163,6 DDD par 1 000 habitants) de la consommation « Accès » et une augmentation de la proportion de la consommation de 66,2 % en 2017 à 75,8 % en 2021.
- Le secteur des soins de santé a connu une diminution de 28,0 % (253,6 à 182,5 DDD par 1 000 habitants). Toutefois, la proportion de médicaments consommés dans le groupe Accès est restée stable autour de 50 % (51,2 % en 2017 et 49,3 % en 2021).
À surveiller
- Les antibiotiques du groupe « À surveiller » sont des médicaments à fort potentiel de résistance. Ils sont généralement utilisés dans le cadre de traitements de première ou de deuxième intention.
- Le groupe « À surveiller » a représenté 26,2 % de la consommation totale d’antibiotiques en 2021, au total. Entre 2017 et 2021, la consommation d’antibiotiques « À surveiller » a diminué de 45,1 %, passant de 2 167,4 à 1 188,9 DDD par 1 000 habitants.
- Dans le secteur communautaire, le groupe « À surveiller » représente 24,1 % de la consommation totale d’antibiotiques en 2021. Entre 2017 et 2021, la consommation d’antibiotiques « À surveiller » dans le secteur communautaire a diminué de 47,8 %, passant de 1 930,4 à 1 008,2 DDD par 1 000 habitants.
- En 2021, la proportion des secteurs des soins de santé « À surveiller » était de 48,8 %. La consommation de « À surveiller » a diminué de 23,8 % (237,0 à 180,7 DDD par 1 000 habitants) entre 2017 et 2021.
De réserve
- Les antibiotiques du groupe « De réserve » sont considérés comme des médicaments de dernier recours, utilisés pour traiter les infections causées par des organismes résistants à plusieurs médicaments.
- Entre 2017 et 2021, la consommation humaine d’antibiotiques de « De réserve » a augmenté de 24,5 %, passant de 8,1 à 10,1 DDD par 1 000 habitants. Cependant, il est important de noter que les médicaments « De réserve » consommés en 2021 ne représentaient que 0,2 % de la consommation totale d’antimicrobiens.
- Une augmentation de 43,1 % (4,9 à 7,1 DDD par 1 000 habitants) des achats de soins de santé est à l’origine de la hausse de la consommation nationale.
- À l’inverse, la dispensation communautaire a diminué de 4,1 % (3,2 à 3,1 DDD par 1 000 habitants) au cours de la même période de cinq ans.
- Les médicaments « De réserve » représentaient 0,1 % et 1,9 % de la consommation dans les secteurs communautaires et des soins de santé, respectivement.
- Entre 2017 et 2021, la daptomycine est l’antimicrobien le plus consommé dans le groupe « De réserve » (6,4 DDD par 1 000 habitants en 2021 au niveau national). Sa consommation a augmenté de 65,8 %, soit la plus forte augmentation par rapport aux autres drogues du groupe « De réserve ».
- La consommation de daptomycine a augmenté de 68,3 % dans le secteur de la santé (de 3,5 en 2017 à 5,9 DDD par 1 000 habitants en 2021).
- De plus, sa consommation a augmenté de 38,0 % dans la communauté (de 0,3 en 2017 à 0,4 DDD par 1 000 habitants en 2021).
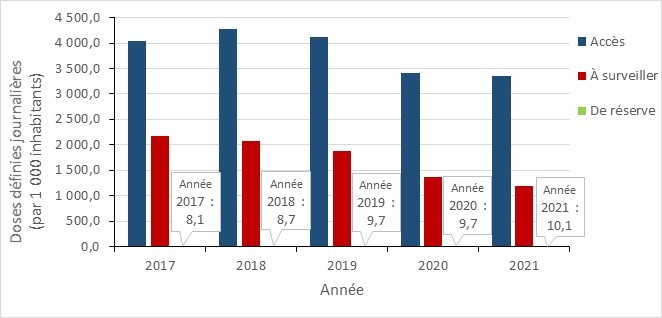
Figure 23 - Équivalent textuel
| Classe d’antimicrobiens AWaRe | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| Accès | 4 041,4 | 4 277,5 | 4 118,5 | 3 410,1 | 3 346,1 |
| À surveiller | 2 167,4 | 2 071,0 | 1 874,9 | 1 377,0 | 1 188,9 |
| De réserve | 8,1 | 8,7 | 9,7 | 9,7 | 10,1 |
Consommation d’antimicrobiens de la classe des carbapénèmes
- La classe antimicrobienne des carbapénèmes est utilisée pour traiter les infections dues à des organismes résistants à plusieurs médicaments. La consommation nationale globale de ces médicaments a diminué de 32,8 % (22,5 à 15,2 DDD par 1 000 habitants) entre 2017 et 2021.
- La consommation de carbapénèmes dans le secteur de la santé a diminué de 50,6 % (de 17,0 à 8,4 DDD par 1 000 habitants) entre 2017 et 2021.
- Le secteur communautaire a connu une augmentation de 21,4 % (5,6 à 6,8 DDD par 1 000 habitants) au cours de la même période.
- En 2021, l’ertapénème et le méropénème représentaient la majeure partie de l’utilisation des antimicrobiens de la classe des carbépénèmes (52,0 % et 42,6 %, respectivement). La consommation annuelle nationale d’ertapénème a diminué de 21,0 % (10,0 à 7,9 DDD par 1 000 habitants) entre 2017 et 2021.
- Le secteur des soins de santé a diminué de 43,8 % (5,8 à 3,2 DDD par 1 000 habitants) et le secteur communautaire a augmenté de 10,0 % (4,2 à 4,6 DDD par 1 000 habitants).
- La consommation nationale de méropénème a diminué de 27,7 % (8,9 à 6,5 DDD par 1 000 habitants).
- Le secteur des soins de santé a diminué de 41,3 % (7,6 à 4,5 DDD pour 1 000 habitants) et le secteur communautaire a augmenté de 51,7 % (1,3 à 2,0 DDD par 1 000 habitants).
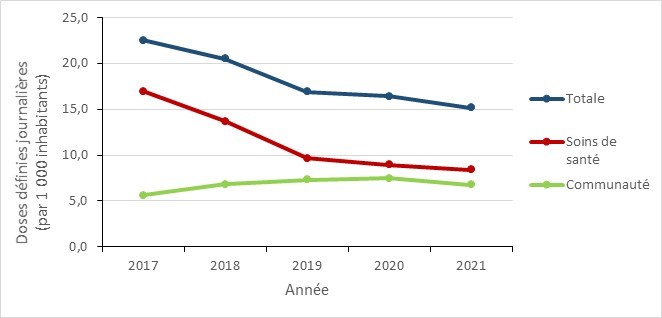
Figure 24 - Équivalent textuel
| Secteur | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| Communauté | 5,6 | 6,8 | 7,3 | 7,4 | 6,8 |
| Soins de santé | 17,0 | 13,7 | 9,6 | 8,9 | 8,4 |
| Total | 22,5 | 20,5 | 16,9 | 16,4 | 15,2 |
Consommation globale d’antimicrobiens par l’humain en 2020 : perspective internationale
Le European Surveillance of Antimicrobial Consumption Network (ESAC-Net), l’un des plus grands systèmes de surveillance normalisés au niveau international mesurant la consommation d’antimicrobiens, collecte et communique des données sur la quantité d’antimicrobiens J01 consommés dans les secteurs communautaires et des soins de santé dans les pays européens. Ces données, rapportées en DDD par 1 000 jours-habitants, étaient comparables aux données canadiennes sur la consommation d’antimicrobiens chez les humain.
En 2020, vingt-neuf pays (27 États membres de l’Union européenne et deux pays de l’Espace économique européen — l’Islande et la Norvège) ont communiqué des données sur la consommation d’antimicrobiens. Vingt-cinq pays ont communiqué des données concernant à la fois la consommation communautaire et la consommation de soins de santé; deux pays (l’Allemagne et l’Islande) n’ont communiqué que la consommation communautaire, et deux pays (Chypre et la République tchèque) ont communiqué la consommation totale pour les deux secteurs combinés.
Dans l’ensemble, le Canada était le dixième plus faible consommateur d’antimicrobiens par habitant en 2020, par rapport aux 30 pays européens qui déclarent au réseau ESAC-Net leur consommation totale combinée. Le Canada a consommé plus de 50,0 % d’antimicrobiens de plus que les Pays-Bas (le pays ayant la plus faible consommation) et environ la moitié de la quantité consommée par Chypre (le pays ayant la plus forte consommation).
- Par rapport aux 29 autres pays ayant communiqué des données sur le secteur communautaire, le Canada était le onzième plus faible consommateur, consommant environ 69 % de plus que l’Autriche (la plus faible utilisation communautaire déclarée) et un peu moins de la moitié de la Grèce (la plus forte utilisation communautaire déclarée).
- Dans le secteur des soins de santé, le Canada s’est classé au deuxième rang des plus petits consommateurs par rapport aux 26 autres pays ayant communiqué des données sur le secteur des soins de santé, avec une utilisation supérieure d’environ 45 % à celle des Pays-Bas et inférieure de moitié à celle de la Lituanie.
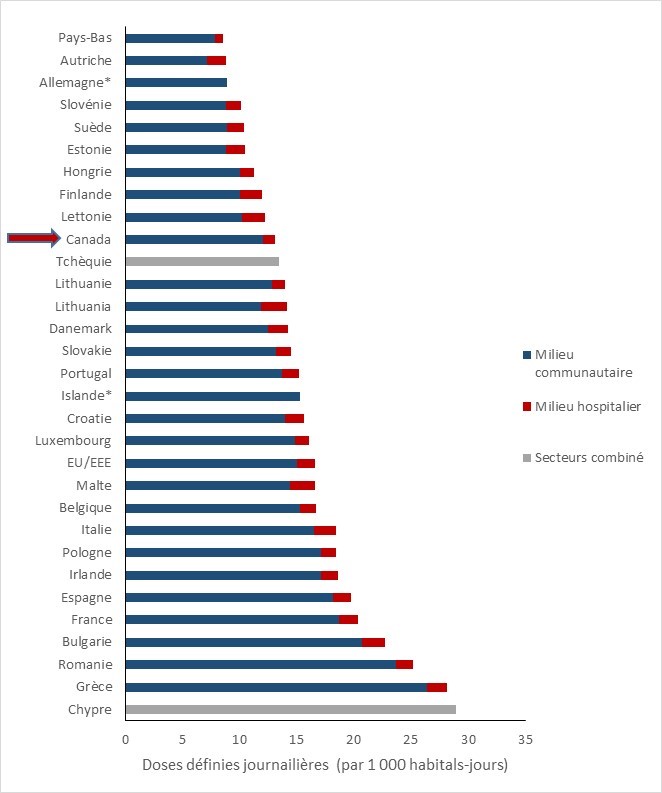
Figure 25 - Équivalent textuel
| Pays | Milieu communautaire | Milieu hospitalier | Total (tel que rapport par l’UE) |
|---|---|---|---|
| Pays-Bas | 7,8 | 0,8 | 8,5 |
| Autriche | 7,1 | 1,7 | 8,8 |
| Allemagne* | 8,9 | n/a | n/a |
| Slovénie | 8,8 | 1,3 | 10,2 |
| Suède | 8,9 | 1,4 | 10,4 |
| Estonie | 8,8 | 1,7 | 10,5 |
| Hongrie | 10,0 | 1,2 | 11,2 |
| Finlande | 10,0 | 1,9 | 11,9 |
| Lettonie | 10,2 | 2,1 | 12,3 |
| Canada | 12,0 | 1,1 | 13,1 |
| Tchéquie | n/a | n/a | 13,4 |
| Norvège | 12,8 | 1,2 | 13,9 |
| Lithuanie | 11,9 | 2,2 | 14,1 |
| Danemark | 12,5 | 1,8 | 14,3 |
| Slovaquie | 13,2 | 1,3 | 14,4 |
| Portugal | 13,7 | 1,5 | 15,2 |
| Islande* | 15,3 | n/a | n/a |
| Croatie | 14,0 | 1,6 | 15,7 |
| Luxembourg | 14,8 | 1,3 | 16,1 |
| EU/EEE* | 15,0 | 1,6 | 16,4 |
| Malte | 14,4 | 2,2 | 16,6 |
| Belgique | 15,3 | 1,4 | 16,6 |
| Italie | 16,5 | 1,9 | 18,4 |
| Pologne | 17,1 | 1,4 | 18,5 |
| Irlande | 17,1 | 1,5 | 18,6 |
| Espagne | 18,2 | 1,6 | 19,8 |
| France | 18,7 | 1,6 | 20,3 |
| Bulgarie | 20,7 | 2,0 | 22,7 |
| Roumanie | 23,7 | 1,4 | 25,2 |
| Grèce | 26,4 | 1,7 | 28,1 |
| Chypre | n/a | n/a | 28,9 |
Consommation d’antimicrobiens par l’humain dans le secteur communautaire
Prescriptions d’antimicrobiens dans le secteur communautaire
Entre 2017 et 2021, le nombre annuel de prescriptions (par jours-habitant) exécutées par les pharmacies de détail du secteur communautaire a diminué de 30,6 %, passant de 1,8 à 1,2 prescription par 1 000 jours-habitants. La baisse la plus importante est de 23,3 %, entre 2019 et 2020.
- En 2021, les pharmacies de détail ont exécuté 451,6 prescriptions pour chaque 1 000 habitants de la communauté.
- Entre 2017 et 2021, le nombre total de prescriptions a diminué de 27,3 %.
Prescriptions d’antimicrobiens délivrées par les pharmacies de détail par 1 000 habitants, stratifiées par âge et par sexe
Entre 2017 et 2021, les prescriptions annuelles d’antimicrobiens sont restées plus faibles chez les hommes que chez les femmes, dans tous les groupes d’âge. Dans l’ensemble, la délivrance de médicaments aux hommes a diminué de 32,5 % (de 533,3 à 360,2 prescriptions par 1 000 habitants) et celle des femmes de 29,4 % (de 766,9 à 541,7 prescriptions par 1 000 habitants) au cours de cette période.
En 2021, ce sont les femmes de 65 ans et plus et les hommes de 65 ans et plus qui ont reçu le plus de prescriptions (826,0 et 670,2 prescriptions par 1 000 habitants, respectivement). Ce sont les hommes de 0 à 18 ans et les femmes de la même catégorie d’âge qui ont reçu le moins de prescriptions (239,2 et 276,5 prescriptions par 1 000 habitants, respectivement).
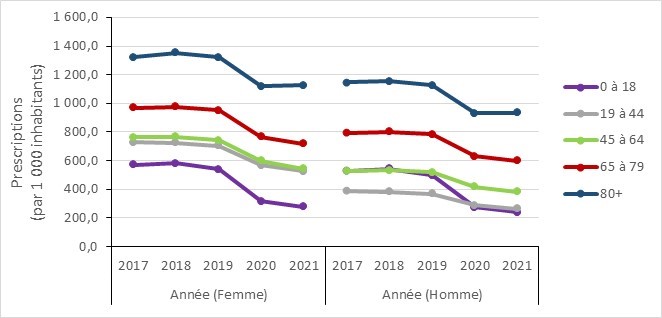
Figure 26 - Équivalent textuel
| Femme | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| 0 à 18 | 571,8 | 582,5 | 538,6 | 314,9 | 276,5 |
| 19 à 44 | 727,5 | 723,7 | 702,3 | 568,8 | 526,8 |
| 45 à 64 | 761,2 | 765,3 | 741,2 | 599,4 | 544,5 |
| 65 à 79 | 968,4 | 975,0 | 950,9 | 765,6 | 716,5 |
| 80+ | 1 322,1 | 1 354 ,0 | 1 321,6 | 1 120,3 | 1 126,3 |
| Homme | 2017 | 2018 | 2019 | 2020 | 2021 |
| 0 à 18 | 530,1 | 543,9 | 498,7 | 274,4 | 239,2 |
| 19 à 44 | 390,6 | 383,7 | 369,0 | 287,7 | 264,8 |
| 45 à 64 | 530,0 | 533,7 | 518,1 | 416,9 | 383,6 |
| 65 à 79 | 793,8 | 802,0 | 784,0 | 630,5 | 598,7 |
| 80+ | 1 146,9 | 1 152,4 | 1 125,7 | 931,7 | 933,4 |
Consommation d’antimicrobiens par l’humain dans le secteur communautaire : origine des prescriptions
Entre 2017 et 2021, une diminution de 42,8 % (387,9 à 222,0 prescriptions par 1 000 habitants) a été observée dans les taux de prescriptions provenant des médecins généralistes (MG) et des médecins de famille (MF). En 2021, les spécialistes, ou les médecins en dehors de la médecine familiale ou de la médecine générale, ont prescrit 18 % d’antimicrobiens de moins qu’en 2017. Le taux de prescriptions provenant de spécialités non médicales a diminué de 5,6 % (137,8 à 130,1 prescriptions par 1 000 habitants) entre 2017 et 2021.
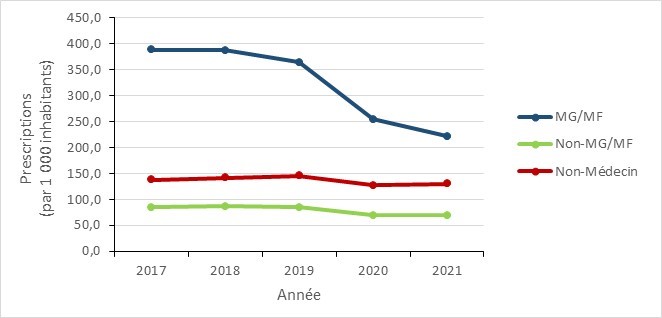
Figure 27 - Équivalent textuel
| Specialité | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| MG/MF | 387,9 | 387,4 | 364,3 | 254,4 | 222,0 |
| Non-MG/MF | 84,8 | 87,2 | 84,9 | 69,2 | 69,5 |
| Non médecin | 137,8 | 142,2 | 145,7 | 127,1 | 130,1 |
Parmi les sources non médicales, la prescription globale par les dentistes a fluctué au cours de la période de cinq ans, il y a eu une augmentation globale de 5,7 % (50,0 en 2017 à 52,8 en 2021 prescriptions par 1 000 habitants). Les prescriptions des infirmières praticiennes ont globalement augmenté de 16,0 % (13,1 en 2017 à 15,2 en 2021 prescriptions par 1 000 habitants) et celles des pharmaciens de 37,9 % (6,8 en 2017 à 9,4 en 2021 prescriptions par 1 000 habitants). Entre 2017 et 2021, le taux annuel d’antimicrobiens délivrés par les pharmaciens et les vétérinaires est resté faible, à moins de 1,1 par 1 000 habitants.
En 2021, 49,2 % des prescriptions d’antimicrobiens provenaient de médecins généralistes et de médecins de famille, 11,7 % de dentistes, 3,4 % d’infirmières praticiennes et 2,1 % de pharmaciens.
Figure 28 - Équivalent textuel
| Spécialités non médicales | 2017 | 2018 | 2019 | 2020 | 2021 |
|---|---|---|---|---|---|
| Dentistes | 50,0 | 48,7 | 51,1 | 48,7 | 52,8 |
| Infirmiers(ères) practiciens(ennes) | 13,1 | 15,0 | 17,1 | 16,1 | 15,2 |
| Optométristes | 0,8 | 0,9 | 0,9 | 0,7 | 0,7 |
| Pharmaciens(ennes) | 6,8 | 8,4 | 10,2 | 9,4 | 9,4 |
| Vétérinaires | 0,9 | 0,8 | 0,9 | 0,9 | 0,9 |
Enquête nationale canadienne sur la prescription d’antimicrobiens, 2018 à 2021
L’Enquête nationale sur la prescription d’antimicrobiens (ENPA) du Canada donne un aperçu des pratiques de prescription d’antimicrobiens dans le secteur de la santé. Les informations obtenues par cette enquête complètent les données sur l’utilisation des antimicrobiens saisies par le Programme canadien de surveillance des infections nosocomiales (PCSIN) et les données sur les achats des hôpitaux d’IQVIA, afin de soutenir l’élaboration de stratégies fondées sur des données probantes visant à améliorer les pratiques de prescription appropriées à l’échelle des hôpitaux.
L’ENPA a été piloté en 2018-2019 par le Sinai Health System-University Health Network5 pour évaluer la faisabilité de la mise en œuvre d’une version canadienne de l’ENPA australien6 basé sur le web pour la collecte de données sur les pratiques de prescription d’antimicrobiens dans l’ensemble des hôpitaux canadiens. Le succès du projet pilote dans 38 hôpitaux a jeté les bases d’une adoption nationale plus large et d’une mise en œuvre dans un plus grand nombre d’hôpitaux. En 2022, l’ENPA comprendra 119 établissements de santé dans les dix provinces (y compris les 12 hôpitaux universitaires pédiatriques du Canada). L’ENPA est un outil qui permet d’effectuer des évaluations quantitatives et qualitatives opportunes de la prescription d’antimicrobiens; elle donne un aperçu des comportements et des tendances en matière de prescription d’antibiotiques dans les hôpitaux canadiens elle permet d’effectuer des analyses comparatives; elle identifie les domaines où les pratiques de prescription diffèrent grandement de celles des autres hôpitaux; elle aide à déterminer les indications cliniques et les modèles d’utilisation des antimicrobiens pour lesquels une intervention efficace et opportune peut être mise en œuvre.
La participation des hôpitaux à l’outil ENPA canadien est volontaire. Les hôpitaux participants actuellement varient en taille et en type d’établissement.
La collecte des données pour l’ENPA est conçue pour être aussi souple et pratique que possible. Les hôpitaux collectent des données en utilisant l’une des quatre méthodes d’enquête suivantes : prévalence ponctuelle à l’échelle de l’hôpital (méthode préférée); échantillonnage aléatoire (hôpitaux de plus de 100 lits); enquête de prévalence ponctuelle répétée à l’échelle de l’hôpital (petits hôpitaux); et enquête de prévalence ponctuelle dirigée (enquêtes courtes visant à se concentrer sur un service, une spécialité, une indication ou un antimicrobien particulier tout en bénéficiant de tous les outils de rapport des enquêtes de prévalence ponctuelle à l’échelle de l’hôpital). Les hôpitaux participants réalisent au moins une enquête de prévalence ponctuelle par année de référence, mais sont libres de choisir le moment de l’enquête pendant cette période. Les années de référence sont définies comme la période de 12 mois commençant en septembre et se terminant en août de l’année suivante.
Le caractère approprié et inapproprié7 a été évalué en fonction du respect des directives approuvées, du choix de l’antimicrobien, du dosage, de la voie d’administration et de la durée.
Principales conclusions
De 2018 à 2021, sur la base de 90 audits du RNSPA provenant de 64 hôpitaux :
- 77,5 % des prescriptions d'antibiotiques dans les hôpitaux ont été jugées appropriées dans tout le Canada, avec un certain degré de variabilité régionale.
- Les prescriptions globales d'antibiotiques basées sur la catégorie AWaRe démontrent que 37,3 % des prescriptions sont issues du groupe « Accès », 60,8 % du groupe « À surveiller » et 1,8 % du groupe « De réserve ».
- Parmi les 20 antibiotiques les plus prescrits, seuls quatre antibiotiques présentaient des niveaux de prescription appropriée inférieurs à 70 % : la nitrofurantoïne (55,3 %), le céfuroxime (64,7 %), la lévofloxacine (66,5 %) et la moxifloxacine (67,9 %).
- Les spécialités présentant le plus haut niveau de pertinence en prescription d'antibiotiques étaient la pédiatrie, l'hématologie, la gynécologie, les maladies infectieuses et le VIH, et la médecine d'urgence.
Résultats
De 2018 à 2021, 90 audits de l’ENPA ont été réalisés par 64 hôpitaux, soit 23 274 patients. La majorité des analyses étaient basées sur les données reçues des enquêtes de prévalence ponctuelle à l’échelle de l’hôpital (57 %), suivies des enquêtes de prévalence ponctuelle dirigée (41 %).
Prescriptions globales d’antibiotiques (2018 à 2021) provenant de tous les hôpitaux participants à l’ENPA et stratifiées par région
Les résultats de l’enquête pilote combinée sur trois ans montrent que 77,5 % des prescriptions d’antibiotiques dans les hôpitaux ont été jugées appropriées dans tout le Canada, avec un certain degré de variabilité régionale. L’adéquation était la plus élevée dans la région de l’Ouest (81,3 %), suivie de la région du Centre (79,5 %) et de la région de l’Est (66,8 %).
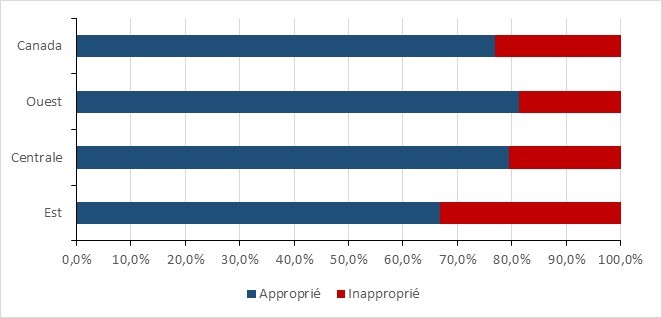
Figure 29 - Équivalent textuel
| Région | Approprié | Inapproprié |
| Canada | 77,0 % | 23,0 % |
| Ouest | 81,3 % | 18,8 % |
| Centrale | 79,5 % | 20,5 % |
| Est | 66,8 % | 33,2 % |
* Ouest : Colombie-Britannique, Alberta, Saskatchewan et Manitoba; Centre : Ontario et Québec; Est : Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve
Pertinence des prescriptions d’antibiotiques stratifiée selon la classification AWaRe de l’OMS
Les prescriptions d’antibiotiques dans l’hôpital saisies par l’ENPA ont été classées dans les trois catégories AWaRe. Les antibiotiques non inclus dans la classification AWaRe ont été exclus de ces analyses.
Entre 2018 et 2021, parmi les prescriptions d’antibiotiques saisies par l’ENPA, 60,8 % de tous les antibiotiques prescrits appartenaient à la catégorie « À surveiller », dont 74,5 % étaient prescrits de manière appropriée. Dans l’ensemble du Canada, 37,3 % de tous les antibiotiques prescrits appartenaient à la catégorie « Accès », dont 75,5 % ont été jugés correctement prescrits, et 1,8 % appartenaient à la catégorie « De réserve », dont 78,0 % ont été jugés correctement prescrits.
Figure 30 - Équivalent textuel
| Classification AWaRe | % |
|---|---|
| Accès | 37,3 % |
| À surveiller | 60,8 % |
| De réserve | 1,8 % |
Figure 31 - Équivalent textuel
| Classification AWaRe | Approprié | Inapproprié |
|---|---|---|
| Accès | 75,5 % | 24,5 % |
| À surveiller | 74,5 % | 25,5 % |
| De réserve | 78,0 % | 22,0 % |
La stratification de la prescription d’antibiotiques par région hospitalière a révélé des différences régionales importantes dans l’utilisation des antibiotiques selon la classification AWaRE. Les antibiotiques de la catégorie « Accès » ont été prescrits plus fréquemment dans les hôpitaux des régions de l'Ouest (n = 16) et de l'Est (n = 22), représentant 47,8 % et 44,7 % des prescriptions. En revanche, dans la région centrale (n = 26), seulement 32,3 % des prescriptions concernaient des antibiotiques de la catégorie « Accès », 66 % de tous les antibiotiques prescrits provenant de la catégorie « À surveiller ».
Figure 32 - Équivalent textuel
| Classification AWaRe | Ouest | Centrale | Est |
|---|---|---|---|
| Accès | 47,8 % | 32,3 % | 44,7 % |
| À surveiller | 50,5 % | 65,5 % | 54,4 % |
| De réserve | 1,6 % | 2,1 % | 0,9 % |
*Ouest : Colombie-Britannique, Alberta, Saskatchewan et Manitoba; Centre : Ontario et Québec; Est : Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve.
Utilisation appropriée par antibiotique spécifique
Le taux de pertinence des cinq antibiotiques les plus fréquemment prescrits (pipéracilline-tazobactam, ceftriaxone, vancomycine, céfazoline et méropénème, par ordre décroissant) se situait entre 91,1 % et 74,6 %. Parmi les 20 antibiotiques les plus prescrits, quatre antibiotiques présentaient des niveaux de prescription appropriée inférieurs à 70 % : la nitrofurantoïne (55,3 %), le céfuroxime (64,7 %), la lévoflaxacine (66,5 %) et la moxifloxacine (67,9 %).
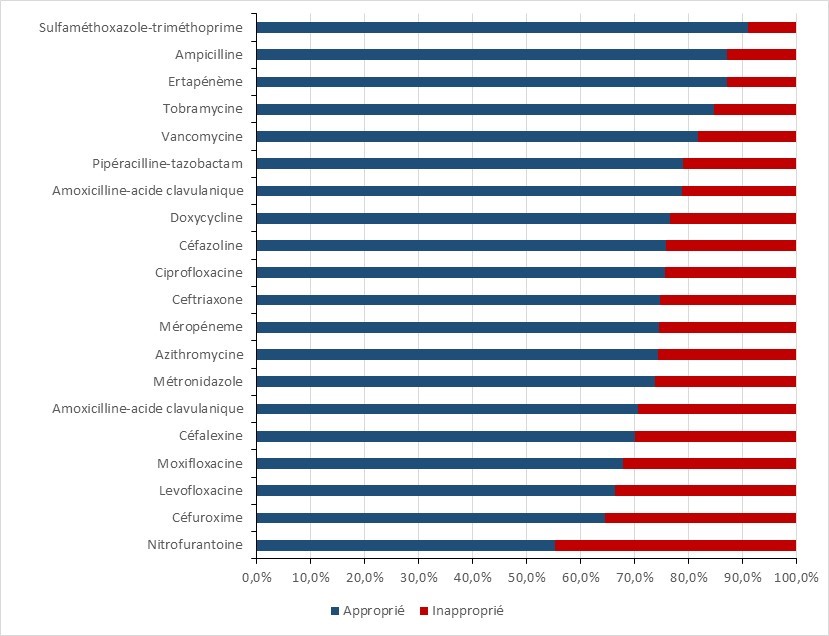
Figure 33 - Équivalent textuel
| Antibiotique | Approprié | Inapproprié |
|---|---|---|
| Sulfaméthoxazole-triméthoprime | 91,1 % | 8,9 % |
| Ampicilline | 87,2 % | 12,8 % |
| Ertapénème | 87,2 % | 12,8 % |
| Tobramycine | 84,8 % | 15,2 % |
| Vancomycine | 81,9 % | 18,1 % |
| Pipéracilline-tazobactam | 79,0 % | 21,0 % |
| Amoxicilline | 78,8 % | 21,2 % |
| Doxycycline | 76,5 % | 23,5 % |
| Céfazoline | 75,8 % | 24,2 % |
| Ciprofloxacine | 75,6 % | 24,4 % |
| Ceftriaxone | 74,7 % | 25,3 % |
| Méropénem | 74,6 % | 25,4 % |
| Azithromycine | 74,5 % | 25,5 % |
| Métronidazole | 73,9 % | 26,1 % |
| Amoxicilline-acide clavulanique | 70,7 % | 29,3 % |
| Céfalexine | 70,2 % | 29,8 % |
| Moxifloxacine | 67,9 % | 32,1 % |
| Lévofloxacine | 66,5 % | 33,5 % |
| Céfuroxime | 64,7 % | 35,3 % |
| Nitrofurantoïne | 55,3 % | 44,7 % |
Pertinence des prescriptions d’antibiotiques selon la spécialité médicale du prescripteurs
Les niveaux d’adéquation varient également en fonction de la spécialité du prescripteur. Les spécialités présentant le niveau le plus élevé en pertinence de la prescription d’antibiotiques étaient la pédiatrie (93,7 %, n = 79), l’hématologie (88,4 %, n = 1 513), la gynécologie (86,2 %, n = 65), les maladies infectieuses et le VIH (83,8 %, n =1 739) et la médecine d’urgence (80,8 %, n = 120). C’est en urologie (n = 152) que la pertinence est la plus faible avec 56,0 %. Il convient de noter que certaines spécialités n’avaient pas un nombre suffisant de personnes pour être évaluées avec précision et ont été regroupées sous la rubrique « Autres ».
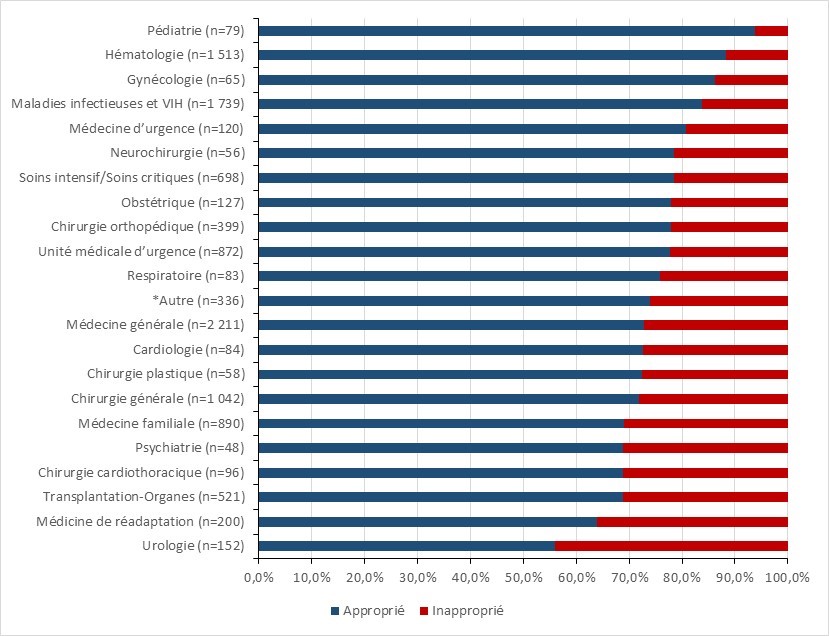
Figure 34 - Équivalent textuel
| Specialité | Approprié | Inapproprié |
|---|---|---|
| Pédiatrie (n=79) | 93,7 % | 6,3 % |
| Hématologie (n=1 513) | 88,4 % | 11,6 % |
| Gynécologie (n=65) | 86,2 % | 13,8 % |
| Maladies infectieuses et VIH (n=1 739) | 83,8 % | 16,2 % |
| Médecine d’urgence (n=120) | 80,8 % | 19,2 % |
| Neurochirurgie (n=56) | 78,6 % | 21,4 % |
| Soins intensif/Soins critiques (n=698) | 78,5 % | 21,5 % |
| Obstétrique (n=127) | 78,0 % | 22,0 % |
| Chirurgie orthopédique (n=399) | 77,9 % | 22,1 % |
| Unité médicale d’urgence (n=872) | 77,6 % | 22,4 % |
| Respiratoire (n=83) | 75,9 % | 24,1 % |
| *Autre (n=336) | 73,9 % | 26,1 % |
| Médecine générale (n=2 211) | 72,8 % | 27,2 % |
| Cardiologie (n=84) | 72,6 % | 27,4 % |
| Chirurgie plastique (n=58) | 72,4 % | 27,6 % |
| Chirurgie générale (n=1 042) | 71,8 % | 28,2 % |
| Médecine familiale (n=890) | 69,0 % | 31,0 % |
| Psychiatrie (n=48) | 68,8 % | 31,3 % |
| Chirurgie cardiothoracique (n=96) | 68,8 % | 31,3 % |
| Transplantation – Organes (n=521) | 68,8 % | 31,3 % |
| Médecine de réadaptation(n=200) | 64,0 % | 36,0 % |
| Urologie (n=152) | 56,0 % | 44,0 % |
* Parmi les autres, citons : les soins aux personnes âgées, la dentisterie, la chirurgie de l’oreille, du nez et de la gorge, la chirurgie gastro-entérologique, la chirurgie de la tête et du cou, la chirurgie maxillo-faciale, la néonatologie, la néphrologie, la neurologie, l’ophtalmologie, la chirurgie orthopédique, les soins palliatifs, la radiologie et les accidents vasculaires cérébraux.
Surveillance de l’utilisation des antimicrobiens chez l’humain dans le secteur communautaire avant8 et pendant9 la pandémie de la COVID-19, Canada
Principales conclusions
- Alors que la moyenne des prescriptions était de 53,5 % par 1 000 habitants pendant la période prépandémique, le taux a précipitamment chuté de 31,3 % entre mars 2020 (début de la pandémie) et avril 2020. Les taux sont ensuite restés faibles pendant la pandémie, avec une moyenne de 37,6 prescriptions par 1 000 habitants.
- Entre la période prépandémique et la période pandémique, les taux moyens de prescription ont diminué dans les catégories « Accès » et « À surveiller » avec des baisses de 23,3 % et 43,5 %, respectivement. Dans la catégorie « De réserve », les taux sont restés pratiquement au même niveau et faibles (0,02 prescription par 1 000 habitants) au cours des deux périodes.
- Par rapport aux hommes, les femmes ont vu une hausse de près de 40 % de prescriptions d’antimicrobiens avant et pendant la pandémie.
- Dans tous les groupes d’âge, on a constaté une baisse marquée du taux de prescription entre la période prépandémique et la période pandémique. L’ampleur de la baisse pendant la pandémie était inversement proportionnelle à l’âge, la plus forte baisse (de 54,7 %) étant observée dans le groupe d’âge le plus jeune (0 à 18 ans).
- Depuis la mi-2021, les taux globaux de prescriptions ont augmenté sans revenir aux niveaux prépandémique.
Résultats
Au cours des deux années qui ont suivi le début de la pandémie (mars 2020 à avril 2022), les prescriptions d’antimicrobiens délivrées par 1 000 habitants recensés dans la communauté ont affiché une baisse marquée et soutenue par rapport à la période prépandémique (mai 2016 à février 2020), tandis que l’utilisation ambulatoire d’antimicrobiens a rebondi et a dépassé le niveau de la période prépandémique dans d’autres milieux (88).
Tendances nationales générales
- Avant le début de la pandémie, le taux de prescription mensuel moyen au Canada était de 53,5, avec des taux fluctuant entre 45,4 (en juillet 2016) et 66,1 (pic atteint en janvier 2018) prescriptions par 1 000 habitants.
- Notamment, entre mars et avril 2020, les prescriptions d’antimicrobiens dans la communauté ont chuté précipitamment de 31,3 %. Pendant la pandémie de la COVID-19, les taux de prescription mensuels moyens sont restés faibles (taux moyen de 37,6 prescriptions par 1 000 habitants, fourchette de 31,7 à 49,3 prescriptions d’antimicrobiens par 1 000 habitants).
- Au cours de la période prépandémique, les taux de prescription d’antimicrobiens étaient les plus élevés entre mai et octobre de chaque année (avec des pics en janvier). Le taux de prescription le plus faible a été observé en juin ou en juillet au cours de ces années.
- Dans le secteur hospitalier, l’utilisation des antimicrobiens a diminué entre la période prépandémique et la période pandémique; la quantité d’antimicrobiens achetés par les hôpitaux a diminué de 25,3 % entre 2017 et 2021, avec une baisse de 8,3 % entre 2019 et 2020.
- Les nouvelles méthode d’accès aux soins de santé, résultant des mesures de santé publique visant à atténuer la propagation du coronavirus, peuvent être l’une des causes possibles de ces changements dans la prescription d’antimicrobiens.
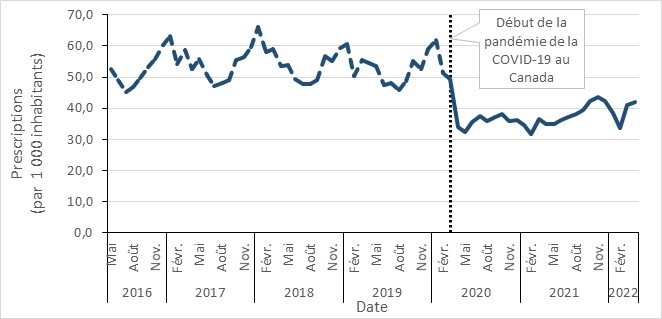
Figure 35 - Équivalent textuel
| Mois | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
|---|---|---|---|---|---|---|---|
| Janvier | n/a | 63,2 | 66,1 | 60,8 | 62,0 | 34,6 | 38,4 |
| Fevrier | n/a | 54,1 | 57,9 | 50,3 | 51,4 | 31,7 | 33,6 |
| Mars | n/a | 58,8 | 59,1 | 55,4 | 49,3* | 36,4 | 40,9 |
| Avril | n/a | 52,6 | 53,7 | 54,7 | 33,9 | 34,9 | 41,9 |
| Mai | 52,5 | 55,7 | 53,8 | 53,5 | 32,3 | 35,0 | n/a |
| Juin | 49,1 | 50,7 | 49,2 | 47,4 | 35,7 | 36,1 | n/a |
| Juillet | 45,4 | 47,3 | 47,7 | 48,2 | 37,7 | 37,2 | n/a |
| Aôut | 46,9 | 48,0 | 47,7 | 45,8 | 36,0 | 38,1 | n/a |
| Septembre | 49,8 | 49,0 | 49,1 | 48,8 | 37,1 | 39,6 | n/a |
| Octobre | 53,3 | 55,4 | 56,8 | 55,2 | 38,2 | 42,2 | n/a |
| Novembre | 55,7 | 56,5 | 55,1 | 52,7 | 35,8 | 43,5 | n/a |
| Décembre | 60,4 | 59,8 | 59,3 | 58,9 | 36,3 | 42,3 | n/a |
| * Début de la pandémie du COVID-19 au Canada | |||||||
Remarque : Mars 2020 marque la déclaration officielle de la pandémie de la COVID-19, qui a entraîné la fermeture de la frontière terrestre entre le Canada et les États-Unis.
Prescriptions d’antimicrobiens avant et pendant la COVID-19 dans la communauté, selon la catégorisation « AWaRe » de l’OMS, Canada, 2019 à 2022
Les prescriptions d’antimicrobiens des catégories « Accès » et « À surveiller » de l’OMS est restée stable pendant la période prépandémique, par rapport à la période depuis le début de la pandémie de la COVID-19.
Accès
- On a constaté une diminution de 23,3 % des prescriptions moyenne d’antimicrobiens de la catégorie « Accès » pendant la période de la pandémie. Les taux de prescription d’antimicrobiens de la catégorie « Accès » de l’OMS avant la pandémie étaient, en moyenne, de 36,4 prescriptions par 1 000 habitants (allant de 31,3 en juillet 2016 à 42,0 en janvier 2018).
- Pendant la pandémie, la prescription d’antimicrobiens « Accès » était en moyenne de 27,9 prescriptions par 1 000 habitants et est restée à des niveaux bas et presque stables (fluctuant entre 23,8 (en février 2021) et 33,9 prescriptions par 1 000 habitants en mars 2020). Cependant, les taux ont commencé à augmenter légèrement depuis septembre 2021 sans revenir aux niveaux prépandémiques.
À surveiller
- Au cours de la période prépandémique, la prescription d’antimicrobiens de la catégorie « À surveiller » était, en moyenne, de 17,2 prescriptions par 1 000 habitants (allant de 12,8 en août 2019 à 24,1 en janvier 2018). On a constaté une diminution globale de 43,5 % de la prescription moyenne d’antimicrobiens de la catégorie « À surveiller » entre la période prépandémique et la période pandémique. Les taux sont devenus presque stables et faibles pendant la pandémie et ont fluctué entre 7,8 en février 2021 et 15,4 en mars 2020. Cependant, depuis septembre 2021, les taux ont commencé à augmenter légèrement sans revenir aux niveaux prépandémique).
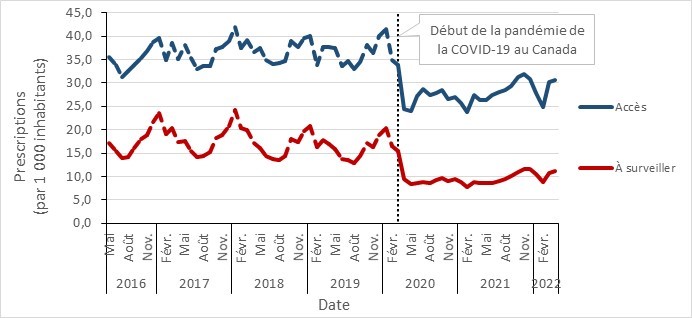
Figure 36 - Équivalent textuel
| Accès | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
|---|---|---|---|---|---|---|---|
| Janvier | n/a | 39,7 | 42,0 | 40,0 | 41,5 | 25,8 | 27,8 |
| Février | n/a | 34,9 | 37,5 | 33,9 | 34,8 | 23,8 | 24,8 |
| Mars | n/a | 38,5 | 39,2 | 37,7 | 33,9* | 27,5 | 30,2 |
| Avril | n/a | 35,2 | 36,5 | 37,8 | 24,4 | 26,3 | 30,7 |
| Mai | 35,5 | 38,1 | 37,5 | 37,5 | 24,0 | 26,4 | n/a |
| Juin | 33,7 | 35,2 | 34,8 | 33,7 | 27,2 | 27,4 | n/a |
| Juillet | 31,3 | 33,1 | 34,0 | 34,6 | 28,7 | 28,0 | n/a |
| Août | 32,6 | 33,7 | 34,2 | 33,0 | 27,4 | 28,5 | n/a |
| Septembre | 33,7 | 33,7 | 34,6 | 34,4 | 27,9 | 29,4 | n/a |
| Octobre | 35,3 | 37,3 | 38,9 | 38,1 | 28,5 | 31,2 | n/a |
| Novembre | 36,8 | 37,6 | 37,7 | 36,4 | 26,7 | 31,9 | n/a |
| Décembre | 38,8 | 38,9 | 39,6 | 40,0 | 26,9 | 30,8 | n/a |
| À surveiller | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Janvier | n/a | 23,5 | 24,1 | 20,7 | 20,4 | 8,8 | 10,6 |
| Février | n/a | 19,2 | 20,3 | 16,4 | 16,5 | 7,8 | 8,8 |
| Mars | n/a | 20,3 | 19,9 | 17,7 | 15,4* | 8,9 | 10,7 |
| Avril | n/a | 17,4 | 17,2 | 16,9 | 9,5 | 8,6 | 11,2 |
| Mai | 17,1 | 17,6 | 16,2 | 15,9 | 8,3 | 8,5 | n/a |
| Juin | 15,4 | 15,5 | 14,4 | 13,8 | 8,6 | 8,7 | n/a |
| Juillet | 14,0 | 14,2 | 13,7 | 13,6 | 8,9 | 9,1 | n/a |
| Août | 14,2 | 14,3 | 13,5 | 12,8 | 8,6 | 9,5 | n/a |
| Septembre | 16,1 | 15,3 | 14,5 | 14,3 | 9,2 | 10,2 | n/a |
| Octobre | 18,1 | 18,1 | 17,9 | 17,1 | 9,7 | 11,1 | n/a |
| Novembre | 18,9 | 18,8 | 17,3 | 16,3 | 9,1 | 11,6 | n/a |
| Décembre | 21,6 | 20,2 | 19,6 | 18,9 | 9,4 | 11,5 | n/a |
| * Début de la pandémie du COVID-19 au Canada | |||||||
De réserve
- Comparés aux taux de prescription des autres catégories « AWaRe », les taux de la catégorie « De réserve » étaient plus faibles, avec un changement minime observé entre les périodes prépandémiques et pandémique. Entre mai 2016 et février 2020, les prescriptions d’antimicrobiens sont restées très faibles avec une moyenne mensuelle de 0,02 prescription par 1 000 habitants. De même, les taux pendant la période de pandémie sont également restés faibles avec une moyenne de 0,02 prescription par 1 000 habitants.
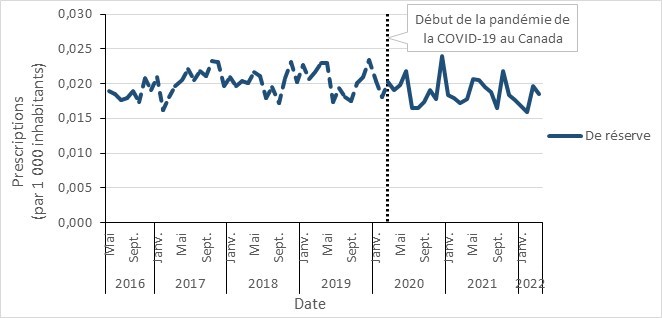
Figure 37 - Équivalent textuel
| De réserve | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
|---|---|---|---|---|---|---|---|
| Janvier | n/a | 0,021 | 0,021 | 0,023 | 0,020 | 0,018 | 0,017 |
| Février | n/a | 0,016 | 0,020 | 0,021 | 0,018 | 0,018 | 0,016 |
| Mars | n/a | 0,018 | 0,020 | 0,022 | 0,020* | 0,017 | 0,020 |
| Avril | n/a | 0,020 | 0,020 | 0,023 | 0,019 | 0,018 | 0,019 |
| Mai | 0,019 | 0,020 | 0,022 | 0,023 | 0,020 | 0,021 | n/a |
| Juin | 0,018 | 0,020 | 0,021 | 0,017 | 0,022 | 0,021 | n/a |
| Juillet | 0,018 | 0,022 | 0,018 | 0,019 | 0,016 | 0,020 | n/a |
| Août | 0,018 | 0,020 | 0,020 | 0,018 | 0,016 | 0,019 | n/a |
| Septembre | 0,019 | 0,022 | 0,017 | 0,018 | 0,017 | 0,017 | n/a |
| Octobre | 0,017 | 0,021 | 0,021 | 0,020 | 0,019 | 0,022 | n/a |
| Novembre | 0,021 | 0,023 | 0,023 | 0,021 | 0,018 | 0,018 | n/a |
| Décembre | 0,019 | 0,020 | 0,020 | 0,023 | 0,024 | 0,018 | n/a |
| * Début de la pandémie du COVID-19 au Canada | |||||||
Prescriptions d’antimicrobiens dans la communauté avant et pendant la pandémie de la COVID-19, stratifiées par sexe, Canada, 2016 à 2022
- Par rapport aux hommes, les femmes ont reçu près de 40 % de plus de prescriptions d’antimicrobiens avant et pendant la pandémie. Chez les femmes, on a observé une diminution de 28,3 % du taux moyen de prescriptions mensuelles dans la communauté entre la période prépandémique et la période pandémique, passant de 63,2 à 45,3 prescriptions par 1 000 habitants.
- Chez les hommes, des tendances similaires ont été observées, il y a eu une diminution de 31,8 % du taux moyen de prescription mensuelle dans la communauté entre la période prépandémique et la période pandémique, passant de 43,8 à 29,9 prescriptions par 1 000 habitants.
- Dans les deux groupes de sexe, les taux de prescriptions d’antimicrobiens sont restés globalement faibles au cours de la pandémie mais ont légèrement augmenté depuis juin 2021, atteignant un pic en novembre 2021 (augmentations de 20,5 % et 20,0 % chez les femmes et les hommes, respectivement) mais sans revenir aux niveaux d’avant la pandémie.
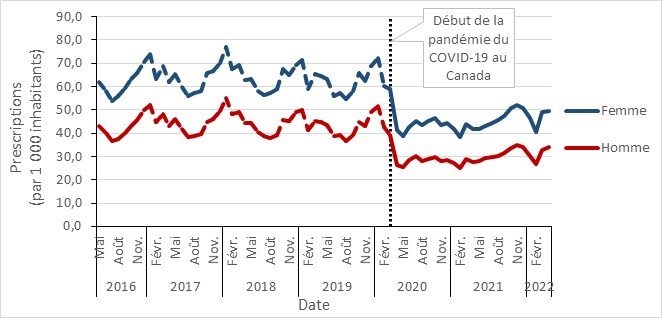
Figure 38 - Équivalent textuel
| Homme | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
|---|---|---|---|---|---|---|---|
| Janvier | n/a | 52,2 | 54,9 | 50,0 | 51,5 | 27,2 | 30,3 |
| Février | n/a | 44,7 | 48,3 | 41,4 | 42,4 | 25,0 | 26,8 |
| Mars | n/a | 48,4 | 48,9 | 45,4 | 39,3* | 29,0 | 32,9 |
| Avril | n/a | 43,3 | 44,3 | 44,8 | 26,1 | 27,8 | 34,1 |
| Mai | 43,2 | 45,9 | 44,2 | 43,7 | 25,6 | 28,0 | n/a |
| Juin | 40,0 | 41,7 | 40,3 | 38,9 | 28,7 | 29,1 | n/a |
| Juillet | 36,7 | 38,5 | 38,7 | 39,0 | 30,0 | 29,7 | n/a |
| Aôut | 37,6 | 38,6 | 38,0 | 36,8 | 28,2 | 30,2 | n/a |
| Septembre | 39,9 | 39,5 | 39,3 | 39,2 | 28,9 | 31,5 | n/a |
| Octobre | 43,1 | 44,9 | 45,8 | 44,6 | 29,7 | 33,7 | n/a |
| Novembre | 45,5 | 46,1 | 45,0 | 43,0 | 28,0 | 35,0 | n/a |
| Décembre | 50,0 | 49,4 | 49,1 | 48,9 | 28,4 | 34,0 | n/a |
| Femme | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Janvier | n/a | 74,0 | 77,2 | 71,4 | 72,3 | 42,0 | 46,4 |
| Février | n/a | 63,2 | 67,3 | 59,1 | 60,2 | 38,3 | 40,4 |
| Mars | n/a | 69,0 | 69,2 | 65,3 | 59,1* | 43,8 | 48,9 |
| Avril | n/a | 61,7 | 62,9 | 64,4 | 41,5 | 41,8 | 49,6 |
| Mai | 61,8 | 65,4 | 63,2 | 63,1 | 39,0 | 41,9 | n/a |
| Juin | 58,0 | 59,7 | 58,0 | 55,9 | 42,7 | 43,0 | n/a |
| Juillet | 53,9 | 55,9 | 56,6 | 57,2 | 45,2 | 44,6 | n/a |
| Aôut | 56,0 | 57,3 | 57,2 | 54,8 | 43,7 | 45,8 | n/a |
| Septembre | 59,5 | 58,3 | 58,8 | 58,2 | 45,3 | 47,5 | n/a |
| Octobre | 63,4 | 65,7 | 67,7 | 65,7 | 46,5 | 50,7 | n/a |
| Novembre | 65,8 | 66,6 | 65,0 | 62,2 | 43,5 | 51,9 | n/a |
| Décembre | 70,6 | 70,0 | 69,3 | 68,9 | 44,2 | 50,6 | n/a |
| * Début de la pandémie du COVID-19 au Canada | |||||||
Prescriptions mensuelles d’antimicrobiens avant et pendant la COVID-19 dans la communauté stratifiées par âge, Canada, 2016 à 2022
- Dans l’ensemble, des taux plus élevés de prescriptions d’antibiotiques ont été signalés dans les groupes d’âge plus avancés tant dans la période prépandémique que dans la période pandémique.
- La baisse marquée et soutenue du taux de prescriptions d’antibiotiques dans la communauté observée au début de la pandémie a été constatée dans tous les groupes d’âge
- L’ampleur de la diminution des prescriptions d’antibiotiques pendant la pandémie était inversement proportionnelle à l’âge, la plus forte diminution du taux de prescription d’antibiotiques étant observée dans le groupe d’âge le plus jeune (0 à 18 ans), où une diminution de 54,7 % des prescriptions a été observée pendant la pandémie, de 45,4 (taux moyen pendant la période prépandémique) à 20,5 prescriptions par 1 000 habitants (taux moyen pendant la période pandémique). En revanche, une diminution de seulement 17,0 % des prescriptions d’antibiotiques a été signalée pendant la pandémie dans le groupe d’âge le plus élevé, celui des 80 ans ou plus, passant d’une moyenne de 103,5 (moyenne pendant la période prépandémique) à 86,0 prescriptions par 1 000 habitants (moyenne pendant la période pandémique).
- Au cours de la pandémie, le taux de prescriptions est resté faible dans l’ensemble, mais a légèrement augmenté depuis juin 2021, pour atteindre un pic en novembre 2021 dans toutes les tranches d’âge, sans toutefois retrouver les niveaux d’avant la pandémie. Le groupe d’âge le plus jeune, celui des 0 à 18 ans, a connu la hausse la plus significative avec une augmentation de 83,5 % entre juin et novembre 2021 (18,0 à 33,1 prescriptions par 1 000 habitants).
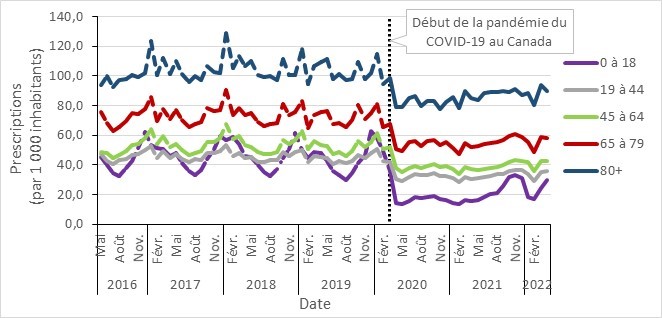
Figure 39 - Équivalent textuel
| De 0 à 18 ans | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
|---|---|---|---|---|---|---|---|
| Janvier | n/a | 53,7 | 56,8 | 50,0 | 58,1 | 14,0 | 18,6 |
| Février | n/a | 51,2 | 58,9 | 44,8 | 49,5 | 13,5 | 17,0 |
| Mars | n/a | 51,0 | 54,4 | 48,7 | 35,7* | 16,2 | 24,7 |
| Avril | n/a | 46,1 | 46,1 | 47,7 | 14,2 | 15,9 | 29,5 |
| Mai | 45,5 | 47,7 | 45,5 | 42,4 | 13,5 | 16,3 | n/a |
| Juin | 40,1 | 41,5 | 39,9 | 36,0 | 15,9 | 18,0 | n/a |
| Juillet | 34,3 | 35,8 | 34,9 | 33,4 | 18,5 | 20,5 | n/a |
| Aôut | 32,8 | 32,9 | 32,2 | 29,7 | 17,8 | 21,3 | n/a |
| Septembre | 38,2 | 36,5 | 37,5 | 34,6 | 18,3 | 26,1 | n/a |
| Octobre | 42,6 | 44,0 | 44,4 | 41,3 | 19,1 | 31,5 | n/a |
| Novembre | 51,5 | 50,5 | 50,6 | 46,6 | 17,2 | 33,1 | n/a |
| Décembre | 62,5 | 59,6 | 61,7 | 63,1 | 16,3 | 31,1 | n/a |
| De 19 à 44 ans | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Janvier | n/a | 52,5 | 53,7 | 50,2 | 50,7 | 31,4 | 33,8 |
| Février | n/a | 44,7 | 46,1 | 42,1 | 42,4 | 28,3 | 29,2 |
| Mars | n/a | 49,5 | 48,1 | 45,9 | 41,6* | 32,0 | 34,9 |
| Avril | n/a | 44,6 | 44,8 | 45,0 | 30,2 | 30,7 | 35,8 |
| Mai | 47,0 | 47,6 | 45,1 | 44,7 | 28,8 | 30,9 | n/a |
| Juin | 42,6 | 44,0 | 42,1 | 40,6 | 31,8 | 31,6 | n/a |
| Juillet | 40,7 | 42,3 | 42,3 | 42,4 | 34,1 | 32,6 | n/a |
| Aôut | 43,0 | 43,7 | 43,2 | 41,0 | 33,2 | 33,7 | n/a |
| Septembre | 44,2 | 43,1 | 43,2 | 42,4 | 33,5 | 33,7 | n/a |
| Octobre | 46,4 | 47,7 | 48,4 | 46,7 | 34,6 | 35,6 | n/a |
| Novembre | 47,6 | 48,1 | 46,2 | 44,3 | 32,4 | 36,7 | n/a |
| Décembre | 49,8 | 49,6 | 48,5 | 47,7 | 32,6 | 36,2 | n/a |
| De 45 à 64 ans | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Janvier | n/a | 64,3 | 67,8 | 62,7 | 61,4 | 37,0 | 41,8 |
| Février | n/a | 53,7 | 57,4 | 50,8 | 50,5 | 33,7 | 35,8 |
| Mars | n/a | 59,5 | 59,4 | 55,8 | 52,1* | 38,8 | 42,5 |
| Avril | n/a | 51,7 | 53,2 | 53,6 | 37,7 | 37,0 | 42,3 |
| Mai | 48,5 | 54,2 | 52,1 | 52,8 | 35,0 | 36,8 | n/a |
| Juin | 47,9 | 49,7 | 48,4 | 47,2 | 37,9 | 37,4 | n/a |
| Juillet | 44,9 | 46,7 | 47,5 | 48,4 | 39,5 | 37,7 | n/a |
| Aôut | 46,6 | 48,0 | 47,7 | 46,3 | 37,7 | 38,6 | n/a |
| Septembre | 49,5 | 49,2 | 49,0 | 49,4 | 39,1 | 39,8 | n/a |
| Octobre | 53,5 | 55,4 | 57,1 | 56,0 | 40,4 | 42,0 | n/a |
| Novembre | 54,2 | 55,6 | 53,9 | 51,9 | 38,4 | 43,3 | n/a |
| Décembre | 58,3 | 58,4 | 57,1 | 55,7 | 39,3 | 42,7 | n/a |
| De 65 à 79 ans | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Janvier | n/a | 85,7 | 90,4 | 82,9 | 81,3 | 51,6 | 55,3 |
| Février | n/a | 69,6 | 73,7 | 65,0 | 65,3 | 47,5 | 48,9 |
| Mars | n/a | 77,9 | 78,2 | 73,7 | 67,9* | 54,9 | 58,7 |
| Avril | n/a | 71,1 | 73,4 | 75,5 | 50,5 | 52,2 | 58,2 |
| Mai | 75,6 | 76,8 | 75,1 | 76,3 | 49,3 | 52,9 | n/a |
| Juin | 68,6 | 70,0 | 68,6 | 67,3 | 55,4 | 54,4 | n/a |
| Juillet | 62,8 | 65,2 | 66,4 | 68,4 | 56,3 | 54,9 | n/a |
| Aôut | 65,6 | 67,7 | 67,5 | 65,8 | 52,9 | 55,5 | n/a |
| Septembre | 69,9 | 69,1 | 68,4 | 70,1 | 55,9 | 57,0 | n/a |
| Octobre | 74,8 | 78,3 | 81,2 | 80,1 | 57,1 | 59,7 | n/a |
| Novembre | 74,5 | 76,0 | 73,9 | 71,2 | 53,6 | 60,7 | n/a |
| Décembre | 77,8 | 77,3 | 75,5 | 74,8 | 55,6 | 58,7 | n/a |
| Plus de 80 ans | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Janvier | n/a | 123,7 | 128,8 | 118,1 | 114,9 | 85,8 | 88,8 |
| Février | n/a | 100,8 | 105,4 | 94,3 | 94,7 | 78,6 | 80,2 |
| Mars | n/a | 111,9 | 113,5 | 106,4 | 98,8* | 90,1 | 94,0 |
| Avril | n/a | 101,1 | 106,8 | 109,3 | 79,2 | 85,4 | 89,8 |
| Mai | 93,5 | 109,9 | 110,3 | 111,4 | 78,8 | 84,1 | n/a |
| Juin | 99,7 | 101,4 | 100,6 | 97,8 | 85,4 | 88,3 | n/a |
| Juillet | 92,6 | 95,6 | 99,0 | 101,3 | 86,5 | 89,1 | n/a |
| Aôut | 97,0 | 99,9 | 100,2 | 97,3 | 79,8 | 89,3 | n/a |
| Septembre | 97,6 | 97,5 | 97,0 | 98,1 | 83,2 | 89,9 | n/a |
| Octobre | 100,8 | 106,8 | 111,5 | 109,6 | 83,0 | 89,5 | n/a |
| Novembre | 99,5 | 102,3 | 100,3 | 97,6 | 77,8 | 90,9 | n/a |
| Décembre | 102,1 | 102,2 | 100,4 | 101,8 | 82,2 | 87,0 | n/a |
| * Début de la pandémie du COVID-19 au Canada | |||||||
Utilisation des antimicrobiens (UAM), résistance aux antimicrobiens (RAM) et RAM et UAM intégrée chez les animaux/aliments et les personnes au Canada
Cette section fournit des renseignements sur les antimicrobiens vendus pour être utilisés chez les animaux, l’utilisation d’antimicrobiens (UAM) déclarée par les fermes d’animaux terrestres sentinelles et l’UAM de toutes les exploitations aquacoles au Canada. La composante agricole du PICRA offre une occasion unique d’explorer l’UAM et la résistance aux antimicrobiens (RAM) dans les mêmes populations. C’est pourquoi nous avons également inclus des résultats intégrés sur l’UAM et la RAM à l’aide de certains indicateurs proposés pour évaluer les progrès réalisés dans la lutte contre la RAM (89).
mg/PCUCA est une mesure de l’utilisation des antimicrobiens qui ajuste la quantité (milligramme/mg) d’antimicrobiens utilisée, consommée ou distribuée par la taille de la population (Unité de correction de la population — Norme canadienne).
Principales conclusions
Antimicrobiens vendus pour être utilisés chez tous les animaux au Canada
- Entre 2019 et 2020, la quantité d’antimicrobiens vendus pour être utilisés chez tous les animaux ont augmenté de 6,5 %, passant de 0,98 million à 1,05 million de kg.
- Entre 2019 et 2020, mesurées en kg, les ventes d’antimicrobiens destinés à la volaille et à l’aquaculture ont diminué tandis que les ventes destinées aux porcs, aux bovins et aux petits ruminants ont augmenté. Les ventes destinées aux chevaux, chats et chiens sont restées stables (moins de 1 % de variation).
- Par rapport aux données de 2020 de 31 pays européens, le Canada a distribué la sixième plus grande quantité d’antimicrobiens destinés à être utilisés chez les animaux. En 2020, la quantité d’antimicrobiens vendus au Canada (mg/PCU) pour les animaux de production était trois fois plus élevée que la médiane des 31 pays européens.
Surveillance de l’utilisation des antimicrobiens et de la résistance aux antimicrobiens à l’échelle des exploitations agricoles dans le cadre du PICRA : poulets de chair, dindes et porcs en croissance-finition
- Entre 2019 et 2020, l’UAM déclarée dans les fermes sentinelles a diminué pour les poulets de chair, les dindes, et les porcs en croissance-finition. Pour la volaille, mesurée en kg d’antimicrobiens déclarés, les tendances des données sur l’UAM et les ventes au niveau de l’exploitation allaient dans la même direction. Cependant, lorsqu’elles sont mesurées en mg/PCUCA, les ventes de volaille ont augmenté de 2019 à 2020, et l’UAM déclarée par la ferme a diminué. Pour les porcs, mesurée en kg d’antimicrobien déclarés, l’UAM de la ferme a augmenté en 2019 et lest ventes ont diminué; pour 2020, il y a eu une baisse de l’UAM agricole avec une augmentation des ventes. Cependant, lorsque l’on utilise les mg/PCUCA, les tendances de l’UMA au niveau de l’exploitation pour les porcs en croissance-finition et les ventes évoluent dans la même direction.
- Alors que les doses et les durées étaient conformes aux allégations figurant sur l'étiquette pour le traitement et/ou la prévention des maladies, en 2020, on a signalé l'utilisation d'antimicrobiens médicalement importants pour favoriser la croissance dans quatre troupeaux sentinelles. Aucune utilisation d'antimicrobiens médicalement importants pour favoriser la croissance n'a été signalée dans les troupeaux sentinelles de poulets de chair ou de dindes. La résistance aux antimicrobiens (reporté entant que pourcentage d’isolats d’E. coli résistants à trois classes ou plus d’antimicrobiens) a montré une tendance à la baisse entre 2016 et 2020 chez ces trois espèces animales.
Utilisation intégrée des antimicrobiens et résistance aux antimicrobiens le long de la chaîne alimentaire : Salmonella résistante aux céphalosporines de troisième génération
- Les données de surveillance du PICRA ont historiquement déterminé une tendance inquiétante concernant la Salmonella résistante aux céphalosporines de troisième génération, qui a conduit à des mesures du gouvernement fédéral canadien (avertissements sur les étiquettes), à des interventions volontaires de l’industrie avicole canadienne et qui a été historiquement incluse dans l’ordonnance fédérale de la Food and Drug Administration des États-Unis (90) pour interdire certaines utilisations non indiquées sur l’étiquette de cette classe d’antimicrobiens chez les animaux destinés à l’alimentation.
- Les interventions ont permis de réduire le risque pour la santé humaine de cette bactérie pathogène résistante aux antimicrobiens.
Informations intégrées sur les antimicrobiens destinés à être utilisés dans tous les secteurs (humains, animaux et cultures)
- En 2020, environ 82 % des antimicrobiens ont été vendus10 pour être utilisés chez les animaux de production, 17 % chez les humains, < 1 % chez les chats et les chiens et < 1 % chez les plantes/cultures. En prenant compte qu’il y a beaucoup plus d’animaux que de personnes au Canada, après ajustement pour la biomasse sous-jacente, il y avait environ 1,8 fois plus d’antimicrobiens vendus pour être utilisés chez les animaux de production (animaux de consommation et chevaux) que chez les personnes.
Antimicrobiens vendus pour être utilisés chez les animaux au Canada
Les modifications apportées au Règlement sur les aliments et drogues (publiées en mai 2017) visent à accroître la surveillance et à promouvoir l’utilisation responsable des antimicrobiens disponibles pour les animaux. Depuis 2018, les fabricants, importateurs et préparateurs doivent fournir des rapports annuels sur les ventes d’antimicrobiens médicalement importants destinés à être utilisés chez les animaux (91). Ces rapports ont remplacé les données fournies historiquement sur une base volontaire par l’Institut canadien de la santé animale (ICSA).
Pour répondre à ces exigences de déclaration, Santé Canada et l’Agence de la santé publique du Canada ont mis au point un système de collecte de données sur les ventes en ligne, appelé Système de déclaration des ventes de médicaments antimicrobiens vétérinaires (SDVMAV).
Pour les données du SDVMAV incluses dans ce rapport, sauf indication précise, seules les informations provenant des fabricants et des importateurs sont incluses, car les préparateurs peuvent acheter leurs produits auprès des fabricants et des importateurs, d’où un risque de double-comptage.
Ce rapport classe les antimicrobiens selon leur importance pour la médecine humaine, conformément à un système élaboré par la Direction des médicaments vétérinaires de Santé Canada (92). Dans ce système, les antimicrobiens de catégorie I sont considérés comme ayant une très grande importance pour la médecine humaine (p. ex., les fluoroquinolones). Les antimicrobiens de la catégorie II sont d’une grande importance pour la médecine humaine (p. ex., les macrolides), et ceux de la catégorie III sont d’une importance moyenne pour la médecine humaine (p. ex., les tétracyclines). Les antimicrobiens de catégorie IV (c.-à-d. de faible importance pour la médecine humaine, comme les ionophores) ne sont pas inclus dans ce document. Au Canada, les antimicrobiens qui sont considérés comme médicalement importants se trouvent dans la Liste A de Santé Canada : Liste de certains ingrédients pharmaceutiques actifs antimicrobiens.
Les données relatives aux ventes sont indiquées en kg, mg/PCU et mg/kgbiomasseSL.
PCU = unité de correction de population calculée en multipliant le nombre d’animaux par leur poids moyen au moment du traitement; mg/PCUEU = milligrammes vendus ajustés par l’unité de correction de population en utilisant les poids standard européens au moment du traitement; mg/PCUCA = milligrammes vendus ajustés par l’unité de correction de population en utilisant les poids standard canadiens au moment du traitement; mg/kgbiomasseSL = milligrammes vendus ajustés par la biomasse des animaux en utilisant un poids vif moyen canadien au moment de l’abattage.
Entre 2019 et 2020, la quantité d’antimicrobiens médicalement importants vendus pour être utilisés chez tous les animaux au Canada a augmenté de 6,5 % (0,98 million à 1,05 million de kg). Cette évolution est due en grande partie aux ventes d’antimicrobiens pour les animaux de production (bétail d’élevage, aquaculture et chevaux). La quantité d’antimicrobiens mesurée en milligrammes (mg) par unité de correction de population (UCP) a augmenté de 7,6 % en utilisant les poids standards des animaux canadiens (132 à 142 mg/UCP), et de 7,6 % (144 à 155 mg/UCP) ou les poids standards européens des animaux (144 à 155 mg/UCP). Quelle que soit l’unité de mesure utilisée, la quantité d’antimicrobiens vendus pour être utilisés chez les animaux de production a diminué en 2019 par rapport à 2018, et a de nouveau augmenté en 2020.
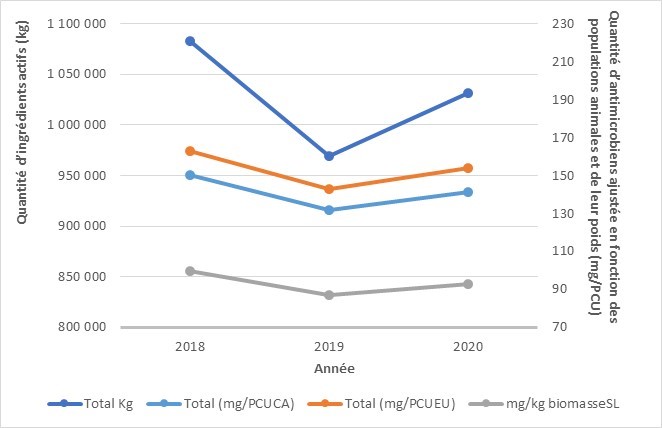
Figure 40 - Équivalent textuel
| Quantité annuelle | 2018 | 2019 | 2020 |
|---|---|---|---|
| Total Kg | 1 082 768 | 968 984 | 1 031 775 |
| Total (mg/PCUEU) – poids européens | 163 | 143 | 154 |
| Total (mg/PCUCA) – poids Canadiens | 150 | 132 | 141 |
| Mg/kg de biomasseSL – Poids à l’abattage | 100 | 87 | 93 |
Remarque : Les données démographiques utilisées pour les chevaux vivants datent de 2010. Les animaux de production comprennent les bovins (lait, bœuf, veau), la volaille, les porcs, l’aquaculture, les petits ruminants, les chevaux et les espèces autres/inconnues, à l’exclusion des chats et des chiens. Les données excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV et les antimicrobiens non catégorisés et non médicalement importants.
En 2020, les cinq principales classes d’antimicrobiens vendus pour être utilisés chez tous les animaux, en termes de poids, étaient les tétracyclines (546 427 kg), les macrolides. (113 552 kg), les pénicillines (105 053 kg), les sulfamides (47 667 kg) et les lincosamides (45 508 kg). Dans l’ensemble, moins d’un pour cent des antimicrobiens vendus pour être utilisés chez les animaux étaient de catégorie I (très grande importance pour la médecine humaine). En outre, les ventes d’antimicrobiens de catégorie I ont diminué de 5,2 % entre 2019 et 2020 (de 5 927 kg à 5 618 kg).
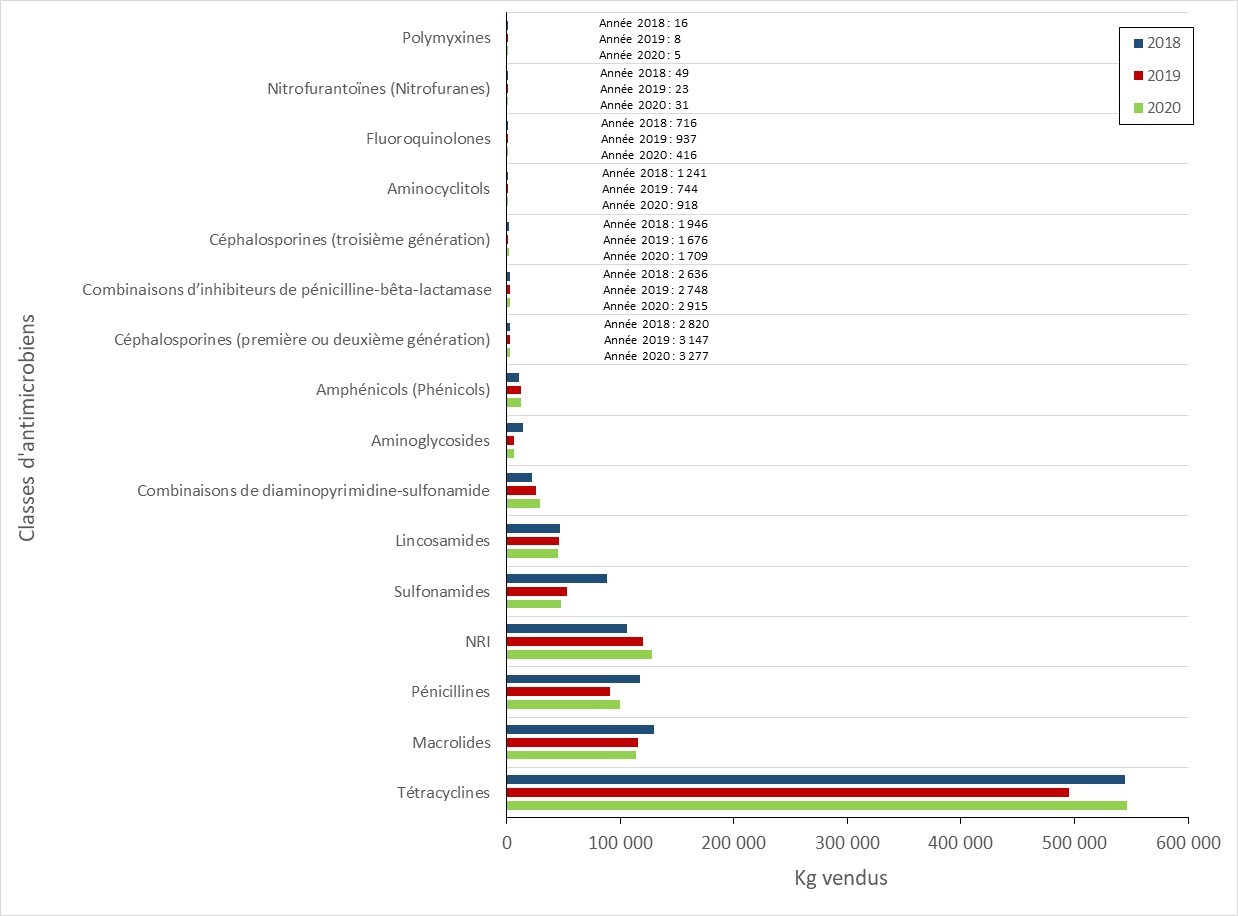
Figure 41 - Équivalent textuel
| Classe d’antimicrobiens | 2018 | 2019 | 2020 |
|---|---|---|---|
| Polymyxines | 16 | 8 | 5 |
| Nitrofurantoïnes (Nitrofuranes) | 49 | 23 | 31 |
| Fluoroquinolones | 716 | 937 | 416 |
| Aminocyclitols | 1 241 | 744 | 918 |
| Céphalosporines (troisième génération) | 1 946 | 1 676 | 1 709 |
| Combinaisons d’inhibiteurs de pénicilline-bêta-lactamase | 2 636 | 2 748 | 2 915 |
| Céphalosporines (première ou deuxième génération) | 2 820 | 3 147 | 3 277 |
| Amphénicols (Phénicols) | 11 318 | 13 030 | 12 981 |
| Aminoglycosides | 14 467 | 6 487 | 6 937 |
| Combinaisons de diaminopyrimidine-sulfonamide | 22 051 | 25 519 | 29 145 |
| Lincosamides | 46 583 | 46 390 | 45 508 |
| Sulfonamides | 88 274 | 53 226 | 47 667 |
| Non rapport indépendamment | 106 121 | 120 455 | 127 738 |
| Pénicillines | 117 222 | 91 095 | 100 117 |
| Macrolides | 129 579 | 115 822 | 113 504 |
| Tétracyclines | 544 102 | 495 116 | 546 427 |
Remarque : Les antimicrobiens non déclarés indépendamment (NDI) comprennent les aminocoumarines, les bacitracines, les diaminopyrimidines, l’acide fusidique, les glycopeptides, les nitroimidazoles, les orthosomycines, les dérivés de l’acide phosphonique, les pleuromutilines, les acides pseudomoniques, les streptogramines et les agents thérapeutiques pour la tuberculose. Les données excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV et les antimicrobiens non catégorisés et non médicalement importants.
Entre 2019 et 2020, les ventes d’antimicrobiens destinés à la volaille et à l’aquaculture, mesurées en kg, ont diminué; les ventes destinées aux porcs, aux bovins et aux petits ruminants ont augmenté; et les ventes destinées aux chevaux et aux chats et chiens sont restées stables. Des tendances similaires ont été observées lorsque les ventes ont été mesurées en milligrammes ajustés en fonction du nombre et du poids des animaux (PCU), à l’exception de la volaille dont les ventes ont légèrement augmenté. Toutefois, le classement relatif des espèces animales en fonction de la quantité d’antimicrobiens vendus a changé.
Aquaculture
- Entre 2019 et 2020, le nombre de kilogrammes d’antimicrobiens vendus à l’aquaculture a diminué d’environ 18 %.
- En 2020, les seules classes d’antimicrobiens vendues pour être utilisées en aquaculture étaient les tétracyclines, les amphénicols et les macrolides, ce qui correspond aux données sur les exploitations rapportées par le ministère des Pêches et des Océans du Canada.
Bovins de boucherie
- Le nombre de kilogrammes d’antimicrobiens vendus pour être utilisés chez les bovins de boucherie a augmenté d’environ 10 % entre 2019 et 2020 malgré une diminution d’environ 31 % des ventes d’antimicrobiens de catégorie I.
- En 2020, les trois principales classes d’antimicrobiens vendus pour être utilisés chez les bovins de boucherie étaient les tétracyclines, les macrolides et les streptogramines.
Bovins laitiers
- Le nombre de kilogrammes d’antimicrobiens vendus pour être utilisés chez les bovins laitiers a diminué de moins de 1 % entre 2019 et 2020, avec une augmentation notable d'environ 52 % des ventes d’antimicrobiens de catégorie I.
- En 2020, les trois principales classes d’antimicrobiens vendus pour être utilisés chez les bovins laitiers étaient les tétracyclines, les combinaisons diaminopyrimidine-sulfonamide et les pénicillines.
Volaille (poulets et dindes)
- Entre 2019 et 2020, les quantités (en kg) d’antimicrobiens vendus pour être utilisés pour les volailles ont diminué d’environ 2 % et augmenté de 1 % après ajustement en fonction du nombre et du poids des animaux (biomasse)
- En 2020, les bacitracines, les pénicillines et les tétracyclines représentaient la plus grande quantité d’antimicrobiens vendus pour être utilisés pour la volaille.
- De petites quantités (moins d’un kg chaque année) de fluoroquinolones (catégorie I, antimicrobiens de très haute importance pour la médecine humaine) ont été combinées pour être utilisées chez les volailles entre 2019 et 2020.
Porcs
- La quantité (en kg) d’antimicrobiens vendus pour être utilisés chez les bovins de boucherie ont augmenté d’environ 9 % entre 2019 et 2020; malgré une diminution d’environ 29 % des ventes d’antimicrobiens de catégorie I.
- En 2020, les trois principales classes d’antimicrobiens vendus pour être utilisés chez les porcs étaient les tétracyclines, les pénicillines et les macrolides.
Chats et chiens
- La quantité (en kg) d’antimicrobiens vendus pour être utilisés chez les chats et les chiens sont restés stables entre 2019 et 2020 (< 1 % de variation) avec une diminution d'environ 2 % des ventes d’antimicrobiens de catégorie I.
- En 2020, les trois principales classes d’antimicrobiens vendues pour une utilisation chez les chats et les chiens étaient les céphalosporines de première ou deuxième génération, les associations d’inhibiteurs de la β-lactamase de la pénicilline et les nitroimidazoles.
Pour de plus amples informations sur les antimicrobiens destinés à être utilisés chez les veaux de boucherie, les chevaux, les petits ruminants et d’autres animaux, veuillez consulter le rapport le plus récent du PICRA.
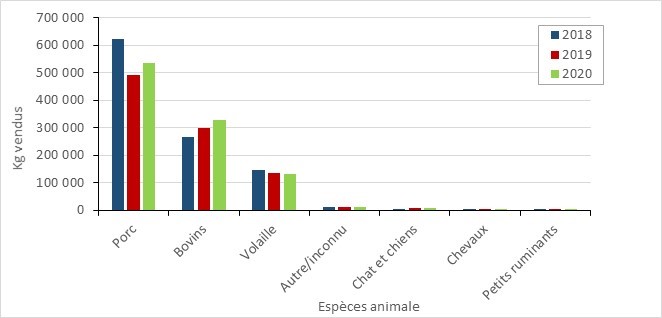
Figure 42 - Équivalent textuel
| Espèces animale | 2018 | 2019 | 2020 |
|---|---|---|---|
| Porc | 620 355 | 491 640 | 535 450 |
| Bovins | 266 343 | 297 810 | 328 221 |
| Volaille | 147 853 | 134 351 | 131 857 |
| Autre/inconnu | 10 274 | 10 093 | 10 830 |
| Chats et chiens | 6 373 | 7 439 | 7 519 |
| Chevaux | 1 236 | 1 504 | 1 511 |
| Petits ruminants | 43 | 68 | 93 |
Remarque : Les données excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV et les antimicrobiens non catégorisés et non médicalement importants.
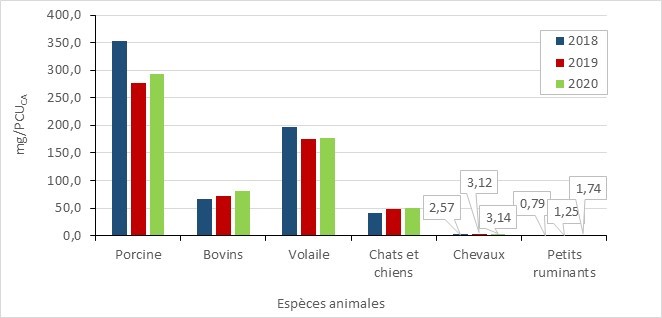
Figure 43 - Équivalent textuel
| Espèce animales | 2018 | 2019 | 2020 |
|---|---|---|---|
| Porcine | 353,84 | 277,48 | 292,55 |
| Bovins | 67,07 | 72,72 | 81,49 |
| Volaille | 196,71 | 175,19 | 176,98 |
| Chats et chiens | 40,80 | 47,62 | 50,84 |
| Chevaux | 2,57 | 3,12 | 3,14 |
| Petits ruminants | 0,79 | 1,25 | 1,74 |
PCUCA = unité de correction de la population utilisant les poids moyens canadiens au moment du traitement.
Remarque : Les données excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV et les antimicrobiens non catégorisés et non médicalement importants.
Antimicrobiens vendus pour être utilisés chez les animaux — Perspective internationale
Le réseau ESVAC (European Surveillance of Veterinary Antimicrobial Consumption) recueille et communique des données sur la quantité d’antimicrobiens destinés à être utilisés chez les animaux dans 31 pays européens. Ces informations sont exprimées en mg/PCU et constituent la meilleure source publiquement disponible pour les comparaisons internationales par pays.
Si l’on compare ces informations avec les dernières données fournies par l’ESVAC et en supposant que les données sont comparables, le Canada se classe au 6e rang en termes de quantités (mg/PCU) d’antimicrobiens vendus pour être utilisés chez les animaux de production par rapport aux pays européens. En 2020, la quantité d’antimicrobiens vendus au Canada (mg/PCU) pour les animaux de production était trois fois plus élevée que la médiane des 31 pays européens.
Il est important de noter que la structure et le niveau de détail des données pour les classes de production animale disponibles dans les ensembles de données européennes diffèrent des ensembles de données canadiennes; par conséquent, cette figure doit être interprétée avec prudence. Les données du dénominateur canadien comprenaient le nombre de vaches de boucherie vivantes qui ne sont pas incluses comme une catégorie distincte dans les données européennes. Les animaux canadiens de certaines classes ou à différentes étapes de la production animale sont plus lourds que ceux d’Europe. C’est pourquoi des poids d’animaux plus élevés au moment du traitement furent utilisé, en se fondant sur des données de surveillance, des données de recherche ou des avis d’experts.
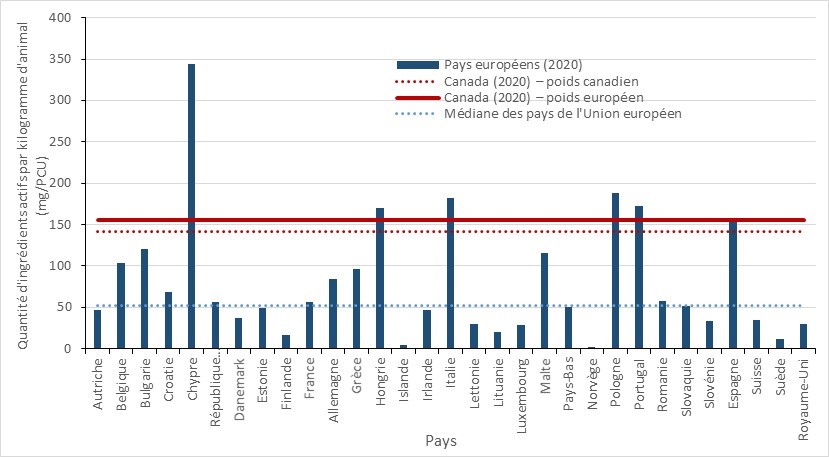
Figure 44 - Équivalent textuel
| Pays européens (2020) | Pays européens (2020) - mg/PCU | Canada – poids canadiens | Canada – poids européen | Médiane (des pays de l’Union européenne) |
|---|---|---|---|---|
| Austriche | 46,3 | 142 | 155 | 51,9 |
| Belgique | 103,4 | 142 | 155 | 51,9 |
| Bulgarie | 120,9 | 142 | 155 | 51,9 |
| Croatie | 68,6 | 142 | 155 | 51,9 |
| Chypre | 344,2 | 142 | 155 | 51,9 |
| République tchèque | 56,2 | 142 | 155 | 51,9 |
| Danemark | 37,2 | 142 | 155 | 51,9 |
| Estonie | 49,2 | 142 | 155 | 51,9 |
| Finlande | 16,2 | 142 | 155 | 51,9 |
| France | 56,6 | 142 | 155 | 51,9 |
| Allemagne | 83,8 | 83,8 | 142 | 155 |
| Grèce | 96,4 | 142 | 155 | 51,9 |
| Hongrie | 169,9 | 142 | 155 | 51,9 |
| Islande | 3,8 | 142 | 155 | 51,9 |
| Irelande | 47,0 | 142 | 155 | 51,9 |
| Italie | 181,8 | 142 | 155 | 51,9 |
| Lettonie | 29,6 | 142 | 155 | 51,9 |
| Lithuanie | 20,5 | 142 | 155 | 51,9 |
| Luxembourg | 29,0 | 142 | 155 | 51,9 |
| Malte | 115,8 | 142 | 155 | 51,9 |
| Pays-Bas | 50,2 | 142 | 155 | 51,9 |
| Norvège | 2,3 | 142 | 155 | 51,9 |
| Pologne | 187,9 | 142 | 155 | 51,9 |
| Portugal | 172,5 | 142 | 155 | 51,9 |
| Romanie | 57,8 | 142 | 155 | 51,9 |
| Slovaquie | 51,9 | 142 | 155 | 51,9 |
| Slovénie | 33,3 | 142 | 155 | 51,9 |
| Espagne | 154,3 | 142 | 155 | 51,9 |
| Suisse | 34,3 | 142 | 155 | 51,9 |
| Suède | 11,1 | 142 | 155 | 51,9 |
| Royaume-Uni | 30,2 | 142 | 155 | 51,9 |
Remarque : Les données (données du fabricant et de l’importateur) excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV et les antimicrobiens non catégorisés non médicalement importants. Le dénominateur de l’UCP a été harmonisé dans la mesure du possible avec le réseau ESVAC (le dénominateur ESVAC n’inclut pas les vaches de boucherie, alors qu’au Canada, les vaches de boucherie constituent une population importante et sont incluses). Les données canadiennes utilisées pour les chevaux vivants datent de 2010. Source : European Medicines Agency. European database of sales of veterinary antimicrobial agents. Disponible à l’adresse suivante : https://esvacbi.ema.europa.eu/analytics/saw.dll?PortalPages&PortalPath=/shared/ESVAC%20Public/_portal/Annual%20Report. Accédé : Le 7 septembre 2022.
Surveillance au niveau de l’exploitation de l’utilisation des antimicrobiens et de la résistance aux antimicrobiens
En 2020, les informations sur l’UAM et les échantillons pour la détermination de la RAM ont été fournis volontairement par 272 fermes sentinelles participant au programme de surveillance au niveau de l’exploitation du PICRA (115 troupeaux de poulets de chair, 61 troupeaux de dindes et 96 troupeaux de porcs en croissance-finition).
Les données de l’UAM pour l’aquaculture, accessibles par le biais des données ouvertes sur le site internet de Pêches et Océans Canada (93), sont déclarées en kilogrammes. Pour toutes les autres espèces sous surveillance, l’UAM est rapportée en utilisant l’unité de mesure et les indicateurs suivants :
DTQvetCA : la « dose thérapeutique quotidienne définie au Canada pour les animaux ». La quantité d’antimicrobiens administrée au cours d’un traitement (dose) varie en fonction de l’antimicrobien, de la manière dont il est administré (p. ex., par injection, dans l’eau ou dans les aliments) et de la population traitée (bovins, poulets, porcs).
nDTQvet/1000 jours-animaux : indicateur d’utilisation d’antimicrobiens qui tient compte à la fois de la variation de la quantité (dose) d’antimicrobiens administrée au cours d’un traitement (DTQvet et n = nombre) et de la durée pendant laquelle un animal ou un groupe d’animaux est sous surveillance.
mg/PCUCA : Indicateur d’utilisation d’antimicrobiens qui ajuste la quantité (milligramme/mg) d’antimicrobiens utilisés en fonction de la taille de la population.
Mesure des tendances dans le temps : Les changements entre les années pour l'UAM sont mesurés en tant que changement de pourcentage.
Les changements entre les années pour la RAM (en utilisant E. coli, résistant à 3 classes ou plus d’antimicrobiens comme organisme indicateur) sont mesurés comme la différence en pourcentages. Vous trouverez plus de détails dans le document PICRA 2018 Design et méthodes (71).
Surveillance de l’utilisation des antimicrobiens au niveau des exploitations agricoles — PICRA
Les tendances temporelles globales des données sur l’UAM au niveau de l’exploitation pour l’aquaculture sont cohérentes avec les données de ventes déclarées pour l’aquaculture (en kg total). Pour les porcs en croissance-finition, lorsqu'on évalue les données en fonction des kg d'antimicrobiens déclarés, l'UAM des exploitations a augmenté en 2019 et les ventes ont diminué, tandis qu'en 2020, l'UAM des exploitations a diminué et les ventes ont augmenté. Lorsqu'on utilise les mg/PCUCA, les tendances de l'UAM à la ferme et des ventes vont dans le même sens. La prédominance relative des classes d'antimicrobiens déclarés pour l'utilisation chez les porcs diffère entre les données d'exploitation et les données de vente, peut-être parce que les données d'exploitation se concentrent sur le stade de production de la croissance-finition, alors que les données de vente incluent tous les stades de production.
Pour la volaille, lorsqu’on évalue les données en fonction du nombre de kilogrammes d’antimicrobiens déclarés, les tendances dans le temps sont cohérentes entre les données de l’UAM des exploitations et les données sur les ventes de volailles. Toutefois, lorsqu’on utilise les mg/PCUCA, la tendance de l’UAM concernant les exploitations (tendance à la baisse) est opposée aux données sur les ventes de volailles (tendance à la hausse). La prédominance relative des classes d’antimicrobiens déclarés pour l’utilisation chez les volailles diffère également entre les données des exploitations et celles des ventes. Ces différences peuvent être dues au fait que les données d'UAM des exploitations sont précises à chacun des secteurs avicoles, alors que les données sur les ventes sont recueillies pour toutes les espèces de volailles.
Pour les espèces animales pour lesquelles il existe des données de surveillance de l’UAM dans les exploitations sentinelles en 2020 (poulets de chair, porcs en croissance-finition et dindes), davantage d’antimicrobiens ont été utilisés pour la prévention des maladies (principalement pour la prévention des maladies entériques) que pour le traitement des maladies (respiratoires, entériques, septicémiques ou boiteries).
Troupeaux de porcs en croissance-finition
- Mesurées en doses thérapeutiques quotidiennes canadiennes pour 1 000 jours-porc en croissance-finition à risque (nDTQvetCA/1 000 jours-porc en croissance-finition à risque), la majorité des antimicrobiens médicalement importants signalés pour l’utilisation dans les troupeaux de porcs en croissance-finition sentinelles de 2017 à 2020 étaient des antimicrobiens de catégorie II et III. Les trois principales classes d’antimicrobiens utilisées en 2020 étaient les macrolides, les tétracyclines et les pénicillines, (mesurées en nDTQvetCA/1 000 jours-porc en croissance-finition à risque).
- La quantité totale d’antimicrobiens médicalement importants utilisés dans les troupeaux sentinelles de porcs en croissance-finition a augmenté de 13,0% de 2019 à 2020 (mesurée en nDTQvetCA/1000 jours-porc en croissance-finition à risque).
- Le seul antimicrobien de catégorie I utilisé dans les élevages de porcs en phase de croissance et de finition était le ceftiofur, administré par injection à des animaux individuels. La quantité de ceftiofur utilisée était très faible par rapport à la quantité d’antimicrobiens de catégorie II et III utilisés.
- Alors que les doses et les durées étaient conformes aux allégations figurant sur l'étiquette pour le traitement et/ou la prévention des maladies, en 2020, on a signalé l'utilisation d'antimicrobiens médicalement importants pour favoriser la croissance dans quatre troupeaux sentinelles
Troupeaux de poulets de chair
- Mesurée en nDTQvetCA/1 000 poulets de chair-jours à risque, l’UAM déclarée a diminué au fil du temps (2016 à 2020). Dans le cadre de cette diminution, on observe également une baisse de l’utilisation relative des antimicrobiens de catégorie II (particulièrement notée dans la comparaison de 2019 et 2020 avec les années précédentes). Ce changement reflète la politique de l’industrie du poulet de chair visant à abandonner l’utilisation préventive des antimicrobiens de catégorie II.
- Les trois principales classes d’antimicrobiens utilisées en 2020 étaient les bacitracines, les orthosomycines et les triméthoprime-sulfonamides (mesurées en nDTQvetCA/1 000 jours à risque pour les poulets de chair).
- La quantité totale d’antimicrobiens médicalement importants utilisés dans les élevages de poulets de chair sentinelles a diminué de 19,0 % de 2019 à 2020 (mesurée en nDTQvetCA/1 000 jours-poulets de chair à risque) et a diminué de 38,9 % par rapport à 2016.
- Aucune utilisation d’antimicrobiens de catégorie I n’a été signalée, sauf en 2018 où l’utilisation d’antimicrobiens de catégorie I a été très limitée (un troupeau à moins de 0,1 nDTQvetCA spécifique à la fluoroquinolone/1 000 jours-poulet de chair à risque). Il n’y a pas eu d’utilisation d’antimicrobiens importants sur le plan médical pour favoriser la croissance.
Troupeaux de dindes
- À l’instar du secteur du poulet de chair, le secteur de la dinde a éliminé l’utilisation préventive de certains antimicrobiens, ce qui a entraîné un passage d’une utilisation plus élevée d’antimicrobiens de catégorie II en 2016 à 2018 à une utilisation plus élevée de catégorie III en 2019 et 2020. Les trois principales classes d’antimicrobiens utilisées en 2020 étaient similaires à celles utilisées chez les poulets de chair (bacitracines, orthosomycines et triméthoprime-sulfonamides, mesurées en nDTQvetCA/1 000 dindes-jours à risque).
- La quantité totale d’antimicrobiens médicalement importants signalés comme étant utilisés dans les élevages de dindes sentinelles a diminué de 33,5 % de 2019 à 2020 (mesurée en nDTQvetCA/1 000 dindes-jours à risque) et a diminué de 34,5 % par rapport à 2016.
- L’utilisation d’antimicrobiens de catégorie I a été très limitée entre 2017 et 2019 (un troupeau chaque année à moins de 0,1 nDTQvetCA précises aux fluoroquinolones/1 000 dindes-jours à risque) et aucune utilisation n’a été signalée en 2020. Il n’y a pas eu d’utilisation d’antimicrobiens importants sur le plan médical pour favoriser la croissance.
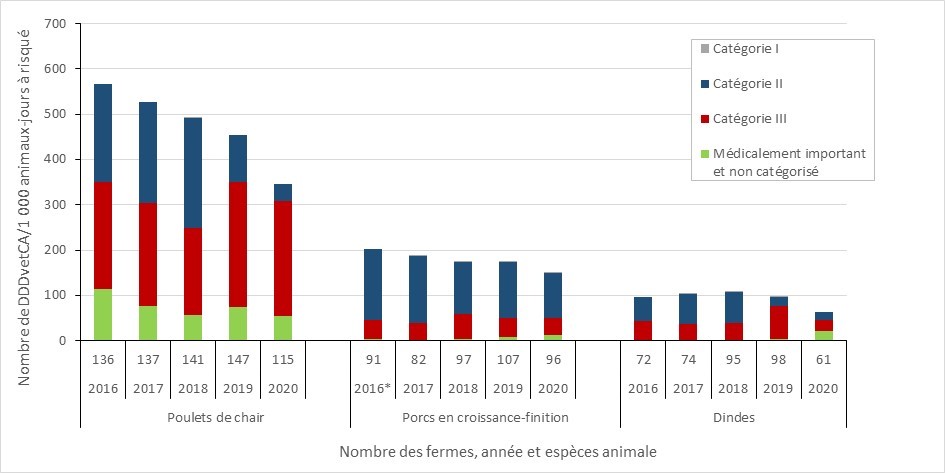
Figure 45 - Équivalent textuel
| Poulets de chair | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Nombre de troupeaux/bandes | 136,0 | 137,0 | 141,0 | 147,0 | 115,0 |
| Médicalement important et non catégorisé | 114,4 | 77,4 | 55,8 | 74,4 | 54,1 |
| Catégorie III | 236,6 | 225,8 | 193,0 | 275,0 | 255,0 |
| Catégorie II | 216,2 | 223,5 | 243,5 | 104,4 | 37,4 |
| Catégorie I | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
| Porcs en croissance-finition | 2016 | 2017 | 2018 | 2019 | 2020 |
| Nombre de troupeaux/bandes | 91,0 | 82,0 | 97,0 | 107,0 | 96,0 |
| Médicalement important et non catégorisé | 2,9 | 2,4 | 4,6 | 8,6 | 11,9 |
| Catégorie III | 42,1 | 36,6 | 54,4 | 40,5 | 37,7 |
| Catégorie II | 157,3 | 148,0 | 115,6 | 123,5 | 99,3 |
| Catégorie I | 0,0 | 0,1 | 0,2 | 0,1 | 0,1 |
| Dindes | 2016 | 2017 | 2018 | 2019 | 2020 |
| Nombre de troupeaux/bandes | 72,0 | 74,0 | 95,0 | 98,0 | 61,0 |
| Médicalement important et non catégorisé | 0,0 | 0,0 | 2,5 | 3,8 | 21,9 |
| Catégorie III | 44,1 | 37,3 | 35,5 | 72,1 | 24,6 |
| Catégorie II | 52,6 | 66,0 | 68,6 | 19,5 | 16,9 |
| Catégorie I | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
Remarque : L’utilisation d’antimicrobiens est mesurée en nombre de doses quotidiennes définies pour 1 000 animaux-jours à risque, ce qui correspond au nombre d’animaux pour 1 000 qui ont été traités quotidiennement avec une dose moyenne. Les antimicrobiens non catégorisés médicalement importants comprennent la tiamuline et l’avilamycine.
*Les données des porcs en croissance-finition en 2016 reflètent l’UAM dans l’alimentation animale uniquement, car les données quantitatives pour l’utilisation dans l’eau et par injection n’étaient pas disponibles avant 2017.
Utilisation d’antimicrobiens dans les exploitations aquacoles — Pêches et Océans Canada
- Selon les « Données nationales sur l’information publique en aquaculture » (93) l’UAM totale déclarée pour les poissons marins et l’aquaculture terrestre en eau douce était de 7 850 kg. Sur ce total, trois classes d’antimicrobiens ont été utilisées : l’érythromycine (< 1 % du kg total), le florfénicol (55,5 % du kg total) et l’oxytétracycline (44,4 % du kg total). L’érythromycine (un macrolide) relève de la catégorie II d’importance pour la médecine humaine, tandis que le florfénicol (un phénicol) et l’oxytétracycline (une tétracycline) sont des antimicrobiens de catégorie III.
Résistance aux antimicrobiens et utilisation des antimicrobiens intégrées à partir de la surveillance des exploitations agricoles — PICRA
- La Figure 46 montre les tendances de la RAM, exprimée en termes de résistance à trois classes d’antimicrobiens ou plus testées en utilisant l’organisme indicateur, Escherichia coli à, et les tendances de l’UAM, mesurée en nDTQvetCA/1 000 animaux-jours à risque. Cette figure est conforme aux meilleures pratiques internationales en matière de surveillance et donne une indication générale de l’évolution de la résistance dans les populations bactériennes par rapport à l’évolution de l’utilisation totale des antimicrobiens médicalement importants. Il est important de noter que les différences dans les classes d'antimicrobiens utilisées au fil du temps et entre les espèces peuvent avoir un impact sur la relation entre la RAM et l'UAM. La disponibilité de données au niveau des exploitations agricoles sur les classes et les ingrédients actifs utilisés permet d'approfondir l'étude et l'analyse de ces tendances.
- Les données indiquent que les tendances de la RAM ont diminué de 2016 à 2020 pour toutes les espèces terrestres sous surveillance (poulets de chair : – 16,0 %; porcs en croissance-finition : -21,0 %; dindes : -17,0 %). Une diminution annuelle prononcée a été observée entre 2019 et 2020 (poulets de chair : – 13,0 % porcs en croissance-finition : -13,0 %; dindes : -15,0 %) qui ont coïncidé avec des changements dans la législation sur les médicaments vétérinaires concernant la gestion de l’utilisation des antimicrobiens. Ces changements, mis en œuvre en décembre 2018, ont exigé que les antimicrobiens médicalement importants ne soient disponibles que sur prescription et que les allégations de promotion de la croissance soient retirées des étiquettes des antimicrobiens médicalement importants. La diminution de la RAM a également coïncidé avec les tendances à la baisse de l’UAM (nDTQvetCA total/1 000 jours-animaux à risque) chez les poulets de chair, les dindes, et les porcs en croissance-finition. La diminution de l'année 2020 chez les porcs en croissance-finition est principalement due à la diminution de l'utilisation d'antimicrobiens de catégorie II (macrolides) dans les aliments pour animaux.
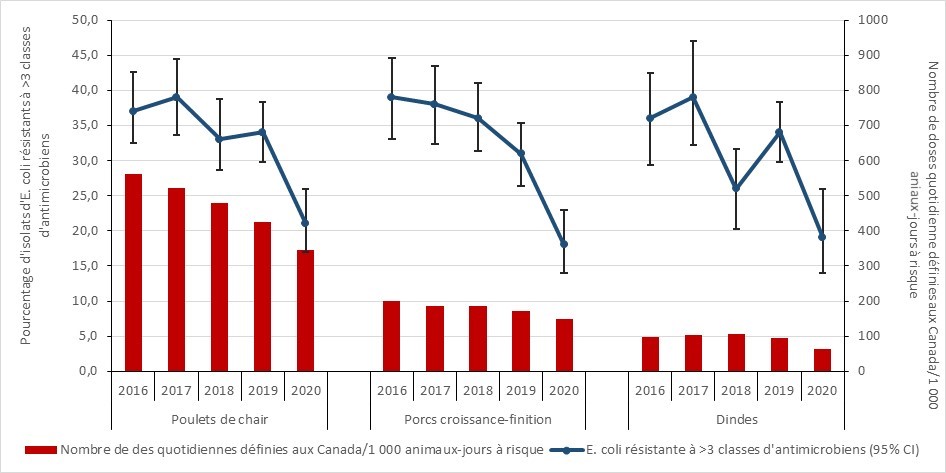
Figure 46 - Équivalent textuel
| Poulets de chair | 2016 | 2017 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|
| Nombre de doses quotidiennes définies aux Canada/1 000 animaux-jours à risque | 562,5 | 520,6 | 479,2 | 424,7 | 343,9 |
| E. coli résistante à > 3 classes d’antimicrobiens (95 % CI) | 37 | 39 | 33 | 34 | 21 |
| Porcs en croissance-finition | 2016 | 2017 | 2018 | 2019 | 2020 |
| Nombre de doses quotidiennes définies aux Canada/1 000 animaux-jours à risque | 200,9 | 186,9 | 185,9 | 171,1 | 149,6 |
| E. coli résistante à > 3 classes d’antimicrobiens (95 % CI) | 39 | 38 | 36 | 31 | 18 |
| Dindes | 2016 | 2017 | 2018 | 2019 | 2020 |
| Nombre de doses quotidiennes définies aux Canada/1 000 animaux-jours à risque | 96,7 | 103,3 | 106,6 | 95,2 | 63,3 |
| E. coli résistante à > 3 classes d’antimicrobiens (95 % CI) | 36 | 39 | 26 | 34 | 19 |
Remarque : La résistance aux antimicrobiens est indiquée comme le pourcentage d’isolats d’E. coli résistants à trois classes ou plus d’antimicrobiens testés (les barres d’erreur hautes et basses indiquant les intervalles de confiance à 95 %). Les données de l’UAM pour les porcs croissance-finition en 2016 ne reflètent que l’utilisation dans l’alimentation
Une recherche conçue pour éclairer l’expansion de la surveillance
Le PICRA a collaboré avec le secteur des poules pondeuses (2020 à 2021) pour piloter une surveillance de l’UAM et de la RAM concernant l’exploitation de 72 troupeaux de pondeuses provenant de quatre grandes provinces productrices d’œufs. Par rapport aux pourcentages d’E. coli résistants à plusieurs classes indiqués dans la figure 46, en 2020, le pourcentage d’isolats d’E. coli provenant de poules pondeuses qui étaient résistants à trois classes ou plus était de 2,5 % (c.-à-d. inférieur à la fréquence pour les espèces animales de la Figure 46). Parmi les antimicrobiens testés, une fréquence modérée de résistance à la tétracycline (24,1 %) a été détectée, ce qui est inférieur aux résultats obtenus pour d'autres espèces animales échantillonnées par le PICRA au niveau des exploitations (par exemple, poulets de chair : 35,0 %, dindes : 53,8 %). Les registres d'utilisation d'antimicrobiens étaient disponibles pour neuf troupeaux, et la bacitracine et la tétracycline étaient les seuls antimicrobiens importants sur le plan médical dont l'utilisation était signalée.
L’UAM et la RAM intégrées tout au long de la chaîne alimentaire
Histoire de la Salmonella résistante aux céphalosporines de troisième génération
La question du risque sanitaire :
- Entre 2002 et 2004, le PICRA a observé une tendance inquiétante de résistance aux céphalosporines de troisième génération parmi les Salmonella Heidelberg récupérées chez les volailles et les personnes malades. La résistance aux céphalosporines de troisième génération était nettement plus élevée dans les isolats de poulets vendus au détail et d’humains malades du Québec que dans ceux de l’Ontario.
Quel impact cela a-t-il sur la santé humaine?
- La Salmonella Heidelberg fait partie des trois principaux sérovars de Salmonella au Canada et peut causer des infections invasives entraînant des maladies plus graves chez l’humain.
- La résistance au ceftiofur, une céphalosporine de troisième génération utilisée chez l’animal, confère une résistance à la ceftriaxone, une céphalosporine de troisième génération utilisée chez l’humain. Les céphalosporines de troisième génération sont des antimicrobiens de catégorie I (très grande importance pour la médecine humaine) et la ceftriaxone est utilisée pour traiter les salmonelloses chez les enfants et les femmes enceintes.
Pourquoi cela s’est-il produit?
- L’utilisation de médicaments en dérogation des directives de l’étiquette (UMDDE) (94) pour le ceftiofur dans les couvoirs de poulets de chair pourrait être à l’origine de la fréquence de la résistance aux céphalosporines de troisième génération chez Salmonella le long de la chaîne alimentaire de la volaille et chez les humains.
Première action politique volontaire de l’industrie :
- L’industrie québécoise du poulet a volontairement interdit l’utilisation du ceftiofur dans les poussins d’incubation et les poussins d’un jour entre le début de 2005 à
- Le PICRA a observé une diminution de la résistance aux céphalosporines de troisième génération chez des Salmonella isolées de poulets vendus au détail et de personnes malades, ainsi qu’une diminution de la résistance aux céphalosporines de troisième génération chez E. coli le long de la chaîne alimentaire des volailles (plusieurs espèces bactériennes touchées, ce qui suggère une pression sélective commune plutôt qu’une souche circulante de bactéries résistantes).
- L’industrie québécoise du poulet a repris l’utilisation du ceftiofur (par rotation) en 2007, ce qui a entraîné la réémergence de la résistance aux céphalosporines de troisième génération dans les isolats de poulet vendus au détail et d’humains.
Nouvelle action politique :
- La Direction des médicaments vétérinaires de Santé Canada a modifié l’étiquette du médicament ceftiofur pour déconseiller l’UMDDE.
- L’industrie a cessé d’utiliser les antimicrobiens de catégorie I (qui comprennent les céphalosporines de troisième génération) à des fins de prévention des maladies chez les poulets de chair et les dindes en mai 2014 et dans le secteur des reproducteurs de poulet de chair en mai 2015.
Impact des politiques internationales :
- Les données du PICRA ont été citées lors des auditions du Congrès américain (2010) soutenant un lien entre l’utilisation d’antimicrobiens dans l’alimentation des animaux et l’impact négatif sur la santé humaine (95).
- Avec d’autres informations, les données du PICRA ont été utilisées par la FDA américaine pour interdire certaines UMDDE de céphalosporines (sauf indication contraire) aux États-Unis (96).
Impact sur la politique intérieure :
- La stratégie d’UAM de l’industrie avicole a permis une diminution significative de l’utilisation déclarée du ceftiofur dans les couvoirs (jusqu’à zéro selon la surveillance des fermes sentinelles du PICRA depuis 2015) et une réduction des Salmonella résistantes aux céphalosporines de troisième génération provenant des poulets vendus au détail et des personnes malades.
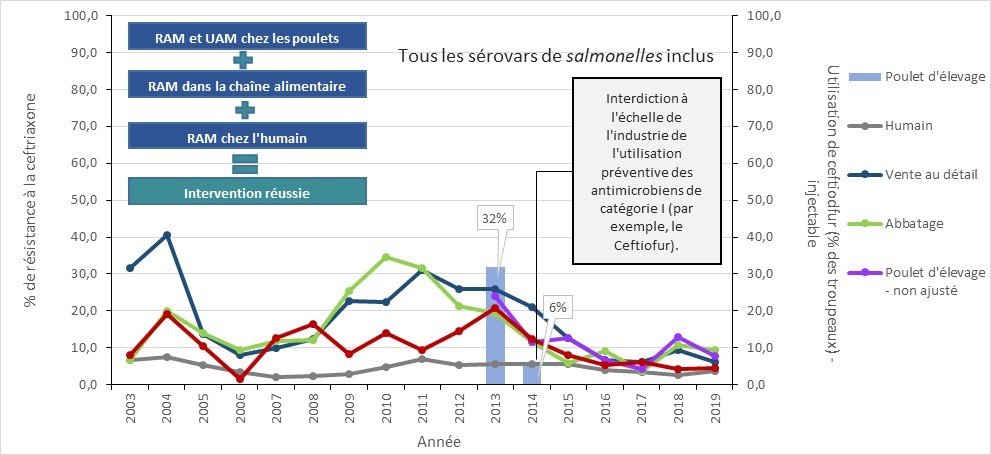
Figure 47 - Équivalent textuel
| Humain | Vente au détail | Abbatage | Poulet d’élevage – Non ajusté | Cas diagnostiques/cliniques | Poulet d’élevage | |
|---|---|---|---|---|---|---|
| 2003 | 6.5 | 31.5 | 6.6 | -2.0 | 8.1 | 0.0 |
| 2004 | 7.5 | 40.5 | 20.0 | -2.0 | 19.1 | 0.0 |
| 2005 | 5.3 | 13.8 | 14.0 | -2.0 | 10.5 | 0.0 |
| 2006 | 3.5 | 8.0 | 9.4 | -2.0 | 1.4 | 0.0 |
| 2007 | 2.1 | 9.9 | 11.9 | -2.0 | 12.6 | 0.0 |
| 2008 | 2.2 | 12.4 | 12.1 | -2.0 | 16.5 | 0.0 |
| 2009 | 2.8 | 22.7 | 25.4 | -2.0 | 8.2 | 0.0 |
| 2010 | 4.7 | 22.5 | 34.6 | -2.0 | 13.9 | 0.0 |
| 2011 | 6.9 | 31.0 | 31.7 | -2.0 | 9.3 | 0.0 |
| 2012 | 5.3 | 26.0 | 21.2 | -2.0 | 14.4 | 0.0 |
| 2013 | 5.6 | 25.9 | 19.4 | 23.9 | 20.8 | -1.0 |
| 2014 | 5.5 | 21.0 | 11.6 | 11.6 | 12.3 | -1.0 |
| 2015 | 5.5 | 12.5 | 5.8 | 12.5 | 7.9 | -1.0 |
| 2016 | 4.0 | 6.6 | 9.2 | 6.7 | 5.3 | -1.0 |
| 2017 | 3.4 | 6.0 | 3.6 | 4.1 | 6.2 | -1.0 |
| 2018 | 2.6 | 9.4 | 10.6 | 12.8 | 4.1 | -1.0 |
| 2019 | 3.7 | 6.2 | 9.4 | 7.6 | 4.5 | -1.0 |
Conclusions :
- La surveillance est une donnée pour l’action.
- Historiquement, les données de surveillance du PICRA ont permis de déterminer une tendance inquiétante, qui a conduit à des actions gouvernementales (avertissements sur les étiquettes), à des interventions volontaires de l’industrie de la volaille et qui a été historiquement incluse dans l’ordonnance fédérale de la US Food and Drug Administration des États-Unis visant à interdire certaines utilisations hors étiquette de cette classe d’antimicrobiens chez les animaux destinés à l’alimentation.
- Les interventions ont permis de réduire le risque pour la santé humaine de cette bactérie pathogène résistante aux antimicrobiens.
- Cette expérience a été utilisée comme un exemple d’analyse et de rapport combinés (une meilleure pratique) par le Groupe consultatif sur la surveillance intégrée de la résistance aux antimicrobiens (AGISAR) de l’Organisation mondiale de la santé dans son document d’orientation intitulé « Surveillance intégrée de la résistance aux antimicrobiens dans les bactéries d’origine alimentaire : Application de l’approche Un monde, une santé » (97).
Informations intégrées sur les antimicrobiens destinés à être utilisés dans tous les secteurs (humains, animaux et cultures)
Le nombre total de kilogrammes d’antimicrobiens vendus10 à l’adresse pour être utilisés dans les secteurs humain, animal et végétal a été calculé en intégrant les données provenant d’IQVIA, du PICRA-SDVMAV et de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada, respectivement.
En 2020, un total de 1,3 million de kg d’antimicrobiens médicalement importants ont été vendus au Canada. Les ventes destinées aux animaux de production représentaient environ 82 % du total, les humains environ 17 %, les animaux de compagnie < 1 % et les antimicrobiens utilisés comme pesticides sur les cultures alimentaires < 1 %.
En 2020, il y avait environ 22 animaux pour chaque humain au Canada (une sous-estimation, car le nombre de poissons n’est pas inclus dans le nombre d’animaux) (98) (99). Lorsque la biomasse des personnes et des animaux a été prise en compte, cela a révélé qu’environ 1,9 fois plus d’antimicrobiens étaient destinés à être utilisés chez les animaux de production que chez les personnes en utilisant le poids standard européen des animaux et 1,8 fois en utilisant le poids standard canadien des animaux.
Si des groupes d’antimicrobiens similaires ont été distribués ou achetés pour être utilisés dans les deux secteurs, les types d’antimicrobiens vendus varient. Les ventes d’antimicrobiens dans le secteur animal ont reflété relativement plus de tétracyclines et de macrolides que dans le secteur humain. Bien que d’autres classes d’antimicrobiens présentent des différences relatives en termes de quantités entre les animaux et les humains, il convient de noter que les ventes d’antimicrobiens de catégorie I, de céphalosporines de troisième génération (et une génération plus élevée) et de fluoroquinolones étaient relativement plus nombreuses dans le secteur humain que dans le secteur animal. Au Canada, les antimicrobiens de la classe des carbapénèmes et les céphalosporines de 4e génération n’ont jamais été autorisés à être utilisés chez les animaux.
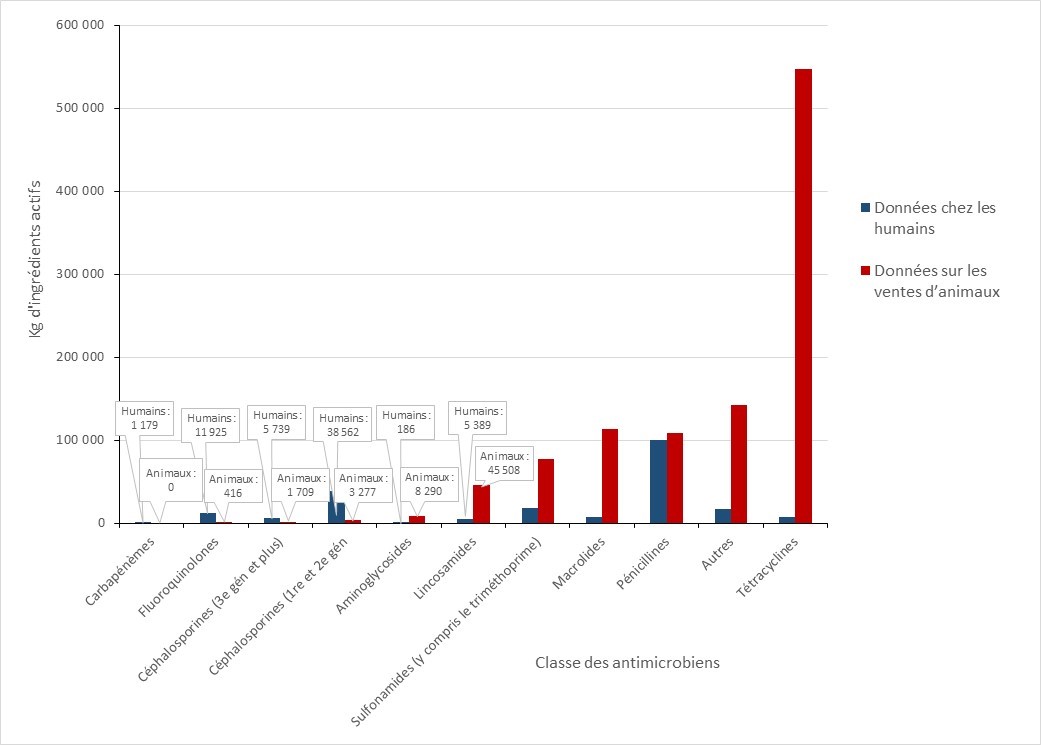
Figure 48 - Équivalent textuel
| Classe des antimicrobiens | Données humaines** | Données sur les ventes d’animaux |
|---|---|---|
| Carbapénèmes | 1 179,3 | 0,0 |
| Fluoroquinolones | 11 925,1 | 415,5 |
| Céphalosporines (troisième génération et plus) | 5 739,4 | 1 709,0 |
| Céphalosporines (première et deuxième génération) | 38 561,6 | 3 277,4 |
| Aminoglycosides | 186,1 | 8 290,3 |
| Lincosamides | 5 389,2 | 45 507,7 |
| Sulfonamides (inclus trimethoprim) | 18 021,5 | 76 878,1 |
| Macrolides | 7 454,4 | 113 551,8 |
| Pénicillines | 99 967,0 | 107 968,1 |
| Autres | 17 112,1 | 141 606,9 |
| Tétracyclines | 7 333,1 | 546 426,9 |
**Comprend l’hôpital humain et la pharmacie de détail
Remarque : Sources des données : IQVIA (analysé par le SCSRA) et PICRA-SDVMAV. Autres pour l’humain : bacitracines, céphalosporines de 5e génération, fosfomycines, acide fusidique, glycopeptides, lipopeptides, macrocycles, monobactames, nitrofuranes, nitroimidazoles, oxazolidinones, phénicols et polymyxines. Les autres produits destinés aux animaux comprennent : les aminocoumarines, les aminocyclitols, les amphénicols, les inhibiteurs de β-lactamase, les polypeptides cycliques (bacitracines), l’acide fusidique, les glycopeptides, les nitrofurantoïnes, les nitroimidazoles, les orthosomycines, les dérivés de l’acide phosphonique, les pleuromutilines, les polymyxines, les acides pseudomoniques, les streptogramines et les agents thérapeutiques contre la tuberculose.
Auteurs
| Auteur principaux | Programme | Collaborateurs | Programme |
|---|---|---|---|
| Stephanie Alexandre Dr. Oscar Niragira Dr. Kahina Abdesselam Jayson Shurgold Tanya Lary Dr. Donald Sheppard |
GTRAM GTRAM GTRAM GTRAM GTRAM GTRAM GTRAM |
Dr. Agnes Agunos Sean Ahmed Brent Avery Jessica Bartoszko Dr. Angelina Bosman Dr. Carolee Carson Joëlle Cayen Sabin Chasse Kelly Baekyung Choi Dr. Anna-Louise Crago Dr. Anne Deckert Walter Demczuk Tim Du Romaine Ediranasinghe Ken Fakharuddin Dr. George Golding Dr. Sheryl Gow Drew Greydanus Averil Griffith Michael Hartmann Romeo Hizon Braden Knight Marie Lafreniere Janelle Lanoix Dr. David Leger Lillian Lourenco Cassandra Lybeck Jami Mackenzie Dr. Melissa Mackinnon Irene Martin Laura F. Mataseje Cecilia McClellan Melissa McCracken Robyn Mitchell Dr. Aboubakar Mounchili Dr. Michael R. Mulvey Linda Pelude Reshel Senoli Perera Delvin Rao Dr. Richard Reid-Smith Caleb Routledge Dr. Wallis Rudnick Pam Sawatzky Anada Silva Glenys Smith Hamza Syed Shari Thomas Robyn Thorington Meg Tunis |
PICRA LNM PICRA PCSIN PICRA PICRA PCSIN GTRAM PCSIN GTRAM PICRA LNM LNM LNM LNM LNM PICRA GTRAM LNM GTRAM LNM GTRAM CTBLSS GTRAM PICRA SARGA SARGA GTRAM PICRA LNM LNM PCSIN PCSIN PCSIN GTRAM LNM PCSIN CTBLSS GTRAM PICRA GTRAM RésRAM, LNM LNM PCSIN GTRAM GTRAM GTRAM LNM GTRAM |
| Remerciements | |||
| Agriculture et Agroalimentaire Canada Sites participants à RésRAM Agence canadienne d’inspection des aliments L’Enquête nationale sur la prescription d’antimicrobiens (ENPA canadien), Sinai Health-University Health Network Antimicrobial Stewardship Program, University Health Network Contributeurs du PICRA Hôpitaux participant au PCSIN Contributeurs du SCSLT Contributeurs du SCDCT Ministère des Pêches et Océans Canada Santé Canada, Système de déclaration des ventes d’antimicrobiens vétérinaires (VASR) Santé Canada, Direction des médicaments vétérinaires IQVIA Agriculteurs, vétérinaires et abattoirs participants Agence de réglementation de la lutte antiparasitaire Statistique Canada Le « National Centre for Antimicrobial Stewardship (NCAS) », University of Melbourne, Australia et le Royal Melbourne Hospital « The National Antimicrobial Prescribing Survey (NAPS™). » NAPS™ est une marque de commerce de Melbourne Health |
|||
Annexes
Annexe A : Ingrédients antibiotiques au sein de chaque classe de l’OMS et de la catégorisation AWaRe
| CLASSE | AWaRe | ATC | MOLÉCULE |
|---|---|---|---|
| n/a | n/a | J01xx10 | Bacitracine |
| Aminocyclitols | Accès | A07aa06 | Paromomycine |
| Aminoglycosides | Accès | J01gb06 | Amikacin |
| Accès | J01gb03 | Gentamicine | |
| À surveiller | J01ga01 | Streptomycine | |
| À surveiller | J01gb01 | Tobramycine | |
| Amphenicols | Accès | J01ba01 | Chloramphénicol |
| Inhibiteur de bêta-lactamase | Accès | J01cr02 | Amoxicilline : Acide clavulanique |
| À surveiller | J01cr05 | Piperacillin:Tazobactam | |
| Carbapénèmes | À surveiller | J01dh03 | Értapénéme |
| À surveiller | J01dh51 | Imipéneme : Cilastatine | |
| À surveiller | J01dh02 | Meropénem | |
| Céphalosporines de deuxième génération | À surveiller | J01dc04 | Céfaclor |
| À surveiller | J01dc01 | Céfoxitine | |
| À surveiller | J01dc10 | Cefprozil | |
| À surveiller | J01dc02 | Céfuroxime | |
| Céphalosporines de troisième génération | À surveiller | J01dd08 | Céfixime |
| À surveiller | J01dd01 | Céfotaxime | |
| À surveiller | J01dd02 | Ceftazidime | |
| À surveiller | J01dd04 | Ceftriaxone | |
| Céphalosporines de quatrième génération | À surveiller | J01de01 | Céfépime |
| Céphalosporines de cinquième génération | Accès | J01db05 | Céfadroxil |
| Accès | J01db04 | Céfazolin | |
| De réserve | J01di01 | Médocaril Ceftobiprole | |
| De réserve | J01di54 | Ceftolozane : Tazobactam | |
| Accès | J01db01 | Céphalexine | |
| Fluoroquinolones | À surveiller | J01ma02 | Ciprofloxacine |
| À surveiller | J01ma16 | Gatifloxacine | |
| À surveiller | J01ma12 | Lévofloxacine | |
| À surveiller | J01ma14 | Moxifloxacine | |
| À surveiller | J01ma06 | Norfloxacine | |
| À surveiller | J01ma01 | Ofloxacine | |
| Glycopeptides | De réserve | J01xa04 | Dalbavancine |
| De réserve | J01xa03 | Télavancine | |
| De réserve | J01aa12 | Tigécycline | |
| À surveiller | A07aa09 | Vancomycine | |
| À surveiller | J01xa01 | Vancomycine | |
| Imidazoles | Accès | J01xd01 | Métronidazole |
| Accès | P01ab01 | Métronidazole | |
| Lincosamides | Accès | J01ff01 | Clindamycine |
| Lipopeptides | De réserve | J01xx09 | Daptomycine |
| Macrolides | À surveiller | J01fa10 | Azithromycine |
| À surveiller | J01fa09 | Clarithromycine | |
| À surveiller | J01fa01 | Érythromycine | |
| À surveiller | A07aa12 | Fidaxomicine | |
| À surveiller | J01fa02 | Spiramycine | |
| Monobactames | De réserve | J01df01 | Aztréonam |
| Dérivés du nitrofurane | Accès | J01xe01 | Nitrofurantoïne |
| Oxazolidinones | De réserve | J01xx08 | Linézolide |
| Pénicillines | Accès | J01ca04 | Amoxicilline |
| Accès | J01ca01 | Ampicilline | |
| Accès | J01cf02 | Cloxacilline | |
| Accès | J01ce01 | Pénicilline G | |
| Accès | J01ce08 | Pénicilline G | |
| Accès | J01ce09 | Pénicilline G | |
| Accès | J01ce02 | Pénicilline V | |
| Accès | J01ce10 | Pénicilline V | |
| À surveiller | J01ca12 | Pipéacilline | |
| Accès | J01ca08 | Pivmecillinam | |
| Phosphoniques | À surveiller | J01xx01 | Fosfomycin |
| Polymyxines | De réserve | J01xb01 | Colistine |
| Antibactériens stéroïdiens | À surveiller | J01xc01 | Acide fusidique |
| Combinaisons sulfonamide-triméthoprime | Accès | J01ee01 | Sulfaméthoxazole : Triméthoprime |
| Sulfonamides | Accès | J01ec02 | Sulfadiazine |
| Accès | J01ec01 | Sulfaméthoxazole | |
| Tétracyclines | Accès | J01aa02 | Doxycycline |
| À surveiller | J01aa08 | Minocycline | |
| Accès | J01aa07 | Tétracycline | |
| Dérivés de la triméthoprime | Accès | J01ea01 | Triméthoprim |
Annexe B : Hôpitaux participants au PCSIN
| Nom de l’hôpital | Ville | Province |
|---|---|---|
| Alberta Children’s Hospital | Calgary | Alberta |
| BC Children’s Hospital | Vancouver | Colombie-Britannique |
| BC Women’s Hospital | Vancouver | Colombie-Britannique |
| Bridgepoint Active Healthcare | Toronto | Ontario |
| Burin Peninsula Health Care Centre | Burin | Terre-Neuve |
| Carbonear General Hospital | Carbonear | Terre-Neuve |
| Centre hospitalier de l’Université de Montréal (CHUM) | Montréal | Québec |
| Centre hospitalier universitaire Sainte-Justine | Montréal | Québec |
| Centre hospitalier pour enfants de l’est de l’Ontario (CHEO) | Ottawa | Ontario |
| Children’s Hospital of Western Ontario | London | Ontario |
| Dartmouth General Hospital | Halifax | Nouvelle-Écosse |
| Dr. GB Cross Memorial Hospital | Clarenville | Terre-Neuve |
| Foothills Medical Centre | Calgary | Alberta |
| General Hospital and Miller Centre | St. John’s | Terre-Neuve |
| Halifax Infirmary | Halifax | Nouvelle-Écosse |
| Hamilton Health Sciences Centre—Site général | Hamilton | Ontario |
| Hamilton Health Sciences Centre—Jurvinski Hospital and Cancer Centre | Hamilton | Ontario |
| Health Sciences Centre—Winnipeg | Winnipeg | Manitoba |
| Hôpital Maisonneuve-Rosemont | Montréal | Québec |
| Hospital for Sick Children | Toronto | Ontario |
| Hôtel-Dieu de Québec | Québec | Québec |
| IWK Health Centre | Halifax | Nouvelle-Écosse |
| Janeway Children’s Hospital and Rehabilitation Centre | St. John’s | Terre-Neuve |
| Kelowna General Hospital | Kelowna | Colombie-Britannique |
| Kingston General Hospital | Kingston | Ontario |
| Hôpital général de Lachine | Lachine | Québec |
| Lion’s Gate, North Vancouver | Vancouver | Colombie-Britannique |
| Centre universitaire de santé McGill — Hôpital de Montréal pour enfants | Montréal | Québec |
| Centre universitaire de santé McGill — Hôpital général de Montréal | Montréal | Québec |
| Centre universitaire de santé McGill — Institut neurologique de Montréal | Montréal | Québec |
| McMaster Children’s Hospital | Hamilton | Ontario |
| Moose Jaw Hospital (Dr. FH Wigmore Regional Hospital) | Moose Jaw | Saskatchewan |
| Mount Sinai Hospital | Toronto | Ontario |
| Nanaimo Regional General Hospital | Nanaimo | Colombie-Britannique |
| North York General Hospital | Toronto | Ontario |
| Ottawa Hospital—Civic Campus | Ottawa | Ontario |
| Ottawa Hospital—General Campus | Ottawa | Ontario |
| Pasqua Hospital | Régina | Saskatchewan |
| Peter Lougheed Centre | Calgary | Alberta |
| Powell River General Hospital | Powell River | Colombie-Britannique |
| Prince County Hospital | Summerside | Île-du-Prince-Édouard |
| Princess Margaret | Toronto | Ontario |
| Qikigtani General Hospital | Iqualuit | Nunavut |
| Queen Elizabeth Hospital | Charlottetown | Île-du-Prince-Édouard |
| Regina General Hospital | Régina | Saskatchewan |
| Rehabilitation Centre | Halifax | Nouvelle-Écosse |
| Richmond General Hospital | Richmond | Colombie-Britannique |
| Rockyview General Hospital | Calgary | Alberta |
| Royal Jubilee | Victoria | Colombie-Britannique |
| Royal University Hospital | Saskatoon | Saskatchewan |
| Hôpital Royal Victoria | Montréal | Québec |
| Sechelt Hospital (auparavant St. Mary’s) | Sechelt | Colombie-Britannique |
| Sir Thomas Roddick Hospital | Stephenville | Terre-Neuve |
| SMBD — Hôpital général juif | Montréal | Québec |
| South Health Campus | Calgary | Alberta |
| Squamish General Hospital | Squamish | Colombie-Britannique |
| St. Clare’s Mercy Hospital | St. John’s | Terre-Neuve |
| St. Joseph’s Healthcare | Hamilton | Ontario |
| St. Michael’s Hospital | Toronto | Ontario |
| St. Paul’s Hospital | Saskatoon | Saskatchewan |
| Stollery Children’s Hospital | Edmonton | Alberta |
| Hôpital régional de Sudbury | Sudbury | Ontario |
| Sunnybrook Hospital | Toronto | Ontario |
| The Moncton Hospital | Moncton | Nouveau-Brunswick |
| Toronto General Hospital | Toronto | Ontario |
| Toronto Western Hospital | Toronto | Ontario |
| UBC Hospital | Vancouver | Colombie-Britannique |
| University Hospital | London | Ontario |
| University Hospital of Northern BC | Prince George | Colombie-Britannique |
| University of Alberta Hospital | Edmonton | Alberta |
| University of Manitoba Children’s Hospital | Winnipeg | Manitoba |
| University of Ottawa Heart Institute | Ottawa | Ontario |
| Vancouver General Hospital | Vancouver | Colombie-Britannique |
| Veterans Memorial Building | Halifax | Nouvelle-Écosse |
| Victoria General | Halifax | Nouvelle-Écosse |
| Victoria General Hospital | Victoria | Colombie-Britannique |
| Victoria Hospital | London | Ontario |
| Western Memorial Regional Hospital | Corner Brook | Terre-Neuve |
Notes de bas de page
- Anciennement Clostridium difficile.
- Depuis 2013, l'Agence de la santé publique du Canada (ASPC) recommande de traiter la gonorrhée à l'aide d'une bithérapie composée d'une céphalosporine de troisième génération (Céfixime 800mg ou Ceftriaxone 250mg) et d'Azithromycine (1g). Cependant, des combinaisons de traitement spécifiques pour la gonorrhée sont spécifiées pour les gays, les bisexuels et les autres hommes ayant des rapports sexuels avec des hommes (gbHARSAH) et les jeunes et adultes non gbHARSAH. La bithérapie composée de ceftriaxone et d'azithromycine est le traitement privilégié des infections anogénitales non compliquées chez les gbHARSAH et des infections pharyngées chez tous les jeunes et autres adultes. Le céfixime et l'azithromycine constituent un autre traitement privilégié pour les infections anogénitales non compliquées chez les jeunes et les adultes non gbHARSAH. Des traitements alternatifs sont spécifiés en cas de contre-indication aux céphalosporines ou en cas d'indications de résistance émergente. Bien qu'il soit raisonnable de fournir le traitement privilégié ou alternatif de la gonorrhée, l'utilisation de traitements alternatifs est réservée aux cas indiqués. Il convient de noter que les traitements alternatifs recommandés par l'ASPC ont changé au fil du temps (de 2013 à 2020) (44) (48).
- Les détails de la méthodologie se trouvent dans les méthodes de SARGA : https://www.canada.ca/en/public-health/services/publications/diseases-conditions/2015-2017-report-enhanced-surveillance-antimicrobial-resistant-gonorrhea.html#a4
- Les sérotypes VPC13 sont évitables par la vaccination, tandis que la vaccination n'a aucune efficacité sur les sérotypes non VPC13.
- www.antimicrobialstewardship.com
- www.ncas-australia.org/naps
- Définition de la pertinence de « Hospital NAPS™, » Melbourne Health. Adapté avec la permission d’être utilié dans le cadre de l’Enquête nationale canadienne sur la prescription d’antimicrobiens. NAPS™ est une marque de commerce de Melbourne Health.
- Défini comme allant de mai 2016 à février 2020.
- Défini comme allant de mars 2020 à avril 2022.
- Il existe des différences dans les cadres de collecte des données, les fournisseurs de données impliqués, les types de données et l'analyse des données dans ces secteurs. Pour ce rapport, les différentes sources de données (c'est-à-dire les données sur les ventes, les dispensations des pharmacies humaines et les données sur les achats des hôpitaux) sont regroupées sous le titre « ventes d'antimicrobiens ».
Références
- Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Aguilar GR, Gray A, et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 2022;399:629-655. doi: https://doi.org/10.1016/S0140-6736(21)02724-0
- Council of Canadian Academies (CCA). Forecasting the future of antimicrobial resistance (AMR) in Canada. 2019; Available at: https://cca-reports.ca/forecasting-the-future-of-amr/.
- Hawkins O, Scott AM, Montgomery A, Nicholas B, Mullan J, van Oijen A, et al. Comparing public attitudes, knowledge, beliefs and behaviours towards antibiotics and antimicrobial resistance in Australia, United Kingdom, and Sweden (2010-2021): a systematic review, meta-analysis, and comparative policy analysis. PLoS One 2022;17(1):e0261917.
- Infectious Diseases Society of America and Research!America. AMR Survey. 2018; Available at: https://www.researchamerica.org/blog/new-survey-more-80-americans-are-concerned-antibiotic-resistance-health-threat. Accessed July/04, 2022.
- Crago AL, Alexandre S., Abdesselam K., GravelTropper D., Hartmann M., Smith G., et al. Understanding Canadians' Knowledge, Attitudes, and Practices Related to Antimicrobial Resistance and Antibiotic Use: Results from Public Opinion research 2019-2022. Can Commun Dis Rep. IN PRESS
- Martin AJ, Shulder S, Dobrzynski D, Quartuccio K, Pillinger KE. Antibiotic Use and Associated Risk Factors for Antibiotic Prescribing in COVID-19 Hospitalized Patients. J Pharm Pract. 2021 Jul 22:8971900211030248. doi: 10.1177/08971900211030248. Epub ahead of print. PMID: 34291681.
- Langford BJ, So M, Raybardhan S, Leung V, Soucy JR, Westwood D, et al. Antibiotic prescribing in patients with COVID-19: rapid review and meta-analysis. Clinical microbiology and infection 2021;27(4):520-531.
- Canadian Nosocomial Infection Surveillance Program (CNISP). Healthcare-associated infections and antimicrobial resistance in Canadian acute care hospitals, 2016-2020. Can Commun Dis Rep 2022;48(7/8):308-24
- Noble W, Valkenburg H, Wolters CH. Carriage of Staphylococcus aureus in random samples of a normal population. Epidemiology & Infection 1967;65(4):567-573.
- Diederen B, Kluytmans J. The emergence of infections with community-associated methicillin resistant Staphylococcus aureus. J Infect 2006;52(3):157-168.
- Cimolai N. Methicillin-resistant Staphylococcus aureus in Canada: a historical perspective and lessons learned. Can J Microbiol 2010;56(2):89-120.
- Loewen K, Schreiber Y, Kirlew M, Bocking N, Kelly L. Community-associated methicillin-resistant Staphylococcus aureus infection: Literature review and clinical update. Can Fam Physician 2017 Jul;63(7):512-520.
- Linden, P.K. 2007a, "Optimizing therapy for vancomycin-resistant enterococci (VRE)", Seminars in respiratory and critical care medicine© Thieme Medical Publishers, pp. 632.
- Centers for Disease Control and Prevention (CDC). Antibiotic resistance in the United States. 2019:2022.
- Ahmed MO, Baptiste KE. Vancomycin-Resistant Enterococci: A Review of Antimicrobial Resistance Mechanisms and Perspectives of Human and Animal Health. Microbial Drug Resistance 2018 06/01; 2022/08;24(5):590-606.
- Public Health Agency of Canada (PHAC). Surveillance of Vancomycin Resistant Enterococci Bloodstream Infections in CNISP Hospitals. 2018;2022.
- Adeolu M, Alnajar S, Naushad S, Gupta RS. Genome-based phylogeny and taxonomy of the ‘Enterobacterales’: proposal for Enterobacterales ord. nov. divided into the families Enterobacteriaceae, Erwiniaceae fam. nov., Pectobacteriaceae fam. nov., Yersiniaceae fam. nov., Hafniaceae fam. nov., Morganellaceae fam. nov., and Budviciaceae fam. nov. Int J Syst Evol Microbiol 2016;66(12):5575-5599.
- Budhram DR, Mac S, Bielecki JM, Patel SN, Sander B. Health outcomes attributable to carbapenemase-producing Enterobacteriaceae infections: A systematic review and meta-analysis. Infection Control & Hospital Epidemiology 2020;41(1):37-43.
- Falagas ME, Karageorgopoulos DE, Nordmann P. Therapeutic options for infections with Enterobacteriaceae producing carbapenem-hydrolyzing enzymes. Future microbiology 2011;6(6):653-666.
- Mataseje LF, Abdesselam K, Vachon J, Mitchel R, Bryce E, Roscoe D, et al. Results from the Canadian nosocomial infection surveillance program on carbapenemase-producing Enterobacteriaceae, 2010 to 2014. Antimicrob Agents Chemother 2016;60(11):6787-6794.
- Nordmann P, Naas T, Poirel L. Global spread of Carbapenemase-producing Enterobacteriaceae. Emerg Infect Dis 2011 Oct;17(10):1791-1798.
- Mataseje L, Bryce E, Roscoe D, Boyd D, Embree J, Gravel D, et al. Carbapenem-resistant gram-negative bacilli in Canada 2009–10: results from the Canadian Nosocomial Infection Surveillance Program (CNISP). J Antimicrob Chemother 2012;67(6):1359-1367.
- Asokan GV, Ramadhan T, Ahmed E, Sanad H. WHO Global Priority Pathogens List: A Bibliometric Analysis of Medline-PubMed for Knowledge Mobilization to Infection Prevention and Control Practices in Bahrain. Oman Med J 2019 May;34(3):184-193.
- Goldfarb D, Harvey S, Jessamine K, Jessamine P, Toye B, Desjardins M. Detection of plasmid-mediated KPC-producing Klebsiella pneumoniae in Ottawa, Canada: evidence of intrahospital transmission. J Clin Microbiol 2009;47(6):1920-1922.
- Van Duin D, Kaye KS, Neuner EA, Bonomo RA. Carbapenem-resistant Enterobacteriaceae: a review of treatment and outcomes. Diagn Microbiol Infect Dis 2013;75(2):115-120.
- Schaeffler H, Breitrueck A. Clostridium difficile–from colonization to infection. Frontiers in microbiology 2018;9:646.
- Smits WK, Lyras D, Lacy DB, Wilcox MH, Kuijper EJ. Clostridium difficile Nature reviews Disease primers 2016;2(1):1-20.
- Rineh A, Kelso MJ, Vatansever F, Tegos GP, Hamblin MR. Clostridium difficile infection: molecular pathogenesis and novel therapeutics. Expert review of anti-infective therapy 2014;12(1):131-150.
- Zhu D, Sorg JA, Sun X. Clostridioides difficile biology: sporulation, germination, and corresponding therapies for C. difficile infection. Frontiers in cellular and infection microbiology 2018;8:29.
- Reigadas E, Vazquez-Cuesta S, Onori R, Villar-Gomara L, Alcala L, Marin M, et al. Clostridioides difficile contamination in a clinical microbiology laboratory? Clinical Microbiology and Infection 2020;26(3):340-344.
- Kato H, Hagihara M, Asai N, Shibata Y, Yamagishi Y, Iwamoto T, et al. A systematic review and meta-analysis of decontamination methods to prevent hospital environmental contamination and transmission of Clostridioides difficile. Anaerobe 2022;73:102478.
- McDonald LC, Gerding DN, Johnson S, Bakken JS, Carroll KC, Coffin SE, et al. Clinical practice guidelines for Clostridium difficile infection in adults and children: 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clinical infectious diseases 2018;66(7):e1-e48.
- Zhong P, Dazhi J, Kim HB, Stratton Charles W., Bin W, Tang Yi-Wei, et al. Update on Antimicrobial Resistance in Clostridium difficile: Resistance Mechanisms and Antimicrobial Susceptibility Testing. J Clin Microbiol 2017 07/01; 2022/07;55(7):1998-2008.
- Eubank TA, Gonzales-Luna AJ, Hurdle JG, Garey KW. Genetic mechanisms of vancomycin resistance in Clostridioides difficile: a systematic review. Antibiotics 2022;11(2):258.
- Spigaglia P. Recent advances in the understanding of antibiotic resistance in Clostridium difficile Ther Adv Infect Dis 2016 Feb;3(1):23-42.
- Carlson, T., Blasingame, D., Gonzales-Luna, A., Alnezary, F. & Garey, K. 2020, Clostridioides difficile ribotype 106: A systematic review of the antimicrobial susceptibility, genetics, and clinical outcomes of this common worldwide strain, Anaerobe, vol. 62, pp. 102142
- Knight, D.R., Squire, M.M., Collins, D.A. & Riley, T.V. 2017, Genome analysis of Clostridium difficile PCR ribotype 014 lineage in Australian pigs and humans reveals a diverse genetic repertoire and signatures of long-range interspecies transmission", Frontiers in microbiology, vol. 7, pp. 2138.
- Chan YA, Hackett KT, Dillard JP. The lytic transglycosylases of Neisseria gonorrhoeae. Microbial drug resistance (Larchmont, NY) 2012;18(3):271-279.
- Unemo M, Shafer WM. Antimicrobial resistance in Neisseria gonorrhoeae in the 21st century: past, evolution, and future. Clin Microbiol Rev 2014;27(3):587-613.
- Bodie M, Gale-Rowe M, Alexandre S, Auguste U, Tomas K, Martin I. Addressing the rising rates of gonorrhea and drug-resistant gonorrhea: There is no time like the present. Can Commun Dis Rep 2019 Feb 7;45(2-3):54-62.
- Public Health Agency of Canada (PHAC). Report on sexually transmitted infection surveillance in Canada, 2019. 2022; Available at: https://www.canada.ca/en/public-health/services/publications/diseases-conditions/report-sexually-transmitted-infection-surveillance-canada-2019.html#s5-3]%202022. Accessed October/05, 2022.
- Public Health Agency of Canada (PHAC). Notifiable Diseases Online. 2022; Available at: https://diseases.canada.ca/notifiable/. Accessed October/05, 2022.
- Sánchez-Busó L, Yeats CA, Taylor B, Goater RJ, Underwood A, Abudahab K, et al. A community-driven resource for genomic epidemiology and antimicrobial resistance prediction of Neisseria gonorrhoeae at Pathogenwatch. Genome medicine 2021;13(1):1-22.
- Public Health Agency of Canada (PHAC). Gonorrhea guide: Treatment and follow up. 2022; Available at: https://www.canada.ca/en/public-health/services/infectious-diseases/sexual-health-sexually-transmitted-infections/canadian-guidelines/gonorrhea/treatment-follow-up.html#a2_1. Accessed August/10, 2022.
- Public Health Agency of Canada (PHAC). Canadian Antimicrobial Resistance Surveillance Report - Update 2020. 2020; Available at: https://www.canada.ca/en/public-health/services/publications/drugs-health-products/canadian-antimicrobial-resistance-surveillance-system-2020-report.html.
- Lefebvre B, Martin I, Demczuk W, Deshaies L, Michaud S, Labbe AC, et al. Ceftriaxone-Resistant Neisseria gonorrhoeae, Canada, 2017. Emerg Infect Dis 2018 Feb;24(2):10.3201/eid2402.171756. Epub 2018 Feb 17.
- Smyczek P, Chu A, Berenger B. Emerging international strain of multidrug-resistant Neisseria gonorrhoeae: Infection in a man with urethral discharge. Canadian Family Physician 2019;65(8):552-554.
- Public Health Agency of Canada (PHAC). Sexually transmitted and blood-borne infections: Guides for health professionals – Gonorrhea guide. 2022; Available at: https://www.canada.ca/en/public-health/services/infectious-diseases/sexual-health-sexually-transmitted-infections/canadian-guidelines.html. Accessed August/10, 2022.
- Maitra A, Munshi T, Healy J, Martin LT, Vollmer W, Keep NH, et al. Cell wall peptidoglycan in Mycobacterium tuberculosis: An Achilles’ heel for the TB-causing pathogen. FEMS Microbiol Rev 2019;43(5):548-575.
- Tornheim JA, Dooley KE. Tuberculosis associated with HIV infection. Microbiology spectrum 2017;5(1):5.1. 30.
- Lyon SM, Rossman MD. Pulmonary tuberculosis. Microbiology spectrum 2017;5(1):5.1. 24.
- Chakaya J, Khan M, Ntoumi F, Aklillu E, Fatima R, Mwaba P, et al. Global Tuberculosis Report 2020–Reflections on the Global TB burden, treatment and prevention efforts. International Journal of Infectious Diseases 2021;113:S7-S12.
- Mounchili A, Perera R, Lee RS, Njoo H, Brooks J. Chapter 1: Epidemiology of tuberculosis in Canada. Canadian Journal of Respiratory, Critical Care, and Sleep Medicine 2022;6(sup1):8-21.
- Cooper R, Houston S, Hughes C, Johnston JC. Chapter 10: Treatment of active tuberculosis in special populations. Canadian Journal of Respiratory, Critical Care, and Sleep Medicine 2022;6(sup1):149-166.
- Bogaert D, de Groot R, Hermans P. Streptococcus pneumoniae colonisation: the key to pneumococcal disease. The Lancet infectious diseases 2004;4(3):144-154.
- European Centre for Disease Control and Prevention (ECDC). Factsheet about pneumococcal disease. 2022; Available at: https://www.ecdc.europa.eu/en/pneumococcal-disease/facts. Accessed July/2022, 2022.
- Demczuk W, Griffith A, Singh R, Montes K, Sawatzky P, Martin I. National laboratory surveillance of invasive streptococcal disease in Canada-annual summary 2013. 2013; Available at: https://www.canada.ca/en/public-health/services/publications/drugs-health-products/laboratory-surveillance-invasive-streptococcal-disease-annual-summary-2013.html. Accessed october 11, 2022.
- Mandell LA, Marrie TJ, Grossman RF, Chow AW, Hyland RH, Canadian CAP Working Group. Summary of Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Disease Society and the Canadian Thoracic Society. Canadian Journal of Infectious Diseases 2000;11(5):237-248.
- Tleyjeh IM, Tlaygeh HM, Hejal R, Montori VM, Baddour LM. The impact of penicillin resistance on short-term mortality in hospitalized adults with pneumococcal pneumonia: a systematic review and meta-analysis. Clinical infectious diseases 2006;42(6):788-797.
- Hausdorff WP, Feikin DR, Klugman KP. Epidemiological differences among pneumococcal serotypes. The Lancet infectious diseases 2005;5(2):83-93.
- Golden A, Griffith A, Demczuk W, Lefebvre B, McGeer A, Tyrrell G, et al. Invasive pneumococcal disease surveillance in Canada, 2020. CCDRCANADA 2022;48(9):396.
- Kanwal S, Vaitla P. Streptococcus Pyogenes. StatPearls Treasure Island (FL): StatPearls Publishing LLC; 2020.
- Avire NJ, Whiley H, Ross K. A Review of Streptococcus pyogenes: Public health risk factors, prevention and control. Pathogens 2021;10(2):248.
- Demczuk W, Martin I, Domingo FR, MacDonald D, Mulvey MR. Identification of Streptococcus pyogenes M1UK clone in Canada. Lancet Infect Dis 2019 Dec;19(12):1284-1285.
- Cunningham MW. Pathogenesis of group A streptococcal infections. Clin Microbiol Rev 2000;13(3):470-511.
- Lynskey NN, Lawrenson RA, Sriskandan S. New understandings in Streptococcus pyogenes. Curr Opin Infect Dis 2011;24(3):196-202.
- Mandell, L.A., Marrie, T.J., Grossman, R.F., Chow, A.W., Hyland, R.H. & Canadian CAP Working Group 2000, "Summary of Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Disease Society and the Canadian Thoracic Society", Canadian Journal of Infectious Diseases, vol. 11, no. 5, pp. 237-248.
- Rafei R, Iaali RA, Osman M, Dabboussi F, Hamze M. A global snapshot on the prevalent macrolide-resistant emm types of Group A Streptococcus worldwide, their phenotypes and their resistance marker genotypes during the last two decades: A systematic review. Infection, Genetics and Evolution 2022:105258.
- Mao Y, Zeineldin M, Usmani M, Uprety S, Shisler JL, Jutla A, et al. Distribution and antibiotic resistance profiles of Salmonella enterica in rural areas of North Carolina after Hurricane Florence in 2018. GeoHealth 2021;5(2):e2020GH000294.
- Public Health Agency of Canada (PHAC). Pethogen Safety Data Sheets: Infectious Substances - Salmonella enterica 2010; Available at: https://www.canada.ca/en/public-health/services/laboratory-biosafety-biosecurity/pathogen-safety-data-sheets-risk-assessment/salmonella-enterica.html. Accessed October/18, 2022.
- Public Health Agency of Canada (PHAC). Canadian Integrated Program for Antimicrobial Resistance Surveillance (CIPARS) 2018: Design and Methods. 2020; Available at: https://www.canada.ca/en/public-health/services/surveillance/canadian-integrated-program-antimicrobial-resistance-surveillance-cipars/cipars-reports/2018-annual-report-design-methods.html. Accessed 12/01, 2020.
- Yu D, Banting G, Neumann NF. A review of the taxonomy, genetics, and biology of the genus Escherichia and the type species Escherichia coli. Can J Microbiol 2021;67(8):553-571.
- Kai A, Konishi N, Obata H. Diarrheagenic Escherichia coli. Nihon Rinsho 2010 Jun;68 Suppl 6:203-207.
- Wijetunge D, Gongati S, DebRoy C, Kim K, Couraud P, Romero I, et al. Characterizing the pathotype of neonatal meningitis causing Escherichia coli (NMEC). BMC microbiology 2015;15(1):1-15.
- Allocati N, Masulli M, Alexeyev MF, Di Ilio C. Escherichia coli in Europe: an overview. International journal of environmental research and public health 2013;10(12):6235-6254.
- Karlowsky JA, Lagacé-Wiens PR, Simner PJ, DeCorby MR, Adam HJ, Walkty A, et al. Antimicrobial resistance in urinary tract pathogens in Canada from 2007 to 2009: CANWARD surveillance study. Antimicrob Agents Chemother 2011;55(7):3169-3175.
- Saatchi A, Yoo JW, Marra F. Outpatient prescribing and prophylactic antibiotic use for recurrent urinary tract infections in British Columbia, Canada. Can Urol Assoc J 2021 Dec;15(12):397-404.
- Paczosa MK, Mecsas J. Klebsiella pneumoniae: going on the offense with a strong defense. Microbiology and Molecular Biology Reviews 2016;80(3):629-661.
- Li B, Zhao Y, Liu C, Chen Z, Zhou D. Molecular pathogenesis of Klebsiella pneumoniae. Future microbiology 2014;9(9):1071-1081.
- Bassetti M, Righi E, Carnelutti A, Graziano E, Russo A. Multidrug-resistant Klebsiella pneumoniae: challenges for treatment, prevention and infection control. Expert review of anti-infective therapy 2018;16(10):749-761.
- Noble W, Valkenburg H, Wolters CH. Carriage of Staphylococcus aureus in random samples of a normal population. Epidemiology & Infection 1967;65(4):567-573.
- Archer GL. Staphylococcus aureus: a well-armed pathogen. Rev Infect Dis 1998;26(5):1179-1181.
- Salgado-Pabón W, Breshears L, Spaulding AR, Merriman JA, Stach CS, Horswill AR, et al. Superantigens are critical for Staphylococcus aureus Infective endocarditis, sepsis, and acute kidney injury. MBio 2013;4(4):e00494-13.
- Musser JM, Schlievert PM, Chow AW, Ewan P, Kreiswirth BN, Rosdahl VT, et al. A single clone of Staphylococcus aureus causes the majority of cases of toxic shock syndrome. Proc Natl Acad Sci U S A 1990 Jan;87(1):225-229.
- Vestergaard M, Frees D, Ingmer H. Antibiotic resistance and the MRSA problem. Microbiology spectrum 2019;7(2):7.2. 18.
- Bartlett JG, Dowell SF, Mandell LA, File Jr TM, Musher DM, Fine MJ. Practice guidelines for the management of community-acquired pneumonia in adults. Clinical infectious diseases 2000;31(2):347-382.
- Yılmaz EŞ, Aslantaş Ö. Antimicrobial resistance and underlying mechanisms in Staphylococcus aureus Asian Pacific journal of tropical medicine 2017;10(11):1059-1064.
- Centers for Disease Control and Prevention (CDC) 2022, 2022 Special report: COVID-19 U.S. impact on antimicrobial resistance. Available: https://www.cdc.gov/drugresistance/pdf/covid19-impact-report-508.pdf [2022, Sept/23].
- European Centre for Disease Prevention and Control (ECDC), European Food Safety Authority (EFSA), European Medicines Agency (EMA) 2017, "ECDC, EFSA and EMA Joint Scientific Opinion on a list of outcome indicators as regards surveillance of antimicrobial resistance and antimicrobial consumption in humans and food-producing animals", vol. 15, no. 10.
- United States Department of Health and Human Services, Food and Drug Administration. New Animal Drugs; Cephalosporin Drugs; Extralabel Animal Drug Use; Order of Prohibition. 2012;77(4).
- Health Canada, Veterinary Drugs Directorate. List A: List of certain antiList A: List of certain antimicrobial active pharmaceutical ingredientsmicrobial active pharmaceutical ingredients. 2018; Available at: https://www.canada.ca/en/public-health/services/antibiotic-antimicrobial-resistance/animals/veterinary-antimicrobial-sales-reporting/list-a.html. Accessed 05/12, 2020.
- Health Canada. Categorization of Antimicrobial Drugs Based on Importance in Human Medicine. 2009; Available at: https://www.canada.ca/en/health-canada/services/drugs-health-products/veterinary-drugs/antimicrobial-resistance/categorization-antimicrobial-drugs-based-importance-human-medicine.html.
- Fisheries and Oceans Canada. Aquaculture public reporting. Open data. National Aquaculture Public Reporting Data. Available at: https://open.canada.ca/data/en/dataset/288b6dc4-16dc-43cc-80a4-2a45b1f93383. Accessed September/08, 2022.
- Health Canada. Extra-Label Drug Use (ELDU) in Animals. 2014; Available at: https://www.canada.ca/en/health-canada/services/drugs-health-products/veterinary-drugs/extra-label-drug-use.html.
- Hearings Before the Subcommittee on Health of the House Committee on Energy and Commerce 2010, "ANTIBIOTIC RESISTANCE AND THE USE OF ANTIBIOTICS IN ANIMAL AGRICULTURE".
- US FDA. New Animal Drugs; Cephalosporin Drugs; Extralabel Animal Drug Use; Order of Prohibition. 2012;77(4):735.
- WHO AGISAR. Integrated Surveillance of Antimicrobial Resistance in Foodborne Bacteria: Application of a One Health Approach. 2017.
- Statistics Canada. Table 17-10-0005-01 Population estimates on July 1st, by age and sex. 2022; Available at: https://www150.statcan.gc.ca/t1/tbl1/en/tv.action?pid=1710000501.
- Public Health Agency of Canada (PHAC). Canadian Integrated Program for Antimicrobial Resistance Surveillance (CIPARS) 2018: Figures and tables. 2020.
