Administration d’InfluvacMD chez les enfants
Une déclaration d’un comité consultatif (DCC)
Comité consultatif national de l’immunisation (CCNI)
Addenda au Chapitre sur la grippe du Guide canadien d’immunisation et Déclaration sur la vaccination antigrippale pour la saison 2017-2018
Table des matières
- I. Recommandations du CCNI
- II. Contexte
- III. Méthodes de revue de la littérature
- IV. Sommaire des données
- V. Liste des abréviations
- VI. Remerciements
- VII. Références
- Annexe A : Caractéristiques des vaccins antigrippaux offerts pour utilisation au Canada, 2017-2018*
- Annexe B : Recommandations du CCNI : force de la recommandation et catégorie des données probantes
- Annexe C : Stratégie et résultats de recherche
- Annexe D : Niveau de données probantes selon la méthodologie de recherche et la cote de qualité (validité interne) des données probantes
- Annexe E : Organigramme du processus de sélection de l’étude des données extraites de la littérature sur l’efficacité potentielle et réelle, l’immunogénicité et l’innocuité du vaccin antigrippal trivalent inactivé InfluvacMD chez les enfants
- Annexe F : Résumé des données extraites de la littérature sur l’efficacité potentielle et réelle du vaccin antigrippal trivalent inactivé InfluvacMD chez les enfants
- Annexe G : Résumé des données sur l’immunogénicité du vaccin antigrippal trivalent inactivé InfluvacMD chez les enfants
- Annexe H : Résumé des données sur l’innocuité du vaccin antigrippal trivalent inactivé InfluvacMD chez les enfants
Préambule
Le Comité consultatif national de l’immunisation (CCNI) donne à l’Agence de la santé publique du Canada (ci-après appelée l’ASPC) des conseils continus et à jour liés à l’immunisation dans le domaine de la médecine, des sciences et de la santé publique. L’ASPC confirme que les conseils et les recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes et diffuse ce document à des fins d’information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la monographie de produit pertinente. Les recommandations d’utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait homologuer les vaccins et ont démontré leur innocuité et leur efficacité lorsqu’ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l’ASPC régissant les conflits d’intérêts, notamment déclarer chaque année les conflits d’intérêts possibles.
Cet addenda au Chapitre sur la grippe du Guide canadien d’immunisation et à la Déclaration sur la vaccination antigrippale pour la saison 2017-2018 comprend les nouvelles recommandations concernant l’utilisation du vaccin antigrippal trivalent inactivé InfluvacMD chez les enfants de 3 à 17 ans.
I. Recommandations du CCNI
Administration du vaccin grippal inactivé trivalent d’InfluvacMD chez les enfants
La récente autorisation par Santé Canada élargissant l’indication pédiatrique d’InfluvacMD (BGP Pharma ULC) aux enfants de 3 à 17 ans a fourni au CCNI l’élan nécessaire pour réexaminer sa recommandation sur l’utilisation du vaccin. Après un examen attentif des données probantes disponibles, le CCNI a révisé sa recommandation sur l’utilisation d’InfluvacMD, un vaccin antigrippal trivalent inactivé (VTI) :
Le CCNI recommande qu’InfluvacMD fasse partie des VTI offerts aux enfants de 3 à 17 ans lorsqu’aucun vaccin antigrippal quadrivalent n’est disponible (forte recommandation du CCNI).
Le CCNI conclut qu’il existe des données probantes acceptables de l’efficacité, de l’immunogénicité et de l’innocuité du vaccin permettant de recommander l’utilisation d’InfluvacMD chez les enfants de 3 à 17 ans (données probantes de catégorie B). Par ailleurs, la quantité et la qualité des données probantes sont insuffisantes pour recommander l’utilisation de ce vaccin chez les enfants âgés de moins de 3 ans (données probantes de catégorie I). La recommandation sur l’utilisation d’InfluvacMD chez les enfants constitue un changement par rapport (p/r) aux précédentes déclarations du CCNI puisque l’utilisation d’InfluvacMD n’était auparavant pas recommandée par le CCNI chez les personnes de moins de 18 ans.
En dépit de cette nouvelle recommandation sur l’utilisation d’InfluvacMD (un VTI), le CCNI continue de recommander qu’une formulation du vaccin quadrivalent soit utilisée chez les personnes de moins de 18 ans. Si aucun vaccin quadrivalent n’est disponible, un VTI doit être utilisé (pour plus de précisions, voir ci-dessous la section Choix de produit vaccinal pour enfants).
On trouvera à l’Annexe A un sommaire mis à jour des caractéristiques des vaccins antigrippaux disponibles au Canada pour la saison grippale 2017-2018. Pour obtenir les renseignements thérapeutiques complets, voir le dépliant du produit ou l’information figurant dans les monographies de produit accessibles à partir de la Base de données sur les produits pharmaceutiques de Santé Canada.
Voir l’Annexe B pour obtenir une explication sur la catégorisation des données probantes du CCNI.
Choix de produit vaccinal pour enfants
Les recommandations actuelles sur le choix du vaccin antigrippal disponible pour utilisation au Canada sont résumées ci-dessous par groupe d’âge pédiatrique. On trouvera plus de renseignements concernant les recommandations du CCNI sur le choix du vaccin pour enfants de 6 à 23 mois et de 2 à 17 ans à la page Web Déclaration du Comité consultatif du CCNI : Chapitre sur la grippe du Guide canadien d’immunisation et Déclaration sur la vaccination antigrippale pour la saison 2017-2018.
Enfants âgés de 6 à 23 mois
Il y a trois types de vaccins autorisés pour ce groupe d’âge : le vaccin antigrippal quadrivalent inactivé (VAQ), le VTI et le VTI avec adjuvant.
Le CCNI recommande, compte tenu du fardeau présenté par la grippe de type B, d’utiliser le VAQ. Si le VAQ n’est pas offert, le VTI, avec ou sans adjuvant, doit être utilisé.
Enfants de 2 à 17 ans
Chez les enfants qui ne présentent pas de contre-indications au vaccin antigrippal, les vaccins antigrippaux suivants peuvent être utilisés : le vaccin antigrippal vivant atténué (VVAI) quadrivalent, le VAQ ou le VTI. Les données probantes actuelles ne justifient pas une recommandation de l’utilisation préférentielle du VVAI chez les enfants de 2 à 17 ans.
Compte tenu du fardeau que constitue le virus de la grippe B chez les enfants et du potentiel de non-concordance entre la souche prédominante du virus de la grippe B en circulation et la souche d’un vaccin trivalent, le CCNI continue à recommander qu’un vaccin quadrivalent soit utilisé chez les enfants de 2 à 17 ans. En l’absence d’un tel vaccin, il faut utiliser le VTI.
II. Contexte
Vaccin antigrippal trivalent inactivé InfluvacMD
InfluvacMD est un vaccin à antigènes de surface, un VTI sous-unitaire qui contient 15 µg d’hémagglutinine (HA) par souche, administré en une dose de 0,5 ml avec une seringue préremplie. Commercialisé pour la première fois en 1982Note de bas de page 1, InfluvacMD est actuellement homologué dans 85 paysNote de bas de page 2. La formulation sans thimérosal d’InfluvacMD a été introduite lors de la saison grippale de 2004-2005 dans l’hémisphère Nord et lors de la saison grippale de 2005 dans l’hémisphère Sud.
L’utilisation d’InfluvacMD est homologuée au Canada depuis 2005 pour les personnes de 18 ans et plus. En mai 2017, Santé Canada a autorisé un élargissement des indications pour InfluvacMD de manière à inclure les enfants de 3 à 17 ans, en se fondant sur une revue de la littérature publiée puis présentée par le fabricantNote de bas de page 3. Bien qu’InfluvacMD soit indiqué pour les personnes de 6 mois et plus ailleurs dans le monde, comme en AustralieNote de bas de page 4 et dans l’Union européenneNote de bas de page 5, le fabricant n’avait pas sollicité d’homologation au Canada pour utilisation chez les enfants de moins de 3 ans, affirmant que l’innocuité et l’efficacité du vaccin n’avaient pas été établies pour ce groupe d’âge plus jeuneNote de bas de page 3. Les justifications appuyant la décision réglementaire d’autoriser InfluvacMD chez les enfants de moins de 3 ans ailleurs dans le monde ne sont pas disponibles. On trouvera tous les détails de la composition d’InfluvacMD dans la monographie du produitNote de bas de page 3.
Afin d’éclairer la recommandation du CCNI sur l’utilisation d’InfluvacMD chez les personnes de moins de 18 ans, une revue systématique de la littérature portant sur les données relatives à l’efficacité potentielle et réelle, à l’immunogénicité et à l’innocuité pour l’usage pédiatrique d’InfluvacMD a été réalisée.
III. Méthodes de revue de la littérature
Stratégie de recherche
Une stratégie de recherche a été mise au point avec l’aide de bibliothécaires scientifiques fédéraux (Bibliothèque de la santé) d’après des paramètres élaborés par le Groupe de travail sur l’influenza du CCNI. Des recherches ont été effectuées dès le début dans les bases de données électroniques EMBASE (de 1974 au 21 juin 2017), Global Health (de 1973 au 21 juin 2017), International Pharmaceutical Abstracts (de 1970 au 29 juin 2017), MEDLINE (de 1947 au 21 juin 2017), ProQuest Public Health Database (de 1963 au 29 juin 2017) et Scopus (de 1960 au 29 juin 2017) à l’aide de la structure de chaîne de recherche par mot clé suivante et, le cas échéant, à l’aide de vocabulaire contrôlé : (Influvac [OU synonymes]) ET (enfants [OU synonymes]). Ces mots clés ont été utilisés pour rechercher des titres et des résumés d’articles, ainsi que le texte intégral lorsqu’il était disponible dans la base de données, afin d’accroître la sensibilité (c.-à-d. l’exhaustivité) de la recherche. Les recherches se sont limitées aux articles publiés en anglais et en français. L’Annexe C présente l’intégralité des stratégies de recherche électronique.
Repérage des études admissibles
Les études repérées dans les recherches effectuées dans les bases de données ont été chargées dans RefWorks (ProQuest LLC, Ann Arbor, MI) et les doublons ont été supprimés. Premièrement, les titres et les résumés obtenus par les recherches dans les bases de données ont été examinés pour en évaluer l’admissibilité. Deuxièmement, le texte intégral des études jugées potentiellement admissibles ou ne possédant pas suffisamment de renseignements pour en déterminer l’admissibilité (p. ex., absence de résumé) – après examen du titre et du résumé – a été retenu pour faire l’objet d’un examen plus approfondi. Les deux étapes ont été effectuées de façon indépendante par deux examinateurs.
Les études ont été incluses aux fins d’examen si elles satisfaisaient aux critères suivants :
- La population étudiée se situait dans la tranche d’âge d’intérêt (moins de 18 ans) ou comprenait moins de 10 % de la population étudiée hors de la tranche d’âge d’intérêt, ou encore, une analyse distincte a été réalisée pour la tranche d’âge d’intérêt;
- L’étude a examiné et fait valoir l’efficacité potentielle et l’efficacité réelle du vaccin InfluvacMD, son immunogénicité (séroprotection, séroconversion ou évaluations sérologiques de l’inhibition de l’hémagglutination [IH] des titres d’anticorps) ou encore l‘innocuité du vaccin (réactogénicité locale et systémique ou effets secondaires suivant l’immunisation [ESSI]).
Les études ont été exclues si elles satisfaisaient à au moins l’un des critères suivants :
- L’étude ne portait pas sur les humains;
- La publication a été rédigée dans une autre langue que l’anglais ou le français;
- Il s’agissait seulement d’une recherche secondaire (p. ex., revue de la littérature, examen systématique, méta-analyse);
- L’article constituait un éditorial, un texte d’opinion ou un bulletin de nouvelles.
Les listes bibliographiques des études incluses ont fait l’objet d’une recherche manuelle de façon indépendante par deux examinateurs afin de repérer d’autres publications pertinentes. Les listes bibliographiques des articles pertinents de la recherche secondaire extraits des bases de données et celle de la version la plus récente de la monographie d’InfluvacMDNote de bas de page 3 ont aussi fait l’objet d’une recherche manuelle.
Extraction des données
Deux examinateurs ont extrait de façon indépendante les données des études incluses aux fins d’examen, et tout désaccord ou toute divergence ont été résolus par la discussion et le consensus. Un modèle d’abstraction de données a été utilisé pour cerner l’information sur la méthodologie de l’étude, la population visée, l’intervention et le ou les résultats d’intérêt.
Plusieurs publications incluses comportaient des ensembles de données qui se chevauchaient partiellement ou complètement. Pour éviter l’extraction de données répétitives, en double ou redondantes, ces publications ont été condensées et décrites sous une seule référence principale dans les tables de données. La publication choisie comme référence principale dans ces cas a été définie comme la publication contenant l’analyse la plus pertinente eu égard aux objectifs du présent examen systématique. Les études uniques ont été considérées comme des références principales.
Synthèse qualitative
L’information extraite des études incluses a été synthétisée sous forme narrative, et les tendances générales dans les données ont été décrites en fonction des résultats d’intérêt.
Évaluation de la qualité de la méthodologie
La qualité méthodologique des études a été évaluée de façon indépendante par deux examinateurs qui se sont appuyés sur la méthodologie de l’étude. Les paramètres propres aux méthodologies d’étude par Harris et al. (2001)Note de bas de page 6 ont été utilisés afin d’évaluer la validité interne de chacune des études (Annexe D). Les études incluses comprenant des méthodologies d’étude qui ne sont pas couverts par les critères de Harris et al. (p. ex., études de type avant/après, études non randomisées contrôlées ou études de surveillance) ne pouvaient pas être cotées au moyen des critères, mais faisaient tout de même l’objet d’une évaluation en fonction des limites méthodologiques essentielles.
IV. Sommaire des données
La section IV.1 présente le résumé du processus de repérage et de sélection des études ainsi que les détails des études. Les données probantes relatives à l’efficacité potentielle et réelle sont résumées dans la section IV.2. Les études d’immunogénicité sont présentées à la section IV.3. Les résultats sur l’innocuité des vaccins sont résumés à la section IV.4.
IV.1 Inclusion et caractéristiques des études
Le processus de repérage, de sélection et d’inclusion des études est résumé de façon schématique à l’Annexe E. Les recherches dans les bases de données tout comme les recherches manuelles subséquentes ont permis d’extraire un total de 199 documents uniques en ce qui a trait à la sélection du titre et du résumé. La sélection des textes intégraux de 92 documents a permis de repérer au total 20 études qui étaient admissibles à la synthèse qualitativeNote de bas de page 7 Note de bas de page 8 Note de bas de page 9 Note de bas de page 10 Note de bas de page 11 Note de bas de page 12 Note de bas de page 13 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16 Note de bas de page 17 Note de bas de page 18 Note de bas de page 19 Note de bas de page 20 Note de bas de page 21 Note de bas de page 22 Note de bas de page 23 Note de bas de page 24 Note de bas de page 25 Note de bas de page 26. Des 20 études publiées incluses aux fins d’examen, trois ont été repérées après une recherche manuelle des listes bibliographiques d’articles de revue pertinents récupérés à partir des bases de donnéesNote de bas de page 8 Note de bas de page 12 Note de bas de page 24. Trois études incluses ont été financéesNote de bas de page 20 ou conduitesNote de bas de page 16 Note de bas de page 25 par le fabricant. Toutes les études incluses étaient rédigées en anglais. Des données de pharmacovigilance inédites relatives à InfluvacMD ont également été fournies par le fabricant au Groupe de travail sur l’influenza du CCNINote de bas de page 2. Ainsi, un total de 21 études ont été incluses dans la synthèse.
Les données extraites des études relatives à l’efficacité potentielle et réelle sont présentées dans le tableau de données à l’Annexe F; les données relatives à l’immunogénicité, à l’Annexe G; les données relatives aux constatations sur l’innocuité, à l’Annexe H (les données confidentielles non publiées sur l’innocuité et fournies par le fabricantNote de bas de page 2 ne sont pas résumées dans le tableau de données). Des 21 études incluses, trois paires d’études connexes ont étérepérées Footnote 10 Note de bas de page 12 Note de bas de page 13 Note de bas de page 18 Note de bas de page 19 Note de bas de page 22. Une étude de chacune des trois paires d’études connexes a subséquemment été repérée comme une référence principale aux fins du présent examenFootnote 10 Footnote 12 Footnote 18. Les données extraites de ces trois références principales ont été complétées par des constatations non dupliquées de leurs études connexes respectives, comme l’indiquent les Annexes F à H.
Après la consolidation des études comportant des ensembles de données se chevauchant, un total de 18 références principales ont été incluses dans la présente revue, dont 10 essais cliniquesNote de bas de page 9 Note de bas de page 10 Note de bas de page 11 Note de bas de page 12 Note de bas de page 16 Note de bas de page 17 Note de bas de page 18 Note de bas de page 23 Note de bas de page 25 Note de bas de page 26, sept études de surveillance de l’innocuité des vaccins (données probantes de catégorie III)Note de bas de page 7 Note de bas de page 8 Note de bas de page 14 Note de bas de page 15 Note de bas de page 20 Note de bas de page 21 Note de bas de page 24 et une étude inédite sur l’innocuité du vaccin réalisée par le fabricant (données probantes de catégorie III)Note de bas de page 2. Des 10 essais cliniques, deux avaient été réalisés en tant qu’essais randomisés contrôlés (ERC) à double insu (données probantes de catégorie I)Note de bas de page 12 Note de bas de page 18, un autre en tant qu’ERC avec évaluation à l’insu des critères d’évaluation (données probantes de catégorie I)Note de bas de page 25, deux étaient des essais cliniques non randomisés (données probantes de catégorie II-1)Note de bas de page 23 Note de bas de page 26, et cinq étaient des études de type avant/après (données probantes de catégorie III)Note de bas de page 9 Note de bas de page 10 Note de bas de page 11 Note de bas de page 16 Note de bas de page 17.
Les 17 références principales publiées incluses ont fait l’objet d’une évaluation de la qualité. Parmi celles-ci, trois études comprenant des méthodologies d’étude sujettes à une évaluation par Harris et al. ont obtenu la cote « acceptable »Note de bas de page 12 Note de bas de page 18 Note de bas de page 25. Pour toutes les autres méthodologies d’étude qui n’ont pas été évaluées à l’aide des critères de Harris et al., aucune lacune importante n’a été observée outre les limites intrinsèques de ces méthodologies. Il faut noter toutefois qu’une étude d’immunogénicité de type avant/après ne comprenait pas d’évaluation des titres IH après l’administration de la deuxième dose du vaccin chez les enfants n’ayant jamais été vaccinésNote de bas de page 17.
Quelques études incluses dans la présente revue ne faisaient pas partie de celles qu’a présentées le fabricant à Santé Canada en vue d’obtenir l’homologation pour utilisation pédiatrique d’InfluvacMDNote de bas de page 7 Note de bas de page 15 Note de bas de page 19 Note de bas de page 21. À l’inverse, plusieurs études soumises par le fabricant en vue d’obtenir un élargissement de l’indication pédiatrique ont été exclues du présent examen pour les motifs suivants :
- une publication dans une langue autre que l’anglais ou le françaisNote de bas de page 27 Note de bas de page 28 Note de bas de page 29;
- une analyse intermédiaire remplacée par une publication plus récente incluse aux fins d’examenNote de bas de page 30;
- un manque de données propres à l’InfluvacMDNote de bas de page 31;
- la transmission de données de recherche secondaire seulementNote de bas de page 32;
- la présentation de résultats sous forme agrégée (c.-à-d. aucune transmission de données distinctes par marque de vaccin)Note de bas de page 33;
- l’inclusion d’une forte proportion de sujets en dehors de la plage d’âge d’intérêtNote de bas de page 34.
IV.2 Efficacité potentielle et réelle
Deux études ont évalué l’efficacité réelle d’InfluvacMD chez les enfantsNote de bas de page 18 Note de bas de page 26.
Une étude incluse aux fins d’examen a évalué l’efficacité réelle d’InfluvacMD pour prévenir l’infection par l’influenza confirmée en laboratoire comme un résultat secondaire. Jansen et al. (2008) a effectué un ERC à double insu comparant InfluvacMD et un vaccin conjugué heptavalent contre le pneumocoque (PCV7), InfluvacMD et un vaccin placebo, ainsi qu’un vaccin témoin contre l’hépatite B et un vaccin placebo chez les enfants âgés de 18 à 72 mois chez qui un médecin avait précédemment diagnostiqué une infection des voies respiratoires (IVR) (n = 579)Note de bas de page 18. L’étude a révélé que l’inoculation du vaccin InfluvacMD et d’un PCV7 (risque relatif [RR] : 0,48; intervalle de confiance à 95 % [IC] : de 0,25 à 0,93) et InfluvacMD et d’un placebo (RR : 0,49; IC à 95 % : de 0,25 à 0,97) étaient tous deux significativement associés sur le plan statistique à un plus faible risque d’infection par le virus de la grippe confirmée en laboratoire comparativement à l’immunisation avec un vaccin non grippal (c.-à-d. le vaccin contre l’hépatite B). On a observé dans le groupe auquel on a administré InfluvacMD et un vaccin PCV7 une réduction significative sur le plan statistique de l’incidence des IVR fébriles de 24 % (rapport du taux d’incidence [RTI] : 0,76; IC à 95 % : de 0,58 à 0,99), alors qu’un taux d’incidence non différent sur le plan statistique a été observé pour l’InfluvacMD et pour le groupe auquel un placebo avait été administré (RTI : 0,87; IC à 95 % : de 0,68 à 1,12) comparativement au groupe témoin. Une réduction significative sur le plan statistique de l’incidence de l’otite moyenne aiguë a été observée chez les groupes ayant reçu InfluvacMD et le PCV7 (RTI : 0,43; IC à 95 % : de 0,20 à 0,94) et InfluvacMD et un placebo (RTI : 0,29 : IC à 95 % : de 0,12 à 0,70) comparativement au groupe témoin. L’essai non randomisé contrôlé, pragmatique et mené en milieu communautaire par Ghendon et al. (2006) a examiné l’efficacité réelle de la vaccination antigrippale pour se protéger contre le syndrome grippal (SG; apparition soudaine de fièvre à plus de 38 °C et de toux ou de maux de gorge) chez des enfants en bonne santé de 3 à 17 ans dans des jardins d’enfants (3 à 6 ans) et dans des écoles (7 à 17 ans) de quatre communautés de Moscou, en RussieNote de bas de page 26. Les enfants de deux communautés ont reçu le vaccin InfluvacMD (taux de couverture de 69,7 % chez 40 611 enfants), tandis que les enfants de deux communautés de contrôle n’ont pas été systématiquement vaccinés (taux de couverture <1 % parmi 60 946 enfants). L’efficacité du vaccin contre le SG atteignait 60,9 % chez les enfants qui fréquentaient les jardins d’enfants, 68,8 % chez les enfants qui fréquentaient l’école, et 63,7 % dans l’ensemble.
Aucune étude sur l’efficacité potentielle d’InfluvacMD n’a été repérée.
IV.3 Immunogénicité
Le test d’IH est un essai couramment utilisé en laboratoire pour quantifier le niveau d’anticorps sériques produits en réponse aux antigènes du vaccin. La concentration d’anticorps sériques observés est calculée comme la moyenne des titres géométriques (MTG), qui est la moyenne des valeurs logarithmiques des titres d’anticorps sériques. Les évaluations sérologiques de la réponse immunitaire, comme la séroprotection, la séroconversion et le facteur d’augmentation de la moyenne des titres géométriques (FAMTG, aussi appelé multiplication de la moyenne géométrique), après la vaccination d’après les titres IH, sont des normes acceptées pour l’évaluation et l’homologation de nouveaux vaccins antigrippauxNote de bas de page 35. Le taux de séroprotection est la proportion des sujets chez qui le titre IH est ≥ 1:40 après la vaccination. On a suggéré de mettre en corrélation un titre d’IH de 1:40 avec une efficacité potentielle de 50 à 70 % contre les symptômes cliniques de la grippe chez les adultes en bonne santé, mais ce titre peut varier en fonction de caractéristiques individuelles, de la population, de l’âge et du type de vaccinNote de bas de page 36. Une corrélation similaire de protection entre le titre d’anticorps et l’efficacité du vaccin n’a pas été établie pour les enfants. Quant au taux de séroconversion, il est la proportion de sujets présentant une augmentation significative des titres d’IH entre la période précédant la vaccination et la période la suivant (≤ 1:10 à ≥ 1:40 ou une augmentation des titres par un facteur d’au moins quatre). Le FAMTG est le rapport entre les titres observés avant et après l’immunisation. Les corrélats de protection contre la grippe n’ont pas été bien établis dans les autres études sérologiques, comme l’essai de microneutralisationNote de bas de page 37 ou l’essai d’inhibition de la neuraminidaseNote de bas de page 38 et, par conséquent, les résultats de ces essais n’ont pas été inclus dans la présente revue.
En ce qui concerne le vaccin antigrippal saisonnier inactivé, le Comité des médicaments à usage humain (CHMP) de l’Agence européenne pour l’évaluation des médicaments a déjà recommandé des seuils précis de protection pour les trois évaluations sérologiques susmentionnées à considérer pour chaque souche (p. ex., H1N1, H3N2, B)Note de bas de page 35. Bien que le CHMP ait révisé ses lignes directrices sur les vaccins antigrippaux pour ne pas se fier à des tests sérologiques avec des seuils de protection prédéfinis pour établir un bénéficeNote de bas de page 39, les seuils précédemment utilisés sont présentés ci-dessous pour faciliter l’interprétation des résultats des études d’immunogénicité dans le cas des sujets adultes de 18 à 60 ans :
- séroprotection chez plus de 70 % des sujets;
- séroconversion chez plus de 40 % des sujets;
- FAMTG de plus de 2,5.
Les critères du CHMP n’ont pas été établis pour les enfants, mais les critères applicables chez les adultes ont été utilisés par les fabricants afin d’évaluer l’immunogénicité des vaccins antigrippaux au cours des essais pédiatriquesNote de bas de page 40.
Le Department of Health and Human Services (HHS) des États-Unis a publié les critères suivants pour les données cliniques nécessaires à l’appui de l’homologation du vaccin antigrippal inactivé saisonnier pour les adultes de moins de 65 ans et pour la population pédiatrique (les critères pour les adultes de 65 ans et plus ne sont pas présentés) :
- La limite inférieure de l’IC bilatéral à 95 % pour le pourcentage des sujets atteignant la séroconversion d’anticorps IH doit atteindre ou dépasser 40 %.
- La limite inférieure de l’IC bilatéral à 95 % pour le pourcentage des sujets atteignant la séroprotection doit atteindre ou dépasser 70 %Note de bas de page 41.
Pour ce qui est des essais cliniques comparant deux vaccins antigrippaux, le HHS recommande les critères suivants pour évaluer la marge non inférieure d’un nouveau vaccin p/r à un vaccin homologué pour tous les âges : la limite supérieure de l’IC à 95 % du rapport bilatéral de la MTG après la vaccination (un vaccin établi p/r à un nouveau vaccin) pour toutes les trois souches du vaccin ne devrait pas dépasser 1,5 alors que la limite supérieure du rapport bilatéral de l’IC à 95 % de la différence entre les taux de séroconversion (le vaccin établi moins le nouveau vaccin) pour toutes les trois souches de vaccin ne devrait pas dépasser 10 %Note de bas de page 41
Santé Canada n’a pas publié de critères similaires aux fins d’évaluation de l’immunogénicité des vaccins antigrippaux.
Enfants en bonne santé
Deux études ont évalué l’immunogénicité d’InfluvacMD chez les enfants en bonne santéNote de bas de page 17 Note de bas de page 25.
Zhu et al. (2008) ont conduit des ERC avec évaluation à l’insu des critères d’évaluation chez 300 enfants en bonne santé de 3 à 12 ans, chez 300 adultes en bonne santé de 18 à 59 ans et chez 240 personnes en bonne santé de 60 ans et plus, dans le but d’évaluer l’immunogénicité d’InfluvacMD p/r à un autre VTI sous-unitaire, AgrippalMD (Seqirus; commercialisé au Canada sous le nom d’AgrifluMD, chez ces groupes d’âgeNote de bas de page 25. Dans les analyses selon le respect du protocole, InfluvacMD atteint des taux de séroprotection de 95 à 99 %, des taux de séroconversion de 87 à 92 % et des FAMTG de 17,4 à 23,3 fois chez les enfants en bonne santé pour les trois souches vaccinales. Les limites inférieures de l’IC à 95 % du rapport des MTG après la vaccination comparant InfluvacMD à AgrippalMD chez les enfants de 3 à 12 ans (de 1,42 à 1,63), de 3 à 5 ans (de 0,94 à 1,29) et de 6 à 12 ans (de 1,44 à 1,70) dépassaient la marge non inférieure de 0,35 établie par l’étude, ce qui indique que l’immunogénicité d’InfluvacMD était au moins comparable à celle d’AgrippalMD chez ces groupes d’âge.
El-Madhun et al. (1998) ont réalisé une étude de type avant/après examinant l’effet d’une exposition antérieure au virus de la grippe (c.-à-d. sensibilisation naturelle) sur la réponse immunitaire après l’administration du vaccin InfluvacMDNote de bas de page 17. La population visée était composée d’un groupe de personnes, dont 18 enfants de 2 à 3 ans qui n’avaient jamais été vaccinés contre la grippe et subissaient une amygdalectomie. Les sujets n’avaient pas de graves problèmes de santé, à l’exception de fréquentes infections des amygdales. En se fondant sur la présence d’anticorps sériques avant la vaccination, il a été observé que, des 18 enfants, 14 avaient été sensibilisés au virus grippal A (H3N2); un autre, au virus grippal A (H1N1); et trois autres, au virus grippal B. Tous les enfants sensibilisés à une souche du virus de la grippe ont démontré une augmentation au moins quatre fois plus forte des titres d’anticorps pour cette souche entre la période précédant la vaccination et la période la suivant de 28 à 42 jours après la première de deux demi-doses du vaccin, alors qu’aucune augmentation importante des titres IH n’a été observée chez les enfants qui n’avaient pas été sensibilisés à cette souche. L’état sérologique n’a pas été évalué après la deuxième dose de vaccin. Un calendrier de deux doses est nécessaire pour assurer la protection des enfants de moins de 9 ans recevant le vaccin contre la grippe saisonnière pour la première foisNote de bas de page 42.
Enfants atteints d’autres affections chroniques
Six études ont évalué l’immunogénicité d’InfluvacMD chez des enfants ayant des affections chroniques : leucémie aiguë lymphoblastique (LAL)Note de bas de page 9 Note de bas de page 10 Note de bas de page 23, hémophilieNote de bas de page 11, asthmeNote de bas de page 12, maladie pulmonaire chronique et maladies cardiaques congénitalesNote de bas de page 16.
Brydak et al. (1998), dans une étude à plusieurs branches de type avant/après, ont évalué l’immunogénicité d’InfluvacMD auprès d’enfants de 7 à 16 ans atteints de LAL (n = 45), comparativement à l’état de vaccination antigrippale précédent et auprès d’un groupe témoin d’enfants en bonne santé non vaccinés de 8 à 15 ans (n = 23)Note de bas de page 10. La majorité des sujets atteints de LAL avaient subi un traitement de chimiothérapie au moins un mois avant la vaccination (n = 43 de 45). L’évaluation de l’état sérologique des sujets a été menée trois semaines et six mois suivant l’administration d’InfluvacMD. Les enfants de 7 à 16 ans atteints de LAL qui avaient déjà été vaccinés (n = 25) affichaient des taux de séroprotection de 52,0 à 92,0 % (>60 % pour deux des trois souches de vaccin) et de 68,0 à 100,0 %, des taux de séroconversion de 52,0 à 92,0 % et de 68,0 à 100,0 % ainsi que des FAMTG de 17,2 à 26,7 et de 22,1 à 38,2 pour les trois souches évaluées trois semaines et six mois suivant la vaccination, respectivement. Chez les enfants de 7 à 11 ans atteints de LAL qui n’avaient pas été précédemment immunisés contre la grippe (n = 20), InfluvacMD a atteint des taux de séroprotection similaires de 55,0 à 85,0 % (>60 % pour deux des trois souches vaccinales) et de 90,0 à 100,0 %, des taux de séroconversion de 55,0 à 80,0 % et de 90,0 à 100,0 % ainsi que des FAMTG de 15,7 à 22,6 et de 30,3 à 39,3 pour trois souches évaluées trois semaines et six mois après la vaccination, respectivement. Les titres IH après la vaccination étaient significativement plus élevés sur le plan statistique chez les enfants vaccinés atteints de LAL p/r aux enfants non vaccinés en bonne santé. Dans une étude de suivi de Brydak et al. (2000), on n’a pas trouvé de différences significatives sur le plan statistique de la réponse immunitaire des sujets atteints de LAL après la vaccination depuis la fin du traitement de chimiothérapieNote de bas de page 9.
Dans une autre étude à plusieurs branches de type avant/après, réalisée par Brydak et al. (1998), la réponse immunitaire provoquée par InfluvacMD a été évaluée dans un groupe de patients hémophiles de 10 à 19 ans qui avaient déjà été vaccinés contre la grippe (n = 38) et comparée aux sujets en bonne santé du groupe témoin qui n’avaient pas reçu de vaccin antigrippal au cours de cette étude ou précédemment (n = 23)Note de bas de page 11. Dans le groupe de patients hémophiles vaccinés, les FAMTG observés se situaient dans la gamme de 3,9 à 10,9 et de 8,4 à 28,6 pour toutes les trois souches de vaccin évaluées trois semaines et six mois après la vaccination, respectivement. Les taux de séroprotection atteignaient de 52,6 à 60,5 % (>60 % pour l’une des trois souches vaccinales) et de 76,3 à 97,4 % pour les trois souches de vaccin à la suite d’une évaluation effectuée trois semaines et six mois après la vaccination, respectivement. Quant au taux de séroconversion, il atteignait de 39,5 à 42,1 % et de 71,1 à 86,8 % pour toutes les trois souches de vaccin évaluées trois semaines et six mois après la vaccination, respectivement. Les mesures de la réponse immunitaire observées semblent être plus élevées chez les patients hémophiles vaccinés que chez les sujets du groupe témoin non vaccinés. Les titres IH après la vaccination chez les patients hémophiles vaccinés étaient significativement plus élevés sur le plan statistique que les titres mesurés avant la vaccination et que les titres observés chez les sujets non vaccinés du groupe témoin. Dans une analyse stratifiée selon la gravité de l’hémophilie, les enfants atteints d’hémophilie grave et peu grave affichaient une MTG et des FAMTG similaires pour les souches de la grippe A et de la grippe B six mois après la vaccination avec InfluvacMDNote de bas de page 22. Les taux de séroprotection et de séroconversion étaient similaires pour les deux types de gravité d’hémophilie pour la grippe A (H3N2) et B; cependant, les patients atteints d’hémophilie grave affichaient de plus faibles taux de séroprotection et de séroconversion p/r aux patients atteints d’hémophilie légère p/r à la grippe A (H1N1) 3 semaines et 6 mois après la vaccination.
Shahgholi et al. (2010) ont mené un essai non randomisé contrôlé évaluant l’immunogénicité d’InfluvacMD chez des enfants de 1 à 18 ans atteints de LAL en première rémission et recevant un traitement d’entretien (n = 32) p/r aux témoins de la fratrie en bonne santé (n = 30)Note de bas de page 23. Par rapport aux titres IH observés avant la vaccination, les patients atteints de LAL affichaient une réaction de protection significativement élevée sur le plan statistique pour les souches des trois vaccins quatre semaines après la vaccination. Après la vaccination, la MTG ne différait pas significativement sur le plan statistique entre les patients atteints de LAL et les sujets en bonne santé du groupe témoin pour la grippe A (H1N1) et B, mais elle était significativement plus faible chez les patients atteints de LAL pour la grippe A (H3N2) (p = 0,041). Les taux de séroprotection étaient plus faibles chez les patients vaccinés atteints de LAL (de 26,0 à 63,3 %) que chez les sujets témoins vaccinés et en bonne santé (de 73,0 à 88,0 %), avec un taux de séroprotection significativement plus faible sur le plan statistique pour les antigènes de la grippe H1N1 (p = 0,04) et de la grippe de type B (p = 0,001). Les taux de séroconversion variaient de 40,6 à 59,4 % pour les patients vaccinés atteints de LAL et de 53,3 à 83,3 % pour les sujets témoins. Les taux de séroconversion étaient significativement plus faibles sur le plan statistique pour les antigènes de la grippe H1N1 et de la grippe de type B (p = 0,04 et 0,038 respectivement), mais pas pour l’antigène du virus H3N2.
Bueving et al. (2004) ont mené un ERC à double insu chez des enfants de 6 à 18 ans atteints d’asthme pour évaluer l’immunogénicité d’InfluvacMD (n = 347) p/r au placebo (n = 349)Note de bas de page 12. InfluvacMD a entraîné des taux de séroprotection (de 85,6 à 98,5 %) et des taux de séroconversion (de 26,5 à 59,9 %) significativement plus élevés sur le plan statistique p/r au placebo pour les trois souches vaccinales de 14 à 21 jours après la vaccination.
Dans une étude à une seule branche de type avant/après menée auprès de 52 enfants de 6 mois à 4 ans atteints d’une maladie pulmonaire chronique ou de cardiopathie congénitale, Daubeney et al. (1997) ont estimé qu’InfluvacMD entraînait des taux de séroprotection de 55 à 71 % (>60 % pour deux des trois souches du vaccin), des taux de séroconversion de 55 à 71 % et des FAMTG de 5,8 à 10,8 pour les trois souches vaccinalesNote de bas de page 16.
IV.4 Innocuité
Quatorze études publiées visant à évaluer l’innocuité d’InfluvacMD chez les enfants ont été répertoriéesNote de bas de page 7 Note de bas de page 8 Note de bas de page 9 Note de bas de page 12 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16 Note de bas de page 18 Note de bas de page 20 Note de bas de page 21 Note de bas de page 23 Note de bas de page 24 Note de bas de page 25 Note de bas de page 26. Le fabricant a également fourni des données de pharmacovigilance inédites pour InfluvacMDNote de bas de page 2.
Tous les essais cliniques visant à évaluer l’innocuité et la tolérabilité inclus pour examen ont mené à conclure qu’InfluvacMD était sûr et bien toléré chez les enfants en bonne santéNote de bas de page 19 Note de bas de page 25 Note de bas de page 26 et chez les enfants atteints de certaines affections chroniquesNote de bas de page 10 Note de bas de page 13 Note de bas de page 16 Note de bas de page 23. Une étude de surveillance a consigné le cas d’un enfant âgé entre 6 mois et 4 ans qui avait reçu InfluvacMD et qui a connu un effet indésirable grave (EIG); l’âge exact de l’enfant et la nature de l’EIG n’ont pas été précisés, mais l’état de l’enfant se serait amélioré en quelques joursNote de bas de page 21. Plusieurs autres études ont noté qu’aucun EIG suivant l’immunisation n’a été observé pour InfluvacMDNote de bas de page 13 Note de bas de page 16 Note de bas de page 19 Note de bas de page 25 Note de bas de page 26. Parmi les essais cliniques inclus aux fins d’examen, les réactions locales signalées comprenaient des érythèmesNote de bas de page 13 Note de bas de page 16 Note de bas de page 19 Note de bas de page 23, des difficultés de mouvement des membresNote de bas de page 19, des raideurs ou des douleurs aux brasNote de bas de page 13, de la douleurNote de bas de page 13 Note de bas de page 23, des enfluresNote de bas de page 19 Note de bas de page 23 et de la sensibilitéNote de bas de page 19. Les réactions systémiques signalées comprenaient la fièvreNote de bas de page 13 Note de bas de page 16 Note de bas de page 19 Note de bas de page 23 Note de bas de page 25, des maux de têteNote de bas de page 19 Note de bas de page 25, une augmentation de l’irritabilitéNote de bas de page 16, de l’insomnieNote de bas de page 16, des malaisesNote de bas de page 19et des myalgiesNote de bas de page 13 Note de bas de page 19. Les réactions locales et systémiques étaient le plus souvent d’intensité légère et transitoire, se résorbant en quelques joursNote de bas de page 16 Note de bas de page 19 Note de bas de page 25.
Plusieurs études d’observation répertoriées portant sur les ESSI chez les enfants ont signalé des résultats particuliers à certains produits, dont InfluvacMD®Note de bas de page 7 Note de bas de page 8 Note de bas de page 14 Note de bas de page 15 Note de bas de page 20 Note de bas de page 21 Note de bas de page 24.
Entre 1998 et 2007, quatre cas d’ESSI liés à InfluvacMD touchant des enfants de 2 à 3 ans, dont trois ont été classés comme graves, ont été signalés à l’Agence danoise des médicaments; toutefois, les détails de l’ESSI n’ont pas été précisés. Aucun ESSI n’a été signalé chez les autres groupes d’âge pédiatrique (moins de 18 ans)Note de bas de page 7.
Dans l’ouest de l’Australie au cours de la saison grippale de 2010 dans l’hémisphère Sud, un VTI à virion fragmenté (FluvaxMD et Fluvax JuniorMD, CSL), a été associé à un taux plus élevé de convulsions fébriles après la vaccination chez les enfants de moins de 5 ans p/r aux saisons précédentesNote de bas de page 43. En guise de comparaison avec les vaccins FluvaxMD et Fluvax JuniorMD, des études de surveillance de l’innocuité découlant des événements fébriles après l’administration du vaccin antigrippal ont révélé un risque de réactions fébriles significativement moins élevé sur le plan statistique chez les enfants âgés de 6 mois à 4 ou 5 ans après l’administration d’InfluvacMD en AustralieNote de bas de page 8 Note de bas de page 24 et en Nouvelle-ZélandeNote de bas de page 20.
Un système en ligne de surveillance active des ESSI (Vaxtracker) de l’État de New South Wales (Australie) a révélé chez des sujets pédiatriques (de moins de 10 ans) ayant reçu le vaccin InfluvacMD une fréquence moindre d’ESSI de tous les types (3,1 %; n = 32) p/r à FluarixMD (11,6 %; n = 43), à VaxigripMD (21,7 %; n = 212) et p/r à toutes les marques de vaccins antigrippaux (17,9 %; n = 290) au cours des saisons grippales de 2012 et 2013 dans l’hémisphère SudNote de bas de page 14.
Le système australien de surveillance nationale de l’innocuité des vaccins (AusVaxSafety) a répertorié les ESSI, dont la fièvre, par marque de vaccin antigrippal au cours de la saison grippale de 2015 dans l’hémisphère Sud. InfluvacMD a cependant été administré chez un nombre insuffisant d’enfants âgés de 6 mois à 4 ans (n = 47) pour permettre d’établir une comparaison fiable entre les taux de fièvre signalés avec d’autres marques de vaccinsNote de bas de page 21.
Un système de surveillance passive géré par des États australiens a signalé un cas pédiatrique d’anaphylaxie après l’administration du vaccin InfluvacMD au cours des saisons grippales de 2008 et de 2009 dans l’hémisphère SudNote de bas de page 15. Le taux d’incidence d’anaphylaxie pour InfluvacMD n’était pas disponible.
Le système de surveillance passive accrue du fabricant n’a décelé aucune réactogénicité inattendue chez les enfants et les adultes ayant reçu le vaccin InfluvacMD au cours de la saison grippale de 2015-2016 dans l’hémisphère NordNote de bas de page 2.
IV.5. Conclusion
La présente revue de la littérature a permis de répertorier des données sur l’efficacité réelle, l’immunogénicité et l’innocuité du VTI InfluvacMD pour une utilisation pédiatrique, mais peu d’études ont été menées avec une rigueur méthodologique élevée (c.-à-d. à partir de données probantes de catégorie I)Note de bas de page 12 Note de bas de page 18 Note de bas de page 25. Aucune étude sur l’efficacité potentielle n’a été répertoriée. Malgré la quantité et la qualité limitées de l’ensemble des données probantes, les conclusions générales des études répertoriées sont cohérentes p/r aux résultats d’intérêt. InfluvacMD s’est avéré efficace, immunogène et sûr chez les enfants en bonne santé et ceux atteints d’affections chroniques particulières.
Seules deux études examinant l’efficacité réelle d’InfluvacMD ont été répertoriées. Ces études ne comparaient pas ce vaccin avec d’autres vaccins antigrippaux. Un ERC à double insu a révélé qu’InfluvacMD était efficace pour réduire le risque d’infection par le virus de la grippe confirmée en laboratoire, l’incidence des IVR fébriles et de l’otite moyenne aiguë chez les enfants âgés de 18 à 72 mois ayant antérieurement reçu d’un médecin un diagnostic d’IVRNote de bas de page 18. Un essai pragmatique et non randomisé contrôlé mené en milieu communautaire auprès d’enfants de 3 à 17 ans a révélé qu’InfluvacMD était efficace contre le syndrome grippal p/r à l’absence de vaccinationNote de bas de page 26.
Plusieurs essais cliniques repérés ont indiqué qu’InfluvacMD avait induit une réponse immunitaire protectrice chez les enfants en bonne santéNote de bas de page 17 Note de bas de page 25 ainsi que chez les enfants atteints d’affections chroniquesNote de bas de page 9 Note de bas de page 10 Note de bas de page 11 Note de bas de page 12 Note de bas de page 16 Note de bas de page 23. Un ERC à double insu a conclu qu’InfluvacMD n’était pas moins immunogène qu’un autre VTI sous-unitaire homologué (AgrippalMD lorsqu’administré chez les enfants en santé de 3 à 12 ansNote de bas de page 25. Chez les enfants de 6 à 18 ans atteints d’asthme, les sujets ayant reçu InfluvacMD affichaient des réponses sérologiques significativement plus élevées sur le plan statistique p/r aux sujets ayant reçu un placebo dans un ERC à double insuNote de bas de page 12. Les résultats de quelques essais dont la méthodologie était comparativement plus faible (étude de type avant/après, essai non randomisé contrôlé), surtout chez les enfants plus âgés (p. ex., 6 ans et plus), indiquaient qu’InfluvacMD a pu induire des réponses immunitaires sérologiques élevées chez les enfants atteints de LALNote de bas de page 9 Note de bas de page 10, d’hémophilieNote de bas de page 11 et de pneumopathie chronique ou de cardiopathie congénitaleNote de bas de page 16. Une petite étude de type avant/après menée auprès d’enfants ayant eu de fréquentes infections amygdaliennes, mais qui étaient autrement en bonne santé et n’avaient pas précédemment reçu de vaccin antigrippal, a conclu qu’InfluvacMD pouvait induire une réponse immunitaire plus forte chez les enfants de 2 à 3 ans qui étaient naturellement sensibilisés au virus après la première de deux demi-doses du vaccin p/r aux enfants non sensibilisés au virusNote de bas de page 17. Toutefois, il convient de noter qu’un calendrier à deux doses est nécessaire pour assurer une protection chez les enfants de moins de 9 ans n’ayant jamais reçu de vaccinNote de bas de page 42.
Des essais cliniques qui ont étudié les EI et des études de surveillance d’innocuité des vaccins ont conclu qu’InfluvacMD était sûr et bien toléré par les enfantsNote de bas de page 7 Note de bas de page 8 Note de bas de page 10 Note de bas de page 13 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16 Note de bas de page 19 Note de bas de page 20 Note de bas de page 21, Note de bas de page 23 Note de bas de page 24 Note de bas de page 25 Note de bas de page 26. Parmi ces études sur l’innocuité des vaccins, peu d’EIG ont été signalés chez les enfants vaccinés avec InfluvacMDNote de bas de page 7 Note de bas de page 21.
Lacunes en matière de données probantes
Il y a un manque de données probantes appuyant l’utilisation d’InfluvacMD chez les enfants de moins de 3 ans, en particulier chez les enfants âgés de 6 à 23 mois. Les données probantes sur l’efficacité réelle et l’immunogénicité d’InfluvacMD chez les enfants âgés de moins de 3 ans sont restreintes à quelques essais cliniquesNote de bas de page 16 Note de bas de page 17 Note de bas de page 18 Note de bas de page 23 et à seulement deux études d’immunogénicité de type avant/après menées auprès de sujets qui appartiennent tous ou principalement à ce groupe d’âgeNote de bas de page 16 Note de bas de page 17. Seules quelques études se penchant sur l’innocuité d’InfluvacMD portaient sur des enfants de moins de 3 ansNote de bas de page 2 Note de bas de page 14 Note de bas de page 16 Note de bas de page 19 Note de bas de page 23.
Les données probantes sur la façon dont InfluvacMD se compare à d’autres VTI chez les enfants se limitent à un seul essai clinique de l’immunogénicité et de l’innocuité ayant un autre VTI sous-unitaire en guise de comparaisonNote de bas de page 25. Aucune information n’est disponible pour démontrer comment InfluvacMD se compare à un VTI à virion fragmenté, à un VTI avec adjuvant ou à un VAQ.
V. Liste des abréviations
- Abréviation
- Terme
- ASPC
- Agence de la santé publique du Canada
- CCNI
- Comité consultatif national de l’immunisation
- CHMP
- Comité des médicaments à usage humain
- CIM
- Classification internationale des maladies
- EI
- Effet indésirable
- EIG
- Effet indésirable grave
- ERC
- Essai randomisé contrôlé
- ESSI
- Effets secondaires suivant l’immunisation
- FAMTG
- Facteur d’augmentation de la moyenne des titres géométriques
- HA
- Hémagglutinine
- HHS
- Department of Health & Human Services (États-Unis)
- IC
- Intervalle de confiance
- IH
- Inhibition de l’hémagglutination
- IM
- Intramusculaire
- IVR
- Infection des voies respiratoires
- LAL
- Leucémie aiguë lymphoblastique
- MTG
- Moyenne des titres géométriques
- N.I.
- Non indiqué
- PCR
- Réaction en chaîne de la polymérase
- PCV7
- Vaccin conjugué heptavalent contre le pneumocoque
- P/R
- Par rapport (à)
- RR
- Risque relatif
- RTI
- Ratio des taux d’incidence
- s.o.
- Sans objet
- SG
- Syndrome grippal
- VAQ
- Vaccin antigrippal quadrivalent inactivé
- VHB
- Vaccin contre l’hépatite B
- VTI
- Vaccin antigrippal trivalent inactivé
- VVAI
- Vaccin antigrippal vivant atténué
VI. Remerciements
Cette déclaration a été rédigée par : Dr L. Zhao, Mme K. Young, Dr R. Stirling, Mme S. Chen, Dr I. Gemmill et approuvée par le CCNI.
Membres du Groupe de travail sur l’influenza : Dre C. Bancej, Mme L. Cochrane, Dre N. Dayneka, Dr I. Gemmill (présidente), Dre L. Grohskopf, Mme E. Henry, Dre D. Kumar, Dre J. Langley, Dr M. Lavoie, Dre J. McElhaney, Dre A. McGeer, Dre D. Moore, Dre B. Warshawsky, Dre J. Xiong.
Membres du CCNI : Dre N. Dayneka, Dre S. Deeks, Dr P. DeWals, Dre R. Harrison, Dr M. Lavoie, Dre C. Quach-Thanh (président), Mme S. Marchant-Short, Dr C. Rotstein, Dre M. Salvadori, Dre B. Sander, Dre N. Sicard, Dre W. Vaudry (vice-président), Dr R. Warrington.
Anciens membres du CCNI : Dr I. Gemmill, Dre B. Henry.
Agents de liaison : Dr J. Brophy (Association canadienne pour la recherche et l’évaluation en immunisation), Dre E. Castillo (Société des obstétriciens et gynécologues du Canada), Dre A. Cohn (Centers for Disease Control and Prevention, États-Unis), Mme T. Cole (Comité canadien sur l’immunisation), Dre J. Emili (Collège des médecins de famille du Canada), Dre C. Mah (Association canadienne de santé publique), Dre D. Moore (Société canadienne de pédiatrie), Dre A. Pham-Huy (Association pour la microbiologie médicale et l’infectiologie Canada).
Anciens agents de liaison : Dr J. Blake (Association canadienne pour la recherche et l’évaluation en immunisation).
Représentants d’office : Dre (Capc) K. Barnes (Défense nationale et Forces armées canadiennes), Mme G. Charos (Centre de l’immunisation et des maladies respiratoires infectieuses [CIMRI]), ASPC], Dre G. Coleman (Direction des produits biologiques et des thérapies génétiques, Santé Canada [SC]), Dr J. Gallivan (Direction des produits de santé commercialisés, SC), Mme J. Pennock (CIMRI, ASPC), Dr T. Wong (Direction générale de la santé des Premières nations et des Inuits, SC).
Le CCNI tient à souligner la contribution de Mme R. Hocking, Mme A. House, Mme K. Merucci et Mme T. Museau.
Annexe A : Caractéristiques des vaccins antigrippaux offerts pour utilisation au Canada, 2017-2018Note de bas de page *
Fabricant et nom du produit |
BGP Pharma ULC InfluvacMD |
GSK FluviralMD |
Seqirus AgrifluMD |
Seqirus Fluad PédiatriqueMD |
Sanofi Pasteur VaxigripMD |
Sanofi Pasteur FluzoneMD |
Sanofi Pasteur FluzoneMD Haute dose |
AstraZeneca FluMistMD |
GSK FlulavalMD tetra |
Sanofi Pasteur FluzoneMD quadrivalent |
|---|---|---|---|---|---|---|---|---|---|---|
Préparations vaccinales |
VTI |
VTI |
VTI |
VTI |
VTI |
VTI |
VTI |
VVAI |
VAQ |
VAQ |
Type de vaccin |
Inactivé, antigène de surface |
Inactivé, à virions fragmentés |
Inactivé, sous-unitaire |
Inactivé, sous-unitaire |
Inactivé, à virions fragmentés |
Inactivé, à virions fragmentés |
Inactivé, à virions fragmentés |
Vivant atténué |
Inactivé, à virions fragmentés |
Inactivé, à virions fragmentés |
Voie d’administration |
IM |
IM |
IM |
IM |
IM |
IM |
Vaporisation intranasale |
IM |
IM |
|
Groupe d’âge pour lequel le vaccin est approuvé |
≥ 3 ansNote de bas de page *** |
≥ 6 mois |
≥ 6 mois |
Enfants : Adultes : |
≥ 6 mois |
≥ 6 mois |
≥ 65 ans |
2 à 59 ans |
≥ 6 mois |
≥ 6 mois |
Quantité d’antigènes (de chacune des souches) |
15 µg HA |
15 µg HA |
15 µg HA |
Enfants : Adultes : |
15 µg HA |
15 µg HA |
60 µg HA |
106,5-7,5 Unités de foyers fluorescents de virus vivants atténués et réassortis |
15 µg HA |
15 µg HA |
Adjuvant |
Non |
Non |
Non |
MF59 (émulsion huile dans eau) |
Non |
Non |
Non |
Non |
Non |
Non |
Présentations offertes |
Seringues préremplies à dose unique avec embout Luer |
Flacon multidose de 5 ml |
Flacon multidose de 5 ml Seringues préremplies à dose unique sans aiguille |
Seringues préremplies à dose unique sans aiguille |
Flacon multidose de 5 ml Ampoule à dose unique Seringues préremplies à dose unique avec ou sans aiguille
|
Flacon multidose de 5 ml Ampoule à dose unique Seringues préremplies à dose unique sans aiguille |
Seringues préremplies à dose unique |
Vaporisateur de verre prérempli à usage unique |
Flacon multidose de 5 ml |
Flacon multidose de 5 ml Flacons à dose unique Seringues préremplies à dose unique sans aiguille |
Durée de conservation des flacons multidoses après perforation |
s.o. |
28 jours |
28 jours |
s.o. |
7 jours |
28 jours |
s.o. |
s.o. |
28 jours |
Jusqu’à la date de péremption indiquée sur l’étiquette de la fiole |
Thimérosal |
Non |
Oui |
Oui (fioles multidoses seulement) |
Non |
Oui (fioles multidoses seulement) |
Oui (fioles multidoses seulement) |
Non |
Non |
Oui |
Oui (fioles multidoses seulement) |
Antibiotiques (traces) |
Gentamicine |
Aucune |
Kanamycine |
Kanamycine |
Néomycine |
Aucune |
Aucune |
Gentamicine |
Aucune |
Aucune |
Autres ingrédients non médicinaux pertinents sur le plan cliniqueNote de bas de page * |
Protéines d’œuf, |
Protéines d’œuf, |
Protéines d’œuf, |
Protéines d’œuf, |
Protéines d’œuf, |
Protéines d’œuf, |
Formaldéhyde, |
Protéines d’œuf, |
Protéines d’œuf, |
Protéines d’œuf, |
Annexe B : Recommandations du CCNI : force de la recommandation et catégorie des données probantes
Force de la recommandation du CCNI |
Catégorie des données probantes |
|---|---|
D’après des facteurs ne se limitant pas à la force des données probantes (p. Ex., besoin en matière de santé publique) |
D’après l’évaluation de l’ensemble des données probantes |
Forte
OU les inconvénients connus/attendus l’emportent sur les avantages connus/attendus (« ne devrait pas »)
|
A – Données probantes suffisantes pour recommander l’immunisation |
B – Données probantes acceptables pour recommander l’immunisation |
|
C – Données probantes contradictoires; cependant, d’autres facteurs peuvent influer sur la prise de décision |
|
D – Données probantes acceptables pour déconseiller l’immunisation |
|
E – Données probantes suffisantes pour déconseiller l’immunisation |
|
I – Données probantes insuffisantes (en quantité ou en qualité); cependant, d’autres facteurs peuvent influer sur la prise de décision |
|
Facultative
OU il existe une incertitude des données sur les avantages et inconvénients
|
A – Données probantes suffisantes pour recommander l’immunisation |
B – Données probantes acceptables pour recommander l’immunisation |
|
C – Données probantes contradictoires; cependant, d’autres facteurs peuvent influer sur la prise de décision |
|
D – Données probantes acceptables pour déconseiller l’immunisation |
|
E – Données probantes suffisantes pour déconseiller l’immunisation |
|
I – Données probantes insuffisantes (en quantité ou en qualité); cependant, d’autres facteurs peuvent influer sur la prise de décision |
Annexe C : Stratégie et résultats de recherche
No de l’ensemble |
Recherches |
Résultats |
|---|---|---|
EMBASE (de 1974 au 20 juin 2017), Global Health (de 1973 au 20 juin 2017) et MEDLINE (de 1947 au 20 juin 2017) |
||
1 |
influenza vaccine/ or influenza vaccination/ |
55 633 |
2 |
exp influenza/pc or exp Influenza virus/pc |
36 160 |
3 |
(exp influenza/ or exp Influenza virus/) and (vaccine/ or virus vaccine/ or inactivated virus vaccine/ or vaccination/) |
37 518 |
4 |
((flu or influenza* or H?N? or (trivalent or inactiv* subunit*)) and (vaccin* or immuni?ation*)).tw,kw. |
104 418 |
5 |
or/1-4 [Flu Vaccine] |
128 519 |
6 |
(abbott or solvay or BGP Pharma or Mylan).mf,ad,tn,ti,ab. |
51 292 |
7 |
5 and 6 [Flu Vaccine by Abbott or Solvay] |
389 |
8 |
influvac*.af. |
349 |
9 |
7 or 8 [Influvac or suspected Influvac] |
576 |
10 |
limit 9 to (infant <to one year> or child <unspecified age> or preschool child <1 to 6 years> or school child <7 to 12 years> or adolescent <13 to 17 years>) [Limit not valid in Global Health,Ovid MEDLINE(R),Ovid MEDLINE(R) Daily Update,Ovid MEDLINE(R) In-Process,Ovid MEDLINE(R) Publisher; records were retained] |
112 |
11 |
juvenile/ or exp child/ or exp adolescent/ |
5 959 007 |
12 |
(baby or babies or infan* or child* or youth* or juvenile* or adolescen* or p?ediatric*).tw,kw. |
4 505 804 |
13 |
9 and (11 or 12) |
120 |
14 |
10 or 13 [Influvac + Children] |
162 |
15 |
limit 14 to (English or French) |
137 |
16 |
(baby or babies or infan* or child* or youth* or juvenile* or adolescen* or p?ediatric*).mp. |
7 812 184 |
17 |
11 or 16 |
8 047 584 |
18 |
9 and (11 or 16) |
128 |
19 |
10 or 18 |
170 |
20 |
limit 19 to (English or French) [Expanding Pediatric Limit] |
144 |
21 |
20 use oemezd |
92 |
22 |
Influenza Vaccines/ |
44 253 |
23 |
Influenza, Human/pc [Prevention & Control] |
18 537 |
24 |
(Influenza, Human/ or exp influenzavirus a/ or exp influenzavirus b/) and exp vaccines/ |
23 917 |
25 |
((flu or influenza* or H?N? or (trivalent or inactiv* subunit*)) and (vaccin* or immuni?ation*)).tw,kf. |
103 905 |
26 |
or/22-25 [Flu Vaccine] |
120 373 |
27 |
(abbott or solvay or BGP Pharma or Mylan).af. |
90 837 |
28 |
26 and 27 [Flu Vaccine by Abbott or Solvay or BGP Pharma] |
497 |
29 |
influvac*.af. |
349 |
30 |
28 or 29 [Influvac or suspected Influvac] |
683 |
31 |
limit 30 to «all child (0 to 18 years)» [Limit not valid in Embase,Global Health; records were retained] |
615 |
32 |
exp Pediatrics/ or exp Infant/ or exp Child/ or Adolescent/ |
6 510 773 |
33 |
(baby or babies or infan* or child* or youth* or juvenile* or adolescen* or p?ediatric*).tw,kw. |
4 505 804 |
34 |
30 and (32 or 33) |
144 |
35 |
31 or 34 [Influvac + Children] |
618 |
36 |
(baby or babies or infan* or child* or youth* or juvenile* or adolescen* or p?ediatric*).mp. |
7 812 184 |
37 |
30 and (32 or 36) |
151 |
38 |
31 or 37 |
618 |
39 |
limit 38 to (English or French) |
560 |
40 |
39 use ppezv |
17 |
41 |
exp influenza viruses/ or influenzavirus a/ or influenzavirus b/ |
103 893 |
42 |
exp vaccination/ or exp vaccines/ or exp immunization/ |
780 965 |
43 |
((flu or influenza* or H?N? or (trivalent or inactiv* subunit*)) and (vaccin* or immuni?ation*)).mp. |
134 380 |
44 |
(41 and 42 or 43) |
134 619 |
45 |
(abbott or solvay or BGP Pharma or Mylan).af. |
90 837 |
46 |
44 and 45 |
576 |
47 |
influvac*.af. |
349 |
48 |
46 or 47 |
757 |
49 |
exp children/ or exp adolescents/ or exp infants/ or exp paediatrics/ |
6 030 218 |
50 |
(baby or babies or infan* or child* or youth* or juvenile* or adolescen* or p?ediatric*).mp. |
7 812 184 |
51 |
48 and (49 or 50) |
166 |
52 |
limit 51 to (English or French) |
148 |
53 |
52 use cagf |
13 |
54 |
21 or 40 or 53 |
122 |
55 |
remove duplicates from 54 |
106 |
International Pharmaceutical Abstracts (de 1970 au 29 juin 2017) |
||
1 |
(«influenza vaccines» or (influenza and vaccines)).sh,hw. |
1 695 |
2 |
((flu or influenza* or H?N? or (trivalent or inactiv* subunit*)) and (vaccin* or immuni?ation*)).mp. |
2 482 |
3 |
1 or 2 |
2 482 |
4 |
(abbott or solvay or BGP Pharma or Mylan).mp. |
241 |
5 |
3 and 4 |
1 |
6 |
Influvac*.mp. |
14 |
7 |
5 or 6 |
15 |
8 |
(baby or babies or infan* or child* or youth* or juvenile* or adolescen* or p?ediatric*).mp. |
35 612 |
9 |
7 and 8 |
0 |
1 |
(«influenza vaccines» or (influenza and vaccines)).sh,hw. |
1 695 |
2 |
((flu or influenza* or H?N? or (trivalent or inactiv* subunit*)) and (vaccin* or immuni?ation*)).mp. |
2 482 |
3 |
1 or 2 |
2 482 |
4 |
(abbott or solvay or BGP Pharma or Mylan).mp. |
241 |
5 |
3 and 4 |
1 |
Base de données de santé publique ProQuest (de 1963 au 29 juin 2017) |
||
- |
(((((ti,ab,ft(flu OR influenza* OR H?N? OR (trivalent OR inactiv* subunit*)) AND (vaccin* OR immuni?ation*)) OR mesh.Exact(«Influenza Vaccines»)) OR ((mesh.Exact(«Influenza, Human» OR «influenzas a» OR «influenzas b») OR SU.EXACT(«Influenza»)) AND (SU.EXACT(«Immunization») OR SU.EXACT(«Vaccines») OR mesh.Exact(«vaccines»)))) AND ti,ab,ft((abbott OR solvay OR «BGP Pharma» OR Mylan) NEAR/5 vaccin*)) OR ti,ab,ft(influvac*)) AND (SU.EXACT(«Children & youth») OR SU.EXACT(«Newborn babies») OR SU.EXACT(«Babies») OR SU.EXACT(«Teenagers») OR mesh.Exact(«Pediatrics» OR «Infant» OR «Child» OR «Adolescent») OR ti,ab(baby OR babies OR infan* OR child* OR youth* OR juvenile* OR adolescen* OR p?ediatric*)) AND stype.exact(«Scholarly Journals») AND la.exact(«English» OR «French») |
43 |
Scopus (de 1960 au 29 juin 2017) |
||
- |
((TITLE-ABS-KEY(((flu OR influenza* OR h?n? OR (trivalent OR inactiv* AND subunit*)) AND (vaccin* OR immunisation* OR immunization*))) AND TITLE-ABS-KEY((abbott OR solvay OR «bgp pharma» OR mylan) W/3 vaccin*)) OR ALL(influvac*)) AND TITLE-ABS-KEY(baby OR babies OR infan* OR child* OR youth* OR juvenile* OR adolescen* OR pediatric* OR paediatric*) AND LANGUAGE(English OR French) |
117 |
Annexe D : Niveau de données probantes selon la méthodologie de recherche et la cote de qualité (validité interne) des données probantes
Niveau |
Description |
|---|---|
I |
Données probantes provenant d’un ou de plusieurs essais randomisés contrôlés. |
II-1 |
Données probantes provenant d’un ou de plusieurs essais contrôlés sans randomisation. |
II-2 |
Données probantes obtenues dans le cadre d’études analytiques de cohortes ou cas-témoins, réalisées de préférence dans plus d’un centre ou par plus d’un groupe de recherche utilisant des indicateurs cliniques de résultats de l’efficacité du vaccin. |
II-3 |
Données probantes obtenues à partir de plusieurs séries chronologiques avec ou sans intervention. Les résultats spectaculaires obtenus dans un contexte non contrôlé (comme les résultats de l’introduction de la pénicilline dans les années 1940) pourraient aussi être considérés comme faisant partie de ce type de données probantes. |
III |
Opinions d’autorités respectées fondées sur des expériences cliniques, études descriptives et rapports de cas ou rapports de comités d’experts. |
Cote de qualité |
Description |
|---|---|
Bonne |
Une étude (y compris les méta-analyses ou les examens systématiques) qui répond bien à tous les critères relatifs à la méthodologieFootnote *. |
Passable |
Une étude (y compris les méta-analyses ou les examens systématiques) qui ne répond pas (ou ne répond pas clairement) à au moins un des critères relatifs à la méthodologieFootnote *, mais ne comportant aucune « lacune fatale » connue. |
Médiocre |
Une étude (y compris les méta-analyses ou les examens systématiques) qui comporte au moins une « lacune fatale » relative à la méthodologie ou une accumulation de lacunes moins importantes faisant en sorte que les résultats de l’étude sont jugés inadéquats en vue de l’élaboration des recommandations. |
Annexe E : Organigramme du processus de sélection de l’étude des données extraites de la littérature sur l’efficacité potentielle et réelle, l’immunogénicité et l’innocuité du vaccin antigrippal trivalent inactivé InfluvacMD chez les enfants
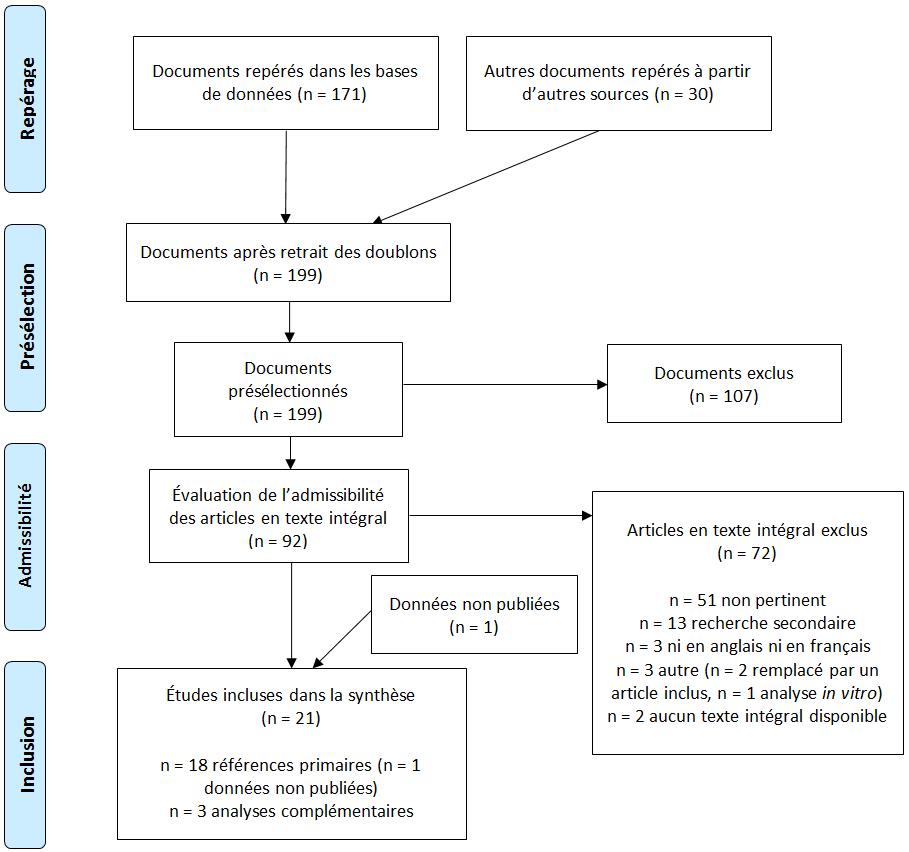
Figure 1 - Équivalent Textuel
L’organigramme d’attrition illustre le processus de sélection des articles pour l’examen de la documentation. Le processus est réparti en quatre étapes : l’identification, l’analyse, l’admissibilité et l’inclusion.
Étape 1 : L’identification
171 documents ont été répertoriés durant la recherche dans les bases. 30 documents ont été répertoriés au moyen d'autres sources.
199 documents ont été retenus après le retrait des doublets dans les 201 documents.
Étape 2 : L’analyse
201 documents ont été triés.
De ces 201 documents, 107 ont été exclus.
Étape 3 : L'admissibilité
92 documents en texte intégral ont été évalués pour leur admissibilité.
De ces 92 documents en texte intégral, 72 ont été exclus. L'élimination s'est effectuée comme suit :
- 51 non pertinent
- 13 recherche secondaire
- 3 ni en anglais ni en français
- 3 autre (2 remplacé par un article inclus et 1 analyse in vitro)
- 2 aucun texte intégral disponible
Stage 4: L'inclusion
Des 92 articles en texte intégral évalués pour leur admissibilité, 21 ont été inclus dans la synthèse. On a recensé 18 références primaires (1 données non publiées) et 3 analyses complémentaires.
Annexe F : Résumé des données extraites de la littérature sur l’efficacité potentielle et réelle du vaccin antigrippal trivalent inactivé InfluvacMD chez les enfants
Détails de l'étude |
Résumé |
|||||
|---|---|---|---|---|---|---|
Étude |
Méthodologie de l’étude |
Vaccin antigrippal |
Participants |
Résumé des principaux résultats |
Niveau – données probantes |
Qualité |
Ghendon et al. (2006)Note de bas de page 26 |
Méthodologie Saison grippale Lieu Suivi EI : 3 à 5 jours après la vaccination |
Vaccin antigrippal Dose et administration Souches |
Définition de la population Groupes de l’étude Groupe témoin : aucune campagne de vaccination (taux de couverture <1,0 %) Taille de l’échantillon Âge Sexe |
Taux d’incidence du SG défini comme l’apparition soudaine d’une fièvre de plus de 38 °C et d’une toux ou d’un mal de gorge Morbidité 7 à 17 ans Total Efficacité réelle du vaccin 3 à 6 ans : 60,9 % (p < 0,001) |
Niveau II-1 |
s.o. |
Jansen et al. (2008a)Note de bas de page 18 Données complétées par des précisions supplémentaires concernant les ESSI, tirées de Jansen et al. (2008b)Note de bas de page 19 |
Méthodologie Saisons grippales Lieu Suivi Saisons 2005-2006 : 6 mois après la vaccination EI : 7 jours après la vaccination |
Vaccin antigrippal Dose et administration Les cohortes de 2003-2004 et de 2004-2005 ont reçu une vaccination supplémentaire l’année suivante Souches Préparation de 2004-2005 : Préparation de 2005-2006 : |
Définition de la population Groupes de l’étude VHB plus placebo (groupe témoin) Taille de l’échantillon Âge (moyen) Sexe Les groupes d’étude étaient similaires en ce qui concerne l’âge, le sexe et les antécédents médicaux. |
Résultats primaires
Taux d’incidence (pour 1 000 jours) (IC à 95%) Ratio des taux d’incidence (IC à 95%) Résultats secondaires
Des enfants qui ont reçu InfluvacMD plus PCV7, 4 % avaient une grippe confirmée, alors que 9 % des enfants du groupe témoin (VHB plus placebo) avaient une grippe confirmée en laboratoire. Le risque relatif pour les patients qui ont reçu InfluvacMD plus PCV7 p/r à ceux qui ont reçu le placebo plus VHB était de 0,48 (IC à 95 % : de 0,25 à 0,93). Des enfants qui ont reçu InfluvacMD plus placebo, 5 % avaient une grippe confirmée, tandis que 9 % de ceux du groupe témoin (VHB plus placebo) avaient une grippe confirmée en laboratoire. Le risque relatif pour les patients qui ont reçu InfluvacMD p/r à ceux qui ont reçu le VHB plus placebo était de 0,49 (IC à 95 % : de 0,25 à 0,97). Les résultats par type de virus de la grippe n’étaient pas précisés.
Taux d’incidence (pour 1 000 jours) (IC à 95 %) Ratio des taux d’incidence (IC à 95 %)
Taux d’incidence (pour 1 000 jours) (IC à 95 %) Ratio des taux d’incidence (IC à 95 %)
Taux d’incidence (pour 1 000 jours) (IC à 95 %) Ratio des taux d’incidence (IC à 95 %) Remarques |
Niveau I |
Passable Cas perdus au suivi : 14 à 20 % |
Annexe G : Résumé des données sur l’immunogénicité du vaccin antigrippal trivalent inactivé InfluvacMD chez les enfants
Détails de l'étude |
Résumé |
|||||
|---|---|---|---|---|---|---|
Étude |
Méthodologie de l’étude |
Vaccin antigrippal |
Participants |
Résumé des principaux résultats |
Niveau des données probantes |
Qualité |
Brydak et al. (2000)Note de bas de page 9 |
Méthodologie Lieu Suivi |
Vaccin antigrippal Dose et administration Souches |
Définition de la population Groupes de l’étude B : ayant terminé la chimiothérapie après 1991 Groupes témoins non vaccinés (enfants en santé) Taille de l’échantillon Âge Sexe |
3 semaines après la vaccination : MTG Groupe B Groupes témoins FAMTG Groupe B Groupes témoins Taux de séroprotection Groupe B H3N2 : 50,0 % Groupes témoins Taux de séroconversion Groupe B Groupes témoins 6 mois après la vaccination : MTG Groupe B Groupes témoins FAMTG Groupe B Groupes témoins Taux de séroprotection Groupe B Groupes témoins Taux de séroconversion Groupe B Groupes témoins Remarques
|
Niveau III |
s.o. |
Brydak et al. (1998a)Note de bas de page 10 |
Méthodologie Lieu Suivi |
Vaccin antigrippal Dose et administration Souches |
Définition de la population Groupes de l’étude Groupes témoins non vaccinés (enfants en santé) Taille de l’échantillon Âge Sexe |
3 semaines après la vaccination : MTG Groupe B Groupes témoins FAMTG Groupe B Groupes témoins Taux de séroprotection Groupe B Groupes témoins Taux de séroconversion Groupe B Groupes témoins 6 mois après la vaccination : MTG Groupe B Groupes témoins FAMTG Groupe B Groupes témoins Taux de séroprotection Groupe B Groupes témoins Taux de séroconversion Groupe B Groupes témoins Remarques
|
Niveau III |
s.o. |
Brydak et al. (1998b)Note de bas de page 11 Données complétées par des précisions supplémentaires tirées d’une analyse stratifiée selon la gravité de l’hémophilie (légère p/r à grave) réalisée par Rokicka-Milewska et al. (1999)Note de bas de page 22 |
Méthodologie Lieu Suivi |
Vaccin antigrippal Dose et administration Souches |
Définition de la population Groupes de l’étude Groupes témoins non vaccinés (enfants en santé) Taille de l’échantillon Âge Sexe |
3 semaines après la vaccination : MTG Groupes témoins FAMTG Groupes témoins Taux de séroprotection Groupes témoins Taux de séroconversion Groupes témoins 6 mois après la vaccination : MTG Groupes témoins FAMTG Groupes témoins Taux de séroprotection Groupes témoins Taux de séroconversion Groupes témoins Analyse stratifiée selon la gravité de l’hémophilie Remarques |
Niveau III |
s.o. |
Bueving (2004a)Note de bas de page 12
Données complétées par des précisions supplémentaires tirées de l’étude de Bueving et al. (2004b) sur les ESSI et l’exacerbation de l’asthme après la vaccinationNote de bas de page 13 |
Méthodologie Lieu Suivi EI : 7 jours après la vaccination (résultats présentés à l’Annexe H) |
Vaccin antigrippal Dose et administration Souches Préparation de 2000-2001 : Les enfants ne pouvaient être vaccinés qu’au cours d’une seule des deux saisons. |
Définition de la population Taille de l’échantillon Âge (moyen) Sexe |
14 à 21 jours après la vaccination : MTG Placebo Le vaccin comparativement au placebo (valeur p) Taux de séroprotection Placebo Le vaccin comparativement au placebo (valeur p) Taux de séroconversion Placebo Le vaccin comparativement au placebo (valeur p) 4 à 5 mois après la vaccination : MTG Placebo Le vaccin comparativement au placebo (valeur p) Taux de séroconversion* Placebo Le vaccin comparativement au placebo (valeur p) * Le taux de séroconversion 4 à 5 mois après la vaccination a été calculé en comparant les résultats d’échantillon obtenus 4 à 5 mois suivant la vaccination aux résultats d’échantillon obtenus 14 à 21 jours après la vaccination. |
Niveau I |
Passable Analyses effectuées selon le protocole |
Daubeney et al. (1997)Note de bas de page 16 |
Méthodologie Lieu Suivi |
Vaccin antigrippal Dose et administration Souches |
Définition de la population Taille de l’échantillon Âge (moyen) Sexe |
MTG MTG après la vaccination (IC à 95 %) FAMTG Taux de séroprotection Taux de séroconversion |
Niveau III |
s.o. |
El-Madhun et al (1998)Note de bas de page 17 |
Méthodologie Lieu Suivi |
Vaccin antigrippal Dose et administration Souches |
Définition de la population
Groupes de l’étude Taille de l’échantillon Âge Sexe |
6 à 8 jours après la 1re dose du vaccin : MTG Sujets non sensibilisés Taux de séroprotection Sujets non sensibilisés 12 à 20 jours après la 1re dose du vaccin : MTG Sujets non sensibilisés Taux de séroprotection Sujets non sensibilisés 28 à 42 jours après la 1re dose du vaccin : MTG Sujets non sensibilisés Taux de séroprotection Sujets non sensibilisés Taux de séroconversion Remarques
|
Niveau III |
s.o. |
Shahgholi et al. (2010)Note de bas de page 23 |
Méthodologie Lieu Suivi EI : 5 jours après la vaccination (résultats présentés à l’Annexe H) |
Vaccin antigrippal Dose et administration 36 mois à 13 ans : 2 doses (0,5 ml), 3 à 4 semaines d’intervalle > 13 ans : 1 dose (0,5 ml) Souches |
Définition de la population Taille de l’échantillon Âge (moyen) Sexe |
4 semaines après la vaccination : MTG Groupes témoins, MTG avant la vaccination (IC à 95 %) Les sujets atteints de LAL comparativement aux groupes témoins, MTG avant la vaccination (valeur p) Sujets atteints de LAL, MTG après la vaccination (IC à 95 %) Groupes témoins, MTG après la vaccination (IC à 95 %) Les sujets atteints de LAL comparativement aux groupes témoins, MTG après la vaccination (valeur p) Taux de séroprotection Groupes témoins, taux de séroprotection La réponse protectrice à l’antigène de la grippe A(H3N2) ne différait pas de façon significative entre le groupe de sujets atteints de LAL et le groupe témoin. Cependant, le taux de réponse aux antigènes de la grippe A(H1N1) et B chez les patients atteints de LAL était significativement inférieur à celui noté chez les sujets témoins en santé (p = 0,04 et 0,001, respectivement). Taux de séroconversion Groupes témoins, après la vaccination (IC à 95 %) Les sujets atteints de LAL comparativement aux groupes témoins, rapport de cotes (IC à 95 %) Les taux de séroconversion aux virus de la grippe A(H1N1) et B étaient significativement inférieurs chez les patients atteints de LAL p/r aux sujets témoins en santé (p = 0,04 et 0,038, respectivement); cette observation ne s’applique pas au virus de la grippe A(H3N2). |
Niveau II-1 |
s.o. Les membres de la fratrie ont été inclus en tant que sujets témoins; cependant, les similitudes quant aux facteurs de confusion importants n’ont fait l’objet d’aucune évaluation. |
Zhu et al. (2008)Note de bas de page 25 |
Méthodologie Lieu Suivi EI : 29 jours après la vaccination (résultats présentés à l’Annexe H) |
Vaccin antigrippal Dose et administration Souches |
Définition de la population Groupes de l’étude Groupe vacciné par AgrippalMD Taille de l’échantillon Sexe |
29 jours après la vaccination : MTG AgrippalMD, MTG avant la vaccination (IC à 95 %) InfluvacMD, MTG après la vaccination (IC à 95 %) AgrippalMD, MTG après la vaccination (IC à 95 %) FAMTG AgrippalMD, FAMTG (IC de 95 %) FAMTG obtenu avec InfluvacMD par sous-groupe d’âge Enfants de 6 à 12 ans (IC à 95 %) Taux de séroprotection Agrippal MD, taux de séroprotection (IC à 95 %) Taux de séroprotection obtenu avec InfluvacMD par sous-groupe d’âge Enfants de 6 à 12 ans (IC à 95 %) Taux de séroconversion Agrippal MD, taux de séroconversion (IC à 95 %) Taux de séroconversion obtenu avec InfluvacMD par sous-groupe d’âge Enfants de 6 à 12 ans (IC à 95 %) Rapports des MTG pour InfluvacMD : AgrippalMD |
Niveau I |
Passable Analyses effectuées selon le protocole Il s’agissait d’une étude avec évaluation à l’insu des critères d’évaluation (et non d’une étude à double insu). |
Annexe H : Résumé des données sur l’innocuité du vaccin antigrippal trivalent inactivé InfluvacMD chez les enfants
Détails de l'étude |
Résumé |
|||||
|---|---|---|---|---|---|---|
Étude |
Méthodologie de l’étude |
Vaccin antigrippal |
Participants |
Résumé des principaux résultats |
Niveau des données probantes |
Qualité |
Aagaard et al. (2011)Note de bas de page 7 |
Méthodologie Saisons grippales Lieu |
Vaccin antigrippal Autres vaccins non antigrippaux |
Définition de la population Âge Sexe |
Un ESSI est défini par toute réaction nocive et non intentionnelle à un médicament qui survient lorsque celui-ci est utilisé selon les doses normales chez les humains pour la prophylaxie, le diagnostic ou le traitement d’une maladie. Quatre ESSI ont été signalés chez les enfants du groupe d’âge des 2 à 3 ans, dont trois étaient graves. Aucun détail n’a été fourni concernant les ESSI. Aucun ESSI n’a été signalé dans les autres groupes d’âge. |
Niveau III |
s.o. |
Armstrong et al. (2011)Note de bas de page 8 |
Méthodologie Étude de cohorte rétrospective Saison grippale Lieu |
Vaccin antigrippal Dose et administration 4 ans : 2 doses (15 µg par souche) Souches |
Surveillance : Définition de la population Définition de cas : Enfants à qui on a attribué le code R56.0 (convulsions fébriles) de la CIM-10 en salle d’urgence dans les 72 heures suivant l’administration d’un VTI ou cas de convulsions fébriles associées à un VTI signalé par des urgentologues, des fournisseurs de soins primaires ou des vaccinateurs. Taille de l’échantillon Âge (moyen) Sexe Cohorte : Définition de la population Taille de l’échantillon Âge Sexe |
Surveillance : Convulsions fébriles 3 à 4 ans, taux/1 000 doses de VTI (IC à 95 %) Réactions fébriles (absence de convulsion)* 3 à 4 ans, taux/1 000 doses de VTI (IC à 95 %) * Consiste des rapports de surveillance passive soumis au système de déclaration des ESSI par opposition aux rapports de surveillance active. Le RR des réactions fébriles pour FluvaxMD et Fluvax JuniorMD combinés p/r à InfluvacMD était de 11,4 (IC à 95 % : de 5,9 à 22,1) chez les enfants de ≤ 2 ans et de 33,0 (IC à 95 % : de 8,2 à 133,2) chez les enfants de 3 à 4 ans. Cohorte : FluvaxMD Fluvax JuniorMD FluvaxMD et Fluvax JuniorMD La fièvre (RC = 5,1), la fatigue (RC = 3,5), les vomissements (RC = 6,0) et les EIG de nature fébrile (RC = 7,0) étaient significativement plus courants chez les enfants ayant reçu l’un des deux vaccins FluvaxMD que chez les enfants ayant reçu InfluvacMD. |
Niveau III |
s.o. |
Brydak et al. (2000)Note de bas de page 9 |
Méthodologie Lieu Suivi |
Vaccin antigrippal Dose et administration Souches |
Définition de la population Groupes de l’étude B : ayant terminé la chimiothérapie après 1991 Groupes témoins non vaccinés (enfants en santé) Taille de l’échantillon Âge Sexe |
Aucun des enfants vaccinés n’a présenté de symptômes d’infection par le virus de la grippe. Les vaccins ont été bien tolérés et n’ont causé aucun EIG. Remarques
|
Niveau III |
s.o. |
Bueving (2004a)Note de bas de page 12 Données complétées par des précisions supplémentaires tirées de l’étude de Bueving et al. (2004b) sur les ESSI et l’exacerbation de l’asthme après la vaccinationNote de bas de page 13 |
Méthodologie Lieu Suivi EI : 7 jours après la vaccination |
Vaccin antigrippal Administration Souches Préparation de 2000-2001 : Les enfants ne pouvaient être vaccinés qu’au cours d’une seule des deux saisons. |
Définition de la population Taille de l’échantillon Âge (moyen) Sexe |
EI Au cours de la saison 1999-2000, on a observé une différence significative en ce qui concerne la fièvre et les tremblements (8 %), les maux de tête (10 %) et la myalgie (18 %) après l’injection entre le groupe vacciné et le groupe placebo. En 2000-2001, seuls les épisodes de voix rauque (5 %) étaient significativement différents entre les deux groupes. Aucune autre différence significative n’a été notée pour ce qui est des réactions générales entre les deux groupes pour l’une ou l’autre des saisons (maladie, vomissements, diarrhée, fatigue, sudation, éternuements, écoulement ou congestion nasale, sensation de brûlure aux yeux, larmoiements, mal de gorge). Parmi les symptômes de l’asthme consignés, les épisodes de toux (8 %) étaient le seul pour lequel une différence significative a été observée au cours de la saison 1999-2000. Aucun EIG n’a été signalé dans l’un ou l’autre des groupes. Exacerbation de l’asthme |
Niveau I |
Passable Analyses effectuées selon le protocole |
Cashman et al. (2014)Note de bas de page 14 |
Méthodologie Saisons grippales Lieu Suivi |
Vaccin antigrippal Autres VTI |
Définition de la population Taille de l’échantillon Taux de réponse à l’enquête : 61 % (n = 290 sur 477) Âge Sexe |
EI suivant la première dose Total Les sujets ayant reçu InfluvacMD ont signalé moins souvent tout ESSI (3,1 %; n = 32) que les sujets ayant reçu FluarixMD (11,6 %; n = 43), VaxigripMD (21,7 %; n = 212) et toute autre marque de vaccin antigrippal (17,9 %; n = 290) au cours des saisons grippales 2012 et 2013 dans l’hémisphère Sud. |
Niveau III |
s.o. |
Cheng et al. (2015)Note de bas de page 15 |
Méthodologie Saisons grippales Lieu Suivi |
Vaccin antigrippal Autres vaccins non antigrippaux Dose et administration |
Définition de la population Définition de cas : La définition de cas établie par Brighton Collaboration a servi à définir le niveau de certitude de survenue d’une réaction anaphylactique. Taille de l’échantillon Âge (moyen) Sexe |
Anaphylaxie suivant la vaccination Remarques |
Niveau III |
s.o. |
Daubeney et al. (1997)Note de bas de page 16 |
Méthodologie Lieu Suivi |
Vaccin antigrippal Dose et administration Souches |
Définition de la population Taille de l’échantillon Âge (moyen) Sexe |
EI
|
Niveau III |
s.o. |
Ghendon et al. (2006)Note de bas de page 26 |
Méthodologie Saison grippale Lieu Suivi EI : 3 à 5 jours après la vaccination |
Vaccin antigrippal Dose et administration |
Définition de la population Groupe témoin : aucune campagne de vaccination (taux de couverture <1,0 %) Taille de l’échantillon Âge Sexe |
EI |
Niveau II-1 |
s.o. |
Jansen et al. (2008a)Note de bas de page 18 Données complétées par des précisions supplémentaires concernant les ESSI, tirées de Jansen et al (2008b)Note de bas de page 19 |
Méthodologie Saisons grippales Lieu Suivi Saisons 2005-2006 : 6 mois après la vaccination EI : 7 jours après la vaccination |
Vaccin antigrippal Autres vaccins non antigrippaux Dose et administration Les cohortes de 2003-2004 et de 2004-2005 ont reçu une vaccination supplémentaire l’année suivante Souches Préparation de 2004-2005 : Préparation de 2005-2006 : |
Définition de la population Groupes de l’étude VTI plus placebo VHB plus placebo (groupe témoin) Taille de l’échantillon Âge (moyen) Sexe Les groupes d’étude étaient similaires en ce qui concerne l’âge, le sexe et les antécédents médicaux. |
EI VTI plus placebo, proportion de sujets présentant un EI VHB plus placebo (groupe témoin), proportion de sujets présentant un EI Aucun EI immédiat n’a été consigné après la vaccination. Les EI locaux consignés pour le VTI en association avec le placebo étaient, par ordre décroissant de fréquence, la sensibilité, l’enflure, l’érythème et les difficultés de mouvement des membres. Aucune réaction grave n’a été notée dans l’un ou l’autre des groupes. |
Niveau I |
Passable Cas perdus au suivi : 14 à 20 % |
Petousis-Harris et al. (2012)Note de bas de page 20 |
Méthodologie Saisons grippales Lieu |
Vaccin antigrippal Autres VTI et un vaccin monovalent contre la grippe H1N1 Souches |
Définition de la population Taille de l’échantillon Âge (moyen) Sexe |
EI de nature fébrile FluvaxMD L’InfluvacMD comparativement au FluvaxMD, rapport de cotes (IC à 95 %) Remarques |
Niveau III |
s.o. |
Pillsbury et al. (2015)Note de bas de page 21 |
Méthodologie Saison grippale Lieu |
Vaccin antigrippal Autres VTI |
Définition de la population Taille de l’échantillon Âge (moyen) Sexe |
Des 47 participants ayant reçu InfluvacMD, 5 ont fait de la fièvre et 2 ont demandé une consultation ou un avis médical. L’un des participants ayant reçu InfluvacMD a présenté un EIG, dont la définition comprenait tout événement médical fâcheux entraînant un décès, menaçant le pronostic vital ou nécessitant une hospitalisation et dont l’amélioration a été observée dans les jours suivants (l’âge exact de l’enfant et la nature de l’EIG n’étaient pas indiqués). InfluvacMD a été administré chez un nombre insuffisant d’enfants âgés de 6 mois à 4 ans (n = 47) pour permettre d’établir une comparaison fiable entre les taux de fièvre signalés et ceux associés aux autres marques de vaccins. |
Niveau III |
s.o. |
Shahgholi et al. (2010)Note de bas de page 23 |
Méthodologie Lieu Suivi EI : 5 jours après la vaccination |
Vaccin antigrippal Dose et administration 36 mois à 13 ans : 2 doses (0,5 ml), 3 à 4 semaines d’intervalle > 13 ans : 1 dose (0,5 ml) Souches |
Définition de la population Taille de l’échantillon Âge (moyen) Sexe Aucune différence significative n’a été observée quant à la répartition selon le sexe et l’âge entre les deux groupes. |
EI Groupes témoins, proportion de participants ayant présenté un effet Les données complètes relatives à la réactogénicité étaient accessibles pour 56 % des participants. Aucun EIG n’a été signalé.
|
Niveau II-1 |
s.o. Les membres de la fratrie ont été inclus en tant que sujets témoins; cependant, les similitudes quant aux facteurs de confusion importants n’ont fait l’objet d’aucune évaluation. |
Wood et al. (2012)Note de bas de page 24 |
Méthodologie Saisons grippales Lieu |
Vaccin antigrippal Souches |
Définition de la population Taille de l’échantillon Âge (moyen) Sexe |
EI de nature fébrile FluvaxMD L’InfluvacMD comparativement au FluvaxMD, effet relatif (IC à 95 %) Aucune mention de convulsion fébrile pour tous les vaccins. Aucun participant vacciné par InfluvacMD n’a eu un épisode de fièvre ≥ 40 °C. |
Niveau III |
s.o. |
Zhu et al. (2008)Note de bas de page 25 |
Méthodologie Lieu Suivi EI : 29 jours après la vaccination |
Vaccin antigrippal Dose et administration Souches |
Bien que des EI aient été consignés pour les deux parties de l’étude, une étude ouverte sur l’innocuité des vaccins a été menée avant la tenue de l’ERC (voir ci-dessous pour obtenir des détails concernant l’étude ouverte sur l’innocuité et l’entrée dans l’Annexe G pour obtenir des détails sur l’ERC). Définition de la population Taille de l’échantillon Âge (moyen) Sexe |
EI Au cours de l’ERC, un enfant a eu des maux de tête et neuf enfants ont fait de la fièvre après avoir reçu le vaccin InfluvacMD. On a fait état de deux enfants ayant eu des maux de tête et de quatre enfants ayant fait de la fièvre après avoir été vaccinés par AgrippalMD. Deux enfants ayant reçu le vaccin InfluvacMD se sont sentis légèrement incommodés comparativement à un enfant ayant reçu le vaccin AgrippalMD. Aucune réaction systémique n’a été signalée au cours de l’étude d’innocuité. Des épisodes d’amygdalite aiguë (n = 1), d’étourdissements (n = 1) et de toux (n = 1) ont été signalés au cours de l’ERC chez des enfants vaccinés par InfluvacMD. Aucun EI n’a été signalé durant l’étude d’innocuité ou chez les enfants ayant reçu le vaccin AgrippalMD. Aucun EIG n’a été signalé au cours de l’étude d’innocuité et de l’ERC. |
Niveau I |
Passable Analyses effectuées selon le protocole. Il s’agissait d’une étude avec évaluation à l’insu des critères d’évaluation (et non d’une étude à double insu). |
