Mise à jour sur l’immunisation durant la grossesse avec le vaccin dcaT

Télécharger le format de rechange
(Format PDF, 417 Ko, 37 pages)
Organisation : Agence de la santé publique du Canada
Publiée : février 2018
Cat. : HP40-207-2018f-PDF
ISBN : 978-0-660-25134-9
Pub. : 170473
Sujets connexes
Une déclaration d'un comité consultatif (DCC)
Comité consultatif national de l'immunisation (CCNI)
Mise à jour sur l'immunisation durant la grossesse avec le vaccin combiné anti-Tétanos, et à dose réduite contre la diphtérie et la coqueluche acellulaire (dcaT)
Table des matières
- Sommaire de l'information contenue dans la présente déclaration du CCNI
- I. Introduction
- II. Méthodologie
- III. Épidémiologie
- IV. Vaccin
- V. Recommandations
- VI. Priorités en matière de recherche et d'évaluation
- VII. Données de surveillance et de suivi
- Tableaux
- Liste des abréviations
- Remerciements
- Références
Préambule
Le Comité consultatif national de l'immunisation (CCNI) donne à l'Agence de la santé publique du Canada (ASPC) des conseils continus et à jour liés à l'immunisation dans le domaine de la médecine, des sciences et de la santé publique. L'ASPC confirme que les conseils et les recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes, et diffuse ce document à des fins d'information. Les personnes qui administrent les vaccins doivent également connaître le contenu de la monographie de produit pertinente. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait homologuer leurs vaccins et ont démontré leur innocuité et leur efficacité lorsqu'ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, notamment en déclarant chaque année les conflits d'intérêts possibles.
Sommaire de l'information contenue dans la présente déclaration du CCNI
Voici résumée de l'information importante pour les vaccinateurs. Veuillez consulter le reste de la Déclaration pour plus de précisions.
- Quoi
La coqueluche causée par Bordetella pertussis est un agent pathogène associé à une maladie respiratoire endémique qui entraîne un risque d'hospitalisation et de décès très élevé chez les nourrissons non immunisés.
- Qui
La présente déclaration concerne l'immunisation des femmes enceintesNote de bas de page a au Canada avec le vaccin dcaT en vue de protéger leurs nouveau-nés des résultats graves d'une infection par la coqueluche.
- Comment
L'immunisation maternelle avec le vaccin dcaT devrait idéalement être effectuée pour chaque grossesse entre la 27e et 32e semaine. Cependant, une telle immunisation pourrait être réalisée dès la 13e semaine et jusqu'au moment de l'accouchement, selon les facteurs particuliers liés aux programmes et à la patiente.
- Pourquoi
En raison de leur forte vulnérabilité à l'infection, les nourrissons chez qui la vaccination n'a pas été commencée ou chez qui la série primaire de vaccins contre la coqueluche n'a pas été achevée, sont les plus à risque de complications dues à la coqueluche, y compris l'hospitalisation et le décès. L'immunisation de la mère pendant la grossesse est sécuritaire et assure la protection du nourrisson jusqu'à ce que ce dernier soit en mesure de recevoir le vaccin contre la coqueluche, à l'âge de deux mois.
En raison de l'activité cyclique changeante au Canada, il est préférable de recourir à l'immunisation systématique au moyen du vaccin dcaT durant la grossesse plutôt que comme mesure de lutte contre une éclosion uniquement. L'utilisation de ce vaccin pour contrer une éclosion pose des défis logistiques et est moins efficace pour prévenir la coqueluche chez les nourrissons, comparativement à l'immunisation systématique de la mère pendant la grossesse.
I Introduction
En 2013, après une multiplication par un facteur d'environ trois du nombre de cas de coqueluche signalés à l'échelle nationale, le Comité consultatif national de l'immunisation (CCNI) a formulé plusieurs recommandations relatives à l'immunisation des femmes enceintes au moyen d'un vaccin combiné anti-Tétanos, et à dose réduite contre la diphtérie et la coqueluche acellulaire (dcaT). À l'époque, d'après les données probantes examinées, le CCNI avait conclu que la vaccination par ce vaccin pendant la grossesse était sécuritaire et immunogène, et avait recommandé ce qui suit :
- Selon les données épidémiologiques régionales, le vaccin dcaT pourrait être offert lors d'éclosions de coqueluche (suivant la définition de l'endroit) aux femmes enceintes qui en sont au moins à leur 26e semaine de grossesse, quels que soient leurs antécédents de vaccination
- Les femmes enceintes qui n'ont pas été immunisées au moyen du vaccin dcaT à l'âge adulte devraient se voir offrir le vaccin contre la coqueluche.
Cependant, à la lumière du faible nombre de résultats graves observés chez les nouveau-nés au Canada et compte tenu de l'incertitude concernant les effets potentiellement indésirables des anticorps d'origine maternelle (induits par le vaccin) sur la réponse du nourrisson à l'immunisation au moyen du vaccin combiné contre la diphtérie, la coqueluche acellulaire et le tétanos (DCaT), la vaccination systématique par le vaccin dcaT durant la grossesse n'a pas été recommandée à ce moment-là. Étant donné la disponibilité des nouvelles données sur l'efficacité déclarées depuis la mise en œuvre de programmes de vaccination maternelle systématique à l'échelle internationale, le groupe de travail du CCNI sur la diphtérie, le tétanos, la coqueluche, la poliomyélite et l'Haemophilus influenzae de type B (GTC) a été une nouvelle fois chargé d'examiner les données probantes concernant l'utilisation du vaccin dcaT durant la grossesse. Conformément aux directives du Comité canadien sur l'immunisation, l'objectif de la présente déclaration du CCNI est de fournir des directives sur l'immunisation maternelle durant la grossesse en tant que stratégie visant à réduire l'incidence de la maladie et les résultats graves (définis comme étant une hospitalisation ou un décès) de l'infection par la coqueluche chez les nourrissons âgés de moins de 12 mois.
Les sujets précis qui ont été examinés par le GTC étaient notamment les suivants :
- le fardeau de la coqueluche chez les nourrissons âgés de moins de 12 mois;
- l'innocuité de l'immunisation maternelle au moyen du vaccin dcaT durant la grossesse;
- l'efficacité potentielle et réelle de l'immunisation maternelle par le vaccin dcaT durant la grossesse pour prévenir les résultats graves dus à une infection par la coqueluche chez les nourrissons de moins de 12 mois;
- les effets de l'immunisation maternelle par le vaccin dcaT durant la grossesse sur la réponse immunologique d'un nourrisson au calendrier de vaccination primaire;
- les répercussions de l'immunisation maternelle par le vaccin dcaT durant la grossesse sur la protection à long terme contre le tétanos, la diphtérie et la coqueluche chez les enfants.
II Méthodologie
Le GTC a élaboré les questions de recherche suivantes, après avoir examiné les données probantes sur le fardeau de la maladie au Canada, l'innocuité et l'immunogénicité du vaccin, et l'efficacité du vaccin dans les territoires de compétence qui ont mis en œuvre des programmes d'immunisation maternelle :
- Existe-t-il une différence significative quant aux effets indésirables (EI) locaux ou généraux pour la mère après une immunisation par le vaccin dcaT durant la grossesse (tous les stades), comparativement à la vaccination des adultes en dehors de la grossesse?
- Existe-t-il une différence significative quant aux résultats fœtaux et néonataux indésirables en matière de santé pour le bébé après l'immunisation de sa mère au moyen du vaccin dcaT pendant la grossesse?
- L'immunisation maternelle durant la grossesse au moyen du vaccin dcaT présente-t-elle une efficacité potentielle ou réelle significativement accrue pour la prévention de maladies graves chez les nourrissons de moins de 12 mois, comparativement à l'absence d'immunisation maternelle durant la grossesse?
- L'immunogénicité du vaccin DCaT chez les enfants nés d'une mère immunisée par le vaccin dcaT durant la grossesse est-elle significativement différente, comparativement aux nourrissons nés d'une mère n'ayant pas été immunisée par le vaccin dcaT durant la grossesse?
- L'immunisation maternelle par le vaccin dcaT durant la grossesse a-t-elle une incidence considérable sur l'efficacité potentielle ou réelle des vaccins DCaT dans la prévention de maladies apparentées chez les enfants âgés de moins de quatre à six ans?
Outre l'examen de données non publiées, y compris les pratiques internationales actuelles, une recherche et une revue documentaire d'articles publiés jusqu'au 28 novembre 2016 ont été menées, et des mises à jour ont été effectuées le 25 juillet 2017. Au total, 59 articles ont été cernés, récupérés et inclus dans la revue pour éclairer la présente déclaration. Les membres du CCNI et du GTC ont également examiné les données d'immunogénicité et d'innocuité d'un essai clinique canadien non publié (NCT00553228), lesquelles se sont avérées conformes aux résultats d'autres essais randomisés contrôlés (ERC) publiés. Une analyse détaillée des études pertinentes est présentée dans le fichier du CCNI Revue documentaire sur l'immunisation durant la grossesse avec le vaccin combiné anti-Tétanos, et à dose réduite contre la diphtérie et la coqueluche acellulaire (dcaT) : Innocuité, immunogénicité et efficacité.
Une analyse épidémiologique a été menée au moyen des données de surveillance nationale, y compris le Système de surveillance des maladies à déclaration obligatoire du Canada (SSMDOC), le Programme canadien de surveillance active de l'immunisation (IMPACT) et la base de données sur les congés des patients (BDCP) de l'Institut canadien d'information sur la santé. Ces données sont soumises à certaines limites : changements dans les pratiques de déclaration au fil du temps, nombre d'établissements participants, changements dans les méthodes de détection de cas de coqueluche utilisées par les laboratoiresReference 1Reference 2Reference 3.
En général, en raison des limitations des systèmes de surveillance existants, les données de surveillance ont tendance à sous-estimer le nombre véritable de cas de coqueluche.
La synthèse des connaissances a été effectuée par deux conseillers techniques de l'ASPC, et supervisée par le GTC. Après l'évaluation critique de chacune des études, ont été préparés des tableaux sommaires comprenant des cotes de qualité des données fondées sur la hiérarchie méthodologique du CCNI, et ont été élaborées des propositions de recommandations relatives à l'utilisation des vaccins. Ces tableaux de données se trouvent dans le fichier du CCNI : Revue documentaire sur l'immunisation durant la grossesse avec le vaccin combiné anti-Tétanos, et à dose réduite contre la diphtérie et la coqueluche acellulaire (dcaT) : Innocuité, immunogénicité et efficacité.
Le président du GTC a présenté les données et les recommandations proposées au cours de la réunion du CCNI du 7 juin 2017. Après la tenue de consultations et l'examen exhaustif des données, le CCNI s'est prononcé sur des recommandations précises le 27 septembre 2017. On trouvera ci-dessous une description des considérations pertinentes, des justifications des décisions et des lacunes dans les connaissances.
III Épidémiologie
Au Canada, la coqueluche est une maladie endémique et cyclique. Les flambées de coqueluche surviennent à des intervalles de deux à cinq ans, l'activité de chaque cycle variant selon la régionReference 4Reference 5. Depuis l'introduction, en 1997-1998, de l'administration systématique du vaccin anticoquelucheux acellulaire, on a observé une diminution globale du taux d'incidence de cette maladie jusqu'en 2011Reference 4. Entre 2012 et 2015, une augmentation des taux d'incidence annuels a été constatée, variant de 3,6 à 13,4 cas pour 100 000 personnesReference 6. Une augmentation en flèche des taux d'incidence en 2012 et 2015 était associée à de nombreuses éclosions dans l'ensemble du CanadaReference 4Reference 7Reference 8Reference 9Reference 10.
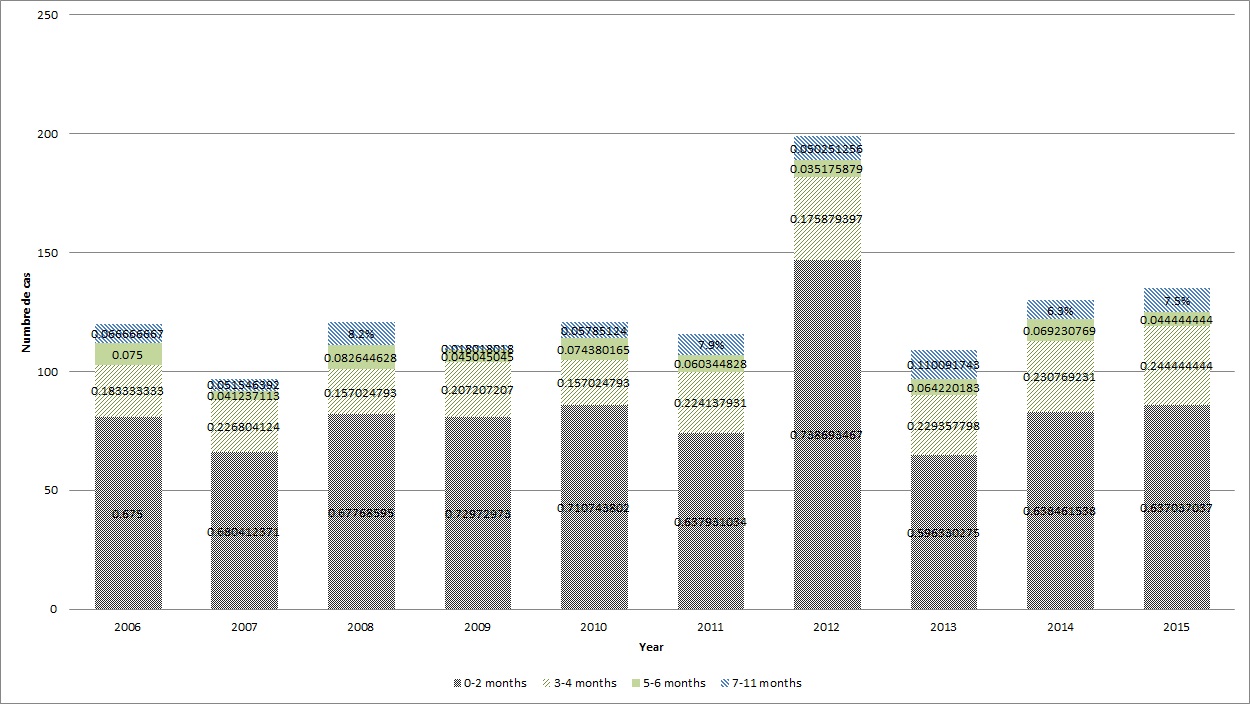
Figure 1 - Équivalent textuel
| Année | Âge en mois | |||
|---|---|---|---|---|
| 0-2 mois | 3-4 mois | 5-6 mois | 7-11 mois | |
| 2006 | 81 | 22 | 9 | 8 |
| 2007 | 66 | 22 | 4 | 5 |
| 2008 | 82 | 19 | 10 | 10 |
| 2009 | 81 | 23 | 5 | 2 |
| 2010 | 86 | 19 | 9 | 7 |
| 2011 | 74 | 26 | 7 | 9 |
| 2012 | 147 | 35 | 7 | 10 |
| 2013 | 65 | 25 | 7 | 12 |
| 2014 | 83 | 30 | 9 | 8 |
| 2015 | 86 | 33 | 6 | 10 |
| Toutes les années | 851 | 254 | 73 | 81 |
*Ces données ont été tirées du Système de surveillance des maladies à déclaration obligatoire du Canada (SSMDOC).
†Les données de cas ont été tirées du SSMDOC. Les administrations suivantes disposaient de données axées sur les cas : CB, AB, SK, ON, QC, IPÉ (2010-2015), YK et NU. Celles-ci ne disposaient pas de données pour 2006-2009 : MB, TNL, NB, NÉ, IPÉ et NT.
L'incidence de la coqueluche varie selon le groupe d'âge, les nourrissons chez qui la vaccination n'a pas été entamée ou achevée étant exposés au risque le plus élevé d'infection et de complications connexesReference 4Reference 5Reference 6Reference 10Reference 11Reference 12. De 2006 à 2015, les taux d'incidence moyens propres à l'âge déclarés par l'intermédiaire du SSMDOC étaient les plus élevés chez les nourrissons de moins d'un an, s'élevant à 71,2 cas pour 100 000 personnes, suivis des enfants dont l'âge était compris entre 1 et 9 ans (43,0 cas pour 100 000 personnes) et des enfants âgés de 10 à 19 ans (26,1 cas pour 100 000 personnes). Comme l'indique la Figure 1, la majorité des cas de coqueluche déclarés entre 2006 et 2015 concernent des nourrissons âgés de moins de deux mois (variant de 60 à 74 %), suivis de nourrissons âgés de trois à quatre mois (variant de 16 à 24 %). Une forte augmentation du nombre de cas a été remarquée en 2012 chez les nourrissons âgés de moins de deux mois.
Les données d'hospitalisation liée à la coqueluche tirées de la BDCP, fondées sur un diagnostic primaire, démontrent que ce sont chez les nourrissons de moins d'un an que l'on trouve la proportion de loin la plus élevée d'hospitalisations et d'admissions en unité de soins spéciaux (USS)Reference 4Reference 5Reference 12. En effet, de 2006 à 2015, les taux d'hospitalisation liée à la coqueluche étaient de 33,6 pour 100 000 habitants chez les nourrissons âgés de moins d'un an, et de moins de 1 pour 100 000 habitants dans d'autres groupes d'âge. Comme l'indique la Figure 2, la majorité des nourrissons hospitalisés étaient âgés de moins de deux mois (variant de 63 à 74 %), suivis des nourrissons de trois à quatre mois (variant de 16 à 29 %). Dans l'ensemble, la majorité des admissions en USS tirées de la BDCP concernait des nourrissons de moins d'un an (320/384). Entre 2006 et 2016, les nourrissons âgés de moins de deux mois représentaient la proportion la plus élevée d'admissions en USS (40,5 %), suivis des nourrissons âgés de trois à quatre mois (21,4 %). À l'instar de la tendance de l'incidence de la coqueluche, une forte augmentation du nombre d'hospitalisations chez les nourrissons âgés de moins de deux mois a été déclarée en 2012.
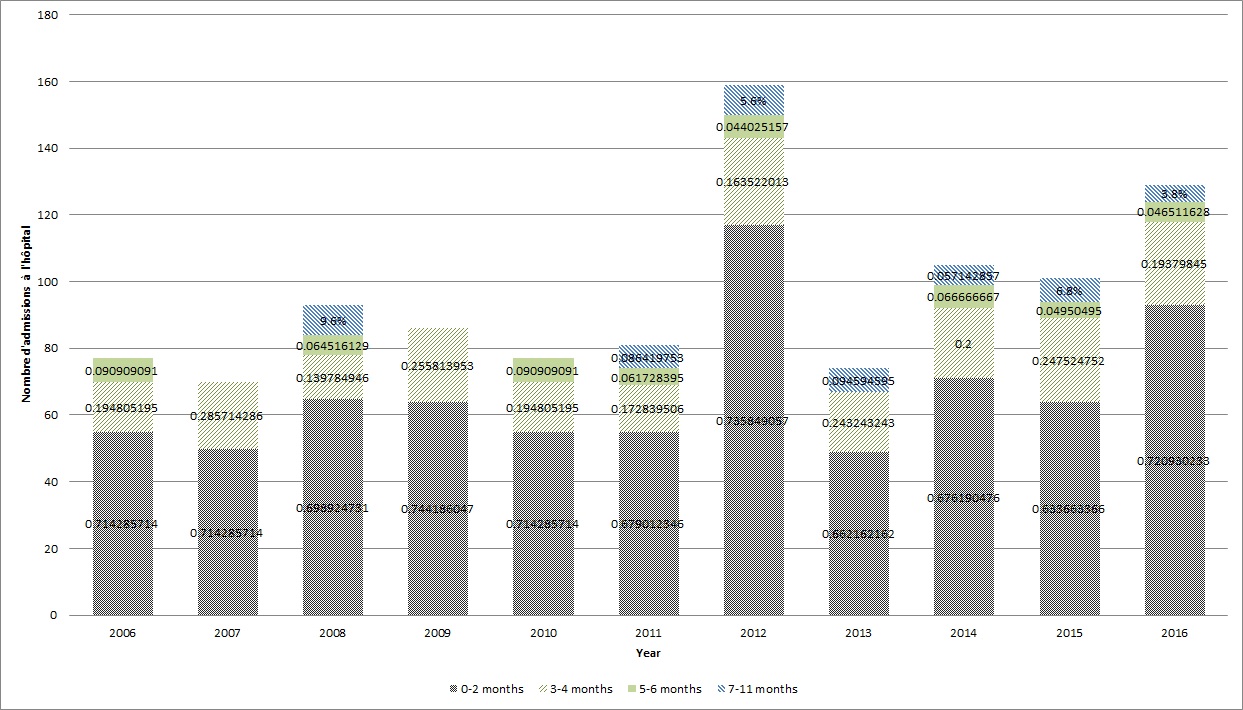
Figure 2 - Équivalent textuel
| Année | Âge en mois | |||
|---|---|---|---|---|
| 0-2 mois | 3-4 mois | 5-6 mois | 7-11 mois | |
| 2006 | 55 | 15 | 7 | <5 |
| 2007 | 50 | 20 | <5 | <5 |
| 2008 | 65 | 13 | 6 | 9 |
| 2009 | 64 | 22 | <5 | 0 |
| 2010 | 55 | 15 | 7 | <5 |
| 2011 | 55 | 14 | 5 | 7 |
| 2012 | 117 | 26 | 7 | 9 |
| 2013 | 49 | 18 | <5 | 7 |
| 2014 | 71 | 21 | 7 | 6 |
| 2015 | 64 | 25 | 5 | 7 |
| 2016 | 93 | 25 | 6 | 5 |
| Toutes les années | 738 | 214 | 50 | 50 |
*Les comptages annuels d'hospitalisations inférieurs à cinq selon la catégorie de l'âge ont été supprimés de la Figure pour raison de confidentialité.
‡ Les données d'hospitalisation ont été tirées de la base de données sur les congés des patients de l'Institut canadien d'information sur la santé. Il n'a pas été possible d'obtenir les données d'hospitalisation pour le Québec, de 2011 à 2015.
On présume que l'absence d'immunité maternelle accroît la vulnérabilité du nourrisson à l'infection en augmentant le risque de maladie chez la mère (et la transmission ultérieure au nourrisson) et en ne fournissant pas une protection passive suffisante par l'intermédiaire du transfert d'anticorps (par la transmission transplacentaire ou par le lait maternel). Une récente enquête sérologique sur les cohortes a révélé que la plupart des femmes enceintes au Canada avaient des niveaux d'anatoxine coquelucheuse non détectablesReference 13Reference 14. Bien qu'aucune corrélation sérologique pour la protection clinique contre la coqueluche n'existe à l'heure actuelle, cela indique probablement que : i) une proportion élevée de femmes enceintes au Canada sont réceptives à la coqueluche; ii) les mères ne seraient pas capables de transmettre de façon passive des anticorps associés à la coqueluche à leurs nouveau-nés, ce qui rend ces derniers vulnérables jusqu'à ce qu'ils commencent à recevoir une protection par l'intermédiaire de la vaccination à l'âge de deux moisReference 13Reference 14Reference 15Reference 16Reference 17Reference 18Reference 19. Les parents (principalement les mères) ainsi que les frères et sœurs sont considérés comme étant la plus importante source de transmission de la coqueluche aux nourrissonsReference 20Reference 21Reference 22Reference 23Reference 24Reference 25Reference 26Reference 27Reference 28Reference 29Reference 30Reference 31Reference 32Reference 33.
Selon l'enquête nationale sur la vaccination des adultesReference 34 (tous les adultes de 18 ans et plus), seuls 9,3 % (IC à 95 %, 8,1 à 10,5) ont déclaré avoir reçu au moins une dose de vaccin acellulaire à composant anticoquelucheux depuis leur 18 eanniversaire. Compte tenu de l'absence de données sur la couverture du vaccin dcaT pendant la grossesse faute de programmes de vaccination systématique des mères au Canada, le GTC a examiné les renseignements sur l'immunisation contre la grippe durant la grossesse. Une étude de cohorteReference 35 qui évaluait la vaccination antigrippale durant la grossesse de 1990 à 2002 en Nouvelle-Écosse a estimé que 2,6 % de toutes les femmes enceintes et 6,7 % des femmes enceintes présentant des comorbidités ont été vaccinées. Une étude de cohorte rétrospective et représentative de la population en Ontario, de 2009 à 2010, a estimé que 42,6 % des femmes avaient été vaccinées contre la grippe durant la grossesse et pendant la saison de pandémie de grippe H1N1. Au Canada, l'âge moyen des femmes devenues mères pour la première fois est de 30 ans, environ 380 000 naissances vivantes étant déclarées chaque année depuis 2010Reference 36Reference 37.
Une enquête récemment menée à l'interne sur les pratiques provinciales/territoriales d'immunisation (non publiées) indique que la mise en œuvre de programmes d'immunisation maternelle par le vaccin dcaT selon les recommandations du CCNI de 2014 ne s'est faite que de manière sporadique, en fonction de l'intensité et du stade de l'éclosion. Les défis logistiques liés à l'administration de vaccins en temps opportun ont été cités comme un obstacle majeur au succès de la mise en œuvre du programme.
On trouvera de plus amples informations concernant l'épidémiologie globale de la coqueluche et la couverture vaccinale au moyen du dcaT au Canada sur le site Web du gouvernement canadien portant sur l'immunisation et les vaccins.
L'analyse du contexte des pratiques internationales a déterminé plusieurs pays qui offrent des programmes d'immunisation maternelle par le vaccin dcaT durant la grossesse. Dans la plupart, ces programmes ont été mis en œuvre dans le cadre d'une stratégie de gestion des éclosions, avec pour objectif de réduire une augmentation des taux d'incidence de la maladie et des décès dans le groupe d'âge de moins d'un an. Depuis lors, dans bon nombre de ces pays (y compris les États-Unis, le Royaume-Uni, l'Irlande, l'Espagne, la Belgique, la Suisse, la Grèce, l'Argentine, le Brésil, la Colombie, le Mexique et Israël), une immunisation maternelle permanente par le vaccin dcaT durant la grossesse a été intégrée aux programmes d'immunisation systématique des adultes. Bien que l'analyse du contexte n'ait pas déterminé de rapports d'évaluation des programmes, une mise à jour détaillée sur le programme d'immunisation maternelle du Royaume-Uni (fournie par Public Health England, l'agence britannique de santé publique) a semblé indiquer une efficacité de 90 % du programme national en ce qui a trait à la prévention de la maladie confirmée en laboratoire (95 % quant à la prévention du décès) chez les nourrissons de moins de deux moisReference 38Reference 39Reference 40Reference 41.
IV Vaccin
IV.1 Préparations du vaccin pour adultes contre la coqueluche homologué au Canada
| Ingrédients de vaccin | AdacelMD, SanofiReference 42 | BoostrixMD, GSKReference 43 |
|---|---|---|
| Anatoxine coquelucheuse (PT, µg) | 2,5 | 8 |
| Hémagglutinine filamenteuse coquelucheuse (FHA, µg) | 5 | 8 |
| Pertactine coquelucheuse (PRN, µg) | 3 | 2,5 |
Fimbriae coquelucheuses |
5 | - |
| Antigène diphtérique (Lf, µg) | 2 | 2,5 |
| Antigène tétanique (Lf, µg) | 5 | 5 |
| Adjuvant à base d'aluminium (mg) | 1,5 | 0,5 |
| Autres ingrédients | 2-phénoxy-éthanol, eau | Chlorure de sodium, eau |
| Infime quantité | formaldéhyde, glutaraldéhyde | |
Notes de bas de page du Tableau 1
|
||
D'après les données sur les essais disponibles au moment de l'homologation, aucune des préparations pour les adultes n'a été indiquée explicitement durant la grossesse. Cependant, selon les monographies de produits actuelles, aucune des préparations pour les adultes homologuées au Canada n'est contre-indiquée durant la grossesse.
IV.2 Immunogénicité
Pendant la grossesse, les anticorps IgG de la mère sont activement transportés à travers le placenta dans la circulation fœtale, le transport s'accélérant au moyen du récepteur néonatal Fc au cours du troisième trimestre. Des titres d'anticorps contre différents antigènes coquelucheux après l'immunisation maternelle ont été signalés pour les femmes enceintes et leur nourrisson avant et après l'administration de vaccins DCaT chez les nourrissons. Lorsque l'on interprète les résultats de ces études, il convient de noter qu'une corrélation définie de protection contre l'infection par la coqueluche reste à déterminer.
IV.2.1 Immunogénicité chez la mère durant la grossesse
La revue de la littérature menée par le CCNI a permis de déterminer 14 études d'immunogénicité pertinentes, dont quatre étaient des ERC. Dans tous ces ERC, la réponse immunitaire était mesurée après l'administration du vaccin dcaT au troisième trimestre de la grossesse. Comparativement au placebo (0,9 % de solution saline ou d'anatoxine tétanique [TT]), dans toutes les études, l'immunisation augmentait les titres d'anticorps anti-PT chez la mère d'un facteur d'au moins 4, tandis que les autres antigènes contenus dans le vaccin augmentaient d'un facteur supérieur à 10Reference 44Reference 45Reference 46. Dans les ERC qui comparaient les réactions immunitaires entre les femmes recevant le vaccin dcaT pendant la grossesse et en dehors de celle-ci, il n'existait pas de différences importantes entre les titres d'anticorps. Dans ces études, bien qu'une inhibition de l'immunité à médiation cellulaire chez les femmes enceintes ait été remarquée, aucune différence dans la réponse cellulaire un an après l'immunisation n'a été observée.
D'autres études cliniques et d'observation, qui évaluaient les réponses immunitaires à l'administration du vaccin dcaT au cours de la grossesse, ont fait état de résultats qui étaient conformes à ceux signalés dans les ERCReference 44Reference 45Reference 46. Dans la plupart des études évaluées, l'augmentation après la vaccination des titres d'anticorps donnait lieu, chez plus de 90 % des femmes, à des titres d'anticorps anti-PT ≥ 10 UI/mL un mois après la vaccinationReference 47Reference 48Reference 49. Dans les études évaluées qui se penchaient sur la persistance des anticorps après l'immunisation durant la grossesse, une diminution importante était observée pour tous les titres d'anticorps contre la coqueluche, les concentrations d'anticorps anti-PT diminuant de moitié un an après l'immunisationReference 50Reference 51. Les études qui mesuraient les concentrations d'anticorps dans le lait colostral et le lait maternel après l'immunisation de la mère durant la grossesse ont révélé seulement une légère augmentation des titres d'anticorps anti-IgA et anti-IgG (anti-PT et anti-FHA), comparativement aux femmes qui n'étaient pas immunisées pendant la grossesseReference 52Reference 53. Cependant, les titres d'anticorps dans ces études demeuraient détectables jusqu'à au moins huit semaines après l'accouchement, ce qui laisse entendre que les nourrissons allaités pourraient en outre bénéficier de la protection offerte par les anticorps contenus dans le lait maternel.
IV.2.2 Titres d'anticorps d'origine maternelle chez les nourrissons avant leur inoculation au moyen du vaccin DCaT
Vingt-et-une études pertinentes ont été relevées dans la recherche documentaire, dont quatre étaient des ERC qui déclaraient les résultats sur les titres d'anticorps maternels chez les nourrissons nés à terme. Toutes les études fournissaient les preuves d'un transfert transplacentaire efficace de tous les anticorps contenus dans le vaccin au fœtus avant l'accouchement.
Bien qu'un déclin rapide des anticorps maternels dans les deux mois suivant la naissance ait été mis en évidence dans tous les essais, les nourrissons nés de mères ayant reçu le vaccin dcaT avaient des titres d'anticorps qui demeuraient beaucoup plus élevés comparativement à ceux observés dans les groupes témoinsReference 44Reference 45Reference 46Reference 54. Ces conclusions ont aussi été confirmées dans toutes les études d'observation évaluéesReference 41Reference 55Reference 56Reference 57Reference 58Reference 59. En outre, des études sérologiques de moindre envergure publiées à ce jour laissent entendre que l'immunisation maternelle durant la grossesse ne semble pas avoir une incidence sur le transfert sélectif d'anticorps de forte avidité et ayant des fonctions précises qui peuvent stimuler de manière efficace des réactions immunitaires innées chez le nourrisson (c.-à-d. activité phagocytaire des cellules NKReference 60Reference 61Reference 62). Une étude a également fait état d'une efficacité accrue du transfert transplacentaire des anticorps chez les mères qui étaient immunisées avec le vaccin dcaT, comparativement à celles qui n'avaient pas reçu le vaccin pendant la grossesseReference 63. À l'exception d'une étude d'observation restreinte, on a constaté que l'immunisation maternelle par le vaccin dcaT durant la grossesse était plus immunogène lorsqu'elle était assurée plus tôt, mais après 13 semaines de grossesseReference 64. Comparativement à 31 à 36 semaines de grossesse, on a observé que l'immunisation pratiquée entre la 27e et 30e semaine de grossesse donnait lieu à des rapports anticorps maternels-cordon ombilical et à un indice d'avidité relative des anticorps anti-PT plus élevés, la maturation d'avidité des anticorps anti-PT dans le cordon ombilical augmentant de manière linéaire avec le temps, jusqu'à l'accouchementReference 65.
Des taux plus élevés d'anticorps dans le cordon ombilical (anti-PRN et anti-PT) ont également été signalés lorsque les mères ont reçu le vaccin dcaT entre la 28e et la 32e semaine de grossesse, comparativement à entre la 33e et la 36e semaine de grossesse; et entre la 13e et la 25e semaine de grossesse, comparativement à entre la 26e et la 36e semaine de grossesseReference 66Reference 67. Deux études qui mesuraient les concentrations d'anticorps anti-PT à la naissance, après une immunisation maternelle à moins de 26 semaines de grossesse, ont révélé des titres d'anticorps supérieurs à 10 unités d'endotoxine (UE)/mL présents chez plus de 90 % des nourrissonsReference 49Reference 67.
Dans les études qui mesuraient les titres d'anticorps contre la coqueluche chez les nourrissons prématurés, l'immunisation au cours du deuxième trimestre donnait lieu à des concentrations plus élevées, ainsi qu'à une proportion plus élevée de nourrissons dont les titres d'anticorps anti-PT sont supérieurs à 5 UE/mL, comparativement à ceux dont les mères étaient immunisées au cours du troisième trimestreReference 68Reference 69. Dans une étude qui évaluait les effets du poids corporel de la mère enceinte sur les titres d'anticorps néonataux, aucune différence significative sur le plan statistique des concentrations d'anticorps n'a été constatée entre les nourrissons nés d'une mère de poids (indice de masse corporelle [IMC]) normal, en surpoids ou obèseReference 70.
IV.2.3 Immunogénicité du vaccin DCaT chez les nourrissons nés d'une mère immunisée avec le vaccin dcaT durant la grossesse
Cinq ERC ont mesuré les réactions immunologiques chez les nourrissons à la suite de l'administration du vaccin DCaT. Dans tous les essais, les titres d'anticorps contre tous les antigènes coquelucheux étaient plus faibles chez les nourrissons dont la mère avait reçu le vaccin dcaT au cours du troisième trimestre de grossesse que chez ceux du groupe témoin. Ces différences ont été observées après la 2e ou 3e dose du vaccin DCaT, les concentrations d'anticorps se recoupant entre l'âge de 4 et 6 moisReference 41Reference 47Reference 55Reference 56Reference 62Reference 68. Dans la plupart des études d'observation et des ERC évalués, les différences significatives sur le plan statistique des titres d'anticorps et de l'avidité disparaissaient avec l'administration de la dose de rappel (quatrième) du vaccin DCaT après l'âge de 15 moisReference 41Reference 47Reference 55Reference 56Reference 62Reference 68.
Les répercussions de l'immunisation maternelle par le vaccin dcaT durant la grossesse sur la réponse du nourrisson à d'autres antigènes contenus dans le vaccin ont été mesurées dans quatre étudesReference 41Reference 45Reference 56Reference 71. Bien qu'une meilleure réponse immunologique au vaccin contre le tétanos et aux vaccins conjugués contre le tétanos et une diminution de la réponse immunologique au vaccin contre la diphtérie et aux vaccins conjugués à la protéine CRM (p. ex., vaccins contre le méningocoque, contre le pneumocoque) aient été observées par plusieurs groupes de recherche, les répercussions cliniques de ces constatations n'ont pas été évaluées dans la documentation examinée. Compte tenu de l'absence de données à long terme, on ignore encore la pertinence de ces constatations à l'égard des programmes d'immunisation existantsReference 71Reference 72.
IV.3 Efficacité de l'immunisation maternelle par le vaccin dcaT durant la grossesse pour prévenir la coqueluche chez les nourrissons
Toutes les études dans lesquelles l'efficacité de l'immunisation maternelle durant la grossesse a été estimée ont systématiquement révélé une protection plus élevée contre la coqueluche chez les nourrissons âgés de moins de trois mois. La plupart des études repérées au moyen de la revue de la littérature provenaient du Royaume-Uni où un programme national d'immunisation maternelle est en place depuis octobre 2012Reference 38Reference 39Reference 40. Chez les nourrissons âgés de moins de deux mois, on a estimé que l'efficacité du vaccin était supérieure à 90 %, aucun décès n'ayant été observé chez les nourrissons dont la mère recevait le vaccin dcaT avant la 36e semaine de grossesse. On a également signalé que l'efficacité du vaccin perdurait après l'administration des trois premières doses du vaccin DCaT, l'immunisation durant la grossesse donnant lieu à un degré de protection supplémentaire pouvant atteindre 70 % chez les enfants dont la mère recevait le vaccin dcaT pendant la grossesse. Des résultats similaires ont par la suite été signalés dans des études menées aux États-Unis d'Amérique et en EspagneReference 73Reference 74Reference 75. Dans une étude américaine qui évaluait l'efficacité de l'immunisation maternelle relativement aux résultats de l'hospitalisation, les nourrissons dont la mère était immunisée avec le vaccin dcaT étaient plus susceptibles de subir des effets moins graves de la maladie et d'être plus âgés lorsqu'ils étaient atteints de la coqueluche, et ils étaient moins susceptibles de présenter les symptômes classiques de la coqueluche (c.-à-d. toux paroxystique, apnée, cyanose)Reference 73. Dans une autre étude américaine, un risque significativement moins élevé d'hospitalisation et d'admission à l'unité de soins intensifs a également été observé chez les nourrissons dont la mère recevait le vaccin dcaTReference 74. Dans la seule étude qui utilisait les données de surveillance pour estimer l'efficacité du programme d'immunisation maternelle par le vaccin dcaT, menée en Argentine, une incidence significativement moins élevée a été observée chez les nourrissons dans certaines régions du pays où la couverture vaccinale des mères était supérieure à 50 %, comparativement aux régions où la couverture était moindreReference 76Reference 77.
IV.4 Effets indésirables
Au total, 16 études ont abordé les EI locaux et généraux chez les mères après l'administration du vaccin dcaT durant la grossesse; et 24 études comportaient des données sur les complications liées à la grossesse ou les EI fœtaux, néonataux ou chez le nourrisson. En outre, le GTC a été informé des données du Vaccine Adverse Event Reporting System (VAERS) (États-Unis) qui ont été présentées à l'Advisory Committee on Immunization Practices (ACIP) au cours de sa réunion en juin 2016. En tout, dix années de données du VAERS signalées de manière passive et huit années de données longitudinales du Vaccine Safety Datalink (VSD) signalées de manière active ont été déclarées dans les publications évaluées par des pairs.
IV.4.1 Effets indésirables locaux et généraux chez la mère
Dans quatre ERC qui abordaient l'innocuité du vaccin dcaT durant la grossesse, aucune différence dans la déclaration d'un point d'injection ou de réactions générales n'a été observée indépendamment du vaccin utilisé dans le groupe témoin (placebo ou anatoxine tétanique)(44-46). Ces essais n'ont pas non plus révélé d'effets indésirables graves (EIG) liés à la vaccination. Cela concordait avec les constatations des études qui décrivaient les résultats de la vaccination après la mise en œuvre de programmes nationaux d'immunisation maternelle par le vaccin dcaT. Les EI les plus courants signalés par le système VAERS (système de surveillance passive) entre novembre 2011 et juin 2016 comprenaient des effets locaux (c.-à-d. réactions au point d'injection ou myalgie aux extrémités) et généraux (fièvre, frissons et maux de tête) associés à l'immunisation par le vaccin dcaTReference 78Reference 79Reference 80. Une analyse des données du système VSD (système de surveillance active) a donné lieu à des résultats semblables, et aucun risque accru n'a été cerné sur le plan des événements neurologiques, du diabète gestationnel, de la thrombocytopénie, de la thromboembolie veineuse ou des incidents cardiaques (myocardite, péricardite, myocardiopathie, insuffisance cardiaque)Reference 81Reference 82. Également, aucune différence n'a été constatée dans les cas de fièvre, de réactions allergiques ou de réactions locales entre les femmes qui recevaient le vaccin dcaT moins de deux ans après leur dernière dose d'un vaccin contenant le tétanos et celles qui le recevaient cinq ans après. En Argentine, aucun effet grave ou à issue mortelle n'a été signalé pendant les deux années de mise en œuvre du programme national d'immunisation maternelleReference 76.
Dans les études d'observation publiées, les résultats variaient selon le lieu, la méthodologie et la taille de l'étude. Dans une étude menée en Australie, des réactions locales étaient plus souvent signalées chez les femmes enceintes recevant le vaccin dcaT seul, comparativement au vaccin antigrippal seul ou administré avec le vaccin dcaTReference 83. Une étude semblable réalisée en Nouvelle-Zélande qui a évalué les résultats de l'administration du vaccin dcaT avec ou sans le vaccin antigrippal a révélé des taux élevés de douleur au point d'injection (80 %)Reference 84. Aucune de ces études n'a relevé d'EIG causés par le vaccin dcaT. Des résultats similaires ont été signalés dans une étude menée en Belgique où une raideur du bras, au point d'injection, a été déclarée par 74 % des participants de l'étude, mais on n'a pas observé d'association entre les EIG et la vaccinationReference 55. Une étude menée aux États-Unis, qui comparait l'immunisation par le vaccin dcaT pendant la grossesse et en dehors de celle-ci, a révélé que les taux de douleur et de malaise modérés à graves au point d'injection étaient plus élevés pendant la grossesse, tandis que les taux de fièvre, de maux de tête, d'enflure et de rougeur au point d'injection étaient similaires entre les deux groupes d'étudeReference 85.
IV.4.2 Effets indésirables liés à la grossesse
Dans une analyse des données du système VAERS (système de surveillance passive), moins de 15 cas (chacun) de fausse couche, d'accouchement prématuré à moins de 37 semaines de grossesse, de mortinaissance, de chorioamnionite et d'oligohydramnios ont été signalés entre 2005 et 2016Reference 78Reference 79Reference 80Reference 86. Environ la moitié des soumissions de cas dans ce système étaient effectuées par les deux fabricants du vaccin dcaT qui recueillaient ces renseignements par l'intermédiaire des registres des grossesses propres à leur produitReference 87. Une analyse des données du système VSD (système de surveillance active) fournissait des constatations similaires, à l'exception de la chorioamnionite pour laquelle un risque relatif faible, mais significatif sur le plan statistique (rapport de taux ajusté : 1,23 [IC à 95 % : 1,17 à 1,28]) a été signaléReference 82Reference 88Reference 89Reference 90. Cependant, une analyse ultérieure de ces données n'a pas révélé de risques accrus concernant les résultats cliniques chez les nourrissons considérés comme associés à la chorioamnionite. En outre, aucun lien n'a été constaté entre les issues défavorables à la naissance et l'âge gestationnel au moment du vaccin dcaT ou au moment antérieur au vaccin antitétaniqueReference 82Reference 89. Une faible hausse du risque de chorioamnionite (risque relatif de 1,11 [IC à 95 % : 1,07 à 1,15]) et d'hémorragie post-partum (risque relatif de 1,23 [IC à 95 % : 1,18 à 1,28]) a aussi été signalée après une analyse des données de réclamations de compagnies d'assurance commerciales concernant plus de 207 000 femmes parmi lesquelles environ 150 000 ont reçu le vaccin dcaT pendant la grossesseReference 91.
Au Royaume-Uni, une analyse des données du système CPRD (système de surveillance active) au cours des six premiers mois de la mise en œuvre du programme national a révélé que les taux de mortinaissance chez les femmes immunisées avec le vaccin dcaT pendant la grossesse étaient similaires au taux national de mortinaissance estiméReference 92. Pendant ce temps, aucun cas de décollement placentaire ou de vasa praevia n'a été signalé après la vaccination et aucune différence significative dans la durée de l'accouchement et le poids médian à la naissance n'a été déclarée entre les femmes ayant reçu le vaccin et celles ne l'ayant pas reçu. Dans les ERC, aucune différence quant à la fréquence de résultats indésirables chez les femmes recevant le vaccin dcaT pendant la grossesse et chez celles recevant le placebo (0,9 % de solution saline ou TT) n'a été signaléeReference 44Reference 45Reference 46. De même, les résultats des grossesses recueillis dans les données de dossiers médicaux électroniques qui ont été évaluées dans des études d'observation n'ont pas révélé de fréquences plus élevées des taux de chorioamnionite ou de mortinaissance chez les nourrissons dont les mères recevaient une ou plusieurs doses du vaccin dcaT durant la grossesseReference 47Reference 55Reference 93Reference 94Reference 95Reference 96Reference 97. Dans des études de cohorte qui évaluaient les résultats des grossesses et pour le nourrisson sans groupe de comparaison, aucun des EIG durant la grossesse n'a été causé par le vaccin dcaTReference 84Reference 98Reference 99.
Le GTC a aussi obtenu une analyse des données sur l'innocuité tirées du Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI). Entre 2007 et 2016, seuls huit effets ont été déclarés relativement à la grossesse après une immunisation avec le vaccin AdacelMD (quatre déclarations) ou le vaccin BoostrixMD (quatre déclarations) administré seul ou en concomitance avec le vaccin antigrippal trivalent inactivé (VTI) (deux déclarations), tous jugés bénignes ou non liés à l'immunisation. Ces effets étaient notamment une réaction au point de vaccination (trois cas), une éruption cutanée localisée ou généralisée (trois cas) et des symptômes gastro-intestinaux (deux cas). Parmi ceux-ci, quatre déclarations comprenaient des résultats indésirables chez la mère (deux patientes totalement rétablies et deux patientes pas encore rétablies au moment de la déclaration) et cinq déclarations avaient trait à l'utilisation de soins pour la mère (deux cas de sollicitation de soins médicaux auprès d'un médecin de premier recours, une consultation en salle d'urgence et un cas n'ayant plus sollicité d'autres soins médicaux).
IV.4.3 Effets indésirables fœtaux et néonataux
Aux États-Unis, les études dans lesquelles les données des systèmes de surveillance VAERS et VSD étaient examinées pour connaître les issues défavorables à la naissance ont révélé qu'un faible nombre de ces effets survenait chez les nourrissons dont la mère recevait le vaccin dcaT durant la grossesseReference 78Reference 79Reference 80Reference 86. Entre 2005 et 2016, seul 1 % (n = 4) des rapports du système VAERS comprenait de graves malformations congénitales, tandis qu'une analyse des données du système VSD qui incluait les résultats de plus de 197 000 grossesses n'a pas révélé un risque accru de résultats cliniques chez les nourrissons qui sont liés à la chorioamnionite de la mère (c.-à-d. tachypnée transitoire du nouveau-né, septicémie néonatale, pneumonie néonatale, syndrome de détresse respiratoire et convulsions chez le nouveau-né). Une analyse des données du système VSD qui comparait les résultats en matière d'innocuité du vaccin dcaT administré à la mère par rapport à l'immunisation contre la grippe durant la grossesse n'a pas révélé un risque accru de microcéphalie, d'accouchement prématuré, de nourrisson de faible poids à la naissance et de nourrisson petit pour son âge gestationnelReference 82Reference 88. Au Royaume-Uni, une étude qui faisait état des données du système de surveillance national (CPRD) au cours des six premiers mois de la mise en œuvre du programme national d'immunisation maternelle par le vaccin dcaT n'a pas révélé de cas de souffrances fœtales ou d'insuffisance rénale chez l'enfantReference 92. Une analyse des données sur l'innocuité tirées du Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) de 2007 à 2016 a déterminé que la seule conséquence sur la grossesse associée à l'immunisation durant la grossesse était un cas de fausse couche dans un ovule dégradé.
Dans les ERC, aucune différence quant à la fréquence des EI néonataux, y compris l'âge gestationnel, le poids à la naissance, les indices d'Apgar, l'examen ou les complications néonatales chez les nourrissons, ainsi que les écarts quant à la croissance et au développement des nourrissons jusqu'à l'âge de 13 mois, n'a été constatée entre les femmes qui recevaient le vaccin dcaT durant la grossesse et celles qui recevaient le placebo (0,9 % de solution saline ou TT)Reference 44Reference 45Reference 46. De même, aucune des études d'observation évaluées qui analysaient les dossiers médicaux relatifs aux EI après l'immunisation maternelle par le vaccin dcaT durant la grossesse n'a révélé une augmentation des fréquences d'anomalies congénitales ou des différences dans les indices d'Apgar évalués à cinq minutes, des valeurs de pH dans le sang de cordon ombilical ou d'autres indicateurs d'EI liés à la naissanceReference 47Reference 55Reference 93Reference 94Reference 95Reference 96Reference 97. Dans une étude qui évaluaient l'hospitalisation et d'autres résultats chez les enfants âgés d'au plus 16 mois, aucune différence quant aux EI n'a été observée sur la base de l'état d'immunisation maternelle, à l'exception d'un bébé de faible poids et d'admissions à l'unité néonatale de soins intensifs (en particulier en raison d'une naissance prématurée et d'une anémie) qui ont été plus souvent signalés dans le groupe des nourrissons dont la mère n'a pas reçu le vaccin dcaT durant la grossesseReference 100. Aucune des études de cohorte qui évaluaient les résultats de santé des nouveau-nés sans un groupe de comparaison n'a signalé de EI chez le nourrissonReference 84Reference 98Reference 99.
Bien qu'aucun problème majeur d'innocuité n'ait été détecté dans la documentation examinée, il convient de noter qu'aucune des études évaluées n'était assez puissante pour détecter des petites différences en matière de risque. Cela est particulièrement pertinent pour les résultats d'intérêt qui sont fréquents chez les personnes non vaccinées (p. ex., bébé de faible poids, naissance prématurée ou fausse couche) pour qui la détection de cas de risques rares associés au vaccin nécessite des essais suffisamment puissants impliquant d'importantes populations ou des données de surveillance post-commercialisation fiablesReference 101.
V Recommandations
À la suite de l'examen approfondi des données disponibles, le CCNI a publié la recommandation suivante. En adoptant cette recommandation et aux fins de la mise en œuvre de programmes financés par l'État, les provinces et territoires pourraient tenir compte de facteurs économiques et d'autres facteurs opérationnels locaux. Le CCNI continuera de surveiller de près les avancées scientifiques relatives à l'immunisation des mères contre la coqueluche et mettra à jour les recommandations à mesure que les données probantes évoluent.
Recommandation : Le CCNI recommande que l'immunisation par le vaccin dcaT soit offerte à toutes les femmes enceintes au cours de chaque grossesse, quels que soient leurs antécédents de vaccination par le vaccin dcaT (forte recommandation du CCNI). Le CCNI a conclu qu'il existait des données probantes suffisantes pour recommander l'immunisation (qualité de preuve A).
L'immunisation maternelle systématique avec le vaccin dcaT durant la grossesse assurera une protection plus robuste et complète contre la coqueluche chez les nourrissons, comparativement à l'immunisation dans le cadre de flambées uniquement.
Il a été démontré que l'immunisation par le vaccin dcaT durant la grossesse fournissait une protection contre la coqueluche chez 9 nourrissons sur 10 de moins de trois mois. Aucun problème d'innocuité significatif n'a été détecté dans la documentation scientifique actuellement disponible et aucun risque accru d'EIG durant la grossesse, chez la mère ou le nourrisson n'a été signalé dans des pays qui offrent de façon systématique ce vaccin pour l'immunisation durant la grossesse. De même, aucun EIG n'a été détecté au Canada par l'intermédiaire du SCSESSI. À l'heure actuelle, il n'existe aucune indication d'un changement important sur le plan clinique de l'effet activateur de la mémoire immunologique chez les nourrissons exposés à des concentrations d'anticorps d'origine maternelle plus élevées après le vaccin dcaT durant la grossesse. Compte tenu du déclin rapide des anticorps maternels observé dans les études, le vaccin devrait être offert durant chaque grossesse, quels que soient les antécédents de vaccination ou l'intervalle entre les grossesses.
- Le CCNI recommande que l'immunisation par le vaccin dcaT soit idéalement assurée entre les 27e et 32e semaines de grossesse (forte recommandation du CCNI, qualité de preuve A). Les données probantes appuient également l'immunisation maternelle par le vaccin dcaT pour un éventail plus large d'âges gestationnels, et le CCNI recommande qu'elle puisse être assurée à partir de la 13e semaine et jusqu'au moment de l'accouchement, à la lumière de considérations liées aux programmes et au patient particulier (recommandation facultative du CCNI, qualité de preuve A/B).
L'immunisation devrait idéalement être offerte entre la 27e et 32e semaine de grossesse. Cette affirmation est appuyée par les données les plus fiables en matière d'innocuité et d'efficacité. L'immunisation entre les 13e et 26e semaines pourrait aussi être envisagée dans certaines situations (p. ex., grossesses à risque accru d'accouchement prématuré) afin de permettre une exposition placentaire plus longue à des titres d'anticorps plus élevés et une maximisation du transfert d'anticorps. Bien qu'il soit préférable que l'immunisation soit administrée suffisamment de temps avant la naissance (c.-à-d. quatre semaines) pour permettre un transfert optimal des anticorps et une protection directe du nourrisson contre la coqueluche, elle devrait être envisagée jusqu'à la fin de la grossesse, car elle pourrait fournir une protection partielle. Si l'immunisation par le vaccin dcaT a été assurée au début de la grossesse (p. ex., avant la reconnaissance de la grossesse), il ne sera pas nécessaire de renouveler l'immunisation après 13 semaines de grossesse.
| Options | Facteurs à considérer | Points de décision |
|---|---|---|
| 1. Immunisation entre la 27e et 32e semaine de grossesse | Innocuité
Efficacité
Immunogénicité
Faisabilité ou acceptabilité Possibilité de jumelage avec la visite prénatale de routine durant laquelle le dépistage du diabète gestationnel est offert (24 à 28 semaines de grossesse). |
Atteinte d'un équilibre optimal entre les données sur l'innocuité, les consultations cliniques, le potentiel limité de déclin des anticorps, la formation efficace d'anticorps et le transfert placentaire pour les grossesses à terme. Cette option est appuyée par les données sur l'innocuité et l'efficacité les plus fiables de toutes les options et offre un temps suffisant pour que la réponse anticorps se développe complètement chez la mère durant la grossesse. La vaccination peut être jumelée aux visites de routine de la mère, mais elle pourrait ne pas offrir une protection pour certaines naissances prématurées. |
| 2. Immunisation entre la 13e et 26e semaine de grossesse | Innocuité
Efficacité
Immunogénicité
Faisabilité ou acceptabilité Possibilité de jumelage avec les visites prénatales de routine, après l'examen de l'échographie anatomique détaillée (généralement effectuée entre la 18e et 22e semaine) ou lorsque le dépistage du diabète gestationnel est effectué (entre la 24e et 28e semaine). |
Les données sur l'innocuité sont moins nombreuses au deuxième trimestre et les données sur l'efficacité ne sont pas stratifiées pour l'immunisation durant le deuxième trimestre. La vaccination au cours du deuxième trimestre augmente la possibilité de consultations cliniques visant à offrir la vaccination et assure la formation et le transfert optimaux des anticorps aux nourrissons prématurés et nés à terme. Pour ce qui est des accouchements prématurés, une étroite fenêtre de possibilités existe entre le début du transfert des anticorps transplacentaires à la 20e semaine et l'accouchement. |
| 3. Immunisation avant la 13e semaine de grossesse | Innocuité
Efficacité
Immunogénicité
Faisabilité ou acceptabilité
|
Les données sur l'innocuité sont limitées avant la 13e semaine, et les données sur l'efficacité ne sont pas stratifiées concernant l'immunisation durant le premier trimestre. Si l'immunisation survient tôt au cours de la grossesse, les anticorps risquent de diminuer avant l'accouchement à terme. Risque d'EI durant la grossesse pouvant être attribués par erreur à la vaccination. |
| 4. Immunisation après la 32e semaine de grossesse | Innocuité
Efficacité
Immunogénicité
Faisabilité ou acceptabilité
|
Les données sur l'innocuité et l'efficacité les plus fiables sont obtenues durant le troisième trimestre. Cette option pourrait ne pas laisser suffisamment de temps (c.-à-d. quatre semaines) pour la formation et le transfert d'anticorps maternels avant l'accouchement. Une immunisation tardive n'offrira pas de protection pour la plupart des naissances prématurées. Les occasions de visites cliniques pourraient se faire plus rares en ce qui a trait à la vaccination en fin de grossesse comparativement à une vaccination plus précoce. |
VI Priorités en matière de recherche et d'évaluation
D'après l'expérience tirée de l'immunisation contre la grippe chez la mère durant la grossesse, compte tenu du nombre important nécessaire pour détecter des résultats rares et du fait que la vaccination contre la coqueluche chez la mère durant la grossesse pourrait avoir une incidence sur le contrôle général de la coqueluche à plus long terme, des recherches et une évaluation plus poussées sont fortement recommandées et devraient être financées dans le cadre d'un nouveau programme. Le CCNI encourage la réalisation de travaux de recherche sur les questions non résolues suivantes associées à la vaccination pendant la grossesse :
- poursuite des travaux en vue de déterminer les répercussions à long terme de la vaccination de la mère durant la grossesse sur l'efficacité du vaccin chez les enfants et les adultes (p. ex., effet à long terme sur l'épidémiologie de la maladie par suite de titres d'anticorps plus faibles chez le nourrisson);
- surveillance des couples mère-nourrisson ayant reçu le vaccin;
- innocuité et répercussions de l'administration répétée du vaccin dcaT lors de grossesses ultérieures;
- innocuité de l'immunisation au début de la grossesse;
- moment optimal de l'administration du dcaT, de façon à tirer le meilleur parti possible du transfert des anticorps transplacentaires et de la protection du nourrisson;
- rapport coût/efficacité de l'immunisation des mères contre la coqueluche durant la grossesse dans le contexte canadien;
- répercussions de la série de primovaccination durant l'enfance de la mère avec un vaccin anticoquelucheux à germes entiers par rapport au vaccin acellulaire;
- mise au point de vaccins pour nourrissons plus efficaces contre la coqueluche.
La recherche touchant la mise en œuvre et l'évaluation sont nécessaires pour déterminer les meilleurs contextes d'administration du vaccin, de façon à optimiser son utilisation et à déterminer comment surmonter tout obstacle d'acceptabilité ou du système de soins de santé en vue d'assurer une bonne couverture vaccinale.
Il importe de poursuivre les activités de recherche visant à combler les lacunes en matière de connaissances liées à la vaccination contre la coqueluche, de façon à parachever les travaux de recherche sur la vaccination pendant la grossesse. Parmi les sujets qui présentent un intérêt particulier, citons les suivants :
- détermination des corrélats de la protection;
- répercussions sur les réactions des nourrissons aux vaccins conjugués aux protéines porteuses TT et CRM (p. ex., vaccin contre le pneumocoque) et sur la protection des nourrissons assurée par ces vaccins.
VII Données de surveillance et de suivi
La coqueluche est une maladie à déclaration obligatoire depuis 1924. La collecte de données et leur analyse, interprétation et diffusion opportune continues et systématiques sont fondamentales pour la planification, la mise en œuvre, l'évaluation et la prise de décisions fondées sur des données probantes. Pour appuyer de tels efforts, le CCNI encourage l'amélioration de la surveillance dans les domaines suivants :
- amélioration de la qualité des données, notamment l'intégralité des renseignements, entre autres, concernant l'état de la vaccination;
- amélioration de la surveillance de la coqueluche pour détecter les éclosions rapidement et connaître le fardeau de la maladie dans les différents groupes d'âge;
- surveillance de la maladie pour déterminer les répercussions de la modification des programmes de vaccination, en mettant l'accent sur la pneumococcie invasive;
- effectuer des recherches sur l'utilisation d'une définition de cas qui tienne compte de cas plus bénins de coquelucheReference 102;
- évaluation et surveillance actives de l'innocuité, y compris l'utilisation de données administratives couplées;
- surveillance de la survenue d'événements rares touchant l'innocuité après la vaccination de la mère durant la grossesse par l'intermédiaire d'un suivi à long terme de cohortes importantes;
- amélioration des méthodes d'évaluation de la couverture vaccinale, y compris l'élaboration de méthodes servant à surveiller la couverture vaccinale chez la mère durant la grossesse (idéalement au moyen de registres de vaccination complets);
- collaboration accrue entre la santé publique et l'industrie à l'échelle nationale et internationale pour surveiller l'incidence de la maladie, l'innocuité des vaccins et les résultats des programmes.
Tableaux
Une analyse détaillée des études pertinentes, y compris les tableaux de données accompagnés d'une évaluation de la qualité des études individuelles, est présentée dans la Revue documentaire sur l'immunisation durant la grossesse par le vaccin combiné anti-Tétanos, et à dose réduite contre la diphtérie et la coqueluche acellulaire (dcaT) : Innocuité, immunogénicité et efficacité du CCNI.
| Niveau | Description |
|---|---|
| I | Données probantes provenant d'un ou de plusieurs essais randomisés contrôlés. |
| II-1 | Données probantes provenant d'un ou de plusieurs essais contrôlés sans randomisation. |
| II-2 | Données probantes obtenues dans le cadre d'études analytiques de cohortes ou cas-témoins, réalisées de préférence dans plus d'un centre ou par plus d'un groupe de recherche utilisant des indicateurs cliniques de résultats de l'efficacité du vaccin. |
| II-3 | Données probantes obtenues à partir de plusieurs séries chronologiques avec ou sans intervention. Les résultats spectaculaires obtenus dans un contexte non contrôlé (comme les résultats de l'introduction de la pénicilline dans les années 1940) pourraient aussi être considérés comme faisant partie de ce type de données probantes. |
| III | Opinions d'autorités respectées fondées sur des expériences cliniques, études descriptives et rapports de cas ou rapports de comités d'experts. |
| Cote de qualité | Description |
|---|---|
| Bonne | Une étude (y compris les méta-analyses ou les examens systématiques) qui répond bien à tous les critères relatifs à la méthodologieTableau 4 note de bas de page *. |
| Passable | Une étude (y compris les méta-analyses ou les examens systématiques) qui ne répond pas (ou ne répond pas clairement) à au moins l'un des critères relatifs à la méthodologie*, mais ne comportant aucune « lacune fatale » connue. |
| Médiocre | Une étude (y compris les méta-analyses ou les examens systématiques) qui comporte au moins une « lacune fatale » relative à la méthodologie* ou une accumulation de lacunes moins importantes faisant en sorte que les résultats de l'étude sont jugés inadéquats en vue de l'élaboration des recommandations. |
Notes de bas de page du Tableau 4
|
|
| Force de la recommandation du ccni | Force des données probantes |
|---|---|
| D'après les facteurs ne se limitant pas à la force des données probantes (p. ex., besoin en matière de santé publique) | D'après l'évaluation de l'ensemble des données probantes |
Forte « devrait/ne devrait pas être réalisée »
|
A - Données probantes suffisantes pour recommander l'immunisation |
| B - Données probantes acceptables pour recommander l'immunisation | |
| C - Données probantes contradictoires; cependant, d'autres facteurs peuvent influer sur la prise de décision | |
| D - Données probantes acceptables pour déconseiller l'immunisation | |
| E - Données probantes suffisantes pour déconseiller l'immunisation | |
| I - Données probantes insuffisantes (en quantité ou en qualité); cependant, d'autres facteurs peuvent influer sur la prise de décision | |
| Facultative
« peut être envisagée »
|
A - Données probantes suffisantes pour recommander l'immunisation |
| B - Données probantes acceptables pour recommander l'immunisation | |
| C - Données probantes contradictoires; cependant, d'autres facteurs peuvent influer sur la prise de décision | |
| D - Données probantes acceptables pour déconseiller l'immunisation | |
| E - Données probantes suffisantes pour déconseiller l'immunisation | |
| I - Données probantes insuffisantes (en quantité ou en qualité); cependant, d'autres facteurs peuvent influer sur la prise de décision |
Liste des abréviations
- ACIP
- Advisory Committee on Immunization Practices (États-Unis)
- ASPC
- Agence de la santé publique du Canada
- BDCP
- Base de données sur les congés des patients
- CDC
- Centers for Disease Control and Prevention (États-Unis)
- CPRD
- Clinical Practice Research Database (Royaume-Uni)
- dcaT
- Vaccin combiné anti-Tétanos, et à dose réduite contre la diphtérie et la coqueluche acellulaire
- DCaT
- Vaccin combiné contre la diphtérie, la coqueluche acellulaire et le tétanos
- DIP
- Toxine/anatoxine diphtérique
- DTceC
- Vaccin à germes entiers contre la diphtérie et le tétanos
- EI
- Effets indésirables
- EIG
- Effets indésirables graves
- ERC
- Essai randomisé contrôlé
- EV
- Efficacité du vaccin
- FHA
- Hémagglutinine filamenteuse coquelucheuse
- FIM 2/3
- Fimbriae coquelucheuses
- FIM
- Fimbriae
- GCI
- Guide canadien d'immunisation
- GTC
- Groupe de travail du CCNI sur la diphtérie, le tétanos, la coqueluche, la poliomyélite et Haemophilus influenzae de type B
- IAR
- Indice d'avidité relative
- IC
- Intervalles de confiance
- IMC
- Indice de masse corporelle
- IMPACT
- Programme canadien de surveillance active de l'immunisation
- JCVI
- Joint Committee on Vaccination and Immunization (Royaume-Uni)
- Lf
- Limite de floculation
- LPF
- Facteur de prolifération des lymphocytes
- MÉV
- Maladies évitables par la vaccination
- OMS
- Organisation mondiale de la Santé
- PRN
- Pertactine
- PT
- Anatoxine coquelucheuse
- SCSESSI
- Système canadien de surveillance des effets secondaires suivant l'immunisation
- TT
- Toxine tétanique
- UE
- Unité d'endotoxine
- µg
- Microgramme
- VAERS
- Vaccine Adverse Event Reporting (États-Unis)
- VSD
- Vaccine Safety Datalink
Remerciements
Cette déclaration a été rédigée par : Dr O. Baclic, Dr M. Tunis, J. Rotondo, M. Saboui, S. Duchesne-Bélanger, Dr J. Brophy, T. Chevalier, C. Moffatt et approuvée par le CCNI.
Membres du GTC : Dr J. Brophy (président), Dr N. Brousseau, Dre E. Castillo, Dre N. Crowcroft, Dre S. Deeks, Dr I. Gemmill, Dr S. Halperin, Dre B. Henry, Dre M. Naus, Dre M. Salvadori, Dr B. Seifert.
Membres du CCNI : Dre C. Quach (présidente), Dre W. Vaudry (vice-président), Dre N. Dayneka, Dre S. Deeks, Dr P. DeWals, Dre V. Dubey, Dre R. Harrison, Dr M. Lavoie, Dr C. Rotstein, Dre M. Salvadori, Dre B. Sander, Dre N. Sicard, Dr R. Warrington.
Ancien membre du CCNI : Dre B. Henry, Dr I. Gemmill, Dre S. Marchant-Short, Dr D. Vinh.
Agents de liaison : Dr J. Brophy (Association canadienne pour la recherche et l'évaluation en immunisation [CAIRE]); Dre E. Castillo (Société des obstétriciens et gynécologues du Canada [SOGC]); Dre A. Cohn (CDC); Mme T. Cole (Comité canadien sur l'immunisation); Dre J. Emili (Collège des médecins de famille du Canada); Dre K. Klein (Conseil des médecins hygiénistes en chef); Dre C. Mah (Association canadienne de santé publique); Dre D. Moore (Société canadienne de pédiatrie); Dre A. Pham-Huy (Association pour la microbiologie médicale et l'infectiologie [AMMI] Canada).
Ancien agent de liaison : Dre J. Blake (SOGC).
Représentants d'office : Dre (Capc) K. Barnes (Défense nationale et Forces armées canadiennes); Mme G. Charos (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI] ASPC); Dre G. Coleman (Direction des produits biologiques et des thérapies génétiques [DPBTG], Santé Canada [SC]); Dr J. Gallivan (Direction des produits de santé commercialisés [DPSC], [SC]), Mme J. Pennock (CIMRI, ASPC); M. G. Poliquin (Laboratoire national de microbiologie, ASPC), Dr T. Wong (Direction générale de la santé des Premières nations et des Inuits [DGSPNI], [SC]).
Le CCNI tient également à souligner la contribution de L. Gamble, Bibliothèque de la santé.
Notes
- Note de bas de page 1
-
Le CCNI reconnaît que ce ne sont pas toutes les personnes donnant naissance qui s'identifieront en tant que femme ou mère. Aux fins du présent document, sont utilisées les expressions « femme enceinte », « mère » et « maternel », lesquelles peuvent également s'appliquer aux personnes qui ne s'identifient pas particulièrement en tant que genre féminin, tout en étant le parent qui assure la gestation du foetus.
Références
- Références 1
-
Canadian Paediatric Society, Infectious Diseases and Immunization Committee. IMPACT after 17 years: Lessons learned about successful networking. Paediatr Child Health (CAN). 2009;14(1):33-5.
- Références 2
-
Richards J, Brown A, Homan C. The data quality study of the Canadian Discharge Abstract Database. Statistics Canada Symposium 2001; 2001;; 2001.
- Références 3
-
Brenner R.A., SimonsMorton B.G., Bhaskar B., Das A., Clemens JD. Prevalence and predictors of immunization among inner-city infants: A birth cohort study. Pediatrics. 2001 2001;108(3):661-70.
- Références 4
-
Smith T, Rotondo J, Desai S, et al. Pertussis surveillance in Canada: Trends to 2012. CCDR. 2014;40(3):21-30.
- Références 5
-
Abu Raya B., Sadarangani M, Rotondo J, et al. Pertussis in Canada, 1996 to 2015. Vaccine. In press 2018.
- Références 6
-
Public Health Agency of Canada. Vaccine preventable diseases in Canada: Surveillance report to December 31, 2015. Can Commun Dis Rep. In press 2017.
- Références 7
-
Chambers C, Skowronski D, Hoang L, et al.. Pertussis surveillance trends in British Columbia, Canada, over a 20-year Period: 1993-2013. CCDR. 2014;40(3):31-41.
- Références 8
-
Fathima S, Ferrato C, Lee BE, Simmonds K, Yan L, Mukhi SN, et al. Bordetella pertussis in sporadic and outbreak settings in Alberta, Canada, July 2004 - December 2012. BMC Infect Dis. 2014;14(1).
- Références 9
-
British Columbia Annual Summary of Reportable Diseases 2015 [Internet]. British Columbia, Canada: British Columbia Centre for Disease Control; 2016 [updated September 3, 2016; cited November 3, 2017]. Available from: http://www.bccdc.ca/resource-gallery/Documents/Statistics%20and%20Research/Statistics%20and%20Reports/Epid/Annual%20Reports/2015CDAnnualReportFinal.pdf.
- Références 10
-
Kilgore PE, Salim AM, Zervos MJ, Schmitt HJ. Pertussis: Microbiology, Disease, Treatment, and Prevention. Clin Microbiol Rev. 2016 Jul;29(3):449-86.
- Références 11
-
Straney L, Schibler A, Ganeshalingham A, Alexander J, Festa M, Slater A, et al. Burden and outcomes of severe pertussis infection in critically ill infants. Pediatr Crit Care Med. 2016;17(8):735-42.
- Références 12
-
Silva A, Rotondo J, et al. Pertussis hospitalizations in Canada, 1990 to 2015. Vaccine. In press 2018.
- Références 13
-
Brooks J, Gilbert N, Rotondo J, et al. Pertussis toxin antibody levels in a cohort of pregnant women in Canada. CCDR. In press 2017.
- Références 14
-
Bigham M., Konrad S., Van Buynder P., Van Buynder J., IsaacRenton J., ElSherif M., et al. Low pertussis toxin antibody levels in two regional cohorts of Canadian pregnant women. Vaccine. 2014 12 Nov 2014;32(48):6493-8.
- Références 15
-
Mooi FR, de Greeff SC. The case for maternal vaccination against pertussis. Lancet Infect Dis. 2007 Sep;7(9):614-24.
- Références 16
-
Van Rie A, Wendelboe AM, Englund JA. Role of maternal pertussis antibodies in infants. Pediatr Infect Dis J. 2005 May;24(5 Suppl):S62-5.
- Références 17
-
Campbell P, McIntyre P, Quinn H, Hueston L, Gilbert GL, McVernon J. Increased population prevalence of low pertussis toxin antibody levels in young children preceding a record pertussis epidemic in Australia. PLoS One. 2012;7(4):e35874.
- Références 18
-
de Greeff SC, de Melker HE, van Gageldonk PGM, Schellekens JFP, van der Klis FRM, Mollema L, et al. Seroprevalence of Pertussis in the Netherlands: Evidence for Increased Circulation of Bordetella pertussis. PLoS One. 2010;5(12):e14183. doi:10.1371/journal.pone.0014183.
- Références 19
-
Plotkin SA. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 2010 July 2010;17(7):1055-65.
- Références 20
-
Broder KR, Cortese MM, Iskander JK, Kretsinger K, Slade BA, Brown KH, et al. Preventing tetanus, diphtheria, and pertussis among adolescents: use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccines recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2006 Mar 24;55(RR-3):1-34.
- Références 21
-
Bisgard KM, Pascual FB, Ehresmann KR, Miller CA, Cianfrini C, Jennings CE, et al. Infant pertussis: who was the source? Pediatr Infect Dis J. 2004 Nov;23(11):985-9.
- Références 22
-
Wendelboe AM, Njamkepo E, Bourillon A, Floret DD, Gaudelus J, Gerber M, et al. Transmission of Bordetella pertussis to young infants. Pediatr Infect Dis J. 2007 Apr;26(4):293-9.
- Références 23
-
Wiley KE, Zuo Y, Macartney KK, McIntyre PB. Sources of pertussis infection in young infants: a review of key evidence informing targeting of the cocoon strategy. Vaccine. 2013 Jan 11;31(4):618-25.
- Références 24
-
Wendelboe AM, Hudgens MG, Poole C, Van Rie A. Estimating the role of casual contact from the community in transmission of Bordetella pertussis to young infants. Emerg Themes Epidemiol. 2007 Oct 19;4:15.
- Références 25
-
De Greeff S.C., Mooi F.R., Westerhof A., Verbakel J.M.M., Peeters M.F., Heuvelman C.J., et al. Pertussis disease burden in the household: How to protect young infants. Clinical Infectious Diseases. 2010 15 May 2010;50(10):1339-45.
- Références 26
-
Crowcroft S, Booy R, Harrison T. Erratum: Severe and unrecognised: Pertussis in UK infants (Archives of Disease in Childhood (2003)88(802-806)). Arch Dis Child. 2006;91(5):453.
- Références 27
-
Crowcroft N.S., Booy R., Harrison T., Spicer L., Britto J., Mok Q., et al. Severe and unrecognised: Pertussis in UK infants. Arch Dis Child. 2003 01 Sep 2003;88(9):802-6.
- Références 28
-
Baron S, Njamkepo E, Grimprel E, Begue P, Desenclos J-, Drucker J, et al. Epidemiology of pertussis in French hospitals in 1993 and 1994: Thirty years after a routine use of vaccination. Pediatr Infect Dis J. 1998;17(5):412-8.
- Références 29
-
Bonmarin I, Levy-Bruhl D, Baron S, Guiso N, Njamkepo E, Caro V. Pertussis surveillance in French hospitals: Results from a 10 year period. Euro Surveill. 2007;12(1):34-8.
- Références 30
-
Halperin SA, Wang EE, Law B, Mills E, Morris R, Dery P, et al. Epidemiological features of pertussis in hospitalized patients in Canada, 1991-1997: report of the Immunization Monitoring Program--Active (IMPACT). Clin Infect Dis. 1999 Jun;28(6):1238-43.
- Références 31
-
Vitek CR, Pascual FB, Baughman AL, Murphy TV. Increase in deaths from pertussis among young infants in the United States in the 1990s. Pediatr Infect Dis J. 2003 Jul;22(7):628-34.
- Références 32
-
Elliott E, McIntyre P, Ridley G, Morris A, Massie J, McEniery J, et al. National study of infants hospitalized with pertussis in the acellular vaccine era. Pediatr Infect Dis J. 2004 Mar;23(3):246-52.
- Références 33
-
Jardine A, Conaty SJ, Lowbridge C, Staff M, Vally H. Who gives pertussis to infants? Source of infection for laboratory confirmed cases less than 12 months of age during an epidemic, Sydney, 2009. Commun Dis Intell. 2010;34(2):116-21.
- Références 34
-
Vaccine uptake in Canadian adults: Results from the 2014 adult National Immunization Coverage Survey (aNICS) [Internet]. Canada: Government of Canada; 2016 [updated February 24, 2016; cited November 3, 2017]. Available from: https://www.canada.ca/en/public-health/services/publications/healthy-living/vaccine-uptake-canadian-adults-results-2014-adult-national-immunization-coverage-survey.html.
- Références 35
-
Dodds L, McNeil SA, Fell DB, Allen VM, Coombs A, Scott J, et al. Impact of influenza exposure on rates of hospital admissions and physician visits because of respiratory illness among pregnant women. CMAJ. 2007 Feb 13;176(4):463-8.
- Références 36
-
Table 102-4504: Mean age of mother at time of delivery (live births), Canada, provinces and territories [Internet]. Canada: Statistics Canada; 2017 [updated October 18, 2017; cited November 3, 2017]. Available from: http://www5.statcan.gc.ca/cansim/a26?lang=eng&retrLang=eng&id=1024504&paSer=&pattern=&stByVal=1&p1=1&p2=38&tabMode=dataTable&csid.
- Références 37
-
Table 6-2 Live births, Canada - Age and parity of mother [Internet]. Canada: Statistics Canada; 2015 [updated November 27, 2015; cited November 3, 2017]. Available from: http://www.statcan.gc.ca/pub/84f0210x/2009000/t008-eng.htm.
- Références 38
-
Amirthalingam G., Andrews N., Campbell H., Ribeiro S., Kara E., Donegan K., et al. Effectiveness of maternal pertussis vaccination in England: An observational study. The Lancet. 2014 25 Oct 2014;384(9953):1521-8.
- Références 39
-
Amirthalingam G, Campbell H, Ribeiro S, Fry NK, Ramsay M, Miller E, et al. Sustained Effectiveness of the Maternal Pertussis Immunization Program in England 3 Years Following Introduction. Clin Infect Dis. 2016 Dec 1;63(suppl 4):S236-43.
- Références 40
-
Dabrera G., Amirthalingam G., Andrews N., Campbell H., Ribeiro S., Kara E., et al. A case-control study to estimate the effectiveness of maternal pertussis vaccination in protecting newborn infants in England and Wales, 2012-2013. Clinical Infectious Diseases. 2015 01 Feb 2015;60(3):333-7.
- Références 41
-
Ladhani SN, Andrews NJ, Southern J, Jones CE, Amirthalingam G, Waight PA, et al. Antibody responses after primary immunization in infants born to women receiving a pertussis-containing vaccine during pregnancy: single arm observational study with a historical comparator. Clin Infect Dis. 2015 Dec 1;61(11):1637-44.
- Références 42
-
Sanofi Pasteur Limited. Adacel Product Monograph; June 11, 2012.
- Références 43
-
GlaxoSmithKline Inc. Boostrix Product Monograh; March 14, 2017.
- Références 44
-
Munoz FM, Bond NH, Maccato M, Pinell P, Hammill HA, Swamy GK, et al. Safety and immunogenicity of tetanus diphtheria and acellular pertussis (Tdap) immunization during pregnancy in mothers and infants: a randomized clinical trial. JAMA. 2014 May 7;311(17):1760-9.
- Références 45
-
Hoang HT, Leuridan E, Maertens K, Nguyen TD, Hens N, Vu NH, et al. Pertussis vaccination during pregnancy in Vietnam: Results of a randomized controlled trial Pertussis vaccination during pregnancy. Vaccine. 2016 Jan 2;34(1):151-9.
- Références 46
-
Villarreal Perez J.Z., Ramirez Aranda J.M., de la O Cavazos M., Zamudio Osuna M.D.J., Perales Davila J., Ballesteros Elizondo M.R., et al. Randomized clinical trial of the safety and immunogenicity of the Tdap vaccine in pregnant Mexican women. Human Vaccines and Immunotherapeutics. 2017 02 Jan 2017;13(1):128-35.
- Références 47
-
Maertens K, Cabore RN, Huygen K, Vermeiren S, Hens N, Van Damme P, et al. Pertussis vaccination during pregnancy in Belgium: Follow-up of infants until 1 month after the fourth infant pertussis vaccination at 15 months of age. Vaccine. 2016 Jun 30;34(31):3613-9.
- Références 48
-
Abu Raya B, Srugo I, Bamberger E, Kessel A. The avidity of pertussis antibodies following gestational acellular pertussis immunization: Reply to Maertens. Vaccine. 2015 Oct 13;33(42):5490-1.
- Références 49
-
Vilajeliu A., Gonce A., Lopez M., Costa J., Rocamora L., Rios J., et al. Combined tetanus-diphtheria and pertussis vaccine during pregnancy: Transfer of maternal pertussis antibodies to the newborn. Vaccine. 2015 18 Feb 2015;33(8):1056-62.
- Références 50
-
Huygen K, Caboré RN, Maertens K, Van Damme P, Leuridan E. Humoral and cell mediated immune responses to a pertussis containing vaccine in pregnant and nonpregnant women. Vaccine. 2015;33(33):4117-23.
- Références 51
-
Abu Raya B, Srugo I, Kessel A, Peterman M, Vaknin A, Bamberger E. The Decline of Pertussis-Specific Antibodies After Tetanus, Diphtheria, and Acellular Pertussis Immunization in Late Pregnancy. J Infect Dis. 2015 Dec 15;212(12):1869-73.
- Références 52
-
Abu Raya B., Srugo I., Kessel A., Peterman M., Bader D., Peri R., et al. The induction of breast milk pertussis specific antibodies following gestational tetanus-diphtheria-acellular pertussis vaccination. Vaccine. 2014 29 Sep 2014;32(43):5632-7.
- Références 53
-
De Schutter S, Maertens K, Baerts L, De Meester I, Van Damme P, Leuridan E. Quantification of vaccine-induced antipertussis toxin secretory IgA antibodies in breast milk: comparison of different vaccination strategies in women. Pediatr Infect Dis J. 2015 Jun;34(6):e149-52.
- Références 54
-
Maertens K, Hoang TTH, Nguyen TD, Cabore RN, Duong TH, Huygen K, et al. The Effect of Maternal Pertussis Immunization on Infant Vaccine Responses to a Booster Pertussis-Containing Vaccine in Vietnam. Clin Infect Dis. 2016 Dec 1;63(suppl 4):S197-204.
- Références 55
-
Maertens K, Caboré RN, Huygen K, Hens N, Van Damme P, Leuridan E. Pertussis vaccination during pregnancy in Belgium: Results of a prospective controlled cohort study. Vaccine. 2016;34(1):142-50.
- Références 56
-
Hardy-Fairbanks AJ, Pan SJ, Decker MD, Johnson DR, Greenberg DP, Kirkland KB, et al. Immune responses in infants whose mothers received Tdap vaccine during pregnancy. Pediatr Infect Dis J. 2013 Nov;32(11):1257-60.
- Références 57
-
Healy C.M., Rench M.A., Baker CJ. Importance of timing of maternal combined tetanus, diphtheria, and acellular pertussis (Tdap) immunization and protection of young infants. Clinical Infectious Diseases. 2013 15 Feb 2013;56(4):539-44.
- Références 58
-
Gall SA, Myers J, Pichichero M. Maternal immunization with tetanus-diphtheria-pertussis vaccine: effect on maternal and neonatal serum antibody levels. Am J Obstet Gynecol. 2011 Apr;204(4):334.e1,334.e5.
- Références 59
-
Abu Raya B, Srugo I, Kessel A, Peterman M, Bader D, Gonen R, et al. The effect of timing of maternal tetanus, diphtheria, and acellular pertussis (Tdap) immunization during pregnancy on newborn pertussis antibody levels - a prospective study. Vaccine. 2014 Oct 7;32(44):5787-93.
- Références 60
-
Goldfarb I.T., Jennewein M., Cosgrove C., Brown J., Krykbaeva M., Cooperrider J.H., et al. Maternal Tdap: How do antibodies protect newborns against pertussis? Netherlands: The Pregnancy Meeting. United States. 216 (1 Supplement 1) (pp S205-S206); Mosby Inc.; 2017.
- Références 61
-
Maertens K, Cabore RN, Huygen K, Hens N, Van Damme P, Leuridan E. Pertussis vaccination during pregnancy in Belgium: Results of a prospective controlled cohort study. Vaccine. 2016 Jan 2;34(1):142-50.
- Références 62
-
Cabore RN, Maertens K, Dobly A, Leuridan E, Van Damme P, Huygen K. Influence of maternal vaccination against diphtheria, tetanus, and pertussis on the avidity of infant antibody responses to a pertussis containing vaccine in Belgium. Virulence. 2017 Feb 22;1-10.
- Références 63
-
Fallo AA, Neyro SE, Manonelles GV, Lara C, Hozbor D, Zintgraff J, et al. Prevalence of Pertussis Antibodies in Maternal Blood, Cord Serum, and Infants From Mothers With and Those Without Tdap Booster Vaccination During Pregnancy in Argentina. Journal of the Pediatric Infectious Diseases Societ. 2016 Dec 30.
- Références 64
-
Vilajeliu A, Ferrer L, Munros J, Gonce A, Lopez M, Costa J, et al. Pertussis vaccination during pregnancy: Antibody persistence in infants. Vaccine. 2016 Jul 19;34(33):3719-22.
- Références 65
-
Abu Raya B, Bamberger E, Almog M, Peri R, Srugo I, Kessel A. Immunization of pregnant women against pertussis: the effect of timing on antibody avidity. Vaccine. 2015 Apr 15;33(16):1948-52.
- Références 66
-
Naidu MA, Muljadi R, Davies-Tuck ML, Wallace EM, Giles ML. The optimal gestation for pertussis vaccination during pregnancy: a prospective cohort study. Am J Obstet Gynecol. 2016 Aug;215(2):237.e1,237.e6.
- Références 67
-
Eberhardt CS, Blanchard-Rohner G, Lemaitre B, Boukrid M, Combescure C, Othenin-Girard V, et al. Maternal Immunization Earlier in Pregnancy Maximizes Antibody Transfer and Expected Infant Seropositivity Against Pertussis. Clin Infect Dis. 2016 Apr 1;62(7):829-36.
- Références 68
-
Kent A, Ladhani SN, Andrews NJ, Matheson M, England A, Miller E, et al. Pertussis Antibody Concentrations in Infants Born Prematurely to Mothers Vaccinated in Pregnancy. Pediatrics. 2016 Jul;138(1).
- Références 69
-
Eberhardt CS, Blanchard-Rohner G, Lemaitre B, Combescure C, Othenin-Girard V, Chilin A, et al. Pertussis Antibody Transfer to Preterm Neonates After Second- Versus Third-Trimester Maternal Immunization. Clin Infect Dis. 2017 Apr 15;64(8):1129-32.
- Références 70
-
Gandhi M, Devaraj S, Sangi-Haghpeykar H, Mastrobattista J. The effect of body mass index on post-vaccination maternal and neonatal pertussis antibody levels. J Reprod Immunol. 2015 Nov;112:34-7.
- Références 71
-
Maertens K., Burbidge P., van Damme P., Goldblatt D., Leuridan E. Pneumococcal Immune Response in Infants Whose Mothers Received Tdap Vaccination During Pregnancy. Pediatr Infect Dis J. 2017(pagination):ate of Pubaton: 10 Ar 2017.
- Références 72
-
Wood N, Siegrist C. Neonatal immunization: where do we stand? Curr Opin Infect Dis. 2011 Jun;24(3):190-5.
- Références 73
-
Winter K, Cherry JD, Harriman K. Effectiveness of Prenatal Tetanus, Diphtheria, and Acellular Pertussis Vaccination on Pertussis Severity in Infants. Clinical Infectious Diseases. 2016 Sep 13.
- Références 74
-
Baxter R, Bartlett J, Fireman B, Lewis E, Klein NP. Effectiveness of Vaccination During Pregnancy to Prevent Infant Pertussis. Pediatrics. 2017 May;139(5).
- Références 75
-
Bellido-Blasco J, Guiral-Rodrigo S, Miguez-Santiyan A, Salazar-Cifre A, Gonzalez-Moran F. A case-control study to assess the effectiveness of pertussis vaccination during pregnancy on newborns, Valencian community, Spain, 1 March 2015 to 29 February 2016. Euro Surveillance: Bulletin Europeen sur les Maladies Transmissibles = European Communicable Disease Bulletin. 2017 Jun 01;22(22).
- Références 76
-
Vizzotti C, Juarez MV, Bergel E, Romanin V, Califano G, Sagradini S, et al. Impact of a maternal immunization program against pertussis in a developing country. Vaccine. 2016 Nov 12.
- Références 77
-
Vizzotti C., Neyro S., Katz N., Juarez M.V., Perez Carrega M.E., Aquino A., et al. Maternal immunization in Argentina: A storyline from the prospective of a middle income country. Vaccine. 2015 25 Nov 2015;33(47):6413-9.
- Références 78
-
Moro PL. Update on the safety of maternal tetanus toxoid, reduced diphtheria toxoid, and acellular pertussis vaccine (Tdap): Introduction and Enhanced Surveillance of Tdap Vaccine Safety in Pregnancy in VAERS. Meeting of the Advisory Committee on Immunization Practices (ACIP); June 22-23, 2016; Atlanta, Georgia. USA: Advidory Committee on Immunization Practices (ACIP); 2016.
- Références 79
-
Moro PL, Cragan J, Tepper N, Zheteyeva Y, Museru O, Lewis P, et al. Enhanced surveillance of tetanus toxoid, reduced diphtheria toxoid, and acellular pertussis (Tdap) vaccines in pregnancy in the Vaccine Adverse Event Reporting System (VAERS), 2011-2015. Vaccine. 2016 Apr 29;34(20):2349-53.
- Références 80
-
Zheteyeva YA, Moro PL, Tepper NK, Rasmussen SA, Barash FE, Revzina NV, et al. Adverse event reports after tetanus toxoid, reduced diphtheria toxoid, and acellular pertussis vaccines in pregnant women. Am J Obstet Gynecol. 2012 Jul;207(1):59.e1,59.e7.
- Références 81
-
Kharbanda E.O., VazquezBenitez G., Lipkind H.S., Klein N.P., Cheetham T.C., Naleway A.L., et al. Maternal Tdap vaccination: Coverage and acute safety outcomes in the vaccine safety datalink, 2007-2013. Vaccine. 2016 10 Feb 2016;34(7):968-73.
- Références 82
-
Sukumaran L, McCarthy NL, Kharbanda EO, Weintraub ES, Vazquez-Benitez G, McNeil MM, et al. Safety of Tetanus Toxoid, Reduced Diphtheria Toxoid, and Acellular Pertussis and Influenza Vaccinations in Pregnancy. Obstet Gynecol. 2015 Nov;126(5):1069-74.
- Références 83
-
Regan A.K., Tracey L.E., Blyth C.C., Richmond P.C., Effler PV. A prospective cohort study assessing the reactogenicity of pertussis and influenza vaccines administered during pregnancy. Vaccine. 2016 29 Apr 2016;34(20):2299-304.
- Références 84
-
Petousis-Harris H, Walls T, Watson D, Paynter J, Graham P, Turner N. Safety of Tdap vaccine in pregnant women: an observational study. BMJ Open. 2016;6(4):e010911.
- Références 85
-
Fortner K.B., Edwards K.M., Broder K.R., Jimenez N., Zhu Y., Walter E.B., et al. Reactogenicity of tetanus toxoid, reduced diphtheria toxoid, and acellular pertussis vaccine (Tdap) in pregnant women. American Journal of Obstetrics and Gynecology.Conference: 36th Annual Meeting of the Society for Maternal-Fetal Medicine: The Pregnancy Meeting.Atlanta, GA United States.Conference Start: 20160201.Conference End: 20160206.Conference Publication:(TRUNCATED). 2016 January 2016;214(1 SUPPL. 1):S193-4.
- Références 86
-
Datwani H, Moro PL, Harrington T, Broder KR. Chorioamnionitis following vaccination in the Vaccine Adverse Event Reporting System. Vaccine. 2015 Jun 17;33(27):3110-3.
- Références 87
-
Wang M., Khromava A., Mahmood A., Dickson N. Pregnant women receiving tetanus-diphtheria-acellular pertussis (Tdap) vaccine: 6 Years of adacel vaccine pregnancy registry data. Pharmacoepidemiol Drug Saf. 2011 August 2011;20:S60-1.
- Références 88
-
DeSilva M, Vazquez-Benitez G, Nordin JD, Lipkind HS, Romitti PA, DeStefano F, et al. Tdap Vaccination During Pregnancy and Microcephaly and Other Structural Birth Defects in Offspring. JAMA. 2016 Nov 1;316(17):1823-5.
- Références 89
-
Kharbanda EO, Vazquez-Benitez G, Lipkind HS, Klein NP, Cheetham TC, Naleway A, et al. Evaluation of the association of maternal pertussis vaccination with obstetric events and birth outcomes. JAMA. 2014 Nov 12;312(18):1897-904.
- Références 90
-
DeSilva M., VazquezBenitez G., Nordin J.D., Lipkind H.S., Klein N.P., Cheetham T.C., et al. Maternal Tdap vaccination and risk of infant morbidity. Vaccine. 2017 22 June 2017;35(29):3655-60.
- Références 91
-
Layton JB, Butler AM, Li D, Boggess KA, Weber DJ, McGrath LJ, et al. Prenatal Tdap immunization and risk of maternal and newborn adverse events. Vaccine. 2017 Jul 24;35(33):4072-8.
- Références 92
-
Donegan K, King B, Bryan P. Safety of pertussis vaccination in pregnant women in UK: observational study. BMJ. 2014;349:g4219.
- Références 93
-
Judy A., Singh A., Lee H., Gaskari S., Brodzinsky L., Vik J., et al. TDaP vaccination safety in pregnancy: A comparison of neonatal and obstetric outcomes among women receiving antepartum and postpartum vaccination. American Journal of Obstetrics and Gynecology. Conference: 35th Annual Meeting of the Society for Maternal-Fetal Medicine: The Pregnancy Meeting. San Diego, CA United States. Conference Publication: (var.pagings). 212 (1 SUPPL. 1) (pp S300-S301); Mosby Inc.; 2015.
- Références 94
-
Berenson AB, Hirth JM, Rahman M, Laz TH, Rupp RE, Sarpong KO. Maternal and infant outcomes among women vaccinated against pertussis during pregnancy. Hum Vaccin Immunother. 2016 Aug 2;12(8):1965-71.
- Références 95
-
Morgan J.L., Baggari S.R., McIntire D.D., Sheffield JS. Pregnancy outcomes after antepartum tetanus, diphtheria, and acellular pertussis vaccination. Obstet Gynecol. 2015 28 Jun 2015;125(6):1433-8.
- Références 96
-
Shakib JH, Korgenski K, Sheng X, Varner MW, Pavia AT, Byington CL. Tetanus, diphtheria, acellular pertussis vaccine during pregnancy: pregnancy and infant health outcomes. J Pediatr. 2013 Nov;163(5):1422,6.e1-4.
- Références 97
-
Walls T, Graham P, Petousis-Harris H, Hill L, Austin N. Infant outcomes after exposure to Tdap vaccine in pregnancy: an observational study. BMJ Open. 2016 Jan 06;6(1):e009536.
- Références 98
-
Klein NP, Hansen J, Lewis E, Lyon L, Nguyen B, Black S, et al. Post-marketing safety evaluation of a tetanus toxoid, reduced diphtheria toxoid and 3-component acellular pertussis vaccine administered to a cohort of adolescents in a United States health maintenance organization. Pediatr Infect Dis J. 2010 Jul;29(7):613-7.
- Références 99
-
Talbot EA, Brown KH, Kirkland KB, Baughman AL, Halperin SA, Broder KR. The safety of immunizing with tetanus-diphtheria-acellular pertussis vaccine (Tdap) less than 2 years following previous tetanus vaccination: Experience during a mass vaccination campaign of healthcare personnel during a respiratory illness outbreak. Vaccine. 2010 Nov 23;28(50):8001-7.
- Références 100
-
Zerbo O, Chan B, Goddard K, Lewis N, Bok K, Klein NP, et al. Kaiser Permanente Northern California pregnancy database: Description and proof of concept study. Vaccine. 2016 Nov 4;34(46):5519-23.
- Références 101
-
De Serres G, Skowronski DM. Re: "Detectable Risks in Studies of the Fetal Benefits of Maternal Influenza Vaccination". Am J Epidemiol. 2017 May 1;185(9):860-1.
- Références 102
-
WHO-recommended surveillance standard of pertussis [Internet]. Geneva, Switzerland: The World Health Organization; 2013 [updated August 10, 2003; cited November 3, 2017]. Available from: http://www.who.int/immunization/monitoring_surveillance/burden/vpd/surveillance_type/passive/pertussis_standards/en/.