Méthode d’essai biologique servant à mesurer la survie de collemboles exposés à des contaminants dans le sol : annexe I
Annexe I
Construction et utilisation du dispositif d’aspiration
Équipement
Composants
- Bocal en verre de 125 mL, avec cercle métallique et couvercle
- Pipette jetable de 5 mL, en borosilicate (p. ex., Pyrex 7077)
- Pipette jetable de 1 mL, en borosilicate (p. ex., Pyrex 7077)
- Tube flexible inerte [diamètre intérieur de 5/16 po (~8 mm)] (nota : les unités de mesure anglo- saxonnes utilisées dans la présente annexe font référence à des composants/outils spécifiques; leur équivalent métrique est fourni à titre indicatif)
- Pointe de pipette jetable de 200 µL
- Trompe à eau [p. ex., Nalgene 6140-0010, en polypropylène, 3/8 po (~9,5 mm), NPT]
- Étamine
- Bande de Parafilm®
- Bande élastique
Outils
- Perceuse électrique, mèches de 3/16 po et 5/16 po (~5 mm et ~8 mm)
- Colle chaude/silicone non toxique (p. ex., GE Silicone II)
- Coupe-verre
- Bec Bunsen
- Pinces
Construction
- Chauffer au bec Bunsen une pipette de l mL en borosilicate, jusqu’à ce qu’elle soit pliable. À l’aide de pinces, la plier délicatement à un angle de 90-120°.
- Avec un coupe-verre, couper la pipette à ~8 cm après le pli et à 4,5 cm du côté opposé.

pipette a été pliée
Voici une photographie d’une pipette de 1 mL qui a été coupée à une longueur d’environ 12,5 cm . La pipette a été pliée à un angle de 45 degrés à 8 cm d’un des bouts.
- Insérer la pointe de pipette sur l’extrémité la plus longue (8 cm ) et enrouler une bande de Parafilm® autour du raccord pour le rendre étanche. Il faudra peut-être couper la pointe de pipette afin qu’elle soit assez large pour permettre d’aspirer les organismes sans les blesser.
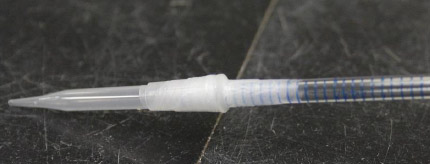
pipette modifiée présentée
Voici une photographie de la même pipette modifiée présentée à la figure I 1 d’où un embout de pipette jetable de 200 µL a été fixé au bout de la plus longue partie à l’aide de Parafilm.
- Couper une longueur de 4 cm d’une pipette droite de 5 mL.
- Percer un trou de 3/16 po (~5 mm) et un autre de 5/16 po (~8 mm) sur les côtés opposés du couvercle en métal (à ~15 mm du bord).

couvercle métallique
Voici une photographie du couvercle métallique d’un bocal en verre à pas de vis. Deux trous ont été percés (un d’environ 5 mm de diamètre et l’autre d’environ 8 mm de diamètre) aux extrémités opposées du couvercle à environ 15 mm du bord chacun.
- Placer le cercle métallique sur le couvercle, puis insérer la pipette pliée dans le trou de 3/16 po (~5 mm) et celle de 4 cm , dans le trou de 5/16 po (~8 mm). Nota : selon l’angle de la pipette pliée de 1 mL, le cercle pourrait être placé après plutôt qu’avant sur le couvercle.
- À l’aide de colle chaude ou de silicone non toxique, former un joint étanche à l’air entre les morceaux de pipette et le couvercle en métal. Laisser sécher pendant ~24 h avant l’emploi.

couvercle métallique mentionné ci-dessus
Voici une photographie du couvercle métallique mentionné ci dessus et de la pipette présentée à la figure I 3. La partie la plus courte de la pipette a été insérée dans le plus petit trou du couvercle et fixée à l’aide de silicone. Une section de 4 cm d’un tube souple de 5/16 po a été insérée dans le plus gros trou et fixée à l’aide de silicone.
- Couper un morceau d’étamine, le plier plusieurs fois, le placer sur la pipette coupée à 4 cm (partie située sur l’envers du couvercle) et le maintenir en place avec une bande élastique.

tube souple
Voici une photographie du fond du couvercle métallique présenté ci dessus avec plusieurs couches de gaze couvrant le fond du tube souple maintenues en place à l’aide d’un élastique.
Utilisation
- À l’aide du tube inerte, relier la trompe à eau raccordée au robinet et la pipette coupée du couvercle du bocal en verre de 125 mL. Visser le cercle métallique pour maintenir le couvercle. Les collemboles aspirés seront recueillis dans ce bocal.

final du dispositif
Voici une photographie présentant l’assemblage final du dispositif. Le couvercle a été vissé sur un bocal en verre de 125 mL et le tube souple a été attaché à une soupape d’aspiration à l’aide d’un tube inerte.
- Régler la puissance d’aspiration en augmentant ou en diminuant le débit d’eau du robinet. Au moment d’aspirer les collemboles, toujours utiliser la puissance la plus basse possible afin de ne pas stresser les organismes.
Séparation des mâles et des femelles
- Une mince couche (~5 mm) de plâtre de Paris (substrat d’élevage) devrait être étalée dans les bocaux de 125 mL utilisés pour séparer, avant la mise en route de l’essai, les mâles et les femelles des élevages synchrones. Il faut utiliser et étiqueter un bocal pour les mâles et un autre pour les femelles.
- Aspirer un petit échantillon de mâles ou de femelles (~20), puis détacher le bocal du dispositif d’aspiration pour vérifier l’état de santé des organismes recueillis. Si les collemboles semblent en santé (ils ne sont pas enroulés sur eux-mêmes et se déplacent activement), poursuivre l’aspiration. S’ils ne semblent pas en bon état, réduire la puissance d’aspiration avant de poursuivre.
- De 5 min en 5 min environ, recueillir des organismes de l’autre sexe - on évitera ainsi que l’aspiration cause un stress excessif aux animaux.
- Après avoir recueilli un nombre suffisant d’organismes, on devrait fermer les bocaux avec les couvercles en métal et les laisser en l’état pendant ≥10 min.
- Vérifier chaque bocal et, à l’aide d’un pinceau, retirer les collemboles blessés ou mal triés.
Collecte d’organismes aux fins des essais
- Utiliser de préférence un bocal en verre de 125 mL, non garni de plâtre de Paris, pour recueillir les organismes aux fins des essais. Afin d’accroître le contraste entre les organismes et l’arrière-plan, on peut couvrir le fond extérieur du bocal avec du papier de couleur ou du ruban-cache.
- Aspirer au hasard les collemboles des élevages synchrones (dans le cas de F. candida) ou recueillir le nombre approprié de mâles et de femelles (v. 3.2.1) à même ceux déjà triés.
- Détacher le bocal de collecte du dispositif d’aspiration et vérifier que le nombre approprié de collemboles a été recueilli.
- Ajouter les organismes aux récipients d’essai en renversant et en tapotant le bocal de collecte au-dessus du sol d’essai. Étant donné que les bocaux ne sont pas garnis de plâtre de Paris, les organismes ne peuvent pas se cramponner au substrat et devraient être faciles à transférer.
- S’assurer que tous les organismes ont été transférés dans le récipient d’essai avant de relier le bocal de collecte au dispositif pour l’aspiration suivante.