Renseignements destinés aux professionnels de la santé : Le cannabis (marijuana, marihuana) et les cannabinoïdes
Plante séchée ou fraîche et huile destinées à l'administration par ingestion ou par d'autres moyens
Agent psychoactif
Le présent document a été préparé par la Direction générale de la légalisation et réglementation du cannabis de Santé Canada pour fournir des renseignements sur l'usage du cannabis (marihuana) et des cannabinoïdes à des fins médicales. Le présent document est un résumé d'articles scientifiques examinés par les pairs et de revues internationales sur les utilisations thérapeutiques possibles et sur les effets néfastes du cannabis et des cannabinoïdes. Ce document ne se veut pas exhaustif et devrait être utilisé en complément avec d'autres sources fiables d'information. Ce document n'est pas une revue systématique ou une méta-analyse de la littérature; une évaluation rigoureuse de la qualité et de la véracité des données disponibles n'a pas été effectuée, et une côte de la qualité des données n'a pas été attribuée. Même si son format s'y apparente, ce document n'est pas une Monographie de produit de médicament qui est un document requis lorsqu'un produit reçoit un Avis de conformité en autorisant la vente au Canada.
Ce document ne saurait être interprété comme constituant l'expression de conclusions ou des opinions de Santé Canada sur l'usage adéquat du cannabis (marihuana) ou des cannabinoïdes à des fins médicales.
Le cannabis n'est pas un produit thérapeutique approuvé, sauf si un produit du cannabis spécifique a obtenu un numéro d'identification de médicament (DIN) et un avis de conformité (AC). La présentation de cette information ne doit pas être interprétée comme une approbation par Santé Canada de l'usage de ce produit ou du cannabis et des cannabinoïdes en général.
Préparé par Santé Canada
Date de la version la plus récente : Printemps 2018
Déclaration de réactions indésirables à des produits à base de cannabis (marihuana, marijuana)
Signaler les effets indésirables associés à la consommation de cannabis et de produits du cannabis est importante afin de pouvoir recueillir des renseignements essentiels concernant les dangers potentiels du cannabis et des produits du cannabis à des fins médicales. Lorsque vous signalez des réactions indésirables, veuillez fournir autant de renseignements que possible, y compris le nom du producteur autorisé, le nom de la marque du produit, le nom de la souche et le numéro de lot du produit utilisé en plus de tout autre renseignement complémentaire sur le formulaire de déclaration des réactions indésirables. Fournir à Santé Canada l'information la plus complète possible au sujet des réactions indésirables aidera Santé Canada à effectuer tout suivi et à prendre toute action qui pourrait être nécessaire.
Toutes les réactions indésirables soupçonnées associées à l'utilisation de cannabis et de produits à base de cannabis (séchée ou fraîche ou sous forme d'huile) à des fins médicales doivent être signalées auprès du Programme Canada Vigilance par l'un des trois moyens suivants :
- En ligne
- En appelant le numéro sans frais 1-866-234-2345
- En remplissant le formulaire de déclaration des réactions indésirables du Programme Canada Vigilance et en l'envoyant :
- par télécopieur (sans frais) au 1-866-678-6789;
- par courrier à l'adresse :
Programme Canada Vigilance
Santé Canada
Indice de l'adresse 0701D
Ottawa (Ontario) K1A 0K9
Vous trouverez des étiquettes affranchies, le formulaire de déclaration de Canada Vigilance et les lignes directrices pour la déclaration des effets indésirables sur le site Web de MedEffetMC Canada.
TABLE DES MATIÈRES
- Liste des figures et des tableaux
- Liste des abréviations
- Paternité de l'œuvre et remerciements
- Aperçu des énoncés récapitulatifs
- 1.0 Le système endocannabinoïde
- 2.0 Pharmacologie clinique
- 3.0 Posologie
- 4.0 Usages thérapeutiques possibles
- 4.1 Soins palliatifs
- 4.2 Qualité de vie
- 4.3 Nausées et vomissements induits par la chimiothérapie
- 4.4 Syndrome cachectique (cachexie, p. ex. résultant de la blessure des tissues par l'infection ou d'une tumeur) et perte de l'appétit (anorexie) chez les patients atteints du SIDA ou d'un cancer, et de l'anorexie mentale
- 4.5 Sclérose en plaques, sclérose latérale amyotrophique, traumatisme médullaire et les maladies de la moelle épinière
- 4.6 Épilepsie
- 4.7 Douleur
- 4.7.1 Douleur aiguë
- 4.7.2 Douleur chronique
- 4.7.2.1 Douleur inflammatoire et neuropathique chronique induite expérimentalement
- 4.7.2.2 Douleur neuropathique et douleur chronique non cancéreuse chez l'humain
- 4.7.2.3 Douleur causée par un cancer
- 4.7.2.4 Effet « d'épargne en opiacés » et la synergie cannabinoïdes-opioïdes
- 4.7.2.5 Céphalées et migraines
- 4.8 Arthritides et troubles musculosquelettiques
- 4.9 Autres maladies et symptômes
- 4.9.1 Troubles du mouvement
- 4.9.2 Glaucome
- 4.9.3 Asthme
- 4.9.4 Hypertension
- 4.9.5 Stress et troubles psychiatriques
- 4.9.6 Maladie d'Alzheimer et démence
- 4.9.7 Inflammation
- 4.9.8 Troubles du système gastro-intestinal (syndrome du côlon irritable, maladie intestinale inflammatoire, hépatite, pancréatite, syndrome métabolique/obésité)
- 4.9.8.1 Syndrome du côlon irritable
- 4.9.8.2 Maladies inflammatoires de l'intestin (maladie de Crohn, colite ulcéreuse)
- 4.9.8.3 Maladies du foie (hépatite, fibrose, stéatose, lésion de reperfusion de l'ischémie, encéphalopathie hépatique)
- 4.9.8.4 Syndrome métabolique, obésité, diabète
- 4.9.8.5 Maladies du pancréas (diabète, pancréatite)
- 4.9.9 Propriétés antinéoplasiques
- 4.9.10 Nouvelles utilisations thérapeutiques possibles
- 5.0 Précautions
- 6.0 Mises en garde
- 7.0 Effets indésirables
- 8.0 Surdose/toxicité
- Références
Liste des figures et des tableaux
Figures
Figure 1
Le système endocannabinoïde dans le système nerveux
Figure 2
Pharmacocinétique du THC
Figure 3
Algorithme clinique proposé à l'intention des médecins qui envisagent d'appuyer l'usage thérapeutique du cannabis chez un patient souffrant de douleur neuropathique chronique incurable
Tableaux
Tableau 1
Actions pharmacologiques sélectionnées du cannabis/cannabinoïdes psychoactifs
Tableau 2
Recommendations pour l'évaluation et la gestion des patients
Tableau 3
Relation entre le pourcentage de THC présent dans la matière végétale et la dose (en mg de THC) disponible dans un joint moyen
Tableau 4
Comparaison entre le cannabis et les médicaments sur ordonnance à base de cannabinoïdes
Tableau 5
Essais cliniques positifs, randomisés, à double insu et contrôlés par placebo publiés sur le cannabis fumé et le cannabis vaporisé et les bienfaits thérapeutiques connexes
Liste des abréviations
- 2-AG :
- 2-arachidonoylglycérol
- 5-ASA :
- acide 5-aminosalicylique (5-aminosalicylic acid)
- 5-HT :
- 5-hydroxytryptamine
- 2-OG :
- 2-oléoyglycérol
- AA :
- acide arachidonique
- ACCESS :
- AIDS Care Cohort to evaluate Exposure to Survival Services
- ACTH :
- hormone adrénocorticotrope (adrenocorticotropic hormone)
- ADN :
- acide désoxyribonucléique
- AEA :
- anandamide
- AINS :
- anti-inflammatoire non stéroïdien
- AIT :
- accident ischémique transitoire
- AKT1 :
- AKT serine/threonine kinase 1
- ALAT :
- alanine aminotransférase
- Alb. :
- Alberta
- ALSPAC :
- Avon Longitudinal Study of Parents and Children
- AMP :
- adénosine monophosphate
- Apo-E :
- apolipoprotéine E
- APRI :
- AST-to-platelet ratio index
- ARN :
- acide ribonucléique
- ARNm :
- acide ribonucléique messager
- ASAT :
- aspartate aminotransférase
- AUC :
- aire sous la courbe (area-under-the-curve)
- AUC12 :
- aire sous la courbe 12 heures (12-hour AUC)
- AVC :
- accident vasculaire cérébral
- BHO :
- huile de haschich butane (butane hash oil)
- b.i.d.. :
- bis in die (c.-à-d. deux fois par jour)
- BCOS :
- Bipolar Comprehensive Outcomes Study
- BDNF :
- facteur neurotrophique issu du cerveau (brain-derived neurotrophic factor)
- BDS :
- extrait botanique (botanical drug substance)
- BPI :
- Brief Pain Inventory
- C :
- commencement
- c. :
- contre
- Ca2+ :
- calcium
- c.-à-d. :
- c'est-à-dire
- CAMPS :
- Cannabis Access for Medical Purposes Survey
- CAMS :
- Cannabis in Multiple Sclerosis
- CAPS :
- Clinician-Administered PTSD Scale
- CARDIA :
- Coronary Artery Risk Development In young Adults
- CB :
- cannabinoïde
- C.-B. :
- Colombie-Britannique
- CBC :
- cannabichromène
- CBD :
- cannabidiol
- CBDA :
- acide cannabidiolique
- CBDV :
- cannabidivarine
- CBG :
- cannabigérol
- CBN :
- cannabinol
- CCL :
- ligan de type chimiokine (motif C-C) (chemokine (C-C motif) ligand)
- CDAI :
- indice d'activité de la maladie de Crohn (Crohn's disease activity index)
- CDKL5 :
- cyclin-dependent kinase-like 5
- CGI-I :
- amélioration de l'impression clinique globale (clinical global impression improvement)
- CGI-S :
- échelle d'impression clinique globale (clinical global impression scale)
- CI50 :
- concentration inhibitrice médiane
- CIM :
- classification internationale des maladies
- Cmax :
- concentration sanguine maximale d'une drogue
- CNR1 :
- récepteur cannabinoïde 1 (cannabinoid receptor 1)
- CNR2 :
- récepteur cannabinoïde 2 (cannabinoid receptor 2)
- COMT :
- catéchol-O-méthyltransférase
- COX :
- cyclo-oxygénase
- CUPID :
- Cannabinoid Use in Progressive Inflammatory Brain Disease
- CVF :
- capacité vitale forcée
- CYP :
- cytochrome P450
- D :
- durée de l'action
- DAG :
- diacylglycérol
- DAGL :
- diacylglycérol lipase
- DAT1 :
- transporteur actif de dopamine 1 (dopamine active transporter 1)
- DE50 :
- dose efficace médiane
- DL50 :
- dose léthale médiane
- DNBS :
- acide dinitrobenzène sulfonique (dinitrobenzene sulfonic acid)
- DSM-5 :
- manuel diagnostique et statistique des troubles mentaux (cinquième édition)
- DSM-IV :
- manuel diagnostique et statistique des troubles mentaux (4e édition)
- E :
- effet maximal
- E.T. :
- écart-type
- ECA :
- enzyme de conversion de l'angiotensine
- EDSP :
- Early Developmental Stages of Psychopathology
- EEG :
- électroencéphalogramme
- EEN :
- échelle d'évaluation numérique
- EEN-ID :
- échelle d'évaluation numérique pour l'intensité de la douleur
- EMBLEM :
- European Mania in Bipolar Longitudinal Evaluation of Medication
- EORTC QLQ-C30 :
- European Organization for Research and Treatment of Cancer Quality of Life Questionnaire, Core Module
- EQ-5D :
- EuroQoL five dimensions questionnaire
- ESAS :
- Edmonton Symptom Assessment System
- ESCCAD :
- Enquête de Surveillance Canadienne de la Consommation d'Alcool et de Drogues
- ESPT :
- état de stress post-traumatique
- ETA :
- éthanolamine
- EVA :
- échelle visuelle analogique
- FAACT :
- l'évaluation fonctionnelle du traitement de l'anorexie/cachexie (Functional Assessment of Anorexia/Cachexia Treatment)
- FAAH :
- hydrolase des amides d'acides gras (fatty acid amide hydrolase)
- FSH :
- hormone folliculo-stimulante (follicle stimulating hormone)
- g :
- gramme
- GABA :
- acide gamma-aminobutyrique (gamma-aminobutyric acid)
- GB :
- Grande-Bretagne
- GI :
- gastro-intestinal
- GnRH :
- gonadolibérine (gonadotropin-releasing hormone)
- GPR55 :
- récepteur 55 couplé aux protéines G (G protein-coupled receptor 55)
- GRADE :
- Grading of Recommendations, Assessment, Development and Evaluation
- h :
- heure
- HDL :
- lipoprotéine de haute densité (high density lipoprotein)
- HHS :
- hypothalamo-hypophyso-surrénalien
- HMG-CoA :
- 3-hydroxy-3-méthylglutaryl-coenzyme A
- HOMA-IR :
- homeostatic model assessment of insulin resistance
- HPO :
- hypothalamo-hypophyso-ovarien
- HR :
- rapport de risques (hazard ratio)
- IC :
- intervalle de confiance
- ICAM-1 :
- molécule-1 d'adhérence intercellulaire (intercellular adhesion molecule-1)
- IFN :
- interféron
- IIQ :
- intervalle interquartile
- IL :
- interleukine
- IM :
- intramusculaire
- IMC :
- indice de masse corporelle
- IND :
- nouveau médicament d'investigation (investigational new drug)
- iNOS :
- oxyde nitrique synthase inductible (inducible nitric oxide synthase)
- IP :
- intrapéritonéal
- Î.-P.-É. :
- Île-du-Prince-Édouard
- IRMf :
- imagerie par résonance magnétique fonctionnelle
- ITD :
- imagerie du tenseur de diffusion
- IV :
- intraveineux
- K+ :
- potassium
- kg :
- kilogramme
- L :
- litre
- LCR :
- liquide céphalorachidien
- LDL :
- lipoprotéine de basse densité (low density lipoprotein)
- LH :
- hormone lutéinisante (luteinizing hormone)
- LOX :
- lipo-oxygénase
- MA :
- maladie d'Alzheimer
- MAGL :
- monoacylglycérol lipase
- Man. :
- Manitoba
- Met :
- méthionine
- mg :
- milligramme
- MGCH :
- maladie du greffon contre l'hôte
- MH :
- maladie de Huntington
- MII :
- maladie inflammatoire de l'intestin
- min :
- minute
- mL :
- millilitre
- MMP :
- métalloprotéinase matricielle (matrix metalloproteinase)
- MOVE 2 :
- Mobility Improvement in Multiple Sclerosis-Induced Spasticity Study
- MP :
- maladie de Parkinson
- MSIS-29 :
- Multiple Sclerosis Impact Scale 29
- MUSEC :
- Multiple Sclerosis and Extract of Cannabis trial
- Na+ :
- sodium
- NAPE :
- N-arachidonoylphosphatidyléthanolamine
- NASEM :
- Académie nationale des sciences, du génie et de la médecine (National Academy of Sciences, Engineering and Medicine)
- N.-B. :
- Nouveau-Brunswick
- NCS :
- National Comorbidity Survey
- NCS-R :
- National Comorbidity Survey - Replication
- N.-É. :
- Nouvelle-Écosse
- NEMESIS :
- Netherlands Mental Health Survey and Incidence Study
- NESARC :
- National Epidemiological Survey on Alcohol and Related Conditions
- ng :
- nanogramme
- NHANES :
- National Health and Nutrition Examination Survey
- NK :
- cellules Natural killer
- NK-1 :
- neurokinine 1
- nM :
- nanomolaire
- NMDA :
- N-méthyle D-aspartate
- nmol :
- nanomole
- NRG1 :
- neuréguline 1
- NSDUH :
- National Survey on Drug Use and Health
- NST :
- nombre de sujets à traiter
- Nt :
- Nunavut
- NVIC :
- nausées et vomissements induits par la chimiothérapie.
- OEA :
- oleoyléthanolamide
- OMS :
- Organisation mondiale de la santé
- Ont. :
- Ontario
- OSSI :
- Organisation de soins de santé intégrés
- PASAT :
- Paced Auditory Serial Addiction Test
- PDQ-39 :
- 39-Item Parkinson Disease Questionnaire
- p. ex. :
- par exemple
- PEA :
- palmitoyléthanolamide
- PIO :
- pression intraoculaire
- PLD :
- phospholipase-D
- PO :
- administration orale
- POMS :
- Profile of Mood States
- p/p :
- poids/poids
- PPAR :
- récepteur activable par les proliférateurs des peroxysomes (peroxisome proliferator-activated receptor)
- PRISMA :
- Preferred Reporting Items for Systematic Reviews and Meta-Analyses
- Qc :
- Québec
- q.i.d. :
- quater in die (c.-à-d. quatre fois par jour)
- QI :
- quotient intellectuel
- QV :
- qualité de vie
- QVLS :
- qualité de vie liée à la santé
- RACFM :
- Règlement sur l'accès au cannabis à des fins médicales
- RC :
- rapport de cotes
- RCA :
- rapport de cotes ajusté
- RR :
- risque relatif
- Rx :
- prescription médicale
- s :
- seconde
- SAFTEE :
- Systematic Assessment of Treatment Emergent Events
- Sask. :
- Saskatchewan
- s.c. :
- sous-cutanée
- SCI :
- syndrome du côlon irritable
- SCI-A :
- SCI à motif alternatif (alternance constipation/diarrhée)
- SCI-C :
- SCI à constipation prédominante
- SCI-D :
- SCI à diarrhée prédominante
- SDRC :
- syndrome de douleur régionale complexe
- SDLP :
- écart-type de la position latérale
- SEC :
- système endocannabinoïde
- SF-36 :
- 36-Item Short Form Health Survey
- SGT :
- syndrome de Gilles de la Tourette
- SHC :
- syndrome d'hyperémèse cannabinoïde
- SHNA :
- stéatose hépatique non alcoolique
- SIBDQ :
- Short Inflammatory Bowel Disease Questionnaire
- SIDA :
- syndrome d'immunodéficience acquise
- SLA :
- sclérose latérale amyotrophique
- SNC :
- système nerveux central
- SNP :
- polymorphisme mononucléotidique (Single Nucleotide Polymorphism)
- S.O. :
- sans objet
- SP :
- sclérose en plaques
- S-TOPS :
- Short-Form Treatment Outcomes in Pain Survey
- SYS :
- Saguenay Youth Study (étude sur les jeunes du Saguenay-Lac-Saint-Jean)
- t.i.d. :
- ter in die (c.-à-d. trois fois par jour)
- TAR :
- traitement antirétroviral
- THC :
- delta-9-tétrahydrocannabinol
- THCA :
- acide tétrahydrocannabinolique
- THCV :
- tétrahydrocannabivarin
- TLCL :
- triglycéride à chaîne longue de lipides
- TM :
- traumatisme médullaire
- Tmax :
- délai pour atteindre la concentration sanguine maximale d'une drogue
- T.-N. :
- Terre-Neuve et Labrador
- TNBS :
- acide trinitrobenzène sulfonique (trinitrobenzene sulfonic acid)
- TNF :
- facteur de nécrose tumorale (tumor necrosis factor)
- T.N.-O. :
- Territoires du Nord-Ouest
- TRH :
- tyrolibérine (thyrotropin-releasing hormone)
- TRPV1 :
- canal ionique àpotentiel de récepteur transitoire vanilloïde de type 1 (transient receptor potential vanilloid channel 1)
- TUC :
- trouble d'utilisation du cannabis
- TWSTRS :
- Toronto Western Spasmodic Torticollis Rating Scale
- UDI :
- utilisateurs de drogues par injection
- UPDRS :
- Unified Parkinson's Disease Rating Scale
- Val :
- valine
- VCAM-1 :
- molécule-1 d'adhérence des cellules vasculaires (vascular cellular adhesion molecule-1)
- VEMS :
- volume expiratoire maximal à la seconde
- VIH :
- virus de l'immunodéficience humaine
- VIS :
- virus d'immunodéficience simienne
- Yn :
- Yukon
- βA :
- beta-amyloïde
- Δ9-THC :
- delta 9-tétrahydrocannabinol
- µg :
- microgramme
- μM :
- micromolaire
Paternité de l'œuvre et remerciements
Auteur : Hanan Abramovici Ph.D.
Co-auteurs : Sophie-Anne Lamour, Ph.D. et George Mammen, Ph.D.
Affiliations :
Direction générale de la légalisation et réglementation du cannabis, Santé Canada, Ottawa, ON, Canada K1A 0K9
Courriel : hanan.abramovici@canada.ca
Remerciements :
Santé Canada tient à exprimer sa reconnaissance et ses remerciements aux personnes ci-après pour leurs commentaires et suggestions sur le contenu de ce document d'information.
Donald I. Abrams, M.D.
Médecin-chef d'hématologie et d'oncologie
Hôpital général de San Francisco
Oncologie intégrée
Centre de médecine intégrée Osher
Professeur de médecine clinique
University of California San Francisco
San Francisco, CA 94143-0874
É-U
Pierre Beaulieu, M.D., Ph.D., F.R.C.A.
Professeur titulaire
Département de pharmacologie et d'anesthésiologie
Faculté de médecine
Université de Montréal
Bureau R-408, Pavillon Roger-Gaudry
C.P. 6128, succursale Centre-ville
Montréal (Québec)
H3C 3J7
Canada
Bruna Brands, Ph.D.
Professeur titulaire
Département de pharmacologie et de toxicologie
Directrice de programme, Programme collaboratif d'études sur la toxicomanie
University of Toronto
33, rue Russell
Toronto (Ontario)
M5S 2S1
Canada
Ziva Cooper, Ph.D.
Professeure adjointe de neurobiologie clinique
Division de l'abus de substances
Institut psychiatrique de l'État de New York et Département de psychiatrie
Collège des médecins et chirurgiens de l'Université Columbia
1051 Riverside Drive
New York, NY 10032
États-Unis
Paul J. Daeninck, M.D., M.Sc., F.R.C.P.C.
Président, Groupes sur le siège de la maladie de la gestion des symptômes et des soins palliatifs
ActionCancer Manitoba
Professeur adjoint
Collège de médecine de l'Université du Manitoba
Hôpital Saint-Boniface
409, avenue Taché
Winnipeg, MB
R2H 2A6
Canada
Mahmoud A. ElSohly, Ph.D.
Professeur de recherche et professeur d'études pharmaceutiques
Centre national de recherches sur les produits naturels et Département d'études pharmaceutiques
École de pharmacie
University of Mississippi
University, MS 38677
É-U
Javier Fernandez-Ruiz, Ph.D.
Professeur titulaire de biochimie et de biologie moléculaire
Département de biochimie et de biologie moléculaire
Faculté de médecine
Université Complutense
Madrid, 28040
Espagne
Tony P. George, M.D., F.R.C.P.C.
Professeur et codirecteur de la Division du cerveau et des produits thérapeutiques
Département de psychiatrie, Université de Toronto
Chef de la Division de la schizophrénie
Centre de toxicomanie et de santé mentale
1001, rue Queen ouest, Unité 2, Pièce 118A
Toronto (Ontario)
M6J 1H4
Canada
Manuel Guzman, Ph.D.
Professeur titulaire
Département de biochimie et de biologie moléculaire
Faculté de Chimie
Université Complutense
Madrid, 28040
Espagne
Matthew N. Hill, Ph.D.
Professeur adjoint
Département de biologie cellulaire et anatomie & psychiatrie
Hotchkiss Brain Institute
University of Calgary
Calgary (Alberta)
T2N 4N1
Canada
Cecilia J. Hillard, Ph.D.
Professeure
Département de pharmacologie et de toxicologie
Directrice du centre de recherche en neuroscience
Medical College of Wisconsin
8701 Watertown Plank Road
Milwaukee, Wisconsin 53226
États-Unis
Mary Lynch, M.D., F.R.C.P.C.
Professeure d'anesthésie, de psychiatrie et de pharmacologie
Dalhousie University
Directeur, Pain Management Unit-Capital Health
Centre des sciences de la santé Queen Elizabeth II
4e étage, édifice Dickson
5820, avenue University
Halifax (N.-É.)
B3H 1V7
Canada
Jason J. McDougall, Ph.D.
Professeur Département de pharmacologie et d'anesthésie, de gestion de la douleur et de médecine périopératoire
Dalhousie University
5850, rue College
Halifax (N.-É.)
B3H 4R2
Canada
Raphael Mechoulam, Ph.D.
Professeur
Institut de recherche sur les drogues, Faculté de médecine
Hebrew University
Jérusalem
91120
Israël
Linda Parker, Ph.D.
Professeure et titulaire de la Chaire de recherche du Canada en neurosciences du comportement
Département de psychologie
University of Guelph
Guelph (Ontario)
N1G 2W1
Canada
Roger G. Pertwee, MA, D.Phil. D.Sc.
Professeur de neuropharmacologie
Institut des sciences médicales
University of Aberdeen
Aberdeen
AB25 2ZD
Écosse, Royaume-Uni
Keith Sharkey, Ph.D.
Professeur
Département de physiologie, de biophysique et de médecine
University of Calgary
HSC 1745
3330 Hospital Drive NW
Calgary (Alberta)
T2N 4N1
Canada
Mark Ware, M.D., M.R.C.P., M.Sc.
Professeur associé
Départements d'Anesthésie et de Médecine Familiale
Université McGill
Directeur de la recherche clinique
Unité de gestion de la douleur Alan Edwards
A5.140-Hôpital général de Montréal
1650, avenue Cedar
Montréal (Québec)
H3G 1A4
Canada
Aperçu des énoncés récapitulatifs
Les énoncés récapitulatifs suivants visent à résumer le contenu des sections 4.0 (Usages thérapeutiques possibles) et 7.0 (Effets indésirables) et leurs sous-sections respectives. Les énoncés récapitulatifs peuvent être également trouvés dans leurs sections et sous-sections respectives dans le corps même du document. Remarque: la plupart des études cliniques sur le cannabis (expérimental ou thérapeutique) ont été réalisées avec du cannabis séché contenant plus de THC que de CBD et typiquement, mais pas toujours, avec du THC de plus faible teneur (< 9 % de THC). De plus, la majorité des études cliniques sur le cannabis (expérimental ou thérapeutique) ont administré du cannabis séché en fumant. Enfin, les résultats d'études cliniques sur le cannabis à des fins thérapeutiques pourraient ne pas être applicables à d'autres chémotypes de cannabis ou d'autres produits du cannabis ayant des teneurs et ratios en THC et en CBD différents.
4.0 Usages thérapeutiques possibles
4.1 Soins palliatifs
- Jusqu'à maintenant, les données provenant d'études d'observation et d'études cliniques suggèrent que le cannabis (données limitées) et les cannabinoïdes sur ordonnance (p. ex., le dronabinol, le nabilone ou le nabiximols) pourraient être pratiques pour le soulagement d'une gamme de symptômes uniques ou cooccurrents souvent observés dans le cadre de soins palliatifs
- Ces symptômes comprennent, mais ne sont pas limités à, la nausée réfractaire et les vomissements associés à la chimiothérapie ou la radiothérapie, l'anorexie ou la cachexie, la douleur réfractaire aiguë, l'humeur dépressive et l'anxiété aiguë et l'insomnie.
- Un nombre limité d'études observationnelles suggèrent que l'usage de cannabinoïdes en soins palliatifs pourrait aussi être associé à une diminution du nombre de certains médicaments utilisés par cette population de patients.
4.2 Qualité de vie
- Les études cliniques disponibles rapportent des effets mixtes du cannabis et des cannabinoïdes sur ordonnance sur les mesures de la qualité de vie (QV) pour une variété de troubles divers.
4.3 Nausées et vomissements induits par la chimiothérapie
- Les études précliniques démontrent que certains cannabinoïdes (THC, CBD, THCV, CBDV) et acides de cannabinoïdes (THCA et CBDA) suppriment les nausées et les vomissements aigus ainsi que les nausées d'anticipation.
- Les études cliniques suggèrent que la consommation de certains cannabinoïdes et de cannabis (données limitées) peut soulager les nausées et les vomissements induits par la chimiothérapie (NVIC).
4.4 Syndrome cachectique (cachexie, p. ex. résultant de la blessure des tissus par l'infection ou d'une tumeur) et perte de l'appétit (anorexie) chez les patients souffrant du SIDA ou d'un cancer, et de l'anorexie mentale
- Les données disponibles provenant d'études cliniques chez l'humain suggèrent que le cannabis (données limitées) et le dronabinol pourraient augmenter l'appétit et la consommation de calories, et promouvoir le gain de poids chez les patients atteints du VIH/SIDA.
- Les preuves pour le dronabinol sont toutefois mixtes et les effets sont modestes chez les patients atteints de cancers et sont faibles chez les patients atteints d'anorexie mentale.
4.5 Sclérose en plaques, sclérose latérale amyotrophique, traumatisme médullaire et les maladies de la moelle épinière
- Les données provenant d'études précliniques suggèrent que le THC, le CBD et le nabiximols soulagent les symptômes de tremblements, d'hypertonie spastique et d'inflammation associés à la sclérose en plaques (SP).
- Les données disponibles d'essais cliniques suggèrent que le cannabis (données limitées) et certains cannabinoïdes (dronabinol, nabiximols, THC/CBD) sont associés à une certaine amélioration des symptômes de la SP et du traumatisme médullaire (TM), y compris la spasticité, les spasmes, la douleur, le sommeil et les symptômes associés au dysfonctionnement de la vessie.
- Des données très limitées provenant d'études précliniques suggèrent que certains cannabinoïdes délaient de manière modeste la progression de la maladie et prolongent la survie dans des modèles animaux de sclérose latérale amyotrophique (SLA), alors que les résultats d'un nombre très limité d'études cliniques sont mixtes.
4.6 Épilepsie
- Les preuves anecdotiques suggèrent un effet antiépileptique du cannabis (souches prédominantes en THC et CBD).
- Les données disponibles d'études précliniques suggèrent que certains cannabinoïdes (CBD) pourraient posséder des caractéristiques antiépileptiques et anti-convulsives, tandis que les agonistes du récepteur CB1 (THC) pourraient posséder des caractéristiques pro- ou antiépileptiques.
- Toutefois, les preuves cliniques pour un effet antiépileptique du cannabis sont plus faibles, mais émergentes et nécessitent des études plus approfondies.
- Des données provenant d'études cliniques avec l'EpidiolexMD (CBD oral) suggèrent l'efficacité et la tolérabilité d'EpidiolexMD pour les convulsions pharmacorésistantes dans le syndrome de Dravet ou pour le syndrome Lennox-Gastaut résistant au traitement.
- Des données provenant d'études observationnelles suggèrent une association entre le CBD (préparations à base de plantes et huile) et une réduction de la fréquence des crises épileptiques ainsi qu'une amélioration de la qualité de vie chez les adolescents atteints d'épilepsie pharmacorésistante rare et grave.
- L'EpidiolexMD a été approuvé par la FDA (Juin 2018) chez les patients de 2 ans et plus pour traiter les crises épileptiques associées au syndrome de Dravet et au syndrome Lennox-Gastaut résistant au traitement.
4.7 Douleur
4.7.1 Douleur aiguë
- Les études précliniques suggèrent que certains cannabinoïdes peuvent bloquer les réactions à la douleur aiguë induite de façon expérimentale dans des modèles animaux.
- Les résultats provenant d'études cliniques avec du cannabis fumé, du THC oral, des extraits de cannabis et le nabilone sur la douleur aiguë induite expérimentalement chez des bénévoles humains en santé sont limités et mixtes et suggèrent des effets selon la dose dans certains cas : des doses plus faibles de THC semblent avoir un effet analgésique et des doses plus élevées semblent avoir un effet hyperalgésique.
- Les études cliniques sur certains cannabinoïdes (nabilone, THC oral, lévonontradol, AZD1940, GW842166) pour la douleur postopératoire suggèrent un manque d'efficacité.
4.7.2 Douleur chronique
4.7.2.1 Douleur inflammatoire et neuropathique chronique induite expérimentalement
- Les endocannabinoïdes, le THC, le CBD, le nabilone et certains cannabinoïdes synthétiques ont tous été identifiés comme possédant des effets antinociceptifs dans des modèles animaux de douleur chronique (inflammatoire et neuropathique).
4.7.2.2 Douleur neuropathique et douleur chronique non cancéreuse chez l'humain
- Quelques études ayant utilisé des méthodes expérimentales possédant de la validité prédictive pour les pharmacothérapies utilisées pour soulager la douleur chronique ont signalé des effets analgésiques du cannabis fumé.
- De plus, il existe des preuves plus cohérentes de l'efficacité des cannabinoïdes (cannabis fumé ou vaporisé, nabiximols, dronabinol) dans le traitement de la douleur chronique d'étiologies différentes, surtout dans des cas où des traitements traditionnels ont été essayés et ont échoué.
4.7.2.3 Douleur causée par un cancer
- Les données cliniques disponibles limitées pour certains cannabinoïdes (le dronabinol, le nabiximols) suggèrent un effet analgésique modeste pour le dronabinol et un effet analgésique modeste et mixte pour le nabiximols sur la douleur causée par le cancer.
4.7.2.4 Effet « d'épargne en opiacés » et la synergie cannabinoïdes-opioïdes
- Bien que les études précliniques et les études de cas suggèrent que certains cannabinoïdes pourraient posséder un effet « d'épargne en opiacés », les études épidémiologiques et cliniques menées avec du THC oral et du nabiximols ont obtenu des résultats mixtes.
- Des études observationnelles suggèrent une association entre les états américains avec des lois autorisant l'accès au cannabis (à des fins médicales et non médicales) et une baisse des taux d'opioïdes prescrits et de mortalité associée aux opioïdes.
4.7.2.5 Céphalées et migraines
- Les preuves soutenant l'utilisation du cannabis et des cannabinoïdes dans le soulagement des céphalées et des migraines sont très limitées et mixtes
4.8 Arthritides et troubles musculosquelettiques
- Les données provenant d'études précliniques suggèrent que la stimulation des récepteurs CB1 et CB2 soulage des symptômes de l'arthrose, et le THC et le CBD soulagent des symptômes de la polyarthrite rhumatoïde.
- Les données provenant d'études cliniques sont très limitées et seuls des effets modestes ont été observés dans l'utilisation du nabiximols dans le traitement de la polyarthrite rhumatoïde.
- Il n'existe aucune étude clinique concernant l'utilisation du cannabis dans le traitement de la fibromyalgie et les données cliniques limitées avec le dronabinol et le nabilone suggèrent un effet modeste sur la réduction de la douleur et de l'anxiété, et l'amélioration du sommeil.
- Le rôle des cannabinoïdes dans l'ostéoporose a seulement été étudié dans des études précliniques et est complexe et contradictoire.
4.9 Autres maladies et symptômes
4.9.1 Troubles du mouvement
4.9.1.1 Dystonie
- Les données limitées provenant d'études précliniques suggèrent qu'un agoniste synthétique des récepteurs CB1 et CB2 pourrait soulager des symptômes ressemblant à ceux de la dystonie, et que le CBD retardes la progression de la dystonie.
- Les données provenant d'un nombre limité d'études de cas et de petits essais cliniques ouverts ou contrôlés par placebo suggèrent une amélioration des symptômes de dystonie avec du cannabis inhalé, des effets mixtes du THC oral, une amélioration des symptômes de dystonie avec du CBD oral et une absence d'effets du nabilone sur les symptômes de dystonie.
4.9.1.2 Maladie de Huntington
- Les données provenant d'études précliniques signalent des résultats mixtes avec le THC sur les symptômes ressemblant à ceux de la Maladie de Huntington (MH).
- Les données limitées provenant d'études de cas et des essais cliniques à petite envergure sont mixtes et suggèrent une absence d'effets du CBD, du nabilone et du nabiximols et une amélioration limitée des symptômes de MH avec le cannabis fumé.
4.9.1.3 Maladie de Parkinson
- Les résultats d'un nombre limité d'études précliniques, de cas, cliniques et observationnelles sur certains cannabinoïdes pour le traitement des symptômes de la maladie de Parkinson (MP) sont mixtes.
- Une étude de cas sur le cannabis fumé ne suggère aucun effet alors qu'une étude observationnelle sur le cannabis fumé suggère une amélioration des symptômes.
- Une étude clinique à petite envergure portant sur le nabilone suggère une amélioration des symptômes, tandis qu'une autre étude clinique sur un extrait oral de cannabis (THC/CBD) et une étude clinique avec du CBD ne suggèrent aucune amélioration des symptômes.
4.9.1.4 Syndrome de Gilles de la Tourette
- Les données limitées provenant de petites études cliniques suggèrent que le THC administré par voie orale améliore certains symptômes du syndrome de Gilles de La Tourette (SGT) (tics).
4.9.2 Glaucome
- Les données limitées provenant de petites études cliniques suggèrent que l'administration orale de THC réduit la pression intraoculaire (PIO), tandis que l'administration orale de CBD pourrait, au contraire, provoquer une augmentation de la PIO.
4.9.3 Asthme
- Les données limitées provenant d'études précliniques et cliniques sur l'effet du THC en aérosol sur les symptômes asthmatiques sont mixtes.
- L'inhalation d'irritants pulmonaires générés par la fumée/vaporisation du cannabis peut aggraver les symptômes asthmatiques.
4.9.5 Stress et troubles psychiatriques
4.9.5.1 Anxiété et dépression
- Des données provenant d'études cliniques et précliniques suggèrent que le THC présente des effets biphasiques sur l'humeur : les faibles doses de THC possèdent des effets anxiolytiques et de hausse de l'humeur et les doses élevées de THC possèdent des effets anxiogènes et de baisse de l'humeur.
- Les données limitées d'un petit nombre d'études cliniques sur le cannabis contenant du THC et sur certains cannabinoïdes sur ordonnance suggèrent que ces substances pourraient améliorer les symptômes d'anxiété et de dépression chez les patients souffrant d'anxiété et/ou de dépression secondaires à d'autres maladies chroniques (p. ex., patients souffrant du VIH/SIDA, SP, douleur neuropathique chronique).
- Les données provenant d'études précliniques suggèrent que le CBD présente des effets anxiolytiques dans différents modèles animaux d'anxiété, tandis que des données limitées provenant d'études cliniques suggèrent que le CBD pourrait posséder des effets anxiolytiques dans un modèle expérimental d'anxiété sociale.
- Les données limitées de certaines études observationnelles suggèrent aussi que le cannabis contenant des concentrations égales de CBD et de THC est associé à une atténuation de certaines perturbations de l'humeur (p. ex., l'anxiété ou le découragement) comme observés avec le cannabis prédominant en THC utilisé par des patients à des fins médicales.
4.9.5.2 Troubles du sommeil
- Les données expérimentales chez l'humain suggèrent que le cannabis et le THC possèdent des effets selon la dose sur le sommeil : les doses plus faibles semblent diminuer la latence d'endormissement et augmenter le sommeil lent et la durée totale de sommeil, alors que les doses élevées semblent causer des perturbations du sommeil.
- Les données limitées d'études cliniques suggèrent aussi que certains cannabinoïdes (le cannabis, le nabilone, le dronabinol et le nabiximols) pourraient améliorer le sommeil chez les patients souffrant de perturbations du sommeil associées à certaines maladies chroniques.
4.9.5.3 État de stress post-traumatique
- Les études expérimentales précliniques et humaines suggèrent un rôle pour certains cannabinoïdes dans le soulagement de symptômes semblables à ceux de l'état de stress post-traumatique (ESPT).
- Toutefois, bien que des données limitées provenant d'études cliniques à court terme suggèrent un potentiel pour le THC oral et le nabilone à diminuer certains symptômes de l'ESPT, il n'existe aucune étude clinique à long-terme pour ces préparations ou aucune étude clinique sur les effets du cannabis fumé ou vaporisé sur l'ESPT.
- Des preuves limitées issues d'études observationnelles suggèrent une association entre la consommation de cannabis à base de plantes et des niveaux persistants / élevés de sévérité des symptômes de l'ESPT au fil du temps.
- Il existe des données limitées suggérant une association entre l'ESPT et le TUC.
4.9.5.4 Symptômes de sevrage de l'alcool et des opioïdes (symptômes de sevrage de drogue/substitution)
- Les études précliniques suggèrent que l'agonisme aux récepteurs CB1 (p. ex. le THC) pourrait aider à augmenter les propriétés renforçantes de l'alcool, augmenter la consommation d'alcool et augmenter les risques de rechute de consommation d'alcool ainsi qu'exacerber la sévérité des symptômes du sevrage alcoolique.
- Les études précliniques suggèrent que certains cannabinoïdes (p. ex. le THC) pourraient soulager les symptômes du sevrage aux opiacés.
- Les données provenant d'études observationnelles suggèrent que la consommation de cannabis pourrait aider à soulager les symptômes du sevrage aux opiacés, mais les données cliniques sont insuffisantes pour tirer conclusions fiables.
4.9.5.5 Schizophrénie et psychose
- Des données considérables provenant d'études précliniques, cliniques et épidémiologiques appuient une association entre la consommation de cannabis (surtout le cannabis prédominant en THC) et le THC et un risque accru de psychoses et de schizophrénie.
- Des preuves émergentes provenant d'études précliniques, cliniques et épidémiologiques suggèrent que le CBD pourrait atténuer la psychose induite par le THC.
4.9.6 Maladie d'Alzheimer et démence
- Les études précliniques suggèrent que le THC et le CBD pourraient protéger contre l'excitotoxicité, le stress oxidatif et l'inflammation dans les modèles animaux de la maladie d'Alzheimer (MA).
- Les études de cas, cliniques et observationnelles limitées suggèrent que le THC oral et le nabilone sont associés à l'amélioration d'un nombre de symptômes associés à la MA (p. ex. activité motrice nocturne, comportement perturbé, sommeil, agitation, résistivité).
4.9.7 Inflammation
4.9.7.1 Maladies inflammatoires de la peau (dermatite, psoriasis, prurit)
- Les résultats provenant d'études précliniques, cliniques et de cas sur le rôle de certains cannabinoïdes dans la modulation d'affections inflammatoires de la peau sont mixtes.
- Certaines études cliniques et de séries prospectives de cas suggèrent que certains cannabinoïdes ont un rôle protecteur (THC, CBD, HU-210), tandis que d'autres suggèrent un rôle nuisible (cannabis, THC, CBN).
4.9.8 Troubles du système gastro-intestinal (syndrome du côlon irritable, maladie intestinale inflammatoire, hépatite, pancréatite, syndrome métabolique/obésité)
4.9.8.1 Syndrome du côlon irritable
- Les études précliniques dans des modèles animaux du syndrome du côlon irritable (SCI) suggèrent que certains agonistes synthétiques des récepteurs de cannabinoïdes inhibent les réactions à la douleur induite par la distension colorectale et ralentissent le transit GI.
- Les études cliniques expérimentales avec des volontaires sains ont signalé des effets selon la dose et le sexe sur diverses mesures de la motilité GI.
- Des données limitées provenant d'une petite étude clinique sur le dronabinol pour le traitement de symptômes du SCI suggèrent que celui-ci pourrait augmenter la conformité du côlon et diminuer l'index de la motilité du côlon chez les femmes atteintes du SCI à diarrhée prédominante SCI-D) ou SCI à motif alternatif (alternance constipation/diarrhée) (SCI-A), tandis qu'une autre petite étude clinique avec le dronabinol suggère une absence d'effet au niveau du transit gastrique, de l'intestin grêle ou du côlon.
4.9.8.2 Maladies inflammatoires de l'intestin (maladie de Crohn, colite ulcéreuse)
- Les études précliniques dans les modèles animaux de maladies inflammatoires de l'intestin (MII) suggèrent que certains cannabinoïdes (les agonistes synthétiques des récepteurs CB1 et CB2, le THC, le CBD, le CBG, le CBC ou les extraits de plante entière de cannabis) pourraient limiter l'inflammation intestinale et la sévérité de la maladie à différents degrés.
- Des données provenant d'études par observation suggèrent que les patients consomment du cannabis afin de soulager les symptômes du MII.
- Un nombre très limité d'études cliniques à petite échelle avec des patients atteints du MII et sur lesquels les traitements traditionnels avaient échoué ont signalé l'amélioration de nombreux symptômes associés au MII après la consommation de cannabis fumé.
4.9.8.3 Maladies du foie (hépatite, fibrose, stéatose, lésion de reperfusion de l'ischémie. encéphalopathie hépatique)
- Les études précliniques suggèrent que l'activation des récepteurs CB1 est défavorable pour les maladies du foie (p. ex. favorise la stéatose, la fibrose), tandis que l'activation des récepteurs CB2 semble avoir quelques effets bénéfiques.
- De plus, les études précliniques suggèrent aussi que le CBD, le THVC et les doses très faibles de THC pourraient posséder des effets protecteurs sur les lésions de réperfusion de l'ischémie hépatique et pour l'encéphalopathie hépatique.
4.9.8.4 Syndrome métabolique, obésité, diabète
- Les études précliniques suggèrent que l'activation aiguë des récepteurs CB1 cause une augmentation de la synthèse et de l'entreposage des gras tandis que l'activation chronique des récepteurs CB1 (ou l'antagonisme des récepteurs CB1) cause la perte de poids et l'amélioration d'une gamme d'indicateurs métaboliques.
- Les études par observation suggèrent une association entre la consommation chronique de cannabis et l'amélioration du profil métabolique, tandis que les données précliniques et les preuves cliniques très limitées suggèrent un effet bénéfique potentiel du THCV sur le contrôle glycémique (chez les patients atteints du diabète de type II).
4.9.8.5 Maladies du pancréas (diabète, pancréatite)
- Les études précliniques dans les modèles animaux expérimentaux de certains cannabinoïdes dans le traitement de la pancréatite aiguë ou chronique sont limitées et contradictoires.
- Les données limitées provenant d'études de cas suggèrent une association entre les épisodes de consommation aiguë de grandes quantités de cannabis et la pancréatite aiguë.
- Des études par observation limitées suggèrent une association entre la consommation chronique de cannabis et l'incidence plus faible du diabète sucré.
- Une étude clinique à petite échelle a signalé que le THC administré oralement ne soulageait pas la douleur abdominale associée à la pancréatite chronique.
4.9.9 Propriétés antinéoplastiques
- Les études précliniques suggèrent que certains cannabinoïdes (le THC, le CBD, le CBG, le CBC, le CBDA) bloquent fréquemment, mais non toujours, la croissance des cellules cancéreuses in vitro et affichent une gamme d'effets antinéoplastiques in vivo bien que normalement à des doses très élevées qui ne seraient pas utilisées cliniquement.
- Bien que des données limitées provenant d'une étude observationnelle suggèrent que les patients atteints de cancer consomment du cannabis pour soulager les symptômes associés au cancer (p. ex., les modifications chimiosensorielles, la perte de poids, la dépression, la douleur), il n'existe qu'une seule étude clinique limitée menée avec des patients atteints de glioblastome multiforme ayant signalé que des injections intratumorales de doses élevées de THC n'ont pas amélioré la survie des patients plus que ce qui est observé avec l'utilisation d'agents chimiothérapeutiques courants.
7.0 Effets indésirables
7.1 Carcinogenèse et mutagenèse
- Les données provenant d'études précliniques suggèrent que la fumée de cannabis contient plusieurs des mêmes cancérogènes et mutagènes que la fumée de tabac et que la fumée de cannabis est aussi mutagénique et cytotoxique, sinon plus, que la fumée de tabac.
- Toutefois, des données limitées et mitigées provenant d'études épidémiologiques ont jusqu'à présent été incapables de découvrir une association robuste et uniforme entre la consommation de cannabis et les différents types de cancer, à l'exception possible d'un lien entre la consommation de cannabis et le cancer des testicules (c.-à-d., tumeurs des cellules germinatives testiculaires).
7.2 Appareil respiratoire
- Des données provenant d'études précliniques suggèrent que la fumée de cannabis contient plusieurs des mêmes irritants pulmonaires et toxines que la fumée de tabac et même, dans certains cas, de plus grandes quantités de certaines de ces substances.
- Les études de cas suggèrent que fumer du cannabis est associé à une gamme de changements histopathologiques des tissus pulmonaires, à une gamme de symptômes respiratoires semblables à ceux observés chez les fumeurs de tabac et des changements dans certaines fonctions pulmonaires dans le cas d'utilisation fréquente à long terme.
- L'association entre l'utilisation intensive et fréquente du cannabis fumé (sans tabac) et la maladie pulmonaire obstructive chronique est incertaine, mais, s'il en existe une, elle est probablement faible.
7.3 Système immunitaire
- Les études précliniques suggèrent que certains cannabinoïdes possèdent une grande variété d'effets complexes sur les fonctions du système immunitaire (pro- ou anti-inflammatoire, stimulant ou inhibant).
- Les études cliniques et par observation limitées des effets du cannabis sur le nombre de cellules immunitaires et sur la charge virale plasmatique du VIH sont mixtes, de même que les données concernant l'usage fréquent de cannabis (c.-à-d. quotidient/TUC) et l'adhésion à la TAR.
- Des preuves limitées, mais croissantes provenant d'études de cas suggèrent aussi que l'utilisation de cannabis est associé à des réactions de types allergiques ou d'hypersensibilité.
7.4 Système reproducteur et endocrinien
- Les données précliniques suggèrent que certains cannabinoïdes peuvent avoir des effets négatifs sur de nombreuses mesures de la santé reproductive. De plus, les données limitées d'études par observation des humains sur le cannabis semblent appuyer les données de certaines des études précliniques.
- Les données des études par observations d'humains suggèrent aussi une association selon la dose et l'âge entre la consommation de cannabis et les tumeurs des cellules germinatives testiculaires.
- Les données précliniques suggèrent clairement que l'exposition in utero à certains cannabinoïdes est associée à de nombreux dommages à court et à long terme sur la progéniture en développement.
- Toutefois, les données provenant d'études par observation des humains sont complexes et suggèrent que bien que des facteurs de confusion pourraient expliquer les associations entre la consommation intensive de cannabis pendant la grossesse et les effets néfastes néonataux ou périnataux, l'utilisation intensive de cannabis pendant la grossesse est associée à une reduction du poids à la naissance.
7.5 Appareil cardiovasculaire
- Les études précliniques suggèrent que des doses très faibles de THC pourraient avoir un effet cardioprotecteur sur l'infarctus du myocarde induit expérimentalement.
- Des données provenant d'études de cas et d'études observationnelles suggèrent que fumer du cannabis de manière aiguë et chronique est associé à des effets néfastes sur la santé vasculaire, cardiovasculaire et cérébrovasculaire (p. ex., infarctus du myocarde, AVC, artérite) en particulier chez les consommateurs d'âge moyen (et plus).
- Cependant, une revue systématique récente suggère que les données examinant les effets du cannabis sur la santé cardiovasculaire sont incohérentes et insuffisantes.
7.6 Système gastro-intestinal et foie
- Des données provenant de rapports de cas suggèrent que la consommation chronique et intensive de cannabis (à THC prédominant) est associée à un risque plus élevé de syndrome d'hyperémèse du cannabis (SHC).
- Des données limitées provenant d'études par observation suggèrent des résultats mitigés entre la consommation de cannabis (à THC prédominant) et les risques de progression de la fibrose du foie associée à une infection de l'hépatite C.
7.7 Système nerveux central
7.7.1 Cognition
- Des données provenant d'études cliniques suggèrent que la consommation aiguë de cannabis (à THC prédominant) est associée à de nombreux effets cognitifs aigus.
- Des données provenant d'études obervationnelles suggèrent que la consommation chronique de cannabis est associée à quelques effets cognitifs et comportemenaux qui pourraient subsister pour des durées de temps variées au-delà de la période d'intoxication aiguë selon de nombreux facteurs.
- Des données limitées provenant d'études cliniques par imagerie sur des humains suggèrent que le THC et le CBD pourraient exercer des effets opposés sur les fonctions neuropsychologiques et neurophysiologiques.
- Des données provenant principalement d'études cliniques transversales par imagerie sur les humains suggèrent que la consommation chronique et intensive de cannabis est associée à de nombreux changements structurels dans la matière grise et la substance blanche dans différentes régions du cerveau.
- En outre, le début précoce de la consommation et la consommation de cannabis à taux élevé et prédominant en THC ont été associés à des risques plus élevés de certains changements structurels du cerveau et de déficience cognitive.
7.7.2 Fonction psychomotrice et conduite automobile
- Des données provenant d'études cliniques expérimentales suggèrent que la consommation aiguë de cannabis (à THC prédominant) affaiblit de nombreuses habiletés psychomotrices et cognitives nécessaires pour conduire un véhicule à moteur.
- Bien que la consommation chronique/fréquente de cannabis puisse être associée à un certain degré de tolérance à certains des effets du cannabis chez certains individus, la consommation chronique de cannabis peut toujours poser des risques à la conduite sécuritaire en raison, en partie, de la charge corporelle importante du THC menant à un niveau chronique de troubles psychomoteurs.
- Des données provenant d'études cliniques et épidémiologiques suggèrent la présence d'effets de réponse selon la dose, avec des doses croissantes de THC augmentant les risques de collisions de véhicule à moteur pouvant entrainer des blessures et la mort.
- Combiner de l'alcool avec du cannabis (THC) est associé à un niveau plus élevé d'affaiblissement des capacités et un risque accru de blessures.
7.7.3 Effets psychiatriques
7.7.3.1 Anxiété, ESPT, dépression et trouble bipolaire
- Des données d'études cliniques suggèrent la présence d'effets biphasiques en fonction de la dose du THC sur l'anxiété et l'humeur puisque des doses faibles de THC semblent avoir des effets anxiolytiques et de hausse de l'humeur tandis que des doses élevées de THC peuvent produire de l'anxiété et diminuer l'humeur.
- Des études épidémiologiques suggèrent une association entre la consommation de cannabis (à THC prédominant), en particulier la consommation chronique et intensive, et l'apparition de troubles anxieux, dépressifs et bipolaires, et la persistance de symptômes liés au à l'ESPT, au trouble panique, au trouble dépressif et au trouble bipolaire.
- Les résultats préliminaires d'enquêtes suggèrent une association entre l'utilisation de produits concentrés de cannabis ultra-puissants (p. ex. huile de haschich butane, BHO) et des taux plus élevés d'anxiété et de dépression autodéclarées et d'autres drogues illicites, ainsi que des niveaux plus élevés de dépendance physique qu'avec l'herbe de cannabis à forte puissance.
7.7.3.2 Schizophrénie et psychose
- Des données provenant d'études cliniques suggèrent que l'exposition aiguë au cannabis (à THC prédominant) ou au THC est associée, en fonction de la dose, à des troubles comportementaux et cognitifs transitoires aigus imitant une psychose aiguë.
- Des études épidémiologiques suggèrent une association entre la consommation de cannabis (à THC prédominant), en particulier la consommation précoce, chronique et intensive, et la psychose et la schizophrénie.
- Les risques de schizophrénie associés à la consommation de cannabis sont particulièrement élevés chez les individus possédant des antécédents personnels ou familiaux de schizophrénie.
- La consommation de cannabis est aussi associée au début précoce de la schizophrénie chez les individus vulnérables, et à l'exacerbation des symptômes schizophréniques actuels et à des conséquences cliniques plus graves.
7.7.3.3 Idées suicidaires, tentatives de suicide et mortalité
- Des données d'études épidémiologiques suggèrent aussi l'existence d'une association en fonction de la dose entre le cannabis et les tendances suicidaires, en particulier chez les hommes.
7.7.3.4 Syndrome amotivationnel
- Les données limitées disponibles pour une association entre la consommation de cannabis et un « syndrome amotivationnel » sont mixtes.
Remarque importante : Par souci d'exhaustivité et pour des raisons contextuelles, le contenu du présent document comprend de l'information aussi bien sur le cannabis séché et autres produits à base de cannabis, que sur certains cannabinoïdes. Toutefois, les produits de cannabis et les cannabinoïdes ne sauraient être considérés comme étant équivalents, bien que les renseignements se rapportant à ceux-ci apparaissent au même endroit dans le texte. Le cannabis et les produits de cannabis sont des matières hautement complexes ayant des centaines de constituants chimiques, alors que les cannabinoïdes sont habituellement des molécules isolées. L'établissement de comparaisons directes entre les produits de cannabis et les cannabinoïdes devrait forcément tenir compte des différences quant aux voies d'administration, à la posologie, aux composantes pharmacologiques individuelles et leurs interactions potentielles, ainsi qu'aux diverses propriétés pharmacocinétiques et pharmacodynamiques de ces différentes substances.
1.0 Le système endocannabinoïde
Le système endocannabinoïde (SEC) (Figure 1) est un ancien système de signalisation lipidique ubiquiste, conservé au cours de l'évolution, que l'on retrouve chez tous les vertébrés, lequel semble jouer un très grand rôle de régulation dans tout le corps humainReference 1. Le SEC participe à la régulation d'un nombre très vaste de procès physiologiques et physiopathologiques, dont le développement du système nerveux, la fonction immunitaire et cardiovasculaire, l'inflammation, l'appétit, le métabolisme et l'homéostasie énergétique, la digestion, le développement osseux, la densité osseuse, la plasticité synaptique et l'apprentissage, la douleur, la reproduction, la maladie psychiatrique, le comportement psychomoteur, la mémoire, les cycles de veille et de sommeil ainsi que la régulation du stress et de l'état émotionnel et de l'humeurReference 2-Reference 4. En outre, tout porte à croire que le dérèglement du SEC contribue à de nombreuses maladies chez l'humain et engendre notamment de la douleur, de l'inflammation, des troubles psychiatriques et des maladies neurodégénérativesReference 5.
Composantes du système endocannabinoïde
Le SEC est principalement composé : des récepteurs de cannabinoïdes 1 et 2 (CB1 et CB2); des ligands des récepteurs CB soit la N-arachidonoyl-éthanolamine (« l'anandamide ») et du 2-arachidonoylglycérol (2-AG); des enzymes de synthèse des endocannabinoïdes la N-acyltransférase, la phospholipase D, la phospholipase C-β et la diacylglycérol lipase (DAGL); et des enzymes de dégradation des endocannabinoïdes, l'hydrolase des amides d'acides gras (FAAH) et la monoacylglycérol lipase (MAGL) (Figure 1)Reference 2. L'anandamide et le 2-AG sont considérés comme des activateurs endogènes primaires de signalisation cannabinoïde, mais d'autres molécules endogènes dont les effets sont semblables à ceux des cannabinoïdes ont également été décrites. Ces autres molécules comprennent le 2-arachidonoylglycérol éther (éther de noladine), la N-arachidonoyl-dopamine, la virodhamine, l'éthanolamine N-homo-γ-linolénoyl et la N-docosatétraenoyléthanolamineReference 2Reference 6-Reference 9. D'autres molécules telles que le palmitoyléthanolamide (PEA) et l'oleoyléthanolamide (OEA) ne semblent pas se fixer aux récepteurs cannabinoïdes, mais plutôt à une isozyme spécifique appartenant à une classe de récepteurs nucléaires et de facteurs de transcription, soit les récepteurs activables par les proliférateurs des peroxysomes (PPARs)Reference 9. Ces éthanolamines d'acyles gras pourraient toutefois avoir tendance, par inhibition compétitive de la FAAH et/ou par effets allostériques directs, à potentialiser l'effet de l'anandamide sur d'autres récepteurs comme le canal ionique à potentiel de récepteur transitoire vanilloïde de type 1 (TRPV1)Reference 10. On appelle généralement ce type d'effet « effet de l'entourage »Reference 10Reference 11. Le terme « effet de l'entourage » est aussi utlisé dans le contexte des interactions entre les phytocannabinoïdes et les terpènes dans un système physiologique (voir Section 1.1.2).
Synthèse des endocannabinoïdes
Les endocannabinoïdes sont les dérivés d'acide arachidonique qui sont synthétisés « sur demande » (p. ex. en réponse à un potentiel d'action dans les neurones ou en réponse à un autre type de stimulus biologique) à partir de précurseurs phospholipides membranaires pour répondre au besoin des cellulesReference 2Reference 12-Reference 14. La synthèse des endocannabinoïdes « sur demande » permet d'assurer que la signalisation des endocannabinoïdes soit étroitement contrôlée sur le plan spatial et temporel. La production de l'anandamide implique principalement, et non exclusivement, le transfert de l'acide arachidonique de la phosphatidylcholine à la phosphatidyléthanolamine par la N-acyltransférase pour aboutir à la N-arachidonoylphosphatidyléthanolamine (NAPE). La NAPE est ensuite hydrolysée pour former l'anandamide par une phospholipase D spécifique de la NAPEReference 2Reference 15. D'autres voies synthétiques comprennent l'élimination de chaînes d'acyles du NAPE par l'enzyme α/β-hydrolase 4 afin d'obtenir du glycérophospho-N-arachidonoyléthanolamine et pour ensuite effectuer l'hydrolyse des liaisons phosphodiesters du glycérophospho-N-arachidonoyléthanolamine à l'aide de l'enzyme phosphodiestérase 1 afin d'obtenir de l'anandamideReference 16. Par contre, le 2-AG est principalement synthétisé au moyen d'une hydrolyse à la phospholipase Cβ du phosphatidylinositol-4,5-bisphosphate avec l'acide arachidonique à la position sn-2 pour produire du diacylglycérol (DAG). Le DAG est ensuite hydrolysé par la DAGL pour former le 2-AGReference 2Reference 15. Bien que l'anandamide et le 2-AG soient des dérivés de l'acide arachidonique, ils sont synthétisés par des voies différentes de celles par lesquelles les éicosanoïdes sont synthétisésReference 17. Néanmoins, il semble qu'il pourrait y avoir un dialogue croisé (« cross-talk ») entre les voies des éicosanoïdes et des endocannabinnoïdesReference 17.
Génétique et signalisation au moyen des récepteurs cannabinoïdes
Les endocannabinoïdes tels que l'anandamide et le 2-AG, de même que les phytocannabinoïdes Δ9-tetrahydrocannabinol (Δ9-THC), le Δ8-THC, le cannabinol (CBN) et bien d'autres, se lient (avec affinité et efficacité variantes) aux récepteurs CB1 et CB2 et les activent, ces derniers étant des récepteurs couplés aux protéines G qui activent les cascades de signalisation à dépendance Gi/Go Reference 18Reference 19. Les récepteurs sont encodés par des gènes distincts qui se trouvent sur des chromosomes distincts; chez les humains, le locus du gène du récepteur CB1 (CNR1) se trouve sur le chromosome 5q15 tandis que le locus du gène du récepteur CB2 (CNR2) se trouve sur le chromosome 1p36Reference 20. La séquence codante du CNR1 consiste en un exon codant pour une protéine de 472 acides aminésReference 21. La protéine de récepteur CB1 partage à 97 - 99 % l'identité de séquence d'acides aminés avec toutes les espèces confondues (humaine, rat, souris)Reference 21. Comme dans la séquence codante du CNR1, la séquence codante du CNR2 ne comprend qu'un seul exon, mais celui-ci code pour une protéine plus courte, soit 360 acides aminés de longueurReference 21. Le récepteur CB2 humain partage à 48 % l'identité d'acide aminé avec le récepteur CB1 humain; le récepteur CB2 de la souris partage à 82 % l'identité de séquence d'acide aminé avec le récepteur CB2 humainReference 21.
L'activation des récepteurs CB1 ou des récepteurs CB2 couplés aux protéines Gi/o aboutit à l'inhibition de l'activité de l'enzyme adenylyl-cyclase, à une baisse de l'accumulation de l'adénosine monophosphate (AMP) cyclique avec une baisse correspondante de l'activité de la protéine kinase A, ainsi qu'à l'inhibition de l'influx calcique (Ca2+) à travers divers canaux du Ca2+; elle entraîne aussi la stimulation de canaux K+ rectifiants entrants et les cascades de signalisation des protéines kinases activées par des agents mitogènesReference 3Reference 13. L'anandamide a un effet agoniste partiel sur les récepteurs de CB et se lie avec un peu plus d'affinité aux récepteurs CB1 par rapport aux récepteurs CB2Reference 2Reference 22. Le 2-AG semble bien se lier également aux deux récepteurs CB (avec un peu plus d'affinité pour le CB1) mais avec plus de puissance et d'efficacité par rapport à l'anandamide aux récepteurs CBReference 2Reference 22.
Dans le système nerveux central (SNC), l'effet global de l'activation du récepteur CB1 est la répression de la libération des neurotransmetteurs (5-hydroxytryptamine (5-HT), glutamate, acétylcholine, acide gamma-aminobutyrique (GABA), noradrénaline, dopamine, D-aspartate, cholécystokinine) au niveau des synapses inhibitrices et excitatrices avec des effets à court et à long termeReference 2Reference 18Reference 23. L'inhibition de la libération des neurotransmetteurs intervient au moyen d'un mécanisme de signalisation rétrograde par lequel les endocannabinoïdes synthétisés et libérés depuis la membrane cellulaire des neurones postsynaptiques se répandent vers l'arrière à travers la fente synaptique et se lient aux récepteurs CB1 situés sur les terminaisons présynaptiques (Figure 1)Reference 3. C'est ce mécanisme de signalisation rétrograde qui permet de régler la neurotransmission de manière spatio-temporelle préciseReference 3. Dans les cellules immunitaires, l'activation des récepteurs CB2 empêche la libération des cytokines ou des chimiokines, et la migration des neutrophiles et des macrophages, entraînant des effets régulateurs complexes sur la fonction du système immunitaireReference 19.
Expression et distribution des récepteurs cannabinoïdes
La plupart des tissus sont dotés d'un SEC fonctionnel, les récepteurs CB1 et CB2 disposant de schémas distincts d'expression tissulaire. Le récepteur CB1 est l'un des récepteurs couplés aux protéines G les plus abondants dans les systèmes nerveux central et périphériqueReference 19. Ce dernier a été décelé au niveau du cortex cérébral, de l'hippocampe, de l'amygdale, des noyaux gris centraux, de la substantia nigra pars reticulata, des segments internes et externes du globus pallidus et du cervelet (couche moléculaire) et aux niveaux central et périphérique des conduits de la douleur y compris la substance grise periaqueductale, la medulla ventrolaterale rostrale, les régions des neurones primaires afférents de la corne dorsale de la moelle épinière y compris les nocicepteurs périphériques et les interneurones médullairesReference 4Reference 23Reference 24. La densité des récepteurs CB1 est la plus élevée dans le gyrus du cingulum, le cortex frontal, l'hippocampe, le cervelet et les noyaux gris centrauxReference 5. Des niveaux d'expression modérés du récepteur CB1 sont constatés dans le cerveau antérieur basal, l'amygdale, le noyau accumbens, la substance grise periaqueductale et l'hypothalamus; des niveaux d'expression beaucoup plus faibles sont observés dans le mésencéphale, le pont de Varole et la medulla ou le tronc cérébralReference 5. Une expression du récepteur CB1 relativement faible est constatée dans le thalamus et le cortex moteur primaireReference 5. Le récepteur CB1 s'exprime également dans plusieurs autres organes et tissus, dont les adipocytes, les leucocytes, la rate, le cœur, les poumons, l'appareil gastro-intestinal (GI) (foie, pancréas, estomac, intestin grêle et gros intestin), les reins, la vessie, les organes reproducteurs, les muscles squelettiques, les os, les articulations et la peauReference 25-Reference 43. Les récepteurs CB2 sont les plus fortement concentrés dans les tissus et les cellules du système immunitaire tels que les leucocytes et la rate, mais ils peuvent aussi être présents dans l'os et dans une moindre mesure dans les cellules hépatiques ainsi que les cellules nerveuses, dont les astrocytes, les oligodendrocytes et les cellules microgliales, et même les sous-populations neuronalesReference 44Reference 45.
D'autres cibles moléculaires pour les cannabinoïdes
Outre les récepteurs CB1 et CB2 bien connus, plusieurs autres cannabinoïdes se lieraient avec bon nombre d'autres cibles moléculaires. De telles cibles comprennent le troisième récepteur cannabinoïde putatif GPR55 (récepteur 55 couplé aux protéines G, G protein-coupled receptor), la famille des canaux cationiques à potentiel de récepteur transitoire, et une classe de récepteurs nucléaires et de facteurs de transcription, les PPARs, ainsi que les récepteurs 5-HT1A, les adréno-récepteurs α2 et les récepteurs d'adénosine et de glycine. Pour plus de détails à ce sujet, veuillez consulter la Section 2.1 ainsi que les ressources ci-aprèsReference 8Reference 9Reference 22Reference 46-Reference 49. La modulation de ces autres cibles des cannabinoïdes complique davantage les multiples effets des cannabinoïdes déjà connus.
Cessation du signal
L'action de deux enzymes hydrolytiques, à savoir la FAAH et la MAGL mettent rapidement fin à la signalisation des endocannabinoïdesReference 3. La FAAH intervient essentiellement au niveau post-synaptiqueReference 50Reference 51 et dégrade de façon préférentielle l'anandamideReference 14; et la MAGL, quant à elle, intervient au niveau pré-synaptiqueReference 50Reference 51 et favorise le catabolisme du 2-AG (Figure 1)Reference 14. Les signaux de terminaison sont essentiels afin de s'assurer que les activités biologiques sont bien régulées et une activité de signalisation prolongée, tel que lors de l'utilisation du cannabis, peut avoir des effets délétèresReference 52Reference 53.
Déréglementation du système endocannabinoïde et enjeux thérapeutiques généraux de la consommation des cannabinoïdes
La déréglementation du SEC semble se lier à un certain nombre de situations pathologiques, et les changements que connaît le fonctionnement du système sont soit protecteurs ou nocifsReference 54. La modulation du SEC au moyen de l'inhibition ciblée de voies métaboliques spécifiques et/ou de l'agonisme ou de l'antagonisme ciblé de ses récepteurs pourrait être prometteuse du point de vue thérapeutiqueReference 13. Toutefois, un enjeu majeur et constant dans l'usage routinier de cannabis (prédominant en THC) et des cannabinoïdes psychoactifs (p. ex. le THC) en clinique demeure celui de parvenir au ciblage sélectif du siège de la maladie ou des symptômes tout en ménageant d'autres régions du corps telles que les centres du cerveau qui s'occupent de la fonction cognitive et de l'humeurReference 23Reference 54-Reference 57. Malgré cet important défi, de plus en plus de données probantes tirées d'études cliniques sur le cannabis fumé ou vaporisé (prédominant en THC) contre la douleur chronique non cancéreuse (principalement la douleur neuropathique) suggèrent que l'utilisation de doses très faibles de THC (< 3 mg/dose) procure des bienfaits thérapeutiques entraînant peu d'effets secondaires psychoactifsReference 58Reference 59 (se reporter aussi à la Section 3.0 et 4.7.2.2 pour obtenir des détails supplémentaires).
Rôle du système endocannabinoïde dans le développement du système nerveux
Le récepteur CB1 s'exprime grandement dans le cerveau en développementReference 60. Par exemple, les récepteurs CB1 s'expriment grandement aux premières étapes du développement fœtal, dès le jour embryonnaire E12,5 (chez la souris) et durant les dernières étapes du développement fœtal (jour embryonnaire E21), le niveau d'expression étant élevé dans la substance blanche, dans plusieurs structures différentes (notamment l'hippocampe, le cervelet, le noyau caudé et le putamen et le cortex cérébral) et continue d'augmenter après la naissance jusqu'à l'âge adulte; en revanche, après la naissance, le niveau d'expression du récepteur CB1 commence à diminuer dans d'autres structures comme le corps calleux, le fornix, la strie terminale et le fascicule rétroflexeReference 60. De plus, dans le cerveau adulte, le récepteur CB1 semble être situé sur la membrane plasmique axonale et dans les endosomes somatodendritiques tandis que, dans le cerveau fœtal, le récepteur CB1 est localisé principalement sur les endosomes, dans les axones et dans la région somatodendritiqueReference 60. Les données dont on dispose semblent indiquer un rôle de neurodéveloppement pour le SEC, y compris dans des fonctions telles que la survie, la prolifération, la migration et la différenciation des progéniteurs neuronauxReference 60. L'activation du récepteur CB1, en réponse à une stimulation par des endocannabinoïdes, comme le 2-AG et l'anandamide, favorise ces fonctions mais retarde la transition à partir d'un phénotype progéniteur compétent multipotent, proliférateur et migratoire vers un phénotype neuronal plus stable post-mitotique bien différenciéReference 60Reference 61. Les études in vitro portant sur les effets de l'activation du récepteur dans les cultures neuronales primaires mènent à penser que le récepteur CB1 est principalement un régulateur négatif de la croissance des neurites étant donné que l'activation du récepteur CB1 entraîne un arrêt, une répulsion ou un effondrement des cônes de croissance et qu'elle influence ainsi la capacité des axones à atteindre leurs ciblesReference 60. Toutefois, ces réponses médiées par les récepteurs CB1 pourraient être surmontables par les effets des effecteurs de promotion de la croissance locaux au cône de croissance et l'équilibre entre les effets des endocannabinoïdes et des facteurs de croissance détermineraient les résultats généraux du développement des neurones. Le récepteur CB1 semble également agir comme un régulateur négatif de la synaptogénèse et peut ainsi avoir une incidence sur le devenir de la communication neuronaleReference 60. L'exposition aux cannabinoïdes qui activent le récepteur CB1 (comme le THC) au cours des périodes de développement du système nerveux comme le développement embryonnaire pendant la grossesse peut modifier le processus de développement neuronal normal de la progéniture et avoir une incidence négative sur les fonctions cérébrales normales pouvant causer une déficience à long terme de plusieurs fonctions et comportements cognitifsReference 61 (voir aussi les Sections 2.5 et 7.4 pour obtenir des renseignements complémentaires). Par exemple, une étude menée sur des souris enceintes a démontré que l'administration d'une faible dose de THC modifie le niveau d'expression de 35 protéines dans le cerveau des fœtusReference 62. De plus, cette étude identifie concrètement une cible moléculaire précise pour le THC dans le SNC en développement dont la modification peut perturber directement et de façon permanente les connexions du réseau neuronal au cours de la corticogénèse en permettant la formation de filopodes neuronaux ectopiques et en transformant la morphologie axonaleReference 62. Une autre étude in vitro à l'aide d'explants de cellules ganglionnaires de la rétine a démontré que l'administration de cannabidiol (CBD) réduit la taille des cônes de croissance neuronaux, le nombre des filopodes, la longueur totale des projections, l'effondrement induit des cônes de croissance et la rétraction des neurites (c.-à-d. la répulsion chimique) par l'entremise du récepteur GPR55Reference 63.
Figure 1. Le système endocannabinoïde dans le système nerveux
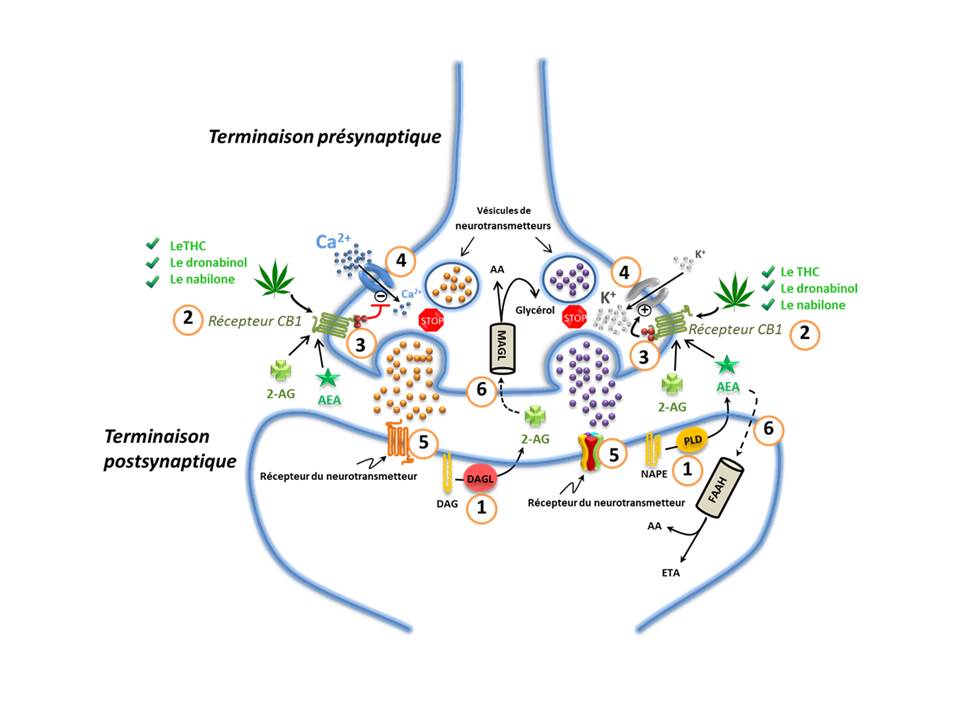
(1) Les endocannabinoïdes sont fabriqués « sur demande » (p. ex. en réponse à un potentiel d'action dans les neurones) au niveau des terminaisons post-synaptiques : l'anandamide (AEA) est produite à partir de l'hydrolyse effectuée par l'intermédiaire de la phospholipase-D (PLD) du lipide membranaire N-arachidonoylphosphatidyléthanolamine (NAPE); le 2-AG est issu de l'hydrolyse effectuée par l'intermédiaire de la diacylglycérol lipase (DAGL) du lipide membranaire diacylglycérol (DAG); (2) Ces endocannabinoïdes (anandamide (AEA) et 2-AG) se répandent de façon rétrograde vers les terminaisons présynaptiques et, à l'instar des cannabinoïdes exogènes tels que le THC (issus du cannabis), le dronabinol et le nabilone, ils se lient et activent les récepteurs présynaptiques CB1 couplés aux protéines G; (3) La liaison des phytocannabinoïdes et des endocannabinoïdes aux récepteurs CB1 déclenche la signalisation à base des protéines Gi/Go et inhibe l'adénylyl-cyclase, entraînant ainsi une baisse de l'accumulation de l'AMP cyclique et l'activité de la protéine kinase A; (4) L'activation du récepteur CB1 aboutit aussi à l'ouverture des canaux K+ rectifiants entrants (représentés par un « + ») engendrant l'hyperpolarisation des terminaisons présynaptiques ainsi que la fermeture des canaux Ca2+ (représentés par un « - ») par les protéines Gi/Go, interrompant la libération des neurotransmetteurs inhibiteurs et excitateurs emmagasinés (p. ex. le glutamate, le GABA, la 5-HT, l'acétylcholine, la noradrénaline, la dopamine, le D-aspartate et la cholécystokinine), lesquels (5) une fois libérés se répandent et se lient aux récepteurs postsynaptiques; (6) L'anandamide et le 2-AG rentrent dans les terminaisons nerveuses post ou présynaptiques (éventuellement grâce à l'intervention d'un transporteur spécialisé symbolisé par un pointillé) où ils sont respectivement catabolisés par l'hydrolase d'amide d'acide gras (FAAH) ou la monoacylglycérol-lipase (MAGL) produisant soit l'acide arachidonique (AA) et l'éthanolamine (ETA), soit l'acide arachidonique (AA) et le glycérol. Consulter le texte pour obtenir plus de détails. Figure adaptée deReference 64-Reference 66.
1.1 Cannabis
1.1.1 Chimie et composition
Le Cannabis sativa (c.-à-d. le cannabis, marihuana, marijuana) est un chanvre qui pousse dans les climats tempérés et tropicauxReference 67. Les feuilles et les sommités fleuries du Cannabis produisent plus de 500 composés distincts répartis en 18 classes chimiques différentes et hébergent plus de 100 différents phytocannabinoïdesReference 68-Reference 71. Les principaux phytocannabinoïdes semblent être le delta-9-tétrahydrocannabinol (Δ9-THC, THC), le CBN et le cannabidiol (CBD)Reference 72-Reference 74, bien que l'abondance relative de ceux-ci et d'autres phytocannabinoïdes puisse varier en fonction d'un certain nombre de facteurs tels que la variété du cannabis, les conditions du sol et les conditions climatiques, ainsi que les techniques de cultureReference 75Reference 76. D'autres phytocannabinoïdes que l'on retrouve dans le cannabis sont le cannabigérol (CBG), le cannabichromène (CBC), le tétrahydrocannabivarin (THCV) et bien d'autresReference 70. Dans la plante vivante, ces phytocannabinoïdes existent aussi bien sous forme d'acide monocarboxylique inactif (p. ex. acide tetrahydrocannabinolic, le THCA) que sous forme décarboxylée active (p. ex. le THC). Toutefois, la chaleur (à des températures supérieures à 120 °C) provoque la décarboxylation (p. ex. du THCA au THC)Reference 77-Reference 79. De plus, la pyrolyse (comme en fumant) transforme chaque membre des centaines de composés contenus dans le cannabis en plusieurs autres composés, dont bon nombre reste encore à caractériser tant d'un point de vue chimique que pharmacologique. Donc, le cannabis peut être considéré comme une drogue brute contenant un nombre important de constituants chimiques et pharmacologiques, et ce n'est que peu à peu que l'on commence à comprendre ses propriétés.
De tous les constituants du cannabis et particulièrement parmi les cannabinoïdes, le Δ9-THC est de loin le cannabinoïde le plus étudié et est à l'origine de nombreux, si ce n'est de la plupart des effets physiques et psychotropiques du cannabisReference 80. D'autres phytocannabinoïdes (tels que le CBD, le CBC et le CBG) sont présents en moindre quantité dans la plante et ont peu de propriétés psychotropiques, voire aucunesReference 80. Cependant, les producteurs canadiens de cannabis autorisés à des fins médicales proposent maintenant une grande variété de souches de cannabis contenant différentes teneurs en THC et CBD, y compris les souches prédominantes de THC, de CBD ou les souches équilibrées pour les patients qui ont reçu une autorisation de la part de leur professionnel de la santé pour avoir accès au cannabis à des fins médicales. Pour obtenir plus de renseignements, veuillez consulter le site Web suivant : producteurs de cannabis à des fins médicales autorisés approvés par Santé Canada.
1.1.2 Autres constituants
Le nombre élevé de composés que l'on trouve dans le cannabis compte plusieurs classes chimiques dont les phytocannabinoïdes, les composés azotés, les acides aminés, les protéines, les enzymes, les glycoprotéines, les hydrocarbures, les alcools simples, les aldéhydes, les cétones et les acides, les acides gras, les esters et les lactones simples, les stéroïdes, les terpènes, les phénols non-cannabinoïdes, les flavonoïdes, les vitamines et les pigmentsReference 70. De plus, des différences en ce qui concerne la présence et l'abondance relative de quelques-unes de ces diverses composantes ont été étudiées et des différences ont été relevées entre l'extrait de cannabis, sa vapeur et sa fumée, mais aussi entre les diverses variétés de celui-ciReference 81. Il convient de noter que la fumée du cannabis contient beaucoup de composés n'ayant pas été détectés ni dans l'extrait ni dans la vapeur de ce dernier, y compris beaucoup d'autres qui sont reconnus ou que l'on soupçonne comme étant cancérogènes ou mutagènesReference 81-Reference 83. Par ailleurs, les comparaisons entre la fumée du cannabis et celle du tabac ont révélé que la fumée du cannabis contient bon nombre des agents chimiques cancérogènes que l'on trouve dans la fumée du tabacReference 82Reference 84 (voir Section 7.1 pour plus de renseignements).
On en sait relativement peu sur les actions pharmacologiques des divers autres composés contenus dans le cannabis (p. ex. les terpènes, les flavonoïdes). Toutefois, on estime que certains de ces composés (p. ex. les terpènes) possèdent un large spectre d'actions (p.ex. comme antioxydant, anxiolytique, anti-inflammatoire, antibactérien, antinéoplastique, antipaludique), mais cette information provient de quelques études in vitro et in vivo seulement, et il n'existe aucun essai clinique pour étayer ces affirmations. Les terpènes varient largement d'une variété de cannabis à une autre et l'on pense qu'ils sont principalement responsables des différences quant au parfum des différentes souches de cannabisReference 75. On estime aussi que les terpènes seraient à l'origine des qualités distinctives de l'inhalation du cannabis fumé et éventuellement du « high » associé à l'activité de fumer du cannabisReference 75, mais encore une fois, cette hypothèse n'a pas encore fait l'objet d'une étude approfondie. La notion selon laquelle les terpènes pourraient, d'une manière ou d'une autre, modifier ou accentuer les effets des cannabinoïdesReference 85Reference 86, c.-à-d. l' « effet de l'entourage » reste. pour l'instant. hypothétique étant donné qu'il existe peu, voire aucune, donnée probante préclinique pour étayer cette hypothèse, et qu'à ce jour il n'y a pas encore eu d'essai clinique à ce sujet.
1.1.3 Stabilité et entreposage
La plupart des renseignements sur la stabilité du cannabis ne font aucune distinction entre le Δ9-THC et son acide carboxylique (Δ9-THCA). Ce dernier est transformé en Δ9-THC par la chaleur lors de la vaporisation ou lors de la cuisson, ou par la pyrolyse lorsqu'il est fumé ou dans l'entrée des chromatographes en phase gazeuse utilisées dans les analyses judiciairesReference 87. Il a été démontré que la décarboxylation complète du Δ9-THCA en Δ9-THC se produit à partir de 98 ºC et jusqu'à une température de 200 ºC. Au fur et à mesure que la température augmente, le taux de décarboxylation augmente : cela prend 4 heures pour une décarboxylation complète à 98 ºC, mais seulement quelques secondes à 200 ºCReference 88-Reference 90. La chaleur, la lumière, l'humidité, l'acidité et l'oxydation affectent tous la stabilité du cannabis et des phytocannabinoïdesReference 91Reference 92. Le National Institute on Drug Abuse signale que les échantillons conservés de ses cigarettes préparées avec soin et normalisées sont stables pendant des mois, particulièrement s'ils sont entreposés sous 0 °C (-18 ºC) dans l'obscurité et dans des contenants hermétiquement fermésReference 93. Toutefois, même à +18 ºC, seul un tiers de la teneur en Δ9-THC est perdu sur cinq ans, avec une certaine augmentation de la concentration du CBN. Il se trouve que les cigarettes de cannabis à concentration plus faible (1,15 % de THC) perdent davantage de Δ9-THC comparativement aux cigarettes à plus forte concentration en Δ9-THC (2,87 % de THC)Reference 93. Turner et coll. ont constaté que la teneur en THC du cannabis diminuait à un taux de 3,83, de 5,38 et de 6,92 % par an pour le cannabis stocké à -18 ºC, 4 ºC et à 22 ºC, respectivementReference 94. Sevigny a fourni la formule suivante pour calculer le déclin de THC : THC0 = THCa / e-(k) (t) où THC0 est la concentration initiale inconnue de THC, THCa est la concentration de THC mise à l'essai, k est la constante du taux de déclin qui peut varier en fonction de deux conditions : k = 0,0263 (taux de déclin moyen de la limite inférieure pour les échantillons stockés dans l'obscurité à 3 ºC) et k = 0,0342 (taux de déclin moyen de la limite supérieure pour les échantillons stockés à la lumière naturelle d'un laboratoire à 22 ºC) et t est le délai d'analyse entre la saisie et l'essai (exprimé en mois)Reference 95. Pour connaître les conditions de stabilité et d'entreposage particulières du cannabis offerts par des producteurs commerciaux autorisés au Canada, veuillez consulter les renseignements fournis par les producteurs commerciaux autorisés.
2.0 Pharmacologie clinique
2.1 Pharmacodynamique
Une grande partie des renseignements pharmacodynamiques sur le cannabis renvoie aux effets du principal constituant, le Δ9-THC, qui a un effet agoniste partiel sur les deux récepteurs CBReference 46Reference 48Reference 96, agit au niveau des récepteurs non-CB et d'autres ciblesReference 46Reference 48Reference 97, et est responsable des effets psychoactifs du cannabis par l'entremise de ses actions sur le récepteur CB1Reference 46Reference 48Reference 98. Le Δ8-THC, un isomère du Δ9-THC, se trouve en des quantités plus réduites dans la plante, mais tout comme le Δ9-THC, il a un effet agoniste partiel sur les deux récepteurs CB et son efficacité et sa puissance sont relativement les mêmes que ceux du Δ9-THC dans des essais in vitroReference 96. Une étude in vivo chez l'animal et une étude clinique laissent supposer que le Δ8-THC serait un antiémétique beaucoup plus puissant que le Δ9-THCReference 99Reference 100.
Le CBN est un produit de l'oxydation du Δ9-THC et possède 10 % de l'activité de celui-ci au niveau du récepteur CB1Reference 101. Peu d'études font cas de ses effets, mais d'après un nombre restreint d'études in vitro, il aurait certaines propriétés immunosuppressivesReference 102.
Le CBG est un agoniste partiel des récepteurs CB1/2 et, d'après un nombre restreint d'études in vitro, il pourrait avoir certaines propriétés anti-inflammatoires et analgésiquesReference 49Reference 101Reference 103Reference 104. Par exemple, les essais in vitro ont révélé que le CBG, à une concentration de 100 µg/mL (correspond approximativement à une concentration de 300 µM et est supérieure à l'intervalle physiologique habituel; elle n'est donc pas vraiment représentative des conditions in vivo chez l'humain), est associé à une inhibition supérieure à 30 % des enzymes cyclo-oxygénases (COX) 1 et 2. En revanche, il n'a entraîné qu'une faible inhibition (< 10 %) de la production de prostaglandines in vivo à des concentrations qui n'ont pas causé de cytotoxicitéReference 104. L'acide cannabigérolique a un profil semblable. Il a aussi été démontré que le CBG bloque les récepteurs 5-HT1A et agit comme un agoniste de l'adrénorécepteur α2Reference 105. Des preuvesémergentes suggèrent que le CBG peut produire des signes d'analgésie en activant les adénorécepteurs α2 Reference 46.
Le CBD n'a pas d'effet psychoactif décelable, et ne semble pas se lier aux récepteurs CB1 ou CB2 à des concentrations physiologiques significatives, mais il existe de nouvelles preuves suggérant que le CBD pourrait agir en tant que modulateur allostérique non-compétitif négatif des récepteurs CB1Reference 106. Il existe aussi une quantité importante de données suggérant que le CBD touche aussi à l'activité de bon nombre d'autres cibles, y compris les canaux ioniques, les récepteurs et les enzymesReference 18Reference 101Reference 107. Par exemple, il a été révélé que le CBD bloque l'activité de la FAAH, ce qui entraîne une augmentation des niveaux de l'anandamide, agit comme un agoniste du canal TRPV1, inhibe l'absorption d'adénosine en agissant comme un agoniste indirect aux récepteurs de l'adénosine, agit comme un agoniste des récepteurs 5-HT1A, agit comme un modulateur allostérique positif des récepteurs glycine et agit comme un antioxydant et un épurateur des espèces réactives de l'oxygène, ainsi que comme une homéostase calcique régulatrice par l'intermédiaire de l'échangeur mitochondrial sodium/calcium (Na+/Ca2+)Reference 108. Les effets du CBD sur ces cibles et sur d'autres cibles moléculaires sont associés à des effets anti-inflammatoires, analgésiques, anti-émétiques, antipsychotiques, anti-ischémiques, anxiolytiques et anti-épileptiformesReference 108.
Le THCV a un effet antagoniste sur le récepteur CB1 et un effet agoniste partiel sur le récepteur CB2 dans des études in vitro et in vivoReference 109Reference 110, ainsi qu'un effet agoniste sur le récepteur 5-HT1AReference 47. Des études précliniques suggèrent que le THCV pourrait posséder des propriétés comme agent anti-épileptiforme ou anti-convulsant, anti-nociceptif et antipsychotique potentielsReference 108.
Une grande partie de ce que l'on sait sur les propriétés bénéfiques de ces cannabinoïdes non-psychotropiques (p. ex. CBD, THCV) provient d'études in vitro et in vivo et il existe peu d'études cliniques rigoureuses et bien menées sur ces substances. Toutefois, les résultats issus de ces études pré-cliniques laissent entrevoir de potentielles indications thérapeutiques telles que la psychose, l'épilepsie, l'anxiété, les troubles du sommeil, la neurodégénération, l'ischémie cérébrale et myocardiaque, l'inflammation, la douleur et les réactions immunitaires, les vomissements, la prise d'aliments, le diabète de type 1, la maladie hépatique, l'ostéogénèse et le cancerReference 18Reference 101Reference 111. Pour plus de renseignements sur la pharmacologie des cannabinoïdes, le lecteur est invité à consulter les ressources suivantesReference 22Reference 46Reference 48Reference 101Reference 112.
Interactions entre phytocannabinoïdes et différences des phytocannabinoïdes parmi diverses souches de cannabis
En dépit des affirmations anecdotiques, il existe peu de renseignements fiables sur les interactions réelles ou potentielles d'importance biologique ou physiologique entre les phytocannabinoïdes, surtout le Δ9-THC et le CBD. Les quelques renseignements existants sont complexes et exigent plus de précisions au moyen d'études supplémentaires. Les paragraphes suivants résument les renseignements disponibles à ce sujet.
Facteurs influençant la nature d'interactions éventuelles entre les phytocannabinoïdes
Diverses études ont signalé une potentialisation des interactions, une opposition des interactions ou des interactions neutres entre le Δ9-THC et le CBDReference 113-Reference 128. Les divergences relevées quant à la nature des interactions entre le Δ9-THC et le CBD rencensées dans la littérature pourraient s'expliquer par les différences liées aux doses et aux ratios du THC et du CBD utilisés dans les différentes études, les différences au niveau de la voie d'administration et au niveau des effets liés à l'ordre d'administration (traitement préliminaire au CBD versus l'administration concomitante simultanée avec le Δ9-THC), les différences au niveau de la durée du traitement (aiguë par rapport à chronique), les différentes espèces animales utilisées, de même que les paramètres tant biologiques que physiologiques faisant l'objet de l'examenReference 129.
Différences entre les interactions pharmacocinétiques et pharmacodynamiques
En général, il semble y avoir deux types de mécanismes pouvant régir d'éventuelles interactions entre le CBD et le Δ9-THC; celles d'origine pharmacocinétiqueReference 121Reference 129 et celles d'origine pharmacodynamiqueReference 114Reference 116. En dépit de la nature limitée et complexe des renseignements disponibles, il semble qu'en général, l'administration préliminaire du CBD pourrait potentialiser certains effets du THC (par un mécanisme pharmacocinétique). La potentialisation des effets du THC par le CBD pourrait être due à l'inhibition du métabolisme du THC dans le foie, entraînant un taux plasmatique plus élevé de THCReference 121Reference 129. L'administration concomitante simultanée du CBD pourrait permettre d'atténuer certains effets du THC (par un mécanisme pharmacodynamique). De plus, le ratio entre les deux phytocannabinoïdes jouerait aussi un rôle pour déterminer si l'effet global sera potentialisateur ou antagoniste. On pourrait observer l'atténuation des effets induits par le THC par l'intermédiaire du CBD lorsque le ratio du CBD et du THC est d'au moins 8 : 1Reference 115Reference 128, tandis que le CBD semble potentialiser certains des effets associés au THC lorsque le ratio du CBD et du THC se situe à environ 2 : 1Reference 128. Il existe de nouvelles preuves provenant d'études précliniques suggérant que des doses infraliminaires antiémétiques d'une combinaison du THC et du CBD ou d'acide cannabidiolique (CBDA) pourraient être efficaces dans des modèles animaux du traitement de la nausée aiguë ou des nausées d'anticipation (veuillez consulter la Section 4.3 pour plus de détails).
Effets psychologiques et physiologiques associés à la variation des concentrations des phytocannabinoïdes
Un certain nombre d'études ont examiné les effets neurophysiologiques, cognitifs, subjectifs ou comportementaux qu'entraîne une variation des concentrations du Δ9-THC, du CBD ou d'autres cannabinoïdes tels que le CBC dans le cannabis fuméReference 120Reference 130. Lors d'une étude, 24 hommes et femmes en santé qui avaient déclaré avoir consommés du cannabis au moins 10 fois dans leur vie avaient été soumis à un essai clinique inter- et intra-sujets à double insu et contrôlé avec placebo; celui-ci a révélé que des variations délibérées systématiques des niveaux du CBD ou du CBC dans le cannabis fumé n'étaient associées à aucune différence importante dans les essais subjectifs, physiologiques ou de performance mesurésReference 120. Lors d'une autre étude, les effets subjectifs liés à l'inhalation ou à l'administration par voie orale du matériel végétal de cannabis avaient fait l'objet d'une comparaison directe aux effets de l'inhalation ou de l'administration par voie orale du Δ9-THC (en utilisant des doses appariées de Δ9-THC) à des sujets normaux en bonne santéReference 130. Cette étude intra-sujets contrôlée, effectuée par permutation et à double insu a signalé peu de différences fiables entre les conditions liées au THC uniquement et celles liées à la plante entière du cannabisReference 130. Les auteurs sont en outre arrivés à la conclusion que les autres cannabinoïdes présents dans le matériel végétal du cannabis n'avaient pas modifié les effets subjectifs du cannabis, mais ils ont aussi spéculé que les échantillons de cannabis à teneur plus élevée en cannabinoïdes ou que différents ratios de cannabinoïdes individuels pourraient raisonnablement entraîner des résultats différents, même si aucune donnée probante à l'appui n'a été avancée dans cette étude. Ils ont également émis l'hypothèse voulant que la plante entière de cannabis et le THC seul pourraient différer en d'autres mesures de résultats plus pertinentes à des entités cliniques (p. ex. la spasticité ou la douleur neuropathique). À l'exception possible d'une étudeReference 131 (voir Section 4.7.2.3. Douleur liée au cancer) qui a suggéré qu'il existe des différences entre l'extrait de la plante entière du cannabis (c.-à-d. le nabiximols, commercialisé sous le nom de SativexMD) et le THC seul dans l'analgésie de la douleur liée au cancer, aucune autre étude clinique n'a examiné cette possibilité. Une étude a comparé les effets subjectifs et physiologiques du THC par voie orale à ceux liés au nabiximols chez des sujets normaux en bonne santéReference 126. Les auteurs ont signalé l'absence d'effets modulateurs du CBD (ou d'autres composantes du cannabis) à des doses thérapeutiques faibles du cannabinoïde, à l'exception éventuelle du « high » subjectifReference 126.
Une étude transversale en ligne menée auprès de 1 877 personnes ayant consommé de façon régulière du cannabis a conclu que les personnes qui avaient indiqué avoir consommés le cannabis dont le ratio CBD/THC était plus élevé avaient aussi indiqué avoir éprouvé peu d'épisodes psychotiques (une expérience typiquement liée à l'exposition à des doses plus élevées de THC)Reference 132. Toutefois, les auteurs ont remarqué que les effets étaient subtils. L'étude avait été aussi entravée par un certain nombre de problèmes méthodologiques qui suggèrent que les conclusions devraient être interprétées avec prudence.
Brunt et coll. (2014) ont mené une étude qui examine la satisfaction thérapeutique auto-déclarée et les effets subjectifs des différentes souches de cannabis de qualité pharmaceutique vendues aux Pays-BasReference 133. Les auteurs ont déclaré qu'au sein de la population à l'étude composée d'environ 100 patients consommant du cannabis à des fins médicales pour des problèmes de santé comme la sclérose en plaques (SP), une douleur chronique, des nausées, un cancer et des problèmes psychologiques, ceux qui consommaient du cannabis avec des concentrations de cannabinoïdes comprenant du THC à 6 % et du CBD à 7,5 % (c.-à-d. cannabis à de « faible taux de THC ») ont signalé que leur niveau d'anxiété et d'abattement (c.-à-d. se sentir triste, déprimé) était beaucoup plus faible, mais ils ont également indiqué que leur appétit était moins stimulé. Fait important, ces patients consommant un « faible taux de THC » ont signalé des taux équivalents de satisfaction thérapeutique, à ceux qui ont déclaré consommer du cannabis comprenant un « taux élevé de THC » (THC à 19 %, CBD < 1 %) et un « taux moyen de THC » (THC à 12 %, CBD < 1 %). Il est également surprenant de constater qu'il y avait peu de différence en matière de quantité quotidienne consommée exprimée en grammes entre les diverses variétés de THC et de CBD, toutes les catégories déclarant, en moyenne, consommer moins d'un gramme de cannabis séché par jour. Les résultats de l'étude sont également conformes au reste des écrits en ce qui concerne la dose moyenne quotidienne en grammes de cannabis séché consommé par les patients (c.-à-d. jusqu'à trois grammes au maximum, mais généralement, environ un gramme ou moins à de concentrations variables de THC). Considérés dans leur ensemble, les résultats de l'étude semblent indiquer que la consommation de cannabis contenant à peu près des concentrations équivalentes « plus faibles » de THC et « plus élevées » de CBD est associée à une efficacité et à une satisfaction thérapeutiques auto-déclarées dans le cadre de plusieurs affections médicales pour lesquelles le cannabis séché est habituellement consommé. Il est aussi lié à une atténuation des niveaux de perturbation de l'humeur. Les données suggèrent également que le cannabis contenant des concentrations plus élevées de THC et de faibles concentrations de CBD n'est pas nécessairement plus efficace que les souches dont les doses sont plus faibles, sauf dans le cas de la stimulation de l'appétit. Cependant, il semble que la consommation de souches à forte concentration de THC est associée à une perturbation de l'humeur plus importante que les souches à concentration faible de THC. L'étude comportait un certain nombre de restrictions, comme l'observation de seulement un petit nombre de patients, d'une quantité limité d'affectations et consistait d'une enquête auto-déclarée.
Deux études in vivo menées chez des primates autres que les humains (c.-à-d. des macaques rhésus) ont démontré que le CBD atténuait certains des effets du THC, y compris les effets d'affaiblissement des capacités cognitives et de perturbation des comportements d'inhibition de l'activité motriceReference 134.
Une étude in vivo menée chez des primates autres que les humains (c.-à-d. des macaques rhésus) a démontré que le CBD, lorsqu'administré selon un rapport de 1 : 1 au THC, atténuait certains des effets d'affaiblissement des capacités cognitives du THC et surtout les effets affectant la mémoire spatiale, mais n'avait aucun effet sur les déficiences du rendement induites par le THC (c.-à-d. les effets non particuliers sur l'activité motrice et la motivation)Reference 134. Une autre étude in vivo menée chez des primates autres que les humains (c.-à-d. des macaques rhésus) examinant les effets aigus et chroniques du CBD sur les perturbations des comportements d'inhibition de l'activité motrice induites par le THC ont démontré que le CBD, à un rapport de 3 : 1 et non de 1 : 1 au THC, atténuait certains des effets comportementaux aigus et chroniques de plus fortes doses de THC sur les perturbation des comportements d'inhibition de l'activité motriceReference 135.
En résumé, bien qu'il semble que le CBD puisse moduler certains effets comportementaux du THC, des études plus approfondies s'imposent afin d'élucider l'influence du CBD et d'autres phytocannabinoïdes ou terpénoïdes aussi bien sur les effets physiologiques ou psychologiques liés à la consommation du Δ9-THC que sur tout trouble médical.
Aperçu des effets pharmacologiques du cannabis
L'essentiel des informations disponibles relatives aux effets aigus du cannabis proviennent des études menées auprès de ceux qui le consomment à des fins non médicales, et beaucoup moins d'informations sont disponibles à partir d'études cliniques menées auprès des patients qui consomment le cannabis à des fins médicales.
Les effets aigus du cannabis fumé ou ingéré comprennent l'euphorie (le « high » de la marijuana) ainsi que des effets cardiovasculaires, bronchopulmonaires, oculaires, psychologiques et psychomoteurs. L'euphorie maximale se produit typiquement rapidement après avoir fumé et prend généralement plus de temps si administré par voie oraleReference 80. Toutefois, certaines personnes peuvent éprouver de la dysphorie et de l'anxiétéReference 136. La tachycardie est le plus fréquent des effets physiologiques aigus associés à la consommation du cannabisReference 137-Reference 140.
Les effets psychoactifs à court terme de la fumée de cannabis chez ceux qui le consomment à des fins non médicales comprennent l'euphorie, telle que mentionnée plus haut, mais aussi la relaxation, la distorsion du temps, la perception accrue d'expériences sensorielles ordinaires (par exemple se nourrir, regarder des films et écouter de la musique) et une perte des inhibitions pouvant déclencher le rireReference 141. Ces effets sont suivis d'une période de dépressionReference 142. La plupart des revues indiquent que la consommation de cannabis est liée à la déficience d'une variété de tâches cognitives et de la mémoire à court termeReference 102Reference 142-Reference 146 et les niveaux de Δ9-THC dans le plasma après avoir fumé le cannabis semblent avoir un effet sur la fonction cognitive qui dépendrait de la dose, du temps et de la concentrationReference 147-Reference 149. La capacité à conduire ou à utiliser de la machinerie complexe, y compris les aéronefs, peut s'avérer considérablement compromiseReference 150-Reference 153.
Le Tableau 1 (ci-dessous), adapté à partir d'une revueReference 154, relève certains des effets pharmacologiques du cannabis dans la marge du dosage thérapeutique. Plusieurs des effets sont biphasiques, par exemple, une activité accrue avec des doses aiguës ou faibles, et une diminution de l'activité avec des doses plus fortes ou un usage chroniqueReference 137Reference 155Reference 156. Les effets diffèrent grandement selon les personnes et peuvent être accrus chez les patients jeunes, gravement malades, plus âgés, ou qui consomment d'autres médicaments.
| Systèmes et appareils de l'organisme et effet | Détails des effets |
|---|---|
| Système nerveux central (SNC) | |
| Psychologique (Sections 4.9.5 et 7.7) |
Euphorie (« high »), dysphorie, anxiété, dépersonnalisation, précipitation ou aggravation de la psychose, schizophrénie ou trouble bipolaire (particulièrement chez les individus vulnérables) et idées suicidaires/tentatives de suicide (particulièrement parmi les hommes), données limitées et mitigées dans l'état de stress post-traumatique (ESPT), données mitigées pour le syndrome amotivationnelReference 80Reference 157-Reference 198. |
| Perception (Section 7.7.1) |
Perception sensorielle élevée, distorsion de la perception de l'espace et du temps, hallucinations, perceptions erronéesReference 170Reference 174Reference 185Reference 199-Reference 206. |
| Sédatif (Sections 6.2 et 7.7) |
Dépression généralisée du SNC, endormissement, somnolence (effet selon la dose sur le sommeil); s'ajoutant aux autres dépresseurs du SNC (opiacés et alcool)Reference 59Reference 137Reference 157Reference 167Reference 171Reference 174Reference 179Reference 180Reference 190Reference 207-Reference 222. |
| Cognition, rendement psychomoteur (Sections 7.7.1 et 7.7.2) |
Fragmentation de la pensée, obnubilation (attention et concentration), troubles de la mémoire/amnésie, déficience globale du rendement particulièrement pour les tâches complexes et exigeantes et s'ajoutant aux autres dépresseurs du SNC (p. ex. l'alcool)Reference 120Reference 145Reference 146Reference 150-Reference 153Reference 180Reference 200Reference 201Reference 222-Reference 231. |
| Fonction motrice (Sections 4.9.1 et 7.7.2) |
Manque de coordination, ataxie, chutes, dysarthrie, faiblesseReference 137Reference 167Reference 169Reference 171Reference 175Reference 201Reference 202Reference 217Reference 222Reference 232-Reference 236. Des données limitées et mitigées dans la dystonie, la maladie de Huntington, le syndrome de Tourette et la maladie de ParkinsonReference 174Reference 237-Reference 257. |
| Épilepsie (Section 4.6) |
Propriétés antiépileptiformes et anticonvulsives avec le CBD (et probablement aussi avec la cannabidivarine (CBDV) et THCV)Reference 210Reference 212Reference 258-Reference 260. Effets mixte pro et antiépileptiformes ainsi que pro et anticonvulsifs avec le THCReference 259Reference 261Reference 262. |
| Analgésique (Section 4.7) |
Données limitées d'effets mixtes pour la douleur aiguëReference 263-Reference 270. Effet modéré contre la douleur chronique non liée au cancer (principalement neuropathique)Reference 58Reference 59Reference 108Reference 171Reference 174Reference 179Reference 180Reference 190Reference 213Reference 217Reference 220Reference 221Reference 264Reference 269Reference 271-Reference 277. Effets modestes et mixtes pour la douleur liée au cancerReference 131Reference 278-Reference 281. Effet « d'épargne en opiacés » mixteReference 131Reference 276Reference 280Reference 282-Reference 284. Données très limitées d'effets mixtes pour les céphalées et migrainesReference 285-Reference 289. |
| Anti-nausées ou antiémétiques; hyperémétiques (Sections 4.3 et 7.6.1) |
Observé après des doses aiguësReference 282Reference 290-Reference 294; la tolérance pourrait se produire en cas d'usage chroniqueReference 295. Inversement, des nausées et/ou des vomissements peuvent aussi être observés avec l'utilisation à des fins médicalesReference 222. L'hyperémèse a aussi été observé avec des doses plus fortes ou en cas d'usage chronique dans des contextes non médicauxReference 296-Reference 306. |
| Appétit (Sections 4.4 et 4.9.8.4) |
Accru chez des sujets normaux en bonne santé mais aussi chez des patients souffrant de l'anorexie et de la cachexie liées au virus de l'immunodéficience humaine (VIH)/ syndrome d'immunodéficience acquise (SIDA)Reference 133Reference 174Reference 218Reference 219Reference 222Reference 307-Reference 310. Données mixtes et modestes pour une perte d'appétit chez les patients atteints du cancerReference 311-Reference 318. Données faibles pour l'anorexie mentaleReference 319Reference 320. |
Tolérance |
Tolérance à la plupart des effets comportementaux et somatiques, y compris le « high » (avec usage chronique)Reference 176Reference 225Reference 321-Reference 330. |
| Dépendance, syndrome de sevrage (Section 2.4) |
La dépendance a été produite expérimentalement et observée après une intoxication prolongéeReference 141Reference 157Reference 185Reference 326Reference 331-Reference 334. L'abstinence entraîne des symptômes de sevrage pouvant inclure la colère, l'anxiété, l'agitation, l'irritabilité, l'humeur dépressive, les troubles de sommeil, des rêves étranges, la diminution de l'appétit et la perte de poids corporelReference 185Reference 326Reference 335-Reference 339. |
| Systèmes cardiovasculaire et cérébrovasculaire | |
| Fréquence et rythme cardiaques (Section 7.5) |
Tachycardie observée après des doses aiguës; la tolérance se produisant avec exposition chroniqueReference 137-Reference 140Reference 179Reference 180Reference 340-Reference 343. Les contractions ventriculaires prématurées, les palpitations, la fibrillation auriculaire, l'arythmie ventriculaire sont aussi observées avec des doses aiguësReference 140Reference 222Reference 344-Reference 348. |
| Circulation périphérique (Section 7.5) |
Vasodilatation, rougeur de la conjonctive, hypertension en position couchée, hypotension posturaleReference 214Reference 222Reference 342Reference 344Reference 349-Reference 351. |
| Débit cardiaque (Section 7.5) |
DébitReference 344 et demande d'oxygène du myocardeReference 349 accrus. |
| Débit sanguin cerebral (Section 7.5) |
Accru avec une dose aiguë, diminué avec usage chronique, variations en fonction de la régionReference 342Reference 352. |
| Infarctus du myocarde (Section 7.5) |
Risque accru d'un infarctus aigu du myocarde une heure après avoir fumé le cannabis, surtout chez des personnes souffrant déjà d'une maladie cardiovasculaireReference 140Reference 349. |
| Accident vasculaire cerebral (Section 7.5) |
Risque accru de subir un accident vasculaire cérébral après un épisode aigu de cannabis fuméReference 344Reference 353Reference 354. |
| Carcinogenèse et mutagenèse | |
| (Section 7.1) | La fumée de cannabis contient beaucoup des mêmes substances chimiques que la fumée de tabac et les condensats de la fumée de cannabis sont plus cytotoxiques et mutagènes que ceux de la fumée de tabacReference 82Reference 84. Des données contradictoires lient fumer du cannabis au cancerReference 355-Reference 358. Lien possible entre fumer du cannabis et le cancer des testiculesReference 359. |
| Système respiratoire | |
| Changements histopathologiques/inflammation (Section 7.2) |
Fumer du cannabis chroniquement est lié aux changements histopathologiques dans les poumons (hyperplasie des cellules basales, stratification, hyperplasie des cellules caliciformes, désorganisation cellulaire, inflammation, épaississement de la membrane basale et métaplasie des cellules squameuses)Reference 360. Fumer du cannabis à long terme est lié à la toux, à la production accrue de mucosités et à la respiration sifflanteReference 361. |
| Bronchodilatation (Sections 4.9.3 et 7.2) |
L'exposition aiguë au THC entraîne la dilatation, éventuellement réversible avec l'exposition chronique (en fumant)Reference 361. Le cannabis fumé ou vaporisé pourrait aggraver les symptômes asthmatiquesReference 362Reference 363. |
| Fonction pulmonaire (VEM1; CVF) (Section 7.2) |
Faible exposition aiguë, éventuellement stimulante; fumer excessivement à long terme éventuellement associé à une diminution de la fonction pulmonaireReference 361Reference 364-Reference 368. |
| Appareil gastrointestinal | |
| (Sections 4.9.8 et 7.6) | Diminution de la motilité gastroinstestinale, sécrétion réduite, vidange gastrique et du colôn réduit, actions anti-inflammatoires, données limitées et mixtes d'un effet bénéfique pour le syndrome du côlon irritable et les maladies inflammatoires de l'intestinReference 33Reference 180Reference 275Reference 369. Douleur abdominale, nausée, vomissements, diarrhéeReference 222. |
| Foie (Section 4.9.8.3 et 7.6.2) |
Risque accru de stéatose ou de fibrose hépatiques, surtout chez des patients atteints d'hépatite CReference 35Reference 370-Reference 372. Augmentation de l'adhérence au traitement de l'hépatite C avec comme résultat l'absence potentielle prolongée de quantités décelables du virus de l'hépatite CReference 373. |
| Pancréas (Section 4.9.8.5) |
Risque de pancréatite aiguë avec l'usage chronique quotidien excessifReference 374-Reference 376Reference 378. |
| Système musculo-squelettique | |
| (Sections 4.5.1, 4.5.3 et 4.8) | Effet bénéfique éventuel positif dans le soulagement de la douleur chronique associée à la polyarthrite rhumatoïdeReference 379-Reference 381 et à la fibromyalgieReference 179Reference 382Reference 383. Pourrait atténuer la spasticité liée à la sclérose en plaques et au traumatisme médullaireReference 220Reference 221Reference 274Reference 384. Pourrait avoir une incidence négative sur la guérison des osReference 385. |
| Yeux | |
| (Section 4.9.2) | Données limitées d'une diminution de la pression intraoculaireReference 386-Reference 388. |
| Système immunitaire | |
| (Section 7.3) | Effets immunomodulateurs complexes avec des effets suppresseurs et/ou stimulants (administration aiguë et chronique)Reference 26Reference 389. Hypersensibilité et réactions allergiquesReference 362Reference 363Reference 390Reference 391. |
| Appareil reproducteur | |
| Hommes (Sections 2.5 et 7.4) |
Niveaux d'hormone folliculo-stimulante (FSH), hormone lutéinisante (LH) et testostérone soit non affectés soit diminués avec une consommation chronique de cannabis fuméReference 392 (mais voirReference 393 qui rapporte des niveaux augmentés de testostérone). Diminution de la concentration de spermatozoïdes et du nombre de spermatozoïdes et morphologie modifiée avec une consommation chronique de cannabis fumé chez les hommesReference 392Reference 393. Diminution de la motilité des spermatozoïdes, de la capacitation et de la réaction acrosomale avec une exposition in vitro au THCReference 392. Effets stimulants (dose élevée) ou inhibiteurs (dose faible) en fonction de la dose sur le comportement sexuel chez les hommesReference 392Reference 394 (mais voirReference 395 qui suggère une augmentation de la fréquence coïtale avec une augmentation de la fréquence de consommation chez les hommes et les femmes). |
| Femmes (Sections 2.5 et 7.4) |
Une administration aiguë de THC supprime la libération de la gonadolibérine (GnRH) et de la tyrolibérine (TRH) avec une libération diminuée de prolactine et de gonadotrophines (FHS et LH) dans des études animales et humainesReference 396. Association entre la consommation de cannabis et des perturbations du cycle menstruel chez les femmes incluant : légère augmentation du taux de cycles menstruels sans ovulation (c.-à-d. cycles anovulatoires), risque plus élevé de fertilité diminuée, phase folliculaire prolongée/ovulation retardée, bien que les données soient mixtesReference 396. Administration chronique/sous-chronique de TCH chez les animaux : fonction de l'axe hypothalamo-hypohyso-ovarien (HPO) altérée, perturbation du développement folliculaire, production d'œstrogène et de progestérone diminuée, poussée de LH bloquée, anovulationReference 396. Le cannabis peut altérer la fonctionnalité de l'axe HPO et les hormones ovariennes produites par l'axe HPOReference 396. Effets inhibiteurs (dose élevée) ou stimulants (dose faible) en fonction de la dose sur le comportement sexuel chez les femmesReference 394 (mais voirReference 395 qui suggère une augmentation de la fréquence coïtale avec une augmentation de la fréquence de consommation chez les hommes et les femmes). |
2.2 Pharmacocinétique
Cette section se limite à la pharmacocinétique humaine de cannabis fumé et vaporisé, aux préparations orales, y compris les médicaments sur ordonnance à base de cannabinoïdes comme le dronabinol (MarinolMD) et le nabiximols (SativexMD) et aux autres voies d'administration (p. ex. rectale, topique). Consultez la Figure 2 (ci-dessous) pour un schéma decrivant la pharmacocinétique du THC.
Figure 2. Pharmacocinétique du THC (et d'autres cannabinoïdes). Figure adaptée selonReference 397.
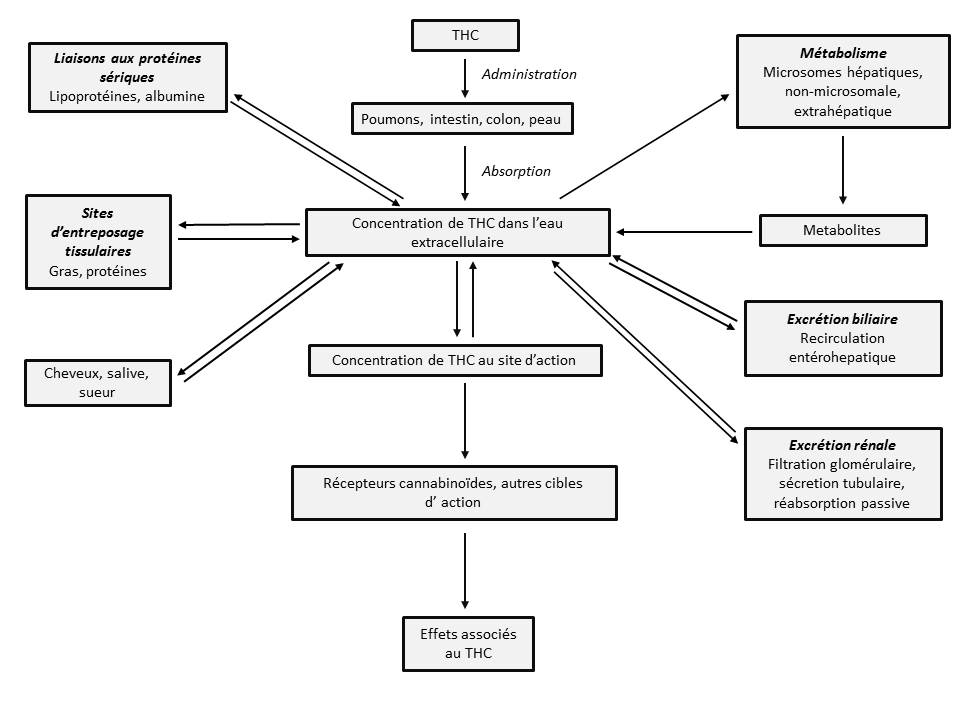
Le THC (et d'autres cannabinoïdes) peut être administré par inhalation (p. ex. en fumant ou en vaporisant), oralement (p. ex. aliments, gélules, sprays), par voie rectale (p. ex. suppositoires) ou par voie cutanée (p. ex. topiques) entraînant une absorption par les poumons, l'intestin, le côlon ou la peau. La concentration de THC (et d'autres cannabinoïdes) dans l'eau extracellulaire varie selon la liaison aux protéines sériques (lipoprotéines, albumine), le stockage tissulaire (gras, protéines), le métabolisme (microsomes hépatiques, non-microsomale, extrahépatique), l'excrétion biliaire (recirculation entérohépatique) et l'excrétion rénale (filtration glomérulaire, sécrétion tubulaire, réabsorption passive). Le métabolisme de THC (et d'autres cannabinoïdes) produit des métabolites qui se trouvent aussi dans l'eau extracellulaire. La concentration de THC dans l'eau extracellulaire affecte la concentration de THC (et d'autres cannabinoïdes) au site d'action. Les effets du THC (et d'autres cannabinoïdes) sont observés lorsque le THC (et d'autres cannabinoïdes) interagit avec les récepteurs cannabinoïdes ou d'autres cibles d'action. Le THC (et d'autres cannabinoïdes) peut également être détecté dans les cheveux, la salive et la sueur.
2.2.1 Absorption
2.2.1.1 Cannabis fumé
L'inhalation de fumée de cannabis déclenche un début d'action plus rapide (en quelques minutes), des concentrations des cannabinoïdes plus élevées dans le sang et une durée plus courte d'effets pharmacodynamiques aigus, comparativement à l'administration par voie oraleReference 78. La quantité de Δ9-THC (et autres cannabinoïdes) produite par les cigarettes de cannabis n'est pas uniforme et constitue une variable essentielle dans l'évaluation de l'absorptionReference 78. La source végétale et la composition de la cigarette/joint ainsi que l'efficience et la façon de fumer du consommateur sont autant de facteurs non contrôlésReference 78Reference 398. Même si l'on signale que les fumeurs peuvent doser leur apport en Δ9-THC, dans une certaine mesure, en adaptant leur comportement de consommation afin d'obtenir les niveaux désirés de Δ9-THCReference 399, d'autres raisons pourraient expliquer les différences observées dans la topographie de la consommationReference 400. Comme mentionné, l'absorption du Δ9-THC par inhalation est extrêmement rapide, quoiqu'assez variable, avec une biodisponibilité de 2 à 56 % par la voie fumée, selon la profondeur de l'inhalation, la durée de l'apnée et la rétention de la boufféeReference 397Reference 401. En pratique, une teneur maximale de 25 à 27 % du THC dans une cigarette de cannabis est absorbée ou libérée dans le système circulatoire à partir de la teneur totale disponibleReference 137Reference 402. On estime qu'entre 2 et 44 µg de THC pénètre dans le cerveau après avoir fumé une cigarette de cannabis contenant de 2 à 22 mg de THC (p. ex. : un joint de 1 g comprenant de 0,2 à 2,2 % de THC livrant entre 0,2 et 5,5 mg de THC selon une biodisponibilité par voie fumée de 10 à 25 %)Reference 403.
Les relations entre la teneur en Δ9-THC du cannabis, la dose administrée et les niveaux plasmatiques qui en découlent ont été étudiés. Les concentrations plasmatiques moyennes de Δ9-THC se situaient à 7,0 ng/mL et à 18,1 ng/mL en une seule inhalation d'une cigarette de cannabis à faible teneur en Δ9-THC de 1,75 % (dose totale disponible ~16 mg Δ9-THC) ou une cigarette de cannabis à forte teneur en Δ9-THC de 3,55 % (dose totale disponible ~34 mg Δ9-THC)Reference 78. Le cannabis fumé contenant 1,64 % de Δ9-THC (dose moyenne disponible de 13,0 mg de Δ9-THC) a donné une pointe moyenne de niveau de THC dans le plasma de 77 ng/mLReference 404. Il en est de même de la consommation des joints de cannabis contenant 1,8 % de Δ9-THC (dose totale disponible ~14 mg Δ9-THC) qui a donné une pointe moyenne de niveaux de THC dans le plasma d'environ 75 ng/mL, tandis qu'avec 3,6 % de Δ9-THC (dose totale disponible ~28,8 mg Δ9-THC) on a pu atteindre une pointe moyenne des niveaux de Δ9-THC dans le plasma de 100 ng/mLReference 405. Une quantité de 25 mg de cannabis fumé dans une pipe contenant 2,5, 6 ou 9,4 % de Δ9-THC (doses totales disponibles de ~0,6, 1,5, ou 2,4 mg de Δ9-THC) était associé à la pointe de concentrations plasmatiques moyennes du Δ9-THC de 10, 25, ou 45 ng/mL de Δ9-THC respectivementReference 59. Une cigarette de cannabis fumé (800 mg) contenant 6,8 % de THC, (p/p) produisant une teneur totale en THC de 54 mg par cigarette était associée à une concentration médiane à la pointe en THC dans le sang total d'environ 60 ng/mL de Δ9-THC (se produisant 15 min après avoir commencer à fumer)Reference 406. Comparativement aux données disponibles pour l'absorption du THC fumé, il existe beaucoup moins de renseignements au sujet du CBD fumé. Dans l'une des premières études cliniques, fumer une cigarette de cannabis comprenant 19 mg de CBD (environ 2,4 % de CBD) a été associé à une pointe moyenne du niveau de CBD dans le plasma sanguin de 110 ng/mL (marge de 42 à 191 ng/mL) trois minutes après l'administration de la doseReference 407. La biodisponibilité systémique estimée du CBD par voie fumée était de 31 % (marge de 11 à 45 %), ce qui est généralement similaire à celle observée avec Δ9-THC.
2.2.1.2 Cannabis vaporisé
La vaporisation du cannabis a été étudiée comme autre solution à la fumée. Les avantages potentiels de la vaporisation comprennent la formation d'une plus petite quantité de sous-produits toxiques comme le monoxyde de carbone, les hydrocarbures aromatiques polycycliques et le goudron, ainsi qu'une extraction plus efficace du Δ9-THC (et du CBD) de la matière végétale du cannabisReference 399Reference 408-Reference 411. Les effets subjectifs et les concentrations plasmatiques du Δ9-THC obtenus par la vaporisation du cannabis sont comparables à ceux obtenus avec le cannabis fuméReference 399. En outre, l'étude a révélé que la vaporisation était bien tolérée, sans effets indésirables signalés, et généralement préféré par rapport à la fumée par les sujets du testReference 399. Même s'il a été signalé que la vaporisation se prête facilement à l'autodosage (comme il a été affirmé pour la fumée)Reference 399Reference 410, l'usage adéquat du vaporisateur visant une administration optimale de cannabis à des fins thérapeutiques doit être établi plus en détailReference 411. La quantité et le type de cannabis placé dans le vaporisateur, la température et la durée de la vaporisation ainsi que le volume du ballon, dans le cas de vaporisateur de type ballon, sont autant de paramètres qui peuvent influencer l'émission de Δ9-THC et autres phytocannabinoïdesReference 410. La bioéquivalence de la vaporisation comparée à la fumée n'a pas été totalement établie. L'inhalation du cannabis vaporisé (900 mg de 3,56 % de Δ9-THC, dose totale disponible de 32 mg de Δ9-THC) chez un groupe de patients prenant des doses à libération soutenue de la morphine ou de l'oxycodone a donné des niveaux de concentration plasmatique moyenne de Δ9-THC de 126,1 ng/mL en l'espace de trois minutes après le début de l'inhalation de cannabis, mais diminuant rapidement pour se situer à 33,7 ng/mL de Δ9-THC en 10 minutes, et atteignant 6,4 ng/mL de Δ9-THC en 60 minutesReference 276. La pointe de concentration (Cmax) de Δ9-THC était atteinte en trois minutes chez tous les participants de l'étudeReference 276. Aucun changement statistiquement significatif n'avait été signalé pour l'AUC12 (aire sous la courbe 12 heures) de la morphine ou de l'oxycodone, cependant, il semblait y avoir une baisse statistiquement significative dans la concentration maximale (Cmax) du sulfate de morphine et du retard dans le temps nécessaire pour atteindre la Cmax de la morphine lors de l'exposition au cannabisReference 276. Une étude clinique a signalé que vaporiser 500 mg de cannabis contenant une faible dose (2,9 %) de THC (environ 14,5 mg de THC) ou une dose élevée (6,7 %) de THC (environ 33,5 mg de THC) a été associé à des valeurs de Cmax médianes pour le sang total de 32,7 (faible dose) et de 42,2 ng/mL (dose élevée) de THC et des valeurs de Cmax médianes pour le plasma sanguin de 46,5 (faible dose) et de 62,1 ng/mL (dose élevée) de THC 10 minutes après l'inhalation, respectivementReference 201. Les valeurs de Cmax médianes pour le sang total pour le 11-hydroxy THC étaient de 2,8 (faible dose) et de 5 ng/mL (dose élevée) et les valeurs de Cmax médianes pour le plasma sanguin étaient de 4,1 (faible dose) et de 7 ng/mL (dose élevée) 10 à 11 minutes après l'inhalation, respectivement. Une autre étude clinique a observé que vaporiser du cannabis contenant de 11 à 12 % de THC (dose administrée de 300 µg/kg) a été associée à des concentrations moyennes dans le plasma sanguin de 73,8 ng/mL de THC et de 6,9 ng/mL de 11-hydroxy THC cinq minutes après la vaporisationReference 412. Une autre étude clinique a démontré que l'inhalation de 8 à 12 bouffées de cannabis vaporisé contenant soit 2,9 % ou 6,7 % de THC (400 mg chacune) a été associée à une Cmax pour le plasma sanguin de 68,5 ng/mL et de 177,3 ng/mL, respectivement, et une concentration médiane dans le plasma sanguin de 23 et 47 ng/mL, respectivementReference 413. La Cmax du 11-hydroxy THC dans le plasma sanguin était de 5,6 et de 12,8 ng/mL, respectivement pour les doses de 2,9 et de 6,7 %.
2.2.1.3 Voie orale
Bien que les effets aigus sur le SNC et les effets physiologiques se ressentent en quelques minutes seulement par la voie fumée ou par vaporisationReference 145Reference 414, ceux-ci se produisent en fonction d'une échelle temporelle en heures en ce qui concerne l'ingestion par voie oraleReference 414Reference 415. L'administration orale aïgue ne permet qu'un déclenchement d'action plus lent, des pics des niveaux de concentrations sanguines des cannabinoïdes plus bas et une durée prolongée des effets pharmacodynamiques par rapport à la fuméeReference 78. L'effet psychotropique ou « high » est observé plus rapidement par la voie fumée que par la voie orale, et c'est la raison pour laquelle la voie fumée semble être la voie préférée d'administration pour de nombreuses personnes, surtout parmi ceux qui utilisent le cannabis à des fins non médicalesReference 416.
En ce qui concerne les médicaments sur ordonnance à base de cannabinoïdes administrés par voie orale tels que le Δ9-THC synthétique (dronabinol, anciennement commercialisé sous le nom de MarinolMD), seulement 10 à 20 % de la dose administrée entre dans la circulation systémique, indiquant un métabolisme de premier passage hépatique intensifReference 222. L'administration d'une dose unique de 2,5 mg de dronabinol chez des volontaires en bonne santé était associée à une concentration plasmatique moyenne maximale (Cmax) de Δ9-THC de 0,7 ng/mL (marge de 0,3 à 1 ng/mL) et à un temps moyen de 2 h (marge de 30 min à 4 h) pour atteindre le pic de concentration plasmatique de Δ9-THCReference 222. Une dose unique de 5 mg de dronabinol a donné une Cmax moyenne de Δ9-THC de 1,8 ng/mL (marge de 0,4 à 3,3 ng/mL), tandis qu'une dose unique de 10 mg a produit une Cmax moyenne de Δ9-THC de 6,2 ng/mL (marge de 3.5 à 9 ng/mL)Reference 222. Encore une fois, le temps moyen au pic de la concentration plasmatique de Δ9-THC se situait entre 30 minutes et 3 h. L'administration deux fois par jour du dronabinol (doses individuelles de 2,5 mg, 5 mg, 10 mg b.i.d.) chez des volontaires en santé a produit des valeurs de Cmax de Δ9-THC de 1,3 ng/mL (marge de 0,7 à 1,9 ng/mL), 2,9 ng/mL (marge de 1,2 à 4,7 ng/mL), et de 7,9 ng/mL (marge de 3,3 à 12,4 ng/mL) respectivement, avec un temps au pic de la concentration plasmatique de Δ9-THC compris entre 30 minutes et 4 h après administration par voie oraleReference 222. Le dosage continu pendant sept jours avec des doses de 20 mg de dronabinol (doses quotidiennes totales de 40 à 120 mg de dronabinol) a produit des concentrations plasmatiques moyennes de Δ9-THC de ~20 ng/mLReference 417.
Une étude de phase I évaluant la pharmacocinétique de trois doses de THC (3 mg, 5 mg et 6,5 mg) administrées par voie orale chez 12 sujets plus âgés en bonne santé (âge moyen de 72 ans, tranches d'âge de 65 à 80 ans) révèle une grande variation entre les personnes en matière de concentrations plasmatiques de THC et de 11-hydroxy-THCReference 175. Chez les sujets ayant atteint la Cmax dans un délai de deux heures, la concentration moyenne de THC était de 1,42 ng/mL (marge de 0,53 à 3,48 ng/mL) pour la dose de 3 mg, 3,15 ng/mL (marge de 1,54 à 6,95 ng/mL) pour la dose de 5 mg et 4,57 ng/mL (marge de 2,11 à 8,65 ng/mL) pour la dose de 6,5 mg.
Une étude à répartition aléatoire, à double insu, contrôlée par placebo et croisée qui évaluait la pharmacocinétique du THC administré par voie orale chez 10 personnes âgées atteintes de démence (âge moyen de 77 ans) au cours d'une période de 12 semaines a signalé que le délai médian pour atteindre la Cmax (Tmax) était compris entre une et deux heures avec la pharmacocinétique du THC augmentant de façon linéaire avec l'augmentation de la dose mais, encore une fois, une grande variation a été observée entre les personnesReference 418. Les patients recevaient 0,75 mg de THC par voie orale deux fois par jour au cours des six premières semaines et 1,5 mg de THC deux fois par jour au cours de la deuxième période de six semaines. La Cmax moyenne était de 0,41 ng/mL après la première dose de THC de 0,75 mg et de 1,01 ng/mL après la première dose de THC de 1,5 mg. Après la deuxième dose de 0,75 mg de THC ou de 1,5 mg de THC, la Cmax était de 0,50 et de 0,98 ng/mL, respectivement.
Il est possible d'ingérer du Δ9-THC par voie orale au moyen d'aliments contenant du cannabis (p. ex. beurre, huile, brownies, biscuits) et des thés préparés à base de feuilles et de sommités fleuries. L'absorption d'une dose orale de 20 mg de Δ9-THC dans un biscuit au chocolat a été décrite comme étant lente et incertaineReference 398, avec une disponibilité systémique de seulement 4 à 12 %Reference 404. Bien que la plupart des sujets aient eu des pics de concentration plasmatique de Δ9-THC (6 ng/mL) entre une et deux heures après ingestion, certains des 11 sujets de l'étude ont eu leur pic à six heures et plusieurs ont eu plus d'un picReference 78. La consommation de brownies préparés avec du cannabis contenant 2,8 % de Δ9-THC (44,8 mg de Δ9-THC total) était associée aux changements comportementaux, bien que les effets aient pris du temps à survenir et étaient variablesReference 415. Les effets se sont produits entre 2,5 et 3,5 heures après la prise de la dose. L'on a aussi noté de modestes changements au niveau du rythme cardiaque et de la pression sanguine. Les concentrations plasmatiques de Δ9-THC n'étaient pas mesurées dans cette étude. Dans une autre étude, la consommation des brownies renfermant une faible dose de Δ9-THC (9 mg de Δ9-THC/ brownie) était associée à des pics de concentrations plasmatiques moyennes de Δ9-THC de 5 ng/mLReference 130. La consommation de brownies contenant une plus forte dose de Δ9-THC (~13 mg Δ9-THC/brownie) était associée à des pics de concentrations plasmatiques moyennes de Δ9-THC de 6 ou de 9 ng/mL selon que le THC dans les brownies provenait de matériel végétal ou y était ajouté sous forme de THC purReference 130. En utilisant des quantités équivalentes de Δ9-THC, l'inhalation par la fumée du cannabis a produit des pics de concentrations plasmatiques de Δ9-THC plusieurs fois (cinq à six fois voire plus) plus élevés que lorsque le Δ9-THC était ingéré par voie oraleReference 130. L'on a documenté des cas de thé préparé à base de sommités fleuries du cannabis séché (19,1 % de Δ9-THCA, 0,6 % de Δ9-THC), cependant, il est probable que la biodisponibilité du Δ9-THC soit plus faible que celle atteinte par la fumée en raison de la faible solubilité dans l'eau du Δ9-THC et des effets de premier passage dans le foieReference 419.
Après l'administration orale de biscuits au chocolat contenant 40 mg de CBD à des sujets humains, les niveaux moyens de CBD dans le plasma sanguin s'étendaient entre 1,1 et 11 ng/mL (moyenne de 5,5 ng/mL) après une heure et le parcours du CBD dans le plasma sanguin après six heures se trouvaient dans la même étendue qu'après 20 mg de THCReference 420. Des doses orales quotidiennes de 10 mg/kg de CBD administrées au cours d'une période de six semaines ont causé des concentrations hebdomadaires dans le plasma sanguin de 5,9 à 11,2 ng/mLReference 421. La prise orale de 5,4 mg de CBD a causé des concentrations de CBD dans le plasma sanguin s'étendant entre 0,2 et 2,6 ng/mL (moyenne : 0,95 ng/mL) après une heureReference 422. La biodisponibilité par voie orale a été estimée comme étant de 6 %Reference 420Reference 423.
Bien que les cannabinoïdes soien lipophiles et que des preuves anecdotiques suggèrent que les cannabinoïdes se dissolvent mieux dans les gras et les huiles, l'influence de divers gras sur l'absorption de cannabinoïdes in vivo n'a pas été très bien étudiée. Une étude clinique préliminaire a examiné les effets des graisses alimentaires sur l'absorption du THC et du CBD chez les ratsReference 424. Une dose de 12 mg/kg de THC ou de CBD dans soit une formule sans lipides ou une formule de triglycérides à chaîne longue de lipides (TLCL) a été administrée à des rats par gavage oral. La biodisponibilité maximale du THC était 2,5 fois plus élevée dans les formules contenant des lipides (Cmax = 172 ng/mL; AUC = 1 050 h.ng/mL) comparativement aux formules sans lipides (Cmax = 65 ng/mL; AUC = 414 h.ng/mL). La biodisponibilité absolue du CBD était trois fois plus élevée dans les formules contenant des lipides (Cmax = 308 ng/mL; AUC = 932 h.ng/mL) comparativement aux formules sans lipides (Cmax = 87 ng/mL; AUC = 327 h.ng/mL). De plus, un modèle de lipolyse in vitro a été utilisé afin d'évaluer le mécanisme à l'aide duquel les lipides pourraient améliorer la biodisponibilité du THC et du CBD. Les résultats ont démontré que 30 % du THC et du CBD étaient en solution dans la phase micellaire et étaient donc facilement accessibles. Des études d'incubation ont permis de déterminer que les cannabinoïdes possèdent une étendue d'association de 70 à 80 % aux chylomicrons naturels des rats et des humains. Les chylomicrons agissent en tant que transporteurs dans les intestins et transfèrent possiblement le THC et le CBD à la grande circulation par l'entremise du système lymphatique et évitent donc le métabolisme de premier passage hépatique, ce qui expliquerait l'augmentation de la biodisponibilité correspondant à l'utilisation de la formule contenant des lipides. Les auteurs ont tiré la conclusion que l'administration de cannabinoïdes accompagnés d'un repas riche en gras ou un biscuit riche en lipides contenant du cannabis peut augmenter l'exposition systémique et peut donc modifier l'efficacité de la substance en transformant une dose presque inefficace en une dose très efficace ou même une dose thérapeutique en une dose toxique.
Des études in vitro et in vivo laissent entrendre que l'exposition du CBD au fluide gastrique (simulé) mène à la conversion du CBD en THC et en hexahydrocannabinolsReference 425Reference 426. Chez la souris, il a été démontré que les hexahydrocannabinols pourraient, comme on l'observe typiquement avec le THC, produire des effets cataleptogènesReference 426. Les répercussions cliniques de cette conversion de CBD en THC et en hexahydrocannabinols font l'objet de débats animés et ne sont actuellement pas claires.
Comparaison de l'administration de doses par voie fumée, vaporisation et prise orale
Une étude clinique a répartition aleatoire, croisée, à double insu, contrôlée par placebo et en double feinte a examiné la pharmacocinétique du THC et de ses métabolites de première et deuxième phase entre les consommateurs de cannabis fréquents et occasionnels après l'administration par voie fumée, vaporisation et prise oraleReference 399. Du matériel végétal de cannabis (800 mg) ayant une teneur de 6,9 % en THC et de 0,2 % de CBD a été utilisé, livrant une dose maximale de 51 mg de THC et une dose maximale de CBD de 1,5 mg. La vaporisation a été effectuée à l'aide du vaporisateur « VolcanoMD » à une température de 210 °C. Le cannabis a été administré oralement par ingestion de brownies au cannabis. Chez les consommateurs de cannabis fréquents (consommant du cannabis cinq fois ou plus par semaine au cours des trois derniers mois), la Cmax de THC moyenne corrigée par rapport aux valeurs de base était de 151 ng/mL après avoir fumé le cannabis, de 85 ng/mL après la vaporisation et de 15 ng/ml après avoir consommé le cannabis par voie orale. Le Tmax moyen était de 7 minutes (voie fumée), 5 minutes (vaporisation) et 2,5 heures (ingestion orale). L'AUC0-72 h moyenne (ug ∙ h/L) était de 200 (voie fumée), 174 (vaporisation) et 167 (ingestion orale). Chez les consommateurs de cannabis occasionnels (consommant du cannabis plus de deux fois par mois, mais trois fois ou moins par semaine), la Cmax de THC moyenne corrigée par rapport aux valeurs de base était de 52 ng/mL après avoir fumé le cannabis, de 48 ng/mL après la vaporisation et de 10 ng/mL après avoir consommé le cannabis par voie orale. Le Tmax moyen était de 7 minutes (voie fumée), 7 minutes (vaporisation) et 2,3 heures (ingestion orale). L'AUC0-72 h moyenne (ug ∙ h/L) était de 20 (voie fumée), 12 (vaporisation) et 43 (ingestion orale). Chez les fumeurs de cannabis fréquents, la Cmax de 11-hydroxy-THC moyenne corrigée par rapport aux valeurs de base était de 9 ng/mL après avoir fumé du cannabis, de 5 ng/mL après la vaporisation et de 7 ng/mL après la consommation orale. Le Tmax moyen était de 13 minutes (voie fumée), 11 minutes (vaporisation) et 2,3 heures (ingestion orale). L'AUC0-72 h moyenne (ug ∙ h/L) était de 31 (voie fumée), 27 (vaporisation) et 52 (ingestion orale). Chez les fumeurs de cannabis occasionnels, la Cmax de 11-hydroxy-THC moyenne corrigée par rapport aux valeurs de base était de 3 ng/mL après avoir fumé du cannabis, de 2 ng/mL après la vaporisation et de 5 ng/mL après la consommation orale. Le Tmax moyen était de 13 minutes (voie fumée), 6 minutes (vaporisation) et 2,4 heures (ingestion orale). L'AUC0-72 h moyenne (ug ∙ h/L) était de 3 (voie fumée), 2 (vaporisation) et 33 (ingestion orale). Ces observations suggèrent que, entre autres, la Cmax de THC dans le sang était considérablement plus faible après la consommation orale comparativement aux voies par inhalation et le temps écoulé avant d'atteindre la concentration maximale de THC dans le sang (Tmax) était beaucoup plus long pour la consommation orale comparativement à l'inhalation pour les consommateurs de cannabis fréquents et occasionnels. De plus, la Cmax était considérablement plus élevée dans les cas où le cannabis était fumé comparativement aux cas où le cannabis était vaporisé, mais seulement parmi les consommateurs de cannabis fréquents. Aussi, les valeurs de Tmax du THC étaient considérablement plus élevées parmi les consommateurs fréquents que parmi les consommateurs occasionnels après avoir consommé du cannabis par voie fumée ou par vaporisation seulement et les valeurs de Cmax pour le 11-hydroxy THC étaient considérablement plus élevées parmi les fumeurs de cannabis fréquents indépendamment de la voie d'administration.
2.2.1.4 Voie oromucosale et intranasale
À la suite d'une seule administration oromucosale de nabiximols (SativexMD) (quatre vaporisations totalisant 10,8 mg de Δ9-THC et 10 mg de CBD), les pics de concentration plasmatique moyenne du THC (~5,5 ng/mL) et du CBD (~3 ng/mL) se produisent généralement entre deux et quatre heures, quoiqu'il y ait une grande variabilité interindividuelle entre les pics de concentrations plasmatiques des cannabinoïdes, le temps du début des effets et le pic de ceux-ciReference 427. Lorsqu'administrées par voie oromucosale, les concentrations sanguines du Δ9-THC et des autres cannabinoïdes sont plus faibles que celles atteintes par l'inhalation du même dosage de cannabis fumé, mais les concentrations sanguines du Δ9-THC sont comparables à celles observées lorsque le dronabinol est administré par voie oraleReference 127Reference 427. L'administration oromucosale de nabiximols se prête aussi facilement à l'autodosageReference 126Reference 380Reference 428Reference 429.
Quelques études précliniques ont exploré l'administration intranasale du THC et du CBD. Dans le cadre d'une étude sur des lapins, l'administration intranasale d'une dose de 1 mg/kg de THC dans une solution liquide ou une formule de gel à base de chitosanes a produit des Cmax de 20 ng/mL et de 31 ng/mL, avec des Tmax de 20 et de 45 minutes, respectivement, comparativement à l'administration par voie intraveineuse où la Cmax était de 1 475 ng/mL et le Tmax était de 0 minuteReference 430. Dans le cadre d'une autre étude sur des rats, l'administration intranasale d'une dose de 200 µg/kg de différentes formules de CBD a produit des valeurs de Cmax s'étendant de 20 à 35 ng/mL avec des valeurs de Tmax s'etendant de 20 à 30 minutes; comparativement à l'administration intraveineuse produisant une Cmax de 3 596 ng/mLReference 431.
2.2.1.5 Voie rectale
Bien que le Δ9-THC en soi ne s'absorbe pas par la voie rectale, la prodrogue, le hémisuccinate de Δ9-THC est absorbée; ce fait, en plus d'une diminution du métabolisme de premier passage par voie rectale entraînent une biodisponibilité plus élevée du Δ9-THC (de 52 à 61 %) par la voie rectale que par la voie oraleReference 432-Reference 436. Les concentrations plasmatiques du Δ9-THC sont dépendantes de la dose et du véhicule et varient aussi selon la structure chimique de l'ester de THCReference 435. Chez les humains, les doses par voie rectale de 2,5 à 5,0 mg du hémisuccinate de l'ester de Δ9-THC ont été associés à des pics de concentrations plasmatiques de Δ9-THC allant de 1,1 à 4,1 ng/mL, dans un délai de deux à huit heures et des pics de concentrations de carboxy-Δ9-THC allant de 6,1 à 42,0 ng/mL, dans un délai de une à huit heures après administrationReference 432.
2.2.1.6 Voie topique
Les cannabinoïdes sont hautement hydrophobes, rendant ainsi le transport à travers la couche aqueuse de la peau l'étape de limitation du taux dans le processus de diffusionReference 78. Il n'existe aucune étude clinique publiée faisant état de l'absorption percutanée d'onguents, de crèmes ou de lotions à base de cannabis. Toutefois, certaines recherches pré-cliniques ont été menées sur l'apport transdermique de cannabinoïdes synthétiques et naturels au moyen d'un timbre dermalReference 437Reference 438. Un timbre contenant 8 mg de Δ8-THC a produit une concentration plasmatique à l'état d'équilibre moyenne de 4,4 ng/mL de Δ8-THC en 1,4 heure chez un modèle de cobaye, et cette concentration était maintenue pendant au moins 48 heuresReference 437. Les perméabilités du CBD et du CBN s'étaient révélées être dix fois plus élevées que celles du Δ8 -THCReference 439. L'application transdermique d'un gel contenant du CBD contenant ou non un agent favorisant la perméabilité de la peau sur des cobayes sans poil a produit des résultats de Cmax de 9 ng/mL sans l'agent et de 36 ng/mL avec l'agent et des Tmax de 38 h et de 31 h après l'administration, respectivementReference 431. De plus, les concentrations à l'état d'équilibre étaient de 6 ng/mL sans et de 24 ng/mL avec l'agent favorisant la perméabilité de la peau. Une autre étude préclinique d'une formule de gel de CBD transdermique (1 % ou 10 %) appliquée quotidiennement en doses croissantes de 0,6, 3,1, 6,2 et 62 mg/jour a produit des résultats de concentrations dans le plasma sanguin de 4 ng/mL, 18 ng/mL, 33 ng/mL et de 1 630 ng/mL, respectivementReference 440. Finalement, une étude préclinique effectuée à l'aide d'une lotion contenant 1 % de CBD a déclaré des résultats de Cmax de 8 ng/mL, un Tmax de 38 h et une concentration de plasma sanguin à l'état d'équilibre de 6 ng/mLReference 441.
2.2.2 Distribution
La distribution du Δ9-THC s'effectue en fonction du temps et commence immédiatement après l'absorption. Il est essentiellement absorbé par les tissus adipeux et les organes hautement perfusés tels que le cerveau, le cœur, les poumons et le foie en raison de son caractère lipophileReference 78. Le Δ9-THC a un grand volume apparent de distribution d'environ 10 L/kg, en raison de sa forte liposolubilitéReference 442. Le volume moyen apparent de distribution du CBD était de 32,7 L/kg (plus élevé que celui du THC) en raison de sa solubilité très élevée dans les lipidesReference 407. Le CBN possède un volume de distribution encore plus élevé : 50 L/kgReference 443. La liaison du Δ9-THC et de ses métabolites aux protéines plasmatiques est d'environ 97 %Reference 444Reference 445. Le Δ9-THC est principalement lié aux lipoprotéines de basse densité (LDL), dont jusqu'à 10 % est présent dans les globules rougesReference 446, tandis que le métabolite, 11-hydroxy THC, est fortement lié à l'albumine, avec seulement 1 % se trouvant dans la fraction libreReference 447.
Les concentrations de Δ9-THC les plus élevées se trouvent dans le cœur et les tissus adipeux, les niveaux atteignant 10 et 1 000 fois celui du plasma, respectivementReference 448. En dépit du haut degré de perfusion du cerveau, la barrière hématoencéphalique semble limiter l'accès et l'accumulation de Δ9-THC dans cet organeReference 78Reference 449Reference 450 et le délai dans la corrélation entre le pic de concentration plasmatique et les effets psychoactifs peut être attribuée, en partie, au temps nécessaire au Δ9-THC pour traverser cette barrièreReference 398. Les études précliniques sur des souris suggèrent un taux de pénétration plus rapide pour le 11-hydroxy THC dans le cerveau comparativement au composé mère à un rapport de 6 : 1 pour le 11-hydroxy THC comparativement au THCReference 397Reference 451Reference 452.
Comme mentionné, le Δ9-THC s'accumule et est retenu dans les tissus adipeux, et sa libération depuis ce site de stockage dans le sang est lentReference 449. On ignore aussi si le Δ9-THC persiste dans le cerveau (un tissu très gras) à long terme; toutefois, la présence d'un déficit cognitif résiduel chez les forts consommateurs de cannabis abstinents suggère que le Δ9-THC pourrait être retenu dans le cerveau au moins à court termeReference 453Reference 454. Une étude qui a caractérisé l'élimination des cannabinoïdes dans le sang de 30 fumeurs masculins journaliers de cannabis pendant leur abstinence continue surveillée au cours d'une période allant jusqu'à 33 jours, dans une unité résidentielle fermée, révèle que du THC et son métabolite inactif 11-nor-9-carboxy Δ9-THC ont été décelés dans le sang jusqu'à un mois après la dernière consommation, ce qui, d'après les auteurs, est quatre fois plus long que ce qui a été décrit précédemmentReference 455. Cette observation appuie encore plus les preuves concernant la distribution, l'accumulation et l'entreposage du THC (et de ses métabolites) dans les tissus adipeux et la libération lente du THC (et de ses métabolites) des réserves des tissus adipeux dans la circulation sanguineReference 225. Le THC dans le plasma (provenant probablement des réserves des tissus adipeux corporels), détecté plusieurs semaines après la dernière consommation, pourrait être associé à un trouble psychomoteur persistant chez les fumeurs chroniques fréquents de cannabis selon les auteurs de l'étudeReference 225. Enfin, une étude expérimentale chez l'animal suggère que la privation d'aliments ou l'administration de l'hormone adrénocorticotrope (ACTH) chez les rats accélère la lipolyse et la libération du Δ9-THC depuis leur réserve de graisse; toutefois, il s'impose davantage de recherches afin de déterminer si ces effets sont associés à de l'intoxication ultérieure ou à des changements comportementaux et cognitifsReference 456.
2.2.3 Métabolisme
En majeure partie, le métabolisme des cannabinoïdes se produit dans le foie et des métabolites différents prédominent selon les voies d'administrationReference 78Reference 398. Le métabolisme complexe du Δ9-THC implique l'oxydation allylique, l'époxydation, la décarboxylation et la conjugaisonReference 398. Le Δ9-THC est oxydé par les oxydases à fonction mixte 2C9, 2C19 et 3A4, associés au cytochrome P450 (CYP) métabolisant les xénobiotiquesReference 78. Les principaux métabolites initiaux du Δ9-THC sont le 11-hydroxy Δ9-THC actif et le 11-nor-9-carboxy Δ9-THC inactifReference 78. Le 11-hydroxy Δ9-THC psychoactif est rapidement formé par l'action susmentionnée des oxydases microsomales dans le foie, des niveaux plasmatiques de ce métabolite étant parallèles à la durée de l'action observable de la drogueReference 457Reference 458.
Le métabolisme de phase I subit par le CBD est très exhaustif, produisant 30 différents métabolites observés dans l'urine dont les plus abondants sont les dérivés hydroxylés 7 (ou 11)-carboxy du CBD et dont le 7 (ou le 11)-hydroxy CBD est un métabolite mineurReference 78Reference 459Reference 460.
Les polymorphismes des isozymes CYP pourraient aussi avoir une incidence sur la pharmacocinétique du THC (et du 11-nor-9-carboxy Δ9-THC). Par exemple les sujets homozygotes pour la variante alléliqueCYP2C9*3 ont révélé des concentrations plasmatiques de Δ9-THC nettement plus élevées, une AUC plus large, et une diminution considérable de la clairance, entre autres mesures, par rapport à l'homozygote du CYP2C9*1 ou à l'hétérozygote du*1/*3Reference 461.
Les xénobiotiques ne sont pas seulement métabolisés par les CYP mais ils modulent également le niveau d'expression et l'activité de ces enzymes; ils sont par conséquent un point central dans les interactions médicamenteuses et les effets indésirables des médicamentsReference 462. Les hydrocarbures aromatiques polycycliques que l'on trouve dans la fumée de tabac et de cannabis augmentent l'expression de CYP1A2Reference 463, alors que le THC, le CBD et le CBN inhibent l'activité des enzymes CYP1A1, 1A2, 1B1 et 2A6Reference 74Reference 464. Il est aussi démontré que le CBD inhibe la formation des métabolites de Δ9-THC catalysés par le CYP3A4, avec moins d'effet sur le CYP2C9Reference 442, bien que suffisamment pour diminuer la formation de 11-hydroxy THCReference 121Reference 465. Veuillez consulter la Section 6.2 pour des renseignements plus détaillées.
Les résultats des expériences in vitro indiquent aussi que le Δ9-THC inhibe le CYP3A4, le CYP3A5, le CYP2C9 et le CYP2C19, alors que le CBD inhibe le CYP2C19, le CYP3A4 et le CYP3A5, bien que des concentrations plus fortes que celles vues en clinique sont nécessaires pour qu'il y ait inhibitionReference 74Reference 427. Bien que peu d'études aient visé spécifiquement à évaluer les interactions entre le cannabis et d'autres médicaments, per se, bon nombre, si ce n'est la plupart des études qui se sont intéressées aux effets thérapeutiques du cannabis (p.ex. le cannabis fumé, vaporisé on ingéré par voie orale) et aux médicaments à base de cannabinoïde (p.ex. le dronabinol, le nabilone, le nabiximols) ont été menées auprès de patients qui prenaient en même temps d'autres médicaments (p. ex. des agents anti-inflammatoires non stéroïdiens (AINS), des opioïdes, des antidépressifs, des anticonvulsivants, des inhibiteurs de protéase), et en général, ces dernières n'avaient pas signalé d'augmentations significatives des cas d'effets indésirables graves liés à la combinaison de cannabis ou des cannabinoïdes et ces autres médicaments. Néanmoins, une surveillance attentive des patients consommant du cannabis ou des cannabinoïdes en même temps que d'autres médicaments métabolisés par les enzymes mentionnés ci-haut peut être justifée. Veuillez consulter la Section 6.2 pour des instructions plus détaillées.
La monographie du produit SativexMD met en garde contre la combinaison de SativexMD et de l'amitriptyline ou du fentanyl (ou des opioïdes connexes) qui sont métabolisés par les cytochromes CYP3A4 et 2C19Reference 427. Un essai clinique qui examinait les effets de la rifampicine, du kétoconazole et de l'oméprazole sur la pharmacocinétique du THC et du CBD produits par SativexMD a indiqué que la coadministration de la rifampicine avec SativexMD est associée à une légère diminution des niveaux plasmatiques de THC, de CBD et de 11-hydroxy-THC, tandis que la coadministration de kétoconazole avec SativexMD est liée à une légère augmentation des niveaux plasmatiques de THC, de CBD et de 11-hydroxy-THCReference 466. Aucun effet significatif sur les niveaux plasmatiques de THC, de CBD ou de 11-hydroxy-THC n'a été constaté avec l'oméprazole.
La fumée de cannabis ainsi que le dronabinol administré par voie orale peuvent aussi avoir un effet sur la pharmacocinétique des médicaments antirétroviraux, bien qu'aucun effet néfaste à court terme sur les effets antirétroviraux d'intérêt clinique ait été observéReference 467. L'administration concurrente de cannabis sous forme de tisane (200 mL à 1 g/L contenant 18 % de THC et 0,8 % de CBD) et de 600 mg d'irinotecan par intraveineuse ou de 180 mg de docétaxel par intraveineuse au cours d'une période de 15 jours consécutifs n'a eu aucun effet considérable sur la pharmacocinétique de l'irinotécan ou du docétaxel dans le plasma sanguinReference 468.
De plus, comme il est observé avec la fumée de tabac, la fumée de cannabis a la capacité d'induire le CYP1A2, augmentant ainsi le métabolisme des xénobiotiques biotransformés par cet isozyme tel que la théophyllineReference 469 ou les antipsychotiques clozapine et olanzapineReference 470. Pour plus de renseignements sur les interactions entre médicaments, consultez la Section 6.2.
2.2.3.1 Voie inhalée
Les valeurs plasmatiques du 11-hydroxy THC apparaissent rapidement et augmentent peu après celles du Δ9-THC, environ 15 minutes après avoir commencé à fumerReference 471. Les pics de concentrations plasmatiques du 11-hydroxy THC sont d'environ 5 à 10 % du THC parent et le profil de la AUC de ce métabolite est en moyenne de 10 à 20 % du THC parentReference 458. Des résultats semblables ont été obtenus avec l'administration de THC par intraveineuseReference 472. Après l'oxydation, les métabolites résultant de la biotransformation de type phase II du médicament libre ou de l'hydroxy-THC apparaissent sous forme de conjugués glucuronésReference 398.
Les pics des valeurs plasmatiques du métabolite psycho-inactif, 11-nor-9-carboxy THC, se produisent entre 1,5 et 2,5 heures après avoir fumé et forment environ le tiers de la concentration du THC parentReference 471.
2.2.3.2 Voie orale
En comparant le métabolisme limité du Δ9-THC au métabolite 11-hydroxy suite à l'administration par voie pulmonaire, on observe que l'administration par voie orale du Δ9-THC entraîne une métabolisation significativement meilleure du Δ9-THC au métabolite 11-hydroxy produisant des concentrations plasmatiques comparables de Δ9-THC et de 11-hydroxy Δ9-THC par la voie oraleReference 401Reference 415Reference 473. Les niveaux plasmatiques du métabolite 11-hydroxy actif atteints par l'administration orale sont environ trois fois supérieures à ceux observés dans le plasma par la voie fuméeReference 458. De plus, l'observation du 11-hydroxy- Δ9-THC révèle que celle-ci est autant psychoactive ou encore plus psychoactive que la molécule THC mèreReference 397Reference 403Reference 474-Reference 476. Les concentrations de la drogue parente et du métabolite atteignent leur sommet à environ deux à quatre heures après la prise orale et diminuent pendant plusieurs joursReference 477.
Les renseignements de nature médicale présents sur la monographie du dronabinol (MarinolMD) suggèrent que des doses uniques du Δ9-THC de 2,5 mg, de 5 mg et de 10 mg chez des volontaires en bonne santé entraînent des valeurs plasmatiques moyennes de Cmax du 11-hydroxy Δ9-THC de 1,19 ng/mL (marge de 0,4 à 1,9 ng/mL), 2,23 ng/mL (marge de 0,7 à 3,7 ng/mL), et de 7,51 ng/mL (marge de 2,25 à 12,8 ng/mL) respectivementReference 222. L'administration deux fois par jour du dronabinol (doses individuelles de 2,5 mg, 5 mg, 10 mg b.i.d) chez des volontaires en bonne santé a produit des valeurs plasmatiques moyennes de Cmax de 1,65 ng/mL (marge de 0,9 à 2,4 ng/mL), de 3,84 ng/mL (marge de 1,5 à 6,1 ng/mL), et de 7,95 ng/mL (marge de 4,8 à 11,1 ng/mL) de 11-hydroxy Δ9-THC respectivementReference 222. Le délai nécessaire avant l'atteinte de la Cmax du 11-hydroxy Δ9-THC se situait entre 30 minutes et 4 heures, avec une moyenne d'environ 2,5 heuresReference 222. Comme mentionné ci-haut, le 11-hydroxy Δ9-THC a des propriétés psychomimétiques équivalentes ou supérieures à celles du Δ9-THCReference 401Reference 403Reference 474-Reference 476Reference 478Reference 479.
2.2.4 Excrétion
Les niveaux plasmatiques du Δ9-THC et du CBD diminuent rapidement après avoir cessé de fumer. Les concentrations plasmatiques moyennes de THC sont d'environ 60 % et 20 % des pics de concentrations plasmatiques obtenus 15 et 30 minutes respectivement après avoir fuméReference 480, et se situent sous 5 ng/mL de THC, deux heures après avoir fumé, bien que les concentrations moyennes de THC dans le sérum sont un peu plus élevées lorsque des cigarettes contenant plus de THC sont fuméesReference 401. Une étude a démontré que les niveaux de CBD dans le plasma sanguin chutent sous 5 ng/mL environ 2,5 h après avoir fumé une cigarette contenant 19 mg de CBDReference 407.
À la suite d'une dose fumée, l'élimination du THC et de ses métabolites se produit par les fèces (65 %) et par l'urine (20 %)Reference 78. L'élimination entière du Δ9-THC et de ses métabolites hydroxylés du corps prend en moyenne 0,2 L/kg-h, mais ceci varie beaucoup en raison de la complexité de la distribution des cannabinoïdesReference 222. Le 11-nor-9-carboxy Δ9-THC psycho-inactif est le principal métabolite acide du Δ9-THC excrété dans l'urineReference 481 et il est le cannabinoïde souvent dépisté dans l'analyse judiciaire des liquides corporelsReference 482Reference 483. Une étude caractérisant l'élimination des cannabinoïdes de 30 fumeurs de cannabis quotidiens mâles au cours d'une période soutenue de jusqu'à 33 jours d'abstinence, surveillée dans une résidence fermée, a observé que de faibles niveaux de THC (approx. < 1 ng/mL) et de son métabolite inactif, les 11-nor-9-carboxy THC, étaient détectés dans le sang jusqu'à un mois après la dernière consommation, ce qui a été déclaré par les auteurs comme étant une période de temps quatre fois plus élevée que celle décrite précédemmentReference 455.
À la suite d'une dose par voie orale, le THC et ses métabolites sont aussi excrétés par les fèces et par l'urineReference 78Reference 458. L'excrétion biliaire est la principale voie d'élimination, dont environ la moitié d'une dose par voie orale de THC radiomarqué est récupérée des fèces dans les 72 heures après l'administration, par opposition à une quantité de 10 à 15 % de THC récupérée de l'urineReference 458. L'élimination du CBD du plasma sanguin est semblable à celle du THC, s'étendant de 58 à 94 L/h (c.-à-d. 960 à 1 560 mL/min)Reference 397Reference 407. Une grande portion du CBD administré est éliminé sous forme intacte ou sous forme de son glucuronideReference 459Reference 484Reference 485. D'une dose de CBD administrée, 16 % de cette dose a été récupérée de l'urine sous forme intacte ou conjuguée dans les 72 h après l'administration, tandis que 33 % d'une dose de CBD administrée a été récupérée des fèces sous forme presque intacte (accompagnée de nombreux métabolites monohydroxylés, dihydroxylés et monocarboxyliques) dans les 72 h après l'administrationReference 407Reference 459.
Le déclin du Δ9-THC dans le plasma est multiphasique et les estimations de la demi-vie terminale du Δ9-THC chez les humains ont augmenté à mesure que les méthodes analytiques sont devenues plus sensiblesReference 442. Alors que les chiffres sur la demi-vie de l'élimination terminale du Δ9-THC semblent varier, il est probablement juste de dire qu'elle dure en moyenne quatre jours et pourrait être beaucoup plus longueReference 78. La variabilité des mesures de la demi-vie terminale est due tant à la dépendance de cette mesure sur la sensibilité de l'essai que sur la durée et le choix du moment au cours duquel les mesures sanguines sont effectuésReference 486. De faibles niveaux de métabolites du THC ont été décelés pendant plus de cinq semaines dans l'urine et les fèces des consommateurs de cannabisReference 442. Le degré de consommation de Δ9-THC ne semble pas influencer la demi-vie plasmatique du Δ9-THCReference 398Reference 487.
Comme le THC, la diminution des niveaux de CBD comporte aussi plusieurs phases et la demi-vie du CBD chez les humains après avoir fumé a été estimée comme étant de 27 à 35 h et de 2 à 5 jours après l'administration par voie oraleReference 398Reference 423Reference 460
2.3 Relations entre la pharmacocinétique et la pharmacodynamique
Une grande partie de l'information sur les relations entre la pharmacocinétique et la pharmacodynamique liées aux cannabinoïdes (surtout le Δ9-THC) provient des études sur la consommation du cannabis à des fins non médicales et non sur des études qui s'intéressent à son utilisation pour des raisons thérapeutiques; mais dans l'un et l'autre cas cette relation dépend dans une certaine mesure au moment précis au cours duquel il s'était effectué des observations suite à l'administration des cannabinoïdes. De plus, la relation temporelle entre les concentrations plasmatiques de Δ9-THC et ses effets cliniques ou thérapeutiques, psychotropes, cognitifs et moteurs n'est pas claire. Mais on sait que l'apparition de ces effets tardent par rapport aux concentrations plasmatiques de Δ9-THC, et l'on sait que la tolérance se développe à certains des effets, mais pas à d'autresReference 120Reference 206Reference 486 (Voir la Section 2.4 Tolérance et dépendance).
Comme mentionné plus haut, la relation entre la dose (et la concentration plasmatique) par rapport à la réponse pour des applications thérapeutiques possibles est mal définie, sauf pour ce qui est de l'information obtenue sur le dosage oral du dronabinol (Δ9-THC synthétique, commercialisé sous le nom de MarinolMD, mais n'est plus disponible au Canada), le nabiximols (un extrait botanique du cannabis contenant des concentrations approximativement égales de Δ9-THC et de CBD et bien d'autres cannabinoïdes, terpénoïdes et flavonoïdes, commercialisé sous le nom de SativexMD) ou le nabilone (l'analogue du Δ9-THC synthétique, commercialisé sous le nom de CesametMD) pour leurs indications limitéesReference 222Reference 427Reference 488. Des renseignements plus limités sont disponibles pour le cannabis inhaléReference 58Reference 59. Les interprétations de la pharmacocinétique du Δ9-THC sont aussi compliquées par la présence de métabolites actifs, particulièrement le 11-hydroxy THC psychoactif, qui atteint des concentrations supérieures après une administration par voie orale que par inhalationReference 415Reference 473.
Les concentrations plasmatiques visées de Δ9-THC dans le plasma ont été extrapolées à partir de la réponse du « high » subjectif qui peut ou non être associée aux applications thérapeutiques possibles. Divers modèles pharmacodynamiques présentent des estimations d'une concentration du plasma sanguin dans l'intervalle de 7 à 29 ng/mL de Δ9-THC nécessaire à la production d'un effet « high » subjectif maximal de 50 %Reference 486. D'autres études suggèrent que les concentrations plasmatiques de Δ9-THC liées à 50 % de l'effet « high » maximal varient entre 2 et 250 ng/mL de Δ9-THC (médiane de 19 ng/mL; moyenne de 43 ng/mL Δ9-THC) pour ce qui est de la fumée et de l'administration par voie intraveineuse, tandis que par la voie orale, les taux vont de 1 à 8 ng/mL Δ9-THC (médiane et moyenne de 5 ng/mL Δ9-THC)Reference 130Reference 489. Notamment, l'affaiblissement de la capacité de conduire est observé lorsque la concentration de THC dans le sérum sanguin se trouve entre 7 et 10 ng/mL (environ 3 à 5 ng/mL dans le sang total) et cette concentration de THC dans le sang a été comparée à un taux d'alcoolémie de 0,05 %, qui est aussi associé à l'affaiblissement de la capacité des conducteursReference 149.
Cannabis fumé
La simulation de multiples dosages avec une cigarette à 1 % de THC contenant 9 mg de Δ9-THC a provoqué un effet de « high » maximal d'une durée d'environ 45 minutes après le dosage initial, diminuant à 50 % de cet effet de pointe environ 100 minutes après avoir fuméReference 206. Un intervalle de dosage d'une heure avec cette dose donnerait un « high continu » et le temps de recouvrement après la dernière dose serait de 150 minutes (c.-à-d. 2,5 h). Le pic de concentration plasmatique de Δ9-THC pendant ce dosage est estimé à environ 70 ng/mL.
Une étude clinique a signalé une augmentation du pic du rythme cardiaque et « un effet plaisant de la drogue » perçu en sept minutes après que les sujets du test aient fumé 1 g de cigarette de cannabis contenant 1,8 % ou 3,9 % de THC (doses moyennes de Δ9-THC dans la cigarette étant de 18 mg ou de 39 mg respectivement)Reference 145. Les deux doses ont révélé des différences statistiquement significatives quant aux mesures subjectives et physiologiques, comparativement au placebo; la dose plus élevée était aussi considérablement différente de la dose moins élevée en ce qui a trait aux effets subjectifs, mais pas aux effets physiologiques tels qu'un effct sur le rythme cardiaque. La modélisation pharmacocinétique et pharmacodynamique de la relation entre la concentration et l'effet du Δ9-THC sur les paramètres du SNC et sur le rythme cardiaque suggère que les effets provoqués par le THC tardent à paraître par rapport à la concentration plasmatique du THC, lesquels effets ayant une durée bien plus longue que ceux des concentrations plasmatiques du Δ9-THCReference 490. L'estimation de la demi-vie d'équilibrage du rythme cardiaque était d'environ 7 minutes, mais il fluctuait entre 39 et 85 minutes en ce qui concerne divers paramètres du SNCReference 490. D'après ce modèle, les effets sur le SNC se sont développés plus lentement et ont duré plus longtemps par rapport aux effets sur le rythme cardiaque.
La performance psychomotrice et les effets subjectifs et physiologiques associés aux concentrations du sang total du Δ9-THC chez des fumeurs excessifs et chroniques du cannabis après un épisode aigu de la fumée du cannabis ont fait l'objet d'une étudeReference 406. Les sujets ont déclaré avoir fumé en moyenne un joint par jour au cours des 14 jours précédant le lancement de l'étude (marge de 0,7 à 12 joints par jour). Pendant l'étude, les sujets ont fumé une cigarette de cannabis (poids moyen de 0,79 g) contenant 6,8 % de THC, 0,25 % de CBD, et 0,21 % du CBN (p/p) produisant une teneur totale en THC, en CBD et en CBN de 54, 2,0 et 1,7 mg, respectivement de ces cannabinoïdes par cigarette. La pointe moyenne du niveau de concentration sanguin du THC et la pointe des données de l'échelle visuelle analogique (EVA) pour différentes mesures subjectives s'est produite 15 minutes après avoir commencé de fumer. D'après les auteurs de l'étude, la relation pharmacodynamique et pharmacocinétique a décrit une hystérésis dans le sens antihoraire (c.-à-d. dans des cas où pour la même concentration plasmatique d'une drogue (p. ex. le THC), les effets pharmacologiques s'en sont trouvés davantage sentis ultérieurement qu'ils ne l'étaient plus tôt) pour tous les effets subjectifs mesurés (p.ex. « effet plaisant de la drogue », « high », « défoncé », « stimulé », « tranquille », « anxieux » et « agité »). Ce type spécifique de relation démontre un manque de corrélation entre les concentrations sanguines de THC et les effets observés, débutant tout de suite après avoir fini de fumer et se poursuivant pendant les phases initiales de distribution et d'élimination. Tous les participants ont signalé un pic de « high » subjectif allant de 66 à 85 sur l'EVA avec le pic des concentrations du sang total de THC au moment de ces réponses allant de 13 à 63 ng/mL. À la suite de l'entame de la fumée du cannabis, le rythme cardiaque a connu une augmentation considérable au bout de 30 minutes, la tension artérielle diastolique ne s'est abaissée de façon importante qu'à partir du délai de 30 minutes à 1 heure, et la tension artérielle systolique et la fréquence respiratoire n'avaient changé à aucun moment.
Une étude portant sur les effets aigus subjectifs associés au cannabis fumé à trois doses différentes (c.-à-d. 29,3, 49,1 et 69,4 mg de THC) a indiqué que le THC augmentait considérablement les sensations de « high », d'« étourdissement », les « troubles de la mémoire et de concentration » ainsi que les sentiments d'« abattement », la sensation d'être « sous sédation » et le sentiment d'« anxiété »Reference 491. De plus, l'étude a également montré que des doses plus élevées de THC étaient associées à une durée plus longue d'effets subjectifs. Les résultats de l'étude ont révélé que la durée requise pour atteindre la cote « de high » maximale était légèrement différée (11 à 16 minutes) comparativement à la durée requise pour atteindre la concentration de sérum maximale de THC. La cote de « high » a diminué après avoir atteint un pic dans les 3,5 premières heures après l'administration de la dose. Les scores sur l'EVA pour les « étourdissements », l'« assèchement de la bouche », les « palpitations », les « troubles de la mémoire et de concentration », le sentiment d'« abattement », la sensation d'être « sous sédation » et le sentiment d'« anxiété » atteignaient leur maximum dans les deux premières heures après l'administration de la dose et ces effets ont été liés à la dose. Avec une dose de 29,3 mg de THC dans la cigarette (équivalente à un joint de 300 mg, par exemple, contenant 10 % de THC ou à un joint de 150 mg contenant 20 % de THC), la concentration sérique maximale de THC était d'environ 120 ng/mL et a été associée à un effet de « high » maximal de 50 %. Une dose de 49,1 mg de THC dans la cigarette (équivalente à un joint de 500 mg, par exemple, contenant 10 % de THC ou à un joint de 250 mg contenant 20 % de THC) a été associée à une concentration sérique maximale de THC de 170 ng/mL et à un effet de « high » maximal de 60 %. Une dose de THC de 69,4 mg (équivalent à 700 mg d'un joint, par exemple, contenant 10 % de THC ou à un joint de 350 mg contenant 20 % de THC) a été associée à une concentration sérique de THC de 200 ng/mL et à un effet de « high » maximal de 80 %. La diminution de la stimulation (c.-à-d. sédation) induite par le THC et l'augmentation de l'anxiété ont duré jusqu'à huit heures après la consommation. En effet, la sédation a augmenté près de six fois comparativement au placebo. Fait intéressant, la dose faible de THC a été associée aux scores les plus élevés des cotes « aime les effets de la drogue » et « volonté de recevoir une dose plus élevée de cette drogue ».
Cannabis vaporisé
L'inhalation de cannabis vaporisé (900 mg de Δ9-THC à 3,56 %; dose totale disponible de 32 mg de Δ9-THC) a entrainé l'observation d'une moyenne du niveau de Δ9-THC dans le plasma sanguin de 126,1 ng/mL moins de trois minutes après avoir amorcé l'inhalation de cannabis, chutant rapidement à 33,7 ng/mL de Δ9-THC après 10 minutes et atteignant 6,4 ng/mL de Δ9-THC après 60 minutesReference 276. La pointe de concentration de Δ9-THC (Cmax) était atteinte en trois minutes chez tous les participants de l'étudeReference 276. Les cotes de « high » subjectives les plus élevées ont été déclarées après 60 minutes du début de l'inhalationReference 276.
Une étude clinique a signalé que vaporiser 500 mg ad libitum de cannabis contenant une faible dose (2,9 %) de THC (environ 14,5 mg de THC) ou une dose élevée (6,7 %) de THC (environ 33,5 mg de THC) a été associé à des valeurs de Cmax médianes pour le sang total de 32,7 (faible dose) et de 42,2 ng/mL (dose élevée) de THC et des valeurs de Cmax médianes pour le plasma sanguin de 46,5 (faible dose) et de 62,1 ng/mL (dose élevée) de THC 10 minutes après l'inhalation, respectivementReference 201. Les valeurs de Cmax médianes pour le sang total pour le 11-hydroxy THC étaient de 2,8 (faible dose) et de 5 ng/mL (dose élevée) et les valeurs de Cmax médianes pour le plasma sanguin étaient de 4,1 (faible dose) et de 7 ng/mL (dose élevée) 10 à 11 minutes après l'inhalation, respectivement. Les effets subjectifs ont été mesurés à de nombreux moments et les effets ont été corrélés avec des concentrations de cannabinoïdes dans la salive et le sang. Les concentrations sanguines de THC ont été associées de façon positive aux sensations de « high », de « bon effet de drogue », de « stimulation », de « défoncé », d'« anxiété », d'« agitation », d' « altération du sens du temps », de « troubles d'élocution », d'« étourdissements » et de « bouche et gorge sèches ». Aucune différence considérable n'a été observée entre les effets de la dose faible (2,9 %) et élevée (6,7 %) de cannabis. Le cannabis vaporisé a augmenté considérablement les effets mesurés de « défoncé » et de « tranquille » immédiatement après l'administration de la dose et ces effets ont duré pendant 3,3 heures (ou 4,3 heures, lorsque combinées avec de l'alcool). Les sentiments d'« anxiété » ont démontré des effets considérables de cannabis en relation à la dose pendant 1,4 heure. Les effets indésirables comme la « sensation de soif » et de « bouche et gorge sèches » ont augmenté au cours des 3,3 premières heures après l'administration de la dose. Les sensations d'« difficulté de concentration » et d'« altération du sens du temps » ont produit des effets divers pendant 2,3 heures. Les effets et les durées des effets étaient semblables entre le cannabis fumé et vaporisé.
Une autre étude a mesuré 17 différents effets psychoactifs en fonction de la dose de THC et du temps pour le cannabis vaporiséReference 272. Dans le cadre de cette étude clinique aléatoire à double insu et contrôlée par placebo, des patients ont inhalé un total de 8 à 12 bouffées de cannabis vaporisé contenant soit 0 %, 2,9 % ou 6,7 % de THC (400 mg chacun). La dose de 2,9 % était associée à une Cmax de 68,5 ng/mL et la dose de 6,7 % était associée à une Cmax de 177,3 ng/mL. La Cmax du 11-hydroxy THC dans le plasma sanguin était de 5,6 et de 12,8 ng/mL, respectivement pour les doses de 2,9 et de 6,7 % respectivementReference 413. La dose plus faible a produit des effets moindres que ceux de la dose élevée et les effets du placebo étaient plus faibles que ceux des deux doses actives pour les sensations d'« effet de drogue général », « effet plaisant de la drogue », de « high », d'« affaiblissement des capacités », de « défoncé », de « tranquille » et d'« altération de la perception de la réalité ». Les cotes des sensations de « mauvais effet de drogue », d'« aime la drogue », de « nausée » et d'« altération du sens du temps » étaient considérablement plus faibles avec le placebo que pour les deux doses actives. La dose plus élevée (6,7 %) a été associée à des cotes considérablement plus élevées de sensations de « désir d'en consommer plus », de « faim », de « troubles de mémoire », d'« ivresse », de « confusion » et de « difficultés de concentration » comparativement à la dose placebo; les seules différences considérables entre la dose faible et la dose élevée étaient les sensations d'« ivresse », de « confusion » et de « difficultés de concentration ». Un effet clair de réponse à la dose a été observé pour la majorité des effets psychoactifs.
Cannabinoïdes administrés par voie orale et oromucosale
Les effets subjectifs et physiologiques suite à l'administration contrôlée de nabiximols (SativexMD) par voie oromucosale ou du Δ9-THC par voie orale ont fait l'objet d'une comparaisonReference 126. Des augmentations dans la tension artérielle systolique ont été notées après l'administration de faibles doses (5 mg) et des doses élevées (15 mg) par voie orale de THC, de même que de faibles doses (5,4 mg de Δ9-THC et 5 mg de CBD) et des doses élevées (16,2 mg de Δ9-THC et 15 mg de CBD) de nabiximols par voie oromucosale, les effets atteignant leurs pics à environ trois heures après l'administration. En revanche, la tension artérielle diastolique s'est abaissée entre quatre et huit heures après la prise de la dose. Le rythme cardiaque a augmenté après tous les traitements actifs. Une augmentation statistiquement importante du rythme cardiaque par rapport au placebo a été observée suite à une forte dose par voie orale du THC (15 mg de Δ9-THC) et une forte dose du nabiximols par voie oromucosale (16,2 mg de Δ9-THC et 15 mg de CBD), mais les auteurs ont indiqué que les augmentations semblaient moins significatives cliniquement par rapport à celles enregistrées typiquement pour le cannabis fumé. De fortes doses par voie orale du THC (15 mg de Δ9-THC) et du nabiximols par voie oromucosale (16,2 mg de Δ9-THC et 15 mg de CBD) ont été associées aux « effets plaisants de la drogue » beaucoup plus importants comparativement au placebo, tandis que de faibles doses de nabiximols par voie oromucosale (5,4 mg de Δ9-THC et 5 mg de CBD) ont été associées aux « effets plaisants de la drogue » nettement plus élevés comparativement à 5 mg du THC. Un sentiment subjectif du « high » a été signalé comme étant beaucoup plus important après 15 mg par voie orale du THC par rapport au placebo et à 5 mg par voie orale du THC. En revanche, ni les fortes doses ni les faibles doses du nabiximols par voie oromucosale n'avaient été signalées comme produisant un sentiment statistiquement important du « high » subjectif. Les sujets de l'étude ont signalé avoir été plus anxieux à quatre heures environ après l'administration par voie orale de 5 mg du THC, à 3 heures suite à la prise de 15 mg de THC par voie orale, à 5,5 heures suite à la prise de la faible dose du nabiximols et à 4,5 heures suite à la prise de la forte dose de nabiximols par voie oromucosale. Tous les traitements médicamenteux actifs ont provoqué significativement plus d'anxiété par rapport au placebo. Après administration par voie orale de 15 mg de THC, l'on a observé que la concentration plasmatique du THC avait une faible corrélation positive, mais statistiquement importante avec la tension artérielle systolique et diastolique, l' « effet plaisant de la drogue », et le « high ». Après administration de nabiximols à dose élevée par voie oromucosale, l'on a aussi observé des corrélations positives entre les concentrations plasmatiques du THC et les résultats sur les mesures « anxieux », l' « effet plaisaint de la drogue », « high », « stimulé » et le M-scale (marijuana-scale, échelle M). Comme est le cas pour d'autres études, les auteurs de cette étude ont rapportés que les corrélations linéaires entre les concentrations plasmatiques du THC et les effets physiologiques et subjectifs étaient faibles. En fin, bien que le CBD ne semble pas moduler les effets du THC, les auteurs ont suggéré qu'il aurait peut-être atténué l'ampleur du « high » subjectif.
Une étude clinique au cours de laquelle la dose a été augmentée et qui a examiné le profil pharmacocinétique et pharmacodynamique de doses de THC suprathérapeutiques et administrées par voie orale (c.-à-d. 15 mg, 30 mg, 45 mg, 60 mg, 75 mg, 90 mg) chez sept consommateurs de cannabis révèle que la Cmax augmentait généralement en fonction de la dose, mais qu'elle variait considérablement d'un sujet à l'autre, en particulier lorsque les doses étaient plus élevéesReference 492. La variabilité de Tmax était aussi significative aussi bien chez les sujets qu'entre ceux-ci, la médiane globale étant de 3,3 heures pour le THC et le 11-hydroxy-THC. Le THC augmenta, en fonction de la dose, le rythme cardiaque tandis que la tension arterielle systolique fut diminué par des basses doses de THC (c.-à-d. 30 mg) mais fut augmenté par des doses plus élevés (c.-à-d. 75 mg et 90 mg). Aucun changement n'a été remarqué pour la tension artérielle diastolique. En ce qui concerne les réponses subjectives, les scores des cotes « tout effet de la drogue » et « soif » ont augmenté en fonction de la dose; cependant, pour les effets tels que « l'effet plaisant de la drogue », le « high », « fatigué/sous sédation », « défoncé », « manque de mémoire » et « confus/difficulté de concentration », les doses supérieures à 30 mg n'ont pas été associées de façon constante à des scores plus élevés.
2.4 Tolérance, dépendance et symptômes de sevrage
Tolérance
La tolérance telle que définie par le Liaison Committee on Pain and Addiction (le comité de liaison sur la douleur et la dépendance, un comité mixte composé de représentants de l'American Pain Society, l'American Academy of Pain Medicine, et l'American Society of Addiction Medicine) est un état d'adaptation par lequel l'exposition à une drogue entraîne des changements qui débouchent sur une diminution de l'un ou plusieurs effets de celle-ci au fil du tempsReference 493.
La tolérance aux effets du cannabis ou des cannabinoïdes semble provenir en grande partie des mécanismes pharmacodynamiques plutôt que pharmacocinétiquesReference 325. Les études précliniques indiquent que la tolérance pharmacodynamique est principalement liée aux changements de la disponibilité des récepteurs cannabinoïdes, surtout le récepteur CB1, à pouvoir signaler. Deux mécanismes moléculaires indépendants, mais étroitement liés, sont à l'origine de ces changements: la désensibilisation (ou le découplage du récepteur des événements d'émission de signaux intracellulaires en aval) et la régulation à la baisse (résultant de l'internalisation et/ou de la dégradation du récepteur) des récepteursReference 494. De plus, dans le cerveau, ces adaptations semblent varier selon les régions, indiquant des mécanismes cellulaires et tissulaires spécifiques qui réglementent la désensibilisation et la régulation à la baisseReference 325. Les études ont indiqué que les récepteurs CB1 dans le noyau caudé-putamen et ses aires de projection (p. ex. globus pallidus et substantia nigra) affichent l'ampleur la moins importante de désensibilisation et de régulation à la baisse des récepteurs CB1, tandis que les récepteurs CB1 dans l'hippocampe présentent l'ampleur la plus importante de désensibilisation et de régulation à la baisse en réponse à une exposition chronique au THCReference 495. Les récepteurs CB1 situés dans le striatum sont aussi moins sensibles à la désensibilisation et à la régulation à la baisse que les mêmes récepteurs dans l'hippocampeReference 495.
Une étude clinique a démontré que l'utilisation chronique de cannabis a été associée à une diminution globale de la disponibilité des récepteurs CB1 dans le cerveau dont des diminutions considérables de la disponibilité des récepteurs CB1 dans le lobe temporal, les cortex cingulaires antérieur et postérieur et le noyau accumbensReference 496. L'étude a principalement été menée sur des mâles d'âge moyen de début d'usage de cannabis de 16 ans, de durée moyenne d'utilisation de cannabis de 10 ans, de quantité de consommation moyenne de cannabis de trois joints par jour dont 60 % des sujets de l'étude étaient considérés comme des consommateurs excessifs (plusieurs fois par jour), 30 % étaient des consommateurs modérés (une fois par jour jusqu'à trois à quatre fois par semaine) et 10 % étaient des utilisateurs infréquents (deux à trois fois par mois ou moins). De plus, quelques études cliniques ont examiné la chronologie des changements de la disponibilité des récepteurs CB1 suivant l'administration chronique de THC et suivant l'abstinenceReference 331Reference 497. Au cours de la première étude, fumer du cannabis excessivement quotidiennement chroniquement (en moyenne 10 joints/jour pendant 12 ans) a été associé à la régulation à la baisse réversible et sélective sur le plan régional (diminution de 20 %) des récepteurs de cannabinoïdes CB1 corticaux du cerveauReference 497. Dans le cadre de la seconde étude, la dépendance au cannabis (fumé chroniquement quotidiennement et de façon modérée) a été associée à la régulation à la baisse des récepteurs CB1 (c.-à-d. diminution d'environ 15 % à la base, non en état d'ivresse ou de sevrage) comparativement aux valeurs témoins sainesReference 331. La régulation à la baisse des récepteurs CB1 a commencé à se renverser rapidement dès la fin de l'utilisation de cannabis (en moins de deux jours) et après 28 jours continuels d'abstinence surveillée la disponibilité des récepteurs CB1 n'était pas statistiquement ni considérablement différente de celle des valeurs témoin saines (bien que la disponibilité des récepteurs n'ait jamais atteint les niveaux observés pour les valeurs témoins saines). La disponibilité des récepteurs CB1 a aussi été corrélée de façon négative à la dépendance au cannabis et aux symptômes de sevrage.
Les variations régionales observées d'adaptations cellulaires au THC dans le cerveau peuvent également s'appliquer à d'autres tissus ou organes, ce qui explique pourquoi une tolérance se développe à l'égard de certains effets du cannabis et des cannabinoïdes, mais pas à l'égard d'autres effets. Chez l'animal, l'ampleur et le délai de la tolérance semble être fonction de l'espèce, du ligand du récepteur cannabinoïde, du dosage et de la durée du traitement, et des mesures appliquées pour déterminer la tolérance au traitement par cannabinoïdesReference 325.
La tolérance à la plupart des effets du cannabis et des cannabinoïdes peut se développer après quelques doses seulement et elle se dissipe aussi rapidement suivant l'interruption de son administrationReference 136. On a signalé le développement de tolérance aux effets du cannabis sur la perception, la psychoativité, l'euphorie, l'affaiblissement des capacités cognitives, l'anxiété, l'augmentation du niveau de cortisol, l'humeur, la pression intraoculaire (PIO), les électroencéphalogrammes (EEG), le rendement psychomoteur et la nausée; certaines personnes ont aussi développé une tolérance aux effets cardiovasculaires tandis que d'autres n'ont pas développé ces tolérancesReference 321Reference 329Reference 330. Il y a également des données qui suggèrent que de la tolérance aux effets du cannabis sur le sommeil peut se développer (examiné dans l'articleReference 204). Tel que mentionné plus haut, la dynamique de la tolérance diffère selon les effets étudiés, et se manifeste plus facilement et rapidement pour certains effets que d'autresReference 327Reference 328. Cependent, la tolérance à certains effets thérapeutiques induits par les cannabinoïdes (c.-à-d. la spasticité, l'analgésie) ne semble pas se développer, du moins chez certains patientsReference 211Reference 322Reference 324. Selon un document, dans le contexte clinique, la tolérance aux effets du cannabis ou des cannabinoïdes peuvent éventuellement être allégés en combinant de faibles doses du cannabis ou des cannabinoïdes avec un ou plusieurs médicaments thérapeutiques supplémentairesReference 498.
Une étude a révélé que la tolérance à certains des effets du cannabis, y compris la tolérance au « high », s'est développée lorsque le THC a été administré par voie orale (30 mg q.i.d. pour quatre jours; dose quotidienne totale de 120 mg)Reference 499 et aussi lorsqu'une dose à peu près équivalente a été fumée (cigarette de 3,1 % de THC; q.i.d. pour quatre jours)Reference 500. Il n'y a eu aucune diminution de l'effet stimulant l'appétit, quelle que soit la voie d'administration. Dans une autre étude, l'intensité des effets aigus subjectifs induits par le THC aurait diminué jusqu'à 80 % après 10 jours d'administration de THC par voie orale (10 - 30 mg THC chaque 3 - 4 h)Reference 501.
Une étude clinique qui a évalué les effets du cannabis fumé sur la fonction psychomotrice, la mémoire de travail, la prise de risque, et les effets subjectifs et physiologiques chez les consommateurs de cannabis occasionnels et fréquents après un plan de consommation contrôlé révèle que, comparativement aux consommateurs de cannabis fréquents, les fumeurs occasionnels présentaient beaucoup plus de troubles psychomoteurs, de la mémoire de travail spatiale, une prise de risque et une impulsivité considérablement accrues, des scores nettement plus élevés pour les cotes « high », et « stimulé », ainsi que davantage d'anxiétéReference 176. Les fumeurs occasionnels ont déclaré des scores nettement supérieurs par rapport aux fumeurs fréquents en ce qui concerne la « difficulté de concentration », la « notion du temps modifiée », la « sensation de faim », la « sensation de soif », les « tremblements » et l'« assèchement de la bouche ou de la gorge ». Comparativement aux fumeurs fréquents, les fumeurs occasionnels présentaient une augmentation significative de la fréquence cardiaque par rapport à la fréquence de base et une tension artérielle systolique et diastolique plus élevée peu de temps après l'administration de la doseReference 176. Ces résultats semblent indiquer que les consommateurs fréquents de cannabis peuvent développer une certaine tolérance à des troubles psychomoteurs, malgré les concentrations sanguines plus élevées de THC. Les fumeurs occasionnels ont aussi signalé des effets subjectifs nettement plus longs et plus intenses comparativement aux fumeurs fréquents chez qui les concentrations de THC étaient plus élevées, ce qui suggère qu'une tolérence aux effets subjectifs peut se développer.
Une étude clinique a évalué le développement de la tolérance aux effets de l'administration par voie orale 24 heures sur 24 du THC (20 mg toutes les 3,5 à 6 heures) sur une période de six jours chez 13 fumeurs masculins journaliers de cannabis en bonne santéReference 321. La dose de THC du matin a fait grimper les cotes d'intoxication le deuxième jour, mais ses effets ont diminué les quatrième (après administration d'une dose de THC cumulative de 260 mg) et sixième jours, tandis que le THC a diminué la tension artérielle et augmenté la fréquence cardiaque au cours de la période de six jours, ce qui laisse supposer le développement d'une tolérance aux effets subjectifs d'intoxication du THC et l'absence de tolérance à ses effets cardiovasculaires. La tolérance aux effets subjectifs d'intoxication du THC administré par voie orale est survenue après une exposition à une dose totale de 260 mg de THC durant quatre joursReference 321.
Une autre étude clinique révèle que bien que les grands consommateurs chroniques de cannabis aient développé une tolérance aux affaiblissements comportementaux du THC, ces sujets n'ont pas développé une tolérance croisée aux effets affaiblissants de l'alcool et ce dernier amplifiait les effets affaiblissants du THC sur des mesures telles que l'attention partagéeReference 502.
Une étude non contrôlée, à prolongation ouverte, suivant une etude à répartition aléatoire faisant intervenir l'administration du nabiximols pour une durée initiale de cinq semaines chez des patients atteints de SP et souffrant de douleur neuropathique centrale révèle l'absence de tolérance pharmacologique (mesurée selon la modification du dosage quotidien moyen du nabiximols), analgésie induite par les cannabinoïdes, même après presque deux ans de traitement chez un groupe de patients choisisReference 324. Une autre étude à long terme et à prolongation ouverte du nabiximols chez des patients atteints de spasticité causée par la SP a appuyé cette étude, révélant aussi l'absence de la tolérance pharmacologique à l'effet contre la spasticité (mesurée selon la modification du dosage quotidien moyen de nabiximols), après presque un an de traitementReference 322. Une étude multicentrique et prospective des cohortes, examinant l'innocuité du cannabis à long terme chez des patients l'utilisant dans le cadre de leur schéma posologique de gestion de la douleur pour la douleur chronique non associée au cancer, a observé de petites augmentations non considérables de la dose quotidienne au cours d'une période d'étude d'un anReference 211.
Plus récemment, une étude clinique croisée à double insu, contrôlée par placebo et à trois volets menée auprès des consommateurs de cannabis réguliers suggère que la tolérance pourrait ne pas se manifester envers certains des effets aigus sur les fonctions neurocognitives malgré la consommation régulière de cannabisReference 412. L'étude comprenait 122 participants consommateurs réguliers de cannabis (durée moyenne de consommation : 7 ans; marge de 1 à 23 années), dont le taux d'utilisation moyen était de 44 occasions (marge de 2 à 100) au cours des trois derniers mois. Les traitements consistaient d'un placebo vaporisé ou de 300 µg/kg de THC (cannabis contenant de 11 à 12 % de THC). L'administration aiguë de cannabis vaporisé a affaibli le rendement d'un grand éventail de domaines neurocognitifs : les fonctions exécutives, la maîtrise des impulsions, l'attention et les fonctions psychomotrices des participants étaient considérablement pires après avoir consommé du cannabis comparativement au placebo. La fréquence d'utilisation du cannabis a été considérablement corrélée aux changements d'ivresse subjective après la consommation de cannabis et a été aussi corrélée et a interagi à des changements du rendement psychomoteur, ce qui signifie que l'ivresse subjective et les troubles psychomoteurs à la suite de l'exposition au cannabis diminuent lorsque consommé plus fréquemment; toutefois, les valeurs de base de l'ivresse subjective et des troubles psychomoteurs étaient déjà plus élevées chez les consommateurs fréquents comparativement aux consommateurs moins fréquents (vraisemblablement en raison de la charge corporelle de THC déjà élevé pouvant causer des niveaux d'ivresse suffisants et de légers troubles psychomoteurs). Les auteurs proposent que les fonctions neurocognitives des consommateurs quotidiens (ou presque) puissent être considérablement affaiblies en raison de la consommation répétée de cannabis, au cours et au-delà de la phase d'ivresse initiale.
La tolérance pharmacocinétique (y compris des modifications dans l'absorption, la distribution, la biotransformation et l'excrétion) a également été documentée lors d'administration répétée de cannabinoïdes, mais celle-ci semble s'observer à un degré moindre par rapport à la tolérance pharmacodynamiqueReference 503.
Dépendance et sevrage
La dépendance peut être classée sous deux concepts indépendants, mais qui dans certaines situations sont interdépendants : la dépendancephysique et la dépendance psychologique (c.-à-d. l'addiction)Reference 493. D'après la définition du Liaison Committee on Pain and Addiction, la dépendance physique est un état d'adaptation qui se manifeste par un syndrome de sevrage d'une catégorie de drogue spécifique pouvant se produire à la suite d'une interruption abrupte, d'une réduction rapide de la dose, d'une diminution de la concentration sanguine du médicament et/ou de l'administration d'un antagonisteReference 493. La dépendance psychologique (c.-à-d. l'addiction) est une maladie neurobiologique, primaire et chronique dont le développement et les manifestations subissent l'influence de facteurs génétiques, psychosociaux et environnementaux; elle se caractérise par l'un ou plusieurs des comportements suivants : perte de la capacité à faire preuve de retenue dans l'usage de la drogue, usage compulsif, continuation de l'usage malgré ses effets néfastes et état de manqueReference 493. Le SEC participe au comportement d'acquisition et du maintien de la consommation de la drogue et à divers processus comportementaux et physiologiques associés à la dépendance psychologique ou à l'addictionReference 2. Dans l'ancien DSM-IV (manuel diagnostique et statistique des troubles mentaux, 4e édition), le terme « dépendance » était étroitement relié au concept d'« addiction », lequel peut ou non comprendre la dépendance physique et est caractérisé par la consommation, malgré les dommages et la perte de contrôle sur la consommationReference 504. Il est démontré que la dépendance au cannabis (physique et psychologique) se produit, et ce surtout en présence d'une consommation élevée et chroniqueReference 141Reference 185Reference 326. Dans le nouveau DSM-5, l'expression « dépendance au cannabis » a été remplacée par le concept de « trouble d'utilisation du cannabis » (TUC) dont l'intensité peut varier de légère à grave en passant par modérée, en fonction du nombre de critères des symptômes approuvésReference 505. Dans le DSM-5, le TUC repose sur les critères de diagnostic suivants : une tendance problématique de consommation de cannabis entraînant une détresse ou un trouble clinique important, se manifestant par au moins deux symptômes, au cours d'une période de 12 mois. Pour une liste des symptômes, veuillez vous référer au DSM-5Reference 505.
Dépendance psychologique
Les facteurs de risque de la transition de la consommation à la dépendance ont été identifiés et comprennent les éléments suivants : être jeune, être mâle, être pauvre, posséder un faible niveau d'éducation, habitant dans un milieu urbain, début de consommation précoce de la substance, consommation d'une autre substance psychoactive et cooccurrence d'un trouble psychiatriqueReference 506. Notamment, la transition à la dépendance au cannabis se produit considérablement plus rapidement que la transition à la dépendance à la nicotine ou à l'alcoolReference 506. Les données signalées indiquent qu'après la première année de consommation de cannabis, la probabilité de transition à la dépendance est d'un peu moins de 2 % tandis que la fréquence de dépendance au cannabis à vie parmi ceux qui ont déjà consommé du cannabis est d'environ 9 %Reference 506. La prévalence du développement du TUC augmente à entre 33 et 50 % parmi les consommateurs quotidiensReference 507. Des données épidémiologiques américaines plus récentes suggèrent que les prévalences sur 12 mois et à vie du TUC du DSM-5 sont de 2,5 % et 6,3 %, respectivement, et que les taux correspondants du DSM-IV sur 12 mois et à vie montrent une augmentation substantielle entre 2001-2002 et 2012-2013, avec les taux sur 12 mois et à vie augmentant de 1,5 % et 8,5 %, respectivement, à 2,9 % et 11,7 %, respectivementReference 508. Ces augmentations de la prévalence à 12 mois et à vie sont considérées comme entraînées par les augmentations de la prévalence d'usagers du cannabis.
La National Epidemiological Survey on Alcohol and Related Conditions (NESARC), une étude prospective de grande envergure des États-Unis menée parmi 34 653 répondeurs examinant l'association entre la consommation de cannabis et les risques de trouble de santé mentale et de consommation de substances dans la population générale adulte des États-Unis, a observé que la consommation de cannabis (dans la première vague : 2001-2002) était associée au développement plus tardif (dans la deuxième vague : 2004-2005) de troubles de consommation de substances (c.-à-d., tout trouble de consommation de substance : RC = 6,2, 95 % IC = 4,1 à 9,4; tout trouble de consommation d'alcool : RC = 2,7, 95 % IC = 1,9 à 3,8; tout TUC : RC = 9,5, 95 % IC = 6,4 à 14,1; tout trouble de consommation d'autres drogues : RC = 2,6, 95 % IC = 1,6 à 4,4; et la dépendance à la nicotine : RC = 1,7; 95 % IC = 1,2 - 2,4), mais non pas à des troubles de l'humeur ou d'anxiétéReference 509. Une plus grande fréquence de consommation de cannabis a été associée à un plus grand risque d'incidence et de prédominance de troubles, appuyant une association de réponse liée à la dose entre la consommation de cannabis et les risques de développement de troubles de consommation de substances.
Une autre étude menée à l'aide des données de la NESARC (2012-2013) a observé que la probabilité de développement du TUC après 12 mois et à vie était plus élevée chez les mâles, ceux de descendance autochtone, les célibataires, les gens à faible revenu et les jeunes adultes (p.ex., parmi les jeunes adultes âgés de 18 à 24 ans comparativement aux adultes âgés de 45 ans et plus, le RC = 7,2, 95 % et l'IC = 5,5 à 9,5)Reference 335. De plus, le TUC après 12 mois a été associé à d'autres troubles de consommation de substances (RC = 6,0 à 9,3), aux troubles d'humeur et affectifs (RC = 2,7 à 5,0), les troubles d'anxiété (RC = 1,7 à 3,7) et les troubles de personnalité (RC = 3,8 à 5,0). Les répondeurs à l'enquête atteints de TUC après 12 mois étaient considérablement différents des autres selon toutes les composantes de l'handicap de l'enquête; les handicaps augmentaient au fur et à mesure que la gravité du TUC augmentait. Parmi les participants atteints de TUC après 12 mois selon le DSM-5, 61 % d'entre eux étaient en état de besoin pour le cannabis, 32 % étaient affectés de symptômes de sevrage au cannabis et 23 % étaient affectés de ces deux dernières affectations.
En comparant les données de la première vague (2001-2002) et de la deuxième vague (2012-2013) du NESARC, une étude a observé que la prévalence de la consommation de cannabis avait plus que doublée au cours de la période entre les deux vagues de l'étudeReference 508. De plus, une grande augmentation de TUC s'est produite au cours de cette période puisque près de 3 consommateurs de cannabis sur 10 ont signalé un TUC en 2012-2013. Les jeunes adultes possédaient le plus grand facteur de risque de développement du TUC dans le cadre des deux vagues de l'enquête (RC = 7,2 pour ceux âgés de 18 - 29 ans; RC = 3,6 pour ceux âgés de 30 - 44 ans), mais l'augmentation relative de la prévalence du TUC chez les adultes âgés de 45 à 64 ans et ceux âgés de 65 ans et plus était beaucoup plus élevée que l'augmentation chez les jeunes adultes.
Une étude rétrospective menée sur un échantillon représentatif de l'ensemble de la population de 6 935 adultes australiens examinant l'initiation à la consommation de cannabis et la transition au TUC a observé que le temps moyen entre la première consommation et le début du TUC était de 3,3 ans (temps médian = 2 ans) dont 90 % des cas survenaient dans les huit ans suivant la première consommationReference 510. Les âges d'initiation plus précoces et la consommation d'autres substances étaient de bons indicateurs de la transition de consommation à TUC. En effet, les âges plus précoces de la première consommation de cannabis étaient associés à un risque plus élevé de transition au TUC et chaque âge subséquent de première consommation étant associé à une diminution de 11 % de la probabilité de développement du TUC. Les troubles d'anxiété sociale et de panique ont aussi été associés à la transition de consommation de cannabis au TUC. Les consommateurs de cannabis mâles couraient de plus grands risques de développement du TUC que les femmes et les femmes atteintes d'un trouble dépressif possédaient un plus grand risque de développement du TUC parmi celles-ci. Le commencement précoce de consommation d'alcool et de tabagisme quotidien ont chacun été associés à un risque accru prononcé d'initiation précoce à la consommation de cannabis.
Quelques études cliniques ont examiné les différences entre les hommes et les femmes en ce qui concerne le développement de la dépendance, les symptômes de sevrage et les rechutesReference 511. Pour plus de renseignements, veuillez consulter la Section 2.5, Effets selon le sexe.
Dépendance physique
La dépendance physique se manifeste très souvent dans l'apparition des symptômes de sevrage lorsque l'usage est interrompu de façon abrupte ou abandonné. Les symptômes de sevrage se produisent au cours du premier ou du deuxième jour suivant l'interruption de la consommation de cannabis (fumée ou par voie orale), et les pics des effets se produisent habituellement entre les jours 2 et 6; la plupart des symptômes se résorbent en une à deux semainesReference 512-Reference 514. Les symptômes les plus courants sont un état de manque, la colère ou l'agression, l'irritabilité, l'anxiété, des cauchemars ou des rêves étranges, l'insomnie et des difficultés à dormir, des maux de tête, l'agitation et une diminution de l'appétit ou une perte de poidsReference 185Reference 326Reference 339Reference 512Reference 513. D'autres symptômes comprendraient une humeur dépressive, des frissons, des douleurs à l'estomac, des tremblements et la sudationReference 185Reference 326Reference 339Reference 513. Des symptômes de sevrage sont signalés par jusqu'à un tiers des utlisateurs réguliers dans la population générale et par 50-95 % chez les gros utilisateurs en traitement ou dans des études de rechercheReference 515. Il y a aussi des rapports émergents d'une augmentation de la dépendence physique avec des extraits très puissants de cannabis (par ex. concentrés tels que le BHO (huile de haschich butane) et dabs) (RC = 1.2, p = 0.014)Reference 516Reference 517.
Il n'existe pas de pharmacothérapies approuvées pour gérer les symptômes de sevrage au cannabisReference 518. Une gamme de médicaments a été étudiée, notamment les antidépresseurs (p. ex. buproprione, néfadozone), les régulateurs de l'humeur (p. ex. divalproex, lithium, lofexidine),Reference 519-Reference 521, et la quétiapineReference 522, mais seulement des effets bénéfiques limités ont été observésReference 518. Le zolpidem a aussi été étudié comme traitement pharmacologique potentiel afin de pouvoir cibler précisément les perturbations du sommeil causées par l'abstinenceReference 523Reference 524. Toutefois, les thérapies de substitution aux agonistes (p.ex., le dronabinol, le nabilone, le nabiximols) pourraient être une approche plus prometteuseReference 518.
Une étude clinique pilote récente mesurant la réalisabilité et les effets de dosages fixés et autotitrés de nabiximols sur les symptômes d'état de manque et de sevrage parmi les participants dépendants au cannabis a observé que, comparativement au placebo, de fortes doses fixées de nabiximols (c.-à-d., jusqu'à 40 vaporisations par jour ou 108 mg de THC et 100 mg de CBD) étaient bien tolérées et diminuaient considérablement les symptômes de sevrage du cannabis au cours de la période d'abstinence, mais non pas les symptômes d'état de manqueReference 336. Les doses autotitrées étaient plus faibles et leur efficacité était limitée comparativement aux doses fixées élevées. Les participants ont aussi signalé des taux de « high » et des durées de « high » moins élevées avec l'administration de nabiximols et du placebo comparativement à fumer du cannabis.
Une étude clinique à répartition aléatoire et double insu, contrôlée par placebo, menée pendant six jours chez des patients hospitalisés et portant sur le nabiximols utilisé à titre de traitement de substitution par des agonistes des symptômes de sevrage au cannabis a indiqué que le traitement au nabiximols atténue les symptômes de sevrage au cannabis et améliore la rétention des patients suivant le traitementReference 518. Toutefois, le placebo était aussi efficace que le nabiximols pour promouvoir une réduction à long terme de la consommation de cannabis tel que mesuré lors du suivi. Le traitement au nabiximols a réduit considérablement la gravité générale des symptômes du sevrage au cannabis par rapport au placebo, notamment les effets sur l'irritabilité, la dépression et l'état de manque, et a eu un effet limité sur les troubles du sommeil, l'anxiété, la perte d'appétit, les symptômes physiques et l'agitation.
Une étude clinique intra-sujet et contrôlée par placebo a démontré que le nabilone (dose quotidienne de 6 à 8 mg) diminue les symptômes de sevrage du cannabis, y compris l'irritabilité et les perturbations du sommeil et de l'alimentation causées par l'abstinence chez les fumeurs de cannabis chroniques recherchant un traitementReference 525. Le nabilone avait aussi réduit l'autoadministration de cannabis au cours de la période d'abstinence dans le cadre d'un modèle de rechute en laboratoire. Bien que le nabilone n'ait pas engendré des cotes subjectives associées à la susceptibilité d'abus (c.-à-d. aimer la drogue, désir de consommer à nouveau), la dose élevée (8 mg) a réduit modérément le rendement des tâches psychomotrices. Une étude de suivi a observé que le nabilone (3 mg b.i.d.) administré accompagné du zolpidem (12,5 mg) avait aussi amélioré les perturbations de l'humeur, du sommeil et de l'appétit causées par l'abstinence et avait aussi réduit la consommation de cannabis fumé dans le cadre du modèle de rechute en laboratoire tout en n'ayant aucun effet sur les capacités cognitives des participantsReference 523.
Un essai clinique à double insu de 11 semaines, contrôlé par placebo et portant sur la lofexidine et le dronabinol dans le traitement de TUC n'a révélé, par rapport au placebo, aucun effet bénéfique significatif sur l'abstinence, la réduction des symptômes de sevrage ou le désir des sujets de poursuivre le traitementReference 526. En revanche, une étude précédente a montré l'efficacité du dronabinol administré à raison de 40 mg par jour par rapport au placebo, le dronabinol ayant atténué les symptômes du sevrage et amélioré la volonté de poursuivre le traitement, mais non l'abstinenceReference 527.
Cannabidiol pour lutter contre la dépendance au cannabis et à d'autres drogues
Une analyse systématique récente des données sur le CBD utilisé comme moyen d'intervention pour remédier aux comportements addictifs a révélé qu'à ce jour, seules 14 études ont été menées principalement sur des animaux et seulement quelques unes chez les humainsReference 338. Le nombre limité d'études précliniques effectuées à ce jour laisse supposer que le CBD aurait un pouvoir thérapeutique dans le traitement de l'addiction aux opioïdes, à la cocaïne et à des psychostimulants et certaines données préliminaires semblent indiquer que le CBD serait aussi bénéfique dans le traitement de l'addiction au cannabis et au tabac chez les humainsReference 338. Le nombre limité d'études précliniques publiées jusqu'à maintenant suggère que le CBD aurait un impact sur la phase d'intoxication et de rechute liée à l'addiction aux opioïdes, alors que le CBD ne semble pas avoir d'impact sur les effets de récompense des stimulants (p. ex. cocaïne, amphétamine) mais qu'il pourrait avoir une influence sur la rechuteReference 338.
En ce qui concerne la dépendance au cannabis, les études précliniques indiquent que le CBD, en tant que tel, ne la renforce pas, mais son effet sur le comportement de dépendance lié au cannabis demeure incertainReference 338. Dans une étude clinique, une femme de 19 ans ayant développé une dépendance au cannabis et manifestant des symptômes de sevrage au cannabis dès l'arrêt de la consommation de cannabis a reçu jusqu'à 600 mg de CBD (marge de 300 à 600 mg) au cours d'une période de traitement de 11 jours et le traitement avec le CBD a été associé à une diminution rapide des symptômes du sevrageReference 338Reference 528. Dans une autre étude menée chez l'humain, le cannabis dont le rapport CBD/THC était plus élevé a été associé à des cotes plus faibles d'effets plaisants des stimuli de la drogue (cote explicite « aime la drogue »), mais aucune différence entre les groupes n'a été observée en ce qui concerne les cotes « état de manque » ou « défoncé »Reference 338Reference 529. Toutefois, une étude à sites multiples, à double insu et contrôlée par placebo a démontré que le CBD (en dose de 200 à 800 mg) n'avait aucun effet sur les cotes subjectives associées à la susceptibilité d'abus de cannabisReference 530.
Une étude clinique à répartition aléatoire et double insu, contrôlée par placebo et portant sur 24 fumeurs de tabac en recherche de traitement contre la dépendance au tabac a examiné l'impact du CBD sur l'addiction à la nicotine et conclut que l'inhalation du CBD (400 µg/inhalation), selon les besoins, était associée à une réduction significative du nombre de cigarettes fuméesReference 338Reference 531.
Une étude clinique croisée à répartition aléatoire et à double insu, menée chez dix volontaires en bonne santé, ayant examiné les effets du CBD sur la phase d'intoxication de l'addiction à l'alcool n'a révélé aucune différence en ce qui concerne les sensations d'être « ivre », « drogué » ou « mal en point » entre le groupe ne consommant que de l'alcool et celui prenant de l'alcool et du CBDReference 338Reference 532.
Aucune étude préclinique n'existe sur l'utilisation du CBD pour traiter les comportements d'addiction aux drogues hallucinogènes, aux sédatifs, au tabac ou à l'alcool et aucune étude menée chez l'humain n'existe sur l'utilisation du CBD pour traiter les comportements d'addiction aux opioïdes, aux psychostimulants, aux drogues hallucinogènes ou aux sédatifsReference 338.
2.5 Populations particulières
Enfants/adolescents
Le SEC est présent aux premières étapes du développement et est essentiel pour le développement du système nerveux. Il maintient son expression dans le cerveau tout au long de la vieReference 533. En outre, le SEC subit des changements dynamiques pendant l'adolescence avec des fluctuations importantes du niveau et de l'emplacement du récepteur CB1 dans le cerveau ainsi que des changements des niveaux des endocannabinoïdes 2-AG et de l'anandamideReference 533. Les changements dynamiques qui surviennent dans le SEC pendant l'adolescence coïncident aussi avec une période importante de plasticité neuronale comprenant la prolifération neuronale, le renouvellement des connexions et la synaptogénèse ainsi que l'élagage dendritique et la myélinisation qui se produit en même tempsReference 534. Il semble que cette période de neuroplasticité importante ne s'achève pas avant l'âge de 25 ansReference 534. Ainsi, cette période de neurodéveloppement est essentielle pour garantir un bon développement neurocomportemental et cognitif et est également influencée par des stimuli externes positifs et négatifs (p. ex. insultes neurotoxiques, traumatisme, stress chronique, abus de drogues)Reference 534. D'après les données scientifiques recueillies, les jeunes sont plus sensibles aux effets indésirables liés à la consommation de cannabis, en particulier lorsqu'il s'agit d'un usage chroniqueReference 177Reference 535. Des études examinant la consommation de cannabis à des fins non médicales suggèrent qu'un début précoce (c.-à-d. à l'adolescence et notamment avant l'âge de 15 ans) et une consommation régulière et persistante de cannabis (de cannabis riche en THC) sont associés à de nombreux effets indésirables sur le cerveau et le développement comportemental, notamment le TUC et l'addiction au cannabis, la consommation d'autres drogues illicites, un fonctionnement cognitif compromis et la baisse du quotient intellectuel (QI), un déficit d'attention, un niveau de scolarité plus faible, des idées suicidaires, des tentatives de suicide et une augmentation du risque de schizophrénie ainsi qu'une apparition précoce de la maladieReference 223Reference 536-Reference 546. D'après les données actuelles recueillies, il est difficile de déterminer pendant combien de temps tous les effets neurocognitifs ou certains d'entre eux persistent après l'arrêt de la consommation. Certains chercheurs ont constaté que certains déficits cognitifs perdurent jusqu'à un an ou plus après l'arrêt de la consommation de cannabis, tandis que d'autres ont démontré une période de rétablissement beaucoup plus courte (c.-à-d. 28 jours) pour une partie, au moins, des déficits révélésReference 146Reference 223Reference 536Reference 547Reference 548. Une récente revue de la littérature sur les études observationnelles et précliniques a révélé des preuves cohérentes d'une association entre la consommation de cannabis chez les adolescents (usage fréquent / intensif) et les résultats neuropsychiatriques persistants à l'âge adulte. Même si les données provenant d'études chez les humains n'ont pas établi de causalité seulement basé sur la consommation de cannabis, les études précliniques sur les animaux indiquent que l'exposition des adolescents aux cannabinoïdes peut catalyser des processus moléculaires conduisant à des déficits fonctionnels à l'âge adulte - des déficits qui ne sont pas trouvés après l'exposition des adultes au cannabis. Les auteurs notent que des conclusions définitives ne peuvent pas encore être tirées pour savoir si la consommation de cannabis, à elle seule, a des impacts négatifs sur le cerveau des adolescents, et des recherches futures peuvent aider à élucider cette relation en intégrant des évaluations de résultats moléculaires, structurels et comportementauxReference 549. Des facteurs qui peuvent influencer la persistance de déficiences cognitives peuvent être notamment l'âge au début de la consommation, la fréquence et la durée de la consommation, les comorbidités et la consommation d'autres drogues (tabac, alcool et autres drogues psychotropes).
Bien que les effets indésirables associés à l'usage du cannabis riche en THC chez les jeunes aient été bien documentés, on a beaucoup moins d'information concernant les effets indésirables liés à l'usage du cannabis riche en CBD. Cependant, comme cela a déjà été mentionné, le SEC joue un rôle important dans le développement du système nerveux in utero, ainsi que pendant l'adolescence (se reporter à la Section 7.4) et l'exposition à des cannabinoïdes exogènes, notamment à des doses plus élevées, tous les jours, et durant une période prolongée, peut modifier l'évolution du neurodéveloppement (veuillez consulter la Section 1.0 pour plus de renseignements concernant le rôle du SEC dans le développement du système nerveux).
Personnes âgées
Les données suggèrent que comme dans le cas des changements observés avec le SEC lors du développement et de l'adolescence, il existe des changements dans le SEC liés au vieillissement. Chez les rongeurs, il existe une forte baisse des taux d'acide ribonucléique messager (ARNm) du récepteur CB1 et/ou une liaison spécifique des agonistes du récepteur CB1 dans le cervelet, le cortex, l'hippocampe et l'hypothalamus d'animaux plus âgésReference 550. En outre, le couplage des récepteurs CB1 aux protéines G est également diminué dans des régions particulières du cerveau chez les animaux plus âgésReference 550. Les changements liés à l'âge en matière d'expression des composantes du SEC semblent être similaires chez les rongeurs et les humainsReference 550. La perturbation des récepteurs CB semble favoriser la détérioration liée à l'âge de plusieurs tissus, ce qui laisse supposer que le SEC joue un rôle important dans le contrôle du processus de vieillissementReference 550.
En général, les personnes âgées semblent être plus sensibles aux effets des médicaments agissant sur le SNCReference 551. Plusieurs facteurs physiologiques peuvent être à l'origine de cette sensibilité accrue, notamment: 1) changements liés à l'âge du volume du cerveau et du nombre de neurones, ainsi que des modifications de la sensibilité des neurotransmetteurs qui peuvent ensemble augmenter les effets pharmacologiques d'un médicament; 2) changements liés à l'âge des niveaux pré- et post-synaptiques de certains récepteurs des neurotransmetteurs; 3) changements liés à l'âge de la sensibilité des récepteurs aux neurotransmetteurs; et 4) changements du devenir d'un médicament chez les personnes âgées généralement associés à de plus fortes concentrations de drogues psychotropes dans le SNC. On dispose de très peu d'information sur les effets du cannabis et des cannabinoïdes dans les populations gériatriques et, d'après les niveaux de preuve actuels, aucunes conclusions définitives ne peuvent être tirées en ce qui concerne l'innocuité ou l'efficacité de médicaments à base de cannabinoïdes chez les personnes âgées (mais voir ci-dessous pour découvrir l'une des quelques études cliniques sur l'innocuité effectuée plus particulièrement dans les populations gériatriques)Reference 418Reference 551Reference 552. De plus, les cannabinoïdes étant lipophiles, ils peuvent avoir tendance à s'accumuler davantage chez les personnes âgées, celles-ci étant plus susceptibles de connaître une augmentation des tissus adipeux, une diminution de la masse maigre et du volume total de l'eau dans le corps ainsi qu'une augmentation du volume de distribution des médicaments lipophiles.Reference 551. Enfin, les changements liés à l'âge de la fonction hépatique, comme une diminution du débit sanguin hépatique et un ralentissement du métabolisme hépatique, peuvent ralentir l'élimination de médicaments lipophiles et augmenter la probabilité des effets indésirablesReference 551.
Études cliniques
Une étude à repartition aléatoire, croisée, à double insu et contrôlée par placebo évaluant la pharmacocinétique du THC dans 10 patients plus âgés atteints de démence (âge moyen de 77 ans), au cours d'une période de 12 semaines, a signalé que le temps médian nécessaire pour atteindre la concentration maximale dans le sang (Tmax) se trouvait entre une et deux heures et que la pharmacocinétique du THC augmentait de façon linéaire avec les doses, mais avec de grandes variations entre les personnesReference 418. Les patients ont reçu une dose de 0,75 mg de THC deux fois par jour au cours des six premières semaines et une dose de 1,5 mg de THC deux fois par jour au cours de la seconde période de six semaines. La Cmax moyenne après la première dose de 0,75 mg de THC était de 0,41 ng/mL et la Cmax après la première dose de 1,5 mg de THC était de 1,01 ng/mL. Les Cmax après l'administration de la seconde dose de 0,75 mg et de 1,5 mg de THC étaient de 0,50 et de 0,98 ng/mL, respectivement.
Pour l'instant, seule une étude clinique examinant plus précisément l'innocuité du THC chez les personnes âgées a été menée. Cette étude de phase I, à répartition aléatoire, à double insu, à double feinte, contrôlée par placebo, croisée de trois doses uniques administrées par voie orale de NamisolMD (nouvelle forme de comprimés contenant 3 mg, 5 mg ou 6,5 mg de THC)Reference 175 révèle que, dans l'ensemble, les effets pharmacodynamiques du THC chez les personnes plus âgées en bonne santé étaient plus faibles que les effets signalés précédemment chez les jeunes adultes. De plus, le THC, aux doses d'essai, a semblé être bien toléré par les personnes plus âgées en bonne santéReference 175. Dans cette étude, 12 adultes âgés de 65 ans ou plus en bonne santé ont été inclus. Les critères d'exclusion comprenaient le risque élevé de chute, la consommation régulière de cannabis, des antécédents de sensibilité au cannabis, l'abus de drogues et d'alcool, la fonction cardiopulmonaire compromise et les comorbidités psychiatriques. Les problèmes de santé les plus souvent signalés étaient l'hypertension et l'hypercholestérolémie et les sujets ont déclaré prendre une moyenne de deux médicaments (p. ex. hypolipidémiants, aspirine et bêta-bloquants). Les effets indésirables les plus souvent signalés incluaient la somnolence (27 %), l'assèchement de la bouche (11 %), les troubles de la coordination (9 %), les céphalées (9 %), les difficultés de concentration (7 %), la vision trouble (5 %), un état de relaxation ou d'euphorie et les étourdissements (5 % chacun); la nausée, la sécheresse oculaire, les malaises et les hallucinations visuelles ont tous été signalés à une fréquence de 2 %Reference 175 dans cet essai. Les premiers événements indésirables sont apparus 20 minutes après l'administration, tous les événements indésirables survenant 55 à 120 minutes après l'administration et disparaissant complètement 3,5 heures après l'administration. Il semble qu'une augmentation liée à la dose du nombre de personnes signalant une augmentation du nombre d'événements indésirables avec une augmentation de la dose de NamisolMD ait été observée. Aucun événement indésirable modéré ou grave n'a été signalé dans cet essai. Bien que cet essai clinique ajoute des renseignements importants concernant l'innocuité et la tolérabilité du THC chez les personnes âgées en bonne santé, des essais supplémentaires sont nécessaires pour évaluer l'innocuité et la tolérabilité du cannabis et des cannabinoïdes chez les personnes âgées présentant diverses comorbidités.
Effets selon le sexe
Chez les humains, des différences d'effets selon le sexe ont fréquemment été observées dans les effets biologiques et comportementaux de l'abus de substances, y compris du cannabisReference 553. Chez les animaux mâles, des densités plus élevées de récepteurs CB1 ont été observées dans presque toutes les régions cérébrales analysées, tandis que chez les femelles, on a observé un couplage plus efficace des récepteurs CB1 à la signalisation de protéines G en avalReference 554. Chez les humains, des différences de la densité des récepteurs CB1 entre les sexes ont aussi été observées : on a observé des densités plus élevées chez les hommes que chez les femmesReference 555. Des différences selon le sexe ont aussi été observées en ce qui concerne le métabolisme des cannabinoïdes. Des études précliniques auprès des femelles signalent une augmentation du métabolisme de THC au 11-hydroxy THC comparativement aux mâles, chez qui le THC est aussi biotransformé en au moins trois métabolites moins actifs différentsReference 556. Il existe aussi des données suggérant que les effets des cannabinoïdes varient en fonction de fluctuations dans les hormones liées à la reproductionReference 511Reference 557. Ensemble, ces trouvailles suggèrent que les mécanismes neurobiologiques sous-jacents aux effets selon le sexe des cannabinoïdes pourraient provenir du dimorphisme sexuel du SEC et du métabolisme du THC, mais aussi des effets des fluctuations du niveau d'hormones dans le SECReference 511Reference 557.
Il existe aussi des données suggérant qu'il existe des différences selon le sexe des effets subjectifs, du développement de la dépendance, des symptômes de sevrage, de la rechute et de l'incidence de troubles d'humeur. Les données combinées de quatre études intra-sujet à double insu mesurant les effets du cannabis « actif » fumé (contenant 3,27 à 5,50 % de THC) comparativement aux effets du cannabis « inactif » fumé (contenant 0,0 % de THC) ont démontré que, lorsque la consommation de cannabis était équivalente (presque quotidienne), les femmes signalaient des cotes plus élevées d'effets liés à l'abus de substance comparativement aux hommes, lorsqu'exposés au cannabis « actif » tout en signalant des cotes de niveau d'ivresse semblableReference 511. Ces observations suggèrent que, au moins dans le cas de consommateurs presque quotidiens de cannabis, il se peut que les femmes soient plus sensibles aux effets subjectifs du cannabis, en particulier aux effets associés à la susceptibilité d'abus de cannabis comparativement aux hommes. Une autre étude démontrait les différences selon la dose et le sexe des réponses subjectives au THC administré par prise oraleReference 558. Dans le cadre de cette étude, des effets subjectifs plus élevés ont été observés pour les femmes à la dose plus faible (5 mg), tandis que des réponses subjectives plus élevées ont été observées chez les hommes pour la dose la plus élevée (15 mg). Ensemble, ces études suggèrent que bien que les femmes soient plus sensibles aux effets subjectifs du THC aux doses plus faibles, elles peuvent développer une tolérance à ces effets aux doses plus élevées qui pourraient, par exemple, avoir des répercussions sur le développement de la dépendance. Par exemple, bien que la consommation de cannabis soit plus prévalente chez les hommes et que les hommes semblent être plus probables que les femmes de devenir dépendants au cannabis, les femmes ont tendance à démontrer des intervalles plus courts entre leur première consommation et la consommation régulière ou le développement de la dépendance (connu communément sous le nom « d'effet de télescopage »)Reference 559. De plus, les femmes s'abstenant de la consommation de cannabis ont signalé plus de symptômes de sevrage dont certains étaient plus graves que ceux observés chez les hommes et qui ont été associés à la rechuteReference 560Reference 561. Les femmes atteintes de TUC présentent aussi de plus grandes fréquences de certains problèmes de santé concomitants, comme les troubles d'humeur et d'anxiétéReference 165Reference 562Reference 563.
3.0 Posologie
Le Collège des médecins de famille du Canada, de concert avec d'autres organismes de réglementation médicale provinciaux, a publié un document d'orientation (en 2018) visant l'utilisation autorisée du cannabis à des fins médicales. Veuillez consulter ces documents et tout autre document d'orientation officiel, le cas échéant, afin d'obtenir des renseignements complémentaires concernant la posologie et autres questions liées à l'utilisation autorisée du cannabis à des fins médicales.
Le cannabis compte bon nombre de variables qui sont incompatibles avec le modèle standard de la prescription de médicamentsReference 402. La pharmacologie complexe des cannabinoïdes, des différences (génétiques) entre individus au niveau de la structure du récepteur cannabinoïde et de son fonctionnement, des différences (génétiques) entre individus quant au métabolisme des cannabinoïdes ayant une incidence sur la biodisponibilité, l'exposition antérieure au cannabis et aux cannabinoïdes et l'expérience avec ceux-ci, la tolérance pharmacologique aux cannabinoïdes, les modifications de la distribution et de la densité des récepteurs cannabinoïdes et/ou de leurs fonctionnements suite à un trouble médical, la teneur variable de la matière végétale du cannabis et de quantités et de ratios variées de différents cannabinoïdes et les différents schémas posologiques et voies d'administration qui ont servi à différentes études de recherche, sont autant de facteurs qui contribuent à la difficulté de l'établissement des schémas posologiques uniformes du cannabis (et/ou des cannabinoïdes)Reference 402Reference 480.
Bien que des posologies précises ne soient pas établies, certaines lignes directrices « brutes » relatives à la posologie du cannabis fumé ou vaporisé ont été publiées (voir ci-dessous). Outre sa consommation par la fumée ou la vaporisation, le cannabis est reconnu pour être consommé en produits cuisinés tels que des biscuits ou des brownies ou bu en thés ou en infusions. Toutefois, l'absorption par voie orale de ces produits est lente et erratique, varie selon la matrice ingérée (p. ex. la teneur en matières grasses), le déclenchement de ses effets retardé, et les effets durent plus longtemps par rapport à la fumée (voir Section 2.2); de plus les posologies de produits administrés par voie orale sont encore moins bien établies, contrairement à la fumée et à la vaporisation; toutefois, des données provisoires ont vu le jour concernant la posologie des huiles de cannabisReference 130Reference 415Reference 419Reference 564Reference 565. D'autres formes de préparation rapportées dans la littérature profane comprennent les beurres, les sucreries, les comestibles, les huiles, les compresses, les crèmes, les onguents et les teintures à base de cannabisReference 80Reference 566-Reference 569, mais encore une fois, elle ne contient qu'une quantité limité d'information sur les posologies avec la plupart des renseignements étant de nature anecdotique.
La posologie demeure hautement individualisée et repose très largement sur le titrageReference 402. Les patients sans expérience antérieure avec le cannabis qui amorcent une thérapie à base du cannabis pour la première fois sont mis en garde de débuter par la plus petite dose et de cesser la thérapie si des effets indésirables ou inacceptables se produisent. La consommation du cannabis fumé ou inhalé ou par voie orale doit se faire lentement, en respectant une pause d'au moins 10 à 20 minutes entre chaque bouffée ou inhalation et, en ce qui concerne les produits à base de cannabis consommés par voie orale (p. ex. biscuits et produits de boulangerie), en attendant au moins 30 minutes, mais préférablement trois heures, entre chaque bouchée afin d'en jauger la puissance des effets et d'éviter d'éventuelles surdoses. L'augmentation subséquente de la dose devrait être faite lentement, une fois que l'expérience avec les effets subjectifs soit pleinement appréciée, jusqu'à l'effet ou la tolérabilité. Si des effets indésirables intolérables apparaissent sans preuve de bénéfice significatif, la dose devrait être diminuée et arrêtée. Les lignes directrices portant sur la réduction de la dose n'ont pas été publiées, mais l'existence d'un syndrome de sevrage (voir Section 2.4) suggère que la réduction de la dose devrait se faire lentement (c'est-à-dire sur plusieurs jours ou semaines).
Dose thérapeutique minimale et marges posologiques
Les études cliniques sur le cannabis et les produits à base de cannabis à des fins thérapeutiques se limitent aux études effectuées avec du cannabis séché qui a été fumé ou vaporisé et avec des produits à base de cannabis synthétisé ou naturel qui ont reçu une autorisation de mise en marché (c.-à-d. le dronabinol, le nabilone et le nabiximols). À l'exception possible d'essais menés avec l'EpidiolexMD (huile enrichie de CBD) pour l'epilepsie et un essai clinique pilote ouvert sur l'huile de THC orale pour les symptômes associés à l'état de stress post-traumatique (ESPT)Reference 565, il n'existe aucune autre étude clinique sur la marijuana fraîche ni les huiles de cannabis utilisées à des fins thérapeutiques. Il est donc impossible d'établir des lignes directrices précises en matière de posologie pour ces produits; il existe toutefois certaines sources d'information qui peuvent être consultées comme point de référence (voir ci-après).
Cannabinoïdes sur ordonnance
Des renseignements obtenus sur la monographie de MarinolMD (dronabinol; n'est plus disponible au Canada) indiquent qu'une dose quotidienne par voie orale aussi faible que 2,5 mg de Δ9-THC est associée à un effet thérapeutique (p. ex. traitement de l'anorexie/cachexie liées au VIH/SIDA). Naturellement, la posologie varie en fonction du trouble sous-jacent et des nombreuses autres variables mentionnées ci-dessus. Les marges posologiques du MarinolMD (dronabinol) varient de 2,5 mg à 40 mg de Δ9-THC par jour (dose maximale quotidienne tolérée chez l'humain = 210 mg de Δ9-THC par jour)Reference 222. La dose quotidienne moyenne de dronabinol est 20 mg et la dose quotidienne recommandée maximale est 40 mgReference 222. Des doses inférieures à 1 mg de THC par séance d'administration de doses pourraient réduire encore plus l'incidence et les risques d'effets indésirables. Les marges posologiques du CesametMD (nabilone) varient de 0,2 mg à 6 mg par jourReference 488Reference 570. Les marges posologiques du SativexMD (nabiximols) varient d'une vaporisation (2,7 mg de Δ9-THC et 2,5 mg de CBD) à 16 vaporisations (43,2 mg de Δ9-THC et 40 mg de CBD) par jourReference 280Reference 427. Des renseignements préliminaires provenant d'études cliniques effectuées avec de l'EpidiolexMD, un extrait de cannabis à base d'huile contenant 98 % de CBD, semblent indiquer une marge posologique quotidienne comprise entre 5 et 20 mg/kg par jourReference 259. Pour obtenir des renseignements complémentaires sur la posologie, veuillez consulter le Règlement sur l'accès au cannabis à des fins médicales - Fiche d'information sur les doses journalières (dose)
Données d'enquêtes et cliniques
Diverses études publiées dans des ouvrages revus par un comité de lecture indiquent que la majorité des personnes qui fument ou ingèrent par voie orale du cannabis à des fins médicales déclarent utiliser entre 10 et 20 g de cannabis par semaine, soit environ 1 à 3 g de cannabis par jourReference 220Reference 402Reference 571.
Une étude transversale internationale réalisée en ligne examinant l'expérience des patients par rapport à différentes méthodes de prise de cannabis signale que la grande majorité des 953 participants volontaires provenant de 31 pays préfère l'inhalation à d'autres moyens d'administration (p. ex. thés, aliments, médicaments cannabinoïdes d'ordonnance) pour traiter des symptômes tels que les douleurs chroniques, l'anxiété, la perte d'appétit, la dépression et l'insomnie ou le trouble du sommeil. Les doses journalières moyennes avec le cannabis fumé ou vaporisé étaient de 3 g (la dose médiane du cannabis fumé était de 2 g par jour; celle du cannabis vaporisé était de 1,5 g par jour)Reference 572. Dans le cas des aliments et des teintures, la dose journalière moyenne était de 3,4 g (la dose médiane était de 1,5 g par jour). Pour ce qui est des thés, la dose journalière médiane était de 2,4 g (dose médiane de 1,5 g). Les renseignements concernant les concentrations de cannabinoïdes des produits à base de cannabis (c.-à-d. concentrations de THC/CBD) n'étaient pas disponibles. La fréquence quotidienne d'utilisation pour la fumée était de six fois par jour, tandis qu'elle était de cinq fois par jour pour la vaporisation. Des thés et des aliments ou des teintures étaient utilisés en moyenne deux fois par jour. La première apparition des effets a été observée en moyenne près de 7 minutes après le début de la consommation du cannabis fumé, 6,5 minutes après le début de la vaporisation, 29 minutes après l'ingestion de thé et 46 minutes après l'ingestion d'aliments ou de teintures. D'autres données semblent indiquer que les patients qui utilisent du cannabis à des fins médicales consomment jusqu'à un gramme par jour. Par exemple, les données provenant des Pays-Bas indiquent que la dose quotidienne moyenne de cannabis séché à des fins médicales est de 0,68 g par jour (marge de 0,65 à 0,82 g par jour). L'information obtenue du programme d'accès au cannabis à des fins médicales en Israël en 2016 indique que la dose quotidienne moyenne utilisée par les patients de ce programme était un peu moins de 1,5 g (communication personnelle de Santé Canada). Les données sur le marché canadien recueillies auprès des producteurs autorisés en vertu du Règlement sur l'accès au cannabis à des fins médicales (RACFM) ont montré qu'entre avril 2017 et mars 2018, les professionnels de la santé avaient autorisé leurs clients à utiliser, mensuellement, une moyenne de 2,1-2,5 g / jour de cannabis séché. Toutefois, puisque ces données sont recueillies par producteur autorisé, elles n'incluent pas les cas où les clients ont scindé leur autorisation en deux autorisations ou plus afin de s'enregistrer auprès de plus d'un producteur autorisé à la fois ou les enregistrements personnels de production auprès de Santé CanadaReference 573. Il n'y a pas de données spécifiques sur la quantité moyenne d'huile autorisée par les professionnels de la santé puisque les quantités autorisées sont toujours en g / jour. Pour remplir les commandes d'huiles, les producteurs autorisés égalisent l'huile au cannabis séché en se basant sur la formulation des produits d'huile. En moyenne, les producteurs autorisés égalisent 1 g de cannabis séché à 6,6 g d'huile. En utilisant ce facteur de conversion moyen, les professionnels de la santé ont autorisé une moyenne équivalente de 13,9-16,5 g / jour d'huile.
Les cotes de satisfaction de critères tels que l'apparition d'effets et la facilité d'établissement de la posologie étaient supérieures en ce qui a trait à la fumée et à la vaporisation (c.-à-d. fumée ou vaporisation privilégiées) par rapport à celles d'autres moyens d'administrationReference 572. Cependant, les médicaments cannabinoïdes d'ordonnance (p. ex. dronabinol, nabilone, nabiximols) ont présenté des résultats semblables à ceux obtenus avec des aliments ou teintures et des thés en ce qui concerne les cotes de satisfaction liées à la dose journalière nécessaire et à la facilité d'établissement de la posologie. Les cotes de satisfaction en matière d'effets secondaires ont été plus élevées pour les produits à base de cannabis sans ordonnance non-réglementé, la voie d'administration par inhalation ayant obtenu la meilleure cote, bien que l'enquête n'ait pas posé de questions précises sur les types d'effets secondaires. Les cotes de satisfaction relatives à des critères tels que la durée des effets n'étaient que légèrement plus élevées pour les produits à base de cannabis ingérés par voie orale. Les cotes de satisfaction en matière de coûts étaient légèrement supérieures pour la fumée ou la vaporisation, les thés et les aliments ou teintures, comparativement aux médicaments cannabinoïdes d'ordonnance. Les cotes de satisfaction en matière de facilité de préparation et d'ingestion ont été les plus faibles en ce qui a trait aux thés et aux aliments ou teintures. La plupart des participants ont indiqué avoir utilisé des produits à base de cannabis avant l'apparition de leurs troubles médicaux.
Une étude prospective longitudinale à volet ouvert de patients atteints de douleur chronique résistante aux traitements a observé que les patients titrent leurs doses de cannabis en commençant avec une bouffée ou une goutte d'huile de cannabis par jour et augmentent d'une bouffée ou d'une goutte d'huile de cannabis par dose trois fois par jour jusqu'à ce qu'ils obtiennent un soulagement satisfaisant de la douleur ou que des effets secondaires apparaissentReference 574. Les concentrations de THC dans les produits fumés s'étendaient entre 6 et 14 % et entre 11 et 19 % dans les formules administrées sous forme d'huile par voie orale et les concentrations de CBD dans les produits fumés se trouvaient entre 0,2 et 3,8 % et entre 0,5 et 5,5 % dans les formules d'huiles administrées par voie orale. La quantité mensuelle moyenne de cannabis prescrite était de 43 g ou 1,4 g/jour.
Les données provenant d'études cliniques aléatoires à double insu et contrôlées par placebo sur le cannabis fumé ou vaporisé utilisaient une dose de jusqu'à 3,2 g de cannabis séché de puissances variées (marge de 1 à 23 % de THC; voir le Tableau 5).
Les données provenant d'un essai clinique pilote effectué avec l'inhalateur SyqeMC révèlent qu'une dose inhalée (vaporisé) de 3 mg de THC (produite par une dose aussi faible que 15 mg de matière végétale du cannabis séché à une concentration de 20 % de THC; dose réelle absorbée est de 1,5 mg) était associée à une efficacité analgésique produisant des effets indésirables minimesReference 58. En comparaison des quantités de cannabis exprimées en grammes et utilisées avec la fumée, la vaporisation et l'administration par voie orale, les doses moyennes quotidiennes de cannabinoïdes sur ordonnance étaient de 30 mg pour le dronabinol, de 4,4 mg pour le nabilone, de 46 mg pour le nabiximols et de 43 mg pour le THC et le CBD (c.-à-d. 17 vaporisations).
Les données dans leur ensemble tirées d'enquêtes menées chez des patients et d'études cliniques indiquent que la plupart des patients consomment jusqu'à 3 g de cannabis séché par jour pour des raisons médicales, bien qu'une quantité nettement inférieure (< 1 g par jour) se traduise par une efficacité manifeste et une diminution de l'incidence des effets secondaires.
Posologie et seuil des effets psychotropes
En ce qui concerne la relation entre la posologie et les effets psychotropes, il a été établi qu'une dose inhalée de 0,045 à 0,1 mg/kg de THC (c.-à-d. une dose inhalée individuelle de 3 à 6 mg de THC) suffirait pour atteindre le seuil des effets psychotropes, et une dose inhalée de 0,15 à 0,3 mg/kg de THC (c.-à-d. un dose inhalée individuelle de 10 et 20 mg de THC) étant suffisante pour produire une intoxication importanteReference 412Reference 575. En outre, on a estimé qu'entre une et trois bouffées de cannabis très puissant suffiraient pour produire des effets psychoactifs importantsReference 491. Une étude a montré que, bien que les fumeurs de cannabis dosent leur apport en THC en inhalant des volumes plus faibles de fumée lorsqu'ils fument des joints « puissants » (c.-à-d. de type « skunk », > 15 % THC), cela ne permet pas de compenser complètement pour les doses plus élevées de THC par joint lorsque du cannabis « puissant » est utilisé. Par conséquent, les utilisateurs de cannabis plus puissant sont exposés à de plus grandes quantités de THCReference 576. En ce qui concerne l'administration par voie orale, une dose de 0,15 à 0,3 mg/kg de THC (c.-à-d. une dose orale individuelle de 10 à 20 mg de THC) suffirait pour atteindre le seuil des effets psychotropes et une dose de 0,45 à 0,6 mg/kg de THC (c.-à-d. une dose orale individuelle de 30 et 40 mg de THC) suffirait pour produire une intoxicationReference 412Reference 575Reference 577.
Surveillance
Le Collège des médecins de famille du Canada a publié un document d'orientation décrivant une stratégie et une approche de surveillance des patients à l'intention des médecins qui envisagent d'autoriser l'utilisation de la marijuana à des fins médicalesReference 578. D'autres organismes provinciaux pourraient aussi fournir de l'orientation sur la surveillanceReference 271.
Beaulieu et coll. ont élaboré des recommandations pour les médecins concernant l'évaluation et la gestion de patients pouvant être des candidats pour le cannabis ou les cannabinoïdesReference 271. Les recommandations sont les suivantes :
Tableau 2. Recommendations pour l'évaluation et la gestion des patients
- Examiner les antécédents médicaux et effectuer un examen physique.
- Évaluer les symptômes à traiter, identifier tous les diagnostics actifs et assurez que les patients sont gérés de façon optimale.
- Évaluer les éléments contribuant à l'état psychologique et les risques de dépendance ou d'abus de substance.
- Documenter tous les antécédents de consommation ou la consommation actuelle de drogues illicites ou de médicaments en vente libre, y compris le cannabis et les cannabinoïdes synthétiques.
- Déterminer les effets de la consommation précédente de cannabinoïdes à des fins médicales.
- Considérer une analyse des urines pour évaluer la consommation actuelle de substances médicamenteuses sur ordonnance et en vente libre.
- Fixer des objectifs de traitements utilisant le cannabis, comme : la réduction de la douleur, l'augmentation des capacités fonctionnelles, l'amélioration de la qualité du sommeil, augmentation de la qualité de vie, diminution de l'utilisation d'autres médicaments.
- Élaborer un plan de traitement incorporant ces objectifs.
- Discuter des effets secondaires probables et possibles associés à la consommation de cannabis ou de cannabinoïdes.
- Discuter des risques de dépendance.
- Élaborer un échéancier de suivi afin de pouvoir surveiller le patient.
- Déterminer si les objectifs de traitement sont atteints et si la réponse est appropriée.
- Surveiller pour le mauvais usage ou l'abus des substances (être conscient des caractéristiques cliniques de la dépendance au cannabis).
- Élaborer une stratégie de traitement, surtout pour les patients à risque.
- Maintenir une relation permanente avec le patient.
3.1 Fumée
Selon l'Organisation mondiale de la Santé (OMS)Reference 579, un joint type contient entre 500 mg et 1,0 g de matière végétale de cannabis (poids moyen de 750 mg) dont la teneur en Δ9-THC peut varier entre 7,5 et 225 mg (c.-à-d. généralement entre 1 et 30 %; voir Tableau 3) et dont la teneur en CBD peut varier entre 0 et 180 mg (c.-à-d. entre 0 et 24 %). La majorité des essais cliniques avec le cannabis fumé à des fins médicales ont utilisé des joints de cannabis séché pesant entre 800 et 900 mg. Des estimations plus récentes suggèrent que le poids moyen du cannabis dans un joint est de 320 mgReference 580. On a estimé que la quantité de matière végétale de cannabis exprimée en gramme et brûlée sous la forme d'une bouffée « type » variait de 25 à 50 mg par bouffée, bien que des quantités aussi élevées que 160 mg par bouffée aient été observéesReference 59Reference 139Reference 400Reference 575Reference 581.
La quantité réelle de Δ9-THC présente dans la fumée varie grandement et on l'estime entre 20 et 70 %, le reste étant perdu dans la combustion ou la fumée secondaireReference 402. De plus, la biodisponibilité du Δ9-THC (la fraction du Δ9-THC dans la cigarette qui atteint le courant sanguin) par la voie fumée est très variable (de 2 à 56 %) et est influencée par la topographie de la fumée (c.-à-d. le nombre, la durée et l'espacement entre les bouffées ainsi que le temps de rétention et le volume inhalé)Reference 401. En outre, l'attente d'une récompense par la drogue peut aussi influencer les dynamiques de consommationReference 582. Ainsi, la dose réelle de Δ9-THC absorbée lorsque fumée n'est pas facilement quantifiable, mais elle a été estimée à environ 25 % de la teneur totale disponible en Δ9-THC dans une cigaretteReference 137Reference 402Reference 583.
Relation entre une dose fumée/vaporisée et une dose consommée par voie orale
Peu d'information fiable existe concernant la conversion d'une « dose fumée » du THC en une dose consommée par voie orale équivalente. Cependant, d'après uniquement les mesures de la biodisponibilité, la multiplication de la « dose fumée » du Δ9-THC par un facteur de conversion de 2,5 (afin de corriger les différences entre la biodisponibilité du Δ9-THC au moyen de la voie fumée [~ 25 %] par rapport à la voie orale [~ 10 %], ~ 3 fois plus lorsqu'inhalée par rapport à la voie orale) peut produire une dose orale approximativement équivalente du Δ9-THCReference 137Reference 575Reference 583. Cependant, il est important de souligner que ces études n'ont pas mesuré avec précision la dose fumée exacte de Δ9-THC qui a été administrée et qu'en tant que telle, elle demeure une approximation très grossière. Il est important aussi de souligner que ce « facteur de conversion » semble concerner surtout les effets psychoactifs (p. ex. euphorie, sensation de bien-être, sensation d'un effet plaisant de la drogue, sensation d'être sous sédation, sensation d'être stimulé, échelle du Addiction Research Center Inventory concernant la marijuana), la performance psychomotrice et la prise d'aliments, et est basé sur un nombre très limité d'études pharmacologiques comparativesReference 130Reference 583Reference 584. D'autres études pharmacologiques comparatives rigoureuses sont nécessaires. De plus, aucune étude comparative n'a été faite avec le vapotage. De plus, ce facteur de conversion théorique peut s'appliquer ou non aux effets thérapeutiques. En effet, il est important de souligner que deux études ont indiqué que les personnes qui utilisent du cannabis à des fins thérapeutiques déclarent qu'elles consommaient à peu près les mêmes quantités de cannabis exprimées en gramme, quelle que soit la voieReference 211Reference 572.
Concentrations plasmatiques de Δ9-THC après la fumée/vaporisation et efficacité thérapeutique
Il existe un nombre restreint d'études portant sur l'efficacité et la quantité de cannabis fumé ou vaporisé et la concentration plasmatique de Δ9-THC nécessaire pour obtenir un effet thérapeutique (voir le Tableau 5 qui présente un bref aperçu ainsi que le contenu de ce document pour obtenir des renseignements plus détaillés).
Une étude canadienne d'établissement de la posologie révèle qu'une seule inhalation d'une dose de 25 mg de cannabis fumé (teneur en Δ9-THC de 9,4 %; dose totale disponible de Δ9-THC = 2,35 mg) produit une concentration plasmatique moyenne du Δ9-THC de 45 ng/mL dans les deux minutes suivant le début de la consommationReference 59. L'étude signale une amélioration du sommeil et un soulagement chez les patients souffrant de douleur neuropathique chronique avec effets psychoactifs minimes/douxReference 59.
Une étude clinique ouverte, à dose unique et menée chez des patients souffrant de douleur neuropathique et consommant de très faibles doses de THC inhalées révèle un soulagement statistiquement significatif de la douleur neuropathique et des effets indésirables minimesReference 58. Dans cette étude clinique, 10 patients souffrant d'un quelconque type de douleur neuropathique ont reçu une dose vaporisée de 3 mg de THC (disponible dans l'appareil; ~ 1,5 mg de THC effectivement absorbé) découlant de la vaporisation de 15 mg de cannabis séché contenant 20 % de THC. L'administration de THC a été associée à une réduction statistiquement significative de l'intensité de la douleur selon l'EVA de référence de 3,4 points (c.-à-d. une diminution de 45 % de la douleur) dans les 20 minutes suivant l'inhalation. L'intensité est revenue au niveau de référence dans les 90 minutes suivantes. Du THC a été décelé dans le sang dans la première minute suivant l'inhalation et elle a atteint un niveau maximal dans les trois minutes suivantes, à une concentration moyenne de 38 ng/mL avec des effets psychoactifs minimes/doux.
Un essai clinique contrôlé randomisé de cannabis vaporisé pour soulager la douleur et la spasticité associée à un traumatisme médullaire (TM) et/ou la maladie de la moelle épinière a rapporté que des concentrations plasmatiques médianes de THC de 23 ng/mL (suite à la vaporisation de 46 mg de cannabis à faible teneur en THC (2,9 %); une inhalation estimée de 1,3 mg de THC) et 47 ng/mL (suite à la vaporisation de 56 mg de cannabis à plus forte teneur en THC (6,7 %); une inhalation estimée de 3,8 mg de THC) ont été associées à une réponse analgésique et anti-spastiqueReference 272. Plusieurs des effets psychoactifs ont montré une dépendence liée à la dose, avec la faible dose (2,9 %) associée à une moindre intensité des effets psychoactifs.
Les études ci-mentionées suggèrent que, du moins dans le cas de la douleur neuropathique chronique, les effets psychoactifs peuvent être séparés des effets thérapeutiques et que des doses très faibles de THC peuvent être suffisantes pour produire une analgésie tout en maintenant les effets psychoactifs à un niveau minimal.
Un examen des essais cliniques américains sur l'utilisation du cannabis fumé dans le traitement des nausées et des vomissements induits par la chimiothérapie (NVIC) a révélé que des concentrations plasmatiques de THC > 10 ng/mL étaient associées à la plus forte suppression des nausées et des vomissements, mais que des niveau plasmatiques entre 5 et 10 ng/mL étaient également efficacesReference 293.
| % de THC | mg de THC par 750 mg de matière végétale séchée* (« joint moyen ») |
|---|---|
| 1 | 7,5 |
| 2.5 | 18,75 |
| 5 | 37,5 |
| 10† | 75† |
| 15 | 112,5 |
| 20 | 150 |
| 30 | 225 |
Notes de bas de page du Tableau 3
|
|
| Cannabinoïdes (Nom générique) | Marque nominative/Nom enregistré | Principaux constituants/ Source | Statut officiel au Canada | Indications approuvées | Commencement (C)/ Effet maximal (E)/ Durée de l'action (D) | Voie d'administration | Couvert par la province ou le territoire | |
|---|---|---|---|---|---|---|---|---|
| Cannabinoïdes Rx | DronabinolTableau 4 note de bas de page † | MarinolMDTableau 4 note de bas de page †Reference 222 | Δ9-THC synthétique | Approuvé (mais n'est plus disponible au Canada - consultez la remarque)Tableau 4 note de bas de page † | Anorexie associée à la perte de poids liée au SIDA;
Nausée et vomissements graves consécutifs à la chimiothérapie anticancéreuse |
C : 30 à 60 mins
E : 2 à 4 h D : - Effect psychoactif : 4 à 6 h - Effet stimulant de l'appétit : jusqu'à 24h ou plus |
Voie orale | Man.Tableau 4 note de bas de page †;
N.-B.Tableau 4 note de bas de page †; N.-ÉTableau 4 note de bas de page †; Ont.Tableau 4 note de bas de page †; Î.-P.-É.Tableau 4 note de bas de page †; QcTableau 4 note de bas de page †; YnTableau 4 note de bas de page † |
| Nabilone | CesametMDReference 488
RAN-Nabilone TEVA-Nabilone CO-Nabilone ACT-Nabilone |
Analogue synthétique du Δ9-THC | Commercialisé | Nausée et vomissements graves consécutifs à la chimiothérapie anticancéreuse | C : 60 à 90 mins
E : 3 à 4 h D : 8 à 12 h |
Voie orale | Alb.; C.-B.; Man.; N.-B.;
T.-N.; N.-É.; Nt; T.N.-O.; Ont.; Î.-P.-É.; Qc; Sask.; Yn |
|
| Nabiximols
(THC+CBD et d'autres cannabinoïde, terpénoïdes et flavonoïdes mineurs) |
SativexMD Reference 427 | Extraits botaniques des souches établies et bien caractérisées de C. sativa | CommercialiséTableau 4 note de bas de page * | Tableau 4 note de bas de page * | C : 5 à 30 mins
E : 1,5 à 4 h D : 12- 24 h |
Vaporisateur oromucosal | N.-É. | |
| Cannabidiol (CBD) | EpidiolexMD | Extraits botaniques des souches établies et bien caractérisées de C. sativa | En cours d'étude dans des essais cliniques.
Pas un produit approuvé (en Mars 2018). |
S.O. | S.O. | Voie orale | S.O. | |
| Produit végétal | Cannabis (fumé ou vaporisé) | S.O. | C. sativa (divers) | Pas un produit approuvé | S.O. | C : 5 mins
E : 20 à 30 mins D : 2 à 3 hReference 491Reference 585 |
Fumée ou inhalation | S.O. |
| Cannabis (huile pour administration sublinguale) | S.O. | C.sativa (divers) | Pas un produit approuvé | S.O. | C : 5 - 30 mins
E : 1,5 - 4 h D : 12 - 24 h (basé sur SativexMD Reference 427 |
Voie orale | S.O. | |
| Cannabis (voie orale, comestible) | S.O. | C. sativa (divers) | Pas un produit approuvé | S.O. | C : 30 à 90 mins
E : 2 à 3 h D : 4 à 12 hReference 397 |
Voie orale | S.O. | |
| Cannabis (topique) | S.O. | C. sativa (divers) | Pas un produit approuvé | S.O. | S.O. | Topique | S.O. | |
Notes de bas de page du Tableau 4
Autorisation de mise sur le marché standard : Traitement auxiliaire pour le soulagement symptomatique de la spasticité chez les adultes souffrant de sclérose en plaques qui n'ont pas suffisamment répondu à d'autres formes de traitement et chez qui l'on décèle une amélioration significative lors de l'essai initial du traitement. Autorisation de mise sur le marché avec conditions : Traitement d'appoint pour le soulagement de la douleur neuropathique chez les adultes atteints de sclérose en plaques; et comme traitement analgésique d'appoint utile chez les adultes atteints de cancer avancé qui présentent une douleur modérée ou grave pendant un puissant traitement opioïde administré à la plus forte dose tolérée contre une douleur de fond persistante. Alb. : Alberta; C.-B. : Colombie-Britannique; Î.-P.-.É. : Île-du-Prince-Édouard; Man. : Manitoba; N.-B. : Nouveau-Brunswick; N.-É. : Nouvelle-Écosse; Nt : Nunavut; Ont. : Ontario; Qc : Québec; Rx : prescription médicale; Sask. : Saskatchewan; S.O. : sans objet; T.-N.: Terre-Neuve et Labrador; T.N.-O. : Territoires du Nord-Ouest; Yn : Yukon |
||||||||
3.2 Voie orale
L'information pharmacocinétique décrite dans la Section 2.2.1.3 indique l'absorption erratique et lente de Δ9-THC par voie orale et les doses orales de THC sont estimées d'après l'information sur la monographie du MarinolMD (dronabinol, plus disponible au Canada). Une dose de 10 mg b.i.d. de MarinolMD (20 mg au total de Δ9-THC par jour) a produit un pic de concentration plasmatique de Δ9-THC moyen de 7,88 ng/mL (marge de 3,33 à 12,42 ng/mL) avec une biodisponibilité allant de 10 à 20 %Reference 222. Par comparaison, la consommation d'un biscuit au chocolat contenant 20 mg de Δ9-THC a entraîné un pic de concentration plasmatique de Δ9-THC moyen de 7,5 ng/mL (marge de 4,4 à 11 ng/mL), avec une biodisponibilité de 6 %Reference 404. Un comprimé de THC de 8 mg administré par voie orale (NamisolMD) a produit une Cmax moyenne de THC dans le plasma sanguin de 4 ng/mL et une Cmax moyenne semblable pour le 11-hydroxy THC dans le plasma sanguinReference 586. Le thé préparé avec des feuilles et des sommets fleuris de cannabis est documenté, mais aucune donnée n'est disponible quant à son efficacitéReference 419.
Marinol
Bien que le MarinolMD (dronabinol) ne soit plus disponible au Canada, sa monographie indique une dose moyenne de 5 mg de Δ9-THC par jour (marge de 2,5 à 20 mg de Δ9-THC par jour) contre l'anorexie associée à la perte de poids liée au SIDAReference 222. Une dose de 2,5 mg pourrait être administrée avant le repas de midi puis une deuxième de 2,5 mg avant le repas du soir. Par ailleurs, afin de réduire ou d'éviter les NVIC, l'administration d'une dose de 5 mg t.i.d. ou q.i.d. est suggérée. Dans l'un ou l'autre cas, la dose devrait être titrée avec prudence afin d'éviter l'apparition d'effets indésirables. Veuillez consulter la monographie de produit de MarinolMD pour des instructions plus détaillées.
Cesamet
La monographie du CesametMD (nabilone) suggère l'administration de 1 à 2 mg du médicament deux fois par jour, la première dose devant être administrée la veille de l'administration du médicament chimiothérapeutiqueReference 488. Une dose de 2 mg du nabilone a donné une concentration plasmatique moyenne de 10 ng/mL de nabilone une à deux heures après l'administration. La deuxième dose est habituellement administrée une à trois heures avant la chimiothérapie. Au besoin, l'administration du nabilone peut se poursuivre jusqu'à 24 heures après que l'agent chimiothérapeutique ait été pris. La dose quotidienne maximale recommandée est de 6 mg en doses fractionnées. L'ajustement de doses (titrage) pourrait être requis afin de parvenir à la réponse souhaitée, ou dans le but d'améliorer la tolérabilité. Plus d'essais cliniques récents rapportent des doses de départ du nabilone de 0,5 mg au coucher contre la douleur ou l'insomnie liée à la fibromyalgie, et contre l'insomnie liée à l'ESPT)Reference 570Reference 587Reference 588. Veuillez consulter la monographie de produit de CesametMD pour des instructions plus détaillées.
Epidiolex
Les données d'une étude clinique ouverte de l'EpidiolexMD pour le traitement de l'épilepsie infantile résistante aux traitements suggèrent qu'une posologie avec l'EpidiolexMD (huile de CBD 98 à 99 % pure) commence avec une dose de 2 à 5 mg/kg par jour séparée en deux doses quotidiennes, en plus d'un schéma posologique antiépileptique de base, puis la dose est augmentée de 2 à 5 mg/kg une fois par semaine jusqu'à ce que l'intolérance ou une dose maximale de 25 mg/kg par jour soit atteinteReference 258. Dans certaines situations particulières, les auteurs de l'étude mentionnent qu'une augmentation à une dose maximale de 50 mg/kg par jour pourrait être considérée. Chez les patients avec des convulsions pharmacorésistantes dans le syndrome de DravetReference 589 ou pour le syndrome Lennox-Gastaud résistant au traitementReference 590, une dose de 20 mg/kg par jour est efficace et généralement bien tolérée.
Huile de Cannabis
Les données d'une étude prospective, longitudinale et ouverte de l'huile de cannabis pour des patients atteints de douleur chronique non associée au cancer résistante aux traitements a observé que les patients titraient leurs doses d'huile de cannabis en commençant avec une goutte d'huile de cannabis par jour et augmentant d'une goutte d'huile de cannabis par dose trois fois par jour jusqu'à ce qu'ils atteignent un effet analgésique satisfaisant ou que des effets secondaires apparaissentReference 574. Dans le cadre de cette étude, les concentrations de THC dans l'huile de cannabis s'étendaient entre 11 et 19 % et les concentrations de CBD s'étendaient entre 0,5 et 5,5 %.
Une étude pilote ouverte portant sur la supplémentation avec le THC oral (25 mg/mL dans l'huile d'olive) dans le traitement des symptômes associés à l'ESPT suggère que le dosage commence par une dose de 2,5 mg de THC placé sous la langue deux fois par jour (c.-à-d. 0,1 mL de la solution d'huile), soit une dose une heure après le réveil et une dose deux heures avant le coucherReference 565. La dose quotidienne maximale était de 5 mg b.i.d. (c.-à-d. 0,2 mL b.i.d.), ou une dose quotidienne totale de 10 mg (c.-à-d. 0,4 mL).
3.3 Voie oromucosale
L'administration de nabiximols (SativexMD) est décrite sur la monographie du produit, de même qu'une méthode de titrage pour une amorce appropriée du traitementReference 427. Brièvement, les indications posologiques sur la monographie suggèrent qu'au premier jour du traitement, les patients prennent une vaporisation en matinée (à toute heure entre le lever du jour et midi) et une autre en après-midi ou en soirée (à toute heure entre 16 h et le coucher). Les jours suivants, le nombre de vaporisations peut être augmenté à raison d'une vaporisation par jour, au besoin et en fonction de la tolérance. Un intervalle de 15 minutes devrait être respecté entre vaporisations. Lors du titrage de départ, les vaporisations devraient être réparties de façon uniforme au long de la journée. Si à un moment quelconque, il se développe des réactions indésirables inacceptables telles que les vertiges et d'autres réactions liées au SNC, l'administration devrait être interrompue ou réduite ou le régime de traitement modifié en augmentant l'intervalle de temps entre les doses. D'après la monographie du produit, la dose moyenne du nabiximols est de cinq vaporisations par jour (c.-à-d. 13 mg de Δ9-THC et 12,5 mg de CBD) pour les patients souffrant de la SP, tandis que pour ceux présentant des douleurs cancéreuses, les doses se situeraient à huit vaporisations en moyenne par jour (c.-à-d. 21,6 mg de Δ9-THC et 20 mg de CBD). La majorité des patients semblent nécessiter 12 vaporisations ou moins; le dosage devrait être ajusté au besoin et en fonction de la tolérabilité. L'administration de quatre vaporisations chez des volontaires en santé (10,8 mg de Δ9-THC et 10 mg de CBD au total) a été associée à une concentration plasmatique maximale moyenne allant de 4,90 à 6,14 ng/mL de Δ9-THC et de 2,50 à 3,02 ng/mL de CBD selon que le médicament ait été administré sous la langue ou à l'intérieur des joues. Veuillez consulter la monographie de produit de SavitexMD pour des instructions plus détaillées.
3.4 Vaporisation
Le Bureau du cannabis médicinal hollandais a publié des lignes directrices « brutes » sur l'usage des vaporisateursReference 419. Bien qu'il faille déterminer la quantité de cannabis utilisée par personne par jour, la posologie initiale devrait être faible et pourrait être augmentée lentement en fonction des symptômes. La quantité de cannabis que l'on doit placer dans le vaporisateur pourrait varier selon le type de vaporisateur utilisé.
Des études utilisant le vaporisateur VolcanoMD rapportent placer jusqu'à un gramme de cannabis séché dans la cavité de l'appareil, mais de 50 à 500 mg de matière végétale est habituellement utiliséeReference 411; des tests sur des concentrations en Δ9-THC allant jusqu'à 6,8 % ont été effectués à l'aide du vaporisateur VolcanoMDReference 399Reference 411. Les sujets semblaient doser eux-mêmes leur apport selon la teneur en Δ9-THC du cannabisReference 399. Les pics plasmatiques du Δ9-THC variaient de 70 à 190 ng/mL selon la puissance du Δ9-THC. Les niveaux de cannabinoïdes libérés dans la phase de vapeur augmentaient avec la température de la vaporisationReference 411. La température de vaporisation est normalement déclarée comme se trouvant entre 180 et 195 °CReference 419; des températures plus importantes (p. ex. 230 °C) augmentent considérablement les quantités de cannabinoïdes libérées, mais aussi les quantités des sous-produitsReference 411.
Une étude a signalé l'utilisation d'une procédure uniforme d'une suite de bouffées à être utilisée avec du cannabis vaporisé à l'aide du vaporisateur VolcanoMD : 5 secondes d'inhalation, retenir la bouffée pour 10 secondes, puis une pause de 45 secondes avant de répéter l'inhalationReference 276. Les participants ont inhalé autant de la dose de 900 mg de cannabis séché (3,56 % de THC; 32 mg de THC) qu'ils pouvaient tolérer. La température de vaporisation a été fixée à 190 °C.
Dans le cadre d'une autre étude, les patients ont suivi une procédure de suite de bouffées semblables et ont inhalé 4 bouffées, suivies d'une ronde additionnelle de 4 à 8 bouffées deux heures plus tard pour un total d'entre 8 et 12 bouffées au cours d'une période d'un peu plus de deux heuresReference 591.
Une autre étude de vaporisation menée à l'aide du vaporisateur VolcanoMD, se servant de la même procédure de suite de bouffées, a utilisé 400 mg de cannabis séché de trois puissances différentes (1 %, 4 % et 7 % de THC ou 4, 16 et 28 mg de THC par session de dosage)Reference 592. La température de vaporisation était de 200 °C.
Finalement, un ensemble plus récent d'études menées à l'aide du vaporisateur VolcanoMD et la même procédure de suite de bouffées a signalé l'utilisation de 400 mg de cannabis séché comportant soit 2,9 % (12 mg) ou 6,7 % (27 mg) de THC et une température de vaporisation de 185 °CReference 272. Les patients ont inhalé 4 bouffées au début de la séance d'essai, suivi d'une ronde additionnelle d'entre 4 et 8 bouffées trois heures plus tard pour un total d'entre 8 et 12 bouffées au cours d'une période de trois heures.
Les données provenant d'un essai clinique pilote effectué avec l'inhalateur SyqeMC ont révélé qu'une dose inhalée d'aussi peu que 3 mg de THC (~1,5 mg de THC absorbé, produite par une dose aussi faible que 15 mg de matière végétale du cannabis séché à une concentration de 20 % de THC) est associée à une efficacité analgésique produisant des effets indésirables minimesReference 58. Du THC a été décelé dans le plasma dans la première minute suivant l'inhalation et elle a atteint un niveau maximal dans les trois minutes suivantes, à une concentration moyenne de 38 ng/mL.
4.0 Usages thérapeutiques possibles
Bien qu'il existe d'innombrables rapports anecdotiques concernant l'utilisation du cannabis à des fins médicales, les études cliniques qui appuient l'innocuité et l'efficacité du cannabis à des fins thérapeutiques pour une variété d'états pathologiques sont limitées, mais commencent lentement à se faire plus nombreuses. En outre, le niveau de données actuelles concernant l'innocuité et l'efficacité du cannabis à des fins médicales ne remplissent pas les conditions exigées de la Loi sur les aliments et drogues et ses règlements, sauf lorsqu'il s'agit des produits ayant reçu un avis de conformité et une autorisation de mise en marché de Santé Canada. À l'exception d'une petite étude clinique pilote ouverte sur du THC administré par voie orale dans une solution d'huile d'olive pour les symptômes associés à l'ESPT et des essais cliniques sur du CBD administé par voie orale dans une solution d'huile (EpidiolexMD) pour les symptômes associés à l'épilepsie infantile (voir Section 4.6 Épilepsie), il n'existe pas d'études cliniques bien contrôlées sur l'utilisation d'autres produits de cannabis administrés par voie orale tels que les aliments comestibles de cannabis (p. ex. biscuits, pâtisseries) ou topiques à des fins thérapeutiques.
Il a été indiqué à plusieurs reprises que les effets secondaires psychotropes associés à l'utilisation de cannabinoïdes (psychoactifs) limitent leur utilité thérapeutiqueReference 23Reference 55Reference 57Reference 264Reference 593. Le Tableau 5 (« Essais cliniques positifs, randomisés, à double insu et contrôlé par placebo publiés sur le cannabis fumé et le cannabis vaporisé et les bienfaits thérapeutiques connexes ») résume l'information sur les essais cliniques publiés qui ont été effectués jusqu'à présent avec du cannabis fumé ou vaporisé et les produits de cannabis à base d'huile.
Une recension exhaustive de 72 études cliniques contrôlées évaluant les effets thérapeutiques des cannabinoïdes (THC, nabilone, nabiximols principalement administrés par voie orale ou extrait de cannabis administré par voie orale) jusqu'à l'année 2005 révèle que les cannabinoïdes ont un potentiel thérapeutique intéressant en tant qu'antiémétiques, pour stimuler l'appétit dans le cas de maladies débilitantes (cancer et SIDA), en tant qu'analgésiques et dans le traitement de la SP, du TM, du syndrome de Gilles de La Tourette (SGT), de l'épilepsie et du glaucomeReference 594.
Cependant, une analyse systématique et une méta-analyse plus récentes d'essais cliniques à répartition aléatoire portant sur des cannabinoïdes (c.-à-d. cannabis fumé, nabiximols, nabilone, dronabinol, CBD, THC, levonontradol, acide ajulémique) révèlent que la plupart des essais montrent un soulagement des symptômes associés à l'utilisation de cannabinoïdes, mais aucune association statistiquement significative n'émerge de l'ensemble des essaisReference 174. Comparativement au placebo, les cannabinoïdes ont été associés à un nombre moyen plus élevé de patients présentant une amélioration complète des symptômes de nausées et de vomissements, une diminution de la douleur, une réduction moyenne plus importante de la douleur selon une échelle numérique d'évaluation de la douleur et une diminution moyenne sur l'échelle de spasticité d'AshworthReference 174. Un risque accru d'événements indésirables à court terme avec les cannabinoïdes a aussi été démontré. Les événements indésirables fréquemment signalés sont notamment les étourdissements, l'assèchement de la bouche, la fatigue, la somnolence, l'euphorie, les vomissements, la désorientation, la confusion, la perte d'équilibre et les hallucinationsReference 174. Dans l'ensemble, les essais recensés et la méta-analyse menés à l'aide de l'approche GRADE (Grading of Recommendations, Assessment, Development and Evaluation) indiquent qu'il existe des données de qualité modérée appuyant l'utilisation de cannabinoïdes dans le traitement de la douleur neuropathique chronique ou liée au cancer ainsi que dans celui de la spasticité associée à la SP. Il existe aussi des données de qualité faible appuyant leur utilisation pour contrer les NVIC, la prise de poids dans le cas d'une infection par le VIH, les troubles du sommeil et le SGTReference 174. Les essais recensés et la méta-analyse ne comprennent qu'une étude menée avec du cannabis fumé et toutes les autres études cliniques ont consisté en l'administration orale ou oromucosale de médicaments à base de cannabinoïdes (p. ex. nabiximols, nabilone, dronabinol).
L'Académie nationale des sciences, du génie et de la médecine (NASEM) a publié rapport sur les effets du cannabis et des cannabinoïdes sur la santé (en anglais)Reference 595. Ce rapport exhaustif comprend des informations sur les effets thérapeutiques du cannabis et des cannabinoïdes, mais aussi sur d'autres effets sur la santé tels que le cancer, les risques cardiométaboliques, les maladies respiratoires, l'immunité, les blessures et les décès, les effets prénataux, périnataux et néonataux, les effets psychosociaux et et sur la santé mentale. Il traite également des défis et des obstacles à la recherche sur le cannabis ainsi que des recommandations visant à appuyer et à améliorer la recherche sur le cannabis. La plupart des données contenues dans le rapport proviennent de revues systématiques et de méta-analyses, ainsi que d'une recherche primaire de grande qualité. Les données recueillies dans le cadre d'études in vitro ou in vivo sur des animaux n'ont pas été incluses.
Dronabinol est le nom générique de la forme orale du Δ9-THC synthétique. Il est commercialisé aux É.-U sous le nom de MarinolMD. Il était disponible pour vente au Canada sous forme de gélule contenant 2,5, 5 et 10 mg du médicament dissous dans de l'huile de sésame. Il est indiqué pour le traitement des NVIC chez les patients atteints du cancer et à l'anorexie liée au SIDA associée à la perte de poidsReference 222. Le médicament n'est plus vendu au Canada (abandon après commercialisation du médicament depuis février 2012; non pour des raisons d'innocuité). Veuillez consulter la monographie de produit de MarinolMD pour de l'information plus détaillée.
Nabilone est le nom générique d'un analogue structurel synthétique de Δ9-THC, administré par voie orale, qui est commercialisé au Canada sous le nom de CesametMD mais aussi maintenant disponible sous forme générique (p. ex. RAN-nabilone, PMS-nabilone, TEVA-nabilone, CO-nabilone, ACT-nabilone). Il est disponible sous forme de gélules de (0,25, 0,5, ou 1 mg) et est indiqué pour le traitement des NVIC chez les patients atteints d'un cancerReference 488. Veuillez consulter la monographie de produit de CesametMD pour des instructions plus détaillées.
Nabiximols est le nom générique d'un extrait de plante entière de deux souches différentes mais normalisées de Cannabis sativa pouvant générer un produit de vaporisation oromucosale contenant des quantités approximativement équivalentes de Δ9-THC (27 mg/mL) et de CBD (25 mg/mL) et d'autres cannabinoïdes, terpénoïdes et flavonoïdes par 100 μl de vaporisation dispensé. Nabiximols est commercialisé au Canada sous le nom de SativexMD et a reçu un avis de conformité pour servir de traitement auxiliaire pour le soulagement symptomatique de la spasticité chez les adultes souffrant de SP qui n'ont pas suffisamment répondu à d'autres formes de traitement et chez qui l'on décèle une amélioration significative lors d'un essai initial du traitement. Il est également mis sur le marché (avec des conditions) comme traitement auxiliaire pour le soulagement symptomatique de la douleur neuropathique chez les adultes souffrant de SP et (avec des conditions) pour les patients adultes atteints d'un cancer avancé qui présentent une douleur modérée ou grave pendant un puissant traitement opioïde administré à la plus forte dose tolérée contre une douleur de fond persistanteReference 427. Veuillez consulter la monographie de produit de SativexMD pour des instructions plus détaillées.
EpidiolexMD est le nom de marque pour l'extrait de plante entière de cannabis d'une souche de Cannabis sativa contenant des niveaux élevés de CBD et est un produit en solution à base d'huile orale contenant au moins 98 % de CBD à une concentration de 100 mg/mL. L'EpidiolexMD a reçu la désignation de médicament orphelin aux États-Unis pour le traitement du syndrome de Lennox-Gastaut, du syndrome de Dravet et de la sclérose tubéreuse de Bourneville. Au moment de la rédaction de ce document, l'EpidiolexMD n'a toujours pas reçu un Avis de conformité de Santé Canada et ne se retrouve pas sur le marché canadien.
Les données scientifiques et cliniques disponibles ayant trait à l'usage du cannabis et des cannabinoïdes dans le traitement de divers symptômes liés à divers états pathologiques sont résumées dans les sections qui suivent à partir de la prochaine page.
| Principales affections médicales et paramètres secondaires connexes (s'il en existe) pour lesquels les bienfaits ont été observés | Pourcentage et dose de Δ9-THC (si connus) |
Durée de l'essai; et nombre de patients ou participants |
Références |
|---|---|---|---|
| Perte de poids liée au VIH/SIDA | Une cigarette de cannabis (~800 mg) contenant 1,8 % ou 3,9 % de THC en poids, fumée une fois par jour
(c.-à-d. une dose par jour) (~14 à 31 mg de Δ9-THC par jour) |
8 séances au total
(3 séances par semaine) 30 participants |
Reference 219 |
| Perte de poids liée au VIH/SIDA; trouble de l'humeur et l'insomnie dus à la maladie | Une cigarette de cannabis (~800 mg) contenant 2,0 % ou 3,9 % de THC en poids, fumée 4 fois par jour
(c.-à-d. quatre doses par jour) (~64 à 125 mg de Δ9-THC par jour) |
4 jours au total
10 participants |
Reference 218 |
| Spasticité et douleur causées par la sclérose en plaques | Une cigarette de cannabis (~800 mg) contenant 4 % de THC en poids, fumée une fois par jour
(c.-à-d. une dose par jour) (~32 mg de Δ9-THC par jour) |
3 jours au total
30 patients |
Reference 274 |
| Douleur neuropathique chronique du système nerveux central et périphérique
(étiologies diverses) |
Une cigarette de cannabis (~800 mg) contenant 3,5 % ou 7 % de THC en poids, fumée en bouts sur une période de 3 h (c.-à-d. une dose par jour)
(dose quotidienne de THC non disponible) |
1 jour au total
38 patients |
Reference 217 |
| Douleur neuropathique chronique causée par la neuropathie sensorielle liée au VIH | Une cigarette de cannabis (~900 mg) contenant 3,56 % de THC en poids, fumée trois fois par jour
(c.-à-d. 3 doses par jour) (~96 mg de Δ9-THC par jour) |
5 jours au total
25 patients |
Reference 190 |
| Douleur neuropathique chronique associée au VIH réfractaire à d'autres médicaments | Une cigarette de cannabis (~800 mg) contenant entre 1 et 8 % de THC en poids, fumée quatre fois par jour
(c.-à-d. 4 doses par jour) (dose quotidienne de THC non disponible) |
5 jours au total
28 patients |
Reference 277 |
| Douleur chronique post-traumatique ou douleur neuropathique postopératoire réfractaires à d'autres médicaments, ainsi que l'insomnie qui y est associée. | Une dose de 25 mg de cannabis contenant 9,4 % de THC en poids, fumé trois fois par jour
(c.-à-d. trois doses par jour) (~7 mg de Δ9-THC par jour) |
5 jours au total
21 patients |
Reference 59 |
| Douleur chronique d'étiologies diverses
(musculosquelettique, post-traumatique, arthritique, neuropathique périphérique, cancéreuse, fibromyalgique, douleur causée par la migraine, la sclérose en plaques, la drépanocytose, et par le syndrome du défilé thoracobrachial) |
Une dose de 900 mg de cannabis vaporisé contenant 3,56 % de THC en poids, administrée trois fois par jour (une dose le premier jour, trois doses par jour au cours des trois jours suivants, et une dose le dernier jour) (~96 mg de Δ9-THC par jour) | 5 jours au total
21 patients |
Reference 276 |
| Douleur neuropathique d'étiologies diverses (traumatisme médullaire, syndrome de doulour régionale complexe [SDRC] de type I, causalgie [SDRC de type 2], neuropathie diabétique, sclérose en plaques, névralgie post-herpétique, neuropathie périphérique idiopathique, plexopathie brachiale, radiculopathie lombosacrale et neuropathie post-accident vasculaire cérébral (AVC) | Inhalation de cannabis vaporisé (800 mg) contenant une faible dose (1,29 % ou 10,3 mg de Δ9-THC) ou une dose moyenne de Δ9-THC (3,53 % de Δ9-THC ou 28,2 mg de Δ9-THC) | 3 séances au total;
39 patients |
Reference 591 |
| Maladie de Crohn | Une cigarette de cannabis (500 mg) contenant 23 % de THC par poids, fumée deux fois par jour
(c.-à-d. deux doses par jour) (23 mg de Δ9-THC par jour) |
8 semaines;
21 patients |
Reference 596 |
| Douleur neuropathique d'étiologies diverses | Inhalation d'une seule dose vaporisée de 15 mg de cannabis séché contenant 20 % de Δ9-THC en poids
(~ 3 mg de Δ9-THC) |
Une séance uniquement;
10 patients |
Reference 58 |
| Neuropathie diabétique périphérique
(c.-à-d. diabète sucré de type I et II) |
Inhalation de doses uniques vaporisées de cannabis séché (400 mg/dose) contenant une dose faible (1 % de Δ9-THC ou 4 mg de Δ9-THC), moyenne (4 % de Δ9-THC ou 16 mg de Δ9-THC) ou élevée (7 % de Δ9-THC ou 28 mg de Δ9-THC) de Δ9-THC (4 sessions de dosage uniques; intervalles égales de 2 semaines) | 4 séances au total;
16 patients |
Reference 592 |
| Douleur neuropathique causée par un traumatisme médullaire ou une maladie de la moelle épinière | Inhalation d'entre 8 et 12 bouffées provenant de 400 mg de cannabis séché (2,9 % et 6,7 % de THC) | 3 séances au total;
42 patients |
Reference 272 |
4.1 Soins palliatifs
- Jusqu'à maintenant, les données provenant d'études d'observation et d'études cliniques suggèrent que le cannabis (données limitées) et les cannabinoïdes sur ordonnance (p. ex., le dronabinol, le nabilone ou le nabiximols) pourraient être pratiques pour le soulagement d'une gamme de symptômes uniques ou cooccurrents souvent observés dans le cadre de soins palliatifs
- Ces symptômes comprennent, mais ne sont pas limités à, la nausée réfractaire et les vomissements associés à la chimiothérapie ou la radiothérapie, l'anorexie ou la cachexie, la douleur réfractaire aiguë, l'humeur dépressive et l'anxiété aiguë et l'insomnie.
- Un nombre limité d'études observationnelles suggèrent que l'usage de cannabinoïdes en soins palliatifs pourrait aussi être associé à une diminution du nombre de certains médicaments utilisés par cette population de patients.
Les objectifs des soins palliatifs tels que décrits par l'Organisation mondiale de la santé (OMS) sont entre autres le soulagement de la douleur et d'autres symptômes pénibles et l'amélioration de la qualité de la vie (QV)Reference 597. Bien que l'intégration du cannabis dans des traitements médicaux classiques puisse être caractérisée d'extrêmement prudente, son usage semble gagner du terrain dans des milieux des soins palliatifs où il est plus question de choix personnel, de l'autonomie du patient, de la responsabilisation et du confort de ce dernier, mais surtout de la QVReference 598. Néanmoins, l'établissement de l'efficacité du cannabis comme une option thérapeutique viable dans des contextes de soins palliatifs appelle d'abord à un examen minutieux de ses effets dans un large éventail d'états. De telles données sont encore insuffisantes et des recherches plus approfondies s'imposentReference 599. Certaines populations de patients (p. ex. les personnes âgées ou les personnes atteintes de maladies psychiatriques préexistantes) pourraient être plus sensibles ou plus susceptibles d'éprouver des effets psychotropiques, cognitifs, psychiatriques ou d'autres effets indésirablesReference 600Reference 601.
Données provenant d'études d'observation
Une étude de série de cas prospective, d'observation, sans répartition aléatoire et sans insu évaluant l'efficacité du traitement adjuvant au nabilone dans la gestion de la douleur et des symptômes ressentis par 112 patients atteints d'un cancer au stade avancé, dans un cadre de soins palliatifs, révèle que les patients qui utilisaient du nabilone ont présenté un taux plus faible de début de prise d'AINS, d'antidépresseurs tricycliques, de gabapentine, de dexaméthasone, de métoclopramide et d'ondansétron et qu'ils ont eu plus tendance à arrêter la prise de ces médicamentsReference 284. Les patients se sont vus prescrire du nabilone pour soulager la douleur (51 %), contre les nausées (26 %) et l'anorexie (23 %). Les patients traités ont commencé à prendre une dose de 0,5 ou 1 mg de nabilone au coucher, durant la première semaine, qu'ils ont augmentée par paliers de 0,5 ou 1 mg par la suite. Au moment du suivi, la plupart des patients recevaient une dose quotidienne de 2 mg de nabilone avec une dose quotidienne moyenne de 1,79 mg. Les deux paramètres primaires de l'étude, la douleur et l'utilisation d'opioïde sous la forme de doses équivalentes totales en sulfate de morphine, ont considérablement diminué chez les patients traités comparativement aux patients non traités. Les effets secondaires causés par le nabilone étaient principalement les étourdissements, la confusion, la somnolence et l'assèchement de la bouche. Les patients avaient également moins tendance à commencer à prendre d'autres nouveaux médicaments et pouvaient réduire ou cesser la prise de médicaments administrés au début de l'étude.
Une étude d'observation à laquelle ont participé plus de 100 patients auto-déclarés utilisant du cannabis dans un cadre de soins palliatifs liés au cancer révèle un soulagement significatif de divers symptômes liés au cancer et aux traitements anticancéreux, y compris les nausées, les vomissements, les troubles de l'humeur, la fatigue, la perte de poids, l'anorexie, la constipation, la fonction sexuelle, les troubles du sommeil, les démangeaisons et la douleurReference 602. Bien que la dose quotidienne de cannabis soit demeurée constante tout au long de la période d'étude, 43 % des patients utilisant des analgésiques ont déclaré une réduction de la dose et 1,7 % ont signalé une augmentation de la dose. En outre, 33 % des patients utilisant du cannabis ont réduit la dose de leurs antidépresseurs ou anxiolytiques. Aucun effet indésirable significatif n'a été constaté chez les personnes consommant du cannabis, à l'exception d'une diminution signalée de la mémoire par environ 20 à 40 % de l'échantillon. La diminution signalée de la mémoire dans une partie de l'échantillon pourrait dépendre de l'utilisation du cannabis avec d'autres médicaments tels que les opioïdes et les antidépresseurs; elle pourrait aussi varier en fonction de l'âge. Une amélioration des résultats relatifs aux symptômes et à la détresse a également été observée. Les limites de l'étude comprennent sa nature d'observation, l'absence d'un groupe témoin approprié et la dépendance envers l'auto-déclaration.
Une autre étude d'observation examinant les tendances d'utilisation du cannabis chez des patients israéliens adultes atteints d'un cancer au stade avancé révèle que parmi environ 17 000 patients atteints de cancer faisant l'objet d'un suivi dans un même établissement de santé israélien, 279 patients étaient autorisés à utiliser du cannabis à des fins médicales; parmi ceux-ci, l'âge moyen était de 60 ans (marge de 19 à 93 ans) et les diagnostics de cancer les plus courants étaient le cancer du poumon (18 %), des ovaires (12 %), du sein (10 %), du côlon (9 %) et du pancréas (7,5 %) et la plupart (84 %) des patients étaient atteints d'une maladie métastatiqueReference 233. La plupart des patients (71 %) recevaient des soins palliatifs actifs, des soins de soutien (13 %) et des soins curatifs (6 %). Chez la plupart des patients, le cannabis a été demandé pour plusieurs indications. L'indication la plus courante pour laquelle du cannabis était prescrit était la douleur (76 %); l'anorexie (56 %), une faiblesse généralisée (52 %) et des nausées (41 %) étant aussi des indications courantes. En outre, 70 % des patients ont déclaré une amélioration du contrôle de la douleur et un bien-être général; 60 % ont signalé une amélioration de l'appétit, 50 % ont fait état d'une diminution des nausées et des vomissements et 44 % ont indiqué une réduction de l'anxiété grâce au cannabis. Selon 83 % des patients, l'efficacité générale du cannabis était élevée. La voie d'administration la plus courante (plus de 90 %) était la fumée. Bien que la plupart des répondants (62 %) n'aient signalé aucun effet indésirable lié à l'utilisation du cannabis, les effets indésirables les plus souvent communiqués étaient la fatigue (20,3 %) et les étourdissements (18,8 %), tandis qu'une minorité de patients ont déclaré des idées délirantes (6 %) et des changements d'humeur (4,4 %).
Pour en savoir plus sur l'usage du cannabis et des cannabinoïdes pour contrôler la nausée et les vomissements, veuillez consulter la Section 4.3 du présent document. Pour plus d'information sur l'usage du cannabis et des cannabinoïdes contre l'anorexie et la cachexie associées aux infections à VIH/SIDA ou au cancer, veuillez consulter les Sections 4.4.1 et 4.4.2 respectivement. Pour des informations supplémentaires sur l'usage du cannabis et des cannabinoïdes contre des syndromes de douleur chronique (y compris la douleur cancéreuse), veuillez consulter les Sections 4.7.2.2 et 4.7.2.3. Pour des informations supplémentaires sur l'usage du cannabis et des cannabinoïdes contre les troubles du sommeil associés aux maladies chroniques, veuillez consulter la Section 4.9.5.2, et consulter la Section 4.9.9 sur l'usage du cannabis et des cannabinoïdes en oncologie.
4.2 Qualité de vie
- Les études cliniques disponibles rapportent des effets mixtes du cannabis et des cannabinoïdes sur ordonnance sur les mesures de la qualité de vie (QV) pour une variété de troubles divers.
Une poignée d'études cliniques ont utilisé des instruments normalisés de mesure de la QV afin de mesurer si l'usage du cannabis ou des cannabinoïdes sur ordonnance (p.ex. le nabilone, le dronabinol ou le nabiximols) est associé aux améliorations de la QV. Les données issues de ces études sont résumées ci-dessous.
Études cliniques avec le dronabinol
Un essai croisé, randomisé, à répartition aléatoire, à double insu, contrôlé par placebo du dronabinol (dose maximale de 10 mg de Δ9-THC par jour pour une durée totale de trois semaines) pour le traitement de la douleur neuropathique centrale chez des patients souffrant de la SP a révélé des améliorations statistiquement importantes dans les mesures de la QV (questionnaire de la QV SF-36 [36-Item Short Form Health Survey]; mesures des douleurs corporelles et de la santé mentale)Reference 603.
Une étude pilote de phase II, bicentrique, randomisée, menée à double insu et contrôlée avec placebo sur 22 jours auprès des patients adultes souffrant de modifications chimiosensorielles (c.-à-d. des modifications de l'olfaction et de la gustation) et d'un manque d'appétit lié à un cancer avancé d'étiologies diverses, a rapporté des améliorations renforcées de la perception chimiosensorielle chez les patients traités avec le dronabinol (2,5 mg b.i.d.) par rapport à ceux ayant reçu un placeboReference 604. La majorité (73 %) des patients traités avec le dronabinol ont autodéclaré une augmentation globale de leur appréciation pour la nourriture par rapport à ceux ayant reçu un placebo (30 %). Bien que les résultats globaux de l'évaluation fonctionnelle du traitement de l'anorexie/cachexie sur l'instrument de mesure de la QV (FAACT [Functional Assessment of Anorexia/Cachexia Treatment]), s'en sont trouvés améliorés au même titre tant pour le groupe ayant été traité par le dronabinol que pour le groupe traité au placebo, le sous-domaine du FAACT relatif au bien-être nutritionnel lié à l'anorexie et à la cachexie a connu une amélioration avec le dronabinol comparé au placebo. Des améliorations statistiquement importantes ont été également relevées en ce qui concerne la qualité du sommeil et la détente avec le dronabinol comparé au placebo. Selon les auteurs de l'étude, les effets psychoactifs négatifs ont été minimisés en commençant le traitement du patient par une faible dose (2,5 mg une fois par jour pendant trois jours) suivi d'une augmentation progressive de la dose (jusqu'à un maximum de 7,5 mg de dronabinol par jour).
Études cliniques avec l'extrait de cannabis
Une étude de phase III multicentrique, randomisée, menée à trois volets, en parallèle et à double insu, et contrôlée avec placebo auprès des patients adultes atteints de cancer avancé incurable et souffrant du syndrome de l'anorexie et de la cachexie liées au cancer, a conclu que ni l'extrait de cannabis (2,5 mg de Δ9-THC, 1 mg de CBD, pendant six semaines) ni le THC (2,5 mg de Δ9-THC b.i.d., pendant six semaines) n'avaient offert aucun bienfait statistiquement important comparativement au placebo dans les mesures de la QV (European Organization for Research and Treatment of Cancer Quality of Life Questionnaire, Core Module - EORTC QLQ-C30)Reference 312.
Études cliniques avec le nabilone
Un essai randomisé du nabilone mené à double insu et contrôlé avec placebo auprès des patients souffrant de la fibromyalgie a révélé que le traitement adjuvant au nabilone (quatre semaines, dose maximale pendant la dernière semaine du traitement, 1 mg b.i.d.) a été associé à une amélioration significative dans les mesures de la QV (Visual Analogue Scale for pain [Échelle visuelle analogique pour l'évaluation de la douleur] et le Fibromyalgia Impact Questionnaire [questionnaire d'impact de la fibromyalgie])Reference 587.
Une étude à recrutement enrichi, à sevrage randomisé, à groupes parallèles, à doses variables, à double insu et contrôlée avec placebo, examinant l'efficacité du nabilone comme traitement adjuvant contre la douleur neuropathique périphérique diabétique de longue durée a rapporté des améliorations statistiquement significatives dans les mesures de la QV (Composite EuroQoL five dimensions questionnaire, EQ-5D, Index Score [score de l'indice composite EQ-5D]) et de l'état des patients en général par rapport au placeboReference 605. Les doses du nabilone allaient de 1 à 4 mg par jour, la durée du traitement était de cinq semaines.
Une étude de sept semaines à répartition aléatoire contrôlée par placebo comparant les effets du nabilone par rapport au placebo sur la QV et les effets secondaires durant la radiothérapie indiquée pour des carcinomes de la tête et du cou révèle qu'à la posologie utilisée (0,5 à 2 mg/jour augmentée pendant la durée de l'étude), le nabilone ne prolonge pas le temps nécessaire pour une détérioration de 15 % de la QV (mesuré sur les échelles QLQ-C30 et QLQ-Head and Neck Module, H&N35, de l'EORTC) et qu'il n'est pas plus efficace que le placebo pour soulager la douleur et les nausées ou améliorer la perte d'appétit et de poids, l'humeur et le sommeilReference 606. Cette étude ne révèle entre autres aucune différence statistiquement significative quant à la présence d'effets indésirables entre le groupe recevant du nabilone et celui recevant un placebo.
Études cliniques avec le nabiximols
Un essai prospectif randomisé sur dix semaines mené à double insu et contrôlé avec placebo visant à évaluer l'innocuité et l'efficacité du nabiximols (SativexMD) comme médicament adjuvant contre la neuropathie diabétique périphérique réfractaire, a conclu que le nabiximols n'avait pas démontré d'améliorations statistiquement significatives dans les mesures de la QV (EuroQOL, SF-36 et le McGill Pain and QoL Questionnaire [Questionnaire de McGill sur la douleur et la QV])Reference 607.
Une étude randomisée du nabiximols contrôlée avec placebo, menée sur 12 semaines à double insu, à groupes parallèles et à recrutement enrichi comme thérapie d'appoint chez les patients souffrant de spasticité réfractaire, a conclue qu'il n'y avait pas de différence significative entre le traitement actif et le traitement au placebo dans les mesures de la QV (EQ-5D Health State Index, EQ-5D Health Status VAS, SF-36 [Indice de l'état de santé EQ-5D, EVA de l'état de santé])Reference 608.
Une étude multicentrique randomisée, menée sur cinq semaines, à double insu, à groupes parallèles, à doses graduées et contrôlée avec placebo a évalué l'efficacité analgésique et l'innocuité du nabiximols dans trois gammes de doses chez des patients atteints de cancer, traités aux opioïdes, et souffrant d'une douleur chronique mal contrôléeReference 280. L'étude a rapporté qu'il n'y avait aucun effet du traitement positif sur la QV en général chez la population ayant fait l'objet de l'étude même avec la dose la plus forte du nabiximols (11 à 16 vaporisations par jour).
Études cliniques et d'observation avec le cannabis fumé
Un essai randomisé croisé, mené à double insu et contrôlé avec placebo en quatre périodes du cannabis fumé au traitement de la douleur neuropathique chronique (d'étiologie post-traumatique ou post-opératoire) a conclu que l'inhalation du cannabis fumé (25 mg de cannabis contenant 2,5, 6,0 ou 9,4 % de Δ9-THC, t.i.d. pendant cinq jours) n'avait pas été associée à une différence statistiquement significative par rapport au placebo dans les mesures de la QV (EQ-5D Health Outcomes Quality of Life instrument [Instrument EQ-5D de mesure de la QV, résultats sur la santé])Reference 59.
En revanche, une enquête transversale visant à examiner les bienfaits associés à l'usage du cannabis chez des patients souffrant de la fibromyalgie a rapporté un bienfait statistiquement significatif dans le score sommaire du volet santé mentale du questionnaire SF-36 sur la QV chez des patients qui avaient utilisé le cannabis par rapport à ceux qui n'en avaient pas utiliséReference 179. Toutefois, aucune différence significative n'a été trouvée entre les consommateurs du cannabis et ceux qui n'en consomment pas dans les autres domaines du SF-36, du Fibromyalgia Impact Questionnaire [questionnaire d'impact de la fibromyalgie] ou du Pittsburgh Sleep Quality Index [l'indice de la qualité du sommeil de Pittsburgh].
Un essai d'observation prospectif préliminaire ouvert, d'un seul volet, auprès d'un groupe de 13 patients atteints de la maladie de Crohn ou de la colite ulcéreuse a rapporté que le traitement à l'aide du cannabis inhalé sur une période de trois mois avait amélioré la QV des sujets, entraîné un gain de poids statistiquement important chez les sujets et amélioré l'indice clinique d'activité de la maladie chez les patients atteints de la maladie de CrohnReference 275. Les patients ont signalé des améliorations statistiquement significatives dans la perception de leur état général de santé et dans leur capacité à accomplir des activités quotidiennes et à mener une vie sociale. Ils ont aussi signalé une réduction statistiquement importante de la douleur physique et une amélioration de la détresse mentale.
Une récente revue systématique et méta-analyse de 20 études (11 essais randomisés contrôlés; 9 études de cohorte ou études transversales) examinant l'impact d'une variété de produits à base de cannabinoïdes (cannabis à base d'herbes, nabiximols, nabilone, dronabinol, dexanabinol) sur la qualité de vie liée à la santé (QVLS) dans de multiples maladies n'a rapporté dans l'ensemble aucune association significative. Les auteurs ont attribué les résultats nuls à l'hétérogénéité des caractéristiques des études et à la limite dans laquelle les QVLS étaient des résultats secondaires et non primaires dans la plupart des études. Cependant, les études montrant une relation positive entre les cannabinoïdes et la QVLS étaient plus susceptibles de provenir de symptômes liés à la douleur (douleur neuropathique, sclérose en plaques, maux de tête, maladies inflammatoires de l'intestin), alors que des relations négatives ont été observées surtout chez les patients atteints du VIH qui ont signalé des réductions significatives de la QVLS physique et mentaleReference 609.
4.3 Nausées et vomissements induits par la chimiothérapie
- Les études précliniques démontrent que certains cannabinoïdes (THC, CBD, THCV, CBDV) et acides de cannabinoïdes (THCA et CBDA) suppriment les nausées et les vomissements aigus ainsi que les nausées d'anticipation.
- Les études cliniques suggèrent que la consommation de certains cannabinoïdes et de cannabis (données limitées) peut soulager les nausées et les vomissements induits par la chimiothérapie (NVIC).
Les NVIC constituent un des effets indésirables les plus communs et les plus stressants associés au traitement du cancerReference 610. En l'absence d'antiémétiques efficaces, les nausées associées à la chimiothérapie peuvent être si graves que 20 % des patients choisissent d'arrêter leur traitement par chimiothérapieReference 611. Une fois qu'un patient souffre de nausées, celles-ci ont tendance à persister tout au long du traitement et à rendre les épisodes subséquents de nausées plus gravesReference 612. Les nausées après le traitement sont aussi associées à des déficiences du patient, à une anxiété accrue, à une dépression et à une diminution de la QV qui, ensemble, peuvent avoir une incidence négative sur l'observance du traitement, voire causer son arrêt totalReference 613.
Bien que les nausées surviennent habituellement avant les vomissements, ils empruntent des circuits neuronaux distincts et présentent des différences du point de vue du comportementReference 291. En outre, bien que les mécanismes centraux des vomissements soient bien connus, ceux responsables des nausées sont moins bien comprisReference 291. Cependant, les études scientifiques soulignent le rôle du cortex insulaire et sa fonction de siège des sensations telles que les nausées et le dégoût, d'autres régions centrales (p. ex. area postrema, noyau parabrachial) ainsi que l'apport GI contribuant également à la production de nauséesReference 291Reference 614.
Alors que les vomissements induits par la chimiothérapie semblent être généralement bien contrôlés grâce aux traitements courants de première ligne et aux trithérapies (p. ex. antagonistes des récepteurs 5-HT3, antagonistes des récepteurs de neurokinine et corticostéroïdes), les nausées aiguës, retardées et, surtout, d'anticipation connexes sont encore mal contrôlées et la consommation de cannabis ou de cannabinoïdes peut procurer dans ces cas quelques bienfaitsReference 292Reference 294Reference 613. Une proportion importante (25 à 59 %) de patients recevant une chimiothérapie connaissent des nausées d'anticipation durant le traitement; une fois qu'elles se développent, ces nausées sont réfractaires au traitement de référence par des antagonistes des récepteurs 5-HT3Reference 613. Des traitements anxiolytiques non spécifiques (p. ex. benzodiazépines) sont utilisés pour traiter les nausées d'anticipation, malgré des inconvénients comme une sédation importanteReference 613.
Il convient de noter qu'il a été rapporté que l'usage excessif du cannabis déclenche paradoxalement un syndrome des vomissements cycliques (c.-à-d. l'hyperémèse) (voir Section 7.6.1 pour plus de détails sur ce syndrome).
Études précliniques
Les affirmations des patients selon lesquelles le cannabis fumé soulage les NVIC sont bien connues, et d'autres données suggèrent aussi que le SEC joue un rôle dans la modulation des nausées et des vomissementsReference 291Reference 292Reference 613Reference 615-Reference 621. Les récepteurs CB1 et CB2 se trouvent dans des zones du tronc cérébral associées au contrôle émètogèneReference 622Reference 623, et les conclusions d'études expérimentales chez l'animal suggèrent que les propriétés antinausées et antiémétiques de certains cannabinoïdes (p.ex. le Δ9-THC, le dronabinol et le nabilone) sont le plus probablement associées à leurs actions agonistes aux récepteurs CB1 Reference 99Reference 292Reference 624. Les niveaux de 2-AG sont augmentés dans le cortex insulaire viscéral pendant un épisode aigu de nausées chez les rats et le blocage localisé de 2-AG par l'inhibition ciblée de MAGL dans le cortex insulaire réduit les nausée aiguësReference 290. De même, l'infusion de 2-AG dans le cortex insulaire bloque de manière liée à la dose les nausées anticipées, tandis que la perfusion d'anandamide n'avait aucun effet. Ces résultats suggèrent que le 2-AG, mais pas l'anandamide, entraîne les nausées aiguës et anticipatrices. Ailleurs, il a été montré que l'élévation des endocannabinoïdes tels que l'anandamide et le 2-AG par inhibition des enzymes de dégradation des endocannabinoïdes, FAAH et MAGL, supprime les nausées aiguës et anticipées chez les modèles animauxReference 291Reference 625 et une perfusion localisée d'un agoniste du récepteur CB1 à restriction périphérique dans le cortex insulaire viscéral avait supprimé le comportement analogue à la nausée chez le rat, alors que l'administration systématique n'avait aucun effetReference 614.
Une étude in vivo chez l'animal et une étude clinique de petite envergure suggèrent aussi que le Δ8-THC est un antiémétique plus puissant que le Δ9-THCReference 99Reference 100. Une étude in vitro montre aussi que le Δ9-THC, outre son action aux récepteurs CB1, antagonise aussi le récepteur 5-HT3 Reference 626, lequel est la cible des médicaments antiémétiques standard. Il est donc possible que les cannabinoïdes puissent exercer leur action antiémétique au moyen de plus d'un mécanisme. D'autres études portant sur les nausées et les vomissements menées chez des animaux montrent que le CBD (5 mg/kg, sous-cutanée (s.c.)) inhibe les vomissements (et les nausées) provoqués par des produits chimiques grâce à une activation potentielle des autorécepteurs 5-HT1A somatodendritiques situés au niveau du noyau du raphé dorsalReference 620, tandis qu'une autre étude indique que les effets antiémétiques du CBD pourraient être réversibles par un prétraitement au CBG [5 mg/kg, intrapéritonéal (IP)]Reference 621.
Acides cannabinoïdes et autres cannabinoïdes
Des travaux supplémentaires ont révélé les nouveaux rôles importants des acides cannabinoïdes (c.-à-d. THCA, CBDA) dans l'inhibition des nausées et des vomissements dans les modèles animauxReference 615Reference 616Reference 618Reference 627Reference 628. Dans une étude, lorsqu'il était administré seul, le CBDA administré à une très faible dose (0,5 µg/kg, IP), inhibe le comportement modélisant des nausées aiguës et une dose sous-liminaire de CBDA (0,1 µg/kg IP), lorsqu'elle est administrée avec de l'ondansétron à une dose de 1 µg/kg, produit une amélioration de l'effet antiémétique aiguReference 618. En outre, la dose efficace de CBDA qui a atténué les nausées aiguës était environ 1 000 fois plus faible que celle du CBDReference 618. Le THCA, administré à des doses de 0,5 et 0,05 mg/kg (IP), a réduit les comportements modélisant les vomissements et nausées aiguës; à une dose de 0,05 mg/kg (IP), il a diminué les comportements modélisant les nausées d'anticipation dans les modèles animaux de nausées et de vomissements aigus et d'anticipationReference 616.
Le THCA a démontré un manque d'activité des récepteurs CB1Reference 629 et son administration n'a pas été associée à certains signes comportementaux classiques des agonistes des récepteurs CB1 chez les animaux (c.-à-d'hypothermie, catalepsie)Reference 616, ce qui confirme de précédents résultats d'absence d'effet psychoactif associé au THCA chez les animauxReference 630. Le THCA s'est aussi révélé au moins 10 fois plus puissant que le THC pour réduire les modèles de nausées aiguës et d'anticipationReference 616.
D'autres travaux ont montré que le THC, le CBDA et la benzodiazépine chlordiazépoxide réduit le comportement modélisant les nausées d'anticipationReference 615. Dans cette étude, le CBDA (0,001, 0,01 et 0,1 mg/kg IP) s'est révélé être entre 5 et 500 fois plus puissant que le THC (0,5 mg/kg) pour réduire les nausées d'anticipation et 20 fois plus puissant que la chlordiazépoxide (10 mg/kg). Le traitement par le CBDA n'était pas associé à des effets sur l'activité de locomotion, quelle que soit la dose testée, tandis que la chlordiazépoxide a diminué de manière significative l'activité de locomotion. La coadministration de doses sous-liminaires de CBDA (0,1 µg/kg IP) et de THCA (5 µg/kg IP) a réduit le comportement modélisant les nausées d'anticipation et les études pharmacologiques laissent supposer l'intervention des récepteurs CB1 (pour le THCA) et 5-HT1A (pour le CBDA) dans le mécanisme de répression des nausées d'anticipation. Des recherches plus approfondies sont nécessaires pour élucider les données contradictoires concernant le mécanisme d'action, le cas échéant, du THCA au récepteur CB1. Quant au CBDA, une dose aussi faible que 1 µg/kg (IP) a manifestement inhibé les nausées d'anticipation dans un modèle animal et comparativement aux doses de CBD nécessaires pour le même degré d'effet (1 à 5 mg/kg IP), on pourrait dire que le CBDA était 1 000 à 5 000 fois plus puissant que le CBD pour réprimer les nausées d'anticipation.
D'autres études menées sur des animaux ont montré que l'administration de doses sous-liminaires de THC (0,01 et 0,1 mg/kg IP) et de CBDA (0,01 et 0,1 µg/kg IP) diminue les nausées aiguës et que des doses plus élevées de THC (1 et 10 mg/kg IP) ou de CBDA (1 et 10 µg/kg IP) administrées seules réduisent également les nausées aiguësReference 627. Contrairement à l'effet observé pour les nausées aiguës, les doses sous-liminaires combinées de THC et de CBDA n'ont pas réprimé les nausées d'anticipation chez les animaux. Les doses plus élevées de THC (1 et 10 mg/kg IP) ou de CBDA (1 et 10 µg/kg IP) se sont avérées efficaces pour réduire les nausées d'anticipation. La dose plus élevée de THC (10 mg/kg) a été associée à une hypoactivité non atténuée par le CBDA.
Une étude subséquente a examiné les effets de la combinaison du CBD avec le THC et du CBDA avec le THC sur les nausées et vomissements aigusReference 628. L'étude a montré que 2,5 mg/kg de CBD (IP), en combinaison avec 1 mg/kg de THC (IP), a donné lieu à une inhibition des nausées et vomissements aigus dans un modèle animal et, de la même façon, lorsque 0,05 mg/kg (IP) de CBDA a été combiné à 1 mg/kg de THC, les nausées et vomissements aigus ont été considérablement inhibés. L'administration unique de 2,5 mg/kg de CBD, de 1 mg/kg de THC ou de 0,05 mg/kg (IP) de CBDA n'a pas été associée à une quelconque inhibition des nausées et vomissements aigus.
Outre le THC, le CBD, le THCA et le CBDA, deux autres phytocannabinoïdes, le THCV et la cannabidivarine (CBDV), ont été étudiés, bien que dans une moindre mesure, en vue d'examiner leur potentiel de réduction des nausées dans les modèles animauxReference 613. Il a été démontré que le THCV, à une dose de 10 mg/kg (IP), et le CBDV, à une dose de 200 mg/kg (IP), réduisent les nausées aiguës chez les rats, potentiellement par l'intermédiaire d'un mécanisme indépendant du récepteur CB1. En revanche, on ignore leur capacité à inhiber les nausées d'anticipationReference 619.
Ensemble, les résultats provenant des études précliniques mentionnées ci-dessus semblent indiquer que le Δ9-THC, le CBD, le CBDA et le THCA peuvent tous inhiber les nausées et les vomissements aigus, ainsi que les nausées d'anticipation, à différents degrés et avec une puissance et une efficacité qui varient, tandis que le THCV et le CBDV inhibent les nausées aiguës. De plus, certains de ces cannabinoïdes, lorsqu'ils sont combinés et utilisés à une dose sous-liminaire, au lieu d'être utilisés seuls, peuvent produire des effets synergiques anti-émétiques.
Études cliniques
Les données sur le cannabis fumé et les cannabinoïdes sur ordonnance tels que le nabilone (CesametMD), le dronabinol (MarinolMD) (et le lévonantradol) dans le traitement des NVIC ont été examinéesReference 174Reference 205Reference 594Reference 631. Une méta-analyse et l'analyse systématique de 28 essais cliniques à répartition aléatoire (N = 2 454 participants) portant sur les cannabinoïdes effectués à l'aide de l'approche GRADE signalent que les cannabinoïdes procurent des bienfaits plus importants comparativement aux comparateurs actifs et au placeboReference 174. Toutefois, ces études n'atteignent pas toutes une signification statistique. Le nombre moyen de patients présentant une réponse complète contre des nausées et des vomissements est plus élevé avec les cannabinoïdes sur ordonnance (dronabinol ou nabiximols) qu'avec le placebo (RC = 3,82 [IC à 95 % : 1,55 à 9,42]).
Alors que les cannabinoïdes sur ordonnance présentent des avantages évidents par rapport au placebo dans le contrôle des NVIC, les données provenant d'essais randomisés démontrent que d'un point de vue clinique, ils ne sont que légèrement supérieurs aux antiémétiques antagonistes conventionnels des récepteurs de dopamine D2Reference 205Reference 631. Dans certains cas, les patients semblaient préférer les cannabinoïdes à ces thérapies conventionnelles, malgré l'augmentation de l'incidence des effets indésirables tels que la somnolence, les étourdissements, la dysphorie, la dépression, les hallucinations, la paranoïa et l'hypotension artérielle. Cela s'explique en partie par le fait que pour certains patients, un degré de sédation et d'euphorie peut être perçu comme étant bénéfique pendant une chimiothérapie.
Bien qu'il n'existe pas d'essais cliniques examinés par les pairs sur le traitement au cannabis fumé des NVIC, Musty et Rossi ont publié une revue portant sur les essais cliniques à ce sujet menées aux É.-U.Reference 293. Il y a eu un soulagement des nausées et des vomissements à une hauteur de 70 à 100 % chez les patients ayant fumé du cannabis, tandis que chez ceux ayant eu recours à la gélule de Δ9-THC, le soulagement était de 76 à 88 %. Les concentrations plasmatiques au dessus de 10 ng/mL du Δ9-THC ont été associées à l'inhibition la plus importante des nausées et des vomissements, bien que les concentrations allant de 5 à 10 ng/mL aient été aussi efficaces. Dans tous les cas, les patients n'étaient admis qu'après que leur traitement régulier aux antiémétiques phénothiazines ait échoué.
Une petite étude ouverte avec huit enfants atteints par divers cancers du sang ayant été administré une dose de Δ8-THC (18 mg/m2) deux heures avant le début de leurs traitements chimiothérapeutiques et aux six heures au cours des 24 heures suivantes a réussi a prévenir les vomissements et aucun épisode retardé de nausée ou de vomissement n'a été observé au cours des deux prochains jours suivant les traitements antinéoplastiquesReference 100. Le Δ8-THC pouvait aussi être administré à des doses considérablement plus élevées que celles du Δ9-THC généralement administré à des patients adultes sans la présence d'effets secondaires graves.
Peu, sinon aucun essai clinique comparant directement les cannabinoïdes aux nouveaux antiémétiques tels que les antagonistes des récepteurs 5-HT3 (ondansétron, granisétron) ou neurokinine 1 (NK-1) n'a été mené jusqu'à maintenantReference 610Reference 631. Dans un essai clinique de petite envergure comparant le cannabis fumé (2,11 % de Δ9-THC en doses de 8,4 mg ou 16,9 mg de Δ9-THC; 0,30 % de CBN, 0,05 % de CBD) à l'ondansétron (8 mg) contre les nausées et les vomissements provoqués par l'ipécacuanha chez des volontaires en santé a démontré que les deux doses de Δ9-THC avaient baissé les évaluations subjectives de la nausée ainsi que les mesures objectives des vomissements; toutefois ces effets s'en trouvaient très modestes par rapport à l'ondansétronReference 294. En outre, seul le cannabis a entraîné des changements d'humeur et d'état subjectif. Dans une autre étude clinique à petite taille d'échantillon, l'ondansétron et le dronabinol (2,5 mg de Δ9-THC le premier jour, 10 mg le deuxième jour, 10 à 20 mg par la suite) ont tous les deux offert le même degré de soulagement aux NVIC retardés, et la combinaison du dronabinol et de l'ondansétron n'ont ajouté aucun avantage au-delà de ceux observés avec un seul agentReference 632. Toutefois, deux études chez l'animal ont démontré que de faibles doses de Δ9-THC combinées à de faibles doses des antagonistes des récepteurs 5-HT3, l'ondansétron ou le tropisétron, étaient plus efficaces dans la diminution de la fréquence des nausées et vomissements que lorsqu'elles étaient administrées individuellementReference 633Reference 634. Davantage de recherches sont nécessaires afin de déterminer si la thérapie combinatoire offre plus d'avantages que ceux observés avec les traitements standards plus récents.
Un examen rétrospectif des dossiers sur l'utilisation du dronabinol pour lutter contre les NVIC chez les adolescents atteints de cancer (c.-à-d. leucémie, lymphome, sarcome, tumeur cérébrale) dans un hôpital pédiatrique de niveau tertiaire a indiqué que la plupart des patients qui recevaient une chimiothérapie modérément ou hautement émétisante et un traitement antiémétisant standard (c.-à-d. antagoniste du récepteur 5-HT3 et corticostéroïdes) recevaient aussi du dronabinolReference 635. La dose de dronabinol la plus souvent prescrite dans le cadre de cette étude était 2,5 mg/mReference 2 de solution orale toutes les six heures (selon les besoins) et le nombre médian de doses de dronabinol reçues par hospitalisation était de 3,5. Soixante pour cent des enfants de cette étude auraient répondu favorablement au dronabinol. Cette étude pose notamment les limites suivantes : recherche rétrospective, absence de groupe de comparaison, absence de normalisation de la chimiothérapie et absence de régimes antiémétiques normalisés.
L'usage des cannabinoïdes (administrés par voie orale ou fumée) est actuellement considéré comme la quatrième meilleure thérapie auxiliaire contre les NVIC là où les thérapies antiémétiques conventionnelles ont échouéReference 414Reference 636-Reference 640. Le nabilone (CesametMD) et le dronabinol (MarinolMD) sont indiqués pour le traitement des NVICReference 222Reference 488, cependant le dronabinol n'est plus disponible à la vente sur le marché canadien. Le nabilone peut être administré par voie orale chaque 12 h à des posologies de 1 à 2 mg, tandis que le dronabinol peut être administré chaque 6 à 8 h par voie orale, par voie rectale ou par voie sublinguale à des posologies de 5 à 10 mgReference 308Reference 641.
4.4 Syndrome cachectique (cachexie, p. ex. résultant de la blessure des tissus par l'infection ou d'une tumeur) et perte de l'appétit (anorexie) chez les patients souffrant du SIDA ou d'un cancer, et de l'anorexie mentale
- Les données disponibles provenant d'études cliniques chez l'humain suggèrent que le cannabis (données limitées) et le dronabinol pourraient augmenter l'appétit et la consommation de calories, et promouvoir le gain de poids chez les patients atteints du VIH/SIDA.
- Les preuves pour le dronabinol sont toutefois mixtes et les effets sont modestes chez les patients atteints de cancers et sont faibles chez les patients atteints d'anorexie mentale.
La capacité du cannabis à stimuler l'appétit suite à une exposition aiguë est connue de façon anecdotique depuis des annéesReference 309. En outre, les résultats provenant d'études épidémiologiques portent à croire que les personnes qui consomment activement du cannabis ont un plus grand apport en énergie et en nutriments que ceux qui n'en consomment pasReference 642. Des études en laboratoire contrôlées avec des sujets sains suggèrent que l'exposition aiguë au cannabis, par inhalation ou par ingestion orale de capsules de Δ9-THC, est corrélée nettement à l'augmentation de la consommation d'aliments, de l'apport calorique et du poids corporelReference 309Reference 310. Des études indiquant une forte concentration de récepteurs CB1 dans les zones cérébrales associées au contrôle de l'apport alimentaire et de la satiété confèrent un appui supplémentaire au lien entre la consommation du cannabis et la régulation de l'appétitReference 643-Reference 645. De plus, d'autres données suggèrent aussi que le SEC joue un rôle non seulement dans la modulation de l'appétit, l'apport et la palatabilité alimentaires, mais aussi dans le métabolisme énergétique et la modulation des métabolismes lipidique et glucosique (articles de revueReference 19Reference 644-Reference 646).
4.4.1 Pour stimuler l'appétit et engendrer un gain de poids chez les patients atteints du SIDA
La capacité du cannabis à stimuler l'appétit et la consommation d'aliments a été mise en application dans des situations cliniques où le gain de poids est considéré bénéfique, comme dans le cas de la perte de poids et de muscles associée au VIH.
Une étude multicentrique randomisée ouverte visant à évaluer l'innocuité et la pharmacocinétique du dronabinol et de l'acétate de mégestrol (médicament à effet orexigène) seul ou en combinaison a relevé que seul le traitement à forte dose de l'acétate de mégestrol seul (750 mg par jour), et non le dronabinol seul (2,5 mg, b.i.d., 5 mg du Δ9-THC total par jour) ou la combinaison de la faible dose d'acétate de mégestrol (250 mg par jour) et du dronabinol (2,5 mg b.i.d., 5 mg du Δ9-THC total par jour), a réussit à produire une augmentation significative du poids moyen pendant 12 semaines de traitement chez des patients atteints du syndrome cachectique consécutif au VIHReference 647. L'absence d'effets cliniques observés dans cette étude pourrait avoir été causée par la faible dose du dronabinol.
Malgré les observations de l'étude mentionnée ci-dessus, l'anorexie associée à la perte de poids chez les patients atteints du SIDA est une indication pour le dronabinol (MarinolMD) au Canada (plus disponible au Canada). La monographie du MarinolMD résume un essai randomisé à double insu, de six semaines, contrôlé par placebo, avec 139 patients, dont 72 sont du groupe expérimental qui ont reçu au départ 2,5 mg de dronabinol deux fois par jour, puis une dose réduite de 2,5 mg à l'heure du coucher à cause des effets indésirables (sensation de « high », étourdissements, confusion et somnolence)Reference 648. Au cours de la période de traitement, le dronabinol a augmenté l'appétit considérablement avec une tendance vers l'amélioration du poids corporel, une meilleure humeur et une diminution des nausées. À la fin des six semaines, l'on a permis aux patients de continuer avec la prise du dronabinol, et pendant ce temps, l'appétit a continué de s'améliorerReference 649. Cette étude secondaire ouverte de suivi, menée sur 12 mois, suggère que l'usage à long terme du dronabinol est sécuritaire et efficace dans le traitement de l'anorexie associée à la perte de poids chez les patients atteints du SIDA. L'usage de fortes doses du dronabinol (20 à 40 mg par jour) est rapporté aussi bien dans la monographie du MarinolMDReference 222 que dans la littératureReference 218Reference 219. Toutefois, il faudrait faire preuve de prudence en augmentant la dose à cause de la fréquence accrue des effets indésirables.
Une étude clinique utilisant de plus fortes doses de dronabinol ou de cannabis fumé a démontré que l'administration aiguë de fortes doses de dronabinol (quatre à huit fois la dose normale de 2,5 mg de Δ9-THC b.i.d ou de 10 à 20 mg de Δ9-THC quotidiennement, trois fois par semaine pour un total de huit séances) et de cannabis fumé (trois bouffées à intervalles de 40 secondes avec des cigarettes d'environ 800 mg contenant 1,8 à 3,9 % de THC fournissant donc une quantité quotidienne estimée totale de 14,4 à 31,2 mg de THC dans la cigarette, trois fois par semaine pour un total de huit séances d'étude) a augmenté l'apport calorique chez des fumeurs de cannabis habitués séropositifs pour le VIH affectés de perte de masse musculaire cliniquement importanteReference 219. Une étude ultérieure sur des patients hospitalisés a utilisé des doses encore plus fortes de dronabinol (20 à 40 mg de Δ9-THC total quotidiennement sur une période de quatre jours) et de cannabis fumé (cigarettes d'environ 800 mg contenant 2 à 3 % de THC, administrés quatre fois par jour, fournissant une quantité quotidienne estimée totale de 64 à 125 mg de THC quotidiennement dans la cigarette, au cours d'une période d'étude totale de quatre jours)Reference 218. Les deux drogues ont produit une augmentation substantielle et comparable de la consommation d'aliments et du poids corporel, ainsi qu'une amélioration de l'humeur et du sommeilReference 218Reference 219. D'autres études ont démontré que les augmentations du poids corporel associé au cannabis dans cette population de patients semblent être le résultat d'une augmentation de la masse adipeuse et non de la masse musculaire maigreReference 650Reference 651.
Une sous-étude pilote croisée à double insu contrôlée par placebo examinant les effets de l'utilisation du cannabis sur les hormones de l'appétit chez des hommes adultes porteurs du VIH et présentant une neuropathie sensorielle associée au VIH sur une combinaison de traitements antirétroviraux (TARs) a relevé que, comparativement au placebo, le cannabis fumé (1 à 8 % de THC) est associé à une augmentation significative des niveaux plasmatiques de ghréline (une augmentation de 42 % p/r à une diminution de 12 % avec le placebo) et de leptine (augmentation de 67 % p/r à 11,7 % avec le placebo) et à une diminution des niveaux plasmatiques du peptide YY (diminution de 14,2 % p/r à une augmentation de 23 % avec le placebo)Reference 652. Les concentrations plus élevées de THC ont été associées à une plus forte augmentation de la ghréline, révélant une relation dose-réponse et une augmentation plus faible de la leptine; aucune dose-réponse n'a été observée pour le peptide YY.
Une méta-analyse et une analyse systématique de 28 essais à répartition aléatoire (N = 2 454 participants) portant sur les cannabinoïdes (c.-à-d. cannabis fumé, nabiximols, nabilone, dronabinol, CBD, THC, levonontradol, acide ajulémique) effectués à l'aide de l'approche GRADE signalent qu'il existait des données selon lesquelles le dronabinol a été associé à une augmentation du poids comparativement au placebo et qu'il peut aussi être associé à une augmentation de l'appétit, à un pourcentage plus élevé des réserves lipidiques, à une diminution du nombre de nausées et à l'amélioration de l'état fonctionnel des patients atteints du VIH/SIDAReference 174.
4.4.2 Pour stimuler l'appétit et engendrer un gain de poids chez les patients atteints d'un cancer
L'anorexie est classée comme un des symptômes dégageant le plus de complications associées au cancer avancé, plus de la moitié des patients atteints d'un cancer avancé vivant un manque d'appétit ou une perte de poids, ou les deuxReference 653Reference 654. Alors qu'il est connu de façon anecdotique que fumer du cannabis peut stimuler l'appétit, les effets sur l'appétit et le gain de poids chez les patients souffrant de cachexie causée par un cancer n'ont pas été étudiés. Les résultats d'essais cliniques avec le Δ9-THC (dronabinol) par voie orale ou l'extrait de cannabis par voie orale sont contrastés et les effets, s'il en existe semblent modestes (recensé dans l'articleReference 311.
Dans deux études précoces, le THC par voie orale (le dronabinol) a amélioré l'appétit et l'alimentation chez certains patients suivant une chimiothérapieReference 316Reference 317. Une étude ouverte sur le dronabinol (2,5 mg de Δ9-THC, deux à trois fois par jour pendant quatre à six semaines) chez les patients atteints d'un cancer inopérable ou avancé a indiqué un meilleur appétit et une meilleure alimentation, mais seulement quelques patients ont pu gagner du poidsReference 314Reference 315. L'on a obtenu un gain de poids modeste avec une dose plus importante de dronabinol (5 mg, t.i.d.), mais les effets indésirables sur le SNC, y compris des étourdissements et de la somnolence, ont été des facteurs limitantsReference 318. En revanche, une étude randomisée, à double insu et contrôlée contre placebo menée auprès des patients atteints d'un cancer et souffrant du syndrome d'anorexie-cachexie n'a pas démontré de différence entre les appétits des patients dans l'ensemble des catégories de traitement (extrait de cannabis par voie orale, Δ9-THC ou placebo)Reference 312. De plus, lorsqu'on le compare à l'acétate de mégestrol, un médicament orexigène, le dronabinol était beaucoup moins efficace dans l'amélioration de l'appétit et le gain de poids signalésReference 313.
Une étude pilote de phase II bicentrique menée à double insu, randomisée et contrôlée contre placebo sur une période de 22 jours auprès des patients adultes atteints d'un cancer avancé a rapporté des améliorations renforcées de la perception chimiosensorielle (c.-à-d. des modifications de l'olfaction et de la gustation) chez des patients traités avec le dronabinol (2,5 mg de Δ9-THC b.i.d.) par rapport à ceux ayant reçu un placeboReference 604. La majorité (73 %) des patients traités avec le dronabinol ont auto déclaré une appréciation globale accrue pour la nourriture par rapport à ceux ayant reçu un placebo (30 %). De la même manière, la majorité des patients traités au dronabinol (64 %) ont rapporté une augmentation de l'appétit, tandis que la majorité des patients recevant le placebo ont rapporté une diminution de l'appétit (50 %) ou aucun changement (20 %). L'apport calorique total par kilogramme de poids n'avait pas sensiblement différé entre groupes de traitement, mais il s'était accru dans les deux groupes, comparativement à la normale. En outre, par rapport au placebo, les patients traités au dronabinol ont rapporté une augmentation de leurs apports en protéines proportionnellement à l'énergie totale. Selon les auteurs de l'étude, les effets psychoactifs négatifs ont été minimisés en commençant le traitement du patient par une faible dose (2,5 mg de Δ9-THC, une fois par jour pendant trois jours) suivi d'une augmentation progressive de la dose (jusqu'à un maximum de 7,5 mg de dronabinol par jour).
Selon un examen de la gestion médicale de la cachexie causée par un cancer, le niveau de preuves actuel pour les cannabinoïdes (p. ex. le dronabinol) dans le traitement de cette maladie demeure faibleReference 655. La cachexie causée par un cancer n'est pas une indication de traitement au dronabinol au Canada, ni aux É.-U.
4.4.3 Anorexie mentale
Le SEC participe à la régulation de l'appétit et l'on croit qu'il joue un rôle dans les troubles de l'alimentation comme l'anorexie mentaleReference 644Reference 656. Une augmentation de l'activité du SEC périphérique (c.-à-d. augmentation de l'anandamide plasmatique et de l'expression de l'ARNm du récepteur CB1 dans le sang) a été constatée chez les patients atteints de troubles de l'alimentationReference 657. Bien que des études épidémiologiques et familiales laissent supposer que l'anorexie mentale aurait des fondements génétiques, les études sur la génétique n'indiquent jusqu'à maintenant aucune association entre l'encodage génétique des protéines du SEC et la manifestation d'anorexie mentaleReference 658Reference 659.
Aucune étude n'a examiné les effets de fumer du cannabis sur l'anorexie mentale et des renseignements limités existent sur l'utilisation des cannabinoïdes pour le traitement de l'anorexie mentale. De plus, des différences inter et intraespèces animales quant au comportement associé à l'anorexie mentale ont dans une certaine mesure entravé les recherches pré-cliniques sur les effets du Δ9-THC sur ce trouble.
Une étude de l'anorexie mentale menée sur un modèle de souris a rapporté des résultats contradictoiresReference 660, tandis qu'une autre étude sur un modèle de rat n'a rapporté une atténuation importante de la perte de poids qu'à de fortes doses de Δ9-THC (2,0 mg/kg par jour de Δ9-THC IP)Reference 661.
Un essai croisé randomisé de petite envergure du Δ9-THC par voie orale chez des patients de sexe féminin a suggéré que le THC a entraîné un gain de poids équivalent au placebo actif (diazépam)Reference 320. Le Δ9-THC a été administré en doses quotidiennes augmentant de 7,5 mg (2,5 mg, t.i.d.) à 30 mg (10 mg, t.i.d.) au maximum, 90 minutes avant les repas sur une période de deux semaines. De graves réactions dysphoriques ont été rapportées chez trois des onze patients à qui l'on a administré le Δ9-THC, lesquels se sont retirés de l'étude.
Enfin, une étude clinique prospective, randomisée, croisée de quatre semaines à répartition aléatoire et à double insu portant sur l'administration de doses quotidiennes de 5 mg de dronabinol chez 24 femmes adultes atteintes d'anorexie grave chronique montre une augmentation légère, mais significative, de l'indice de masse corporelle (IMC) comparativement au placeboReference 319.
4.5 Sclérose en plaques, sclérose latérale amyotrophique, traumatisme médullaire et les maladies de la moelle épinière
- Les données provenant d'études précliniques suggèrent que le THC, le CBD et le nabiximols soulagent les symptômes de tremblements, d'hypertonie spastique et d'inflammation associés à la sclérose en plaques (SP).
- Les données disponibles d'essais cliniques suggèrent que le cannabis (données limitées) et certains cannabinoïdes (dronabinol, nabiximols, THC/CBD) sont associés à une certaine amélioration des symptômes de la SP et du traumatisme médullaire (TM), y compris la spasticité, les spasmes, la douleur, le sommeil et les symptômes associés au dysfonctionnement de la vessie.
- Des données très limitées provenant d'études précliniques suggèrent que certains cannabinoïdes délaient de manière modeste la progression de la maladie et prolongent la survie dans des modèles animaux de sclérose latérale amyotrophique (SLA), alors que les résultats d'un nombre très limité d'études cliniques sont mixtes.
La SP est une maladie à médiation (auto)immunitaire, démyélinisante et neurodégénérative chronique du SNC qui touche deux à trois millions de personnes dans le monde et qui se caractérise par des périodes de poussées neurologiques cycliques et par une perte des capacités s'échelonnant sur plusieurs annéesReference 662Reference 663. La démyélinisation et la perte axonale et neuronale dans différentes voies neuronales du SNC entraînent divers problèmes cognitifs, sensoriels et de motricité (p. ex. douleur et spasticité) qui s'accumulent à mesure que la maladie évolueReference 662. La SLA est une maladie neurodégénérative progressive causée par des atteintes sélectives des motoneurones dans la moelle épinière, le tronc cérébral et le cortex moteurReference 664. Bien que la majorité des cas soient sporadiques, des cas familiaux peuvent survenir dans un mode de transmission génétique récessif autosomique, dominant ou dominant lié par le chromosome XReference 665. La pathogenèse de la SLA comprend les lésions excitotoxiques, l'inflammation chronique, le stress oxydatif et l'agrégation de protéinesReference 664.
Un examen systématique de l'efficacité et de l'innocuité des cannabinoïdes pour le traitement de troubles neurologiques sélectionnés comprenant des symptômes comme l'hypertonie spastique, la douleur centralisée, des spasmes musculaires douloureux, des troubles urinaires et des tremblements associés à la SP, par exemple, a suggéré que, selon les données disponibles d'essais cliniques, les cannabinoïdes étaient vraisemblablement efficaces pour le soulagement de l'hypertonie spastique signalée par le patient et mesurée objectivement, efficaces ou vraisemblablement efficaces pour le soulagement de la douleur centrale ou des spasmes musculaires douloureux, vraisemblablement efficaces pour la réduction du nombre de mictions par jour, mais n'étaient probablement pas efficaces pour le soulagement de plaintes de la vessie et ne sont probablement ou possiblement pas efficaces pour la réduction des tremblementsReference 666.
En revanche aux observations de l'examen systématique ci-dessus, une méta-analyse et une analyse systématique plus récentes de 28 essais cliniques à répartition aléatoire (N = 2 454 participants) portant sur les cannabinoïdes (c.-à-d. cannabis fumé, nabiximols, nabilone, dronabinol, CBD, THC, levonontradol, acide ajulémique) effectués à l'aide de l'approche GRADE révèlent que les cannabinoïdes sont associés à une amélioration de la spasticité, mais qu'elle ne parvient pas à atteindre une importance statistiqueReference 174. Les cannabinoïdes (nabiximols, dronabinol et THC/CBD) ont été associés à une amélioration moyenne plus importante de la spasticité sur l'échelle d'Ashworth comparativement au placebo, bien qu'elle n'ait pas atteint une importance statistique. Les cannabinoïdes (nabilone et nabiximols) ont également été associés à une amélioration moyenne plus importante de la spasticité évaluée à l'aide d'échelles numériques. Aussi, le nombre moyen de patients ayant signalé une amélioration d'un score d'impression globale de changement a été plus élevé avec le nabiximols qu'avec le placebo.
Les différences entre les observations de ces deux examens systémiques des cannabinoïdes pour des troubles neurologiques sélectionnés comprennent des différences de méthodologie, d'approche et de critères d'inclusion et d'exclusion. Néanmoins, les deux examens systématiques suggèrent que le cannabis ou les cannabinoïdes étaient associés à un certain niveau de soulagement de l'hypertonie spastique, de spasmes musculaires et de la douleur pour certains des troubles neurologiques sélectionnés (p. ex., la SP, le TM et les maladies de la moelle épinière).
Vous retrouverez ci-dessous un résumé des données examinées par les pairs sur l'utilisation du cannabis et des cannabinoïdes dans le traitement de la SP, la SLA, le TM et les maladies de la moelle épinière.
4.5.1 Sclérose en plaques
De nombreuses études aussi bien chez les patients souffrant de SP que sur les modèles animaux de la maladie suggèrent que le trouble est associé aux changements des niveaux d'endocannabinoïdes, bien que les conclusions restent contradictoiresReference 662Reference 663Reference 667-Reference 670.
Études précliniques
Des études précliniques chez différentes espèces d'animal suggèrent que les cannabinoïdes améliorent les signes du dysfonctionnement moteur dans des modèles expérimentaux de la SP (articles de revueReference 662Reference 663Reference 671). Lyman a été l'une des premières personnes à faire état des effets du Δ9-THC dans l'un de ces modèlesReference 672. Dans son étude, des animaux atteints traités au Δ9-THC ne présentaient aucun signe clinique de la maladie ou des signes cliniques légers à apparition retardée. Les animaux traités ont typiquement connu une réduction nette de l'inflammation des tissus du SNC par rapport aux animaux non traités. Des études ultérieures sur des modèles murins de la SP ont corroboré et élargi ces conclusions, démontrant que le Δ9-THC, mais pas le CBD, a amélioré non seulement les tremblements, mais aussi la spasticité, tout en diminuant la gravité clinique de la maladie en généralReference 667Reference 673. Des travaux supplémentaires soulignent l'importance des récepteurs CB1 dans le contrôle des tremblements, de la spasticité et de la réponse neuroinflammatoire. Par contre, le rôle exact du récepteur CB2 dans la SP reste quelque peu imprécis, quoique l'on croie qu'il joue un rôle dans la régulation de la réponse neuroinflammatoireReference 673-Reference 675.
Deux études ont examiné les effets thérapeutiques potentiels de trois types d'extraits de cannabis d'origine végétale sur différents modèles de souris atteintes de SP (c.-à-d. la maladie démyélinisante induite par le virus de l'encéphalomyélite murine de Theiler et l'encéphalite auto-immune expérimentale)Reference 676Reference 677. Les extraits utilisés étaient un extrait semblable au nabiximols contenant un ratio du THC et de CBD de 1 : 1 à 10 mg/kg pour chaque phytocannabinoïde, un extrait riche en THC (5 mg/kg ou 20 mg/kg) contenant 67,1 % de THC, 0,3 % de CBD, 0,9 % de CBG, 0,9 % de CBC et 1,9 % d'autres phytocannabinoïdes ou un extrait riche en CBD (5 mg/kg ou 20 mg/kg) contenant 64,8 % de CBD, 2,3 % de THC, 1,1 % de CBG, 3 % de CBC et 1,5 % d'autres phytocannabinoïdes. L'une des études signale qu'un schéma thérapeutique de 10 jours avec l'extrait semblable au nabiximols a amélioré l'activité motrice et réduit les infiltrats du SNC, l'activité microgliale et les dommages axonaux et rétabli la morphologie de la myéline; l'extrait riche en CBD (5 mg/kg) seul a semblé atténuer la dégénérescence motrice d'une manière similaire à l'extrait semblable au nabiximols, tandis que l'extrait riche en THC (5 mg/kg) a semblé produire des effets plus faiblesReference 676. L'autre étude indique que le traitement avec l'extrait semblable au nabiximols (10 mg/kg) ainsi que l'extrait riche en THC (20 mg/kg), mais non l'extrait riche en CBD (20 mg/kg), a amélioré les déficits neurologiques habituellement observés chez les souris atteintes d'encéphalite auto-immune expérimentale et réduit également le nombre et l'étendue des agrégats cellulaires présents dans la moelle épinière. En revanche, l'extrait riche en CBD a semblé retarder l'apparition de la maladie seulement, sans toutefois retarder sa progression, et a réduit les infiltrats cellulaires dans la moelle épinièreReference 677. Dans l'ensemble, ces études indiquent que les effets thérapeutiques optimaux dans ces modèles animaux atteints de SP dépendent d'une combinaison de THC, CBD et, potentiellement, d'autres phytocannabinoïdes. Une autre étude a signalé que des traitements quotidiens topiques à l'aide d'une lotion contenant 1 % de CBD produisaient des effets neuroprotecteurs contre le modèle expérimental de l'encéphalomyélite auto-immune de la SPReference 441. Le traitement a été associé à une réduction du score d'activité clinique de la maladie, l'atténuation de la paralysie des membres inférieurs et l'amélioration des cotes histologiques (c.-à-d. la réduction de la démyélinisation, des pertes axonales et des infiltrations de cellules inflammatoires) et de l'expression de cytokines pro-inflammatoires.
Données historiques et d'enquêtes
Chez l'humain, des rapports publiés s'étendant sur une centaine d'années indiquent que les personnes souffrantes d'hypertonie spastique (l'un des symptômes associés à la SP) pourraient éprouver un soulagement avec le cannabisReference 678. En GB, 43 % des patients souffrant de la SP ont déclaré avoir fait l'expérience du cannabis à un moment donné et 68 % de cette population l'avait utilisé pour soulager les symptômes de la SPReference 679. Au Canada, l'on a rapporté en l'an 2000 que la prévalence de l'usage du cannabis à des fins médicales chez des patients à la recherche d'un traitement contre la SP se situait à 16 % en Alberta, 43 % des répondants signalant avoir eu recours au cannabis à un moment donné dans leurs viesReference 221. Quatorze pour cent des personnes souffrant de la SP interrogées en 2002 en Nouvelle-Écosse ont déclaré avoir utilisé le cannabis à des fins médicales, et 36 % déclarant avoir consommé le cannabis pour toute raisonReference 220. Les patients atteints de la SP ont indiqué avoir consommé du cannabis afin de gérer leurs symptômes tels que la spasticité et la douleur chronique, ainsi que l'anxiété ou la dépression, ou les deuxReference 220Reference 221. Les patients atteints de la SP ont aussi déclaré une amélioration de leur sommeil. Les dosages du cannabis fumé rapportés par ces patients varient de quelques bouffées à 1 g ou plus à la foisReference 220.
Études cliniques sur les cannabinoïdes administrés par voie orale (extrait de cannabis, THC par voie orale, le nabiximols)
Les conclusions d'essais randomisés contrôlés avec placebo des cannabinoïdes administrés par voie orale pour le traitement de la spasticité musculaire chez des patients souffrant de la SP sont encourageantes, mais elles restent modestes.
La vaste étude randomisée multicentrique contrôlée avec placebo du cannabis sur la SP (CAMS, CAnnabis in Multiple Sclerosis), qui a évalué les effets des cannabinoïdes dans le traitement de la spasticité et d'autres symptômes relatifs à la SP a fait participer plus de 600 patientsReference 384. Le résultat principal était la modification des mesures globales de spasticité selon l'échelle d'Ashworth. L'étude n'a pas démontré d'amélioration statistiquement significative dans l'échelle (objective) d'Ashworth chez les patients consommant un extrait de cannabis par voie orale ((CannadorMD) contenant 2,5 mg de Δ9-THC et 1,25 mg de CBD (et < 5 % d'autres cannabinoïdes)) ou de Δ9-THC pendant 15 semaines. Toutefois, il y a eu des données subjectives, signalées par les patients quant à l'effet du traitement significatif sur la spasticité et la douleur, avec des améliorations de la spasticité suite à l'administration de l'extrait de cannabis par voie orale (61 %) (doses de 5 à 25 mg de Δ9-THC, de 5 à 15 mg de CBD par jour et < 5 % d'autres cannabinoïdes, ajustés en fonction du poids corporel et dosés en tenant compte des effets secondaires) ou du Δ9-THC par voie orale (60 %) (doses de 10 à 25 mg de Δ9-THC par jour, ajusté en fonction du poids corporel et dosé en tenant compte des effets secondaires) par rapport au placebo (46 %). Les patients prenaient d'autres médicaments en même temps pour gérer les symptômes liés à la SP. En revanche, un suivi à long terme (12 mois) à double insu de l'étude du cannabis sur la SP (CAMS) a montré un léger effet du traitement au Δ9-THC par voie orale (doses de 5 à 25 mg de Δ9-THC par jour, ajusté au poids corporel et dosé selon les effets secondaires) sur la spasticité musculaire, évaluée par des méthodes objectives, tandis qu'un effet du traitement subjectif sur la spasticité musculaire a été constaté aussi bien en ce qui concerne le Δ9-THC par voie orale que l'extrait de cannabis par voie orale (CannadorMD)Reference 680. CannadorMD n'est pas présentement disponible au Canada.
D'autres essais cliniques randomisés sur les capsules d'extrait de cannabis standardisé (contenant 2,5 mg de Δ9-THC et 0,9 mg de CBD par capsule)Reference 681 ou le nabiximols (SativexMD)Reference 428Reference 682Reference 683 ont démontré des résultats semblables, soit des améliorations n'ont été constatées que pour les effetsrapportés par les patients, mais non pas avec les mesures objectives (p.ex. l'Échelle d'Ashworth). Les raisons expliquant ces divergences apparentes entre les mesures subjectives et objectives demeurent incertaines; toutefois, un certain nombre d'explications éventuelles pourraient justifier ces différences. Par exemple, l'on sait que la spasticité est un phénomène complexeReference 684 qui est influencé par les symptômes des patients, le fonctionnement physique et la disposition psychologiqueReference 680. La spasticité est intrinsèquement difficile à mesurer et elle ne possède pas un seul élément qui la définisseReference 683. De plus, la fiabilité et la sensibilité de l'échelle d'Ashworth (dans la mesure objective de la spasticité) ont été remises en questionReference 384Reference 683.
L'efficacité, l'innocuité et la tolérabilité de l'extrait de la plante entière du cannabis administré en capsules (2,5 mg de THC et 0,9 mg de CBD par capsule) ont fait l'objet d'une étude dans un essai clinique prospectif randomisé et croisé mené au cours de 14 jours à double insu et contrôlée avec placebo auprès des patients cliniquement stables souffrant de spasticité associée à la SP et ayant obtenu un score supérieur à 2 sur l'échelle d'AshworthReference 681. Un peu plus de la moitié des sujets de l'étude ont reçu une dose d'entretien de 20 mg ou plus de THC par jour (30 mg de THC par jour au maximum). Les patients prenaient en même temps des médicaments contre la spasticité. Bon nombre des sujets de l'étude avaient déjà expérimenté avec le cannabis; un nombre considérable de ceux qui s'étaient retirés de l'étude aussitôt qu'ils avaient débuté le traitement avec l'extrait du cannabis n'avaient pas d'expérience précédente avec le cannabis. Bien qu'il n'y ait pas eu de différences statistiquement significatives entre le traitement actif à l'extrait du cannabis et le placebo, les tendances en faveur du traitement actif pour la mobilité, la fréquence de spasme autodéclarée par les patients, ainsi que pour l'amélioration de la capacité à s'endormir ont été constatés. L'extrait du cannabis a été généralement bien toléré sans événements indésirables graves pendant la période de l'étude. Toutefois, des événements indésirables ont été légèrement plus fréquents et sévères pendant la période de traitement actif.
Nabiximols
Une étude clinique multicentrique randomisée menée sur six semaines, à double insu, à groupes parallèles et contrôlée avec placebo du nabiximols (SativexMD) pour le traitement de cinq principaux symptômes associés à la SP (spasticité, fréquence de spasme, problème de vessie, tremblements et douleur) a rapporté des résultats mitigésReference 428. Les patients souffraient de SP stable, tous types confondus, cliniquement confirmée, et étaient sous un régime posologique stable. La moitié environ des sujets de l'étude tant du groupe actif que du groupe placebo avait de l'expérience précédente avec du cannabis, que ce soit à des fins non médicales ou médicales. Bien qu'en se fondant sur le score global du symptôme principal [global primary symptom score], qui est une combinaison des scores de tous les cinq symptômes, il ne se soit dégagé de différence significative entre le groupe de traitement actif et le groupe placebo, les patients prenant l'extrait de cannabis ont démontré des différences statistiquement importantes par rapport au placebo en terme des mesures subjectives mais pas en terme de mesures objectives de la spasticité (c.-à-d. l'échelle d'Ashworth). Des différences statistiquement importantes ont aussi été décelées selon l'échelle d'évaluation de l'incapacité neurologique de Guy (Guy's Neurological Disability Score), et dans la qualité du sommeil mais pas en ce qui concerne la fréquence de spasme, la douleur, les tremblements ou les problèmes de vessie, entre autres mesures de résultats. Les patients ont effectué leurs propres titrages à une dose moyenne d'entretien du nabiximols de 40,5 mg de THC et 37,5 mg de CBD (c.-à-d. ~15 vaporisations par jour). Les effets indésirables associés au traitement actif ont été les étourdissements, la perturbation de la faculté d'attention, la fatigue, la désorientation, une sensation d'ivresse et le vertige.
Une étude clinique de suivi ouverte menée à long terme du nabiximols (SativexMD) a conclu que l'effet bénéfique observé dans l'étude par Wade et coll. 2004Reference 428 s'est poursuivi chez des patients qui avaient initialement bénéficié du médicament. La durée moyenne de participation des sujets s'étant inscrits dans l'étude de suivi était de 434 jours (marge de 21 à 814 jours)Reference 682. La quantité moyenne de doses quotidiennes prises par les sujets est demeurée constante ou légèrement réduite au fil du temps. La quantité moyenne de doses quotidiennes du nabiximols était de 11, soit l'équivalent d'une dose de 30 mg de THC et de 28 mg de CBD par jourReference 682. L'usage à long terme du nabiximols chez cette population de patients a été associé à des baisses quant aux mesures subjectives de la spasticité, de la fréquence de spasme, de la douleur et des problèmes de vessie. Les étourdissements, la diarrhée, les nausées, les céphalées et la somnolence étaient parmi les effets indésirables les plus fréquemment signalés, associés à l'usage chronique du nabiximols dans cette étude. Une étude de retrait de deux semaines intégrée à l'étude de suivi à long terme a suggéré que l'interruption de l'usage du nabiximols n'était pas associée à un syndrome de sevrage conséquent, mais que celle-ci était associée aux symptômes assimilés au sevrage (p.ex. perturbation de sommeil, bouffées de chaleur ou sensation de froid, fatigue, humeur dépressive, diminution de l'appétit, labilité émotionnelle, rêves d'apparence réelle, intoxication) de même que la réapparition ou l'aggravation de certains symptômes de la SP.
L'efficacité, l'innocuité et la tolérabilité du nabiximols dans le traitement de la SP ont fait l'objet d'enquête au cours d'une étude clinique randomisée de phase III multicentrique, menée sur six semaines, à double insu avec groupes parallèles et contrôlée avec placebo auprès des patients souffrant de SP stable qui n'avaient pas connu suffisamment de soulagement avec des approches thérapeutiques standardReference 683. Les patients devaient avoir une spasticité importante dans deux groupes musculaires au moins et un score de 2 ou plus sur l'échelle d'Ashworth pour pouvoir participer à l'étude. Un nombre important de patients avait de l'expérience précédente avec du cannabis. Quarante pour cent des sujets ayant été traités au nabiximols ont démontré une baisse auto déclarée de ≥ 30 % de spasticité sur une échelle d'évaluation numérique (EEN) subjective de 11 points par rapport aux sujets recevant le placebo (21,9 %) (différence en faveur du nabiximols = 18 %; IC à 95 % = 4,73, 31,52; p = 0,014). Le nombre moyen de vaporisations par jour était de 9,4 (~25 mg de THC et ~24 mg de CBD). Les sujets tant sous placebo que sous nabiximols ont présenté des incidences d'effets indésirables semblables, mais les effets sur le SNC s'en trouvaient plus courants au sein du groupe du nabiximols. La majorité d'événements indésirables ont été de sévérité légère ou modérée (p.ex. étourdissements, fatigue, humeur dépressive, désorientation, dysgeusie, perturbation de la faculté d'attention, vision floue).
Une étude d'observation, prospective, multicentrique et non interventionnelle sur la pratique clinique (c.-à-d. the MObility improVEment in MS-induced spasticity study, étude MOVE 2) a examiné l'innocuité et l'efficacité du nabiximols dans le traitement des symptômes associés à la SPReference 685. Des patients atteints de SP ont été suivis pendant trois à quatre mois afin de mesurer les résultats, la tolérabilité, la QV et la satisfaction par rapport au traitement. Avant de commencer l'administration du nabiximols, d'autres médicaments antispastiques ont été mis à l'essai chez 90 % des patients de l'étude et la plupart d'entre eux (73 %) se sont vus prescrire du nabiximols. Le nombre moyen de vaporisations par jour du nabiximols était de 6,9 (marge de 1 à 12) déclaré à la période de suivi 1 et de 6,7 (marge de 1 à 16) déclaré à la période de suivi 2. L'évaluation des patients selon les médecins laisse supposer qu'une série de traitements au nabiximols pendant un mois procure un soulagement de la spasticité liée à la SP résistante chez la plupart des patients auxquels le médicament a été administré. Après une période d'un mois, une première réponse à la spasticité a été décelée chez 42 % des patients et une réponse pertinente sur le plan clinique à la spasticité a été détectée chez 25 % de ces patients. Au troisième mois, une première réponse à la spasticité a été décelée chez 59 % des patients et une réponse pertinente sur le plan clinique à la spasticité a été détectée chez 40 % de ces patients. Les scores relatifs aux troubles moyens du sommeil ont diminué de 33 % au cours d'une période de traitement d'un mois chez les patients ayant présenté une première réponse et de 40 % chez les patients ayant manifesté une réponse pertinente sur le plan clinique. Les scores sur l'échelle d'Ashworth modifiée ont diminué de 12 % après un traitement d'un mois chez les patients ayant présenté une première réponse et de 15 % chez les patients ayant manifesté une réponse pertinente sur le plan clinique. Les scores sur l'échelle composite de santé physique de mesure de la QV dans la SP comportant 54 énoncés (MSQoL-54) et le score composite de santé mentale ont révélé une amélioration statistiquement significative au cours de la période de trois mois chez les patients présentant une première réponse et une réponse pertinente sur le plan clinique. Après un traitement au nabiximols de trois mois, la valeur moyenne de l'indice EQ-5D-3L est demeurée stable et une diminution statistiquement significative du pourcentage de patients considérant la raideur musculaire, la limitation de la mobilité, la douleur et les troubles de la vessie comme les symptômes les plus dérangeants a été observée. Dans l'ensemble, après la période de traitement de trois mois, près de 80 % de la population de patients à l'étude recevant du nabiximols étaient « totalement satisfaits » ou « satisfaits » de l'efficacité du nabiximols. Les événements indésirables les plus souvent observés avec le nabiximols ont été les étourdissements (4 %), la fatigue (2,5 %), la somnolence (1,9 %), les nausées (1,9 %) et l'assèchement de la bouche (1,2 %).
Une étude de prolongation de 12 mois sur l'essai clinique MOVE 2 visant à déterminer l'efficacité et l'innocuité à long terme du nabiximols dans la pratique clinique signale que parmi les 52 patients participant à l'étude qui étaient inclus dans l'analyse de l'efficacité, le score moyen de la spasticité sur une échelle numérique a diminué considérablement, passant de 6,0 points au début de l'étude à 4,8 points après un mois et est demeuré à ce niveau après la période de 12 mois, y compris chez les patients qui avaient présenté « une première réponse au traitement »Reference 686. Au début de l'étude, le score relatif aux troubles moyens du sommeil sur l'EEN était de 5,1 points dans le sous-échantillon de participants et, après 12 mois, il a diminué pour passer à 3,2 points. Chez les patients présentant une première réponse, les scores ont diminué, passant de 5,4 à 2,4 et chez les patients présentant une réponse pertinente sur le plan clinique les scores relatifs aux troubles moyens du sommeil sur l'EEN ont diminué, passant de 5,3 points à 1,9 point. En outre, les valeurs moyennes du score composite de santé physique du MSQoL-54 et le score moyen de santé mentale ont tous deux affiché des améliorations, sans être toutefois statistiquement significatifs. La valeur de l'indice EQ-5D-3L a affiché une amélioration au cours de la période de 12 mois chez les patients qui ont présenté une première réponse et une résponse pertinente sur le plan clinique. En outre, à la fin de l'étude, un nombre moins important de patients ayant présenté une première réponse et une réponse pertinente sur le plan clinique ont jugé que les symptômes relatifs à la spasticité liée à la SP, à savoir la raideur musculaire, la douleur, la limitation de la mobilité, la fatigue et les troubles de la vessie, ont été les plus dérangeants par rapport au début de l'étude. Du point de vue des patients, la capacité d'effectuer les activités quotidiennes s'est considérablement améliorée après un traitement de 12 mois au nabiximols, comparativement au début de l'étude, et moins de patients se sont plaints d'une déficience quotidienne dans les activités. L'amélioration était notamment plus prédominante chez les répondants que dans le groupe de l'étude considéré dans son ensemble. La plupart des patients n'ont pas signalé d'événements indésirables. Ceux qui ont été les plus souvent signalés sont notamment les troubles GI, les troubles psychiatriques et les troubles du système nerveux. Le nombre moyen de vaporisations quotidiennes du nabiximols était de 6,2 (marge de 2 à 12) et au moins un autre médicament antispastique a continué à être prescrit chez 28 patients (p. ex. baclofène, tizanidine, tolpérisone ou gabapentine).
Une étude pilote prospective de surveillance post-commercialisation, multicentrique et non interventionnelle menée pour recueillir des données sur la capacité de conduire un véhicule, la tolérabilité et l'innocuité auprès de 33 patients atteints de SP et commençant le traitement au nabiximols signale qu'une période de traitement de quatre à six semaines avec du nabiximols (moyenne de 5,1 vaporisations par jour ou 13,7 mg de THC et 12,8 mg de CBD par jour) a été associée à une amélioration statistiquement significative de la spasticité auto-évaluée, mais qu'elle n'était pas associée à une détérioration statistiquement significative de la capacité de conduire des patients mesurée en laboratoire à l'aide d'une série d'essais cognitifs et psychomoteursReference 687. Cependant, moins de la moitié des patients répondaient aux critères « apte à la conduite ». En outre, 4 patients sur 33 ont éprouvé un événement indésirable non grave, léger ou modéré associé au traitement au nabiximols (p. ex. étourdissements et vertiges).
Une étude non-contrôlée par placebo, sans répartition aléatoire, a évalué de manière quantitative les effets fonctionnels du traitement au nabiximols sur les schémas de marche de 20 patients atteints de SPReference 688. Les patients atteints de SP inscrits avaient un score selon l'échelle étendue d'incapacité de Kurtzke de 5,3 au début de l'étude, ne répondaient pas aux traitements de la spasticité et étaient capables de marcher sans aide pendant six minutes. Les patients étaient traités par nabiximols pendant un mois (nombre moyen de vaporisations par jour = 5,6 ou dose quotidienne de 15 mg de THC et de 14 mg de CBD) et l'étude a indiqué que le traitement au nabiximols était associé à une amélioration statistiquement significative du score du profil de marche, de la vitesse, de la cadence et de la longueur de foulée.
Une étude clinique prospective croisée de quatre semaines à répartition aléatoire et à double insu, contrôlée par placebo et portant sur 44 patients atteints de SP progressive primaire ou secondaire dont la spasticité est modérée à sévère et qui présentent une réaction inadéquate aux agents antispastiques, a examiné les modifications induites par le nabiximols des mesures neurophysiologiques de spasticité chez les patients ayant une spasticité associée à la SP aux membres inférieurs, ainsi que les modifications de la spasticité et des paramètres fonctionnels connexesReference 689. Au début de l'étude, les patients prenaient de façon concomitante de l'acétate de glatiramère, du cyclophosphamide, de l'azathioprine, du fingolimod, du natalizumab, de l'interféron bêta-1b, de l'interféron bêta-1a et du méthotrexate. Les autres médicaments étaient notamment le baclofène, l'épérisone, la tizanidine et des benzodiazépines. La dose quotidienne moyenne de nabiximols consistait en sept vaporisations par jour ou 18,9 mg de THC et 17,5 mg de CBD. L'étude n'a indiqué aucune différence significative de la modification, du début de l'étude à la semaine 4, de la mesure neurophysiologique de spasticité (ratio H/M). De plus, aucun effet significatif n'a été constaté pour toutes les mesures neurophysiologiques secondaires. Cependant, il s'est produit une amélioration statistiquement significative du score moyen des membres inférieurs selon l'échelle modifiée d'Ashworth avec le nabiximols comparativement au placebo. Il n'y a pas eu de différence statistiquement significative des résultats fonctionnels (marche chronométrée sur dix mètres, test 9-Hole Peg, scores relatifs à la douleur sur l'EEN, scores relatifs au sommeil sur l'EEN et scores sur l'échelle d'évaluation de l'intensité de la fatigue) entre le nabiximols et le placebo. La plupart des patients ont éprouvé un événement indésirable : celui le plus souvent signalé se rapportait à des étourdissements légers à modérés (21 %), suivi d'une faiblesse des membres inférieurs, de vertiges, d'hypotension, d'hypertension, de somnolence et d'une pharyngodynie. La plupart des effets secondaires étaient transitoires et sont apparus surtout pendant la phase d'ajustement ou pendant l'augmentation du nombre de vaporisations; ils se sont résorbés après une diminution du nombre de vaporisations. Les limites de l'étude comprennent notamment la taille réduite de l'échantillon, la courte période de traitement et un nombre relativement important d'abandons (14 %) qui ont limité sa robustesse sur le plan statistique.
Une étude de cohorte prospective échelonnée sur un an portant sur 144 patients atteints d'une spasticité modérée ou sévère occasionnée par la SP et présentant des signes d'une réaction inadéquate aux médicaments antispastiques a examiné l'efficacité, l'innocuité et la tolérabilité du nabiximols aux semaines 4, 14 et 48 et a également évalué si les caractéristiques démographiques et cliniques de référence pouvaient prédire la réponse au traitementReference 690. Les patients ont participé au départ à une « phase d'ajustement » de quatre semaines afin de déterminer les sujets répondant au traitement qui présentaient une réduction d'au moins 20 % de la spasticité selon une EEN par rapport aux valeurs initiales. Les répondants ont par la suite participé à l'étude. Le score de spasticité mesurée à l'aide d'une EEN a considérablement baissé chez les répondants en passant de 7,6 (valeur initiale) à 5,2 à la semaine 4, le nombre moyen de vaporisations quotidiennes étant de 6,5 chez les répondants par rapport à 7,7 chez ceux n'ayant pas répondu au traitement. Le score de la spasticité selon l'EEN a continué de progresser dans le groupe de répondants pour atteindre un score de 5 (ou une réduction cliniquement significative de 30 % du score EEN de la spasticité) entre le traitement de la semaine 4 et celui de la semaine 14. Le score sur l'échelle d'Ashworth modifiée était de 4 au début de l'étude chez les personnes ayant répondu au traitement et il s'est considérablement amélioré à la 4e semaine pour décliner constamment jusqu'à la 14e semaine par rapport au début de l'étude. Le traitement au nabiximols a aussi été associé à une amélioration significative du test de la marche de dix minutes, après le traitement de quatre semaines et cette amélioration s'est maintenue à la 14e semaine par rapport au début de l'étude. L'indice de marche a également affiché une progression significative chez les sujets ayant répondu au traitement à la 4e semaine et s'est maintenu à la 14e semaine, malgré un score sur l'échelle étendue d'incapacité de Kurtzke qui est demeuré stable tout au long de la période de l'étude. Le score de la douleur sur une EEN chez les répondants a affiché une diminution statistiquement significative en passant de 4,2 au début de l'étude à 3,3 après le traitement de quatre semaines et sa baisse s'est poursuivie pour atteindre 2,9 à la 14e semaine. Chez les répondants qui ont continué à participer à l'étude, lors du suivi à la 48e semaine, l'efficacité du nabiximols s'est maintenue avec un score de spasticité qui est demeuré considérablement plus faible sur les plans clinique et statistique par rapport au début de l'étude (c.-à-d. réduction de 33 %) et le nombre moyen de vaporisations prises quotidiennement était de 6,2. L'amélioration du score médian sur l'échelle d'Ashworth modifiée est demeurée visible, avec un score de 3 à la 48e semaine par rapport à 4 au début de l'étude. Le score sur l'échelle numérique d'évaluation de la douleur était constamment plus faible à la 48e semaine comparativement au début de l'étude. Aucune autre amélioration n'a été constatée en ce qui concerne le test de la marche de 10 minutes ou l'indice de marche. Quatre-vingts pour cent des patients de l'étude ont signalé des effets secondaires qui sont apparus à une dose quotidienne moyenne de 7,2 vaporisations (19,44 mg de THC et 18 mg de CBD). Les effets secondaires les plus souvent déclarés sont la confusion et le ralentissement idéomoteur (35 %), les étourdissements (24 %), et la fatigue (20 %). L'intensité de la plupart des effets secondaires signalés qui se sont développés pendant la phase d'ajustement était légère et a diminué à mesure que la posologie a été ajustée. Neuf pour cent de tous les patients ayant participé à l'étude (répondants et non-répondants) ont arrêté le traitement dans les quatre semaines suivant le début de l'administration du nabiximols en raison d'effets secondaires, tandis que 9 % des répondants ont cessé le traitement pour la même raison dans les 14 semaines suivant le début du traitement. Un sujet a signalé une dépersonnalisation deux mois après avoir commencé le traitement au nabiximols, tandis qu'un autre a souffert d'une dépression. Enfin, l'analyse démographique suggère que les patients plus jeunes et dont la durée de la maladie était plus courte ont eu tendance à réagir de manière plus favorable au nabiximols (c.-à-d. les « répondants »). Les limites de l'étude comprennent notamment la conception d'observation, la taille limitée de l'échantillon et l'absence d'évaluation de la QV et de l'invalidité dans la vie quotidienne.
Études cliniques CUPID et MUSEC
L'étude CUPID (Cannabinoid Use in Progressive Inflammatory Brain Disease) était une enquête randomisée, à double insu visant à mesurer si le Δ9-THC, administré par voie orale, était en mesure de retarder la progression de la SP. Cet essai de trois ans, financé par les fonds publics s'est effectué au Peninsula Medical School en GB à la suite de la précédente étude CAMS d'un an. Un total de 493 sujets atteints de SP progressive primaire ou secondaire, mais non cyclique, avaient été recrutés partout en GB en 2006. L'essai CUPID n'a trouvé aucune preuve permettant d'étayer l'effet de Δ9-THC sur la progression de la SP, mesuré à l'aide de l'échelle étendue d'incapacité de Kurtzke ou de l'échelle MSIS-29 (Multiple Sclerosis Impact Scale 29 [échelle d'impact de la SP]). Toutefois, les auteurs ont conclu qu'il y avait quelques données qui laissent croire qu'il y aurait des effets bénéfiques chez des participants qui étaient au bas de l'échelle d'incapacité lors du recrutement des patients. Puisque les bienfaits observés l'ont été seulement chez un petit groupe de patients, il serait nécessaire d'effectuer des études supplémentaires en vue d'examiner de plus près les raisons de ces effets sélectifsReference 691.
Une étude clinique randomisée de phase III, menée à double insu, et contrôlée avec placebo (le MUltiple Sclerosis and Extract of Cannabis trial ou MUSEC), publiée par le même groupe de chercheurs que ceux ayant effectué l'essai CUPID, a rapporté qu'un traitement pendant 12 semaines à l'extrait de cannabis par voie orale (CannadorMD) (2,5 mg de Δ9-THC et 0,9 mg de CBD par capsule) a été associé à un soulagement statistiquement significatif déclarée par les patients de la raideur musculaire, des spasmes musculaires et les douleurs corporelles de même qu'une amélioration statistiquement significative du sommeil, comparativement au placebo, chez des patients souffrant de SP stableReference 692. Il n'y a eu aucune différence statiquement significative entre l'extrait de cannabis et le placebo quant aux mesures fonctionnelles telles que celles qui évaluent les effets de la spasticité sur les activités de la vie quotidienne, l'habileté motrice comme la marche ou les effets sur le fonctionnement social. La majorité des patients ayant recours à l'extrait de cannabis utilisaient des doses quotidiennes de 10, 15 ou 25 mg de Δ9-THC avec des doses correspondantes de 3,6, 5,4 et 9 mg de CBD. La majorité des patients de l'étude étaient en même temps sous des analgésiques et des médicaments contre la spasticité, mais ils étaient exclus s'ils prenaient des médicaments immunomodulateurs (p.ex. les interférons). Le traitement actif à l'extrait a été associé à une hausse du nombre d'événements indésirables, mais la majorité de ceux-ci étaient jugés comme étant légers ou modérés et n'avaient pas duré au-delà de la période de l'étude. Le plus grand nombre d'événements indésirables a été observé pendant la période initiale de deux semaines de titrage et ces derniers semblaient baisser progressivement au fil des séances de traitement restantes. Les événements indésirables les plus souvent observés étaient ceux associés aux perturbations du fonctionnement du SNC (p.ex. étourdissements, perturbations de la faculté d'attention, trouble de l'équilibre, somnolence, sentiment anormal, désorientation, confusion et chutes). Les perturbations de la fonction GI étaient le deuxième événement indésirable le plus important couramment signalé (p. ex. les nausées, l'assèchement de la bouche).
Études cliniques avec le cannabis fumé
Seule une étude clinique jusqu'à présent s'est penchée sur l'usage du cannabis fumé pour des symptômes liés à la SPReference 274. L'étude clinique qui était un essai croisé à double insu et contrôlé avec placebo a rapporté une réduction statiquement significative des scores des patients sur l'échelle d'Ashworth modifiée pour l'évaluation de la spasticité après que les patients aient fumé du cannabis une fois par jour pendant trois jours (chaque cigarette contenait 800 mg de 4 % de Δ9-THC; dose totale de Δ9-THC disponible de 32 mg par cigarette). La fumée du cannabis a été associée à une réduction statistiquement significative des scores des patients sur l'EVA pour la douleur, quoique censément au départ, les niveaux de douleurs des patients s'en trouvaient faibles. Aucune différence n'a été observée entre le placebo et le cannabis dans la tâche de marche chronométrée (timed-walk task), une évaluation de la performance physique. La fonction cognitive telle qu'évaluée à l'aide du test PASAT (Paced Auditory Serial Addition Test [test d'addition en séries visant à mesurer la vitesse de traitement des informations auditives]) semblait diminuer de façon significative immédiatement après l'administration du cannabis; toutefois, l'importance clinique à long terme de cette découverte n'a pas fait l'objet d'examen dans cette étude. La majorité des patients (70 %) étaient sous thérapie modificatrice de la maladie (p.ex. l'interféron β-1a, l'interféron β-1b ou le glatiramer) et 60 % étaient sous agents antispastiques (p.ex. le baclofène ou la tizanidine). Le traitement au cannabis a été associé à un certain nombre d'effets indésirables différents mais couramment observés dont les étourdissements, la céphalée, la fatigue, les nausées, irritation de la gorge et sensation d'être trop « high ». Parmi les limitations de l'étude se trouvait le fait que la majorité des patients aient déjà eu de l'expérience précédente avec le cannabis et le fait que l'étude ait été menée sans insu, étant donné que les patients étaient en mesure de distinguer le placebo du traitement au cannabis.
Tolérabilité du cannabis/cannabinoïdes chez les patients atteints de sclérose en plaques
De manière générale, l'on rapporte que le cannabis et les médicaments sur ordonnance à base de cannabinoïdes administrés par voie orale (p.ex. le dronabinol, le nabilone, le nabiximols, CannadorMD) sont bien tolérés chez les patients souffrant de SPReference 681Reference 685-Reference 687Reference 689Reference 690Reference 693Reference 694. Les essais cliniques effectués jusqu'à maintenant n'indiquent pas d'effets indésirables graves associés à l'usage des médicaments sur ordonnance à base de cannabinoïdes (ou du cannabis). Toutefois, il semble y avoir une augmentation en nombre d'effets indésirables non graves associés à l'usage à court terme des cannabinoïdesReference 4. Les effets indésirables physiques les plus communs rapportés sont les étourdissements, la somnolence et l'assèchement de la boucheReference 384Reference 694.
L'usage prolongé du cannabis ingéré ou inhalé a été associé à des performances moins bonnes dans divers domaines cognitifs (vitesse de traitement d'information, mémoire de travail, fonction exécutive, perception visuospatiale) chez des patients atteints de SP, selon une étude transversaleReference 229. Une autre étude transversale a signalé que bien que les patients atteints de SP qui avaient fumé du cannabis quotidiennement étaient plus atteints de troubles cognitifs que ceux qui n'avaient pas consommé, en particulier en ce qui concerne la mémoire de travail, l'attention et la vitesse de traitement de l'information; aucune différence de structure (volume des lésions, l'atrophie générale, les mesures de l'imagerie du tenseur de diffusion [ITD]) n'était observable entre les consommateurs et les non consommateursReference 695. Toutefois, une étude de suivi suggère chez les mêmes patients fumeurs de cannabis, mais non les patients non consommateurs, les réductions de la matière grise et de la substance blanche (dans les régions temporales médiales et latérales, le thalamus, les noyaux gris centraux et le cortex préfrontal) étaient associées aux troubles cognitifs généralisés observésReference 696.
En revanche, une autre étude a conclu que le traitement au nabiximols, chez des patients atteints de SP et n'ayant jamais consommé de cannabis, n'était pas associé à une déficience cognitiveReference 694. Toutefois, l'étude a soulevé la possibilité que des doses plus fortes puissent précipiter des changements dans la disposition psychologique, en particulier chez les patients ayant déjà vécu une psychose. Dans tous les cas, il y a en général un manque d'information sur les effets indésirables à long terme de l'usage chronique des cannabinoïdes chez les patients atteints de la SP, et de manière plus générale pour les patients utilisant ces produits à des fins thérapeutiques.
Dysfonction vésicale associée à la sclérose en plaques ou au traumatisme médullaire
La dysfonction vésicale se produit chez la plupart des patients souffrant de SP ou de TMReference 697. Les plaintes les plus fréquentes sont l'augmentation de la pollakiurie, la miction impérieuse, l'incontinence par impériosité et l'incontinence réflexeReference 698. Les récepteurs cannabinoïdes sont exprimés dans le détrusor et l'urothélium vésical humainReference 37Reference 38, et pourraient aider à réguler le tonus du détrusor et la contraction vésicale ainsi qu'influencer les voies de la réaction nociceptive de la vessie (recensé dansReference 38).
Une première enquête effectuée auprès des patients atteints de SP consommant régulièrement du cannabis pour soulager leurs symptômes de problèmes urinaires a indiqué que plus de la moitié de ces patients ont affirmé une amélioration de la miction impérieuseReference 532. Une étude pilote ouverte de 16 semaines sur les extraits à base de cannabis (cure de traitement au nabiximols suivie de l'entretien avec 2,5 mg de Δ9-THC seulement) contre la dysfonction vésicale chez 15 patients atteints de SP avancée a indiqué une diminution notable de la miction impérieuse, du nombre et du volume des épisodes d'incontinence, de leur fréquence et de la nycturieReference 699. Des améliorations ont aussi été remarquées dans l'auto-évaluation de la douleur et de la qualité du sommeil des patients. Un essai contrôlé randomisé subséquent de 250 patients atteints de SP a suggéré un effet clinique de cannabinoïdes administrés par voie orale (2,5 mg de Δ9-THC ou 1,25 mg de CBD, avec < 5 % d'autres cannabinoïdes par capsule, jusqu'à un maximum de 25 mg/jour) sur les épisodes d'incontinenceReference 697.
4.5.2 Sclérose latérale amyotrophique
Il existe des données précliniques impliquant le SEC dans la progression d'une maladie semblable à la SLA chez les modèles de souris atteintes du trouble; sous certaines conditions les cannabinoïdes, ou l'élévation des niveaux d'endocannabinoïdes au moyen d'une inhibition pharmacologique ou d'une ablation génétique, retarderaient modérément la progression de la maladie et prolongeraient la survie chez ces modèles animaux (recensé dans l'articleReference 700.
Des rapports anecdotiques suggèrent une diminution des crampes musculaires et des fasciculations chez les patients atteints de SLA qui avaient fumé du cannabis ou bu du thé à base de cannabis, et jusqu'à 10 % de ces patients utilisent le cannabis pour le contrôle des symptômesReference 701Reference 702.
Seules deux études cliniques existent sur le cannabis pour le traitement des symptômes associés à la SLA et les résultats de celles-ci sont contrastés. Dans une étude pilote par permutation à double insu randomisée d'une durée de quatre semaines auprès de 19 patients atteints de SLA, les doses de 2,5 à 10 mg par jour de dronabinol (Δ9-THC) ont été créditées d'une amélioration du sommeil et de l'appétit, mais pas des crampes ni des fasciculationsReference 703. En revanche, une étude plus courte de deux semaines n'a indiqué aucune amélioration de ces mesures chez les patients atteints de SLA consommant 10 mg de dronabinol par jourReference 702. Dans les deux cas, le dronabinol a été bien toléré et a présenté peu d'effets secondaires chez cette population de patients aux doses testées.
4.5.3 Traumatisme médullaire (ou maladie de la moelle épinière)
Les études précliniques menées sur des animaux ont révélé l'existence d'un SEC dans la moelle épinière et d'un tonus endocannabinoïde basal dans les moelles épinières non atteintesReference 704. Bien que le rôle du SEC dans la moelle épinière non atteinte ne soit que partiellement connu, les endocannabinoïdes modulent l'analgésie ainsi que l'excitabilité de la moelle épinière en participant au contrôle physiologique des réflexesReference 704. Des études précliniques menées sur des animaux suggèrent que le TM déclenche des changements dans les activités du SEC avec un pic prononcé de la production d'anandamide et du 2-AG dans l'épicentre de la zone atteinteReference 704. Le pic des niveaux d'endocannabinoïdes, lequel reflète un processus de protection actif induit par une lésion, retourne aux niveaux basaux quelques jours après la lésion. Cependant, les niveaux de 2-AG subissent une nouvelle hausse secondaire et plus longue au cours d'une période subséquente de 28 joursReference 704. Le blocage des récepteurs CB1 et CB2 aggrave les lésions associées au TM, tandis que la stimulation de ces deux récepteurs cannabinoïdes semble jouer un rôle protecteur et pourrait aussi soulager la douleur neuropathique associée au TMReference 705-Reference 707. Une étude préclinique a aussi révélé un effet bénéfique du CBD dans le rétablissement de la fonction motrice et une réduction de l'importance des lésions après un TM dans un modèle murinReference 708. Des améliorations subjectives ont été signalées de façon anecdotique par des patients atteints de TM qui fument du cannabisReference 636Reference 709.
Cependant, malgré les données probantes tirées d'études menées sur des animaux et signalées de manière anecdotique, on dispose de données cliniques limitées sur l'usage du cannabis et des cannabinoïdes dans le traitement des symptômes associés au TM comme la douleur, la spasticité, les spasmes musculaires, l'incontinence urinaire et la difficulté à dormir. Des études croisées contrôlées par placebo, menées à double insu et portant sur le Δ9-THC par voie orale ou sur le nabiximols révèlent de modestes améliorations de la douleur, de la spasticité, des spasmes musculaires et de la qualité du sommeil chez les patients atteints de TMReference 636Reference 710Reference 711. Plus récemment, une étude parallèle, contrôlée, à répartition aléatoire et à double insu utilisant un minimum de 15 à 20 mg de Δ9-THC/jour (doses quotidiennes moyennes de 31 mg de Δ9-THC par voie orale, ou 43 mg de hémisuccinate de Δ9-THC par voie rectale) a démontré une amélioration statistiquement significative dans les mesures de spasticité chez des patients atteints de TMReference 712 et une étude croisée, contrôlée et à double insu utilisant le nabilone (0,5 mg b.i.d.) a également indiqué une réduction de la spasticité, comparativement au placebo, chez les patients atteints de TMReference 713.
Un essai clinique récent croisé, à double insu et contrôlé par placebo sur le cannabis vaporisé a démontré des effets bénéfiques d'analgésique et d'agent antispastique pour les patients atteints de TM et de maladies de la moelle épinièreReference 272. Dans le cadre de cet essai clinique, on a administré à 42 patients (dont la majorité consomment actuellement ou ont déjà consommé du cannabis) souffrant de douleur neuropathique causée par un TM ou une maladie de la moelle épinière entre 8 et 12 inhalations de placebo de cannabis ou du cannabis contenant soit une concentration faible (2,9 %) ou élevée (6,7 %) de THC au cours d'une séance de traitement de huit heures (400 mg de matériel de cannabis séché; température de vaporisation de 185 °C). Bien que 400 mg de cannabis séché ait été placé dans le vaporisateur, seulement 45,9 mg (marge de 29,9 à 83,8 mg) du cannabis à concentration de THC faible et 56,3 mg (marge de 15,7 à 172,9 mg) de cannabis à concentration de THC élevé ont été vaporisés. Ces quantités et puissances suggèrent qu'en moyenne entre 1,3 et 3,8 mg de THC aurait pu être inhalé (marge de 0,86 à 11,6 mg de THC). Les concentrations médianes de THC dans le plasma sanguin étaient de 23 ng/mL (max : 68,5 ng/mL) pour le cannabis de puissance de 2,9 % et de 47 ng/mL (max : 177 ng/mL) pour le cannabis de puissance de 6,7 % trois heures après une première ronde de quatre inhalations et immédiatement après une seconde ronde d'entre quatre et huit inhalations additionnelles. L'intensité de la douleur (résultat principal) a diminué selon l'augmentation de la teneur en THC et était statistiquement considérablement différente des valeurs du placebo pour les deux différentes teneurs de THC après la première ronde d'exposition (première ronde = quatre inhalations) et s'est encore plus améliorée comparativement au placebo après la seconde ronde d'inhalations (quatre à huit inhalations additionnelles, pour un total de 8 à 12 inhalations totales). Le soulagement de la douleur était aussi statistiquement considérablement différent entre les concentrations comparativement au placebo. Les nombres de sujets à traiter (NST) pour atteindre une réduction de 30 % de la douleur au cours des séances de traitement de huit heures étaient de 4 pour la concentration faible (2,9 %) et de 3 pour la concentration élevée (6,7 %) comparativement au placebo, tandis que le NST était de 6 lors de la comparaison entre les deux concentrations (mais les deux IC étaient grandes). En comparaison, pour la douleur neuropathique le NST pour la prégabaline est de 3,9 et le NST pour la gabapentine est de 3,8. Les deux puissances de cannabis ont fourni des améliorations considérables à une gamme de descriptions de douleur (c.-à-d. vivacité, brûlure, douloureux, froid, sensibilité, désagrément, douleur profonde et douleur superficielle), mais seulement le cannabis à puissance plus élevée offrait un soulagement à court terme pour les démangeaisons. Aucun effet général n'a été observé pour l'allodynie. Seul le cannabis de puissance faible (2,9 %) a été associé à une réduction statistiquement considérable de l'hypertonie spastique et seulement trois heures après le début du traitement. Généralement, aucune différence statistiquement considérable n'a été observée entre les médicaments de l'étude pour les différents indicateurs de rendement neuropsychologique. De nombreux des effets psychoactifs (« high », « bon effet de drogue », « effet général de drogue », « affaibli », « défoncé », « calmé ») ont démontré une dépendance à la dose avec des effets plus prononcés associés à la dose plus puissante comparativement à la dose plus faible et aussi dans le cas de comparaison des deux puissances au placebo. Les auteurs suggèrent que les patients souffrant de TM ou de maladie de la moelle épinière désirant éviter les effets psychodysleptiques tout en recevant les avantages des effets thérapeutiques devraient considérer d'utiliser la dose plus faible (2,9 %).
4.6 Épilepsie
- Les preuves anecdotiques suggèrent un effet antiépileptique du cannabis (souches prédominantes en THC et CBD).
- Les données disponibles d'études précliniques suggèrent que certains cannabinoïdes (CBD) pourraient posséder des caractéristiques antiépileptiques et anti-convulsives, tandis que les agonistes du récepteur CB1 (THC) pourraient posséder des caractéristiques pro- ou antiépileptiques.
- Toutefois, les preuves cliniques pour un effet antiépileptiqus du cannabis sont plus faibles, mais émergentes et nécessitent des études plus approfondies.
- Des données provenant d'études cliniques avec l'EpidiolexMD (CBD oral) suggèrent l'efficacité et la tolérabilité d'EpidiolexMD pour les crises épileptiques pharmacorésistantes dans le syndrome de Dravet ou pour le syndrome Lennox-Gastaut résistant au traitement.
- Des données provenant d'études observationnelles suggèrent une association entre le CBD (préparations à base de plantes et huile) et une réduction de la fréquence des crises épileptiques ainsi qu'une amélioration de la qualité de vie chez les adolescents atteints d'épilepsie pharmacorésistante rare et grave.
- L'EpidiolexMD a été approuvé par la FDA (Juin 2018) chez les patients de 2 ans et plus pour traiter les crises épileptiques associées au syndrome de Dravet et au syndrome Lennox-Gastaut résistant au traitement.
L'épilepsie est l'un des troubles neurologiques les plus courants dont la prévalence dans le monde est d'environ 1 %Reference 212Reference 714. Il ne s'agit pas d'une seule entité pathologique, mais de divers troubles reflétant une dysfonction du cerveau qui a de nombreuses causes différentesReference 715. L'épilepsie est caractérisée par des crises récurrentes non provoquées qui sont des signes et des symptômes transitoires occasionnés par une activité neuronale excessive ou synchronie anormale dans le cerveauReference 715. Les crises peuvent être de divers types, notamment génétiques et se produisant dans l'enfance (p. ex. syndrome de Dravet, syndrome Lennox-Gastaut) ou acquises et se produisant à l'âge adulte (p. ex. après un traumatisme crânien grave, un accident vasculaire cérébral [AVC] ou causées par une tumeur)Reference 261. Les comorbidités associées à l'épilepsie sont notamment un déclin cognitif, des troubles dépressifs et la schizophrénieReference 716.
Malgré la disponibilité de nombreux médicaments antiépileptiques, près de 30 % des patients atteints d'épilepsie demeurent réfractaires aux traitements classiques, ce qui les conduit à chercher d'autres modalités thérapeutiques, comme le cannabis (e.g. huiles de cannabis enrichies avec CBD)Reference 717.
Système endocannabinoïde et épilepsie
Le SEC est connu pour réguler l'excitabilité corticale, et certains chercheurs ont avancé que les endocannabinoïdes produisent un effet stabilisateur sur l'équilibre entre les neurotransmetteurs excitateurs et les neurotransmetteurs inhibiteurs dans le SNCReference 718.
L'épilepsie du lobe temporal, l'une des formes d'épilepsie les plus courantes observées chez les adultes, est associée à des variations dans l'hippocampe où l'expression du récepteur CB1 est régulée à la baisse durant la phase aiguë, peu de temps après l'effet déclencheur, mais elle est ensuite régulée à la hausse au cours de la phase chronique du troubleReference 212Reference 261Reference 719Reference 720. En outre, il semble que l'expression du récepteur CB1 sur les terminaisons des axones glutamatergiques excitateurs, ainsi que l'expression de la DAGL, laquelle est responsable de la production de l'endocannabinoïde 2-AG, sont toutes deux régulées à la baisseReference 261. En revanche, l'expression du récepteur CB1 sur les terminaisons des axones GABAergiques inhibiteurs semble être régulée à la hausse. De plus, des niveaux réduits de l'endocannabinoïde anandamide ont été décelés dans le liquide céphalorachidien (LCR) des patients ayant reçu un diagnostic récent d'épilepsie du lobe temporal non traitéeReference 721, tandis que normalement, de l'anandamide est trouvé en fortes concentrations dans l'hippocampe, région du cerveau que l'on sait intervenient dans l'épileptogenèse et les troubles convulsifsReference 259. Ensemble, ces études et d'autres qui révèlent des variations de l'expression du récepteur CB1 et DAGL dans l'hippocampe et des changements des niveaux d'anandamideReference 722-Reference 724 indiquent des variations importantes et généralisées du fonctionnement du SEC dans le cas de l'épilepsie. Étant donné que l'on pense que le SEC agit généralement comme un système d'inhibition des neurotransmetteurs, le dérèglement signalé du SEC dans le cas de l'épilepsie pourrait jouer un rôle dans la génération et le maintien de crises épileptiquesReference 261. Il existe aussi des éléments de preuve qui permettent de penser que les endocannabinoïdes favorisent le maintien, mais non le déclenchement, d'une activité épileptiforme en activant les récepteurs du CB1 situés sur les astrocytesReference 725.
Études précliniques
Des études in vitro et in vivo indiquent que certains phytocannabinoïdes (et endocannabinoïdes) pourraient jouer un rôle anticonvulsif, mais aussi, dans certains cas, un rôle proconvulsifReference 259Reference 261Reference 262Reference 714Reference 716Reference 726-Reference 734.
Les récepteurs CB1 sont situés principalement en position présynaptique, où ils inhibent habituellement la libération de neurotransmetteurs classiquesReference 735. On pense que le présumé effet antiépileptique des cannabinoïdes (p. ex. THC) est facilité par l'inhibition présynaptique dépendante des récepteurs CB1 de la libération de glutamateReference 261Reference 723Reference 736; par ailleurs, les effets épileptogènes peuvent être déclenchés par l'inhibition de l'acide gamma-aminobutyriqueReference 261Reference 731Reference 734Reference 737-Reference 739. Par conséquent, les agonistes des récepteurs CB1 (p. ex. THC) ont la capacité de déclencher ou de réprimer l'activité épileptiforme selon les terminaisons présynaptiques sensibles aux cannabinoïdes qui sont de préférence touchés (c.-à-d. glutamatergique ou GABAergique)Reference 262Reference 736Reference 740. En raison de la capacité des agonistes des récepteurs CB1, tels que le THC, à produire des activités proconvulsives ou anticonvulsives et du développement signalé de la tolérance à leurs effets anticonvulsivants, on pense que les agonistes des récepteurs CB1 sont peu susceptibles de produire un avantage thérapeutique pour les patients atteints d'épilepsieReference 259Reference 262.
Contrairement à la situation ambiguë avec les agonistes des récepteurs CB1, tels que le THC, les phytocannabinoïdes, comme le CBD, le CBDV, le THCV et le CBN, semblent avoir principalement des rôles anticonvulsivants et pourraient avoir une plus grande valeur thérapeutique pour le traitement de l'épilepsieReference 259Reference 262. Un certain nombre d'études in vivo ont démontré les effets antiépileptiques du CBD dans différents modèles animaux d'épilepsie (examiné dansReference 259). Des études antérieures utilisant différents modèles d'épilepsie chez le rat et la souris indiquent que le CBD est un anticonvulsivant efficace et que sa puissance augmente considérablement lorsqu'il est combiné avec un médicament antiépileptique tel que la phénytoïne et le phénobarbital utilisés pour traiter des crises majeuresReference 259Reference 741. En revanche, le CBD diminue la puissance anticonvulsivante du chlordiazépoxide, du clonazépam, de la triméthadione et de l'éthosuximide utilisés pour traiter les crises mineuresReference 259Reference 741. Les DE50 de CBD chez les rats variaient de 12 mg/kg (PO) à 380 mg/kg (IP) chez la sourisReference 259Reference 741Reference 742. Une autre étude a signalé que le CBD atténue l'activité épileptiforme in vitro dans des tranches d'hippocampe et affiche une activité anticonvulsive in vivo (100 mg/kg) dans un modèle murin d'épilepsie, celui-ci atténuant ainsi la gravité de la crise, les crises tonicocloniques et la mortalitéReference 730. Une étude de suivi effectuée par ce même groupe a examiné les effets anticonvulsivants du CBD dans deux autres modèles d'épilepsie partielle et du lobe temporal chez le ratReference 728. Le CBD à des doses de 1, 10 et 100 mg/kg a atténué considérablement le pourcentage d'animaux présentant des événements de convulsion (épilepsie du lobe temporal). Cependant, il n'y a eu aucun effet significatif sur le nombre moyen d'événements de convulsion par animal ou sur la gravité de la crise. Dans le modèle de crise partielle, le CBD (1, 10, 100 mg/kg) a diminué le pourcentage d'animaux ayant manifesté des crises tonicocloniques et a été associé à une diminution du taux de mortalité (à 10 et 100 mg/kg); mais il n'a eu aucun effet sur la gravité générale de la crise. Il a également été indiqué que le CBD a quelques effets négatifs mineurs sur la fonction motrice à une dose de 100 mg/kg. Paradoxalement, ces effets se sont atténués lorsque la dose a été doublée (200 mg/kg)Reference 728.
Les effets anticonvulsivants du CBDV pur ainsi que les extraits végétaux contenant du CBDV (et des quantités significatives de CBD), avec et sans THC et THCV, ont été examinés dans un certain nombre de modèles d'épilepsie chez des animauxReference 259Reference 714Reference 716Reference 743. On a constaté que le CBDV (> 10 µM) atténue considérablement l'activité épileptiforme in vitro et qu'il a aussi des effets anticonvulsivants significatifs in vivo (min. > 50 mg/kg IP) dans différents modèles murins d'épilepsieReference 743. Une dose de 200 mg/kg (IP) de CBDV a été associée à un arrêt complet des convulsions toniques dans deux modèles d'épilepsie et a atténué la gravité de la crise et la mortalité à une dose de 200 mg/kg IP. Elle a retardé également considérablement l'apparition de la crise dans un troisième modèle d'épilepsieReference 743. En outre, la coadministration du CBDV et des médicaments antiépileptiques valproate, éthosuximide ou phénobarbital a été associée à des effets anticonvulsivants significatifsReference 743. Par exemple, la coadministration du CBDV (200 mg/kg) et du valproate (50 à 250 mg/kg) ou de l'éthosuximide (60 à 175 mg/kg) a été associée à des effets anticonvulsivants significatifsReference 743. La coadministration de 200 mg/kg de CBDV et du phénobarbital (10 à 40 mg/kg) a été associée également à des effets anticonvulsivants significatifsReference 743. Le CBDV ne semble pas avoir d'effets significatifs sur la performance motrice aux doses testées et il semble aussi être bien toléré lorsqu'il est administré en concomitance avec ces médicaments antiépileptiquesReference 743. Chez la souris et le rat, le CBDV a eu des effets anticonvulsivants significatifs à des doses variant de 50 mg/kg à 400 mg/kg ou plusReference 259Reference 714Reference 716. En outre, des études in vivo menées sur des animaux faisant intervenir deux types d'extraits végétaux enrichis en CBDV (47,4 à 57,8 %) et en CBD (13,7 à 13,9 %) avec et sans THC (1 %) et THCV (2,5 %) ont porté sur les effets anticonvulsivants ainsi que la toxicité de ces extraitsReference 716. L'étude a constaté que les deux extraits végétaux ont eu des actions anticonvulsives significatives similaires dans trois modèles d'épilepsie différents chez des animaux et que la présence de THC/THCV aux doses administrées dans les extraits n'a pas contribué aux actions anticonvulsivesReference 716. Par contre, la présence de THC/THCV dans l'extrait a favorisé certains effets moteurs indésirablesReference 716. Enfin, on a constaté que le CBDV ne ce lie que faiblement au récepteur CB1, ce qui suggère que le mécanisme d'action anticonvulsif du CBDV ne dépend pas du récepteur CB1Reference 716.
Contrairement au CBD et au CBDV, les effets anticonvulsivants du CBN n'ont pas été aussi bien étudiés. Dans une étude, le CBN a produit des effets anticonvulsivants avec une dose efficace médiane (DE50) de 18 mg/kgReference 259Reference 741.
Bien que les études in vitro montrent que le THCV se lie aux récepteurs CB1 avec une affinité relativement élevéeReference 740Reference 744, le THCV ne semble pas être un agoniste puissant au récepteur CB1Reference 259Reference 740Reference 744. Au lieu de cela, les études expérimentales suggèrent que le THCV agit plus comme un antagoniste du récepteur CB1 et comme un agoniste partiel puissant du récepteur CB2Reference 18Reference 259Reference 740Reference 744Reference 745. À des doses plus élevées, toutefois, le THCV semble avoir quelques activités agonistes sur le récepteur CB1Reference 18. En outre, des études in vitro indiquent que le THCV a quelques effets anti-épileptiformes à des concentrations micromolairesReference 740 et des études in vivo suggèrent que le THCV (0,25 mg/kg) a quelques effets anticonvulsivants limités dans un modèle murin d'épilepsieReference 262Reference 740.
Il existe jusqu'à présent peu de données expérimentales concernant les effets anticonvulsivants du CBG. Bien qu'une étude in vitro indique la présence d'une activité anti-épileptiforme pour le CBG, une étude in vivo chez le rat suggère que dans un modèle d'épilepsie, le CBG (à des doses variant de 50 à 200 mg/kg) n'a pas d'effet anticonvulsivantReference 259Reference 746.
Données provenant d'études d'observation et d'enquêtes menées auprès de patients
Selon certaines études, environ 20 % des patients atteints d'épilepsie consomment activement du cannabisReference 717Reference 726Reference 747Reference 748. Une enquête téléphonique menée auprès de 136 patients d'un centre canadien de soins tertiaires de l'épilepsie a révélé que 48 % avaient utilisé du cannabis à un moment de leur vie, 21 % étaient des consommateurs actifs, 13 % étaient des consommateurs fréquents (un jour par semaine ou plus) et 8,1 % étaient de grands consommateurs (tous les deux jours ou plus)Reference 748. Trois pour cent des sujets ont répondu aux critères de dépendance au cannabis. Lorsqu'ils ont été interrogés concernant leur expérience personnelle liée à l'utilisation de cannabis, 68 % des répondants ont déclaré que la gravité de leur crise s'était atténuée, tandis que 32 % ont indiqué ne ressentir aucun effet. En ce qui concerne la fréquence des crises, 54 % ont allégué une amélioration, tandis que 46 % ont déclaré l'absence d'effet. Onze pour cent ont constaté moins d'effets secondaires découlant des médicaments lorsqu'ils utilisaient du cannabis, tandis que 85 % n'ont pas observé d'effet. Quarante-trois pour cent des répondants ont avancé des raisons médicales pour justifier l'utilisation du cannabis. Les auteurs de l'enquête ont fait observer que la consommation de cannabis a été associée à une augmentation de la fréquence des crises et à une plus longue durée de la maladie. Bien que l'on ne connaisse pas avec certitude les raisons de ces associations, il est possible que les patients atteints d'une épilepsie plus grave soient plus enclins à essayer ou à utiliser du cannabis ou que la consommation de cannabis soit associée à une aggravation de l'épilepsie.
Une autre étude a interrogé des patients en consultation externe atteints d'épilepsie dans une clinique allemande de soins tertiaires de l'épilepsie. Parmi les 310 patients atteints d'épilepsie qui ont été interrogés, 28 % ont affirmé qu'ils avaient utilisé du cannabis à un moment ou un autre de leur vie, tandis que 63 % avaient consommé du cannabis après leur diagnostic d'épilepsieReference 747. Près de 70 % des patients atteints d'épilepsie avaient une épilepsie partielle, un peu plus de 20 % avaient une épilepsie idiopathique généralisée et environ 10 % avaient une épilepsie non déterminée. Les raisons courantes de l'utilisation de cannabis comprenaient notamment la curiosité, le plaisir et la relaxation. La plupart des patients (84 %) qui ont commencé à utiliser du cannabis après leur diagnostic d'épilepsie n'ont pas observé d'effet sur l'épilepsie, 5 % ont signalé une amélioration des crises ou des symptômes associés à l'utilisation du cannabis et 11 % ont déclaré une aggravation des crises associée à la consommation de cannabis.
Un examen rétrospectif des dossiers médicaux de 18 patients canadiens atteints d'épilepsie qui étaient autorisés à posséder du cannabis à des fins médicales a signalé que 61 % d'entre eux étaient atteints d'épilepsie focale et 39 % étaient atteints d'épilepsie généraliséeReference 749. Aussi, 22 % étaient atteints de sclérose temporale mésiale, 17 % étaient atteints d'épilepsie idiopathique, 17 % étaient atteints d'épilepsie associée à une tuméfaction, 11 % avaient été diagnostiqués du syndrome de Lennox-Gastaut, 11 % étaient atteints d'épilepsie associée à une malformation congénitale et 11 % étaient classé comme étant atteint d'épilepsie d'origine inconnue. La prévalence de la comorbidité psychiatrique était commune (61 %) et le trouble dépressif était la maladie concomitante la plus fréquente. La majorité des patients avaient utilisé en moyenne cinq médicaments antiépileptiques auparavant. De plus, 89 % des patients possédaient de longs antécédents de consommation de cannabis avant d'obtenir une autorisation d'en posséder. Le mode de consommation était principalement par voie fumée (83 %). Le nombre moyen de bouffées quotidiennes était de quatre et la quantité estimée de cannabis consommée par jour était de 2 g. Tous les patients ayant cessé leur consommation de cannabis ont signalé l'exacerbation de crises épileptiques associées au sevrage. Aucun d'entre eux n'a reporté un état de mal épileptique comme complication. Tous les patients ont signalé une amélioration de la sévérité ou de la fréquence de crises épileptiques. Tous les patients ont signalé une amélioration des troubles d'humeur et du bien-être général; 89 % des patients ont signalé une absence d'effets secondaires; 89 % des patients ont signalé une amélioration de la qualité de sommeil et de l'appétit. Les limites de cette étude comprennent sa nature rétrospective et un biais associé à l'autodéclaration ainsi que l'absence d'un groupe témoin et la petite taille de la population étudiée.
Épilepsie infantile résistante aux traitements
Les résultats de deux enquêtes réalisées auprès de parents d'enfants présentant une épilepsie infantile réfractaire aux traitements et qui ont essayé des huiles de cannabis ont été publiés et résumés iciReference 210Reference 260. Dans une enquête portant sur 19 enfants, 13 avaient le syndrome de Dravet, 4 avaient le syndrome de Doose et 1 enfant avait le syndrome de Lennox-Gastaut; 1 enfant présentait une épilepsie idiopathique d'apparition précoceReference 260. L'âge des enfants était compris entre 2 et 16 ans. Les parents ont indiqué que les enfants souffraient de différents types de crise, y compris des spasmes focaux, tonicocloniques, myocloniques, atoniques et infantiles. Dans pratiquement tous les cas, l'étude révèle que les enfants ont reçu un traitement contre l'épilepsie pendant plus de trois ans avant d'essayer du cannabis enrichi en CBD. Les enfants avaient essayé en moyenne 12 autres médicaments antiépileptiques avant de commencer un traitement au cannabis enrichi en CBD. Les doses de CBD signalées variaient entre moins de 0,5 mg/kg/jour et 28,6 mg/kg/jour, tandis que les doses de THC indiquées variaient de 0 à 0,8 mg/kg/jour. La durée signalée d'utilisation de cannabis enrichi en CBD variait entre deux semaines et plus d'un an. Quatre-vingt-quatre pour cent des parents ayant répondu à l'enquête ont déclaré une réduction de la fréquence des crises de leur enfant. Deux parents ont signalé un arrêt complet des crises chez leurs enfants après plus de quatre mois de traitement. Quarante-deux pour cent des parents interrogés ont signalé une diminution supérieure à 80 % de la fréquence des crises, 16 % ont déclaré une réduction supérieure à 50 % de la fréquence des crises et la même proportion de parents a indiqué une baisse supérieure à 25 % ainsi que l'absence de diminution. Soixante pour cent des parents ont déclaré avoir sevré leur enfant d'un autre médicament antiépileptique après le début du traitement au cannabis enrichi en CBD. Les parents ont fait état d'effets bénéfiques comprenant une meilleure humeur (79 %), une vivacité d'esprit accrue (74 %), un meilleur sommeil (68 %) et une diminution de l'autostimulation (32 %), tandis que les effets indésirables étaient notamment la somnolence (37 %) et la fatigue (16 %). Les limites de cette enquête comprennent notamment le biais d'auto-sélection, l'absence de groupe témoin, l'incapacité de vérifier de façon indépendante les allégations des parents, y compris les renseignements concernant la posologie, ainsi que la taille réduite de l'échantillon et la sous-représentation des types d'épilepsie autres que le syndrome de Dravet.
Les résultats d'une deuxième enquête menée auprès de parentsReference 210 ont également été publiés. Dans cette enquête, 117 parents d'enfants atteints d'une épilepsie réfractaire aux traitements ont répondu. Quarante-cinq pour cent des parents ont signalé un enfant souffrant de spasmes infantiles ou atteints du syndrome de Lennox-Gastaut, tandis que 13 % ont déclaré une épilepsie myoclonique sévère du nourrisson (syndrome de Dravet). Quatre pour cent ont fait état d'une épilepsie myoclonique astatique (syndrome de Doose) et 38 % ont signalé d'autres types d'épilepsie. L'âge des enfants variait de 3 à 10 ans et le nombre médian de médicaments antiépileptiques essayés et n'ayant pas fonctionné avant l'essai de préparations de cannabis enrichi en CBD était de huit. La durée médiane du traitement au cannabis était de 6,8 mois (marge de 3,8 à 9,8 mois). La posologie médiane de CBD dans les préparations était de 4,3 mg/kg/jour (marge de 2,9 à 7,5 mg/kg/jour). La grande majorité de répondants a déclaré utiliser des extraits à base d'huile enrichis en CBD, habituellement administrés deux à trois fois par jour. Le ratio indiqué du CBD et du THC dans les préparations d'huile était d'au moins 15 : 1. Quatre-vingt-cinq pour cent des répondants ont fait état d'une diminution de la fréquence des crises et, notamment, 14 % ont signalé une absence totale des crises, tandis que 9 % n'ont pas déclaré de changement et 4 % ont indiqué une augmentation de la fréquence des crises. Quatre-vingt-six pour cent des répondants ont déclaré une amélioration ou une aggravation dans les 14 jours suivant le début du traitement. Les effets indésirables associés au traitement comprennent notamment une augmentation de l'appétit (29,9 %) et une prise de poids (29,1 %). Fait intéressant, le nombre médian d'effets secondaires signalés pendant l'exposition au traitement était beaucoup plus faible que celui indiqué avant cette exposition. La diminution déclarée du nombre d'effets secondaires durant le traitement a été attribuée à l'arrêt allégué d'au moins un médicament contre les crises d'épilepsie pendant le traitement. Bien que, dans l'ensemble, la prévalence d'effets indésirables ait diminué pendant le traitement avec la préparation de cannabis, les effets indésirables les plus souvent rencontrés étaient la somnolence (12,8 %), la fatigue (9,4 %), l'irritabilité (9,4 %) et les nausées (6,8 %). Les répondants ont signalé une amélioration du sommeil (53 %), de la vivacité d'esprit (71 %) et de l'humeur (63 %). Une fois encore, comme avec l'enquête menée par Porter et coll., celle réalisée par Hussain et coll. 2015 comporte les mêmes limites et les données doivent être interprétées avec prudence.
Un examen rétrospectif des dossiers de 75 enfants et adolescents vivant au Colorado et auxquels des extraits de cannabis ont été administrés par voie orale pour le traitement de l'épilepsie réfractaire aux traitements révèle que 57 % des patients présentaient une amélioration du contrôle des crises et 33 % ont signalé une diminution de plus de 50 % des crisesReference 750. L'âge moyen était de 7,3 ans (marge de 6 mois à 18 ans) au moment du début du traitement à l'extrait de cannabis par voie orale. Quatre pour cent des patients avaient un syndrome de Doose, 17 % avaient un syndrome de Dravet et 12 % ont reçu un diagnostic du syndrome de Lennox-Gastaut. Parmi les enfants ayant un syndrome précis, ceux atteints du syndrome de Lennox-Gastaut représentaient la proportion la plus importante de répondants aux extraits de cannabis par voie orale (89 %), suivis de ceux ayant le syndrome de Dravet (23 %). Les patients atteints du syndrome de Doose ont semblé répondre le moins au traitement (0 %). Lorsqu'ils étaient classés selon le type de convulsion, ceux présentant des convulsions atoniques ont semblé avoir le taux de réponse le plus important (44 %), suivis de ceux ayant des convulsions focales (38 %) et des spasmes épileptiques (36 %), des convulsions tonicocloniques généralisées (30 %), des absences (28 %), des convulsions myocloniques (20 %) et des convulsions toniques (17 %)Reference 210. Les améliorations signalées comprenaient notamment une augmentation de la vivacité d'esprit et du comportement (33 %), des aptitudes du langage (11 %), de l'habileté motrice (11 %) et du sommeil (7 %). Des événements indésirables ont été signalés chez 44 % des patients traités à l'aide d'extrait de cannabis par voie orale. Les effets indésirables associés à l'administration d'extrait de cannabis par voie orale comprenaient notamment l'aggravation des crises (13 %), la somnolence (12 %), la présence de symptômes GI (11 %) et l'irritabilité (5 %). Étonnamment, aucune différence de réaction n'a été signalée fondée sur la souche ou le type d'extrait de cannabis par voie orale à l'aide desquels les patients étaient traités (c.-à-d. teneur élevée en CBD, CBD et autres extraits de cannabis par voie orale, THCA et autres types d'extrait de cannabis par voie orale). La plupart des patients ont reçu un extrait de cannabis par voie orale accompagné d'une teneur élevée en CBD avec ou sans autres extraits de cannabis par voie orale. Les limites de l'étude comprennent notamment les suivantes : taille réduite de l'échantillon, hétérogénéité des produits utilisés, incertitude quant aux doses des cannabinoïdes, incapacité de déterminer la dose-réponse et écarts concernant les évaluations des avantages du traitement entre les familles qui ont emménagé au Colorado pour suivre le traitement et celles qui y résidaient.
Une étude rétrospective et multicentrique a examiné l'effet du traitement au CBD pour lutter contre l'épilepsie incurable grave (c.-à-d. épilepsie acquise, encéphalopathie épileptique précoce avec étiologie génétique connue, encéphalopathie épileptique avec étiologie génétique inconnue, malformation congénitale du cerveau, encéphalopathie hypoxique ischémique et autres maladies, présentant une résistance à cinq à sept médicaments antiépileptiques, au régime cétogène et à la stimulation du nerf vague)Reference 208. L'étude a examiné les dossiers cliniques de visites à la clinique et par téléphone d'enfants et d'adolescents (tranche d'âge : 1 an à 18 ans) atteints d'épilepsie réfractaire et traités dans quatre centres de soins de l'épilepsie pédiatrique en Israël. Soixante-quatorze enfants et adolescents ont été inclus dans l'étude et la dose quotidienne signalée de CBD (1 à 20 mg/kg par jour) a été administrée au cours d'une période moyenne de six mois (au moins trois mois). La dose quotidienne la plus élevée de CBD a été de 270 mg par jour. Quatre-vingts pour cent des enfants inclus dans l'étude ont reçu moins de 10 mg/kg par jour de CBD, le reste (20 %) recevant plus de 10 mg/kg par jour de CBD. Le ratio du CBD et du THC a été de 20 : 1 et les cannabinoïdes ont été dissous dans de l'huile de canola. Des parents ou des enfants plus âgés ont signalé un changement du nombre de crises. Le traitement au CBD a été associé à une diminution de la fréquence des crises ainsi qu'à une amélioration du comportement et de la vivacité d'esprit, du langage, des capacités motrices et de communication et du sommeil. Environ la moitié des parents ont signalé des effets secondaires, 18 % ayant déclaré une aggravation des crises, 22 % ayant indiqué une somnolence et de la fatigue et 7 % ayant fait état de problèmes GI et d'une irritabilité. Les effets secondaires ont conduit à l'abandon de l'extrait d'huile de cannabis chez cinq patients. Les limites de l'étude comprennent notamment sa conception rétrospective, l'absence d'un groupe témoin, l'absence de taux constant d'augmentation des doses, l'utilisation des déclarations des parents pour connaître les effets sur la fréquence des crises, la courte durée de l'étude et son absence de résultats à long terme, l'absence de résultats sur l'EEG et l'absence de mesure de la concentration d'autres médicaments.
Études cliniques
Remarque : L'EpidiolexMD est la marque nominative pour l'extrait de plante entière de cannabis d'une souche de Cannabis sativa contenant des niveaux élevés de CBD et est un produit en solution orale à base d'huile contenant au moins 98 % de CBD à une concentration de 100 mg/mL. L'EpidiolexMD a été approuvé par la FDA (Juin 2018) chez les patients de 2 ans et plus pour traiter les crises épileptiques associées au syndrome de Dravet et au syndrome Lennox-Gastaut. Il a aussi reçu la désignation de médicament orphelin aux États-Unis pour le traitement du syndrome de Lennox-Gastaut, du syndrome de Dravet et de la sclérose tubéreuse de Bourneville. Au moment de la rédaction de ce document, l'EpidiolexMD n'a toujours pas reçu un Avis de conformité de Santé Canada et ne se retrouve pas sur le marché canadien.
Bien qu'il existe de nombreux récits anecdotiques d'améliorations impressionnantes avec des produits à base de cannabis contenant des ratios CBD/THC élevés (p. ex. 20 > 1), les données cliniques recueillies confirmant l'innocuité et l'efficacité du cannabis dans le traitement de l'épilepsie sont relativement raresReference 212Reference 262Reference 666. Les données probantes recueillies tirées d'études cliniques sont examinées ci-dessous et résumées dans une étude CochraneReference 212.
Une étude clinique à répartition aléatoire, contrôlée par placebo, portant sur neuf personnes atteintes d'une épilepsie du lobe temporal non contrôlée et qui n'ont pas répondu au traitement comprenant plusieurs médicaments antiépileptiques révèle ce qui suit : deux des personnes ayant reçu des doses quotidiennes de 200 mg de CBD pendant trois mois n'ont éprouvé aucune crise, une personne a présenté une amélioration partielle et une autre personne n'a pas ressenti d'améliorationReference 212Reference 751. Aucun des patients traités par placebo n'a présenté de signes d'amélioration. Aucun effet indésirable n'a été constaté. Les limites de cette étude comprennent notamment l'absence de comparaison entre le groupe traité par CBD et le groupe recevant un placebo pour déterminer les caractéristiques de référence d'une crise, la taille réduite de l'échantillon, une méthodologie vague, une absence possible d'insu et une absence d'analyse statistique.
Une autre étude clinique à répartition aléatoire, contrôlée par placebo et portant sur 15 patients épileptiques atteints d'une épilepsie du lobe temporal non contrôlée révèle qu'un traitement quotidien avec des doses de 200 et 300 mg de CBD (en combinaison avec divers médicaments antiépileptiques classiques) d'une durée de 3 à 18 semaines a été associé à un arrêt des crises chez quatre (parmi huit) patients traités par le CBDReference 212Reference 752. Un patient (parmi sept) traité par placebo n'a éprouvé aucune crise. Les réactions indésirables comprenaient la somnolence. Les limites de cette étude comprennent notamment l'absence de comparaison entre le groupe traité par CBD et le groupe recevant un placebo pour déterminer les caractéristiques de référence d'une crise, la taille réduite de l'échantillon, une méthodologie vague, une absence possible d'insu et une absence d'analyse statistique.
Un essai clinique contrôlé par placebo portant sur 12 patients souffrant de crises fréquentes qui ne prenaient pas de médicaments antiépileptiques n'a révélé aucune différence statistiquement significative dans la fréquence des crises entre les patients ayant reçu des doses quotidiennes de 200 à 300 mg de CBD pendant quatre semaines et ceux ayant reçu un placeboReference 212Reference 753. Les effets indésirables signalés comprennent notamment la somnolence. Les limites de l'étude comprennent notamment la taille réduite de l'échantillon, l'absence d'insu possible, l'absence de comparaison entre le groupe traité par le CBD et celui recevant un placebo pour déterminer les caractéristiques de référence d'une crise et une méthodologie vague.
Une étude clinique croisée à répartition aléatoire et à double insu, contrôlée par placebo et portant sur 12 patients atteints d'une forme d'épilepsie non totalement contrôlée révèle qu'un traitement avec 100 mg de CBD, administré trois fois par jour pendant six mois, est associé à une diminution de la fréquence des crises, bien que cette dernière ne soit pas bien mesurée et qu'aucune analyse statistique n'ait été effectuéeReference 212Reference 754. Le traitement par le CBD ne semble pas non plus être associé à des changements comportementaux défavorables. Les limites de cette étude comprennent notamment la taille réduite de l'échantillon, l'absence d'analyse statistique et l'absence d'une mesure objective de la fréquence des crises.
Une étude Cochrane portant sur les données cliniques du traitement à base de cannabinoïde destiné à lutter contre l'épilepsie s'est penchée sur les quatre études cliniques mentionnées précédemmentReference 751-Reference 754 et a conclu que, d'après leurs critères d'évaluation, la qualité de tous ces rapports était faible et qu'aucune conclusion fiable ne pouvait en être tirée en ce qui concerne l'efficacité des cannabinoïdes (CBD) comme traitement contre l'épilepsie. Cependant, une dose quotidienne de 200 à 300 mg de CBD pourrait être administrée sans danger à un nombre restreint de patients pendant de courtes périodes, mais l'innocuité du traitement à long terme au CBD n'a pas pu être évaluée de façon fiable dans ces étudesReference 212.
Épilepsie infantile résistante aux traitements
Une étude clinique a examiné les différences entre les composantes du SEC et entre les cibles moléculaires associées à l'action du CBD et a retrouvé une augmentation dans les niveaux d'expression de la sous-unité α-1h des canaux calciques dépendant d'un potentiel d'action, de l'expression du gène du récepteur CB2, et une réduction de l'expression du gène de transport de la sérotonine dans les lymphocytes isolés de patients atteints du syndrome de DravetReference 755.
Un rapport provenant d'un essai à accès élargi relatif à un nouveau médicament d'investigation (IND), l'EpidiolexMD, extrait de cannabis à base d'huile contenant 98 % v/v de CBD, a examiné l'interaction entre le clobazam et l'EpidiolexMD (CBD) pendant le traitement d'une épilepsie réfractaire chez l'enfantReference 232. Treize sujets atteints d'une épilepsie réfractaire ont été inclus dans l'étude. Les diagnostics comprenaient le syndrome de Dravet, le syndrome de Doose, la dysgénésie corticale, le syndrome de duplication du chromosome 15q13 isodicentrique, la mutation du gène CDKL5 (Cyclin-Dependent Kinase-like 5), la sclérose tubéreuse de Bourneville et la lissencéphalie. Soixante-dix pour cent des patients inclus ont manifesté une diminution de plus de 50 % des crises. Les doses quotidiennes d'EpidiolexMD ont varié de 5 mg/kg par jour à une dose maximale de 25 mg/kg par jour. La dose quotidienne moyenne de clobazam a été de 1 mg/kg par jour, la marge étant comprise entre 0,18 et 2,24 mg/kg par jour. La coadministration de CBD et de clobazam a été associée à des niveaux plasmatiques plus élevés de clobazam et de son métabolite actif n-desméthylclobazam. Une étroite surveillance des niveaux plasmatiques de clobazam et de n-desméthylclobazam est recommandée, tout comme un ajustement posologique du clobazam, selon les besoins, pour prévenir la surdose. Des effets secondaires ont été signalés chez 77 % des 13 sujets de l'étude et il s'agissait notamment de la somnolence, de l'ataxie, de l'irritabilité, d'un sommeil agité, de rétention urinaire, de tremblements et d'une perte d'appétit.
Un essai clinique de 12 semaines, d'accès élargi, prospectif et à volets ouverts de l'EpidiolexMD (solution orale d'huile de CBD 98 à 99 % à une concentration de 100 mg/mL) chez des patients âgés de 1 à 30 ans atteints d'épilepsie infantile sévère et insoluble résistante aux traitements (principalement les syndromes de Dravet et de Lennox-Gastaut) a examiné l'efficacité, l'innocuité, et la tolérabilité de l'addition du CBD aux régimes posologiques antiépileptiques actuelsReference 258. En premier lieu, les patients ont été administrés une dose de CBD d'entre 2 et 5 mg/kg/jour divisés en deux doses quotidiennes ajoutées à des traitements antiépileptiques actuels (c.-à-d. un régime cétogène, de clobazam, de valproate) qui a ensuite été titrée à la hausse lentement de 2 à 5 mg/kg une fois par semaine jusqu'à ce que l'intolérance ou la dose maximale de 25 mg/kg par jour (ou jusqu'à un maximum de 50 mg/kg/jour, selon le site de l'étude). La dose maximale à la 12e visite clinique était de 41 mg/kg/jour et la dose moyenne de CBD à la 12e semaine était de 23 mg/kg dans le groupe d'analyse de l'innocuité. La fréquence médiane mensuelle des convulsions motrices était de 30 à la base et de 16 après la période de traitement de 12 semaines et la réduction médiane mensuelle de convulsions motrices était de 37 %. La plus grande réduction de convulsions s'est produite chez les patients atteints de crises épileptiques partielles (réduction de 55 %), de crises atoniques (réduction de 54 %), de crises toniques (réduction de 37 %) ou de convulsions tonico-cloniques (réduction de 16 %). La thérapie combinée (CBD avec clobazam ou valproate) a été associée avec une plus grande réduction de convulsions comparativement aux patients n'utilisant pas le clobazam ou le valproate. Des effets néfastes ont été déclarés chez 79 % des patients du groupe d'innocuité. Des effets néfastes qui ont été observés dans plus de 5 % des cas comprennent : la somnolence (25 %), la perte d'appétit (19 %), la diarrhée (19 %), la fatigue (13 %), des convulsions (11 %), des changements d'appétit (9 %), des états de mal épileptique (8 %), la léthargie (7 %), des changements de concentrations dans le sang de médicaments antiépileptiques concomitantes (6 %), des perturbations d'allure et la sédation. La majorité des effets néfastes étaient faibles ou moyens et transitoires. Les effets néfastes graves qui ont été déterminés comme étant possiblement associés à l'utilisation de CBD (10 %) comprenaient l'état de mal épileptique (6 %), la diarrhée (2 %), la pneumonie (moins de 1 %) et la perte de poids (1 %). Les patients utilisant plus de 15 mg/kg/jour de CBD étaient plus probables de signaler des diarrhées ou des effets secondaires associés (p. ex. la perte de poids). De tous les patients inscrits à l'étude, 3 % s'en sont retirés pour des raisons comprenant des allergies à l'excipient d'huile de sésame, l'hépatotoxicité, la somnolence excessive, de faibles taux d'efficacité, l'intolérance GI, une aggravation des convulsions et l'hyperammoniémie. Les limitations principales de cette étude comprennent la conception à volets ouverts et l'absence d'un groupe témoin adéquat. De plus, l'enjeu d'une réponse considérable au placebo dans les essais pédiatriques a été noté par les auteurs comme étant d'importance particulière dans les essais pédiatriques de traitements à base de cannabis. Les auteurs remarquent que la réponse au placebo dans les essais aléatoires contrôlés de traitements adjuvants chez les patients atteints d'épilepsie semble être plus importante dans la population pédiatrique comparativement aux adultes (19 % comparativement à 9,9 à 15 %).
Un essai randomisé, à double insu et contrôlé par placebo a été mené pour déterminer l'efficacité et l'innocuité de l'EpidiolexMD dans le traitement des convulsions pharmacorésistantes dans le syndrome de DravetReference 589. Après une période de référence de 4 semaines, un total de 120 enfants et jeunes adultes affectés (2,3 à 18,4 ans) ont été randomisés (1:1) pour recevoir soit 20 mg/kg/jour d'une solution orale de CBD ou un placebo, en plus du traitement antiépileptique standard, pendant 14 semaines (2 semaines d'augmentation de la dose et 12 semaines de maintien de la dose). À la fin de la période de traitement, il y a eu une période de transition de 10 jours (10 % de réduction de la dose par jour) suivie d'une période de suivi de 4 semaines. Le type de crise convulsive le plus courant était une crise tonico-clonique généralisée (78 %), suivi d'une crise tonico-clonique généralisée secondaire (21 %).Des convulsions non convulsives ont été rapportées par 61 % des patients du groupe CBD et 69 % dans le groupe placebo. Le traitement par CBD a diminué la fréquence médiane des crises convulsives par mois (critère principal) de 12,4 (extrêmes: 3,9 à 1,717) à 5,9 (extrêmes: 0,0 à 2,159), tandis que le placebo n'a eu aucun effet (de 14,9 à 14,1). La différence médiane ajustée entre les groupes CBD et placebo dans la variation de la fréquence des crises a été de -22,8 points de pourcentage (IC à 95 % = -41,1 à -5,4, p = 0,01). Les effets du CDB sur les crises convulsives ont été observés au cours du premier mois de la période d'entretien. Dans le groupe CBD, 43 % des patients ont présentés une réduction d'au moins 50 % de la fréquence des crises convulsives, comparativement à 27 % dans le groupe placebo (RC, 2,00; IC à 95 % = 0,93 à 4,30; p = 0,08). Au cours de la période de traitement, 3 patients (5 %) du groupe CBD et aucun patient du groupe placebo ont été libérés de leurs convulsions (p = 0,08). Le CBD a diminué de 24,0 à 13,7 la fréquence médiane des crises par mois (réduction ajustée de 28,6 %), tandis que le placebo a diminué de 41,5 à 31,1 (réduction ajustée de 9,0 %), pour une différence médiane ajustée significative entre les groupes de -19,2 points de pourcentage (p = 0,03). Il n'y a pas eu de différence significative entre les groupes pour la réduction des crises non convulsives (p = 0,88). Les effets indésirables fréquents (fréquence> 10 %) dans le groupe CBD ont été: la somnolence (36 %), la diarrhée (31 %), la perte d'appétit (28 %), la fatigue (20 %), les vomissements (15 %), la pyrexie (15 %), la léthargie (13 %), l'infection des voies respiratoires supérieures (11 %) et les convulsions (11 %). La plupart d'entre eux ont été d'intensité légère ou modérée (84 % dans le groupe CBD) et considérés comme liés à l'agent d'essai (75 %). Dans le groupe CBD, 8 patients se sont retirés de l'étude en raison d'effets indésirables, contre 1 dans le groupe placebo.
Au total, 12 patients du groupe CBD et 1 du groupe placebo ont présenté des taux élevés d'aminotransférase; tous prenaient également du valproate. Sur les 9 patients qui ont continué à prendre du CBD (3 patients se sont retirés de l'essai), les taux d'enzymes sont revenus à la normale pendant l'essai, ce qui suggère un stress métabolique transitoire sur le foie. Les différences d'impalabilité entre le traitement actif et le placebo ont pu affecter la cécité chez un petit nombre de patients. La durée de l'essai n'a pas permis d'évaluer le développement potentiel de la tolérance, de sorte que des données supplémentaires sont nécessaires pour déterminer l'efficacité et l'innocuité à long terme du CDB pour le syndrome de DravetReference 589.
Un essai clinique randomisé, à double insu et contrôlé par placebo a été mené pour étudier l'efficacité de l'EpidiolexMD comme traitement d'appoint pour les crises d'épilepsie chez les patients atteints du syndrome de Lennox-Gastaut résistant au traitementReference 590. Après une période de référence de 4 semaines, 171 patients admissibles (âgés de 2 à 55 ans) ont été répartis au hasard (1:1) pour recevoir 20 mg/kg de CBD par jour (n = 86) ou un placebo (n = 85) sous forme de 2 doses équivalentes (matin et soir) pendant 14 semaines (2 semaines d'augmentation de la dose et 12 semaines de maintien de la dose). Le pourcentage médian de réduction de la fréquence mensuelle des crises d'épilepsie par rapport au départ (paramètre primaire) a été de 43,9 % [intervalle interquartile (IIQ) -69,6 à -1,9] dans le groupe CBD et de 21,8 % (IIQ -45,7 à 1,7) dans le groupe placebo. La différence médiane estimée entre les groupes de traitement a été de -17,21 (IC à 95 % -30,32 à -4,09; p = 0,0135) pendant la période de traitement de 14 semaines. L'effet du traitement du CBD sur le critère d'évaluation primaire a été établi au cours des 4 premières semaines de la période d'entretien et a été maintenu pendant toute la période de traitement. Dans le groupe CBD, 38 patients (44 %) ont présenté une réduction de la fréquence des crises d'épilepsie de ≥ 50 % par rapport au début du traitement, comparativement à 20 patients (24 %) dans le groupe placebo (RC 2,57, IC à 95 %, 1,33-4,97; p = 0,0043). Trois patients du groupe CBD ont été exempts de crises d'épilepsie pendant toute la période de maintien de 12 semaines; leur fréquence mensuelle des crises d'épilepsie au début de l'étude se situait dans la fourchette inférieure de 15,6 à 99,2. Au cours de la période de traitement, le CBD a également réduit de façon significative la différence médiane estimée de la fréquence mensuelle des convulsions totales [-21,1 (IC à 95 % -33,3 à -9,4; p = 0,0005)] et des convulsions sans chute [-26,1 (IC à 95 % -46,1 à -8,3; p = 0,0044)] par rapport au placebo. Cela a suggéré que l'ajout de CDB peut avoir des effets à large spectre sur la réduction des convulsions. Les effets indésirables courants (survenant chez ≥10 % des patients) dans le groupe CBD ont été la diarrhée (19 %), la somnolence (15 %), la pyrexie (13 %), la diminution de l'appétit (13 %) et les vomissements (10 %). La plupart des effets indésirables ont été d'intensité légère ou modérée (78 % dans le groupe CBD) et ont disparu à la fin de l'essai (61 %). Les effets indésirables ont entraîné le retrait de l'étude de 12 patients (14 %) du groupe CBD et 1 patient (1 %) du groupe placebo. Sur les 20 patients du groupe CBD qui ont présenté des élévations de l'ALAT ou de l'ASAT (> 3 fois la limite supérieure de la normale), qu'ils aient été signalés ou non comme effets indésirables, 16 prenaient également du valproate. Les effets indésirables graves liés au traitement les plus fréquents (survenant chez > 3 % des patients) ont été signalés collectivement chez 4 patients du groupe CBD et ont compris une augmentation des concentrations d'ALAT (n = 4), d'ASAT (n = 4) et de γ-glutamyltransférase (n = 3). Aucun patient n'a répondu aux critères standards pour les lésions hépatiques graves induites par les médicaments (loi de Hy). Dans l'ensemble, cet essai a démontré que l'ajout de CBD a été efficace pour le traitement des patients présentant des crises d'épilepsie associées au syndrome de Lennox-Gastaut et qu'il a été généralement bien toléré. Toutefois, seule une dose unique de CBD a été testée dans cet essai; les effets de dose-réponse seront évalués d'une manière plus poussée dans une autre étude (GWPCARE3; ClinicalTrials.gov, numéro NCT02224560). Une évaluation plus poussée de l'efficacité et de l'innocuité à long terme du CDB est en cours dans le cadre de l'extension ouverte de cet essai et sera également réalisée à l'aide de données réelles, une fois qu'elles seront disponiblesReference 590.
Un essai clinique en double aveugle contre placebo a été mené pour déterminer l'efficacité et l'innocuité de l'EpidiolexMD (CBD) en association avec des antiépileptiques conventionnels pour traiter les effondrements épileptiques chez les patients atteints du syndrome de Lennox-Gastaut, une encéphalopathie épileptique développementale sévèreReference 756. Un total de 225 patients (âgés de 2 à 55 ans) atteints du syndrome de Lennox-Gastaut et souffrant de ≥ 2 effondrements épileptiques par semaine pendant une période initiale de 28 jours ont été randomisés pour recevoir 20 mg/kg de CBD (n = 76), 10 mg/kg de CBD (n = 73) ou un placebo (n = 76) en 2 doses égales, tous les jours pendant 14 semaines (2 semaines d'augmentation de la dose suivies de 12 semaines de maintien). La réduction médiane en pourcentage par rapport à la valeur initiale de la fréquence des effondrements épileptiques par 28 jours pendant la période de traitement (critère principal) a été, respectivement, de 41,9 % (p = 0,005), 37,2 % (p = 0,002) et 17,2 % dans les groupes recevant 20 mg/kg de CBD, 10 mg/kg de CBD et un placebo. Pendant la période de traitement, un total de 30 patients (39 %) du groupe recevant 20 mg/kg de CBD (OR 3,8; IC 95 % 1,75-8,47; p < 0,001), 26 patients (36 %) du groupe recevant 10 mg/kg de CBD (OR 3,27; IC 95 % 1,46-7,26; p = 0,003) et 11 patients (14 %) du groupe placebo ont présenté une réduction de ≥ 50 % par rapport à leur valeur initiale de la fréquence des effondrements épileptiques. Le pourcentage de patients qui ont présenté une réduction de ≥ 75 % de la fréquence des effondrements épileptiques par rapport à la valeur initiale a été plus élevé dans le groupe recevant 20 mg/kg de CBD (25 %) et dans le groupe recevant 10 mg/kg de CBD (11 %) que dans le groupe placebo (3 %). Aucun patient n'a été exempt d'effondrements épileptiques pendant toute la période de traitement (à partir du premier jour). Cependant, 5 patients (7 %), 3 patients (4 %) et 1 patient (1 %), respectivement, dans les groupes recevant 20 mg/kg de CBD, 10 mg/kg de CBD et un placebo, n'ont pas eu d'effondrements épileptiques pendant toute la phase de maintien (à partir du 15e jour). La réduction médiane en pourcentage par rapport à la valeur initiale de la fréquence de toutes les convulsions par 28 jours pendant la période de traitement a été, respectivement, de 38,4 % (p = 0,009), 36,4 % (p = 0,002) et 18,5 % dans les groupes recevant 20 mg/kg de CBD, 10 mg/kg de CBD et un placebo. Des effets indésirables, dont la majorité (89 %) a été considérée comme d'intensité légère ou modérée, ont été signalés chez 72 à 94 % des patients. Les effets indésirables les plus fréquents avec le CBD ont été la somnolence (n = 14-25), la diminution d'appétit (n = 11-21) et la diarrhée (n = 7-12); ces effets sont survenus plus fréquemment dans le groupe recevant 20 mg/kg de CBD. Les effets indésirables graves (n = 26 vs n = 7) et les retraits de l'essai (n = 7 vs n = 1) ont été plus fréquents dans les groupes CBD que dans le groupe placebo. Des effets indésirables graves considérés comme liés au CBD sont survenus chez 7 patients (1 patient a eu plusieurs événements) et ont inclus une concentration élevée d'aspartate aminotransférase (n = 2), une concentration élevée d'alanine aminotransférase (n = 1), une concentration élevée de γ-glutamyltransférase (n = 1), la somnolence (n = 1), l'augmentation des convulsions pendant le sevrage (n = 1), le status épilepticus non convulsif (n = 1), la léthargie (n = 1), la constipation (n = 1) et l'aggravation de la cholécystite chronique (n = 1). Les élévations maximales des concentrations d'aspartate aminotransférase ou d'alanine aminotransférase 3,2 à 12,2 fois la limite supérieure de la normale ont été les effets indésirables les plus fréquents menant au retrait de l'essai dans les groupes CBD (n = 5). Les élévations des concentrations d'aminotransférase > 3 fois la limite supérieure de la normale sont survenues plus fréquemment chez les patients recevant 20 mg/kg de CBD (n = 11) que chez ceux recevant 10 mg/kg de CBD (n = 3). Dans la plupart de ces cas (n = 11, 79 %), les patients recevaient du valproate simultanément. Aucun patient n'a rencontré les critères pour les lésions hépatiques graves induites par le médicament (drug-induced liver injury ou DILI). La majorité de ces cas (n = 9) ont été résolus après que la dose de CBD a été diminuée ou interrompue, ou que la dose d'un autre médicament antiépileptique a été réduiteReference 756.
Une récente revue systématique de 36 études (30 observationnelles, 6 essais randomisés contrôlés) concernant l'impact des cannabinoïdes comme traitement adjuvant chez les patients épileptiques (âge moyen de 16 ans) a suggéré que le CBD de qualité pharmaceutique était plus efficace que le placebo pour réduire la fréquence des crises épileptiques de 50 %, pour atteindre une complète libération des crise épileptiques [risque relatif (RR) 6,17, IC 95 % 1,50-25,32], et pour améliorer la qualité de vie (RR 1,73, IC à 95 % 1,33-2,26) par rapport au placebo. Les effets indésirables du CBD de qualité pharmaceutique comprenaient la somnolence, la fatigue, la diarrhée, des changements dans l'appétit et l'ataxie. Ces résultats étaient spécifiques aux personnes atteintes de formes rares et graves d'épilepsie pharmacorésistante; par conséquent, les résultats ne peuvent pas être généralisés à la population adulte / âgée ou à ceux ayant des syndromes d'épilepsie moins sévèresReference 757.
4.7 Douleur
Il est désormais bien établi que le SEC joue un rôle important dans la modulation des états nociceptifs et douloureux. Le positionnement précis de la machinerie de signalisation du SEC sur les synapses neuronales joue un rôle essentiel dans les voies de traitement de la douleur aux niveaux supraspinal, spinal et périphériqueReference 24Reference 758-Reference 760.
Rôle des récepteurs CB1 et CB2
Les récepteurs CB1 et CB2 jouent un rôle important dans la nociception et la douleur. Les structures intervenant dans la transmission et le traitement des signaux nociceptifs, comme les nocicepteurs, la corne dorsale de la moelle épinière, le thalamus, la substance grise périaqueducale, l'amygdale et la medulla ventromédiale rostrale, présentent un niveau d'expression modéré à élevé du récepteur CB1Reference 761. Dans divers modèles de douleur chronique chez des animaux, l'expression de l'ARNm et les niveaux de protéines des récepteurs CB1 et CB2 dans le SNC sont régulés à la hausseReference 761. La suppression sélective du récepteur CB1 chez la souris semble fortement atténuer l'efficacité antinociceptive des cannabinoïdes dans les modèles de douleur aiguë et chronique chez ces animaux, ce qui suggère que ce récepteur joue un rôle essentiel dans la modulation de la nociception et de la douleurReference 758Reference 762. Sur les terminaisons périphériques et centrales des nerfs sensoriels nociceptifs, les récepteurs CB1 bloquent la transduction de stimuli nocifs périphériques en des signaux neuronaux centraux de la douleurReference 758Reference 763, tandis que dans la moelle épinière, les récepteurs CB1 agissent pour réduire ou favoriser la propagation de signaux de la douleur dans le cerveauReference 758Reference 764-Reference 766. Au niveau du circuit neuronal, le résultat final de l'activité du récepteur CB1 peut être excitateur ou inhibiteur, selon l'identité de la cellule présynaptique et son emplacement dans le réseau neuronalReference 758. Dans des régions supérieures du cerveau dont la fonction consiste à traiter des afférences nociceptives telles que la substance grise périaqueducale et la medulla ventromédiale rostrale, les récepteurs CB1 peuvent déclencher une inhibition descendante ou bloquer la facilitation descendante vers les circuits nociceptifs de la moelle épinièreReference 758Reference 767-Reference 772. Plus important encore, en ce qui concerne la douleur, les récepteurs CB1 s'expriment grandement dans des voies fronto-limbiques dans le cerveau qui jouent un rôle essentiel dans les aspects affectifs et émotifs de la douleur chez les êtres humainsReference 758Reference 768Reference 773. Les récepteurs CB2 semblent également jouer un rôle important dans la signalisation de la douleur, notamment dans l'apparition d'états de douleur chronique, en inhibitant la libération de médiateurs pro-inflammatoires et pronociceptifs, atténuant donc les réactions inflammatoires et hyperalgésiquesReference 758Reference 774. À cet égard, la localisation stratégique des récepteurs CB2 sur diverses cellules immunitaires (macrophages, lymphocytes et mastocytes dans la périphérie), sur les astrocytes et les microglies dans le SNC (c.-à-d. la moelle épinière) est essentielle pour les rôles joués par les récepteurs CB2 dans la modulation des états douloureux.
Rôle des endocannabinoïdes, de l'anandamide et du 2-AG
Il a été démontré que les endocannabinoïdes, tels que l'anandamide et le 2-AG, ont des effets analgésiques ou antinociceptifs aux niveaux périphérique, spinal et central, principalement en raison de leur capacité à stimuler l'activité des récepteurs CB, bien que d'autres récepteurs (p. ex. TRPV1) interviennent aussi probablementReference 775. Il s'avère que l'inhibition périphérique des enzymes FAAH et MAGL (qui hydrolysent l'anandamide et le 2-AG respectivement) et l'augmentation qui en résulte des taux synaptiques de l'anandamide et du 2-AG réduit la nociception dans les modèles de douleur aiguë et chronique chez des animauxReference 758Reference 763Reference 776-Reference 787. Pendant ce temps, la fraction du arachidonoyl de l'anandamide et du 2-AG rend ces endocannabinoïdes sensibles au métabolisme par des enzymes biosynthétiques eicosanoïdes tels que les COXs, les lipo-oxygénases (LOXs) et les CYPs avec la production subséquente de métabolites endocannabinoïdes prostamides pro-nociceptifs potentiels ou connusReference 758Reference 788Reference 789. Donc la régulation positive de l'expression de la COX-2 dans les états de douleur chronique favoriserait la production supplémentaire de ces métabolites pro-nociceptifs de manière périphérique et centralisée et contribuerait ainsi à la nociception et à la douleurReference 761.
Considérations et mises en garde
Études chez l'animal c. chez l'humain
Des études précliniques chez l'animal prédisent que les cannabinoïdes devraient soulager autant la douleur aiguë que chronique chez l'humain. Toutefois, les résultats des modèles expérimentaux de la douleur chez les volontaires humains ainsi que des essais cliniques auprès des patients souffrant de douleur suggèrent que les cannabinoïdes seraient plutôt plus efficaces contre la douleur chronique qu'aiguë chez l'humainReference 790-Reference 792. Il pourrait y avoir un certain nombre d'explications pour justifier les divergences entre les résultats obtenus d'études effectuées chez des animaux et des essais cliniques auprès des humains. De telles justifications comprennent des variations inter-espèces, des différences de stimulis expérimentales et de protocoles auxquels les études ont eu recours, et des différences des résultats mesurés dans les études. Les données des modèles de douleur chez l'animal se fondent principalement sur des observations des changements comportementaux, et des doses des cannabinoïdes suffisantes pour favoriser une action anti-nociceptive pertinente chez les rongeurs sont semblable à celles qui entraînent d'autres effets comportementaux tels que l'hypomotilité et la catatonieReference 23Reference 793. Ce chevauchement pharmacologique peut rendre difficile la distinction entre les effets anti-nociceptifs associés aux cannabinoïdes et les effets comportementauxReference 23Reference 793.
Modèles expérimentaux de la douleur aiguë c. la douleur chronique
La traduction des résultats de recherches des modèles expérimentaux de la douleur chez l'humain (c.-à-d. la douleur aiguë) à la douleur (chronique) clinique est aussi complexe et non évidenteReference 264. Contrairement à la douleur aiguë, la douleur chronique est une condition complexe impliquant l'interaction des composantes sensorielles, affectives et cognitivesReference 264. En outre, contrairement à la douleur aiguë, la douleur chronique est considérée comme une maladie, qui généralement provient d'une douleur aiguë prolongée dont la prise en charge n'est pas assurée de façon rapide et efficaceReference 794. La douleur chronique semble faire appel à des mécanismes neuronaux spatiotemporels distincts qui diffèrent de ceux de la douleur aiguë et expérimentaleReference 795; la douleur chronique implique une transmission neurale altérée et des changements à long terme de la plasticité dans les systèmes nerveux central et périphérique qui génèrent et maintiennent l'état de la douleur chroniqueReference 794Reference 795. Alors, il s'avère difficile de comparer les études sur les interventions pour la douleur chronique à des études portant sur la douleur induite expérimentalement en raison des différences fondamentales quant à l'état physiologique des sujets, des différences relatives aux stimulis et aux protocoles expérimentaux auxquels les études ont eu recours et en raison des différences au niveau des résultats qui ont été mesurésReference 264.
Effet placebo
L'effet placebo est une autre considération à ne pas oublier lorsque l'on examine les études sur le cannabis et les cannabinoïdes pour le traitement de la douleur. L'effet placebo, un phénomène psychobiologique, est peut-être plus saillant pour des troubles ayant une composante subjective ou psychologique plus significative (p.ex. douleur, anxiété ou dépression) et pourrait n'être pas aussi saillant en ce qui concerne des maladies ayant une composante objective plus physiopathologique (p.ex. maladies infectieuses, cancer)Reference 796Reference 797. Il convient de noter que, dans une étude clinique randomisée à répartition aléatoire contrôlée par placebo portant sur le cannabis vaporisé pour le traitement d'une neuropathie diabétique douloureuse, l'effet du placebo était aussi élevé que 56 % pour l'euphorie et était aussi élevé que 37,5 % pour la somnolence d'un pourcentage maximal de réaction de 100 % pour l'euphorie et de 73,3 % pour la somnolence (observé avec la dose la plus élevée de THC de 7 %)Reference 592. Des preuves émergentes suggèrent aussi un rôle important pour le SEC dans la médiation des effets analgésiques des placebosReference 798-Reference 800. Ces observations soulignent les complexités de l'étude du véritable potentiel analgésique des cannabinoïdes et soulignent aussi l'importance d'inclure un groupe témoin contrôlé par placebo adéquat dans l'étude du potentiel analgésique des cannabinoïdes.
Population des patients ou sujets de l'étude
Beaucoup, voire la plupart des essais cliniques portant sur les cannabinoïdes pour le traitement de la douleur (et même d'autres troubles tels que la SP) ont recruté des patients ou des volontaires ayant été précédemment exposés au cannabis ou aux cannabinoïdes. Cela soulève la question de « levée de l'insu », car tout sujet de l'étude ayant précédemment fait l'expérience du cannabis ou des cannabinoïdes serait plus en mesure de faire la distinction entre un traitement actif avec ces drogues et un traitement au placeboReference 605. De plus, un nombre d'essais cliniques sur le traitement de la douleur (ou d'autres troubles) par le cannabis ou les cannabinoïdes ont eu recours à une « période ouverte » au cours de laquelle la qualité de patients ayant eu des réactions favorables au traitement a été enrichie et, inversement, les sujets éliminés auraient déjà mal réagi aux cannabinoïdes ou ils auraient eu amplement de temps d'en éprouver les effets indésirablesReference 55. Par conséquent, le recours aux personnes ayant précédemment fait l'expérience du cannabis ou des cannabinoïdes ou le recours à une « période ouverte » augmenterait la proportion des patients produisant des résultats qui tendent à surestimer certains bienfaits thérapeutiques potentiels du cannabis et des cannabinoïdes, tout en ayant tendance aussi à sous-estimer l'ampleur ou le degré d'effets indésirables au sein de la population de patients en généralReference 55Reference 605. Il existe aussi des données provenant d'études cliniques et précliniques qui suggèrent l'existence d'effets liés au sexe sur l'analgésie induite par le cannabis et les cannabinoïdes (consultez la Section 2.5,Effets selon le sexe pour plus de renseignements)Reference 557Reference 801-Reference 803.
Autres considérations
Il convient aussi peut-être de mentionner qu'un certain nombre d'essais cliniques laissent croire à une marge thérapeutique relativement étroite de l'usage du cannabis et des cannabinoïdes sur ordonnance pour le traitement de la douleurReference 23Reference 55Reference 57Reference 793. L'on sait que les effets secondaires psychotropes et somatiques très connus, liés à l'usage du cannabis enrichi en THC et des cannabinoïdes (p.ex. le dronabinol, le nabilone, le nabiximols) limitent l'utilité thérapeutique de ces drogues; il est donc suggéré qu'il serait souhaitable de recourir à des traitements axés sur la manipulation du SEC (p. ex. en inhibant les enzymes de dégradation des endocannabinoïdes, FAAH ou MAGL) ou de combiner de faibles doses de cannabinoïdes avec de faibles doses d'autres analgésiques pour atteindre l'effet thérapeutique souhaité tout en minimisant l'incidence, la fréquence et la gravité des effets indésirablesReference 23Reference 57.
Fort des considérations et des mises en garde susmentionnées, les sections suivantes résument les résultats des études ayant examiné le potentiel analgésique du cannabis et des cannabinoïdes dans des modèles précliniques et cliniques de la douleur aiguë induite expérimentalement, ainsi que des études cliniques sur la douleur chronique.
4.7.1 Douleur aiguë
- Les études précliniques suggèrent que certains cannabinoïdes peuvent bloquer les réactions à la douleur aiguë induite de façon expérimentale dans des modèles animaux.
- Les résultats provenant d'études cliniques avec du cannabis fumé, du THC oral, des extraits de cannabis et le nabilone sur la douleur aiguë induite expérimentalement chez des bénévoles humains en santé sont limités et mixtes et suggèrent des effets selon la dose dans certains cas : des doses plus faibles de THC semblent avoir un effet analgésique et des doses plus élevées semblent avoir un effet hyperalgésique.
- Les études cliniques sur certains cannabinoïdes (nabilone, THC oral, lévonontradol, AZD1940, GW842166) pour la douleur postopératoire suggèrent un manque d'efficacité.
4.7.1.1 Douleur aiguë induite de façon expérimentale
Études précliniques
La modulation cannabinergique des circuits neuronaux dans le cerveau et la moelle épinière peuvent inhiber le traitement des signaux nociceptifsReference 804-Reference 807 et un certain nombre d'études précliniques portent à croire que l'anandamide, le THC et certains cannabinoïdes synthétiques bloquent les réactions à la douleur dans différents modèles animaux de douleur aiguë (examiné enReference 23Reference 793).
Études cliniques avec le cannabis fumé
Une étude antérieure par Hill auprès de 26 hommes fumeurs du cannabis n'a pas démontré d'effet analgésique du cannabis fumé (1,4 % de Δ9-THC, 12 mg de Δ9-THC disponible dans la cigarette) en réponse à la stimulation électrique transcutanéeReference 808. Cette étude a néanmoins rapporté une augmentation de la sensibilité sensorielle et de la douleur au stimulus appliqué. En revanche, Milstein a démontré que le cannabis fumé (1,3 % de Δ9-THC, 7,5 mg de Δ9-THC disponible dans la cigarette) a accru la tolérance à la douleur d'un stimulus de pression chez des sujets n'ayant jamais consommé de cannabis et chez ceux qui en ont fait l'expérience, comparativement au placeboReference 809. Une autre étude impliquant des fumeurs de cannabis en santé a rapporté que la fumée des cigarettes du cannabis (contenant 3,55 % de Δ9-THC, ou environ 62 mg de Δ9-THC disponible dans la cigarette) a été associée à un faible effet antinocicepteur proportionnel à la dose en réponse à un stimulus thermiqueReference 269. Un essai par permutation et randomisé plus récent, mené à double insu et contrôlée avec placebo a examiné les effets de trois doses différentes de cannabis fumé sur la douleur intradermique provoquée par la capsaïcine et sur l'hyperalgésie chez 15 volontaires en santéReference 264. La capsaïcine a été administrée 5 ou 45 minutes après la fumée du cannabis. Les effets semblaient dépendre de la dose et du temps. Aucun effet n'a été observé cinq minutes après la fumée, mais l'analgésie a été observée 45 minutes après la fumée et seulement avec la dose médiane du cannabis fumé (4 % de Δ9-THC). La faible dose (2 % de Δ9-THC) n'a eu aucun effet tandis qu'une forte dose (8 % de Δ9-THC) a été associée à une hyperalgésie considérable. Cette étude a identifié une soi-disant « marge thérapeutique étroite »; une dose moyenne a offert des bénéfices analgésiques, une forte dose a aggravé la douleur et a été associée à des effets indésirables supplémentaires, et une faible dose n'a eu aucun effet.
Études cliniques avec le THC par voie orale et l'extrait de cannabis
Une étude en permutation et randomisée, menée à double insu et contrôlée avec placebo auprès de 12 volontaires en santé n'ayant jamais consommé de cannabis chez qui l'on a administré une seule dose par voie orale de 20 mg de Δ9-THC, a rapporté l'absence d'un effet analgésique significatif après exposition à une batterie de tests de douleur multi modèle (pression, chaleur, froid et stimulation électrique transcutanée)Reference 268. En outre, une hyperalgésie considérable a été observée dans le test de la douleur causée par la chaleur. Les effets secondaires psychotropes et somatiques étaient courants et comprenaient l'anxiété, des changements perceptifs, les hallucinations, des pensées, des idées, et l'humeur étranges, la désorientation, l'euphorie, les nausées, la céphalée et les étourdissements.
Une autre étude par permutation et randomisée, contrôlée avec placebo et témoin actif et à double insu auprès de 18 volontaires femelles en santé a signalé l'absence de l'analgésie ou de l'antihyperalgésie avec un extrait de cannabis par voie orale contenant 20 mg de THC et 10 mg de CBD (d'autres cannabinoïdes végétaux constituaient moins de 5 %) dans deux différents modèles expérimentaux de la douleur (de capsaïcine intradermique ou de coup de soleil)Reference 263. Des effets secondaires (sédation, nausées, étourdissements) ont été fréquemment observés. L'hyperalgésie a été aussi observée à la plus forte dose comme cela a été le cas dans l'étude dirigée par Wallace (ci-dessus)Reference 264.
Études cliniques avec le nabilone
Une étude par permutation, randomisée, menée à double insu et contrôlée avec placebo d'une dose unique par voie orale du nabilone (0,5 ou 1 mg) n'a indiqué aucun effet analgésique lors d'un stimulus de douleur tonique provoquée par la chaleurReference 810. Toutefois, un effet antihypéralgésique a été observé à la plus forte dose administrée mais seulement chez les femmes. Les auteurs ont relevé un effet placebo significatif et ont aussi suggéré que le manque d'effet analgésique pourrait avoir été dû à l'administration à dose unique du cannabinoïde; une augmentation progressive de la dose aurait pu éventuellement produire un effet.
Dans le même ordre d'idée, une étude par permutation, randomisée, menée à double insu et contrôlée avec placebo chez des sujets prenant une dose unique par voie orale du nabilone (1, 2 ou 3 mg) n'a indiqué aucun effet analgésique, ni d'effets antihyperalgésiques primaires ou secondaires en réponse à une douleur provoquée par la capsaïcine chez des volontaires mâles en santéReference 593. Des effets indésirables d'intensité légère à modérée ont été relevés chez la majorité des sujets. Des réactions indésirables sévères (p.ex. les étourdissements, la sédation, l'anxiété, l'agitation, l'euphorie, des perturbations perceptuelles et cognitives) ont été rapportées seulement à la plus forte dose d'administration (3 mg) chez quatre sujets, entraînant leur retrait de l'étude. Des effets sur le SNC proportionnels à la dose ont été observés 1,5 à 6 h après le dosage, jusqu'à une durée maximale entre 4 et 6 h après l'administration.
4.7.1.2 Douleur postopératoire
En dépit de l'introduction de nouvelles normes, des lignes directrices et des efforts éducatifs, les données indiquent que la douleur postopératoire continue d'être sous ou mal gérée et bon nombre de médicaments utilisés dans ce cadre ne sont pas suffisamment efficaces ou engendrent des effets secondaires inacceptablesReference 266Reference 811. À ce jour, il existe huit rapports publiés et une revue systématique sur l'usage du cannabis contre la douleur postopératoireReference 265-Reference 267Reference 270Reference 792Reference 812-Reference 815. Les conclusions de la revue systématique sont que les cannabinoïdes étudiés (THC, nabilone, ou un extrait de cannabis par voie orale contenant du THC et du CBD dans un rapport de 2 : 1, lévonontradol, AZD1940, GW842166) ne sont pas des substances idéales pour gérer la douleur postopératoire parce que leur efficacité est soit modéréeReference 266Reference 270, soit moins que le placeboReference 812, soit équivalente au placeboReference 267Reference 792Reference 813Reference 814, ou même antianalgésique à fortes dosesReference 265.
4.7.2 Douleur chronique
Une douleur aiguë mal gérée peut donner lieu à une douleur chroniqueReference 816Reference 817. Contrairement à la douleur aiguë, la douleur chronique est habituellement considérée comme étant une condition bien plus complexe impliquant des facteurs physiques, psychologiques et psychosociaux, et qui contribue à la diminution de la qualité de vieReference 818. L'Association internationale pour l'étude de la douleur considère que la douleur est chronique quand elle persiste au-delà de la période normale de guérison des tissus comprise entre trois et six moisReference 819. En outre, la douleur chronique est associée à un état de réactivité anormal ou à une hausse accrue des voies nociceptives dans le SNC (dénommé « sensibilisation centrale »), ainsi qu'à une modification du fonctionnement cognitifReference 819. Les renseignements ci-dessous résument les études précliniques menées sur des modèles animaux de douleur chronique et les études cliniques menées sur des patients humains à qui on a administré un stimulus expérimental imitant la douleur chronique ou des patients souffrant de douleur chronique d'étiologies différentes.
4.7.2.1 Douleur inflammatoire et neuropathique chronique induite expérimentalement
- Les endocannabinoïdes, le THC, le CBD, le nabilone et certains cannabinoïdes synthétiques ont tous été identifiés comme possédant des effets antinociceptifs dans des modèles animaux de douleur chronique (inflammatoire et neuropathique).
L'efficacité anti-nociceptive des cannabinoïdes a été catégoriquement démontrée dans plusieurs modèles animaux de douleur inflammatoire et neuropathique (examiné enReference 761Reference 775Reference 820Reference 821). De plus, les conclusions de ces études suggèrent que la modulation du SEC, par l'administration d'agonistes des récepteurs cannabinoïdes spécifiques ou par l'élévation des niveaux d'endocannabinoïdes, supprime l'hyperalgésie et l'allodynie induites par divers états neuropathiques (examiné enReference 761Reference 775Reference 821). Ainsi donc, comme dans le cas de la douleur aiguë, des études précliniques de la douleur chronique chez des modèles animaux suggèrent que les endocannabinoïdes (l'anandamide et le 2-AG), le THC et plusieurs cannabinoïdes synthétiques ont des effets bénéfiques (examiné enReference 23Reference 793Reference 821).
En ce qui concerne le CBD, son administration chronique par voie orale ait effectivement diminué l'hyperalgésie sur un modèle de la douleur inflammatoire chez le ratReference 822. Une étude suggère qu'une dose moyenne ou forte de CBD atténuait l'allodynie tactile et l'hypersensibilité thermique chez le modèle murin de la neuropathie diabétique lorsqu'elle était administrée au tout début de la maladie. En revanche, il y avait peu, voire pas, d'effet régénérateur quand le CBD était administré ultérieurementReference 823. À l'inverse, la même étude a démontré que le nabilone n'a pas été aussi efficace que le CBD lorsqu'il a été administré au tout début, mais il a semblé avoir un faible effet bénéfique lorsqu'il était administré plus tard au cours de la maladie. Le CBD a semblé aussi atténuer la microgliose dans la partie lombaire ventrale de la moelle épinière, mais seulement quand il a été administré au tout début de la maladie, tandis que le nabilone n'a eu aucun effet. Xiong et coll. (2012) signalent que l'administration systémique et intrathécale du CBD amplifie les courants induits par la glycine, par l'intermédiaire de récepteurs à glycine α3, dans les neurones de la corne dorsale de coupes de moelle épinière chez le rat et atténue aussi la douleur inflammatoire et neuropathique chronique in vivoReference 824.
4.7.2.2 Douleur neuropathique et douleur chronique non cancéreuse chez l'humain
- Quelques études ayant utilisé des méthodes expérimentales possédant de la validité prédictive pour les pharmacothérapies utilisées pour soulager la douleur chronique ont signalé des effets analgésiques du cannabis fumé.
- De plus, il existe des preuves plus cohérentes de l'efficacité des cannabinoïdes (cannabis fumé ou vaporisé, nabiximols, dronabinol) dans le traitement de la douleur chronique d'étiologies différentes, surtout dans des cas où des traitements traditionnels ont été essayés et ont échoué.
Études cliniques avec des cannabinoïdes
Une méta-analyse et une analyse systématique de 28 essais randomisés contrôlés (ERC) (N = 2 454 participants) portant sur la douleur chronique (y compris le cannabis fumé, le nabiximols, le dronabinol) ont révélé qu'il existait des données de qualité modérée de l'efficacité permettant d'appuyer l'utilisation de cannabinoïdes dans le traitement de la douleur chronique d'étiologies diverses, soulageant principalement la douleur neuropathique centrale ou périphérique dans des individus recevant déjà des médicaments analgésiquesReference 174. La définition de travail de la douleur chronique comprend la douleur neuropathique (centrale, périphérique), la douleur cancéreuse, la neuropathie diabétique périphérique, la fibromyalgie, la neuropathie sensorielle associée au VIH, la douleur réfractaire due à la SP ou à une autre maladie neurologique, la polyarthrite rhumatoïde, la douleur non cancéreuse (nociceptive/neuropathique), la douleur centrale, la douleur musculo-squelettique et la douleur provoquée par une chimiothérapie. Le nombre moyen de patients ayant signalé une diminution de la douleur d'au moins 30 % a été plus élevé avec les cannabinoïdes par rapport au placebo (RC = 1,41), bien que le cannabis fumé ait un effet plus important (RC = 3,43). Les effets secondaires semblaient être comparables aux traitements actuels et comprennent des étourdissements, des sensations de faiblesse, des nausées, des sensations de fatigue, de la somnolence, des sensations d'euphorie, des vomissements, la désorientation, l'endormissement, la confusion, la perte d'équilibre, les hallucinations, la sédation, l'ataxie, les sensations d'intoxication, de xérostomie, de dysgueusie et de faim Reference 167Reference 171Reference 1660Reference 1661. Cependant, ces effets secondaires peuvent être mitigés en consommant de faibles doses de cannabinoïdes, qui peuvent être augmentées de façon graduelle, selon le besoin.
La partie suivante résume les données cliniques existantes sur l'utilisation du cannabis fumé/vaporisé et des cannabinoïdes (THC, nabilone, dronabinol et nabiximols) dans le traitement d'une douleur neuropathique et chronique non cancéreuse.
Études cliniques avec le cannabis fumé ou vaporisé
Une étude clinique intra-sujets à répartition aléatoire contrôlée par placebo, à double placebo et à double insu, a comparé le potentiel analgésique thérapeutique aigu de deux concentrations de cannabis fumé (1,98 % et 3,56 % de THC, cigarettes de 800 mg avec 16 mg et 28 mg de THC respectivement) avec deux doses de dronabinol (10 et 20 mg) en réponse à un stimulus douloureux expérimental (c.-à-d. épreuve au froid) qui possède une validité prédictive pour les pharmacothérapies utilisées pour traiter la douleur chroniqueReference 825. L'étude a observé que le cannabis et le dronabinol produisaient des effets analgésiques dans ce modèle et qu'il n'existait aussi de différences significatives entre le dronabinol et le cannabis fumé dans les mesures de sensibilité à la douleur (p. ex. latence avant de ressentir de la douleur en premier lieu). Cependant, en ce qui concerne la tolérance à la douleur, une faible concentration de cannabis fumé (1,98 % de THC) et des doses faibles et élevées de dronabinol ont augmenté la latence avant la signalisation d'une douleur par rapport au placebo. Les deux concentrations de cannabis et la dose élevée de dronabinol (20 mg) ont réduit les évaluations subjectives de l'intensité de la douleur et l'aspect importun de l'épreuve au froid par rapport au placebo, bien que ces réductions étaient plus élevées après la consommation de cannabis comparativement au dronabinol. Les deux concentrations de cannabis et la dose élevée de dronabinol ont augmenté les évaluations subjectives du « high » et de l'« effet plaisant de la drogue » par rapport au placebo et les deux concentrations de cannabis (mais pas la dose faible de dronabinol) ont augmenté les évaluations de la sensation d'être « stimulé » par rapport au placebo. Enfin, les deux concentrations de cannabis et la dose élevée de dronabinol ont augmenté les évaluations relatives des cotes de « puissance de la marijuana », « aime » et à la « volonté d'en reprendre ». Il ne semblait pas exister de différences liées au sexe en ce qui concerne les mesures de référence de la douleur, les effets analgésiques, subjectifs ou physiologiques dans l'ensemble des conditions de cannabis ou de dronabinol. Dans l'ensemble, le dronabinol a diminué la sensibilité à la douleur et augmenté la tolérance à celle-ci et ces effets ont atteint leur plus haut niveau plus tardivement et ont duré plus longtemps comparativement au cannabis fumé, tandis que ce dernier a produit une atténuation plus importante des évaluations subjectives de l'intensité de la douleur comparativement au dronabinol. Les évaluations subjectives maximales des effets thérapeutiques du dronabinol se sont produites beaucoup plus tôt par rapport à la diminution de la sensibilité à la douleur et à l'augmentation de la tolérance à la douleur (60 min p/r à 4 h). Les limites de cette étude comprennent notamment une population de l'étude biaisée potentielle composée de consommateurs quotidiens de cannabis et la nature expérimentale du stimulus douloureux chez des sujets n'éprouvant généralement pas de douleur.
Une analyse rétrospective comparant les effets analgésiques, subjectifs et physiologiques du cannabis fumé (3,56 ou 5,60 % de THC dans des cigarettes de 800 mg avec 28 mg et 45 mg de THC respectivement) dans 21 hommes et 21 femmes sous des conditions à double insu et contrôlée par placebo a démontré que parmi les hommes le cannabis a considérablement réduit leur sensibilité à la douleur au cours d'épreuves au froid comparativement au placebo tandis que chez les femmes le cannabis actif n'a pas réussi à réduire la sensibilité à la douleur comparativement au placeboReference 803. Le cannabis actif a augmenté la tolérance à la douleur pour les hommes et les femmes immédiatement après être fumé ainsi qu'une augmentation des cotes subjectives associées aux tendances à l'abus (« consommerai à nouveau », « aime », « bon effet de drogue »), de la puissance de la drogue et du « high » comparativement au placebo. Les cotes du « high » variaient selon le sexe, les hommes démontraient des cotes plus élevées au cours de la séance comparativement aux femmes. Les hommes démontraient aussi de plus grandes augmentations de la fréquence cardiaque après avoir fumé du cannabis comparativement aux femmes. Les participants de l'étude ont fumé du cannabis chaque jour ou presque et fumaient en moyenne de 7 à 10 cigarettes de cannabis par jour.
Dans une étude randomisée et contrôlée avec placebo, l'on a signalé une diminution de plus de 30 % de la douleur neuropathique sensorielle associée au VIH chez 52 % des patients fumant une cigarette de cannabis contenant 3,56 % de Δ9-THC (32 mg de Δ9-THC total disponible par cigarette) trois fois par jour (teneur totale quotidienne de 96 mg de Δ9-THC) pendant cinq jours, comparativement à une baisse de 24 % de la douleur dans le groupe placeboReference 190. Le NST afin de réduire de 30 % la douleur était de 3,6 et comparable à celui signalé pour les autres analgésiques dans le traitement de la douleur neuropathique chronique. Dans la portion de l'étude portant sur « la douleur induite de façon expérimentale » le cannabis fumé n'a pas été associé à une différence statistiquement importante en ce qui concerne le seuil de la douleur aiguë provoquée par la chaleur comparativement au placebo. Toutefois, il semblait réduire la surface de la chaleur ainsi que hyperalgésie secondaire induite par la capsaïsine. Les patients prenaient d'autres médicaments contre la douleur pendant l'essai tels que des opioïdes, la gabapentine ou d'autres drogues. Les effets indésirables du cannabis fumé dans cette étude comprenaient la sédation, les étourdissements, la confusion, l'anxiété et la désorientation.
Une autre étude menée par permutation, randomisée et à double insu et contrôlée avec placebo auprès des patients ayant déjà fait l'expérience du cannabis, souffrant de la douleur neuropathique d'étiologies diverses (syndrome de douleur régionale complexe (SDRC), douleur neuropathique centrale consécutive au TM ou à la SP, ou de la douleur neuropathique périphérique consécutive au diabète ou aux lésions nerveuses) a rapporté que l'administration d'une faible ou une forte dose du cannabis fumé (3,5 % de Δ9-THC, 19 mg de Δ9-THC total disponible; ou 7 % de Δ9-THC, 34 mg de Δ9-THC total disponible) était associée à des diminutions équianalgésiques statistiquement significatives de la douleur neuropathique centrale et périphériqueReference 217. Aucun effet analgésique n'a été observé dans des tests de douleur induite de façon expérimentale (stimuli tactile ou thermique) chez ces participants. Les patients prenaient d'autres médicaments contre la douleur pendant l'essai tels que des opioïdes, des antidépressifs, des AINS, ou des anticonvulsivants. Les effets indésirables associés à l'usage du cannabis semblaient dépendre de la dose et comprenaient la sensation de « high », la sédation, la confusion, et la déficience neurocognitive. Des changements cognitifs semblaient être plus accentués avec de fortes doses de Δ9-THC.
Un essai clinique par permutation de phase II mené à double insu et contrôlé contre placebo du cannabis fumé contre la douleur neuropathique réfractaire associée au VIH a rapporté une diminution de 30 % de la douleur polyneuropathique sensorielle distale prédominante associée au VIH chez 46 % des patients ayant fumé du cannabis pendant cinq jours (1 à 8 % de Δ9-THC, q.i.d.) par rapport à une baisse de 18 % dans le groupe placeboReference 277. Le NST dans cette étude était de 3,5. La quasi-totalité des sujets avaient déjà été exposés au cannabis et consommaient en même temps d'autres analgésiques tels que des opioïdes, des médicaments AINS, des antidépressifs, et des anticonvulsivants. L'on a signalé que les effets indésirables associés à l'usage du cannabis ont été fréquents avec une tendance d'effets indésirables modérés ou sévères pendant la phase de traitement actif comparativement au placebo.
Une étude clinique par permutation, randomisée, menée en quatre périodes à double insu et contrôlée avec placebo du cannabis fumé contre la douleur neuropathique chronique causée par le traumatisme ou la chirurgie réfractaire aux thérapies conventionnelles a rapporté que par rapport au placebo, une seule exposition par inhalation de 25 mg de cannabis fumé contenant 9,4 % de Δ9-THC (2,35 mg de Δ9-THC total disponible par cigarette) trois fois par jour (7,05 mg de Δ9-THC total par jour) pendant cinq jours a été associée à une baisse modeste mais statistiquement significative de l'intensité de la douleur moyenne quotidienneReference 59. De plus, il y a eu des améliorations statistiquement significatives au niveau des mesures de la qualité du sommeil et de l'anxiété avec le cannabis. La majorité des sujets avaient déjà été exposés au cannabis et la plupart d'entre eux prenaient en même temps d'autres analgésiques tels que des opioïdes, des antidépressifs, et des anticonvulsivants, ou des médicaments AINS. Les effets indésirables associés à l'usage du cannabis comprenaient des céphalées, un assèchement des yeux, une sensation de brûlure dans les voies respiratoires supérieures (gorge), des étourdissements, des engourdissements et une toux.
Une étude clinique a examiné les effets du cannabis vaporisé sur la pharmacocinétique, les effets subjectifs, les cotes de douleur et l'innocuité des opioïdes administrés par voie orale des patients souffrant de la douleur chronique (musculosquelletique, post-traumatique, arthritique, neuropathique périphérique, cancéreuse, fibromyalgique, causée par la SP, la drépanocytose, et par le syndrome du défilé thoraco-brachial)Reference 276. L'étude a rapporté que l'inhalation du cannabis vaporisé (900 mg, 3,56 % de Δ9-THC) trois fois par jour pendant cinq jours a été associée à une baisse statistiquement significative de la douleur (27 %, IC = 9 - 46). Les sujets prenaient des doses stables à libération soutenue de sulfate de morphine ou d'oxycodone et avaient déjà précédemment consommé du cannabis. Il y a eu une diminution statistiquement importante de la Cmax de sulfate de morphine, mais pas d'oxycodone pendant l'exposition au cannabis. Aucun effet indésirable cliniquement important n'a été relevé, mais tous les sujets ont rapporté avoir ressenti le « high ». La méthodologie de l'étude comportait un certain nombre de limitations dont la petite taille d'échantillon, la courte durée, population de sujet non randomisée, et l'absence d'un placebo.
Une étude par permutation menée à double insu et contrôlée avec placebo auprès de patients souffrant de la douleur neuropathique d'étiologies diverses (p.ex. le TM, le SDRC de type 1, la causalgie (SDRC type 2), la neuropathie diabétique, la SP, la névralgie post-herpétique, la neuropathie périphérique idiopathique, la plexopathie brachiale, la radiculopathie lombosacrale, et la neuropathie post-AVC) a rapporté que l'inhalation du cannabis vaporisé (800 mg contenant une faible dose de Δ9-THC (1,29 % de Δ9-THC; teneur totale disponible de Δ9-THC de 10,3 mg) ou une dose moyenne de Δ9-THC (3,53 % de Δ9-THC; teneur totale disponible de Δ9-THC de 28,2 mg)) pendant trois séances séparées de 6 h chacune a été associée à une réduction statistiquement significative de l'intensité de la douleurReference 591. L'inhalation s'est effectuée selon un protocole normalisé (c.-à-d. « la procédure Foltin ») : il a été signalé verbalement aux participants de tenir le sac du vaporisateur d'une main et de mettre son embouchure dans la bouche, lorsque prêt, d'inhaler (5 s), de retenir la vapeur dans leurs poumons (10s), et enfin d'expirer et d'attendre avant de répéter le cycle de l'inhalation (40s). Des différences non significatives ont été constatées entre le placebo et les traitements actifs en ce qui concerne les cotes d'évaluation de la douleur à la 60e minute suivant le lancement de la séance de l'étude. Après quatre inhalations suivant un signal de l'une ou l'autre dose de THC à la 60e minute, un effet du traitement significatif a été noté 60 minutes plus tard (c.-à-d. à la 120e minute après le lancement de l'essai). Une deuxième inhalation du cannabis vaporisé suivant le signal à la 180e minute après le lancement de l'essai (quatre à huit bouffées, dosage flexible, deux heures suivant la première inhalation) a été associée à une analgésie continue d'une durée supplémentaire de deux heures. Les deux doses : 1,29 % et 3,53 % de Δ9-THC étaient équianalgésiques et nettement meilleures que le placebo pour atteindre l'analgésie. Le NST pour une réduction de la douleur de l'ordre de 30 % était de 3,2 pour la faible dose contre le placebo, 2,9 pour la dose moyenne contre le placebo et 25 pour la dose moyenne contre la faible dose. Les auteurs suggèrent que les conditions des NST pour le traitement actif contre le placebo sont dans la fourchette de deux anticonvulsivants couramment utilisés pour le traitement de la douleur neuropathique (prégabaline, 3,9; gabapentine, 3,8). En se servant du Global Impression of Change rating scale [échelle d'évaluation de l'impression globale du patient à propos de l'évolution de son état], le soulagement de la douleur semblait être maximal après le deuxième dosage à 180 minutes, s'estompant entre une et deux heures plus tard. Les deux doses actives ont produit des effets équivalents dans l'évaluation de « l'acuité » de la douleur, tandis que la faible dose a été plus efficace que le placebo ou la dose moyenne contre la douleur décrite comme étant une douleur « brûlante » ou « lancinante ». Tous les sujets avaient déjà été exposés au cannabis et ils prenaient en même temps d'autres médicaments (opioïdes, anticonvulsivants, antidépressifs et médicaments AINS). Le traitement au cannabis a été associé à une faible déficience de certaines fonctions cognitives, les effets les plus importants étant observés dans les domaines d'apprentissage et de mémoire. L'étude a connu un certain nombre d'inconvénients dont le nombre relativement réduit de patients, une période d'étude courte, et l'éventualité de la levée de l'insu lors du traitement.
Une analyse de l'utilisation du cannabis fumé pour le traitement d'une douleur neuropathique suggère que l'efficacité du cannabis fumé (NST = 3,6, pour une diminution de 30 % de la douleur) est comparable à celle d'agents thérapeutiques classiques (p. ex. gabapentine, NST = 3,7), ce qui est légèrement inférieur à l'efficacité observée avec des antidépresseurs tricycliques (NST = 2,2), mais supérieur à l'efficacité de la lamotrigine (NST = 5,4) et des inhibiteurs sélectifs de la recapture de la sérotonine (NST = 6,7)Reference 826. L'auteur indique que les concentrations de THC dans le cannabis fumé variaient entre 2 et 9 %, une concentration moyenne de 4 % permettant d'atteindre une bonne efficacité. En outre, l'auteur indique que le cannabis pourrait constituer un traitement de substitution ou d'appoint raisonnable pour les patients atteints d'une neuropathie périphérique réfractaire sévère qui ont essayé d'autres approches thérapeutiques sans obtenir de résultats satisfaisants. Cet examen, avec un autre examen plus récentReference 271 offrent un algorithme clinique utile pour déterminer si un patient est un candidat au traitement au cannabis contre la douleur neuropathique périphérique (voir Figure 3).
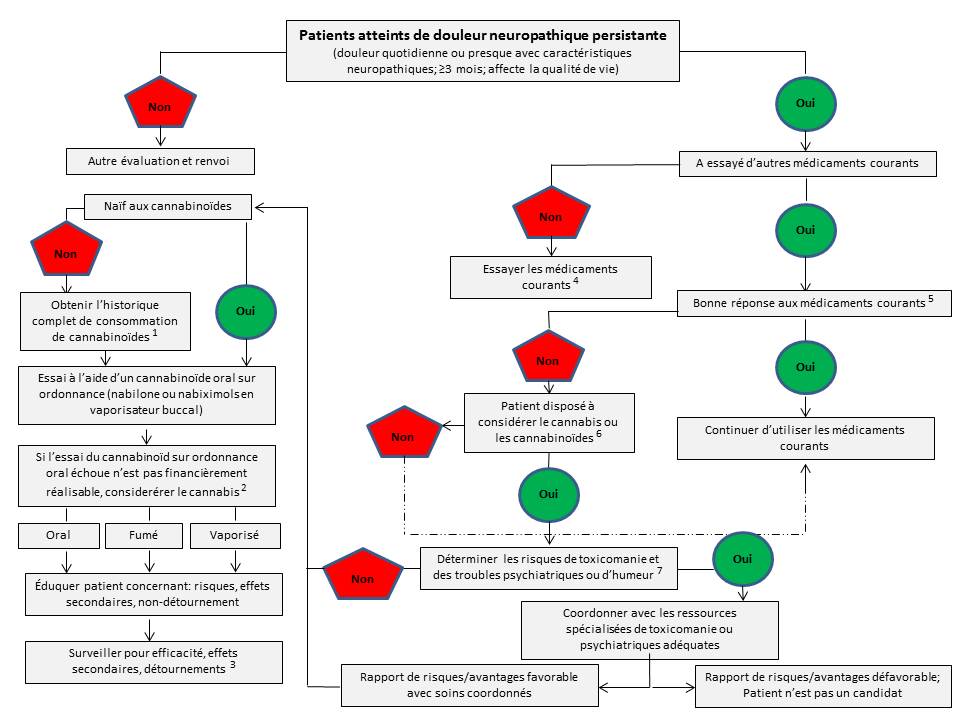
Figure 3 - Équivalent textuel
Déterminer si le patient est atteint de douleur neuropathique persistante. Les critères de dépistage de la douleur neuropathique persistante comprennent une douleur quotidienne ou presque avec les caractéristiques neuropathiques typiques; une durée d'au moins trois mois; et un impact sur la qualité de vie du patient. Si le patient ne satisfait pas les critères de dépistage de la douleur neuropathique persistante, procéder à une autre évaluation et faites un renvoi à un autre professionnel de la santé. Si le patient satisfait les critères de dépistage de la douleur neuropathique persistante, déterminer si le patient a essayé d'autres médicaments courants. Si non, essayer les médicaments courants. (Note a : Les médicaments courants comprennent les antidépresseurs, les anticonvulsants, les opiacés, les anti-inflammatoires non stéroïdiens). Si oui, déterminer s'il y a, ou s'il y a eu, une bonne réponse aux médicaments courants. (Note b : Au moins 30 % de réduction de l'intensité de la douleur). Si oui, continuer d'utiliser les médicaments courants. Si non, déterminer si le patient est disposé à considérer le cannabis ou les cannabinoïdes. (Note c : Considérer les antécédents de consommation de cannabis ou de cannabinoïdes, les effets secondaires potentiels ou les antécédents d'effets secondaires, la volonté de fumer/vaporiser/prendre oralement). Si non, envisager de continuer les médicaments courants. Si oui, déterminer s'il y a des risques de toxicomanie et de troubles psychiatriques ou de l'humeur. (Note d : Déterminer l'historique complet de toxicomanie et de troubles psychiatriques ou de l'humeur. Si oui ou s'il y a un risque élevé de toxicomanie, agir avec prudence et attention particulière (consulter les Sections 2.4, 5.0 et 6.0); coordonner avec les programmes de traitement de la toxicomanie. S'il existe des antécédents ou des risques de troubles psychiatriques (schizophrénie) ou bipolaires, consulter la Section 7.7.3 et consulter un spécialiste en psychiatrie avant de poursuivre). Si oui, coordonner avec les ressources spécialisées de toxicomanie ou psychiatriques adéquates pour déterminer si le rapport de risques/avantages est favorable avec des soins coordonnés. S'il est défavorable, le patient n'est pas un candidat pour le cannabis ou les cannabinoïdes. S'il est favorable ou s'il n'y a pas de risque de toxicomanie et de troubles psychiatriques ou de l'humeur, déterminer si le patient est naïf au cannabis ou aux cannabinoïdes. Si non, obtenir l'historique complet de consommation de cannabinoïdes. (Note e : Cannabinoïde particulier, dose, voie d'administration; symptômes traités et résultats; effets néfastes). Si le patient est naïf au cannabis ou aux cannabinoïdes ou une fois que l'historique complet de consommation de cannabinoïdes d'un patient non naïf a été obtenu, essayer un cannabinoïde oral sur ordonnance, comme le nabilone ou le nabiximols en vaporisateur buccal. Si l'essai avec le cannabinoïde oral sur ordonnance échoue ou si ce n'est pas financièrement réalisable, considérer le cannabis. (Note f : Discuter du fait qu'il n'existe toujours pas de lignes directrices claires concernant l'efficacité, le dosage et la toxicité; accroître la sensibilisation aux voies d'administration de cannabis oral et vaporisé; diriger les patients vers le site Web et les documents de Santé Canada concernant l'accès aux produits de cannabis; suivre les lignes directrices cliniques habituelles d'introduction par dose faible pour ensuite titrer la dose lentement). Le cannabis peut être administré oralement, en fumant ou en vaporisant. Il est important d'éduquer le patient concernant les risques, les effets secondaires et le non-détournement du cannabis. Finalement, surveiller le patient pour déterminer l'efficacité, les effets secondaires et les détournements du cannabis et ajuster en fonction les traitements. (Note g : L'efficacité visée devrait être une réduction de l'intensité de la douleur d'au moins 30 %).
Légende :
a Les médicaments courants comprennent les antidépresseurs, les anticonvulsivants, les opiacés, les anti-inflammatoires non stéroïdiens.
b Au moins 30 % de réduction de l'intensité de la douleur.
c Considérer les antécédents de consommation de cannabis ou de cannabinoïdes, les effets secondaires potentiels ou les antécédents d'effets secondaires, la volonté de fumer/vaporiser/prendre oralement.
d Déterminer l'historique complet de toxicomanie et de troubles psychiatriques ou de l'humeur. Si oui ou s'il y a un risque élevé de toxicomanie, agir avec prudence et attention particulière (consulter les Sections 2.4, 5.0 et 6.0); coordonner avec les programmes de traitement de la toxicomanie. S'il existe des antécédents ou des risques de troubles psychiatriques (schizophrénie) ou bipolaires, consulter la Section 7.7.3 et consulter un spécialiste en psychiatrie avant de poursuivre.
e Cannabinoïde particulier, dose, voie d'administration; symptômes traités et résultats; effets néfastes.
f Discuter du fait qu'il n'existe toujours pas de ligne directrice claire concernant l'efficacité, le dosage et la toxicité; accroître la sensibilisation aux voies d'administration de cannabis oral et vaporisé; diriger les patients vers le site Web et les documents de Santé Canada concernant l'accès aux produits de cannabis; suivre les lignes directrices cliniques habituelles d'introduction par dose faible pour ensuite titrer la dose lentement.
g L'efficacité visée devrait être une réduction de l'intensité de la douleur d'au moins 30 %.
Une étude clinique ouverte à dose unique menée chez des patients souffrant de douleur neuropathique et consommant de très faibles doses de THC (provenant du cannabis vaporisé) révèle une amélioration statistiquement significative de la douleur neuropathique accompagnée d'effets indésirables minimesReference 58. Dans cette étude clinique, 10 patients souffrant d'un type quelconque de douleur neuropathique (TM, SDRC, radiculopathie lombosacrale, douleur neuropathique pelvienne) perdurant au moins trois mois qui ont reçu un régime analgésique stable pendant au moins 60 jours (p. ex. opioïdes, antidépresseurs, anticonvulsivants, benzodiazépines, stéroïdes, AINS, cannabis) ont reçu une dose vaporisée de 3 mg de THC (disponible dans l'appareil; ~ 1,5 mg de THC effectivement produit) découlant de la vaporisation de 15 mg de cannabis séché contenant 20 % de THC. L'administration de THC a été associée à une diminution statistiquement significative de l'intensité de référence de la douleur selon l'EVA de 3,4 points (c.-à-d. une réduction de 45 % de la douleur) dans les 20 minutes suivant l'inhalation, avec un retour à la valeur de référence dans les 90 minutes suivantes. Les effets indésirables étaient minimes, mais ils comprenaient des étourdissements, dans les dix minutes suivant l'inhalation, qui ont duré environ 30 minutes et se sont ensuite totalement résorbés. Les sujets ont déclaré consommer entre 2 et 40 g de cannabis par mois (c.-à-d. 0,067 g par jour et 1,3 g par jour). Du THC a été décelé dans le sang dans la première minute suivant l'inhalation et elle a atteint un niveau maximal dans les trois minutes suivantes, à une concentration moyenne de THC de 38 ng/mL.
Une étude canadienne de cohorte multicentrique, prospective sur l'innocuité menée auprès de patient utilisant du cannabis dans le cadre de leur régime de gestion de la douleur pour lutter contre une douleur chronique non cancéreuse révèle que l'utilisation du cannabis n'a pas été associée à une augmentation de la fréquence d'événements indésirables graves par rapport aux témoins, mais qu'elle a été associée à une augmentation de la fréquence d'événements indésirables non gravesReference 211. Dans cette étude, 216 patients souffrant d'une douleur chronique non cancéreuse (nociceptive, neuropathique ou les deux) consommateurs de cannabis et 215 patients du groupe témoin ayant une douleur chronique et non consommateurs de cannabis, ont fait l'objet d'un suivi pendant une période d'un an et ont subi une évaluation afin de connaître la fréquence et le type d'événements indésirables associés à l'utilisation d'un produit normalisé de cannabis végétal (CanniMed comportant 12,5 % de THC, < 0,5 % de CBD). Une proportion importante des sujets de l'étude prenaient des opioïdes, des antidépresseurs ou des anticonvulsivants. Près d'un tiers des sujets de l'étude ayant signalé fumer du cannabis au moins une fois ont déclaré en consommer exclusivement par la fumée, 44 % ont indiqué en consommer par la fumée et l'ingestion orale, 14 % ont déclaré vaporiser, fumer ou ingérer du cannabis par voie orale et un peu moins de 4 % ont indiqué en consommer uniquement par la fumée ou la vaporisation. Les objectifs secondaires visaient à examiner les effets de la consommation de cannabis sur la fonction pulmonaire et neurocognitive et à étudier l'efficacité du cannabis contre la douleur chronique non cancéreuse, y compris l'intensité de la douleur et la QV. Pour le résultat principal, le nombre total d'événements indésirables graves était similaire entre le groupe prenant du cannabis et le groupe témoin et aucun événement indésirable grave n'a été jugé « certainement » ou « très probablement » lié au cannabis fourni par les enquêteurs. Un événement indésirable grave (convulsion) a été considéré comme étant « probablement » lié au cannabis administré dans le cadre de l'étude. Les patients du groupe de traitement au cannabis ont éprouvé une médiane de trois événements par sujet (p/r à une médiane de deux événements par sujet dans les groupes témoins). Le taux d'incidence d'événements indésirables dans le groupe de traitement au cannabis était de 4,61 événements par année-personne et il a été considérablement plus élevé par rapport au groupe témoin où le taux d'incidence était de 2,85 événements par année-personne. Les catégories d'événements indésirables les plus courantes parmi le groupe de traitement au cannabis ont été les troubles du système nerveux (20 %), les troubles GI (13,4 %) et les troubles respiratoires (12,6 %) et le taux relatif aux troubles du système nerveux, aux troubles respiratoires, aux infections et aux troubles psychiatriques s'est avéré considérablement plus élevé dans le groupe traité au cannabis par rapport au groupe témoin. En outre, les événements indésirables légers (51 %) et modérés (48 %) ont été plus courants que les événements graves (10 %) dans le groupe traité au cannabis. La somnolence (0,6 %), l'amnésie (0,5 %), la toux (0,5 %), les nausées (0,5 %), les étourdissements (0,4 %), l'humeur euphorique (0,4 %), l'hyperhidrose (0,2 %) et la paranoïa (0,2 %) ont été jugés « certainement/très probablement » liés au traitement au cannabis. L'augmentation de la dose quotidienne de cannabis n'a pas été associée à un risque plus élevé d'événements indésirables graves et non graves, bien que la quantité maximale quotidienne recommendée de cannabis ait été fixée à 5 g par jour (la dose médiane quotidienne de cannabis était de 2,5 g par jour). En ce qui a trait aux paramètres secondaires, aucune différence dans la fonction neurocognitive n'a été observée entre les utilisateurs de cannabis et les témoins, après un an de traitement et après avoir contrôlé plusieurs facteurs de confusion potentiels. Aucune modification significative n'a été constatée dans certains tests sur la fonction pulmonaire (capacité vitale lente, capacité résiduelle fonctionnelle, capacité pulmonaire totale) au cours de la période de l'étude, bien que des réductions aient été observées dans le volume résiduel, le volume expiratoire maximal par seconde (VEMS) et dans le rapport VEMS/ capacité vitale forcée (CVF) (diminution de 0,78 %). Aucun changement n'a été remarqué dans les fonctions hépatiques, rénales ou endocrines. En ce qui concerne l'efficacité contre la douleur, comparativement au début de l'étude, une réduction significative de l'intensité de la douleur moyenne a été constatée dans le groupe de traitement au cannabis, mais pas dans le groupe témoin (différence = 1,10). Les patients consommant notamment du cannabis ont éprouvé une douleur et une incapacité de référence plus élevées par rapport aux témoins. Même s'il existait une amélioration significative par rapport à l'intensité de la douleur de référence dans le groupe témoin et dans le groupe de traitement au cannabis, une amélioration plus importante de la fonction physique a été observée dans le groupe traité au cannabis par rapport au groupe témoin. Enfin, la composante sensorielle de la douleur et le score total de détresse liée aux symptômes [Edmonton Symptom Assessment System, ESAS] ainsi que l'échelle globale des troubles de l'humeur du profil des états d'humeur [Profile of Mood States, POMS] ont révélé une amélioration dans le groupe traité au cannabis par rapport au groupe témoin. Les limites de l'étude comprennent notamment la taille relativement réduite de l'échantillon et la courte période de suivi qui ont empêché la détermination d'événements indésirables graves rares, un taux d'abandon important attribuable à des événements indésirables (surtout chez les patients n'ayant jamais été traités au cannabis et chez les anciens utilisateurs), l'absence d'efficacité perçue et/ou l'aversion à l'égard du produit de l'étude. La plupart (66 %) des sujets du groupe traité au cannabis étaient des consommateurs de cannabis expérimentés et les auteurs de l'étude avancent qu'un taux plus élevé d'événements indésirables concernant le cannabis aurait été observé si seuls de nouveaux utilisateurs du cannabis avaient été inclus. Par conséquent, les résultats de l'étude concernant l'innocuité de l'utilisation du cannabis contre la douleur chronique non cancéreuse ne peuvent pas être appliqués aux patients n'ayant jamais été traités au cannabis. Enfin, il ne s'agissait pas d'une étude contrôlée à répartition aléatoire et la répartition n'a pas été effectuée à l'insu. Par conséquent, les améliorations des mesures d'efficacité secondaires doivent être interprétées avec prudence.
Une méta-analyse d'études à répartition aléatoire, à double insu et contrôlées par placebo portant sur le cannabis fumé ou vaporisé contre la douleur neuropathique révèle que le cannabis inhalé a donné lieu à une réduction à court terme de la douleur neuropathique chronique chez un patient sur cinq ou six traités (NST = 5,6)Reference 827. En outre, les résultats de l'étude indiquent que le cannabis inhalé serait aussi puissant que la gabapentine (NST = 5,9). Dans cette étude, cent soixante-dix-huit participants d'âge moyen souffrant d'une neuropathie douloureuse perdurant au moins trois mois ont été inscrits aux cinq essais contrôlés à répartition aléatoire nord-américains examinés : deux essais n'ont recruté que des personnes atteintes du VIH et des sujets présentant une neuropathie chronique douloureuse liée au VIH, tandis que les trois essais restants ont recruté des patients atteints d'une neuropathie entraînant un traumatisme, un TM, un diabète sucré et un SDRC. Aucune étude n'a examiné les résultats au-delà de deux semaines. Les effets thérapeutiques ont semblé augmenter parallèlement à la hausse de la teneur en THC. Les abandons des études en raison d'effets indésirables ont été rares. Les effets secondaires subjectifs comprenaient notamment une légère anxiété, une désorientation, de la difficulté à se concentrer, des céphalées, une sécheresse oculaire, une sensation de brûlure, des étourdissements et des engourdissements. La fréquence des effets psychoactifs (p. ex. « sensation de high ») a augmenté parallèlement à la hausse de la dose. Les limites de cette étude reflètent principalement les limites associées aux études d'origine (c.-à-d. petit nombre d'études disponibles, nombre réduit de participants, lacunes dans la dissimulation des répartitions et l'attrition). La méta-analyse n'a pas permis de tirer des conclusions quant à l'efficacité ou l'innocuité à long terme du cannabis inhalé contre la douleur neuropathique chronique étant donné que la durée maximale des études d'origine n'allait pas au delà de deux semaines.
Une étude clinique croisée à répartition aléatoire et à double insu, contrôlée par placebo et à dose unique portant sur des doses faibles, moyennes et élevées de cannabis vaporisé chez 16 patients atteints d'une neuropathie diabétique périphérique douloureuse et visant à mesurer l'efficacité et la tolérabilité à court terme du cannabis a signalé une différence statistiquement significative des scores de douleurs spontanées entre les doses et un effet négatif statistiquement significatif de la dose élevée sur certaines mesures neuropsychologiquesReference 592. Les participants de l'étude avaient un diabète sucré de type I ou II et des antécédents d'au moins six mois de neuropathie diabétique périphérique douloureuse. Les sujets ont participé à quatre séances séparées par deux semaines et ont été exposés au placebo, à des doses faibles (1 % de THC, < 1 % de CBD, 400 mg de matière végétale totale), moyennes (4 % de THC, < 1 % de CBD, 400 mg de matière végétale totale) et élevées (7 % de THC, < 1 % de CBD, 400 mg de matière végétale totale) de THC. Les doses réelles de THC disponibles pour l'inhalation ont été estimées à 0, 4, 16 ou 28 mg de THC par séance d'administration. Des mesures de référence de la douleur spontanée, de la douleur provoquée et des tests cognitifs ont été effectués. On a signalé une différence statistiquement significative des scores de la douleur spontanée entre les doses, avec les scores de l'intensité de la douleur moyenne aux doses faibles, moyennes et élevées étant significativement différents de ceux obtenus avec le placebo et le score de la douleur moyenne à la dose élevée étant significativement différent de celui observé aux doses moyennes, faibles et avec le placebo. Aucune différence statistiquement significative n'a été constatée dans l'intensité de la douleur moyenne entre la dose moyenne et la dose faible. Il y a eu une réduction statistiquement significative des scores de la douleur moyenne provoquée entre la dose de placebo et la dose élevée, entre la dose faible et la dose élevée et entre la dose moyenne et la dose élevée de cannabis. En moyenne, le score de la douleur minimale le plus faible a été obtenu avec la dose élevée (7 % de THC) et le score de la douleur minimale le plus élevé a été observé avec la dose de placebo. Bien que les résultats aient démontré une réduction statistiquement significative pour la douleur spontanée et évoquée entre les doses, la comparaison des proportions de participants ayant obtenu une réduction d'au moins 30 % des scores de la douleur spontanée et provoquée n'a pas révélé des résultats statistiquement significatifs entre les différentes doses. La performance dans certains tests neurocognitifs (l'attention, la mémoire opérationnelle) a fait apparaître des différences statistiquement significatives entre les doses, avec certaines déficiences durant jusqu'à 120 minutes après l'administration. Un effet lié à la dose dans le score du « high » subjectif s'est dissipé après quatre heures. En outre, les résultats de l'étude ont semblé indiquer une corrélation entre le score du « high » subjectif et le score de la douleur spontanée; chaque augmentation d'un point du score du « high » étant associée à une diminution du score de la douleur de 0,32 point. Une euphorie a été observée chez 100 % des personnes à la dose la plus élevée (7 % du THC) et une différence statistiquement significative a été relevée concernant l'euphorie entre la dose élevée et le placebo et entre la dose moyenne et le placebo. Une somnolence a été constatée chez 73 % des personnes à la dose élevée et elle s'est révélée statistiquement significative qu'avec la dose élevée p/r au placebo. Fait intéressant, 56 % des personnes ont signalé une euphorie avec la dose de placebo, ce qui suggère un taux d'anticipation élevé. Les limites de l'étude comprennent notamment la taille réduite de l'échantillon, l'insuffisance de puissance et la courte durée de l'étude, des tests neuropsychiatriques limités et l'absence d'insu potentielle.
Une analyse systématique d'essais contrôlés à répartition aléatoire portant sur les cannabinoïdes (nabilone, vaporisation du cannabis par voie oromucosale, extrait de cannabis par voie orale, cannabis fumé ou vaporisé et inhibiteurs de la FAAH) dans le traitement de la douleur chronique non cancéreuse a été menée conformément aux lignes directrices PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) relatives aux examens systématiques faisant rapport des résultats des soins de santé et révèle que la plupart des essais ont démontré un effet analgésique significatif ainsi qu'une amélioration des paramètres secondaires (p. ex. sommeil, raideur musculaire, spasticité)Reference 171. Les effets indésirables fréquents, et probablement liés à la consommation de cannabis, ont été notamment la somnolence, la fatigue, les étourdissements, l'assèchement de la bouche, les nausées et les effets cognitifs dont la gravité était généralement légère à modérée et qui ont été généralement bien tolérés. Les effets indésirables graves ont été notamment l'infection des voies urinaries, le traumatisme cranien, la maladie pulmonaire interstitielle (avec extrait oral de cannabis), les délires (avec le nabilone), des idées suicidaires et la désorientation (avec vaporisateur oro-mucosal de cannabis). Les limites des résultats ont trait principalement à la courte durée de l'étude, à la taille réduite des échantillons des essais inclus et à l'ampleur modeste des effets. Des essais contrôlés à répartition aléatoire plus longs et dont la taille des échantillons est plus importante sont nécessaires pour confirmer les signaux d'efficacité établis par les études de « validation de concept » de plus petite envergure et pour la surveillance à plus long terme de patients afin d'évaluer les facteurs d'innocuité à long terme.
Une autre analyse systématique de six essais contrôlés à répartition aléatoire (N = 226 patients) portant sur le cannabis fumé ou vaporisé pour lutter contre la douleur chronique non cancéreuse a confirmé la pertinence de l'utilisation du cannabis à de faibles doses dans la douleur neuropathique réfractaire conjointement avec des analgésiques classiquesReference 167. La qualité de cinq des six essais analysés a été jugée élevée (selon l'échelle Jadad). Deux cent vingt-six adultes (âge moyen compris entre 45 et 50 ans) souffrant d'une douleur neuropathique chronique (neuropathie associée au VIH, neuropathie post-traumatique, neuropathie mixte) ont été inclus dans l'analyse. Tous les essais ont exclu les patients ayant des antécédents de troubles psychotiques ou des antécédents d'abus de cannabis ou de dépendance au cannabis. Quatre des cinq essais qui ont permis aux patients de continuer à utiliser des opioïdes, des anticonvulsivants et des antidépresseurs ont révélé que plus de 50 % des sujets consommaient des opioïdes concomitants. La dose de THC variait d'environ 1 % à 9,4 % (en poids sec) avec la quantité quotidienne totale de THC produite qui était comprise entre 1,9 mg par jour et 34 mg par jour au maximum. Les deux essais ouverts aux sujets n'ayant jamais été traités au cannabis ont indiqué des abandons ou retraits associés à des effets indésirables potentiels du cannabis fumé (p. ex. psychose, toux persistante, sensation de « high », étourdissements, fatigue), les autres raisons des abandons n'étant pas liées à des effets indésirables. Toutes les études ont fait état d'un effet analgésique statistiquement significatif. Un effet analgésique cliniquement significatif (> 30 % d'amélioration du soulagement de la douleur) a été signalé dans seulement trois des études incluses. Les effets indésirables comprenaient principalement des événements neurologiques ou psychiatriques (p. ex. céphalées, sédation, euphorie, dysphorie, difficulté à se concentrer, faible capacité d'attention et de mémorisation) et l'incidence des effets indésirables a semblé augmenter en fréquence avec l'augmentation de la dose de THC. Les auteurs concluent que les effets cognitifs indésirables à court terme signalés dans les ERC inclus étaient similaires à ceux ressentis avec des opioïdes et ils suggèrent d'appliquer les précautions prises avec les opioïdes au cannabis. Les auteurs affirment que le THC à faible dose (< 34 mg de THC par jour) est associé à une amélioration de la douleur neuropathique réfractaire de gravité modérée chez les adultes consommant des analgésiques concomitants. La possibilité de généralisation des résultats concernant la douleur chronique non cancéreuse est limitée par la qualité des études, la taille réduite des échantillons, la courte durée de l'étude et la variabilité des doses et de l'horaire de prise des doses.
Études cliniques avec les médicaments sur ordonnance à base de cannabinoïdes administrés par voie orale
Nabilone
Une étude descriptive rétrospective ouverte de 20 patients adultes souffrant de douleur chronique, non liée au cancer, et de diverses étiologies (douleur postopératoire ou traumatique, dystrophie sympathique réflexe, l'arthrite, la maladie de Crohn, cystite interstitielle, douleur neuropathique, la myopathie associée au VIH, syndrome post-poliomyélite, douleur inguinale idiopathique et céphalées chroniques) a démontré une amélioration générale subjective et une réduction de l'intensité de la douleur au moyen du nabilone comme traitement auxiliaire de soulagement de la douleurReference 818. De plus, les effets bénéfiques sur le sommeil et les nausées étaient les principales raisons menant à la continuité de son utilisation. Les patients ont utilisé entre 1 et 2 mg de nabilone par jour. De fortes doses (3 à 4 mg/ jour) ont été associées à une incidence accrue d'effets indésirables. Ceux-ci comprenaient l'assèchement de la bouche, les céphalées, les nausées et les vomissements, la fatigue, la déficience cognitive, les étourdissements, et la somnolence. Beaucoup de patients prenaient en même temps d'autres médicaments tels que les AINS, les opioïdes, et divers types d'antidépresseurs. Bon nombre de patients ont aussi signalé avoir utilisé le cannabis dans le passé pour gérer leurs symptômes. Les lacunes de la méthodologie de l'étude comprenaient l'absence d'un groupe témoin et un petit nombre de patients.
Une étude récente évaluant l'efficacité du nabilone à recrutement enrichi, à sevrage randomisé, en groupes parallèles, à doses variables, à double insu et contrôlée avec placebo comme traitement adjuvant contre la douleur neuropathique périphérique diabétique a rapporté une diminution statistiquement significative de la douleur, par rapport au placebo, avec 85 % des sujets du groupe du nabilone déclarant une diminution de la douleur de ≥ 30 % du début à la fin de l'étude et 31 % des sujets du groupe du nabilone déclarant une diminution de la douleur de ≥ 50 % du début à la fin de l'étudeReference 605. Les sujets prenant le nabilone ont aussi rapporté des améliorations significatives de l'anxiété, du sommeil, de la QV et de l'état du patient en général. Les doses du nabilone allaient de 1 à 4 mg/jour. La plupart des patients prenaient en même temps divers autres médicaments contre la douleur, tels que les AINS, les opioïdes, les antidépresseurs et les anxiolytiques. Les événements indésirables associés à l'intervention au nabilone comprenaient les étourdissements, l'assèchement de la bouche, la somnolence, les troubles de la mémoire, la léthargie, la confusion, l'euphorie, les céphalées, l'augmentation de l'appétit, quoique le gain de poids n'ait pas été observé.
Dronabinol
Un essai par permutation et randomisé, mené à double insu et contrôlé avec placebo auprès des patients souffrant de la douleur neuropathique centrale consécutive à la SP a rapporté une baisse de la douleur centrale avec des doses quotidiennes maximales de 10 mg de dronabinolReference 603. Le dosage a commencé avec 2,5 mg de dronabinol/jour, procédant par une augmentation progressive de la dose tous les deux jours; la durée totale de l'essai était de trois semaines (marge de 18 à 21 jours). Les médicaments contre la douleur autres que le paracétamol n'étaient pas autorisés lors de l'essai. Le nombre de patients nécessaire pour traiter contre une réduction de 50 % de la douleur étant de 3,5 (l'IC à 95 % = 1,9, 24,8). Cinquante-quatre pour cent des patients ont eu une réduction de la douleur de l'ordre de ≥ 33 % pendant le traitement au dronabinol comparativement à 21 % des patients ayant reçu le placebo. Le degré de réduction de la douleur dans cette étude a été comparable à celle enregistrée avec d'autres médicaments couramment utilisés dans le traitement des conditions de douleur neuropathique. Aucune différence significative n'a été rapportée entre le groupe de traitement et le groupe placebo quant à la sensibilité thermique, la détection tactile, la détection de la douleur, la sensibilité vibratoire, la sommation temporelle ou l'allodynie mécanique ou l'allodynie au froid. Toutefois, il y a eu une augmentation statistiquement significative du seuil de la douleur à la pression chez des sujets traités au dronabinol. Les effets indésirables auto déclarés ont été courants, surtout lors de la première semaine du traitement actif. Ces derniers comprenaient les étourdissements, les vertiges, la somnolence, les céphalées, la myalgie, la faiblesse musculaire, l'assèchement de la bouche, les palpitations, et l'euphorie.
Un essai de phase I randomisé, mené à dose unique, par permutation et à double insu et contrôlé avec placebo auprès de 30 patients prenant des opioïdes à action courte ou prolongée (68 mg des équivalents de la morphine/jour par voie orale; marge de 7,5 à 228 mg) contre la douleur chronique non liée au cancer réfractaire (d'étiologies diverses), a rapporté que des doses de 10 mg et 20 mg du dronabinol ont été associées à un soulagement significatif de la douleur comparativement au placebo, quoique aucune différence n'ait été observée dans le soulagement de la douleur entre les deux traitements actifsReference 283. L'intensité de la douleur et la douleur évoquée ont aussi été réduites de façon significative chez les sujets ayant reçu les traitements actifs comparativement au placebo. Le soulagement significatif de la douleur par rapport à l'état initial a été aussi rapporté dans une étude ouverte de phase II, une prolongation de l'essai initial de phase I mentioné ci-haut. On a demandé aux patients de suivre une posologie progressive, commençant par une dose de 5 mg par jour et d'augmenter la dose jusqu'à un maximum de 20 mg trois fois par jour. Des effets secondaires importants ont été constatés chez la majorité des patients de l'essai à dose unique, lesquels étaient conformes à des effets secondaires relevés dans d'autres essais cliniques et se sont manifestés plus fréquemment chez les sujets recevant les plus fortes doses du médicament de l'étude. Les auteurs ont rapporté que comparativement à l'essai à dose unique de phase I, la fréquence des effets secondaires auto déclarés de l'étude ouverte de phase II a diminué avec l'usage continu du dronabinol. Les lacunes dans la méthodologie de l'étude comprenaient le nombre réduit des sujets de l'étude, le nombre important de sujets s'étant déjà exposés au cannabis, l'absence de groupes de comparaison appropriés, et l'absence d'un placebo actif. D'autres lacunes propres à l'essai ouvert de phase II comprenaient l'absence d'un groupe témoin ou d'un volet croisé.
Le nabiximols
Santé Canada a approuvé le SativexMD (avec conditions) comme traitement auxiliaire pour le soulagement symptomatique de la douleur neuropathique chez les patients souffrant de SPReference 427.
Un certain nombre d'études randomisées menées par permutation, en groupes parallèles et à double insu et contrôlées avec placebo ont démontré des réductions importantes de la douleur neuropathique centrale et périphérique d'étiologies diverses (p. ex. l'avulsion du plexus brachial liée à la SP) suite à un traitement au nabiximols (SativexMD)Reference 429Reference 828Reference 829. Dans les trois études, les patients prenaient en même temps d'autres médicaments pour gérer leur douleur (p.ex. des antiépileptiques, des antidépresseurs tricycliques, des opioïdes, des médicaments AINS, des inhibiteurs spécifiques du recaptage de la sérotonine, des benzodiazépines, des myorelaxants). Le NST pour une réduction de la douleur de l'ordre de 30 % (jugé cliniquement significatif) variait entre 8 et 9, alors que le NST pour une réduction de l'ordre de 50 % de la douleur neuropathique centrale était de 3,7, et de 8,5 pour la douleur périphérique. Dans deux des trois études, la majorité des patients avaient déjà fait l'expérience du cannabis à des fins médicales ou à des fins non médicalesReference 828Reference 829. De plus, la majorité des sujets faisant partie du groupe de traitement actif ont ressenti des effets indésirables mineurs ou modérés par rapport au groupe placebo, à savoir les nausées, les vomissements, la constipation, les étourdissements, l'intoxication, la fatigue, l'assèchement de la bouche, et autres.
D'après la déclaration et lignes directrices consensuelles en matière de traitement pharmacologique de la douleur neuropathique chronique de la Société canadienne pour le traitement de la douleur mises à jour en 2014, des thérapies à base de cannabinoïdes sont considérées (p.ex. le dronabinol et le nabiximols et le cannabis fumé) comme étant des traitements de troisième ligne (en 2007 elles étaient considérées comme étant des traitements de quatrième ligne) contre la douleur neuropathique; et surtout comme étant des analgésiques adjuvants pour le traitement de la douleur réfractaire aux médicaments standardsReference 830Reference 831 (mais voir aussi la Section 4.8.3 etReference 832 pour des lignes directrices cliniques mises à jour sur l'usage des cannabinoïdes pour le traitement des symptômes associés à la fibromyalgie).
Une étude ouverte de prolongation de neuf mois (38 semaines) a examiné l'efficacité à long terme, l'innocuité et la tolérabilité du nabiximols chez 380 patients (234 sujets ont terminé l'étude) souffrant d'une douleur neuropathique périphérique associée au diabète sucré ou à l'allodynie et utilisant de façon concomitante un autre traitement analgésiqueReference 833. Cent soixante-six patients avaient déjà pris du nabiximols dans le cadre d'un essai clinique apparenté, contrôlé, à répartition aléatoire semblable (doses quotidiennes moyennes contre l'allodynie : 8,9 vaporisations; doses quotidiennes moyennes contre la neuropathie diabétique : 9,5 vaporisations). La dose quotidienne moyenne de nabiximols dans l'étude de prolongation était comprise entre six et huit doses à la pompe (16,2 mg de THC et 15 mg de CBD et 21,6 mg de THC et 20 mg de CBD) et aucune augmentation des doses à la pompe n'a été observée au fil du temps, ce qui semble indiquer une absence de tolérance au médicament de l'étude. Onze pour cent des patients ayant reçu du nabiximols pendant l'essai contrôlé à répartition aléatoire apparenté se sont retirés de l'étude de prolongation en raison d'événements indésirables, tandis que 27 % des patients ayant reçu un placebo pendant l'étude apparentée se sont retirés de l'étude de prolongation en raison d'événements indésirables. Treize pour cent des patients qui avaient reçu du nabiximols dans le cadre de l'essai contrôlé à répartition aléatoire apparenté se sont retirés en raison de son manque d'efficacité. Un médicament analgésique concomitant a été utilisé par 84 % des patients. Les médicaments analgésiques les plus souvent utilisés étaient notamment des anticonvulsivants, des antidépresseurs tricycliques, des opioïdes et des AINS. Les médicaments concomitants non analgésiques étaient notamment des inhibiteurs de la 3-hydroxy-3-méthylglutaryl-coenzyme A (HMG-CoA) réductase, des inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA), des biguanides et des inhibiteurs de l'agrégation plaquettaire. La grande majorité des patients avaient déjà essayé sans succès au moins un analgésique pour lutter contre leur douleur neuropahique périphérique (c.-à-d. anticonvulsivants et AINS). Tous les patients ont signalé une amélioration du score de la douleur selon l'EEN au fil du temps, en passant du score initial de 6,9 au départ, dans les ERC semblables, à un score de 4,2 à la fin de la période des études de prolongation ouvertes de neuf mois. La moitié au moins des patients ont signalé une amélioration cliniquement significative de 30 % de la douleur comparativement au début des essais contrôlés à répartition aléatoire apparentés et au moins 30 % des patients ont présenté une amélioration de 50 % de la douleur au fil du temps. La réduction maximale des scores de la douleur s'est produite entre la 14e et la 26e semaine, pendant l'étude de prolongation. Une amélioration des scores relatifs à la qualité du sommeil selon l'EEN et des résultats du questionnaire sur la santé EQ-5D s'est maintenue tout au long de la période de l'étude de prolongation. Les événements indésirables toutes causes confondues les plus souvent signalés, selon la classe de système d'organes, ont été les troubles du système nerveux (44 %), les troubles GI (36 %), les troubles généraux et touchant le point d'administration (24 %), les infections et infestations (23 %) et les troubles psychiatriques (21 %). Les événements indésirables liés au traitement les plus courants ont été les étourdissements (19 %), les nausées (9 %), l'assèchement de la bouche (8 %), la dysgueusie (7 %), la fatigue (7 %), la somnolence (7 %) et la sensation d'ivresse (6 %). La plupart (74 %) des événements indésirables liés au traitement se sont résorbés sans conséquence à la fin de la période de l'étude. Cependant, les chercheurs ont continué d'observer des événements indésirables à la fin de l'étude, entre autres la fatigue, les étourdissements et l'insomnie. Onze pour cent des patients ont éprouvé un événement indésirable grave pendant l'étude, 1 % ayant ressenti un effet indésirable lié au traitement. Les événements indésirables jugés liés au traitement étaient notamment des troubles du système nerveux et des troubles psychiatriques : deux patients ont subi une amnésie et de la paranoïa et une tentative de suicide ont été déclarés. Dix-huit pour cent des patients ont cessé de prendre le médicament de l'étude en raison d'événements indésirables liés au traitement. La plupart de ces événements sont survenus au cours de la première semaine de traitement.
4.7.2.3 Douleur causée par un cancer
- Les données cliniques disponibles limitées pour certains cannabinoïdes (le dronabinol, le nabiximols) suggèrent un effet analgésique modeste pour le dronabinol et un effet analgésique modeste et mixte pour le nabiximols sur la douleur causée par le cancer.
Études cliniques avec le dronabinol
Deux études cliniques menées à double insu par permutation et randomisées, contrôlée avec placebo suggèrent que le Δ9-THC (dronabinol) par voie orale présente un effet analgésique chez les patients souffrant de douleur continue d'intensité modérée à grave causée par un cancer avancé. La première est une petite étude d'établissement de la posologie de 5, 10, 15 et 20 mg de Δ9-THC, administrées au cours de jours successifs à 10 patients atteints d'un cancerReference 834. Un soulagement notable de la douleur a été constaté avec les doses de 15 et 20 mg, mais à ces niveaux de fortes doses, les patients se trouvaient sous forte sédation et l'obnubilation était commune. Une deuxième étude contrôlée avec placebo a comparé les doses de 10 et 20 mg de Δ9-THC par voie orale à 60 et 120 mg de codéine chez 36 patients ayant une douleur causée par un cancerReference 281. Bien que les plus faibles et les plus fortes doses de THC avaient un effet analgésique équivalent aux plus faibles et plus fortes doses de codéine respectivement, on a obtenu des différences statistiquement significatives en analgésie qu'entre le placebo et 20 mg de Δ9-THC et entre le placebo et 120 mg de codéine. La dose de 10 mg de Δ9-THC était bien tolérée et, malgré son effet sédatif, elle avait un potentiel analgésique léger. La dose de 20 mg de THC a provoqué la somnolence, des étourdissements, l'ataxie et une vision trouble. Une anxiété extrême a aussi été observée à la dose de 20 mg chez bon nombre de patients.
Études cliniques avec le nabiximols
Un essai clinique, mené par permutation, randomisé, à double insu, en groupes parallèles et contrôlé avec placebo auprès de patients souffrant d'une douleur réfractaire liée à un cancer (mixte, osseuse, neuropathqiue, viscérale, somatique et incidente) a suggéré qu'une dose administrée par voie orale d'extrait de THC et de CBD (nabiximols) contenant 2,7 mg de Δ9-THC et 2,5 mg de CBD par dose est un traitement auxiliaire efficace pour le traitement de la douleur liée au cancer dont les opioïdes forts n'ont pu pleinement soulagerReference 131. Les équivalents par jour de la dose médiane au départ de la morphine variaient de 80 à 120 mg. Quarante-trois pour cent des patients (n = 60) prenant l'extrait ont connu une amélioration ≥ 30 % dans leurs scores d'évaluation de la douleur, ce qui représente le double du nombre de patients ayant atteint ce résultat au sein des groupes du THC seulement (n = 58) et du placebo (n = 59). On a rapporté que les deux médicaments : le nabiximols et le THC ont été bien tolérés chez cette population de patients et que les événements indésirables étaient semblables à ceux d'autres essais cliniques du nabiximols (p.ex. la somnolence, les étourdissements, et les nausées).
Cette étude a été suivie par une étude de prolongation ouverte qui a évalué l'innocuité et la tolérabilité à long terme du nabiximols (de même que le vaporisateur oromucosal du THC) comme traitement auxiliaire contre la douleur chez des patients souffrant de la douleur liée à un cancer en phase terminale réfractaire aux analgésiques opioïdes puissantsReference 279. Les patients qui avaient pris part à l'étude et s'étaient pleinement conformés à ses exigences, et chez qui aucun événement indésirable ne s'était manifesté lors de l'étude parente initiale et chez qui l'on s'attendait à des bienfaits cliniques du nabiximols (avec tolérabilité acceptable) ont été inscrits dans l'étude de prolongation. Le type de douleur le plus fréquemment signalé (50 %) a été la douleur mixte (nociceptive et neuropathique) suivie de la douleur neuropathique (37 %) et la douleur osseuse (28 %). La durée médiane du traitement au nabiximols (n = 39 patients) était de 25 jours (marge de 2 à 579 jours), tandis que la durée moyenne du traitement au vaporisateur oromucosal du THC (n = 4 patients) était de 151,5 jours (marge de 4 à 657 jours). Le nombre moyen de vaporisations par jour du nabiximols pendant les sept derniers jours du dosage était de 5,4 contre 14,5 vaporisations/jour pour le THC seulement. Aucune augmentation de dose n'a été relevée chez les patients prenant le nabiximols au-delà de six mois et jusqu'à un an après l'initiation du traitement. Bien que l'étude ait été ouverte et non comparative sans vérification d'hypothèse formelle et essentiellement utilisée à des fins de statistiques descriptives, une diminution par rapport à la valeur de départ selon le formulaire court d'inventaire de la douleur mesurée [Brief Pain Inventory Short Form] a été constatée en ce qui concerne « la gravité de la douleur » et « la douleur la plus intense » au cours des cinq semaines de traitement. Toutefois, les auteurs ont relevé que les chercheurs cliniques ont jugé que la gestion de la douleur de leurs patients était sous-optimale. Un changement négatif par rapport à la valeur de départ (c.-à-d. indication d'une aggravation) a été rapporté dans le score de fonctionnement physique de l'EORTC QLQ-C30 bien qu'il y ait eu quelques améliorations des scores relatifs au sommeil et à la douleur entre les valeurs de départ et la cinquième semaine de traitement. Huit pour cent des patients sous le nabiximols ont développé de graves événements indésirables liés au nabiximols. Les événements indésirables les plus fréquemment signalés relatifs au nabiximols ont été les nausées ou les vomissements, l'assèchement de la bouche, les étourdissements, la somnolence et la confusion.
Contrairement aux études susmentionnées à l'aide du nabiximols, un essai clinique randomisé, mené par permutation et à double insu, en groupes parallèles et contrôlé avec placebo auprès de patients atteints de cancer et traités aux opioïdes qui souffrent d'une douleur chronique réfractaire liée à un cancer (mixte, osseuse, neuropathqiue, somatique, viscérale) n'a rapporté aucune différence statistiquement importante à la fin de l'essai entre le placebo et le groupe de traitement au nabiximols quant au paramètre primaire de soulagement de 30 % par rapport à la douleur en début de traitementReference 280. Toutefois, en faisant une analyse des taux de réponse continue comme paramètre d'évaluation secondaire (c.-à-d. en comparant la proportion de répondants au traitement avec le médicament actif et le placebo dans l'ensemble des réponses de 0 à 100 %), l'étude a pu rapporter un effet du traitement statistiquement significatif en faveur du nabiximols. Les patients prenaient l'équivalent des doses médianes d'opioïdes variant entre 120 et 180 mg/jour. Les événements indésirables étaient liés à la dose, et seul le groupe ayant reçu la plus forte dose se comparait défavorablement au placebo. Les auteurs ont relevé que l'essai était une étude d'établissement de la posologie et que des études de confirmation étaient indispensables. La méthodologie de l'étude n'a pas permis l'évaluation d'un indice thérapeutique.
Un essai clinique pilote en croisé, aléatoire et contrôlé par placebo du nabiximols pour le soulagement de la douleur neuropathique établie induite par la chimiothérapie n'a observé aucune différence statistiquement significative entre les groupes de traitement et de placebo sur une échelle d'évaluation numérique pour l'intensité de la douleur (EEN-ID)Reference 278. Les auteurs ont noté que cinq participants (répondeurs) ont éprouvé une baisse de deux points ou plus sur l'EEN-ID au cours du traitement ce qui était statistiquement significative comparativement au placebo. La dose moyenne de médicament utilisée dans le domaine de traitement était de huit vaporisations par jour (marge de 3 à 12) et de 11 vaporisations dans le domaine du placebo dont la majorité de ces patients ont titré jusqu'à la dose maximale. Des effets secondaires associés aux médicaments ont été signalés par la majorité des participants et comprenaient la fatigue, la xérostomie, des étourdissements, la nausée, des maux de tête, des « pensées floues », l'augmentation de l'appétit et la diarrhée. Dix des participants ont poursuit dans la phase d'extension de l'essai et les niveaux de douleur continuaient à diminuer d'une base de 6,9 à 5,0 après trois mois et de 4,2 après six mois. La dose moyenne était de 4,5 vaporisations par jour (marge de 2 à 10 vaporisations par jour).
Au Canada, le nabiximols (SativexMD) est approuvé (avec conditions) comme analgésique auxiliaire chez les adultes atteints d'un cancer avancé qui souffrent de douleur modérée à grave prenant la plus forte dose tolérée lors d'une thérapie à fortes doses d'opioïdes contre la douleur persistanteReference 427. Les recommandations de dosage actuelles pour le nabiximols suggèrent une dose quotidienne maximale de 12 vaporisations (32,4 mg de THC et 30 mg de CBD) au cours d'une période de 24 hReference 126Reference 131Reference 427, quoiqu'un plus grand nombre de vaporisations/jour ait été utilisé ou documenté dans des études cliniquesReference 280Reference 427. Il convient de noter que les augmentations du nombre de vaporisations/jour étaient accompagnées d'une incidence accrue d'effets indésirables.
4.7.2.4 Effet « d'épargne en opiacés » et la synergie cannabinoïdes-opioïdes
- Bien que les études précliniques et les études de cas suggèrent que certains cannabinoïdes pourraient posséder un effet « d'épargne en opiacés », les études épidémiologiques et cliniques menées avec du THC oral et du nabiximols ont obtenu des résultats mixtes.
- Des études observationnelles suggèrent une association entre les états américains avec des lois autorisant l'accès au cannabis (à des fins médicales et non médicales) et une baisse des taux d'opioïdes prescrits et de mortalité associée aux opioïdes.
L'effet « d'épargne en opiacés » renvoie à la capacité des médicaments non opiacés de servir comme analgésique auxiliaire avec l'aide d'une dose plus faible de l'opioïde, diminuant ainsi les effets secondaires associés à ces derniers. Bien qu'il existe quelques données précliniques et données provenant d'études de cas étayant de tels effets pour les cannabinoïdes, il s'agit ici d'un fait moins attesté et publié dans des études cliniques. De plus, il existe certaines données provenant d'études épidémiologiques et d'observation suggérant que les individus consommant des opioïdes pour le traitement de douleur non causée par le cancer pourraient aussi utiliser du cannabis afin de gérer la détresse provenant de la douleur non gérée et qu'une certaine portion d'individus consommant de plus fortes doses d'opioïdes pour le traitement de douleur chronique non causée par le cancer pourraient aussi éprouver de plus grands problèmes dans l'ensemble de nombreux domaines, y compris de plus grands risques de TUC.
Les informations suivantes résument les résultats des études précliniques, épidémiologiques et cliniques s'étant penchées sur les interactions cannabinoïde-opioïde ainsi que le potentiel « effet d'épargne en opiacés » des cannabinoïdes.
Données précliniques
Il existe une quantité raisonnable de données probantes pour laisser croire qu'il y ait une interaction fonctionnelle entre les systèmes de récepteurs cannabinoïdes et opioïdes, quoique des recherches supplémentaires s'imposent pour pouvoir comprendre avec précision comment les deux systèmes communiquent entre eux. Les données étayant une interaction putative entre les systèmes cannabinoïdes et opioïdes reposent sur un certain nombre d'observations. D'abord, il a été démontré que les cannabinoïdes et les opioïdes produisent des effets biologiques semblables tels que l'hypothermie, la sédation, l'hypotension, l'inhibition de la motilité GI, l'inhibition de l'activité locomotrice et une activité anti-nociceptiveReference 835-Reference 837. De plus, des études neuroanatomiques chez les animaux ont démontré un chevauchement de la distribution tissulaire des récepteurs cannabinoïdes et opioïdes, les deux types de récepteurs se trouvant dans les tissus du système nerveux liés au traitement des stimuli douloureux, à savoir la substance grise périaqueducale, les noyaux du raphé et les noyaux thalamiques centro-médiansReference 835-Reference 837. Il y a aussi des données qui indiquent que les récepteurs CB1 et les récepteurs mu opioïdes peuvent se colocaliser dans certaines des mêmes sous-populations neuronales telles que celles localisées dans les portions superficielles de la corne dorsale de la moelle épinièreReference 835. Cette colocalisation pourrait jouer un grand rôle dans la modulation des afférences nociceptives périphériques au niveau spinalReference 835. Les deux récepteurs partagent aussi des molécules et voies de transduction de signal dont l'activation entraîne généralement l'inhibition de la libération des neurotransmetteursReference 835Reference 837. Le rôle que jouent ces systèmes de récepteurs dans l'inhibition de la libération des neurotransmetteurs est davantage appuyé par leur emplacement sur les membranes présynaptiquesReference 835. Des données issues de certaines études précliniques portent aussi à croire qu'une administration aiguë d'agonistes de récepteurs cannabinoïdes peut engendrer une sécrétion des peptides opioïdes endogènes, et qu'une administration chronique du THC accroît l'expression génique des précurseurs des opioïdes endogènes (p. ex. préproenképhaline, prodynorphine et proopiomélanocortine) dans diverses structures médullaires et sus-épineuses qui participent à la perception de la douleurReference 835. Quelques études ont même démontré l'existence des hétéromères de récepteurs cannabinoïdes-opioïdes, quoique l'importance biologique de telle hétéromérisation de récepteur ne soit pas encore entièrement élucidéeReference 838Reference 839. Prises ensemble, ces conclusions suggèrent l'existence de chevauchement entre les systèmes de récepteurs cannabinoïdes et opioïdes. De plus, des études précliniques ayant eu recours à la combinaison de différents opioïdes (la morphine, la codéine) et des cannabinoïdes (THC) à doses aiguës ou inférieures au seuil d'efficacité ont révélé des effets additifs et mêmes synergiquesReference 840-Reference 842Reference 842-Reference 845. Une revue systématique récente et une méta-analyse d'études précliniques examinant la force des données existantes de l'effet « d'épargne en opiacés » des cannabinoïdes dans le contexte de l'analgésie ont conclu qu'il y a un effet significatif « d'épargne en opiacés » entre la morphine et le THC lorsqu'ils sont administrés en concomitance, bien qu'il y a une hétérogénéité significative dans les donnéesReference 846. Néanmoins, comparée à l'administration de morphine seule, la DE50 médiane de la morphine est 3,6 fois plus faible lorsqu'elle est administrée en combinaison avec du THC. Un effet significatif « d'épargne en opiacés » a également été signalé pour le THC lorsqu'il est administré en concomitance avec la codéine (DE50 9,5 fois plus faible lorsque le THC est combiné à la codéine par rapport à la codéine seule).
Série de cas cliniques et donées épidémiologiques
Un récent sondage en ligne en section transversale mené auprès de 2 897 participants d'une base de données de 67 422 patients utilisant du cannabis médical dans l'État de Californie a permis de recueillir des données sur l'utilisation du cannabis comme substitut aux analgésiques opioïdes et non opioïdesReference 847. La majorité des participants de l'échantillon a déclaré être en mesure de réduire la quantité d'opioïdes qu'ils consomment lorsqu'ils consomment aussi du cannabis. Les limites de cette étude comprennent l'autodéclaration et un taux de réponse très faible (4 %) ainsi qu'un échantillon biaisé.
L'analyse d'une série de cas de patients révèle une réduction de la dose d'opioïde avec la consommation de cannabis dans le traitement de la douleur chronique non cancéreuseReference 848. Dans un cas, une femme de 47 ans ayant des antécédents de SP chronique progressive depuis dix ans, accompagnés de céphalées, de douleurs musculaires à plusieurs endroits, de spasmes de la vessie et d'une spasticité des jambes, et recevant un traitement quotidien composé de 75 mg de morphine à longue durée d'action, de 24 mg de tizanidine et de 150 mg de sertraline au coucher, a aussi commencé à consommer du cannabis au coucher. Au cours des six mois suivants, la patiente a commencé à fumer régulièrement deux à quatre bouffées de cannabis au coucher et a signalé avoir réduit sa consommation quotidienne de morphine, de tizanidine et de sertraline au coucher aux doses suivantes : 45 mg, 6 mg et entre 100 et 150 mg, respectivement. La patiente a signalé une amélioration de la douleur, de la spasticité, des spasmes de la vessie et du sommeil. La patiente a également signalé ne pas avoir éprouvé d'effets indésirables autres que la sensation d'être quelque peu « high » si elle fumait plus de quatre bouffées à la fois. Un autre patient, un homme de 35 ans atteint de VIH, qui souffrait d'une neuropathie périphérique douloureuse liée au VIH touchant les membres inférieurs et les mains et qui prenait 360 mg par jour de morphine à longue durée d'action avec une dose supplémentaire de 75 mg de sulfate de morphine quatre fois par jour contre la douleur aiguë et 2 400 mg de gabapentine par jour a commencé à consommer du cannabis fumé à raison de trois à quatre bouffées, trois à quatre fois par jour. Au cours des quatre mois suivants, le patient a diminué sa dose de morphine jusqu'à 180 mg par jour; au bout de neuf mois, le patient a cessé de prendre de la morphine ainsi que de la gabapentine. Le patient n'a pas non plus signalé d'effets secondaires liés à l'utilisation de cannabis. Enfin, un homme âgé de 44 ans ayant des antécédents depuis six ans de lombalgie et de douleur à la jambe gauche et prenant 150 mg par jour de morphine à longue durée d'action et 10 mg de cyclobenzaprine, trois fois par jour, qui ne lui permettent pas de bien contrôler la douleur, a commencé à fumer du cannabis, à raison de plusieurs bouffées et, jusqu'à un joint, quatre à cinq fois par jour. Après avoir régulièrement fumé du cannabis pendant deux semaines, le patient a été en mesure de diminuer sa dose de morphine à 90 mg par jour, puis à 60 mg de morphine par jour et de diminuer sa dose de cyclobenzaprine à 10 mg une fois par jour et il a signalé une amélioration du contrôle de la douleur. Les auteurs de l'étude de série de cas déclarent qu'ensemble, les trois patients ont été en mesure de réduire leur dose d'opioïde de 60 à 100 % après avoir commencé le traitement au cannabis. En outre, les patients ont déclaré eux-mêmes avoir pu mieux contrôler la douleur grâce à l'introduction du cannabis dans leur stratégie de gestion de la douleur. Tous les patients ont signalé avoir déjà utilisé du cannabis avant l'apparition d'une morbidité.
Une étude de série de cas prospective, d'observation, sans répartition aléatoire et sans insu évaluant l'efficacité du traitement adjuvant au nabilone dans la gestion de la douleur et des symptômes ressentis par 112 patients atteints d'un cancer au stade avancé, dans un cadre de soins palliatifs, révèle que les patients qui utilisaient du nabilone ont présenté un taux plus faible de début de prise d'AINS, d'antidépresseurs tricycliques, de gabapentine, de dexaméthasone, de métoclopramide et d'ondansétron et qu'ils ont eu plus tendance à arrêter la prise de ces médicamentsReference 284. Les patients se sont vus prescrire du nabilone pour soulager la douleur (51 %), contre les nausées (26 %) et l'anorexie (23 %). Les patients traités ont commencé à prendre une dose de 0,5 ou 1 mg de nabilone au coucher, durant la première semaine, qu'ils ont augmentée par paliers de 0,5 ou 1 mg par la suite. Au moment du suivi, la plupart des patients recevaient une dose quotidienne de 2 mg de nabilone avec une dose quotidienne moyenne de 1,79 mg. Les deux paramètres primaires de l'étude, la douleur et l'utilisation d'opioïde sous la forme de doses équivalentes totales en sulfate de morphine, ont considérablement diminué chez les patients traités comparativement aux patients non traités. Les effets secondaires causés par le nabilone étaient principalement les étourdissements, la confusion, la somnolence et l'assèchement de la bouche. Les patients avaient également moins tendance à commencer à prendre d'autres nouveaux médicaments et pouvaient réduire ou cesser la prise de médicaments administrés au début de l'étude.
Une analyse de séries chronologiques ayant examiné les données de certificats de décès sur une période donnée (1999-2010) entre les États américains ayant établi des programmes d'accès au cannabis à des fins médicales et ceux qui en sont dépourvus a porté sur l'existence d'une association entre la présence de lois étatiques sur le cannabis médical et les taux de mortalité causée par une surdose d'analgésiques opioïdes. Cette analyse révèle que le taux de décès causé par une surdose d'analgésiques opioïdes et corrigé en fonction de l'âge pour 100 000 habitants dans les États qui ont adopté des lois sur le cannabis consommé à des fins médicales est près de 25 % plus faible que celui des États qui en sont dépourvus (IC à 95 % = -37,5 % à -9,5 %)Reference 849. Cette association a semblé se renforcer au fil du temps, avec une réduction du taux moyen annuel de mortalité causée par une surdose d'opioïde de 19,9 % au cours de la première année et une réduction du taux de mortalité due à une surdose d'opioïde de 33,3 % au cours de la sixième année, après l'adoption de lois par l'État sur le cannabis médical. Cette étude indique que les lois sur le cannabis médical seraient associées à une réduction de la mortalité due à une surdose d'analgésiques opioïdes au niveau de la population. Cependant, les mécanismes par lesquels cela semble se produire ne sont pas clairs pour le moment et nécessitent un examen plus approfondi.
Une analyse chronologique qui a examiné l'association entre la légalisation du cannabis par le Colorado à des fins non médicales et les décès liés aux opioïdes (2000-2015) a fait état d'une réduction de 0,7 décès par mois (b = -0,68; 95 % IC = -1,34, -0,03). Plus précisément, il y a eu une diminution de 6 % des décès liés aux opioïdes deux ans après la légalisation du cannabis non médical par rapport à deux états témoins (l'un autorisant le cannabis à des fins médicales, l'autre n'autorisant pas le cannabis à des fins médicales ou non médicales). Toutefois, les auteurs notent que la fenêtre de suivi de deux ans après la légalisation est relativement courte et que des recherches supplémentaires impliquant des périodes de suivi plus longues (et l'examen d'autres états qui ont légalisé le cannabis à des fins non médicales) sont nécessaires pour déterminer si ces réductions sont maintenues ou se dissipent au fil du tempsReference 850.
Deux récentes études observationnelles utilisant des données sur les soins de santé aux États-Unis (Medicare et Medicaid) ont examiné la différence entre les taux de prescription d'opioïdes dans les états américains avec et sans accès légal au cannabis. Bradford et ses collaborateursReference 851 ont constaté que, dans le temps (2010-2015), les états qui ont adopté des lois sur le cannabis médical ont déclaré moins de doses quotidiennes d'opioïdes prescrits (2,21 millions par année) que les états sans loi sur le cannabis médical. Parallèlement à cette découverte, Wen et HockenberryReference 852 ont conclu en utilisant des données transversales que les états ayant des lois sur le cannabis médical ont déclaré une réduction de 5,88 % du taux d'opioïdes prescrits. Cette étude a également examiné les schémas de prescription d'opioïdes dans les états ayant des lois sur le cannabis à des fins non médicales et a montré que l'accès au cannabis était également associé à une réduction des taux de prescription d'opioïdes (c.-à-d. 6,38 % plus bas que dans les états sans cannabis non médical légalisé). Les principales limites de ces études sont la nature associative des résultats, ce qui signifie que la causalité ne peut être établie et le fait qu'il est impossible de déterminer si le cannabis a vraiment remplacé ou s'est substitué à l'usage d'opioïdes, puisque les utilisateurs auraient pu avoir accès et utiliser des opioïdes provenant d'autres sources non médicales.
Une étude rétrospective transversale de 244 patients ayant accès à du cannabis à des fins médicales d'un dispensaire du Michigan a signalé que la consommation de cannabis à des fins médicales était associée à une réduction considérable de consommation d'opiacés ainsi qu'une réduction du nombre d'autres médicaments utilisés et du nombre d'effets secondaires associés à l'utilisation d'autres médicaments ainsi que des améliorations de la QVReference 853. La majorité (80 %) des participants à l'étude ont signalé avoir fumé du cannabis quotidiennement. La réduction moyenne autodéclarée de consommation d'opiacés parmi tous les répondeurs de l'étude était de 64 %. De plus, il existait une réduction statistiquement significative du nombre de médicaments autres que les opiacés (p. ex. les AINS, les médicaments antirhumatismaux modificateurs de la maladie, les antidépresseurs, les inhibiteurs de recaptage de la sérotonine et de la noradrénaline et les inhibiteurs spécifiques du recaptage de la sérotonine) après la consommation de cannabis. Les lacunes de la méthodologie de l'étude comprennent un biais de rappel possible, une population autosélectionnée, l'autodéclaration et des changements dans les taux d'émissions d'ordonnances d'opiacés de la part des médecins.
Une étude prospective, à volets ouverts, à bras unique et longitudinal de 274 patients atteints de douleur chronique resistante aux traitements (c.-à-d. douleur musculosquelettique répandue, douleur neuropathique périphérique, douleur radiculaire lombaire, douleur cancéreuse) a examiné les effets à long terme de traitements de cannabis à des fins médicales sur la douleur et les résultats fonctionnelsReference 574. L'analyse de principe de vouloir traiter a été effectuée sur 206 patients qui ont fourni les données de base et 176 participants ont terminé l'étude et ont été compris dans l'analyse finale. Les patients pouvaient fumer le cannabis, le consommer sous forme de biscuits ou l'utiliser dans un extrait d'huile d'olive sous forme de gouttes (jusqu'à un équivalent maximal de 20 g par mois, mais avec la possibilité d'augmenter cette quantité, s'il y a lieu). Les patients ont reçu la consigne de titrer leur dose de cannabis en commençant par une bouffée de cigarette (ou une goutte d'huile de cannabis) par jour et d'augmenter d'une bouffée ou d'une goutte par dose jusqu'à trois fois par jour jusqu'à ce qu'ils aient atteint un niveau de soulagement de la douleur satisfaisant ou que des effets secondaires apparaissent. On leur a aussi donné la consigne de s'abstenir de conduire pour au moins six heures après avoir consommé du cannabis ou pour plus longtemps s'ils se sentaient désorientés ou ensommeillés. Les concentrations de THC dans les produits fumés s'étendaient entre 6 et 14 % et entre 11 et 19 % dans les formules administrées par voie orale et les concentrations de CBD dans les produits fumés se trouvaient entre 0,2 et 3,8 % et entre 0,5 et 5,5 % dans les formules administrées par voie orale. La quantité mensuelle moyenne d'ordonnances de cannabis lors du suivi était de 43 g (moyenne de 1,4 g par jour). Les traitements au cannabis ont été ajoutés aux schémas posologiques actuels des analgésiques. Parmi les utilisateurs d'opiacés, la dose quotidienne médiane de consommation, en quantité équivalente de sulfates de morphine par prise orale quotidienne, était de 60 mg. Lors de suivis (après une période moyenne de sept mois après le début des traitements), les cotes des symptômes de douleur s'étaient améliorées d'une cote médiane de 83,3 à une cote médiane de 75,0 (p < 0.001) dans le cadre du questionnaire du Short-Form Treatment Outcomes in Pain Survey (S-TOPS) dont 66 % des participants ont déclaré une amélioration, 8 % n'ont déclaré aucun changement et 26 % ont déclaré une détérioration. Au cours d'analyses des sous-groupes, aucune différence n'a été observée dans les résultats principaux entre la douleur neuropathique et non neuropathique ou entre les patients masculins et féminins. Des améliorations ont aussi été observées dans les cotes de l'échelle du Brief Pain Inventory (BPI) de sévérité et d'interférence de la douleur ainsi que dans la majorité des cotes de déficience sociale et affective (c.-à-d. cotes de S-TOPS pour les déficiences sociales associées à la famille, les troubles émotionnels en relation au rôle, la satisfaction envers les résultats, l'index des troubles de sommeil). La consommation d'opiacés au moment du suivi avait aussi diminué de 44 %. La dose (quotidienne) équivalente de morphine orale médiane parmi les participants recevant toujours des opiacés au moment du suivi a diminué de 60 mg à 45 mg, sans toutefois atteindre un niveau statistiquement significatif. Neuf des participants ont abandonné le traitement en raison d'effets néfastes faibles à modérer, principalement la sédation, la lourdeur, la nervosité et les troubles de concentration. Deux autres participants ont abandonné le traitement en raison d'effets secondaires graves : l'un en raison de taux élevés de transaminases hépatiques et l'autre, un participant âgé, a été admis aux soins d'urgence et hospitalisé pour des symptômes de confusion. Le taux total d'abandon du cannabis était de 5,3 %. Les lacunes de la méthodologie de l'étude comprennent l'absence d'un groupe témoin et d'un concept à volet ouvert, l'absence d'évaluations périodiques fréquentes de tous les effets néfastes et la sous-représentation des femmes.
Les résultats d'une étude prospective, transversale, en cohortes et effectuée au cours de deux ans sur 1 514 individus auxquels ont été ordonnés des opiacés pharmaceutiques afin de soulager la douleur chronique non associée au cancer (l'étude « Pain and Opioids IN Treatment ») a examiné le degré de consommation de cannabis par ce groupeReference 209. L'étude a signalé qu'un participant sur six (16 %) avait consommé du cannabis pour soulager la douleur et que 25 % ont signalé qu'ils en auraient consommé pour soulager la douleur s'ils y avaient accès. Parmi ceux consommant du cannabis pour soulager la douleur, le soulagement moyen signalé causé par leur consommation était de 70 % comparativement au soulagement moyen de 50 % signalé pour l'utilisation de médicaments opiacés. Presque la moitié (43 %) avaient consommé du cannabis à des fins non médicales à un moment donné et 12 % de la cohorte entière correspondaient aux critères d'un TUC de la classification internationale des maladies (CIM) au cours de leur vie. Les individus ayant signalé avoir consommé du cannabis à des fins de soulagement de la douleur étaient en moyenne plus jeune et mâles et étaient considérablement plus probables de correspondre aux critères de troubles de consommation d'autres substances licites et illicites et aux critères de risque de dépression modérée ou grave et d'anxiété générale. Les individus qui avaient consommé du cannabis pour soulager la douleur étaient plus probables de signaler des douleurs aux dos et au cou et avaient enduré la douleur pendant une période de temps beaucoup plus longue que ceux n'ayant pas utilisé le cannabis. Ceux qui avaient consommé du cannabis pour soulager la douleur signalaient de la douleur plus aiguë, plus d'interférence liée à la douleur, moins d'adaptation à la douleur et plus de jours hors de rôle au cours de l'année précédente. De plus, ces individus recevaient des ordonnances d'opiacés depuis plus longtemps, recevaient des doses d'opiacés plus élevées, étaient plus probables d'avoir été ordonnés des benzodiazépines et étaient plus probables de ne pas adhérer à leur régime d'opiacés. D'après les auteurs, ces individus consommant du cannabis pour soulager la douleur semblent être un groupe possédant plus de problèmes faisant parti d'un grand nombre de domaines, y compris des troubles psychologiques et des troubles de consommation de substances, à un tel degré que la consommation de cannabis pour soulager la douleur pourrait refléter ces caractéristiques. Alternativement, les auteurs suggèrent que la consommation complémentaire de cannabis pour soulager la douleur pourrait refléter une tentative de la part de ces individus de gérer leurs troubles, étant donné la sensation signalée d'un plus haut niveau d'interférence de douleur signalée. Les limites de cette étude comprennent la sous-déclaration potentielle, un biais potentiel associé à l'autodéclaration et le manque de renseignements sur la quantité et la puissance de cannabis consommée.
Pour appuyer ces résultats, une étude observant les taux de TUC dans un échantillon national de patients de la Veterans Health Administration (n= 1 316 464) diagnostiquée de douleur chronique non associée au cancer et recevant des médicaments opiacés suggère qu'un plus grand nombre de remplissages d'ordonnances d'opiacés était associé à une possibilité plus élevée de diagnostic d'un TUCReference 854. On a observé que les patients ayant reçu une ordonnance pour des opiacés et étant diagnostiqués d'un TUC étaient considérablement plus jeunes et plus probables d'être sans-abri. Ceux diagnostiqués d'un TUC étaient aussi plus probables d'être diagnostiqués d'une maladie du foie et du VIH, bien que moins probables d'être diagnostiqués de démence et de troubles rénaux comparativement à ceux non diagnostiqués d'un TUC. Les patients diagnostiqués d'un TUC étaient aussi plus probables d'être diagnostiqué de schizophrénie, d'autres psychoses, de troubles dépressifs majeurs, de troubles d'anxiété, de troubles d'adaptation, de troubles de la personnalité et de diagnostic mixte. Ceux atteints d'un TUC étaient aussi plus probables d'être diagnostiqués d'abus ou de dépendance d'hallucinogènes, de cocaïne, d'amphétamines, d'opiacés ou d'alcool. La conclusion des auteurs de cette étude suggère que le cannabis, au lieu d'agir en tant que substitut aux opiacés (c.-à-d. le TUC serait associé à une consommation plus faible d'opiacés), ces substances semblent se complémenter puisqu'une consommation plus élevée de médicaments opiacés est associée à un risque plus élevé de TUC. Les limites de cette étude comprennent un échantillon de population principalement homogène (vétérans militaires mâles) et le recours à des entrevues de diagnostic non normalisées semi-structurées soulevant la possibilité que la prévalence actuelle du TUC dans cette population de patients ait été sous-estimée.
Une étude épidémiologique utilisant les données recueillies à partir des vagues 1 et 2 du NESARC (2001 - 2002 et 2004 - 2005) a examiné prospectivement l'association entre la consommation de cannabis et la consommation incidente d'opioïdes prescrits sur ordonnance à des fins non médicales et le trouble 3 ans plus tard, ainsi que la question de savoir si la consommation de cannabis chez les adultes ayant une consommation non médicale d'opioïdes sur ordonnance est associée à une diminution subséquente de la consommation d'opioïdes à des fins non médicalesReference 855. La consommation de cannabis à la vague 1 a été associée à une augmentation significative des probabilités de consommation d'opioïdes sur ordonnance à des fins non médicales pendant la période de suivi à la vague 2, laquelle a persisté même après ajustement pour tenir compte des facteurs de confusion. Cette association a été observée chez les adultes n'ayant pas de trouble de consommation de cannabis au cours des 12 derniers mois et chez les adultes présentant une douleur modérée ou plus intense à la vague 1. De plus, chez les personnes n'ayant pas consommé d'opioïdes à des fins non médicales au cours des 12 mois précédant l'entrevue de la vague 1, il y a eu une association significative entre la consommation de cannabis à la vague 1 et la consommation incidente d'opioïdes à des fins non médicales au cours de la période de suivi. La consommation de cannabis a semblé également être associée à des risques plus faibles de diminution de la consommation d'opioïdes, mais les diminutions ont été nettement plus fréquentes que les augmentations de la consommation d'opioïdes. Après ajustement pour les autres covariables, des associations significatives ont persisté entre la consommation de cannabis à la vague 1 et la prévalence et l'incidence de trouble de consommation d'opioïdes à des fins non médicales à la vague 2. Chez les adultes présentant une douleur modérée ou plus intense à la vague 1, la consommation de cannabis a été associée à un trouble prédominant de consommation d'opioïdes dans les analyses ajustées. Malgré les constatations ci-dessus, la grande majorité des adultes qui ont consommé du cannabis n'ont pas commencé ou augmenté leur consommation d'opioïdes à des fins non médicales.
Une étude de cohorte préliminaire, historique et de petite taille a examiné le lien entre l'inscription à un programme de cannabis à des fins médicales et la consommation d'opioïdes sur ordonnanceReference 856. L'inscription à un programme de cannabis à des fins médicales est associée à une probabilité plus élevée et statistiquement significative de cesser les ordonnances d'opiacés (RC = 17,27; IC = 1,89; 157,36), un RC = 5,12 de réduire les doses quotidiennes d'opiacés (IC = 1,56; 16,88). Des améliorations ont été notées dans la réduction de la douleur, la qualité de vie, la vie sociale, les niveaux d'activité et la concentration avec peu d'effets secondaires.
Données provenant d'essais cliniques
Une revue systématique récente et une méta-analyse d'études cliniques examinant la force des données existantes pour l'effet « d'épargne en opiacés » des cannabinoïdes dans le contexte de l'analgésie ont conclu à l'absence d'études cliniques randomisées et bien contrôlées qui fournissent des preuves d'un effet « d'épargne en opiacés » des cannabinoïdesReference 846. De plus, les données existantes tirées d'essais cliniques examinant la capacité de « réduction de la quantité requise d'opioïdes » du cannabis sont variables. Une étude clinique croisée, contrôlée par placebo, à double insu portant sur des volontaires humains en bonne santé auxquels de faibles doses de THC, de morphine ou une combinaison des deux médicaments ont été administrées n'a pas réussi à établir de différences entre les évaluations des réactions sensorielles des sujets à un stimulus thermique douloureuxReference 857. Cependant, l'étude révèle que la combinaison de la morphine et du THC est liée à une diminution de la réaction affective des sujets au stimulus thermique douloureux. Les auteurs suggèrent que la morphine et le THC pourraient se combiner pour produire une réaction analgésique synergique à aspect affectif d'un stimulus douloureux évoqué de façon expérimentale.
Une récente étude clinique en double aveugle, contrôlée par placebo et intra-sujets a examiné si le cannabis augmente les effets analgésiques de l'oxycodone (à faible dose) et l'impact de la combinaison du cannabis et de l'oxycodone sur le risque d'abus. Dix-huit fumeurs 'actuels' de cannabis en bonne santé (au moins 3 fois par semaine; évalués par toxicologie urinaire et auto-déclaration) ont reçu de l'oxycodone (0, 2,5 et 5,0 mg, PO) avec du cannabis fumé (0,0, 5,6 % THC), et les effets analgésiques ont été mesurés par le test de pression à froid. Les résultats ont révélé que l'oxycodone seule (5,0 mg) augmentait significativement le seuil de douleur (F [1, 17] = 7,5, p ≤ 0,01) et la tolérance (F [1, 17] = 5,4, p ≤ 0,05) par rapport au placebo (cannabis inactif et 0,0 mg d'oxycodone). Lorsqu'il est administré avec du cannabis actif, le 5,0 mg d'oxycodone a également augmenté la tolérance à la douleur par rapport au placebo et au cannabis actif seul (F [1, 17] = 5,5, p ≤ 0,05). La combinaison de cannabis actif et de 2,5 mg d'oxycodone a augmenté le seuil de douleur et la tolérance par rapport au placebo (F [1, 17] = 5,9, p ≤ 0,05 et F [1, 17] = 6,5, p ≤ 0,05, respectivement) et le cannabis actif seul (F [1, 17] = 5,2, p ≤ 0,05 et F [1, 17] = 5,5, p ≤ 0,05, respectivement). En ce qui concerne le risque d'abus, l'oxycodone n'a pas augmenté les évaluations subjectives de l'abus de cannabis ou de l'auto-administration du cannabis. Cependant, une combinaison d'oxycodone (2,5 mg) et de cannabis a entraîné une augmentation légère mais significative du risque d'abus d'oxycodone (p ≤ 0,05). Les chercheurs ont conclu que les résultats démontrent les effets d'épargne en opiacés du cannabis pour l'analgésie qui peuvent s'accompagner d'une augmentation du risque d'abus potentiel lié à l'oxycodoneReference 858.
Une autre étude cliniqueReference 283 a signalé que les patients atteints de douleur chronique non liée au cancer et ne répondant pas aux opioïdes ont ressenti une analgésie accrue, une diminution de l'intensité de la douleur et une diminution de la douleur évoquée lorsqu'on leurs a donné 10 ou 20 mg du dronabinol (pour plus de détails, voir la Section 4.7.2.2, sous « Médicaments sur ordonnance à base de cannabinoïdes administrés par voie orale »).
Dans une autre étude, il a été signalé que les patients atteints de douleur chronique d'étiologies diverses n'ayant pas ressenti de soulagement avec des doses stables d'opioïdes (morphine ou oxycodone à libération prolongée) ont ressenti un plus grand soulagement de la douleur statistiquement significatif (-27 %, IC = 9, -46) par suite de l'inhalation du cannabis vaporisé (900 mg, 3,56 % de THC, t.i.d. pendant cinq jours)Reference 276 (pour plus de détails, consulter la Section 4.7.2.2, sous « Études cliniques avec le cannabis fumé ou vaporisé »). Ces conclusions indiquent que l'ajout de cannabinoïdes (dans le cas dont il est question, le cannabis vaporisé inhalé) à la thérapie d'opioïdes existante contre la douleur pourrait servir à améliorer l'analgésie associée à l'opioïde.
Par contre, une autre étude n'a pas relevé de baisse significative dans les quantités de médicaments opiacés de base ou de celles pour soulager les percées de douleur consommés par la majorité des patients souffrant de la douleur liée au cancer réfractaire, et prenant le nabiximols ou le THCReference 131. Dans le même ordre d'idée, aucun changement statistiquement significatif n'a été constaté dans les quantités de doses des médicaments opiacés de base ou de celles pour soulager les percées de douleur prises par des patients souffrant de la douleur liée au cancer réfractaire, à qui l'on a administré le nabiximolsReference 280. Toutefois, la méthodologie de cette dernière n'a pas permis une évaluation en bonne et due forme d'un « effet d'épargne de l'opioïde » du nabiximols.
En résumé, les études précliniques et les études de cas semblent appuyer un effet « d'épargne en opiacés » du THC, mais les résultats des études cliniques et épidémiologiques sont mitigés. Bien que « la synergie cannabinoïdes-opioïdes » ait été suggéré comme un moyen d'accroître de façon significative les effets analgésiques des opioïdes, tout en évitant ou en minimisant la tolérance aux effets analgésiques des opioïdes et le contournement ou l'atténuation des effets secondaires indésirables bien connus associés à l'usage des cannabinoïdes ou des opioïdes, certaines preuves sont mitigées et nécessitent une étude plus pousséeReference 835Reference 837.
4.7.2.5 Céphalées et migraines
- Les preuves soutenant l'utilisation du cannabis et des cannabinoïdes dans le soulagement des céphalées et des migraines sont très limitées et mixtes.
En ce qui concerne la migraine, une déficience des endocannabinoïdes a été posée comme principe sous-jacent de la pathophysiologie de la migraineReference 859; toutefois les données à l'appui de cette hypothèse s'en trouvent limitées et mixtes. Les études cliniques suggèrent que les concentrations de l'anandamide sont plus basses dans le LCR des migraineux, alors que les niveaux de peptides liés au gène de la calcitonine et d'oxyde nitreux (habituellement inhibés par l'anandamide et impliqués dans le déclenchement de la migraine) sont plus élevésReference 860Reference 861. Au contraire, l'activité de l'enzyme de dégradation de l'anandamide, la FAAH, est considérablement diminuée chez les migraineux chroniques, comparativement au groupe contrôleReference 862.
Bien que des données historiques et anecdotiques attribuent un rôle des cannabinoïdes dans le traitement des céphalées et des migrainesReference 863, aucune étude clinique contrôlée du cannabis ou des cannabinoïdes sur ordonnance pour le traitement des céphalées ou des migraines n'a jusqu'à ce jour été effectuéeReference 864Reference 865.
Dans un exposé de cas, un patient souffrant d'hypertension intracrânienne bénigne et de céphalée chronique a indiqué un soulagement important de la douleur après avoir fumé du cannabisReference 289. Dans un autre exposé de cas, un patient se plaignant d'algie vasculaire de la face réfractaire aux multiples médicaments aigus et préventifs a aussi signalé une amélioration grâce au cannabis fumé ou à la prise du dronabinol (5 mg)Reference 287. Toutefois, il faudrait interpréter ces études de cas à patient unique avec précaution.
Un récent rapport a fait état que l'usage du cannabis était plus fréquent au sein d'une population de patients français souffrant d'algie vasculaire de la face épisodique ou chronique et parmi les patients ayant fait recours au cannabis pour traiter leur céphalée, la majorité de ceux-ci ont signalé des effets variables, incertains, voire même négatifs de la fumée du cannabis sur l'algie vasculaire de la faceReference 286.
Une analyse rétrospective des dossiers de 121 adultes présentant un diagnostic primaire de migraine, et à qui un médecin provenant d'une des deux cliniques spécialisées dans le cannabis médical au Colorado a recommandé un traitement ou une prophylaxie avec du cannabis à des fins médicales, indique que la fréquence des migraines diminuait de 10,4 à 4,6 migraines par mois (p < 0,0001) avec la consommation de cannabis à des fins médicalesReference 285. Quarante pour cent des patients ont signalé des effets positifs, l'effet le plus courant étant la prévention de migraines, la diminution de leur fréquence et leur interruption. Le cannabis inhalé a été jugé plus efficace que son ingestion par voie orale. Des effets négatifs ont été signalés chez 12 % des patients, les produits comestibles étant associés à des effets plus négatifs (c.-à-d. problèmes avec la concordance dans le temps et l'intensité des effets).
Il convient aussi de noter que l'usage du cannabis a été associé au syndrome de vasoconstriction cérébral réversible et à de violentes céphaléesReference 288. De plus, la céphalée est un effet indésirable souvent constaté qui est associé à l'usage de cannabis ou des médicaments sur ordonnance à base de cannabinoïdesReference 59Reference 222Reference 427Reference 488Reference 683Reference 711, et la céphalée est aussi l'un des symptômes physiques les plus souvent signalés associés au sevrage du cannabisReference 866.
Une revue récente de l'utilisation du cannabis pour traiter les maux de tête a révélé qu'il n'y a pas suffisamment de données provenant d'essais cliniques bien contrôlés pour appuyer l'utilisation du cannabis pour soulager les maux de tête, malgré un nombre suffisant de résultats anecdotiques et préliminaires ainsi que des mécanismes neurobiologiques plausibles mandatant des études cliniquesReference 867.
4.8 Arthritides et troubles musculosquelettiques
- Les données provenant d'études précliniques suggèrent que la stimulation des récepteurs CB1 et CB2 dans le soulagement des symptômes de l'arthrose et le THC et le CBD soulagent des symptômes de la polyarthrite rhumatoïde.
- Les données provenant d'études cliniques sont très limitées et seuls des effets modestes ont été observés dans l'utilisation du nabiximols dans le traitement de la polyarthrite rhumatoïde.
- Il n'existe aucune étude clinique concernant l'utilisation du cannabis dans le traitement de la fibromyalgie et les données cliniques limitées avec le dronabinol et le nabilone suggèrent un effet modeste sur la réduction de la douleur et de l'anxiété, et l'amélioration du sommeil.
- Le rôle des cannabinoïdes dans l'ostéoporose a seulement été étudié dans desétudes précliniques et est complexe et contradictoire.
Les arthritides comprennent un large éventail de troubles différents (p. ex. l'arthrose et la polyarthrite rhumatoïde, la spondylarthrite ankylosante, la goutte, et bien d'autres encore) ayant tous en commun le fait qu'ils ciblent et atteignent les articulations. Des études scientifiques ont démontré que les articulations, les os et les muscles contiennent tous un SEC fonctionnel, que certaines arthritides, comme l'arthrose et la polyarthrite rhumatoïde, sont associées à des changements du fonctionnement du SEC et que la modulation de celui-ci peut aider à soulager certains symptômes associés à certaines arthritidesReference 40-Reference 42Reference 774Reference 868-Reference 876. La section ci-dessous résume les données concernant le cannabis/cannabinoïdes dans l'arthrose et la polyarthrite rhumatoïde. Cette section traite également des troubles musculosquelettiques comme la fibromyalgie et l'ostéoporose.
Données tirées d'enquêtes
L'Enquête de surveillancecanadienne de la consommation d'alcool et de drogues (ESCCAD) de 2011 indique qu'une proportion significative de Canadiens âgés de 15 ans et plus signalant utiliser du cannabis à des fins médicales déclarent qu'ils en consomment contre la douleur chronique associée à l'arthrite, par exempleReference 877.
En outre, une étude qui a examiné l'expérience de consommation du cannabis à des fins médicales chez des personnes australiennes révèle que parmi les 128 participants à l'enquête, 35 % ont affirmé qu'ils consommaient du cannabis pour traiter des symptômes associés à l'arthriteReference 878.
Un questionnaire auto-administré adressé à 947 personnes au Royaume-Uni ayant déclaré avoir déjà utilisé du cannabis à des fins médicales révèle que 21 % des personnes interogées ont affirmé qu'elles avaient consommé du cannabis pour traiter des symptômes associés à l'arthrite. Sept pour cent de ces personnes avaient utilisé du cannabis de façon continue pendant une durée médiane de quatre ansReference 571.
Une enquête portant sur 628 personnes canadiennes ayant elles-mêmes déclaré utiliser du cannabis à des fins médicales a cherché à savoir quelle était leur consommation de cannabis à des fins médicalesReference 879. Environ 15 % des personnes déclarant utiliser du cannabis à des fins médicales le consomment pour traiter des symptômes associés à la douleur arthritique, à l'inflammation, à l'insomnie, à l'anxiété, à la dépression et aux spasmes. La plupart d'entre elles ont déclaré préférer la fumée (53 %) plutôt que la vaporisation ou l'ingestion par voie orale (39 % dans les deux cas). La plupart (47 %) des personnes utilisant du cannabis pour soulager l'arthrite ont déclaré consommer du cannabis quatre fois ou plus par jour et une proportion égale a indiqué utiliser au moins 2 g ou plus par jour. La quantité médiane exprimée en gramme parmi les personnes qui utilisaient 2 g ou plus par jour était d'environ 4 g par jour.
4.8.1 Arthrose
Parmi les arthritides, l'arthrose est de loin le type d'arthrite le plus courant et il s'agit de la principale cause d'invalidité chez les sujets âgés de plus de 65 ans dans les pays développésReference 880. L'arthrose découle de lésions du cartilage articulaire induites par une interaction complexe de facteurs génétiques, métaboliques, biochimiques et biomécaniques, suivie d'une activation de réactions inflammatoires impliquant l'interaction du cartilage, de l'os sous-chondral et de la membrane synoviale entraînant d'autres lésions et dégradations du cartilage articulaire et de l'os sous-chondral, de la membrane synoviale et des faisceaux de renforcementReference 871Reference 872. Les résultats subséquents sont une déficience fonctionnelle des articulations et une douleur graveReference 871Reference 872. La douleur associée à l'arthrose n'est généralement pas adéquatement ou sécuritairement maîtrisée à l'aide d'analgésiques, ce qui incite à chercher d'autres méthodes thérapeutiquesReference 872. La maladie touche aussi bien les hommes que les femmes, bien qu'elle semble survenir plus souvent chez les femmesReference 871. De plus, l'arthrose touche le plus souvent les personnes d'âge moyen et les personnes âgées, même si les jeunes personnes peuvent également être concernées par la maladie à la suite d'une blessure ou d'un surmenageReference 871. La douleur associée à l'arthrose comprend des composantes nociceptives et non nociceptives, ainsi que des composantes neuropathiques et inflammatoires; elle est associée à des voies de la douleur anormalement excitables dans le système nerveux périphérique et le SNCReference 871. La douleur et l'incapacité physique associées à l'arthrose s'accompagnent également d'anxiété, de dépression et de changements des facultés cognitives qui ont tous un effet négatif sur la QVReference 870. Les études en neuroimagerie ont révélé que plusieurs régions cérébrales participent au traitement de la douleur due à l'arthrose, y compris l'activation bilatérale des cortex somatosensoriels primaire et secondaire, ainsi que des cortex insulaire, cingulaire, pré-frontal et orbito-préfrontal, et du thalamus, ainsi que l'activation unilatérale du putamen et de l'amygdaleReference 881Reference 882.
Études précliniques
Les modèles d'arthrose chez les animaux comprennent un certain nombre de limites telles que des différences dans l'anatomie, la fonctionnalité, les dimensions, les processus de réparation du cartilage et l'épaisseur comparativement aux articulations d'un être humainReference 871. En outre, les lésions qui se développent dans les modèles d'arthrose chez les animaux correspondent à celles observées chez l'humain, uniquement à un stade particulier de la maladieReference 871. De plus, aucun modèle d'arthrose chez les animaux ne reproduit complètement tous les types de signes et de symptômes de l'arthrose chez l'humain. Ensemble, ces facteurs présentent tous plusieurs difficultés importantes liées à la conversion des résultats obtenus dans ces modèles chez les patients souffrant d'arthrose. Cependant, les modèles d'arthrose chez les animaux sont utiles pour comprendre les effets thérapeutiques potentiels du cannabis et des cannabinoïdes.
Il existe un nombre toujours plus important de preuves qui semblent indiquer que le SEC joue un rôle important dans la physiopathologie de la douleur articulaire associée à l'arthroseReference 871. En ce qui concerne le tonus endocannabinoïde, une étude sur les animaux a signalé des niveaux élevés des endocannabinoïdes anandamide et 2-AG, et des composés dits « d'entourage », le PEA et l'OEA, dans la moelle épinière de rats ayant l'arthrose de l'articulation du genou induite de façon expérimentaleReference 883. Bien qu'aucun changement n'ait été constaté quant aux niveaux ou aux activités des enzymes cataboliques des endocannabinoïdes, FAAH ou MAGL dans la moelle épinière des rats touchés, on a signalé que les taux de protéines des enzymes majeures responsables de la synthèse endocannabinoïde s'en trouvaient considérablement élevésReference 883.
Les récepteurs CB1 et CB2 ont été localisés dans les articulations des genoux confirmant que le contrôle localisé de la douleur des articulations est réalisable sans la nécessité d'impliquer les récepteurs cannabinoïdes centrauxReference 884Reference 885. On a signalé une régulation négative de l'expression des gènes des récepteurs CB1 et CB2 dans la partie lombaire de la moelle épinière de la souris atteinte d'arthrose, probablement en réaction à une augmentation du tonus endocannabinoïde provenant des articulations atteintes d'arthroseReference 886.
Une étude chez les rats révèle que l'injection intra-articulaire de l'agoniste des récepteurs CB1 arachidonyl-2-chloroethylamide chez des animaux témoins a été associée à une réduction du taux d'allumage et la répression de l'activité nociceptive provenant des fibres nerveuses nociceptives innervant les articulations lorsqu'elles ont été soumises à une rotation normale ou nuisibleReference 887. En outre, des animaux souffrant d'arthrose dans les articulations ont manifesté un accroissement de la réponse à l'activation des récepteurs CB1 articulaires. L'effet antinocicepteur a été bloqué par une administration concomitante d'un antagoniste du récepteur CB1 dans les articulations atteintes d'arthrose, mais pas dans les articulations témoins.
L'administration locale de l'URB597 (un inhibiteur de la FAAH) par injection intra-artérielle proximale sur une articulation atteinte par l'arthrose a été associée à une diminution de la mécano-sensibilité des fibres afférentes des articulations chez deux différents modèles de rongeurs de l'arthroseReference 888. Les expériences comportementales menées chez ces animaux ont permis de supposer que le traitement avec l'inhibiteur a aussi diminué la douleur articulaire mesurée en fonction de la baisse de l'incapacitance des membres postérieursReference 888. En plus d'une réponse d'antinociception à l'inhibition de la FAAH, l'URB597 a démontré des effets de réduction de la circulation des leucocytes dans la membrane synoviale indiquant que les endocannabinoïdes pourraient posséder des propriétés antiinflammatoires au niveau des articulationsReference 874.
L'administration systémique d'un agoniste du récepteur CB2 dans un modèle d'arthrite chez le rat a été associée à un renversement lié à la dose de la force de préhension dans le membre atteint, une mesure indirecte de la douleurReference 889. L'efficacité analgésique maximale s'est avérée comparable à celle observée avec le célécoxib dans ce modèle animal d'arthroseReference 889.
Dans une autre étude sur les animaux, il a été démontré que le récepteur CB2 de la partie lombaire de la moelle épinière joue un rôle significatif dans la modulation de la douleur arthritiqueReference 886. En outre, la régulation positive de l'expression du récepteur CB2 dans la partie lombaire de la moelle épinière a été associée à une atténuation de la douleur articulaire. De plus, l'expression des récepteurs mu opioïdes dans la partie lombaire de la moelle épinière était régulée de manière négative, tandis que l'expression des récepteurs delta- et kappa-opioïdes était régulée de manière positive, ce qui laisse supposer la présence d'interactions fonctionnelles entre les systèmes endocannabinoïdes et opioïdes. La diminution de l'expression des récepteurs mu opioïdes et l'augmentation concomitante de l'expression des récepteurs kappa- et delta-opioïdes pourraient en outre contribuer à la composante nociceptive de la maladie.
Une étude sur les animaux menée avec un modèle d'arthrose chez le rat indique que les taux d'ARNm du récepteur CB2 ont considérablement augmenté dans la moelle épinière des rats atteints d'arthroseReference 890. En outre, la stimulation sélective du récepteur CB2 par l'administration de doses systémiques avec un agoniste des récepteurs cannabinoïdes synthétiques a été associée à une atténuation significative du développement et du maintien du comportement lié à la douleur et des réponses neuronales dans la moelle épinière. L'atténuation des taux de cytokines inflammatoires telles que l'interleukine (IL)-1β, le facteur de nécrose tumorale (TNF) α et l'IL-10 a aussi été considérable après le traitement par l'agoniste du récepteur CB2. Les rats n'ont pas semblé acquérir une tolérance aux effets antinocicepteurs de l'agoniste du récepteur CB2 après plusieurs administrations du médicament. L'étude révèle également un lien négatif entre les taux d'ARNm du récepteur CB2 et la chondropathie dans des échantillons post mortem de la moelle épinière chez l'humain.
Une étude sur les animaux portant sur l'arthrose chez la souris a établi un lien entre la maladie et l'augmentation significative des taux du 2-AG dans le cortex préfrontal, région du cerveau intervenant dans le traitement cognitif, des émotions et de la douleur, ainsi que dans le plasmaReference 870. L'arthrose dans ce modèle murin a aussi été liée à une augmentation du comportement apparenté au stress et à l'anxiété chez les souris de type sauvage touchées et les souris dépourvues de l'expression du récepteur CB1, mais pas chez les souris dépourvues de l'expression du récepteur CB2, ce qui indique que ces deux récepteurs auraient des rôles distincts dans la physiopathologie de l'arthrose. La stimulation sélective des récepteurs CB1 et CB2 a été associée à une amélioration de l'allodynie mécanique. Enfin, les patients atteints d'arthrose ont présenté une augmentation significative des niveaux plasmatiques du 2-AG, mais pas de l'anandamide, comparativement aux témoins en bonne santé dont les résultats concordent avec ceux obtenus avec le modèle murin. En outre, l'expression des récepteurs CB1 et CB2 était régulée de façon positive dans les lymphocytes du sang de ces patients et des corrélations positives importantes ont été observées entre les niveaux plasmatiques du 2-AG, la douleur au genou et les scores de dépression, ainsi que des corrélations négatives importantes entre le questionnaire SF-36 (QV) et les scores de performance de la mémoire.
Une étude préclinique chez la souris dépourvue de l'expression du récepteur CB2 appuie également le rôle du récepteur CB2 dans la physiopathologie de l'arthroseReference 891. Une arthrose bien plus grave s'est développée chez ces souris comparativement aux témoins de type sauvage. En outre, le traitement des souris de type sauvage avec un agoniste du récepteur CB2 a semblé occasionner une protection partielle contre l'arthrose. En revanche, une autre étude a observé que la livraison directe d'un agoniste des récepteurs CB2 augmentait l'activité des récepteurs nociceptifs des articulations et que la réaction de douleur intensifiée qui en découlait impliquait les canaux ioniques TRPV1Reference 885.
Une étude préclinique menée chez les rats et qui a examiné les effets du CBD sur la dégénérescence des disques intervertébraux révèle qu'une injection intradiscale directe de 120 nmol de CBD (mais non inférieures à 30 ou 60 nmol), immédiatement après une lésion discale, a considérablement atténué la gravité de la blessure discale et l'effet bénéfique s'est maintenu jusqu'à 15 jours après la blessureReference 892.
Études cliniques
Il n'existe aucunes études cliniques publiées sur le cannabis pour l'arthrose. Chez les humains, une étude révèle que les niveaux d'endocannabinoïdes anandamide et 2-AG dans le liquide synovial de patients atteints d'arthrose ont été supérieurs à ceux de témoins sans inflammation, bien que la pertinence de ces constatations demeure incertaineReference 42.
Une étude clinique croisée multicentrique, à double insu, à double placebo, à répartition aléatoire et contrôle actif d'un inhibiteur de la FAAH révèle l'absence d'activité analgésique (douleur cotée sur l'échelle des Universités de Western Ontario et McMaster) chez des patients atteints d'arthrose du genouReference 893. En revanche, l'administration du naproxène dans le cadre de cette étude a été associée à une analgésie significative. Fait important, cette étude clinique soulève des questions importantes quant à la traduisibilité des résultats des études sur les animaux pour les études menées chez les humains étant donné que l'inhibiteur de la FAAH s'est révélé efficace dans le modèle animal, mais pas chez l'humain. De plus, d'autres enjeux préoccupants comprennent les essais d'un inhibiteur de la FAAH dans une population hétérogène de patients atteints d'arthrose et d'effets hors cible (p. ex. sur le TRPV1).
4.8.2 Polyarthrite rhumatoïde
La polyarthrite rhumatoïde est une maladie inflammatoire auto-immune destructive et systémique qui touche une proportion plus petite, mais non négligeable, de la population adulteReference 880. Elle est caractérisée par une infiltration inflammatoire de la membrane synoviale entraînant une synovite progressive et une destruction éventuelle du cartilage et des articulations, une incapacité fonctionnelle, une douleur significative et des complications systémiques (p. ex. troubles cardiovasculaires, pulmonaires, psychologiques et squelettiques comme l'ostéoporose)Reference 873Reference 894Reference 895. Comme est le cas pour l'arthrose, le SEC joue un rôle important dans la physiopathologie du trouble et la manipulation du SEC s'avère prometteuse sur le plan thérapeutique.
Études précliniques
Une étude préclinique de la polyarthrite rhumatoïde menée sur un modèle chez le rat indique que le traitement avec le THC ou l'anandamide a été associé à une action anti-nociceptive importante dans le test de pression sur la patteReference 379. Une autre étude sur la polyarthrite rhumatoïde (aiguë et chronique) menée sur deux modèles murins différents révèle que l'administration systémique (IP) d'une marge posologique de CBD (2,5 mg/kg, 5 mg/kg, 10 mg/kg, 20 mg/kg par jour), après l'apparition de symptômes arthritiques aigus, pendant une période de dix jours, est associée à l'arrêt de la progression de tels symptômesReference 896. La dose quotidienne de 5 mg/kg IP a été jugée optimale dans les modèles aigus (dix jours) et chroniques (cinq semaines) d'arthrite. Aucun effet secondaire évident n'a été constaté, quelles que soient les doses mises à l'essai. L'administration par voie orale de 25 mg/kg de CBD pendant 10 jours, après l'apparition de symptômes arthritiques aigus, a été associée à une répression de la progression de ces symptômes, bien qu'une dose orale quotidienne de 50 mg/kg se soit avérée presque aussi efficace. La dose quotidienne administrée par voie orale de 25 mg/kg s'est avérée aussi efficace pour réprimer la progression des symptômes arthritiques chroniques lorsqu'elle était administrée pendant une période de cinq semaines. Les effets protecteurs associés à l'exposition au CBD étaient notamment la prévention de dommages histologiques supplémentaires des articulations arthritiques de la patte arrière, la répression de la libération du TNF à partir de cellules synoviales arthritiques, l'atténuation de la prolifération des cellules de ganglions lymphatiques, la répression de la production d'intermédiaires oxygénés réactifs et l'atténuation de la prolifération des lymphocytes.
Les résultats d'une étude examinant les effets anti-nociceptifs du THC dans un modèle de polyarthrite rhumatoïde chez le rat semblent indiquer que l'administration par voie intrapéritonéale de 4 mg/kg de THC est associée à une baisse significative des taux de dynorphine spinale, à une augmentation de l'analgésie par des récepteurs kappa-opioïdes et à une diminution de l'hyperalgésie par des récepteurs N-méthyle D-aspartate (NMDA)Reference 897. Une autre étude effectuée par le même groupe et utilisant le même modèle animal a démontré que le THC est aussi puissant et aussi efficace que la morphine en ce qui concerne l'action anti-nociceptive dans le test de pression sur la patte et qu'il existe une interaction anti-nociceptive synergique entre le THC et la morphine chez des rats arthritiques et non arthritiques dans le test de pression sur la patteReference 381. Une étude de suivi utilisant encore une fois le même modèle animal laisse supposer que le récepteur CB2 joue un rôle important dans la modulation des effets anti-nociceptifs du THCReference 898.
En effet, plusieurs études supplémentaires ont continué de confirmer le rôle important du récepteur CB2 dans la polyarthrite rhumatoïdeReference 868Reference 873Reference 899. Des échantillons de tissus prélevés à partir d'articulations rhumatoïdes d'humains ont révélé une augmentation de l'expression du récepteur CB2 comparativement aux articulations arthrosiques, l'expression du récepteur CB2 étant située sur la couche membranaire et la couche interstitielle sous-membranaire ainsi que sur les agrégats s'apparentant à des folliculesReference 873Reference 899. De plus, l'activation du récepteur CB2 sur les synoviocytes similaires aux fibroblastes découlant d'articulations rhumatoïdes a été associée à une inhibition de la production d'une variété de médiateurs inflammatoires observés dans la polyarthrite rhumatoïde, y compris l'IL-6, la métalloprotéinase matricielle (MMP)-3, la MMP-13 et le ligand de type chimiokine (motif C-C) (CCL) 2Reference 873Reference 899. L'activation des récepteurs CB2 a aussi été associée à une amélioration dépendante de la dose de la gravité de l'arthrose dans un modèle de polyarthrite rhumatoïde chez la sourisReference 899. La stimulation sélective du récepteur CB2 a considérablement diminué le gonflement des articulations, l'inflammation synoviale et la destruction des articulations, ainsi que les concentrations sériques d'anticorps anti-collagènes de type II dans un modèle murin de polyarthrite rhumatoïdeReference 868. Toutefois, d'autres ont déclaré que la stimulation des récepteurs CB2 des articulations cause l'hyperémie synoviale par l'entremise d'un mécanisme impliquant les canaux ioniques TRPV1Reference 900. L'effet vasodilatateur de ces agonistes des récepteurs CB2 est atténué dans les modèles d'arthrite aiguë et chronique suggérant que les récepteurs CB2 sont réglementés à la baisse dans les articulations enflammées.
Une étude préclinique récente a examiné l'efficacité du CBD transdermique pour la réduction de l'inflammation et de la douleur dans un modèle de rat de polyarthrite rhumatoïdeReference 901. Au cours de cette étude, des gels topiques contenant des doses croissantes de CBD (0,6, 3,1, 6,2 et 62,3 mg/jour) ont été appliqués à la surface de la peau dorsale pour quatre jours consécutifs après l'induction d'arthrite pseudorhumatoïde. L'absorption transdermique a causé des augmentations selon la dose de concentrations de CBD dans le plasma sanguin. Le résultat de ces quatre jours d'application a causé des concentrations moyennes dans le plasma sanguin de 3,8 ng/mL, de 17,5 ng/mL, de 33,3 ng/mL et de 1 629,9 ng/mL, respectivement. Les trois doses inférieures ont démontré des corrélations pharmacocinétiques linéaires, mais non la dose la plus élevée. De plus, les doses de gel de 6,2 mg et de 62,3 mg de CBD ont considérablement réduit le gonflement articulaire, les cotes de position des membres en tant qu'échelle d'évaluation de la douleur spontanée, l'infiltration des cellules immunitaires et l'épaississement de la membrane synoviale. La dose de 6,2 mg de CBD a réduit de façon optimale le gonflement et l'épaississement de la membrane synoviale. Le traitement avec le CBD n'était pas associé aux changements du comportement explorateur, suggérant donc l'absence d'effets psychoactifs.
Études cliniques
Chez les humains, une étude a relevé que les niveaux de l'anandamide et de 2-AG dans le liquide synovial des patients atteints de polyarthrite rhumatoïde étaient plus élevés comparativement à ceux des contrôles normaux non enflammés, bien que l'importance de ces donées demeure incertaineReference 42.
Il n'existe pas d'études cliniques publiées sur le cannabis pour la polyarthrite rhumatoïde.
Une étude préalable évaluant l'efficacité du nabiximols (SativexMD) contre la douleur causée par la polyarthrite rhumatoïde a indiqué un effet analgésique modeste mais statistiquement significatif en mouvement et au repos, ainsi qu'une amélioration de la qualité du sommeilReference 380. L'administration de nabiximols a été bien tolérée et aucune toxicité importante n'a été observée. La dose quotidienne moyenne au cours de la dernière semaine du traitement était de 5,4 activations de la pompe (l'équivalent de 14,6 mg de THC et de 13,5 mg de CBD par jour, et la durée du traitement était de trois semaines). Les différences observées étaient minces et variables parmi les participants.
Une revue effectuée par le Centre de collaboration Cochrane en 2012 a conclu que les données à l'appui de l'usage du cannabis oromucosal (p. ex. le nabiximols) pour le traitement de la douleur consécutive à la polyarthrite rhumatoïde sont faibles et vu le profil des effets secondaires considérables associés à l'usage des cannabinoïdes, les risques éventuels semblent emporter sur tout bienfait modeste procuréReference 894.
4.8.3 Fibromyalgie
La fibromyalgie est un trouble caractérisé par la douleur généralisée (l'allodynie et l'hypéralgie) et une pléthore d'autres symptômes dont le trouble du sommeil, la fatigue, des perturbations émotionnelles et cognitivesReference 902. Bien que la physiopathologie sous-jacente de la fibromyalgie ne soit pas claire, des perturbations du recrutement ou du fonctionnement des voies périphérique et centrale du traitement de la sensation de la douleur et des niveaux de plusieurs neurotransmetteurs importants (sérotonine, noradrénaline, dopamine, opioïdes, glutamate et substance P) ont été relevés chez des patients souffrant de fibromyalgieReference 903-Reference 906. Des symptômes comorbides de la dépression ont aussi été associés à un déficit prononcé d'inhibition de la douleur de même qu'à une augmentation de la douleur chez les patients fibromyalgiquesReference 907.
Études cliniques avec le cannabis fumé ou ingéré par voie orale
Il n'existe pas d'essais cliniques du cannabis fumé ou ingéré pour le traitement de la fibromyalgie. Toutefois, une enquête transversale menée auprès des patients souffrant de la fibromyalgie a relevé que les patients signalaient avoir consommé le cannabis (en le fumant, en le mangeant ou les deux) pour soulager la douleur, les troubles de sommeil, les raideurs, les troubles de l'humeur, l'anxiété, les céphalées, la fatigue, la fatigue matinale, et les troubles digestifs consécutifs à la fibromyalgieReference 179. Les sujets (pour la plupart des femmes d'âge moyen qui n'ont pas répondu au traitement actuel) ont signalé avoir connu des baisses statistiquement importantes de la douleur et des raideurs et une amélioration statistiquement importante de la relaxation, de la somnolence, et du bien-être 2 h après l'administration de cannabis. Les effets secondaires comprenaient la somnolence, l'assèchement de la bouche, les étourdissements, le « high », la tachycardie, l'irritation de la conjonctive, et l'hypotension. L'étude a connu un certain nombre de lacunes notamment la méthodologie de celle-ci, la petite taille d'échantillon, la variabilité dans la fréquence et la durée de la consommation du cannabis et une population de sujets biaisée.
Études cliniques avec les médicaments sur ordonnance à base de cannabinoïdes
Il existe peu d'études cliniques contrôlées s'étant penchées sur le rôle des cannabinoïdes dans le traitement de la fibromyalgie. Les données probantes disponibles sont résumées ci-dessous.
Dronabinol
Une étude pilote contrôlée sans placebo examinant les effets du dronabinol en monothérapie (2,5 à 15 mg de Δ9-THC/jour; avec des augmentations hebdomadaires de 2,5 mg de Δ9-THC, jusqu'à un maximum de 15 mg de THC/jour) sur la douleur induite de façon expérimentale, la poussée réflexe d'axone et le soulagement de la douleur chez des patients fibromyalgiques a rapporté qu'une sous population de ces patients ont connu un soulagement considérable de la douleur (diminution de la perception de la douleur) avec 10 et 15 mg/jour de Δ9-THC mais aucun changement n'a été observé en ce qui concerne la poussée réflexe d'axoneReference 382. L'allodynie évoquée par le toucher et l'hyperalgésie induite par piqûre n'ont pas été affectées de façon significative par le Δ9-THC. Des sujets ayant terminé un cycle de traitement de trois mois (15 mg/jour de Δ9-THC) ont signalé une réduction de la douleur > 50 %. L'étude a néanmoins connu une faible puissance en raison du taux d'abandon élevé par les patients à cause des effets secondaires intolérables du traitement.
Une étude multicentrique rétrospective auprès de patients souffrants de fibromyalgie à qui l'on avait prescrit une dose quotidienne moyenne de 7,5 mg de Δ9-THC sous une période de traitement de sept mois en moyenne, a rapporté une baisse significative du score de la douleur et de la dépression, et une réduction significative de la prise concomitante des médicaments antidouleurs tels que les opioïdes, les antidépressifs, les anticonvulsivants et les médicaments AINS suite au traitement avec le Δ9-THCReference 383. Il est important de noter que l'étude a connu un nombre considérable de lacunes (méthode de collecte de données, critères de sélection hétérogènes de patients, et un taux élevé d'abandon par les sujets) et ainsi donc, les résultats devraient être interprétés avec précaution.
Nabilone
Un essai clinique randomisé du nabilone (1 mg b.i.d.) mené à double insu et contrôlé avec placebo pour le traitement de la fibromyalgie a relevé des améliorations statistiquement importantes aussi bien dans une mesure subjective de soulagement de la douleur et de l'anxiété que dans les scores du questionnaire d'impact de la fibromyalgie, après quatre semaines de traitementReference 587. Toutefois, aucun changement significatif n'a été constaté quant au nombre des points de fibromyalgie ou du seuil de la douleur des points de la fibromyalgie (remarque : le recours aux « points de fibromyalgie » comme critère de diagnostic de la fibromyalgie ne constitue plus une exigence absolue)Reference 908. Les patients prenaient en même temps des médicaments antidouleur tels que les AINS, les opioïdes, et les antidépressifs et les myorelaxants. Le nabilone n'a pas eu de bienfait durable chez les sujets à l'arrêt du traitement.
Une étude clinique randomisée de deux semaines menée par permutation, à double insu et contre témoin actif auprès de 29 patients souffrant de fibromyalgie a rapporté que le nabilone (0,5 à 1,0 mg avant le coucher) a amélioré le sommeil chez cette population de patientsReference 588.
Les Lignes directrices canadiennes pour le diagnostic et la prise en charge du syndrome de fibromyalgie (approuvées par la Société canadienne pour le traitement de la douleur et la Société canadienne de rhumatologie) indiquent qu'en ce qui a trait au traitement éventuel, l'essai d'un cannabinoïde pharmacologique sur ordonnance pourrait être envisagé chez un fibromyalgique, en particulier dans le réglage du trouble de sommeil important (cette recommandation s'est fondée sur la preuve de Niveau 3, Grade C)Reference 832. Pour des renseignements supplémentaires relatifs à l'usage du cannabis et des cannabinoïdes pour soulager les troubles ou les perturbations du sommeil, veuillez consulter la Section 4.9.5.2.
Une revue systématique par Cochrane des données disponibles sur l'efficacité, l'innocuité et la tolérabilité des produits de cannabis provenant d'essais cliniques randomisés, à double insu et d'une durée d'au moins quatre semaines pour le traitement de la fibromyalgie chez les adultes a révélé que 1 mg de nabilone à l'heure du coucher n'est pas associé à des preuves de qualité élevée à modérée pour un résultat d'efficacité (soulagement de la douleur reporté par le participant de > 50 % et impression globale de changement du patient (Patient Global Impression of Change) très ou beaucoup améliorée), de tolérabilité (retrait dû à des événements indésirables), et d'innocuité (événements indésirbales sérieux)Reference 909. Des données de faible qualité ont été trouvées pour le nabilone par rapport au placebo en ce qui concerne le soulagement de la douleur et la qualité de vie liée à la santé, mais pas pour la fatigue, et pour le nabilone par rapport à l'amitriptyline en ce qui concerne l'amélioration de la qualité du sommeil, mais pas pour la douleur et la qualité de vie liée à la santé. Les effets indésirables non graves associés à l'utilisation du nabilone incluent les étourdissements et la somnolence, la sécheresse de la bouche et le vertige, et l'incidence des effets indésirables non graves associés à l'utilisation du nabilone a été plus élevée que celle du placebo ou de l'amitriptyline.
4.8.4 Douleurs musculaires
Les douleurs musculaires touchent une grande proportion de la population et représentent un problème clinique majeurReference 910Reference 911. Les constatations des études précliniques utilisant deux modèles de douleur musculaire aiguë chez des animaux indiquent que l'administration systémique (0,3 à 5 mg/kg IP) et locale ( 0,0125 à 0,1 mg/kg intramusculaire (IM)) de THC serait associée à une diminution dépendante à la dose de la fréquence des tremblements des pattes et à une réduction de la durée du comportement nocifensif après un stimulus musculaire nocifReference 910. Des différences dans les types de récepteurs cannabinoïdes en jeu ont été observées selon la voie d'administration : l'administration systémique du THC a été liée à un engagement des récepteurs CB1 ou CB2, tandis que l'administration locale du THC dans la patte a été principalement liée à un engagement des récepteurs CB2Reference 910. Il n'existe aucune étude expérimentale ou clinique faisant intervenir les cannabinoïdes pour lutter contre la douleur musculaire.
4.8.5 Ostéoporose
L'ostéoporose est une maladie marquée par une diminution de la densité minérale osseuse et un risque accru de fractures de fragilitéReference 912. Elle se manifeste lorsque le cycle de remodelage osseux est perturbé, entraînant une diminution nette du dépôt osseux et une augmentation nette de la résorption osseuseReference 913.
Études précliniques
Les récepteurs cannabinoïdes CB1 et CB2 ont été détectés dans les ostéoblastes et les ostéoclastes des souris, quoique le CB1 s'exprime à de très faibles niveaux par rapport au CB2Reference 20Reference 914Reference 915. En fait, il semble que les récepteurs CB1 s'expriment plus abondamment dans les terminaisons nerveuses sympathiques du muscle squelettique à proximité immédiate des ostéoblastesReference 916. Outre ces récepteurs, le 2-AG et l'anandamide ont été détecté dans l'os trabéculaire de la souris et dans des cultures d'ostéoblastes des souris et des cultures d'ostéoclastes humainesReference 915Reference 917Reference 918. Prises ensemble, ces conclusions suggèrent l'existence d'un SEC fonctionnel dans les os.
Le rôle du SEC dans la physiologie osseuse a fait l'objet d'une étude à l'aide de souris portant des suppressions génétiques des gènes CNR1 ou CNR2. Des phénotypes squelettiques des souris « knock-out » CB1 semblent varier en fonction de la stratégie de ciblage du gène utilisée, de la souche de souris, du sexe, des points temporels auxquels les phénotypes ont fait l'objet d'étude ainsi que des différentes méthodologies expérimentales auxquelles l'on a fait recours pour mesurer la densité osseuseReference 20. Chez une souche de souris présentant une carence en CB1, de jeunes souris femelles avaient des os trabéculaires normaux avec une légère expansion corticale, tandis que de jeunes souris mâles avaient une masse osseuse élevéeReference 914Reference 916. La perte de la fonction du récepteur CB1 a été associée à la protection contre la perte osseuse induite par ovariectomieReference 914. De plus, l'antagonisme des récepteurs CB1 et CB2 a prévenu la perte osseuse induite par ovariectomie in vivoReference 914.
Une étude ultérieure par le même groupe a rapporté que les souris « knock-out » CB1 avaient un pic de la masse osseuse accru, mais qu'elles ont par la suite développé l'ostéoporose liée à l'âgeReference 912. L'augmentation du pic de la masse osseuse a été attribuée à une baisse de la formation et de l'activité des ostéoclastes avec préservation de l'activité des ostéoblastes. En revanche, la perte osseuse chez les souris mutantes semble être due à une formation et une accumulation préférentielles des adipocytes aux dépens d'ostéoblastes dans l'espace de moelle osseuse, ainsi qu'à une décroissance de la formation osseuseReference 912. Contrairement à ces études, une autre étude ayant eu recours à une stratégie différente de ciblage de gêne et à une autre souche de souris a rapporté que les souris « knock-out » CB1 mâles et femelles, ont connu de faibles densités osseuses, une augmentation du nombre des ostéoclastes et une baisse du taux de la formation osseuseReference 916. Les effets de l'ovariectomie chez cette lignée de souris n'ont pas fait l'objet d'étude, très probablement parce que la masse osseuse initiale était trop faible pour permettre de bien mesurer les différences entre les souris soumises à l'ovariectomie et les contrôles.
Une autre étude préclinique effectuée chez des rats plus jeunes et plus âgés révèle que le blocage de l'activité des récepteurs CB1, par l'administration du rimonabant, a eu des effets différents sur l'épaisseur de la corticale osseuse induite par des glucocorticoïdes et sur la densité moyenne de l'os trabéculaireReference 919. Chez les jeunes rats, le rimonabant a atténué les effets ostéoporotiques du traitement par glucocorticoïde chronique, tandis que chez les rats plus âgés, l'effet opposé a été constaté. Les constatations provenant de cette étude corroborent également la théorie selon laquelle le récepteur CB1 jouerait un rôle différent en fonction de l'âge dans les processus de renouvellement des cellules osseuses.
Chez la souris, il a été démontré que l'activation des récepteurs CB1 par THC ralentit considérablement l'allongement des os et possiblement la taille corporelle générale, du moins chez la souris adolescente femelleReference 920. La concentration de THC systémique administré chez la souris (5 mg/kg par jour) a été déclarée similaire à celle décrite pour les fumeurs quotidiens de cannabis.
Une étude préclinique chez les rats évaluant l'incidence de la fumée du cannabis sur la guérison des os autour d'implants en titane a rapporté qu'une exposition chronique à la fumée du cannabis a réduit la guérison des os spongieux autour des implants en réduisant le remplissage des os et le contact entre l'os et l'implant dans le filetage de l'implantReference 385. Aucun effet de ce genre n'a été observé pour l'os cortical.
Les phénotypes squelettiques des souris « knock-out » en récepteur CB2 ont aussi fait l'objet d'étude. Ofek a rapporté que les souris déficientes en CB2 ont présenté un faible phénotype de la densité osseuse ainsi qu'une perte d'os trabéculaire liée à l'âgeReference 921. Ces déficits ont été liés à l'augmentation des nombres de précurseurs d'ostéoclastes et à la diminution des nombres de précurseurs d'ostéoblastesReference 921. De plus, l'on a rapporté qu'un agoniste des récepteurs CB2 sélectif a augmenté la prolifération et l'activité des ostéoblastes et a diminué la formation in vitro des cellules semblables à celles des ostéoclastes et que l'administration de cet agoniste a atténué la perte osseuse induite par ovariectomie in vivoReference 921. Bien qu'une étude plus récente ait rapporté avoir constaté une perte osseuse liée à l'âge, elle n'a pas réussi à déceler des différences significatives des pics de la masse osseuse entre les souris de type sauvage et les souris « knock-out »Reference 922. De plus, contrairement à l'étude menée par OfekReference 921 une stimulation sélective du récepteur CB2 a été associée à une augmentation de la différenciation et de la fonction ostéoblastiques plutôt qu'à une prolifération. Une autre étude n'a pas rapporté de différences concernant les pics de la masse osseuse entre les souris « knock-out » en récepteur CB2 et les souris de type sauvage dans des conditions normalesReference 923. La perte osseuse liée à l'âge n'a pas été mesurée dans cette étude. L'ablation génique du récepteur CB2 semblait protéger contre la perte osseuse induite par ovariectomie, un effet imité par l'administration de l'antagoniste sélectif des récepteurs CB2 Reference 923. Inversement, les résultats des études in vitro portent à croire que l'antagoniste sélectif des récepteurs CB2 a de façon significative accru la formation et la taille des ostéoclastesReference 923. Il serait peut-être utile de noter ici que des polymorphismes mononucléotidiques (SNP) et ses halotypes se trouvant dans la région codante du gène du récepteur CB2 ont aussi été associés à l'ostéoporose chez les humainsReference 924-Reference 926.
4.9 Autres maladies et symptômes
4.9.1 Troubles du mouvement
Les composantes individuelles du SEC sont particulièrement abondantes dans les zones du cerveau qui contrôlent le mouvement, comme les noyaux gris centrauxReference 927. Les effets moteurs surviennent habituellement comme conséquence des changements de l'activité du SEC, et l'activation des récepteurs CB1 entraînant habituellement l'inhibition du mouvementReference 927. De nombreuses études ont indiqué des changements des niveaux et de l'activité des récepteurs CB1 dans les maladies motrices comme la maladie de Parkinson (MP) et de Huntington (MH)Reference 928-Reference 931 et les résultats de ces études suggèrent un lien complexe entre le SEC et leur physiopathologie et celle d'autres maladies neurologiques.
Une analyse systématique de l'efficacité et de l'innocuité des cannabinoïdes contre les troubles du mouvement, comme la MH, la MP, la dystonie cervicale et le SGT indique que les cannabinoïdes seraient probablement inefficaces ou qu'ils auraient une efficacité inconnue et que les risques et avantages du traitement aux cannabinoïdes doivent être soigneusement évaluésReference 666. En outre, l'efficacité comparative du cannabinoïde par rapport à d'autres traitements est inconnue pour ces indicationsReference 666.
4.9.1.1 Dystonie
- Les données limitées provenant d'études précliniques suggèrent qu'un agoniste synthétique des récepteurs CB1 et CB2 pourrait soulager de symptômes ressemblant à ceux de la dystonie, et que le CBD retarde la progression de la dystonie.
- Les données provenant d'un nombre limité d'études de cas et de petits essais cliniques ouverts ou contrôlés par placebo suggèrent une amélioration des symptômes de dystonie avec du cannabis inhalé, des effets mixtes du THC oral, une amélioration des symptômes de dystonie avecdu CBD oral et une absence d'effets du nabilone sur les symptômes de dystonie.
La dystonie se traduit par une hyperactivité des muscles nécessaires pour effectuer un mouvement normal, avec force supplémentaire ou l'activation de muscles avoisinants mais non nécessaires; outre le fait qu'elle entrave la fonction motrice, elle est souvent douloureuseReference 932. La dystonie peut être primaire et inclure le torticolis et le blépharospasme ou la dyskinésie ou dystonie orofaciale (syndrome de Meige). Elle peut aussi être associée à une autre maladie, comme la MH et la dyskinésie tardive survenant après la prise de médicaments bloquant la dopamineReference 932.
Données précliniques
Une étude préclinique menée chez un modèle de hamster de dystonie primaire généralisée a rapporté une diminution dose-dépendante de la gravité de la maladie avec l'administration de l'agoniste des récepteurs cannabinoïdes synthétiques CB1 et CB2, le WIN 55,212-2Reference 933. Toutefois, des doses anti-dystoniques de l'agoniste, ont été associées à de sévères effets secondaires notamment la dépression de l'activité locomotrice spontanée et la catalepsie. De plus, cet agoniste de récepteur CB a accru les effets anti-dystoniques du diazépamReference 933. Une étude de suivi effectuée par le même groupe a confirmé l'efficacité anti-dystonique du WIN 55,212-2 et a aussi démontré que le CBD avait retardé la progression de la dystonie, mais seulement à une très forte doseReference 934. Une étude préclinique de la dystonie aiguë induite par les antipsychotiques et la dyskinésie tardive chez les singes a démontré que la dyskinésie buccale mais pas la dystonie avait été réduite en fonction de la dose par l'agoniste de récepteur CB1 synthétique, le CP 55,940Reference 935.
Données cliniques
Bien que des rapports anecdotiques suggèrent que le cannabis puisse soulager les symptômes associés à la dystonie chez les humainsReference 244, aucune étude clinique bien contrôlée du traitement de la dystonie par le cannabis n'a été publiée.
Une étude de cas a signalé une amélioration du torticolis après avoir fumé du cannabisReference 936. Une autre étude de cas a signalé une amélioration chez un patient souffrant de douleurs thalamiques centrales et d'une dystonie hémiplégique douloureuse du côté droit qui a fumé un joint le matin, une fois par semaine, pendant trois semainesReference 937. Après avoir fumé, le patient a signalé un soulagement total de la douleur et un soulagement de la paresthésie, ainsi qu'une amélioration notable de la dystonie et une amélioration de la capacité à écrire et à faire quelques pas, sans aide. Le soulagement de la douleur a semblé persister jusqu'à 48 heures après chaque épisode de cannabis fumé. Aucune tolérance aux effets du cannabis n'a été observée et le patient a arrêté le traitement analgésique aux opioïdes. Un autre rapport de cas portant sur un patient âgé de 25 ans et consommant du cannabis dans le traitement d'une dystonie généralisée découlant de la maladie de Wilson révèle que le fait de fumer trois à quatre grammes de cannabis par jour a significativement amélioré sa dystonieReference 244. L'observation du médecin a confirmé les allégations du patient : le cannabis a diminué de 50 % le score sur l'échelle d'évaluation de la dystonie de Burke-Fahn-Marsden et celui sur l'échelle d'incapacité. Les effets thérapeutiques n'ont pas semblé durer au-delà de chaque période de 24 heures, ce qui exigeait que le patient consomme du cannabis chaque jour.
Un essai à dose unique de 5 mg de Δ9-THC, contrôlé avec placebo et administré oralement à un musicien atteint de dystonie focale (« dystonie du musicien ») a rapporté une amélioration du contrôle moteur au niveau de la main atteinte du sujet, avec la fatigue et les troubles de concentration cités comme étant les effets secondaires associés à l'usage de Δ9-THCReference 246. Les effets thérapeutiques ont persisté jusqu'à deux heures après la prise avec un retour progressif à des valeurs initiales après cinq heures.
Une étude croisée de phase IIa de huit semaines, à répartition aléatoire et contrôlée par placebo portant sur le dronabinol (15 mg par jour) menée chez neuf patients atteints d'une dystonie cervicale a signalé l'absence d'effet du dronabinol comparativement au placebo sur toute mesure de résultat (échelle clinique Toronto Western Spasmodic Torticollis Rating Scale [TWSTRS], EVA pour l'évaluation de la douleur, impression globale de changement)Reference 240. La plupart des sujets ont éprouvé un événement indésirable, mais aucun n'a été jugé grave. Les événements indésirables liés à l'administration de dronabinol comprenaient notamment les étourdissements, la somnolence, l'assèchement de la bouche, une vision trouble, un goût amer et des vertiges, et ceux-ci étaient jugés légers.
Une autre étude de cas révèle que le dronabinol (2,5 mg, b.i.d. au départ, puis 5 mg, b.i.d.) a été associé à une amélioration de la dystonie chez un patient atteint de SP, de dystonie paroxystique, de tics vocaux complexes et de dépendance au cannabis (consommation quotidienne minimale de cinq joints de cannabis) et qui avait déjà signalé une amélioration des symptômes après avoir fumé du cannabisReference 243. Le patient a aussi fait état d'une réduction importante de l'état de manque de cannabis, une amélioration de la qualité du sommeil, une diminution de la vocalisation, une diminution de l'anxiété et de la fréquence de la dystonie paroxystique avec le dronabinol.
Un essai pilote ouvert de six semaines auprès de cinq patients prenant 100 à 600 mg par jour de CBD a rapporté des améliorations modestes des mouvements dystoniques liées aux doses chez tous les sujets de l'étude, mais aussi l'aggravation des tremblements et de l'hypokinésie chez deux patients ayant en parallèle la MP qui avaient reçus des doses de CBD > 300 mg/jourReference 257. Les effets secondaires du CBD étaient légers et comprenaient une hypotension, une bouche sèche, un ralentissement psychomoteur, des étourdissements et une sédation.
Les résultats d'une étude randomisée menée à double insu et contrôlée avec placebo auprès de 15 patients prenant une dose unique de 0,03 mg/kg du nabilone et ne prenant pas d'autres médicaments antidystoniques n'ont montré aucune réduction significative de la dystonieReference 249.
4.9.1.2 Maladie de Huntington
- Les données provenant d'études précliniques signalent des résultats mixtes avec le THC sur les symptômes ressemblant à ceux de la Maladie de Huntington (MH).
- Les données limitées provenant d'études de cas et des essais cliniques à petite envergure sont mixtes et suggèrent une absence d'effets du CBD, du nabilone et du nabiximols et une amélioration limitée des symptômes de MH avec le cannabis fumé.
Données précliniques et expérimentales chez l'humain
Les résultats d'études effectuées chez les modèles animaux de la MH ainsi que des études effectuées post-mortem sur des patients décédés atteints de la MH suggèrent que les récepteurs CB1 présents dans le cerveau, surtout ceux qui se trouvent au niveau des noyaux gris centraux sont régulés à la baisse et/ou désensibilisés à la suite de l'expression de la protéine mutante huntingtine, et que cela se manifeste au tout début de la maladie, et avant l'apparition de symptômes cliniques évidentsReference 928Reference 938-Reference 947. Une étude in vivo par tomographie à émission de positrons (TEP) menée auprès de patients atteints de la MH corrobore ces conclusions, démontrant d'importantes baisses de la disponibilité du récepteur CB1 partout dans la substance grise du cerveau, du cervelet et du tronc cérébral des patients atteints de la MH, et ce même au stade précoce de la maladieReference 948. Des études précliniques et post mortem supplémentaires chez des patients décédés atteints de la MH indiquent que la diminution des niveaux du récepteur CB1 semble être accompagnée par une croissance des niveaux du récepteur CB2 dans les cellules gliales, les astrocytes et dans les cellules gliales réactivesReference 943Reference 949. Ainsi, une quantité significative de données précliniques et de données cliniques limitées suggèrent que des changements dans le SEC sont étroitement liés à la physiopathologie de la MHReference 943Reference 946-Reference 948.
Une étude préclinique chez un modèle de la souris de la MH n'a pas rapporté d'effets bénéfiques du Δ9-THC (10 mg/kg/jour)Reference 950, tandis qu'une autre étude a rapporté que le Δ9-THC (2 mg/kg/jour) a été associé à une baisse de la pathologie et à une apparition retardée de symptômes semblables à ceux de la MH comparativement aux souris non traitées souffrant de la MHReference 945. Une autre étude préclinique animale sur un modèle de rat de la MD a démontré que l'activation du récepteur CB2 était associée à la réduction des marqueurs d'inflammation associés à un phénotype ressemblant à la MH et à la protection des neurones de projection du néostriatumReference 951. Une étude préclinique a aussi signalé qu'une population limitée de récepteurs CB1 sélectivement situés sur les bornes glutamatergiques des projections corticostriatales pourrait jouer un rôle protecteur, attenuant les dommages excitotoxiques associés à la libération excessive de glutamate chez des patients atteints de la MH, soulevant la possibilité que le ciblage sélectif de ce groupe de récepteurs puisse aider à atténuer la neurodégénération chez les patients atteints de la MHReference 952.
Données cliniques
Les résultats d'études de cas à patient unique sont contrastés. Dans une étude, une dose quotidienne de 1,5 mg de nabilone a augmenté les mouvements choréiquesReference 252, alors que dans un autre cas, le médicament a amélioré l'humeur et a diminué la chorée chez un patient qui avait fumé du cannabis puis avait poursuivi avec 1 mg de nabilone b.i.d.Reference 953.
En ce qui concerne les études cliniques, un essai randomisé mené par permutation et à double insu et contrôlé avec placebo auprès de 15 patients souffrant de la MH prenant 10 mg/kg/jour de CBD par voie orale n'a pas rapporté d'améliorations des symptômes associés à la MHReference 254. Une étude pilote par permutation, randomisée, à double insu et contrôlée contre placebo indique peu d'effets bénéfiques, sinon aucun, de doses de 1 à 2 mg de nabilone par rapport au placebo chez 37 patients atteints de la MHReference 241. Toutefois, le nabilone a été bien toléré dans cette population de patients et n'a pas semblé exacerber la chorée ou la psychose associée à la MH, bien que certains effets indésirables tels que la somnolence et des pertes de mémoire aient été observés. Les patients prenaient en même temps d'autres médicaments contre la MH.
Une étude pilote récemment publiée, de 12 semaines, à double insu, aléatoire, contrôlée par placebo et transversale a examiné l'innocuité et la tolérance du nabiximols chez les patients atteints de la MH et n'a signalé aucune différence considérable des résultats sur les fonctions motrices, cognitives, comportementales ou fonctionnelles associées avec l'utilisation de nabiximols comparativement au placebo chez 26 patients atteints de la MH à l'exception d'une incidence croissante d'étourdissements et de perte d'attention dans le groupe de traitementReference 237. Les lacunes de la méthodologie de l'étude comprennent le manque de puissance afin de pouvoir déterminer si le nabiximols est efficace et sécuritaire à long terme ou s'il est analysé dans une population plus vaste. De plus, les auteurs suggèrent que le manque d'efficacité observé pourrait avoir été expliqué, au moins en partie, par le traitement au cours des stades plus avancés de la MH et que les traitements aux stades antérieurs devraient être étudiés au cours d'études cliniques futures.
4.9.1.3 Maladie de Parkinson
- Les résultats d'un nombre limité d'études précliniques, de cas, cliniques et observationnelles sur certains cannabinoïdes pour le traitement des symptômes de la maladie de Parkinson (MP) sont mixtes.
- Une étude de cas sur le cannabis fumé ne suggère aucun effet alors qu'une étude observationnelle sur le cannabis fumé suggère une amélioration des symptômes.
- Une étude clinique à petite envergure portant sur le nabilone suggère une amélioration des symptômes, tandis qu'une autre étude clinique surun extrait oral de cannabis (THC/CBD) et une étude clinique avec du CBD ne suggèrent aucune amélioration des symptômes.
Une enquête menée auprès de 630 patients suivis dans une clinique des troubles de mouvement a signalé que parmi les 339 répondants, 25 % avaient utilisé du cannabis; 31 % ont déclaré des bienfaits sur les tremblements au repos, 45 % ont constaté une amélioration de la bradykinésie et 14 % ont observé une amélioration de la dyskinésieReference 954.
Données précliniques et expérimentales humaines
Les ligands endocannabinoïdes, leurs enzymes de synthèse et de dégradation et les récepteurs activés par les cannabinoïdes sont très abondants dans les noyaux gris centraux, les structures cérébrales les plus touchées par la MPReference 927. L'on a rapporté que les patients ayant récemment reçu un diagnostic de la MP et ceux chez qui l'élimination du médicament de la MP était en cours, avaient plus que le double du niveau d'anandamide dans leur LCR comparativement aux témoins, et ces résultats correspondent à ceux constatés chez les modèles animaux de la MP où la perte des cellules dopaminergiques s'accompagne d'une augmentation des niveaux d'anandamideReference 955. Chez les modèles animaux de la MP, les niveaux de récepteurs CB1 semblent se réguler à la baisse au tout début des phases pré symptômatiques de la maladie, mais ils sont suivis d'une augmentation de la densité et de la fonction du récepteur CB1, de même qu'une élévation des niveaux d'endocannabinoïdes aux stades intermédiaires et avancés de la maladieReference 955Reference 956. Mises ensemble, ces études suggèrent un lien complexe entre la physiopathologie de la MP et des changements dans le SEC.
Les résultats issus de certaines études animales suggèrent que les agonistes de récepteur cannabinoïde induisent l'hypokinésie et par conséquent, seraient peu souhaitables comme traitement de première ligne contre la MPReference 927Reference 957. D'autre part, l'hypokinésie induite par les cannabinoïdes pourrait servir à atténuer la dyskinésie observée chez les patients atteints de la MP et suivant un traitement au levodopa à long termeReference 957. D'autres études animales suggèrent que l'antagonisme des récepteurs CB1 (par l'entremise de traitements au rimonabant) atténue partiellement l'hypokinésie associée à la mort des cellules de la substance noire et encourage la survie des neurones dopaminergiques dans le pars compacta de la substance noire par l'entremise d'une augmentation de la densité des astrocytesReference 958Reference 959. Toutefois, la reproduction de cet effet bénéfique de l'antagonisme des récepteurs CB1 n'a pas été possible dans le cadre d'une étude clinique à petite échelleReference 247. Compte tenu du niveau de preuves actuel concernant les cannabinoïdes dans le traitement de la MP, il semblerait qu'un traitement neuroprotecteur à base de cannabinoïdes contre la MP devrait être fondé sur une association adéquate de composés sélectionnés qui confèrent des effets antioxydants (p. ex. par l'intermédiaire de mécanismes indépendants des récepteurs CB), notamment au moyen de l'activation de la famille de récepteurs nucléaires PPAR, de l'activation de récepteurs CB2 et du contrôle de l'inflammation, et par l'intermédiaire de l'antagonisme des récepteurs CB1 pour améliorer l'akinésie et réduire l'inhibition motriceReference 960. L'association d'un cannabinoïde ayant des propriétés anti-inflammatoires et anti-oxydantes (CBD) avec un cannabinoïde ayant des propriétés mixtes d'antagonistes du récepteur CB1 et d'agonistes du récepteur CB2, ainsi que des effets antioxydants (tel que le THCV), pourrait avoir un certain potentiel thérapeutique, mais des recherches beaucoup plus approfondies sont nécessairesReference 960.
Données cliniques
Les résultats des essais cliniques qui examinent le rôle des cannabinoïdes (le cannabis fumé, le nabilone, le CBD, le rimonabant et l'extrait de cannabis normalisé par voie orale) dans le traitement contre la MP sont contrastés.
Dans une étude de cas avec cinq patients souffrant de la MP idiopathique, l'on n'a pas observé d'amélioration des tremblements après avoir fumé du cannabis (une cigarette de 1 g contenant 2,9 % de Δ9-THC, 29 mg de Δ9-THC total disponible), alors que tous les sujets ont bénéficié de l'administration de levodopa et d'apomorphineReference 255.
Une étude d'observation ouverte a évalué l'effet clinique du cannabis fumé sur les symptômes moteurs et non moteurs de 22 patients atteints de la MP qui consommaient du cannabis quotidiennement pendant au moins deux mois, sans présenter d'effets secondaires majeursReference 238. On a demandé aux patients de fumer leur dose régulière de cannabis (500 mg) et 30 minutes plus tard, les séries d'essais relatifs aux symptômes moteurs et non moteurs ont été administrées et les scores ont été enregistrés par deux cliniciens. Le score total moyen sur l'échelle d'évaluation unifiée pour la MP [Unified Parkinson's Disease Rating Scale, UPDRS], s'est considérablement amélioré après l'exposition au cannabis, passant d'un score de 33 au début de l'étude à 23 après la consommation de cannabis (p < 0,001). Une amélioration significative a également été observée en matière de tremblements, de rigidité, de bradykinésie, de sommeil et de douleur, mais aucune amélioration n'a été constatée concernant la posture. Tous les patients prenaient de façon concomitante d'autres médicaments contre la MP, y compris la lévodopa, l'amantadine, la rasagiline, la sélégiline, l'inhibiteur de l'acétylcholinestérase et d'autres médicaments. Aucun événement indésirable grave n'a été signalé. Les principaux effets indésirables auto-déclarés découlant de la consommation par la fumée de cannabis à long terme étaient la somnolence, les palpitations et un goût désagréable. Les limites de l'étude sont notamment sa conception ouverte et sa courte période.
Une étude clinique exploratoire, aléatoire, à double insu et contrôlée par placebo des antagonistes de la neurokinine B, de la neurotensine et des récepteurs CB1 (rimonabant) sur la sévérité des symptômes moteurs et de la dyskinésie induite par la lévodopa après une dose unique de lévodopa chez 24 patients atteints de la MP a observé qu'à ce niveau de dose, les trois substances étaient bien tolérées et ne pouvaient pas améliorer l'handicap moteur parkinsonienReference 247. Les doses d'antagonistes de la neurokinine B, de la neurotensine et des récepteurs CB1 étaient de 180 mg, 200 mg et de 20 mg, respectivement. Chaque substance a été administrée une fois par jour, une heure avant l'administration de la lévodopa pendant une période de 9 (pour la neurokinine et la neurotensine B) ou de 16 jours (rimonabant).
Une étude clinique de petite envergure à répartition aléatoire portant sur le nabilone (0,03 mg/kg) menée chez sept patients atteints de la MP, révèle que le nabilone a réduit la dyskinésie induite par la lévodopaReference 250.
En revanche, une étude croisée de quatre semaines à répartition aléatoire et à double insu a démontré qu'un extrait de cannabis par voie orale (2,5 mg de Δ9-THC et 1,25 mg de CBD par gélule, b.i.d.; dose quotidienne maximale de 0,25 mg/kg de Δ9-THC) n'a produit aucune action en faveur de la MP ou contre celle-ciReference 245.
Enfin, une étude clinique exploratoire à double insu menée auprès de 21 patients atteints de la MP (ne présentant pas de démence ou de trouble psychiatrique comorbide) a évalué le score des symptômes moteurs et généraux (UPDRS), le fonctionnement et bien-être, le QV (questionnaire PDQ-39, 39-item Parkinson Disease Questionnaire) et les effets neuroprotecteurs possibles (facteur neurotrophique issu du cerveau (BDNF) dans le plasma et spectrométrie par résonance magnétique du proton [H1]) suivant un traitement par placebo ou CBD (75 mg ou 300 mg par jour) pendant six semainesReference 239. Aucune différence statistiquement significative n'a été observée entre le placebo et toutes les doses de CBD concernant les scores sur l'UPDRS, les taux de BDNF dans le plasma ou la spectrométrie par résonance magnétique du proton (H1). Cependant, la dose de CBD de 300 mg a été associée à une différence statistiquement significative des scores totaux moyens par rapport au placebo dans le questionnaire PDQ-39, ce qui semble indiquer que la dose quotidienne de CBD de 300 mg est associée à une amélioration des mesures de la QV chez les patients atteints de la MP qui ne présentent pas de comorbidités psychiatriques.
4.9.1.4 Syndrome de Gilles de la Tourette
- Les données limitées provenant de petites études cliniques suggèrent que le THC administré par voie orale améliore certains symptômes du syndrome de Gilles de La Tourette (SGT) (tics).
Des rapports anecdotiques et de cas suggèrent une amélioration des symptômes associés au SGT avec le cannabis fuméReference 253Reference 256. De plus, un essai par permutation randomisé, à double insu et contrôlé avec placebo d'une durée de deux jours, comportant une seule dose par voie orale de Δ9-THC (5, 7,5 ou 10 mg) chez 12 patients adultes atteints de SGT a indiqué une amélioration liée à la concentration plasmatique du contrôle des tics moteurs et vocaux ainsi que du comportement obsessif-compulsif, et sans effets secondaires graves, bien que de légers effets indésirables passagers (p.ex. céphalée, nausées, ataxie, fatigue et anxiété) ont été notés chez cinq patientsReference 251. Contrairement aux consommateurs de cannabis sains, ni une dose de 5 mg ni de 10 mg de Δ9-THC n'a causé de déficience cognitive chez les patients atteints du SGT. Cette étude a été suivie d'un essai de suivi contrôlé avec placebo, à double insu et randomisé de six semaines par le même groupe de recherche. Les auteurs ont signalé une différence statistiquement significative dans la réduction des tics, comparativement au placebo chez certains patients et aucun effet nuisible sur la performance neuropsychologique pendant ou après le traitement consistant de doses de 10 mg de Δ9-THCReference 248. Les principales lacunes de la méthodologie de ces trois études cliniques sont la petite taille de leur échantillon et leur durée relativement courte.
Une revue de l'efficacité et de l'innocuité des cannabinoïdes dans le traitement des tics, du comportement obsessif-compulsif et de la sensation prémonitoire, effectuée récemment par le Centre de collaboration Cochrane chez les patients atteints du SGT a conclu qu'il n'existe pas suffisamment de données permettant d'appuyer l'usage de cannabinoïdes dans le traitement des tics et du comportement obsessif-compulsif chez les personnes atteintes du SGTReference 242.
Cependant, une méta-analyse et une analyse systématique plus récente de 28 essais contrôlés à répartition aléatoire (N = 2 454 participants) sur les cannabinoïdes (c.-à-d. cannabis fumé, nabiximols, nabilone, dronabinol, CBD, THC, levonontradol, acide ajulémique) effectués à l'aide de l'approche GRADE ont conclu que, d'après deux études contrôlées par placebo de petite envergure portant sur le THC administré par voie orale sous forme de gélule dans le traitement des symptômes associés au SGT, le THC par voie orale serait associé à une amélioration significative de la gravité des tics chez les patients atteints du SGTReference 174.
4.9.1.5 Ataxie spinocérébelleuse
Il existe des preuves émergentes que le SEC pourrait avoir un rôle dans la pathophysiologie de l'ataxie spinocérébelleuseReference 961Reference 962. Les études post-mortem d'échantillons cérébelleux recueillis de patients décédés atteints d'ataxie héréditaire autosomale dominante ont révélée des augmentations considérables dans les niveaux d'expression de protéines de la FAAH et du MAGL dans les cellules de Purkinje de la couche cellulaire du milieu du cortex cérébelleux, dans les neurones du noyau dentelé et dans la substance blanche cérébelleuse comparativement aux témoinsReference 962. Dans le cadre d'une autre étude, les niveaux d'expression des protéines des récepteurs CB1 et CB2 de ces mêmes régions du cortex cérébelleux ont été observés comme étant considérablement plus élevés comparativement aux valeurs témoinsReference 961. Ces études suggèrent qu'une augmentation des niveaux d'expression d'un certain nombre de composantes du SEC dans les régions cérébelleuses est associée à l'ataxie héréditaire autosomale dominante.
4.9.2 Glaucome
- Les données limitées provenant de petites études cliniques suggèrent que l'administration orale de THC réduit la pression intraoculaire (PIO), tandis que l'administration orale de CBD pourrait, au contraire, provoquer une augmentation de la PIO.
Le glaucome est une maladie multifactorielle caractérisée par la dégénérescence progressive du nerf optique et la nécrose des cellules ganglionnaires de la rétine, menant par conséquent vers une cécité irréversibleReference 963. Une PIO élevée participe à la physiopathologie du glaucome; toutefois, un apport sanguin inadéquat vers le nerf optique, des dommages oxydants et une apoptose des cellules ganglionnaires rétiniennes sont aussi des facteurs qui contribuent à la maladieReference 387Reference 963-Reference 965. Un SEC existe dans bon nombre de tissus oculaires et des études post-mortem ont décelé une diminution des taux d'endocannabinoïdes dans ces tissus prélevés chez des patients décédés atteints de glaucomeReference 966.
Une administration oculaire (et systémique) de cannabinoïdes diminue généralement la PIO jusqu'à 30 % (voirReference 387 pour une liste des lectures de référence complète). La façon dont les cannabinoïdes réduisent la PIO n'est toujours pas claire, mais plusieurs mécanismes possibles ont été proposés, y compris la réduction de la tension capillaire, une diminution de la production de l'humeur aqueuse et une amélioration du débit uvéoscléral de l'humeur aqueuse et de sa circulationReference 967-Reference 971.
Les résultats d'une enquête effectuée auprès de 1 516 patients atteints de glaucome dans des cliniques de glaucome tertiaires à Toronto et à Montréal ont suggéré qu'environ 13 % de ces patients avaient déclaré avoir eu recours aux thérapies complémentaires et alternatives pour traiter le glaucome et de ces patients, 2,3 % ont déclaré avoir utilisé le cannabis pour traiter leur glaucomeReference 972.
Une étude pilote clinique bien contrôlée auprès de six patients atteints de l'hypertension oculaire ou de glaucome primaire à angle ouvert au stade précoce a indiqué que les doses sublinguales de 5 mg de Δ9-THC (administrées au moyen d'un spray oromucosal) réduisaient temporairement mais de façon significative la PIO, 2 h après administrationReference 386. Une dose unique sublinguale de 20 mg de CBD (administré en concomitance avec ~ 1 mg Δ9-THC) n'avait aucun effet, alors qu'une seule dose sublinguale de 40 mg de CBD (administré en concomitance avec ~ 2 mg de Δ9-THC) a entraîné une hausse significative passagère de la PIO après administration. Une étude clinique non randomisée, non masquée et non contrôlée a rapporté une certaine amélioration de la PIO après ingestion par voie orale du Δ9-THC (2,5 ou 5 mg q.i.d. pour un maximum de 20 mg/jour; durée du traitement : 3 à 36 semaines) chez les patients atteints de glaucome à angle ouvert au stade final résistant aux médicaments standards et aux interventions chirurgicalesReference 388. Certains patients ont semblé développer une tolérance aux effets de la diminution de la PIO du Δ9-THC et près de la moitié d'entre eux ont interrompu le traitement pour cause d'effets secondaires associées au Δ9-THC (p. ex. les étourdissements l'assèchement de la bouche, la somnolence, la dépression, la confusion). Mis à part le fait de diminuer la PIO, les cannabinoïdes, tels que le Δ9-THC (et le CBD), peuvent aussi avoir des effets neuroprotecteurs pouvant être utiles dans la gestion du glaucomeReference 387Reference 973-Reference 982.
En conclusion, quoique l'on ait démontré que fumer ou ingérer du cannabis (ou du Δ9-THC oral) entraîne une réduction de la PIOReference 983-Reference 985, le traitement à base de cannabinoïdes semble limité en raison de l'action des cannabinoïdes de courte durée (de 3 à 4 h) et des effets physiques et psychotropiques non désirés.
4.9.3 Asthme
- Les données limitées provenant d'études précliniques et cliniques sur l'effet du THC en aérosol sur les symptômes asthmatiques sont mixtes.
- L'inhalation d'irritants pulmonaires générés par la fumée/vaporisation du cannabis peut aggraver les symptômes asthmatiques.
Il existe certaines données historiques et anecdotiques sur le cannabis comme traitement de l'asthmeReference 986. En ce qui concerne les données précliniques, il y a des données qui attribuent un rôle du SEC dans la régulation du tonus musculaire lisse bronchiqueReference 987 et des études avec des animaux employant des cannabinoïdes classiques ou synthétiques suggèrent un rôle prometteur des composantes à base de cannabinoïdes dans le traitement de l'asthmeReference 988-Reference 990.
Des études cliniques antérieures ont démontré une diminution importante de la résistance des voies aériennes et une augmentation de la conductance des voies aériennes spécifique chez les consommateurs réguliers et sains de cannabis, peu après en avoir fuméReference 991Reference 992. Cet effet a été largement attribué aux propriétés bronchodilatatoires du Δ9-THCReference 993. Toutefois, pour les asthmatiques, les avantages de fumer du cannabis ont de fortes chances d'être minimes. Alors que fumer du cannabis semble diminuer les bronchospasmes, augmenter la bronchodilatation et améliorer de façon modeste les fonctions respiratoires chez certains asthmatiques à court termeReference 994-Reference 996, la fumée de cannabis contient des gaz et des particules nocifs qui irritent et endommagent l'appareil respiratoireReference 993; par conséquent, elle ne constitue probablement pas une thérapie viable à long terme contre l'asthme. Un certain nombre d'études ont aussi révélé des réactions d'hypersensibilité, notamment des crises d'asthme aiguës en réponse à l'inhalation du cannabis fuméReference 362Reference 363.
C'est pourquoi, d'autres véhicules du Δ9-THC, par aérosol ou par administration orale ont aussi été étudiés. Des doses de 100 et 200 µg de Δ9-THC en aérosol ont augmenté de façon significative les fonctions ventilatoires chez les asthmatiques et étaient généralement bien tolérésReference 997Reference 998. Dans une autre étude, de 5 à 20 mg de Δ9-THC en aérosol a rapidement augmenté la conductance aérienne de façon efficace chez les sujets sains, mais a causé soit une bronchodilatation ou une bronchoconstriction chez les asthmatiquesReference 999. L'administration par voie orale de 10 mg de Δ9-THC ou de 2 mg de nabilone n'ont pas produit de bronchodilatation d'importance clinique chez les patients ayant une obstruction des voies respiratoires réversibleReference 986Reference 1000Reference 1001.
4.9.4 Hypertension
Les récepteurs CB1 sont exprimés sur divers tissus périphériques, y compris le cœur et le système vasculaire, et les agonistes des récepteurs cannabinoïdes et les endocannabinoïdes diminuent la tension artérielle et la contractilité cardiaque (examiné enReference 1002).
Très peu d'études existent sur les effets du cannabis et des cannabinoïdes sur l'hypertension. Dans une étude antérieure, l'inhalation de fumée de cannabis à teneur de 2,8 % de Δ9-THC a causé une plus grande diminution de la tension artérielle qui a duré plus longtemps chez les sujets hypertensifs, comparativement aux normotensifsReference 1003. Dans un exposé de cas, une femme souffrant d'hypertension intracrânienne idiopathique de longue durée a signalé une amélioration de ses symptômes après avoir fumé du cannabis ou après avoir subi un traitement au dronabinol (10 mg b.i.d au départ, puis 5 mg b.i.d.).
Il n'existe pas de rapport faisant état de l'usage des cannabinoïdes à de faibles doses comme traitement supplémentaire de l'hypertension.
4.9.5 Stress et troubles psychiatriques
Il existe des affirmations anecdotiques, et dans certains cas, historiques relatives aux effets bénéfiques du cannabis et des cannabinoïdes dans le traitement de divers troubles psychiatriques, dont l'anxiété, la dépression, les troubles du sommeil, l'ESPT, et les symptômes de sevrage associés à l'abus de drogues/toxicomanie. La section suivante porte sur les informations recueillies dans des publications scientifiques et médicales au sujet de l'usage de cannabis et des cannabinoïdes dans le traitement des troubles psychiatriques.
Système endocannabinoïde, stress et troubles psychiatriques
Un nombre croissant de preuves semble indiquer le rôle important du SEC dans la régulation du stress, de l'humeur et des troubles psychiatriquesReference 162Reference 1004Reference 1005. Les perturbations pharmacologiques ou génétiques de la signalisation des endocannabinoïdes chez les animaux produisent une réponse neurocomportementale qui simule la réponse classique au stress, notamment l'activation de l'axe hypothalamo-hypophyso-surrénalien (HHS), une anxiété accrue, un comportement alimentaire réprimé, une diminution de la réactivité à des stimuli de récompense, une hypervigilance et un éveil, un toilettage accru et une flexibilité cognitive altéréeReference 162.
Dans les modèles de stress aigu chez des animaux, l'exposition à divers facteurs de stress psychologiques aigus entraîne généralement une réduction rapide des niveaux d'anandamide dans le cerveau accompagnée de plusieurs réponses comportementales et physiologiques, notamment une augmentation de l'anxiété, une activité accrue de l'axe HHS, une diminution de la neurogenèse, une diminution de la capacité à supprimer les souvenirs de peur et l'anhédonie, qui sont aussi toutes des caractéristiques des troubles de l'humeurReference 162Reference 1005. Le stress chronique semble aussi généralement produire une réduction de l'anandamide similaire à celle observée avec le stress aiguReference 162. Toutefois, contrairement à la situation avec l'anandamide, le stress aigu et le stress chronique, entraînent une augmentation prolongée des taux de 2-AG dans le cerveau qui est précédée d'une augmentation de la corticostérone découlant de l'activité accrue de l'axe HHSReference 162. En outre, l'élévation des taux de 2-AG dans le cerveau est associée à une rupture de la réponse de l'axe HPA, à une habituation de l'axe HPA, à une modulation de la plasticité synaptique, à une diminution de la remémoration et à une diminution de la douleurReference 162. Le SEC semble donc être une cible et un régulateur de l'activation induite par le stress de l'axe HHSReference 162.
Les endocannabinoïdes semblent réduire les signes comportementaux de l'anxiété, notamment dans des conditions stressantes, de phobie, ou d'autres conditions difficilesReference 162. L'élévation du 2-AG et de la signalisation de l'anandamide atténue l'anxiété induite par le stress, bien que cela se fasse par l'intermédiaire de différents mécanismesReference 162Reference 1004. Il existe un nombre toujours plus important de preuves selon lesquelles le SEC a un rôle qui consiste à favoriser l'extinction de souvenirs désagréables sur le plan émotionnelReference 162Reference 1004. Chez l'humain, les études expérimentales ayant recours à des moyens pharmacologiques pour perturber la signalisation des endocannabinoïdes par l'intermédiaire de l'utilisation de l'antagoniste/agoniste inverse du récepteur CB1, le rimonabant, indiquent qu'une déficience de la signalisation des endocannabinoïdes entraînerait une augmentation de la sensibilité aux effets de stress, y compris l'anxiété et l'anhédonieReference 162Reference 1004. La dépression et l'ESPT ont été associés à une diminution des taux d'endocannabinoïdes en circulationReference 162Reference 1004.
Dans l'ensemble, les preuves laissent supposer que le SEC fonctionne comme un mécanisme homéostatique pour atténuer le stress, inhiber l'activation non nécessaire de l'axe HHS et favoriser le rétablissement de l'axe HHS une fois que le stimulus stressant est passéReference 1004Reference 1005. Le dysfonctionnement du SEC augmente la sensibilité au stress et prolonge les réactions mésadaptées au stress en absence d'un autre stimulus du stressReference 1004Reference 1005. Fait important, le stress chronique semble réduire la capacité du SEC à atténuer efficacement le stress et peut contribuer à accélérer l'apparition d'une psychopathologie, notamment l'anxiété et la dépressionReference 1004Reference 1005. Les interventions pharmacologiques dont le rôle est d'augmenter le tonus endocannabinoïde, p. ex. en inhibant les enzymes de dégradation des endocannabinoïdes, FAAH et MAGL, semblent avoir des effets anxiolytiques et antidépresseurs, du moins dans les modèles d'anxiété et de dépression chez les animauxReference 162Reference 172Reference 1005. Des nouvelles données indiquent que l'inhibition sélective par le substrat de la COX-2 augmenterait également les taux d'endocannabinoïdes dans le cerveau et pourrait avoir des effets anxiolytiquesReference 162Reference 1006Reference 1007.
4.9.5.1 Anxiété et depression
- Des données provenant d'études cliniques et précliniques suggèrent que le THC présente des effets biphasiques sur l'humeur : les faibles doses de THC possèdent des effets anxiolytiques et de hausse de l'humeur et les doses élevées de THC possèdent des effets anxiogènes et de baisse de l'humeur.
- Les données limitées d'un petit nombre d'études cliniques sur le cannabis contenant du THC et sur certains cannabinoïdes sur ordonnance suggèrent que ces substances pourraient améliorer les symptômes d'anxiété et de dépression chez les patients souffrant d'anxiété et/ou de dépression secondaires à d'autres maladies chroniques (p. ex., patients souffrant du VIH/SIDA, SP, douleur neuropathique chronique).
- Les données provenant d'études précliniques suggèrent que le CBD présente des effets anxiolytiques dans différents modèles animaux d'anxiété, tandis que des données limitées provenant d'études cliniques suggèrent que le CBD pourrait posséder des effets anxiolytiques dans un modèle expérimental d'anxiété sociale.
- Les données limitées de certaines études observationnelles suggèrent aussi que le cannabis contenant des concentrations égales de CBD et de THC est associé à une atténuation de certaines perturbations de l'humeur (p. ex., l'anxiété ou le découragement) comme observés avec le cannabis prédominant en THC utilisé par des patients à des fins médicales.
Comme mentionné précédemment, la consommation de cannabis, notamment le cannabis contenant principalement du THC, semble avoir une incidence proportionnelle à la dose sur l'anxiété, les faibles doses (de THC) étant potentiellement anxiolytiques et les doses élevées (de THC) étant inefficaces ou potentiellement anxiogènesReference 172. Bien que la consommation aiguë de doses plus élevées de cannabis à haute teneur en THC puisse, chez certaines personnes et dans certains environnements nouveaux et stressants, déclencher une anxiété importante qui peut ressembler à une crise de panique, les consommateurs de cannabis à long terme déclarent une diminution de l'anxiété, une amélioration de la relaxation et un soulagement de la tensionReference 186. Selon une enquête menée chez plus de 4 400 répondants, ceux qui ont consommé du cannabis quotidiennement ou hebdomadairement ont déclaré ressentir une diminution de l'humeur dépressive et une augmentation de l'effet positif comparativement aux répondants qui n'en avaient jamais consomméReference 1008. Cependant, cette étude a fait l'objet de plusieurs revers importants et doit donc être interprétée avec prudence. D'autres études épidémiologiques suggèrent l'opposéReference 1009Reference 1010. Il se peut aussi que les utilisateurs quotidiens signalent des réductions d'anxiété qui pourraient réellement être le soulagement de symptômes de sevrage associés au TUC. De plus, le trouble d'anxiété sociale semble être particulièrement associé au TUC et selon au moins une étude, certaines personnes souffrant d'anxiété sociale pourraient venir à s'appuyer sur le cannabis pour les aider à faire face à certaines situations sociales, continuant donc à consommer du cannabis malgré le fait qu'ils ressentent des effets négatifs associés à la consommation de cannabis et développant donc un TUCReference 1011.
Études précliniques
Des données précliniques (et cliniques) indiquent que le système encannabinoïde joue un rôle majeur au niveau de l'anxiété et des troubles de l'humeur. Les résultats issus des études animales suggèrent que de faibles doses d'agonistes du récepteur CB1 améliorent le comportement lié à l'anxiété et augmentent les réponses liées aux antidépresseursReference 1012Reference 1013. Les agonistes du récepteur CB1 semblent améliorer la neurotransmission sérotoninergique et noradrénergique au niveau central similaire aux actions des antidépresseursReference 1014Reference 1015. D'autre part, un haut niveau de stimulation du récepteur CB1 ou l'administration des antagonistes du récepteur CB1 annule cette réponse et peut aussi déclencher des symptômes de dépression ainsi que la dépression comme telleReference 184Reference 1014Reference 1016Reference 1017. La suppression de l'envoi de signaux par les endocannabinoïdes est suffisante pour provoquer un état semblable à celui de la dépression aussi bien chez les animaux que chez les humains (examiné enReference 1018). En outre, les concentrations basales sériques de l'anandamide et du 2-AG se sont révélés être considérablement réduites chez les femmes ayant des troubles dépressifs majeursReference 1019. Ces conclusions suggèrent qu'une signalisation adéquate au niveau des endocannabinoïdes est importante pour la régulation de l'humeur.
Données cliniques et d'observation pour le cannabis et le THC
Même si l'utilisation régulière de cannabis à forte teneur en THC ou de médicaments cannabinoïdes d'ordonnance contenant principalement du THC (dronabinol) pour traiter l'anxiété ou la dépression primaire devrait être considérée avec prudence, et surtout être déconseillée chez les patients ayant des antécédents de troubles psychotiques (consulter la Section 7.7.3.2), des données cliniques limitées indiquent que ces produits pourraient présenter de nouvelles thérapies pouvant être utilisées chez les patients qui souffrent d'anxiété ou de dépression qui accompagne certaines maladies chroniques. Par exemple, lors d'une étude menée chez des patients séropositifs qui déclarent utiliser du cannabis pour gérer leurs symptômes, 93 % ont affirmé ressentir une amélioration de l'anxiété et 86 % une amélioration du trouble dépressifReference 1020. Il est important de noter que 47 % des personnes interrogées ont signalé une détérioration de leur mémoire. Dans une autre étude clinique, intra-sujets, à double insu, controlée par placebo, réalisée chez des fumeurs de cannabis séropositifs, une dose élevée de dronabinol (5 mg q.i.d. pour une dose quotidienne totale de 20 mg pendant deux jours, suivis de 10 mg q.i.d. pour une dose quotidienne totale de 40 mg pendant 14 jours) a été associée à une augmentation des auto-déclarations « d'affect positif » (sensation de « contentement »), mais aucun changement n'a été observé dans les mesures d'anxiété ou « d'affect négatif »Reference 295. La posologie utilisée dans le cadre de cette étude était huit fois plus grande que la dose de départ recommandée pour stimuler l'appétit (c.-à-d. 2,5 mg, b.i.d.) et deux fois plus grande que la dose quotidienne maximale recommandée. On a aussi signalé une amélioration de l'humeur à titre d'effet bénéfique de la consommation de cannabis chez les patients atteints de SPReference 1021. On a aussi relevé des améliorations de l'anxiété ou du trouble dépressif lors d'une étude clinique menée chez des patients souffrant de douleur neuropathique chronique et qui avaient fumé du cannabisReference 59. Fait intéressant, le rimonabant, un antagoniste du récepteur CB1 commercialisé au départ en tant que médicament anti-obésité, a été retiré du marché parce que son utilisation a été associée à une incidence importante d'anxiété, de trouble dépressif et de suicide, ce qui souligne le rôle du récepteur CB1 dans la régulation de l'humeurReference 1017Reference 1022. Pour plus de renseignements sur les associations entre le cannabis, l'anxiété et la dépression, veuillez consulter la Section 7.7.3.1 et entre le cannabis et le suicide, veuillez consulter la Section 7.7.3.3.
Cannabidiol
Données précliniques
Plus de 30 études précliniques ont été menées pour examiner les effets anxiolytiques du CBD dans plusieurs modèles de divers types de troubles anxieux chez des animaux, y compris le trouble anxieux généralisé, la phobie sociale, le trouble panique, le trouble obsessivo-compulsif et l'ESPTReference 166. En général, les constatations de ces études précliniques confirment les effets anxiolytiques du CBDReference 166. De plus, le CBD semble également avoir des effets panicolytiques et anti-compulsifs et diminue l'éveil autonome et l'expression de peur conditionnée. Le CBD semble aussi favoriser la disparition de la peur et le blocage de la reconsolidation et empêche les effets de stress anxiogènes à long termeReference 166. Bien que le mécanisme d'action anxiolytique exact du CBD ne soit pas clair, on a proposé que la cible moléculaire du CBD est le récepteur 5-HT1AReference 166.
Données cliniques
Les résultats des études en neuroimagerie fonctionnelle indiquent des effets différents sur le débit sanguin cérébral associés à l'administration du CBD comparativement à ceux observés avec un placebo ou le THCReference 166. Les études d'imagerie cérébrale réalisées par tomographie par émission monophotonique (SPECT) ont révélé que, contrairement au placebo, le CBD diminue le débit sanguin régional cérébral dans les parties corticales limbiques et paralimbiques, des régions concernées dans la physiopathologie de l'anxiétéReference 1023. De plus, une étude à répartition aléatoire, contrôlée par placebo et à double insu a démontré que 600 mg de CBD atténuait l'activité cérébrale (réaction liée au niveau d'oxygénation sanguine) dans ces régions corticales en réaction aux stimuli anxiogènesReference 123. À l'opposé, 10 mg de Δ9-THC ont augmenté l'anxiété à la base ou en réaction aux stimuli anxiogènes, mais les régions cérébrales touchées par le Δ9-THC différaient de celles touchées par le CBDReference 123. Bien que le mécanisme précis par lequel le CBD exerce ses effets anxiolytiques ne soit pas bien établi, il peut agir soit en diminuant le débit sanguin des régions cérébrales associées au traitement de l'anxiété ou des stimuli axés sur la peur (comme mentionné ci-dessus), soit possiblement en modulant la neurotransmission sérotonergiqueReference 166Reference 1024Reference 1025.
Au moins dix études cliniques ont examiné les propriétés anxiolytiques aiguës du CBDReference 166. En effet, de plus en plus de données probantes suggèrent que le CBD pur, à des doses de plusieurs centaines de milligrammes (c.-à-d. 300 à 600 mg, PO) serait efficace pour diminuer l'angoisse sociale aiguë induite de façon expérimentale dans la clinique, bien que la mesure dans laquelle le CBD (à des concentrations relativement plus faibles comme observées dans le cannabis à forte teneur en THC) est capable de parvenir à une anxiolyse dans un cadre expérimental ou, fait encore plus important, dans une situation réelle, demeure incertaine. Bien que les résultats cliniques liés aux effets anxiolytiques du CBD se limitent à l'heure actuelle à des modèles expérimentaux aigus d'angoisse socialeReference 166, une étude d'observation portant sur 100 patients ayant déclaré eux-mêmes utiliser du cannabis à des fins médicales pour lutter contre des maladies telles que la SP, la douleur chronique, les nausées, le cancer et des problèmes psychologiques, révèle que ceux qui ont consommé du cannabis avec des concentrations de cannabinoïdes composées de 6 % de THC et de 7,5 % de CBD (c.-à-d. situation de « faible teneur en THC ») ont signalé un niveau d'anxiété et d'abattement beaucoup plus faible (c.-à-d. se sentir triste, déprimé), mais ont indiqué également que leur appétit était moins stimulé comparativement à ceux ayant déclaré utiliser des souches à « forte teneur en THC » (19 % de THC, < 1 % de CBD) ou à « teneur moyenne en THC » (12 % de THC, < 1 % de CBD)Reference 133.
4.9.5.2 Troubles du sommeil
- Les données expérimentales chez l'humain suggèrent que le cannabis et le THC possèdent des effets selon la dose sur le sommeil : les doses plus faibles semblent diminuer la latence d'endormissement et augmenter le sommeil lent et la durée totale de sommeil, alors que les doses élevées semblent causer des perturbations du sommeil.
- Les données limitées d'études cliniques suggèrent aussi que certains cannabinoïdes (le cannabis, le nabilone, le dronabinol et le nabiximols) pourraient améliorer le sommeil chez les patients souffrant de perturbations du sommeil associées à certaines maladies chroniques.
Données expérimentales humaines
Il existe certaines données probantes provenant d'études expérimentales chez l'humain suggérant que le SEC joue un rôle dans la régulation du sommeil. Les sujets privés de sommeil pendant 24 h présentaient des concentrations plus élevées d'OEA, un analogue naturel de l'anandamide, dans leur LCR, mais non dans le sérum, alors que les concentrations d'anandamide étaient inchangéesReference 1026. Des études récentes ont démontré des variations quotidiennes des concentrations de 2-AG qui sont amplifiées dans des conditions de restriction du sommeilReference 1027. Les niveaux de 2-AG semblent être à leur plus faible vers le milieu du cycle de sommeil et augmentent continuellement au cours de la matinée, atteignant leur niveau maximal en début/ milieu de l'après-midi et les concentrations de 2-oléoylglycérol (2-OG), un analogue structurel du 2-AG, suivent un cycle semblableReference 1028. Chez le rat, l'administration aiguë et sous-chronique d'anandamide entraîne le sommeilReference 1029. Le cannabis contenant principalement du THC, ainsi que le Δ9-THC lui-même sont connus pour avoir plusieurs effets sur le sommeil chez l'humain, qui pourraient être dépendants de la dose (c.-à-d. les doses faibles semblent avoir un effet bénéfique sur certaines mesures du sommeil, les doses élevées entraînant des perturbations du sommeil). En général, il semble qu'à de faibles doses, ces substances (cannabis prédominant en THC, THC) baissent la latence d'endormissement et sont associées à une facilité accrue à s'endormir, tandis que l'opposé est vrai à des doses élevées; il y a une diminution constante du sommeil paradoxal et de la densité des mouvements oculaires (examiné dansReference 204Reference 337). Les doses faibles de THC augmentent aussi le sommeil lent profond bénéfique (essentiel pour l'apprentissage, la consolidation mnésique et la remémoration) et la durée totale de sommeil, tandis que les doses élevées diminuent le sommeil lent profondReference 337. En outre, en raison de la longue demi-vie du THC, les effets sédatifs peuvent persister jusqu'à la journée suivant l'administrationReference 204.
Données tirées d'études de sevrage
Les grands consommateurs de cannabis (nombre moyen de joints fumés par semaine = 100) qui cessent subitement de consommer du cannabis ont présenté des changements dans les mesures polysomnographiques du sommeil, notamment un temps de sommeil plus bas et une baisse du sommeil lent, une induction du sommeil plus longue, une latence du sommeil paradoxal plus courte et des paramètres d'efficacité et de continuité du sommeil plus négatifs, comparativement aux témoinsReference 337Reference 1030. La difficulté à s'endormir, de même que les cauchemars et/ou des rêves étranges et des sueurs nocturnes étaient des symptômes souvent mentionnés par rapport au sevrage du cannabisReference 339. Ces troubles du sommeil se déroulent au cours des deux premières semaines d'abstinenceReference 1031. De plus, les troubles du sommeil provenant d'une cessation abrupte de la consommation de cannabis peuvent provoquer une rechute chez les utilisateursReference 400Reference 1031. Les symptômes observés au cours de l'abstinence de cannabis peuvent aussi révéler un trouble du sommeil préexistant qui était masqué par la drogue.
Données cliniques
Une analyse systématique et une méta-analyse de 28 ERC (N = 2 454 participants) portant sur les cannabinoïdes (c.-à-d. cannabis fumé, nabiximols, nabilone, dronabinol, CBD, THC, levonontradol, acide ajulémique) et effectués à l'aide de l'approche GRADE indiquent que, selon certaines données, les cannabinoïdes pourraient améliorer le sommeil (insomnie, qualité du sommeil, perturbation du sommeil)Reference 174.
De nombreuses études cliniques indiquent un rôle possiblement bénéfique pour le cannabis fumé ou les cannabinoïdes d'ordonnance (dronabinol, nabilone, nabiximols) dans le traitement des difficultés ou des perturbations du sommeil associées à la douleur chronique (douleur liée au cancer, douleur chronique non liée au cancer, neuropathie diabétique périphérique), à l'anorexie-cachexie associée au VIH, à la SP, à la SLA, au TM, à la polyarthrite rhumatoïde, à la fibromyalgie, à la maladie inflammatoire de l'intestin (MII), à la dysfonction de la vessie associée à la SP, à l'ESPT, aux variations chimiosensorielles et à l'anorexie-cachexie associées au cancer avancéReference 59Reference 179Reference 180Reference 218-Reference 220Reference 295Reference 380Reference 570Reference 588Reference 604Reference 605Reference 636Reference 692Reference 699Reference 703Reference 710Reference 711Reference 818Reference 832. Dans la plupart de ces études, l'effet sur le sommeil était mesuré en tant que résultat secondaire.
Bien qu'on les présente dans les sections qui s'y rapportent ailleurs dans le texte, de brefs sommaires de ces études sont présentés ci-dessous.
Dronabinol
Une étude clinique pilote croisée, à double insu, randomisée d'une durée de quatre semaines auprès de 19 patients atteints de SLA à qui l'on administrait de 2,5 à 10 mg de dronabinol par jour a déclaré observer des améliorations de leur sommeilReference 703. Deux études cliniques ont déclaré que le dronabinol (20 à 40 mg de Δ9-THC par jour en tout) et le cannabis fumé (cigarettes de ~800 mg contenant 2 ou 3,9 % de THC administrées q.i.d. pendant quatre jours correspondaient à une quantité quotidienne estimée de 64 à 125 mg de Δ9-THC consommé) produisaient des améliorations dans l'humeur et le sommeil des patients atteints d'anorexie-cachexie associée au VIH/SIDAReference 218Reference 219. Une étude clinique de fumeurs de cannabis séropositifs traités à l'aide de dronabinol pendant 14 jours (10 mg q.i.d., 40 mg par jour) a rapporté des améliorations des mesures objectives et subjectives du sommeil, mais seulement pendant les huit premiers jours du traitementReference 295. Une étude clinique pilote contrôlée par placebo, à double insu, randomisée, de phase II menée dans deux centres et d'une durée de 22 jours réalisée auprès de patients adultes souffrant de variations chimiosensorielles et de faible appétit associés au cancer avancé de différentes étiologies rapportait des améliorations des mesures de la qualité du sommeil et de la relaxation avec le traitement de dronabinol (2,5 mg b.i.d.) comparativement au placeboReference 604. Une étude pilote ouverte portant sur le THC oral en complément (25 mg/mL de THC dans l'huile d'olive; 2,5 mg de THC b.i.d., dose quotidienne maximale de 10 mg de THC) chez les patients atteints de l'ESPT chronique a révélé une amélioration de la qualité de sommeil et de la fréquence des cauchemars.
Nabilone
Une étude descriptive rétrospective, hors indication, de 20 patients adultes souffrant de douleur chronique de différentes étiologies non liées au cancer (douleur postopératoire ou traumatique, dystrophie sympathique réflexe, arthrite, maladie de Crohn, douleur neuropathique, cystite interstitielle, myopathie associée au VIH, syndrome de post-poliomyélite, douleur inguinale idiopathique, céphalée chronique) signalait des effets bénéfiques du nabilone (1 à 2 mg/jour) sur le sommeilReference 818. Une étude de sevrage randomisée à recrutement enrichi, à doses flexibles, à double insu, contrôlée par placebo, à groupes parallèles sur l'efficacité du nabilone (1 à 4 mg/jour) à titre d'adjuvant dans le traitement de la douleur neuropathique périphérique diabétique rapportait des améliorations statistiquement significatives du sommeil et de l'état global des patientsReference 605. Une étude croisée, randomisée, à double insu et contre témoin actif d'une durée de deux semaines auprès de 29 patients souffrant de fibromyalgie a rapporté que le nabilone (0,5 à 1 mg avant le coucher) améliorait le sommeil chez cette population de patientsReference 588. Deux études cliniques ont étudié l'utilisation du nabilone comme traitement des perturbations du sommeil causées par l'ESPT. Un essai ouvert sans placebo sur le nabilone pour traiter l'ESPT rapportait que le traitement à l'aide de nabilone était associé à une amélioration du temps de sommeil, à une cessation ou à une diminution de la gravité des cauchemars et une cessation des sueurs nocturnesReference 570. La posologie du nabilone était de 0,5 mg 1 h avant le coucher; la gamme des concentrations efficaces était de 0,2 mg à 4 mg toutes les nuits; toutes les doses étaient maintenues au-dessous de 6 mg par jour. Une étude clinique préalable subséquente, aléatoire, à double insu, contrôlée par placebo et en croisée de 10 membres du personnel militaire canadien mâle souffrant d'ESPT qui ne répondaient pas aux traitements traditionnels et qui continuaient d'éprouver des cauchemars causés par des traumatismes ont reçu une dose de 0,5 mg de nabilone ou un placebo et ont titré la dose jusqu'à ce qu'ils aient atteint la dose effective (c.-à-d. la suppression de leurs cauchemars) ou la dose maximale quotidienne de 3 mg de nabiloneReference 1032. La dose moyenne de nabilone atteinte était de 2 mg/jour. Les volets de traitement ont duré sept semaines chacun avec une période de sevrage thérapeutique de deux semaines entre les volets. La moitié (50 %) des patients ont signalé une amélioration considérable de la suppression de leurs cauchemars avec le nabilone, tandis que seulement 11 % ont signalé une amélioration avec le placebo.
Cannabis fumé
Les enquêtes effectuées auprès de patients atteints de SP déclaraient des améliorations associées au cannabis du sommeil pour cette population de patientsReference 220Reference 221. Les concentrations déclarées de cannabis fumé allaient de quelques bouffées à 1 g ou plus à la foisReference 220. Une enquête transversale chez des patients atteints de fibromyalgie signalait que les sujets déclaraient consommer du cannabis (en le fumant ou en le mangeant) afin de soulager divers symptômes associés à la fibromyalgie, notamment les troubles du sommeilReference 179. Une enquête transversale auprès de 291 patients atteints de MII (maladie de Crohn ou colite ulcéreuse) signalait que l'une des raisons pour lesquelles les patients consommaient du cannabis était afin d'améliorer le sommeilReference 180. Une étude croisée, contrôlée par placebo, à double insu et randomisée d'une durée de deux semaines sur les patients souffrant de douleur neuropathique chronique signalait que ceux qui fumaient 25 mg de cannabis contenant 9,4 % de Δ9-THC trois fois par jour pendant cinq jours (2,35 mg de Δ9-THC total disponible par cigarette ou 7,05 mg de Δ9-THC total par jour) s'endormaient plus facilement et plus rapidement, tout en éprouvant moins de périodes d'état d'éveilReference 59.
Médicaments cannabinoïdes d'ordonnance administrés par voie orale (Cannador et nabiximols)
Une étude à double insu, contrôlée par placebo et de phase III à laquelle participaient des patients atteints d'une SP stable (c.-à-d. l'étude MUSEC) signalait qu'un traitement de 12 semaines à l'aide d'extrait de cannabis à consommer par voie orale (Cannador) (2,5 mg de Δ9-THC et 0,9 mg de CBD/dose) était associé à une amélioration statistiquement significative du sommeil, par rapport au placeboReference 692. La plus grande partie des patients qui utilisaient l'extrait de cannabis consommaient des doses quotidiennes totales de 10, 15 ou 25 mg de Δ9-THC et des doses correspondantes de 3,6, 5,4 et 9 mg de CBD. Les résultats des études cliniques croisées, à double insu et contrôlée par placebo sur l'extrait de Δ9-THC et/ou de Δ9-THC : CBD administré par voie orale (nabiximols, en vente sous le nom de SativexMD) suggérait des améliorations modestes de la douleur, de la spasticité, des spasmes musculaires et de la qualité du sommeil chez les patients atteints de TMReference 636Reference 710Reference 711. Une étude clinique préliminaire évaluant l'efficacité de nabiximols sur la douleur provoquée par la polyarthrite rhumatoïde rapportait un effet analgésique modeste mais statistiquement significatif, et une amélioration correspondante de la qualité du sommeilReference 380. La dose quotidienne moyenne au cours de la dernière semaine de traitement était de 5,4 doses à la pompe (équivalentes à 14,6 mg de Δ9-THC et à 13,5 mg de CBD). Une étude pilote ouverte de 16 semaines sur les extraits à base de cannabis (un traitement à l'aide de nabiximols suivi de soins d'entretien à l'aide de 2,5 mg de Δ9-THC seul) pour traiter la dysfonction de la vessie chez 15 patients atteints de SP avancée rapportait des baisses importantes de la polyurie nocturne et une amélioration de l'auto-évaluation des patients sur la qualité de leur sommeilReference 699.
Les Lignes directrices canadiennes pour le diagnostic et la prise en charge du syndrome de fibromyalgie (endossées par la Société canadienne pour le traitement de la douleur et la Société canadienne de rhumatologie) recommandent, en ce qui a trait aux traitements possibles, qu'un essai d'un cannabinoïde pharmacologique prescrit peut être considéré chez un patient atteint de fibromyalgie, particulièrement dans le contexte de troubles importants du sommeil (cette recommandation était fondée sur des données probantes de niveau 3, grade C)Reference 832.
4.9.5.3 État de stress post-traumatique
- Les études expérimentales précliniques et humaines suggèrent un rôle pour certains cannabinoïdes dans le soulagement de symptômes semblables à ceux de l'état de stress post-traumatique (ESPT).
- Toutefois, bien que des données limitées provenant d'études cliniques à court terme suggèrent un potentiel pour le THC et le nabilone à diminuer certains symptômes de l'ESPT, il n'existe aucune étude clinique à long-terme pour ces préparations ou aucune étude clinique sur les effets du cannabis fumé ou vaporisé sur l'ESPT.
- Des preuves limitées issues d'études observationnelles suggèrent une association entre la consommation de cannabis à base de plantes et des niveaux persistants / élevés de sévérité des symptômes de l'ESPT au fil du temps.
- Il existe des données limitées suggérant une association entre l'ESPT et le TUC.
L'ESPT est un trouble psychiatrique dont la prévalence et la morbidité sont importantesReference 1033. Dans l'ensemble de la population, plus de deux tiers des personnes peuvent subir un événement traumatisant grave à un moment ou un autre de leur vieReference 1033. L'ESPT désigne le développement d'un ensemble de symptômes caractéristiques qui suivent l'exposition à un facteur de stress extrême et qui semble impliquer le traitement anormal des souvenirs et une détérioration de l'adaptation aux nouvelles conditions environnementalesReference 1034. Les symptômes caractéristiques comprennent des souvenirs dérangeants et persistants ou une reviviscence de l'événement traumatique d'origine (à travers des rêves ou des cauchemars et des épisodes dissociatifs), l'émoussement des émotions et une conduite d'évitement, de même qu'un état d'alerteReference 570. La perturbation du sommeil survient également dans 90 % des casReference 1032. Les patients atteints d'ESPT courent aussi le risque de déveloper d'autres troubles psychologiques, y compris, sans toutefois s'y limiter, le trouble d'anxiété généralisée, le trouble dépressif majeur et les troubles liés à l'alcoolisme et à la toxicomanie, ainsi que des problèmes physiques comprenant la douleur chronique, l'hypertension et l'asthmeReference 1035. Il semble exister un lien entre l'exposition à un événement traumatisant et la consommation de cannabis, notamment chez les anciens militaires, et les recherches indiquent que les personnes atteintes d'ESPT seraient particulièrement susceptibles d'utiliser du cannabis, en particulier pour soulager les symptômes d'ESPT et la détresse qui les accompagneReference 1033Reference 1035Reference 1036. Il existe aussi des éléments de preuve qui permettent de suggérer que des symptômes particuliers et des corrélats d'ESPT, y compris l'anxiété, le stress, l'insomnie et la dépression, font partie des raisons les plus souvent citées pour lesquelles les personnes consomment du cannabisReference 1036. Malgré de nombreuses données empiriques semblant indiquer les avantages de l'utilisation de cannabis pour traiter l'ESPT, il n'existe pas suffisamment d'essais contrôlés normalisés de grande envergure pour tirer des conclusions définitives concernant l'efficacité ou l'innocuité du cannabis pour le traitement de l'ESPTReference 1037.
Bien que les personnes concernées puissent utiliser du cannabis pour faire face à des états internes négatifs, il existe de plus en plus d'éléments de preuve selon lesquels ces personnes pourraient également connaître une utilisation du cannabis plus problématique, ainsi qu'un sevrage et un état de manque aigus lorsqu'elles ne sont pas intoxiquéesReference 1036. En effet, comparativement aux personnes non atteintes d'ESPT, celles qui en souffrent (et notamment celles dont les symptômes sont graves) déclarent une utilisation du cannabis considérablement accrue pour faire face à leur état et pour dormir, une gravité accrue du sevrage et des expériences d'état de manque liées au comportement compulsif, à l'émotivité et à l'anticipation. Ces constatations laissent supposer l'existence d'une boucle de rétroaction positive entre les symptômes d'ESPT et l'utilisation du cannabisReference 1036Reference 1038. À l'appui de ces constatations, les données provenant de la National Comorbidity Study (NCS) ont également démontré que les adultes souffrant d'ESPT étaient trois fois plus susceptibles de recevoir un diagnostic de dépendance au cannabis que ceux non atteints d'ESPTReference 1039. De plus, une étude épidémiologique sur la prévalence et les corrélats du TUC comme définit dans le DSM-5 en utilisant des données de la vague de 2012 - 2013 de l'étude NESARC-III a signalé que le TUC au cours de la dernière année était associé à l'ESPT (IC ajustée = 4,3) et que le TUC tout au long de la vie était aussi associé à l'ESPT (IC ajustée = 3,8)Reference 335. De plus, l'association entre l'ESPT et le TUC au cours de la dernière année a augmenté avec l'accroissement de la sévérité du TUC (IC ajustée = 2,1, 6,2 et 9,5 pour les cas de TUC légers, modérés et sévères, respectivement). De plus, une étude qui a examiné la prévalence et les corrélats de 186 patients cherchant à consommer du cannabis à des fins médicales pour la première fois a constaté que les patients qui obtenaient un résultat positif au test de dépistage pour l'ESPT avaient un pourcentage plus élevé d'usage d'opioïdes sur ordonnance, de cocaïne, de sédatifs sur ordonnance et d'opioïdes provenant de la rue (55 %, 38 %, 41 % et 17 %, respectivement), ainsi qu'un pourcentage plus élevé d'usage récent de sédatifs sur ordonnance (29 %) que les patients qui obtenaient un résultat négatif au test de dépistage de l'ESPTReference 1040.
Rôle du système endocannabinoïde dans l'ESPT
De plus en plus de données suggèrent que le SEC joue un rôle important dans l'ESPT. Le SEC a été associé à la régulation des états émotionnels et des processus cognitifs, et des études neuroanatomiques ont détecté la présence d'éléments du SEC dans diverses structures cérébrales ayant trait à l'apprentissage et à la mémoire, de même que dans des structures qui jouent aussi un rôle central dans le conditionnement de la peur et la réaction à celle-ci impliqué dans l'ESPT (examiné enReference 1034). Le SEC crée un lien entre l'exposition au stress et des changements de la plasticité synaptique, ce qui contribue à l'activation et au contrôle des rétroactions de l'axe HHS et facilite l'activation de facteurs de résilience au cours ou après l'exposition au stressReference 1041. Une hypothèse a suggérée que le stress chronique créé un « état hypocannabinergique » qui cause la perturbation de l'extinction de la peur (comme observé dans le cas d'ESPT) et que cet état peut être allégé à l'aide d'agonistes du récepteur CB1Reference 1041. Des expériences de conditionnement de la peur effectuées sur des animaux laissent supposer que le circuit cortico-striatal de l'amygdale et de l'hippocampe joue le rôle de circuit cérébral principal responsable du traitement et du stockage des souvenirs liés à la peur et de la coordination de comportements liés à la peurReference 1042. D'autres données chez les humains indiquent que l'ESPT serait caractérisé par une hyperactivité ou une hyperréactivité de l'amygdale, accompagnées d'une déficience de la régulation des structures corticales préfrontales, ainsi que de fonctions anormales au niveau de l'hippocampe et des noyaux gris centrauxReference 1042. L'existence de similitudes entre l'expression de peur et d'anxiété chez les humains souffrant de phobie, d'ESPT ou d'autres troubles d'anxiété et l'expression de peur conditionnée chez les animaux suggérant que l'utilisation de certains modèles comportementaux chez l'animal pour étudier l'ESPT est réalisable et pertinenteReference 1034Reference 1043.
Données précliniques
Il existe des éléments de preuve indiquant que les endocannabinoïdes, l'anandamide et le 2-AG joueraient un rôle important dans le développement et le fonctionnement du circuit neurologique dans l'ESPT, notamment lors de réactions de stressReference 1042. On pense que la déficience de la fonction du récepteur CB1 pourrait être un mécanisme étiologique important de l'ESPTReference 1042. De nombreuses études précliniques démontrent que la délétion du récepteur CB1 ou son inhibition à l'aide d'antagonistes pharmacologiques prévient la disparition des souvenirs aversifs (c.-à-d. l'inhibition acquise de la peur), un processus naturellement adaptatifReference 1043-Reference 1046. À l'inverse, dans certains cas, l'agonisme du récepteur CB1 ou une augmentation de la neurotransmission médiée par endocannabinoïde (p.ex. par l'inhibition de la FAAH) semblait rehausser la disparition des souvenirs aversifs à un certain degréReference 1043Reference 1046, mais plus de recherches sont nécessaires pour préciser et appuyer cet effet. Des études chez les animaux démontrent aussi que la réduction des niveaux d'endocannabinoïdes (surtout ceux du 2-AG, mais aussi de l'anandamide) par l'entremise de l'inactivation du gène Dagla est associée à des niveaux plus élevés d'anxiété, de stress et de réaction de peurReference 1047. Ensemble, les données probantes tirées d'études précliniques suggèrent un rôle pour le SEC dans la disparition des souvenirs aversifs, et la déficience de la remémoration. En outre, les données recueillies soulèvent la possibilité que la manipulation du SEC, par l'intermédiaire de l'inhibition de la FAAH, d'une régulation positive de DAGL, d'un tonus accru de l'anandamide ou 2-AG, voire peut-être par l'intermédiaire d'administration de CBD favorise la perturbation des souvenirs de peur contextuels et qu'elle ait des effets anti-anxiogènesReference 1033Reference 1048. Ceux-ci pourraient représenter les options thérapeutiques potentielles pour le traitement de maladies associées à la conservation inappropriée de souvenirs désagréables ou à des réactions inadéquates à des situations désagréables, p. ex. l'ESPT ou des phobiesReference 1044, bien que de nombreuses recherches supplémentaires soient nécessaires.
Données expérimentales chez l'humain et données cliniques
Les études menées chez les humains ont montré que les personnes atteintes d'ESPT présentent des concentrations d'endocannabinoïdes en circulation plus faibles et une régulation positive des récepteurs CB1 dans le cerveauReference 1005Reference 1042Reference 1049-Reference 1051. De plus, il existe des preuves sous-entendant que les humains (et les souris) porteurs d'une variation commune du gène FAAH (C385A; rs325520) conférant une réduction de la stabilité de la protéine FAAH et une augmentation de la signalisation d'anandamide démontrent une réduction des réactions amygdaliennes liées aux dangers, une augmentation des réactions striatales ventrales liées aux récompenses et une augmentation de l'extinction de la peurReference 1052Reference 1053.
Une étude clinique intrasujet, à double insu et contrôlée par placebo mené sur 16 volontaires sains étudiant les effets du THC sur les réactions de l'amygdale aux dangers a observé qu'une dose de 7,5 mg de dronabinol (comparativement au placebo) a été associée à une réduction importante de la réactivité de l'amygdale à des signes sociaux de danger, sans affecter l'activité du cortex visuel primaire ni du cortex moteurReference 1054. Ces observations correspondent aux preuves supposant que, au moins en faibles doses, le THC pourrait avoir un effet anxiolytique sur les mécanismes centraux des comportements de peur.
Au cours d'une étude clinique intrasujet aléatoire à double insu et contrôlée par placebo menée sur 29 volontaires sains (dont de nombreux ayant auparavant consommé des quantités minimales de cannabis) ont été administrés 7,5 mg de dronabinol ou de placebo deux heures avant l'apprentissage d'extinction à la suite d'un paradigme de conditionnement à la peurReference 1055. L'étude démontre que l'administration du THC avant l'extinction facilitait l'extinction de la peur conditionnée chez des sujets humains sains. Les lacunes de la méthodologie de l'étude comprennent l'utilisation d'une population de sujets sains (les résultats pourraient varier chez d'autres populations) et une absence de généralisabilité des résultats à une population de consommateurs chroniques de cannabis. Les auteurs suggèrent que cette étude était la première effectuée sur des humains afin de démontrer la faisabilité d'améliorations pharmacologiques de l'apprentissage d'extinction, bien qu'ils avertissent que plus de développement et d'essais cliniques sont justifiés.
Une étude de suivi menée par le même groupe faisant usage d'imagerie par résonance magnétique fonctionnelle (IRMf) dans le cadre d'une étude intrasujet aléatoire à double insu et contrôlée par placebo menée sur 28 volontaires sains (dont de nombreux ayant auparavant consommé des quantités minimales de cannabis) a démontré que les sujets de l'étude ayant reçu 7,5 mg de dronabinol (comparativement au placebo) démontraient une diminution de la réactivité de l'amygdale et une augmentation de l'activation du cortex préfrontal médio-ventral et de l'hippocampe à un stimulus conditionné antérieurement éteint au cours d'un rappel de mémoire d'extinctionReference 1056.
Une autre étude clinique, intra-sujet, aléatoire, à double insu, et contrôlée par placebo menée sur 48 participants sains a observé que le CBD améliorait la consolidation mnésique de l'extinction explicite de la peur chez les humainsReference 1057. Dans le cadre de cette étude, on a administré aux participants 32 mg de CBD par inhalation (une dose sous-anxiolytique) avant l'extinction et 32 mg de CBD ou un placebo après l'extinction. Le CBD administré après l'apprentissage par extinction a été associé à l'atténuation de la réponse à la peur explicite au cours d'un rappel de mémoire d'extinction et de la réintégration. Toutefois, une tendance a été observée concernant la réduction de la réintégration chez les sujets ayant été administrés du CBD soit avant ou après l'extinction. Les auteurs suggèrent que l'atténuation des réponses à la peur liée au CBD n'était probablement pas causée par un effet anxiolytique puisqu'il n'existe aucune preuve de la réduction des niveaux d'anxiété après l'administration du CBD. Les auteurs suggèrent aussi que le CBD pourrait être un complément aux thérapies de troubles d'anxiété axées sur l'extinction, ce qui justifie des études plus approfondies.
Une étude clinique pilote ouverte préliminaire portant sur l'administration par voie orale du THC (25 mg/mL), comme traitement d'appoint chez 10 patients atteints d'ESPT chronique et suivant un traitement médicamenteux stable (p. ex. duloxétine, escitalopram, mirtazapine, buproprione, clonazépam, lorazépam) révèle une amélioration statistiquement significative de la gravité globale des symptômes, de la qualité du sommeil, de la fréquence des cauchemars et des symptômes d'hyperexcitation de l'ESPT au cours d'une période d'étude de trois semainesReference 565. On a demandé aux participants de commencer l'administration en plaçant 2,5 mg de THC, deux fois par jour (c.-à-d. 0,1 mL d'une solution à base d'huile d'olive de 25 mg/mL contenant du THC) sous la langue, une heure après le réveil et deux heures avant le coucher. La dose quotidienne maximale était de 5 mg de THC deux fois par jour (c.-à-d. 0,2 mL b.i.d.) ou une dose quotidienne totale de 10 mg (c.-à-d. 0,4 mL). Une diminution statistiquement significative de la gravité des symptômes a été observée concernant les symptômes d'hyperexcitation de l'ESPT, l'échelle d'impression clinique globale (CGI-S), l'amélioration de l'impression clinique globale (CGI-I), la qualité du sommeil, la fréquence des cauchemars et les scores totaux de l'enquête sur les effets des cauchemars [Nightmare Effects Survey]. Vingt pour cent des participants sont parvenus à une rémission complète des cauchemars après la troisième semaine. Des effets indésirables ont été signalés chez 40 % des sujets et comprenaient l'assèchement de la bouche, les céphalées et les étourdissements. Les limites de cette étude comprennent notamment la taille réduite de l'échantillon, la conception ouverte et l'absence de placebo témoin, ainsi que la courte période de suivi.
Une étude clinique ouverte, non contrôlée par placebo portant sur le nabilone utilisé contre l'ESPT a été menée chez 47 patients civils ayant reçu un diagnostic d'ESPT et ayant des antécédents sur au moins deux ans de cauchemars liés à l'ESPT, qui sont réfractaires aux traitements classiques, qui connaissent des cauchemars au moins une fois par semaine et qui n'ont pas d'antécédents de sensibilité aux cannabinoïdes ou des preuves de réactions psychotiquesReference 570. Les patients n'ont pas cessé de prendre des médicaments psychotropes concomitants et ils ont commencé à prendre 0,5 mg de nabilone, une heure avant le coucher. Toutes les doses ont été maintenues en dessous de la dose quotidienne de 6 mg. La gamme des concentrations efficaces s'étendait de 0,2 mg à 4 mg par soir. Soixante-douze pour cent des patients ont déclaré eux-mêmes un arrêt total ou une diminution de la gravité des cauchemars (durée du traitement de 4 à 12 mois ou plus). Les autres avantages auto-déclarés comprenaient une amélioration du temps de sommeil, une diminution des flashbacks au cours de la journée et une cessation des sueurs nocturnes. Les effets secondaires signalés comprenaient l'amnésie, les étourdissements et les céphalées. Aucune tolérance au nabilone n'a été observée dans cet essai clinique.
Une étude clinique préliminaire, croisée, à répartition aléatoire et à double insu, contrôlée par placebo portant sur dix militaires canadiens masculins atteints d'ESPT, qui ne répondaient pas au traitement classique et qui continuaient à avoir des cauchemars dus au traumatisme, a été menée. Les sujets ont reçu 0,5 mg de nabilone ou un placebo et la posologie a été ajustée jusqu'à la dose efficace (c.-à-d. suppression des cauchemars) ou jusqu'à une dose maximale de 3 mg (par jour) de nabiloneReference 1032. La dose moyenne quotidienne obtenue pour le nabilone était de 2,0 mg par jour. Chaque bras de traitement durait sept semaines et une période de sevrage de deux semaines s'écoulait entre ces groupes de traitement. Le score sur l'échelle d'impression globale de la gravité de l'ESPT était de 3,3 à l'examen préliminaire (4 = extrême). La réduction moyenne des cauchemars mesurée selon les scores de l'échelle Clinician-Administered PTSD scale (CAPS) pour les rêves répétitifs et boulversants était de -3,6 et de -1,0 dans le groupe recevant du nabilone et celui recevant un placebo, respectivement (p = 0,03). L'amélioration globale moyenne mesurée par l'échelle d'impression clinique globale de changement [Clinical Global Impression of Change] a été statistiquement significative entre le groupe traité au nabilone et celui traité au placebo. La moitié (50 %) des sujets ont signalé une amélioration significative de la suppression des cauchemars avec le nabilone, tandis que seulement 11 % des sujets ont déclaré une amélioration avec le placebo. Les scores moyens relatifs au questionnaire sur le bien-être général (General Well-Being Questionnaire) ont révélé une différence par rapport au début de l'étude de 20,8 et de -0,4 pour le groupe recevant du nabilone et celui recevant un placebo, respectivement. Les taux d'incidence d'événements indésirables dans le groupe recevant du nabilone et celui recevant un placebo étaient à peu près les mêmes (50 % p/r à 60 %, respectivement). Les effets indésirables les plus courants associés au traitement au nabilone étaient l'assèchement de la bouche et les céphalées. Aucun événement indésirable ou abandon n'a été relevé. Bien que les résultats de l'étude soient prometteurs, la taille de l'échantillon était très petite.
Une récente revue systématique a trouvé « des preuves insuffisantes » sur les bénéfices et les effets nocifs du cannabis dans le traitement de l'ESPT chez les adultes. Seules cinq études répondaient aux critères d'inclusion (les cannabinoïdes pharmaceutiques étaient exclus), dont deux étaient des revues systématiques qui aboutissaient à des conclusions non concluantes avec la présente revue, et trois étaient des études observationnelles, dont deux ne montrant aucun lien entre la consommation de cannabis et les résultats de l'ESPT, et une autre montrant que l'usage de cannabis était associé longitudinalement à des niveaux plus sévères de symptômes d'ESPT par rapport aux personnes s'abstenant de consommer du cannabis. Les auteurs ont souligné que les preuves étaient trop limitées pour tirer des conclusions et que des essais cliniques et davantage d'études de cohortes sont nécessaires pour déterminer l'innocuité et l'efficacité du cannabis à base de plante pour l'ESPTReference 1058.
4.9.5.4 Symptômes de sevrage de l'alcool et des opioïdes (symptômes de sevrage de drogue/substitution)
- Les études précliniques suggèrent que l'agonisme aux récepteurs CB1 (p. ex. le THC) pourrait aider à augmenter les propriétés renforçantes de l'alcool, augmenter la consommation d'alcool et augmenter les risques de rechute de consommation d'alcool ainsi qu'exacerber la sévérité des symptômes du sevrage alcoolique.
- Les études précliniques suggèrent que certains cannabinoïdes (p. ex. le THC) pourraient soulager les symptômes du sevrage aux opiacés.
- Les données provenant d'études observationnelles suggèrent que la consommation de cannabis pourrait aider à soulager les symptômes du sevrage aux opiacés, mais les données cliniques sont insuffisantes pour tirer des conclusions fiables.
Il existe un intérêt grandissant à l'égard de l'utilisation du cannabis comme substitut de l'alcool, des opioïdes et d'autres drogues, y compris les drogues illicites, tant en matière de diminution des symptômes du sevrage de drogues associés à l'abstinence de telles drogues, qu'en matière de diminution de certains des risques associés à l'utilisation de ces drogues (p. ex. morbidité et mortalité associées aux opioïdes). Dans le cas des opioïdes, des études in vitro et in vivo ont démontré un chevauchement physiologique et pharmacologique, une tolérance croisée, une potentialisation mutuelle, et une communication réciproque entre les systèmes endocannabinoïdes et opioïdes endogènes (voir la Section 4.7.2.3)Reference 1059Reference 1060. De plus, ces deux mécanismes physiologiques endogènes ont été impliqués dans le mécanisme d'action de plusieurs autres médicaments comportant un potentiel d'abus et de dépendance, comme l'éthanol, la nicotine et les psychostimulantsReference 1059.
Une enquête qui examinait les tendances de consommation de cannabis et les affections et symptômes médicaux (enquête CAMPS, Cannabis Access for Medical Purposes Survey), parmi 473 personnes s'identifiant comme des utilisateurs courants de cannabis à des fins médicales, a révélé que plus de 80 % des répondants avaient eux-mêmes déclaré utiliser du cannabis pour remplacer les médicaments sur ordonnance, que pour plus de 51 %, le cannabis remplaçait l'alcool et que pour plus de 32 %, il remplaçait les substances illicitesReference 1061. La quantité hebdomadaire médiane de cannabis utilisé était de 14 g (ou 2 g par jour). Les raisons de la substitution les plus souvent approuvées étaient « moins d'effets secondaires négatifs » et une « meilleure gestion des symptômes ». Les limites de l'étude comprennent notamment l'auto-déclaration et l'absence de confirmation par un médecin d'affections médicales et de l'importance de l'amélioration du patient (ou l'absence de celle-ci), ainsi que le potentiel qu'un seul répondant présente plusieurs réactions et un échantillon de population biaisé avec une surreprésentation des personnes répondant favorablement au cannabis.
Alcool
Des données suggèrent des interactions fonctionelles complexes entre l'éthanol et le SEC (examiné enReference 1062). L'administration aiguë et chronique d'éthanol chez l'animal est associée à des changements propres à la région cérébrale en matière de taux d'endocannabinoïdes (aiguë : augmentation/diminution des niveaux d'endocannabinoïdes; chronique : augmentation des niveaux d'endocannabinoïdes) et d'expression des composantes du SEC (chronique : diminution des niveaux du récepteur CB1, et de la FAAH). Dans les études humaines, l'administration aigüe d'éthanol a été associée à une augmentation de la disponibilité des récepteurs CB1, tandis que la consommation chronique d'éthanol (c.-à-d. chez les patients alcooliques) a été associée à une réduction importante de la disponibilité des récepteurs CB1 (20 à 30 %) persistant au moins de deux à quatre semaines après l'abstinenceReference 207Reference 1063Reference 1064. La consommation chronique d'alcool a aussi été associée à la réduction des niveaux de la FAAH, à la réduction du couplage des récepteurs CB1 aux protéines G et à la réduction de l'activité de la FAAHReference 207. L'agonisme des récepteurs CB1 ainsi que la suppression génétique de la FAAH, ou sa suppression par moyens pharmacologiques, semblent médiatiser les propriétés renforçantes de l'éthanol, faciliter la consommation d'éthanol et améliorer la réintégration de l'auto-administration d'éthanol dans les modèles animauxReference 1062. D'autre part, l'ablation génétique de l'expression des récepteurs de CB1 ou de leur suppression par moyens pharmacologiques (p. ex. le rimonabant) cause généralement une diminution de la consommation d'alcool dans les modèles animauxReference 207. Il existe aussi des données probantes limitées et mixtes tirées d'études animales suggérant que le SEC pourrait jouer un rôle dans la modulation des symptômes de sevrage de l'alcool; l'agonisme du récepteur CB1 (p. ex. par THC et nabilone) apparemment exacerbant la gravité du sevrage et, inversement, l'antagonisme des récepteurs CB1 soit atténue ou aggrave les symptômes du sevrage alcooliqueReference 207Reference 1065-Reference 1068.
Opioïdes
Les renseignements anecdotiques et les résultats empiriques tirés d'études animales suggèrent que les cannabinoïdes (p.ex. THC) pourraient être utiles pour traiter les symptômes associés au sevrage des opioïdesReference 837Reference 1069-Reference 1072, mais aucune étude clinique d'efficacité n'appuie cette hypothèse. Toutefois, le chevauchement de la distribution neuroanatomique, la convergence des mécanismes neurochimiques et les propriétés neurobiologiques fonctionnelles comparables du système cannabinoïde et opioïde peuvent aider à expliquer pourquoi les cannabinoïdes pourraient remplacer les opioïdes pour possiblement soulager les symptômes de sevrage associés à l'abstinence des opioïdesReference 836. Une recension des écrits suggère que, dans certaines circonstances, l'utilisation du cannabis peut être associée à un pronostic de traitement positif dans les cohortes dépendantes aux opioïdesReference 1060. L'abus de cannabis et la dépendance à celui-ci ont été qualifiés de facteurs prédictifs de la diminution de l'usage d'héroïne et de cocaïne pendant le traitement et l'utilisation intermittente de cannabis et a été associée à un pourcentage plus faible de résultats positifs lors de tests de dépistage urinaire d'opioïdes et à une meilleure observance du traitement par naltrexoneReference 1060. Quelques études qualitatives ont indiqué que les personnes qui utilisent de l'héroïne déclarent qu'elles sont capables de réduire leur usage d'héroïne en consommant du cannabisReference 1073Reference 1074. Une étude examinant les utilisateurs de drogues par injection (UDI) révèle que le cannabis fumé réduit l'anxiété et l'état de manque ressentis pendant l'abandon de l'utilisation quotidienne d'héroïneReference 1073; dans une autre étude, des patients consommant du cannabis à des fins médicales ont déclaré utiliser du cannabis pour remplacer les opioïdes sur ordonnance ou se sevrer de ceux-ciReference 1074. Une autre étude révèle que les UDI recrutés dans la rue qui déclarent utiliser du cannabis consomment des opioïdes (c.-à-d. de l'héroïne) moins souventReference 1075. Cependant, une étude qui a examiné l'utilisation du cannabis fumé pour atténuer les symptômes de sevrage des opioïdes n'a pas semblé trouver d'effet découlant de la consommation de cannabis sur les symptômes de sevrage des opioïdesReference 1076. Dans cette étude, 116 utilisateurs d'héroïne et de cocaïne en consultation externe (parmi lesquels 46 utilisateurs étaient également des consommateurs de cannabis) participant à la phase de réduction de la méthadone sur 10 semaines d'un essai clinique à répartition aléatoire ont été évalués afin de connaître les symptômes de sevrage des opioïdes qu'ils avaient eux-mêmes déclarés. L'étude révèle que les scores de sevrage des opioïdes ne différent pas entre les utilisateurs de cannabis et ceux qui n'en consomment pas, ce qui porte à croire que le cannabis fumé ne réduirait pas les symptômes de sevrage des opioïdes dans cette population de patients. Enfin, dans une étude d'innocuité de cinq semaines à répartition aléatoire, contrôlée par placebo et à double insu portant sur le dronabinol utilisé pour traiter les symptômes de sevrage des opioïdes d'intensité modérée chez des adultes dépendants aux opioïdes, des doses de 5 ou 10 mg de dronabinol étaient bien tolérées, tandis que des doses de 20, 30 ou 40 mg de dronabinol ont produit une augmentation soutenue du rythme cardiaque et de l'anxiété ou du sentiment de panique chez certains sujetsReference 1077.
4.9.5.5 Schizophrénie et psychose
- Des données considérables provenant d'études précliniques, cliniques et épidémiologiques appuient une association entre la consommation de cannabis (surtout le cannabis prédominant en THC) et le THC et un risque accru de psychoses et de schizophrénie.
- Des preuves émergentes provenant d'études précliniques, cliniques et épidémiologiques suggèrent que le CBD pourrait atténuer la psychose induite par le THC.
La schizophrénie est un trouble mental chronique et dévastateur qui se manifeste généralement à la fin de l'adolescence ou au début de l'âge adulteReference 1078. Il se caractérise par des symptômes dits positifs, négatifs et par une déficience des fonctions cognitivesReference 1079. Les symptômes positifs sont notamment la méfiance, les délires paranoïaques et de grandeur, une désorganisation conceptuelle, des pensées fragmentées et de modifications perceptuellesReference 1079. Par contre, les symptômes négatifs comprennent l'émoussement de l'affect, le retrait affectif, un ralentissement psychomoteur, une absence de spontanéité et des relations réduitesReference 1079. Les déficiences cognitives sont notamment des troubles de l'apprentissage verbal, de la mémoire à court terme, de la mémoire de travail, de la fonction exécutive, de la capacité de raisonnement abstrait, des capacités de prise de décision et de l'attentionReference 1078Reference 1079. Par contre, les épisodes psychotiques sont caractérisés par une déréalisation, une dépersonnalisation, une dissociation, des hallucinations, de la paranoïa, un trouble de la concentration, et des modifications perceptuelles et qui sont habituellement de nature passagère et autolimitativeReference 1079.
Ce qui suit est un examen du rôle du SEC dans la schizophrénie et la psychose, ainsi qu'un examen du rôle du THC et du CBD dans ces troubles. Bien que les données montrent clairement que l'exposition au THC est préjudiciable aux personnes ayant des antécédents personnels ou familiaux de schizophrénie, les données recueillies semblent également indiquer un rôle potentiel anti-psychotique ou anti-schizophrène concernant le CBD, quoique plus de recherches soient nécessaires.
Le système endocannabinoïde et les troubles psychotiques
Il existe de plus en plus de données selon lesquelles le SEC est relié à la schizophrénie et à la psychoseReference 172Reference 1079Reference 1080. Les résultats provenant d'échantillons sanguins et de LCR, et d'études postmortem, génétiques et en neuroimagerie appuient fermement l'implication du SEC dans la schizophrénie et la psychoseReference 172. Par exemple, les taux d'anandamide dans le LCR et le sérum étaient déclarés comme étant élevés de façon significative chez les patients atteints de prodromes psychotiques initiauxReference 1081. De plus, les taux d'anandamide étaient aussi élevés dans le sérum et le LCR de patients atteints de schizophrénie active n'ayant jamais reçu d'antipsychotiqueReference 1082Reference 1083. Le traitement de patients schizophrènes au moyen d'antagonistes des récepteurs de dopamine D2 (traitement pharmacologique standard pour la schizophrénie) baisse aussi les taux d'anandamide qui reviennent à la normaleReference 1084Reference 1085. Des études postmortem se penchant sur les densités du récepteur CB1 dans le cerveau de patients schizophrènes décédés ont aussi relevé une régulation à la hausse des taux du récepteur CB1 dans le cortex dorsolatéral préfrontal, le cortex cingulaire antérieur et le cortex cingulaire postérieurReference 1086-Reference 1090, des parties du cerveau habituellement touchées par la schizophrénieReference 1080. Des études en neuroimagerie mesurant la disponibilité in vivo du récepteur CB1 chez les patients schizophrènes relèvent aussi une augmentation généralisée des taux du récepteur CB1 dans plusieurs autres régions du cerveau, notamment le noyau accumbens, le lobe de l'insula, le cortex cingulaire, le cortex frontal inférieur, le cortex pariétal, le lobe médio-temporal et le pont de VaroleReference 1091Reference 1092. Des études génétiques indiquent que des polymorphismes dans plusieurs gènes différents, tels que les gènescatéchol-O-méthyltransférase (COMT), AKT serine/threonine kinase 1 (AKT1),transporteur actif de dopamine 1 (DAT1), récepteur cannabinoïde 1 (CNR1) et BDNF, pourraient augmenter la vulnérabilité individuelle à la psychose et à la schizophrénie (voir ci-dessous et également la Section 7.7.3.2) surtout lors de l'interaction avec des facteurs environnementaux tels que l'urbanicité, l'abus, la maltraitance, les traumatismes et l'utilisation du cannabis et d'autres substancesReference 1079.
Comorbidité de toxicomanies et de troubles psychotiques
Il est intéressant de constater que les patients atteints de graves maladies mentales comme la schizophrénie présentent des taux élevés de toxicomanies, le cannabis étant l'une des substances les plus souvent consommées ou abusées par cette populationReference 1093Reference 1094. Deux hypothèses conflictuelles ont tenté d'expliquer pourquoi les patients atteints de graves maladies mentales comme la schizophrénie présentent aussi une toxicomanie comorbide. L'hypothèse « d'automédication » dans le contexte des troubles psychiatriques suggère que les personnes souffrant de tels troubles (p. ex. les schizophrènes) consomment du cannabis afin de soulager des symptômes psychopathologiques précis ou encore diminuer les effets secondaires causés par l'utilisation de médicamentsReference 1094Reference 1095. Par exemple, un examen récent portant sur les raisons de l'utilisation du cannabis chez les personnes présentant des troubles psychotiques révèle que les raisons les plus courantes de la consommation de cannabis dans cette population étaient liées au souhait d'améliorer l'humeur et de soulager la dysphorie, de se détendre et d'augmenter le plaisir, d'être « high », de diminuer l'anxiété, d'améliorer sa vie sociale et de réduire l'ennuiReference 1096. Cependant, les auteurs font remarquer que, malgré les raisons bénéfiques et les effets subjectifs positifs allégués par les personnes atteintes de troubles psychotiques utilisant du cannabis, les éléments de preuve suggèrent une détérioration des symptômes positifs de certains patients ainsi qu'une observance thérapeutique et une évolution clinique plus difficiles avec l'utilisation de cannabis. D'autres preuves contre l'hypothèse d'« automédication » proviennent aussi de recherches suggérant que l'arrêt de la consommation de cannabis par des patients atteints de schizophrénie est associé à une amélioration des fonctions cognitives et générales, ainsi que des symptômes de psychose et de dépressionReference 1097. En effet, un examen systématique et une méta-analyse récents ont démontré qu'indépendamment du stade de la maladie, la poursuite de la consommation de cannabis par les patients souffrant de troubles psychotiques préexistants était associée à une plus grande incidence de rechute de psychose comparativement aux patients qui n'avaient jamais consommé de cannabis ou qui avaient interrompu leur consommationReference 159. La poursuite de la consommation a aussi été associée à des périodes d'hospitalisation plus longues. De plus, la consommation continuelle avait un plus grand effet que la consommation interrompue sur la rechute, les symptômes positifs et les niveaux de fonctionnement, mais non sur les symptômes négatifs. Une étude par observation subséquente de patients âgés de 18 à 65 ans souffrant d'un premier épisode de psychose a démontré que les anciens consommateurs de cannabis réguliers ayant arrêté leur consommation après le début de leur psychose possédaient le meilleur cours de la maladie en ce qui concerne les risques de rechuteReference 160. La poursuite de consommation à haute fréquence (c.-à-d. quotidienne) de cannabis de puissance élevée (ressemblant au type « skunk ») possédait les pires résultats (risque élevé de rechute subséquente, de plus de rechutes, de période de mois plus courte avant la rechute et de soins psychiatriques plus intensifs). Une autre étude prospective de cohortes a signalé qu'il est plus probable que la poursuite de la consommation de cannabis après le début de la psychose soit directement liée et liée selon la dose à l'augmentation des risques de rechute de la psychose, causant l'hospitalisation pour traitement psychiatriqueReference 161. Bien que l'hypothèse d'« auto-médication » présente une explication compassionnelle, intéressante et attirante pour comprendre pourquoi les schizophrènes éprouvent des toxicomanies comorbides, l'évidence présentée ici ainsi que le manque de lien entre les symptômes psychotiques précoces et un risque accru de consommation tardive de cannabis ont remis en question l'hypothèseReference 1098-Reference 1100. D'un autre côté, l'hypothèse de « vulnérabilité aux dépendances » affirme que la vulnérabilité à la toxicomanie et les symptômes schizophrènes partagent une même neuropathologieReference 1099Reference 1101. En d'autres termes, cette hypothèse se fie à l'idée que certaines modifications pathologiques de la structure et de la fonction du cerveau prédisposeront certaines personnes à développer la schizophrénie, ainsi que des toxicomanies.
Cannabis/THC et psychose
Il existe de nombreuses preuves scientifiques qui suggèrent une association positive forte entre la consommation de cannabis, en particulier le cannabis à forte teneur en THC, et le développement d'une psychose aiguë et persistante chez certaines personnes, l'apparition précoce de la schizophrénie, (surtout chez les adolescents sensibles aux troubles psychotiques,Reference 182Reference 183Reference 191Reference 194Reference 197), ainsi que l'exacerbation de symptômes existants et un traitement plus complexe chez ceux souffrant déjà de schizophrénieReference 533Reference 1079Reference 1096Reference 1099Reference 1102Reference 1103. Malgré ces constatations, les éléments de preuve suggèrent que le cannabis n'est ni nécessaire ni suffisant pour entraîner un trouble psychotique persistant. Il semble plutôt que le cannabis n'est qu'un facteur qui interagit avec d'autres facteurs pour entraîner une psychoseReference 178. Un nombre toujours plus important de données suggèrent que le lien entre le cannabis et la psychose continue de se modérer en fonction de l'âge au début de la consommation, des abus dont les patients ont été victimes durant leur enfance (facteurs de stress) et de la vulnérabilité génétiqueReference 178.
L'adolescence et le début de l'âge adulte sont des périodes de développement essentielles et l'exposition à divers stimuli environnementaux, y compris le cannabis, peut avoir des effets néfastes sur le bon processus du développement neurobiologique et déclencher l'apparition précoce de la schizophrénie chez ceux présentant une vulnérabilité génétiqueReference 533Reference 1079Reference 1103-Reference 1105. La période de maturation cérébrale pendant l'adolescence s'étend de l'âge de 10 ans à 24 ans avec une synaptogénèse, une myélogénèse, un élagage dendritique et synaptique, une croissance volumétrique continue, des changements dans la distribution des récepteurs et une programmation des taux neurotrophiques durant cette période, en particulier dans le cortex préfrontal et le système limbiqueReference 534Reference 1100. L'adolescence est aussi la période durant laquelle le SEC du cerveau subit des changements dynamiques, y compris un pic des taux d'ARNm du récepteur CB1, une augmentation constante du taux d'anandamide et une diminution plus marquée des taux de 2-AGReference 533. Le SEC participe à la myélinisation de diverses voies, à la neuroplasticité et à la fonction synaptiqueReference 533. Il se peut dès lors que des cannabinoïdes administrés de façon exogène, tels que le THC, puissent perturber le juste équilibre des taux d'endocannabinoïdes et le bon fonctionnement du récepteur CB1, entraînant ainsi un changement du processus de neurodéveloppement durant cette période. Dans une étude cas-témoin menée chez 280 patients ayant présenté un premier épisode de psychose et auprès de 174 témoins, les patients ont déclaré utiliser du cannabis plus puissant à forte teneur en THC et à faible teneur en CBD, comparativement aux témoins qui ont déclaré utiliser du cannabis contenant des quantités égales de THC et de CBDReference 1106. En outre, l'utilisation quotidienne de cannabis à forte puissance contenant des quantités élevées de THC et de faibles quantités de CBD a été associée à la manifestation précoce d'une psychoseReference 1107. Les personnes qui ont commencé à utiliser du cannabis à l'âge de 15 ans ou plus tôt ont également manifesté une psychose d'apparition précoce par rapport à celles qui ont commencé à en consommer après l'âge de 15 ansReference 1107.
Les études sur des modèles animaux de schizophrénie révèlent que le traitement chronique de rats adolescents, mais non de rats adultes, avec un agoniste de récepteur cannabinoïde entraîne un phénotype semblable à la schizophrénie qui est accompagné de changements de l'activité neuronale basale dans diverses structures cérébrales, notamment le noyau accumbens, l'amygdale, le putamen et l'hippocampe (voirReference 1100Reference 1108Reference 1109).
Parallèlement, des études cliniques contrôlées effectuées chez des patients sans antécédent de trouble psychotique ont indiqué la manifestation de symptômes transitoires semblables à la schizophrénie provoqués par l'administration intraveineuse de Δ9-THCReference 196. Ces symptômes comprenaient des symptômes psychotiques positifs transitoires, des modifications perceptuelles, des symptômes négatifs, une euphorie, de l'anxiété et des déficiences cognitives de l'attention, de la mémoire de travail et de la remémoration verbaleReference 196. De même, l'administration par intraveineuse de Δ9-THC chez les schizophrènes a été associée à une exacerbation transitoire des principaux symptômes psychotiquesReference 194. En résumé, les symptômes psychotomimétiques aigus associés au cannabis ou à l'intoxication au THC peuvent inclure la dépersonnalisation, la déréalisation, la paranoïa, les idées de persécution, la fuite des idées, les pensées sous pression, les pensées désorganisées, les délires de persécution, la mégalomanie, les hallucinations auditives et visuelles et l'altération de l'attention et de la mémoire (chez environ 20 à 50 % des personnes)Reference 1079. Ces effets ont été systématiquement documentés avec le cannabis fumé, le cannabis administré par voie orale (5 à 20 mg de THC) et le THC administré par intraveineuse (0,015 à 0,03 mg/kg)Reference 1079.
Facteurs génétiques
Un grand nombre d'études ont examiné l'influence de facteurs génétiques possibles dans le développement de la psychose et de la schizophrénie, plus particulièrement en tant que fonction d'interaction avec la consommation de cannabis. Certaines études ont mis l'accent sur le rôle des polymorphismes génétiques dans le gène COMTReference 1110-Reference 1117, et d'autres se sont centrées sur les polymorphismes du gène AKT1Reference 1118-Reference 1121. Ensemble, les données de ces études permettent fortement de croire que les SNPs du gène COMT ou AKT1 interagissent avec la consommation de cannabis afin de prédire l'âge au moment de l'apparition, de même que la probabilité de développer une psychose ou une schizophrénie chez les personnes vulnérables. Plus récemment, de nouvelles données sont apparues impliquant des polymorphismes aux gènes CNR1, neuréguline 1 (NRG1) ainsi qu'au gène DAT1 et au gène BDNF et la consommation de THC et de cannabis avec l'apparition d'effets psychotomimétiques ainsi que l'apparition précoce de la schizophrénieReference 1079Reference 1122-Reference 1124. Veuillez consulter la Section 7.7.3.2 pour plus de renseignements sur les effets psychiatriques indésirables associés à l'utilisation de cannabis et de cannabinoïdes psychoactifs (comme le THC), et sur le rôle de la prédisposition génétique par rapport au risque de développer un trouble psychotique.
Les conclusions présentées ci-dessus et aux sections 7.7.3 et 7.7.3.2 suggèrent que l'utilisation de cannabis (et de cannabis à forte teneur en THC), de même que l'exposition au Δ9-THC seul ne serait pas bénéfique, et pourrait en fait être dangereuse pour les personnes qui souffrent de troubles psychotiques ou qui pourraient avoir une prédisposition génétique ou des antécédents familiaux de psychose ou de schizophrénie. En revanche, des nouvelles données suggèrent que le CBD protégerait des effets du THC provoquant une psychose (voir ci-dessous).
Cannabidiol
Contrairement aux effets néfastes observés avec le THC et le cannabis à forte teneur en THC dans la psychose et la schizophrénie, certaines données probantes tirées d'études d'observation et d'études précliniques et cliniques préliminaires laissent supposer que le CBD pourrait protéger contre la psychose induite par le THC et pourrait même servir de traitement potentiel de la schizophrénie.
Études d'observation
Deux études ayant analysé les concentrations des cannabinoïdes dans des échantillons de cheveux de 140 personnes révèlent que celles contenant que de THC dans leurs cheveux avaient des symptômes positifs plus importants avec des niveaux plus élevés d'hallucinations et de délire que les personnes dont le THC et le CBD se trouvaient dans leurs cheveux ainsi que ceux sans cannabinoïdesReference 1125Reference 1126. À l'opposé, une autre étude portant sur les consommateurs de cannabis n'a pas réussi à démontrer une différence dans la prévalence de symptômes de type psychotique entre les sujets qui avaient déclaré fumer du cannabis contenant des taux « faibles » ou « élevés » de CBD; toutefois, les auteurs mentionnent divers facteurs de confusion, notamment le manque d'ajustement en fonction de la consommation d'alcool, ce qui pourrait aider à expliquer ce manque d'uniformité entre les étudesReference 529.
Une étude transversale menée en ligne et effectuée auprès de 1 877 personnes ayant des antécédents réguliers d'utilisation de cannabis indique que les personnes ayant consommé du cannabis dont le rapport CBD/THC était plus élevé ont éprouvé moins d'épisodes psychotiques; toutefois les auteurs soulignent que les effets observés étaient subtilsReference 132. De plus, divers problèmes méthodologiques ont gêné cette étude, ce qui suggère que les conclusions devraient être interprétées avec prudence.
Dans une étude cas-témoin menée auprès de 280 patients ayant présenté un premier épisode de psychose et auprès de 174 témoins, les patients ont déclaré utiliser du cannabis plus puissant à forte teneur en THC et à faible teneur en CBD, comparativement aux témoins qui ont déclaré utiliser du cannabis contenant des quantités égales de THC et de CBDReference 1106. En outre, l'utilisation quotidienne de cannabis à forte puissance contenant des quantités élevées de THC et de faibles quantités de CBD a été associée à la manifestation précoce de psychose par rapport aux personnes ne consommant pas de cannabisReference 1107.
Dans une étude de suivi de type cas-cohorte de 410 patients ayant eu un premier épisode de psychose et auprès de 370 témoins dans la population, la consommation quotidienne de cannabis de type « skunk » (très forte teneur en THC, très faible teneur en CBD) a été associée à un risque cinq fois plus élevé de premier épisode de psychose, tandis que l'utilisation en fin de semaine de cannabis de type « skunk » a été associée à un risque presque trois fois plus élevé de premier épisode de psychoseReference 168. En revanche, le RC d'un premier épisode de psychose associé à l'utilisation de cannabis de type « skunk » moins d'une fois par semaine, ou quotidiennement, en fin de semaine, ou à l'utilisation de cannabis moins puissant moins d'une fois par semaine n'a pas été statistiquement significatif par rapport aux sujets n'ayant jamais consommé de cannabisReference 168.
Les données ci-dessus suggèrent que la présence de THC et l'absence de CBD dans le cannabis pourraient augmenter le risque de connaître des réactions psychotiques et suggèrent aussi e qu'il y ait un effet lié à la dose entre le THC et le risque d'un premier épisode de psychose.
Études précliniques et cliniques
Conformément à ces constatations, plusieurs études précliniques et cliniques ont suggéré que le CBD pourrait en effet protéger contre les effets psychoactifs et psychotiques du THC et du cannabis à forte teneur en THC et qu'il pourrait aussi avoir un usage thérapeutique dans le traitement de personnes atteintes de psychose et de schizophrénieReference 114Reference 1127-Reference 1137. Une mise en garde concernant ceci est que dans des modèles animaux, il semble que le prétraitement au CBD 15 à 60 minutes avant l'administration de THC, mais pas l'administration en concomitance, est associé à une augmentation des concentrations sanguines et intracérébrales de THC et à une immobilité liée au THCReference 1138Reference 1139. En outre, un rapport plus élevé de CBD par rapport au THC semble également important pour atténuer les effets psychoactifs du THCReference 114Reference 1102Reference 1130.
Études précliniques
Des études dans certains modèles de psychose chez le rat et la souris semblent indiquer que le CBD (à des doses de 15 à 60 mg/kg ou à des doses chez l'humain à peu près équivalentes de 1,25 mg/kg à 10 mg/kg de CBD) réduit les effets comportementaux de type psychotique d'une manière comparable à celle observée avec des antipsychotiques atypiquesReference 1140Reference 1141.
Études cliniques menées auprès de volontaires en bonne santé
Dans peut-être l'une des premières études cliniques examinant les effets du CBD sur la psychoactivité induite par le THC, Karniol et coll. ont administré un placebo, du THC (30 mg), du CBD (15, 30 ou 60 mg) ou une combinaison de THC et de CBD par voie orale à 40 volontaires sains de sexe masculin, à double insu, et ont mesuré les effets psychoactifs subjectifs qui s'ensuivaientReference 114. L'administration de 30 mg de THC a entraîné de fortes réactions psychologiques (principalement de l'anxiété) qui, dans certains cas, ont atteint un état proche de la panique et ont mené à une déficience importante du rendement à une tâche d'estimation temporelle. Ces deux effets se sont atténués proportionnellement à l'augmentation des doses de CBD. Un rapport CBD/THC de 2 : 1 (60 mg : 30 mg) s'est révélé surtout efficace pour atténuer l'intensité des effets psychoactifs induits par le THC dans cette étude. Le CBD a semblé modifier non seulement l'intensité, mais également la qualité des effets psychoactifs induits par le THC.
Dans une autre étude menée auprès de 15 volontaires sains, l'inhalation simultanée de CBD (150 µg/kg) et de THC (25 µg/kg) a atténué l'euphorie subjective associée au THC et révélé une tendance vers une diminution du trouble psychomoteur induit par le THCReference 1128. Aucun effet sur l'euphorie et le trouble psychomoteur induits par le THC n'a été remarqué lorsque la même dose de CBD a été administrée 30 minutes avant le THC.
Dans une étude clinique à double insu, contrôlée par placebo, huit volontaires sains ont reçu par voie orale un placebo, du THC (0,5 mg/kg), du CBD (1 mg/kg) ou un mélange de THC (0,5 mg/kg) et de CBD (1 mg/kg)Reference 1129. L'administration du THC seul a été associée à plusieurs effets psychoactifs, notamment la dépersonnalisation, des pensées décousues, des idées paranoïdes et de l'anxiété, lesquels se sont estompés pour la plupart lorsque du CBD a été administré en concomitance avec du THC.
Dans une autre étude clinique portant sur neuf volontaires sains, une dose orale de 200 mg de CBD a atténué la déficience de l'inversion de la profondeur binoculaire (un modèle de perception entravée durant des états psychotiques) induite par 1 mg de nabilone par voie oraleReference 1137.
Par contre, l'administration orale d'un extrait de cannabis (contenant 10 mg de THC et 5,4 mg de CBD), mais pas du THC pur (10 mg de THC), à 24 volontaires sains dans le cadre d'une étude clinique contrôlée par placebo et à double insu, a été associée à une diminution de la fréquence de tapotement des doigts (une mesure de la perturbation motrice liée à une symptomatologie schizophrène) et à la gravité de la maladieReference 1130.
Une étude clinique intra-sujets à répartition pseudo-aléatoire, contrôlée par placebo et à double insu a démontré que le prétraitement de sujets humains sains au CBD (5 mg par voie intraveineuse), mais pas au placebo, a diminué l'émergence de symptômes psychotiques positifs 30 minutes après l'administration par voie intraveineuse de 1,25 mg de Δ9-THCReference 124.
Dans une étude clinique à répartition aléatoire et à double insu, contrôlée par placebo, portant sur 48 sujets sains ayant reçu un placebo, du THC (1,5 mg IV) ou du CBD (600 mg, PO), le prétraitement au CBD 3,5 heures avant l'administration du THC a atténué la paranoïa et la déficience de la mémoire épisodique, mais non la mémoire de travail, associées au THCReference 1131.
Dans leur ensemble, les constatations susmentionnées suggèrent que le CBD, en particulier à des rapports de 2 : 1 et lorsqu'il est administré en concomitance, peut atténuer les effets aigus psychotiques et anxiogènes ainsi que certains aspects de l'altération des fonctions cognitives observés avec l'administration du THC.
Études cliniques et de cas chez les patients présentant des symptômes psychotiques
Un rapport de cas portant sur une patiente schizophrène de 19 ans, traitée par halopéridol et recevant du CBD par voie orale, révèle que le traitement avec 1500 mg de CBD chaque jour pendant 26 jours, mais sans halopéridol, a été associé à une atténuation des symptômes psychotiquesReference 1132. Une autre étude de cas d'une envergure légèrement plus importante et effectuée par le même groupe de chercheurs a indiqué une légère amélioration des symptômes psychotiques chez l'un des trois patients schizophrènes résistants aux traitements et ayant reçu 1280 mg par voie orale de CBD quotidiennement pendant quatre semaines; aucun effet indésirable n'a été remarquéReference 1134. Dans une étude clinique effectuée, encore une fois, par le même groupe, six patients atteints de la MP ayant aussi manifesté des symptômes psychotiques ont reçu 600 mg par jour de CBD par voie orale pendant quatre semainesReference 1142. Ce schéma thérapeutique a été associé à une réduction significative de la symptomatologie psychotique, sans effets indésirables.
Dans une étude clinique contrôlée par placebo, à dose unique, effectuée par Hallak et coll. (2010), 28 patients schizophrènes ont reçu un placebo, 300 mg ou 600 mg de CBD par voie orale. Bien qu'aucune amélioration de la symptomatologie psychotique n'ait été remarquée, on a signalé une amélioration statistiquement significative de l'attention avec le placebo et la dose de 300 mg de CBD, mais pas avec la dose de 600 mg de CBD avec laquelle il semblait y exister une détérioration potentielle de l'attention possiblement causée par un effet de sédation à la dose plus élevéeReference 1135.
Un essai clinique de quatre semaines formé de groupes parallèles, à contrôle actif, à double insu et à répartition aléatoire comparant le CBD (200 mg, q.i.d., jusqu'à une quantité quotidienne totale de 800 mg) et l'amilsupride (un antagoniste des récepteurs de dopamine D2/D3 utilisé dans le traitement de la schizophrénie) révèle que les deux médicaments ont été associés à de grandes améliorations cliniques des symptômes, sans grande différence entre les deux traitementsReference 1136. Le traitement à l'aide du CBD était bien toléré et a produit beaucoup moins d'effets secondaires que le traitement antipsychotique (p. ex. la présence de symptômes extrapyramidaux et d'une libération plus grande de prolactine). De plus, le CBD n'a pas semblé toucher la fonction hépatique de manière significative, ni la fonction cardiaque. Le traitement par le CBD, mais non celui par l'amilsupride, a aussi été associé à une augmentation des taux sériques d'anandamide.
Dans leur ensemble, les données probantes tirées d'un nombre limité d'études d'observation, précliniques et cliniques émergentes indiquent que le CBD jouerait un rôle protecteur dans la manifestation de symptômes psychotiques transitoires associés à une exposition au THC ou au cannabis à forte teneur en THC. Le CBD pourrait aussi offrir des promesses thérapeutiques dans le traitement de personnes présentant des symptômes psychotiques ou la schizophrénie, bien que de nombreuses recherches supplémentaires soient nécessaires à cet égard pour confirmer et corroborer cet effect.
Cela étant dit, la mesure dans laquelle le CBD, aux concentrations habituellement observées dans le cannabis, est capable d'améliorer les symptômes psychotiques n'a pas été fermement établie et, en effet, la plupart du cannabis consommé, que ce soit à des fins non médicales ou médicales, contient généralement des concentrations relativement faibles de CBD et des concentrations plus élevées de THCReference 76Reference 1143. Par exemple, la teneur en CBD du cannabis vendu dans la rue varie habituellement entre 0,1 et 0,5 %, bien que des concentrations de CBD allant jusqu'à 8,8 % (dans le hachisch) aient été observéesReference 132. Par conséquent, à titre d'exemple, un joint de 1 g pourrait contenir 1 mg (0,1 %) à 88 mg (8,8 %) de CBD, concentrations qui sont beaucoup plus faibles que celles habituellement administrées dans des essais cliniques (600 à 1500 mg par jour)Reference 1144. Certaines souches de cannabis séché vendu à des fins médicales par des producteurs canadiens autorisés par Santé Canada peuvent contenir jusqu'à 24 % de CBD avec peu de THC. Par conséquent, un joint de 1 g de cette souche de cannabis pourrait contenir jusqu'à 240 mg de CBD. Il s'agit d'une dose encore bien inférieure à celle utilisée dans les essais cliniques de CBD pour la psychose/schizophrénie. Cependant, de nombreux producteurs autorisés vendent aussi des souches de cannabis dont les concentrations de THC et de CBD sont à peu près égales et certaines dont le rapport CBD/THC est de 2 : 1-cette proportion a été rapporté à réduire l'incidence de symptômes psychotiques chez les personnes utilisant du cannabis. Bien que des recherches supplémentaires soient nécessaires, les patients qui déclarent consommer du cannabis dont les concentrations de THC et de CBD sont à peu près égales signalent moins de perturbations de l'humeurReference 133. En outre, les producteurs autorisés de cannabis à des fins médicales sont également autorisés à produire et à vendre de l'huile de cannabis contenant des teneurs élevées en CBD (c.-à-d. jusqu'à 24 %).
En conclusion, la consommation de cannabis contenant principalement du THC ainsi que la consommation d'autres cannabinoïdes psychoactifs (p. ex. dronabinol, nabilone) devrait être abordée avec une grande prudence chez les patients atteints de la schizophrénie (ou ceux à risque de psychose), puisque l'on croit que ces substances déclenchent des épisodes psychotiques, baissent l'âge au moment de l'apparition des symptômes et contribuent à un pronostic négatif à long terme chez les personnes vulnérables. De plus, le potentiel thérapeutique du CBD seul dans le traitement de la schizophrénie/psychose, quoique prometteur, requiert davantage d'études.
4.9.6 Maladie d'Alzheimer et démence
- Les études précliniques suggèrent que le THC et le CBD pourraient protéger contre l'excitotoxicité, le stress oxidatif et l'inflammation dans les modèles animaux de la maladie d'Alzheimer (MA).
- Les études de cas, cliniques et observationnelles limitées suggèrent que le THC oral et le nabilone sont associés à l'amélioration d'un nombre de symptômes associés à la MA (p. ex. activité motrice nocturne, comportement perturbé, sommeil, agitation, résistivité).
La démence affecte 36 millions d'individus au monde, dont la MA représente de 60 à 80 % de ces casReference 551. Bien qu'elle fasse encore l'objet de débats, une théorie largement reconnue pour la physiopathologie de la MA est que le dépôt de protéine beta-amyloïde (βA) dans certaines parties du cerveau mène à des réactions neuroinflammatoires localisées et à une accumulation d'enchevêtrements neurofibrillaires intracellulaires (composés de protéine tau hyperphosphorylée); ces événements entraînent la mort cellulaire des neurones et la perte correspondante des synapses fonctionnelles, ainsi que des changements dans les niveaux de neurotransmetteursReference 1145. On croit que ces processus pathologiques donnent naissance aux symptômes associés à la maladie, comme le déficit de la mémoire et les déficiences motricesReference 1145.
Le système endocannabinoïde et la maladie d'Alzheimer
Il existe certaines données probantes qui suggèrent qu'il y ait une association entre le SEC et la physiopathologie de la MAReference 1145Reference 1146. Une étude in vivo signalait une élévation des concentrations d'endocannabinoïde 2-AG suite à l'administration intracérébrale de peptide βA1-42 chez les animauxReference 1147. Une autre étude sur des échantillons cérébraux postmortem provenant de patients décédés atteints de MA a démontré une association entre des concentrations plus faibles d'anandamide et des concentrations plus élevées d'βA1-42, mais aucune association aux concentrations d'βA40, à la charge de plaques d'amyloïdes, ni à la phosphorylation de la protéine tauReference 1148. Finalement, la régulation positive des récepteurs CB2 et de la FAAH (et de l'activité de la FAAH) ont été observés respectivement dans des cellules microgliales réactives et des astrocytes entourant les plaques séniles dans les tissus cérébraux recueillis postmortem de patients atteints de la MAReference 1149.
Données précliniques
Les études précliniques portent à croire que le SEC protège de l'excitotoxicité, du stress oxydatif et de l'inflammation - tous des événements pathologiques clés associés au développement de la MAReference 1150.
Les résultats provenant d'expériences in silico et in vivo suggèrent que le Δ9-THC pourrait lier et inhiber de manière compétitive l'acétylcholinestérase qui, dans le contexte de la MA, fonctionne comme un chaperon moléculaire en accélérant la formation de fibrilles amyloïdes et en formant des complexes stables avec la βAReference 1151. De cette manière, le Δ9-THC bloque l'effet amyloïdogène de l'acétylcholinestérase, ce qui diminue l'agrégation de βAReference 1151. D'autres études in vitro suggèrent que le CBD pourrait avoir des effets neuroprotecteurs, antioxydants et antiapoptotiques, ainsi que la capacité de prévenir l'hyperphosphorylation de la protéine tau dans les modèles cellulaires de la MAReference 1152-Reference 1154. On a aussi démontré in vitro que les endocannabinoïdes préviennent la perméabilisation lyosomale provoquée par la βA et l'apoptose neuronale subséquenteReference 1150. Une étude in vivo indique que l'amélioration du tonus endocannabinoïde par l'intermédiaire de l'inhibition de FAAH, est associée à une baisse significative de la quantité totale de la proteine précurseur d'amyloïde, des peptides solubles βA1-40 et βA1-42 et de la densité de la plaque neuritique, ainsi qu'à une baisse de la microgliose et de l'astrogliose dans un modèle murin de MAReference 1155.
Des études in vivo ont rapporté que le CBD inhibe grandement et de manière liée à la dose la gliose réactive et les réactions neuroinflammatoires subséquentes chez les souris à qui l'on avait injecté de la βA aux doses de 2,5 mg/kg/jour et de 10 mg/kg/jour IP au cours d'un traitement de sept joursReference 1156. Une autre étude qui utilisait des modèles in vitro et in vivo de la MA signalait des rôles opposés pour les récepteurs CB1 et CB2 dans ce contexte : l'agonisme du récepteur CB1 et l'antagonisme du récepteur CB2 étaient tous deux associés à une astrogliose réactive atténuée provoquée par la βA et une atténuation de l'expression des marqueurs neuroinflammatoiresReference 1157.
L'administration de doses non psychoactives d'extraits végétaux enrichies de THC (67,1 % de THC, 0,3 % de CBD, 0,9 % de CBG, 0,9 % de CBC et 1,9 % d'autres phytocannabinoïdes), un extrait végétal enrichi de CBD (64,8 % de CBD, 2,3 % de THC, 1,1 % de CBG, 3,0 % de CBC et 1,5 % d'autres phytocannabinoïdes) ou de nabiximols (combinaison de THC et de CBD, 2,7 % THC et 2,5 % CBD) pendant une période de cinq semaines aux premiers stades de la phase symptomatique a diminué l'affectation de la mémoire observée dans les souris PPβA/PS1Reference 1158. De plus, l'exposition chronique à l'extrait végétal enrichi de THC, mais non à l'extrait enrichi de CBD ou au nabiximols, a causé une diminution du rendement de la mémoire de souris de type sauvage comparativement aux compagnons de portée traités par le véhicule du médicament. Bien que le traitement chronique à l'aide de THC, de CBD ou de nabiximols n'ait pas modifié considérablement la charge totale de βA dans le cortex cérébral ou dans l'hippocampe de souris PPβA/PS1, la combinaison de THC et de CBD (nabiximols) a diminué les niveaux de protéine βA1-42 soluble, mais non de protéines βA1-40, suggérant un effet protecteur. Le THC, le CBD ou la combinaison des deux (nabiximols) ont aussi été associés à une réduction de l'astrogliose associée à la déposition de βA et la combinaison du THC et du CBD a aussi considérablement réduit la microgliose.
Données cliniques et d'observation
Il existe très peu d'études cliniques sur le cannabis ou les cannabinoïdes pour le traitement de la MA. Un examen systématique de la base de données Cochrane sur les cannabinoïdes dans le traitement de la démence a conclu qu'il existait insuffisamment de données probantes cliniques pour suggérer que les cannabinoïdes puissent être efficaces dans l'amélioration des troubles du comportement présents dans les cas de démence ou dans le traitement des autres symptômes de la démenceReference 1159. Pour le moment, aucune conclusion définitive ne peut être tirée concernant l'innocuité et l'efficacité de médicaments à base de cannabinoïdes chez les personnes plus âgées qui représentent la population la plus susceptible d'être touchée par la MAReference 551.
Une étude croisée de six semaines, à double insu et contrôlée par placebo, menée chez 12 patients atteints d'une démence de type Alzheimer à signalé qu'une dose quotidienne de 5 mg de dronabinol (Δ9-THC) a été associée à une baisse de troubles du comportement et une augmentation du poids corporelReference 1160. Toutefois, des réactions indésirables comme la fatigue, la somnolence et l'euphorie (probablement non voulue) ont été signalées. Une étude pilote ouverte menée chez six patients suggère qu'une dose de 2,5 mg de dronabinol (Δ9-THC) administrée en soirée diminuerait l'activité motrice nocturne et l'agitation chez les personnes atteintes de démence graveReference 1161. Une étude clinique contrôlée par placebo menée chez 24 patients pour lesquels un diagnostic de démence probable de type Alzheimer avec comportement agité a été posé et ayant reçu du dronabinol (2,5 mg, deux fois par jour, pendant deux semaines) révèle qu'ils ont présenté une diminution de l'activité motrice nocturne par rapport au début de l'étude, sans incidence signalée d'événements indésirablesReference 1162. Dans un rapport de cas, un patient atteint de démence de type Alzheimer ayant été traité sans succès à l'aide de donepezil, de mémantine, de gabapentine, de trazodone et de citalopram a reçu du nabilone (0,5 mg au coucher au départ, puis b.i.d.) et a manifesté une diminution immédiate de la gravité de l'agitation et de la nervosité, puis une amélioration de divers symptômes comportementaux après six semaines de traitement continuReference 1163. Un rapport de cas portant sur un homme de 71 ans souffrant d'une démence mixte vasculaire et fronto-temporale accompagnée d'une désinhibition sexuelle a fait état de l'impossibilité de restreindre ses comportements, malgré des essais avec divers agents, notamment la sertraline, le divalproex, la trazodone, la rispéridone et l'aripiprazoleReference 1164. Le traitement au nabilone (0,5 mg toutes les huit heures) a entraîné une amélioration significative des symptômes comportementaux; toutefois, une sédation et une léthargie ont été observées, mais uniquement au cours de la phase d'ajustement posologique.
Une analyse rétrospective de dossiers a évalué les données de 40 patients atteints de démence (dont 13 de la MA) qui avaient été traités pendant 17 jours en moyenne (marge de 4 à 50 jours) par le dronabinol pour traiter les troubles du comportement et de l'appétitReference 418Reference 551Reference 1165. L'administration d'une dose moyenne de dronabinol de 7 mg par jour a été associée à une amélioration significative des scores sur l'échelle d'agitation de Pittsburgh [Pittsburgh Agitation Scale] et sur l'échelle d'impression globale clinique [Clinical Global Impression], mais pas sur l'échelle globale du fonctionnement [Global Assessment of Functioning Scale]Reference 418Reference 551Reference 1165. Des améliorations significatives ont été remarquées au niveau de la durée de sommeil ainsi que le pourcentage d'aliments consommés pendant le traitement au dronabinol. Vingt-six événements indésirables ont été détectés dans l'étude et les événements les plus fréquents ont été notamment la sédation, le délire, l'infection des voies urinaires et la confusionReference 1165. Bien qu'aucune relation de causalité n'ait été établie, les événements indésirables n'ont pas entraîné l'arrêt du traitement.
Il est incertain si les améliorations des symptômes de la MA associés avec l'utilisation de cannabinoïdes psychoactifs (THC, nabilone) sont liées à leurs effets sédatifs non particuliers ou aux mécanismes d'action particuliers aux cannabinoïdes puisque certaines études signalent la sédation, la somnolence et la fatigue tandis que d'autres rapports suggèrent que ces effets néfastes sont transitoires et se dissipent après que le patient ait passé la phase initiale de titration de la dose et a atteint une dose stable de cannabinoïde.
Néanmoins, il convient aussi de remarquer qu'une étude transversale a rapporté que l'utilisation prolongée de cannabis ingéré ou inhalé était associée à une efficacité diminuée dans divers domaines cognitifs (p. ex. vitesse de traitement des renseignements, mémoire de travail, fonction exécutive et perception visuospatiale) chez les patients atteints de SPReference 229. Des effets indésirables semblables provenant du cannabis ou des cannabinoïdes sur la cognition pourraient possiblement se manifester dans le contexte d'une démence de type Alzheimer.
4.9.7 Inflammation
Le rôle du SEC dans l'inflammation est complexe puisqu'il a été impliqué dans les processus pro- et anti-inflammatoiresReference 1146. On sait que les endocannabinoïdes comme l'anandamide et le 2-AG sont produits et libérés par les cellules immunitaires activées et qu'ils agissent aussi en tant que chimioattractants des cellules immunitaires, ce qui favorise ou dirige la réaction inflammatoireReference 1166. D'un autre côté, les cannabinoïdes peuvent aussi supprimer la production de cytokines et de chimiokines proinflammatoires, et peuvent par conséquent avoir des applications thérapeutiques en ce qui concerne les maladies comportant une composante inflammatoire sous-jacenteReference 1166Reference 1167. Pour des renseignements sur d'autres maladies comportant une composante inflammatoire comme les arthritides ou la MII, veuillez consulter les Sections 4.8 et 4.9.8.2 du présent document.
4.9.7.1 Maladies inflammatoires de la peau (dermatite, psoriasis, prurit)
- Les résultats provenant d'études précliniques, cliniques et de cas sur le rôle decertains cannabinoïdes dans la modulation d'affections inflammatoires de la peau sont mixtes.
- Certaines études cliniques et de séries prospectives de cas suggèrent que certains cannabinoïdes ont un rôle protecteur (THC, CBD, HU-210), tandis que d'autres suggèrent un rôle nuisible (cannabis, THC, CBN).
La peau possède un SECReference 43. Les récepteurs CB1 et CB2 s'expriment dans un grand nombre de types de cellules cutanées, notamment les kératinocytes épidermiques, les nerfs cutanés et les fibres nerveuses, les cellules sébacées, les cellules myoépithéliales des glandes eccrines sudoripares et des conduits des glandes sudoripares, les mastocytes et les macrophagesReference 1168. Le SEC, et certaines voies de signalisations associées (p. ex. PPARγ, TRPV1), semblent réguler l'équilibre entre la prolifération, la différenciation et l'apoptose des kératinocytes; ensemble, ces systèmes peuvent jouer un rôle dans l'homéostasie cutanée, mais aussi dans les maladies comme le psoriasis, qui est caractérisé par la prolifération et l'inflammation des kératinocytesReference 43Reference 1169-Reference 1171.
Études précliniques et cliniques
Une étude préclinique chez des souris atteintes d'une dermatite de contact allergique provoquée par le dinitrophenolflurorobenzène (DNFB) révèle qu'une solution topique contenant 1 µM de THC appliquée sur la peau a été associée à une atténuation de la réaction inflammatoire non liée aux récepteurs CB1/CB2Reference 1172. Une autre étude préclinique indique que l'application de CBD (10 µM) sur les sébocytes humains cultivés et à une culture d'organe de peau humaine a inhibé les actions lipogènes (« favorables à l'acné ») de divers composés et réprimé la lipogenèse et la prolifération des sébocytes, en plus d'exercer des effets anti-inflammatoires, ce qui évoque la possibilité que le CBD agisse comme traitement contre l'acnéReference 1173. Une autre étude in vitro a démontré que le CBD et le CBG (0,5 µM), mais non le CBDV, ont considérablement réduit l'expression d'un nombre de gènes exprimés dans des kératinocytes humains différenciés (c.-à-d., les kératines, l'involucrine et la transglutaminase) en augmentant la méthylation de l'acide désoxyribonucléique (ADN) du gène de la kératine 10Reference 1174. Le CBD a aussi augmenté le niveau global de méthylation de l'ADN augmentant la possibilité que le CBD puisse exercer un contrôle épigénétique de la différentiation de la peau et puisse potentiellement ouvrir la voie vers laquelle de nouvelles approches axées sur les phytocannabinoïdes pour le traitement des maladies de la peau; selon les auteurs de cette étude.
Lors d'études cliniques, le prurit déclenché par l'histamine provoqué expérimentalement était diminué par l'administration périphérique du puissant agoniste du récepteur cannabinoïde CB1/CB2, HU-210, et les augmentations correspondantes du débit sanguin, de même que les poussées neurogènes médiées étaient atténuéesReference 1175. Lors d'une autre étude clinique, le HU-210 appliqué sur la peau diminuait grandement la perception de douleur localisée chez les sujets humains après l'application de capsaïcine restreinte localement sur la peau et diminuait l'hyperalgésie thermique subséquente et l'allodynie au toucher sans effets psychomimétiquesReference 1176. Plus récemment, trois séries prospectives de cas ont fait état de l'utilisation d'une préparation topique de cannabis (préparée dans de l'huile de tournesol) pour le pyoderma gangrenosumReference 1177. Entre 0,5 et 1,0 mL de deux formulations différentes d'huiles de cannabis topiques ont été utilisées dans les traitements (5 mg/mL THC et 6 mg/mL CBD; et 7 mg/mL THC et 9 mg/mL CBD), appliquées quotidiennement sur la plaie et jusqu' à 3 fois par jour, avec deux à trois applications supplémentaires par jour pour la douleur aiguë. L'application de la préparation topique d'huile de cannabis a été associée à l'apparition d'une analgésie dans les 5 minutes, avec tous les cas démontrant une réduction cliniquement significative de la douleur supérieure à 30 % et un effet d'épargne en opiacés statistiquement significatif.
Une revue récente des cannabinoïdes topiques pour les troubles inflammatoires et la prise en charge de la douleur a conclu que, malgré des données prometteuses provenant des modèles de rongeurs, il n'existe pas d'études rigoureuses confirmant l'innocuité ou l'efficacité chez les humainsReference 1178. Avec les interventions qui mènent à des zones actives de cicatrisation des plaies, l'application topique de produits cannabinoïdes peut augmenter le risque de contamination et d'infection à moins que le produit ne soit rigoureusement testé et approuvé pour une utilisation dermatologique.
Contrairement aux données ci-dessus, il existe aussi quelques rapports de cas d'urticaire de contact après une exposition à la fleur de cannabis, et on a également consigné une sensibilisation extrême au Δ9-THC et au CBN dans un modèle animal de dermatite de contactReference 1179Reference 1180 (aussi consulter la Section 7.3 pour des renseignements additionnels sur l'hypersensibilité ou les allergies au cannabis).
Par conséquent, même s'il est possible que certains cannabinoïdes (p. ex. HU-210, CBD) puissent posséder une valeur thérapeutique dans le traitement de certaines affections cutanées (comme le psoriasis, le prurit, la dermatite et l'acné), il est aussi possible que certains cannabinoïdes (cannabis, THC, CBD) provoquent des réactions cutanées indésirables. Des études beaucoup plus approfondies sont nécessaires sur le sujet.
4.9.8 Troubles du système gastro-intestinal (syndrome du côlon irritable, maladie intestinale inflammatoire, hépatite, pancréatite, syndrome métabolique/obésité)
Des rapports historiques et anecdotiques suggèrent que le cannabis a été utilisé pour traiter divers troubles GI (p. ex. la diarrhée, l'inflammation et la douleur d'origine GI)Reference 1181-Reference 1183.
Le système endocannabinoïde et les troubles gastro-intestinaux
L'expression des récepteurs CB1 et CB2 a été détectée dans le système nerveux entérique du tractus GI (neurones entériques, fibres et terminaisons nerveuses), alors que l'épithélium du côlon, les lignées cellulaires de l'épithélium du côlon et les cellules pariétales de l'estomac chez l'humain ne semblent exprimer que le récepteur CB1Reference 30Reference 31. L'expression du récepteur CB2 semble être régulée de manière positive dans des parties du côlon chez les patients atteints de MIIReference 33. Tandis que l'expression et la localisation des enzymes de synthèse des endocannabinoïdes n'ont pas été bien établiesReference 33, des études chez les animaux indiquent que les enzymes de dégradation des endocannabinoïdes, FAAH et MAGL peuvent être présentes dans le système nerveux entérique et dans d'autres sites du tractus GIReference 33. Par exemple, la FAAH s'exprime dans l'estomac, de même que dans le gros intestin et l'intestin grêle, mais a aussi été localisée dans le corps cellulaire du plexus myentériqueReference 33. L'expression de la MAGL a été détectée dans les couches musculaires et muqueuses du duodénum et de l'iléon, de même que dans le côlon proximal et distal, et dans le corps des cellules nerveuses et des fibres nerveuses du système nerveux entériqueReference 1184. Il semble aussi y avoir une certaine variation régionale dans les taux d'endocannabinoïdes dans l'intestin; le 2-AG semble être plus abondant dans l'iléon que dans le côlon, alors que c'est le contraire pour l'anandamideReference 33. Les récepteurs CB1 et CB2 semblent s'exprimer dans le pancréasReference 32, alors que le récepteur CB1, mais non le récepteur CB2, s'exprime dans le foie dans des conditions normalesReference 34Reference 35.
Les cannabinoïdes semblent posséder de nombreuses fonctions dans le système digestif, notamment l'inhibition de la production d'acide gastrique, la motilité GI, la sécrétion et le transport ionique, ainsi que l'atténuation de la sensation viscérale et de l'inflammation (examiné enReference 33). Des perturbations dans le niveau de diverses composantes du SEC ont été remarquées dans les modèles expérimentaux animaux des troubles GI, de même que dans des études cliniques (examiné enReference 33). Les parties ci-dessous résument les renseignements portant sur les utilisations du cannabis et des cannabinoïdes dans le traitement de divers troubles du système GI.
4.9.8.1 Syndrome du côlon irritable
- Les études précliniques dans des modèles animaux du syndrome du côlon irritable (SCI) suggèrent que certains agonistes synthétiques des récepteurs de cannabinoïdes inhibent les réactions à la douleur induite par la distension colorectale et ralentissent le transit GI.
- Les études cliniques expérimentales avec des volontaires sains ont signalé des effets selon la dose et le sexe sur diverses mesures de la motilité GI.
- Des données limitées provenant d'une petite étude clinique sur le dronabinol pour le traitement de symptômes du SCI suggèrent que celui-ci pourrait augmenter la conformité du côlon et diminuer l'index de la motilité du côlon chez les femmes atteintes du SCI à diarrhée prédominante SCI-D) ou SCI à motif alternatif (alternance constipation/diarrhée) (SCI-A), tandis qu'une autre petite étude clinique avec le dronabinol suggère une absence d'effet au niveau du transit gastrique, de l'intestin grêle ou du côlon.
Le syndrome du côlon irritable (SCI) est le trouble GI fonctionnel le plus couramment observé en médecine cliniqueReference 1185. Il s'agit d'un spectre de troubles caractérisé par la présence de douleur abdominale chronique et/ou d'inconfort et de changements des habitudes intestinalesReference 1185Reference 1186. Les profils de symptômes peuvent être catégorisés en tant que diarrhée prédominante (SCI-D), constipation prédominante (SCI-C) et motif alternatif (alternance constispation/diarrhée) (SCI-A)Reference 1186Reference 1187. Bien que la physiopathologie du SCI demeure imprécise, on pense que le trouble est provoqué par la dérégulation de l'axe cerveau-intestin suite à des facteurs de stress psychologiques ou environnementaux, ou à des facteurs de stress physiques comme l'infection ou l'inflammation et est caractérisé par une modification de la motilité intestinale, de même qu'une hypersensibilité viscéraleReference 1185. Il existe aussi des données récentes qui suggèrent une association entre les modifications génétiques chez les gènes codants de certaines protéines du SEC (p. ex. FAAH et CNR1) et la physiopathologie du SCIReference 1188-Reference 1190.
Données précliniques
Quelques études précliniques ont été effectuées sur des modèles animaux de SCI à ce jour. Deux études ont utilisé la distension colorectale provoquée mécaniquement pour déclencher une réaction de douleur viscérale aiguë chez des rongeurs en tant que modèle d'hypersensibilité viscérale associée au SCI. Une étude chez le rat a démontré que l'injection intrapéritonéale de divers agonistes synthétiques des récepteurs cannabinoïdes inhibait les réactions liées à la douleur suite à la distension colorectale provoquée expérimentalement lorsqu'ils étaient administrés avant le stimulus expérimentalReference 1191. L'administration intraveineuse de différents agonistes synthétiques des récepteurs cannabinoïdes semblait aussi inhiber les réactions globales liées à la douleur suite à la distension colorectale provoquée expérimentalement chez le rat, de même que la souris, lorsqu'ils étaient administrés après le stimulus expérimentalReference 1192. Lors d'une autre étude, on a déclaré que l'administration sous-cutanée d'agonistes sélectifs du récepteur CB1 ou CB2 diminuait le transit rehaussé de l'intestin grêle observé dans un modèle de SCI post-inflammatoire chez la sourisReference 1193.
Données cliniques avec dronabinol
Il n'existe qu'une poignée d'études ayant examiné les effets des cannabinoïdes (dronabinol) dans des modèles expérimentaux du SCI chez l'humain et chez les patients atteints de SCI.
Une étude clinique à groupes parallèles, contrôlée par placebo, randomisée et à double insu examinait les effets du dronabinol sur le transit GI, le volume gastrique, la satiété et les symptômes postprandiaux dans un groupe de volontaires en santéReference 1194. Une dose de 5 mg de dronabinol était associée à un retard important de la vidange gastrique chez les femmes, mais non chez les hommes. Aucune différence importante dans le transit de l'intestin grêle ou du côlon n'a été relevée entre les sujets qui avaient reçu le dronabinol ou le placebo dans un sexe comme dans l'autre. La dose de 5 mg de dronabinol a été utilisée, car une dose de 7,5 mg provoquait des effets secondaires intolérables chez plus de la moitié des sujets. Les effets indésirables associés à la consommation d'une dose de 5 mg de dronabinol comprenaient les étourdissements, l'assèchement de la bouche, un trouble de la concentration mentale et la nausée.
Une étude clinique à groupes parallèles, contrôlée par placebo, randomisée et à double insu subséquente s'est penchée sur les effets du dronabinol sur la fonction sensorielle et motrice du côlon chez des volontaires en santéReference 1195. L'administration d'une dose de 7,5 mg de dronabinol augmentait grandement la conformité du côlon, particulièrement chez les femmes, et diminuait la motilité et la pression phasique pré- et postprandiale du côlon. La compliance du côlon désigne le changement dans la capacité de dilatation du côlon suite à un changement dans la pression appliquée dans le côlon, et est utilisée pour mesurer les propriétés visco-élastiques du côlon, mais aussi en tant qu'indicateur d'activité motrice/contractileReference 1195-Reference 1197. Une baisse de la compliance est généralement associée à une sensation d'urgence des selles et à la diarrhée, alors qu'une hausse de la compliance est généralement associée à la constipationReference 1196Reference 1198. Une augmentation de la compliance du côlon dans ce contexte pourrait indiquer un retour du côlon à une fonction adéquate. Contrairement aux résultats observés par les études précliniques chez les rongeurs, le dronabinol augmentait la cote sensorielle de douleur, mais ne touchait pas la cote sensorielle de gaz, ni les seuils de la première sensation de gaz ou de la douleur pendant les distensions phasiques aléatoires provoquées expérimentalementReference 1195.
Une étude clinique à groupes parallèles, randomisée et à double insu s'est penché sur les effets de doses de plus en plus élevées de dronabinol sur la fonction sensorielle et motrice du côlon chez une population de patients comptant principalement des femmes ayant reçu un diagnostic de SCI (SCI-C, SCI-D ou SCI-A; c.-à-d. alternance entre la diarrhée et la constipation) selon les critères Rome IIIReference 1199. Seule la dose la plus élevée de dronabinol ayant été testée (5 mg) était associée à une augmentation légère, mais statistiquement significative de la compliance du côlon. De plus, l'effet sur la compliance du côlon semblait plus prononcé dans le sous-groupe de SCI-A, comparativement au groupe de SCI-C. Aucune différence importante n'a été observée sur le tonus du côlon jeûne ou prostprandial après l'administration de toute dose de dronabinol. Toutefois, la dose de dronabinol la plus élevée (5 mg) était associée à une diminution statistiquement significative de l'indice de motilité du côlon proximal gauche, avec une tendance vers des indices de diminution de la motilité du côlon. Les effets du traitement étaient statistiquement significatifs sur le plan de l'indice de motilité du côlon proximal chez les patients atteints de SCI-D/A, mais non de SCI-C, et seulement à la dose la plus élevée. On n'a pas rapporté de différences statistiquement significatives entre les groupes de traitement sur les seuils de sensation et les cotes de sensation pour les gaz et la douleur au cours des distensions progressives provoquées expérimentalement. Les effets du génotype et de l'interaction de la dose de dronabinol sur les côtes de sensation des gaz et de la douleur, de même que sur les indices de motilité de jeûne proximal et de jeûne distal ont aussi fait l'objet d'une enquête. Les résultats de ces études pharmacogénétiques préliminaires soulèvent la possibilité que les effets du dronabinol sur la compliance du côlon et la motilité du côlon proximal puissent être influencés par des variations génétiques des gènes FAAH et CNR1, mais plus d'études sont nécessaires pour appuyer cette hypothèse
Une étude clinique à groupes parallèles, contrôlée par placebo, randomisée et à double insu subséquente chez une population composée principalement de patientes atteintes de SCI-D (critères de Rome III) a examiné davantage les interactions entre les gènes et le traitement sur la motilité du côlon chez ce sous-ensemble de patients atteints du SCIReference 1200. Ni la dose de 2,5 mg de dronabinol b.i.d., ni celle de 5 mg b.i.d. n'avait d'effet statistiquement significatif sur le transit gastrique, de l'intestin grêle ou du côlon. Les effets sur le transit du côlon ont aussi fait l'objet d'un examen en tant que fonction de l'interaction génotype par traitement de la dose. Bien que le traitement à l'aide de dronabinol semble faire baisser le transit du côlon chez les sujets porteurs du polymorphisme CNR1 rs806378 CT/TT, ces effets n'étaient pas statistiquement significatifs. On a rapporté que les effets indésirables ne différaient pas beaucoup entre les groupes de traitement.
4.9.8.2 Maladies inflammatoires de l'intestin (maladie de Crohn, colite ulcéreuse)
- Les études précliniques dans les modèles animaux de maladies inflammatoires de l'intestin (MII) suggèrent que certains cannabinoïdes (les agonistes synthétiques des récepteurs CB1 et CB2, le THC, le CBD, le CBG, le CBC ou les extraits de plante entière de cannabis) pourraient limiter l'inflammation intestinale et la sévérité de la maladie à différents degrés.
- Des données provenant d'études par observation suggèrent que les patients consomment du cannabis afin de soulager les symptômes du MII.
- Un nombre très limité d'études cliniques à petite échelle avec des patients atteints du MII et sur lesquels les traitements traditionnels avaient échoué ont signalé l'amélioration de nombreux symptômes associés au MII après la consommation de cannabis fumé.
Les maladies intestinales inflammatoires (MII) comprennent la maladie de Crohn et la colite ulcéreuseReference 1201. La maladie de Crohn se caractérise par une inflammation intramurale inégale qui peut toucher n'importe quelle partie du tractus GIReference 1202. Les symptômes comprennent les douleurs abdominales, la diarrhée et la perte de poids, ainsi que des symptômes systémiques de malaise, d'anorexie et/ou de fièvreReference 1202. La maladie de Crohn peut provoquer une obstruction intestinale en raison de resserrements, de fistules ou d'abcèsReference 1202. La colite ulcéreuse se caractérise par une inflammation mucosale diffuse qui se limite au côlonReference 1202. Les symptômes comprennent couramment la diarrhée sanglante, des douleurs abdominales de type colique, la sensation d'urgence des selles ou le ténesmeReference 1202. Les deux maladies sont associées à un risque accru équivalent de carcinomes du côlonReference 1202.
Le système endocannabinoïde et les maladies inflammatoires de l'intestin
On a relevé des changements du SEC dans le tractus GI de modèles expérimentaux des MII chez les animaux, de même que chez les patients atteints de MIIReference 33Reference 1201. Ces changements comprennent ceux des taux d'endocannabinoïdes, des récepteurs cannabinoïdes et des enzymes de synthèse et de dégradation des endocannabinoïdes.Reference 30Reference 33Reference 1201Reference 1203-Reference 1205.
Données précliniques
Les expériences précliniques chez les modèles animaux des MII suggèrent que les cannabinoïdes et les endocannabinoïdes pourraient limiter l'inflammation intestinale et la gravité de la maladie au moyen de l'activation des récepteurs CB1 et CB2Reference 1206-Reference 1211.
Colite aiguë
Les souris porteuses d'une délétion génétique du récepteur CB1 éprouvaient une réaction inflammatoire du côlon plus intenseReference 1206 après l'administration rectale d'acide dinitrobenzène sulfonique (DNBS), une méthode établie pour provoquer un phénotype aigu de type colite chez la sourisReference 1212. À l'opposé de la souris de type sauvage, un examen histologique du côlon de souris déficientes en récepteur CB1 traitées à l'aide de DNBS a révélé une perturbation de la structure épithéliale avec une nécrose hémorragique importante et une infiltration de neutrophiles dans la muqueuse avec une inflammation aiguë qui s'étendait dans la sous-muqueuse et la couche musculaireReference 1206. Le blocage pharmacologique du récepteur CB1 chez les souris de type sauvage a produit des effets semblables accompagnés d'un épaississement de la paroi intestinale, des infiltrats inflammatoires et une augmentation de la taille des follicules lymphoïdes associés à l'adhérence aux tissus environnantsReference 1206. De plus, contrairement à la souris déficiente en récepteur CB1, la souris de type sauvage a conservé un poids corporel beaucoup plus élevé suite au traitement à l'aide de DNBSReference 1206. Le traitement de la souris de type sauvage à l'aide du puissant agoniste synthétique des récepteurs CB1 et CB2, HU-210, avant et après l'agression de DNBS diminuait grandement la réaction inflammatoire macroscopique du côlonReference 1206. Les souris porteuses d'une délétion génétique de l'enzyme FAAH présentaient aussi une réaction inflammatoire atténuée suite au DNBS, comparativement aux individus sauvagesReference 1206.
Une étude analogue a déterminé que les souris déficientes en récepteur CB1 et CB2 et celles doublement déficientes en récepteur CB1/CB2 présentaient une plus grande étendue d'inflammation du côlon, une perte accrue d'architecture de la crypte, une hyperémie/un œdème accrus et un degré d'infiltration de cellules inflammatoires plus élevé comparativement aux souris de type sauvage après avoir provoqué une colite aiguë à l'aide d'acide trinitrobenzène sulfonique (TNBS)Reference 1210. Toutes les trois souches déficientes présentaient une grave colite transmurale, avec une grave perte d'épithélium, un épaississement de la paroi intestinale et des infiltrats inflammatoires, comparativement aux souris de type sauvage. La délétion génétique de l'un des récepteurs CB ou des deux chez les souris traitées à l'aide de TNBS était aussi associée à des taux beaucoup plus élevés d'ARNm de diverses cytokines pro-inflammatoires par rapport aux souris traitées à l'aide de TNBS de type sauvage.
La colite aiguë provoquée par le TNBS chez les souris était associée à une régulation positive importante des taux d'ARNm du récepteur CB2 dans le côlon proximal et distal des souris traitéesReference 1213. L'administration intra-péritonéale d'agonistes du récepteur CB2 avant et après la colite provoquée par le TNBS était associée à une diminution du score des lésions macroscopiques; celle-ci étant une échelle linéaire qui mesure l'étendue des lésions macroscopiques du côlon et comprend des marqueurs comme la présence ou l'absence d'hyperémie, l'ulcération, l'inflammation, des adhésions, la longueur des lésions et la diarrhée. Par opposé, l'administration d'un antagoniste du récepteur CB2 aggravait la colite provoquée par le TNBS.
Dans un modèle expérimental différent sur la souris atteinte de colite aiguë, l'agoniste sélectif du récepteur CB1, l'arachidonyl-2-chloroéthylamide, et l'agoniste synthétique sélectif du récepteur CB2, le JWH-133, lorsqu'injecté de manière intrapéritonéale avant et après l'agression du côlon, diminuait grandement le gain de poids du côlon, le rétrécissement du côlon, le score de lésions inflammatoires du côlon et la diarrhéeReference 1209.
L'inhibition de l'enzyme de dégradation du 2-AG, MAGL, chez la souris par administration intrapéritonéale d'un inhibiteur du MAGL avant l'induction d'une colite aiguë par le TNBS était associée à une baisse des modifications macroscopiques et histologiques du côlon, ainsi qu'une baisse de l'expression de cytokines pro-inflammatoires dans le côlonReference 1214. L'inhibition du MAGL était aussi associée à une diminution de l'inflammation systémique et centrale dans le foie et le SNC reliée à la colite. L'administration conjointe d'antagonistes sélectifs du récepteur CB1 ou CB2 éliminait complètement l'effet protecteur dans le côlon accordé par l'inhibition du MAGL et inversait en partie les effets protecteurs anti-inflammatoires associés à l'inhibition du MAGL dans le foie.
Colite aiguë et cannabidiol
L'injection intra-péritonéale de CBD (5 à 10 mg/kg) avant la colite aiguë provoquée par le DNBS était associée à une atténuation statistiquement significative de la perte de poids corporel causée par le DNBSReference 1215. Le CBD diminuait aussi le rapport de poids frais / longueur du côlon du tissu inflammatoire du côlon, un indicateur de la gravité et de l'étendue de la réaction inflammatoire. De plus, le CBD (5 à 10 mg/kg) diminuait, de manière statistiquement significative, les lésions macroscopiques associées à l'administration du DNBS (œdème léger, hyperémie et petites adhésions intestinales), ainsi que les lésions microscopiques (érosion de l'épithélium, et infiltration mucosale et sous-mucosale des cellules inflammatoires avec œdème). En dernier lieu, le traitement à l'aide de CBD atténuait de manière statistiquement significative les augmentations relevées de certains marqueurs biologiques associés à l'inflammation et au stress oxydatif, et atténuait aussi les augmentations relevées dans les niveaux d'anandamide et de 2-AG dans le côlon
Une autre étude a rapporté que le traitement préalable intrapéritonéal (10 mg/kg) ou intrarectal (20 mg/kg) à l'aide de CBD, une fois de plus administré avant l'induction de la colite par le TNBS, a entraîné une amélioration statistiquement significative du score de la colite et une baisse de l'activité de la myéloperoxydase (une mesure de l'accumulation de neutrophiles dans le tissu du côlon)Reference 1216. Aucune différence de ce genre n'a été relevée pour le CBD administré par voie orale. Un examen histologique du tissu du côlon a aussi révélé une diminution de la destruction de la muqueuse épithéliale, une diminution de l'épaisseur du côlon et une baisse de l'infiltration d'immunocytes, comparativement aux souris traitées par excipient. Contrairement à l'étude précédenteReference 1215, aucune différence du poids corporel n'a été relevée entre les souris traitées par excipient et celles traitées à l'aide de CBD après l'apparition d'une coliteReference 1216.
Les effets des injections intrapéritonéales de THC, de CBD et d'une combinaison de THC et de CBD sur la colite aiguë provoquée par le TNBS chez le rat ont fait l'objet d'une enquêteReference 1211. Lors d'une expérience, un traitement à l'aide de 10 mg/kg de THC seul, un traitement combiné à l'aide de 5 mg/kg de THC et de 10 mg/kg de CBD, ou une combinaison de 10 mg/kg de THC et 10 mg/kg de CBD, ou de sulfasalazine seule a été associé à une baisse statistiquement significative du score de lésions macroscopiques. L'activité de la myelopéroxydase, une mesure de l'infiltration des granulocytes, était grandement diminuée chez les rats traités à l'aide de CBD et chez les rats traités à l'aide de 10 ou de 20 mg/kg de THC, ou de 5 mg/kg de THC et de 10 mg/kg de CBD. Le traitement à l'aide de 10 mg/kg de CBD, de 10 mg/kg de THC, et de 10 mg/kg de THC et 10 mg/kg CBD, ou de sulfasalazine seule était aussi associé à une baisse des perturbations de la motilité du côlon provenant de la colite provoquée par le TNBS.
Une étude plus récente a étudié les effets de l'extrait de plante entière de cannabis à haute teneur en CBD sur un modèle expérimental d'inflammation de l'intestinReference 1217. Dans le cadre de cette étude, les auteurs ont démontré que cet extrait, lorsqu'administré soit par voie intrapéritonéale (à une dose de 30 mg/kg de CBD) ou par gavage oral (à une dose de 60 mg/kg de CBD) suivant la manifestation d'inflammation intestinale a réduit l'étendue des dommages dans le modèle du DNBS de la colite. De plus, l'extrait, lorsqu'administré à une dose de départ de 1 mg/kg de CBD par voie intrapéritonéale et de 5mg/kg par voie orale, réduisait selon la dose l'hypermotilité intestinale dans le modèle de l'huile de croton de l'hypermotilité intestinale. Toutefois, bien que l'administration de CBD pur, selon toutes les doses analysées, n'ait pas soulagé la colite, elle a toutefois réussi à normaliser l'hypermotilité induite par l'huile de croton lorsqu'administrée par voie intrapéritonéale et par voie orale (à une dose de 5 mg/kg).
La colite aiguë, le cannabigérol et le cannabichromène
Une étude examinant les effets du cannabinoïde non psychotrope, le CBG, sur la maladie intestinale inflammatoire (MII) expérimentale (c.-à-d., la colite) a signalé que le CBD en doses de 1 mg/kg i.p. (préventive) et de 5 mg/kg i.p. (curative) administrée soit avant (préventive) ou après (curative) un cas de colite aiguë induite par le DNBS dans des souris réduisait de manière statistiquement significative les effets endommageant du DNBS sur le rapport entre le poids et la longueur du côlonReference 1218. Au cours d'études de suivi, une dose curative de 30 mg/kg de CBG a été associée à des réductions des signes de lésions au côlon, d'œdème sous-muqueux, de prolifération des cellules, de la perméabilité intestinale, de l'activité de la myéloperoxydase (c.-à-d. l'inflammation intestinale), l'activité de la superoxyde dismutase, l'expression de l'oxyde nitrique synthase inductible (iNOS) et de la COX-2, la production de dérivés réactifs de l'oxygène et les niveaux de l'IL-1β, de l'IL-10 et de l'interféron-γ (IFN-γ) observés dans les côlons enflammés traités au DNBS.
Une autre étude ayant examiné les effets d'un autre cannabinoïde non psychotrope, le CBC, sur la MII expérimentale (c.-à-d. la colite) dans les souris a signalé que l'administration du CBC (en doses de 1 mg/kg, IP) était associée à une réduction importante des effets endommageants de DNBS sur le rapport entre le poids et la longueur du côlon, ainsi qu'une réduction importante de la perméabilité intestinale, de l'activité de la myéloperoxydase, de l'érosion intestinale et de la prolifération des cellulesReference 1219. Des études in vitro ont en outre confirmé les effets anti-inflammatoires du CBCReference 1219.
Colite chronique
L'administration intrapéritonéale de l'agoniste synthétique sélectif du récepteur CB2, JWH-133, a atténué de manière statistiquement significative la perte de poids corporel associée à la colite, l'inflammation, l'infiltration de leucocytes et les lésions des tissus dans un modèle de colite chronique spontanée chez la sourisReference 1220. Cet agoniste sélectif du récepteur CB2 diminuait aussi la prolifération de cellules T, augmentait l'apoptose des cellules T et augmentait le nombre de mastocytes et de cellules muqueusesReference 1220.
Iléite
L'iléite se caractérise par des perturbations de la muqueuse, l'infiltration de lymphocytes dans la sous-muqueuse, une augmentation de l'activité myelopéroxydase et une perméabilité vasculaireReference 1221. L'effet du CBC sur l'hypermotilité provoquée par l'inflammation dans un modèle d'iléite intestinale chez la souris a fait l'objet d'une étudeReference 1221. L'administration de CBC (15 mg/kg IP) après une inflammation intestinale provoquée par l'huile de croton était associée à une diminution de l'expression de l'ARNm des récepteurs CB1 et CB2 dans le jéjunum, mais non dans l'iléonReference 1221. Le CBC n'a pas semblé toucher le transit GI supérieur, la propulsion du côlon ou le transit intestinal global chez les souris intraitées, mais a diminué la motilité intestinale chez les souris traitées à l'aide d'huile de croton aux doses de 10 et de 20 mg/kg IPReference 1221. Le CBC a aussi inhibé les contractions de l'iléon, isolé des souris de contrôle et de celles traitées à l'aide d'huile de croton, provoquées par l'acétylcholine ainsi que par la stimulation du champ électrique in vitro de manière statistiquement significative et liée à la doseReference 1221. L'effet inhibiteur du CBC semblait indépendant des récepteurs cannabinoïdesReference 1221.
Information provenant d'e nquêtes avec le cannabis
On a estimé qu'entre 10 et 12 % des patients atteints d'une MII sont des consommateurs actifs de cannabis et les enquêtes menées auprès de patients ayant une MII révèlent qu'entre 44 et 51 % des patients ont utilisé du cannabis à un moment ou un autre de leur vieReference 180Reference 369Reference 1222-Reference 1224. En outre, entre 10 et 50 % des patients atteints de MII consommeraient du cannabis pour supprimer les symptômes de la maladie (c.-à-d. des symptômes comme les douleurs abdominales, les nausées et la diarrhée)Reference 180Reference 369Reference 1223Reference 1224.
Les conclusions tirées d'une enquête transversale auprès de 291 patients atteints de MII (maladie de Crohn ou colite ulcéreuse) suggéraient que la grande majorité de ces patients avaient déclaré utiliser le cannabis pour soulager leurs douleurs abdominales et pour augmenter leur appétitReference 180. Contrairement aux patients atteints de la maladie de Crohn, une proportion plus élevée de patients atteints de colite ulcéreuse avait déclaré utiliser le cannabis pour soulager les symptômes diarrhéiques. En général, les patients ont déclaré être plus susceptibles d'utiliser le cannabis pour soulager leurs symptômes s'ils avaient des antécédents de chirurgie abdominale, d'utilisation chronique d'analgésiques, d'utilisation de médecine alternative/complémentaire et un score plus faible du SIBDQ (Short Inflammatory Bowel Disease Questionnaire). Les patients atteints de colite ulcéreuse ou de maladie de Crohn ont déclaré utiliser le cannabis pour améliorer leur niveau de stress et de sommeil. La durée moyenne de l'utilisation de cannabis (actuelle ou précédente) était de sept ans. La plupart des consommateurs de cannabis déclaraient en consommer une fois par mois ou moins, mais 16 % d'entre eux ont déclaré consommer du cannabis une ou plusieurs fois par jour. La grande majorité (77 %) des utilisateurs a déclaré fumer le cannabis en tant que joint sans tabac, 18 % des utilisateurs le fumaient avec du tabac, 3 % utilisaient une pipe à eau et 1 % déclaraient une ingestion orale. Environ le tiers des patients dans cette étude ont déclaré d'importants effets secondaires associés à la consommation de cannabis, comme la paranoïa et l'anxiété, de même que des palpitations. D'autres effets secondaires couramment rapportés comprenaient un sentiment de « high », l'assèchement de la bouche, la somnolence, la perte de mémoire, les hallucinations et la dépression.
Une étude rétrospective d'observation auprès de 30 patients atteints de la maladie de Crohn a examiné l'activité de la maladie, l'utilisation de médicaments, le besoin d'intervention chirurgicale et d'hospitalisation avant et après la consommation de cannabisReference 369. La durée moyenne de la maladie était de 11 ans (marge de 1 à 41 ans). Vingt patients souffraient d'inflammation de l'iléon terminal, cinq patients présentaient une inflammation de l'iléon proximal et huit patients étaient atteints de la maladie de Crohn du côlon. L'indication en matière de cannabis était l'absence de réaction au traitement conventionnel chez la plus grande partie des patients et une douleur réfractaire chronique chez la plupart des autres patients. La plupart des patients fumaient le cannabis en tant que joints (0,5 g de cannabis/joint), quelques-uns inhalaient la fumée à travers l'eau, et un patient consommait le cannabis de manière orale. Parmi ceux qui fumaient le cannabis, la plupart des patients fumaient d'un à trois joints par jour. Un patient fumait sept joints par jour. La durée d'utilisation moyenne de cannabis était de deux ans (marge de deux mois à neuf ans). Tous les patients déclaraient que la consommation de cannabis avait un effet positif sur l'activité de leur maladie. Les scores obtenus en matière d'indice de Harvey-Bradshaw (un indice de l'activité de la maladie de Crohn) étaient beaucoup plus faibles après l'utilisation de cannabis, et l'utilisation d'autres médicaments (p. ex. 5-AAS, corticostéroïdes, thiopurine, méthotrexate et antagoniste du TNF) semblait aussi grandement diminuée après avoir utilisé le cannabis. L'étude était limitée par son concept et sa petite taille.
Une analyse de cas basée sur la population provenant de la National Health And Nutrition Examination Survey (NHANES) (2009-2010) menée auprès de patients atteints de la colite ulcéreuse ou de la maladie de Crohn par rapport aux témoins a démontré que les sujets atteints de MII présentaient une incidence plus élevée de consommation de marijuana ou de hachisch (c.-à-d. 67 % p/r à 60 %) ainsi qu'une apparition précoce de la maladie (c.-à-d. 15,7 p/r à 19,6 ans)Reference 1224. En outre, les patients atteints de MII étaient moins susceptibles d'avoir consommé de la marijuana ou du hachisch quotidiennement mais, lorsqu'ils en consommaient, les quantités étaient beaucoup plus importantes (c.-à-d. 65 % des patients atteints de MII utilisaient au moins trois joints par jour p/r à 81 % des patients ne souffrant pas de MII qui utilisaient au plus deux joints par jour). Les patients de sexe masculin et âgés de plus de 40 ans semblaient être enclins à consommer de la marijuana ou du hachisch.
Une étude de cohorte prospective menée chez 292 patients atteints de MII et examinant la consommation de cannabis pour MII a relevé que les patients qui signalent en consommer pour soulager les symptômes associés à la MII (16 %) déclaraient en utiliser pour traiter les douleurs abdominales (90 %), les nausées et le manque d'appétit (73 % chacun) et la diarrhée (42 %)Reference 1223. La plupart (61 %) des patients consommant du cannabis dans cette enquête ont déclaré en fumer. La plupart des patients consommant du cannabis ont également signalé que le cannabis était « très utile » ou « soulageait complètement » les symptômes qu'ils cherchaient à soulager. Parmi les utilisateurs passés, la plupart ont signalé avoir utilisé du cannabis à des fins non médicales. Les consommateurs de cannabis courants étaient plus jeunes que ceux qui n'en consommaient pas, avaient des scores plus faibles du SIBDQ et étaient plus susceptibles de souffrir de douleurs abdominales. Un âge plus jeune, des antécédents de chirurgie, la maladie de Crohn et les douleurs abdominales chroniques étaient des conditions propices à la consommation de cannabis à des fins médicales. Les consommateurs de cannabis actuels étaient aussi plus susceptibles que les utilisateurs passés d'utiliser des narcotiques pour traiter leurs douleurs abdominales. Les limites de l'étude comprennent notamment le biais de mémoire possible des patients, l'absence de mesures objectives de l'activité de la maladie avant et après la consommation de cannabis et les incertitudes liées à la conversion des résultats de l'étude à une population plus large de patients atteints de MII.
Une enquête menée auprès de 313 patients canadiens atteints de MII ayant déclaré consommer ou ne pas consommer de cannabis à des fins médicales a examiné les motifs, les tendances de consommation et les effets bénéfiques et nocifs subjectifs des patients qui utilisaient eux-mêmes du cannabis à des fins médicalesReference 1225. Les résultats obtenus ont suggéré que 18 % des patients ayant participé à l'enquête ont déclaré consommer du cannabis pour traiter des symptômes associés à la MII. La plupart de ces patients ont déclaré utiliser du cannabis pour réduire les symptômes plutôt qu'à des fins prophylactiques. La plupart des patients consommant du cannabis ont déclaré fumer du cannabis (95 %), tandis que 9 % ont signalé en ingérer par voie orale et 5 % par la boisson. Parmi les patients consommant du cannabis, 91 % ont affirmé qu'ils sentaient que le cannabis les aidait avec leur MII et ces patients ont déclaré que le cannabis contribuait à lutter contre les douleurs abdominales (84 %), à améliorer les crampes abdominales (77 %), à améliorer la douleur des articulations (48 %) et à améliorer la diarrhée (29 %). Vingt pour cent des patients consommant du cannabis ont déclaré que la consommation de cannabis leur permettait de diminuer la dose de leurs médicaments classiques contre les MII, 13 % ont affirmé qu'ils étaient en mesure de cesser complètement la prise de leurs médicaments classiques contre les MII et 4 % ont indiqué devoir augmenter la prise de leurs médicaments classiques contre les MII. Cependant, il a été aussi constaté que l'utilisation prolongée de cannabis (pendant plus de six mois consécutifs), mais non l'utilisation intermittente, pour traiter les symptômes de MII était un facteur de prédiction important de la nécessité d'une chirurgie chez les patients atteints de la maladie de Crohn (RC = 5,03, IC = 1,45 à 17,46) et il a également été observé que le RC de l'utilisation prolongée de cannabis était proche de celui de l'usage du tabac (RC = 5,71, IC à 95 % = 1,92 à 16,98). On ignore toutefois si l'usage du cannabis précédait ou suivait la chirurgie et, pour cette raison, aucune association temporelle entre la consommation de cannabis et la nécessité d'une chirurgie n'a pu être établie. Le risque d'hospitalisation dans le cas de MII n'a pas été associé à la consommation de cannabis. La plupart des patients consommant du cannabis ont ressenti des effets secondaires associés à l'usage de cannabis, notamment de l'anxiété, l'augmentation de l'appétit, l'assèchement de la bouche, la somnolence et l'euphorie. L'intensité des effets a été jugée légère. La plupart (71 %) des patients consommant du cannabis ont déclaré ne pas devoir connaître de l'euphorie pour obtenir une amélioration des symptômes, tandis qu'un nombre plus faible de patients (20 %) ont allégué qu'ils devaient être « high » pour ressentir les effets bénéfiques. Les limites de l'étude comprennent notamment un biais de renvoi possible, un échantillonnage non aléatoire, une sous-estimation de la véritable dose de consommation de cannabis et un biais de déclaration des patients.
Données provenant d'études cliniques
Une étude clinique croisée, contrôlée par placebo, randomisée et à double insu portant sur les effets de 5 et de 10 mg de Δ9-THC sur la sensibilité viscérale a rapporté que le Δ9-THC ne modifiait pas la perception rectale normale par rapport à la distension provoquée expérimentalement, ni les seuils sensoriels d'inconfort après la stimulation sigmoïde comparativement au placebo chez les témoins en santé ou les patients atteints de MIIReference 1226. Les auteurs ont toutefois souligné une partialité dans les critères de sélection des patients qui pourrait avoir expliqué le manque d'effet apparent.
Un essai clinique préliminaire d'observation, ouvert et prospectif comportant un seul groupe composé de 13 patients atteints de maladie de Crohn ou de colite ulcéreuse a signalé que le traitement à l'aide de cannabis inhalé au cours d'une période de trois mois améliorait la QV des sujets, entraînait une augmentation statistiquement significative du poids des sujets et améliorait l'indice clinique d'activité de la maladie chez les patients atteints de maladie de CrohnReference 275. Les patients signalaient une amélioration statistiquement significative au niveau de leur perception de leur état de santé général, leur capacité d'effectuer des activités quotidiennes et leur capacité à maintenir une vie sociale. Les patients ont aussi signalé une diminution statistiquement significative de la douleur physique, ainsi qu'une amélioration de la souffrance mentale. Aucun événement indésirable grave n'a été relevé. Les limites de l'étude comprenaient le concept de l'étude, la partialité de sélection des sujets, l'absence de groupe témoin et d'un placebo adéquats, le faible nombre de sujets et l'incapacité d'établir un effet de dose-réponse.
Une étude clinique pilote de huit semaines à répartition aléatoire et à double insu, contrôlée par placebo, menée chez 21 patients atteints de la maladie de Crohn révèle la présence d'effets bénéfiques de la consommation de cannabis par la fumée sur la gravité de la maladieReference 596. Les patients fumaient des joints composés de 0,5 g de fleurs de cannabis séchées contenant 11,5 mg de Δ9-THC (23 % de THC, < 0,5 % de CBD), deux fois par jour, pendant huit semaines, suivies d'une période de sevrage de deux semaines. L'objectif principal de l'étude était l'induction d'une rémission qui était définie comme un indice d'activité de la maladie de Crohn (CDAI) de 150 ou moins après huit semaines de traitement au cannabis. Les objectifs secondaires étaient la diminution du taux de réponse (définie comme une réduction de 100 points du CDAI) d'au moins 0,5 mg/dL des taux de protéine C-réactive ou l'amélioration de la QV d'au moins 50 points mesurée par le formulaire court sur la santé (SF-36). Tous les patients n'avaient jamais consommé le cannabis et n'avaient pas répondu à au moins une forme de traitement médical contre la maladie, notamment la mésalamine, les corticostéroïdes, les thiopurines, le méthotrexate ou les anti-TNF-α. Les patients ont pris de façon concomitante d'autres médicaments pendant la période de l'étude (acide 5-aminosalicylique (5-ASA), corticostéroïdes, analogue de la purine, méthotrexate, opioïdes et anti-TNF-α). Bien que 45 % des patients dans le groupe de l'étude soient parvenus à une rémission complète (score de CDAI ≤ 150) comparativement à 10 % des patients dans le groupe placebo, cette différence n'était pas statistiquement significative. Cependant, le taux de réponse (réduction de CDAI > 100 points) était de 90 % dans le groupe traité au cannabis et différait de manière statistiquement significative de celui du groupe placebo. Pendant la période de sevrage de deux semaines, le CDAI est revenu aux niveaux de référence observés avant l'étude, ce qui laisse supposer que les effets bénéfiques de l'usage de cannabis par la fumée ne se maintiennent pas en l'absence du traitement. Les patients prenant des corticostéroïdes ou des opioïdes et affectés au groupe traité au cannabis étaient capables de cesser l'usage des drogues pendant le traitement au cannabis. Une augmentation statistiquement significative de la QV, mesurée à l'aide de l'instrument de mesure de la QV SF-36, a été associée au traitement par le cannabis, mais pas à celui par le placebo. Une amélioration statistiquement significative de la douleur, de l'appétit et de la satisfaction du patient a été signalée avec le traitement par le cannabis, mais pas par le placebo. Aucun changement significatif des taux de protéine C-réactive, de la fonction hépatique ou rénale ou des paramètres de la numération globulaire (p. ex. taux d'hémoglobine, leucocytémie et hématocrite) entre le groupe recevant le traitement et celui recevant le placebo n'a été observé, bien que les taux de protéine C-réactive chez certaines personnes dans les deux groupes aient semblé diminuer de 0,5 mg/dL. Selon les auteurs de l'étude, l'amélioration signalée de l'activité de la maladie semblait être symptomatique, sans preuve objective apparente de réduction de l'activité inflammatoire. Les principales limites de cette étude sont la taille réduite de l'échantillon et la probabilité élevée de la levée de l'insu lors du traitement. Les auteurs ont signalé l'absence d'effets secondaires significatifs associés au traitement au cannabis. De plus, aucun symptôme de sevrage n'a été signalé pendant la période de sevrage de deux semaines.
Remarque : En ce qui a trait aux sections 4.9.8.3, 4.9.8.4 et 4.9.8.5 ci-dessous, aucune étude clinique sur le rôle du cannabis dans le traitement de ces troubles n'a été réalisée à ce jour.
4.9.8.3 Maladies du foie (hépatite, fibrose, stéatose, lésion de reperfusion de l'ischémie, encéphalopathie hépatique)
- Les études précliniques suggèrent que l'activation des récepteurs CB1 est défavorable pour les maladies du foie (p. ex. favorise la stéatose, la fibrose), tandis que l'activation des récepteurs CB2 semble avoir quelques effets bénéfiques.
- De plus, les études précliniques suggèrent aussi que le CBD, le THVC et les doses très faibles de THC pourraient posséder des effets protecteurs sur les lésions de réperfusion de l'ischémie hépatique et pour l'encéphalopathie hépatique.
De plus en plus de preuves permettent de supposer que le SEC joue un rôle important dans la physiopathologie d'une multitude de maladies touchant le foie, les récepteurs CB1 et CB2 jouant des rôles opposés : l'activation des récepteurs CB1 a principalement des effets néfastes, alors que l'activation des récepteurs CB2 a généralement un effet protecteurReference 35Reference 1227. Les récepteurs CB1 s'expriment à de faibles taux dans tout le foie, les hépatocytes, les cellules stellaires et les cellules de l'endothélium vasculaire hépatique, mais on a détecté une expression du récepteur CB1 plus élevée dans le contexte de maladies comme le carcinome hépatocellulaire et la cirrhose biliaire primaire (examiné enReference 1228) ainsi que dans le cas de la maladie hépatique provoquée par l'alcool, de la stéatose hépatique non alcoolique (SHNA), de la régénération du foie et de la fibrogenèseReference 1227. Les récepteurs CB2 sont indétectables dans le foie normal mais, tout comme les récepteurs CB1, ils sont régulés de façon positive dans des conditions pathologiques; entre autres dans la SHNA, la fibrose du foie, le foie en cours de régénération et le carcinome hépatocellulaire (examiné enReference 1228). Les augmentations des taux des endocannabinoïdes, de l'anandamide et du 2-AG dans le foie semblent varier selon la condition physiopathologique dont il est questionReference 35.
Stéatose et fibrose
Comme cela a déjà été mentionné, les récepteurs CB1 et CB2 semblent jouer des rôles opposés dans le foie; l'activation des récepteurs CB1 entraîne la progression et l'aggravation de la stéatose alcoolique et métabolique, la SHNA, de la fibrogenèse du foie et de la défaillance circulatoire associées à la cirrhose; la stimulation des récepteurs CB2, en général, semble conférer des effets bénéfiques en matière de stéatose hépatique alcoolique, d'inflammation hépatique, des lésions du foie, de régénération du foie et de fibrose (examiné enReference 35Reference 1227, consulter aussiReference 370-Reference 372Reference 1229). À l'opposé, l'antagonisme du récepteur CB1 semble atténuer la fibrose hépatique dans les modèles animaux en interférant avec la production de plusieurs médiateurs profibrotiques, pro-inflammatoires ainsi qu'anti-inflammatoires sécrétés dans le foie au cours de lésions hépatiques chroniques et du processus de guérisonReference 370Reference 1230.
Des études in vitro indiquent que le CBD peut aussi jouer un rôle protecteur en atténuant la fibrose du foie provoquée par des lésions hépatiques aiguës ou par l'exposition chronique à l'alcoolReference 1231. Le CBD a déclenché, proportionnellement à la dose, l'apoptose de cellules stellaires hépatiques cultivées activées ayant été isolées du foie de rats exposés de façon chronique à une alimentation riche en éthanolReference 1231. On juge que l'activation des cellules stellaires hépatiques en reponse à des lésions hépatiques constitue un événement cellulaire clé qui sous-tend la fibrogenèse hépatiqueReference 1231. De plus, le CBD a favorisé, proportionnellement à la dose, l'apoptose sélective des cellules stellaires hépatiques activées, mais non les cellules stellaires hépatiques témoins ni les hépatocytes primaires, en déclenchant un stress cellulaire associé au réticulum endoplasmique menant à l'apoptose; cet effet s'est avéré indépendant de l'activation des récepteurs CBReference 1231.
Lésion de reperfusion de l'ischémie et encéphalopathie hépatique
La lésion de reperfusion de l'ischémie est la principale cause de dysfonction primaire du greffon (c.-à-d. survenant dans 10 à 30 % des greffes) et de dysfonction primaire de l'allogreffe du foie (c.-à-d. survenant dans 5 % des greffes)Reference 1232. Les études précliniques indiquent un rôle protecteur pour le CBD en matière d'ischémie hépatique/lésion de reperfusion et d'encéphalopathie hépatique chez la souris et le ratReference 1233-Reference 1235.
Le traitement préalable de la souris avec 3 ou 10 mg/kg de poids corporel de CBD (IP) 2 h avant l'induction d'une reperfusion de l'ischémie dans le foie a atténué les élévations sériques de transaminase proportionnellement à la dose à 2 et 6 h suivant la reperfusion, comparativement au témoinReference 1233. Le CBD administré immédiatement après l'induction de l'ischémie ou 90 minutes après la reperfusion a atténué tout de même les lésions hépatiques mesurées six heures après la reperfusion, mais à un degré moindre que lorsqu'il était administré avant l'induction de lésion de reperfusion de l'ischémie. Le traitement préalable par le CBD a aussi grandement diminué les signes de nécrose de coagulation observés 24 heures après la reperfusion de l'ischémie, a grandement atténué l'apoptose des cellules hépatiques, a grandement diminué l'expression de chimiokines et de cytokines pro-inflammatoires, a atténué l'infiltration de neutrophiles dans le site de la lésion et a diminué l'expression des marqueurs de lésions cellulaires et des tissus.
Des résultats bénéfiques semblables ont été signalés dans un modèle de lésion de reperfusion de l'ischémie chez le rat lors d'une étude différente, où le CBD (5 mg/kg intraveineux (IV)) a été administré après la lésion de reperfusion de l'ischémieReference 1234. Le traitement de CBD a entraîné d'importantes diminutions des taux sériques de transaminase, la peroxydation des lipides hépatiques et l'atténuation de divers marqueurs de lésions cellulaires ou des tissus associés à la reperfusion de l'ischémie.
L'administration de Δ8-THCV (3 ou 10 mg/kg, IP) deux heures avant l'induction de la lésion de reperfusion de l'ischémie hépatique a atténué, de façon liée à la dose, les élévations sériques de transaminase deux et six heures après la reperfusion, comparativement au témoinReference 1236. L'administration du Δ8-THCV après l'ischémie a atténué, quoique dans une moindre mesure, la lésion hépatique mesurée six heures après la reperfusion. Le traitement préalable par le Δ8-THCV a diminué aussi grandement l'étendue de la nécrose de coagulation dans le foie, atténué l'infiltration de neutrophiles, baissait l'expression de chimiokines et de cytokines hépatiques pro-inflammatoires, réduit les taux hépatiques des marqueurs de stress oxydatif et diminué le degré de mort cellulaire des hépatocytes après la lésion de reperfusion de l'ischémie.
L'administration intrapéritonéale de CBD (5 mg/kg, IP) a amélioré les fonctions neurologiques, locomotrices et cognitives dans un modèle d'encéphalopathie hépatique fulminante chez la sourisReference 1235. Le CBD a atténué aussi le degré d'astrogliose, sans toucher toutefois l'étendue et la gravité des lésions nécrotiques dans le foie. Le CBD a rétabli l'ensemble des taux de 5-HT dans le cerveau, de même que les taux des marqueurs de la fonction hépatique (ammoniac, bilirubine, aspartate aminotransférase [ASAT], alanine aminotransférase [ALAT]) chez les souris touchées.
Enfin, contrairement à une dose élevée de THC (obtenue avec le cannabis fumé ou vaporisé), une dose très faible de THC (0,002 mg/kg) administrée deux heures avant l'induction de la lésion de reperfusion de l'ischémie hépatique chez la souris a été associée à une réduction significative de la lésion hépatique ainsi qu'à une atténuation importante des élévations des transminases hépatiques sériques (ALT, AST), du stress oxydatif hépatique et des réactions pro-inflammatoires aiguës (p. ex. élévation des niveaux de TNF-α, IL-1 α, IL-10)Reference 1232.
4.9.8.4 Syndrome métabolique, obésité, diabète
- Les études précliniques suggèrent que l'activation aiguë des récepteurs CB1 cause une augmentation de la synthèse et de l'entreposage des gras tandis que l'activation chronique des récepteurs CB1 (ou l'antagonisme des récepteurs CB1) cause la perte de poids et l'amélioration d'une gamme d'indicateurs métaboliques.
- Les études par observation suggèrent une association entre la consommation chronique de cannabis et l'amélioration du profil métabolique, tandis que les données précliniques et les preuves cliniques très limitées suggèrent un effet bénéfique potentiel du THCV sur le contrôle glycémique (chez les patients atteints du diabète de type II).
Le système endocannabinoïde et le métabolisme de l'énergie
De plus en plus de données probantes suggèrent que le SEC joue un rôle important dans la régulation de l'équilibre énergétique et du métabolisme, étant donné qu'il exerce un contrôle régulateur sur pratiquement chaque aspect lié à la recherche, à l'apport, au métabolisme et au stockage de caloriesReference 1237Reference 1238. En effet, le SEC s'exprime et fonctionne dans diverses structures neuronales impliquées dans la régulation de l'équilibre énergétique et du métabolisme, comme l'hypothalamus (qui module l'équilibre énergétique et le métabolisme périphérique), les structures corticolimbiques (qui modulent les aspects hédoniques de la prise d'aliments) et le tronc cérébral (qui coordonne la communication centrale-périphérique)Reference 1237Reference 1238. Le tonus endocannabinoïde semble être modulé par des hormones et des peptides, notamment la leptine, l'insuline, la ghréline et les corticostéroïdesReference 19. Les endocannabinoïdes, quant à eux, semblent moduler la libération de neurotransmetteurs et de neuropeptides comme les opioïdes, la sérotonine et le GABA, qui jouent un rôle dans la régulation de l'appétit, principalement par l'entremise de mécanismes centrauxReference 1239. Le dérèglement du SEC est associé au développement d'un syndrome métabolique et d'obésité ou, à l'inverse, d'anorexie, mais il peut aussi augmenter le risque de développer une athérosclérose et le diabète de type 2Reference 12Reference 19Reference 1238Reference 1240.
Les études précliniques effectuées dans des modèles d'obésité chez des animaux et les études cliniques effectuées chez des humains obèses signalent une augmentation du tonus endocannabinoïde dans le tissu adipeux, le foie, le pancréas et l'hypothalamus par rapport aux témoinsReference 1241. En outre, les études ont démontré que les niveaux plasmatiques de l'anandamide et du 2-AG jouent des rôles différents dans la régulation du comportement alimentaire; l'anandamide agit pour démarrer l'apport en calories, tandis que le 2-AG semble être responsable du maintien de l'apport en nutriments au-delà des besoins physiologiquesReference 1237.
Comme cela a déjà été mentionné, la régulation de l'équilibre énergétique par le SEC semble se manifester au niveau central (dans le SNC, particulièrement dans l'hypothalamus) et périphérique (dans de nombreux organes comme le tissu adipeux blanc, les muscles de l'appareil musculosquelettique, le pancréas, le foie et l'intestin grêle)Reference 12Reference 19Reference 1237Reference 1240Reference 1242. En général, l'hyperactivité du SEC (p. ex. l'activation des récepteurs CB1) est associée à une augmentation de la consommation d'éléments nutritifs (c.-à-d. motivation accrue à l'égard d'aliments appétissants, augmentation des propriétés hédoniques des aliments appétissants, préférence accrue pour les graisses et augmentation de la consommation de celles-ci, réponse neurale accrue au goût sucré, sensibilité accrue aux odeurs, comportement accru de recherche de nourriture), à une hausse des réserves d'énergie (c.-à-d. augmentation de l'adipogenèse, diminution de l'oxydation d'acide gras, augmentation du captage du glucose, augmentation de la sécrétion d'insuline, augmentation de la lipogenèse hépatique, diminution de la clairance de l'insuline hépatique, diminution de la signalisation provoquée par l'insuline hépatique), à une diminution des dépenses en énergie (c.-à-d. diminution de la lipolyse du tissu adipeux, diminution de la biogenèse mitochondriale) et à une diminution de la thermogenèse (au niveau du tissu adipeux brun)Reference 19Reference 1237Reference 1238. L'inhibition centrale et périphérique de l'activité des récepteurs CB1 et, de manière plus générale, du SEC, est bénéfique pour le traitement de l'obésité et des troubles métaboliquesReference 1237.
Données précliniques
Le THC et le rôle du récepteur CB1
Lors d'études précliniques in vitro, le THC inhibait de manière statistiquement significative la lipolyse de base et la lipolyse déclenchée par la catécholamine dans une lignée cellulaire adipocyte différenciée chez la souris de manière liée à la concentration, et a provoqué une accumulation de gouttelettes lipidiques liée à la dose dans ces cellules tandis que le blocage de l'activation des récepteurs CB1 est associé à l'effet opposéReference 25Reference 1238Reference 1243-Reference 1249.
Chez la souris, l'activation du récepteur CB1 a entraîné l'augmentation de la synthèse d'acides gras de novo dans le foie et a augmenté la formation et les réserves de triglycérides dans le tissu adipeuxReference 12Reference 1250-Reference 1252. Chez le rat, la stimulation centrale du récepteur CB1 était associée au développement d'une résistance du tissu hépatique et adipeux à l'insulineReference 1241. Les souris dépourvues d'une expression génique globale du récepteur CB1, étaient hypophages et étaient plus maigres que les souris de type sauvage peu importe l'alimentation, présentaient des concentrations plasmatiques d'insuline moins élevées, n'ont pas développé de résistance à l'insuline ou d'obésité provoquée par l'alimentation et présentaient une sensibilité accrue à la leptineReference 651Reference 1249Reference 1250. Chez la souris, la délétion ciblée du récepteur CB1 dans les neurones projecteurs du cerveau antérieur de l'hypothalamus, et dans le noyau du tractus solitaire et la délétion partielle dans les neurones sympathiques était associée à un phénotype maigre et à une résistance à l'obésité provoquée par l'alimentation, ainsi qu'à des augmentations dans les concentrations plasmatiques de leptine, d'insuline, de glucose, d'acides gras libres et de triglycérides; ces effets provenaient d'une augmentation de l'oxydation et de la thermogenèse des lipides en raison d'un tonus sympathique accru et d'une baisse en absorption d'énergieReference 1253. De manière semblable, la délétion partielle ciblée du CNR1 dans l'hypothalamus de la souris adulte a entraîné une baisse importante du gain de poids corporel déclenchée par une augmentation des dépenses d'énergie plutôt qu'une baisse de la consommation d'alimentsReference 1252.
L'activation des récepteurs CB1 dans les hépatocytes favorise l'accumulation de lipides et cause une stéatose hépatiqueReference 1250. La délétion ciblée du CNR1 dans le foie de la souris a été associée au développement d'une obésité provoquée par l'alimentation, mais aussi à la rétention de la sensibilité au glucose, à l'insuline et à la leptine, ainsi qu'à des indices des lipides, alors que la réexpression hépatique ciblée du CNR1 chez la souris déficiente en CNR1 a été associée à l'intolérance au glucose et à la résistance à l'insuline en réaction à une alimentation riche en matières grasses, en provoquant toutefois le maintien d'un poids corporel adéquatReference 1254Reference 1255.
Les études faites sur les antagonistes/agonistes inverses du récépteur CB1 suggèrent fortement que l'antagonisme/agonisme inverse du récepteur CB1 est associé à un apport calorique plus faible, à une perte de poids, à une amélioration ou à un renversement de la stéatose hépatique et au rétablissement de la sensibilité à l'insuline et au glucose, de même que des indices des lipides normaux dans divers modèles animaux d'obésité provoquée par l'alimentationReference 651Reference 1256-Reference 1262. Les études cliniques effectuées avec l'antagoniste du CB1, le rimonabant, ont grandement appuyé les données obtenues d'études animalesReference 1263-Reference 1269. Les taux d'endocannabinoïdes dans les muscles et l'expression du récepteur CB1 dans les muscles semblent aussi avoir été modifiés par la consommation d'aliments riches en gras et dans le cas de l'obésitéReference 1238Reference 1270. En outre, l'activation du SEC inhibe les voies oxydatives et la biogenèse mitochondrialeReference 1238Reference 1271.
Une étude sur les animaux qui a examiné les effets de l'administration chronique du THC sur la prise de masse corporelle et le microbiote intestinal chez la souris a signalé que le traitement chronique quotidien de la souris atteinte d'une obésité provoquée par l'alimentation ou de la souris maigre à l'aide du THC (dose = 2 mg/kg pendant trois semaines et 4 mg/kg pendant une semaine supplémentaire) a été associé à une diminution du poids et de la masse grasse, ainsi qu'à une réduction de l'apport en énergie chez la souris atteinte d'une obésité provoquée par l'alimentation, mais pas chez la souris maigreReference 1272. En outre, les changements de la microflore intestinale normalement observés chez la souris atteinte d'une obésité provoquée par l'alimentation ont été empêchés par l'administration du THC. Le changement du poids corporel, de la masse grasse et de l'apport quotidien en énergie a semblé être proportionnel à la dose, la dose de 4 mg/kg étant bien plus efficace que la dose de 2 mg/kg. La souris atteinte d'une obésité provoquée par l'alimentation n'a pas présenté d'effet du THC au fil du temps sur l'activité de locomotion ou le transit intestinal, quelles que soient les doses administrées de THC. Chez la souris atteinte d'une obésité provoquée par l'alimentation, l'alimentation riche en matières grasses a entraîné une augmentation du ratio firmicutes/bacteroïdètes qui a été empêchée par l'administration du THC. De plus, le THC a augmenté l'abondance d'Akkermansia muciniphila spp. intervenant dans le contrôle du stockage des graisses et du métabolisme des tissus adipeux menant à une perte de poids.
Ensemble, les conclusions ci-dessus suggèrent un rôle important pour le récepteur CB1, tant de manière centrale que périphérique, dans la régulation de l'équilibre énergétique; la stimulation du récepteur CB1 favorise les réserves d'énergie et la lipogénèse, alors que l'antagonisme du récepteur CB1 ou l'agonisme chronique provoque l'effet contraire. Conformément à certaines de ces constatations, l'administration aiguë du cannabis et de cannabinoïdes sur ordonnance (dronabinol, nabilone) est connue pour accroître l'appétit et le poids corporel et elle a été utilisée pour traiter l'anorexie/cachexie liées au VIH/SIDA et possiblement aussi la cachexie liée au cancer (voir les Sections 4.4.1 et 4.4.2, respectivement).
Études par observation
Contrairement aux effets de l'agonimse aigu des récepteurs CB1 (p. ex. exposition aiguë au THC), les études examinant les effets de l'usage chronique du cannabis sur le poids corporel et l'état métabolique dans les populations non cliniques ont signalé les effets opposés.
Une étude transversale de cas-témoins chez 30 fumeurs de cannabis et 30 sujets témoins visant à vérifier s'il existe une association entre le cannabis fumé et la zone graisseuse abdominale, la stéatose hépatique, l'insulinorésistance, la fonction réduite des cellules bêta et la dyslipidémie a indiqué que la consommation chronique du cannabis fumé était associée à une zone graisseuse abdominale totale statistiquement significative plus petite ainsi qu'à une zone lipidique abdominale sous-cutanée plus petite, bien qu'aucune différence n'ait été constatée en ce qui concerne la zone lipidique viscérale abdominaleReference 1273. Cependant, les fumeurs chroniques de cannabis ont affiché une augmentation relative statistiquement significative du pourcentage de graisse viscérale comparativement aux témoins. En outre, la consommation chronique du cannabis fumé n'a pas été associée à une stéatose hépatique, à une insensibilité à l'insuline, à une déficience de la fonction des cellules pancréatiques bêta ou à une intolérance au glucose. La durée médiane auto-déclarée de consommation de cannabis était de 12 ans (marge de 2 à 38 ans) et le nombre médian de joints fumés par jour était de 9,5 (marge de 3 à 30). Le pourcentage de graisse viscérale n'était pas lié à l'âge, à la fréquence ou à la durée de l'usage de cannabis. Le niveau de lipides dans le foie n'était pas non plus différente entre le groupe consommant du cannabis et le groupe témoin et elle n'était pas liée à l'âge, à la fréquence ou à la durée de consommation de cannabis. Les taux à jeun de glucose, d'insuline, de cholestérol total, de cholestérol à LDL, de triglycérides ou d'acides gras libres n'ont pas varié entre les témoins et les utilisateurs de cannabis.
D'autres études signalent que la prévalence d'obésité serait significativement plus faible chez les consommateurs de cannabis que chez ceux qui n'en consomment pas et la proportion de personnes obèses a semblé aussi diminuer avec la fréquence de consommation de cannabis, selon l'analyse transversale de deux études épidémiologiques américainesReference 1274. Dans une étude, les chercheurs ont examiné les données provenant de la NESARC et de la National Comorbidity Survey-R eplication (NCS-R), deux enquêtes directes portant sur des adultes âgés de 18 ans ou plus provenant de la population civile hors établissement institutionnel aux États-Unis. La NESARC compte 43 093 répondants (taux de réponse de 81 %), tandis que la NCS-R est une enquête indépendante qui compte 9 282 répondants (taux de réponse de 73 %). La prévalence corrigée de l'obésité était de 22 % et de 25 % chez les participants qui ont signalé ne pas avoir consommé du cannabis au cours des 12 derniers mois dans laNESARC et NCS-R, respectivementReference 1275. Cependant, la prévalence corrigée de l'obésité était de 14 % et de 17 % chez les participants signalant avoir consommé du cannabis trois jours par semaine ou plus dans la NESARC et la NCS-R, respectivementReference 1275. Après la correction pour tenir compte du sexe et de l'âge, ainsi que de la consommation d'autres drogues, la consommation de cannabis a été associée à des différences d'IMC dans les deux échantillons.
Les données provenant de la NHANES III (1988 à 1994), étude transversale menée chez 10 896 adultes, révèlent que les consommateurs actuels de marijuana avaient une prévalence de diabète sucré corrigée en fonction de l'âge faible comparativement aux adultes ne consommant pas de marijuana (RC = 0,42, IC à 95 % = 0,33 à 0,55)Reference 1276. En outre, la prévalence de protéine C-réactive élevée était significativement plus élevée chez les personnes ne consommant pas de marijuana (18,9 %) que chez les consommateurs passés (13 %), les consommateurs faibles actuels (16 %) ou les grands consommateurs (9 %) de marijuana. Les probabilités plus faibles de diabète sucré parmi les consommateurs de marijuana ont été statistiquement significatives (RC = 0,36, IC à 95 % = 0,24 à 0,55). Une méta-analyse portant sur huit échantillons de réplication provenant d'études épidémiologiques américaines de grande envergure, la NHANES (2005 à 2012) et la National Survey on Drug Use and Health (NSDUH, 2005 à 2012), a appuyé ces constatations selon lesquelles la consommation récemment active de cannabis fumé et le diabète sucré sont inversement liés, avec un rapport des cotes de 0,7 (IC à 95 % = 0,6 à 0,8)Reference 1277.
Une autre étude menée chez 4 657 hommes et femmes adultes de la NHANES (2005 à 2010) révèle que la consommation courante de marijuana est, de façon statistiquement significative, associée à une plus petite circonférence de la taille, ainsi qu'à des taux à jeun d'insuline plus faibles de 16 % et à une résistance à l'insuline plus faible de 17 % (homeostatic model assessment of insulin resistance, HOMA-IR)Reference 1278.
Une autre étude visant à déterminer la relation entre l'usage de cannabis, l'obésité et la résistance à l'insuline, d'après les données issues de 786 Inuits adultes de la Nunavik Inuit Health Survey (2004), signale que la consommation de cannabis était très répandue dans la population de l'étude (57 %) et qu'elle était associée, sur le plan statistique, à un IMC plus faible, à un pourcentage de la masse grasse plus faible, à une insuline à jeun plus faible et à un score de la résistance à l'insuline plus faible (HOMA-IR)Reference 1279. Dans une analyse à plusieurs variables, la consommation de cannabis au cours de l'année précédente a été associée à une probabilité plus faible d'obésité de 0,56 (IC à 95 % = 0,37 à 0,84).
Un examen de la consommation de cannabis et du risque cardiométabolique a relevé un IMC plus faible et une diminution de l'insuline à jeun, du glucose, de la résistance à l'insuline et de la prévalence de diabète parmi les consommateurs actuels de cannabisReference 1280.
Dans leur ensemble, les études susmentionnées laissent supposer l'existence d'une association entre la consommation chronique de cannabis et une amélioration du profil métabolique (c.-à-d. IMC plus faible, insuline à jeun plus faible, score plus faible de la résistance à l'insuline, probabilité plus faible d'obésité, prévalence plus faible de diabète sucré).
Rôle du récepteur CB2
Le récepteur CB2 semble aussi jouer un rôle important dans l'équilibre énergétiqueReference 1281. Les études précliniques faites chez la souris indiquent que le récepteur CB2 s'exprime dans le tissu adipeux de l'épididyme chez les souris maigres et les niveaux de ce récepteur semblent augmenter dans les fractions cellulaires non-parenchymateuses du tissu adipeux et du foie chez les souris génétiquement obèses ou les souris de type sauvage nourries à l'aide d'une alimentation riche en matières grassesReference 1281. De plus, l'administration systémique d'un agoniste sélectif du récepteur CB2 aux souris maigres ou obèses, ou l'exposition de coussins adipeux de culture au même agoniste était associée à une régulation positive d'un sous-ensemble de gènes liés à l'inflammation dans le tissu adipeux, mais non dans le foieReference 1281. À l'inverse, l'administration d'un antagoniste sélectif du CB2 a diminué l'inflammation dans le tissu adipeux, ainsi que dans le foie des animaux obèses. Lorsqu'elles étaient soumises à une alimentation riche en matières grasses, les souris à qui le récepteur CB2 manquait, ont démontré une évolution du poids corporel plus lente; et elles étaient aussi plus sensibles à l'insuline que les souris de type sauvage. Les souris déficientes en CB2 recevant une alimentation riche en matières grasses ont présenté une stéatose hépatique minime comparativement aux souris de type sauvage. Les souris déficientes en expression du récepteur CB2 ont présenté aussi une consommation accrue d'aliments et une augmentation du poids corporel comparativement aux souris de type sauvageReference 1282. Les souris déficientes en récepteur CB2 n'ont manifesté aucune résistance à l'insuline et ont présenté une absorption du glucose rehaussée stimulée par l'insuline dans les muscles squelettiques.
Une autre étude qui a examiné le rôle du récepteur CB2 dans l'obésité révèle que les souris à qui le récepteur CB2 manquait ont présenté une obésité dépendante de l'âge associée à une hypertrophie de la graisse viscérale, une polarisation des cellules immunitaires vers des sous-populations pro-inflammatoires dans la graisse et le foie, et une hypertension ainsi qu'une mortalité accrue, malgré une glycémie normaleReference 1283. Ces souris ont aussi développé une inflammation plus forte des pattes. Ces effets n'étaient pas issus d'une hyperphagie ou d'un manque d'activité physique. À l'inverse, l'agonisme du récepteur CB2 chez les souris de type sauvage nourris à l'aide d'une alimentation riche en matières grasses a empêché l'hypertension provoquée par l'alimentation et a réduit également les réactions immunitaires pro-inflammatoires provoquées par l'alimentation, mais il n'a pas diminué la prise de poids. Dans leur ensemble, ces résultats confirment le rôle important et complexe du récepteur CB2 dans l'équilibre énergétique et l'obésité, et des études supplémentaires sont nécessaires pour mieux comprendre son rôle.
Autres cannabinoïdes
Le Δ9-THCV pur administré IP (3 mg/kg, 10 mg/kg ou 30 mg/kg) chez la souris inhibait l'alimentation et diminuait grandement le gain de poids corporel, mais cet effet semblait bloqué avec l'utilisation d'un extrait végétal contenant du Δ9-THCV ainsi que du Δ9-THCReference 111. L'inclusion de CBD dans l'extrait végétal afin d'atténuer les effets hyperphagiques proposés du THC dans le cadre de cette étude a entraîné une tendance vers une baisse de la consommation d'aliments chez les souris traitées, mais l'effet n'a pas atteint une importance statistique.
Dans une autre étude, l'administration chronique de 5 mg/kg et de 12,5 mg/kg de THCV chez la souris atteinte d'obésité provoquée par l'alimentation a été associée à une réduction statistiquement significative de la masse grasse du corps, mais pas du poids corporel totalReference 1284. Le THCV aux doses maximales d'essai (5 et 12,5 mg/kg) a aussi eu tendance à augmenter la dépense énergétique. De plus, le THCV a amélioré, de façon liée à la dose, la glycémie à jeun et la tolérance au glucose après une provocation et à une amélioration de la sensibilité à l'insuline (c.-à-d. l'insuline plasmatique à jeun et la réaction à l'insuline). L'administration du THCV a aussi été associée à une réduction des taux de triglycérides dans le foie.
Les rats maigres ou obèses à qui l'on a injecté un extrait de cannabis (un jour sur deux pendant 28 jours) contenant un ratio THC : CBN : CBD de 1 : 1,2 : 0,4 (5 mg/kg de Δ9-THC) présentaient une diminution importante en poids corporel pendant la période d'étude, mais le traitement à l'aide d'extrait de cannabis n'était associé à aucun changement des taux d'insuline ou de glucoseReference 1285.
Une étude aléatoire, à double insu, contrôlée par placebo, pilote et à groupes parallèles a examiné l'efficacité et l'innocuité du CBD, du THCV et du traitement combiné sur les paramètres glycémiques et lipidiques chez des patients atteints de diabète de type 2Reference 1286. Dans le cadre de cette étude clinique, 62 patients ont été attribués de façon aléatoire dans l'un de cinq volets de traitement : CBD (100 mg b.i.d.), THCV (5 mg b.i.d.), rapport 1 : 1 de CBD et de THCV (5 mg : 5 mg b.i.d.), rapport 20 : 1 de CBD et de THCV (100 mg : 5 mg b.i.d) ou un placebo apparié pour une période de 13 semaines. Comparativement au placebo, le THCV a considérablement réduit la glycémie à jeun et a amélioré la fonction des cellules β du pancréas, ainsi que les niveaux de l'adiponectine et de l'apolipoprotéine A, tandis que les niveaux de lipoprotéines de haute densité (HDL) dans le plasma sanguin n'ont pas été affectés. Comparativement aux valeurs de base, le CBD a réduit les niveaux de résistine et a augmenté les niveaux de peptide insulinotropique glucose-dépendant bien qu'aucun des traitements combinés n'ait eu d'effet sur le résultat final. De plus, le CBD et le THCV semblaient être bien tolérés. La majorité des patients ont éprouvé des événements indésirables de sévérité faible à moyenne, mais l'incidence des événements indésirables était semblable entre tous les groupes de traitement. La réduction de l'appétit était l'événement indésirable le plus communément signalé dans la majorité des groupes à l'exception du groupe du rapport 20 : 1 de CBD : THCV. Les auteurs suggèrent que le THCV pourrait représenter une nouvelle cible thérapeutique pour le contrôle de la glycémie chez les patients atteints de diabète de type II.
4.9.8.5 Maladies du pancréas (diabète, pancréatite)
- Les études précliniques dans les modèles animaux expérimentaux dscertains cannabinoïdes dans le traitement de la pancréatite aiguë ou chronique sont limitées et contradictoires.
- Les données limitées provenant d'études de cas suggèrent une association entre les épisodes de consommation aiguë de grandes quantités de cannabis ont été associés à la pancréatite aiguë.
- Des études par observation limitées suggèrent une association entre la consommation chronique de cannabis et l'incidence plus faible du diabète sucré.
- Une étude clinique à petite échelle a signalé que le THC administré oralement ne soulageait pas la douleur abdominale associée à la pancréatite chronique.
Fonction du système endocannabinoïde dans le pancréas
Bien qu'il semble y avoir une absence générale de consensus ainsi que des renseignements insuffisants par rapport à l'expression, la distribution et la fonction exacte des diverses composantes du SEC dans le pancréas entre les diverses espèces, le pancréas semble posséder quelques éléments individuels du SEC, et dans certains cas, un grand nombre d'entre euxReference 1239Reference 1287Reference 1288.
Deux études réalisées à l'aide de cellules des îlots pancréatiques de source humaine primaire suggèrent que les récepteurs CB1 et CB2 s'expriment dans ces cellules, et que la stimulation du récepteur CB1 est associée à la sécrétion d'insuline et de glucagon, alors que la stimulation du récepteur CB2 est associée à la hausse ou à la baisse de la sécrétion d'insulineReference 1239Reference 1287Reference 1289. Plus récemment, l'endocannabinoïde 2-AG a été impliqué dans la régulation de la sécrétion d'insuline et de glucagon dans le pancréas humainReference 1288.
L'administration intramusculaire de la résine de cannabis (contenant 6,3 % de Δ9-THC, 3,2 % de CBD et 1,9 % de CBN) en doses croissantes (Δ9-THC à 2,5, 5 et 10 mg/kg) chez le chien était associée à une augmentation croissante des concentrations plasmatiques du glucose, qui ont atteint des valeurs maximales 90 minutes suivant l'administration, puis sont revenues aux niveaux de référence 180 minutes suivant l'administrationReference 1290. L'injection d'anandamide ou d'un agoniste sélectif du récepteur CB1 chez le rat était associée à une intolérance aiguë au glucose, alors que l'administration d'un agoniste inverse du récepteur CB1 atténuait cet effetReference 1291. Chez l'humain, l'injection intraveineuse de 6 mg de Δ9-THC à des volontaires mâles, non obèses, en santé était associée à une défaillance aiguë de la tolérance au glucose après un test de provocation au glucose, sans modification des concentrations plasmatiques d'insulineReference 1292.
Données de l'enquête
Une étude transversale comptant 10 896 adultes âgés de 20 à 59 ans qui participaient au NHANES III, un échantillon représentatif de la population des É.-U. à l'échelle nationale, a déterminé que l'utilisation du cannabis était associée de manière indépendante à une baisse de la prévalence du diabète sucré et que les consommateurs de cannabis étaient moins susceptibles de contracter le diabète sucré que les non-consommateursReference 1276. La prévalence la plus basse de diabète sucré a été observée chez les consommateurs actuels occasionnels, mais les grands consommateurs actuels ainsi que les anciens consommateurs présentaient aussi une prévalence plus basse de diabète sucré que les non-consommateurs. En raison de limites présentes dans la méthodologie de l'étude (p. ex. nature transversale de l'étude, biais d'auto-sélection et manque d'uniformité dans la méthode d'échantillonnage), ainsi que la possibilité de facteurs de confusion supplémentaires et non contrôlés, les auteurs indiquent qu'il est toujours impossible de conclure que l'utilisation du cannabis n'entraîne pas le diabète sucré, ni qu'on devrait considérer le cannabis en tant que traitement pour ce trouble.
Le cannabis, le système endocannabinoïde et la pancréatite aiguë et chronique
La consommation de cannabis aiguë et intense a été reliée à l'apparition de pancréatite aiguëReference 374-Reference 378. Une revue systématique récente sur la pancréatite aiguë provoquée par le cannabis suggère une prévalence accrue principalement chez les patients plus jeunes de moins de 35 ansReference 377. De plus, une analyse de causalité subséquente suggère que le cannabis pourrait être un facteur de risque possible de pancréatite aiguë induite par la toxine. La pancréatite aiguë est un trouble possiblement mortel causant l'inflammation, la mort cellulaire et des interactions neuro-immunitaires complexes; la gestion de la pancréatite chronique demeure difficile sur le plan clinique et sans remède définitif, les mesures de soutien constituant le seul traitement disponibleReference 1293Reference 1294. On a rapporté que le tissu pancréatique isolé des patients atteints de pancréatite aiguë possédait une régulation positive des récepteurs CB1 et CB2 dans les acini et les conduits, ainsi que des concentrations élevées de l'endocannabinoïde anandamide, mais non du 2-AGReference 1293.
Lors d'une étude subséquente, on a consigné une augmentation des niveaux d'expression des récepteurs CB1 et CB2, ainsi qu'une baisse des niveaux des endocannabinoïdes (anandamide et 2-AG) dans les échantillons de tissus isolés de patients atteints de pancréatite chronique comparativement aux tissus pancréatiques tirés de sujets en santéReference 1294. De plus, contrairement aux conclusions obtenues concernant la pancréatite aiguëReference 1293, les tissus isolés des patients atteints de pancréatite chronique semblaient présenter des concentrations moins élevées d'anandamide et de 2-AGReference 1294. L'activation des récepteurs CB1 et CB2 chez les cellules stellaires pancréatiques obtenues à partir de pancréatite chronique était aussi associée à l'induction d'un phénotype des cellules quiescentes, ainsi qu'à la régulation négative d'une production de protéines de la matrice extracellulaire, de même que d'une production de cytokine inflammatoireReference 1294.
Données précliniques et pancréatite aiguë ou chronique
Il n'existe qu'une poignée de rapports sur les effets des cannabinoïdes dans les modèles d'expérimentation animale sur la pancréatite aiguë ou chronique, et les résultats de ces rapports sont contradictoires.
Des augmentations des concentrations plasmatiques de l'anandamide ont été remarquées dans un modèle de pancréatite aiguë chez le ratReference 1295, et l'administration de l'antagoniste du récepteur CB1, AM-251, après l'induction de la pancréatite a semblé améliorer l'évolution de la maladieReference 1295. Lors d'une autre étude, l'administration d'anandamide avant l'induction de lésions pancréatiques a aggravé encore plus l'évolution habituelle de la maladie, alors que le traitement préalable à l'aide de l'antagoniste du récepteur CB1, AM-251, a empêché le développement d'une pancréatite provoquée par la céruléine, et lorsqu'il était administré après les lésions, il a semblé aussi renverser les dommages pancréatiques provoqués par la céruléineReference 1296. De manière semblable, les souris traitées à l'aide du rimonabant, un antagoniste du récepteur CB1, avant la pancréatite provoquée par la céruléine présentaient des dommages pancréatiques beaucoup moins importants, ainsi qu'une production plus faible de cytokines inflammatoiresReference 1297. L'administration sous-cutanée d'un agoniste synthétique du récepteur CB1/CB2 avant, ainsi qu'après l'induction d'une pancréatite aiguë chez la souris atténuait les douleurs abdominales, l'inflammation et la pathologie des tissus reliés à la pancréatiteReference 1293. À l'opposé, une étude différente a signalé qu'un traitement préalable des rats à l'aide d'un agoniste synthétique du récepteur CB1/CB2 avant l'induction d'une pancréatite provoquée expérimentalement atténuait l'étendue des lésions des tissus et de la production de cytokines inflammatoires, alors que l'administration du même agoniste après l'induction de la pancréatite avait l'effet contraire, et semblait empirer l'évolution de la maladieReference 1298. Ces conclusions contradictoires peuvent être attribuées aux différences dans les méthodes expérimentales, aux différences dans le moment de l'administration du médicament, aux différences dans les types d'agonistes et d'antagonistes utilisés, aux différences dans les voies d'administration et aux différences dans les espèces animales.
Données cliniques
Une étude clinique croisée à répartition aléatoire et double insu, à dose unique et contrôlée par placebo chez 24 patients (divisés en deux groupes : les consommateurs quotidiens d'opioïdes et ceux ne consommant pas d'opioïdes) souffrant de douleurs abdominales associées à une pancréatite chronique a examiné l'efficacité analgésique, la pharmacocinétique et la tolérabilité de 8 mg de THC administré par voie orale ou du placebo actif (5 ou 10 mg de diazépam) dans une conception à double feinteReference 586. L'étude signale un manque d'efficacité du THC dans la réduction de la douleur chronique associée à une pancréatite chronique mais une bonne tolérance accompagnée d'événements indésirables légers ou modérés seulement. Aucune différence n'a été relevée entre le THC et le diazépam dans les mesures selon l'EVA de la vivacité d'esprit, de l'humeur et du calme, mais le THC a été associé à une augmentation significative de l'anxiété comparativement au diazépam. Le THC a augmenté aussi de manière significative le rythme cardiaque comparativement au diazépam. Les événements indésirables les plus fréquents associés au THC étaient la somnolence, l'assèchement de la bouche, les étourdissements et l'humeur euphorique. Aucun événement indésirable grave n'a été signalé. Les paramètres pharmacocinétiques du THC étaient similaires entre les consommateurs d'opioïdes et les personnes qui n'en consommaient pas et ils révèlent une absorption retardée et une variabilité accrue comparativement aux volontaires sains. Les limites de l'étude sont notamment le faible nombre de sujets de l'étude, la courte durée des essais, la conception à dose unique et les faibles doses de THC.
4.9.9 Propriétés antinéoplasiques
- Les études précliniques suggèrent que certains cannabinoïdes (le THC, le CBD, le CBG, le CBC, le CBDA) bloquent fréquemment, mais non toujours, la croissance des cellules cancéreuses in vitro et affichent une gamme d'effets antinéoplastiques in vivo bien que normalement à des doses très élevées qui ne seraient pas utilisées cliniquement.
- Bien que des données limitées provenant d'une étude observationnelle suggèrent que les patients atteints de cancer consomment du cannabis pour soulager les symptômes associés au cancer (p. ex., les modifications chimiosensorielles, la perte de poids, la dépression, la douleur), il n'existe qu'une seule étude clinique limitée menée avec des patients atteints de glioblastome multiforme ayant signalé que des injections intratumorales de doses élevées de THC n'ont pas amélioré la survie des patients plus que ce qui est observé avec l'utilisation d'agents chimiothérapeutiques courants.
Un grand nombre d'études ont associé le SEC dans la physiopathologie du cancer. En général, les endocannabinoïdes semblent avoir un effet protecteur contre la carcinogenèse, et la régulation adéquate du tonus du SEC local constitue probablement un facteur important dans le contrôle de la malignité des différents cancers - le dérèglement du SEC est associé à la carcinogenèseReference 1299Reference 1300.
Lorsqu'on les compare aux tissus sains, les concentrations d'endocannabinoïdes semblent élevées dans les glioblastomes, les méningiomes, les adénomes de l'hypophyse, les carcinomes de la prostate et du côlon et les sarcomes de l'endomètreReference 1203Reference 1301-Reference 1305. En outre, les niveaux d'expression des récepteurs des cannabinoïdes sont régulés différemment dans les cellules normales par rapport aux cellules malignes, les niveaux de ces récepteurs étant élevés ou diminués selon le type de cancer (examiné dansReference 1300). De telles différences dans les niveaux des endocannabinoïdes et dans les tendances des niveaux d'expression des récepteurs des cannabinoïdes entre les différents types de cancer reflètent le rôle complexe du SEC dans le cancer et créeront probablement des difficultés en ce qui a trait aux approches thérapeutiques possibles. Néanmoins, un grand nombre d'études précliniques ont démontré que les endocannabinoïdes, certains agonistes synthétiques des cannabinoïdes et certains phyto-cannabinoïdes inhibent la croissance des tumeurs et la progression de nombreux types de cancer à l'aide de divers mécanismes, notamment la promotion de l'apoptose, l'arrêt du cycle cellulaire/inhibition de la croissance et la prévention de métastases au moyen de l'inhibition de l'invasion, de la migration et de la néo-angiogenèse tumorale (recensé dansReference 1300Reference 1306).
Dans certaines études in vitro, les effets antinéoplasiques du Δ9-THC semblent biphasiques : les doses plus faibles (inférieures à 100 nM) sont jugées pro-prolifératives, et les doses plus élevées (supérieures à 100 nM) sont jugées anti-proliférativesReference 1307, bien que l'on ait relevé plusieurs exceptions. De plus, les concentrations de cannabinoïdes supérieures à 100 nM, c'est-à-dire deux ordres de grandeur au-dessus de l'affinité moyenne de ces récepteurs envers les cannabinoïdes, sont susceptibles de produire des effets non ciblés, indépendants des récepteurs des cannabinoïdesReference 1308. À titre de référence, les doses uniques de dronabinol (Δ9-THC) de 2,5, 5 et 10 mg administrées par voie orale ont été associées à des concentrations plasmatiques maximales moyennes de Δ9-THC de 0,65, 1,83 et 6,22 ng/ml respectivementReference 222. Ces concentrations correspondent à des concentrations de 2, 6 et 20 nM de Δ9-THC. Le double de ces doses orales quotidiennes est associé à des concentrations plasmatiques maximales de Δ9-THC moyennes de 1,3, 2,9 et 7,9 ng/ml respectivementReference 222, ce qui correspond à 4, 9 et 30 nM de Δ9-THC. L'administration continue pendant sept jours à l'aide de 20 mg de dronabinol (doses totales quotidiennes de 40 à 120 mg de dronabinol) a entraîné des concentrations plasmatiques moyennes de Δ9-THC d'environ 20 ng/ml ou environ 60 nMReference 417. On peut supposer, selon la littérature, que fumer un joint de 1 g contenant 12,5 % de Δ9-THC entraînera des concentrations plasmatiques maximales de Δ9-THC situées entre 50 et 100 ng/ml ou plus (consulter la Section 3.1 « Le Cannabis fumé », la sous-section « Concentrations plasmatiques de Δ9-THC après la fumée »). De telles concentrations plasmatiques de Δ9-THC correspondent à 160 et 320 nM de Δ9-THC, respectivement. On sait que les concentrations plasmatiques de Δ9-THC varient beaucoup selon les personnes et baissent plus rapidement lorsque le cannabis (ou le Δ9-THC) est fumé comparativement à lorsque le cannabis (ou le Δ9-THC) est ingéré par voie orale. En ce qui a trait aux doses exprimées en mg/kg du poids corporel, on peut estimer qu'une dose orale unique de 2,5 mg de dronabinol (Δ9-THC) peut correspondre à une dose d'environ 0,04 mg/kg (en supposant un poids corporel de 70 kg), alors qu'une dose orale quotidienne de 40 mg de dronabinol correspondrait à une dose d'environ 0,6 mg/kg de dronabinol. Fumer un joint de 1 g contenant 12,5 % de Δ9-THC correspondrait à une dose hypothétique de 1,8 mg/kg de Δ9-THC. Ces valeurs représentent des comparaisons estimatives puisque les concentrations actuelles de cannabinoïdes dans les tissus peuvent varier de façon importante chez des individus particuliers tout comme entre les individus, parmi les voies d'administration différentes et les types de cellules; et les micro-environnements in vitro et in vivo sont vraisemblablement différents.
Les quelques paragraphes suivants résument les principales conclusions de multiples études précliniques in vitro et in vivo sur les cannabinoïdes au niveau des maladies néoplasiques. Les données cliniques sont présentées à la fin de cette section.
Données précliniques
Les études in vitro suggèrent que le Δ9-THC baisse la prolifération cellulaire et augmente la mort cellulaire chez les lignées cellulaires de glioblastome multiforme humain, l'activation du récepteur CB ne représentant qu'une partie des effets observésReference 1309. Dans le cas des astrocytomes, les concentrations plus élevées étaient jugées préférables sur le plan clinique parce qu'elles contourneraient l'activation des récepteurs CB et induiraient l'apoptose chez toutes les sous-populations cellulaires de l'astrocytomeReference 1310. Dans le cas du cancer du sein, le Δ9-THC diminuait la prolifération cellulaire du cancer du sein humain aux concentrations de 4 à 10 μM, les cellules tumorales à récepteurs d'œstrogènes négatifs plus agressives étant plus sensibles aux effets du THCReference 1311. En revanche, une autre étude a démontré que le Δ9-THC (50 μM in vitro ou 50 mg/kg in vivo) rehaussait la croissance et la métastase du cancer du sein bien que les cellules cancéreuses du sein n'aient pas exprimé des niveaux détectables de récepteurs CB, suggérant un mécanisme d'action indépendant des récepteurs CB1 Reference 1312. De plus, le Δ9-THC, le CBD et le CBN stimulaient tous la prolifération cellulaire du cancer du sein aux concentrations allant de 5 à 20 μMReference 1313, mais cet effet semblait, dans une certaine mesure, dépendre du milieu hormonal (les niveaux d'œstrogène plus faibles favorisaient la croissance, alors que les niveaux d'œstrogène plus élevés l'inhibaient). D'un autre côté, les cannabinoïdes comme le CBG, le CBC, le CBDA et THCA, ainsi que les extraits de cannabinoïdes enrichis de Δ9-THC ou de CBD inhibaient la prolifération cellulaire (de l'ordre micromolaire) dans de multiples lignées cellulaires différentes du cancer du seinReference 1314. Chez les études in vitro qui examinaient le rôle des cannabinoïdes dans le cancer du poumon, le Δ9-THC (10 à 15 μM) atténuait la migration et l'invasion provoquées par les facteurs de croissance des lignées cellulaires du cancer du poumon « non à petites cellules »Reference 1315. Dans le cas du cancer colorectal, le Δ9-THC en concentrations de 2,5 μM ou plus (marge de 7,5 à 12,5 μM) était associé à une baisse dans la survie des cellules du cancer colorectal, alors que les concentrations plus faibles (100 nM à 1 μM) n'avaient aucun effetReference 1316. Une étude in vitro examinant le rôle du THC dans le cancer de la peau a signalé que 5 et 10 µM de THC n'ont pas eu d'effet sur la prolifération cellulaire des cellules du cancer de la peau HCmel12 ou B16Reference 1317. Une autre étude in vitro examinant les effets antinéoplasiques du CBG sur la carcinogenèse du côlon révèle que le CBG (3 à 30 µM) inhibe la viabilité des cellules du cancer du côlon, mais que cet effet est dépendant du temps et de l'environnementReference 1318. Une autre étude a signalé que l'extrait botanique du CBD (66 % de CBD, 2,4 % de THC, 1,0 % de CBG, 0,9 % de CBDV, 0,3 % de CBDA, 0,1 % de CBN) ainsi que le CBD pur (à des concentrations comprises entre 1 et 5 µM) n'ont pas eu d'effet sur la viabilité des cellules du cancer colorectal (DLD-1 et HCT116)Reference 1319. Cependant, l'extrait botanique de CBD et le CBD pur a exercé des effets anti-prolifératifs sur ces cellules du cancer du côlon, mais pas sur les cellules sainesReference 1319. Une étude in vitro a évalué l'effet anti-prolifératif du CBD et du THC utilisés seuls et en association avec une radiothérapieReference 1320. Dans cette étude, le traitement de deux lignées cellulaires de gliome humain et d'une lignée cellulaire de gliome murin avec du CBD pur, du THC pur ou deux extraits botaniques de cannabinoïdes (BDS) enrichis en CBD ou en THC (CBD BDS = 64 % de CBD, 3,6 % de THC, 1,1 % de CBG, 5,2 % de CBC, 1,3 % de CBDV, 0,4 % de CBDA; ou THC BDS = 65 % de THC, 0,4 % de CBD, 1,3 % de CBG, 1,8 % de CBC, 0,9 % de THCV, 0,4 % de THCA, 2 % de CBN et 0,2 % de cannabitriol) a été associé à une réduction du nombre de cellules dans les trois lignées cellulaires en proportion à la doseReference 1320. Une dose d'environ 10 µmol/L pour toutes les substances testées a été associée à une réduction de 50 % du nombre de cellules (CI50). Le THC pur combiné au CBD pur était lié à un effet inhibiteur hyperadditif sur le nombre de cellules. Dans des expériences supplémentaires, le prétraitement des trois lignées cellulaires de gliome avec le THC pur combiné au CBD pur (10 µmol/L chacun) accompagné d'une irradiation, a été associé à un ralentissement de la réparation des cassures « double-brin » de l'ADN et à une tendance vers une mort cellulaire accrueReference 1320. Dans une autre étude, l'efficacité antileucémique du THC a été examinée dans plusieurs lignées cellulaires leucémiques et des blastes leucémiques naturelles cultivées ex vivoReference 1321. Le THC a produit une inhibition significative et dépendante à la dose de la prolifération cellulaire avec une CI50 de 15 µM dans une lignée cellulaire leucémique de type lymphoblastique T et avec une CI50 de 18 µM dans une lignée cellulaire leucémique aiguë de type myéloïde. Des doses plus élevées ont été associées à une apoptose dépendante des récepteurs CB1 et CB2. Le traitement au THC des blastes de leucémie myéloïde et de leucémie lymphatique issues d'un prélèvement chez des patients et cultivées ex vivo a été associé à une réduction du nombre de cellules viablesReference 1321.
Lorsqu'on en fait une lecture globale, ces études et d'autres études in vitro suggèrent que les cannabinoïdes peuvent fréquemment, mais pas toujours, exercer des actions d'inhibition de la croissance sur des cellules cancéreuses cultivées et avoir des effets biologiques complexes dans le contexte des tumeurs malignes. Les différences dans les conditions expérimentales, le type de cellules cancéreuses, l'environnement de croissance cellulaire, l'expression des récepteurs CB, de même que les niveaux hormonaux et l'existence des mécanismes régulateurs dépendants et indépendants des récepteurs CB semblent tous influencer le contrôle de la croissance, de la prolifération et de l'invasion des cellules cancéreuses en réponse aux cannabinoïdes. De plus, ces résultats suggèrent que les concentrations inhibitoires efficaces de Δ9-THC observées in vitro sont significativement plus élevées (c.-à-d. un à quatre ordres de magnitude) que les concentrations de Δ9-THC observées cliniquement selon la voie d'administration.
Une étude préclinique in vivo chez le rat a démontré que l'administration intra-tumorale du Δ9-THC provoquait une régression importante des gliomes malins intracrâniens, et une augmentation correspondante du temps de survie des animaux sans qu'il y ait de neurotoxicité envers les tissus sainsReference 1322. De plus, aucun changement important n'a été observé dans certaines mesures comportementales, ce qui suggère que les effets du Δ9-THC se limitaient aux tissus neuraux malades. D'autres études démontraient que l'administration péritumorale de 0,5 mg de Δ9-THC/jour, deux fois par semaine pendant 90 jours ralentissait de manière statistiquement significative la croissance focale des tumeurs du sein, bloquait la génération de tumeurs, baissait la charge tumorale totale, retardait l'apparition de tumeurs subséquentes et nuisait à la vascularisation dans le modèle de cancer du sein métastasique ErbB2 positif chez la sourisReference 1323. Le Δ9-THC, administré de manière intrapéritonéale ou intratumorale en doses de 5 mg/kg/jour, faisait considérablement chuter la croissance et la métastase, ainsi que la vascularisation des lignées cellulaires du cancer du poumon « non à petites cellules » xénotransplantées chez des souris immunodéficientesReference 1315. Le CBD (5 mg/kg) ou l'extrait riche en CBD (6,5 mg/kg) administré de manière intratumorale ou intrapéritonéale, deux fois par semaine, chez des souris athymiques ayant subi une xénotransplantation de cellules du cancer du sein a baissé de manière importante le volume des tumeurs et le nombre de nodules métastatiquesReference 1314. D'autres chercheurs ont démontré que l'administration intrapéritonéale de CBD en doses de 1 à 5 mg/kg/jour diminuait de manière statistiquement significative la croissance et la métastase d'une lignée cellulaire de cancer du sein agressif chez des souris immuno-compétentesReference 1324. Il est important de souligner qu'après 25 jours de traitement, la tumeur primaire avait acquis une résistance aux propriétés inhibitoires du CBD. Une étude in vivo qui a évalué l'efficacité antitumorale des microparticules polymériques biodégradables permettant la libération lente de THC (25 mg administrés, 10 mg libérés) et de CBD (27 mg administrés, 11 mg libérés) dans des xénogreffes de gliomes a démontré une réduction significative de la croissance des gliomes. Ces doses sont bien plus élevées que celles qui pourraient être atteintes par une administration systémique de ces cannabinoïdes et elles seraient aussi associées à des effets psychoactifs significatifsReference 1325. Une étude in vivo examinant les effets antinéoplasiques du CBG sur la carcinogenèse du côlon révèle que le CBG (3 et 10 mg/kg de CBG) inhibe de 45 % la croissance des cellules cancéreuses du côlon xénotransplantéesReference 1318. Une étude in vivo évaluant l'effet curatif d'un extrait botanique du CBD sur le cancer colorectal signale qu'une injection quotidienne de l'extrait (5 mg/kg, IP) a diminué considérablement le volume tumoral moyen, mais l'effet ne s'est maintenu que pendant sept jours, après quoi aucune différence dans la taille des tumeurs n'a été observée entre le groupe expérimental et le groupe témoinReference 1319. Une étude a examiné l'effet de combiner le THC, le CBD et la radiothérapie dans un modèle de gliome chez la sourisReference 1320. Dans cette étude, le THC associé au CBD (100 µmol/L chacun) a été associé à une réduction de la progression tumorale et l'ajout de l'irradiation au traitement cannabinoïde combiné a été associé à une réduction supplémentaire de la croissance tumoraleReference 1320. Une étude in vivo des effets du THC en ce qui concerne le cancer de la peau a signalé que des doses de 5 mg/kg (s.c.) de THC par jour réduisaient considérablement la croissance des mélanomes de type HCmel12, mais pas celle des mélanomes B16Reference 1317. En outre, l'effet antinéoplasique s'est révélé dépendre des récepteurs CB. Enfin, l'examen de l'activité antinéoplasique in vivo du CBD révèle que l'administration systémique chronique de CBD à des doses comprises entre 1 et 5 mg/kg est associée à une activité anti-métastatique, tandis que des doses comprises entre 15 et 25 mg/kg de CBD administré de façon systémique et 10 mg/kg de CBD administré par voie orale sont nécessaires pour limiter la progression tumorale dans le modèle murin de xénogreffe qui se rapproche plus de la croissance d'une tumeur primaireReference 1326. En outre, on a signalé que les doses de THC et de CBD de 4 mg/kg chacune administrée systémiquement et que 100 mg/kg de CBD administré par voie orale sensibilisaient les tumeurs aux agents de première intention dans les modèles murins de xénogreffe qui se rapprochent plus de la croissance d'une tumeur primaireReference 1326. Ensemble, ces études suggèrent que les cannabinoïdes comme le Δ9-THC et le CBD peuvent, au moins selon un ensemble de circonstances précises, avoir des effets antinéoplasiques dans divers modèles animaux de cancers à certaines doses ou concentrations.
Association de cannabinoïdes avec d'autres agents chimiothérapeutiques
Des études précliniques in vitro et in vivo examinant les effets de l'association de cannabinoïdes avec des agents chimiothérapeutiques fréquemment utilisés ont aussi été menées. Une étudein vitro a démontré que combiner des doses sous-maximales de Δ9-THC (0,75 μM) avec la cisplatine ou la doxorubicine diminuait la viabilité d'une lignée cellulaire de l'astrocytome de manière synergiqueReference 1327. De manière semblable, combiner des doses sous-maximales de Δ9-THC avec du témozolomide diminuait la viabilité de plusieurs lignées cellulaires de gliome humain tirées de biopsies de glioblastome multiforme humain in vitroReference 1328. Pour appuyer ces conclusions, une étude in vivo a démontré qu'un traitement combiné de Δ9-THC (15 mg/kg/jour) et de témozolomide (5 mg/kg/jour) diminuait la croissance des xénotransplantations de tumeurs gliomes chez la souris de manière synergiqueReference 1328. Ces études suggèrent que les cannabinoïdes pourraient sensibiliser certaines tumeurs aux actions antinéoplastiques de médicaments chimiothérapeutiques courants.
Données d'observation et cliniques
Une enquête non aléatoire transversale et une analyse rétrospective des dossiers de 15 patients (principalement mâles) possédant des antécédents de cancer de la tête et du cou traités à l'aide de la radiothérapie ou de la chimiothérapie ayant aussi consommé du cannabis à des fins médicales a examiné les caractéristiques des patients et les raisons énoncées pour obtenir une ordonnance de cannabis à des fins médicales pour la gestion de morbidités associées au traitement du cancer de la tête et du cou à long termeReference 1329. L'étude a révélé que la majorité des participants à l'étude ont signalé avoir fumé le cannabis, tandis que les autres ont signalé avoir ingéré, vaporisé ou utilisé une huile concentrée maison comme méthode d'administration. La majorité des patients ont signalé avoir consommé du cannabis quotidiennement ou plus fréquemment. Le cannabis fournissait des effets bénéfiques envers les effets secondaires de la radiothérapie suivants : altération du goût, gestion du poids corporel, la dépression, la douleur, l'appétit, la dysphagie, la xérostomie, les spasmes musculaires et la salive collante.
Un rapport de cas de deux enfants atteints d'astrocytomes du septum pellucidum ou pilocytiques fornicéens a remarqué la régression spontanée des tumeurs au cours de la même période que la consommation de cannabis par inhalation (fréquence de trois fois par semaine à quotidiennement rapportée, puissance et composition inconnue)Reference 1330. Les patients n'ont reçu aucun traitement adjuvant après la chirurgie et des suivis ont été effectués au cours d'années subséquentes; la régression des tumeurs semble coïncider avec l'administration de cannabis ce qui, selon les auteurs, soulève la possibilité que le cannabis ait joué un rôle dans la régression tumorale.
Il n'existe qu'un seul rapport d'étude clinique utilisant le Δ9-THC pour traiter le cancerReference 1331. Dans cette étude pilote sans placebo, neuf patients présentant des glioblastomes multiformes chez qui la radiothérapie et la chirurgie standard avaient échoué, qui présentaient une progression tumorale claire et dont l'index de Karnofsky était d'au moins 60 ont été traités à l'aide de doses de 20 à 40 µg de Δ9-THC administrés de manière intratumorale par jour (certaines doses allant jusqu'à 80 ou 180 µg de Δ9-THC par jour). La durée médiane du traitement était de 15 jours. L'administration intratumorale de Δ9-THC semblait bien tolérée, et les effets du Δ9-THC sur la survie des patients étaients semblables à ceux observés dans les autres études à l'aide d'agents chimiothérapeutiques comme le témozolomide ou la carmustineReference 1332Reference 1333. L'administration du Δ9-THC a réduit l'expression de certains marqueurs moléculaires de la progression du glioblastome multiforme dans les spécimens de tumeurs obtenus de patients traitésReference 1327Reference 1331Reference 1334 et in vitro, le Δ9-THC inhibait la prolifération et diminuait la viabilité des cellules tumorales isolées des biopsies de glioblastome, probablement à l'aide d'une combinaison d'apoptose et d'arrêt du cycle cellulaireReference 1331Reference 1335. De plus, les résultats d'une étude distincte in vitro suggèrent que le CBD avait rehaussé les effets inhibitoires du Δ9-THC sur la prolifération et la survie des cellules du glioblastome humainReference 1335.
Malgré les données présentées dans ces études et bien d'autres, il existe certaines préoccupations concernant l'utilisation du Δ9-THC dans les stratégies antitumorales, surtout si celui-ci est administré systémiquement en raison de son hydrophobicité élevée, de sa puissance comme agoniste relativement faible et de ses propriétés psychoactives bien connuesReference 1300Reference 1336Reference 1337. On ignore aussi toujours beaucoup de choses par rapport aux niveaux d'expression des récepteurs cannabinoïdes dans les différents cancers, les effets des différents cannabinoïdes sur différents types de cellules cancéreuses, l'identification des facteurs qui confèrent une résistance au traitement cannabinoïde, ainsi que les approches les plus efficaces pour rehausser l'activité anti-tumorale des cannabinoïdes utilisés seuls ou en association avec d'autres traitementsReference 1314Reference 1336. Enfin, l'effet biphasique évident des cannabinoïdes souligne encore davantage le besoin d'études plus exhaustives sur la relation dose-effetReference 1338.
4.9.10 Nouvelles utilisations thérapeutiques possibles
Athérosclérose
Il existe quelques rapports précliniques qui suggèrent que l'administration d'une faible dose de THC, d'un antagoniste du récepteur CB1 ou d'un agoniste du récepteur CB2 pourrait diminuer la progression de l'athérosclérose dans les modèles de la maladie chez les sourisReference 1339-Reference 1341. L'administration orale de THC (1 mg/kg/jour) a été associée à une grande inhibition de la progression de la maladie chez la souris déficiente en apolipoprotéine E (Apo-E), un modèle d'athérosclérose chez la sourisReference 1339. Les effets bénéfiques du THC dans cette étude étaient médiés par le récepteur CB2, probablement dù à ses effets inhibitoires sur les cellules du système immunitaire (macrophages et cellules T) situées dans les lésions athéroscléreuses ou près de celles-ci. Ces résultats étaient appuyés par une autre étude qui a démontré que l'administration intrapéritonéale d'un agoniste du récepteur CB1/CB2 diminuait de manière statistiquement significative la surface de la plaque aortique chez la souris déficiente en Apo-EReference 1341. L'administration de l'agoniste du récepteur CB diminuait l'adhésion et l'infiltration des macrophages dans la plaque athérosclérotique ainsi que diminuait l'expression dea la molécule-1 d'adhérence des cellules vasculaires (VCAM-1), de la molécule-1 d'adhérence intercellulaire (ICAM-1) et de la P-sélectine dans l'aorte. Une fois de plus, les effets bénéfiques observés semblaient être médiés par l'activation du récepteur CB2. Une étude distincte a confirmé les effets athéroprotecteurs de l'activation séléctive du récepteur CB2 en démontrant une infiltration accrue des leucocytes vasculaires dans les plaques athérosclérotiques chez les souris à qui les récepteurs de l'Apo-E et CB2 manquaient par rapport aux souris déficientes en Apo-E, une baisse dans la formation de plaque athérosclérotique de même que dans la production de superoxyde vasculaire chez les souris déficientes en Apo-E traitées avec un agoniste sélectif du récepteur CB2Reference 1342. Contrairement à ces conclusions, une étude différente démontrait que l'activation ou l'élimination du récepteur CB2 ne modulait pas l'athérogenèse dans le modèle d'athérosclérose chez la souris déficiente en récepteur de LDLReference 1343. Une autre étude suggérait que le récepteur CB2, bien qu'il n'influence pas la taille des lésions athéroslérotiques chez la souris déficiente en récepteur de LDL, augmentait l'accumulation des macrophages lésionnels et l'infiltration des cellules musculaires lisses, tout en diminuant l'apoptose lésionnelle et en modifiant la matrice extracellulaire des lésionsReference 1344. Les conclusions de cette étude suggéraient que même si le récepteur CB2 ne jouait pas un grand rôle dans la formation initiale des lésions athérosclérotiques, il en jouait toutefois un dans la modulation de la progression de la maladie. D'un autre côté, l'activation du récepteur CB1 est associée à la production d'espèces réactives de l'oxygène et à la mort des cellules endothélialesReference 1345, et le blocage du récepteur CB1 par le rimonabant chez les souris déficientes en Apo-E était associé à une diminution importante de la taille relative des lésions athérosclérotiques aortiquesReference 1340. En conclusion, il semble que dans le cas de l'athérosclérose, les récepteurs CB1 et CB2 jouent des rôles opposés : le récepteur CB1 semble athérogène alors que le récepteur CB2 semble anti-athérogèneReference 1340Reference 1342Reference 1345-Reference 1347 bien qu'une certaine incertitude demeure quant au rôle exact du récepteur CB2Reference 1348. On a aussi démontré que le CBD inhibait grandement l'activité de l'enzyme 15-lipoxygénase, qui contribuait à la physiopathologie de l'athérogenèseReference 1346Reference 1349. Davantage d'études sont nécessaires sur le sujet.
5.0 Précautions
Les contre-indications concernant les personnes qui songent à utiliser des traitements axés sur les cannabinoïdes d'ordonnance (comme le nabilone [p. ex. CesametMD], le nabiximols [p. ex. SativexMD] ou le dronabinol [p. ex. MarinolMD, plus disponible au Canada]) sont aussi valides pour celles qui songent consommer du cannabis contenant du THC ou du cannabis à haute teneur en THC. Les professionnels de la santé devraient aussi consulter le document d'orientation provisoire du Collège des médecins de famille du Canada concernant l'autorisation du cannabis séché à des fins médicalesReference 578 et la récente ligne directrice simplifiée pour la prescription de cannabinoïdes médicaux dans les soins primairesReference 1350.
Le rapport risque-avantage de la consommation de cannabis (surtout pour le cannabis à THC prédominant) devrait être évalué avec soin chez les patients qui présentent les états pathologiques suivants en raison de la variabilité de la réponse et de la tolérance à ses effets, ainsi qu'à la difficulté d'établir le dosage indiqué à la Section 3.0. Consultez aussi la Figure 3 pour davantage de conseils.
- Le cannabis (surtout le cannabis administré par voie fumée ou vaporisée) contenant principalement du THC (et en particulier des concentrations élevées de THC contenant très peu de CBD, s'il y a lieu) ne devrait pas être utilisé chez toute personne âgée de moins de 25 ansReference 534Reference 1100; à moins que le rapport risque-avantage est considéré favorable par le médecin. Les effets indésirables de la consommation de cannabis (à THC prédominant) sur la santé mentale sont plus graves pendant le développement, particulièrement durant l'adolescence (entre 10 et 24 ans), qu'à l'âge adulte, les risques augmentant avec l'âge plus jeune, la consommation fréquente et la puissance du THCReference 177Reference 193Reference 200Reference 223Reference 535Reference 535Reference 1110Reference 1114 (consulter la Section 7.7.3). Des preuves émergeantes suggèrent une association statistiquement significative entre la consommation de concentrés de cannabis à très forte puissance comme le BHO et des niveaux plus élevés de dépendance physiqueReference 516.
- Le cannabis ne devrait pas être consommé par des patients possédant des antécédents d'hypersensibilité à tout autre cannabinoïde ou à la fumée (dans le cas où le cannabis serait fumé)Reference 362Reference 363Reference 390Reference 391Reference 1351Reference 1352 (consulter la Section 7.3).
- Le cannabis ne devrait pas être utilisé chez les patients atteints de maladie cardiovasculaire ou cérébrovasculaire sévère en raison d'hypotension artérielle occasionnelle, d'hypertension artérielle possible, de syncope, de tachycardie, d'infarctus du myocarde ou d'AVC Reference 175Reference 137Reference 350Reference 351Reference 1521Reference 1662Reference 1663 (consulter la Section 7.5).
- On ne recommande habituellement pas le cannabis fumé chez les patients atteints d'une maladie respiratoire (p. ex. insuffisance telle que l'asthme ou une maladie pulmonaire obstructive chronique)Reference 361Reference 362 (consulter la Section 7.2).
- Le cannabis ne devrait pas être utilisé chez les patients atteints d'insuffisance hépatique ou rénale grave. Chez les patients atteints d'hépatite C chronique, la consommation quotidienne de cannabis a été démontré comme un prédicteur de la gravité de la stéatose chez ces personnesReference 34Reference 1353 (consulter la Section 7.6.2).
- Le cannabis contenant principalement du THC (contenant très peu de CBD, s'il y a lieu) et surtout contenant de hauts niveaux de THC ne devrait pas être utilisé chez les patients qui ont des antécédents personnels de troubles psychiatriques (c.-à-d. psychose, schizophrénie, troubles d'anxiété et de l'humeur) ou des antécédents familiaux de schizophrénieReference 178Reference 1079 (consulter la Section 7.7.3).
- Le cannabis devrait être utilisé avec prudence chez les patients qui ont des antécédents de toxicomanie, y compris l'abus d'alcool, car de telles personnes peuvent être plus susceptibles d'abuser du cannabis qui, lui-même, constitue une substance fréquemment abuséeReference 1072Reference 1354Reference 1355 (consulter les Sections 2.4 et 4.9.5.4).
- Le cannabis devrait être utilisé avec prudence chez les patients qui reçoivent un traitement concomitant à l'aide de sédatifs hypnotiques ou d'autres médicaments psychoactifs en raison de la possibilité d'effets psychoactifs ou dépresseurs du SNC synergiques ou additifsReference 214-Reference 216 (consulter aussi la Section 7.7). Le cannabis peut aussi exacerber les effets dépresseurs de l'alcool sur le SNC et augmenter l'incidence d'effets indésirables, ainsi que la conduite intoxiquée (consulter la Section 7.7.2). Les patients devraient être informés des effets négatifs du cannabis/des cannabinoïdes psychoactifs sur la mémoire, habiletés cognitives et psychomotrices et devraient rapporter toute instabilité mentale ou modification du comportement qui survient après avoir consommé du cannabisReference 229Reference 230.
- Le cannabis n'est pas recommandé chez les femmes en âge de procréer qui n'utilisent pas un contraceptif fiable, de même que celles qui prévoient devenir enceintes, et les femmes enceintes ou les femmes qui allaitentReference 61Reference 1356Reference 1357 (consulter les Sections 6.0 et 7.4).
6.0 Mises en garde
Le cannabis constitue l'une des drogues illicites dont l'abus est le plus courant, et peut produire une dépendance physique et psychologiqueReference 141Reference 185Reference 326Reference 1358Reference 1359. Cette drogue possède des effets complexes sur le SNC et peut provoquer une déficience cognitive et des troubles de la mémoire, des changements d'humeur, une altération de la perception et une diminution de la maîtrise des impulsions parmi plusieurs autres effetsReference 231Reference 1360-Reference 1362.
Les patients devraient être supervisés lorsque l'administration est amorcée et devraient ensuite être surveillés régulièrement.
Posologie : Dans le cas du cannabis fumé/vaporisé, la dose nécessaire afin d'obtenir les effets thérapeutiques et éviter les effets indésirables est difficile à évaluer et est influencée par la puissance du produit, la manière dont les produits ont été traitées et les différentes techniques pour fumer ou de vaporisation. Celles-ci comprennent la profondeur de l'inhalation et la retenue de la respiration ainsi que le nombre de bouffées et leur fréquence, en plus du nombre de cigarettes fumées ou de la quantité de matériel végétal/liquide vaporisée. Les premières doses devraient être les plus faibles possible pour maximiser les effets potentiels thérapeutiques et minimizer les risques d'effets indésirables. On devrait fumer ou vaporiser le produit lentement et prudemment de manière progressive (avec assez de temps entre les bouffées ou inhalations pour pouvoir évaluer les effets - p. ex. 30 min), et y mettre fin si le patient commence à éprouver les effets suivants : désorientation, étourdissements, agitation, ataxie, anxiété, tachycardie et hypotension orthostatique, dépression, hallucination ou psychose. Aussi, il n'existe pas suffisamment de renseignements par rapport aux doses administrées par voie orale, mais les patients devraient être informés que les effets suivant une administration orale ne se font ressentir que de 30 minutes à une heure ou plus après l'ingestion et culminent de trois à quatre heures suivant celle-ci, et que la consommation de produits à base de cannabis (p. ex. biscuits, produits de boulangerie) devrait être effectuée lentement. Les produits comestibles ne devraient être consommés qu'en petites quantités à la fois avec assez de temps entre les doses afin d'en évaluer les effets et prévenir les surdosesReference 222Reference 402 (consulter la Section 3.0).
Psychose : Toute personne qui éprouve une réaction psychotique aiguë au cannabis ou aux cannabinoïdes devrait cesser immédiatement de consommer la drogue et consulter un professionnel de la santé dans les plus brefs délais. Une réaction psychotique désigne une perte de contact avec la réalité caractérisée par l'un des éléments suivants ou plus : changements de schémas de pensée (difficulté à se concentrer, perte de mémoire et/ou pensées décousues), idées délirantes (croyances enracinées et fausses sans rapport avec la réalité), hallucinations (voir, entendre, goûter, sentir ou ressentir des choses qui en réalité n'existent pas), changements d'humeur (explosions d'émotion, sensation de vide émotif, affect émoussé), comportement ou discours désorganisé et pensées lugubres ou suicidairesReference 160Reference 168Reference 505Reference 1363 (consulter la Section 7.7.3.2).
Risques professionnels : Les patients qui consomment du cannabis/des cannabinoïdes devraient être prévenus de ne pas conduire ou de ne pas exécuter des tâches dangereuses comme manœuvrer de la machinerie lourde, parce que la baisse de l'éveil mental et de la coordination physique engendrée par la consommation de cannabis ou de cannabinoïdes pourrait nuire de manière significative à leur capacité d'exécuter de pareilles tâchesReference 149Reference 150Reference 199Reference 225Reference 236Reference 491Reference 1364 Selon la dose, cette baisse peut durer pendant plus de 24 h après la dernière consommation en raison de la longue demi-vie du Δ9-THCReference 78Reference 147Reference 427Reference 1365Reference 1366. De plus, la défaillance peut être exacerbée par la consommation conjointe d'autres dépresseurs du SNC (p. ex. benzodiazépines, barbituriques, opioïdes, antihistaminiques, relaxants musculaires ou éthanol)Reference 154Reference 214Reference 215Reference 222Reference 1367-Reference 1370 (consulter la Section 7.7.2).
Grossesse : Des études précliniques suggèrent que de mutiples composants du SEC ainsi que le tonus du SEC joue un rôle crucial dans la fertilisation, le transit tubaire, l'implantation et le développement fœtal/placentaire (examiné enReference 1371-Reference 1373). En fait, les récepteurs CB1 et CB2 sont exprimés (protéines) dans le tissu ovarien, l'oviducte, l'utérus et les testicules des rongeurs et des humainsReference 1373. Ces récepteurs sont aussi détectés (protéines) dans les ovocytes à tous les stades de maturationReference 1373. De plus, l'ARNm du récepteur CB1 est exprimé du stade de quatre cellules jusqu'au stade de blastocyste, tandis que l'ARNm du récepteur CB2 est exprimé du stade de cellule unique au stade de blastocysteReference 1374. Des taux élevés d'anandamide en circulation ont été associés à une incidence accrue de fausses couchesReference 1375. De plus, il existe un risque que l'exposition au cannabis ou aux cannabinoïdes puisse nuire à la conception et/ou à l'évolution de la grossesse. Toutefois, deux méta-analyses et analyses systématiques plus récentes ont signalé des conclusions mitigées concernant les dangers à la santé néonatale lors de la consommation de cannabis in uteroReference 1356Reference 1357. Néanmoins, on devrait éviter la consommation de cannabis pendant la grossesse, puisqu'il existe des données probantes selon lesquelles des problèmes de développement à long terme ont été relevés chez des enfants exposés au cannabis in uteroReference 1376-Reference 1379. Le THC traverse facilement la barrière placentaireReference 1379. Les récepteurs CB1 sont exprimés (protéines) dans les cellules germinales, des spermatogonies aux spermatozoïdes, et dans les cellules de Leydig, tandis que les récepteurs CB2 (protéines) sont exprimés dans les cellules de SertoliReference 1373. On recommande aux hommes, particulièrement ceux à la limite de l'infertilité et qui ont l'intention de fonder une famille, d'éviter le cannabis puisque l'exposition au cannabis ou au THC pourrait éventuellement diminuer le taux de réussite des grossesses désiréesReference 393(consulter la Section 7.4).
Lactation : Les cannabinoïdes sont excrétés dans le lait maternel humain, et peuvent être absorbés par le bébé allaitéReference 1380Reference 1381. En raison des risques possibles envers l'enfant, les mères qui allaitent ne devraient pas consommer de cannabis.
6.1 Tolérance, dépendance et symptômes de sevrage
La consommation prolongée de cannabis peut entraîner une tolérance et une dépendance physique de même que psychologiqueReference 176Reference 321Reference 326. La dépendance se développe plus lentement et semble se manifester plus couramment chez les personnes qui consomment des doses plus élevées et plus fréquentesReference 333Reference 334Reference 506Reference 509. Des preuves émergentes suggèrent que l'utilisation de concentrés de cannabis de très haute puissance tels que le BHO est associée à des niveaux plus élevés de dépendance physiqueReference 516. Consulter la Section 2.4 pour obtenir plus de renseignements sur la tolérance, la dépendance et les symptômes de sevrage.
6.2 Interactions médicamenteuses
On peut s'attendre à ce que les interactions médicamenteuses au cannabis et au cannabinoïdes varient considérablement en ce qui a trait à la signification clinique compte tenu de la grande variabilité des produits, des puissances, des rapports de THC et de CBD, des doses, des voies d'administration et des populations utilisant des cannabinoïdes et d'autres facteursReference 464. Cependant, certaines interactions plus significatives sur le plan clinique pourraient se produire lorsque du cannabis est consommé avec d'autres médicaments dépresseurs du SNC, tels que les sédatifs hypnotiques non barbituriques ou l'alcoolReference 154Reference 214-Reference 216Reference 1367-Reference 1369Reference 1382Reference 1383. Une surdose peut se produire si un patient fume/vaporise le cannabis et consomme des cannabinoïdes administrés par voie orale, qu'il s'agisse de médicaments cannabinoïdes d'ordonnance (p. ex. dronabinol, nabilone) ou de consommation de thés, de pâtisseries ou d'autres produitsReference 222Reference 427.
Potentialisation ou inhibition du métabolisme des cannabinoïdes médiée par les agents xénobiotiques
Le Δ9-THC est oxydé en environ 80 métabolites par les hydroxylases des enzymes CYP à fonctions mixtes du métabolisme xénobiotique suivantes : 2C9, 2C19 et 3A4Reference 78Reference 464. Par conséquent, les substances qui inhibent ces isoenzymes du CYP comme certains anti-dépresseurs (p. ex. fluoxétine, fluvoxamine, moclobémide et néfazodone), les inhibiteurs de la pompe à protons (p. ex. cimétidine et oméprazole), les macrolides (p. ex. arithromycine, érythromycine, télithromycine et troléandomycine), les antimycotiques (p. ex. itraconazole, fluconazole, kétoconazole, miconazole, voriconazole, posaconazole), les antagonistes du calcium (p. ex. diltiazem, vérapamil), les inhibiteurs de la protéase du VIH (p. ex. ritonavir, indinavir, nelfinavir, saquinavir, telaprevir, atazanavir, boceprevir, lopinavir), l'amiodarone, le conivaptan, le sulfaphenazole, l'azamuline, le ticlopidine, le nootkatone, le jus de pamplemousse, le mibefradil et l'isoniazide peuvent éventuellement augmenter la biodisponibilité du Δ9-THC (et des métabolites tels que 11-hydroxy-THC), de même que les risques d'éprouver des effets secondaires reliés au THC et au 11-hydroxy-THCReference 419Reference 464Reference 466Reference 1384. Une tachycardie additive, une hypertension et une somnolence ont été signalées avec le THC et une consommation concomitante d'antidépresseurs tricycliques tels que amytryptiline, amoxapine et desipramineReference 222Une hypertension additive, une tachycardie et une éventuelle cardiotoxicité ont été rapportées avec le THC et une consommation concomitante d'agents sympathomimétiques tels que les amphétamines et la cocaïneReference 222. Une tachycardie additive ou supra-additive et une somnolence ont été signalées avec le THC et une consommation concomitane d'atropine, de scopolamine, d'antihistaminiques ou d'autres anticholinergiquesReference 222. Une réaction hypomanique réversible a été rapportée avec une consommation concomitante de THC avec disulfiramReference 222.
D'un autre côté, les médicaments qui accélèrent le métabolisme du Δ9-THC par l'intermédiaire des isoenzymes 2C9 et 3A4 comme la rifampicine, la carbamazépine, le phénobarbital, la phénytoïne, la primidone, la rifabutine, la troglitazone, l'avasimibe et le millepertuis peuvent, à l'inverse, diminuer la biodisponibilité du THC et du CBD et par conséquent leur efficacité si on l'utilise dans un contexte thérapeutiqueReference 419Reference 464Reference 466Reference 1384.
Comme le THC, le CBD est aussi métabolisé par les CYP 2C19 et 3A4, mais il pourrait aussi agir comme un substrat potentiel des CYP 1A1, 1A2, 2C9, 2D6, 2E1 et 3A5Reference 464. Ainsi la biodisponibilité du CBD pourrait être augmentée par de nombreuses substances similaires énumérées pour le THC, ainsi que par le buproprione, la paroxétine, la quinidine, le clométhiazole, le diallyl, le disulfure, le diéthyldithiocarbamate et le disulfirameReference 464.
Le CBN est métabolisé par les CYP 2C9 et 3A4, mais il pourrait aussi agir comme substrat potentiel du CYP2C19Reference 464.
La monographie du produit SativexMD met en garde contre la combinaison de SativexMD et de l'amitriptyline ou du fentanyl (ou des opioïdes connexes) qui sont métabolisés par les cytochromes CYP 3A4 et 2C19Reference 427. Un essai clinique mené auprès de sujets sains et portant sur les effets de la rifampicine, du kétoconazole et de l'oméprazole sur la pharmacocinétique du THC et du CBD produits par SativexMD a indiqué que la coadministration de la rifampicine avec SativexMD est associée à une légère diminution des niveaux plasmatiques de THC, de CBD et de 11-hydroxy-THC, tandis que la coadministration de kétoconazole avec SativexMD est liée à une légère augmentation des niveaux plasmatiques de THC, CBD et à une augmentation importante des niveaux plasmatiques du métabolite psychoactif puissant, le 11-hydroxy-THC (c.-à-d. plus de trois fois)Reference 466. L'administration concomitante de SativexMD avec le kétoconazole a aussi été associée à une augmentation de la fréquence d'événements indésirables apparus en cours de traitement faisant intervenir principalement le système nerveux. Bien qu'aucun effet indésirable grave n'ait été observé; on a relevé une augmentation de l'incidence de somnolence, d'étourdissements, d'humeur euphorique, de léthargie, d'anxiété, de dysgueusie et de céphalées. Aucun effet significatif sur les niveaux plasmatiques de THC, de CBD ou de 11-hydroxy-THC n'a été observé avec l'oméprazole.
Régulation du métabolisme et du transport des drogues médiée par les cannabinoïdes
Bien que le THC, le CBD et le CBN inhibent les isoenzymes du CYP comme le CYP 1A1, 1A2, 1B1 et 2A6Reference 74Reference 464, la fumée de cannabis peut aussi induire les enzymes CYP 1A1 et 1A2 dans une mesure semblable à celle observée avec la fumée de tabac avec des effets supplémentaires lorsque ceux-ci sont utilisés ensemble, plus probablement par l'entremise des effets des hydrocarbures polyaromatiques provenant du matériel végétal brûlé se trouvant sur les récepteurs d'hydrocarbure aromatiqueReference 1385. L'induction des enzymes CYP 1A1 et 1A2 peut causer une réduction des concentrations dans le plasma sanguin de la chlorpromazine et de la théophyllineReference 469Reference 1385-Reference 1388. Malgré le potentiel d'induction de CYP à partir de la fumée de cannabis, d'autres données tirées d'expériences in vitro suggèrent que le Δ9-THC a aussi le pouvoir d'inhiber les isozymes CYP 3A4, 3A5, 2C9 et 2C19, tandis que le CBD a aussi le pouvoir d'inhiber CYP 2C19, 3A4 et 3A5Reference 74Reference 427. Le THC, le CBD ou le CBN ainsi que le cannabis contenant ces cannabinoïdes pourraient donc augmenter la biodisponibilité des drogues métabolisées par ces enzymes. Ces drogues comprennent l'amitryptiline, la phénacétine, la phénytoïne, la théophylline, le granisétron, la dacarbazine et la flutamideReference 74.
Des données laissent aussi supposer qu'il existe une interaction potentielle entre le CBD et la phénytoïne étant donné que ces deux substances possèdent des caractéristiques de conformation spatiale étroitement liées; toutes les deux agissent en tant qu'anticonvulsivants; le CBD inhibe les cytochromes CYP 2C19, 3A4, 1A2 et 2A6 qui métabolisent la phénytoïne ou les métabolites de la phénytoïne. En outre, les données probantes tirées d'étude précliniques indiquent que le CBD améliore les effets anticonvulsifs de la phénytoïneReference 464Reference 741Reference 1389. Ainsi, il faut surveiller les concentrations de phénytoïne dans le sang des patients prenant du CBD et des anticonvulsivants tels que la phénytoïne et les doses de phénytoïne devraient être ajustées en conséquence pour éviter le potentiel d'excès de concentrations de phénytoïne dans le sang et une surdose de phénytoïne.
Une étude clinique menée chez des enfants atteints d'une épilepsie réfractaire et prenant du CBD (EpidiolexMD) (5 mg/kg par jour jusqu'à une dose maximale de 25 mg/kg par jour) et du clobazam (dose quotidienne moyenne de 1 mg/kg par jour, marge de 0,18 à 2,24 mg/kg par jour) pour contrôler les crises a signalé une augmentation médiée par le CBD des niveaux plasmatiques de clobazam et de son métabolite, le n-desméthylclobazamReference 232. Le clobazam et le n-désméthylclobazam sont métabolisés par les enzymes CYP 3A4 et 2C19 à différents degrés et le CBD a été démontré comme étant un inhibiteur de ces deux enzymes CYP. L'augmentation moyenne des concentrations de clobazam s'est chiffrée à 60 % à la quatrième semaine (mais non jugée statistiquement significative) après le traitement et une augmentation moyenne des concentrations de n-desméthylclobazam de 500 % à la semaine quatre (jugée statistiquement significative). Neuf des 13 enfants ont présenté une diminution supérieure à 50 % des crises et les effets secondaires (augmentation de la fréquence des crises, ataxie, sommeil agité, tremblements, endormissement, irritabilité, perte d'appétit et rétention urinaire) ont été gérés par une réduction de la dose de clobazam. Les auteurs de l'étude recommandent de surveiller les concentrations de clobazam et de n-desméthylclobazam dans le cadre du traitement clinique des patients prenant de façon concomitante du clobazam et du CBD (EpidiolexMD).
En outre, le THC, le carboxy-Δ9-THC, le CBD et le CBN stimulent tous, et dans certains cas inhibent même, l'activité de la P-glycoprotéinein vitro, protéine responsable du transport des droguesReference 72. Le CBD pourrait aussi inhiber les UDP-glucuronosyltransférases 1A9 et 2B7 et le CBN pourrait inhiber l'UDP-glucuronosyltransférase 1A9Reference 464 Cette propriété suggère possiblement un rôle supplémentaire pour ces cannabinoïdes en matière d'influence sur l'efficacité du médicament et la toxicité des médicaments coadministrésReference 72.
À la lumière de ces faits, les cliniciens doivent donc être au courant des autres médicaments pris par le patient, et surveiller soigneusement les patients qui utilisent le cannabis ou les cannabinoïdes parallèlement à d'autres médicaments.
Interaction entre les cannabinoïdes et les opioïdes
Les patients qui reçoivent du fentanyl (ou des opioïdes connexes) et des médicaments antipsychotiques (clozapine ou olanzapine) peuvent courir le risque d'éprouver des effets indésirables s'ils consomment du cannabis ou des cannabinoïdes en parallèleReference 467Reference 469Reference 470Reference 828Reference 1390.
Lors d'une étude, les sujets ont signalé une augmentation de l'intensité et de la durée du « high » ressenti lorsque l'on associait l'oxycodone à l'inhalation de cannabis à forte tenueur en THC vaporisé; cet effet n'avait pas été observé lorsque la morphine était associée à l'inhalation de cannabis vaporiséReference 276. De plus, dans cette étude, l'inhalation de cannabis vaporisé à haute teneur en THC était associée à une baisse statistiquement significative de la Cmax du sulfate de morphine à libération prolongée, et le délai avant d'atteindre le Cmax pour la morphine était aussi allongé, bien que le délai n'ait pas été très important. Il n'y a eu aucun changement dans l'AUC concernant les métabolites de la morphine ou dans le rapport des métabolites de la morphine et la morphine d'origine. Contrairement aux effets relevés avec le sulfate de morphine, l'inhalation de cannabis vaporisé à haute teneur en THC n'était pas associée à un changement de la pharmacocinétique de l'oxycodone.
Une étude clinique croisée, à double insu et contrôlée contre placebo a été menée afin de déterminer l'innocuité et la pharmacocinétique du CBD administré en combinaison au fentanyl intraveineuxReference 1391. On a recruté 17 participants sains pour l'étude à qui on a administré soit un placebo, une dose de 400 mg ou une dose de 800 mg de CBD oral (10 à 15 mg/kg) suivi d'une dose unique de fentanyl intraveineux de 0,5 ou 1,0 µg/kg. Aucun changement considérable à la pharmacocinétique n'a été observé dans les doses analysées d'administration combinée du CBD et de l'opiacé. De plus, les données du Systematic Assessment of Treatment Emergent Events (SAFTEE) étaient semblables entre les groupes de traitement et aucune dépression respiratoire ou complication cardiovasculaire n'est survenue au cours des analyses. Des événements indésirables mineurs ont été signalés par les participants pendant et immédiatement après les séances d'analyse et comprenaient : des étourdissements, l'endormissement, des démangeaisons ou des éruptions cutanées, des céphalées, des malaises abdominaux, la nausée, des vomissements et la diarrhée.
Données probantes tirées d'études pharmacogénétiques
Des études pharmacogénétiques ont suggéré que les patients homozygotes pour l'allèle CYP2C9*3 semblent posséder un métabolisme affaibli du THC et peuvent présenter des signes d'intoxication plus intenses que les hétérozygotes *1/*3 ou les homozygotes *1/*1Reference 461.
Données tirées des études cliniques
Une grande proportion d'études cliniques publiées sur le cannabis ou les médicaments cannabinoïdes d'ordonnance ont utilisé des populations de patients qui prenaient des médicaments concomitants pour toutes sortes de troubles, comme la douleur neuropathique de différentes étiologiesReference 58Reference 59Reference 190Reference 211Reference 217Reference 276Reference 277Reference 283Reference 383Reference 429Reference 591Reference 591Reference 592Reference 605Reference 818Reference 828, la douleur reliée au cancerReference 131Reference 279Reference 280, la fibromyalgieReference 179Reference 383Reference 587Reference 588, la douleur et la spasticité associées à la SPReference 274Reference 384Reference 428Reference 603Reference 681Reference 829, et les symptômes associés à la MH ou MPReference 241Reference 250.
Des exemples de médicaments couramment utilisés et que l'on observe dans les essais cliniques sur le cannabis ou les médicaments cannabinoïdes d'ordonnance (p. ex. dronabinol, nabilone et nabiximols) comprennent les médicaments AINS (p. ex. acétaminophène, inhibiteurs de la COX-2), le métamizole, les stéroïdes topiques, les relaxants musculaires, les opioïdes à durée courte ou prolongée (p. ex. codéine, morphine, hydromorphone, oxycodone, OxyContin, tramadol, fentanyl, méthadone), la kétamine, les anticonvulsivants (p. ex. gabapentine, prégabaline), les antidépresseurs (p. ex. tricycliques, inhibiteurs spécifiques du recaptage de la sérotonine, inhibiteurs du recaptage de la sérotonine et de la noradrénaline, inhibiteurs antagonistes du recaptage de la sérotonine) et les anxiolytiques.
Selon les études cliniques citées, l'utilisation concomitante du cannabis ou des médicaments cannabinoïdes d'ordonnance avec d'autres médicaments était déclarée comme étant bien tolérée, et de nombreux effets indésirables observés étaient typiquement associés aux effets psychotropes du cannabis et des cannabinoïdes (p. ex. défaillance transitoire des fonctions sensorielles et perceptives, trouble de la pensée, perturbation de la faculté d'attention, étourdissements, confusion, sédation, fatigue, euphorie, dysphorie, dépression, paranoïa, hallucinations, anxiété, maux de tête, mais aussi dessèchement de la bouche, hypotension artérielle, tachycardie, irritation de la gorge (lorsque fumé) et problèmes GI (nausée)).
Une étude indique que les patients atteints du sida pourraient courir un risque accru d'éprouver des résultats cardiovasculaires indésirables provoqués par des interactions entre le cannabis et les médicaments antirétroviraux comme le ritonavir, qui a été associé lui-même à des événements cardiovasculaires indésirablesReference 1392.
6.3 Tests de dépistage de drogues
En raison de la longue demi-vie d'élimination des cannabinoïdes et de leurs métabolites, les tests de dépistage de la drogue peuvent être positifs des semaines après avoir consommé du cannabis/des cannabinoïdesReference 1393Reference 1394 en fonction, entre autre, de la sensibilité du test utilisé, la fréquence d'utilisation et du moment lors duquel le test est effectué.
7.0 Effets indésirables
La signalisation d'effets néfastes associés à la consommation de cannabis et de produits du cannabis est importante afin de pouvoir recueillir des renseignements essentiels concernant les dangers potentiels du cannabis et des produits du cannabis à des fins médicales. Lorsque vous signalez des réactions indésirables, veuillez fournir autant de renseignements que possible, y compris le nom du producteur autorisé, le nom de la marque du produit, le nom de la souche et le numéro de lot du produit utilisé en plus de tout autre renseignement complémentaire sur le formulaire de déclaration des réactions indésirables. Fournir à Santé Canada l'information la plus complète possible au sujet des réactions indésirables aidera Santé Canada à effectuer tout suivi et à prendre toute action qui pourrait être nécessaire.
Les professionnels de la santé et les consommateurs sont invités et encouragés à soumettre des déclarations sur tous les effets indésirables associés au cannabis à des fins médicales au Programme Canada Vigilance des manières suivantes :
Déclarer en ligne, en appelant au numéro sans frais 1-866-234-2345, en remplissant un formulaire de déclaration des effets indésirables du Programme Canada Vigilance et en l'envoyant par télécopieur (sans frais) au
1-866-678-6789 ou par courrier à l'adresse :
Programme Canada Vigilance
Santé Canada
Indice de l'adresse 0701D
Ottawa, Ontario K1A 0K9
Vous trouverez des étiquettes affranchies, le formulaire de déclaration de Canada Vigilance et les lignes directrices pour la déclaration des effets indésirables sur le site Web de MedEffetMC Canada.
Il existe généralement beaucoup plus de renseignements dans les publications médicales à propos des effets indésirables associés à la consommation de cannabis à des fins non médicales qu'il n'en existe sur la consommation de cannabis à des fins thérapeutiques. Par conséquent, une grande partie des renseignements présentés ci-dessous par rapport aux effets indésirables entraînés par la consommation de cannabis proviennent d'études effectuées chez des personnes qui en consommaient à des fins non médicales. Moins de renseignements sur les effets indésirables associés à la consommation de cannabis à des fins thérapeutiques proviennent d'études cliniques, principalement en raison du nombre restreint d'études de ce genre qui ont été effectuées jusqu'à maintenant. De plus, bien qu'il existe certains renseignements sur les effets indésirables à court terme associés à la consommation de cannabis à des fins thérapeutiques, il y en a encore moins à propos des conséquences à long terme de la consommation de cannabis à des fins thérapeutiques, car la plupart des études cliniques disponibles étaient de courte durée.
Un examen systématique canadien sur les effets indésirables des médicaments cannabinoïdes d'ordonnance est arrivé à la conclusion que le taux d'effets indésirables non graves était presque deux fois plus élevé chez les patients qui utilisaient des médicaments cannabinoïdes d'ordonnance que chez les groupes témoinsReference 1395. Les effets indésirables les plus souvent cités en association avec l'utilisation de médicaments cannabinoïdes d'ordonnance (p. ex. dronabinol, nabilone, nabiximols) étaient les troubles du système nerveux, les troubles mentaux, les troubles GI, ainsi que les troubles vasculaires et cardiaques.
Une étude de cohorte multicentrique, prospective, sur l'innocuité menée auprès des patients utilisant du cannabis dans le cadre de leur régime de gestion de la douleur pour lutter contre une douleur chronique non cancéreuse révèle que l'utilisation du cannabis n'est pas associée à une augmentation de la fréquence d'événements indésirables graves par rapport aux témoins, mais qu'elle est associée à une augmentation de la fréquence d'événements indésirables non gravesReference 211. Dans cette étude, 216 patients souffrant d'une douleur chronique non cancéreuse (nociceptive, neuropathique ou les deux) et utilisant du cannabis et 215 patients du groupe témoin ayant une douleur chronique, mais qui ne consomment pas de cannabis, ont fait l'objet d'un suivi pendant une période d'un an et ont subi une évaluation afin de connaître la fréquence et le type d'événements indésirables associés à l'utilisation d'un produit végétal normalisé (CanniMed comportant 12,5 % de THC, < 0,5 % de CBD). Une proportion importante des sujets de l'étude prenaient des opioïdes, des antidépresseurs ou des anticonvulsivants. Près d'un tiers des sujets de l'étude ont déclaré en consommer exclusivement par la fumée, 44 % ont indiqué en consommer par la fumée et l'ingestion orale, 14 % ont déclaré vaporiser, fumer ou ingérer du cannabis par voie orale et un peu moins de 4 % ont indiqué en consommer uniquement par la fumée ou la vaporisation. Les catégories d'événements indésirables les plus courantes dans le groupe de traitement au cannabis étaient les troubles du système nerveux (20 %), les troubles GI (13,4 %) et les troubles respiratoires (12,6 %) et le taux relatif aux troubles du système nerveux, aux troubles respiratoires, aux infections et aux troubles psychiatriques était considérablement plus élevé dans le groupe traité au cannabis par rapport au groupe témoin. En outre, des événements légers (51 %) et modérés (48 %) étaient plus courants que les événements graves (10 %) dans le groupe traité au cannabis. La somnolence (0,6 %), l'amnésie (0,5 %), la toux (0,5 %), les nausées (0,5 %), les étourdissements (0,4 %), l'humeur euphorique (0,4 %), l'hyperhidrose (0,2 %) et la paranoïa (0,2 %) ont été évalués comme étant « certainement/très probablement » liés au traitement au cannabis. Fait intéressant, l'augmentation de la dose quotidienne de cannabis n'était pas associée à un risque plus élevé d'événements indésirables graves et non graves, bien que la quantité totale quotidienne de cannabis autorisée ait été fixée à 5 g par jour (la dose médiane quotidienne de cannabis était de 2,5 g par jour).
Un autre point important à considérer dans l'évaluation des effets indésirables associés à la consommation de cannabis est l'utilisation concomitante du tabac et de l'alcool, sans oublier les médicaments avec ou sans prescription, ou encore les drogues illicitesReference 141Reference 1396-Reference 1399 (consulter aussi la Section 6.2).
7.1 Carcinogenèse et mutagenèse
- Les données provenant d'études précliniques suggèrent que la fumée de cannabis contient plusieurs des mêmes cancérogènes et mutagènes que la fumée de tabac et que la fumée de cannabis est aussi mutagénique et cytotoxique, sinon plus, que la fumée de tabac.
- Toutefois, des données limitées et mitigées provenant d'études épidémiologiques ont jusqu'à présent été incapables de découvrir une association robuste et uniforme entre la consommation de cannabis et les différents types de cancer, à l'exception possible d'un lien entre la consommation de cannabis et le cancer des testicules (c.-à-d., tumeurs des cellules germinatives testiculaires).
Études précliniques
Sur le plan qualitatif, les condensats de fumée de cannabis contiennent un grand nombre des mêmes produits chimiques que la fumée du tabacReference 84. De plus, de nombreuses études in vitro ont fourni de solides données probantes selon lesquelles la fumée produite par le cannabis qui brûle est cancérogène (examinée enReference 136). Le potentiel cytotoxique et mutagène des condensats de fumée de cannabis a été comparé à son homologue, le tabac et contrairement aux condensats de fumée de tabac, ceux tirés de la fumée de cannabis semblaient plus cytotoxiques et mutagènes, alors que c'était l'inverse en ce qui a trait aux lésions cytogénétiquesReference 82. De plus, en ce qui concerne la fumée de cannabis ou de tabac, la phase particulaire était beaucoup plus cytotoxique que la phase gazeuse. Une analyse toxicogénomique globale, de suivi, comparant les condensats de fumée de cannabis et de tabac in vitro révèle que l'exposition aux condensats de fumée de tabac a été associée à l'expression de gènes intervenant dans le métabolisme des xénobiotiques, le stress oxydatif, l'inflammation et la réponse aux dommages à l'ADNReference 1400. En outre, ces mêmes voies et fonctions ont été aussi modifiées de manière significative après une exposition aux condensats de fumée de cannabis, ce qui suggère que les condensats de fumée de cannabis touchent les mêmes processus et fonctions moléculaires que ceux affectés par les condensats de fumée de tabac, bien que des différences notables entre les condensats de fumée de cannabis et ceux de tabac, en ce qui concerne les voies moléculaires touchées, aient été observéesReference 1400. Ensemble, ces études suggèrent que la fumée de cannabis ne peut pas être jugée « moins dangereuse » que la fumée de tabac. Toutefois, malgré des données in vitro persuasives, les données probantes épidémiologiques tentant de démontrer un lien entre la fumée de cannabis et le cancer demeurent surtout inconcluantes en raison de résultats contradictoires obtenus dans quelques études. Ci-dessous se retrouve un résumé des données indiquant des liens entre la consommation de cannabis et le cancer.
Études épidémiologiques
Une étude épidémiologique réalisée auprès de clients relativement jeunes d'une organisation de soins de santé intégrés (OSSI) a permis de constater une plus grande incidence de cancer de la prostate chez les hommes ayant fumé du cannabis et des substances autres que le tabacReference 355. Aucun autre lien n'a été relevé entre la consommation de cannabis et les autres types de cancer; toutefois, l'étude se limitait aux démographies de la clientèle de l'OSSI, et au seuil d'exposition au cannabis très faible ayant servi à définir les « consommateurs » dans l'étude.
Une étude de cas-témoins suggérait que fumer du cannabis pourrait augmenter le risque de cancer de la tête et du cou (rapport de probabilité = 2,6; IC = 1,1, 6,6) avec une forte association dose-réponse comparativement aux groupes témoins qui ne fumaient pasReference 356. Toutefois, les auteurs remarquent un grand nombre de limites dans leur étude, comme la sous-déclaration, la déclaration inexacte de la dose de cannabis, la sensibilité des essais et une faible puissance.
Une grande étude de cas-témoins axée sur la population incluant 1 212 cas de cancer incidents et 1 040 témoins appariés non atteints du cancer n'a su établir aucun lien important entre fumer du cannabis à long terme et le cancer du poumon et des voies aérodigestives supérieuresReference 357.
Toutefois, une étude de cas-témoins beaucoup plus petite réalisée auprès de jeunes adultes (≤ 55 ans) a examiné 79 cas de cancer du poumon par rapport à 324 témoins et a rapporté que le risque de cancer du poumon augmentait de 8 % (IC de 95 % = 2, 15 %) par « année-joint » (c.-à-d. une année au cours de laquelle une personne fume un joint par jour), après avoir apporté des modifications pour tenir compte de la fumée de cigaretteReference 358.
Une étude de cohorte longitudinale basée sur la population a examiné plus de 49 000 hommes âgés de 18 à 20 ans pour se pencher sur l'usage du cannabis et d'autres variables de santé pertinentes durant une conscription militaire en SuèdeReference 1401. Les participants ont fait l'objet d'un suivi au cours d'une période de plus de 40 ans afin de déterminer les cas de cancer du poumon incidents dans les registres médicaux interconnectés à l'échelle nationale. L'analyse révèle que la consommation élevée de cannabis (mais pas celle de personnes qui avaient déjà consommé au moins une fois du cannabis) présente un lien significatif avec un risque deux fois plus élevé (rapport des risques = 2,12, IC à 95 % = 1,08 à 4,14) d'avoir un cancer du poumon au cours de la période de suivi de 40 ans, même après un ajustement statistique pour tenir compte de la consommation de tabac, d'alcool, de troubles respiratoires et du statut socio-économique au départ. Cependant, la grande majorité de personnes déclarant consommer du cannabis ont aussi signalé consommer du tabac et il n'y a pas eu d'indication claire de l'existence d'une relation dose-réponse entre la fréquence de consommation de cannabis et les cas de cancer du poumon. En outre, l'étude ne comprenait pas une évaluation détaillée des tendances de consommation du cannabis et du tabac précédant le processus de conscription au départ et elle ne contenait pas non plus de renseignements sur la consommation de tabac et de cannabis après la conscription.
Une méta-analyse récente de 4 études de cohortes et de 30 études de contrôle de cas (11 études sur les cancers des voies aérodigestives supérieures, 6 études sur le cancer du poumon, 3 études sur les tumeurs des cellules germinatives testiculaires, 6 études sur les cancers pédiatriques, 1 étude sur tous les types de cancers, une étude sur le cancer anal, 1 étude sur le cancer du pénis, 2 études sur le lymphome non hodgkinien, 1 étude sur le gliome principal malin, 1 étude sur le cancer de la vessie et 1 étude sur la maladie de Kaposi) a examiné la corrélation entre la consommation de cannabis et les risques associés aux différents cancersReference 1402. La conclusion de la méta-analyse est que pour les cancers de la tête et du cou, les données étaient contradictoires, mais pourraient être cohérentes avec aucune association ou avec des directions d'association opposées selon les sous-groupes de populations. Dans le cas du cancer du poumon, bien que les auteurs expriment qu'il était généralement difficile d'éliminer l'effet résiduel de confusion attribuable au tabagisme, les auteurs suggèrent qu'en général les études menées jusqu'à présent ne suggèrent aucune association entre la consommation de cannabis et ce cancer; les auteurs désiraient toutefois prudemment mettre l'accent sur le fait qu'il est fondamentalement difficile d'affirmer l'absence d'association. À la lumière des nombreuses sources de données suggérant que fumer du cannabis pourrait être un facteur de risque du développement du cancer (p. ex., présence de quantité considérable de cancérogènes dans la fumée de cannabis, risques élevés associés à la topologie de la consommation de cannabis fumé et les preuves cliniques et précliniques de lésions précancéreuses) l'absence d'une association claire à la consommation de cannabis soulève de nombreuses questions intéressantes concernant les raisons de l'absence d'associations, y compris le rôle potentiel des cannabinoïdes en tant qu'agent antitumoral. Finalement, la méta-analyse a atteint la conclusion que les trois études de contrôle de cas sur le cancer des testicules avaient déclarée des observations semblables avec un risque plus élevé observé pour la fréquence de consommation et la durée d'utilisation modeste, tandis que pour d'autres cancers, comme celui de la vessie et les cancers pédiatriques, il est l'opinion des auteurs qu'il n'existe pas assez de données afin de pouvoir tirer des conclusions solides d'une association à la consommation de cannabis.
Malgré les données probantes contradictoires concernant le potentiel cancérogène de la fumée de cannabis chez les humains, il est conseillé de limiter (ou éliminer) le degré auquel une personne fume le cannabis. De plus, des études épidémiologiques bien contrôlées sont nécessaires afin de mieux établir s'il existe une relation de causalité entre la fumée de cannabis et la carcinogenèse dans les populations humaines.
En dernier lieu, dans le cas des patients atteints de cancer, les risques possibles de carcinogenèse et de mutagenèse associés à la fumée de cannabis doivent être évalués par rapport à tout avantage thérapeutique possible pour cette population de patients; les voies d'administration autres que de le fumer (p. ex. vaporisation, administration orale) mériteraient sérieusement d'être étudiées. Puisque la vaporisation constitue un processus à température plus basse par rapport à la pyrolyse (c.-à-d. fumer), la vaporisation semble associée à la formation d'une plus petite quantité de sous-produits toxiques comme le monoxyde de carbone, les hydrocarbures aromatiques polycycliques et le goudron, ainsi qu'une meilleure extraction de Δ9-THC de la matière de cannabisReference 399Reference 408-Reference 411. Ensemble, ces études appuient que, pour des raisons d'innocuité, l'on devrait éviter de fumer comme voie d'administration préférable des cannabinoïdes et les autres méthodes d'administration (voie orale, préparations oromucosales, vaporisation ou administration rectale) devraient préférablement être considérées puisque celles-ci pourraient être, à certains égards, moins nocives que fumer.
7.2 Appareil respiratoire
- Des données provenant d'études précliniques suggèrent que la fumée de cannabis contient plusieurs des mêmes irritants pulmonaires et toxines que la fumée de tabac et même, dans certains cas, de plus grandes quantités de certaines de ces substances.
- Les études de cas suggèrent que fumer du cannabis est associé à une gamme de changements histopathologiques des tissus pulmonaires, à une gamme de symptômes respiratoires semblables à ceux observés chez les fumeurs de tabac et des changements dans certaines fonctions pulmonaires dans le cas d'utilisation fréquente à long terme.
- L'association entre l'utilisation intensive et fréquente du cannabis fumé (sans tabac) et la maladie pulmonaire obstructive chronique est incertaine, mais, s'il en existe une, elle est probablement faible.
Un examen des effets de la consommation régulière de cannabis fumé sur les voies respiratoires a signalé une augmentation de la prévalence de la toux chronique et de la production d'expectorations, de la respiration sifflante et de l'essoufflement et une augmentation de l'incidence d'épisodes de bronchite aiguë ou de consultations au cabinet médical dues à une maladie respiratoire aiguëReference 1403. Cependant, à l'heure actuelle, aucun lien positif concluant ne peut être établi entre la consommation de cannabis fumé et l'incidence de cancer du poumon ou des voies respiratoires supérieures, malgré la présence de composés procancérogènes dans le cannabis fuméReference 1402Reference 1403 (consulter aussi la Section 7.1). Il existe également des rapports de cas isolés sur l'aspergillose pulmonaire chez les patients immunodéprimés fumant du cannabis, des rapports sur la tuberculose pulmonaire chez ceux fumant du cannabis à l'aide d'une pipe à eau contaminée, ainsi que des rapports sur le pneumothorax, le pneumomédiastin et les bulles dans les poumons chez les grands fumeurs de cannabisReference 1403. Dans l'ensemble, la synthèse des données fournies suggère que les risques de complications pulmonaires découlant de la consommation régulière de cannabis semblent être relativement moins importants que ceux associés à la consommation de tabac, bien que cela ne signifie pas que la consommation de cannabis puisse être jugée « sécuritaire » ou plus sécuritaire que la consommation de tabac. De plus, tous les risques associés à la consommation de cannabis fumé doivent être évalués par rapport à tous les effets thérapeutiques potentiels du cannabis.
Voici un résumé de la documentation sur les effets du cannabis fumé sur les voies respiratoires.
On indique que les différences entre les techniques utilisées par les fumeurs de cannabis et les fumeurs de tabac (c.-à-d. bouffées plus longues, inhalations plus profondes et retenue plus longue de la respiration) entraînent des niveaux trois ou quatre fois supérieurs de goudron et cinq fois supérieurs de monoxyde de carbone conservé dans les poumons en fumant le cannabis par rapport au tabacReference 1403Reference 1404.
Une comparaison systématique de la composition ordinaire de la fumée de cannabis (12,5 % THC, < 0,5 % CBD) et des cigarettes (préparées de la même façon et consommées de manière identique) selon deux différents ensembles de conditions pour fumer (« standard » et « extrême ») a été signaléeReference 84. La condition « standard » reflète les conditions typiques concernant le tabagisme, alors que la condition « extrême » concerne celles observées typiquement chez les fumeurs de cannabis. L'ammoniac contenu dans la fumée ordinaire de cannabis était 20 fois supérieur à celui retrouvé dans la fumée de tabac, et les oxydes d'azote et l'acide cyanhydrique étaient de trois à cinq fois plus élevés dans la fumée de cannabis que dans la fumée de tabac. Le monoxyde de carbone était beaucoup plus faible dans la fumée ordinaire de cannabis, dans les deux conditions. Le goudron était beaucoup plus élevé sur le plan statistique dans la fumée ordinaire de cannabis, mais seulement dans la condition « extrême ».
Les échantillons de biopsies de la muqueuse tirés des fumeurs de cannabis chroniques qui déclaraient ne fumer que du cannabis présentaient un grand nombre de changements histopathologiques, notamment une hyperplasie des cellules basales, une stratification, une hyperplasie des cellules caliciformes, une désorganisation cellulaire, une inflammation, un épaississement de la membrane basale et une métaplasie des cellules squameusesReference 360Reference 1403. Toutefois, l'étude utilisait un petit nombre de sujets et se fiait à l'exactitude et à l'intégrité de la mémoire des sujets pour établir un état de fumeur, de même que la fréquence et la durée de leur consommation.
Des études épidémiologiques ont relevé certains changements bénins dans la fonction pulmonaire, surtout chez les grands fumeurs de cannabis, notamment une baisse du VEMS, une augmentation de la résistance aérienne et une baisse de la conductance aérienneReference 364-Reference 366. Les grands fumeurs de cannabis chroniques présentaient des symptômes de bronchite, notamment une respiration sifflante, la production de mucosité et une toux chroniqueReference 141Reference 1405. Tous les changements étaient plus évidents chez les grands fumeurs chroniques, définis comme ceux ayant fumé plus de trois joints par jour pendant 25 ansReference 355Reference 1406, bien que l'on ait aussi observé des signes de symptômes respiratoires mesurables (p. ex. baisse du rapport de VEMS/CVF) chez des jeunes dépendants au cannabis dont les habitudes de consommation étaient comparables à celles des fumeurs de tabac qui consommaient une à dix cigarettes par jourReference 1407.
Bien que le risque de contracter une maladie pulmonaire obstructive chronique au moyen d'une utilisation à long terme de cannabis et/ou une dépendance a été déclaré possiblement aussi important que chez les consommateurs de tabacReference 1407, une étude longitudinale qui a recueilli les mesures répétées de la fonction pulmonaire et du tabagisme sur une période de 20 ans dans une cohorte de 5 115 hommes et femmes dans quatre villes des États-Unis (Coronary Artery Risk Development In Young Adults study, c.-à-d. l'étude CARDIA) dresse un portrait plus complexe. L'étude a relevé une association non linéaire entre la fumée de cannabis et la fonction pulmonaireReference 367. En comparaison, l'exposition au tabac (actuelle et au cours de la vie) était associée de manière linéaire à un VEMS et une CVF plus faibles. Les concentrations faibles de consommation cumulative de cannabis n'étaient pas associées à des effets indésirables sur la fonction pulmonaire. En fait, dans ces concentrations, la consommation de cannabis était associée à une augmentation du VEMS et de la CVF. À sept « années-joints » (une « année-joint » étant définie comme fumer un joint/jour, 365 jours/année) d'exposition au cours d'une vie ou moins, il n'y avait aucun signe de fonction pulmonaire diminuée. Toutefois, la consommation élevée et chronique de cannabis (> ~30 années-joints ou > ~25 consommations par mois) était associée à une accélération du déclin de la fonction pulmonaire (VEMS, mais non la CVF).
Une étude d'observation transversale menée auprès de 500 personnes dans une population de pratique générale (248 personnes fumant uniquement du tabac, 252 personnes fumant du cannabis et du tabac) a signalé que les personnes indiquant fumer du cannabis (et du tabac) ont déclaré elles-mêmes un plus grand nombre de symptômes respiratoires (c.-à-d. expectoration, mucosités, respiration sifflante) que les personnes déclarant fumer uniquement du tabacReference 368. La plupart des participants de l'étude ayant déclaré fumer du cannabis ont affirmé qu'ils fumaient de la résine de cannabis (dans un joint avec du tabac), un groupe plus petit ayant indiqué fumer du cannabis sous forme végétale. Chaque année-joint supplémentaire d'usage de cannabis était associée à une petite augmentation de 0,3 % (IC à 95 % = 0 à 0,5) de la prévalence de la maladie pulmonaire obstructive chronique. Plus d'études sont requises pour définir clairement les changements complexes de la fonction pulmonaire que l'on retrouve chez les fumeurs de cannabis et pour établir s'il existe une relation de cause à effet entre fumer du cannabis et le développement de maladie du poumon, notamment la maladie pulmonaire obstructive chronique.
Fumer du cannabis peut aussi augmenter le risque de contracter des infections pulmonaires chez les consommateurs chroniquesReference 1408 par exposition à des organismes infectieux comme les champignons et les moisissures que l'on peut retrouver dans le matériel végétalReference 1409 ou encore en affaiblissant les défenses naturelles de l'hôteReference 1410. Toutefois, il est aussi nécessaire d'effectuer plus d'études épidémiologiques afin d'établir une relation de causalité entre la fumée de cannabis et les infections respiratoires.
Vaporiser le cannabis séché pourrait constituer une solution de rechange plutôt que de le fumer, bien que des études soient nécessaires afin de déterminer si la vaporisation à long-terme entraîne des effets indésirables sur la santé des poumons ou la fonction pulmonaire. De plus, un autre élément qui complique encore la situation est l'apparition de cigarettes électroniques au cannabis (« e-cigarettes » ou « e-joints ») contenant du THC et/ou CBD dans divers solvants tels que le propylène glycol, le glycérol ou les deuxReference 1411-Reference 1413. Malgré le fait qu'elles soient fréquemment annoncées comme étant une alternative plus saine que de fumer, il existe beaucoup d'incertitudes concernant l'impact des cigarettes électroniques sur la santé et la qualité de l'air intérieurReference 1414. Les études ont signalé que les aérosols produits par les cigarettes électroniques peuvent contenir des cancérogènes comme le formaldéhyde, l'acétaldéhyde et l'acroléine et ce surtout dans les cas où des appareils ou des réglages à haute tension sont utilisés, bien que même aux réglages de fonctionnement normal les niveaux de formaldéhyde, par exemple, puissent être élevés malgré l'absence de soi-disant « doses à sec » ou « bouffées à sec » caractérisées par un goût désagréable que les utilisateurs plus chevronnés peuvent détecterReference 1415. Des paramètres de concept et d'exploitation différents ont des effets considérables sur les niveaux d'émission des composés toxiques, y compris le vaporisateur utilisé et la puissance de sortie de la pile et ces éléments déterminent ensuite la température de la bobine et de la vapeurReference 1416. On estime que ces émissions sont causées par la décomposition thermique du propylène glycol ou du glycérolReference 1417Reference 1418 et que la quantité de formaldéhyde et d'autres carbonyles augmentent selon la puissanceReference 1417-Reference 1419 et la température de la bobineReference 1420. Donc, les températures trop élevées et le contact prolongé de la bobine thermique et du liquide à vapoter doivent être évités afin de prévenir la formation de sous-produits pyrolitiques toxiques, bien que les réglages plus faibles peuvent aussi produire certains de ces sous-produits toxiquesReference 1411. L'étendue de l'exposition aux substances toxiques qui pourrait se produire au cours de l'utilisation normale d'une cigarette électronique est actuellement incertaine, bien qu'une étude des marqueurs biologiques urinaires suggère que l'exposition à d'autres carbonyles réactifs (p. ex., l'acroléine et le crotonaldéhyde) était considérablement plus faible parmi les vapoteurs que parmi les fumeurs de tabacReference 1421. À l'exception de l'inhalation des sous-produits cancérogènes déjà mentionnés, les vapoteurs actifs pourraient aussi inhaler des concentrations relativement élevées de particules de propylèneglycol, de glycérol et d'aérosolsReference 1414. Finalement, il existe quelques rapports de cas de stéatose pulmonaire exogène, de pneumonies éosinophiliques et de toxicité bronchiale subaïgue associés au vapotage de liquides à vapoter à base de glycérolReference 1422-Reference 1424. Pour plus de renseignements sur la vaporisation, veuillez consulter les Sections 1.1.1, 1.1.2, 2.2.1.2, 3.4, 4.7.2.2, 4.7.2.3 et le Tableau 4.
7.3 Système immunitaire
- Les études précliniques suggèrent que certains cannabinoïdes possèdent une grande variété d'effets complexes sur les fonctions du système immunitaire (pro- ou anti-inflammatoire, stimulant ou inhibant).
- Les études cliniques et par observation limitées des effets du cannabis sur le nombre de cellules immunitaires et sur la charge virale plasmatique du VIH sont mixtes, de même que les données concernant l'usage fréquent de cannabis (c.-à-d. quotidient/TUC) et l'adhésion à la TAR.
- Des preuves limitées, mais croissantes provenant d'études de cas suggèrent aussi que l'utilisation de cannabis est associé à des réactions de types allergiques ou d'hypersensibilité.
Études précliniques
Les données probantes tirées d'études in vivo et in vitro suggèrent que le SEC possède des rôles complexes et apparemment dichotomiques sur la fonction du système immunitaireReference 26. Premièrement, on sait que les récepteurs CB1 et CB2 s'expriment dans divers immunocytes (lymphocytes B, monocytes, neutrophiles, lymphocytes T, macrophages, mastocytes), l'expression du récepteur CB2 étant généralement plus abondante que l'expression du récepteur CB1; le rapport d'expression du récepteur CB2 et CB1 varie de 10 à 100 : 1 respectivement, selon le type de cellule immunitaire en questionReference 26Reference 27. En outre, l'expression du récepteur CB2 est la plus abondante dans les cellules B, suivies des cellules NK, des monocytes, des neutrophiles et enfin, des cellules TReference 1425. Deuxièmement, les cellules immunitaires ont aussi la capacité de synthétiser, de sécréter, de transporter et de cataboliser les endocannabinoïdesReference 26. Troisièmement, bien que l'on semble généralement associer la stimulation du récepteur CB2 à des effets immunosuppressifs, l'activation du récepteur CB1 semble être associée à un effet immunostimulateur contraireReference 26. Quatrièmement, bien qu'il ait été démontré que certains cannabinoïdes modulent la production de cytokines pro- ou anti-inflammatoires, on a aussi rapporté que de leur côté, les cytokines pro-inflammatoires (comme TNF-α) influencent le fonctionnement du SEC en régulant positivement l'expression de l'ARNm et les niveaux de protéines du récepteur CB1 et CB2Reference 27. Par conséquent, il semble y avoir un certain niveau de communication réciproque entre le SEC et le système immunitaire. Cinquièmement, comme c'est le cas pour certains de ses autres effets, le Δ9-THC semble avoir un effet biphasique sur la fonction du système immunitaire. Les doses faibles de Δ9-THC semblent avoir des effets stimulateurs ou pro-inflammatoires, alors que les doses plus élevées semblent avoir des effets inhibitoires ou immunosuppressifsReference 389. On a rapporté que le Δ9-THC et le CBD modulent tous deux l'immunité à médiation cellulaire et l'immunité humorale au moyen de mécanismes dépendants et indépendants du récepteur CBReference 389Reference 1426Reference 1427. Les cannabinoïdes visent diverses voies de signalisation et transcriptionnelles, ce qui entraîne, dans certains cas, l'inhibition de la libération de cytokines pro-inflammatoires (p. ex. IL-1β, IL-6, IFN-β) et/ou la stimulation de la libération de cytokines anti-inflammatoires (p. ex. IL-4, IL-5, IL-10, IL-13)Reference 27Reference 389. Le CBD semble aussi stimuler une modification de l'équilibre immunitaire Th1/Th2Reference 1426.
Bien que dans certaines circonstances, les cannabinoïdes semblent posséder des effets anti-inflammatoires et immunosuppresseurs qui pourraient être avantageux dans le cas des des conditions pathologiques ayant des caractéristiques inflammatoires, ces effects bénéfiques pourraient, par exemple, devenir problématiques dans le contexte de réactions de défense essentielles en cas d'infectionReference 26. Par exemple, les expériences in vitro ainsi qu'in vivo effectuées chez les animaux suggèrent que les cannabinoïdes (c.-à-d. THC) ont une influence sur les interactions entre les virus et les cellules hôtesReference 1428. Le traitement cannabinoïde (c.-à-d. THC) a été associé à une augmentation de la réplication virale du virus de l'herpès simplex 2, du VIH-1, du virus associé au sarcome de Kaposi, de l'influenza et du virus de la stomatite vésiculaire ou a été associé à une augmentation des mesures de substitution d'infection dans ces modèles expérimentaux ce qui indique qu'au moins certains cannabinoïdes (THC) pourraient avoir un effet néfaste en ce qui concerne les infections viralesReference 1425Reference 1429-Reference 1436. Une autre étude a aussi démontré que l'exposition chronique au THC diminue l'efficacité de la réponse immunitaire anamnestique à une infection par Candida albicans chez la sourisReference 1437. Cependant, chez les macaques rhésus mâles, l'administration chronique de THC (0,32 mg/kg, b.i.d.) est associée à une diminution de la mortalité prématurée due à une infection par le VIS (virus de l'immunodéficience simiesque), à une atténuation de la charge virale dans le plasma, le LCR, et l'intestin, à une diminution des réponses inflammatoires GI, à une diminution de la réplication virale et à une rétention modeste de la masse corporelleReference 1438-Reference 1440. Des effets protecteurs similaires n'ont toutefois pas été observés chez les macaques femellesReference 1441, ce qui semble indiquer un effet lié au sexe.
Ainsi, les données précliniques recueillies indiquent que les cannabinoïdes pourraient systématiquement influencer les infections virales par l'intermédiaire d'une série de mécanismes tels que la régulation de l'immunité de l'hôte et des réponses inflammatoires, le métabolisme cellulaire et la capacité de pénétrer dans les cellules hôtes, de s'intégrer dans le génome hôte, de se répliquer, d'être libéré ainsi que par l'intermédiaire de nouveaux mécanismes régulateurs de l'épigénome et des micro-ARNReference 1429. De plus, l'ensemble des renseignements disponibles suggère que les différences relevées dans les effets observés des cannabinoïdes sur la fonction du système immunitaire (c.-à-d. immunosuppressif par rapport à immunostimulateur) pourraient s'expliquer par des différences dans les voies/méthodes d'administration (fumée, orale ou autre voie), la durée d'exposition aux cannabinoïdes, la dose et le type de cannabinoïde utilisé et les récepteurs visés de préférence, et aussi par des différences entre les espèces, les protocoles expérimentaux et les mesures des résultats utilisées, et de plus, pour les études cliniques (voir ci-dessous), l'état de santé/la condition médicale des sujets humainsReference 389.
Études cliniques
Les effets de la fumée de cannabis ou du THC sur le système immunitaire humain ont fait l'objet d'études, quoique seulement de manière très limitée et les preuves sont mixtes. Bien que les études in vitro avec des cellules immunitaires humaines suggèrent que le THC possède des propriétés immunosuppressivesReference 1442-Reference 1448, les données tirées d'études cliniques sur le cannabis fumé et les cannabinoïdes psychoactifs (THC oral, THC/CBD oral) ne semblent pas démontrer une augmentation des risques d'infections ou d'infestations chez les patients qui consomment du cannabis fumé ou des cannabinoïdesReference 211Reference 1395.
Cannabis et dénombrement des cellules immunitaires
Une préoccupation importante concernant les personnes immunodéprimées, telles que les fumeurs de cannabis séropositifs ou les patients (qui fument) atteints d'un cancer et en chimiothérapie, est qu'ils pourraient être plus vulnérables que les autres fumeurs de cannabis à ses effets immunosuppressifs ou qu'ils risquent de s'exposer aux organismes infectieux associés au matériel végétal du cannabisReference 636. Un ensemble d'études a abordé la première préoccupation en partie.
Dans une étude, des patients séropositifs recevant un TAR ont été répartis aléatoirement de sorte qu'ils fumaient du cannabis ou recevaient du dronabinol par voie orale. Les résulats de cette étude ne révèlent aucun changement dans le nombre de lymphocytes T CD4+ et CD8+, de lymphocytes B ou de cellules NK et divers autres paramètres comparativement au groupe recevant un placebo sur une période d'étude de 21 joursReference 1449. Une étude longitudinale a été effectuée chez 481 hommes atteints du VIH qui ont consommé du cannabis. Ceux-ci ont fait l'objet d'un suivi pendant une moyenne de cinq ans, et l'étude a conclu que bien que l'on associe habituellement la consommation de cannabis à un nombre de cellules CD4+ plus élevé chez les hommes infectés et les témoins, aucune association significative sur le plan clinique, indésirable ou non, entre la consommation de cannabis, le nombre et les pourcentages de lymphocytes T n'a pu être établieReference 1450. La consommation de cannabis n'a pas non plus été associée à un taux accru de progression vers le sida chez les personnes infectées par le VIHReference 1451. Dans une autre étude, fumer du cannabis a été associé à des concentrations plasmatiques plus faibles des inhibiteurs de la protéase, l'indinavir et le nelfinavir; tandis que le dronabinol et le placebo n'ont eu aucun effetReference 467. Toutefois, la baisse des niveaux plasmatiques d'inhibiteur de la protéase n'a pas été associée à une charge virale accrue ou à des changements dans le nombre de cellules CD4+ ou CD8+Reference 650. En outre, une étude de cohorte rétrospective, longitudinale et d'observation menée chez des consommateurs de drogues illicites n'ayant jamais reçu de TAR révèle qu'une consommation au moins quotidienne de cannabis a été associée à une charge virale d'ARN de VIH-1 dans le plasma plus faible au cours de la première année suivant la séroconversionReference 1452. Dans une autre étude, des consommateurs de cannabis séropositifs (consommation légère ou modérée à consommation importante) ont présenté un nombre de cellules CD4 dans le plasma plus élevé et une charge virale plus faible que les personnes séropositives ne consommant pas de cannabis; le statut du TAR des sujets n'était pas connuReference 1453. Par contre, une étude d'observation menée chez 157 hommes ayant des relations sexuelles avec d'autres hommes a constaté que la consommation de cannabis lors de rapports sexuels était fortement liée à une probabilité plus élevée de charge virale d'ARN de VIH dans le plasma séminal, malgré le succès du TAR combinéReference 1454. Chez les humains, fumer du cannabis a aussi été associé à des échecs thérapeutiques chez les patients atteints d'hépatite C chroniqueReference 1397Reference 1455.
Cannabis et adhésion aux traitements antirétroviraux
Une étude transversale a examiné l'association entre le statut d'utilisation du cannabis et l'adhésion au TAR, ainsi que l'association entre le statut d'utilisation du cannabis, les symptômes de VIH et les effets secondaires associés au TAR auprès d'un échantillon de personnes séropositivesReference 1456. L'étude a signalé que les sujets manifestant un TUC respectaient beaucoup moins le traitement que les personnes qui déclaraient consommer du cannabis une fois par semaine ou plus, mais moins d'une fois par jour ou pas du tout. Les personnes atteintes d'un TUC possédaient aussi une charge virale plus élevée que celles qui consommaient le cannabis moins d'une fois par jour, mais au moins une fois par semaine, ainsi que celles qui n'en consommaient pas du tout; le nombre de CD4 absolu n'était pas significativenent différent entre les groupes. De plus, les sujets atteints d'un TUC ont signalé des symptômes du VIH et/ou des effets secondaires de médicaments beaucoup plus fréquents et plus graves que ceux qui en consommaient moins d'une fois par jour, mais au moins une fois par semaine, ou ceux qui avaient déclaré ne pas avoir du tout consommé de cannabis. Une limite de cette étude est sa nature transversale, ce qui empêche d'établir un lien de cause à effet.
Par contre, une étude de cohorte prospective, à long terme et d'observation (ACCESS [AIDS Care Cohort to evaluate Exposure to Survival Services]) qui a examiné la relation entre la consommation de cannabis de forte intensité et le respect d'un TAR parmi 523 consommateurs de drogues illicites séropositifs révèle qu'une consommation au moins quotidienne ou plus fréquente n'a pas été associée au respect d'un TARReference 1457.
CBD et maladie du greffon contre l'hôte
Une étude clinique de phase II, sans répartition aléatoire, non contrôlée et sans insu portant sur les effets du CBD sur la prévention de la maladie du greffon contre l'hôte (MGCH) après une greffe de cellules hématopoïétiques allogènes indique que l'administration par voie orale de CBD (300 mg/jour) à compter de sept jours avant la greffe et jusqu'à 30 jours après la greffe est associée à une réduction de l'incidence de la MGCH aiguë lorsqu'elle est associée à la prophylaxie standard pour prévenir la MGCH (c.-à-d. cyclosporine et méthotrexate)Reference 1458. De plus, aucune toxicité de Grade 3 ou 4 n'a été attribuée au traitement au CBD. Quarante-huit patients adultes ont participé à cette étude clinique, 38 patients étant atteints d'une leucémie aiguë ou du syndrome myélodysplasique et 35 patients ayant reçu un conditionnement myéloablatif. Les limites de l'étude comprennent notamment le fait qu'elle ne porte que sur un seul groupe et qu'elle est basée sur une comparaison rétrospective avec des témoins historiques. Néanmoins, les conclusions de cette étude indiquent que le CBD pourrait avoir des propriétés immunosuppressives significatives. Des recherches supplémentaires sont nécessaires.
Hypersensibilité et réactions allergiques
Il existe un nombre toujours plus élevé de déclarations d'hypersensibilité ou de réactions allergiques au cannabisReference 362Reference 390Reference 391Reference 1351Reference 1352. Les symptômes cliniques de telles réactions ont été notamment les suivants : maux de gorge, congestion nasale, rhinite, conjonctivite, pharyngite, allergie alimentaire, eczéma, urticaire de contact, anaphylaxie, respiration sifflante, dyspnée, angio-œdème palpébral et larmoiementReference 362Reference 390Reference 1351. Chez les consommateurs chroniques et de doses élevées, des manifestations plus graves de bronchite et d'asthme avec une capacité vitale réduite ont été observéesReference 1351. En outre, l'allergie au cannabis a aussi été associée à des allergies croisées à d'autres plantes et fluides comme le blé, le tabac, le latex, les noix et certains fruits et légumes (p. ex. la tomate, la cerise, la mandarine, la banane, les agrumes, le pamplemousse, le poivron, la figue, la peau de la pêche, la pomme, le houblon, le raisin)Reference 362Reference 390Reference 391.
7.4 Système reproducteur et endocrinien
- Les données précliniques suggèrent que certains cannabinoïdes peuvent avoir des effets négatifs sur de nombreuses mesures de la santé reproductive. De plus, les données limitées d'études par observation des humains sur le cannabis semblent appuyer les données de certaines des études précliniques.
- Les données des études par observations d'humains suggèrent aussi une association selon la dose et l'âge entre la consommation de cannabis et les tumeurs des cellules germinatives testiculaires.
- Les données précliniques suggèrent clairement que l'exposition in utero à certains cannabinoïdes est associée à de nombreux dommages à court et à long terme sur la progéniture en développement.
- Toutefois, les données provenant d'études par observation des humains sont complexes et suggèrent que bien que des facteurs de confusion pourraient expliquer les associations entre la consommation intensive de cannabis pendant la grossesse et les effets néfastes néonataux ou périnataux, l'utilisation intensive de cannabis pendant la grossesse est associée à une reduction du poids à la naissance.
Rôle du système endocannabinoïde dans la physiologie sexuelle
Le récepteur CB1 s'exprime grandement dans diverses structures cérébrales comme le striatum, l'hippocampe et le cervelet, de même que l'amygdale, le mésencéphale et le cortex cérébral-des structures impliquées dans la régulation des différents aspects des comportements reproductifs, sexuels et des fonctions endocriniennesReference 394. Par exemple, les récepteurs CB1 situés dans le striatum et le cervelet peuvent réguler l'activité et la fonction motrice; les récepteurs CB1 situés dans les structures corticolimbiques (p. ex. le cortex préfrontal, l'amygdale et l'hippocampe) peuvent réguler la réponse au stress et le comportement émotif; les récepteurs CB1 situés dans le noyau raphé dorsal et l'aire tegmentale ventrale peuvent réguler les réflexes génitaux, la motivation et l'inhibition sexuelle; en dernier lieu, les récepteurs CB1 exprimés dans l'hypothalamus et l'hypophyse peuvent moduler les effets endocriniens de l'axe HHS soit directement par modulation de l'hormone de libération des gonadotrophines, soit indirectement par d'autres voiesReference 394Reference 1459.
La modulation de l'axe HHS médiée par le récepteur CB1 entraîne la suppression de l'hormone lutéinisante, de la thyréostimuline, de l'hormone de croissance et de la libération de prolactine par l'hypophyse, alors que les effets sur l'hormone follicostimulante semblent indiquer une suppression probable de la libérationReference 392Reference 396Reference 1460Reference 1461. Chez l'animal, ces effets sont accompagnés de changements dans la fonction reproductive et du comportement reproducteur, notamment l'anovulation, des baisses dans les concentrations plasmatiques de testostérone, des changements dégénératifs chez les spermatocytes et les spermatides, et une diminution possible de comportement copulatoireReference 1459Reference 1460. En plus des rôles des récepteurs cannabinoïdes dans le cerveau, le système reproducteur mâle ou femelle contient aussi un SEC, et de plus en plus de preuves expérimentales suggèrent des rôles importants pour le SEC dans la régulation des différentes fonctions reproductives comme la folliculogenèse, la spermatogenèse, l'ovulation, la fertilisation, le transit tubaire, l'implantation, le développement embryonnaire, la grossesse et l'accouchement (examiné enReference 39Reference 1371). La régulation étroite du tonus de signalisation des endocannabinoïdes aux premiers stades de la grossesse semble être essentielle pour assurer le succès de reproduction chez la femmeReference 1371.
Effets du cannabis sur le comportement sexuel humain
Il existe un certain manque de données en ce qui a trait aux effets du cannabis ou des cannabinoïdes sur le comportement sexuel humain. Un article de revue a résumé les quelques études dont on dispose sur le sujetReference 394. Il a conclu qu'en général, les effets du cannabis sur le fonctionnement et le comportement sexuel semblent liés à la dose. En ce qui concerne les femmes, les renseignements disponibles suggèrent des effets bénéfiques sur le comportement et le fonctionnement sexuels (p. ex. déclarations de sensibilité accrue au toucher, plus grande relaxation et une augmentation correspondante de la réceptivité sexuelle) à dose faible ou modérée et des réactions possiblement inverses aux doses plus élevées. En ce qui concerne les hommes, les renseignements disponibles suggèrent que la consommation de cannabis à dose faible ou modérée peut faciliter le désir sexuel, de même que l'activité sexuelle, mais que les doses plus élevées ou la consommation plus fréquente ou chronique peuvent inhiber la motivation sexuelle, ainsi que la fonction érectile. Les résultats obtenus à l'aide d'études animales semblent refléter quelques-unes de ces conclusions, bien que l'on ait relevé des exceptions. Même si on ne comprend toujours pas complètement les effets du cannabis sur le comportement sexuel humain, certains de ses effets bénéfiques déclarés ont été liés spéculativement à ses propriétés psychoactives (p. ex. augmentation de la sensibilité/perception tactile ou ralentissement de la perception temporelle), et/ou à une perte des inhibitions et à un état de relaxation accru. En revanche, une étude épidémiologique transversale récente menée auprès de 28 176 femmes et de 22 943 hommes a révélé que la fréquence de consommation de cannabis est associée à une fréquence accrue des rapports sexuels tant chez les femmes que chez les hommesReference 395.
Effets sur le sperme et la santé testiculaire
Le SEC a été impliqué dans la spermatogenèse et la production de testostéroneReference 1462-Reference 1466. Il a été démontré que les spermatozoïdes humains expriment des récepteurs fonctionnels CB1 et CB2Reference 1466. Des récepteurs CB1 et CB2 ont été trouvés sur la membrane plasmique de spermatozoïdes humains et on a détecté des récepteurs CB1 sur la membrane plasmique de la région acrosomique, mais aussi au niveau de la pièce intermédiaire et de la flagelle du spermatozoïdeReference 1466Reference 1467. Par contre, il a été démontré que le récepteur CB2 se trouve dans la région post-acrosomique, la pièce intermédiaire et la flagelle des spermatozoïdesReference 1466Reference 1468Reference 1469. Des études in vitro ont signalé que l'activation du récepteur CB1 par l'anandamide pourrait avoir une incidence négative sur la motilité, la capacitation et la réaction acrosomique des spermatozoïdesReference 1466Reference 1467Reference 1469Reference 1470. Il a été démontré que l'hyper-activation ainsi que l'hypo-activation du récepteur CB2 dans les cellules germinales des mâles perturbe la dynamique temporelle du cycle spermatogéniqueReference 1471. Une étude transversale menée chez 86 hommes se présentant à une clinique d'infertilité a signalé que les taux d'anandamide dans le plasma séminal sont beaucoup plus faibles chez les hommes atteints d'asthénozoospermie ou d'oligoasthenotératozoospermie comparativement aux hommes normozoospermiquesReference 1466. De plus, les taux d'ARNm du récepteur CB1 des spermatozoïdes ont diminué considérablement chez les hommes atteints d'une asthénozoospermie ou d'une oligoasthenotératozoospermie comparativement aux hommes normozoospermiquesReference 1466. Ces conclusions permettent de supposer qu'il existe une association entre le taux d'anandamide dans le plasma séminal et la motilité anormale des spermatozoïdes. En outre, dans leur ensemble, ces conclusions laissent entrevoir le rôle important que joue le SEC dans le fonctionnement des spermatozoïdes et la reproduction des mâlesReference 1472 et elles soulèvent aussi la possibilité que l'exposition aux sources exogènes de cannabinoïdes (p. ex. le THC provenant du cannabis) ait une incidence sur le fonctionnement des spermatozoïdes. Les cannabinoïdes sont lipophiles et peuvent s'accumuler dans les membranes et la graisse testiculaire/épididymaire d'où ils peuvent être libérés lentement; cela peut affecter les spermatozoïdes et leur fonctionReference 392.
THC
Les effets du cannabis et du Δ9-THC sur le sperme humain ont fait l'objet d'études in vivo et in vitroReference 392Reference 1473-Reference 1475. On a observé une baisse importante du nombre, de la concentration et de la motilité des spermatozoïdes, ainsi qu'une augmentation de morphologie anormale des spermatozoïdes chez les hommes qui avaient fumé du cannabis (8 à 20 cigarettes/jour) pendant quatre semainesReference 1473. Lors d'une étude in vitro, la motilité des spermatozoïdes et les réactions acrosomiales avaient baissé dans les fractions de sperme de 90 %, mais aussi dans les fractions de sperme de 45 %; la première étant celle possédant le meilleur potentiel fertilisant et la seconde constituant une sous-population plus faibleReference 1475. Une baisse de la motilité des spermatozoïdes a été observée dans les deux fractions en réponse à des concentrations de Δ9-THC, imitant celles atteintes par une consommation à des fins non médicales (0,32 et 4,8 μM) et dans la fraction de 45 % en réponse à des concentrations de Δ9-THC observées habituellement dans la consommation à des fins thérapeutiques (0,032 μM). L'inhibition de la réaction acrosomiale n'a été observée qu'aux concentrations testées de Δ9-THC les plus élevées (4,8 µM) dans la fraction de 90 %, alors que celle de 45 % présentait une baisse des réactions acrosomiales aux trois concentrations de Δ9-THC testées. De tels effets évoquent la possibilité que le cannabis (c.-à-d. le Δ9-THC) puisse perturber les fonctions cruciales des spermatozoïdes et la fertilité des hommes, surtout chez les hommes déjà sur le seuil de l'infertilitéReference 1475.
CBD
Chez les jeunes souris mâles, l'administration IP de CBD à des doses de 10 ou 25 mg/kg (57 mg ou 142 mg/70 kg)Note de bas de page i pendant 5 jours consécutifs n'a pas eu d'effet négatif sur la morphologie des spermatozoïdesReference 1476. Dans une autre étude, des souris femelles ont été exposées à une dose orale unique de 50 mg/kg de CBD (284 mg/70 kg)Note de bas de page i au 12e jour de gestation ou dans les 12 heures suivant la parturition. Les mâles dont la mère a reçu le CBD au jour 1 post-partum ont eu environ 20 % de spermatozoïdes en moins. Le pourcentage d'imprégnations réussies chez les mâles dont les mères ont reçu le CBD a été réduit par rapport au groupe témoin. Le poids des testicules a également été réduit chez les souris mâles exposées au CBD au 12e jour de gestationReference 1477. Dans une autre étude, la progéniture mâle de souris femelles ayant reçu une dose orale unique de 50 mg/kg de CBD (284 mg/70 kg)Note de bas de page i au 18e jour de gestation, ont eu une augmentation significative du poids des testicules et des vésicules séminalesReference 1478. L'exposition de la mère à une dose orale unique de 50 mg/kg de CBD dans les 12 heures suivant la parturition a entraîné des altérations à long terme de la fonction neuroendocrine chez la progéniture mâle et femelle. De plus, chez les mâles exposés à la CBD, le poids des testicules a été considérablement réduit et la concentration de testostérone testiculaire a été réduiteReference 1479.
Les études qui ont examiné les effets de la consommation de cannabis sur les niveaux de testostérone chez les hommes ont donné des résultats contradictoiresReference 394. Alors que certains chercheurs ont trouvé que la consommation aiguë ou chronique de cannabis baissait grandement les concentrations plasmatiques de testostérone d'une manière liée à la dose, d'autres chercheurs n'ont apparemment pas réussi à obtenir des effets semblables, alors qu'une étude plus récente a révélé une augmentation des taux de testostéroneReference 393Reference 1018. Les différences retrouvées chez les différentes études dans les effets déclarés du cannabis sur les niveaux de testostérone ont été attribuées en partie aux différences dans les protocoles expérimentaux utilisésReference 394.
Une étude épidémiologique examinant l'association entre la consommation de cannabis et les hormones reproductrices mâles et la qualité du sperme chez 1 215 jeunes hommes en bonne santé, âgés de 18 à 28 ans, a révélé que la consommation régulière de cannabis fumé (> 1 / semaine) est associée à une réduction de 28 % (IC 95 %): -48, -1) de la concentration des spermatozoïdes et une réduction de 29 % (IC à 95 %: -46, -1) du nombre de spermatozoïdes après ajustement pour les agents confondants, mais est également associée à des niveaux plus élevés de testostéroneReference 393. La consommation de cannabis combinée plus d'une fois par semaine avec d'autres drogues non médicales a été associée à une réduction de 52 % (IC 95 %: -68, -27) de la concentration des spermatozoïdes et à une réduction de 55 % du nombre total de spermatozoïdes (IC 95 %: -71, -31). Les auteurs ont également noté des taux de testostérone plus élevés chez les fumeurs de cannabis de sexe masculin dans la même fourchette que les fumeurs de cigarettes.
Une méta-analyse et un examen systématique des études examinant l'exposition au cannabis et le risque de cancer des testicules ont révélé que la consommation actuelle, chronique et fréquente de cannabis était associée à des tumeurs des cellules germinales dans les testicules, comparativement à ceux qui n'avaient jamais consommé de cannabisReference 359. Sur 149 dossiers trouvés, seules trois études cas-témoinReference 1480-Reference 1482 répondaient aux critères d'inclusion rigoureux de la méta-analyse. La méta-analyse était peu concluante en ce qui a trait à l'association entre ceux ayant déjà consommé du cannabis et le développement de tumeurs des cellules germinales dans les testicules (RC regroupé = 1,19, IC = 0,72 à 1,95) comparativement à ceux n'ayant jamais consommé. Une conclusion similaire a été obtenue avec un usage antérieur et les tumeurs des cellules germinales dans les testicules (RC regroupé = 1,54, IC = 0,84 à 2,85). En revanche, la consommation courante de cannabis augmente de 62 % les probabilités d'apparition de tumeurs des cellules germinales dans les testicules (RC = 1,62, IC = 1,13 à 2,31). En outre, la fréquence de consommation de cannabis était associée au développement de tumeurs des cellules germinales dans les testicules, avec un usage hebdomadaire (ou plus fréquent) doublant les probabilités de développer des tumeurs des cellules germinales dans les testicules (RC = 1,92, IC = 1,35 à 2,72). De plus, il existe des preuves d'une association entre la durée de consommation de cannabis (> = 10 ans p/r à ceux n'en ayant jamais consommé) et le développement de tumeurs des cellules germinales dans les testicules (RC = 1,50, IC = 1,08 à 2,09). Il existe aussi des preuves d'une association entre la consommation de cannabis et le développement de tumeurs des cellules germinales autres que des séminomes, la consommation courante faisant plus que doubler les probabilités d'apparition de tumeurs (RC = 2,09, IC = 1,29 à 3,37). Les personnes consommant du cannabis au moins une fois par semaine avaient 2,5 fois plus de probabilités d'apparition de tumeurs par rapport à celles qui n'en ont jamais consommé. Celles qui ont consommé du cannabis pendant au moins 10 ans avaient 2,5 fois plus de probabilités d'apparition des tumeurs autres que des séminomes comparativement aux personnes qui n'en ont jamais consommé. On ne dispose pas de suffisamment de preuves pour conclure qu'il existe une relation entre les tumeurs séminomes et l'usage de cannabis. Les auteurs de l'étude affirment que la consommation de cannabis avant l'âge de 18 ans pourrait augmenter le risque de développer des tumeurs des cellules germinales autres que des séminomes (RC corrigé = 2,80, IC = 1,60 à 5,10) comparativement à une consommation après l'âge de 18 ans (RC corrigé = 1,30, IC = 0,60 à 3,20).
Effets sur le développement fœtal et le développement de l'enfant et de l'adolescent
Développement fœtal
Le cannabis est la plus importante source d'abus de substances chez les femmes enceintes : aux États-Unis, sa prévalence dépasse 10 % chez les femmes enceintesReference 1483. Les femmes ont autodéclaré avoir consommé du cannabis pendant la grossesse pour leurs propriétés antiémétiques, surtout au cours du premier trimestreReference 1484. On en sait relativement peu sur les changements de la pharmacocinétique du cannabis pendant la grossesse et sur le transfert materno-foetal et la pharmacocinétique fœtale du THCReference 1379. Le THC et ses métabolites peuvent être détectés dans le méconium et l'urine du nourrisson (comme indicateur de la consommation maternelle de cannabis). Le THC traverse facilement le placenta, mais peut être activement transporté hors du placentaReference 1379. Les concentrations placentaires de THC ont été rapportées à une concentration moyenne de 200 ng/g, tandis que la concentration moyenne de THC dans les restes fœtaux est de 119 ng/gReference 1379. Le SEC étant un réseau de signalisation conservé au cours de l'évolution qui s'est révélé guider des aspects essentiels du développement du cerveauReference 1483 et parce qu'il a été démontré que le THC traverse le placenta, cela a suscité la crainte que l'usage de cannabis pendant la grossesse, et même pendant la période périnatale, ait des effets nuisibles sur le développement fœtal et potentiellement sur le développement de l'enfant, de l'adolescent et de l'adulteReference 1379.
Études précliniques
L'exposition in vitro au THC a provoqué une inhibition dose-dépendante du développement embryonnaire des blastocystes, mais même à la plus forte concentration utilisée (160 nM), il n'y a jamais eu d'arrêt complet du développement embryonnaire. Le THC a été relativement moins puissant que les autres agonistes synthétiques des cannabinoïdes (CP 55 940, Win 55, 212-2 et anandamide); les autres agonistes des cannabinoïdes ont seulement besoin de 0,7 à 14 nM pour inhiber le développement embryonnaire. L'arrêt du développement s'est principalement produit entre les stades de quatre cellules et de huit cellulesReference 1374.
In vitro, l'exposition au CBD à des concentrations de 6,4 à 160 nM n'a pas modifié de façon significative le développement embryonnaireReference 1374Reference 1485. De plus, l'exposition in vitro à 1 à 25 µM de CBD n'a pas affecté la viabilité des lignées cellulaires non tumorales stabilisées (kératinocytes humains, préadipocytes de rat et macrophages monocytes de souris). La viabilité des cellules gliales n'a pas non plus été affectée par le traitement au CBD jusqu'à 50 µMReference 1485.
L'exposition in utero au THC ou aux cannabinoïdes chez les rongeurs est associée à une malformation de groupements d'axones au stade prénatal, à une diminution du poids à la naissance, à une augmentation de l'activité de redressement et de locomotion, à une hyperactivité, à une déficience en matière d'apprentissage, à une vocalisation et à une déficience de la formation de synapses après la naissance, à une altération du rendement au champ ouvert, à une déficience de la consolidation de la mémoire à long terme et à une interaction sociale et un comportement de jeu inhibés durant l'adolescence, à des troubles de mémoire, à une réduction de la plasticité synaptique, à une altération des fonctions cognitives, à une altération du comportement social et à un profil de type anxiogène à l'âge adulteReference 1376.
Une étude menée sur des souris enceintes a démontré que l'administration d'une faible dose de THC modifie le niveau d'expression de 35 protéines dans le cerveau des fœtusReference 62. De plus, cette étude a concrètement identifié une cible moléculaire précise pour le THC dans le SNC en développement dont les modifications peuvent perturber directement et de façon permanente les connexions du réseau neuronal au cours de la corticogénèse en permettant la formation de filopodes neuronaux ectopiques et en transformant la morphologie axonaleReference 62. Une autre étude in vitro à l'aide d'explants de cellules ganglionnaires de la rétine a démontré que l'administration de CBD (300 nM) a réduit la taille des cônes de croissance neuronaux, le nombre des filopodes, la longueur totale des projections, l'effondrement induit des cônes de croissance et la rétraction des neurites (c.-à-d. la répulsion chimique) par l'entremise du récepteur GPR55Reference 63.
Les données émergentes tirées d'études précliniques indiquent la présence de modifications multigénérationnelles concernant l'expression des gènes et la neurotransmission chez les descendants après une exposition des parents aux cannabinoïdesReference 1486. On a constaté que les rats de sexe masculin et féminin exposés au THC produisent des descendants présentant une expression réduite des récepteurs cannabinoïdes, dopaminergiques et glutamates, une liaison réduite au récépteur NMDA et une dépression à long terme accrue dans le striatum dorsalReference 1486Reference 1487. De plus, il a été démontré que l'exposition au THC chez la souris cause des changements pangénomiques dans la méthylation des histonesReference 1486Reference 1488. Ensemble, ces conclusions soulèvent la possibilité qu'une exposition des parents aux cannabinoïdes confère des effets multigénérationnels et potentiellement transgénérationnels sur l'expression des gènes, la méthylation des histones et la neurotransmission auprès des descendantsReference 1489.
Études cliniques
Les résultats d'études épidémiologiques chez les humains examinant les résultats néonatales à court terme chez des femmes ayant fumé du cannabis pendant leur grossesse sont équivoques pour certains effets; des rapports ont signalé des réductions du poids et de la taille à la naissanceReference 1490-Reference 1493 ou un risque légèrement accru de mort subite du nourrissonReference 1494, tandis que d'autres signalent une absence d'effetsReference 1495-Reference 1497. Cependant, une récente revue systématique a conclu que l'effet le plus robuste du cannabis est une réduction du poids à la naissanceReference 1357. Par contre, il semble exister des effets à long terme sur le développement d'enfants nés de mères qui consomment fortement du cannabis pendant la grossesse. La consommation prénatale de cannabis a été associée à des scores plus faibles en ce qui concerne le langage, la mémoire et le raisonnement abstrait ou visuel chez les enfants d'âge préscolaireReference 1376Reference 1498-Reference 1500. Chez les enfants d'âge scolaire, l'exposition prénatale au cannabis a aussi été associée à des déficiences de l'attention ainsi que la présence d'impulsivité et d'hyperactivitéReference 1376Reference 1501-Reference 1503. Plus tard, chez les enfants âgés de 9 à 12 ans, l'exposition prénatale au cannabis a été associée à une diminution du rendement des fonctions exécutives (p. ex., affectations de la mémoire de travail, l'inattention, l'impulsivité et incapacité de planifier)Reference 1378Reference 1504, ces déficiences apparaissant également chez des enfants âgés de 13 à 16 ansReference 1505 et chez des personnes âgées de 18 à 22 ansReference 1506.
Une étude prospective structurelle en neuroimagerie menée auprès de jeunes enfants (âgés de 6 à 8 ans) (c.-à-d. l'étude « Generation R ») a signalé que bien qu'une exposition prénatale au cannabis n'ait pas été associée à des différences significatives du volume total du cerveau, du volume de la matière grise, du volume de la matière blanche ou du volume ventriculaire, la consommation prénatale de cannabis a été associée à des différences au niveau de l'épaisseur corticaleReference 1507. Comparativement aux témoins non exposés au cannabis, les enfants exposés au cannabis en période prénatale ont présenté un cortex frontal plus épais, tandis que les enfants ayant été exposés au tabac en période prénatale ont présenté un amincissement du cortex, principalement dans le cortex frontal et pariétal. L'augmentation de l'épaisseur corticale chez les enfants exposés au cannabis soulève la possibilité d'une diminution de l'élagage synaptique et d'une altération de la maturation du développement neuronal dans des régions du cerveau associées à des fonctions cognitives supérieures.
Une étude épidémiologique portant sur 1 709 élèves du secondaire, sélectionné aléatoirement, qui a examiné l'association entre le TUC des parents et le risque de TUC chez les descendants signale l'existence de risques de TUC plus élevés chez les descendants dont les parents ont des antécédents de TUC, de troubles de consommation de drogues dures et une personnalité antisocialeReference 1508. Les indices de risque de TTC étaient de 1,93 (IC à 95 % = 1,30 à 2,88) parmi la progéniture possédant des antécédents parentaux de TUC, de 1,96 (IC à 95 % = 1,32 à 2,90) parmi la progéniture possédant des antécédents parentaux de troubles de consommation de drogues dures et de 1,73 (IC à 95 % = 1,06 à 2,82) pour la progéniture de parents atteints de trouble de la personnalité antisociale. Les effets étaient particulièrement importants parmi la progéniture féminine possédant des antécédents maternels de TUC.
Des données suggèrent que les cannabinoïdes s'accumulent dans le lait maternel des femmes qui fument du cannabis, et sont ensuite transférés au nouveau-né en l'allaitantReference 1380Reference 1509. En effet, la concentration de THC dans le lait maternel chez l'humain peut être jusqu'à huit fois plus élevée que celle détectée dans le sang de la mèreReference 1380Reference 1483. Dans une étude cas-témoinReference 1510, l'exposition au cannabis à partir du lait maternel, pendant le premier mois post-partum, semblait associée à une baisse du développement moteur du nourrisson à l'âge d'un an.
Une récente étude sur les risques de la consommation de cannabis pendant la grossesse a montré que plus de femmes se tournaient vers le cannabis pour son rôle antiémétique au cours du premier trimestre, qui représente la période de plus grand risque pour les effets néfastes des drogues sur le fœtus. Cependant, bien que les preuves concernant les effets du cannabis sur le développement prénatal humain soient actuellement limitées, les auteurs affirment que les recherches disponibles soutiennent une cause de préoccupation. Les preuves collectives soulignent que les femmes qui ont consommé du cannabis pendant la grossesse par rapport aux femmes qui n'ont pas consommé de cannabis pendant la grossesse étaient plus susceptibles: d'être anémiques, d'avoir un bébé de faible poids et d'avoir besoin d'un placement en soins intensifs néonatals. D'autres études montrent des liens entre l'exposition fœtale au cannabis et des résultats défavorables à long terme au cours des années scolaires concernant le contrôle des impulsions, la mémoire visuelle et l'attention. Les mécanismes exacts qui sous-tendent ces effets sont peu étudiés, mais sont supposés résulter de l'interférence du cannabis avec le développement du système nerveux. Le système endocannabinoïde, détecté pour la première fois au 16e jour de la gestation humaine, jouerait un rôle important dans les circuits neuronaux et le développement cérébral en régulant la neurogenèse et la migration, l'excroissance des axones et des dendrites et la recherche de trajectoires axonalesReference 1511.
Effets sur la santé mentale des adolescents
L'adolescence est une étape importante de la maturation comportementale et du développement cérébral marquée par une neuroplasticité significative qui laisse le cerveau ouvert à l'influence de facteurs externes tels que l'usage de droguesReference 546. De plus, la plupart des troubles psychiatriques commencent à apparaître à la fin de l'adolescence ou au début de l'âge adulte, y compris les troubles tels que l'usage de drogues, la dépendance/addiction aux drogues, l'anxiété, la dépression, le trouble bipolaire et la schizophrénie ou la psychoseReference 1512Reference 1513. L'expression large et abondante du récepteur CB1 dans les circuits neuronaux impliqués dans la dépendance/addiction et dans les troubles psychiatriques semble indiquer une association entre le SEC et la physiopathologie de ces maladiesReference 546. Durant l'adolescence, les taux des endocannabinoïdes, de l'anandamide et du 2-AG fluctuent considérablement dans les différentes régions cérébrales, telles que le striatum et le cortex préfrontal, les taux de 2-AG étant réduits du début à la fin de l'adolescence et les taux de l'anandamide semblant augmenter de façon continue dans le cortex préfrontal, au cours de l'adolescenceReference 546. De plus en plus de données semblent également indiquer l'effet différentiel de l'exposition au cannabis (THC) sur le cerveau humain qui varie en fonction de l'âge au moment de l'exposition, certaines données sous-entendant le potentiel d'effets durables associés à une consommation précoce, chronique et de longue duréeReference 177Reference 535Reference 546Reference 1514. Aussi, voir les Sections 2.4, 4.9.5 et 7.7.3 pour des informations supplémentaires.
7.5 Appareil cardiovasculaire
- Les études précliniques suggèrent que des doses très faibles de THC pourraient avoir un effet cardioprotecteur sur l'infarctus du myocarde induit expérimentalement.
- Des données provenant d'études de cas et d'études observationnelles suggèrent que fumer du cannabis de manière aiguë et chronique est associé à des effets néfastes sur la santé vasculaire, cardiovasculaire et cérébrovasculaire (p. ex., infarctus du myocarde, AVC, artérite) en particulier chez les consommateurs d'âge moyen (et plus).
- Cependant, une revue systématique récente suggère que les données examinant les effets du cannabis sur la santé cardiovasculaire sont incohérentes et insuffisantes.
Bien que le cannabis soit connu comme causant la vasodilatation périphérique, l'hypotension orthostatique et le rougissement conjonctival caractéristique après l'avoir fuméReference 1515, l'effet physiologique aigu le plus constant associé avec fumer du cannabis est la tachycardie liée à la doseReference 140Reference 343Reference 349. La tolérance aux effets cardiovasculaires (c.-à-d. l'hypotension et la tachycardie) associée à l'utilisation chronique a été déclarée par certaines sources, mais pas par d'autresReference 137Reference 176Reference 321Reference 1516Reference 1517. Bien que la tachycardie induite par le cannabis ne soit pas généralement jugée dangereuse pour les jeunes utilisateurs en santé, elle peut être dangereuse pour ceux qui sont déjà atteints de troubles cardiaques ou d'angineReference 136Reference 1518. L'inhalation de la fumée de cannabis diminue de 50 % la quantité d'exercice nécessaire pour provoquer une crise d'angineReference 1519 et a été associée à un risque cinq fois plus élevé d'infarctus du myocarde au cours de la première heure après avoir fuméReference 349. Cet effet peut être provoqué par une augmentation du débit cardiaque, de la demande d'oxygène du myocarde, des concentrations de catécholamines, de carboxyhémoglobine ainsi que l'hypotension orthostatique liée au Δ9-THCReference 343Reference 344Reference 1520.
Un examen des incidences de déclaration de drogue d'un réseau français d'addictovigilance, un système de déclaration spontanée d'abus grave de drogues et de dépendance grave à celles-ci, au cours d'une période de quatre ans, (2006 à 2010) révèle que le nombre de déclarations de troubles cardiovasculaires liés au cannabis a doubléReference 1521. Même si, dans l'ensemble, le nombre de déclarations de troubles cardiovasculaires liés au cannabis était faible (c.-à-d. 5 cas sur 468 déclarations liées au cannabis en 2006 et 11 cas sur 309 déclarations liées au cannabis en 2010), l'augmentation au fil du temps était significative et les déclarations de troubles cardiovasculaires liés au cannabis représentaient près de 2 % de toutes les déclarations d'incidences pour toutes les drogues déclarées sur le réseau d'addictovigilance. Les auteurs suggèrents que ces chiffres faibles représentent probablement un taux significatif de sous-déclarations, comme on peut s'y attendre dans le cas d'un programme de pharmacovigilance à déclaration spontanée classique et dans le cas d'une drogue illicite. Les patients étaient principalement des hommes (86 %) et étaient âgés en moyenne de 34 ans et près de la moitié avait des antécédents de maladie cardiaque ou vasculaire et des facteurs de risque cardiaque et vasculaire. La plupart des patients (60 %) étaient aussi des consommateurs concomitants de tabac. Parmi les 22 complications cardiaques déclarées, 20 étaient des symptômes coronariens aigus et 2 étaient des troubles reliés au rythme cardiaque. Dix complications périphériques (membre inférieur ou artériopathie juvénile et maladies de type Buerger) et trois complications cérébrales (angiopathie cérébrale aiguë, cécité corticale transitoire et spasme de l'artère cérébrale) ont été déclarées. Dans neuf cas, l'événement a entraîné le décès du patient.
Conformément aux conclusions de l'examen ci-haut, plusieurs rapports de cas d'artérite associée à une consommation de cannabis fumé chronique, quotidienne et de longue date ont également été déclarésReference 1522-Reference 1525. Des rapports de cas ont aussi suggéré un lien entre les fumeurs de cannabis qui en consomment de manière quotidienne et chronique et la sténose intracrânienne multifocaleReference 1526 et l'AVCReference 353Reference 354. Un rapport de cas était lié à une incidence d'AVC hémorragique et ischémique après des doses élevées de cannabis (c.-à-d. 4 g par jour)Reference 1527. Dans ce cas, le patient de 38 ans était atteint d'une hémiplégie droite, d'une aphasie motrice et d'une altération de la conscience et avait des antécédents de consommation fréquente d'alcool, de tabagisme (18 paquets-années) et de consommation de cannabis, mais il n'avait pas d'antécédents d'hypertension ou d'autre maladie cardiaque, neurologique ou vasculaire. Les auteurs affirment que l'altération de l'autorégulation cérébrale et de l'hypoperfusion régionale pourrait avoir jouer un rôle dans la pathogénie de l'accident ischémique cérébral lié au cannabis et l'hypertension artérielle transitoire provoquée par le cannabis, et que la défaillance de l'autorégulation cérébrovasculaire pourrait avoir joué un rôle dans l'AVC hémorragique lié au cannabis.
Une enquête auprès de la population générale portant sur plus de 7 500 personnes âgées de 20 à 64 ans et examinant les probabilités d'AVC et d'accident ischémique transitoire (AIT) pendant toute une vie chez des participants qui avaient déclaré fumer du cannabis au cours de l'année précédente a indiqué que 2,1 % avaient signalé avoir eu un AVC ou un AITReference 1528. Après correction pour tenir compte de la cohorte d'âge, les consommateurs de cannabis au cours de l'année précédente avaient 3,3 fois le taux d'AVC ou d'AIT (IC à 95 % = 1,8 à 6,3), ce chiffre diminuant légèrement (RTI = 2,3) après correction pour tenir compte des covariables liés à l'AVC comme le tabagisme. Le risque élevé d'AVC/AIT était propre aux personnes qui consommaient du cannabis chaque semaine ou plus souvent (RTI = 4,7, IC à 95 % = 2,1 à 10,7). En outre, ces cas étaient plus courants dans les cohortes plus âgées, avec un RTI de 4,9 dans le groupe âgé de 40 à 44 ans p/r au groupe âgé de 20 à 24 ans et, parallèlement, un RTI de 18,1 dans le groupe âgé de 60 à 64 ans p/r au groupe âgé de 20 à 24 ans.
Une étude indique aussi que les patients atteints du sida pourraient courir un risque accru d'éprouver des résultats cardiovasculaires indésirables provoqués par des interactions entre le cannabis et les médicaments antirétroviraux comme le ritonavir, qui a été associé lui-même à des événements cardiovasculaires indésirablesReference 1392.
À l'opposé des constatations provenant des études précédentes sur la consommation chronique de cannabis (THC), des données ont été obtenues d'une étude préclinique que des doses très faibles de THC pourraient posséder des caractéristiques cardioprotectricesReference 1529. Dans le cadre de cette étude préclinique, les auteurs déclarent que le traitement préalable des souris à l'aide d'une dose très faible de THC (0,002 mg/kg) 2 h et 48 h avant l'induction expérimentale d'un infarctus du myocarde a été associé au rétablissement partiel des fonctions cardiaques; cet effet n'avait pas été observé dans les souris traitées seulement à l'aide d'un mélange d'éthanol, de cremophor et de solution saline (1:1:18, respectivement) qui était le véhicule de traitement du THC. De plus, le traitement préalable à l'aide de la dose très faible de THC a été associé à une réduction statistiquement significative de la taille de l'infarctus, un taux sérique considérablement plus faible de troponine T, une réduction des dommages aux tissus et une réduction de l'étendue de l'infiltration de neutrophiles. Les constatations de l'étude suggèrent qu'une application unique d'une dose très faible de THC dans des souris fournit une protection considérable contre une insulte ischémique au cœur.
Une revue systématique récente de 24 études (22 observationnelles, 2 essais randomisés contrôlés) suggère que les données examinant l'effet du cannabis sur la santé cardiovasculaire sont incohérentes et insuffisantes. Sur la base de données limitées qui ont été évaluées comme étant de qualité médiocre à modérée avec un risque élevé de biais, il n'y avait pas d'association significative entre l'usage de cannabis et les résultats cardiovasculaires indésirables liés au diabète, à la dyslipidémie, à l'infarctus aigu du myocarde, aux accidents vasculaires cérébraux ou à la mortalité cardiovasculaire et toutes causes confondues. Six études ont suggéré un bénéfice métabolique de la consommation de cannabis, cependant, ces études étaient de nature transversale et n'établissent pas de lien de causalité. Les auteurs ont souligné que les données provenaient de cohortes « à faible risque » et que l'inclusion des populations « à risque élevé » aurait pu révéler des résultats différentsReference 1530.
7.6 Système gastro-intestinal et foie
- Des données provenant de rapports de cas suggèrent que la consommation chronique et intensive de cannabis (à THC prédominant) est associée à un risque plus élevé de syndrome d'hyperémèse du cannabis (SHC).
- Des données limitées provenant d'études par observation suggèrent des résultats mitigés entre la consommation de cannabis (à THC prédominant) et les risques de progression de la fibrose du foie associée à une infection de l'hépatite C.
7.6.1 Hyperémèse
Un nombre grandissant de rapports de cas se font publier en ce qui concerne le SHC. Le SHC est un état observé chez des personnes qui consomment du cannabis de manière chronique et quotidienne, souvent pendant des années, caractérisé par de graves épisodes de nausées et de vomissements cycliques réfractaires accompagnés de douleurs abdominales (habituellement épigastriques ou périombilicales); ces symptômes sont habituellement soulagés par un bain chaud ou une douche chaude prise de manière compulsiveReference 296-Reference 306. L'hyperémèse cannabinoïde semble triphasique avec des phases prodromique, hyperémétique et de récupérationReference 1531. La phase prodomale inclut la nausée et l'inconfort abdominal, généralement pire le matin. Pendant la phase hyperémétique, un épuisement important du volume peut se produire, accompagné d'une insuffisance rénale aiguë et d'anomalies électrolytiques. La phase de récupération peut durer de quelques jours à quelques mois.On ne comprend pas très bien la physiopathologie du SHCReference 304. On a rapporté que le traitement des patients qui présentent ce syndrome comprend une recommandation de cesser la consommation de cannabis, une réhydratation et des consultations auprès d'un psychologueReference 302Reference 304. L'efficacité d'antiémétiques comme la métoclopramide, l'ondansétron, la prochlorpérazine et la prométhazine en ce qui concerne le soulagement des symptômes de la nausée et des vomissements chez les patients atteints de SHC semble discutableReference 300Reference 302Reference 303Reference 306. Un récent rapport de cas suggère que le lorazépam (1 mg par IV, suivi de comprimés de 1 mg b.i.d.) peut fournir certains avantages pour atténuer les symptômes du SHC, du moins à court termeReference 1532.
Des preuves limitées provenant d'un certain nombre de rapports de cas ont suggéré que l'application topique de la crème de capsaïcine (0,075 % à 0,25 %) à l'abdomen, ou à une partie de la peau (par ex. dos ou poitrine), peut aider à atténuer les symptômes associés à la SHC dans les 30 à 45 min suivant l'application, et ce, sans effets secondaires dermatologiques, lorsque d'autres mesures thérapeutiques connues avaient échoué, à l'exception de l'halopéridolReference 1531Reference 1533Reference 1534.
7.6.2 Foie
Un grand nombre d'études ont fortement associé le SEC aux maladies du foie chroniquesReference 1535-Reference 1539. Les études effectuées auprès de patients atteints d'hépatite C chronique ont établi un lien important entre les fumeurs de cannabis en consommant de manière quotidienne et la fibrose modérée à graveReference 1455, et que la fumée de cannabis peut être un indicateur de progression de la fibrose et de gravité de la stéatoseReference 1397. La stéatose est un indicateur indépendant de la progression de la fibrose et un facteur établi de réaction faible aux traitements antivirauxReference 1540. Les auteurs des études citées recommandent que l'on conseille fortement aux patients atteints d'hépatite C chronique de s'abstenir d'utiliser le cannabis quotidiennement. En revanche, une étude de cohorte longitudinale révèle que la consommation de cannabis fumé n'a pas été associée à une progression de la maladie du foie, mesurée à l'aide du score APRI (AST- to-platelet ratio index), chez des personnes atteintes d'une co-infection par le VIH et l'hépatite CReference 1541. Bien que fumer du cannabis semble accélérer la progression vers un diagnostic clinique de cirrhose (rapport des risques = 1,33 par 10 joints/semaine; IC = 1,09 à 1,62), la correction pour tenir compte des facteurs de confusion semble atténuer cette constatation. De même, fumer du cannabis a été associé à une légère augmentation du risque de progression vers un diagnostic clinique combiné de cirrhose et de maladie du foie en stade terminal (indice de risque : 1,13, IC = 1,01 à 1,28), mais cet effet n'était plus significatif lorsqu'une correction était effectuée pour tenir compte des facteurs de confusion. Les différences observées dans les conclusions entre ces études pourraient avoir été causées par des différences dans la méthode des études et aussi potentiellement par les différences dans le degré d'exposition au cannabis (c.-à-d. consommation quotidienne p/r à consommation hebdomadaire). À l'opposé, une autre étude a révélé qu'une consommation modeste de cannabis (c'est-à-dire toute utilisation inférieure à une consommation quotidienne dans cette étude) était associée à une augmentation du temps où les patients poursuivaient leur TARReference 373. On a proposé que cet effet contribue, du moins en partie, à une augmentation du pourcentage de patients qui faisaient preuve d'une réponse virologique soutenue (c.-à-d. l'absence de niveaux détectables d'ARN du virus de l'hépatite C, six mois après la fin du traitement).
7.7 Système nerveux central
Les effets indésirables les plus fréquemment signalés, dans le cas des cannabinoïdes (principalement psychoactifs), sont ceux touchant le SNC. Les événements impliquant le SNC mentionnés les plus fréquemment dans les essais cliniques contrôlés sur le dronabinol (MarinolMD, n'est plus disponible au Canada) et les nabiximols (SativexMD) sont des réactions qui ressemblent à une intoxication, notamment la somnolence, les étourdissements et une défaillance transitoire des fonctions sensorielles et perceptivesReference 222Reference 427. Un « high » (rire facile, exaltation, conscience accrue), qui pourrait être non désiré ou déplaisant pour certains patients, a été déclaré chez 24 % des patients qui recevaient MarinolMD en tant qu'antiémétique, et chez 8 % des patients qui en recevaient pour stimuler leur appétitReference 222. Les autres événements indésirables se produisant au taux de > 1 % pour MarinolMD comprennent l'anxiété/la nervosité, la confusion et la dépersonnalisationReference 222. Les taux d'étourdissements, d'euphorie, de paranoïa, de somnolence et des troubles de la pensée étaient de 3 à 10 %Reference 222. Le taux d'amnésie, d'ataxie et d'hallucinations était de > 10 % lorsqu'on l'utilisait en tant qu'antiémétique aux doses plus élevéesReference 222. Les étourdissements constituent l'effet d'intoxication le plus courant avec SativexMD, signalé à la base chez 35 % des patients qui titraient leur dose; l'incidence rapportée de cet effet dans l'utilisation à long terme est d'environ 25 %Reference 1542. Tous les autres effets semblables à l'intoxication sont rapportés par moins de 5 % des utilisateurs (à l'exception de la somnolence, qui figure à 7 %)Reference 1542. Les autres événements signalés dans le cas de SativexMD comprennent la désorientation et la dissociation. Bon nombre des effets sur le SNC mentionnés ci-dessus, sinon tous, se manifestent aussi avec le cannabis (prédominant en THC).
7.7.1 Cognition
- Des données provenant d'études cliniques suggèrent que la consommation aiguë de cannabis (à THC prédominant) est associée à de nombreux effets cognitifs aigus.
- Des données provenant d'études observationnelles suggèrent que la consommation chronique de cannabis est associée à quelques effets cognitifs et comportemenaux qui pourraient subsister pour des durées de temps variées au-delà de la période d'intoxication aiguë selon de nombreux facteurs.
- Des données limitées provenant d'études cliniques par imagerie sur des humains suggèrent que le THC et le CBD pourraient exercer des effets opposés sur les fonctions neuropsychologiques et neurophysiologiques.
- Des données provenant principalement d'études cliniques transversales par imagerie sur les humains suggèrent que la consommation chronique et intensive de cannabis est associée à de nombreux changements structurels dans la matière grise et la substance blanche dans différentes régions du cerveau.
- En outre, le début précoce de la consommation et la consommation de cannabis à taux élevé et prédominant en THC ont été associés à des risques plus élevés de certains changements structurels du cerveau et de déficience cognitive.
Les effets aigus du cannabis sur la cognition ont fait l'objet d'examens approfondisReference 146Reference 177Reference 200Reference 223Reference 535Reference 547. L'exposition aiguë au cannabis (THC) nuit à un nombre de facultés cognitives comme la mémoire à court terme, l'attention, la concentration, la fonction exécutive et la perception visuelle; il se peut que le CBD puisse protéger contre certains de ces effets néfastesReference 146Reference 177Reference 200Reference 223Reference 535Reference 547Reference 1543-Reference 1545.
Les effets à long terme du cannabis sur les facultés cognitives continuent de susciter un débat. Certaines études rapportent un lien positif entre la consommation de cannabis à long-terme et des déficits cognitifsReference 146Reference 223Reference 1546-Reference 1548, ou suggèrent que certains déficits cognitifs perdurent après l'abstinence (surtout si l'initiation a eu lieu durant l'adolescence)Reference 146Reference 231Reference 547Reference 548Reference 1514Reference 1544Reference 1549. Cependant, d'autres études n'ont relevé aucun lien entre l'utilisation de cannabis et un déclin cognitif à long termeReference 548Reference 1549Reference 1550. Les limites méthodologiques, les différences dans les types de mesures cognitives étudiées et les différences dans la durée et la fréquence d'exposition, l'âge au moment de la première consommation et la durée d'abstinence, ainsi que la présence de facteurs de confusion résiduels et l'absence d'effets puissants, ont tous contribué aux difficultés dans l'évaluation des effets de l'utilisation chronique et pourraient aider à expliquer les écarts entre les études.
Néanmoins, les études suggèrent généralement que les consommateurs chroniques de cannabis souffrent de différents degrés de déficits cognitifs qui pourraient être de longue durée, surtout si la consommation débute tôt à l'adolescence (à l'âge de moins de 16 ans), est fréquente (c.-à-d., quotidiennement ou presque) et persiste (c.-à-d., pendant de nombreuses années)Reference 143Reference 177Reference 200Reference 535Reference 1514.
Selon une étude transversale, l'utilisation prolongée de cannabis ingéré ou inhalé chez les patients atteints d'une SP a été associée à une performance diminuée de divers domaines cognitifs (p. ex. vitesse de traitement de l'information, mémoire de travail, fonction exécutive et perception visuospatiale)Reference 229.
Lors d'une étude longitudinale prospective portant sur l'association entre l'utilisation persistante de cannabis et le fonctionnement neuropsychologique dans une cohorte de naissances de 1 037 personnes suivies sur une période de 20 ans, une utilisation persistante de cannabis (c.-à-d. TUC) à compter de l'adolescence était associée à un déclin neuropsychologique global statistiquement significatif dans un grand nombre d'aspects du fonctionnementReference 1514. De plus, l'arrêt de la consommation de cannabis pendant une période d'un an ou plus n'a pas semblé rétablir entièrement le fonctionnement neuropsychologique chez les consommateurs de cannabis persistants depuis l'adolescence. La correction pour tenir compte de plusieurs facteurs de confusion n'a pas semblé diminuer considérablement l'effet.
Cependant, une autre étude portant sur une période plus courte d'utilisation chronique, et une utilisation plus modeste, et sur un groupe d'âge légèrement différent a indiqué que les déficiences cognitives ne persistaient pas au-delà de la période d'intoxicationReference 1550. Dans le cadre de cette étude longitudinale de cohorte prospective de 2 235 adolescents (Avon Longitudinal Study of Parents And Children, ALSPAC), les consommateurs de cannabis semblaient avoir des résultats d'analyses du QI adolescent plus faibles et leur rendement académique était aussi plus faible comparativement aux participants non consommateurs. De plus, les consommateurs de cannabis possédaient des taux plus élevés de troubles de comportement de l'enfance, de symptômes de dépression, de consommation d'autres substances (y compris le tabac et l'alcool) et de consommation maternelle de cannabis. Toutefois, après avoir ajusté les résultats en fonction des différences entre les groupes, la consommation de cannabis avant l'âge de 15 ans était incapable de prédire soit des résultats d'analyse du QI à l'age de 15 ans ou un rendement académique plus faible à l'age de 16 ans. Les auteurs ont suggéré que la consommation de cannabis en quantité modeste dans cet échantillon d'adolescents n'était pas en relation de cause aux déficits cognitifs, mais ont aussi reconnu que la courte période de consommation (un à deux ans), la fréquence de consommation modeste (une fois par semaine ou moins) et d'autres facteurs n'éliminent en aucun cas que la consommation chronique, fréquente et persistante de cannabis pourrait avoir des effets néfastes sur les fonctions cognitives.
Un rapport examinant les associations entre la consommation de cannabis et les changements du rendement intellectuel de deux études longitudinales sur des jumeaux adolescents discordants sur le plan de la consommation de cannabis (n= 789 et n= 2277) ont signalé que les jumeaux ayant consommé du cannabis possédaient des résultats académiques plus faibles que les jumeaux non consommateurs et qu'ils affichaient un déclin important de l'intelligence cristallisée (c.-à-d., l'habileté verbale, les connaissances générales) entre la préadolescence et la fin de l'adolescenceReference 1551. Toutefois, le rapport n'a pas réussi à identifier une relation selon la dose entre la fréquence de consommation et les changements du QI et les jumeaux consommateurs de cannabis ne démontraient pas un déclin considérablement plus grand du QI comparativement à leur fratrie abstinente. Les limites de cette étude comprennent les enjeux méthodologiques causant une incapacité de mesurer adéquatement un effet de réaction selon la dose.
Une étude longitudinale récente examinant les effets néfastes du cannabis sur le développement du cerveau adolescent a signalé que l'exposition intense répétée au cannabis à l'adolescence pourrait avoir des effets défavorables sur la connectivité fonctionnelle au repos, l'intelligence et les fonctions cognitivesReference 1552. Lorsque comparés au témoin sain, les individus possédant un diagnostic de TUC démontraient une réduction de la connectivité fonctionnelle de régions particulières du cerveau (c.-à-d., les cortex cingulaire antérieur caudal, dorsolatéral et orbitofrontal) au cours d'une période d'étude de 18 mois. Dans le cas de consommation plus intense de cannabis au cours de la période entre le point de départ et le suivi, les chercheurs ont prédit un QI global faible et des fonctions cognitives plus faibles correspondant aux observations de Meir et coll. (2012)Reference 1514.
Données provenant d'études en imagerie structurelle et fonctionnelle
La capacité du cannabis à avoir un impact sur divers processus cognitifs après une exposition aiguë et chronique a inévitablement soulevé des questions concernant les aspects structurels et fonctionnels dans le cerveau touchés par une exposition au cannabis à court terme et à long terme. Deux examens systématiques portant sur les effets aigus et chroniques de l'exposition au cannabis sur la structure et fonction cérébrales ont été publiésReference 1553Reference 1554. En général, les constatations d'études examinant les effets de l'exposition au cannabis sur la structure et les fonctions du cerveau sont mitigées, principalement en raison de la nature croisée des études, de l'absence de mesures de contrôle constantes et exhaustives pour les facteurs de confusion et la petite taille des échantillonsReference 1555. Les constatations d'un certain nombre de ces études sont résumées ci-dessous.
Effets neurophysiologiques
Dans le premier examen systématique de 45 études menées chez des humains et sur des animaux qui portaient sur les effets d'une exposition aiguë au cannabis sur le cerveau, on a remarqué que le THC et le CBD exercent des effets neurophysiologiques opposés, à l'exception générale de la mémoire et de l'apprentissage verbal sur lesquels le CBD n'a aucun effetReference 1553. L'administration aiguë de THC a été constamment associée à une augmentation du débit sanguin cérébral principalement dans les régions préfrontale, insulaire, cérébelleuse et cingulaire antérieure qui sont connues pour être enrichies en récepteurs CB1 et qui dirigent plusieurs fonctions cognitives et jouent également un rôle important dans la neurobiologie de la toxicomanie. Les degrés subjectifs d'intoxication, la « sensation de high », l'anxiété, la perception du temps altérée, la dépersonnalisation, les expériences dissociatives et les mesures de confusion ont présenté une corrélation avec un débit sanguin cérébral global accru. D'autres régions du cerveau où des changements dans le débit sanguin cérébral ont été observés en réaction à l'administration du THC sont notamment les noyaux gris centraux, l'hippocampe et l'amygdale, le thalamus et tous les cortex cérébraux. Une activité cérébrale anormale a été observée après l'administration du THC pendant l'exécution de tâches associées à la mémoire, au traitement affectif, à l'attention, à la fonction motrice, à la récompense, ainsi qu'à l'inhibition de réponse, au traits saillants, et au traitement sensoriel. Le CBD semble moduler l'activité cérébrale au repos principalement dans les cortex limbique et paralimbique, des régions impliquées dans la physiopathologie de l'anxiété.
Effets structurels
Dans le deuxième examen systématique de 43 études les constatations révèlent l'existence d'anomalies cérébrales structurelles (principalement dans les régions du cerveau riches en récepteurs CB1) et une altération de l'activité neuronale au repos et dans divers types de paradigmes cognitifs. Chez les adolescents, les constatations laissent supposer une altération structurelle et fonctionnelle qui pourrait apparaître juste après avoir commencé à consommer la drogue et qui serait liée au sexe du sujetReference 1554. Dans le cas des anomalies structurelles, les constatations provenant des études disponibles sont hétérogènes signalant soit des augmentations ou des réductions du volume de la matière grise; toutefois, les modifications déclarées de façon plus constante étaient la réduction du volume de l'hippocampe (qui, selon les déclarations, persiste au moins plusieurs mois après la dernière consommation et qui est associée à la quantité de cannabis utilisé), ainsi que la réduction du volume de l'amygdale, du cervelet et du cortex frontal. Les études en imagerie du tenseur de diffusion ont relevé des différences dans l'épaisseur de la substance blanche dans le corps calleux, ainsi que le tractus de fibres de la substance blanche (augmente ou diminue) ce qui, selon les auteurs, semble indiquer que l'exposition chronique au cannabis pourrait modifier l'intégrité structurelle de la substance blanche en ayant une incidence sur la démyélinisation, en causant des dommages axonaux, ou indirectement, par un retard du développement cérébral normal. Les études en imagerie fonctionnelle qui comparent l'activation chez les consommateurs chroniques de cannabis adultes et adolescents à des témoins en bonne santé pendant l'exécution de différentes tâches cognitives indiquent que les consommateurs chroniques de cannabis utilisent des régions cérébrales similaires à celles des témoins en bonne santé, mais elles démontrent un schéma d'activité cérébrale modifié. Malgré ce schéma d'activité cérébrale modifié, le niveau d'exécution des tâches cognitives des consommateurs de cannabis était généralement compris dans ce que les auteurs considèrent être une plage de valeurs normale de l'exécution des tests, ce qui suggère que les cerveaux des consommateurs chroniques de cannabis utilisent des comportements neuroadaptatifs, par exemple en mobilisant d'autres régions cérébrales pour effectuer des tâches afin de maintenir une performance cognitive normale. Cependant, bien que la performance puisse ne pas être considérablement modifiée dans le contexte artificiel d'un laboratoire, les répercussions de ces modifications cérébrales subtiles sur les tâches sociales et professionnelles en situation réelle, surtout lors de contextes congnitifs complexes et exigeants, pourraient être différentes. Les limites de cet examen sont notamment les différences entre les études incluses dans l'examen, y compris les différences méthodologiques, sociodémographiques et relatives au sexe, à l'âge au début de la consommation, à la consommation pendant toute une vie et à la période d'abstinence avant l'acquisition de données d'imagerie.
Plus récemment, une étude rétrospective examinant la morphologie du cerveau dans un échantillon de consommateurs de cannabis quotidiens et de non-consommateurs adolescents et adultes a signalé que la consommation de cannabis n'était pas associée à des changements considérables du volume ou de la forme de la matière grise de régions du cerveau, y compris du noyau accumbens, de l'amygdale, de l'hippocampe et du cerveletReference 1556. Notablement, cette étude a corrigé pour de nombreux facteurs de confusion comme la consommation d'alcool et le tabagisme qui n'étaient pas toujours corrigés dans le cadre d'autres études. Toutefois, les limites principales de cette étude comprenaient l'absence de renseignements concernant l'âge de début de consommation, les antécédents, la durée d'exposition au cannabis (c.-à-d., la consommation des adultes n'était mesurée que pour les deux derniers mois et la consommation des adolescents n'était mesurée que pour les trois derniers mois), la puissance et la composition du cannabis consommé et le statut socio-économique. Une autre des limites de cette étude était sa nature croisée.
Une étude qui a examiné l'association entre la puissance du cannabis ainsi que la fréquence et l'âge de la première consommation sur l'organisation microstructurelle du corps calleux, mesurée à l'aide de la tractographie par imagerie du tenseur de diffusion, révèle que la consommation fréquente de cannabis très puissant était associée à une perturbation de l'organisation microstructurelle du corps calleux chez les personnes atteintes ou non d'une psychoseReference 1557. Dans cette étude, 56 personnes ayant eu un premier épisode de psychose (parmi lesquelles 37 étaient des consommateurs de cannabis) et 43 personnes ne présentant pas de psychose (parmi lesquelles 22 étaient des consommateurs de cannabis) ont été examinées afin de trouver des preuves de différences structurelles dans le corps calleux, le plus grand tractus de substance blanche dans le cerveau et contenant une forte abondance de récepteurs CB1. Les utilisateurs de cannabis très puissant (patients et personnes ne présentant pas de psychose) ont présenté une diffusivité moyenne beaucoup plus élevée dans le corps calleux (c.-à-d. densité plus faible du tractus de substance blanche) que les utilisateurs de cannabis peu puissant et que ceux n'ayant jamais consommé de cannabis. Il existait aussi une association significative entre la fréquence d'utilisation et la diffusivité moyenne du corps calleux total, les consommateurs quotidiens ayant une diffusivité moyenne plus élevée que les consommateurs occasionnels et ceux n'ayant jamais consommé de cannabis. En outre, les consommateurs quotidiens de cannabis très puissant avaient une diffusivité moyenne beaucoup plus élevée que les consommateurs quotidiens de cannabis peu puissant et ceux n'ayant jamais utilisé du cannabis ou qui en consommaient de façon hebdomadaire. Enfin, aucune différence statistiquement significative dans la diffusivité moyenne du corps calleux n'a été constatée entre les consommateurs ayant commencé tôt à utiliser du cannabis et ceux ayant commencé à en consommer plus tard.
Une autre étude a examiné les changements longitudinaux dans la microstructure de la substance blanche après une consommation élevée de cannabis à l'aide de l'imagerie du tenseur de diffusionReference 1558. Dans cette étude, 23 jeunes consommateurs adultes réguliers de cannabis et 23 témoins n'utilisant pas de cannabis, dont l'âge, le sexe et le QI correspondaient à ceux des consommateurs de cannabis et qui avaient des antécédents limités d'usage de substances ont participé. Leur consommation de cannabis a commencé avant l'âge de 17 ans. Les résultats de l'étude indiquent que la consommation de cannabis était associée à des déficiences de la substance blanche structurelle dans plusieurs régions cérébrales différentes. Ces effets sur l'intégrité de la substance blanche ont été liés à la dose, ce qui laisse supposer que la consommation continue élevée de cannabis durant l'adolescence et au début de l'âge adulte est associée à une détérioration plus profonde de la substance blanche et qu'elle contribue à une déficience fonctionnelle (p. ex. apprentissage verbal).
Une étude plus récente examinant les liens entre de nombreuses variables principales (c.-à-d., l'âge de début de la consommation de cannabis, durée de consommation, fréquence d'utilisation et dose) et les changements de l'intégrité de la substance blanche a signalé qu'une intensité de consommation de cannabis plus élevée était associée à une réduction de l'intégrité de la substance blanche de régions particulières du cerveauReference 1559. L'étude a remarqué que les changements (augmentation ou réduction) de l'intégrité de la matière blanche variaient selon l'âge de début de la consommation régulière de cannabis, la durée de consommation et la dose actuelle, mais non selon la fréquence de consommation actuelle. Des changements de l'intégrité de la substance blanche ont été observés dans les voies frontales, pariétales et de la motricité. On a aussi observé des niveaux de diffusion axiale et radiale plus faibles parmi les consommateurs plus jeunes et des niveaux de diffusion axiale et radiale plus élevés chez les consommateurs plus âgés. Des niveaux de diffusion axiale plus faibles sont associés à une réduction du volume axonal tandis que des niveaux de diffusion radiale plus élevés sont associés à la réduction de la myélinisation; autrement dit, on a observé une réduction du volume axonal et une augmentation de la myélination chez les jeunes consommateurs et une augmentation du volume axonal et une réduction de la myélination chez les jeunes consommateurs plus âgés. Notablement, des changements qui n'avaient pas été observés auparavant de l'intégrité de la substance blanche associée à la consommation de cannabis ont été observés dans les consommateurs plus âgés (plus de 32 ans). Les auteurs suggèrent que l'exposition à des puissances de cannabis plus faibles au cours de l'adolescence ou du début de l'âge adulte en combinaison aux effets de l'exposition prolongée au cannabis au cours de nombreuses années causent des perturbations de l'intégrité de la substance blanche. Les lacunes de la méthodologie de l'étude comprennent sa nature transversale et de nombreux facteurs de confusion, comme le tabagisme qui était plus fréquent dans le groupe consommateur de cannabis.
Un autre examen de 31 études a examiné les associations entre les changements neuroanatomiques (surtout dans les régions du cerveau ayant une haute densité de récepteurs CB1) et la consommation régulière de cannabis (c.-à-d., quotidienne ou presque) ainsi que les liens au niveau de consommation (c.-à-d. la dose, la durée, l'âge de début)Reference 1560. L'étude a observé la présence de changements neuroanatomiques dans des régions du cerveau ayant une haute densité de récepteurs de cannabinoïdes (c.-à-d., l'hippocampe, le cortex préfrontal, l'amygdale, le cervelet) et la prise de doses plus élevées et l'âge de début plus précoce ont été associés à ces changements. La majorité des consommateurs de cannabis ont commencé à en fumer entre l'âge de 15 et 17 ans et la durée de consommation variait grandement dans l'ensemble des études examinées (c.-à-d. entre 2 et 23 ans de consommation régulière). Les cas de consommation de cannabis à vie s'étendaient de 402 à 5 625. Plusieurs des études examinées avaient corrigé pour les facteurs de confusions du tabagisme et de la consommation d'alcool. Des irrégularités entre les consommateurs de cannabis et le groupe témoin étaient le plus régulièrement observés dans l'hippocampe, puis dans les régions préfrontales de très haute densité de récepteurs de cannabinoïdes (c.-à-d. le cortex préfrontal latéral et le cortex cingulaire antérieur). En général, les changements neuroanatomiques les plus fréquents étaient : (1) des réductions volumétriques dans toutes les régions (sauf dans le cervelet et le striatum, où des augmentations ont été observées); (2) des densités de matière grise plus élevées dans la majorité des régions (c.-à-d. l'amygdale, le cortex préfrontal et pariétal et le striatum); (3) changements de la forme et de l'anatomie des sillons et des circonvolutions cérébrales; et (4) l'épaisseur corticale. Essentiellement, on a observé plus régulièrement des changements neuroanatomiques dans les régions de plus hautes densités de récepteurs de cannabinoïdes. Les doses de cannabis étaient plus régulièrement associées à des changements neuroanatomiques dans l'hippocampe et le cortex préfrontal et moins fréquemment dans l'amygdale, le striatum, le gyrus parahippocampique, l'insula et le lobe temporal. L'âge de début de consommation de cannabis était le plus régulièrement associé à la neuroanatomie préfrontale et le moins fréquemment aux changements neuroanatomiques du gyrus parahippocampique, du cortex temporal et des mesures générales du cerveau. La durée de consommation régulière était le plus fréquemment associée aux changements neuroanatomiques du cortex préfrontal et de l'hippocampe et le moins fréquemment aux changements de l'amygdale, du gyrus parahippocampique, du cervelet ou du striatum. Ensemble, les études examinées dans le cadre de cet examen suggèrent que la consommation régulière de cannabis est associée à des changements neuroanatomiques de nombreuses régions du cerveau dont les changements les plus fréquemment observés sont ceux de l'hippocampe (réduction du volume et de la densité de la matière grise, changement de la forme), suivi de ceux de l'amygdale et du striatum, du cortex orbitofrontal, du cortex pariétal, du cortex insulaire et du cervelet. De plus, certains liens ont été observés entre les doses plus élevées de cannabis et les changements de l'hippocampe et entre les âges de début de consommation plus précoces et les changements du cortex préfrontal. Les auteurs mentionnent aussi des données préliminaires suggérant un effet protecteur de la part du CBD et un effet toxique de la part du THC sur les régions de l'hippocampe, du cervelet, préfrontales et linguistiques. En conclusion, l'âge de début de consommation précoce, la durée de consommation, la dose et le rapport relatif entre les concentrations de THC et de CBD ont tous été associés à des changements neuroanatomiques de diverses régions du cerveau.
Finalement, un examen a étudié les effets du cannabis sur la structure et les fonctions du cerveau selon des études par imagerie (principalement transversales)Reference 1561. L'examen a tiré les conclusions suivantes : (1) les plus petits volumes de l'hippocampe des consommateurs de cannabis en comparaison aux valeurs témoin saine était l'une des constatations les plus fréquemment signalées; (2) il existe une relation inverse entre la consommation de cannabis et le volume de l'hippocampe; (3) la dose et la durée de consommation de cannabis semblent être les facteurs déterminants des effets du cannabis sur le volume de l'hippocampe; (4) la consommation de cannabis est associée à des volumes plus petits du cortex orbitofrontal; (5) le début précoce de la consommation de cannabis interagit avec les périodes de développement de l'adolescence, causant des perturbations des processus de neurodéveloppement normaux (p.ex. : élagage et neuroplasticité); (6) les vulnérabilités préexistantes interagissent avec la dose, la durée et le début de la consommation de cannabis afin de déterminer les conséquences; (7) la consommation de cannabis est associée à la microstructure moins efficace et moins mature de la substance blanche du genou, du rostre et du splénium du corps calleux ainsi que du faisceau longitudinal supérieur et du faisceau arqué; (8) la combinaison de la consommation de cannabis et d'alcool cause des changements beaucoup plus importants au tractus de substance blanche (c.-à-d. dans le faisceau longitudinal supérieur, les rayonnements thalamiques postérieurs droits, les fibres thalamiques préfrontales droites, le gyrus temporal supérieur droit, le faisceau longitudinal inférieur droit et la corona radiata postérieure gauche); (9) le début précoce et plus intensif de consommation de cannabis à l'adolescence est lié à moins d'activité cérébrale de la part de ces consommateurs comparativement à ceux ayant commencé leur consommation plus tard à l'adolescence; (10) la consommation de cannabis est associée à l'augmentation du recrutement de régions du cerveau additionnelles typiquement non utilisées dans certains processus afin de compenser pour les déficits d'autres régions.
Une récente revue systématique et méta-analyse de 69 études transversales (2152 utilisateurs de cannabis / 6575 non-utilisateurs) chez les adolescents et les jeunes adultes (≤ 26 ans) a rapporté que la consommation fréquente / forte de cannabis était associée à une petite taille d'effet pour un fonctionnement cognitif réduit lié à la mémoire différée, à l'attention et à la vitesse de traitement de l'information (d, -0,25, IC à 95 %, -0,32 à -0,17). La taille de l'effet a toutefois diminué après 72 heures d'abstinence (d, -0,08, IC à 95 %, -0,22 à 0,07), ce qui laisse croire que toute déficience cognitive aiguë liée à la consommation de cannabis peut être rétablie après trois jours d'abstinence. Aucun déficit plus important n'a été observé chez les adolescents par rapport aux jeunes adultes. Les principales limites de ces résultats sont liées à la conception transversale (causalité non établie) et aux variables non comptabilisées dans les analyses (p. ex., durée d'utilisation antérieure, fonctionnement cognitif avant l'usage de cannabis)Reference 1562.
Une récente revue de la littérature sur la puissance du THC soutient que des niveaux plus élevés de puissance, comparés à des niveaux plus bas, sont associés à un risque plus élevé de TUC, de psychose, de troubles cognitifs aigus (surtout dans les tâches de contrôle moteur et de fonctionnement exécutif) et de changements structurels de la substance blanche dans le corps calleux. Les auteurs recommandent aux cliniciens de non seulement demander et de surveiller la fréquence et la durée d'utilisation générique du cannabis, mais aussi les concentrations spécifiques de THC utilisées pour mieux évaluer ses effets indésirables et ses risques. Dans le contexte de la prescription de cannabis à des fins médicales, les cliniciens devraient peser les risques potentiels d'un cannabis de plus forte puissance par rapport à ses effets thérapeutiques potentielsReference 1563.
7.7.2 Fonction psychomotrice et conduite automobile
- Des données provenant d'études cliniques expérimentales suggèrent que la consommation aiguë de cannabis (à THC prédominant) affaiblit de nombreuses habiletés psychomotrices et cognitives nécessaires pour conduire un véhicule à moteur.
- Bien que la consommation chronique/fréquente de cannabis puisse être associée à un certain degré de tolérance à certains des effets du cannabis chez certains individus, la consommation chronique de cannabis peut toujours poser des risques à la conduite sécuritaire en raison, en partie, de la charge corporelle importante du THC menant à un niveau chronique de troubles psychomoteurs.
- Des données provenant d'études cliniques et épidémiologiques suggèrent la présence d'effets de réponse selon la dose, avec des doses croissantes de THC augmentant les risques de collisions de véhicule à moteur pouvant entrainer des blessures et la mort.
- Combiner de l'alcool avec du cannabis (THC) est associé à un niveau plus élevé d'affaiblissement des capacités et un risque accru de blessures.
Il est notoire, d'après les études menées chez des personnes consommant du cannabis à des fins non médicales, que l'exposition au cannabis à forte teneur en THC et aux cannabinoïdes psychoactifs nuit à la fonction psychomotriceReference 136Reference 146Reference 234 et que les patients doivent être avertis de ne pas conduire ou faire fonctionner de la machinerie complexe après avoir consommé du cannabis fumé ou vaporisé ou après en avoir ingéré par voie orale ou, encore, après avoir consommé des médicaments cannabinoïdes psychoactifs (p. ex. dronabinol, nabilone, nabiximols) avant qu'un laps de temps suffisant, leur permettant de conduire un véhicule en toute sécurité, ne se soit écoulé. Il existe aussi maintenant un nombre toujours plus important de preuves de troubles chroniques associés à une consommation fréquente de cannabis (même après sevrage) à plus long terme qui pourrait aussi avoir un impact sur la capacité de conduire en toute sécurité (Reference 146Reference 225Reference 687Reference 1564Reference 1565 et voir ci-dessous).
Des données probantes tirées d'études post mortem chez les humains montrent que le cerveau peut accumuler des concentrations relativement élevées de THC et de 11-hydroxy-THC, tandis que les concentrations de ces cannabinoïdes demeurent beaucoup plus faibles dans le sangReference 1566. Dans cette étude, 12 échantillons de sang et de cerveau post mortem appariés provenant de personnes impliquées dans des accidents de la route mortels ont été examinés. Dans un cas, la concentration de THC dans le cerveau était de 19,4 ng/g, tandis que la concentration de THC dans le sang était de 4,4 ng/mL. Dans un autre cas, la concentration de THC dans le cerveau était de 29,9 ng/g, tandis que la concentration de THC dans le sang était inférieure ou égale à 0,2 ng/mLReference 1566. En outre, l'examen de régions cérébrales précises a démontré une accumulation significative du THC et du 11-hydroxy-THC dans la substance noire, l'hippocampe, le lobe occipital, le striatum, putamen et pallidum, le lobe frontal, la moelle épinière et le corps calleux, le cortex et la substance blancheReference 1566. Ces constatations révèlent que, malgré des concentrations faibles ou pratiquement indétectables de THC ou de 11-hydroxy-THC dans le sang, ces cannabinoïdes psychoactifs peuvent s'accumuler dans plusieurs régions cérébrales associées à la pensée, à la prise de décision ou à la fonction exécutive, à la vision, à la mémoire et à la coordination et qui jouent un rôle important dans la conduite adéquate d'un véhicule.
Cannabis
Un article d'examen se penchant sur les effets psychomoteurs néfastes du cannabis sur la conduite a indiqué que la fonction d'évaluation psychomotrice est réduite jusqu'à cinq à six heures après la consommation de cannabis fumé, une grande partie de l'altération survenant dans les deux premières heures suivant la consommation de cannabis fumé, bien que d'autres tendent à indiquer une période d'au moins trois à six heures après en avoir fuméReference 234. Compte tenu de la variabilité des données et de l'apparition de nouvelles études portant sur du cannabis plus puissant et démontrant la persistance de certains effets psychoactifs (p. ex. la sédation) jusqu'à huit heures après la dernière inhalation, les auteurs de l'étude recommandent que les patients s'abstiennent de conduire pendant au moins huit heures après avoir atteint une sensation de « high » découlant de la consommation de cannabis, bien que la durée d'attente minimale puisse, par exemple, être plus longue chez ceux consommant du cannabis par voie orale, le début de l'intoxication et des troubles psychomoteurs étant retardé, comparativement à l'inhalation, et durant plus longtemps.
Études cliniques
Aiguë
Des études cliniques ont démontré que l'administration aiguë de cannabis (c.-à-d. THC) touche des régions du cerveau impliquées dans la perception, l'attention, la concentration, le contrôle inhibiteur ou de l'impulsivité, le contrôle exécutif ou la prise de décision, la prise de conscience, la vivacité d'esprit et la coordination, qui sont tous requis pour la conduite adéquate d'un véhicule, bien que les consommateurs fréquents de cannabis puissent développer une tolérance à certains, mais pas tous, des effets euphorisants ou néfastes associés à la consommation aiguë de cannabisReference 146Reference 234. Certains de ces effets pourraient aussi persister au-delà de la période d'intoxication aiguë, en particulier chez les consommateurs chroniques et fréquentsReference 146.
Une étude clinique de laboratoire a signalé que des doses de THC comprises entre 40 µg/kg et 300 µg/kg entraînent une réduction proportionnelle à la dose du rendement lors de tâches en laboratoire mesurant la mémoire, l'attention partagée et l'attention soutenue, le temps de réaction, la fonction motrice et de suiviReference 149.
Une autre étude clinique s'est penchée sur les effets psychomoteurs et neurocognitifs d'une exposition aiguë au cannabis fumé afin d'évaluer les effets aigus du cannabis sur les capacités nécessaires pour conduire de façon sécuritaire (c.-à-d. contrôler de façon précise un véhicule et réagir rapidement aux événements sur la route)Reference 199. Les domaines examinés sont notamment la fonction psychomotrice, la mémoire de travail, la prise de risque et les effets subjectifs et physiologiques chez les fumeurs fréquents et occasionnels de cannabis après la consommation contrôlée d'une cigarette contenant 6,8 % de THC (c.-à-d. 54 mg de THC disponible total dans la cigarette) jusqu'à 22,5 heures après avoir fumé. Les fumeurs fréquents fumaient au moins quatre fois par semaine, tandis que les fumeurs occasionnels fumaient moins de deux fois par semaine. La concentration moyenne de THC dans le sang à 0,5 heure après avoir fumé était de 32 ng/mL chez les fumeurs fréquents et de 17,4 ng/mL chez les fumeurs occasionnels. Au bout de six heures, les fumeurs fréquents avaient une concentration de THC dans le sang de 4,1 ng/mL, tandis que la plupart des sujets catégorisés comme des fumeurs occasionnels avaient des concentrations de THC dans le sang inférieures à 1,3 ng/mL. Au bout de 24 heures, les concentrations de THC dans le sang de tous les fumeurs occasionnels étaient inférieures à la limite de détection, tandis que les fumeurs fréquents avaient une concentration moyenne de THC dans le sang de 2,9 ng/mL. Les fumeurs occasionnels avaient des scores beaucoup plus élevés sur les mesures de sensation de « high » et d'être « stimulé », ainsi qu'une anxiété plus intense. Des scores significativement plus élevés ont aussi été signalés par des consommateurs occasionnels sur les mesures de la « difficulté à se concentrer » (au bout de trois heures) et de la « notion du temps modifiée » (au bout de trois et quatre heures). Les auteurs ont constaté que fumer du cannabis nuit considérablement à la fonction psychomotrice jusqu'à 3,5 heures après avoir fumé une cigarette contenant 6,8 % de THC. Le cannabis fumé semblait nuire à la fonction psychomotrice (erreur de suivi, coups, fausses alarmes et temps de réaction) dans une plus grande mesure chez les fumeurs occasionnels comparativement aux fumeurs fréquents, ce qui soulève la possibilité d'une tolérance à certains effets néfastes du cannabis chez les fumeurs fréquents. Les fumeurs occasionnels ont aussi signalé des effets subjectifs nettement plus longs et plus intenses comparativement aux fumeurs fréquents dont les concentrations de THC dans le sang étaient plus élevées.
Une étude de cas croisée, qui a déterminé si la consommation aiguë de cannabis entraînait un risque accru de collision chez 860 conducteurs qui se présentaient aux services d'urgence de Toronto et d'Halifax en raison d'une blessure causée par une collision de la route, révèle que 11 % des conducteurs se présentant (IC à 95 % = 9 à 13,1) ont déclaré avoir consommé du cannabis avant de conduireReference 1567. L'analyse de régression qui mesurait l'exposition, à l'aide de données d'auto-déclarations et sur le sang, a indiqué que la consommation de cannabis seul était associée à une augmentation par quatre (RC = 4,11; IC à 95 % = 1,98 à 8,52) du risque de collision. Ces personnes qui utilisaient du cannabis avant de conduire étaient aussi plus susceptibles d'être des hommes (91 %). La consommation d'éthanol a été associée à une augmentation du risque de collision (RC = 3,89, IC à 95 % = 1,86 à 8,09).
Une étude clinique à répartition aléatoire et double insu, contrôlée par placebo, a examiné les effets aigus de deux doses différentes de THC (13 mg p/r à 17 mg) sur les habiletés cognitives et motrices (c.-à-d. vitesse et précision), la flexibilité cognitive, la capacité de prise de décision et l'estimation de la durée et de la distance (c.-à-d. par rapport à un véhicule qui s'approche) chez les consommateurs réguliers de cannabisReference 1364. Quatorze sujets qui ont consommé du cannabis tous les jours pendant au moins cinq ans ont été choisis en vue de l'étude. La dose de THC de 17 mg a été associée à une augmentation significative des collisions avec les murs dans la tâche virtuelle de labyrinthe, tandis que les effets des deux doses de THC ont été aussi significatifs dans certains essais de flexibilité cognitive. Une hausse significative de tâches de prise de risque a aussi été remarquée avec la dose plus élevée de THC de 17 mg. Les effets du THC sur les évaluations subjectives de la « satisfaction », du « plaisir », du « high » et de l'« effet de la drogue » augmentaient considérablement chez les sujets qui recevaient la dose faible (13 mg) ou la dose élevée (17 mg) de THC comparativement au placebo. Ces résultats semblent appuyer l'effet dose-réponse du THC sur l'altération des fonctions cognitives ayant une incidence sur les facultés nécessaires pour conduire un véhicule de façon sécuritaire. À titre de référence, une étude récente a estimé que le poids moyen du cannabis dans un joint est de 300 mgReference 580. Ainsi, un joint de 300 mg dont la concentration de THC est de 4,3 % produirait une dose de 13 mg de THC, tandis qu'un joint de 300 mg dont la concentration de THC est de 5,7 % produirait une dose de 17 mg de THC.
Une étude clinique croisée à répartition aléatoire et double insu, contrôlée par placebo, a examiné les effets aigus de concentrations variées de cannabis sur les évaluations de divers effets subjectifs (c.-à-d. intensité et durée des effets)Reference 491. Des joints d'un gramme contenant des doses croissantes de THC (c.-à-d. 29 mg, 49 mg et 69 mg) ayant des concentrations de THC respectives de 9,75 %, de 16 % ou de 23 % dans un groupe de consommateurs réguliers de cannabis à des fins non médicales ont révélé l'effet important du cannabis très puissant sur les évaluations d'effets subjectifs. Les participants ont déclaré avoir utilisé en moyenne 7,7 joints par mois au cours de l'année précédente avec une durée moyenne de consommation de cannabis de 7,7 ans. Fumer la dose faible (29 mg de THC) a été associé à une Cmax sérique moyenne de THC de 120 ng/mL et à un score maximal de la sensation de « high » juste en dessous de 60 sur l'EVA; fumer la dose moyenne (49 mg de THC) a été associé à une Cmax sérique moyenne de THC de 160 ng/mL et est lié à un score maximal de la sensation de « high » juste au-dessus de 60 sur l'EVA, tandis que fumer la dose la plus élevée (69 mg de THC) a été associé à une Cmax sérique moyenne de THC de 190 ng/mL et à un score maximal du « high » de 80 sur l'EVA, ce qui confirme un effet de dose-réponse. Bien que les concentrations de THC dans le sang aient diminué rapidement pour finir sous le seuil de 25 ng/mL dans les deux heures suivant l'administration de la dose la plus élevée, les évaluations subjectives de la sensation de « high » ont diminué beaucoup plus progressivement et ont persisté plus longtemps comparativement aux concentrations de THC dans le sang. Les scores sur l'EVA pour les étourdissements, l'assèchement de la bouche, les palpitations, les troubles de la mémoire et de concentration, le sentiment d'abattement, la sensation d'être sous sédation et le sentiment d'anxiété atteignaient leur maximum dans les deux premières heures après l'administration de la dose. L'effet de la dose de THC a été significatif. Près de deux heures après avoir fumé la dose la plus élevée, les participants ayant fumé la cigarette ayant la plus forte concentration de cannabis ont déclaré être beaucoup moins alertes, satisfaits et calmes comparativement à ceux ayant fumé un placebo. Quatre heures après l'administration de la dose, les scores relatifs à la « sensation d'un effet thérapeutique » ont augmenté parallèlement avec l'augmentation des doses de THC, avec des différences significatives entre les conditions du traitement au THC par rapport au placebo et entre la dose élevée et la dose faible. La diminution de la stimulation induite par le THC et l'augmentation de l'anxiété ont duré jusqu'à huit heures après avoir fumé. Dans l'ensemble, les résultats de l'étude indiquent que les effets psychoactifs et cognitifs étaient plus prononcés dans les deux premières heures suivant l'administration de la dose, même si une augmentation significative de la sédation était encore mesurable huit heures après l'administration de la dose. La cote maximale du « high » a été atteinte en quelques minutes pour toutes les doses, mais elle était 1,4 fois plus élevée avec la dose élevée de THC (69 mg) par rapport à la dose faible (29 mg). La cote des étourdissements a doublé avec la dose la plus élevée comparativement aux doses moyennes et faibles (29 et 49 mg de THC) jusqu'à deux heures après avoir fumé. La sédation a augmenté presque six fois plus avec la dose de THC la plus élevée (69 mg) comparativement au placebo. Les effets subjectifs ressentis étaient désagréables avec les doses moyennes et élevées de THC, par rapport à la dose faible (29 mg) pour laquelle les scores « appréciation de la drogue » et « volonté de recevoir une dose plus élevée de la drogue » étaient les plus élevés.
Une étude croisée à double insu et contrôlée par placebo qui faisait une comparaison des effets aigus d'une dose moyenne de dronabinol (20 mg) et de deux décoctions de lait de cannabis contenant des doses moyennes (16,5 mg) ou élevées (45,7 mg) de THC a rapporté un affaiblissement grave de plusieurs compétences nécessaires pour conduire de manière sécuritaireReference 1568. Une dose « modérée » (21 mg de THC) était associée à des affaiblissements des compétences motrices et perceptives nécessaires pour conduire de façon sécuritaireReference 1569. Lors d'une étude, le déficit du fonctionnement semblait moins important chez les grands consommateurs de cannabis, comparativement aux consommateurs occasionnels, possiblement en raison du développement d'une tolérance ou d'un comportement compensatoireReference 216. On a proposé que, contrairement à la consommation d'alcool, les consommateurs de cannabis soient conscients de leur niveau d'intoxication et compensent en devenant extrêmement prudents; dans les tâches comme la conduite automobile, ce type de comportement se traduit par une baisse de vitesse, une baisse de la fréquence de dépassements et une augmentation de la distance entre véhiculesReference 1570Reference 1571. D'autres personnes sont en désaccord avec cette affirmationReference 227Reference 1572.
Une récente étude croisée, randomisée, contrôlée contre placebo, à double insu et à trois permutations a suggéré que l'administration aiguë de dronabinol nuisait à la conduite de manière liée à la dose chez les consommateurs occasionnels (qui consommaient des cannabinoïdes de 5 à 36 fois par année) et chez les grands consommateurs (qui fumaient d'un à trois joints par jour, > 160 fois par année)Reference 1573. Cependant, la taille du déficit semblait moins importante chez les grands consommateurs, possiblement en raison de la tolérance. Les auteurs indiquent que l'affaiblissement des facultés nécessaires pour conduire après avoir consommé du dronabinol possédait une pertinence clinique et semblable à celle des conducteurs qui utilisent leur véhicule lorsque la concentration d'alcool dans leur sang est supérieure à 0,8 mg/mL (0,08 g%). Environ 25 % des « grands consommateurs » ont présenté un affaiblissement de leurs facultés équivalent ou plus grave que celui signalé pour les conducteurs dont la concentration d'alcool dans le sang est de 0,5 mg/mL (0,05 g%). L'affaiblissement des facultés nécessaires pour conduire après avoir consommé du dronabinol était évident, même si les concentrations plasmatiques de THC étaient relativement faibles (située de 2 à 10 ng/mL)Reference 226Reference 1573.
Chronique
Il existe aussi des données récentes provenant d'études menées auprès de consommateurs fréquents et chroniques de cannabis à des fins non médicales, présentant une charge corporelle élevée en THC, qui signalent des concentrations de THC dans le sang supérieures à 5 ng/mL (considérées comme étant une dose « nuisible ») pendant des périodes durant plusieurs jours après la dernière exposition au THCReference 225. Ces nouvelles constatations soulèvent la possibilité d'un degré de détérioration persistant qui pourrait durer aussi longtemps que trois à sept jours après la dernière consommation chez des utilisateurs chroniques, fréquents (grands consommateurs) de cannabis et qui pourrait nuire aux habiletés psychomotrices nécessaires pour une bonne conduite.
Une étude clinique en laboratoire, qui a évalué la fonction psychomotrice chez les fumeurs chroniques et quotidiens de cannabis durant trois semaines d'abstinence continuellement surveillée dans une unité de recherche sécurisée, révèle que la fonction psychomotrice dans des tâches de suivi critique et d'attention partagée était altérée même après trois semaines d'abstinenceReference 1564. Dans cette étude, 19 fumeurs de cannabis chroniques, quotidiens et de sexe masculin qui avaient eux-mêmes déclaré consommer 11 joints de cannabis par jour au cours des dix dernières années (au moins cinq jours par semaine pendant six mois avant leur admission) ont été comparés à un groupe témoin de consommateurs occasionnels de cannabis ou d'ecstasy en ce qui a trait à la performance dans deux tests psychomoteurs : la tâche de suivi critique qui mesure la commande motrice perceptive d'un sujet et qui s'avère être sensible aux effets néfastes du THC et la tâche d'attention partagée qui évalue la capacité d'une personne à partager son attention entre deux tâches effectuées simultanément et qui s'avère également sensible aux effets néfastes du THC. Les concentrations moyennes de THC et de 11-hydroxy-THC dans le plasma au moment de l'admission étaient de 5,3 ng/mL et de 2,1 ng/mL, respectivement tandis qu'au 8e jour suivant l'admission elles étaient de 1,3 et de 0,2 ng/mL, respectivement. Les valeurs du THC sont passées en dessous de 1 ng/mL les 14e et 16e jours. Les résultats ont démontré que la fonction psychomotrice (tâche de suivi critique et tâche d'attention partagée) des fumeurs de cannabis chroniques et quotidiens s'est améliorée au cours d'une période de trois semaines d'abstinence, mais elle est demeurée sensiblement inférieure à celle du groupe témoin de consommateurs occasionnels de cannabis et d'ecstasy. Les auteurs émettent l'hypothèse selon laquelle les troubles psychomoteurs persistants observés pourraient avoir découlé d'effets du sevrage, de concentrations résiduelles de THC dans le sang à la suite d'une charge corporelle importante en THC et de la libération de réserves périphériques. Enfin, ils pourraient provenir des effets d'un apport cumulé pendant toute la durée de vie reflétant des changements continuels de la fonction psychomotrice chez les fumeurs chroniques de cannabis.
Une étude qui caractérisait l'élimination des cannabinoïdes dans le sang de 30 fumeurs quotidiens de cannabis de sexe masculin pendant leur abstinence continue surveillée au cours d'une période allant jusqu'à 33 jours, dans une unité résidentielle fermée, révèle que du THC et son métabolite inactif 11-nor-9-carboxy-THC ont été décelés dans le sang jusqu'à un mois après la dernière consommation par fumée, ce qui, d'après les auteurs, est quatre fois plus long que ce qui avait été décrit précédemmentReference 455. L'étude a aussi signalé que les hommes avaient un temps maximal de détection plus court du 11-hydroxy-THC (72 heures) comparativement aux femmes (sept jours). La grande majorité des participants étaient positifs au test du THC au moment de leur admission, avec une concentration médiane de 1,4 ng/mL de THC dans le sang et les concentrations de THC diminuaient progressivement au fil du temps.
Une étude a examiné les temps de détection de cannabinoïdes dans le plasma chez les fumeurs de cannabis chroniques et fréquents et elle a aussi tenté de déterminer si les concentrations de cannabinoïdes dans le plasma présentaient un lien avec la fonction psychomotrice dans des tâches de suivi critique et d'attention partagéeReference 225. Vingt-huit participants de sexe masculin qui ont déclaré fumer en moyenne 10,6 joints par jour (marge de 1 à 30) pendant, en moyenne, 10,6 années (marge de 4 à 28) et qui se sont abstenus de fumer du cannabis pendant une période allant jusqu'à 30 jours, présentaient une marge médiane de référence de THC dans le sang, au moment de leur admission, de 4,2 ng/mL. Les concentrations de THC dans le sang diminuent considérablement 24 heures après l'admission. Trois jours après l'admission, un nombre important de participants avaient des concentrations de THC dans le sang supérieures ou égales à 5 ng/mL, tandis que sept jours après l'admission, près de 30 % des participants avaient des concentrations de THC dans le sang supérieures à 2 ng/mL. Un participant a présenté une concentration de THC dans le plasma supérieure ou égale à 2 ng/mL pendant 18 jours consécutifs. Du THC a été décelé dans certains échantillons, jusqu'à 30 jours après l'admission (0,3 à 1,3 ng/mL). Plusieurs années de consommation antérieure de cannabis présentaient un lien significatif avec la concentration de THC au moment de l'admission. L'erreur de suivi avait un lien avec le THC, le 11-hydroxy-THC et le 11-nor-9-carboxy-THC au début de l'étude et avec le 11-hydroxy-THC au 8e jour. Aucune autre mesure des résultats, telle que la tâche d'attention partagée ou celle du suivi critique, n'a été significativement liée aux concentrations de cannabinoïdes. D'après les résultats de cette étude, les auteurs réfutent l'utilité du THC et du 11-hydroxy-THC détectables dans le plasma de fumeurs de cannabis chroniques fréquents comme marqueur fiable de la consommation récente de cannabis. Les concentrations dans le sang du 11-hydroxy-THC n'ont jamais semblé dépasser 2 ng/mL au-delà de 24 heures, ce qui, selon les auteurs, pourrait représenter un seuil pour l'utilisation récente de cannabis (dans les 24 heures). Les auteurs avancent que le THC dans le plasma, plusieurs semaines après la dernière consommation, serait associé à une défaillance chez les fumeurs chroniques fréquents de cannabis. En outre, ils affirment que bien qu'une tolérance partielle à certains effets néfastes du cannabis puisse apparaître chez des fumeurs chroniques fréquents de cannabis, certains troubles résiduels pourraient limiter la conduite appropriée d'un véhicule ou d'équipement mécanique, ce qui pourrait entraîner des blessures ou un contentieux criminel.
Études épidémiologiques
Une récente étude de cas-témoin faisait une estimation du risque d'accident posé par différentes substances, notamment l'alcool, les médicaments et les drogues illégales, a déterminé que le rapport de probabilité concernant le risque d'accident pour toutes les concentrations de THC mesurées (1 à > 5 ng/mL) était statistiquement significatifReference 1574. Aux concentrations de ≥ 2 ng/mL de THC dans le sang total, le risque d'avoir un accident était beaucoup plus grand. Une étude a déterminé que le risque de responsabilité en matière d'accidents de la route mortels lorsqu'une personne conduit sous les effets du cannabis augmentait selon les concentrations sanguines de THC, de telle sorte que l'on peut constater une forte relation de dose à effet entre le risque de responsabilité d'accidents de la route mortel et les concentrations sanguines de THC. L'étude a révélé que le rapport de probabilité d'avoir un accident mortel passait de 2,18, si les concentrations sanguines étaient situées entre 0 et 1 ng/mL de THC, à 4,72 si les concentrations sanguines de THC étaient de ≥ 5 ng/mLReference 1575. Les conclusions de cette étude appuient davantage la notion de relation causale entre la consommation de cannabis et les accidentsReference 1575.
Une autre étude suggérait que les conducteurs jugés comme ayant des facultés affaiblies (par un médecin des services de police) avaient des concentrations sanguines de THC plus élevées que les conducteurs jugés comme n'ayant pas les facultés affaiblies (médiane : 2,5 ng/mL par rapport à 1,9 ng/mL)Reference 1576. À l'aide d'un modèle de régression logique binaire, le rapport de probabilité en ce qui a trait au pronostic de facultés affaiblies semblait augmenter au fil des concentrations de drogue, à compter de 2,9 ng/mL et plus. Les concentrations sériques de THC situées entre 2 et 5 ng/mL ont été établies en tant que seuil au-dessus duquel les facultés affaiblies provoquées par le THC en matière de conduite deviennent apparentesReference 149Reference 1574.
Une méta-analyse d'études d'observation portant sur la consommation aiguë de cannabis et le risque de collision entre véhicules à moteur rapportait que conduire sous les effets du cannabis était associé à un risque beaucoup plus élevé de collisions entre véhicules à moteur, comparativement à la conduite sans faculté affaiblie, avec un rapport de probabilité de 1,92 (IC de 95 % = 1,35, 2,73)Reference 226. Les estimations de risque de collision étaient plus élevées dans les études de cas-témoin et les études de collisions mortelles que dans les études de responsabilité et les études de collisions non mortelles. On a signalé que les personnes qui prennent le volant au cours d'une heure après avoir consommé du cannabis sont près de deux fois plus susceptibles de subir des accidents impliquant des véhicules motorisés que ceux qui ne consomment pas de cannabisReference 1569. Dans le cadre de cette méta-analyse, seules les études d'observation comptant un groupe témoin ou un groupe de comparaison étaient inclus, ce qui comprenait notamment les concepts de cohorte (étude historique prospective), de cas-témoins et de responsabilité, à l'exclusion des études expérimentales en laboratoire ou des études en simulateurReference 226. De plus, seules les études qui évaluaient l'utilisation aiguë ou récente de cannabis ont été examinées. Cette méta-analyse appuie les conclusions d'autres études qui suggèrent que la consommation de cannabis nuit à l'exécution des tâches cognitives et motrices nécessaires pour conduire de manière sécuritaire, ce qui augmente le risque de collisionReference 226. Bien que des études sur simulateurs de conduite aient signalé un effet de dose-réponse dans lequel les concentrations élevées de THC étaient associées à un plus grand risque d'accident, des effets de dose-réponse n'ont pu être établis dans cette étudeReference 226.
Une méta-analyse et un examen systématique récent ont conclu que, après un ajustement de la qualité de l'étude, l'utilisation de cannabis était associée à un risque estimé sept fois plus grand d'avoir un accident mortel, l'utilisation de benzodiazépines était associée à un risque estimé deux fois plus grand d'avoir un accident mortel, et l'utilisation d'opiacés était associée à un risque estimé trois fois plus grand d'avoir un accident mortelReference 228. À l'inverse, l'utilisation de cannabis était associée à un risque estimé 1,5 fois plus grand d'avoir un accident qui ne provoque que des blessures, l'utilisation de benzodiazépines était associée à un risque estimé 0,71 fois plus grand, alors que les opiacés étaient associés à un risque 21 fois plus grand d'avoir un accident ne provoquant que des blessures.
Consommation à des fins médicales et conduite
Une étude pilote prospective de surveillance post-commercialisation, multicentrique et non interventionnelle menée pour recueillir des données sur la capacité de conduire un véhicule, la tolérabilité et l'innocuité auprès de 33 patients atteints de SP et commençant le traitement au nabiximols signale qu'une période de traitement de quatre à six semaines avec du nabiximols (moyenne de 5,1 vaporisations par jour ou 13,7 mg de THC et 12,8 mg de CBD par jour) a été associée à une amélioration statistiquement significative de la spasticité auto-évaluée, mais qu'elle n'était pas associée à une détérioration statistiquement significative de la capacité de conduire des patients mesurée en laboratoire à l'aide d'une série d'essais cognitifs et psychomoteursReference 687. Cependant, moins de la moitié des patients répondaient aux critères « apte à la conduite ». En outre, 4 patients sur 33 ont éprouvé un événement indésirable non grave, léger ou modéré associé au traitement au nabiximols (p. ex. étourdissements et vertiges).
Cannabis et alcool
Études cliniques
Une étude intra-sujet, à l'insu, contrôlée par placebo, avec simulateur de conduite a examiné les sensations subjectives et les aptitudes de conduite de 14 étudiants en bonne santé après avoir fumé deux différentes cigarettes de cannabis dont les puissances varient (13 et 17 mg de THC) ou après avoir consommé de l'alcool (0,5 g/kg de poids corporel pour une concentration d'alcool dans le sang de 0,05 %)Reference 1577. Tous les participants consommaient du cannabis et de l'alcool en quantité faible ou modérée et ont déclaré qu'ils utilisaient du cannabis une à quatre fois par mois. Bien que la quantité d'alcool et la dose plus faible de THC (13 mg) aient considérablement augmenté le temps de réaction par rapport au placebo, l'ampleur des effets était plus importante avec une dose plus élevée de THC (17 mg). Aucun effet résiduel sur le temps de réaction n'a été observé 24 heures après avoir fumé la dose de THC la plus élevée. Comparativement au placebo, les doses faibles (13 mg) et élevées (17 mg) de THC ont considérablement ralenti la vitesse moyenne de conduite de manière proportionnelle à la dose, tandis que l'alcool l'a augmentée. Les doses faibles et élevées de THC augmentaient considérablement les déviations de trajectoire comparativement au placebo, tandis que seule la dose faible de THC a augmenté considérablement les déviations du volant. La vitesse moyenne, les déviations de trajectoire et les déviations du volant sont retournées aux niveaux de référence 24 heures après avoir fumé. Il semble aussi exister une augmentation dépendante de la dose du nombre de collisions, un doublement apparent du nombre de personnes impliquées dans une collision ayant été observé avec seulement une augmentation modeste de la quantité de THC administrée (c.-à-d. 4 mg ou une hausse de 23 % du THC). Les effets subjectifs ont également été examinés et l'étude révèle une augmentation significative de l'inconfort physique, de l'effort physique et un manque d'énergie avec la dose la plus élevée de THC comparativement au placebo, bien que la dose la plus faible ait aussi produit un inconfort et un effort physiques. Bien que la dose de THC la plus faible (13 mg) et l'alcool (0,05 % de concentration d'alcool dans le sang) semblaient produire un affaiblissement des facultés nécessaires pour conduire, il paraît exister des différences dans les effets subjectifs entre le THC et l'alcool.
Une étude contrôlée par placebo, contre-balancée, à double insu sur simulateur de conduite a signalé que la faculté de conduite était plus affaiblie chez les sujets qui consommaient de l'alcool conjointement avec des doses faibles ou élevées de THC en fumant des cigarettes de cannabisReference 227. La concentration de THC décelée dans le sang était plus élevée lorsque du cannabis était consommé avec de l'alcool que lorsqu'il était consommé seul. Il semble aussi que les consommateurs de cannabis réguliers font plus d'erreurs que les consommateurs de cannabis non réguliers lorsqu'ils conduisaient.
Une étude expérimentale intra-sujets à double insu et répartition aléatoire, contrôlée par placebo et faisant intervenir un simulateur de conduite a été menée chez 18 sujets ayant déclaré eux-mêmes consommer du cannabis de manière occasionnelle (≥ une fois lors des trois derniers mois, ≥ trois jours/semaine). Cette étude a déterminé dans quelle mesure les concentrations de THC dans le sang sont liées à un affaiblissement des facultés nécessaires pour conduire un véhicule avec et sans alcoolReference 224. L'étude révèle que le cannabis vaporisé (0,5 g de cannabis vaporisé séché avec une concentration de THC de 2,9 % ou de 6,7 % ou 14,5 mg de THC ou 33,5 mg de THC), lorsqu'il était associé à l'alcool (0,065 % de concentration maximale d'alcool dans la respiration), augmente l'écart-type de la position latérale (SDLP) s'apparentant à 0,05 et 0,08 % de concentration d'alcool dans le sang. En outre, les effets de l'alcool et du cannabis sur le SDLP étaient additifs plutôt que synergiques, avec 5 ng/mL de THC et 0,05 % de concentration d'alcool dans le sang, montrant un SDLP semblable à la concentration d'alcool dans le sang seule de 0,08 %.
Une étude clinique à l'insu, à répartition aléatoire et contrôlée par placebo a évalué l'élimination des cannabinoïdes dans le sang et le plasma après l'administration aiguë contrôlée de cannabis vaporisé avec et sans administration par voie orale d'une faible dose d'alcoolReference 201. Cette étude révèle que l'administration par voie orale d'une faible dose d'alcool augmente considérablement les concentrations médianes maximales (Cmax) de THC et de 11-hydroxy-THC dans le sang. Dix-neuf participants en bonne santé qui ont déclaré eux-mêmes avoir consommé du cannabis au moins une fois tous les trois mois, mais pas plus de trois jours par semaine au cours des trois derniers mois (c.-à-d. consommation occasionnelle) ont reçu tous les traitements de l'étude. La vaporisation de 0,5 g de fleurs de cannabis séchées contenant une faible dose de THC (2,9 % de THC, 0,22 % de CBD) sans administration par voie orale d'alcool était associée à une Cmax médiane de THC dans le sang de 32,7 ng/mL, tandis que la vaporisation de cannabis contenant une dose élevée de THC (6,7 % de THC, 0,37 % de CBD) était associée à une Cmax médiane de THC dans le sang de 42,2 ng/mL. Dans les mêmes conditions, la Cmax médiane de 11-hydroxy-THC dans le sang avec la dose faible de THC était de 2,8 ng/mL, tandis qu'avec la dose élevée de THC, la Cmax médiane de 11-hydroxy-THC dans le sang était de 5,0 ng/mL. Le temps nécessaire pour atteindre les Cmax de THC et de 11-hydroxy-THC dans le sang était de 10 minutes. L'administration concomitante d'une dose administrée par voie orale d'alcool produisant une concentration d'alcool dans la respiration de 0,065 % avec la vaporisation de la dose faible de THC était associée à une Cmax médiane de THC dans le sang de 35,3 ng/mL, tandis qu'avec la dose élevée de THC, la Cmax médiane de THC dans le sang était de 67,5 ng/mL. Avec l'administration concomitante d'alcool, la Cmax médiane de 11-hydroxy-THC dans le sang avec la dose faible de THC était de 3,7 ng/mL, tandis qu'avec la dose élevée de THC, la Cmax médiane de 11-hydroxy-THC dans le sang était de 6,0 ng/mL. Ces résultats indiquent que la consommation concomitante d'alcool avec le THC peut entraîner des concentrations beaucoup plus élevées de THC et de 11-hydroxy-THC dans le sang comparativement au THC seul qui pourrait contribuer à augmenter l'altération des fonctions cognitives, ce qui peut compromettre les capacités de conduite sécuritaire. Les auteurs de l'étude ont aussi affirmé que la vaporisation du cannabis, dans les conditions de l'étude, fournit du THC de la même manière que le cannabis fumé et génère des profils de concentration des cannabinoïdes similaires. Les facteurs ayant une incidence sur la production de THC vaporisé étaient notamment la température de chauffage, le nombre de remplissages de ballons, la quantité et le mélange de cannabis et la durée entre la volatilisation et l'inhalation (c.-à-d. adhérence possible du THC à la surface du ballon). Les participants semblaient devoir moins nécessiter un autodosage à la dose plus faible de THC et devoir plus nécessiter un autodosage à la dose plus élevée de THC, ce qui est reflété par la plus grande variabilité du THC dans le sang dans la condition de dose élevée de THC.
Études épidémiologiques
Une étude de suivi a examiné les effets de l'alcool (0,05 % de concentration d'alcool dans le sang), du THC (13 mg) et de leur association sur les tâches liées à la conduite et celles sans rapport avec la conduite, ainsi que la mesure dans laquelle les personnes sont disposées à conduire, d'après leurs sensations subjectives et les effets ressentis des droguesReference 215. L'association de l'alcool et du THC a entraîné un plus grand nombre de collisions dans une tâche du simulateur de conduite chez les participants, comparativement à l'alcool ou au THC seul ou au placebo. Les déviations de trajectoire ont augmenté considérablement sous les effets combinés de l'alcool et du THC, par rapport à d'autres traitements qui ne différaient pas les uns des autres. L'association de l'alcool et du THC ont causé une bien meilleure sensation de « sédation » comparativement à tous les autres traitements. En outre, l'association de THC et d'alcool avait des effets significatifs et intenses sur des aspects particuliers du Swedish Occupational Fatigue Inventory, comme le « manque d'énergie », l'« effort physique » et le « manque de motivation ». D'après les résultats de l'étude, les auteurs affirment que les sujets ont ressenti que l'association de l'alcool et du THC était le traitement le plus puissant et qu'il avait un effet additif sur certaines sensations subjectives comparativement aux effets des deux drogues seules. Aucun effet résiduel, quel que soit le traitement, n'a été observé 24 heures après le traitement.
Une étude cas-témoin, qui a examiné les données relatives aux accidents des conducteurs compilées par le National Center for Statistics and Analysis of the National Highway Traffic Safety Administration des États-Unis au cours d'une période de 17 ans (1991 à 2008), a indiqué que la prévalence de THC et d'alcool chez les conducteurs âgés de 20 ans et plus impliqués dans un accident mortel était devenue environ cinq fois plus importante, en passant d'un taux inférieur à 2 % en 1991 à un taux supérieur à 10 % en 2008Reference 1370. De plus, les auteurs de l'étude ont déclaré que chaque unité de concentration d'alcool dans le sang (taux d'alcoolémie) de 0,01 augmentait le risque d'une conduite dangereuse, une mesure indirecte de la responsabilité dans un accident, d'environ 9 à 11 %. Après correction pour tenir compte de l'âge, du sexe, de la consommation d'alcool, de la polyconsommation de drogues et du dossier de conduite des conducteurs, ceux qui avaient été déclarés positifs pour le THC seul présentaient un risque accru de 16 % de conduite dangereuse. Lorsque l'alcool et le THC étaient associés, les risques d'une conduite dangereuse augmentaient d'environ 8 à 10 % pour chaque hausse de 0,01 du taux d'alcoolémie dans le sang par rapport à l'alcool ou au THC seuls. Les conducteurs dont les limites légales habituelles de concentration d'alcool dans le sang étaient de 0,05 et de 0,08 présentaient un risque plus important de conduite dangereuse de 66 % et de 117 %, respectivement, comparativement aux conducteurs sobres qui ne consommaient pas de THC. Cependant, les auteurs affirment que lorsque l'alcool était associé au THC, ce risque augmentait pour atteindre 81 % et 128 %, respectivement. En outre, l'effet de l'association du THC et de l'alcool était le plus prononcé aux taux les plus faibles de concentrations d'alcool dans le sang. En d'autres termes, à mesure que le taux d'alcoolémie augmente, les effets néfastes de l'alcool dominent la relation entre le THC et l'alcool. Les auteurs concluent que les conducteurs qui étaient positifs pour l'alcool et le THC étaient plus susceptibles de faire des erreurs que les conducteurs qui étaient positifs pour l'alcool ou le cannabis seul.
Enfin, les données provenant d'une étude annuelle transversale à passages répétés menée auprès d'adultes de l'Ontario et qui a examiné plus de 16 000 adultes et enregistré l'incidence de collisions auto-déclarées parmi des conducteurs ayant déclaré conduire sous l'influence de l'alcool et du cannabis ont révélé que les conducteurs qui ne déclaraient être sous l'influence ni de l'alcool ni du cannabis avaient la prévalence de collisions la plus faible (6,7 %)Reference 1578. Cependant, ceux ayant déclaré conduire sous l'influence de l'alcool ou du cannabis ont signalé une prévalence beaucoup plus élevée d'implication dans une collision de 9,6 %. La plus forte probabilité d'implication dans une collision a été observée chez les conducteurs déclarant les deux comportements (30,5 %). En d'autres termes, ceux ayant déclaré conduire sous l'influence du cannabis et de l'alcool étaient plus de trois fois plus susceptibles d'être impliqués dans une collision comparativement à ceux ayant déclaré l'un ou l'autre comportement (RC = 3,65, IC = 2,12 à 6,28).
7.7.3 Effets psychiatriques
7.7.3.1 Anxiété, ESPT, dépression et trouble bipolaire
- Des données d'études cliniques suggèrent la présence d'effets biphasiques en fonction de la dose du THC sur l'anxiété et l'humeur puisque des doses faibles de THC semblent avoir des effets anxiolytiques et de hausse de l'humeur tandis que des doses élevées de THC peuvent produire de l'anxiété et diminuer l'humeur.
- Des études épidémiologiques suggèrent une association entre la consommation de cannabis (à THC prédominant), en particulier la consommation chronique et intensive, et l'apparition de troubles anxieux, dépressifs et bipolaires, et la persistance de symptômes liés à l'ESPT, au trouble panique, au trouble dépressif et au trouble bipolaire.
- Les résultats préliminaires d'enquêtes suggèrent une association entre l'utilisation de produits concentrés de cannabis ultra-puissants (p. ex. huile de haschich butane, BHO) et des taux plus élevés d'anxiété et de dépression autodéclarées et d'autres drogues illicites, ainsi que des niveaux plus élevés de dépendance physique qu'avec l'herbe de cannabis à forte puissance.
Anxiété et dépression
Des études épidémiologiques suggèrent un lien possible entre la consommation régulière de cannabis et le développement de l'anxiété et des troubles dépressifs; toutefois, les preuves disponibles sur un lien entre la consommation de cannabis et l'anxiété ou les troubles anxieux et la dépression sont plus nuancées et moins cohérentes que celles observées entre la consommation de cannabis et la psychoseReference 157. Cela dit, les troubles anxieux et dépressifs semblent être non seulement associés à la dépendance au cannabis, mais sont aussi prédictifs de si les individus effectueront la transition de la consommation à la dépendanceReference 157. Il semblerait que le THC puisse exercer des effets bidirectionnels sur l'anxiété et l'humeur (c.-à-d., des effets anxiolytiques et de hausse de l'humeur à des doses faibles et l'opposé à des doses élevées) et sur le dysfonctionnement du SEC, comme ceux causés par l'activation de la signalisation chronique de haut degré au niveau des récepteurs CB1 (ou, inversement, l'antagonisme des récepteurs CB1), en particulier à l'adolescence, pouvant augmenter ou exacerber les risques de développement de la dépression et d'anxiété ou de troubles anxieuxReference 1579Reference 1580. Plus récemment, quelques enquêtes transversales ont exploré les effets des produits concentrés de cannabis à très forte puissance comme l'huile de haschich butane (BHO) sur divers résultats psychiatriques. Dans une étude portant sur 83 867 consommateurs de cannabis, dont 5 922 ont déclaré avoir consommé du BHO, les participants qui ont déclaré avoir reçu, au cours de leur vie, un diagnostic de dépression (RC = 1,15; p = 0,003), d'anxiété (RC = 1,72; p < 0,001) et de consommation d'autres substances (RC = 1,29; p < 0,001) sont plus susceptibles de consommer du BHO que de l'herbe de cannabis à haute puissanceReference 1581. De plus, les utilisateurs de BHO ont signalé des effets négatifs plus forts et moins positifs avec le BHO qu'avec l'herbe de cannabis à haute puissance. Dans une autre étude, l'utilisation plus fréquente de BHO a été associée à des niveaux plus élevés de dépendance physique (RR = 1,8; p < 0,001; RR ajusté = 1,2; p = 0,014), qui sont demeurés significatifs même après l'ajustement avec les facteurs de confusionReference 516. Bien qu'il y a eu une association entre l'usage de BHO et les troubles du contrôle (RR = 1,3; p < 0,001), les problèmes scolaires et professionnels liés au cannabis (RR = 1,5; p = 0,004), le manque de soins personnels (RR = 1,3; p = 0,002) et les comportements à risque liés au cannabis (RR = 1,2; p = 0,001), ces associations n'ont pas persisté après avoir contrôlé pour les facteurs de confusion.
Anxiété
Les affirmations anecdotiques au sujet de l'utilisation du cannabis pour soulager l'anxiété ont été postulées comme résultant réellement d'une soi-disant [« hypothèse de malattribution du stress »] supposant que les consommateurs de cannabis pourraient attribuer par erreur des symptômes de stress ou de tension à l'anxiétéReference 1580Reference 1582. Selon cette hypothèse, les individus affectés croient qu'ils consomment du cannabis pour soulager des symptômes d'anxiété, signalant donc la consommation de cannabis comme automédication, tandis qu'en réalité ils éprouvent des symptômes de stress (c.-à-d., tension, irritabilité, symptômes d'éveil constant) ainsi que, ou au lieu, des symptômes d'anxiétéReference 1580Reference 1582.
Les données recueillies suggèrent que le SEC joue un rôle dans la modulation des réactions anxieuses, dans des conditions environnementales basales non aversives, mais aussi dans des conditions environnementales aversives ou stressantesReference 172. L'amélioration pharmacologique de la signalisation des endocannabinoïdes dans des conditions aversives ou stressantes dans divers modèles d'anxiété chez des animaux, soit par l'inhibition de la dégradation des endocannabinoïdes, soit par le blocage de la recapture des endocannabinoïdes, a généralement été associée à un effet anxiolytique, principalement au moyen d'un mécanisme dépendant du récepteur CB1Reference 172.
La consommation de cannabis, notamment le cannabis contenant principalement du THC, a une incidence proportionnelle à la dose sur les comportements d'angoisse, les doses faibles étant généralement anxiolytiques et les doses élevées étant soit inefficaces ou potentiellement anxiogènesReference 172. En effet, on a démontré que la consommation de cannabis à forte teneur en THC cause un épisode d'anxiété aigu et bref chez environ 20 à 30 % des consommateursReference 1582, ressemblant souvent à une crise de panique; ce phénomène se produit plus couramment chez les nouveaux consommateurs de cannabis et chez ceux qui consomment des doses plus élevées de cannabis ou de THC (p. ex. > 5 mg de Δ9-THC par voie orale), et aussi lorsque le cannabis est consommé dans un environnement nouveau ou stressantReference 184Reference 186. Bien que les essais cliniques sur le cannabis ou le Δ9-THC, administré par voie orale pour traiter l'anxiété ou la dépression révèlent une absence d'amélioration ou encore une aggravation de ces troublesReference 1583-Reference 1586, il existe certaines données selon lesquelles le cannabis ou les cannabinoïdes pourraient être utiles dans le traitement de l'anxiété ou de la dépression liée à d'autres troubles (p. ex. douleur chronique, ESPT). De plus, bien qu'il existe un grand nombre de données précliniques suggérant un rôle comme anxiolytique pour le CBD, il existe moins de données cliniques, mais émergentes, suggérant un rôle potentiel d'atténuation de l'angoisse sociale pour le CBDReference 166Reference 1587, bien que plus de recherches soient nécessaires. Pour plus de renseignements sur les utilisations thérapeutiques possibles du cannabis ou des cannabinoïdes, comme le CBD, pour traiter l'anxiété et la dépression, veuillez consulter la Section 4.9.5.1.
Des études récentes suggèrent que la consommation de cannabis chez des personnes ayant des troubles anxieux est associée à une aggravation des fonctions liées à la santé mentale. Une étude a signalé que la QV liée à la santé mentale était beaucoup plus faible chez les personnes atteintes de troubles anxieux et qui consommaient également du cannabisReference 1588. Les données pour cette étude sont tirées de la NESARC où des enquêtes directes ont été menées auprès de plus de 43 000 adultes américains âgés de 18 ans et plus provenant de la population civile hors établissement institutionnel. Les troubles anxieux inclus dans cette étude faisaient référence au trouble de panique, au trouble d'anxiété sociale, à une phobie spécifique et au trouble d'anxiété généralisée au cours des 12 derniers mois. La « consommation régulière de cannabis » était définie comme une consommation qui était au moins hebdomadaire et la « consommation occasionnelle » était définie comme une consommation dont la fréquence était inférieure à une fois par semaine. Comparativement aux personnes qui ne consomment pas de cannabis, les consommateurs réguliers de cannabis de sexe féminin et masculin déclarent beaucoup plus souvent que leurs problèmes émotionnels ou physiques avaient des répercussions sur leurs activités sociales, qu'ils accomplissent moins de choses en raison de leurs problèmes émotionnels et qu'ils effectuent leur travail ou d'autres activités moins soigneusement compte tenu de leurs problèmes émotionnels. Ils déclarent également qu'ils se sentent moins souvent sereins et calmes et qu'ils ont tendance à être plus souvent déprimés. En revanche, peu de différences ont été trouvées entre les consommateurs de cannabis occasionnels et ceux n'en consommant jamais en ce qui a trait à la QV liée à la santé mentale, bien que les consommatrices occasionnelles de cannabis aient déclaré se sentir moins souvent sereines. Parmi les hommes atteints de troubles anxieux, les consommateurs occasionnels de cannabis déclaraient se sentir plus souvent sereins et calmes, être moins souvent déprimés et ressentir moins de répercussions sur leurs activités sociales par rapport aux consommateurs réguliers de cannabis. Par contre, la consommation régulière de cannabis était associée à une QV liée à la santé mentale beaucoup plus mauvaise chez les hommes et les femmes, comparativement aux personnes qui ne consommaient pas de cannabis. La consommation régulière de cannabis a aussi été associée à des scores moyens relatifs à la santé mentale beaucoup plus faibles chez les hommes et les femmes, et à des scores moyens plus faibles sur les sous-échelles du fonctionnement social chez les femmes et sur les sous-échelles de la santé mentale, et du rôle émotionnel chez les hommes, comparativement à la consommation occasionnelle de cannabis. Les analyses de régression linéaire examinant les associations entre les niveaux de consommation du cannabis et la QV mentale ont montré une QV mentale beaucoup plus mauvaise chez les consommateurs réguliers, mais pas chez les consommateurs occasionnels de cannabis et ce phénomène s'appliquait tant aux femmes qu'aux hommes. Les auteurs concluent que la consommation régulière, mais non occasionnelle, de cannabis chez les personnes souffrant de troubles anxieux est associée à une QV liée à la santé mentale plus mauvaise et réfutent l'hypothèse d'auto-médication.
Une étude de cohorte longitudinale représentative sur 15 ans, menée auprès de 1 943 personnes, qui examinait l'association entre la consommation de cannabis chez les adolescents et les troubles mentaux courants au début de l'âge adulte n'a signalé aucun lien constant entre la fréquence de consommation de cannabis chez l'adolescent et la dépression (c.-à-d. épisode dépressif majeur) à l'âge de 29 ansReference 1589. Cependant, la consommation quotidienne de cannabis a été associée à un risque deux fois plus important de trouble anxieux à l'âge de 29 ans (rapport de cote ajusté (RCA) = 2,5; IC à 95 % = 1,2 à 5,2) et de dépendance au cannabis (RCA = 2,2; IC à 95 % = 1,1 à 4,4). Chez les adolescents consommant du cannabis chaque semaine ou plus d'une fois par semaine (c.-à-d. quotidiennement) qui ont continué d'en consommer quotidiennement à l'âge de 29 ans, il existe encore une augmentation significative du risque de trouble anxieux (RCA = 3,2; IC à 95 % = 1,1 à 9,2). Une consommation précoce et régulière de cannabis durant l'adolescence augmente le risque de trouble anxieux à l'âge de 29 ans et les risques sont légèrement plus élevés si la consommation régulière survient également à l'âge de 29 ans.
Une méta-analyse et une recension systématique des écrits, qui ont recueilli les données de 31 études portant sur des échantillons tirés de 112 000 cas de l'ensemble de la population de dix pays, ont évalué de manière quantitative la relation entre l'anxiété (c.-à-d. diagnostics d'anxiété avec ou sans dépression comorbide selon les critères de diagnostic du DSM ou de la CIM) et la consommation de cannabisReference 1590. L'étude fait état d'une association positive entre l'anxiété et la consommation de cannabis (RC = 1,24; IC à 95 % = 1,06 à 1,45; p = 0,006; N = 15 études) ou le TUC (RC = 1,68; IC à 95 % = 1,23 à 2,31; p = 0,001; N = 13 études) et entre l'anxiété comorbide, la dépression et la consommation de cannabis (RC = 1,68; IC à 95 % = 1,17 à 2,40; p = 0,004; N = 5 études). L'association positive entre l'anxiété et la consommation de cannabis (ou le TUC) a été établie dans les sous-groupes d'études avec des RCA pour tenir compte de facteurs de confusion possibles et dans les études comportant des diagnostics cliniques de l'anxiété. La consommation de cannabis au début de l'étude a présenté aussi un lien significatif avec l'anxiété, lors du suivi dans cinq études (RC = 1,28; IC à 95 % = 1,06 à 1,54; p = 0,01). Les personnes manifestant divers troubles anxieux et une anxiété et dépression concomitantes étaient plus susceptibles de consommer du cannabis ou de présenter un TUC (c.-à-d. dépendance ou abus/usage nocif) comparativement à celles ne présentant pas de troubles anxieux. Les auteurs affirment que la consommation de cannabis pourrait encore aggraver les symptômes existants d'anxiété en fonction de la vulnérabilité génétique, de la gravité des symptômes d'anxiété, du sexe et de l'âge, parmi d'autres facteurs. Les conclusions sont fondées sur les échantillons de la population générale qui ne suit pas de traitement contre l'anxiété ni contre le TUC.
Une étude prospective de cohorte selon la population du Royaume-Uni (ALSPAC) menée sur 4 561 individus étudiant les associations entre la consommation de cannabis ou le tabagisme à l'âge de 16 ans et la dépression ou l'anxiété à l'âge de 18 ans a observé des preuves plutôt faibles d'un lien entre la consommation de cannabis et l'anxiété (RC non ajusté = 1,13, IC À 95 % = 0,98 à 1,31) qui ont disparu après avoir entièrement ajusté pour les facteurs de confusion (RCA = 0,96, IC À 95 % = 0,75 à 1,24)Reference 1591. Les lacunes de la méthodologie de l'étude comprennent la taille (relativement) petite de l'échantillon pour détecter un petit effet, la consommation de cannabis autodéclarée et l'évaluation des résultats par entrevue informatisée.
Une étude épidémiologique comparant les données de deux vagues de la NESARC (2001 à 2002 et 2004 à 2005) et examinant la relation entre la consommation de cannabis et les troubles psychiatriques parmi 35 000 répondeurs n'a signalé aucune association entre la consommation de cannabis au cours de la dernière année et tout trouble d'anxiété (RC = 0,9, IC À 95 % = 0,7 à 1,1)Reference 509. Les lacunes de la méthodologie de l'étude comprennent la période de suivi limitée (c.-à-d., seulement trois ans), la consommation de cannabis autodéclarée et les catégories limitées de fréquence de consommation de cannabis (c.-à-d. aucune consommation de cannabis au cours de la dernière année; un peu de consommation de cannabis au cours de la dernière année, mais moins d'une fois par mois; et une consommation de cannabis ou plus par mois).
Une étude épidémiologique fournissant les premières données représentatives au niveau national sur la prévalence et la corrélation du TUC selon le DSM-5 se servant de données de la vague de 2012 à 2013 du NESARC-III a signalé que le TUC au cours de la dernière année était associé aux troubles anxieux (RCA = 2,8) et que le TUC à vie était aussi associé aux troubles anxieux (RCA = 2,9)Reference 335. De plus, l'association entre tout trouble anxieux et le TUC au cours de la dernière année a augmenté avec l'accroissement de la sévérité du TUC (RCA = 2,2, 2,9 et 4,4 pour les cas de TUC légers, modérés et sévères, respectivement). Les liens entre le trouble panique ou le trouble d'anxiété généralisée et le TCC au cours de la dernière année était particulièrement étroit, possédant des RC de 2,5, de 2,8 et de 6,6 (pour les cas de TUC légers, modérés et sévères, respectivement) pour le trouble panique et des RC de 3,0, 3,6 et 6,3 (pour les cas de TUC légers, modérés et sévères, respectivement) pour le trouble d'anxiété généralisée.
ESPT
Une récente revue systématique a trouvé « des preuves insuffisantes » sur les bénéfices et les effets nocifs du cannabis dans le traitement de l'ESPT chez les adultes. Seules cinq études répondaient aux critères d'inclusion (les cannabinoïdes pharmaceutiques étaient exclus), dont deux étaient des revues systématiques qui aboutissaient à des conclusions non concluantes avec la présente revue, et trois étaient des études observationnelles, dont deux ne montrant aucun lien entre la consommation de cannabis et les résultats de l'ESPT, et une autre montrant que l'usage de cannabis était associé longitudinalement à des niveaux plus sévères de symptômes d'ESPT par rapport aux personnes s'abstenant de consommer du cannabis. Les auteurs ont souligné que les preuves étaient trop limitées pour tirer des conclusions et que des essais cliniques et davantage d'études de cohortes sont nécessaires pour déterminer l'innocuité et l'efficacité du cannabis à base de plante pour l'ESPTReference 1058.
Dépression
En ce qui concerne la dépression, les conclusions tirées d'études précliniques suggèrent que la réduction de la signalisation du SEC est associée à des symptômes de type dépressifsReference 172. La manipulation pharmacologique du SEC entraînant une élévation de l'anandamide par exemple, a été associée à un comportement de type antidépresseur dans les modèles animaux de stress chroniqueReference 172.
Un examen a signalé que le niveau de comorbidité entre l'utilisation élevée ou problématique de cannabis et la dépression lors d'enquêtes sur la population générale dépasse ce qui serait normalement attribuable au hasardReference 1592. Les auteurs ont aussi relevé une association modeste entre l'utilisation régulière ou problématique précoce et la dépression plus tard dans la vie. Toutefois, les limites quant aux études recensées sur le cannabis et la dépression, y compris les limites dans les concepts d'études, de même que dans la capacité de mesurer la consommation de cannabis et de mesurer la dépression ont aussi été soulignées.
Une étude réalisée aux États-Unis sur des adultes qui a recueilli les données d'une enquête longitudinale nationale (n = 8 759) a déterminé que les probabilités de développer une dépression chez les personnes ayant consommé du cannabis au cours de la dernière année étaient 1,4 fois plus élevées que les probabilités des non-utilisateurs de développer une dépressionReference 1593. Toutefois, une fois les différences de groupe prises en compte, l'association n'était plus significative. Lors d'une étude de suivi, le même groupe a examiné le lien entre l'utilisation de cannabis et la dépression chez les jeunes à l'aide d'une cohorte longitudinale de 1 494 adolescents. Comme pour l'étude sur les adultes, les résultats ne confirment pas le lien causal entre les problèmes de consommation de cannabis amorcés à l'adolescence et la dépression au début de l'âge adulteReference 1594.
À l'inverse, une autre étude faite aux É.-U. et axée sur les résultats du NESARC (n = 43 093) de 2001 - 2002 a déterminé que la dépression majeure est associée de manière statistiquement significative aux troubles de consommation du cannabis et à la dépendance au cannabis au cours de la vieReference 1595. Une analyse subséquente des mêmes données examinant les associations entre la consommation de cannabis et la QV en fonction de la santé parmi les individus atteints de troubles dépressifs a observé que les femmes atteintes de troubles dépressifs consommant du cannabis régulièrement avaient signalé une mauvaise QV mentaleReference 165. Bien que les observations soient demeurées notables après avoir ajusté en fonction des variables sociodémographiques, celles-ci n'étaient plus maintenues après l'ajustement en fonction des troubles anxieux comorbides. La consommation de cannabis occasionnelle chez les femmes n'a pas été associée avec une QV inférieure comparativement aux femmes non consommatrices. Peu de différences ont été notées entre les hommes atteints de troubles dépressifs lors de la comparaison entre les consommateurs de cannabis et les non-consommateurs.
Une étude réalisée en 2007 qui a recueilli les données de la NEtherlands MEntal Health Survey and Incidence Study (NEMESIS) a relevé un risque légèrement accru d'un premier épisode dépressif (RC = 1,62; 1,06 à 2,48) associé à la consommation de cannabis, après avoir effectué un contrôle des facteurs de confusion importantsReference 1596. Un aspect plus important dans le cadre de cette étude est le risque grandement accru de trouble bipolaire (RC = 4,98; 1,80 à 13,81) avec l'utilisation de cannabis (consulter la section ci-dessous pour des renseignements sur le cannabis et le trouble bipolaire). Une relation dose-réponse était associée au risque de « tout trouble d'humeur » pour les utilisateurs presque quotidiens et les utilisateurs hebdomadaires, mais pas pour les utilisateurs qui en consommaient moins fréquemment.
Une méta-analyse et un examen systématique d'études longitudinales axées sur la population ou d'études cas-témoin, emboîtées dans des conceptions longitudinales, ont examiné l'association entre la consommation de cannabis et le risque d'effets psychotiques ou affectifs sur la santé mentale (p.ex. dépression, pensées suicidaires et anxiété)Reference 191. Le RCA global pour les effets de dépression associés à la consommation la plus fréquente de cannabis, comparativement aux personnes qui n'en consomment pas, était de 1,49 (IC à 95 % = 1,15 à 1,94). En ce qui concerne les idéations suicidaires, l'étude a signalé une hétérogénéité significative des données et n'a pas été en mesure de mener une méta-analyse et de fournir un RCA global.
Une analyse intégrative de quatre cohortes d'Australie (c.-à-d. laVictorian Adolescent Health Cohort Study, laPersonality and Total Health study, leAustralian Temperament Project et la Christchurch Health and Development Study) qui étudiait les relations entre la consommation de cannabis et le développement de symptômes de dépression à partir du milieu de l'adolescence et jusqu'à l'âge adulte chez plus de 6 900 participants a indiqué un lien faible à modéré entre la consommation hebdomadaire de cannabis et les symptômes de dépression comparativement aux personnes ne consommant pas de cannabis (écart-type [E.-T.] de 0,3 à 0,5)Reference 1597. Après avoir apporté des modifications pour tenir compte de facteurs de confusion, l'association entre la consommation hebdomadaire de cannabis et les symptômes de dépression a persisté, même si elle était légèrement réduite (E.-T. de 0,24; IC à 95 % = 0,18 à 0,30). La solidité de l'association entre la consommation de cannabis et la dépression variait aussi selon l'âge : les liens étaient plus forts au milieu de l'adolescence et diminuaient pour atteindre des effets généralement faibles et négligeables à l'âge adulte.
Une étude de cohorte longitudinale auprès de 45 087 conscrits suédois de sexe masculin examinant le lien entre la consommation de cannabis et les troubles mentaux n'a relevé aucune association entre la fréquence de consommation du cannabis et le risque de dépression, même chez les sujets dont le niveau de consommation de cannabis est le plus élevé (après avoir apporté des modifications pour tenir compte de facteurs de confusion potentiels)Reference 1598. Cependant, l'étude a signalé un lien fort gradué entre la consommation de cannabis et le trouble schizo-affectif, une grande consommation conférant le risque le plus important (RC = 7,5; IC à 95 % = 3,4 à 16,7) comparativement aux personnes n'ayant jamais consommé de cannabis.
Une étude de cohorte longitudinale représentative échelonnée sur 15 ans, menée chez 1943 personnes, qui a examiné l'association entre la consommation de cannabis chez les adolescents et les troubles mentaux courants au début de l'âge adulte n'a signalé aucun lien constant entre la fréquence de consommation de cannabis chez l'adolescent et la dépression (c.-à-d. épisode dépressif majeur) à l'âge de 29 ansReference 1589. Cependant, la consommation quotidienne de cannabis a été associée à un risque deux fois plus important de trouble anxieux à l'âge de 29 ans (RCA = 2,5; IC à 95 % = 1,2 à 5,2) et de dépendance au cannabis (RCA = 2,2; IC à 95 % = 1,1 à 4,4). Chez les adolescents consommant du cannabis chaque semaine ou plus d'une fois par semaine (c.-à-d. quotidiennement) qui ont continué d'en consommer quotidiennement à l'âge de 29 ans, il existait encore une augmentation significative du risque de trouble anxieux (RCA = 3,2; IC à 95 % = 1,1 à 9,2). La consommation précoce et régulière de cannabis durant l'adolescence a augmenté le risque de trouble anxieux à l'âge de 29 ans et les risques étaient légèrement plus élevés si la consommation régulière est survenue également à l'âge de 29 ans.
Une méta-analyse et un examen systématique de 14 études longitudinales examinant l'association entre la consommation de cannabis et la dépression dans une population de 76 058 sujets ont indiqué que le RC regroupé concernant la dépression chez les personnes consommant du cannabis comparativement aux témoins était de 1,17 (IC à 95 % = 1,05 à 1,30)Reference 1010. La « consommation de cannabis » a été définie comme tout usage de cannabis, usage mensuel, ou comme un usage pendant toute une vie à cinq reprises. La consommation élevée de cannabis (définie comme un usage respectant les critères du DSM-IV du TUC ou encore un usage de cannabis au moins hebdomadaire) était associée à une incidence accrue de dépression avec un RC regroupé de 1,62 (IC à 95 % = 1,21 à 2,16). La définition de la dépression, effectuée à l'aide d'outils cliniques validés, comprenait le trouble dépressif majeur, la dysthymie ou les symptômes dépressifs. Les auteurs de l'étude ont conclus que la consommation de cannabis est associée à un risque légèrement accru de développer des troubles dépressifs et que la consommation élevée de cannabis est associée à un risque accru plus fort, mais encore modéré, de développer une dépression. Les métarégressions permettant de détecter tout effet de l'âge sur l'association entre la consommation de cannabis et la dépression n'ont pas réussi à démontrer des effets, malgré le manque de puissance des tests résultant du nombre réduit d'études incluses dans la méta-analyse. Les résultats de cette méta-analyse et de cet examen systématique laissent supposer l'existence d'une relation modeste dépendante de la dose entre la consommation de cannabis et les symptômes dépressifs. Certaines limites de cette étude sont méthodologiques et d'autres inhérentes aux études primaires inclus dans l'analyse.
Une étude longitudinale a examiné l'influence de symptômes dépressifs subcliniques sur les effets fonctionnels et cliniques à long terme chez 64 patients ayant eu un premier épisode de psychose et qui étaient des consommateurs de cannabis, ainsi que sur la capacité des patients à cesser de consommer du cannabisReference 1599. L'étude a signalé que la présence de symptômes dépressifs subcliniques chez les patients ayant eu un premier épisode de psychose au cours de cinq années de suivi était associée à un abus continu de cannabis (β = 4,45, IC à 95 % = 1,78 - 11,17, p = 0,001) et à une aggravation du fonctionnement (β = -5.50, IC à 95 % = -9,02 - -0,33, p = 0,009). Les auteurs affirment que les symptômes dépressifs subcliniques doivent être traités chez les patients ayant eu un premier épisode de psychose afin d'empêcher l'apparition d'une évolution clinique et fonctionnelle défavorable, notamment chez les utilisateurs de cannabis.
Une étude prospective de cohorte selon la population du Royaume-Uni (ALSPAC) menée sur 4 561 individus étudiant les associations entre la consommation de cannabis ou le tabagisme à l'âge de 16 ans et la dépression ou l'anxiété à l'âge de 18 ans a observé que la consommation de cannabis (RC non ajusté = 1,5, IC à 95 % = 1,26 à 1,80) ainsi que le tabagisme (RC non ajusté = 1,37, IC à 95 % = 1,16 à 1,61) augmentent le risque de développement d'un trouble dépressif; l'ajustement en fonction des facteurs de confusion a atténué ces relations bien que les associations aient persisté pour la consommation de cannabis (RCA = 1,30, IC à 95 % = 0,98 à 1,72) suggérant une augmentation de presque le double des risques de dépression au niveau le plus élevé de consommation de cannabis autodéclaré (plus de 60 fois) lorsque comparé à ceux qui n'avaient jamais consomméReference 1591. Les lacunes de la méthodologie de l'étude comprennent la taille (relativement) petite de l'échantillon pour détecter un petit effet, la consommation de cannabis autodéclarée et l'évaluation des résultats par entrevue informatisée.
Une étude épidémiologique comparant les données de deux vagues de la NESARC (2001 à 2002 et 2004 à 2005) et examinant la relation entre la consommation de cannabis et les risques de troubles psychiatriques n'a signalé aucune association entre la consommation de cannabis et tout trouble d'humeur (RC = 1,1, IC à 95 % = 0,8 à 1,4)Reference 509. Les lacunes de la méthodologie de l'étude comprennent la période de suivi limitée (c.-à-d., seulement trois ans), la consommation de cannabis autodéclarée et les catégories limitées de fréquence de consommation de cannabis (c.-à-d., aucune consommation de cannabis au cours de la dernière année; un peu de consommation de cannabis au cours de la dernière année, mais moins d'une fois par mois; et une consommation de cannabis ou plus par mois).
Une étude épidémiologique fournissant les premières données représentatives au niveau national sur la prévalence et la corrélation du TUC selon le DSM-5 se servant de données de la vague de 2012 à 2013 du NESARC-III a signalé que le TUC au cours de la dernière année était associé au trouble dépressif majeur (RCA = 2,8) et que le TUC à vie était aussi associé au trouble dépressif majeur (RCA = 2,6)Reference 335. De plus, l'association entre le trouble dépressif majeur et le TUC au cours de la dernière année a augmenté avec l'accroissement de la sévérité du TUC (RCA = 2,2, 3,1 et 4,2 pour les cas de TUC légers, modérés et sévères, respectivement).
Trouble bipolaire
On a signalé que les troubles bipolaires de type I et II survenaient chez environ 1 à 3 % et 3 à 5 % de la population, respectivementReference 1600. Les troubles liés aux substances concomitants, qui sont associés à une augmentation des comorbidités, compliquent aussi souvent les troubles bipolairesReference 1600. Plus précisément, le cannabis constitue l'une des drogues illicites dont les personnes ayant reçu un diagnostic de trouble bipolaire abusent le plus fréquemmentReference 188Reference 1601-Reference 1604. La consommation de cannabis au cours de la vie chez les patients bipolaires semble représenter 70 %, et environ 30 % des patients atteints d'un trouble bipolaire ont une comorbidité d'utilisation abusive du cannabis ou de dépendance à celui-ci - un taux au-delà de ceux observés dans la population totaleReference 1605. La consommation de cannabis en présence de trouble bipolaire est aussi associée à des résultats plus médiocres, à une gravité accrue des symptômes et à une plus mauvaise observance thérapeutiqueReference 1606. Les données actuelles recueillies indiquent qu'il existe une relation significative entre la consommation de cannabis et l'exacerbation ainsi que l'apparition subséquentes de symptômes de manie. De plus, ces données portent à croire que le cannabis pourrait aggraver l'évolution du trouble bipolaire en augmentant la probabilité, la gravité ou la durée de phases maniaquesReference 1607. Bien que la consommation de cannabis précède souvent les premiers épisodes de manie, on suppose que la consommation de cannabis est une cause potentielle et une conséquence du trouble bipolaire précoceReference 1605.
Voici un résumé des études qui ont examiné la relation entre la consommation de cannabis et le trouble bipolaire, son effet sur l'évolution de la maladie et son effet sur l'observance thérapeutique.
Une étude prospective sur trois ans comptant 4 815 sujets a tenté de déterminer si une utilisation de cannabis de base augmentait le risque de développer des symptômes maniaques, si l'association entre l'utilisation de cannabis et les manies était indépendante de l'apparition de symptômes psychotiques, et si les manies de départ pouvaient prédire l'utilisation de cannabis lors du suiviReference 1601. Les auteurs ont déterminé que l'utilisation de cannabis au départ était associée à des manies plus tard (RC = 5,32, IC de 95 % : 3,59, 7,89). Après avoir pris en compte les facteurs de confusion, le lien persistait, bien qu'il ait diminué (RC = 2,70, IC de 95 % : 1,54, 4,75). Le risque de développer des symptômes maniaques semblait augmenter parallèlement à l'augmentation de la fréquence de base d'utilisation de cannabis. L'intensité des effets était plus grande pour les personnes qui consommaient du cannabis de trois à quatre jours/semaine, suivies de celles qui en consommaient quotidiennement et un à deux jours/semaine, et finalement par celles qui en consommaient d'un à trois jours/mois. Les auteurs ont rapporté que la présence de symptômes maniaques lors de l'évaluation initiale ne permettait pas de prédire la consommation de cannabis pendant le suivi. Les auteurs ont conclu que la consommation de cannabis augmentait le risque de développer des symptômes maniaques subséquents et que cet effet était lié à la dose.
Un autre groupe de chercheurs a effectué une étude prospective de cohorte sur cinq ans qui examinait trois groupes de patients : un groupe où un TUC précédait l'apparition du trouble bipolaire, un autre où le trouble bipolaire précédait un TUC et un groupe n'éprouvant qu'un trouble bipolaireReference 1602. Les auteurs ont déterminé que la consommation de cannabis était associée à un allongement des épisodes affectifs (maniaques ou mixtes) et à des cycles rapides, mais il était impossible d'établir un lien causal entre l'utilisation de cannabis et le trouble bipolaire.
Une étude prospective distincte a fait un suivi d'un groupe de patients bipolaires de type I sur une période de 10 ans débutant à l'apparition de la maladie, et a conclu qu'il existait une forte association entre la consommation de cannabis et les épisodes ou les symptômes maniaques/hypomaniaques, et que l'abus de cette substance précédait ou coïncidait avec, sans toutefois suivre, les exacerbations de maladie affectiveReference 1608.
Une étude d'observation prospective sur deux ans qui se penchait sur le résultat des traitements pharmacologiques de la manie (l'étude European Mania in Bipolar Longitudinal Evaluation of Medication ou EMBLEM) a fait un suivi de 3 459 patients internes et externes admissibles qui étaient traités pour une manie aiguë dans un trouble bipolaire, et cette étude a aussi évalué l'utilisation actuelle de cannabis des patients, de même que l'influence de l'exposition au cannabis sur les mesures des résultats du traitement clinique et socialReference 188. L'étude a conclu qu'au cours d'une période de traitement d'un an, les patients consommant du cannabis respectaient moins leur traitement et présentaient des niveaux plus élevés de gravité globale de leur maladie, de manie et de psychose, comparativement aux non-consommateurs. Les patients consommant du cannabis ont aussi déclaré éprouver moins de satisfaction face à la vie.
Une étude préliminaire a déterminé que les patients ayant reçu un diagnostic de trouble bipolaire avec caractéristiques psychotiques étaient beaucoup plus susceptibles de présenter un polymorphisme fonctionnel dans la région du promoteur du gène du transporteur du 5-HT, mais aussi de recevoir un diagnostic d'abus/de dépendance en matière de cannabis, comparativement aux patients bipolaires qui ne présentaient aucun symptôme psychotiqueReference 1604. Des études génétiques ont aussi soulevé la possibilité d'un lien entre les variantes alléliques du gène du récépteur cannabinoïde 1 (CNR1) et la susceptibilité aux troubles de l'humeurReference 1609Reference 1610.
L'influence de la consommation de cannabis sur l'âge au moment de l'apparition de la schizophrénie et du trouble bipolaire (avec symptômes psychotiques) a fait l'objet d'une étude à l'aide d'une analyse de régressionReference 181. Les auteurs de cette étude ont déterminé que même si l'utilisation de cannabis et d'autres substances était plus fréquente chez les patients atteints de schizophrénie que chez ceux ayant reçu un diagnostic de trouble bipolaire, la consommation de cannabis était néanmoins associée à un âge plus bas au moment de l'apparition chez les deux troubles. La consommation de cannabis précédait aussi la première hospitalisation dans la grande majorité des cas (95,4 %). De plus, la période de consommation la plus intensive (« plusieurs fois par jour ») précédait la première admission dans 87,1 % des cas. Chez les patients bipolaires, la consommation de cannabis baissait l'âge au moment de l'apparition par une moyenne de neuf ans. À l'opposé, chez les patients schizophrènes, la consommation de cannabis baissait l'âge au moment de l'apparition de la maladie par une moyenne de 1,5 an. Aucune différence importante n'a été remarquée au niveau de l'âge au moment de l'apparition de la maladie entre les hommes et les femmes dans l'un ou l'autre des groupes diagnostiques.
Une autre étude a examiné les facteurs associés à l'âge au moment de l'apparition du trouble bipolaire et a aussi examiné la séquence d'apparition de la consommation excessive de substances et du trouble bipolaireReference 1611. Un total de 151 patients atteints de trouble bipolaire (de type I ou II) et qui recevaient un traitement psychiatrique ont participé à l'étude. Les auteurs ont déterminé que, comparativement à la consommation d'alcool, une consommation excessive de cannabis (définie comme répondant aux critères du DMS-IV sur le trouble de consommation de substances ou une consommation hebdomadaire de cannabis sur une période d'au moins quatre ans) était associée à un âge plus précoce au moment de l'apparition des troubles bipolaires primaires et secondaires, même après avoir fait un ajustement des variables confusionnellesReference 1603. De plus, l'âge moyen au début de la consommation excessive de cannabis précédait l'âge au moment de l'apparition du trouble bipolaire; cette donnée était inversée dans le groupe utilisant l'alcool.
Une étude a signalé que lorsque comparés aux témoins, les patients atteints de trouble bipolaire étaient presque sept fois (IC à 95 % : 5,41 à 8,52) plus susceptibles de présenter des antécédents de consommation de cannabis au cours de leur vieReference 1603. De plus, cette association semblait indépendante du sexe. Les patients ayant consommé du cannabis après l'apparition des symptômes bipolaires ou en même temps étaient plus jeunes au moment de l'apparition du trouble (17,5 ans comparativement à 21,5 ans). De plus, ceux qui avaient consommé du cannabis avant l'apparition d'un épisode bipolaire étaient 1,75 fois (IC à 95 % : 1,05 à 2,91) plus susceptibles de présenter une incapacité attribuable au trouble bipolaire.
D'autre part, une analyse rétrospective d'une grande cohorte de sujets bipolaires de type I avec ou sans antécédent de TUC a signalé que les patients bipolaires atteints d'un TUC étaient d'un âge semblable à celui des patients sans un tel trouble de consommation au moment de l'apparition de la maladieReference 1612. Toutefois, les patients atteints d'un TUC étaient plus susceptibles d'avoir éprouvé une psychose à un certain moment pendant leur maladie, comparativement aux patients qui n'avaient jamais répondu aux critères du trouble de consommation
Une étude épidémiologique utilisant les données de la NESARC (2001 - 2002) a examiné la relation entre le trouble bipolaire et le TUC et a signalé que chez environ 2 000 personnes ayant une prévalence durant toute la vie de trouble bipolaire, les taux de TUC au cours des 12 derniers mois étaient de 7,2 % (IC = 5,8 à 9) comparativement à 1,2 % (IC = 1,1 à 1,3) dans la population généraleReference 1600. De plus, l'analyse de régression logistique laisse supposer que les personnes atteintes d'un trouble bipolaire et d'un TUC concomitant présentaient des risques plus élevés de dépendance à la nicotine (RCA = 3,8), de troubles liés à la consommation d'alcool (RCA = 6,6) et de drogues (RCA = 11,9), ainsi que de personnalité antisociale (RCA = 2,8), comparativement à celles qui ne sont pas atteintes d'un TUC. Parmi les personnes atteintes de troubles bipolaires, la plupart de celles manifestant un TUC étaient des hommes (62 %) et des jeunes (18 à 29 ans) (70 %). En outre, l'âge de l'apparition du trouble bipolaire était plus jeune chez les personnes atteintes du TUC concomitant, que le premier épisode soit dépressif ou maniaque/hypomaniaque. Aucune différence significative n'a été observée dans les taux, au cours de la vie, de tentatives de suicide ou d'idéations suicidaires chez les personnes atteintes ou non d'un TUC. Chez les personnes atteintes du trouble bipolaire et du TUC concomitant, 75 % ont eu un épisode hypomaniaque, maniaque ou dépressif au cours des 12 derniers mois. Le TUC a aussi été associé à une QV physique plus mauvaise (c.-à-d. artériosclérose). Les limites de l'étude sont notamment la méthodologie auto-déclarée, l'absence d'entrevues semi-structurées effectuées par des professionnels de la santé mentale et l'exclusion des adolescents qui sont les plus vulnérables.
Une étude d'observation transversale menée auprès de 324 patients atteints d'un trouble bipolaire dont le diagnostic a été établi par l'intermédiaire d'entrevues diagnostiques structurées a mis en évidence une relation dose-réponse entre la consommation de cannabis et l'âge au moment de l'apparition du trouble bipolaire qui demeurait statistiquement significative après la prise en compte de facteurs de confusion possibles (c.-à-d. sexe, antécédents familiaux, tabagisme, consommation d'alcool ou troubles liés à l'utilisation d'autres substances). Cependant, les auteurs n'ont pas relevé d'association entre la consommation de cannabis et la présentation d'une polarité ou la présence d'une psychoseReference 1613. Les constatations révèlent une diminution de l'âge au moment de l'apparition d'environ trois ans chez ceux qui déclaraient consommer du cannabis plus de 10 fois par mois, comparativement à ceux n'ayant jamais consommé du cannabis ou à ceux ayant déclaré en consommer moins de 10 fois par mois. En outre, ces patients atteints d'un TUC au cours de la vie (c.-à-d. abus ou dépendance) connaissaient la diminution la plus importante de l'âge au moment de l'apparition, qui correspondait à environ cinq ans, comparativement à ceux n'ayant jamais consommé de cannabis ou à ceux qui en consommaient moins de 10 fois par mois. Les patients présentant une polarité dépressive étaient plus jeunes au moment de l'apparition comparativement à ceux ayant eu des symptômes maniaques (hypomaniaques) et mixtes ou des épisodes mixtes, tandis que l'âge au moment de l'apparition diminuait à mesure que la consommation de cannabis augmentait. Les auteurs ont conclu qu'il existe des preuves d'une relation dose-réponse entre la consommation de cannabis et l'apparition précoce d'un trouble bipolaire. Ils affirment aussi que l'apparition du trouble bipolaire a tendance à être précédée de la consommation de cannabis, ce qui indique que la consommation de cannabis pourrait être un facteur de risque du déclenchement du trouble bipolaire.
Une enquête prospective de suivi sur trois ans qui se penche sur l'association entre la consommation de cannabis, le trouble dépressif majeur et le trouble bipolaire à partir de la NESARC de 2001 - 2002, a observé une association grossière entre la consommation hebdomadaire (c.-à-d. 2,25 jours de consommation par semaine et 1,88 joint par jour) et la consommation quotidienne ou presque quotidienne (c.-à-d. 6,45 jours de consommation de cannabis par semaine et 3,45 joints par jour) de cannabis et le trouble bipolaireReference 1614. Toutefois, cette association n'existait plus une fois que les modifications aient été apportées pour tenir compte de facteurs de confusion. Les auteurs affirment que l'association entre la consommation de cannabis et les troubles bipolaires pourrait être due à d'autres facteurs tels que des troubles psychiatriques et des troubles liés à l'utilisation de substances.
EMBLEM, une étude d'observation prospective sur deux ans auprès d'adultes ayant eu un épisode maniaque ou mixte de trouble bipolaire, révèle que parmi 1 922 patients analysés, les anciens consommateurs de cannabis avaient les taux de rémission (68,1 %) et de rétablissement (38,7 %) les plus élevés et les taux de réapparition (42,1 %) et de rechute (29,8 %) les plus faiblesReference 1615. Par contre, les utilisateurs courants avaient un taux de rétablissement et de rémission plus faible, un taux de réapparition plus élevé, des problèmes plus importants au travail et ils étaient plus susceptibles de ne pas vivre en couple par rapport aux personnes n'ayant jamais consommé de cannabis. En outre, les consommateurs courants de cannabis avaient un taux beaucoup plus élevé de tentatives de suicide au cours du suivi de deux ans, comparativement aux anciens consommateurs et aux personnes n'ayant jamais consommé de cannabis. Ces constatations ont amené les auteurs de l'étude à conclure que les patients bipolaires qui cessent de consommer du cannabis durant un épisode maniaque ou mixte ont, après deux ans, des résultats cliniques et fonctionnels similaires à ceux des personnes n'ayant jamais consommé de cannabis, tandis que les patients qui continuent d'utiliser du cannabis présentent un risque plus élevé de rechute et de problèmes de fonctionnement.
Une étude ayant recours à la méthode d'échantillonnage de l'expérience, par l'intermédiaire d'entrées de journal, afin de suivre les associations temporelles au cours d'une période de six jours entre le cannabis, l'affect et les symptômes de trouble bipolaire chez 24 participants ayant reçu un diagnostic de trouble bipolaire de type I ou II révèle que les niveaux plus élevés d'affect positif augmentent les risques de consommation de cannabis (RC = 1,25, IC = 1,06 à 1,47) et la consommation de cannabis a été associée à une augmentation subséquente d'affect positif (mais pas d'affect négatif), de symptômes maniaques et de symptômes dépressifsReference 1606. Par contre, ni l'affect négatif, ni les symptômes maniaques ou dépressifs ne prédisaient la consommation de cannabis. Le nombre moyen de joints utilisés par jour était de 2,5, la plupart (54 %) des répondants signalant consommer du cannabis de type « skunk » (c.-à-d. très puissant). Les auteurs suggèrent que les personnes atteintes d'un trouble bipolaire ne consomment pas du cannabis pour soigner elles-mêmes des variations mineures de l'affect négatif et de symptômes bipolaires. Les limites de l'étude comprennent notamment la taille réduite de l'échantillon, l'auto-déclaration, le manque d'information granulaire sur la puissance du cannabis, et les preuves limitées de validité des échelles relatives aux épisodes maniaques et dépressifs conçues pour l'étude utilisant la méthode d'échantillonnage de l'expérience. Les auteurs de l'étude soulignent que, bien que certaines personnes considèrent le cannabis comme une stratégie de gestion utile dans la prise en charge de symptômes du trouble bipolaire, les résultats de l'étude indiquent que le cannabis n'est pas utilisé pour l'automédication de changements de symptômes dans le cadre de la vie quotidienne et laissent supposer qu'il pourrait en réalité compliquer davantage les états affectifs.
Une étude d'observation prospective, naturaliste sur 24 mois qui utilise les données recueillies dans le cadre de la Bipolar Comprehensive Outcomes Study (BCOS) a examiné l'incidence de la consommation de cannabis chez 239 patients atteints d'un trouble bipolaire de type I et d'un trouble schizo-affectif de type bipolaire et a indiqué que la consommation de cannabis présentait un lien significatif avec la diminution de probabilité de rémission durant la période de suivi de 24 moisReference 1616. Les analyses par sous-groupe ont révélé que la consommation de cannabis présentait un lien significatif avec des taux de rémission plus faibles sur l'échelle d'évaluation de la dépression de Hamilton chez les femmes et les patients à qui l'on prescrivait des régulateurs de l'humeur. Par contre, chez les hommes et les patients à qui l'on prescrivait de l'olanzapine et/ou un régulateur de l'humeur, la consommation de cannabis présentait un lien significatif avec des taux de rémission plus faibles sur l'échelle d'évaluation de la manie de Young. Les taux de rémission semblaient être les plus bas dans le groupe signalant une consommation concomitante de cannabis et de tabac, suivi du groupe déclarant ne fumer que du tabac et du groupe ne fumant pas. Dans l'ensemble, les auteurs de cette étude suggèrent que la consommation de cannabis est associée à une diminution de la probabilité d'une rémission à long terme des troubles du spectre bipolaire, avec des effets d'interaction particuliers de la consommation de cannabis et des symptômes de l'humeur sur le sexe et le type de médicament.
Une étude épidémiologique fournissant les premières données représentatives au niveau national sur la prévalence et la corrélation du TUC selon le DSM-5 se servant de données de la vague de 2012 à 2013 du NESARC-III a signalé que le TUC au cours de la dernière année était associé au trouble bipolaire de type I (RCA = 5,0) et que le TUC à vie était aussi associé au trouble bipolaire de type I (RCA = 3,8); le TUC au cours de la dernière année était associé au trouble bipolaire de type II (RCA = 2,7) et le TUC à vie était aussi associé au trouble bipolaire de type II (RCA = 2,8)Reference 335. De plus, seulement l'association entre le trouble bipolaire de type I et le TUC au cours de la dernière année a augmenté avec l'accroissement de la sévérité du TUC (RCA = 3,4, 4,1, et 10,1 pour les cas de TUC légers, modérés et sévères, respectivement).
Un article d'examen qui se penchait sur la situation des données concernant la consommation de cannabis comme facteur de prédiction de l'apparition précoce du trouble bipolaire et des tentatives de suicide a signalé que la consommation de cannabis, chez les patients atteints d'un trouble bipolaire, est associée à un risque accru de tentatives de suicide et à un jeune âge à l'apparition du trouble (réduit de six à neuf ans)Reference 1617. Le jeune âge à l'apparition du trouble est associé à un plus grand nombre d'épisodes répétitifs rapides, d'épisodes mixtes, d'épisodes psychotiques, de trouble de panique, de trouble anxieux, de trouble lié à l'utilisation de substances, de dépression majeure, de réponse aggravée au lithium et de comportement suicidaire. Les limites de l'article portant sur l'analyse sont notamment la documentation rare sur la consommation de cannabis, le jeune âge à l'apparition du trouble bipolaire et les tentatives de suicide; la définition changeante du jeune âge à l'apparition du trouble entre les études incluses; la méthodologie et d'autres différences entre les études.
Une récente revue systématique de 12 études de cohortes (2 588 personnes "plus exposées" au cannabis / 9 371 "moins exposées au cannabis") a examiné l'association longitudinale entre la consommation de cannabis et les résultats symptomatiques chez les personnes vivant avec une anxiété de base ou un trouble de l'humeur. Par rapport aux personnes moins exposées au cannabis (y compris les abstinents), la revue a fourni des preuves consistantes que la consommation "récente" de cannabis (au cours des six derniers mois) a été associée à des résultats symptomatiques négatifs au fil du temps en ce qui concerne le ESPT, le trouble panique, le trouble bipolaire et le trouble dépressif. Plus précisément, ceux qui consomment du cannabis sont plus susceptibles de signaler des symptômes persistants au fil du temps et moins susceptibles d'améliorer leurs symptômes à la suite d'un traitement (c.-à-d. médicaments ou psychothérapie). Certains éléments de preuve confirment que la réduction ou l'arrêt de l'utilisation est associée à des résultats plus favorables. Dans l'ensemble, l'étude suggère que les données disponibles ne soutiennent pas que le cannabis peut aider les symptômes à long terme associés à l'anxiété et aux troubles de l'humeur, mais plutôt que la consommation de cannabis peut soutenir les symptômes longitudinalement et prévenir les efforts de rétablissement. Toutefois, les auteurs notent que les résultats doivent être interprétés avec prudence, compte tenu de la conception observationnelle des études (causalité non établie) et des biais associés aux échantillons (p. ex. les patients hospitalisés) et aux sources de cannabis consommées (c.-à-d. les sources non réglementées dont les concentrations de THC sont probablement plus élevées et les concentrations de CBD minimales)Reference 1618.
7.7.3.2 Schizophrénie et psychose
- Des données provenant d'études cliniques suggèrent que l'exposition aiguë au cannabis (à THC prédominant) ou au THC est associée, en fonction de la dose, à des troubles comportementaux et cognitifs transitoires aigus imitant une psychose aiguë.
- Des études épidémiologiques suggèrent une association entre la consommation de cannabis (à THC prédominant), en particulier la consommation précoce, chronique et intensive, et la psychose et la schizophrénie.
- Les risques de schizophrénie associés à la consommation de cannabis sont particulièrement élevés chez les individus possédant des antécédents personnels ou familiaux de schizophrénie.
- La consommation de cannabis est aussi associée au début précoce de la schizophrénie chez les individus vulnérables, et à l'exacerbation des symptômes schizophréniques actuels et à des conséquences cliniques plus graves.
Réactions psychotiques aiguës
Le cannabis à forte teneur en THC et les cannabinoïdes psychoactifs (p. ex. THC, nabilone, dronabinol, nabiximols) ont été liée à des épisodes de psychose aiguë chez les utilisateurs réguliers, tout comme ceux qui n'avaient jamais consommé de drogueReference 141Reference 177Reference 178Reference 195Reference 200Reference 535Reference 1079Reference 1619.
Les résultants d'une étude clinique expérimentale impliquant l'administration intraveineuse de THC (parallelant la concentration sanguine de THC maximale atteinte par voie fumée non médicale) à des volontaires sains sans antécédent de trouble psychiatrique ou de consommation actuelle concomitante de drogues ont démontrés que l'administration de THC était associée à une gamme d'effets comportementaux et cognitifs aigus transitoires normalement associés à une réaction psychotique aiguëReference 196. Ces effets comprennent la méfiance, les délires paranoïdes et des grandeurs, les pensées désorganisées et les hallucinations. On a aussi signalé une dépersonnalisation, une déréalisation, des perceptions sensorielles déformées, des sentiments d'irréalité et de ralentissement extrême du temps. De plus, on a observé un affect émoussé, une diminution des rapports, un manque de spontanéité, un retard psychomoteur et un repli sur soi.
Schizophrénie et psychose
La schizophrénie est un trouble mental chronique et dévastateur qui apparaît généralement à la fin de l'adolescence ou au début de l'âge adulteReference 1078. Bien que l'incidence de schizophrénie soit relativement faible, étant comprise entre 10 et 22 pour 100 000 habitants, sa prévalence est relativement élevée (0,3 à 0,7 pour 100 habitants) en raison de sa nature chroniqueReference 1078.
L'augmentation des preuves laisse supposer que le SEC joue un rôle important dans la pathophysiologie de la schizophrénie et de la psychoseReference 172Reference 1078Reference 1079 et voir aussi la Section 4.9.5.5 pour obtenir plus de renseignements. En outre, il existe un consensus dans l'ensemble des études d'une forte association entre la consommation de cannabis et la schizophrénie ou la psychose. Par exemple, plusieurs études indiquent que les taux de consommation de cannabis semblent être deux fois plus élevés chez les patients atteints d'une psychose par rapport aux témoinsReference 1620. En outre, il a été démontré que le cannabis (et le THC) produisent chez des volontaires sains un éventail complet de symptômes positifs (p. ex. méfiance, délires paranoïaques et de grandeurs, hallucinations, désorganisation conceptuelle, pensées fragmentées et modification perceptuelle), de symptômes négatifs (p. ex. affect émoussé, retrait affectif, ralentissement psychomoteur, absence de spontanéité et relations réduites) et de déficiences cognitives (p. ex. troubles de l'apprentissage verbal, de la mémoire à court terme, de la mémoire de travail, de la fonction exécutive, de la capacité de raisonnement abstrait, des capacités de prise de décision ou de l'attention et anomalies de la perception du temps) qui ressemblent de près aux symptômes classiques de schizophrénieReference 178Reference 1079.
L'association entre le cannabis et la psychose remplit un grand nombre des critères de causalité standard, tels que la relation temporelle, le gradient biologique, la plausibilité biologique, la cohérence, l'uniformité et les preuves expérimentales, mais pas tousReference 178Reference 1079. En outre, le cannabis ne semble être ni nécessaire ni suffisant pour causer un trouble psychotique persistant comme la schizophrénieReference 178Reference 1079. Il semble plutôt que la consommation de cannabis n'est qu'un élément qui peut, de concert avec des facteurs connus et inconnus, contribuer au risque général de schizophrénieReference 178Reference 1079. Par exemple, le lien entre le cannabis et la psychose est modéré par des facteurs tels que l'âge au début de la consommation de cannabis, les abus durant l'enfance et la vulnérabilité génétiqueReference 178.
Le poids de la preuve suggère que l'association entre l'exposition au cannabis et la schizophrénie est modeste, mais constanteReference 178. En outre, une grande partie des écrits révèlent que les personnes ayant des antécédents familiaux de schizophrénie, celles manifestant des symptômes avant-coureurs et les personnes qui éprouvent des épisodes discrets de psychose liés au cannabis devraient être fortement dissuadées de consommer du cannabis (à forte teneur en THC) et des cannabinoïdes psychoactifsReference 178.
Les sections suivantes résument certains documents les plus pertinents concernant l'association entre la consommation de cannabis et la schizophrénie et la psychose. Il convient de noter que la plupart des études ont mis l'accent sur la consommation de cannabis et les symptômes positifs, en accordant beaucoup moins d'attention à l'association entre la consommation de cannabis et les symptômes négatifs ainsi que les déficiences cognitives dans la schizophrénieReference 178.
Une étude de cohorte longitudinale, prospective sur 15 ans menée auprès de 45 000 conscrits suédois de sexe masculin et qui examinait l'association entre la consommation de cannabis et le risque de schizophrénie a signalé que le risque relatif de schizophrénie chez les grands consommateurs de cannabis (> 50 fois pendant toute une vie) était de 6,0 (IC à 95 % = 4,0 à 8,9) par rapport aux personnes qui ne consommaient pas de cannabisReference 198. Le risque relatif était de 2,4 chez les personnes qui déclaraient avoir consommé du cannabis au moins une fois par rapport à celles qui n'en avaient jamais consommé (IC à 95 % = 1,8 à 3,3). De plus, le risque relatif était proportionnel à la dose et avait augmenté parallèlement à la hausse du niveau de consommation. Outre la consommation de cannabis, le diagnostic de maladies psychiatriques autres que la schizophrénie lors d'une conscription, une éducation perturbée, un abus de solvant et une mauvaise adaptation à l'école ont tous été fortement liés à l'augmentation de l'apparition de schizophrénie. Les corrections pour tenir compte d'autres facteurs de confusion affaiblissaient l'association entre la consommation de cannabis est le risque de schizophrénie, même si l'association a continué d'exister et est demeurée statistiquement significative.
Une étude prospective, longitudinale, axée sur la population, d'une durée de trois ans et portant sur la prévalence, l'incidence, l'évolution et les conséquences de troubles psychiatriques dans la population générale néerlandaise (NEMESIS) a signalé que les antécédents de base de la consommation de cannabis augmentaient le risque d'effet de psychose au suivi chez les sujets sans psychose au cours de leur vie (RCA = 2,76, IC à 95 % : 1,18 à 6,47) et qu'ils augmentaient également le risque de degré grave de symptômes psychotiques (RC = 24,17, IC à 95 % = 5,44 à 107,46)Reference 197. De plus, elle a démontré une relation dose-réponse entre la charge d'exposition et l'effet de psychose. Une forte interaction cumulée a été observée entre la consommation de cannabis et la vulnérabilité établie au trouble psychotique (différence de risque de 54,7 %) par rapport aux personnes sans vulnérabilité établie (différence de risque de 2,2 %).
Dans une étude de cohorte historique auprès de plus de 50 000 conscrits suédois de sexe masculin, la consommation autodéclarée de cannabis durant l'adolescence était associée à une augmentation de risque de développer une schizophrénie et ce risque était lié à la fréquence d'exposition au cannabis (c.-à-d. qu'elle était liée à la dose, selon la fréquence d'utilisation)Reference 1621. Le rapport des cotes ajusté pour une consommation de cannabis au cours de la vie supérieure à 50 fois était de 6,7 dans le groupe de personnes ayant déclaré consommer uniquement du cannabis.
La Dunedin Multidisciplinary Health and Development Study est une étude de cohorte prospective et longitudinale menée chez 1 000 personnes suivies dès leur naissance et jusqu'à l'âge de 26 ans qui, entre autres, visait à évaluer les effets de la consommation de cannabis sur les effets de la santé mentaleReference 1622. L'étude a évalué la santé psychiatrique des personnes avant l'âge habituel de début d'usage de drogues (à l'âge de 11 ans), ainsi qu'à l'âge de 26 ans et elle a également permis d'obtenir des renseignements sur l'usage de drogues aux âges de 15 et 18 ans à partir d'auto-déclarations individuelles. Les analyses de régression linéaire ont montré que les personnes déclarant consommer du cannabis à 15 et 18 ans présentaient beaucoup plus de symptômes de schizophrénie que les témoins à l'âge de 26 ans, même après avoir corrigé pour des symptômes psychiatriques à l'âge de 11 ans. De plus, l'étude a indiqué que les personnes qui consommaient du cannabis à 15 ans, mais pas à 18 ans, étaient plus de quatre fois plus susceptibles de recevoir un diagnostic de trouble schizophréniforme à 26 ans que les témoins; toutefois, cet effet n'était plus significatif après une correction pour des symptômes psychotiques à l'âge de 11 ans. La consommation de cannabis à 15 ans ne permettait toutefois pas de prédire des effets dépressifs (c.-à-d. symptômes dépressifs ou trouble dépressif) à l'âge de 26 ans. Les auteurs ont conclu que l'exposition au cannabis parmi les adolescents vulnérables sur le plan psychologique, notamment à l'âge de 15 ans, devrait être fortement déconseillée.
L'examen de cinq études épidémiologiquesReference 197Reference 198Reference 1621-Reference 1623 par Arseneault et coll. (2004) a indiqué que le cannabis ne semble être ni nécessaire ni suffisant pour causer une psychose ou une schizophrénie. Il s'agit plutôt seulement d'un facteur dans un ensemble plus vaste de facteurs contributifsReference 1620. À l'échelle individuelle, la consommation de cannabis multiplie par deux, dans l'ensemble, le risque relatif de schizophrénie tardive (RCA = 2,34, IC à 95 % = 1,69 à 2,95), tandis qu'à l'échelle de la population, l'arrêt de la consommation de cannabis réduirait l'incidence de schizophrénie d'environ 8 %, en supposant que la relation est réellement un lien de causalitéReference 1620.
Une étude sur l'incidence de premier contact axée sur la population et menée aux Pays-Bas auprès de 133 patients qui évaluait les influences indépendantes du sexe et de la consommation de cannabis au début de l'évolution de la schizophrénie a signalé que les patients de sexe masculin étaient beaucoup plus jeunes que les patients de sexe féminin au moment de la première dysfonction sociale ou professionnelle, du premier épisode psychotique et des premiers symptômes négatifsReference 1513. À ces étapes, les patients consommant du cannabis étaient aussi beaucoup plus jeunes que les patients qui ne consommaient pas de cannabis. Une autre analyse a montré que la consommation de cannabis, mais pas le sexe, contribue de façon indépendante à la prédiction de l'âge au premier épisode psychotique, les consommateurs de cannabis de sexe masculin étant en moyenne presque sept ans plus jeunes au début de la maladie que les personnes de sexe masculin qui n'en consomment pas.
On a aussi étudié la relation entre la consommation de cannabis et les symptômes psychotiques dans une cohorte prospective de 2 437 jeunes (âgés de 14 à 24 ans) qui possédaient une prédisposition à la psychose supérieure à la moyenne et qui avaient consommé du cannabis pour la première fois pendant leur adolescenceReference 193. L'étude fait partie de l'étude Early Developmental Stages of Psychopathology (EDSP) dans le cadre de laquelle des données sur la prévalence, l'incidence, les facteurs de risque, la comorbidité et l'évolution sur quatre ans des troubles mentaux ont été recueillies dans un échantillon de population représentatif régional aléatoire d'adolescents et de jeunes adultes. Après correction pour tenir compte de facteurs de confusion, la consommation de cannabis au début de l'étude a été associée à une augmentation de l'incidence cumulative de symptômes psychotiques au suivi, quatre ans plus tard (RCA = 1,67, IC à 95 % = 1,13 à 2,46). L'effet de la consommation de cannabis était beaucoup plus fort chez les personnes ayant une prédisposition à la psychose au début de l'étude (différence corrigée en matière de risque de 24 %, IC à 95 % = 7,9 à 39,7, p = 0,003) comparativement à celles sans prédisposition (5,6 %, IC à 95 % = 0,4 à 10,8, p = 0,003). Les auteurs ont également découvert une relation dose-réponse entre la fréquence de consommation de cannabis et le risque de psychose. Une consommation de cannabis presque quotidienne au début de l'étude a été associée à un rapport des cotes corrigé de plus de 2 points pour les symptômes psychotiques, tandis que la consommation de cannabis dont la fréquence était inférieure à une fois par mois comportait les mêmes risques que l'absence de consommation de cannabis. Enfin, la prédisposition à la psychose au début de l'étude ne permettait pas de prédire de façon significative la consommation de cannabis quatre ans plus tard (RCA = 1,42, IC à 95 % = 0,88 à 2,31). Les auteurs concluent qu'une consommation de cannabis au début de l'étude augmente le risque de symptômes psychotiques chez les jeunes, mais ceux ayant une prédisposition à la psychose présentent un risque bien plus élevé de développer des symptômes psychotiques à la suite d'une consommation de cannabis.
Une étude longitudinale d'une durée de 25 ans portant sur la santé, le développement et l'ajustement d'une cohorte de naissance de 1 265 enfants néo-zélandais (c.-à-d. la Christchurch Health and Development Study) qui a examiné l'association entre la consommation de cannabis et les effets sur la santé mentale indique que les consommateurs quotidiens de cannabis avaient des taux de symptômes psychotiques 1,6 à 1,8 fois (p < 0,001) supérieurs à ceux n'en consommant pasReference 1624. Les modèles de régression ont indiqué que la consommation de cannabis avait un effet positif et significatif sur les symptômes psychotiques, ce qui laisse supposer que l'augmentation de la consommation de cannabis était associée à une augmentation des symptômes. En outre, selon les auteurs, les données indiquent qu'il est peu probable que le développement des symptômes psychotiques entraîne une augmentation de la consommation de cannabis.
Une méta-analyse et une analyse systématique des études longitudinales axées sur la population ou des études cas-témoin, emboîtées dans des conceptions longitudinales, qui ont examiné la consommation de cannabis et le risque d'effets psychotiques ou affectifs sur la santé mentale, ont relevé un risque accru d'effet psychotique chez les personnes qui avaient déjà consommé du cannabis par rapport à celles n'en ayant jamais consommé (RCA regroupé = 1,41, IC à 95 % = 1,20 à 1,65)Reference 191. Cela s'est traduit par une augmentation du risque de psychose d'environ 40 % chez les participants qui ont déjà consommé du cannabisReference 191. En outre, les constatations semblaient révéler un effet lié à la dose, le risque étant plus élevé pour les personnes qui consommaient du cannabis plus souvent (RC = 2,09, IC à 95 % = 1,54 à 2,84)Reference 181Reference 187Reference 191.
Lors d'une étude, le lien entre l'âge au moment de l'apparition de la psychose et les autres caractéristiques cliniques chez un échantillon de patients bien caractérisés ayant reçu un diagnostic de trouble bipolaire avec psychose, de trouble schizo-affectif ou de schizophrénie a été examinéReference 187. L'étude a conclu que l'utilisation abusive/la dépendance au cannabis au cours de la vie était associée à un âge beaucoup plus précoce au moment de l'apparition de la psychose (3,1 ans, IC de 95 % : 1,4 - 4,8). De plus, parmi les patients atteints d'utilisation abusive/dépendance au cannabis au cours de la vie, l'âge au moment de l'apparition de la consommation abusive/dépendance au cannabis précédait l'apparition d'une maladie psychotique de presque un autre trois ans. Toutefois, les patients qui avaient reçu un diagnostic de consommation abusive/dépendance au cannabis au cours de la vie et un diagnostic de consommation abusive/dépendance à l'alcool au cours de la vie avaient un âge beaucoup plus avancé au moment de l'apparition de la psychose
Une autre étude a examiné l'influence de la consommation de cannabis sur l'âge au moment de l'apparition de la schizophrénie et du trouble bipolaire (avec symptômes psychotiques) à l'aide d'une analyse de régressionReference 181. Les auteurs de cette étude ont déterminé que même si l'utilisation de cannabis et d'autres substances était plus fréquente chez les patients atteints de schizophrénie que chez ceux ayant reçu un diagnostic de trouble bipolaire, la consommation de cannabis était néanmoins associée à une baisse de l'âge au moment de l'apparition pour les deux troubles. La consommation de cannabis précédait aussi la première hospitalisation dans la grande majorité des cas (95,4 %). De plus, la période de consommation la plus intensive (« plusieurs fois par jour ») précédait la première admission dans 87,1 % des cas. Chez les patients bipolaires, la consommation de cannabis a baissé en moyenne de neuf ans l'âge où le trouble est apparu. À l'opposé, chez les patients schizophrènes, la consommation de cannabis a baissé en moyenne de 1,5 an l'âge où le trouble est apparu. Aucune différence importante n'a été remarquée dans l'âge au moment de l'apparition de la maladie entre les hommes et les femmes dans l'un ou l'autre des groupes diagnostiques.
Une étude de cohorte de suivi sur 35 ans menée chez 50 087 conscrits suédois qui a examiné l'association entre la consommation de cannabis et les effets sur la santé mentale révèle que le rapport des cotes concernant les effets psychotiques chez les consommateurs de cannabis fréquents, par rapport à ceux qui n'en consommaient pas, était de 3,7 (IC à 95 % = 2,3 à 5,8) pour la schizophrénie, de 2,2 (IC à 95 % = 1,0 à 4,7) pour la psychose brève et de 2,0 (IC à 95 % = 0,8 à 4,7) pour les autres psychoses non affectivesReference 1625. En outre, le risque de schizophrénie a baissé au fil des décennies chez les utilisateurs modérés, mais il a diminué beaucoup moins chez les consommateurs fréquents. Ainsi, les auteurs ont observé une association dépendante de la dose entre la consommation de cannabis et le risque de schizophrénie. En outre, la présence d'une psychose brève n'a pas augmenté le risque de schizophrénie tardive chez les consommateurs de cannabis par rapport à ceux qui n'en consommaient pas. Selon les auteurs de l'étude, cela porte à croire que le cannabis ne joue pas un rôle important dans le passage d'épisodes psychotiques brefs à une schizophrénie. L'une des principales limites de l'étude portant sur les conscrits suédois était que les données concernant la consommation de cannabis se limitent à la période précédant la conscription.
Une étude préliminaire, qui évaluait les effets de la consommation de cannabis sur les fonctions neurocognitives chez 28 patients en consultation externe atteints de schizophrénie qui respectaient les critères du DSM-IV relatifs à la schizophrénie (âgés de 18 à 45 ans), a signalé une déficience de l'attention soutenue et une augmentation de l'impulsivité chez les patients souffrant de schizophrénie et déclarant une consommation élevée de cannabisReference 1626. Cependant, il a également semblé que les sujets dont la consommation de cannabis était élevée avaient généralement un niveau de fonctionnement plus élevé et qu'ils ne se distinguaient pas des patients atteints de schizophrénie et ne consommant pas de cannabis en ce qui concerne les autres fonctions testées, ce qui soulève la possibilité d'un niveau fonctionnement prémorbide plus élevé chez les patients atteints de schizophrénie et consommant du cannabis. Étant donné que l'étude était transversale, il n'est pas possible de déterminer le lien de causalité entre le fonctionnement neurocognitif et la consommation élevée de cannabis chez les patients atteints de schizophrénie.
Dans une étude cas-témoin menée chez 280 patients ayant présenté un premier épisode de psychose et auprès de 174 témoins en santé, les patients ont déclaré utiliser du cannabis plus puissant à forte teneur en THC (16 % THC) et à faible teneur en CBD (cannabis de type « skunk »), comparativement aux témoins qui ont déclaré utiliser du cannabis contenant des quantités égales de THC et de CBDReference 1106. En outre, l'utilisation quotidienne de cannabis de type « skunk » a été associée à la manifestation précoce d'une psychose par rapport aux personnes ne consommant pas de cannabisReference 1107. Dans une étude de suivi de type cas-cohorte effectuée par le même groupe auprès de 410 patients ayant eu un premier épisode de psychose et auprès de 370 témoins dans la population, la consommation quotidienne de cannabis de type « skunk » étaient associée à un risque cinq fois plus élevé de premier épisode de psychose, tandis que l'utilisation en fin de semaine de cannabis de type « skunk » était associée à un risque presque trois fois plus élevé de premier épisode de psychoseReference 168. En revanche, le RC d'un premier épisode de psychose associé à l'utilisation de cannabis de type « skunk » moins d'une fois par semaine, à la consommation de hachisch tous les jours, en fin de semaine et moins d'une fois par semaine n'était pas statistiquement significatif par rapport à ceux n'ayant jamais consommé de cannabisReference 168.
Une étude de cohorte de naissance prospective axée sur la population menée auprès de 1 756 adolescents (ALSPAC) a examiné la relation entre le cannabis, le tabac et les expériences psychotiquesReference 1627. Premièrement, l'usage de cigarette et la consommation de cannabis à l'âge de 16 ans présentaient une corrélation importante. Ensuite, la consommation de cannabis et l'usage de cigarette à l'âge de 16 ans étaient toutes deux associées, à un degré similaire, à des expériences psychotiques à l'âge de 18 ans (RC = 1,48, IC à 95 % = 1,18 à 1,86; ou encore une multiplication par 3,2 des probabilités d'expériences psychotiques pour ceux qui consommaient du cannabis plus de 60 fois). Pour les cigarettes, le RC était de 1,61 (IC à 95 % = 1,31 à 1,98; ou une multiplication par 4,2 de la probabilité chez les fumeurs quotidiens par rapport aux non-fumeurs). La correction pour tenir compte de la fréquence du tabagisme (RCA = 1,27, IC à 95 % = 0,91 à 1,76; ou une multiplication par 1,2 du risque chez ceux qui consommaient beaucoup de cannabis par rapport à ceux qui n'en avaient jamais consommé) ou de l'usage d'autres drogues illicites (RCA = 1,25, IC à 95 % = 0,91 à 1,73), a atténué considérablement la relation entre le cannabis et les expériences psychotiques. Le degré d'atténuation était moindre lorsque la consommation de cannabis était corrigée dans l'association de la cigarette et de l'expérience psychotique (RC = 1,42, IC à 95 % = 1,05 à 1,92; ou une multiplication par 2,9 du risque chez les fumeurs quotidiens par rapport aux non-fumeurs). Les auteurs de l'étude suggèrent que la mesure du risque d'expériences psychotiques associée à l'exposition au cannabis est sensible à des facteurs de confusion comme le tabagisme, un comportement qui présente une forte corrélation avec la consommation de cannabis et qui est difficile à séparer de celle-ci.
Une étude cas-témoin longitudinale menée en Suède exminant la nature causale du lien entre l'abus de cannabis et un diagnostic futur de schizophrénie a signalé que dans la population générale suédoise, l'abus de cannabis était fortement lié à une schizophrénie tardive (RC = 10,44, IC à 95 % = 8,99 à 12,11)Reference 1628. Le lien était considérablement atténué lorsque le retard temporel entre l'exposition au cannabis, sous la forme d'un abus, et le diagnostic de schizophrénie était augmenté et lorsque l'augmentation des degrés des facteurs de confusion familiaux était contrôlée. Le contrôle total des facteurs de confusion familiaux réduisait l'association entre l'abus de cannabis et la schizophrénie tardive (RC = 3,3 et 1,6 avec des retards temporels de trois et sept ans, respectivement). Il convient de noter que l'abus d'opiacés, de sédatifs, de cocaïne ou de stimulants et de drogues hallucinogènes était aussi fortement lié à une schizophrénie subséquente dans la population générale. Fait important, les auteurs de l'étude affirment qu'une grande partie de l'association entre l'abus de cannabis et la schizophrénie observée dans la population générale n'est pas causale et provient d'effets de confusion dus à des facteurs familiaux communs. Ainsi, les facteurs de risque génétiques communs contribuent considérablement à l'association entre l'abus de cannabis et la schizophrénie. Les auteurs remarquent aussi que les facteurs environnementaux familiaux influencent également la concomitance de l'abus de cannabis et de la schizophrénie. Cependant, les auteurs de l'étude avancent que les résultats de l'étude continuent d'appuyer l'hypothèse selon laquelle l'abus de cannabis suffisamment grave a un effet causal sur le risque futur de schizophrénie. Ainsi, il semble que le risque de schizophrénie fasse l'objet d'un certain nombre d'influences, y compris la prédisposition génétique, l'environnement familial et la gravité de l'abus de cannabis.
Une méta-analyse et une analyse systématique de la documentation examinant l'association entre la quantité de cannabis consommé et les effets liés à une psychose révèlent que des taux plus élevés de consommation de cannabis ont été associés à un risque accru de psychose avec un RC égal à 3,90 (IC à 95 % = 2,84 à 5,34) pour le risque de schizophrénie et d'autres effets liés à une psychose chez les plus grands consommateurs de cannabis, par rapport à ceux qui n'en consomment pasReference 1363.
Une étude prospective en ligne qui a recruté un peu plus de 700 participants dans le but d'examiner l'existence d'une relation longitudinale entre le changement de la consommation de cannabis et les expériences psychotiques a signalé qu'une réduction de la consommation de cannabis était associée à une diminution de la fréquence d'expériences psychotiques au moment du suivi (β = -0,096, p = 0,01)Reference 1629. Par contre, l'augmentation de la consommation de cannabis n'a présenté aucun lien significatif avec le nombre d'expériences psychotiques au moment du suivi. Même si la diminution de la consommation de cannabis a été associée à une diminution des symptômes positifs au moment du suivi dans le modèle non corrigé (β = -0,12, p = 0,002), cela n'a pas été le cas dans le modèle corrigé (β = -0,06, p = 0,06). L'augmentation de la consommation de cannabis a été associée à un score plus élevé sur la sous-échelle de mesure des symptômes positifs CAPE (évaluation communautaire des expériences psychiques) (β = 0,07, p = 0,02) dans le modèle totalement corrigé, tandis qu'aucune association significative n'a été constatée entre le changement de la consommation de cannabis et la sous-échelle de mesure des symptômes négatifs. La diminution de la consommation de cannabis constituait un facteur prédictif d'un score plus faible au moment du suivi sur la sous-échelle des symptômes dépressifs, mais uniquement dans le modèle non corrigé. Compte tenu des résultats, les auteurs affirment que l'arrêt de la consommation de cannabis pourrait contribuer à réduire le risque de psychose clinique, et notamment le risque de symptômes positifs, à long terme.
Un examen systématique et une méta-analyse récents de 24 études sur plus de 16 000 participants ont démontré qu'indépendamment du stade de la maladie, la poursuite de la consommation de cannabis par les patients souffrant de troubles psychotiques préexistants était associée à une plus grande incidence de rechute de psychose comparativement aux patients qui n'avaient jamais consommé de cannabis ou qui avaient suspendu leur consommationReference 159. La poursuite de la consommation a aussi été associée à des périodes d'hospitalisation plus longues. De plus, la consommation continue avait un plus grand effet que la consommation interrompue sur la rechute, les symptômes positifs et les niveaux de fonctionnement, mais non sur les symptômes négatifs.
Une étude par observation subséquente de 256 patients âgés de 18 à 65 ans ayant un premier épisode de psychose a démontré que les anciens fumeurs de cannabis réguliers ayant cessé de consommer lorsque le premier épisode de psychose est survenu possédaient le cours de la maladie le plus favorable en ce qui concerne les risques de rechute comparativement à la consommation continue de fréquence élevée (c.-à-d. consommation quotidienne) de cannabis très puissant (ressemblant au type « skunk ») qui était associée aux pires résultatsReference 160. Les consommateurs fréquents de cannabis puissant possédaient un RC de 3,28 (IC à 95 % = 1,22 à 9,18) de rechute subséquente, un RC de 1,77 (IC à 95 % = 0,96 à 3,25) de plus de rechutes et un RC de 3,16 (IC à 95 % = 1,26 à 8,09) de nécessité des soins psychiatriques plus intensifs après le début de la psychose ainsi que moins de mois avant qu'une rechute ne survienne.
Une autre étude prospective de cohorte récente de 220 patients âgés de 18 à 65 ans ayant un premier épisode de psychose a signalé une augmentation des risques de rechute de psychose au cours de périodes de consommation de cannabis comparativement aux périodes sans consommation (RC = 1,13; IC à 95 % = 1,03 à 2,24)Reference 161. Les auteurs suggèrent qu'il est plus probable que non que la consommation continue de cannabis après le début de la psychose soit causalement et en fonction de la dose associée à l'augmentation des risques de rechute de psychose causant une hospitalisation en psychiatrie.
Facteurs génétiques
Un grand nombre d'études ont examiné l'influence de facteurs génétiques possibles dans le développement de la psychose et de la schizophrénie, plus particulièrement en tant que fonction d'interaction avec la consommation de cannabis. Certaines études ont mis l'accent sur le rôle des polymorphismes génétiques dans le locus génique COMTReference 1110-Reference 1114, alors que d'autres se sont centrées sur les polymorphismes du locus géniqueAKT1Reference 1118-Reference 1121, du locus génique BDNFReference 1630, DAT1 ou CNR1Reference 1631-Reference 1633.
La schizophrénie et le gène COMT
La COMT régule la décomposition des catécholamines, notamment des neurotransmetteurs comme la dopamine, l'adrénaline et la noradrénalineReference 1114. Une mutation faux-sens du codon 158 dans le gène COMT, ce qui provoque une substitution de la méthionine (Met) à la valine positionnelle (Val) (Val158Met), entraîne une enzyme dont l'activité est plus faible et un catabolisme de la dopamine conséquemment plus lentReference 1634Reference 1635. On sait que les changements dans la tonicité et la signalisation dopaminergique influence la fonction neurophysiologique et que ces changements joueraient un rôle dans la physiopathologie de la schizophrénieReference 1636. Même si une étude d'association à grande échelle et une méta-analyse antérieure n'avaient pas réussi à établir un lien solide entre le polymorphisme de la COMT Val158Met et la vulnérabilité à la schizophrénieReference 1637, des études subséquentes suggèrent une association (voir ci-dessous).
Caspi et coll.Reference 1110 ont fait un suivi d'une cohorte épidémiologique de naissances constituée de 1 037 enfants de manière longitudinale au cours des 30 premières années de vie. Ils ont conclu que le génotype homozygote COMT Val/Val interagissait avec la consommation de cannabis débutée à l'adolescence, mais non avec la consommation débutée à l'âge adulte, pour prédire l'émergence d'une psychose à l'âge adulte. Les études subséquentes ont confirmé et enrichi ces constatationsReference 1111-Reference 1114Reference 1120. Les porteurs de l'allèle Val étaient les plus sensibles aux expériences psychotiques provoquées par le Δ9-THC (surtout s'ils obtenaient un résultat élevé selon une évaluation du risque de psychose) et étaient aussi plus sensibles aux défaillances de la mémoire et de l'attention provoquées par le Δ9-THC, comparativement aux porteurs de l'allèle MetReference 1111. Les porteurs homozygotes de l'allèle Val, mais non les sujets possédant le génotype homozygote Met, présentaient une augmentation dans l'incidence des hallucinations après avoir été exposé au cannabis, cependant ce résultat était conditionnel à des preuves psychométriques de risque de psychoseReference 1112. Les patients hétérozygotes Val/Met semblaient aussi plus sensibles aux effets du cannabis que les homozygotes Met, mais moins sensibles que les homozygotes ValReference 1112.
Une autre étude suggérait que la consommation de cannabis pourrait diminuer l'effet retardataire (protecteur) de l'allèle COMT Met en matière d'influence sur l'âge d'apparition de la psychoseReference 1113. Ces conclusions étaient appuyées et enrichies par une étude subséquente démontrant que les personnes qui commençaient à consommer du cannabis plus tôt étaient plus jeunes lors de l'apparition de troubles psychiatriques et que les porteurs du génotype homozygote Val étaient plus jeunes à l'apparition de la psychose comparativement aux porteurs du MetReference 1114. Les auteurs de cette étude ont conclu que l'interaction entre les gènes et l'environnement (c'est-à-dire la combinaison du polymorphisme de la COMT Val à Met et la consommation de cannabis) peut moduler l'émergence d'une psychose chez les adolescentsReference 1114. De plus, des données génomiques fonctionnelles convergentes recueillies indiquent que le gène COMT (de même que les gènes CNR1 et 2) joue un rôle dans la physiopathologie de la schizophrénieReference 1638.
Ensemble, ces études suggèrent aussi la présence d'un effet entre les gènes et la dose, avec un risque accru de maladie chez les homozygotes Val/Val, un risque modéré chez les hétérozygotes Val/Met et un risque moins important chez les homozygotes Met/Met.
La schizophrénie et le gène AKT1
D'autres études ont mis l'accent sur le rôle de AKT1, un gène qui code une protéine kinase participant aux cascades de signalisation des récepteurs de la dopamine et des cannabinoïdes, et jouant un rôle dans la régulation du métabolisme cellulaire, le stress cellulaire, la régulation du cycle cellulaire et l'apoptose, de même que la régulation de la taille et la survie cellulaire des neuronesReference 1118. Lors d'une étude, les auteurs ont trouvé des preuves d'interaction entre les gènes et l'environnement, celle-ci entre un SNP dans le gène AKT1 (rs2494732, polymorphisme homozygote C/C) et la consommation de cannabisReference 1119. Les personnes présentant un polymorphisme homozygote C/C couraient un risque environ deux fois plus élevé de recevoir un diagnostic de trouble psychotique après avoir consommé du cannabis de manière quotidienne ou hebdomadaireReference 1119. À l'inverse, les personnes hétérozygotes C/T ne couraient qu'un risque légèrement plus élevé de développer une psychose reliée au cannabis, comparativement aux homozygotes T/T qui ont servi de groupe témoinReference 1119. Lors d'une autre étude réalisée par le même groupe, les personnes possédant un polymorphisme homozygote C/C rs2494732 présentaient un déficit d'attention soutenue, mais non en mémoire verbale, même en l'absence de consommation actuelle de cannabisReference 1118. Une étude naturaliste menée chez 442 jeunes consommateurs de cannabis en bonne santé (308 hommes et 114 femmes) âgés de 16 à 23 ans a examiné les associations entre les variations du locus du gène AKT1 et les symptômes psychotiques aigus et la fonction cognitive et la concentration de THC dans le cannabis appartenant aux sujetsReference 1121. L'étude révèle que la variation au niveau du locus du gène AKT1 permettait de prévoir une réponse psychotique aiguë au cannabis ainsi qu'une dépendance au cannabis et des symptômes schizotypiques au début de l'étude. De plus, l'étude a démontré que la mémoire de travail après une exposition aiguë au cannabis était pire chez les femmes que chez les hommes.
La schizophrénie et le gène BDNF
Une étude a déterminé que la consommation de cannabis, avant un diagnostic de schizophrénie, était associée à une baisse de l'âge au moment de l'apparition d'un trouble psychotique, ce qui provoquait une baisse de l'âge au moment de la première admission à l'hôpital de presque trois ansReference 1630. De plus, une association liée à la dose entre la consommation de cannabis et l'âge au moment de l'apparition de symptômes psychotiques a été établie, l'apparition du trouble psychotique étant plus précoce chez les plus grands consommateurs. On a aussi relevé un lien important entre un âge de première consommation de cannabis plus précoce et une apparition de trouble psychotique plus rapide, même après avoir effectué un contrôle des facteurs confusionnels possibles. Dans cette étude, la consommation de cannabis permettait de prédire de manière indépendante l'apparition d'un trouble psychotique chez les hommes, alors que chez les femmes la consommation de cannabis n'était associée qu'à l'âge au moment de l'apparition du trouble psychotique chez les personnes porteuses d'une mutation de l'allèle Met dans le gène BDNF. Les porteuses de l'allèle mutant Met présentaient des symptômes psychotiques sept ans plus tôt que les patients qui n'avaient pas consommé de cannabis et qui possédaient un génotype BDNF Val/Val.
Pour conclure, compte tenu des données probantes suggérant une forte composante génétique dans la modulation de la psychose, et surtout dans le cas de la psychose ou la schizophrénie précipitée par la consommation de cannabis, le prélèvement d'antécédents médicaux exhaustifs, particulièrement ceux qui comprennent des antécédents ou une évaluation psychiatriques, serait très utile pour déterminer si le cannabis ou les cannabinoïdes représentent une possibilité thérapeutique raisonnable et viable.
Une étude axée sur la population a évalué si l'association entre la consommation de cannabis (à l'âge de 16 ans) et la maturation corticale chez les adolescents est modérée par un score de risque polygénique pour la schizophrénieReference 1104. Dans cette étude, trois différents groupes de population ont été examinés : 1 024 adolescents des deux sexes de l'étude canadienne sur les jeunes du Saguenay-Lac-Saint-Jean, la Saguenay Youth Study (SYS), 426 adolescents des deux sexes de l'étude IMAGEN et 504 jeunes hommes de l'étude ALSPAC. Au total, 1577 participants (âgés de 12 à 21 ans) ont fait l'objet de cette étude. Les résultats de l'étude indiquent une association négative entre la consommation de cannabis au début de l'adolescence et l'épaisseur corticale chez les sujets de sexe masculin dont le score de risque polygénique pour la schizophrénie est élevé. Dans les groupes des études SYS et IMAGEN, les scores de risque plus élevés étaient associés à une épaisseur corticale plus faible uniquement chez les hommes qui consommaient du cannabis. Dans le groupe de l'étude ALSPAC, les personnes qui consommaient du cannabis plus souvent (au moins 61 fois) avaient une épaisseur corticale plus faible par rapport à celles qui n'avaient jamais consommé de cannabis et à celles qui en consommaient peu. Les auteurs ont conclu que la consommation de cannabis au début de l'adolescence modère l'association entre le risque génétique pour la schizophrénie et la maturation corticale chez les sujets de sexe masculin. De plus, les auteurs font observer que la consommation de cannabis pourrait nuire à la maturation du cortex cérébral chez les adolescents de sexe masculin dont le risque de schizophrénie est élevé. L'exposition au cannabis pourrait encore accélérer la progression naturelle de l'amincissement du cortex chez les adolescents dont le score de risque polygénique est élevé.
Détermination des groupes à risque élevé
Plusieurs études ont cherché à déterminer les sous-groupes de personnes dont le risque de développer une psychose et une schizophrénie associées à la consommation de cannabis est particulièrement élevéReference 1103. L'âge au moment de la première consommation, la sensibilité génétique, les antécédents familiaux, les traumatismes subis durant l'enfance et les souches de cannabis ont tous été considérés dans l'examen effectué par Gage et coll. (2015)Reference 1103. En ce qui concerne l'âge au moment de la première consommation, les données indiquent que la consommation précoce de cannabis est associée à un risque accru de psychose, de trouble schizophréniforme ou de schizophrénie bien que, pour le moment, on ignore si cela résulte d'une « période de vulnérabilité » particulière durant l'adolescence ou plutôt d'une période plus longue d'un usage cumulatif (c.-à-d. que les personnes ayant commencé plus tôt à utiliser du cannabis pourraient en avoir déjà consommé plusieurs fois lors de l'évaluation de la mesure des résultats) ou même si cela dépend d'autres facteurs de confusion tels que les antécédents d'abus ou le niveau socioéconomique de la familleReference 1079Reference 1103Reference 1105.
Une récente étude longitudinale de 15 ans portant sur 6 534 adolescents finlandais a suggéré que la consommation de cannabis était associée à un risque accru de développer une psychose avant l'âge de 30 ans. Les données de l'enquête ont révélé que les personnes qui ont essayé le cannabis au moins cinq fois ou plus présentaient le risque le plus élevé [rapport de risques (hazard ratio) (HR) = 6,5, IC à 95 % 3,0-13,9] de développer une psychose 15 ans plus tard, même après avoir contrôlé pour les symptômes prodromiques, la polytoxicomanie et la psychose parentaleReference 1639.
Une récente étude longitudinale de quatre ans portant sur les données individuelles de 3720 adolescents canadiens a révélé que la consommation "fréquente" (quotidienne/presque quotidienne) de cannabis au départ (âge de 13 ans) prédisait les symptômes psychotiques auto-déclarés un an plus tard (âge de 14 ans). Les participants ont rempli un sondage annuel en ligne pendant quatre ans, de 13 à 16 ans. Dans les évaluations chronologiques subséquentes qui ont suivi les données de base, l'usage de cannabis a prédit les symptômes psychotiques cette année-là et un an plus tard. Par exemple, la consommation de cannabis à 14 ans a prédit les symptômes psychotiques à 14 ans et un an plus tard (15 ans); la consommation de cannabis à 15 ans a prédit les symptômes psychotiques à 15 ans et un an plus tard (16 ans). Les résultats globaux impliquent que consommer souvent du cannabis pendant les premières années de l'adolescence peut augmenter le risque de développement et de persistance des symptômes psychotiques. Les principales limites de cette étude ont trait aux résultats associatifs (causalité non établie) et ne tiennent pas compte des antécédents familiaux de psychose dans les analysesReference 1640.
En ce qui concerne la sensibilité génétique, plusieurs études avancent qu'un certain nombre de gènes différents jouent un rôle important dans la modulation de la sensibilité aux troubles psychotiques chez les sujets qui consomment du cannabis (COMT, AKT1, BDNF, DAT1, NRG1, CNR1 et voir la section précédente). Bien que les données concernant l'influence du gène COMT aient été remises en question, d'autres gènes (AKT1, BDNF, DAT1, NRG1, CNR1) pourraient encore contribuer au risque de manifestation de troubles psychotiques associés à la consommation de cannabisReference 1079Reference 1103Reference 1105.
Quelques études révèlent que les traumatismes subis durant l'enfance, lorsqu'ils sont associés à la consommation de cannabis, augmentent le risque absolu de psychose dans une plus grande mesure que la somme de l'un ou l'autre des facteurs de risque considérés isolémentReference 1079Reference 1103Reference 1105. On a indiqué que les RCs de développement de psychose durant l'adolescence, lorsqu'il existe des antécédents d'abus ou de traumatisme, sont compris entre 11,96 (IC à 95 % = 2,10 à 68,22) et 20,9 (IC à 95 % = 2,3 à 173,5)Reference 1079.
On a également établi des liens entre des antécédents familiaux positifs de schizophrénie et un risque accru de troubles psychotiques provoqués par le cannabisReference 1079. Par exemple, une étude de cohorte axée sur la population et menée auprès de 2 276 309 personnes, qui a visé à établir les ratios des taux de psychose provoquée par le cannabis associés à une prédisposition à la psychose et à d'autres troubles psychiatriques chez un parent au premier degré en les comparant aux ratios des taux correspondants de développement de troubles du spectre de la schizophrénie, révèle que les enfants dont la mère était atteinte de schizophrénie présentent un risque cinq fois plus élevé d'être atteints de schizophrénie et un risque 2,5 fois plus élevé d'avoir une psychose provoquée par le cannabisReference 1641.
Enfin, plusieurs études ont examiné l'association entre la consommation de différentes souches de cannabis et le risque de psychoseReference 1079Reference 1103Reference 1105. Dans l'ensemble, les résultats indiquent que les souches dont la teneur en THC est supérieure à la teneur en CBD sont associées à un risque accru de psychose, bien que des études supplémentaires soient requises pour corroborer ces conclusionsReference 1103.
7.7.3.3 Idées suicidaires, tentatives de suicide et mortalité
- Des données d'études épidémiologiques suggèrent aussi l'existence d'une association en fonction de la dose entre le cannabis et les tendances suicidaires, en particulier chez les hommes.
Des données provenant d'études épidémiologiques suggèrent que les pensées et comportements suicidaires (idées, planification et tentatives) sont étroitement liés aux comportements de consommation de substances, y compris du cannabisReference 173. De nombreuses études épidémiologiques ont constaté un lien statistiquement considérable entre la consommation de cannabis, surtout la consommation précoce intensive (c.-à-d. quotidiennement) et la suicidalitéReference 163Reference 164Reference 173Reference 1642. Bien que le mécanisme d'action particulier liant la consommation de cannabis, surtout la consommation intensive, au risque plus élevé de suicidalité reste incertain, des données provenant d'études cliniques menées avec le rimonabant, un antagoniste des récepteurs CB1, a démontré que la consommation de rimonabant était associée statistiquement et considérablement à des risques plus élevés d'idées suicidaires et de tentatives de suicide (RC = 1,9, IC À 95 % = 1,1 à 3,1)Reference 1643Reference 1644. Ensemble, les résultats provenant d'études épidémiologiques et d'études cliniques avec le rimonabant soulèvent la possibilité que la régulation à la baisse des récepteurs CB1, causée soit par la consommation fréquente et intensive de cannabis (à THC prédominant ou cannabis enrichi de THC) ou par l'administration d'un antagoniste des récepteurs CB1 (p. ex. rimonabant) pourrait potentiellement provoquer la suicidalité, particulièrement chez les individus susceptibles.
Une étude longitudinale de cohorte d'une durée de 30 ans (Christchurch Health and Development Study) de 1 265 enfants a signalé qu'après avoir ajusté pour les caractéristiques personnelles et familiales, il demeurait toujours un rapport statistiquement considérable entre les idées suicidaires et la consommation de cannabis au moins mensuelleReference 1642. Dans le cadre de cette étude, la consommation régulière de cannabis (c.-à-d., consommation d'au moins plusieurs fois par semaines à quotidienne) a été évaluée comme augmentant d'un degré considérable les risques de transition à des pensées suicidaires chez les hommes susceptibles, mais non pour les femmes. Notablement, l'étude n'a pas constaté un effet considérable d'idées suicidaires sur l'adoption de consommation régulière de cannabis (c.-à-d. aucune causalité inverse).
Une étude utilisant deux échantillons communautaires de jumeaux provenant du Australian Twin Registry composé de 9 583 individus a signalé que tous les niveaux de consommation de cannabis étaient associés aux idées suicidaires, indépendamment de la durée d'utilisation (RC = 1,28 à 2,00, p < 0,01)Reference 173. La consommation de cannabis et l'appui de trois symptômes ou plus ont été associés à des tentatives de suicide non planifiées (RC = 1,95 et 2,51, respectivement, p < 0,05), mais non à des tentatives planifiées. Les idées suicidaires, indépendamment de la durée, ont démontré un lien en fonction de la dose à la consommation de cannabis, celles-ci étant plus communes chez ceux ayant signalé de trois à six symptômes de TUC (21 à 28 %) comparativement à ceux qui n'avaient jamais consommé (6 à 12 %), ceux qui n'éprouvaient aucun symptôme (9 à 17 %) et ceux n'éprouvant qu'un ou deux symptômes (13 à 21 %). Notablement, les liens persistaient même après avoir ajusté en fonction d'autres troubles psychiatriques et la consommation d'autres substances. Les auteurs de l'étude suggèrent la présence d'effets génétiques et environnementaux chevauchants responsables de la covariance entre le cannabis et les idées suicidaires.
Une étude utilisant des données provenant des deux premières vagues du NESARC a signalé que la consommation de cannabis était étroitement associée à l'accroissement de l'incidence de la suicidalité chez les hommes (RCA pour toute consommation de cannabis = 1,91, IC à 95 % = 1,02 à 3,56) et encore plus dans le cas de la consommation intensive (c.-à-d. quotidiennement ou presque) (RCA = 4,28, IC à 95 % = 1,32 à 13,86), mais non pour les femmesReference 163. Parmi les femmes, les valeurs de base pour la suicidalité ont été associées avec l'initiation de la consommation de cannabis (RCA = 2,34, IC à 95 % = 1,42 à 3,87), mais non pour les hommes. Bien que l'étude ait déclaré une association considérable entre la consommation de cannabis et les idées suicidaires, aucune association n'a été constatée entre la consommation de cannabis et les tentatives de suicide.
Un examen et une méta-analyse récents des associations entre la consommation de cannabis et la suicidalité ont constaté que la consommation de cannabis, en particulier la consommation intensive (c.-à-d. quotidiennement ou presque), est associée à un effet modeste sur la suicidalitéReference 164. Bien que les preuves d'une association entre la consommation aiguë de cannabis et les risques imminents à la suicidalité étaient insuffisantes, des données étaient disponibles appuyant que la consommation chronique de cannabis puisse prédire la suicidalité. Les méta-analyses regroupées ont démontré que toute consommation de cannabis était associée à une augmentation de l'incidence d'idées suicidaires (RC = 1,43, IC à 95 % = 1,13 à 1,83) et que la consommation intensive de cannabis était associée à des risques plus élevés d'idées suicidaires (RC = 2,53, IC à 95 % = 1,00 à 6,39). De plus, les RC regroupés approximés pour toute consommation de cannabis et les tentatives de suicide étaient de 2,23 (IC à 95 % = 1,24 à 4,00) et le RC pour la consommation intensive de cannabis était de 3,20 (IC à 95 % = 1,72 à 5,94). Les lacunes de la méta-analyse comprennent l'hétérogénéité des études ainsi qu'un biais de publication.
7.7.3.4 Syndrome amotivationnel
- Les données limitées disponibles pour une association entre la consommation de cannabis et un « syndrome amotivationnel » sont mixtes.
On utilise habituellement le terme « syndrome amotivationnel » pour désigner des personnes qui présentent de l'apathie, un manque de motivation, un retrait social, un cercle d'intérêts plus étroit, une léthargie, un déficit de la mémoire, un déficit de la concentration, un jugement affaibli et de mauvais résultats professionnelsReference 1645.
Certains chercheurs proposent que la consommation élevée et chronique de cannabis est liée au développement d'un tel syndromeReference 1645; l'abstinence de consommation semble typiquement entrainer la disparition des symptômesReference 1360Reference 1646. Toutefois, d'autres chercheurs n'ont trouvé aucune relation de causalité de ce genreReference 1645Reference 1647. Certaines hypothèses ont été émises sur le fait que des études antérieures pourraient avoir été faussées par un certain nombre de variables telles que l'abus d'autres substances, la pauvreté ou d'autres troubles psychiatriques qui offriraient d'autres explications au dit « syndrome amotivationnel »Reference 178.
8.0 Surdose/toxicité
À ce jour, il n'y a eu aucune preuve documentée de décès attribuable exclusivement à une surdose de cannabisReference 1648, très probablement en raison de l'expression rare des récepteurs CB1 dans les régions du tronc cérébral responsables du contrôle respiratoire et cardiovasculaireReference 767. En utilisant les valeurs de DL50 des rongeurs pour l'administration orale, la dose mortelle équivalente de THC chez les humains a été extrapolée à > 15 000 mgReference 1649Reference 1650. En utilisant un échantillon de cannabis qui contient 20 % de THC comme exemple, une personne devrait ingérer oralement 75 000 mg de cannabis pour atteindre cette quantité, ce qui est supérieur à la quantité de cannabis qu'un très gros consommateur consommerait en une journée (1 025 mg, intervalle 652-1 336 mg, selon les données européennesReference 1651). La marge d'exposition pour le THC est > 100 pour l'exposition individuelle, l'exposition de la population calculée à partir des données de prévalence et l'exposition de la population calculée à partir de l'analyse des eaux uséesReference 1652. Cependant, une surdose de cannabis et de THC peut produire des effets mentaux et physiques dépendants de la dose, non voulus et potentiellement significatifs, généralement des étourdissements, une sédation, l'intoxication (euphorie), l'altération des fonctions cognitives, l'altération transitoire des fonctions sensorielles et perceptuelles, la maladresse, l'assèchement de la bouche, l'hypotension ou l'augmentation du rythme cardiaqueReference 222Reference 1653. Ces effets indésirables sont généralement tolérables chez les adultes en bonne santé et sont assez semblables à ceux éprouvés avec d'autres médicamentsReference 136.
Les complications psychologiques aiguës (p. ex. les crises de panique, l'anxiété sévère, la psychose, la paranoïa, les hallucinations, les convulsions, l'hyperémèse) qui pourraient devoir être traitées par les services des urgences des hôpitaux peuvent être gérées à l'aide de mesures classiques, comme rassurer le patient dans un milieu calme et/ou administrer des benzodiazépines (5 à 10 mg de diazépam PO) ou des liquides administrés par IV, au besoinReference 1654. Tel qu'indiqué pour la surdose de MarinolMD Reference 222, les signes et les symptômes observés du cannabis fumé ou ingéré sont une extension des effets psychotomimétiques et physiologiques du THC. Les personnes qui éprouvent des réactions psychotiques devraient cesser de consommer du cannabis ou des cannabinoïdes immédiatement et consulter rapidement un médecin ou un psychiatre. La monographie du MarinolMD suggère que, dans le cas d'une ingestion récente potentiellement grave, celle-ci devrait être gérée avec une décontamination gastro-intestinaleReference 222. Chez les patients inconscients, assurer la perméabilité des voies respiratoires et le maintient d'une ventilation pulmonaire adéquate, et administrer par sonde nasogastrique du charbon activé (30 à 100 g chez les adultes, 1 à 2 g/kg chez les nourissons)Reference 222. On peut ajouter un soluté physiologique cathartique ou du sorbitol à la première dose de charbon activéReference 222.
Les différences sur le plan de la pharmacocinétique et de la pharmacodynamique entre les différentes voies d'administration, comme la voie fumée ou la vaporisation et l'ingestion par voie orale, confèrent différents risques de surdose. L'inhalation est généralement associée à une augmentation importante et rapide des taux de cannabinoïdes dans le sang, tandis que l'ingestion par voie orale est associée à une augmentation moins importante et plus lente des taux de cannabinoïdes dans le sang (voir la Section 2.2.1 pour obtenir davantage de détails). Conformément à ces différences sur le plan de la pharmacocinétique, les effets néfastes aigus associés à l'inhalation ont une durée d'action et un délai d'action plus courts, tandis que les effets néfastes aigus associés à l'ingestion par voie orale ont une durée d'action et un délai d'action plus longs (voir les Sections 2.2.1.1 à 2.2.1.4 pour obtenir plus de détails). Le pic soudain de taux de cannabinoïdes plus élevés dans le sang associé à l'inhalation pourrait entraîner un épisode aigu de surdose si l'autodosage n'est pas correctement utilisé. Une étude a montré que, bien que les consommateurs de cannabis dosent leur apport en THC en inhalant des volumes plus faibles de fumée lorsqu'ils fument des joints « puissants », cela ne permet pas de compenser complètement pour les doses plus élevées de THC par joint lorsque du cannabis « puissant » est utilisé et, par conséquent, les utilisateurs de cannabis plus puissant sont exposés à de plus grandes quantités de THCReference 576. Par contre, l'apparition prolongée d'effets aigus associés à l'ingestion par voie orale peut inciter certaines personnes à consommer plus de cannabis (et de THC) que ce qui est réellement nécessaire pour obtenir un effet thérapeutique, croyant qu'elles n'en ont pas consommé assez ou qu'une augmentation de la dose conduira à une apparition plus rapide des effets. Ces croyances erronées et ces comportements pourraient entraîner une surdose. Dans le cadre d'un rapport de séries de cas du Colorado, cinq patients qui fumaient du cannabis quotidiennement et qui avaient signalé avoir consommé plus de 10 fois la dose recommandée de 10 mg de THC ont été admis au service d'urgences psychiatriques pour des cas de psychose induite par cannabis comestibleReference 170. Les symptômes signalés comprennent des pensées désorganisées instables, un manque de jugement et de lucidité, des délires hyperreligieux, l'absence totale d'émotions, le délire des grandeurs, des hallucinations visuelles et auditoires, un comportement combatif et agité, la paranoïa, l'euphorie, parler très rapidement, fuite des idées, des idées suicidaires, l'insomnie et des cas d'humeur dépressive. Dans tous les cas, la psychose s'est dissipée après un à deux jours suite à un traitement et tous les patients sont retournés à leur état mental normal de base. Aucun traitement psychiatrique de suivi n'a été recommandé à leur sortie de l'hôpital. Deux patients avaient déjà vécu un épisode de psychose induite par du cannabis inhalé. Dans l'un des cas, les antécédents familiaux étaient positifs pour la présence de schizophrénie et du trouble bipolaire, mais les antécédents étaient incertains pour les autres patients. Le traitement était composé d'halopéridol intramusculaire ou de lorazepam ou de midalozam, d'olanzapine oral, l'isolement ou l'immobilisation, et du risperidone oral. Dans l'un des rapports de cas, un homme de 19 ans qui avait surdosé à l'aide d'un produit comestible de cannabis (c.-à-d. un biscuit de cannabis) a apparemment commencé à exhiber des comportements hostiles et des paroles erratiques au cours des 2,5 premières heures après la consommation et est décédé de traumatisme corporel causé par un saut d'un balcon environ 3,5 heures après avoir consommée le produit comestibleReference 169.
THC
Les valeurs de dose léthale médiane (DL50) chez les rats auxquels on a administré des doses uniques de THC ou d'extrait de cannabis brut par voie orale se situent environ à 1 000 mg/kgReference 1655. Les chiens et les singes sont capables de tolérer des doses orales de THC ou d'extrait de cannabis beaucoup plus élevées de 3 000 mg/kg (ou plus dans certains cas)Reference 1655. La dose estimée de THC mortelle administrée par intraveineuse pour l'humain est de 30 mg/kg (2 100 mg/70 kg)Reference 222. La conversion de cette dose en dose moyenne inhalée ou orale suggère une dose moyenne inhalée de 7 350 mg de THC (marge de 6 300 mg à 8 400 mg / 70 kg) et une dose moyenne orale de 31 500 mg de THC (marge de 21 000 à 42 000 mg / 70 kg), selon un facteur de conversion compris entre trois et six fois entre la voie intraveineuse et la voie inhalée, et entre 10 et 20 fois entre la voie intraveineuse et la voie oraleReference 575Reference 1656. On observe des symptômes importants sur le SNC aux doses orales de 0,4 mg/kg (28 mg/ 70 kg) de dronabinol (MarinolMD)Reference 222. Les signes et symptômes d'une intoxication sévère avec le MarinolMD comprennent une diminution de la coordination motrice, de la léthargie, des troubles de l'élocution et de l'hypotension posturaleReference 222.
CBD
Les valeurs de DL50 après des doses uniques de CBD administrées par intraveineuse ont été de 50 mg/kg (285 mg/ 70 kg)Note de bas de page ii chez les sourisReference 1657, 232 à 252 mg/kg (2 619 à 2 845 mg/70 kg)Note de bas de page ii chez les ratsReference 427 et 212 mg/kg (4 787 mg/70 kg)Note de bas de page ii chez les singesReference 1658. Il n'y a pas eu de décès chez les rats et les singes ayant reçu des doses orales quotidiennes de 25 à 300 mg/kg de CBD (282 mg à 6 774 mg/70 kg)Note de bas de page ii pendant 90 joursReference 427. Dans les études chez l'humain, le CBD administré une fois à des doses orales de 15 à 160 mg, par inhalation à une dose de 0,15 mg/kg (10,5 mg/70 kg)Note de bas de page ii ou par injection IV à des doses de 5 à 30 mg n'a pas produit d'effets indésirables. Dans un rapport de cas, un adolescent souffrant de schizophrénie qui a reçu jusqu'à 1 500 mg/jour de CBD n'a souoffert d'aucun effet indésirableReference 1485. Dans une étude de Devinsky et coll.Reference 258, la dose moyenne de CBD à 12 semaines a été de 22,9 mg/kg (1 603 mg/70 kg)Note de bas de page ii chez les patients atteints d'épilepsie résistante au traitement avec 48 patients recevant jusqu'à 50 mg/kg/jour (3 500 mg/70 kg)Note de bas de page ii de CBD augmenté sur une période de 12 semaines. Des effets indésirables ont été signalés chez 79 % des patients, mais la plupart d'entre eux ont été légers ou modérés et transitoires. Des effets indésirables graves pouvant être liés à l'utilisation de CBD ont été enregistrés chez 20 patients (12 %) comprenant l'état épileptique, la diarrhée, la pneumonie et la perte de poids. Une analyse post-hoc a montré que la dose de CBD à la semaine 12 n'était pas corrélée avec le nombre d'événements indésirables signalés dans l'ensembleReference 258.
Reference
- Reference 1
-
Rodriguez de Fonseca F, del Arco I, Bermudez-Silva FJ, Bilbao A, Cippitelli A, Navarro M. The endocannabinoid system: Physiology and pharmacology. Alcohol Alcohol 2005 01;40(0735-0414; 0735-0414; 1):2-14.
- Reference 2
-
Serrano A, Parsons LH. Endocannabinoid influence in drug reinforcement, dependence and addiction-related behaviors. Pharmacol Ther 2011 12;132(1879-016; 0163-7258; 3):215-41.
- Reference 3
-
Maccarrone M, Gasperi V, Catani MV, Diep TA, Dainese E, Hansen HS, Avigliano L. The endocannabinoid system and its relevance for nutrition. Annu Rev Nutr 2010 08/21;30(1545-4312; 0199-9885):423-40.
- Reference 4
-
Aggarwal SK. Cannabinergic pain medicine: A concise clinical primer and survey of randomized-controlled trial results. Clin J Pain 2012 02/23;29(1536-5409; 0749-8047; 2):162-71.
- Reference 5
-
Hillard CJ. The endocannabinoid signaling system in the CNS: A primer. Int Rev Neurobiol 2015;125:1-47.
- Reference 6
-
Bradshaw HB, Walker JM. The expanding field of cannabimimetic and related lipid mediators. Br J Pharmacol 2005 02;144(0007-1188; 0007-1188; 4):459-65.
- Reference 7
-
De Petrocellis L, Di Marzo V. An introduction to the endocannabinoid system: From the early to the latest concepts. Best.Pract.Res.Clin.Endocrinol.Metab 2009 02;23(1878-1594; 1521-690; 1):1-15.
- Reference 8
-
De Petrocellis L, Di M,V. Non-CB1, non-CB2 receptors for endocannabinoids, plant cannabinoids, and synthetic cannabimimetics: Focus on G-protein-coupled receptors and transient receptor potential channels. J.Neuroimmune.Pharmacol. 2010 03;5(1557-1904; 1557-1890; 1):103-21.
- Reference 9
-
O'Sullivan SE, Kendall DA. Cannabinoid activation of peroxisome proliferator-activated receptors: Potential for modulation of inflammatory disease. Immunobiology 2010 08;215(1878-3279; 0171-2985; 8):611-6.
- Reference 10
-
Hansen HS. Palmitoylethanolamide and other anandamide congeners. proposed role in the diseased brain. Exp Neurol 2010 07;224(1090-2430; 0014-4886; 1):48-55.
- Reference 11
-
Ben-Shabat S, Fride E, Sheskin T, Tamiri T, Rhee MH, Vogel Z, Bisogno T, De PL, Di M,V, Mechoulam R. An entourage effect: Inactive endogenous fatty acid glycerol esters enhance 2-arachidonoyl-glycerol cannabinoid activity. Eur J Pharmacol 1998 07/17;353(0014-2999; 0014-2999; 1):23-31.
- Reference 12
-
Quarta C, Mazza R, Obici S, Pasquali R, Pagotto U. Energy balance regulation by endocannabinoids at central and peripheral levels. Trends Mol Med 2011 09;17(1471-499; 1471-4914; 9):518-26.
- Reference 13
-
Battista N, Di TM, Bari M, Maccarrone M. The endocannabinoid system: An overview. Front Behav Neurosci 2012;6(1662-5153; 1662-5153):9.
- Reference 14
-
Horvath B, Mukhopadhyay P, Hasko G, Pacher P. The endocannabinoid system and plant-derived cannabinoids in diabetes and diabetic complications. Am J Pathol 2012 02;180(1525-2191; 0002-9440; 2):432-42.
- Reference 15
-
Hermanson DJ, Marnett LJ. Cannabinoids, endocannabinoids, and cancer. Cancer Metastasis Rev 2011 12;30(1573-7233; 0167-7659; 3-4):599-612.
- Reference 16
-
Simon GM, Cravatt BF. Anandamide biosynthesis catalyzed by the phosphodiesterase GDE1 and detection of glycerophospho-N-acyl ethanolamine precursors in mouse brain. J Biol Chem 2008 Apr 4;283(14):9341-9.
- Reference 17
-
Rouzer CA, Marnett LJ. Endocannabinoid oxygenation by cyclooxygenases, lipoxygenases, and cytochromes P450: Cross-talk between the eicosanoid and endocannabinoid signaling pathways. Chem Rev 2011 10/12;111(1520-6890; 0009-2665; 10):5899-921.
- Reference 18
-
Pertwee RG. The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: Delta9-tetrahydrocannabinol, cannabidiol and delta9-tetrahydrocannabivarin. Br J Pharmacol 2008 01;153(0007-1188; 0007-1188; 2):199-215.
- Reference 19
-
Di Marzo V, Piscitelli F, Mechoulam R. Cannabinoids and endocannabinoids in metabolic disorders with focus on diabetes. Handb Exp Pharmacol 2011(0171-2004; 0171-2004; 203):75-104.
- Reference 20
-
Bab I, Zimmer A. Cannabinoid receptors and the regulation of bone mass. Br J Pharmacol 2008 01;153(0007-1188; 0007-1188; 2):182-8.
- Reference 21
-
Howlett AC, Barth F, Bonner TI, Cabral G, Casellas P, Devane WA, Felder CC, Herkenham M, Mackie K, Martin BR, et al. International union of pharmacology. XXVII. classification of cannabinoid receptors. Pharmacol Rev 2002 06;54(0031-6997; 0031-6997; 2):161-202.
- Reference 22
-
Pertwee RG, Howlett AC, Abood ME, Alexander SP, Di M,V, Elphick MR, Greasley PJ, Hansen HS, Kunos G, Mackie K, et al. International union of basic and clinical pharmacology. LXXIX. cannabinoid receptors and their ligands: Beyond CB and CB. Pharmacol Rev 2010 12;62(1521-0081; 0031-6997; 4):588-631.
- Reference 23
-
Kraft B. Is there any clinically relevant cannabinoid-induced analgesia? Pharmacology 2012;89(1423-0313; 0031-7012; 5-6):237-46.
- Reference 24
-
Guindon J, Hohmann AG. The endocannabinoid system and pain. CNS.Neurol.Disord Drug Targets. 2009 12;8(1996-3181; 1871-5273; 6):403-21.
- Reference 25
-
Teixeira D, Pestana D, Faria A, Calhau C, Azevedo I, Monteiro R. Modulation of adipocyte biology by delta(9)-tetrahydrocannabinol. Obesity.(Silver.Spring) 2010 11;18(1930-739; 1930-7381; 11):2077-85.
- Reference 26
-
Greineisen WE, Turner H. Immunoactive effects of cannabinoids: Considerations for the therapeutic use of cannabinoid receptor agonists and antagonists. Int Immunopharmacol 2010 05;10(1878-1705; 1567-5769; 5):547-55.
- Reference 27
-
Jean-Gilles L, Gran B, Constantinescu CS. Interaction between cytokines, cannabinoids and the nervous system. Immunobiology 2010 08;215(1878-3279; 0171-2985; 8):606-10.
- Reference 28
-
Rice W, Shannon JM, Burton F, Fiedeldey D. Expression of a brain-type cannabinoid receptor (CB1) in alveolar type II cells in the lung: Regulation by hydrocortisone. Eur J Pharmacol 1997 05/30;327(0014-2999; 0014-2999; 2-3):227-32.
- Reference 29
-
Shmist YA, Goncharov I, Eichler M, Shneyvays V, Isaac A, Vogel Z, Shainberg A. Delta-9-tetrahydrocannabinol protects cardiac cells from hypoxia via CB2 receptor activation and nitric oxide production. Mol Cell Biochem 2006 02;283(0300-8177; 0300-8177; 1-2):75-83.
- Reference 30
-
Wright K, Rooney N, Feeney M, Tate J, Robertson D, Welham M, Ward S. Differential expression of cannabinoid receptors in the human colon: Cannabinoids promote epithelial wound healing. Gastroenterology 2005 08;129(0016-5085; 0016-5085; 2):437-53.
- Reference 31
-
Marquez L, Suarez J, Iglesias M, Bermudez-Silva FJ, Rodriguez de FF, Andreu M. Ulcerative colitis induces changes on the expression of the endocannabinoid system in the human colonic tissue. PLoS.One. 2009;4(1932-6203; 1932-6203; 9):e6893.
- Reference 32
-
Linari G, Agostini S, Amadoro G, Ciotti MT, Florenzano F, Improta G, Petrella C, Severini C, Broccardo M. Involvement of cannabinoid CB1- and CB2-receptors in the modulation of exocrine pancreatic secretion. Pharmacol Res 2009 03;59(1043-6618; 1043-6618; 3):207-14.
- Reference 33
-
Izzo AA, Sharkey KA. Cannabinoids and the gut: New developments and emerging concepts. Pharmacol Ther 2010 04;126(1879-016; 0163-7258; 1):21-38.
- Reference 34
-
Purohit V, Rapaka R, Shurtleff D. Role of cannabinoids in the development of fatty liver (steatosis). AAPS.J. 2010 06;12(1550-7416; 1550-7416; 2):233-7.
- Reference 35
-
Mallat A, Teixeira-Clerc F, Deveaux V, Manin S, Lotersztajn S. The endocannabinoid system as a key mediator during liver diseases: New insights and therapeutic openings. Br J Pharmacol 2011 08;163(1476-5381; 0007-1188; 7):1432-40.
- Reference 36
-
Jenkin KA, McAinch AJ, Grinfeld E, Hryciw DH. Role for cannabinoid receptors in human proximal tubular hypertrophy. Cell Physiol Biochem 2010;26(1421-9778; 1015-8987; 6):879-86.
- Reference 37
-
Gratzke C, Streng T, Park A, Christ G, Stief CG, Hedlund P, Andersson KE. Distribution and function of cannabinoid receptors 1 and 2 in the rat, monkey and human bladder. J Urol 2009 04;181(1527-3792; 0022-5347; 4):1939-48.
- Reference 38
-
Tyagi P, Tyagi V, Yoshimura N, Chancellor M. Functional role of cannabinoid receptors in urinary bladder. Indian J.Urol. 2010 01;26(1998-3824; 0970-1591; 1):26-35.
- Reference 39
-
Karasu T, Marczylo TH, Maccarrone M, Konje JC. The role of sex steroid hormones, cytokines and the endocannabinoid system in female fertility. Hum Reprod Update 2011 05;17(1460-2369; 1355-4786; 3):347-61.
- Reference 40
-
Idris AI, Ralston SH. Cannabinoids and bone: Friend or foe? Calcif Tissue Int 2010 10;87(1432-0827; 0171-967; 4):285-97.
- Reference 41
-
Watkins BA, Hutchins H, Li Y, Seifert MF. The endocannabinoid signaling system: A marriage of PUFA and musculoskeletal health. J Nutr Biochem 2010 12;21(1873-4847; 0955-2863; 12):1141-52.
- Reference 42
-
Richardson D, Pearson RG, Kurian N, Latif ML, Garle MJ, Barrett DA, Kendall DA, Scammell BE, Reeve AJ, Chapman V. Characterisation of the cannabinoid receptor system in synovial tissue and fluid in patients with osteoarthritis and rheumatoid arthritis. Arthritis Res.Ther. 2008;10(1478-6362; 1478-6354; 2):R43.
- Reference 43
-
Biro T, Toth BI, Hasko G, Paus R, Pacher P. The endocannabinoid system of the skin in health and disease: Novel perspectives and therapeutic opportunities. Trends Pharmacol Sci 2009 08;30(1873-3735; 0165-6147; 8):411-20.
- Reference 44
-
Mackie K. Signaling via CNS cannabinoid receptors. Mol Cell Endocrinol 2008 04/16;286(0303-7207; 0303-7207; 1-2):S60-5.
- Reference 45
-
Cabral GA. Marihuana and the immune system. In: G. G. Nahas, K. M. Sutin, D. J. Harvey, S. Agurell, editors. Marihuana and medicine. Totowa: Humana Press; 1999. ID: 2678; RP: NOT IN FILE.
- Reference 46
-
Cascio MG, Pertwee RG. Known pharmacological actions of nine non-psychotropic phytocannabinoids. In: R. G. Pertwee, editor. Handbook of cannabis. Oxforrd: Oxford University Press; 2015..
- Reference 47
-
Cascio MG, Zamberletti E, Marini P, Parolaro D, Pertwee RG. The phytocannabinoid, delta(9)-tetrahydrocannabivarin, can act through 5-HT(1)A receptors to produce antipsychotic effects. Br J Pharmacol 2015 Mar;172(5):1305-18.
- Reference 48
-
Pertwee RG, Cascio MG. Known pharmacological actions of delta-9-tetrahydrocannabinol and of four other chemical constituents of cannabis that activate cannabinoid receptors. In: R. G. Pertwee, editor. Handbook of cannabis. Oxford: Oxford University Press; 2015..
- Reference 49
-
De Petrocellis L, Ligresti A, Moriello AS, Allara M, Bisogno T, Petrosino S, Stott CG, Di Marzo V. Effects of cannabinoids and cannabinoid-enriched cannabis extracts on TRP channels and endocannabinoid metabolic enzymes. Br J Pharmacol 2011 08;163(1476-5381; 0007-1188; 7):1479-94.
- Reference 50
-
Alger BE. Endocannabinoids: Getting the message across. Proc Natl Acad Sci U S A 2004 06/08;101(0027-8424; 0027-8424; 23):8512-3.
- Reference 51
-
Bisogno T. Endogenous cannabinoids: Structure and metabolism. J Neuroendocrinol 2008 05;20 Suppl 1(1365-2826; 0953-8194):1-9.
- Reference 52
-
Murray RM, Morrison PD, Henquet C, Di Forti M. Cannabis, the mind and society: The hash realities. Nat Rev Neurosci 2007 Nov;8(11):885-95.
- Reference 53
-
Morgan CJ, Page E, Schaefer C, Chatten K, Manocha A, Gulati S, Curran HV, Brandner B, Leweke FM. Cerebrospinal fluid anandamide levels, cannabis use and psychotic-like symptoms. Br J Psychiatry 2013 May;202(5):381-2.
- Reference 54
-
Miller LK, Devi LA. The highs and lows of cannabinoid receptor expression in disease: Mechanisms and their therapeutic implications. Pharmacol Rev 2011 09;63(1521-0081; 0031-6997; 3):461-70.
- Reference 55
-
Martin-Sanchez E, Furukawa TA, Taylor J, Martin JL. Systematic review and meta-analysis of cannabis treatment for chronic pain. Pain Med. 2009 11;10(1526-4637; 1526-2375; 8):1353-68.
- Reference 56
-
Gowran A, Noonan J, Campbell VA. The multiplicity of action of cannabinoids: Implications for treating neurodegeneration. CNS.Neurosci.Ther. 2011 12;17(1755-5949; 1755-5930; 6):637-44.
- Reference 57
-
Guindon J, Lai Y, Takacs SM, Bradshaw HB, Hohmann AG. Alterations in endocannabinoid tone following chemotherapy-induced peripheral neuropathy: Effects of endocannabinoid deactivation inhibitors targeting fatty-acid amide hydrolase and monoacylglycerol lipase in comparison to reference analgesics following cisplatin treatment. Pharmacol Res 2012 11/02;67(1096-1186; 1043-6618; 1):94-109.
- Reference 58
-
Eisenberg E, Ogintz M, Almog S. The pharmacokinetics, efficacy, safety, and ease of use of a novel portable metered-dose cannabis inhaler in patients with chronic neuropathic pain: A phase 1a study. J Pain Palliat Care Pharmacother 2014 Sep;28(3):216-25.
- Reference 59
-
Ware MA, Wang T, Shapiro S, Robinson A, Ducruet T, Huynh T, Gamsa A, Bennett GJ, Collet JP. Smoked cannabis for chronic neuropathic pain: A randomized controlled trial. CMAJ 2010 08/30;182(1488-2329; 0820-3946; 14):E694-701.
- Reference 60
-
Gaffuri AL, Ladarre D, Lenkei Z. Type-1 cannabinoid receptor signaling in neuronal development. Pharmacology 2012;90(1-2):19-39.
- Reference 61
-
Zhou Y, Falenta K, Lalli G. Endocannabinoid signalling in neuronal migration. Int J Biochem Cell Biol 2014 Feb;47:104-8.
- Reference 62
-
Tortoriello G, Morris CV, Alpar A, Fuzik J, Shirran SL, Calvigioni D, Keimpema E, Botting CH, Reinecke K, Herdegen T, et al. Miswiring the brain: Delta9-tetrahydrocannabinol disrupts cortical development by inducing an SCG10/stathmin-2 degradation pathway. EMBO J 2014 Apr 1;33(7):668-85.
- Reference 63
-
Cherif H, Argaw A, Cecyre B, Bouchard A, Gagnon J, Javadi P, Desgent S, Mackie K, Bouchard JF. Role of GPR55 during axon growth and target innervation. ENeuro 2015 Nov 9;2(5):10.1523/ENEURO.0011,15.2015. eCollection 2015 Sep-Oct.
- Reference 64
-
Russo EB, Hohmann AG. Role of cannabinoids in pain management. In: T. R. Deer, M. S. Leong, editors. Comprehensive treatment of chronic pain by medical, interventional, and behavioral approaches: The AMERICAN ACADEMY OF PAIN MEDICINE textbook on patient management. New York: Springer; 2012. ID: 2927; RP: NOT IN FILE.
- Reference 65
-
Guzman M. Cannabinoids: Potential anticancer agents. Nat Rev Cancer 2003 10;3(1474-175; 1474-175; 10):745-55.
- Reference 66
-
Di Marzo V, Bifulco M, De Petrocellis L. The endocannabinoid system and its therapeutic exploitation. Nat Rev Drug Discov 2004 09;3(1474-1776; 1474-1776; 9):771-84.
- Reference 67
-
Bazzaz FA, Dusek D, Seigler DS, Haney AW. Photosynthesis and cannabinoid content of temperate and tropical populations of cannabis sativa.. Biochem Syst Ecol 1975;3(1):15-8.
- Reference 68
-
Radwan MM, ElSohly MA, El-Alfy AT, Ahmed SA, Slade D, Husni AS, Manly SP, Wilson L, Seale S, Cutler SJ, et al. Isolation and pharmacological evaluation of minor cannabinoids from high-potency cannabis sativa. J Nat Prod 2015 Jun 26;78(6):1271-6.
- Reference 69
-
Elsohly MA, Gul W. Constituents of cannabis sativa. In: R. G. Pertwee, editor. Handbook of cannabis. Oxford University Press; 2014..
- Reference 70
-
Elsohly MA, Slade D. Chemical constituents of marijuana: The complex mixture of natural cannabinoids. Life Sci 2005 12/22;78(0024-3205; 0024-3205; 5):539-48.
- Reference 71
-
Hanus L, Meyer S, Munoz E, Taglialatela-Scafati O, Appendino G. Phytocannabinoids: A unified inventory. Nat Prod Rep 2016;33(12):1357-92.
- Reference 72
-
Zhu HJ, Wang JS, Markowitz JS, Donovan JL, Gibson BB, Gefroh HA, Devane CL. Characterization of P-glycoprotein inhibition by major cannabinoids from marijuana. J Pharmacol Exp Ther 2006 05;317(0022-3565; 0022-3565; 2):850-7.
- Reference 73
-
Balducci C, Nervegna G, Cecinato A. Evaluation of principal cannabinoids in airborne particulates. Anal Chim Acta 2009 05/08;641(1873-4324; 0003-2670; 1-2):89-94.
- Reference 74
-
Yamaori S, Kushihara M, Yamamoto I, Watanabe K. Characterization of major phytocannabinoids, cannabidiol and cannabinol, as isoform-selective and potent inhibitors of human CYP1 enzymes. Biochem Pharmacol 2010 06/01;79(1873-2968; 0006-2952; 11):1691-8.
- Reference 75
-
Hillig KW, Mahlberg PG. A chemotaxonomic analysis of cannabinoid variation in cannabis (cannabaceae). Am J Bot 2004 06;91(0002-9122; 0002-9122; 6):966-75.
- Reference 76
-
Mehmedic Z, Chandra S, Slade D, Denham H, Foster S, Patel AS, Ross SA, Khan IA, Elsohly MA. Potency trends of delta(9)-THC and other cannabinoids in confiscated cannabis preparations from 1993 to 2008*. J Forensic Sci 2010 05/04;55(1556-4029; 0022-1198; 5):1209-17.
- Reference 77
-
Whittle BA, Guy GW. Development of cannabis-based medicines: Risk, benefit and serendipity. In: G. W. Guy, B. A. Whittle, P. J. Robson, editors. The medicinal uses of cannabis and cannabinoids. London: Pharmaceutical Press; 2004. ID: 2582; RP: NOT IN FILE.
- Reference 78
-
Huestis MA. Human cannabinoid pharmacokinetics. Chem.Biodivers. 2007 08;4(1612-1880; 1612-1872; 8):1770-804.
- Reference 79
-
Dussy FE, Hamberg C, Luginbuhl M, Schwerzmann T, Briellmann TA. Isolation of Delta9-THCA-A from hemp and analytical aspects concerning the determination of Delta9-THC in cannabis products. Forensic Sci Int 2005 04/20;149(0379-0738; 0379-0738; 1):3-10.
- Reference 80
-
Ashton CH. Pharmacology and effects of cannabis: A brief review. Br J Psychiatry 2001 02;178(0007-1250; 0007-1250):101-6.
- Reference 81
-
Fischedick J, Van der Kooy F, Verpoorte R. Cannabinoid receptor 1 binding activity and quantitative analysis of cannabis sativa L. smoke and vapor. Chem Pharm Bull 2010 02;58(1347-5223; 0009-2363; 2):201-7.
- Reference 82
-
Maertens RM, White PA, Rickert W, Levasseur G, Douglas GR, Bellier PV, McNamee JP, Thuppal V, Walker M, Desjardins S. The genotoxicity of mainstream and sidestream marijuana and tobacco smoke condensates. Chem Res Toxicol 2009 08;22(1520-5010; 0893-228; 8):1406-14.
- Reference 83
-
International Agency for Research on Cancer. IARC monographs on the evaluation of carcinogenic risks to humans: Tobacco smoke and involuntary smoking. 2004(83):81-3.
- Reference 84
-
Moir D, Rickert WS, Levasseur G, Larose Y, Maertens R, White P, Desjardins S. A comparison of mainstream and sidestream marijuana and tobacco cigarette smoke produced under two smoking conditions. Chem Res Toxicol 2008;21:494-502.
- Reference 85
-
Russo EB, McPartland JM. Cannabis is more than simply delta(9)-tetrahydrocannabinol. Psychopharmacology (Berl) 2003 02;165(0033-3158; 0033-3158; 4):431-2.
- Reference 86
-
Russo EB. Taming THC: Potential cannabis synergy and phytocannabinoid-terpenoid entourage effects. Br J Pharmacol 2011 08;163(1476-5381; 0007-1188; 7):1344-64.
- Reference 87
-
Baker PB, Taylor BJ, Gough TA. The tetrahydrocannabinol and tetrahydrocannabinolic acid content of cannabis products. J Pharm Pharmacol 1981 06;33(0022-3573; 6):369-72.
- Reference 88
-
Decarboxylation of tetrahydrocannabinolic acid (THCA) to active THC [Internet]; c2016. Available from: http://eiha.org/media/2014/08/16-10-25-Decarboxylation-of-THCA-to-active-THC.pdf.
- Reference 89
-
Taschwer M, Schmid MG. Determination of the relative percentage distribution of THCA and delta(9)-THC in herbal cannabis seized in austria - impact of different storage temperatures on stability. Forensic Sci Int 2015 Sep;254:167-71.
- Reference 90
-
Wang M, Wang YH, Avula B, Radwan MM, Wanas AS, van Antwerp J, Parcher JF, ElSohly MA, Khan IA. Decarboxylation study of acidic cannabinoids: A novel approach using ultra-high-performance supercritical fluid Chromatography/Photodiode array-mass spectrometry. Cannabis Cannabinoid Res 2016 Dec 1;1(1):262-71.
- Reference 91
-
Fairbairn JW, Liebmann JA, Rowan MG. The stability of cannabis and its preparations on storage. J Pharm Pharmacol 1976;28(1):1-7.
- Reference 92
-
Garrett ER, Hunt CA. Physiochemical properties, solubility, and protein binding of delta9-tetrahydrocannabinol. J Pharm Sci 1974 07;63(0022-3549; 7):1056-64.
- Reference 93
-
Thomas BF, Parker VL, Caddell LW, Jones LV, Sabharwal SK, McDaniel AI, Keimowitz AR, Scheffler NM, Hart ED, Mitchell JM, et al. Composition and stability of a standard marihuana cigarette. In: C. G. Nahas, K. M. Sutin, D. J. Harvey, S. Agurell, editors. Marihuana and medicine. Totowa, New Jersey: Humana Press; 1999. ID: 2354; RP: NOT IN FILE.
- Reference 94
-
Turner CE, Hadley KW, Fetterman PS, Doorenbos NJ, Quimby MW, Waller C. Constituents of cannabis sativa L. IV. stability of cannabinoids in stored plant material. J Pharm Sci 1973 Oct;62(10):1601-5.
- Reference 95
-
Sevigny EL. Is today's marijuana more potent simply because it's fresher? Drug Test Anal 2013 Jan;5(1):62-7.
- Reference 96
-
Govaerts SJ, Hermans E, Lambert DM. Comparison of cannabinoid ligands affinities and efficacies in murine tissues and in transfected cells expressing human recombinant cannabinoid receptors. Eur J Pharm Sci 2004 11;23(0928-0987; 0928-0987; 3):233-43.
- Reference 97
-
Pertwee RG. Receptors and channels targeted by synthetic cannabinoid receptor agonists and antagonists. Curr Med Chem 2010;17(1875-533; 0929-8673; 14):1360-81.
- Reference 98
-
Hajos N, Ledent C, Freund TF. Novel cannabinoid-sensitive receptor mediates inhibition of glutamatergic synaptic transmission in the hippocampus. Neuroscience 2001;106(0306-4522; 0306-4522; 1):1-4.
- Reference 99
-
Darmani NA, Janoyan JJ, Crim J, Ramirez J. Receptor mechanism and antiemetic activity of structurally-diverse cannabinoids against radiation-induced emesis in the least shrew. Eur J Pharmacol 2007 06/01;563(0014-2999; 0014-2999; 1-3):187-96.
- Reference 100
-
Abrahamov A, Abrahamov A, Mechoulam R. An efficient new cannabinoid antiemetic in pediatric oncology. Life Sci 1995;56(0024-3205; 0024-3205; 23-24):2097-102.
- Reference 101
-
Izzo AA, Borrelli F, Capasso R, Di M,V, Mechoulam R. Non-psychotropic plant cannabinoids: New therapeutic opportunities from an ancient herb. Trends Pharmacol Sci 2009 10;30(1873-3735; 0165-6147; 10):515-27.
- Reference 102
-
Institute of Medicine. Cannabinoids and animal physiology. In: J. E. Joy, S. J. Watson, J. A. Benson, editors. Marijuana and medicine: Assessing the science base. Washington, DC: National Academy Press; 1999. ID: 2355; RP: NOT IN FILE.
- Reference 103
-
Musty RE. Natural cannabinoids: Interactions and effects. In: G. W. Guy, B. A. Whittle, P. J. Robson, editors. The medicinal uses of cannabis and cannabinoids. London: Pharmaceutical Press; 2004. ID: 2679; RP: NOT IN FILE.
- Reference 104
-
Ruhaak LR, Felth J, Karlsson PC, Rafter JJ, Verpoorte R, Bohlin L. Evaluation of the cyclooxygenase inhibiting effects of six major cannabinoids isolated from cannabis sativa. Biol Pharm Bull 2011;34(1347-5215; 0918-6158; 5):774-8.
- Reference 105
-
Cascio MG, Gauson LA, Stevenson LA, Ross RA, Pertwee RG. Evidence that the plant cannabinoid cannabigerol is a highly potent alpha2-adrenoceptor agonist and moderately potent 5HT1A receptor antagonist. Br J Pharmacol 2010 01;159(1476-5381; 0007-1188; 1):129-41.
- Reference 106
-
Laprairie RB, Bagher AM, Kelly ME, Denovan-Wright EM. Cannabidiol is a negative allosteric modulator of the cannabinoid CB1 receptor. Br J Pharmacol 2015 Oct;172(20):4790-805.
- Reference 107
-
Brown AJ. Novel cannabinoid receptors. Br J Pharmacol 2007 11;152(0007-1188; 0007-1188; 5):567-75.
- Reference 108
-
McPartland JM, Duncan M, Di Marzo V, Pertwee RG. Are cannabidiol and delta(9) -tetrahydrocannabivarin negative modulators of the endocannabinoid system? A systematic review. Br J Pharmacol 2015 Feb;172(3):737-53.
- Reference 109
-
Thomas A, Stevenson LA, Wease KN, Price MR, Baillie G, Ross RA, Pertwee RG. Evidence that the plant cannabinoid Delta9-tetrahydrocannabivarin is a cannabinoid CB1 and CB2 receptor antagonist. Br J Pharmacol 2005 12;146(0007-1188; 0007-1188; 7):917-26.
- Reference 110
-
Bolognini D, Costa B, Maione S, Comelli F, Marini P, Di M,V, Parolaro D, Ross RA, Gauson LA, Cascio MG, et al. The plant cannabinoid Delta9-tetrahydrocannabivarin can decrease signs of inflammation and inflammatory pain in mice. Br J Pharmacol 2010 06;160(1476-5381; 0007-1188; 3):677-87.
- Reference 111
-
Riedel G, Fadda P, McKillop-Smith S, Pertwee RG, Platt B, Robinson L. Synthetic and plant-derived cannabinoid receptor antagonists show hypophagic properties in fasted and non-fasted mice. Br J Pharmacol 2009 04;156(1476-5381; 0007-1188; 7):1154-66.
- Reference 112
-
Pertwee RG. Pharmacological actions of cannabinoids. Handb Exp Pharmacol 2005(0171-2004; 0171-2004; 168):1-51.
- Reference 113
-
Jones G, Pertwee RG. A metabolic interaction in vivo between cannabidiol and 1 -tetrahydrocannabinol. Br J Pharmacol 1972 06;45(0007-1188; 0007-1188; 2):375-7.
- Reference 114
-
Karniol IG, Shirakawa I, Kasinski N, Pfeferman A, Carlini EA. Cannabidiol interferes with the effects of delta 9 - tetrahydrocannabinol in man. Eur J Pharmacol 1974 09;28(0014-2999; 0014-2999; 1):172-7.
- Reference 115
-
Zuardi AW, Finkelfarb E, Bueno OF, Musty RE, Karniol IG. Characteristics of the stimulus produced by the mixture of cannabidiol with delta 9-tetrahydrocannabinol. Arch Int Pharmacodyn Ther 1981 01;249(0003-9780; 0003-9780; 1):137-46.
- Reference 116
-
Zuardi AW, Shirakawa I, Finkelfarb E, Karniol IG. Action of cannabidiol on the anxiety and other effects produced by delta 9-THC in normal subjects. Psychopharmacology (Berl) 1982;76(0033-3158; 0033-3158; 3):245-50.
- Reference 117
-
Zuardi AW, Karniol IG. Effects on variable-interval performance in rats of delta 9-tetrahydrocannabinol and cannabidiol, separately and in combination. Braz J Med Biol Res 1983 07;16(0100-879; 0100-879; 2):141-6.
- Reference 118
-
Reid MJ, Bornheim LM. Cannabinoid-induced alterations in brain disposition of drugs of abuse. Biochem Pharmacol 2001 06/01;61(0006-2952; 0006-2952; 11):1357-67.
- Reference 119
-
Fadda P, Robinson L, Fratta W, Pertwee RG, Riedel G. Differential effects of THC- or CBD-rich cannabis extracts on working memory in rats. Neuropharmacology 2004 12;47(0028-3908; 0028-3908; 8):1170-9.
- Reference 120
-
Ilan AB, Gevins A, Coleman M, Elsohly MA, de WH. Neurophysiological and subjective profile of marijuana with varying concentrations of cannabinoids. Behav Pharmacol 2005 09;16(0955-8810; 0955-8810; 5-6):487-96.
- Reference 121
-
Nadulski T, Pragst F, Weinberg G, Roser P, Schnelle M, Fronk EM, Stadelmann AM. Randomized, double-blind, placebo-controlled study about the effects of cannabidiol (CBD) on the pharmacokinetics of Delta9-tetrahydrocannabinol (THC) after oral application of THC versus standardized cannabis extract. Ther Drug Monit 2005 12;27(0163-4356; 0163-4356; 6):799-810.
- Reference 122
-
Varvel SA, Wiley JL, Yang R, Bridgen DT, Long K, Lichtman AH, Martin BR. Interactions between THC and cannabidiol in mouse models of cannabinoid activity. Psychopharmacology (Berl) 2006 06;186(0033-3158; 0033-3158; 2):226-34.
- Reference 123
-
Fusar-Poli P, Crippa JA, Bhattacharyya S, Borgwardt SJ, Allen P, Martin-Santos R, Seal M, Surguladze SA, O'Carrol C, Atakan Z, et al. Distinct effects of {delta}9-tetrahydrocannabinol and cannabidiol on neural activation during emotional processing. Arch Gen Psychiatry 2009 01;66(1538-3636; 0003-990; 1):95-105.
- Reference 124
-
Bhattacharyya S, Morrison PD, Fusar-Poli P, Martin-Santos R, Borgwardt S, Winton-Brown T, Nosarti C, O' Carroll CM, Seal M, Allen P, et al. Opposite effects of delta-9-tetrahydrocannabinol and cannabidiol on human brain function and psychopathology. Neuropsychopharmacology 2010 02;35(1740-634; 0006-3223; 3):764-74.
- Reference 125
-
Winton-Brown TT, Allen P, Bhattacharyya S, Borgwardt SJ, Fusar-Poli P, Crippa JA, Seal ML, Martin-Santos R, Ffytche D, Zuardi AW, et al. Modulation of auditory and visual processing by delta-9-tetrahydrocannabinol and cannabidiol: An FMRI study. Neuropsychopharmacology 2011 06;36(1740-634; 0006-3223; 7):1340-8.
- Reference 126
-
Karschner EL, Darwin WD, McMahon RP, Liu F, Wright S, Goodwin RS, Huestis MA. Subjective and physiological effects after controlled sativex and oral THC administration. Clin Pharmacol Ther 2011 03;89(1532-6535; 0009-9236; 3):400-7.
- Reference 127
-
Karschner EL, Darwin WD, Goodwin RS, Wright S, Huestis MA. Plasma cannabinoid pharmacokinetics following controlled oral delta9-tetrahydrocannabinol and oromucosal cannabis extract administration. Clin Chem 2011 01;57(1530-8561; 0009-9147; 1):66-75.
- Reference 128
-
Zuardi AW, Hallak JE, Crippa JA. Interaction between cannabidiol (CBD) and (9)-tetrahydrocannabinol (THC): Influence of administration interval and dose ratio between the cannabinoids. Psychopharmacology (Berl) 2012 01;219(1432-2072; 0033-3158; 1):247-9.
- Reference 129
-
Klein C, Karanges E, Spiro A, Wong A, Spencer J, Huynh T, Gunasekaran N, Karl T, Long LE, Huang XF, et al. Cannabidiol potentiates delta(9)-tetrahydrocannabinol (THC) behavioural effects and alters THC pharmacokinetics during acute and chronic treatment in adolescent rats. Psychopharmacology (Berl) 2011 11;218(1432-2072; 0033-3158; 2):443-57.
- Reference 130
-
Wachtel SR, Elsohly MA, Ross SA, Ambre J, de WH. Comparison of the subjective effects of delta(9)-tetrahydrocannabinol and marijuana in humans. Psychopharmacology (Berl) 2002 06;161(0033-3158; 0033-3158; 4):331-9.
- Reference 131
-
Johnson JR, Burnell-Nugent M, Lossignol D, Ganae-Motan ED, Potts R, Fallon MT. Multicenter, double-blind, randomized, placebo-controlled, parallel-group study of the efficacy, safety, and tolerability of THC:CBD extract and THC extract in patients with intractable cancer-related pain. J Pain Symptom Manage 2010 02;39(1873-6513; 0885-3924; 2):167-79.
- Reference 132
-
Schubart CD, Sommer IE, van Gastel WA, Goetgebuer RL, Kahn RS, Boks MP. Cannabis with high cannabidiol content is associated with fewer psychotic experiences. Schizophr Res 2011 05/16;130(1573-2509; 1-3):216-21.
- Reference 133
-
Brunt TM, van Genugten M, Honer-Snoeken K, van de Velde MJ, Niesink RJ. Therapeutic satisfaction and subjective effects of different strains of pharmaceutical-grade cannabis. J Clin Psychopharmacol 2014 Jun;34(3):344-9.
- Reference 134
-
Wright MJ,Jr, Vandewater SA, Taffe MA. Cannabidiol attenuates deficits of visuospatial associative memory induced by delta(9) tetrahydrocannabinol. Br J Pharmacol 2013 Dec;170(7):1365-73.
- Reference 135
-
Jacobs DS, Kohut SJ, Jiang S, Nikas SP, Makriyannis A, Bergman J. Acute and chronic effects of cannabidiol on delta(9)-tetrahydrocannabinol (delta(9)-THC)-induced disruption in stop signal task performance. Exp Clin Psychopharmacol 2016 Oct;24(5):320-30.
- Reference 136
-
Institute of Medicine. First, do no harm: Consequences of marijuana use and abuse. In: J. E. Joy, S. J. Watson, J. A. Benson, editors. Marijuana and medicine: Assessing the science base. Washington, DC: National Academy Press; 1999. ID: 2387; RP: NOT IN FILE.
- Reference 137
-
Zuurman L, Ippel AE, Moin E, van Gerven JM. Biomarkers for the effects of cannabis and THC in healthy volunteers. Br J Clin Pharmacol 2009 01;67(1365-2125; 0306-5251; 1):5-21.
- Reference 138
-
Beaconsfield P, Ginsburg J, Rainsbury R. Marihuana smoking. cardiovascular effects in man and possible mechanisms. N Engl J Med 1972 08/03;287(0028-4793; 5):209-12.
- Reference 139
-
Perez-Reyes M. Marijuana smoking: Factors that influence the bioavailability of tetrahydrocannabinol. NIDA Res Monogr 1990;99(1046-9516):42-62.
- Reference 140
-
Aryana A, Williams MA. Marijuana as a trigger of cardiovascular events: Speculation or scientific certainty? Int J Cardiol 2007 05/31;118(1874-1754; 0167-5273; 2):141-4.
- Reference 141
-
Hall W, Solowij N. Adverse effects of cannabis. Lancet 1998 11/14;352(0140-6736; 9140):1611-6.
- Reference 142
-
Ameri A. The effects of cannabinoids on the brain. Prog Neurobiol 1999 07;58(0301-0082; 4):315-48.
- Reference 143
-
Hollister LE. Health aspects of cannabis: Revisited. Int J Neuropsychopharmacol 1998 07;1(1461-1457; 1):71-80.
- Reference 144
-
Miller LL. Marihuana: Acute effects on human memory. In: C. G. Nahas, K. M. Sutin, D. J. Harvey, S. Agurell, editors. Marihuana and medicine. Totowa, New Jersey: Humana Press; 1999. ID: 2358; RP: NOT IN FILE.
- Reference 145
-
Hart CL, Ilan AB, Gevins A, Gunderson EW, Role K, Colley J, Foltin RW. Neurophysiological and cognitive effects of smoked marijuana in frequent users. Pharmacol Biochem Behav 2010 09;96(1873-5177; 0091-3057; 3):333-41.
- Reference 146
-
Crean RD, Crane NA, Mason BJ. An evidence based review of acute and long-term effects of cannabis use on executive cognitive functions. J.Addict.Med. 2011 03/01;5(1935-3227; 1932-0620; 1):1-8.
- Reference 147
-
Heishman SJ, Huestis MA, Henningfield JE, Cone EJ. Acute and residual effects of marijuana: Profiles of plasma THC levels, physiological, subjective, and performance measures. Pharmacol Biochem Behav 1990 11;37(0091-3057; 3):561-5.
- Reference 148
-
Curran HV, Brignell C, Fletcher S, Middleton P, Henry J. Cognitive and subjective dose-response effects of acute oral delta 9-tetrahydrocannabinol (THC) in infrequent cannabis users. Psychopharmacology (Berl) 2002 10;164(0033-3158; 0033-3158; 1):61-70.
- Reference 149
-
Ramaekers JG, Moeller MR, van RP, Theunissen EL, Schneider E, Kauert G. Cognition and motor control as a function of Delta9-THC concentration in serum and oral fluid: Limits of impairment. Drug Alcohol Depend 2006 11/08;85(0376-8716; 0376-8716; 2):114-22.
- Reference 150
-
O'Kane CJ, Tutt DC, Bauer LA. Cannabis and driving: A new perspective. Emerg.Med.(Fremantle.) 2002 09;14(1035-6851; 3):296-303.
- Reference 151
-
Hansteen RW, Miller RD, Lonero L, Reid LD, Jones B. Effects of cannabis and alcohol on automobile driving and psychomotor tracking. Ann N Y Acad Sci 1976;282(0077-8923):240-56.
- Reference 152
-
Leirer VO, Yesavage JA, Morrow DG. Marijuana carry-over effects on aircraft pilot performance. Aviat Space Environ Med 1991 03;62(0095-6562; 3):221-7.
- Reference 153
-
Smiley A. Marijuana: On-road and driving-simulator studies. In: H. Kalant, W. Corrigall, W. Hall, R. Smart, editors. The health effects of cannabis. Toronto, Canada: Centre of Addiction and Mental Health; 1999. ID: 2359; RP: NOT IN FILE.
- Reference 154
-
Kumar RN, Chambers WA, Pertwee RG. Pharmacological actions and therapeutic uses of cannabis and cannabinoids. Anaesthesia 2001 11;56(0003-2409; 0003-2409; 11):1059-68.
- Reference 155
-
British Medical Association. Therapeutic uses of cannabis. Amsterdam: Harwood Academic Publishers; 1997. ID: 2345; RP: NOT IN FILE.
- Reference 156
-
Hill MN, Froese LM, Morrish AC, Sun JC, Floresco SB. Alterations in behavioral flexibility by cannabinoid CB1 receptor agonists and antagonists. Psychopharmacology (Berl) 2006 08;187(0033-3158; 0033-3158; 2):245-59.
- Reference 157
-
Curran HV, Freeman TP, Mokrysz C, Lewis DA, Morgan CJ, Parsons LH. Keep off the grass? cannabis, cognition and addiction. Nat Rev Neurosci 2016 May;17(5):293-306.
- Reference 158
-
Schoeler T, Kambeitz J, Behlke I, Murray R, Bhattacharyya S. The effects of cannabis on memory function in users with and without a psychotic disorder: Findings from a combined meta-analysis. Psychol Med 2016 Jan;46(1):177-88.
- Reference 159
-
Schoeler T, Monk A, Sami MB, Klamerus E, Foglia E, Brown R, Camuri G, Altamura AC, Murray R, Bhattacharyya S. Continued versus discontinued cannabis use in patients with psychosis: A systematic review and meta-analysis. Lancet Psychiatry 2016 Mar;3(3):215-25.
- Reference 160
-
Schoeler T, Petros N, Di Forti M, Klamerus E, Foglia E, Ajnakina O, Gayer-Anderson C, Colizzi M, Quattrone D, Behlke I, et al. Effects of continuation, frequency, and type of cannabis use on relapse in the first 2 years after onset of psychosis: An observational study. Lancet Psychiatry 2016 Aug 23.
- Reference 161
-
Schoeler T, Petros N, Di Forti M, Pingault JB, Klamerus E, Foglia E, Small A, Murray R, Bhattacharyya S. Association between continued cannabis use and risk of relapse in first-episode psychosis: A quasi-experimental investigation within an observational study. JAMA Psychiatry 2016 Sep 28.
- Reference 162
-
Morena M, Patel S, Bains JS, Hill MN. Neurobiological interactions between stress and the endocannabinoid system. Neuropsychopharmacology 2016 Jan;41(1):80-102.
- Reference 163
-
Shalit N, Shoval G, Shlosberg D, Feingold D, Lev-Ran S. The association between cannabis use and suicidality among men and women: A population-based longitudinal study. J Affect Disord 2016 Nov 15;205:216-24.
- Reference 164
-
Borges G, Bagge CL, Orozco R. A literature review and meta-analyses of cannabis use and suicidality. J Affect Disord 2016 May;195:63-74.
- Reference 165
-
Aspis I, Feingold D, Weiser M, Rehm J, Shoval G, Lev-Ran S. Cannabis use and mental health-related quality of life among individuals with depressive disorders. Psychiatry Res 2015 Dec 15;230(2):341-9.
- Reference 166
-
Blessing EM, Steenkamp MM, Manzanares J, Marmar CR. Cannabidiol as a potential treatment for anxiety disorders. Neurotherapeutics 2015 Oct;12(4):825-36.
- Reference 167
-
Deshpande A, Mailis-Gagnon A, Zoheiry N, Lakha SF. Efficacy and adverse effects of medical marijuana for chronic noncancer pain: Systematic review of randomized controlled trials. Can Fam Physician 2015 Aug;61(8):e372-81.
- Reference 168
-
Di Forti M, Marconi A, Carra E, Fraietta S, Trotta A, Bonomo M, Bianconi F, Gardner-Sood P, O'Connor J, Russo M, et al. Proportion of patients in south london with first-episode psychosis attributable to use of high potency cannabis: A case-control study. Lancet Psychiatry 2015 Mar;2(3):233-8.
- Reference 169
-
Hancock-Allen JB, Barker L, VanDyke M, Holmes DB. Notes from the field: Death following ingestion of an edible marijuana product--colorado, march 2014. MMWR Morb Mortal Wkly Rep 2015 Jul 24;64(28):771-2.
- Reference 170
-
Hudak M, Severn D, Nordstrom K. Edible cannabis-induced psychosis: Intoxication and beyond. Am J Psychiatry 2015 Sep 1;172(9):911-2.
- Reference 171
-
Lynch ME, Ware MA. Cannabinoids for the treatment of chronic non-cancer pain: An updated systematic review of randomized controlled trials. J Neuroimmune Pharmacol 2015 Jun;10(2):293-301.
- Reference 172
-
Rubino T, Zamberletti E, Parolaro D. Endocannabinoids and mental disorders. Handb Exp Pharmacol 2015;231:261-83.
- Reference 173
-
Delforterie MJ, Lynskey MT, Huizink AC, Creemers HE, Grant JD, Few LR, Glowinski AL, Statham DJ, Trull TJ, Bucholz KK, et al. The relationship between cannabis involvement and suicidal thoughts and behaviors. Drug Alcohol Depend 2015 May 1;150:98-104.
- Reference 174
-
Whiting PF, Wolff RF, Deshpande S, Di Nisio M, Duffy S, Hernandez AV, Keurentjes JC, Lang S, Misso K, Ryder S, et al. Cannabinoids for medical use: A systematic review and meta-analysis. JAMA 2015 Jun 23-30;313(24):2456-73.
- Reference 175
-
Ahmed AI, van den Elsen GA, Colbers A, van der Marck MA, Burger DM, Feuth TB, Rikkert MG, Kramers C. Safety and pharmacokinetics of oral delta-9-tetrahydrocannabinol in healthy older subjects: A randomized controlled trial. Eur Neuropsychopharmacol 2014 Sep;24(9):1475-82.
- Reference 176
-
Desrosiers NA, Himes SK, Scheidweiler KB, Concheiro-Guisan M, Gorelick DA, Huestis MA. Phase I and II cannabinoid disposition in blood and plasma of occasional and frequent smokers following controlled smoked cannabis. Clin Chem 2014 Apr;60(4):631-43.
- Reference 177
-
Volkow ND, Baler RD, Compton WM, Weiss SR. Adverse health effects of marijuana use. N Engl J Med 2014 Jun 5;370(23):2219-27.
- Reference 178
-
Wilkinson ST, Radhakrishnan R, D'Souza DC. Impact of cannabis use on the development of psychotic disorders. Curr Addict Rep 2014 Jun 1;1(2):115-28.
- Reference 179
-
Fiz J, Duran M, Capella D, Carbonell J, Farre M. Cannabis use in patients with fibromyalgia: Effect on symptoms relief and health-related quality of life. PLoS.One. 2011;6(1932-6203; 1932-6203; 4):e18440.
- Reference 180
-
Lal S, Prasad N, Ryan M, Tangri S, Silverberg MS, Gordon A, Steinhart H. Cannabis use amongst patients with inflammatory bowel disease. Eur J Gastroenterol Hepatol 2011 10;23(1473-5687; 0954-691; 10):891-6.
- Reference 181
-
De Hert M, Wampers M, Jendricko T, Franic T, Vidovic D, De Vriendt N, Sweers K, Peuskens J, van WR. Effects of cannabis use on age at onset in schizophrenia and bipolar disorder. Schizophr Res 2011 03;126(1573-2509; 1-3):270-6.
- Reference 182
-
Korver N, Nieman DH, Becker HE, van de Fliert JR, Dingemans PH, de HL, Spiering M, Schmitz N, Linszen DH. Symptomatology and neuropsychological functioning in cannabis using subjects at ultra-high risk for developing psychosis and healthy controls. Aust N Z J Psychiatry 2010 03;44(1440-1614; 0004-8674; 3):230-6.
- Reference 183
-
Henquet C, van OJ, Kuepper R, Delespaul P, Smits M, Campo JA, Myin-Germeys I. Psychosis reactivity to cannabis use in daily life: An experience sampling study. Br J Psychiatry 2010 06;196(1472-1465; 0007-1250; 6):447-53.
- Reference 184
-
Moreira FA, Grieb M, Lutz B. Central side-effects of therapies based on CB1 cannabinoid receptor agonists and antagonists: Focus on anxiety and depression. Best.Pract.Res.Clin.Endocrinol.Metab 2009 02;23(1532-1908; 1521-690; 1):133-44.
- Reference 185
-
Vandrey R, Haney M. Pharmacotherapy for cannabis dependence: How close are we? CNS.Drugs 2009;23(1172-7047; 1172-7047; 7):543-53.
- Reference 186
-
Crippa JA, Zuardi AW, Martin-Santos R, Bhattacharyya S, Atakan Z, McGuire P, Fusar-Poli P. Cannabis and anxiety: A critical review of the evidence. Hum.Psychopharmacol. 2009 10;24(1099-1077; 0885-6222; 7):515-23.
- Reference 187
-
Ongur D, Lin L, Cohen BM. Clinical characteristics influencing age at onset in psychotic disorders. Compr Psychiatry 2009 01;50(1532-8384; 0010-440; 1):13-9.
- Reference 188
-
van Rossum I, Boomsma M, Tenback D, Reed C, van Os J. Does cannabis use affect treatment outcome in bipolar disorder? A longitudinal analysis. J Nerv Ment Dis 2009 01;197(1539-736; 0022-3018; 1):35-40.
- Reference 189
-
Zammit S, Moore TH, Lingford-Hughes A, Barnes TR, Jones PB, Burke M, Lewis G. Effects of cannabis use on outcomes of psychotic disorders: Systematic review. Br J Psychiatry 2008 11;193(1472-1465; 0007-1250; 5):357-63.
- Reference 190
-
Abrams DI, Jay CA, Shade SB, Vizoso H, Reda H, Press S, Kelly ME, Rowbotham MC, Petersen KL. Cannabis in painful HIV-associated sensory neuropathy: A randomized placebo-controlled trial. Neurology 2007 02/13;68(1526-632; 7):515-21.
- Reference 191
-
Moore TH, Zammit S, Lingford-Hughes A, Barnes TR, Jones PB, Burke M, Lewis G. Cannabis use and risk of psychotic or affective mental health outcomes: A systematic review. Lancet 2007 07/28;370(1474-547; 9584):319-28.
- Reference 192
-
Boyce A, McArdle P. Long-term effects of cannabis. Pediatrics and Child Health 2007;18(1):37-41.
- Reference 193
-
Henquet C, Krabbendam L, Spauwen J, Kaplan C, Lieb R, Wittchen HU, van OJ. Prospective cohort study of cannabis use, predisposition for psychosis, and psychotic symptoms in young people. BMJ 2005 01/01;330(1468-5833; 7481):11-5.
- Reference 194
-
D'Souza DC, Abi-Saab WM, Madonick S, Forselius-Bielen K, Doersch A, Braley G, Gueorguieva R, Cooper TB, Krystal JH. Delta-9-tetrahydrocannabinol effects in schizophrenia: Implications for cognition, psychosis, and addiction. Biol Psychiatry 2005 03/15;57(0006-3223; 0006-3223; 6):594-608.
- Reference 195
-
Favrat B, Menetrey A, Augsburger M, Rothuizen LE, Appenzeller M, Buclin T, Pin M, Mangin P, Giroud C. Two cases of "cannabis acute psychosis" following the administration of oral cannabis. BMC Psychiatry 2005;5(1471-244; 1471-244):17-22.
- Reference 196
-
D'Souza DC, Perry E, MacDougall L, Ammerman Y, Cooper T, Wu YT, Braley G, Gueorguieva R, Krystal JH. The psychotomimetic effects of intravenous delta-9-tetrahydrocannabinol in healthy individuals: Implications for psychosis. Neuropsychopharmacology 2004 08;29(0893-133; 0006-3223; 8):1558-72.
- Reference 197
-
van Os J, Bak M, Hanssen M, Bijl RV, de Graaf R, Verdoux H. Cannabis use and psychosis: A longitudinal population-based study. Am J Epidemiol 2002 08/15;156(0002-9262; 4):319-27.
- Reference 198
-
Andreasson S, Allebeck P, Engstrom A, Rydberg U. Cannabis and schizophrenia. A longitudinal study of swedish conscripts. Lancet 1987 Dec 26;2(8574):1483-6.
- Reference 199
-
Desrosiers NA, Ramaekers JG, Chauchard E, Gorelick DA, Huestis MA. Smoked cannabis' psychomotor and neurocognitive effects in occasional and frequent smokers. J Anal Toxicol 2015 May;39(4):251-61.
- Reference 200
-
Hall W. What has research over the past two decades revealed about the adverse health effects of recreational cannabis use? Addiction 2015 Jan;110(1):19-35.
- Reference 201
-
Hartman RL, Brown TL, Milavetz G, Spurgin A, Gorelick DA, Gaffney G, Huestis MA. Controlled cannabis vaporizer administration: Blood and plasma cannabinoids with and without alcohol. Clin Chem 2015 Jun;61(6):850-69.
- Reference 202
-
Hunault CC, Mensinga TT, Bocker KB, Schipper CM, Kruidenier M, Leenders ME, De V,I, Meulenbelt J. Cognitive and psychomotor effects in males after smoking a combination of tobacco and cannabis containing up to 69 mg delta-9-tetrahydrocannabinol (THC). Psychopharmacology (Berl) 2009 05;204(1432-2072; 0033-3158; 1):85-94.
- Reference 203
-
Corcoran CM, Kimhy D, Stanford A, Khan S, Walsh J, Thompson J, Schobel S, Harkavy-Friedman J, Goetz R, Colibazzi T, et al. Temporal association of cannabis use with symptoms in individuals at clinical high risk for psychosis. Schizophr Res 2008 12;106(0920-9964; 2-3):286-93.
- Reference 204
-
Schierenbeck T, Riemann D, Berger M, Hornyak M. Effect of illicit recreational drugs upon sleep: Cocaine, ecstasy and marijuana. Sleep Med.Rev. 2008 10;12(1087-0792; 1087-0792; 5):381-9.
- Reference 205
-
Tramer MR, Carroll D, Campbell FA, Reynolds DJ, Moore RA, McQuay HJ. Cannabinoids for control of chemotherapy induced nausea and vomiting: Quantitative systematic review. BMJ 2001 07/07;323(0959-8138; 7303):16-21.
- Reference 206
-
Harder S, Rietbrock S. Concentration-effect relationship of delta-9-tetrahydrocannabiol and prediction of psychotropic effects after smoking marijuana. Int J Clin Pharmacol Ther 1997 04;35(0946-1965; 4):155-9.
- Reference 207
-
Henderson-Redmond AN, Guindon J, Morgan DJ. Roles for the endocannabinoid system in ethanol-motivated behavior. Prog Neuropsychopharmacol Biol Psychiatry 2016 Feb 4;65:330-9.
- Reference 208
-
Tzadok M, Uliel-Siboni S, Linder I, Kramer U, Epstein O, Menascu S, Nissenkorn A, Yosef OB, Hyman E, Granot D, et al. CBD-enriched medical cannabis for intractable pediatric epilepsy: The current israeli experience. Seizure 2016 Feb;35:41-4.
- Reference 209
-
Degenhardt L, Lintzeris N, Campbell G, Bruno R, Cohen M, Farrell M, Hall WD. Experience of adjunctive cannabis use for chronic non-cancer pain: Findings from the pain and opioids IN treatment (POINT) study. Drug Alcohol Depend 2015 Feb 1;147:144-50.
- Reference 210
-
Hussain SA, Zhou R, Jacobson C, Weng J, Cheng E, Lay J, Hung P, Lerner JT, Sankar R. Perceived efficacy of cannabidiol-enriched cannabis extracts for treatment of pediatric epilepsy: A potential role for infantile spasms and lennox-gastaut syndrome. Epilepsy Behav 2015 Jun;47:138-41.
- Reference 211
-
Ware MA, Wang T, Shapiro S, Collet JP, COMPASS study team. Cannabis for the management of pain: Assessment of safety study (COMPASS). J Pain 2015 Dec;16(12):1233-42.
- Reference 212
-
Gloss D, Vickrey B. Cannabinoids for epilepsy. Cochrane Database Syst Rev 2014 Mar 5;3:CD009270.
- Reference 213
-
Lynch ME, Campbell F. Cannabinoids for treatment of chronic non-cancer pain; a systematic review of randomized trials. Br J Clin Pharmacol 2011 03/23;72(1365-2125; 0306-5251; 5):735-44.
- Reference 214
-
Bramness JG, Khiabani HZ, Morland J. Impairment due to cannabis and ethanol: Clinical signs and additive effects. Addiction 2010 06;105(1360-0443; 0965-2140; 6):1080-7.
- Reference 215
-
Ronen A, Chassidim HS, Gershon P, Parmet Y, Rabinovich A, Bar-Hamburger R, Cassuto Y, Shinar D. The effect of alcohol, THC and their combination on perceived effects, willingness to drive and performance of driving and non-driving tasks. Accid Anal Prev 2010 11;42(1879-2057; 0001-4575; 6):1855-65.
- Reference 216
-
Sewell RA, Poling J, Sofuoglu M. The effect of cannabis compared with alcohol on driving. Am J Addict 2009 05;18(1521-0391; 1055-0496; 3):185-93.
- Reference 217
-
Wilsey B, Marcotte T, Tsodikov A, Millman J, Bentley H, Gouaux B, Fishman S. A randomized, placebo-controlled, crossover trial of cannabis cigarettes in neuropathic pain. J.Pain 2008 06;9(1526-5900; 1526-5900; 6):506-21.
- Reference 218
-
Haney M, Gunderson EW, Rabkin J, Hart CL, Vosburg SK, Comer SD, Foltin RW. Dronabinol and marijuana in HIV-positive marijuana smokers. caloric intake, mood, and sleep. J Acquir Immune Defic Syndr 2007 08/15;45(1525-4135; 1525-4135; 5):545-54.
- Reference 219
-
Haney M, Rabkin J, Gunderson E, Foltin RW. Dronabinol and marijuana in HIV(+) marijuana smokers: Acute effects on caloric intake and mood. Psychopharmacology (Berl) 2005 08;181(0033-3158; 1):170-8.
- Reference 220
-
Clark AJ, Ware MA, Yazer E, Murray TJ, Lynch ME. Patterns of cannabis use among patients with multiple sclerosis. Neurology 2004 06/08;62(1526-632; 11):2098-100.
- Reference 221
-
Page SA, Verhoef MJ, Stebbins RA, Metz LM, Levy JC. Cannabis use as described by people with multiple sclerosis. Can J Neurol Sci 2003 08;30(0317-1671; 0317-1671; 3):201-5.
- Reference 222
-
Abbott Products Inc. Marinol product monograph. 2010.
- Reference 223
-
Broyd SJ, van Hell HH, Beale C, Yucel M, Solowij N. Acute and chronic effects of cannabinoids on human cognition-A systematic review. Biol Psychiatry 2016 Apr 1;79(7):557-67.
- Reference 224
-
Hartman RL, Brown TL, Milavetz G, Spurgin A, Pierce RS, Gorelick DA, Gaffney G, Huestis MA. Cannabis effects on driving lateral control with and without alcohol. Drug Alcohol Depend 2015 Sep 1;154:25-37.
- Reference 225
-
Karschner EL, Swortwood MJ, Hirvonen J, Goodwin RS, Bosker WM, Ramaekers JG, Huestis MA. Extended plasma cannabinoid excretion in chronic frequent cannabis smokers during sustained abstinence and correlation with psychomotor performance. Drug Test Anal 2015 Jun 11.
- Reference 226
-
Asbridge M, Hayden JA, Cartwright JL. Acute cannabis consumption and motor vehicle collision risk: Systematic review of observational studies and meta-analysis. BMJ 2012;344(1756-1833; 0959-535):e536.
- Reference 227
-
Downey LA, King R, Papafotiou K, Swann P, Ogden E, Boorman M, Stough C. The effects of cannabis and alcohol on simulated driving: Influences of dose and experience. Accid Anal Prev 2012 08/04;50(1879-2057; 0001-4575):879-86.
- Reference 228
-
Elvik R. Risk of road accident associated with the use of drugs: A systematic review and meta-analysis of evidence from epidemiological studies (in press). Accid Anal Prev 2012 07/09(1879-2057; 0001-4575).
- Reference 229
-
Honarmand K, Tierney MC, O'Connor P, Feinstein A. Effects of cannabis on cognitive function in patients with multiple sclerosis. Neurology 2011 03/29;76(1526-632; 0028-3878; 13):1153-60.
- Reference 230
-
Ilan AB, Smith ME, Gevins A. Effects of marijuana on neurophysiological signals of working and episodic memory. Psychopharmacology (Berl) 2004 11;176(0033-3158; 0033-3158; 2):214-22.
- Reference 231
-
Solowij N, Stephens RS, Roffman RA, Babor T, Kadden R, Miller M, Christiansen K, McRee B, Vendetti J. Cognitive functioning of long-term heavy cannabis users seeking treatment. JAMA 2002 03/06;287(0098-7484; 9):1123-31.
- Reference 232
-
Geffrey AL, Pollack SF, Bruno PL, Thiele EA. Drug-drug interaction between clobazam and cannabidiol in children with refractory epilepsy. Epilepsia 2015 Aug;56(8):1246-51.
- Reference 233
-
Waissengrin B, Urban D, Leshem Y, Garty M, Wolf I. Patterns of use of medical cannabis among israeli cancer patients: A single institution experience. J Pain Symptom Manage 2015 Feb;49(2):223-30.
- Reference 234
-
Neavyn MJ, Blohm E, Babu KM, Bird SB. Medical marijuana and driving: A review. J Med Toxicol 2014 Sep;10(3):269-79.
- Reference 235
-
Weinstein A, Brickner O, Lerman H, Greemland M, Bloch M, Lester H, Chisin R, Mechoulam R, Bar-Hamburger R, Freedman N, et al. Brain imaging study of the acute effects of Delta9-tetrahydrocannabinol (THC) on attention and motor coordination in regular users of marijuana. Psychopharmacology (Berl) 2008 Jan;196(1):119-31.
- Reference 236
-
Williamson EM, Evans FJ. Cannabinoids in clinical practice. Drugs 2000 12;60(0012-6667; 0012-6667; 6):1303-14.
- Reference 237
-
Lopez-Sendon Moreno JL, Garcia Caldentey J, Trigo Cubillo P, Ruiz Romero C, Garcia Ribas G, Alonso Arias MA, Garcia de Yebenes MJ, Tolon RM, Galve-Roperh I, Sagredo O, et al. A double-blind, randomized, cross-over, placebo-controlled, pilot trial with sativex in huntington's disease. J Neurol 2016 Jul;263(7):1390-400.
- Reference 238
-
Lotan I, Treves TA, Roditi Y, Djaldetti R. Cannabis (medical marijuana) treatment for motor and non-motor symptoms of parkinson disease: An open-label observational study. Clin Neuropharmacol 2014 Mar-Apr;37(2):41-4.
- Reference 239
-
Chagas MH, Zuardi AW, Tumas V, Pena-Pereira MA, Sobreira ET, Bergamaschi MM, dos Santos AC, Teixeira AL, Hallak JE, Crippa JA. Effects of cannabidiol in the treatment of patients with parkinson's disease: An exploratory double-blind trial. J Psychopharmacol 2014 Nov;28(11):1088-98.
- Reference 240
-
Zadikoff C, Wadia PM, Miyasaki J, Chen R, Lang AE, Fox SH. Cannabinoid, CB1 agonists in cervical dystonia: Failure in a phase IIa randomized controlled trial. Basal Ganglia 2011;1:91.
- Reference 241
-
Curtis A, Mitchell I, Patel S, Ives N, Rickards H. A pilot study using nabilone for symptomatic treatment in huntington's disease. Mov Disord 2009 11/15;24(1531-8257; 0885-3185; 15):2254-9.
- Reference 242
-
Curtis A, Clarke CE, Rickards HE. Cannabinoids for tourette's syndrome. Cochrane Database Syst Rev 2009(1469-493; 1361-6137; 4):CD006565.
- Reference 243
-
Deutsch SI, Rosse RB, Connor JM, Burket JA, Murphy ME, Fox FJ. Current status of cannabis treatment of multiple sclerosis with an illustrative case presentation of a patient with MS, complex vocal tics, paroxysmal dystonia, and marijuana dependence treated with dronabinol. CNS Spectr 2008 May;13(5):393-403.
- Reference 244
-
Uribe Roca MC, Micheli F, Viotti R. Cannabis sativa and dystonia secondary to wilson's disease. Mov Disord 2005 01;20(0885-3185; 0885-3185; 1):113-5.
- Reference 245
-
Carroll CB, Bain PG, Teare L, Liu X, Joint C, Wroath C, Parkin SG, Fox P, Wright D, Hobart J, et al. Cannabis for dyskinesia in parkinson disease: A randomized double-blind crossover study. Neurology 2004 10/12;63(1526-632; 7):1245-50.
- Reference 246
-
Jabusch HC, Schneider U, Altenmuller E. Delta9-tetrahydrocannabinol improves motor control in a patient with musician's dystonia. Mov Disord 2004 08;19(0885-3185; 0885-3185; 8):990-1.
- Reference 247
-
Mesnage V, Houeto JL, Bonnet AM, Clavier I, Arnulf I, Cattelin F, Le Fur G, Damier P, Welter ML, Agid Y. Neurokinin B, neurotensin, and cannabinoid receptor antagonists and parkinson disease. Clin Neuropharmacol 2004 May-Jun;27(3):108-10.
- Reference 248
-
Muller-Vahl KR, Schneider U, Prevedel H, Theloe K, Kolbe H, Daldrup T, Emrich HM. Delta 9-tetrahydrocannabinol (THC) is effective in the treatment of tics in tourette syndrome: A 6-week randomized trial. J Clin Psychiatry 2003 04;64(0160-6689; 4):459-65.
- Reference 249
-
Fox SH, Kellett M, Moore AP, Crossman AR, Brotchie JM. Randomised, double-blind, placebo-controlled trial to assess the potential of cannabinoid receptor stimulation in the treatment of dystonia. Mov Disord 2002 01;17(0885-3185; 1):145-9.
- Reference 250
-
Sieradzan KA, Fox SH, Hill M, Dick JP, Crossman AR, Brotchie JM. Cannabinoids reduce levodopa-induced dyskinesia in parkinson's disease: A pilot study. Neurology 2001 12/11;57(0028-3878; 11):2108-11.
- Reference 251
-
Muller-Vahl KR, Koblenz A, Jobges M, Kolbe H, Emrich HM, Schneider U. Influence of treatment of tourette syndrome with delta9-tetrahydrocannabinol (delta9-THC) on neuropsychological performance. Pharmacopsychiatry 2001 01;34(0176-3679; 1):19-24.
- Reference 252
-
Muller-Vahl KR, Schneider U, Emrich HM. Nabilone increases choreatic movements in huntington's disease. Mov Disord 1999 11;14(0885-3185; 0885-3185; 6):1038-40.
- Reference 253
-
Hemming M, Yellowlees PM. Effective treatment of tourette's syndrome with marijuana. Journal of Psychopharmacology 1993;7(4):389-91.
- Reference 254
-
Consroe P, Laguna J, Allender J, Snider S, Stern L, Sandyk R, Kennedy K, Schram K. Controlled clinical trial of cannabidiol in huntington's disease. Pharmacol Biochem Behav 1991 11;40(0091-3057; 3):701-8.
- Reference 255
-
Frankel JP, Hughes A, Lees AJ, Stern GM. Marijuana for parkinsonian tremor. J Neurol Neurosurg Psychiatr 1990 05;53(0022-3050; 5):436.
- Reference 256
-
Sandyk R, Awerbuch G. Marijuana and tourette's syndrome. J Clin Psychopharmacol 1988 12;8(0271-0749; 6):444-5.
- Reference 257
-
Consroe P, Sandyk R, Snider SR. Open label evaluation of cannabidiol in dystonic movement disorders. Int J Neurosci 1986 11;30(0020-7454; 4):277-82.
- Reference 258
-
Devinsky O, Marsh E, Friedman D, Thiele E, Laux L, Sullivan J, Miller I, Flamini R, Wilfong A, Filloux F, et al. Cannabidiol in patients with treatment-resistant epilepsy: An open-label interventional trial. Lancet Neurol 2016 Mar;15(3):270-8.
- Reference 259
-
dos Santos RG, Hallak JE, Leite JP, Zuardi AW, Crippa JA. Phytocannabinoids and epilepsy. J Clin Pharm Ther 2015 Apr;40(2):135-43.
- Reference 260
-
Porter BE, Jacobson C. Report of a parent survey of cannabidiol-enriched cannabis use in pediatric treatment-resistant epilepsy. Epilepsy Behav 2013 Dec;29(3):574-7.
- Reference 261
-
Soltesz I, Alger BE, Kano M, Lee SH, Lovinger DM, Ohno-Shosaku T, Watanabe M. Weeding out bad waves: Towards selective cannabinoid circuit control in epilepsy. Nat Rev Neurosci 2015 May;16(5):264-77.
- Reference 262
-
Devinsky O, Cilio MR, Cross H, Fernandez-Ruiz J, French J, Hill C, Katz R, Di Marzo V, Jutras-Aswad D, Notcutt WG, et al. Cannabidiol: Pharmacology and potential therapeutic role in epilepsy and other neuropsychiatric disorders. Epilepsia 2014 Jun;55(6):791-802.
- Reference 263
-
Kraft B, Frickey NA, Kaufmann RM, Reif M, Frey R, Gustorff B, Kress HG. Lack of analgesia by oral standardized cannabis extract on acute inflammatory pain and hyperalgesia in volunteers. Anesthesiology 2008 07;109(1528-1175; 0003-3022; 1):101-10.
- Reference 264
-
Wallace M, Schulteis G, Atkinson JH, Wolfson T, Lazzaretto D, Bentley H, Gouaux B, Abramson I. Dose-dependent effects of smoked cannabis on capsaicin-induced pain and hyperalgesia in healthy volunteers. Anesthesiology 2007 11;107(0003-3022; 0003-3022; 5):785-96.
- Reference 265
-
Beaulieu P. Effects of nabilone, a synthetic cannabinoid, on postoperative pain. Can J Anaesth 2006 08;53(0832-610; 8):769-75.
- Reference 266
-
Holdcroft A, Maze M, Dore C, Tebbs S, Thompson S. A multicenter dose-escalation study of the analgesic and adverse effects of an oral cannabis extract (cannador) for postoperative pain management. Anesthesiology 2006 05;104(0003-3022; 5):1040-6.
- Reference 267
-
Buggy DJ, Toogood L, Maric S, Sharpe P, Lambert DG, Rowbotham DJ. Lack of analgesic efficacy of oral delta-9-tetrahydrocannabinol in postoperative pain. Pain 2003 11;106(0304-3959; 1-2):169-72.
- Reference 268
-
Naef M, Curatolo M, Petersen-Felix S, Arendt-Nielsen L, Zbinden A, Brenneisen R. The analgesic effect of oral delta-9-tetrahydrocannabinol (THC), morphine, and a THC-morphine combination in healthy subjects under experimental pain conditions. Pain 2003 09;105(0304-3959; 1-2):79-88.
- Reference 269
-
Greenwald MK, Stitzer ML. Antinociceptive, subjective and behavioral effects of smoked marijuana in humans. Drug Alcohol Depend 2000 06/01;59(0376-8716; 3):261-75.
- Reference 270
-
Jain AK, Ryan JR, McMahon FG, Smith G. Evaluation of intramuscular levonantradol and placebo in acute postoperative pain. J Clin Pharmacol 1981 08;21(0091-2700; 8-9):320S-6S.
- Reference 271
-
Beaulieu P, Boulanger A, Desroches J, Clark AJ. Medical cannabis: Considerations for the anesthesiologist and pain physician. Can J Anaesth 2016 May;63(5):608-24.
- Reference 272
-
Wilsey B, Marcotte TD, Deutsch R, Zhao H, Prasad H, Phan A. An exploratory human laboratory experiment evaluating vaporized cannabis in the treatment of neuropathic pain from spinal cord injury and disease. J Pain 2016 Sep;17(9):982-1000.
- Reference 273
-
Hill KP. Medical marijuana for treatment of chronic pain and other medical and psychiatric problems: A clinical review. JAMA 2015 Jun 23-30;313(24):2474-83.
- Reference 274
-
Corey-Bloom J, Wolfson T, Gamst A, Jin S, Marcotte TD, Bentley H, Gouaux B. Smoked cannabis for spasticity in multiple sclerosis: A randomized, placebo-controlled trial. CMAJ 2012 07/10;184(1488-2329; 0820-3946; 10):1143-50.
- Reference 275
-
Lahat A, Lang A, Ben-Horin S. Impact of cannabis treatment on the quality of life, weight and clinical disease activity in inflammatory bowel disease patients: A pilot prospective study. Digestion 2012;85(1421-9867; 0012-2823; 1):1-8.
- Reference 276
-
Abrams DI, Couey P, Shade SB, Kelly ME, Benowitz NL. Cannabinoid-opioid interaction in chronic pain. Clin Pharmacol Ther 2011 12;90(1532-6535; 0009-9236; 6):844-51.
- Reference 277
-
Ellis RJ, Toperoff W, Vaida F, van den Brande G, Gonzales J, Gouaux B, Bentley H, Atkinson JH. Smoked medicinal cannabis for neuropathic pain in HIV: A randomized, crossover clinical trial. Neuropsychopharmacology 2009 02;34(1740-634; 0006-3223; 3):672-80.
- Reference 278
-
Lynch ME, Cesar-Rittenberg P, Hohmann AG. A double-blind, placebo-controlled, crossover pilot trial with extension using an oral mucosal cannabinoid extract for treatment of chemotherapy-induced neuropathic pain. J Pain Symptom Manage 2014 Jan;47(1):166-73.
- Reference 279
-
Johnson JR, Lossignol D, Burnell-Nugent M, Fallon MT. An open-label extension study to investigate the long-term safety and tolerability of THC/CBD oromucosal spray and oromucosal THC spray in patients with terminal cancer-related pain refractory to strong opioid analgesics. J Pain Symptom Manage 2012 11/07(1873-6513; 0885-3924).
- Reference 280
-
Portenoy RK, Ganae-Motan ED, Allende S, Yanagihara R, Shaiova L, Weinstein S, McQuade R, Wright S, Fallon MT. Nabiximols for opioid-treated cancer patients with poorly-controlled chronic pain: A randomized, placebo-controlled, graded-dose trial. J.Pain 2012 05;13(1528-8447; 1526-5900; 5):438-49.
- Reference 281
-
Noyes R,Jr., Brunk SF, Avery DA, Canter AC. The analgesic properties of delta-9-tetrahydrocannabinol and codeine. Clin Pharmacol Ther 1975 07;18(0009-9236; 1):84-9.
- Reference 282
-
Lynch ME, Young J, Clark AJ. A case series of patients using medicinal marihuana for management of chronic pain under the canadian marihuana medical access regulations. J Pain Symptom Manage 2006 11;32(0885-3924; 0885-3924; 5):497-501.
- Reference 283
-
Narang S, Gibson D, Wasan AD, Ross EL, Michna E, Nedeljkovic SS, Jamison RN. Efficacy of dronabinol as an adjuvant treatment for chronic pain patients on opioid therapy. J.Pain 2008 03;9(1526-5900; 1526-5900; 3):254-64.
- Reference 284
-
Maida V, Ennis M, Irani S, Corbo M, Dolzhykov M. Adjunctive nabilone in cancer pain and symptom management: A prospective observational study using propensity scoring. J Support Oncol 2008 Mar;6(3):119-24.
- Reference 285
-
Rhyne DN, Anderson SL, Gedde M, Borgelt LM. Effects of medical marijuana on migraine headache frequency in an adult population. Pharmacotherapy 2016 Jan 9.
- Reference 286
-
Leroux E, Taifas I, Valade D, Donnet A, Chagnon M, Ducros A. Use of cannabis among 139 cluster headache sufferers. Cephalalgia 2012 11/29;33(1468-2982; 0333-1024; 3):208-13.
- Reference 287
-
Robbins MS, Tarshish S, Solomon S, Grosberg BM. Cluster attacks responsive to recreational cannabis and dronabinol. Headache 2009 06;49(1526-4610; 0017-8748; 6):914-6.
- Reference 288
-
Ducros A, Boukobza M, Porcher R, Sarov M, Valade D, Bousser MG. The clinical and radiological spectrum of reversible cerebral vasoconstriction syndrome. A prospective series of 67 patients. Brain 2007 12;130(1460-2156; 0006-8950):3091-101.
- Reference 289
-
Evans RW, Ramadan NM. Are cannabis-based chemicals helpful in headache? Headache 2004 07;44(0017-8748; 0017-8748; 7):726-7.
- Reference 290
-
Sticht MA, Limebeer CL, Rafla BR, Abdullah RA, Poklis JL, Ho W, Niphakis MJ, Cravatt BF, Sharkey KA, Lichtman AH, et al. Endocannabinoid regulation of nausea is mediated by 2-arachidonoylglycerol (2-AG) in the rat visceral insular cortex. Neuropharmacology 2016 Mar;102:92-102.
- Reference 291
-
Parker LA, Rock EM, Sticht MA, Wills KL, Limebeer CL. Cannabinoids suppress acute and anticipatory nausea in preclinical rat models of conditioned gaping. Clin Pharmacol Ther 2015 Feb 17.
- Reference 292
-
Parker LA, Rock E, Limebeer C. Regulation of nausea and vomiting by cannabinoids. Br J Pharmacol 2010 12/22;163(1476-5381; 0007-1188; 7):1411-22.
- Reference 293
-
Musty R, Rossi R. Effects of smoked cannabis and oral delta-9-tetrahydrocannabinol on nausea and emesis after cancer chemotherapy: A review of state clinical trials. J Cannabis Therapeutics 2001;1(1):29-42.
- Reference 294
-
Soderpalm AH, Schuster A, de WH. Antiemetic efficacy of smoked marijuana: Subjective and behavioral effects on nausea induced by syrup of ipecac. Pharmacol Biochem Behav 2001 07;69(0091-3057; 0091-3057; 3-4):343-50.
- Reference 295
-
Bedi G, Foltin RW, Gunderson EW, Rabkin J, Hart CL, Comer SD, Vosburg SK, Haney M. Efficacy and tolerability of high-dose dronabinol maintenance in HIV-positive marijuana smokers: A controlled laboratory study. Psychopharmacology (Berl) 2010 12;212(1432-2072; 0033-3158; 4):675-86.
- Reference 296
-
Sannarangappa V, Tan C. Cannabinoid hyperemesis. Intern Med J 2009 11;39(1445-5994; 1444-0903; 11):777-8.
- Reference 297
-
Donnino MW, Cocchi MN, Miller J, Fisher J. Cannabinoid hyperemesis: A case series. J Emerg Med 2011 04;40(0736-4679; 0736-4679; 4):e63-6.
- Reference 298
-
Sullivan S. Cannabinoid hyperemesis. Can J Gastroenterol 2010 05;24(0835-7900; 0835-7900; 5):284-5.
- Reference 299
-
Miller JB, Walsh M, Patel PA, Rogan M, Arnold C, Maloney M, Donnino M. Pediatric cannabinoid hyperemesis: Two cases. Pediatr Emerg Care 2010 12;26(1535-1815; 0749-5161; 12):919-20.
- Reference 300
-
Patterson DA, Smith E, Monahan M, Medvecz A, Hagerty B, Krijger L, Chauhan A, Walsh M. Cannabinoid hyperemesis and compulsive bathing: A case series and paradoxical pathophysiological explanation. J.Am.Board Fam.Med. 2010 11;23(1557-2625; 1557-2625; 6):790-3.
- Reference 301
-
Choung RS, Locke GR,III, Lee RM, Schleck CD, Zinsmeister AR, Talley NJ. Cyclic vomiting syndrome and functional vomiting in adults: Association with cannabinoid use in males. Neurogastroenterol Motil 2012 01;24(1365-2982; 1350-1925; 1):20,6, e1.
- Reference 302
-
Francis H. Emerging role of chronic cannabis usage and hyperemesis syndrome. South Med J 2011 09;104(1541-8243; 0038-4348; 9):665.
- Reference 303
-
Schmid SM, Lapaire O, Huang DJ, Jurgens FE, Guth U. Cannabinoid hyperemesis syndrome: An underreported entity causing nausea and vomiting of pregnancy. Arch Gynecol Obstet 2011 11;284(1432-0711; 0932-0067; 5):1095-7.
- Reference 304
-
Wallace EA, Andrews SE, Garmany CL, Jelley MJ. Cannabinoid hyperemesis syndrome: Literature review and proposed diagnosis and treatment algorithm. South Med J 2011 09;104(1541-8243; 0038-4348; 9):659-64.
- Reference 305
-
Simonetto DA, Oxentenko AS, Herman ML, Szostek JH. Cannabinoid hyperemesis: A case series of 98 patients. Mayo Clin Proc 2012 02;87(1942-5546; 0025-6196; 2):114-9.
- Reference 306
-
Wild K, Wilson H. Cannabinoid hyperemesis. Emerg Med J 2012 01;29(1472-0213; 1472-0205; 1):67-9.
- Reference 307
-
Pisanti S, Malfitano AM, Grimaldi C, Santoro A, Gazzerro P, Laezza C, Bifulco M. Use of cannabinoid receptor agonists in cancer therapy as palliative and curative agents. Best.Pract.Res.Clin.Endocrinol.Metab 2009 02;23(1532-1908; 1521-690; 1):117-31.
- Reference 308
-
Sutton IR, Daeninck P. Cannabinoids in the management of intractable chemotherapy-induced nausea and vomiting and cancer-related pain. J.Support.Oncol. 2006 11;4(1544-6794; 1544-6794; 10):531-5.
- Reference 309
-
Mattes RD, Engelman K, Shaw LM, Elsohly MA. Cannabinoids and appetite stimulation. Pharmacol Biochem Behav 1994 09;49(0091-3057; 1):187-95.
- Reference 310
-
Foltin RW, Fischman MW, Byrne MF. Effects of smoked marijuana on food intake and body weight of humans living in a residential laboratory. Appetite 1988 08;11(0195-6663; 1):1-14.
- Reference 311
-
Reuter SE, Martin JH. Pharmacokinetics of cannabis in cancer cachexia-anorexia syndrome. Clin Pharmacokinet 2016 Feb 16.
- Reference 312
-
Strasser F, Luftner D, Possinger K, Ernst G, Ruhstaller T, Meissner W, Ko YD, Schnelle M, Reif M, Cerny T. Comparison of orally administered cannabis extract and delta-9-tetrahydrocannabinol in treating patients with cancer-related anorexia-cachexia syndrome: A multicenter, phase III, randomized, double-blind, placebo-controlled clinical trial from the cannabis-in-cachexia-study-group. J Clin Oncol 2006 07/20;24(1527-7755; 21):3394-400.
- Reference 313
-
Jatoi A, Windschitl HE, Loprinzi CL, Sloan JA, Dakhil SR, Mailliard JA, Pundaleeka S, Kardinal CG, Fitch TR, Krook JE, et al. Dronabinol versus megestrol acetate versus combination therapy for cancer-associated anorexia: A north central cancer treatment group study. J Clin Oncol 2002 01/15;20(0732-183; 2):567-73.
- Reference 314
-
Nelson K, Walsh D, Deeter P, Sheehan F. A phase II study of delta-9-tetrahydrocannabinol for appetite stimulation in cancer-associated anorexia. J Palliat Care 1994;10(0825-8597; 1):14-8.
- Reference 315
-
Plasse TF, Gorter RW, Krasnow SH, Lane M, Shepard KV, Wadleigh RG. Recent clinical experience with dronabinol. Pharmacol Biochem Behav 1991 11;40(0091-3057; 3):695-700.
- Reference 316
-
Sallan SE, Cronin C, Zelen M, Zinberg NE. Antiemetics in patients receiving chemotherapy for cancer: A randomized comparison of delta-9-tetrahydrocannabinol and prochlorperazine. N Engl J Med 1980 01/17;302(0028-4793; 3):135-8.
- Reference 317
-
Ekert H, Waters KD, Jurk IH, Mobilia J, Loughnan P. Amelioration of cancer chemotherapy-induced nausea and vomiting by delta-9-tetrahydrocannabinol. Med J Aust 1979 12/15;2(0025-729; 12):657-9.
- Reference 318
-
Regelson W, Butler JR, Schulz J. Delta-9-tetrahydrocannabinol as an effective antidepressant and appetite-stimulating agent in advanced cancer patients. In: M. Braude, S. Szara, editors. The pharmacology of marihuana: A monograph of the national institute on drug abuse. New York: Raven Press; 1976. ID: 2375; RP: NOT IN FILE.
- Reference 319
-
Andries A, Frystyk J, Flyvbjerg A, Stoving RK. Dronabinol in severe, enduring anorexia nervosa: A randomized controlled trial. Int J Eat Disord 2014 Jan;47(1):18-23.
- Reference 320
-
Gross H, Ebert MH, Faden VB, Goldberg SC, Kaye WH, Caine ED, Hawks R, Zinberg N. A double-blind trial of delta 9-tetrahydrocannabinol in primary anorexia nervosa. J Clin Psychopharmacol 1983 06;3(0271-0749; 3):165-71.
- Reference 321
-
Gorelick DA, Goodwin RS, Schwilke E, Schwope DM, Darwin WD, Kelly DL, McMahon RP, Liu F, Ortemann-Renon C, Bonnet D, et al. Tolerance to effects of high-dose oral delta9-tetrahydrocannabinol and plasma cannabinoid concentrations in male daily cannabis smokers. J Anal Toxicol 2013 Jan-Feb;37(1):11-6.
- Reference 322
-
Serpell MG, Notcutt W, Collin C. Sativex long-term use: An open-label trial in patients with spasticity due to multiple sclerosis. J Neurol 2012 08/10;260(1432-1459; 0340-5354; 1):285-95.
- Reference 323
-
D'Souza DC, Ranganathan M, Braley G, Gueorguieva R, Zimolo Z, Cooper T, Perry E, Krystal J. Blunted psychotomimetic and amnestic effects of delta-9-tetrahydrocannabinol in frequent users of cannabis. Neuropsychopharmacology 2008 09;33(1740-634; 0006-3223; 10):2505-16.
- Reference 324
-
Rog DJ, Nurmikko TJ, Young CA. Oromucosal delta9-tetrahydrocannabinol/cannabidiol for neuropathic pain associated with multiple sclerosis: An uncontrolled, open-label, 2-year extension trial. Clin Ther 2007 09;29(0149-2918; 0149-2918; 9):2068-79.
- Reference 325
-
Gonzalez S, Cebeira M, Fernandez-Ruiz J. Cannabinoid tolerance and dependence: A review of studies in laboratory animals. Pharmacol Biochem Behav 2005 06;81(0091-3057; 0091-3057; 2):300-18.
- Reference 326
-
Lichtman AH, Martin BR. Cannabinoid tolerance and dependence. Handb Exp Pharmacol 2005(0171-2004; 0171-2004; 168):691-717.
- Reference 327
-
De Vry J, Jentzsch KR, Kuhl E, Eckel G. Behavioral effects of cannabinoids show differential sensitivity to cannabinoid receptor blockade and tolerance development. Behav Pharmacol 2004 02;15(0955-8810; 0955-8810; 1):1-12.
- Reference 328
-
Pertwee R. Tolerance to and dependence on psychotropic cannabinoids. In: J. Pratt, editor. The biological bases of drug tolerance and dependence. London: Academic Press; 1991. ID: 2395; RP: NOT IN FILE.
- Reference 329
-
Compton DR, Dewey WL, Martin BR. Cannabis dependence and tolerance production. Adv Alcohol Subst Abuse 1990;9(0270-3106; 1-2):129-47.
- Reference 330
-
Jones RT, Benowitz N, Bachman J. Clinical studies of cannabis tolerance and dependence. Ann N Y Acad Sci 1976;282(0077-8923):221-39.
- Reference 331
-
D'Souza DC, Cortes-Briones JA, Ranganathan M, Thurnauer H, Creatura G, Surti T, Planeta B, Neumeister A, Pittman B, Normandin M, et al. Rapid changes in CB1 receptor availability in cannabis dependent males after abstinence from cannabis. Biol Psychiatry Cogn Neurosci Neuroimaging 2016 Jan 1;1(1):60-7.
- Reference 332
-
Cooper ZD, Haney M. Cannabis reinforcement and dependence: Role of the cannabinoid CB1 receptor. Addict Biol 2008 06;13(1369-1600; 1355-6215; 2):188-95.
- Reference 333
-
Hall W, Solowij N. The adverse health and psychological consequences of cannabis dependence. In: R. A. Roffman, R. S. Stephens, editors. Cannabis dependence. Cambridge: Cambridge University Press; 2006. ID: 2645; RP: NOT IN FILE.
- Reference 334
-
Kalant H. Adverse effects of cannabis on health: An update of the literature since 1996. Prog Neuropsychopharmacol Biol Psychiatry 2004 08;28(0278-5846; 0278-5846; 5):849-63.
- Reference 335
-
Hasin DS, Kerridge BT, Saha TD, Huang B, Pickering R, Smith SM, Jung J, Zhang H, Grant BF. Prevalence and correlates of DSM-5 cannabis use disorder, 2012-2013: Findings from the national epidemiologic survey on alcohol and related conditions-III. Am J Psychiatry 2016 Jun 1;173(6):588-99.
- Reference 336
-
Trigo JM, Lagzdins D, Rehm J, Selby P, Gamaleddin I, Fischer B, Barnes AJ, Huestis MA, Le Foll B. Effects of fixed or self-titrated dosages of sativex on cannabis withdrawal and cravings. Drug Alcohol Depend 2016 Apr 1;161:298-306.
- Reference 337
-
Garcia AN, Salloum IM. Polysomnographic sleep disturbances in nicotine, caffeine, alcohol, cocaine, opioid, and cannabis use: A focused review. Am J Addict 2015 Oct;24(7):590-8.
- Reference 338
-
Prud'homme M, Cata R, Jutras-Aswad D. Cannabidiol as an intervention for addictive behaviors: A systematic review of the evidence. Subst Abuse 2015 May 21;9:33-8.
- Reference 339
-
Allsop DJ, Norberg MM, Copeland J, Fu S, Budney AJ. The cannabis withdrawal scale development: Patterns and predictors of cannabis withdrawal and distress. Drug Alcohol Depend 2011 12/01;119(1879-0046; 0376-8716; 1-2):123-9.
- Reference 340
-
Renault PF, Schuster CR, Heinrich R, Freeman DX. Marihuana: Standardized smoke administration and dose effect curves on heart rate in humans. Science 1971 11/05;174(0036-8075; 0036-8075; 4009):589-91.
- Reference 341
-
Clark SC, Greene C, Karr GW, MacCannell KL, Milstein SL. Cardiovascular effects of marihuana in man. Can J Physiol Pharmacol 1974 06;52(0008-4212; 0008-4212; 3):706-19.
- Reference 342
-
O'Leary DS, Block RI, Koeppel JA, Flaum M, Schultz SK, Andreasen NC, Ponto LB, Watkins GL, Hurtig RR, Hichwa RD. Effects of smoking marijuana on brain perfusion and cognition. Neuropsychopharmacology 2002 06;26(0893-133; 0006-3223; 6):802-16.
- Reference 343
-
Trouve R, Nahas G. Cardiovascular effects of marihuana and cannabinoids. In: C. G. Nahas, K. M. Sutin, D. J. Harvey, S. Agurell, editors. Marihuana and medicine. Totowa, New Jersey: Humana Press; 1999. ID: 2389; RP: NOT IN FILE.
- Reference 344
-
Jones RT. Cardiovascular system effects of marijuana. J Clin Pharmacol 2002 11;42(0091-2700; 11):58S-63S.
- Reference 345
-
Hollister LE. Health aspects of cannabis. Pharmacol Rev 1986 03;38(0031-6997; 1):1-20.
- Reference 346
-
Miller RH, Dhingra RC, Kanakis C,Jr., Leon F, Rosen KM. The electrophysiological effects of delta-9-tetrahydrocannabinol (cannabis) on cardiac conduction in man. Am Heart J 1977 12;94(0002-8703; 0002-8703; 6):740-7.
- Reference 347
-
Lindsay AC, Foale RA, Warren O, Henry JA. Cannabis as a precipitant of cardiovascular emergencies. Int J Cardiol 2005 09/30;104(0167-5273; 0167-5273; 2):230-2.
- Reference 348
-
Beaconsfield P. Some cardiovascular effects of cannabis. Am Heart J 1974 02;87(0002-8703; 0002-8703; 2):143-6.
- Reference 349
-
Mittleman MA, Lewis RA, Maclure M, Sherwood JB, Muller JE. Triggering myocardial infarction by marijuana. Circulation 2001 06/12;103(1524-4539; 23):2805-9.
- Reference 350
-
Mathew RJ, Wilson WH, Davis R. Postural syncope after marijuana: A transcranial doppler study of the hemodynamics. Pharmacol Biochem Behav 2003 05;75(0091-3057; 0091-3057; 2):309-18.
- Reference 351
-
Gorelick DA, Heishman SJ. Methods for clinical research involving cannabis administration. Methods Mol Med 2006;123(1543-1894; 1543-1894):235-53.
- Reference 352
-
Lundqvist T. Cognitive consequences of cannabis use: Comparison with abuse of stimulants and heroin with regard to attention, memory and executive functions. Pharmacol Biochem Behav 2005 06;81(0091-3057; 2):319-30.
- Reference 353
-
Singh NN, Pan Y, Muengtaweeponsa S, Geller TJ, Cruz-Flores S. Cannabis-related stroke: Case series and review of literature. J.Stroke Cerebrovasc.Dis. 2012 10;21(1532-8511; 1052-3057; 7):555-60.
- Reference 354
-
Renard D, Taieb G, Gras-Combe G, Labauge P. Cannabis-related myocardial infarction and cardioembolic stroke. J.Stroke Cerebrovasc.Dis. 2012 01;21(1532-8511; 1052-3057; 1):82-3.
- Reference 355
-
Sidney S, Quesenberry Jr CP, Friedman GD, Tekawa IS. Marijuana use and cancer incidence (california, united states). Cancer Causes Control 1997;8:722-8.
- Reference 356
-
Zhang ZF, Morgenstern H, Spitz MR, Tashkin DP, Yu GP, Marshall JR, Hsu TC, Schantz SP. Marijuana use and increased risk of squamous cell carcinoma of the head and neck. Cancer Epidemiol Biomarkers Prev 1999 12;8(1055-9965; 12):1071-8.
- Reference 357
-
Hashibe M, Morgenstern H, Cui Y, Tashkin DP, Zhang ZF, Cozen W, Mack TM, Greenland S. Marijuana use and the risk of lung and upper aerodigestive tract cancers: Results of a population-based case-control study. Cancer Epidemiol Biomarkers Prev 2006 10;15(1055-9965; 10):1829-34.
- Reference 358
-
Aldington S, Harwood M, Cox B, Weatherall M, Beckert L, Hansell A, Pritchard A, Robinson G, Beasley R. Cannabis use and risk of lung cancer: A case-control study. Eur Respir J 2008 02;31(1399-3003; 0903-1936; 2):280-6.
- Reference 359
-
Gurney J, Shaw C, Stanley J, Signal V, Sarfati D. Cannabis exposure and risk of testicular cancer: A systematic review and meta-analysis. BMC Cancer 2015 Nov 11;15:897,015-1905-6.
- Reference 360
-
Fligiel SE, Roth MD, Kleerup EC, Barsky SH, Simmons MS, Tashkin DP. Tracheobronchial histopathology in habitual smokers of cocaine, marijuana, and/or tobacco. Chest 1997 08;112(0012-3692; 0012-3692; 2):319-26.
- Reference 361
-
Tetrault JM, Crothers K, Moore BA, Mehra R, Concato J, Fiellin DA. Effects of marijuana smoking on pulmonary function and respiratory complications: A systematic review. Arch Intern Med 2007 02/12;167(0003-9926; 0003-9926; 3):221-8.
- Reference 362
-
Ocampo TL, Rans TS. Cannabis sativa: The unconventional "weed" allergen. Ann Allergy Asthma Immunol 2015 Mar;114(3):187-92.
- Reference 363
-
Tessmer A, Berlin N, Sussman G, Leader N, Chung EC, Beezhold D. Hypersensitivity reactions to marijuana. Ann Allergy Asthma Immunol 2012 Apr;108(4):282-4.
- Reference 364
-
Bloom JW, Kaltenborn WT, Paoletti P, Camilli A, Lebowitz MD. Respiratory effects of non-tobacco cigarettes. Br Med J (Clin Res Ed) 1987 12/12;295(0267-0623; 6612):1516-8.
- Reference 365
-
Tashkin DP, Coulson AH, Clark VA, Simmons M, Bourque LB, Duann S, Spivey GH, Gong H. Respiratory symptoms and lung function in habitual heavy smokers of marijuana alone, smokers of marijuana and tobacco, smokers of tobacco alone, and nonsmokers. Am Rev Respir Dis 1987 01;135(0003-0805; 1):209-16.
- Reference 366
-
Roth MD, Arora A, Barsky SH, Kleerup EC, Simmons M, Tashkin DP. Airway inflammation in young marijuana and tobacco smokers. Am J Respir Crit Care Med 1998 03;157(1073-449; 3):928-37.
- Reference 367
-
Pletcher MJ, Vittinghoff E, Kalhan R, Richman J, Safford M, Sidney S, Lin F, Kertesz S. Association between marijuana exposure and pulmonary function over 20 years. JAMA 2012 01/11;307(1538-3598; 0098-7484; 2):173-81.
- Reference 368
-
Macleod J, Robertson R, Copeland L, McKenzie J, Elton R, Reid P. Cannabis, tobacco smoking, and lung function: A cross-sectional observational study in a general practice population. Br J Gen Pract 2015 Feb;65(631):e89-95.
- Reference 369
-
Naftali T, Lev LB, Yablecovitch D, Half E, Konikoff FM. Treatment of crohn's disease with cannabis: An observational study. Isr Med Assoc J 2011 08;13(1565-1088; 8):455-8.
- Reference 370
-
Patsenker E, Stoll M, Millonig G, Agaimy A, Wissniowski T, Schneider V, Mueller S, Brenneisen R, Seitz HK, Ocker M, et al. Cannabinoid receptor type I modulates alcohol-induced liver fibrosis. Mol Med 2011;17(1528-3658; 1076-1551; 11-12):1285-94.
- Reference 371
-
Trebicka J, Racz I, Siegmund SV, Cara E, Granzow M, Schierwagen R, Klein S, Wojtalla A, Hennenberg M, Huss S, et al. Role of cannabinoid receptors in alcoholic hepatic injury: Steatosis and fibrogenesis are increased in CB2 receptor-deficient mice and decreased in CB1 receptor knockouts. Liver Int. 2011 07;31(1478-3231; 1478-3223; 6):860-70.
- Reference 372
-
Reichenbach V, Ros J, Fernandez-Varo G, Casals G, Melgar-Lesmes P, Campos T, Makriyannis A, Morales-Ruiz M, Jimenez W. Prevention of fibrosis progression in CCl4-treated rats: Role of the hepatic endocannabinoid and apelin systems. J Pharmacol Exp Ther 2012 03;340(1521-0103; 0022-3565; 3):629-37.
- Reference 373
-
Sylvestre DL, Clements BJ, Malibu Y. Cannabis use improves retention and virological outcomes in patients treated for hepatitis C. Eur J Gastroenterol Hepatol 2006 10;18(0954-691; 0954-691; 10):1057-63.
- Reference 374
-
Grant P, Gandhi P. A case of cannabis-induced pancreatitis. JOP. 2004 01;5(1590-8577; 1590-8577; 1):41-3.
- Reference 375
-
Bournet B, Buscail L. [Cannabis: A rare cause of acute pancreatitis]. Gastroenterol Clin Biol 2008 11;32(0399-8320; 0399-8320; 11):922-3.
- Reference 376
-
Belze O,Jr., Legras A, Ehrmann S, Garot D, Perrotin D. Cannabis-induced acute pancreatitis. Am J Emerg Med 2011 01;29(1532-8171; 0735-6757; 1):131-4.
- Reference 377
-
Barkin JA, Nemeth Z, Saluja AK, Barkin JS. Cannabis-induced acute pancreatitis: A systematic review. Pancreas 2017 Sep;46(8):1035-8.
- Reference 378
-
Wargo KA, Geveden BN, McConnell VJ. Cannabinoid-induced pancreatitis: A case series. JOP. 2007;8(1590-8577; 1590-8577; 5):579-83.
- Reference 379
-
Smith FL, Fujimori K, Lowe J, Welch SP. Characterization of delta9-tetrahydrocannabinol and anandamide antinociception in nonarthritic and arthritic rats. Pharmacol Biochem Behav 1998 05;60(0091-3057; 0091-3057; 1):183-91.
- Reference 380
-
Blake DR, Robson P, Ho M, Jubb RW, McCabe CS. Preliminary assessment of the efficacy, tolerability and safety of a cannabis-based medicine (sativex) in the treatment of pain caused by rheumatoid arthritis. Rheumatology (Oxford) 2006 01;45(1462-0324; 1):50-2.
- Reference 381
-
Cox ML, Haller VL, Welch SP. Synergy between delta9-tetrahydrocannabinol and morphine in the arthritic rat. Eur J Pharmacol 2007 Jul 12;567(1-2):125-30.
- Reference 382
-
Schley M, Legler A, Skopp G, Schmelz M, Konrad C, Rukwied R. Delta-9-THC based monotherapy in fibromyalgia patients on experimentally induced pain, axon reflex flare, and pain relief. Curr Med Res Opin 2006 07;22(0300-7995; 0300-7995; 7):1269-76.
- Reference 383
-
Weber J, Schley M, Casutt M, Gerber H, Schuepfer G, Rukwied R, Schleinzer W, Ueberall M, Konrad C. Tetrahydrocannabinol (delta 9-THC) treatment in chronic central neuropathic pain and fibromyalgia patients: Results of a multicenter survey. Anesthesiol.Res.Pract. 2009;2009(1687-6970; 1687-6962; 2009):827290.
- Reference 384
-
Zajicek J, Fox P, Sanders H, Wright D, Vickery J, Nunn A, Thompson A. Cannabinoids for treatment of spasticity and other symptoms related to multiple sclerosis (CAMS study): Multicentre randomised placebo-controlled trial. Lancet 2003 11/08;362(1474-547; 9395):1517-26.
- Reference 385
-
Nogueira-Filho GR, Cadide T, Rosa BT, Neiva TG, Tunes R, Peruzzo D, Nociti FH,Jr., Cesar-Neto JB. Cannabis sativa smoke inhalation decreases bone filling around titanium implants: A histomorphometric study in rats. Implant Dent 2008 12;17(1538-2982; 1056-6163; 4):461-70.
- Reference 386
-
Tomida I, Azuara-Blanco A, House H, Flint M, Pertwee RG, Robson PJ. Effect of sublingual application of cannabinoids on intraocular pressure: A pilot study. J Glaucoma 2006 10;15(1057-0829; 5):349-53.
- Reference 387
-
Tomida I, Pertwee RG, zuara-Blanco A. Cannabinoids and glaucoma. Br J Ophthalmol 2004 05;88(0007-1161; 5):708-13.
- Reference 388
-
Flach AJ. Delta-9-tetrahydrocannabinol (THC) in the treatment of end-stage open-angle glaucoma. Trans Am Ophthalmol Soc 2002;100(0065-9533; 0065-9533):215-22.
- Reference 389
-
Tanasescu R, Constantinescu CS. Cannabinoids and the immune system: An overview. Immunobiology 2010 08;215(1878-3279; 0171-2985; 8):588-97.
- Reference 390
-
Decuyper I, Ryckebosch H, Van Gasse AL, Sabato V, Faber M, Bridts CH, Ebo DG. Cannabis allergy: What do we know anno 2015. Arch Immunol Ther Exp (Warsz) 2015 Oct;63(5):327-32.
- Reference 391
-
Faber M, Van Gasse A, Sabato V, Hagendorens MM, Bridts CH, De Clerck LS, Ebo DG. Marihuana allergy: Beyond the joint. J Investig Allergol Clin Immunol 2015;25(1):70-2.
- Reference 392
-
du Plessis SS, Agarwal A, Syriac A. Marijuana, phytocannabinoids, the endocannabinoid system, and male fertility. J Assist Reprod Genet 2015 Nov;32(11):1575-88.
- Reference 393
-
Gundersen TD, Jorgensen N, Andersson AM, Bang AK, Nordkap L, Skakkebaek NE, Priskorn L, Juul A, Jensen TK. Association between use of marijuana and male reproductive hormones and semen quality: A study among 1,215 healthy young men. Am J Epidemiol 2015 Sep 15;182(6):473-81.
- Reference 394
-
Gorzalka BB, Hill MN, Chang SC. Male-female differences in the effects of cannabinoids on sexual behavior and gonadal hormone function. Horm Behav 2010 06;58(1095-6867; 0018-506; 1):91-9.
- Reference 395
-
Sun AJ, Eisenberg ML. Association between marijuana use and sexual frequency in the united states: A population-based study. J Sex Med 2017 Nov;14(11):1342-7.
- Reference 396
-
Brents LK. Marijuana, the endocannabinoid system and the female reproductive system. Yale J Biol Med 2016 Jun 27;89(2):175-91.
- Reference 397
-
Grotenhermen F. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacokinet 2003;42(0312-5963; 4):327-60.
- Reference 398
-
Agurell S, Halldin M, Lindgren JE, Ohlsson A, Widman M, Gillespie H, Hollister L. Pharmacokinetics and metabolism of delta 1-tetrahydrocannabinol and other cannabinoids with emphasis on man. Pharmacol Rev 1986 03;38(0031-6997; 1):21-43.
- Reference 399
-
Abrams DI, Vizoso HP, Shade SB, Jay C, Kelly ME, Benowitz NL. Vaporization as a smokeless cannabis delivery system: A pilot study. Clin Pharmacol Ther 2007 04/11;82(0009-9236; 5):572-8.
- Reference 400
-
McClure EA, Stitzer ML, Vandrey R. Characterizing smoking topography of cannabis in heavy users. Psychopharmacology (Berl) 2012 03;220(1432-2072; 0033-3158; 2):309-18.
- Reference 401
-
Huestis MA. Pharmacokinetics and metabolism of the plant cannabinoids, delta9-tetrahydrocannabinol, cannabidiol and cannabinol. Handb Exp Pharmacol 2005(0171-2004; 168):657-90.
- Reference 402
-
Carter GT, Weydt P, Kyashna-Tocha M, Abrams DI. Medicinal cannabis: Rational guidelines for dosing. IDrugs. 2004 05;7(1369-7056; 5):464-70.
- Reference 403
-
Adams IB, Martin BR. Cannabis: Pharmacology and toxicology in animals and humans. Addiction 1996 Nov;91(11):1585-614.
- Reference 404
-
Ohlsson A, Lindgren JE, Wahlen A, Agurell S, Hollister LE, Gillespie HK. Plasma delta-9 tetrahydrocannabinol concentrations and clinical effects after oral and intravenous administration and smoking. Clin Pharmacol Ther 1980 09;28(0009-9236; 3):409-16.
- Reference 405
-
Cooper ZD, Haney M. Comparison of subjective, pharmacokinetic, and physiological effects of marijuana smoked as joints and blunts. Drug Alcohol Depend 2009 08/01;103(1879-0046; 0376-8716; 3):107-13.
- Reference 406
-
Schwope DM, Bosker WM, Ramaekers JG, Gorelick DA, Huestis MA. Psychomotor performance, subjective and physiological effects and whole blood delta(9)-tetrahydrocannabinol concentrations in heavy, chronic cannabis smokers following acute smoked cannabis. J Anal Toxicol 2012 07;36(1945-2403; 0146-4760; 6):405-12.
- Reference 407
-
Ohlsson A, Lindgren JE, Andersson S, Agurell S, Gillespie H, Hollister LE. Single-dose kinetics of deuterium-labelled cannabidiol in man after smoking and intravenous administration. Biomed Environ Mass Spectrom 1986 Feb;13(2):77-83.
- Reference 408
-
Gieringer DH. Cannabis "vaporization". J Cannabis Therapeutics 2001;1(3):153-70.
- Reference 409
-
Gieringer D, St Laurent J, Goodrich S. Cannabis vaporizer combines efficient delivery of THC with effective suppression of pyrolytic compounds. J Cannabis Therapeutics 2004;4(1):7-27.
- Reference 410
-
Hazekamp A, Ruhaak R, Zuurman L, van GJ, Verpoorte R. Evaluation of a vaporizing device (volcano) for the pulmonary administration of tetrahydrocannabinol. J Pharm Sci 2006 06;95(0022-3549; 6):1308-17.
- Reference 411
-
Pomahacova B, Van der Kooy F, Verpoorte R. Cannabis smoke condensate III: The cannabinoid content of vaporised cannabis sativa. Inhal Toxicol 2009 11;21(1091-7691; 0895-8378; 13):1108-12.
- Reference 412
-
Ramaekers JG, van Wel JH, Spronk DB, Toennes SW, Kuypers KP, Theunissen EL, Verkes RJ. Cannabis and tolerance: Acute drug impairment as a function of cannabis use history. Sci Rep 2016 May 26;6:26843.
- Reference 413
-
Wilsey BL, Deutsch R, Samara E, Marcotte TD, Barnes AJ, Huestis MA, Le D. A preliminary evaluation of the relationship of cannabinoid blood concentrations with the analgesic response to vaporized cannabis. J Pain Res 2016 Aug 31;9:587-98.
- Reference 414
-
Walsh D, Nelson KA, Mahmoud FA. Established and potential therapeutic applications of cannabinoids in oncology. Support Care Cancer 2003 03;11(0941-4355; 0941-4355; 3):137-43.
- Reference 415
-
Cone EJ, Johnson RE, Paul BD, Mell LD, Mitchell J. Marijuana-laced brownies: Behavioral effects, physiologic effects, and urinalysis in humans following ingestion. J Anal Toxicol 1988 07;12(0146-4760; 4):169-75.
- Reference 416
-
Iversen LL. The pharmacology of THC, the psychoactive ingredient in cannabis. In: The science of marijuana. New York, New York;: Oxford University Press; 2000. ID: 2348; RP: NOT IN FILE.
- Reference 417
-
Schwilke EW, Schwope DM, Karschner EL, Lowe RH, Darwin WD, Kelly DL, Goodwin RS, Gorelick DA, Huestis MA. Delta9-tetrahydrocannabinol (THC), 11-hydroxy-THC, and 11-nor-9-carboxy-THC plasma pharmacokinetics during and after continuous high-dose oral THC. Clin Chem 2009 12;55(1530-8561; 0009-9147; 12):2180-9.
- Reference 418
-
Ahmed AI, van den Elsen GA, Colbers A, Kramers C, Burger DM, van der Marck MA, Olde Rikkert MG. Safety, pharmacodynamics, and pharmacokinetics of multiple oral doses of delta-9-tetrahydrocannabinol in older persons with dementia. Psychopharmacology (Berl) 2015 Jul;232(14):2587-95.
- Reference 419
-
Office of Medicinal Cannabis,The Netherlands Ministry of Health,Welfare and Sports. Medicinal cannabis, information for health care professionals. 2008.
- Reference 420
-
Agurell S, Carlsson S, Lindgren JE, Ohlsson A, Gillespie H, Hollister L. Interactions of delta 1-tetrahydrocannabinol with cannabinol and cannabidiol following oral administration in man. assay of cannabinol and cannabidiol by mass fragmentography. Experientia 1981 Oct 15;37(10):1090-2.
- Reference 421
-
Consroe P, Kennedy K, Schram K. Assay of plasma cannabidiol by capillary gas chromatography/ion trap mass spectroscopy following high-dose repeated daily oral administration in humans. Pharmacol Biochem Behav 1991 Nov;40(3):517-22.
- Reference 422
-
Nadulski T, Sporkert F, Schnelle M, Stadelmann AM, Roser P, Schefter T, Pragst F. Simultaneous and sensitive analysis of THC, 11-OH-THC, THC-COOH, CBD, and CBN by GC-MS in plasma after oral application of small doses of THC and cannabis extract. J Anal Toxicol 2005 Nov-Dec;29(8):782-9.
- Reference 423
-
Zhornitsky S, Potvin S. Cannabidiol in humans-the quest for therapeutic targets. Pharmaceuticals (Basel) 2012 May 21;5(5):529-52.
- Reference 424
-
Zgair A, Wong JC, Lee JB, Mistry J, Sivak O, Wasan KM, Hennig IM, Barrett DA, Constantinescu CS, Fischer PM, et al. Dietary fats and pharmaceutical lipid excipients increase systemic exposure to orally administered cannabis and cannabis-based medicine. Am J Transl Res 2016;8(8):3448-59.
- Reference 425
-
Merrick J, Lane B, Sebree T, Yaksh T, O'Neill C, Banks SL. Identification of psychoactive degradants of cannabidiol in simulated gastric and physiological fluid. Cannabis and Cannabinoid Research 2016;1(1):102-12.
- Reference 426
-
Watanabe K, Itokawa Y, Yamaori S, Funahashi T, Kimura T, Usami N, Yamamoto I. Conversion of cannabidiol to Δ9-tetrahydrocannabinol and related cannabinoids in artificial gastric juice, and their pharmacological effects in mice. Journal of Forensic Toxicology 2007;25(1):16-21.
- Reference 427
-
Pharmaceuticals G. Sativex product monograph. 2010.
- Reference 428
-
Wade DT, Makela P, Robson P, House H, Bateman C. Do cannabis-based medicinal extracts have general or specific effects on symptoms in multiple sclerosis? A double-blind, randomized, placebo-controlled study on 160 patients. Mult Scler 2004 08;10(1352-4585; 4):434-41.
- Reference 429
-
Nurmikko TJ, Serpell MG, Hoggart B, Toomey PJ, Morlion BJ, Haines D. Sativex successfully treats neuropathic pain characterised by allodynia: A randomised, double-blind, placebo-controlled clinical trial. Pain 2007 12/15;133(1872-6623; 0304-3959; 1-3):210-20.
- Reference 430
-
Al-Ghananeem AM, Malkawi AH, Crooks PA. Bioavailability of delta(9)-tetrahydrocannabinol following intranasal administration of a mucoadhesive gel spray delivery system in conscious rabbits. Drug Dev Ind Pharm 2011 Mar;37(3):329-34.
- Reference 431
-
Paudel KS, Hammell DC, Agu RU, Valiveti S, Stinchcomb AL. Cannabidiol bioavailability after nasal and transdermal application: Effect of permeation enhancers. Drug Dev Ind Pharm 2010 Sep;36(9):1088-97.
- Reference 432
-
Brenneisen R, Egli A, Elsohly MA, Henn V, Spiess Y. The effect of orally and rectally administered delta 9-tetrahydrocannabinol on spasticity: A pilot study with 2 patients. Int J Clin Pharmacol Ther 1996 10;34(0946-1965; 10):446-52.
- Reference 433
-
Mattes RD, Shaw LM, Edling-Owens J, Engelman K, Elsohly MA. Bypassing the first-pass effect for the therapeutic use of cannabinoids. Pharmacol Biochem Behav 1993 03;44(0091-3057; 3):745-7.
- Reference 434
-
Perlin E, Smith CG, Nichols AI, Almirez R, Flora KP, Cradock JC, Peck CC. Disposition and bioavailability of various formulations of tetrahydrocannabinol in the rhesus monkey. J Pharm Sci 1985 02;74(0022-3549; 0022-3549; 2):171-4.
- Reference 435
-
Elsohly MA, Little TL,Jr., Hikal A, Harland E, Stanford DF, Walker L. Rectal bioavailability of delta-9-tetrahydrocannabinol from various esters. Pharmacol Biochem Behav 1991 11;40(0091-3057; 0091-3057; 3):497-502.
- Reference 436
-
Elsohly MA, Stanford DF, Harland EC, Hikal AH, Walker LA, Little TL,Jr., Rider JN, Jones AB. Rectal bioavailability of delta-9-tetrahydrocannabinol from the hemisuccinate ester in monkeys. J Pharm Sci 1991 10;80(0022-3549; 0022-3549; 10):942-5.
- Reference 437
-
Valiveti S, Hammell DC, Earles DC, Stinchcomb AL. Transdermal delivery of the synthetic cannabinoid WIN 55,212-2: In vitro/in vivo correlation. Pharm Res 2004 07;21(0724-8741; 0724-8741; 7):1137-45.
- Reference 438
-
Valiveti S, Kiptoo PK, Hammell DC, Stinchcomb AL. Transdermal permeation of WIN 55,212-2 and CP 55,940 in human skin in vitro. Int J Pharm 2004 06/18;278(0378-5173; 0378-5173; 1):173-80.
- Reference 439
-
Stinchcomb AL, Valiveti S, Hammell DC, Ramsey DR. Human skin permeation of Delta8-tetrahydrocannabinol, cannabidiol and cannabinol. J Pharm Pharmacol 2004 03;56(0022-3573; 0022-3573; 3):291-7.
- Reference 440
-
Hammell DC, Zhang LP, Ma F, Abshire SM, McIlwrath SL, Stinchcomb AL, Westlund KN. Transdermal cannabidiol reduces inflammation and pain-related behaviours in a rat model of arthritis. Eur J Pain 2016 Jul;20(6):936-48.
- Reference 441
-
Giacoppo S, Galuppo M, Pollastro F, Grassi G, Bramanti P, Mazzon E. A new formulation of cannabidiol in cream shows therapeutic effects in a mouse model of experimental autoimmune encephalomyelitis. Daru 2015 Oct 21;23:48,015-0131-8.
- Reference 442
-
Harvey DJ. Absorption, distribution and biotransformation of the cannabinoids. In: C. G. Nahas, K. M. Sutin, D. J. Harvey, S. Agurell, editors. Marihuana and medicine. Totowa, New Jersey: Humana Press; 1999. ID: 2363; RP: NOT IN FILE.
- Reference 443
-
Johansson E, Agurell S, Hollister LE, Halldin MM. Prolonged apparent half-life of delta 1-tetrahydrocannabinol in plasma of chronic marijuana users. J Pharm Pharmacol 1988 05;40(0022-3573; 5):374-5.
- Reference 444
-
Widman M, Agurell S, Ehrnebo M, Jones G. Binding of (+)- and (minus)-delta-1-tetrahydrocannabinols and (minus)-7-hydroxy-delta-1-tetrahydrocannabinol to blood cells and plasma proteins in man. J Pharm Pharmacol 1974 11;26(0022-3573; 11):914-6.
- Reference 445
-
Garrett ER, Hunt CA. Pharmacokinetics of delta9-tetrahydrocannabinol in dogs. J Pharm Sci 1977 03;66(0022-3549; 3):395-407.
- Reference 446
-
Wahlqvist M, Nilsson IM, Sandberg F, Agurell S. Binding of delta-1-tetrahydrocannabinol to human plasma proteins. Biochem Pharmacol 1970 09;19(0006-2952; 9):2579-84.
- Reference 447
-
Widman M, Nilsson IM, Agurell S, Borg H, Granstrand B. Plasma protein binding of 7-hydroxy- 1-tetrahydrocannabinol: An active 1-tetrahydrocannabinol metabolite. J Pharm Pharmacol 1973 06;25(0022-3573; 6):453-7.
- Reference 448
-
Truitt EB,Jr. Biological disposition of tetrahydrocannabinols. Pharmacol Rev 1971 12;23(0031-6997; 4):273-8.
- Reference 449
-
Nahas GG. The pharmacokinetics of THC in fat and brain: Resulting functional responses to marihuana smoking. Hum.Psychopharmacol. 2001 04;16(1099-1077; 0885-6222; 3):247-55.
- Reference 450
-
Schou J, Prockop LD, Dahlstrom G, Rohde C. Penetration of delta-9-tetrahydrocannabinol and 11-OH-delta-9-tetrahydrocannabinol through the blood-brain barrier. Acta Pharmacol Toxicol 1977 07;41(0001-6683; 0001-6683; 1):33-8.
- Reference 451
-
Perez-Reyes M, Simmons J, Brine D, Davis KH, Wall ME. Rate of penetration of delta-9-tetrahydrocannabinol and 11-hydroxy-delta-9-tetrahydrocannabinol to the brain of mice. In: Nahas,G.G., Patton, D.M., editor. Marihuana: Chemistry, biochemistry, and cellular effects. New York: Springer Berlin Heidelberg; 1976..
- Reference 452
-
Grotenhermen F. Clinical pharmacokinetics of cannabinoids. In: E. B. Russo, F. Grotenhermen, editors. Handbook of cannabis therapeutics: From bench to bedside. New York: Routledge: Taylor and Francis Group; 2006..
- Reference 453
-
Pope HG,Jr., Gruber AJ, Hudson JI, Huestis MA, Yurgelun-Todd D. Cognitive measures in long-term cannabis users. J Clin Pharmacol 2002 11;42(0091-2700; 0091-2700; 11):41S-7S.
- Reference 454
-
Mura P, Kintz P, Dumestre V, Raul S, Hauet T. THC can be detected in brain while absent in blood. J Anal Toxicol 2005 11;29(0146-4760; 0146-4760; 8):842-3.
- Reference 455
-
Bergamaschi MM, Karschner EL, Goodwin RS, Scheidweiler KB, Hirvonen J, Queiroz RH, Huestis MA. Impact of prolonged cannabinoid excretion in chronic daily cannabis smokers' blood on per se drugged driving laws. Clin Chem 2013 Mar;59(3):519-26.
- Reference 456
-
Gunasekaran N, Long LE, Dawson BL, Hansen GH, Richardson DP, Li KM, Arnold JC, McGregor IS. Reintoxication: The release of fat-stored delta(9)-tetrahydrocannabinol (THC) into blood is enhanced by food deprivation or ACTH exposure. Br J Pharmacol 2009 11;158(1476-5381; 0007-1188; 5):1330-7.
- Reference 457
-
Lemberger L. Tetrahydrocannabinol metabolism in man. Drug Metab Dispos 1973 01;1(0090-9556; 0090-9556; 1):461-8.
- Reference 458
-
Wall ME, Sadler BM, Brine D, Taylor H, Perez-Reyes M. Metabolism, disposition, and kinetics of delta-9-tetrahydrocannabinol in men and women. Clin Pharmacol Ther 1983 09;34(0009-9236; 3):352-63.
- Reference 459
-
Ujvary I, Hanus L. Human metabolites of cannabidiol: A review on their formation, biological activity, and relevance in therapy. Cannabis and Cannabinoid Research 2016;1(1):90 - 101.
- Reference 460
-
Harvey DJ, Mechoulam R. Metabolites of cannabidiol identified in human urine. Xenobiotica 1990 Mar;20(3):303-20.
- Reference 461
-
Sachse-Seeboth C, Pfeil J, Sehrt D, Meineke I, Tzvetkov M, Bruns E, Poser W, Vormfelde SV, Brockmoller J. Interindividual variation in the pharmacokinetics of Delta9-tetrahydrocannabinol as related to genetic polymorphisms in CYP2C9. Clin Pharmacol Ther 2009 03;85(1532-6535; 0009-9236; 3):273-6.
- Reference 462
-
Oates JA. The science of drug therapy. In: L. L. Brunton, J. S. Lazo, K. L. Parker, editors. Goodman and gilman's the pharmacological basis of therapeutics. New York: McGraw-Hill; 2006. ID: 2616; RP: NOT IN FILE.
- Reference 463
-
Graham MJ, Lake BG. Induction of drug metabolism: Species differences and toxicological relevance. Toxicology 2008 12/30;254(0300-483; 0300-483; 3):184-91.
- Reference 464
-
Stout SM, Cimino NM. Exogenous cannabinoids as substrates, inhibitors, and inducers of human drug metabolizing enzymes: A systematic review. Drug Metab Rev 2014 Feb;46(1):86-95.
- Reference 465
-
Bornheim LM, Everhart ET, Li J, Correia MA. Characterization of cannabidiol-mediated cytochrome P450 inactivation. Biochem Pharmacol 1993 03/24;45(0006-2952; 6):1323-31.
- Reference 466
-
Stott C, White L, Wright S, Wilbraham D, Guy G. A phase I, open-label, randomized, crossover study in three parallel groups to evaluate the effect of rifampicin, ketoconazole, and omeprazole on the pharmacokinetics of THC/CBD oromucosal spray in healthy volunteers. Springerplus 2013 May 24;2(1):236,1801-2-236. Print 2013 Dec.
- Reference 467
-
Kosel BW, Aweeka FT, Benowitz NL, Shade SB, Hilton JF, Lizak PS, Abrams DI. The effects of cannabinoids on the pharmacokinetics of indinavir and nelfinavir. AIDS 2002 03/08;16(0269-9370; 4):543-50.
- Reference 468
-
Engels FK, de Jong FA, Sparreboom A, Mathot RA, Loos WJ, Kitzen JJ, de Bruijn P, Verweij J, Mathijssen RH. Medicinal cannabis does not influence the clinical pharmacokinetics of irinotecan and docetaxel. Oncologist 2007 Mar;12(3):291-300.
- Reference 469
-
Jusko WJ, Schentag JJ, Clark JH, Gardner M, Yurchak AM. Enhanced biotransformation of theophylline in marihuana and tobacco smokers. Clin Pharmacol Ther 1978 10;24(0009-9236; 4):405-10.
- Reference 470
-
Zullino DF, Delessert D, Eap CB, Preisig M, Baumann P. Tobacco and cannabis smoking cessation can lead to intoxication with clozapine or olanzapine. Int Clin Psychopharmacol 2002 05;17(0268-1315; 3):141-3.
- Reference 471
-
Huestis MA, Henningfield JE, Cone EJ. Blood cannabinoids. I. absorption of THC and formation of 11-OH-THC and THCCOOH during and after smoking marijuana. J Anal Toxicol 1992 09;16(0146-4760; 5):276-82.
- Reference 472
-
Agurell S, Leander K. Stability, transfer and absorption of cannabinoid constituents of cannabis (hashish) during smoking. Acta Pharm Suec 1971 09;8(0001-6675; 4):391-402.
- Reference 473
-
Wall ME, Perez-Reyes M. The metabolism of delta 9-tetrahydrocannabinol and related cannabinoids in man. J Clin Pharmacol 1981 08;21(0091-2700; 8-9):178S-89S.
- Reference 474
-
Lemberger L, Martz R, Rodda B, Forney R, Rowe H. Comparative pharmacology of Delta9-tetrahydrocannabinol and its metabolite, 11-OH-Delta9-tetrahydrocannabinol. J Clin Invest 1973 Oct;52(10):2411-7.
- Reference 475
-
Hollister LE. Structure-activity relationships in man of cannabis constituents, and homologs and metabolites of delta9-tetrahydrocannabinol. Pharmacology 1974;11(1):3-11.
- Reference 476
-
Howlett AC. Regulation of adenylate cyclase in a cultured neuronal cell line by marijuana constituents, metabolites of delta-9-tetrahydrocannabinol, and synthetic analogs having psychoactivity. 1987;79(NIDA research monograph series).
- Reference 477
-
McGilveray IJ. Pharmacokinetics of cannabinoids. Pain Res.Manag. 2005;Autumn:15A-22A.
- Reference 478
-
Christensen HD, Freudenthal RI, Gidley JT, Rosenfeld R, Boegli G, Testino L, Brine DR, Pitt CG, Wall ME. Activity of delta8- and delta9-tetrahydrocannabinol and related compounds in the mouse. Science 1971 04/09;172(0036-8075; 979):165-7.
- Reference 479
-
Perez-Reyes M, Timmons MC, Lipton MA, Davis KH, Wall ME. Intravenous injection in man of 9 -tetrahydrocannabinol and 11-OH- 9 -tetrahydrocannabinol. Science 1972 08/18;177(0036-8075; 49):633-5.
- Reference 480
-
Huestis MA, Sampson AH, Holicky BJ, Henningfield JE, Cone EJ. Characterization of the absorption phase of marijuana smoking. Clin Pharmacol Ther 1992 07;52(0009-9236; 1):31-41.
- Reference 481
-
Huestis MA, Mitchell JM, Cone EJ. Urinary excretion profiles of 11-nor-9-carboxy-delta 9-tetrahydrocannabinol in humans after single smoked doses of marijuana. J Anal Toxicol 1996 10;20(0146-4760; 6):441-52.
- Reference 482
-
Hawks RL. The constituents of cannabis and the disposition and metabolism of cannabinoids. NIDA Res Monogr 1982;42(1046-9516):125-37.
- Reference 483
-
Martin BR, Cone EJ. Chemistry and pharmacology of cannabis. In: H. Kalant, W. Corrigall, W. Hall, R. Smart, editors. The health effects of cannabis. Toronto, Canada: Centre of Addiction and Mental Health; 1999. ID: 2367; RP: NOT IN FILE.
- Reference 484
-
Harvey DJ, Brown NK. Comparative in vitro metabolism of the cannabinoids. Pharmacol Biochem Behav 1991 Nov;40(3):533-40.
- Reference 485
-
Harvey DJ, Samara E, Mechoulam R. Comparative metabolism of cannabidiol in dog, rat and man. Pharmacol Biochem Behav 1991 Nov;40(3):523-32.
- Reference 486
-
Cone EJ, Huestis MA. Relating blood concentrations of tetrahydrocannabinol and metabolites to pharmacologic effects and time of marijuana usage. Ther Drug Monit 1993 12;15(0163-4356; 6):527-32.
- Reference 487
-
Toennes SW, Ramaekers JG, Theunissen EL, Moeller MR, Kauert GF. Comparison of cannabinoid pharmacokinetic properties in occasional and heavy users smoking a marijuana or placebo joint. J Anal Toxicol 2008 09;32(0146-4760; 0146-4760; 7):470-7.
- Reference 488
-
Canada V. Cesamet product monograph. 2009.
- Reference 489
-
Hollister LE, Gillespie HK, Ohlsson A, Lindgren JE, Wahlen A, Agurell S. Do plasma concentrations of delta 9-tetrahydrocannabinol reflect the degree of intoxication? J Clin Pharmacol 1981 08;21(0091-2700; 0091-2700; 8-9):171S-7S.
- Reference 490
-
Strougo A, Zuurman L, Roy C, Pinquier JL, van Gerven JM, Cohen AF, Schoemaker RC. Modelling of the concentration--effect relationship of THC on central nervous system parameters and heart rate -- insight into its mechanisms of action and a tool for clinical research and development of cannabinoids. J Psychopharmacol 2008 09;22(0269-8811; 0269-8811; 7):717-26.
- Reference 491
-
Hunault CC, Bocker KB, Stellato RK, Kenemans JL, de Vries I, Meulenbelt J. Acute subjective effects after smoking joints containing up to 69 mg Delta9-tetrahydrocannabinol in recreational users: A randomized, crossover clinical trial. Psychopharmacology (Berl) 2014 Dec;231(24):4723-33.
- Reference 492
-
Lile JA, Kelly TH, Charnigo RJ, Stinchcomb AL, Hays LR. Pharmacokinetic and pharmacodynamic profile of supratherapeutic oral doses of delta(9) -THC in cannabis users. J Clin Pharmacol 2013 Jul;53(7):680-90.
- Reference 493
-
Lynch ME, Watson CP. The pharmacotherapy of chronic pain: A review. Pain Res.Manag. 2006;11(1203-6765; 1203-6765; 1):11-38.
- Reference 494
-
Wu DF, Yang LQ, Goschke A, Stumm R, Brandenburg LO, Liang YJ, Hollt V, Koch T. Role of receptor internalization in the agonist-induced desensitization of cannabinoid type 1 receptors. J Neurochem 2008 02;104(1471-4159; 0022-3042; 4):1132-43.
- Reference 495
-
Lazenka MF, Selley DE, Sim-Selley LJ. Brain regional differences in CB1 receptor adaptation and regulation of transcription. Life Sci 2013 Mar 19;92(8-9):446-52.
- Reference 496
-
Ceccarini J, Kuepper R, Kemels D, van Os J, Henquet C, Van Laere K. 18F]MK-9470 PET measurement of cannabinoid CB1 receptor availability in chronic cannabis users. Addict Biol 2015 Mar;20(2):357-67.
- Reference 497
-
Hirvonen J, Goodwin RS, Li CT, Terry GE, Zoghbi SS, Morse C, Pike VW, Volkow ND, Huestis MA, Innis RB. Reversible and regionally selective downregulation of brain cannabinoid CB1 receptors in chronic daily cannabis smokers. Mol Psychiatry 2012 06;17(1476-5578; 1359-4184; 6):642-9.
- Reference 498
-
Pertwee RG. Emerging strategies for exploiting cannabinoid receptor agonists as medicines. Br J Pharmacol 2009 02;156(1476-5381; 0007-1188; 3):397-411.
- Reference 499
-
Haney M, Ward AS, Comer SD, Foltin RW, Fischman MW. Abstinence symptoms following oral THC administration to humans. Psychopharmacology (Berl) 1999 02;141(0033-3158; 4):385-94.
- Reference 500
-
Haney M, Ward AS, Comer SD, Foltin RW, Fischman MW. Abstinence symptoms following smoked marijuana in humans. Psychopharmacology (Berl) 1999 02;141(0033-3158; 0033-3158; 4):395-404.
- Reference 501
-
Jones RT, Benowitz NL, Herning RI. Clinical relevance of cannabis tolerance and dependence. J Clin Pharmacol 1981 Aug-Sep;21(8-9 Suppl):143S-52S.
- Reference 502
-
Ramaekers JG, Theunissen EL, de Brouwer M, Toennes SW, Moeller MR, Kauert G. Tolerance and cross-tolerance to neurocognitive effects of THC and alcohol in heavy cannabis users. Psychopharmacology (Berl) 2011 Mar;214(2):391-401.
- Reference 503
-
Maldonado R. Study of cannabinoid dependence in animals. Pharmacol Ther 2002 08;95(0163-7258; 0163-7258; 2):153-64.
- Reference 504
-
American Psychiatric Association. Substance-related disorders. In: American Psychiatric Association, editor. Diagnostic and statistical manual of mental disorders text revision (DSM-IV-TR). Washington, D.C.: American Psychiatric Association; 2000. ID: 2674; RP: NOT IN FILE.
- Reference 505
-
American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 2013.
- Reference 506
-
Lopez-Quintero C, Perez de los Cobos J, Hasin DS, Okuda M, Wang S, Grant BF, Blanco C. Probability and predictors of transition from first use to dependence on nicotine, alcohol, cannabis, and cocaine: Results of the national epidemiologic survey on alcohol and related conditions (NESARC). Drug Alcohol Depend 2011 May 1;115(1-2):120-30.
- Reference 507
-
van der Pol P, Liebregts N, de Graaf R, Korf DJ, van den Brink W, van Laar M. Predicting the transition from frequent cannabis use to cannabis dependence: A three-year prospective study. Drug Alcohol Depend 2013 Dec 1;133(2):352-9.
- Reference 508
-
Hasin DS, Saha TD, Kerridge BT, Goldstein RB, Chou SP, Zhang H, Jung J, Pickering RP, Ruan WJ, Smith SM, et al. Prevalence of marijuana use disorders in the united states between 2001-2002 and 2012-2013. JAMA Psychiatry 2015 Dec;72(12):1235-42.
- Reference 509
-
Blanco C, Hasin DS, Wall MM, Florez-Salamanca L, Hoertel N, Wang S, Kerridge BT, Olfson M. Cannabis use and risk of psychiatric disorders: Prospective evidence from a US national longitudinal study. JAMA Psychiatry 2016 Apr;73(4):388-95.
- Reference 510
-
Butterworth P, Slade T, Degenhardt L. Factors associated with the timing and onset of cannabis use and cannabis use disorder: Results from the 2007 australian national survey of mental health and well-being. Drug Alcohol Rev 2014 Sep;33(5):555-64.
- Reference 511
-
Cooper ZD, Haney M. Investigation of sex-dependent effects of cannabis in daily cannabis smokers. Drug Alcohol Depend 2014 Mar 1;136:85-91.
- Reference 512
-
Bonnet U, Specka M, Stratmann U, Ochwadt R, Scherbaum N. Abstinence phenomena of chronic cannabis-addicts prospectively monitored during controlled inpatient detoxification: Cannabis withdrawal syndrome and its correlation with delta-9-tetrahydrocannabinol and -metabolites in serum. Drug Alcohol Depend 2014 Oct 1;143:189-97.
- Reference 513
-
Lee D, Schroeder JR, Karschner EL, Goodwin RS, Hirvonen J, Gorelick DA, Huestis MA. Cannabis withdrawal in chronic, frequent cannabis smokers during sustained abstinence within a closed residential environment. Am J Addict 2014 May-Jun;23(3):234-42.
- Reference 514
-
Budney AJ, Hughes JR, Moore BA, Vandrey R. Review of the validity and significance of cannabis withdrawal syndrome. Am J Psychiatry 2004 11;161(0002-953; 11):1967-77.
- Reference 515
-
Hasin DS. US epidemiology of cannabis use and associated problems. Neuropsychopharmacology 2017 Aug 30.
- Reference 516
-
Meier MH. Associations between butane hash oil use and cannabis-related problems. Drug Alcohol Depend 2017 Oct 1;179:25-31.
- Reference 517
-
Loflin M, Earleywine M. A new method of cannabis ingestion: The dangers of dabs? Addict Behav 2014 Oct;39(10):1430-3.
- Reference 518
-
Allsop DJ, Copeland J, Lintzeris N, Dunlop AJ, Montebello M, Sadler C, Rivas GR, Holland RM, Muhleisen P, Norberg MM, et al. Nabiximols as an agonist replacement therapy during cannabis withdrawal: A randomized clinical trial. JAMA Psychiatry 2014 Mar;71(3):281-91.
- Reference 519
-
Haney M, Hart CL, Vosburg SK, Nasser J, Bennett A, Zubaran C, Foltin RW. Marijuana withdrawal in humans: Effects of oral THC or divalproex. Neuropsychopharmacology 2004 Jan;29(1):158-70.
- Reference 520
-
Haney M, Hart CL, Vosburg SK, Comer SD, Reed SC, Foltin RW. Effects of THC and lofexidine in a human laboratory model of marijuana withdrawal and relapse. Psychopharmacology (Berl) 2008 Mar;197(1):157-68.
- Reference 521
-
Johnston J, Lintzeris N, Allsop DJ, Suraev A, Booth J, Carson DS, Helliwell D, Winstock A, McGregor IS. Lithium carbonate in the management of cannabis withdrawal: A randomized placebo-controlled trial in an inpatient setting. Psychopharmacology (Berl) 2014 Dec;231(24):4623-36.
- Reference 522
-
Cooper ZD, Foltin RW, Hart CL, Vosburg SK, Comer SD, Haney M. A human laboratory study investigating the effects of quetiapine on marijuana withdrawal and relapse in daily marijuana smokers. Addict Biol 2013 Nov;18(6):993-1002.
- Reference 523
-
Herrmann ES, Cooper ZD, Bedi G, Ramesh D, Reed SC, Comer SD, Foltin RW, Haney M. Effects of zolpidem alone and in combination with nabilone on cannabis withdrawal and a laboratory model of relapse in cannabis users. Psychopharmacology (Berl) 2016 Jul;233(13):2469-78.
- Reference 524
-
Vandrey R, Smith MT, McCann UD, Budney AJ, Curran EM. Sleep disturbance and the effects of extended-release zolpidem during cannabis withdrawal. Drug Alcohol Depend 2011 Aug 1;117(1):38-44.
- Reference 525
-
Haney M, Cooper ZD, Bedi G, Vosburg SK, Comer SD, Foltin RW. Nabilone decreases marijuana withdrawal and a laboratory measure of marijuana relapse. Neuropsychopharmacology 2013 Jul;38(8):1557-65.
- Reference 526
-
Levin FR, Mariani JJ, Pavlicova M, Brooks D, Glass A, Mahony A, Nunes EV, Bisaga A, Dakwar E, Carpenter KM, et al. Dronabinol and lofexidine for cannabis use disorder: A randomized, double-blind, placebo-controlled trial. Drug Alcohol Depend 2016 Feb 1;159:53-60.
- Reference 527
-
Levin FR, Mariani JJ, Brooks DJ, Pavlicova M, Cheng W, Nunes EV. Dronabinol for the treatment of cannabis dependence: A randomized, double-blind, placebo-controlled trial. Drug Alcohol Depend 2011 Jul 1;116(1-3):142-50.
- Reference 528
-
Crippa JA, Hallak JE, Machado-de-Sousa JP, Queiroz RH, Bergamaschi M, Chagas MH, Zuardi AW. Cannabidiol for the treatment of cannabis withdrawal syndrome: A case report. J Clin Pharm Ther 2013 Apr;38(2):162-4.
- Reference 529
-
Morgan CJ, Schafer G, Freeman TP, Curran HV. Impact of cannabidiol on the acute memory and psychotomimetic effects of smoked cannabis: Naturalistic study: Naturalistic study [corrected]. Br J Psychiatry 2010 10;197(1472-1465; 0007-1250; 4):285-90.
- Reference 530
-
Haney M, Malcolm RJ, Babalonis S, Nuzzo PA, Cooper ZD, Bedi G, Gray KM, McRae-Clark A, Lofwall MR, Sparenborg S, et al. Oral cannabidiol does not alter the subjective, reinforcing or cardiovascular effects of smoked cannabis. Neuropsychopharmacology 2016 Jul;41(8):1974-82.
- Reference 531
-
Morgan CJ, Das RK, Joye A, Curran HV, Kamboj SK. Cannabidiol reduces cigarette consumption in tobacco smokers: Preliminary findings. Addict Behav 2013 Sep;38(9):2433-6.
- Reference 532
-
Consroe P, Carlini EA, Zwicker AP, Lacerda LA. Interaction of cannabidiol and alcohol in humans. Psychopharmacology (Berl) 1979;66(1):45-50.
- Reference 533
-
Chadwick B, Miller ML, Hurd YL. Cannabis use during adolescent development: Susceptibility to psychiatric illness. Front Psychiatry 2013 Oct 14;4:129.
- Reference 534
-
Arain M, Haque M, Johal L, Mathur P, Nel W, Rais A, Sandhu R, Sharma S. Maturation of the adolescent brain. Neuropsychiatr Dis Treat 2013;9:449-61.
- Reference 535
-
Hall W, Degenhardt L. The adverse health effects of chronic cannabis use. Drug Test Anal 2014 Jan-Feb;6(1-2):39-45.
- Reference 536
-
Meier MH, Caspi A, Ambler A, Harrington H, Houts R, Keefe RS, McDonald K, Ward A, Poulton R, Moffitt TE. Persistent cannabis users show neuropsychological decline from childhood to midlife. Proc Natl Acad Sci U S A 2012 10/02;109(1091-6490; 0027-8424; 40):E2657-64.
- Reference 537
-
Pardini D, White HR, Xiong S, Bechtold J, Chung T, Loeber R, Hipwell A. Unfazed or dazed and confused: Does early adolescent marijuana use cause sustained impairments in attention and academic functioning? J Abnorm Child Psychol 2015 Oct;43(7):1203-17.
- Reference 538
-
Fergusson DM, Horwood LJ, Swain-Campbell N. Cannabis use and psychosocial adjustment in adolescence and young adulthood. Addiction 2002 Sep;97(9):1123-35.
- Reference 539
-
Lisdahl KM, Price JS. Increased marijuana use and gender predict poorer cognitive functioning in adolescents and emerging adults. J Int Neuropsychol Soc 2012 Jul;18(4):678-88.
- Reference 540
-
Silins E, Horwood LJ, Patton GC, Fergusson DM, Olsson CA, Hutchinson DM, Spry E, Toumbourou JW, Degenhardt L, Swift W, et al. Young adult sequelae of adolescent cannabis use: An integrative analysis. Lancet Psychiatry 2014 Sep;1(4):286-93.
- Reference 541
-
Silins E, Fergusson DM, Patton GC, Horwood LJ, Olsson CA, Hutchinson DM, Degenhardt L, Tait RJ, Borschmann R, Coffey C, et al. Adolescent substance use and educational attainment: An integrative data analysis comparing cannabis and alcohol from three australasian cohorts. Drug Alcohol Depend 2015 Nov 1;156:90-6.
- Reference 542
-
Horwood LJ, Fergusson DM, Hayatbakhsh MR, Najman JM, Coffey C, Patton GC, Silins E, Hutchinson DM. Cannabis use and educational achievement: Findings from three australasian cohort studies. Drug Alcohol Depend 2010 Aug 1;110(3):247-53.
- Reference 543
-
Fergusson DM, Horwood LJ, Beautrais AL. Cannabis and educational achievement. Addiction 2003 Dec;98(12):1681-92.
- Reference 544
-
Lynskey MT, Coffey C, Degenhardt L, Carlin JB, Patton G. A longitudinal study of the effects of adolescent cannabis use on high school completion. Addiction 2003 May;98(5):685-92.
- Reference 545
-
Bray JW, Zarkin GA, Ringwalt C, Qi J. The relationship between marijuana initiation and dropping out of high school. Health Econ 2000 Jan;9(1):9-18.
- Reference 546
-
Hurd YL, Michaelides M, Miller ML, Jutras-Aswad D. Trajectory of adolescent cannabis use on addiction vulnerability. Neuropharmacology 2014 Jan;76 Pt B:416-24.
- Reference 547
-
Solowij N, Pesa N. Cannabis and cognition: Short- and long-term effects. In: D. Castle, R. M. Murray, Cyril Deepak D'Souza, editors. Marijuana and madness. Cambridge: Cambridge University Press; 2011..
- Reference 548
-
Pope HG,Jr., Gruber AJ, Hudson JI, Huestis MA, Yurgelun-Todd D. Neuropsychological performance in long-term cannabis users. Arch Gen Psychiatry 2001 10;58(0003-990; 10):909-15.
- Reference 549
-
Levine A, Clemenza K, Rynn M, Lieberman J. Evidence for the risks and consequences of adolescent cannabis exposure. J Am Acad Child Adolesc Psychiatry 2017 Mar;56(3):214-25.
- Reference 550
-
Di Marzo V, Stella N, Zimmer A. Endocannabinoid signalling and the deteriorating brain. Nat Rev Neurosci 2015 Jan;16(1):30-42.
- Reference 551
-
Ahmed A, van der Marck MA, van den Elsen G, Olde Rikkert M. Cannabinoids in late-onset alzheimer's disease. Clin Pharmacol Ther 2015 Jun;97(6):597-606.
- Reference 552
-
van den Elsen GA, Ahmed AI, Lammers M, Kramers C, Verkes RJ, van der Marck MA, Rikkert MG. Efficacy and safety of medical cannabinoids in older subjects: A systematic review. Ageing Res Rev 2014 Mar;14:56-64.
- Reference 553
-
Fattore L, Fratta W. How important are sex differences in cannabinoid action? Br J Pharmacol 2010 Jun;160(3):544-8.
- Reference 554
-
Rubino T, Parolaro D. Sexually dimorphic effects of cannabinoid compounds on emotion and cognition. Front Behav Neurosci 2011 Sep 28;5:64.
- Reference 555
-
Van Laere K, Goffin K, Casteels C, Dupont P, Mortelmans L, de Hoon J, Bormans G. Gender-dependent increases with healthy aging of the human cerebral cannabinoid-type 1 receptor binding using [(18)F]MK-9470 PET. Neuroimage 2008 Feb 15;39(4):1533-41.
- Reference 556
-
Narimatsu S, Watanabe K, Yamamoto I, Yoshimura H. Sex difference in the oxidative metabolism of delta 9-tetrahydrocannabinol in the rat. Biochem Pharmacol 1991 Apr 15;41(8):1187-94.
- Reference 557
-
Craft RM, Marusich JA, Wiley JL. Sex differences in cannabinoid pharmacology: A reflection of differences in the endocannabinoid system? Life Sci 2013 Mar 19;92(8-9):476-81.
- Reference 558
-
Fogel JS, Kelly TH, Westgate PM, Lile JA. Sex differences in the subjective effects of oral Delta9-THC in cannabis users. Pharmacol Biochem Behav 2016 Jan 15.
- Reference 559
-
Rubino T, Parolaro D. Sex-dependent vulnerability to cannabis abuse in adolescence. Front Psychiatry 2015 Apr 20;6:56.
- Reference 560
-
Copersino ML, Boyd SJ, Tashkin DP, Huestis MA, Heishman SJ, Dermand JC, Simmons MS, Gorelick DA. Sociodemographic characteristics of cannabis smokers and the experience of cannabis withdrawal. Am J Drug Alcohol Abuse 2010 Nov;36(6):311-9.
- Reference 561
-
Herrmann ES, Weerts EM, Vandrey R. Sex differences in cannabis withdrawal symptoms among treatment-seeking cannabis users. Exp Clin Psychopharmacol 2015 Dec;23(6):415-21.
- Reference 562
-
Agrawal A, Gardner CO, Prescott CA, Kendler KS. The differential impact of risk factors on illicit drug involvement in females. Soc Psychiatry Psychiatr Epidemiol 2005 Jun;40(6):454-66.
- Reference 563
-
Khan SS, Secades-Villa R, Okuda M, Wang S, Perez-Fuentes G, Kerridge BT, Blanco C. Gender differences in cannabis use disorders: Results from the national epidemiologic survey of alcohol and related conditions. Drug Alcohol Depend 2013 Jun 1;130(1-3):101-8.
- Reference 564
-
Hazekamp A, Bastola K, Rashidi H, Bender J, Verpoorte R. Cannabis tea revisited: A systematic evaluation of the cannabinoid composition of cannabis tea. J Ethnopharmacol 2007 08/15;113(0378-8741; 0378-8741; 1):85-90.
- Reference 565
-
Roitman P, Mechoulam R, Cooper-Kazaz R, Shalev A. Preliminary, open-label, pilot study of add-on oral Delta9-tetrahydrocannabinol in chronic post-traumatic stress disorder. Clin Drug Investig 2014 Aug;34(8):587-91.
- Reference 566
-
Pertwee RG. Tolerance to the effect of delta1-tetrahydrocannabinol on corticosterone levels in mouse plasma produced by repeated administration of cannabis extract or delta1-tetrahydrocannabinol. Br J Pharmacol 1974 07;51(0007-1188; 0007-1188; 3):391-7.
- Reference 567
-
Lozano I. The therapeutic uses of cannabis sativa (L.) in arabic medicine. J Cannabis Therapeutics 2001;1(1):63-70.
- Reference 568
-
Russo E. History of cannabis as a medicine. In: G. W. Guy, B. A. Whittle, P. J. Robson, editors. The medicinal uses of cannabis and cannabinoids. London: Pharmaceutical Press; 2004. ID: 2622; RP: NOT IN FILE.
- Reference 569
-
Russo EB. History of cannabis and its preparations in saga, science, and sobriquet. Chem.Biodivers. 2007 08;4(1612-1880; 1612-1872; 8):1614-48.
- Reference 570
-
Fraser GA. The use of a synthetic cannabinoid in the management of treatment-resistant nightmares in posttraumatic stress disorder (PTSD). CNS.Neurosci.Ther. 2009;15(1755-5949; 1755-5930; 1):84-8.
- Reference 571
-
Ware MA, Adams H, Guy GW. The medicinal use of cannabis in the UK: Results of a nationwide survey. Int J Clin Pract 2005 03;59(1368-5031; 3):291-5.
- Reference 572
-
Hazekamp A, Ware MA, Muller-Vahl KR, Abrams D, Grotenhermen F. The medicinal use of cannabis and cannabinoids--an international cross-sectional survey on administration forms. J Psychoactive Drugs 2013 Jul-Aug;45(3):199-210.
- Reference 573
-
Market data - Cannabis for Medical Purposes [Internet]; c09 July 2018. Available from: https://www.canada.ca/en/health-canada/services/drugs-medication/cannabis/licensed-producers/market-data.html.
- Reference 574
-
Haroutounian S, Ratz Y, Ginosar Y, Furmanov K, Saifi F, Meidan R, Davidson E. The effect of medicinal cannabis on pain and quality of life outcomes in chronic pain: A prospective open-label study. Clin J Pain 2016 Feb 17.
- Reference 575
-
Grotenhermen F. Harm reduction associated with inhalation and oral administration of cannabis and THC. Journal of Cannabis Therapeutics 2001;1(3/4):133.
- Reference 576
-
van der Pol P, Liebregts N, Brunt T, van Amsterdam J, de Graaf R, Korf DJ, van den Brink W, van Laar M. Cross-sectional and prospective relation of cannabis potency, dosing and smoking behaviour with cannabis dependence: An ecological study. Addiction 2014 Jul;109(7):1101-9.
- Reference 577
-
Ramaekers JG, Berghaus G, van Laar MW, Drummer OH. Dose related risk of motor vehicle crashes after cannabis use: An update. In: J. C. Verster, S. R. Pandi-Perumal, J. G. Ramaekers, J. J. de Gier, editors. Drugs, driving and traffic safety. 1st ed. Springer Science and Business Media; 2009..
- Reference 578
-
College of Family Physicians of Canada. Authorizing dried cannabis for chronic pain or anxiety: Preliminary guidance from the college of family physicians of canada. Mississauga, ON: College of Family Physicians of Canada; 2014.
- Reference 579
-
Cannabis: a health perspective and research agenda [Internet]; c1997.
- Reference 580
-
Ridgeway G, Kilmer B. Bayesian interference for the distribution of grams of marijuana in a joint. Drug Alcohol Depend. 2016;165:175-80.
- Reference 581
-
Gray KM, Watson NL, Christie DK. Challenges in quantifying marijuana use. Am J Addict 2009 Mar-Apr;18(2):178-9.
- Reference 582
-
Cami J, Guerra D, Ugena B, Segura J, de la Torre R. Effect of subject expectancy on the THC intoxication and disposition from smoked hashish cigarettes. Pharmacol Biochem Behav 1991 09;40(0091-3057; 0091-3057; 1):115-9.
- Reference 583
-
Isbell H, Gorodetzsky CW, Jasinski D, Claussen U, von Spulak F, Korte F. Effects of (--)delta-9-trans-tetrahydrocannabinol in man. Psychopharmacologia 1967;11(2):184-8.
- Reference 584
-
Hart CL, Ward AS, Haney M, Comer SD, Foltin RW, Fischman MW. Comparison of smoked marijuana and oral delta(9)-tetrahydrocannabinol in humans. Psychopharmacology (Berl) 2002 Dec;164(4):407-15.
- Reference 585
-
Barrus DG, Capogrossi KL, Cates SC, Gourdet CK, Peiper NC, Novak SP, Lefever TW, Wiley JL. Tasty THC: Promises and challenges of cannabis edibles. Methods Rep RTI Press 2016 Nov;2016.
- Reference 586
-
de Vries M, Van Rijckevorsel DC, Vissers KC, Wilder-Smith OH, Van Goor H. Single dose delta-9-tetrahydrocannabinol in chronic pancreatitis patients: Analgesic efficacy, pharmacokinetics and tolerability. Br J Clin Pharmacol 2016 Mar;81(3):525-37.
- Reference 587
-
Skrabek RQ, Galimova L, Ethans K, Perry D. Nabilone for the treatment of pain in fibromyalgia. J.Pain 2008 02;9(1526-5900; 1526-5900; 2):164-73.
- Reference 588
-
Ware MA, Fitzcharles MA, Joseph L, Shir Y. The effects of nabilone on sleep in fibromyalgia: Results of a randomized controlled trial. Anesth Analg 2010 02/01;110(1526-7598; 0003-2999; 2):604-10.
- Reference 589
-
Devinsky O, Cross JH, Laux L, Marsh E, Miller I, Nabbout R, Scheffer IE, Thiele EA, Wright S, Cannabidiol in Dravet Syndrome Study Group. Trial of cannabidiol for drug-resistant seizures in the dravet syndrome. N Engl J Med 2017 May 25;376(21):2011-20.
- Reference 590
-
Thiele EA, Marsh ED, French JA, Mazurkiewicz-Beldzinska M, Benbadis SR, Joshi C, Lyons PD, Taylor A, Roberts C, Sommerville K, et al. Cannabidiol in patients with seizures associated with lennox-gastaut syndrome (GWPCARE4): A randomised, double-blind, placebo-controlled phase 3 trial. Lancet 2018 Jan 25.
- Reference 591
-
Wilsey B, Marcotte T, Deutsch R, Gouaux B, Sakai S, Donaghe H. Low-dose vaporized cannabis significantly improves neuropathic pain. J.Pain 2012 12/10;14(1528-8447; 1526-5900; 2):136-48.
- Reference 592
-
Wallace MS, Marcotte TD, Umlauf A, Gouaux B, Atkinson JH. Efficacy of inhaled cannabis on painful diabetic neuropathy. J Pain 2015 Jul;16(7):616-27.
- Reference 593
-
Kalliomaki J, Philipp A, Baxendale J, Annas P, Karlsten R, Segerdahl M. Lack of effect of central nervous system-active doses of nabilone on capsaicin-induced pain and hyperalgesia. Clin Exp Pharmacol Physiol 2012 04;39(1440-1681; 0305-1870; 4):336-42.
- Reference 594
-
Ben Amar M. Cannabinoids in medicine: A review of their therapeutic potential. J Ethnopharmacol 2006 Apr 21;105(1-2):1-25.
- Reference 595
-
National Academies of Sciences, Engineering, and Medicine. The health effects of cannabis and cannabinoids: The current state of evidence and recommendations for research. Washington, D.C.: National Academies Press; 2017.
- Reference 596
-
Naftali T, Bar-Lev Schleider L, Dotan I, Lansky EP, Sklerovsky Benjaminov F, Konikoff FM. Cannabis induces a clinical response in patients with crohn's disease: A prospective placebo-controlled study. Clin Gastroenterol Hepatol 2013 Oct;11(10):1276,1280.e1.
- Reference 597
-
World Health Organization (WHO). WHO definition of palliative care. 2012.
- Reference 598
-
Green AJ, De-Vries K. Cannabis use in palliative care - an examination of the evidence and the implications for nurses. J Clin Nurs 2010 09;19(1365-2702; 0962-1067; 17-18):2454-62.
- Reference 599
-
Gardiner C, Ingleton C. Commentary on green AJ & de-vries K (2010) cannabis use in palliative care--an examination of the evidence and the implications for nurses. journal of clinical nursing 19, 2454-2462. J Clin Nurs 2010 11;19(1365-2702; 0962-1067; 21-22):3253-5.
- Reference 600
-
Glare P, Miller J, Nikolova T, Tickoo R. Treating nausea and vomiting in palliative care: A review. Clin.Interv.Aging 2011;6(1178-1998; 1176-9092):243-59.
- Reference 601
-
Fine PG. Treatment guidelines for the pharmacological management of pain in older persons. Pain Med. 2012 04;13 Suppl 2(1526-4637; 1526-2375):S57-66.
- Reference 602
-
Bar-Sela G, Vorobeichik M, Drawsheh S, Omer A, Goldberg V, Muller E. The medical necessity for medicinal cannabis: Prospective, observational study evaluating the treatment in cancer patients on supportive or palliative care. Evid Based Complement Alternat Med 2013;2013:510392.
- Reference 603
-
Svendsen KB, Jensen TS, Bach FW. Does the cannabinoid dronabinol reduce central pain in multiple sclerosis? randomised double blind placebo controlled crossover trial. BMJ 2004 07/31;329(1468-5833; 7460):253-60.
- Reference 604
-
Brisbois TD, de Kock IH, Watanabe SM, Mirhosseini M, Lamoureux DC, Chasen M, MacDonald N, Baracos VE, Wismer WV. Delta-9-tetrahydrocannabinol may palliate altered chemosensory perception in cancer patients: Results of a randomized, double-blind, placebo-controlled pilot trial. Ann Oncol 2011 09;22(1569-8041; 0923-7534; 9):2086-93.
- Reference 605
-
Toth C, Mawani S, Brady S, Chan C, Liu C, Mehina E, Garven A, Bestard J, Korngut L. An enriched-enrolment, randomized withdrawal, flexible-dose, double-blind, placebo-controlled, parallel assignment efficacy study of nabilone as adjuvant in the treatment of diabetic peripheral neuropathic pain. Pain 2012 10;153(1872-6623; 0304-3959; 10):2073-82.
- Reference 606
-
Cote M, Trudel M, Wang C, Fortin A. Improving quality of life with nabilone during radiotherapy treatments for head and neck cancers: A randomized double-blind placebo-controlled trial. Ann Otol Rhinol Laryngol 2016 Apr;125(4):317-24.
- Reference 607
-
Selvarajah D, Gandhi R, Emery CJ, Tesfaye S. Randomized placebo-controlled double-blind clinical trial of cannabis-based medicinal product (sativex) in painful diabetic neuropathy: Depression is a major confounding factor. Diabetes Care 2010 01;33(1935-5548; 0149-5992; 1):128-30.
- Reference 608
-
Novotna A, Mares J, Ratcliffe S, Novakova I, Vachova M, Zapletalova O, Gasperini C, Pozzilli C, Cefaro L, Comi G, et al. A randomized, double-blind, placebo-controlled, parallel-group, enriched-design study of nabiximols* (sativex((R))), as add-on therapy, in subjects with refractory spasticity caused by multiple sclerosis. Eur J Neurol 2011 09;18(1468-1331; 1351-5101; 9):1122-31.
- Reference 609
-
Goldenberg M, Reid MW, IsHak WW, Danovitch I. The impact of cannabis and cannabinoids for medical conditions on health-related quality of life: A systematic review and meta-analysis. Drug Alcohol Depend 2017 May 1;174:80-90.
- Reference 610
-
Navari RM. Pharmacological management of chemotherapy-induced nausea and vomiting: Focus on recent developments. Drugs 2009;69(0012-6667; 0012-6667; 5):515-33.
- Reference 611
-
Jordan K, Kasper C, Schmoll HJ. Chemotherapy-induced nausea and vomiting: Current and new standards in the antiemetic prophylaxis and treatment. Eur J Cancer 2005 Jan;41(2):199-205.
- Reference 612
-
Bovbjerg DH. The continuing problem of post chemotherapy nausea and vomiting: Contributions of classical conditioning. Auton Neurosci 2006 Oct 30;129(1-2):92-8.
- Reference 613
-
Rock EM, Limebeer CL, Parker LA. Anticipatory nausea in animal models: A review of potential novel therapeutic treatments. Exp Brain Res 2014 Aug;232(8):2511-34.
- Reference 614
-
Limebeer CL, Rock EM, Mechoulam R, Parker LA. The anti-nausea effects of CB1 agonists are mediated by an action at the visceral insular cortex. Br J Pharmacol 2012 Nov;167(5):1126-36.
- Reference 615
-
Rock EM, Limebeer CL, Navaratnam R, Sticht MA, Bonner N, Engeland K, Downey R, Morris H, Jackson M, Parker LA. A comparison of cannabidiolic acid with other treatments for anticipatory nausea using a rat model of contextually elicited conditioned gaping. Psychopharmacology (Berl) 2014 Aug;231(16):3207-15.
- Reference 616
-
Rock EM, Kopstick RL, Limebeer CL, Parker LA. Tetrahydrocannabinolic acid reduces nausea-induced conditioned gaping in rats and vomiting in suncus murinus. Br J Pharmacol 2013 Oct;170(3):641-8.
- Reference 617
-
Rock EM, Parker LA. Suppression of lithium chloride-induced conditioned gaping (a model of nausea-induced behaviour) in rats (using the taste reactivity test) with metoclopramide is enhanced by cannabidiolic acid. Pharmacol Biochem Behav 2013 Oct;111:84-9.
- Reference 618
-
Rock EM, Parker LA. Effect of low doses of cannabidiolic acid and ondansetron on LiCl-induced conditioned gaping (a model of nausea-induced behaviour) in rats. Br J Pharmacol 2013 Jun;169(3):685-92.
- Reference 619
-
Rock EM, Sticht MA, Duncan M, Stott C, Parker LA. Evaluation of the potential of the phytocannabinoids, cannabidivarin (CBDV) and delta(9) -tetrahydrocannabivarin (THCV), to produce CB1 receptor inverse agonism symptoms of nausea in rats. Br J Pharmacol 2013 Oct;170(3):671-8.
- Reference 620
-
Rock EM, Bolognini D, Limebeer CL, Cascio MG, Anavi-Goffer S, Fletcher PJ, Mechoulam R, Pertwee RG, Parker LA. Cannabidiol, a non-psychotropic component of cannabis, attenuates vomiting and nausea-like behaviour via indirect agonism of 5-HT(1A) somatodendritic autoreceptors in the dorsal raphe nucleus. Br J Pharmacol 2012 04;165(1476-5381; 0007-1188; 8):2620-34.
- Reference 621
-
Rock EM, Goodwin JM, Limebeer CL, Breuer A, Pertwee RG, Mechoulam R, Parker LA. Interaction between non-psychotropic cannabinoids in marihuana: Effect of cannabigerol (CBG) on the anti-nausea or anti-emetic effects of cannabidiol (CBD) in rats and shrews. Psychopharmacology (Berl) 2011 06;215(1432-2072; 0033-3158; 3):505-12.
- Reference 622
-
Hornby PJ. Central neurocircuitry associated with emesis. Am J Med 2001 12/03;111 Suppl 8A(0002-9343; 0002-9343):106S-12S.
- Reference 623
-
Van Sickle MD, Duncan M, Kingsley PJ, Mouihate A, Urbani P, Mackie K, Stella N, Makriyannis A, Piomelli D, Davison JS, et al. Identification and functional characterization of brainstem cannabinoid CB2 receptors. Science 2005 10/14;310(1095-9203; 0036-8075; 5746):329-32.
- Reference 624
-
Darmani NA. The cannabinoid CB1 receptor antagonist SR 141716A reverses the antiemetic and motor depressant actions of WIN 55, 212-2. Eur J Pharmacol 2001 10/26;430(0014-2999; 0014-2999; 1):49-58.
- Reference 625
-
Limebeer CL, Abdullah RA, Rock EM, Imhof E, Wang K, Lichtman AH, Parker LA. Attenuation of anticipatory nausea in a rat model of contextually elicited conditioned gaping by enhancement of the endocannabinoid system. Psychopharmacology (Berl) 2014 Feb;231(3):603-12.
- Reference 626
-
Barann M, Molderings G, Bruss M, Bonisch H, Urban BW, Gothert M. Direct inhibition by cannabinoids of human 5-HT3A receptors: Probable involvement of an allosteric modulatory site. Br J Pharmacol 2002 11;137(0007-1188; 5):589-96.
- Reference 627
-
Rock EM, Limebeer CL, Parker LA. Effect of combined doses of delta-tetrahydrocannabinol (THC) and cannabidiolic acid (CBDA) on acute and anticipatory nausea using rat (sprague- dawley) models of conditioned gaping. Psychopharmacology (Berl) 2015 Sep 18.
- Reference 628
-
Rock EM, Parker LA. Synergy between cannabidiol, cannabidiolic acid, and delta(9)-tetrahydrocannabinol in the regulation of emesis in the suncus murinus (house musk shrew). Behav Neurosci 2015 Jun;129(3):368-70.
- Reference 629
-
Ahmed SA, Ross SA, Slade D, Radwan MM, Zulfiqar F, Matsumoto RR, Xu YT, Viard E, Speth RC, Karamyan VT, et al. Cannabinoid ester constituents from high-potency cannabis sativa. J Nat Prod 2008 Apr;71(4):536-42.
- Reference 630
-
Grunfeld Y, Edery H. Psychopharmacological activity of the active constituents of hashish and some related cannabinoids. Psychopharmacologia 1969;14(3):200-10.
- Reference 631
-
Machado Rocha FC, Stefano SC, De Cassia HR, Rosa Oliveira LM, Da Silveira DX. Therapeutic use of cannabis sativa on chemotherapy-induced nausea and vomiting among cancer patients: Systematic review and meta-analysis. Eur J Cancer Care (Engl) 2008 09;17(1365-2354; 0961-5423; 5):431-43.
- Reference 632
-
Meiri E, Jhangiani H, Vredenburgh JJ, Barbato LM, Carter FJ, Yang HM, Baranowski V. Efficacy of dronabinol alone and in combination with ondansetron versus ondansetron alone for delayed chemotherapy-induced nausea and vomiting. Curr Med Res Opin 2007 03;23(1473-4877; 0300-7995; 3):533-43.
- Reference 633
-
Kwiatkowska M, Parker LA, Burton P, Mechoulam R. A comparative analysis of the potential of cannabinoids and ondansetron to suppress cisplatin-induced emesis in the suncus murinus (house musk shrew). Psychopharmacology (Berl) 2004 07;174(0033-3158; 0033-3158; 2):254-9.
- Reference 634
-
Wang Y, Ray AP, McClanahan BA, Darmani NA. The antiemetic interaction of Delta9-tetrahydrocannabinol when combined with tropisetron or dexamethasone in the least shrew. Pharmacol Biochem Behav 2009 01;91(0091-3057; 0091-3057; 3):367-73.
- Reference 635
-
Elder JJ, Knoderer HM. Characterization of dronabinol usage in a pediatric oncology population. J Pediatr Pharmacol Ther 2015 Nov-Dec;20(6):462-7.
- Reference 636
-
Institute of Medicine. The medical value of marijuana and related substances. In: J. E. Joy, S. J. Watson, J. A. Benson, editors. Marijuana and medicine: Assessing the science base. Washington, DC: National Academy Press; 1999. ID: 2372; RP: NOT IN FILE.
- Reference 637
-
Health Department of New South Wales,Australia. Working party on the use of cannabis for medical purposes.; 2000. Report nr 2:ID: 2373; RP: NOT IN FILE.
- Reference 638
-
Herrstedt J, Dombernowsky P. Anti-emetic therapy in cancer chemotherapy: Current status. Basic Clin.Pharmacol.Toxicol. 2007 09;101(1742-7835; 3):143-50.
- Reference 639
-
Canadian Pharmacists Association. Compendium of pharmaceuticals and specialties. Ottawa: Canadian Pharmacists Association; 2009. ID: 2537; RP: NOT IN FILE.
- Reference 640
-
National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology. 2010.
- Reference 641
-
Clary PL, Lawson P. Pharmacologic pearls for end-of-life care. Am Fam Physician 2009 06/15;79(0002-838; 0002-838; 12):1059-65.
- Reference 642
-
Smit E, Crespo CJ. Dietary intake and nutritional status of US adult marijuana users: Results from the third national health and nutrition examination survey. Public Health Nutr 2001 06;4(1368-9800; 3):781-6.
- Reference 643
-
Di Marzo V, Matias I. Endocannabinoid control of food intake and energy balance. Nat Neurosci 2005 05;8(1097-6256; 1097-6256; 5):585-9.
- Reference 644
-
Matias I, Bisogno T, Di M,V. Endogenous cannabinoids in the brain and peripheral tissues: Regulation of their levels and control of food intake. Int.J.Obes.(Lond) 2006 04;30 Suppl 1(0307-0565):S7-S12.
- Reference 645
-
Tibirica E. The multiple functions of the endocannabinoid system: A focus on the regulation of food intake. Diabetol.Metab Syndr. 2010;2(1758-5996):5-10.
- Reference 646
-
Farrimond JA, Mercier MS, Whalley BJ, Williams CM. Cannabis sativa and the endogenous cannabinoid system: Therapeutic potential for appetite regulation. Phytother Res 2011 02;25(1099-1573; 0951-418; 2):170-88.
- Reference 647
-
Timpone JG, Wright DJ, Li N, Egorin MJ, Enama ME, Mayers J, Galetto G. The safety and pharmacokinetics of single-agent and combination therapy with megestrol acetate and dronabinol for the treatment of HIV wasting syndrome. the DATRI 004 study group. division of AIDS treatment research initiative. AIDS Res Hum Retroviruses 1997 03/01;13(0889-2229; 0889-2229; 4):305-15.
- Reference 648
-
Beal JE, Olson R, Laubenstein L, Morales JO, Bellman P, Yangco B, Lefkowitz L, Plasse TF, Shepard KV. Dronabinol as a treatment for anorexia associated with weight loss in patients with AIDS. J Pain Symptom Manage 1995 02;10(0885-3924; 2):89-97.
- Reference 649
-
Beal JE, Olson R, Lefkowitz L, Laubenstein L, Bellman P, Yangco B, Morales JO, Murphy R, Powderly W, Plasse TF, et al. Long-term efficacy and safety of dronabinol for acquired immunodeficiency syndrome-associated anorexia. J Pain Symptom Manage 1997 07;14(0885-3924; 1):7-14.
- Reference 650
-
Abrams DI, Hilton JF, Leiser RJ, Shade SB, Elbeik TA, Aweeka FT, Benowitz NL, Bredt BM, Kosel B, Aberg JA, et al. Short-term effects of cannabinoids in patients with HIV-1 infection: A randomized, placebo-controlled clinical trial. Ann Intern Med 2003 08/19;139(1539-3704; 4):258-66.
- Reference 651
-
Ravinet-Trillou C, Delgorge C, Menet C, Arnone M, Soubrie P. CB1 cannabinoid receptor knockout in mice leads to leanness, resistance to diet-induced obesity and enhanced leptin sensitivity. Int J Obes Relat Metab Disord 2004 04;28(0307-0565; 0307-0565; 4):640-8.
- Reference 652
-
Riggs PK, Vaida F, Rossi SS, Sorkin LS, Gouaux B, Grant I, Ellis RJ. A pilot study of the effects of cannabis on appetite hormones in HIV-infected adult men. Brain Res 2012 Jan 11;1431:46-52.
- Reference 653
-
Tchekmedyian NS, Zahyna D, Halpert C, Heber D. Clinical aspects of nutrition in advanced cancer. Oncology 1992;49 Suppl 2(0030-2414; 0030-2414):3-7.
- Reference 654
-
Walsh D, Donnelly S, Rybicki L. The symptoms of advanced cancer: Relationship to age, gender, and performance status in 1,000 patients. Support Care Cancer 2000 05;8(0941-4355; 0941-4355; 3):175-9.
- Reference 655
-
Mantovani G. Randomised phase III clinical trial of 5 different arms of treatment on 332 patients with cancer cachexia. Eur Rev Med Pharmacol Sci 2010 04;14(1128-3602; 1128-3602; 4):292-301.
- Reference 656
-
Monteleone P, Matias I, Martiadis V, De PL, Maj M, Di M,V. Blood levels of the endocannabinoid anandamide are increased in anorexia nervosa and in binge-eating disorder, but not in bulimia nervosa. Neuropsychopharmacology 2005 06;30(0893-133; 0006-3223; 6):1216-21.
- Reference 657
-
Monteleone P, Maj M. Dysfunctions of leptin, ghrelin, BDNF and endocannabinoids in eating disorders: Beyond the homeostatic control of food intake. Psychoneuroendocrinology 2013 Mar;38(3):312-30.
- Reference 658
-
Siegfried Z, Kanyas K, Latzer Y, Karni O, Bloch M, Lerer B, Berry EM. Association study of cannabinoid receptor gene (CNR1) alleles and anorexia nervosa: Differences between restricting and binging/purging subtypes. Am.J.Med.Genet.B Neuropsychiatr.Genet. 2004 02/15;125B(1552-4841; 1):126-30.
- Reference 659
-
Muller TD, Reichwald K, Bronner G, Kirschner J, Nguyen TT, Scherag A, Herzog W, Herpertz-Dahlmann B, Lichtner P, Meitinger T, et al. Lack of association of genetic variants in genes of the endocannabinoid system with anorexia nervosa. Child Adolesc.Psychiatry Ment.Health 2008;2(1753-2000; 1753-2000; 1):33-9.
- Reference 660
-
Lewis DY, Brett RR. Activity-based anorexia in C57/BL6 mice: Effects of the phytocannabinoid, Delta9-tetrahydrocannabinol (THC) and the anandamide analogue, OMDM-2. Eur Neuropsychopharmacol 2010 09;20(1873-7862; 0924-977; 9):622-31.
- Reference 661
-
Verty AN, Evetts MJ, Crouch GJ, McGregor IS, Stefanidis A, Oldfield BJ. The cannabinoid receptor agonist THC attenuates weight loss in a rodent model of activity-based anorexia. Neuropsychopharmacology 2011 06;36(1740-634; 0006-3223; 7):1349-58.
- Reference 662
-
Pryce G, Baker D. Endocannabinoids in multiple sclerosis and amyotrophic lateral sclerosis. Handb Exp Pharmacol 2015;231:213-31.
- Reference 663
-
Baker D, Pryce G, Jackson SJ, Bolton C, Giovannoni G. The biology that underpins the therapeutic potential of cannabis-based medicines for the control of spasticity in multiple sclerosis. Mult Scler Relat Disord 2012 Apr;1(2):64-75.
- Reference 664
-
Moreno-Martet M, Espejo-Porras F, Fernandez-Ruiz J, de Lago E. Changes in endocannabinoid receptors and enzymes in the spinal cord of SOD1(G93A) transgenic mice and evaluation of a sativex((R)) -like combination of phytocannabinoids: Interest for future therapies in amyotrophic lateral sclerosis. CNS Neurosci Ther 2014 Sep;20(9):809-15.
- Reference 665
-
Souza PVSd, Pinto WBVdR, Chieia MAT, Oliveira ASB. Clinical and genetic basis of familial amyotrophic lateral sclerosis. Arquivos De Neuro-Psiquiatria 2015;73(12):1026.
- Reference 666
-
Koppel BS, Brust JC, Fife T, Bronstein J, Youssof S, Gronseth G, Gloss D. Systematic review: Efficacy and safety of medical marijuana in selected neurologic disorders: Report of the guideline development subcommittee of the american academy of neurology. Neurology 2014 Apr 29;82(17):1556-63.
- Reference 667
-
Baker D, Pryce G, Croxford JL, Brown P, Pertwee RG, Huffman JW, Layward L. Cannabinoids control spasticity and tremor in a multiple sclerosis model. Nature 2000 03/02;404(0028-0836; 0028-0836; 6773):84-7.
- Reference 668
-
Centonze D, Rossi S, Finazzi-Agro A, Bernardi G, Maccarrone M. The (endo)cannabinoid system in multiple sclerosis and amyotrophic lateral sclerosis. Int Rev Neurobiol 2007;82(0074-7742; 0074-7742):171-86.
- Reference 669
-
Di Filippo M, Pini LA, Pelliccioli GP, Calabresi P, Sarchielli P. Abnormalities in the cerebrospinal fluid levels of endocannabinoids in multiple sclerosis. J Neurol Neurosurg Psychiatr 2008 11;79(1468-330; 0022-3050; 11):1224-9.
- Reference 670
-
Jean-Gilles L, Feng S, Tench CR, Chapman V, Kendall DA, Barrett DA, Constantinescu CS. Plasma endocannabinoid levels in multiple sclerosis. J Neurol Sci 2009 12/15;287(1878-5883; 0022-510; 1-2):212-5.
- Reference 671
-
Pertwee RG. Cannabinoids and multiple sclerosis. Mol Neurobiol 2007 08;36(0893-7648; 0893-7648; 1):45-59.
- Reference 672
-
Lyman WD, Sonett JR, Brosnan CF, Elkin R, Bornstein MB. Delta 9-tetrahydrocannabinol: A novel treatment for experimental autoimmune encephalomyelitis. J Neuroimmunol 1989 06;23(0165-5728; 0165-5728; 1):73-81.
- Reference 673
-
Maresz K, Pryce G, Ponomarev ED, Marsicano G, Croxford JL, Shriver LP, Ledent C, Cheng X, Carrier EJ, Mann MK, et al. Direct suppression of CNS autoimmune inflammation via the cannabinoid receptor CB1 on neurons and CB2 on autoreactive T cells. Nat Med 2007 04;13(1078-8956; 1078-8956; 4):492-7.
- Reference 674
-
Pryce G, Baker D. Control of spasticity in a multiple sclerosis model is mediated by CB1, not CB2, cannabinoid receptors. Br J Pharmacol 2007 02;150(0007-1188; 0007-1188; 4):519-25.
- Reference 675
-
Croxford JL, Pryce G, Jackson SJ, Ledent C, Giovannoni G, Pertwee RG, Yamamura T, Baker D. Cannabinoid-mediated neuroprotection, not immunosuppression, may be more relevant to multiple sclerosis. J Neuroimmunol 2008 01;193(0165-5728; 0165-5728; 1-2):120-9.
- Reference 676
-
Feliu A, Moreno-Martet M, Mecha M, Carrillo-Salinas FJ, de Lago E, Fernandez-Ruiz J, Guaza C. A sativex((R)) -like combination of phytocannabinoids as a disease-modifying therapy in a viral model of multiple sclerosis. Br J Pharmacol 2015 Jul;172(14):3579-95.
- Reference 677
-
Moreno-Martet M, Feliu A, Espejo-Porras F, Mecha M, Carrillo-Salinas FJ, Fernandez-Ruiz J, Guaza C, de Lago E. The disease-modifying effects of a sativex-like combination of phytocannabinoids in mice with experimental autoimmune encephalomyelitis are preferentially due to Delta9-tetrahydrocannabinol acting through CB1 receptors. Mult Scler Relat Disord 2015 Nov;4(6):505-11.
- Reference 678
-
Consroe P, Sandyk R. Therapeutic potential of cannabinoids in neurological disorders. In: R. Mechoulam, editor. Marijuana/Cannabinoids as therapeutic agents. Boca Raton, FL: CRC Press; 1986. ID: 2378; RP: NOT IN FILE.
- Reference 679
-
Chong MS, Wolff K, Wise K, Tanton C, Winstock A, Silber E. Cannabis use in patients with multiple sclerosis. Mult Scler 2006 10;12(1352-4585; 1352-4585; 5):646-51.
- Reference 680
-
Zajicek JP, Sanders HP, Wright DE, Vickery PJ, Ingram WM, Reilly SM, Nunn AJ, Teare LJ, Fox PJ, Thompson AJ. Cannabinoids in multiple sclerosis (CAMS) study: Safety and efficacy data for 12 months follow up. J Neurol Neurosurg Psychiatr 2005 12;76(0022-3050; 12):1664-9.
- Reference 681
-
Vaney C, Heinzel-Gutenbrunner M, Jobin P, Tschopp F, Gattlen B, Hagen U, Schnelle M, Reif M. Efficacy, safety and tolerability of an orally administered cannabis extract in the treatment of spasticity in patients with multiple sclerosis: A randomized, double-blind, placebo-controlled, crossover study. Mult Scler 2004 08;10(1352-4585; 4):417-24.
- Reference 682
-
Wade DT, Makela PM, House H, Bateman C, Robson P. Long-term use of a cannabis-based medicine in the treatment of spasticity and other symptoms in multiple sclerosis. Mult Scler 2006 10;12(1352-4585; 5):639-45.
- Reference 683
-
Collin C, Davies P, Mutiboko IK, Ratcliffe S. Randomized controlled trial of cannabis-based medicine in spasticity caused by multiple sclerosis. Eur J Neurol 2007 03;14(1468-1331; 3):290-6.
- Reference 684
-
Hobart JC, Riazi A, Thompson AJ, Styles IM, Ingram W, Vickery PJ, Warner M, Fox PJ, Zajicek JP. Getting the measure of spasticity in multiple sclerosis: The multiple sclerosis spasticity scale (MSSS-88). Brain 2006 01;129(1460-2156; 0006-8950):224-34.
- Reference 685
-
Flachenecker P, Henze T, Zettl UK. Nabiximols (THC/CBD oromucosal spray, sativex(R)) in clinical practice--results of a multicenter, non-interventional study (MOVE 2) in patients with multiple sclerosis spasticity. Eur Neurol 2014;71(5-6):271-9.
- Reference 686
-
Flachenecker P, Henze T, Zettl UK. Long-term effectiveness and safety of nabiximols (tetrahydrocannabinol/cannabidiol oromucosal spray) in clinical practice. Eur Neurol 2014;72(1-2):95-102.
- Reference 687
-
Freidel M, Tiel-Wilck K, Schreiber H, Prechtl A, Essner U, Lang M. Drug-resistant MS spasticity treatment with sativex((R)) add-on and driving ability. Acta Neurol Scand 2015 Jan;131(1):9-16.
- Reference 688
-
Coghe G, Pau M, Corona F, Frau J, Lorefice L, Fenu G, Spinicci G, Mamusa E, Musu L, Massole S, et al. Walking improvements with nabiximols in patients with multiple sclerosis. J Neurol 2015 Nov;262(11):2472-7.
- Reference 689
-
Leocani L, Nuara A, Houdayer E, Schiavetti I, Del Carro U, Amadio S, Straffi L, Rossi P, Martinelli V, Vila C, et al. Sativex((R)) and clinical-neurophysiological measures of spasticity in progressive multiple sclerosis. J Neurol 2015 Nov;262(11):2520-7.
- Reference 690
-
Ferre L, Nuara A, Pavan G, Radaelli M, Moiola L, Rodegher M, Colombo B, Keller Sarmiento IJ, Martinelli V, Leocani L, et al. Efficacy and safety of nabiximols (sativex((R))) on multiple sclerosis spasticity in a real-life italian monocentric study. Neurol Sci 2016 Feb;37(2):235-42.
- Reference 691
-
Ball S, Vickery J, Hobart J, Wright D, Green C, Shearer J, Nunn A, Cano MG, MacManus D, Miller D, et al. The cannabinoid use in progressive inflammatory brain disease (CUPID) trial: A randomised double-blind placebo-controlled parallel-group multicentre trial and economic evaluation of cannabinoids to slow progression in multiple sclerosis. Health Technol Assess 2015 Feb;19(12):vii,viii, xxv-xxxi, 1-187.
- Reference 692
-
Zajicek JP, Hobart JC, Slade A, Barnes D, Mattison PG. MUltiple sclerosis and extract of cannabis: Results of the MUSEC trial. J Neurol Neurosurg Psychiatr 2012 11;83(1468-330; 0022-3050; 11):1125-32.
- Reference 693
-
Killestein J, Hoogervorst EL, Reif M, Kalkers NF, Van Loenen AC, Staats PG, Gorter RW, Uitdehaag BM, Polman CH. Safety, tolerability, and efficacy of orally administered cannabinoids in MS. Neurology 2002 05/14;58(0028-3878; 0028-3878; 9):1404-7.
- Reference 694
-
Aragona M, Onesti E, Tomassini V, Conte A, Gupta S, Gilio F, Pantano P, Pozzilli C, Inghilleri M. Psychopathological and cognitive effects of therapeutic cannabinoids in multiple sclerosis: A double-blind, placebo controlled, crossover study. Clin Neuropharmacol 2009 01;32(1537-162; 0362-5664; 1):41-7.
- Reference 695
-
Pavisian B, MacIntosh BJ, Szilagyi G, Staines RW, O'Connor P, Feinstein A. Effects of cannabis on cognition in patients with MS: A psychometric and MRI study. Neurology 2014 May 27;82(21):1879-87.
- Reference 696
-
Romero K, Pavisian B, Staines WR, Feinstein A. Multiple sclerosis, cannabis, and cognition: A structural MRI study. Neuroimage Clin 2015 Apr 9;8:140-7.
- Reference 697
-
Freeman RM, Adekanmi O, Waterfield MR, Waterfield AE, Wright D, Zajicek J. The effect of cannabis on urge incontinence in patients with multiple sclerosis: A multicentre, randomised placebo-controlled trial (CAMS-LUTS). Int Urogynecol J Pelvic Floor Dysfunct 2006 11;17(0937-3462; 0937-3462; 6):636-41.
- Reference 698
-
Sliwa JA, Bell HK, Mason KD, Gore RM, Nanninga J, Cohen B. Upper urinary tract abnormalities in multiple sclerosis patients with urinary symptoms. Arch Phys Med Rehabil 1996 03;77(0003-9993; 0003-9993; 3):247-51.
- Reference 699
-
Brady CM, DasGupta R, Dalton C, Wiseman OJ, Berkley KJ, Fowler CJ. An open-label pilot study of cannabis-based extracts for bladder dysfunction in advanced multiple sclerosis. Mult Scler 2004 08;10(1352-4585; 1352-4585; 4):425-33.
- Reference 700
-
Rossi S, Bernardi G, Centonze D. The endocannabinoid system in the inflammatory and neurodegenerative processes of multiple sclerosis and of amyotrophic lateral sclerosis. Exp Neurol 2010 07;224(1090-2430; 0014-4886; 1):92-102.
- Reference 701
-
Amtmann D, Weydt P, Johnson KL, Jensen MP, Carter GT. Survey of cannabis use in patients with amyotrophic lateral sclerosis. Am J Hosp Palliat Care 2004 03;21(1049-9091; 1049-9091; 2):95-104.
- Reference 702
-
Weber M, Goldman B, Truniger S. Tetrahydrocannabinol (THC) for cramps in amyotrophic lateral sclerosis: A randomised, double-blind crossover trial. J Neurol Neurosurg Psychiatr 2010 05/24;81(1468-330; 0022-3050; 10):1135-40.
- Reference 703
-
Gelinas DF, Miller RG, Abood M. Pilot study of safety and tolerability of delta 9-THC (marinol) treatment for ALS. Amyotroph Lateral Scler Other Motor Neuron Disord 2002;3(2):23-4.
- Reference 704
-
Arevalo-Martin A, Molina-Holgado E, Garcia-Ovejero D. Cannabinoids to treat spinal cord injury. Prog Neuropsychopharmacol Biol Psychiatry 2016 Jan 4;64:190-9.
- Reference 705
-
Garcia-Ovejero D, Arevalo-Martin A, Petrosino S, Docagne F, Hagen C, Bisogno T, Watanabe M, Guaza C, Di M,V, Molina-Holgado E. The endocannabinoid system is modulated in response to spinal cord injury in rats. Neurobiol Dis 2009 01;33(1095-953; 0969-9961; 1):57-71.
- Reference 706
-
Hama A, Sagen J. Antinociceptive effect of cannabinoid agonist WIN 55,212-2 in rats with a spinal cord injury. Exp Neurol 2007 03;204(0014-4886; 0014-4886; 1):454-7.
- Reference 707
-
Hama A, Sagen J. Sustained antinociceptive effect of cannabinoid receptor agonist WIN 55,212-2 over time in rat model of neuropathic spinal cord injury pain. J Rehabil Res Dev 2009;46(1938-1352; 0748-7711; 1):135-43.
- Reference 708
-
Kwiatkoski M, Guimaraes FS, Del-Bel E. Cannabidiol-treated rats exhibited higher motor score after cryogenic spinal cord injury. Neurotox Res 2012 Apr;21(3):271-80.
- Reference 709
-
Malec J, Harvey RF, Cayner JJ. Cannabis effect on spasticity in spinal cord injury. Arch Phys Med Rehabil 1982 03;63(0003-9993; 0003-9993; 3):116-8.
- Reference 710
-
Maurer M, Henn V, Dittrich A, Hofmann A. Delta-9-tetrahydrocannabinol shows antispastic and analgesic effects in a single case double-blind trial. Eur Arch Psychiatry Clin Neurosci 1990;240(0940-1334; 0940-1334; 1):1-4.
- Reference 711
-
Wade DT, Robson P, House H, Makela P, Aram J. A preliminary controlled study to determine whether whole-plant cannabis extracts can improve intractable neurogenic symptoms. Clin Rehabil 2003 02;17(0269-2155; 0269-2155; 1):21-9.
- Reference 712
-
Hagenbach U, Luz S, Ghafoor N, Berger JM, Grotenhermen F, Brenneisen R, Mader M. The treatment of spasticity with Delta9-tetrahydrocannabinol in persons with spinal cord injury. Spinal Cord 2007 08;45(1362-4393; 1362-4393; 8):551-62.
- Reference 713
-
Pooyania S, Ethans K, Szturm T, Casey A, Perry D. A randomized, double-blinded, crossover pilot study assessing the effect of nabilone on spasticity in persons with spinal cord injury. Arch Phys Med Rehabil 2010 05;91(1532-821; 0003-9993; 5):703-7.
- Reference 714
-
Amada N, Yamasaki Y, Williams CM, Whalley BJ. Cannabidivarin (CBDV) suppresses pentylenetetrazole (PTZ)-induced increases in epilepsy-related gene expression. PeerJ 2013 Nov 21;1:e214.
- Reference 715
-
Fisher RS, van Emde Boas W, Blume W, Elger C, Genton P, Lee P, Engel J,Jr. Epileptic seizures and epilepsy: Definitions proposed by the international league against epilepsy (ILAE) and the international bureau for epilepsy (IBE). Epilepsia 2005 Apr;46(4):470-2.
- Reference 716
-
Hill TD, Cascio MG, Romano B, Duncan M, Pertwee RG, Williams CM, Whalley BJ, Hill AJ. Cannabidivarin-rich cannabis extracts are anticonvulsant in mouse and rat via a CB1 receptor-independent mechanism. Br J Pharmacol 2013 Oct;170(3):679-92.
- Reference 717
-
Detyniecki K, Hirsch L. Marijuana use in epilepsy: The myth and the reality. Curr Neurol Neurosci Rep 2015 Oct;15(10):65,015-0586-5.
- Reference 718
-
Vilela LR, Medeiros DC, Rezende GH, de Oliveira AC, Moraes MF, Moreira FA. Effects of cannabinoids and endocannabinoid hydrolysis inhibition on pentylenetetrazole-induced seizure and electroencephalographic activity in rats. Epilepsy Res 2013 May;104(3):195-202.
- Reference 719
-
Karlocai MR, Toth K, Watanabe M, Ledent C, Juhasz G, Freund TF, Magloczky Z. Redistribution of CB1 cannabinoid receptors in the acute and chronic phases of pilocarpine-induced epilepsy. PLoS One 2011;6(11):e27196.
- Reference 720
-
Magloczky Z, Toth K, Karlocai R, Nagy S, Eross L, Czirjak S, Vajda J, Rasonyi G, Kelemen A, Juhos V, et al. Dynamic changes of CB1-receptor expression in hippocampi of epileptic mice and humans. Epilepsia 2010 Jul;51 Suppl 3:115-20.
- Reference 721
-
Romigi A, Bari M, Placidi F, Marciani MG, Malaponti M, Torelli F, Izzi F, Prosperetti C, Zannino S, Corte F, et al. Cerebrospinal fluid levels of the endocannabinoid anandamide are reduced in patients with untreated newly diagnosed temporal lobe epilepsy. Epilepsia 2010 05;51(1528-1167; 0013-9580; 5):768-72.
- Reference 722
-
Falenski KW, Blair RE, Sim-Selley LJ, Martin BR, DeLorenzo RJ. Status epilepticus causes a long-lasting redistribution of hippocampal cannabinoid type 1 receptor expression and function in the rat pilocarpine model of acquired epilepsy. Neuroscience 2007 05/25;146(0306-4522; 0306-4522; 3):1232-44.
- Reference 723
-
Ludanyi A, Eross L, Czirjak S, Vajda J, Halasz P, Watanabe M, Palkovits M, Magloczky Z, Freund TF, Katona I. Downregulation of the CB1 cannabinoid receptor and related molecular elements of the endocannabinoid system in epileptic human hippocampus. J Neurosci 2008 03/19;28(1529-2401; 0270-6474; 12):2976-90.
- Reference 724
-
Falenski KW, Carter DS, Harrison AJ, Martin BR, Blair RE, DeLorenzo RJ. Temporal characterization of changes in hippocampal cannabinoid CB(1) receptor expression following pilocarpine-induced status epilepticus. Brain Res 2009 03/25;1262(1872-6240; 0006-8993):64-72.
- Reference 725
-
Coiret G, Ster J, Grewe B, Wendling F, Helmchen F, Gerber U, Benquet P. Neuron to astrocyte communication via cannabinoid receptors is necessary for sustained epileptiform activity in rat hippocampus. PLoS One 2012;7(5):e37320.
- Reference 726
-
Szaflarski JP, Bebin EM. Cannabis, cannabidiol, and epilepsy--from receptors to clinical response. Epilepsy Behav 2014 Dec;41:277-82.
- Reference 727
-
Citraro R, Russo E, Ngomba RT, Nicoletti F, Scicchitano F, Whalley BJ, Calignano A, De Sarro G. CB1 agonists, locally applied to the cortico-thalamic circuit of rats with genetic absence epilepsy, reduce epileptic manifestations. Epilepsy Res 2013 Sep;106(1-2):74-82.
- Reference 728
-
Jones NA, Glyn SE, Akiyama S, Hill TD, Hill AJ, Weston SE, Burnett MD, Yamasaki Y, Stephens GJ, Whalley BJ, et al. Cannabidiol exerts anti-convulsant effects in animal models of temporal lobe and partial seizures. Seizure 2012 Jun;21(5):344-52.
- Reference 729
-
Bhaskaran MD, Smith BN. Cannabinoid-mediated inhibition of recurrent excitatory circuitry in the dentate gyrus in a mouse model of temporal lobe epilepsy. PLoS One 2010 May 17;5(5):e10683.
- Reference 730
-
Jones NA, Hill AJ, Smith I, Bevan SA, Williams CM, Whalley BJ, Stephens GJ. Cannabidiol displays antiepileptiform and antiseizure properties in vitro and in vivo. J Pharmacol Exp Ther 2010 Feb;332(2):569-77.
- Reference 731
-
Shafaroodi H, Samini M, Moezi L, Homayoun H, Sadeghipour H, Tavakoli S, Hajrasouliha AR, Dehpour AR. The interaction of cannabinoids and opioids on pentylenetetrazole-induced seizure threshold in mice. Neuropharmacology 2004 09;47(0028-3908; 3):390-400.
- Reference 732
-
Wallace MJ, Blair RE, Falenski KW, Martin BR, DeLorenzo RJ. The endogenous cannabinoid system regulates seizure frequency and duration in a model of temporal lobe epilepsy. J Pharmacol Exp Ther 2003 10;307(0022-3565; 1):129-37.
- Reference 733
-
Clement AB, Hawkins EG, Lichtman AH, Cravatt BF. Increased seizure susceptibility and proconvulsant activity of anandamide in mice lacking fatty acid amide hydrolase. J Neurosci 2003 05/01;23(1529-2401; 9):3916-23.
- Reference 734
-
Wallace MJ, Martin BR, DeLorenzo RJ. Evidence for a physiological role of endocannabinoids in the modulation of seizure threshold and severity. Eur J Pharmacol 2002 10/11;452(0014-2999; 3):295-301.
- Reference 735
-
Alger BE. Retrograde signaling in the regulation of synaptic transmission: Focus on endocannabinoids. Prog Neurobiol 2002 11;68(0301-0082; 4):247-86.
- Reference 736
-
Smith PF. Cannabinoids as potential anti-epileptic drugs. Curr Opin Investig Drugs 2005 07;6(1472-4472; 7):680-5.
- Reference 737
-
Mechoulam R, Lichtman AH. Neuroscience. stout guards of the central nervous system. Science 2003 10/03;302(1095-9203; 5642):65-7.
- Reference 738
-
Hoffman AF, Lupica CR. Mechanisms of cannabinoid inhibition of GABA(A) synaptic transmission in the hippocampus. J Neurosci 2000 04/01;20(1529-2401; 7):2470-9.
- Reference 739
-
Nakatsuka T, Chen HX, Roper SN, Gu JG. Cannabinoid receptor-1 activation suppresses inhibitory synaptic activity in human dentate gyrus. Neuropharmacology 2003 07;45(0028-3908; 1):116-21.
- Reference 740
-
Hill AJ, Weston SE, Jones NA, Smith I, Bevan SA, Williamson EM, Stephens GJ, Williams CM, Whalley BJ. Delta-tetrahydrocannabivarin suppresses in vitro epileptiform and in vivo seizure activity in adult rats. Epilepsia 2010 08;51(1528-1167; 0013-9580; 8):1522-32.
- Reference 741
-
Consroe P, Wolkin A. Cannabidiol--antiepileptic drug comparisons and interactions in experimentally induced seizures in rats. J Pharmacol Exp Ther 1977 Apr;201(1):26-32.
- Reference 742
-
Consroe P, Benedito MA, Leite JR, Carlini EA, Mechoulam R. Effects of cannabidiol on behavioral seizures caused by convulsant drugs or current in mice. Eur J Pharmacol 1982 Sep 24;83(3-4):293-8.
- Reference 743
-
Hill AJ, Mercier MS, Hill TD, Glyn SE, Jones NA, Yamasaki Y, Futamura T, Duncan M, Stott CG, Stephens GJ, et al. Cannabidivarin is anticonvulsant in mouse and rat. Br J Pharmacol 2012 Dec;167(8):1629-42.
- Reference 744
-
Dennis I, Whalley BJ, Stephens GJ. Effects of Delta9-tetrahydrocannabivarin on [35S]GTPgammaS binding in mouse brain cerebellum and piriform cortex membranes. Br J Pharmacol 2008 Jul;154(6):1349-58.
- Reference 745
-
Ma YL, Weston SE, Whalley BJ, Stephens GJ. The phytocannabinoid delta(9)-tetrahydrocannabivarin modulates inhibitory neurotransmission in the cerebellum. Br J Pharmacol 2008 May;154(1):204-15.
- Reference 746
-
Hill AJ, Jones NA, Smith I, Hill CL, Williams CM, Stephens GJ, Whalley BJ. Voltage-gated sodium (NaV) channel blockade by plant cannabinoids does not confer anticonvulsant effects per se. Neurosci Lett 2014 Apr 30;566:269-74.
- Reference 747
-
Hamerle M, Ghaeni L, Kowski A, Weissinger F, Holtkamp M. Cannabis and other illicit drug use in epilepsy patients. Eur J Neurol 2014;21(1):167-70.
- Reference 748
-
Gross DW, Hamm J, Ashworth NL, Quigley D. Marijuana use and epilepsy: Prevalence in patients of a tertiary care epilepsy center. Neurology 2004 Jun 8;62(11):2095-7.
- Reference 749
-
Ladino LD, Hernandez-Ronquillo L, Tellez-Zenteno JF. Medicinal marijuana for epilepsy: A case series study. Can J Neurol Sci 2014 Nov;41(6):753-8.
- Reference 750
-
Press CA, Knupp KG, Chapman KE. Parental reporting of response to oral cannabis extracts for treatment of refractory epilepsy. Epilepsy Behav 2015 Apr;45:49-52.
- Reference 751
-
Mechoulam R, Carlini EA. Toward drugs derived from cannabis. Naturwissenschaften 1978 Apr;65(4):174-9.
- Reference 752
-
Cunha JM, Carlini EA, Pereira AE, Ramos OL, Pimentel C, Gagliardi R, Sanvito WL, Lander N, Mechoulam R. Chronic administration of cannabidiol to healthy volunteers and epileptic patients. Pharmacology 1980;21(0031-7012; 3):175-85.
- Reference 753
-
Ames FR, Cridland S. Anticonvulsant effect of cannabidiol. S Afr Med J 1986 01/04;69(0256-9574; 1):14.
- Reference 754
-
Trembly B, Sherman M. Double-blind clinical study of cannabidiol as a secondary anticonvulsant. Proceedings of the Marijuana '90 International Conference on Cannabis and Cannabinoids 1990:5.
- Reference 755
-
Rubio M, Valdeolivas S, Piscitelli F, Verde R, Satta V, Barroso E, Montolio M, Aras LM, Di Marzo V, Sagredo O, et al. Analysis of endocannabinoid signaling elements and related proteins in lymphocytes of patients with dravet syndrome. Pharmacol Res Perspect 2016 Mar 5;4(2):e00220.
- Reference 756
-
Devinsky O, Patel AD, Cross JH, Villanueva V, Wirrell EC, Privitera M, Greenwood SM, Roberts C, Checketts D, VanLandingham KE, et al. Effect of cannabidiol on drop seizures in the lennox-gastaut syndrome. N Engl J Med 2018 May 17;378(20):1888-97.
- Reference 757
-
Stockings E, Zagic D, Campbell G, Weier M, Hall WD, Nielsen S, Herkes GK, Farrell M, Degenhardt L. Evidence for cannabis and cannabinoids for epilepsy: A systematic review of controlled and observational evidence. J Neurol Neurosurg Psychiatry 2018 Jul;89(7):741-53.
- Reference 758
-
Woodhams SG, Sagar DR, Burston JJ, Chapman V. The role of the endocannabinoid system in pain. Handb Exp Pharmacol 2015;227:119-43.
- Reference 759
-
Zogopoulos P, Vasileiou I, Patsouris E, Theocharis SE. The role of endocannabinoids in pain modulation. Fundam Clin Pharmacol 2013 Feb;27(1):64-80.
- Reference 760
-
Hama AT, Sagen J. Cannabinoid receptor-mediated antinociception with acetaminophen drug combinations in rats with neuropathic spinal cord injury pain. Neuropharmacology 2010 03;58(1873-7064; 0028-3908; 4-5):758-66.
- Reference 761
-
Rani Sagar D, Burston JJ, Woodhams SG, Chapman V. Dynamic changes to the endocannabinoid system in models of chronic pain. Philos Trans R Soc Lond B Biol Sci 2012 Dec 5;367(1607):3300-11.
- Reference 762
-
Agarwal N, Pacher P, Tegeder I, Amaya F, Constantin CE, Brenner GJ, Rubino T, Michalski CW, Marsicano G, Monory K, et al. Cannabinoids mediate analgesia largely via peripheral type 1 cannabinoid receptors in nociceptors. Nat Neurosci 2007 07;10(1097-6256; 1097-6256; 7):870-9.
- Reference 763
-
Guindon J, Beaulieu P. Antihyperalgesic effects of local injections of anandamide, ibuprofen, rofecoxib and their combinations in a model of neuropathic pain. Neuropharmacology 2006 Jun;50(7):814-23.
- Reference 764
-
Woodhams SG, Wong A, Barrett DA, Bennett AJ, Chapman V, Alexander SP. Spinal administration of the monoacylglycerol lipase inhibitor JZL184 produces robust inhibitory effects on nociceptive processing and the development of central sensitization in the rat. Br J Pharmacol 2012 Dec;167(8):1609-19.
- Reference 765
-
Sagar DR, Jhaveri MD, Richardson D, Gray RA, de LE, Fernandez-Ruiz J, Barrett DA, Kendall DA, Chapman V. Endocannabinoid regulation of spinal nociceptive processing in a model of neuropathic pain. Eur J Neurosci 2010 04;31(1460-9568; 0953-816; 8):1414-22.
- Reference 766
-
Pernia-Andrade AJ, Kato A, Witschi R, Nyilas R, Katona I, Freund TF, Watanabe M, Filitz J, Koppert W, Schuttler J, et al. Spinal endocannabinoids and CB1 receptors mediate C-fiber-induced heterosynaptic pain sensitization. Science 2009 Aug 7;325(5941):760-4.
- Reference 767
-
Herkenham M, Lynn AB, Johnson MR, Melvin LS, de Costa BR, Rice KC. Characterization and localization of cannabinoid receptors in rat brain: A quantitative in vitro autoradiographic study. J Neurosci 1991 Feb;11(2):563-83.
- Reference 768
-
Burns HD, Van Laere K, Sanabria-Bohorquez S, Hamill TG, Bormans G, Eng WS, Gibson R, Ryan C, Connolly B, Patel S, et al. 18F]MK-9470, a positron emission tomography (PET) tracer for in vivo human PET brain imaging of the cannabinoid-1 receptor. Proc Natl Acad Sci U S A 2007 Jun 5;104(23):9800-5.
- Reference 769
-
Rea K, Roche M, Finn DP. Supraspinal modulation of pain by cannabinoids: The role of GABA and glutamate. Br J Pharmacol 2007 Nov;152(5):633-48.
- Reference 770
-
Petrosino S, Palazzo E, de Novellis V, Bisogno T, Rossi F, Maione S, Di Marzo V. Changes in spinal and supraspinal endocannabinoid levels in neuropathic rats. Neuropharmacology 2007 Feb;52(2):415-22.
- Reference 771
-
Nadal X, La Porta C, Andreea Bura S, Maldonado R. Involvement of the opioid and cannabinoid systems in pain control: New insights from knockout studies. Eur J Pharmacol 2013 Sep 15;716(1-3):142-57.
- Reference 772
-
Martin WJ, Coffin PO, Attias E, Balinsky M, Tsou K, Walker JM. Anatomical basis for cannabinoid-induced antinociception as revealed by intracerebral microinjections. Brain Res 1999 Mar 20;822(1-2):237-42.
- Reference 773
-
Lee MC, Ploner M, Wiech K, Bingel U, Wanigasekera V, Brooks J, Menon DK, Tracey I. Amygdala activity contributes to the dissociative effect of cannabis on pain perception. Pain 2013 Jan;154(1):124-34.
- Reference 774
-
Burston JJ, Woodhams SG. Endocannabinoid system and pain: An introduction. Proc Nutr Soc 2014 Feb;73(1):106-17.
- Reference 775
-
Starowicz K, Przewlocka B. Modulation of neuropathic-pain-related behaviour by the spinal endocannabinoid/endovanilloid system. Philos Trans R Soc Lond B Biol Sci 2012 Dec 5;367(1607):3286-99.
- Reference 776
-
Ignatowska-Jankowska BM, Ghosh S, Crowe MS, Kinsey SG, Niphakis MJ, Abdullah RA, Tao Q, O'Neal ST, Walentiny DM, Wiley JL, et al. In vivo characterization of the highly selective monoacylglycerol lipase inhibitor KML29: Antinociceptive activity without cannabimimetic side effects. Br J Pharmacol 2014 Mar;171(6):1392-407.
- Reference 777
-
Desroches J, Charron S, Bouchard JF, Beaulieu P. Endocannabinoids decrease neuropathic pain-related behavior in mice through the activation of one or both peripheral CB(1) and CB(2) receptors. Neuropharmacology 2014 Feb;77:441-52.
- Reference 778
-
Kinsey SG, Wise LE, Ramesh D, Abdullah R, Selley DE, Cravatt BF, Lichtman AH. Repeated low-dose administration of the monoacylglycerol lipase inhibitor JZL184 retains cannabinoid receptor type 1-mediated antinociceptive and gastroprotective effects. J Pharmacol Exp Ther 2013 Jun;345(3):492-501.
- Reference 779
-
Long JZ, Li W, Booker L, Burston JJ, Kinsey SG, Schlosburg JE, Pavon FJ, Serrano AM, Selley DE, Parsons LH, et al. Selective blockade of 2-arachidonoylglycerol hydrolysis produces cannabinoid behavioral effects. Nat Chem Biol 2009 Jan;5(1):37-44.
- Reference 780
-
Kinsey SG, Long JZ, O'Neal ST, Abdullah RA, Poklis JL, Boger DL, Cravatt BF, Lichtman AH. Blockade of endocannabinoid-degrading enzymes attenuates neuropathic pain. J Pharmacol Exp Ther 2009 Sep;330(3):902-10.
- Reference 781
-
Bisogno T, Burston JJ, Rai R, Allara M, Saha B, Mahadevan A, Razdan RK, Wiley JL, Di Marzo V. Synthesis and pharmacological activity of a potent inhibitor of the biosynthesis of the endocannabinoid 2-arachidonoylglycerol. ChemMedChem 2009 Jun;4(6):946-50.
- Reference 782
-
Russo R, Loverme J, La Rana G, Compton TR, Parrott J, Duranti A, Tontini A, Mor M, Tarzia G, Calignano A, et al. The fatty acid amide hydrolase inhibitor URB597 (cyclohexylcarbamic acid 3'-carbamoylbiphenyl-3-yl ester) reduces neuropathic pain after oral administration in mice. J Pharmacol Exp Ther 2007 Jul;322(1):236-42.
- Reference 783
-
Chang L, Luo L, Palmer JA, Sutton S, Wilson SJ, Barbier AJ, Breitenbucher JG, Chaplan SR, Webb M. Inhibition of fatty acid amide hydrolase produces analgesia by multiple mechanisms. Br J Pharmacol 2006 May;148(1):102-13.
- Reference 784
-
Fegley D, Gaetani S, Duranti A, Tontini A, Mor M, Tarzia G, Piomelli D. Characterization of the fatty acid amide hydrolase inhibitor cyclohexyl carbamic acid 3'-carbamoyl-biphenyl-3-yl ester (URB597): Effects on anandamide and oleoylethanolamide deactivation. J Pharmacol Exp Ther 2005 Apr;313(1):352-8.
- Reference 785
-
Lichtman AH, Leung D, Shelton CC, Saghatelian A, Hardouin C, Boger DL, Cravatt BF. Reversible inhibitors of fatty acid amide hydrolase that promote analgesia: Evidence for an unprecedented combination of potency and selectivity. J Pharmacol Exp Ther 2004 11;311(0022-3565; 2):441-8.
- Reference 786
-
Kathuria S, Gaetani S, Fegley D, Valino F, Duranti A, Tontini A, Mor M, Tarzia G, La Rana G, Calignano A, et al. Modulation of anxiety through blockade of anandamide hydrolysis. Nat Med 2003 Jan;9(1):76-81.
- Reference 787
-
Jayamanne A, Greenwood R, Mitchell VA, Aslan S, Piomelli D, Vaughan CW. Actions of the FAAH inhibitor URB597 in neuropathic and inflammatory chronic pain models. Br J Pharmacol 2006 Feb;147(3):281-8.
- Reference 788
-
Turcotte C, Chouinard F, Lefebvre JS, Flamand N. Regulation of inflammation by cannabinoids, the endocannabinoids 2-arachidonoyl-glycerol and arachidonoyl-ethanolamide, and their metabolites. J Leukoc Biol 2015 Jun;97(6):1049-70.
- Reference 789
-
Witkamp R, Meijerink J. The endocannabinoid system: An emerging key player in inflammation. Curr Opin Clin Nutr Metab Care 2014 Mar;17(2):130-8.
- Reference 790
-
Manzanares J, Julian M, Carrascosa A. Role of the cannabinoid system in pain control and therapeutic implications for the management of acute and chronic pain episodes. Curr.Neuropharmacol. 2006 07;4(1570-159; 1570-159; 3):239-57.
- Reference 791
-
Christie MJ, Mallet C. Endocannabinoids can open the pain gate. Sci.Signal. 2009;2(1937-9145; 88):pe57.
- Reference 792
-
Ostenfeld T, Price J, Albanese M, Bullman J, Guillard F, Meyer I, Leeson R, Costantin C, Ziviani L, Nocini PF, et al. A randomized, controlled study to investigate the analgesic efficacy of single doses of the cannabinoid receptor-2 agonist GW842166, ibuprofen or placebo in patients with acute pain following third molar tooth extraction. Clin J Pain 2011 05/02;27(1536-5409; 0749-8047; 8):668-76.
- Reference 793
-
Karst M, Wippermann S, Ahrens J. Role of cannabinoids in the treatment of pain and (painful) spasticity. Drugs 2010 12/24;70(0012-6667; 0012-6667; 18):2409-38.
- Reference 794
-
Mirchandani A, Saleeb M, Sinatra R. Acute and chronic mechanisms of pain. In: N. Vadivelu, R. D. Urman, R. L. Hines, editors. Essentials of pain management. New York: Springer; 2011. ID: 3011; RP: NOT IN FILE.
- Reference 795
-
Seifert F, Maihofner C. Functional and structural imaging of pain-induced neuroplasticity. Curr.Opin.Anaesthesiol. 2011 10;24(1473-6500; 0952-7907; 5):515-23.
- Reference 796
-
Zubieta JK, Stohler CS. Neurobiological mechanisms of placebo responses. Ann N Y Acad Sci 2009 03;1156(1749-6632; 0077-8923):198-210.
- Reference 797
-
Finniss DG, Kaptchuk TJ, Miller F, Benedetti F. Biological, clinical, and ethical advances of placebo effects. Lancet 2010 02/20;375(1474-547; 0140-6736; 9715):686-95.
- Reference 798
-
Pecina M, Martinez-Jauand M, Hodgkinson C, Stohler CS, Goldman D, Zubieta JK. FAAH selectively influences placebo effects. Mol Psychiatry 2014 Mar;19(3):385-91.
- Reference 799
-
Pecina M, Zubieta JK. Molecular mechanisms of placebo responses in humans. Mol Psychiatry 2015 Apr;20(4):416-23.
- Reference 800
-
Benedetti F, Carlino E, Piedimonte A. Increasing uncertainty in CNS clinical trials: The role of placebo, nocebo, and hawthorne effects. Lancet Neurol 2016 Jun;15(7):736-47.
- Reference 801
-
Tseng AH, Craft RM. Sex differences in antinociceptive and motoric effects of cannabinoids. Eur J Pharmacol 2001 Oct 26;430(1):41-7.
- Reference 802
-
Craft RM, Wakley AA, Tsutsui KT, Laggart JD. Sex differences in cannabinoid 1 vs. cannabinoid 2 receptor-selective antagonism of antinociception produced by delta9-tetrahydrocannabinol and CP55,940 in the rat. J Pharmacol Exp Ther 2012 Mar;340(3):787-800.
- Reference 803
-
Cooper ZD, Haney M. Sex-dependent effects of cannabis-induced analgesia. Drug Alcohol Depend 2016 Oct 1;167:112-20.
- Reference 804
-
Martin BR, Compton DR, Semus SF, Lin S, Marciniak G, Grzybowska J, Charalambous A, Makriyannis A. Pharmacological evaluation of iodo and nitro analogs of delta 8-THC and delta 9-THC. Pharmacol Biochem Behav 1993 10;46(0091-3057; 0091-3057; 2):295-301.
- Reference 805
-
Meng ID, Manning BH, Martin WJ, Fields HL. An analgesia circuit activated by cannabinoids. Nature 1998 09/24;395(0028-0836; 0028-0836; 6700):381-3.
- Reference 806
-
Finn DP, Jhaveri MD, Beckett SR, Roe CH, Kendall DA, Marsden CA, Chapman V. Effects of direct periaqueductal grey administration of a cannabinoid receptor agonist on nociceptive and aversive responses in rats. Neuropharmacology 2003 10;45(0028-3908; 0028-3908; 5):594-604.
- Reference 807
-
Azad SC, Monory K, Marsicano G, Cravatt BF, Lutz B, Zieglgansberger W, Rammes G. Circuitry for associative plasticity in the amygdala involves endocannabinoid signaling. J Neurosci 2004 11/03;24(1529-2401; 0270-6474; 44):9953-61.
- Reference 808
-
Hill SY, Schwin R, Goodwin DW, Powell BJ. Marihuana and pain. J Pharmacol Exp Ther 1974 02;188(0022-3565; 2):415-8.
- Reference 809
-
Milstein SL, MacCannell K, Karr G, Clark S. Marijuana-produced changes in pain tolerance. experienced and non-experienced subjects. Int Pharmacopsychiatry 1975;10(0020-8272; 3):177-82.
- Reference 810
-
Redmond WJ, Goffaux P, Potvin S, Marchand S. Analgesic and antihyperalgesic effects of nabilone on experimental heat pain. Curr Med Res Opin 2008 04;24(1473-4877; 0300-7995; 4):1017-24.
- Reference 811
-
Wu CL, Raja SN. Treatment of acute postoperative pain. Lancet 2011 06/25;377(1474-547; 0140-6736; 9784):2215-25.
- Reference 812
-
Guillaud M, Legagneux F, Paulet C, Leoni J, Lassner J. Essai du levonontradol pour l'analgesie postoperatoire. Cahiers d'Anesthesiologie 1983;31:243-8.
- Reference 813
-
Seeling W, Kneer L, Buchele B, Gschwend JE, Maier L, Nett C, Simmet T, Steffen P, Schneider M, Rockemann M. Delta(9)-tetrahydrocannabinol and the opioid receptor agonist piritramide do not act synergistically in postoperative pain. Anaesthesist 2006 Apr;55(4):391-400.
- Reference 814
-
Kalliomaki J, Annas P, Huizar K, Clarke C, Zettergren A, Karlsten R, Segerdahl M. Evaluation of the analgesic efficacy and psychoactive effects of AZD1940, a novel peripherally acting cannabinoid agonist, in human capsaicin-induced pain and hyperalgesia. Clin Exp Pharmacol Physiol 2013 Mar;40(3):212-8.
- Reference 815
-
Stevens AJ, Higgins MD. A systematic review of the analgesic efficacy of cannabinoid medications in the management of acute pain. Acta Anaesthesiol Scand 2017 Mar;61(3):268-80.
- Reference 816
-
Voscopoulos C, Lema M. When does acute pain become chronic? Br J Anaesth 2010 12;105 Suppl 1(1471-6771; 0007-0912):i69-85.
- Reference 817
-
Fine PG, Burton AW, Passik SD. Transformation of acute cancer pain to chronic cancer pain syndromes. J.Support.Oncol. 2012 05;10(1544-6794; 1544-6794; 3):89-95.
- Reference 818
-
Berlach DM, Shir Y, Ware MA. Experience with the synthetic cannabinoid nabilone in chronic noncancer pain. Pain Med. 2006 01;7(1526-2375; 1526-2375; 1):25-9.
- Reference 819
-
de Vries M, van Rijckevorsel DC, Wilder-Smith OH, van Goor H. Dronabinol and chronic pain: Importance of mechanistic considerations. Expert Opin Pharmacother 2014 Aug;15(11):1525-34.
- Reference 820
-
Walker JM, Huang SM. Cannabinoid analgesia. Pharmacol Ther 2002 08;95(0163-7258; 0163-7258; 2):127-35.
- Reference 821
-
Rahn EJ, Hohmann AG. Cannabinoids as pharmacotherapies for neuropathic pain: From the bench to the bedside. Neurotherapeutics. 2009 10;6(1878-7479; 1878-7479; 4):713-37.
- Reference 822
-
Costa B, Trovato AE, Comelli F, Giagnoni G, Colleoni M. The non-psychoactive cannabis constituent cannabidiol is an orally effective therapeutic agent in rat chronic inflammatory and neuropathic pain. Eur J Pharmacol 2007 02/05;556(0014-2999; 1-3):75-83.
- Reference 823
-
Toth CC, Jedrzejewski NM, Ellis CL, Frey WH. Cannabinoid-mediated modulation of neuropathic pain and microglial accumulation in a model of murine type I diabetic peripheral neuropathic pain. Mol.Pain 2010;6(1744-8069; 1744-8069):16.
- Reference 824
-
Xiong W, Cui T, Cheng K, Yang F, Chen SR, Willenbring D, Guan Y, Pan HL, Ren K, Xu Y, et al. Cannabinoids suppress inflammatory and neuropathic pain by targeting alpha3 glycine receptors. J Exp Med 2012 Jun 4;209(6):1121-34.
- Reference 825
-
Cooper ZD, Comer SD, Haney M. Comparison of the analgesic effects of dronabinol and smoked marijuana in daily marijuana smokers. Neuropsychopharmacology 2013 Sep;38(10):1984-92.
- Reference 826
-
Grant I. Medicinal cannabis and painful sensory neuropathy. Virtual Mentor 2013 May 1;15(5):466-9.
- Reference 827
-
Andreae MH, Carter GM, Shaparin N, Suslov K, Ellis RJ, Ware MA, Abrams DI, Prasad H, Wilsey B, Indyk D, et al. Inhaled cannabis for chronic neuropathic pain: A meta-analysis of individual patient data. J Pain 2015 Dec;16(12):1221-32.
- Reference 828
-
Berman JS, Symonds C, Birch R. Efficacy of two cannabis based medicinal extracts for relief of central neuropathic pain from brachial plexus avulsion: Results of a randomised controlled trial. Pain 2004 12;112(0304-3959; 0304-3959; 3):299-306.
- Reference 829
-
Rog DJ, Nurmikko TJ, Friede T, Young CA. Randomized, controlled trial of cannabis-based medicine in central pain in multiple sclerosis. Neurology 2005 09/27;65(1526-632; 6):812-9.
- Reference 830
-
Moulin DE, Clark AJ, Gilron I, Ware MA, Watson CP, Sessle BJ, Coderre T, Morley-Forster PK, Stinson J, Boulanger A, et al. Pharmacological management of chronic neuropathic pain - consensus statement and guidelines from the canadian pain society. Pain Res.Manag. 2007;12(1203-6765; 1):13-21.
- Reference 831
-
Moulin D, Boulanger A, Clark AJ, Clarke H, Dao T, Finley GA, Furlan A, Gilron I, Gordon A, Morley-Forster PK, et al. Pharmacological management of chronic neuropathic pain: Revised consensus statement from the canadian pain society. Pain Res Manag 2014 Nov-Dec;19(6):328-35.
- Reference 832
-
Fitzcharles MA, Ste-Marie PA, Goldenberg DL, Pereira JX, Abbey S, Choinier M, Ko G, Moulin D, Panopalis D, Proulx J, et al. 2012 canadian guidelines for the diagnosis and management of fibromyalgia syndrome. 2012.
- Reference 833
-
Hoggart B, Ratcliffe S, Ehler E, Simpson KH, Hovorka J, Lejcko J, Taylor L, Lauder H, Serpell M. A multicentre, open-label, follow-on study to assess the long-term maintenance of effect, tolerance and safety of THC/CBD oromucosal spray in the management of neuropathic pain. J Neurol 2015 Jan;262(1):27-40.
- Reference 834
-
Noyes R,Jr., Brunk SF, Baram DA, Canter A. Analgesic effect of delta-9-tetrahydrocannabinol. J Clin Pharmacol 1975 02;15(0091-2700; 2-3):139-43.
- Reference 835
-
Bushlin I, Rozenfeld R, Devi LA. Cannabinoid-opioid interactions during neuropathic pain and analgesia. Curr.Opin.Pharmacol. 2010 02;10(1471-4973; 1471-4892; 1):80-6.
- Reference 836
-
Desroches J, Beaulieu P. Opioids and cannabinoids interactions: Involvement in pain management. Curr Drug Targets 2010 04;11(1873-5592; 1389-4501; 4):462-73.
- Reference 837
-
Parolaro D, Rubino T, Vigano D, Massi P, Guidali C, Realini N. Cellular mechanisms underlying the interaction between cannabinoid and opioid system. Curr Drug Targets 2010 04;11(1873-5592; 1389-4501; 4):393-405.
- Reference 838
-
Rios C, Gomes I, Devi LA. Mu opioid and CB1 cannabinoid receptor interactions: Reciprocal inhibition of receptor signaling and neuritogenesis. Br J Pharmacol 2006 06;148(0007-1188; 0007-1188; 4):387-95.
- Reference 839
-
Rozenfeld R, Bushlin I, Gomes I, Tzavaras N, Gupta A, Neves S, Battini L, Gusella GL, Lachmann A, Ma'ayan A, et al. Receptor heteromerization expands the repertoire of cannabinoid signaling in rodent neurons. PLoS.One. 2012;7(1932-6203; 1932-6203; 1):e29239.
- Reference 840
-
Welch SP, Stevens DL. Antinociceptive activity of intrathecally administered cannabinoids alone, and in combination with morphine, in mice. J Pharmacol Exp Ther 1992 07;262(0022-3565; 0022-3565; 1):10-8.
- Reference 841
-
Pugh G,Jr., Smith PB, Dombrowski DS, Welch SP. The role of endogenous opioids in enhancing the antinociception produced by the combination of delta 9-tetrahydrocannabinol and morphine in the spinal cord. J Pharmacol Exp Ther 1996 11;279(0022-3565; 0022-3565; 2):608-16.
- Reference 842
-
Smith FL, Cichewicz D, Martin ZL, Welch SP. The enhancement of morphine antinociception in mice by delta9-tetrahydrocannabinol. Pharmacol Biochem Behav 1998 06;60(0091-3057; 0091-3057; 2):559-66.
- Reference 843
-
Cichewicz DL. Synergistic interactions between cannabinoid and opioid analgesics. Life Sci 2004 01/30;74(0024-3205; 0024-3205; 11):1317-24.
- Reference 844
-
Cichewicz DL, McCarthy EA. Antinociceptive synergy between delta(9)-tetrahydrocannabinol and opioids after oral administration. J Pharmacol Exp Ther 2003 03;304(0022-3565; 0022-3565; 3):1010-5.
- Reference 845
-
Smith PA, Selley DE, Sim-Selley LJ, Welch SP. Low dose combination of morphine and delta9-tetrahydrocannabinol circumvents antinociceptive tolerance and apparent desensitization of receptors. Eur J Pharmacol 2007 10/01;571(0014-2999; 0014-2999; 2-3):129-37.
- Reference 846
-
Nielsen S, Sabioni P, Trigo JM, Ware MA, Betz-Stablein BD, Murnion B, Lintzeris N, Khor KE, Farrell M, Smith A, et al. Opioid-sparing effect of cannabinoids: A systematic review and meta-analysis. Neuropsychopharmacology 2017 Aug;42(9):1752-65.
- Reference 847
-
Reiman A, Welty M, Solomon P. Cannabis as a substitute for opioid-based pain medication: Patient self-report. Cannabis Cannabinoid Res 2017 Jun 1;2(1):160-6.
- Reference 848
-
Lynch ME, Clark AJ. Cannabis reduces opioid dose in the treatment of chronic non-cancer pain. J Pain Symptom Manage 2003 Jun;25(6):496-8.
- Reference 849
-
Bachhuber MA, Saloner B, Cunningham CO, Barry CL. Medical cannabis laws and opioid analgesic overdose mortality in the united states, 1999-2010. JAMA Intern Med 2014 Oct;174(10):1668-73.
- Reference 850
-
Livingston MD, Barnett TE, Delcher C, Wagenaar AC. Recreational cannabis legalization and opioid-related deaths in colorado, 2000-2015. Am J Public Health 2017;107(11):1827-9.
- Reference 851
-
Bradford AC, Bradford WD, Abraham A, Adams GB. Association between US state medical cannabis laws and opioid prescribing in the medicare part D population. JAMA Internal Medicine 2018;178(5):667-72.
- Reference 852
-
Wen H, Hockenberry JM. Association of medical and adult-use marijuana laws with opioid prescribing for medicaid enrollees. JAMA Intern Med 2018 May 1;178(5):673-9.
- Reference 853
-
Boehnke KF, Litinas E, Clauw DJ. Medical cannabis use is associated with decreased opiate medication use in a retrospective cross-sectional survey of patients with chronic pain. J Pain 2016 Jun;17(6):739-44.
- Reference 854
-
Hefner K, Sofuoglu M, Rosenheck R. Concomitant cannabis abuse/dependence in patients treated with opioids for non-cancer pain. Am J Addict 2015 Sep;24(6):538-45.
- Reference 855
-
Olfson M, Wall MM, Liu SM, Blanco C. Cannabis use and risk of prescription opioid use disorder in the united states. Am J Psychiatry 2017 Sep 26:appiajp201717040413.
- Reference 856
-
Vigil JM, Stith SS, Adams IM, Reeve AP. Associations between medical cannabis and prescription opioid use in chronic pain patients: A preliminary cohort study. PLoS One 2017 Nov 16;12(11):e0187795.
- Reference 857
-
Roberts JD, Gennings C, Shih M. Synergistic affective analgesic interaction between delta-9-tetrahydrocannabinol and morphine. Eur J Pharmacol 2006 01/13;530(0014-2999; 1-2):54-8.
- Reference 858
-
Cooper ZD, Bedi G, Ramesh D, Balter R, Comer SD, Haney M. Impact of co-administration of oxycodone and smoked cannabis on analgesia and abuse liability. Neuropsychopharmacology 2018:1.
- Reference 859
-
Russo EB. Clinical endocannabinoid deficiency (CECD): Can this concept explain therapeutic benefits of cannabis in migraine, fibromyalgia, irritable bowel syndrome and other treatment-resistant conditions? Neuro.Endocrinol.Lett. 2004 02;25(0172-780; 0172-780; 1-2):31-9.
- Reference 860
-
Sarchielli P, Pini LA, Coppola F, Rossi C, Baldi A, Mancini ML, Calabresi P. Endocannabinoids in chronic migraine: CSF findings suggest a system failure. Neuropsychopharmacology 2007 06;32(0893-133; 0006-3223; 6):1384-90.
- Reference 861
-
Villalon CM, Olesen J. The role of CGRP in the pathophysiology of migraine and efficacy of CGRP receptor antagonists as acute antimigraine drugs. Pharmacol Ther 2009 12;124(1879-016; 0163-7258; 3):309-23.
- Reference 862
-
Cupini LM, Costa C, Sarchielli P, Bari M, Battista N, Eusebi P, Calabresi P, Maccarrone M. Degradation of endocannabinoids in chronic migraine and medication overuse headache. Neurobiol Dis 2008 05;30(1095-953; 0969-9961; 2):186-9.
- Reference 863
-
Greco R, Gasperi V, Maccarrone M, Tassorelli C. The endocannabinoid system and migraine. Exp Neurol 2010 07;224(1090-2430; 0014-4886; 1):85-91.
- Reference 864
-
Napchan U, Buse DC, Loder EW. The use of marijuana or synthetic cannabinoids for the treatment of headache. Headache 2011 03;51(1526-4610; 0017-8748; 3):502-5.
- Reference 865
-
McGeeney BE. Hallucinogens and cannabinoids for headache. Headache 2012 10;52 Suppl 2(1526-4610; 0017-8748):94-7.
- Reference 866
-
Levin KH, Copersino ML, Heishman SJ, Liu F, Kelly DL, Boggs DL, Gorelick DA. Cannabis withdrawal symptoms in non-treatment-seeking adult cannabis smokers. Drug Alcohol Depend 2010 05/24;111(1879-0046; 0376-8716; 1-2):120-7.
- Reference 867
-
Lochte BC, Beletsky A, Samuel NK, Grant I. The use of cannabis for headache disorders. Cannabis Cannabinoid Res 2017 Apr 1;2(1):61-71.
- Reference 868
-
Gui H, Liu X, Liu LR, Su DF, Dai SM. Activation of cannabinoid receptor 2 attenuates synovitis and joint distruction in collagen-induced arthritis. Immunobiology 2015 Jun;220(6):817-22.
- Reference 869
-
Gui H, Tong Q, Qu W, Mao CM, Dai SM. The endocannabinoid system and its therapeutic implications in rheumatoid arthritis. Int Immunopharmacol 2015 May;26(1):86-91.
- Reference 870
-
La Porta C, Bura SA, Llorente-Onaindia J, Pastor A, Navarrete F, Garcia-Gutierrez MS, De la Torre R, Manzanares J, Monfort J, Maldonado R. Role of the endocannabinoid system in the emotional manifestations of osteoarthritis pain. Pain 2015 Oct;156(10):2001-12.
- Reference 871
-
La Porta C, Bura SA, Negrete R, Maldonado R. Involvement of the endocannabinoid system in osteoarthritis pain. Eur J Neurosci 2014 Feb;39(3):485-500.
- Reference 872
-
Rahman W, Dickenson AH. Emerging targets and therapeutic approaches for the treatment of osteoarthritis pain. Curr Opin Support Palliat Care 2015 Jun;9(2):124-30.
- Reference 873
-
Gui H, Liu X, Wang ZW, He DY, Su DF, Dai SM. Expression of cannabinoid receptor 2 and its inhibitory effects on synovial fibroblasts in rheumatoid arthritis. Rheumatology (Oxford) 2014 May;53(5):802-9.
- Reference 874
-
Krustev E, Reid A, McDougall JJ. Tapping into the endocannabinoid system to ameliorate acute inflammatory flares and associated pain in mouse knee joints. Arthritis Res Ther 2014 Sep 27;16(5):437,014-0437-9.
- Reference 875
-
Staunton CA, Mobasheri A, Barrett-Jolley R. High hopes for cannabinoid agonists in the treatment of rheumatic diseases. BMC Musculoskelet Disord 2014 Dec 4;15:410,2474-15-410.
- Reference 876
-
McDougall JJ, Linton P. Neurophysiology of arthritis pain. Curr Pain Headache Rep 2012 Dec;16(6):485-91.
- Reference 877
-
Canadian Alcohol and Drug Use Monitoring Survey (CADUMS) [Internet]: Health Canada; c2011 [cited 2015. Available from: http://hc-sc.gc.ca/hc-ps/drugs-drogues/stat/_2011/summary-sommaire-eng.php#a3.
- Reference 878
-
Swift W, Gates P, Dillon P. Survey of australians using cannabis for medical purposes. Harm Reduct J 2005 Oct 4;2:18.
- Reference 879
-
Walsh Z, Callaway R, Belle-Isle L, Capler R, Kay R, Lucas P, Holtzman S. Cannabis for therapeutic purposes: Patient characteristics, access, and reasons for use. Int J Drug Policy 2013 Nov;24(6):511-6.
- Reference 880
-
Dunkley L, Tattersall R. Osteoarthritis and the inflammatory arthritides. Surgery 2012;30(2):67-71.
- Reference 881
-
Baliki MN, Geha PY, Jabakhanji R, Harden N, Schnitzer TJ, Apkarian AV. A preliminary fMRI study of analgesic treatment in chronic back pain and knee osteoarthritis. Mol Pain 2008 Oct 25;4:47,8069-4-47.
- Reference 882
-
Kulkarni B, Bentley DE, Elliott R, Julyan PJ, Boger E, Watson A, Boyle Y, El-Deredy W, Jones AK. Arthritic pain is processed in brain areas concerned with emotions and fear. Arthritis Rheum 2007 Apr;56(4):1345-54.
- Reference 883
-
Sagar DR, Staniaszek LE, Okine BN, Woodhams S, Norris LM, Pearson RG, Garle MJ, Alexander SP, Bennett AJ, Barrett DA, et al. Tonic modulation of spinal hyperexcitability by the endocannabinoid receptor system in a rat model of osteoarthritis pain. Arthritis Rheum 2010 12;62(1529-0131; 0004-3591; 12):3666-76.
- Reference 884
-
McDougall JJ. Cannabinoids and pain control in the periphery. In: B. E. Cairns, editor. Peripheral receptor targets for analgesia: Novel approaches to pain management. Hoboken, New Jersey: John Wiley and Sons Inc.; 2009..
- Reference 885
-
Schuelert N, Zhang C, Mogg AJ, Broad LM, Hepburn DL, Nisenbaum ES, Johnson MP, McDougall JJ. Paradoxical effects of the cannabinoid CB2 receptor agonist GW405833 on rat osteoarthritic knee joint pain. Osteoarthritis Cartilage 2010 Nov;18(11):1536-43.
- Reference 886
-
La Porta C, Bura SA, Aracil-Fernandez A, Manzanares J, Maldonado R. Role of CB1 and CB2 cannabinoid receptors in the development of joint pain induced by monosodium iodoacetate. Pain 2013 Jan;154(1):160-74.
- Reference 887
-
Schuelert N, McDougall JJ. Cannabinoid-mediated antinociception is enhanced in rat osteoarthritic knees. Arthritis Rheum 2008 01;58(0004-3591; 0004-3591; 1):145-53.
- Reference 888
-
Schuelert N, Johnson MP, Oskins JL, Jassal K, Chambers MG, McDougall JJ. Local application of the endocannabinoid hydrolysis inhibitor URB597 reduces nociception in spontaneous and chemically induced models of osteoarthritis. Pain 2011 05;152(1872-6623; 0304-3959; 5):975-81.
- Reference 889
-
Yao BB, Hsieh GC, Frost JM, Fan Y, Garrison TR, Daza AV, Grayson GK, Zhu CZ, Pai M, Chandran P, et al. In vitro and in vivo characterization of A-796260: A selective cannabinoid CB2 receptor agonist exhibiting analgesic activity in rodent pain models. Br J Pharmacol 2008 Jan;153(2):390-401.
- Reference 890
-
Burston JJ, Sagar DR, Shao P, Bai M, King E, Brailsford L, Turner JM, Hathway GJ, Bennett AJ, Walsh DA, et al. Cannabinoid CB2 receptors regulate central sensitization and pain responses associated with osteoarthritis of the knee joint. PLoS One 2013 Nov 25;8(11):e80440.
- Reference 891
-
Sophocleous A, Borjesson AE, Salter DM, Ralston SH. The type 2 cannabinoid receptor regulates susceptibility to osteoarthritis in mice. Osteoarthritis Cartilage 2015 Sep;23(9):1586-94.
- Reference 892
-
Silveira JW, Issy AC, Castania VA, Salmon CE, Nogueira-Barbosa MH, Guimaraes FS, Defino HL, Del Bel E. Protective effects of cannabidiol on lesion-induced intervertebral disc degeneration. PLoS One 2014 Dec 17;9(12):e113161.
- Reference 893
-
Huggins JP, Smart TS, Langman S, Taylor L, Young T. An efficient randomised, placebo-controlled clinical trial with the irreversible fatty acid amide hydrolase-1 inhibitor PF-04457845, which modulates endocannabinoids but fails to induce effective analgesia in patients with pain due to osteoarthritis of the knee. Pain 2012 Sep;153(9):1837-46.
- Reference 894
-
Richards BL, Whittle SL, Buchbinder R. Neuromodulators for pain management in rheumatoid arthritis. Cochrane Database Syst Rev 2012;1(1469-493; 1361-6137):CD008921.
- Reference 895
-
McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. N Engl J Med 2011 12/08;365(1533-4406; 0028-4793; 23):2205-19.
- Reference 896
-
Malfait AM, Gallily R, Sumariwalla PF, Malik AS, Andreakos E, Mechoulam R, Feldmann M. The nonpsychoactive cannabis constituent cannabidiol is an oral anti-arthritic therapeutic in murine collagen-induced arthritis. Proc Natl Acad Sci U S A 2000 Aug 15;97(17):9561-6.
- Reference 897
-
Cox ML, Welch SP. The antinociceptive effect of Delta9-tetrahydrocannabinol in the arthritic rat. Eur J Pharmacol 2004 Jun 16;493(1-3):65-74.
- Reference 898
-
Cox ML, Haller VL, Welch SP. The antinociceptive effect of Delta9-tetrahydrocannabinol in the arthritic rat involves the CB(2) cannabinoid receptor. Eur J Pharmacol 2007 Sep 10;570(1-3):50-6.
- Reference 899
-
Fukuda S, Kohsaka H, Takayasu A, Yokoyama W, Miyabe C, Miyabe Y, Harigai M, Miyasaka N, Nanki T. Cannabinoid receptor 2 as a potential therapeutic target in rheumatoid arthritis. BMC Musculoskelet Disord 2014 Aug 12;15:275,2474-15-275.
- Reference 900
-
McDougall JJ, Yu V, Thomson J. In vivo effects of CB2 receptor-selective cannabinoids on the vasculature of normal and arthritic rat knee joints. Br J Pharmacol 2008 Jan;153(2):358-66.
- Reference 901
-
Hammell DC, Zhang LP, Ma F, Abshire SM, McIlwrath SL, Stinchcomb AL, Westlund KN. Transdermal cannabidiol reduces inflammation and pain-related behaviours in a rat model of arthritis. Eur J Pain 2016 Jul;20(6):936-48.
- Reference 902
-
Smith HS, Bracken D, Smith JM. Pharmacotherapy for fibromyalgia. Front Pharmacol. 2011;2(1663-9812):17.
- Reference 903
-
Julien N, Goffaux P, Arsenault P, Marchand S. Widespread pain in fibromyalgia is related to a deficit of endogenous pain inhibition. Pain 2005 03;114(0304-3959; 0304-3959; 1-2):295-302.
- Reference 904
-
Clauw DJ, Arnold LM, McCarberg BH. The science of fibromyalgia. Mayo Clin Proc 2011 09;86(1942-5546; 0025-6196; 9):907-11.
- Reference 905
-
Normand E, Potvin S, Gaumond I, Cloutier G, Corbin JF, Marchand S. Pain inhibition is deficient in chronic widespread pain but normal in major depressive disorder. J Clin Psychiatry 2011 02;72(1555-2101; 0160-6689; 2):219-24.
- Reference 906
-
Becker S, Schweinhardt P. Dysfunctional neurotransmitter systems in fibromyalgia, their role in central stress circuitry and pharmacological actions on these systems. Pain Res.Treat. 2012;2012(2090-1550; 2090-1542):741746.
- Reference 907
-
de Souza JB, Potvin S, Goffaux P, Charest J, Marchand S. The deficit of pain inhibition in fibromyalgia is more pronounced in patients with comorbid depressive symptoms. Clin J Pain 2009 02;25(1536-5409; 0749-8047; 2):123-7.
- Reference 908
-
Wolfe F, Clauw DJ, Fitzcharles MA, Goldenberg DL, Katz RS, Mease P, Russell AS, Russell IJ, Winfield JB, Yunus MB. The american college of rheumatology preliminary diagnostic criteria for fibromyalgia and measurement of symptom severity. Arthritis Care Res.(Hoboken.) 2010 05;62(2151-4658; 2151-464; 5):600-10.
- Reference 909
-
Walitt B, Klose P, Fitzcharles MA, Phillips T, Hauser W. Cannabinoids for fibromyalgia. Cochrane Database Syst Rev 2016 Jul 18;7:CD011694.
- Reference 910
-
Bagues A, Martin MI, Sanchez-Robles EM. Involvement of central and peripheral cannabinoid receptors on antinociceptive effect of tetrahydrocannabinol in muscle pain. Eur J Pharmacol 2014 Dec 15;745:69-75.
- Reference 911
-
Sanchez Robles EM, Bagues Arias A, Martin Fontelles MI. Cannabinoids and muscular pain. effectiveness of the local administration in rat. Eur J Pain 2012 Sep;16(8):1116-27.
- Reference 912
-
Idris AI, Sophocleous A, Landao-Bassonga E, Canals M, Milligan G, Baker D, van't Hof RJ, Ralston SH. Cannabinoid receptor type 1 protects against age-related osteoporosis by regulating osteoblast and adipocyte differentiation in marrow stromal cells. Cell Metab 2009 08;10(1932-7420; 1550-4131; 2):139-47.
- Reference 913
-
Bab I, Smoum R, Bradshaw H, Mechoulam R. Skeletal lipidomics: Regulation of bone metabolism by fatty acid amide family. Br J Pharmacol 2011 08;163(1476-5381; 0007-1188; 7):1441-6.
- Reference 914
-
Idris AI, van 't Hof RJ, Greig IR, Ridge SA, Baker D, Ross RA, Ralston SH. Regulation of bone mass, bone loss and osteoclast activity by cannabinoid receptors. Nat Med 2005 07;11(1078-8956; 1078-8956; 7):774-9.
- Reference 915
-
Whyte LS, Ford L, Ridge SA, Cameron GA, Rogers MJ, Ross RA. Cannabinoids and bone: Endocannabinoids modulate human osteoclast function in vitro. Br J Pharmacol 2012 04;165(1476-5381; 0007-1188; 8):2584-97.
- Reference 916
-
Tam J, Ofek O, Fride E, Ledent C, Gabet Y, Muller R, Zimmer A, Mackie K, Mechoulam R, Shohami E, et al. Involvement of neuronal cannabinoid receptor CB1 in regulation of bone mass and bone remodeling. Mol Pharmacol 2006 09;70(0026-895; 0026-895; 3):786-92.
- Reference 917
-
Tam J, Trembovler V, Di M,V, Petrosino S, Leo G, Alexandrovich A, Regev E, Casap N, Shteyer A, Ledent C, et al. The cannabinoid CB1 receptor regulates bone formation by modulating adrenergic signaling. FASEB J 2008 01;22(1530-6860; 0892-6638; 1):285-94.
- Reference 918
-
Rossi F, Siniscalco D, Luongo L, De PL, Bellini G, Petrosino S, Torella M, Santoro C, Nobili B, Perrotta S, et al. The endovanilloid/endocannabinoid system in human osteoclasts: Possible involvement in bone formation and resorption. Bone 2009 03;44(1873-2763; 1873-2763; 3):476-84.
- Reference 919
-
Samir SM, Malek HA. Effect of cannabinoid receptors 1 modulation on osteoporosis in a rat model of different ages. J Physiol Pharmacol 2014 Oct;65(5):687-94.
- Reference 920
-
Wasserman E, Tam J, Mechoulam R, Zimmer A, Maor G, Bab I. CB1 cannabinoid receptors mediate endochondral skeletal growth attenuation by Delta9-tetrahydrocannabinol. Ann N Y Acad Sci 2015 Jan;1335:110-9.
- Reference 921
-
Ofek O, Karsak M, Leclerc N, Fogel M, Frenkel B, Wright K, Tam J, Attar-Namdar M, Kram V, Shohami E, et al. Peripheral cannabinoid receptor, CB2, regulates bone mass. Proc Natl Acad Sci U S A 2006 01/17;103(0027-8424; 0027-8424; 3):696-701.
- Reference 922
-
Sophocleous A, Landao-Bassonga E, van't Hof RJ, Idris AI, Ralston SH. The type 2 cannabinoid receptor regulates bone mass and ovariectomy-induced bone loss by affecting osteoblast differentiation and bone formation. Endocrinology 2011 06;152(1945-7170; 0013-7227; 6):2141-9.
- Reference 923
-
Idris AI, Sophocleous A, Landao-Bassonga E, van't Hof RJ, Ralston SH. Regulation of bone mass, osteoclast function, and ovariectomy-induced bone loss by the type 2 cannabinoid receptor. Endocrinology 2008 11;149(0013-7227; 0013-7227; 11):5619-26.
- Reference 924
-
Karsak M, Cohen-Solal M, Freudenberg J, Ostertag A, Morieux C, Kornak U, Essig J, Erxlebe E, Bab I, Kubisch C, et al. Cannabinoid receptor type 2 gene is associated with human osteoporosis. Hum Mol Genet 2005 11/15;14(0964-6906; 0964-6906; 22):3389-96.
- Reference 925
-
Karsak M, Malkin I, Toliat MR, Kubisch C, Nurnberg P, Zimmer A, Livshits G. The cannabinoid receptor type 2 (CNR2) gene is associated with hand bone strength phenotypes in an ethnically homogeneous family sample. Hum Genet 2009 11;126(1432-1203; 0340-6717; 5):629-36.
- Reference 926
-
Huang QY, Li GH, Kung AW. Multiple osteoporosis susceptibility genes on chromosome 1p36 in chinese. Bone 2009 05;44(1873-2763; 1873-2763; 5):984-8.
- Reference 927
-
Fernandez-Ruiz J. The endocannabinoid system as a target for the treatment of motor dysfunction. Br J Pharmacol 2009 04;156(1476-5381; 0007-1188; 7):1029-40.
- Reference 928
-
Glass M, Dragunow M, Faull RL. The pattern of neurodegeneration in huntington's disease: A comparative study of cannabinoid, dopamine, adenosine and GABA(A) receptor alterations in the human basal ganglia in huntington's disease. Neuroscience 2000;97(0306-4522; 0306-4522; 3):505-19.
- Reference 929
-
Romero J, Berrendero F, Perez-Rosado A, Manzanares J, Rojo A, Fernandez-Ruiz JJ, de Yebenes JG, Ramos JA. Unilateral 6-hydroxydopamine lesions of nigrostriatal dopaminergic neurons increased CB1 receptor mRNA levels in the caudate-putamen. Life Sci 2000;66(0024-3205; 0024-3205; 6):485-94.
- Reference 930
-
Lastres-Becker I, Fezza F, Cebeira M, Bisogno T, Ramos JA, Milone A, Fernandez-Ruiz J, Di M,V. Changes in endocannabinoid transmission in the basal ganglia in a rat model of huntington's disease. Neuroreport 2001 07/20;12(0959-4965; 0959-4965; 10):2125-9.
- Reference 931
-
Garcia-Arencibia M, Garcia C, Fernandez-Ruiz J. Cannabinoids and parkinson's disease. CNS.Neurol.Disord.Drug Targets. 2009 12;8(1996-3181; 1871-5273; 6):432-9.
- Reference 932
-
Koppel BS. Cannabis in the treatment of dystonia, dyskinesias, and tics. Neurotherapeutics 2015 Oct;12(4):788-92.
- Reference 933
-
Richter A, Loscher W. (+)-WIN 55,212-2, a novel cannabinoid receptor agonist, exerts antidystonic effects in mutant dystonic hamsters. Eur J Pharmacol 1994 11/03;264(0014-2999; 0014-2999; 3):371-7.
- Reference 934
-
Richter A, Loscher W. Effects of pharmacological manipulations of cannabinoid receptors on severity of dystonia in a genetic model of paroxysmal dyskinesia. Eur J Pharmacol 2002 11/15;454(0014-2999; 0014-2999; 2-3):145-51.
- Reference 935
-
Madsen MV, Peacock LP, Werge T, Andersen MB, Andreasen JT. Effects of cannabinoid CB(1) receptor agonism and antagonism on SKF81297-induced dyskinesia and haloperidol-induced dystonia in cebus apella monkeys. Neuropharmacology 2011 02;60(1873-7064; 0028-3908; 2-3):418-22.
- Reference 936
-
Marsden CD.
Treatment of torsion dystonia In: A. Barbeau, editor. Disorders of movement, current status of modern therapy. Philadelphia, PA.: Lippincott; 1981.. - Reference 937
-
Chatterjee A, Almahrezi A, Ware M, Fitzcharles MA. A dramatic response to inhaled cannabis in a woman with central thalamic pain and dystonia. J Pain Symptom Manage 2002 Jul;24(1):4-6.
- Reference 938
-
Denovan-Wright EM, Robertson HA. Cannabinoid receptor messenger RNA levels decrease in a subset of neurons of the lateral striatum, cortex and hippocampus of transgenic huntington's disease mice. Neuroscience 2000;98(0306-4522; 0306-4522; 4):705-13.
- Reference 939
-
Lastres-Becker I, Gomez M, de MR, Ramos JA, Fernandez-Ruiz J. Loss of cannabinoid CB(1) receptors in the basal ganglia in the late akinetic phase of rats with experimental huntington's disease. Neurotox.Res. 2002 11;4(1476-3524; 1029-8428; 7-8):601-8.
- Reference 940
-
Naver B, Stub C, Moller M, Fenger K, Hansen AK, Hasholt L, Sorensen SA. Molecular and behavioral analysis of the R6/1 huntington's disease transgenic mouse. Neuroscience 2003;122(0306-4522; 0306-4522; 4):1049-57.
- Reference 941
-
McCaw EA, Hu H, Gomez GT, Hebb AL, Kelly ME, Denovan-Wright EM. Structure, expression and regulation of the cannabinoid receptor gene (CB1) in huntington's disease transgenic mice. Eur J Biochem 2004 12;271(0014-2956; 0014-2956; 23-24):4909-20.
- Reference 942
-
Centonze D, Rossi S, Prosperetti C, Tscherter A, Bernardi G, Maccarrone M, Calabresi P. Abnormal sensitivity to cannabinoid receptor stimulation might contribute to altered gamma-aminobutyric acid transmission in the striatum of R6/2 huntington's disease mice. Biol Psychiatry 2005 06/15;57(0006-3223; 0006-3223; 12):1583-9.
- Reference 943
-
Pazos MR, Sagredo O, Fernandez-Ruiz J. The endocannabinoid system in huntington's disease. Curr Pharm Des 2008;14(1873-4286; 1381-6128; 23):2317-25.
- Reference 944
-
Dowie MJ, Bradshaw HB, Howard ML, Nicholson LF, Faull RL, Hannan AJ, Glass M. Altered CB1 receptor and endocannabinoid levels precede motor symptom onset in a transgenic mouse model of huntington's disease. Neuroscience 2009 09/29;163(1873-7544; 0306-4522; 1):456-65.
- Reference 945
-
Blazquez C, Chiarlone A, Sagredo O, Aguado T, Pazos MR, Resel E, Palazuelos J, Julien B, Salazar M, Borner C, et al. Loss of striatal type 1 cannabinoid receptors is a key pathogenic factor in huntington's disease. Brain 2011 01;134(1460-2156; 0006-8950):119-36.
- Reference 946
-
Casteels C, Vandeputte C, Rangarajan JR, Dresselaers T, Riess O, Bormans G, Maes F, Himmelreich U, Nguyen H, Van LK. Metabolic and type 1 cannabinoid receptor imaging of a transgenic rat model in the early phase of huntington disease. Exp Neurol 2011 06;229(1090-2430; 0014-4886; 2):440-9.
- Reference 947
-
Mievis S, Blum D, Ledent C. Worsening of huntington disease phenotype in CB1 receptor knockout mice. Neurobiol Dis 2011 06;42(1095-953; 0969-9961; 3):524-9.
- Reference 948
-
Van Laere K., Casteels C, Dhollander I, Goffin K, Grachev I, Bormans G, Vandenberghe W. Widespread decrease of type 1 cannabinoid receptor availability in huntington disease in vivo. J Nucl Med 2010 09;51(1535-5667; 0161-5505; 9):1413-7.
- Reference 949
-
Palazuelos J, Aguado T, Pazos MR, Julien B, Carrasco C, Resel E, Sagredo O, Benito C, Romero J, Azcoitia I, et al. Microglial CB2 cannabinoid receptors are neuroprotective in huntington's disease excitotoxicity. Brain 2009 11;132(1460-2156; 0006-8950):3152-64.
- Reference 950
-
Dowie MJ, Howard ML, Nicholson LF, Faull RL, Hannan AJ, Glass M. Behavioural and molecular consequences of chronic cannabinoid treatment in huntington's disease transgenic mice. Neuroscience 2010 09/29;170(1873-7544; 0306-4522; 1):324-36.
- Reference 951
-
Sagredo O, Gonzalez S, Aroyo I, Pazos MR, Benito C, Lastres-Becker I, Romero JP, Tolon RM, Mechoulam R, Brouillet E, et al. Cannabinoid CB2 receptor agonists protect the striatum against malonate toxicity: Relevance for huntington's disease. Glia 2009 Aug 15;57(11):1154-67.
- Reference 952
-
Chiarlone A, Bellocchio L, Blazquez C, Resel E, Soria-Gomez E, Cannich A, Ferrero JJ, Sagredo O, Benito C, Romero J, et al. A restricted population of CB1 cannabinoid receptors with neuroprotective activity. Proc Natl Acad Sci U S A 2014 Jun 3;111(22):8257-62.
- Reference 953
-
Curtis A, Rickards H. Nabilone could treat chorea and irritability in huntington's disease. J Neuropsychiatry Clin Neurosci 2006;18(0895-0172; 0895-0172; 4):553-4.
- Reference 954
-
Venderova K, Ruzicka E, Vorisek V, Visnovsky P. Survey on cannabis use in parkinson's disease: Subjective improvement of motor symptoms. Mov Disord 2004 Sep;19(9):1102-6.
- Reference 955
-
Pisani V, Moschella V, Bari M, Fezza F, Galati S, Bernardi G, Stanzione P, Pisani A, Maccarrone M. Dynamic changes of anandamide in the cerebrospinal fluid of parkinson's disease patients. Mov Disord 2010 05/15;25(1531-8257; 0885-3185; 7):920-4.
- Reference 956
-
Garcia-Arencibia M, Garcia C, Kurz A, Rodriguez-Navarro JA, Gispert-Sachez S, Mena MA, Auburger G, de Yebenes JG, Fernandez-Ruiz J. Cannabinoid CB1 receptors are early downregulated followed by a further upregulation in the basal ganglia of mice with deletion of specific park genes. J Neural Transm Suppl 2009(0303-6995; 0303-6995; 73):269-75.
- Reference 957
-
Papa SM. The cannabinoid system in parkinson's disease: Multiple targets to motor effects. Exp Neurol 2008 06;211(1090-2430; 0014-4886; 2):334-8.
- Reference 958
-
Gonzalez S, Scorticati C, Garcia-Arencibia M, de Miguel R, Ramos JA, Fernandez-Ruiz J. Effects of rimonabant, a selective cannabinoid CB1 receptor antagonist, in a rat model of parkinson's disease. Brain Res 2006 Feb 16;1073-1074:209-19.
- Reference 959
-
Cerri S, Levandis G, Ambrosi G, Montepeloso E, Antoninetti GF, Franco R, Lanciego JL, Baqi Y, Muller CE, Pinna A, et al. Neuroprotective potential of adenosine A2A and cannabinoid CB1 receptor antagonists in an animal model of parkinson disease. J Neuropathol Exp Neurol 2014 May;73(5):414-24.
- Reference 960
-
Fernandez-Ruiz J, Romero J, Ramos JA. Endocannabinoids and neurodegenerative disorders: Parkinson's disease, huntington's chorea, alzheimer's disease, and others. Handb Exp Pharmacol 2015;231:233-59.
- Reference 961
-
Rodriguez-Cueto C, Benito C, Fernandez-Ruiz J, Romero J, Hernandez-Galvez M, Gomez-Ruiz M. Changes in CB(1) and CB(2) receptors in the post-mortem cerebellum of humans affected by spinocerebellar ataxias. Br J Pharmacol 2014 Mar;171(6):1472-89.
- Reference 962
-
Rodriguez-Cueto C, Benito C, Romero J, Hernandez-Galvez M, Gomez-Ruiz M, Fernandez-Ruiz J. Endocannabinoid-hydrolysing enzymes in the post-mortem cerebellum of humans affected by hereditary autosomal dominant ataxias. Pathobiology 2014;81(3):149-59.
- Reference 963
-
Cheung W, Guo L, Cordeiro MF. Neuroprotection in glaucoma: Drug-based approaches. Optom Vis Sci 2008 06;85(1040-5488; 1040-5488; 6):406-16.
- Reference 964
-
Jarvinen T, Pate DW, Laine K. Cannabinoids in the treatment of glaucoma. Pharmacol Ther 2002 08;95(0163-7258; 2):203-20.
- Reference 965
-
Jampel H. American glaucoma society position statement: Marijuana and the treatment of glaucoma. J Glaucoma 2010 02;19(1536-481; 1057-0829; 2):75-6.
- Reference 966
-
Chen J, Matias I, Dinh T, Lu T, Venezia S, Nieves A, Woodward DF, Di M,V. Finding of endocannabinoids in human eye tissues: Implications for glaucoma. Biochem Biophys Res Commun 2005 05/20;330(0006-291; 0006-291; 4):1062-7.
- Reference 967
-
Porcella A, Casellas P, Gessa GL, Pani L. Cannabinoid receptor CB1 mRNA is highly expressed in the rat ciliary body: Implications for the antiglaucoma properties of marihuana. Brain Res Mol Brain Res 1998 07/15;58(0169-328; 1-2):240-5.
- Reference 968
-
Straiker AJ, Maguire G, Mackie K, Lindsey J. Localization of cannabinoid CB1 receptors in the human anterior eye and retina. Invest Ophthalmol Vis Sci 1999 09;40(0146-0404; 10):2442-8.
- Reference 969
-
Porcella A, Maxia C, Gessa GL, Pani L. The human eye expresses high levels of CB1 cannabinoid receptor mRNA and protein. Eur J Neurosci 2000 03;12(0953-816; 3):1123-7.
- Reference 970
-
Song ZH, Slowey CA. Involvement of cannabinoid receptors in the intraocular pressure-lowering effects of WIN55212-2. J Pharmacol Exp Ther 2000 01;292(0022-3565; 1):136-9.
- Reference 971
-
Porcella A, Maxia C, Gessa GL, Pani L. The synthetic cannabinoid WIN55212-2 decreases the intraocular pressure in human glaucoma resistant to conventional therapies. Eur J Neurosci 2001 01;13(0953-816; 2):409-12.
- Reference 972
-
Wan MJ, Daniel S, Kassam F, Mutti G, Butty Z, Kasner O, Trope GE, Buys YM. Survey of complementary and alternative medicine use in glaucoma patients. J Glaucoma 2012 02;21(1536-481; 1057-0829; 2):79-82.
- Reference 973
-
Yoles E, Belkin M, Schwartz M. HU-211, a nonpsychotropic cannabinoid, produces short- and long-term neuroprotection after optic nerve axotomy. J Neurotrauma 1996 01;13(0897-7151; 1):49-57.
- Reference 974
-
Shen M, Thayer SA. Cannabinoid receptor agonists protect cultured rat hippocampal neurons from excitotoxicity. Mol Pharmacol 1998 09;54(0026-895; 3):459-62.
- Reference 975
-
Levin LA. Direct and indirect approaches to neuroprotective therapy of glaucomatous optic neuropathy. Surv Ophthalmol 1999 06;43 Suppl 1(0039-6257):S98-101.
- Reference 976
-
Jin KL, Mao XO, Goldsmith PC, Greenberg DA. CB1 cannabinoid receptor induction in experimental stroke. Ann Neurol 2000 08;48(0364-5134; 2):257-61.
- Reference 977
-
Panikashvili D, Simeonidou C, Ben-Shabat S, Hanus L, Breuer A, Mechoulam R, Shohami E. An endogenous cannabinoid (2-AG) is neuroprotective after brain injury. Nature 2001 10/04;413(0028-0836; 6855):527-31.
- Reference 978
-
Marsicano G, Moosmann B, Hermann H, Lutz B, Behl C. Neuroprotective properties of cannabinoids against oxidative stress: Role of the cannabinoid receptor CB1. J Neurochem 2002 02;80(0022-3042; 3):448-56.
- Reference 979
-
Mechoulam R, Panikashvili D, Shohami E. Cannabinoids and brain injury: Therapeutic implications. Trends Mol Med 2002 02;8(1471-4914; 2):58-61.
- Reference 980
-
Braida D, Pegorini S, Arcidiacono MV, Consalez GG, Croci L, Sala M. Post-ischemic treatment with cannabidiol prevents electroencephalographic flattening, hyperlocomotion and neuronal injury in gerbils. Neurosci Lett 2003 07/31;346(0304-3940; 1-2):61-4.
- Reference 981
-
El-Remessy AB, Al-Shabrawey M, Khalifa Y, Tsai NT, Caldwell RB, Liou GI. Neuroprotective and blood-retinal barrier-preserving effects of cannabidiol in experimental diabetes. Am J Pathol 2006 01;168(0002-9440; 1):235-44.
- Reference 982
-
Gilbert GL, Kim HJ, Waataja JJ, Thayer SA. Delta9-tetrahydrocannabinol protects hippocampal neurons from excitotoxicity. Brain Res 2007 01/12;1128(0006-8993; 1):61-9.
- Reference 983
-
Hepler RS, Frank IR. Marihuana smoking and intraocular pressure. JAMA 1971 09/06;217(0098-7484; 0098-7484; 10):1392.
- Reference 984
-
Merritt JC, Crawford WJ, Alexander PC, Anduze AL, Gelbart SS. Effect of marihuana on intraocular and blood pressure in glaucoma. Ophthalmology 1980 03;87(0161-6420; 0161-6420; 3):222-8.
- Reference 985
-
Zhan GL, Camras CB, Palmberg PF, Toris CB. Effects of marijuana on aqueous humor dynamics in a glaucoma patient. J Glaucoma 2005 04;14(1057-0829; 1057-0829; 2):175-7.
- Reference 986
-
Abboud RT, Sanders HD. Effect of oral administration of delta-tetrahydrocannabinol on airway mechanics in normal and asthmatic subjects. Chest 1976 10;70(0012-3692; 0012-3692; 4):480-5.
- Reference 987
-
Calignano A, Katona I, Desarnaud F, Giuffrida A, La RG, Mackie K, Freund TF, Piomelli D. Bidirectional control of airway responsiveness by endogenous cannabinoids. Nature 2000 11/02;408(0028-0836; 0028-0836; 6808):96-101.
- Reference 988
-
Jan TR, Farraj AK, Harkema JR, Kaminski NE. Attenuation of the ovalbumin-induced allergic airway response by cannabinoid treatment in A/J mice. Toxicol Appl Pharmacol 2003 04/01;188(0041-008; 0041-008; 1):24-35.
- Reference 989
-
Giannini L, Nistri S, Mastroianni R, Cinci L, Vannacci A, Mariottini C, Passani MB, Mannaioni PF, Bani D, Masini E. Activation of cannabinoid receptors prevents antigen-induced asthma-like reaction in guinea pigs. J Cell Mol Med 2008 12;12(1582-1838; 1582-1838; 6):2381-94.
- Reference 990
-
Fukuda H, Abe T, Yoshihara S. The cannabinoid receptor agonist WIN 55,212-2 inhibits antigen-induced plasma extravasation in guinea pig airways. Int Arch Allergy Immunol 2010;152(1423-0097; 1018-2438; 3):295-300.
- Reference 991
-
Vachon L, FitzGerald MX, Solliday NH, Gould IA, Gaensler EA. Single-dose effects of marihuana smoke. bronchial dynamics and respiratory-center sensitivity in normal subjects. N Engl J Med 1973 05/10;288(0028-4793; 0028-4793; 19):985-9.
- Reference 992
-
Tashkin DP, Shapiro BJ, Frank IM. Acute pulmonary physiologic effects of smoked marijuana and oral 9 -tetrahydrocannabinol in healthy young men. N Engl J Med 1973 08/16;289(0028-4793; 0028-4793; 7):336-41.
- Reference 993
-
Tashkin DP. Airway effects of marijuana, cocaine, and other inhaled illicit agents. Curr Opin Pulm Med 2001 03;7(1070-5287; 2):43-61.
- Reference 994
-
Tashkin DP, Shapiro BJ, Frank IM. Acute effects of smoked marijuana and oral delta9-tetrahydrocannabinol on specific airway conductance in asthmatic subjects. Am Rev Respir Dis 1974 04;109(0003-0805; 0003-0805; 4):420-8.
- Reference 995
-
Tashkin DP, Shapiro BJ, Lee YE, Harper CE. Effects of smoked marijuana in experimentally induced asthma. Am Rev Respir Dis 1975 09;112(0003-0805; 0003-0805; 3):377-86.
- Reference 996
-
Gong H,Jr., Tashkin DP, Simmons MS, Calvarese B, Shapiro BJ. Acute and subacute bronchial effects of oral cannabinoids. Clin Pharmacol Ther 1984 01;35(0009-9236; 0009-9236; 1):26-32.
- Reference 997
-
Williams SJ, Hartley JP, Graham JD. Bronchodilator effect of delta1-tetrahydrocannabinol administered by aerosol of asthmatic patients. Thorax 1976 12;31(0040-6376; 0040-6376; 6):720-3.
- Reference 998
-
Hartley JP, Nogrady SG, Seaton A. Bronchodilator effect of delta1-tetrahydrocannabinol. Br J Clin Pharmacol 1978 06;5(0306-5251; 0306-5251; 6):523-5.
- Reference 999
-
Tashkin DP, Reiss S, Shapiro BJ, Calvarese B, Olsen JL, Lodge JW. Bronchial effects of aerosolized delta 9-tetrahydrocannabinol in healthy and asthmatic subjects. Am Rev Respir Dis 1977 Jan;115(1):57-65.
- Reference 1000
-
Davies BH, Radcliffe S, Seaton A, Graham JD. A trial of oral delta-1-(trans)-tetrahydrocannabinol in reversible airways obstruction. Thorax 1975 02;30(0040-6376; 0040-6376; 1):80-5.
- Reference 1001
-
Gong H,Jr., Tashkin DP, Calvarese B. Comparison of bronchial effects of nabilone and terbutaline in healthy and asthmatic subjects. J Clin Pharmacol 1983 04;23(0091-2700; 0091-2700; 4):127-33.
- Reference 1002
-
Pacher P, Batkai S, Kunos G. Cardiovascular pharmacology of cannabinoids. Handb Exp Pharmacol 2005(0171-2004; 0171-2004; 168):599-625.
- Reference 1003
-
Crawford WJ, Merritt JC. Effects of tetrahydrocannabinol on arterial and intraocular hypertension. Int J Clin Pharmacol Biopharm 1979 05;17(0340-0026; 0340-0026; 5):191-6.
- Reference 1004
-
Hillard CJ. Stress regulates endocannabinoid-CB1 receptor signaling. Semin Immunol 2014 Oct;26(5):380-8.
- Reference 1005
-
Hill MN, Patel S. Translational evidence for the involvement of the endocannabinoid system in stress-related psychiatric illnesses. Biol Mood Anxiety Disord 2013 Oct 22;3(1):19,5380-3-19.
- Reference 1006
-
Hermanson DJ, Hartley ND, Gamble-George J, Brown N, Shonesy BC, Kingsley PJ, Colbran RJ, Reese J, Marnett LJ, Patel S. Substrate-selective COX-2 inhibition decreases anxiety via endocannabinoid activation. Nat Neurosci 2013 Sep;16(9):1291-8.
- Reference 1007
-
Hermanson DJ, Gamble-George JC, Marnett LJ, Patel S. Substrate-selective COX-2 inhibition as a novel strategy for therapeutic endocannabinoid augmentation. Trends Pharmacol Sci 2014 Jul;35(7):358-67.
- Reference 1008
-
Denson TF, Earleywine M. Decreased depression in marijuana users. Addict Behav 2006 04;31(0306-4603; 0306-4603; 4):738-42.
- Reference 1009
-
Lev-Ran S, Le Foll B, McKenzie K, George TP, Rehm J. Cannabis use and cannabis use disorders among individuals with mental illness. Compr Psychiatry 2013 Aug;54(6):589-98.
- Reference 1010
-
Lev-Ran S, Roerecke M, Le Foll B, George TP, McKenzie K, Rehm J. The association between cannabis use and depression: A systematic review and meta-analysis of longitudinal studies. Psychol Med 2014 Mar;44(4):797-810.
- Reference 1011
-
Buckner JD, Heimberg RG, Schneier FR, Liu SM, Wang S, Blanco C. The relationship between cannabis use disorders and social anxiety disorder in the national epidemiological study of alcohol and related conditions (NESARC). Drug Alcohol Depend 2012 Jul 1;124(1-2):128-34.
- Reference 1012
-
Witkin JM, Tzavara ET, Nomikos GG. A role for cannabinoid CB1 receptors in mood and anxiety disorders. Behav Pharmacol 2005 09;16(0955-8810; 0955-8810; 5-6):315-31.
- Reference 1013
-
Moreira FA, Wotjak CT. Cannabinoids and anxiety. Curr.Top.Behav.Neurosci. 2010;2(1866-3370; 1866-3370):429-50.
- Reference 1014
-
Bambico FR, Katz N, Debonnel G, Gobbi G. Cannabinoids elicit antidepressant-like behavior and activate serotonergic neurons through the medial prefrontal cortex. J Neurosci 2007 10/24;27(1529-2401; 0270-6474; 43):11700-11.
- Reference 1015
-
Bambico FR, Gobbi G. The cannabinoid CB1 receptor and the endocannabinoid anandamide: Possible antidepressant targets. Expert.Opin.Ther.Targets. 2008 11;12(1744-7631; 1472-8222; 11):1347-66.
- Reference 1016
-
Hill MN, Gorzalka BB. Pharmacological enhancement of cannabinoid CB1 receptor activity elicits an antidepressant-like response in the rat forced swim test. Eur Neuropsychopharmacol 2005 12;15(0924-977; 0924-977; 6):593-9.
- Reference 1017
-
Christensen R, Kristensen PK, Bartels EM, Bliddal H, Astrup A. Efficacy and safety of the weight-loss drug rimonabant: A meta-analysis of randomised trials. Lancet 2007 11/17;370(1474-547; 0140-6736; 9600):1706-13.
- Reference 1018
-
Gorzalka BB, Hill MN. Putative role of endocannabinoid signaling in the etiology of depression and actions of antidepressants. Prog Neuropsychopharmacol Biol Psychiatry 2010 11/24;35(1878-4216; 0278-5846; 7):1575-85.
- Reference 1019
-
Hill MN, Miller GE, Carrier EJ, Gorzalka BB, Hillard CJ. Circulating endocannabinoids and N-acyl ethanolamines are differentially regulated in major depression and following exposure to social stress. Psychoneuroendocrinology 2009 09;34(1873-3360; 0306-4530; 8):1257-62.
- Reference 1020
-
Woolridge E, Barton S, Samuel J, Osorio J, Dougherty A, Holdcroft A. Cannabis use in HIV for pain and other medical symptoms. J Pain Symptom Manage 2005 04;29(0885-3924; 0885-3924; 4):358-67.
- Reference 1021
-
Page SA, Verhoef MJ. Medicinal marijuana use: Experiences of people with multiple sclerosis. Can Fam Physician 2006 01;52(0008-350; 0008-350):64-5.
- Reference 1022
-
Mitchell PB, Morris MJ. Depression and anxiety with rimonabant. Lancet 2007 11/17;370(1474-547; 0140-6736; 9600):1671-2.
- Reference 1023
-
Crippa JA, Zuardi AW, Garrido GE, Wichert-Ana L, Guarnieri R, Ferrari L, Azevedo-Marques PM, Hallak JE, McGuire PK, Filho BG. Effects of cannabidiol (CBD) on regional cerebral blood flow. Neuropsychopharmacology 2004 02;29(0893-133; 0006-3223; 2):417-26.
- Reference 1024
-
Resstel LB, Tavares RF, Lisboa SF, Joca SR, Correa FM, Guimaraes FS. 5-HT1A receptors are involved in the cannabidiol-induced attenuation of behavioural and cardiovascular responses to acute restraint stress in rats. Br J Pharmacol 2009 01;156(1476-5381; 0007-1188; 1):181-8.
- Reference 1025
-
Gomes FV, Resstel LB, Guimaraes FS. The anxiolytic-like effects of cannabidiol injected into the bed nucleus of the stria terminalis are mediated by 5-HT1A receptors. Psychopharmacology (Berl) 2011 02;213(1432-2072; 0033-3158; 2-3):465-73.
- Reference 1026
-
Koethe D, Schreiber D, Giuffrida A, Mauss C, Faulhaber J, Heydenreich B, Hellmich M, Graf R, Klosterkotter J, Piomelli D, et al. Sleep deprivation increases oleoylethanolamide in human cerebrospinal fluid. J Neural Transm 2009 03;116(1435-1463; 0300-9564; 3):301-5.
- Reference 1027
-
Hanlon EC, Tasali E, Leproult R, Stuhr KL, Doncheck E, de Wit H, Hillard CJ, Van Cauter E. Sleep restriction enhances the daily rhythm of circulating levels of endocannabinoid 2-arachidonoylglycerol. Sleep 2016 Mar 1;39(3):653-64.
- Reference 1028
-
Hanlon EC, Tasali E, Leproult R, Stuhr KL, Doncheck E, de Wit H, Hillard CJ, Van Cauter E. Circadian rhythm of circulating levels of the endocannabinoid 2-arachidonoylglycerol. J Clin Endocrinol Metab 2015 Jan;100(1):220-6.
- Reference 1029
-
Herrera-Solis A, Vasquez KG, Prospero-Garcia O. Acute and subchronic administration of anandamide or oleamide increases REM sleep in rats. Pharmacol Biochem Behav 2010 03;95(1873-5177; 0091-3057; 1):106-12.
- Reference 1030
-
Bolla KI, Lesage SR, Gamaldo CE, Neubauer DN, Funderburk FR, Cadet JL, David PM, Verdejo-Garcia A, Benbrook AR. Sleep disturbance in heavy marijuana users. Sleep 2008 06;31(0161-8105; 0161-8105; 6):901-8.
- Reference 1031
-
Bolla KI, Lesage SR, Gamaldo CE, Neubauer DN, Wang NY, Funderburk FR, Allen RP, David PM, Cadet JL. Polysomnogram changes in marijuana users who report sleep disturbances during prior abstinence. Sleep Med 2010 10;11(1878-5506; 1389-9457; 9):882-9.
- Reference 1032
-
Jetly R, Heber A, Fraser G, Boisvert D. The efficacy of nabilone, a synthetic cannabinoid, in the treatment of PTSD-associated nightmares: A preliminary randomized, double-blind, placebo-controlled cross-over design study. Psychoneuroendocrinology 2015 Jan;51:585-8.
- Reference 1033
-
Trezza V, Campolongo P. The endocannabinoid system as a possible target to treat both the cognitive and emotional features of post-traumatic stress disorder (PTSD). Front Behav Neurosci 2013 Aug 9;7:100.
- Reference 1034
-
Lutz B. The endocannabinoid system and extinction learning. Mol Neurobiol 2007 08;36(0893-7648; 0893-7648; 1):92-101.
- Reference 1035
-
Betthauser K, Pilz J, Vollmer LE. Use and effects of cannabinoids in military veterans with posttraumatic stress disorder. Am J Health Syst Pharm 2015 Aug 1;72(15):1279-84.
- Reference 1036
-
Boden MT, Babson KA, Vujanovic AA, Short NA, Bonn-Miller MO. Posttraumatic stress disorder and cannabis use characteristics among military veterans with cannabis dependence. Am J Addict 2013 May-Jun;22(3):277-84.
- Reference 1037
-
Yarnell S. The use of medicinal marijuana for posttraumatic stress disorder: A review of the current literature. Prim Care Companion CNS Disord 2015 May 7;17(3):10.4088/PCC.15r01786. eCollection 2015.
- Reference 1038
-
Bonn-Miller MO, Babson KA, Vandrey R. Using cannabis to help you sleep: Heightened frequency of medical cannabis use among those with PTSD. Drug Alcohol Depend 2014 Mar 1;136:162-5.
- Reference 1039
-
Kessler RC, Sonnega A, Bromet E, Hughes M, Nelson CB. Posttraumatic stress disorder in the national comorbidity survey. Arch Gen Psychiatry 1995 Dec;52(12):1048-60.
- Reference 1040
-
Bohnert KM, Perron BE, Ashrafioun L, Kleinberg F, Jannausch M, Ilgen MA. Positive posttraumatic stress disorder screens among first-time medical cannabis patients: Prevalence and association with other substance use. Addict Behav 2014 Oct;39(10):1414-7.
- Reference 1041
-
Lutz B, Marsicano G, Maldonado R, Hillard CJ. The endocannabinoid system in guarding against fear, anxiety and stress. Nat Rev Neurosci 2015 Dec;16(12):705-18.
- Reference 1042
-
Neumeister A, Seidel J, Ragen BJ, Pietrzak RH. Translational evidence for a role of endocannabinoids in the etiology and treatment of posttraumatic stress disorder. Psychoneuroendocrinology 2015 Jan;51:577-84.
- Reference 1043
-
Pamplona FA, Prediger RD, Pandolfo P, Takahashi RN. The cannabinoid receptor agonist WIN 55,212-2 facilitates the extinction of contextual fear memory and spatial memory in rats. Psychopharmacology (Berl) 2006 11;188(0033-3158; 0033-3158; 4):641-9.
- Reference 1044
-
Marsicano G, Wotjak CT, Azad SC, Bisogno T, Rammes G, Cascio MG, Hermann H, Tang J, Hofmann C, Zieglgansberger W, et al. The endogenous cannabinoid system controls extinction of aversive memories. Nature 2002 08/01;418(0028-0836; 0028-0836; 6897):530-4.
- Reference 1045
-
Varvel SA, Lichtman AH. Evaluation of CB1 receptor knockout mice in the morris water maze. J Pharmacol Exp Ther 2002 06;301(0022-3565; 0022-3565; 3):915-24.
- Reference 1046
-
Chhatwal JP, Davis M, Maguschak KA, Ressler KJ. Enhancing cannabinoid neurotransmission augments the extinction of conditioned fear. Neuropsychopharmacology 2005 03;30(0893-133; 0006-3223; 3):516-24.
- Reference 1047
-
Jenniches I, Ternes S, Albayram O, Otte DM, Bach K, Bindila L, Michel K, Lutz B, Bilkei-Gorzo A, Zimmer A. Anxiety, stress, and fear response in mice with reduced endocannabinoid levels. Biol Psychiatry 2016 May 15;79(10):858-68.
- Reference 1048
-
Stern CA, Gazarini L, Takahashi RN, Guimaraes FS, Bertoglio LJ. On disruption of fear memory by reconsolidation blockade: Evidence from cannabidiol treatment. Neuropsychopharmacology 2012 Aug;37(9):2132-42.
- Reference 1049
-
Pietrzak RH, Huang Y, Corsi-Travali S, Zheng MQ, Lin SF, Henry S, Potenza MN, Piomelli D, Carson RE, Neumeister A. Cannabinoid type 1 receptor availability in the amygdala mediates threat processing in trauma survivors. Neuropsychopharmacology 2014 Oct;39(11):2519-28.
- Reference 1050
-
Hill MN, Bierer LM, Makotkine I, Golier JA, Galea S, McEwen BS, Hillard CJ, Yehuda R. Reductions in circulating endocannabinoid levels in individuals with post-traumatic stress disorder following exposure to the world trade center attacks. Psychoneuroendocrinology 2013 Dec;38(12):2952-61.
- Reference 1051
-
Neumeister A, Normandin MD, Pietrzak RH, Piomelli D, Zheng MQ, Gujarro-Anton A, Potenza MN, Bailey CR, Lin SF, Najafzadeh S, et al. Elevated brain cannabinoid CB1 receptor availability in post-traumatic stress disorder: A positron emission tomography study. Mol Psychiatry 2013 Sep;18(9):1034-40.
- Reference 1052
-
Hariri AR, Gorka A, Hyde LW, Kimak M, Halder I, Ducci F, Ferrell RE, Goldman D, Manuck SB. Divergent effects of genetic variation in endocannabinoid signaling on human threat- and reward-related brain function. Biol Psychiatry 2009 Jul 1;66(1):9-16.
- Reference 1053
-
Dincheva I, Drysdale AT, Hartley CA, Johnson DC, Jing D, King EC, Ra S, Gray JM, Yang R, DeGruccio AM, et al. FAAH genetic variation enhances fronto-amygdala function in mouse and human. Nat Commun 2015 Mar 3;6:6395.
- Reference 1054
-
Phan KL, Angstadt M, Golden J, Onyewuenyi I, Popovska A, de Wit H. Cannabinoid modulation of amygdala reactivity to social signals of threat in humans. J Neurosci 2008 Mar 5;28(10):2313-9.
- Reference 1055
-
Rabinak CA, Angstadt M, Sripada CS, Abelson JL, Liberzon I, Milad MR, Phan KL. Cannabinoid facilitation of fear extinction memory recall in humans. Neuropharmacology 2013 Jan;64:396-402.
- Reference 1056
-
Rabinak CA, Angstadt M, Lyons M, Mori S, Milad MR, Liberzon I, Phan KL. Cannabinoid modulation of prefrontal-limbic activation during fear extinction learning and recall in humans. Neurobiol Learn Mem 2014 Sep;113:125-34.
- Reference 1057
-
Das RK, Kamboj SK, Ramadas M, Yogan K, Gupta V, Redman E, Curran HV, Morgan CJ. Cannabidiol enhances consolidation of explicit fear extinction in humans. Psychopharmacology (Berl) 2013 Apr;226(4):781-92.
- Reference 1058
-
O'Neil ME, Nugent SM, Morasco BJ, Freeman M, Low A, Kondo K, Zakher B, Elven C, Motu'apuaka M, Paynter R, et al. Benefits and harms of plant-based cannabis for posttraumatic stress disorder: A systematic review. Ann Intern Med 2017 Sep 5;167(5):332-40.
- Reference 1059
-
Befort K. Interactions of the opioid and cannabinoid systems in reward: Insights from knockout studies. Front Pharmacol 2015 Feb 5;6:6.
- Reference 1060
-
Scavone JL, Sterling RC, Van Bockstaele EJ. Cannabinoid and opioid interactions: Implications for opiate dependence and withdrawal. Neuroscience 2013 Sep 17;248:637-54.
- Reference 1061
-
Lucas P, Walsh Z, Crosby K, Callaway R, Belle-Isle L, Kay R, Capler R, Holtzman S. Substituting cannabis for prescription drugs, alcohol and other substances among medical cannabis patients: The impact of contextual factors. Drug Alcohol Rev 2015 Sep 14.
- Reference 1062
-
Pava MJ, Woodward JJ. A review of the interactions between alcohol and the endocannabinoid system: Implications for alcohol dependence and future directions for research. Alcohol 2012 05;46(1873-6823; 0741-8329; 3):185-204.
- Reference 1063
-
Hirvonen J, Zanotti-Fregonara P, Umhau JC, George DT, Rallis-Frutos D, Lyoo CH, Li CT, Hines CS, Sun H, Terry GE, et al. Reduced cannabinoid CB1 receptor binding in alcohol dependence measured with positron emission tomography. Mol Psychiatry 2013 Aug;18(8):916-21.
- Reference 1064
-
Ceccarini J, Hompes T, Verhaeghen A, Casteels C, Peuskens H, Bormans G, Claes S, Van Laere K. Changes in cerebral CB1 receptor availability after acute and chronic alcohol abuse and monitored abstinence. J Neurosci 2014 Feb 19;34(8):2822-31.
- Reference 1065
-
Sprague GL, Craigmill AL. Effects of two cannabinoids upon abstinence signs in ethanol-dependent mice. Pharmacol Biochem Behav 1978 Jul;9(1):11-5.
- Reference 1066
-
Kralik PM, Ho BT, Matthews HR. Effect of delta-THC on ethanol withdrawal in mice. Experientia 1976 Jun 15;32(6):723-5.
- Reference 1067
-
Rubio M, Fernandez-Ruiz J, de Miguel R, Maestro B, Michael Walker J, Ramos JA. CB1 receptor blockade reduces the anxiogenic-like response and ameliorates the neurochemical imbalances associated with alcohol withdrawal in rats. Neuropharmacology 2008 May;54(6):976-88.
- Reference 1068
-
Rubio M, Villain H, Docagne F, Roussel BD, Ramos JA, Vivien D, Fernandez-Ruiz J, Ali C. Pharmacological activation/inhibition of the cannabinoid system affects alcohol withdrawal-induced neuronal hypersensitivity to excitotoxic insults. PLoS One 2011;6(8):e23690.
- Reference 1069
-
Deikel SM, Carder B. Attentuation of precipitated abstinence in methadone-dependent rats by delta9-THC. Psychopharmacol Commun 1976;2(0098-616; 0098-616; 1):61-5.
- Reference 1070
-
Vela G, Fuentes JA, Bonnin A, Fernandez-Ruiz J, Ruiz-Gayo M. Perinatal exposure to delta 9-tetrahydrocannabinol (delta 9-THC) leads to changes in opioid-related behavioral patterns in rats. Brain Res 1995 05/22;680(0006-8993; 0006-8993; 1-2):142-7.
- Reference 1071
-
Yamaguchi T, Hagiwara Y, Tanaka H, Sugiura T, Waku K, Shoyama Y, Watanabe S, Yamamoto T. Endogenous cannabinoid, 2-arachidonoylglycerol, attenuates naloxone-precipitated withdrawal signs in morphine-dependent mice. Brain Res 2001 08/03;909(0006-8993; 0006-8993; 1-2):121-6.
- Reference 1072
-
Reiman A. Cannabis as a substitute for alcohol and other drugs. Harm.Reduct.J. 2009;6(1477-7517; 1477-7517):35-9.
- Reference 1073
-
Wenger LD, Lopez AM, Comfort M, Kral AH. The phenomenon of low-frequency heroin injection among street-based urban poor: Drug user strategies and contexts of use. Int J Drug Policy 2014 May;25(3):471-9.
- Reference 1074
-
Peters DC. Patients and caregivers report using medical marijuana to decrease prescription narcotics use. Humboldt Journal of Social Relations 2013(35):24.
- Reference 1075
-
Kral AH, Wenger L, Novak SP, Chu D, Corsi KF, Coffa D, Shapiro B, Bluthenthal RN. Is cannabis use associated with less opioid use among people who inject drugs? Drug Alcohol Depend 2015 Aug 1;153:236-41.
- Reference 1076
-
Epstein DH, Preston KL. No evidence for reduction of opioid-withdrawal symptoms by cannabis smoking during a methadone dose taper. Am J Addict 2015 Jun;24(4):323-8.
- Reference 1077
-
Jicha CJ, Lofwall MR, Nuzzo PA, Babalonis S, Elayi SC, Walsh SL. Safety of oral dronabinol during opioid withdrawal in humans. Drug Alcohol Depend 2015 Dec 1;157:179-83.
- Reference 1078
-
Bossong MG, Jansma JM, Bhattacharyya S, Ramsey NF. Role of the endocannabinoid system in brain functions relevant for schizophrenia: An overview of human challenge studies with cannabis or 9-tetrahydrocannabinol (THC). Prog Neuropsychopharmacol Biol Psychiatry 2014 Jul 3;52:53-69.
- Reference 1079
-
Radhakrishnan R, Wilkinson ST, D'Souza DC. Gone to pot - A review of the association between cannabis and psychosis. Front Psychiatry 2014 May 22;5:54.
- Reference 1080
-
Fernandez-Espejo E, Viveros MP, Nunez L, Ellenbroek BA, Rodriguez de Fonseca F. Role of cannabis and endocannabinoids in the genesis of schizophrenia. Psychopharmacology (Berl) 2009 11;206(1432-2072; 0033-3158; 4):531-49.
- Reference 1081
-
Koethe D, Giuffrida A, Schreiber D, Hellmich M, Schultze-Lutter F, Ruhrmann S, Klosterkotter J, Piomelli D, Leweke FM. Anandamide elevation in cerebrospinal fluid in initial prodromal states of psychosis. Br J Psychiatry 2009 04;194(1472-1465; 0007-1250; 4):371-2.
- Reference 1082
-
Leweke FM, Giuffrida A, Wurster U, Emrich HM, Piomelli D. Elevated endogenous cannabinoids in schizophrenia. Neuroreport 1999 06/03;10(0959-4965; 0959-4965; 8):1665-9.
- Reference 1083
-
De Marchi N, De Petrocellis L, Orlando P, Daniele F, Fezza F, Di Marzo V. Endocannabinoid signalling in the blood of patients with schizophrenia. Lipids Health Dis. 2003 08/19;2(1476-511; 1476-511):5.
- Reference 1084
-
Desfosses J, Stip E, Bentaleb LA, Lipp O, Chiasson JP, Furtos A, Venne K, Kouassi E, Potvin S. Plasma endocannabinoid alterations in individuals with substance use disorder are dependent on the "mirror effect" of schizophrenia. Front Psychiatry 2012 Sep 25;3:85.
- Reference 1085
-
Giuffrida A, Leweke FM, Gerth CW, Schreiber D, Koethe D, Faulhaber J, Klosterkotter J, Piomelli D. Cerebrospinal anandamide levels are elevated in acute schizophrenia and are inversely correlated with psychotic symptoms. Neuropsychopharmacology 2004 Nov;29(11):2108-14.
- Reference 1086
-
Dean B, Sundram S, Bradbury R, Scarr E, Copolov D. Studies on [3H]CP-55940 binding in the human central nervous system: Regional specific changes in density of cannabinoid-1 receptors associated with schizophrenia and cannabis use. Neuroscience 2001;103(1):9-15.
- Reference 1087
-
Dalton VS, Long LE, Weickert CS, Zavitsanou K. Paranoid schizophrenia is characterized by increased CB1 receptor binding in the dorsolateral prefrontal cortex. Neuropsychopharmacology 2011 Jul;36(8):1620-30.
- Reference 1088
-
Jenko KJ, Hirvonen J, Henter ID, Anderson KB, Zoghbi SS, Hyde TM, Deep-Soboslay A, Innis RB, Kleinman JE. Binding of a tritiated inverse agonist to cannabinoid CB1 receptors is increased in patients with schizophrenia. Schizophr Res 2012 Nov;141(2-3):185-8.
- Reference 1089
-
Zavitsanou K, Garrick T, Huang XF. Selective antagonist [3H]SR141716A binding to cannabinoid CB1 receptors is increased in the anterior cingulate cortex in schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry 2004 Mar;28(2):355-60.
- Reference 1090
-
Newell KA, Deng C, Huang XF. Increased cannabinoid receptor density in the posterior cingulate cortex in schizophrenia. Exp Brain Res 2006 Jul;172(4):556-60.
- Reference 1091
-
Wong DF, Kuwabara H, Horti AG, Raymont V, Brasic J, Guevara M, Ye W, Dannals RF, Ravert HT, Nandi A, et al. Quantification of cerebral cannabinoid receptors subtype 1 (CB1) in healthy subjects and schizophrenia by the novel PET radioligand [11C]OMAR. Neuroimage 2010 Oct 1;52(4):1505-13.
- Reference 1092
-
Ceccarini J, De Hert M, Van Winkel R, Peuskens J, Bormans G, Kranaster L, Enning F, Koethe D, Leweke FM, Van Laere K. Increased ventral striatal CB1 receptor binding is related to negative symptoms in drug-free patients with schizophrenia. Neuroimage 2013 Oct 1;79:304-12.
- Reference 1093
-
McCreadie RG. Use of drugs, alcohol and tobacco by people with schizophrenia: Case-control study. Br J Psychiatry 2002 10;181(0007-1250; 0007-1250):321-5.
- Reference 1094
-
Gregg L, Barrowclough C, Haddock G. Reasons for increased substance use in psychosis. Clin Psychol Rev 2007 05;27(0272-7358; 0272-7358; 4):494-510.
- Reference 1095
-
Khantzian EJ. The self-medication hypothesis of addictive disorders: Focus on heroin and cocaine dependence. Am J Psychiatry 1985 11;142(0002-953; 0002-953; 11):1259-64.
- Reference 1096
-
Perez LG, Santacana AM, Baquero DB, Perez-Sola V. Reasons and subjective effects of cannabis use among people with psychotic disorders: A systematic review. Actas. Esp. Psiquiatr 2014;42(2):83.
- Reference 1097
-
Rabin RA, Goodman MS, George TP, Barr MS. Neurobiology of comorbid substance use disorders in mental illness: A closer look at the underlying commonalities between cannabis and schizophrenia.
Current Addiction Reports 2014;1:261. - Reference 1098
-
Lembke A. Time to abandon the self-medication hypothesis in patients with psychiatric disorders. Am J Drug Alcohol Abuse 2012 11;38(1097-9891; 0095-2990; 6):524-9.
- Reference 1099
-
van Winkel R, Kuepper R. Epidemiological, neurobiological, and genetic clues to the mechanisms linking cannabis use to risk for nonaffective psychosis. Annu Rev Clin Psychol 2014;10:767-91.
- Reference 1100
-
Renard J, Krebs MO, Le Pen G, Jay TM. Long-term consequences of adolescent cannabinoid exposure in adult psychopathology. Front Neurosci 2014 Nov 10;8:361.
- Reference 1101
-
Chambers RA, Krystal JH, Self DW. A neurobiological basis for substance abuse comorbidity in schizophrenia. Biol Psychiatry 2001 07/15;50(0006-3223; 0006-3223; 2):71-83.
- Reference 1102
-
Iseger TA, Bossong MG. A systematic review of the antipsychotic properties of cannabidiol in humans. Schizophr Res 2015 Mar;162(1-3):153-61.
- Reference 1103
-
Gage SH, Hickman M, Zammit S. Association between cannabis and psychosis: Epidemiologic evidence. Biol Psychiatry 2016 Apr 1;79(7):549-56.
- Reference 1104
-
French L, Gray C, Leonard G, Perron M, Pike GB, Richer L, Seguin JR, Veillette S, Evans CJ, Artiges E, et al. Early cannabis use, polygenic risk score for schizophrenia and brain maturation in adolescence. JAMA Psychiatry 2015 Oct 1;72(10):1002-11.
- Reference 1105
-
Gage SH, Hickman M, Zammit S. Association between cannabis and psychosis: Epidemiologic evidence. Biol Psychiatry 2015 Aug 12.
- Reference 1106
-
Di Forti M, Morgan C, Dazzan P, Pariante C, Mondelli V, Marques TR, Handley R, Luzi S, Russo M, Paparelli A, et al. High-potency cannabis and the risk of psychosis. Br J Psychiatry 2009 Dec;195(6):488-91.
- Reference 1107
-
Di Forti M, Sallis H, Allegri F, Trotta A, Ferraro L, Stilo SA, Marconi A, La Cascia C, Reis Marques T, Pariante C, et al. Daily use, especially of high-potency cannabis, drives the earlier onset of psychosis in cannabis users. Schizophr Bull 2014 Nov;40(6):1509-17.
- Reference 1108
-
Arnold JC, Boucher AA, Karl T. The yin and yang of cannabis-induced psychosis: The actions of delta(9)-tetrahydrocannabinol and cannabidiol in rodent models of schizophrenia. Curr Pharm Des 2012;18(32):5113-30.
- Reference 1109
-
Wegener N, Koch M. Neurobiology and systems physiology of the endocannabinoid system. Pharmacopsychiatry 2009 May;42 Suppl 1:S79-86.
- Reference 1110
-
Caspi A, Moffitt TE, Cannon M, McClay J, Murray R, Harrington H, Taylor A, Arseneault L, Williams B, Braithwaite A, et al. Moderation of the effect of adolescent-onset cannabis use on adult psychosis by a functional polymorphism in the catechol-O-methyltransferase gene: Longitudinal evidence of a gene X environment interaction. Biol Psychiatry 2005 05/15;57(0006-3223; 0006-3223; 10):1117-27.
- Reference 1111
-
Henquet C, Rosa A, Krabbendam L, Papiol S, Fananas L, Drukker M, Ramaekers JG, van OJ. An experimental study of catechol-o-methyltransferase Val158Met moderation of delta-9-tetrahydrocannabinol-induced effects on psychosis and cognition. Neuropsychopharmacology 2006 12;31(0893-133; 0006-3223; 12):2748-57.
- Reference 1112
-
Henquet C, Rosa A, Delespaul P, Papiol S, Fananas L, van OJ, Myin-Germeys I. COMT ValMet moderation of cannabis-induced psychosis: A momentary assessment study of 'switching on' hallucinations in the flow of daily life. Acta Psychiatr Scand 2009 02;119(1600-0447; 0001-690; 2):156-60.
- Reference 1113
-
Pelayo-Teran JM, Perez-Iglesias R, Mata I, Carrasco-Marin E, Vazquez-Barquero JL, Crespo-Facorro B. Catechol-O-methyltransferase (COMT) Val158Met variations and cannabis use in first-episode non-affective psychosis: Clinical-onset implications. Psychiatry Res 2010 10/30;179(0165-1781; 0165-1781; 3):291-6.
- Reference 1114
-
Estrada G, Fatjo-Vilas M, Munoz MJ, Pulido G, Minano MJ, Toledo E, Illa JM, Martin M, Miralles ML, Miret S, et al. Cannabis use and age at onset of psychosis: Further evidence of interaction with COMT Val158Met polymorphism. Acta Psychiatr Scand 2011 06;123(1600-0447; 0001-690; 6):485-92.
- Reference 1115
-
Zammit S, Spurlock G, Williams H, Norton N, Williams N, O'Donovan MC, Owen MJ. Genotype effects of CHRNA7, CNR1 and COMT in schizophrenia: Interactions with tobacco and cannabis use. Br J Psychiatry 2007 Nov;191:402-7.
- Reference 1116
-
Zammit S, Owen MJ, Evans J, Heron J, Lewis G. Cannabis, COMT and psychotic experiences. Br J Psychiatry 2011 Nov;199(5):380-5.
- Reference 1117
-
Costas J, Sanjuan J, Ramos-Rios R, Paz E, Agra S, Tolosa A, Paramo M, Brenlla J, Arrojo M. Interaction between COMT haplotypes and cannabis in schizophrenia: A case-only study in two samples from spain. Schizophr Res 2011 Apr;127(1-3):22-7.
- Reference 1118
-
van Winkel R, van Beveren NJ, Simons C. AKT1 moderation of cannabis-induced cognitive alterations in psychotic disorder. Neuropsychopharmacology 2011 11;36(1740-634; 0006-3223; 12):2529-37.
- Reference 1119
-
van Winkel R. Family-based analysis of genetic variation underlying psychosis-inducing effects of cannabis: Sibling analysis and proband follow-up. Arch Gen Psychiatry 2011 02;68(1538-3636; 0003-990; 2):148-57.
- Reference 1120
-
Di Forti M, Iyegbe C, Sallis H, Kolliakou A, Falcone MA, Paparelli A, Sirianni M, La Cascia C, Stilo SA, Marques TR, et al. Confirmation that the AKT1 (rs2494732) genotype influences the risk of psychosis in cannabis users. Biol Psychiatry 2012 11/15;72(1873-2402; 0006-3223; 10):811-6.
- Reference 1121
-
Morgan CJ, Freeman TP, Powell J, Curran HV. AKT1 genotype moderates the acute psychotomimetic effects of naturalistically smoked cannabis in young cannabis smokers. Transl Psychiatry 2016 Feb 16;6:e738.
- Reference 1122
-
Zhang P, Bian Y, Liu N, Tang Y, Pan C, Hu Y, Tang Z. The SNP rs1625579 in miR-137 gene and risk of schizophrenia in chinese population: A meta-analysis. Compr Psychiatry 2016 May;67:26-32.
- Reference 1123
-
Suarez-Pinilla P, Roiz-Santianez R, Ortiz-Garcia de la Foz V, Guest PC, Ayesa-Arriola R, Cordova-Palomera A, Tordesillas-Gutierrez D, Crespo-Facorro B. Brain structural and clinical changes after first episode psychosis: Focus on cannabinoid receptor 1 polymorphisms. Psychiatry Res 2015 Aug 30;233(2):112-9.
- Reference 1124
-
Cho Y, Ryu S, Huh I, Cho EY, Oh H, Lee YS, Lee WK, Park T, Kwon JS, Hong KS. Effects of genetic variations in NRG1 on cognitive domains in patients with schizophrenia and healthy individuals. Psychiatr Genet 2015 Aug;25(4):147-54.
- Reference 1125
-
Morgan CJ, Curran HV. Effects of cannabidiol on schizophrenia-like symptoms in people who use cannabis. Br J Psychiatry 2008 Apr;192(4):306-7.
- Reference 1126
-
Morgan CJ, Gardener C, Schafer G, Swan S, Demarchi C, Freeman TP, Warrington P, Rupasinghe I, Ramoutar A, Tan N, et al. Sub-chronic impact of cannabinoids in street cannabis on cognition, psychotic-like symptoms and psychological well-being. Psychol Med 2012 Feb;42(2):391-400.
- Reference 1127
-
Musty R. Cannabinoids and anxiety. In: R. Mechoulam, editor. Cannabinoids as therapeutics. Basel: Birkhaüser; 2005. ID: 2278; RP: NOT IN FILE.
- Reference 1128
-
Dalton WS, Martz R, Lemberger L, Rodda BE, Forney RB. Influence of cannabidiol on delta-9-tetrahydrocannabinol effects. Clin Pharmacol Ther 1976 Mar;19(3):300-9.
- Reference 1129
-
Zuardi AW, Shirakawa I, Finkelfarb E, Karniol IG. Action of cannabidiol on the anxiety and other effects produced by delta 9-THC in normal subjects. Psychopharmacology (Berl) 1982;76(3):245-50.
- Reference 1130
-
Roser P, Gallinat J, Weinberg G, Juckel G, Gorynia I, Stadelmann AM. Psychomotor performance in relation to acute oral administration of Delta9-tetrahydrocannabinol and standardized cannabis extract in healthy human subjects. Eur Arch Psychiatry Clin Neurosci 2009 Aug;259(5):284-92.
- Reference 1131
-
Englund A, Morrison PD, Nottage J, Hague D, Kane F, Bonaccorso S, Stone JM, Reichenberg A, Brenneisen R, Holt D, et al. Cannabidiol inhibits THC-elicited paranoid symptoms and hippocampal-dependent memory impairment. J Psychopharmacol 2013 Jan;27(1):19-27.
- Reference 1132
-
Zuardi AW, Morais SL, Guimaraes FS, Mechoulam R. Antipsychotic effect of cannabidiol. J Clin Psychiatry 1995 Oct;56(10):485-6.
- Reference 1133
-
Zuardi AW, Crippa JA, Hallak JE, Moreira FA, Guimaraes FS. Cannabidiol, a cannabis sativa constituent, as an antipsychotic drug. Braz J Med Biol Res 2006 Apr;39(4):421-9.
- Reference 1134
-
Zuardi AW, Hallak JE, Dursun SM, Morais SL, Sanches RF, Musty RE, Crippa JA. Cannabidiol monotherapy for treatment-resistant schizophrenia. J Psychopharmacol 2006 Sep;20(5):683-6.
- Reference 1135
-
Hallak JE, Machado-de-Sousa JP, Crippa JA, Sanches RF, Trzesniak C, Chaves C, Bernardo SA, Regalo SC, Zuardi AW. Performance of schizophrenic patients in the stroop color word test and electrodermal responsiveness after acute administration of cannabidiol (CBD). Rev Bras Psiquiatr 2010 Mar;32(1):56-61.
- Reference 1136
-
Leweke FM, Piomelli D, Pahlisch F, Muhl D, Gerth CW, Hoyer C, Klosterkotter J, Hellmich M, Koethe D. Cannabidiol enhances anandamide signaling and alleviates psychotic symptoms of schizophrenia. Transl Psychiatry 2012 Mar 20;2:e94.
- Reference 1137
-
Leweke FM, Schneider U, Radwan M, Schmidt E, Emrich HM. Different effects of nabilone and cannabidiol on binocular depth inversion in man. Pharmacol Biochem Behav 2000 May;66(1):175-81.
- Reference 1138
-
Klein C, Karanges E, Spiro A, Wong A, Spencer J, Huynh T, Gunasekaran N, Karl T, Long LE, Huang XF, et al. Cannabidiol potentiates delta(9)-tetrahydrocannabinol (THC) behavioural effects and alters THC pharmacokinetics during acute and chronic treatment in adolescent rats. Psychopharmacology (Berl) 2011 Nov;218(2):443-57.
- Reference 1139
-
Reid MJ, Bornheim LM. Cannabinoid-induced alterations in brain disposition of drugs of abuse. Biochem Pharmacol 2001 Jun 1;61(11):1357-67.
- Reference 1140
-
Zuardi AW, Rodrigues JA, Cunha JM. Effects of cannabidiol in animal models predictive of antipsychotic activity. Psychopharmacology (Berl) 1991;104(0033-3158; 0033-3158; 2):260-4.
- Reference 1141
-
Moreira FA, Guimaraes FS. Cannabidiol inhibits the hyperlocomotion induced by psychotomimetic drugs in mice. Eur J Pharmacol 2005 04/11;512(0014-2999; 0014-2999; 2-3):199-205.
- Reference 1142
-
Zuardi AW, Crippa JA, Hallak JE, Pinto JP, Chagas MH, Rodrigues GG, Dursun SM, Tumas V. Cannabidiol for the treatment of psychosis in parkinson's disease. J Psychopharmacol 2009 Nov;23(8):979-83.
- Reference 1143
-
[Internet]. Available from: https://canvasrx.com/.
- Reference 1144
-
Zuardi AW. Cannabidiol: From an inactive cannabinoid to a drug with wide spectrum of action. Rev.Bras.Psiquiatr. 2008 09;30(1516-4446; 1516-4446; 3):271-80.
- Reference 1145
-
Benito C, Nunez E, Pazos MR, Tolon RM, Romero J. The endocannabinoid system and alzheimer's disease. Mol Neurobiol 2007 08;36(0893-7648; 0893-7648; 1):75-81.
- Reference 1146
-
Koppel J, Davies P. Targeting the endocannabinoid system in alzheimer's disease. J Alzheimer's Dis 2008 11;15(1387-2877; 1387-2877; 3):495-504.
- Reference 1147
-
van der Stelt M, Mazzola C, Esposito G, Matias I, Petrosino S, De FD, Micale V, Steardo L, Drago F, Iuvone T, et al. Endocannabinoids and beta-amyloid-induced neurotoxicity in vivo: Effect of pharmacological elevation of endocannabinoid levels. Cell Mol Life Sci 2006 06;63(1420-682; 1420-682; 12):1410-24.
- Reference 1148
-
Jung KM, Astarita G, Yasar S, Vasilevko V, Cribbs DH, Head E, Cotman CW, Piomelli D. An amyloid beta(42)-dependent deficit in anandamide mobilization is associated with cognitive dysfunction in alzheimer's disease. Neurobiol Aging 2011 05/03;33(1558-1497; 0197-4580; 8):1522-32.
- Reference 1149
-
Benito C, Nunez E, Tolon RM, Carrier EJ, Rabano A, Hillard CJ, Romero J. Cannabinoid CB2 receptors and fatty acid amide hydrolase are selectively overexpressed in neuritic plaque-associated glia in alzheimer's disease brains. J Neurosci 2003 Dec 3;23(35):11136-41.
- Reference 1150
-
Noonan J, Tanveer R, Klompas A, Gowran A, McKiernan J, Campbell VA. Endocannabinoids prevent beta-amyloid-mediated lysosomal destabilization in cultured neurons. J Biol Chem 2010 12/03;285(1083-351; 0021-9258; 49):38543-54.
- Reference 1151
-
Eubanks LM, Rogers CJ, Beuscher AE, Koob GF, Olson AJ, Dickerson TJ, Janda KD. A molecular link between the active component of marijuana and alzheimer's disease pathology. Mol.Pharm. 2006 11;3(1543-8384; 1543-8384; 6):773-7.
- Reference 1152
-
Iuvone T, Esposito G, Esposito R, Santamaria R, Di RM, Izzo AA. Neuroprotective effect of cannabidiol, a non-psychoactive component from cannabis sativa, on beta-amyloid-induced toxicity in PC12 cells. J Neurochem 2004 04;89(0022-3042; 0022-3042; 1):134-41.
- Reference 1153
-
Esposito G, De FD, Carnuccio R, Izzo AA, Iuvone T. The marijuana component cannabidiol inhibits beta-amyloid-induced tau protein hyperphosphorylation through Wnt/beta-catenin pathway rescue in PC12 cells. J.Mol.Med.(Berl) 2006 03;84(0946-2716; 0946-2716; 3):253-8.
- Reference 1154
-
Booz GW. Cannabidiol as an emergent therapeutic strategy for lessening the impact of inflammation on oxidative stress. Free Radic Biol Med 2011 01/14;51(1873-4596; 0891-5849; 5):1054-61.
- Reference 1155
-
Vazquez C, Tolon RM, Grande MT, Caraza M, Moreno M, Koester EC, Villaescusa B, Ruiz-Valdepenas L, Fernandez-Sanchez FJ, Cravatt BF, et al. Endocannabinoid regulation of amyloid-induced neuroinflammation. Neurobiol Aging 2015 Nov;36(11):3008-19.
- Reference 1156
-
Esposito G, Scuderi C, Savani C, Steardo L,Jr., De FD, Cottone P, Iuvone T, Cuomo V, Steardo L. Cannabidiol in vivo blunts beta-amyloid induced neuroinflammation by suppressing IL-1beta and iNOS expression. Br J Pharmacol 2007 08;151(0007-1188; 0007-1188; 8):1272-9.
- Reference 1157
-
Esposito G, Iuvone T, Savani C, Scuderi C, De FD, Papa M, Di M,V, Steardo L. Opposing control of cannabinoid receptor stimulation on amyloid-beta-induced reactive gliosis: In vitro and in vivo evidence. J Pharmacol Exp Ther 2007 09;322(0022-3565; 0022-3565; 3):1144-52.
- Reference 1158
-
Aso E, Sanchez-Pla A, Vegas-Lozano E, Maldonado R, Ferrer I. Cannabis-based medicine reduces multiple pathological processes in AbetaPP/PS1 mice. J Alzheimers Dis 2015;43(3):977-91.
- Reference 1159
-
Krishnan S, Cairns R, Howard R. Cannabinoids for the treatment of dementia. Cochrane Database Syst Rev 2009(1469-493; 1361-6137; 2):CD007204.
- Reference 1160
-
Volicer L, Stelly M, Morris J, McLaughlin J, Volicer BJ. Effects of dronabinol on anorexia and disturbed behavior in patients with alzheimer's disease. Int J Geriatr Psychiatry 1997 09;12(0885-6230; 9):913-9.
- Reference 1161
-
Walther S, Mahlberg R, Eichmann U, Kunz D. Delta-9-tetrahydrocannabinol for nighttime agitation in severe dementia. Psychopharmacology (Berl) 2006 05;185(0033-3158; 0033-3158; 4):524-8.
- Reference 1162
-
Mahlberg R, Walther S. Actigraphy in agitated patients with dementia. monitoring treatment outcomes. Z Gerontol Geriatr 2007 Jun;40(3):178-84.
- Reference 1163
-
Passmore MJ. The cannabinoid receptor agonist nabilone for the treatment of dementia-related agitation. Int J Geriatr Psychiatry 2008 01;23(0885-6230; 0885-6230; 1):116-7.
- Reference 1164
-
Zajac DM, Sikkema SR, Chandrasena R. Nabilone for the treatment of dementia-associated sexual disinhibition. Prim Care Companion CNS Disord 2015 Feb 19;17(1):10.4088/PCC.14l01695. eCollection 2015.
- Reference 1165
-
Woodward MR, Harper DG, Stolyar A, Forester BP, Ellison JM. Dronabinol for the treatment of agitation and aggressive behavior in acutely hospitalized severely demented patients with noncognitive behavioral symptoms. Am J Geriatr Psychiatry 2014 Apr;22(4):415-9.
- Reference 1166
-
Klein TW. Cannabinoid-based drugs as anti-inflammatory therapeutics. Nat.Rev.Immunol. 2005 05;5(1474-1733; 1474-1733; 5):400-11.
- Reference 1167
-
Nagarkatti P, Pandey R, Rieder SA, Hegde VL, Nagarkatti M. Cannabinoids as novel anti-inflammatory drugs. Future.Med.Chem. 2009 10;1(1756-8927; 1756-8919; 7):1333-49.
- Reference 1168
-
Stander S, Schmelz M, Metze D, Luger T, Rukwied R. Distribution of cannabinoid receptor 1 (CB1) and 2 (CB2) on sensory nerve fibers and adnexal structures in human skin. J Dermatol Sci 2005 06;38(0923-1811; 0923-1811; 3):177-88.
- Reference 1169
-
Toth BI, Dobrosi N, Dajnoki A, Czifra G, Olah A, Szollosi AG, Juhasz I, Sugawara K, Paus R, Biro T. Endocannabinoids modulate human epidermal keratinocyte proliferation and survival via the sequential engagement of cannabinoid receptor-1 and transient receptor potential vanilloid-1. J Invest Dermatol 2011 05;131(1523-1747; 0022-202; 5):1095-104.
- Reference 1170
-
Maccarrone M, Di RM, Battista N, Gasperi V, Guerrieri P, Rossi A, Finazzi-Agro A. The endocannabinoid system in human keratinocytes. evidence that anandamide inhibits epidermal differentiation through CB1 receptor-dependent inhibition of protein kinase C, activation protein-1, and transglutaminase. J Biol Chem 2003 09/05;278(0021-9258; 0021-9258; 36):33896-903.
- Reference 1171
-
Wilkinson JD, Williamson EM. Cannabinoids inhibit human keratinocyte proliferation through a non-CB1/CB2 mechanism and have a potential therapeutic value in the treatment of psoriasis. J Dermatol Sci 2007 02;45(0923-1811; 0923-1811; 2):87-92.
- Reference 1172
-
Gaffal E, Cron M, Glodde N, Tuting T. Anti-inflammatory activity of topical THC in DNFB-mediated mouse allergic contact dermatitis independent of CB1 and CB2 receptors. Allergy 2013 Aug;68(8):994-1000.
- Reference 1173
-
Olah A, Toth BI, Borbiro I, Sugawara K, Szollosi AG, Czifra G, Pal B, Ambrus L, Kloepper J, Camera E, et al. Cannabidiol exerts sebostatic and antiinflammatory effects on human sebocytes. J Clin Invest 2014 Sep;124(9):3713-24.
- Reference 1174
-
Pucci M, Rapino C, Di Francesco A, Dainese E, D'Addario C, Maccarrone M. Epigenetic control of skin differentiation genes by phytocannabinoids. Br J Pharmacol 2013 Oct;170(3):581-91.
- Reference 1175
-
Dvorak M, Watkinson A, McGlone F, Rukwied R. Histamine induced responses are attenuated by a cannabinoid receptor agonist in human skin. Inflamm Res 2003 06;52(1023-3830; 1023-3830; 6):238-45.
- Reference 1176
-
Rukwied R, Watkinson A, McGlone F, Dvorak M. Cannabinoid agonists attenuate capsaicin-induced responses in human skin. Pain 2003 04;102(0304-3959; 0304-3959; 3):283-8.
- Reference 1177
-
Maida V, Corban J. Topical medical cannabis: A new treatment for wound pain-three cases of pyoderma gangrenosum. J Pain Symptom Manage 2017 Nov;54(5):732-6.
- Reference 1178
-
Hashim PW, Cohen JL, Pompei DT, Goldenberg G. Topical cannabinoids in dermatology. Cutis 2017 Jul;100(1):50-2.
- Reference 1179
-
Watson ES, Murphy JC, Turner CE. Allergenic properties of naturally occurring cannabinoids. J Pharm Sci 1983 08;72(0022-3549; 0022-3549; 8):954-5.
- Reference 1180
-
Williams C, Thompstone J, Wilkinson M. Work-related contact urticaria to cannabis sativa. Contact Derm 2008 01;58(1600-0536; 0105-1873; 1):62-3.
- Reference 1181
-
Mikuriya TH. Marijuana in medicine: Past, present and future. Calif Med 1969 01;110(0008-1264; 0008-1264; 1):34-40.
- Reference 1182
-
Kalant H. Medicinal use of cannabis: History and current status. Pain Res.Manag. 2001;6(1203-6765; 1203-6765; 2):80-91.
- Reference 1183
-
Zuardi AW. History of cannabis as a medicine: A review. Rev.Bras.Psiquiatr. 2006 06;28(1516-4446; 1516-4446; 2):153-7.
- Reference 1184
-
Duncan M, Thomas AD, Cluny NL, Patel A, Patel KD, Lutz B, Piomelli D, Alexander SP, Sharkey KA. Distribution and function of monoacylglycerol lipase in the gastrointestinal tract. Am J Physiol Gastrointest Liver Physiol 2008 12;295(0193-1857; 0193-1857; 6):G1255-65.
- Reference 1185
-
Kennedy PJ, Clarke G, Quigley EM, Groeger JA, Dinan TG, Cryan JF. Gut memories: Towards a cognitive neurobiology of irritable bowel syndrome. Neurosci Biobehav Rev 2012 01;36(1873-7528; 0149-7634; 1):310-40.
- Reference 1186
-
Storr MA, Yuce B, Andrews CN, Sharkey KA. The role of the endocannabinoid system in the pathophysiology and treatment of irritable bowel syndrome. Neurogastroenterol Motil 2008 08;20(1365-2982; 1350-1925; 8):857-68.
- Reference 1187
-
Yao X, Yang YS, Cui LH, Zhao KB, Zhang ZH, Peng LH, Guo X, Sun G, Shang J, Wang WF, et al. Subtypes of irritable bowel syndrome on rome III criteria: A multicenter study. J Gastroenterol Hepatol 2012 04;27(1440-1746; 0815-9319; 4):760-5.
- Reference 1188
-
Camilleri M, Carlson P, McKinzie S, Grudell A, Busciglio I, Burton D, Baxter K, Ryks M, Zinsmeister AR. Genetic variation in endocannabinoid metabolism, gastrointestinal motility, and sensation. Am J Physiol Gastrointest Liver Physiol 2008 01;294(0193-1857; 0193-1857; 1):G13-9.
- Reference 1189
-
Park JM, Choi MG, Cho YK, Lee IS, Kim SW, Choi KY, Chung IS. Cannabinoid receptor 1 gene polymorphism and irritable bowel syndrome in the korean population: A hypothesis-generating study. J Clin Gastroenterol 2011 01;45(1539-2031; 0192-0790; 1):45-9.
- Reference 1190
-
Camilleri M, Katzka DA. Irritable bowel syndrome: Methods, mechanisms, and pathophysiology. genetic epidemiology and pharmacogenetics in irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol 2012 05/15;302(1522-1547; 0193-1857; 10):G1075-84.
- Reference 1191
-
Sanson M, Bueno L, Fioramonti J. Involvement of cannabinoid receptors in inflammatory hypersensitivity to colonic distension in rats. Neurogastroenterol Motil 2006 10;18(1350-1925; 1350-1925; 10):949-56.
- Reference 1192
-
Brusberg M, Arvidsson S, Kang D, Larsson H, Lindstrom E, Martinez V. CB1 receptors mediate the analgesic effects of cannabinoids on colorectal distension-induced visceral pain in rodents. J Neurosci 2009 02/04;29(1529-2401; 0270-6474; 5):1554-64.
- Reference 1193
-
Kimball ES, Wallace NH, Schneider CR, D'Andrea MR, Hornby PJ. Small intestinal cannabinoid receptor changes following a single colonic insult with oil of mustard in mice. Front Pharmacol. 2010;1(1663-9812):132.
- Reference 1194
-
Esfandyari T, Camilleri M, Ferber I, Burton D, Baxter K, Zinsmeister AR. Effect of a cannabinoid agonist on gastrointestinal transit and postprandial satiation in healthy human subjects: A randomized, placebo-controlled study. Neurogastroenterol Motil 2006 09;18(1350-1925; 1350-1925; 9):831-8.
- Reference 1195
-
Esfandyari T, Camilleri M, Busciglio I, Burton D, Baxter K, Zinsmeister AR. Effects of a cannabinoid receptor agonist on colonic motor and sensory functions in humans: A randomized, placebo-controlled study. Am J Physiol Gastrointest Liver Physiol 2007 07;293(0193-1857; 0193-1857; 1):G137-45.
- Reference 1196
-
Rao SS, Singh S. Clinical utility of colonic and anorectal manometry in chronic constipation. J Clin Gastroenterol 2010 10;44(1539-2031; 0192-0790; 9):597-609.
- Reference 1197
-
Coulie B, Camilleri M, Bharucha AE, Sandborn WJ, Burton D. Colonic motility in chronic ulcerative proctosigmoiditis and the effects of nicotine on colonic motility in patients and healthy subjects. Aliment Pharmacol Ther 2001 05;15(0269-2813; 0269-2813; 5):653-63.
- Reference 1198
-
Lembo T, Wright RA, Bagby B, Decker C, Gordon S, Jhingran P, Carter E. Alosetron controls bowel urgency and provides global symptom improvement in women with diarrhea-predominant irritable bowel syndrome. Am J Gastroenterol 2001 09;96(0002-9270; 0002-9270; 9):2662-70.
- Reference 1199
-
Wong BS, Camilleri M, Busciglio I, Carlson P, Szarka LA, Burton D, Zinsmeister AR. Pharmacogenetic trial of a cannabinoid agonist shows reduced fasting colonic motility in patients with nonconstipated irritable bowel syndrome. Gastroenterology 2011 11;141(1528-0012; 0016-5085; 5):1638-47.
- Reference 1200
-
Wong BS, Camilleri M, Eckert D, Carlson P, Ryks M, Burton D, Zinsmeister AR. Randomized pharmacodynamic and pharmacogenetic trial of dronabinol effects on colon transit in irritable bowel syndrome-diarrhea. Neurogastroenterol Motil 2012 04;24(1365-2982; 1350-1925; 4):358-e169.
- Reference 1201
-
Di Sabatino A, Battista N, Biancheri P, Rapino C, Rovedatti L, Astarita G, Vanoli A, Dainese E, Guerci M, Piomelli D, et al. The endogenous cannabinoid system in the gut of patients with inflammatory bowel disease. Mucosal.Immunol. 2011 09;4(1935-3456; 1933-0219; 5):574-83.
- Reference 1202
-
Mowat C, Cole A, Windsor A, Ahmad T, Arnott I, Driscoll R, Mitton S, Orchard T, Rutter M, Younge L, et al. Guidelines for the management of inflammatory bowel disease in adults. Gut 2011 05;60(1468-3288; 0017-5749; 5):571-607.
- Reference 1203
-
Ligresti A, Bisogno T, Matias I, De PL, Cascio MG, Cosenza V, D'Argenio G, Scaglione G, Bifulco M, Sorrentini I, et al. Possible endocannabinoid control of colorectal cancer growth. Gastroenterology 2003 09;125(0016-5085; 0016-5085; 3):677-87.
- Reference 1204
-
Guagnini F, Valenti M, Mukenge S, Matias I, Bianchetti A, Di PS, Ferla G, Di M,V, Croci T. Neural contractions in colonic strips from patients with diverticular disease: Role of endocannabinoids and substance P. Gut 2006 07;55(0017-5749; 0017-5749; 7):946-53.
- Reference 1205
-
D'Argenio G, Petrosino S, Gianfrani C, Valenti M, Scaglione G, Grandone I, Nigam S, Sorrentini I, Mazzarella G, Di M,V. Overactivity of the intestinal endocannabinoid system in celiac disease and in methotrexate-treated rats. J Mol Med 2007 05;85(0946-2716; 0946-2716; 5):523-30.
- Reference 1206
-
Massa F, Marsicano G, Hermann H, Cannich A, Monory K, Cravatt BF, Ferri GL, Sibaev A, Storr M, Lutz B. The endogenous cannabinoid system protects against colonic inflammation. J Clin Invest 2004 04;113(0021-9738; 0021-9738; 8):1202-9.
- Reference 1207
-
D'Argenio G, Valenti M, Scaglione G, Cosenza V, Sorrentini I, Di M,V. Up-regulation of anandamide levels as an endogenous mechanism and a pharmacological strategy to limit colon inflammation. FASEB J 2006 03;20(1530-6860; 0892-6638; 3):568-70.
- Reference 1208
-
Storr M, Emmerdinger D, Diegelmann J, Yuce B, Pfennig S, Ochsenkuhn T, Goke B, Lohse P, Brand S. The role of fatty acid hydrolase gene variants in inflammatory bowel disease. Aliment Pharmacol Ther 2009 03/01;29(1365-2036; 0269-2813; 5):542-51.
- Reference 1209
-
Kimball ES, Schneider CR, Wallace NH, Hornby PJ. Agonists of cannabinoid receptor 1 and 2 inhibit experimental colitis induced by oil of mustard and by dextran sulfate sodium. Am J Physiol Gastrointest Liver Physiol 2006 08;291(0193-1857; 0193-1857; 2):G364-71.
- Reference 1210
-
Engel MA, Kellermann CA, Burnat G, Hahn EG, Rau T, Konturek PC. Mice lacking cannabinoid CB1-, CB2-receptors or both receptors show increased susceptibility to trinitrobenzene sulfonic acid (TNBS)-induced colitis. J Physiol Pharmacol 2010 02;61(1899-1505; 0867-5910; 1):89-97.
- Reference 1211
-
Jamontt JM, Molleman A, Pertwee RG, Parsons ME. The effects of delta-tetrahydrocannabinol and cannabidiol alone and in combination on damage, inflammation and in vitro motility disturbances in rat colitis. Br J Pharmacol 2010 06;160(1476-5381; 0007-1188; 3):712-23.
- Reference 1212
-
Di Paola R, Mazzon E, Patel NS, Genovese T, Muia C, Thiemermann C, De Sarro A, Cuzzocrea S. Beneficial effects of GW274150 treatment on the development of experimental colitis induced by dinitrobenzene sulfonic acid. Eur J Pharmacol 2005 01/10;507(0014-2999; 0014-2999; 1-3):281-9.
- Reference 1213
-
Storr MA, Keenan CM, Zhang H, Patel KD, Makriyannis A, Sharkey KA. Activation of the cannabinoid 2 receptor (CB2) protects against experimental colitis. Inflamm Bowel Dis 2009 11;15(1536-4844; 1078-0998; 11):1678-85.
- Reference 1214
-
Alhouayek M, Lambert DM, Delzenne NM, Cani PD, Muccioli GG. Increasing endogenous 2-arachidonoylglycerol levels counteracts colitis and related systemic inflammation. FASEB J 2011 08;25(1530-6860; 0892-6638; 8):2711-21.
- Reference 1215
-
Borrelli F, Aviello G, Romano B, Orlando P, Capasso R, Maiello F, Guadagno F, Petrosino S, Capasso F, Di M,V, et al. Cannabidiol, a safe and non-psychotropic ingredient of the marijuana plant cannabis sativa, is protective in a murine model of colitis. J.Mol.Med.(Berl) 2009 11;87(1432-1440; 0946-2716; 11):1111-21.
- Reference 1216
-
Schicho R, Storr M. Topical and systemic cannabidiol improves trinitrobenzene sulfonic acid colitis in mice. Pharmacology 2012;89(1423-0313; 0031-7012; 3-4):149-55.
- Reference 1217
-
Pagano E, Capasso R, Piscitelli F, Romano B, Parisi OA, Finizio S, Lauritano A, Marzo VD, Izzo AA, Borrelli F. An orally active cannabis extract with high content in cannabidiol attenuates chemically-induced intestinal inflammation and hypermotility in the mouse. Front Pharmacol 2016 Oct 4;7:341.
- Reference 1218
-
Borrelli F, Fasolino I, Romano B, Capasso R, Maiello F, Coppola D, Orlando P, Battista G, Pagano E, Di Marzo V, et al. Beneficial effect of the non-psychotropic plant cannabinoid cannabigerol on experimental inflammatory bowel disease. Biochem Pharmacol 2013 May 1;85(9):1306-16.
- Reference 1219
-
Romano B, Borrelli F, Fasolino I, Capasso R, Piscitelli F, Cascio M, Pertwee R, Coppola D, Vassallo L, Orlando P, et al. The cannabinoid TRPA1 agonist cannabichromene inhibits nitric oxide production in macrophages and ameliorates murine colitis. Br J Pharmacol 2013 May;169(1):213-29.
- Reference 1220
-
Singh UP, Singh NP, Singh B, Price RL, Nagarkatti M, Nagarkatti PS. Cannabinoid receptor-2 (CB2) agonist ameliorates colitis in IL-10(-/-) mice by attenuating the activation of T cells and promoting their apoptosis. Toxicol Appl Pharmacol 2012 01/15;258(1096-0333; 0041-008; 2):256-67.
- Reference 1221
-
Izzo AA, Capasso R, Aviello G, Borrelli F, Romano B, Piscitelli F, Gallo L, Capasso F, Orlando P, Di M,V. Inhibitory effect of cannabichromene, a major non-psychotropic cannabinoid extracted from cannabis sativa, on inflammation-induced hypermotility in mice. Br J Pharmacol 2012 06;166(1476-5381; 0007-1188; 4):1444-60.
- Reference 1222
-
García-Planella E, Marín L, Domènech E, Bernal I, Mañosa M, Zabana Y, Gassull M. Use of complementary and alternative medicine and drug abuse in patients with inflammatory bowel disease. Medicina Clinica (Barc.) 2007;128(2):45.
- Reference 1223
-
Ravikoff Allegretti J, Courtwright A, Lucci M, Korzenik JR, Levine J. Marijuana use patterns among patients with inflammatory bowel disease. Inflamm Bowel Dis 2013 Dec;19(13):2809-14.
- Reference 1224
-
Weiss A, Friedenberg F. Patterns of cannabis use in patients with inflammatory bowel disease: A population based analysis. Drug Alcohol Depend 2015 Nov 1;156:84-9.
- Reference 1225
-
Storr M, Devlin S, Kaplan GG, Panaccione R, Andrews CN. Cannabis use provides symptom relief in patients with inflammatory bowel disease but is associated with worse disease prognosis in patients with crohn's disease. Inflamm Bowel Dis 2014 Mar;20(3):472-80.
- Reference 1226
-
Klooker TK, Leliefeld KE, van den Wijngaard RM, Boeckxstaens GE. The cannabinoid receptor agonist delta-9-tetrahydrocannabinol does not affect visceral sensitivity to rectal distension in healthy volunteers and IBS patients. Neurogastroenterol Motil 2011 01;23(1365-2982; 1350-1925; 1):30,5, e2.
- Reference 1227
-
Mallat A, Teixeira-Clerc F, Lotersztajn S. Cannabinoid signaling and liver therapeutics. J Hepatol 2013 Oct;59(4):891-6.
- Reference 1228
-
Tam J, Liu J, Mukhopadhyay B, Cinar R, Godlewski G, Kunos G. Endocannabinoids in liver disease. Hepatology 2011 01;53(1527-3350; 0270-9139; 1):346-55.
- Reference 1229
-
Teixeira-Clerc F, Belot MP, Manin S, Deveaux V, Cadoudal T, Chobert MN, Louvet A, Zimmer A, Tordjmann T, Mallat A, et al. Beneficial paracrine effects of cannabinoid receptor 2 on liver injury and regeneration. Hepatology 2010 09;52(1527-3350; 0270-9139; 3):1046-59.
- Reference 1230
-
Giannone FA, Baldassarre M, Domenicali M, Zaccherini G, Trevisani F, Bernardi M, Caraceni P. Reversal of liver fibrosis by the antagonism of endocannabinoid CB1 receptor in a rat model of CCl(4)-induced advanced cirrhosis. Lab Invest 2012 03;92(1530-0307; 0023-6837; 3):384-95.
- Reference 1231
-
Lim MP, Devi LA, Rozenfeld R. Cannabidiol causes activated hepatic stellate cell death through a mechanism of endoplasmic reticulum stress-induced apoptosis. Cell Death.Dis. 2011;2(2041-4889):e170.
- Reference 1232
-
Hochhauser E, Lahat E, Sultan M, Pappo O, Waldman M, Sarne Y, Shainberg A, Gutman M, Safran M, Ari ZB. Ultra low dose delta 9-tetrahydrocannabinol protects mouse liver from ischemia reperfusion injury. Cell Physiol Biochem 2015;36(5):1971-81.
- Reference 1233
-
Mukhopadhyay P, Rajesh M, Horvath B, Batkai S, Park O, Tanchian G, Gao RY, Patel V, Wink DA, Liaudet L, et al. Cannabidiol protects against hepatic ischemia/reperfusion injury by attenuating inflammatory signaling and response, oxidative/nitrative stress, and cell death. Free Radic Biol Med 2011 05/15;50(1873-4596; 0891-5849; 10):1368-81.
- Reference 1234
-
Fouad AA, Jresat I. Therapeutic potential of cannabidiol against ischemia/reperfusion liver injury in rats. Eur J Pharmacol 2011 11/16;670(1879-0712; 0014-2999; 1):216-23.
- Reference 1235
-
Avraham Y, Grigoriadis N, Poutahidis T, Vorobiev L, Magen I, Ilan Y, Mechoulam R, Berry E. Cannabidiol improves brain and liver function in a fulminant hepatic failure-induced model of hepatic encephalopathy in mice. Br J Pharmacol 2011 04;162(1476-5381; 0007-1188; 7):1650-8.
- Reference 1236
-
Batkai S, Mukhopadhyay P, Horvath B, Rajesh M, Gao RY, Mahadevan A, Amere M, Battista N, Lichtman AH, Gauson LA, et al. Delta8-tetrahydrocannabivarin prevents hepatic ischaemia/reperfusion injury by decreasing oxidative stress and inflammatory responses through cannabinoid CB2 receptors. Br J Pharmacol 2012 04;165(1476-5381; 0007-1188; 8):2450-61.
- Reference 1237
-
Mazier W, Saucisse N, Gatta-Cherifi B, Cota D. The endocannabinoid system: Pivotal orchestrator of obesity and metabolic disease. Trends Endocrinol Metab 2015 Oct;26(10):524-37.
- Reference 1238
-
Gatta-Cherifi B, Cota D. Endocannabinoids and metabolic disorders. Handb Exp Pharmacol 2015;231:367-91.
- Reference 1239
-
Li C, Jones PM, Persaud SJ. Role of the endocannabinoid system in food intake, energy homeostasis and regulation of the endocrine pancreas. Pharmacol Ther 2011 03;129(1879-016; 0163-7258; 3):307-20.
- Reference 1240
-
Silvestri C, Ligresti A, Di M,V. Peripheral effects of the endocannabinoid system in energy homeostasis: Adipose tissue, liver and skeletal muscle. Rev.Endocr.Metab Disord 2011 09;12(1573-2606; 1389-9155; 3):153-62.
- Reference 1241
-
O'Hare JD, Zielinski E, Cheng B, Scherer T, Buettner C. Central endocannabinoid signaling regulates hepatic glucose production and systemic lipolysis. Diabetes 2011 04;60(1939-327; 0012-1797; 4):1055-62.
- Reference 1242
-
Engeli S. Central and peripheral cannabinoid receptors as therapeutic targets in the control of food intake and body weight. Handb Exp Pharmacol 2012(0171-2004; 0171-2004; 209):357-81.
- Reference 1243
-
Bensaid M, Gary-Bobo M, Esclangon A, Maffrand JP, Le Fur G, Oury-Donat F, Soubrie P. The cannabinoid CB1 receptor antagonist SR141716 increases Acrp30 mRNA expression in adipose tissue of obese fa/fa rats and in cultured adipocyte cells. Mol Pharmacol 2003 Apr;63(4):908-14.
- Reference 1244
-
Cota D, Marsicano G, Lutz B, Vicennati V, Stalla GK, Pasquali R, Pagotto U. Endogenous cannabinoid system as a modulator of food intake. Int J Obes Relat Metab Disord 2003 Mar;27(3):289-301.
- Reference 1245
-
Bouaboula M, Hilairet S, Marchand J, Fajas L, Le Fur G, Casellas P. Anandamide induced PPARgamma transcriptional activation and 3T3-L1 preadipocyte differentiation. Eur J Pharmacol 2005 Jul 11;517(3):174-81.
- Reference 1246
-
Matias I, Bisogno T, Di Marzo V. Endogenous cannabinoids in the brain and peripheral tissues: Regulation of their levels and control of food intake. Int J Obes (Lond) 2006 Apr;30 Suppl 1:S7-S12.
- Reference 1247
-
Matias I, Di Marzo V. Endocannabinoid synthesis and degradation, and their regulation in the framework of energy balance. J Endocrinol Invest 2006;29(3 Suppl):15-26.
- Reference 1248
-
Matias I, Di Marzo V. Endocannabinoids and the control of energy balance. Trends Endocrinol Metab 2007 Jan-Feb;18(1):27-37.
- Reference 1249
-
Cota D, Marsicano G, Tschop M, Grubler Y, Flachskamm C, Schubert M, Auer D, Yassouridis A, Thone-Reineke C, Ortmann S, et al. The endogenous cannabinoid system affects energy balance via central orexigenic drive and peripheral lipogenesis. J Clin Invest 2003 Aug;112(3):423-31.
- Reference 1250
-
Osei-Hyiaman D, Depetrillo M, Pacher P, Liu J, Radaeva S, Batkai S, Harvey-White J, Mackie K, Offertaler L, Wang L, et al. Endocannabinoid activation at hepatic CB1 receptors stimulates fatty acid synthesis and contributes to diet-induced obesity. J Clin Invest 2005 05;115(0021-9738; 0021-9738; 5):1298-305.
- Reference 1251
-
Pagano C, Pilon C, Calcagno A, Urbanet R, Rossato M, Milan G, Bianchi K, Rizzuto R, Bernante P, Federspil G, et al. The endogenous cannabinoid system stimulates glucose uptake in human fat cells via phosphatidylinositol 3-kinase and calcium-dependent mechanisms. J Clin Endocrinol Metab 2007 12;92(0021-972; 0021-972; 12):4810-9.
- Reference 1252
-
Cardinal P, Bellocchio L, Clark S, Cannich A, Klugmann M, Lutz B, Marsicano G, Cota D. Hypothalamic CB1 cannabinoid receptors regulate energy balance in mice. Endocrinology 2012 09;153(1945-7170; 0013-7227; 9):4136-43.
- Reference 1253
-
Quarta C, Bellocchio L, Mancini G, Mazza R, Cervino C, Braulke LJ, Fekete C, Latorre R, Nanni C, Bucci M, et al. CB(1) signaling in forebrain and sympathetic neurons is a key determinant of endocannabinoid actions on energy balance. Cell Metab 2010 04/07;11(1932-7420; 1550-4131; 4):273-85.
- Reference 1254
-
Osei-Hyiaman D, Liu J, Zhou L, Godlewski G, Harvey-White J, Jeong WI, Batkai S, Marsicano G, Lutz B, Buettner C, et al. Hepatic CB1 receptor is required for development of diet-induced steatosis, dyslipidemia, and insulin and leptin resistance in mice. J Clin Invest 2008 09;118(0021-9738; 0021-9738; 9):3160-9.
- Reference 1255
-
Liu J, Zhou L, Xiong K, Godlewski G, Mukhopadhyay B, Tam J, Yin S, Gao P, Shan X, Pickel J, et al. Hepatic cannabinoid receptor-1 mediates diet-induced insulin resistance via inhibition of insulin signaling and clearance in mice. Gastroenterology 2012 05;142(1528-0012; 0016-5085; 5):1218-28.
- Reference 1256
-
Ravinet TC, Arnone M, Delgorge C, Gonalons N, Keane P, Maffrand JP, Soubrie P. Anti-obesity effect of SR141716, a CB1 receptor antagonist, in diet-induced obese mice. Am J Physiol Regul Integr Comp Physiol 2003 02;284(0363-6119; 0363-6119; 2):R345-53.
- Reference 1257
-
Poirier B, Bidouard JP, Cadrouvele C, Marniquet X, Staels B, O'Connor SE, Janiak P, Herbert JM. The anti-obesity effect of rimonabant is associated with an improved serum lipid profile. Diabetes Obes Metab 2005 01;7(1462-8902; 1462-8902; 1):65-72.
- Reference 1258
-
Jbilo O, Ravinet-Trillou C, Arnone M, Buisson I, Bribes E, Peleraux A, Penarier G, Soubrie P, Le FG, Galiegue S, et al. The CB1 receptor antagonist rimonabant reverses the diet-induced obesity phenotype through the regulation of lipolysis and energy balance. FASEB J 2005 09;19(1530-6860; 0892-6638; 11):1567-9.
- Reference 1259
-
Watanabe T, Kubota N, Ohsugi M, Kubota T, Takamoto I, Iwabu M, Awazawa M, Katsuyama H, Hasegawa C, Tokuyama K, et al. Rimonabant ameliorates insulin resistance via both adiponectin-dependent and adiponectin-independent pathways. J Biol Chem 2009 01/16;284(0021-9258; 0021-9258; 3):1803-12.
- Reference 1260
-
Jourdan T, Djaouti L, Demizieux L, Gresti J, Verges B, Degrace P. CB1 antagonism exerts specific molecular effects on visceral and subcutaneous fat and reverses liver steatosis in diet-induced obese mice. Diabetes 2010 04;59(1939-327; 0012-1797; 4):926-34.
- Reference 1261
-
Crespillo A, Suarez J, Bermudez-Silva FJ, Rivera P, Vida M, Alonso M, Palomino A, Lucena MA, Serrano A, Perez-Martin M, et al. Expression of the cannabinoid system in muscle: Effects of a high-fat diet and CB1 receptor blockade. Biochem J 2011 01/01;433(1470-8728; 0264-6021; 1):175-85.
- Reference 1262
-
Bell-Anderson KS, Aouad L, Williams H, Sanz FR, Phuyal J, Larter CZ, Farrell GC, Caterson ID. Coordinated improvement in glucose tolerance, liver steatosis and obesity-associated inflammation by cannabinoid 1 receptor antagonism in fat aussie mice. Int.J.Obes.(Lond) 2011 12;35(1476-5497; 0307-0565; 12):1539-48.
- Reference 1263
-
Van Gaal L, Pi-Sunyer X, Despres JP, McCarthy C, Scheen A. Efficacy and safety of rimonabant for improvement of multiple cardiometabolic risk factors in overweight/obese patients: Pooled 1-year data from the rimonabant in obesity (RIO) program. Diabetes Care 2008 02;31 Suppl 2(1935-5548; 0149-5992):S229-40.
- Reference 1264
-
Van Gaal LF, Scheen AJ, Rissanen AM, Rossner S, Hanotin C, Ziegler O. Long-term effect of CB1 blockade with rimonabant on cardiometabolic risk factors: Two year results from the RIO-europe study. Eur Heart J 2008 07;29(1522-9645; 0195-668; 14):1761-71.
- Reference 1265
-
Despres JP, Golay A, Sjostrom L. Effects of rimonabant on metabolic risk factors in overweight patients with dyslipidemia. N Engl J Med 2005 11/17;353(1533-4406; 0028-4793; 20):2121-34.
- Reference 1266
-
Pi-Sunyer FX, Aronne LJ, Heshmati HM, Devin J, Rosenstock J. Effect of rimonabant, a cannabinoid-1 receptor blocker, on weight and cardiometabolic risk factors in overweight or obese patients: RIO-north america: A randomized controlled trial. JAMA 2006 02/15;295(1538-3598; 0098-7484; 7):761-75.
- Reference 1267
-
Scheen AJ, Finer N, Hollander P, Jensen MD, Van Gaal LF. Efficacy and tolerability of rimonabant in overweight or obese patients with type 2 diabetes: A randomised controlled study. Lancet 2006 11/11;368(1474-547; 0140-6736; 9548):1660-72.
- Reference 1268
-
Van Gaal LF, Rissanen AM, Scheen AJ, Ziegler O, Rossner S. Effects of the cannabinoid-1 receptor blocker rimonabant on weight reduction and cardiovascular risk factors in overweight patients: 1-year experience from the RIO-europe study. Lancet 2005 04/16;365(1474-547; 0140-6736; 9468):1389-97.
- Reference 1269
-
Despres JP, Ross R, Boka G, Almeras N, Lemieux I. Effect of rimonabant on the high-triglyceride/ low-HDL-cholesterol dyslipidemia, intraabdominal adiposity, and liver fat: The ADAGIO-lipids trial. Arterioscler Thromb Vasc Biol 2009 03;29(1524-4636; 1079-5642; 3):416-23.
- Reference 1270
-
Silvestri C, Di Marzo V. The endocannabinoid system in energy homeostasis and the etiopathology of metabolic disorders. Cell Metab 2013 Apr 2;17(4):475-90.
- Reference 1271
-
Tedesco L, Valerio A, Dossena M, Cardile A, Ragni M, Pagano C, Pagotto U, Carruba MO, Vettor R, Nisoli E. Cannabinoid receptor stimulation impairs mitochondrial biogenesis in mouse white adipose tissue, muscle, and liver: The role of eNOS, p38 MAPK, and AMPK pathways. Diabetes 2010 Nov;59(11):2826-36.
- Reference 1272
-
Cluny NL, Keenan CM, Reimer RA, Le Foll B, Sharkey KA. Prevention of diet-induced obesity effects on body weight and gut microbiota in mice treated chronically with Delta9-tetrahydrocannabinol. PLoS One 2015 Dec 3;10(12):e0144270.
- Reference 1273
-
Muniyappa R, Sable S, Ouwerkerk R, Mari A, Gharib AM, Walter M, Courville A, Hall G, Chen KY, Volkow ND, et al. Metabolic effects of chronic cannabis smoking. Diabetes Care 2013 Aug;36(8):2415-22.
- Reference 1274
-
Le Strat Y, Le Foll B. Obesity and cannabis use: Results from 2 representative national surveys. Am J Epidemiol 2011 Oct 15;174(8):929-33.
- Reference 1275
-
Le Foll B, Trigo JM, Sharkey KA, Le Strat Y. Cannabis and Delta9-tetrahydrocannabinol (THC) for weight loss? Med Hypotheses 2013 May;80(5):564-7.
- Reference 1276
-
Rajavashisth TB, Shaheen M, Norris KC, Pan D, Sinha SK, Ortega J, Friedman TC. Decreased prevalence of diabetes in marijuana users: Cross-sectional data from the national health and nutrition examination survey (NHANES) III. BMJ Open. 2012;2(2044-6055):e000494.
- Reference 1277
-
Alshaarawy O, Anthony JC. Cannabis smoking and diabetes mellitus: Results from meta-analysis with eight independent replication samples. Epidemiology 2015 Jul;26(4):597-600.
- Reference 1278
-
Penner EA, Buettner H, Mittleman MA. The impact of marijuana use on glucose, insulin, and insulin resistance among US adults. Am J Med 2013 Jul;126(7):583-9.
- Reference 1279
-
Ngueta G, Belanger RE, Laouan-Sidi EA, Lucas M. Cannabis use in relation to obesity and insulin resistance in the inuit population. Obesity (Silver Spring) 2015 Feb;23(2):290-5.
- Reference 1280
-
Vidot DC, Prado G, Hlaing WM, Arheart KL, Messiah SE. Emerging issues for our nation's health: The intersection of marijuana use and cardiometabolic disease risk. J Addict Dis 2014;33(1):1-8.
- Reference 1281
-
Deveaux V, Cadoudal T, Ichigotani Y, Teixeira-Clerc F, Louvet A, Manin S, Nhieu JT, Belot MP, Zimmer A, Even P, et al. Cannabinoid CB2 receptor potentiates obesity-associated inflammation, insulin resistance and hepatic steatosis. PLoS.One. 2009;4(1932-6203; 1932-6203; 6):e5844.
- Reference 1282
-
Agudo J, Martin M, Roca C, Molas M, Bura AS, Zimmer A, Bosch F, Maldonado R. Deficiency of CB2 cannabinoid receptor in mice improves insulin sensitivity but increases food intake and obesity with age. Diabetologia 2010 12;53(1432-0428; 0012-186; 12):2629-40.
- Reference 1283
-
Schmitz K, Mangels N, Haussler A, Ferreiros N, Fleming I, Tegeder I. Pro-inflammatory obesity in aged cannabinoid-2 receptor-deficient mice. Int J Obes (Lond) 2016 Feb;40(2):366-79.
- Reference 1284
-
Wargent ET, Zaibi MS, Silvestri C, Hislop DC, Stocker CJ, Stott CG, Guy GW, Duncan M, Di Marzo V, Cawthorne MA. The cannabinoid delta(9)-tetrahydrocannabivarin (THCV) ameliorates insulin sensitivity in two mouse models of obesity. Nutr Diabetes 2013 May 27;3:e68.
- Reference 1285
-
Levendal RA, Schumann D, Donath M, Frost CL. Cannabis exposure associated with weight reduction and beta-cell protection in an obese rat model. Phytomedicine 2012 05/15;19(1618-095; 0944-7113; 7):575-82.
- Reference 1286
-
Jadoon KA, Ratcliffe SH, Barrett DA, Thomas EL, Stott C, Bell JD, O'Sullivan SE, Tan GD. Efficacy and safety of cannabidiol and tetrahydrocannabivarin on glycemic and lipid parameters in patients with type 2 diabetes: A randomized, double-blind, placebo-controlled, parallel group pilot study. Diabetes Care 2016 Oct;39(10):1777-86.
- Reference 1287
-
Li C, Bowe JE, Huang GC, Amiel SA, Jones PM, Persaud SJ. Cannabinoid receptor agonists and antagonists stimulate insulin secretion from isolated human islets of langerhans. Diabetes Obes Metab 2011 10;13(1463-1326; 1462-8902; 10):903-10.
- Reference 1288
-
Li C, Vilches-Flores A, Zhao M, Amiel SA, Jones PM, Persaud SJ. Expression and function of monoacylglycerol lipase in mouse beta-cells and human islets of langerhans. Cell Physiol Biochem 2012;30(1421-9778; 1015-8987; 2):347-58.
- Reference 1289
-
Bermudez-Silva FJ, Suarez J, Baixeras E, Cobo N, Bautista D, Cuesta-Munoz AL, Fuentes E, Juan-Pico P, Castro MJ, Milman G, et al. Presence of functional cannabinoid receptors in human endocrine pancreas. Diabetologia 2008 03;51(0012-186; 0012-186; 3):476-87.
- Reference 1290
-
De Pasquale A, Costa G, Trovato A. The influence of cannabis on glucoregulation. Bull Narc 1978 07;30(0007-523; 0007-523; 3):33-41.
- Reference 1291
-
Bermudez-Siva FJ, Serrano A, Diaz-Molina FJ, Sanchez V,I, Juan-Pico P, Nadal A, Fuentes E, Rodriguez de FF. Activation of cannabinoid CB1 receptors induces glucose intolerance in rats. Eur J Pharmacol 2006 02/15;531(0014-2999; 0014-2999; 1-3):282-4.
- Reference 1292
-
Hollister LE, Reaven GM. Delta-9-tetrahydrocannabinol and glucose tolerance. Clin Pharmacol Ther 1974 08;16(0009-9236; 0009-9236; 2):297-302.
- Reference 1293
-
Michalski CW, Laukert T, Sauliunaite D, Pacher P, Bergmann F, Agarwal N, Su Y, Giese T, Giese NA, Batkai S, et al. Cannabinoids ameliorate pain and reduce disease pathology in cerulein-induced acute pancreatitis. Gastroenterology 2007 05;132(0016-5085; 0016-5085; 5):1968-78.
- Reference 1294
-
Michalski CW, Maier M, Erkan M, Sauliunaite D, Bergmann F, Pacher P, Batkai S, Giese NA, Giese T, Friess H, et al. Cannabinoids reduce markers of inflammation and fibrosis in pancreatic stellate cells. PLoS.One. 2008;3(1932-6203; 1932-6203; 2):e1701.
- Reference 1295
-
Matsuda K, Mikami Y, Takeda K, Fukuyama S, Egawa S, Sunamura M, Maruyama I, Matsuno S. The cannabinoid 1 receptor antagonist, AM251, prolongs the survival of rats with severe acute pancreatitis. Tohoku J Exp Med 2005 10;207(0040-8727; 0040-8727; 2):99-107.
- Reference 1296
-
Dembinski A, Warzecha Z, Ceranowicz P, Dembinski M, Cieszkowski J, Pawlik WW, Konturek SJ, Tomaszewska R, Hladki W, Konturek PC. Cannabinoids in acute gastric damage and pancreatitis. J Physiol Pharmacol 2006 11;57 Suppl 5(1899-1505; 0867-5910):137-54.
- Reference 1297
-
Zyromski NJ, Mathur A, Pitt HA, Wade TE, Wang S, Swartz-Basile DA, Prather AD, Lillemoe KD. Cannabinoid receptor-1 blockade attenuates acute pancreatitis in obesity by an adiponectin mediated mechanism. J Gastrointest Surg 2009 05;13(1873-4626; 1091-255; 5):831-8.
- Reference 1298
-
Petrella C, Agostini S, Alema' GS, Casolini P, Carpino F, Giuli C, Improta G, Linari G, Petrozza V, Broccardo M. Cannabinoid agonist WIN55,212 in vitro inhibits interleukin-6 (IL-6) and monocyte chemo-attractant protein-1 (MCP-1) release by rat pancreatic acini and in vivo induces dual effects on the course of acute pancreatitis. Neurogastroenterol Motil 2010 11;22(1365-2982; 1350-1925; 11):1248,56, e323.
- Reference 1299
-
Velasco G, Hernandez-Tiedra S, Davila D, Lorente M. The use of cannabinoids as anticancer agents. Prog Neuropsychopharmacol Biol Psychiatry 2016 Jan 4;64:259-66.
- Reference 1300
-
Malfitano AM, Ciaglia E, Gangemi G, Gazzerro P, Laezza C, Bifulco M. Update on the endocannabinoid system as an anticancer target. Expert.Opin.Ther.Targets. 2011 03;15(1744-7631; 1472-8222; 3):297-308.
- Reference 1301
-
Pagotto U, Marsicano G, Fezza F, Theodoropoulou M, Grubler Y, Stalla J, Arzberger T, Milone A, Losa M, Di M,V, et al. Normal human pituitary gland and pituitary adenomas express cannabinoid receptor type 1 and synthesize endogenous cannabinoids: First evidence for a direct role of cannabinoids on hormone modulation at the human pituitary level. J Clin Endocrinol Metab 2001 06;86(0021-972; 0021-972; 6):2687-96.
- Reference 1302
-
Schmid PC, Wold LE, Krebsbach RJ, Berdyshev EV, Schmid HH. Anandamide and other N-acylethanolamines in human tumors. Lipids 2002 09;37(0024-4201; 0024-4201; 9):907-12.
- Reference 1303
-
Nithipatikom K, Endsley MP, Isbell MA, Falck JR, Iwamoto Y, Hillard CJ, Campbell WB. 2-arachidonoylglycerol: A novel inhibitor of androgen-independent prostate cancer cell invasion. Cancer Res 2004 12/15;64(0008-5472; 0008-5472; 24):8826-30.
- Reference 1304
-
Petersen G, Moesgaard B, Schmid PC, Schmid HH, Broholm H, Kosteljanetz M, Hansen HS. Endocannabinoid metabolism in human glioblastomas and meningiomas compared to human non-tumour brain tissue. J Neurochem 2005 04;93(0022-3042; 0022-3042; 2):299-309.
- Reference 1305
-
Cianchi F, Papucci L, Schiavone N, Lulli M, Magnelli L, Vinci MC, Messerini L, Manera C, Ronconi E, Romagnani P, et al. Cannabinoid receptor activation induces apoptosis through tumor necrosis factor alpha-mediated ceramide de novo synthesis in colon cancer cells. Clin Cancer Res 2008 12/01;14(1078-0432; 1078-0432; 23):7691-700.
- Reference 1306
-
Grimaldi C, Capasso A. The endocannabinoid system in the cancer therapy: An overview. Curr Med Chem 2011;18(1875-533; 0929-8673; 11):1575-83.
- Reference 1307
-
Pisanti S, Bifulco M. Endocannabinoid system modulation in cancer biology and therapy. Pharmacol Res 2009 08;60(1096-1186; 1043-6618; 2):107-16.
- Reference 1308
-
Stella N. Cannabinoid and cannabinoid-like receptors in microglia, astrocytes, and astrocytomas. Glia 2010 07;58(1098-1136; 0894-1491; 9):1017-30.
- Reference 1309
-
McAllister SD, Chan C, Taft RJ, Luu T, Abood ME, Moore DH, Aldape K, Yount G. Cannabinoids selectively inhibit proliferation and induce death of cultured human glioblastoma multiforme cells. J Neurooncol 2005 08;74(0167-594; 0167-594; 1):31-40.
- Reference 1310
-
Cudaback E, Marrs W, Moeller T, Stella N. The expression level of CB1 and CB2 receptors determines their efficacy at inducing apoptosis in astrocytomas. PLoS.One. 2010;5(1932-6203; 1932-6203; 1):e8702.
- Reference 1311
-
Caffarel MM, Sarrio D, Palacios J, Guzman M, Sanchez C. Delta9-tetrahydrocannabinol inhibits cell cycle progression in human breast cancer cells through Cdc2 regulation. Cancer Res 2006 07/01;66(0008-5472; 0008-5472; 13):6615-21.
- Reference 1312
-
McKallip RJ, Nagarkatti M, Nagarkatti PS. Delta-9-tetrahydrocannabinol enhances breast cancer growth and metastasis by suppression of the antitumor immune response. J Immunol 2005 03/15;174(0022-1767; 0022-1767; 6):3281-9.
- Reference 1313
-
Takeda S, Yamaori S, Motoya E, Matsunaga T, Kimura T, Yamamoto I, Watanabe K. Delta(9)-tetrahydrocannabinol enhances MCF-7 cell proliferation via cannabinoid receptor-independent signaling. Toxicology 2008 03/12;245(0300-483; 0300-483; 1-2):141-6.
- Reference 1314
-
Ligresti A, Moriello AS, Starowicz K, Matias I, Pisanti S, De PL, Laezza C, Portella G, Bifulco M, Di M,V. Antitumor activity of plant cannabinoids with emphasis on the effect of cannabidiol on human breast carcinoma. J Pharmacol Exp Ther 2006 09;318(0022-3565; 0022-3565; 3):1375-87.
- Reference 1315
-
Preet A, Ganju RK, Groopman JE. Delta9-tetrahydrocannabinol inhibits epithelial growth factor-induced lung cancer cell migration in vitro as well as its growth and metastasis in vivo. Oncogene 2008 01/10;27(1476-5594; 0950-9232; 3):339-46.
- Reference 1316
-
Greenhough A, Patsos HA, Williams AC, Paraskeva C. The cannabinoid delta(9)-tetrahydrocannabinol inhibits RAS-MAPK and PI3K-AKT survival signalling and induces BAD-mediated apoptosis in colorectal cancer cells. Int J Cancer 2007 11/15;121(1097-0215; 0020-7136; 10):2172-80.
- Reference 1317
-
Glodde N, Jakobs M, Bald T, Tuting T, Gaffal E. Differential role of cannabinoids in the pathogenesis of skin cancer. Life Sci 2015 Oct 1;138:35-40.
- Reference 1318
-
Borrelli F, Pagano E, Romano B, Panzera S, Maiello F, Coppola D, De Petrocellis L, Buono L, Orlando P, Izzo AA. Colon carcinogenesis is inhibited by the TRPM8 antagonist cannabigerol, a cannabis-derived non-psychotropic cannabinoid. Carcinogenesis 2014 Dec;35(12):2787-97.
- Reference 1319
-
Romano B, Borrelli F, Pagano E, Cascio MG, Pertwee RG, Izzo AA. Inhibition of colon carcinogenesis by a standardized cannabis sativa extract with high content of cannabidiol. Phytomedicine 2014 Apr 15;21(5):631-9.
- Reference 1320
-
Scott KA, Dalgleish AG, Liu WM. The combination of cannabidiol and Delta9-tetrahydrocannabinol enhances the anticancer effects of radiation in an orthotopic murine glioma model. Mol Cancer Ther 2014 Dec;13(12):2955-67.
- Reference 1321
-
Kampa-Schittenhelm KM, Salitzky O, Akmut F, Illing B, Kanz L, Salih HR, Schittenhelm MM. Dronabinol has preferential antileukemic activity in acute lymphoblastic and myeloid leukemia with lymphoid differentiation patterns. BMC Cancer 2016 Jan 16;16:25,015-2029-8.
- Reference 1322
-
Galve-Roperh I, Sanchez C, Cortes ML, Gomez dP, Izquierdo M, Guzman M. Anti-tumoral action of cannabinoids: Involvement of sustained ceramide accumulation and extracellular signal-regulated kinase activation. Nat Med 2000 03;6(1078-8956; 1078-8956; 3):313-9.
- Reference 1323
-
Caffarel MM, Andradas C, Mira E, Perez-Gomez E, Cerutti C, Moreno-Bueno G, Flores JM, Garcia-Real I, Palacios J, Manes S, et al. Cannabinoids reduce ErbB2-driven breast cancer progression through akt inhibition. Mol.Cancer 2010;9(1476-4598; 1476-4598):196-206.
- Reference 1324
-
McAllister SD, Murase R, Christian RT, Lau D, Zielinski AJ, Allison J, Almanza C, Pakdel A, Lee J, Limbad C, et al. Pathways mediating the effects of cannabidiol on the reduction of breast cancer cell proliferation, invasion, and metastasis. Breast Cancer Res Treat 2010 09/22;129(1573-7217; 0167-6806; 1):37-47.
- Reference 1325
-
Hernan Perez de la Ossa,D., Gil-Alegre ME, Ligresti A, Aberturas Mdel R, Molpeceres J, Torres AI, Di Marzo V. Preparation and characterization of delta(9)-tetrahydrocannabinol-loaded biodegradable polymeric microparticles and their antitumoral efficacy on cancer cell lines. J Drug Target 2013 Sep;21(8):710-8.
- Reference 1326
-
McAllister SD, Soroceanu L, Desprez PY. The antitumor activity of plant-derived non-psychoactive cannabinoids. J Neuroimmune Pharmacol 2015 Jun;10(2):255-67.
- Reference 1327
-
Carracedo A, Lorente M, Egia A, Blazquez C, Garcia S, Giroux V, Malicet C, Villuendas R, Gironella M, Gonzalez-Feria L, et al. The stress-regulated protein p8 mediates cannabinoid-induced apoptosis of tumor cells. Cancer Cell 2006 04;9(1535-6108; 1535-6108; 4):301-12.
- Reference 1328
-
Torres S, Lorente M, Rodriguez-Fornes F, Hernandez-Tiedra S, Salazar M, Garcia-Taboada E, Barcia J, Guzman M, Velasco G. A combined preclinical therapy of cannabinoids and temozolomide against glioma. Mol.Cancer Ther. 2011 01;10(1538-8514; 1535-7163; 1):90-103.
- Reference 1329
-
Elliott DA, Nabavizadeh N, Romer JL, Chen Y, Holland JM. Medical marijuana use in head and neck squamous cell carcinoma patients treated with radiotherapy. Support Care Cancer 2016 Aug;24(8):3517-24.
- Reference 1330
-
Foroughi M, Hendson G, Sargent MA, Steinbok P. Spontaneous regression of septum pellucidum/forniceal pilocytic astrocytomas--possible role of cannabis inhalation. Childs Nerv Syst 2011 Apr;27(4):671-9.
- Reference 1331
-
Guzman M, Duarte MJ, Blazquez C, Ravina J, Rosa MC, Galve-Roperh I, Sanchez C, Velasco G, Gonzalez-Feria L. A pilot clinical study of Delta9-tetrahydrocannabinol in patients with recurrent glioblastoma multiforme. Br J Cancer 2006 07/17;95(0007-0920; 0007-0920; 2):197-203.
- Reference 1332
-
Dinnes J, Cave C, Huang S, Milne R. A rapid and systematic review of the effectiveness of temozolomide for the treatment of recurrent malignant glioma. Br J Cancer 2002 02/12;86(0007-0920; 0007-0920; 4):501-5.
- Reference 1333
-
Brem H, Piantadosi S, Burger PC, Walker M, Selker R, Vick NA, Black K, Sisti M, Brem S, Mohr G, et al. Placebo-controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. the polymer-brain tumor treatment group. Lancet 1995 04/22;345(0140-6736; 0140-6736; 8956):1008-12.
- Reference 1334
-
Salazar M, Carracedo A, Salanueva IJ, Hernandez-Tiedra S, Lorente M, Egia A, Vazquez P, Blazquez C, Torres S, Garcia S, et al. Cannabinoid action induces autophagy-mediated cell death through stimulation of ER stress in human glioma cells. J Clin Invest 2009 May;119(5):1359-72.
- Reference 1335
-
Marcu JP, Christian RT, Lau D, Zielinski AJ, Horowitz MP, Lee J, Pakdel A, Allison J, Limbad C, Moore DH, et al. Cannabidiol enhances the inhibitory effects of delta9-tetrahydrocannabinol on human glioblastoma cell proliferation and survival. Mol.Cancer Ther. 2010 01;9(1538-8514; 1535-7163; 1):180-9.
- Reference 1336
-
Velasco G, Carracedo A, Blazquez C, Lorente M, Aguado T, Haro A, Sanchez C, Galve-Roperh I, Guzman M. Cannabinoids and gliomas. Mol Neurobiol 2007 08;36(0893-7648; 0893-7648; 1):60-7.
- Reference 1337
-
Parolaro D, Massi P. Cannabinoids as potential new therapy for the treatment of gliomas. Expert.Rev.Neurother. 2008 01;8(1744-8360; 1473-7175; 1):37-49.
- Reference 1338
-
Alexander A, Smith PF, Rosengren RJ. Cannabinoids in the treatment of cancer. Cancer Lett 2009 11/18;285(1872-7980; 0304-3835; 1):6-12.
- Reference 1339
-
Steffens S, Veillard NR, Arnaud C, Pelli G, Burger F, Staub C, Karsak M, Zimmer A, Frossard JL, Mach F. Low dose oral cannabinoid therapy reduces progression of atherosclerosis in mice. Nature 2005 04/07;434(1476-4687; 0028-0836; 7034):782-6.
- Reference 1340
-
Sugamura K, Sugiyama S, Nozaki T, Matsuzawa Y, Izumiya Y, Miyata K, Nakayama M, Kaikita K, Obata T, Takeya M, et al. Activated endocannabinoid system in coronary artery disease and antiinflammatory effects of cannabinoid 1 receptor blockade on macrophages. Circulation 2009 01/06;119(1524-4539; 0009-7322; 1):28-36.
- Reference 1341
-
Zhao Y, Yuan Z, Liu Y, Xue J, Tian Y, Liu W, Zhang W, Shen Y, Xu W, Liang X, et al. Activation of cannabinoid CB2 receptor ameliorates atherosclerosis associated with suppression of adhesion molecules. J Cardiovasc Pharmacol 2010 03;55(1533-4023; 0160-2446; 3):292-8.
- Reference 1342
-
Hoyer FF, Steinmetz M, Zimmer S, Becker A, Lutjohann D, Buchalla R, Zimmer A, Nickenig G. Atheroprotection via cannabinoid receptor-2 is mediated by circulating and vascular cells in vivo. J Mol Cell Cardiol 2011 12;51(1095-8584; 0022-2828; 6):1007-14.
- Reference 1343
-
Willecke F, Zeschky K, Ortiz RA, Colberg C, Auwarter V, Kneisel S, Hutter M, Lozhkin A, Hoppe N, Wolf D, et al. Cannabinoid receptor 2 signaling does not modulate atherogenesis in mice. PLoS.One. 2011;6(1932-6203; 1932-6203; 4):e19405.
- Reference 1344
-
Netherland CD, Pickle TG, Bales A, Thewke DP. Cannabinoid receptor type 2 (CB2) deficiency alters atherosclerotic lesion formation in hyperlipidemic ldlr-null mice. Atherosclerosis 2010 11;213(1879-1484; 0021-9150; 1):102-8.
- Reference 1345
-
Rajesh M, Mukhopadhyay P, Hasko G, Liaudet L, Mackie K, Pacher P. Cannabinoid-1 receptor activation induces reactive oxygen species-dependent and -independent mitogen-activated protein kinase activation and cell death in human coronary artery endothelial cells. Br J Pharmacol 2010 06;160(1476-5381; 0007-1188; 3):688-700.
- Reference 1346
-
Singla S, Sachdeva R, Mehta JL. Cannabinoids and atherosclerotic coronary heart disease. Clin Cardiol 2012 06;35(1932-8737; 0160-9289; 6):329-35.
- Reference 1347
-
Montecucco F, Di M,V. At the heart of the matter: The endocannabinoid system in cardiovascular function and dysfunction. Trends Pharmacol Sci 2012 06;33(1873-3735; 0165-6147; 6):331-40.
- Reference 1348
-
Steffens S, Pacher P. Targeting cannabinoid receptor CB(2) in cardiovascular disorders: Promises and controversies. Br J Pharmacol 2012 09;167(1476-5381; 0007-1188; 2):313-23.
- Reference 1349
-
Takeda S, Usami N, Yamamoto I, Watanabe K. Cannabidiol-2',6'-dimethyl ether, a cannabidiol derivative, is a highly potent and selective 15-lipoxygenase inhibitor. Drug Metab Dispos 2009 08;37(1521-009; 0090-9556; 8):1733-7.
- Reference 1350
-
Allan GM, Ramji J, Perry D, Ton J, Beahm NP, Crisp N, Dockrill B, Dubin RE, Findlay T, Kirkwood J, et al. Simplified guideline for prescribing medical cannabinoids in primary care. Can Fam Physician 2018 Feb;64(2):111-20.
- Reference 1351
-
Nayak AP, Green BJ, Sussman G, Berlin N, Lata H, Chandra S, ElSohly MA, Hettick JM, Beezhold DH. Characterization of cannabis sativa allergens. Ann Allergy Asthma Immunol 2013 Jul;111(1):32-7.
- Reference 1352
-
Larramendi CH, Lopez-Matas MA, Ferrer A, Huertas AJ, Pagan JA, Navarro LA, Garcia-Abujeta JL, Andreu C, Carnes J. Prevalence of sensitization to cannabis sativa. lipid-transfer and thaumatin-like proteins are relevant allergens. Int Arch Allergy Immunol 2013;162(2):115-22.
- Reference 1353
-
Hezode C, Zafrani ES, Roudot-Thoraval F, Costentin C, Hessami A, Bouvier-Alias M, Medkour F, Pawlostky JM, Lotersztajn S, Mallat A. Daily cannabis use: A novel risk factor of steatosis severity in patients with chronic hepatitis C. Gastroenterology 2008 02;134(1528-0012; 0016-5085; 2):432-9.
- Reference 1354
-
Barrett SP, Darredeau C, Pihl RO. Patterns of simultaneous polysubstance use in drug using university students. Hum.Psychopharmacol. 2006 06;21(0885-6222; 0885-6222; 4):255-63.
- Reference 1355
-
Agrawal A, Lynskey MT. Does gender contribute to heterogeneity in criteria for cannabis abuse and dependence? results from the national epidemiological survey on alcohol and related conditions. Drug Alcohol Depend 2007 05/11;88(0376-8716; 0376-8716; 2-3):300-7.
- Reference 1356
-
Conner SN, Bedell V, Lipsey K, Macones GA, Cahill AG, Tuuli MG. Maternal marijuana use and adverse neonatal outcomes: A systematic review and meta-analysis. Obstet Gynecol 2016 Oct;128(4):713-23.
- Reference 1357
-
Gunn JK, Rosales CB, Center KE, Nunez A, Gibson SJ, Christ C, Ehiri JE. Prenatal exposure to cannabis and maternal and child health outcomes: A systematic review and meta-analysis. BMJ Open 2016 Apr 5;6(4):e009986,2015-009986.
- Reference 1358
-
Budney AJ, Hughes JR. The cannabis withdrawal syndrome. Curr.Opin.Psychiatry 2006 05;19(0951-7367; 0951-7367; 3):233-8.
- Reference 1359
-
National Institute on Drug Abuse. NIDA InfoFacts: Marijuana. 2009.
- Reference 1360
-
Johns A. Psychiatric effects of cannabis. Br J Psychiatry 2001 02;178(0007-1250):116-22.
- Reference 1361
-
Mathew RJ, Wilson WH, Coleman RE, Turkington TG, DeGrado TR. Marijuana intoxication and brain activation in marijuana smokers. Life Sci 1997;60(0024-3205; 0024-3205; 23):2075-89.
- Reference 1362
-
Ramaekers JG, Kauert G, van RP, Theunissen EL, Schneider E, Moeller MR. High-potency marijuana impairs executive function and inhibitory motor control. Neuropsychopharmacology 2006 10;31(0893-133; 0006-3223; 10):2296-303.
- Reference 1363
-
Marconi A, Di Forti M, Lewis CM, Murray RM, Vassos E. Meta-analysis of the association between the level of cannabis use and risk of psychosis. Schizophr Bull 2016 Feb 15.
- Reference 1364
-
Weinstein A, Brickner O, Lerman H, Greemland M, Bloch M, Lester H, Chisin R, Sarne Y, Mechoulam R, Bar-Hamburger R, et al. A study investigating the acute dose-response effects of 13 mg and 17 mg delta 9- tetrahydrocannabinol on cognitive-motor skills, subjective and autonomic measures in regular users of marijuana. J Psychopharmacol 2008 Jun;22(4):441-51.
- Reference 1365
-
Kurzthaler I, Hummer M, Miller C, Sperner-Unterweger B, Gunther V, Wechdorn H, Battista HJ, Fleischhacker WW. Effect of cannabis use on cognitive functions and driving ability. J Clin Psychiatry 1999 06;60(0160-6689; 0160-6689; 6):395-9.
- Reference 1366
-
Reisfield GM, Wasan AD, Jamison RN. The prevalence and significance of cannabis use in patients prescribed chronic opioid therapy: A review of the extant literature. Pain Med. 2009 11;10(1526-4637; 1526-2375; 8):1434-41.
- Reference 1367
-
Ashton CH. Adverse effects of cannabis and cannabinoids. Br J Anaesth 1999 10;83(0007-0912; 0007-0912; 4):637-49.
- Reference 1368
-
de Jong FA, Engels FK, Mathijssen RH, van ZL, Verweij J, Peters RP, Sparreboom A. Medicinal cannabis in oncology practice: Still a bridge too far? J Clin Oncol 2005 05/01;23(0732-183; 0732-183; 13):2886-91.
- Reference 1369
-
Ballard ME, de WH. Combined effects of acute, very-low-dose ethanol and delta(9)-tetrahydrocannabinol in healthy human volunteers. Pharmacol Biochem Behav 2011 02;97(1873-5177; 0091-3057; 4):627-31.
- Reference 1370
-
Dubois S, Mullen N, Weaver B, Bedard M. The combined effects of alcohol and cannabis on driving: Impact on crash risk. Forensic Sci Int 2015 Mar;248:94-100.
- Reference 1371
-
Maccarrone M. Endocannabinoid signaling in female reproductive events: A potential therapeutic target? Expert Opin Ther Targets 2015;19(11):1423-7.
- Reference 1372
-
Battista N, Pasquariello N, Di TM, Maccarrone M. Interplay between endocannabinoids, steroids and cytokines in the control of human reproduction. J Neuroendocrinol 2008 05;20 Suppl 1(1365-2826; 0953-8194):82-9.
- Reference 1373
-
Correa F, Wolfson ML, Valchi P, Aisemberg J, Franchi AM. Endocannabinoid system and pregnancy. Reproduction 2016 Dec;152(6):R191-200.
- Reference 1374
-
Paria BC, Das SK, Dey SK. The preimplantation mouse embryo is a target for cannabinoid ligand-receptor signaling. Proc Natl Acad Sci U S A 1995 Oct 10;92(21):9460-4.
- Reference 1375
-
Habayeb OM, Taylor AH, Finney M, Evans MD, Konje JC. Plasma anandamide concentration and pregnancy outcome in women with threatened miscarriage. JAMA 2008 03/12;299(1538-3598; 0098-7484; 10):1135-6.
- Reference 1376
-
Calvigioni D, Hurd YL, Harkany T, Keimpema E. Neuronal substrates and functional consequences of prenatal cannabis exposure. Eur Child Adolesc Psychiatry 2014 Oct;23(10):931-41.
- Reference 1377
-
Fried PA. Conceptual issues in behavioral teratology and their application in determining long-term sequelae of prenatal marihuana exposure. J Child Psychol Psychiatry 2002 01;43(0021-9630; 1):81-102.
- Reference 1378
-
Richardson GA, Ryan C, Willford J, Day NL, Goldschmidt L. Prenatal alcohol and marijuana exposure: Effects on neuropsychological outcomes at 10 years. Neurotoxicol Teratol 2002 05;24(0892-0362; 3):309-20.
- Reference 1379
-
Grant KS, Petroff R, Isoherranen N, Stella N, Burbacher TM. Cannabis use during pregnancy: Pharmacokinetics and effects on child development. Pharmacol Ther 2017 Aug 25.
- Reference 1380
-
Perez-Reyes M, Wall ME. Presence of delta9-tetrahydrocannabinol in human milk. N Engl J Med 1982 09/23;307(0028-4793; 13):819-20.
- Reference 1381
-
Garry A, Rigourd V, Amirouche A, Fauroux V, Aubry S, Serreau R. Cannabis and breastfeeding. J.Toxicol. 2009;2009(1687-8205; 1687-8191):596149.
- Reference 1382
-
Chait LD, Perry JL. Acute and residual effects of alcohol and marijuana, alone and in combination, on mood and performance. Psychopharmacology (Berl) 1994 07;115(0033-3158; 3):340-9.
- Reference 1383
-
Lukas SE, Orozco S. Ethanol increases plasma delta(9)-tetrahydrocannabinol (THC) levels and subjective effects after marihuana smoking in human volunteers. Drug Alcohol Depend 2001 10/01;64(0376-8716; 2):143-9.
- Reference 1384
-
Spina E, Santoro V, D'Arrigo C. Clinically relevant pharmacokinetic drug interactions with second-generation antidepressants: An update. Clin Ther 2008 07;30(0149-2918; 0149-2918; 7):1206-27.
- Reference 1385
-
Anderson GD, Chan LN. Pharmacokinetic drug interactions with tobacco, cannabinoids and smoking cessation products. Clin Pharmacokinet 2016 Nov;55(11):1353-68.
- Reference 1386
-
Jusko WJ, Gardner MJ, Mangione A, Schentag JJ, Koup JR, Vance JW. Factors affecting theophylline clearances: Age, tobacco, marijuana, cirrhosis, congestive heart failure, obesity, oral contraceptives, benzodiazepines, barbiturates, and ethanol. J Pharm Sci 1979 Nov;68(11):1358-66.
- Reference 1387
-
Gardner MJ, Tornatore KM, Jusko WJ, Kanarkowski R. Effects of tobacco smoking and oral contraceptive use on theophylline disposition. Br J Clin Pharmacol 1983 Sep;16(3):271-80.
- Reference 1388
-
Chetty M, Miller R, Moodley SV. Smoking and body weight influence the clearance of chlorpromazine. Eur J Clin Pharmacol 1994;46(6):523-6.
- Reference 1389
-
Tamir I, Mechoulam R, Meyer AY. Cannabidiol and phenytoin: A structural comparison. J Med Chem 1980 Feb;23(2):220-3.
- Reference 1390
-
Davison SN, Davison JS. Is there a legitimate role for the therapeutic use of cannabinoids for symptom management in chronic kidney disease? J Pain Symptom Manage 2011 04;41(1873-6513; 0885-3924; 4):768-78.
- Reference 1391
-
Manini AF, Yiannoulos G, Bergamaschi MM, Hernandez S, Olmedo R, Barnes AJ, Winkel G, Sinha R, Jutras-Aswad D, Huestis MA, et al. Safety and pharmacokinetics of oral cannabidiol when administered concomitantly with intravenous fentanyl in humans. J Addict Med 2015 May-Jun;9(3):204-10.
- Reference 1392
-
Purnell JQ, Zambon A, Knopp RH, Pizzuti DJ, Achari R, Leonard JM, Locke C, Brunzell JD. Effect of ritonavir on lipids and post-heparin lipase activities in normal subjects. AIDS 2000 01/07;14(0269-9370; 1):51-7.
- Reference 1393
-
Ellis GM,Jr., Mann MA, Judson BA, Schramm NT, Tashchian A. Excretion patterns of cannabinoid metabolites after last use in a group of chronic users. Clin Pharmacol Ther 1985 11;38(0009-9236; 0009-9236; 5):572-8.
- Reference 1394
-
Lowe RH, Abraham TT, Darwin WD, Herning R, Cadet JL, Huestis MA. Extended urinary Delta9-tetrahydrocannabinol excretion in chronic cannabis users precludes use as a biomarker of new drug exposure. Drug Alcohol Depend 2009 11/01;105(1879-0046; 0376-8716; 1-2):24-32.
- Reference 1395
-
Wang T, Collet JP, Shapiro S, Ware MA. Adverse effects of medical cannabinoids: A systematic review. CMAJ 2008 06/17;178(1488-2329; 0820-3946; 13):1669-78.
- Reference 1396
-
Amos A, Wiltshire S, Bostock Y, Haw S, McNeill A. 'You can't go without a fag...you need it for your hash'--a qualitative exploration of smoking, cannabis and young people. Addiction 2004 01;99(0965-2140; 0965-2140; 1):77-81.
- Reference 1397
-
Hezode C, Roudot-Thoraval F, Nguyen S, Grenard P, Julien B, Zafrani ES, Pawlotsky JM, Dhumeaux D, Lotersztajn S, Mallat A. Daily cannabis smoking as a risk factor for progression of fibrosis in chronic hepatitis C. Hepatology 2005 07;42(0270-9139; 1):63-71.
- Reference 1398
-
Vandrey RG, Budney AJ, Hughes JR, Liguori A. A within-subject comparison of withdrawal symptoms during abstinence from cannabis, tobacco, and both substances. Drug Alcohol Depend 2008 01/01;92(0376-8716; 0376-8716; 1-3):48-54.
- Reference 1399
-
Agrawal A, Scherrer JF, Lynskey MT, Sartor CE, Grant JD, Haber JR, Madden PA, Jacob T, Bucholz KK, Xian H. Patterns of use, sequence of onsets and correlates of tobacco and cannabis. Addict Behav 2011 12;36(1873-6327; 0306-4603; 12):1141-7.
- Reference 1400
-
Maertens RM, White PA, Williams A, Yauk CL. A global toxicogenomic analysis investigating the mechanistic differences between tobacco and marijuana smoke condensates in vitro. Toxicology 2013 Jun 7;308:60-73.
- Reference 1401
-
Callaghan RC, Allebeck P, Sidorchuk A. Marijuana use and risk of lung cancer: A 40-year cohort study. Cancer Causes Control 2013 Oct;24(10):1811-20.
- Reference 1402
-
Huang YH, Zhang ZF, Tashkin DP, Feng B, Straif K, Hashibe M. An epidemiologic review of marijuana and cancer: An update. Cancer Epidemiol Biomarkers Prev 2015 Jan;24(1):15-31.
- Reference 1403
-
Tashkin DP. Effects of marijuana smoking on the lung. Ann Am Thorac Soc 2013 Jun;10(3):239-47.
- Reference 1404
-
Wu TC, Tashkin DP, Djahed B, Rose JE. Pulmonary hazards of smoking marijuana as compared with tobacco. N Engl J Med 1988 02/11;318(0028-4793; 6):347-51.
- Reference 1405
-
Taylor DR, Fergusson DM, Milne BJ, Horwood LJ, Moffitt TE, Sears MR, Poulton R. A longitudinal study of the effects of tobacco and cannabis exposure on lung function in young adults. Addiction 2002 08;97(0965-2140; 8):1055-61.
- Reference 1406
-
Tashkin DP. Marihuana and the lung. In: C. G. Nahas, K. M. Sutin, D. J. Harvey, S. Agurell, editors. Marihuana and medicine. Totowa, New Jersey: Humana Press; 1999. ID: 2388; RP: NOT IN FILE.
- Reference 1407
-
Taylor DR, Poulton R, Moffitt TE, Ramankutty P, Sears MR. The respiratory effects of cannabis dependence in young adults. Addiction 2000 11;95(0965-2140; 0965-2140; 11):1669-77.
- Reference 1408
-
Denning DW, Follansbee SE, Scolaro M, Norris S, Edelstein H, Stevens DA. Pulmonary aspergillosis in the acquired immunodeficiency syndrome. N Engl J Med 1991 03/07;324(0028-4793; 10):654-62.
- Reference 1409
-
Moore BA, Augustson EM, Moser RP, Budney AJ. Respiratory effects of marijuana and tobacco use in a U.S. sample. J Gen Intern Med 2005 01;20(1525-1497; 0884-8734; 1):33-7.
- Reference 1410
-
Roth MD, Whittaker K, Salehi K, Tashkin DP, Baldwin GC. Mechanisms for impaired effector function in alveolar macrophages from marijuana and cocaine smokers. J Neuroimmunol 2004 02;147(0165-5728; 0165-5728; 1-2):82-6.
- Reference 1411
-
Giroud C, de Cesare M, Berthet A, Varlet V, Concha-Lozano N, Favrat B. E-cigarettes: A review of new trends in cannabis use. Int J Environ Res Public Health 2015 Aug 21;12(8):9988-10008.
- Reference 1412
-
Varlet V, Concha-Lozano N, Berthet A, Plateel G, Favrat B, De Cesare M, Lauer E, Augsburger M, Thomas A, Giroud C. Drug vaping applied to cannabis: Is "cannavaping" a therapeutic alternative to marijuana? Sci Rep 2016 May 26;6:25599.
- Reference 1413
-
Peace MR, Butler KE, Wolf CE, Poklis JL, Poklis A. Evaluation of two commercially available cannabidiol formulations for use in electronic cigarettes. Front Pharmacol 2016 Aug 29;7:279.
- Reference 1414
-
Geiss O, Bianchi I, Barahona F, Barrero-Moreno J. Characterisation of mainstream and passive vapours emitted by selected electronic cigarettes. Int J Hyg Environ Health 2015 Jan;218(1):169-80.
- Reference 1415
-
Jensen RP, Luo W, Pankow JF, Strongin RM, Peyton DH. Hidden formaldehyde in e-cigarette aerosols. N Engl J Med 2015 Jan 22;372(4):392-4.
- Reference 1416
-
Sleiman M, Logue JM, Montesinos VN, Russell ML, Litter MI, Gundel LA, Destaillats H. Emissions from electronic cigarettes: Key parameters affecting the release of harmful chemicals. Environ Sci Technol 2016 Sep 6;50(17):9644-51.
- Reference 1417
-
Kosmider L, Sobczak A, Fik M, Knysak J, Zaciera M, Kurek J, Goniewicz ML. Carbonyl compounds in electronic cigarette vapors: Effects of nicotine solvent and battery output voltage. Nicotine Tob Res 2014 Oct;16(10):1319-26.
- Reference 1418
-
Gillman IG, Kistler KA, Stewart EW, Paolantonio AR. Effect of variable power levels on the yield of total aerosol mass and formation of aldehydes in e-cigarette aerosols. Regul Toxicol Pharmacol 2016 Mar;75:58-65.
- Reference 1419
-
Farsalinos KE, Voudris V, Poulas K. E-cigarettes generate high levels of aldehydes only in 'dry puff' conditions. Addiction 2015 Aug;110(8):1352-6.
- Reference 1420
-
Geiss O, Bianchi I, Barrero-Moreno J. Correlation of volatile carbonyl yields emitted by e-cigarettes with the temperature of the heating coil and the perceived sensorial quality of the generated vapours. Int J Hyg Environ Health 2016 May;219(3):268-77.
- Reference 1421
-
Hecht SS, Carmella SG, Kotandeniya D, Pillsbury ME, Chen M, Ransom BW, Vogel RI, Thompson E, Murphy SE, Hatsukami DK. Evaluation of toxicant and carcinogen metabolites in the urine of e-cigarette users versus cigarette smokers. Nicotine Tob Res 2015 Jun;17(6):704-9.
- Reference 1422
-
McCauley L, Markin C, Hosmer D. An unexpected consequence of electronic cigarette use. Chest 2012 Apr;141(4):1110-3.
- Reference 1423
-
Thota D, Latham E. Case report of electronic cigarettes possibly associated with eosinophilic pneumonitis in a previously healthy active-duty sailor. J Emerg Med 2014 Jul;47(1):15-7.
- Reference 1424
-
Hureaux J, Drouet M, Urban T. A case report of subacute bronchial toxicity induced by an electronic cigarette. Thorax 2014 Jun;69(6):596-7.
- Reference 1425
-
Eisenstein TK, Meissler JJ. Effects of cannabinoids on T-cell function and resistance to infection. J Neuroimmune Pharmacol 2015 Jun;10(2):204-16.
- Reference 1426
-
LIU DZ, HU CM, HUANG CH, WEY SP, Jan TR. Cannabidiol attenuates delayed-type hypersensitivity reactions via suppressing T-cell and macrophage reactivity. Acta Pharmacol Sin 2010 12;31(1745-7254; 1671-4083; 12):1611-7.
- Reference 1427
-
Kozela E, Pietr M, Juknat A, Rimmerman N, Levy R, Vogel Z. Cannabinoids delta(9)-tetrahydrocannabinol and cannabidiol differentially inhibit the lipopolysaccharide-activated NF-kappaB and interferon-beta/STAT proinflammatory pathways in BV-2 microglial cells. J Biol Chem 2010 01/15;285(1083-351; 0021-9258; 3):1616-26.
- Reference 1428
-
Reiss CS. Cannabinoids and viral infections. Pharmaceuticals (Basel) 2010;3(6):1873-86.
- Reference 1429
-
Tahamtan A, Tavakoli-Yaraki M, Rygiel TP, Mokhtari-Azad T, Salimi V. Effects of cannabinoids and their receptors on viral infections. J Med Virol 2016 Jan;88(1):1-12.
- Reference 1430
-
Mishkin EM, Cabral GA. Delta-9-tetrahydrocannabinol decreases host resistance to herpes simplex virus type 2 vaginal infection in the B6C3F1 mouse. J Gen Virol 1985 12;66 ( Pt 12)(0022-1317; 0022-1317):2539-49.
- Reference 1431
-
Cabral GA, McNerney PJ, Mishkin EM. Delta-9-tetrahydrocannabinol enhances release of herpes simplex virus type 2. J Gen Virol 1986 09;67 ( Pt 9)(0022-1317; 0022-1317):2017-22.
- Reference 1432
-
Cabral GA, Lockmuller JC, Mishkin EM. Delta 9-tetrahydrocannabinol decreases alpha/beta interferon response to herpes simplex virus type 2 in the B6C3F1 mouse. Proc Soc Exp Biol Med 1986 02;181(0037-9727; 0037-9727; 2):305-11.
- Reference 1433
-
Roth MD, Baldwin GC, Tashkin DP. Effects of delta-9-tetrahydrocannabinol on human immune function and host defense. Chem Phys Lipids 2002 12/31;121(0009-3084; 0009-3084; 1-2):229-39.
- Reference 1434
-
Buchweitz JP, Karmaus PW, Harkema JR, Williams KJ, Kaminski NE. Modulation of airway responses to influenza A/PR/8/34 by Delta9-tetrahydrocannabinol in C57BL/6 mice. J Pharmacol Exp Ther 2007 11;323(0022-3565; 0022-3565; 2):675-83.
- Reference 1435
-
Zhang X, Wang JF, Kunos G, Groopman JE. Cannabinoid modulation of kaposi's sarcoma-associated herpesvirus infection and transformation. Cancer Res 2007 08/01;67(0008-5472; 0008-5472; 15):7230-7.
- Reference 1436
-
Herrera RA, Oved JH, Reiss CS. Disruption of IFN-gamma- mediated antiviral activity in neurons: The role of cannabinoids. Viral Immunol 2008 06;21(0882-8245; 0882-8245; 2):141-52.
- Reference 1437
-
Blumstein GW, Parsa A, Park AK, McDowell BL, Arroyo-Mendoza M, Girguis M, Adler-Moore JP, Olson J, Buckley NE. Effect of delta-9-tetrahydrocannabinol on mouse resistance to systemic candida albicans infection. PLoS One 2014 Jul 24;9(7):e103288.
- Reference 1438
-
Molina PE, Amedee A, LeCapitaine NJ, Zabaleta J, Mohan M, Winsauer P, Vande Stouwe C. Cannabinoid neuroimmune modulation of SIV disease. J Neuroimmune Pharmacol 2011 Dec;6(4):516-27.
- Reference 1439
-
Molina PE, Winsauer P, Zhang P, Walker E, Birke L, Amedee A, Stouwe CV, Troxclair D, McGoey R, Varner K, et al. Cannabinoid administration attenuates the progression of simian immunodeficiency virus. AIDS Res Hum Retroviruses 2011 Jun;27(6):585-92.
- Reference 1440
-
Chandra LC, Kumar V, Torben W, Vande Stouwe C, Winsauer P, Amedee A, Molina PE, Mohan M. Chronic administration of Delta9-tetrahydrocannabinol induces intestinal anti-inflammatory microRNA expression during acute simian immunodeficiency virus infection of rhesus macaques. J Virol 2015 Jan 15;89(2):1168-81.
- Reference 1441
-
Amedee AM, Nichols WA, LeCapitaine NJ, Stouwe CV, Birke LL, Lacour N, Winsauer PJ, Molina PE. Chronic delta(9)-tetrahydrocannabinol administration may not attenuate simian immunodeficiency virus disease progression in female rhesus macaques. AIDS Res Hum Retroviruses 2014 Dec;30(12):1216-25.
- Reference 1442
-
Morahan PS, Klykken PC, Smith SH, Harris LS, Munson AE. Effects of cannabinoids on host resistance to listeria monocytogenes and herpes simplex virus. Infect Immun 1979 Mar;23(3):670-4.
- Reference 1443
-
Shay AH, Choi R, Whittaker K, Salehi K, Kitchen CM, Tashkin DP, Roth MD, Baldwin GC. Impairment of antimicrobial activity and nitric oxide production in alveolar macrophages from smokers of marijuana and cocaine. J Infect Dis 2003 Feb 15;187(4):700-4.
- Reference 1444
-
Specter S, Lancz G. Effects of marijuana on human natural killer cell activity. Adv Exp Med Biol 1991;288:47-56.
- Reference 1445
-
Specter S, Lancz G, Goodfellow D. Suppression of human macrophage function in vitro by delta 9-tetrahydrocannabinol. J Leukoc Biol 1991 Nov;50(5):423-6.
- Reference 1446
-
Specter S, Lancz G, Westrich G, Friedman H. Delta-9-tetrahydrocannabinol augments murine retroviral induced immunosuppression and infection. Int J Immunopharmacol 1991;13(4):411-7.
- Reference 1447
-
Tindall B, Cooper DA, Donovan B, Barnes T, Philpot CR, Gold J, Penny R. The sydney AIDS project: Development of acquired immunodeficiency syndrome in a group of HIV seropositive homosexual men. Aust N Z J Med 1988 Feb;18(1):8-15.
- Reference 1448
-
Molina PE, Amedee AM, Winsauer P, Nelson S, Bagby G, Simon L. Behavioral, metabolic, and immune consequences of chronic alcohol or cannabinoids on HIV/AIDs: Studies in the non-human primate SIV model. J Neuroimmune Pharmacol 2015 Jun;10(2):217-32.
- Reference 1449
-
Bredt BM, Higuera-Alhino D, Shade SB, Hebert SJ, McCune JM, Abrams DI. Short-term effects of cannabinoids on immune phenotype and function in HIV-1-infected patients. J Clin Pharmacol 2002 11;42(0091-2700; 0091-2700; 11):82S-9S.
- Reference 1450
-
Chao C, Jacobson LP, Tashkin D, Martinez-Maza O, Roth MD, Margolick JB, Chmiel JS, Rinaldo C, Zhang ZF, Detels R. Recreational drug use and T lymphocyte subpopulations in HIV-uninfected and HIV-infected men. Drug Alcohol Depend 2008 04/01;94(0376-8716; 0376-8716; 1-3):165-71.
- Reference 1451
-
Di Franco MJ, Sheppard HW, Hunter DJ, Tosteson TD, Ascher MS. The lack of association of marijuana and other recreational drugs with progression to AIDS in the san francisco men's health study. Ann Epidemiol 1996 07;6(1047-2797; 1047-2797; 4):283-9.
- Reference 1452
-
Milloy MJ, Marshall B, Kerr T, Richardson L, Hogg R, Guillemi S, Montaner JS, Wood E. High-intensity cannabis use associated with lower plasma human immunodeficiency virus-1 RNA viral load among recently infected people who use injection drugs. Drug Alcohol Rev 2015 Mar;34(2):135-40.
- Reference 1453
-
Thames AD, Mahmood Z, Burggren AC, Karimian A, Kuhn TP. Combined effects of HIV and marijuana use on neurocognitive functioning and immune status. AIDS Care 2016 May;28(5):628-32.
- Reference 1454
-
Ghosn J, Leruez-Ville M, Blanche J, Delobelle A, Beaudoux C, Mascard L, Lecuyer H, Canestri A, Landman R, Zucman D, et al. HIV-1 DNA levels in peripheral blood mononuclear cells and cannabis use are associated with intermittent HIV shedding in semen of men who have sex with men on successful antiretroviral regimens. Clin Infect Dis 2014 Jun;58(12):1763-70.
- Reference 1455
-
Ishida JH, Peters MG, Jin C, Louie K, Tan V, Bacchetti P, Terrault NA. Influence of cannabis use on severity of hepatitis C disease. Clin.Gastroenterol.Hepatol. 2008 01;6(1542-7714; 1542-3565; 1):69-75.
- Reference 1456
-
Bonn-Miller MO, Oser ML, Bucossi MM, Trafton JA. Cannabis use and HIV antiretroviral therapy adherence and HIV-related symptoms (in press). J Behav Med 2012 10/07(1573-3521; 0160-7715).
- Reference 1457
-
Slawson G, Milloy MJ, Balneaves L, Simo A, Guillemi S, Hogg R, Montaner J, Wood E, Kerr T. High-intensity cannabis use and adherence to antiretroviral therapy among people who use illicit drugs in a canadian setting. AIDS Behav 2015 Jan;19(1):120-7.
- Reference 1458
-
Yeshurun M, Shpilberg O, Herscovici C, Shargian L, Dreyer J, Peck A, Israeli M, Levy-Assaraf M, Gruenewald T, Mechoulam R, et al. Cannabidiol for the prevention of graft-versus-host-disease after allogeneic hematopoietic cell transplantation: Results of a phase II study. Biol Blood Marrow Transplant 2015 Oct;21(10):1770-5.
- Reference 1459
-
Brown TT, Dobs AS. Endocrine effects of marijuana. J Clin Pharmacol 2002 11;42(0091-2700; 0091-2700; 11):90S-6S.
- Reference 1460
-
Sadeu JC, Hughes CL, Agarwal S, Foster WG. Alcohol, drugs, caffeine, tobacco, and environmental contaminant exposure: Reproductive health consequences and clinical implications. Crit Rev Toxicol 2010 08;40(1547-6898; 1040-8444; 7):633-52.
- Reference 1461
-
Rossato M, Pagano C, Vettor R. The cannabinoid system and male reproductive functions. J Neuroendocrinol 2008 05;20 Suppl 1(1365-2826; 0953-8194):90-3.
- Reference 1462
-
Sugiura T, Kondo S, Sukagawa A, Tonegawa T, Nakane S, Yamashita A, Waku K. Enzymatic synthesis of anandamide, an endogenous cannabinoid receptor ligand, through N-acylphosphatidylethanolamine pathway in testis: Involvement of ca(2+)-dependent transacylase and phosphodiesterase activities. Biochem Biophys Res Commun 1996 Jan 5;218(1):113-7.
- Reference 1463
-
Gye MC, Kang HH, Kang HJ. Expression of cannabinoid receptor 1 in mouse testes. Arch Androl 2005 May-Jun;51(3):247-55.
- Reference 1464
-
Cobellis G, Cacciola G, Scarpa D, Meccariello R, Chianese R, Franzoni MF, Mackie K, Pierantoni R, Fasano S. Endocannabinoid system in frog and rodent testis: Type-1 cannabinoid receptor and fatty acid amide hydrolase activity in male germ cells. Biol Reprod 2006 Jul;75(1):82-9.
- Reference 1465
-
Cacciola G, Chioccarelli T, Mackie K, Meccariello R, Ledent C, Fasano S, Pierantoni R, Cobellis G. Expression of type-1 cannabinoid receptor during rat postnatal testicular development: Possible involvement in adult leydig cell differentiation. Biol Reprod 2008 Oct;79(4):758-65.
- Reference 1466
-
Amoako AA, Marczylo TH, Marczylo EL, Elson J, Willets JM, Taylor AH, Konje JC. Anandamide modulates human sperm motility: Implications for men with asthenozoospermia and oligoasthenoteratozoospermia. Hum Reprod 2013 Aug;28(8):2058-66.
- Reference 1467
-
Rossato M, Ion Popa F, Ferigo M, Clari G, Foresta C. Human sperm express cannabinoid receptor Cb1, the activation of which inhibits motility, acrosome reaction, and mitochondrial function. J Clin Endocrinol Metab 2005 Feb;90(2):984-91.
- Reference 1468
-
Agirregoitia E, Carracedo A, Subiran N, Valdivia A, Agirregoitia N, Peralta L, Velasco G, Irazusta J. The CB(2) cannabinoid receptor regulates human sperm cell motility. Fertil Steril 2010 Mar 15;93(5):1378-87.
- Reference 1469
-
Aquila S, Guido C, Santoro A, Perrotta I, Laezza C, Bifulco M, Sebastiano A. Human sperm anatomy: Ultrastructural localization of the cannabinoid1 receptor and a potential role of anandamide in sperm survival and acrosome reaction. Anat Rec (Hoboken) 2010 Feb;293(2):298-309.
- Reference 1470
-
Aquila S, Guido C, Santoro A, Gazzerro P, Laezza C, Baffa MF, Ando S, Bifulco M. Rimonabant (SR141716) induces metabolism and acquisition of fertilizing ability in human sperm. Br J Pharmacol 2010 Feb;159(4):831-41.
- Reference 1471
-
Di Giacomo D, De Domenico E, Sette C, Geremia R, Grimaldi P. Type 2 cannabinoid receptor contributes to the physiological regulation of spermatogenesis. FASEB J 2016 Apr;30(4):1453-63.
- Reference 1472
-
Maccarrone M. Endocannabinoids and reproductive biology. Hum Reprod 2009 Jul;24(7):1771.
- Reference 1473
-
Hembree WC, Nahas GG, Zeidenberg P, Huang HFS. Changes in human spermatozoa associated with high-dose marihuana smoking. In: G. G. Nahas, K. M. Sutin, D. J. Harvey, S. Agurell, editors. Marihuana and medicine. Totowa: Humana Press; 1999. ID: 2665; RP: NOT IN FILE.
- Reference 1474
-
Hong CY, Chaput de Saintonge DM, Turner P, Fairbairn JW. Comparison of the inhibitory action of delta-9-tetrahydrocannabinol and petroleum spirit extract of herbal cannabis on human sperm motility. Hum Toxicol 1982 03;1(0144-5952; 0144-5952; 2):151-4.
- Reference 1475
-
Whan LB, West MC, McClure N, Lewis SE. Effects of delta-9-tetrahydrocannabinol, the primary psychoactive cannabinoid in marijuana, on human sperm function in vitro. Fertil Steril 2006 03;85(1556-5653; 3):653-60.
- Reference 1476
-
Zimmerman AM, Bruce WR, Zimmerman S. Effects of cannabinoids on sperm morphology. Pharmacology 1979;18(3):143-8.
- Reference 1477
-
Dalterio SL, deRooij DG. Maternal cannabinoid exposure. effects on spermatogenesis in male offspring. Int J Androl 1986 Aug;9(4):250-8.
- Reference 1478
-
Dalterio S, Steger R, Mayfield D, Bartke A. Early cannabinoid exposure influences neuroendocrine and reproductive functions in male mice: I. prenatal exposure. Pharmacol Biochem Behav 1984 Jan;20(1):107-13.
- Reference 1479
-
Dalterio S, Steger R, Mayfield D, Bartke A. Early cannabinoid exposure influences neuroendocrine and reproductive functions in mice: II. postnatal effects. Pharmacol Biochem Behav 1984 Jan;20(1):115-23.
- Reference 1480
-
Daling JR, Doody DR, Sun X, Trabert BL, Weiss NS, Chen C, Biggs ML, Starr JR, Dey SK, Schwartz SM. Association of marijuana use and the incidence of testicular germ cell tumors. Cancer 2009 Mar 15;115(6):1215-23.
- Reference 1481
-
Trabert B, Sigurdson AJ, Sweeney AM, Strom SS, McGlynn KA. Marijuana use and testicular germ cell tumors. Cancer 2011 Feb 15;117(4):848-53.
- Reference 1482
-
Lacson JC, Carroll JD, Tuazon E, Castelao EJ, Bernstein L, Cortessis VK. Population-based case-control study of recreational drug use and testis cancer risk confirms an association between marijuana use and nonseminoma risk. Cancer 2012 Nov 1;118(21):5374-83.
- Reference 1483
-
Alpar A, Di Marzo V, Harkany T. At the tip of an iceberg: Prenatal marijuana and its possible relation to neuropsychiatric outcome in the offspring. Biol Psychiatry 2016 Apr 1;79(7):e33-45.
- Reference 1484
-
Volkow ND, Compton WM, Wargo EM. The risks of marijuana use during pregnancy. Journal of American Medical Association 2016:E1-2.
- Reference 1485
-
Bergamaschi MM, Queiroz RH, Zuardi AW, Crippa JA. Safety and side effects of cannabidiol, a cannabis sativa constituent. Curr Drug Saf 2011 Sep 1;6(4):237-49.
- Reference 1486
-
Yohn NL, Bartolomei MS, Blendy JA. Multigenerational and transgenerational inheritance of drug exposure: The effects of alcohol, opiates, cocaine, marijuana, and nicotine. Prog Biophys Mol Biol 2015 Jul;118(1-2):21-33.
- Reference 1487
-
Szutorisz H, DiNieri JA, Sweet E, Egervari G, Michaelides M, Carter JM, Ren Y, Miller ML, Blitzer RD, Hurd YL. Parental THC exposure leads to compulsive heroin-seeking and altered striatal synaptic plasticity in the subsequent generation. Neuropsychopharmacology 2014 May;39(6):1315-23.
- Reference 1488
-
Yang X, Hegde VL, Rao R, Zhang J, Nagarkatti PS, Nagarkatti M. Histone modifications are associated with Delta9-tetrahydrocannabinol-mediated alterations in antigen-specific T cell responses. J Biol Chem 2014 Jul 4;289(27):18707-18.
- Reference 1489
-
Zumbrun EE, Sido JM, Nagarkatti PS, Nagarkatti M. Epigenetic regulation of immunological alterations following prenatal exposure to marijuana cannabinoids and its long term consequences in offspring. J Neuroimmune Pharmacol 2015 Jun;10(2):245-54.
- Reference 1490
-
Zuckerman B, Frank DA, Hingson R, Amaro H, Levenson SM, Kayne H, Parker S, Vinci R, Aboagye K, Fried LE, et al. Effects of maternal marijuana and cocaine use on fetal growth. N Engl J Med 1989 03/23;320(0028-4793; 12):762-8.
- Reference 1491
-
Hurd YL, Wang X, Anderson V, Beck O, Minkoff H, Dow-Edwards D. Marijuana impairs growth in mid-gestation fetuses. Neurotoxicol Teratol 2005 03;27(0892-0362; 0892-0362; 2):221-9.
- Reference 1492
-
El-Marroun H, Tiemeier H, Steegers EA, Jaddoe VW, Hofman A, Verhulst FC, van den Brink W, Huizink AC. Intrauterine cannabis exposure affects fetal growth trajectories: The generation R study. J Am Acad Child Adolesc Psychiatry 2009 10/23;48(1527-5418; 0890-8567; 12):1173-81.
- Reference 1493
-
Gray TR, Eiden RD, Leonard KE, Connors GJ, Shisler S, Huestis MA. Identifying prenatal cannabis exposure and effects of concurrent tobacco exposure on neonatal growth. Clin Chem 2010 09;56(1530-8561; 0009-9147; 9):1442-50.
- Reference 1494
-
Scragg RK, Mitchell EA, Ford RP, Thompson JM, Taylor BJ, Stewart AW. Maternal cannabis use in the sudden death syndrome. Acta Paediatr 2001 01;90(0803-5253; 1):57-60.
- Reference 1495
-
Shiono PH, Klebanoff MA, Nugent RP, Cotch MF, Wilkins DG, Rollins DE, Carey JC, Behrman RE. The impact of cocaine and marijuana use on low birth weight and preterm birth: A multicenter study. Obstet Gynecol 1995 01;172(0002-9378; 1):19-27.
- Reference 1496
-
Fried PA, Watkinson B, Gray R. Growth from birth to early adolescence in offspring prenatally exposed to cigarettes and marijuana. Neurotoxicol Teratol 1999 09;21(0892-0362; 0892-0362; 5):513-25.
- Reference 1497
-
van Gelder MM, Reefhuis J, Caton AR, Werler MM, Druschel CM, Roeleveld N. Characteristics of pregnant illicit drug users and associations between cannabis use and perinatal outcome in a population-based study. Drug Alcohol Depend 2010 06/01;109(1879-0046; 0376-8716; 1-3):243-7.
- Reference 1498
-
Day NL, Richardson GA, Geva D, Robles N. Alcohol, marijuana, and tobacco: Effects of prenatal exposure on offspring growth and morphology at age six. Alcohol Clin Exp Res 1994 Aug;18(4):786-94.
- Reference 1499
-
Day NL, Richardson GA, Goldschmidt L, Robles N, Taylor PM, Stoffer DS, Cornelius MD, Geva D. Effect of prenatal marijuana exposure on the cognitive development of offspring at age three. Neurotoxicol Teratol 1994 Mar-Apr;16(2):169-75.
- Reference 1500
-
Fried PA, Watkinson B. 36- and 48-month neurobehavioral follow-up of children prenatally exposed to marijuana, cigarettes, and alcohol. J Dev Behav Pediatr 1990 Apr;11(2):49-58.
- Reference 1501
-
Fried PA, O'Connell CM, Watkinson B. 60- and 72-month follow-up of children prenatally exposed to marijuana, cigarettes, and alcohol: Cognitive and language assessment. J Dev Behav Pediatr 1992 Dec;13(6):383-91.
- Reference 1502
-
Fried PA, Watkinson B, Gray R. A follow-up study of attentional behavior in 6-year-old children exposed prenatally to marihuana, cigarettes, and alcohol. Neurotoxicol Teratol 1992 Sep-Oct;14(5):299-311.
- Reference 1503
-
Leech SL, Richardson GA, Goldschmidt L, Day NL. Prenatal substance exposure: Effects on attention and impulsivity of 6-year-olds. Neurotoxicol Teratol 1999 Mar-Apr;21(2):109-18.
- Reference 1504
-
Fried PA, Watkinson B, Gray R. Differential effects on cognitive functioning in 9- to 12-year olds prenatally exposed to cigarettes and marihuana. Neurotoxicol Teratol 1998 May-Jun;20(3):293-306.
- Reference 1505
-
Fried PA, Watkinson B, Gray R. Differential effects on cognitive functioning in 13- to 16-year-olds prenatally exposed to cigarettes and marihuana. Neurotoxicol Teratol 2003 Jul-Aug;25(4):427-36.
- Reference 1506
-
Smith AM, Fried PA, Hogan MJ, Cameron I. Effects of prenatal marijuana on visuospatial working memory: An fMRI study in young adults. Neurotoxicol Teratol 2006 Mar-Apr;28(2):286-95.
- Reference 1507
-
El Marroun H, Tiemeier H, Franken IH, Jaddoe VW, van der Lugt A, Verhulst FC, Lahey BB, White T. Prenatal cannabis and tobacco exposure in relation to brain morphology: A prospective neuroimaging study in young children. Biol Psychiatry 2015 Sep 1.
- Reference 1508
-
Kosty DB, Farmer RF, Seeley JR, Gau JM, Duncan SC, Lewinsohn PM. Parental transmission of risk for cannabis use disorders to offspring. Addiction 2015 Jul;110(7):1110-7.
- Reference 1509
-
Ahmad GR, Ahmad N. Passive consumption of marijuana through milk: A low level chronic exposure to delta-9-tetrahydrocannabinol(THC). J Toxicol Clin Toxicol 1990;28(0731-3810; 0731-3810; 2):255-60.
- Reference 1510
-
Astley SJ, Little RE. Maternal marijuana use during lactation and infant development at one year. Neurotoxicol Teratol 1990 03;12(0892-0362; 2):161-8.
- Reference 1511
-
Volkow ND, Compton WM, Wargo EM. The risks of marijuana use during pregnancy. JAMA 2017;317(2):129-30.
- Reference 1512
-
Kessler RC, Berglund P, Demler O, Jin R, Merikangas KR, Walters EE. Lifetime prevalence and age-of-onset distributions of DSM-IV disorders in the national comorbidity survey replication. Arch Gen Psychiatry 2005 Jun;62(6):593-602.
- Reference 1513
-
Veen ND, Selten JP, van der Tweel I, Feller WG, Hoek HW, Kahn RS. Cannabis use and age at onset of schizophrenia. Am J Psychiatry 2004 Mar;161(3):501-6.
- Reference 1514
-
Meier MH, Caspi A, Ambler A, Harrington H, Houts R, Keefe RS, McDonald K, Ward A, Poulton R, Moffitt TE. Persistent cannabis users show neuropsychological decline from childhood to midlife. Proc Natl Acad Sci U S A 2012 Oct 2;109(40):E2657-64.
- Reference 1515
-
Merritt JC, Cook CE, Davis KH. Orthostatic hypotension after delta 9-tetrahydrocannabinol marihuana inhalation. Ophthalmic Res 1982;14(0030-3747; 2):124-8.
- Reference 1516
-
Chesher G, Hall WD. Effects of cannabis on the cardiovascular and gastrointestinal systems. In: H. Kalant, W. Corrigal, W. D. Hall, R. Smart, editors. The health effects of cannabis. Toronto, Canada: Centre for Addiction and Mental Health; 1999..
- Reference 1517
-
Fisher BA, Ghuran A, Vadamalai V, Antonios TF. Cardiovascular complications induced by cannabis smoking: A case report and review of the literature. Emerg Med J 2005 Sep;22(9):679-80.
- Reference 1518
-
Mittleman MA, Mostofsky E. Physical, psychological and chemical triggers of acute cardiovascular events: Preventive strategies. Circulation 2011 07/19;124(1524-4539; 0009-7322; 3):346-54.
- Reference 1519
-
Aronow WS, Cassidy J. Effect of marihuana and placebo-marihuana smoking on angina pectoris. N Engl J Med 1974 06/11;291(0028-4793; 2):65-7.
- Reference 1520
-
Sidney S. Cardiovascular consequences of marijuana use. J Clin Pharmacol 2002 11;42(0091-2700; 11):64S-70S.
- Reference 1521
-
Jouanjus E, Lapeyre-Mestre M, Micallef J, French Association of the Regional Abuse and Dependence Monitoring Centres (CEIP-A) Working Group on Cannabis Complications*. Cannabis use: Signal of increasing risk of serious cardiovascular disorders. J Am Heart Assoc 2014 Apr 23;3(2):e000638.
- Reference 1522
-
Cottencin O, Karila L, Lambert M, Arveiller C, Benyamina A, Boissonas A, Goudemand M, Reynaud M. Cannabis arteritis: Review of the literature. J.Addict.Med. 2010 12;4(1932-0620; 1932-0620; 4):191-6.
- Reference 1523
-
Noel B, Ruf I, Panizzon RG. Cannabis arteritis. J Am Acad Dermatol 2008 05;58(1097-6787; 0190-9622; 5):S65-7.
- Reference 1524
-
Combemale P, Consort T, Denis-Thelis L, Estival JL, Dupin M, Kanitakis J. Cannabis arteritis. Br J Dermatol 2005 01;152(0007-0963; 0007-0963; 1):166-9.
- Reference 1525
-
Disdier P, Granel B, Serratrice J, Constans J, Michon-Pasturel U, Hachulla E, Conri C, Devulder B, Swiader L, Piquet P, et al. Cannabis arteritis revisited--ten new case reports. Angiology 2001 01;52(0003-3197; 0003-3197; 1):1-5.
- Reference 1526
-
Wolff V, Lauer V, Rouyer O, Sellal F, Meyer N, Raul JS, Sabourdy C, Boujan F, Jahn C, Beaujeux R, et al. Cannabis use, ischemic stroke, and multifocal intracranial vasoconstriction: A prospective study in 48 consecutive young patients. Stroke 2011 06;42(1524-4628; 0039-2499; 6):1778-80.
- Reference 1527
-
Ince B, Benbir G, Yuksel O, Koseoglu L, Uluduz D. Both hemorrhagic and ischemic stroke following high doses of cannabis consumption. Presse Med 2015 Jan;44(1):106-7.
- Reference 1528
-
Hemachandra D, McKetin R, Cherbuin N, Anstey KJ. Heavy cannabis users at elevated risk of stroke: Evidence from a general population survey. Aust N Z J Public Health 2015 Nov 11.
- Reference 1529
-
Waldman M, Hochhauser E, Fishbein M, Aravot D, Shainberg A, Sarne Y. An ultra-low dose of tetrahydrocannabinol provides cardioprotection. Biochem Pharmacol 2013 Jun 1;85(11):1626-33.
- Reference 1530
-
Ravi D, Ghasemiesfe M, Korenstein D, Cascino T, Keyhani S. Associations between marijuana use and cardiovascular risk factors and outcomes: A systematic review. Ann Intern Med 2018.
- Reference 1531
-
Dezieck L, Hafez Z, Conicella A, Blohm E, O'Connor MJ, Schwarz ES, Mullins ME. Resolution of cannabis hyperemesis syndrome with topical capsaicin in the emergency department: A case series. Clin Toxicol (Phila) 2017 Sep;55(8):908-13.
- Reference 1532
-
Cox B, Chhabra A, Adler M, Simmons J, Randlett D. Cannabinoid hyperemesis syndrome: Case report of a paradoxical reaction with heavy marijuana use. Case.Report.Med. 2012;2012(1687-9635):757696.
- Reference 1533
-
Burillo-Putze G, Llorens P, Roman F. Use of capsaicin cream in cannabis hyperemesis syndrome. The Journal of Emergency Medicine 2017.
- Reference 1534
-
Pelissier F, Claudet I, Gandia-Mailly P, Benyamina A, Franchitto N. Use of capsaicin cream in cannabis hyperemesis syndrome. J Emerg Med 2017 Mar 9.
- Reference 1535
-
Batkai S, Jarai Z, Wagner JA, Goparaju SK, Varga K, Liu J, Wang L, Mirshahi F, Khanolkar AD, Makriyannis A, et al. Endocannabinoids acting at vascular CB1 receptors mediate the vasodilated state in advanced liver cirrhosis. Nat Med 2001 07;7(1078-8956; 1078-8956; 7):827-32.
- Reference 1536
-
Fernandez-Rodriguez CM, Romero J, Petros TJ, Bradshaw H, Gasalla JM, Gutierrez ML, Lledo JL, Santander C, Fernandez TP, Tomas E, et al. Circulating endogenous cannabinoid anandamide and portal, systemic and renal hemodynamics in cirrhosis. Liver Int. 2004 10;24(1478-3223; 1478-3223; 5):477-83.
- Reference 1537
-
Julien B, Grenard P, Teixeira-Clerc F, Van Nhieu JT, Li L, Karsak M, Zimmer A, Mallat A, Lotersztajn S. Antifibrogenic role of the cannabinoid receptor CB2 in the liver. Gastroenterology 2005 03;128(0016-5085; 0016-5085; 3):742-55.
- Reference 1538
-
Teixeira-Clerc F, Julien B, Grenard P, Tran Van NJ, Deveaux V, Li L, Serriere-Lanneau V, Ledent C, Mallat A, Lotersztajn S. CB1 cannabinoid receptor antagonism: A new strategy for the treatment of liver fibrosis. Nat Med 2006 06;12(1078-8956; 1078-8956; 6):671-6.
- Reference 1539
-
Siegmund SV, Schwabe RF. Endocannabinoids and liver disease. II. endocannabinoids in the pathogenesis and treatment of liver fibrosis. Am J Physiol Gastrointest Liver Physiol 2008 02;294(0193-1857; 0193-1857; 2):G357-62.
- Reference 1540
-
Mallat A, Hezode C, Lotersztajn S. Environmental factors as disease accelerators during chronic hepatitis C. J Hepatol 2008 04;48(0168-8278; 0168-8278; 4):657-65.
- Reference 1541
-
Brunet L, Moodie EE, Rollet K, Cooper C, Walmsley S, Potter M, Klein MB, Canadian Co-infection Cohort Investigators. Marijuana smoking does not accelerate progression of liver disease in HIV-hepatitis C coinfection: A longitudinal cohort analysis. Clin Infect Dis 2013 Sep;57(5):663-70.
- Reference 1542
-
Guy GW, Stott CG. The development of sativex⌐- a natural cannabis-based medicine. In: R. Mechoulam, editor. Cannabinoids as therapeutics. Basel: Birkhäuser Verlag; 2005. ID: 2335; RP: NOT IN FILE.
- Reference 1543
-
Solowij N, Stephens R, Roffman RA, Babor T. Does marijuana use cause long-term cognitive deficits? JAMA 2002 05/22;287(0098-7484; 20):2653-4.
- Reference 1544
-
Bolla KI, Brown K, Eldreth D, Tate K, Cadet JL. Dose-related neurocognitive effects of marijuana use. Neurology 2002 11/12;59(0028-3878; 9):1337-43.
- Reference 1545
-
Rubino T, Parolaro D. Long lasting consequences of cannabis exposure in adolescence. Mol Cell Endocrinol 2008 04/16;286(0303-7207; 0303-7207; 1-2):S108-13.
- Reference 1546
-
Fletcher JM, Page JB, Francis DJ, Copeland K, Naus MJ, Davis CM, Morris R, Krauskopf D, Satz P. Cognitive correlates of long-term cannabis use in costa rican men. Arch Gen Psychiatry 1996 11;53(0003-990; 11):1051-7.
- Reference 1547
-
Pope HG,Jr., Gruber AJ, Hudson JI, Cohane G, Huestis MA, Yurgelun-Todd D. Early-onset cannabis use and cognitive deficits: What is the nature of the association? Drug Alcohol Depend 2003 04/01;69(0376-8716; 3):303-10.
- Reference 1548
-
Messinis L, Kyprianidou A, Malefaki S, Papathanasopoulos P. Neuropsychological deficits in long-term frequent cannabis users. Neurology 2006 03/14;66(1526-632; 5):737-9.
- Reference 1549
-
Lyketsos CG, Garrett E, Liang KY, Anthony JC. Cannabis use and cognitive decline in persons under 65 years of age. Am J Epidemiol 1999 05/01;149(0002-9262; 9):794-800.
- Reference 1550
-
Mokrysz C, Landy R, Gage SH, Munafo MR, Roiser JP, Curran HV. Are IQ and educational outcomes in teenagers related to their cannabis use? A prospective cohort study. J Psychopharmacol 2016 Feb;30(2):159-68.
- Reference 1551
-
Jackson NJ, Isen JD, Khoddam R, Irons D, Tuvblad C, Iacono WG, McGue M, Raine A, Baker LA. Impact of adolescent marijuana use on intelligence: Results from two longitudinal twin studies. Proc Natl Acad Sci U S A 2016 Feb 2;113(5):E500-8.
- Reference 1552
-
Camchong J, Lim KO, Kumra S. Adverse effects of cannabis on adolescent brain development: A longitudinal study. Cereb Cortex 2016 Feb 23.
- Reference 1553
-
Batalla A, Crippa JA, Busatto GF, Guimaraes FS, Zuardi AW, Valverde O, Atakan Z, McGuire PK, Bhattacharyya S, Martin-Santos R. Neuroimaging studies of acute effects of THC and CBD in humans and animals: A systematic review. Curr Pharm Des 2014;20(13):2168-85.
- Reference 1554
-
Batalla A, Bhattacharyya S, Yucel M, Fusar-Poli P, Crippa JA, Nogue S, Torrens M, Pujol J, Farre M, Martin-Santos R. Structural and functional imaging studies in chronic cannabis users: A systematic review of adolescent and adult findings. PLoS One 2013;8(2):e55821.
- Reference 1555
-
Lorenzetti V, Alonso-Lana S, Youssef GJ, Verdejo-Garcia A, Suo C, Cousijn J, Takagi M, Yucel M, Solowij N. Adolescent cannabis use: What is the evidence for functional brain alteration? Curr Pharm Des 2016 Aug 5.
- Reference 1556
-
Weiland BJ, Thayer RE, Depue BE, Sabbineni A, Bryan AD, Hutchison KE. Daily marijuana use is not associated with brain morphometric measures in adolescents or adults. J Neurosci 2015 Jan 28;35(4):1505-12.
- Reference 1557
-
Rigucci S, Marques TR, Di Forti M, Taylor H, Dell'Acqua F, Mondelli V, Bonaccorso S, Simmons A, David AS, Girardi P, et al. Effect of high-potency cannabis on corpus callosum microstructure. Psychol Med 2016 Mar;46(4):841-54.
- Reference 1558
-
Becker MP, Collins PF, Lim KO, Muetzel RL, Luciana M. Longitudinal changes in white matter microstructure after heavy cannabis use. Dev Cogn Neurosci 2015 Dec;16:23-35.
- Reference 1559
-
Jakabek D, Yucel M, Lorenzetti V, Solowij N. An MRI study of white matter tract integrity in regular cannabis users: Effects of cannabis use and age. Psychopharmacology (Berl) 2016 Aug 8.
- Reference 1560
-
Lorenzetti V, Solowij N, Yucel M. The role of cannabinoids in neuroanatomic alterations in cannabis users. Biol Psychiatry 2016 Apr 1;79(7):e17-31.
- Reference 1561
-
Brumback T, Castro N, Jacobus J, Tapert S. Effects of marijuana use on brain structure and function: Neuroimaging findings from a neurodevelopmental perspective. Int Rev Neurobiol 2016;129:33-65.
- Reference 1562
-
Scott JC, Slomiak ST, Jones JD, Rosen AF, Moore TM, Gur RC. Association of cannabis with cognitive functioning in adolescents and young adults: A systematic review and meta-analysis. JAMA Psychiatry 2018;75(6):585-95.
- Reference 1563
-
Pierre JM. Risks of increasingly potent cannabis: The joint effects of potency and frequency: As THC levels rise, the risk of psychosis, cognitive deficits, and structural brain changes increases. Current Psychiatry 2017;16(2):14-21.
- Reference 1564
-
Bosker WM, Karschner EL, Lee D, Goodwin RS, Hirvonen J, Innis RB, Theunissen EL, Kuypers KP, Huestis MA, Ramaekers JG. Psychomotor function in chronic daily cannabis smokers during sustained abstinence. PLoS One 2013;8(1):e53127.
- Reference 1565
-
Hartman RL, Huestis MA. Cannabis effects on driving skills. Clin Chem 2013 Mar;59(3):478-92.
- Reference 1566
-
Mura P, Kintz P, Dumestre V, Raul S, Hauet T. THC can be detected in brain while absent in blood. J Anal Toxicol 2005 Nov-Dec;29(8):842-3.
- Reference 1567
-
Asbridge M, Mann R, Cusimano MD, Trayling C, Roerecke M, Tallon JM, Whipp A, Rehm J. Cannabis and traffic collision risk: Findings from a case-crossover study of injured drivers presenting to emergency departments. Int J Public Health 2014 Apr;59(2):395-404.
- Reference 1568
-
Menetrey A, Augsburger M, Favrat B, Pin MA, Rothuizen LE, Appenzeller M, Buclin T, Mangin P, Giroud C. Assessment of driving capability through the use of clinical and psychomotor tests in relation to blood cannabinoids levels following oral administration of 20 mg dronabinol or of a cannabis decoction made with 20 or 60 mg Delta9-THC. J Anal Toxicol 2005 07;29(0146-4760; 5):327-38.
- Reference 1569
-
Asbridge M, Poulin C, Donato A. Motor vehicle collision risk and driving under the influence of cannabis: Evidence from adolescents in atlantic canada. Accid Anal Prev 2005 11;37(0001-4575; 0001-4575; 6):1025-34.
- Reference 1570
-
Gieringer DH. Marijuana, driving, and accident safety. J Psychoactive Drugs 1988 01;20(0279-1072; 1):93-101.
- Reference 1571
-
Sexton BF, Tunbridge RJ, Brook-Carter N, Jackson PG, Wright K, Stark MM, Englehart K. The influence of cannabis on driving. Berkshire, UK: TRL Limited; 2007 2007/08. Report nr 477:ID: 2343; RP: NOT IN FILE; 23.
- Reference 1572
-
Moskowitz H. Marihuana and driving. Accid Anal Prev 1985 08;17(0001-4575; 4):323-45.
- Reference 1573
-
Bosker WM, Kuypers KP, Theunissen EL, Surinx A, Blankespoor RJ, Skopp G, Jeffery WK, Walls HC, van Leeuwen CJ, Ramaekers JG. Medicinal delta(9) -tetrahydrocannabinol (dronabinol) impairs on-the-road driving performance of occasional and heavy cannabis users but is not detected in standard field sobriety tests. Addiction 2012 10;107(1360-0443; 0965-2140; 10):1837-44.
- Reference 1574
-
Kuypers KP, Legrand SA, Ramaekers JG, Verstraete AG. A case-control study estimating accident risk for alcohol, medicines and illegal drugs. PLoS.One. 2012;7(1932-6203; 1932-6203; 8):e43496.
- Reference 1575
-
Laumon B, Gadegbeku B, Martin JL, Biecheler MB. Cannabis intoxication and fatal road crashes in france: Population based case-control study. BMJ 2005 12/10;331(1756-1833; 0959-535; 7529):1371.
- Reference 1576
-
Khiabani HZ, Bramness JG, Bjorneboe A, Morland J. Relationship between THC concentration in blood and impairment in apprehended drivers. Traffic.Inj.Prev. 2006 06;7(1538-9588; 1538-9588; 2):111-6.
- Reference 1577
-
Ronen A, Gershon P, Drobiner H, Rabinovich A, Bar-Hamburger R, Mechoulam R, Cassuto Y, Shinar D. Effects of THC on driving performance, physiological state and subjective feelings relative to alcohol. Accid Anal Prev 2008 May;40(3):926-34.
- Reference 1578
-
Sayer G, Ialomiteanu A, Stoduto G, Wickens CM, Mann RE, Le Foll B, Brands B. Increased collision risk among drivers who report driving after using alcohol and after using cannabis. Can J Public Health 2014 Feb 4;105(1):e92-3.
- Reference 1579
-
Volkow ND, Hampson AJ, Baler R. Don't worry, be happy: Endocannabinoids and cannabis at the intersection of stress and reward. Annu Rev Pharmacol Toxicol 2016 Sep 2.
- Reference 1580
-
Patel S, Hill MN, Hillard CJ. Effects of phytocannabinoids on anxiety, mood, and the endocrine system. In: R. G. Pertwee, editor. Handbook of cannabis. Oxford: Oxford University Press; 2014..
- Reference 1581
-
Chan GCK, Hall W, Freeman TP, Ferris J, Kelly AB, Winstock A. User characteristics and effect profile of butane hash oil: An extremely high-potency cannabis concentrate. Drug Alcohol Depend 2017 Sep 1;178:32-8.
- Reference 1582
-
Temple EC, Driver M, Brown RF. Cannabis use and anxiety: Is stress the missing piece of the puzzle? Front Psychiatry 2014 Nov 24;5:168.
- Reference 1583
-
Kotin J, Post RM, Goodwin FK. 9 -tetrahydrocannabinol in depressed patients. Arch Gen Psychiatry 1973 03;28(0003-990; 0003-990; 3):345-8.
- Reference 1584
-
Ablon SL, Goodwin FK. High frequency of dysphoric reactions to tetrahydrocannabinol among depressed patients. Am J Psychiatry 1974 04;131(0002-953; 0002-953; 4):448-53.
- Reference 1585
-
Glass RM, Uhlenhuth EH, Hartel FW, Schuster CR, Fischman MW. A single dose study of nabilone, a synthetic cannabinoid. Psychopharmacology (Berl) 1980;71(0033-3158; 0033-3158; 2):137-42.
- Reference 1586
-
Glass RM, Uhlenhuth EH, Hartel FW, Schuster CR, Fischman MW. Single-dose study of nabilone in anxious volunteers. J Clin Pharmacol 1981 08;21(0091-2700; 0091-2700; 8-9):383S-96S.
- Reference 1587
-
Bergamaschi MM, Queiroz RH, Chagas MH, de Oliveira DC, De Martinis BS, Kapczinski F, Quevedo J, Roesler R, Schroder N, Nardi AE, et al. Cannabidiol reduces the anxiety induced by simulated public speaking in treatment-naive social phobia patients. Neuropsychopharmacology 2011 05;36(1740-634; 0006-3223; 6):1219-26.
- Reference 1588
-
Lev-Ran S, Le Foll B, McKenzie K, Rehm J. Cannabis use and mental health-related quality of life among individuals with anxiety disorders. J Anxiety Disord 2012 Dec;26(8):799-810.
- Reference 1589
-
Degenhardt L, Coffey C, Romaniuk H, Swift W, Carlin JB, Hall WD, Patton GC. The persistence of the association between adolescent cannabis use and common mental disorders into young adulthood. Addiction 2013 Jan;108(1):124-33.
- Reference 1590
-
Kedzior KK, Laeber LT. A positive association between anxiety disorders and cannabis use or cannabis use disorders in the general population--a meta-analysis of 31 studies. BMC Psychiatry 2014 May 10;14:136,244X-14-136.
- Reference 1591
-
Gage SH, Hickman M, Heron J, Munafo MR, Lewis G, Macleod J, Zammit S. Associations of cannabis and cigarette use with depression and anxiety at age 18: Findings from the avon longitudinal study of parents and children. PLoS One 2015 Apr 13;10(4):e0122896.
- Reference 1592
-
Degenhardt L, Hall W, Lynskey M. Exploring the association between cannabis use and depression. Addiction 2003 11;98(0965-2140; 0965-2140; 11):1493-504.
- Reference 1593
-
Harder VS, Morral AR, Arkes J. Marijuana use and depression among adults: Testing for causal associations. Addiction 2006 10;101(0965-2140; 0965-2140; 10):1463-72.
- Reference 1594
-
Harder VS, Stuart EA, Anthony JC. Adolescent cannabis problems and young adult depression: Male-female stratified propensity score analyses. Am J Epidemiol 2008 09/15;168(1476-6256; 0002-9262; 6):592-601.
- Reference 1595
-
Stinson FS, Ruan WJ, Pickering R, Grant BF. Cannabis use disorders in the USA: Prevalence, correlates and co-morbidity. Psychol Med 2006 10;36(0033-2917; 0033-2917; 10):1447-60.
- Reference 1596
-
van Laar M, van Dorsselaer S, Monshouwer K, de Graaf R. Does cannabis use predict the first incidence of mood and anxiety disorders in the adult population? Addiction 2007 08;102(0965-2140; 0965-2140; 8):1251-60.
- Reference 1597
-
Horwood LJ, Fergusson DM, Coffey C, Patton GC, Tait R, Smart D, Letcher P, Silins E, Hutchinson DM. Cannabis and depression: An integrative data analysis of four australasian cohorts. Drug Alcohol Depend 2012 Dec 1;126(3):369-78.
- Reference 1598
-
Manrique-Garcia E, Zammit S, Dalman C, Hemmingsson T, Allebeck P. Cannabis use and depression: A longitudinal study of a national cohort of swedish conscripts. BMC Psychiatry 2012 Aug 16;12:112,244X-12-112.
- Reference 1599
-
Gonzalez-Ortega I, Alberich S, Echeburua E, Aizpuru F, Millan E, Vieta E, Matute C, Gonzalez-Pinto A. Subclinical depressive symptoms and continued cannabis use: Predictors of negative outcomes in first episode psychosis. PLoS One 2015 Apr 15;10(4):e0123707.
- Reference 1600
-
Lev-Ran S, Le Foll B, McKenzie K, George TP, Rehm J. Bipolar disorder and co-occurring cannabis use disorders: Characteristics, co-morbidities and clinical correlates. Psychiatry Res 2013 Oct 30;209(3):459-65.
- Reference 1601
-
Henquet C, Krabbendam L, de GR, ten HM, van OJ. Cannabis use and expression of mania in the general population. J Affect Disord 2006 10;95(0165-0327; 0165-0327; 1-3):103-10.
- Reference 1602
-
Strakowski SM, DelBello MP, Fleck DE, Adler CM, Anthenelli RM, Keck PE,Jr., Arnold LM, Amicone J. Effects of co-occurring cannabis use disorders on the course of bipolar disorder after a first hospitalization for mania. Arch Gen Psychiatry 2007 01;64(0003-990; 0003-990; 1):57-64.
- Reference 1603
-
Agrawal A, Nurnberger JI,Jr., Lynskey MT. Cannabis involvement in individuals with bipolar disorder. Psychiatry Res 2011 02/28;185(0165-1781; 0165-1781; 3):459-61.
- Reference 1604
-
De Pradier M, Gorwood P, Beaufils B, Ades J, Dubertret C. Influence of the serotonin transporter gene polymorphism, cannabis and childhood sexual abuse on phenotype of bipolar disorder: A preliminary study. Eur Psychiatry 2010 10;25(1778-3585; 0924-9338; 6):323-7.
- Reference 1605
-
Bally N, Zullino D, Aubry JM. Cannabis use and first manic episode. J Affect Disord 2014 Aug;165:103-8.
- Reference 1606
-
Tyler E, Jones S, Black N, Carter LA, Barrowclough C. The relationship between bipolar disorder and cannabis use in daily life: An experience sampling study. PLoS One 2015 Mar 4;10(3):e0118916.
- Reference 1607
-
Gibbs M, Winsper C, Marwaha S, Gilbert E, Broome M, Singh SP. Cannabis use and mania symptoms: A systematic review and meta-analysis. J Affect Disord 2015 Jan 15;171:39-47.
- Reference 1608
-
Baethge C, Hennen J, Khalsa HM, Salvatore P, Tohen M, Baldessarini RJ. Sequencing of substance use and affective morbidity in 166 first-episode bipolar I disorder patients. Bipolar Disord 2008 09;10(1399-5618; 1398-5647; 6):738-41.
- Reference 1609
-
Martinez-Gras I, Hoenicka J, Ponce G, Rodriguez-Jimenez R, Jimenez-Arriero MA, Perez-Hernandez E, Ampuero I, Ramos-Atance JA, Palomo T, Rubio G. (AAT)n repeat in the cannabinoid receptor gene, CNR1: Association with schizophrenia in a spanish population. Eur Arch Psychiatry Clin Neurosci 2006 10;256(0940-1334; 0940-1334; 7):437-41.
- Reference 1610
-
Monteleone P, Bifulco M, Maina G, Tortorella A, Gazzerro P, Proto MC, Di FC, Monteleone F, Canestrelli B, Buonerba G, et al. Investigation of CNR1 and FAAH endocannabinoid gene polymorphisms in bipolar disorder and major depression. Pharmacol Res 2010 05;61(1096-1186; 1043-6618; 5):400-4.
- Reference 1611
-
Lagerberg TV, Sundet K, Aminoff SR, Berg AO, Ringen PA, Andreassen OA, Melle I. Excessive cannabis use is associated with earlier age at onset in bipolar disorder. Eur Arch Psychiatry Clin Neurosci 2011 09;261(1433-8491; 0940-1334; 6):397-405.
- Reference 1612
-
Braga RJ, Burdick KE, Derosse P, Malhotra AK. Cognitive and clinical outcomes associated with cannabis use in patients with bipolar I disorder. Psychiatry Res 2012 07/17;200(0165-1781; 0165-1781; 2-3):242-5.
- Reference 1613
-
Lagerberg TV, Kvitland LR, Aminoff SR, Aas M, Ringen PA, Andreassen OA, Melle I. Indications of a dose-response relationship between cannabis use and age at onset in bipolar disorder. Psychiatry Res 2014 Jan 30;215(1):101-4.
- Reference 1614
-
Feingold D, Weiser M, Rehm J, Lev-Ran S. The association between cannabis use and mood disorders: A longitudinal study. J Affect Disord 2014 Oct 13;172C:211-8.
- Reference 1615
-
Zorrilla I, Aguado J, Haro JM, Barbeito S, Lopez Zurbano S, Ortiz A, Lopez P, Gonzalez-Pinto A. Cannabis and bipolar disorder: Does quitting cannabis use during manic/mixed episode improve clinical/functional outcomes? Acta Psychiatr Scand 2015 Feb;131(2):100-10.
- Reference 1616
-
Kim SW, Dodd S, Berk L, Kulkarni J, de Castella A, Fitzgerald PB, Kim JM, Yoon JS, Berk M. Impact of cannabis use on long-term remission in bipolar I and schizoaffective disorder. Psychiatry Investig 2015 Jul;12(3):349-55.
- Reference 1617
-
Leite RT, Nogueira Sde O, do Nascimento JP, de Lima LS, da Nobrega TB, Virginio Mda S, Moreno LM, Sampaio BH, Souza FG. The use of cannabis as a predictor of early onset of bipolar disorder and suicide attempts. Neural Plast 2015;2015:434127.
- Reference 1618
-
Mammen G, Rueda S, Roerecke M, Bonato S, Lev-Ran S, Rehm J. Association of cannabis with long-term clinical symptoms in anxiety and mood disorders: A systematic review of prospective studies. J Clin Psychiatry 2018 Jun 5;79(4):10.4088/JCP.17r11839.
- Reference 1619
-
Thornicroft G. Cannabis and psychosis. is there epidemiological evidence for an association? Br J Psychiatry 1990 07;157(0007-1250; 0007-1250):25-33.
- Reference 1620
-
Arseneault L, Cannon M, Witton J, Murray RM. Causal association between cannabis and psychosis: Examination of the evidence. Br J Psychiatry 2004 02;184(0007-1250):110-7.
- Reference 1621
-
Zammit S, Allebeck P, Andreasson S, Lundberg I, Lewis G. Self reported cannabis use as a risk factor for schizophrenia in swedish conscripts of 1969: Historical cohort study. BMJ 2002 11/23;325(1468-5833; 7374):1199-203.
- Reference 1622
-
Arseneault L, Cannon M, Poulton R, Murray R, Caspi A, Moffitt TE. Cannabis use in adolescence and risk for adult psychosis: Longitudinal prospective study. BMJ 2002 11/23;325(1468-5833; 7374):1212-3.
- Reference 1623
-
Fergusson DM, Horwood LJ, Swain-Campbell NR. Cannabis dependence and psychotic symptoms in young people. Psychol Med 2003 Jan;33(1):15-21.
- Reference 1624
-
Fergusson DM, Horwood LJ, Ridder EM. Tests of causal linkages between cannabis use and psychotic symptoms. Addiction 2005 Mar;100(3):354-66.
- Reference 1625
-
Manrique-Garcia E, Zammit S, Dalman C, Hemmingsson T, Andreasson S, Allebeck P. Cannabis, schizophrenia and other non-affective psychoses: 35 years of follow-up of a population-based cohort. Psychol Med 2012 Jun;42(6):1321-8.
- Reference 1626
-
Lev-Ran S, Segev A, Braw Y, Levkovitz Y. Neurocognitive functions of heavy cannabis using schizophrenia patients. Eur Psychiatry 2012 Jul;27(5):365-8.
- Reference 1627
-
Gage SH, Hickman M, Heron J, Munafo MR, Lewis G, Macleod J, Zammit S. Associations of cannabis and cigarette use with psychotic experiences at age 18: Findings from the avon longitudinal study of parents and children. Psychol Med 2014 Dec;44(16):3435-44.
- Reference 1628
-
Giordano GN, Ohlsson H, Sundquist K, Sundquist J, Kendler KS. The association between cannabis abuse and subsequent schizophrenia: A swedish national co-relative control study. Psychol Med 2015 Jan;45(2):407-14.
- Reference 1629
-
van Gastel WA, Vreeker A, Schubart CD, MacCabe JH, Kahn RS, Boks MP. Change in cannabis use in the general population: A longitudinal study on the impact on psychotic experiences. Schizophr Res 2014 Aug;157(1-3):266-70.
- Reference 1630
-
Decoster J, van OJ, Kenis G, Henquet C, Peuskens J, De HM, van WR. Age at onset of psychotic disorder: Cannabis, BDNF Val66Met, and sex-specific models of gene-environment interaction. Am.J.Med.Genet.B Neuropsychiatr.Genet. 2011 04;156B(1552-485; 1552-4841; 3):363-9.
- Reference 1631
-
Bhattacharyya S, Atakan Z, Martin-Santos R, Crippa JA, Kambeitz J, Prata D, Williams S, Brammer M, Collier DA, McGuire PK. Preliminary report of biological basis of sensitivity to the effects of cannabis on psychosis: AKT1 and DAT1 genotype modulates the effects of delta-9-tetrahydrocannabinol on midbrain and striatal function. Mol Psychiatry 2012 Dec;17(12):1152-5.
- Reference 1632
-
Sherif M, Radhakrishnan R, D'Souza DC, Ranganathan M. Human laboratory studies on cannabinoids and psychosis. Biol Psychiatry 2016 Apr 1;79(7):526-38.
- Reference 1633
-
Krebs MO, Morvan Y, Jay T, Gaillard R, Kebir O. Psychotomimetic effects at initiation of cannabis use are associated with cannabinoid receptor 1 (CNR1) variants in healthy students. Mol Psychiatry 2014 Apr;19(4):402-3.
- Reference 1634
-
Tunbridge EM, Harrison PJ, Weinberger DR. Catechol-o-methyltransferase, cognition, and psychosis: Val158Met and beyond. Biol Psychiatry 2006 07/15;60(0006-3223; 0006-3223; 2):141-51.
- Reference 1635
-
McIntosh AM, Baig BJ, Hall J, Job D, Whalley HC, Lymer GK, Moorhead TW, Owens DG, Miller P, Porteous D, et al. Relationship of catechol-O-methyltransferase variants to brain structure and function in a population at high risk of psychosis. Biol Psychiatry 2007 05/15;61(0006-3223; 0006-3223; 10):1127-34.
- Reference 1636
-
Miyake N, Thompson J, Skinbjerg M, Abi-Dargham A. Presynaptic dopamine in schizophrenia. CNS.Neurosci.Ther. 2011 04;17(1755-5949; 1755-5930; 2):104-9.
- Reference 1637
-
Fan JB, Zhang CS, Gu NF, Li XW, Sun WW, Wang HY, Feng GY, St CD, He L. Catechol-O-methyltransferase gene Val/Met functional polymorphism and risk of schizophrenia: A large-scale association study plus meta-analysis. Biol Psychiatry 2005 01/15;57(0006-3223; 0006-3223; 2):139-44.
- Reference 1638
-
Ayalew M, Le-Niculescu H, Levey DF, Jain N, Changala B, Patel SD, Winiger E, Breier A, Shekhar A, Amdur R, et al. Convergent functional genomics of schizophrenia: From comprehensive understanding to genetic risk prediction. Mol Psychiatry 2012 09;17(1476-5578; 1359-4184; 9):887-905.
- Reference 1639
-
Mustonen A, Niemelä S, Nordström T, Murray GK, Mäki P, Jääskeläinen E, Miettunen J. Adolescent cannabis use, baseline prodromal symptoms and the risk of psychosis. The British Journal of Psychiatry 2018;212(4):227-33.
- Reference 1640
-
Bourque J, Afzali MH, Conrod PJ. Association of cannabis use with adolescent psychotic symptoms. JAMA Psychiatry 2018.
- Reference 1641
-
Arendt M, Mortensen PB, Rosenberg R, Pedersen CB, Waltoft BL. Familial predisposition for psychiatric disorder: Comparison of subjects treated for cannabis-induced psychosis and schizophrenia. Arch Gen Psychiatry 2008 Nov;65(11):1269-74.
- Reference 1642
-
van Ours JC, Williams J, Fergusson D, Horwood LJ. Cannabis use and suicidal ideation. J Health Econ 2013 May;32(3):524-37.
- Reference 1643
-
Topol EJ, Bousser MG, Fox KA, Creager MA, Despres JP, Easton JD, Hamm CW, Montalescot G, Steg PG, Pearson TA, et al. Rimonabant for prevention of cardiovascular events (CRESCENDO): A randomised, multicentre, placebo-controlled trial. Lancet 2010 Aug 14;376(9740):517-23.
- Reference 1644
-
Rimonabant Briefing Document: Endocrine and Metabolic Drugs Advisory Committee Meeting
NDA 21-888 [Internet]; c2007 [cited 2016. Available from: http://www.fda.gov/ohrms/dockets/ac/07/briefing/2007-4306b1-fda-backgrounder.pdf. - Reference 1645
-
D'Souza DC, Sewell RA, Ranganathan M. Cannabis and psychosis/schizophrenia: Human studies. Eur Arch Psychiatry Clin Neurosci 2009 10;259(1433-8491; 0940-1334; 7):413-31.
- Reference 1646
-
Castle DJ, Solowij N. Acute and subacute psychomimetic effects of cannabis in humans. In: D. Castle, R. Murray, editors. Marijuana and madness. Cambridge: Cambridge University Press; 2004. ID: 2673; RP: NOT IN FILE.
- Reference 1647
-
Fridberg DJ, Vollmer JM, O'Donnell BF, Skosnik PD. Cannabis users differ from non-users on measures of personality and schizotypy. Psychiatry Res 2011 03/30;186(0165-1781; 0165-1781; 1):46-52.
- Reference 1648
-
Calabria B, Degenhardt L, Hall W, Lynskey M. Does cannabis use increase the risk of death? systematic review of epidemiological evidence on adverse effects of cannabis use. Drug Alcohol Rev 2010 May;29(3):318-30.
- Reference 1649
-
Gable RS. Comparison of acute lethal toxicity of commonly abused psychoactive substances. Addiction 2004 Jun;99(6):686-96.
- Reference 1650
-
World Health Organization (WHO). The health and social effects of nonmedical cannabis use..
- Reference 1651
-
van Laar M, Frijns T, Trautmann F, Lombi L. Part 1: Report I cannabis market: User types, availability and consumption estimates. In: F. Trautmann, B. Kilmer, P. Turnbull, editors. Further insights into aspects of the EU illicit drug markets. Publications Office of European Union; 2013..
- Reference 1652
-
Lachenmeier DW, Rehm J. Comparative risk assessment of alcohol, tobacco, cannabis and other illicit drugs using the margin of exposure approach. Sci Rep 2015 Jan 30;5:8126.
- Reference 1653
-
Robson P. Therapeutic aspects of cannabis and cannabinoids. Br J Psychiatry 2001 02;178(0007-1250):107-15.
- Reference 1654
-
Weinstein AM, Gorelick DA. Pharmacological treatment of cannabis dependence. Curr Pharm Des 2011;17(1873-4286; 1381-6128; 14):1351-8.
- Reference 1655
-
Thompson GR, Rosenkrantz H, Schaeppi UH, Braude MC. Comparison of acute oral toxicity of cannabinoids in rats, dogs and monkeys. Toxicol Appl Pharmacol 1973 07;25(0041-008; 0041-008; 3):363-72.
- Reference 1656
-
Guidance for industry: estimating the maximum safe starting dose in initial clinical trials for therapeutics in adult healthy volunteers [Internet]Rockville, Maryland: U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research; c2005 [cited 2016 12/23]. Available from: http://www.fda.gov/downloads/Drugs/Guidances/UCM078932.pdf.
- Reference 1657
-
Uliss DB, Dalzell HC, Handrick GR, Howes JF, Razdan RK. Hashish. importance of the phenolic hydroxyl group in tetrahydrocannabinols. J Med Chem 1975 Feb;18(2):213-5.
- Reference 1658
-
Rosenkrantz H, Fleischman RW, Grant RJ. Toxicity of short-term administration of cannabinoids to rhesus monkeys. Toxicol Appl Pharmacol 1981 Mar 30;58(1):118-31.
- Reference 1659
-
Nair AB, Jacob S. A simple practice guide for dose conversion between animals and human. J Basic Clin Pharm 2016 Mar;7(2):27-31.
- Reference 1660
-
Ashton JC, Milligan ED. Cannabinoids for the treatment of neuropathic pain: Clinical evidence. Curr Opin Investig Drugs 2008 01;9(1472-4472; 1472-4472; 1):65-75.
- Reference 1661
-
Grotenhermen F. The toxicology of cannabis and cannabis prohibition. Chem.Biodivers. 2007 08;4(1612-1880; 1612-1872; 8):1744-69.
- Reference 1662
-
Draz EI, Oreby MM, Elsheikh EA, Khedr LA, Atlam SA. Marijuana use in acute coronary syndromes. The American Journal of Drug and Alcohol Abuse 2016:1-7.
- Reference 1663
-
Hemachandra D, McKetin R, Cherbuin N, Anstey KJ. Heavy cannabis users at elevated risk of stroke: Evidence from a general population survey. Aust N Z J Public Health 2015 Nov 11.
Notes de bas de page
- Note de bas de page 1
-
Les doses équivalentes chez l'humain ont été calculées en fonction de la surface corporelle : les doses animales en mg/kg ont été divisées par 12,3 pour la souris1659.
- Note de bas de page 2
-
Les doses équivalentes chez l'humain ont été calculées en fonction de la surface corporelle : les doses animales en mg/kg ont été divisées par 12,3 pour les souris, 6,2 pour les rats et 3,1 pour les singes1659.