Recommandations pour la qualité de l'eau potable au Canada : document technique – bromoxynil
Télécharger en format PDF
(127 ko, 3 pages)
Organisation : Santé Canada
Type : Lignes directrices
Date publiée : 2022-03
Valeur de la recommandation
La concentration maximale acceptable (CMA) de bromoxynil dans l'eau potable est de 0,03 mg/L (30 µg/L).
Résumé
Le présent document technique, qui a été préparé en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, s'appuie sur des évaluations du bromoxynil menées par l'Agence de réglementation de la lutte antiparasitaire de Santé Canada et sur des documents connexes.
Exposition
Le bromoxynil est un herbicide homologué servant à lutter contre les mauvaises herbes à feuilles larges dans les cultures destinées à la consommation humaine ou animale. En 2018 (soit l'année la plus récente pour laquelle des données sont disponibles), plus de 1 million de kilogrammes de bromoxynil ont été vendus au Canada. Le bromoxynil pénètre dans l'environnement par les eaux de ruissellement, par la dérive de pulvérisation ou sous forme de particules adsorbées à des particules de poussière.
Les données canadiennes indiquent que le bromoxynil n'est pas couramment détecté dans les sources d'approvisionnement en eau ou dans l'eau potable, mais de faibles concentrations de bromoxynil peuvent être détectées dans les sources d'approvisionnement en eau et dans l'eau potable des zones agricoles où il est utilisé. Le bromoxynil est rarement détecté dans les aliments.
Effets sur la santé
Des études chez les animaux montrent que le bromoxynil cible principalement le foie. À des doses élevées, on a constaté que le bromoxynil causait des effets sur le développement (effets sur le squelette, diminution du poids des petits), mais pas sur le système reproducteur. Aucune étude des effets du bromoxynil sur le foie n'a été réalisée chez l'humain. La CMA de 0,03 mg/L (30 µg/L) est fondée sur une augmentation des signes cliniques (c'est-à-dire des effets constatés d'après des observations réelles comparativement à des effets théoriques ou expérimentaux; halètement, salivation, matières fécales liquides, gencives pâles) et du poids du foie, ainsi que des diminutions du poids corporel et du gain de poids corporel observées lors d'une étude d'un an menée sur des chiens.
Considérations relatives à l'analyse et au traitement
L'établissement d'une recommandation sur la qualité de l'eau potable tient compte de la capacité de mesurer le contaminant et de l'enlever des approvisionnements d'eau potable. Plusieurs méthodes d'analyse existent pour mesurer le bromoxynil dans l'eau à des concentrations bien inférieures à la CMA.
À l'échelle municipale, on dispose de peu de renseignements sur l'efficacité des technologies de traitement visant à enlever le bromoxynil de l'eau potable. L'oxydation, les procédés d'oxydation avancée et la biofiltration ont permis d'atteindre un large éventail de taux d' enlèvement. L'adsorption sur charbon actif et les procédés membranaires devraient être efficaces. Bien que le bromoxynil puisse être enlevé par oxydation, les responsables de systèmes d'approvisionnement en eau potable devraient être conscients du potentiel de formation de sous-produits de dégradation. Il est recommandé de réaliser des études pilotes ou à l'échelle de banc d'essai avant une mise en œuvre à grande échelle.
Dans les cas où l'on souhaite enlever le bromoxynil à l'échelle résidentielle ou des petits systèmes par exemple lorsque l'approvisionnement en eau potable provient d'un puits privé, un dispositif de traitement d'eau potable résidentiel pourrait être employé. Même s'il n'existe pas encore de dispositif de traitement certifié permettant d'enlever le bromoxynil de l'eau potable, des techniques comme l'adsorption sur charbon actif et l'osmose inverse devraient être efficaces. Lorsqu'on utilise un tel dispositif de traitement d'eau potable, il est important de prélever des échantillons d'eau à l'entrée et à la sortie du dispositif et de les envoyer à un laboratoire accrédité pour analyse afin de confirmer un enlèvement adéquat du bromoxynil.
Application des recommandations
Remarque : Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité appropriée en matière d'eau potable.
Les recommandations relatives au bromoxynil visent à offrir une protection contre les effets sur la santé associés à une exposition à cet herbicide par l'eau potable toute la vie durant. Tout dépassement de la CMA devrait faire l'objet d'une enquête suivie par des mesures correctives, au besoin. En cas de dépassement dans une source d'approvisionnement en eau où il n'y a aucun traitement en place, une surveillance supplémentaire devrait être mise en place afin de confirmer le dépassement. Si on confirme que les concentrations de bromoxynil dans la source d'eau dépassent la CMA, une enquête devrait être menée pour déterminer le moyen le plus approprié de diminuer l'exposition au bromoxynil. Les options possibles comprennent l'utilisation d'un autre approvisionnement en eau ou l'installation d'un système de traitement de l'eau . Si un système de traitement est déjà en place lorsqu'un dépassement survient, une enquête devrait être menée pour vérifier efficacité du traitement et déterminer si des ajustements visant à diminuer la concentration dans l'eau traitée sous la CMA s'imposent.
Table des matières
- 1.0 Considérations relatives à l'exposition
- 2.0 Considérations relatives à la santé
- 3.0 Calcul de la valeur basée sur la santé
- 4.0 Considérations relatives à l'analyse et au traitement
- 5.0 Stratégies de gestion
- 6.0 Considérations internationales
- 7.0 Justification
- 8.0 Références
- Annexe A : Liste d'abréviations
- Annexe B : Données sur la qualité de l'eau au Canada
1.0 Considérations relatives à l'exposition
1.1 Sources et utilisations
Le bromoxynil phénol (3,5-dibromo-4-hydroxybenzonitrile, composé parent) et ses dérivés esters sont habituellement regroupés sous le nom de « bromoxynil ». Toutefois, c'est la forme phénolique du bromoxynil qu'on appelle « bromoxynil » (US EPA, 1998; CCME, 1999a). Par conséquent, dans ce document, le terme « bromoxynil » désignera le bromoxynil phénol.
Le bromoxynil est un herbicide à base de benzonitrile sélectif, de contact et de postlevée servant à lutter contre un large éventail de mauvaises herbes à feuilles larges dans les cultures destinées à la consommation humaine ou animale (Santé Canada, 2019a). Il inhibe la photosynthèse, ce qui stoppe la production d'énergie et nuit à la respiration des plantes (US EPA, 1998). Le bromoxynil et ses esters octanoate et heptanoate sont actuellement homologués au Canada pour utilisation dans des produits à usage commercial. Aucun produit d'usage domestique homologué au Canada ne contient du bromoxynil ou ses dérivés esters (Santé Canada, 2019a). Le bromoxynil figurait sur la Liste annuelle des 10 substances actives herbicides les plus vendues au Canada établie par l'Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada en 2018 (l'année la plus récente pour laquelle il existe des données). Plus de 1 000 000 kg d'ingrédient actif (bromoxynil) ont été vendus pour application sur des cultures terrestres destinées à la consommation humaine ou animale (Santé Canada, 2020a).
Le bromoxynil et ses esters octanoate et heptanoate sont rejetés dans l'environnement par la dérive de pulvérisation résultant d'utilisations agricoles et par ruissellement des eaux de surface provenant des zones traitées (Anderson et coll., 1998; CCME, 1999a, Waite et coll., 2005; Santé Canada, 2019a). De plus, des particules de poussière contenant du bromoxynil, de l'octanoate de bromoxynil et/ou de l'heptanoate de bromoxynil adsorbé à leur surface pourraient aussi contaminer l'eau de surface (CCME, 1999a).
Le bromoxynil est modérément soluble dans l'eau (voir le tableau 1). Compte tenu de la conversion aérobie et anaérobie rapide du bromoxynil en dioxyde de carbone, il risque peu de contaminer l'eau souterraine (US EPA, 1998; Santé Canada, 2008). Une demi-vie de 9 à 17 jours est observée pour le bromoxynil dans les étangs des zones humides des prairies, bien que des résidus (> 2 ng/L) puissent y demeurer jusqu'à 120 jours après application (Muir et coll., 1991). Dans le sol, la demi-vie du bromoxynil est de 4,12 jours et son taux de dissipation est de 91,25 % sur 21 jours (Chen et coll., 2011).
L'octanoate et l'heptanoate de bromoxynil sont très semblables sur les plans chimique et physique; ainsi, l'information relative au devenir dans l'environnement de l'ester d'octanoate s'applique également à l'ester d'heptanoate (US EPA, 1998; Santé Canada, 2008). Les deux esters sont pratiquement insolubles dans l'eau et s'hydrolysent facilement en bromoxynil à un pH alcalin, les demi-vies étant de 1,7 à 34,1 jours selon le pH (CCME, 1998a; US EPA, 1998; Santé Canada, 2008). L'octanoate de bromoxynil se dégrade rapidement dans l'eau et le sol selon des demi-vies de photolyse de 2 à 4,6 jours; ses demi-vies de dégradation microbienne sont de 12 heures à 3,7 jours. L'octanoate de bromoxynil est mobile dans le sable, les loams sableux et les sols limoneux. Étant donné que l'octanoate de bromoxynil se dégrade facilement en bromoxynil par hydrolyse, la possibilité que l'octanoate de bromoxynil contamine l'eau souterraine (et soit une source d'exposition) est faible. De plus, l'octanoate de bromoxynil ne devrait pas persister dans les eaux de surface (US EPA, 1998).
La pression de vapeur et la constante de la loi d'Henry rapportées (voir le tableau 1) indiquent que le bromoxynil et ses esters octanoate et heptanoate ne devraient pas se volatiliser facilement à partir des eaux de surface ni être transportés dans l'air sur une longue distance (US EPA, 1998; Santé Canada, 2008).
1.2 Identité de la substance
Le bromoxynil (numéro de registre CAS 1689-84-5, C7H3Br2NO) est une substance solide incolore et inodore (CCME, 1999b). L'octanoate de bromoxynil (numéro de registre CAS 1689-99-2, C15H17Br2NO2) et l'heptanoate de bromoxynil (numéro de registre CAS 56634-95-8, C14H15Br2NO2) sont des substances solides cristallines (US EPA, 1998). Dans leurs évaluations, l'Environmental Protection Agency des États-Unis (US EPA) (1998) et l'ARLA (Santé Canada, 2019a) se sont concentrées seulement sur les données portant sur l'octanoate de bromoxynil, puisqu'il a été constaté que celui-ci était chimiquement et physiquement similaire à l'heptanoate de bromoxynil. Par conséquent, ce sont les propriétés physico-chimiques du bromoxynil et de l'octanoate de bromoxynil qui sont résumées dans le tableau 1.
| Propriété | Bromoxynil | Interprétation | Octanoate de bromoxynil | Interprétation |
|---|---|---|---|---|
| Numéro de registre CAS | 1689-84-5 | Sans objet | 1689-99-2 | Sans objet |
| Formule moléculaire | C7H3Br2NO | Sans objet | C15H17Br2NO2 | Sans objet |
| Poids moléculaire (g/mol) |
276,9 | Sans objet | 403,1 | Sans objet |
| Hydrosolubilité (mg/L) |
130 à 20 °C | Solubilité modérée dans l'eau | 3 à 25 °C | Faible solubilité dans l'eau |
| Pression de vapeur (volatilité) (mPa) |
6,3 x 10-3 à 20 °C | Volatilité faible, présence improbable dans l'air | 1,9 x 10-1 à 25 °C | Volatilité faible, présence improbable dans l'air |
| Constante de la loi d'Henry | 5,3 x 10-4 Pam3/molTableau 1 Note de bas de page a | Faible potentiel de volatilisation à partir d'eaux de surface ou de sols humides | 9,76 x 10-8 atmm3/molTableau 1 Note de bas de page b |
Faible potentiel de volatilisation à partir d'eaux de surface ou de sols humides |
| Constante de dissociation | pKa = 3,86 | Le bromoxynil se dissocie rapidement en anions aux pH environnementaux | Aucune dissociation | Sans objet |
| Coefficient de partage n-octanol:eau (logKOW) |
2,8 | Bioaccumulation improbable | 5,4 | Bioaccumulation improbable |
1.3 Exposition
La population générale canadienne pourrait être exposée au bromoxynil par le biais des aliments et de l'eau potable (Santé Canada, 2019a).
Des données de surveillance de l'eau provenant des provinces et des territoires (sources municipales et non municipales), de l'ARLA et d'Environnement Canada (2011) (annexe B) étaient disponibles pour le bromoxynil.
Les données fournies sur l'exposition correspondent à diverses limites de détection de la méthode (LDM) de laboratoires accrédités utilisées par les secteurs de compétence et leurs programmes de surveillance. Par conséquent, l'analyse statistique des données sur l'exposition ne fournit qu'un tableau partiel de la situation. Selon les données fournies par les provinces et les territoires, les niveaux de bromoxynil sont inférieurs au seuil de déclaration de la méthode (SDM) ou à la LDM dans la majorité des échantillons prélevés. Ces échantillons provenaient de divers approvisionnements en eau au Canada, notamment les eaux de surface et les eaux souterraines ainsi que l'eau potable traitée et distribuée ayant fait l'objet d'une surveillance (British Columbia Ministry of Health, 2019; Services aux Autochtones Canada, 2019; Développement durable Manitoba, 2019; ministère de l'Environnement et de la Lutte contre les changements climatiques du Québec, 2019; Nova Scotia Environment, 2019; Saskatchewan Water Security Agency, 2019; Ministère de l'Environnement, de la Protection de la nature et des Parcs de l'Ontario, 2020). Le tableau 2 résume les données de surveillance des secteurs de compétence concernés rapportant des concentrations inférieures à la LDM. Le tableau 3, quant à lui, résume les données de surveillance des secteurs de compétence concernés où des détections de bromoxynil ont été signalées. Une concentration maximale de 6,69 μg/L a été observée dans un réseau de distribution du Québec alimenté par des eaux de surface.
Aucune donnée de surveillance n'était disponible pour le Nouveau-Brunswick, Terre-Neuve-et-Labrador, l'Île-du-Prince-Édouard et le Yukon (département de l'Environnement et des gouvernements locaux du Nouveau-Brunswick, 2019; Newfoundland and Labrador Municipal Affairs and Environment, 2019; ministère des Communautés, des Terres et de l'Environnement de l'Île-du-Prince-Édouard, 2019; Yukon Environmental Health Services, 2019).
| Secteur de compétence (LDM µg/L) |
Période de surveillance | Type de système d'eau |
Type d'eau (Source municipale : eau souterraine/eau de surface - brute, traitée, distribuée) |
Nombre de détections/ échantillons |
|---|---|---|---|---|
| Colombie-Britannique (0,02-0,5) |
2013-2018 | Source municipale | Eau de surface - brute | 0/18 |
| DGSPNI région de l'Ontario (0,2-0,5) |
2014-2018 | Réseaux publics d'approvisionnement en eau | Eau souterraine - brute | 0/13 |
| Eau souterraine - traitée | 0/190 | |||
| Eau souterraine - distribution | 0/16 | |||
| Eau de surface - brute | 0/33 | |||
| Eau de surface - traitée | 0/308 | |||
| Eau de surface - distribuée | 0/23 | |||
| Réseaux semi-publics d'approvisionnement en eau | Eau souterraine - brute | 0/3 | ||
| Eau souterraine - traitée | 0/16 | |||
| Eau souterraine - distribuée | 0/68 | |||
| Eau de surface - brute | 0/1 | |||
| Eau de surface - traitée | 0/9 | |||
| Eau de surface - distribuée | 0/2 | |||
| Réseaux privés d'approvisionnement en eau | Eau souterraine - traitée | 0/3 | ||
| Eau souterraine - distribuée | 0/50 | |||
| Eau de surface - traitée | 0/5 | |||
| DGSPNI région de l'Atlantique (0,5) |
2014-2018 | Réseaux publics d'approvisionnement en eau | Eau souterraine - traitée | 0/4 |
| Eau souterraine - distribuée | 0/4 | |||
| Eau de surface - traitée | 0/1 | |||
| DGSPNI région du Québec (0,02) |
2014-2018 | Système d'approvisionnement en eau potable | 0/4 | |
| Nouvelle-Écosse (0,3-1) |
2007-2018 | Source municipal | Eau souterraine - brute | 0/72 |
| Eau souterraine - traitée | 0/35 | |||
| Eau de surface - brute | 0/35 | |||
| Eau de surface - traitée | 0/39 | |||
| Distribuée | 0/1 | |||
| Saskatchewan (0,05) |
2014-2019 | Source municipal | Eau souterraine et de surface - distribution | 0/35 |
| Eau souterraine et de surface - traitée | 0/4 | |||
| Eau souterraine - brute | 0/17 | |||
| Province (LDM µg/L) |
Type d'eau (Source municipale : eau souterraine/eau de surface - brute, traitée, distribuée; source non municipale : eau souterraine) | Nombre de détections/ échantillons | Valeur max. (µg/L) |
|---|---|---|---|
| Manitoba [2012-2018] (0,02-0,17) |
Eau de surface - ambiante | 17/393 | 0,188 |
| Ontario [2011-2020] (0,02-3) |
Eau souterraine - traitée | 4/3889 | 2 |
| Eau de surface - traitée | 3/3750 | 0,5 | |
| Inconnu - distribuée | 0/60 | - | |
| Québec [2012-2018] (0,02-3) |
Source municipale [2013-2018] : | ||
| Eau souterraine - distribution | 0/389 | - | |
| Eau de surface - distribution | 6/1312 | 6,69 | |
| Source municipale (projets spéciaux) : | |||
| Projet sur la pomme de terre [2017-2018]Tableau 3 Note de bas de page a: | |||
| Eau souterraine - brute | 0/46 | - | |
| Eau souterraine - traitée | 0/17 | - | |
| Eau souterraine - distribuée | 0/5 | - | |
| Petits systèmes [2012-2018]Tableau 3 Note de bas de page b: | |||
| Eau souterraine - brute | 0/83 | - | |
| Source non municipale : | |||
| Eau souterraine - brute | 0/19 | - | |
Dans son évaluation, l'ARLA (Santé Canada, 2019a) a indiqué qu'aucune trace quantifiable de bromoxynil n'avait été détectée dans les eaux souterraines canadiennes. Du bromoxynil a été détecté dans des eaux de surface en Alberta, au Manitoba, en Saskatchewan, en Ontario et au Québec. Les données canadiennes montrent que la fréquence globale de détection était inférieure à 50 % dans la plupart des études, et que les concentrations ponctuelles les plus élevées dans les eaux de surface pouvant constituer des sources potentielles d'eau potable étaient égales ou inférieures à 0,96 μg/L.
Lors d'une étude portant sur 15 réservoirs d'eau potable (alimentés principalement par la fonte des neiges sur des terres cultivées et des ruissellements pluviaux occasionnels) en Alberta, au Manitoba et en Saskatchewan, du bromoxynil a été détecté dans 54 % des 206 échantillons prélevés dans les réservoirs en 2003 et 2004; les concentrations moyenne et maximale étaient de 2,4 ng/L et de 384 ng/L, respectivement (limite de détection = 0,99 ng/L) (Donald et coll., 2007). Les auteurs ont affirmé que des concentrations moyennes nettement supérieures avaient été observées en juillet après l'application de l'herbicide (entre mai et le début juin, 29,6 ± 12,5 ng/L), comparativement à avril/mai (1,5 ± 0,3 ng/L) après la fonte des neiges.
Au Québec, on a échantillonné des rivières situées dans des zones de culture intensive du maïs et du soya entre 2015 et 2017 pour mesurer la concentration de bromoxynil. Pour ces années, la fréquence de détection moyenne a été de 6,4 % et une concentration maximale de 0,51 μg/L a été observée dans les rivières Chibouet, des Hurons, Saint-Régis et Saint-Zéphirin. En 2015, la fréquence de détection du bromoxynil a été de 18,2 %, 18,2 % et 27,3 % dans les rivières Chaudière, Beaurivage et Le Bras, respectivement, les concentrations détectées de bromoxynil étant de l'ordre de < 5 μg/L. En 2016, la fréquence de détection du bromoxynil a été de 10 % dans la rivière Yamaska, les concentrations détectées de bromoxynil étant de l'ordre de < 5 μg/L (Giroux, 2019).
En 2001 et 2002, du bromoxynil a été détecté dans une station municipale de traitement des eaux usées sur les sept stations étudiées au Québec; la fréquence de détection était de 3 % et la concentration maximale, de 0,26 μg/L (LDM = 0,02 μg/L) (Giroux et Therrien, 2005).
Santé Canada (2020b) a fixé un seuil maximal de résidus de bromoxynil dans divers produits alimentaires (notamment les fruits, les légumes et les tissus et organes animaux) de 0,02 à 0,9 ppm. Des échantillons de produits alimentaires canadiens et importés (fruits et légumes frais, graines, noix, arachides et produits transformés à base de fruits et de légumes) ont été prélevés et des essais ont été effectués par l'Agence canadienne d'inspection des aliments entre le 1er avril 2015 et le 31 mars 2016. Aucun échantillon (n = 798) ne s'est avéré renfermer du bromoxynil (ACIA, 2019).
L'exposition potentielle occasionnelle par inhalation de la dérive de pulvérisation découlant des applications agricoles du bromoxynil devrait être négligeable et on considère qu'elle ne contribue pas de manière significative à l'exposition totale au bromoxynil (Santé Canada, 2019a). Les résultats d'un programme national de surveillance aérienne de 3 ans (2003-2006) mené par le Canadian Atmospheric Network for Currently Used Pesticides ont montré que les concentrations atmosphériques de bromoxynil variaient selon les années et les périodes de temps, les moyennes se situant entre 4,7 et 1 840 pg/m3 (n = 8 emplacements, LDM = 1,2 pg/m3) (Yao et coll., 2008).
Du bromoxynil a été détecté dans le sol à un des sites d'échantillonnage lors de l'étude de surveillance menée en 2005 par le Canadian Atmospheric Network for Currently Used Pesticides; la concentration moyenne y était de 6,23 ng/g (LDM = 0,2 ng/g) (Yao et coll., 2008).
2.0 Considérations relatives à la santé
Tous les pesticides, y compris le bromoxynil, sont réglementés par l'ARLA. L'Agence effectue des évaluations approfondies et des examens cycliques des pesticides, ce qui comprend l'étude des informations non publiées et de nature exclusive, de même que celle d'examens réalisés à l'étranger par d'autres organismes de réglementation comme l'US EPA. Ainsi, la présente évaluation des risques pour la santé repose principalement sur les évaluations menées par l'ARLA (Santé Canada, 2008, 2019a) et sur des documents d'appui. De plus, toutes les évaluations et documents pertinents disponibles depuis l'évaluation de l'ARLA ont également été considérés
2.1 Cinétique
La pharmacocinétique du bromoxynil, de l'octanoate de bromoxynil et de l'heptanoate de bromoxynil sont considérées comme identiques chez les animaux (US EPA, 1998; EFSA, 2017). Par conséquent, les études portant sur la pharmacocinétique des esters octanoate et heptanoate donnent une indication du comportement pharmacocinétique du bromoxynil (US EPA, 1998).
Absorption : Le bromoxynil est facilement absorbé (> 80 %) par les animaux qui y sont exposés par voie orale (Salama et coll., 2016; EFSA, 2017). Chez les rats, l'absorption cutanée du bromoxynil augmente avec la durée d'exposition. Des quantités de 0,10, 1,0 et 10,0 mg/rat ont abouti à un pourcentage d'absorption cutanée après 10 heures de 1,92 %, 1,74 % et 1,24 %, respectivement, et après 24 heures de 3,12 %, 3,24 % et 3,02 %, respectivement (US EPA, 1998).
Distribution : Du bromoxynil a été observé dans le foie, les reins et le cerveau (les seuls tissus analysés) de rats mâles dans les 30 minutes suivant l'administration orale (12,9 mg/kg de poids corporel [p.c.]). Les pics de concentration ont été atteints après 48 heures dans le sérum, le foie et le cerveau, et après 24 heures dans les reins à la suite de l'administration (Salama et coll., 2016). De même, chez des rats à qui on avait administré de l'octanoate de bromoxynil radiomarqué (14C) par gavage, la radioactivité s'est distribuée dans la plupart des tissus, les concentrations les plus élevées ayant été observées dans le sang, le plasma (pics de concentration atteints après 7 à 10 heures), le foie, les reins et la thyroïde (surtout chez les femelles). En général, les femelles présentaient des taux plus élevés de radioactivité dans les tissus que les mâles (US EPA, 1998). Le bromoxynil ne devrait pas s'accumuler dans les tissus animaux (Salama et coll., 2016; EFSA, 2017).
Métabolisme : Le bromoxynil est métabolisé par hydrolyse et conjugaison. Bien que des métabolites de bromoxynil n'aient pas été identifiés dans la littérature scientifique, aucun métabolite humain unique n'est prévu (EFSA, 2017). Chez les rats, l'octanoate de bromoxynil a été rapidement et presque complètement converti en composé d'origine (bromoxynil) par hydrolyse d'ester, et le bromoxynil a été la seule espèce chimique repérée dans les tissus de rats (US EPA, 1998).
Élimination : Chez des rats mâles, le bromoxynil a été principalement excrété dans l'urine à la suite d'une administration orale. En l'espace de 24 heures, 2,80 % et 0,01 % du bromoxynil avaient été éliminés dans l'urine et les matières fécales, respectivement. En l'espace de 168 heures, l'excrétion urinaire et celle fécale cumulées du bromoxynil avaient atteint 21,90 % et 14,11 %, respectivement. Les demi-vies d'élimination (mesurées dans le sérum, le foie, le cerveau et les reins) variaient de 34,8 (reins) à 62,0 heures (foie) (Salama, et coll., 2016). Sept jours après l'administration d'octanoate de bromoxynil radiomarqué (14C) à des rats, de 84 % à 89 % et de 76 % à 80 % de la radioactivité avait été excrétée dans l'urine des mâles et des femelles, respectivement, et de 6 % à 10 % dans les matières fécales des mâles et des femelles. Les seules espèces chimiques présentes dans l'urine étaient le bromoxynil libre et conjugué. L'octanoate de bromoxynil a été détecté seulement dans les matières fécales (US EPA, 1998).
2.2 Effets sur la santé
La base de données sur la toxicité du bromoxynil est adéquate, car elle couvre plusieurs effets et divers types d'exposition (voir US EPA, 1998 pour un examen plus poussé). Comme il a été déterminé que le bromoxynil et l'octanoate de bromoxynil étaient équivalents sur le plan toxicologique, des études portant sur les deux formes chimiques ont été prises en compte dans la présente section (Santé Canada, 2019a). En général, le bromoxynil et son ester octanoate présentent une toxicité orale aiguë faible à élevée chez les animaux de laboratoire selon l'espèce étudiée (les cochons d'Inde étant l'espèce la plus sensible). En outre, le bromoxynil et son ester octanoate présentent une toxicité aiguë par voie cutanée faible et ils ont été bien tolérés lors d'études de toxicité cutanée à doses répétées menées chez des lapins. Des études de toxicité orale à doses répétées menées sur des animaux montrent que les effets sur le foie sont les plus sensibles.
2.3 Effets sur les humains
En matière d'expositions aiguës au bromoxynil ou à l'octanoate de bromoxynil, aucune donnée pertinente sur les humains n'était disponible.
Agricultural Health Study (étude sur la santé des agriculteurs) : En ce qui a trait aux expositions à long terme, des études épidémiologiques ont examiné diverses conséquences découlant de l'exposition au bromoxynil. L'Agricultural Health Study (AHS) est une vaste étude de cohorte prospective (plus de 89 000 participants) toujours en cours et reposant sur un questionnaire qui porte sur les effets cancérogènes et non cancérogènes observés auprès d'une cohorte de préposés à l'application de pesticides homologués et leurs conjoints en Iowa et en Caroline du Nord. L'étude a commencé en 1993 par la collecte de renseignements de base sur les pratiques agricoles (dont l'emploi de pesticides), le mode de vie et la santé. Des entrevues ou des questionnaires de suivi (y compris des renseignements sur le régime alimentaire) et des prélèvements d'ADN ont été effectués périodiquement. Des registres du cancer ont servi à évaluer l'incidence de cette maladie. Dans l'ensemble, les points forts de l'AHS sont l'envergure de l'étude, l'inclusion d'un grand nombre de femmes, la collecte de renseignements de base et de renseignements sur la santé, le mode de vie et les facteurs génétiques, l'utilisation de registres du cancer et les nombreux pesticides et maladies évalués. Ses limites sont notamment l'évaluation indirecte de l'exposition (au moyen d'un questionnaire), l'absence de mesures d'affinement de l'exposition (aucune analyse du temps d'induction ou du temps d'arrêt) et un biais de sélection lors de la prise en compte de facteurs de confusion multiples en raison de l'exclusion de nombreux sujets pour lesquels il manque des données (Sathiakumar et coll., 2011).
Effets cancérogènes : Koutros et coll. (2016), lors de leur examen des données de l'AHS recueillies entre 1993 et 1997, ont découvert une association entre l'exposition au bromoxynil et l'incidence du cancer de la vessie. Cependant, les données portant sur l'utilisation de bentazone et celle de bromoxynil étaient modérément en corrélation, et les auteurs suggèrent que le bentazone a un impact plus important que le bromoxynil sur le risque observé de cancer de la vessie.
Effets non cancérogènes : Lors de leur examen des effets non cancérogènes en utilisant les données de l'AHS recueillies entre 2005 et 2010, Hoppin et coll. (2017) n'ont trouvé aucune association entre l'utilisation du bromoxynil et une respiration sifflante chez les préposés à l'application de pesticides. Baumert et coll. (2018) n'ont trouvé aucune association entre l'utilisation du bromoxynil et l'apnée du sommeil selon les données d'une étude de cas-témoins sur l'asthme faisant partie de l'étude prospective AHS (2005-2010).
Semchuk et coll. (2007) ont examiné l'association entre la détection d'anticorps antinucléaires (un indicateur d'auto-immunité) et l'exposition au bromoxynil dans le cadre d'une étude transversale portant sur 208 résidents (94 femmes, 114 hommes) d'une région de production céréalière en Saskatchewan. Chez les participants masculins, la présence d'anticorps antinucléaires était inversement associée à des concentrations détectables de bromoxynil dans des échantillons de sang. Cette étude présentait certaines faiblesses, notamment la faible taille de l'échantillon et l'absence d'analyse d'autres facteurs comme les maladies chroniques. En outre, les auteurs ont suggéré que les résultats ne pouvaient pas être généralisés au-delà de la population visée par l'étude ou de la zone étudiée, car l'étude a été réalisée lors de la saison printanière d'application des pesticides dans une région agricole de la Saskatchewan présentant des caractéristiques particulières (utilisation d'herbicides, climat, taille des exploitations agricoles, etc.).
Yang et coll. (2014) ont examiné les associations possibles entre l'exposition précoce pendant la grossesse (en fonction de la proximité du lieu de résidence) aux pesticides agricoles utilisés dans la vallée de San Joaquin, en Californie, entre 1997 et 2006, et certaines anomalies congénitales. L'exposition à l'octanoate de bromoxynil a été associée au spina bifida (malformation du tube neural), mais les auteurs ont conclu que les associations observées pourraient être le fruit du hasard, compte tenu des limites de l'étude (p. ex. échantillons de petite taille, comparaisons multiples, exclusion d'autres sources d'exposition aux pesticides, comme le travail ou l'utilisation à domicile).
Globalement, la base de données épidémiologiques donne seulement des indications incertaines d'associations entre l'exposition au bromoxynil ou à l'octanoate de bromoxynil et divers effets sur la santé. Ces limites empêchent d'utiliser les résultats de ces études dans une évaluation quantitative des risques.
2.4 Effets chez les animaux
Des études toxicologiques portant sur le bromoxynil et l'octanoate de bromoxynil ont été identifiées. Il a été démontré que le bromoxynil est toxique pour des animaux de laboratoire. Les doses létales médianes (DL50) orales rapportées pour certaines espèces sont les suivantes : 63 mg/kg p.c. chez le cochon d'Inde, de 81 à 440 mg/kg p.c. chez le rat, de 100 à 245 mg/kg p.c. chez la souris et de 260 à 2 000 mg/kg p.c. chez le lapin (US EPA, 1998; CCME, 1999b). Des DL50 cutanées de > 2 000 mg/kg (peau abrasée, mâles et femelles) chez les lapins et des concentrations létales médianes (CL50) par inhalation de 0,150 mg/L (femelles) et 0,269 mg/L (mâles) chez les rats ont été rapportées. En ce qui concerne l'octanoate de bromoxynil, les DL50 orales rapportées étaient de 238 mg/kg p.c. (femelles) et de 400 mg/kg p.c. (mâles) chez le rat; les DL50 cutanées étaient de 1 310 mg/kg (peau intacte, femelles) et de > 2 000 mg/kg (peau abrasée, mâles) chez le lapin, et les CL50 par inhalation étaient de 0,72 mg/L (femelles) et de 0,81 mg/L (mâles) chez le rat (US EPA, 1998).
Effets sur le foie : Des études de toxicité à doses répétées menées sur des rats, des souris et des chiens montrent que le bromoxynil affecte le foie (Johnson et coll., 1980; Hamada, 1988; Harling et coll., 1988; Higgins, 1989; Williams, 1994). Le chien est l'espèce la plus sensible. Les effets rapportés comportaient des changements dans les enzymes hépatiques, des changements histopathologiques et une augmentation du poids relatif et absolu du foie (US EPA, 1998; Santé Canada, 2019b).
Dans une étude d'un an, des beagles (6/sexe/dose) ont reçu 0, 0,1, 0,3, 1,5 ou 7,5 mg/kg p.c. par jour de bromoxynil de qualité technique sous forme de capsules de gélatine. Une augmentation du poids absolu du foie et des rapports poids du foie/poids corporel, des modifications des paramètres biochimiques, tels un accroissement de l'alanine-aminotransférase (ALT) et de l'urée, et une diminution de la phosphatase alcaline (PAL) et des protéines ont été observées chez des chiens femelles et mâles à la dose la plus élevée. Une augmentation du poids du foie a été observée chez des chiens femelles et mâles ayant reçu 1,5 mg/kg p.c. par jour (Harling et coll., 1988; Santé Canada, 2019b).
Des effets similaires ont été observés chez les rats et les souris. Dans une étude combinée de deux ans portant sur la toxicité chronique par voie orale et la cancérogénicité, réalisée par Hamada (1988), des rats Sprague-Dawley (70/sexe/dose) ont reçu une diète contenant de 60 à 600 ppm (ce qui équivaut à 2,6-28 mg/kg p.c. par jour pour les mâles et à 3,3-41 mg/kg p.c. par jour chez les femelles) de bromoxynil de qualité technique. Chez les rats mâles, une incidence accrue de changements histopathologiques a été observée dans le foie à 190 ppm (spongiose hépatique) et à 600 ppm (spongiose hépatique et foyers d'altérations cellulaires éosinophiliques). Lors d'une étude menée par Johnson et coll. (1980), des souris albinos suisses ont reçu de 10 à 100 ppm (ce qui équivaut à 1,3-13 mg/kg p.c. par jour) de bromoxynil de qualité technique pendant 18 mois. Une incidence accrue de nodules hyperplasiques dans le foie (lésions non néoplasiques) a été observée chez les souris mâles à la dose moyenne (30 ppm) et à la dose la plus élevée (100 ppm). Des souris CD-1 (60/sexe/dose) ont reçu de 20 à 300 ppm (ce qui équivaut à 3,1-46 mg/kg p.c. par jour chez les mâles et à 3,7-53 mg/kg p.c. par jour chez les femelles) de bromoxynil de qualité technique pendant 18 mois. Une augmentation du poids du foie, une hausse de l'incidence d'une coloration foncée du foie répartie de façon clairsemée et une augmentation de l'incidence de lésions microscopiques non néoplasiques du foie ont été observées dans le groupe ayant reçu la dose la plus élevée, tant chez les souris mâles que femelles. Les lésions histopathologiques observées dans le foie comprenaient l'hypertrophie hépatocellulaire centrolobulaire, la dégénérescence/nécrose hépatocellulaire, ainsi que des pigments dans les hépatocytes et les cellules de Kupffer. Des lésions non néoplasiques similaires ont également été observées dans le foie de certaines souris mâles et femelles du groupe ayant reçu 75 ppm (Williams, 1994).
Deux études de toxicité subchronique par voie orale ont montré des effets hépatiques similaires chez des rats Sprague-Dawley (15/sexe/dose) et des souris CD-1 (10/sexe/dose) à qui on avait administré, dans la diète, de 400 à 1 456 ppm (ce qui équivaut à 28-168 mg/kg par jour chez les mâles et à 35-250 mg/kg par jour chez les femelles) de bromoxynil de qualité technique pendant 13 semaines et de 10 à 3 000 ppm (équivalentes à 1,3-390 mg/kg par jour) de bromoxynil de qualité technique pendant 12 semaines, respectivement; la dose la plus élevée utilisée dans chaque étude a été très toxique (Wolfe, 1990; Williams, 1992). Une augmentation de l'aspartate-aminotransférase, de l'ALT et de la PAL a été observée chez les rats mâles à 755 ppm. Chez les rats femelles, une augmentation de la PAL a été notée à 755 et 1 456 ppm (Wolfe, 1990). Une augmentation du poids du foie et une hypertrophie hépatocellulaire ont été observées chez les souris mâles à 100 ppm et plus; une dégénérescence et une vacuolisation des hépatocytes ont aussi été observées chez les souris mâles à 300 ppm et plus. Chez les souris femelles, une augmentation du poids du foie, une hypertrophie hépatocellulaire, une dégénérescence et une vacuolisation ont été observées à 300 ppm et plus. À 1 000 ppm et plus, d'autres effets pathologiques sur le foie (non spécifiés) ont été remarqués chez les souris femelles et mâles (Williams, 1992).
Lors d'une étude de 13 semaines, des rats Sprague-Dawley (20-30/sexe/dose) ont reçu dans leur diète des doses de 150 à 1 100 ppm (équivalentes à 11-91 mg/kg par jour chez les mâles et à 13-111 mg/kg par jour chez les femelles) d'octanoate de bromoxynil de qualité technique. Une augmentation du poids du foie a été observée chez les rats femelles à 600 ppm (Henwood, 1992).
Toxicité pour la reproduction et le développement : Lors d'une étude de toxicité pour la reproduction sur deux générations, des rats Sprague-Dawley (24/sexe/dose) ont reçu dans leur diète de 10 à 250 ppm (ce qui équivaut à 0,8-21 mg/kg par jour) de bromoxynil de qualité technique durant 14 semaines avant l'accouplement; aucun effet n'a été observé sur la fonction reproductrice quelle qu'ait été la dose administrée (Higgins, 1989).
Des études sur la toxicité pour le développement ont été réalisées avec du bromoxynil (chez le rat, le lapin et la souris) et de l'octanoate de bromoxynil (chez le rat et le lapin). L'effet sur le développement le plus couramment observé dans les études de toxicité par voie orale et cutanée a été l'incidence accrue de côtes surnuméraires (le plus souvent touchant la 14e côte). Cet effet a aussi été considéré par l'ARLA comme étant l'effet développemental le plus sensible à la toxicité du bromoxynil (Santé Canada, 2019a).
Dans l'étude réalisée par Higgins (1989), la toxicité développementale chez les petits s'est manifestée par une diminution du poids corporel durant la lactation et un retard de l'ouverture des yeux à 250 ppm. Dans trois études sur la toxicité développementale par voie orale lors desquelles du bromoxynil de qualité technique (de 1,7 à 40 mg/kg par jour) a été administré par gavage à des groupes de rates Sprague-Dawley gravides aux jours de gestation (JG) 6 à 15 ou 5 à 17 inclusivement, une incidence accrue de côtes surnuméraires a été observée à des doses aussi faibles que 5 mg/kg par jour. D'autres effets ont été observés telles une augmentation des pertes post-implantation (à 12,5 mg/kg par jour) et une diminution du poids corporel des fœtus (à 35 et 40 mg/kg par jour). Une hausse de l'incidence de décès intra-utérins tardifs et de l'incidence totale d'anomalies mineures a également été observée à une dose de 35 mg/kg par jour. Enfin, un nombre accru de petits fœtus ainsi qu'une augmentation de l'incidence d'anomalies des tissus mous et du squelette (notamment l'anophtalmie [absence d'un ou des deux yeux], la microphtalmie [yeux plus petits que la normale ou minuscules], des papilles rénales courtes et des anomalies osseuses de la colonne vertébrale et de la cage thoracique) ont été observés à une dose de 40 mg/kg par jour (Copping, 1981; Rubin et Nyska, 1987; US EPA, 1998). Des effets similaires ont été rapportés dans deux études sur la toxicité développementale par voie orale durant lesquelles du bromoxynil de qualité technique a été administré par gavage à des groupes de lapines néo-zélandaises blanches gravides (de 15 à 60 mg/kg par jour, JG : 5 à 20 et 6 à 18); une augmentation de l'incidence de toutes les formes de côtes surnuméraires a été observée à la dose la plus faible (Copping et Brown, 1983; Holson, 1984). Chez des souris CD-1 gravides à qui du bromoxynil de qualité technique a été administré par gavage oral (de 11 à 96 mg/kg par jour, JG : 6 à 15 inclusivement), une augmentation statistiquement significative de l'incidence d'une 14e côte chez les portées, une diminution du poids des fœtus et une baisse du nombre de fœtus présentant des vertèbres caudales ossifiées ont été observées à la dose la plus élevée.
Lorsque de l'octanoate de bromoxynil a été administré par gavage à des rates Sprague-Dawley gravides (de 2,4 à 21,8 mg/kg, JG : 6 à 15 inclusivement), une augmentation statistiquement significative de l'incidence d'une 14e côte chez les portées et une diminution du poids des fœtus ont été rapportées à la dose la plus élevée (US EPA, 1998).
Dans des études sur la toxicité développementale par voie cutanée, des côtes surnuméraires ont été rapportées chez le rat et associées à des doses de 50 mg/kg p.c. par jour (bromoxynil) et de 15 mg/kg p.c. par jour (octanoate de bromoxynil). Aucune toxicité développementale n'a été entraînée par l'administration de doses allant jusqu'à 80 mg/kg p.c. par jour lors d'une étude de la toxicité par voie cutanée réalisée au moyen d'une préparation contenant de l'octanoate de bromoxynil qui a été administrée à des groupes de lapines néo-zélandaises blanches gravides (US EPA, 1998; Santé Canada, 2019a).
Les effets observés chez les fœtus de rongeurs sont survenus seulement en présence de toxicité maternelle se traduisant par des diminutions du poids corporel, de la consommation d'aliments et du gain de poids corporel ainsi que des augmentations de la mortalité et du poids du foie. Chez le lapin, des effets ont été observés chez les fœtus à des doses inférieures à celles ayant causé une toxicité maternelle, mais supérieures à celles ayant causé une hépatotoxicité chez le chien (Santé Canada, 2019a).
Autres effets : Des effets sur le système cardiovasculaire ont été observés chez le rat et le chien beagle, mais sont survenus uniquement aux doses les plus élevées utilisées (rats : 1 100 ppm d'octanoate de bromoxynil de qualité technique [ce qui équivaut à 91 mg/kg par jour chez le mâle et à 111 mg/kg par jour chez la femelle], chiens beagle : 7,5 mg/kg p.c. par jour de bromoxynil de qualité technique). De plus, des signes cliniques (halètement, salivation, matières fécales liquides, gencives pâles) et une augmentation du poids de la prostate ont été rapportés chez le chien beagle à 7,5 mg/kg p.c. par jour de bromoxynil de qualité technique (voir la section 2.7) (Henwood, 1992; Harling et coll., 1988).
Une diminution du gain de poids corporel a aussi été observée dans des études de toxicité subchronique et chronique par voie orale chez des rats et des chiens à qui on avait administré du bromoxynil ou de l'octanoate de bromoxynil (Noel et coll., 1965; Hamada, 1988; Harling et coll., 1988; Higgins, 1989; Wolfe, 1990; Henwood, 1992; Makin, 1993).
2.5 Génotoxicité et cancérogénicité
À la lumière des données collectives tirées de plusieurs essais in vitro et in vivo, le bromoxynil n'est ni mutagène, ni génotoxique (EFSA, 2017; Santé Canada, 2019a).
Le bromoxynil a entraîné des résultats négatifs dans deux études in vivo (test du micronoyau de la souris) (Holmstrom et McGregor, 1982; Holmstrom et coll., 1991). Parmi les études in vitro négatives, mentionnons : la synthèse non programmée de l'ADN; l'essai de transformation cellulaire réalisé sur des cultures de cellules de souris C3H/10T1/2C18; l'essai d'échange de chromatides sœurs dans des cellules ovariennes de hamsters chinois (CHO) (avec et sans activation); l'essai de mutation directe sur des lymphomes de souris (sans activation); l'analyse d'aberrations chromosomiques (CHO, sans activation); l'essai de mutation CHO/hypoxanthine-guanine phosphoribosyltransférase (HGPRT) (avec et sans activation); et le test d'Ames utilisant Salmonella typhimurium (avec et sans activation) (Cifone et Balinas, 1982; Galloway et Lebowitz, 1982; Myhr et McKeon, 1982; Rundell et Matthews, 1982; Cifone, 1991; Lawlor, 1991). Cependant, des résultats positifs ont été obtenus dans trois études in vitro : l'essai de mutation directe sur des lymphomes de souris (avec activation); l'essai de réparation de l'ADN bactérien utilisant la souche d'Escherichia coli (avec et sans activation) comme indicateur; et l'analyse d'aberrations chromosomiques (CHO, avec activation) (Cifone et Balinas, 1982; Galloway et Lebowitz, 1982; Jagannath et coll., 1982). Bien que le bromoxynil a entraîné des résultats positifs dans trois études in vitro, des résultats négatifs ont été obtenus dans la majorité des études in vitro et des essais in vivo.
L'octanoate de bromoxynil s'est révélé négatif lors d'essais in vitro (test d'Ames utilisant Salmonella typhimurium [avec et sans activation] et essai de synthèse non programmée de l'ADN) et in vivo (test du micronoyau chez la souris) (Dillon, 1993; US EPA, 1998).
Des études de cancérogénicité utilisant le bromoxynil ont été réalisées sur des rats et des souris. Des souris albinos suisses (60/sexe/dose) ont reçu dans leur diète de 10 à 100 ppm (ce qui équivaut à 1,3-13 mg/kg p.c. par jour) de bromoxynil de qualité technique. L'incidence combinée des adénomes et carcinomes hépatiques chez les mâles a augmenté avec la dose administrée, l'augmentation étant statistiquement significative qu'à la dose la plus élevée. Aucune incidence accrue des tumeurs liée au traitement n'a été constatée chez les souris suisses femelles (Williams, 1994). Des souris CD-1 (60/sexe/dose) ont reçu dans leur diète de 20 à 300 ppm (ce qui équivaut à 3,1-46 mg/kg p.c. par jour chez les mâles et à 3,7-53 mg/kg p.c. par jour chez les femelles) de bromoxynil de qualité technique. L'incidence combinée des adénomes et carcinomes hépatiques était plus élevée chez les mâles traités que chez les mâles témoins, et ce, pour chaque dose administrée; cependant, la relation dose-effet n'était pas linéaire. Une hausse de l'incidence combinée des adénomes et carcinomes hépatiques a aussi été constatée chez les souris CD-1 femelles ayant reçu la dose la plus élevée (US EPA, 1998; Santé Canada, 2019a).
Aucune lésion néoplasique n'a été associée au traitement dans une étude combinée de deux ans portant sur la cancérogénicité et la toxicité chronique par voie orale dans laquelle des rats Sprague-Dawley (70/sexe/dose) ont reçu dans leur diète de 60 à 600 ppm (ce qui équivaut à 2,6-28 mg/kg p.c. par jour chez les mâles et à 3,3-41 mg/kg p.c. par jour chez les femelles) de bromoxynil de qualité technique (Hamada, 1988).
Le bromoxynil s'est révélé cancérogène chez la souris, mais non chez le rat. L'US EPA (1998) a classé le bromoxynil dans le groupe C, soit possiblement cancérogène pour les humains, en se basant principalement sur les tumeurs hépatiques observées chez les souris, et a utilisé un modèle linéaire sans seuil pour évaluer le risque de cancer lié au bromoxynil auquel est exposée la population générale. Le Centre international de recherche sur le cancer n'a pas évalué la cancérogénicité du bromoxynil. Dans son examen spécial du bromoxynil et des préparations commerciales connexes, l'ARLA (Santé Canada, 2019a) a conclu que les valeurs de référence retenues pour la caractérisation des risques autres que de cancer liés aux expositions répétées au bromoxynil assurent une protection suffisante contre toute autre préoccupation concernant le potentiel oncogène du bromoxynil (voir section 2.7).
2.6 Mode d'action
Le bromoxynil est un agent découplant qui perturbe la phosphorylation oxydative, un mécanisme qui pourrait être responsable de l'hépatotoxicité observée dans les études toxicologiques (EFSA, 2017).
Il a été démontré que le bromoxynil entraînait aussi une augmentation de l'incidence des adénomes et carcinomes hépatiques chez la souris. On a suggéré que la formation de tumeurs hépatocellulaires pourrait résulter d'un mode d'action impliquant l'activation du récepteur-alpha activé par les proliférateurs des peroxysomes (PPARα) ou du récepteur constitutif des androstanes (CAR). En tant que telle, l'activation du PPARα entraîne l'altération des voies de croissance cellulaire suivie d'une perturbation de la croissance et de la survie des cellules, l'expansion clonale sélective des cellules prénéoplasiques et, enfin, la formation de tumeurs hépatiques (Santé Canada, 2019a). L'activation du CAR peut entraîner une augmentation de la synthèse de l'ADN par réplication des hépatocytes, une induction des enzymes de détoxification et des transporteurs, ainsi qu'une hausse des foyers hépatiques altérés et des adénomes/carcinomes hépatocellulaires (Lake, 2018). Le rôle de l'activité du PPARα n'a pu être clairement distingué de celui du CAR (Santé Canada, 2019a).
2.7 Étude clé sélectionnée
Dans son examen spécial du bromoxynil et des préparations commerciales connexes (PSRD2019-01), l'ARLA (Santé Canada (2019a) a désigné le foie comme l'organe cible le plus sensible selon les données de la littérature scientifique. C'est pourquoi une étude d'un an non publiée sur la toxicité par voie orale chez le chien dont les effets observés incluent des effets sur le foie a été considérée comme l'étude clé pour l'évaluation des risques pour la santé humaine du bromoxynil dans l'eau potable (Santé Canada, 2019a, 2019b). Aux fins du calcul de l'apport quotidien acceptable (AQA), l'ARLA choisit souvent des études critiques de toxicité axées sur des périodes moins longues que l'exposition chronique, notamment des études de neurotoxicité pour le développement, des études sur la toxicité pour la reproduction, des études sur la toxicité pour le développement et des études sur la toxicité chez le chien pendant un an. Si une étude de toxicité d'une durée moins longue que l'exposition chronique est choisie pour le calcul de l'AQA, c'est parce que l'effet critique assure une protection contre les effets chroniques et tient compte de tous les effets préoccupants relevés dans la base de données toxicologiques (Santé Canada, 2021a).
Dans cette étude, du bromoxynil de qualité technique a été administré sous forme de capsules de gélatine à des groupes de chiens beagle (6/sexe/dose) à des doses de 0 (groupe témoin), 0,1, 0,3, 1,5 ou 7,5 mg/kg p.c. par jour. L'administration du bromoxynil a entraîné des signes cliniques tels que le halètement chez les animaux ayant reçu 1,5 ou 7,5 mg/kg p.c. par jour, ainsi que la salivation, des matières fécales liquides et des gencives pâles surtout chez les animaux ayant reçu 7,5 mg/kg p.c. par jour. Des diminutions du poids corporel et du gain de poids corporel ont été notées chez les mâles ayant reçu au moins 1,5 mg/kg p.c. par jour et chez les femelles ayant reçu 7,5 mg/kg p.c. par jour. Une diminution statistiquement significative des paramètres des globules rouges (taux d'hématocrite, hémoglobine et globules rouges) a été notée chez les animaux des deux sexes ayant reçu la dose la plus élevée. Une diminution de ces paramètres a aussi été notée chez les mâles ayant reçu 1,5 mg/kg p.c. par jour; cependant, cette diminution n'était pas statistiquement significative. Parmi les changements survenus aux paramètres biochimiques, mentionnons une augmentation des valeurs d'urée et d'ALT ainsi qu'une baisse des valeurs de PAL et de protéines chez les mâles et les femelles ayant reçu 7,5 mg/kg p.c. par jour. Une analyse du poids des organes a révélé une augmentation du poids du foie chez les animaux ayant reçu 1,5 ou 7,5 mg/kg p.c. par jour, une diminution du poids de la rate chez les mâles ayant reçu 7,5 mg/kg p.c. par jour, et une augmentation du poids de la prostate chez les mâles ayant reçu 7,5 mg/kg p.c. par jour (Santé Canada, 2019b). Une dose orale sans effet nocif observé (NOAEL) de 0,3 mg/kg p.c. par jour a été déterminée dans le cadre de cette étude sur la base d'une augmentation des signes cliniques et du poids du foie ainsi que d'une diminution du poids corporel et du gain de poids corporel observées à la dose minimale avec effet nocif observé de 1,5 mg/kg p.c. par jour (Santé Canada, 2019a, 2019b).
Bien qu'il ait été conclu que le bromoxynil est cancérogène chez la souris, l'examen qu'a fait l'ARLA des données disponibles dans la base de données toxicologiques a permis d'établir que le bromoxynil n'est pas génotoxique à la lumière des résultats collectifs tirés de plusieurs essais in vitro et in vivo. Dans le cadre des études de longue durée sur l'exposition par le régime alimentaire, le bromoxynil phénol s'est révélé cancérogène chez la souris, mais non chez le rat. L'incidence combinée des adénomes et des carcinomes hépatocellulaires augmentait en fonction de la dose chez les souris ayant reçu du bromoxynil comparativement au groupe témoin. Le mode d'action relatif aux adénomes et aux carcinomes hépatocellulaires consistait en la formation de tumeurs hépatocellulaires résultant de l'activation du PPARα, laquelle entraîne l'altération des voies de croissance cellulaire, la perturbation de la croissance et de la survie des cellules, l'expansion clonale sélective des cellules prénéoplasiques et, enfin, la formation de tumeurs hépatiques. Dans l'ensemble, les évènements clés concernant le mode d'action relatif aux tumeurs hépatiques étaient suffisamment clairs et démontrables pour appuyer l'existence d'un mode d'action de prolifération cellulaire médiée par un récepteur. Les données probantes les plus solides penchaient en faveur d'un processus médié par le PPARα, mais l'ARLA a conclu que l'influence de l'activité du CAR ne pouvait pas être exclue. La dose et la concordance temporelle étaient généralement acceptables en ce qui concerne les paramètres observés; cependant, les renseignements disponibles étaient insuffisants pour caractériser le début de l'activation du PPARα et l'altération subséquente des voies de croissance cellulaire aux doses non tumorigènes. Malgré cette lacune, les évènements clés ont été systématiquement observés dans la base de données, et ils correspondaient aux effets hépatiques attendus dans une voie de prolifération cellulaire médiée par un récepteur. L'ARLA a jugé que le mode d'action était biologiquement plausible et cohérent. Toutefois, comme le rôle de l'activité du PPARα n'a pu être clairement distingué de celui du CAR, il a été conclu que les données disponibles ne permettaient pas d'exclure un effet chez l'humain. Il a été déterminé que le risque de cancer hépatique chez l'humain (peu importe qu'il soit médié par le PPAR ou le CAR) pouvait être analysé à l'aide d'une approche avec seuil et que l'utilisation d'un excès de risque unitaire (ERU) pour l'évaluation du risque de cancer était exagérément prudente. L'AQA de 0,003 mg/kg p.c. par jour, fondé sur la NOAEL de 0,3 mg/kg p.c. par jour tirée de l'étude d'un an menée chez le chien et sur un facteur d'évaluation global de 100, a permis d'appliquer une marge de 1 000 à la plus faible dose tumorigène, qui était de 3 mg/kg p.c. par jour chez la souris. L'AQA est donc considéré comme assurant une protection suffisante contre la cancérogénicité potentielle chez l'humain, et il n'est pas nécessaire d'utiliser un autre facteur que l'AQA pour assurer cette protection.
L'AQA de 0,003 mg/kg p.c. par jour assure également une protection suffisante contre toute autre préoccupation liée à la toxicité potentielle du bromoxynil sur le plan du développement chez l'humain. L'ensemble complet d'études exigées pour évaluer la toxicité potentielle du bromoxynil chez les jeunes animaux était disponible. Aucune sensibilité n'a été observée chez les jeunes animaux dans l'étude sur la toxicité pour la reproduction chez le rat; les effets chez les petits ont été constatés à la dose qui avait entraîné des effets toxiques chez les adultes. En ce qui concerne la toxicité prénatale potentielle, des effets touchant le développement sont survenus en présence de toxicité maternelle chez le rat et la souris. Les effets sur le développement aux plus faibles doses se limitaient à des variations (incidence accrue des côtes surnuméraires) et à des diminutions du poids corporel des fœtus; aucun de ces effets n'a été considéré comme un effet grave. Des effets graves, comme des malformations, sont survenus aux doses plus élevées. Chez le lapin, des effets sur le développement sont survenus à des doses inférieures à celles ayant causé une toxicité maternelle; il s'agissait de variations, de malformations et de diminutions de la taille et du poids des fœtus. Dans l'ensemble, l'incidence accrue des côtes surnuméraires chez le rat (constatée à la dose minimale avec effet nocif observé [LOAEL] de 12 mg/kg p.c. par jour) n'a été considérée comme l'effet le plus sensible pour le développement dans la base de données toxicologiques. Puisque cet effet n'était pas considéré comme grave et qu'il est survenu en présence de toxicité maternelle, il a été jugé moins préoccupant. Compte tenu de ce qui précède, le facteur prévu par la Loi sur les produits antiparasitaires (LPA) (qui tient compte du degré de complétude des données d'exposition et de toxicité relatives aux nourrissons et aux enfants ainsi que de la toxicité prénatale et postnatale potentielle) a été ramené à 1 pour les évaluations des risques utilisant cet effet. Cet effet et le facteur de la LPA connexe offrent des marges adéquates pour les malformations observées; ils assurent aussi une protection adéquate pour la sensibilité observée chez les fœtus de lapin. L'AQA de 0,003 mg/kg p.c. par jour a été établi selon un point de départ plus faible tiré de l'étude d'un an sur la toxicité par le régime alimentaire chez le chien (0,3 mg/kg p.c. par jour) et a permis d'appliquer une marge adéquate de 4 000 à la plus faible dose (12 mg/kg p.c. par jour) où des effets ont été observés sur le développement (Santé Canada, 2021a). L'AQA assure donc une protection suffisante contre les effets potentiels sur le plan du développement, et il n'est pas nécessaire d'utiliser un autre facteur que l'AQA pour assurer cette protection.
La NOAEL de l'étude menée chez le chien est considérée comme celle qui convient le mieux aux fins du calcul de l'AQA et de l'évaluation de l'exposition répétée au bromoxynil par le régime alimentaire, et ce, en raison de la voie d'exposition pertinente et des effets sensibles à la LOAEL. Ceux-ci assurent une protection suffisante contre les autres effets non cancérogènes liés à une exposition répétée, y compris ceux observés dans les études de longue durée chez la souris et le rat, et contre toute autre préoccupation concernant le potentiel cancérogène du bromoxynil (Santé Canada, 2021a).
3.0 Calcul de la valeur basée sur la santé
Comme nous l'avons déjà mentionné, l'évaluation des risques actuelle repose sur la NOAEL de 0,3 mg/kg p.c. par jour associée à l'augmentation des signes cliniques et du poids du foie ainsi que la diminution du poids corporel et du gain de poids corporel chez le chien. À l'aide de cette NOAEL de 0,3 mg/kg p.c. par jour, d'un facteur d'incertitude de 100 (10 pour la variation intraspécifique et 10 pour la variation interspécifique) et d'un facteur de 1 prescrit par la LPA, l'AQA de bromoxynil (Santé Canada, 2008, 2019a, 2019b) a été calculé comme suit :
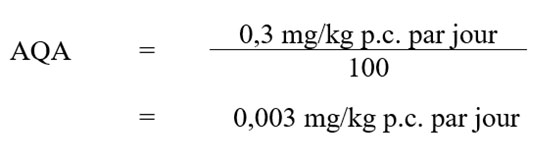
Équation 1 : Équivalent textuel
Cette équation permet de calculer l'apport quotidien acceptable de Bromoxynil. La AQA est calculée en divisant des modifications des paramètres de biochimie clinique pour Bromoxynil (0,3 microgrammes par kilogramme de poids corporel par jour) par le facteur d'incertitude de 100 qui est égal à 0,003 microgramme par kilogramme de poids corporel par jour.
Où :
- 0,3 mg/kg p.c. par jour est la NOAEL, sur la base d'une augmentation des signes cliniques et du poids du foie et d'une diminution du poids corporel et des gains de poids corporel chez les chiens beagle;
- 100 est le facteur d'incertitude, choisi pour tenir compte de la variation interspécifique (×10) et de la variation intraspécifique (×10).
En se basant sur l'AQA de 0,003 mg/kg p.c. par jour, on a calculé comme suit la valeur basée sur la santé (VBS) pour le bromoxynil dans l'eau potable :

Équation 2 : Équivalent textuel
Cette équation permet de calculer la valeur de la Bromoxynil basée sur la santé. La valeur basée sur la santé est calculée en multipliant l'apport quotidien tolérable de 0,003 microgramme par kilogramme de poids corporel par jour par un poids corporel de 74 kilogrammes et par un facteur de répartition de 0,20, puis en divisant par un volume d'eau ingéré par jour de 1,53 litre. Cela équivaut à une valeur basée sur la santé de 0.03 microgrammes par litre.
Où :
- 0,003 mg/kg p.c. par jour est l'AQA calculé à partir d'une NOAEL de 0,3 mg/kg p.c. par jour (Santé Canada, 2019);
- 74 kg est le poids corporel moyen d'un adulte canadien (Santé Canada, 2021b);
- 1,53 L par jour correspond au volume quotidien en eau du robinet consommé par un adulte (Santé Canada, 2021b);
- 0,20 est le facteur d'attribution pour l'eau potable. Étant donné que l'eau potable n'est pas une source importante d'exposition au bromoxynil et que des données indiquent que le bromoxynil se trouve dans d'autres sources d'exposition (c.-à-d. la nourriture), une valeur plancher de 0,20 (20 %) a été appliquée, ce qui signifie que l'eau potable peut représenter entre 0 % et 20 % de la dose quotidienne (Krishnan et Carrier, 2013).
4.0 Considérations relatives à l'analyse et au traitement
4.1 Méthodes d'analyse Méthodes d'analyse utilisées pour la détection du bromoxynil
Des méthodes normalisées pour l'analyse du bromoxynil dans les sources d'approvisionnement en eau et l'eau potable ainsi que leurs limites de détection respectives sont résumées au tableau 4. Les limites de détection de la méthode (LDM) dépendent de la matrice de l'échantillon, de l'instrumentation et des conditions de fonctionnement choisies, et varient d'un laboratoire à l'autre. Ces méthodes sont sujettes à diverses interférences qui sont décrites dans les références pertinentes.
On a contacté plusieurs laboratoires accrédités au Canada pour déterminer les LDM et les SDM aux fins d'analyse du bromoxynil. Les LDM étaient du même ordre de grandeur que celles figurant dans le tableau 4, et les SDM allaient de 0,1 à 0,5 μg/L (AGAT Laboratories Ltd., 2019; ALS Environmental [Waterloo], 2019; Bureau Veritas Laboratories, 2019; CARO Analytical Services [laboratoire de Richmond], 2019; Element Materials Technology Canada Inc., 2019; SGS Environmental Services, 2019).
Les responsables des systèmes d'approvisionnement en eau potable devraient discuter des exigences en matière d'échantillonnage avec le laboratoire accrédité qui réalise l'analyse, afin de s'assurer que les procédures de contrôle de la qualité sont respectées et que les SDM sont assez bas pour assurer une surveillance précise aux concentrations inférieures à la CMA. Les considérations relatives au traitement des échantillons et aux interférences des méthodes utilisées pour l'analyse du bromoxynil dans l'eau potable (p. ex. conservation et entreposage des échantillons) se trouvent dans les références énumérées au tableau 4. Il faut noter que la désactivation est cruciale si un oxydant est présent dans les échantillons, afin d'empêcher toute dégradation supplémentaire du bromoxynil avant l'analyse.
| Méthode (Référence) |
Méthodologie | Interférences/commentaires | LDM (µg/L) |
|---|---|---|---|
| EPA 8270D rév. 5 (US EPA, 2014) |
Chromatographie en phase gazeuse avec détection par spectrométrie de masse (CPG-SM) | Aucune indication dans la méthode | 10Tableau 4 Note de bas de page a |
| USGS-NWQL: O-1131-95 (Werner et coll., 1996) |
Chromatographie liquide à haute performance avec détection par ultraviolets (CLHP-UV) | Aucune indication dans la méthode | 0,035 |
| USGS-NWQL: O-2060-01 (Furlong et coll., 2001) |
Chromatographie liquide à haute performance avec détection par spectrométrie de masse (CLHP-SM) | Aucune indication dans la méthode | 0,0155 |
4.2 Considérations liées au traitement
Certaines techniques de traitement d'efficacité variable permettent de réduire les concentrations de bromoxynil dans l'eau potable. En voici des exemples : le charbon actif, la filtration sur membrane, l'oxydation, les procédés d'oxydation avancée (POA) et la biofiltration. Des études ont montré que le charbon actif en grains (CAG) pouvait enlever le bromoxynil de l'eau (Baup et coll., 2000, 2002; Yang et coll., 2004). Des données publiées sur la performance d' enlèvement du bromoxynil sont disponibles pour l'oxydation, les POA et la biofiltration, et révèlent d'une plage d'efficacité très variable (de 39 % à 99 %) (Preuss et coll., 1996; Bourgine et coll., 1997; Chelme-Ayala et coll., 2010a, 2010b, 2011). Les études pilotes constituent une étape importante pour les responsables des systèmes d'approvisionnement en eau qui envisagent le recours à ces procédés pour enlever des pesticides de l'eau potable. À l'échelle résidentielle, les dispositifs de traitement certifiés utilisant l'osmose inverse (OI) ou l'adsorption sur charbon actif devraient pouvoir enlever le bromoxynil de manière efficace.
4.2.1 Traitement à l'échelle municipale
Le choix d'un bon procédé de traitement dépend de nombreux facteurs, entre autres la source d'eau brute et ses caractéristiques, les conditions d'utilisation de la méthode de traitement choisie et les objectifs de traitement des responsables de systèmes de distribution d'eau potable. La réalisation d'études à l'échelle de banc d'essai ou d'études pilotes est recommandée pour s'assurer que la source d'approvisionnement en eau peut être traitée avec succès et que la conception d'un procédé optimal soit établi.
L'étude sur l'eau de surface réalisée par Donald et coll. (2007) dont il est question à la section 1.3 présentait également les concentrations de bromoxynil dans l'eau traitée provenant de 15 réservoirs d'eau potable. Chaque source d'approvisionnement en eau potable faisait l'objet de divers procédés de traitement; cependant, dans tous les cas on utilisait la chloration et dans la plupart des cas on faisait appel à la floculation (alun)/décantation, au charbon actif et/ou à la filtration sur sable. Les données brutes n'ayant pas été fournies, seules des statistiques globales ont pu être déterminées, et non pas le rendement des procédés de traitement individuels. Les concentrations moyennes de bromoxynil dans les réservoirs et l'eau traitée étaient de 2,4 ng/L et 1 ng/L, respectivement (n = 163), et la concentration maximale de bromoxynil dans l'eau traitée était de 227 ng/L. À partir de 12 échantillons appariés, une diminution moyenne de 46 % du bromoxynil a été déterminée (intervalle allant de 0 % à 98 %).
Lorsqu'on fait appel à l'oxydation ou à un POA pour enlever un pesticide de l'eau potable, il faut être conscient du potentiel de formation de sous-produits de dégradation du composé cible (Ikehata et Gamal El-Din, 2006; Beduk et coll., 2012; Li et coll., 2019). L'objectif principal devrait être l'enlèvement du pesticide, tandis que l'objectif secondaire devrait être la réduction au minimum la formation de sous-produits si ces derniers présentent des risques pour la santé. De plus, les responsables des systèmes d'approvisionnement en eau devraient tenir compte de la possibilité de formation de sous-produits de désinfection selon l'oxydant choisi et la qualité qualité de la source d'approvisionnement en eau.
4.2.1.1 Traitement conventionnel
Les procédés classiques de filtration (coagulation chimique, clarification et filtration rapide sur sable) employés seuls ne sont pas efficaces, mais l'ajout de chlore à l'étape de la désinfection diminuera les concentrations de bromoxynil par oxydation. Cependant, les processus de dégradation comme l'oxydation entraînent la formation des sous-produits (voir la section 4.2.1.5). Aucune étude sur l'eau d'enlèvement du bromoxynil par filtration conventionnelle n'a été identifiée dans la littérature scientifique.
4.2.1.2 Adsorption sur charbon actif
L'adsorption sur charbon actif est une technique largement utilisée pour diminuer la concentration de micropolluants, dont un vaste éventail de pesticides, dans l'eau potable (Haist-Gulde et Happel, 2012; van der Aa et coll., 2012). Le charbon actif peut être appliqué de deux manières : applications d'une solution en suspension de charbon actif en poudre (CAP) ou réacteur à lit fixe utilisant du CAG (Chowdhury et coll., 2013).
Il existe très peu de publications sur l'utilisation du charbon actif pour enlever le bromoxynil et aucune donnée sur son rendement. Par conséquent, avant toute mise en œuvre à grande échelle, il sera essentiel de mener des études pilotes ou à l'échelle de banc d'essai. L' enlèvement du bromoxynil de l'eau naturelle à l'aide de charbon actif peut être influencée négativement par la présence d'autres contaminants qui entrent en compétition ou par la matière organique naturelle (MON), la formation de biofilm, la température, la concentration dans l'influent, les caractéristiques du charbon et le taux de charge hydraulique (Speth et Miltner, 1998; Haist-Gulde et Happel, 2012).
Les données tirées d'études à l'échelle de banc d'essai visant à déterminer les coefficients d'adsorption des pesticides sont utiles pour prédire si le charbon actif adsorbera un pesticide quelconque (US EPA, 2011). En général, les pesticides présentant une constante d'adsorption (c.-à-d. coefficient de Freundlich [K]) supérieure à 200 µg/g (L/µg)1/n sont considérés comme appropriés pour l'enlèvement par adsorption sur charbon (Speth et Adams, 1993; Speth et Miltner, 1998; US EPA, 2011). Toutefois, les auteurs ont précisé que la capacité du charbon actif dépendait de nombreux facteurs, dont le caractère ionique du composé et le pH de la solution.
Deux études à l'échelle de banc d'essai présentent les coefficients de Freundlich pour l'adsorption du bromoxynil, du diuron et de l'atrazine sur différents charbons actifs (Baup et coll., 2000, 2002). Les auteurs ont signalé dans les deux études par lot que le bromoxynil présentait une adsorption située entre celle du diuron et celle de l'atrazine, ce qui montre que le charbon actif est une bonne option pour l' enlèvement du bromoxynil. Des études à long terme menées sur une période de 90 jours ont fait appel à du charbon actif en grains et en poudre (Baup et coll., 2002). Les auteurs ont observé que l'adsorption à court terme était meilleure avec le CAP qu'avec le CAG et ont affirmé que cela était peut-être attribuable à une meilleure accessibilité aux pores et sites d'adsorption. Une étude à l'échelle de banc d'essai évaluant l'adsorption a montré que la capacité d'adsorption baissait à mesure que le pH augmentait (voir le tableau 5) (Yang et coll., 2004).
L'utilisation de CAP offre l'avantage de fournir du charbon vierge selon les besoins (durant la saison d'application du pesticide) (Miltner et coll., 1989). L'efficacité d' enlèvement du CAP dépend de la dose de CAP, du temps de contact, des caractéristiques du CAP (type, taille des particules), de la capacité d'adsorption du contaminant et de la présence de MON (Gustafson et coll., 2003; Summers et coll., 2010; Haist-Gulde et Happel, 2012; Chowdhury et coll., 2013). En plus de la capacité d'adsorption du CAG, la durée d'opération des adsorbeurs de CAG pour enlever les pesticides dépend de la vitesse de filtration, du temps de contact en lit vide, des caractéristiques du CAG (type, taille des particules), de la capacité d'adsorption du contaminant et de la matrice organique (Haist-Gulde et Happel, 2012). Puisque les adsorbeurs à lit fixe de CAG fonctionnent généralement en continu, le CAG peut devenir encrassé (ou préchargé) par de la MON, ce qui rendrait ce procédé entièrement ou partiellement inefficace pour l'enlèvement des pesticides (Knappe et coll., 1999; Summers et coll., 2010; Haist-Gulde et Happel, 2012; Chowdhury et coll., 2013).
Lorsque le bromoxynil est oxydé, des sous-produits de dégradation peuvent se former comme il est expliqué à la section 4.2.1.5. Une étude à l'échelle de banc d'essai a évalué l'adsorption du bromoxynil sur CAP et celle d'un sous-produit de dégradation de l'ozone, le 3-bromo-4,5-dihydroxybenzonitrile (Br-DHBN) (Schoutteten et coll., 2016). Des essais d'adsorption distincts ont été réalisés avec une concentration initiale de bromoxynil ou de Br-DHBN de 5 mg C/L; de 0 à 18 mg de CAP ont été mélangés à 80 mL de solution et placés sur un agitateur durant trois jours à 25 ⁰C. Les auteurs ont indiqué que le sous-produit de dégradation, le Br-DHBN, présentait une meilleure adsorption sur le CAP que le bromoxynil.
| Initiale (mg/L) | Charbon actif | Capacité d'adsorption (mg/m2) | pH | Description globale | Référence |
|---|---|---|---|---|---|
| 35,6 | Darco G-60 | 0,62 | 2,47 | Étude à l'échelle de banc d'essai Mélangé pendant 24 heures à température ambiante (T ~ 25 ⁰C) Darco G-60 (surface = 776 m2/g; masse = |
Yang et coll. (2004) |
| 0,45 | 4,53 | ||||
| 0,28 | 6,58 |
4.2.1.3 Filtration sur membrane
En général, la nanofiltration (NF) et OI sont des procédés de séparation membranaire à gradient de pression efficaces pour l' enlèvement des pesticides de l'eau potable (Van der Bruggen et Vandecasteele, 2003; US EPA, 2011). L'efficacité de la NF et de l'OI à enlever les pesticides dépend des caractéristiques de la membrane, des propriétés des pesticides, de la composition de l'eau d'alimentation, des conditions opérationnelles et de l'encrassement de la membrane (Van der Bruggen et Vandecasteele, 2003; Plakas et Karabelas, 2012).
Puisque le mécanisme principal d'enlèvement des pesticides des membranes de NF et d'OI est l'exclusion par la taille, le seuil de rétention des molécules en raison de leur poids moléculaire (MWCO) par la membrane constitue une caractéristique importante. Pour choisir une membrane, il faudrait tenir compte du poids moléculaire du bromoxynil (> 276 Da). Outre l'effet de tamis, la rétention de petites molécules de pesticide par des membranes dont la taille des pores est plus grande peut être influencée par les interactions physicochimiques entre le pesticide et la surface de la membrane (Plakas et Karabelas, 2012). Bellona et coll. (2004) présentent un diagramme de flux utilisant les caractéristiques du pesticide dans l'eau (p. ex. poids moléculaire, log KOW, diamètre moléculaire) et celles de la membrane (p. ex. MWCO, taille des pores) pour déterminer le potentiel d'enlèvement. Le bromoxynil est légèrement hydrophobe (log KOW > 2) et présente une pKa plutôt faible, ce qui indique une possibilité d'enlèvement accrue par liaison hydrophobe sur la surface de la membrane et par exclusion électrostatique (Bellona et coll., 2004; Plakas et Karabelas, 2012). Compte tenu de ces propriétés physicochimiques, on pourrait s'attendre à ce que le bromoxynil soit enlevé par des procédés membranaires.
Étant donné qu'il n'existe aucun document publié sur l'enlèvement du bromoxynil au moyen de la filtration sur membrane, avant toute mise en œuvre à grande échelle, il est important de mener les essais appropriés dans les conditions opérationnelles proposées avec la membrane et la source d'approvisionnement en eau afin de s'assurer d'un enlèvement adéquat du bromoxynil.
4.2.1.4 Oxydation
Les études pilotes et à l'échelle de banc d'essai sur l'oxydation du bromoxynil grâce à la photolyse par ozone (O3) et rayons ultraviolets (UV) montrent que ces méthodes de traitement peuvent être efficaces pour enlever le bromoxynil de l'eau, en fonction de divers facteurs comme le temps de contact, la dose d'oxydant et la matrice d'eau (pH, alcalinité et matière organique) (Bourgine et coll., 1997; Chelme-Ayala et coll., 2010a, 2010b; Chelme-Ayala et coll., 2011). Bourgine et coll. (1997) ont indiqué qu'il existait seulement quelques données sur une étude pilote faisant appel à la photolyse UV pour diminuer les concentrations de plusieurs pesticides dans l'eau souterraine, dont le bromoxynil. Les auteurs ont mentionné que le bromoxynil se dégradait facilement et que la photolyse par rayons UV permettait un taux d'enlèvement supérieur à 85 %. Lors d'une étude à l'échelle de banc d'essai, Chelme-Ayala et coll. (2010a) ont examiné la dégradation du bromoxynil dans l'eau naturelle au moyen de la photolyse UV directe. Les échantillons d'eau ont été prélevés dans la rivière Saskatchewan Nord en amont de la ville d'Edmonton (W1) et dans un flux de retour d'irrigation se déversant dans la rivière Redwater (W2). La qualité de ces eaux naturelles est décrite dans le tableau 6. Selon les résultats obtenus, 30 et 56 minutes ont été nécessaires pour atteindre une dégradation de 50 % du bromoxynil présent dans les échantillons W1 et W2, respectivement. De plus, des doses accrues de rayons UV ont été requises pour dégrader le bromoxynil dans les échantillons d'eau dont la concentration en carbone organique total (COT) et l'alcalinité étaient élevées (voir le tableau 6). Les doses de rayons UV rapportées sont très supérieures à celles habituellement exigées pour inactiver les micro-organismes (Santé Canada, 2019c, 2019d).
Une étude à l'échelle de banc d'essai sur l'ozonation a fait état d'une augmentation de l'efficacité de la dégradation du bromoxynil avec une augmentation du pH (de 2,0 à 7,0) dans de l'eau ultra-pure tamponnée (Chelme-Ayala et coll., 2010b). La différence dans la réactivité du bromoxynil s'explique par la réactivité plus élevée de l'espèce de bromoxynil déprotoné qui s'est formée lorsque le pH a augmenté. Les constantes de vitesse de réaction allaient de 2,3 x 102 à 4,6 x 102 M-1s-1 à un pH de 2,0 et de 6,0 x 102 à 6,4 x 102 M-1s-1 à un pH de 7,0 pour la réaction de l'ozone avec le bromoxynil par le biais d'une méthode cinétique différente (voir le tableau 6). Dans l'ensemble, les réactions d'oxydation de l'ozone peuvent suivre deux voies. Lors de réactions survenant dans des conditions acides, l'ozonation directe des molécules est le procédé dominant, tandis qu'un mécanisme indirect impliquant des radicaux hydroxyles (OH) contrôle les réactions à des pH supérieurs à 10,0 (Hoigné et Bader, 1976). Gottschalk et coll. (2000) ont indiqué que les deux voies d'oxydation, l'ozonation directe et l'oxydation par radicaux hydroxyles, pouvaient se dérouler à des pH supérieurs à 7,0.
Des études à l'échelle de banc d'essai sur l'ozonation ont examiné les effets du pH, de l'alcalinité et des acides humiques sur la dégradation du bromoxynil dans l'eau ultrapure et naturelle (dont l'échantillonnage a été abordé plus haut) (Chelme-Ayala et coll., 2011) (voir le tableau 7). Une augmentation du taux de dégradation du bromoxynil a été observée lorsque le pH passait de 7,0 à 9,0. En raison de l'effet piégeur sur les ions bicarbonates qu'ont les réactions en chaîne des radicaux d'ozone et la réaction de l'ozone avec les acides humiques, une dégradation plus efficace du bromoxynil a été signalée dans des échantillons d'eau dont les niveaux de matière organique et d'alcalinité étaient bas. L'effet piégeur des ions carbonates et bicarbonates et de nitrite de sodium sur la dégradation photolytique du bromoxynil a aussi été mentionné par Kochany et coll. (1990b) et Kochany (1992).
Lorsque le bromoxynil est oxydé, des sous-produits de dégradation peuvent se former tel qu'il est expliqué dans la section 4.2.1.5.
| Oxydant | Eau à traiter (M) | Dose d'oxydant | % d'enlèvement | Description du procédé | Références |
|---|---|---|---|---|---|
| Rayons UV | Non disponible | Énergie 100-500 Wh/m3 |
66,6 % - 100 Wh/m3 87,9 % - 200 Wh/m3 93,1 % - 300 Wh/m3 93,3 % - 500 Wh/m3 |
Essai pilote : eau souterraine; pH 7,1-7,2; turbidité 0,1-0,2 uTN; COT 0,5-1,54 mg/L; nitrate 35-40 mg/L; sulfate 50-60 mg/L; Lampe au mercure à pression moyenne. |
Bourgine et coll. (1997) |
| 3,6 x 10-6 M | 483 mJ/cm2 574 mJ/cm2 |
90 % - W1Tableau 6 Note de bas de page a 90 % - W2Tableau 6 Note de bas de page b |
Étude à l'échelle de banc d'essai : eau naturelle dopée avec du bromoxynil; W1 : alcalinité 136 mg/L - CaCO3; COT 2,8 mg/L; pH 8,1; W2 : alcalinité 230 mg/L - CaCO3; COT 20,6 mg/L; pH 8,4. |
Chelme-Ayala et coll. (2010a) | |
| O3 | 9 x 10-6 M | 0,1-0,5 mM | 98 % à un pH de 7,0 en 2 minutes | Étude à l'échelle de banc d'essai : eau ultrapure tamponnée; pH de 2,0 et 7,0; T0 ambiante : 20 0C; alcool tert-butylique 10 mM (piégeur de OH). | Chelme-Ayala et coll. (2010b) |
| Oxydant | Eau à traiter (M) | Dose d'oxydant | % d'enlèvement | Description du procédé | Référence |
|---|---|---|---|---|---|
| O3 | 3,6 x 10-6 M | 1,7 x 10-5 M | 87 % à un pH de 7,0 99 % à un pH de 9,0 |
Eau ultrapure : pH 7,0 et 9,0. | Chelme-Ayala et coll. (2011) |
89 % - 0,0 mM 47 % - 5,0 mM |
Eau ultrapure : alcalinité 0,0 et 5,0 mM - CaCO3; pH 7,0. | ||||
88 % - 8,8 x 10-6 M 72 % - 22,0 x 10-6 M |
Eau ultrapure : acide humique 8,8 x 10-6 et 22,0 x 10-6 M; alcalinité 1,0 mM. |
||||
| 2,1 x 10-5 M | 60 % - W1Tableau 7 Note de bas de page a 39 % - W2Tableau 7 Note de bas de page b |
Eau naturelle dopée avec du bromoxynil; W1 : alcalinité de 136 mg/L - CaCO3; COT 2,8 mg/L; pH 8,1; W2 : alcalinité de 230 mg/L - CaCO3; COT 20,6 mg/L; pH 8,4. |
|||
4.2.1.5 Procédés d'oxydation avancée
Des études à l'échelle de banc d'essai ont révélé une réactivité élevée du bromoxynil avec les OH générés par la décomposition de l'ozone dans des conditions basiques (pH > 10) (Chelme-Ayala et coll., 2010b; Chelme-Ayala et coll., 2011). Chelme-Ayala et coll. (2010b) ont calculé une constante de vitesse de réaction de 8,45 x 109 M-1s-1 pour la réaction de l'ozone (0,015 mM) avec une concentration de bromoxynil de 9,0 µM à un pH de 11,0.
L' enlèvement du bromoxynil utilisant deux POA, UV/H2O2 et O3/H2O2, et des échantillons d'eau naturelle (cet échantillonnage est abordé à la section 4.2.1.4) a été étudiée à l'échelle de banc d'essai (Chelme-Ayala et coll., 2010a; Chelme-Ayala et coll., 2011). Une augmentation de la dégradation du bromoxynil a été rapportée lorsque les procédés UV/H2O2 et O3/H2O2 furent utilisés au lieu de la photolyse UV directe et de l'ozonation moléculaire respectivement. Les résultats figurant au tableau 8 montrent qu'une dégradation plus importante du bromoxynil a été obtenue dans des échantillons d'eau dont la concentration en COT et l'alcalinité étaient plus basses (échantillons W1). La présence de matière organique et d'ions bicarbonates dans l'eau naturelle a fait baisser la concentration des OH pouvant réagir avec les pesticides (Chelme-Ayala et coll., 2010a; Chelme-Ayala et coll., 2011).
Des études ont relevé plusieurs sous-produits de dégradation de l'oxydation du bromoxynil à la suite de la photolyse UV et/ou de l'ozonation dans une solution aqueuse : le 3-bromo-4-hydroxybenzonitrile, le 4-hydroxybenzonitrile, le 3-bromo-4-hydroxy-5-nitrobenzonitrile, le 4-hydroxy-3-nitrobenzonitrile, le 3,5-dibromo-2,4-dihydroxybenzonitrile, et le 3-bromo-4,5-dihydroxybenzonitrile (Kochany et Chaudhry, 1990a; Kochany et coll., 1990b; Marchado et coll., 1995; Chelme-Ayala et coll., 2010b). Chelme-Ayala et coll. (2010b) ont suggéré que la dégradation du bromoxynil s'effectuait par hydroxylation et débromation. Des études ont révélé que certains sous-produits de la dégradation de pesticides sont plus persistants que la molécule d'origine. Par conséquent, l'application de doses accrues d'oxydant pourrait être requise pour permettre de dégrader la molécule cible et les sous-produits de dégradation générés durant le traitement (Chelme-Ayala et coll., 2011; Beduk et coll., 2012; Li et coll., 2019). Il a été suggéré qu'un rapport H2O2/O3 de 0,4 à 0,6 était optimal pour dégrader les pesticides (Glaze et coll., 1987; Acero et von Gunten, 2001; Can et Cakir, 2010). Bien que l'oxydation et les POA semblent des traitements efficaces pour enlever le bromoxynil, les responsables des services d'approvisionnement en eau doivent prendre en compte la formation de sous-produits de dégradation qui dépendra de l'oxydant choisi et de la qualité de l'eau.
| Procédé | Eau à traiter (M) | Dose d'oxydant | % d'enlèvement | Description du procédé | Références | |
|---|---|---|---|---|---|---|
| UV/H2O2 | 3,6 x 10-6 M | 333 mJ/cm2 | H2O2 - 8,8 x 10-4 M |
90 % - W1Tableau 8 Note de bas de page a | bromoxynil; W1 : alcalinité 136 mg/L - CaCO3; COT 2,8 mg/L; pH 8,1; W2 : alcalinité 230 mg/L - CaCO3; COT 20,6 mg/L; pH 8,4. |
Chelme-Ayala et coll. (2010a) |
| 366 mJ/cm2 | 90 % - W2Tableau 8 Note de bas de page b | |||||
| O3/H2O2 | 3,6 x 10-6 M | O3 - 2 x 10-5 M; H2O2 - 1 x 10-5 M (H2O2/O3 = 0,5) |
70 % - W1 49 % - W2 |
Chelme-Ayala et coll. (2011) | ||
4.2.1.6 Biofiltration
Le traitement biologique nécessite de cibler l'enlèvement de la partie biodégradable de la matière organique. L'efficacité d'un tel traitement dépend de la concentration initiale, des propriétés de la source d'approvisionnement en eau, de la communauté microbienne, du temps de contact, des propriétés du sol et de la température (Drewes et coll., 2009; Diem et coll., 2013). Les principaux procédés de traitement biologique de l'eau potable comprennent la filtration sur berge, un procédé de filtration rapide sur milieu granulaire sans le maintien d'un désinfectant résiduel à travers le lit, et la filtration lente sur sable.
Une étude par lots à l'échelle de banc d'essai a été réalisée pour observer la biodégradation du bromoxynil en utilisant de l'eau souterraine ajoutée à un milieu salé (Preuss et coll. 1996). Dans des conditions anaérobies, la biodégradation du bromoxynil a atteint > 99 % après 32 jours. Aucune biodégradation n'a été observée dans des conditions aérobies.
4.2.2 Traitement à l'échelle résidentielle
Dans les cas où l'on souhaite enlever le bromoxynil à l'échelle résidentielle, par exemple lorsque l'eau potable d'une maison provient d'un puits privé, un dispositif de traitement résidentiel peut être employé pour diminuer les concentrations de bromoxynil dans l'eau potable. Avant d'installer un appareil de traitement, les consommateurs doivent faire analyser l'eau afin d'en caractériser la chimie générale et d'en vérifier la concentration de bromoxynil dans la source d'approvisionnement en eau. Les études sur l'efficacité des techniques de traitement sont insuffisantes; cependant, l'adsorption (sur charbon actif) et l'osmose inverse sont des techniques de traitement qui sont susceptibles d'enlever le bromoxynil à l'échelle résidentielle. Pour vérifier l'efficacité d'un dispositif de traitement, il faut régulièrement prélever des échantillons de l'eau qui entre dans le dispositif de traitement et qui en sort, et envoyer ceux-ci à un laboratoire accrédité à des fins d'analyses. Les appareils peuvent perdre de leur capacité d' enlèvement avec le temps et l'usure; il faut les entretenir et/ou les remplacer. Les consommateurs devraient vérifier la durée de vie prévue des composants de leur dispositif de traitement selon les recommandations du fabricant et en assurer l'entretien lorsque requis. Certains dispositifs résidentiels peuvent avoir une capacité nominale permettant de traiter des volumes supérieurs à ceux d'une seule résidence, de sorte qu'ils peuvent aussi être utilisés dans petits systèmes.
Santé Canada ne recommande aucune marque particulière de dispotif de traitement de l'eau potable, mais conseille fortement aux consommateurs d'utiliser des dispotifs dont la conformité aux normes pertinentes de NSF International Standard/American National Standard (NSF/ANSI) est certifiée par un organisme de certification accrédité. Ces normes visent à établir des exigences minimales relatives aux matériaux, à la conception et à la construction des dispositifs de traitement de l'eau potable qui peuvent être vérifiées par un tiers. Elles permettent de prévenir le relargage dans l'eau potable des contaminants présents dans les matériaux (c.-à-d. innocuité des matériaux). De plus, les normes englobent des exigences de performance qui précisent le taux d'enlèvement qui doit être atteint pour certains contaminants (p. ex. déclaration de réduction) qui peuvent être présents dans l'eau. Les organismes de certification (c.-à-d. des tiers), qui doivent être accrédités par le Conseil canadien des normes (CCN), garantissent qu'un produit est conforme aux normes en vigueur. Les organismes accrédités au Canada comprennent :
- Groupe CSA (www.csagroup.org/fr/);
- NSF International (www.nsf.org) (disponible en anglais seulement);
- Water Quality Association (www.wqa.org) (disponible en anglais seulement);
- UL LLC (canada.ul.com/fr/);
- Bureau de normalisation du Québec (www.bnq.qc.ca);
- International Association of Plumbing and Mechanical Officials (www.iapmo.org) (disponible en anglais seulement);
- Truesdail Laboratories Inc. (www.truesdail.com) (disponible en anglais seulement).
On peut obtenir une liste à jour des organismes de certification accrédités auprès du CCN (www.scc.ca/fr/).
À l'heure actuelle, le bromoxynil n'est pas visé par les exigences de performance des normes NSF/ANSI. Toutefois, les consommateurs peuvent utiliser un dispositif de traitement qui est certifié conforme aux normes relatives à l'OI ou à l'adsorption pour s'assurer que l'innocuité des matériaux a été évaluée. En outre, les dispositifs certifiés conformes pour l'enlèvement de l'atrazine sont plus susceptibles d'être efficaces pour enlever le bromoxynil, puisqu'il a été démontré que le bromoxynil présentait une meilleure adsorption que l'atrazine (voir la section 4.2.1.2).
L'eau traitée par OI peut être corrosive pour les composants internes de plomberie; ces dispositifs devraient donc être installés uniquement au point d'utilisation. De plus, comme il faut de grandes quantités d'influent pour obtenir le volume requis d'eau traitée, ces dispositifs ne sont généralement pas pratiques si on les installe au point d'entrée.
5.0 Stratégies de gestion
Tous les responsables de systèmes de l'approvisionnement en eau potable devraient mettre en œuvre une approche de gestion des risques comme l'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau pour assurer la salubrité de l'eau (CCME, 2004; OMS, 2017a, 2017b). Ces approches exigent une évaluation du système pour caractériser la source d'approvisionnement en eau, décrire les procédés de traitement qui empêchent ou réduisent la contamination, déterminer les conditions pouvant entraîner une contamination et mettre en œuvre des mesures de contrôle. Une surveillance opérationnelle est ensuite établie, et des protocoles opérationnels et de gestion sont mis en place (p. ex. procédure normale d'exploitation, mesures correctives et interventions en cas d'incident). La surveillance de la conformité est établie et d'autres protocoles de validation du plan de salubrité de l'eau sont mis en œuvre (p. ex. tenue de registres, satisfaction des consommateurs). La formation des opérateurs est également nécessaire pour assurer en tout temps l'efficacité du plan de salubrité de l'eau (Smeets et coll., 2009).
5.1 Surveillance
Le bromoxynil peut être présent dans les eaux souterraines et les eaux de surface des régions où il est utilisé, selon le type et l'étendue de son application, les facteurs environnementaux (p. ex. quantité de précipitations, type de sol, milieu hydrogéologique) et le devenir dans l'environnement (p. ex. mobilité, potentiel de lessivage, dégradation) dans les zones à proximité. Les responsables des systèmes d'approvisionnement en eau potable devraient tenir compte de la possibilité que le bromoxynil entre dans les sources d'approvisionnement en eau (p. ex. approvisionnement en eau brute vers le système d'eau potable) selon les caractéristiques propres à chaque site.
Une fois qu'on a déterminé que le bromoxynil peut être présent et qu'une surveillance est nécessaire, il faudrait caractériser les sources d'eau de surface et d'eau souterraine afin d'établir la concentration de bromoxynil. Cela devrait comprendre la surveillance des sources d'eau de surface pendant les périodes de pointe d'utilisation et de précipitations et/ou la surveillance annuelle des sources d'eau souterraine. Lorsque les données de référence indiquent que la source d'approvisionnement ne contient pas de bromoxynil, la surveillance peut être réduite.
Lorsqu'un traitement est nécessaire pour enlever le bromoxynil, il faudrait assurer une surveillance opérationnelle pour déterminer si le procédé de traitement fonctionne comme prévu. La fréquence de la surveillance opérationnelle dépendra de la qualité de l'eau, de la fluctuation des concentrations d'eau brute et du procédé de traitement. Les autorités responsables devraient être conscientes de l'effet de la MON sur les systèmes au charbon actif, car cette interaction peut influer sur les objectifs de la qualité de l'eau en ce qui a trait à l'enlèvement du bromoxynil.
Lorsqu'un traitement est utilisé pour enlever le bromoxynil, il faudrait effectuer une surveillance de la conformité (en jumelant des échantillons d'eau brute avec ceux de l'eau traitée afin de confirmer l'efficacité du traitement) au moins tous les ans et pendant les périodes de pointe d'utilisation. Lorsque la surveillance opérationnelle périodique indique un risque de pénétration du contaminant, comme avec le CAG, la surveillance devrait être exercée chaque trimestre afin qu'on puisse planifier la régénération ou le remplacement du matériel filtrant. Lorsqu'on a recours à un procédé de dégradation, la surveillance de la formation de sous-produits d'oxydation devrait aussi être envisagée.
6.0 Considérations internationales
D'autres organisations nationales et internationales ont établi des lignes directrices, des normes et/ou des valeurs recommandées relatives à la présence de bromoxynil dans l'eau potable. Les valeurs peuvent varier en fonction de la date à laquelle remonte l'évaluation sur laquelle elles sont fondées ou selon les différences relatives aux politiques et aux démarches appliquées, telles que le choix de l'étude clé et le recours à des taux de consommation, des poids corporels et des facteurs d'attribution différents.
L'Australie a établi une valeur recommandée de 0,01 mg/L (10 µg/L) pour le bromoxynil dans l'eau potable (NHMRC et NRMMC, 2011). Cette valeur se base sur une dose sans effet observé de 0,3 mg/kg p.c. par jour utilisée lors d'une étude alimentaire de 12 mois menée sur des chiens, durant laquelle on a signalé une diminution du gain de poids corporel à 1,5 mg/kg p.c. par jour et des signes d'anémie à 7,5 mg/kg p.c. par jour. L'US EPA n'a pas établi de valeur réglementaire concernant le bromoxynil; elle a conclu qu'il n'existait aucun risque chronique ou aigu préoccupant associé à la consommation d'eau potable quelle que soit la sous-population concernée (US EPA, 1998). L'Organisation mondiale de la Santé n'a pas fixé de valeur recommandée spécifique à l'égard du bromoxynil. L'utilisation du bromoxynil n'est pas approuvée par l'Union européenne (Commission européenne, 2020).
7.0 Justification
Le bromoxynil est homologué au Canada pour la lutte contre un large éventail de mauvaises herbes à feuilles larges dans les cultures destinées à la consommation humaine ou animale. Même si ce produit est largement utilisé au Canada, les données fournies par les provinces et les territoires qui assurent la surveillance du bromoxynil dans les sources d'approvisionnement en eau et l'eau potable indiquent que, lorsqu'elles sont détectées, les concentrations de bromoxynil sont bien inférieures à la CMA. Le foie est considéré comme l'organe cible de la toxicité du bromoxynil. Bien qu'aucune étude réalisée chez l'humain n'ait porté sur les effets du bromoxynil sur le foie, des études menées sur plusieurs espèces animales (rat, souris et chien) ont montré de façon constante une hépatotoxicité à la suite d'une exposition au bromoxynil. Santé Canada, conjointement avec le Comité fédéral-provincial-territorial sur l'eau potable, a établi une CMA de 0,03 mg/L (30 µg/L) en se fondant sur les considérations suivantes :
- Une VBS de 0,03 mg/L (30 µg/L) basée sur une augmentation des signes cliniques et du poids du foie ainsi qu'une diminution du poids corporel et du gain de poids corporel observées chez les chiens.
- Le bromoxynil peut être mesuré avec précision à des concentrations bien inférieures à la CMA.
- On s'attend à ce que le bromoxynil soit enlevé à l'échelle municipale et résidentielle.
La CMA confère une protection contre les effets potentiels sur la santé. Dans le cadre de son processus d'examen continu des recommandations, Santé Canada continuera de surveiller les nouvelles recherches dans ce domaine, y compris les résultats des évaluations de l'ARLA, et de recommander toute modification de ce document technique jugée nécessaire.
8.0 Références
Acero, J.L. et von Gunten, U. (2001). Characterization of oxidation processes: ozonationetthe AOP O3/h3O2. J. Am. Water Works Assoc., 93(10): 90-100.
ACIA (2019). Rapport annuel du Programme national de surveillance des résidus chimiques et Programme de surveillance de la salubrité des aliments 2015-2016. Agence canadienne d'inspection des aliments, Ottawa, Ontario.
AGAT Laboratories Ltd. (2019). Communication personnelle avec N. Boulton, Mississauga, ON.
ALS Environmental (2019). Communication personnelle avec A. Ganouri-Lumsden. Waterloo, ON.
Anderson, A. -M., Trew, D.O., Neilson, R.D., MacAlpine, N.D.et Borg, R. (1998). Impacts of agriculture on surface water quality in Alberta. Part I: Haynes Creek Study. Alberta Government. Disponible à : https://open.alberta.ca/publications/2069737
Baumert, B.O., Ulmer Carnes, M., Hoppin, J.A., Jackson, C.L., Sandler, D.P., Beane Freeman, L., Hanneberger, P.K., Umbach, D.M., Shrestha, S., Long, S.et London, S.J. (2018). Sleep apnea et pesticide exposure in a study of US farmers. Sleep Health, 4(1): 20-26.
Baup, S., Wolbert, D. et Laplanche, A. (2000). Adsorption of pesticides onto granular activated carbon: Determination of surface diffusivities using simple batch experiments. Adsorption, 6(3): 219-228.
Baup, S., Wolbert, D. et Laplanche, A. (2002). Importance of surface diffusivities in pesticide adsorption kinetics onto granular versus powdered activated carbon: Experimental determination and modeling. Environ. Technol., 23(10): 1107-1117.
Beduk, F., Aydin, M.E. et Ozcan, S. (2012). Degradation of malathion and parathion by ozonation, photolytic ozonation, and heterogeneous catalytic ozonation processes. Clean-Soil, Air, Water, 40(2): 179-187.
Bellona, C., Drewes, J.E., Xu, P. et Amy, G. (2004). Factors affecting the rejection of organic solutes during NF/RO treatment - a literature review. Wat. Res., 38(12): 2795-2809.
Bourgine, F., Chapman, J. et Martin, S. (1997). Traitement des pesticides par photolyse UV; Les aspects scientifiques du traitement de l'eau en vue de sa potabilisation. TSM. Techniques sciences méthodes, génie urbain génie rural, (7-8): 23-29.
British Columbia Ministry of Health (2019). Communication personnelle avec D. Fishwick.
Bureau Veritas Laboratories (2019). Communication personnelle avec C. MacDermid. Mississauga, ON.
Can, S.Z. et Cakir, E., (2010). Treatability of organic constituents in the Pasakoy wastewater treatment plant effluent by O3 and O3/h3O2. Ozone Sci. Eng., 32(3): 209-214.
CARO Analytical Services (2019). Communication personnelle avec K. Fyffe, Richmond, BC.
CCME (1999a). Recommandations canadiennes pour la qualité des eaux : protection de la vie aquatique : Bromoxynil. Dans : Recommandations canadiennes pour la qualité de l'environnement, 1999, Le Conseil canadien des ministres de l'environnement, Winnipeg, Manitoba.
CCME (1999b). Recommandations canadiennes pour la qualité des eaux : protection des utilisations de l'eau à des fins agricoles : Bromoxynil. Dans : Recommandations canadiennes pour la qualité de l'environnement, 1999, Le Conseil canadien des ministres de l'environnement, Winnipeg, Manitoba.
CCME (2004). De la source au robinet: guide d'application de l'approche à barrières multiples pour une eau potable saine. Le Conseil canadien des ministres de l'environnement, Winnipeg, Manitoba.
Chelme-Ayala, P., Gamal El-Din, M. et Smith, D. (2010a). Degradation of bromoxynil and trifluralin in natural water by direct photolysis and UV plus H2O2 advanced oxidation process. Wat. Res., 44(7): 2221-2228
Chelme-Ayala, P., Gamal El-Din, M. et Smith, D. (2010b). Kinetics and mechanism of the degradation of two pesticides in aqueous solutions by ozonation. Chemosphere, 78(5): 557-562
Chelme-Ayala, P., Gamal El-Din, M., Smith, D. et Adams, C. (2011). Oxidation kinetics of two pesticides in natural waters by ozonation and ozone combined with hydrogen peroxide. Wat. Res., 45(8): 2517-2526
Chen, X. -X., Li, W. -M., Wu, Q., Zhi, Y. -N. et Han, L. -J. (2011). Bromoxynil residues and dissipation rates in maize crops and soil. Ecotoxicol. Environ. Saf., 74: 1659-1663.
Chowdhury, Z.K., Summers, R.S., Westerhoff, G.P., Leto, B.J., Nowack, K.O. et Corwin, C.J. (2013). Activated carbon: Solutions for improving water quality. Passantino, L. B.(ed.). American Water Works Association. Denver, Colorado.
Cicotti, M. (1994). Determination of the Henry's law constant of bromoxynil. Rhône-Poulenc Agrochimie, BE-P-1-91-HC-01-BG Doc n°435905, Switzerland. (tel que cité dans : European Commission, 2004)
Cifone, M. et Balinas, V. (1982). Mutagenicity evaluation of bromoxynil phenol (marks) in the mouse lymphoma forward mutation assay: LBI project no. 20989. Rev. Final Rept. Unpublished study received Oct 5, 1982 under 264-204; prepared by Litton Bionetics, Inc., submitted by Union Carbide Agricultural Products Co., Inc., Research Triangle Park, NC; CDL:248546-D. (tel que cité dans : US EPA, 1998)
Cifone, M. (1991). Mutagenicity test on bromoxynil phenol in the CHO/HGPRT forward mutation assay: final report: Lab project number: 12550-0-435. Unpublished study prepared by Hazleton Washington, Inc. 46 p. (tel que cité dans : US EPA, 1998)
Commission européenne (2004). Review report for the active substance bromoxynil finalised by the Standing Committee on the Food Chain and Animal Health at its meeting on 13 February 2004 in view of the inclusion of bromoxynil in Annex I of Directive 91/414/EEC. Health & Consumer protection Directorate, SANCO/4347/2000-final. Disponible à : https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/active-substances/?event=as.details&as_id=483
Commission européenne (2020). Final Renewal report for the active substance bromoxynil finalised by the Standing Committee on Plants, Animals, Food ad Feed on 17 July 2020 in view of the non-renewal of the approval of bromoxynil as active substance in accordance with Regulation (EC) No 1107/2009. Directorate-general for health and food safety, SANTE/10156/2020 Rev 2. Disponible à : https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/active-substances/?event=as.details&as_id=483
Copping, G. (1981). Bromoxynil technical: Teratogenicity study by the oral route in the rat: Report ref. R. Tox. 66. Unpublished study received Sep 10, 1982 under 264-340; prepared by May & Baker, Ltd., Eng., submitted by Union Carbide Agricultural Products Co., Inc., Research Triangle Park, NC; CDL:071084-A. (tel que cité dans : US EPA, 1998)
Copping, G. et Brown, P. (1983). Bromoxynil technical: Teratogenicity study by the oral route in the rabbit: Report ref. R.TOX.219. Unpublished study received Nov 17, 1983 under 359-564; prepared by May & Baker, Ltd., Eng., and Univ. of Bristol, Eng., submitted by Rhone-Poulenc, Inc., Monmouth Junction, NJ; CDL:252166-A; 252165. (tel que cité dans : US EPA, 1998)
Département de l'Environnement et Gouvernements locaux du Nouveau-Brunswick (2019). Communication personnelle avec K. Gould.
Développement durable Manitoba (2019). Communication personnelle avec D. Coulibaly, Water Quality Management Section.
Diem, S., Von Rohr, M. R., Hering, J., Kohler, H.-P.E., Shirmer, M. et Von Gunten, U. (2013). NOM degradation during river infiltration: Effects of the climate variables temperature and discharge. Water Res., 47(17): 6585-6595.
Dillon, D. (1993). Bromoxynil octanoate, batch no. HN 81536: Testing for mutagenic activity with Salmonella Typhimurium TA1535, TA 1537, TA 1538, TA 98, and TA 100: Lab project number: 754148: 9904: IRI 754148. Unpublished study prepared by Inveresk Research International. 52 p. (tel que cité dans : US EPA, 1998)
Donald, D.B., Cessna, A.J., Sverko, E. et Glozier, N.E. (2007). Pesticides in surface drinking-water supplies of the northern great plains. Environ. Health Perspect., 115(8): 1183-1191.
Drewes, J.E., Hoppe, C., Oldham, G., McCray, J. et Thompson, K. (2009). Removal of bulk organic matter, organic micropollutants, and nutrients during riverbank filtration. Report number 3180. Water Research Foundation, Denver, Colorado.
EFSA (2017). Conclusion on the peer review of the pesticide risk assessment of the active substance bromoxynil (variant evaluated bromoxynil octanoate). European Food Safety Authority (EFSA) Journal, 15(6): 4790.
Element Materials Technology Canada Inc. (2019). Communication personnelle avec H. Du, Calgary, AB.
Environnement Canada (2011). Présence et concentrations des pesticides prioritaires dans certains écosystèmes aquatiques canadiens. En14-40/2011F-PDF. Direction des sciences et de la technologie de l'eau.
Furlong, E.T., Anderson, B.D., Werner, S.L., Soliven, P.P., Coffey, L.J., et Burkhardt, M.R. (2001). Methods of analysis by the U.S. Geological Survey National Water Quality Laboratory-Determination of pesticides in water by graphitized carbon-based solid-phase extraction and high-performance liquid chromatography/mass spectometry: U.S. Geological Survey Water-Resources Investigations Report 01-4134.
Galloway, S. et Lebowitz, H. (1982). Mutagenicity evaluation of bromoxynil phenol (marks) in an in vitro cytogenetic assay measuring chromosome aberration frequencies in Chinese hamster ovary (CHO) cells: LBI project no. 20990. Rev. Final Rept. Unpublished study received Oct 5, 1982 under 264-204; prepared by Litton Bionetics, Inc., submitted by Union Carbide Agricultural Products Co., Inc., Research Triangle Park, NC; CDL:248546-F. (tel que cité dans : US EPA, 1998)
Giroux, I. et Therrien, M. (2005). Les pesticides utilisés dans les espaces verts urbains: Présence dans l'eau des rejets urbains et dans l'air ambiant. Direction du suivi de l'état de l'environnement, ministère du Développement durable, de l'Environnement et des Parcs, gouvernement du Québec. Disponible à : http://www.environnement.gouv.qc.ca/eau/flrivlac/pesticides.htm
Giroux, I. (2019). Présence de pesticides dans l'eau au Québec: Portrait et tendances dans les zones de maïs et de soya - 2015 à 2017. Direction générale du suivi de l'état de l'environnement, ministère de l'Environnement et de la Lutte contre les changements climatiques, gouvernement du Québec. Disponible à : http://www.environnement.gouv.qc.ca/eau/flrivlac/pesticides.htm
Glaze, W.H., Kang, J.W., Chapin, D.H. (1987). The chemistry of water treatment processes involving ozone, hydrogen peroxide and ultraviolet radiation. Ozone Sci. Eng., 9(4): 335-352.
Gottschalk, C., Libra, J.A. et Saupe, A. (2000). Ozonation of Drinking Water and of Wastewater. Wiley-Vch, Weinheim, Federal Republic of Germany.
Gustafson, D.K., Carr, K.H., Carson, D.B., Fuhrman, J.D., Hackett, A.G., Hoogheem, T.J., Snoeyink, V.L., Curry, M., Heijman, B., Chen, S., Herti, P. and van Wesenbeeck, I. (2003). Activated carbon adsorption of chloroacetanilide herbicides and their degradation products from surface water supplies. J. Water Supply Res. Technol. AQUA, 52(6): 443-454.
Haist-Gulde, B. et Happel, O. (2012). Removal of pesticides and their ionic degradates by adsorptive processes. Report no. 4022. Water Research Foundation, Denver, Colorado.
Hamada, N. (1988). Combined chronic toxicity and oncogenicity study with bromoxynil phenol in rats: HLA study no. 400-712. Unpublished study prepared by Hazleton Laboratories, Inc. 3213 p. (tel que cité dans : US EPA, 1998)
Harling, R., Burford, P., Fryer S. et al. (1988). Bromoxynil: Preliminary oral toxicity study in beagle dogs: final report - repeated daily dosage for 13 weeks: Lab project number: M&B/245: M&B 245/861692. Unpublished study prepared by Huntingdon Research Center Ltd. 180 p. (tel que cité dans : US EPA, 1998)
Henwood, S. (1992). 13-week dietary toxicity study with bromoxynil octanoate in rats: [Final report]: Lab project number: HWI 6224-170. Unpublished study prepared by Hazleton Wisconsin, Inc. 1022 p. (tel que cité dans : US EPA, 1998)
Higgins, C. (1989). Bromoxynil: Effects upon reproductive performance of rats treated continuously throughout two successive generations: LSR report no. 89/0343. Unpublished study prepared by Life Science Research, Ltd. 789 p. (tel que cité dans : US EPA, 1998)
Hoigné, J. et Bader, H. (1976). The Role of Hydroxyl Radical Reactions in Ozonation Processes in Aqueous Solutions. Wat. Res., 10(5): 377-386.
Holmstrom, M. et McGregor, D. (1982). Bromoxynil: Micronucleus test in CD-1 mice: IRI project no. 705635. Unpublished study received Jan 11, 1983 under 264-204; prepared by Inveresk Research International, submitted by Union Carbide Agricultural Products Co., Inc., Research Triangle, NC; CDL:249219-A. (tel que cité dans : US EPA, 1998)
Holmstrom, M., Innes, D. et Craig, W. (1991). Bromoxynil Phenol: Micronucleus test in bone marrow of CD-1 mice: Lab project number: 8227: 751084. Unpublished study prepared by Inveresk Research International. 68 p. (tel que cité dans : US EPA, 1998)
Holson, J. (1984). Teratology potential of bromoxynil phenol in New Zealand White rabbits: UNC/SAI 1282017. Unpublished study prepared by Science Applications, Inc. 199 p. (tel que cité dans : US EPA, 1998)
Hoppin, J.A., Umback, D.M., Long, S., London, J.S., Hanneberger, P.K., Blair, A., Alavanja, M., Beane Freeman, L.E. et Sandler, P.D. (2017). Pesticides are associated with allergic and non-allergic wheeze among male farmers. Environ. Health Perspect., 125(4): 535-543.
Ikehata, K. and Gamal El-Din, M. (2006). Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and Fenton-type advanced oxidation processes: a review. J. Environ. Eng. Sci., 5(2): 81-135.
Jagannath, D., Brusick, D. et Robenold, C. (1982). Evaluation of the test article bromoxynil phenol (marks) in the bacterial DNA repair test: LBI project no. 20988. Rev. Final Rept. Unpublished study received Oct 5, 1982 under 264-204; prepared by Litton Bionetics, Inc., submitted by Union Carbide Agricultural Products Co., Inc., Research Triangle Park, NC; CDL:248546-E. (tel que cité dans : US EPA, 1998)
Johnson, W.D., Becci, P.J. et Parent, R.A. (1980). The evaluation of the oncogenic potential of bromoxynil administered in the diet to Swiss Albino mice for 18 consecutive months: Laboratory no. 5798. Unpublished study received Jan 23, 1981 under 264-204; prepared by Food and Drug Research Laboratories, Inc., submitted by Union Carbide Agricultural Products Co., Inc., Ambler, Pa.; CDL:244203-A; 244204. (tel que cité dans : US EPA, 1998)
Knappe, D.R.U., Snoeyink, V.L., Roche, P., Prados, M.J. et Bourbigot, M.-M. (1999). Atrazine removal by preloaded GAC. J. Am. Water Works Assoc., 91(10): 97-109.
Kochany, J. et Chaudhry, G.G (1990a). Photochemistry of halogenated benzene derivatives. Part XII. Effect of sodium nitrite on the environmental phototransformation of bromoxynil (3,5-dibromo-4-hydroxybenzonitrile) herbicide in water: The photocorporation of nitrite ions into bromoxynil. Toxicol. Environ. Chem., 27(4): 225-239
Kochany, J. Chaudhry, G.G. et Webster, B. (1990b). Soil organic matter chemistry. Effects of soil fulvic acids on the environmental photodecomposition of bromoxynil (3,5-dibromo-4-hydroxybenzonitrile) herbicide in water. The Sci, Total Envir., 92: 181-188
Kochany, J. (1992). Effect of carbonates on the aquatic photodegradation rate of bromoxynil (3,5-Dibromo-4- hydroxybenzonitrile) herbicide. Chemosphere, 24(8): 1119-1126.
Koutros, S., Silverman, D.T., Alavanja C.R.M., Andreotti, G., Lerro, C.C., Heltshe, S., Lynch, F.C., Sandler, P.D., Blair, A. et Beane Freeman, E.L. (2016). Occupational exposure to pesticides and bladder cancer risk. Int. J. Epidemiol., 45(3): 792-805.
Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39-51.
Lake, G.B. (2018). Human relevance of rodent liver tumour formation by constitutive androstane receptor (CAR) activators. Toxicol. Res., 7(4): 697-717.
Lawlor, T. (1991). Mutagenicity test on bromoxynil phenol in the Salmonella/mammalian-microsome reverse mutation assay (Ames test): Final report: Lab Project Number: 12550-0-401. Unpublished study prepared by Hazleton Washington, Inc. 48 p. (tel que cité dans : US EPA, 1998)
Li, W., Zhao, Y., Yan, X., Duan, J., Saint, C.P. et Beecham, S. (2019). Transformation pathway and toxicity assessment of malathion in aqueous solution during UV photolysis and photocatalysis. Chemosphere, 234: 204-214.
Makin, A. (1993). Bromoxynil octanoate: Toxicity to dogs by repeated oral administration for 13 weeks: Final report: Lab Project Number: RNP 416/930670: RNP 416. Unpublished study prepared by Huntingdon Research Centre, Ltd. 124 p. (tel que cité dans : US EPA, 1998)
Marchado, F., Collin, L. et Boule, P. (1995). Photolysis of bromoxynil (3,5-Dibromo-4- hydroxybenzonitrile) in aqueous Solution. Pestic. Sci., 45(2): 107-110.
Miltner, R.J., Baker, D.B., Speth, T.F. et Fronk, C.A. (1989). Treatment of Seasonal Pesticides in Surface Waters. J. Am. Water Works Assoc., 81(1): 43-52.
Ministère de l'Environnement, de la Protection de la nature et des Parcs de l'Ontario (2020). Communication personnelle avec S. Deshpande.
Ministère de l'Environnement et de la Lutte contre les changements climatiques (2019). Communication personnelle avec P. Cantin.
Muir, D.C.G., Kenny, D.F., Grift, N.P., Robinson, R.D., Titman, R.D. et Murkin, H.R. (1991). Fate and acute toxicity of bromoxynil esters in an experimental prairie wetland. Environ. Toxicol. Chem., 10: 395-406. (tel que cité dans : CCME, 1999a)
Myhr, B. et McKeon, M. (1982). Evaluation of bromoxynil, marks in the primary rat hepatocyte unscheduled DNA synthesis assay: LBI project no. 20991. Final Rept. Unpublished study received Oct 5, 1982 under 264-204; prepared by Litton Bionetics, Inc., submitted by Union Carbide Agricultural Products Co., Inc., Research Triangle Park, NC; CDL:248546-A. (tel que cité dans : US EPA, 1998)
Newfoundland and Labrador Municipal Affairs and Environment (2019). Communication personnelle avec H. Khan
NHMRC et NRMMC (2011). Australian drinking water guidelines Paper 6 national water quality management strategy. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra. Disponible à : https://www.nhmrc.gov.au/about-us/Publications/Australian-Drinking-Water-Guidelines
Noel, P.R., Thomson, M. et Street, A.E. (1965). Chronic toxicity of M & B 10731 (technical grade) in the dog: 1177/65/94:3. Unpublished study received Jun 24, 1965 under unknown admin. no.; prepared by Huntingdon Research Centre, England, submitted by: unspecified. CDL:107617-B. (tel que cité dans : US EPA, 1998)
Nova Scotia Environment (2019). Communication personnelle avec A. Polegato.
OMS (2017a). Directives de qualité pour l'eau de boisson: Quatrième édition intégrant le premier additif. Organisation mondiale de la Santé, Genève, Suisse.
OMS (2017b). Planifier la gestion de la sécurité sanitaire de l'eau pour l'approvisionnement en eau des petites communautés. Organisation mondiale de la Santé, Genève, Suisse.
PEI Department of Communities, Land and Environment (2019). Communication personnelle avec G. Somers.
Plakas, K.V. et Karabelas, A.J (2012). Removal of pesticides from water by NF and RO membranes - a review. Desalination, 287: 255-265.
Preuss, G., Zullei-Seibert, N., Heimlich, N., Nolte, F. (1996). Degradation of the herbicide bromoxynil in batch cultures under groundwater conditions. Int. J. Environ. An. Ch., 58(1-4): 207-213.
Rubin, Y. et Nyska, A. (1987). Bromoxynil tech: Teratology study in the rat: Laboratory project ID AGN/161/BRO. Unpublished study performed by Life Science Research Israel Ltd. 242 p. (tel que cité dans : US EPA, 1998)
Rundell, J. et Matthews, E. (1982). Evaluation of bromoxynil phenol in the in vitro transformation of C3H/10T1/2C1 8 cells sssay: LBI project no. 20992. Final Rept. Unpublished study received Oct 5, 1982 under 264-204; prepared by Litton Bionetics, Inc., submitted by Union Carbide Agricultural Products Co., Inc., Research Triangle Park, NC; CDL:248546-B. (tel que cité dans : US EPA, 1998)
Salama, A.K., Osman, K.A., El-Bakary, S.A. et Salama, M.S. (2016). Tissue distribution and pharmacokinetics of bromoxynil in rat. Int. J. Cur. Res. Rev., 8(4): 54-60.
Santé Canada (2008). Décision de réévaluation. Bromoxynil. RVD2008-21. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa, Ontario.
Santé Canada (2019a). Projet de décision d'examen spécial. PSRD2019-01. Examen spécial du bromoxynil et des préparations commerciales connexes. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa, Ontario.
Santé Canada (2019b). Communication personnelle avec l'Agence de réglementation de la lutte antiparasitaire (ARLA) à la Direction de l'évaluation sanitaire.
Santé Canada (2019c). Recommandations pour la qualité de l'eau potable au Canada. Les virus entériques. Santé Canada, Ottawa, ON. Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-virus-enteriques.html
Santé Canada (2019d). Recommandations pour la qualité de l'eau potable au Canada. Protozoaires entériques : Giardia et Cryptosporidium. Santé Canada, Ottawa, ON. Disponible à : https://www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/qualite-eau/protozoaires-enteriques-giardia-cryptosporidium.html
Santé Canada (2020a). Rapport sur les ventes de produits antiparasitaires en 2018. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa, Ontario.
Santé Canada (2020b). Base de données des limites maximales de résidus pour pesticides (LMR): bromoxynil. Santé Canada. Disponible à : https://pr-rp.hc-sc.gc.ca/mrl-lrm/index-fra.php
Santé Canada (2021a). Communication personnelle avec la Direction de l'évaluation sanitaire, Agence de réglementation de la lutte antiparasitaire (ARLA).
Santé Canada (2021b). Facteurs d'exposition utilisés dans les évaluations des risques pour la santé humaine au Canada. Fiche de renseignements. Santé Canada, Ottawa, Ontario. Disponible à : https://www.canada.ca/fr/sante-canada/services/substances-chimiques/fiches-renseignements/facteurs-exposition-evaluations-risques-sante-humaine-canada.html
Saskatchewan Water Security Agency (2019). Communication personnelle avec S. Ferris.
Sathiakumar, N., MacLennan, P.A., Mandel, J. et Delzell, E. (2011). A review of epidemiologic studies of triazine herbicides and cancer. Crit. Rev. Toxicol., 41(sup.1): 1-34.
Schoutteten, K.V.K.M., Hennebel, T., Dheere, E., Bertelkamp, C., De Ridder, D.J., Maes, S., Chys, M., Van Hulle, S.W.H., Vanden Bussche, J., Vanhaecke, L. et Verliefde, A.R.D. (2016). Effect of oxidation and catalytic reduction of trace organic contaminants on their activated carbon adsorption. Chemosphere, 165: 191-201.
Semchuk, K.M., Rosenberg, M.A., McDuffie, H.H., Cessna, A.J., Pahwa, P. et Irvine, D.G. (2007). Antinuclear antibodies and bormoxynil exposure in a rural sample. J. Toxicol. Environ. Health Sci., 70(7): 638-657.
Services aux Autochtones Canada (2019). Communication personnelle avec X. Redhead.
SGS Environmental Services (2019). Communication personnelle avec D. Griffin. Lakefield, ON.
Smeets, P.W.M.H., Medema, G.J. et van Dijk, J.C. (2009). The Dutch secret: how to provide safe drinking water without chlorine in the Netherlands. Drinking Water Eng. Sci., 2: 1-14.
Speth, T.F. et Adams, J.Q. (1993). GAC and Air Stripping Design Support for the Safe Drinking Water Act, Strategies and Technologies for Meeting SDWA Requirements. Clark, R. and S. Summers, Eds., Lewis Publishers, Ann Arbor, MI, pp. 47-89.
Speth, T.F. et Miltner, R.J. (1998). Technical note: adsorption capacity of GAC for synthetic organics. Jour. AWWA. 90(4): 171-174.
Summers, R.S., Knappe, D.R.U. et Snoeyink, V.L. (2010). Chapter 14: Adsorption of organic compounds by activated carbon. In: Edzwald, J.K. (ed.), Water quality and treatment: A handbook on drinking water. 6th edition. McGraw-Hill, New York, NY.
US EPA (1998). Reregistration Eligibility Decision (RED). Bromoxynil. Office of Prevention, Pesticides and Toxic Substances (7508W). United States Environmental Protection Agency, EPA738-R-98-013, Washington, D.C.
US EPA (2011). Finalization of Guidance on Incorporation of Water Treatment Effects on Pesticide Removal and Transformation in Drinking Water Exposure Assessments.
US EPA (2014). Method 8270D. Semivolatile Organic Compounds by Gas Chromatography/Mass Spectrometry. Revision 5.
Van der Aa, L.T.J., Kolpa, R.J., Rietveld, L.C. et van Dijk, J.C. (2012). Improved removal of pesticides in biological granular activated carbon filters by pre-oxidation of natural organic matter. J. Water Supply Res. Technol. AQUA, 61(3): 153-163.
Van der Bruggen, B. et Vandecasteele, C. (2003). Removal of pollutants from surface water and groundwater by nanofiltration: overview of possible applications in drinking water industry. Environ. Pollut., 122(3): 435-445.
Waite, D.T., Bailey, P., Sproull, J.F., Quiring, D.V., Chau, D.F., Bailey, J. et Cessna, A.J. (2005). Atmospheric concentrations and dry and wet deposits of some herbicides currently used on the Canadian Prairies. Chemosphere, 58(6): 693-703.
Werner, S.L., Burkhardt, M.R. et DeRusseau, S.N. (1996). Methods of analysis by the U.S. Geological Survey National Water Quality Laboratory - Determination of pesticides in water by Carbopak-B solid-phase extraction and high-performance liquid chromatography. U.S. Geological Survey Open-File Report 96-216.
Williams, K. (1992). Subchronic toxicity study with bromoxynil phenol in mice: Final report: Lab project number: HWI 6224-167. Unpublished study prepared by Hazleton Wisconsin, Inc. 294 p. (tel que cité dans : US EPA, 1998)
Williams, K. (1994). Oncogenicity study with bromoxynil phenol in mice: Final report: Lab project number: HWI 6224-174. Unpublished study prepared by Hazleton Wisconsin, Inc. 1929 p. (tel que cité dans : US EPA, 1998)
Wolfe, G. (1990). Bromoxynil subchronic toxicity study in rats: Final report: Lab project number: 400-711. Unpublished study prepared by Hazleton Laboratories America. 619 p. (tel que cité dans : US EPA, 1998)
Yang, Y., Chun, Y., Sheng, G. et Huang, M. (2004). pH-Dependence of Pesticide Adsorption by Wheat-Residue-Derived Black Carbon. Langmuir, 20(16): 6736-3741.
Yang, W., Carmichael, S.L., Roberts, E.M., Kegley, S.E., Padula, A.M., English, P.B. et Shaw, G.M. (2014). Residential agricultural pesticide exposures and risk of neural tube defects and orofacial clefts among offspring in the San Joaquin Valley of California. Am. J. Epidemiol., 179(6): 740-748.
Yao, Y., Harner, T., Blanchard, P., Tuduri, L., Waite, D., Poissant, L., Murphy, C., Belzer, W., Aulagnier, F. et Sverko, E. (2008). Pesticides in the atmosphere across Canadian agricultural regions. Environ. Sci. Technol., 42(16): 5931-5937.
Yukon Environmental Health Services (2019). Communication personnelle avec P. Brooks.
Annexe A : Liste d'abréviations
- ADN
- acide désoxyribonucléique
- AHS
- Agricultural Health Study
- ALT
- alanine-aminotransférase
- ANSI
- American National Standards Institute
- AQA
- apport quotidien acceptable
- ARLA
- Agence de réglementation de la lutte antiparasitaire
- Br-DHBN
- 3-bromo-4,5-dihydroxybenzonitrile
- CAG
- charbon actif en grains
- CAP
- charbon actif en poudre
- CAR
- récepteur constitutif des androstanes
- CAS
- Chemical Abstracts Service
- CCN
- Conseil canadien des normes
- CD-1
- souche de souris
- CHO
- lignée cellulaire ovarienne de hamster chinois
- CL50
- concentration létale médiane
- CLHP-SM
- chromatographie liquide à haute performance avec détection par spectrométrie de masse
- CLHP-UV
- chromatographie liquide à haute performance avec détection par ultraviolets
- CMA
- concentration maximale acceptable
- CSA
- Groupe CSA ou Association canadienne de normalisation
- COT
- concentration en carbone organique total
- CPG-SM
- chromatographie en phase gazeuse avec détection par spectrométrie de masse
- DGSPNI
- Direction générale de la santé des Premières nations et des Inuits
- DL50
- dose létale médiane
- HGPRT
- hypoxanthine-guanine phosphoribosyltransférase
- JG
- jours de gestation
- KOW
- coefficient de partage n-octanol:eau
- LDM
- limite de détection de la méthode
- LPA
- Loi sur les produits antiparasitaires
- MON
- matière organique naturelle
- MWCO
- seuil de rétention des molécules
- NF
- nanofiltration
- NOAEL
- dose sans effet nocif observé
- OH radical hydroxyleOI osmose inverse
- OMS
- Organisation mondiale de la Santé
- p.c.
- poids corporel
- PAL
- phosphatase alcaline
- POA
- procédé d'oxydation avancée
- PPARa
- récepteur-alpha activé de la prolifération des peroxysomes
- SDM
- seuil de déclaration de la méthode
- US EPA
- Environmental Protection Agency des États-Unis (United States Environmental Protection Agency)
- UTN
- unité de turbidité néphélémétrique
- UV
- ultraviolets
- VBS
- valeur basée sur la santé
Annexe B : Données sur la qualité de l'eau au Canada
| Province (année d'échantillonnage) | Nombre de détections/échantillons | LDM (ng/L) | Intervalle (ng/L) | 25e centile (ng/L) | Moyenne (ng/L) | Médiane (ng/L) | 75e centile (ng/L) | |
|---|---|---|---|---|---|---|---|---|
| Min | Max | |||||||
| Eau du robinet | ||||||||
| Alb., Sask., Man. -communautés rurales (2004-2005) |
?/28 | - | 0,99 | 227,00 | - | 12,80 | - | - |
| Eau de surface | ||||||||
| C.-B. - Vallée du bas Fraser et bassin de l'Okanagan (2003-2005) | 0/83 | 0,25 | < 0,25 | - | - | - | - | - |
| Ont. (2003) | 22/162 | 0,99 | 1,13 | 692 | - | - | - | - |
| Ont. (2004) | 81/228 | 0,99 | 1,00 | 110 | - | - | - | - |
| Ont. (2005) | 46/183 | 0,99 | 1 | 45,8 | - | - | - | - |
| Qc (2003) | 1/51 | 20 | < 20 | 50 | - | - | - | - |
| Qc (2004) | 2/70 | 10-20 | < 10 | 40 | - | - | - | - |
| Qc (2005) | 1/59 | 20 | < 20 | 270 | - | - | - | - |
| Rivières | ||||||||
| Alb., Sask., Man. - 8 sites (2003) | 22/64 | 0,99 | < 0,99 | 63,3 | - | - | 1 | - |
| Eau de réservoirs | ||||||||
| Alb., Sask., Man. - 15 sites (2003-2004) |
111/206 | 0,99 | 0,5 | 384 | 0,99 | - | 0,99 | 3,68 |
