Déclaration sur la prévention de l’encéphalite japonaise
Dernière mise à jour partielle du contenu
Septembre 2024:
La déclaration sur la prévention de l'encéphalite japonaise (EJ) a été mise à jour afin d'inclure des directives supplémentaires sur les contraintes de temps pour l'administration de la dose de rappel du vaccin EJ dans les recommandations non fondées sur la méthode GRADE. Cette mise à jour inclut également des modifications à l'Annexe 2 et l'Annexe 3 qui fournis de l'information sur la répartition géographique par pays de EJ.
Table des matières
- Préambule
- Principaux points et messages
- Recommandations GRADE
- Fondement de la recommandation GRADE concernant l'administration du vaccin
- Interprétation des recommandations GRADE
- Recommandations non fondées sur la méthode GRADE
- Introduction
- Contexte
- Méthodologie
- Résultats
- Généralités
- Questions GRADE
- Questions PICO
- Figure 1. Taux de séroconversion du vaccin contre l'encéphalite japonaise chez les adultes (intervalle de confiance de 95 %)
- Questions liées au contexte
- Figure 2. Proportion cumulative de cas d'encéphalite japonaise parmi les voyageurs selon la durée du voyage en jours.
- Figure 3. Proportion de cas d'encéphalite japonaise (n = 66) chez les voyageurs par pays d'exposition
- Tableau 1 : Taux d'attaque clinique global estimé de l'encéphalite japonaise de 2006 à 2015. Selon les statistiques sur les voyages au Canada, la durée moyenne des déplacements dans les régions endémiques était d'environ 15 jours.
- Tableau 2 : Taux d'événements d'EJ prévus (cas cliniques, séquelles à long terme et décès) avec et sans VEJ si le risque global est de 1 cas/11,65 millions de voyages. Exprimé comme taux d'attaque pour 10 millions de voyages dans des régions endémiques.
- Tableau 3 : Nombre de personnes devant être vaccinées afin de prévenir un cas, des séquelles à long terme et le décès à notre seuil de recommandation du VEJ (1 cas/100 000 voyages) et au risque global estimé (1 cas/11 650 000 voyages) d'EJ pour les voyageurs canadiens1.
- Questions non fondées sur la méthode GRADE
- Conclusions et besoins en matière de recherche
- Remerciements
- Conflit d'intérêts
- Références
- Annexe 1. Résumé des résultats de la comparaison du VEJ au placebo : Événements indésirables (EI)
- Annexe 2. Répartition géographique de l'encéphalite japonaise
- Annexe 3. Notes propres aux pays1 sur l'encéphalite japonaise
- Annexe 4. Cadre d'analyse du vaccin contre l'encéphalite japonaise (VEJ)
- Annexe 5. Exemples de stratégie de recherche
- Annexe 6. Résumé des résultats de la comparaison entre le VEJ et le vaccin inactivé dérivé du cerveau de la souris (MBV) : Taux de séroconversion (TSC) et événements indésirables (EI)
- Annexe 7. Résumé des résultats pour la comparaison du calendrier de vaccination habituel du JEV (0, 28 jours) et du calendrier accéléré (0, 7 jours) : Taux de séroconversion (TSC) et événements indésirables (EI)
- Annexe 8. Résumé des résultats de l'évaluation GRADE de l'Advisory Committee on Immunization Practice (ACIP)
- Annexe 9. Évaluation de la qualité concernant le risque d'encéphalite japonaise chez les voyageurs du Canada, des États-Unis et de l'Europe
- Annexe 10. Facteurs à prendre en considération lors de l'évaluation du risque d'exposition d'un voyageur au virus de l'encéphalite japonaise
- Annexe 11. Résumé des études prises en considération pour inclusion dans l'analyse GRADE
Préambule
Le Comité consultatif de la médecine tropicale et de la médecine des voyages (CCMTMV) donne de façon continue à l'Agence de la santé publique du Canada des conseils opportuns de nature médicale, scientifique et de santé publique concernant les maladies tropicales infectieuses et les risques pour la santé associés aux voyages internationaux. L'Agence reconnaît que les conseils et les recommandations formulés dans cette déclaration reposent sur les pratiques médicales et les connaissances scientifiques les plus récentes et les diffuse dans le but d'informer les voyageurs ainsi que les professionnels de la santé qui sont appelés à leur prodiguer des soins.
Les personnes qui administrent ou utilisent des médicaments, des vaccins ou d'autres produits devraient bien connaître la monographie des produits, ainsi que toute autre norme ou instruction approuvée concernant leur usage. Les recommandations relatives à l'usage des produits et les autres renseignements présentés ici peuvent différer de ceux qui figurent dans la monographie ou toute autre norme ou instruction approuvée pertinente établie par les fabricants autorisés. Les fabricants font approuver leurs produits et démontrent l'innocuité et l'efficacité de ceux-ci uniquement lorsque ces produits sont utilisés conformément à la monographie ou à toute autre norme ou instruction approuvée semblable.
Principaux points et messages
- L'encéphalite japonaise (EJ) est une maladie potentiellement mortelle causée par un virus transmis par les moustiques. Elle est endémique presque partout en Asie et aussi dans certaines parties de l'Océanie.
- Depuis 1973, 66 cas d'EJ ont été signalés chez des voyageurs et des expatriés occidentaux, dont deux chez des voyageurs canadiens. On estime que le risque global d'EJ chez les voyageurs est négligeable, soit moins de 1 cas/10 000 000 voyages. Même si un seul cas d'EJ sur dix était signalé, on estime que le risque global est négligeable, c.-à-d. environ 1 cas/1 000 000 voyages.
- Le seul vaccin contre l'EJ actuellement disponible au Canada (VEJ) est le IXIAROMD, un vaccin inactivé produit dans des cellules Vero qui est homologué pour les personnes âgées de deux mois et plusNote de bas de page 1.
- À la suite d'un examen systématique de la documentation, des recommandations relatives à l'administration du VEJ ont été élaborées à l'aide de la méthodologie GRADE (Grading of Recommendations, Assessment, Development and Evaluation). L'évaluation a porté sur les avantages et les risques attribuables au VEJ, l'utilisation d'un calendrier de vaccination accéléré et l'administration du VEJ chez les enfants.
- Aucune donnée probante sur les valeurs et les préférences des voyageurs ou des fournisseurs de soins de santé relatives à l'utilisation du VEJ n'a été trouvée. Toutefois, des données probantes indiquent que certains patients (y compris les voyageurs) choisiront et paieront pour une protection vaccinale contre des maladies rares (p. ex., un risque de 1/100 000), mais graves. Se fondant en partie sur ces données probantes, le CCMTMV a déterminé qu'un risque de contracter l'EJ de 1/100 000 par voyage correspond au seuil à partir duquel la majorité des voyageurs accepteraient les inconvénients, les coûts et les risques attribuables au VEJ.
- Étant donné que l'estimation du risque global de contracter l'EJ par voyage (< 1 cas/10 000 000 ou environ 1 cas/1 000 000 avec un taux de déclaration dix fois plus faible) est considérablement inférieure à ce seuil, nous suggérons de ne pas administrer le VEJ systématiquement pour les voyages dans les régions endémiques.
- Dans certaines circonstances, sur la base de facteurs qui peuvent augmenter le risque (par exemple, exposition en milieu rural, déplacements répétés dans des zones à risque, durée cumulée du voyage plus longue [par exemple,> 30 jours], déplacements dans des zones touchées par une épidémie), le VEJ offrira un avantage absolu relativement plus important et un plus grand nombre de voyageurs choisiront probablement de le recevoir.
Recommandations GRADE
Quand administrer le VEJ
- Le CCMTMV suggère que le vaccin contre l'encéphalite japonaise (VEJ)(IXIAROMD) ne soit pas administré systématiquement aux personnes qui voyagent dans les régions endémiques.
(Recommandation conditionnelle contre l'administration [voir les encadrés 1 et 2 pour savoir ce que le CCMTMV suggère que cela signifie]; niveau de confiance modéré dans l'estimation de l'effet)- Pour la grande majorité des voyageurs, la probabilité de développer une EJ symptomatique lors d'un séjour dans une région d'endémie (voir le tableau 1) est négligeable (le taux global d'attaque par voyage est estimé à environ 1/10 000 000), tout comme l'avantage absolu estimé du VEJ (confiance modérée, risque de biais moyen en raison de la possibilité de cas cliniques non déclarés). Compte tenu des coûts, des inconvénients et du risque potentiel d'effets indésirables, la plupart des voyageurs choisiraient de ne pas recevoir le VEJ dans cette situation.
- La probabilité relative de contracter l'EJ est probablement élevée pour certaines populations (par exemple, voyages de longue durée, exposition dans des zones rurales, voyages multiples dans des zones endémiques et/ou voyages dans une zone touchée par une éclosion) et un plus grand nombre de voyageurs choisiraient de recevoir le vaccin en de telles circonstances (les données probantes relatives aux facteurs de risque n'ont pas été évaluées à l'aide de la méthode GRADE, voir les explications ci-dessous).
- Étant donné que cette recommandation est conditionnelle, les fournisseurs doivent discuter avec le voyageur des avantages et des risques attribuables au vaccin qui sont prévus (y compris les coûts financiers) associés au VEJ afin de l'aider à prendre une décision qui correspond à ses propres valeurs et préférences. La discussion devrait inclure d'éventuelles stratégies de rechange et/ou complémentaires à la vaccination (p. ex., l'utilisation de méthodes de protection personnelle contre les piqûres de moustiques).
- Voir l'encadré 3 pour une liste des facteurs qui influent sur la prise de décisions relatives à l'administration du vaccin contre l'EJ.
- Pour de plus amples renseignements sur la façon dont le CCMTMV est arrivé à cette recommandation, voir « Fondement de la recommandation GRADE concernant l'utilisation de vaccins ».
Administration du vaccin
Le calendrier de dosage habituel du VEJ homologué pour les adultes au Canada est de 2 doses espacées de 28 joursNote de bas de page 1.
- Le CCMTMV suggère d'utiliser un calendrier accéléré (0 et 7 jours) pour les adultes âgés de 18 à 65 ans dans le cas où le calendrier de dosage habituel (jour 0 et jour 28) ne peut être appliqué en raison de contraintes de temps.
(Recommandation conditionnelle pour l'administration; confiance modérée dans l'estimation de l'effet)- Ce calendrier accéléré a été approuvé pour utilisation au CanadaNote de bas de page 1 et en EuropeNote de bas de page 2.
- Le calendrier accéléré a entraîné des niveaux de séroconversion et des effets indésirables semblables à ceux du calendrier habituel.
- Le CCMTMV suggère que le VEJ (calendrier habituel) peut être utilisé chez les enfants âgés de 2 mois à moins de 18 ans.
(Recommandation conditionnelle pour l'administration; confiance modérée dans l'estimation de l'effet)- Le calendrier habituel a été approuvé pour utilisation chez les enfants (de 2 mois à moins de 18 ans) au CanadaNote de bas de page 1 et il est également approuvé aux États-UnisNote de bas de page 3.
- On a constaté que les taux de séroconversion et les taux d'effets indésirables étaient semblables chez les adultes et les enfants.
- Il est recommandé que les enfants âgés de 2 mois à moins de 3 ans reçoivent une dose réduite de vaccin (0,25 ml) comparativement à celle qui est administrée aux enfants plus âgés et aux adultes (0,5 ml)Note de bas de page 1 Note de bas de page 4.
- Bien que le calendrier habituel soit préférable, un calendrier accéléré peut être envisagé (hors étiquette) pour les enfants dans le cas où le calendrier de dosage habituel ne peut être appliqué en raison de contraintes de temps.
Fondement de la recommandation GRADE concernant l'administration du vaccin
Qualité des données probantes
- Efficacité du vaccin :
- confiance modérée dans l'estimation de l'effet
- Risques attribuables au vaccin :
- confiance modérée à élevée dans l'estimation de l'effet
- Risque de base de contracter l'EJ chez les voyageurs :
- confiance modérée dans l'estimation du risque
- Facteurs de risques relatifs à l'EJ :
- données probantes insuffisantes pour formuler une recommandation GRADE
- Valeurs et préférences :
- données probantes insuffisantes pour formuler une recommandation GRADE
Sommaire de l'équilibre des avantages et des risques attribuables au vaccin
On s'attend à ce que le VEJ (IXIAROMD) offre un niveau élevé de protection (>95 %) contre l'EJ (figure 1). De plus, il s'agit d'un vaccin bien toléré. Dans l'essai d'innocuité pivotNote de bas de page 5, le profil d'effets indésirables du VEJ était semblable à celui du placebo, bien que les effets indésirables mineurs, p. ex., la douleur au point d'injection, soient courants (annexe 1; confiance modérée à élevée dans les estimations de l'effet). Les démangeaisons, qui se sont produites moins souvent (RR 0,52; intervalle de confiance [IC] à 95 % de 0,29 à 0,92) avec le VEJ comparativement au placebo, constituaient l'exception.
Toutefois, comme pour d'autres vaccins, des effets indésirables rares, mais graves sont possibles. Ce dernier point devient de plus en plus important avec la diminution du risque d'EJ, en ce sens que la possibilité que des effets indésirables rares, mais graves soient plus prévalents que les cas d'EJ évités par la vaccination augmente.
Au cours de la période allant de 2009 à 2012, 42 effets indésirables ont été signalés à l'US Vaccine Adverse Event Reporting System (VAERS) à la suite de l'administration du VEJNote de bas de page 6. La majorité de ces cas (25/42) ont été signalés après qu'un patient ait reçu plusieurs vaccins, dont le VEJ. En utilisant une estimation de 275 848 doses de vaccin distribuées, le taux global d'EI était de 15,2/100 000 doses, et le taux d'EI grave était de 1,8/100 000 dosesNote de bas de page 6. Les effets indésirables graves les plus fréquemment signalés étaient des réactions d'hypersensibilité (0,7/100 000 doses). Aucun cas d'anaphylaxie ou de décès n'a été signalé. Le VAERS a récemment publié une mise à jour sur les événements liés aux EI signalés au cours de la période 2012-2016. 119 EI ont été déclarés après l'administration du VEJ. Si l'on se fonde sur les quelque 802 229 doses de vaccin distribuées, le taux global d'EI au cours de cette période était de 14,8/100 000 doses. On a signalé 9 EI graves, ce qui correspond à un taux de 1,1/100 000 doses. Les effets indésirables graves comprenaient un rapport d'anaphylaxie et un décès (mort cardiaque causée par une cardiopathie ischémique)Note de bas de page 7. Fait important, les rapports saisis dans le VAERS n'impliquent pas nécessairement des relations causales.
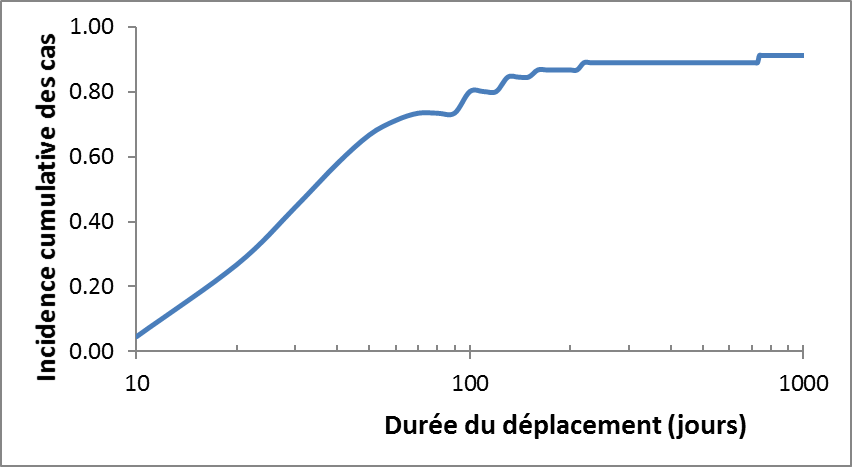
Pour la plupart des voyageurs qui se rendent dans des régions d'endémie, la probabilité de contracter l'EJ est négligeable (estimée à environ 1 cas symptomatique/10 millions de voyages) (tableau 1) et le nombre de personnes devant être vaccinées afin de prévenir un cas est par conséquent très élevé, c'est-à-dire supérieur à 10 000 000 (voir les tableaux 2 et 3). La durée médiane des voyages dans les régions endémiques a été estimée à environ deux semaines (voir la figure 2).
Selon le taux d'attaque global estimé de l'EJ chez les Canadiens se rendant dans les zones d'endémie, soit 1 cas symptomatique/11 650 000 voyages-personne (IC à 95 % [1/2 056 512 à 1/65 996 483]) (durée médiane des voyages estimée à 15 jours), le nombre de personnes devant être vaccinées afin de prévenir un cas d'EJ symptomatique, une séquelle grave d'EJ ou 1 décès lié à l'EJ est respectivement d'environ 12 millions, 33 millions et 49 millions (voir les tableaux 2 et 3). À ce même risque de maladie, on s'attend à ce qu'il y ait environ 5 millions d'EI légers.
Nous n'avons pas trouvé de données précises sur les valeurs et les préférences des voyageurs. Toutefois, il existe des données probantes qui indiquent que certains patients (y compris les voyageurs) choisiront de recevoir une protection vaccinale contre des maladies rares (p. ex., un risque de 1/100 000), mais graves pour laquelle ils seront prêts à payerNote de bas de page 8,Note de bas de page 9.
Le seuil de risque devrait tenir compte des valeurs et des préférences des patients, du risque de contracter l'EJ, de l'efficacité et du profil d'innocuité du VEJ, ainsi que du coût et des inconvénients associés au vaccinNote de bas de page 10. En l'absence de données précises sur les valeurs et les préférences des patients, le comité a jugé que la plupart des voyageurs seraient prêts à accepter les inconvénients, le coût (actuellement plusieurs centaines de dollars) et les risques attribuables au vaccin si le risque d'EJ était de 1/100 000 ou plus, mais pas à des risques moindres. Ce seuil pour l'administration du vaccin est de plusieurs ordres de grandeur supérieur à l'estimation globale du risque de contracter l'EJ. Par conséquent, nous recommandons de ne pas administrer le VEJ de façon systématique pour les déplacements dans les régions d'endémie.
Certaines populations, p. ex., les voyageurs de longue durée (p. ex., plus de 30 jours), les voyageurs qui font de multiples voyages dans des régions d'endémie, les personnes qui séjournent pendant de longues périodes dans des régions rurales, les personnes qui visitent une région touchée par une éclosion d'EJ, sont probablement relativement plus à risque de contracter l'EJ (voir la section ci-dessous sur les facteurs de risque). En raison de la gravité des conséquences possibles de l'EJ et de l'absence de traitements particuliers, il est plausible que les personnes qui sont dans ces situations soient plus susceptibles de choisir de recevoir le VEJ.
Pourquoi la recommandation d'une recommandation conditionnelle?
La recommandation d'utiliser le VEJ est conditionnelle. Cela reflète, entre autres, l'incidence mal définie de facteurs de risque comme la destination, la saisonnalité, l'itinéraire de voyage et la durée du séjour sur le risque lié à l'EJ, ainsi que notre croyance que les voyageurs pourraient avoir des valeurs et des préférences divergentes (y compris la volonté de payer) en ce qui a trait à l'administration du VEJ. Pour une analyse plus détaillée de ce que signifie une recommandation conditionnelle dans le contexte de l'EJ, voir l'encadré 2.
Interprétation des recommandations GRADE
| Catégorie de recommandations basées sur GRADE | Implication pour les praticiens |
|---|---|
| Recommandation forteNote de bas de page * pour | L'équilibre entre les risques et les avantages est tel que la plupart des voyageurs choisiraient l'intervention. |
| Recommandation forte contre | L'équilibre entre les risques et les avantages est tel que la plupart des voyageurs ne choisiraient pas l'intervention. |
| Recommandation conditionnelleNote de bas de page ** pour | Avec une recommandation conditionnelle, différents voyageurs peuvent faire des choix différents. Les praticiens doivent présenter les risques et les avantages de l'intervention et aider chaque voyageur à prendre une décision conforme à ses valeurs et à ses préférences. |
| Recommandation conditionnelle contre | Avec une recommandation conditionnelle, différents voyageurs peuvent faire des choix différents. Les praticiens doivent présenter les risques et les avantages de l'intervention et aider chaque voyageur à prendre une décision conforme à ses valeurs et à ses préférences. |
|
|
Encadré 2 : Que signifie une recommandation conditionnelle dans le contexte du VEJ?
Les recommandations GRADE pour le VEJ sont « conditionnelles ». Cela signifie que la majorité des voyageurs bien informés qui se rendent dans des régions d'endémie choisiraient la ligne de conduite recommandée et n'utiliseraient pas le VEJ. Toutefois, cela signifie également que certains voyageurs choisiraient de recevoir le VEJ. Parmi les raisons pour lesquelles les recommandations sont conditionnelles, citons le très faible risque global de contracter l'EJ lors d'un voyage, l'incidence mal définie de facteurs de risque comme la destination, la saisonnalité, l'itinéraire de voyage et la durée du séjour, et notre croyance selon laquelle les voyageurs pourraient avoir des valeurs et des préférences divergentes en ce qui a trait à l'administration du VEJ.
Appliquées aux voyageurs individuels, nos recommandations pourraient donner lieu aux types suivants de décisions conjointes (voyageurs et cliniciens) :
- On estime que les personnes qui demeurent dans des zones urbaines de pays où l'EJ est endémique pendant des périodes relativement courtes (p. ex., moins d'un mois) présentent un risque extrêmement faible de développer une EJ. Dans cette situation, et compte tenu du coût et des inconvénients de la vaccination, très peu de voyageurs choisiraient de recevoir le VEJ.
- On estime que les personnes qui demeurent plus longtemps dans des zones urbaines de pays d'endémie et/ou qui sont exposées à court terme (p. ex., une semaine) dans des zones rurales présentent un risque relativement plus élevé, mais encore extrêmement faible, de développer une EJ. Très peu de voyageurs choisiraient de recevoir le VEJ dans cette situation.
- Les personnes qui restent plus longtemps (p. ex., plus de 30 jours) dans des zones d'endémie et qui sont exposées en milieu rural pendant la saison de risque sont susceptibles d'avoir un risque relativement plus élevé, mais tout de même très faible, de développer une EJ. Toutefois, il peut y avoir des personnes dans cette population pour lesquelles le risque relatif est considérablement élevé, p. ex., parce qu'elles demeurent dans une région de forte endémie pendant une période prolongée. Dans cette situation, il y aurait beaucoup plus de voyageurs qui choisiraient de recevoir le VEJ, mais un grand nombre d'entre eux, par exemple, en fonction de leurs valeurs et de leurs préférences, choisiraient de ne pas recevoir le vaccin.
Encadré 3 : Points à prendre en considération au moment de discuter du vaccin contre l'EJ (adapté de la référenceNote de bas de page 11)
Raisons qui pourraient accroître la probabilité que le voyageur choisisse de se faire vacciner
- incertitude analytique, c.-à-d. que le risque global pourrait être sous-estimé en raison de la non-déclaration de cas
- gravité de la maladie, taux élevé de décès et fréquence élevée des séquelles graves chez les survivants
- tolérance au risque relativement plus faible pour les maladies « exotiques »
- la personne se rend dans une zone d'épidémie connue
- séjours de plus longue durée, p. ex., plus de 30 jours dans des zones d'endémie avec exposition en milieu rural
- exposition nocturne importante en milieu rural
- déplacements répétés dans les zones à risque (temps cumulé)
- établissement du profil d'innocuité du vaccin
- haut niveau d'efficacité du vaccin
Raisons qui réduisent la probabilité que le voyageur choisisse de se faire vacciner
- très faible risque global pour la grande majorité des voyageurs
- tolérance au risque relativement plus élevée pour les maladies « exotiques »
- coût relativement élevé du vaccin
- voyages en milieu urbain/à court terme
- préoccupations au sujet des effets indésirables liés à la vaccination en général
- inconvénients de la vaccination, y compris les doses multiples
- disponibilité d'interventions de rechange, p. ex., méthodes de prévention des piqûres
Recommandations non fondées sur la méthode GRADE
- Pour les Canadiens (adultes et enfants) qui demeurent à risque et qui souhaitent être protégés par le vaccin, le CCMTMV suggère qu'une seule dose de rappel du VEJ soit administrée de 12 à 24 mois après la série primaire et qu'un deuxième rappel ne soit pas nécessaire pendant au moins 10 ans.
- Après la série primaire, de 80 à 95 % des receveurs du vaccin ayant reçu toutes les doses ont maintenu une réponse immunitaire adéquate après 6 mois et de 58 à 83 % l'ont maintenue après 12 à 15 mois.
- Il existe des données probantes à l'appui qu'une réponse immunitaire adéquate persiste pendant une période prolongée chez les adultes après une dose de rappel (Note de bas de page 12 Note de bas de page 13). Le CCMTMV suggère donc que des doses supplémentaires de rappel ne sont pas nécessaires pendant au moins 10 ans après le rappel initial dans la situation où une protection contre l'EJ est souhaitée.
- Chez les enfants, les données probantes sur la séroprotection à long terme sont limitées, mais suggèrent que les réponses immunitaires sont au moins aussi persistantes chez les enfants que chez les adultesNote de bas de page 14. Pour cette raison, le CCMTMV suggère qu'il est raisonnable de suivre la même approche de deuxième rappel recommandée pour les enfants (hors étiquette) que pour les adultes.
- Le CCMTMV reconnaît qu'il n'existe pas de données directes sur la réponse à une première dose de rappel administrée plus de 24 mois après la série primaire de VEJ dérivé de la culture de cellules Vero (fabriqué sous le nom d'IXIARO au Canada), mais selon un principe général de vaccinologie, il n'est pas nécessaire de recommencer un calendrier de vaccination interrompu. Dans les cas où l'intervalle entre la série primaire et la dose de rappel est supérieur à 24 mois, le calendrier doit être repris, sans qu'il soit nécessaire de répéter la série primaire.
- Chez les adultes de 65 ans et plus, le CCMTMV suggère qu'une seule dose de rappel du VEJ soit considérée plus tôt (avant 12 mois) après la série primaire.
- Le VEJ est généralement bien toléré chez les patients plus âgés, bien que les taux de séroconversion soient plus faibles que chez les adultes plus jeunesNote de bas de page 15.
- L'évaluation du moment précis de l'administration du vaccin devrait être faite au cas par cas si le voyageur demeure à risque pour l'EJ et souhaite être protégé.
- Le CCMTMV recommande que, si un voyageur adulte souhaite recevoir le VEJ et que le calendrier de vaccination habituel ou accéléré ne peut être suivi en raison de contraintes de temps, une dose supplémentaire de vaccin puisse être fournie avec la première dose (jour 0).
- Cette recommandation est fondée sur des données probantes montrant que cette approche permet d'atteindre un taux de séroconversion d'environ 60 % 10 jours après la vaccination, comparativement à environ 30 % après une seule dose. Si cette approche à deux doses est utilisée, les doses subséquentes (si la protection est toujours nécessaire) devraient être administrées de façon conforme au calendrier habituel.
- Le CCMTMV recommande à tous les voyageurs d'utiliser des mesures de protection individuelle (MPI) comme des insectifuges topiques, des moustiquaires de lit traitées et/ou des vêtements traités afin d'éviter les piqûres de moustique.
- Les recommandations en matière de mesures de protection individuelle se trouvent dans la Déclaration relative aux mesures de protection individuelle pour prévenir les piqûres ou morsures d'arthropodes du CCMTMVNote de bas de page 16.
Introduction
L'encéphalite japonaise (EJ) est causée par un flavivirus transmis par des moustiques du genre Culex. Ce virus est l'une des principales causes d'encéphalite virale en Asie : selon les estimations, on répertorie chaque année au moins 70 000 cas et jusqu'à 20 000 décès par an (Note de bas de page 17Note de bas de page 18). L'annexe 2 montre les régions où l'EJ est endémique, et l'annexe 3 fournit des renseignements propres à chaque pays sur les zones de risque et la saisonnalité. Il n'existe pas de traitement spécifique contre l'EJNote de bas de page 4, mais un vaccin contre l'EJ (IXIAROMD) est homologué pour les adultes au CanadaNote de bas de page 1. L'immunisation au moyen d'un vaccin efficace et/ou le recours à des mesures de protection individuelle (MPI) contre les piqûres de moustique offrent une protection substantielle contre la maladie (Note de bas de page 4Note de bas de page 17 Note de bas de page 19 Note de bas de page 20).
Contexte
Caractéristiques cliniques et épidémiologiques
La probabilité de développer une maladie symptomatique après l'infection par le virus de l'EJ est faible (environ 1/250)Note de bas de page 21. Si une maladie symptomatique se développe (après une période d'incubation de 5 à 15 jours), le pronostic est mauvais. Environ 20 à 30 % des patients meurent et, parmi les survivants, environ 50 % ont des séquelles neurologiques et/ou psychologiques à long terme (Note de bas de page 19 Note de bas de page 21). Dans les régions endémiques où il n'y a pas de programme de vaccination, la maladie survient souvent chez les enfantsNote de bas de page 22, alors que les adultes plus âgés, peut-être en raison de la sénescence immunitaire, semblent être le plus à risque de développer la maladie dans les pays/régions dotés de programmes de vaccination robustes et de longue dateNote de bas de page 21.
Le virus se perpétue dans un cycle enzootique dans lequel interviennent des moustiques du genre Culex et des oiseaux sauvages, et le porc joue parfois le rôle d'hôte amplificateurNote de bas de page 21. C'est dans les zones rurales agricoles que l'EJ constitue surtout une menace, et la transmission peut se faire toute l'année avec des pics pendant la saison des pluies (zones subtropicales/tropicales), ou être limitée aux périodes plus chaudes de l'année lorsque les moustiques vecteurs sont actifs (zones tempérées) (Note de bas de page 17 Note de bas de page 23). L'annexe 3 résume les modèles de transmission dans les pays où l'EJ est endémique.
Les programmes de vaccination contre l'EJ, les modifications des pratiques d'élevage et l'urbanisation accrue ont entraîné une réduction majeure du nombre de cas humains d'EJ dans certains pays comme le Japon et la Corée (Note de bas de page 17 Note de bas de page 23). Cependant, l'EJ peut toujours poser un risque pour les personnes non immunisées (p. ex. voyageurs) dans ces pays parce que la transmission peut s'y poursuivre dans un cycle zoonotique.
Vaccin
Le seul vaccin contre l'EJ actuellement disponible au Canada est le IXIAROMD, un vaccin inactivé produit dans des cellules Vero commercialisé au Canada par Valneva Canada et homologué pour les personnes âgées de deux mois et plus. Il est important que ceux qui prescrivent et/ou administrent IXIAROMD lisent la monographie de produitNote de bas de page 1. Les renseignements concernant les caractéristiques importantes de IXIAROMD sont également résumés dans le Guide canadien d'immunisationNote de bas de page 24.
Méthodologie
Généralités
La présente déclaration a été préparée par un groupe de travail (GT) du CCMTMV qui n'a signalé aucun conflit d'intérêts. Le GT, avec l'aide du secrétariat, était responsable de la recherche, de la synthèse et de l'analyse documentaires, de la formulation de questions clés et des recommandations préliminaires ainsi que de la rédaction de la déclaration. La déclaration définitive et les recommandations ont été approuvées par le CCMTMV.
Certaines des recommandations formulées dans la présente déclaration ont été élaborées à l'aide de la méthode GRADE. D'autres des recommandations formulées dans la présente déclaration n'ont pas été élaborées à l'aide de la méthode GRADE, par exemple celles liées aux doses de rappel ou à l'utilisation de mesures de protection individuelle pour prévenir les piqûres de moustiques. Cela ne reflétait pas une absence de données probantes sur ces sujets, mais plutôt une décision de la part du GT et du comité de concentrer les ressources sur les questions cliniques qui étaient jugées les plus susceptibles de bénéficier d'une évaluation des données probantes à l'aide de la méthode GRADE. Les recommandations non fondées sur la méthode GRADE sont fondées sur un examen narratif de la documentation pertinente et sur l'opinion d'experts. Pour de plus amples renseignements sur l'approche du CCMTMV en matière d'élaboration de recommandations et de lignes directrices, voir la déclaration sur le Processus fondé sur les preuves pour l'élaboration de lignes directrices et de recommandations liées à la médecine de voyage et à la médecine tropicaleNote de bas de page 10.
Voici un résumé du processus utilisé pour élaborer la présente déclaration et les recommandations :
Recommandations GRADE
- Un cadre analytique définissant les mesures préventives cliniques (interventions) et les facteurs de risque pour l'EJ a été élaboré (annexe 4).
- À partir du cadre analytique, le groupe de travail a cerné des concepts clés sous la forme de question d'intérêt « PICO » (population of interest [population d'intérêt], intervention [intervention], comparison [comparaison] et outcome [résultat]) afin d'élaborer des recommandations GRADE ciblées. Les données probantes sur l'efficacité et les risques attribuables au VEJ ont été prises en compte pour chaque question PICO.
Les questions d'intérêt PICO suivantes ont été formulées :
- Chez les voyageurs canadiens adultes, l'administration du VEJ (calendrier habituel) diminue-t-elle le risque de contracter l'EJ par comparaison à la non-vaccination (placebo)?
- Chez les voyageurs canadiens adultes, l'utilisation d'un calendrier de vaccination accéléré pour le VEJ (jours 0 et 7) permet-elle d'atteindre des niveaux de protection semblables ou supérieurs à ceux d'un calendrier normal (jours 0 et 28)?
- Chez les enfants canadiens, l'administration du VEJ permet-elle d'atteindre des niveaux de protection semblables à ceux observés chez les voyageurs adultes, et l'administration du VEJ est-elle associée à des effets indésirables semblables à ceux qui sont observés chez les adultes?
- D'autres concepts du cadre analytique ont été identifiés pour appuyer l'évaluation fondée sur la méthode GRADE, mais ont été définis comme des questions non PICO. Les questions contextuelles suivantes ont été cernées :
- Quel est le risque de développer une EJ symptomatique chez les voyageurs canadiens?
- Quels sont les facteurs de risque importants de l'EJ chez les voyageurs canadiens (p. ex., destination, durée du voyage)?
- Quelles sont les valeurs et les préférences des voyageurs canadiens en ce qui concerne l'ampleur de la réduction des risques liés à l'EJ qui rendrait l'utilisation du VEJ recommandable compte tenu des coûts et des inconvénients connexes?
- Les données probantes ont été extraites en effectuant des recherches dans des bases de données électroniques (Ovid MEDLINE, Embase, Global Health et Scopus) et en effectuant des recherches manuelles dans Google pour trouver des données non officielles. La période de recherche a commencé des premières publications jusqu'en juin 2015. Il y a eu 2 recherches documentaires : 1. Vaccin contre l'EJ (efficacité et risques attribuables au vaccin) et voyageurs et 2. Risque de base et facteurs de risque pour le développement de l'EJ chez les voyageurs. Des renseignements détaillés sur les stratégies de recherche et les dates sont donnés à l'annexe 5. Deux membres du GT ont appliqué les critères d'inclusion et d'exclusion aux études identifiées, en fonction d'une sélection initiale des titres et des résumés. Les études ont été exclues si elles semblaient non pertinentes, n'étaient pas publiées en anglais ou en français, ou s'il s'agissait de doublons.
- Ces recherches ont permis de trouver des documents pertinents. S'il n'y avait pas de données probantes portant sur les voyageurs canadiens, on a extrait des données provenant d'autres populations occidentales ou d'autres populations, dans cet ordre de préférence.
- Des évaluations de la qualité ont été effectuées pour l'efficacité du vaccin et les événements indésirables (EI) et le risque de développer l'EJ chez les voyageurs. Les résultats ont été regroupés en tableaux de résumé des conclusions (voir les annexes 5-7 et 9). Nous avons décidé qu'il n'y avait pas suffisamment de données probantes pour soumettre les autres questions au processus GRADE.
- Les recommandations ont été élaborées en tenant compte de ce qui suit Note de bas de page 10 :
- la confiance du CCMTMV dans les estimations de l'effet pour l'efficacité du JEV et les EI qui lui sont associés;
- l'équilibre des risques attribuables au vaccin et des avantages;
- Le jugement du CCMTMV sur les valeurs et les préférences des voyageurs ou des fournisseurs de soins de santé relatives à l'utilisation du VEJ.
Recommandations non fondées sur la méthode GRADE
- D'autres des questions n'ont pas été sélectionnées pour l'examen fondé sur la méthode GRADE par le groupe de travail. Il s'agissait des questions suivantes :
- Quel est l'intervalle de rappel approprié pour le VEJ?
- Chez les voyageurs canadiens plus âgés (âgés de plus de 65 ans), l'administration du VEJ permet-elle d'atteindre des niveaux de protection semblables à ceux des voyageurs adultes?
- L'administration d'une dose supplémentaire de vaccin au jour 0 permet-elle d'obtenir un taux de séroconversion plus élevé qu'une seule dose?
- Les mesures de protection individuelle offrent-elles une protection contre les piqûres du ou des types de moustiques qui transmettent l'EJ?
- Les données probantes pertinentes à ces questions ont été identifiées dans le cadre de la recherche documentaire précédemment décrite, ou ont été extraites des déclarations existantes du CCMTMV. Les recommandations sont fondées sur un examen narratif des données probantes et sur l'opinion d'experts.
Résultats
Généralités
La recherche documentaire sur le vaccin contre l'EJ et les voyageurs a permis d'identifier 423 études, dont 310 ont été exclues. La recherche sur les facteurs de risque pour l'EJ a permis de relever 131 études, dont 127 ont été exclues. Les 117 autres articles pertinents portaient sur les risques attribuables au vaccin et/ou ses avantages (n = 36), la dose de rappel (n = 10), le calendrier accéléré (n = 4), l'utilisation pédiatrique (n = 6) et les facteurs de risque (n = 4). De plus, 57 études portant sur le fardeau de la maladie (incidence, morbidité, mortalité, hospitalisations) chez les voyageurs, les facteurs de risque propres à la population (p. ex., âge), les facteurs de risque propres à l'itinéraire (p. ex., destination, durée du voyage), l'efficacité des mesures de prévention (p. ex., mesures de protection individuelles) et/ou le traitement/la prise en charge de la maladie ont été retenus. Une fois la recension des écrits terminée, une étude supplémentaire sur les valeurs et les préférences a été identifiée et incluseNote de bas de page 8. De plus, en 2018, une mise à jour de la monographie de produit de IXIAROMDNote de bas de page 1 a été publiée avec des recommandations élargies pour utilisation au Canada et a été utilisée comme référence.
Questions GRADE
Questions PICO
Chez les voyageurs adultes canadiens, l'administration du VEJ (calendrier habituel) diminue-t-elle le risque de contracter l'EJ par comparaison à la non-vaccination (placebo)?
Nous n'avons pas trouvé de données probantes montrant que le VEJ réduit l'incidence de l'EJ (et des risques connexes attribuables au vaccin) chez les voyageurs qui se rendent dans des régions d'endémie. L'efficacité est plutôt déduite des études utilisant des corrélats sérologiques de protection. L'efficacité du VEJ (IXIAROMD) a d'abord été établie par une comparaison de la non-inférioritéNote de bas de page 25 au vaccin inactivé contre l'EJ dérivé du cerveau de la souris (MBV), commercialisé sous le nom JEVAX, qui n'est plus homologué au Canada. La protection a été définie en utilisant le taux de séroconversion (TSC) comme paramètre, c.-à-d. un PRNT50 < 10 au niveau de référence et ≥ 10 après la vaccination, ou une augmentation de 4 fois par rapport à un niveau de référence de ≥ 10Note de bas de page 17. Les données probantes dérivées de cet essaiNote de bas de page 25, qui comprenaient des résultats en matière d'innocuité et d'immunogénicité, sont résumées aux annexes 1 et 6. Le VEJ et le MBV ont obtenu de bons résultats pour ce qui est de l'obtention d'un TSC élevé (> 95 % des personnes vaccinées) (confiance modérée dans les estimations de l'effet, qualité des données probantes évaluée à la baisse pour caractère indirect compte tenu du fait que la séroconversion est un substitut de la protection). Les vaccins étaient associés à des taux similaires d'effets indésirables systémiques; toutefois, les réactions locales étaient plus courantes avec le MBV (confiance élevée dans l'estimation de l'effet).
D'autres études, sans comparateur, ont démontré de façon constante que 2 doses de VEJ (jours 0 et 28) permettent d'obtenir un TSC élevé (Note de bas de page 15Note de bas de page 26 Note de bas de page 27 Note de bas de page 28 Note de bas de page 29 Note de bas de page 30 Note de bas de page 31). Les résultats de ces études sont résumés à la figure 1.
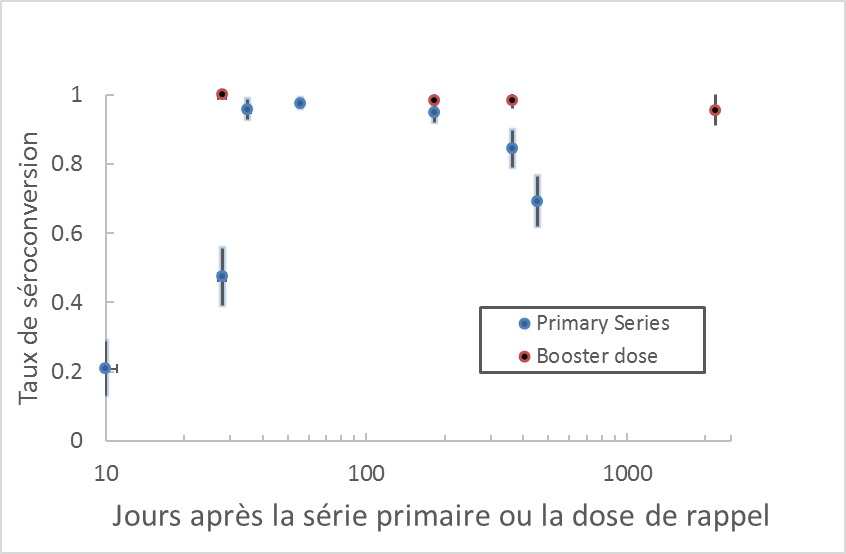
Données extraites de 9 études (Note de bas de page 12 Note de bas de page 13 Note de bas de page 15Note de bas de page 25 Note de bas de page 26 Note de bas de page 27 Note de bas de page 28 Note de bas de page 29 Note de bas de page 30).
Chez les voyageurs canadiens adultes, l'utilisation d'un calendrier de vaccination accéléré pour le VEJ (jour 0 et 7) permet-elle d'atteindre des niveaux de protection semblables ou supérieurs à ceux d'un calendrier normal (jour 0 et 28)?
Chez les adultes, l'administration du VEJ selon un calendrier de vaccination accéléré (première dose le jour 0 et deuxième dose le jour 7) a donné des résultats semblables à ceux du calendrier normal (1 dose aux jour 0 et 28) (confiance modérée dans l'estimation de l'effet) (annexe 7). À un point temporel semblable (10 à 14 jours) après la dose initialeNote de bas de page 26, le calendrier accéléré était associé à un TSC (RR 3,95; IC à 95 %, 3,16 à 4,92) beaucoup plus élevé que le calendrier normal (faible confiance dans l'estimation de l'effet). Les profils d'innocuité (annexe 7) du calendrier accéléré et du calendrier normal étaient semblables (confiance modérée à élevée dans les estimations de l'effet). Ce calendrier accéléré a récemment été approuvé pour utilisation au Canada pour les adultes de 18 à 65 ansNote de bas de page 1.
Chez les enfants canadiens, l'administration du VEJ permet-elle d'atteindre des niveaux de protection semblables à ceux observés chez les voyageurs adultes, et l'administration du VEJ est-elle associée à des risques semblables à ceux qui sont observés chez les adultes?
La recension des écrits a permis de trouver les évaluations GRADE publiées en 2013 par le United States Advisory Committee on Immunization Practices (ACIP)Note de bas de page 32. Ces travaux portaient spécifiquement sur la question « Devrait-on recommander l'administration du vaccin inactivé contre l'encéphalite japonaise dérivé de la culture de cellules Vero (JE-VC) chez les enfants de 2 mois à 16 ans qui présente un risque accru d'exposition au virus de l'encéphalite japonaise liée au voyage ». Les adultes ont été inclus dans les analyses à titre de comparateur. Nous avons jugé que l'analyse GRADE de l'ACIP pouvait être utilisée pour répondre à notre question PICO : « Chez les enfants canadiens, l'administration du VEJ permet-elle d'atteindre des niveaux de protection semblables à ceux observés chez les voyageurs adultes? » Nous n'avons pas trouvé de données probantes supplémentaires pertinentes publiées depuis cette recension dans notre recherche documentaire.
L'ACIP a conclu que le TSC (confiance modérée dans l'estimation de l'effet) et les taux d'effets indésirables graves (faible confiance dans l'estimation de l'effet) ou systémiques (confiance modérée dans l'estimation de l'effet) étaient semblables chez les adultes et les enfants (voir l'annexe 8). Une explication complète de l'évaluation de la qualité de la preuve est disponible ailleursNote de bas de page 32. Brièvement, on a évalué la qualité des données probantes à la baisse en raison de leur caractère indirect (p. ex., parce que l'efficacité n'a pas été mesurée directement et/ou parce que les données probantes ont été élaborées principalement avec des adultes) et des sources possibles de biais (p. ex., études en non insu). L'administration du VEJ chez les enfants âgés de 2 mois à moins de 18 ans a récemment été approuvée au CanadaNote de bas de page 1.
On n'a pas trouvé de données probantes à l'appui de l'utilisation d'un calendrier accéléré chez les enfants et l'utilisation d'un calendrier accéléré chez les enfants n'est pas approuvée au CanadaNote de bas de page 1. Par conséquent, le calendrier de vaccination normal du VEJ devrait être utilisé pour les enfants dans la mesure du possible. Toutefois, il semble raisonnable d'utiliser un calendrier accéléré non indiqué sur l'étiquette pour les enfants dans les cas où le temps ne permet pas d'utiliser le calendrier habituel, surtout pour les enfants plus âgés.
Questions liées au contexte
Quel est le risque de développer une EJ symptomatique chez les voyageurs canadiens?
Le tableau 1 présente les estimations de la probabilité de développer une EJ symptomatique lors des déplacements. Pour les calculs, le numérateur reflète le nombre de cas publiés sur une période de 10 ans (2006-2015). Nous avons utilisé des cas identifiés dans les données d'un examen précédentNote de bas de page 33 publié en 2010 et nous avons identifié des rapports plus récents (Note de bas de page 34 Note de bas de page 35 Note de bas de page 36 Note de bas de page 37 Note de bas de page 38 Note de bas de page 39 Note de bas de page 40 Note de bas de page 41) en appliquant la stratégie de recherche décrite dans l'examen. Pour être inclus, les cas publiés doivent avoir été ceux d'un voyageur revenant au Canada, aux États-Unis ou en Europe. Pour le dénominateur, nous avons utilisé les statistiques sur les voyages à l'étranger pour le Canada, les États-Unis et l'Europe (Note de bas de page 42 Note de bas de page 43 Note de bas de page 44).
Nous estimons que la probabilité de développer une EJ symptomatique est d'environ 1/10 000 000 de voyages (confiance modérée dans l'estimation de l'effet) pour le Canada, les États-Unis et l'Europe (tableau 1). La qualité de l'ensemble des données probantes a été évaluée à la baisse en raison du risque de biais (annexe 9), c.-à-d. qu'il se peut que ce ne soit pas tous les cas de voyageurs qui aient été signalés dans la documentation. À cet égard, bien que nous ne puissions pas être certains de la mesure dans laquelle les cas sont sous-déclarés, on a laissé entendreNote de bas de page 33 que la majorité des cas sont identifiés dans la littérature. De plus, même si l'on supposait que seulement un cas d'EJ sur 10 chez les voyageurs était signalé, le risque global de l'EJ demeurerait très faible, soit environ 1 cas/1 000 000 de voyages.
Des estimations antérieures pour les voyageurs américains et européens (Note de bas de page 11 Note de bas de page 45) ont également indiqué un risque global très faible pour l'EJ.
Quels sont les facteurs de risque importants de l'EJ chez les voyageurs canadiens (p. ex., destination, durée du voyage)?
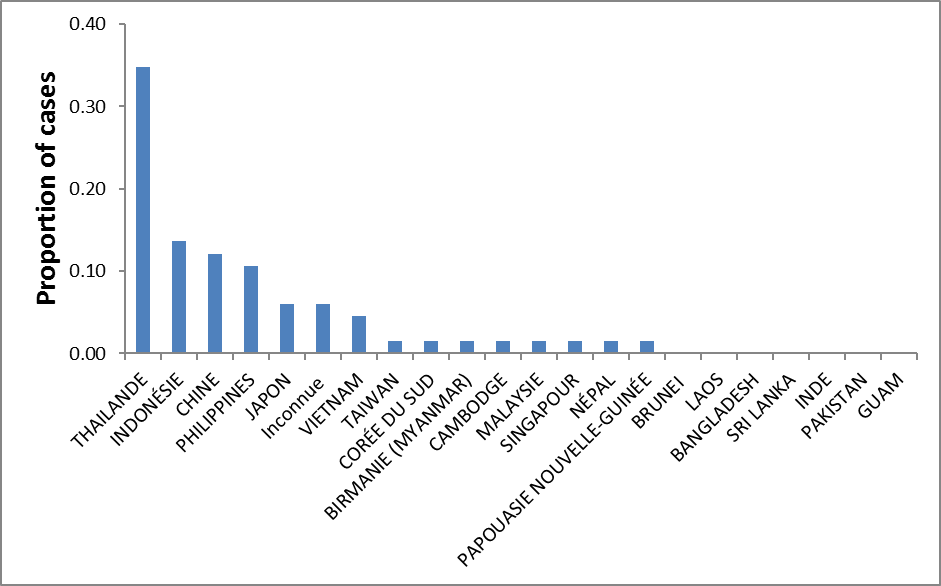
Pour la période de 2006 à 2015, nous avons recensé 18 rapports publiés sur l'EJ, dont 17 concernaient des voyageurs revenant au Canada (1 cas), aux États-Unis (5 cas) ou en Europe (11 cas). L'inclusion des rapports publiés avant 2006 a porté le nombre total de cas à 67. Un seul des cas identifiés ne concernait pas un voyageur de l'hémisphère occidental et a donc été exclu de l'analyse. Dans l'ensemble, le taux de mortalité était de 20 % (12/60) (résultat inconnu dans 6 cas); la plupart des cas étaient des hommes (59 %); l'âge moyen des cas était de 39 ans, et la durée moyenne des déplacements était de 35 jours (figure 2). Les pays auxquels l'exposition était le plus souvent attribuée étaient la ThaïlandeNote de bas de page 27, l'IndonésieNote de bas de page 46, la ChineNote de bas de page 47 et les PhilippinesNote de bas de page 48 (figure 3).
Nous estimons que les cas d'EJ associée aux déplacements sont rare, ce qui correspond aux estimations antérieuresNote de bas de page 11. Toutefois, il est également largement admis que certaines sous-populations de voyageurs sont relativement plus à risque de contracter l'EJ, par exemple, ceux qui voyagent pendant une période prolongée et/ou ceux qui passent beaucoup de temps dans des régions rurales où les vecteurs sont plus répandus (Note de bas de page 33 Note de bas de page 45 Note de bas de page 49 Note de bas de page 50 Note de bas de page 51 Note de bas de page 52 Note de bas de page 53). Nous n'avons pas trouvé de données probantes (études d'observation ou essais randomisés) qui permettraient d'établir des estimations robustes de l'incidence différentielle de ces facteurs sur le risque, et pour cette raison, nous n'avons pas évalué ces données probantes avec la méthode GRADE. D'après les cas d'EJ contractée pendant un voyage qui ont été identifiés (n = 66, voir ci-dessus), nous faisons néanmoins les observations suivantes :
- Parmi les cas où l'âge est connu (n = 57), il n'y a pas de tendance évidente associée à l'âge, p. ex., les enfants de 10 ans ou moins (5 cas) représentaient 9 % du total et les adultes de 60 ans ou plus (12 cas) représentaient 21 % du total.
- Il y a une tendance à la hausse de la probabilité de contracter l'EJ pendant les déplacements à plus long terme. Plus précisément, il y a environ deux fois plus de cas pour une durée médiane de déplacement de 35 jours (figure 2) en comparaison avec une durée médiane de 15 jours et ce, pour tous les déplacements dans les régions d'endémie (Note de bas de page 43 Note de bas de page 44). Il n'y a toutefois pas de limite claire quant à la durée du voyage en deçà de laquelle le risque est absent (des cas ont été signalés chez des voyageurs à court terme) ou à la durée de déplacement à laquelle la probabilité de contracter la maladie franchit un « seuil » incitant à recevoir le VEJ.
- Les cas publiés font souvent état d'itinéraires qui comprennent une exposition en milieu ruralNote de bas de page 33. Toutefois, l'activité rurale n'est pas un facteur de risque universel et, dans la situation où l'on passe du temps dans les régions rurales et urbaines, la composante rurale du voyage ne peut pas être considérée comme l'activité liée à l'exposition. Par conséquent, bien qu'il y ait un consensus selon lequel les activités dans les régions rurales sont « plus risquées », l'ampleur absolue de l'augmentation du risque est inconnue.
La façon dont ces facteurs et d'autres pourraient être utilisés dans le cadre d'une évaluation des risques pour une personne voyageant dans une zone à risque d'EJ est décrite à l'annexe 10.
| Région d'embarquement | Nombre de cas | Volume estimatif de voyages (en millions) 2006-2015 | Taux d'attaque global (cas/voyages) chez les voyageurs (intervalle de confiance de 95 %), 2006-2015Note de bas de page 6 |
|---|---|---|---|
| Canada | 1Note de bas de page 1 | 11,65Note de bas de page 3 | 1/11 650 000 (1/2 056 512 à 1/65 996 483) |
| États-Unis | 5Note de bas de page 2 | 55,4Note de bas de page 4 | 1/11 078 000 (1/4,731859 à 1/25 935 276) |
| Europe | 11Note de bas de page 2 | 150Note de bas de page 5 | 1/13 636 363 (1/7 614 592 à 1/24 420 2750) |
|
|||
| Groupe | EJ clinique (pas de vaccin) | EJ clinique (avec vaccin) | Séquelles de l'EJ (pas de vaccin) | Séquelles de l'EJ (avec vaccin) | Décès (aucun vaccin) | Décès (avec vaccin) |
|---|---|---|---|---|---|---|
| Taux d'attaque (événements/10 000 000 voyages) | ||||||
| Voyageurs canadiens dans des régions endémiques | 0,858 | 0,043 | 0,322 | 0,016 | 0,215 | 0,011 |
|
||||||
| Risque de base (aucun vaccin) | EJ clinique | Séquelles graves | Décès |
|---|---|---|---|
| 1/100 000 | 105 263 | 280 702 | 421 053 |
| 1/11 650 000 | 12 263 158 | 32 701 754 | 49 052 631 |
|
|||
Quelles sont les valeurs et les préférences des voyageurs en ce qui concerne l'ampleur de la réduction des risques d'EJ qui rendrait l'administration du VEJ recommandable compte tenu des coûts et des inconvénients connexes?
L'administration de vaccins pour prévenir l'EJ peut être rentable dans les pays où elle est endémique (Note de bas de page 17 Note de bas de page 54 Note de bas de page 55 Note de bas de page 56 Note de bas de page 57 Note de bas de page 58). Toutefois, il s'agit de scénarios où le fardeau de la maladie est relativement élevé et le coût de l'intervention relativement réduit par rapport au contexte de voyage typique. De plus, le rapport coût-efficacité peut être discutable pour les voyageurs, car ce sont souvent eux qui paient pour les vaccins administrés en raison d'un voyage. Nous n'avons pas trouvé de données précises sur les valeurs et les préférences des voyageurs en ce qui concerne le VEJ, y compris leur volonté de payer pour la protection offerte par un vaccin.
En ce qui concerne d'autres immunisations contre des maladies à faible probabilité, mais à risque élevé (comme l'EJ), il y a des données probantes à l'appui que les patients sont parfois prêts à payer une somme modeste pour être protégés. Par exemple, une expérience en choix discretNote de bas de page 9 a montré que les patients, en moyenne, étaient prêts à payer environ 250 à 300 dollars australiens pour la protection offerte par un vaccin contre le méningocoque B qui était : efficace à 90 %; nécessitait une seule dose primaire; assurait une protection qui durait 10 ans et qui n'avait pas d'effets négatifs. Toutefois, la volonté de payer diminuait considérablement si les caractéristiques du vaccin ne répondaient pas à ces normes de rendement, p. ex., si l'efficacité était inférieure à 90 %, la durée de la protection était plus courte, il y avait des effets indésirables associés et/ou plus d'une injection était nécessaire. De même, une étude en choix discret chez les voyageurs qui acceptaient de payer pour des vaccins de voyage hypothétiques a révélé que le risque de maladie, la gravité de la maladie et le coût de l'intervention étaient les facteurs ayant la plus grande incidence sur la prise de décisionNote de bas de page 8. De plus, les répondants à l'étude ont montré un biais important en faveur du non refus de la vaccination, jusqu'à un niveau de risque de 1/100 000. Les niveaux de risque moins élevés, p. ex., que l'on connaîtrait normalement pour l'EJ, n'ont pas été évalués dans le cadre de l'étude, pas plus que l'aspect de l'innocuité des vaccins hypothétiques.
Si la volonté de payer était influencée par des facteurs semblables pour le VEJ, certains voyageurs pourraient être prêts à payer pour recevoir le vaccin malgré le faible risque de maladie. Cela serait tempéré par les caractéristiques du vaccin perçues comme étant sous-optimales, ce qui, à son tour, entraînerait une réduction de la volonté de payer. Pour le VEJ, cela comprendrait l'exigence de doses multiples et la durée relativement courte de la protection après la vaccination primaire.
Questions non fondées sur la méthode GRADE
Quel est l'intervalle de rappel approprié pour le VEJ?
Dans les essais cliniques menés à ce jour, le titre d'anticorps protecteurs induits par la série primaire de VEJ a diminué graduellement au fil du temps, de 80 à 95 % des receveurs du vaccin entièrement immunisés conservant des anticorps adéquats après 6 mois et de 58 à 83 % maintenant des taux adéquats après 12 à 15 mois (Note de bas de page 1 Note de bas de page 13 Note de bas de page 30 Note de bas de page 59). 24 mois après l'administration de la série primaire, les données sont moins claires, une étude indiquant que seulement 48 % des patients ont conservé un niveau de séroprotectionNote de bas de page 59 et une autre étude montrant que 82 % ont maintenu un TSC adéquatNote de bas de page 1.
Une étude clinique de phase 3 menée auprès de 198 sujets en Autriche et en Allemagne a révélé que l'administration d'une dose de rappel 15 mois après la série primaire augmentait le TSC à 100 % à 28 jours et que le TSC demeurait à 99 % 12 mois après la dose de rappelNote de bas de page 13. Une prolongation de l'essai qui a suivi un sous-ensemble des participants précédents (n = 67) a permis de démontrer une protection à long termeNote de bas de page 12. Au 76e mois, 96 % des participants avaient un TSC adéquatNote de bas de page 12 (voir la figure 1). Les moyennes géométriques des titres (MGT) stratifiées selon l'âge, le sexe et les vaccins antérieurs ont été examinées. On a constaté des différences selon l'âge, les participants de plus de 50 ans (n = 6) présentant des MGT statistiquement significativement plus faibles que les participants de moins de 50 ans, bien que la taille de l'échantillon ait été très petiteNote de bas de page 12.
Les données sur l'immunogénicité d'un vaccin de rappel chez les enfants demeurent limitées. Les données d'une petite étude sur les enfants (n = 18) provenant de régions où l'EJ n'est pas endémique ont montré que, bien que les titres des anticorps aient diminué au fil du temps, le TSC était encore élevé (89 %) 36 mois après la vaccinationNote de bas de page 14. Une étude pédiatrique plus vaste portant sur 149 enfants et adolescents d'une région d'endémie a révélé des résultats semblables, avec un TSC de plus de 80 % dans tous les groupes d'âge jusqu'au 36e moisNote de bas de page 14. Bien que limitées, les données disponibles suggèrent que les réponses immunitaires sont au moins aussi persistantes chez les enfants que chez les adultes.
Les premières probantes données dérivées d'un modèle mathématique basé sur les titres après les doses primaires et 12 mois après l'administration d'une dose de rappel ont prédit que 50 % des receveurs de vaccin demeureraient protégés après 8 ansNote de bas de page 13. Une estimation par modélisation mise à jour basée sur des données à 76 mois indique qu'un seul rappel peut fournir une période de protection encore plus longue que ce qui avait été estimé précédemmentNote de bas de page 12. Des renseignements supplémentaires sur la durée de la protection stratifiés par sous-groupes de population d'intérêt sont requis.
Selon les données disponibles pour l'humain, il semble raisonnable d'administrer une seule dose de rappel de VEJ si la série primaire a été administrée plus d'un an auparavant. En 2011, l'ACIP a déclaré qu'une dose de rappel pouvait être administrée si la série primaire avait été administrée plus d'un an auparavant et qu'il y avait un risque d'exposition au virus de l'EJNote de bas de page 20. En 2018, la monographie canadienne de IXIAROMD a été mise à jourNote de bas de page 1 et recommande maintenant que les adultes et les enfants reçoivent une dose de rappel de 12 à 24 mois après la série primaire, avant la réexpositionNote de bas de page 1.
Une deuxième dose de rappel est suggérée chez les adultes (âgés de 18 à 65 ans) dans la monographie canadienne, 10 ans après le premier rappelNote de bas de page 1 et avant toute nouvelle exposition. Une approche similaire a été approuvée par l'Agence européenne des médicamentsNote de bas de page 2. Chez les enfants, les données probantes sur la séroprotection à long terme sont limitées, mais suggèrent que les réponses immunitaires sont au moins aussi persistantes chez les enfants que chez les adultes. Pour cette raison, le CCMTMV suggère qu'il est raisonnable de suivre la même approche de deuxième rappel recommandée pour les enfants (hors étiquette) que pour les adultes.
Chez les voyageurs canadiens plus âgés (âgés de plus de 65 ans), l'administration du VEJ permet-elle d'atteindre des niveaux de protection semblables à ceux des voyageurs adultes?
En général, les personnes âgées sont plus susceptibles d'être infectées et de développer une maladie plus grave, peut-être en raison de l'immunosénescence, d'obstacles physiques à l'infection moins robustes et de comorbidités médicalesNote de bas de page 60. Il convient de noter que seule une infime minorité des participants à d'importants essais cliniques sur le VEJ qui ont établi l'innocuité et l'efficacité semblent avoir été âgés de plus de 65 ansNote de bas de page 13Note de bas de page 15Note de bas de page 25Note de bas de page 30Note de bas de page 31Note de bas de page 61. Fait intéressant, entre 2009 et 2012, 9,8 % des voyageurs évalués dans les cliniques de médecine du voyage Global TravEpiNet aux États-Unis qui ont été jugés à risque de contracter l'encéphalite japonaise étaient âgés de plus de 65 ansNote de bas de page 62. Cette proportion pourrait augmenter : de 2012 à 2015, le nombre annuel de voyageurs canadiens âgés de 54 ans et plus qui visitent les régions à risque d'EJ est passé d'environ 600 000 à plus d'un millionNote de bas de page 43. Heureusement, entre 2009 et 2012, aucun des 42 EI ayant suivi la vaccination par le VEJ aux États-Unis qui ont été signalés dans le Vaccine Adverse Event Reporting System n'avait affecté une personne de plus de 60 ansNote de bas de page 6.
Un essai clinique ouvert de phase IV non contrôlé par placébo du VEJ a été réalisé chez des adultes en santé âgés de plus de 65 ans afin d'évaluer son innocuité et son immunogénicité chez cette population spécifiqueNote de bas de page 15. Sur les 249 personnes qui se sont présentées dans des cliniques de médecine de voyage et des sites d'essai clinique du vaccin, 200 ont reçu la première dose et 193 ont reçu une deuxième dose 28 jours plus tard. La séroconversion a été observée chez 65 % (IC à 95 % 58 à 71 %) au jour 70. Aucune différence significative n'a été observée chez les adultes de 65 à 74 ans et chez ceux de plus de 75 ans. Ces TSC semblent être beaucoup plus faibles que ceux observés lors d'essais antérieurs portant sur des adultes plus jeunesNote de bas de page 25. Les auteurs ont postulé que la durée de la protection peut également être beaucoup plus courte chez les personnes âgées et ont recommandé d'envisager la vaccination de rappel avant un an après la série primaire, bien qu'ils n'aient pas précisé exactement quel devrait être l'intervalle optimal de rappel. Seule une petite minorité des personnes (24 sur 200, 12 %) avait plus de 75 ans. Dans l'ensemble, 61 % des participants ont subi des effets indésirables, 47 % d'entre eux ayant subi un effet indésirable que l'on croyait lié au vaccin; aucune différence n'a été observée entre les différents groupes d'âge. Il se peut que ces taux aient été plus élevés que ceux des EI observés à la suite de la vaccination lors d'essais cliniques antérieurs portant sur des adultes plus jeunesNote de bas de page 31. Un tiers des participants ont signalé des EI locaux dans la première semaine après avoir reçu n'importe quelle dose de vaccin et 27 % ont signalé des EI systémiques (dont 72 % étaient jugés légers), le plus souvent des maux de tête et des myalgies. On n'a rapporté aucun EI grave ou nécessitant une assistance médicale attribuable au vaccin.
La nouvelle monographie de produit IXIAROMD recommande aux adultes de 65 ans et plus qui demeurent à risque de réexposition de prendre en considération l'administration d'une dose de rappel plus précoce, bien que la période ne soit pas préciséeNote de bas de page 1. Le CCMTMV suggère que pour les adultes âgés de plus de 65 ans, une seule dose de rappel de VEJ soit prise en considération moins de 12 mois après la série primaire et que l'évaluation du moment précis de l'administration du vaccin soit effectuée au cas par cas.
L'administration d'une dose supplémentaire de vaccin au jour 0 permet-elle d'obtenir un TSC plus élevé qu'une seule dose?
Comme il a été mentionné précédemment, il y a des avantages évidents à abréger les protocoles de vaccination. Une étude initiale de phase II a montré une séroconversion un mois après l'immunisation chez 22 des 23 personnes en bonne santé (96 %) recrutées au Walter Reed Army Institute of Research qui avaient reçu une double dose (12 μg) de JE-VCNote de bas de page 28. Malheureusement, une étude de suivi multicentrique de phase III n'a pas été en mesure de reproduire ces résultatsNote de bas de page 27. Sur 490 personnes ayant été vues en Allemagne et en Irlande du Nord, 374 ont été inscrites et randomisées (1:1:1) à une seule dose de 12 μg, deux doses de 6 μg (shéma posologique standard) ou une seule dose de 6 μg. La séroconversion a été observée chez seulement 66 % (IC à 95 %, 57 %-74 %) des patients affectés par randomisation au groupe dose unique de 12 μg à 28 jours, pourcentage qui a encore diminué à 41 % (IC à 95 %, 32-50 %) à 56 jours. Cela était évidemment plus faible que celle du shéma posologique standard de 2 doses de 6 μg, qui était associé à un taux de séroconversion de 97 % (IC à 95 %, 94-100 %) à 56 joursNote de bas de page 27.
Par conséquent, un shéma posologique comportant une dose unique de 12 μg ne peut être recommandé de façon systématique. Dans certains scénarios précis, lorsque le calendrier de dosage habituel ou accéléré du VEJ ne peut être appliqué en raison de contraintes de temps, les fournisseurs de vaccins peuvent envisager d'administrer une dose de 12 μg, car cela semble entraîner une meilleure réponse immunitaire celle d'une dose standard unique. Dans la mesure du possible, ces voyageurs devraient terminer leur série de vaccins s'ils risquent d'être à nouveau exposés au virus de l'EJ.
Les mesures de protection individuelle offrent-elles une protection contre les piqûres du ou des types de moustiques qui transmettent l'EJ?
Les insectifuges (Note de bas de page 63 Note de bas de page 64), les moustiquaires de lit imprégnées de perméthrine (Note de bas de page 65 Note de bas de page 66) et les vêtements traités à la perméthrineNote de bas de page 67 sont efficaces contre les types de moustiques (Culex) qui transmettent le virus de l'EJ. Par conséquent, ces interventions devraient être utilisées pour réduire l'exposition aux moustiques vecteurs de l'EJ. Les lecteurs qui souhaitent avoir des renseignements détaillés sur ces interventions ainsi que sur d'autres approches visant à prévenir les piqûres d'arthropodes sont priés de consulter la déclaration du CCMTMV sur les mesures de protection individuelle visant à prévenir les piqûres d'insectesNote de bas de page 16.
Conclusions et besoins en matière de recherche
Nos recommandations reposent sur l'hypothèse que la probabilité de contracter l'EJ est négligeable pour la grande majorité des voyageurs (confiance modérée). Toutefois, nous n'avons pas été en mesure de déterminer l'ampleur de l'augmentation du risque d'EJ en raison d'autres facteurs, comme la durée des déplacements ou l'exposition en milieu rural. Des recherches visant à définir l'incidence de ces facteurs de risque sur la probabilité de contracter l'EJ lors d'un voyage permettraient d'élaborer des recommandations plus précises. De même, la confiance du CCMTMV dans les estimations des valeurs et des préférences des patients, y compris la VDP pour le VEJ, était faible. Une plus grande attention portée à l'élaboration de données probantes pour définir ces paramètres pour le VEJ, ainsi qu'à d'autres interventions liées aux déplacements, permettrait aux concepteurs de lignes directrices d'élaborer des recommandations plus précises et aux praticiens d'élaborer des conseils plus ciblés pour les patients individuels.
Remerciements
- La présente déclaration a été préparée par le groupe de travail sur l'encéphalite japonaise :
-
Schofield S (président), Brophy J, Pernica J et approuvé par le CCMTMV.
Le CCMTMV reconnaît et apprécie le soutien technique et administratif du Bureau de la santé des voyageurs et des frontières de l'Agence de la santé publique du Canada pour l'élaboration de cette déclaration.
- Membres du CCMTMV :
- McCarthy A (présidente), Acharya A, Boggild A, Brophy J, Bui Y, Crockett M, Greenaway C, Libman M, Teitelbaum P, Vaughan S.
- Membres de liaison :
- Angelo K (US Centers for Disease Control Prevention), Audcent T (Société canadienne de pédiatrie) et Pernica J (Association pour la microbiologie médicale et l'infectiologie Canada).
- Membres d'office:
- Marion D (Centre des services de santé des Forces canadiennes, ministère de la Défense nationale), McDonald P (Bureau des sciences médicales, Santé Canada), Rossi C (Renseignements médicaux, Ministère de la Défense nationale) et Schofield S (Entomologie de la lutte antiparasitaire, Ministère de la Défense nationale).
Conflit d'intérêts
Aucun n'a été déclaré.
Références
- Note de bas de page 1
-
Valneva Austria GmbH. IXIARO Product Monograph. 2018.
- Note de bas de page 2
-
European Medicines Agency. Ixiaro - Japanese-encephalitis vaccine (inactivated, adsorbed). 2016; Accessible à l'adresse suivante : http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000963/human_med_000862.jsp&mid=WC0b01ac058001d124 (en anglais seulement).
- Note de bas de page 3
-
US Food and Drug Administration. Approval Letter - IXIARO. May 17, 2013; Accessible à l'adresse suivante : https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm353334.htm (en anglais seulement). Accédé le 11 avril 2017.
- Note de bas de page 4
-
Centers for Disease Control and Prevention. Use of Japanese encephalitis vaccine in children: Recommendations of the advisory committee on immunization practices, 2013. MMWR Morb Mortal Wkly Rep 2013;62Note de bas de page 45:898-900.
- Note de bas de page 5
-
Tauber E, Kollaritsch H, Von Sonnenburg F, Lademann M, Jilma B, Firbas C, et al. Randomized, double-blind, placebo-controlled phase 3 trial of the safety and tolerability of IC51, an inactivated Japanese encephalitis vaccine. J Infect Dis 2008 15 Aug 2008;198Note de bas de page 4:493-499.
- Note de bas de page 6
-
Rabe IB, Miller ER, Fischer M, Hills SL. Adverse events following vaccination with an inactivated, Vero cell culture-derived Japanese encephalitis vaccine in the United States, 2009-2012. Vaccine 2015 Jan 29;33Note de bas de page 5:708-712.
- Note de bas de page 7
-
Walker WL, Hills SL, Miller ER, Fischer M, Rabe IB. Adverse events following vaccination with an inactivated, Vero cell culture-derived Japanese encephalitis vaccine in the United States, 2012-2016. Vaccine 2018 Jul 5;36Note de bas de page 29:4369-4374.
- Note de bas de page 8
-
Poulos C, Curran D, Anastassopoulou A, De Moerlooze L. German travelers' preferences for travel vaccines assessed by a discrete choice experiment. Vaccine 2018 Feb 8;36Note de bas de page 7:969-978.
- Note de bas de page 9
-
Marshall HS, Chen G, Clarke M, Ratcliffe J. Adolescent, parent and societal preferences and willingness to pay for meningococcal B vaccine: A Discrete Choice Experiment. Vaccine 2016 1/27;34Note de bas de page 5:671-677.
- Note de bas de page 10
-
Comité consultative de la médecine tropicale et de la médecine des voyages (CCMTMV). Processus fondée sur les preuves pour l'élaboration de ligned directrices et de recommandations liées à la médecine de voyage et à la médecine tropicale. 2017; Accessible à l'adresse suivante : https://www.canada.ca/fr/sante-publique/services/publications/maladies-et-affections/processus-fondee-preuves-elaboration-lignes-directrices-recommandations-medecine-voyage-medicine-tropicale.html. Accédé le 9 janvier 2018, 2018.
- Note de bas de page 11
-
Hatz C, Werlein J, Mutsch M, Hufnagel M, Behrens RH. Japanese encephalitis: defining risk incidence for travelers to endemic countries and vaccine prescribing from the UK and Switzerland. Journal of Travel Medicine 2009;16Note de bas de page 3:200-203.
- Note de bas de page 12
-
Paulke-Korinek M, Kollaritsch H, Kundi M, Zwazl I, Seidl-Friedrich C, Jelinek T. Persistence of antibodies six years after booster vaccination with inactivated vaccine against Japanese encephalitis. Vaccine 2015;33Note de bas de page 30:3600-3604.
- Note de bas de page 13
-
Eder S, Dubischar-Kastner K, Firbas C, Jelinek T, Jilma B, Kaltenboeck A, et al. Long term immunity following a booster dose of the inactivated Japanese Encephalitis vaccine IXIARO(R), IC51. Vaccine 2011 Mar 21;29Note de bas de page 14:2607-2612.
- Note de bas de page 14
-
Valneva Austria GmbH. New Clinical Data for IXIARO®Japanese Encephalitis Vaccine, Inactivated, Adsorbed. 2016 February 24.
- Note de bas de page 15
-
Cramer JP, Jelinek T, Paulke-Korinek M, Reisinger EC, Dieckmann S, Alberer M, et al. One-year immunogenicity kinetics and safety of a purified chick embryo cell rabies vaccine and an inactivated Vero cell-derived Japanese encephalitis vaccine administered concomitantly according to a new, 1-week, accelerated primary series. J Travel Med 2016 Mar 19;23Note de bas de page 3:10.1093/jtm/taw011. Print 2016 Mar.
- Note de bas de page 16
-
Committee to Advise on Tropical Medicine and Travel. Statement on personal protective measures to prevent arthropod bites. Can Commun Dis Rep 2012;38(ACS-3).
- Note de bas de page 17
-
World Health Organization. Japanese Encephalitis Vaccines: WHO position paper - February 2015. Weekly Epidemiological Record 2015;9Note de bas de page 90:69-88.
- Note de bas de page 18
-
Campbell GL, Hills SL, Fischer M, Jacobson JA, Hoke CH, Hombach JM, et al. Estimated global incidence of Japanese encephalitis: a systematic review. Bull World Health Organ 2011;89Note de bas de page 10:766-774.
- Note de bas de page 19
-
Centers for Disease Control and Prevention. Japanese Encephalitis Vaccines: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2010;59(RR01):1-27.
- Note de bas de page 20
-
Centers for Disease Control and Prevention. Recommendations for use of a booster dose of inactivated vero cell culture-derived Japanese encephalitis vaccine: advisory committee on immunization practices, 2011. MMWR Morb Mortal Wkly Rep 2011;60Note de bas de page 20:661-663.
- Note de bas de page 21
-
Halstead SB, Jacobson J, Dubischar-Kastner K. Japanese encephaltis vaccines. In: Plotkin S, Orenstein WA, Offit P, editors. Vaccines. 6th ed. China: Elsevier Saunders; 2013. p. 312-351.
- Note de bas de page 22
-
Solomon T, Nguyen MD, Kneen R, Gainsboroug M, Vaughn DW, Khanh VT. Japanese encephalitis. J Neurol Neurosurg Ps 2000;68:405-415.
- Note de bas de page 23
-
Erlanger TE, Weiss S, Keiser J, Utzinger J, Wiedenmayer K. Past, Present, and Future of Japanese Encephalitis. Emerg Infect Dis 2009;15Note de bas de page 1:1-7.
- Note de bas de page 24
-
Agence de la santé publique du Canada. Guide canadien d'immunisation : Partie 4 – Agents d'immunisation active. 2014; Accessible à l'adresse suivante : https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-11-vaccin-contre-encephalite-japonaise.html.
- Note de bas de page 25
-
Tauber E, Kollaritsch H, Korinek M, Rendi-Wagner P, Jilma B, Firbas C, et al. Safety and immunogenicity of a Vero-cell-derived, inactivated Japanese encephalitis vaccine: a non-inferiority, phase III, randomised controlled trial. Lancet 2007;370Note de bas de page 9602:1847-1853.
- Note de bas de page 26
-
Jelinek T, Burchard GD, Dieckmann S, Bühler S, Paulke-Korinek M, Nothdurft HD, et al. Short-Term Immunogenicity and Safety of an Accelerated Pre-Exposure Prophylaxis Regimen With Japanese Encephalitis Vaccine in Combination With a Rabies Vaccine: A Phase III, Multicenter, Observer-Blind Study. Journal of Travel Medicine 2015.
- Note de bas de page 27
-
Schuller E, Klade CS, Wölfl G, Kaltenböck A, Dewasthaly S, Tauber E. Comparison of a single, high-dose vaccination regimen to the standard regimen for the investigational Japanese encephalitis vaccine, IC51: A randomized, observer-blind, controlled Phase 3 study. Vaccine 2009;27Note de bas de page 15:2188-2193.
- Note de bas de page 28
-
Lyons A, Kanesa-thasan N, Kuschner RA, Eckels KH, Putnak R, Sun W, et al. A Phase 2 study of a purified, inactivated virus vaccine to prevent Japanese encephalitis. Vaccine 2007;25Note de bas de page 17:3445-3453.
- Note de bas de page 29
-
Kaltenböck A, Dubischar-Kastner K, Schuller E, Datla M, Klade CS, Kishore TSA. Immunogenicity and safety of IXIARO®(IC51) in a Phase II study in healthy Indian children between 1 and 3 years of age. Vaccine 2010;28Note de bas de page 3:834-839.
- Note de bas de page 30
-
Schuller E, Jilma B, Voicu V, Golor G, Kollaritsch H, Kaltenböck A, et al. Long-term immunogenicity of the new Vero cell-derived, inactivated Japanese encephalitis virus vaccine IC51. Six and 12 month results of a multicenter follow-up phase 3 study. Vaccine 2008;26Note de bas de page 34:4382-4386.
- Note de bas de page 31
-
Tauber E, Kollaritsch H, Von Sonnenburg F, Lademann M, Jilma B, Firbas C, et al. Randomized, double-blind, placebo-controlled phase 3 trial of the safety and tolerability of IC51, an inactivated Japanese encephalitis vaccine. J Infect Dis 2008;198Note de bas de page 4:493-499.
- Note de bas de page 32
-
Centers for Disease Control and Prevention. Grading of recommendations, assessment, development, and evaluation (GRADE) for use of inactivated Vero cell culture-derived Japanese encephalitis vaccine in children. 2014; Accessible à l'adresse suivante : http://www.cdc.gov/vaccines/acip/recs/grade/je-child.html (en anglais seulement). Accédé le 16 mai 2016.
- Note de bas de page 33
-
Hills SL, Griggs AC, Fischer M. Japanese encephalitis in travelers from non-endemic countries, 1973-2008. Am J Trop Med Hyg 2010;82Note de bas de page 5:930-936.
- Note de bas de page 34
-
Hills S.L., Stoltey J., Martinez D., Kim P.Y., Sheriff H., Zangeneh A., et al. A case series of three US adults with Japanese encephalitis, 2010-2012. 2014;. Accessed 5, 21.
- Note de bas de page 35
-
Lagarde S., Lagier J.-C., Charrel R., Querat G., Vanhomwegen J., Despres P., et al. Japanese encephalitis in a French traveler to Nepal. 2014;. Accessed 1, 20.
- Note de bas de page 36
-
Chen L, Peek M, Stokich D, Todd R, Anderson M, Murphy FK, et al. Japanese encephalitis in two children-United States, 2010. Morb Mortal Weekly Rep 2011;60Note de bas de page 9:276-278.
- Note de bas de page 37
-
Langevin S, Libman M, Drebot MA, Laverdiere M. A case of Japanese encephalitis virus infection acquired during a trip in Thailand. Journal of Travel Medicine 2012 March-April 2012;19Note de bas de page 2:127-129.
- Note de bas de page 38
-
Werlinrud AM, Christiansen CB, Koch A. Japanese encephalitis in a Danish short-term traveler to Cambodia. Journal of Travel Medicine 2011;18Note de bas de page 6:411-413. 10 ref.
- Note de bas de page 39
-
Doti P, Castro P, Martinez MJ, Zboromyrska Y, Aldasoro E, Inciarte A, et al. A case of Japanese encephalitis in a 20 year-old Spanish sportsman, February 2013. Euro Surveill 2013 Aug 29;18Note de bas de page 35:20573.
- Note de bas de page 40
-
Tappe D, Nemecek A, Zipp F, Emmerich P, Gabriel M, Gunther S, et al. Two laboratory-confirmed cases of Japanese encephalitis imported to Germany by travelers returning from Southeast Asia. J Clin Virol 2012 Jul;54Note de bas de page 3:282-285.
- Note de bas de page 41
-
Jeurissen A, Strauven T. A case of aseptic meningitis due to Japanese encephalitis virus in a traveller returning from the Philippines. Acta Neurol Belg 2011 Jun;111Note de bas de page 2:143-145.
- Note de bas de page 42
-
Eurostat: Statistics Explained. File: Extra -EU-28 Transport of passengers in 2014. 2015; Accessible à l'adresse suivante : http://ec.europa.eu/eurostat/statistics-explained/index.php?title=File :Extra-EU-28_transport_of_passengers_in_2014.jpg&direction=prev&oldid=314881 (en anglais seulement). Accédé le 11 avril 2017.
- Note de bas de page 43
-
Statistics Canada. International Travel Survey. Custom extract. 2014.
- Note de bas de page 44
-
U.S. Department of Commerce. National Travel and Tourism Office: 2014 U.S. Resident Travel to Asia. 2014; Accessible à l'adresse suivante : http://travel.trade.gov/outreachpages/download_data_table/2014-US-to-Asia.pdf (en anglais seulement).
- Note de bas de page 45
-
Fischer M, Lindsey N, Staples JE, Hills S, Centers for Disease Control and Prevention (CDC). Japanese encephalitis vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP). Morbidity & Mortality Weekly Report.Recommendations & Reports 2010;59(RR-1):1-27.
- Note de bas de page 46
-
Artsob H, Spence L. Imported arbovirus infections in Canada, 1974-89. Can J Infect Dis 1991;2Note de bas de page 3:95-100.
- Note de bas de page 47
-
Boggild AK, Castelli F, Gautret P, Torresi J, von Sonnenburg F, Barnett ED, et al. Vaccine preventable diseases in returned international travelers: Results from the GeoSentinel Surveillance Network. Vaccine 2010;28Note de bas de page 46:7389-7395.
- Note de bas de page 48
-
Freedman DO, Weld LH, Kozarsky PE, Fisk T, Robins R, Von Sonnenburg F, et al. Spectrum of disease and relation to place of exposure among ill returned travelers. New Engl J Med 2006;354Note de bas de page 2:119-130.
- Note de bas de page 49
-
World Health Organization. Japanese Encephalitis. International Travel and Health;2017.
- Note de bas de page 50
-
World Health Organization. BACKGROUND PAPER ON JAPANESE ENCEPHALITIS VACCINES. International Health and Travel 2014.
- Note de bas de page 51
-
Australian Government Department of Health. 4.8 Japanese encephalitis. THE AUSTRALIAN IMMUNISATION HANDBOOK 10TH EDITION; 2015. p. 261-270.
- Note de bas de page 52
-
Direction générale de la Santé, Comité technique des vaccinations. Guide des vaccinations. Édition 2012. Saint-Denis : Inpes, France; 2012.
- Note de bas de page 53
-
Institut de veille sanitaire : Bulletin epidemiologique hebdomadaire. Recommendations sanitaire pour les voyageurs 2014. 2014 3 juin;16-17.
- Note de bas de page 54
-
Touch S, Suraratdecha C, Samnang C, Heng S, Gazley L, Huch C, et al. A cost-effectiveness analysis of Japanese encephalitis vaccine in Cambodia. Vaccine 2010 6/23;28Note de bas de page 29:4593-4599.
- Note de bas de page 55
-
Yin Z, Beeler Asay GR, Zhang L, Li Y, Zuo S, Hutin YJ, et al. An economic evaluation of the use of Japanese encephalitis vaccine in the expanded program of immunization of Guizhou province, China. Vaccine 2012 8/10;30Note de bas de page 37:5569-5577.
- Note de bas de page 56
-
Upreti SR, Janusz KB, Schluter WW, Bichha RP, Shakya G, Biggerstaff BJ, et al. Estimation of the impact of a Japanese encephalitis immunization program with live, attenuated SA 14-14-2 vaccine in Nepal. Am J Trop Med Hyg 2013 Mar;88Note de bas de page 3:464-468.
- Note de bas de page 57
-
GAVI Alliance. Japanese encephalitis vaccine. 2017; Accessible à l'adresse suivante : http://www.gavi.org/support/process/apply/.
- Note de bas de page 58
-
Elias C, Okwo-Bele JM, Fischer M. A strategic plan for Japanese encephalitis control by 2015. Lancet Infect Dis 2009 Jan;9Note de bas de page 1:7-3099Note de bas de page 0870290-1.
- Note de bas de page 59
-
Dubischar-Kastner K, Eder S, Buerger V, Gartner-Woelfl G, Kaltenboeck A, Schuller E, et al. Long-term immunity and immune response to a booster dose following vaccination with the inactivated Japanese encephalitis vaccine IXIARO®, IC51. Vaccine 2010;28Note de bas de page 32:5197-5202.
- Note de bas de page 60
-
Liang SY. Sepsis and Other Infectious Disease Emergencies in the Elderly. Emerg Med Clin North Am 2016 8;34Note de bas de page 3:501-522.
- Note de bas de page 61
-
Erra EO, Askling HH, Yoksan S, Rombo L, Riutta J, Vene S, et al. Cross-protection elicited by primary and booster vaccinations against Japanese encephalitis: A two-year follow-up study. Vaccine 2013 12/17;32Note de bas de page 1:119-123.
- Note de bas de page 62
-
Deshpande BR, Rao SR, Jentes ES, Hills SL, Fischer M, Gershman MD, et al. Use of Japanese encephalitis vaccine in US travel medicine practices in Global TravEpiNet. Am J Trop Med Hyg 2014;91Note de bas de page 4:694-698. 13 ref.
- Note de bas de page 63
-
Croft AM. Malaria: prevention in travellers (non-drug interventions). Clinical Evidence 2014;2014.
- Note de bas de page 64
-
Balshem H, Helfand M, Schunemann HJ, Oxman AD, Kunz R, Brozek J, et al. GRADE guidelines: 3. Rating the quality of evidence. J Clin Epidemiol 2011 Apr;64Note de bas de page 4:401-406.
- Note de bas de page 65
-
Moore SJ DM. History of insect repellents. In: Debboun M, Francis S, Strickman D, editor. Insect repellents: Principles, methods and uses: CRC Press; 2007. p. 3-29.
- Note de bas de page 66
-
Agence de réglementation de la lutte antiparasitaire. Page d'accueil. 2011; Accessible à l'adresse suivante : https://www.canada.ca/fr/sante-canada/organisation/a-propos-sante-canada/directions-generales-agences/agence-reglementation-lutte-antiparasitaire.html.
- Note de bas de page 67
-
United States Environmental Protection Agency. Office of Pesticide Programs. 2011; Accessible à l'adresse suivante : http://www.epa.gov/pesticides (en anglais seulement).
- Note de bas de page 68
-
Centers for Disease Control and Prevention (CDC). CDC Yellow Book 2024: Health Information for International Travellers. (New York, 2023)
- Note de bas de page 69
-
Schuller E, Klingler A, DubischarKastner K, Dewasthaly S, Muller Z. Safety profile of the Vero cell-derived Japanese encephalitis virus (JEV) vaccine IXIAROReg. Vaccine 2011;29Note de bas de page 47:8669-8676. 39 ref.
- Note de bas de page 70
-
Kaltenböck A, Dubischar-Kastner K, Eder G, Jilg W, Klade C, Kollaritsch H, et al. Safety and immunogenicity of concomitant vaccination with the cell-culture based Japanese Encephalitis vaccine IC51 and the hepatitis A vaccine HAVRIX®1440 in healthy subjects: A single-blind, randomized, controlled Phase 3 study. Vaccine 2009;27Note de bas de page 33:4483-4489.
- Note de bas de page 71
-
Yun KW, Lee HJ, Kang JH, Eun BW, Kim Y, Kim K, et al. Safety and immunogenicity of a freeze-dried, Vero cell culture-derived, inactivated Japanese encephalitis vaccine (KD-287, ENCEVAC®) versus a mouse brain-derived inactivated Japanese encephalitis vaccine in children: a phase III, multicenter, double-blinded, randomized trial. BMC infectious diseases 2015;15Note de bas de page 1:1.
- Note de bas de page 72
-
Eder S, DubischarKastner K, Firbas C, Jelinek T, Jilma B, Kaltenboeck A, et al. Long term immunity following a booster dose of the inactivated Japanese Encephalitis vaccine IXIAROReg., IC51. Vaccine 2011;29Note de bas de page 14:2607-2612. 27 ref.
Annexe 1. Résumé des résultats de la comparaison du VEJ au placebo : Événements indésirables (EI)
| Résultats | Risques comparatifs à titre illustratifNote de bas de page * (IC à 95 %) | Effet relatif (IC À 95 %) |
Nombre de participants (études) |
Qualité de la preuve (GRADE)Note de bas de page ɫ |
Commentaires | |
|---|---|---|---|---|---|---|
| Risque présumé Placebo (EI) |
Risque correspondant VEJ |
|||||
| Tout EISI grave | Population à l'étude | RR 0,55 (0,2 à 1,51) |
2650 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 9 par 1000 | 5 par 1000 (2 à 14) |
|||||
| Tout EISI | Population à l'étude | RR 1,04 (0,96 à 1,12) |
2650 (1 étude) |
⊕⊕⊕⊕ élevé |
Aucune | |
| 566 par 1000 | 589 par 1000 (544 à 634) |
|||||
| Gastrointestinal | Population à l'étude | RR 1,06 (0,81 à 1,39) |
2650 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 94 par 1000 | 100 par 1000 (76 à 131) |
|||||
| Musculosquelettique | Population à l'étude | RR 0,99 (0,82 à 1,19) |
2650 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 183 par 1000 | 181 par 1000 (150 à 217) |
|||||
| Céphalées | Population à l'étude | RR 1,07 (0,93 à 1,24) |
2656 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 261 par 1000 | 279 par 1000 (243 à 324) |
|||||
| Éruption cutanée | Population à l'étude | RR 0,86 (0,42 à 1,77) |
2650 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 15 par 1000 | 13 par 1000 (6 à 27) |
|||||
| Douleur | Population à l'étude | RR 1,16 (1 à 1,35) |
2650 Note de bas de page 1 |
⊕⊕⊕⊕ élevé |
Aucune | |
| 250 par 1000 | 290 par 1000 (250 à 337) |
|||||
| Démangeaisons | Population à l'étude | RR 0,52 (0,29 à 0,92) |
2650 (1 étude) |
⊕⊕⊕⊕ élevé |
Aucune | |
| 29 par 1000 | 15 par 1000 (8 à 27) |
|||||
| Sensibilité | Population à l'étude | RR 1,21 (1,06 à 1,38) |
2650 (1 étude) |
⊕⊕⊕⊕ élevé |
Aucune | |
| 294 par 1000 | 355 par 1000 (311 à 405) |
|||||
| Durcissement | Population à l'étude | RR 0,95 (0,66 à 1,38) |
2650 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 55 par 1000 | 52 par 1000 (36 à 76) |
|||||
| Enflure | Population à l'étude | RR 1,01 (0,59 à 1,73) |
2650 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 26 par 1000 | 26 par 1000 (15 à 45) |
|||||
| Rougeur | Population à l'étude | RR 1,23 (0,85 à 1,79) |
2650 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 50 par 1000 | 62 par 1000 (43 à 90) |
|||||
|
||||||
Annexe 2. Répartition géographique de l'encéphalite japonaise
Les pays ayant des zones à risque identifiées pour le virus de l'encéphalite japonaise sont répertoriés ci-dessous, avec une description des zones touchées dans chaque pays. Les autres zones, en dehors de ces pays, ne présentent aucun risque connu d'encéphalite japonaise.
Texte descriptif
| Pays | Régions à risque d'encéphalite japonaise |
|---|---|
| Australie | Dans le sud-est de l'Australie (Victoria, Nouvelle-Galles-du-Sud, sud du Queensland et Australie du Sud), en particulier dans les zones rurales entourant la rivière Murray, ainsi que dans les îles Outer Torres et les îles Tiwi |
| Bangladesh | Répandue |
| Bhoutan | Présumée répandue dans les régions non montagneuses |
| Brunéi Darussalam | Présumée répandue |
| Cambodge | Répandue |
| Chine | Cas humains signalés dans toutes les provinces sauf Xizang (Tibet), Xinjiang et Qinghai; virus de l'EJ isolé des moustiques au Tibet |
| Corée du Nord | Données limitées; présumée répandue |
| Corée du Sud | Répandue |
| Inde | Cas humains signalés dans tous les États sauf Dadra, Daman, Diu, Gujarat, Himachal Pradesh, Jammu et Cachemire, Lakshadweep, Meghalaya, Nagar Haveli, Punjab, Rajasthan et Sikkim |
| Indonésie | Répandue |
| Japon | Rares cas humains sporadiques sur toutes les îles sauf Hokkaido. Activité enzootique continue. |
| Laos | Répandue |
| Malaysie | Répandue |
| Myanmar (Birmanie) | Données limitées; présumée répandue |
| Népal | Endémique dans les basses terres du sud (Terai); des cas ont également été signalés dans les districts des zones de montagnes et de collines, y compris la vallée de Katmandou. |
| Pakistan | Données limitées |
| Papouasie-Nouvelle-Guinée | Répandue |
| Philippines | Répandue |
| Russie | De rares cas humains ont été signalés dans les zones maritimes de l'Extrême-Orient au sud de Khabarovsk |
| Singapour | Présumée dans des zones focales |
| Sri Lanka | Répandue, sauf dans les régions montagneuses |
| Taiwan | Rares cas humains sporadiques à l'échelle de l'île |
| Thaïlande | Répandue; épidémies saisonnières dans les provinces du Nord |
| Timor-Leste (Timor oriental) | Présumée répandue |
| Vietnam | Répandue |
Annexe 3. Notes propres aux paysNote de bas de page 1 sur l'encéphalite japonaise
| Pays | Régions touchées | Saison de transmission | Commentaires |
|---|---|---|---|
| Australie | Dans le sud-est de l'Australie (Victoria, Nouvelle-Galles-du-Sud, sud du Queensland et Australie du Sud), en particulier dans les zones rurales entourant la rivière Murray, ainsi que dans les îles Outer Torres et les îles Tiwi | La plupart des cas ont été signalés entre novembre et avril. Tous les cas humains ont été signalés entre février et avril |
De janvier 2021 à février 2023, 45 cas d'encéphalite japonaise ont été signalés sur la partie continentale de l'Australie, en particulier dans les régions rurales entourant la rivière Murray. En novembre 2022, le virus de l'encéphalite japonaise a été détecté chez des porcs dans la région du fleuve Murray, confirmant le risque d'infection chez l'humain. |
| Bangladesh | Répandue | La plupart des cas humains sont signalés de juillet à novembre. | La surveillance sentinelle a permis d'identifier des cas humains dans les divisions de Chittagong, Dhaka, Khulna, Rajshahi, Ranjpur et Sylhet; l'incidence la plus élevée a été signalée par la Division Rajshahi; une éclosion a été signalée par le district de Tangail, division de Dhaka, en 1977 |
| Bhutan | Présumée répandue dans les régions non montagneuses | Inconnu | La proximité d'autres zones d'endémie et la présence de vecteurs portent à croire que la transmission du virus est probable |
| Brunéi Darussalam | Présumée répandue | Inconnu; présumée à l'année | Une éclosion avec des cas confirmés en laboratoire s'est produite pendant la période allant d'octobre à décembre 2013 |
| Myanmar (Birmanie) | Données limitées; présumée répandue | Inconnu; la plupart des cas humains ont été signalés entre mai et octobre | Des éclosions de cas chez l'humain ont été documentées dans les États de Shan et de Rakhine; présence d'anticorps documentés chez les animaux et les humains dans d'autres régions |
| Cambodge | Répandue | Toute l'année, haute saison de mai à octobre | La surveillance sentinelle a permis d'identifier des cas humains dans au moins 15 des 23 provinces, dont Phnom Penh, Takeo, Kampong Cham, Battambang, Svay Rieng et Siem Reap; 1 cas signalé en 2010 chez un voyageur qui a visité seulement Phnom Penh et Angkor Wat/Siem Reap |
| Chine | Cas humains signalés dans toutes les provinces sauf Xizang (Tibet), Xinjiang et Qinghai; virus de l'EJ isolé des moustiques au Tibet | La plupart des cas humains sont signalés de juin à octobre | Les taux les plus élevés ont été signalés dans les provinces de Guizhou, Shaanxi, du Sichuan et du Yunnan, et dans la ville de Chongqing; le vaccin n'est pas systématiquement recommandé pour les déplacements à Beijing, Shanghai, Hong Kong/Kowloon, Macao ou dans d'autres grandes villes |
| Inde | Cas humains signalés dans tous les États sauf Dadra, Daman, Diu, Gujarat, Himachal Pradesh, Jammu et Cachemire, Lakshadweep, Meghalaya, Nagar Haveli, Punjab, Rajasthan et Sikkim | La plupart des cas humains ont été signalés de mai à novembre, surtout dans le nord de l'Inde. La saison peut être prolongée ou durer toute l'année dans certaines régions, surtout dans le sud de l'Inde | Les taux les plus élevés de cas humains ont été signalés dans les États d'Andhra Pradesh, Assam, Bihar, Goa, Haryana, Karnataka, Kerala, Tamil Nadu, Uttar Pradesh et du Bengale-Occidental |
| Indonésie | Répandue | Toute l'année; la saison de pointe varie selon l'île | La surveillance sentinelle a permis d'identifier des cas humains à Bali, Kalimantan, Java, Nusa Tenggara, Papouasie et Sumatra; plusieurs cas de voyageurs signalés au cours des dernières années à Bali |
| JaponNote de bas de page 2 | Rares cas humains sporadiques sur toutes les îles sauf Hokkaido. Activité enzootique continue. | La plupart des cas humains sont signalés de juin à octobre | Un grand nombre de cas humains ont été signalés jusqu'à l'introduction du programme de vaccination de l'EJ à la fin des années 1960. La plus récente petite éclosion a été signalée dans le district de Chugoku en 2002. Une transmission enzootique sans cas humain a été observée sur l'île d'Hokkaido. Le vaccin n'est pas systématiquement recommandé aux voyageurs qui se rendent uniquement à Tokyo ou dans d'autres grandes villes |
| Corée du Nord | Données limitées; présumée répandue | Aucune donnée; la proximité de la Corée du Sud porte à croire que la transmission pourrait atteindre un sommet de mai à novembre | S/O |
| Corée du SudNote de bas de page 2 | Répandue | La plupart des cas humains sont signalés de mai à octobre | Un grand nombre de cas humains ont été signalés jusqu'à l'introduction du programme de vaccination de routine de l'EJ au milieu des années 1980; la dernière éclosion importante a été signalée en 1982. Le vaccin n'est pas systématiquement recommandé pour les déplacements à Séoul ou dans d'autres grandes villes |
| Laos | Répandue | Toute l'année, haute saison de juin à septembre | La surveillance sentinelle a permis d'identifier des cas humains dans le nord, le centre et le sud du Laos |
| Malaysie | Répandue | À l'année; à Sarawak, la saison de pointe va d'octobre à décembre | La plupart des cas humains ont été signalés à Sarawak. Le vaccin n'est pas systématiquement recommandé pour les déplacements limités à Kuala Lumpur ou dans d'autres grandes villes |
| Népal | Endémique dans les basses terres du sud (Terai); des cas ont également été signalés dans les districts des zones de montagnes et de collines, y compris la vallée de Katmandou. | La plupart des cas humains sont signalés de juin à octobre | Les taux les plus élevés de maladie chez l'humain sont signalés dans les districts des plaines du sud de Teraï. Le vaccin n'est pas systématiquement recommandé pour ceux qui font de la randonnée en haute altitude |
| Pakistan | Données limitées | Inconnue | Cas humains signalés dans les environs de Karachi |
| Papouasie-Nouvelle-Guinée | Répandue | Inconnu; présumée toute l'année | Cas humains sporadiques signalés dans la province de l'Ouest; les preuves sérologiques de la maladie ont été observées dans les provinces du Golfe et des Hautes-Terres-du-Sud; un cas d'EJ a été signalé près de Port Moresby en 2004 |
| Philippines | Répandue | Toute l'année, haute saison d'avril à août | Des études sur les humains, les animaux et les moustiques ont indiqué une transmission dans 32 provinces situées dans toutes les régions du pays. Transmission probable sur toutes les îles. |
| Russie | De rares cas humains ont été signalés dans les zones maritimes de l'Extrême-Orient au sud de Khabarovsk | La plupart des cas humains ont été signalés de juillet à septembre | Le vaccin n'est pas recommandé de façon systématique |
| Singapour | Présumée dans des zones focales | Toute l'année | Rares cas humains sporadiques signalés. Le vaccin n'est pas recommandé de façon systématique |
| Sri Lanka | Répandue, sauf dans les régions montagneuses | Toute l'année avec des pics variables en fonction des pluies de mousson | Les taux les plus élevés de cas humains ont été signalés dans les districts d'Anuradhapura, de Gampaha, de Kurunegala, de Polonnaruwa et de Puttalam |
| TaiwanNote de bas de page 2 | Rares cas humains sporadiques à l'échelle de l'île | La plupart des cas humains sont signalés de mai à octobre | Un grand nombre de cas humains ont été signalés jusqu'à l'introduction de la vaccination systématique contre l'EJ en 1968. Le vaccin n'est pas systématiquement recommandé pour les déplacements à Taipei ou dans d'autres grandes villes |
| Thaïlande | Répandue; épidémies saisonnières dans les provinces du Nord | Toute l'année, haute saison de mai à octobre, surtout dans le Nord | Les taux les plus élevés de cas humains ont été signalés dans la vallée de Chiang Mai. Plusieurs cas ont été signalés récemment chez des voyageurs ayant visité des centres de villégiature ou des régions côtières du sud de la Thaïlande |
| Timor-Leste (Timor oriental) | Présumée répandue | Pas de données; cas signalés toute l'année au Timor occidental voisin | S/O |
| Vietnam | Répandue | Toute l'année, haute saison de mai à octobre, surtout dans le Nord | Taux de maladies les plus élevés dans les provinces du nord autour de Hanoï et dans les provinces du nord-ouest et du nord-est bordant la Chine |
| Îles du Pacifique Ouest | Des éclosions de cas humains ont été signalées à Guam en 1947-1948 et à Saipan en 1990 | Inconnu; la plupart des cas humains sont signalés d'octobre à mars | Les éclosions ont probablement suivi l'introduction du virus, le cycle enzootique n'étant pas continu; le vaccin n'est pas recommandé |
|
|||
Annexe 4. Cadre d'analyse du vaccin contre l'encéphalite japonaise (VEJ)
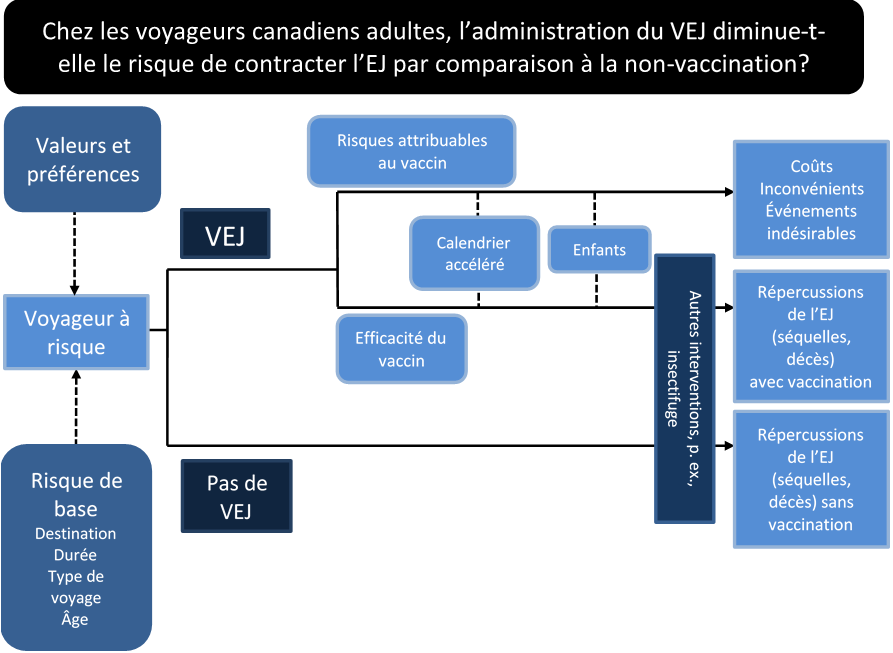
Annexe 5. Exemples de stratégie de recherche
Vaccination contre l'encéphalite japonaise chez les voyageurs
Bases de données : Ovid MEDLINE®, Ovid MEDLINE®In-Process & Other Non-Indexed Citations, Ovid MEDLINE®Daily et Ovid OLDMEDLINE®de 1946 au 22 juin 2015
| No | Recherches | Résultats |
|---|---|---|
| 1 | Encephalitis, Japanese/ep, mo, pc, px, sn, th | 1155 |
| 2 | Note de bas de page * Encephalitis, Japanese/ | 1985 |
| 3 | Note de bas de page * Encephalitis Virus, Japanese/ | 1417 |
| 4 | "Japanese encephalitis".tw,kw,kf. | 3739 |
| 5 | or/1-4 | 4188 |
| 6 | Japanese Encephalitis Vaccines/ad, ae, ct, im, st, tu, to [Administration & Dosage, Adverse Effects, Contraindications, Immunology, Standards, Therapeutic Use, Toxicity] | 334 |
| 7 | Note de bas de page * Japanese Encephalitis Vaccines/ | 296 |
| 8 | Vaccination/ | 57681 |
| 9 | Immunization, Secondary/ or Immunization/ or Immunization Schedule/ | 56292 |
| 10 | (immunizNote de bas de page * or immunisNote de bas de page * or vaccinNote de bas de page *).tw. | 306066 |
| 11 | or/6-10 | 333811 |
| 12 | ("IC51" or "IC-51" or "IC 51" or Ixiaro).mp. | 41 |
| 13 | Travel/ | 20053 |
| 14 | (touristNote de bas de page * or travelNote de bas de page *).tw. | 44184 |
| 15 | 13 ou 14 | 53724 |
| 16 | 5 and 11 and (12 or 15) | 172 |
| 17 | exp Canada/ or (Canada or CanadianNote de bas de page *).mp. | 162641 |
| 18 | (5 or 6 or 7) and 17 | 16 |
| 19 | 16 ou 18 | 177 |
| 20 | animals/ not (humans/ and animals/) | 3968004 |
| 21 | letter/ or comment/ or editorial/ | 1418699 |
| 22 | 19 not (20 or 21) | 168 |
| 23 | remove duplicates from 22 | 165 |
Embase de 1974 au 22 juin 2015
| No | Recherches | Résultats |
|---|---|---|
| 1 | Japanese encephalitis/co, dt, ep, et, pc, th [Complication, Drug Therapy, Epidemiology, Etiology, Prevention, Therapy] | 430 |
| 2 | Note de bas de page * Japanese encephalitis/ | 502 |
| 3 | Note de bas de page * Japanese encephalitis virus/ | 1664 |
| 4 | "Japanese encephalitis".tw,kw. | 4291 |
| 5 | or/1-4 | 4601 |
| 6 | Japanese encephalitis vaccine/ae, ct, ad, it, dt, to [Adverse Drug Reaction, Clinical Trial, Drug Administration, Drug Interaction, Drug Therapy, Drug Toxicity] | 791 |
| 7 | Note de bas de page * Japanese encephalitis vaccine/ | 478 |
| 8 | vaccination reaction/ or vaccination/ | 108357 |
| 9 | immunization/ | 82401 |
| 10 | (immunizNote de bas de page * or immunisNote de bas de page * or vaccinNote de bas de page *).tw. | 351057 |
| 11 | or/6-10 | 389810 |
| 12 | ("IC51" or "IC-51" or "IC 51" or Ixiaro).mp. | 124 |
| 13 | travel/ | 28902 |
| 14 | (touristNote de bas de page * or travelNote de bas de page *).tw. | 54771 |
| 15 | or/13-14 | 65389 |
| 16 | 5 and 11 and (12 or 15) | 275 |
| 17 | exp Canada/ or (Canada or CanadianNote de bas de page *).mp. | 213446 |
| 18 | 17 and (5 or 6 or 7) | 25 |
| 19 | 16 ou 18 | 290 |
| 20 | animal/ not (human/ and animal/) | 1258280 |
| 21 | editorial/ or letter/ | 1363656 |
| 22 | 19 not (20 or 21) | 278 |
| 23 | remove duplicates from 22 | 276 |
Global Health de 1973 au 22 juin 2015
| No | Recherches | Résultats |
|---|---|---|
| 1 | Japanese encephalitis/ | 2266 |
| 2 | "Japanese encephalitis".tw,hw. | 4114 |
| 3 | Japanese encephalitis virus.od. | 3202 |
| 4 | or/1-3 | 4114 |
| 5 | vaccination/ | 46057 |
| 6 | immunization/ | 51546 |
| 7 | (immunizNote de bas de page * or immunisNote de bas de page * or vaccinNote de bas de page *).tw. | 104918 |
| 8 | or/5-7 | 104918 |
| 9 | ("IC51" or "IC-51" or "IC 51" or Ixiaro).mp. | 22 |
| 10 | exp travel/ or exp travel associated diseases/ | 4246 |
| 11 | (touristNote de bas de page * or travelNote de bas de page *).tw. | 17930 |
| 12 | or/10-11 | 18052 |
| 13 | 4 and 8 and (9 or 12) | 162 |
| 14 | exp Canada/ or (Canada or CanadianNote de bas de page *).mp. | 33670 |
| 15 | 14 and 4 | 14 |
| 16 | 13 ou 15 | 171 |
| 17 | remove duplicates from 16 | 170 |
- Note de bas de page *
-
désigne la troncation; une technique utilisée dans l'élaboration de stratégies de recherche documentaire qui élargit la recherche pour inclure diverses terminaisons au terme de recherche.
SCOPUS jusqu'au 22 juin 2015
(((TITLE-ABS("Japanese encephalitis")) and (TITLE-ABS-KEY((immuniz* or immunis* or vaccin*)))) and ((TITLE-ABS-KEY(("IC51" or "IC-51" or "IC 51" or Ixiaro))) or (TITLE-ABS-KEY((tourist* or travel*))))) or ((TITLE-ABS((Canada or Canadian*))) and (TITLE-ABS("Japanese encephalitis"))) AND ( EXCLUDE(DOCTYPE,"le") OR EXCLUDE(DOCTYPE,"ch") OR EXCLUDE(DOCTYPE,"ed")) 214 Document results
Google Search, 22 juin 2015
Centers for Disease Control and Prevention
CDC's Health Information for International Travel (Yellow Book)
http://wwwnc.cdc.gov/travel/yellowbook/2010/chapter-2/japanese-encephalitis.aspx
Administration du vaccin contre l'encéphalite japonaise chez les enfants : Recommandations du Comité consultatif sur les pratiques d'immunisation, 2013
http://www.cdc.gov/mmwr/preview/mmwrhtml/mm6245a3.htm
Monographie du produit Novartis : https://www.ask.novartispharma.ca/download.htm?res=ixiaro_patient_f.pdf&resTitleId=462
Agence de la santé publique du Canada
https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active.html
Food and Drug Administration des États-Unis
http://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm179132.htm
L'encéphalite japonaise : Facteurs de risque pour les voyageurs
Ovid MEDLINE(R) In-Process & Other Non-Indexed Citations, Ovid MEDLINE(R) Daily, Ovid MEDLINE(R) and Ovid OLDMEDLINE(R) de 1946 au 19 juin 2015
| No | Recherches | Résultats |
|---|---|---|
| 1 | Encephalitis, Japanese/ep, mo, pc, px, sn, th | 1155 |
| 2 | Note de bas de page *Encephalitis, Japanese/ | 1985 |
| 3 | Note de bas de page *Encephalitis Virus, Japanese/ | 1417 |
| 4 | (Japanese adj encephalitis).mp. | 3771 |
| 5 | or/1-4 | 4205 |
| 6 | Risk Factors/ | 603019 |
| 7 | ("risk factorNote de bas de page *" or (riskNote de bas de page * adj25 "japanese encephalitis")).tw. | 386859 |
| 8 | 6 ou 7 | 792870 |
| 9 | Travel/ | 20052 |
| 10 | (travelNote de bas de page * or touristNote de bas de page *).tw. | 44149 |
| 11 | or/9-10 | 53689 |
| 12 | 5 and 8 and 11 | 61 |
| 13 | animals/ not (humans/ and animals/) | 3967673 |
| 14 | letter/ or comment/ or editorial/ | 1417918 |
| 15 | 12 not (13 or 14) | 59 |
| 16 | remove duplicates from 15 | 58 |
Embase de 1974 au 19 juin 2015
| No | Recherches | Résultats |
|---|---|---|
| 1 | Japanese encephalitis/ | 957 |
| 2 | Japanese encephalitis virus/ | 2887 |
| 3 | (Japanese adj encephalitis).mp. | 5454 |
| 4 | or/1-3 | 5454 |
| 5 | risk factor/ | 685974 |
| 6 | ("risk factorNote de bas de page *" or (riskNote de bas de page * adj25 "japanese encephalitis")).tw. | 531075 |
| 7 | or/5-6 | 876042 |
| 8 | travel/ | 28870 |
| 9 | travelNote de bas de page *.tw. | 52460 |
| 10 | (travelNote de bas de page * or touristNote de bas de page *).tw. | 54731 |
| 11 | 8 ou 10 | 65347 |
| 12 | 4 and 7 and 11 | 85 |
| 13 | animal/ not (human/ and animal/) | 1258280 |
| 14 | letter/ or editorial/ | 1363439 |
| 15 | 12 not (13 or 14) | 85 |
Global Health de 1973 au 19 juin 2015
| No | Recherches | Résultats |
|---|---|---|
| 1 | Japanese encephalitis/ | 2266 |
| 2 | "Japanese encephalitis".tw,hw. | 4114 |
| 3 | Japanese encephalitis virus.od. | 3202 |
| 4 | or/1-3 | 4114 |
| 5 | risk factors/ | 134937 |
| 6 | ("risk factorNote de bas de page *" or (riskNote de bas de page * adj25 "japanese encephalitis")).tw. | 168829 |
| 7 | 5 ou 6 | 168829 |
| 8 | exp travel/ | 4046 |
| 9 | (touristNote de bas de page * or travelNote de bas de page *).tw. | 17930 |
| 10 | 8 ou 9 | 18052 |
| 11 | 4 and 7 and 10 | 43 |
- Note de bas de page *
-
Indique une troncation; une technique utilisée dans l'élaboration de stratégies de recherche documentaire qui élargit la recherche pour inclure diverses terminaisons au terme de recherche.
Scopus au 19 juin 2015
(TITLE("Japanese encephalitis") AND TITLE-ABS-KEY(risk*)AND TITLE-ABS-KEY(travel*)) AND ( LIMIT-TO(DOCTYPE,"ar") OR LIMIT-TO(DOCTYPE,"re"))
Annexe 6. Résumé des résultats de la comparaison entre le VEJ et le vaccin inactivé dérivé du cerveau de la souris (MBV) : Taux de séroconversion (TSC) et événements indésirables (EI)
| Résultats | Risques comparatifs à titre illustratifNote de bas de page * (IC à 95 %) | Effet relatif (IC À 95 %) |
Nombre de participants (études) |
Qualité de la preuve (GRADE) ɫ |
|
|---|---|---|---|---|---|
| Risque présumé MBV |
Risque correspondant VEJ |
||||
| TSC | Population à l'étude | RR 1,03 (1,01 à 1,06) |
725 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
|
| 953 par 1000 | 982 par 1000 (963 à 1000) |
||||
|
|||||
| Résultats | Risques comparatifs à titre illustratifNote de bas de page * (IC à 95 %) | Effet relatif (IC À 95 %) |
Nombre de participants (études) |
Qualité de la preuve (GRADE) Note de bas de page ɫ |
|
|---|---|---|---|---|---|
| Risque présumé MBV |
Risque correspondant VEJ |
||||
| Céphalées | Population à l'étude | RR 0,92 (0,74 à 1,14) |
863 (1 étude) |
⊕⊕⊕⊕ élevé |
|
| 287 par 1000 | 264 par 1000 (213 à 328) |
||||
| ILI | Population à l'étude | RR 1 (0,7 à 1,42) |
863 (1 étude) |
⊕⊕⊕⊕ élevé |
|
| 126 par 1000 | 126 par 1000 (89 à 180) |
||||
| Myalgie | Population à l'étude | RR 1,3 (0,97 à 1,72) |
863 (1 étude) |
⊕⊕⊕⊕ élevé |
|
| 159 par 1000 | 206 par 1000 (154 à 273) |
||||
| Fatigue | Population à l'étude | RR 1,14 (0,79 à 1,65) |
863 (1 étude) |
⊕⊕⊕⊕ élevé |
|
| 110 par 1000 | 126 par 1000 (87 à 182) |
||||
| Rougeur | Population à l'étude | RR 0,09 (0,03 à 0,24) |
863 (1 étude) |
⊕⊕⊕⊕ élevé |
|
| 106 par 1000 | 10 par 1000 (3 à 25) |
||||
| Gonflement | Population à l'étude | RR 0,13 (0,04 à 0,44) |
863 (1 étude) |
⊕⊕⊕⊕ élevé |
|
| 53 par 1000 | 7 par 1000 (2 à 23) |
||||
| Durcissement | Population à l'étude | RR 0,16 (0,06 à 0,46) |
863 (1 étude) |
⊕⊕⊕⊕ élevé |
|
| 57 par 1000 | 9 par 1000 (3 à 26) |
||||
|
|||||
Annexe 7. Résumé des résultats pour la comparaison du calendrier de vaccination habituel du JEV (0, 28 jours) et du calendrier accéléré (0, 7 jours) : Taux de séroconversion (TSC) et événements indésirables (EI)
| Résultats | Risques comparatifs à titre illustratifNote de bas de page * (IC à 95 %) | Effet relatif (IC À 95 %) |
Nombre de participants (études) |
Qualité de la preuve (GRADE)ɫ |
Commentaires | |
|---|---|---|---|---|---|---|
| Risque présumé Habituel |
Risque correspondant Accéléré |
|||||
| TSC jour 10-14 | Population à l'étude | RR 3,95 (3,16 à 4,92) |
441 (1 étude) |
⊕⊕⊝⊝ faibleNote de bas de page 1,Note de bas de page 2 |
Aucune | |
| 252 par 1000 | 996 par 1000 (797 à 1000) |
|||||
| TSC 35 | Population à l'étude | RR 0,99 (0,97 à 1,01) |
410 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 2 |
Aucune | |
| 995 par 1000 | 985 par 1000 (965 à 1000) |
|||||
|
||||||
| Résultats | Risques comparatifs à titre illustratifNote de bas de page * (IC à 95 %) | Effet relatif (IC À 95 %) |
Nombre de participants (études) |
Qualité de la preuve (GRADE)Note de bas de page ɫ |
Commentaires | |
|---|---|---|---|---|---|---|
| Risque présumé Témoin |
Risque correspondant EI, IXIAROMD calendrier accéléré |
|||||
| Tout EI | Population à l'étude | RR 1 (0,91 à 1,09) |
383 (1 étude) |
⊕⊕⊕⊕ élevé |
Aucune | |
| 831 par 1000 | 831 par 1000 (757 à 906) |
|||||
| Local | Population à l'étude | RR 0,99 (0,88 à 1,11) |
383 (1 étude) |
⊕⊕⊕⊕ élevé |
Aucune | |
| 753 par 1000 | 745 par 1000 (663 à 836) |
|||||
| Systémique | Population à l'étude | RC 1,28 (0,84 à 1,94) |
383 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 602 par 1000 | 660 par 1000 (560 à 746) |
|||||
| Autre | Population à l'étude | RC 1,01 (0,59 à 1,74) |
383 (1 étude) |
⊕⊕⊕⊝ modéréNote de bas de page 1 |
Aucune | |
| 169 par 1000 | 170 par 1000 (107 à 261) |
|||||
|
||||||
Annexe 8. Résumé des résultats de l'évaluation GRADE de l'Advisory Committee on Immunization Practice (ACIP)
Contexte :
- En 2009, l'ACIP des Centers for Disease Control and Prevention (CDC) a approuvé des recommandations pour l'administration du vaccin inactivé VEJ contre l'encéphalite japonaise dérivé de la culture de cellules Vero chez les adultes de 17 ans et plusNote de bas de page 45.
- En 2013, l'ACIP a effectué un examen GRADE pour l'administration du VEJ dérivé de la culture de cellules Vero chez les enfants(4,32). La question était la suivante : Devrait-on recommander l'administration du vaccin inactivé contre l'encéphalite japonaise dérivé de la culture de cellules Vero chez les enfants de 2 mois à 16 ans qui présente un risque accru d'exposition au virus de l'encéphalite japonaise liée au voyage ?
- Population : enfants de 2 mois à 16 ans
- Intervention : VEJ administré en série primaire de deux doses
- Option actuelle : Le VEJ n'est pas recommandé et disponible pour administration chez les enfants
- Les avantages étaient la séroprotection 1 et 6 mois après la vaccination. Les risques associés au vaccin étaient des effets indésirables systémiques (p. ex., fièvre, éruptions, hypersensibilité ou urticaire, effets indésirables neurologiques et effets exigeant une assistance médicale) ou des effets indésirables graves (tableau A1).
Méthodologie :
- Des documents publiés entre le 1er janvier 2006 et le 30 avril 2013 ont été examinés et des critères d'inclusion et d'exclusion sont fournis dans le document (données primaires, aucune étude de cas, dose approuvée par la FDA, sujets humains, etc.).
- 67 études identifiées et 51 exclues
- Les données probantes relatives aux résultats critiques ont été évaluées à l'aide des critères GRADE (tableau A2).
Résultats :
- Le VEJ est efficace si la séroprotection est utilisée comme paramètre final et sécuritaire chez les enfants de 2 mois à 16 ans. Le groupe de travail a proposé d'étendre les recommandations antérieures de l'ACIPNote de bas de page 45 pour l'administration du VEJ chez les adultes aux enfants âgés de deux mois ou plus; aucun autre changement aux recommandations existantes de l'ACIP n'a été proposé. Les principaux facteurs pris en compte dans la formulation de la recommandation sont résumés au tableau A3.
| Résultat | Conception (Nbre d'études)Note de bas de page 1 |
Risque de biais | Incohérence | Caractère indirect | Imprécision | Autres considérationsNote de bas de page 2 | Type de données probantesNote de bas de page 3 |
|---|---|---|---|---|---|---|---|
| Avantages | |||||||
| Séroprotection à 1 mois | ECRNote de bas de page 4 | Aucun risque de biais important | Aucune incohérence importante | OuiNote de bas de page 4 | Aucune imprécision grave | Aucune | 2 |
| ObsNote de bas de page 6 | Aucun risque de biais important | Aucune incohérence importante | Aucun caractère indirect | Aucune imprécision grave | Aucune | 3 | |
| Séroprotection à 6 mois | ECRNote de bas de page 2 | Aucun risque de biais important | Aucune incohérence importante | OuiNote de bas de page 4 | Aucune imprécision grave | Aucune | 2 |
| ObsNote de bas de page 3 | Aucun risque de biais important | Aucune incohérence importante | Aucun caractère indirect | Aucune imprécision grave | Aucun | 3 | |
| Risques attribuables au vaccin | |||||||
| Événements indésirables graves | ECRNote de bas de page 8 | OuiNote de bas de page 5 | Aucune incohérence importante | OuiNote de bas de page 6 | Aucune imprécision grave | Aucune | 3 |
| ObsNote de bas de page 5 | Aucun risque de biais important | Aucune incohérence importante | OuiNote de bas de page 6 | Aucune imprécision grave | Aucune | 4 | |
| Événements indésirables systémiques | ECRNote de bas de page 5 | OuiNote de bas de page 5 | Aucune incohérence importante | Aucun caractère indirect | Aucune imprécision grave | Aucune | 2 |
| ObsNote de bas de page 4 | Aucun risque de biais important | Aucune incohérence importante | Aucun caractère indirect | Aucune imprécision grave | Aucune | 3 | |
|
|||||||
| Résultat | Conception de l'étude (Nbre d'études)Note de bas de page 1 |
Résultats | Type de données probantesNote de bas de page 2,Note de bas de page 3 |
Qualité globale des données |
|---|---|---|---|---|
| Séroprotection à 1 mois | ECRNote de bas de page 4 | Élevée (> 95 %) à 1 mois | 2 | 2 |
| Séroprotection à 6 mois | ECRNote de bas de page 2 | Maintenue (85 à 90 %) à 6 mois | 2 | |
| Événements indésirables graves | ECRNote de bas de page 8 | Faible incidence; semblable aux vaccins de comparaison | 3 | |
| Événements indésirables systémiques | ECRNote de bas de page 5 | Semblable aux vaccins de comparaison | 2 | |
|
||||
| Facteurs clés | Commentaires |
|---|---|
| Type de données probantes sur les avantages et les risques attribuables au vaccin |
|
| Équilibre entre les avantages et les risques attribuables au vaccin |
|
| Valeur |
|
| Rapport coût-efficacité |
|
Annexe 9. Évaluation de la qualité concernant le risque d'encéphalite japonaise chez les voyageurs du Canada, des États-Unis et de l'Europe
| Administration | Risque de biaisNote de bas de page 1 | Incohérence | Caractère indirect | Imprécision | Autres considérations | Taux d'attaque estimé | Confiance dans l'estimation du risque de référenceNote de bas de page ɫ |
|---|---|---|---|---|---|---|---|
| CanadaNote de bas de page 2 | |||||||
| Rapports de cas par rapport au nombre de voyages (dénominateur) (2006-2015) |
Moyen | Aucune incohérence importante | Aucun caractère indirect important | Aucune | Aucune | 1/11 650 000 (IC À 95 % 1/65 996 483; 1/2 056 512) | ⊕⊕⊕⊝ MODÉRÉE |
| États-UnisNote de bas de page 3 | |||||||
| Rapports de cas par rapport au nombre de voyages (dénominateur) (2006-2015) |
Moyen | Aucune incohérence importante | Aucun caractère indirect important | Aucune | Aucune | 1/11 078 000 (IC À 95 % 1/25 935 276; 1/4,731859) | ⊕⊕⊕⊝ MODÉRÉE |
| EuropeNote de bas de page 4 | |||||||
| Rapports de cas par rapport au nombre de voyages (dénominateur) (2006-2015) |
Moyen | Aucune incohérence importanteNote de bas de page i | Aucun caractère indirect important | Aucune | Aucune | 1/13 636 363 (IC À 95 % 24 420 2750; 7 614 592) | ⊕⊕⊕⊝ MODÉRÉE |
|
|||||||
Annexe 10. Facteurs à prendre en considération lors de l'évaluation du risque d'exposition d'un voyageur au virus de l'encéphalite japonaise
- Destination
- Le virus de l'EJ est présent dans la plupart des régions de l'Asie et dans certaines parties du Pacifique occidental. Il est généralement reconnu que la probabilité d'exposition à l'EJ est la plus élevée dans les régions agricoles rurales.
- Durée du voyage
- Un séjour plus long accroît la probabilité qu'un voyageur soit exposé à un moustique infecté par le virus de l'EJ.
- Saison
- Dans la plupart des régions tempérées de l'Asie, la transmission du virus de l'EJ est saisonnière, et le nombre de cas humains atteint habituellement un sommet en été et en automne. Dans les zones subtropicales et tropicales, les modes de transmission du virus de l'EJ varient, et les cas humains peuvent être sporadiques ou survenir toute l'année. L'annexe 2 fournit des informations au niveau du pays.
- Activités
-
Les moustiques qui transmettent le virus de l'EJ piquent le plus souvent les humains à l'extérieur, les périodes de pointe étant généralement les heures où il fait noir.
La pratique d'activités de plein air (p. ex., camping, randonnée, vélo, pêche, chasse ou agriculture), surtout le soir ou la nuit, augmente le risque d'être exposé à un moustique infecté par l'EJ.
Le risque d'exposition aux moustiques qui transmettent l'EJ et d'autres maladies à transmission vectorielle (p. ex., dengue et paludisme) est plus élevé dans les hébergements sans climatisation, moustiquaires de fenêtre ou moustiquaires de lit.
- Utilisation de mesures de protection individuelle (MPI)
- On s'attend à ce que l'utilisation de MPI, p. ex., moustiquaires de lit, insectifuges, traitement des vêtements, offre une protection substantielle contre les piqûres de moustiques qui transmettent l'EJ. Le niveau de conformité personnelle avec les MPI peut modifier considérablement le risque d'exposition au virus de l'EJ.
Annexe 11. Résumé des études prises en considération pour inclusion dans l'analyse GRADE
| Référence | Sujet | Conception de l'étude | Dose et calendrier d'administration du vaccin/comparateur | Population | Données démographiques | Objectifs | Commentaires |
|---|---|---|---|---|---|---|---|
| Tauber 2008Note de bas de page 31 | Innocuité | Essai de phase 3 randomisé, à double insu, contrôlé par placebo, multicentrique. | VEJ aux jours 0 et 28 (6 μg de virus dans 0,5 ml/dose) comparativement à la solution de PBS avec hydroxyde d'aluminium aux jours 0 et 28 (0,5 ml/dose). | 2 650 sujets. 1 993 ont reçu le VEJ et 657 ont reçu un placebo. | Des sujets de sexe masculin et féminin en santé âgés de 18 ans et plus et sans antécédents de vaccination contre l'EJ. | Paramètre principal, taux d'EIAV graves et d'EIAV modérés de la première dose jusqu'à 4 semaines après la fin de la vaccination. Le paramètre secondaire était le taux d'EIAV locaux tel que rapporté dans le journal du patient. | Étude incluse dans l'analyse |
| Tauber 2007Note de bas de page 25 | Immunogénicité et innocuité | Essai en non-infériorité de phase 3 multicentrique, à l'insu de l'observateur, randomisé centralement, contrôlé par placebo. | VEJ aux jours 0 et 28 (6 μg de virus dans 0,5 ml/dose) et un placebo (0,5 ml d'hydroxyde d'aluminium) au jour 7 en comparaison avec le JE-VAX aux jours 0, 7, 28 (1 ml/dose). | 863 des 867 personnes randomisées ont reçu le médicament à l'étude. 428 ont reçu le VEJ et 435 ont reçu le MBV. | Hommes et femmes âgés de 18 ans et plus. Aucune immunisation antérieure pour l'EJ ou la FJ. | La séroconversion (paramètre principal) a été évaluée le jour 56. L'innocuité (paramètre secondaire) a été évaluée pendant les visites et au moyen du journal du patient. | Étude incluse dans l'analyse |
| Schuller 2011Note de bas de page 69 | Innocuité | Article de revue | 10 essais individuels de phase 3 ont été examinés | S/O | S/O | Rapports sur les profils d'innocuité tirés des données disponibles après la mise en marché et recueil des analyses des données cliniques sur l'innocuité | Exclu (article de revue) |
| Schuller 2009Note de bas de page 27 | Innocuité et immunogénicité | Essai de phase 3 à répartition aléatoire multicentrique, contrôlé par placebo, à simple insu, en groupe parallèle. | Dose unique de VEJ (6 μg/dose) aux jours 0 et 28 comparativement à 2 doses de VEJ (6 μg/dose) au jour 0 comparativement à une seule dose de VEJ (6 μg/dose) au jour 0. | 374 sujets. 124 ont reçu la dose unique élevée (1 x 12 μg), 125 ont reçu le shéma posologique standard (2 x 6 μg) et 125 ont reçu la dose unique standard (1 x 6 μg). | Sujets masculins et féminins âgés de 18 ans et plus en santé. Aucune immunisation antérieure pour l'EJ. | Séroconversion (paramètre principal) évaluée aux jours 10, 28, 35 et 56 après la première vaccination. L'innocuité (paramètre secondaire) a été évaluée pendant les visites et au moyen du journal du patient. | Étude incluse dans l'analyse |
| Kaltenböck 2009Note de bas de page 70 | Innocuité et immunogénicité | Essai de phase 3 à répartition aléatoire multicentrique, contrôlé par placebo, à simple insu. | VEJ (6 μg/dose) aux jours 0 et 28 et placebo (0,5 ml) au jour 0 comparativement au placebo (0,5 ml) aux jours 0 et 28 et au VHA au jour 0 comparativement au VEJ (6 μg/dose) aux jours 0 et 28 et au VHA au jour 0 | 192 sujets. 65 ont reçu le VEJ + placebo, 65 ont reçu le VHA + placebo et 62 ont reçu le VEJ + le VHA. | Sujets masculins et féminins âgés de 18 ans et plus en bonne santé. Aucune immunisation antérieure contre l'EJ, la fièvre jaune ou l'hépatite A. | La séroconversion (paramètre principal) avec le VEJ (jour 56). Le taux de séroconversion (paramètre secondaire) obtenu avec le VEJ en comparaison avec l'administration concomitante du VEJ et du VHA (jour 56). L'innocuité (paramètre secondaire) a été évaluée pendant les visites et au moyen du journal du patient. | S/O |
| Dubischar-Kastner 2010Note de bas de page 59 | Innocuité et immunogénicité | Essai clinique de suivi ouvert de phase III, non contrôlé par placebo, multicentrique. Extension de l'étude décrite précédemment (Schuller et coll., 2009). |
L'immunogénicité a été évaluée à 6, 12 et 24 mois après la première vaccination chez des sujets de l'étude précédente. Les sujets qui ont reçu un résultat négatif au test de séroneutralisation par réduction des plages de lyse à 6 ou 12 mois ont reçu une dose de rappel de VEJ (6 μg) 11 ou 23 mois plus tard. | 349 sujets. 206 ont reçu une dose de rappel au mois 11, 43 ont reçu une dose de rappel au mois 23 et 1 a reçu une dose de rappel aux mois 11 et 23. | Sujets masculins et féminins en santé, âgés de 18 ans et plus, ayant déjà participé à l'étude sur le VEJ. | La séroconversion (paramètre primaire) a été évaluée 24 mois après la première vaccination avec le VEJ. Innocuité, évaluée pendant les visites et au moyen du journal du patient. |
Exclu (uniquement lié à l'administration d'une dose de rappel) |
| Lyons 2007Note de bas de page 28 | Innocuité et immunogénicité | Essai de phase 2 ouvert à répartition aléatoire dans un centre unique. | VEJ (6 μg/dose) aux jours 0 et 28 comparativement au VEJ (6 μg/dose) aux jours 0, 14 et 28 comparativement au VEJ (12 μg/dose) aux jours 0, 7 et 28. | 94 sujets. 24 ont reçu le VEJ à raison de 2 doses de 6 μg, 24 ont reçu le VEJ (3 x 6 μg), 25 ont reçu le VEJ (2 x12 μg) et 21 ont reçu le JE-Vax (3 doses). | Sujets militaires ou civils âgés de 18 à 49 ans. Les exclusions incluaient une exposition antérieure à la dengue, à l'EJ, à la FJ ou à l'encéphalite à tiques. | La séroconversion (paramètre principal) a été évaluée aux jours 28 et 56. Suivi facultatif à 6, 12, 18 et 24 mois. L'innocuité (paramètre secondaire) a été évaluée pendant les visites et au moyen du journal du patient. | Étude incluse dans l'analyse |
| Kaltenböck 2010Note de bas de page 29 | Innocuité et immunogénicité | Essai de phase 2 ouvert à répartition aléatoire dans un centre unique. | VEJ (3 μg/dose) comparativement à VEJ (6 μg/dose) comparativement à JenceVac (0,5 ml/dose) | 60 sujets. 24 ont reçu du VEJ 3 μg, 24 du VEJ 6 μg et 12 du JenceVac. | Enfants en santé de l'un ou l'autre sexe âgés de 1 à 3 ans. Aucune immunisation antérieure contre l'EJ, la fièvre jaune ou la dengue. | La séroconversion (paramètre principal) a été évaluée aux jours 28 et 56. Innocuité évaluée pendant les visites et au moyen du journal du patient rempli par procuration. |
Étude incluse dans l'analyse |
| Yun 2015Note de bas de page 71 | S/O | Étude multicentrique, à double insu, à répartition aléatoire centrale sur l'ENCEVAC et non sur le VEJ. |
S/O | S/O | S/O | S/O | Exclu (le VEJ n'a pas été utilisé). |
| Jelinek 2015Note de bas de page 26 | Innocuité et immunogénicité | Essai de phase III à répartition aléatoire multicentrique à simple insu. | VEJ (0,5 ml/dose) aux jours 0, 28 + rage aux jours 0, 7 comparativement à VEJ (0,5 ml/dose) aux jours 0, 7 + rage aux jours 0, 3 comparativement à VEJ (0,5 ml/dose) seulement aux jours 0 et 28. |
440 sujets. 167 ont reçu le shéma posologique standard EJ + rage, 217 le shéma posologique accéléré EJ + rage et 56 le shéma posologique standard EJ. | S/O | 440 adultes en santé âgés de 18 à 65 ans. Personnes ayant déjà reçu le vaccin contre l'EJ. La séroconversion (paramètre principal) a été évaluée 28 jours après la fin de la série (jour 35 ou jour 56). L'innocuité (paramètre secondaire) a été évaluée pendant les visites et au moyen du journal du patient. | S/O |
| Eder 2011Note de bas de page 72 | Innocuité et immunogénicité | Étude d'extension prospective, ouverte et multicentrique de phase 3. Dose de rappel du VEJ administrée15 mois après la première dose de la série primaire. | S/O | S/O | S/O | Sujets de sexe masculin et féminin en santé d'au moins 18 ans (198 sujets). Patient ayant déjà reçu la série primaire de doses de VEJ. La séroconversion (paramètre principal) a été évaluée 1, 6 et 12 mois après le rappel. L'innocuité (paramètre secondaire) a été évaluée pendant les visites et au moyen du journal du patient. | S/O |
| Paulke-Korinek 2015Note de bas de page 12 |
Immunogénicité | Prolongation de l'étude décrite précédemment (Eder et coll., 2011). | S/O | S/O | S/O | Un prélèvement sanguin a été effectué au 76e mois chez les 67 patients qui ont participé à l'étude sur les doses de rappel. La séroconversion était le paramètre principal. | S/O |
| Schuller 2008Note de bas de page 30 | Immunogénicité | Étude de suivi multicentrique de phase 3 non contrôlée par placebo. VEJ et MBV. | S/O | S/O | S/O | 298 des 3258 sujets qui ont terminé les études précédentes de phase 3 étaient inscrits. La séroconversion (paramètre principal) a été évaluée à 6 mois (298 sujets) et à 12 mois (180 sujets). | S/O |
| ACIP 2013Note de bas de page 4 | Innocuité et immunogénicité | Analyse GRADE de l'administration du VEJ chez les enfants. | S/O | S/O | S/O | Plusieurs études ainsi que des données probantes non publiées ont été incluses. | Incluse |