Rapport sur le système de surveillance accrue de la résistance de la gonorrhée aux antimicrobiens (SARGA) : 2018-2021

Télécharger le rapport complet
(Format PDF, 3.2 Mo, 72 pages)
Organisation : Agence de la santé publique du Canada
Sur cette page
- 1.0. Les messages clés
- 2.0. Introduction
- 3.0. Les méthodes
- 4.0. Les résultats
- 4.1. Nombre de cultures de gonorrhée fournies par les PT participant à la SARGA, 2018 à 2021
- 4.2. Caractéristiques des cas
- 4.3. Pertinence de l'utilisation des antimicrobiens
- 4.3.1. Lignes directrices fédérales et provinciales/territoriales pour le traitement de la gonorrhée, 2018 à 2021
- 4.3.2. Pertinence de l'utilisation des antimicrobiens parmi les cas SARGA, 2018 à 2021
- 4.3.3. Échec du traitement de la gonorrhée parmi les cas SARGA, 2018 à 2021
- 4.3.4. Sensibilité aux antimicrobiens parmi les cas SARGA, 2018 à 2021
- 4.3.4.a. Fardeau de la gonorrhée RAM parmi les cas SARGA et par sexe/comportement sexuel
- 4.3.4.b. AzithromycineR, céfiximeSR et ceftriaxoneSR parmi toutes les cultures SARGA et par sexe/comportement sexuel
- 4.3.4.c. Les antimicrobiens résistants les plus répandus et les autres tendances de la résistance aux antimicrobiens parmi tous les cas SARGA et par sexe/comportement sexuel
- 4.3.5. Caractéristiques des cas et séquences types des cas SARGA avec des cultures démontrant la présence d'azithromycineR, de céfiximeSR ou de ceftriaxoneSR, 2018 à 2021
- 4.3.5.a. Caractéristiques des cas et séquences types des cas SARGA avec des cultures démontrant la présence d'azithromycineR
- 4.3.5.b. Caractéristiques des cas et séquences types des cas SARGA avec des cultures démontrant la présence de céfiximeSR
- 4.3.5.c. Caractéristiques des cas et séquences types des cas SARGA avec des cultures démontrant la présence de ceftriaxoneSR
- 4.4. Typage des séquences
- 5.0. Qualité et limites des données
- 6.0. Discussion
- 7.0. Conclusion
- Annexe 1. Liste des figures et tableaux supplémentaires
- Annexe 2. Comparaison des résultats de PSAG - Canada et de SARGA 2021
- Annexe 3. Résistance (R) et sensibilité réduite (SR) aux antimicrobiens sélectionnés par province ou territoire, 2018 à 2021
- 8.0. Références
1. Les messages clés
- Neisseria gonorrhoeae, la bactérie responsable de la gonorrhée, est considérée comme une menace sérieuse pour la santé publique car elle développe de plus en plus de résistance aux antimicrobiens recommandés pour le traitement.
- L'Agence de la santé publique du Canada (ASPC) a lancé le système de Surveillance accrue de la résistance de la gonorrhée aux antimicrobiens (SARGA) en 2013 afin de mieux comprendre les tendances actuelles de la N. gonorrhoeae résistante aux antimicrobiens . Les résultats de la SARGA permettent d'élaborer des lignes directrices pour le traitement et des interventions de santé publique afin de minimiser la propagation de la gonorrhée résistante aux antimicrobiens (RAM) au Canada.
- Entre 2018 et 2021, il y a eu un total de 3 377 cas SARGA avec une culture primaire. Ces données représentent, en moyenne, 19,8 % de toutes les cultures de N. gonorrhoeae soumises au Laboratoire national de microbiologie (LNM) et 2,5 % de tous les cas de gonorrhée déclarés au Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO) dans l'ensemble du Canada pour les années 2018 à 2021. Parmi ces 3 377 cas SARGA,
- 83,0 % des cas ont été signalés par l'Alberta, 14,3 % par le Manitoba, 1,8 % par la Nouvelle-Écosse et 0,9 % par les Territoires du Nord-Ouest.
- la plupart des cas étaient des hommes (80,2 %, n=2709), dont 55,5 % en moyenne était des hommes gais, bisexuels et autres hommes ayant des relations sexuelles avec des hommes (GBHARSAH).
- la plus grande proportion des cas étaient âgés de 20 à 39 ans (proportion moyenne de 72,8 %, intervalle : 70,1 % à 75,4 %)
- le site d'infection gonococcique (GC) primaire le plus fréquent variait en fonction du sexe et du comportement sexuel. Parmi les cas GBHARSAH, les infections rectales (moyenne : 39,3 %) et pharyngées (moyenne : 34,6 %) étaient les sites d'infection primaire les plus fréquemment déclarés. En revanche, les infections génitales ont été plus souvent déclarées chez les hommes hétérosexuels (moyenne : 90 %) et chez les hommes au comportement sexuel inconnu (moyenne : 52,5 %).
- 30,3 % des cas ont été déclarés en 2018 (n=1022), 29,6 % (n=999) en 2019, 21,1 % (n=711) en 2020 et 19,1 % (n=645) en 2021.
- Parmi les cas SARGA présentant un site d'infection primaire anogénital (défini comme un site d'isolement par écouvillonnage du GC cervical, rectal ou urogénital) ou pharyngé de 2018 à 2021, l'adhésion globale des prescripteurs aux lignes directrices de traitement de la gonorrhée de l'ASPC et des provinces ou territoires (PT) était élevée (moyenne de 91,4 % d'adhésion aux lignes directrices de l'ASPC et de 89,5 % d'adhésion aux lignes directrices des PT) et principalement stable. L'adhésion des prescripteurs aux lignes directrices de traitement était similaire selon le comportement sexuel et le site d'infection; les cas parmi les GBHARSAH se sont vu prescrire principalement le régime de traitement recommandé d'azithromycine 1 g avec ceftriaxone 250 mg et tous les autres cas adultes se sont vu prescrire principalement le régime de traitement recommandé d'azithromycine 1 g avec céfixime 800 mg.
- De 2018 à 2020, la prévalence de la gonorrhée RAM (indiquée par la résistance à au moins un antimicrobien testé) parmi les cas de SARGA est restée stable. Cependant, la prévalence de la gonorrhée RAM a augmenté, passant de 69,3 % en 2020 à 77,4 % en 2021. Cela correspondait quasiment au double des cas dont les cultures GC démontraient une résistance ou une sensibilité réduite à deux antimicrobiens différents, passant de 24,8 % en 2020 à 44,5 % en 2021.
- En 2021, le fardeau de la gonorrhée RAM était la plus élevée chez les GBHARSAH (85,2 % des cultures isolées chez les GBHARSAH étaient résistantes à au moins un antimicrobien testé), suivis par les hommes hétérosexuels (73,5 % des cultures provenant d'hommes hétérosexuels étaient résistantes à au moins un antimicrobien testé) et les femmes (66,7 % de toutes les cultures GC isolées chez les femmes étaient résistantes à au moins un antimicrobien testé). La résistance à la ciprofloxacine et à la tétracycline était élevée dans tous les groupes de comportement sexuel, mais plus élevée chez les GBHARSAH.
- De 2018 à 2020, le nombre et la proportion de cas SARGA présentant une sensibilité réduite au céfixime (céfiximeSR) étaient très faibles et stables (<1%). Cependant, de 2020 à 2021, le nombre de cas SARGA avec une sensibilité réduite au céfixime a presque triplé, passant de 6 (0,8 %) en 2020 à 22 (3,4 %) en 2021. Sur les 32 cas de céfiximeSR, 19 étaient des GBHARSAH (59,4 %).
- Les cas SARGA présentant une sensibilité réduite à la ceftriaxone (ceftriaxoneSR) ont diminué en nombre et en proportion, passant de huit cas (0,8 %) en 2018 à un cas (0,2 %) en 2021.
- Le nombre de cas présentant une résistance à l'azithromycine (azithromycineR) a augmenté (principalement parmi les GBHARSAH), passant de 18 (1,8 %) en 2018 à 78 cas (7,8 %) en 2019. Toutefois, ce nombre a fortement diminué pour atteindre huit cas (1,1 %) en 2020 et 12 cas (1,9 %) en 2021 (en dessous du seuil de préoccupation de 5 % de l'Organisation mondiale de la santé (OMS)).
- Aucun cas SARGA ne présentait à la fois de l'azithromycineR et du céfiximeSR ou de la ceftriaxoneSR (les antimicrobiens recommandés par les PT et l'ASPC et les plus prescrits). La présence de céfiximeSR et de ceftriaxoneSR a été détectée dans un cas en 2018, en 2020 et en 2021, et dans trois cas en 2019.
- Entre 2020 et 2021, parmi tous les antimicrobiens testés, la résistance à la ciprofloxacine était la plus répandue (46,6 % en 2020 et 63,1 % en 2021). La deuxième résistance aux antibiotiques la plus répandue parmi les cas SARGA était la résistance à la tétracycline (45,9 % en 2020 et 58,6 % en 2021). Auparavant, la résistance à la tétracycline était la plus répandue, avec 52,1 % en 2018 et 51,8 % en 2019. La résistance à l'érythromycine a diminué annuellement et fortement, passant de 30,0 % en 2018 à 8,5 % en 2021. La prévalence de la résistance à la pénicilline a été relativement stable de 2018 à 2020 (6,8 % en 2018, 7,2 % en 2019 et 8,2 % en 2020), mais a chuté à 3,9 % en 2021.
- Quatorze cas ont été signalés par les autorités de santé publique comme des échecs thérapeutiques. Toutefois, aucun d'entre eux n'a présenté de résistance ou de diminution de la sensibilité à l'ensemble des traitements prescrits, ce qui suggère que ces cas ont été réinfectés ou qu'ils n'ont pas pris leurs médicaments correctement.
- Entre 2018 et 2020, 396 séquences types (ST) uniques par typage de séquences multi-antigènes de N. gonorrhoeae (N. gonorrhoeae multiantigen sequence typing (NG-MAST)) ont été identifiés à partir de 3 377 isolats de N. gonorrhoeae prélevés dans des cas SARGA. Dans l'ensemble, il n'y a pas eu de tendance claire à l'augmentation ou à la diminution de la prévalence de l'azithromycineR, du céfiximeSR ou de la ceftriaxoneSR parmi les 10 principaux ST pour chaque année.
2. Introduction
La gonorrhée est une infection transmissible sexuellement (ITS) causée par la bactérie N. gonorrhoeae. La gonorrhée est la deuxième ITS à déclaration obligatoire la plus déclarée au Canada. En 2021, 32 192 cas de gonorrhée ont été déclarés au Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO), soit un taux national de 84,2 cas pour 100 000 personnes Note de bas de page 1. Avant la pandémie de la COVID-19, les taux de cas déclarés de gonorrhée ont triplé entre 2010 (33,5 cas pour 100 000 personnes) et 2019 (94,4 cas pour 100 000 personnes). Entre 2019 et 2021, le taux de gonorrhée a diminué de 14 %. Cela a probablement été influencé par les protocoles de prévention liés à la pandémie qui ont mené à une réduction de l'accès et de la demande de dépistage et de soins de la gonorrhée, ainsi que de la déclaration à la santé publique Note de bas de page 2. Le nombre de cas et les taux de gonorrhée déclarés sous-estiment la prévalence réelle de la gonorrhée au Canada, car de nombreux cas de gonorrhée sont asymptomatiques et ne sont pas détectés et, par conséquent, ne sont pas déclarés.
La gonorrhée se propage facilement, est associée à des contacts sexuels liés à des voyages, est souvent observée en même temps que la chlamydia et augmente le risque d'acquisition du VIHNote de bas de page 2. Les individus ayant un infection à N. gonorrhoeae, qu'ils soient asymptomatiques ou symptomatiques, peuvent transmettre la bactérie à leurs partenaires sexuels. Les personnes testées pour la gonorrhée sont plus susceptibles d'être des personnes symptomatiques, des personnes ayant un risque plus élevé d'exposition à N. gonorrhoeae qui sont régulièrement dépistés pour les ITS (par exemple, les GBHARSAH) et les contacts des cas de gonorrhée Note de bas de page 3.
Bien que la gonorrhée soit curable avec les antimicrobiens appropriés, elle demeure une menace importante pour la santé publique au Canada et dans le monde, car l'agent pathogène, N. gonorrhoeae, a développé une résistance à de nombreux antimicrobiens au fil du temps, y compris les traitements actuellement recommandés au Canada et à l'étranger. En outre, la prévalence de la gonorrhée RAM dans les cultures de gonorrhée a augmenté au fil du temps - la proportion de cultures canadiennes résistantes à au moins un antimicrobien testé a triplé, passant d'un quart des cultures en 2000 à près de trois quarts des cultures (73 %) en 2021Note de bas de page 2.
Si elle n'est pas traitée adéquatement ou si elle n'est pas traitée du tout, la gonorrhée peut provoquer une maladie inflammatoire pelvienne qui peut mener à la stérilité ou à des grossesses extra-utérines chez les femmes, et à une épididymite chez les hommesNote de bas de page 2. Dans environ un pour cent des cas, la gonorrhée peut également se propager au sang, provoquant une infection gonococcique disséminée (IGD), qui peut mettre la vie en danger. La gonorrhée peut également être transmise à un bébé à la naissance, provoquant des infections oculaires ou une IGD chez le bébéNote de bas de page 3.
La surveillance continue des souches de gonorrhée RAM, des échecs de traitement de la GC et des données relatives aux prescriptions pour le traitement de la gonorrhée liées aux données épidémiologiques peut informer l'utilité et la précision des lignes directrices pour le traitement de la gonorrhée et contribuer à réduire la propagation de la gonorrhée hautement résistante. À cette fin, l'ASPC surveille la gonorrhée RAM au moyen de deux systèmes de surveillance en laboratoire.
Le premier est le Programme de surveillance antimicrobienne du gonocoque (PSAG - Canada), dirigé par le Laboratoire national de microbiologie (LNM) de l'ASPC; il s'agit d'un programme national de surveillance passive lancé dans les années 1980 qui recueille et surveille les données sur la gonorrhée RAM obtenues à partir des tests de sensibilité aux antimicrobiens (TSAM) et de la caractérisation moléculaire (à l'aide de ST obtenus par NG-MAST) des cultures de gonorrhéeNote de bas de page 2. Ce programme dispose de nombreuses données de laboratoire mais de peu de données épidémiologiques sur les cas de GC.
Le deuxième est le système de SARGA, qui relie un sous-ensemble des données de la gonorrhée RAM de PSAG - Canada aux données épidémiologiques et cliniques afin d'améliorer la compréhension des tendances de la gonorrhée RAM à travers le Canada. La SARGA a débuté en 2013 et est dirigé par le Centre de lutte contre les maladies transmissibles et les infections (CLMTI) de l'ASPC et du LNM. L'objectif de la SARGA est d'aider à informer les interventions de santé publique afin de minimiser la propagation de la gonorrhée RAM au Canada.
Ce rapport résume les données de SARGA de 2018 à 2021. L'Alberta, le Manitoba, la Nouvelle-Écosse ( Central Zone Health Authority uniquement) et les Territoires du Nord-Ouest ont fourni des données cliniques et épidémiologiques. D'autres provinces et territoires canadiennes s'efforcent de relier leurs données sur la gonorrhée RAM du PSAG - Canada aux données épidémiologiques et cliniques afin de les inclure dans les futures analyses SARGA.
3. Les méthodes
3.1. Définition d'un cas de SARGA
Un cas de SARGA désigne tout client âgé de 16 ans ou plus qui répond à la définition d'un cas de gonorrhée de l'ASPC (c'est-à-dire nationale) et dont la culture de GC a été analysée soit par le LNM de l'ASPC, soit par un laboratoire régionalNote de bas de page 4. Si un client avait obtenu plusieurs cultures dans un délai de 30 jours, la culture primaire incluse dans l'analyse était celle qui présentait la plus grande résistance aux antimicrobiens. Lorsqu'il n'y avait pas de différence dans les profils de résistance, la culture primaire a été classée par ordre de priorité en fonction de la probabilité relative d'échec au traitement sur le site d'infection (comme suit, de la probabilité la plus élevée d’échec de traitement à la probabilité la plus faible : cultures pharyngées, rectales, urétrales et cervicales). Seules les données des cultures primaires ont été utilisées dans les analyses. Si un client a eu plus d'une culture à plus de 30 jours d'intervalle, ces cultures ont été traitées comme des cas de SARGA distincts car il s'agissait probablement de réinfections.
3.2. Données de SARGA
Les données de la SARGA comprennent des données liées (via un identifiant unique non identifiable) et dépersonnalisées de laboratoire (profil de résistance de la gonorrhée RAM et les ST par NG-MAST), cliniques (site d'infection/culture, traitement prescrit et échec présumé du traitement) et épidémiologiques (démographie et comportement à risque) des cas de gonorrhée.
Les données cliniques et épidémiologiques ont été extraites des formulaires de déclaration de cas de gonorrhée de surveillance routine/rehaussée provinciaux et territoriaux et fournies par les autorités sanitaires des PT participant à la SARGA, notamment l'Alberta, le Manitoba, la Nouvelle-Écosse et les Territoires du Nord-Ouest. Les données de laboratoire ont été obtenues à partir de PSAG - Canada avec le consentement des PT participants. Les données de PSAG - Canada comprennent les données des TSAM et les données de caractérisation moléculaire par NG-MAST.
Toutes les données de SARGA ont été saisies directement ou téléversées dans une base de données protégée par un mot de passe, accessible sur le Web et filtrée par juridiction, hébergée sur la plateforme du Réseau canadien de renseignements sur la santé publique (RCRSP).
3.3. Période d'analyse des données
Bien que la SARGA ait été lancé en 2013, ce rapport se limite aux données des cas SARGA dont les isolats de GC ont été collectés entre 2018 et 2021, car cette période reflète les plus récentes lignes directrices pour le traitement de la gonorrhée de l'ASPC (dernière mise à jour en juin 2017) Note de bas de page 5.
3.4. Définitions des variables de SARGA
Les variables suivantes ont été créées à partir des données épidémiologiques de la SARGA :
- Sexe :
La variable « sexe » est un mélange de données sur le sexe et le genre, car certains PT fournissent des données sur le sexe, d'autres sur le genre et d'autres un mélange des deux. - Comportement sexuel :
Les cas déclarés comme masculins qui ont déclaré que leurs partenaires sexuels étaient des hommes, ou des hommes et des femmes, ont été classés dans la catégorie « GBHARSAH ». Les « hommes hétérosexuels » ont été définis comme les cas de sexe masculin qui ont déclaré n'avoir que des partenaires féminines. Enfin, les « hommes au comportement sexuel inconnu » ont été définis comme les cas masculins qui n'avaient pas d'informations sur leurs partenaires sexuels. - Site d'infection primaire (site d'infection) :
Le site d'infection primaire est le site d'infection à partir duquel la culture primaire a été prélevée. Les sites d'infection comprenaient le pharynx (gorge), les organes génitaux (urétral, urogénital, cervical ou vaginal), le rectum et d'autres sites. Conformément aux Lignes directrices canadiennes sur les infections transmissibles sexuellement (LDCITS) de l'ASPC, une « infection anogénitale » a été définie comme un site d'isolement cervical, rectal ou urogénital par écouvillonnage GC, ainsi que les sites d'isolement dans lesquels « autre » était spécifié comme un site anatomique anogénital (par exemple, lèvres, périnée) Note de bas de page 6. Les sites d'isolement de GC spécifiés comme étant la gorge ont été classés dans la catégorie « infections pharyngées ». - Raison de la visite médicale :
Les cas SARGA peuvent avoir eu une ou plusieurs raisons pour leur visite médicale. Cependant, une seule raison a été incluse dans les résultats. La raison de la visite médicale incluse dans toutes les analyses a été sélectionnée dans l'ordre suivant : test de guérison, signes et symptômes, contact avec un cas connu de gonorrhée (contact avec le cas), dépistage d'une ITS et autre. - Donnée relative à la prescription d'un traitement contre la gonorrhée :
Les « autres adultes » comprennent les hommes hétérosexuels, les femmes et les individus transgenres. Elle n'inclut pas les hommes GBHARSAH ou les hommes dont le comportement sexuel est inconnu.
3.5. Méthodes de laboratoire
3.5.1. Analyse de la sensibilité aux antimicrobiens des cultures de gonorrhée
La concentration minimale inhibitrice (CMI) d'un traitement antimicrobien (c.-à-d. un antibiotique) qui inhibe la croissance de N. gonorrhoeae a été déterminée pour l'azithromycine, la ceftriaxone, le céfixime, la ciprofloxacine, l'érythromycine, la pénicilline, la spectinomycine et la tétracycline pour toutes les cultures de N. gonorrhoeae à l'aide d'une dilution sur gélose ou d'un Etest®(BioMérieux, Laval, Québec). Les Etest® sont utilisés pour les cultures sensibles de l'Alberta qui ne sont pas envoyées au LNM. Les interprétations des CMI étaient basées sur les seuils du Clinical and Laboratory Standards Institute (CLSI), sauf pour la sensibilité réduite au céfixime (définie comme une CMI ≥ 0,25 mg/L), la sensibilité réduite à la ceftriaxone (CMI ≥ 0,125 mg/L) et la résistance à l'érythromycine (CMI ≥ 2,0 mg/L) (voir l'annexe A et l'annexe B pour plus de détails; les annexes A à I sont disponibles sur demande à l'adresse sti-hep-its@phac-aspc.gc.ca) Note de bas de page 7 Note de bas de page 8 Note de bas de page 9.
3.5.2. Typage des séquences pour les cultures de N. gonorrhoeae
Le typage des séquences a été réalisé pour toutes les cultures soumises au LNM à l'aide de la méthode NG-MAST qui incorpore l'amplification du gène de la porine (porB) et du gène de la protéine de liaison à la transferrine (tbpB)Note de bas de page 5. Les séquences d'ADN des deux brins ont été assemblées et comparées à l'aide du logiciel DNAStar, Inc. Les séquences résultantes ont été soumises à la base de données PubMLST NG-MAST afin de déterminer les ST. Le test NG-MAST n'a pas été effectué sur les isolats susceptibles dont les cultures n'ont pas été soumises au LNM. Le NG-MAST est très distinctif et peut être utilisé pour enquêter sur les échecs de traitement de la gonorrhée et les éclosions. Les ST NG-MAST ont également montré une association étroite avec la RAMNote de bas de page 2.
Les méthodes de laboratoire de PSAG - Canada ont déjà été publiées et décrites plus en détail que ce qui est résumé ici Note de bas de page 10.
3.5.3. Analyse des données
Les données relatives aux ordonnances pour le traitement de la gonorrhée ont été analysées pour les cas de SARGA qui i) avaient des données d'ordonnance ii) répondaient aux définitions ci-dessus de « GBHARSAH » ou « autres adultes » et iii) avaient un site d'infection primaire qui était soit anogénital, soit pharyngé (ii et iii correspondent aux deux définitions de catégories de clients traités pour la gonorrhée décrites dans les lignes directrices de traitement de l'ASPC et des PT). Les clients dont le site d'infection était inconnu ou autre ont été exclusNote de bas de page 6 Note de bas de page 11 Note de bas de page 12 Note de bas de page 13. Le nombre et la proportion d'ordonnances correspondant aux lignes directrices de i) l'ASPC et ii) des PT pour le traitement de la gonorrhée ont été calculés parmi a) les GBHARSAH et b) les autres adultes stratifiés par site d'infection gonococcique anogénitale ou pharyngéeNote de bas de page 6 Note de bas de page 11 Note de bas de page 12 Note de bas de page 13.
Les tendances de la gonorrhée RAM ont été étudiées par sexe et par comportement sexuel. Les résultats sont résumés par GBHARSAH, hommes hétérosexuels, hommes au comportement sexuel inconnu et femmes. Les tendances de la gonorrhée RAM n'ont pas été étudiées en fonction du comportement sexuel des femmes en raison i) du faible nombre de cas ii) du fait que lorsque le nombre de cas par groupe de comportement sexuel chez les femmes était suffisamment élevé, les tendances de la gonorrhée RAM étaient similaires.
Le nombre de cas et les proportions ont été calculés pour les caractéristiques des cas, l'adhésion aux lignes directrices de traitement de la gonorrhée par les prescripteurs et les variables de la gonorrhée RAM. Les changements en pourcentage dans les proportions du nombre de cas ont été calculés à l'aide de nombres non arrondis.
4. Les résultats
4.1 Nombre de cultures de gonorrhée fournies par les PT participant à la SARGA, 2018 à 2021
De 2018 à 2021, 3 377 cultures primaires (représentant 3 377 cas de SARGA) ont été incluses dans l'analyse décrite dans ce rapport. Dans l'ensemble, le nombre de cultures primaires a diminué chaque année, passant de 1022 cultures déclarées en 2018 à 645 cultures déclarées en 2021. Ces cultures représentent, en moyenne, 19,8 % (intervalle : 18,2 %-22,7 %) de toutes les cultures de N. gonorrhoeae soumises au LNM et 2,5 % (intervalle : 2,0 %-2,8 %) de tous les cas de gonorrhée déclarés au SCSMDO dans l'ensemble du Canada pour les années 2018 à 2021 Note de bas de page 2 Note de bas de page 14 Note de bas de page 15 Note de bas de page 16 Note de bas de page 17. De 2018 à 2021, la majorité des données de SARGA provenaient de l'Alberta (83,0 %), suivie du Manitoba (14,3 %), de la Nouvelle-Écosse (1,8 %) et des Territoires du Nord-Ouest (0,9 %) (tableau 1). De 2018 à 2021, ces provinces représentaient en moyenne 18 % de la population canadienne Note de bas de page 18. Pour connaître le nombre et le taux de cas de gonorrhée déclarés au SCSMDO parmi les PT participant à la SARGA, veuillez consulter l'annexe C supplémentaire.
Province ou territoire |
2018 |
2019 |
2020 |
2021 |
Total |
|||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | |
| Alberta | 812 | 79,5 % | 803 | 80,4 % | 587 | 82,6 % | 600 | 93,0 % | 2,802 | 83,0 % |
| Manitoba | 174 | 17,0 % | 155 | 15,5 % | 116 | 16,3 % | 39 | 6,0 % | 484 | 14,3 % |
| Nouvelle-Écosse | 31 | 3,0 % | 24 | 2,4 % | 1 | 0,1 % | 5 | 0,8 % | 61 | 1,8 % |
| Territoires du Nord-Ouest | 5 | 0,5 % | 17 | 1,7 % | 7 | 1,0 % | 1 | 0,2 % | 30 | 0,9 % |
| Total | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % | 3,377 | 100,0 % |
4.2. Caractéristiques des cas
Les caractéristiques des cas SARGA sont résumées dans le tableau 2 et décrites ci-dessous.
4.2.1. Sexe et comportement sexuel des cas SARGA, 2018 à 2021
De 2018 à 2021, les cas SARGA ont été majoritairement identifiés comme étant des hommes (moyenne : 80,2 %; intervalle : 78,0 % à 82,1 %, n= 2709). Parmi les hommes, 55,5 % en moyenne (intervalle : 51,6 % à 59,7 %) étaient des GBHARSAH et 31,7 % (intervalle : 29,3 % à 35,6 %) étaient hétérosexuels. Les proportions annuelles de ces populations sont restées relativement stables au fil des ans, tandis que la proportion d'hommes au comportement sexuel inconnu a diminué, passant de 16,8 % en 2018 à 4,6 % en 2021 Note de bas de page 1. En moyenne, 19,1 % (n=645) des cas ont été déclarés comme étant des femmes. Parmi les cas SARGA de sexe féminin, la plupart ont déclaré avoir eu des rapports sexuels avec des partenaires masculins (moyenne de 62,2 %, intervalle : 55,6 % à 68,1 %). Les femmes ayant un comportement sexuel inconnu variaient de 10,8 % (13/120, 2021) à 32,5 % (41/126, 2020). Enfin, 0,2 % (n=8) des cas SARGA ont été identifiés comme transgenres et 0,1 % (n=5) étaient inconnus.
4.2.2. Répartition par âge des cas SARGA, 2018 à 2021
Entre 2018 et 2021, la plupart des cas SARGA étaient âgés de 20 à 39 ans (moyenne : 72,8 %, intervalle : 70,1 % à 75,4 %). La plus grande proportion de cas se situait dans les groupes d'âge de 25 à 29 ans (moyenne : 22,0 %, intervalle : 17,5 % à 25,9 %) et de 30 à 34 ans (moyenne : 21,6 %, intervalle : 19,0 % à 24,4 %).
4.2.3. Raison de la visite médicale parmi les cas SARGA, 2018 à 2021
Entre 2018 et 2021, la plupart des cas SARGA ont été testés pour la gonorrhée parce qu'ils présentaient des signes et symptômes de GC (moyenne : 58,4 %; intervalle : 53,2 % à 69,0 %). Ils étaient suivis par les cas ayant été soumis à un dépistage des ITS (moyenne : 12,6 %; intervalle : 9,0 % à 15,0 %) et par ceux qui ont été contactés parce qu'un partenaire sexuel avait été testé positif à la GC (moyenne : 10,2 %; intervalle : 8,4 % à 11,8 %). Huit cas (quatre cas en 2020 et en 2021) ont demandé un « test de guérison ». Deux cas (un en 2018 et en 2019) ont été testés en tant que « réexpositions » potentielles (tableau 3). En moyenne, 18,4 % (intervalle : 8,5 % à 21,9 %) des cas avaient un motif de visite médicale inconnu. Les hommes hétérosexuels, les GBHARSAH et les femmes ont été principalement testés pour la GC en raison de signes et de symptômes (moyenne : 92,3 %, 58,6 % et 49,6 %, respectivement), suivis par le dépistage des ITS (moyenne : 5,9 %, 19,7 % et 12,0 %, respectivement).
4.2.4. Site d'infection primaire parmi les cas SARGA, 2018 à 2021
Entre 2018 et 2021, le site d'infection le plus fréquent correspondant à la culture primaire (le site d'infection primaire) variait selon le sexe et le comportement sexuel (tableau 4). Parmi les cas de GBHARSAH, les infections rectales (moyenne de 39,3 %, intervalle : 37,4 % à 43,7 %) et pharyngées (moyenne de 34,6 %, intervalle : 25,4 % à 38,1 %) étaient plus fréquentes que les infections génitales (moyenne de 26,1 %, intervalle : 24,6 % à 30,8 %). En revanche, les infections génitales étaient le site d'infection le plus souvent signalé chez les hommes hétérosexuels (moyenne de 90 %, intervalle : 92,1 % à 99,5 %) et chez les hommes au comportement sexuel inconnu (moyenne de 52,5 %, intervalle : 20,0 % à 59,5 %).
Au cours de la période de déclaration, la proportion d'hommes au comportement sexuel inconnu présentant des infections pharyngées a diminué, passant de 20,9 % (29/139) en 2018 à 8,3 % (2/24) en 2021. Par la suite, on a observé une augmentation du nombre d'hommes au comportement sexuel inconnu déclarant des sites d'infection « autres » au cours de cette période, de 3,6 % (5/139) en 2018 à 37,5 % (9/24) en 2021 (tableau 4).
Chez les femmes, de 2018 à 2021, les sites d'infections primaires les plus signalés étaient génitaux (moyenne de 35,2 %, intervalle : 31,3 % à 41,7 %) et pharyngés (moyenne de 32,4 %, intervalle : 30,9 % à 33,6 %).
| Caractéristiques des cas | 2018 | 2019 | 2020 | 2021 | Total | ||||
|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | |
| Sexe Note de bas de page a | |||||||||
| Hommes | 827 | 80,9 % | 779 | 78,0 % | 584 | 82,1 % | 519 | 80,5 % | 2709 |
| Femmes | 191 | 18,7 % | 217 | 21,7 % | 126 | 17,7 % | 120 | 18,6 % | 654 |
| Transgenres Note de bas de page b | 4 | 0,4 % | 2 | 0,2 % | 0 | 0,0 % | 2 | 0,0 % | 8 |
| Autres Note de bas de page b | 0 | 0,0 % | 0 | 0,0 % | 1 | 0,1 % | 0 | 0,0 % | 1 |
| Inconnu | 0 | 0,0 % | 1 | 0,1 % | 0 | 0,0 % | 4 | 0,6 % | 5 |
| Total par sexe/genre | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % | 3377 |
| Comportement sexuel | |||||||||
| Comportement sexuel parmi les hommes | |||||||||
| GBHARSAH Note de bas de page c | 443 | 53,6 % | 402 | 51,6 % | 334 | 57,2 % | 310 | 59,7 % | 1489 |
| Hommes hétérosexuels | 245 | 29,6 % | 253 | 32,5 % | 171 | 29,3 % | 185 | 35,6 % | 854 |
| Hommes au comportement sexuel inconnu | 139 | 16,8 % | 124 | 15,9 % | 79 | 13,5 % | 24 | 4,6 % | 366 |
| Total des hommes par comportement sexuel Note de bas de page c | 827 | 100,0 % | 779 | 100,0 % | 584 | 100,0 % | 519 | 100,0 % | 2709 |
| Comportement sexuel parmi les femmes Note de bas de page d | |||||||||
| Femmes - partenaires sexuels masculins | 130 | 68,1 % | 132 | 60,8 % | 70 | 55,6 % | 77 | 64,2 % | 409 |
| Femmes - partenaires sexuels féminins | 2 | 1,0 % | 2 | 0,9 % | 0 | 0,0 % | 1 | 0,8 % | 5 |
| Femmes - sexe avec hommes et femmes | 30 | 15,7 % | 34 | 15,7 % | 15 | 11,9 % | 29 | 24,2 % | 108 |
| Femmes au comportement sexuel inconnu | 29 | 15,2 % | 49 | 22,6 % | 41 | 32,5 % | 13 | 10,8 % | 132 |
| Total des femmes par comportement sexuel | 191 | 100,0 % | 217 | 100,0 % | 126 | 100,0 % | 120 | 100,0 % | 654 |
| Sexe/comportement sexuel Note de bas de page e | |||||||||
| GBHARSAH Note de bas de page c | 443 | 43,3 % | 402 | 40,2 % | 334 | 47,0 % | 310 | 48,1 % | 1489 |
| Hommes hétérosexuels | 245 | 24,0 % | 253 | 25,3 % | 171 | 24,1 % | 185 | 28,7 % | 854 |
| Hommes au comportement sexuel inconnu | 139 | 13,6 % | 124 | 12,4 % | 79 | 11,1 % | 24 | 3,7 % | 366 |
| Femmes | 191 | 18,7 % | 217 | 21,7 % | 126 | 17,7 % | 120 | 18,6 % | 654 |
| Transgenres Note de bas de page b | 4 | 0,4 % | 2 | 0,2 % | 0 | 0,0 % | 2 | 0,3 % | 8 |
| Autres Note de bas de page b | 0 | 0,0 % | 0 | 0,0 % | 1 | 0,1 % | 0 | 0,0 % | 1 |
| Inconnu | 0 | 0,0 % | 1 | 0,1 % | 0 | 0,0 % | 4 | 0,6 % | 5 |
| Total par sexe/comportement sexuel | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % | 3377 |
| Âge (années) Note de bas de page f | |||||||||
| 16-19 | 29 | 2,8 % | 35 | 3,5 % | 18 | 2,5 % | 16 | 2,5 % | 98 |
| 20-24 | 151 | 14,8 % | 142 | 14,2 % | 104 | 14,6 % | 88 | 13,6 % | 485 |
| 25-29 | 265 | 25,9 % | 213 | 21,3 % | 152 | 21,4 % | 113 | 17,5 % | 743 |
| 30-34 | 197 | 19,3 % | 244 | 24,4 % | 135 | 19,0 % | 153 | 23,7 % | 729 |
| 35-39 | 157 | 15,4 % | 127 | 12,7 % | 120 | 16,9 % | 99 | 15,3 % | 503 |
| 40-44 | 88 | 8,6 % | 105 | 10,5 % | 58 | 8,2 % | 67 | 10,4 % | 318 |
| 45-49 | 54 | 5,3 % | 58 | 5,8 % | 51 | 7,2 % | 47 | 7,3 % | 210 |
| 50-54 | 31 | 3,0 % | 31 | 3,1 % | 28 | 3,9 % | 27 | 4,2 % | 117 |
| 55-59 | 36 | 3,5 % | 28 | 2,8 % | 28 | 3,9 % | 22 | 3,4 % | 114 |
| 60+ | 14 | 1,4 % | 15 | 1,5 % | 17 | 2,4 % | 13 | 2,0 % | 59 |
| Total par groupe d'âge | 1022 | 100,0 % | 998 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % | 3376 |
| Travail de sexe | |||||||||
| Oui | 52 | 5,1 % | 49 | 4,9 % | 35 | 4,9 % | 21 | 3,3 % | 157 |
| Non | 729 | 71,3 % | 674 | 67,5 % | 460 | 64,7 % | 474 | 73,5 % | 2337 |
| Inconnu | 241 | 23,6 % | 276 | 27,6 % | 216 | 30,4 % | 150 | 23,3 % | 883 |
| Total par travail du sexe | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % | 3377 |
|
|||||||||
| Raison de la visite médicale | 2018 | 2019 | 2020 | 2021 | Total | ||||
|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | |
| GBHARSAH | |||||||||
| Signes et symptômes | 227 | 51,2 % | 201 | 50,0 % | 224 | 67,1 % | 205 | 66,1 % | 857 |
| Dépistage des ITS | 109 | 24,6 % | 105 | 26,1 % | 48 | 14,4 % | 43 | 13,9 % | 305 |
| Contact avec un cas | 81 | 18,3 % | 67 | 16,7 % | 46 | 13,8 % | 47 | 15,2 % | 241 |
| Test de guérison | SO | SO | SO | SO | 3 | 0,9 % | 4 | 1,3 % | 7 |
| Autres | 0 | 0,0 % | 4 | 1,0 % | 10 | 3,0 % | 7 | 2,3 % | 21 |
| Inconnu | 26 | 5,9 % | 25 | 6,2 % | 3 | 0,9 % | 4 | 1,3 % | 58 |
| Total | 443 | 100,0 % | 402 | 100,0 % | 334 | 100,0 % | 310 | 100,0 % | 1489 |
| Hommes hétérosexuels | |||||||||
| Signes et symptômes | 229 | 93,5 % | 228 | 90,1 % | 161 | 94,2 % | 169 | 91,4 % | 787 |
| Dépistage des ITS | 8 | 3,3 % | 12 | 4,7 % | 4 | 2,3 % | 11 | 5,9 % | 35 |
| Contact avec un cas | 3 | 1,2 % | 11 | 4,3 % | 3 | 1,8 % | 5 | 2,7 % | 22 |
| Test de guérison | SO | SO | SO | SO | 1 | 0,6 % | 0 | 0,0 % | 1 |
| Autres | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 |
| Inconnu | 5 | 2,0 % | 2 | 0,8 % | 2 | 1,2 % | 0 | 0,0 % | 9 |
| Total | 245 | 100,0 % | 253 | 100,0 % | 171 | 100,0 % | 185 | 100,0 % | 854 |
| Hommes au comportement sexuel inconnu | |||||||||
| Signes et symptômes | 3 | 2,2 % | 1 | 0,8 % | 0 | 0,0 % | 0 | 0,0 % | 4 |
| Dépistage des ITS | 1 | 0,7 % | 1 | 0,8 % | 0 | 0,0 % | 0 | 0,0 % | 2 |
| Contact avec un cas | 2 | 1,4 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 2 |
| Test de guérison | SO | SO | SO | SO | 0 | 0,6 % | 0 | 0,0 % | 0 |
| Autres | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 |
| Inconnu | 133 | 95,7 % | 122 | 98,4 % | 79 | 100,0 % | 24 | 100,0 % | 358 |
| Total | 139 | 100,0 % | 124 | 100,0 % | 79 | 100,0 % | 24 | 100,0 % | 366 |
| Femmes | |||||||||
| Signes et symptômes | 92 | 48,2 % | 99 | 45,8 % | 58 | 46,0 % | 70 | 58,3 % | 319 |
| Dépistage des ITS | 21 | 11,0 % | 32 | 14,8 % | 12 | 9,5 % | 15 | 12,5 % | 80 |
| Contact avec un cas | 35 | 18,3 % | 19 | 8,8 % | 11 | 8,7 % | 14 | 11,7 % | 79 |
| Test de guérison | SO | SO | SO | SO | 0 | 0,6 % | 0 | 0,0 % | 0 |
| Autres | 0 | 0,0 % | 1 | 0,5 % | 2 | 1,6 % | 4 | 3,3 % | 7 |
| Inconnu | 43 | 22,5 % | 65 | 30,1 % | 43 | 34,1 % | 17 | 14,2 % | 168 |
| Total | 191 | 100,0 % | 216 | 100,0 % | 126 | 100,0 % | 120 | 100,0 % | 653 |
| Tous les cas Note de bas de page a | |||||||||
| Signes et symptômes | 551 | 53,9 % | 531 | 53,2 % | 444 | 62,4 % | 445 | 69,0 % | 1971 |
| Dépistage des ITS | 141 | 13,8 % | 150 | 15,0 % | 64 | 9,0 % | 71 | 11,0 % | 426 |
| Contact avec un cas | 121 | 11,8 % | 97 | 9,7 % | 60 | 8,4 % | 69 | 10,7 % | 347 |
| Test de guérison | 0 | 0,0 % | 0 | 0,0 % | 4 | 0,6 % | 4 | 0,6 % | 8 |
| Autres | 1 | 0,1 % | 7 | 0,7 % | 12 | 0,0 % | 11 | 0,2 % | 31 |
| Inconnu | 208 | 20,4 % | 214 | 21,9 % | 127 | 19,5 % | 45 | 8,5 % | 594 |
| Total | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % | 3377 |
SO : Sans objet |
|||||||||
| Sexe / comportement sexuel | 2018 | 2019 | 2020 | 2021 | Total | ||||
|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | |
| GBHARSAH | |||||||||
| Rectum | 172 | 38,8 % | 151 | 37,6 % | 146 | 43,7 % | 116 | 37,4 % | 585 |
| Pharynx | 161 | 36,3 % | 151 | 37,6 % | 85 | 25,4 % | 118 | 38,1 % | 515 |
| Génital | 110 | 24,8 % | 99 | 24,6 % | 103 | 30,8 % | 76 | 24,5 % | 388 |
| Autres | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 |
| Inconnu | 0 | 0,0 % | 1 | 0,2 % | 0 | 0,0 % | 0 | 0,0 % | 1 |
| Total | 443 | 100,0 % | 402 | 100,0 % | 334 | 100,0 % | 310 | 100,0 % | 1489 |
| Hommes hétérosexuels | |||||||||
| Rectum | 0 | 0,0 % | 1 | 0,4 % | 0 | 0,0 % | 0 | 0,0 % | 0 |
| Pharynx | 3 | 1,2 % | 20 | 7,9 % | 4 | 2,3 % | 1 | 0,5 % | 28 |
| Génital | 242 | 98,8 % | 232 | 91,7 % | 167 | 97,7 % | 184 | 99,5 % | 825 |
| Autres | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 |
| Inconnu | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 |
| Total | 245 | 100,0 % | 253 | 100,0 % | 171 | 100,0 % | 185 | 100,0 % | 853 |
| Hommes au comportement sexuel inconnu | |||||||||
| Rectum | 32 | 23,0 % | 19 | 15,3 % | 6 | 7,6 % | 0 | 0,0 % | 57 |
| Pharynx | 29 | 20,9 % | 25 | 20,2 % | 5 | 6,3 % | 2 | 8,3 % | 61 |
| Génital | 70 | 50,4 % | 62 | 50,0 % | 47 | 59,5 % | 12 | 50,0 % | 191 |
| Autres | 5 | 3,6 % | 6 | 4,8 % | 2 | 2,5 % | 9 | 37,5 % | 22 |
| Inconnu | 3 | 2,2 % | 12 | 9,7 % | 19 | 24,1 % | 1 | 4,2 % | 35 |
| Total | 139 | 100,0 % | 124 | 100,0 % | 79 | 100,0 % | 24 | 100,0 % | 366 |
| Femme | |||||||||
| Rectum | 52 | 27,2 % | 57 | 26,3 % | 23 | 18,3 % | 25 | 20,8 % | 157 |
| Pharynx | 59 | 30,9 % | 73 | 33,6 % | 41 | 32,5 % | 39 | 32,5 % | 212 |
| Génital | 67 | 35,1 % | 68 | 31,3 % | 41 | 32,5 % | 50 | 41,7 % | 226 |
| Autres | 8 | 4,2 % | 8 | 3,7 % | 2 | 1,6 % | 4 | 3,3 % | 22 |
| Inconnu | 5 | 2,6 % | 11 | 5,1 % | 19 | 15,1 % | 2 | 1,7 % | 37 |
| Total | 191 | 100,0 % | 217 | 100,0 % | 126 | 100,0 % | 120 | 100,0 % | 654 |
| Tous les cas Note de bas de page a | |||||||||
| Rectum | 258 | 25,2 % | 229 | 22,9 % | 175 | 24,6 % | 142 | 22,0 % | 804 |
| Pharynx | 252 | 24,7 % | 269 | 26,9 % | 136 | 19,1 % | 164 | 25,4 % | 821 |
| Génital | 490 | 47,9 % | 463 | 46,3 % | 358 | 50,4 % | 323 | 50,1 % | 1634 |
| Autres | 13 | 1,3 % | 14 | 1,4 % | 4 | 0,6 % | 13 | 2,0 % | 44 |
| Inconnu | 9 | 0,9 % | 24 | 2,4 % | 38 | 5,3 % | 3 | 0,5 % | 74 |
| Total | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % | 3377 |
SO : Sans objet |
|||||||||
4.3. Pertinence de l'utilisation des antimicrobiens
4.3.1. Lignes directrices fédérales et provinciales/territoriales pour le traitement de la gonorrhée, 2018 à 2021
L'ASPC a tenu compte des nouvelles tendances de la gonorrhée RAM dans l'élaboration en cours des lignes directrices sur le traitement de la gonorrhée. De 2018 à 2021, les lignes directrices de l'ASPC sur le traitement de la gonorrhée étaient la version datée de juillet 2017 (tableau 5)Note de bas de page 6. Les lignes directrices de l'ASPC recommandent aux prescripteurs de suivre les lignes directrices de traitement de la gonorrhée spécifiques aux PT plutôt que les leurs, car les directives spécifiques aux PT reflètent les tendances locales de la gonorrhée et de la gonorrhée RAM. Parmi les PT participant à la SARGA, l'Alberta, le Manitoba et les Territoires du Nord-Ouest ont tous des lignes directrices spécifiques à leur juridiction, tandis que la Nouvelle-Écosse suit les lignes directrices de l'ASPC pour le traitement de la GCNote de bas de page 11 Note de bas de page 12 Note de bas de page 13.
Les recommandations de l'ASPC (et donc de la Nouvelle-Écosse), de l'Alberta et du Manitoba en matière de traitement de GC dépendent i) du site de l'infection : anogénital ou pharyngé et ii) du comportement sexuel du client : GBHARSAH ou autres adultes (les autres adultes comprennent les jeunes de plus de 8 ans et les adultes non GBHARSAH). En outre, les régimes thérapeutiques sont définis comme « préférentiels » ou « alternatifs ». Les traitements alternatifs sont recommandés lorsqu'il y a des contre-indications aux traitements préférentiels ou lorsqu'il y a des indications de résistance émergente ou de réduction des stocks de médicaments. Ainsi, si les critères de traitement alternatif sont remplis, il est approprié de prescrire à un client soit le traitement préférentiel, soit le traitement alternatif. Les lignes directrices de traitement des Territoires du Nord-Ouest recommandent les mêmes régimes thérapeutiques préférentiels et alternatifs pour la gonorrhée non compliquée, quel que soit le site d'infection ou le comportement sexuel du client. Voir l'annexe D pour les lignes directrices de traitement provinciales et territoriales détaillées.
En général, les lignes directrices de l'ASPC et de tous les PT participant à la SARGA recommandent une bithérapie préférentielle ou alternative consistant en une céphalosporine de troisième génération (céfixime 800 mg ou ceftriaxone 250 mg) en association avec l'azithromycine (1 g) pour traiter la gonorrhée non compliquée, quel que soit le site de l'infection, le comportement sexuel ou l'âge du client.
| Infections anogénitales | Infections pharyngées | |||
|---|---|---|---|---|
| Traitement préférentiel | Traitement alternatif | Traitement préférentiel | Traitement alternatif | |
| GBHARSAH | Ceftriaxone 250 mg IM Note de bas de page a + Azithromycine 1 g PO Note de bas de page a |
Céfixime 800 mg PO Note de bas de page a + Azithromycine 1 g PO Note de bas de page a |
Ceftriaxone 250 mg IM Note de bas de page a + Azithromycine 1 g PO Note de bas de page a |
Céfixime 800 mg PO Note de bas de page a + Azithromycine 1 g PO Note de bas de page a |
Céfixime 800 mg PO Note de bas de page a + Doxycycline 100 mg PO Note de bas de page b |
||||
| Autres adultes | Ceftriaxone 250 mg IM Note de bas de page a + Azithromycine 1 g PO Note de bas de page a | Céfixime 800 mg PO Note de bas de page a + Doxycycline 100 mg PO Note de bas de page b OU |
Ceftriaxone 250 mg IM Note de bas de page a + Azithromycine 1 g PO Note de bas de page a |
Céfixime 800 mg PONote de bas de page a + Azithromycine 1g PO Note de bas de page a |
| Céfixime 800 mg PO Note de bas de page a + Azithromycine 1g PO Note de bas de page a | ||||
Note : PO = par voie orale; IM = par voie intramusculaire; IV = par voie intraveineuse.
|
||||
4.3.2. Pertinence de l'utilisation des antimicrobiens parmi les cas SARGA, 2018 à 2021
La SARGA mesure l'utilisation appropriée des antimicrobiens en comparant les régimes de traitement de la gonorrhée prescrits aux cas de SARGA aux traitements recommandés dans les lignes directrices de l'ASPC et de la PT déclarante en matière de traitement de la gonorrhée. Le respect des recommandations de traitement a été associé à la réduction du développement de la RAM Note de bas de page 19. À ce jour, il n'existe pas d'objectif connu concernant la proportion idéale d'adhésion des prescripteurs aux lignes directrices de traitement de la GC pour limiter l'émergence de la gonorrhée RAM Note de bas de page 19.
La figure 1 montre la proportion i) de cas GBHARSAH et ii) d'autres cas adultes SARGA à qui l'on a prescrit un régime thérapeutique préférentiel ou alternatif de l'ASPC ou de la PT déclarante (voir les tableaux 6, 7, 8 et 9 pour plus de détails) par rapport à tous les autres régimes thérapeutiques, par site d'infection. Au cours de la période couverte par le rapport, l'adhésion globale des prescripteurs aux lignes directrices de traitement de la gonorrhée de l'ASPC et des PT a été élevée (moyenne de 91,4 % d'adhésion aux lignes directrices de l'ASPC et de 89,5 % d'adhésion aux lignes directrices des PT) et relativement stable (intervalle d'adhésion aux lignes directrices : (ASPC : 88,4 % à 94,6 %); (PT : 87,3 % à 91,6 %). Dans l'ensemble, cependant, l'adhésion des prescripteurs aux lignes directrices de traitement spécifiques aux PT était légèrement inférieure à celle des lignes directrices de traitement de l'ASPC.
Les résultats étaient similaires pour les GBHARSAH et les autres adultes. L'adhésion des prescripteurs était généralement stable dans le temps pour tous les groupes, à l'exception des autres adultes atteints d'infections pharyngées. De 2018 à 2021, l'adhésion des prescripteurs aux lignes directrices de l'ASPC et des PT était élevée et stable pour les GBHARSAH atteints d'infections anogénitales (moyenne de 92,8 % pour l'ASPC et de 86,7 % pour les PT) et d'infections pharyngées (moyenne de 88,4 % pour l'ASPC et de 89,4 % pour les PT). L'adhésion des prescripteurs était également élevée chez les autres adultes atteints d'infections anogénitales (moyenne de l'ASPC de 93,7 %; moyenne des PT de 91,7 %) et d'infections pharyngées (moyenne de l'ASPC de 92,8 %; moyenne des PT de 90,2 %).
Figure 1. Proportion de cas SARGA (parmi tous les cas SARGA auxquels un traitement a été prescrit) à qui l'on a prescrit un régime de traitement de la gonorrhée préférentiel ou alternatif de l'ASPC ou de la PT par rapport à d'autres traitements prescrits parmi les GBHARSAH et les autres adultes, 2018 à 2021.
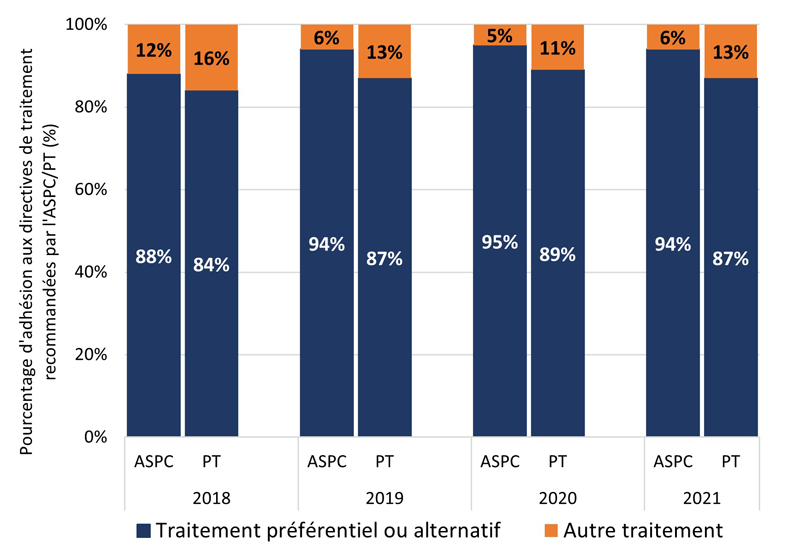
Figure 1A - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | ||
|---|---|---|---|---|---|
| PT | P+A | 84 % | 87 % | 89 % | 87 % |
| PT | Autres | 16 % | 13 % | 11 % | 13 % |
| ASPC | P+A | 88 % | 94 % | 95 % | 94 % |
| ASPC | Autres | 12 % | 6 % | 5 % | 6 % |
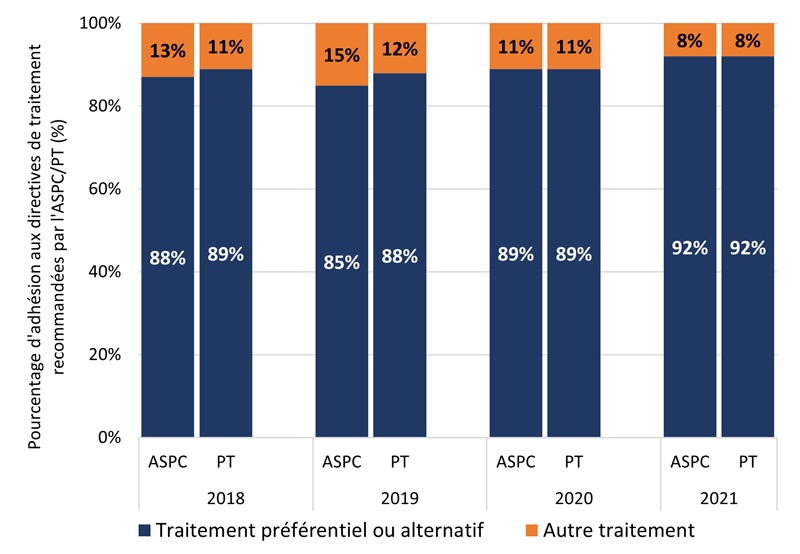
Figure 1B - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | ||
|---|---|---|---|---|---|
| PT | P+A | 89 % | 88 % | 89 % | 92 % |
| PT | Autres | 11 % | 12 % | 11 % | 8 % |
| ASPC | P+A | 88 % | 85 % | 89 % | 92 % |
| ASPC | Autres | 13 % | 15 % | 11 % | 8 % |
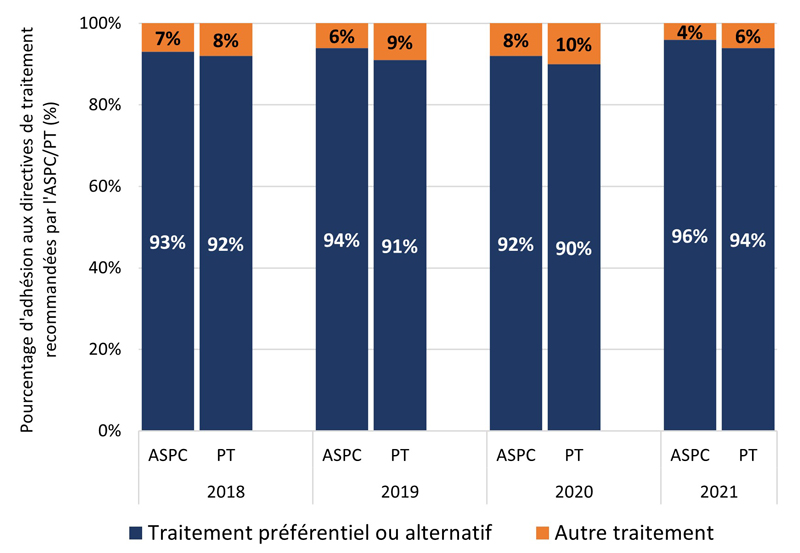
Figure 1C - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | ||
|---|---|---|---|---|---|
| PT | P+A | 92 % | 91 % | 90 % | 94 % |
| PT | Autres | 8 % | 9 % | 10 % | 6 % |
| ASPC | P+A | 93 % | 94 % | 92 % | 96 % |
| ASPC | Autres | 7 % | 6 % | 8 % | 4 % |
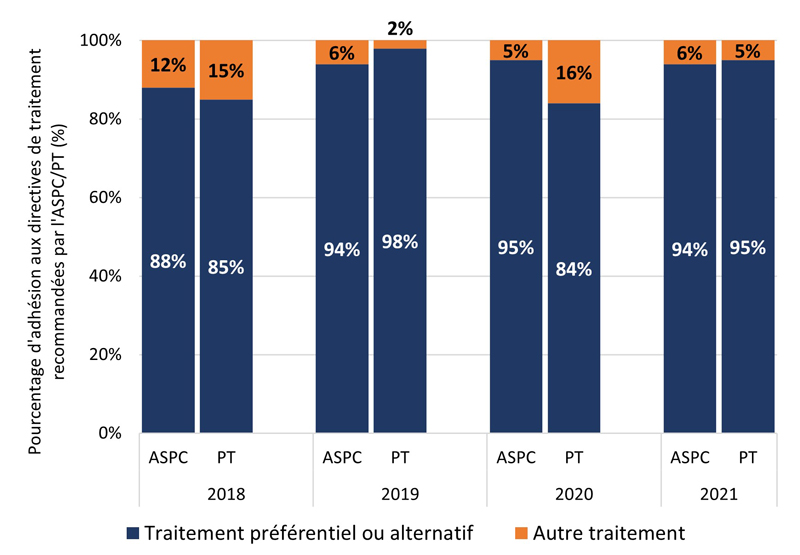
Figure 1D - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | ||
|---|---|---|---|---|---|
| PT | P+A | 85 % | 98 % | 84 % | 95 % |
| PT | Autres | 15 % | 2 % | 16 % | 5 % |
| ASPC | P+A | 88 % | 94 % | 95 % | 94 % |
| ASPC | Autres | 12 % | 6 % | 5 % | 6 % |
Remarque : les infections anogénitales comprennent les infections rectales, cervicales, urogénitales et vaginales. Les infections pharyngées se réfèrent aux infections de la gorge. Les autres traitements comprennent les cas auxquels on a prescrit un régime i) connu et qui n'était pas un traitement préférentiel ou alternatif ou ii) incomplet ou inconnu.
Les sections suivantes résument les régimes thérapeutiques prescrits aux cas SARGA, la fréquence de ces prescriptions et s'ils ont été recommandés conformément aux lignes directrices de l'ASPC ou des PT participants pour le traitement de la gonorrhée. Les proportions présentées de cas SARGA auxquels un traitement préférentiel ou alternatif a été prescrit sont prudentes.
4.3.2.a. Traitements contre la gonorrhée prescrits parmi les cas de GBHARSAH, 2018 à 2021
Traitements contre la gonorrhée prescrits parmi les cas de GBHARSAH présentant des infections anogénitales ou pharyngées
De 2018 à 2021, les cas de GBHARSAH se sont vu prescrire majoritairement le traitement préférentiel recommandé par l'ASPC et les PT, à savoir azithromycine 1 g plus ceftriaxone 250 mg, pour traiter les infections anogénitales (moyenne : 82,9 %; intervalle : 81,4 % à 84,3 %) (tableau 6) et les infections pharyngées (moyenne : 86,7 %; intervalle : 85,3 % à 90,7 %) (tableau 7). Ce traitement était suivi de la ceftriaxone 250 mg plus doxycycline 100 mg - un régime thérapeutique alternatif figurant uniquement dans les lignes directrices de l'ASPC pour le traitement des infections anogénitales (moyenne : 6,3 %; intervalle : 4,3 % à 9,1 %). Bien qu'aucune directive ne le recommande pour les infections pharyngées, il a également été prescrit pour les infections pharyngées (moyenne : 4,4 %; intervalle : 2,5 % à 6,0 %). La proportion de cas anogénitaux de GBHARSAH à qui l'on a prescrit le régime thérapeutique alternatif recommandé par l'ASPC et la PT, à savoir 1 g d'azithromycine plus 800 mg de céfixime, est restée relativement faible au cours de toutes les années (moyenne : 3,5 %; intervalle : 2,4 % à 6,4 %). Tous les autres régimes prescrits combinés représentaient moins de 3,8 % des cas de GBHARSAH anogénitaux et 4,4 % des cas de GBHARSAH pharyngés.
| Régime de traitement de la gonorrhée | Traitement préférentiel (P) ou alternatif (A) selon les lignes directrices de l'ASPC ou des PT | Nombre et proportion de cas GBHARSAH auxquels un traitement a été prescrit pour les infections anogénitales | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2018 | 2019 | 2020 | 2021 | Total | ||||||||||
| ASPC | Alb. | Man. | N.-ÉNote de bas de page a | T.N.-O | n | % | n | % | n | % | n | % | n | |
| Azithromycine 1 g, Ceftriaxone 250 mg | P | P | P | P | P | 227 | 81,4 % | 210 | 84,3 % | 205 | 82,3 % | 157 | 84,0 % | 799 |
| Ceftriaxone 250 mg, Doxycycline 100 mg | A | NR | NR | A | NR | 12 | 4,3 % | 15 | 6,0 % | 14 | 5,6 % | 17 | 9,1 % | 58 |
| Autre - non spécifié | NR | NR | NR | NR | NR | 16 | 5,7 % | 12 | 4,8 % | 7 | 2,9 % | 3 | 1,6 % | 38 |
| Azithromycine 1 g, Céfixime 800 mg | A | A | A | A | A | 7 | 2,5 % | 6 | 2,4 % | 16 | 6,4% | 5 | 2,7 % | 34 |
| Azithromycine 2 gNote de bas de page b | NR | NR | A | NR | A | 6 | 2,2 % | 1 | 0,4 % | 1 | 0,4 % | 2 | 1,1 % | 10 |
| Azithromycine 2 g, Autre - non spécifié | NR | NR | NR | NR | NR | 2 | 0,7 % | 2 | 0,8 % | 1 | 0,4 % | 0 | 0,0 % | 5 |
| Doxycycline 100 mg | NR | NR | NR | NR | NR | 0 | 0,0 % | 1 | 0,4 % | 1 | 0,4 % | 2 | 1,1 % | 4 |
| Céfixime 800 mg, Doxycycline 100 mgNote de bas de page c | A | NR | NR | A | NR | 0 | 0,0 % | 1 | 0,4 % | 1 | 0,4 % | 0 | 0,0 % | 2 |
| Ceftriaxone 250 mg, Autre - non spécifié | NR | NR | NR | NR | NR | 1 | 0,4 % | 0 | 0,0 % | 1 | 0,4 % | 0 | 0,0 % | 2 |
| Azithromycine 1 g, Ceftriaxone 250 mg, Doxycycline 100 mg PO BID x 14 jours | NR | NR | NR | NR | NR | 2 | 0,7 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 2 |
| Azithromycine 1 g, Ceftriaxone 250 mg, Doxycycline 100 mg PO BID x 14 jours plus Métronidazole 500 mg PO BID x 14 jours | NR | NR | NR | NR | NR | 2 | 0,7 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 2 |
| Pénicilline G benzathine 2 400 000 unités | NR | NR | NR | NR | NR | 0 | 0,0 % | 1 | 0,4 % | 1 | 0,4 % | 0 | 0,0 % | 2 |
| Azithromycine 1 g | NR | NR | NR | NR | NR | 1 | 0,4 % | 1 | 0,4 % | 0 | 0,0 % | 0 | 0,0 % | 2 |
| Ceftriaxone 250 mg | NR | NR | NR | NR | NR | 1 | 0,4 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 0,5 % | 2 |
| Azithromycine 2 g, Ceftriaxone 250 mg | NR | NR | NR | NR | NR | 1 | 0,4 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 |
| Céfixime 800 mg | NR | NR | NR | NR | NR | 1 | 0,4 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 |
| Total | 279 | 100,0 % | 249 | 100,0 % | 249 | 100,0 % | 187 | 100,0 % | 964 | |||||
Remarque : dans le tableau, le traitement « préférentiel » est indiqué par « P », le traitement « alternatif » est indiqué par « A » et le traitement « non recommandé » est indiqué par « NR »; PO = par voie orale; IM = par voie intramusculaire; IV = par voie intraveineuse; BID = deux fois par jour; OD = une fois par jour.
|
||||||||||||||
| Régime de traitement de la gonorrhée | Traitement préférentiel (P) ou alternatif (A) selon les lignes directrices de l'ASPC ou de la PT | Nombre et proportion de cas GBHARSAH auxquels un traitement a été prescrit pour les infections pharyngées |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2018 | 2019 | 2020 | 2021 | Total | ||||||||||
| ASPC | Alb. | Man. | N.-ÉNote de bas de page a | T.N.-O | n | % | n | % | n | % | n | % | n | |
| Azithromycine 1 g, Ceftriaxone 250 mg | P | P | P | P | P | 137 | 85,6 % | 128 | 85,3 % | 72 | 85,7 % | 107 | 90,7 % | 444 |
| Ceftriaxone 250 mg, Doxycycline 100 mg | NR | NR | NR | NR | NR | 4 | 2,5 % | 9 | 6,0 % | 4 | 4,8 % | 5 | 4,2 % | 22 |
| Autre - non spécifié | NR | NR | NR | NR | NR | 8 | 5,0 % | 7 | 4,7 % | 4 | 4,8 % | 2 | 1,7 % | 21 |
| Azithromycine 1 g, Céfixime 800 mg | A | A | A | A | A | 3 | 1,9 % | 0 | 0,0 % | 3 | 3,6 % | 1 | 0,8 % | 7 |
| Azithromycine 2 gNote de bas de page b | NR | NR | A | NR | A | 2 | 1,3 % | 2 | 1,3 % | 0 | 0,0 % | 0 | 0,0 % | 4 |
| Azithromycine 2 g, Autre - non spécifié | NR | NR | NR | NR | NR | 1 | 0,6 % | 0 | 0,0 % | 1 | 1,2 % | 0 | 0,0 % | 2 |
| Azithromycine 2 g, Gentamicine 240 mg IM en 2 doses séparées de 3 mlNote de bas de page c | NR | A | NR | NR | NR | 0 | 0,0 % | 2 | 1,3 % | 0 | 0,0 % | 0 | 0,0 % | 2 |
| Ceftriaxone 250 mg, Autre - non spécifié | NR | NR | NR | NR | NR | 1 | 0,6 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 0,8 % | 2 |
| Doxycycline 100 mg | NR | NR | NR | NR | NR | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 2 | 1,7 % | 2 |
| Azithromycine 1 g | NR | NR | NR | NR | NR | 1 | 0,6 % | 1 | 0,7 % | 0 | 0,0 % | 0 | 0,0 % | 2 |
| Ceftriaxone 250 mg | NR | NR | NR | NR | NR | 1 | 0,6 % | 1 | 0,7 % | 0 | 0,0 % | 0 | 0,0 % | 2 |
| Céfixime 800 mg | NR | NR | NR | NR | NR | 1 | 0,6 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 |
| Azithromycine 1 g, Ceftriaxone 250 mg, Gentamicine 240 mg IM en 2 injections séparées de 3 ml de solution à 40 mg/ml, | NR | NR | NR | NR | NR | 1 | 0,6 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 |
| Total | 160 | 100,0 % | 150 | 100,0 % | 84 | 100,0 % | 118 | 100,0 % | 512 | |||||
Remarque : dans le tableau, le traitement « préférentiel » est indiqué par « P », le traitement « alternatif » est indiqué par « A » et le traitement « non recommandé » est indiqué par « NR »; IM = par voie intramusculaire.
|
||||||||||||||
4.3.2.b. Traitements contre la gonorrhée prescrits à d'autres adultes dans la SARGA, 2018 à 2021
Les traitements contre la gonorrhée prescrits chez les autres adultes comprennent les hommes hétérosexuels, les femmes, les personnes transgenres et les personnes d'un autre sexe/genre. Les autres adultes excluent les hommes au comportement sexuel inconnu et les GBHARSAH.
Traitements contre la gonorrhée prescrits chez d'autres adultes atteints d'infections anogénitales
Entre 2018 et 2021, la plupart des autres adultes atteints d'infections anogénitales se sont vu prescrire le régime thérapeutique recommandé par l'ASPC, l'Alberta et le Manitoba, soit 800 mg de céfixime et 1 g d'azithromycine (moyenne de 86,2 %; intervalle : 86,4 % à 88,4 %) (tableau 8). Il a été suivi par le régime thérapeutique préférentiel alternatif de l'ASPC, du Manitoba et de la Nouvelle-Écosse, le seul traitement préférentiel des Territoires du Nord-Ouest et le régime thérapeutique alternatif de l'Alberta, 1 g d'azithromycine avec 250 mg de ceftriaxone (moyenne de 4,1 %; intervalle : 3,2 % à 5,2 %) (tableau 8). La moyenne combinée (de 2018 à 2021) des déclarations pour tous les autres régimes thérapeutiques uniques variait de 0,1 % à 1,8 %.
Traitements de la gonorrhée chez d'autres adultes atteints d'infections pharyngées
De 2018 à 2021, le traitement le plus fréquemment prescrit chez les autres adultes atteints d'infections pharyngées était le régime thérapeutique alternatif d'azithromycine 1 g avec céfixime 800 mg (moyenne 50,4 % : intervalle : 43,2 % à 56,3 %) qui est recommandé par tous les PT participant à la SARGA (tableau 9). Il a été suivi par le régime thérapeutique préférentiel (recommandé par tous les PT participant à la SARGA) d'azithromycine 1 g avec ceftriaxone 250 mg (moyenne 39,4 %; intervalle : 33,9 % à 43,2 % (16/37) en 2021). La proportion moyenne combinée (de 2018 à 2021) des prescriptions pour tous les autres régimes thérapeutiques uniques variait de 0,3 % à 2,7 %.
| Régime de traitement de la gonorrhée | Traitement préférentiel (P) ou alternatif (A) selon les lignes directrices de l'ASPC ou de la PT | Nombre et proportion des autres cas adultes auxquels un traitement a été prescrit pour les infections anogénitales |
||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2018 | 2019 | 2020 | 2021 | Total | ||||||||||||
| ASPC | AB | MB | NÉNote de bas de page a | T.N.-O. | n | % | n | % | N | % | n | % | n | |||
| Azithromycine 1 g, Céfixime 800 mg | P | P | P | P | A | 306 |
88,4 % | 299 |
86,4 % | 190 | 86,4 % | 219 | 88,0 % | 1 014 | ||
| Azithromycine 1 g, Ceftriaxone 250 mg | P | A | P | P | P | 11 |
3,2 % | 14 |
4,0 % | 9 | 4,1 % | 13 | 5,2 % | 47 | ||
| Ceftriaxone 250mg, Doxycycline 100mgNote de bas de page b | A | NR | NR | A | NR | 3 |
0,9 % | 9 |
2,6 % | 4 | 1,8 % | 5 | 2,0 % | 21 | ||
| Ceftriaxone 250 mg, Autre - non spécifié | NR | NR | NR | NR | NR | 8 |
2,3 % | 0 |
0,0 % | 8 | 3,6 % | 1 | 0,4 % | 17 | ||
| Autre - non spécifié | NR | NR | NR | NR | NR | 5 |
1,4 % | 3 |
0,9 % | 2 | 0,9 % | 1 | 0,4 % | 11 | ||
| Azithromycine 1 g | NR | NR | NR | NR | NR | 1 |
0,3 % | 2 |
0,6 % | 2 | 0,9 % | 3 | 1,2 % | 8 | ||
| Céfixime 800 mg, Doxycycline 100 mgNote de bas de page b | A | NR | NR | A | NR | 2 |
0,6 % | 4 |
1,2 % | 0 | 0,0 % | 3 | 1,2 % | 9 | ||
| Azithromycine 2 g, Autre - non spécifié | NR | NR | NR | NR | NR | 2 |
0,6 % | 0 |
0,0 % | 3 | 1,4 % | 1 | 0,4 % | 6 | ||
| Ceftriaxone 250 mg, Doxycycline 100 mg et Métronidazole 500 mg | NR | NR | NR | NR | NR | 0 |
0,0 % | 4 |
1,2 % | 0 | 0,0 % | 1 | 0,4 % | 5 | ||
| Azithromycine 2 gNote de bas de page b | NR | NR | A | NR | A | 4 |
1,2 % | 1 |
0,3 % | 0 | 0,0 % | 0 | 0,0 % | 5 | ||
| Céfixime 800 mg, Azithromycine 1 g, Pénicilline G 2 400 00 unités | NR | NR | NR | NR | NR | 0 |
0,0 % | 3 |
0,9 % | 1 | 0,5 % | 1 | 0,4 % | 5 | ||
| Azithromycine 2 g, Gentamicine 240 mg IM en 2 injections séparées de 3 ml de solution à 40 mg/mlNote de bas de page c | A | A | NR | A | NR | 0 |
0,0 % | 2 |
0,6 % | 0 | 0,0 % | 1 | 0,4 % | 3 | ||
| Azithromycine 1 g, Autre - non spécifié | NR | NR | NR | NR | NR | 0 |
0,0 % | 2 |
0,6 % | 0 | 0,0 % | 0 | 0,0 % | 2 | ||
| Azithromycine 1 g, Céfixime 800 mg, Doxycycline 100 mg PO BID x 14 jours | NR | NR | NR | NR | NR | 2 |
0,6 % | 0 |
0,0 % | 0 | 0,0 % | 0 | 0,0 % | 2 | ||
| Pénicilline G benzathine 2 400 000 unités | NR | NR | NR | NR | NR | 0 |
0,0 % | 0 |
0,0 % | 1 | 0,5 % | 0 | 0,0 % | 1 | ||
| Lévofloxacine 500 mg PO OD x 14 jours avec métronidazole 500 mg PO BID x 14 jours | NR | NR | NR | NR | NR | 0 |
0,0 % | 1 |
0,3 % | 0 | 0,0 % | 0 | 0,0 % | 1 | ||
| Azithromycine 2g, Gemifloxacine 320mg PO SDNote de bas de page d | A | A | NR | A | NR | 0 |
0,0 % | 1 |
0,3 % | 0 | 0,0 % | 0 | 0,0 % | 1 | ||
| Ceftriaxone 250 mg | NR | NR | NR | NR | NR | 0 |
0,0 % | 1 |
0,3 % | 0 | 0,0 % | 0 | 0,0 % | 1 | ||
| Céfixime 800 mg | NR | NR | NR | NR | NR | 1 |
0,3 % | 0 |
0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | ||
| Céfixime 400 mg | NR | NR | NR | NR | NR | 1 |
0,3% | 0 |
0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | ||
| Total | 346 | 100,0 % |
346 | 100,0 % |
220 | 100,0 % | 249 | 100,0 % | 1,161 | |||||||
Remarque : dans le tableau, le traitement « préférentiel » est indiqué par « P », le traitement « alternatif » est indiqué par « A » et le traitement « non recommandé » est indiqué par « NR »; PO = par voie orale; IM = par voie intramusculaire; IV = par voie intraveineuse; BID = deux fois par jour; OD = une fois par jour.
|
||||||||||||||||
| Régime de traitement de la gonorrhée | Traitement préférentiel (P) ou alternatif (A) selon les lignes directrices de l'ASPC ou de la PT | Nombre et proportion des autres cas adultes auxquels un traitement a été prescrit pour des infections pharyngées |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2018 | 2019 | 2020 | 2021 | Total | ||||||||||
| ASPC | AB | MB | NÉ Note de bas de page a | T.N.-O. | n | % | n | % | n | % | n | % | n | |
| Azithromycine 1 g, Céfixime 800 mg | A | A | A | A | A | 30 | 50,8 % | 49 | 56,3 % | 19 | 43,2 % | 19 | 51,4 % | 117 |
| Azithromycine 1 g, Ceftriaxone 250 mg | P | P | P | P | P | 20 | 33,9 % | 36 | 41,4 % | 18 | 40,9 % | 16 | 43,2 % | 89 |
| Autre - non spécifié | NR | NR | NR | NR | NR | 1 | 1,7 % | 1 | 1,1 % | 2 | 4,5 % | 1 | 2,7 % | 5 |
| Ceftriaxone 250 mg, Doxycycline 100 mg | NR | NR | NR | NR | NR | 0 | 0,0 % | 0 | 0,0 % | 2 | 4,5 % | 1 | 2,7 % | 5 |
| Azithromycine 2 g, Autre - non spécifié | NR | NR | NR | NR | NR | 2 | 3,4 % | 0 | 0,0 % | 1 | 2,3 % | 0 | 0,0 % | 3 |
| Azithromycine 2 g Note de bas de page b | NR | NR | A | NR | A | 2 | 3,4 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 2 |
| Ceftriaxone 250 mg, Autre - non spécifié | NR | NR | NR | NR | NR | 2 | 3,4 % | 0 | 0,0 % | 1 | 2,3 % | 0 | 0,0 % | 1 |
| Azithromycine 1 g, Céfixime 800 mg, Doxycycline 100 mg PO BID x 14 jours | NR | NR | NR | NR | NR | 1 | 1,7 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 |
| Azithromycine 1 g, Ceftriaxone 250 mg, Céfixime 800 mg, Pénicilline 600 mg, BID x 10 jours | NR | NR | NR | NR | NR | 0 | 0,0 % | 1 | 1,1 % | 0 | 0,0 % | 0 | 0,0 % | 1 |
| Azithromycine 1 g | NR | NR | NR | NR | NR | 0 | 0,0 % | 0 | 0,0 % | 1 | 2,3 % | 0 | 0,0 % | 1 |
| Ceftriaxone 250 mg | NR | NR | NR | NR | NR | 1 | 1,7 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 |
| Total | 59 | 100,0 % | 87 | 100,0 % | 44 | 100,0 % | 37 | 100,0 % | 226 | |||||
Remarque : dans le tableau, le traitement « préférentiel » est indiqué par « P », le traitement « alternatif » est indiqué par « A » et le traitement « non recommandé » est indiqué par « NR »; PO = par voie orale; BID = deux fois par jour; OD = une fois par jour.
|
||||||||||||||
4.3.2.c. Traitement de la gonorrhée chez les hommes au comportement sexuel inconnu dans la SARGA, 2018 à 2021
Les traitements prescrits aux hommes dont le comportement sexuel est inconnu sont énumérés à l'annexe E. Ces cas ont été principalement signalés par le Manitoba (88,6 %, 171/193). La plupart des hommes dont le comportement sexuel était inconnu et qui souffraient d'une infection anogénitale se sont vu prescrire de l'azithromycine à 1 g et du céfixime à 800 mg (moyenne : 41,3 %). Le deuxième traitement le plus souvent prescrit à ce groupe était l'azithromycine 1 g plus ceftriaxone 250 mg (moyenne : 22,2 %). Les hommes dont le comportement sexuel est inconnu et qui ont contracté une infection pharyngée se sont vu prescrire en majorité soit le régime thérapeutique préférentiel, soit le régime thérapeutique alternatif (moyenne : 90,2 %).
4.3.3. Échec du traitement de la gonorrhée parmi les cas SARGA, 2018 à 2021
Entre 2018 et 2021, 14 cas SARGA ont été signalés comme des échecs du traitement de GC (6/956 (0,6 %) en 2018 et 8/935 (0,9 %) en 2019; 92,8 % (13) des cas étaient des hommes, 64,3 % (9) des cas étaient des GBHARSAH; 78,6 % (11) des cas étaient des infections anogénitales). Six cas se sont vu prescrire de l'azithromycine 1 g et du céfixime 800 mg, cinq cas de la ceftriaxone 250 mg et de l'azithromycine 1 g, un cas de l'azithromycine 1 g, un cas de l'azithromycine 2 g et de la gentamicine 240 mg, et un cas a eu un traitement non spécifié. Sur les 13 échecs thérapeutiques signalés dont les données de prescription étaient disponibles, aucun n'a montré une diminution de la sensibilité/résistance à tous les traitements du régime thérapeutique prescrit; par conséquent, aucun n'était un échec thérapeutique confirmé (annexe F). Le cas dont le traitement n'a pas été précisé était résistant à la ciprofloxacine, à la pénicilline et à la tétracycline. Comme aucun de ces médicaments ne figure parmi les thérapies les plus recommandées et les plus prescrites, il est peu probable que ce cas soit un véritable échec thérapeutique. Les échecs thérapeutiques signalés peuvent être des réinfections ou des personnes qui n'ont pas pris leur traitement tel que prescrit.
4.3.4. Sensibilité aux antimicrobiens parmi les cas SARGA, 2018 à 2021
4.3.4.a. Fardeau de la gonorrhée RAM parmi les cas SARGA et par sexe/comportement sexuel
La proportion des cas avec des cultures sensibles à tous les antimicrobiens testés (c'est-à-dire azithromycine, ceftriaxone, céfixime, ciprofloxacine, érythromycine, pénicilline, spectinomycine et tétracycline) était relativement stable de 2018 à 2020 et s'élevait en moyenne à 29,6 % de 2018 à 2021 (figure 2A, figure 3A) (pour une répartition par PT, veuillez consulter l'annexe 3). Parmi tous les cas SARGA, les GBHARSAH étaient les plus touchés par la gonorrhée RAM par rapport aux hommes hétérosexuels, aux hommes dont le comportement sexuel était inconnu et aux femmes (figures 2B, 2C, 2D, 2E, 3B, 3C, 3D et 3E). Parmi les GBHARSAH, la proportion de cultures sensibles à tous les antibiotiques a diminué, passant de 25,9 % en 2018 à 14,8 % en 2021 (baisse de 42,9 %). Chez les hommes hétérosexuels, la proportion de cultures sensibles à tous les antibiotiques était en moyenne de 40,0 % de 2018 à 2020, mais a fortement chuté pour ne plus représenter qu'environ un quart de la population (26,5 %) en 2021 (figures 2B et 3B). En revanche, chez les hommes au comportement sexuel inconnu, la proportion de cultures sensibles à tous les antibiotiques a augmenté, passant de 15,8 % en 2018 à 37,5 % en 2021 (figures 2D et 3D). Par ailleurs, chez les femmes, la proportion de cultures sensibles à tous les antibiotiques a légèrement fluctué entre 2018 et 2021 (moyenne sur quatre ans de 36,1 %) (figures 2E et 3E).
De 2020 à 2021, la proportion de cultures présentant une résistance ou une sensibilité réduite (R/SR) à deux antimicrobiens a fortement augmenté chez les GBHARSAH (de 31,4 % en 2020 à 56,1 % en 2021) et les hommes hétérosexuels (de 19,9 % en 2020 à 37,3 % en 2021), ainsi que chez les femmes (de 11,1 % en 2020 à 29,2 % en 2021) (figures 3B, 3C et 3E). Pour une ventilation plus détaillée des données relatives à la sensibilité aux antimicrobiens, par sexe, par comportement sexuel et par site d'infection, voir l'annexe G-I.
Figure 2. Proportion de cultures SARGA présentant une résistance (R) à l'azithromycine, à la ciprofloxacine, à l'érythromycine, à la spectinomycine, à la pénicilline ou à la tétracycline, ou une sensibilité réduite (SR) au céfixime et à la ceftriaxone, parmi tous les cas SARGA et par sexe/comportement sexuel, 2018 à 2021.
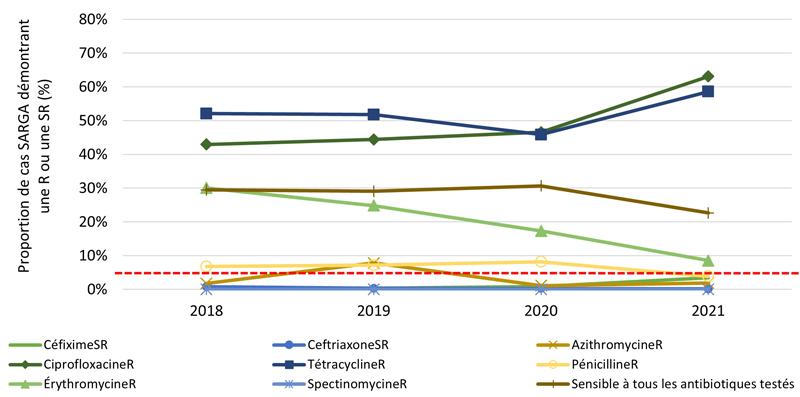
Figure 2A - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 1 | 0,1 % | 3 | 0,3 % | 6 | 0,8 % | 22 | 3,4 % |
| CeftriaxoneSR | 8 | 0,8 % | 3 | 0,3 % | 2 | 0,3 % | 1 | 0,2 % |
| AzithromycineR | 18 | 1,8 % | 78 | 7,8 % | 8 | 1,1 % | 12 | 1,9 % |
| CiprofloxacineR | 439 | 43,0 % | 444 | 44,4 % | 331 | 46,6 % | 407 | 63,1 % |
| TétracyclineR | 532 | 52,1 % | 517 | 51,8 % | 326 | 45,9 % | 378 | 58,6 % |
| PénicillineR | 69 | 6,8 % | 72 | 7,2 % | 58 | 8,2 % | 25 | 3,9 % |
| ErythromycineR | 307 | 30,0 % | 248 | 24,8 % | 123 | 17,3 % | 55 | 8,5 % |
| SpectinomycineR | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Sensible à tous les antibiotiques testés | 301 | 29,5 % | 290 | 29,0 % | 218 | 30,7 % | 146 | 22,6 % |
| Total | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % |
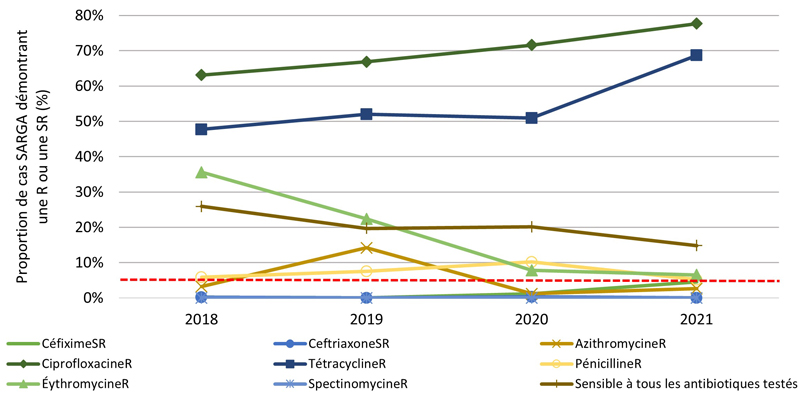
Figure 2B - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 1 | 0,2 % | 0 | 0,0 % | 4 | 1,2 % | 14 | 4,5 % |
| CeftriaxoneSR | 1 | 0,2 % | 0 | 0,0 % | 1 | 0,3 % | 0 | 0,0 % |
| AzithromycineR | 14 | 3,2 % | 57 | 14,2 % | 4 | 1,2 % | 8 | 2,6 % |
| CiprofloxacineR | 280 | 63,1 % | 269 | 66,9 % | 239 | 71,6 % | 241 | 77,7 % |
| TétracyclineR | 212 | 47,7 % | 209 | 52,0 % | 170 | 50,9 % | 213 | 68,7 % |
| PénicillineR | 26 | 5,9 % | 30 | 7,5 % | 34 | 10,2 % | 16 | 5,2 % |
| ErythromycineR | 158 | 35,6 % | 90 | 22,4 % | 26 | 7,8 % | 20 | 6,5 % |
| SpectinomycineR | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Sensible à tous les antibiotiques testés | 115 | 25,9 % | 79 | 19,7 % | 67 | 20,1 % | 46 | 14,8 % |
| Total GBHARSAH | 444 | 100,0 % | 402 | 100,0 % | 334 | 100,0 % | 310 | 100,0 % |
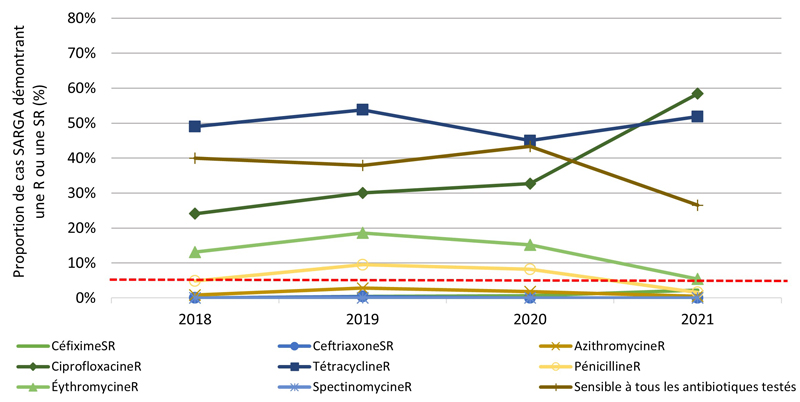
Figure 2C - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 0 | 0,0 % | 1 | 0,4 % | 1 | 0,6 % | 4 | 2,2 % |
| CeftriaxoneSR | 0 | 0,0 % | 1 | 0,4 % | 0 | 0,0 % | 0 | 0,0 % |
| AzithromycineR | 2 | 0,8 % | 7 | 2,8 % | 3 | 1,8 % | 1 | 0,5 % |
| CiprofloxacineR | 59 | 24,1 % | 76 | 30,0 % | 56 | 32,7 % | 108 | 58,4 % |
| TétracyclineR | 120 | 49,0 % | 136 | 53,8 % | 77 | 45,0 % | 96 | 51,9 % |
| PénicillineR | 12 | 4,9 % | 24 | 9,5 % | 14 | 8,2 % | 3 | 1,6 % |
| ErythromycineR | 32 | 13,1 % | 47 | 18,6 % | 26 | 15,2 % | 10 | 5,4 % |
| SpectinomycineR | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Sensible à tous les antibiotiques testés | 98 | 40,0 % | 96 | 37,9 % | 74 | 43,3 % | 49 | 26,5 % |
| Total des hommes hétérosexuels | 245 | 100,0 % | 253 | 100,0 % | 171 | 100,0 % | 185 | 100,0 % |
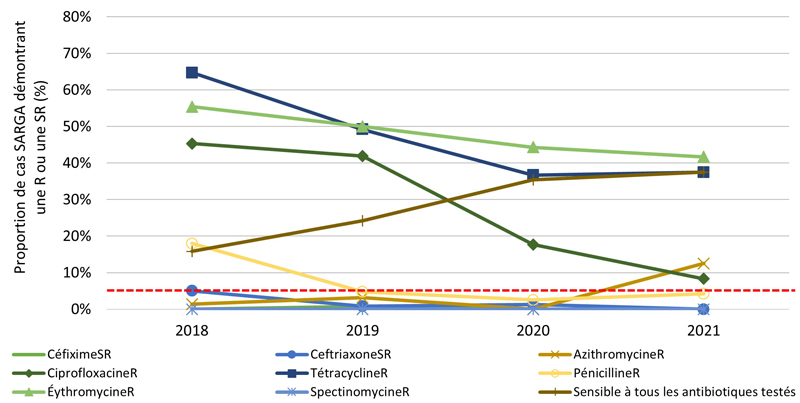
Figure 2D - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 0 | 0,0 % | 1 | 0,8 % | 0 | 0,0 % | 0 | 0,0 % |
| CeftriaxoneSR | 7 | 5,0 % | 1 | 0,8 % | 1 | 1,3 % | 0 | 0,0 % |
| AzithromycineR | 2 | 1,4 % | 4 | 3,2 % | 0 | 0,0 % | 3 | 12,5 % |
| CiprofloxacineR | 63 | 45,3 % | 52 | 41,9 % | 14 | 17,7 % | 2 | 8,3 % |
| TétracyclineR | 90 | 64,7 % | 61 | 49,2 % | 29 | 36,7 % | 9 | 37,5 % |
| PénicillineR | 25 | 18,0 % | 6 | 4,8 % | 2 | 2,5 % | 1 | 4,2 % |
| ErythromycineR | 77 | 55,4 % | 62 | 50,0 % | 35 | 44,3 % | 10 | 41,7 % |
| SpectinomycineR | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Sensible à tous les antibiotiques testés | 22 | 15,8 % | 30 | 24,2 % | 28 | 35,4 % | 9 | 37,5 % |
| Total des hommes dont le comportement sexuel est inconnu | 139 | 100,0 % | 124 | 100,0 % | 79 | 100,0 % | 24 | 100,0 % |
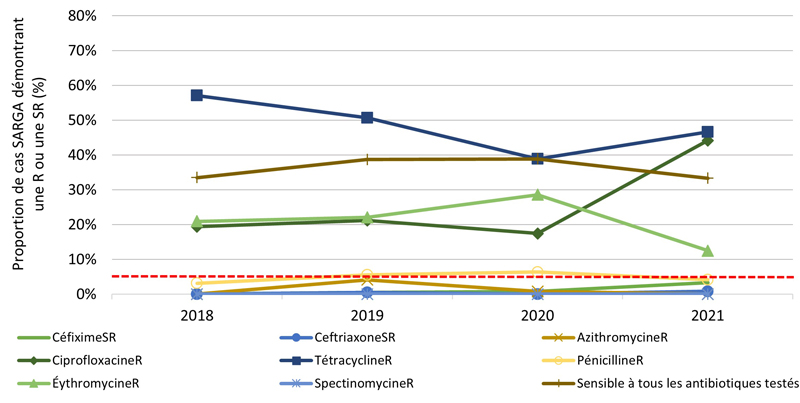
Figure 2E - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 0 | 0,0 % | 1 | 0,5 % | 1 | 0,8 % | 4 | 3,3 % |
| CeftriaxoneSR | 0 | 0,0 % | 1 | 0,5 % | 0 | 0,0 % | 1 | 0,8 % |
| AzithromycineR | 0 | 0,0 % | 9 | 4,1 % | 1 | 0,8 % | 0 | 0,0 % |
| CiprofloxacineR | 37 | 19,4 % | 46 | 21,2 % | 22 | 17,5 % | 53 | 44,2 % |
| TétracyclineR | 109 | 57,1 % | 110 | 50,7 % | 49 | 38,9 % | 56 | 46,7 % |
| PénicillineR | 6 | 3,1 % | 12 | 5,5 % | 8 | 6,3 % | 5 | 4,2 % |
| ErythromycineR | 40 | 20,9 % | 48 | 22,1 % | 36 | 28,6 % | 15 | 12,5 % |
| Sensible à tous les antibiotiques testés | 64 | 33,5 % | 84 | 38,7 % | 49 | 38,9 % | 40 | 33,3 % |
| Total des femmes | 191 | 100,0 % | 217 | 100,0 % | 126 | 100,0 % | 120 | 100,0 % |
NB : La ligne pointillée rouge représente le seuil de préoccupation de l'Organisation mondiale de la santé (OMS) pour la gonorrhée RAM (≥ 5 %). C'est le niveau de résistance à partir duquel l'OMS recommande d'interrompre l'utilisation d'un antimicrobien dans le cadre d'un traitement empirique Note de bas de page 20.
Figure 3. Proportion de cas SARGA avec des cultures de CG démontrant une résistance (R) et/ou une sensibilité réduite (SR) à aucun ou jusqu'à cinq antimicrobiensNote de bas de page a, parmi tous les cas SARGA et par sexe/comportement sexuel, 2018 à 2021
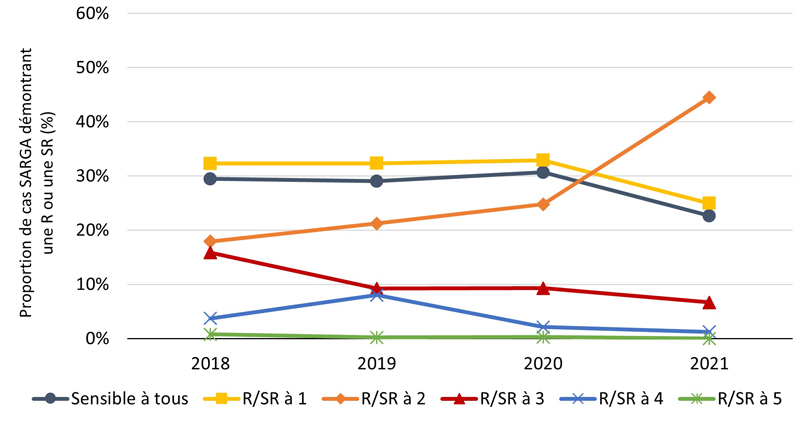
Figure 3A - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| Sensible à tous | 301 | 29 % | 290 | 29 % | 218 | 31 % | 146 | 23 % |
| R/SR à 1 | 330 | 32 % | 323 | 32 % | 234 | 33 % | 161 | 25 % |
| R/SR à 2 | 183 | 18 % | 212 | 21 % | 176 | 25 % | 287 | 45 % |
| R/SR à 3 | 162 | 16 % | 92 | 9 % | 66 | 9 % | 43 | 7 % |
| R/SR à 4 | 38 | 4 % | 80 | 8 % | 15 | 2 % | 8 | 1 % |
| R/SR à 5 | 8 | 1 % | 2 | 0 % | 2 | 0 % | 0 | 0 % |
| Total | 1022 | 100 % | 999 | 100 % | 711 | 100 % | 645 | 100 % |
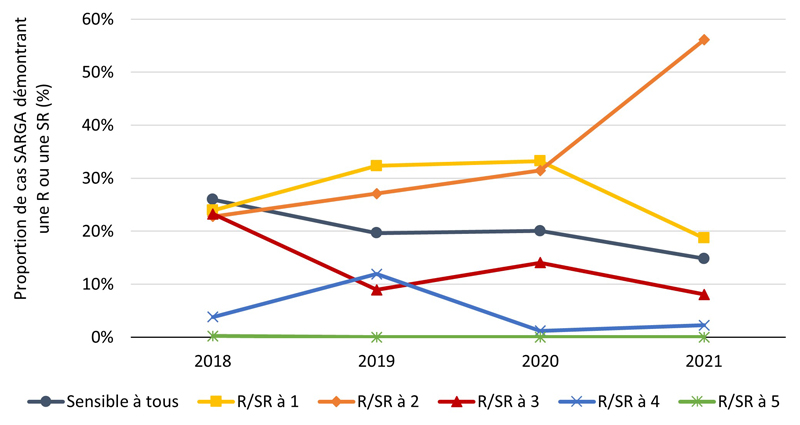
Figure 3B - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| Sensible à tous | 115 | 26 % | 79 | 20 % | 67 | 20 % | 46 | 15 % |
| R/SR à 1 | 106 | 24 % | 130 | 32 % | 111 | 33 % | 58 | 19 % |
| R/SR à 2 | 101 | 23 % | 109 | 27 % | 105 | 31 % | 174 | 56 % |
| R/SR à 3 | 103 | 23 % | 36 | 9 % | 47 | 14 % | 25 | 8 % |
| R/SR à 4 | 17 | 4 % | 48 | 12 % | 4 | 1 % | 7 | 2 % |
| R/SR à 5 | 1 | 0 % | 0 | 0 % | 0 | 0 % | 0 | 0 % |
| Total GBHARSAH | 443 | 100 % | 402 | 100 % | 334 | 100 % | 310 | 100 % |
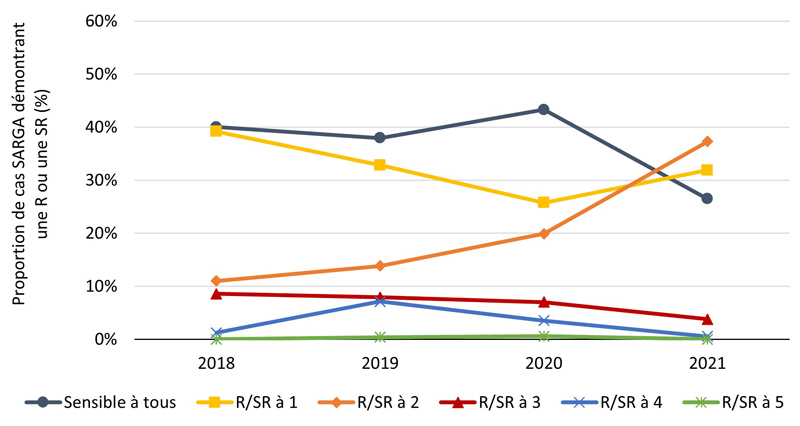
Figure 3C - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| Sensible à tous | 98 | 40 % | 96 | 38 % | 74 | 43 % | 49 | 26 % |
| R/SR à 1 | 96 | 39 % | 83 | 33 % | 44 | 26 % | 59 | 32 % |
| R/SR à 2 | 27 | 11 % | 35 | 14 % | 34 | 20 % | 69 | 37 % |
| R/SR à 3 | 21 | 9 % | 20 | 8 % | 12 | 7 % | 7 | 4 % |
| R/SR à 4 | 3 | 1 % | 18 | 7 % | 6 | 4 % | 1 | 1 % |
| R/SR à 5 | 0 | 0 % | 1 | 0 % | 1 | 1 % | 0 | 0 % |
| Total des hommes hétérosexuels | 245 | 100 % | 253 | 100 % | 171 | 100 % | 185 | 100 % |
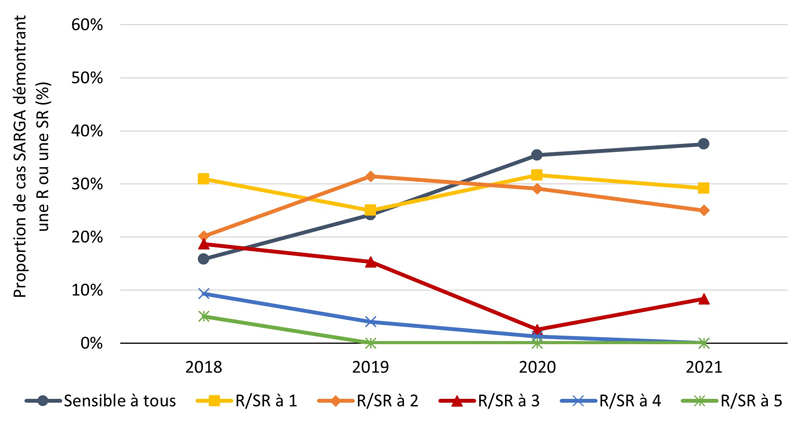
Figure 3D - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| Sensible à tous | 22 | 16 % | 30 | 24 % | 28 | 35 % | 9 | 38 % |
| R/SR à 1 | 43 | 31 % | 31 | 25 % | 25 | 32 % | 7 | 29 % |
| R/SR à 2 | 28 | 20 % | 39 | 31 % | 23 | 29 % | 6 | 25 % |
| R/SR à 3 | 26 | 19 % | 19 | 15 % | 2 | 3 % | 2 | 8 % |
| R/SR à 4 | 13 | 9 % | 5 | 4 % | 1 | 1 % | 0 | 0 % |
| R/SR à 5 | 7 | 5 % | 0 | 0 % | 0 | 0 % | 0 | 0 % |
| Total des hommes dont le comportement sexuel est inconnu | 139 | 100 % | 124 | 100 % | 79 | 100 % | 24 | 100 % |
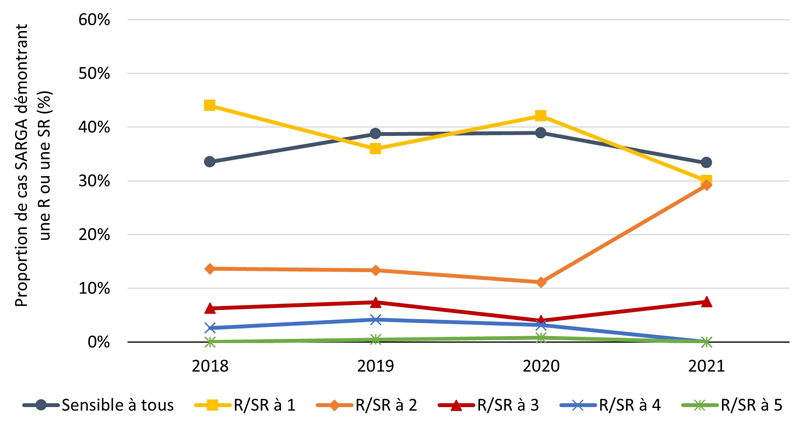
Figure 3E - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| Sensible à tous les antibiotiques testés | 64 | 34 % | 84 | 39 % | 49 | 39 % | 40 | 33 % |
| R/SR à 1 | 84 | 44 % | 78 | 36 % | 53 | 42 % | 36 | 30 % |
| R/SR à 2 | 26 | 14 % | 29 | 13 % | 14 | 11 % | 35 | 29 % |
| R/SR à 3 | 12 | 6 % | 16 | 7 % | 5 | 4 % | 9 | 8 % |
| R/SR à 4 | 5 | 3 % | 9 | 4 % | 4 | 3 % | 0 | 0 % |
| R/SR à 5 | 0 | 0 % | 1 | 0 % | 1 | 1 % | 0 | 0 % |
| Total des femmes | 191 | 100 % | 217 | 100 % | 126 | 100 % | 120 | 100 % |
- Note de bas de page a
-
Les cultures GC ont été testées pour la résistance à l'azithromycine, à la ciprofloxacine, à l'érythromycine, à la pénicilline, à la spectinomycine et à la tétracycline, ainsi que pour la sensibilité réduite au céfixime et à la ceftriaxone.
4.3.4.b. AzithromycineR, céfiximeSR et ceftriaxoneSR parmi toutes les cultures SARGA et par sexe/comportement sexuel
De 2018 à 2021, aucune culture n'a révélé la présence d'azithromycineR et de céfiximeSR ou d'azithromycineR et de ceftriaxoneSR (les antimicrobiens les plus recommandés et les plus prescrits) (tableau 10). En général, la prévalence de l'azithromycineR, du céfiximeSR et de la ceftriaxoneSR était faible au cours des années de déclaration (figure 4A). De 2018 à 2020, la prévalence du céfiximeSR était < 1 % et stable. Cependant, de 2020 à 2021, le nombre (et la proportion) de cultures SARGA démontrant la présence de céfiximeSR a presque triplé, passant de six (0,8 %) en 2020 à 22 (3,4 %) en 2021. En revanche, le nombre et la proportion de cultures démontrant la présence de ceftriaxoneSR ont diminué, passant de 8 (0,8 %) en 2018 à 1 (0,2 %) en 2021. La fréquence des cultures démontrant la présence d'azithromycineR a augmenté de 18 (1,8 %) en 2018 à 78 (7,8 %) en 2019. Toutefois, ce nombre a fortement diminué, passant à huit (1,1 %) en 2020 et à 12 (1,9 %) en 2021.
Les figures 4B, 4C, 4D, 4E présentent un aperçu des proportions d'azithromycineR, de céfiximeSR et de ceftriaxoneSR au sein des groupes par sexe/comportement sexuel (voir l'annexe G). De 2018 à 2019, la prévalence des cultures d'azithromycineR a augmenté, mais cette augmentation a été suivie d'une forte baisse de la prévalence de l'azithromycineR en 2020 et 2021 parmi les GBHARSAH (3,2 % en 2018, 14,2 % en 2019, 1,2 % en 2020, 2,6 % en 2021), les hommes hétérosexuels (0,8 % en 2018, 2,8 % en 2019, 1,8 % en 2020, 0,5 % en 2021) et les femmes (0,0 % en 2018, 4,1 % en 2019, 0,8 % en 2020, 0,0 % en 2021). En revanche, la prévalence de l'azithromycineR dans les cultures isolées chez les hommes au comportement sexuel inconnu était très faible de 2018 à 2020, mais a ensuite augmenté de 0,0 % en 2020 à 12,5 % (3/24 cas) en 2021.
La prévalence de la ceftriaxoneSR au sein du groupe de sexe/comportement sexuel était très faible, < 0,9 %, pour toutes les années, sauf en 2018, où la proportion était de 5,0 % dans les cultures isolées chez les hommes au comportement sexuel inconnu. La prévalence du céfiximeSR était également relativement faible (< 5 %) pour tous les groupes de sexe/comportement sexuel, mais il y avait une tendance à l'augmentation du céfiximeSR au fil des ans chez les GBHARSAH (0,2 % en 2018 à 4,5 % en 2021), les hommes hétérosexuels (0,0 % en 2018 à 2,2 % en 2021) et les femmes (0,0 % en 2018 à 3,3 % en 2021), mais pas chez les hommes dont le comportement sexuel est inconnu.
Parmi les cas identifiés comme transgenres ou de genre/sexe inconnu ou autre, aucune culture n'a été identifiée comme étant de l'azithromycineR, du céfiximeSR ou de la ceftriaxoneSR (résultats non montrés).
Figure 4. Proportion de cas SARGA avec des cultures démontrant une résistance (R) à l'azithromycine ou une sensibilité réduite (SR)Note de bas de page a au céfixime et à la ceftriaxone, parmi tous les cas SARGA et par sexe/comportement sexuel, 2018 à 2021.
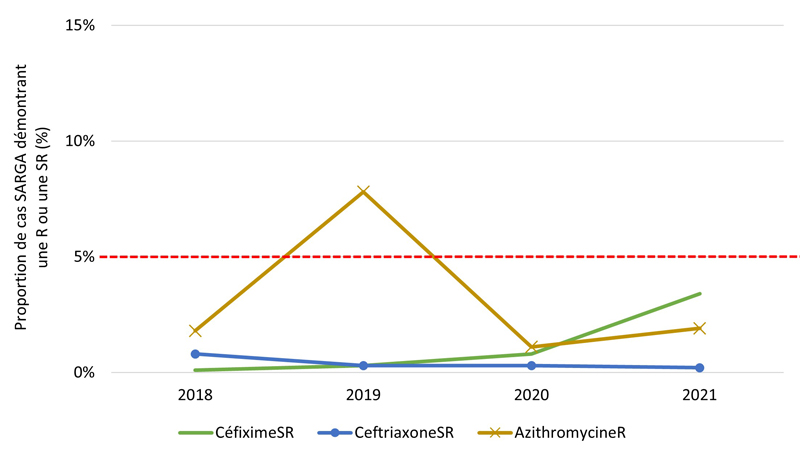
Figure 4A - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 1 | 0,1 % | 3 | 0,3 % | 6 | 0,8 % | 22 | 3,4 % |
| CeftriaxoneSR | 8 | 0,8 % | 3 | 0,3 % | 2 | 0,3 % | 1 | 0,2 % |
| AzithromycineR | 18 | 1,8 % | 78 | 7,8 % | 8 | 1,1 % | 12 | 1,9 % |
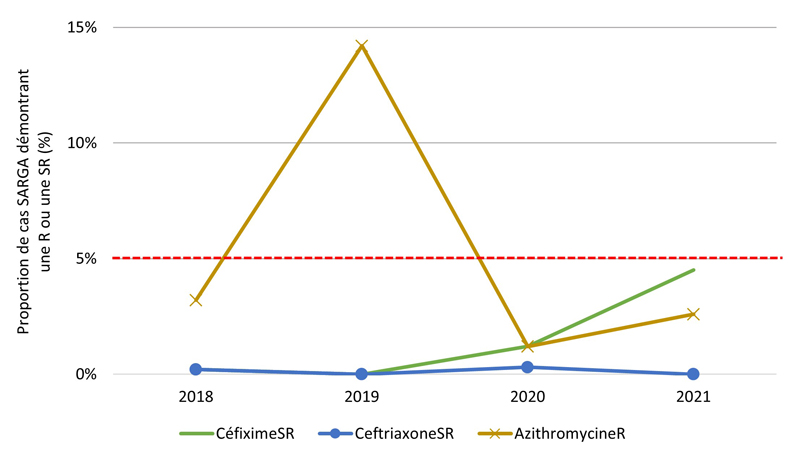
Figure 4B - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 1 | 0,2 % | 0 | 0,0 % | 4 | 1,2 % | 14 | 4,5 % |
| CeftriaxoneSR | 1 | 0,2 % | 0 | 0,0 % | 1 | 0,3 % | 0 | 0,0 % |
| AzithromycineR | 14 | 3,2 % | 57 | 14,2 % | 4 | 1,2 % | 8 | 2,6 % |
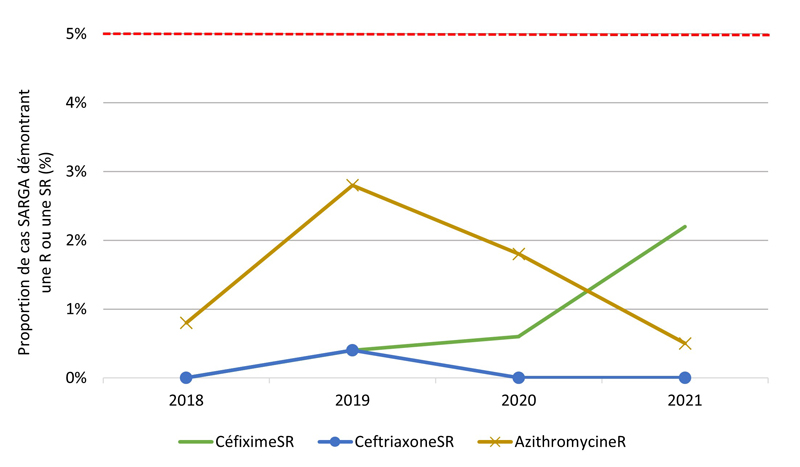
Figure 4C - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 0 | 0,0 % | 1 | 0,4 % | 1 | 0,6 % | 4 | 2,2 % |
| CeftriaxoneSR | 0 | 0,0 % | 1 | 0,4 % | 0 | 0,0 % | 0 | 0,0 % |
| AzithromycineR | 2 | 0,8 % | 7 | 2,8 % | 3 | 1,8 % | 1 | 0,5 % |
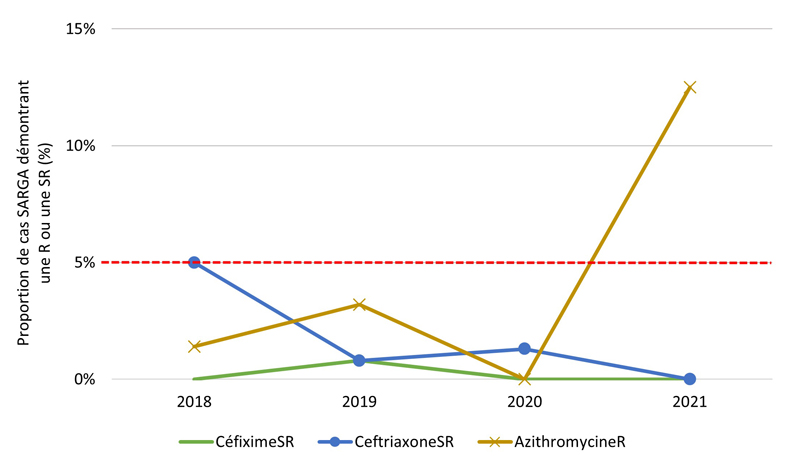
Figure 4D - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 0 | 0,0 % | 1 | 0,8 % | 0 | 0,0 % | 0 | 0,0 % |
| CeftriaxoneSR | 7 | 5,0 % | 1 | 0,8 % | 1 | 1,3 % | 0 | 0,0 % |
| AzithromycineR | 2 | 1,4 % | 4 | 3,2 % | 0 | 0,0 % | 3 | 12,5 % |
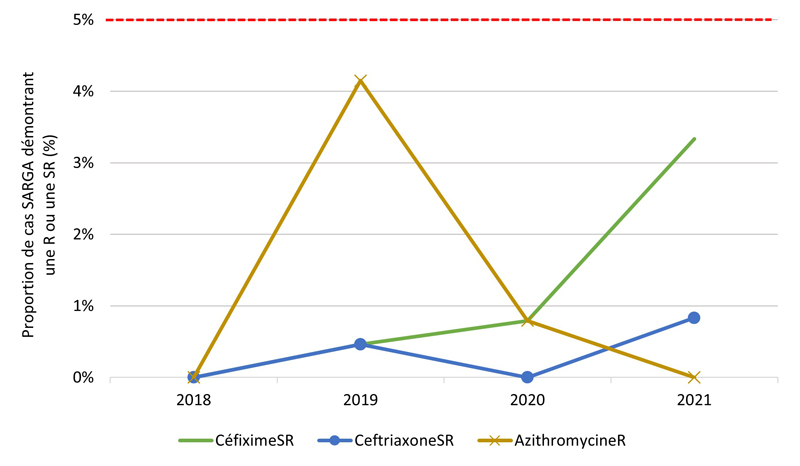
Figure 4E - Équivalent textuel
| 2018 | 2019 | 2020 | 2021 | |||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| CéfiximeSR | 0 | 0,0 % | 1 | 0,5 % | 1 | 0,8 % | 4 | 3,3 % |
| CeftriaxoneSR | 0 | 0,0 % | 1 | 0,5 % | 0 | 0,0 % | 1 | 0,8 % |
| AzithromycineR | 0 | 0,0 % | 9 | 4,1 % | 1 | 0,8 % | 0 | 0,0 % |
- Note de bas de page a
-
R/SR : Résistance ou sensibilité réduite.
NB : La ligne pointillée rouge représente le seuil de préoccupation de l'Organisation mondiale de la santé (OMS) pour la gonorrhée RAM ( ≥ 5 % ). C'est le niveau de résistance à partir duquel l'OMS recommande d'interrompre l'utilisation d'un antimicrobien dans le cadre d'un traitement empiriqueNote de bas de page 20.
| Antimicrobien R/SR | 2018 | 2019 | 2020 | 2021 | Total | ||||
|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | |
| AzithromycineR + CéfiximeSR | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 |
| AzithromycineR + CeftriaxoneSR | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 |
| CéfiximeSR + CeftriaxoneSR | 1 | 0,1 % | 3 | 0,3 % | 1 | 0,1 % | 1 | 0,2 % | 6 |
| Total | 1 | 3 | 1 | 1 | 6 | ||||
|
|||||||||
4.3.4.c. Les antimicrobiens résistants les plus répandus et les autres tendances de la résistance aux antimicrobiens parmi tous les cas SARGA et par sexe/comportement sexuel
Parmi toutes les cultures SARGA, entre 2018 et 2020, de tous les antimicrobiens testés, la résistance à la ciprofloxacine (ciprofloxacineR) était la plus répandue à 46,6 % en 2020, passant à 63,1 % en 2021, suivie par la résistance à la tétracycline (tétracyclineR) à 45,9 % en 2020 et 58,6 % en 2021 (figure 3A). Auparavant, la tétracyclineR était la plus répandue, avec 52,1 % en 2018 et 51,8 % en 2019, suivie de la ciprofloxacineR. La résistance à l'érythromycine (érythromycineR) a diminué annuellement et fortement, passant de 30,0 % en 2018 à 8,5 % en 2021. Les taux de résistance à la pénicilline ont été relativement stables de 2018 à 2020 (6,8 % en 2018, 7,2 % en 2019 et 8,2 % en 2020), mais ont chuté à 3,9 % en 2021.
En fonction du sexe et du comportement sexuel (Fig 3B, 3C, 3D, 3E), en 2021, les proportions de ciprofloxacineR et de tétracyclineR au sein du groupe étaient les plus élevées parmi les cultures collectées auprès des GBHARSAH (77,7 % de ciprofloxacine; 68,7 % de tétracycline; proportions croissantes au fil du temps, voir les annexes G et I), des hommes hétérosexuels (58,4 % de ciprofloxacine; 51,9 % de tétracycline) et des femmes (44,2 % de ciprofloxacine; 46,7 % de tétracycline). L'érythromycineR était la plus répandue dans les cultures isolées chez les hommes au comportement sexuel inconnu (ce groupe a montré une forte diminution de la prévalence de la ciprofloxacineR et de la tétracyclineR au fil du temps). La résistance aux antimicrobiens était similaire selon le site d'infection chez les GBHARSAH et les autres adultes (annexe I).
4.3.5. Caractéristiques des cas et séquences types des cas SARGA avec des cultures démontrant la présence d'azithromycineR, de céfiximeSR ou de ceftriaxoneSR, 2018 à 2021.
4.3.5.a. Caractéristiques des cas et séquences types des cas SARGA avec des cultures démontrant la présence d'azithromycineR
Entre 2018 et 2021, il y a eu 116 cas SARGA avec des cultures de N. gonorrhoeae démontrant la présence d'azithromycineR (tableau 11). La plupart de ces cultures ont été prélevées chez des hommes (90,5 %, (105/116)); parmi eux, 79,0 % (83) étaient des GBHARSAH, 34,6 % (44) étaient âgés de 30 à 39 ans et 61,9 % (65) ont déclaré des infections anogénitales. Un cas (1,3 %, 1/78), en 2019, a été signalé comme un échec thérapeutique présumé. La plupart des cas ont été observés en 2019 (78/116, 67,2% du total des isolats avec azithromycineR).
| 2018 | 2019 | 2020 | 2021 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | |
| Isolats avec azithromycineR | 18 | 1,8 % | 78 | 7,8 % | 8 | 1,1 % | 12 | 1,9 % | 116 | 3,4 % |
| Total des isolats | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % | 3377 | 100,0 % |
| Séquences types | ||||||||||
| ST-12302 | 4 | 22,20 % | 33 | 42,30 % | 3 | 37,50 % | 0 | 0,00 % | 40 | 34,5 % |
| ST-16288 | 3 | 16,70 % | 20 | 25,60 % | 1 | 12,50 % | 0 | 0,00 % | 24 | 20,7 % |
| ST-3935 | 1 | 5,60 % | 5 | 6,40 % | 0 | 0,00 % | 0 | 0,00 % | 6 | 5,2 % |
| ST-11508 | 0 | 0,00 % | 2 | 2,60 % | 0 | 0,00 % | 2 | 16,70 % | 4 | 3,4 % |
| ST-11724 | 0 | 0,00 % | 0 | 0,00 % | 0 | 0,00 % | 4 | 33,30 % | 4 | 3,4 % |
| ST-14698 | 3 | 16,70 % | 1 | 1,30 % | 0 | 0,00 % | 0 | 0,00 % | 4 | 3,4 % |
| ST-4357 | 1 | 5,60 % | 2 | 2,60 % | 0 | 0,00 % | 0 | 0,00 % | 3 | 1,7 % |
| ST non listés (≤ 2 ou inconnus)Note de bas de page a | 6 | 33,30 % | 15 | 23,10 % | 4 | 50,00 % | 6 | 50,00 % | 31 | 19,0 % |
| Total AzithromycineR | 18 | 100,0 % | 78 | 100,0 % | 8 | 100,0 % | 12 | 100,0 % | 116 | 100,0 % |
| Sexe/Genre | ||||||||||
| Hommes | 18 | 100,0 % | 68 | 87,2 % | 7 | 87,5 % | 12 | 100,0 % | 105 | 90,5 % |
| Femmes | 0 | 0,0 % | 9 | 11,5 % | 1 | 12,5 % | 0 | 0,0 % | 10 | 8,6 % |
| Total AzithromycineR | 18 | 100,0 % | 78 | 100,0 % | 8 | 100,0 % | 12 | 100,0 % | 116 | 100,0 % |
| Comportement sexuel parmi les hommes | ||||||||||
| GBHARSAH | 14 | 77,8 % | 57 | 83,8 % | 4 | 57,1 % | 8 | 66,7 % | 83 | 79,0 % |
| Hommes hétérosexuels | 2 | 11,1 % | 7 | 10,3 % | 3 | 42,9 % | 1 | 8,3 % | 13 | 12,4 % |
| Hommes au comportement sexuel inconnu | 2 | 11,1 % | 4 | 5,1 % | 0 | 0,0 % | 3 | 25,0 % | 9 | 8,6 % |
| Total Hommes AzithromycineR | 18 | 100,0% | 68 | 100,0% | 7 | 100,0% | 12 | 100,0% | 105 | 100,0% |
| Comportement sexuel parmi les femmes | ||||||||||
| Partenaires sexuels masculins et féminins | 0 | 0,0 % | 1 | 11,1% | 0 | 0,0 % | 0 | 0,0 % | 1 | 10,0 % |
| Partenaires sexuels féminins | 0 | 0,0 % | 0 | 0,0% | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Partenaires sexuels masculins | 0 | 0,0 % | 4 | 44,4% | 1 | 100,0 % | 0 | 0,0 % | 5 | 50,0 % |
| Femmes au comportement sexuel inconnu | 0 | 0,0 % | 4 | 44,4% | 0 | 0,0 % | 0 | 0,0 % | 4 | 40,0 % |
| Total Femmes AzithromycineR | 0 | 0,0 % | 9 | 100,0% | 1 | 100,0 % | 0 | 0,0 % | 10 | 100,0 % |
| Sexe/genre et âge | ||||||||||
| Hommes (années) | ||||||||||
| < 20 | 0 | 0,0 % | 1 | 1,5 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 1,0 % |
| 20-29 | 6 | 33,3 % | 23 | 33,8 % | 2 | 28,6 % | 5 | 41,7 % | 36 | 25,0 % |
| 30-39 | 8 | 44,4 % | 26 | 38,2 % | 4 | 57,1 % | 6 | 50,0 % | 44 | 34,6 % |
| 40-49 | 4 | 22,2 % | 12 | 17,6 % | 0 | 0,0 % | 1 | 8,3 % | 17 | 12,5 % |
| 50-59 | 0 | 0,0 % | 6 | 8,8 % | 1 | 14,3 % | 0 | 0,0 % | 7 | 6,7 % |
| 60+ | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Total Hommes AzithromycineR | 18 | 100,0 % | 68 | 100,0 % | 7 | 100,0 % | 12 | 100,0 % | 105 | 100,0 % |
| Femmes (années) | ||||||||||
| < 20 | 0 | 0,0 % | 3 | 33,3 % | 0 | 0,0 % | 0 | 0,0 % | 3 | 33,3 % |
| 20-29 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| 30-39 | 0 | 0,0 % | 3 | 33,3 % | 1 | 100,0 % | 0 | 0,0 % | 4 | 44,4 % |
| 40-49 | 0 | 0,0 % | 1 | 11,1 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 11,1 % |
| 50-59 | 0 | 0,0 % | 2 | 22,2 % | 0 | 0,0 % | 0 | 0,0 % | 2 | 11,1 % |
| 60+ | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Total Femmes AzithromycineR | 0 | 0,0 % | 9 | 100,0 % | 1 | 100,0 % | 0 | 0,0 % | 10 | 100,0 % |
| Type d'infection | ||||||||||
| Hommes | ||||||||||
| Infection anogénitale | 10 | 55,6 % | 45 | 66,2 % | 5 | 71,5 % | 5 | 41,7 % | 65 | 61,9 % |
| Infection pharyngée | 8 | 44,4 % | 23 | 33,8 % | 2 | 28,5 % | 5 | 41,7 % | 38 | 36,2 % |
| Non spécifiée | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 2 | 16,7 % | 2 | 1,9 % |
| Total Hommes AzithromycineR | 18 | 100,0 % | 68 | 100,0 % | 7 | 100,0 % | 12 | 100,0 % | 105 | 100,0 % |
| Femmes | ||||||||||
| Infection anogénitale | 0 | 0,0 % | 5 | 55,5 % | 0 | 0,0 % | 0 | 0,0 % | 5 | 50,0 % |
| Infection pharyngée | 0 | 0,0 % | 3 | 33,3 % | 1 | 12,5 % | 0 | 0,0 % | 4 | 40,0 % |
| Non spécifiée | 0 | 0,0 % | 1 | 11,1 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 10,0 % |
| Total Femmes AzithromycineR | 0 | 0,00 % | 9 | 100,0 % | 1 | 100,0 % | 0 | 0,0 % | 10 | 100,0 % |
| Province ou territoire | ||||||||||
| Alberta | 13 | 72,2 % | 67 | 85,9 % | 8 | 100,0 % | 9 | 75,0 % | 97 | 83,6 % |
| Manitoba | 3 | 16,7 % | 7 | 9,0 % | 0 | 0,0 % | 3 | 25,0 % | 13 | 11,2 % |
| Nouvelle-Écosse | 2 | 11,1 % | 4 | 5,1 % | 0 | 0,0 % | 0 | 0,0 % | 6 | 5,2 % |
| Territoires du Nord-Ouest | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Total AzithromycineR | 18 | 100,0 % | 78 | 100,0 % | 8 | 100,0 % | 12 | 100,0 % | 116 | 100,0 % |
| Échec présumé du traitementNote de bas de page b | ||||||||||
| Oui | 0 | 0,0 % | 1 | 1,3 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 0,9 % |
| Non | 18 | 100,0 % | 77 | 98,7 % | 8 | 100,0 % | 12 | 100,0 % | 115 | 98,3 % |
| Total AzithromycineR | 18 | 100,0 % | 78 | 100,0 % | 8 | 100,0 % | 12 | 100,0 % | 116 | 100,0 % |
|
||||||||||
Entre 2018 et 2021, 31 ST typables avec l'azithromycineR ont été identifiées (annexe J). Le tableau 11 et la figure 5 présentent les sept ST les plus courantes (c'est-à-dire les ST associées à l'azithromycineR dans plus de deux cas SARGA). La ST NG-MAST la plus identifiée était la ST-12302, suivi de la ST-16288. Ces deux ST représentaient 85,2 % de tous les cas d'azithromycineR de 2018 à 2021 (tableau 11).
En 2018, ST-16288 et ST-12302 ont été identifiées dans 83 et 40 isolats, respectivement (Figure 5). Cependant, seuls 4 % et 10 % de ces isolats, respectivement, ont été identifiés comme azithromycineR. En 2019, ces ST ont été identifiées beaucoup moins fréquemment (dans 16 et 24 isolats, respectivement); cependant, la majorité de ces isolats ont été identifiés comme étant azithromycineR (75,0 % et 92,0 %, respectivement). La prévalence de ces ST a diminué en 2020 pour atteindre respectivement quatre et huit isolats en 2020 et zéro en 2021.
En 2021, la ST-11724 a été identifiée pour la première fois (depuis 2018) dans seulement quatre isolats, mais 100,0 % de ces isolats étaient azithromycineR. La ST-11508 (dans les dix premiers ST identifiées parmi les cas SARGA en 2019, 2020 et 2021) était présente dans toutes les années de déclaration, mais ce n'est qu'en 2019 et 2021 que la ST a démontré la présence d'azithromycineR dans 6,7 % (2/30) et 18,2 % (2/11) des isolats avec cette ST, respectivement. Toutes les autres ST associées à l'azithromycineR étaient peu fréquentes et variaient fortement d'une année à l'autre (figure 5).

Figure 5 - Équivalent textuel
| Année | ST | AzithromycineR | Total | % |
|---|---|---|---|---|
| 2018 | ST-12302 | 4 | 40 | 10 % |
| ST-16288 | 3 | 83 | 4 % | |
| ST-3935 | 1 | 6 | 17 % | |
| ST-11508 | 0 | 6 | 0 % | |
| ST-11724 | 0 | 0 | 0 % | |
| ST-14698 | 3 | 10 | 30 % | |
| ST-17283 | 2 | 3 | 67 % | |
| 2019 | ST-12302 | 22 | 24 | 92 % |
| ST-16288 | 12 | 16 | 75 % | |
| ST-3935 | 5 | 6 | 83 % | |
| ST-11508 | 2 | 30 | 7 % | |
| ST-11724 | 0 | 0 | 0 % | |
| ST-14698 | 1 | 1 | 100 % | |
| ST-17283 | 0 | 0 | 0 % | |
| 2020 | ST-12302 | 3 | 8 | 38 % |
| ST-16288 | 1 | 4 | 25 % | |
| ST-3935 | 0 | 3 | 0 % | |
| ST-11508 | 0 | 46 | 0 % | |
| ST-11724 | 0 | 0 | 0 % | |
| ST-14698 | 0 | 0 | 0 % | |
| ST-17283 | 0 | 0 | 0 % | |
| 2021 | ST-12302 | 0 | 0 | 0 % |
| ST-16288 | 0 | 0 | 0 % | |
| ST-3935 | 0 | 2 | 0 % | |
| ST-11508 | 2 | 11 | 18 % | |
| ST-11724 | 4 | 4 | 100 % | |
| ST-14698 | 0 | 0 | 0 % | |
| ST-17283 | 0 | 0 | 0 % |
Note : Cette figure montre les ST les plus fréquemment observées associées à l'azithromycineR (parmi tous les isolats SARGA collectés de 2018 à 2021), pour une année civile donnée. Le nombre total de cultures SARGA avec une ST donnée est indiqué en gris et le nombre d'isolats (pour une ST donnée) avec azithromycineR est indiqué en jaune. Les données indiquées sur les barres correspondent à la proportion d'isolats pour lesquels la présence d'azithromycineR a été démontrée pour chaque ST.
4.3.5.b. Caractéristiques des cas et séquences types des cas SARGA avec des cultures démontrant la présence de céfiximeSR
Entre 2018 et 2021, il y a eu 32 cas SARGA avec des cultures de GC démontrant la présence de céfiximeSR (tableau 12). Parmi ces cas, 81,3 % (26) des cultures ont été prélevées chez des hommes, dont 73,1 % (19) étaient des GBHARSAH et 23,1 % (6) étaient hétérosexuels. Par conséquent, le nombre de céfiximeSR était légèrement plus élevé chez les GBHARSAH par rapport aux caractéristiques de base de SARGA. Sur les six (18,8 %) cas féminins dont les cultures ont révélé la présence de céfiximeSR, cinq (83,3 %) étaient des femmes ayant eu des rapports sexuels avec des hommes. Le céfiximeSR a été observé plus fréquemment chez les hommes âgés de 30 à 39 ans (38,5 %, 10 cas) et de 40 à 49 ans (26,9 %, 7 cas) et chez les femmes âgées de 20 à 29 ans (50,0 %). Le site d'infection primaire variait entre les hommes et les femmes; parmi les cas masculins avec des cultures de céfiximeSR, 18 (69,2 %) ont rapporté une infection anogénitale, tandis que cinq cas féminins (83,3 %) ont rapporté une infection pharyngée.
Parmi les 11 ST NG-MAST associées au céfiximeSR, la ST-17261 a été la plus fréquemment identifiée. Elle a été observée pour la première fois dans quatre cultures SARGA en 2020, ce qui représentait 66,7 % des cultures de céfiximeSR typées en 2020. En 2021, elle a été observée dans 11 cultures (50,0 % des cultures de céfiximeSR typées cette année-là) (tableau 12). Cependant, parmi les 94 isolats (sur 3 377 isolats) présentant la ST-17261, le céfiximeSR a été détecté dans aucune culture en 2018, 9,5 % (4/42) en 2020 et 22,4 % (11/49) en 2021 (Figure 6). Toutes les autres ST associées au céfiximeSR étaient peu fréquentes et variaient fortement d'une année à l'autre.
| 2018 | 2019 | 2020 | 2021 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | n | % | n | % | n | |
| Isolats avec céfiximeSR | 1 | 0,1 % | 3 | 0,3 % | 6 | 80,0% | 22 | 410,0% | 32 | 0,9% |
| Total des isolats | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0% | 645 | 100,0% | 3377 | 100,0% |
| Séquences types | ||||||||||
| ST-17261 | 0 | 0,0 % | 0 | 0,0 % | 4 | 66,7% | 11 | 50,0% | 15 | 46,9% |
| ST-16639 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 4 | 18,2% | 4 | 12,5% |
| ST-5308 | 1 | 100,0 % | 2 | 66,7 % | 0 | 0,0% | 0 | 0,0% | 3 | 9,4% |
| ST-19757 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 2 | 9,1% | 2 | 6,3% |
| ST-non typable | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 1 | 4,5% | 1 | 3,1% |
| ST-11477 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 1 | 4,5% | 1 | 3,1% |
| ST-19921 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 1 | 4,5% | 1 | 3,1% |
| ST-10451 | 0 | 0,0 % | 0 | 0,0 % | 1 | 16,7% | 0 | 0,0% | 1 | 3,1% |
| ST-6778 | 0 | 0,0 % | 1 | 33,3 % | 0 | 0,0% | 0 | 0,0% | 1 | 3,1% |
| ST-19810 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 1 | 4,5% | 1 | 3,1% |
| ST-17267 | 0 | 0,0 % | 0 | 0,0 % | 1 | 16,7% | 0 | 0,0% | 1 | 3,1% |
| ST-19820 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 1 | 4,5% | 1 | 3,1% |
| Total CéfiximeSR | 1 | 100,0 % | 3 | 100,0 % | 6 | 100,0% | 22 | 100,0% | 32 | 100,0% |
| Sexe/Genre | ||||||||||
| Hommes | 1 | 100,0 % | 2 | 66,7 % | 5 | 83,3% | 18 | 81,8% | 26 | 81,3% |
| Femmes | 0 | 0,0 % | 1 | 33,3 % | 1 | 16,7% | 4 | 18,2% | 6 | 18,8% |
| Total CéfiximeSR | 1 | 100,0 % | 3 | 100,0 % | 6 | 100,0% | 22 | 100,0% | 32 | 100,0% |
| Comportement sexuel parmi les hommes | ||||||||||
| GBHARSAH | 1 | 100,0 % | 0 | 0,0 % | 4 | 80,0% | 14 | 77,8% | 19 | 73,1% |
| Hommes hétérosexuels | 0 | 0,0 % | 1 | 50,0 % | 1 | 20,0% | 4 | 22,2% | 6 | 23,1% |
| Hommes au comportement sexuel inconnu | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0% | 0 | 0,0% | 1 | 3,8% |
| Total Hommes CéfiximeSR | 1 | 100,0 % | 2 | 100,0 % | 5 | 100,0% | 18 | 100,0% | 26 | 100,0% |
| Comportement sexuel parmi les femmes | ||||||||||
| Partenaires sexuels masculins et féminins | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 1 | 25,0% | 1 | 16,7% |
| Partenaires sexuels féminins | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 0 | 0,0% | 0 | 0,0% |
| Partenaires sexuels masculins | 0 | 0,0 % | 1 | 33,3 % | 1 | 100,0% | 3 | 75,0% | 5 | 83,3% |
| Femmes au comportement sexuel inconnu | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 0 | 0,0% | 0 | 0,0% |
| Total Femmes CéfiximeSR | 0 | 0,0 % | 0 | 0,0 % | 1 | 100,0% | 4 | 100,0% | 6 | 100,0% |
| Sexe/genre et âge | ||||||||||
| Hommes (années) | ||||||||||
| < 20 | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0% | 0 | 0,0% | 1 | 3,8% |
| 20-29 | 1 | 100,0 % | 0 | 0,0 % | 1 | 20,0% | 3 | 16,7% | 5 | 19,2% |
| 30-39 | 0 | 0,0 % | 0 | 0,0 % | 2 | 40,0% | 8 | 44,4% | 10 | 38,5% |
| 40-49 | 0 | 0,0 % | 1 | 50,0 % | 2 | 40,0% | 4 | 22,2% | 7 | 26,9% |
| 50-59 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 2 | 11,1% | 2 | 7,7% |
| 60+ | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 1 | 5,6% | 1 | 3,8% |
| Total Hommes CéfiximeSR | 1 | 100,0 % | 2 | 100,0 % | 5 | 100,0% | 18 | 100,0% | 26 | 100,0% |
| Femmes (années) | ||||||||||
| < 20 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| 20-29 | 0 | 0,0 % | 1 | 100,0 % | 0 | 0,0 % | 2 | 50,0 % | 3 | 50,0 % |
| 30-39 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 2 | 50,0 % | 2 | 33,3 % |
| 40-49 | 0 | 0,0 % | 0 | 0,0 % | 1 | 100,0 % | 0 | 0,0 % | 1 | 16,7 % |
| 50-59 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| 60+ | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Total Femmes CéfiximeSR | 0 | 0,0 % | 1 | 33,3 % | 1 | 100,0 % | 4 | 100,0 % | 6 | 100,0 % |
| Type d'infection | ||||||||||
| Hommes | ||||||||||
| Infection anogénitale | 0 | 0,0 % | 2 | 100,0 % | 3 | 60,0 % | 13 | 72,2 % | 18 | 69,2 % |
| Infection pharyngée | 1 | 100,0 % | 0 | 0,0 % | 2 | 40,0 % | 5 | 27,8 % | 8 | 30,8 % |
| Total Hommes CéfiximeSR | 1 | 100,0 % | 2 | 100,0 % | 5 | 100,0 % | 18 | 100,0 % | 26 | 100,0 % |
| Femmes | ||||||||||
| Infection anogénitale | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 25,0 % | 1 | 16,7 % |
| Infection pharyngée | 0 | 0,0 % | 1 | 100,0 % | 1 | 100,0 % | 3 | 75,0 % | 5 | 83,3 % |
| Total Femmes CéfiximeSR | 0 | 0,0 % | 1 | 100,0 % | 1 | 100,0 % | 4 | 100,0 % | 6 | 100,0 % |
| Province ou territoire | ||||||||||
| Alberta | 1 | 100,0 % | 2 | 66,7 % | 6 | 100,0 % | 22 | 100,0 % | 31 | 96,9 % |
| Manitoba | 0 | 0,0 % | 1 | 33,3 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 3,1 % |
| Nouvelle-Écosse | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Territoires du Nord-Ouest | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Total CéfiximeSR | 1 | 100,0 % | 3 | 100,0 % | 6 | 100,0 % | 22 | 100,0 % | 32 | 100,0 % |
| Échec présumé du traitementNote de bas de page a | ||||||||||
| Oui | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Non | 1 | 100,0 % | 3 | 100,0 % | 6 | 100,0 % | 22 | 100,0 % | 32 | 100,0 % |
| Total CéfiximeSR | 1 | 100,0 % | 3 | 100,0 % | 6 | 100,0 % | 22 | 100,0 % | 32 | 100,0 % |
|
||||||||||
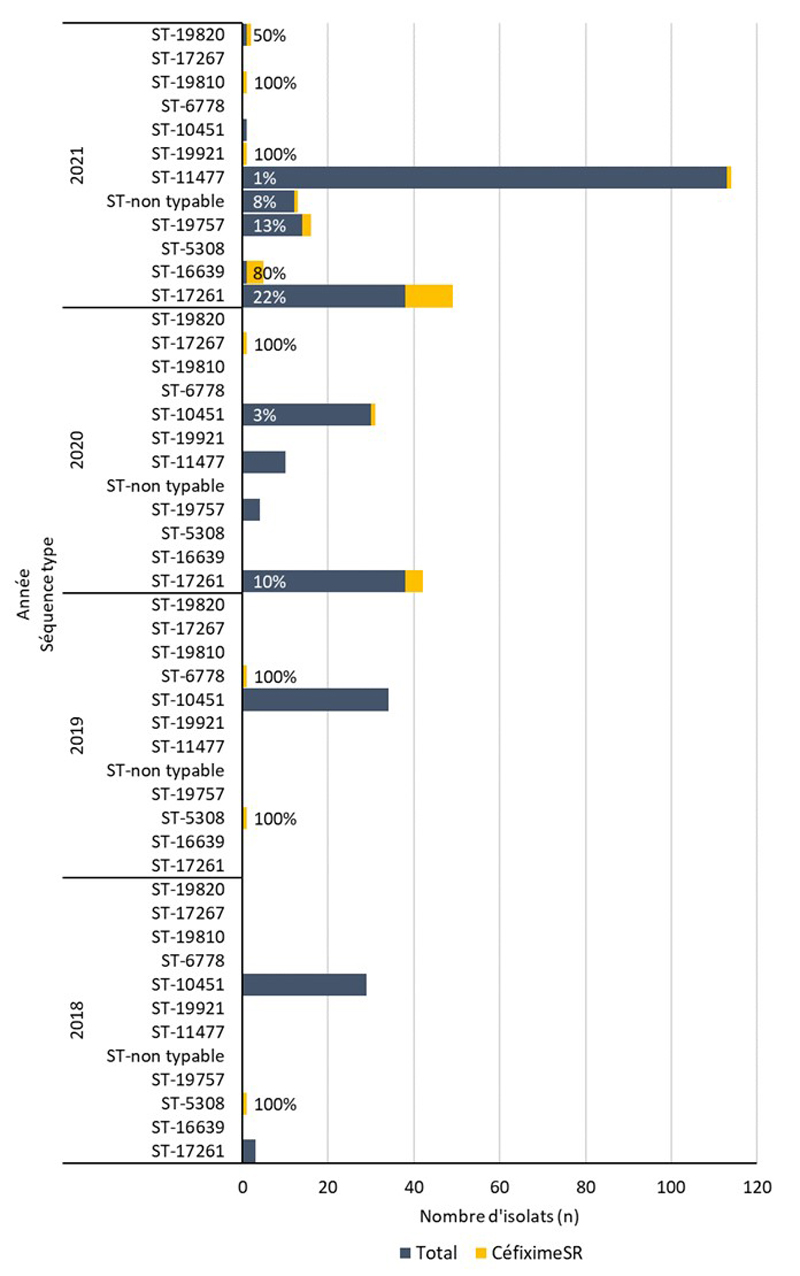
Figure 6 - Équivalent textuel
| Année | ST | CéfiximeSR | Total | % |
|---|---|---|---|---|
| 2018 | ST-17261 | 0 | 3 | 0 % |
| ST-16639 | 0 | 0 | 0 % | |
| ST-5308 | 1 | 1 | 100 % | |
| ST-19757 | 0 | 0 | 0 % | |
| ST-non typable | 0 | 0 | 0 % | |
| ST-11477 | 0 | 0 | 0 % | |
| ST-19921 | 0 | 0 | 0 % | |
| ST-10451 | 0 | 29 | 0 % | |
| ST-6778 | 0 | 0 | 0 % | |
| ST-19810 | 0 | 0 | 0 % | |
| ST-17267 | 0 | 0 | 0 % | |
| ST-19820 | 0 | 0 | 0 % | |
| 2019 | ST-17261 | 0 | 0 | 0 % |
| ST-16639 | 0 | 0 | 0 % | |
| ST-5308 | 1 | 1 | 100 % | |
| ST-19757 | 0 | 0 | 0 % | |
| ST-non typable | 0 | 0 | 0 % | |
| ST-11477 | 0 | 0 | 0 % | |
| ST-19921 | 0 | 0 | 0 % | |
| ST-10451 | 0 | 34 | 0 % | |
| ST-6778 | 1 | 1 | 100 % | |
| ST-19810 | 0 | 0 | 0 % | |
| ST-17267 | 0 | 0 | 0 % | |
| ST-19820 | 0 | 0 | 0 % | |
| 2020 | ST-17261 | 4 | 42 | 10 % |
| ST-16639 | 0 | 0 | 0 % | |
| ST-5308 | 0 | 0 | 0 % | |
| ST-19757 | 0 | 4 | 0 % | |
| ST-non typable | 0 | 0 | 0 % | |
| ST-11477 | 0 | 10 | 0 % | |
| ST-19921 | 0 | 0 | 0 % | |
| ST-10451 | 1 | 31 | 3 % | |
| ST-6778 | 0 | 0 | 0 % | |
| ST-19810 | 0 | 0 | 0 % | |
| ST-17267 | 1 | 1 | 100% | |
| ST-19820 | 0 | 0 | 0 % | |
| 2021 | ST-17261 | 11 | 49 | 22 % |
| ST-16639 | 4 | 5 | 80 % | |
| ST-5308 | 0 | 0 | 0 % | |
| ST-19757 | 2 | 16 | 13 % | |
| ST-non typable | 1 | 13 | 8 % | |
| ST-11477 | 1 | 114 | 1 % | |
| ST-19921 | 1 | 1 | 100 % | |
| ST-10451 | 0 | 1 | 0 % | |
| ST-6778 | 0 | 0 | 0 % | |
| ST-19810 | 1 | 1 | 100 % | |
| ST-17267 | 0 | 0 | 0 % | |
| ST-19820 | 1 | 2 | 50 % |
Note : Cette figure montre les ST associées au céfiximeSR (parmi tous les isolats SARGA collectés de 2018 à 2021), pour une année civile donnée. Le nombre total de cultures SARGA avec une ST donnée est indiqué en gris et le nombre d'isolats (pour une ST donnée) avec céfiximeSR est indiqué en jaune. Les données indiquées sur les barres correspondent à la proportion d'isolats présentant un SD de céfixime pour chaque ST .
4.3.5.c. Caractéristiques des cas et séquences types des cas SARGA avec des cultures démontrant la présence de ceftriaxoneSR
De 2018 à 2021, la proportion de cultures SARGA GC démontrant la présence de ceftriaxoneSR a diminué chaque année, passant de 0,8 % (8/1022) en 2018 à 0,2 % (1/645) en 2021 (moyenne de la période de 0,4 % (14/3377) (tableau 13). Sur les 14 cultures de ceftriaxoneSR, 12 (85,7 %) ont été prélevées chez des hommes. La plupart de ces cas masculins (9, 75,0%) avaient un comportement sexuel inconnu et un site d'infection primaire anogénital (7, 58,3%), et étaient âgés de 20 à 29 ans (6, 50,0 %). Aucun cas n'a été attribué à un échec thérapeutique (tableau 13).
Six ST NG-MAST ont été identifiées parmi les cultures SARGA démontrant la présence de ceftriaxoneSR entre 2018 et 2021. La ST-7856 a été identifiée plus fréquemment et représentait la moitié (moyenne de 50,0 %; 7/14) des cas de ceftriaxoneSR (tous étaient de 2018) (tableau 13). Parmi les 27 (sur 3 377 cas) isolats SARGA identifiés comme ST-7856 (uniquement identifiés au cours des années 2018 et 2020), 26,0 % (7/27) ont présenté une ceftriaxoneSR en 2018 et aucun en 2020 (Figure 7). Toutes les autres ST associées à une ceftriaxoneSR étaient peu fréquentes et variaient fortement d'une année à l'autre (Figure 7).
| 2018 | 2019 | 2020 | 2021 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | |
| Isolats avec ceftriaxoneSR | 8 | 0,8 % | 3 | 0,3 % | 2 | 0,3 % | 1 | 0,2 % | 14 |
0,4 % |
| Total des isolats | 1022 | 100,0 % | 999 | 100,0 % | 711 | 100,0 % | 645 | 100,0 % | 3377 | 100,0 % |
| Séquences types | ||||||||||
| ST-7856 | 7 | 87,5 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 7 | 50,0 % |
| ST-5308 | 1 | 12,5 % | 2 | 66,7 % | 0 | 0,0 % | 0 | 0,0 % | 3 | 21,4 % |
| ST-6778 | 0 | 0,0 % | 1 | 33,3 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 7,1 % |
| ST-16639 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 100,0 % | 1 | 7,1 % |
| ST-10386 | 0 | 0,0 % | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0 % | 1 | 7,1 % |
| ST-17261 | 0 | 0,0 % | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0 % | 1 | 7,1 % |
| Total CeftriaxoneSR | 8 | 100,0 % | 3 | 100,0 % | 2 | 100,0 % | 1 | 100,0 % | 14 | 100,0 % |
| Sexe/Genre | ||||||||||
| Hommes | 8 | 100,0 % | 2 | 100,0 % | 2 | 100,0 % | 0 | 0,0 % | 12 | 85,7% |
| Femmes | 0 | 0,0 % | 1 | 33,3 % | 0 | 0,0 % | 1 | 100,0 % | 2 | 14,3 % |
| Total CeftriaxoneSR | 8 | 100,0 % | 3 | 100,0 % | 2 | 100,0 % | 1 | 100,0 % | 14 | 100,0 % |
| Comportement sexuel parmi les hommes | ||||||||||
| GBHARSAH | 1 | 12,5 % | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0 % | 2 | 16,7 % |
| Hommes hétérosexuels | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0 % | 0 | 0,0% | 1 | 8,3 % |
| Hommes au comportement sexuel inconnu | 7 | 87,5 % | 1 | 50,0 % | 1 | 50,0 % | 0 | 0,0 % | 9 | 75,0 % |
| Total Hommes CeftriaxoneSR | 8 | 100,0 % | 2 | 100,0 % | 2 | 100,0 % | 0 | 0,0 % | 12 | 100,0 % |
| Comportement sexuel parmi les femmes | ||||||||||
| Partenaires sexuels masculins et féminins | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Partenaires sexuels féminins | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Partenaires sexuels masculins | 0 | 0,0 % | 1 | 0,0 % | 0 | 0,0 % | 1 | 100,0 % | 2 | 100,0 % |
| Femmes au comportement sexuel inconnu | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Total Femmes CeftriaxoneSR | 0 | 0,0 % | 1 | 0,0 % | 0 | 0,0 % | 1 | 100,0 % | 2 | 100,0 % |
| Sexe/genre et âge | ||||||||||
| Hommes (années) | ||||||||||
| < 20 | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 8,3 % |
| 20-29 | 6 | 75,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 6 | 50,0 % |
| 30-39 | 0 | 0,0 % | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0 % | 1 | 8,3 % |
| 40-49 | 2 | 25,0 % | 1 | 50,0 % | 1 | 50,0 % | 0 | 0,0 % | 4 | 33,3 % |
| 50-59 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| 60+ | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Total Hommes CeftriaxoneSR | 8 | 100,0 % | 2 | 100,0 % | 2 | 100,0 % | 0 | 0,0 % | 12 | 100,0 % |
| Femmes (années) | ||||||||||
| < 20 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| 20-29 | 0 | 0,0 % | 1 | 100,0 % | 0 | 0,0 % | 1 | 100,0 % | 2 | 100,0 % |
| 30-39 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| 40-49 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% | 0 | 0,0 % | 0 | 0,0 % |
| 50-59 | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0% |
| 60+ | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Total Femmes CeftriaxoneSR | 0 | 0,0 % | 1 | 0,0 % | 0 | 0,0 % | 1 | 100,0 % | 2 | 100,0 % |
| Type d'infection | ||||||||||
| Hommes | ||||||||||
| Infection anogénitale | 4 | 50,0 % | 2 | 100,0 % | 1 | 50,0 % | 0 | 0,0 % | 7 | 58,3 % |
| Infection pharyngée | 4 | 50,0 % | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0 % | 5 | 41,7 % |
| Total Hommes CeftriaxoneSR | 8 | 100,0 % | 2 | 100,0 % | 2 | 100,0 % | 0 | 0,0 % | 12 | 100,0 % |
| Femmes | ||||||||||
| Infection anogénitale | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 100,0 % | 1 | 50,0 % |
| Infection pharyngée | 0 | 0,0 % | 1 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 50,0 % |
| Total Femmes CeftriaxoneSR | 0 | 0,0 % | 1 | 0,0 % | 0 | 0,0 % | 1 | 100,0 % | 2 | 100,0 % |
| Province ou territoire | ||||||||||
| Alberta | 1 | 12,5 % | 2 | 66,7 % | 1 | 50,0 % | 1 | 100,0 % | 5 | 35,7 % |
| Manitoba | 7 | 87,5 % | 1 | 33,3 % | 1 | 50,0 % | 0 | 0,0 % | 9 | 64,3 % |
| Nouvelle-Écosse | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Territoires du Nord-Ouest | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Total CeftriaxoneSR | 8 | 100,0 % | 3 | 100,0 % | 2 | 100,0 % | 1 | 100,0 % | 14 | 100,0 % |
| Échec présumé du traitementNote de bas de page a | ||||||||||
| Oui | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % |
| Non | 8 | 100,0 % | 2 | 66,7 % | 2 | 100,0 % | 1 | 100,0 % | 13 | 92,9 % |
| Total CeftriaxoneSR | 8 | 100,0 % | 3 | 100,0 % | 2 | 100,0 % | 1 | 100,0 % | 14 | 100,0 % |
|
||||||||||
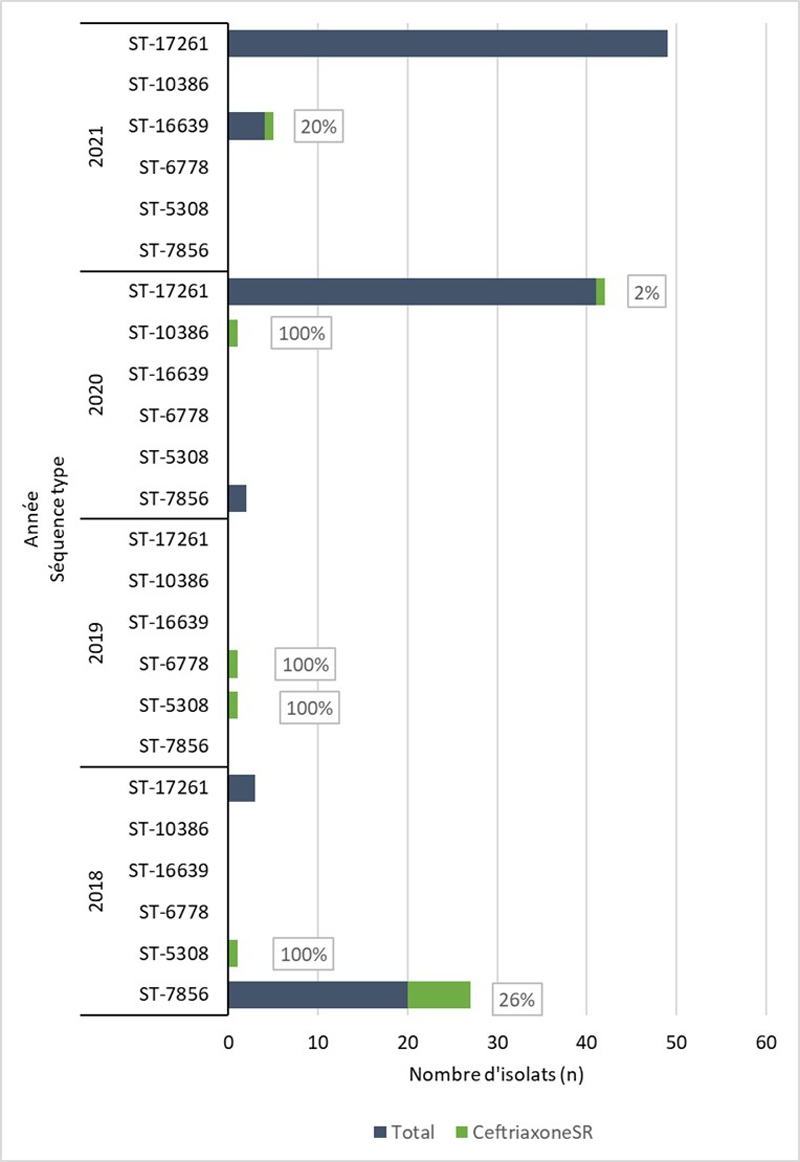
Figure 7 - Équivalent textuel
| Année | ST | CeftriaxoneSR | Total | % |
|---|---|---|---|---|
| 2018 | ST-7856 | 7 | 27 | 26 % |
| ST-5308 | 1 | 1 | 100 % | |
| ST-6778 | 0 | 0 | 0 % | |
| ST-16639 | 0 | 0 | 0 % | |
| ST-10386 | 0 | 0 | 0 % | |
| ST-17261 | 0 | 3 | 0 % | |
| 2019 | ST-7856 | 0 | 0 | 0 % |
| ST-5308 | 1 | 1 | 100 % | |
| ST-6778 | 1 | 1 | 100 % | |
| ST-16639 | 0 | 0 | 0 % | |
| ST-10386 | 0 | 0 | 0 % | |
| ST-17261 | 0 | 0 | 0 % | |
| 2020 | ST-7856 | 0 | 2 | 0 % |
| ST-5308 | 0 | 0 | 0 % | |
| ST-6778 | 0 | 0 | 0% | |
| ST-16639 | 0 | 0 | 0 % | |
| ST-10386 | 1 | 1 | 100 % | |
| ST-17261 | 1 | 42 | 2 % | |
| 2021 | ST-7856 | 0 | 0 | 0 % |
| ST-5308 | 0 | 0 | 0 % | |
| ST-6778 | 0 | 0 | 0 % | |
| ST-16639 | 1 | 5 | 20 % | |
| ST-10386 | 0 | 0 | 0 % | |
| ST-17261 | 0 | 49 | 0 % |
Note : Cette figure montre les ST associées à la ceftriaxoneSR (parmi tous les isolats SARGA collectés de 2018 à 2021), pour une année civile donnée. Le nombre total de cultures SARGA avec une ST donnée est indiqué en gris et le nombre d'isolats (pour une ST donnée) avec ceftriaxoneSR est indiqué en jaune. Les données indiquées sur les barres correspondent à la proportion d'isolats présentant une SR de ceftriaxone pour chaque ST.
4.4. Typage des séquences
Il y a eu 396 ST NG-MAST uniques identifiées à partir de 3377 isolats de N. gonorrhoeae, collectés à partir de cas SARGA entre 2018 et 2021. Les 10 ST les plus fréquemment observées représentaient un peu plus de la moitié de toutes les ST identifiées au cours de chaque année de déclaration (tableau 14).
| Nombre d'isolats | 2018 | 2019 | 2020 | 2021 | ||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | |
| Nombre d'isolats ayant une ST parmi les 10 principales ST pour une année donnée | 491 | 57,4 % | 476 | 55,8 % | 301 | 54,0 % | 332 | 52,9 % |
| Nombre d'isolats total | 855 | 100,0 % | 853 | 100,0 % | 557 | 100,0 % | 628 | 100,0 % |
| 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|
AzithromycineR |
||||
| AzithromycineR dans les 10 principales ST | 7 | 25 | 0 | 3 |
| Total AzithromycineR (N) | 18 | 55 | 8 | 11 |
| Proportion (%) | 38,9 % | 45,5 % | 0,0 % | 27,3 % |
CéfiximeSR |
||||
| CéfiximeSR dans les 10 principales ST | 0 | 0 | 5 | 15 |
| Total CéfiximeSR (N) | 1 | 2 | 6 | 22 |
| Proportion (%) | 0,0 % | 0,0 % | 83,3 % | 68,2 % |
CeftriaxoneSR |
||||
| CeftriaxoneSR dans les 10 principales ST | 7 | 0 | 1 | 0 |
| Total CeftriaxoneSR (N) | 8 | 2 | 2 | 1 |
| Proportion (%) | 87,5 % | 0,0 % | 50,0 % | 0,0 % |
Il n'y avait pas de tendance claire dans la proportion de cas SARGA avec des cultures qui avaient une des 10 principales ST et qui démontraient soit de l'azithromycineR, du céfiximeSR ou de la ceftriaxoneSR (tableau 15). La proportion de cultures, avec l'une des 10 principales ST, présentant de l'azithromycineR a varié selon les années, mais a globalement diminué (38,9 %, 7/18 cas en 2018; 45,5 %, 25/55 en 2019; 0,0 %, 0/8 en 2020; et 27,3 %, 3/11 en 2021).
Alors que les cultures démontrant la présence de céfiximeSR et de ceftriaxoneSR ont été peu fréquentes au cours de toutes les années de déclaration, le céfiximeSR a été principalement détecté dans les cultures provenant de cas ayant une ST parmi les 10 principales pour les années 2020 (83,3 %, 5/6 cas) et 2021 (68,2 %, 15/22 cas) seulement. La ceftriaxoneSR a été principalement détectée dans les cultures qui figuraient parmi les 10 principales ST pour l'année 2018 (87,5 %, 7/8 cas) et dans la moitié des cultures en 2020 (50,0 %, 1/2 cas) uniquement.
Les figures 8, 9, 10 et 11 présentent les 10 principales ST en fonction du nombre d'isolats avec la ST, du nombre d'isolats avec la ST et répondant aux seuils pour l'azithromycineR, le céfiximeSR ou la ceftriaxoneSR, et de la proportion de cas SARGA présentant ces ST selon i) le comportement sexuel et ii) le type d'infection primaire pour les années 2018 à 2021 (les changements de ST au cours de cette période parmi les 10 principales ST sont présentés à l'annexe K). Les ST les plus répandues ont varié au cours des années de déclaration en fonction de leur type, de leur fréquence et de leur profil de résistance. La discussion ci-dessous se concentre sur les 10 ST associées au céfiximeSR, à la ceftriaxoneSR et à l'azithromycineR.
Figure 8 : Les 10 séquences types NG-MAST les plus fréquentes dans les isolats de N. gonorrhoeae et la proportion par sexe/genre et comportement sexuel et par type d'infection, 2021.
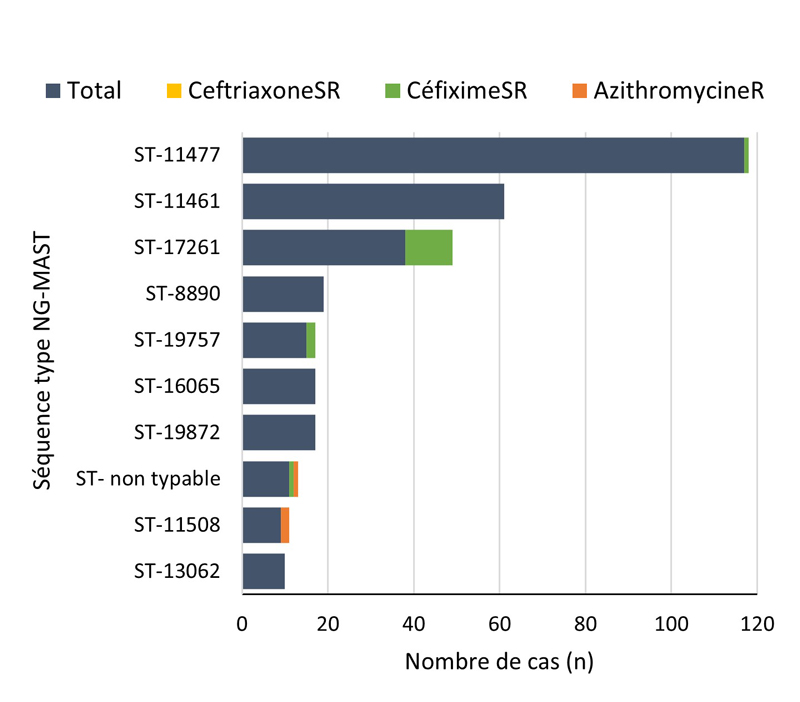
Figure 8A - Équivalent textuel
| ST NG- MAST | AzithromycineR | CéfiximeSR | CeftriaxoneSR | Nombre total d'isolats avec ST pour cette année |
|---|---|---|---|---|
| ST-13062 | 0 | 0 | 0 | 10 |
| ST-11508 | 2 | 0 | 0 | 11 |
| ST-non typable | 1 | 1 | 0 | 13 |
| ST-19872 | 0 | 0 | 0 | 17 |
| ST-16065 | 0 | 0 | 0 | 17 |
| ST-19757 | 0 | 2 | 0 | 17 |
| ST-8890 | 0 | 0 | 0 | 19 |
| ST-17261 | 0 | 11 | 0 | 49 |
| ST-11461 | 0 | 0 | 0 | 61 |
| ST-11477 | 0 | 1 | 0 | 118 |
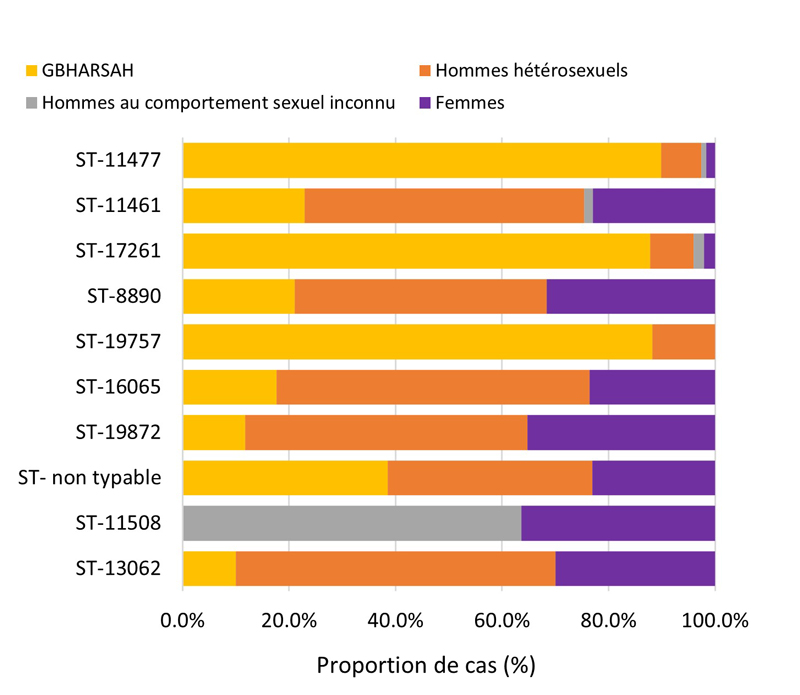
Figure 8B - Équivalent textuel
| ST NG- MAST | GBHARSAH | Hommes hétérosexuels | Hommes au comportement sexuel inconnu | Femmes |
|---|---|---|---|---|
| ST-13062 | 10,0 % | 60,0 % | 0,0 % | 30,0 % |
| ST-11508 | 0,0 % | 0,0 % | 63,6 % | 36,4 % |
| ST-non typable | 38,5 % | 38,5 % | 0,0 % | 23,1 % |
| ST-19872 | 11,8 % | 52,9 % | 0,0 % | 35,3 % |
| ST-16065 | 17,6 % | 58,8 % | 0,0 % | 23,5 % |
| ST-19757 | 88,2 % | 11,8 % | 0,0 % | 0,0 % |
| ST-8890 | 21,1 % | 47,4 % | 0,0 % | 31,6 % |
| ST-17261 | 87,8 % | 8,2 % | 2,0 % | 2,0 % |
| ST-11461 | 23,0 % | 52,5 % | 1,6 % | 23,0 % |
| ST-11477 | 89,8 % | 7,6 % | 0,8 % | 1,7 % |
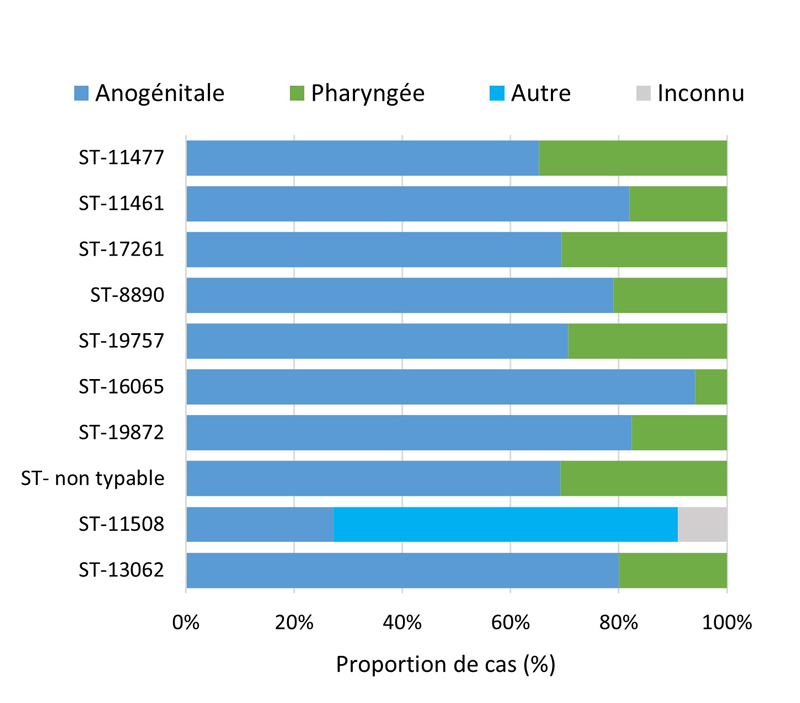
Figure 8C - Équivalent textuel
| ST NG- MAST | Infection anogénitale | Infection pharyngée | Autre infection | Infection inconnue |
|---|---|---|---|---|
| ST-13062 | 8 | 2 | 0 | 0 |
| ST-11508 | 3 | 0 | 7 | 1 |
| ST-non typable | 9 | 4 | 0 | 0 |
| ST-19872 | 14 | 3 | 0 | 0 |
| ST-16065 | 16 | 1 | 0 | 0 |
| ST-19757 | 12 | 5 | 0 | 0 |
| ST-8890 | 15 | 4 | 0 | 0 |
| ST-17261 | 34 | 15 | 0 | 0 |
| ST-11461 | 50 | 11 | 0 | 0 |
| ST-11477 | 77 | 41 | 0 | 0 |
Figure 9 : Les 10 séquences types NG-MAST les plus fréquentes dans les isolats de N. gonorrhoeae et la proportion par sexe/genre et comportement sexuel et par type d'infection, 2020.
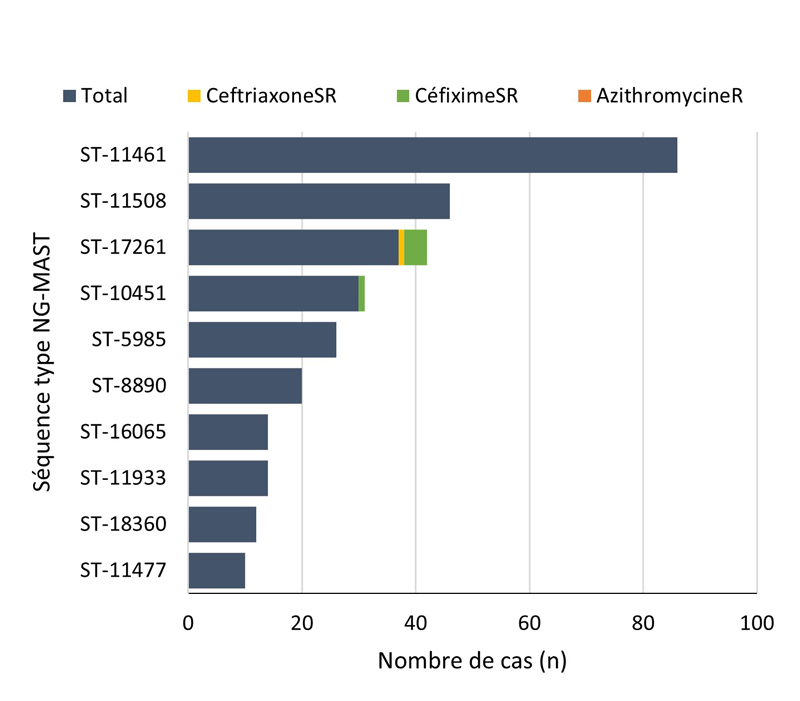
Figure 9A - Équivalent textuel
| ST NG- MAST | AzithromycineR | CéfiximeSR | CeftriaxoneSR | Total des isolats avec ST pour cette année |
|---|---|---|---|---|
| ST-11477 | 0 | 0 | 0 | 10 |
| ST-18360 | 0 | 0 | 0 | 12 |
| ST-11933 | 0 | 0 | 0 | 14 |
| ST-16065 | 0 | 0 | 0 | 14 |
| ST-8890 | 0 | 0 | 0 | 20 |
| ST-5985 | 0 | 0 | 0 | 26 |
| ST-10451 | 0 | 1 | 0 | 31 |
| ST-17261 | 0 | 4 | 1 | 42 |
| ST-11508 | 0 | 0 | 0 | 46 |
| ST-11461 | 0 | 0 | 0 | 86 |
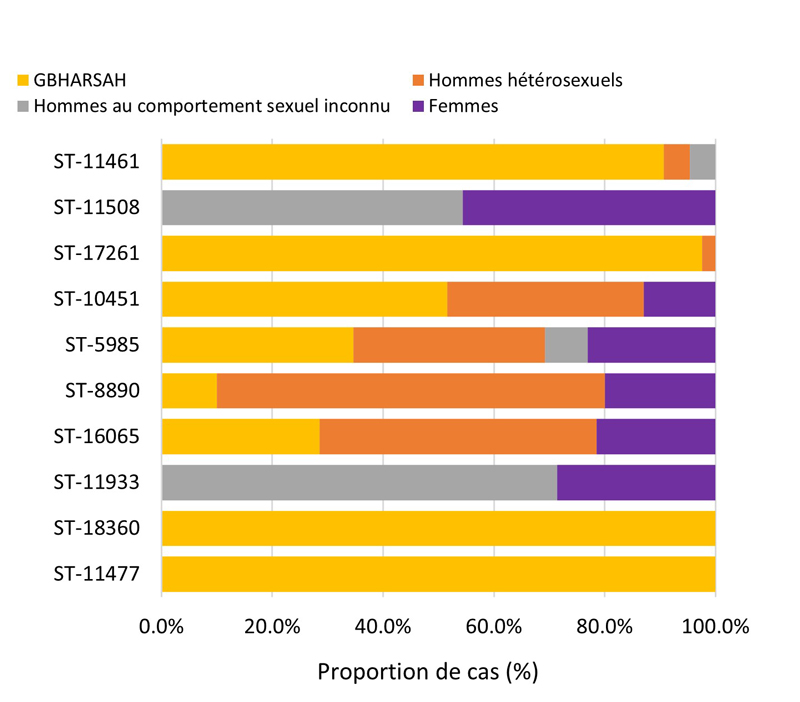
Figure 9B - Équivalent textuel
| ST NG- MAST | GBHARSAH | Hommes hétérosexuels | Hommes au comportement sexuel inconnu | Femmes |
|---|---|---|---|---|
| ST-11477 | 100,0 % | 0,0 % | 0,0 % | 0,0 % |
| ST-18360 | 100,0 % | 0,0 % | 0,0 % | 0,0 % |
| ST-11933 | 0,0 % | 0,0 % | 71,4 % | 28,6 % |
| ST-16065 | 28,6 % | 50,0 % | 0,0 % | 21,4 % |
| ST-8890 | 10,0 % | 70,0 % | 0,0 % | 20,0 % |
| ST-5985 | 34,6 % | 34,6 % | 7,7 % | 23,1 % |
| ST-10451 | 51,6 % | 35,5 % | 0,0 % | 12,9 % |
| ST-17261 | 97,6 % | 2,4 % | 0,0 % | 0,0 % |
| ST-11508 | 0,0 % | 0,0 % | 54,3 % | 45,7 % |
| ST-11461 | 90,7 % | 4,7 % | 4,7 % | 0,0 % |
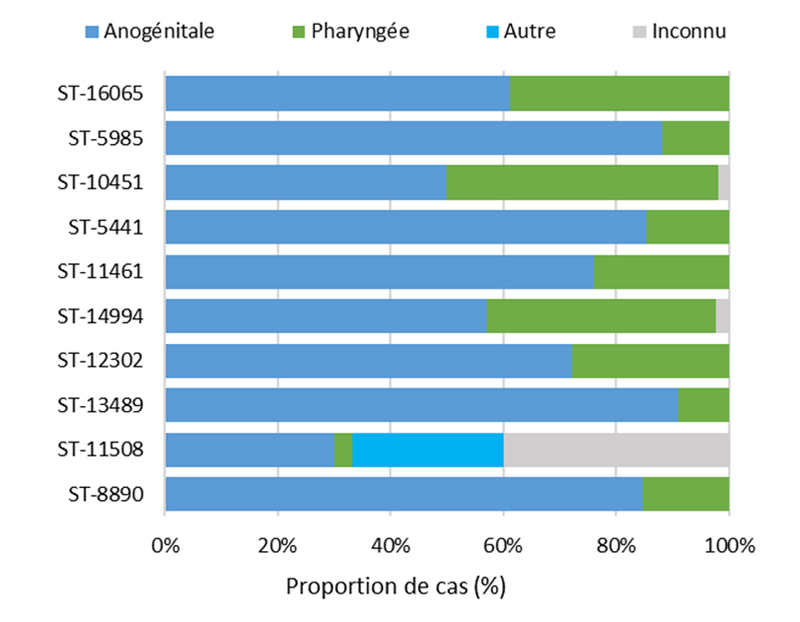
Figure 9C - Équivalent textuel
| ST NG- MAST | Infection anogénitale | Infection pharyngée | Autre infection | Infection inconnue |
|---|---|---|---|---|
| ST-11477 | 8 | 2 | 0 | 0 |
| ST-18360 | 9 | 3 | 0 | 0 |
| ST-11933 | 13 | 0 | 0 | 1 |
| ST-16065 | 12 | 2 | 0 | 0 |
| ST-8890 | 18 | 2 | 0 | 0 |
| ST-5985 | 24 | 2 | 0 | 0 |
| ST-10451 | 23 | 8 | 0 | 0 |
| ST-17261 | 27 | 15 | 0 | 0 |
| ST-11508 | 15 | 3 | 3 | 25 |
| ST-11461 | 63 | 23 | 0 | 0 |
Figure 10 : Les 10 séquences types NG-MAST les plus fréquentes dans les isolats de N. gonorrhoeae et la proportion par sexe/genre et comportement sexuel et par type d'infection, 2019.
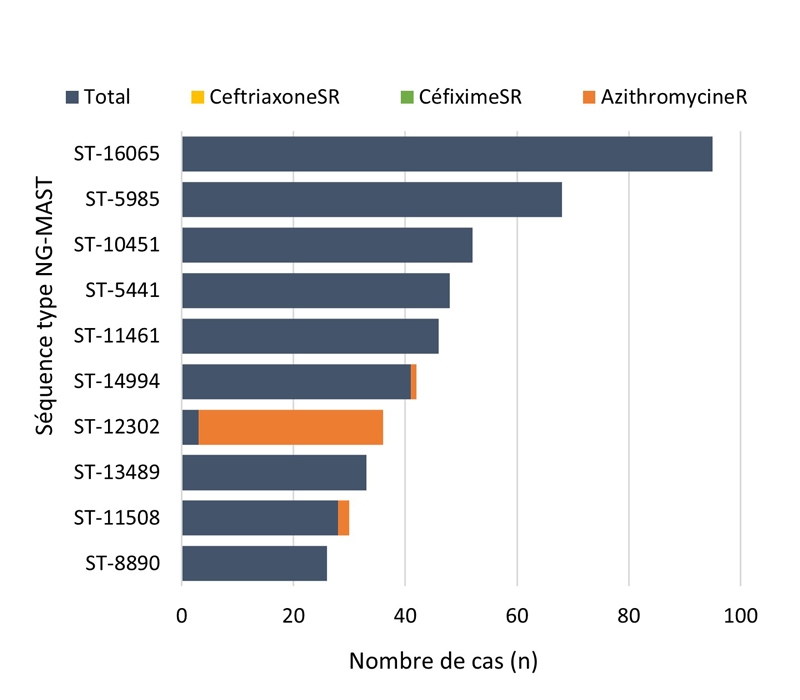
Figure 10A - Équivalent textuel
| ST NG- MAST | AzithromycineR | CéfiximeSR | CeftriaxoneSR | Total des isolats avec ST pour cette année |
|---|---|---|---|---|
| ST-8890 | 0 | 0 | 0 | 26 |
| ST-11508 | 2 | 0 | 0 | 30 |
| ST-13489 | 0 | 0 | 0 | 33 |
| ST-12302 | 33 | 0 | 0 | 36 |
| ST-14994 | 1 | 0 | 0 | 42 |
| ST-11461 | 0 | 0 | 0 | 46 |
| ST-5441 | 0 | 0 | 0 | 48 |
| ST-10451 | 0 | 0 | 0 | 52 |
| ST-5985 | 0 | 0 | 0 | 68 |
| ST-16065 | 0 | 0 | 0 | 95 |
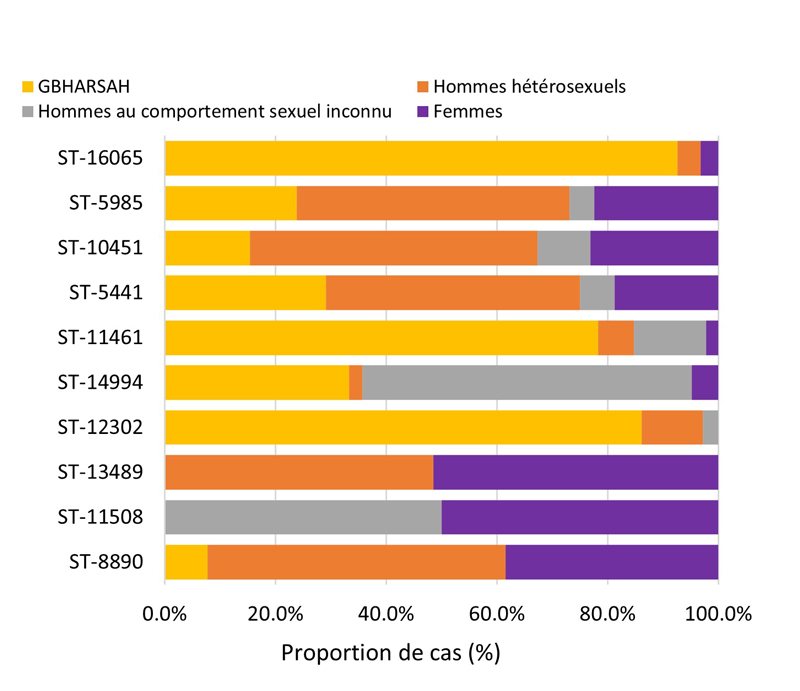
Figure 10B - Équivalent textuel
| ST NG- MAST | GBHARSAH | Hommes hétérosexuels | Hommes au comportement sexuel inconnu | Femmes |
|---|---|---|---|---|
| ST-8890 | 7,7 % | 53,8 % | 0,0 % | 38,5 % |
| ST-11508 | 0,0 % | 0,0 % | 50,0 % | 50,0 % |
| ST-13489 | 0,0 % | 48,5 % | 0,0 % | 51,5 % |
| ST-12302 | 86,1 % | 11,1 % | 2,8 % | 0,0 % |
| ST-14994 | 33,3 % | 2,4 % | 59,5 % | 4,8 % |
| ST-11461 | 78,3 % | 6,5 % | 13,0 % | 2,2 % |
| ST-5441 | 29,2 % | 45,8 % | 6,3 % | 18,8 % |
| ST-10451 | 15,4 % | 51,9 % | 9,6 % | 23,1 % |
| ST-5985 | 23,9 % | 49,3 % | 4,5 % | 22,4 % |
| ST-16065 | 92,6 % | 4,2 % | 0,0 % | 3,2 % |
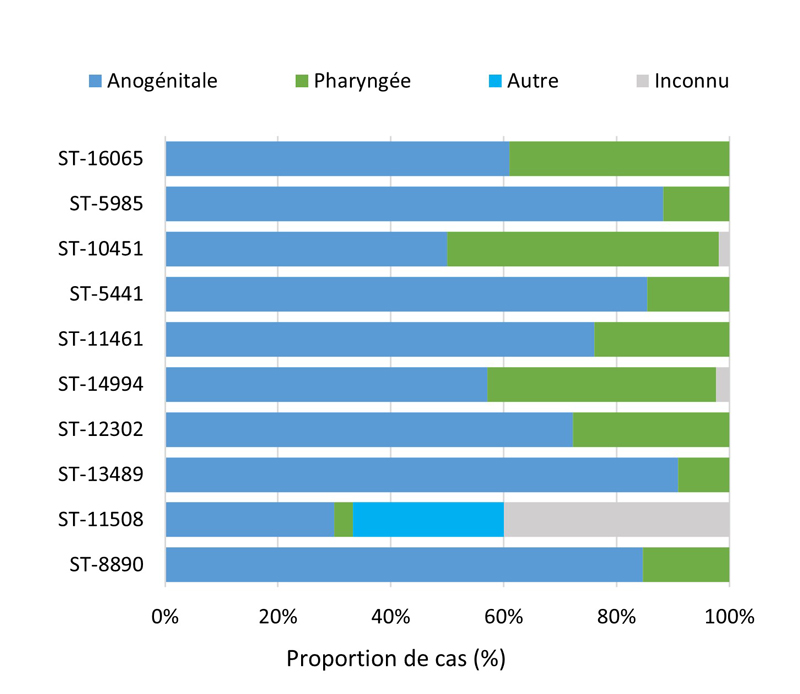
Figure 10C - Équivalent textuel
| ST NG- MAST | Infection anogénitale | Infection pharyngée | Autre infection | Infection inconnue |
|---|---|---|---|---|
| ST-8890 | 22 | 4 | 0 | 0 |
| ST-11508 | 9 | 1 | 8 | 12 |
| ST-13489 | 30 | 3 | 0 | 0 |
| ST-12302 | 26 | 10 | 0 | 0 |
| ST-14994 | 24 | 17 | 0 | 1 |
| ST-11461 | 35 | 11 | 0 | 0 |
| ST-5441 | 41 | 7 | 0 | 0 |
| ST-10451 | 26 | 25 | 0 | 1 |
| ST-5985 | 60 | 8 | 0 | 0 |
| ST-16065 | 58 | 37 | 0 | 0 |
Figure 11 : Les 10 séquences types NG-MAST les plus fréquentes dans les isolats de N. gonorrhoeae et la proportion par sexe/genre et comportement sexuel et par type d'infection, 2018.
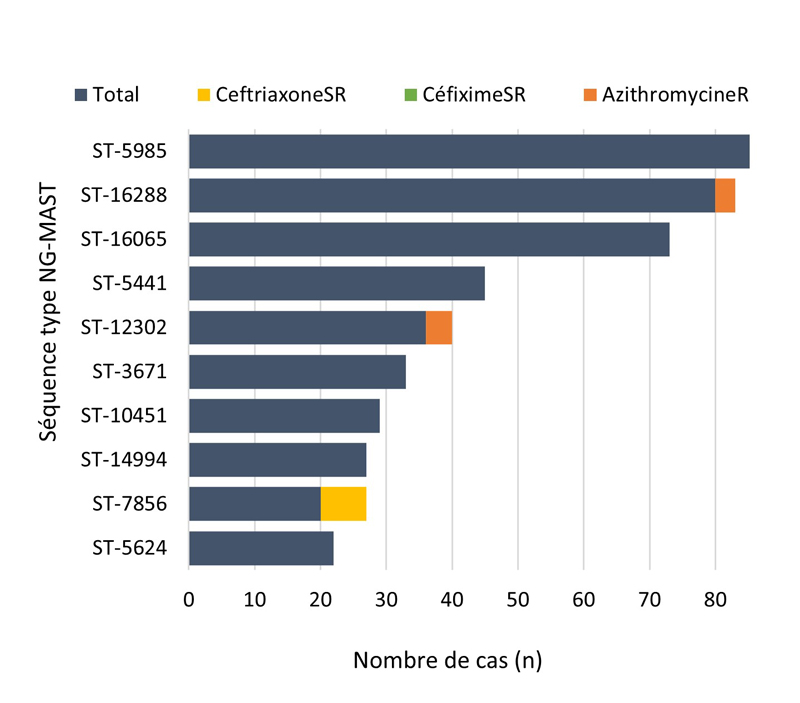
Figure 11A - Équivalent textuel
| ST NG- MAST | AzithromycineR | CéfiximeSR | CeftriaxoneSR | Total des isolats avec ST pour cette année |
|---|---|---|---|---|
| ST-5624 | 0 | 0 | 0 | 22 |
| ST-7856 | 0 | 0 | 7 | 27 |
| ST-14994 | 0 | 0 | 0 | 27 |
| ST-10451 | 0 | 0 | 0 | 29 |
| ST-3671 | 0 | 0 | 0 | 33 |
| ST-12302 | 4 | 0 | 0 | 40 |
| ST-5441 | 0 | 0 | 0 | 45 |
| ST-16065 | 0 | 0 | 0 | 73 |
| ST-16288 | 3 | 0 | 0 | 83 |
| ST-5985 | 0 | 0 | 0 | 112 |
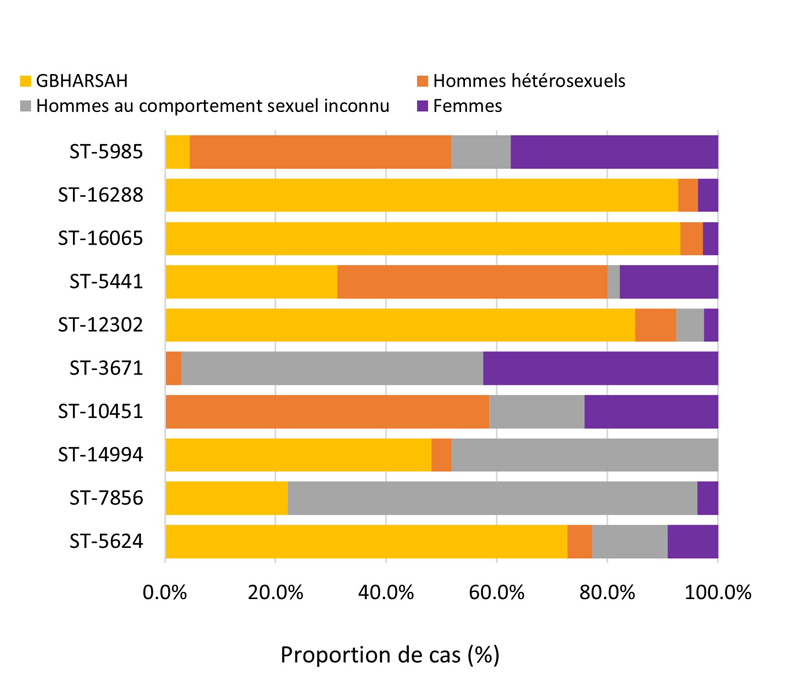
Figure 11B - Équivalent textuel
| ST NG- MAST | GBHARSAH | Hommes hétérosexuels | Hommes au comportement sexuel inconnu | Femmes |
|---|---|---|---|---|
| ST-5624 | 72,7 % | 4,5 % | 13,6 % | 9,1 % |
| ST-7856 | 22,2 % | 0,0 % | 74,1 % | 3,7 % |
| ST-14994 | 48,1 % | 3,7 % | 48,1 % | 0,0 % |
| ST-10451 | 0,0 % | 58,6 % | 17,2 % | 24,1 % |
| ST-3671 | 0,0 % | 3,0 % | 54,5 % | 42,4 % |
| ST-12302 | 85,0 % | 7,5 % | 5,0 % | 2,5 % |
| ST-5441 | 31,1 % | 48,9 % | 2,2 % | 17,8 % |
| ST-16065 | 93,2 % | 4,1 % | 0,0 % | 2,7 % |
| ST-16288 | 92,8 % | 3,6 % | 0,0% | 3,6 % |
| ST-5985 | 4,5 % | 47,3 % | 10,7 % | 37,5 % |
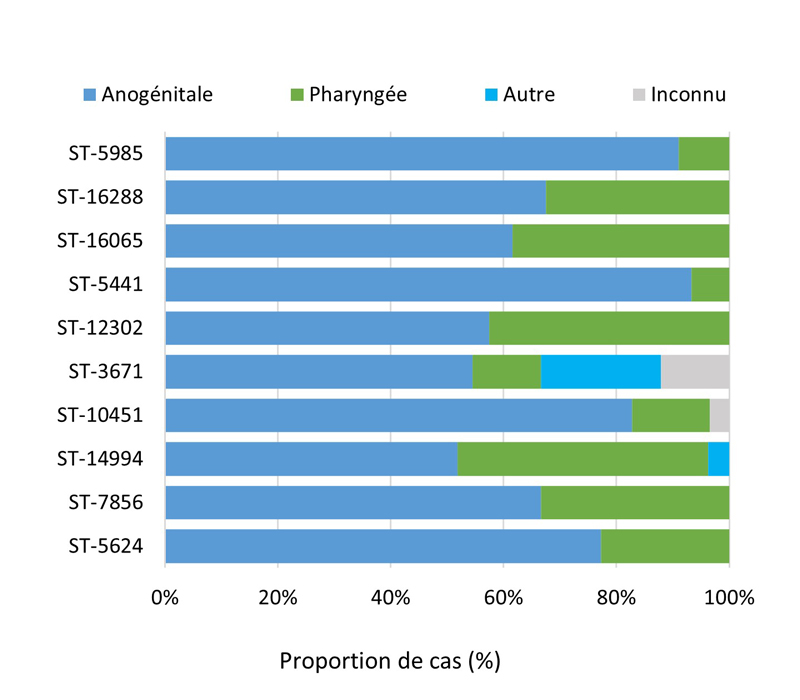
Figure 11C - Équivalent textuel
| ST NG- MAST | Infection anogénitale | Infection pharyngée | Autre infection | Infection inconnue |
|---|---|---|---|---|
| ST-5624 | 17 | 5 | 0 | 0 |
| ST-7856 | 18 | 9 | 0 | 0 |
| ST-14994 | 14 | 12 | 1 | 0 |
| ST-10451 | 24 | 4 | 0 | 1 |
| ST-3671 | 18 | 4 | 7 | 4 |
| ST-12302 | 23 | 17 | 0 | 0 |
| ST-5441 | 42 | 3 | 0 | 0 |
| ST-16065 | 45 | 28 | 0 | 0 |
| ST-16288 | 56 | 27 | 0 | 0 |
| ST-5985 | 102 | 10 | 0 | 0 |
En 2021, trois des dix principales ST ont été associées au céfiximeSR (ST-11477, ST-17261, ST-19757) et une à l'azithromycineR (ST-11508). Aucune ceftriaxoneSR n'a été détectée dans les dix principales ST en 2021. Alors que la ST-11477 était la ST la plus fréquemment observée en 2021 (18,3 %, 118/645), seul un isolat porteur de la ST-11477 présentait un céfiximeSR (0,8 %, 1/118) et aucun ne présentait de azithromycineR ou de ceftriaxoneSR (figure 8A). Cette ST a été principalement observée dans les isolats prélevés chez les hommes (98,3 %, 116/118), en particulier chez les GBHARSAH (89,8 %, 106/118) et parmi les cas SARGA présentant des infections anogénitales (65,3 %, 77/118) (figures 8B et 8C).
Toujours en 2021, la ST-19757 est apparue comme l'une des 10 principales ST (n=17; 5e ST la plus fréquente). La ST-19757 a été associée au céfiximeSR dans deux cas (11,8 %, 2/17) et a été principalement détectée chez les GBHARSAH (88,2 %, 15/17), suivis des hommes hétérosexuels (11,8 %, 2/17). En outre, deux cas (2/11, 18,2 %) de ST -11508 (la ST la plus fréquente en 2021) ont démontré la présence d'azithromycineR en 2021, tous les cas étant survenus chez des hommes au comportement sexuel inconnu (63,6 %, 7/11) et chez des femmes (36,4 %, 4/11). Il est intéressant de noter que cette ST figure parmi les 10 principales ST depuis 2019 (9e place en 2019; 2e place en 2020) et a été associée à l'azithromycineR en 2019 (6,7 %, 2/30), mais pas en 2020 (0,0 % 0/46).
En 2021 et 2020, la ST-17261 est apparue comme la troisième ST la plus observée (16,3 % (49/301) en 2021 et 13,9 % (42/301) en 2020) et a été associée à la plus grande résistance des 10 principales ST pour ces années. Plus précisément, cette ST était associée au céfiximeSR en 2021 (22,4 %, 11/49) et en 2020 (9,5 %, 4/42) et à la ceftriaxoneSR (2,4 %, 1/42) en 2020 (Figure 8A et Figure 9A). Au cours des deux années, la ST-17261 a été principalement détectée chez les GBHARSAH (87,8 % (43/49) en 2021; 97,6 % (41/42) en 2020), suivis par les hommes hétérosexuels (8,2 % (4/49) en 2021; 2,4 % (1/42) en 2020). En 2021, la ST-17261 a également été détectée chez des femmes (2,0 %, 1/43) et des hommes au comportement sexuel inconnu (2,0 %, 1/43). La ST-17261 ne figurait pas parmi les dix principales ST avant 2020.
En 2020, la ST-10451 (N=31; 4e principale ST) et la ST-17261 étaient les deux seules ST parmi les 10 principales ST à présenter une sensibilité réduite aux médicaments (figure 9A). La ST-10451 était associé au céfiximeSR (2,4 %, 1/31) et était principalement observée chez les GBHARSAH (51,6 %, 16/31), suivis par les hommes hétérosexuels (35,5 %, 11/31) et les femmes (12,9 %, 4/31) (figure 9B). Bien qu'il s'agisse également d'une des 10 principales ST en 2018 et 2019, il n'y a eu aucun cas de réduction de la sensibilité aux médicaments au cours de ces années.
En 2019, outre la ST-11508, les ST-14994 et ST-12302 ont également été associées à l'azithromycineR (Figure 10A) Note de bas de page 21. Aucune des dix principales ST de 2019 n'était associée à la ceftriaxoneSR ou au céfiximeSR. Les isolats ST-14994 et ST-12302 figuraient également parmi les 10 principales ST en 2018. La proportion d'isolats ST-14994 avec azithromycineR a augmenté de 2,6 % (1/39) en 2019 par rapport à 0,0 % en 2018, tandis que la proportion d'azithromycineR de ST-12302 a augmenté de 10,0 % (4/40) à 91,7 % (33/36). En 2019, la ST-14994 a été principalement identifiée chez les hommes au comportement sexuel inconnu (59,5 %, 25/42), suivis des GBHARSAH (33,3 %, 14/42); quant à la ST-12302, elle a été principalement détectée chez les GBHARSAH (86,1 %, 31/36). Cependant, les deux ST ont disparu des 10 principales ST en 2020 et 2021.
En 2018, la ST-16288 (2e principale ST en 2018) et la ST-12302 (5e principale ST en 2018) ont été associées à l'azithromycineR (10,0 %, 4/40 pour ST-16288 et 3,6 %, 3/83 pour ST-12302) (figure 11A). En outre, la ST-7856 (9e principale ST en 2018) était associée à la ceftriaxoneSR (25,9 %, 7/27). La ST-16288 a été principalement détectée chez les GBHARSAH (92,8 %, 77/83), tandis que la ST-7856 a été principalement détectée chez les hommes ayant un comportement sexuel inconnu (74,1 %, 20/27). La prévalence des deux ST a diminué après 2018, car aucun des deux ne figurait parmi les principales ST pour 2019, 2020 ou 2021. Aucune diminution de la sensibilité au céfixime n'a été observée chez les isolats présentant l'une des 10 principales ST NG-MAST en 2018.
5. Qualité et limites des données
5.1. Qualité des données
Au cours de cette période de déclaration, les variables « statut de travail de sexe » et « infection à GC liée au voyage », qui ont été présentées dans les rapports SARGA précédents, n'ont pas pu être présentées en raison d'une collecte de données insuffisante.
5.2. Limites et considérations
- Les résultats de la SARGA ne sont pas représentatifs de tous les cas de gonorrhée ou des cas de gonorrhée confirmés par culture au Canada, puisque la plupart des cas de gonorrhée sont diagnostiqués par des test d'amplification des acides nucléiques (TAAN). Parmi les quatre PT qui ont fourni des données SARGA de 2018 à 2021, la plupart des données provenaient de l'Alberta. De plus, les sites sentinelles de la Nouvelle-Écosse peuvent ne pas être représentatifs de l'ensemble de la province. Les résultats agrégés doivent être interprétés avec prudence.
- Environ 80,5 % des cas recensés par la SARGA étaient des hommes, dont 55,5 % étaient GBHARSAH. Toutefois, en 2021, 62,9 % de tous les cas de gonorrhée déclarés à l'échelle nationale à l'ASPC étaient des hommes (les données relatives à l'orientation sexuelle ne sont pas disponibles pour les cas de gonorrhée signalés au niveau national)Note de bas de page 1.
- La collecte de données de santé publique sur la gonorrhée au niveau des clients est plus susceptible d'être effectuée dans certaines cliniques médicales avec des populations de clients qui peuvent ne pas être généralisables à l'ensemble de la PT ou du Canada.
- Les proportions déclarées des cas où l'on a prescrit un traitement de la gonorrhée recommandé préférentiel ou alternatif sont prudentes. La disponibilité des antimicrobiens recommandés, les erreurs de déclaration (par exemple, la déclaration erronée des ordonnances utilisées pour traiter des co-infections ou des comorbidités ou la déclaration d'informations incomplètes sur le traitement de la gonorrhée) et les considérations liées à la comorbidité ou au comportement à risque sont autant de raisons possibles de ne pas respecter les directives recommandées pour le traitement de la gonorrhée. Par exemple, les lignes directrices de l'ASPC sur le traitement de la gonorrhée recommandent d'envisager un traitement contre la chlamydia (c'est-à-dire 1 g d'azithromycine (en une seule dose) et 100 mg de doxycycline (pendant 7 jours)) parallèlement au traitement de la gonorrhée si un partenaire sexuel est atteint de gonorrhée ou si le suivi n'est pas assuré.
- Les tests de guérison et les échecs de traitement peuvent être difficiles à mesurer à l'aide des données de surveillance, car ils reposent sur la capacité à détecter des résultats négatifs. De plus, il est inconnu en quelle mesure les échecs de traitement de la gonorrhées sont détectés ou déclarés par les provinces et territoires. Il est donc possible que les échecs thérapeutiques soient sous-déclarés.
- Les PT ont eu une capacité réduite à fournir le dépistage de routine de la gonorrhée, des soins et des activités de déclaration de santé publique en 2020 et pendant une partie de 2021 en raison de nombreux facteurs liés à la pandémie de la COVID-19.
6. Discussion
Ce rapport est le quatrième rapport de résultats de la SARGA décrivant les tendances GC-RAM dans l'ensemble et parmi les groupes clés, ainsi que les pratiques de prescription de traitements GC parmi les PT participant à la SARGA. Dans le précédent rapport SARGA 2015-2017, les PT participant à la SARGA ont augmenté le nombre de cultures de gonorrhée collectées au fil du tempsNote de bas de page 5. Cependant, à partir de 2018, le nombre de cultures parmi les PT de la SARGA a diminué chaque année. La pandémie de la COVID-19 peut également avoir contribué à cette diminution, de nombreux PT ayant dû s'adapter et modifier leurs stratégies de soins des ITSS (voir la section sur les limitations)Note de bas de page 22. Les changements dans les méthodes de collecte de données des PT au cours de cette période peuvent également avoir joué un rôle dans la diminution des cas de SARGA et ne peuvent être exclus.
Après trois années de stabilité (2018 à 2020), la prévalence de la gonorrhée RAM (indiquée par la résistance à au moins un antimicrobien testé) parmi les cas SARGA a augmenté, passant de 69,3 % en 2020 à 77,4 % en 2021. En 2021, le fardeau liée à la gonorrhée RAM était le plus important parmi les cas SARGA qui étaient des GBHARSAH (85,2 %), suivis par les hommes hétérosexuels (73,5 %) et les femmes (66,7 %). La résistance à la ciprofloxacine et à la tétracycline était élevée dans tous les groupes de comportement sexuel, mais de manière plus importante chez les GBHARSAH. Il s'agit d'une information importante à surveiller en permanence, car les premières études ont démontré l'efficacité à court terme de la doxycycline en tant que prophylaxie post-exposition pour les ITS bactériennes chez les GBHARSAH cisgenres et les femmes transgenresNote de bas de page 23 Note de bas de page 24. En conséquence, certaines juridictions recommandent ou envisagent l'utilisation de la doxycycline comme prophylaxie post-exposition dans la population des GBHARSAH Note de bas de page 23.
Entre 2018 et 2021, bien qu'il y ait eu 14 déclarations d'échecs thérapeutiques présumés, les profils de résistance en laboratoire ont montré qu'aucun ne présentait de résistance à tous les régimes thérapeutiques prescrits, ce qui suggère que ces clients étaient soit réinfectés, soit qu'ils ne prenaient pas leurs médicaments correctement, voire pas du tout (étant donné que la plupart des thérapies prescrites à ces clients étaient des doses uniques). Il n'y a donc eu aucun échec thérapeutique confirmé parmi les cas SARGA ayant reçu une prescription de traitement de la gonorrhée au cours de la période d'étude. Ceci est dans le contexte d'une adhésion stable et élevée aux lignes directrices de traitement de la gonorrhée et malgré 3,4 % des cas (116/3377) démontrant l'azithromycineR, 0,4 % (14) démontrant la ceftriaxoneSR, et 0,9 % (32) démontrant le céfiximeSR. L'écart entre les échecs thérapeutiques suspectés et confirmés parmi les cas SARGA renforce la recommandation de l'ASPC de cultiver les isolats lorsqu'une résistance aux antibiotiques est suspectée et d'effectuer un test de guérison pour tous les sites positifs pour tous les cas de GCNote de bas de page 25.
Il est encourageant de constater que la grande majorité des cas de GBHARSAH et des autres cas de SARGA chez les adultes se sont vu prescrire le traitement préférentiel ou alternatif de la gonorrhée décrit par l'ASPC ou les PT au cours de toutes les années de déclaration (moyenne de 91,4 % d'adhésion aux lignes directrices de l'ASPC et de 89,5 % d'adhésion aux lignes directrices des PT). Une forte adhésion aux recommandations de l'ASPC a été observée dans les rapports SARGA précédents. Il s'agit du premier rapport qui résume l'adhésion aux lignes directrices de traitement des GC spécifiques aux PT participants (l'adhésion était légèrement plus élevée aux lignes directrices de l'ASPC qu'à celles des PT). Parmi tous les cas de GBHARSAH, la majorité a reçu le traitement préférentiel anogénital et pharyngé d'azithromycine avec ceftriaxone. Ce traitement a été suivi, bien que rarement, par la ceftriaxone et la doxycycline, qui n'est pas un traitement recommandé par les PT; il s'agit cependant d'un traitement alternatif recommandé par l'ASPC pour les infections anogénitales. Parmi les autres adultes (c'est-à-dire les cas SARGA non GBHARSAH), la plupart se sont vu prescrire de l'azithromycine et du céfixime (l'un des deux régimes thérapeutiques préférentiels pour les infections anogénitales, mais un régime thérapeutique alternatif pour les infections pharyngées). Cette constatation a été faite dans des rapports précédents de la SARGA et peut s'expliquer par le fait que le client a d'abord été diagnostiqué par TAAN et traité comme ayant une infection anogénitale, et qu'il s'est avéré par la suite qu'il avait également une infection pharyngée. Pour toutes les personnes, les infections pharyngées sont souvent asymptomatiques et peuvent être dépistées moins fréquemment.
Malgré son taux élevé de prescription, les isolats avec ceftriaxoneSR sont restés peu nombreux, sans tendance à la hausse, pour tous les groupes de comportement sexuel, ce qui est encourageant et soutient la recommandation généralisée dans les lignes directrices de traitement nationales et par PTNote de bas de page 6 Note de bas de page 11 Note de bas de page 12 Note de bas de page 13. Sur les 14 cas de ceftriaxoneSR, la majorité (huit) sont survenus en 2018 (trois en 2019, deux en 2020 et un en 2021) et neuf cas concernaient des hommes au comportement sexuel inconnu, ce qui rend les données difficiles à interpréter. Très peu de cas (deux) étaient des GBHARSAH ou des femmes.
Alors que la prévalence était faible, le céfiximeSR est en augmentation depuis 2019 chez les GBHARSAH (0,0 % en 2019 à 4,5 % en 2021) et depuis 2018 chez ceux à qui ce médicament est le plus souvent prescrit, les hommes hétérosexuels (0,0 % en 2018 à 2,2 % en 2021) et les femmes (0,0 % en 2018 à 3,3 % en 2021). Toutefois, une proportion supérieure à la valeur de référence de tous les cas SARGA de céfiximeSR a été observée chez les GBHARSAH. L'OMS recommande de surveiller attentivement tout antimicrobien dont la prévalence est supérieure à 5,0 % des isolats ou qui est en augmentation rapide Note de bas de page 21. Les prochains rapports fourniront des informations sur les tendances du céfiximeSR au sein de ces populations.
La prévalence de l'azithromycineR était similaire en 2018 à ce qui avait été observé dans le précédent rapport SARGA, mais elle a augmenté jusqu'à 7,8 % en 2019, suivie d'une forte baisse à 1,9 % en 2021 dans l'ensemble (ces tendances ont également été observées par groupe de comportement sexuel)Note de bas de page 5. Entre 2018 et 2021, la majorité des cas SARGA liés à l'azithromycineR étaient disproportionnés chez les hommes (90,5 %), dont 79,0 % étaient des GBHARSAH. Des tendances similaires concernant l'azithromycineR ont été observées dans le dernier rapport PSAG - Canada, où il a été noté que l'azithromycineR a diminué de manière significative entre 2017 (11,7 %) et 2021 (7,6 %) (p<0,001). Cependant, le rapport PSAG - Canada a noté une augmentation significative (p<0,001) de la proportion de cultures présentant une concentration minimale inhibitrice d'azithromycine ≥1mg/L (2017=22,2 % à 2021=28,1 %) (pour d'autres comparaisons entre les résultats de la SARGA et de PSAG - Canada 2021, voir l'annexe 2, dans le présent document) Note de bas de page 14. L'azithromycineR a été influencée par les ST ST-16288 et ST-12302. Heureusement, la prévalence de ces ST a diminué à quatre et huit isolats SARGA, respectivement, en 2020 et à zéro en 2021.
7. Conclusion
Le système SARGA a continué à surveiller la sensibilité aux antimicrobiens de N. gonorrhoeae, les pratiques de prescription des cliniciens, la raison de la visite médicale et les données sur les échecs thérapeutiques par variables démographiques et comportements sexuels de 2018 à 2021. Ces données complètent la surveillance passive en laboratoire de la gonorrhée RAM de l'ASPC par l'entremise de PSAG - Canada. Les données de la SARGA pour 2018 à 2021 ont montré une faible prévalence, dans l'ensemble, aux traitements GC les plus prescrits et recommandés, soit la ceftriaxoneSR et le céfiximeSR, bien qu'une légère augmentation du céfiximeSR parmi les cas SARGA (en particulier chez les GBHARSAH) ait été observée en 2021. La prévalence de l'azithromycineR a également diminué en 2020 et 2021 par rapport à 2018 et 2019.
Les traitements de la gonorrhée résistants à l'azithromycine et à la ceftriaxone sont un problème mondial et ont été signalés dans plusieurs pays. Outre le Canada, des cas de résistance à la ceftriaxone ont été signalés en Australie, en Autriche, en Chine, au Danemark, en France, au Japon, en Slovénie, en Suède et au Royaume-Uni Note de bas de page 2 Note de bas de page 26 Note de bas de page 27 Note de bas de page 28 Note de bas de page 29 Note de bas de page 30 Note de bas de page 31 Note de bas de page 32 Note de bas de page 33 Note de bas de page 34 Note de bas de page 35 Note de bas de page 36.
La SARGA démontre qu'il est possible d'améliorer la surveillance de la gonorrhée RAM en intégrant la surveillance locale/provinciale/territoriale de la gonorrhée et la surveillance des laboratoires nationaux. La SARGA a permis de surveiller la sensibilité aux antimicrobiens de la gonorrhée malgré l'utilisation décroissante des cultures dans la pratique clinique pour le diagnostic de la gonorrhée et les tests de sensibilité aux antimicrobiens. Le Canada étant confronté à un nombre croissant de cas de gonorrhée et à l'évolution, l'émergence et la propagation continues de la gonorrhée RAM, des efforts sont actuellement déployés pour recruter des sites SARGA supplémentaires afin de permettre la collecte de données plus représentatives.
Le suivi continu des tendances de la gonorrhée RAM par le biais de la surveillance est d'une importance primordiale pour garantir l'efficacité des antimicrobiens recommandés pour traiter les infections de gonorrhée. La SARGA peut jouer un rôle important dans l'évaluation et le suivi de l'efficacité des options de traitement de la GC et dans la réussite des initiatives canadiennes de lutte contre la gonorrhée RAM.
Annexe 1. Liste des figures et tableaux supplémentaires
Les figures et les tableaux supplémentaires sont disponibles sur demande à l'adresse suivante : sti-hep-its@phac-aspc.gc.ca.
- Annexe A : Critères de résistance aux antimicrobiens et classifications de l'OMS en matière d'accès, de surveillance et de réserve
- Tableau 1. Critères de résistance aux antimicrobiens du Neisseria gonorrhoeae
- Tableau 2. Classifications antimicrobiennes de l'OMS en matière d'accès, de surveillance et de réserve pour l'évaluation et la surveillance
- Annexe B : Définitions de la caractérisation de la résistance aux antimicrobiens de Neisseria gonorrhoeae
- Annexe C : Nombre et taux de cas de gonorrhée signalés au SCSMDO dans les provinces et territoires participant à la SARGA, 2018 à 2021
- Annexe D : Lignes directrices sur le traitement de Neisseria gonorrhoeae dans les provinces et territoires participant à la SARGA
- Annexe E : Liste des traitements prescrits chez les hommes dont le comportement sexuel est inconnu, par site d'infection, SARGA 2018-2021
- Tableau 1. Proportion d'hommes au comportement sexuel inconnu présentant des infections anogénitales ou pharyngées, SARGA 2018 à 2021
- Tableau 2. Traitements prescrits pour les infections anogénitales chez les hommes au comportement sexuel inconnu, SARGA 2018-2021
- Tableau 3. Traitements prescrits pour les infections pharyngées chez les hommes au comportement sexuel inconnu, SARGA 2018 à 2021
- Annexe F : Échecs du traitement contre Neisseria gonorrhoeae parmi les cas de SARGA, 2018 à 2021
- Annexe G : Nombre et proportion de cas démontrant une résistance à l'azithromycine, la ciprofloxacine, l'érythromycine, la spectinomycine, la pénicilline ou tétracycline ou une sensibilité réduite au céfixime ou la ceftriaxone par sexe et comportement sexuel, SARGA 2018 à 2021
- Tableau 1: Nombre et proportion de cas démontrant une résistance ou une sensibilité réduite aux antimicrobiens chez les hommes, SARGA 2018 à 2021
- Tableau 2: Nombre et proportion de cas démontrant une résistance ou une sensibilité réduite aux antimicrobiens par comportement sexuel chez les femmes, SARGA 2018 à 2021
- Figure 1: Proportion de cas démontrant une résistance à l'azithromycine ou une sensibilité réduite au céfixime ou la ceftriaxone par comportement sexuel chez les femmes, SARGA 2018 à 2021
- Annexe H: Nombre et proportion de cas avec des cultures de CG démontrant une résistance et/ou une sensibilité réduite (SR) à aucun ou jusqu'à cinq antimicrobiens parmi tous les cas SARGA et par sexe/comportement sexuel, SARGA 2018 à 2021
- Tableau 1: Nombre et proportion de cas avec des cultures de CG démontrant une résistance et/ou une sensibilité réduite à aucun ou jusqu'à cinq antimicrobiens parmi les hommes, SARGA 2018 à 2021
- Tableau 2: Nombre et proportion de cas avec des cultures de CG démontrant une résistance et/ou une sensibilité réduite à aucun ou jusqu'à cinq antimicrobiens par comportement sexuel chez les femmes, SARGA 2018 à 2021
- Figure 1: Proportion de cas avec des cultures de CG démontrant une résistance et/ou une sensibilité réduite à aucun ou jusqu'à cinq antimicrobiens par comportement sexuel chez les femmes, SARGA 2018 à 2021
- Annexe I: Distribution de la résistance aux antimicrobiens parmi les GBHARSAH et les autres adultes, et par site d'infection selon les directives de traitement canadiennes, SARGA 2018 à 2021
- Annexe J : Nombre de séquences types NG-MAST démontrant une résistance à l'azithromycine, SARGA 2018 à 2021
- Annexe K : Nombre d'isolats pour les 30 principales séquences types NG-MAST de Neisseria gonorrhoeae, SARGA 2018 à 2021.
Annexe 2. Comparaison des résultats de PSAG - Canada et de SARGA 2021
| Résultats du rapport PSAG - Canada 2021 | Résultats du rapport SARGA 2021 | Résumé de la comparaison des résultats de la SARGA et du PSAG - Canada |
|---|---|---|
| Données de culture | ||
En 2021, 3 439 cultures ont été signalées au PSAG - Canada, soit une augmentation de 9,9 % par rapport à 2020 (n = 3130). Si le nombre de cultures GC à travers le Canada a légèrement augmenté entre 2020 (n=3 130) et 2021 (n=3 439), il est inférieur de 30 % à celui observé en 2019 (n=4 859). |
En 2021, 645 cultures (cas) ont été signalées à la SARGA, soit une baisse de 9,3 % par rapport à 2020 (n=711). Le nombre de cas SARGA a diminué régulièrement de 2018 à 2021 (1022 cas en 2018, 999 cas en 2019, 711 cas en 2020 et 645 cas en 2021). |
Différence dans les tendances : PSAG - Canada a constaté une augmentation du nombre de cultures de GC soumises de 2020 à 2021. LA SARGA a constaté une baisse du nombre de cultures GC (cas) entre 2020 et 2021. |
| En 2021, la plupart des données de la gonorrhée RAM proviennent du Québec (n=1561), suivi de l'Ontario (n=886) et de l'Alberta (n=783). | 83,0 % des cas SARGA ont été signalés par l'Alberta, 14,3 % par le Manitoba, 1,8 % par la Nouvelle-Écosse et 0,9 % par les Territoires du Nord-Ouest. | Différentes sources principales de données PT. |
| Caractéristiques des cas | ||
| En 2021, 71,2 % des cultures de N. gonorrhoeae du PSAG - Canada provenaient de personnes âgées de 21 à 40 ans. | Entre 2018 et 2021, 72,8 % des cas SARGA étaient âgés de 20 à 39 ans. | Âge similaire des cas SARGA et PSAG - Canada. |
En 2021, 84,4 % des cultures ont été principalement collectées auprès d'hommes et 15,1 % (438/2 909) de femmes. |
Entre 2018 et 2021, 80,4 % des cas SARGA étaient des hommes et 19,1 % des cas étaient des femmes. |
Proportions très similaires d'hommes et de femmes dans les cas SARGA et PSAG - Canada. La SARGA présente également des données par comportement sexuel. PSAG - Canada ne recueille pas de données sur le comportement sexuel. |
| En 2021, le site d'isolement gonococcique primaire le plus répandu chez les hommes était le pénis/l'urètre (56,8 %) et la gorge chez les femmes (33,8 %, 148/438). | Entre 2018 et 2021, le site d'isolement primaire du gonocoque le plus prévalent pour les hommes et les femmes était génital (34,6 % pour les femmes et 51,8 % pour les hommes). Il était suivi par le rectum pour les hommes (23,7 %) et le pharynx pour les femmes (32,4 %). Chez les hommes, le principal site d'infection par GC était, chez les GBHARSAH, rectal (39,3 %) et pharyngé (34,6 %) et, chez les hétérosexuels, le pénis/l'urètre (c'est-à-dire les organes génitaux) (26,1 %). |
Site d'isolement primaire similaire selon le sexe. La SARGA présente également des données par comportement sexuel. PSAG - Canada ne recueille pas de données sur le comportement sexuel. |
| Tendances de la gonorrhée RAM | ||
| En 2021, plus de 70 % (72,7 %, n=2 501/3 349) des cultures de GC soumises au PSAG - Canada étaient résistantes à au moins un antibiotique. | En 2021, plus de 70 % (77,4 %, n=499/645) des cultures de GC soumises à la SARGA étaient résistantes à au moins un antibiotique. | Résultats similaires - PSAG - Canada et SARGA ont rapporté que plus de 70 % des cultures étaient résistantes à au moins un antibiotique en 2021. |
| Aucun changement significatif n'a été détecté dans la proportion de cultures de GC du PSAG - Canada qui présentaient une ceftriaxoneSR entre 2017 (0,55 %) et 2021 (0,6 %) (p > 0,001). Cependant, un isolat résistant à la ceftriaxone a été identifié. | Le nombre et la proportion de ceftriaxoneSR ont diminué, passant de 8 (0,8 %) cas en 2018 à un cas (0,2 %) en 2021. Toutes les cultures SARGA étaient sensibles à la ceftriaxone en 2020 et 2021. | Résultats légèrement différents : En 2021, une proportion légèrement plus importante de cultures de GC à base de ceftriaxoneSR a été détectée parmi les cultures du PSAG - Canada (0,6 %) que parmi les cultures de la SARGA (0,2 %). Au cours des périodes de déclaration, les tendances de la prévalence de la ceftriaxoneSR sont restées stables parmi les cultures GC du PSAG - Canada, alors qu'elles ont légèrement diminué parmi les cultures GC de la SARGA. |
Le céfiximeSR a augmenté de manière significative, passant de 0,6 % en 2017 à 1,5 % en 2021 (p < 0,001), mais a également diminué de manière significative par rapport aux 2,8 % rapportés en 2020 (p < 0,001) La proportion plus élevée d'isolats avec céfiximeSR en 2020 a été principalement causée par des isolats identifiés comme ST-16639 en Ontario et au Québec. La proportion de cette ST a diminué de 3,3 % (n=53/1 590) en 2020 à 1,3 % (n=26/2 006) en 2021. |
De 2018 à 2020, le nombre et la proportion de cultures SARGA GC démontrant la présence de céfiximeSR ont augmenté, passant de 0,1 % en 2018 à 3,4 % en 2021. | En 2021, une plus grande proportion de cultures de céfiximeSR a été détectée parmi les cultures de la SARGA (3,4 %) que parmi les cultures du PSAG - Canada (1,5 %). Au cours des périodes de référence, la proportion de cultures de la SARGA et de PSAG - Canada démontrant la présence de céfiximeSR a augmenté. Les tendances ont fluctué entre 2020 et 2021 pour PSAG - Canada, tandis que la SARGA a maintenu une augmentation constante. |
| La prévalence de l'azithromycineR a augmenté de 7,6 % en 2018 à 11,7 % des cas en 2019 et a diminué à 6,10 % et 7,6 % des cas en 2020 et 2021, respectivement. | L'azithromycineR est passée de 18 cas (1,8 %) en 2018 à 78 cas (7,8 %) en 2019. Toutefois, ce nombre a fortement diminué pour atteindre huit cas (1,1 %) en 2020 et 12 cas (1,9 %) en 2021. | En 2021, une plus grande proportion de cultures d'azithromycineR a été détectée parmi les cultures du PSAG - Canada (7,6 %) que parmi les cultures de la SARGA (1,9 %). Dans l'ensemble, la proportion de cultures SARGA et PSAG - Canada démontrant la présence d'azithromycineR a diminué de 2019 à 2021, après une augmentation des cas en 2019. |
| La prévalence de la ciprofloxacineR est restée élevée et stable (entre 49 % et 57 %) de 2017 à 2021. | La ciprofloxacineR était la gonorrhée RAM la plus répandue en 2021 (63,1 %) et en 2020 (46,6 %). Elle était la deuxième gonorrhée RAM la plus répandue en 2019 (44,0 %) et en 2018 (43,0 %). | Résultats très similaires : La résistance à la ciprofloxacine et à la tétracycline était élevée dans les cultures de la SARGA et du PSAG - Canada. |
| La prévalence de la tétracyclineR a fluctué mais est restée élevée et stable de 2017 à 2020 (entre 40 % et 50 %). En 2021, elle a atteint un niveau record de 65,9 %. | La tétracyclineR a été la gonorrhée RAM la plus répandue (52,1 % en 2018 et 51,8 % en 2019) et la deuxième gonorrhée RAM la plus répandu een 2020 (45,9 %) et en 2021 (58,6 %). | |
| L'érythromycineR a fluctué entre 2017 et 2021. La prévalence était d'environ 60 % en 2017, mais elle a diminué chaque année pour atteindre environ 30 % en 2020. Elle a ensuite augmenté pour atteindre 51,5 % en 2021. | L'érythromycineR a diminué annuellement et fortement, passant de 30 % en 2018 à 8,5 % en 2021. | Des résultats différents : En 2021, la prévalence de l'érythromycineR était beaucoup plus élevée dans les cultures du PSAG - Canada (51,5 %) que dans celles de la SARGA (8,5 %). La prévalence de l'érythromycineR a fluctué au fil du temps pour PSAG - Canada, mais a diminué pour SARGA. |
| De 2017 à 2021, la pénicilline était inférieure à 7 %. | Les taux de pénicillineR sont restés relativement stables de 2018 à 2020 (6,8 % en 2018, 7,2 % en 2019 et 8,2 % en 2020), mais ont chuté à 3,9 % en 2021, ce qui est inférieur au seuil de préoccupation de l'OMS (5 %). | Les tendances relatives à la pénicillineR étaient similaires dans les deux groupes, bien qu'en 2021, la prévalence soit légèrement plus faible dans les cultures de la SARGA (3,9 %) que dans celles du PSAG - Canada (7,0 %). |
| Séquences types | ||
En 2021, la ST NG-MAST la plus fréquemment détectée au Canada était ST-19875 (15,3 %, n=306), suivie de ST-11477 (n=137) et ST-17972 (n=127). Environ 20,3 % des isolats ST-19875 ont été identifiés avec l'azithromycineR, tandis que le ST-11477 était principalement résistant à la ciprofloxacine et à la tétracycline, et les isolats ST-17972 étaient principalement résistants à la ciprofloxacine et à l'érythromycine. * La ST-19875 a été identifiée pour la première fois en 2020 en petit nombre (n=22) et uniquement au Québec. En 2021, ce type de ST s'est répandu dans cinq autres provinces. * De 2017 à 2020, les ST-12302 et ST-14994 étaient les plus répandues, tandis qu'en 2021, ils étaient respectivement les huitième et neuvième ST les plus répandues. Alors que le nombre d'isolats avec ST-12302 (n=47) a diminué, en 2021, 15 autres ST ont été identifiées avec deux paires de bases ou moins de différences par rapport à ST-12302 (ce groupe représentait n= 144 des isolats). 61,8 % (n=89/144) étaient des azithromycineR, soit 34,1 % (n=89/261) des azithromycineR isolés en 2021. |
La ST-11477 était la ST la plus fréquemment observée en 2021 (18,3 %, 118/645), seul un isolat avec la ST-11477 présentait un céfiximeSR (0,8 %, 1/118) et aucun ne présentait une azithromycineR ou de ceftriaxoneSR. ST-11461 et ST-17261 sont les deuxième et troisième ST les plus courantes observées en 2021. ST-12302 était la 5e ST la plus fréquemment observée en 2018 et la 8e ST la plus fréquemment observée en 2019. Plus de 50 % des isolats porteurs de la ST-12302 en 2019 étaient des azithromycineR. Il convient de noter que les ST-19875 et ST-17972 n'ont pas été classées parmi les 10 ST les plus fréquentes pour la SARGA, quelle que soit l'année entre 2018 et 2021. |
Des résultats différents : Tendances différentes des ST entre les échantillons PSAG - Canada et SARGA. |
Annexe 3. Résistance (R) et sensibilité réduite (SR) aux antimicrobiens sélectionnés par province ou territoire, 2018 à 2021
| Susceptibilité | Alberta | Manitoba | Territoires du Nord-Ouest | Nouvelle-Écosse | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2018 | 2019 | 2020 | 2021 | 2018 | 2019 | 2020 | 2021 | 2018 | 2019 | 2020 | 2021 | 2018 | 2019 | 2020 | 2021 | |
| Sensible à tous | 267 (32,9 %) | 236 (29,4 %) | 177 (30,2 %) | 130 (21,7 %) | 28 (16,1 %) | 48 (31,0 %) | 41 (35,3 %) | 16 (41,0 %) | 0 (0,0 %) | 1 (5,9 %) | 0 (0,0 %) | 0 (0,0 %) | 6 (19,4 %) | 5 (20,8 %) | 0 (0,0 %) | 0 (0,0 %) |
| R/SRNote de bas de page * à 1 | 267 (32,9 %) | 272 (33,9 %) | 188 (32,0 %) | 146 (24,3 %) | 56 (32,2 %) | 39 (25,2 %) | 40 (34,5 %) | 14 (35,9 %) | 3 (60,0 %) | 10 (58,8 %) | 6 (85,7 %) | 0 (0,0 %) | 4 (12,9 %) | 2 (8,3 %) | 0 (0,0 %) | 1 (20,0 %) |
| R/SR à 2 | 141 (17,4 %) | 155 (19,3 %) | 144 (24,5 %) | 275 (45,8 %) | 37 (21,3 %) | 42 (27,1 %) | 31 (26,7 %) | 7 (17,9 %) | 1 (20,0 %) | 5 (29,4 %) | 1 (14,3 %) | 1 (100,0 %) | 4 (12,9 %) | 10 (41,7 %) | 0 (0,0 %) | 4 (80,0 %) |
| R/SR à 3 | 120 (14,8 %) | 66 (8,2 %) | 62 (10,6 %) | 41 (6,8 %) | 26 (14,9 %) | 21 (13,5 %) | 3 (2,6 %) | 2 (5,1 %) | 1 (20,0 %) | 1 (5,9 %) | 0 (0,0 %) | 0 (0,0 %) | 15 (48,4 %) | 4 (16,7 %) | 1 (100,0 %) | 0 (0,0 %) |
| R/SR à 4 | 16 (2,0 %) | 72 (9,0 %) | 14 (2,4 %) | 8 (1,3 %) | 20 (11,5 %) | 5 (3,2 %) | 3 (0,9 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 2 (6,5 %) | 3 (12,5 %) | 0 (0,0 %) | 0 (0,0 %) |
| R/SR à 5 | 1 (0,1 %) | 2 (0,2 %) | 2 (0,3 %) | 2 (0,0 %) | 7 (4,0 %) | 5 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) | 0 (0,0 %) |
| Total | 812 (100,0 %) | 803 (100,0 %) | 587 (100,0 %) | 600 (100,0 %) | 174 (100,0 %) | 155 (100,0 %) | 116 (100,0 %) | 39 (100,0 %) | 5 (100,0 %) | 17 (100,0 %) | 7 (100,0 %) | 1 (100,0 %) | 31 (100,0 %) | 24 (100,0 %) | 1 (100,0 %) | 5 (100,0 %) |
|
||||||||||||||||
8.0. Références
- Note de bas de page 1
-
Agence de la santé publique du Canada. Chlamydia, gonorrhée et syphilis infectieuse au Canada : Données de surveillance de 2021 (Internet). Canada.ca. 2023 (cité le 2023 oct). Disponible à l'adresse : https://www.canada.ca/fr/sante-publique/services/publications/maladies-et-affections/chlamydia-gonorrhee-syphilis-infectieuse-2021-donnees-surveillance.html
- Note de bas de page 2
-
Sawatzky P, Lefebvre B, Diggle M, Hoang L, Wong J, Patel S, Van Caessele P, Minion J, Garceau R, Jeffrey S, Haldane D, Lourenco L, Gravel G, Mulvey M, Martin I. Sensibilité de Neisseria gonorrhoeae aux antimicrobiens au Canada, 2021. 2023 Sep [cité en 2023]; Disponible à l'adresse : https://www.canada.ca/fr/sante-publique/services/rapports-publications/releve-maladies-transmissibles-canada-rmtc/numero-mensuel/2023-49/numero-9-septembre-2023/sensibilite-neisseria-gonorrhoeae-antimicrobiens.html
- Note de bas de page 3
-
Gouvernement du Canada, Agence de santé publique du Canada Guide sur la gonorrhée: Facteurs de risque et manifestations cliniques (Internet). Canada.ca 2008 (cité en 2024). Disponible à l'adresse : https://www.canada.ca/en/public-health/services/infectious-diseases/sexual-health-sexually-transmitted-infections/canadian-guidelines/gonorrhea/risk-factors-clinical-manifestation.html
- Note de bas de page 4
-
Gouvernement du Canada, Agence de santé publique du Canada. Définition nationale de cas : Gonorrhée (Internet). Canada.ca. 2008 (cité en 2023). Disponible à l'adresse : https://www.canada.ca/fr/sante-publique/services/maladies/gonorrhee/definition-nationale-cas.html
- Note de bas de page 5
-
Gouvernement du Canada, Agence de santé publique du Canada. Rapport sur le système de surveillance accrue de la résistance de la gonorrhée aux antimicrobiens : Résultats de 2015 à 2017 (Internet). 2021 février (cité en 2023). Disponible à l'adresse : https://www.canada.ca/fr/sante-publique/services/publications/maladies-et-affections/2015-2017-rapport-systeme-surveillance-accrue-resistance-gonorrhee-antimicrobiens.html
- Note de bas de page 6
-
Gouvernement du Canada, Agence de santé publique du Canada. Guide sur la gonorrhée : Traitement et suivi (Internet). Canada.ca. (cité en 2023). Disponible à l'adresse : https://www.canada.ca/fr/sante-publique/services/maladies-infectieuses/sante-sexuelle-infections-transmissibles-sexuellement/lignes-directrices-canadiennes/gonorhee/traitement-suivi.html
- Note de bas de page 7
-
CLSI. Normes de performance pour les antibiogrammes : Thirtieth informational supplement. Clinical & Laboratory Standards Institute; 2020.
- Note de bas de page 8
-
Organisation mondiale de la santé. Global action plan to control the spread and impact of antimicrobial resistance in Neisseria gonorrhoeae. (Internet). 2012 mai (cité en 2023). Disponible à l'adresse : https://www.who.int/publications/i/item/9789241503501
- Note de bas de page 9
-
Ehret JM, Nims LJ, Judson FN. A clinical isolate of Neisseria gonorrhoeae with in vitro resistance to erythromycin and decreased susceptibility to azithromycin. Sex Transm Dis. 1996;23(4):270-2.
- Note de bas de page 10
-
Martin IMC, Ison CA, Aanensen DM, Fenton KA, Spratt BG. Rapid sequence-based identification of gonococcal transmission clusters in a large metropolitan area. J Infect Dis (Internet). 2004;189(8):1497-505. Disponible à l'adresse : https://academic.oup.com/jid/article/189/8/1497/821449
- Note de bas de page 11
-
Alberta Government. Alberta treatment guidelines for sexually transmitted infections (STI) (Internet). 2018 mai (cité en 2023). Disponible à l'adresse : https://open.alberta.ca/dataset/93a97f17-5210-487d-a9ae-a074c66ad678/resource/bc78159b-9cc4-454e-8dcd-cc85e0fcc435/download/sti-treatment-guidelines-alberta-2018.pdf
- Note de bas de page 12
-
Government of Northwest Territories. NWT Clinical Practice Guidelines for the Treatment of Uncomplicated Gonorrhea (Internet). Gov.nt.ca. 2019 (cité en 2023). Disponible à l'adresse : https://www.hss.gov.nt.ca/professionals/sites/professionals/files/resources/treatment-uncomplicated-gonorrhea.pdf
- Note de bas de page 13
-
Manitoba Public Health Branch. Communicable Disease Management Protocol: Gonorrhea (Internet). Gov.mb.ca. 2015 (cité en 2023). Disponible à l'adresse : https://www.gov.mb.ca/health/publichealth/cdc/protocol/gonorrhea.pdf
- Note de bas de page 14
-
Thorington R, Sawatzky P, Lefebvre B, Diggle M, Hoang L, Patel S, Van Caessele P, Minion J, Garceau R, Matheson M, Haldane D, Gravel G, Mulvey MR, Martin I. Sensibilités aux antimicrobiens du Neisseria gonorrhoeae au Canada, 2020. Relevé des maladies transmissibles au Canada 2022;48(11/12):629-37. https://doi.org/10.14745/ccdr.v48i1112a10f
- Note de bas de page 15
-
Gouvernement du Canada, Agence de la santé publique du Canada. Surveillance nationale de la sensibilité aux antimicrobiens de Neisseria gonorrhoeae : Rapport sommaire annuel de 2018 (Internet). Canada.ca. 2020 (cité en 2023). Disponible à l'adresse : https://www.canada.ca/fr/sante-publique/services/publications/medicaments-et-produits-sante/surveillance-nationale-sensibilite-antimicrobiens-neisseria-gonorrhoeae-rapport-sommaire-annuel-2018.html
- Note de bas de page 16
-
Gouvernement du Canada, Agence de la santé publique du Canada. Surveillance nationale de la sensibilité aux antimicrobiens de Neisseria gonorrhoeae : Rapport sommaire annuel de 2019 (Internet). Canada.ca. 2021 (cité en 2023). Disponible à l'adresse : https://www.canada.ca/fr/services/sante/publications/medicaments-et-produits-sante/surveillance-nationale-sensibilite-antimicrobiens-neisseria-gonorrhoeae-rapport-sommaire-annuel-2019.html
- Note de bas de page 17
-
Gouvernement du Canada, Agence de la santé publique du Canada. Maladies à déclaration obligatoire en direct (Internet). Canada.ca. 2000. (cité en 2023). Disponible à l'adresse : https://maladies.canada.ca/declaration-obligatoire/
- Note de bas de page 18
-
Gouvernement du Canada, Canada S. Estimations de la population du Canada, premier trimestre 2022 (Internet). Statcan.gc.ca. 2022 (cité le 16 octobre 2023). Disponible à l'adresse : Estimations de la population du Canada, premier trimestre de 2022
- Note de bas de page 19
-
van den Bosch CMA, Geerlings SE, Natsch S, Prins JM, Hulscher MEJL. Quality Indicators to Measure Appropriate Antibiotic Use in Hospitalized Adults. Clin Infect Dis (Internet). 2015;60(2):281-91. Disponible à l'adresse : http://dx.doi.org/10.1093/cid/ciu747
- Note de bas de page 20
-
Wi T, Lahra MM, Ndowa F, Bala M, Dillon J-AR, Ramon-Pardo P, et al. Antimicrobial resistance in Neisseria gonorrhoeae : Global surveillance and a call for international collaborative action. PLoS Med (Internet). 2017 (cité en 2024);14(7):e1002344. Disponible à l'adresse : http://dx.doi.org/10.1371/journal.pmed.1002344
- Note de bas de page 21
-
Sawatzky P, Demczuk W, Lefebvre B, Allen V, Diggle M, Hoang L, et al. Increasing azithromycin resistance in Neisseria gonorrhoeae due to NG-MAST 12302 clonal spread in Canada, 2015 to 2018. Antimicrob Agents Chemother (Internet). 2022 (cité en 2024);66(3). Disponible à l'adresse : https://pubmed.ncbi.nlm.nih.gov/34978884/
- Note de bas de page 22
-
Agence de la santé publique du Canada. Plan ministériel 2022-23 de l'Agence de la santé publique du Canada. 2022.
- Note de bas de page 23
-
Luetkemeyer AF, Donnell D, Dombrowski JC, Cohen S, Grabow C, Brown CE, et al. Postexposure doxycycline to prevent bacterial sexually transmitted infections. N Engl J Med (Internet). 2023;388(14):1296-306. Disponible à l'adresse : http://dx.doi.org/10.1056/nejmoa2211934
- Note de bas de page 24
-
Molina JM, Charreau I, Chidiac C, Pialoux G, Cua E, Delaugerre C, et al. Post-exposure prophylaxis with doxycycline to prevent sexually transmitted infections in men who have sex with men : an open-label randomised substudy of the ANRS IPERGAY trial. Lancet Infect Dis [Internet]. 2018;18(3):308-17. Disponible à l'adresse : http://dx.doi.org/10.1016/s1473-3099(17)30725-9
- Note de bas de page 25
-
Agence de la santé publique du Canada. Guide sur la gonorrhée : Dépistage et tests diagnostiques (Internet). Canada.ca. (cité en 2023). Disponible à l'adresse : https://www.canada.ca/fr/sante-publique/services/maladies-infectieuses/sante-sexuelle-infections-transmissibles-sexuellement/lignes-directrices-canadiennes/gonorhee/depistage-test-diagnostiques.html
- Note de bas de page 26
-
OMS. Gonorrhée multirésistante (Internet). 2023. Disponible à l'adresse : https://www.who.int/fr/news-room/fact-sheets/detail/multi-drug-resistant-gonorrhoea
- Note de bas de page 27
-
Pleininger S, Alexander I, Golparian D, Heger F, Schindler S, Jacobsson S, Heidler S, Unemo M. Extensively drug-resistant (XDR) Neisseria gonorrhoeae causing possible gonorrhoea treatment failure with ceftriaxone plus azithromycin in Austria, April 2022. Euro Surveill (Internet). 2022;27(24). Disponible à l'adresse : https://doi.org/10.2807/1560-7917.ES.2022.27.24.2200455
- Note de bas de page 28
-
Maubaret C, Caméléna F, Mrimèche M, Braille A, Liberge M, Mainardis M, Guillaume C, Noel F, Bébéar C, Molina JM, Lot F, Chazelle E, Berçot B. Two cases of extensively drug-resistant (XDR) Neisseria gonorrhoeae infection combining ceftriaxone-resistance and high-level azithromycin resistance, France, November 2022 and May 2023. Euro Surveill (Internet). 2023;28(37). Disponible à l'adresse : https://doi.org/10.2807/1560-7917.ES.2023.28.37.2300456
- Note de bas de page 29
-
Berçot B, Caméléna F, Mérimèche M, Jacobsson S, Sbaa G, Mainardis M, Valin C, Molina JM, Bébéar C, Chazelle E, Lot F, Golparian D, Unemo M. Ceftriaxone-resistant, multidrug-resistant Neisseria gonorrhoeae with a novel mosaic penA-237.001 gene, France, June 2022. Euro Surveill (Internet). 2022;27(50). Disponible à l'adresse : https://doi.org/10.2807/1560-7917.ES.2022.27.50.2200899
- Note de bas de page 30
-
Poncin T, Fouere S, Braille A, Camelena F, Agsous M, Bebear C, Kumanski S, Lot F, Mercier-Delarue S, Ngangro Ndeindo Ndeikoundam, Salmona M, Schnepf N, Timsit J, Unemo M, Bercot B. Multidrug-resistant Neisseria gonorrhoeae failing treatment with ceftriaxone and doxycycline in France, November 2017 (Internet). 2018;23(21). Disponible à l'adresse: https://doi.org/10.2807/1560-7917.ES.2018.23.21.1800264
- Note de bas de page 31
-
Unemo M, Golparian D, Potočnik M, Jeverica S. Treatment failure of pharyngeal gonorrhoea with internationally recommended first-line ceftriaxone verified in Slovenia, September 2011. Euro. Surveill (Internet). 2012;17(25). Disponible à l'adresse : https://doi.org/10.2807/ese.17.25.20200-en
- Note de bas de page 32
-
Unemo M, Golparian D, Hestner A. Ceftriaxone treatment failure of pharyngeal gonorrhoea verified by international recommendations, Sweden, July 2010. Euro. Surveill [Internet]. 2011;16(6). Disponible à l'adresse : https://doi.org/10.2807/ese.16.06.19792-en
- Note de bas de page 33
-
Golparian D, Ohlsson AK, Janson H, Lidbrink P, Richtner T, Ekelund O, Fredlund H, Unemo M. Four treatment failures of pharyngeal gonorrhoea with ceftriaxone (500 mg) or cefotaxime (500 mg), Sweden, 2013 and 2014. Euro Surveill (Internet). 2014;19(30). Disponible à l'adresse : https://doi.org/10.2807/1560-7917.ES2014.19.30.20862
- Note de bas de page 34
-
Day M, Pitt R, Mody N, Saunders J, Rai R, Nori A, Church H, Mensforth S, Corkin H, Jones J, Naicker P, Khan WM, Thomson Glover R, Mortimer K, Hylton C, Moss E, Pasvol TJ, Richardson A, Sun S, Woodford N, Mohammed H, Sinka K, Fifer H. Detection of 10 cases of ceftriaxone-resistant Neisseria gonorrhoeae in the United Kingdom, December 2021 to June 2022. Euro Surveill (Internet). 2022 Nov;27(46). Disponible à l'adresse : https://doi.org/10.2807/1560-7917.ES.2022.27.46.2200803
- Note de bas de page 35
-
Eyre DW, Town K, Street T, Barker L, Sanderson N, Cole MJ, Mohammed H, Pitt R, Gobin M, Irish C, Gardiner D, Sedgwick J, Beck C, Saunders J, Turbitt D, Cook C, Phin N, Nathan B, Horner P, Fifer H. Detection in the United Kingdom of the Neisseria gonorrhoeae FC428 clone, with ceftriaxone resistance and intermediate resistance to azithromycin, October to December 2018. Euro Surveill (Internet). 2019;24(10). Disponible à l'adresse : https://doi.org/10.2807/1560-7917.ES.2019.24.10.1900147
- Note de bas de page 36
-
Eyre DW, Sanderson ND, Lord E, Regisford-Reimmer N, Chau K, Barker L, Morgan M, Newnham R, Golparian D, Unemo M, Crook DW, Peto TEA, Hughes G, Cole MJ, Fifer H, Edwards A, Andersson MI. Gonorrhoea treatment failure caused by a Neisseria gonorrhoeae strain with combined ceftriaxone and high-level azithromycin resistance, England, February 2018. Euro Surveill (Internet). 2018;23(27). Disponible à l'adresse : https://doi.org/10.2807/1560-7917.ES.2018.23.27.1800323