Mise à jour sur les souches du VIH-1 et la pharmacorésistance transmise au Canada : Résultats du Programme canadien de surveillance des souches et de la résistance aux médicaments ayant trait au VIH, 2012-2013

Télécharger le format de rechange
(Format PDF, 1,25 Mo, 50 pages)
Organisation : Agence de la santé publique du Canada
Date publiée : 2017-12-01
Remerciements : Nous tenons à remercier les coordonnateurs, les laboratoires, les fournisseurs de soins de santé et les médecins provinciaux des programmes sur le VIH/sida d’avoir fourni les données nécessaires pour publier ce rapport. La liste de ces collaborateurs figure à l’Annexe V.
Note : Le présent document doit être cité comme source lorsque des données en sont extraites ou sont utilisées.
Citation proposée : Agence de la santé publique du Canada. Mise à jour sur les souches du VIH-1 et la pharmacorésistance transmise au Canada : 2012-2013. Centre de la lutte contre les maladies transmissibles et les infections, Agence de la santé publique du Canada, 2017.
Table des matières
- Liste des figures
- Liste des tableaux
- Liste des annexes
- Acronymes et abréviations
- Résumé
- Introduction
- Méthodologie
- Résultats
- Limites
- Conclusion
- Références
- Annexes
Liste des figures
- Figure 1 : Aperçu du Programme canadien de surveillance des souches et de la résistance aux médicaments ayant trait au VIH
- Figure 2 : Aperçu des échantillons du Programme canadien de surveillance des souches et de la résistance aux médicaments ayant trait au VIH, 2012-2013
- Figure 3 : Nombre et proportion des sous-types autres que B par province, 2012-2013
- Figure 4 : Nombre et proportion de sous-types autres que B par groupe d’âge, 2012-2013
- Figure 5 : Nombre et proportion d’échantillons pharmacorésistants par province, 2012-2013
- Figure 6 : Nombre et proportion d’échantillons pharmacorésistants par groupe d’âge, 2012-2013
- Figure 7 : Répartition des échantillons pharmacorésistants par classe de médicaments, 2012-2013 (n = 251)
- Figure 8 : Proportion de résistance aux classes de médicaments par province, 2012-2013
- Figure 9 : Résistance aux médicaments de la classe des INNTI couramment prescrits, 2012-2013
- Figure 10 : Résistance aux médicaments de la classe des INTI couramment prescrits, 2012-2013
- Figure 11 : Résistance aux médicaments de la classe des IP couramment prescrits, 2012-2013
Liste des tableaux
- Tableau 1 : Caractéristiques de l’échantillon des nouveaux cas de VIH diagnostiqués par rapport aux cas inclus dans le Programme SSR, 2012-2013
- Tableau 2 : Nombre et proportion des sous-types du VIH-1, 2012-2013
- Tableau 3 : Nombre et proportion de sous-types B et autres que B par sexe et par race ou origine ethnique, 2012-2013
- Tableau 4 : Nombre et proportion de sous-types B et autres que B par sexe et par catégorie d’exposition, 2012-2013
- Tableau 5 : Nombre et proportion de sous-types B et autres que B par race ou origine ethnique et par catégorie d’exposition, 2012-2013
- Tableau 6 : Nombre et proportion d’échantillons pharmacorésistants par sexe et par race ou origine ethnique, 2012-2013
- Tableau 7 : Nombre et proportion d’échantillons pharmacorésistants par sexe et par catégorie d’exposition, 2012-2013
- Tableau 8 : Nombre et proportion d’échantillons pharmacorésistants par race ou origine ethnique et par catégorie d’exposition, 2012-2013
- Tableau 9 : Nombre et proportion d’échantillons pharmacorésistants (résistance à une seule classe de médicaments et multirésistance) par sous-type, 2012-2013
- Tableau 10 : Nombre et proportion d’échantillons pharmacorésistants (n’importe quelle classe de médicaments et multirésistance) par sous-type, 2012-2013
- Tableau 11 : Comparaison du nombre et de la proportion d’échantillons pharmacorésistants en 2008 par rapport à 2012-2013
- Tableau 12 : Nombre et proportion des sous-types du VIH-1 parmi les personnes pour lesquelles un premier essai de génotypage a été effectué au Québec, 2012-2013
- Tableau 13 : Nombre et proportion des sous-types du VIH-1 par année au Québec, 2012-2013
- Tableau 14 : Nombre et proportion des sous-types du VIH-1 par sexe au Québec, 2012-2013
- Tableau 15 : Nombre et proportion des sous-types du VIH-1 par groupe d’âge au Québec, 2012-2013
- Tableau 16 : Répartition par groupe d’âge de la pharmacorésistance transmise chez les personnes n’ayant jamais été traitées au Québec, 2012-2013
- Tableau 17 : Répartition de la pharmacorésistance transmise entre les infections récentes et établies au Québec, 2012-2013
Liste des annexes
- Annexe I : Classification par catégorie d’exposition
- Annexe II : Souches du VIH et résistance aux médicaments au Québec, 2012-2013
- Annexe III : Liste des pays où le VIH est endémique
- Annexe IV : Nombre et proportion des mutations conférant une pharmacorésistance par classe de médicaments, 2012-2013
- Annexe V : Système de notation de la résistance aux médicaments
- Annexe VI : Partenaires provinciaux du Programme SSR
Acronymes et abréviations
- 3TC
- Lamivudine
- ABC
- Abacavir
- ADN
- Acide désoxyribonucléique
- Alb.
- Alberta
- ARN
- Acide ribonucléique
- ARS
- Aucun risque signalé
- ASPC
- Agence de la santé publique du Canada
- ATV/r
- Atazanavir/Ritonavir
- AZT
- Zidovudine
- C.-B.
- Colombie-Britannique
- CLMTI
- Centre de la lutte contre les maladies transmissibles et les infections
- CRF
- Forme recombinante en circulation
- D4T
- Stavudine
- DDI
- Didanosine
- DRV/r
- Darunavir/Ritonavir
- EFV
- Éfavirenz
- ETR
- Étravirine
- FPV/r
- Fosamprénavir/Ritonavir
- FTC
- Emtricitabine
- HARSAH
- Hommes ayant des relations sexuelles avec d’autres hommes
- HARSAH/UDI
- Hommes ayant des relations sexuelles avec d’autres hommes et utilisant des drogues injectables
- IDV/r
- Indinavir/Ritonavir
- INNTI
- Inhibiteur non nucléosidique de la transcriptase inverse
- INTI
- Inhibiteur nucléosidique de la transcriptase inverse
- IP
- Inhibiteur de protéase
- LNVR
- Laboratoires nationaux du VIH et de rétrovirologie
- LPV/r
- Lopinavir/Ritonavir
- Man.
- Manitoba
- MR
- Multirésistance aux médicaments
- N.-É.
- Nouvelle-Écosse
- NFV
- Nelfinavir
- NVP
- Névirapine
- OMS
- Organisation mondiale de la Santé
- Ont.
- Ontario
- PCR
- Réaction en chaîne de la polymérase
- PPE
- Prophylaxie post-exposition
- PPrE
- Prophylaxie préexposition
- PR
- Pharmacorésistance
- RPV
- Rilpivirine
- RT
- Transcription inverse
- Sask.
- Saskatchewan
- Sida
- Syndrome d’immunodéficience acquise
- SQV/r
- Saquinavir/Ritonavir
- SSR
- Programme canadien de surveillance des souches et de la résistance aux médicaments ayant trait au VIH
- TDF
- Fumarate de ténofovir disoproxil
- TPV/r
- Tipranavir
- UDI
- Utilisation de drogues injectables
- URF
- Forme recombinante unique
- VIH
- Virus de l’immunodéficience humaine
Résumé
Le VIH est un problème de santé publique important. L’un des principaux éléments du suivi de l’épidémie est la surveillance des sous-types du VIH et de la résistance aux médicaments. Par le passé, le sous-type B représentait plus de 95 % des nouveaux diagnostics au Canada; toutefois, la proportion des sous-types autres que B a progressivement augmenté et représente aujourd’hui environ 20 % des nouveaux diagnostics. La surveillance des sous-types du VIH permet de guider la mise au point des vaccins et fournit l’occasion d’examiner les variations potentielles du risque de transmission et de la réussite des traitements par sous-type. En outre, la surveillance nationale de la résistance du VIH aux médicaments est importante car la transmission du VIH pharmacorésistant influe sur le traitement ainsi que sur les activités de prévention et de contrôle. En 1998, l’Agence de la santé publique du Canada (ASPC) a créé le Programme canadien de surveillance des souches et de la résistance aux médicaments ayant trait au VIH (Programme SSR) afin de surveiller les sous-types du VIH-1 et la résistance aux antirétroviraux avant traitement au Canada. Six provinces collaborent avec l’ASPC dans le cadre de cette initiative : la Colombie-Britannique, l’Alberta, la Saskatchewan, le Manitoba, l’Ontario et la Nouvelle-Écosse.
Le présent rapport fournit des renseignements sur les sous-types et sur les mutations conférant une pharmacorésistance chez les nouveaux cas de VIH-1 diagnostiqués en 2012 et 2013 au Canada. Les prélèvements sanguins résiduels après le diagnostic du VIH chez ces personnes, dont on a supposé qu’elles n’avaient jamais été traitées, ont été envoyés par les laboratoires provinciaux aux Laboratoires nationaux du VIH et de rétrovirologie (LNVR) pour faire l’objet d’un génotypage, permettant de détecter le sous-type du VIH et la pharmacorésistance à trois classes d’antirétroviraux. Les résultats de laboratoire ont ensuite été liés aux données épidémiologiques recueillies dans le cadre de la surveillance des cas de VIH afin de mener une analyse plus poussée. Ce rapport examine les sous-types du VIH et la résistance aux médicaments par sexe, par groupe d’âge, par race ou origine ethnique et par catégorie d’exposition. La comparaison avec les rapports précédents est limitée en raison de l’absence de données de 2009 à 2011. De plus, les résultats de la province du Québec, où les souches et la pharmacorésistance sont surveillées indépendamment du Programme SSR, sont également inclus (voir l’Annexe I).
Au total, 1 811 échantillons ont été analysés pour ce rapport, représentant 56,1 % des personnes ayant reçu un diagnostic de VIH dans les six provinces participant au Programme SSR en 2012 et 2013. Dans l’ensemble, 20,4 % des échantillons étaient des sous-types autres que B. La proportion de sous-types autres que B était plus élevée chez les femmes que chez les hommes (46,0 % par rapport à 14,0 %, respectivement). Des proportions supérieures de sous-types autres que B ont été observées dans les groupes d’âge de 30 à 34 ans, de 35 à 39 ans et de 40 à 44 ans (25,3 %, 24,0 % et 22,8 %, respectivement), comparativement aux autres groupes d’âge. Les personnes de race ou d’origine ethnique noire présentaient une proportion plus importante (62,1 %) de sous-types autres que B par rapport aux autres groupes, et les personnes de la catégorie d’exposition Contacts hétérosexuels/régions endémiques présentaient une proportion plus élevée (85,0 %) de sous-types autres que B comparativement aux autres catégories d’exposition. Par rapport à 2008, la proportion d’échantillons de sous-types autres que B dans le Programme SSR était supérieure en 2012-2013 (11,6 % par rapport à 20,4 %, respectivement).
En ce qui concerne la pharmacorésistance, 13,9 % des échantillons étaient résistants à au moins une classe de médicaments et 2,3 % étaient résistants à plusieurs classes. La proportion de pharmacorésistance était plus élevée chez les hommes que chez les femmes (14,6 % par rapport à 11,0 %, respectivement). Le groupe d’âge des moins de 25 ans présentait la proportion la plus importante de pharmacorésistance (21,0 %) parmi tous les groupes d’âge. Les personnes de race ou d’origine ethnique autochtone ou blanche présentaient des proportions supérieures de pharmacorésistance (14,6 % et 14,4 %, respectivement) par rapport aux groupes des autres races ou origines ethniques. Si l’on examine les données par catégorie d’exposition, les catégories d’exposition des hommes ayant des relations sexuelles avec d’autres hommes (HARSAH) et des utilisateurs de drogues injectables (UDI) présentaient les plus fortes proportions de pharmacorésistance (16,0 % et 18,3 %, respectivement). De plus, la prévalence de la pharmacorésistance était plus élevée parmi les échantillons du sous-type B (15,5 % par rapport à 7,6 % des échantillons des sous-types autres que B, respectivement). Par rapport à 2008, la proportion d’échantillons présentant une pharmacorésistance dans le Programme SSR était comparable en 2012-2013 (13,4 % par rapport à 13,9 %, respectivement).
Pour l’avenir, le Programme SSR est en train d’étudier de nouveaux moyens d’améliorer la surveillance des souches et de la résistance aux médicaments et continuera de représenter une part importante des efforts de surveillance du VIH à l’échelle nationale.
Introduction
Malgré les progrès dans notre compréhension du VIH et les gains procurés par le traitement antirétroviral, le VIH demeure un problème de santé publique important. L’un des principaux éléments du suivi de l’épidémie est la surveillance des sous-types du VIH et de la résistance aux médicaments. Le VIH-1 prend la forme d’un certain nombre de sous-types différents, et le sous-type B représentait par le passé plus de 95 % de tous les nouveaux diagnostics au CanadaNote de bas de page 1. Cependant, avec l’évolution des tendances migratoires, les sous-types autres que B, qui sont habituellement présents en Afrique subsaharienne et en AsieNote de bas de page 2, représentent désormais une proportion beaucoup plus importante. La surveillance des sous-types du VIH fournit des renseignements sur les sous-types particuliers qui sont présents au Canada. Elle pourrait ainsi aider à évaluer l’utilité d’un vaccin potentiel, puisque celui-ci sera très probablement propre à un sous-type particulier. Elle offre également l’occasion d’examiner les différences potentielles au niveau du risque de transmission et de l’efficacité du traitement par sous-type, étant donné qu’il existe des données limitées indiquant que le risque de transmission du VIH varie par sous-typeNote de bas de page 3 (bien que des recherches plus poussées soient nécessaires pour avoir une compréhension plus complète de ce phénomène).
Le traitement antirétroviral a considérablement modifié l’évolution du VIH et du sida. Grâce au recours au traitement antirétroviral, les personnes infectées par le VIH vivent plus longtemps, avec une espérance de vie proche de celles des personnes non séropositivesNote de bas de page 4. Néanmoins, alors que la disponibilité et l’utilisation du traitement antirétroviral continuent de s’accroître, la nécessité de surveiller et de contrôler la résistance aux médicaments contre le VIH est apparue comme une priorité mondiale. L’apparition et la transmission d’un VIH pharmacorésistant limitent les options de traitement et peuvent contribuer à des taux accrus d’échec thérapeutique, ce qui, à terme, a des répercussions sur la prévention et le contrôle du VIH. La prévalence de la résistance aux médicaments chez les nouveaux cas d’infection au VIH diagnostiqués montre dans quelle mesure les souches pharmacorésistantes du VIH se transmettent, ce qui peut aider à évaluer l’efficacité des programmes de prévention et de counseling. Pour toutes ces raisons, l’Organisation mondiale de la Santé (OMS) recommande l’établissement de programmes nationaux de surveillance de la pharmacorésistance du VIH, et elle a publié un nouveau plan d’action quinquennal mondial pour la période 2017-2021 en vue de soutenir un effort international coordonné pour prévenir l’émergence de la résistance du VIH aux médicaments, la surveiller et y faire faceNote de bas de page 5.
Le Programme canadien de surveillance des souches et de la résistance aux médicaments ayant trait au VIH (Programme SSR) a été lancé par l’Agence de la santé publique du Canada (ASPC) en 1998, en collaboration avec six provinces (Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario et Nouvelle-Écosse), afin de surveiller les sous-types du VIH-1 et la résistance aux antirétroviraux au Canada. Par la surveillance des échantillons servant au diagnostic du VIH, la portée de ce programme consiste à évaluer la pharmacorésistance transmise dans la population, c’est-à-dire l’infection présumée par des souches du VIH résistantes aux médicaments (par opposition à une pharmacorésistance acquise qui peut se développer au cours du traitement). En outre, étant donné que le VIH-2 est rare au Canada, le Programme SSR ne surveille que le VIH-1.
Le premier rapport du Programme a été publié en 2002, et les rapports suivants en 2004, 2005 et 2012, couvrant la période allant jusqu’en décembre 2008.Note de bas de page 1 Le présent rapport fournit des renseignements sur les sous-types et la résistance du VIH aux médicaments chez les personnes jamais traitées ayant reçu un nouveau diagnostic de VIH-1 en 2012 et 2013.
Note à l’intention du lecteur
Le présent rapport se distingue des rapports précédents par le fait que les tendances dans le temps sont limitées. Après la publication du rapport Les souches VIH-1 et la transmission de la pharmacorésistance au Canada : Rapport de surveillance en date du 31 décembre 2008, les Laboratoires nationaux du VIH et de rétrovirologie (LNVR) ont déménagé d’Ottawa au Centre de recherche en infectiologie JC Wilt de Winnipeg. Pendant cette période, le génotypage effectué a été limité. En raison de la rupture dans la continuité des données, le présent rapport présente des comparaisons limitées des résultats de 2012 et 2013 avec les années précédentes.
Méthodologie
Collecte d’échantillons et de données épidémiologiques
La Figure 1 présente un aperçu du Programme SSR.Lorsqu’une personne se présente pour un dépistage du VIH ou obtient un résultat positif à un test rapide de dépistage du VIH, un échantillon sanguin diagnostique est envoyé au laboratoire provincial aux fins de dépistage du VIH. Les échantillons sanguins positifs pour le VIH sont ensuite stockés par le laboratoire provincial. Des échantillons sont choisis pour le Programme SSR et envoyés aux LNVR selon les critères d’admissibilité établis par chaque province participante. Certaines provinces examinent leurs données et excluent les échantillons s’il apparaît que la personne a déjà reçu un diagnostic de VIH ou été exposée à un traitement antirétroviral. Certaines provinces excluent également des échantillons en fonction de l’âge, de la résidence en dehors de la province au moment du diagnostic ou d’un volume de prélèvement insuffisant. En Ontario, en raison du nombre relativement important de diagnostics de VIH par rapport aux autres provinces, un échantillon aléatoire de prélèvements a été sélectionné, représentant 53,9 % du nombre total de diagnostics de VIH en Ontario de 2012 à 2013.
Pour chaque personne recevant un nouveau diagnostic de VIH, des données épidémiologiques non nominales sont recueillies et soumises au ministère de santé publique provincial. Les données comprennent le sexe, le groupe d’âge, la race ou l’origine ethnique et le mode probable d’exposition au VIH (c.-à-d. la catégorie d’exposition; pour de plus amples renseignements sur la classification par catégorie d’exposition, voir l’Annexe I). Le ministère de santé publique provincial transmet ensuite ces données au Centre de la lutte contre les maladies transmissibles et les infections (CLMTI) de l’ASPC, qui coordonne le Programme SSR. Ce processus est légèrement différent en Ontario, où les données épidémiologiques sont recueillies par le laboratoire provincial et envoyées au CLMTI. L’ASPC communique les résultats de l’analyse provinciale des souches et de la résistance aux médicaments à ses partenaires provinciaux.
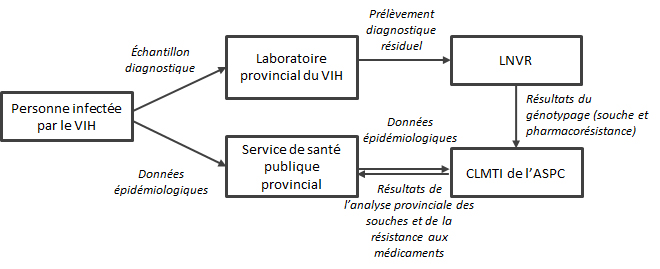
Figure 1 - Description textuel
Lorsqu’une personne se présente pour un dépistage du VIH ou obtient un résultat positif à un test rapide de dépistage du VIH, un échantillon sanguin diagnostique est envoyé au laboratoire provincial aux fins de dépistage du VIH. Les échantillons sanguins positifs pour le VIH sont ensuite stockés par le laboratoire provincial. Des échantillons sont choisis pour le Programme SSR et envoyés aux LNVR selon les critères d’admissibilité établis par chaque province participante.
Pour chaque personne recevant un nouveau diagnostic de VIH, des données épidémiologiques non nominales sont recueillies et soumises au ministère de santé publique provincial. Les données comprennent le sexe, le groupe d’âge, la race ou l’origine ethnique et le mode probable d’exposition au VIH (c.-à-d. la catégorie d’exposition). Le ministère de santé publique provincial transmet ensuite ces données au Centre de la lutte contre les maladies transmissibles et les infections (CLMTI) de l’ASPC, qui coordonne le Programme SSR. Ce processus est légèrement différent en Ontario, où les données épidémiologiques sont recueillies par le laboratoire provincial et envoyées au CLMTI. L’ASPC communique les résultats de l’analyse provinciale des souches et de la résistance aux médicaments à ses partenaires provinciaux.
Le génotypage visant à déterminer le sous-type et la pharmacorésistance du VIH est effectué aux LNVR. Les échantillons sont classés comme étant pharmacorésistants s’ils présentent au moins une mutation figurant dans la liste consensuelle des mutations pour la surveillance de la pharmacorésistance transmise du VIH-1 publiée par l’Organisation mondiale de la Santé.
Génotypage du VIH
Le génotypage visant à déterminer le sous-type et la pharmacorésistance du VIH est effectué aux LNVR. Des aliquotes d’échantillons sériques diagnostiques du VIH sont reçues sur de la glace sèche aux LNVR, où elles sont codées et entreposées à -80 °C. L’ARN du VIH est extrait des échantillons au moyen d’une technologie robotique semi-automatisée. L’ARN purifié subit une transcription inverse puis une réaction en chaîne de la polymérase (PCR) nichée avec des amorces spécifiques pour pol englobant le gène de protéase entier et les 235 premiers acides aminés de la transcriptase inverse. Les amorces sont conçues pour amplifier efficacement tous les sous-types de VIH du groupe M. L’acide nucléique amplifié est purifié et la séquence de l’ADN est déterminée selon la méthodologie Big Dye Terminator sur un analyseur génétique ABI 3130XL. La séquence de l’acide nucléique viral est déterminée pour les deux brins avec des séries d’amorces se chevauchant qui couvrent le gène de la protéase entier et la plus grande partie du gène de la transcriptase inverse. Le Calibrated Population Resistance ToolNote de bas de page 6 (outil d’analyse de la résistance calibrée de la population) lié à la base de données sur la résistance du VIH aux médicaments de l’Université Stanford est utilisé pour interpréter les séquences génétiques afin de déceler les mutations conférant une pharmacorésistance. La pharmacorésistance est analysée par rapport à trois classes d’antirétroviraux : les inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI), les inhibiteurs nucléosidiques de la transcriptase inverse (INTI) et les inhibiteurs de la protéase (IP). Les échantillons sont classés comme étant pharmacorésistants s’ils présentent au moins une mutation figurant dans la liste consensuelle des mutations pour la surveillance de la pharmacorésistance transmise du VIH-1 publiée par l’Organisation mondiale de la SantéNote de bas de page 7.
Analyse et interprétation
Le CLMTI relie les données sur le sous-type et la pharmacorésistance des échantillons reçues des LNVR aux données épidémiologiques correspondantes fournies par les services de santé publique provinciaux.
Pour ce rapport, la répartition des sous-types et de la pharmacorésistance du VIH a été analysée par sexe, par groupe d’âge, par race ou origine ethnique et par catégorie d’exposition. Aucune technique statistique n’a été appliquée pour rendre compte des données manquantes. En outre, le présent rapport comprend une section indépendante concernant les résultats du Québec sur les souches et la pharmacorésistance du VIH (voir l’Annexe II).
Résultats
Parmi les 3 226 nouveaux cas de VIH diagnostiqués entre 2012 et 2013 dans les six provinces participant au Programme SSR, les résultats du génotypage ont été reçus pour 1 811 échantillons (56,1 %) (voir la Figure 2). Le génotypage n’a pas pu être effectué lorsqu’il ne restait pas de prélèvement ou qu’il en restait une quantité insuffisante pour le génotypage (n = 1 151). Certains échantillons soumis aux LNVR aux fins de génotypage n’ont pas pu être séquencés (n = 264).
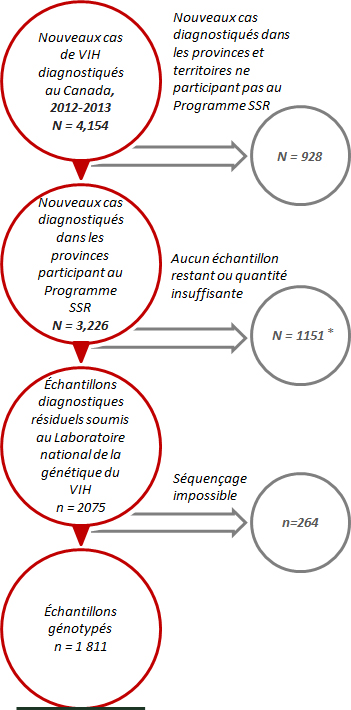
Figure 2 - Note * L’Ontario a soumis un échantillon aléatoire d’environ 500 prélèvements par an; ce nombre inclut les échantillons non soumis.
Figure 2 - Description textuel
Il y a 4 154 cas nouvellement diagnostiqués avec le VIH au Canada pour 2012-2013. 928 des cas étaient dans des provinces et territoires sans programme de programme canadien de surveillance des souches et de la résistance aux médicaments ayant trait au VIH (SSR) établi. Il y a des cas 3226 nouvellement diagnostiquées dans les provinces où un programme SSR est établi, dont 1151 cas n’étaient pas en mesure de fournir des données de génotypage. Il restait 2 075 autres spécimens dont 1811 cas étaient en mesure de fournir des données de génotypage pour ce rapport.
Caractéristiques de l’échantillon
Les caractéristiques des nouveaux cas de VIH diagnostiqués sont présentées dans le Tableau 1 et sont comparées aux cas inclus dans le Programme SSR.
| Nombre total de diagnostics du VIH dans les provinces participant au Programme SSRTableau 1 - Note * |
Diagnostics du VIH inclus dans le Programme SSR |
||
|---|---|---|---|
| Caractéristiques de l’échantillon | n | n | rang (%) |
| Province | |||
| Colombie-Britannique | 506 | 309 | 61,1 |
| Alberta | 500 | 276 | 55,2 |
| Saskatchewan | 315 | 213 | 67,6 |
| Manitoba | 188 | 88 | 46,8 |
| Ontario | 1 684 | 907 | 53,9 |
| Nouvelle-Écosse | 35 | 18 | 51,4 |
| Sexe | |||
| Hommes | 2 480 | 1 443 | 58,2 |
| Femmes | 736 | 363 | 49,3 |
| Inconnu | 12 | 5 | 41,7 |
| Groupe d’âge | |||
| Moins de 20 ans | 82 | 33 | 40,2 |
| 20 à 29 ans | 749 | 434 | 57,9 |
| 30 à 39 ans | 965 | 533 | 55,2 |
| 40 à 49 ans | 870 | 493 | 56,7 |
| 50 ans et plus | 563 | 318 | 56,5 |
| Inconnu | 1 | 0 | 0 |
| Race/origine ethnique | |||
| Blancs | 1 182 | 758 | 64,1 |
| Noirs | 502 | 219 | 43,6 |
| Autochtones | 471 | 301 | 63,9 |
| Asiatiques ou Asiatiques de l’Est ou du Sud-Est | 155 | 96 | 61,9 |
| Asiatiques du Sud ou de l’Ouest ou Arabes | 118 | 72 | 61 |
| Latino-américains | 116 | 63 | 54,3 |
| Autre | 41 | 27 | 65,9 |
| Inconnue | 643 | 275 | 42,8 |
| Catégorie d’exposition | |||
| HARSAHTableau 1 - Note † | 1 316 | 813 | 61,8 |
| HARSAH/UDITableau 1 - Note ‡ | 68 | 37 | 54,4 |
| UDITableau 1 - Note § | 398 | 235 | 59 |
| Contacts hétérosexuels/régions endémiquesTableau 1 - Note ¦ | 358 | 147 | 41,1 |
| Contacts hétérosexuels/régions non endémiques | 563 | 368 | 65,4 |
| Autre | 88 | 26 | 29,5 |
| Inconnue | 437 | 185 | 42,3 |
| Total | 3 228 | 1 811 | 56,1 |
Sur l’échantillon du Programme SSR, la majorité (79,7 %) était des hommes. Les personnes âgées de 20 à 49 ans constituaient le groupe d’âge le plus important dans l’échantillon (80,6 %). Les races ou origines ethniques qui représentaient plus de 10 % de l’échantillon étaient les Blancs (41,9 %), les Autochtones (16,6 %) et les Noirs (12,1 %), avec un sous-groupe important pour lequel les données sur la race ou l’origine ethnique étaient inconnues (15,1 %). La catégorie d’exposition des hommes ayant des relations sexuelles avec d’autres hommes (HARSAH) représentait 44,9 % de l’échantillon total.
Sous-types du VIH-1
Répartition par sous-types
Sur les 1 811 échantillons génotypés, 1 441 (79,6 %) étaient du sous-type B (voir le Tableau 2). Parmi les sous-types autres que B, il y avait 26 souches uniques; la plupart étaient du sous-type C (8,9 % de l’échantillon total et 43,5 % des sous-types autres que B). Les autres sous-types remarquables étaient les suivants : A (3,2 %), CRF02_AG (2,6 %), CRF01_AE (1,3 %) et B recombinant (1,0 %).
| Sous-type du VIH-1 | n | % | % dans les échantillons de sous-types autres que B |
|---|---|---|---|
| B | 1 441 | 79,6 | - |
| C | 161 | 8,9 | 43,5 |
| A | 58 | 3,2 | 15,7 |
| CRF02_AG | 47 | 2,6 | 12,7 |
| CRF01_AE | 24 | 1,3 | 6,5 |
| G | 10 | 0,6 | 2,7 |
| D | 4 | 0,2 | 1,1 |
| F | 3 | 0,2 | 0,8 |
| H | 3 | 0,2 | 0,8 |
| Autres CRFTableau 2 - Note * | |||
| CRF07_BC | 7 | 0,4 | 1,9 |
| CRF06_CPX | 4 | 0,2 | 1,1 |
| CRF12_BF | 3 | 0,2 | 0,8 |
| CRF20_BG | 3 | 0,2 | 0,8 |
| CRF19_CPX | 2 | 0,1 | 0,5 |
| CRF24_BG | 2 | 0,1 | 0,5 |
| CRF18_CPX | 1 | 0,1 | 0,3 |
| CRF43_02G | 1 | 0,1 | 0,3 |
| URFTableau 2 - Note † | |||
| B recombinant | 19 | 1,0 | 5,1 |
| AD recombinant | 4 | 0,2 | 1,1 |
| BD recombinant | 4 | 0,2 | 1,1 |
| A recombinant | 2 | 0,1 | 0,5 |
| AC recombinant | 2 | 0,1 | 0,5 |
| AB recombinant | 1 | 0,1 | 0,3 |
| C recombinant | 1 | 0,1 | 0,3 |
| D recombinant | 2 | 0,1 | 0,5 |
| G recombinant | 1 | 0,1 | 0,3 |
| GF recombinant | 1 | 0,1 | 0,3 |
| Total | 1 811 | ||
Sous-types autres que B par province
La figure 3 représente le nombre et la proportion des sous-types autres que B par province. La prévalence des sous-types autres que B était la plus élevée au Manitoba (38,6 %), était comprise entre 5,6 % et 27,9 % dans les autres provinces, et était la plus faible en Colombie-Britannique et en Nouvelle‑Écosse.
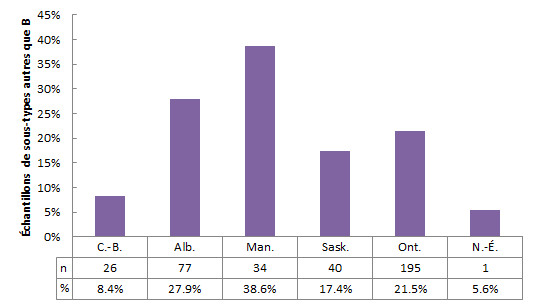
Figure 3 - Description textuel
| C.-B. | Alb. | Man. | Sask. | Ont. | N.-É. | |
|---|---|---|---|---|---|---|
| % | 8,4 % | 27,9 % | 38,6 % | 17,4 % | 21,5 % | 5,6 % |
| n | 26 | 77 | 34 | 40 | 195 | 1 |
Sous-types autres que B par caractéristiques épidémiologiques
Sexe et race ou origine ethnique
Le Tableau 3 montre le nombre et la proportion des sous-types B et autres que B par sexe et par race ou origine ethnique. Les sous-types autres que B représentaient 46,0 % des échantillons provenant de femmes, contre 14,0 % des échantillons prélevés chez des hommes. La proportion de sous-types autres que B était plus élevée chez les femmes que chez les hommes dans toutes les catégories de race ou d’origine ethnique.
| Hommes | Femmes | TotalTableau 3 - Note ‡ | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Race/origine ethnique | n | Sous-types autres que B | % | n | Sous-types autres que B | % | n | Sous-types autres que B | % |
| Blancs | 677 | 40 | 5,9 | 80 | 18 | 22,5 | 757 | 58 | 7,7 |
| Noirs | 132 | 59 | 44,7 | 87 | 77 | 88,5 | 219 | 136 | 62,1 |
| Autochtones | 171 | 21 | 12,3 | 130 | 27 | 20,8 | 301 | 48 | 15,9 |
| AsiatiquesTableau 3 - Note * | 136 | 33 | 24,3 | 7 | 6 | 85,7 | 143 | 39 | 27,3 |
| AutreTableau 3 - Note † | 102 | 13 | 12,7 | 13 | 6 | 46,2 | 115 | 19 | 16,5 |
| Inconnue | 225 | 36 | 16,0 | 46 | 33 | 71,7 | 271 | 69 | 25,5 |
| Total | 1 443 | 202 | 14,0 | 363 | 167 | 46,0 | 1 806 | 369 | 20,4 |
Dans l’ensemble, les personnes de race ou d’origine ethnique noire présentaient une proportion plus importante de sous-types autres que B (62,1 %), tandis que les personnes de race ou d’origine ethnique blanche avaient la plus faible proportion de sous-types autres que B (7,7 %). Étant donné que c’est dans les pays où le VIH est endémique que les sous-types autres que B sont les plus prévalents, la proportion supérieure de sous-types autres que B s’expliquait probablement par le fait que plus de la moitié (57,5 %) des personnes de race ou d’origine ethnique noire étaient classées dans la catégorie d’exposition Contacts hétérosexuels/régions endémiques (voir le Tableau 5).
Âge
La Figure 4 représente le nombre et la proportion des sous-types autres que B par groupe d’âge. La proportion des sous-types autres que B allait de 9,9 % à 21,0 % selon les tranches d’âge.
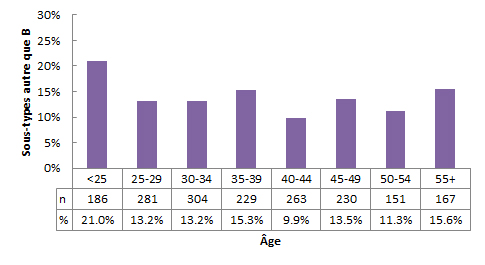
Figure 4 - Description textuel
| Âge | % | n |
|---|---|---|
| <25 | 21,0 % | 186 |
| 25-29 | 13,2 % | 281 |
| 30-34 | 13,2 % | 304 |
| 35-39 | 15,3 % | 229 |
| 40-44 | 9,9 % | 263 |
| 45-49 | 13,5 % | 230 |
| 50-54 | 11,3 % | 151 |
| 55+ | 15,6 % | 167 |
Sexe et catégorie d’exposition
Le Tableau 4 représente le nombre et la proportion des sous-types autres que B par sexe et par catégorie d’exposition. Les personnes de la catégorie d’exposition Contacts hétérosexuels/régions endémiques présentaient la proportion la plus élevée (85,0 %) de sous-types autres que B, suivies par celles de la catégorie d’exposition Contacts hétérosexuels/régions non endémiques (25,5 %). La proportion de sous-types autres que B était plus élevée chez les femmes que chez les hommes dans toutes les catégories d’exposition.
| Hommes | Femmes | TotalTableau 4 - Note * | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Catégorie d’exposition | n | Sous-types autres que B | % | n | Sous-types autres que B | % | n | Sous-types autres que B | % |
| HARSAH | 813 | 68 | 8,4 | - | - | - | 813 | 68 | 8,4 |
| HARSAH/UDI | 37 | 4 | 10,8 | - | - | - | 37 | 4 | 10,8 |
| UDI | 149 | 11 | 7,4 | 86 | 7 | 8,1 | 235 | 18 | 7,7 |
| Contacts hétérosexuels/régions endémiques | 65 | 49 | 75,4 | 82 | 76 | 92,7 | 147 | 125 | 85,0 |
| Contacts hétérosexuels/régions non endémiques | 222 | 39 | 17,6 | 146 | 55 | 37,7 | 368 | 94 | 25,5 |
| Autre | 13 | 5 | 38,5 | 13 | 6 | 46,2 | 26 | 11 | 42,3 |
| Inconnue | 144 | 26 | 18,1 | 36 | 23 | 63,9 | 180 | 49 | 27,2 |
| Total | 1 443 | 202 | 14,0 | 363 | 167 | 46,0 | 1 806 | 369 | 20,4 |
Race ou origine ethnique et catégorie d’exposition
Le Tableau 5 représente le nombre et la proportion des sous-types B et autres que B par race ou origine ethnique et par catégorie d’exposition. Une proportion plus importante de sous-types autres que B (pour lesquels la taille de l’échantillon était supérieure à deux) a été observée chez les personnes de race ou d’origine ethnique noire qui appartenaient à la catégorie d’exposition Contacts hétérosexuels/régions endémiques (85,7 %), chez les personnes de race ou d’origine ethnique noire qui appartenaient à la catégorie d’exposition Contacts hétérosexuels/régions non endémiques (45,8 %) et chez les personnes de race ou d’origine ethnique autochtone qui appartenaient à la catégorie d’exposition Contacts hétérosexuels/régions non endémiques (23,8 %).
| Blancs | Noirs | Autochtones | Asiatiques | Autre | Inconnue | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Catégorie d’exposition | n | Sous-types autres que B | % | n | Sous-types autres que B | % | n | Sous-types autres que B | % | n | Sous-types autres que B | % | n | Sous-types autres que B | % | n |
| HARSAH | 481 | 23 | 4,8 | 59 | 10 | 16,9 | 20 | 1 | 5,0 | 104 | 20 | 19,2 | 78 | 11 | 14,1 | 71 |
| HARSAH/UDI | 21 | 1 | 4,8 | 2 | 0 | 0,0 | 7 | 0 | 0,0 | 4 | 2 | 50,0 | 2 | 0 | 0,0 | 1 |
| UDI | 84 | 4 | 4,8 | 1 | 0 | 0,0 | 131 | 14 | 10,7 | 0 | 0 | 0,0 | 9 | 0 | 0,0 | 10 |
| Contacts hétérosexuels/ régions endémiques |
2 | 1 | 50,0 | 126 | 108 | 85,7 | 0 | 0 | 0,0 | 1 | 1 | 100 | 3 | 2 | 66,7 | 15 |
| Contacts hétérosexuels/ régions non endémiques |
149 | 27 | 18,1 | 24 | 11 | 45,8 | 126 | 30 | 23,8 | 24 | 12 | 50,0 | 20 | 6 | 30,0 | 25 |
| Autre | 8 | 1 | 12,5 | 5 | 5 | 100 | 7 | 2 | 28,6 | 1 | 1 | 100 | 1 | 0 | 0,0 | 4 |
| Inconnue | 13 | 1 | 7,7 | 2 | 2 | 100 | 10 | 1 | 10,0 | 9 | 3 | 33,3 | 2 | 0 | 0,0 | 149 |
| Total | 758 | 58 | 7,7 | 219 | 136 | 62,1 | 301 | 48 | 15,9 | 143 | 39 | 27,3 | 115 | 19 | 16,5 | 275 |
Discussion
Dans l’ensemble, il y avait une proportion plus élevée d’échantillons de sous-types autres que B dans le Programme SSR entre 2012 et 2013 par rapport aux échantillons du Programme en 2008Note de bas de page 1 (20,4 % par rapport à 11,6 %, respectivement). Les sous-types C, A, CRF02_AG et CRF01_AE continuaient de représenter la proportion la plus élevée de sous-types autres que B.
Résistance aux médicaments
Résistance aux médicaments par province
Des mutations associées à une résistance à au moins une classe de médicaments étaient présentes dans 251 échantillons sur 1 811 (13,9 %) entre 2012 et 2013. La figure 5 représente le nombre et la proportion des échantillons pharmacorésistants par province. La Nouvelle-Écosse a été exclue en raison du faible nombre d’échantillons (n = 2). La Saskatchewan présentait la plus forte proportion d’échantillons pharmacorésistants (17,4 %), suivie par le Manitoba et l’Ontario (15,9 % et 14,7 %, respectivement). La prévalence de la résistance aux médicaments dans les autres provinces était comprise entre 10,7 % et 11,6 %.
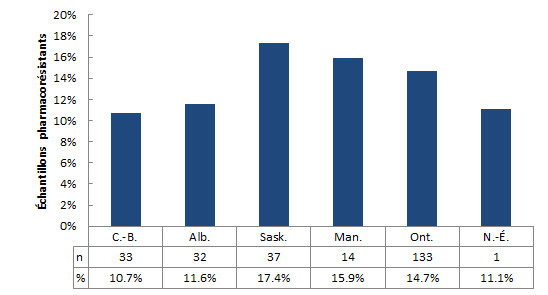
Figure 5 - Description textuel
| C.-B. | Alb. | Sask. | Man. | Ont. | |
|---|---|---|---|---|---|
| % | 10,7 % | 11,6 % | 17,4 % | 15,9 % | 14,7 % |
| n | 33 | 32 | 37 | 14 | 133 |
Résistance aux médicaments par caractéristiques épidémiologiques
Sexe et race ou origine ethnique
Le Tableau 6 présente le nombre et la proportion des échantillons pharmacorésistants par sexe et par race ou origine ethnique. Les proportions globales de pharmacorésistance étaient les plus élevées dans les catégories de race ou d’origine ethnique des Autochtones (14,6 %) et des Blancs (14,4 %). Les personnes de race ou d’origine ethnique noire présentaient la plus faible proportion de résistance aux médicaments (11,9 %). Une proportion plus élevée d’échantillons pharmacorésistants a été observée chez les hommes par rapport aux femmes dans toutes les catégories de race ou d’origine ethnique, à l’exception de la catégorie « Autre ».
| Hommes | Femmes | Total | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Race/origine ethnique | n | PRTableau 6 - Note * | % | n | PR | % | n | PR | % |
| Blancs | 677 | 101 | 14,9 | 80 | 8 | 10,0 | 757 | 109 | 14,4 |
| Noirs | 132 | 18 | 13,6 | 87 | 8 | 9,2 | 219 | 26 | 11,9 |
| Autochtones | 171 | 29 | 17,0 | 130 | 15 | 11,5 | 301 | 44 | 14,6 |
| Asiatiques | 136 | 19 | 14,0 | 7 | 0 | 0,0 | 143 | 19 | 13,3 |
| Autre | 102 | 12 | 11,8 | 13 | 2 | 15,4 | 115 | 14 | 12,2 |
| Inconnue | 225 | 32 | 14,2 | 46 | 7 | 15,2 | 271 | 39 | 14,4 |
| Total | 1 443 | 211 | 14,6 | 363 | 40 | 11,0 | 1 806 | 251 | 13,9 |
Âge
Le nombre et la proportion des échantillons présentant une résistance aux médicaments par groupe d’âge sont présentés dans la figure 6. Les échantillons des groupes d’âge de moins de 25 ans et de 20 à 24 ans présentaient les plus fortes proportions de résistance aux médicaments (21,0 % et 20,9 %, respectivement). La proportion d’échantillons pharmacorésistants était comprise entre 9,9 % et 16,7 % dans les autres catégories d’âge et était la plus faible dans le groupe d’âge de 40 à 44 ans.
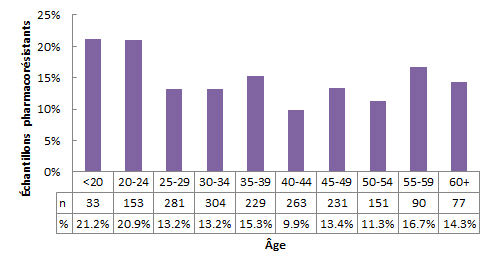
Figure 6 - Description textuel
| Âge | % | n |
|---|---|---|
| <20 | 21,2 % | 33 |
| 20-24 | 20,9 % | 153 |
| 25-29 | 13,2 % | 281 |
| 30-34 | 13,2 % | 304 |
| 35-39 | 15,3 % | 229 |
| 40-44 | 9,9 % | 263 |
| 45-49 | 13,4 % | 231 |
| 50-54 | 11,3 % | 151 |
| 55-59 | 16,7 % | 90 |
| 60+ | 14,3 % | 77 |
Sexe et catégorie d’exposition
Le Tableau 7 présente le nombre et la proportion des échantillons pharmacorésistants par sexe et par catégorie d’exposition. Les échantillons des personnes appartenant aux catégories d’exposition UDI et HARSAH présentaient des proportions plus élevées de résistance aux médicaments, avec 18,3 % et 16,0 %, respectivement. Les échantillons des personnes appartenant à la catégorie d’exposition Contacts hétérosexuels/régions non endémiques présentaient la plus faible proportion de résistance aux médicaments, avec 8,7 %. Les échantillons prélevés chez des femmes présentaient des proportions plus élevées de résistance aux médicaments dans toutes les catégories d’exposition sauf celle des UDI.
| Hommes | Femmes | TotalTableau 7 - Note † | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Catégorie d’exposition | n | PRTableau 7 - Note * | % | n | PR | % | n | PR | % |
| HARSAH | 813 | 130 | 16,0 | - | - | - | 813 | 130 | 16,0 |
| HARSAH/UDI | 37 | 5 | 13,5 | - | - | - | 37 | 5 | 13,5 |
| UDI | 149 | 31 | 20,8 | 86 | 12 | 14,0 | 235 | 43 | 18,3 |
| Contacts hétérosexuels/régions endémiques | 65 | 6 | 9,2 | 82 | 9 | 11,0 | 147 | 15 | 10,2 |
| Contacts hétérosexuels/régions non endémiques | 222 | 19 | 8,6 | 146 | 13 | 8,9 | 368 | 32 | 8,7 |
| Autre | 13 | 1 | 7,7 | 13 | 2 | 15,4 | 26 | 3 | 11,5 |
| Inconnue | 144 | 19 | 13,2 | 36 | 4 | 11,1 | 180 | 23 | 12,8 |
| Total | 1 443 | 211 | 14,6 | 363 | 40 | 11,0 | 1 806 | 251 | 13,9 |
Race ou origine ethnique et catégorie d’exposition
Le Tableau 8 présente le nombre et la proportion des échantillons pharmacorésistants par race ou origine ethnique et par catégorie d’exposition. La résistance aux médicaments était la plus élevée chez les personnes de race ou d’origine ethnique autochtone appartenant à la catégorie d’exposition HARSAH/UDI (28,6 %), chez les personnes de race ou d’origine ethnique autochtone appartenant à la catégorie d’exposition HARSAH (25 %) et chez les personnes de race ou d’origine ethnique blanche appartenant à la catégorie d’exposition UDI (22,6 %). Toutefois, compte tenu des faibles nombres, la prudence est de rigueur dans l’interprétation de ces données.
| Blancs | Noirs | Autochtones | Asiatiques | Autre | Inconnue | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Catégorie d’exposition | n | PR | % | n | PR | % | n | PR | % | n | PR | % | n | PR | % | n |
| HARSAH | 481 | 79 | 16,4 | 59 | 10 | 16,9 | 20 | 5 | 25,0 | 104 | 18 | 17,3 | 78 | 9 | 11,5 | 71 |
| HARSAH/UDI | 21 | 2 | 9,5 | 2 | 0 | 0,0 | 7 | 2 | 28,6 | 4 | 0 | 0,0 | 2 | 1 | 50,0 | 1 |
| UDI | 84 | 19 | 22,6 | 1 | 0 | 0,0 | 131 | 22 | 16,8 | 0 | 0 | 0,0 | 9 | 1 | 11,1 | 10 |
| Contacts hétérosexuels/ régions endémiques |
2 | 0 | 0,0 | 126 | 12 | 9,5 | 0 | 0 | 0,0 | 1 | 0 | 0,0 | 3 | 0 | 0,0 | 15 |
| Contacts hétérosexuels/ régions non endémiques |
149 | 8 | 5,4 | 24 | 4 | 16,7 | 126 | 13 | 10,3 | 24 | 0 | 0,0 | 20 | 3 | 15,0 | 25 |
| Autre | 8 | 0 | 0,0 | 5 | 0 | 0,0 | 7 | 2 | 28,6 | 1 | 0 | 0,0 | 1 | 0 | 0,0 | 4 |
| Inconnue | 13 | 1 | 7,7 | 2 | 0 | 0,0 | 10 | 0 | 0,0 | 9 | 1 | 11,1 | 2 | 0 | 0,0 | 149 |
| Total | 758 | 109 | 14,4 | 219 | 26 | 11,9 | 301 | 44 | 14,6 | 143 | 19 | 13,3 | 115 | 14 | 12,2 | 275 |
Résistance aux médicaments par classe de médicaments
La figure 7 présente la répartition de la pharmacorésistance par classe de médicaments. Plus des trois quarts (83,7 %) des échantillons pharmacorésistants n’étaient résistants qu’à une seule classe de médicaments. Sur les 251 échantillons présentant une résistance aux médicaments, la résistance uniquement à la classe des INNTI prédominait (45,0 %). Sur les échantillons multirésistants (MR), c’est-à-dire résistants à au moins deux classes de médicaments, la résistance aux INNTI et aux INTI était la plus courante (12,0 % de tous les échantillons pharmacorésistants). Une liste détaillée du nombre et de la proportion des mutations associées à une pharmacorésistance par classe de médicaments est présentée à l’annexe IV.
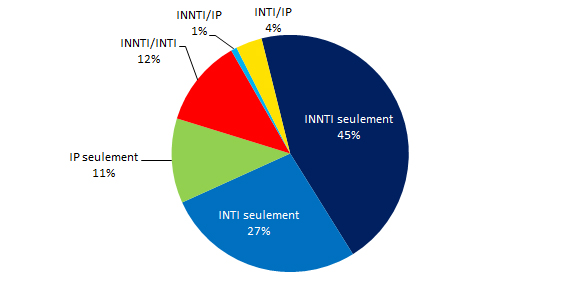
Figure 7 - Description textuel
| Résistance aux médicaments | n | % |
|---|---|---|
| INNTI seulement | 113 | 5,2 |
| INTI seulement | 68 | 3,9 |
| IP seulement | 29 | 1,8 |
| INNTI/INTI | 30 | 1,8 |
| INNTI/IP | 2 | 0,1 |
| INTI/IP | 9 | 0,6 |
La répartition de la résistance aux classes de médicaments par province est présentée dans la figure 8. La Nouvelle-Écosse a été exclue en raison du faible nombre d’échantillons (n = 2). La résistance aux INNTI était prédominante en Saskatchewan (81,1 % de toutes les échantillons pharmacorésistants), la résistance aux INTI était prédominante au Manitoba (64,3 % de tous les échantillons pharmacorésistants), la résistance aux IP était la plus élevée en Colombie-Britannique (24,2 % de tous les échantillons pharmacorésistants), et la multirésistance était prédominante en Ontario (25,6 % de tous les échantillons pharmacorésistants).
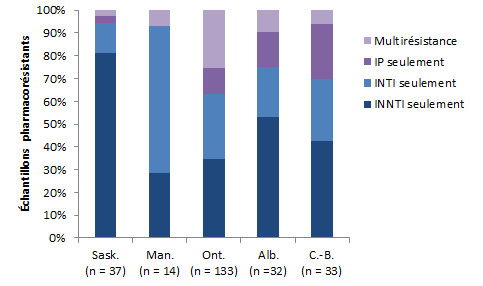
Figure 8 - Description textuel
| INNTI seulement | INTI seulement | IP seulement | Multirésistance | |
|---|---|---|---|---|
| Sask, (n = 37) |
14,1 % | 2,3 % | 0,5 % | 0,5 % |
| Man, (n = 14) |
4,5 % | 10,2 % | 0,0 % | 1,1 % |
| Ont, (n = 133) |
5,1 % | 4,2 % | 1,7 % | 3,7 % |
| Alb, (n =32) |
6,2 % | 2,5 % | 1,8 % | 1,1 % |
| C,-B, (n = 33) |
4,5 % | 2,9 % | 2,6 % | 0,6 % |
Résistance aux médicaments par sous-type
Le Tableau 9 et le Tableau 10 présentent le nombre et la proportion des échantillons pharmacorésistants par sous-type. Les échantillons du sous-type B présentaient une proportion de multirésistance comparable à celle des échantillons de sous-types autres que B (2,3 % et 2,2 %, respectivement), mais une proportion supérieure de pharmacorésistance globale (15,5 % et 7,6 %, respectivement).
| Sous-type B | Sous-types autre que B | Total | ||||
|---|---|---|---|---|---|---|
| Pharmacorésistance | n | % | n | % | n | % |
| Aucune | 1 218 | 84,5 | 342 | 92,4 | 1 560 | 86,1 |
| Résistance à une seule classe de médicaments | ||||||
| INNTI seulement | 100 | 6,9 | 13 | 3,5 | 113 | 6,2 |
| INTI seulement | 65 | 4,5 | 3 | 0,8 | 68 | 3,8 |
| IP seulement | 25 | 1,7 | 4 | 1,1 | 29 | 1,6 |
| Résistance à plusieurs classes de médicaments | ||||||
| INNTI/INTI | 23 | 1,6 | 7 | 1,9 | 30 | 1,7 |
| INNTI/IP | 2 | 0,1 | 0 | 0,0 | 2 | 0,1 |
| INTI/IP | 8 | 0,6 | 1 | 0,3 | 9 | 0,5 |
| INNTI/INTI/IP | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Total des échantillons | 1 441 | 100 % | 370 | 100 % | 1 811 | 100 % |
| Sous-type B | Sous-types autre que B | Total | ||||
|---|---|---|---|---|---|---|
| Pharmacorésistance | n | % | n | % | n | % |
| Aucune | 1 218 | 84,5 | 342 | 92,4 | 1 560 | 86,1 |
| Pharmacorésistance toutes classes confondues – Total | 223 | 15,5 | 28 | 7,6 | 251 | 13,9 |
| Résistance aux INNTI – Total | 125 | 8,7 | 20 | 5,4 | 145 | 8.0 |
| Résistance aux INTI – Total | 96 | 6,7 | 11 | 3,0 | 107 | 5,9 |
| Résistance aux IP – Total | 35 | 2,4 | 5 | 1,4 | 40 | 2,2 |
| Multirésistance – Total | 33 | 2,3 | 8 | 2,2 | 41 | 2,3 |
Résistance aux médicaments couramment prescrits contre le VIH
La section suivante rend compte des niveaux de pharmacorésistance aux antirétroviraux couramment prescrits. L’analyse a été effectuée au moyen du Genotypic Resistance Interpretation Algorithm (algorithme d’interprétation de la résistance génotypique) lié à la base de données sur la résistance du VIH aux médicaments de l’Université Stanford, qui associe les mutations conférant une pharmacorésistance à une résistance potentielle faible, faible, modérée ou élevéeNote de bas de page 8. De plus amples renseignements sur ces interprétations sont présentés à l’annexe V.
Inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI)
La Figure 9 représente la résistance aux médicaments de la classe des INNTI couramment prescrits. Au total, 145 échantillons (8,0 % de tous les échantillons et 57,8 % de tous les échantillons pharmacorésistants) étaient résistants à au moins un INNTI. Tous les échantillons résistants aux INNTI présentaient une certaine forme de résistance à la névirapine (NVP; 100 %) et à l’éfavirenz (EFV; 100 %), et les échantillons résistants à la NVP présentaient presque tous (99,3 %) une résistance élevée.
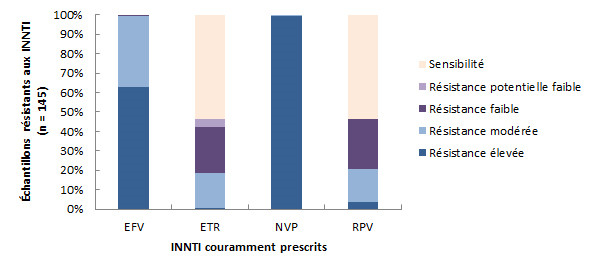
Figure 9 - Description textuel
| ATV/r | DRV/r | FPV/r | IDV/r | LPV/r | NFV | SQV/r | TPV/r | |
|---|---|---|---|---|---|---|---|---|
| Résistance élevée | 8 | 0 | 5 | 8 | 8 | 20 | 8 | 0 |
| Résistance modérée | 2 | 0 | 7 | 11 | 2 | 2 | 11 | 10 |
| Résistance faible | 11 | 2 | 9 | 2 | 11 | 12 | 5 | 0 |
| Résistance potentielle faible | 15 | 0 | 12 | 12 | 11 | 1 | 0 | 5 |
| Sensibilité | 3 | 37 | 6 | 6 | 7 | 4 | 15 | 24 |
Inhibiteurs nucléosidiques de la transcriptase inverse (INTI)
Les niveaux de résistance aux médicaments de la classe des INTI couramment prescrits sont présentés dans la figure 10. Au total, 107 échantillons (5,9 % de tous les échantillons et 42,6 % de tous les échantillons pharmacorésistants) étaient résistants à au moins un INTI. La majorité des échantillons présentant une résistance à un INTI étaient résistants à la zidovudine (AZT; 89,7 %), à l’abacavir (ABC; 90,7 %), à la stavudine (D4T; 92,5 %) et/ou à la didanosine (DDI; 98,1 %). En comparaison, moins d’un quart des échantillons étaient résistants à la lamivudine (3TC) et/ou à l’emtricitabine (FTC) (18,7 % pour les deux).
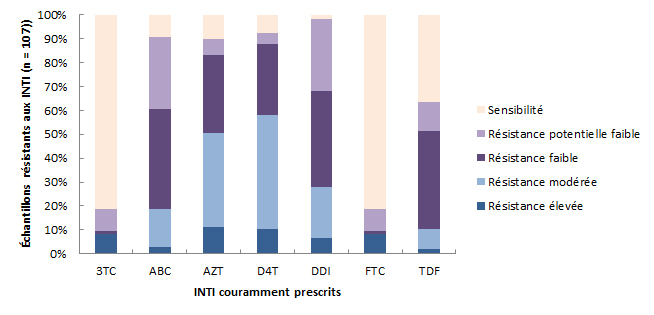
Figure 10 - Description textuel
| 3TC | ABC | AZT | D4T | DDI | FTC | TDF | |
|---|---|---|---|---|---|---|---|
| Résistance élevée | 9 | 3 | 12 | 11 | 7 | 9 | 2 |
| Résistance modérée | 0 | 17 | 42 | 51 | 23 | 0 | 9 |
| Résistance faible | 1 | 45 | 35 | 32 | 43 | 1 | 44 |
| Résistance potentielle faible | 10 | 32 | 7 | 5 | 32 | 10 | 13 |
| Sensibilité | 87 | 10 | 11 | 8 | 2 | 87 | 39 |
Inhibiteurs de la protéase (IP)
La Figure 11 représente les niveaux de résistance aux médicaments de la classe des IP couramment prescrits. Au total, 40 échantillons (2,2 % de tous les échantillons et 15,9 % de tous les échantillons pharmacorésistants) présentaient une résistance à au moins un IP; 89,7 % étaient résistants au nelfinavir (NFV). En comparaison, seulement 5,1 % et 38,5 % des échantillons étaient résistants au darunavir/ritonavir (DRV/r) et au tipranavir (TPV/r), respectivement.
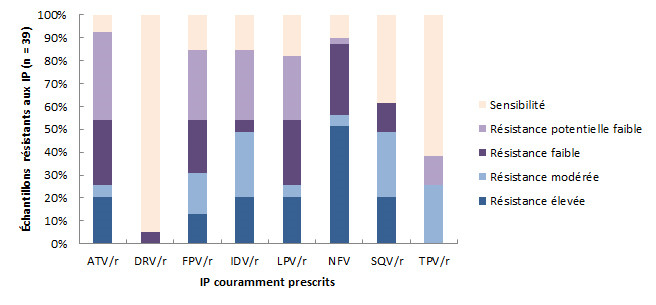
Figure 11 - Description textuel
| EFV | ETR | NVP | RPV | |
|---|---|---|---|---|
| Résistance élevée | 91 | 1 | 144 | 5 |
| Résistance modérée | 53 | 26 | 1 | 25 |
| Résistance faible | 1 | 34 | 0 | 37 |
| Résistance potentielle faible | 0 | 6 | 0 | 0 |
| Sensibilité | 0 | 78 | 0 | 78 |
Discussion
Dans l’ensemble, la proportion d’échantillons pharmacorésistants dans le Programme SSR entre 2012 et 2013 était relativement comparable à la proportion d’échantillons pharmacorésistants dans le Programme en 2008 (13,9 % par rapport à 13,4 %, respectivement). Le tableau 11 présente une comparaison du nombre et de la proportion d’échantillons pharmacorésistants en 2008 par rapport à 2012-2013.
| 2008 | 2012-2013 | |||
|---|---|---|---|---|
| Pharmacorésistance | n | % | n | % |
| INNTI seulement | 29 | 49,2 | 113 | 45,0 |
| INTI seulement | 19 | 32,2 | 68 | 27,0 |
| IP seulement | 6 | 10,2 | 29 | 11,0 |
| Multirésistance | 5 | 8,5 | 41 | 17,0 |
| Pharmacorésistance – Total | 59 | 100,0 | 251 | 100,0 |
Limites
Les données présentées dans ce rapport sont soumises à quelques limites. En premier lieu, le Programme SSR a pour but de surveiller la pharmacorésistance transmise chez les personnes n’ayant jamais été traitées. Étant donné que la surveillance est basée sur les prélèvements diagnostiques résiduels, on suppose que ces personnes n’ont jamais reçu de traitement contre le VIH. Toutefois, il est possible que, dans certains cas, des personnes aient déjà été exposées à un traitement antirétroviral, notamment dans le cadre d’une prophylaxie préexposition ou d’une prophylaxie post-exposition. En second lieu, dans certains cas, les échantillons étaient de trop petite taille pour permettre une interprétation significative et la prudence est de rigueur lors des comparaisons entre les groupes. Enfin, comme cela a été mentionné plus haut, ce rapport présente des comparaisons limitées des tendances dans le temps en raison d’une interruption des données entre 2008 et 2012-2013.
Conclusion
Le Programme SSR fait partie intégrante de l’effort national de lutte contre l’épidémie de VIH au Canada. De 2012 à 2013, le programme a collecté et génotypé 1 811 échantillons de personnes ayant reçu un nouveau diagnostic de VIH dans six provinces et a associé les résultats aux données épidémiologiques. Parmi les échantillons qui ont pu être génotypés avec succès, 13,9 % présentaient une certaine forme de résistance aux médicaments, ce qui était comparable à la proportion d’échantillons présentant une pharmacorésistance en 2008 (13,4 %).
La surveillance de la résistance aux médicaments permet d’améliorer le suivi de l’infection au VIH au Canada, en apportant des connaissances sur les souches du VIH en circulation et sur la pharmacorésistance transmise, en particulier dans les populations présentant un risque accru d’être infectées par le VIH, afin de cibler les efforts de prévention et de contrôle. Pour l’avenir, le Programme SSR étudie de nouveaux moyens de poursuivre la surveillance des souches du VIH et de la résistance aux médicaments qui permettraient de réaliser des économies de ressources. Ces renseignements continueront de guider les cliniciens, les professionnels de la santé publique, les gestionnaires des programmes de lutte contre le VIH et les responsables des politiques dans la mise au point d’options de traitement, de recommandations de santé publique et de programmes d’intervention ciblés.
Références
Annexes
Annexe I : Classification par catégorie d’exposition
Les cas de VIH sont classés par les provinces et les territoires dans une seule catégorie d’exposition en fonction des données sur les facteurs de risque reçues dans le cadre de la surveillance de routine des cas. Ces catégories d’exposition sont définies ci-dessous.
Lorsque plus d’un facteur de risque est signalé pour un cas, la hiérarchie des catégories d’exposition élaborée par chaque province est utilisée pour classer le cas selon la catégorie d’exposition qui figure en premier (ou le plus haut) dans la hiérarchie. Par exemple, les utilisateurs de drogues injectables (UDI) peuvent également présenter un risque d’infection au VIH en raison de leurs activités hétérosexuelles. Toutefois, l’utilisation de drogues injectables est considérée comme l’activité la plus risquée entraînant un plus grand risque de transmission du VIH. La seule exception est celle des hommes ayant des relations sexuelles avec d’autres hommes (HARSAH) et qui se sont également injectés des drogues, étant donné qu’il est généralement accepté que ces activités présentent un niveau de risque relativement équivalent et qu’on ne sait pas lequel de ces facteurs est à l’origine de l’infection au VIH. Ces cas sont classés dans la catégorie d’exposition combinée HARSAH/UDI.
Pour la plupart des analyses de ce rapport, les catégories d’exposition Transmission périnatale, Receveur de sang et Receveur de facteurs de coagulation ont été regroupées avec la catégorie d’exposition Autre. En outre, les catégories d’exposition Contacts hétérosexuels/régions non endémiques – Risque élevé et Contacts hétérosexuels/régions non endémiques – Aucun risque signalé ont été regroupées en une seule catégorie d’exposition Contacts hétérosexuels/régions non endémiques.
Catégories d’exposition
- Transmission périnatale :
- Transmission du VIH d’une mère infectée à son enfant in utero, durant l’accouchement ou par l’allaitement maternel.
- HARSAH/UDI :
- Hommes ayant des relations sexuelles avec d’autres hommes et qui s’injectent des drogues.
- HARSAH :
- Hommes ayant des relations sexuelles avec d’autres hommes, que ces relations soient homosexuelles ou bisexuelles.
- UDI :
- Utilisation de drogues injectables.
- Receveur de facteurs de coagulation :
- Personne qui a reçu des produits provenant des échantillons regroupés de concentrés de facteurs de coagulation VIII ou IX pour le traitement de l’hémophilie ou d’une autre coagulopathie.
- Receveur de sang :
- Personne qui a reçu avant 1985 une transfusion de sang total ou de composants sanguins, comme des concentrés de globules rouges, du plasma, des plaquettes ou des cryoprécipités.
- Contacts hétérosexuels/régions endémiques :
- Personne née dans un pays où le VIH est endémique (Annexe III).
- Contacts hétérosexuels/régions non endémiques – Risque élevé :
- Personne déclarant des contacts hétérosexuels avec un individu infecté par le VIH ou à risque accru d’infection au VIH (p. ex. une personne qui s’injecte des drogues, un homme bisexuel ou une personne originaire d’un pays où le VIH est endémique).
- Contacts hétérosexuels/régions non endémiques – Aucun risque signalé :
- Personne pour laquelle les contacts hétérosexuels sont le seul facteur de risque signalé et on ne sait rien du risque d’infection au VIH du partenaire.
- Autre :
- Personne pour laquelle le mode de transmission du VIH est connu, mais ne peut pas être classé dans l’une des grandes catégories d’exposition présentées ici (par exemple, une femme qui reçoit du sperme d’un donneur séropositif pour le VIH).
- Inconnue :
- Personne pour laquelle la catégorie d’exposition n’est pas signalée ou est inconnue.
- D’après :
- Agence de la santé publique du Canada. Le VIH et le sida au Canada : Rapport de surveillance en date du 31 décembre 2014. Ottawa : Ministre des Travaux publics et des Services gouvernementaux Canada; 2015.
Annexe II : Souches du VIH et résistance aux médicaments au Québec, 2012-2013
Introduction
Le génotypage est effectué dans le cadre du suivi clinique des patients infectés par le VIH afin de déterminer la résistance aux antirétroviraux. En cas d’échec thérapeutique, le génotypage constitue un outil précieux pour guider les cliniciens en vue de déterminer la stratégie de traitement optimale adaptée au profil de résistance du VIH-1 chez le patient. Dans la province du Québec, le traitement antirétroviral est disponible universellement pour toutes les personnes infectées par le VIH.
Le génotypage du VIH effectué dans le cadre du suivi clinique de routine a débuté en octobre 2001 par l’intermédiaire d’un réseau de trois laboratoires situés à l’Hôpital Notre-Dame (HND) au Centre hospitalier de l’Université de Montréal (CHUM), au Centre Sida McGill à l’Hôpital général juif (HGJ) et au Laboratoire de santé publique du Québec (LSPQ). Un comité consultatif clinique est en place, qui détermine les indications pour le génotypage du VIH et examine la nécessité d’ajouter de nouveaux tests d’analyse à ce programme. Depuis 2001, les indications cliniques pour le génotypage du VIH comprennent l’échec thérapeutique, la transmission périnatale, les femmes enceintes séropositives pour le VIH et l’infection primaire au VIH. Cette dernière est définie comme une infection au VIH récemment diagnostiquée pour laquelle la séroconversion a probablement eu lieu dans les six mois précédant le prélèvement de l’échantillon diagnostique. En 2004, le génotypage a commencé pour les patients atteints d’une infection au VIH établie dans le but d’évaluer la résistance aux antirétroviraux chez les personnes n’ayant jamais été traitées qui sont séropositives depuis au moins six mois.
Méthodologie
Les trois laboratoires du réseau utilisent des appareils normaux d’amplification des gènes et des méthodes de séquençage standard. En 2012 et 2013, le programme du Québec a publié des rapports sur la résistance aux médicaments à partir du phénotypage virtuel (VirtualPhenotype ou vircoTYPE, Virco) effectué selon des méthodes analytiques mises au point par Virco (Janssen Diagnostics). Malgré la décentralisation des analyses, les données du génotypage ainsi que l’interprétation des résultats sur la résistance aux antirétroviraux générés par les trois laboratoires sont regroupées dans une base de données unique. Des données sociodémographiques non nominales, des renseignements cliniques relatifs au test de génotypage prescrit et des mesures de la charge virale du VIH sont ajoutés aux résultats du génotypage. La charge virale peut être évaluée à partir du même échantillon que celui soumis pour le génotypage ou peut avoir été analysée sur un échantillon antérieur prélevé jusqu’à deux mois avant le test de génotypage. Il n’est pas obligatoire de fournir une justification clinique et des données sur la charge virale pour que le génotypage soit effectué.
Dans l’ensemble, la base de données du programme provincial sert d’outil de gestion et de contrôle de la qualité interne. Les données d’analyse sont saisies directement à partir des résultats fournis par les essais de séquençage, tandis que les interprétations de la résistance et les sous-types du VIH-1 sont obtenus à partir de rapports secondaires. Les données sociodémographiques sont demandées par chacun des laboratoires de façon rétroactive et sont intégrées à la base de données selon un calendrier prédéterminé. Chaque centre utilise un identifiant unique pour le suivi des dossiers. Ces données n’étant pas nominales, il n’est pas possible d’identifier les patients pour lesquels les analyses sont effectuées plus d’une fois. Les procédures relatives à la gestion intégrée des analyses de laboratoire, telles que l’archivage périodique, limitent également la possibilité de suivre les résultats des patients individuels dans le temps.
Pour toutes les raisons ci-dessus, et afin d’essayer d’exclure les cas en double, les données présentées dans ce rapport s’appuient sur des extraits sélectifs de la base de données. Les données ont été affinées à partir de comparaisons des identifiants uniques, des dates de naissance, des profils de résistance et des séquences de nucléotides. Par exemple, lorsque les séquences de nucléotides de patients ayant la même date de naissance présentaient une différence de moins de 2,0 %, seule la séquence la plus ancienne a été incluse dans l’analyse. La comparaison des profils de résistance a permis la validation des cas sélectionnés. La même méthodologie est systématiquement utilisée pour détecter et contrôler la contamination croisée dans les laboratoires. Bien qu’elle ne soit pas parfaite, cette méthode permet un certain degré de précision dans le repérage du premier test de génotypage effectué pour un patient par le programme provincial. Les résultats présentés par année le sont en fonction de la date de collecte de l’échantillon.
Résultats
Répartition des sous-types du VIH-1
Les données présentées dans cette section s’appuient sur les rapports de résistance aux médicaments du premier test de génotypage du VIH effectué par le programme du Québec (depuis 2001) pour chaque patient enregistré dans la base de données voie/génome (pgDB) en 2012 et 2013. Tous les patients pour lesquels un génotypage du VIH a été effectué ont été inclus.
Le Tableau 12 montre que divers sous-types du VIH ont circulé dans la province du Québec pendant la période étudiée, mais que les sous-types B restaient prédominants (80,9 %). Depuis 2001, il y a eu une augmentation lente mais régulière de la proportion de sous-types autres que B parmi les personnes traitées par des antirétroviraux et suivies par génotypage. Toutefois, parmi les sous-types autres que B, il n’y a pas eu d’augmentation d’un sous-type particulier par rapport aux autres sous-types dans le temps ( Tableau 13 ). La proportion des isolats séquencés correspondant à des échantillons du sous-type C a augmenté pour atteindre 6,6 % en 2005, mais a diminué les années suivantes et est restée stable autour de 5 % en 2012-2013. Ces proportions n’ont pas changé entre 2012 et 2013 ( Tableau 13 ).
Sous-type du VIH-1 |
Nombre | Proportion (%) | % dans les échantillons de sous-types autres que B |
|---|---|---|---|
| B | 1 077 | 81,0 | - |
| C | 62 | 4,7 | 24,5 |
| A/AE | 71 | 5,3 | 28,1 |
| AG | 61 | 4,6 | 23,7 |
| D | 8 | 0,6 | 3,2 |
| F | 12 | 0,9 | 4,7 |
| G | 13 | 1,0 | 5,1 |
| H | 0 | 0,0 | 0,0 |
| J | 1 | 0,1 | 0,4 |
| K | 4 | 0,3 | 1,6 |
| Autres formes recombinantes en circulation | 22 | 1,7 | 8,7 |
| Indéterminé (autre que B) | 0 | 0,0 | 0,0 |
| Total | 1 331 | - | - |
| Année | Sous-type du VIH-1 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| B n (%) |
C | A/AE | AG | D | F | G | H | J | K | Autres CRFTableau 13 - Note * | Indét. | Total | |
| 2012 | 541 (81,5) | 36 | 30 | 32 | 0 | 4 | 7 | 0 | 1 | 3 | 10 | 0 | 664 |
| 2013 | 536 (80,4) | 26 | 41 | 29 | 8 | 8 | 6 | 0 | 0 | 1 | 12 | 0 | 667 |
| Total | 1 077 (80,9) | 62 | 71 | 61 | 8 | 12 | 13 | 0 | 1 | 4 | 22 | 0 | 1 331 |
Près de 77 % des tests de génotypage ont été effectués chez des hommes ( Tableau 14 ). Cette proportion est comparable à la répartition des nouveaux cas de VIH diagnostiqués par sexe au Québec pendant la période étudiée. La proportion de sous-types B était plus élevée chez les hommes (86,4 %) que chez les femmes (62,6 %). La prévalence des sous-types autres que B chez les femmes était donc 2,78 fois supérieure au taux observé chez les hommes.
| Sexe | Sous-type du VIH-1 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| B n (%) |
C | A/AE | AG | D | F | G | H | J | K | Autres CRFTableau 14 - Note * | Indét. | Total | |
| Hommes | 884 (86,4) | 35 | 49 | 27 | 4 | 4 | 3 | 0 | 0 | 4 | 13 | 0 | 1 023 |
| Femmes | 186 (62,2) | 26 | 22 | 33 | 4 | 8 | 10 | 0 | 1 | 0 | 9 | 0 | 299 |
| Inconnu | 7 (77,8) | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 9 |
| Total | 1 077 (80,9) | 62 | 71 | 61 | 8 | 12 | 13 | 0 | 1 | 4 | 22 | 0 | 1 331 |
La répartition des sous-types par groupe d’âge est présentée dans le tableau 15. Une différence a été observée quant à la proportion des sous-types autres que B entre les jeunes et les personnes plus âgées. La proportion de sous-types autres que B diminuait avec l’âge, passant de 58,8 % chez les enfants de moins de 20 ans à 11,6 % chez les personnes âgées de 50 ans et plus; toutefois, la prudence est de rigueur en ce qui concerne l’interprétation compte tenu du faible nombre de personnes dans le groupe d’âge de moins de 20 ans. En général, la prévalence des sous-types autres que B était plus élevée dans les groupes d’âge en dessous de 40 ans par rapport aux personnes des groupes d’âge de plus de 40 ans.
| Groupe d’âge | Sous-type du VIH-1 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| B n (%) |
C | A/AE | AG | D | F | G | H | J | K | Autres CRFTableau 15 - Note * | Indét. | Total | |
| Moins de 15 ans | 4 (28,6) | 4 | 2 | 4 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 15 |
| 15 à 19 ans | 10 (52,6) | 2 | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 19 |
| 20 à 29 ans | 170 (81,3) | 12 | 9 | 11 | 2 | 3 | 1 | 0 | 0 | 0 | 1 | 0 | 209 |
| 30 à 39 ans | 241 (74,1) | 22 | 18 | 26 | 2 | 3 | 3 | 0 | 1 | 0 | 9 | 0 | 325 |
| 40 à 49 ans | 340 (82,9) | 11 | 24 | 14 | 2 | 3 | 5 | 0 | 0 | 3 | 8 | 0 | 410 |
| 50 à 59 ans | 230 (88,1) | 8 | 8 | 4 | 2 | 2 | 3 | 0 | 0 | 1 | 3 | 0 | 261 |
| 60 ans et plus | 82 (89,1) | 3 | 4 | 2 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 92 |
| Total | 1 077 (80,9) | 62 | 71 | 61 | 8 | 12 | 13 | 0 | 1 | 4 | 22 | 0 | 1 331 |
Résistance primaire du VIH-1 aux médicaments
La transmission du VIH résistant aux antirétroviraux est préoccupante d’un point de vue clinique, car il réduit les options de traitement pour les patients. La transmission de souches résistantes aux médicaments complique également le choix des médicaments adéquats pour une prophylaxie post-exposition. La répartition de la pharmacorésistance transmise est présentée dans le Tableau 16 . Les résultats de cette section s’appuient sur des échantillons provenant de patients n’ayant jamais reçu de traitement antirétroviral. Seuls les patients pour lesquels le génotypage du VIH était indiqué à la suite d’un nouveau diagnostic d’infection au VIH (récente ou établie) ou d’une transmission périnatale ont été inclus afin d’exclure les patients déjà traités. La résistance aux antirétroviraux a été évaluée par la présence des mutations primaires figurant dans la mise à jour de 2009 de la liste des mutations pour la surveillance de la pharmacorésistance transmise du VIH publiée par l’Organisation mondiale de la SantéNote de bas de page 7. Ces mutations sont considérées comme étant induites précisément par le traitement antirétroviral. Les mutations associées aux polymorphismes des sous-types du VIH-1 étaient exclues de cette liste.
| Groupe d’âge | Type sauvage | INTI | INNTI | IP | Multirésistance | Total | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | n | |
| Moins de 15 ans | 6 | 100,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 6 |
| 15 à 19 ans | 8 | 100,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 8 |
| 20 à 29 ans | 146 | 92,4 | 0 | 0,0 | 10 | 6,3 | 0 | 0,0 | 2 | 1,3 | 158 |
| 30 à 39 ans | 207 | 93,2 | 3 | 1,4 | 9 | 4,1 | 2 | 0,9 | 1 | 0,5 | 222 |
| 40 à 49 ans | 186 | 92,5 | 4 | 2,0 | 10 | 5,0 | 1 | 0,5 | 0 | 0,0 | 201 |
| 50 à 59 ans | 114 | 91,2 | 5 | 4,0 | 4 | 3,2 | 1 | 0,8 | 1 | 0,8 | 125 |
| 60 ans et plus | 46 | 93,9 | 1 | 2,0 | 2 | 4,1 | 0 | 0,0 | 0 | 0,0 | 49 |
| Total | 713 | 92,7 | 13 | 1,7 | 35 | 4,6 | 4 | 0,5 | 4 | 0,5 | 769 |
Pendant la période étudiée, la majorité (92,7 %) des échantillons génotypés était de type sauvage. Les mutations conférant une résistance aux INNTI étaient les plus courantes parmi les échantillons pharmacorésistants. Une multirésistance (virus présentant des mutations conférant une résistance à trois classes de médicaments) a été décelée dans seulement quatre cas. La présence de mutations conférant une résistance aux antirétroviraux chez des personnes n’ayant jamais reçu de traitement porte à croire que le VIH pharmacorésistant se transmet. Dans l’ensemble, les taux de pharmacorésistance transmise étaient comparables entre les groupes d’âge de 20 ans et plus. Aucune résistance aux médicaments n’a été observée chez les enfants et les jeunes adultes (âgés de moins de 20 ans).
Le Tableau 17 présente la répartition de la pharmacorésistance transmise dans les échantillons prélevés avant le traitement chez les personnes atteintes d’une infection au VIH récente par rapport à celles atteintes d’une infection établie. La proportion de souches résistantes était semblable dans les deux groupes. Une proportion plus élevée de mutations associées à une résistance aux INNTI a été observée parmi les cas d’infection récente, tandis qu’une proportion plus importante de mutations associées à une résistance aux INTI a été constatée parmi les cas d’infection établie.
Durée de l’infection |
Type sauvage | INTI | INNTI | IP | Multirésistance | Total | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | n | |
| Infection récente | 219 | 93,6 | 3 | 1,3 | 11 | 4,7 | 1 | 0,4 | 0 | 0,0 | 234 |
| Infection établie | 494 | 92,3 | 10 | 1,9 | 24 | 4,5 | 3 | 0,6 | 4 | 0,7 | 535 |
| Total | 713 | 92,7 | 13 | 1,7 | 35 | 4,6 | 4 | 0,5 | 4 | 0,5 | 769 |
Discussion
Pour replacer les données du Québec présentées dans ce rapport dans le bon contexte, il est important de répéter qu’au Québec, les échantillons soumis pour le génotypage du VIH ne sont généralement pas les mêmes que ceux qui sont prélevés pour la confirmation en laboratoire de l’infection au VIH. De plus, les personnes séropositives pour le VIH peuvent être asymptomatiques et ne découvrir leur état sérologique que plusieurs années plus tard. Entre le moment de l’infection et le début du traitement antirétroviral, certaines mutations associées à une pharmacorésistance, en particulier celles qui réduisent la capacité réplicative du virus, peuvent disparaître des sous-types en circulation en l’absence de la pression sélective exercée par les médicaments. Par exemple, la mutation M184V, qui confère une résistance à la lamivudine, disparaît rapidement après l’arrêt du traitement. À l’inverse, les mutations aux positions 103, 181 et 190 qui sont induites par les INNTI peuvent persister pendant plusieurs mois ou années, même en l’absence de pression sélective.
En résumé, les données agrégées présentées par le programme provincial du Québec sur l’analyse de la pharmacorésistance du VIH mettent en évidence une évolution dans la répartition des sous-types du VIH. Le sous-type B était le plus prévalent chez les adultes de plus de 50 ans, mais sa proportion relative a diminué dans les groupes d’âge plus jeunes. Cela coïncide avec l’évolution de l’épidémie de VIH au cours de la dernière décennie, sous l’effet des modifications des tendances de transmission du VIH et des déplacements internationaux. La pharmacorésistance transmise n’a apparemment pas augmenté au cours de la période étudiée. Les nouvelles options thérapeutiques qui facilitent l’observance, ainsi que l’introduction de nouvelles classes de médicaments, contribueront probablement à une diminution de l’échec thérapeutique, ce qui pourra faire baisser la transmission des virus résistants aux antirétroviraux. Néanmoins, il est essentiel de poursuivre la surveillance épidémiologique, car elle permet l’amélioration des options de traitement pour la prophylaxie post-exposition.
Auteurs : Hugues Charest, Linda Lemieux et Michel Desrochers (Laboratoire de santé publique du Québec/Institut national de santé publique du Québec).
Collaborateurs : Isabelle Hardy et Michel Roger (Hôpital Notre-Dame du Centre hospitalier universitaire de l’Université de Montréal), Bluma Brenner et Mark Wainberg (Centre Sida McGill, Hôpital général juif de Montréal).
Annexe III : Liste des pays où le VIH est endémique
Pays où le VIH est endémique
- Afrique du Sud
- Angola
- Anguilla
- Antigua-et-Barbuda
- Antilles néerlandaises
- Bahamas
- Barbade
- Bénin
- Bermudes
- Birmanie (Myanmar)
- Botswana
- Burkina Faso
- Burundi
- Cambodge
- Cameroun
- Cap-Vert
- Congo (République démocratique du)
- Côte-d'Ivoire
- Dahomey (Bénin)
- Djibouti
- Dominique
- Érythrée
- Éthiopie
- Gabon
- Gambie
- Ghana
- Grenade
- Guadeloupe
- Guinée équatoriale
- Guinée-Bissau
- Guinée
- Guyana
- Guyane française
- Haïti
- Honduras
- Îles Caïmans
- Îles Turks et Caicos
- Îles Vierges américaines
- Îles Vierges britanniques
- Jamaïque
- Kenya
- Lesotho
- Libéria
- Malawi
- Mali
- Martinique
- Montserrat
- Mozambique
- Namibie
- Niger
- Nigéria
- Ouganda
- République centrafricaine
- République dominicaine
- République du Congo
- Rwanda
- Saint-Kitts-et-Nevis
- Saint-Vincent-et-les-Grenadines
- Sainte-Lucie
- Sénégal
- Sierra Leone
- Somalie
- Soudan
- Suriname
- Swaziland
- Tanzanie
- Tchad
- Thaïlande
- Togo
- Trinité-et-Tobago
- Zaïre (République démocratique du Congo)
- Zambie
- Zimbabwe
Agence de la santé publique du Canada. Personnes provenant de pays où le VIH est endémique – Population noire de descendance africaine et caribéenne vivant au Canada. Agence de la santé publique du Canada, 2010.
| Classe de médicament | Mutation(s) | nAnnexe IV - Note * | % |
|---|---|---|---|
| INTI (Total = 107) | M41L | 56 | 52,3 |
| T215E | 29 | 27,1 | |
| T215S | 17 | 15,9 | |
| L210W | 14 | 13,1 | |
| T215C | 12 | 11,2 | |
| M184V | 9 | 8,4 | |
| D67N | 8 | 7,5 | |
| K219Q | 7 | 6,5 | |
| V75M | 6 | 5,6 | |
| T69D | 5 | 4,7 | |
| L74I | 5 | 4,7 | |
| T215D | 5 | 4,7 | |
| D67G | 2 | 1,9 | |
| K70R | 2 | 1,9 | |
| K65R | 1 | 0,9 | |
| K70E | 1 | 0,9 | |
| F116Y | 1 | 0,9 | |
| Q151M | 1 | 0,9 | |
| K219R | 1 | 0,9 | |
| INNTI (Total = 145) | K103N | 82 | 56,6 |
| G190A | 33 | 22,8 | |
| Y181C | 22 | 15,2 | |
| K101E | 3 | 2,1 | |
| K101P | 2 | 1,4 | |
| K103S | 2 | 1,4 | |
| V106A | 2 | 1,4 | |
| Y181V | 2 | 1,4 | |
| Y188L | 2 | 1,4 | |
| G190E | 2 | 1,4 | |
| P225H | 2 | 1,4 | |
| V106M | 1 | 0,7 | |
| IP (Total = 40) | M46I | 12 | 30 |
| L90M | 9 | 22,5 | |
| G48V | 8 | 20,0 | |
| I54T | 8 | 20,0 | |
| V82A | 8 | 20,0 | |
| M46L | 4 | 10,0 | |
| F53L | 2 | 5,0 | |
| I54L | 2 | 5,0 | |
| I54V | 2 | 5,0 | |
| V82M | 2 | 5,0 | |
| I85V | 2 | 5,0 | |
| D30N | 1 | 2,5 | |
| F53Y | 1 | 2,5 | |
| G73S | 1 | 2,5 | |
| N88D | 1 | 2,5 | |
Annexe V : Système de notation de la résistance aux médicaments
Le système de notation suivant est tiré des instructions d’utilisation du Genotypic Resistance Interpretation Algorithm (algorithme d’interprétation de la résistance génotypique) lié à la base de données sur la résistance du VIH aux médicaments de l’Université StanfordNote de bas de page d.
- Sensibilité :
- Aucun signe de sensibilité réduite aux antirétroviraux par rapport à un virus de type sauvage.
- Résistance potentielle faible :
- La séquence peut contenir des mutations indiquant une exposition antérieure aux antirétroviraux ou peut contenir des mutations qui sont associées à une pharmacorésistance uniquement lorsqu’elles sont accompagnées de mutations supplémentaires.
- Résistance faible :
- Le virus encodé par la séquence soumise peut présenter une sensibilité réduite in vitro aux antirétroviraux, ou les patients porteurs des virus présentant les mutations soumises peuvent avoir une réponse virologique sous-optimale au traitement par l’antirétroviral.
- Résistance modérée :
- Il y a une forte probabilité que l’activité d’un médicament soit réduite, mais le médicament conservera probablement une activité antivirale résiduelle significative.
- Résistance élevée :
- Le niveau de résistance prévu est semblable à celui observé dans des virus présentant des niveaux supérieurs de pharmacorésistance in vitro, ou il existe des données cliniques démontrant que les patients infectés par des virus présentant des mutations de ce type ont généralement une réponse virologique faible, voire nulle, au traitement par l’antirétroviral.
Annexe VI : Partenaires provinciaux du Programme SSR
Colombie-Britannique
- Mel Krajden, Centre de contrôle des maladies de la Colombie-Britannique
- Jason Wong, Centre de contrôle des maladies de la Colombie-Britannique
- Elsie Wong, agente de surveillance sur le terrain
Ontario
- Vanessa Allen, Santé publique Ontario
- Alex Marchand-Austin, Santé publique Ontario
- Doug Sider, Santé publique Ontario
- Ashleigh Sullivan, agente de surveillance sur le terrain
Alberta
- Carmen Charlton, Laboratoire provincial de santé publique de l’Alberta
- Sumana Fathima, ministère de la Santé de l’Alberta
- Mariam Osman, ministère de la Santé de l’Alberta
- Sabrina Plitt, agente de surveillance sur le terrain
Saskatchewan
- Helen Bangura, ministère de la Santé de la Saskatchewan
- Patty Beck, ministère de la Santé de la Saskatchewan
- Greg Horsman, Laboratoire de lutte contre les maladies de la Saskatchewan
- Suresh Khatkar, agent de surveillance sur le terrain
- Paul Levett, Laboratoire de contrôle des maladies de la Saskatchewan
- John Manalo, ministère de la Santé de la Saskatchewan
- Valerie Mann, ministère de la Santé de la Saskatchewan
Manitoba
- Jared Bullard, Laboratoire provincial Cadham
- Paul Van Caeseele, Laboratoire provincial Cadham
- Kamran Kadkhoda, Laboratoire provincial Cadham
- Carla Loeppky, Santé Manitoba
- Tracey Russnak-Redden, agente de surveillance sur le terrain
Nouvelle-Écosse
- Todd Hatchette, Queen Elizabeth II Health Sciences Lab
- Elaine Holmes, ministère de la Santé et du Mieux-être de la Nouvelle-Écosse
- Marie LaFreniere, agente de surveillance sur le terrain