Rapport de 2021 du Système canadien de surveillance de la résistance aux antimicrobiens
Télécharger en format PDF
(Format PDF, 6,38 Mo, 90 pages)
Contactez nous : carss-scsra@phac-aspc.gc.ca
Organisation: Agence de la santé publique du Canada
Publiée : 2022-04-04
Tableau des matières
- Glossaire
- Introduction
- Résumé
- Principales conclusions
- Annexe technique
- Bactériémies au Staphylococcus aureus résistant à la méthicilline (SARM)
- Bactériémies à entérocoques résistants à la vancomycine (ERV)
- Infections et colonisation par des entérobactéries productrices de carbapénémase (EPC)
- Infections au Clostridioides difficile (ICD)
- Infections au Neisseria gonorrhoeae (GC)
- Infections au Mycobacterium tuberculosis (TB)
- Infections au Streptococcus pneumoniae invasif (PI)
- Infections au Streptococcus pyogenes (streptocoque du groupe A) invasif
- Consommation d’antimicrobiens par les humains, Canada 2015 à 2019
- Principales conclusions
- Consommation globale d’antimicrobiens par les humains : perspective nationale
- Consommation globale d’antimicrobiens par les humains : provinces et territoires du Canada
- Consommation globale d’antimicrobiens par les humains : les 5 principales classes d’antimicrobiens
- Consommation globale d’antimicrobiens par les humains : classification AWaRe
- Consommation globale d’antimicrobiens par les humains : perspective internationale
- Consommation d’antimicrobiens par les humains dans le milieu communautaire : doses définies journalières
- Consommation d’antimicrobiens par les humains dans le milieu communautaire : prescriptions exécutées
- Consommation d’antimicrobiens par les humains dans le milieu communautaire : origine des prescriptions
- Consommation d’antimicrobiens par les humains dans le milieu communautaire : carbapénèmes délivrés
- Antimicrobiens achetés par le milieu hospitalier : doses définies journalières
- Prescription d’antimicrobiens dans le milieu communautaire avant et pendant la pandémie de COVID-19
- Antimicrobiens destinés à être utilisés chez les animaux au Canada
- Principales conclusions
- Antimicrobiens vendus pour être utilisés chez les animaux
- Antimicrobiens vendus pour être utilisés chez les animaux : perspective internationale
- Indication de l’utilisation d’antimicrobiens chez les animaux (surveillance au niveau des exploitations)
- Intégration des renseignements sur les antimicrobiens destinés à être utilisés dans tous les secteurs (pour les humains, les animaux et les cultures)
- Auteurs
- Annexes
- Notes de bas de page
- Références
Glossaire
- RAM
- Résistance aux antimicrobiens
- UAM
- Utilisation des antimicrobiens
- MRA
- Microorganismes résistants aux antimicrobiens
- TSA
- Test de sensibilité aux antimicrobiens
- ATC
- Anatomique thérapeutique chimique
- Bactériémie
- Infection du sang
- OC
- Origine communautaire
- ICSA
- Institut canadien de la santé animale
- SCSRA
- Système canadien de surveillance de la résistance aux antimicrobiens
- ICD
- Infection à Clostridioides difficile
- PICRA
- Programme intégré canadien de surveillance de la résistance aux antimicrobiens
- SCSMDO
- Système canadien de surveillance des maladies à déclaration obligatoire
- PCSIN
- Programme canadien de surveillance des infections nosocomiales
- EPC
- Entérobactéries productrices de carbapénémase
- SCSLT
- Système canadien de surveillance des laboratoires de tuberculose
- DDD
- Dose définie journalière
- DDDvetCA
- Dose définie journalière canadienne à usage vétérinaire
- ESAC-Net
- Réseau de surveillance européenne de la consommation d’antibiotiques
- eSTREP
- Surveillance nationale en laboratoire de la maladie invasive due au streptocoque
- ESVAC
- Surveillance européenne de la consommation d’antibiotiques à usage vétérinaire
- SGA
- Streptocoque du groupe A (Streptococcus pyogenes)
- GASP-Canada
- Programme de surveillance de la résistance des gonocoques aux antimicrobiens - Canada
- ASS
- Associé aux soins de santé
- Kg
- Kilogramme
- KPC
- Klebsiella pneumoniae productrice de carbapénémase
- MR
- Multirésistant(e)
- mg/PCU
- Milligrammes par unité corrigée de la population
- CMI
- Concentration minimale inhibitrice
- MLST
- Typage génomique multilocus
- SARM
- Staphylococcus aureus résistant à la méthicilline
- NAP
- Type nord-américain en champ pulsé
- NDM
- New Delhi métallo-bêta-lactamase
- SSNA
- Programme des services de santé non assurés
- LNM
- Laboratoire national de microbiologie
- OXA
- Oxacillinase
- PCU
- Unité corrigée de la population
- ASPC
- Agence de la santé publique du Canada
- ARLA
- Agence de réglementation de la lutte antiparasitaire
- SEM
- Enzyme de Serratia marcescens
- TG
- Type génomique
- TB
- Tuberculose (Mycobacterium tuberculosis)
- ERV
- Entérocoques résistants à la vancomycine
- OMS
- Organisation mondiale de la Santé
- UR
- Ultrarésistant(e)
Introduction
La résistance aux antimicrobiens (RAM) est une menace croissante pour la santé mondiale et l’Organisation mondiale de la santé et les Nations Unies la reconnaît comme l’une des dix principales menaces pour la santé de l’humanité. À l’échelle mondiale, on estime que 4,95 millions de décès en 2019 étaient associés à des infections bactériennes résistantes aux antimicrobiens, dont 1,27 million de décès directement attribuables à la RAM (Murray et al., 2022). Au Canada, il a été estimé qu’en 2018, plus d’un quart des infections bactériennes étaient résistantes à au moins un antibiotique et que 14 000 décès canadiens étaient liés à la RAM, pour 5 400, la RAM était directement responsable (Conseil des académies canadiennes, 2019). Étant donné que les niveaux croissants de la RAM menacent l’efficacité continue des thérapies antimicrobiennes, des efforts doivent être déployés pour développer de nouveaux antimicrobiens et y avoir accès, ainsi que pour préserver l’efficacité des antimicrobiens existants en améliorant leur utilisation judicieuse. Sinon, l’exécution de procédures courantes, notamment de la chimiothérapie, des césariennes et des chirurgies invasives, sera compromise.
Le rapport de 2021 du Système canadien de surveillance de la résistance aux antimicrobiens (SCSRA) présente une vision intégrée des données nationales disponibles générées par l’Agence de la santé publique du Canada (ASPC) et ses partenaires à partir des populations humaines et animales au sujet de la résistance aux antimicrobiens (RAM) et de l’utilisation des antimicrobiens (UAM). Bien qu’il faille reconnaître qu’il est toujours possible de renforcer davantage les données sur la RAM et l’UAM incluses dans ce rapport, les données de ces systèmes de surveillance contributifs peuvent être utilisées pour détecter les changements dans les tendances épidémiologiques associées au fil du temps à la RAM dans les organismes prioritaires et à l’UAM chez les humains et les animaux.
La lutte contre la RAM au Canada exige une intervention multisectorielle coordonnée de la part des partenaires du gouvernement, des domaines de la santé humaine, de la santé animale, de l’agroalimentaire, de l’industrie, du milieu universitaire, des associations professionnelles et du grand public. Bien que de nombreux domaines méritent une attention particulière au Canada, l’ASPC s’engage à améliorer la surveillance de la RAM et de l’UAM dans les domaines prioritaires. Cela comprend :
- Saisir les tendances de la RAM et de l’UAM dans les principales régions rurales et éloignées sous-représentées en recrutant des hôpitaux supplémentaires et en étendant la surveillance dans les régions qui ne sont pas actuellement représentées par les données de l’ASPC.
- Évaluer le fardeau de la RAM et la pertinence de l’UAM chez les Canadiens âgés, le groupe d’âge qui reçoit, de loin, le plus de prescriptions, en recueillant des données sur les soins de longue durée afin de mieux déterminer le risque posé pour ce groupe précis de population à risque.
- Détecter et surveiller la propagation de la RAM au Canada en intégrant les données des laboratoires de diagnostic générées par les partenaires de la santé publique provinciaux, territoriaux et privés afin de déterminer les nouvelles menaces de RAM.
- Surveiller les tendances de l’UAM dans les populations par le biais d’une épidémiologie basée sur les eaux usées afin de permettre une analyse des tendances et des interventions plus ciblées.
- Améliorer notre connaissance des populations touchées par la gonorrhée résistante aux antimicrobiens afin de mieux documenter les interventions et prévenir la propagation.
- Lancer la surveillance de la RAM et de l’UAM dans la communauté par l’utilisation de dossiers médicaux électroniques dépersonnalisés afin d’étudier le fardeau de la RAM dans le cadre des soins primaires et de cerner les pratiques de prescription inappropriées.
- Améliorer la détection des menaces de la RAM dans la chaîne alimentaire en étendant la surveillance agroalimentaire aux exploitations de bovins et de vaches laitières et en augmentant le nombre de produits de viandes testés et vendus au détail en regard de la RAM.
Les résultats de la surveillance présentés dans ce rapport reflètent largement la période pré-pandémique. Les effets de la pandémie de la COVID-19 sur la RAM et l’UAM au Canada commencent seulement à se faire sentir et seront probablement complexes. Par exemple, alors que l’UAM des patients ambulatoires semble avoir diminué au début de la pandémie, l’utilisation inappropriée d’antimicrobiens (un des principaux facteurs de la RAM) dans les établissements de soins aigus peut avoir augmenté en raison des risques réels ou perçus de co-infection bactérienne de la COVID-19. En outre, les risques associés aux contraintes en matière de ressources de soins de santé (p. ex., personnel réaffecté ou insuffisant) peuvent avoir limité les activités de surveillance de la RAM, empêchant une intervention rapide aux menaces possibles de la RAM. Inversement, les mesures renforcées de prévention et de contrôle des infections adoptées pour empêcher la propagation de la COVID-19 peuvent avoir l’avantage collatéral de prévenir la propagation de la RAM, et la diminution globale du nombre de Canadiens admis dans les hôpitaux peut par conséquent réduire la fréquence des infections acquises dans le cadre des soins de santé. À ce jour, l’effet net des facteurs liés à la pandémie sur le fardeau de la RAM au Canada demeure inconnu.
Grâce à l’intervention liée à la COVID-19, le Canada a renforcé la collaboration multisectorielle et la capacité en matière de santé publique, et est mieux placé pour faire face aux menaces émergentes et futures pour la santé publique, y compris celles liées à la RAM. Les mesures de surveillance supplémentaires entreprises serviront à renforcer la collecte et l’analyse des tendances de la RAM et de l’UAM afin d’informer le développement d’interventions ciblées supplémentaires pour faire face à la menace croissante que représente la RAM.
Résumé
Ce rapport de 2021 du Système canadien de surveillance de la résistance aux antimicrobiens (SCSRA) s'appuie sur des données et des méthodologies déjà publiées, en priorisant les données acquises par l'Agence de la santé publique du Canada et ses partenaires en matière de résistance aux antimicrobiens et de l'utilisation des antimicrobiens chez les humains, les animaux et les cultures.
Bien que la plupart des informations contenues dans ce rapport soient antérieures à la pandémie de la COVID-19, ces données contribueront à l'analyse des tendances de la RAM et de l'UAM au Canada avant la COVID-19 et serviront de référence importante pour les analyses futures.
Résumé des résultats entre 2015 et 2019 (sauf indication contraire)
La résistance aux antimicrobiens chez l'humain :
Les taux de résistance ont augmenté pour 3 des 4 organismes prioritaires surveillés chez les patients hospitalisés : infections sanguines Staphylococcus aureus résistant à la méthicilline (SARM), Enterococcus résistant à la vancomycine (ERV) et les entérobactéries productrices de carbapénémases (EPC), mais ils ont diminué pour les infections à Clostridioides difficile.
D'autres tendances sont particulièrement préoccupantes :
- Si les infections de la circulation sanguine à SARM sont traditionnellement associées aux hospitalisations, le taux de SARM d'origine communautaire a plus que doublé.
- Le nombre de patients testés positifs pour les CPE (avec ou sans signes d'infection) a augmenté de 250 %.
Pour les infections généralement contractées dans le secteur communautaire, la principale préoccupation est l'augmentation de 44 % du taux de gonorrhée multirésistante.
Les autres tendances sont les suivantes :
- La proportion d'infections invasives à Streptococcus pneumoniae multirésistantes prévenues par un vaccin (VPC-13) a augmenté de 25 % (2014 à 2018), mais est restée universellement sensible à la pénicilline.
- Les taux de RAM chez les Mycobacterium tuberculosis à culture positive sont restés stables.
Utilisation d'antimicrobiens chez les humains :
Dans l'ensemble, l'utilisation des antimicrobiens (UAM) a diminué de 5 %, mais certains domaines sont préoccupants :
- La prescription d'antimicrobiens chez les personnes âgées de 80 ans ou plus a augmenté de 13 %.
- L'utilisation communautaire des carbapénèmes, les antimicrobiens disponibles à spectre le plus large, a augmenté de 68 %.
- La consommation par habitant d'antimicrobiensNote de bas de page 1 de la catégorie « Réserve » a augmenté de 2 %.
La prescription d'antimicrobiens dans le secteur communautaire au cours des 8 premiers mois de la pandémie de la COVID-19 a été plus faible que les années précédentes. Cette tendance semble être liée à une diminution du nombre de visites chez le médecin pendant cette période.
- Le taux global de prescription d'antimicrobiens a diminué jusqu'à 40 %.
- La plus forte baisse du taux de prescription d'antimicrobiens a été observée dans les populations pédiatriques (de 70 %). Cependant, le taux de prescription d'antimicrobiens chez les personnes âgées (80 ans ou plus) n'a diminué que de 28 %.
Utilisation d'antimicrobiens chez les animauxNote de bas de page 2 :
En 2019, environ 1 million de kilogrammes d'antimicrobiens ont été vendus pour être utilisés chez les animaux, ce qui représente 78 % de tous les antimicrobiens distribués au Canada (par rapport à 79 % en 2018). Les autres tendances sont les suivantes :
- Dans l'ensemble, le tonnage des ingrédients antimicrobiens actifs vendus pour être utilisés chez les animaux de production a diminué de 11 % entre 2018 et 2019.
- Après ajustement en fonction de la population et du poids des animaux, les animaux du Canada ont consommé près de 3 fois plus d'antibiotiques en 2019 par rapport à la valeur médiane déclarée par 31 pays européens en 2018.
Principales conclusions
Ce résumé des tendances fournit une interprétation de haut niveau tirée des informations cliniques, épidémiologiques et/ou de résistance disponibles au moment de la publication. Plus d’informations peuvent être trouvées dans l’Annexe Technique.
Résumé des tendances
| Sujet | Années sur lesquelles porte le rapport | Tendance |
|---|---|---|
| Bactériémies au Staphylococcus aureus résistant à la méthicilline (SARM) | 2015 à 2019 | Aggravation |
| Bactériémies à entérocoques résistants à la vancomycine (ERV) | 2015 à 2019 | Aggravation |
| Infections et colonisation par des entérobactéries productrices de carbapénémase (EPC) | 2015 à 2019 | Aggravation |
| Infections à Clostridioides difficile (ICD) | 2015 à 2019 | Amélioration |
| Infections au Neisseria gonorrhoeae (GC) | 2015 à 2019 | Aggravation |
| Infections au Mycobacterium tuberculosis (TB) résistant aux médicaments | 2015 à 2019 | Stable |
| Infections au Streptococcus pneumoniae invasif (PI) | 2014 à 2018 |
Aggravation |
| Infections au Streptococcus pyogenes (streptocoque du groupe A) invasif | 2014 à 2018 | Stable |
| Utilisation d’antimicrobiens chez les humains | 2015 à 2019 |
Mise en garde |
| Antimicrobiens destinés à être utilisés chez les animaux | 2015 à 2019 | Mise en garde |
| Incidence de la COVID-19 sur l’utilisation des antimicrobiens chez les humains | 2015 à 2019 | Tendance à la baisse |
Bactériémies au Staphylococcus aureus résistant à la méthicilline (SARM) : 2015 à 2019
- Le taux de bactérémies au Staphylococcus aureus résistant à la méthicilline (SARM) a augmenté de 57 %, en raison d’une augmentation de 125 % des SARM d’origine communautaire (OC).
- 18 % des cas de bactériémie à SARM sont décédés dans les 30 jours suivant le diagnostic (mortalité toutes causes confondues).
- Tous les isolats sanguins de SARM sont restés sensibles au linézolide et à la vancomycine. La résistance est restée élevée pour la clindamycine, l’érythromycine et la résistance à la tétracycline a doublé.
Au total :
- 61 à 69 hôpitaux déclarants
- 3 333 cas de bactériémie à SARM
- 589 décès
Source :
- Le Programme canadien de surveillance des infections nosocomiales (PCSIN)
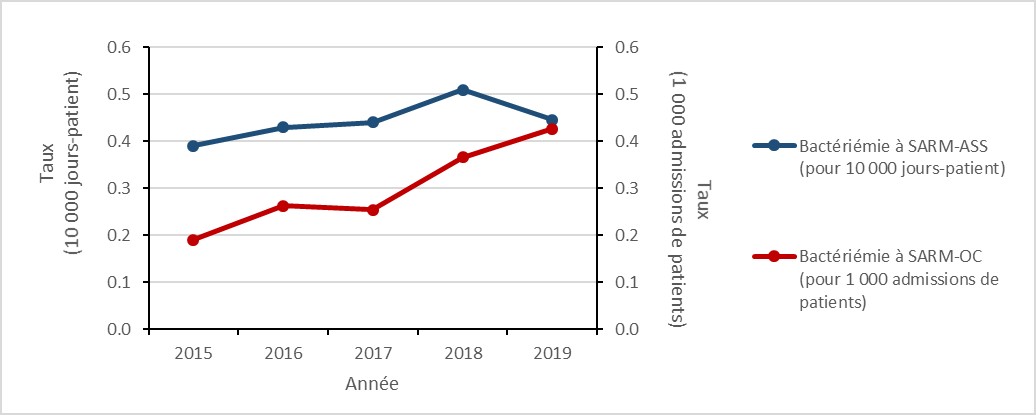
Figure a : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Bactériémie à SARM-ASS (pour 10 000 jours-patient) | 0,39 | 0,43 | 0,44 | 0,51 | 0,45 |
| Bactériémie à SARM-OC (pour 1 000 admissions de patients) | 0,19 | 0,26 | 0,25 | 0,37 | 0,43 |
Bactériémies à entérocoques résistants à la vancomycine (ERV) : 2015 à 2019
- Le taux de bactériémies à ERV associées aux soins de santé (ASS) a doublé.
- La résistance à la daptomycine est passée de 0,0 % en 2015 à 4,3 % en 2019
- 34 % des cas de bactériémies à ERV-ASS sont décédés dans les 30 jours suivant le diagnostic (mortalité toutes causes confondues).
Au total :
- 57 à 68 hôpitaux déclarants
- 773 cas de bactériémie à ERV-ASS
- 257 décès
Source :
- Le Programme canadien de surveillance des infections nosocomiales (PCSIN)

Figure b : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Bactériémie à ERV-ASS | 0,13 | 0,17 | 0,22 | 0,31 | 0,26 |
Infections et colonisation par des entérobactéries productrices de carbapénémase (EPC) : 2015 à 2019
- Le taux de colonisation par les entérobactéries productrices de carbapénémase (EPC) associée aux soins de santé (ASS) a triplé.
- Alors que le nombre d’infections par EPC-ASS est resté faible, le taux d’infection par EPC-ASS a plus que doublé.
- 21 % des patients atteints d’une infection par EPC-ASS sont décédés dans les 30 jours suivant le diagnostic (mortalité toutes causes confondues).
- Les EPC restent très résistantes à la plupart des antimicrobiens.
Au total :
- 58 à 72 hôpitaux déclarants
- 110 infections par EPC-ASS
- 23 décès
Source :
- Le Programme canadien de surveillance des infections nosocomiales (PCSIN)
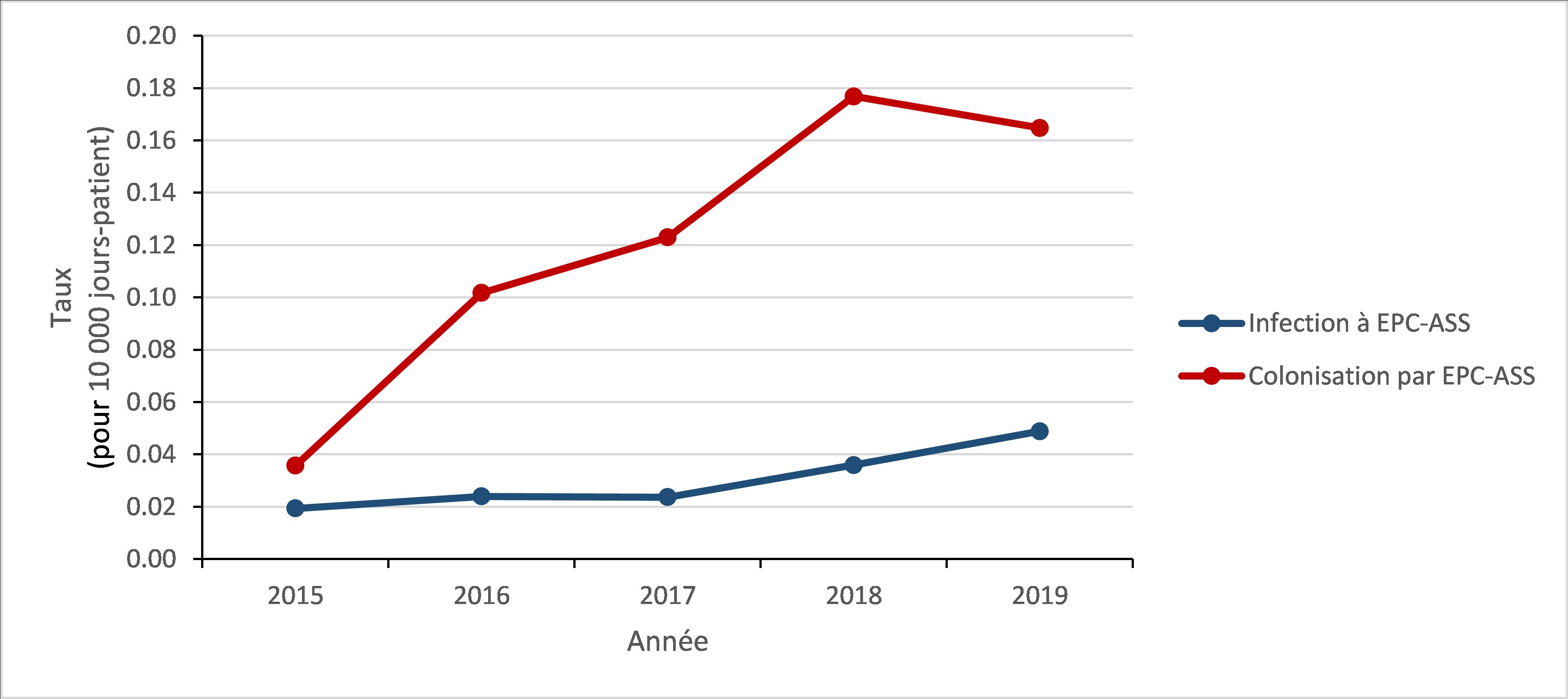
Figure c : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Infection à EPC-ASS | 0,02 | 0,02 | 0,02 | 0,04 | 0,05 |
| Colonisation par EPC-ASS | 0,04 | 0,10 | 0,12 | 0,18 | 0,16 |
Infections à Clostridioides difficile (ICD) : 2015 à 2019
- Le taux d’infections à Clostridioides difficile (ICD) associées aux soins de santé (ASS) a diminué de 22 %.
- 2,4 % des cas d’ICD-ASS sont décédés dans les 30 jours suivant le diagnostic (mortalité attribuable).
- Le taux d’ICD d’origine communautaire (OC) a diminué de 22 %.
Au total :
- 66 à 73 hôpitaux déclarants
- 19 579 cas d’ICD (ASS + OC)
- 1 684 décès (estimation)
- 450 attribuables à l’ICD (estimation)
Source :
- Le Programme canadien de surveillance des infections nosocomiales (PCSIN)
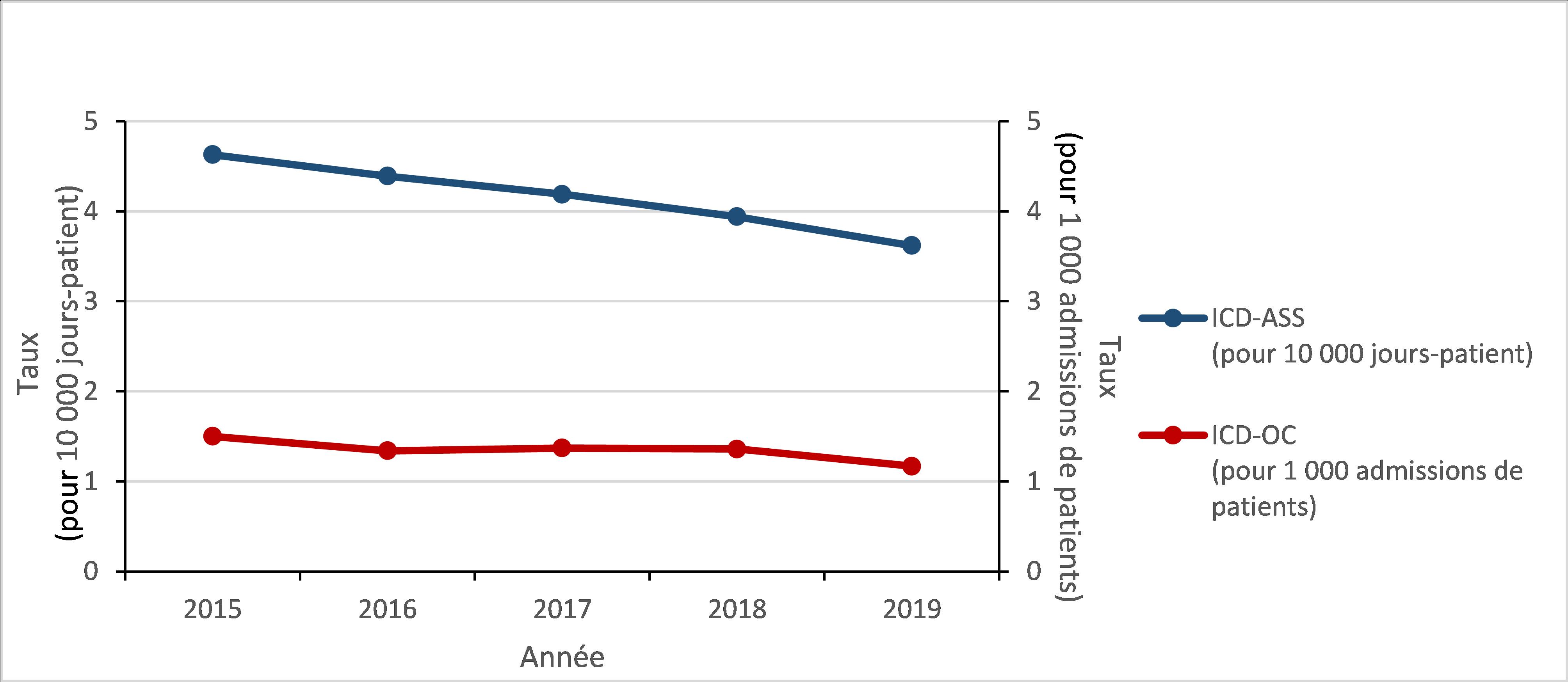
Figure d : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| ICD-ASS (pour 10 000 jours-patient) |
4,63 | 4,39 | 4,19 | 3,94 | 3,62 |
| ICD-OC (pour 1 000 admissions de patients) |
1,5 | 1,34 | 1,37 | 1,36 | 1,17 |
Infections au Neisseria gonorrhoeae : 2015 à 2019
- Le taux d'infections au Neisseria gonnorhoeae a augmenté de 70 %.
- La proportion d'isolats cultivés multirésistants (MR) de Neisseria gonorrhoeae (GC) a augmenté de 44 %.
- Onze cas de gonocoques ultrarésistants (UR) ont été identifiés au Canada
Au total :
- 142 633 cas rapportés
- 24 484 isolats testés pour la RAM
- 2 459 cas MR
Source :
- Le Programme de surveillance des antimicrobiens gonococciques (GASP-Canada) et le Système canadien de surveillance des maladies à déclaration obligatoire
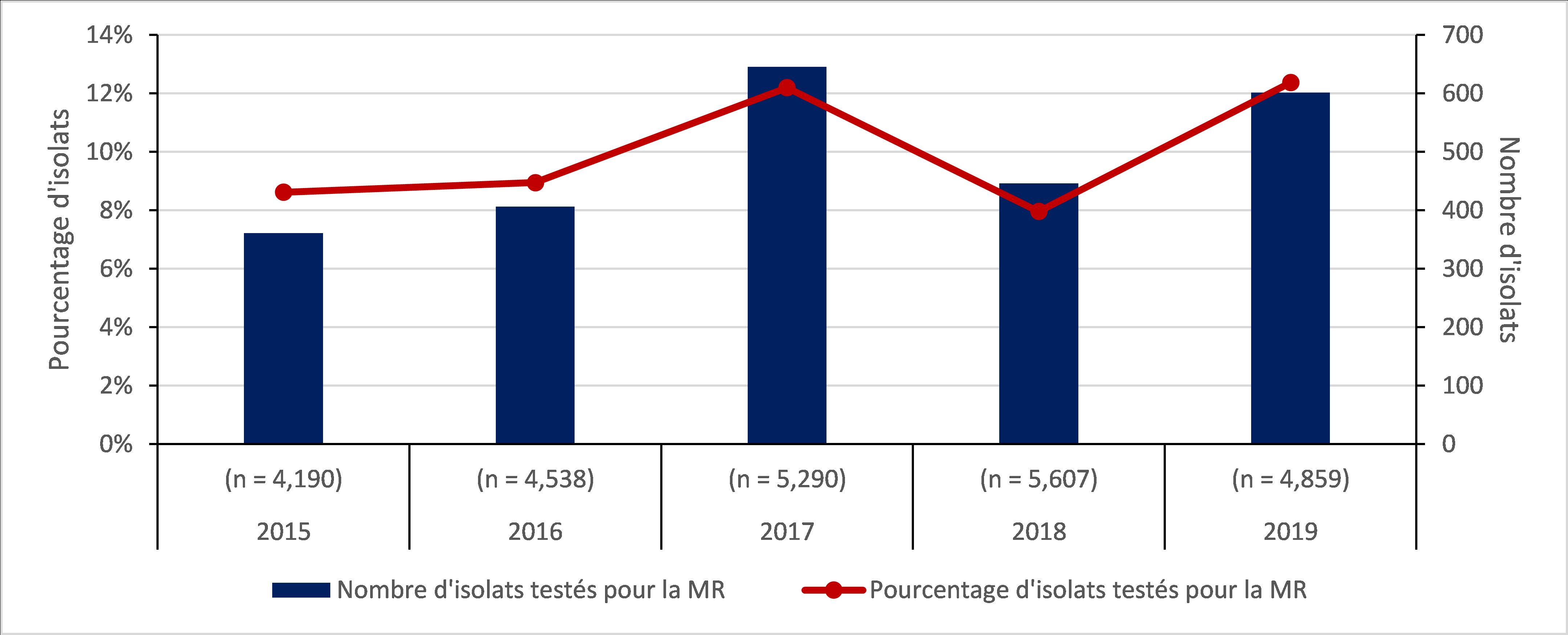
Figure e : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Total d'isolats testés (n) | (n = 4 190) | (n = 4 538) | (n = 5 290) | (n = 5 607) | (n = 4 859) |
| Nombre d'isolats testés pour la MR | 361 | 406 | 645 | 446 | 601 |
| Pourcentage d'isolats testés pour la MR | 8,6 % | 8,9 % | 12,2 % | 8,0 % | 12,4 % |
Infections au Mycobacterium tuberculosis (TB) résistant aux médicaments : 2015 à 2019
- Le taux d’infections au Mycobacterium tuberculosis au Canada est resté stable à environ 4,8 cas pour 100 000 habitants.
- La proportion d’isolats de TB à culture positive résistants à un ou plusieurs médicaments antituberculeux était de 10 % en 2019.
- La proportion d’isolats de TB à culture positive multirésistantsNote de bas de page 3 (MR) était de 1,3 % en 2019.
- Un seul cas de TB ultrarésistante (UR) a été signalé depuis 2015.
Au total :
- 7 368 cas de TB
- 701 cas de TB à culture positive et résistants
- 95 cas de TB-MR
Source :
- Le Programme canadien de surveillance des laboratoires de tuberculose (SCSLT)

Figure f : Description textuelle
| Modèle de résistance | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| TB monorésistant | 8,5 % | 7,4 % | 6,8 % | 8,3 % | 8,9 % |
| TB polyrésistant | 0,2 % | 0,3 % | 0,4 % | 0,3 % | 0,3 % |
| TB-MR | 1,6 % | 1,2 % | 0,9 % | 1,4 % | 1,2 % |
| TB-UR | 0,0 % | 0,0 % | 0,0 % | 0,1 % | 0,0 % |
Infections au Streptococcus pneumoniae - maladies pneumococciques invasives (PI) : 2014 à 2018
- Le taux de maladies pneumococciques invasives (PI) a augmenté de 9,0 à 10,9 cas par 100 000 habitants.
- La proportion de multirésistance (c’est-à-dire d’isolats de Streptococcus pneumoniae résistants à trois classes d’antimicrobiens ou plus) identifiée dans les cas de PI évitables par la vaccination (VPC13) a augmenté de 25 %, passant de 9,2 % à 11,5 %.
- La proportion d’isolats multirésistants (MR) identifiés dans les cas de PI non évitables par la vaccination (non-VPC13) a augmenté de 74 %.
Au total :
- 17 182 cas de PI
- 1 220 cas de PI-MR (estimation)
Source :
- La Surveillance nationale en laboratoire de la maladie invasive due au streptocoque (eSTREP) et le Système Canadien de Surveillance des Maladies à Déclaration Obligatoire (SCSMDO)

Figure g : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| MR (sérotypes VCP13) | 9,2 % | 12,3 % | 10,2 % | 14,6 % | 11,5 % |
| MR (sérotypes non VCP13) | 3,5 % | 4,8 % | 4,8 % | 7,8 % | 6,1 % |
Infections au Streptococcus pyogenes – streptocoque du groupe A invasif : 2014 à 2018
- Le taux d’infections par le streptocoque du groupe A invasif (iSGA) a augmenté de 65 %.
- Tous les isolats de Streptococcus pyogenes testés étaient sensibles à la pénicilline.
Au total :
- 11 310 cas de SGA
- 0 cas résistant à la pénicilline
Source :
- La Surveillance nationale en laboratoire de la maladie invasive due au streptocoque (eSTREP) et le Système Canadien de Surveillance des Maladies à Déclaration Obligatoire (SCSMDO)
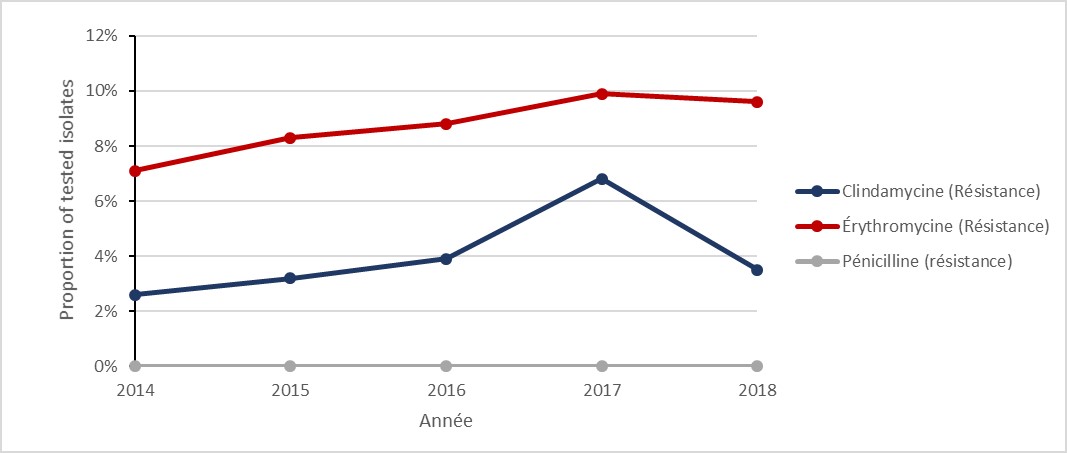
Figure h : Description textuelle
| Année | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|---|---|---|---|---|
| Pénicilline (Résistance) | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
| Érythromycine (Résistance) | 7,1 % | 8,3 % | 8,8 % | 9,9 % | 9,6 % |
| Clindamycine (Résistance) | 2,6 % | 3,2 % | 3,9 % | 6,8 % | 3,5 % |
Utilisation d’antimicrobiens chez les humains : 2015 à 2019
- La consommation d’antimicrobiens par les humains a diminué de 5 %.
- Les personnes âgées de 80 ans ou plus ont continué à avoir les taux les plus élevés de prescription d’antimicrobiens dans le milieu communautaire, avec une augmentation de 13 %.
- Le taux de prescriptions communautaires d’antimicrobiens de la classe des carbapénèmes a augmenté de 68 %.
Au total :
- 207.6 millions doses journalières définies d’antimicrobiens exécutées par les pharmacies de détail en milieu communautaire en 2019
- 16.4 millions doses journalières définies d’antibiotiques achetées par les hôpitaux en 2019
Source :
- IQVIA, Services aux Autochtones Canada, Statistique Canada et l’Organisation Mondiale de la Santé

Figure i : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| 0 à 18 | 539,9 | 556,1 | 530,6 | 526,7 | 490,9 |
| 19 à 44 | 582,5 | 570,0 | 554,1 | 547,7 | 528,4 |
| 45 à 64 | 611,9 | 626,3 | 645,5 | 649,6 | 628,6 |
| 65 à 79 | 903,6 | 873,7 | 875,7 | 883,1 | 859,3 |
| 80+ | 1090,4 | 1161,3 | 1246,1 | 1266,3 | 1230,7 |
Utilisation d’antimicrobiens chez les animaux
- Le nombre de kilogrammes d’ingrédients antimicrobiens actifs vendus pour être utilisés chez les animaux a diminué de 11 % entre 2018 et 2019.
- Entre 2018 et 2019 :
- les ventes d’antimicrobiens destinés aux porcs, à la volaille et à l’aquaculture ont diminué;
- les ventes d’antimicrobiens destinés aux bovins, aux chevaux, aux animaux de compagnie et aux petits ruminants ont augmenté.
- En 2019, le Canada a distribué la huitième plus grande quantité d'antimicrobiens destinés aux animaux de rente comparés aux dernières données de 31 pays européens.
Au total :
- 975 000 kilogrammes d’antimicrobiens distribués
Sources :
- Le Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA), l’Institut canadien de la santé animale (ICSA), Santé Canada (SC) et la Surveillance européenne de la consommation d’antibiotiques à usage vétérinaire (ESVAC), Pêches et Océans Canada, Statistique Canada, Agriculture et Agroalimentaire Canada, Canada Équestre, Producteurs de poulet du Canada, Producteurs d'œufs du Canada, Producteurs canadiens d'œufs d'incubation et Canfax.
Remarques :
- Depuis le 1er Décembre 2018, la réglementation de SC impose aux fabricants, importateurs et préparateurs de médicaments de déclarer les ventes annuelles d’antimicrobiens importants sur le plan médical destinés à être utilisés chez les animaux. Ces données remplacent les données historiquement fournies sur une base volontaire par l’ICSA. Les tendances utilisant les deux sources de données doivent être interprétées avec prudence.
- L’utilisation de promoteurs de croissance antimicrobiens a passé à celle des antimicrobiens importants sur le plan médical.
- La PCU (Population Correction Unit ou Unité de Correction de la Population) tient compte de la taille de la population animale, y compris le nombre et le poids moyen au moment du traitement. Le mg/PCU (milligrammes par la PCU) est le nombre de mg d’antimicrobiens vendus ou utilisés chez les animaux divisé par l’unité corrigée de la population. Cela exclut les ionophores et les coccidiostatiques chimiques.

Figure j : Description textuelle
| Données pour la figure | Total (kg) | Total (mg/PCUEU – poids européens) | Total (mg/PCUCA – poids canadiens) |
|---|---|---|---|
| 2015 (ICSA) | 1187135,8 | 183,0 | 175,2 |
| 2016 (ICSA) | 1051010,0 | 160,0 | 154,2 |
| 2017 (ICSA) | 934872,7 | 141,2 | 136,8 |
| 2018 (ICSA/RVMVA) | 1082768,0 | 162,9 | 150,3 |
| 2019 (RVMVA) | 968985,0 | 143,0 | 131,7 |
Analyse spéciale : prescription d’antimicrobiens chez les humains pendant la pandémie de COVID-19
Pour décrire l’incidence de la pandémie de COVID-19 sur la consommation d’antimicrobiens chez les humains au Canada, le taux mensuel de prescription en 2020 a été comparé à celui du même mois en 2019. Le mois de mars a été choisi comme début de la pandémie de COVID-19 canadienne, correspondant à la fermeture de la frontière terrestre entre le Canada et les États-Unis.
- Entre mars et octobre 2020, le taux global de prescription d’antimicrobiens dans le milieu communautaire a diminué de 26 %.
- Le taux global de prescription d’antimicrobiens dans la communauté a diminué d’un maximum de 40 % en mai 2020.
Le taux de prescription d’antimicrobiens en pédiatrie a diminué d’un maximum de 70 %, contre un maximum de 29 % chez les personnes âgées de 80 ans ou plus.
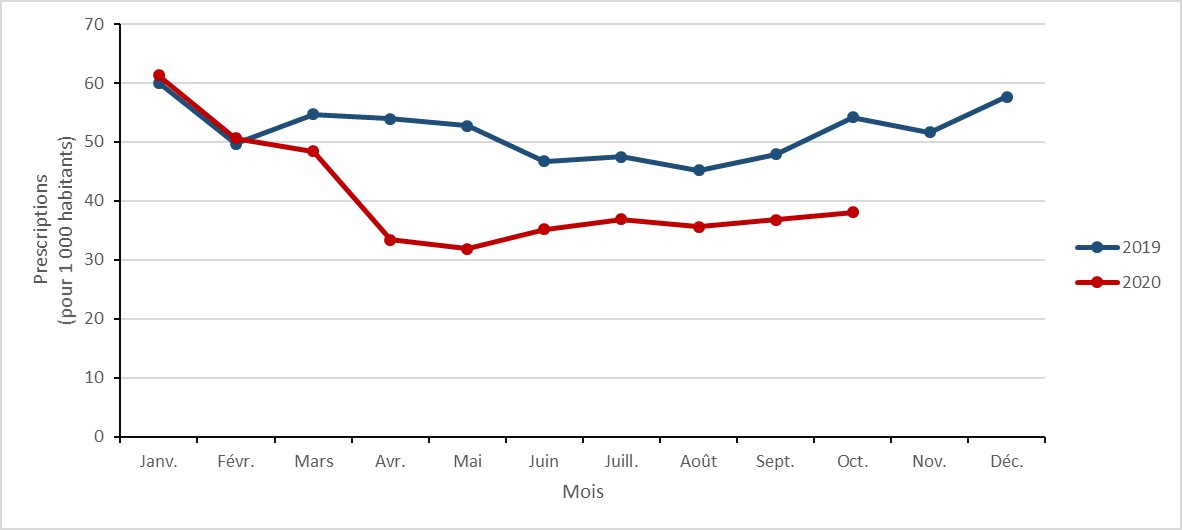
Figure k : Description textuelle
| Mois | Janvier | Février | Mars | Avril | Mai | Juin | Juillet | Août | Septembre | Octobre | Novembre | Décembre |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2019 | 60,0 | 49,7 | 54,7 | 54,0 | 52,7 | 46,7 | 47,5 | 45,2 | 47,9 | 54,2 | 51,7 | 57,6 |
| 2020 | 61,3 | 50,6 | 48,4 | 33,4 | 31,9 | 35,2 | 36,9 | 35,6 | 36,8 | 38,1 | Non disponible | Non disponible |
Annexe technique
Bactériémies à Staphylococcus aureus résistant à la méthicilline : 2015 à 2019
Principales conclusions
- Le taux de bactériémies à Staphylococcus aureus résistant à la méthicilline (SARM) d’origine communautaire (OC) a plus que doublé entre 2015 et 2019.
- 18 % des cas de bactériémies à SARM identifiés entre 2015 et 2019 sont décédés dans les 30 jours suivant le diagnostic (mortalité toutes causes confondues).
- Tous les isolats sanguins de SARM étaient sensibles à la vancomycine et au linézolide.

- Notez la différence entre les deux axes Y
Figure 1 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Bactériémie à SARM-ASS (pour 10 000 jours-patient) |
0,39 | 0,43 | 0,44 | 0,51 | 0,45 |
| Bactériémie à SARM-OC (pour 1 000 admissions de patients) |
0,19 | 0,26 | 0,25 | 0,37 | 0,43 |
Résultats relatifs aux bactériémies à SARM associées aux soins de santé (ASS)
Entre 2015 et 2019, le taux de bactériémies à SARM-ASS a augmenté de 15,4 %, passant de 0,39 à 0,45 cas pour 10 000 jours-patient. Pour tous les cas de bactériémies à SARM-ASS identifiés entre 2015 et 2019, la mortalité toutes causes confondues dans les 30 jours suivant le diagnostic était de 22,1 %.
En 2019, on disposait de résultats de laboratoire pour 79,3 % des cas de bactériémie à SARM-ASS signalés. Entre 2015 et 2019, la proportion du type de souche SARMC 2 a diminué de 56,3 % à 36,1 %, celle de SARMC 7 a augmenté de 5,0 % à 6,1 % et celle de SARMC 10 a augmenté de 26,6 % à 37,5 %.
| Souche canadienne | Souche américaine | Secteur |
|---|---|---|
| SARMC2 | USA100/USA800 | Historiquement associée aux soins de santé |
| SARMC7 | USA400 | Historiquement d’origine communautaire |
Entre 2015 et 2019, tous les isolats sanguins de SARM-ASS étaient sensibles à la vancomycine (l’antimicrobien le plus utilisé dans les SARM-ASS), et moins de 1 % étaient non sensibles à la daptomycine. Le schéma global de sensibilité au SARM pour 2019, y compris ceux pour les médicaments qui ne sont pas utilisés pour les infections du sang, était le suivant : aucune résistance au linézolide n’a été détectée, et la prévalence de la résistance à la tétracycline (6,9 %), à la rifampicine (2,3 %) et au triméthoprime-sulfaméthoxazole (1,1 %) était faible. La résistance à la tétracycline a augmenté de 115,6 %, passant de 3,2 % à 6,9 % entre 2015 et 2019.
| Proportion (%) d’isolats résistants par année | |||||
|---|---|---|---|---|---|
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
| Isolats testés (n) | 219 | 273 | 296 | 334 | 261 |
| Ciprofloxacine | 80,4 | 78,4 | 77,0 | 74,6 | 72,0 |
| Clindamycine | 66,7 | 48,0 | 47,6 | 50,3 | 49,2 |
| Daptomycine | 0,0 | 1,1 | 0,7 | 0,0 | 0,0 |
| Érythromycine | 84,0 | 79,9 | 80,7 | 76,9 | 75,1 |
| Linézolide | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
| Rifampicine | 0,5 | 2,6 | 1,0 | 0,9 | 2,3 |
| Tétracycline | 3,2 | 4,8 | 5,4 | 4,5 | 6,9 |
| Tigécycline | 0,9 | 0,0 | 0,0 | 0,0 | 0,0 |
| Triméthoprime-sulfaméthoxazole | 1,8 | 1,5 | 1,4 | 0,9 | 1,1 |
| Vancomycine | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
Un sous-ensemble d’isolats a été testé contre la ciprofloxacine en 2015 et la clindamycine en 2019. Certains antimicrobiens ne sont présentés qu’à des fins épidémiologiques. La daptomycine et la tigécycline sont signalées comme non sensibles.
Résultats relatifs aux bactériémies à SARM d’origine communautaire (OC)
Entre 2015 et 2019, le taux de bactériémies à SARM-OC a augmenté de 126,3 %, passant de 0,19 à 0,43 cas par 1 000 admissions de patients. Pour les cas de bactériémies à SARM-OC identifiés entre 2015 et 2019, la mortalité toutes causes confondues dans les 30 jours suivant le diagnostic était de 13,3 %.
En 2019, on disposait de résultats de laboratoire pour 71,4 % des cas de bactériémie à SARM-OC signalés chez des patients hospitalisés. Entre 2015 et 2019, la proportion du type de souche SARMC 2 a augmenté de 13,0 % à 15,2 %, celle de SARMC 7 a augmenté de 11,0 % à 14,4 % et celle de SARMC 10 a diminué de 62,3 % à 59,2 %.
Entre 2015 et 2019, tous les isolats sanguins de SARM-OC étaient sensibles à la vancomycine (l’antimicrobien le plus utilisé dans ce contexte), et moins de 1 % étaient non sensibles à la daptomycine. Le schéma global de sensibilité au SARM pour 2019, y compris ceux pour les médicaments qui ne sont pas utilisés pour les infections non sanguines était le suivant : aucune résistance au linézolide ou à la rifampicine n’a été détectée, et la prévalence de la résistance à la tétracycline (6,6 %) et au triméthoprime-sulfaméthoxazole (1,6 %) était faible.
| Proportion (%) d’isolats résistants par année | |||||
|---|---|---|---|---|---|
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
| Isolats testés (n) | 154 | 228 | 232 | 334 | 320 |
| Ciprofloxacine | 81,1 | 75,4 | 76,3 | 69,2 | 68,1 |
| Clindamycine | 36,4 | 39,5 | 36,6 | 33,2 | 29,4 |
| Daptomycine | 0,6 | 0,9 | 1,3 | 0,0 | 0,0 |
| Érythromycine | 77,9 | 75,9 | 81,0 | 73,4 | 76,3 |
| Linézolide | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
| Rifampicine | 0,6 | 1,3 | 2,6 | 0,9 | 0,0 |
| Tétracycline | 3,9 | 7,5 | 7,8 | 9,9 | 6,6 |
| Tigécycline | 0,6 | 0,0 | 0,0 | 0,0 | 0,0 |
| Triméthoprime-sulfaméthoxazole | 1,3 | 2,6 | 1,3 | 3,3 | 1,6 |
| Vancomycine | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
Un sous-ensemble d’isolats a été testé contre la ciprofloxacine en 2015 et la daptomycine en 2019. Certains antimicrobiens ne sont présentés qu’à des fins épidémiologiques. La daptomycine et la tigécycline sont signalées comme non sensibles.
Source des données : Programme canadien de surveillance des infections nosocomiales (61 à 69 hôpitaux déclarants).
La méthodologie a été publiée précédemment dans le rapport du SCSRA 2020.
Bactériémies à entérocoques résistants à la vancomycine : 2015 à 2019
Principales conclusions
- Globalement, le taux de bactériémies à entérocoques résistants à la vancomycine (ERV) associées aux soins de santé (ASS) a doublé entre 2015 et 2019, baissant de 16 % entre 2018 et 2019.
- 34 % des cas de bactériémies à SARM-OC identifiés entre 2015 et 2019 sont décédés dans les 30 jours suivant le diagnostic (mortalité toutes causes confondues).
Résultats relatifs aux bactériémies à ERV associées aux soins de santé (ASS)
Entre 2015 et 2019, le taux de bactériémies à ERV-ASS a doublé (de 0,13 à 0,26 pour 10 000 jours-patient), malgré une diminution de 16,1 % entre 2018 et 2019 (de 0,31 à 0,26 pour 10 000 jours-patient). Pour tous les patients avec bactériémies à ERV-ASS identifiés entre 2015 et 2019, la mortalité toutes causes confondues dans les 30 jours suivant le diagnostic était de 33,6 %. En 2019, 86,6 % de toutes les bactériémies à ERV signalées étaient associées aux soins de santé, une diminution par rapport à 96,3 % en 2015.
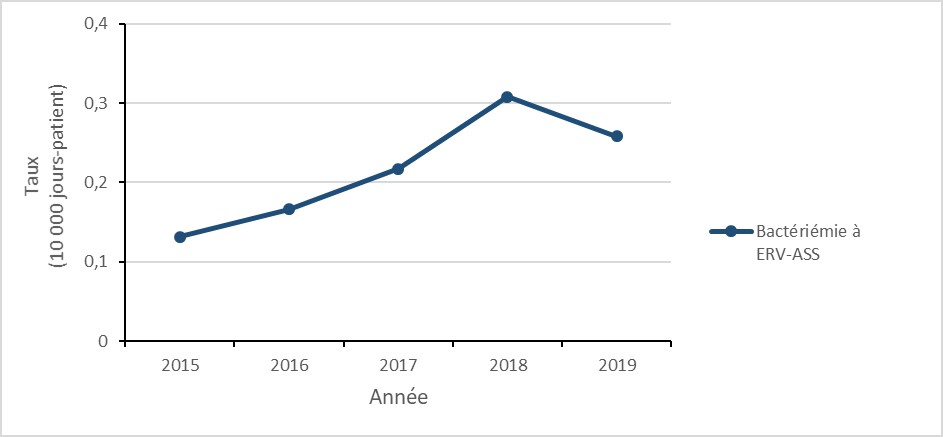
Figure 2 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Bactériémie à ERV-ASS | 0,13 | 0,17 | 0,22 | 0,31 | 0,26 |
Bactériémies à ERV associées aux soins de santé dans les populations adultes et pédiatriques
Bien que le nombre de bactériémies à ERV-ASS identifiées dans les hôpitaux pédiatriques entre 2015 et 2019 ait été faible (n=19), le taux a augmenté de 0,03 à 0,25 cas pour 10 000 jours-patient. Au cours de la même période, le taux de bactériémies à ERV-ASS identifiées dans les hôpitaux pour adultes a plus que doublé (de 0,16 à 0,35 cas pour 10 000 jours-patient), notant une diminution de 22,2 % entre 2018 et 2019 (de 0,45 à 0,35 pour 10 000 jours-patient). Les augmentations signalées dans les hôpitaux pédiatriques en 2019 étaient limitées à deux hôpitaux et les taux préliminaires de 2020 indiquent une diminution significative.
Typage génomique multilocus (MLST) et test de sensibilité aux antimicrobiens
En 2019, les organismes identifiés comme étant à l’origine des bactériémies à ERV-ASS étaient à 98,8 % l’E. faecium et à 1,2 % l’E. faecalis; les résultats du MLST et du test de sensibilité aux antimicrobiens étaient disponibles pour 98,2 % des isolats d’E. faecium. La souche ST1478 est restée le type de souche prédominant (32,7 %), suivie de ST734 (11,5 %) et de ST117 (9,7 %).
En 2019, la non-sensibilité à la daptomycine est restée détectable (4,3 %), la résistance à la gentamicine de haut niveau est restée élevée (30,4 %) et la résistance au linézolide a augmenté (de 0,0 % en 2015 à 2,2 % en 2019).
| Proportion (%) d’isolats résistants par année | |||||
|---|---|---|---|---|---|
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
| Isolats testés (n) | 73 | 83 | 108 | 159 | 138 |
| Ampicilline | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 |
| Chloramphénicol | 0,0 | 2,4 | 9,3 | 2,5 | 17,4 |
| Ciprofloxacine | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 |
| Daptomycine | 0,0 | 8,4 | 8,3 | 6,9 | 4,3 |
| Érythromycine | 95,9 | 90,4 | 94,4 | 95,6 | 94,9 |
| Gentamicine (haut niveau) | 8,2 | 14,5 | 38,0 | 43,4 | 30,4 |
| Lévofloxacine | 100,0 | 100,0 | 100,0 | 98,7 | 100,0 |
| Linézolide | 0,0 | 1,2 | 0,0 | 1,3 | 2,2 |
| Nitrofurantoïne | 31,5 | 36,1 | 44,4 | 29,6 | 38,4 |
| Pénicilline | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 |
| Synergicid | 2,7 | 9,6 | 7,4 | 10,1 | 9,4 |
| Rifampicine | 94,5 | 94,0 | 94,4 | 89,3 | 89,9 |
| Streptomycine (haut niveau) | 35,6 | 34,9 | 35,2 | 32,1 | 26,1 |
| Tétracycline | 60,3 | 51,8 | 57,4 | 64,2 | 71,0 |
| Tigécycline | 0,0 | 0,0 | 0,0 | 0,6 | 0,0 |
Certains antimicrobiens ne sont présentés qu’à des fins épidémiologiques. La daptomycine est signalée comme non sensible.
Source des données : Programme canadien de surveillance des infections nosocomiales (PCSIN) (57 à 68 hôpitaux déclarants).
La méthodologie a été publiée précédemment dans le rapport du SCSRA 2020.
Infections et colonisation aux Entérobactéries productrices de carbapénémase : 2015 à 2019
Principales conclusions
- Entre 2015 et 2019, le taux de colonisation par des entérobactéries productrices de carbapénémase (ECP) associées aux soins de santé (ASS) a triplé.
- Alors que le taux d’infection par EPC-ASS a plus que doublé, le nombre d’infections par EPC est resté faible.
- 21 % des patients atteints d’une infection par EPC-ASS sont décédés dans les 30 jours suivant le diagnostic (mortalité toutes causes confondues).
Résultats de colonisation et d’infection par des ECP
Entre 2015 et 2019, le taux de colonisation par EPC-ASS chez les patients hospitalisés a triplé (de 0,04 à 0,17 pour 10 000 jours-patient), malgré une diminution de 5,6 % entre 2018 et 2019. De même, entre 2015 et 2019, le taux d’infection à EPC-ASS chez les patients hospitalisés a augmenté de 150 % (de 0,02 à 0,05 cas pour 10 000 jours-patient). Pour toutes les infections à ECP-ASS identifiées entre 2015 et 2019, la mortalité toutes causes confondues était de 20,9 % (n=23/110). Bien que la relation entre la détection accrue des EPC et les pratiques de dépistage dans les hôpitaux n’ait pas été évaluée, les EPC restent une menace émergente pour la santé publique importante.

Figure 3 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Infection à EPC-ASS | 0,02 | 0,02 | 0,02 | 0,04 | 0,05 |
| Colonisation par EPC-ASS | 0,04 | 0,10 | 0,12 | 0,18 | 0,16 |
Au total, 918 isolats d’EPC ont été soumis à l’ASPC à des fins d’analyse entre 2015 et 2019 (c’est-à-dire des isolats de tests cliniques, de dépistage et de référence provenant de milieux hospitaliers et ambulatoires). Les carbapénémases les plus prédominantes étaient la Klebsiella pneumoniae productrice de carbapénémase (KPC) (48,7 %), la New Delhi métallo-bêta-lactamase (NDM) (28,2 %) et l’oxacillinase-48 (OXA-48) (14,8 %). La proportion de microorganismes résistants est restée élevée pour la majorité des antimicrobiens évalués.
| Proportion (%) d’isolats résistants par année | |||||
|---|---|---|---|---|---|
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
| Isolats testés (n) | 81 | 161 | 187 | 228 | 261 |
| Amikacine | 27,2 | 26,1 | 17,1 | 19,3 | 8,8 |
| Céfotaxime | 90,1 | 92,5 | 92,5 | 93,0 | 95,8 |
| Ceftazidime | 85,2 | 86,3 | 85,6 | 84,2 | 89,3 |
| Ciprofloxacine | 79,0 | 82,6 | 73,8 | 69,3 | 70,1 |
| Gentamicine | 49,4 | 38,5 | 34,2 | 35,1 | 33,0 |
| Méropénem | 84,0 | 87,0 | 80,0 | 86,8 | 72,8 |
| Pipéracillin-tazobactam | 92,6 | 72,0 | 85,0 | 92,1 | 90,8 |
| Tigécycline | 16,0 | 19,9 | 9,6 | 13,2 | 13,8 |
| Tobramycine | 49,4 | 46,6 | 38,0 | 44,3 | 46,4 |
| Triméthoprime-sulfaméthoxazole | 72,8 | 63,4 | 60,4 | 62,7 | 73,9 |
Source : Programme canadien de surveillance des infections nosocomiales (PCSIN) (58 à 72 hôpitaux déclarants).
La méthodologie a été publiée précédemment dans le rapport du SCSRA 2020.
« L’émergence mondiale de bactéries productrices de carbapénémase capables d’hydrolyser les antibiotiques carbapénèmes autrefois efficaces est considérée comme un problème de santé publique contemporain » (Hansen, 2021)
Infections à Clostridioides difficile (CDI) : 2015 à 2019
Principales conclusions
- Le taux d’infection à Clostridioides difficile (ICD) associée aux soins de santé (ASS) a diminué de 22 % entre 2015 et 2019.
- 2 % des cas d’ICD-ASS identifiés entre 2015 et 2019 sont décédés dans les 30 jours suivant le diagnostic (mortalité attribuable).
Résultats relatifs aux ICD associées aux soins de santé
Entre 2015 et 2019, le taux d’ICD-ASS a diminué de 21,7 % (de 4,6 à 3,6 cas pour 10 000 jours-patient). Pour tous les cas d’ICD-ASS identifiés entre 2015 et 2019, la mortalité toutes causes confondues dans les 30 jours suivant le diagnostic était de 9,4 % et la mortalité attribuable était de 2,4 %.
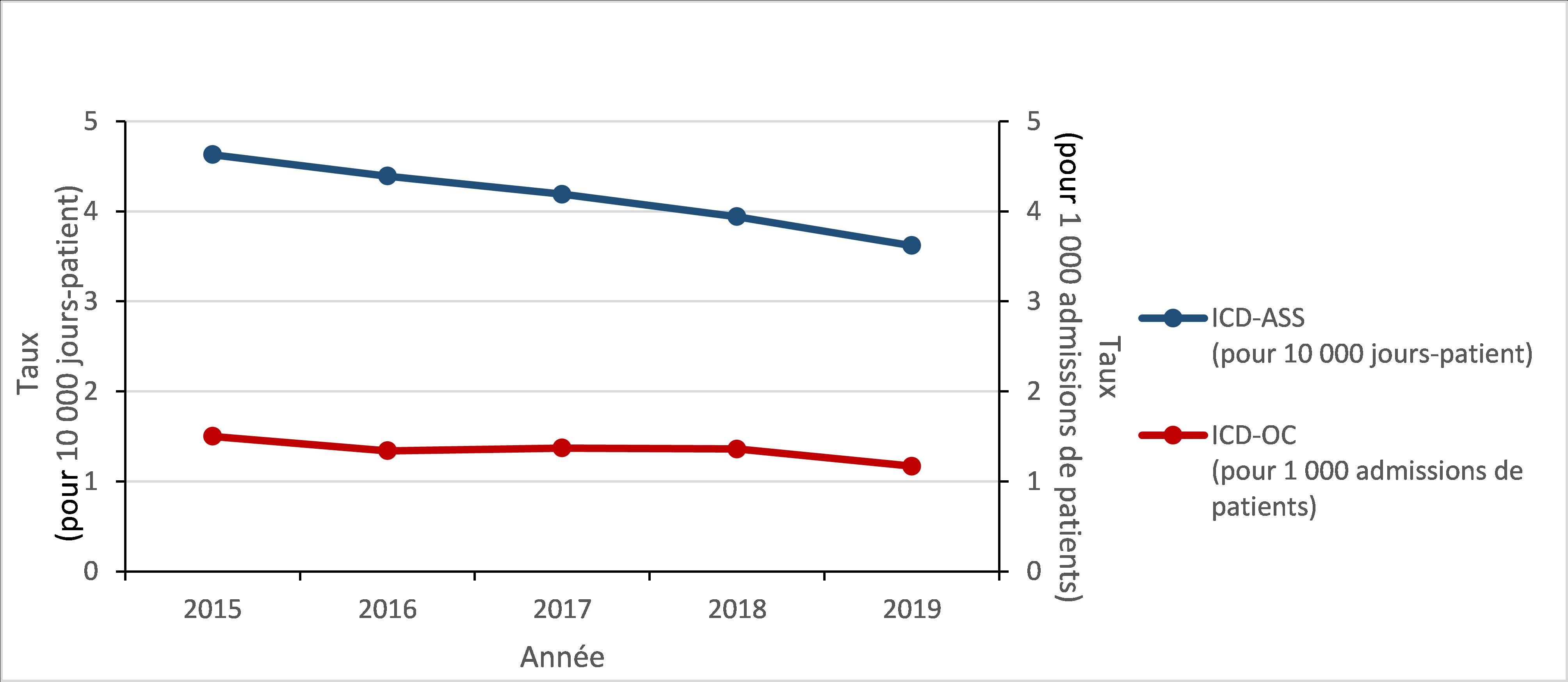
Figure 4 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| ICD-ASS (pour 10 000 jours-patient) |
4,63 | 4,39 | 4,19 | 3,94 | 3,62 |
| ICD-OC (pour 1 000 admissions de patients) |
1,5 | 1,34 | 1,37 | 1,36 | 1,17 |
En 2019, on disposait de résultats de laboratoire pour 74,6 % (n = 425/570) des ICD-ASS éligibles (c’est-à-dire les cas identifiés en mars et en avril). Les souches de ribotypes de type nord-américain en champ pulsé (NAP) 4 et NAP-11 étaient prédominantes (20,5 % et 20,2 %, respectivement), suivies des souches de ribotype NAP-1 (9,4 %).
| Proportion (%) d’isolats résistants par année | |||||
|---|---|---|---|---|---|
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
| Isolats testés (n) | 540 | 494 | 526 | 475 | 425 |
| Clindamycine | 25,0 | 22,1 | 21,9 | 47,4 | 40,2 |
| Métronidazole | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
| Moxifloxacine | 28,1 | 17,2 | 18,6 | 12,4 | 11,8 |
| Rifampicine | 2,0 | 1,6 | 2,5 | 1,7 | 0,7 |
| Vancomycine | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
Un isolat résistant au métronidazole a été identifié en 2018. L’augmentation de la résistance à la clindamycine en 2018 représente une reclassification (une augmentation des échantillons avec des valeurs CMI de 6-8 mg/L; la résistance à la clindamycine de haut niveau est restée stable). Certains antimicrobiens ne sont présentés qu’à des fins épidémiologiques.
Résultats relatifs aux ICD d’origine communautaire
Entre 2015 et 2019, le taux d’ICD-OC a diminué de 22,0 % (de 1,5 à 1,2 cas pour 1 000 admissions de patients). Pour tous les cas d’ICD-OC identifiés entre 2015 et 2019, la mortalité toutes causes confondues dans les 30 jours suivant le diagnostic était de 5,8 % et la mortalité attribuable était de 1,9 %.
En 2019, on disposait de résultats de laboratoire pour 74,4 % (n = 122/164) des ICD-OC éligibles (c’est-à-dire les cas identifiés en mars et en avril). Les souches de ribotypes de type nord-américain en champ pulsé (NAP) 4 et NAP-11 étaient prédominantes (19,7 % et 18,0 %, respectivement), suivies des souches de ribotype NAP-1 (6,6 %).
| Proportion (%) d’isolats résistants par année | |||||
|---|---|---|---|---|---|
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
| Isolats testés (n) | 205 | 163 | 150 | 156 | 122 |
| Clindamycine | 28,8 | 22,1 | 22,7 | 52,6 | 39,3 |
| Métronidazole | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
| Moxifloxacine | 16,1 | 11,0 | 10,7 | 7,1 | 11,5 |
| Rifampicine | 1,5 | 0,6 | 0,7 | 1,3 | 1,6 |
| Vancomycine | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
L’augmentation de la résistance à la clindamycine en 2018 représente une reclassification (une augmentation des échantillons avec des valeurs CMI de 6-8 mg/L; la résistance à la clindamycine de haut niveau est restée stable). Certains antimicrobiens ne sont présentés qu’à des fins épidémiologiques.
| Types de NAP | Ribotypes |
|---|---|
| NAP-1 | 027, 176, 075, 385, 080, 036, 019 |
| NAP-4 | 020, 014, 076, 629, 207, 077, 511, 221, 011, ns70, 006, 154, 354, 325, 296 |
| NAP-11 | 106, 103, 024, 072, 016 |
Source des données : Programme canadien de surveillance des infections nosocomiales (66 à 73 hôpitaux déclarants).
La méthodologie a été publiée précédemment dans le rapport du SCSRA 2020.
Infections au Neisseria gonorrhoeae : 2015 à 2019
Principales conclusions
- Le taux d'infections au Neisseria gonorrhoeae a augmenté de 70 %, passant de 55,5 à 94,3 cas pour 100 000 habitants.
- La proportion d'isolats cultivés de Neisseria gonorrhoeae (GC) multirésistants (MR) a augmenté de 44 %, passant de 8,6 % à 12,4 % principalement à cause de la résistance aux macrolides (c'est-à-dire à l'azithromycine).
- Onze cas de gonocoques ultrarésistants (UR) ont été identifiés au Canada, menaçant le succès des recommandations thérapeutiques actuelles.
Résultats
Entre 2015 et 2019, le nombre de cas de gonorrhée diagnostiqués au Canada est passé de 55,5 à 94,3 cas pour 100 000 habitants. Au total, 142 633 cas ont été signalés au cours de la période de cinq ans, dont 24 484 (17,6 %) ont été testés pour la résistance aux antimicrobiens. Une résistance à au moins un antibiotique a été identifiée dans 67,7 % (n = 16 570/24 484) des isolats testés, 10 % (2 459/24 484) étaient MR et moins de 0,1 % (11/24 484) étaient UR.

Figure 5 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Total d'isolats testés (n) | (n = 4,190) | (n = 4,538) | (n = 5,290) | (n = 5,607) | (n = 4,859) |
| Nombre d'isolats testés pour la MR | 361 | 406 | 645 | 446 | 601 |
| Pourcentage d'isolats testés pour la MR | 8,6 % | 8,9 % | 12,2 % | 8,0 % | 12,4 % |
Notes :
- La source de données : Programme de surveillance des antimicrobiens gonococciques – Canada et Système canadien de surveillance des maladies à déclaration obligatoire.
- La méthodologie a déjà été publiée dans le rapport CARSS 2020.
- Remerciements aux laboratoires provinciaux de santé publique participants.
Définitions de la résistance aux médicaments du Neisseria gonorrhoeae :
- La multirésistance (MR) du Neisseria gonorrhoeae (GC) est définie comme une sensibilité réduite à la céphalosporine ou une résistance à l'azithromycine ainsi qu'à au moins deux autres antimicrobiens
- Les gonocoques ultrarésistants (UR) sont définis comme possédant une sensibilité réduite à une céphalosporine plus une résistance à l'azithromycine ainsi qu'une résistance à au moins deux autres antimicrobiens
Infections au Mycobacterium tuberculosis (TB) : 2015 à 2019
Principales conclusions
- Le taux d’infections au Mycobacterium tuberculosis (TB) au Canada est resté stable à environ 4,8 cas pour 100 000 habitants entre 2015 et 2019.
- En 2019, 11 % des isolats de TB étaient résistants à tout médicament antituberculeux de première intention :
- 8,9 % étaient monorésistants;
- 0,3 % étaient polyrésistants;
- 1,3 % étaient multirésistants.
- Un seul cas de TB ultrarésistante (UR) a été signalé depuis 2015.
Résultats
En 2019, 1 627 cas incidents de TB ont été signalés au Canada. Le complexe Mycobacterium tuberculosis (TB) a été isolé dans 98,7 % (n=1 607) des cas et Mycobacterium bovis dans les 1,7 % restants (n=20). Une résistance à au moins un médicament antituberculeux a été détectée chez 10,4 % (n=168) des isolats du complexe TB à culture positive (Figure 5). Parmi ces isolats, 81,5 % (n=137) étaient résistants à l’isoniazide, 25,6 % (n=43) à la pyrazinamide, 13,7 % (n=23) à la rifampicine. En 2019, 11,9 % (n=20) des isolats du complexe TB résistants étaient multirésistants (Figure 6) et aucun isolat du complexe TB n’était TB-UR (Tableau 7).
Bien que la différence entre les groupes d’âge soit minime, le complexe TB isolé chez les personnes âgées (>74 ans) était relativement moins résistant aux antituberculeux que le complexe TB isolé dans les groupes d’âge plus jeunes (Figure 7). Après une stratification selon le sexe, la proportion de complexes TB résistants isolés chez les hommes a historiquement été inférieure à la proportion de complexes TB résistants isolés chez les femmes; toutefois, cette proportion était à peu près égale en 2019.

Figure 6 : Description textuelle
Graphiques à secteurs pour les isolats de tuberculose testés pour la résistance aux médicaments antituberculeux au Canada, en 2019. Au total, 1 627 isolats ont été testés. 20 d’entre eux étaient des isolats de bacille de Calmette-Guérin (BCG) M. Bovis; les 1 607 autres étaient des isolats du complexe Mycobacterium tuberculosis (TB). Sur les 1 607 isolats du complexe Mycobacterium tuberculosis, 1 439 étaient sensibles, tandis que les 168 restants étaient résistants aux antituberculeux de première intention. Parmi les 168 isolats résistants, 143 étaient monorésistants, 5 étaient polyrésistants et 20 étaient multirésistants. Sur les 143 isolats monorésistants, 112 étaient résistants à l’isoniazide (INH), 3 étaient résistants à la rifampicine (RMP), 27 étaient résistants au pyrazinamide (PZA) et 1 était résistant à l’éthambutol (EMB). Parmi les 20 isolats multirésistants, 8 étaient résistants à l’isoniazide et à la rifampicine; 1 était résistant à l’isoniazide, à la rifampicine et à l’éthambutol; 4 étaient résistants à l’isoniazide, à la rifampicine, à l’éthambutol et au pyrazinamide; et 7 étaient résistants à l’isoniazide, à la rifampicine et au pyrazinamide. Parmi les 5 isolats polyrésistants, tous les 5 étaient résistants à l’isoniazide et au pyrazinamide. Aucun isolat n’était ultrarésistant.
Abréviations :
- TB : Mycobacterium Tuberculosis
- BCG : Mycobacterium bovis
- MR : Multirésistant
- UR : Ultrarésistant
- INH : Isoniazide
- RMP : Rifampicine
- PZA : Pyrazinamide
- EMB : Éthambutol
| Proportion (%) d’isolats résistants par année | |||||
|---|---|---|---|---|---|
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
| Isolats testés (n) | 1 331 | 1 450 | 1 522 | 1 458 | 1 607 |
| Toute résistance | 10,4 | 9,0 | 8,1 | 10,1 | 10,5 |
| Monorésistant | 8,5 | 7,4 | 6,8 | 8,3 | 8,9 |
| Polyrésistant | 0,2 | 0,3 | 0,4 | 0,3 | 0,3 |
| Multirésistant | 1,6 | 1,2 | 0,9 | 1,4 | 1,2 |
| Ultrarésistant | 0,0 | 0,0 | 0,0 | 0,1 | 0,0 |
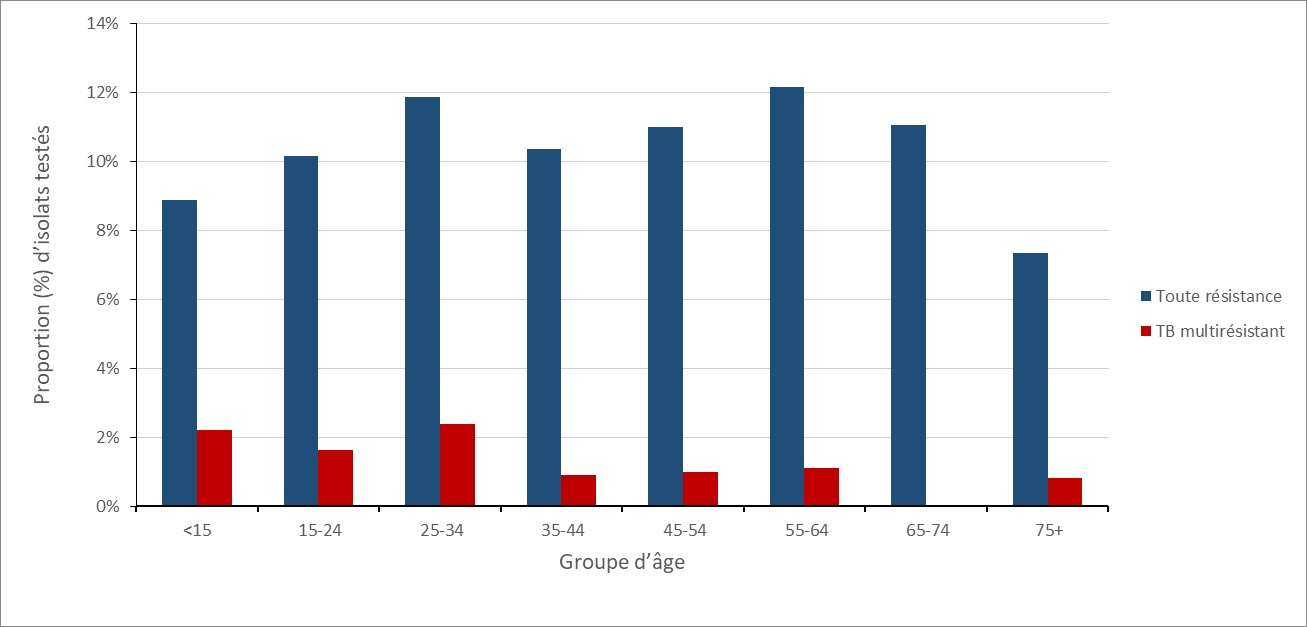
Figure 7 : Description textuelle
| Groupe d’âge | Toute résistance | TB multirésistant |
|---|---|---|
| <15 | 8,9 % | 2,2 % |
| 15-24 | 10,2 % | 1,6 % |
| 25-34 | 11,9 % | 2,4 % |
| 35-44 | 10,4 % | 0,9 % |
| 45-54 | 11,0 % | 1,0 % |
| 55-64 | 12,2 % | 1,1 % |
| 65-74 | 11,0 % | 0,0 % |
| 75+ | 7,3 % | 0,8 % |
Source : Système canadien de surveillance en laboratoires de la tuberculose (SCSLT) et Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO)
Méthodes
Les données sur la résistance de la TB aux antituberculeux de première et de deuxième intention ont été soumises par toutes les juridictions canadiennes au Système canadien de surveillance des laboratoires de tuberculose (SCSLT). Les isolats des cas de TB à culture positive ont été testés pour la sensibilité aux antimicrobiens. Tous les isolats de TB présentant des cultures positives du complexe M. tuberculosis (M. tuberculosis, M. africanum, M. canetti, M. caprae, M. microti, M. pinnipedii ou M. bovis) ont été inclus dans les analyses. Les isolats de bacille de Calmette-Guérin (BCG) M. bovis ont été exclus car ils représentent une complication de la vaccination antituberculeuse souvent rencontrée chez les patients immunodéprimés, où la souche n’est pas infectieuse. Les types de résistance aux médicaments ont été répertoriés et une tendance sur cinq ans a été évaluée :
- monorésistance (c’est-à-dire la résistance à un seul médicament antituberculeux de première intention);
- polyrésistance (c’est-à-dire la résistance à plus d’un médicament antituberculeux de première intention, autre que l’isoniazide et la rifampicine);
- multirésistance (c’est-à-dire la résistance à au moins l’isoniazide et la rifampicine);
- ultrarésistance (c’est-à-dire la résistance à toute fluoroquinolone, comme la ciprofloxacine et la moxifloxacine), et à au moins un des trois médicaments injectables de deuxième intention (capréomycine, kanamycine et amikacine), en plus de la multirésistance.
Infections au Streptococcus pneumoniae maladies pneumococciques invasives (PI) : 2014 à 2018
Principales conclusions
- Le taux de maladie pneumococcique invasive (PI) a augmenté de 21 % de 9 à 10,9 cas par 100 000 habitants entre 2014 et 2018.
- La proportion de multirésistance (c’est-à-dire d’isolats de Streptococcus pneumoniae résistants à trois classes d’antimicrobiens ou plus) identifiée dans les cas de PI évitables par la vaccination (VPC13) a augmenté de 25 %, de 9 % à 12 % entre 2014 et 2018.
- La proportion de multirésistance (MR) identifiée dans les cas de PI non évitables par la vaccination (non VPC13) a augmenté de 74 %, de 4 % à 6 % entre 2014 et 2018.
Résultats
Entre 2014 et 2018, le taux de maladies invasives dues au S. pneumoniae a augmenté de 21,1 %, passant de 9,0 à 10,9 pour 100 000 habitants. En 2018, on disposait de résultats de laboratoire pour 44,5 % (n= 1 792/4 026) de tous les cas de PI. La proportion d’isolats de S. pneumoniae résistants à la clarithromycine était de 25,8 %, suivie par la pénicilline (11,1 %) (en utilisant les seuils de méningite) et la résistance à la doxycycline était de 8,4 %. Tous les isolats de S. pneumoniae étaient sensibles à la daptomycine, au linézolide, à la tigécycline et à la vancomycine.
Entre 2014 et 2018, la proportion d’isolats de S. pneumoniae identifiés comme MR (c’est-à-dire des isolats résistants à trois classes ou plus d’antimicrobiens) a augmenté de 52,0 %, passant de 5,0 % (n=56) à 7,6 % (n=137). La proportion de MR était la plus élevée dans les sérotypes 15A (non évitable par la vaccination) et 19A (évitable par la vaccination), avec 58,0 % (n=23) et 29,0 % (n=27) démontrant ce modèle de résistance, respectivement.
Résistance dans les cas de PI évitables par la vaccination
Les PI (y compris certains sérotypes de PI associés à la MR) peuvent être évitées par l’utilisation du vaccin pneumococcique conjugué 13-valent (VPC-13) et du vaccin polysaccharidique contre le pneumocoque 23-valent (PNEUMOVAXMD23). En 2018, la proportion la plus élevée de résistance dans les sérotypes de PI évitables par le vaccin PCV13 était la clarithromycine (22,5 %), suivie par la doxycycline (13,8 %), la clindamycine (11,0 %) et la pénicilline (10,6 %). Entre 2014 et 2018, aucune résistance n’a été observée à l’ertapénème et <1 % des isolats étaient résistants à la moxifloxacine. Entre 2014 et 2018, la proportion de MR dans les sérotypes de PI évitables par le vaccin VPC13 a augmenté de 25,0 %, passant de 9,1 % à 11,6 %.
| Année | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|---|---|---|---|---|
| Isolats testés (n) | 294 | 292 | 284 | 295 | 520 |
| Sensible | 66,7 | 69,5 | 70,4 | 65,8 | 70,6 |
| Résistant à une classe d’antimicrobiens | 15,3 | 12,3 | 12,3 | 10,2 | 10,8 |
| Résistant à deux classes d’antimicrobiens | 8,8 | 5,8 | 7,0 | 9,5 | 7,1 |
| Multirésistant | 9,2 | 12,3 | 10,2 | 14,6 | 11,5 |
La multirésistance est définie comme une résistance à trois classes d’antimicrobiens ou plus.
Cas de PI résistants non évitables par la vaccination
En 2018, la proportion la plus élevée de résistance dans les sérotypes de PI non évitables par la vaccination (non VPC13) était la clarithromycine (27,1 %) et la pénicilline (11,3 %). Entre 2014 et 2018, <1 % des isolats étaient résistants à l’ertapénème, l’imipéneme et la moxifloxacine. Entre 2014 et 2018, la proportion de MR dans les sérotypes de PI non évitables par la vaccination (non VPC13) a augmenté de 74,3 %, passant de 3,5 % à 6,1 %.
| Proportion (%) d’isolats résistants par année | |||||
|---|---|---|---|---|---|
| Année | 2014 | 2015 | 2016 | 2017 | 2018 |
| Isolats testés (n) | 822 | 836 | 830 | 834 | 1 272 |
| Sensible | 69,0 | 69,6 | 68,8 | 64,5 | 61,5 |
| Résistant à une classe d’antimicrobiens | 19,3 | 20,6 | 20,2 | 22,8 | 26,7 |
| Résistant à deux classes d’antimicrobiens | 8,2 | 5,0 | 6,1 | 4,9 | 5,7 |
| Multirésistant | 3,5 | 4,8 | 4,8 | 7,8 | 6,1 |
La multirésistance est définie comme une résistance à trois classes d’antimicrobiens ou plus.
Notes :
- Sources : La Surveillance nationale en laboratoire de la maladie invasive due au streptocoque (eSTREP) et le Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO).
- La méthodologie a été publiée précédemment dans le rapport du SCSRA 2020.
- Avec la reconnaissance des contributions de l'Université du Manitoba, du Toronto Bacterial Disease Network, du Laboratoire provincial de l'Alberta, du Laboratoire de santé publique du Québec et de tous les laboratoires de santé publique provinciaux/territoriaux qui soumettent des isolats au programme eSTREP.
Infections au Streptococcus pyogenes (Streptocoques du groupe A) invasif : 2014 à 2018
Principales conclusions
- Le taux de maladies invasives dues au streptocoque du groupe A (iSGA) a augmenté de 65 %, de 5,2% à 8,6 % par 100 000 habitants entre 2014 et 2018.
- Tous les isolats de Streptococcus pyogenes étaient sensibles à la pénicilline et à la vancomycine.
- La résistance à l'érythromycine est restée stable avec des taux de 7,1 % à 9,6 % entre 2014 et 2018.
Résultats
Entre 2014 et 2018, le taux d’iSGA a augmenté de 65,4 %, passant de 5,2 à 8,6 cas par 100 000 habitants. En 2018, on disposait de résultats de laboratoire pour 94,5 % (n=2 760/2 922) des cas d’iSGA (en notant les variations dans la définition des sites stériles par province). Tous les isolats de Streptococcus pyogenes étaient sensibles à la pénicilline et à la vancomycine.
| Proportion (%) d’isolats résistants par année | |||||
|---|---|---|---|---|---|
| Année | 2014 | 2015 | 2016 | 2017 | 2018 |
| Isolats testés (n) | 1 460 | 1 453 | 1 768 | 2 052 | 2 760 |
| Clindamycine (Résistance) | 2,6 | 3,2 | 3,9 | 6,8 | 3,5 |
| Érythromycine (Résistance) | 7,1 | 8,3 | 8,8 | 9,9 | 9,6 |
| Pénicilline (Résistance) | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
| Vancomycine (Résistance) | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 |
Notes :
- Sources : La Surveillance nationale en laboratoire de la maladie invasive due au streptocoque (eSTREP) et le Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO)
- La méthodologie a été publiée précédemment dans le rapport du SCSRA 2020
- Avec la reconnaissance des contributions de l'Université du Manitoba, du Toronto Bacterial Disease Network, du Laboratoire provincial de l'Alberta, du Laboratoire de santé publique du Québec et de tous les laboratoires de santé publique provinciaux/territoriaux qui soumettent des isolats au programme eSTREP.
Consommation d’antimicrobiens par les humains, Canada, 2015 à 2019
Principales conclusions
- Entre 2015 et 2019, la consommation humaine globale d’antimicrobiens a diminué de 5 %, en notant une augmentation de 2 % de l’utilisation d’antimicrobiens qui devraient être réservés aux infections multirésistantes suspectées ou confirmées.
- Le taux de prescriptions d’antimicrobiens dans le secteur communautaire était le plus élevé chez les personnes âgées de 80 ans ou plus et a augmenté de 13 % entre 2015 et 2019.
- Entre 2015 et 2019, le taux de prescriptions provenant d’infirmiers et de pharmaciens a augmenté de 68 % et 210 %, respectivement.
Consommation globale d’antimicrobiens par les humains : perspective nationale
Entre 2015 et 2019, la consommation d’antimicrobiens chez l’homme (y compris les antimicrobiens délivrés par les pharmacies de détail en milieu communautaire et les antimicrobiens achetés par les hôpitaux) a diminué de 5,4 %, passant de 17,3 à 16,3 doses définies journalières (DDD) pour 1 000 jours-habitant, sous l’effet d’une diminution de 19,7 % des doses achetées par les hôpitaux.
En 2019, 16,3 doses d’antimicrobiens ont été consommées chaque jour pour chaque 1000 personnes au Canada.
En 2019, 92,7 % des DDD ont été délivrées en milieu communautaire par des pharmacies de détail œuvrant en milieu communautaire, et les 7,3 % restants ont été utilisés par des hôpitaux. Entre 2015 et 2019, le coût estimé (ajusté en dollars canadiens de 2019) de tous les antimicrobiens consommés a diminué de 9,2 %, passant de 836,3 millions de dollars à 759,6 millions de dollars.

Figure 8 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Milieu hospitalier (achat) | 544,2 | 526,0 | 509,9 | 611,7 | 437,1 |
| Milieu communautaire (distribution) | 5 755,1 | 5 741,5 | 5 710,4 | 5 713,1 | 5 523,4 |
Consommation globale d’antimicrobiens par les humains : provinces et territoires du Canada
En 2019, l’Île-du-Prince-Édouard et Terre-Neuve-et-Labrador (données combinées) ont consommé la plus grande quantité d’antimicrobiens par habitant, diminuant de 9,2 % depuis 2015 (de 10 010,2 à 9 087,1 DDD pour 1 000 habitants). La Colombie-Britannique et les territoires (données combinées) ont consommé la plus petite quantité d’antimicrobiens par habitant.
Entre 2015 et 2019, la consommation d’antimicrobiens a diminué dans toutes les provinces et tous les territoires du Canada; la Saskatchewan a connu le plus grand changement de consommation, avec une diminution de 10,7 % (de 7 889,4 à 7 045,3 DDD pour 1 000 habitants), suivie de l’Île-du-Prince-Édouard et de Terre-Neuve-et-Labrador à 9,2 % (de 9,827.9 à 9,087.1 DDD pour 1 000 habitants).

Figure 9 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| C.-B. et terr. | 6 008,3 | 5 776,0 | 5 745,1 | 5 729,8 | 5 475,9 |
| Alb. | 6 768,5 | 6 708,0 | 6 547,2 | 6 414,1 | 6 442,1 |
| Sask. | 7 889,4 | 7 843,2 | 7 260,7 | 7 189,8 | 7 045,3 |
| Man. | 6 811,7 | 6 863,1 | 6 747,5 | 6 697,0 | 6 322,1 |
| Ont. | 6 182,8 | 6 164,8 | 6 129,2 | 6 500,1 | 5 860,3 |
| Qc | 5 603,3 | 5 724,8 | 5 713,6 | 5 676,7 | 5 479,6 |
| N.-B. | 7 140,0 | 6 946,5 | 7 171,9 | 7 125,2 | 7 034,6 |
| N.-É. | 7 564,7 | 7 316,1 | 7 607,1 | 7 582,5 | 7 245,0 |
| î.-P.-É. et T.-N.-L. | 10 010,2 | 9 827,9 | 9 986,7 | 9 682,8 | 9 087,1 |
Abréviations : C.-B. et terr. = Colombie-Britannique combinée avec le Yukon, les Territoires du Nord-Ouest et le Nunavut; Alb. = Alberta; Sask. = Saskatchewan; Man. = Manitoba; Ont. = Ontario; Qc = Québec; N.-B. = Nouveau-Brunswick; N.-É. = Nouvelle-Écosse; î.-P.-É. et T.-N.-L. = Île-du-Prince-Édouard combinée avec Terre-Neuve-et-Labrador.
Consommation globale d’antimicrobiens par les humains : les 5 principales classes d’antimicrobiens
En 2019, les classes d’antimicrobiens les plus consommées par les humains étaient les tétracyclines (1 186,2 DDD pour 1 000 habitants), les pénicillines à large spectre (1 178,7 DDD pour 1 000 habitants), les macrolides (781,9 DDD pour 1 000 habitants), les associations de pénicillines (489,4 DDD pour 1 000 habitants) (Amoxicilline/Acide Clavulanique) et les céphalosporines de première génération (474,3 DDD pour 1 000 habitants). Entre 2018 et 2019, les fluoroquinolones sont passées de la quatrième à la sixième classe d’antimicrobiens la plus consommée (de 551,8 à 469,3 DDD pour 1 000 habitants).
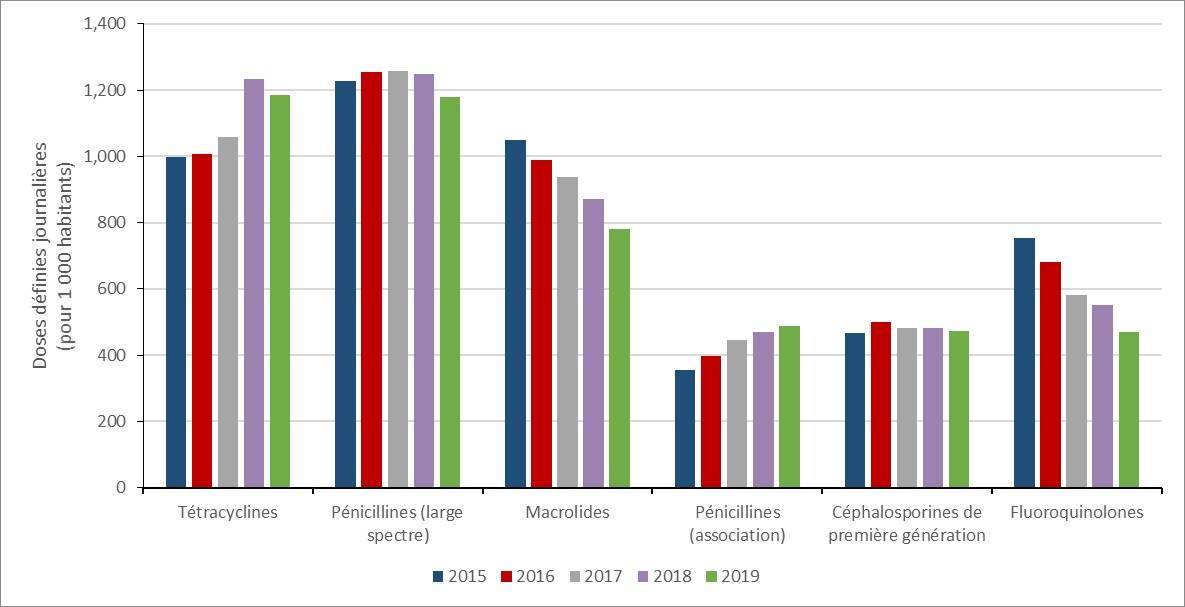
Figure 10 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Tétracyclines | 997,0 | 1 008,1 | 1 058,6 | 1 234,0 | 1 186,2 |
| Pénicillines (large spectre) | 1 228,2 | 1 255,1 | 1 257,3 | 1 247,5 | 1 178,7 |
| Macrolides | 1 047,8 | 987,5 | 937,6 | 872,3 | 781,9 |
| Pénicillines (association) | 355,0 | 396,6 | 446,6 | 471,2 | 489,4 |
| Céphalosporines de première génération | 467,4 | 498,9 | 481,2 | 481,7 | 474,3 |
| Fluoroquinolones | 754,5 | 679,9 | 581,9 | 551,8 | 469,3 |
Consommation globale d’antimicrobiens par les humains : classification AWaRe
Le programme AWaRe de l’Organisation mondiale de la Santé a publié une liste d’antibiotiques qui devraient être réservés au traitement des organismes multirésistants suspectés ou confirmés, appelés antibiotiques de « réserve ». Entre 2015 et 2019, la consommation de ces antibiotiques au Canada a augmenté de 2,3 %. Cette augmentation était en grande partie due à une hausse de 83,1 % de la consommation de daptomycine (de 2,7 à 5,0 DDD pour 1 000 habitants).
Entre 2015 et 2019, la consommation d’antibiotiques « à utiliser sélectivement » de la classification AWaRe de l’OMS (c’est-à-dire des antibiotiques qui ont un risque de résistance élevé) a diminué de 25,2 % (de 2 471,4 à 1 848,4 DDD pour 1 000 habitants) et la consommation d’antibiotiques « dont l’accessibilité est essentielle » de la classification AWaRe de l’OMS (c’est-à-dire des antibiotiques qui sont actifs contre de nombreux agents pathogènes sensibles courants et associés à un risque de résistance plus faible) a augmenté de 7,5 % (de 3 817,0 à 4 102,7 DDD pour 1 000 habitants).
En 2019, près de 70 % de tous les antimicrobiens consommés par les humains au Canada étaient classés dans la catégorie « dont l’accessibilité est essentielle » par le système AWaRe de l’OMS.
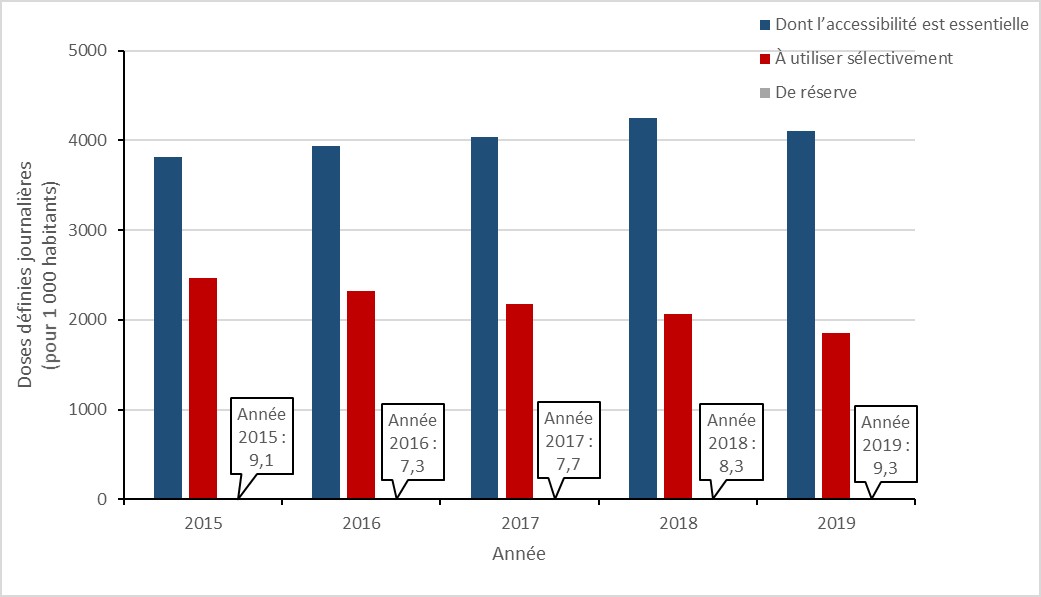
Figure 11 : Description textuelle
| Année | Dont l’accessibilité est essentielle | À utiliser sélectivement | De réserve |
|---|---|---|---|
| 2015 | 3 817,0 | 2 471,4 | 9,1 |
| 2016 | 3 934,3 | 2 325,3 | 7,3 |
| 2017 | 4 036,6 | 2 175,9 | 7,7 |
| 2018 | 4 252,2 | 2 064,1 | 8,3 |
| 2019 | 4 102,6 | 1 848,4 | 9,3 |
Consommation globale d’antimicrobiens par les humains : perspective internationale
En 2019, le Canada a consommé la 13e plus faible quantité d’antimicrobiens par rapport aux 30 pays qui se rapportent au Réseau de surveillance européenne de la consommation d’antibiotiques (ESAC-Net) – l’un des plus grands systèmes de surveillance de la consommation d’antimicrobiens normalisés à l’échelle internationale. La mesure de comparaison est celle des antimicrobiens J01 (antibiotiques à usage systémique), mesurée en DDD consommées par habitant par les humains dans les milieux communautaire et hospitalier.
En général, le taux de consommation d’antimicrobiens chez les humains aux Pays-Bas (le pays où la consommation déclarée est la plus faible, 9,5 DDD pour 1 000 jours-habitant) est approximativement la moitié du taux au Canada (16,3 DDD pour 1 000 jours-habitant). Le taux de consommation d’antimicrobiens chez les humains au Canada correspond à environ la moitié de celui de la Grèce (le pays où la consommation déclarée est la plus élevée, soit 34,1 DDD pour 1 000 jours-habitant).

Figure 12 : Description textuelle
| Pays | Milieu communautaire | Milieu hospitalier | Total (tel que rapporté par l’UE) |
|---|---|---|---|
| Grèce | 32,4 | 1,68 | 34,1 |
| Chypre | n/a | n/a | 30,1 |
| Roumanie | 24,0 | 1,73 | 25,8 |
| France | 23,3 | 1,74 | 25,1 |
| Espagne | 23,1 | 1,63 | 24,7 |
| Pologne | 22,2 | 1,42 | 23,6 |
| Irlande | 21 | 1,77 | 22,8 |
| Italie | 19,8 | 1,89 | 21,7 |
| Belgique | 19,8 | 1,54 | 21,3 |
| Luxembourg | 19,8 | 1,38 | 21,1 |
| Bulgarie | 19,1 | 1,63 | 20,7 |
| Malte | 18,7 | 1,99 | 20,7 |
| Islande | 19,5 | n/a | 19,5 |
| Slovaquie | 18,0 | 1,38 | 19,3 |
| Portugal | 17,9 | 1,4 | 19,3 |
| Croatie | 16,9 | 1,85 | 18,8 |
| Royaume-Uni | 15,6 | 2,53 | 18,2 |
| Tchéquie | n/a | n/a | 16,9 |
| Canada | 15,12 | 1,19 | 16,3 |
| Lituanie | 13,4 | 2,12 | 15,6 |
| Danemark | 13,4 | 1,86 | 15,3 |
| Norvège | 13,6 | 1,3 | 14,9 |
| Finlande | 12,6 | 2,1 | 14,7 |
| Hongrie | 13,3 | 1,16 | 14,4 |
| Lettonie | 12,0 | 1,88 | 13,9 |
| Slovénie | 11,5 | 1,5 | 13,0 |
| Suède | 10,3 | 1,48 | 11,8 |
| Estonie | 10,2 | 1,54 | 11,8 |
| Allemagne | 11,4 | n/a | 11,4 |
| Autriche | 9,9 | n/a | 9,9 |
| Pays-Bas | 8,7 | 0,8 | 9,5 |
Remarques : L’Autriche, l’Allemagne et l’Islande ne déclarent que la consommation dans le milieu communautaire. La Tchéquie et Chypre rapportent la consommation globale (milieux communautaire et hospitalier combinés). Les données du Royaume-Uni représentent l’Angleterre, l’Irlande du Nord et l’Écosse. La consommation déclarée par le Canada comprend la vancomycine, le métronidazole, la colistine et la fidaxomicine.
Source : Le Centre européen de prévention et de contrôle des maladies et l’Agence de santé publique du Canada.
Consommation d’antimicrobiens par les humains dans le milieu communautaire : doses définies journalières
Entre 2015 et 2019, la consommation d’antimicrobiens chez l’humain dans le milieu communautaire a diminué de 4,0 % (de 15,8 à 15,1 DDD pour 1 000 jours-habitant) et la proportion du total des DDD délivrées au Canada attribuée au milieu communautaire a augmenté de 91,4 % à 92,7 %.
Consommation d’antimicrobiens par les humains dans le milieu communautaire : prescriptions exécutées
Entre 2015 et 2019, le taux de prescription d’antimicrobiens exécutées par les pharmacies de détail a diminué de 3,0 % (de 641,6 à 622,5 prescriptions pour 1 000 habitants) et le nombre de DDD a diminué de 4,0 % (de 5 755,1 à 5 523,4 DDD pour 1 000 habitants).
En 2019, 1,7 prescription d’antimicrobiens a été exécutée par les pharmacies de détail canadiennes chaque jour pour chaque 1 000 personnes au Canada.
En 2019, le taux de prescription d’antimicrobiens exécutées par les pharmacies de détail était le plus élevé chez les femmes âgées de 80 ans ou plus (1 310,0 prescriptions pour 1 000 habitants), suivies des hommes âgés de 80 ans ou plus (1 112,7 prescriptions pour 1 000 habitants). Le taux le plus bas était celui des hommes âgés de 19 à 44 ans (364,9 prescriptions pour 1 000 habitants), suivi des hommes âgés de 0 à 18 ans (471,1 prescriptions pour 1 000 habitants) et des femmes âgées de 0 à 18 ans (511,7 prescriptions pour 1 000 habitants).
Le taux par lequel les antimicrobiens étaient prescrits a diminué pour toutes les catégories d’âge entre 2018 et 2019.

Figure 13 : Description textuelle
| Sexe | Femme | Homme | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Année | 2015 | 2016 | 2017 | 2018 | 2019 | 2015 | 2016 | 2017 | 2018 | 2019 |
| 0 à 18 | 561,9 | 576,6 | 551,8 | 546,8 | 511,7 | 519,0 | 536,5 | 510,3 | 507,5 | 471,1 |
| 19 à 44 | 760,9 | 745,1 | 724,4 | 720,0 | 697,3 | 407,5 | 398,9 | 387,9 | 380,3 | 364,9 |
| 45 à 64 | 725,1 | 738,8 | 760,4 | 764,8 | 739,2 | 497,5 | 512,3 | 528,9 | 532,7 | 516,1 |
| 65 à 79 | 996,2 | 958,9 | 958,5 | 965,0 | 938,1 | 802,4 | 780,8 | 785,5 | 793,8 | 773,5 |
| 80+ | 1 153,9 | 1 228,6 | 1 316,4 | 1 347,7 | 1 310,0 | 989,9 | 1 056,9 | 1 138,4 | 1 143,5 | 1 112,7 |
Consommation d’antimicrobiens par les humains dans le milieu communautaire : origine des prescriptions
Entre 2015 et 2019, une diminution de 8,4 % (420,3 à 384,8 prescriptions pour 1 000 habitants) a été observée dans les taux de prescriptions provenant des omnipraticiens et des médecins de famille (MF) et le taux de prescription provenant de toutes les autres spécialités médicales a augmenté de 3,4 % (de 83,9 à 86,8 prescriptions pour 1 000 habitants).
Parmi les sources non médicales, le taux de prescription a augmenté de 9,8 % (de 137,0 à 150,4 prescriptions pour 1 000 habitants) entre 2015 et 2019. Alors que la prescription globale des dentistes a augmenté de 1,2 % (de 46,9 à 47,4 prescriptions pour 1 000 habitants), celle des infirmiers praticiens et des pharmaciens a augmenté de 67,6 % (de 10,0 à 16,8 prescriptions pour 1 000 habitants) et de 210,3 % (de 3,3 à 10,1 prescriptions pour 1 000 habitants), respectivement.
En 2019, 61,8 % des prescriptions d’antimicrobiens provenaient des omnipraticiens et des médecins de famille, 7,6 % des dentistes, 2,7 % des infirmiers praticiens et 1,6 % des pharmaciens
En 2019, les médecins de famille et les omnipraticiens étaient responsables de 62 % des prescriptions, comparativement aux dentistes (8 %), aux infirmiers (3 %) et aux pharmaciens (2 %).
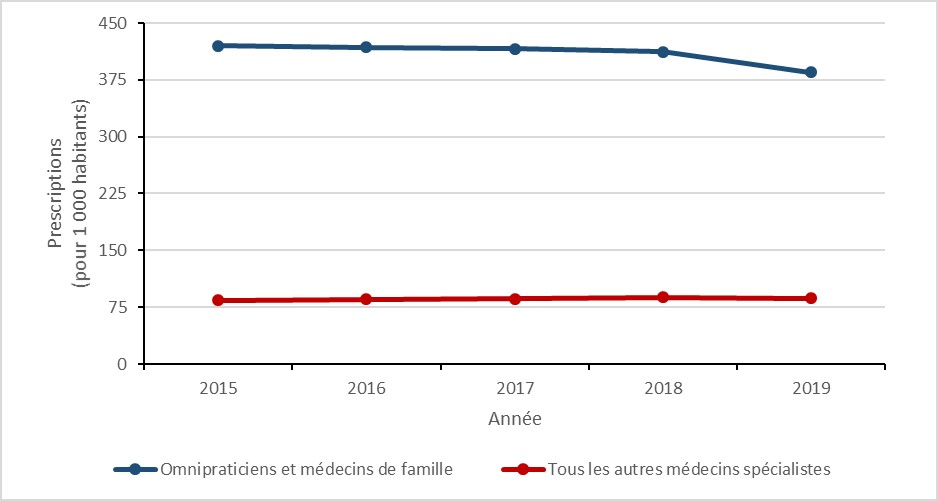
Figure 14 : Description textuelle
| Année | Omnipraticiens et médecins de famille | Tous les autres médecins spécialistes |
|---|---|---|
| 2015 | 420,3 | 83,9 |
| 2016 | 418,1 | 85,2 |
| 2017 | 415,9 | 86,2 |
| 2018 | 412,0 | 88,4 |
| 2019 | 384,8 | 86,8 |
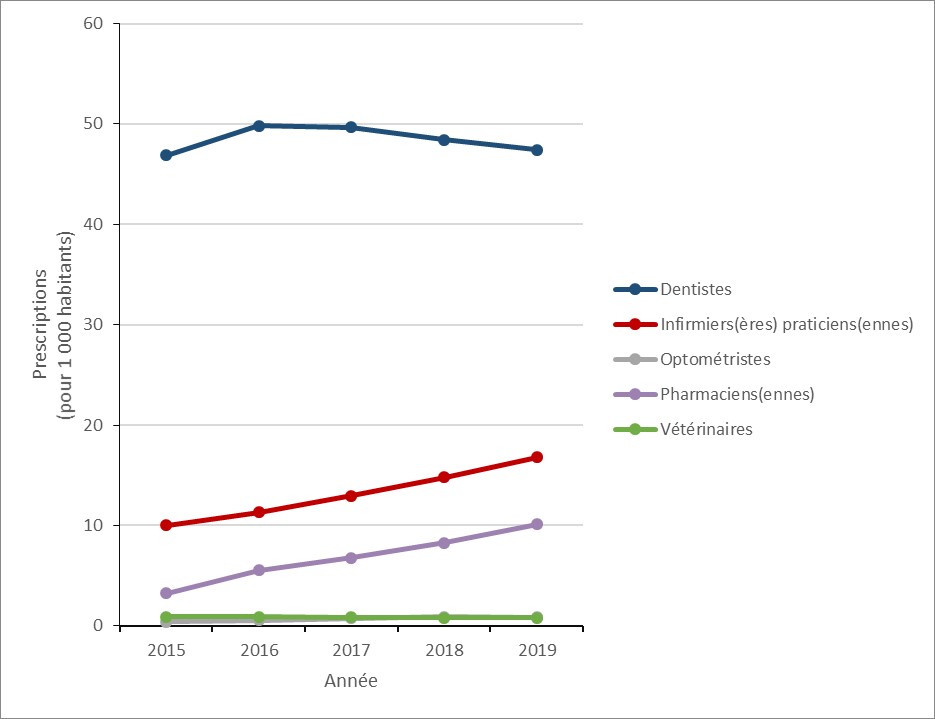
Figure 15 : Description textuelle
| Année | Dentistes | Infirmiers(ères) praticiens(ennes) | Optométristes | Pharmaciens(ennes) | Vétérinaires |
|---|---|---|---|---|---|
| 2015 | 46,9 | 10,0 | 0,4 | 3,3 | 0,9 |
| 2016 | 49,8 | 11,3 | 0,6 | 5,6 | 0,9 |
| 2017 | 49,7 | 13,0 | 0,8 | 6,8 | 0,9 |
| 2018 | 48,4 | 14,8 | 0,9 | 8,3 | 0,8 |
| 2019 | 47,4 | 16,8 | 0,9 | 10,1 | 0,8 |
Consommation d’antimicrobiens par les humains dans le milieu communautaire : carbapénèmes délivrés
Les carbapénèmes sont une classe d’antimicrobiens qui peuvent être utilisés pour traiter les infections multirésistantes et sont parfois considérés comme des médicaments de dernier recours. Au Canada, l’utilisation des carbapénèmes chez les animaux n’a jamais été autorisée.
Entre 2015 et 2019, la consommation de carbapénèmes dans la communauté a augmenté de 68,3 % (de 3,8 à 6,4 DDD pour 1 000 habitants), en grande partie en raison d’une augmentation de 156,4 % de l’utilisation du méropénem (de 0,6 à 1,6 DDD pour 1 000) et d’une augmentation de 49,8 % de l’utilisation de l’ertapénème (de 3,1 à 4,6 DDD pour 1 000 habitants).

Figure 16 : Description textuelle
| Année | Tous les carbapénèmes | Ertapénème | Méropénem |
|---|---|---|---|
| 2015 | 3,8 | 3,1 | 0,6 |
| 2016 | 4,8 | 3,8 | 1,0 |
| 2017 | 5,6 | 4,2 | 1,3 |
| 2018 | 6,8 | 4,7 | 2,0 |
| 2019 | 6,4 | 4,6 | 1,6 |
Antimicrobiens achetés par le milieu hospitalier : doses définies journalières
Entre 2015 et 2019, la quantité d’antimicrobiens achetés par les hôpitaux a diminué de 19,7 % (de 544,2 à 437,1 DDD pour 1 000 habitants), en grande partie en raison d’une diminution de 28,5 % entre 2018 et 2019 (de 611,7 à 437,1 DDD pour 1 000 habitants, sous réserve d’un ajustement pour tenir compte des retours). La proportion du total des DDD consommées par les humains au Canada attribuée aux achats des hôpitaux a diminué de 8,6 % en 2015 à 7,3 % en 2019.
Prescription d’antimicrobiens dans le milieu communautaire avant et pendant la pandémie de COVID-19 : résultats préliminaires, janvier à octobre 2020
Principales conclusions
- Entre mars et octobre 2020, le taux global de prescription d’antimicrobiens a diminué de 27 % par rapport à la même période de huit mois en 2019.
- La prescription globale a diminué d’un maximum de 40 % en mai 2020.
- La prescription aux enfants (âgés de 0 à 18 ans) a diminué de 70 % maximum en avril 2020.
- La prescription aux personnes âgées (80 ans ou plus) a diminué d’un maximum de 28 % en mai 2020.
Méthodes
Pour évaluer l’incidence de la pandémie de COVID-19 sur les pratiques de prescription au Canada, le taux de prescription par mois en 2020 a été comparé à celui du mois correspondant en 2019. Le début de la période pandémique canadienne a été établi comme étant en mars 2020, ce qui correspond à la fermeture de la frontière terrestre entre le Canada et les États-Unis. Les statistiques définitives sur l’ensemble de la période de pandémie seront publiées dans un prochain rapport.
L’ensemble des données d’analyse était composé de données sur la délivrance de prescriptions d’antibiotiques dans la communauté pour une période de 20 mois et provenant de la base de données canadienne CompuScript (CS) d’IQVIA, couvrant les dix provinces canadiennes de mars 2019 à octobre 2020. Les informations sur les concentrations et la posologie des médicaments sur ordonnance ont été obtenues à partir de la Base de données sur les produits pharmaceutiques (BDPP) de Santé Canada en utilisant les numéros d’identification des médicaments (DIN). Les estimations de population ont été obtenues à partir des estimations de population du recensement de mi-année de Statistique Canada.
Au début de la pandémie COVID-19 (mars à octobre 2020), le taux moyen de prescription d’antimicrobiens a diminué de 26,5 % par rapport aux mêmes mois en 2019 (de 50,4 à 37,0 prescriptions pour 1 000 habitants). Les baisses les plus importantes ont été observées au cours des premiers mois de la pandémie; le taux de prescription d’antimicrobiens a diminué de 38 % (de 54,0 à 33,4 prescriptions pour 1 000 habitants) en avril 2020 et de 40 % (de 52,7 à 31,9 prescriptions pour 1 000 habitants) en mai 2020. Si la disparité s’est réduite pendant les mois entre juin et septembre 2020, le taux de prescription d’antimicrobiens a de nouveau diminué de 30 % (de 54,2 à 38,1 prescriptions pour 1 000 habitants) en octobre 2020.

Figure 17 : Description textuelle
| Année | 2019 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Mois | Janvier | Février | Mars | Avril | Mai | Juin | Juillet | Août | Septembre | Octobre | Novembre | Décembre |
| Avant la COVID-19 | 60,0 | 49,7 | 54,7 | 54,0 | 52,7 | 46,7 | 47,5 | 45,2 | 47,9 | 54,2 | 51,7 | 57,6 |
| Pendant la COVID-19 | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable |
| Année | 2019 | |||||||||||
| Mois | Janvier | Février | Mars | Avril | Mai | Juin | Juillet | Août | Septembre | Octobre | Novembre | Décembre |
| Avant la COVID-19 | 61,3 | 50,6 | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable |
| Pendant la COVID-19 | Non applicable | Non applicable | 48,4 | 33,4 | 31,9 | 35,2 | 36,9 | 35,6 | 36,8 | 38,1 | Non disponible | Non disponible |
Remarque : Le début de la période pandémique canadienne a été établi comme étant en mars 2020, ce qui correspond à la fermeture de la frontière terrestre entre le Canada et les États-Unis.
Entre les mois de mars à octobre 2019 comparativement les mêmes mois en 2020, le taux de prescription d’antimicrobiens était plus élevé chez les femmes que chez les hommes.
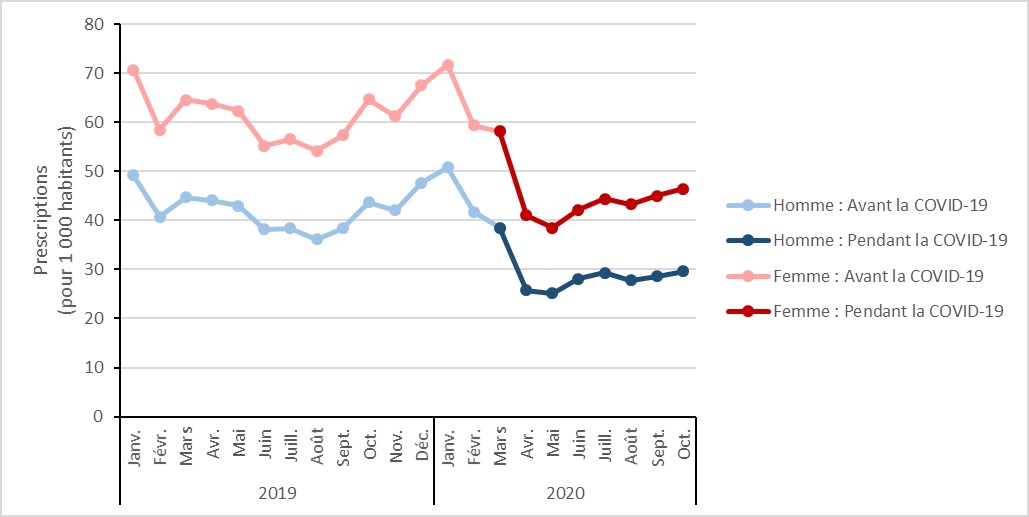
Figure 18 : Description textuelle
| Année | 2019 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Mois | Janvier | Février | Mars | Avril | Mai | Juin | Juillet | Août | Septembre | Octobre | Novembre | Décembre |
| Homme : Avant la COVID-19 | 49,2 | 40,7 | 44,7 | 44,1 | 43,0 | 38,2 | 38,4 | 36,2 | 38,4 | 43,7 | 42,0 | 47,6 |
| Homme : Pendant la COVID-19 | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable |
| Femme : Avant la COVID-19 | 70,7 | 58,5 | 64,6 | 63,7 | 62,3 | 55,2 | 56,5 | 54,2 | 57,4 | 64,6 | 61,2 | 67,5 |
| Femme : Pendant la COVID-19 | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable |
| Année | 2020 | |||||||||||
| Mois | Janvier | Février | Mars | Avril | Mai | Juin | Juillet | Août | Septembre | Octobre | Novembre | Décembre |
| Homme : Avant la COVID-19 | 50,9 | 41,7 | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable |
| Homme : Pendant la COVID-19 | Non applicable | Non applicable | 38,5 | 25,7 | 25,2 | 28,1 | 29,3 | 27,8 | 28,6 | 29,6 | Non disponible | Non disponible |
| Femme : Avant la COVID-19 | 71,7 | 59,4 | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable | Non applicable |
| Femme : Pendant la COVID-19 | Non applicable | Non applicable | 58,2 | 41,0 | 38,5 | 42,1 | 44,4 | 43,2 | 45,0 | 46,4 | Non disponible | Non disponible |
Le taux moyen de prescription d’antimicrobiens a diminué pour toutes les catégories d’âge au cours des huit premiers mois de la pandémie de COVID-19 (mars à octobre). La plus faible réduction au cours de cette période a été observée chez les personnes âgées de 80 ans ou plus, avec une diminution de 18,8 % (de 102,8 à 83,5 prescriptions pour 1 000 habitants); la plus forte réduction au cours de cette période a été observée chez les personnes âgées de 0 à 18 ans, avec une diminution de 50,7 % (de 37,2 à 18,3 prescriptions pour 1 000 habitants).
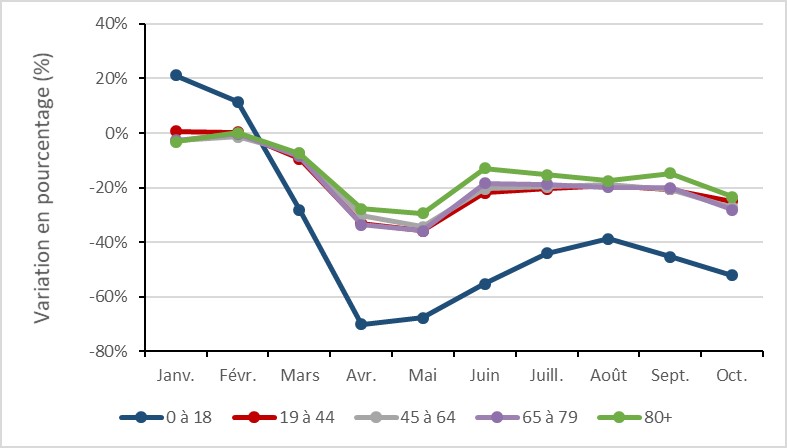
Figure 19 : Description textuelle
| Groupe d’âge | Janvier | Février | Mars | Avril | Mai | Juin | Juillet | Août | Septembre | Octobre |
|---|---|---|---|---|---|---|---|---|---|---|
| 0 à 18 | 21,12 % | 11,50 % | -28,12 % | -70,07 % | -67,60 % | -55,16 % | -44,03 % | -38,68 % | -45,31 % | -52,03 % |
| 19 à 44 | 0,64 % | 0,39 % | -9,49 % | -33,08 % | -35,75 % | -21,94 % | -20,37 % | -19,10 % | -20,51 % | -24,90 % |
| 45 à 64 | -2,87 % | -1,29 % | -7,48 % | -30,29 % | -34,32 % | -20,42 % | -19,64 % | -19,00 % | -20,58 % | -27,22 % |
| 65 à 79 | -2,60 % | -0,19 % | -8,43 % | -33,53 % | -35,87 % | -18,30 % | -18,69 % | -19,80 % | -20,08 % | -28,13 % |
| 80+ | -3,16 % | 0,10 % | -7,32 % | -27,74 % | -29,47 % | -12,94 % | -15,19 % | -17,54 % | -14,75 % | -23,3 3 % |
Antimicrobiens destinés à être utilisés chez les animaux au Canada
Principales conclusions
- Entre 2018 et 2019, le tonnage des ingrédients actifs antimicrobiens distribué pour être utilisé chez les animaux a diminué de 11 %Note de bas de page 2.
- Entre 2018 et 2019 :
- les ventes d’antimicrobiens destinés aux porcs, à la volaille et à l’aquaculture ont diminué;
- les ventes d’antimicrobiens destinés aux bovins, aux chevaux, aux animaux de compagnie et aux petits ruminants ont augmenté.
- En 2019, le Canada a distribué la huitième plus grande quantité d’antimicrobiens destinés aux animaux, par rapport aux dernières données (2018) de 31 pays européens.
Mise à jour de la méthodologie
Les modifications apportées au Règlement sur les aliments et drogues (publiées en Mai 2017) visent à renforcer la surveillance des antimicrobiens disponibles pour une utilisation chez les animaux. Depuis 2018, les fabricants, importateurs et préparateurs de médicaments doivent fournir des rapports de ventes annuels en ce qui a trait aux antimicrobiens importants sur le plan médical destinés à être utilisés chez les animaux (Santé Canada, 2020). Ces rapports remplaceront les données historiquement fournies sur une base volontaire par l’Institut canadien de la santé animale (ICSA).
Pour répondre à ces exigences de déclaration, Santé Canada et l’Agence de la santé publique du Canada ont mis au point un système de collecte en ligne des données sur les ventes, appelé système de rapports sur les ventes de médicaments vétérinaires antimicrobiens (RVMVA).
Ce rapport classe les antimicrobiens en fonction de leur importance pour la médecine humaine, selon un système de classement élaboré par la Direction des médicaments vétérinaires de Santé Canada. Dans ce système, les antimicrobiens de catégorie I sont considérés comme ayant une très grande importance pour la médecine humaine (par exemple, les fluoroquinolones). Les antimicrobiens de la catégorie II sont d’une grande importance pour la médecine humaine (par exemple, les macrolides), et ceux de la catégorie III sont d’une importance moyenne pour la médecine humaine (par exemple, les tétracyclines). Les antimicrobiens de catégorie IV (c’est-à-dire de faible importance pour la médecine humaine, comme les ionophores) ne sont pas inclus dans ce document. Au Canada, les antimicrobiens qui sont considérés comme importants sur le plan médical se trouvent dans la Liste A : Liste de certains ingrédients actifs pharmaceutiques antimicrobiens de Santé Canada.
Terminologie
L’Unité corrigée de la population (Population correction Unit -PCU-) : également appelée mesure de la biomasse, le PCU tient compte de la taille de la population, y compris le nombre et le poids des animaux ou des personnes dans la population. Pour le PCU animale, le poids correspond au poids moyen estimé de l’animal au moment du traitement.
Antimicrobiens vendus pour être utilisés chez les animaux
Entre 2018 et 2019, le nombre de kilogrammes d’antimicrobiens vendus pour être utilisés chez tous les animaux a diminué de 10,0 % (de 1,1 million à 1,0 million de kilogrammes). De même, pour les animaux de rente, la quantité d’antimicrobiens mesurée en milligrammes (mg) par unité corrigée de la population (PCU) a diminué de 12 % (de 150 à 132 mg/PCU) en utilisant les poids standards canadiens des animaux et de 12 % (de 163 à 143 mg/PCU) en utilisant les poids standards européens des animaux.

Figure 20 : Description textuelle
| Données pour la figure | Total (kg) | Total (mg/PCUEU – poids européens) | Total (mg/PCUCA – poids canadiens) |
|---|---|---|---|
| 2015 (ICSA) | 1187135,8 | 183,0 | 175,2 |
| 2016 (ICSA) | 1051010,0 | 160,0 | 154,2 |
| 2017 (ICSA) | 934872,7 | 141,2 | 136,8 |
| 2018 (ICSA/RVMVA) | 1082768,0 | 162,9 | 150,3 |
| 2019 (RVMVA) | 968985,0 | 143,0 | 131,7 |
Remarques :
- Les données démographiques utilisées pour les chevaux vivants datent de 2010. Les données RVMVA excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV (example : ionophores) et les antimicrobiens non catégorisés non importants sur le plan médical (example : coccidiostats chimiques). Les données de l’ICSA excluent les ionophores et les coccidiostats chimiques.
- Sources : Le Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA), l’Institut canadien de la santé animale (ICSA), la Surveillance européenne des antimicrobiens vétérinaires Consommation (ESVAC), Pêches et Océans Canada, Statistique Canada, Agriculture et Agroalimentaire Canada, Canada Équestre, Producteurs de poulet du Canada, Producteurs d'œufs du Canada, Producteurs canadiens d'œufs d'incubation et Canfax.
- La figure indique une rupture des lignes entre les données telles que fournies par l’ICSA (2015, 2016 et 2017) et les données fournies dans le système RVMVA. Ces deux sources de données ont des fournisseurs de données différents; les tendances doivent être interprétées avec prudence.
En 2019, les cinq principales classes d’ingrédients actifs antimicrobiens vendus pour être utilisés chez les animaux en termes de poids (à l’exclusion des classes d’antimicrobiens qui ne peuvent pas être déclarées indépendamment) étaient les tétracyclines (495 116 kilogrammes), les macrolides (115 822 kilogrammes), les pénicillines (91 095 kilogrammes), les sulfamides (53 226 kilogrammes) et les lincosamides (46 390 kilogrammes). Dans l’ensemble, un pour cent des ingrédients actifs antimicrobiens vendus pour être utilisés chez les animaux étaient de catégorie I (c’est-à-dire d’une très grande importance pour la médecine humaine); toutefois, les ventes d’antimicrobiens de catégorie I ont augmenté de 10 % entre 2018 et 2019.

Figure 21 : Description textuelle
| Classe d'antimicrobiens | Kilogrammes vendus | |
|---|---|---|
| 2018 | 2019 | |
| Nitrofuranes | 49 | 23 |
| Polymyxines | 16 | 8 |
| Fluoroquinolones | 716 | 937 |
| Aminocyclitols | 1 241 | 744 |
| Céphalosporines (troisième génération) | 1 946 | 1 676 |
| Associations d'inhibiteurs de bêta-lactamase | 2 636 | 2 748 |
| Céphalosporines (première ou deuxième génération) | 2 820 | 3 147 |
| Aminoglycosides | 14 467 | 6 487 |
| Amphénicols | 11 318 | 13 030 |
| Associations diamino-sulfa | 22 051 | 25 519 |
| Lincosamides | 46 583 | 46 390 |
| Sulfamides | 88 274 | 53 226 |
| Pénicillines | 117 222 | 91 095 |
| Non rapporté indépendamment | 106 121 | 120 455 |
| Macrolides | 129 579 | 115 822 |
| Tétracyclines | 544 102 | 495 116 |
Remarques : Les antimicrobiens non rapportés indépendamment (NRI) comprennent les aminocoumarines, les bacitracines, les diaminopyrimidines, l'acide fusidique, les glycopeptides, les nitroimidazoles, les orthosomycines, les dérivés d'acide phosphonique, les pleuromutilines, les acides pseudomoniques, les streptogramines et les agents thérapeutiques contre la tuberculose. Les données excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV et les antimicrobiens non classés sans importance médicale.
Entre 2018 et 2019, les ventes d’antimicrobiens destinés aux porcs, à la volaille et à l’aquaculture ont diminué; les ventes destinées aux bovins, aux chevaux, aux animaux de compagnie et aux petits ruminants ont augmenté. Pour de plus amples renseignements sur les antimicrobiens destinés à être utilisés chez les veaux de boucherie, les chevaux, les petits ruminants et d’autres animaux, veuillez consulter le plus récent rapport du PICRA.
Aquaculture
- Le nombre de kilogrammes d’antimicrobiens vendus pour être utilisés dans l’aquaculture a diminué de 29 % entre 2018 et 2019.
- En 2019, les seules classes d’antimicrobiens vendus pour être utilisés en aquaculture étaient les tétracyclines et les amphénicols.
Bovins de boucherie
- Le nombre de kilogrammes d’antimicrobiens vendus pour être utilisés chez les bovins de boucherie a augmenté de 13 % entre 2018 et 2019, notant une augmentation de 6 % des ventes d’antimicrobiens de catégorie I.
- En 2019, les trois principales classes d’antimicrobiens vendus pour être utilisés chez les bovins de boucherie étaient les tétracyclines, les macrolides et les amphénicols.
Bovins laitiers
- Le nombre de kilogrammes d’antimicrobiens vendus pour être utilisé chez les bovins laitiers a augmenté de 15 % entre 2018 et 2019, notant une diminution de 25 % des ventes d’antimicrobiens de catégorie I.
- En 2019, les trois principales classes d’antimicrobiens vendus pour être utilisés chez les bovins laitiers étaient les tétracyclines, les associations diaminopyrimidine-sulfonamide et les pénicillines.
Volailles (poulets et dindes)
- Le nombre de kilogrammes d’antimicrobiens vendus pour être utilisés chez les volailles a diminué de 9 % entre 2018 et 2019.
- De petites quantités (moins d’un kilogramme) de fluoroquinolones et de céphalosporines de troisième génération (antimicrobiens de très haute importance pour la médecine humaine) ont été vendues ou préparées pour être utilisées chez les volailles en 2018 et 2019.
Porcs
- Le nombre de kilogrammes d’antimicrobiens vendus pour être utilisés chez les porcs a diminué de 21 % entre 2018 et 2019, notant une diminution de 24 % des ventes d’antimicrobiens de catégorie I.
- En 2019, les trois principales classes d’antimicrobiens vendus pour être utilisés chez les porcs étaient les tétracyclines, les macrolides et les pénicillines.
Animaux de compagnie
- Le nombre de kilogrammes d’antimicrobiens vendus pour être utilisés chez les animaux de compagnie a augmenté de 17 % entre 2018 et 2019, notant une augmentation de 24 % des ventes d’antimicrobiens de catégorie I.
- En 2019, les trois principales classes d’antimicrobiens vendus pour être utilisés chez les animaux de compagnie étaient les céphalosporines de première ou deuxième génération, les inhibiteurs des associations de pénicillines-bêta-lactamase et les antimicrobiens regroupés dans la catégorie « non déclarée de manière indépendante ».
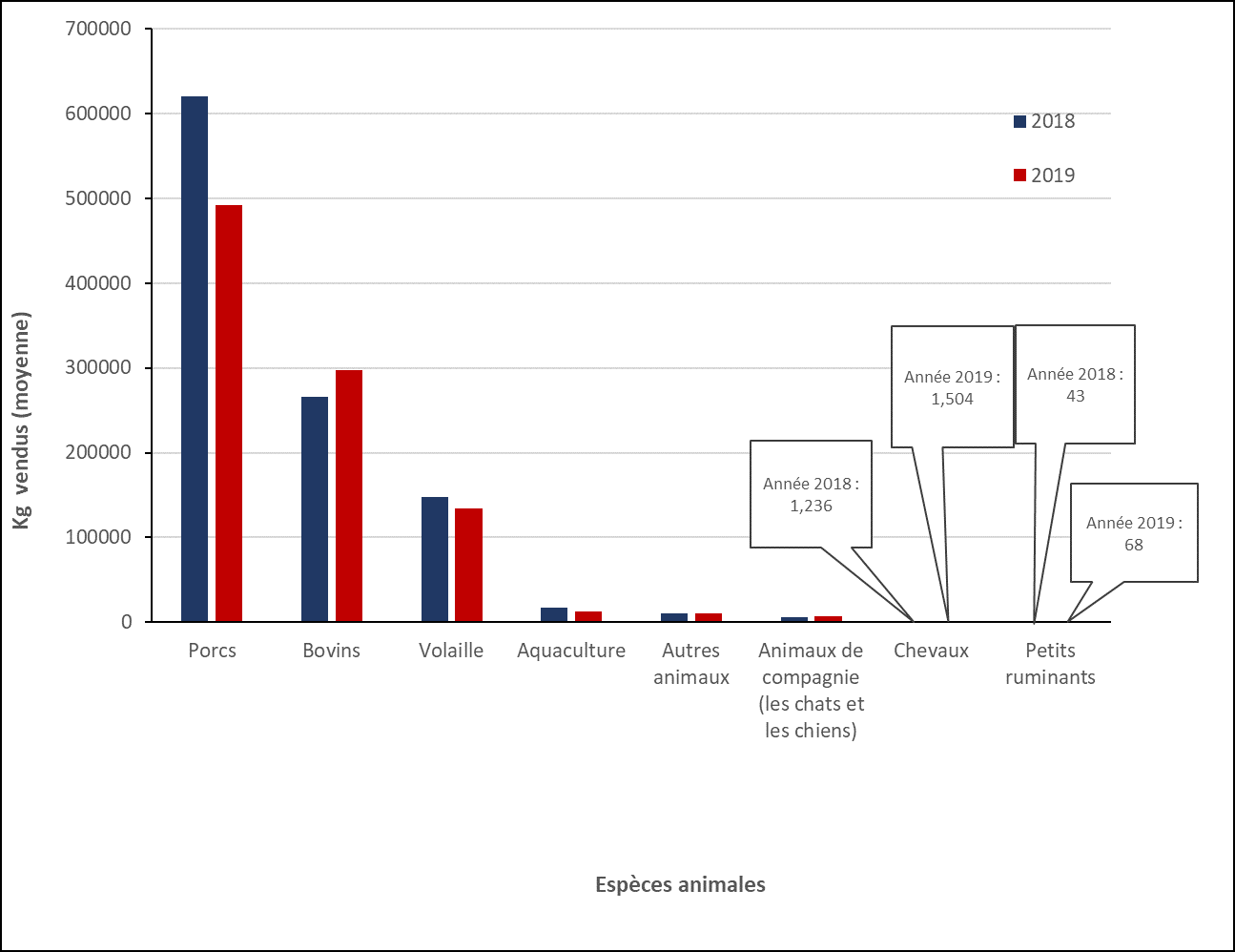
Figure 22 : Description textuelle
| Année | 2018 | 2019 |
|---|---|---|
| Espèces animales | Moyenne | Moyenne |
| Porcs | 620355 | 491640 |
| Bovins | 266343 | 297810 |
| Volaille | 147853 | 134351 |
| Aquaculture | 17596 | 12507 |
| Autres animaux | 10274 | 10093 |
| Animaux de compagnie | 6373 | 7440 |
| Chevaux | 1236 | 1504 |
| Petits ruminants | 43 | 68 |
Remarques : Les données RVMVA excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV et les antimicrobiens non catégorisés non importants sur le plan médical.

Figure 23 : Description textuelle
| Année | 2018 | 2019 |
|---|---|---|
| Espèces animales | Moyenne | Moyenne |
| Porcs | 353,8 | 277,5 |
| Volaille | 196,7 | 175,2 |
| Bovins | 67,1 | 72,7 |
| Aquaculture | 92,5 | 66,9 |
| Animaux de compagnie | 40,8 | 47,6 |
| Chevaux | 2,6 | 3,1 |
| Petits ruminants | 0,8 | 1,2 |
Remarques : Les données RVMVA excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV et les antimicrobiens non catégorisés non importants sur le plan médical. Les espèces « Autres animaux » n’ont pu être assignées à aucune des espèces actuelles; aucun dénominateur n’a donc pu être déterminé pour ces espèces et ces données ont été exclues. Il est à noter que le dénominateur pour l’aquaculture a été calculé différemment de celui des espèces animales terrestres (approche ESVAC modifiée). Des renseignements supplémentaires sont disponibles dans le plus récent rapport du PICRA.
Antimicrobiens vendus pour être utilisés chez les animaux : perspective internationale
Le réseau de Surveillance européenne de la consommation d’antimicrobiens à usage vétérinaire (ESVAC) recueille et communique des données sur la quantité d’antimicrobiens destinés à être utilisés chez les animaux dans 31 pays européens. Ces renseignements sont rapportés en milligrammes par unité corrigée de la population (mg/PCU) et constituaient la meilleure source publiquement disponible pour des comparaisons internationales par pays.
Si l’on compare les données les plus récentes fournies par l’ESVAC et qu’on suppose que les données sont comparables, le Canada se classe au huitième rang pour ce qui est des quantités les plus élevées d’antimicrobiens vendus pour être utilisés chez les animaux de rente par rapport aux pays européens.
Il est important de noter que la structure et le niveau de détail des données relatives aux classes de production animale disponibles dans les ensembles de données européennes diffèrent de ceux des ensembles de données canadiennes; ce chiffre doit donc être interprété avec prudence. Les données du dénominateur canadien comprenaient le nombre de bovins de boucherie vivants, qui ne sont pas inclus en tant que catégorie distincte dans les données européennes.

Figure 24 : Description textuelle
| Pays européens (2018) | Pays européens (2018) | Canada (2019) – poids européens | Canada (2019) – poids canadiens | Médiane (des pays de l’Union européenne) |
|---|---|---|---|---|
| Autriche | 50 | 143 | 132 | 57 |
| Belgique | 113 | 143 | 132 | 57 |
| Bulgarie | 119 | 143 | 132 | 57 |
| Croatie | 66 | 143 | 132 | 57 |
| Chypre | 466 | 143 | 132 | 57 |
| Tchéquie | 57 | 143 | 132 | 57 |
| Danemark | 38 | 143 | 132 | 57 |
| Estonie | 53 | 143 | 132 | 57 |
| Finlande | 18 | 143 | 132 | 57 |
| France | 64 | 143 | 132 | 57 |
| Allemagne | 88 | 143 | 132 | 57 |
| Grèce | 90 | 143 | 132 | 57 |
| Hongrie | 180 | 143 | 132 | 57 |
| Islande | 4 | 143 | 132 | 57 |
| Irlande | 46 | 143 | 132 | 57 |
| Italie | 244 | 143 | 132 | 57 |
| Lettonie | 36 | 143 | 132 | 57 |
| Lituanie | 33 | 143 | 132 | 57 |
| Luxembourg | 33 | 143 | 132 | 57 |
| Malte | 150 | 143 | 132 | 57 |
| Pays-Bas | 57 | 143 | 132 | 57 |
| Norvège | 2 | 143 | 132 | 57 |
| Pologne | 167 | 143 | 132 | 57 |
| Portugal | 186 | 143 | 132 | 57 |
| Roumanie | 82 | 143 | 132 | 57 |
| Slovaquie | 49 | 143 | 132 | 57 |
| Slovénie | 43 | 143 | 132 | 57 |
| Espagne | 219 | 143 | 132 | 57 |
| Suède | 12 | 143 | 132 | 57 |
| Suisse | 40 | 143 | 132 | 57 |
| Royaume-Uni | 29 | 143 | 132 | 57 |
Remarques : Les données RVMVA (données des fabricants et importateurs) excluent les antifongiques, les antiparasitaires, les antiviraux, les antimicrobiens de catégorie IV et les antimicrobiens non catégorisés non importants sur le plan médical. Le dénominateur de PCU a été harmonisé dans la mesure du possible avec le réseau ESVAC (le dénominateur de l’ESVAC n’inclut pas les bovins de boucherie, alors qu’au Canada les bovins de boucherie constituent une population importante et sont inclus; l’ESVAC exclut les données sur les animaux de compagnie du numérateur). Les données canadiennes utilisées pour les chevaux vivants datent de 2010.
Sources : Agence européenne des médicaments, Surveillance européenne de la consommation d’antibiotiques à usage vétérinaire, 2020. Sale of veterinary antimicrobial agents in 31 European countries in 2018. (EMA/24309/2020). Accessible à : https://www.ema.europa.eu/en/documents/report/sales-veterinary-antimicrobial-agents-31-european-countries-2018-trends-2010-2018-tenth-esvac-report_en.pdf (en anglais) Consulté le 23 janvier 2021.
Il est important de noter que la structure et le niveau de détail des données relatives aux classes de production animale disponibles dans les ensembles de données européennes diffèrent de ceux des ensembles de données canadiennes; cette figure doit donc être interprétée avec prudence.
Indication de l’utilisation d’antimicrobiens chez les animaux (surveillance au niveau des exploitations)
Les renseignements sur l’indication de l’UAM chez les poulets de chair, les porcs d’engraissement et les dindes étaient disponibles grâce à la surveillance des fermes sentinelles menée en 2019. La majorité de l’UAM avait pour but la prévention des maladies (principalement pour la prévention des maladies entériques).
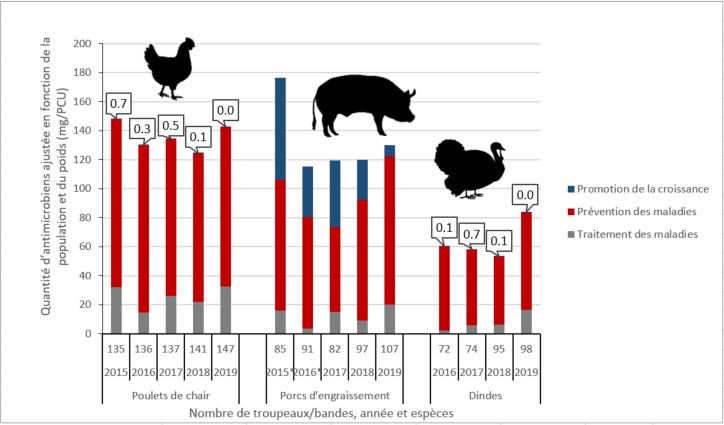
Figure 25 : Description textuelle
| Poulets de chair | |||||
|---|---|---|---|---|---|
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
| Nombre de troupeaux/bandes | 135 | 136 | 137 | 141 | 147 |
| Traitement des maladies | 32,3 | 14,5 | 26,0 | 22,2 | 32,8 |
| Prévention des maladies | 115,5 | 115,4 | 108,0 | 102,1 | 109,7 |
| Promotion de la croissance | 0,7 | 0,3 | 0,5 | 0,1 | 0,0 |
| Porcs d'engraissement | |||||
| Année | 2015Note de bas de page * | 2016Note de bas de page * | 2017 | 2018 | 2019 |
| Nombre de troupeaux/bandes | 85 | 91 | 82 | 97 | 107 |
| Traitement des maladies | 16,0 | 3,7 | 15,1 | 8,9 | 20,2 |
| Prévention des maladies | 90,0 | 76,8 | 58,2 | 83,5 | 102,1 |
| Promotion de la croissance | 70,3 | 35,0 | 46,1 | 27,6 | 7,9 |
| Dindes | |||||
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
| Nombre de troupeaux/bandes | Non disponible | 72 | 74 | 95 | 98 |
| Traitement des maladies | Non disponible | 2,0 | 6,0 | 6,2 | 16,3 |
| Prévention des maladies | Non disponible | 58,1 | 51,9 | 47,0 | 67,2 |
| Promotion de la croissance | Non disponible | 0,1 | 0,7 | 0,1 | 0,0 |
Notes de bas de page
|
|||||
Troupeaux de porcs d’engraissement
En 2019, il y a eu utilisation continue d’antimicrobiens importants sur le plan médical à des fins de promotion de la croissance dans trois des 107 fermes sentinelles.
Si l’on exclut l’utilisation d’antimicrobiens de catégorie IV (y compris les ionophores et les flavophospholipols) dans les aliments pour animaux, la quantité déclarée d’antimicrobiens utilisés pour favoriser la croissance a diminué à 21 DDD/1 000 PJAR, soit 13 % (21/162) de l’utilisation globale dans les aliments pour animaux pour 2019. En comparaison, elle était de 42 DDD/1 000 PJAR, soit 24 % (42/178) en 2018. Les antimicrobiens administrés par l’eau et par injection étaient utilisés uniquement pour la prévention ou le traitement des maladies, et non pour favoriser la croissance.
Pour les élevages de poulets de chair
Aucune ferme sentinelle d’élevage de poulets de chair n’a signalé l’utilisation d’antimicrobiens pour favoriser la croissance en 2019.
Pour les élevages de dindes
Aucune ferme sentinelle d’élevage de dindes n’a signalé l’utilisation d’antimicrobiens pour favoriser la croissance en 2019.
Intégration des renseignements sur les antimicrobiens destinés à être utilisés dans tous les secteurs (pour les humains, les animaux et les cultures)
Dans l’ensemble
Le nombre total de kilogrammes d’antimicrobiens vendus pour être utilisés dans les secteurs des humains et des animaux ainsi que des plantes a été calculé grâce à l’intégration de données provenant d’IQVIA, des RVMVA et de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada.
En 2019, un total de 1,2 million de kilogrammes d’antimicrobiens importants sur le plan médical a été vendu au Canada. Les ventes destinées aux animaux de rente représentaient 78 % du total, aux humains 22 %, aux animaux de compagnie <1 % et les antimicrobiens utilisés comme pesticides sur les cultures alimentaires représentaient <1 %.
Cependant, en 2019, il y avait environ 23 animaux pour chaque humain au Canada (une sous-estimation, car le nombre de poissons n’est pas inclus dans le nombre d’animaux). Lorsque la biomasse des personnes et des animaux a été prise en compte, il a été révélé qu’environ 1,4 fois plus d’antimicrobiens étaient destinés à être utilisés chez les animaux de rente que chez les personnes en utilisant les poids standards européens des animaux. Le ratio serait de 1,3 fois en utilisant les poids standards canadiens des animaux.
Si des groupes d’antimicrobiens similaires ont été distribués ou achetés pour être utilisés dans les deux secteurs, les types d’antimicrobiens vendus variaient (Figure 26 ). Les ventes d’antimicrobiens dans le secteur animal ont reflété relativement plus de tétracyclines et de macrolides que dans le secteur humain. Inversement, il y a eu relativement plus de ventes de céphalosporines de troisième génération (et de génération supérieure) et de fluoroquinolones dans le secteur humain que dans le secteur animal. Au Canada, l’utilisation des antimicrobiens de la classe des carbapénèmes chez les animaux n’a jamais été autorisée.
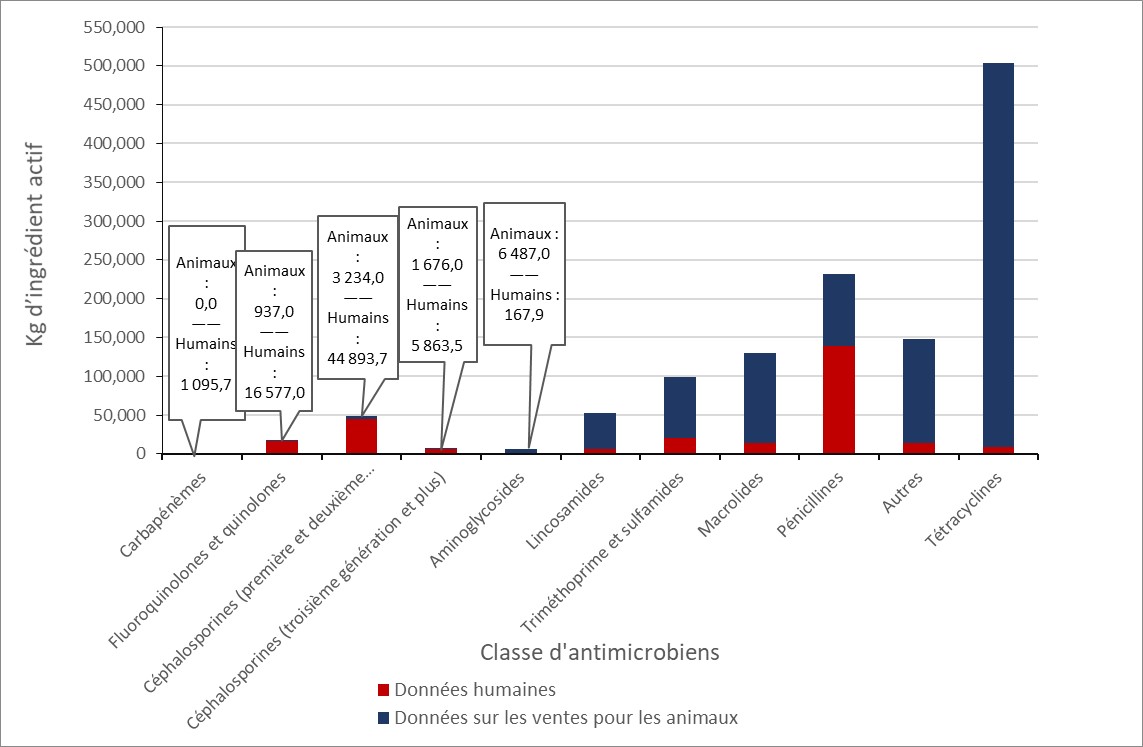
Figure 26 : Description textuelle
| Classe d'antimicrobiens | Données humaines | Données sur les ventes pour les animaux |
|---|---|---|
| Carbapénèmes | 1095,7 | 0,0 |
| Fluoroquinolones et quinolones | 16577,0 | 937,0 |
| Céphalosporines (première et deuxième génération) | 44893,7 | 3234,0 |
| Céphalosporines (troisième génération et plus) | 5863,5 | 1676,0 |
| Aminoglycosides | 167,9 | 6487,0 |
| Lincosamides | 6514,4 | 46390,0 |
| Triméthoprime et sulfamides | 19827,0 | 78962,0 |
| Macrolides | 14073,9 | 115822,0 |
| Pénicillines | 138390,6 | 93843,0 |
| Autres | 14108,3 | 134044,0 |
| Tétracyclines | 8328,4 | 495116,0 |
Sources des données : IQVIA et RVMVA.
Les autres produits destinés aux humains comprennent : bacitracine, ceftobiprole médocaril, ceftolozane : tazobactam, chloramphénicol, colistine, daptomycine, fidaxomicine, fosfomycine, acide fusidique, linézolide, métronidazole, nitrofurantoïne et vancomycine.
Les autres produits destinés aux animaux comprennent : aminocoumarines, aminocyclitols, amphénicols, inhibiteurs de bêta-lactamase, polypeptides cycliques, acide fusidique, glycopeptides, nitrofurantoïnes, nitro-imidazoles, orthosomycines, dérivés d’acide phosphonique, pleuromutilins, polymyxines, acides pseudomoniques, streptogramines et les agents thérapeutiques contre la tuberculose.
Méthodes : renseignements sur l’utilisation des antimicrobiens (c’est-à-dire données au niveau des fermes)
En 2019, les renseignements sur l’utilisation des antimicrobiens ont été fournis volontairement par 352 fermes sentinelles participant au Programme Intégré Canadien de Surveillance de la Résistance aux Antimicrobiens (PICRA; 147 élevages de poulets de chair, 98 élevages de dindes et 107 élevages de porcs d’engraissement). Vous trouverez plus de détails dans le document PICRA 2019 : Design et méthodes (Agence de la santé publique du Canada [ASPC], 2020).
Auteurs
| Auteurs principaux | Programme | Collaborateurs | Programme | Remerciements | Programme |
|---|---|---|---|---|---|
Dr Oscar Niragira |
SCSRA |
Dr Aboubakar Mounchili |
SCSLT |
Caroline M Desjardins |
SCSRA |
Annexes
Annexe A : Antibiotiques inclus dans chaque classe (par exemple : regroupement ATC), secteur humain
| Atc4 | Atc4 description | Atc5 | Atc5 description | Molecule |
|---|---|---|---|---|
A07a |
Anti-infectieux intestinaux |
A07aa |
Antibiotiques |
Fidaxomicine |
Vancomycin |
||||
J01a |
Tétracyclines |
J01aa |
Tétracyclines |
Doxycycline |
Minocycline |
||||
Tétracycline |
||||
Tigécycline |
||||
J01b |
Amphénicols |
J01ba |
Amphénicols |
Chloramphénicol |
J01c |
Bêta-lactamines antibactériennes, pénicillines |
J01ca |
Pénicillines à large spectre |
Amoxicilline |
Ampicilline |
||||
Pipéracilline |
||||
J01ce |
Pénicillines sensibles aux bêta-lactamases |
Pénicilline G |
||
Pénicilline V |
||||
J01cf |
Pénicillines résistantes aux bêta-lactamases |
Cloxacilline |
||
Dicloxacilline |
||||
Flucloxacilline |
||||
Oxacilline |
||||
J01cr |
Associations de pénicillines, dont les inhibiteurs de bêta-lactamases |
Amoxicilline : acide clavulanique |
||
Acide clavulanique : ticarcilline |
||||
Pipéracilline |
||||
Pipéracilline : tazobactam |
||||
J01d |
Autres bêta-lactamines antibactériennes |
J01db |
Céphalosporines de première génération |
Céfadroxil |
Céfazoline |
||||
Céphalexine |
||||
J01dc |
Céphalosporines de deuxième génération |
Céfaclor |
||
Céfoxitine |
||||
Cefprozil |
||||
Céfuroxime |
||||
J01dd |
Céphalosporines de troisième génération |
Céfixime |
||
Céfotaxime |
||||
Ceftazidime |
||||
Ceftriaxone |
||||
J01de |
Céphalosporines de quatrième génération |
Céfépime |
||
J01df |
Monobactams |
Aztréonam |
||
J01dh |
Carbapénèmes |
Cilastatine : imipénème |
||
Ertapénème |
||||
Méropénème |
||||
J01di |
Autres céphalosporines et pénèmes |
Ceftobiprole médocaril |
||
Ceftolozane : tazobactam |
||||
J01e |
Sulfamides et triméthoprime |
J01ea |
Triméthoprime et dérivés |
Triméthoprime |
J01ec |
Sulfamides à action intermédiaire |
Sulfadiazine |
||
Sulfaméthoxazole |
||||
J01ee |
Associations de sulfamides et de triméthoprime, y compris les dérivés |
Sulfaméthoxazole : triméthoprime |
||
J01f |
Macrolides, lincosamides et streptogramines |
J01fa |
Macrolides |
Azithromycine |
Clarithromycine |
||||
Érythromycine |
||||
Éthylsuccinate d’érythromycine |
||||
Spiramycine |
||||
J01ff |
Lincosamides |
Clindamycine |
||
Lincomycine |
||||
J01g |
Aminoglycosides antibactériens |
J01ga |
Streptomycines |
Streptomycine |
J01gb |
Autres aminoglycosides |
Amikacine |
||
Gentamicine |
||||
Tobramycine |
||||
J01m |
Quinolones antibactériennes |
J01ma |
Fluoroquinolones |
Ciprofloxacine |
Gatifloxacine |
||||
Lévofloxacine |
||||
Moxifloxacine |
||||
Norfloxacine |
||||
Ofloxacine |
||||
J01x |
Autres antibactériens |
J01xa |
Glycopeptides antibactériens |
Télavancine |
Vancomycine |
||||
J01xb |
Polymyxines |
Colistine |
||
Polymyxine B |
||||
J01xc |
Antibactériens stéroïdiens |
Acide fusidique |
||
J01xd |
Dérivés de l’imidazole |
Métronidazole |
||
J01xe |
Dérivés des nitrofuranes |
Nitrofurantoïne |
||
J01xx |
Autres antibactériens |
Bacitracine |
||
Daptomycine |
||||
Fosfomycine |
||||
Linézolide |
||||
Méthénamine |
||||
P01a |
Agents contre l’amibiase et autres maladies à protozoaires |
P01ab |
Dérivés du nitro-imidazole |
Métronidazole |
Annexe B : Graphiques supplémentaires

Figure 27 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Hôpitaux pour adultes | 0,78 | 0,91 | 0,95 | 1,25 | 1,20 |
| Hôpitaux mixtes | 0,57 | 0,76 | 0,71 | 0,81 | 0,96 |
| Hôpitaux pédiatriques | 0,70 | 0,78 | 0,68 | 0,83 | 0,98 |
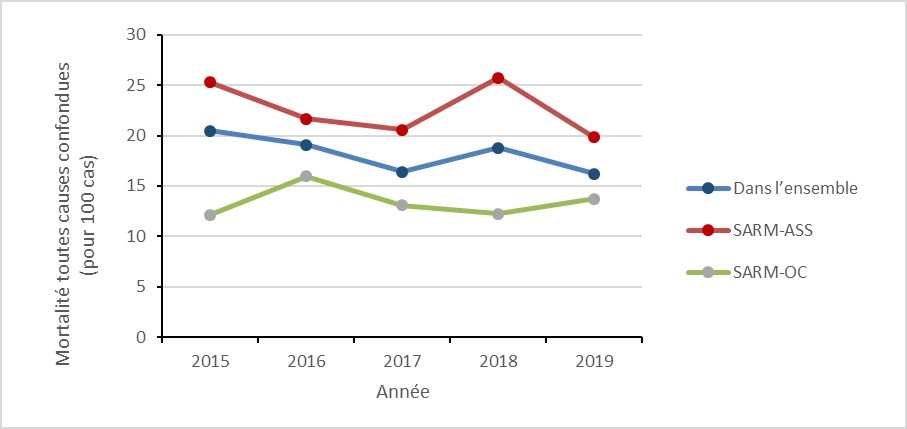
Figure 28 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Dans l’ensemble | 20,5 | 19,1 | 16,4 | 18,8 | 16,2 |
| SARM-ASS | 25,3 | 21,7 | 20,6 | 25,7 | 19,8 |
| SARM-OC | 12,1 | 16,0 | 13,1 | 12,3 | 13,7 |
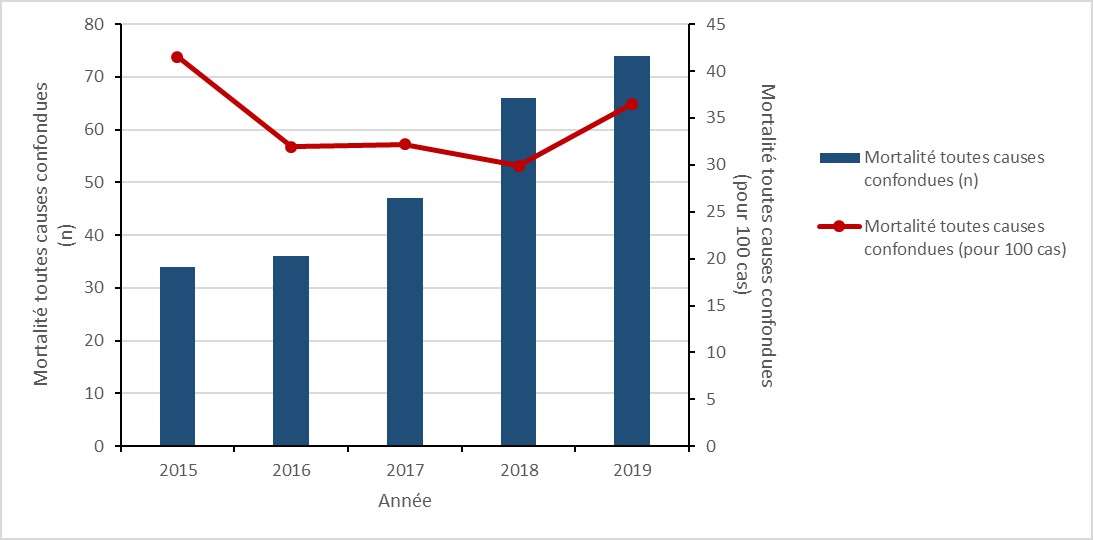
Figure 29 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Mortalité toutes causes confondues (n) | 34 | 36 | 47 | 66 | 74 |
| Mortalité toutes causes confondues (pour 100 cas) | 41,5 | 31,9 | 32,2 | 29,9 | 36,5 |

Figure 30 : Description textuelle
| Année | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|
| Dans l’ensemble (toutes causes confondues) | 9,8 | 8,4 | 7,9 | 8,0 | 8,6 |
| Dans l’ensemble (attribuable) | 3,0 | 2,4 | 2,3 | 1,3 | 2,3 |
| ICD-ASS (toutes causes confondues) | 11,4 | 9,1 | 9,0 | 9,2 | 8,2 |
| ICD-ASS (attribuable) | 3,4 | 2,5 | 2,8 | 1,1 | 2,1 |
| ICD-OC (toutes causes confondues) | 5,1 | 6,3 | 4,0 | 4,1 | 9,8 |
| ICD-OC (attribuable) | 1,9 | 2,1 | 0,6 | 1,8 | 3,0 |
Annexe C : Hôpitaux participant au PCSIN
| Nom de l’hôpital | Ville | Province |
|---|---|---|
Hôpital pour enfants de l'Alberta |
Calgary |
Alb. |
Hôpital pour enfants de la Colombie-Britannique |
Vancouver |
C.-B |
Hôpital pour femmes de la Colombie-Britannique |
Vancouver |
C.-B |
Bridgepoint Active Healthcare |
Toronto |
Ont. |
Centre de soins de santé de la péninsule de Burin |
Burin |
T.-N.-L. |
Hôpital général de Carbonear |
Carbonear |
T.-N.-L. |
Centre hospitalier de l'Université de Montréal (CHUM) |
Montreal |
Qc |
Centre hospitalier pour enfants de l'est de l'Ontario (CHEO) |
Ottawa |
Ont. |
Hôpital pour enfants de l'ouest de l'Ontario |
London |
Ont. |
Centre hospitalier universitaire Sainte-Justine |
Montreal |
Qc |
Campus Civic, Hôpital d'Ottawa |
Ottawa |
Ont. |
Hôpital général de Dartmouth |
Halifax |
N.-É |
Dr. G.B. Cross Memorial Hospital |
Clarenville |
T.-N.-L. |
Centre médical de Foothills |
Calgary |
Alb. |
Campus Général, Hôpital d'Ottawa |
Ottawa |
Ont. |
Hôpital général et centre Miller |
St. John |
T.-N.-L. |
Hôpital général, Centre des sciences de la santé de Hamilton |
Hamilton |
Ont. |
Halifax Infirmary |
Halifax |
N.-É |
Centre des sciences de la santé - Winnipeg |
Winnipeg |
Man. |
Hôpital Maisonneuve-Rosemont |
Montréal |
Qc |
Hôpital pour enfants malades |
Toronto |
Ont. |
Hôtel-Dieu de Québec |
Québec |
Qc |
Centre de santé IWK |
Halifax |
N.-É |
Hôpital pour enfants et centre de réadaptation de Janeway |
St. John |
T.-N.-L. |
Hôpital Jurvinski et centre de cancérologie, Centre des sciences de la santé de Hamilton |
Hamilton |
Ont. |
Hôpital général de Kelowna |
Kelowna |
C.-B |
Hôpital général de Kingston |
Kingston |
Ont. |
Lions Gate Hospital |
Vancouver Nord |
C.-B |
Hôpital pour enfants McMaster, Centre des sciences de la santé de Hamilton |
Hamilton |
Ont. |
Hôpital de Montréal pour enfants, Centre universitaire de santé McGill |
Montréal |
Qc |
Hôpital général de Montréal, Centre universitaire de santé McGill |
Montréal |
Qc |
Institut neurologique de Montréal, Centre universitaire de santé McGill |
Montréal |
Qc |
Hôpital du Moose Jaw |
Moose Jaw |
Sask. |
Hôpital du Mont Sinaï |
Toronto |
Ont. |
Hôpital général régional de Nanaimo |
Nanaimo |
C.-B |
Hôpital général de North York |
Toronto |
Ont. |
Hôpital général de Powell River |
Powell River |
C.-B |
Hôpital du comté de Prince |
Summerside |
PE |
Princesse Margaret |
Toronto |
Ont. |
Hôpital général de Qikiqtani |
Iqaluit |
Nvt. |
Hôpital Queen Elizabeth |
Charlottetown |
PE |
Hôpital général de Regina |
Regina |
Sask. |
Centre de réhabilitation |
Halifax |
N.-É |
Hôpital général de Richmond |
Richmond |
C.-B |
Hôpital général de Rockyview |
Calgary |
Alb. |
Jubilé royal |
Victoria |
BC |
Hôpital universitaire royal |
Saskatoon |
Sask. |
Hôpital Royal Victoria, Centre universitaire de santé McGill |
Montréal |
Qc |
Hôpital Sechelt (anciennement St. Mary's) |
Sechelt |
C.-B |
SMBD - Hôpital général juif |
Montréal |
Qc |
Campus de santé du Sud |
Calgary |
Alb. |
Hôpital général de Squamish |
Squamish |
C.-B |
Soins de santé de Saint-Joseph |
Hamilton |
Ont. |
Hôpital St. Clare's Mercy |
St. John |
T.-N.-L. |
L'hôpital St. Michael |
Toronto |
Ont. |
L'hôpital St. Paul |
Saskatoon |
Sask. |
Hôpital pour enfants Stollery |
Edmonton |
Alb. |
Hôpital régional de Sudbury |
Sudbury |
Ont. |
Hôpital Sunnybrook |
Toronto |
Ont. |
L'hôpital de Moncton |
Moncton |
N.B. |
Hôpital général de Toronto |
Toronto |
Ont. |
Hôpital Toronto Western |
Toronto |
Ont. |
Hôpital de l'UBC |
Vancouver |
C.-B |
Hôpital universitaire |
London |
Ont. |
Hôpital universitaire du nord de la Colombie-Britannique |
Prince George |
C.-B |
Hôpital de l'Université d'Alberta |
Edmonton |
Alb |
Hôpital pour enfants de l'Université du Manitoba |
Winnipeg |
Man. |
Institut de cardiologie de l'Université d'Ottawa, Hôpital d'Ottawa |
Ottawa |
Ont. |
Hôpital général de Vancouver (VGH) |
Vancouver |
C.-B |
Édifice commémoratif des anciens combattants |
Halifax |
N.-É |
Général Victoria |
Halifax |
N.-É |
Hôpital général de Victoria |
Victoria |
C.-B |
Hôpital Victoria |
London |
Ont. |
Hôpital régional Western Memorial |
Corner Brook |
T.-N.-L. |
Notes de bas de page
- Note de bas de page 1
-
Tel que classé par le programme AWaRe de l'OMS
- Note de bas de page 2
-
Certaines de ces tendances peuvent être le résultat de la mise à jour du Règlement sur les aliments et drogues au Canada (voir le chapitre 10 pour plus de détails)
- Note de bas de page 3
-
Comprend les isolats de TB à culture positive polyrésistants et ultrarésistants
Références
- Murray CJ, Ikuta KS, Sharara F, et al. Global burden of bacterial antimicrobial resistance in 2019 : A systematic analysis. The Lancet. 2022.
- Le Conseil des académies canadiennes (CAC) 2019, Prévision des taux futurs de résistance aux antimicrobiens (RAM) au Canada. Disponible : https://www.rapports-cac.ca/regardez-la-seance-quand-les-antibiotiques-echouent/
- Laxminarayan, R. 2022. The overlooked pandemic of antimicrobial resistance. The Lancet. AVENT, M. L., et coll. « Antimicrobial stewardship in the primary care setting : from dream to reality ? », BMC Family Practice, vol. 21, no 1, 2020, pp. 1-9.
- Institut canadien d’information sur la santé (ICIS) 2021, Incidence de la COVID-19 sur les soins hospitaliers. Accessible à : https://www.cihi.ca/fr/ressources-sur-la-covid-19/lincidence-de-la-covid-19-sur-les-systemes-de-sante-du-canada/ soins-hospitaliers [2021, 06/15].
- CHU, Derek K., et coll. « Physical distancing, face masks, and eye protection to prevent person-to-person transmission of SARS-CoV-2 and COVID-19 : a systematic review and meta-analysis » The Lancet, vol. 395, no 10242, 2020, pp. 1973-1987.
- HANSEN, Glen T. « Continuous evolution : perspective on the epidemiology of carbapenemase resistance among enterobacterales and other gram-negative bacteria », Infectious Diseases and Therapy, 2021, pp. 1-18.
- KWON, Sohee, et coll. « Association of social distancing and masking with risk of COVID-19 », medRxiv, 2020.
- MIRANDA, Carla, et coll. « Implications of antibiotics use during the COVID-19 pandemic : present and future », Journal of Antimicrobial Chemotherapy, vol. 75, no 12, 2020, pp. 3413-3416.
- Agence de santé publique du Canada (ASPC) 2020. Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA) 2018 : Design et méthodes. Accessible à : https://www.canada.ca/fr/sante-publique/services/ surveillance/programme-integre-canadien-surveillance-resistance-antimicrobiens-picra/rapports-publications-picra/2018-rapport-annuel-design-methodes.html
- Agence de la santé publique du Canada (ASPC) 2020. « Surveillance nationale en laboratoire de la maladie invasive due au streptocoque au Canada – Rapport sommaire annuel 2018 ».
- Organisation mondiale de la Santé (OMS) 2020, Résistance aux antimicrobiens. Accessible à : https://www.who.int/fr/news-room/fact-sheets/detail/antimicrobial-resistance
- Santé Canada 2021-08-13, Déclaration des ventes d’antimicrobiens vétérinaires. Disponible : https://www.canada.ca/fr/sante-publique/services/resistance-aux-antibiotiques-antimicrobiens/animaux/rapports-ventes-medicaments-veterinaires-antimicrobiens.html [2021/11/04].
