Archivée Système canadien de surveillance de la résistance aux antimicrobiens – Rapport de 2016
Table des matières
- Glossaire
- Message de l'Administrateur en chef de la santé publique et de la présidente de l'Agence de la santé publique du Canada
- Résumé
- Annexes techniques
- Résistance aux antimicrobiens et utilisation des antimicrobiens
- Résistance aux antimicrobiens au canada
- Clostridium difficile
- Enterobacteriaceae multirésistante aux médicaments et Acinetobacter
- Staphylococcus aureus résistant à la méthicilline (SARM)
- Entérocoques résistants à la vancomycine (ERV)
- Streptococcus mulitrésistant aux médicaments
- Neisseria gonorrhoeae
- Salmonella typhique résistant aux médicaments
- Salmonella non-typhique résistant aux médicaments
- Tuberculose résistante aux médicaments
- Résistance dans les bactéries d'origine alimentaire
- Utilisation des antimicrobiens au Canada
- Références

Télécharger le format de rechange
(Format PDF, 1 716 Mo, 128 pages)
Glossaire
- APC
- Acinetobacter producteur de carbapénémase
- ASPC
- Agence de la santé publique du Canada
- Bactériémie
- Infection du sang
- BCCDC
- British Columbia Centre for Disease Control
- BGN
- Bacilles Gram négatif
- BLSE
- Bêta-lactamases à spectre étendu
- CARA
- Canadian Antimicrobial Resistance Alliance
- CDC des É.-U.
- Centers for Disease Control and Prevention des États-Unis
- CDMTI
- Comité directeur sur les maladies transmissibles et infectieuses
- CMI
- Concentration minimale inhibitrice
- DTQ
- Doses thérapeutiques quotidiennes
- EARS-Net
- Réseau européen de surveillance de la résistance aux antimicrobiens
- EIP
- Emerging Infections Program
- EPC
- Entérobactéries productrices de carbapénémases
- ERC
- Entérobactéries résistantes aux carbapénèmes
- ERV
- Entérocoques résistants à la vancomycine
- ESAC-Net
- Réseau de l’ European Surveillance of Veterinary Antimicrobial Consumption
- ESVAC
- European Surveillance of Veterinary Antimicrobial Consumption
- HARSAH
- Hommes ayant des relations sexuelles avec d’autres hommes
- ICD
- Infection à Clostridium difficile
- ICD associée aux soins de santé
- Infection à Clostridium difficile associé aux soins de santé
- ICSA
- Institut canadien de la santé animale
- INH
- Isonicotinylhydrazide
- INNTI
- Inhibiteur non nucléosidique de la transcriptase inverse
- INTI
- Inhibiteur nucléosidique de la transcriptase inverse
- IPTM
- Infection de la peau et des tissus mous
- IV
- Intraveineuse
- IVU
- Infection des voies urinaires
- LLZA
- Laboratoire de lutte contre les zoonoses d’origine alimentaire
- LNM
- Laboratoire national de microbiologie
- Multirésistant
- Multirésistance aux médicaments
- NHSN
- National Healthcare Safety Network
- OIE
- Organisation mondiale de la santé animale
- OMS
- Organisation mondiale de la santé
- OPC
- Organismes producteurs de carbapénémases
- ORC
- Organismes résistants aux carbapénèmes
- PCSIN
- Programme canadien de surveillance des infections nosocomiales
- PCV13
- Vaccin conjugué 13-valent contre le pneumocoque
- PI
- Pneumococcie invasive
- PICRA
- Programme intégré canadien de surveillance de la résistance aux antimicrobiens
- RAM
- Résistance aux antimicrobiens
- SARGA
- Surveillance accrue de la résistance de la gonorrhée aux antimicrobiens
- RCP
- Réaction en chaîne de la polymérase
- RLSPC
- Réseau des laboratoires de santé publique du Canada
- RMP
- Rifampicine
- RSP
- Réseau de santé publique
- RTCLT
- Réseau technique canadien des laboratoires de tuberculose
- SARGA
- Surveillance accrue de la résistance de la gonorrhée aux antimicrobiens
- SARM
- Staphylococcus aureus résistant à la méthicilline
- SARM associé aux soins de santé
- Staphylococcus aureus résistant à la méthicilline associé aux soins de santé
- SARM d’origine communautaire
- Staphylococcus aureus résistant à la méthicilline d’origine communautaire
- SARV
- S. aureus résistant à la vancomycine
- SCDCT
- Système canadien de déclaration des cas de tuberculoses
- SCSLT
- Système canadien de surveillance des laboratoires de tuberculose
- SCSRA
- Système canadien de surveillance de la résistance aux antimicrobiens
- SGA
- Streptocoque du groupe A
- SHU
- Syndrome hémolytique et urémique
- SSMDO
- Système canadien de surveillance des maladies à déclaration obligatoire
- SSNA
- Programme des services de santé non assurés
- TB
- Tuberculose
- TB-MR
- Tuberculose multirésistante aux antibiotiques
- TMP/SMX
- Triméthoprime-sulfaméthoxazole
- TSA
- Tests de sensibilité aux antimicrobiens
- UAM
- Utilisation des antimicrobiens
- UCP
- Unité corrigée de la population
Message de l'Administrateur en chef de la santé publique et de la présidente de l'Agence de la santé publique du Canada
La résistance aux antimicrobiens (RAM) continue d’être un problème de santé publique grave tant au Canada qu’à l’étranger. Des infections courantes et traitables pourraient redevenir des infections mortelles. Cette réalité est illustrée par la détection récente du gène mrc-1 encodant une résistance à la colistine dans des isolats provenant de sources animales, alimentaires et humaines au Canada, aux États-Unis et ailleurs dans le monde.
L’année dernière, le rapport inaugural intitulé Système canadien de surveillance de la résistance aux antimicrobiens – Rapport de 2015, a présenté un résumé regroupant des renseignements provenant de neuf systèmes de surveillance et de services de laboratoire de référenceNote de bas de page 1 de l’Agence de la santé publique du Canada (ASPC) dans le but de fournir des renseignements sur la RAM et l’UAM au Canada et d’aider les professionnels de la santé et les responsables des politiques à prendre des décisions éclairées.
Ce deuxième rapport reflète l’élan qui a été manifesté tout au long de l’année et fait suite au premier rapport en accroissant l’étendue et la richesse des données de surveillance et des analyses.
Voici les points saillants de ce rapport : identification des organismes prioritaires pour aider à orienter les efforts de surveillance; résultats d’un projet pilote de surveillance accrue de la résistance de la gonorrhée aux antimicrobiens visant à améliorer les interventions à l’égard de la réapparition de la gonorrhée signalée au cours des dernières années; résultats d’une étude de faisabilité sur « AMR-Net », une application Web utilisée pour la collecte et l’analyse de données sur la RAM au niveau communautaire qui pourrait servir d’outil de sensibilisation des professionnels de la santé et des Canadiens aux tendances de la RAM en milieu communautaire. Le rapport souligne aussi des lacunes en matière de surveillance que nous tenterons de combler pour les prochains rapports du SCSRA afin de fournir un tableau plus complet de la RAM et de l’UAM au Canada.
Les efforts de surveillance de l’ASPC ne peuvent être fructueux sans la contribution et la collaboration de ses partenaires, c’est-à-dire les provinces et territoires, les professionnels de la santé, les vétérinaires, les associations et organismes, les collectivités et les individus. Ces partenaires fournissent des données et des conseils essentiels qui permettront de faire du Système canadien de surveillance de la résistance aux antimicrobiens (SCSRA) le point central national des données de surveillance de la RAM et de l’UAM au Canada. Nous remercions tous les contributeurs pour leur temps, leur expertise et leur soutien continu.
Dr Gregory Taylor
Administrateur en chef de la santé publique du Canada
Dre Siddika Mithani
Présidente de l'Agence de la santé publique du Canada
Résumé
Introduction
L’établissement du Système canadien de surveillance de la résistance aux antimicrobiens (SCSRA) constitue un engagement clé formulé dans le Plan d’action fédéral sur la résistance et le recours aux antimicrobiens au Canada : Prolongement du cadre d’action fédéral. Le système fournit un tableau exhaustif de la RAM et de l’UAM au Canada en présentant des données provenant de neuf systèmes de surveillance et services de référence en laboratoire de l’ASPC qui suivent les organismes prioritaires définis. Le premier rapport du SCSRA publié en 2015 présentait les données sur la RAM et l’UAM au Canada jusqu’en 2013. Le rapport de cette année démontre que le gouvernement du Canada s’engage toujours à mener des activités visant à prévenir, à limiter et à contrôler l’émergence et la propagation de la RAM, comme le décrit le document Résistance aux antimicrobiens et utilisation de ces derniers au Canada : un cadre d’action fédéral.
L’une des principales réalisations de cette année est la collaboration avec les partenaires fédéraux-provinciaux-territoriaux dans l’élaboration d’une liste d’organismes prioritaires qui pourraient avoir développé une résistance aux antimicrobiens. La liste a été élaborée en tirant parti de l’expertise du Comité directeur sur les maladies transmissibles et infectieuses (CDMTI) du Réseau pancanadien de santé publique. Un groupe de travail, en collaboration avec l’ASPC, a identifié et classé par priorité les organismes résistants aux antimicrobiens qui sont préoccupants au Canada; a déterminé les secteurs au sein desquels suffisamment de données de surveillance sont recueillies ainsi que les secteurs où il pourrait y avoir des écarts; et a formulé des recommandations pour combler certains de ces écarts. La liste des organismes prioritaires est une étape importante pour déterminer quelles données doivent être recueillies par tous les partenaires de surveillance au Canada.
Depuis la publication du rapport de 2015 du SCSRA, l’ASPC a déployé des efforts importants dans la surveillance de la RAM et de l’UAM. Elle a, entre autres, mis en œuvre deux initiatives pilotes pour combler les écarts en milieu communautaire signalés dans le premier rapport du SCSRA et dans le Rapport du printemps 2015 du vérificateur général du Canada portant sur la résistance aux antimicrobiens. Le projet pilote portant sur la surveillance accrue de la gonorrhée aux antimicrobiens (SARGA) a été mis en place en raison des niveaux élevés de résistance aux antimicrobiens signalés dans les traitements de la gonorrhée. Le projet SARGA a évalué s’il était possible de recueillir des données de surveillance pour mieux comprendre les niveaux et tendances actuels de résistance à la gonorrhée au Canada. Ce projet avait pour objectif de fournir une preuve plus concrète afin d’orienter l’élaboration de lignes directrices sur le traitement et les interventions de santé publique pour réduire au minimum la propagation de la gonorrhée résistante aux antimicrobiens. Le projet pilote de l’application « AMR-Net » a été entrepris afin d’explorer la faisabilité de l’obtention et de l’analyse de données existantes sur la sensibilité aux antimicrobiens en milieu communautaire; d’améliorer la mesure dans laquelle l’ASPC peut répondre aux menaces émergentes et à soutenir les efforts d’intendance en apportant des données probantes sur lesquels fonder la prise de décision. Les résultats de ces deux initiatives pilotes ont confirmé qu’il est possible de recueillir des données dans les milieux communautaires.
Résistance aux antimicrobiens et utilisation des antimicrobiens
La résistance aux antimicrobiens désigne la capacité des micro-organismes (y compris les bactéries, les champignons, les virus et les parasites) à devenir résistants au traitement par médicaments antimicrobiens, comme les antibiotiquesNote de bas de page 2. La résistance peut apparaître naturellement au fur et à mesure que les micro-organismes évoluent, subissent une mutation ou se multiplient. Les micro-organismes, en particulier les bactéries, peuvent aussi transférer leurs traits résistants à d’autres micro-organismes, accroissant ainsi la propagation de la RAM. L’ampleur de la résistance est accentuée par une utilisation excessive ou inutile de médicaments antimicrobiens dans le traitement d’infections bactériennes, p. ex. des professionnels de la santé prescrivant des médicaments de façon inappropriée et des patients ne prenant pas les médicaments prescrits selon l’ordonnance.
Résistance aux antimicrobiens
La résistance aux antimicrobiens porte un coup sérieux à notre capacité de combattre les maladies infectieuses, ce qui entraîne un nombre accru d’hospitalisations et des séjours hospitaliers prolongés. Par conséquent, il en résulte une augmentation non seulement des coûts des soins de santé, mais aussi des coûts pour la société (p. ex. hausse d’absences du travail, nombre accru de demandes de prestations d’invalidité et baisse de productivité).
Une résistance aux antimicrobiens est maintenant signalée dans tous les pays déclarants du monde. À l’échelle mondiale, des bactéries comme Staphylococcus aureus, Escherichia coli et Klebsiella pneumoniae démontrent des taux de résistance déclarés entre 5 % et 80 % pour les souches testées. La surveillance actuelle au Canada démontre des taux de résistance relativement stables et, dans certains cas, on a même enregistré dans les dernières années une baisse des taux d’infection de certains organismes ayant une résistance aux antimicrobiens. Par exemple, les taux d’infection à Staphylococcus aureus résistant à la méthicilline (SARM) contractée en milieu hospitalier ont chuté de 25 % depuis 2008, et une baisse des taux d’infection aux entérocoques résistants à la vancomycine (ERV) a été observée au cours des deux dernières années. Cela dit, les taux d’incidence des cas d’infection à SARM et aux ERV ne sont pas encore à des niveaux comparables à ceux enregistrés avant 2007, année où on a commencé à enregistrer des augmentations de la résistance. Il y a donc d’autres travaux à faire pour inverser le problème.
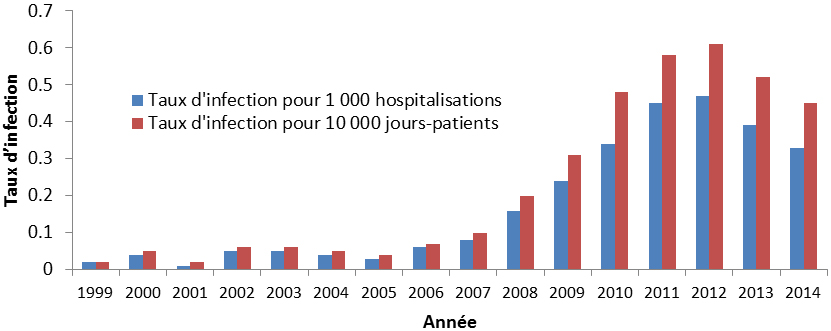
Taux d’incidence des infections aux entérocoques résistants à la vancomycine pour 1 000 hospitalisations et pour 10 000 jours-patients, de 1999 à 2014
Équivalent textuel
| 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Taux d’infection par 1,000 hospitalisation | 0,02 | 0,04 | 0,01 | 0,05 | 0,05 | 0,04 | 0,03 | 0,06 | 0,08 | 0,16 | 0,24 | 0,34 | 0,45 | 0,47 | 0,39 | 0,33 |
| Taux d’infection par 10,000 jours-patients | 0,02 | 0,05 | 0,02 | 0,06 | 0,06 | 0,05 | 0,04 | 0,07 | 0,1 | 0,2 | 0,31 | 0,48 | 0,58 | 0,61 | 0,52 | 0,45 |
L’histogramme groupé présente les taux d’incidence des infections à entérocoques résistant à la vancomycine pour 1,000 hospitalisation et pour 10,000 jours-patients (chaque taux est représenté par sa propre barre), au Canada de 1999 à 2014. L’axe horizontal représente l’année et l’axe vertical le taux d’infection.
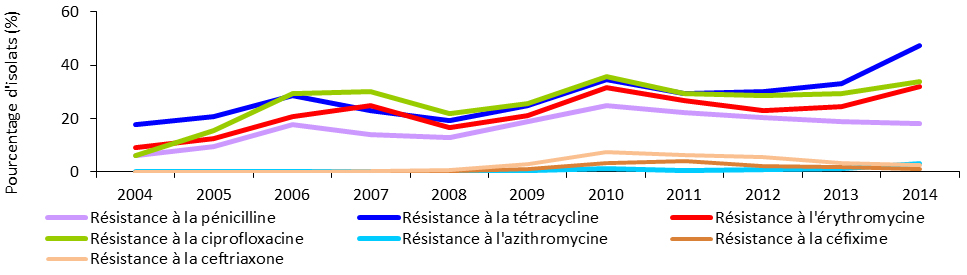
Même si la résistance générale au Canada n’a pas encore atteint les taux signalés dans d’autres pays, la surveillance soulève tout de même des points préoccupants. Par exemple, les données disponibles indiquent que plus d’un tiers des cas de gonorrhée ont une résistance à la fois à la ciprofloxacine, à l’érythromycine et à la tétracycline. Au cours des dernières années, il y a eu très peu de cas (< 0,3 %) pour lesquels une résistance a été signalée à la fois à l’azithromycine et aux céphalosporines (ceftriaxone et céfixime), qui est le traitement à double modalité actuellement recommandé pour la gonorrhéeNote de bas de page 3. Le Canada enregistre des taux de résistance à l’azithromycine dans les isolats de N. gonorrhoeae (3,3 % en 2014) plus élevés que ceux enregistrés aux États-Unis (0,6 % en 2013) et au Royaume-Uni (1,6 % en 2013)Note de bas de page 4,Note de bas de page 5.
Si le taux de résistance continue d’augmenter, le succès du traitement à double modalité actuellement recommandé pourrait être compromis. Il est donc impératif d’assurer une surveillance continue de la RAM afin d’aider à maintenir l’efficacité des schémas thérapeutiques actuels et d’orienter leur modification, le cas échéant.
Pourcentage d’isolats de gonorrhée résistants aux antibiotiques, de 2004 à 2014
Équivalent textuel
| 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Résistance à la pénicilline | 6,02 | 9,42 | 17,59 | 13,94 | 12,8 | 18,7 | 25,05 | 22,2 | 20,26 | 18,94 | 18,22 |
| Résistance à la tétracycline | 17,79 | 20,92 | 28,59 | 22,88 | 19,09 | 24,7 | 34,61 | 29,4 | 30,3 | 32,99 | 47,34 |
| Résistance à l’érythromycine | 9,28 | 12,54 | 20,92 | 24,89 | 16,7 | 21,3 | 31,52 | 26,6 | 23,12 | 24,32 | 32 |
| Résistance à la ciprofloxacine | 6,25 | 15,67 | 29,42 | 30,2 | 21,96 | 25,5 | 35,93 | 29,3 | 28,52 | 29,33 | 34,02 |
| Résistance à l’azithromycine | 0,15 | 0,22 | 0,19 | 0,16 | 0,13 | 0,35 | 1,25 | 0,39 | 0,86 | 1,16 | 3,33 |
| Sensibilité diminuée à la céfixime | 0,07 | 0 | 0,07 | 0,09 | 0,46 | 1,19 | 3,3 | 4,2 | 2,24 | 1,75 | 1,1 |
| Sensibilité diminuée à la céftriaxone | 0 | 0 | 0,019 | 0,42 | 0,61 | 3,12 | 7,34 | 6,2 | 5,53 | 3,51 | 2,65 |
Le graphique représente le pourcentage d’isolats de gonorrhée qui sont résistants à différents antimicrobiens (chacun est représenté par sa propre ligne) au Canada à partir de 2004 jusqu’à 2014. L’axe horizontal représente l’année et l’axe vertical le pourcentage d’isolats.
Utilisation des antimicrobiens chez les humains
Au Canada, la majorité des antimicrobiens destinés aux humains sont sur ordonnance seulement. Au cours des 13 dernières années, le volume d’ordonnances d’antimicrobiens pour les humains est demeuré relativement stable. En 2014, 23 millions d’ordonnances d’antimicrobiens ont été délivrées, dont 93 % ont été préparées dans les pharmacies communautaires. L’ensemble des dépenses liées aux antimicrobiens au Canada s’élevait à 786 millions de dollars; la délivrance en milieu communautaire représentait 87 % de ce montant, tandis que les achats effectués par les hôpitaux représentaient 13 %.
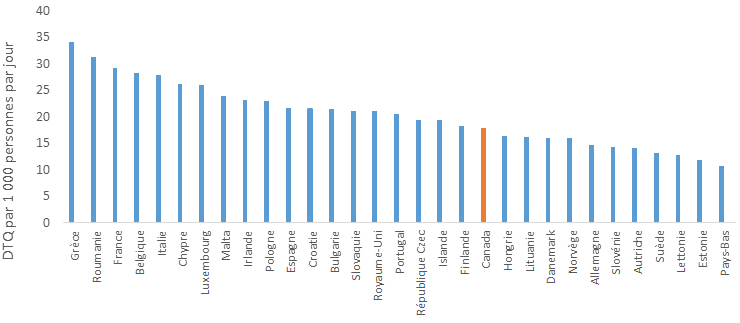
Les antimicrobiens ont été le plus souvent recommandés pour le traitement d’infections des voies respiratoires. Ce protocole a été appliqué pour 82 % des cas de sinusite aiguë, 77 % des diagnostics de bronchite aiguë et 74 % des diagnostics de pneumonie. D’autres travaux s’imposent pour évaluer la pertinence des recommandations d’antimicrobiens par les professionnels de la santé et le respect des directives cliniques concernant certains antimicrobiens pour des traitements de première ligne. Un exemple serait le traitement des infections des voies urinaires inférieures, où la ciprofloxacine est recommandée plus souvent que les médicaments suggérés dans les lignes directrices, soit le triméthoprime-sulfaméthoxazole ou la nitrofurantoïne. En 2014, un total de 30 pays européens ont fourni des renseignements à l’European Surveillance of Antimicrobial Consumption Network (ESAC-Net) sur les antimicrobiens consommés au sein de leurs collectivités. Lorsque ces données ont été comparées au taux de consommation d’antimicrobiens en milieu extra-hospitalier au Canada en 2014, le Canada (17,8 doses thérapeutiques quotidiennes [DTQ] par 1 000 habitants-jour) s’est classé au 12e rang sur 31 pays par ordre croissant d’utilisation d’antimicrobiens, le taux déclaré au Canada équivalant à près de la moitié de celui signalé par la Grèce (pays où l’utilisation est la plus élevée, soit 34 DTQ par 1 000 habitants-jour)Note de bas de page 6.
Utilisation d’antimicrobiens en milieu extra-hospitalier (Dose thérapeutique quotidienne [DTQ] par 1 000 habitants-jour) déclarée par 30 pays européens et le Canada
Équivalent textuel
| Pays | DTQ/1,OOO personness/jour |
|---|---|
| Grèce | 34 |
| Roumanie | 31,2 |
| France | 29 |
| Belgique | 28,2 |
| Italie | 27,8 |
| Chypre | 26,1 |
| Luxembourg | 25,8 |
| Malte | 23,7 |
| Irlande | 23,1 |
| Pologne | 22,8 |
| Espagne | 21,6 |
| Croatie | 21,4 |
| Bulgarie | 21,3 |
| Slovaquie | 20,9 |
| Royaume Uni | 20,9 |
| Portugal | 20,3 |
| République Tchèque | 19,3 |
| Islande | 19,3 |
| Finlande | 18,1 |
| Canada | 17,79 |
| Hongrie | 16,2 |
| Lituanie | 16 |
| Danemark | 15,9 |
| Norvège | 15,9 |
| Allemagne | 14,6 |
| Slovénie | 14,2 |
| Autriche | 13,9 |
| Suède | 13 |
| Lettonie | 12,6 |
| Estonie | 11,7 |
| Pays-Bas | 10,6 |
Ce graphique à barres représente l’utilisation d’antimicrobiens ambulatoire du Canada et de 30 pays européens. L’utilisation d’antimicrobiens est mesurée à l’aide de doses quotidiennes définies par 1,000 personnes par jour. L’axe horizontal représente le pays et l’axe vertical représente les doses quotidiennes définies par 1,000 personnes par jour.
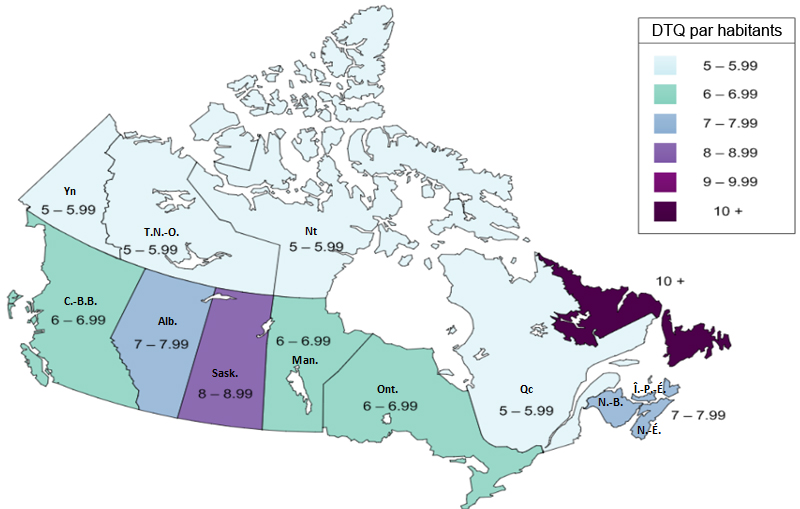
Une variation importante est constatée dans les taux de prescription d’antimicrobiens au Canada. Les écarts signalés dans les ordonnances d’antimicrobiens parentéraux (injectables et intraveineux) exécutées par les pharmacies communautaires reflètent vraisemblablement les différences dans les politiques provinciales de remboursement des antimicrobiens parentéraux des patients en consultation externe. Contrairement aux variations importantes observées parmi les cinq principaux antimicrobiens achetés par les hôpitaux, des points communs sont observés dans les antimicrobiens distribués dans les collectivités partout dans les provinces et territoires. Par exemple, l’amoxicilline et la clarithromycine se classent parmi les cinq principaux antimicrobiens exécutés ayant le plus grand nombre de doses thérapeutiques quotidiennes (DTQ) par habitant dans chaque province et territoire. Une analyse plus approfondie est requise pour expliquer les différences observées.
Total des antimicrobiens délivrés par les pharmacies communautaires dans les provinces et les territoires au Canada en 2014Note de bas de page 7
Équivalent textuel
| Provinces et les territoires | DTQ par inhabitants |
|---|---|
| Yukon | 5-5,99 |
| Territoires du Nord-Ouest | 5-5,99 |
| Nunavut | 5-5,99 |
| Colombie-Britannique | 6-6,99 |
| Alberta | 7-7,99 |
| Saskatchewan | 8-8,99 |
| Manitoba | 6-6,99 |
| Ontario | 6-6,99 |
| Québec | 5-5,99 |
| Nouveau-Brunswick | 7-7,99 |
| Nouvelle-Écosse | 7-7,99 |
| Île-du-Prince-Édouard | 10+ |
| Terre-Neuve-et-Labrador | 10+ |
Une carte des provinces et territoires du Canada est utilisé pour représenter les différences de quantité d’antimicrobiens distribués entre les provinces et territoires. La quantité total d’antimicrobien distribué est rapporté en utilisant des doses quotidiennes définies par habitant.
Utilisation des antimicrobiens chez les animaux
Il y a de plus en plus de preuves indiquant que l’utilisation d’agents antimicrobiens dans les domaines de la médecine vétérinaire et de la production de bétail est un important facteur contributif dans l’émergence et la persistance des microbes résistants chez les humains. La propagation des organismes ayant des caractéristiques de résistance de l’animal à l’homme nécessite l’évaluation des risques pour la santé humaine associés à l’UAM chez les animaux destinés à l’alimentation.
Le Canada est un important producteur d’animaux destinés à l’alimentation sur les marchés national et international; le pays compte environ 19 fois plus d’animaux que d’humains. La majorité (73 %) des antimicrobiens distribués à l’usage vétérinaire appartenaient aux mêmes catégories que celles utilisées en médecine humaine. En 2014, environ 82 %Note de bas de page 8 des antimicrobiens importants pour la médecine humaine étaient distribués ou vendus pour les animaux destinés à l’alimentation. On utilise les antimicrobiens chez les animaux destinés à l’alimentation (p. ex. les poulets, les porcs et le bétail) dans le traitement et la prévention des maladies, et pour améliorer l’indice de transformation ou stimuler la croissance.
Au Canada, comme dans de nombreux autres pays, la RAM est surveillée dans les produits de poulet, de porc et de bœuf pour détecter la présence de trois bactéries (Escherichia coli, Campylobacter et Salmonella) afin de mesurer le mouvement potentiel des organismes prioritaires résistants aux antimicrobiens de l’animal à l’homme. En comparaison avec les autres pays membres du réseau de l’European Surveillance of Veterinary Antimicrobial Consumption (ESVAC), le Canada est arrivé au 7e rang sur 27 pays classés en ordre croissant des ventes d’antimicrobiens, ajustés en fonction des populations et des poidsNote de bas de page 9. En milligrammes, les quantités totales rajustées par populations distribuées au Canada étaient 44 fois plus élevées qu’en Norvège (pays où les ventes sont les plus faibles) et moins de la moitié des quantités signalées à Chypre (pays où les ventes sont les plus élevées).
Ventes d’antimicrobiens à usage vétérinaire (quantités ajustées en fonction des populations et des poids) au Canada (2014) et dans les pays membres du réseau de l’European Surveillance of Veterinary Antimicrobial Consumption (2013)
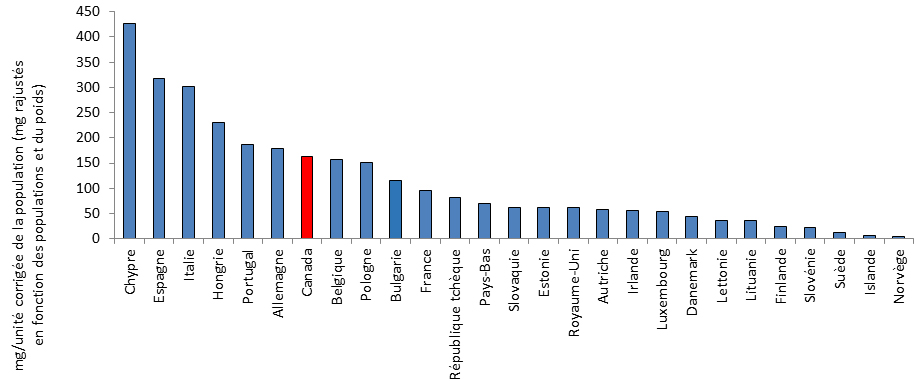
Sources des données : Institut canadien de la santé animale, Statistique Canada, Agriculture et Agroalimentaire Canada, Canada Hippique et réseau de Surveillance européenne de la consommation d'antibiotiques à usage vétérinaire (ESVAC). Les importations pour usage personnel et les importations d'ingrédients actifs à usage pharmaceutique ne sont pas incluses dans les données canadiennes.
Sont exclus les ionophores et les anticoccidiens chimiques.
Le dénominateur a été harmonisé le plus possible avec l'ESVAC en tenant compte des différentes sources de donnée sur les populations d'animaux. L'approche de l'ESVAC exclut les animaux de compagnie du numérateur. Le dénominateur canadien inclut les bovins, un type qui n’est pas inclut par l’ESVAC.
Toutes les données, provenant des pays représentés, tiennent compte des mêmes poids moyens au moment du traitement. Cependant, au Canada, dans quelques classes de production, les poids moyens s'avèrent plus élevés que les poids moyens européens.
Équivalent textuel
| Pays | mg/PCU |
| Chypre | 426 |
| Espagne | 317 |
| Italie | 302 |
| Hongrie | 230 |
| Portugal | 187 |
| Allemagne | 179 |
| Canada | 163 |
| Belgique | 157 |
| Pologne | 151 |
| Canada (poids canadiens) | 140 |
| Bulgarie | 116 |
| France | 95 |
| République Tchèque | 82 |
| Pays-Bas | 70 |
| Slovaquie | 63 |
| Estonie | 62 |
| Royaume Uni | 62 |
| Autriche | 57 |
| Irlande | 57 |
| Luxembourg | 54 |
| Danemark | 45 |
| Lettonie | 37 |
| Lituanie | 37 |
| Finlande | 24 |
| Slovénie | 22 |
| Suède | 13 |
| Island | 5 |
| Norvège | 4 |
Ce graphique à barres représente les ventes d’antimicrobiens pour les animaux pour le Canada et les pays membres du réseau de l’European Surveillance of Veterinary Antimicrobial Consumption. L'axe horizontal représente le pays et l'axe vertical représente les milligrammes par unité de correction de population avec milligrammes ajustés pour les populations et le poids.
Organismes prioritaires résistants aux antimicrobiens
Les systèmes de surveillance de l’ASPC sont des outils essentiels dans les efforts qu’elle déploie pour protéger les Canadiens contre les risques pour la santé associés à la résistance aux antimicrobiens. Les données de surveillance éclairent la compréhension des voies de transmission et aident à évaluer l’ampleur et les tendances de la morbidité et de la mortalité connexes. Dans ce contexte, l’ASPC a repéré 138 agents pathogènes infectieux (micro-organisme susceptible de causer une maladie) dans le monde qui ont présenté une résistance et, en se fondant sur les données obtenues, a utilisé une approche en plusieurs étapes afin d’évaluer et de déterminer les agents pathogènes résistants aux antimicrobiens pertinents au Canada. Les critères utilisés comprenaient ceux qui suivent : incidences, transmissibilité, caractère préventif, possibilité de traitement, incidences cliniques et mortalité.
Par la suite, le Comité directeur sur les maladies transmissibles et infectieuses (CDMTI) du RSP a créé un groupe de travail afin de déterminer les agents pathogènes ayant la plus grande importance pour la santé publique au Canada. Dirigé par l’ASPC, le groupe de travail comprenait des épidémiologistes, des experts en maladies infectieuses et en santé publique de tout le pays de même que des experts fédéraux, provinciaux et territoriaux.
Même s’il a été reconnu que la résistance peut survenir dans tous les types d’organismes, y compris les virus, les champignons et les parasites, le groupe de travail s’est concentré sur les bactéries présentes chez les humains et les animaux en ce qui se rapporte à la santé humaine. Le groupe a établi que les organismes suivants doivent constituer la principale priorité des activités de surveillance, lesquels devraient faire, ou font actuellement, l’objet d’une surveillance au Canada :
- Clostridium difficile
- Organismes producteurs de bêta-lactamases à spectre étendu (BLSE)Note de bas de page 10
- Organismes résistants aux carbapénèmesNote de bas de page 11 (Acinetobacter et Enterobacteriaceae spp.)
- Enterococcus spp.
- Neisseria gonorrhoeae
- Streptococcus pyogenes (streptocoque du groupe A) et pneumoniae
- Salmonella spp.
- Staphylococcus aureus
- Mycobacterium tuberculosis
- Campylobacter spp.
Organismes transmis dans les milieux de soins de santé
Les systèmes de surveillance de l’ASPC assurent actuellement le suivi des bactéries prioritaires suivantes, qui sont transmises principalement dans les milieux de soins de santé :
Clostridium difficile (C. difficile) est une infection nosocomiale d’importance associée à un taux de mortalité et de morbidité élevé. Même si elle répond généralement bien aux traitements standards actuels, l’infection se propage rapidement, car elle est naturellement résistante à de nombreux médicaments utilisés pour traiter d’autres infections. La plupart des cas d’infection à C. difficile surviennent chez les patients qui prennent certains antibiotiques à des doses élevées ou sur de longues périodes de temps, les personnes qui ont des problèmes médicaux sous-jacents ou les personnes qui ont subi une intervention médicale invasive. À la suite d’une augmentation des taux d’infection à C. difficile chez les patients hospitalisés observée pendant une décennie, les taux ont diminué en 2014, passant de 5,2 cas pour 1 000 hospitalisations à 3,4 cas pour 1 000 hospitalisations.
Les organismes résistants aux carbapénèmes (ORC) et les entérobactéries résistantes aux carbapénèmes (ERC) sont à l’origine d’infections pouvant survenir dans les voies urinaires, le système respiratoire ou le sang ou d’infections de plaies chez les patients vulnérables (p. ex. les très jeunes enfants, les personnes âgées et les personnes immunodéprimées). Le groupe d’antibiotiques du type carbapénème est le plus souvent la dernière ligne de traitement pour les entérobactéries, et il est habituellement réservé aux entérobactéries multirésistantes. L’apparition d’ERC et d’un groupe connexe appelé organismes producteurs de carbapénémases (OPC) est devenue une préoccupation grave en matière de santé publique à l’échelle internationale, car il existe peu de traitements de substitution en cas de résistance à ce groupe d’antimicrobiens. Au Canada, les niveaux d’ERC et d’OPC demeurent systématiquement faibles depuis 2010, mais continuent de faire l’objet d’une surveillance étroite étant donné l’augmentation des niveaux dans d’autres pays.
Staphylococcus aureus résistant à la méthiciline (SARM) est l’une des causes les plus fréquentes d’infections associées aux soins de santé au Canada. La méthicilline est l’un des antibiotiques de première intention utilisés pour le traitement des infections à Staphylococcus aureus. SARM peut causer des infections graves et parfois mortelles en milieu hospitalier. Compte tenu de la résistance à la méthicilline, la vancomycine est désormais le principal antimicrobien utilisé pour traiter les infections à SARM. Par conséquent, la résistance à la vancomycine doit faire l’objet d’une surveillance pour orienter les mesures visant à préserver cette option de traitement. Depuis 2008, les taux globaux d’infection à SDRM dans les hôpitaux ont diminué de 25 %, sans toutefois atteindre les taux observés au début des années 2000.
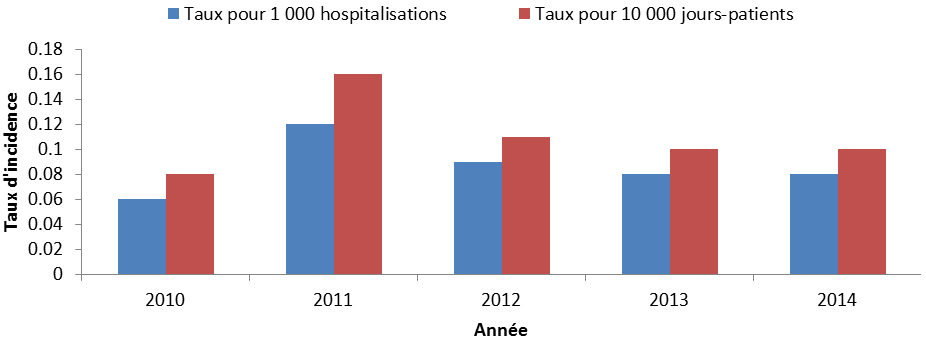
Les entérocoques résistants à la vancomycine (ERV) sont responsables de diverses infections pouvant se produire dans les voies urinaires, le sang ainsi que les plaies chirurgicales des patients hospitalisés. La vancomycine est généralement prescrite pour le traitement d’infections graves causées par des organismes résistants aux autres antimicrobiens. Par conséquent, la résistance à la vancomycine limite encore plus les options thérapeutiques. Les taux d’infection à ERV ont fortement augmenté de 2007 (0,10 cas pour 10 000 jours-patients) à 2012 (0,61 cas pour 10 000 jours-patients), puis ont diminué en 2013 et en 2014 (0,45 cas pour 10 000 jours-patients). Malgré les récentes baisses des taux d’infection à ERV au Canada, la prévalence de ces infections est à la hausse partout dans le monde; par conséquent, elles continuent de représenter une menace pour la santé mondiale, qui pourrait resurgir au Canada.Organismes transmis en milieu communautaire
Les systèmes de surveillance de l’ASPC assurent le suivi des organismes bactériens prioritaires suivants, qui sont transmis principalement en milieu communautaire :
Streptococcus pneumoniae (S. pneumoniae) cause une forme d’infection grave qui peut entraîner une pneumonie et une méningite, laquelle est plus souvent diagnostiquée chez les jeunes enfants et les personnes âgées. S. pneumoniae a présenté une résistance aux classes de médicaments des pénicillines et des érythromycines. Le taux d’incidence annuel de la pneumococcie invasive à l’échelle nationale et la résistance à un certain nombre d’antimicrobiens utilisés pour traiter le S. pneumoniae diminuent depuis 2010 avec la mise en œuvre des programmes d’immunisation des enfants par le vaccin conjugué 13-valent contre le pneumocoque (VCP13).
Le streptocoque du groupe A (SGA) peut causer plusieurs maladies, certaines étant invasives, comme la fasciite nécrosante (« maladie mangeuse de chair »), et d’autres non invasives, comme l’angine streptococcique et la scarlatine. De 2009 à 2013, le taux d’incidence national des infections invasives à SGA a augmenté, passant de 4,0 à 4,7 cas pour 100 000 habitants, la plus forte incidence ayant été observée chez les nourrissons de moins d’un an et chez les personnes âgées de 60 ans et plus. En 2014, tous les échantillons d’infections invasives à SGA ont répondu aux antimicrobiens de première intention, tandis que la résistance aux antimicrobiens de deuxième intention est restée relativement stable ou a diminué. Compte tenu de la nature grave des infections causées par le SGA, la résistance aux antimicrobiens doit faire l’objet d’une surveillance étroite pour veiller à ce que des traitements efficaces demeurent accessibles.
Neisseria gonorrhoeae (gonorrhée) peut causer une inflammation ou des dommages de l’appareil génital et, possiblement, l’infertilité. Entre 2004 et 2013, le taux de cas de gonorrhée signalés a augmenté de 43,1 % (passant de 27,4 à 39,3 cas pour 100 000 habitants), et il a en particulier augmenté chez les femmes. En plus de l’augmentation du nombre de cas de gonorrhée, N. gonorrhoeae a acquis une résistance à divers antimicrobiens utilisés pour traiter ce type d’infection. En 2014, 18,2 % des isolats étaient résistants à la pénicilline, 47,3 % étaient résistants à la tétracycline, 32,0 % étaient résistants à l’érythromycine et 34,0 % étaient résistants à la ciprofloxacine. La proportion d’isolats présentant une sensibilité réduite au céfixime, à la ceftriaxone ou à l’azithromycine a aussi diminué, réduisant ainsi l’accessibilité aux options de traitement.
Le taux d’infection à Mycobacterium tuberculosis (tuberculose) au Canada est parmi les plus faibles au monde. Cependant, la tuberculose touche de façon disproportionnée les Autochtones et les immigrants au Canada en provenance de régions du monde ayant des taux élevés de tuberculose. Dans l’ensemble, il n’y a eu aucune évolution notable de la résistance aux antituberculeux de première intention au Canada de 2004 à 2014, et la résistance demeure faible (8 % de résistance à un médicament et 1 % de résistance à plusieurs médicaments) et inférieure aux niveaux internationaux. Même si la tuberculose pharmacorésistante n’est pas un problème majeur au Canada, l’apparition potentielle d’un plus grand nombre de cas au Canada pourrait survenir en raison de l’augmentation du nombre de cas dans d’autres pays et de la facilité des voyages internationaux.
Organismes transmis chez les animaux
Le Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA) de l’ASPC assure le suivi des bactéries prioritaires suivantes transmises par les animaux :
Les bactéries Escherichia coli (E. coli) sont très courantes, puisqu’elles résident dans le tractus gastrointestinal des animaux et des humains en santé. Elles constituent un bon indicateur de la pression de sélection antimicrobienne, peuvent être porteuses de gènes de résistance qu’elles peuvent transmettre à d’autres bactéries et, dans certains cas, peuvent causer des maladies. En 2014, la proportion d’échantillons de viande de poulet, de porc et de bœuf (d’élevage, à l’abattoir et vendus au détail) positifs pour E. coli générique était de 96 %, de 55 % et de 56 %, respectivement. À la suite de l’interdiction de l’industrie, en mai 2014, d’utiliser de façon préventive des antimicrobiens considérés comme étant de très haute importance en médecine humaine, notamment le ceftiofur, une céphalosporine de troisième génération, le PICRA a observé une diminution de la résistance d’E. coli aux céphalosporines de troisième génération chez les poulets et dans les isolats provenant de viande de poulet. Par exemple, 28 % des isolats provenant de viande de poulet étaient résistants aux céphalosporines de troisième génération en 2013, alors que le pourcentage de ces isolats était de seulement 19 % en 2014. L’ASPC a remarqué une baisse de l’utilisation du ceftiofur dans les élevages de poulets à griller, soit de 31 % en 2013 à 6 % en 2014.
La bactérie Campylobacter est une cause majeure de maladies diarrhéiques d’origine alimentaire chez l’homme. Les infections à Campylobacter sont en général bénignes, mais peuvent être graves ou même fatales chez les très jeunes enfants, les personnes âgées et les personnes immunodéprimées. En 2014, la proportion d’échantillons de viande de poulet, de porc et de bœuf (d’élevage, à l’abattoir et vendus au détail) positifs pour Campylobacter était de 25 %, de 73 % et de 87 %, respectivement. Le PICRA a observé une diminution, correspondant à l’interdiction de l’industrie d’utiliser de façon préventive des antimicrobiens de très haute importance pour la santé humaine, du nombre de fermes ayant signalé l’utilisation de fluoroquinolones, lequel est passé de 2/99 en 2013 à 0/142 en 2014.
Salmonella spp. La salmonellose est l’une des maladies d’origine alimentaire les plus courantes et les plus répandues, plusieurs dizaines de millions de cas étant recensés chez l’homme chaque année dans le monde. Causés par plus de 2 500 types différents de Salmonella, les infections causent généralement une gastro-entérite bénigne, mais peuvent devenir graves chez les enfants, les personnes âgées et les personnes immunodéprimées. En 2014, la proportion d’échantillons de viande de poulet et de porc (d’élevage, à l’abattoir et vendus au détail) positifs pour Salmonella spp. était de 34 % et de 16 %, respectivement. Comme dans le cas d’E. coli, on a noté une diminution de la résistance aux céphalosporines de troisième génération dans les isolats de Salmonella non typhique provenant de poulets et de viande de poulet en 2014 comparativement à 2013. Par exemple, 22 % des isolats provenant de poulets échantillonnés à la ferme étaient résistants aux céphalosporines de troisième génération en 2013, alors que le pourcentage de ces isolats était de seulement 12 % en 2014. En comparaison, le taux de résistance aux céphalosporines de troisième génération dans les isolats de Salmonella provenant de porcs était inférieur à 5 % en 2014.
Lacunes en matière de données de surveillance
L’ASPC, en collaboration avec les provinces et les territoires, a mis en évidence des lacunes en matière de surveillance, qui doivent être corrigées afin de dresser un tableau complet de la résistance et du recours aux antimicrobiens au Canada. Un élément encore plus important est le manque de données relatives à la résistance de plusieurs pathogènes prioritaires constituant une préoccupation pour la santé des Canadiens. Ceux-ci comprennent les bactéries E.coli, Neisseria gonorrhoeae et Shigella résistantes aux antimicrobiens. Les autres lacunes comprennent les données limitées sur la résistance aux antimicrobiens dans les petits hôpitaux non universitaires, l’absence de données relatives aux milieux de soins de santé dans les zones rurales et nordiques et aux collectivités inuites et des Premières nations ainsi que les données limitées sur la résistance aux antimicrobiens dans la collectivité, les cliniques de consultation externe, les établissements de soins de longue durée et les cabinets de médecin et de dentiste.
Comme les microbes résistants sont généralement présents dans les milieux où le recours aux antimicrobiens est plus courant, il est essentiel de déterminer et de corriger les lacunes en matière de données sur le recours aux antimicrobiens pour atténuer la menace de la résistance aux antimicrobiens. L’ASPC obtient des données sur les médicaments par ordonnance délivrés par les pharmacies de détail et les antimicrobiens achetés par les hôpitaux ainsi que sur les diagnostics posés par des médecins recommandant le recours à ces médicaments dans la communautéNote de bas de page 12. Bien que l’on comprenne partiellement les habitudes de prescription en milieu hospitalier et communautaire, d’autres lacunes en matière d’information limitent la capacité à évaluer les indications d’emploi appropriées et à déterminer les éventuelles classes de médicaments visés par une surprescription.
À l’heure actuelle, il existe peu de données sur le recours aux antimicrobiens chez les animaux ainsi que certaines lacunes dans la surveillance de la résistance aux antimicrobiens chez les animaux et dans la chaîne alimentaire. On constate un manque de données sur les quantités d’antimicrobiens importées pour usage personnel ou comme ingrédients pharmaceutiques actifs destinés aux préparations des vétérinaires et utilisés chez les animaux destinés à l’alimentation. On s’attend à ce que la mise en œuvre de nouveaux règlements fédéraux concernant la surveillance par les vétérinaires du recours aux antimicrobiens, prévue en décembre 2016, permette d’obtenir certaines de ces données.
Enfin, il existe une lacune importante dans la compréhension des liens entre le recours aux antimicrobiens et les profils de résistance observés ainsi que la propagation d’agents pathogènes au Canada.
| Organisme prioritaire | Collecte de données de surveillance | |
|---|---|---|
| Milieu communautaire | Milieu hospitalier | |
| Clostridium difficile | Ne répond pas aux données de surveillance exigées | Répond aux données de surveillance exigées |
| Enterobacteriaceae spp., E. coli, Klebsiella (infection du sang) |
Obtenues en milieu hospitalier | Répond partiellement aux données de surveillance exigées |
| Enterococcus spp. et Staphylococcus aureus (infection du sang) | Obtenues en milieu hospitalier | Répond partiellement aux données de surveillance exigées |
| Staphylococcus aureus (autres types d’infection) |
Répond partiellement aux données de surveillance exigées | Répond partiellement aux données de surveillance exigées |
| Streptococcus pyogenes et pneumoniae | Répond partiellement aux données de surveillance exigées | Répond partiellement aux données de surveillance exigées |
| Répond partiellement aux données de surveillance exigées | Répond partiellement aux données de surveillance exigées | |
| Neisseria gonorrhoeae | Répond partiellement aux données de surveillance exigées | Obtenues en milieu communautaire |
| Mycobacterium tuberculosis | Répond aux données de surveillance exigées | Répond aux données de surveillance exigées |
| Salmonella spp. | Répond aux données de surveillance exigées | Répond aux données de surveillance exigées |
| Campylobacter spp. | Répond partiellement aux données de surveillance exigées | Répond partiellement aux données de surveillance exigées |
Prochaines étapes/conclusion
L’ASPC a réalisé des progrès importants visant à renforcer ses systèmes de surveillance afin de fournir un portrait complet et intégré de la santé publique en ce qui concerne la résistance et le recours aux antimicrobiens au Canada. Les lacunes en matière de surveillance continue présentent un défi lorsqu’il s’agit de dresser un tableau complet de la situation en milieu hospitalier et communautaire. L’ASPC s’engage à travailler avec les gouvernements provinciaux et territoriaux et d’autres partenaires pour corriger les lacunes en matière de surveillance. La mise en évidence de la résistance accrue des micro-organismes aux antimicrobiens et les questions quant à l’utilisation appropriée des antimicrobiens démontrent la nécessité de maintenir une vigilance constante afin de donner suite à la question de la résistance et du recours aux antimicrobiens au Canada. L’élargissement des activités de surveillance pour recueillir des données de qualité sur les pratiques de prescription des professionnels de la santé, les taux d’infection et les profils de résistance des organismes prioritaires, en particulier en milieu communautaire, constituera la priorité de l’ASPC au cours de l’année à venir.
La résistance aux antimicrobiens est un problème mondial qui ne peut pas être résolu sans une collaboration à l’échelle mondiale. L’ASPC continuera de travailler avec ses partenaires internationaux tels que l’Organisation mondiale de la Santé (OMS) pour déterminer et mesurer les indicateurs communs ainsi que partager les pratiques exemplaires de gestion des antimicrobiens afin de lutter contre la résistance aux antimicrobiens au Canada.
Annexes techniques
Résistance aux antimicrobiens et utilisation des antimicrobiens
L’annexe technique qui suit donne un aperçu plus détaillé des données de surveillance sur les organismes prioritaires ciblés par les systèmes de surveillance de l’ASPC. La section portant sur la résistance aux antimicrobiens met l’accent sur les organismes prioritaires et décrit les méthodes de surveillance, la situation au Canada et une perspective internationale. Les organismes prioritaires énumérés dans cette section comprennent : Clostridium difficile, Enterobacteriaceaeet Acinetobacter multirésistants, Staphylococcus aureus résistant à la méthicilline, Enterococcus spp. résistant à la vancomycine; Streptococcus pharmacorésistant, Neisseria gonorrhoeae, Salmonella Typhi, Salmonella non typhique et Mycobacterium tuberculosis.
La section portant sur le recours aux antimicrobiens présente de l’information sur l’utilisation des antimicrobiens chez les humains et les animaux. Elle fournit, dans le volet axé sur les humains, des détails sur la quantité d’antimicrobiens exécutés par les pharmacies communautaires, la répartition des spécialisations des prescripteurs ainsi que les achats et l’utilisation d’antimicrobiens par les hôpitaux. Dans le volet axé sur les animaux, cette section présente des données sur les quantités d’antimicrobiens distribués pour la vente, les indications d’emploi et des comparaisons à l’échelle internationale.
Résistance aux antimicrobiens au Canada
Clostridium difficile
Clostridium difficile (C. difficile) est un bacille anaérobie sporulé gram positif, qui est la cause la plus fréquente de la diarrhée infectieuse associée aux soins de santé au Canada et dans les autres pays développés. Au cours de la dernière décennie, on a constaté une nette augmentation de l’incidence des infections à C. difficile (ICD) et de la mortalité liée à cette maladie aux États-Unis, au Canada et en EuropeNote de bas de page a. La plupart des cas d’ICD surviennent chez les patients plus âgés et qui présentent d’autres problèmes médicaux sous-jacents. Le bacille se propage rapidement dans les milieux de soins de santé par contact direct, car il est naturellement résistant à de nombreux antimicrobiens utilisés pour traiter d’autres infections. Les spores de C. difficile présentes dans l’environnement sont aussi généralement résistantes aux désinfectants les plus couramment utilisés. On estime que 1,5 % de tous les patients hospitalisés contracteront une ICD pendant leur hospitalisation. Environ 15 % d’entre eux développeront une maladie grave et 6 % des cas graves décéderont des suites de l’infectionNote de bas de page b,Note de bas de page c.
Bien que la résistance aux traitements standard actuels contre l’ICD (vancomycine, métronidazole) ne constitue pas une préoccupation pour le moment, le recours important aux antimicrobiens dans les hôpitaux pour traiter les patients confère souvent à C. difficile un avantage concurrentiel.On a observé qu’une souche virulente de C. difficile, la souche de type 1 nord-américain en champ pulsé (NAP1), apparue en 2000, était résistante aux fluoroquinolones, une classe d’antimicrobiens fréquemment utilisée pour traiter d’autres infections en milieu hospitalier et communautaire. Cette souche s’est propagée partout en Amérique du Nord et en Europe; elle est responsable de l’augmentation des taux d’ICD, d’éclosions en milieu hospitalier et de maladies plus graves, particulièrement chez les personnes âgéesNote de bas de page c. Alors que le type NAP1 semble être le plus prévalent dans les cas d’ICD chez les adultes, on a constaté que la souche de type NAP4 était le type le plus couramment observé dans les cas pédiatriques d’ICD touchant des enfants âgés de 1 an à 18 ansNote de bas de page d.
Méthodologie
Depuis 2005, l’ASPC recueille des renseignements sur l’infection à C. difficile (ICD) associée aux soins de santé dans le cadre du Programme canadien de surveillance des infections nosocomiales (PCSIN). En 2014, le PCSIN avait recueilli des renseignements dans 58 grands hôpitaux de dix provinces. Lorsqu’un cas d’ICD est repéré par le laboratoire de l’hôpital, un questionnaire normalisé lié au patient est rempli à l’occasion d’un examen simultané ou rétrospectif réalisé par un professionnel en prévention des infections. Des renseignements détaillés sur le patient, y compris les données relatives aux résultats (admis dans une unité de soins intensifs en raison de complications découlant de l’ICD, colectomie ou décès) ont été fournis à l’ASPC pour chaque cas d’infection repéré. La mortalité attribuable a été relevée du 1er mars au 30 avril de chaque année. Dans la mesure du possible, les échantillons de selles congelés provenant de patients atteints d’une infection à Clostridium difficile associée aux soins de santé confirmée en laboratoire ont été envoyés au Laboratoire national de microbiologie pour isoler la souche de C. difficile et en déterminer les caractéristiques moléculaires. Les échantillons de selles provenant de patients adultes âgés de 18 ans et plus atteints d’une infection à Clostridium difficile associée aux soins de santé ont été envoyés entre le 1er mars et le 30 avril de chaque année, tandis que les échantillons de selles d’enfants âgés de 1 an à moins de 18 ans ont été soumis au LNM toute l’année durant.
Infection à Clostridium difficile au Canada
En 2008, le taux d’infection a atteint un sommet à 5,8 cas pour 1 000 hospitalisations et 7,5 cas pour 10 000 jours-patients. Depuis 2011, les taux ont lentement diminué, passant de 5,2 cas pour 1 000 hospitalisations en 2011 à 3,4 cas en 2014. De même, depuis 2011, les taux d’infection pour 10 000 jours-patients ont baissé, passant de 6,6 cas en 2011 à 4,4 cas en 2014 (Figure 1).
Figure 1 : Taux nationaux d’ICD associée aux soins de santé, de 2007 à 2014
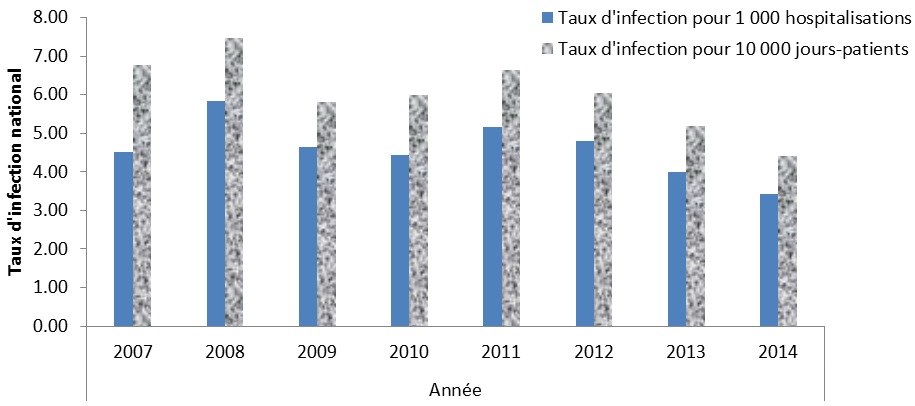
Équivalent textuel
| Année | ||||||||
|---|---|---|---|---|---|---|---|---|
| 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
Taux d’infection par 1 000 hospitalisations |
4,51 | 5,84 | 4,64 | 4,44 | 5,16 | 4,80 | 3,99 | 3,43 |
Taux d’infection par 10 000 jours-patients |
6,77 | 7,47 | 5,82 | 5,99 | 6,64 | 6,03 | 5,19 | 4,40 |
Histogramme groupé montrant le taux d’infection à Clostridium difficile par 1 000 hospitalisation et par 10 000 jours-patients (chaque taux est représenté par sa propre barre) rapporté au Canada de 2007 à 2014. L’axe horizontal représente l’année et l’axe vertical représente le taux national d’infection.
En 2014, l’âge moyen des adultes étaient 68,1 ans (étendue: de 18 ans à 102 ans) et 51 % (n = 1 324) étaient des hommes. Pour ce qui est des cas pédiatriques (n = 133), l’âge moyen était de 7,5 ans (étendue : de 1 an à 17 ans), et 56 % (n = 74) étaient de sexe masculin.
Les taux signalés demeurent plus élevés chez les adultes que dans les groupes d’âge pédiatriquesNote de bas de page 13. Depuis 2011, les taux d’incidence chez les adultes semblent diminuer, tandis que les taux pédiatriques paraissent relativement plus stables (Figure 2)Note de bas de page 14.
Figure 2 : Taux d’ICD associée aux soins de santé, chez les adultes et chez les enfants, de 2007 à 2014
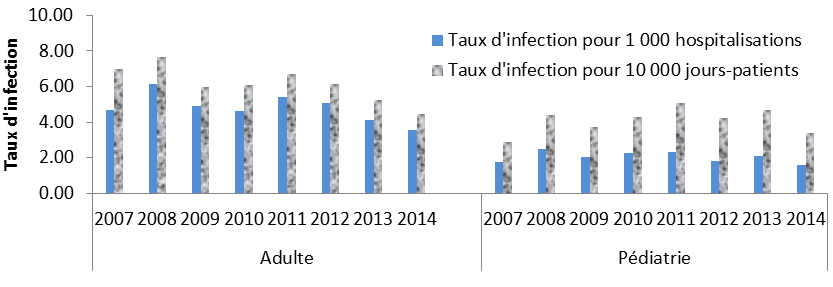
Équivalent textuel
| Adulte | Pédiatrie | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
| Taux d’infection par 1 000 hospitalisations | 4,67 | 6,12 | 4,89 | 4,61 | 5,43 | 5,07 | 4,15 | 3,57 | 1,75 | 2,52 | 2,05 | 2,27 | 2,31 | 1,80 | 2,11 | 1,60 |
| Taux d’infections par 10 000 jours-patients | 6,98 | 7,66 | 5,95 | 6,09 | 6,72 | 6,12 | 5,22 | 4,44 | 2,90 | 4,39 | 3,74 | 4,27 | 5,06 | 4,23 | 4,66 | 3,40 |
Ce graphique à barres présente le taux d'infections à Clostridium difficile pour 1 000 hospitalisation et par 10 000 jours-patients (chaque taux représenté par sa propre barre) rapporté au Canada de 2007 à 2014. L'axe horizontal est représenté par l'année et est séparé en cas adultes et pédiatriques. L'axe vertical représente les taux d'infection.
Les données sur les résultats 30 jours après la date du premier test positif de détection de C. difficile étaient disponibles pour 512 cas adultes et 107 cas pédiatriques en 2014. Sur les 512 adultes, 61 décès ont été déclarés, soit 11,9 %. Parmi ces décès, l’ICD avait contribué au décès mais n’en était pas la cause pour 19 cas, et elle était la cause du décès pour 6 cas. Le lien de cause à effet entre l’ICD et le décès était inconnu pour 15 cas. Pour les 21 cas restants, l’infection n’était pas associée au décès de la personne. Parmi les 107 cas pédiatriques, un décès a été signalé et ce résultat n’était pas attribuable à l’ICD.
En 2014, les résultats du typage des souches étaient indiqués pour 388 cas adultes et 97 cas pédiatriques. Parmi les cas adultes, 28,4 % des souches de C. difficile étaient de type 1 nord-américain en champ pulsé (NAP1); en revanche, chez les enfants, seulement 4,1 % des cas étaient provoqués par la souche de type NAP1 tandis que 23,7 % des cas pédiatriques correspondaient à la souche de type NAP4 (Figure 3).
Figure 3 : Types de souches responsables des ICD associées aux soins de santé, en comparant les cas adultes et les cas pédiatriques, en 2014
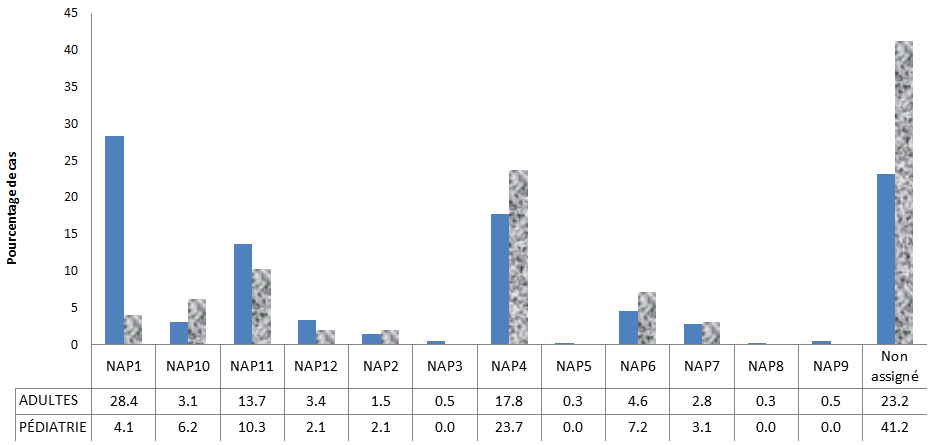
Équivalent textuel
| Types de souches | Pourcentage de cas | |
|---|---|---|
| Adultes | Pédiatrie | |
| NAP1 | 28,4 | 4,1 |
| NAP10 | 3,1 | 6,2 |
| NAP11 | 13,7 | 10,3 |
| NAP12 | 3,4 | 2,1 |
| NAP2 | 1,5 | 2,1 |
| NAP3 | 0,5 | 0,0 |
| NAP4 | 17,8 | 23,7 |
| NAP5 | 0,3 | 0,0 |
| NAP6 | 4,6 | 7,2 |
| NAP7 | 2,8 | 3,1 |
| NAP8 | 0,3 | 0,0 |
| NAP9 | 0,5 | 0,0 |
| Non assignée | 23,2 | 41,2 |
Les résultats des antibiogrammes étaient disponibles pour 2 290 cas adultes et 518 cas pédiatriques diagnostiqués entre 2007 et 2014. Les résultats des tests de sensibilité étaient indiqués pour les agents antimicrobiens suivants : clindamycine, métronidazole, moxifloxacine, rifampicine, tigécycline et vancomycine. Chez les adultes, entre 2007 et 2014, aucune résistance au métronidazole ni à la tigécycline n’a été signalée, et un cas s’est avéré résistant à la vancomycine. En 2009, 63,3 % des cas adultes étaient résistants à la moxifloxacine. De 2009 à 2014, le pourcentage de cas présentant une résistance à cet antimicrobien a lentement diminué et, en 2014, 34,3 % des cas signalés étaient résistants à la moxifloxacine. En 2009, 37,5 % des cas recensés étaient résistants à la clindamycine, et la résistance a chuté jusqu’à son niveau le plus bas pour la période en 2012, avec 13,4 % des cas déclarés. Toutefois, en 2013, 30,7 % des cas présentaient une résistance à la clindamycine, et ce taux a continué d’augmenter pour atteindre 41,3 % en 2014.
Par rapport aux adultes, la résistance à la clindamycine a été signalée plus fréquemment chez les enfants. En 2009, 62 % des cas déclarés étaient résistants et, malgré une baisse spectaculaire observée en 2010 jusqu’à 13,5 %, la proportion des cas présentant une résistance a augmenté de 2011 à 2014 pour atteindre 51,5 %. Chez les enfants, la proportion des cas résistants à la moxifloxacine était plus faible que chez les adultes. En 2009, 14,3 % des enfants présentaient une résistance à cet antimicrobien. Entre 2010 et 2012, ce taux est resté relativement stable, avant de chuter à 5,0 % en 2013. En 2014, la proportion de cas résistants à la moxifloxacine a légèrement augmenté, passant à 5,2 %.
Perspective internationale
L’absence de définitions des cas normalisées et reconnues à l’échelle internationale aux fins de la surveillance de l’ICD dans les différents pays entrave l’interprétation de l’épidémiologie de cette infection (voir l’annexe 2; Définitions des cas, SCSRA, 2016). Aux États-Unis, la surveillance de C. difficile est assurée au moyen de deux systèmes. Le premier est l’Emerging Infections Program (EIP), un système de surveillance active basé sur la population et les laboratoires qui est présent dans diverses régions géographiques du pays. L’EIP a été créé en 2009 et fonctionne actuellement dans 10 centres de l’EIP permettant de surveiller environ 11,7 millions de personnes. D’autre part, les données des hôpitaux sont recueillies par l’intermédiaire du National Healthcare Safety Network (NHSN) (disponible en anglais seulement) depuis 2013Note de bas de page e.
Il est assez difficile de comparer les taux d’ICD au Canada et aux États-Unis, car les données américaines sont calculées à partir d’estimations de la population alors que les taux nationaux canadiens sont exprimés en jours-patients. Toutefois, la baisse des taux constatée au Canada a également été observée aux États-Unis. Une diminution de 10 % de l’incidence de l’ICD apparue en milieu hospitalierNote de bas de page 15 a été signalée entre 2011 et 2013 aux États-UnisNote de bas de page f. En 2010, les taux globaux d’ICD associée aux soins de santéNote de bas de page 16 aux États-Unis étaient compris entre 58,5 et 94,8 cas pour 100 000 habitants sur sept centres de l’EIPNote de bas de page g. En 2011, le taux moyen déclaré sur 10 centres s’élevait à 92,8 cas pour 100 000 habitantsNote de bas de page h. On a également observé que la souche de type NAP1 était plus prévalente dans les cas d’ICD associée aux soins de santé que dans les infections d’origine communautaire (30,7 % p/r à 18,8 %, P < 0,001) en 2011Note de bas de page h. Aux États-Unis, les décès attribuables à C. difficile ont augmenté de 400 % entre 2000 et 2007. La moitié environ des cas d’ICD surviennent chez des personnes de moins de 65 ans; pourtant, plus de 90 % des décès déclarés concernent des personnes âgées de 65 ans et plusNote de bas de page i.
En Angleterre et au Pays de Galles, une surveillance volontaire de l’ICD est effectuée depuis 1990. Depuis janvier 2004, les groupes hospitaliers de soins de courte durée (acute trusts) du National Health Service (NHS) doivent obligatoirement déclarer les cas recensés chez les personnes âgées de 65 ans et plus. En 2007, la surveillance obligatoire par les groupes hospitaliers de soins de courte durée du NHS a été élargie, et elle inclut désormais tous les patients âgés de 2 ans et plus et toutes les infections à C. difficile. D’après les données de Public Health England, les taux globaux d’« ICD attribuée aux groupes hospitaliers »Note de bas de page 17 à déclaration obligatoire ont diminué entre 2007-2008 (89,6 cas pour 100 000 jours-patient) et 2014-2015 (15,1 cas pour 100 000 jours-patient). Toutefois, une augmentation de 2,9 % a été observée entre 2013-2014 (14,7 cas pour 100 000 jours-patient) et 2014-2015. Tout comme au Canada et aux États-Unis, on a observé au Royaume-Uni une nette tendance à la baisse de la proportion de cas déclarés d’ICD apparue en milieu hospitalier (au moins 3 jours après l’hospitalisation), qui est passée de 78,8 % en 2007-2008 à 57,4 % en 2014-2015Note de bas de page j.
Encadré 1 : Système canadien de surveillance des maladies à déclaration obligatoire (SSMDO) : Figure A : Chronologie des provinces et territoires participant au signalement des ICD au SSMDO Figure B : Taux de cas d’ICD signalés pour 100 000 habitants au Canada de 2009 à 2014
Équivalent textuel

Équivalent textuel
Enterobacteriaceae multirésistante aux médicaments et Acinetobacter
Les entérobactéries (Enterobacteriaceae) sont des bacilles Gram négatif fréquemment présents dans les milieux de soins de santé, qui comprennent notamment les espèces Escherichia coli, Klebsiella et Enterobacter. Ces organismes font partie de la flore normale du tractus gastro-intestinal des humains en santé, mais ils sont la cause d’infections, notamment des voies urinaires, des voies respiratoires, du sang et des plaies. Les entérobactéries possèdent une sensibilité mixte aux antimicrobiens prescrits couramment. Une forme de résistance des bacilles Gram négatif survient lorsqu’ils acquièrent la capacité de produire des β-lactamases à spectre étendu, une classe d’enzymes qui les rend très résistants aux céphalosporines à spectre étendu (de troisième génération) fréquemment utilisées (p. ex. ceftazidime, céfotaxime et ceftriaxone), ainsi qu’aux associations d’inhibiteurs de bêta-lactamine/lactamase (pipéracilline et tazobactam, etc.)Note de bas de page k.
Une autre forme de résistance implique le groupe des carbapénèmes, une classe d’antimicrobiens relativement sécuritaire et généralement efficace dans le traitement contre les β-lactamases à spectre étendu et d’autres organismes Gram négatif hautement résistants, et il existe peu de traitements de deuxième intention lorsqu’une résistance aux carbapénèmes apparaît. Lorsque ces bacilles Gram négatif ont acquis une résistance aux carbapénèmes, on parle d’entérobactéries résistantes aux carbapénèmes (ERC). Certaines ERC sont également des organismes producteurs de carbapénémases (OPC), par leur capacité à produire des enzymes (appelées carbapénémases) qui désintègrent les carbapénèmesNote de bas de page k. D’autres bacilles Gram négatif ne faisant pas partie de la famille des entérobactéries présentent également une résistance aux carbapénèmes, notamment Acinetobacter spp. et Pseudomonas spp.
Méthodologie
Le Programme canadien de surveillance des infections nosocomiales (PCSIN) recueille des données sur les ERC et sur les OPC chez les patients hospitalisés depuis 2010Note de bas de page l. Cette surveillance s’est élargie, le nombre d’hôpitaux participant au programme étant passé de 33 en 2010 à 58 en 2014. Tous les ERC et ARC repérés dans les hôpitaux participants sont soumis au LNM pour y subir des tests complémentaires. Si le LNM détermine qu’un isolat est producteur de carbapénémases (OPC), un questionnaire détaillé sur le patient est rempli. Parmi les données recueillies figurent notamment les caractéristiques démographiques du patient, le milieu d’obtention de la culture (urine, plaie, etc.), les antécédents de voyage et le décès ou non du patient.
Entérobactéries résistantes aux carbapénèmes au Canada
De 2010 à 2014, au total, 653 cas d’ERC ont été recensés par les centres du PCSIN. Le taux d’entérobactéries résistantes aux carbapénèmes (ERC) n’a pas varié de façon significative entre 2010 (0,19 cas pour 1 000 hospitalisations) et 2014 (0,22 cas pour 1 000 hospitalisations); cependant, il a atteint des sommets à deux reprises, en 2011 et en 2013, années où le taux d’incidence a quasiment doublé par rapport à celui de 2010 pour atteindre un taux d’incidence de 0,32 cas pour 1 000 hospitalisations en 2011 et de 0,28 cas pour 1 000 hospitalisations en 2013 (Figure 4). L’augmentation observée ces deux années était en grande partie due à une éclosion toujours en cours dans un seul hôpital et n’était pas représentative d’une tendance nationale.
Figure 4 : Taux nationaux d’incidence des ERC pour 10 000 jours-patients et pour 1 000 hospitalisations, de 2010 à 2014
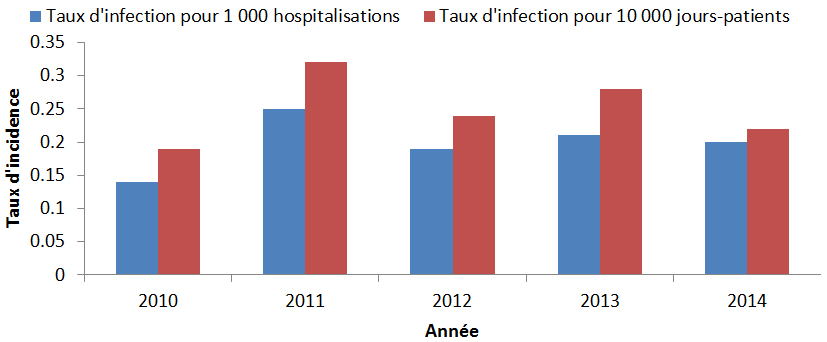
Équivalent textuel
| 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|
| Taux d’infection par 1 000 hospitalisations | 0,14 | 0,25 | 0,19 | 0,21 | 0,2 |
| Taux d’infection par 10 000 jours-patients | 0,19 | 0,32 | 0,24 | 0,28 | 0,22 |
Organismes producteurs de carbapénémases au Canada
Entre 2010 et 2014, les hôpitaux du PCSIN ont recensé au total 301 isolats d’organismes producteurs de carbapénémases (OPC), représentant 273 personnes. Parmi ces patients, 25 (9,1 %) étaient porteurs d’au moins deux OPC. À l’échelle nationale, le taux d’incidence des OPC est resté stable de 2010 (0,10 cas pour 10 000 jours-patients) à 2014 (0,11 cas pour 10 000 jours-patients) (Figure 5).
Figure 5 : Taux nationaux d’incidence des OPC pour 10 000 jours-patients et pour 1 000 hospitalisations, de 2010 à 2014
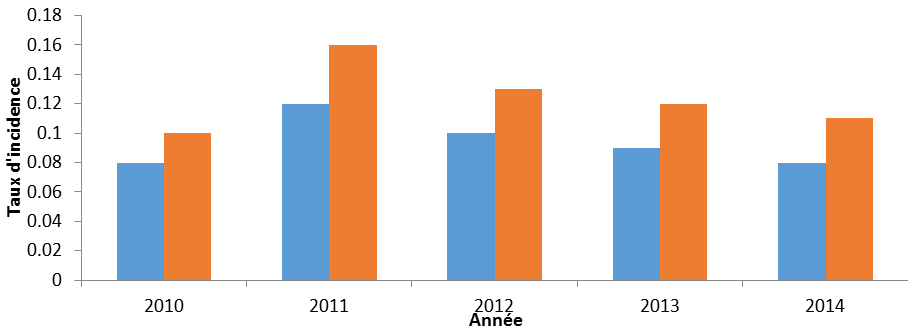
Équivalent textuel
| 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|
| Taux d’infection par 1 000 hospitalisations | 0,08 | 0,12 | 0,1 | 0,09 | 0,08 |
| Taux d’infection par 10 000 jours-patients | 0,1 | 0,16 | 0,13 | 0,12 | 0,11 |
La Figure 6 présente la répartition des cas signalés d’OPC selon le sexe et l’âge sur la période de 2010 à 2014 pour 269 personnes. Dans l’ensemble, les hommes représentaient 62 % (n = 167) du nombre total de cas et les personnes âgées de 65 ans et plus représentaient 58 % (n = 158) du nombre total de cas d’OPC.
Figure 6 : Nombre total de cas d’OPC par groupe d’âge et par sexe, de 2010 à 2014
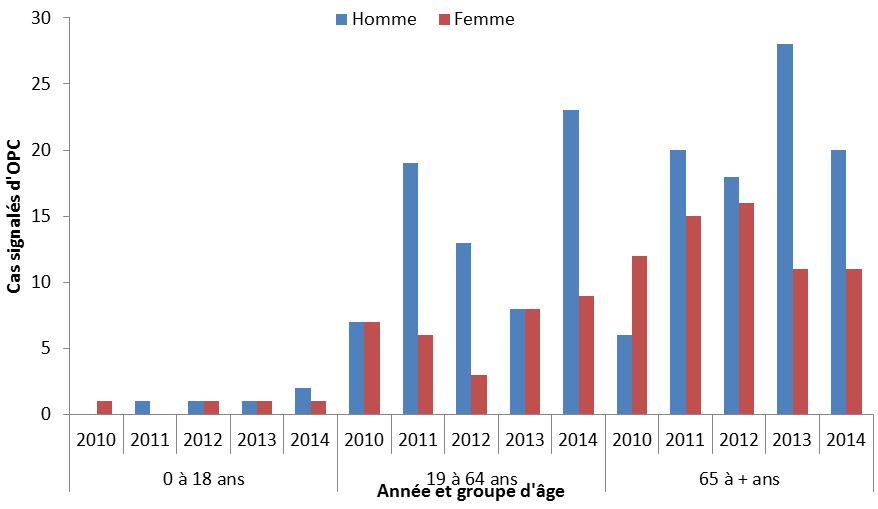
Équivalent textuel
| 0 à 18 ans | 19 à 64 ans | 65 à + ans | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2010 | 2011 | 2012 | 2013 | 2014 | 2010 | 2011 | 2012 | 2013 | 2014 | 2010 | 2011 | 2012 | 2013 | 2014 | |
| Homme | 0 | 1 | 1 | 1 | 2 | 7 | 19 | 13 | 8 | 23 | 6 | 20 | 18 | 28 | 20 |
| Femme | 1 | 0 | 1 | 1 | 1 | 7 | 6 | 3 | 8 | 9 | 12 | 15 | 16 | 11 | 11 |
Parmi les 273 personnes porteuses d’OPC entre 2010 et 2014, 105 cas (38,8 %) étaient des infections, 131 (48 %) étaient des patients qui hébergeaient la bactérie sans présenter de signe d’infection (colonisation), et le statut était inconnu pour 38 cas (13,9 %). La majorité des isolats d’OPC recensés provenaient d’écouvillonnages rectaux ou des selles (n = 91). Les échantillons rectaux et de selles représentaient 46 % de l’ensemble des cas d’OPC déclarés, soit 22 % des cas d’infection et 69,5 % des cas de colonisation. En ce qui a trait aux infections par un OPC (n = 106), les isolats provenaient en majorité de l’urine (n = 72, 67 %), puis du sang (n = 24, 23 %), et enfin des expectorations, de la peau, des selles et des plaies chirurgicales (Figure 7).
Figure 7 : Nombre total de cas d’infection et de colonisation par des OPC selon le siège de l’infection, de 2010 à 2014Note de bas de page 18
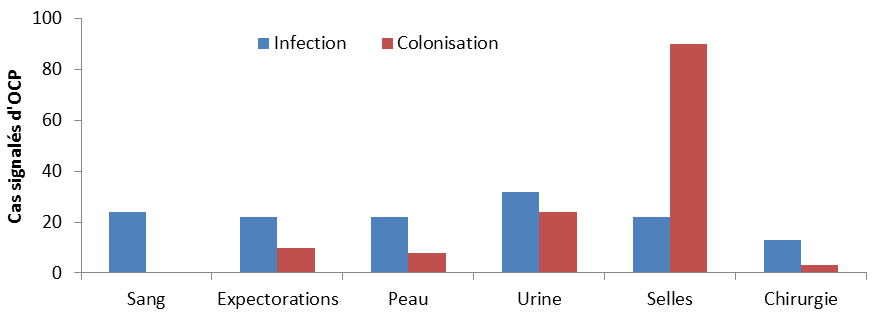
Équivalent textuel
| Sang | Expectorations | Peau | Urine | Selles | Chirurgie | |
|---|---|---|---|---|---|---|
| Infection | 24 | 22 | 22 | 32 | 22 | 13 |
| Colonisation | 0 | 10 | 8 | 24 | 90 | 3 |
Entre 2010 et 2014, la proportion de patients décédés dans les 30 jours suivant la date de la première culture positive pour un OPC est restée relativement stable, passant de 15 % en 2010 à 12 % en 2014. Les décès sont déclarés en tant que « mortalité toutes causes confondues » et ils ne sont pas nécessairement attribuables à l’infection par un OPC. De 2010 à 2013, les données sur le traitement étaient disponibles pour 122 personnes sur les 206 porteurs d’OPC (59,2 %). Les antimicrobiens les plus souvent prescrits entre 2010 et 2013 étaient les β-lactamines (32,0 %), suivies par les glycopeptides (29,5 %), les fluoroquinolones (22,0 %) et les carbapénèmes (19,7 %). En 2013, le recours à la colistine et à la tétracycline pour traiter les infections par des OPC a augmenté, tandis que l’utilisation des β-lactamines et des glycopeptides a diminué entre 2010 et 2013 (Figure 8). La collecte des données sur les traitements antimicrobiens a été abandonnée en 2014.
Figure 8 : Patients infectés par un OPC traités par les antimicrobiens suivants, de 2010 à 2013
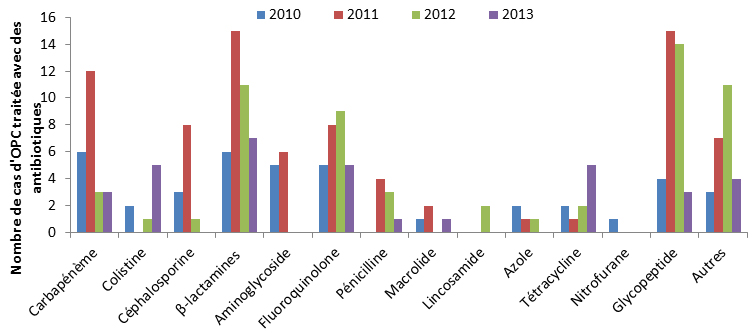
Équivalent textuel
| 2010 | 2011 | 2012 | 2013 | |
|---|---|---|---|---|
| Carbapénème | 6 | 12 | 3 | 3 |
| Colistin | 2 | 0 | 1 | 5 |
| Céphalosporine | 3 | 8 | 1 | 0 |
| Blacatamines | 6 | 15 | 11 | 7 |
| Aminoglycoside | 5 | 6 | 0 | 0 |
| Fluoroquinolone | 5 | 8 | 9 | 5 |
| Pénicilline | 0 | 4 | 3 | 1 |
| Macrolide | 1 | 2 | 0 | 1 |
| Lincosamide | 0 | 0 | 2 | 0 |
| Azole | 2 | 1 | 1 | 0 |
| Tétracycline | 2 | 1 | 2 | 5 |
| Nitrofurans | 1 | 0 | 0 | 0 |
| Glycopeptide | 4 | 15 | 14 | 3 |
| Autres | 3 | 7 | 11 | 4 |
L’histogramme groupé présente le nombre de cas d'organismes producteurs de carbapénèmase traités avec des antibiotiques par type d’antimicrobiens au Canada de 2010 à 2013. Chaque année est représentée par sa propre barre. L'axe horizontal représente le type d’antimicrobien et l'axe vertical le nombre de cas d'organismes producteurs de carbapénèmase traités avec des antimicrobiens.
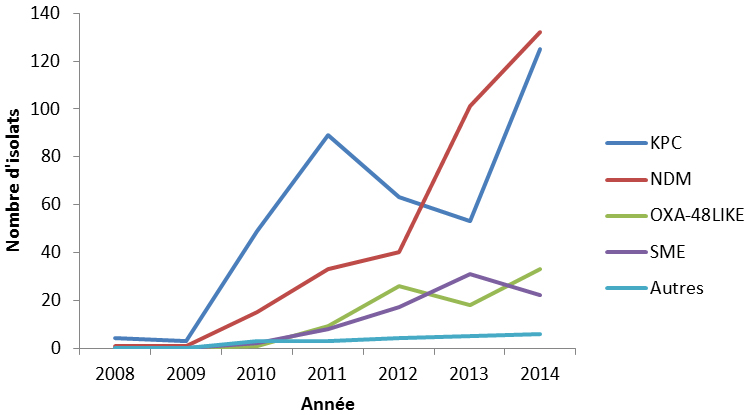
La Figure 9 présente la synthèse des isolats ayant obtenu un résultat positif au dépistage d’un gène de carbapénémase (n=303), par le test de polymérase en chaîne et par les bandelettes Etest, au Laboratoire national de microbiologie, en fonction du type correspondant de bactérie des espèces Enterobacteriaceae et Acinetobacter. Certaines carbapénémases sont spécifiques à certains genres. Les carbapénémases de la famille SME sont propres à l’espèce Serratia, plus précisément à Serratia marcescens, les familles OXA-51 et OXA-23 concernent uniquement Acinetobacter baumannii, et la famille NMC est propre à Enterobacter cloacae. Ces observations ont été en outre étayées par les résultats des données de laboratoire collectées de 2010 à 2014, selon lesquels le type SME a été identifié uniquement dans les isolats de Serratia spp., les types OXA-51 et OXA-23 dans Acinetobacter spp. et le type NMC dans Enterobacter spp. Les organismes producteurs de carbapénémases de type KPC (carbapénémase de Klebsiella pneumoniae) s’étendent à plusieurs genres, notamment Klebsiella, Enterobacter, Citrobacter, Serratia et E. coli Note de bas de page m,Note de bas de page n. Ils sont dominants dans l’espèce Klebsiella, ce qui était prévisible puisque l’on supposait initialement qu’ils étaient uniques à K. pneumoniae. Les enzymes de type GES sont dominants dans les isolats de Pseudomonas aeruginosa; toutefois, ils ont été observés dans de nombreux autres genres de la famille des entérobactéries, dont Klebsiella, Citrobacter, Serratia spp. et E. coliNote de bas de page m,Note de bas de page n,Note de bas de page o. Parmi ces isolats, les enzymes de type NDM (métallo-bêta-lactamase de New Delhi) et OXA-48 (oxacillinase-48) sont plus fréquemment présents dans les isolats de Klebsiella pneumoniae et d’E. coli; néanmoins, étant donné que ces gènes peuvent se propager facilement d’un microorganisme à un autre par transfert horizontal de gènes, on les retrouve également dans d’autres espècesNote de bas de page p.
Figure 9 : Répartition des OPC par type de carbapénémase, de 2010 à 2014
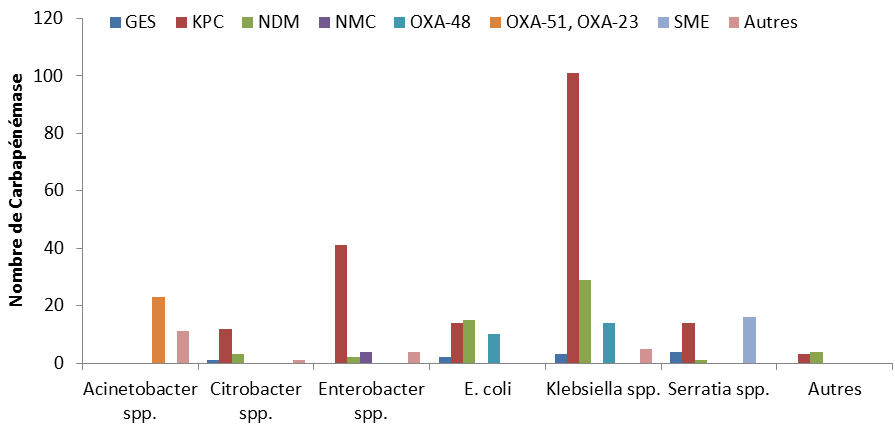
Équivalent textuel
| Espèce | GES | KPC | NDM | NMC | OXA-48 | OXA-51, OXA-23 | SME | Autres |
|---|---|---|---|---|---|---|---|---|
| Acinetobacter spp. | 0 | 0 | 0 | 0 | 0 | 23 | 0 | 11 |
| Citrobacter spp. | 1 | 12 | 3 | 0 | 0 | 0 | 0 | 1 |
| Enterobacter spp. | 0 | 41 | 2 | 4 | 0 | 0 | 0 | 4 |
| E. coli | 2 | 14 | 15 | 0 | 10 | 0 | 0 | 0 |
| Klebsiella spp. | 3 | 101 | 29 | 0 | 14 | 0 | 0 | 5 |
| Serratia spp. | 4 | 14 | 1 | 0 | 0 | 0 | 16 | 0 |
| Autres | 0 | 3 | 4 | 0 | 0 | 0 | 0 | 0 |
L’histogramme groupé présente le nombre de carbapénémase (chacun est représenté par sa propre barre) répartis entre les organismes producteurs de carbapénèmase au Canada de 2010 à 2014. L'axe horizontal représente les organismes producteurs de carbapénèmase tandis que l'axe vertical représente le nombre de carbapénèmases.
Entérobactéries productrices de carbapénémases (EPC)
Entre 2010 et 2014, le Programme canadien de surveillance des infections nosocomiales (PCSIN) a déclaré 270 isolats porteurs d’EPC. Les taux globaux d’EPC ont augmenté d’environ 33 % de 2010 (0,06 pour 1 000 hospitalisations) à 2014 (0,08 pour 1 000 hospitalisations). Cela dit, on a toutefois noté une augmentation en flèche en 2011. Le taux d’incidence a doublé comparativement à 2010 (0,12 pour 1 000 hospitalisations) (Figure 10).
Figure 10 : Taux nationaux d'infections et de colonisations et de colonisations d'EPC pour 10 000 jours-patients et pour 1 000 hospitalisations, de 2010 à 2014
Équivalent textuel
| 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|
| Taux par 1 000 hospitalisations | 0,06 | 0,12 | 0,09 | 0,08 | 0,08 |
| Taux par 10 000 jours-patients | 0,08 | 0,16 | 0,11 | 0,1 | 0,1 |
L’histogramme groupé présente le taux d'incidence d’entérobactéries productrices de carbapénémase par 1 000 hospitalisation et 10 000 jours-patients (chaque taux est représenté par sa propre barre), au Canada de 2010 à 2014. L'axe horizontal représente l'année et l'axe vertical du taux d'incidence.
Encadré 2 : Entérobactéries productrices de carbapénémases (EPC) au Canada : données du Réseau des laboratoires de santé publique du Canada (RLSPC) Figure A : Entérobactéries productrices de carbapénémases (EPC) au Canada : données du Réseau des laboratoires de santé publique du Canada (RLSPC), 2008 à 2014
Équivalent textuel
Acinetobacter producteur de carbapénémase (APC)
Entre 2010 et 2014, le PCSIN a déclaré 31 isolats porteurs d’APC. Après une augmentation en flèche des taux d’incidence d’APC en 2010 (0,02 pour 1 000 hospitalisations, 0,03 pour 10 000 jours-patients), les taux globaux d’APC sont demeurés stables depuis 2012 (0,01 pour 1 000 hospitalisations) (Figure 11).
Figure 11 : Taux nationaux d'infections et de colonisations et de colonisations d'APC pour 10 000 jours-patients et pour 1 000 hospitalisations, de 2010 à 2014
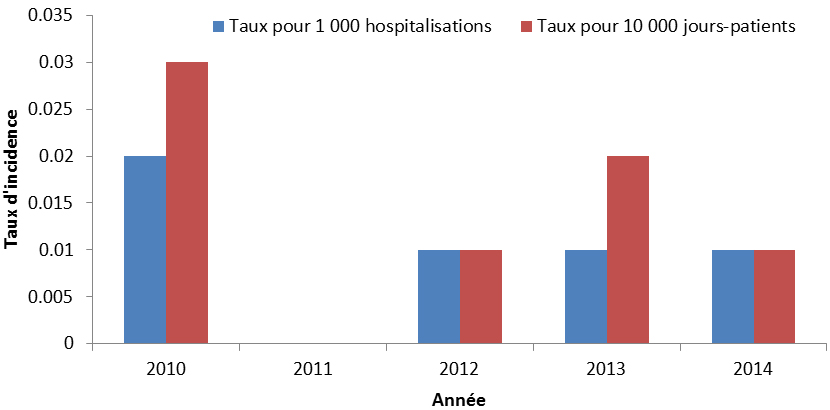
Équivalent textuel
| 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|
| Taux par 1 000 hospitalisations | 0,02 | 0 | 0,01 | 0,01 | 0,01 |
| Taux par 10 000 jours-patients | 0,03 | 0 | 0,01 | 0,02 | 0,01 |
L’histogramme groupé présente le taux d'incidence d’Acinetobacter productrices de carbapénémase par 1 000 hospitalisation et 10 000 jours-patients (chaque taux est représenté par sa propre barre), au Canada de 2010 à 2014. L'axe horizontal représente l'année et l'axe vertical du taux d'incidence.
Encadré 3 : Émergence d’un gène mcr-1 encodant une résistance à la colistine dans la bactérie E. coli au Canada
- Liu, Y-Y, Wang, Y, Walsh, TR et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: A microbiological and molecular biological study. Lancet Infect Dis 2015;16(2):161–168. http://dx.doi.org/10.1016/S1473-3099(15)00424-7.
- Ellis C, Chung C, Tijet N, et al. OXA-48-like Carbapenemase-producing Enterobacteriaceae in Ottawa, Canada. Diagn Microbiol Infect Dis 2013;76:399–400.
Perspective internationale
La résistance aux carbapénèmes fait l’objet d’une surveillance régulière par le Réseau européen de surveillance de la résistance aux antimicrobiens (EARS-Net). Les données sur la résistance aux antimicrobiens sont exprimées en pourcentage des isolats résistants par rapport à l’ensemble des isolats pour lesquels il existe des résultats de tests de sensibilité sur la résistance aux carbapénèmes pour un pathogène particulier. En Europe, entre 2011 et 2014, la résistance aux carbapénèmes a nettement augmenté pour K. pneumoniae (de 6,0 % en 2011 à 7,3 % en 2014), mais elle est restée relativement stable à 0,1 % pour E. coli. De 2011 à 2014, de nettes tendances à la hausse de la résistance aux carbapénèmes ont été observées dans sept pays (Allemagne, Bulgarie, Croatie, Espagne, France, Italie et Portugal) pour K. pneumoniae. Pourtant, en 2014, le taux national de résistance aux carbapénèmes était de 0,0 % en Estonie, en Finlande, en Islande, en Norvège et en Suède pour K. pneumoniae. En outre, aucune résistance aux carbapénèmes dans les isolats d’E. coli n’a été observée à Chypre, en Croatie, en Estonie, en Finlande, en Hongrie, en Islande, en Lettonie, en Lituanie, à Malte, en Norvège, aux Pays-Bas, en République tchèque, en Slovaquie, en Slovénie ou en Suède. La résistance à une association d’antimicrobiens incluant les carbapénèmes est restée faible (moins de 0,1 %) dans les isolats d’E. coli en 2014. D’autre part, environ 5,7 % de l’ensemble des isolats de K. pneumoniae étaient résistants à l’association des fluoroquinolones, des céphalosporines de troisième génération, des aminoglucosides et des carbapénèmesNote de bas de page q.
En 2015, les Centers for Disease Control and Prevention (CDC) des États-Unis ont modifié la définition de la surveillance des ERC de façon à inclure les entérobactéries présentant une résistance aux carbapénèmes et celles productrices de carbapénémases. La définition précédente visait les ERC productrices de carbapénémases et incluait la résistance aux carbapénèmes (à l’exception de l’ertapénème) et aux céphalosporines de troisième générationNote de bas de page r. En 2013, les CDC ont déclaré que la menace des ERC était de niveau urgent (menace de santé publique immédiate nécessitant une intervention agressive). Aux États-Unis, au cours du premier semestre 2012, au moins un cas grave d’ERC a été signalé parmi 4 % des hôpitaux de court séjour. D’autre part, 18 % des hôpitaux de soins de longue durée ont recensé un cas. Chaque année, près de 600 décès sont causés par des bactéries résistantes aux carbapénèmes des espèces Klebsiella et E. coli (les types d’ERC les plus courants aux États-Unis). En 2012, 11 % des isolats de Klebsiella spp. et 2 % des isolats d’E. coli étaient résistants aux carbapénèmes dans les hôpitaux américainsNote de bas de page i.
D’après le rapport 2014 de l’EARS-Net, en Europe, la résistance aux carbapénèmes était médiée par les métallo-bêta-lactamases (p. ex. enzymes de type VIM [métallo-bêta-lactamase encodée par l’intégron de Vérone] et NDM) ou par les carbapénémases sérines (p. ex. enzymes de type KPC)Note de bas de page q. Il a été démontré que les souches d’ERC porteuses de carbapénémases encodées par le plasmide, telles que les enzymes de type NDM et KPC, ont la capacité de se propager rapidement et sont donc préoccupantes pour la santé publiqueNote de bas de page s. De plus, on a également constaté que les enzymes de type OXA-48, une famille ayant une activité semblable à celle des carbapénémases, réduisent la sensibilité aux carbapénèmesNote de bas de page q. Il s’est avéré que cette dernière famille d’enzymes a une grande capacité à se propager et à causer des éclosions en milieu hospitalier. Cela peut s’expliquer par l’efficience de transfert élevée des gènes de type OXA-48 contenant le plasmide.
Aux États-Unis, entre 2010 et 2015, 52 isolats d’ERC (prélevés chez 43 patients) produisaient une carbapénémase de type OXA-48. Il s’agissait essentiellement d’isolats de K. pneumoniae, qui représentaient 81 % des patients, puis d’isolats d’E. coli (16 % des patients)Note de bas de page s. En Europe, seulement trois pays (l’Islande, le Monténégro et l’ancienne République yougoslave de Macédoine) n’ont déclaré aucun cas d’ERC en 2013. La Grèce, l’Italie et Malte ont indiqué que des ERC étaient régulièrement isolées chez des patients dans la plupart des hôpitaux, ce qui correspond à une situation endémiqueNote de bas de page t.
Staphylococcus aureus résistant à la méthicilline (SARM)
Le staphylocoque doré ou Staphylococcus aureus (S. aureus) est une bactérie Gram positif courante que l’on trouve normalement sur la peau de personnes en santé. On peut aussi la trouver dans le nez et dans la région de l’aine de personnes en santé, sans qu’elle cause de maladie (colonisation). S. aureus peut provoquer diverses infections, plus particulièrement de la peau et des tissus mous, des os et de la circulation sanguine (bactériémie). Dès le début des années 1960, certains staphylocoques dorés avaient acquis une résistance aux antimicrobiens de la classe des β-lactamines (p. ex. pénicillines telles que l’oxacilline, la méthicilline et la dicloxacilline). Ces types de S. aureus sont appelés Staphylococcus aureus résistants à la méthicilline (SARM)Note de bas de page u.
S. aureus, y compris le SARM, est l’une des causes les plus fréquentes d’infections associées aux soins de santé au Canada et il se propage d’une personne à l’autre par contact direct ou par contact avec des surfaces contaminées. À l’origine, le SARM était principalement présent dans les milieux de soins de santé, mais, au cours des dix dernières années, le SARM d’origine communautaire s’est répandu au Canada, en particulier dans certaines populations (p. ex. Autochtones, sans-abri et utilisateurs de drogues injectables). Il peut causer de graves infections, comme l’infection du sang ou bactériémie en milieu hospitalier, qui peut entraîner la mort. En milieu communautaire, il est plus souvent responsable d’infections de la peau et des tissus mous.
Méthodologie
L’ASPC recueille des données sur les infections à SARM chez les patients hospitalisés par l’intermédiaire du Programme canadien de surveillance des infections nosocomiales (PCSIN) depuis 1995. Les hôpitaux participant au PCSIN déclarent les échantillons de dépistage, les isolats cliniques (de sièges anatomiques autres que le sang) et les isolats d’hémoculture. Les échantillons de dépistage représentent des cas colonisés et ils sont isolés dans le nez, la région périnéale, l’aine, la région axillaire ou d’autres sièges de dépistage. Pour chaque site, les colonisations sont déclarées sous la forme d’un nombre total accompagné des renseignements sur le lieu où le SARM a été contracté (c.-à-d. cas associé aux soins de santé). Les patients chez qui le SARM a été décelé par l’intermédiaire d’un isolat clinique ou d’une hémoculture ayant obtenu un résultat positif sont classés en tant qu’infection clinique ou bactériémie, respectivement. Les renseignements sur le cas comprennent les caractéristiques démographiques et les données cliniques du patient, des renseignements sur les hospitalisations au cours des douze derniers mois, le site de culture positive, l’endroit où l’infection à SARM est supposée avoir été acquise (soit dans la collectivité, soit à l’hôpital), et le résultat dans les trente jours suivant le diagnostic positif d’une culture pour le SARM. Les hôpitaux participants envoient un isolat clinique de SARM pour chaque cas clinique infecté recueilli entre le 1er janvier et le 31 mars de chaque année civile au Laboratoire national de microbiologie (LNM) à des fins de test moléculaire. Un isolat d’hémoculture issu de cas survenant à tout moment pendant l’année de surveillance est également envoyé au LNM à des fins de test moléculaire.
SARM au Canada
Les données sur les infections à SARM chez les patients hospitalisés qui sont présentées ici ont été déclarées au PCSIN, puis classées en trois catégories : infections associées aux soins de santé, infections d’origine communautaire et bactériémies à SARM. En 2014, le taux d’infection à SARM, tous types confondus, chez les patients était de 2,12 pour 1 000 hospitalisations et de 2,89 pour 10 000 jours-patients (Figure 12). Dans l’ensemble, les taux d’infection à SARM ont augmenté en continu de 1995 à 2008. Depuis 2008, on a enregistré une baisse d’environ 25 % des taux d’infection à SARM (2,92 pour 1 000 hospitalisations et 3,64 pour 10 000 jours-patients en 2008).
Figure 12 : Taux nationaux d’infection à SARM, de 1995 à 2014
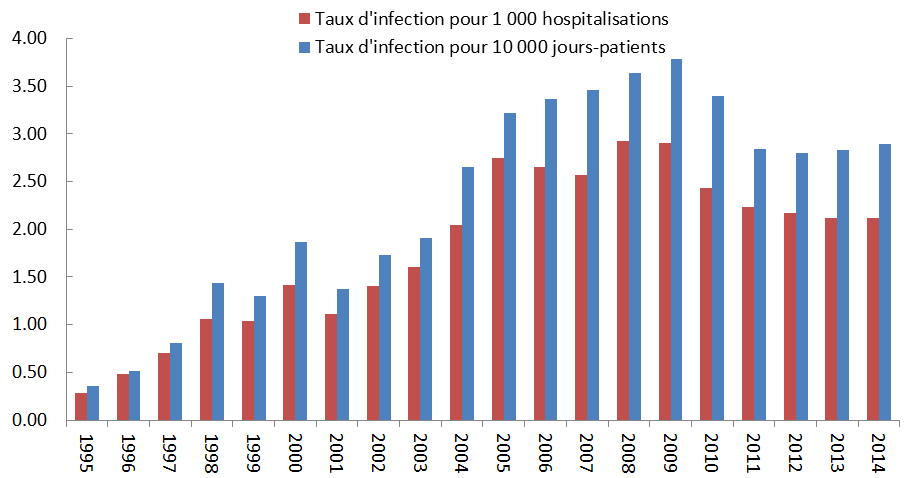
Équivalent textuel
| 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Taux par 1 000 hospitalisations | 0,28 | 0,48 | 0,70 | 1,06 | 1,04 | 1,42 | 1,11 | 1,41 | 1,60 | 2,04 | 2,75 | 2,65 | 2,57 | 2,92 | 2,90 | 2,43 | 2,23 | 2,17 | 2,12 | 2,12 |
| Taux par 10 000 jours-patients | 0,36 | 0,51 | 0,81 | 1,44 | 1,30 | 1,87 | 1,37 | 1,73 | 1,91 | 2,65 | 3,22 | 3,37 | 3,46 | 3,64 | 3,78 | 3,40 | 2,84 | 2,80 | 2,83 | 2,89 |
L’histogramme groupé présente le taux d'infection de Staphylococcus aureus résistant à la méticilline par 1 000 hospitalisation et 10 000 jours-patients (chaque taux est représenté par sa propre barre), au Canada de 1995 à 2014. L'axe horizontal représente l'année et l'axe vertical du taux d'infection.
Depuis 2008, la baisse la plus spectaculaire des taux d’infection à SARM a été observée pour les infections identifiées comme étant associées aux soins de santé. Les taux d’infection à SARM associée aux soins de santé ont augmenté de façon continue de 1995 à 2008 environ; toutefois, depuis 2008, on a constaté une baisse d’environ 30 % des taux d’infection à SARM associée aux soins de santé. En 2008, les taux d’infection à SARM associée aux soins de santé s’élevaient à 2,02 pour 1 000 hospitalisations et 2,52 pour 10 000 jours-patients; en 2014, ils étaient descendus à 1,26 pour 1 000 hospitalisations et 1,72 pour 10 000 jours-patients (Figure 13).
Figure 13 : Taux nationaux d’infection à SARM associée aux soins de santé, de 1995 à 2014

Équivalent textuel
| 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Taux par 1 000 hospitalisations | 0,16 | 0,27 | 0,44 | 0,68 | 0,61 | 0,91 | 0,58 | 0,69 | 0,75 | 0,96 | 1,33 | 1,54 | 1,53 | 2,02 | 1,96 | 1,62 | 1,51 | 1,35 | 1,31 | 1,26 |
| Taux par 10 000 jours-patients | 0,21 | 0,29 | 0,51 | 0,93 | 0,76 | 1,19 | 0,72 | 0,85 | 0,90 | 1,25 | 1,56 | 1,96 | 2,07 | 2,52 | 2,56 | 2,26 | 1,93 | 1,74 | 1,75 | 1,72 |
L’histogramme groupé présente le taux d'infection de Staphylococcus aureus résistant à la méticilline en milieu hospitalier par 1 000 hospitalisation et 10 000 jours-patients (chaque taux est représenté par sa propre barre), au Canada de 1995 à 2014. L'axe horizontal représente l'année et l'axe vertical du taux d'infection.
Les taux d’infection à SARM d’origine communautaire sont restés relativement faibles jusqu’en 2005, année marquée par une augmentation spectaculaire (plus de 400 %). En 2004, les taux d’infection à SARM d’origine communautaire étaient de 0,21 pour 1 000 hospitalisations et 0,28 pour 10 000 jours-patients et, en 2005, ils s’élevaient à 0,79 et 0,93, respectivement. Toutefois, depuis 2005, les taux d’infection à SARM d’origine communautaire sont demeurés relativement constants (Figure 14).
Figure 14 : Taux nationaux d’infection à SARM d’origine communautaire, de 1995 à 2014
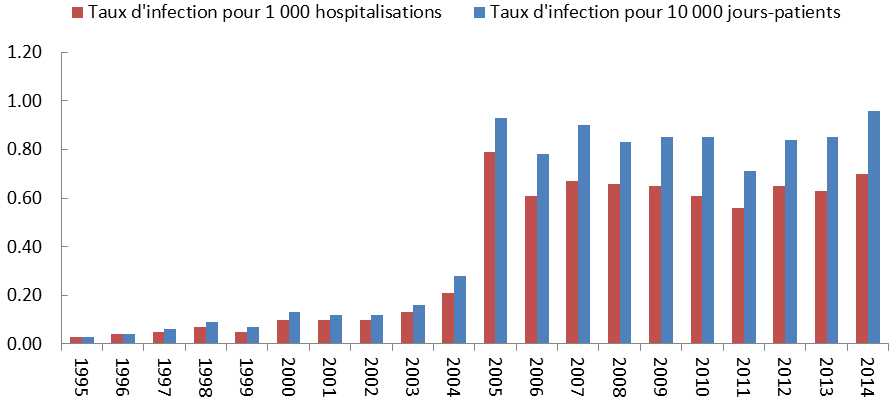
Équivalent textuel
| 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Taux par 1 000 hospitalisations | 0,03 | 0,04 | 0,05 | 0,07 | 0,05 | 0,10 | 0,10 | 0,10 | 0,13 | 0,21 | 0,79 | 0,61 | 0,67 | 0,66 | 0,65 | 0,61 | 0,56 | 0,65 | 0,63 | 0,70 |
| Taux par 10 000 jours-patients | 0,03 | 0,04 | 0,06 | 0,09 | 0,07 | 0,13 | 0,12 | 0,12 | 0,16 | 0,28 | 0,93 | 0,78 | 0,90 | 0,83 | 0,85 | 0,85 | 0,71 | 0,84 | 0,85 | 0,96 |
L’histogramme groupé présente le taux d'infection de Staphylococcus aureus résistant à la méticilline en milieu communautaire par 1 000 hospitalisation et 10 000 jours-patients (chaque taux est représenté par sa propre barre), au Canada de 1995 à 2014. L'axe horizontal représente l'année et l'axe vertical du taux d'infection.
Pour ce qui est des tendances nationales de la bactériémie à SARM entre 1995 et 2014, on a observé une lente augmentation des taux jusqu’en 2009. Depuis, les taux de bactériémie à SARM sont restés relativement stables (Figure 15).
Figure 15 : Taux nationaux de bactériémie à SARM, de 1995 à 2014
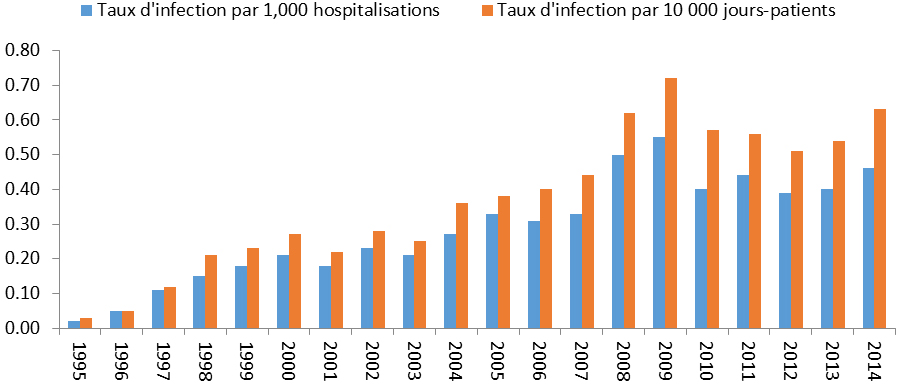
Équivalent textuel
| 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Taux par 1 000 hospitalisations | 0,02 | 0,05 | 0,11 | 0,15 | 0,18 | 0,21 | 0,18 | 0,23 | 0,21 | 0,27 | 0,33 | 0,31 | 0,33 | 0,50 | 0,55 | 0,40 | 0,44 | 0,39 | 0,40 | 0,46 |
| Taux par 10 000 jours-patients | 0,03 | 0,05 | 0,12 | 0,21 | 0,23 | 0,27 | 0,22 | 0,28 | 0,25 | 0,36 | 0,38 | 0,40 | 0,44 | 0,62 | 0,72 | 0,57 | 0,56 | 0,51 | 0,54 | 0,63 |
L’histogramme groupé présente le taux de bactériémie à Staphylococcus aureus résistant à la méticilline par 1 000 hospitalisation et 10 000 jours-patients (chaque taux est représenté par sa propre barre), au Canada de 1995 à 2014. L'axe horizontal représente l'année et l'axe vertical du taux d'infection.
En 2014, 444 infections à SARM (22 %) ont été détectées dans la circulation sanguine et 1 537 (78 %) provenaient d’autres sources cliniques. Les infections de la peau et des tissus mous constituaient la plus grande proportion (43 %) des infections à SARM détectées à partir de sources cliniques autres que le sang – 37 % lorsque les isolats d’hémoculture étaient inclus.
La majorité des cas ont été recensés chez des personnes de 25 ans et plus. Les hommes représentaient 59 % du nombre total de cas d’infection à SARM (Figure 16).
Figure 16 : Âge des patients atteints d’infection à SARM, en 2014
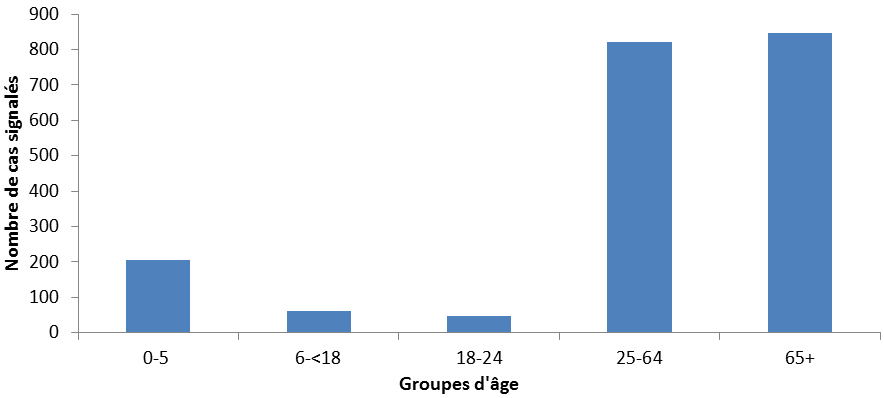
Équivalent textuel
| Âge (ans) | Nombre de cas signalés |
|---|---|
| 0-5 | 206 |
| 6-<18 | 62 |
| 18-24 | 46 |
| 25-64 | 821 |
| 65+ | 846 |
Quatre-vingt pourcent des patients hospitalisés atteints d’une infection à SARM déclarée en 2014 ont survécu, tandis que 10 % seulement des patients étaient décédés 30 jours après le diagnostic d’infection à SARM. Néanmoins, parmi les patients atteints d’une bactériémie à SARM, 23 % étaient morts 30 jours après le diagnostic de bactériémie à SARM, contre 6 % seulement des patients atteints d’une infection clinique (ne touchant pas le sang). Les décès sont déclarés en tant que « mortalité toutes causes confondues » et ils ne sont pas nécessairement attribuables à l’infection à SARM. Par conséquent, on ne sait pas si les décès constatés étaient directement liés à l’infection à SARM des patients.
Le Tableau 1 décrit les souches épidémiques de SARM identifiées à partir d’isolats d’hémoculture et d’isolats cliniques non sanguins soumis chaque année pour des cas présentant une infection clinique ou une bactériémie à SARM. Trois types de souche, SARMC-2, SARMC-10 et SARMC-7, représentaient à eux seuls près de 90 % de tous les types de souche identifiés au cours de la période de surveillance de sept ans. La souche SARMC-2 (correspondant à la souche USA100/800) est la plus couramment désignée comme un génotype associé aux soins de santé, tandis que les souches SARMC-7 (correspondant à la souche USA400) et SARMC-10 (correspondant à la souche USA300) sont considérées comme des génotypes d’origine communautaire. La souche la plus souvent associée au milieu hospitalier, SARMC-2, demeure le type de souche le plus répandu à l’échelle nationale dans les isolats cliniques et d’hémoculture, suivie des souches SARMC-10 et SARMC-7 qui sont les deux types de souche les plus couramment associés aux milieux communautaires. Aussi bien dans les isolats cliniques que d’hémoculture, la proportion de la souche SARMC-10 est en hausse régulière depuis 2008.
| Type de souche | Bactériémies | Infections Cliniques (ne touchant pas le sang) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2008 (%) |
2009 (%) |
2010 (%) |
2011 (%) |
2012 (%) |
2013 (%) |
2014 (%) |
2008 (%) |
2009 (%) |
2010 (%) |
2011 (%) |
2012 (%) |
2013 (%) |
2014 (%) |
|
| SARMC-2 (USA100/800) |
127 (53,8) |
163 (58,6) |
165 (58,9) |
157 (54,7) |
123 (50,2) |
133 (46,7) |
162 (49,2) |
218 (53,2) |
173 (52,6) |
197 (54,1) |
160 (54,4) |
149 (51,2) |
145 (47,9) |
128 (38,6) |
| SARMC-7 (USA400) |
15 (6,4) |
6 (2,2) |
7 (2,5) |
16 (5,6) |
7 (2,9) |
15 (5,3) |
17 (5,2) |
29 (7,1) |
15 (4,6) |
22 (6,0) |
25 (8,5) |
21 (7,2) |
10 (3,3) |
23 (6,9) |
| SARMC-10 (USA300) |
63 (26,7) |
79 (28,4) |
72 (25,7) |
84 (29,3) |
89 (36,3) |
101 (35,4) |
110 (33,4) |
112 (27,3) |
99 (30,1) |
109 (29,9) |
80 (27,2) |
90 (30,9) |
113 (37,3) |
137 (41,3) |
Bien que la vancomycine par intraveineuse soit l’un des principaux antimicrobiens recommandés pour le traitement des infections à SARM, le linézolide (par intraveineuse ou par voie orale) et la daptomycine (par intraveineuse) sont utilisés dans les milieux de soins de santé au Canada. D’autres antimicrobiens constituent des options thérapeutiques pour des sièges particuliers d’infection à SARM, notamment : la télavancine (par intraveineuse) et la doxycycline pour les infections de la peau et des tissus mous, le triméthoprime-sulfaméthoxazole (TMP/SMX – par intraveineuse) et la clindamycine (par intraveineuse et par voie orale) pour le traitement des infections de la peau et des tissus mous ainsi que de la pneumonieNote de bas de page v.
Dans de rares cas, le S. aureus pourrait devenir résistant à la vancomycine, l’antimicrobien le plus fréquemment utilisé pour traiter des infections à SARM graves. Cela laisse peu d’options de traitement, car le S. aureus résistant à la vancomycine (SARV) observé jusqu’à présent est également résistant à l’oxacilline et à d’autres classes d’antimicrobiens. Bien que le SARV ait été détecté aux États-Unis et au Royaume-Uni, aucun cas n’a été répertorié au Canada à ce jourNote de bas de page w. Dans les isolats du PCSIN testés de 2008 à 2013, aucune résistance à la tigécycline, au linézolide ou à la daptomycine n’a été attestée. Au Canada, la proportion d’isolats de SARM testés qui présentaient une résistance à la ciprofloxacine, à l’érythromycine et à la clindamycine est demeurée relativement la même au cours de cette période (Tableau 2). On a constaté une légère baisse de la proportion d’isolats testés résistants à la tétracycline et au TMP/SMX.
Les profils de sensibilité aux antimicrobiens peuvent grandement varier selon les régions géographiques. Au Canada, la résistance à la ciprofloxacine, à l’érythromycine et à la clindamycine demeure légèrement plus élevée dans les régions de l’Est, alors que la résistance à la tétracycline et au TMP/SMX y est plus faible par rapport au reste du CanadaNote de bas de page x.
| Antimicrobiens | Isolats cliniques | Isolats sanguins | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2008 (N=376) (%) |
2009 (N=312) (%) |
2010 (N=631) (%) |
2011 (N=288) (%) |
2012 (N=274) (%) |
2013 (N=298) (%) |
2008 (N=234) (%) |
2009 (N=241) (%) |
2010 (N=277) (%) |
2011 (N=249) (%) |
2012 (N=236) (%) |
2013 (N=260) (%) |
|
| Clindamycine | 241 (64,1) |
146 (46,8) |
223 (61,8) |
180 (62,5) |
150 (54,7) |
178 (59,7) |
152 (65,0) |
109 (45,2) |
188 (67,9) |
163 (65,5) |
137 (58,1) |
103 (39,6) |
| Érythromycine | 324 (86,2) |
279 (89,4) |
306 (84,8) |
240 (83,3) |
221 (80,7) |
268 (89,9) |
197 (84,2) |
217 (90,0) |
246 (88,8) |
226 (90,8) |
207 (87,7) |
228 (87,7) |
| Ciprofloxacine | 324 (86,2) |
278 (89,1) |
309 (85,6) |
249 (86,5) |
223 (81,4) |
257 (86,2) |
196 (83,8) |
223 (92,5) |
249 (89,9) |
217 (87,1) |
202 (85,6) |
222 (85,4) |
| Acide fusidique | 16 (4,3) |
16 (5,1) |
31 (8,6) |
19 (6,6) |
17 (6,2) |
27 (9,1) |
19 (8,1) |
14 (5,8) |
21 (7,6) |
14 (5,6) |
13 (5,5) |
30 (11,5) |
| Gentamicine | 28 (7,4) |
22 (7,1) |
11 (3,0) |
13 (4,5) |
6 (2,2) |
16 (5,4) |
16 (6,8) |
6 (2,5) |
11 (4,0) |
5 (2,0) |
2 (0,8) |
12 (4,6) |
| Mupirocine | 48 (12,8) |
22 (7,1) |
34 (9,4) |
31 (10,8) |
29 (10,6) |
17 (5,7) |
23 (9,8) |
18 (7,5) |
19 (6,9) |
30 (12,0) |
15 (6,4) |
12 (4,6) |
| Tétracycline | 30 (8,0) |
20 (6,4) |
17 (4,7) |
7 (2,4) |
7 (2,6) |
12 (4,0) |
22 (9,4) |
9 (3,7) |
13 (4,7) |
13 (5,2) |
12 (5,1) |
13 (5,0) |
Perspective internationale
Aux États-Unis, les infections invasives à SARM sont surveillées par l’intermédiaire de l’Emerging Infections Program (EIP), un système de surveillance active basé sur la population et les laboratoires qui est présent dans diverses régions géographiques du pays, en plus du National Healthcare Safety Network (NHSN), qui collecte les données des hôpitauxNote de bas de page y. Aux États-Unis, les taux sont indiqués en fonction d’estimations de la population, contrairement au Canada, où les taux sont exprimés en hospitalisations et en jours-patients.
Il est donc assez difficile de comparer les taux d’incidence du SARM au Canada et aux États-Unis en raison des méthodes différentes utilisées. Néanmoins, la tendance globale à la baisse remarquée au Canada a également été observée aux États-Unis. Les taux d’infection à SARM associée aux soins de santéNote de bas de page 19 (apparue en milieu hospitalier ou en milieu communautaire) aux États-Unis ont chuté de 32,5 % entre 2007-2008 (27,1 cas pour 100 000 habitants) et 2013 (18,3 cas pour 100 000 habitants)Note de bas de page z. Pour ce qui est de la bactériémie à SARM, le taux d’incidence au Canada est resté relativement stable depuis 2009, tandis qu’aux États-Unis, on a observé une réduction de 73 % du taux d’incidence de 2001 à 2009 chez les patients en unité de soins intensifs munis d’un cathéter centralNote de bas de page aa). De plus, une diminution globale de 8 % des bactériémies à SARM apparues en milieu hospitalier aux États-Unis a été observée entre 2011 et 2013Note de bas de page ab.
Contrairement au Canada et aux États-Unis, l’incidence des cas de SARM augmente dans d’autres pays. Au Danemark, le taux le plus élevé de nouveaux cas de SARMNote de bas de page 20 a été enregistré en 2014 (52,7 cas pour 100 000 habitants). Le nombre de nouveaux cas de SARM en 2014 (n = 2 965) représentait une augmentation de 42 % par rapport à l’année 2013 (n = 2 092) et était cinq fois plus élevé qu’en 2007 (n = 663). En 2014, au Danemark, la bactériémie à SARM représentait 2,9 % de tous les cas de bactériémie à S. aureus, en hausse par rapport à une proportion de 1,7 % en 2013. Il convient de noter qu’au Danemark, seuls les cas de bactériémie à SARM (isolats d’hémoculture uniquement) sont déclarés et que cette déclaration était volontaire jusqu’en 2006Note de bas de page ac.
Au Danemark, en 2014, les plus fortes proportions de multirésistance ont été observées pour la pénicilline (77 %), l’acide fusidique (15 %), l’érythromycine (8 %), la clindamycine (8 %) et la norfloxacine (6 %). En outre, entre 2005 et 2014, on a enregistré une augmentation de la résistance à l’érythromycine (de 5 % à 8 %), à la clindamycine (de 4 % à 8 %), à l’acide fusidique (de 10 % à 15 %) et à la norfloxacine (de 3 % à 6 %)Note de bas de page ac. En comparaison, au Canada, en 2013, les quatre principaux médicaments pour lesquels une résistance a été constatée dans les isolats d’hémoculture de SARM étaient la céfoxitine (99,6 %), l’érythromycine (87,7 %), la ciprofloxacine (85,4 %) et la clindamycine (39,6 %). De plus, la résistance de la bactériémie à S. aureus a augmenté pour la ciprofloxacine, l’érythromycine et l’acide fusidique, passant de 83,8 %, 84,2 % et 8,1 % en 2008 à 85,4 %, 87,7 % et 11,5 % en 2013, respectivement. À l’inverse, la résistance à la clindamycine a diminué, passant de 65 % à 39,6 % sur la même période. Aucune résistance au linézolide n’a été observée au cours des périodes de surveillance dans les deux pays.
Entérocoques résistants à la vancomycine (ERV)
Les entérocoques (Enterococci) font partie du microbiote intestinal normal chez les humains et les animaux, mais peuvent également provoquer diverses maladies. De nombreuses souches responsables d’infections proviennent de la flore intestinale du patient. À partir de là, elles peuvent se propager et, le plus fréquemment, causer des infections des voies urinaires, du sang, intra-abdominales ou des plaies chirurgicales chez les patients hospitalisés. Enterococcus faecalis (E. faecalis) et Enterococcus faecium (E. faecium) sont les espèces les plus prévalentes dans les cultures provenant de cas humains; elles représentent plus de 90 % des isolats cliniquesNote de bas de page ad.
Le degré naturellement élevé de résistance aux antimicrobiens que présentent les entérocoques rend ces infections difficiles à traiterNote de bas de page ac. L’acquisition d’une résistance à la vancomycine par les entérocoques a changé la donne en ce qui concerne les options de traitement et alimenté le débat au sujet des pratiques de dépistage et de contrôle des infections pour cet organismeNote de bas de page ae,Note de bas de page af. Les entérocoques résistants à la vancomycine (ERV), en particulier les souches d’E. faecium, sont souvent résistants à la totalité ou à la majorité des antibiotiques qui constituent habituellement un traitement efficace dans le cas des entérocoques sensibles (non résistants) à la vancomycine. Les options thérapeutiques sont donc limitées pour les cliniciens devant traiter des infections à ERV.
Méthodologie
L’ASPC collecte des données sur des patients hospitalisés souffrant d’infections à ERVNote de bas de page 21 par l’intermédiaire du Programme canadien de surveillance des infections nosocomiales (PCSIN) depuis 1999. Lorsqu’un cas d’ERV est repéré par le laboratoire de l’hôpital, un questionnaire normalisé lié au patient est rempli à l’occasion d’un examen simultané ou rétrospectif réalisé par un professionnel en prévention des infections. Le questionnaire comprend les caractéristiques démographiques et les données cliniques du patient, des renseignements sur les hospitalisations au cours des douze derniers mois, le site de culture positive, l’endroit où l’infection à ERV est supposée avoir été acquise (dans la collectivité ou à l’hôpital), et indique si le patient présentait une infection concomitante à Staphylococcus aureus résistant à la méthicilline (SARM). Tous les échantillons de cas d’infection à ERV sont envoyés par les hôpitaux participants au Laboratoire national de microbiologie à des fins de test moléculaire. La réaction en chaîne de la polymérase (RCP) est utilisée pour déterminer la présence des gènes résistants à la vancomycine vanA, B, C, D, E, G et L. Un typage génomique multilocus et une microdilution en bouillon à l’aide de panels Gram positif Sensititre sont effectués uniquement pour les échantillons de sang infecté afin de déterminer, respectivement, un lien génétique et la sensibilité aux antimicrobiens.
ERV au Canada
D’après ces données, de 1999 à 2007, les taux d’infection à ERV sont restés relativement stables, à 0,10 cas pour 10 000 jours-patients. Entre 2008 et 2012, les taux ont commencé à augmenter régulièrement, pour atteindre un sommet à 0,61 cas pour 10 000 jours-patients en 2012. En 2014, le taux est redescendu à 0,45 cas pour 10 000 jours-patients (Figure 17).
Figure 17 : Taux d’incidence des infections à entérocoques résistants à la vancomycine pour 1 000 hospitalisations et pour 10 000 jours-patients, de 1999 à 2014

Équivalent textuel
| 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Taux par 1 000 hospitalisations | 0,02 | 0,04 | 0,01 | 0,05 | 0,05 | 0,04 | 0,03 | 0,06 | 0,08 | 0,16 | 0,24 | 0,34 | 0,45 | 0,47 | 0,39 | 0,33 |
| Taux par 10 000 jours-patients | 0,02 | 0,05 | 0,02 | 0,06 | 0,06 | 0,05 | 0,04 | 0,07 | 0,1 | 0,2 | 0,31 | 0,48 | 0,58 | 0,61 | 0,52 | 0,45 |
L’histogramme groupé présente le taux d'infection d’entérocoques résistants à la vancomycine par 1 000 hospitalisation et 10 000 jours-patients (chaque taux est représenté par sa propre barre), au Canada de 1999 à 2014. L'axe horizontal représente l'année et l'axe vertical du taux d'infection.
En 2014, 54 hôpitaux ont déclaré au total 294 infections à ERV à l’Agence, pour un taux d’infection de 0,45 pour 10 000 jours-patients. La caractérisation moléculaire de l’organisme responsable de l’infection était connue pour 60 % (n = 175) des cas recensés et, sur ces 175 cas, 99 % (n = 173) étaient de type E. faecium et 1 % (n = 2) était de type E. faecalis. Le gène Van A était le gène prédominant identifié dans 98 % (n = 172) des infections à ERV.
Sur les 294 cas signalés, 85 % étaient associés aux soins de santé et avaient été contractés dans l’hôpital déclarant. Les 15 % restants étaient répartis entre des cas associés aux soins de santé – contractés dans tout autre établissement ou milieu de soins de santé (en dehors de l’hôpital déclarant) –, des cas d’origine communautaire et des cas d’origine inconnue.
La Figure 18 indique le siège de l’infection à ERV pour les cas déclarés en 2014. Elle montre que les infections du sang constituaient le siège le plus souvent signalé, suivi de près par les infections détectées dans l’urine. Des données antérieures indiquent que les taux de bactériémie à ERV augmentent lentement au fil du temps.
Figure 18 : Siège des infections à ERV pour les cas diagnostiqués, en 2014
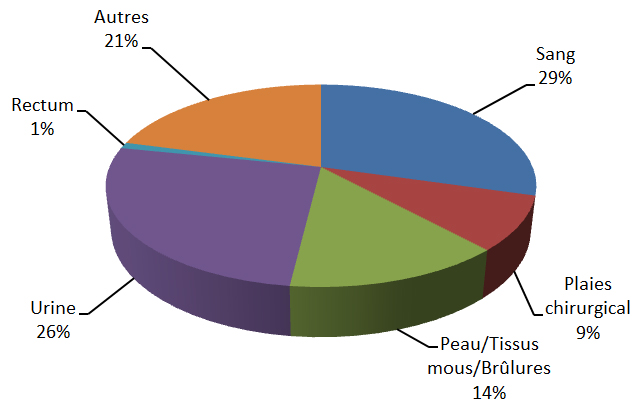
Équivalent textuel
| Siège des infections | Pourcentage |
|---|---|
| Sangs | 29,5 |
| Plaies chirurgical | 8,7 |
| Peau/Tissus mous/ Brûlures | 13,8 |
| Urine | 26,3 |
| Rectum | 1,0 |
| Autres | 20,8 |
En 2014, les ERV ont été isolés à partir de plusieurs sièges pour 16 cas. Le sang en association avec un autre siège était la présentation la plus courante chez les personnes infectées à deux sièges ou plus. Parmi les cas recensés d’ERV, 52 % (n = 153) étaient âgés de plus de 65 ans et 1 % (n = 3) avait moins de 19 ans. Les hommes représentaient 52 % (n = 152) des infections à ERV déclarées.
Les résultats des tests de sensibilité à 12 agents antimicrobiens étaient disponibles pour 368 cas de bactériémie à ERV diagnostiqués entre 2009 et 2014 (Figure 19). Les agents pour lesquels des résultats ont été présentés étaient les suivants : ampicilline, ciprofloxacine, érythromycine, gentamicine 500, lévofloxacine, linézolide, nitrofurantoïne, pénicilline, quinupristine/dalfopristine, rifampicine, streptomycine de niveau élevé et tétracycline.
Parmi les cas testés entre 2009 et 2014, presque tous étaient résistants à l’ampicilline, à la ciprofloxacine, à l’érythromycine, à la lévofloxacine et à la pénicilline. La proportion de cas présentant une résistance à ces antibiotiques est restée stable sur toute la période de surveillance. De 2009 à 2013, la résistance à la rifampicine a lentement augmenté; toutefois, la proportion a ensuite diminué, passant de 95 % en 2013 à 78 % en 2014. Depuis 2011, la résistance à la nitrofurantoïne a également affiché une hausse régulière, passant de 8 % des cas en 2011 à 20 % en 2014.
Entre 2009 et 2010, on a constaté une nette diminution de la proportion de cas présentant une résistance à la streptomycine; cependant, depuis 2010, cette résistance est demeurée constante. La résistance à la tétracycline a fluctué entre 38 % des cas et 54 % des cas sur la période de surveillance. La résistance à la gentamicine 500 a atteint un sommet en 2012, avec 23 % des cas testés présentant une résistance; néanmoins, en 2014, cette proportion était tombée à 10 %.
Seuls quelques cas se sont avérés résistants au linézolide et à l’association quinupristine/dalfopristine entre 2009 et 2014. Parmi les 368 cas ayant fait l’objet de tests de résistance, on a déterminé qu’un cas était résistant au linézolide et que 10 cas étaient résistants à l’association quinupristine/dalfopristine.
Figure 19 : Proportion de cas de bactériémie à ERV résistants à certains antimicrobiens, de 2009 à 2014
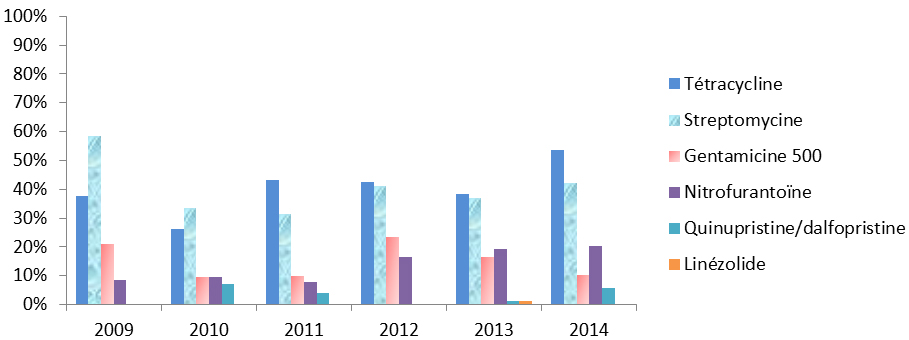
Équivalent textuel
| 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|
| Tétracycline | 38% | 26% | 43% | 42% | 38% | 54% |
| Streptomycine | 58% | 33% | 31% | 41% | 37% | 42% |
| Gentamicin 500 | 21% | 10% | 10% | 23% | 16% | 10% |
| Nitrofurantoïne | 8% | 10% | 8% | 16% | 19% | 20% |
| Quinupristine/dalfopristine | 0% | 7% | 4% | 0% | 1% | 6% |
| Linézolide | 0% | 0% | 0% | 0% | 1% | 0% |
L’histogramme groupé présente la proportion des cas de bactériémies à entérocoques résistants à la vancomycine résistants à certains antimicrobiens (chaque antimicrobiens est représenté par sa propre barre) par année, au Canada de 2009 à 2014. L’axe horizontal représente l’année et l’axe vertical représente la proportion de cas résistants.
Pour l’année 2014, le résultat 30 jours après la date de l’hémoculture positive était inconnu ou n’était pas fourni pour 3 % (n = 2) des cas de bactériémie à ERV. Sur les 62 autres cas pour lesquels cette donnée était disponible, 36 % (n = 23) des patients étaient toujours en vie et hospitalisés, et 34 % (n = 22) avaient quitté l’hôpital et été transférés au moment du suivi après 30 jours. Parmi les cas de bactériémie à ERV déclarés au PCSIN en 2014, 27 % (n = 17) étaient décédés.
Perspective internationale
Depuis la première description d’un ERV dans un isolat clinique en Europe en 1988, la prévalence des ERV a augmenté dans le monde entier. D’après le National Healthcare Safety Network, de 2009 à 2010, 35,5 % des infections à entérocoques associées au milieu hospitalier étaient résistantes à la vancomycine, ce qui en fait la deuxième cause la plus fréquente d’infections nosocomiales aux États-UnisNote de bas de page ag. Chaque année, près de 20 000 cas d’ERV sont signalés chez les patients hospitalisés, entraînant environ 1 300 décèsNote de bas de page i.
En 2012, la majorité des pays européens ont fait état d’un taux de résistance à la vancomycine inférieur à 5 % dans les isolats d’E. faecium, tandis que quelques pays seulement ont indiqué des estimations supérieures à 10 %Note de bas de page ah. D’après les données d’EARS-Net, les proportions moyennes d’ERV ont augmenté en Europe, passant de 6,2 % en 2011 à 7,9 % en 2014. En 2014, la fréquence de la résistance allait de 0 %, en Estonie, en Finlande, en Islande et à Malte, à 45,1 %, en Irlande. De 2011 à 2014, des tendances à la hausse ont été observées en Bulgarie, en Croatie, au Danemark, en Hongrie, en Irlande, en Italie, au Royaume-Uni et en SlovaquieNote de bas de page q.
À l’échelle mondiale, la plupart des cas d’ERV sont causés par le gène Van A, qui est principalement porté par la bactérie E. faeciumNote de bas de page ai.
Streptococcus mulitrésistant aux médicaments
La bactérie S. pneumoniae est la cause de la pneumococcie invasive, une forme grave d’infection pouvant entraîner une pneumonie doublée d’une bactériémie et d’une méningite. Le fardeau de la maladie est le plus lourd chez les jeunes enfants et les personnes âgées. S. pneumoniae peut également provoquer une otite moyenne (infection de l’oreille moyenne), une sinusite, une péritonite et, dans de rares cas, une endocarditeNote de bas de page aj. On peut réussir à prévenir l’infection par certains sérotypes de S. pneumoniae grâce à l’immunisation par les vaccins contre le pneumocoqueNote de bas de page ak. Streptococcus pyogenes peut causer des maladies invasives à streptocoque du groupe A, comme le syndrome de choc toxique streptococcique, la fasciite nécrosante (« maladie mangeuse de chair ») et la sepsie bactérienne, ainsi que des maladies non invasives telles que la pharyngite (« angine à streptocoques »), la scarlatine, la fièvre rhumatismale et les infections de la peau comme l’impétigoNote de bas de page aj.
Méthodologie
Les laboratoires provinciaux de santé publique soumettent les isolats invasifs de Streptococcus au LNM à des fins de sérotypage, en incluant les données relatives à l’âge, au sexe, à la source clinique et à la date de prélèvement. Le laboratoire de santé publique du Québec, le laboratoire provincial de santé publique de l’Alberta et le Toronto Invasive Bacterial Diseases Network soumettent quant à eux les données de sérotypage sur l’infection invasive à isolats de Streptococcus pneumoniae qui ont été recueillies dans leurs laboratoires. Les données ont été réunies par groupe d’âge, soit les < 2 ans, les 2-14 ans, les 15-49 ans, les 50-64 ans et les ≥ 65 ans, et par région, soit l’Ouest (Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Yukon, Territoires du Nord-Ouest et Nunavut), le Centre (Ontario et Québec) et l’Est (Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard et Terre-Neuve-et-Labrador). L’envoi d’isolats au LNM est volontaire et n’est pas systématique à l’échelle nationale.
En 2011, le LNM a entrepris un projet de collaboration avec le Health Sciences Centre – Canadian Antimicrobial Resistance Alliance (CARA) de l’Université du Manitoba en vue de la réalisation de tests de sensibilité aux antimicrobiens (TSA) sur les isolats de S. pneumoniae soumis au LNM; ce projet est désigné par l’acronyme SAVE (sérotypage de S. pneumoniae et sensibilité aux antimicrobiens : Évaluation de l’efficacité des vaccins au Canada après l’introduction du Pneu-C-13). Ont été inclus dans l’étude tous les isolats ayant causé une pneumococcie invasive qui ont été soumis par les huit provinces et territoires participants (Saskatchewan, Manitoba, Ontario, Québec, Nouvelle-Écosse, Île-du-Prince-Édouard, Nouveau-Brunswick, Terre-Neuve-et-Labrador).
S. pneumoniae multirésistant au Canada
Au Canada, depuis le lancement en 2010 des programmes d’immunisation systématique par le vaccin conjugué 13-valent contre le pneumocoque (VCP13), le taux national annuel d’incidence de la pneumococcie invasive a diminué, passant de 9,6 cas pour 100 000 habitants en 2011 à 8,9 cas pour 100 000 habitants en 2014. Au cours de cette période, le taux d’incidence annuel moyen était le plus élevé chez les personnes âgées de 60 ans et plus (21,8 cas pour 100 000 habitants), puis chez les nourrissons de moins de un an (18,4 cas pour 100 000 habitants) et chez les enfants de un à quatre ans (12,8 cas pour 100 000 habitants).
La résistance de S. pneumoniae à la pénicilline a diminué entre 2011 et 2014, passant de 12 % à 9 % (Figure 20), et la résistance à la clindamycine a également baissé, de 7 % à 4 %, sur la même période. La résistance à la doxycycline (8 %) est restée relativement stable depuis 2010. La résistance à la clarithromycine, qui peut être utilisée dans les cas de pneumonie d’origine communautaire, a diminué, passant de 25 % en 2013 à 22 % en 2014, et la résistance au triméthoprime-sulfaméthoxazole (TMP/SMX) est demeurée stable à 6 %. À ce jour, aucune résistance n’a été signalée à l’égard du linézolide, de la tigécycline ou de la vancomycine. La résistance aux carbapénèmes dans les isolats de S. pneumoniae est moins courante et a été détectée à des taux inférieurs à 2 % en 2014.
Figure 20 : Résistance aux antimicrobiens des isolats de Streptococcus pneumoniae, de 2011 à 2014Note de bas de page 22
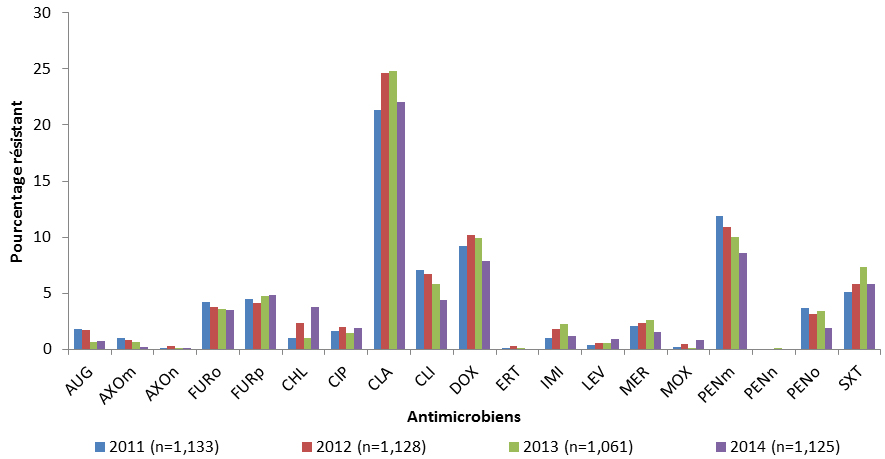
Équivalent textuel
| Ans | AUG | AXOm | AXOn | FURo | FURp | CHL | CIP | CLA | CLI | DOX | ERT | IMI | LEV | MER | MOX | PENm | PENn | PENo | SXT |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2011 (n=1 133) | 1,77 | 0,97 | 0,09 | 4,24 | 4,50 | 0,97 | 1,59 | 21,36 | 7,06 | 9,18 | 0,09 | 0,97 | 0,35 | 2,03 | 0,18 | 11,92 | 0,00 | 3,71 | 5,12 |
| 2012 (n=1 128) | 1,68 | 0,80 | 0,27 | 3,72 | 4,17 | 2,30 | 1,95 | 24,65 | 6,74 | 10,20 | 0,27 | 1,77 | 0,53 | 2,30 | 0,44 | 10,90 | 0,00 | 3,10 | 5,85 |
| 2013 (n=1 061) | 0,66 | 0,66 | 0,09 | 3,58 | 4,71 | 1,04 | 1,42 | 24,76 | 5,84 | 9,89 | 0,09 | 2,26 | 0,57 | 2,64 | 0,09 | 9,99 | 0,09 | 3,39 | 7,37 |
| 2014 (n=1 125) | 0,71 | 0,18 | 0,09 | 3,47 | 4,80 | 3,73 | 1,87 | 22,04 | 4,36 | 7,91 | 0,00 | 1,16 | 0,89 | 1,51 | 0,80 | 8,62 | 0,00 | 1,87 | 5,78 |
L’histogramme groupé présente le pourcentage d’isolats de Streptococcus pneumoniae résistants à certains antimicrobiens (chaque antimicrobiens est représenté par sa propre barre) par année, au Canada de 2011 à 2014. L’axe horizontal représente l’année et l’axe vertical représente le pourcentage d’isolats résistants.
Depuis 2010 a été introduit au Canada le VCP13, qui confère une protection contre le sérotype multirésistant 19A. La baisse de l’incidence des sérotypes contenus dans le VCP13 (y compris le sérotype multirésistant 19A) induite par la vaccination a entraîné une diminution simultanée de la résistance globale des pneumocoques aux antimicrobiens (Figure 21)Note de bas de page al. L’incidence des sérotypes du VCP13 a diminué, passant de 50 % des isolats en 2011 à 31 % en 2014. La résistance à trois classes d’antimicrobiens ou plus a également baissé, de 8 % à 5 %, sur la même période. L’effet du vaccin contre le pneumocoque sur les souches résistantes illustre l’importance d’inclure la vaccination dans une stratégie d’atténuation des répercussions de la résistance aux antimicrobiens.
Figure 21 : Multirésistance et proportion des sérotypes de pneumocoques contenus dans le VCP13, de 2011 à 2014
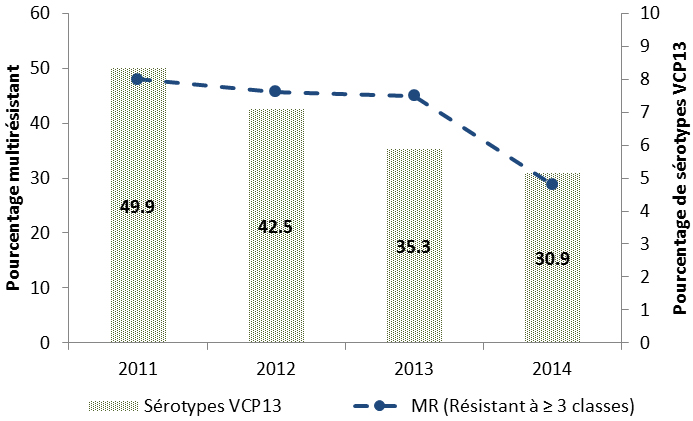
Équivalent textuel
| IPD Sérotypes | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|
| PCV13 Sérotypes | 49,9 | 42,5 | 35,3 | 30,9 |
| MR (Résistant à ≥ 3 classes) | 8,0 | 7,6 | 7,5 | 4,8 |
Le graphique représente le pourcentage d’isolats de Streptococcus pneumoniae qui sont résistants à trois ou plus classes d'antibiotiques (chacun représentés par une ligne) et le pourcentage de Streptococcus pneumoniae qui sont de sérotype PCV13 (représenté par une barre) au Canada 2011-2014. L'axe horizontal représente l’année. L'axe vertical gauche représente le pourcentage d'isolats multirésistants tandis que l'axe vertical de droite représente le pourcentage d'isolats qui sont sérotypes PCV13.
S. pyogenes multirésistant au Canada
De 2009 à 2013, le taux d’incidence national du SGA invasif au Canada a affiché une augmentation significative (p < 0,0001), de 4,0 à 4,7 cas pour 100 000 habitants, avec un taux d’incidence annuel moyen de 4,5 cas pour 100 000 habitants (étendue : de 4,0 à 4,9). Le taux d’incidence annuel moyen pour 100 000 habitants le plus élevé a été observé chez les nourrissons de moins de un an (9,4 cas; fourchette : de 8,7 à 9,8), puis dans le groupe d’âge des plus de 60 ans (7,2 cas; fourchette : de 6,6 à 7,6).
En 2014, les types prédominants de SGA invasif étaient les types emm 1 et 89, qui représentaient 28 % et 10 % des isolats testés, respectivement. La plupart des isolats de SGA invasif provenaient d’échantillons sanguins (69 %), puis du liquide synovial (8 %). Tous les isolats de SGA invasif étaient sensibles à la pénicilline et à la vancomycine. La résistance à la clindamycine, un médicament de deuxième intention pour le traitement des infections à SGA invasif, est restée relativement inchangée entre 2010 et 2014, avec environ 2 % des isolats résistants à cet antimicrobien, tandis que la résistance à l’érythromycine et la non-sensibilité au chloramphénicol ont diminué, de 14 % à 7 % et de 9 % à 0,1 %, respectivement, sur la même période (Figure 22).
Figure 22 : Résistance aux antimicrobiens des isolats de Streptococcus pyogenes (SGA) invasif, de 2010 à 2014
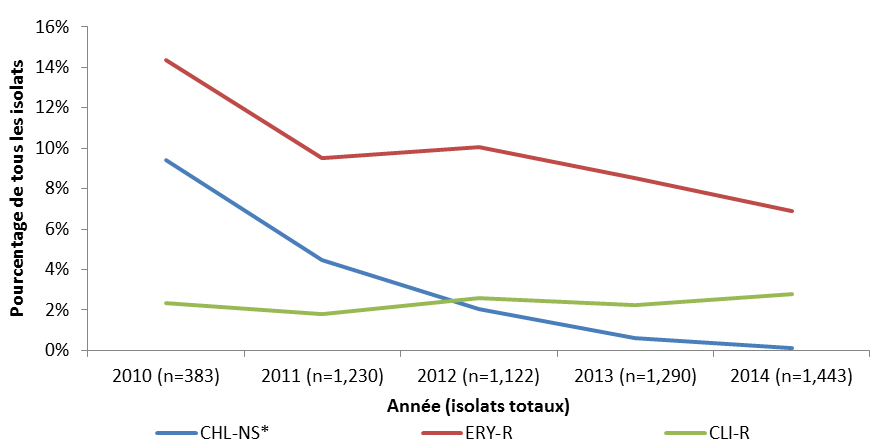
*CHL-NS : non sensible au chloramphénicol
Équivalent textuel
| Pourcentage de résistance de tous les isolats | |||
|---|---|---|---|
| CHL-NS* | ERY-R | CLI-R | |
| 2010 (n=383) | 9,4% | 14,4% | 2,3% |
| 2011 (n=1 230) | 4,5% | 9,5% | 1,8% |
| 2012 (n=1 122) | 2,0% | 10,1% | 2,6% |
| 2013 (n=1 290) | 0,6% | 8,5% | 2,2% |
| 2014 (n=1 443) | 0,1% | 6,9% | 2,8% |
Le graphique présente le pourcentage d’isolats Streptococcus pyogenes qui sont résistants à différents antimicrobiens (chacun est représenté par sa propre ligne) au Canada de 2010 à 2014. L'axe horizontal représente l'année et l'axe vertical le pourcentage d’isolats.
Perspective internationale
Comme au Canada, le taux global de pneumococcie invasive a diminué aux États-Unis entre 2011 et 2014 (de 11,8 cas à 8,7 cas pour 100 000 habitants, respectivement). Aux États-Unis, les taux de pneumococcie invasive chez les personnes âgées de 65 ans et plus ont augmenté, de 35 cas pour 100 000 habitants en 2011 à 40,9 cas en 2014, alors que ces taux sont restés relativement stables au Canada sur la même période. De la même façon qu’au Canada, chez les enfants de moins de cinq ans, les taux aux États-Unis ont diminué, passant de 12 cas pour 100 000 habitants en 2011 à 8,4 cas en 2014.
Aux États-Unis, de 2011 à 2014, une résistance à l’érythromycine a été détectée dans 28,4 % de l’ensemble des isolats de pneumococcie invasive sur toute la période; ce taux a augmenté entre 2011 et 2014, passant de 26,2 % à 30,2 %. Le taux de résistance à la tétracycline était plus faible, à 11,5 % sur l’ensemble de la période, et a affiché une baisse entre 2011 et 2014, de 13,2 % à 11,7 %. La résistance au TMP/SMX était de 10,7 % en moyenne, avec une diminution entre 2011 et 2014, de 14,3 % à 9,7 %Note de bas de page am,Note de bas de page an.
Au Canada, les trois principaux médicaments pour lesquels on a observé une résistance étaient la clarithromycine (23,2 %), suivie de la pénicilline (10,4 %) et de la doxycycline (9,3 %). En 2014, la résistance à la pénicilline au Canada (8,6 %) était plus élevée qu’aux États-Unis (2 %) et qu’au Royaume-Uni (0,5 %)Note de bas de page ao.
Aux États-Unis, les taux de SGA invasif étaient stables de 2009 à 2013 (de 3,6 à 3,7 cas pour 100 000 habitants), contrairement à la hausse significative observée au CanadaNote de bas de page ap,Note de bas de page aq. Toutefois, en 2014, les taux aux États-Unis ont augmenté de 13 % pour s’établir à 4,4 cas pour 100 000 habitantsNote de bas de page ar.
Neisseria gonorrhoeae
N. gonorrhoeae cause la gonorrhée, une maladie transmissible sexuellement extrêmement infectieuse. Elle entraîne une infection aiguë de l’appareil génital et peut être symptomatique ou non. Si elle n’est pas traitée ou si elle est traitée inadéquatement, elle peut causer une inflammation génitale ou de l’appareil reproductif, ainsi que l’infertilité. Le traitement et le contrôle de la gonorrhée sont compliqués, car N. gonorrhoeae développe une résistance aux antimicrobiens utilisés pour la traiter, notamment les pénicillines, les tétracyclines, les macrolides et les quinolones. Récemment, on a vu apparaître des isolats présentant une résistance à l’azithromycine et une sensibilité réduite aux céphalosporines, qui menacent les dernières options de traitement. Les Lignes directrices canadiennes sur les infections transmissibles sexuellement ont mis à jour les recommandations concernant l’utilisation d’un traitement d’association contre la gonorrhée composé de 250 mg de ceftriaxone par voie intramusculaire et de 1 g d’azithromycine par voie orale comme traitement de première intention dans le cas des infections anogénitales ou pharyngées non compliquées chez les adultesNote de bas de page as.
Méthodologie
Les laboratoires provinciaux de santé publique soumettent des isolats de N. gonorrhoeae au Laboratoire national de microbiologie (LNM) dans le cadre du Programme national de surveillance passive de Neisseria gonorrhoeae, accompagnés de renseignements sur l’âge et le sexe du patient ainsi que sur le siège anatomique de l’infection. Les laboratoires soumettent des isolats lorsqu’une résistance à un antimicrobien a été déterminée ou si les laboratoires provinciaux n’effectuent pas de tests de sensibilité aux antimicrobiens. La soumission d’isolats est volontaire et n’est pas uniforme dans l’ensemble du pays. Le nombre total d’isolats mis en culture dans toutes les provinces a été utilisé comme dénominateur pour calculer la proportion de résistance. Les tests de sensibilité aux antimicrobiens ont été effectués à l’aide de la dilution en gélose pour les antimicrobiens suivants : la pénicilline, la tétracycline, l’érythromycine, la spectinomycine, la ciprofloxacine, la ceftriaxone, la céfixime, l’azithromycine, l’ertapénème et la gentamicine.
Gonorrhée au Canada
Au Canada, la gonorrhée constitue la deuxième infection bactérienne transmissible sexuellement la plus signalée. Entre 2004 et 2013, le taux de cas déclarés de gonorrhée a augmenté de 43,1 %, passant de 27,4 à 39,3 cas pour 100 000 habitants, et il a en particulier augmenté chez les femmes. En 2013, comme pour les années précédentes, le taux de cas déclarés de gonorrhée était plus élevé chez les hommes que chez les femmes (47,4 cas contre 31,1 cas pour 100 000 habitants). C’est chez les femmes âgées de 15 à 24 ans et les hommes âgés de 20 à 29 ans que les taux de gonorrhée les plus élevés ont été signalés en 2013Note de bas de page at.
Sur les 3 809 isolats de N. gonorrhoeae mis en culture en 2014 dans les laboratoires de santé publique partout au Canada, un total de 1 955 de ces isolats ont démontré une résistance à au moins un antibiotique testé, ce qui indique que 52,4 % de tous les cas diagnostiqués au moyen d’une culture en 2014 étaient résistants à un ou plusieurs antibiotiquesNote de bas de page au.
La proportion d’isolats présentant une susceptibilité réduite à la ceftriaxone (concentration minimale inhibitrice [CMI] ≥ 0,125 mg/L) a diminué, passant de 7,3 % (n = 218/2 970) en 2010 à 2,7 % (n = 101/3 809) en 2014. La proportion d’isolats présentant une susceptibilité réduite au céfixime (CMI ≥ 0,25 mg/L) a baissé également, passant de 4,2 % (n = 140/3 360) en 2011 à 1,1 % (n = 42/3 809) en 2014. La proportion d’isolats de N. gonorrhoeae résistants à l’azithromycine (CMI ≥ 2 mg/L) a augmenté, de 0,4 % (n = 11/3 106) en 2009 à 3,3 % (n = 127/3 809) en 2014, dont 38 isolats provenant d’une éclosion (Figure 23). En 2014, 34,0 % (n = 1 296/3 809) des isolats étaient résistants à la ciprofloxacine, 32,0 % (n = 1 219/3 809) étaient résistants à l’érythromycine, 18,2 % (n = 693/3 809) étaient résistants à la pénicilline et 47,3 % (n = 1 809/3 809) étaient résistants à la tétracycline (Figure 24)Note de bas de page au.
Depuis 2012, des isolats de N. gonorrhoeae présentant une résistance à l’azithromycine et une sensibilité réduite aux céphalosporines (céfixime et ceftriaxone) ont été observés au Canada, représentant au total 0,2 % (n = 7/3 036) en 2012, 0,3 % (n = 8/3 195) en 2013 et 0,03 % (n = 1/3 809) en 2014. En dépit de ces petits nombres, ces isolats sont préoccupants, car ils représentent une menace pour le succès des options de traitement à double modalité actuellement recommandéesNote de bas de page au.
Figure 23 : Pourcentage d’isolats de gonorrhée présentant une résistance à l’azithromycine et une sensibilité réduite au céfixime et à la ceftriaxone, de 2009 à 2014*
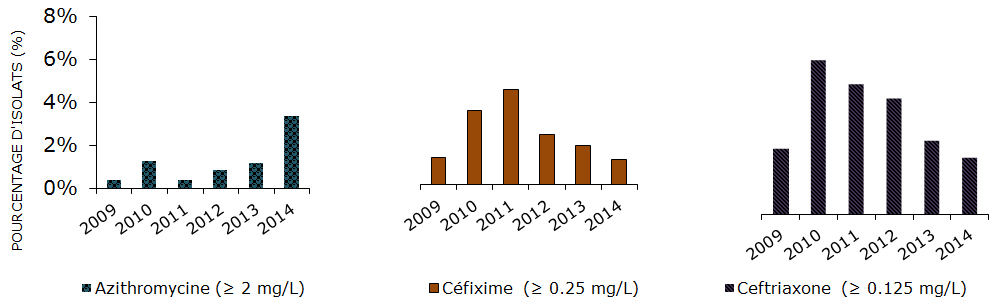
* Normes d’interprétation de la CMI : azithromycine (CDC, 2014); céfixime et ceftriaxoneNote de bas de page av.
Équivalent textuel
| 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|
| Azithromycine (≥ 2 mg/L) | 0,35% | 1,25% | 0,39% | 0,86% | 1,16% | 3,33% |
| Céfixime (≥ 0,25 mg/L) | 1,19% | 3,30% | 4,20% | 2,24% | 1,75% | 1,10% |
| Ceftriaxone (≥ 0,125 mg/L) | 3,12% | 7,34% | 6,20% | 5,53% | 3,51% | 2,68% |
Ce graphique à barres présente le pourcentage d’isolats de gonorrhée résistant à l'azithromycine, qui ont une sensibilité réduite à la céfixime ou une sensibilité réduite à la ceftriaxone (chacun représentés par ses propres barres) au Canada de 2009 à 2014. L'axe horizontal est représenté par l'agent antimicrobien (y compris le point d'arrêt) et l'année , tandis que l'axe vertical représente le pourcentage d'isolats .
Figure 24 : Pourcentage d’isolats de gonorrhée résistants aux antibiotiques, de 2004 à 2014
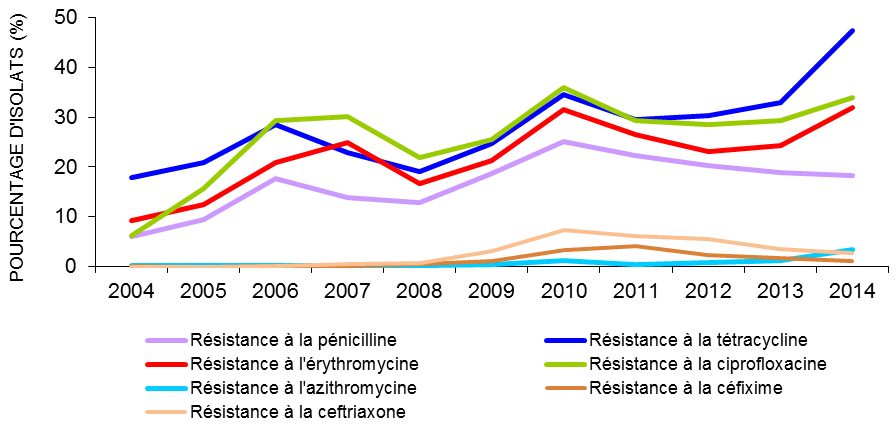
Équivalent textuel
| 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Résistance à Pénicilline | 6,02 | 9,42 | 17,59 | 13,94 | 12,8 | 18,7 | 25,05 | 22,2 | 20,26 | 18,94 | 18,22 |
| Résistance à Tétracycline | 17,79 | 20,92 | 28,59 | 22,88 | 19,09 | 24,7 | 34,61 | 29,4 | 30,3 | 32,99 | 47,34 |
| Résistance à Érythromycine | 9,28 | 12,54 | 20,92 | 24,89 | 16,7 | 21,3 | 31,52 | 26,6 | 23,12 | 24,32 | 32 |
| Résistance à Ciprofloxacine | 6,25 | 15,67 | 29,42 | 30,2 | 21,96 | 25,5 | 35,93 | 29,3 | 28,52 | 29,33 | 34,02 |
| Résistance à Azithromycine | 0,15 | 0,22 | 0,19 | 0,16 | 0,13 | 0,35 | 1,25 | 0,39 | 0,86 | 1,16 | 3,33 |
| Sensibilité diminuée à la Cefixime | 0,07 | 0 | 0,07 | 0,09 | 0,46 | 1,19 | 3,3 | 4,2 | 2,24 | 1,75 | 1,1 |
| Sensibilité diminuée à la Céftriaxone | 0 | 0 | 0,019 | 0,42 | 0,61 | 3,12 | 7,34 | 6,2 | 5,53 | 3,51 | 2,65 |
Le graphique représente le pourcentage d’isolats de gonorrhée qui sont résistants à différents antimicrobiens (chacun est représenté par sa propre ligne) au Canada à partir de 2004 jusqu’à 2014. L’axe horizontal représente l’année et l’axe vertical le pourcentage d’isolats.
Perspective internationale
La baisse de la proportion d’isolats présentant des CMI élevées à l’égard des céphalosporines qui a été observée au Canada a également été constatée aux États-Unis et au Royaume-Uni. Aux États-Unis, la proportion d’isolats présentant une sensibilité réduite au céfixime a diminué, passant de 1,4 % en 2011 à 0,4 % en 2013, tout comme la proportion d’isolats présentant une sensibilité réduite à la ceftriaxone, qui est passée de 0,4 % en 2011 à 0,05 % en 2013Note de bas de page aw. Le Royaume-Uni a indiqué que la proportion d’isolats présentant une sensibilité réduite au céfixime avait diminué, passant de 6,3 % en 2010 à 1,3 % en 2013, de même que la proportion d’isolats présentant une sensibilité réduite à la ceftriaxone, passée de 0,3 % en 2009 à 0,1 % en 2013Note de bas de page ax. Au Canada, les taux de résistance à l’azithromycine dans les isolats de N. gonorrhoeae étaient plus élevés qu’aux États-Unis (CMI ≥ 2 mg/L), où ils étaient compris entre 0,2 % et 0,6 % de 2009 à 2013, et qu’au Royaume-Uni (CMI ≥ 1 mg/L), où ils étaient de 1,6 % en 2013Note de bas de page ay,Note de bas de page az. L’Australie a fait état d’un taux de résistance à l’azithromycine de 2,1 % parmi ses isolats en 2013Note de bas de page ax.
Encadré 4 : Projet pilote sur la surveillance accrue de la résistance de la gonorrhée aux antimicrobiens (SARGA) Figure A : Traitement prescrit aux patients atteints d’infections anogénitales selon le comportement sexuel, dans le cadre du programme pilote de surveillance accrue de la résistance de la gonorrhée aux antimicrobiens, en 2014

* L’autre traitement consiste en une monothérapie ou un traitement d’association. Le traitement d’association peut inclure des médicaments acceptables en remplacement de l’azithromycine ou des antibiotiques recommandés comme traitement privilégié ou comme autres traitements, mais les renseignements posologiques n’étaient pas disponibles.
** Le traitement privilégié et les autres traitements pour les infections anogénitales varient entre les HARSAH et les autres adultes (p. ex. femmes, et hommes ayant des relations sexuelles exclusivement avec des femmes), mais ils comprennent les traitements suivants : ceftriaxone à 250 mg par voie intramusculaire plus azithromycine à 1 g par voie orale, céfixime à 800 mg par voie orale plus azithromycine à 1 g par voie orale, spectinomycine à 2 g par voie intramusculaire plus azithromycine à 1 g par voie orale, ou azithromycine à 2 g par voie orale.
Équivalent textuel
(n = 95)
(n = 117)
(n = 23)
(n = 11)
Traitement préférentiel/alternatif
Autre traitement
Aucune information de traitement
Salmonella typhique résistant aux médicaments
La fièvre entérique est causée par les sérotypes Typhi et Paratyphi de Salmonella.Il s’agit d’une maladie entérique fébrile caractérisée par de la fièvre, une éruption cutanée, une diarrhée (plus fréquente chez les enfants) ou une constipation (plus courante chez les adultes). Les enfants présentent généralement des symptômes plus légers que les adultes. Des manifestations systémiques graves peuvent également survenir (p. ex. myocardite). Pour 3 % des patients, il y a un risque d’hémorragie due à une perforation intestinaleNote de bas de page ay.
L’homme est le seul réservoir de la salmonellose typhique. L’infection se déclenche généralement suite à la consommation d’aliments ou d’eau ayant été contaminés par une personne malade ou par un porteur asymptomatique chroniqueNote de bas de page az. Au Canada, la fièvre entérique est dans la plupart des cas contractée en voyage, et la destination constitue le facteur de prédiction le plus fiable du risque de S. Typhi, les voyages en Asie du SudNote de bas de page 23 représentant le risque le plus élevé.
Le traitement empirique de première intention est une fluoroquinolone, la ciprofloxacine étant la plus couramment utiliséeNote de bas de page ba. Toutefois, pour décider du traitement empirique optimal, les profils de résistance aux antibiotiques observés dans les pays de destination doivent être pris en considérationNote de bas de page ay. Lorsqu’on soupçonne une résistance aux fluoroquinolones, les céphalosporines de troisième génération injectables constituent le traitement empirique privilégié. L’azithromycine est de plus en plus utilisée pour traiter la fièvre entérique en raison de l’émergence de souches multirésistantesNote de bas de page ba.
Méthodologie
Les laboratoires provinciaux de santé publique soumettent tous les isolats de Salmonella Typhi, Paratyphi A et Paratyphi B au LNM aux fins de tests de sensibilité aux antimicrobiens, accompagnés de renseignements sur l’âge et le sexe du patient ainsi que sur le siège anatomique de l’infection. Le Yukon, les Territoires du Nord-Ouest et le Nunavut transmettent leurs isolats à l’un des laboratoires provinciaux. Les laboratoires soumettent des isolats dans le cadre du Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA). Les tests de sensibilité aux antimicrobiens ont été effectués, dans la mesure du possible, à l’aide de la technique de microdilution en milieu liquide et des points de cassure établis par le Clinical Laboratory Standards Institute. Les antimicrobiens de la plaque de sensibilité comprennent : l’amoxicilline-acide clavulanique, le ceftiofur, la ceftriaxone, la ciprofloxacine, l’ampicilline, l’azithromycine, la céfoxitine, la gentamicine, la kanamycine, l’acide nalidixique, la streptomycine, le triméthoprime-sulfaméthoxazole, le chloramphénicol, le sulfisoxazole et la tétracycline.
Salmonella Typhi résistant aux médicaments au Canada
Au Canada, le taux de salmonellose typhique est passé d’un niveau plancher de 0,5 cas pour 100 000 habitants en 2003 à un plafond de 0,7 cas pour 100 000 habitants en 2008. Entre 2009 et 2011, les taux d’infection à S. Typhi étaient très faibles au Canada, entre 0,39 et 0,53 cas pour 100 000 habitants, respectivementNote de bas de page bb. En 2014, au total, 184 isolats typhiques ont été soumis à des épreuves de sensibilité aux antimicrobiens par le Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA), répartis comme suit : S. Typhi (n = 148), S. Paratyphi A (n = 29) et S. Paratyphi B Note de bas de page 24 (n = 7). La majorité des isolats typhiques testés en 2014 provenaient de résidents de l’Ontario, de la Colombie-Britannique et de l’Alberta.
La résistance aux antimicrobiens de Salmonella (sérotypes typhiques et non typhiques) est suivie par le PICRA depuis 2002. Comme les années précédentes, la majorité des isolats typhiques (82 %) étaient résistants à l’acide nalidixique (Figure 25). La résistance à la ciprofloxacine a nettement augmenté au Canada, passant de 0 % en 2003 à 17 % en 2013 et 14 % en 2014. Aucune résistance à la ceftriaxone ni à l’azithromycine n’a été observée en 2014. Au total, 18 % (33/184) des isolats étaient sensibles à tous les antimicrobiens testés, tandis que 16 % étaient multirésistants (résistance à au moins trois classes d’antimicrobiens).
Figure 25 : Tendances de la résistance aux antimicrobiens pour différents antimicrobiens testés sur les isolats de Salmonella typhique, de 2004 à 2014
Équivalent textuel
| Pourcentage d’isolats résistants | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ampicillin | 0,12 | 0,19 | 0,13 | 0,17 | 0,14 | 0,14 | 0,14 | 0,25 | 0,14 | 0,08 | 0,14 |
| Céftriaxone | 0,00 | 0,00 | 0,01 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| Gentamicine | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| Nalidixic acid | 0,64 | 0,73 | 0,81 | 0,76 | 0,70 | 0,77 | 0,81 | 0,84 | 0,86 | 0,75 | 0,82 |
| Streptomycine | 0,12 | 0,20 | 0,10 | 0,17 | 0,14 | 0,12 | 0,14 | 0,24 | 0,13 | 0,08 | 0,15 |
| Tétracycline | 0,11 | 0,19 | 0,08 | 0,11 | 0,06 | 0,05 | 0,03 | 0,03 | 0,00 | 0,05 | 0,01 |
| Triméthoprime-sulfaméthoxazole | 0,12 | 0,17 | 0,11 | 0,16 | 0,13 | 0,12 | 0,15 | 0,26 | 0,15 | 0,09 | 0,15 |
| Nombre total d’isolats | 168 | 191 | 230 | 201 | 251 | 214 | 211 | 210 | 174 | 177 | 184 |
Perspective internationale
En 2014, l’Organisation mondiale de la santé (OMS) a estimé qu’environ 21 millions de cas d’infection à S. Typhi, associés à 222 000 décès, se produisent chaque année dans le monde entierNote de bas de page bc. Près de 90 % de ces décès surviennent en Asie. On estime que le taux annuel d’incidence des cas confirmés par hémoculture dans les bidonvilles urbains en Asie est compris entre 180 et 494 cas pour 100 000 habitants chez les enfants de 5 à 15 ans et que les taux sont semblables ou plus élevés chez les enfants de moins de cinq ans dans ces zonesNote de bas de page bd. La résistance à l’acide nalidixique et la sensibilité réduite à la ciprofloxacine sont en train de devenir endémiques dans le sous-continent indien et en Asie du Sud-EstNote de bas de page be.
Aux États-Unis, environ 300 cas d’infection à S. Typhi et 100 cas d’infection à S. Paratyphi confirmés par hémoculture sont recensés chaque année. Comme cela a été observé au Canada, la grande majorité des cas (plus de 80 % pour S. Typhi et plus de 90 % pour S. Paratyphi A) survient parmi les personnes ayant voyagé en Asie du Sud. À l’inverse, le risque d’infection à S. Typhi a diminué dans certains pays de destination. Par conséquent, les CDC ont supprimé les recommandations relatives à la vaccination antityphoïdique avant les voyages en Europe de l’Est et au Moyen-OrientNote de bas de page ba. Les CDC ont déclaré que la résistance de S. Typhi constitue une menace sérieuse. La résistance à la ciprofloxacine a nettement augmenté aux États-Unis, passant de 20 % en 1999 à plus de 70 % en 2011. Entre 2009 et 2011, environ 67 % des infections à S. Typhi étaient résistantes ou partiellement résistantes à la ciprofloxacine. En revanche, les CDC ont indiqué que, jusqu’en 2013, aucune résistance à l’azithromycine ni à la ceftriaxone n’a été observée aux États-Unis pour S. TyphiNote de bas de page bf.
Salmonella non-typhique résistant aux médicaments
Méthodologie
Les laboratoires provinciaux de santé publique soumettent tous les isolats de Salmonella Typhi, Paratyphi A et Paratyphi B au LNM aux fins de tests de sensibilité aux antimicrobiens, accompagnés de renseignements sur l’âge et le sexe du patient ainsi que sur le siège anatomique de l’infection. Le Yukon, les Territoires du Nord-Ouest et le Nunavut transmettent leurs isolats à l’un des laboratoires provinciaux. Les laboratoires soumettent des isolats dans le cadre du Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA).
Les tests de sensibilité aux antimicrobiens ont été effectués, dans la mesure du possible, à l’aide de la technique de microdilution en milieu liquide et des points de cassure établis par le Clinical Laboratory Standards Institute. Les antimicrobiens de la plaque de sensibilité comprennent : l’amoxicilline-acide clavulanique, le ceftiofur, la ceftriaxone, la ciprofloxacine, l’ampicilline, l’azithromycine, la céfoxitine, la gentamicine, la kanamycine, l’acide nalidixique, la streptomycine, le triméthoprime-sulfaméthoxazole, le chloramphénicol, le sulfisoxazole et la tétracycline.
Salmonella non-typhique résistant aux médicaments au Canada
En 2014, au total, 2 496 isolats humains de Salmonella non typhique ont été soumis à l’Agence aux fins d’épreuves de sensibilité aux antimicrobiens; la majorité provenait de l’Ontario (35 %), puis du Québec (17 %), de la Colombie-Britannique (11 %) et de l’Alberta (11 %). Salmonella Enteritidis était le plus courant des sérotypes associés aux infections humaines soumis pour les tests de sensibilité, suivi par S. Heidelberg et S. Typhimurium.
Les isolats de Salmonella ont été obtenus en majorité à partir d’échantillons de selles (83 %), puis de sang (5 %) et d’urine (4 %) (Tableau 3).
| Source de l’échantillon | S. Enteritidis | S. Heidelberg | S. 4,[5],12:i:- | S. Newport | S. Typhimurium | Autres sérotypes |
|---|---|---|---|---|---|---|
| Sang | 59 | 42 | 4 | 6 | 10 | 7 |
| Selles | 1013 | 267 | 128 | 173 | 308 | 184 |
| Urine | 29 | 27 | 2 | 10 | 10 | 20 |
| Autres | 11 | 4 | 1 | 0 | 1 | 2 |
| Inconnu | 106 | 22 | 3 | 12 | 27 | 8 |
| Total | 1218 | 362 | 138 | 201 | 356 | 221 |
En 2014, 75 % de l’ensemble des isolats humains de Salmonella non typhique étaient sensibles à tous les antimicrobiens testés, tandis que 7 % des isolats présentaient une résistance à trois classes d’antimicrobiens ou plus (multirésistance) (Tableau 4). L’ampicilline était l’antimicrobien auquel la plus grande proportion des isolats était résistante (8 %), suivie par la tétracycline (7 %), la streptomycine (6 %) et la gentamicine (6 %). Aucune résistance à l’azithromycine n’a été observée en 2014 et seulement 1 % des isolats étaient résistants à la ciprofloxacine, ces deux antimicrobiens étant utilisés dans le traitement des infections graves chez les humains. Au fil du temps, la résistance à la plupart des antimicrobiens a diminué depuis 2004 (Figure 26), à l’exception de la résistance à l’acide nalidixique qui a presque doublé entre 2013 (5 %) et 2014 (9 %). La plupart des isolats humains résistants à l’acide nalidixique sont de type Salmonella Enteritidis, et l’augmentation de la résistance à cet antimicrobien est probablement attribuable au grand nombre de cas de S. Enteritidis observés en 2014.
| Antimicrobiens | Humain (%) | Poulets (%) | Porcs (%) |
|---|---|---|---|
| Clinique | Chaîne alimentaire | Chaîne alimentaire | |
| Amoxicilline- acide clavulanique | 5 | 17 | 3 |
| Ampicilline | 13 | 17 | 31 |
| Azithromycine | 0 | 0 | 2 |
| Céfoxitine | 5 | 16 | 3 |
| Ceftiofur | 6 | 16 | 3 |
| Ceftriaxone | 6 | 17 | 4 |
| Chloramphénicol | 4 | 0 | 14 |
| Ciprofloxacine | 1 | 0 | 0 |
| Gentamicine | 1 | 2 | 2 |
| Acide nalidixique | 9 | 0 | 0 |
| Streptomycine | 9 | 26 | 42 |
| Sulfisoxazole | 0 | 7 | 44 |
| Tétracycline | 10 | 30 | 62 |
| Triméthoprime- sulfaméthoxazole | 2 | 0 | 6 |
| Complètement sensibles | 75 | 56 | 33 |
| Résistant à multiples classes | 7 | 6 | 44 |
| Nombre d’isolats | 2497 | 694 | 325 |
| Enteritidis | 49 | 24 | 0 |
| Heidelberg | 15 | 18 | 0 |
| Kentucky | 0 | 24 | 1 |
| Typhimurium | 14 | 3 | 22 |
| Autres | 22 | 30 | 77 |
Figure 26 : Résistance à certains antimicrobiens dans les isolats humains de Salmonella spp. non typhique au Canada, de 2003 à 2014
Équivalent textuel
| Pourcentage d’isolats résistants | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ampicilline | 0,21 | 0,20 | 0,20 | 0,15 | 0,10 | 0,10 | 0,11 | 0,14 | 0,15 | 0,13 | 0,14 | 0,13 |
| Céftriaxone | 0,06 | 0,08 | 0,06 | 0,04 | 0,02 | 0,02 | 0,03 | 0,05 | 0,07 | 0,06 | 0,06 | 0,06 |
| Gentamicine | 0,02 | 0,02 | 0,01 | 0,01 | 0,01 | 0,02 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 |
| Acide nalidixique | 0,05 | 0,07 | 0,04 | 0,08 | 0,07 | 0,07 | 0,06 | 0,05 | 0,08 | 0,06 | 0,05 | 0,09 |
| Streptomycine | 0,16 | 0,14 | 0,15 | 0,13 | 0,10 | 0,10 | 0,09 | 0,10 | 0,09 | 0,09 | 0,12 | 0,09 |
| Tétracycline | 0,22 | 0,20 | 0,19 | 0,16 | 0,15 | 0,13 | 0,11 | 0,12 | 0,11 | 0,11 | 0,14 | 0,10 |
| Triméthoprime-sulfaméthoxazole | 0,03 | 0,03 | 0,03 | 0,04 | 0,02 | 0,02 | 0,02 | 0,03 | 0,03 | 0,03 | 0,03 | 0,02 |
| Nombre total d’isolats | 2 887 | 2 964 | 2 967 | 2 975 | 3 103 | 3 350 | 3 180 | 2 785 | 2 435 | 3 363 | 2 987 | 2 496 |
Perspective internationale
Aux États-Unis, les CDC ont indiqué avoir observé une résistance à la ceftriaxone dans environ 3 % des isolats testés de Salmonella non typhique, ainsi qu’un certain degré de résistance à la ciprofloxacine dans environ 3 % des isolats. Une multirésistance (résistance à plus de cinq classes d’antimicrobiens) a été constatée dans environ 5 % des isolats de Salmonella non typhique testés par les CDCNote de bas de page i.
Encadré 5 : Multirésistance de Salmonella 4,[5],12:i:- chez les humains et le long de la chaîne alimentaire au Canada
| Humain | Porcs | ||||
|---|---|---|---|---|---|
| Clinique | Ferme | Abattoir | Détail | Clinique | |
| Complètement sensible (%) | 28 | 6 | 50 | 0 | 4 |
| ASSuT+ motif (%) | 37 | 63 | 50 | 0 | 74 |
| Nombre d’isolats testés | 138 | 16 | 2 | 1 | 50 |
Tuberculose résistante aux médicaments
La tuberculose est une maladie infectieuse causée par Mycobacterium tuberculosis, qui touche principalement les poumons mais peut également affecter n’importe quelle autre partie de l’organisme. Elle se transmet par l’inhalation de noyaux de condensation infectieux transmis par voie aérienne produits par une personne atteinte de tuberculose pulmonaire et/ou laryngienne infectieuse lorsque celle-ci tousse, éternue, parle ou crache. Bien que la dose infectieuse soit très faible, puisqu’elle varie entre un et dix bacilles, une exposition prolongée est généralement nécessaire avant qu’une personne vulnérable devienne infectée. Les adolescents et les adultes sont les plus susceptibles de transmettre l’infection tuberculeuse, même si les jeunes enfants peuvent parfois être infectieuxNote de bas de page bj.
On dit que les personnes auxquelles on a diagnostiqué une tuberculose active présentent une tuberculose pharmacorésistante si la souche de tuberculose responsable de leur maladie est résistante à un ou plusieurs des quatre antituberculeux majeurs. Les profils de résistance suivants sont préoccupants : la « monorésistance » – définie comme une résistance à un seul antituberculeux majeur (isoniazide, rifampicine, éthambutol ou pyrazinamide); la « polyrésistance (autres profils) » – définie comme une résistance à plus d’un antituberculeux majeur, à l’exclusion de la résistance à la fois à l’isoniazide et à la rifampicine; la « tuberculose multirésistante (TB-MR) » – définie comme une résistance à l’isoniazide et à la rifampicine avec ou sans résistance à d’autres antituberculeux; et la « tuberculose ultrarésistante (TB-UR) » – définie comme une résistance à l’isonicotinylhydrazide (INH), rifampicine (RMP) ainsi qu’à toute fluoroquinolone et à au moins un des trois antituberculeux mineurs injectables (amikacine, capréomycine ou kanamycine).
La tuberculose représente un problème de santé publique majeur qui touche des millions de personnes dans le monde entier, principalement dans les pays à faible revenu et à revenu intermédiaireNote de bas de page bk. Elle demeure toutefois une menace sanitaire persistante dans les pays à revenu élevé, en particulier dans les catégories les plus démunies et les plus vulnérables de la populationNote de bas de page bl. À l’échelle mondiale, la prescription inadéquate d’antituberculeux, la prescription d’antituberculeux adéquats mais non disponibles, la supervision inadéquate et, plus rarement, la malabsorption des antituberculeux ont augmenté la prévalence de la tuberculose multirésistanteNote de bas de page bj.
Méthodologie
L’Agence de la santé publique du Canada (ASPC) recueille des renseignements sur la tuberculose au Canada par l’entremise du Système canadien de surveillance des laboratoires de tuberculose (SCSLT) et le Système canadien de déclaration des cas de tuberculose (SCDCT). Le SCSLT est un système de surveillance basé sur les isolats qui vise à recueillir des données opportunes sur la résistance aux antituberculeux dans tout le Canada. Au nombre des laboratoires participants figurent les membres du Réseau technique canadien des laboratoires de tuberculose (RTCLT), qui représentent toutes les provinces et tous les territoires. Les laboratoires participants soumettent les résultats des épreuves de sensibilité à tous les antituberculeux majeurs (isoniazide, éthambutol, rifampicine et pyrazinamide) et les résultats pour au moins une des fluoroquinolones (lévofloxacine, moxifloxacine ou ofloxacine, moxifloxacine) et pour les agents injectables (amikacine, capréomycine et kanamycine). Le SCDCT est un système de surveillance fondé sur les cas qui tient à jour des données sur les personnes diagnostiquées comme porteuses d’une tuberculose active. Les autorités de santé publique provinciales et territoriales soumettent volontairement les données sur les nouveaux cas et les cas de retraitement qui répondent à la définition des cas pour le Canada. On dit que les personnes auxquelles on a diagnostiqué une tuberculose active présentent une tuberculose pharmacorésistante si la souche de tuberculose responsable de leur maladie est résistante à un ou plusieurs des quatre antituberculeux majeurs.
Tuberculose résistante aux médicaments au Canada
Le Canada présente l’un des taux de tuberculose les plus faibles au mondeNote de bas de page bk. De 2004 à 2014, le nombre de cas de tuberculose déclarés et les taux globaux d’incidence au Canada sont restés relativement stables (Figure 27). Au total, entre 2004 et 2014, 17 902 cas de tuberculose active ont été signalés au Système canadien de déclaration des cas de tuberculose (SCDCT), pour une moyenne de 1 627 cas déclarés par an. Au cours de la même période, le taux d’incidence est resté relativement stable, entre 4,4 et 5,0 cas pour 100 000 habitants.
Entre 2004 et 2014, 80 % (14 338) de l’ensemble des cas de tuberculose déclarés étaient des cas à culture positive. Parmi ces cas, 98 % (14 047) ont été soumis à des tests de résistance. Neuf pourcent (9 %, 1 268) des cas à culture positive étaient résistants à au moins un des antituberculeux majeurs. La résistance à l’isoniazide était le profil de résistance à un antituberculeux majeur le plus couramment observé (Figure 27).
Figure 27 : Pourcentage des cas de tuberculose à culture positive résistants à chacun des quatre antituberculeux majeurs, de 2004 à 2014
Équivalent textuel
| 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| % Résistance INH | 7,3 | 8,8 | 7,3 | 8,1 | 7,3 | 8,6 | 7,7 | 8,5 | 7,8 | 6,8 | 7,1 |
| % Résistance RMP | 0,8 | 2,3 | 1,3 | 1,0 | 1,2 | 1,5 | 1,1 | 1,3 | 0,7 | 1,3 | 1,6 |
| % Résistance EMB | 1,0 | 1,9 | 1,1 | 1,6 | 1,0 | 1,2 | 1,0 | 0,7 | 0,4 | 0,8 | 0,7 |
| % Résistance PZA | 1,2 | 2,6 | 1,1 | 0,6 | 1,2 | 1,3 | 2,3 | 1,8 | 2,1 | 2,0 | 2,9 |
Entre 2004 et 2014, parmi les cas à culture positive soumis à des tests de résistance (n = 14 047), 8 % des (n = 1 070) étaient monorésistants, 0,5 % (n = 60) des cas étaient polyrésistants, 1 % (n = 150) des cas étaient multirésistants et moins de 0,1 % (n = 5) des cas étaient ultrarésistants (Figure 28). Le pourcentage de cas atteints de tuberculose multirésistante est resté compris entre 1 % et 2 % sur la période de 2004 à 2014 (Figure 28).
Figure 28 : Pourcentage des cas de tuberculose à culture positive par profil de résistance, de 2004 à 2014
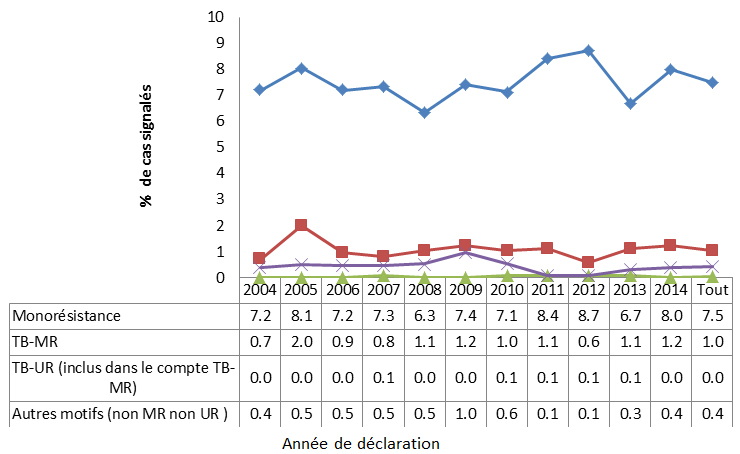
Équivalent textuel
| 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | ALL | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Monorésistance | 7,2 | 8,1 | 7,2 | 7,3 | 6,3 | 7,4 | 7,1 | 8,4 | 8,7 | 6,7 | 8,0 | 7,5 |
| TB-MR | 0,7 | 2,0 | 0,9 | 0,8 | 1,1 | 1,2 | 1,0 | 1,1 | 0,6 | 1,1 | 1,2 | 1,0 |
| TB (inclus dans le compte TB-MR) | 0,0 | 0,0 | 0,0 | 0,1 | 0,0 | 0,0 | 0,1 | 0,1 | 0,1 | 0,1 | 0,0 | 0,0 |
| Autres motifs (non MR non UR) | 0,4 | 0,5 | 0,5 | 0,5 | 0,5 | 1,0 | 0,6 | 0,1 | 0,1 | 0,3 | 0,4 | 0,4 |
Le graphique à ligne présente le pourcentage d'isolats de tuberculose qui démontrent différents types de résistance (chacun représenté par sa propre ligne) au Canada de 2004 à 2014. L’axe horizontal représente l'année et l’axe vertical le pourcentage d’isolats.
Répartition géographiqueNote de bas de page 25
Les données du Système canadien de surveillance des laboratoires de tuberculose (SCSLT) montrent que toutes les provinces et tous les territoires du Canada ont déclaré au moins un cas de tuberculose multirésistante entre 2004 et 2014Note de bas de page bm. De plus, l’Alberta, la Colombie-Britannique, le Manitoba, l’Ontario et le Québec ont tous signalé des cas de tuberculose multirésistante. Parmi les cinq cas de tuberculose ultrarésistante recensés entre 2004 et 2014, trois ont été déclarés en Ontario, un au Manitoba et un au Québec.
Entre 2004 et 2014, parmi les cas déclarés de tuberculose multirésistante (c.-à-d. résistante à au moins un des antimicrobiens majeurs), 46 % (n = 585) étaient des femmes et 54 % (n = 683) étaient des hommes. La tuberculose était résistante à au moins un des antituberculeux majeurs chez 10 % des femmes et 9 % des hommes testés. Chez les hommes aussi bien que chez les femmes, 1 % des cas testés présentaient une tuberculose résistante à la fois à l’isoniazide et à la rifampicine. Parmi les cas de tuberculose ultrarésistante, quatre cas sur cinq étaient des femmes. Pour l’ensemble des cas, la majorité, soit 42 % (n = 541), avait entre 25 et 44 ans.
Au total, 2 % (n = 69) des cas autochtones nés au Canada, 9 % (n = 141) des cas non autochtones nés au Canada et 11 % (n = 1 047) des cas nés à l’étranger présentaient une résistance à au moins un des antimicrobiens majeurs (Figure 29). Les personnes nées à l’étranger représentaient 83 % (n = 1 047) de tous les cas résistants, 97 % (n = 145) des cas de tuberculose multirésistante et quatre des cinq cas de tuberculose ultrarésistante.
Figure 29 : Pourcentage de tous les cas de tuberculose par type de multirésistance et par origine, de 2004 à 2014
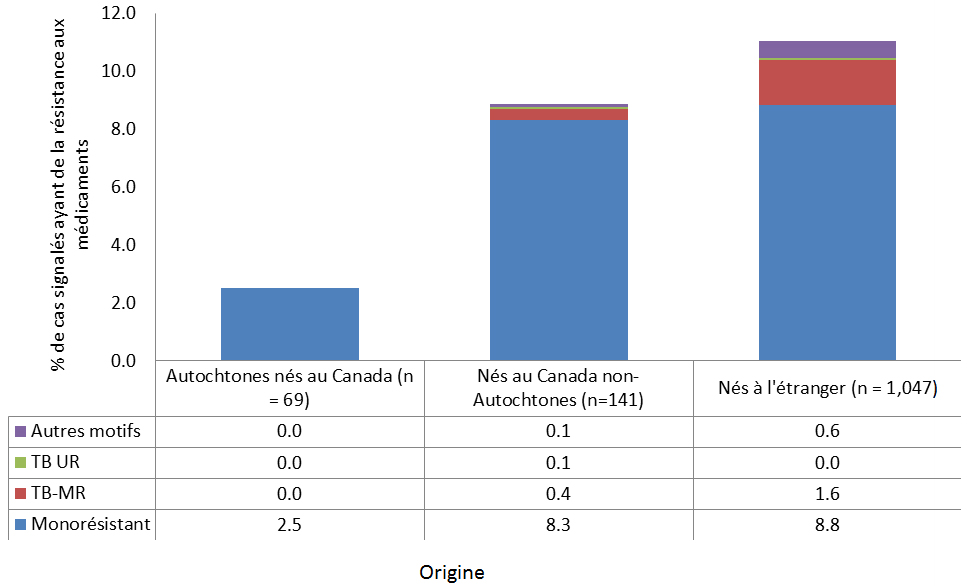
Équivalent textuel
| Autochtones nés au Canada (n = 69) | Nés au Canada non-Autochtones (n=141) | Né à l’étrangers (n = 1,047) | |
|---|---|---|---|
| Monorésistant | 2,5 | 8,3 | 8,8 |
| TB-MR | 0,0 | 0,4 | 1,6 |
| TB-UR | 0,0 | 0,1 | 0,0 |
| Autres motifs | 0,0 | 0,1 | 0,6 |
Parmi les personnes nées à l’étranger, les cas de tuberculose multirésistante sont apparus plus tôt après l’arrivée au Canada que les cas de tuberculose sensible aux antituberculeux (Figure 30). Parmi les cas sensibles aux antituberculeux pour lesquels l’année d’arrivée était indiquée (n = 7 517), 42 % étaient arrivés au Canada dans les cinq années précédant le diagnostic de tuberculose, comparativement à 60 % des cas de tuberculose multirésistante (n = 144).
Figure 30 : Temps écoulé entre l’arrivée au Canada et le diagnostic pour les cas de tuberculose à culture positive nés à l’étranger, selon le profil de sensibilité aux médicaments
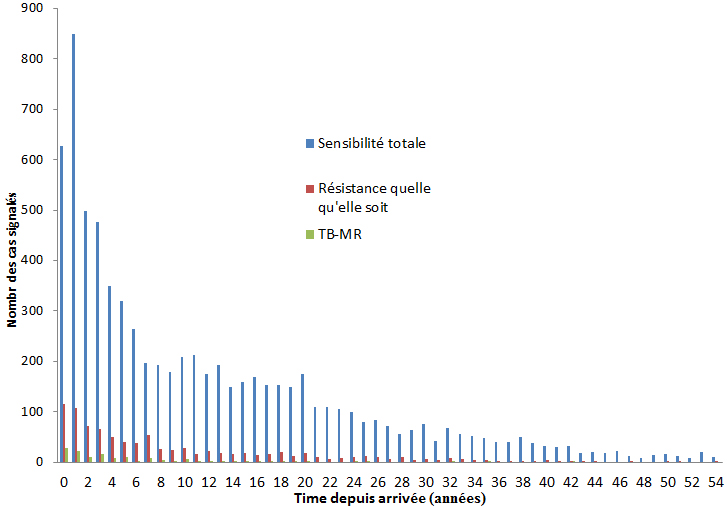
Équivalent textuel
| Temps depuis arrivée (années) | Une sensibilité totale | Une résistance | TB-MR |
|---|---|---|---|
| 0 | 627 | 115 | 28 |
| 1 | 848 | 108 | 23 |
| 2 | 499 | 72 | 11 |
| 3 | 477 | 65 | 17 |
| 4 | 350 | 50 | 8 |
| 5 | 319 | 41 | 11 |
| 6 | 265 | 38 | 2 |
| 7 | 197 | 53 | 9 |
| 8 | 193 | 27 | 4 |
| 9 | 178 | 24 | 2 |
| 10 | 208 | 29 | 6 |
| 11 | 212 | 16 | 2 |
| 12 | 174 | 23 | 2 |
| 13 | 193 | 18 | 1 |
| 14 | 149 | 17 | 2 |
| 15 | 159 | 19 | 1 |
| 16 | 168 | 14 | 2 |
| 17 | 154 | 16 | 1 |
| 18 | 154 | 20 | 1 |
| 19 | 149 | 13 | 2 |
| 20 | 175 | 18 | 2 |
| 21 | 109 | 10 | 0 |
| 22 | 110 | 7 | 0 |
| 23 | 106 | 9 | 0 |
| 24 | 100 | 11 | 2 |
| 25 | 79 | 12 | 2 |
| 26 | 83 | 11 | 0 |
| 27 | 72 | 7 | 0 |
| 28 | 56 | 10 | 0 |
| 29 | 63 | 4 | 0 |
| 30 | 75 | 7 | 0 |
| 31 | 43 | 5 | 0 |
| 32 | 68 | 8 | 1 |
| 33 | 56 | 7 | 0 |
| 34 | 52 | 4 | 0 |
| 35 | 47 | 5 | 1 |
| 36 | 40 | 2 | 0 |
| 37 | 40 | 1 | 0 |
| 38 | 50 | 1 | 0 |
| 39 | 38 | 1 | 0 |
| 40 | 32 | 4 | 0 |
| 41 | 30 | 1 | 0 |
| 42 | 33 | 1 | 1 |
| 43 | 18 | 3 | 0 |
| 44 | 21 | 2 | 0 |
| 45 | 19 | 0 | 0 |
| 46 | 22 | 0 | 0 |
| 47 | 13 | 1 | 0 |
| 48 | 9 | 0 | 0 |
| 49 | 15 | 0 | 0 |
| 50 | 17 | 2 | 0 |
| 51 | 12 | 3 | 0 |
| 52 | 9 | 0 | 0 |
| 53 | 20 | 0 | 0 |
| 54 | 11 | 1 | 0 |
L’histogramme groupée représente le temps depuis l’arrivée au Canada pour un diagnostic positif de tuberculose venant de l’étranger par type de résistance (chacun représenté par sa propre barre). L’axe horizontal représente le nombre d’années depuis l’arrivée au Canada et l’axe vertical représente le nombre de cas rapportés.
Entre 2004 et 2014, la tuberculose multirésistante a été observée légèrement plus souvent chez les cas ayant des antécédents de tuberculose (cas de retraitement) que chez ceux n’ayant aucun antécédent de la maladie (nouveaux cas). Sur les 12 901 nouveaux cas de tuberculose active signalés, 0,9 % (n = 114) étaient multirésistants, alors que sur les 907 cas de retraitement, 3,8 % (n = 35) présentaient une tuberculose multirésistante. Cet écart entre les proportions est significatif (χ² = 70,27, p < 0,001).
Étant donné que les cas de tuberculose ne sont pas systématiquement testés pour la résistance aux fluoroquinolones (lévofloxacine, moxifloxacine et ofloxacine) ou aux agents injectables (amikacine, kanamycine et capréomycine) au Canada, l’épidémiologie de la résistance aux antituberculeux mineurs n’est pas clairement décrite. Les tests sont généralement envisagés lorsqu’une résistance à l’isoniazide et à la rifampicine a été établie. Cela dit, sur les 155 cas résistants à la fois à l’isoniazide et à la rifampicine, 142 ont fait l’objet de tests de résistance à au moins une fluoroquinolone et à un des agents injectables. Sur ces 142 cas, 10 % (n = 15) étaient également résistants à une fluoroquinolone et 13 % à au moins un des trois agents injectables.
Le résultat final du traitement a été évalué pour les cas diagnostiqués entre 2006 et 2013. Parmi ces cas (n = 10 525), le résultat du traitement était indiqué pour 92 % (n = 9 730) des cas. Parmi ceux-ci, 84 % des cas sensibles aux quatre antituberculeux majeurs, 83 % des cas monorésistants et 79 % des cas de tuberculose multirésistante ont été déclarés guéris ou ont terminé le traitement. Au moment où les données sur le résultat ont été transmises à l’ASPC, 3 % des cas présentant une sensibilité totale étaient toujours sous traitement, tandis que 11 % des cas de tuberculose multirésistante étaient toujours sous traitement. Le décès a été indiqué comme résultat final pour 10 % des cas présentant une sensibilité totale et pour 4 % des cas de tuberculose multirésistante.
La durée du traitement variait en fonction du profil de multirésistance détecté. Pour les cas présentant une sensibilité totale (n = 7 332), la durée moyenne du traitement était de 8,7 mois (niveau de confiance à 95 % : de 8,6 à 8,8 mois). Pour les cas présentant une résistance, quelle qu’elle soit, à l’exception des cas de tuberculose multirésistante (n = 588), la durée du traitement était de 10,8 mois (niveau de confiance à 95 % : de 10,5 à 11,1 mois). Enfin, chez les cas résistants à l’isoniazide et à la rifampicine pour lesquels les données sur le résultat étaient disponibles (n = 72), la durée moyenne du traitement était de 23 mois (niveau de confiance à 95 % : de 21 à 24 mois).
Perspective internationale
L’OMS estime qu’à l’échelle mondiale, en 2014, 9,6 millions de personnes ont contracté la tuberculose et 1,5 million d’entre elles sont décédées. D’après les estimations, 480 000 personnes étaient atteintes de tuberculose multirésistante et 9,7 % de celles-ci présentaient une tuberculose ultrarésistante. Il est estimé que 3,3 % des nouveaux cas et 20 % des cas déjà traités auparavant étaient atteints de tuberculose multirésistante. Ces estimations sont restées inchangées par rapport à celles annoncées en 2012. À l’échelle mondiale, en 2014, parmi les personnes auxquelles on a diagnostiqué une tuberculose multirésistante ou résistante à la rifampicine, 75 % vivaient dans la région européenne, en Inde, en Afrique du Sud ou en ChineNote de bas de page bk.
En 2014, le taux d’incidence de la tuberculose déclaré aux États-Unis était de 3,4 cas pour 100 000 habitants, ce qui était inférieur au taux canadien pour la même annéeNote de bas de page bn. Entre 2004 et 2014, aux États-Unis, on a diagnostiqué une tuberculose multirésistante chez 1 % de tous les nouveaux cas déclarés et chez 5 % des cas de retraitement. Ces pourcentages sont comparables aux proportions observées au Canada. De 2009 à 2014, 15 cas de tuberculose ultrarésistante ont été recensés aux États-Unis, ce qui représentait moins de 0,1 % de l’ensemble des cas à culture positive déclarés au cours de cette période. Cette proportion est également semblable à celle observée au Canada, où moins de 0,1 % (n = 5) des cas déclarés entre 2004 et 2014 étaient ultrarésistantsNote de bas de page bo.
Le fardeau de la tuberculose au Canada chez les personnes nées à l’étranger est représentatif des tendances de la tuberculose à l’échelle mondiale. Entre 2004 et 2014, on a recensé 17 902 cas de tuberculose active au Canada, dont 67 % (n = 11 942) étaient nés à l’étranger. Parmi tous les cas nés à l’étranger, 46 % étaient originaires de trois pays, la Chine, l’Inde et les Philippines, qui font partie des pays considérés par l’Organisation mondiale de la Santé comme des pays à forte charge de tuberculose. Les autres cas étaient originaires de plus de 180 pays différents. Parmi les cas déclarés de tuberculose multirésistante, 96 % (n = 149) étaient nés à l’étranger et 56 % (n = 84) étaient nés aux Philippines (n = 26), en Chine (n = 22), en Inde (n = 20) et au Vietnam (n = 16)Note de bas de page bp.
Encadré 6 : Projet pilote de surveillance communautaire de la résistance aux antimicrobiens
Résistance dans les bactéries d'origine alimentaire
Le Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA) surveille la résistance aux antimicrobiens de trois bactéries zoonotiques : Escherichia coli générique, Campylobacter et Salmonella. La contamination des animaux et des produits animaux par des bactéries résistantes aux antimicrobiens a été identifiée comme une source d’infection humaine causée par des organismes résistants et ces organismes sont une cause fréquente de poussées d’origine alimentaire.
La plupart des personnes infectées par les bactéries des espèces E. coli, Salmonella et Campylobacter souffriront de diarrhée, de fièvre et de crampes abdominales. Dans la plupart des cas, la maladie est résolutive et le traitement n’est pas nécessaire. Certaines personnes vulnérables, comme les personnes âgées, les très jeunes enfants et les personnes présentant un état pathologique sous-jacent, pourraient devoir être hospitalisées en cas de diarrhée aiguë. Les femmes enceintes présentent également un risque accru de complications liées à ces organismes. Certaines souches d’E. coli, telles que l’E. coli O157:H7 ou l’E. coli entérohémorragique (EHEC) peuvent causer une affection mettant en jeu le pronostic vital appelée « syndrome hémolytique et urémique (SHU) ». Les personnes présentant le SHU peuvent souffrir de lésions rénales permanentes et éventuellement perdre la vie.
Méthodologie
Le Programme intégré canadien de surveillance de la résistance aux antimicrobiens (PICRA) surveille la résistance aux antimicrobiens de trois bactéries zoonotiques : Escherichia coli générique, Campylobacter et Salmonella. Des échantillons sont prélevés à trois stades de la chaîne alimentaire : 1) chez des animaux sains à la ferme, 2) chez des animaux sains à l’abattoir et 3) dans la viande vendue dans les magasins d’alimentation au détail. Dans le cadre du PICRA, l’échantillonnage se concentre sur les trois types de viande les plus consommés au Canada, à savoir le poulet, le porc et le bœuf. Le tableau 5 indique quelles bactéries zoonotiques ont été isolées dans quelles espèces animales le long de la chaîne alimentaire en 2014. En outre, des isolats cliniques de Salmonella humains et animaux ont également été soumis à des tests de résistance aux antimicrobiens.
| Ferme | Abattoir | Viande au détail | |
|---|---|---|---|
| Poulets | E. coli Campylobacter Salmonella |
E. coli Campylobacter Salmonella |
E. coli Campylobacter Salmonella |
| Porcs | E. coli Salmonella |
E. coli Campylobacter Salmonella |
E. coli |
| Bovins | S.O. | E. coli Campylobacter |
E. coli |
Eschericia coli (E. coli) générique
Poulets
Les bactéries E. coli génériques sont présentes partout, puisqu’elles résident dans le tractus gastrointestinal des animaux et des humains; par conséquent, elles constituent un bon indicateur de la pression de sélection de la résistance aux antimicrobiens. En 2014, au total, 1 294 échantillons provenant de poulets ont fait l’objet d’un isolement bactérien et été soumis à des épreuves de sensibilité aux antimicrobiens. Bien que le nombre total d’échantillons soumis aux tests de dépistage bactérien ait augmenté au fil du temps (Tableau 6), la proportion d’échantillons positifs pour E. coli générique est restée constante et, en 2014, 96 % des échantillons prélevés se sont avérés positifs.
| Année | Nombre d’isolats récupérés / Nombre d’échantillons soumis aux tests de dépistage | Pourcentage d’isolats récupérés |
|---|---|---|
| 2004 | 739/752 | 98% |
| 2005 | 914/934 | 98% |
| 2006 | 543/558 | 97% |
| 2007 | 612/636 | 96% |
| 2008 | 649/699 | 93% |
| 2009 | 799/836 | 96% |
| 2010 | 679/737 | 92% |
| 2011 | 714/752 | 95% |
| 2012 | 621/648 | 96% |
| 2013 | 963/1 003 | 96% |
| 2014 | 1 238/1 294 | 96% |
| Total | 8 471/8 849 | 96% |
En 2014, parmi les isolats d’E. coli obtenus à partir d’échantillons de poulets prélevés le long de la chaîne alimentaire, la plus forte proportion présentait une résistance à la tétracycline, avec la moitié des isolats, suivie par la résistance à l’ampicilline (43 %) et à la streptomycine (42 %) (Figure 31). La résistance à la ceftriaxone a diminué entre 2004 (31 %) et 2014 (21 %), tandis que la résistance à la gentamicine et au triméthoprime-sulfaméthoxazole a augmenté durant cette période, de 9 % à 18 % et de 9 % à 16 %, respectivement.
Figure 31 : Résistance à certains antimicrobiens parmi les isolats d’Escherichia coli générique à partir d’échantillons de poulets prélevés à la ferme (poulets à griller), à l’abattoir et dans les magasins d’alimentation au détail au Canada, de 2004 à 2014
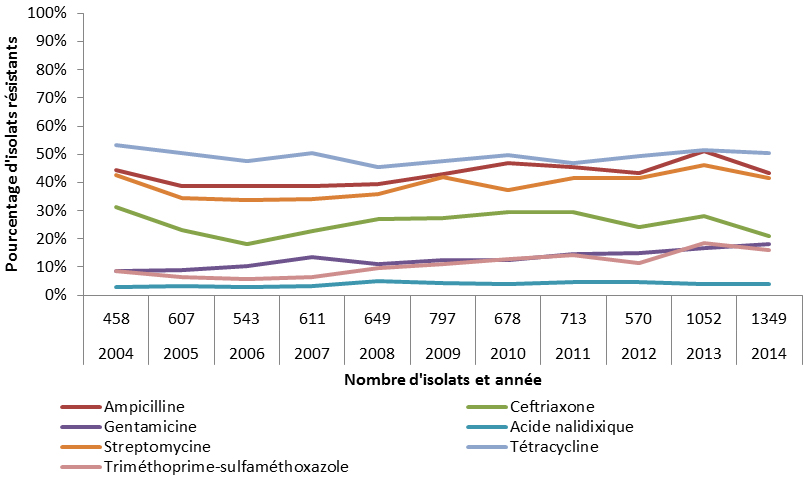
Équivalent textuel
| Pourcentage d’isolats résistants | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ampicilline | 0,45 | 0,39 | 0,389 | 0,39 | 0,39 | 0,43 | 0,47 | 0,46 | 0,43 | 0,51 | 0,43 |
| Céftriaxone | 0,31 | 0,23 | 0,18 | 0,23 | 0,27 | 0,27 | 0,30 | 0,29 | 0,24 | 0,28 | 0,21 |
| Gentamicine | 0,09 | 0,09 | 0,10 | 0,13 | 0,11 | 0,13 | 0,13 | 0,15 | 0,15 | 0,17 | 0,18 |
| Acide nalidixique | 0,03 | 0,03 | 0,03 | 0,03 | 0,05 | 0,04 | 0,04 | 0,05 | 0,05 | 0,04 | 0,04 |
| Streptomycine | 0,43 | 0,35 | 0,34 | 0,34 | 0,36 | 0,42 | 0,37 | 0,42 | 0,41 | 0,46 | 0,42 |
| Tétracycline | 0,53 | 0,51 | 0,48 | 0,50 | 0,46 | 0,48 | 0,50 | 0,47 | 0,49 | 0,52 | 0,50 |
| Triméthoprime-sulfaméthoxazole | 0,09 | 0,07 | 0,06 | 0,07 | 0,10 | 0,11 | 0,13 | 0,14 | 0,11 | 0,19 | 0,16 |
| Nombre total d’isolats | 458 | 607 | 543 | 611 | 649 | 797 | 678 | 713 | 570 | 1052 | 1349 |
Le graphique à lignes présente le pourcentage d’isolats d'Escherichia coli générique qui sont résistants à l'ampicilline, la ceftriaxone, la gentamicine, l'acide nalidixique, la streptomycine, la tétracycline ou le triméthoprime -sulfaméthoxazole (chacun représenté par sa propre ligne) parmi les échantillons de poulet au Canada de 2004 à 2014. L'axe horizontal représente l'année et le nombre total d'isolats testés, tandis que l'axe vertical représente le pourcentage d'isolats résistants.
En 2014, toutes les provinces et régions participant au programme des fermes d’élevage de poulets à griller du PICRA ont signalé une baisse de l’utilisation du ceftiofur, une céphalosporine de troisième génération, par rapport à 2013. Cela s’est traduit par une diminution des taux de résistance aux céphalosporines de troisième génération dans les isolats d’E. coli générique provenant de poulets à griller. En 2014, l’industrie canadienne du poulet a mis en œuvre une politique d’élimination de l’utilisation préventive des antimicrobiens considérés comme étant de très haute importance en médecine humaine, notamment les céphalosporines de troisième génération, et cette intervention est probablement en grande partie responsable de la baisse de l’utilisation des céphalosporines de troisième génération déclarée par les élevages de poulets à griller.
Porcs
Des échantillons de porcs ont été prélevés par le PICRA à différents stades de la chaîne alimentaire : dans les fermes sentinelles d’élevage de porcs en croissance-finition, dans les abattoirs sous inspection fédérale et dans les magasins d’alimentation au détail de tout le pays. Au fil du temps, le taux d’isolement d’E. coli générique dans les échantillons de porcs prélevés le long de la chaîne alimentaire a fluctué entre 50 % (2005) et 62 % (2004) et, en 2014, 55 % de l’ensemble des échantillons de porcs prélevés étaient contaminés par cet organisme (Tableau 7).
| Année | Nombre d’échantillons positifs / Nombre d’échantillons soumis | Pourcentage positif (récupération) |
|---|---|---|
| 2004 | 467/751 | 62% |
| 2005 | 479/961 | 50% |
| 2006 | 641/1133 | 57% |
| 2007 | 4 746/1 326 | 56% |
| 2008 | 819/1 492 | 55% |
| 2009 | 1 076/1 876 | 57% |
| 2010 | 915/1 702 | 54% |
| 2011 | 1 076/1 907 | 56% |
| 2012 | 832/1497 | 56% |
| 2013 | 904/1 507 | 60% |
| 2014 | 1 024/1 852 | 55% |
| Total | 8 979/16 004 | 56% |
Parmi tous les isolats d’E. coli provenant de porcs, 69 % étaient résistants à la tétracycline en 2014. De plus, 2 % des isolats étaient résistants à la ceftriaxone et à la gentamicine, et moins de 1 % était résistant à l’acide nalidixique (Figure 32). Depuis le début de la surveillance à la ferme des porcs en croissance-finition en 2006, le taux de résistance dans les isolats d’E. coli provenant de porcs est resté relativement stable.
Figure 32: Résistance à certains antimicrobiens parmi les isolats d’Escherichia coli générique obtenus à partir d’échantillons de porcs prélevés à la ferme (porcs en croissance-finition), à l’abattoir et dans les magasins d’alimentation au détail au Canada, de 2004 à 2014
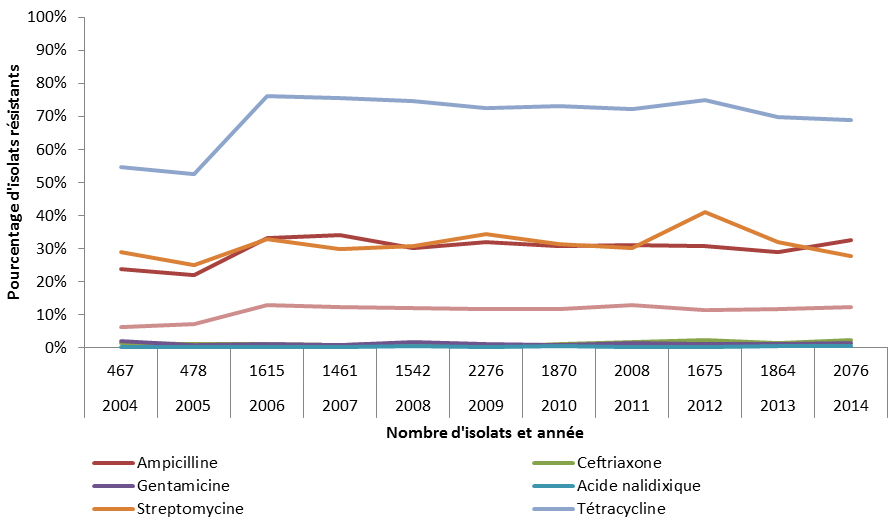
Équivalent textuel
| Pourcentage d’isolats résistants | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ampicilline | 0,24 | 0,22 | 0,33 | 0,34 | 0,30 | 0,32 | 0,31 | 0,31 | 0,31 | 0,29 | 0,33 |
| Céftriaxone | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,00 | 0,01 | 0,02 | 0,02 | 0,02 | 0,02 |
| Gentamicine | 0,02 | 0,01 | 0,01 | 0,01 | 0,02 | 0,01 | 0,01 | 0,02 | 0,01 | 0,01 | 0,02 |
| Acide nalidixique | 0,00 | 0,00 | 0,00 | 0,00 | 0,01 | 0,00 | 0,01 | 0,00 | 0,00 | 0,00 | 0,00 |
| Streptomycine | 0,29 | 0,25 | 0,33 | 0,30 | 0,31 | 0,35 | 0,31 | 0,30 | 0,41 | 0,32 | 0,28 |
| Tétracycline | 0,55 | 0,53 | 0,76 | 0,75 | 0,75 | 0,73 | 0,73 | 0,72 | 0,75 | 0,70 | 0,69 |
| Triméthoprime-sulfaméthoxazole | 0,06 | 0,07 | 0,13 | 0,12 | 0,12 | 0,12 | 0,12 | 0,13 | 0,12 | 0,12 | 0,12 |
| Nombre total d’isolats | 467 | 478 | 1 615 | 1 461 | 1 542 | 2 276 | 1 870 | 2 008 | 1 675 | 1 864 | 2 076 |
Le graphique à lignes présente le pourcentage d’isolats d'Escherichia coli générique qui sont résistants à l'ampicilline, la ceftriaxone, la gentamicine, l'acide nalidixique, la streptomycine, la tétracycline ou le triméthoprime -sulfaméthoxazole (chacun représenté par sa propre ligne) parmi les échantillons de porc au Canada de 2004 à 2014. L'axe horizontal représente l'année et le nombre total d'isolats testés, tandis que l'axe vertical représente le pourcentage d'isolats résistants.
Bovins
Les échantillons mis en culture pour détecter E. coli ont été prélevés par le PICRA à l’abattoir et dans la viande vendue au détail. À l’heure actuelle, il n’y a pas de surveillance des bovins à la ferme. Les taux d’isolement d’E. coli générique dans les échantillons provenant des abattoirs et de la vente au détail sont présentés ci-dessous (Tableau 8).
| Année | Nombre d’isolats récupérés / Nombre d’échantillons soumis aux tests de dépistage | Pourcentage d’isolats (récupérés) |
|---|---|---|
| 2004 | 518/692 | 75% |
| 2005 | 579/758 | 76% |
| 2006 | 576/767 | 75% |
| 2007 | 690/877 | 79% |
| 2008 | 748/980 | 76% |
| 2009 | 772/1 048 | 74% |
| 2010 | 590/912 | 65% |
| 2011 | 612/937 | 65% |
| 2012 | 571/849 | 67% |
| 2013 | 413/740 | 56% |
| 2014 | 605/1 076 | 56% |
| Total | 6 674/9 636 | 69% |
Comme cela a été observé dans les échantillons de poulets et de porcs, la plus grande proportion des isolats d’E. coli générique était résistante à la tétracycline, puisque 20 % des isolats présentaient une résistance à cet antimicrobien en 2014 (Figure 33). Une très faible résistance (≤ 0,3 %) à la ceftriaxone ainsi qu’à la gentamicine et à l’acide nalidixique a été observée.
Figure 33 : Résistance à certains antimicrobiens parmi les isolats d’Escherichia coli générique obtenus à partir d’échantillons de bovins prélevés à l’abattoir et dans les magasins d’alimentation au détail au Canada, de 2004 à 2014
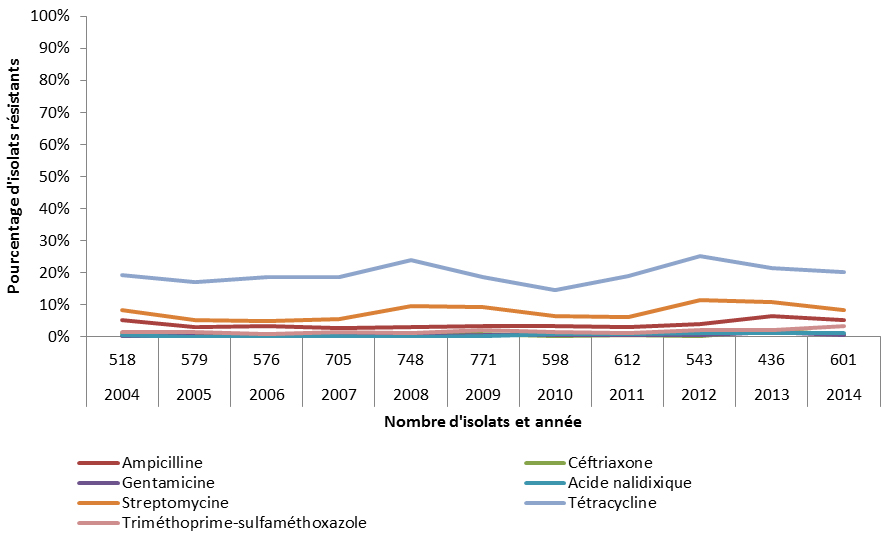
Équivalent textuel
| Pourcentage d’isolats résistants | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ampicilline | 0,05 | 0,03 | 0,03 | 0,03 | 0,03 | 0,03 | 0,03 | 0,03 | 0,04 | 0,07 | 0,05 |
| Céftriaxone | 0,01 | 0,00 | 0,00 | 0,00 | 0,01 | 0,01 | 0,00 | 0,00 | 0,00 | 0,02 | 0,00 |
| Gentamicine | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,01 | 0,01 | 0,01 | 0,01 | 0,02 | 0,00 |
| Acide nalidixique | 0,01 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 |
| Streptomycine | 0,08 | 0,05 | 0,05 | 0,06 | 0,10 | 0,09 | 0,07 | 0,06 | 0,12 | 0,11 | 0,08 |
| Tetracycline | 0,19 | 0,17 | 0,19 | 0,19 | 0,24 | 0,19 | 0,15 | 0,19 | 0,25 | 0,21 | 0,20 |
| Triméthoprime-sulfaméthoxazole | 0,02 | 0,01 | 0,01 | 0,01 | 0,01 | 0,02 | 0,02 | 0,01 | 0,02 | 0,02 | 0,03 |
| Nombre total d’isolats | 518 | 579 | 576 | 705 | 748 | 771 | 598 | 612 | 543 | 436 | 601 |
Le graphique à lignes présente le pourcentage d’isolats d'Escherichia coli générique qui sont résistants à l'ampicilline, la ceftriaxone, la gentamicine, l'acide nalidixique, la streptomycine, la tétracycline ou le triméthoprime -sulfaméthoxazole (chacun représenté par sa propre ligne) parmi les échantillons de bovins au Canada de 2004 à 2014. L'axe horizontal représente l'année et le nombre total d'isolats testés, tandis que l'axe vertical représente le pourcentage d'isolats résistants.
Campylobacter spp.
Poulets
Les tests de détection de la contamination par Campylobacter spp. sont effectués sur des échantillons de poulets prélevés à la ferme (poulets à griller), à l’abattoir et dans les magasins d’alimentation au détail dans tout le Canada. Les taux d’isolement totaux sont présentés ci-dessous (Tableau 9). En 2014, 26 % (294/1149) des échantillons de viande vendue au détail, 27 % (187/683) des échantillons prélevés à l’abattoir et 16 % (93/564) des échantillons de poulets à la ferme étaient positifs pour Campylobacter.
| Année | Nombre d’isolats récupérés / Nombre d’échantillons soumis aux tests de dépistage | Pourcentage d’isolats (récupérés) |
|---|---|---|
| 2004 | 320/676 | 47% |
| 2005 | 307/784 | 38% |
| 2006 | 261/761 | 34% |
| 2007 | 263/857 | 30% |
| 2008 | 268/958 | 28% |
| 2009 | 349/1 164 | 30% |
| 2010 | 386/1 369 | 28% |
| 2011 | 398/1 669 | 24% |
| 2012 | 449/1 562 | 29% |
| 2013 | 489/1 857 | 26% |
| 2014 | 563/2 273 | 25% |
| Total | 4 037/13 930 | 29% |
En 2014, 44 % des isolats de Campylobacter spp. étaient résistants à la tétracycline (Figure 34). La résistance à la ciprofloxacine constatée en 2014 (11 %) était supérieure à celle observée en 2004 (4 %) et était constante à tous les stades de la chaîne alimentaire : dans la viande vendue au détail (11 %; 30/277), à l’abattoir (11 %; 20/188) et à la ferme (10 %; 9/93).
Figure 34 : Résistance à certains antimicrobiens parmi les isolats de Campylobacter spp. obtenus à partir d’échantillons de poulets prélevés à la ferme (poulets à griller), à l’abattoir et dans les magasins d’alimentation au détail au Canada, de 2004 à 2014
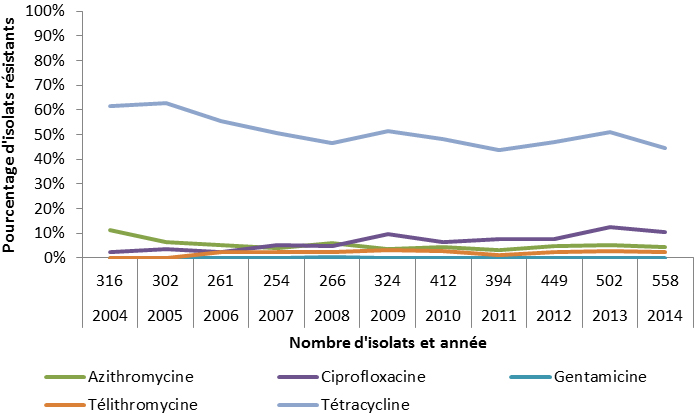
Équivalent textuel
| Pourcentage d’isolats résistants | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Azithromycine | 0,11 | 0,06 | 0,05 | 0,04 | 0,06 | 0,04 | 0,04 | 0,03 | 0,05 | 0,05 | 0,04 |
| Ciprofloxacine | 0,03 | 0,04 | 0,02 | 0,05 | 0,05 | 0,10 | 0,07 | 0,08 | 0,08 | 0,12 | 0,11 |
| Gentamycine | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| Télithromycine | 0,00 | 0,00 | 0,02 | 0,02 | 0,02 | 0,03 | 0,03 | 0,01 | 0,02 | 0,03 | 0,02 |
| Tétracycline | 0,62 | 0,63 | 0,56 | 0,51 | 0,47 | 0,51 | 0,48 | 0,44 | 0,47 | 0,51 | 0,44 |
| Nombre total d’isolats | 316 | 302 | 261 | 254 | 266 | 324 | 412 | 394 | 449 | 502 | 558 |
Le graphique à lignes présente le pourcentage d’isolats de Campylobacter qui sont résistants à l'azithromycine, la ciprofloxacine, la gentamicine, la télithromycine, ou la tétracycline (chacun représenté par sa propre ligne) parmi les échantillons de poulet au Canada de 2004 à 2014. L'axe horizontal représente l'année et le nombre total d'isolats testés, tandis que l'axe vertical représente le pourcentage d'isolats résistants.
La danofloxacine et l’enrofloxacine sont des fluoroquinolones homologuées pour une utilisation chez les animaux d’élevage au Canada, précisément pour traiter les maladies respiratoires chez les bovins et les porcs (aucune utilisation n’est approuvée pour les poulets). Lorsque les données sur la résistance à la ciprofloxacine dans les isolats de Campylobacter spp. obtenus à partir d’échantillons de poulets ont été examinées au niveau régional, on a remarqué que les tendances variaient considérablement entre les provinces ou les régions et que la diminution de l’utilisation déclarée de fluoroquinolones dans certaines provinces semblait coïncider avec la baisse observée de la résistance à la ciprofloxacine.
Porcs
Les échantillons de porcs servant à la détection de Campylobacter spp. ne sont prélevés qu’à l’abattoir, et les tests de dépistage de Campylobacter n’ont commencé qu’en 2012. Les échantillons de viande vendue au détail ne font pas l’objet de tests de dépistage de Campylobacter en raison des faibles taux détectés au début de la surveillance. Campylobacter est couramment isolé chez les porcs à l’abattoir (Tableau 10); la plupart des isolats provenant de porcs sont de type Campylobacter coli.
| Année | Nombre d’isolats récupérés / Nombre d’échantillons soumis aux tests de dépistage | Pourcentage d’isolats (Récupérés) |
|---|---|---|
| 2012 | 289/370 | 78% |
| 2013 | 236/315 | 75% |
| 2014 | 237/326 | 73% |
| Total | 762/1 011 | 75% |
En 2014, 78 % des isolats présentaient une résistance à la tétracycline, suivie par l’azithromycine (53 %) et la télithromycine (43 %). De plus, 11 % des isolats étaient résistants à la ciprofloxacine (Figure 35).
Figure 35 : Résistance à certains antimicrobiens parmi les isolats de Campylobacter spp. obtenus à partir d’échantillons de porcs prélevés à l’abattoir au Canada, de 2012 à 2014
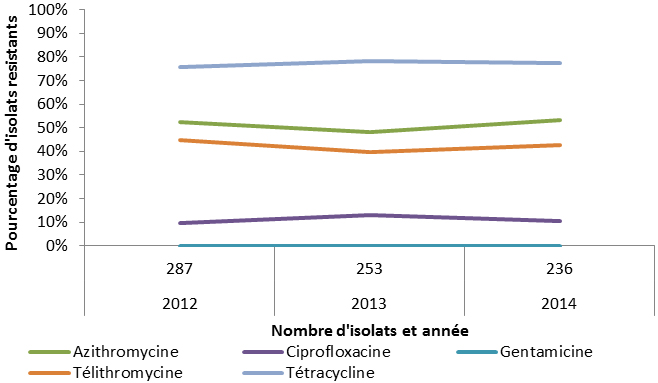
Équivalent textuel
| Pourcentage d’isolats résistants | 2012 | 2013 | 2014 |
|---|---|---|---|
| Azithromycine | 0,53 | 0,48 | 0,53 |
| Ciprofloxacine | 0,10 | 0,13 | 0,11 |
| Gentamicine | 0,00 | 0,00 | 0,00 |
| Télithromycine | 0,45 | 0,40 | 0,43 |
| Tétracycline | 0,76 | 0,78 | 0,78 |
| Nombre total d’isolats | 287 | 253 | 236 |
Le graphique à lignes présente le pourcentage d’isolats de Campylobacter qui sont résistants à l'azithromycine, la ciprofloxacine, la gentamicine, la télithromycine, ou la tétracycline (chacun représenté par sa propre ligne) parmi les échantillons de porc au Canada de 2012 à 2014. L'axe horizontal représente l'année et le nombre total d'isolats testés, tandis que l'axe vertical représente le pourcentage d'isolats résistants.
Bovins
Campylobacter spp. est isolé à partir d’échantillons de bovins prélevés à l’abattoir depuis 2008. De même que chez les porcs, Campylobacter spp. ne fait pas l’objet de tests de dépistage dans les échantillons de viande de bœuf vendue au détail en raison des faibles taux de détection observés au début du programme de surveillance.
Le taux d’isolement de Campylobacter spp. dans les échantillons de bovins a fluctué entre 53 % en 2010 et 92 % en 2012 et, en 2014, 87 % des échantillons ont produit des résultats positifs aux tests de détection de Campylobacter spp. (Tableau 11).
| Année | Nombre d’isolats récupérés / Nombre d’échantillons soumis aux tests de dépistage | Pourcentage d’isolats (Récupérés) |
|---|---|---|
| 2008 | 129/182 | 71% |
| 2009 | 86/126 | 68% |
| 2010 | 37/70 | 53% |
| 2011 | 108/142 | 76% |
| 2012 | 152/166 | 92% |
| 2013 | 54/152 | 36% |
| 2014 | 123/142 | 87% |
| Total | 689/980 | 70% |
La résistance aux antimicrobiens observée dans les isolats de Campylobacter spp. provenant d’échantillons de bovins concerne principalement la tétracycline, avec 54 % des isolats résistants à cet antimicrobien en 2014 (Figure 36). Une résistance à l’azithromycine et à la télithromycine a été signalée pour la première fois en 2014, même si moins de 1 % des isolats étaient résistants à ces antimicrobiens. La résistance à la ciprofloxacine a augmenté entre 2008 et 2014, passant de 2 % à 7 % sur cette période.
Figure 36 : Résistance à certains antimicrobiens parmi les isolats de Campylobacter spp. obtenus à partir d’échantillons de bovins prélevés à l’abattoir au Canada, de 2008 à 2014
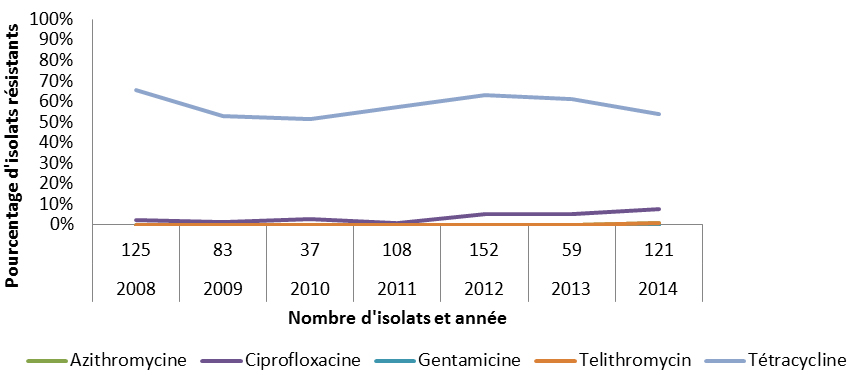
Équivalent textuel
| Pourcentage d’isolats résistants | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|
| Azithromycine | 0 | 0 | 0 | 0 | 0 | 0 | 0,01 |
| Ciprofloxacine | 0,02 | 0,01 | 0,03 | 0,01 | 0,05 | 0,05 | 0,07 |
| Gentamicine | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Télithromycine | 0 | 0 | 0 | 0 | 0 | 0 | 0,01 |
| Tétracycline | 0,66 | 0,53 | 0,51 | 0,57 | 0,63 | 0,61 | 0,54 |
| Nombre total d’isolats | 125 | 83 | 37 | 108 | 152 | 59 | 121 |
Le graphique à lignes présente le pourcentage d’isolats de Campylobacter qui sont résistants à l'azithromycine, la ciprofloxacine, la gentamicine, la télithromycine, ou la tétracycline (chacun représenté par sa propre ligne) parmi les échantillons de bovins au Canada de 2008 à 2014. L'axe horizontal représente l'année et le nombre total d'isolats testés, tandis que l'axe vertical représente le pourcentage d'isolats résistants.
Salmonella spp.
Poulets
Le dépistage de Salmonella spp. est effectué sur des échantillons de poulets prélevés à la ferme, à l’abattoir et dans les magasins d’alimentation au détail. En 2014, on a constaté que 34 % de tous les échantillons de poulets prélevés au Canada étaient contaminés par Salmonella spp. (Tableau 12). Parmi les isolats de Salmonella obtenus à partir d’échantillons de poulets, S. Enteritidis et S. Kentucky étaient les principaux sérotypes identifiés, S. Heidelberg étant le troisième sérotype le plus courant.
| Année | Nombre d’isolats récupérés / Nombre d’échantillons soumis aux tests de dépistage | Pourcentage d’isolats (Récupérés) |
|---|---|---|
| 2004 | 250/1 553 | 16% |
| 2005 | 278/1 898 | 15% |
| 2006 | 293/1 045 | 28% |
| 2007 | 556/1 665 | 33% |
| 2008 | 616/1 810 | 34% |
| 2009 | 704/1 935 | 36% |
| 2010 | 523/1 614 | 32% |
| 2011 | 505/1 674 | 30% |
| 2012 | 444/1 550 | 29% |
| 2013 | 624/1 924 | 32% |
| 2014 | 700/2 050 | 34% |
| Total | 5493/18 718 | 29% |
En 2014, 56 % de tous les isolats de Salmonella provenant d’échantillons de poulets prélevés le long de la chaîne alimentaire étaient complètement sensibles à tous les antimicrobiens testés, tandis que 6 % des isolats ont été classés comme multirésistants (résistance à trois classes d’antimicrobiens ou plus). Dans les isolats de Salmonella, la plus forte proportion était résistante à la tétracycline (30 %), suivie par la streptomycine (26 %) et l’ampicilline, l’amoxicilline-acide clavulanique et la ceftriaxone (17 % chacun) (Figure 37). En 2014, aucune résistance n’a été observée à l’azithromycine ni à la ciprofloxacine, deux antimicrobiens utilisés en médecine humaine pour traiter la salmonellose grave et invasive.
Figure 37 : Résistance à certains antimicrobiens parmi les isolats de Salmonella spp. obtenus à partir d’échantillons de poulets à griller prélevés à la ferme, à l’abattoir et dans les magasins d’alimentation au détail au Canada, de 2004 à 2014
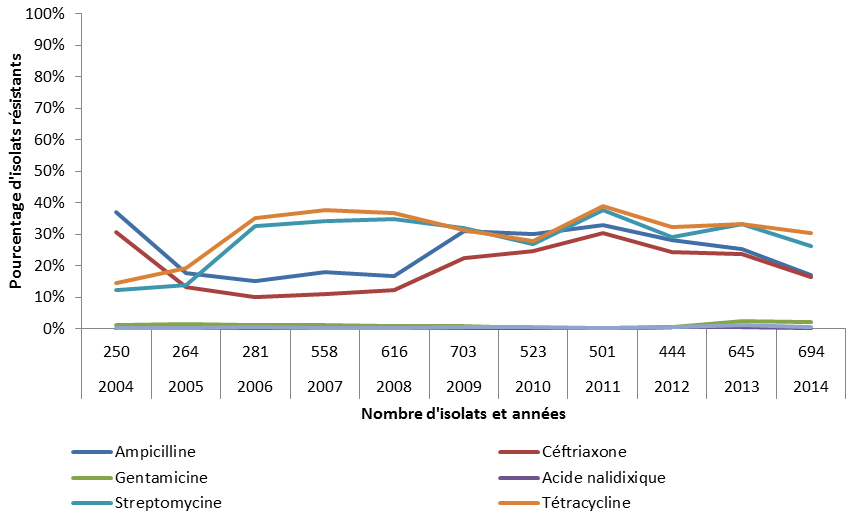
Équivalent textuel
| Pourcentage d’isolats résistants | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ampicilline | 0,37 | 0,18 | 0,15 | 0,18 | 0,17 | 0,31 | 0,30 | 0,33 | 0,28 | 0,25 | 0,17 |
| Ceftriaxone | 0,31 | 0,13 | 0,10 | 0,11 | 0,12 | 0,22 | 0,25 | 0,30 | 0,24 | 0,24 | 0,17 |
| Gentamicine | 0,01 | 0,02 | 0,01 | 0,01 | 0,01 | 0,01 | 0,00 | 0,00 | 0,01 | 0,03 | 0,02 |
| Acide nalidixique | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,01 | 0,00 |
| Streptomycine | 0,12 | 0,14 | 0,33 | 0,34 | 0,35 | 0,32 | 0,27 | 0,38 | 0,29 | 0,33 | 0,26 |
| Tétracycline | 0,14 | 0,19 | 0,35 | 0,38 | 0,37 | 0,31 | 0,28 | 0,39 | 0,32 | 0,33 | 0,30 |
| Triméthoprime-sulfaméthoxazole | 0,00 | 0,00 | 0,01 | 0,00 | 0,00 | 0,01 | 0,01 | 0,00 | 0,00 | 0,01 | 0,00 |
| Nombre total d’isolats | 250 | 264 | 281 | 558 | 616 | 703 | 523 | 501 | 444 | 645 | 694 |
Le graphique à lignes présente le pourcentage d’isolats de Salmonella qui sont résistants à l'ampicilline, la ceftriaxone, la gentamicine, l'acide nalidixique, la streptomycine, ou la tétracycline (chacun représenté par sa propre ligne) parmi les échantillons de poulets au Canada de 2004 à 2014. L'axe horizontal représente l'année et le nombre total d'isolats testés, tandis que l'axe vertical représente le pourcentage d'isolats résistants.
Dans la viande de poulet vendue au détail et chez les poulets à l’abattoir, le sérotype de Salmonella le plus couramment associé à une résistance aux céphalosporines de troisième génération était S. Heidelberg. De plus amples renseignements sur la résistance aux céphalosporines de troisième génération de Salmonella non typhique sont fournis dans la section intitulée Intégration de l’utilisation des antimicrobiens et de la résistance aux antimicrobiens le long de la chaîne alimentaire.
Porcs
L’isolement de Salmonella spp. dans les échantillons de porcs obtenus à la ferme (porcs en croissance-finition), à l’abattoir et dans les magasins d’alimentation au détail a diminué au fil du temps, passant de 38 % en 2004 à 16 % en 2014 (Tableau 13). La majorité des isolats de Salmonella identifiés étaient de type S. Typhimurium et, contrairement à ce qui a été observé dans les produits à base de poulet, les sérotypes S. Enteritidis, S. Heidelberg et S. Kentucky ont rarement été détectés dans les échantillons testés.
| Année | Nombre d’isolats récupérés / Nombre d’échantillons soumis aux tests de dépistage | Pourcentage d’isolats (Récupérés) |
|---|---|---|
| 2004 | 270/703 | 38% |
| 2005 | 212/486 | 44% |
| 2006 | 206/750 | 27% |
| 2007 | 207/1 508 | 14% |
| 2008 | 221/1 675 | 13% |
| 2009 | 286/2 038 | 14% |
| 2010 | 296/1 910 | 16% |
| 2011 | 276/2 095 | 13% |
| 2012 | 263/1 683 | 16% |
| 2013 | 277/1 668 | 17% |
| 2014 | 332/2 015 | 16% |
| Total | 2 846/16 531 | 17% |
En 2014, 33 % de tous les isolats de Salmonella obtenus à partir d’échantillons de porcs prélevés le long de la chaîne alimentaire étaient sensibles à tous les antimicrobiens testés, et 44 % ont été identifiés comme multirésistants. La majorité des isolats (62 %) étaient résistants à la tétracycline, suivie par le sulfisoxazole (44 %) et la streptomycine (42 %). Aucune résistance à l’acide nalidixique n’a été observée depuis le début de la période de surveillance. La résistance à l’ampicilline, à la streptomycine et à la tétracycline a augmenté entre 2004 et 2014 (Figure 38).
Figure 38 : Résistance à certains antimicrobiens parmi les isolats de Salmonella spp. obtenus à partir d’échantillons de porcs prélevés à la ferme, à l’abattoir et dans les magasins d’alimentation au détail au Canada, de 2004 à 2014
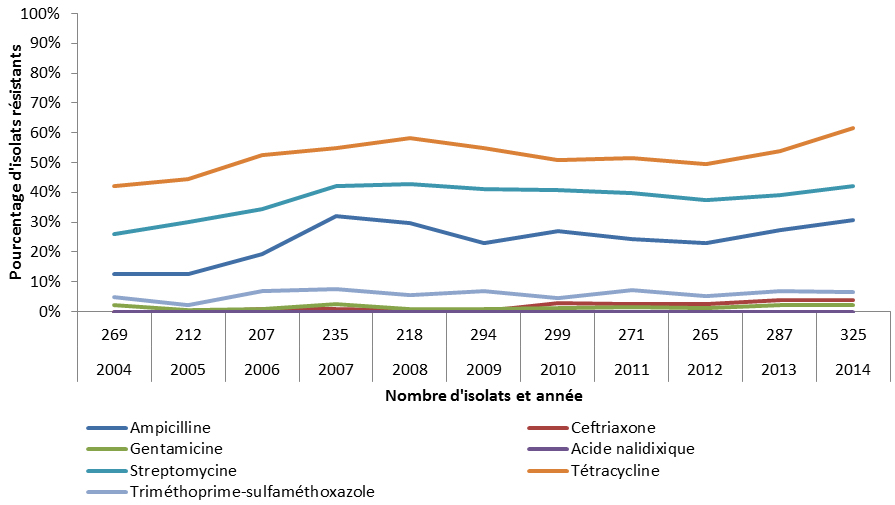
Équivalent textuel
| Pourcentage d’isolats résistants | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ampicilline | 0,13 | 0,13 | 0,19 | 0,32 | 0,30 | 0,23 | 0,27 | 0,24 | 0,23 | 0,28 | 0,31 |
| Ceftriaxone | 0,00 | 0,00 | 0,01 | 0,01 | 0,00 | 0,00 | 0,03 | 0,03 | 0,03 | 0,04 | 0,04 |
| Gentamicine | 0,02 | 0,00 | 0,01 | 0,03 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,02 | 0,02 |
| Acide nalidixique | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| Streptomycine | 0,26 | 0,30 | 0,34 | 0,42 | 0,43 | 0,41 | 0,41 | 0,40 | 0,37 | 0,39 | 0,42 |
| Tétracycline | 0,42 | 0,44 | 0,53 | 0,55 | 0,58 | 0,55 | 0,51 | 0,52 | 0,49 | 0,54 | 0,62 |
| Triméthoprime-sulfaméthoxazole | 0,05 | 0,02 | 0,07 | 0,08 | 0,06 | 0,07 | 0,05 | 0,07 | 0,05 | 0,07 | 0,06 |
| Nombre total d’isolats | 269 | 212 | 207 | 235 | 218 | 294 | 299 | 271 | 265 | 287 | 325 |
Le graphique à lignes présente le pourcentage d’isolats de Salmonella qui sont résistants à l'ampicilline, la ceftriaxone, la gentamicine, l'acide nalidixique, la streptomycine, triméthoprime-sulfaméthoxazole ou la tétracycline (chacun représenté par sa propre ligne) parmi les échantillons de porcs au Canada de 2004 à 2014. L'axe horizontal représente l'année et le nombre total d'isolats testés, tandis que l'axe vertical représente le pourcentage d'isolats résistants.
Utilisation des antimicrobiens au Canada
Utilisation des antimicrobiens chez les humains
Dans l’ensemble, l’utilisation des antimicrobiens chez les humains au Canada est demeuré relativement stable au cours des 8 dernières années (Figure 39), de légers changements ayant été observés quant à la quantité totale d’antimicrobiens achetés par les hôpitaux (diminution de 4 %), alors que la quantité totale d’antimicrobiens exécutés par les pharmacies communautaires en 2014 comparativement à 2013 est restée la même. La distribution d’antimicrobiens dans la collectivité représente 93 % de l’utilisation globale des antimicrobiens au Canada, avec un total de 17,8 doses thérapeutiques quotidiennes (DTQ) exécutées par 1 000 habitants-jour par rapport à 1,4 DTQ achetées par les hôpitaux.
Cela représente un total de 240 939 kilogrammes d’ingrédients actifs et 786 millions de dollars dépensés en antimicrobiens en 2014. Des changements ont été observés quant aux taux d’utilisation de chaque antimicrobien, des tendances différentes ayant été observées en milieu hospitalier et en milieu communautaire.
Figure 39 : Nombre de doses thérapeutiques quotidiennes par 1 000 habitants - jour d'antimicrobiens exécutés par les pharmacies communautaires ou achetés par les hôpitaux au Canada, 2007-2014.
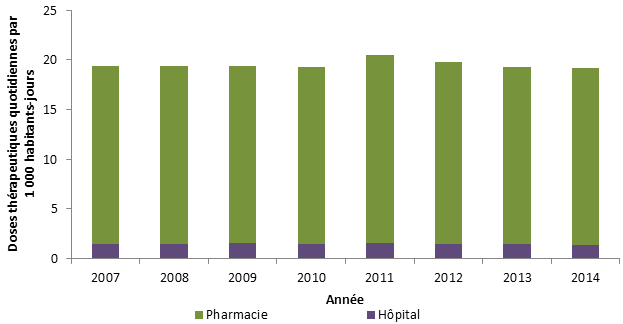
Équivalent textuel
| Année | Hôpital | Pharmacie |
|---|---|---|
| 2007 | 1,51 | 17,84 |
| 2008 | 1,49 | 17,92 |
| 2009 | 1,54 | 17,85 |
| 2010 | 1,41 | 17,84 |
| 2011 | 1,52 | 18,92 |
| 2012 | 1,49 | 18,32 |
| 2013 | 1,46 | 17,78 |
| 2014 | 1,40 | 17,79 |
Graphique à colonnes empilées indiquant le nombre de doses quotidiennes définies par 1 000 jours-habitants distribués soit dans les pharmacies ou achetés par les hôpitaux au Canada de 2007 à 2014. L'axe horizontal représente l'année et l'axe vertical représente le total des doses quotidiennes définies pour 1 000 journées-population.
Utilisation dans la collectivité
Médicaments exécutés en pharmacie
En moyenne, 65 % des Canadiens ont fait exécuter une ordonnance d’antimicrobiens pour une infection bactérienne en 2014 (Figure 40), ce qui s’est traduit par un total de 23 millions d’ordonnances exécutées. De tous les antimicrobiens exécutés, l’amoxicilline représentait la plus grande proportion (26 %), suivie de l’azithromycine (9 %) et de la ciprofloxacine (8 %). D’après les DTQ par habitant, les ordonnances par habitant et les DTQ par ordonnance, l’utilisation totale d’antimicrobiens au sein de la collectivité à l’échelle nationale est demeurée stable entre 2013 et 2014 (Tableau 14). Toutefois, de 2004 à 2014, il y a eu une légère augmentation du nombre de DTQ par ordonnance et une diminution du nombre d’ordonnances par habitant.
La plupart des antimicrobiens utilisés parmi la population canadienne de patients externes en 2014 étaient des médicaments administrés par voie orale. À l’échelle nationale, plus de 213 ordonnances et 237 DTQ d’antimicrobiens oraux ont été exécutées pour chaque ordonnance d’antimicrobiens parentéraux.
| Antimicrobien | Rang | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|---|
| Amoxicilline | 1 | 1 597,2 | 1 624,1 | 1 641,8 | 1 691,4 | 1 836,3 | 1 768,9 | 1 758,9 | 1 843,5 |
| Amoxicilline et inhibiteur enzymatique | 4 | 244,5 | 262,0 | 271,6 | 239,0 | 314,7 | 333,9 | 368,5 | 405,8 |
| Azithromycine | 7 | 284,4 | 288,0 | 289,4 | 282,7 | 370,6 | 367,7 | 308,9 | 310,3 |
| Céfalexine | 6 | 342,6 | 348,6 | 337,4 | 330,0 | 354,1 | 358,7 | 368,9 | 371,1 |
| Ciprofloxacine | 5 | 439,6 | 442,8 | 425,2 | 434,4 | 444,1 | 428,2 | 405,8 | 390,8 |
| Clarithromycine | 2 | 982,5 | 997,6 | 1 009,0 | 985,6 | 1 028,8 | 965,6 | 830,6 | 743,0 |
| Doxycycline | 3 | 313,0 | 336,6 | 346,9 | 411,5 | 449,9 | 477,8 | 510,1 | 548,0 |
| Minocycline | 9 | 371,6 | 370,9 | 349,2 | 374,4 | 357,8 | 319,6 | 299,4 | 275,4 |
| Nitrofurantoïne | 8 | 211,7 | 226,4 | 241,9 | 256,2 | 271,4 | 284,5 | 283,8 | 292,5 |
| Sulfaméthoxazole et triméthoprime | 10 | 287,5 | 285,2 | 282,8 | 279,3 | 274,9 | 254,1 | 248,3 | 245,3 |
| TOTAL | 3 477,4 | 5 182,2 | 5 195,2 | 5 284,5 | 5 702,6 | 5 559 | 5 383,2 | 5 425,7 | |
|
|||||||||
Figure 40 : Quantité totale d’antimicrobiens exécutés par les pharmacies communautaires au Canada, déterminée d’après par les doses thérapeutiques quotidiennes par ordonnance, les doses thérapeutiques quotidiennes par habitant et les ordonnances par habitant, de 2007 à 2014Note de bas de page 28
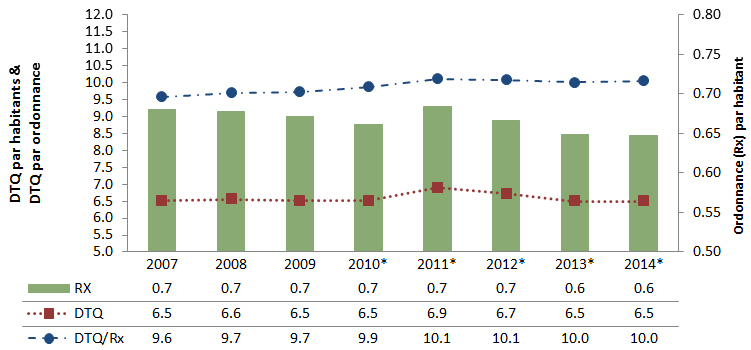
Équivalent textuel
| Mesure par habitant | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|
| RX | 0,7 | 0,7 | 0,7 | 0,7 | 0,7 | 0,7 | 0,6 | 0,6 |
| DTQ | 6,5 | 6,6 | 6,5 | 6,5 | 6,9 | 6,7 | 6,5 | 6,5 |
| DTQ/RX | 9,6 | 9,7 | 9,7 | 9,9 | 10,1 | 10,1 | 10,0 | 10,0 |
Le graphique représente le montant total d’antimicrobiens distribués dans les pharmacies communautaires par doses quotidiennes définies par ordonnance (représenté par une ligne en pointillés), par doses quotidiennes définies par habitant (représenté par une ligne de carrées) et par prescriptions par habitant (représenté par un barre) au Canada à partir de 2007 à 2014. L'axe horizontal représente l'année. L'axe vertical gauche représente les doses quotidiennes définies par personne et par prescription tandis que l'axe vertical de droite représente le nombre de prescriptions par personne.
Les taux d’ordonnances chez les enfants (≤ 14 ans) ont diminué de 8 % en 2014 comparativement à 2010 et de 1 % comparativement à 2013 (Figure 41). En 2014, 63 % des enfants âgés de 0 à 14 ans ont reçu, en moyenne, un antimicrobien. L’amoxicilline comptait pour 54 % des ordonnances, suivie de l’azithromycine (10 %) et de la clarithromycine (9 %). Comparativement à 2010, les taux d’exécution des ordonnances d’amoxicilline et d’inhibiteur enzymatique ont augmenté de 27 % en 2014, tandis que les taux se rapportant uniquement à l’amoxicilline ont augmenté de 8 %.
Figure 41 : Tendances en matière d’utilisation d’antimicrobiens exécutés par les pharmacies canadiennes, par groupe d’âge, de 2010 à 2014
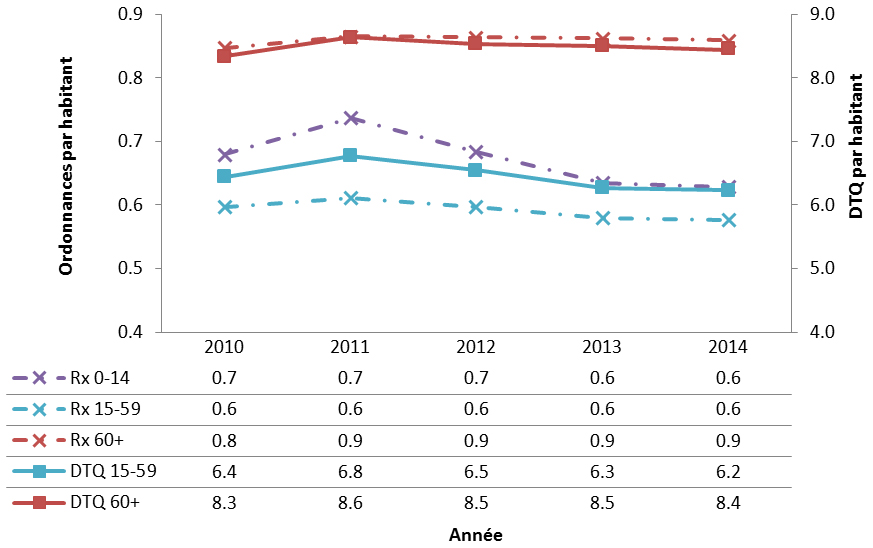
Équivalent textuel
| Ordonnance | Âge | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|
| DTQ | 15-59 | 6,4 | 6,8 | 6,5 | 6,3 | 6,2 |
| DTQ | 60+ | 8,3 | 8,6 | 8,5 | 8,5 | 8,4 |
| Rx | 0-14 | 0,7 | 0,7 | 0,7 | 0,6 | 0,6 |
| Rx | 15-59 | 0,6 | 0,6 | 0,6 | 0,6 | 0,6 |
| Rx | 60+ | 0,8 | 0,9 | 0,9 | 0,9 | 0,9 |
Ce graphique linéaire représente l'utilisation d’antimicrobiens mesurée par nombre de prescriptions par personne et doses quotidiennes définies par groupe d'âge (chacun est représenté par sa propre ligne) distribuée par les pharmacies canadiennes, au Canada de 2010 à 2014. L'axe horizontal représente l’année. L'axe vertical gauche représente les prescriptions par personne tandis que l’axe de droite représente les doses quotidiennes définies par personne.
En 2014, 58 % des adultes (de 15 à 59 ans) ont reçu une ordonnance d’antimicrobiens comparativement à 86 % des personnes âgées (60 ans et plus). Bien que les taux d’ordonnances aient diminué entre 2010 et 2014 dans les groupes d’âge plus jeunes (8 % chez les enfants et 3 % chez les adultes), ces diminutions n’ont pas été observées chez les personnes âgées. De plus, les adultes ont reçu un plus grand nombre de doses par ordonnance que les personnes âgées (environ 11 jours de traitement par ordonnance chez les adultes, comparativement à 10 chez les aînés).
Des variations dans l’utilisation des antimicrobiens ont été observées dans l’ensemble des provinces et des territoires du Canada, TerreNeuveet-Labrador ayant le plus grand nombre de DTQ par habitant que toute autre province. En 2014, les DTQ par habitant à TerreNeuve-etLabrador étaient de 33 % plus élevées que celles de la province suivante (Saskatchewan) (Figure 42).
Figure 42 : Nombre total d’antimicrobiens exécutés par les pharmacies communautaires dans les provinces et les territoires au Canada en 2014Note de bas de page 29

Équivalent textuel
| Provinces/Territoires | DTQ par habitant |
|---|---|
| Yukon | 5-5,99 |
| Territoires du Nord-Ouest | 5-5,99 |
| Nunavut | 5-5,99 |
| Colombie-Britannique | 6-6,99 |
| Alberta | 7-7,99 |
| Saskatchewan | 8-8,99 |
| Manitoba | 6-6,99 |
| Ontario | 6-6,99 |
| Québec | 5-5,99 |
| Nouveau-Brunswick | 7-7,99 |
| Nouvelle-Écosse | 7-7,99 |
| Île-du-Prince-Édouard | 10+ |
| Terre-Neuve-et-Labrador | 10+ |
Une carte des provinces et territoires du Canada est utilisé pour représenter les différences de quantité d’antimicrobiens distribués entre les provinces et territoires. La quantité total d’antimicrobien distribué est rapporté en utilisant des doses quotidiennes définies par habitant.
En 2014, les variations entre les provinces et les territoires quant aux doses totales de différents antimicrobiens considérés séparément étaient particulièrement importantes pour l’amoxicilline (le nombre le plus élevé étant de 3,4 DTQ par habitant à Terre-Neuve-et-Labrador et le plus faible étant de 1,3 DTQ par habitant au Québec) (Tableau 15). L’amoxicilline et la clarithromycine étaient les deux seuls médicaments parmi les cinq principaux antimicrobiens exécutés ayant le plus grand nombre de DTQ par habitant dans chaque province et territoire. La ciprofloxacine comptait parmi les cinq principaux antimicrobiens exécutés en Colombie-Britannique (nº 5), au Québec (nº 4) et à Terre-Neuve-et-Labrador (nº 3).
| Antimicrobien | RangNote de bas de page 31 | ALB | C,-B, | MAN | N,-B, | T,-N,-L | N,-É, | ONT | Î,-P,-E | QC | SASK | TE |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Amoxicilline | 1 | 2 026,2 | 1 533,6 | 2 004,0 | 1 820,7 | 3 360,0 | 1 904,9 | 2 090,9 | 1 771,2 | 1 321,7 | 2 377,7 | 1 072,7 |
| Amoxicilline et inhibiteur enzymatique | 4 | 497,5 | 337,7 | 443,7 | 462,5 | 654,8 | 416,3 | 326,9 | 781,8 | 504,6 | 346,9 | 179,8 |
| Azithromycine | 7 | 298,5 | 181,7 | 423,3 | 330,2 | 539,2 | 207,8 | 356,1 | 309,4 | 280,4 | 391,9 | 127,7 |
| Céfalexine | 6 | 483,5 | 425,3 | 504,6 | 464,3 | 658,8 | 543,9 | 403,9 | 544,8 | 110,5 | 730,2 | 235,2 |
| Ciprofloxacine | 5 | 397,5 | 374,8 | 404,4 | 337,8 | 1 018,0 | 367,6 | 340,8 | 366,0 | 449,6 | 375,6 | 145,0 |
| Clarithromycine | 2 | 877,4 | 689,5 | 452,2 | 766,0 | 1 073,9 | 831,4 | 696,6 | 838,4 | 819,5 | 583,3 | 215,7 |
| Doxycycline | 3 | 675,3 | 837,5 | 592,3 | 585,6 | 649,8 | 798,9 | 433,4 | 727,6 | 339,2 | 1 464,7 | 319,2 |
| Minocycline | 9 | 436,0 | 288,4 | 255,3 | 260,8 | 302,6 | 386,0 | 191,0 | 218,1 | 345,5 | 99,6 | |
| Nitrofurantoïne | 8 | 277,6 | 353,1 | 225,9 | 325,7 | 339,5 | 413,1 | 352,8 | 316,8 | 139,0 | 428,9 | |
| Sulfaméthoxazole et triméthoprime | 10 | 264,3 | 268,3 | 329,9 | 322,3 | 537,8 | 388,3 | 238,3 | 407,9 | 152,5 | 421,0 | 175,0 |
| TOTAL | 0 | 6 233,8 | 5 289,9 | 5 635,6 | 5 675,9 | 9 134,4 | 6 258,2 | 5 430,7 | 6 282 | 4 462,5 | 7 219,8 | 2 470,3 |
Encadré 7 : Consommation d’antimicrobiens dans les collectivités autochtones du Canada Figure A : Consommation d'antimicrobiens en milieu extra-hospitalier parmi les populations Autochtones (SSNA) et non-Autochtones (non-SSNA) au Canada, 2007 à 2014 Figure B : Nombre total d’ordonnances par personne exécutées au Canada, par groupe d’âge et population, de 2007 à 2014 Figure C : Quantité totale d’antimicrobiens (DTQ par personne) exécutés par les pharmacies communautaires, par groupe d’âge et population, de 2007 à 2014
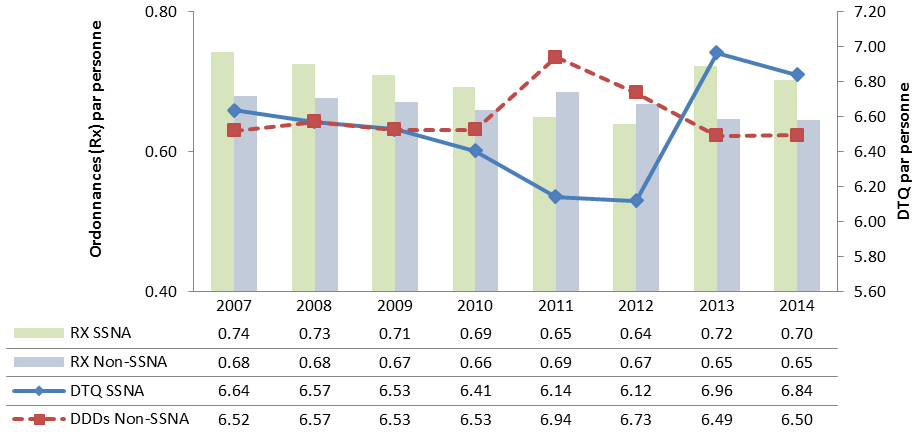
Équivalent textuel
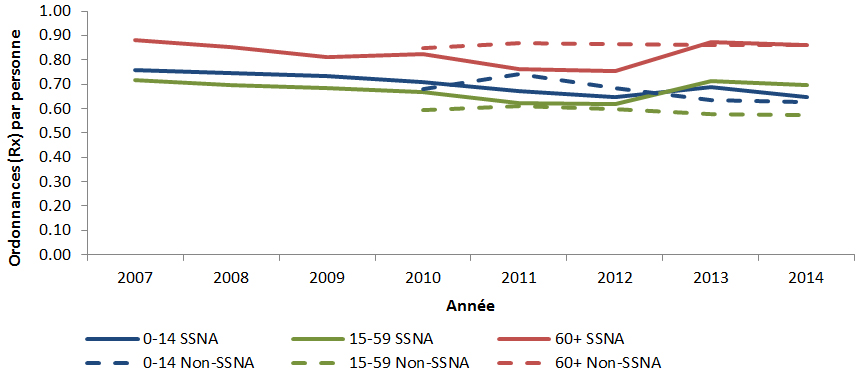
Équivalent textuel
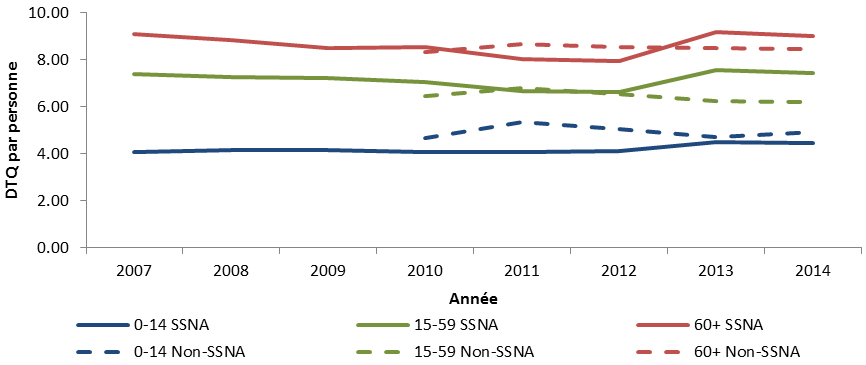
Équivalent textuel
Pratiques de prescription selon le domaine de spécialisation
Les renseignements sur la spécialisation des prescripteurs figuraient dans les données relatives aux médicaments exécutés en pharmacie communautaire pour 2010 à 2014. Au total, 31 spécialités médicales et non médicales ont été répertoriées au moyen d’une autre catégorie intitulée « toute autre spécialité »Note de bas de page 32. Afin de faciliter l’examen des données, ces spécialités ont été classées en huit groupes plus largesNote de bas de page 33 (médecins de famille et omnipraticiens; dermatologues; médecine diagnostique; médecine d’urgence; pédiatrie, médecine; chirurgie; et toute autre spécialité).
Les « praticiens communautaires » ont rédigé 66 % de toutes les ordonnances exécutées par les pharmacies communautaires, suivis des spécialistes inclus dans les catégories « Toute autre spécialité » (21 %) et « Médecine » (5 %). Les antimicrobiens les plus couramment prescrits par les « praticiens communautaires » étaient l’amoxicilline, l’azithromycine et la ciprofloxacine. Bien que l’amoxicilline ait été le principal antimicrobien prescrit par les professionnels de la santé des catégories « Toute autre spécialité » et « Médecine », la clindamycine et la pénicilline V comptaient parmi les trois médicaments les plus souvent prescrits par les praticiens de la catégorie « Toute autre spécialité », alors que l’azithromycine et le sulfaméthoxazole figuraient parmi les trois médicaments les plus souvent prescrits par les praticiens de la catégorie « Médecine ».
Les ordonnances rédigées par les « praticiens communautaires » et les professionnels de la santé des catégories « Toute autre spécialité » et « Médecine » représentaient le plus grand nombre de DTQ par 1 000 habitants en 2014 (Figure 43). Bien que les quantités totales d’antimicrobiens prescrits par les praticiens des différentes spécialités soient demeurées relativement stables au fil du temps par rapport à 2010, la plus importante diminution à cet égard survenue en 2014 a été observée dans la catégorie « Médecine diagnostique » (réduction de 21 %). Une augmentation de 26 % a toutefois été observée en 2014, comparativement à 2010, en ce qui concerne le nombre total d’ordonnances d’antimicrobiens exécutées dans la catégorie « Médecine ». Cette augmentation était principalement attribuable aux taux plus élevés d’exécution des ordonnances d’amoxicilline, d’azithromycine, de céfadroxil, de céfazoline, de nitrofurantoïne et de tétracycline au cours de la période quinquennale.
Figure 43 : Nombre total de doses thérapeutiques quotidiennes par 1 000 habitants des antimicrobiens prescrits par les praticiens des différentes spécialités et exécutés par les pharmacies communautaires au Canada, de 2010 à 2014
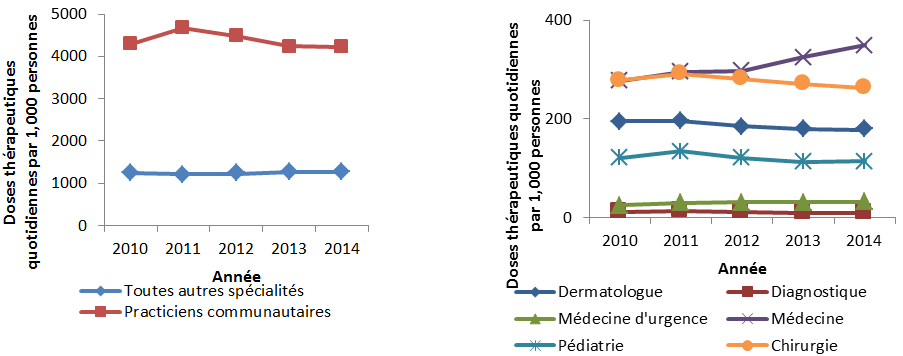
Équivalent textuel
| Classification | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|
| Toutes autres spécialités | 1 247,43 | 1 212,09 | 1 229,37 | 1 260,26 | 1 266,87 |
| Practiciens communautaires | 4 290,56 | 4 670,94 | 4 491,16 | 4 242,06 | 4 221,67 |
| Dermatologue | 195,03 | 196,14 | 185,49 | 180,61 | 178,45 |
| Diagnostique | 12,12 | 13,42 | 11,72 | 10,20 | 9,62 |
| Médecine d’urgence | 25,75 | 29,61 | 30,86 | 30,87 | 31,68 |
| Médicine | 277,33 | 295,82 | 297,79 | 324,48 | 349,36 |
| Pédiatrie | 121,26 | 134,53 | 120,91 | 113,37 | 114,51 |
| Chirurgie | 278,28 | 291,59 | 280,92 | 271,47 | 263,56 |
Le graphique présente les doses quotidiennes définies journalières pour 1 000 personnes pour les antimicrobiens prescrits par les différentes spécialisations et distribués par les pharmacies communautaires (chacun est représenté par sa propre ligne) au Canada de 2010 à 2014. Cela comprend les dermatologues, de diagnostic, la médecine d’urgence, la médecine, la chirurgie, la pédiatrie, les praticiens communautaires et toutes les autres spécialités. L'axe horizontal représente l'année et l'axe vertical représente les doses quotidiennes définies par 1 000 personnes.
En ce qui concerne les quantités totales d’antimicrobiens prescrites par ordonnance, les dermatologues se situaient au premier rang avec 26 DTQ par ordonnance, suivis des praticiens des catégories « Toute autre spécialité » (19 DTQ par ordonnance) et « Médecine » (10 DTQ par ordonnance) (Figure 44). Les plus grandes quantités d’antimicrobiens par ordonnance prescrites par les dermatologues s’expliquent par les traitements de plus longue durée des affections cutanées, comme l’acné. Les principaux médicaments prescrits par ces spécialistes comprennent la sulfadiazine, la doxycycline, la tétracycline et les produits contenant du triméthoprime. Les pratiques de prescription sont demeurées stables au cours de la période quinquennale, aucun changement notable n’ayant été observé quant aux quantités totales d’antimicrobiens par ordonnance prescrites par l’un ou l’autre des spécialistes prescripteurs.
Figure 44 : Nombre total de doses thérapeutiques quotidiennes par ordonnance prescrites par les praticiens des différentes spécialités et exécutées par les pharmacies communautaires au Canada, de 2010 à 2014

Équivalent textuel
| Classification | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|
| Toutes autres spécialités | 18,20 | 18,80 | 18,86 | 18,49 | 18,93 |
| Practiciens communautaires | 9,77 | 10,01 | 9,97 | 9,90 | 9,90 |
| Dermatologue | 24,98 | 25,98 | 26,93 | 26,22 | 26,32 |
| Diagnostique | 8,90 | 9,13 | 8,90 | 8,76 | 8,69 |
| Médecine d’urgence | 8,18 | 8,44 | 8,46 | 8,55 | 8,63 |
| Médicine | 10,69 | 10,70 | 10,70 | 10,54 | 10,42 |
| Pédiatrie | 8,03 | 8,35 | 8,50 | 8,61 | 8,92 |
| Chirurgie | 9,43 | 9,55 | 9,51 | 9,47 | 9,33 |
Le graphique présente les doses quotidiennes définies par prescription pour les antimicrobiens prescrits par différentes spécialisations et distribué par les pharmacies communautaires (chacun est représenté par sa propre ligne) au Canada de 2010 à 2014. Cela comprend les dermatologues, les diagnostiques, la médecine d’urgence, la médecine, la chirurgie, la pédiatrie, praticiens communautaires et toutes les autres spécialités. L'axe horizontal représente l'année et l'axe vertical représente les doses quotidiennes définies par 1000 personnes.
Recommandations d’antimicrobiens selon le diagnostic
En 2014, les praticiens communautaires ont posé 297 millions de diagnostics médicaux, ce qui équivaut à un peu plus de 23 millions de recommandations d’antimicrobiens. Les recommandations d’antimicrobiens ne sont pas nécessairement liées à une ordonnance, puisque le patient pourrait s’être opposé à recevoir une ordonnance d’antimicrobien, ne pas avoir fait exécuter l’ordonnance à la demande du médecin d’attendre une certaine période ou encore avoir décidé de ne pas la faire exécuter; le médecin pourrait avoir fourni un échantillon ou l’ordonnance pourrait avoir constitué le renouvellement d’une ordonnance antérieure.
Huit pour cent de tous les diagnostics ont entraîné la recommandation d’un antimicrobien aux fins de traitement en 2014. Quarante pour cent (40 %) de toutes les recommandations d’antimicrobiens ont été émises pour le traitement d’infections respiratoires. Parmi ces recommandations, 38 % ont été émises pour le traitement d’affections des voies respiratoires supérieures, 21 % pour des bronchites aiguës et 14 % pour des sinusites aiguës. Dans l’ensemble, 82 % de tous les diagnostics de sinusite aiguë ont entraîné la recommandation d’un antimicrobien, suivis des diagnostics de bronchite aiguë (77 %) et de pneumonie (74 %) (Figure 45).
Les enfants (âgés de 0 à 9 ans) présentaient le plus haut taux de recommandations d’antimicrobiens, avec près de huit enfants sur dix ayant reçu une recommandation d’antimicrobiens comme traitement en 2014. Par conséquent, ce groupe d’âge comptait la plus importante proportion de diagnostics donnant lieu à la recommandation d’un antimicrobien (11 %). La plupart des recommandations se rapportaient au traitement des maladies de l’oreille (42 %), suivies des infections des voies respiratoires supérieures (24 %) et des infections de la peau et des tissus mous (8 %). L’amoxicilline était le principal antimicrobien recommandé pour le traitement des maladies de l’oreille (73 % de toutes les recommandations) et des infections des voies respiratoires supérieures (77 %).
Même si les jeunes de 10 à 19 ans présentaient le plus faible taux de recommandations (0,51 par personne) en 2014, ils se classaient au deuxième rang quant à la proportion de diagnostics donnant lieu à la recommandation d’un antimicrobien (10 %). La plupart des recommandations concernaient le traitement des infections des voies respiratoires supérieures (32 %), des maladies de l’oreille (12 %) et de l’acné (8 %). Tout comme ce qui a été observé chez les enfants, l’amoxicilline était le principal antimicrobien recommandé pour le traitement des maladies de l’oreille (61 %) et des infections des voies respiratoires supérieures (51 %).
Sept personnes âgées sur dix se sont vu recommander un antimicrobien en 2014, principalement pour le traitement d’une infection des voies urinaires inférieures ou cystite (16 %), d’une bronchite aiguë (11 %) ou d’une infection de la peau et des tissus mous (10 %). En 2014, 39 % de toutes les recommandations d’antimicrobiens prescrits pour le traitement des infections de la peau et des tissus mous se rapportaient à la céfalexine. Pour ce qui est du traitement de la bronchite aiguë, une proportion équivalente de recommandations se rapportait à l’azithromycine (27 %) et à la clarithromycine (25 %). De même, la ciprofloxacine (41 %) et la nitrofurantoïne (41 %) ont été recommandées pour le traitement des infections des voies urinaires inférieures ou cystites.
Figure 45 : Nombre de diagnostics précis par habitant et pourcentage de ces diagnostics avec recommandations d’un antimicrobien au Canada, en 2014Note de bas de page 34
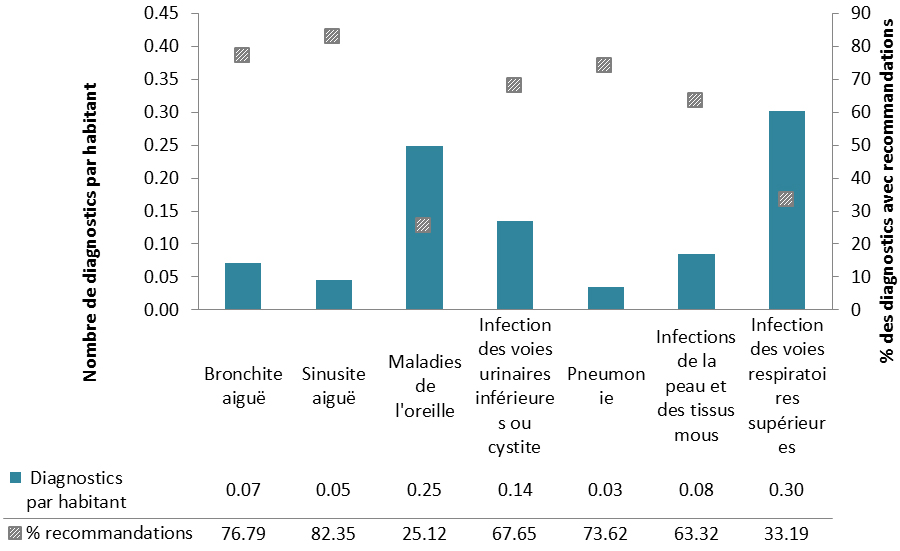
Équivalent textuel
| Diagnostic précis | Nombre de diagnostics par habitant | % des diagnostics avec recommandations |
|---|---|---|
| Bronchite aiguë | 0,07 | 76,79 |
| Sinusite aiguë | 0,05 | 82,35 |
| Maladies de l’oreille | 0,25 | 25,12 |
| Infections des voies urinaires inférieures ou cystite | 0,14 | 67,65 |
| Pneumonie | 0,03 | 73,62 |
| Infections de la peau et des tissus mous | 0,08 | 63,32 |
| Infection des voies respiratoires supérieures | 0,30 | 33,19 |
Le graphique à barres montre le nombre total de diagnostics pour chaque catégorie de diagnostic par personne et des boîtes montrent le pourcentage de chaque diagnostic qui a abouti à une recommandation d’antimicrobiens au Canada au cours de 2014. L'axe horizontal représente la classe de diagnostic. L'axe vertical gauche représente le nombre de diagnostics par personne tandis que l'axe vertical de droite représente le pourcentage de diagnostics avec une recommandation d’antimicrobiens.
En moyenne, le pourcentage de diagnostics pour lesquels un antimicrobien a été recommandé est demeuré stable au fil du temps, alors que les taux de recommandations d’antimicrobiens par personne ont chuté (Figure 46).
Figure 46 : Taux globaux de recommandations d’antimicrobiens et pourcentage des diagnostics ayant donné lieu à la recommandation d’un antimicrobien par les médecins en milieu communautaire pour les troubles sélectionnés, au Canada, de 2007 à 2014
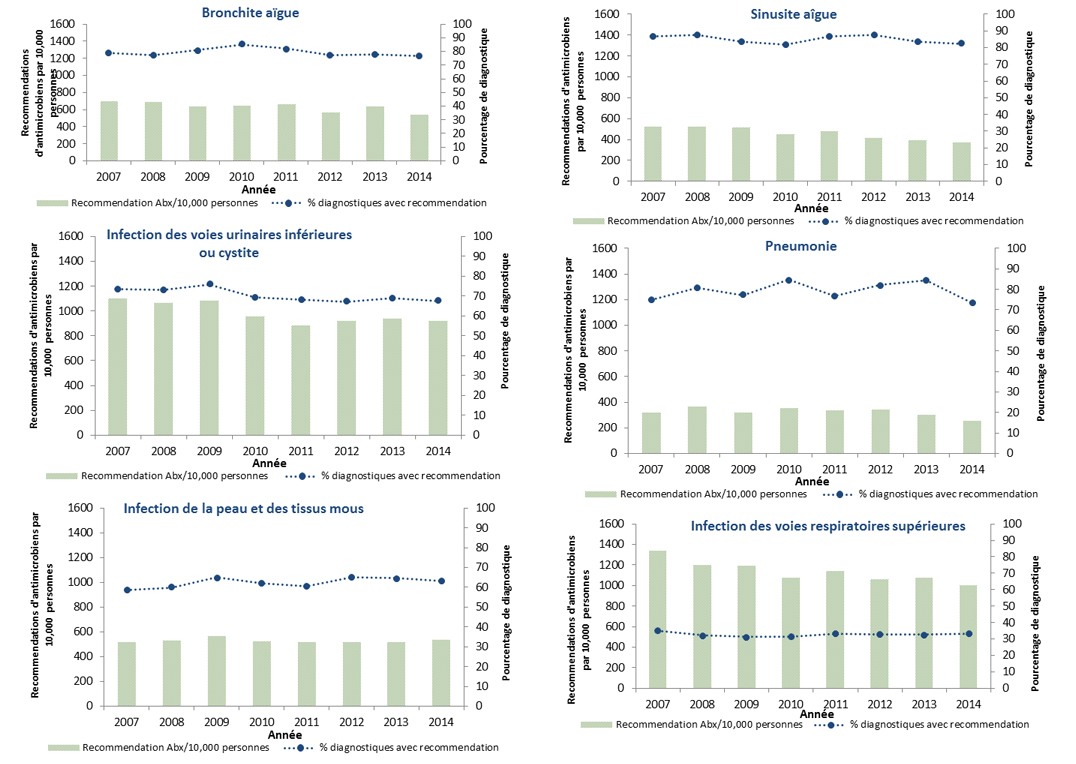
Équivalent textuel
| Diagnostics précis | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|---|---|---|---|---|
| Bronchite aiguë | % de diagnostic | 78,9 | 77,3 | 80,9 | 85,1 | 82,1 | 77,0 | 77,9 | 76,8 |
| Recommendations d’antimicrobiens par 10 000 personnes | 694 | 685 | 634 | 643 | 661 | 566 | 632 | 541 | |
| Sinusite aiguë | % de diagnostic | 86,7 | 87,6 | 83,7 | 81,6 | 86,7 | 87,8 | 83,5 | 82,4 |
| Recommendations d’antimicrobiens par 10 000 personnes | 522 | 521 | 515 | 454 | 482 | 412 | 392 | 371 | |
| Infections des voies urinaires inférieures ou cystite | % de diagnostic | 73,5 | 73,3 | 76,0 | 69,3 | 68,3 | 67,3 | 68,9 | 67,6 |
| Recommendations d’antimicrobiens par 10 000 personnes | 1099 | 1061 | 1081 | 953 | 884 | 916 | 935 | 916 | |
| Pneumonie | % de diagnostic | 75,0 | 80,9 | 77,3 | 84,8 | 76,6 | 82,1 | 84,5 | 73,6 |
| Recommendations d’antimicrobiens par 10 000 personnes | 317 | 365 | 320 | 353 | 334 | 342 | 303 | 255 | |
| Infections de la peau et des tissus mous | % de diagnostic | 58,6 | 59,9 | 64,9 | 62,1 | 60,6 | 65,2 | 64,5 | 63,3 |
| Recommendations d’antimicrobiens par 10 000 personnes | 513 | 530 | 562 | 524 | 516 | 514 | 519 | 532 | |
| Infection des voies respiratoires supérieures | % de diagnostic | 35,1 | 32,1 | 31,2 | 31,5 | 33,3 | 32,8 | 32,6 | 33,2 |
| Recommendations d’antimicrobiens par 10 000 personnes | 1334 | 1197 | 1192 | 1076 | 1142 | 1058 | 1073 | 1002 | |
Ces graphiques à barres représentent les taux globaux de recommandations d’antimicrobiens et pourcentage des diagnostics ayant donné lieu à la recommandation d’un antimicrobien par les médecins en milieu communautaire pour les trouble sélectionnés (Bronchite aiguë, Sinusite aiguë, Infections des voies urinaires inférieures ou cystite, Pneumonie, Infections de la peau et des tissus mous et Infection des voies respiratoires supérieures) au Canada en 2007 à 2014. L’axe horizontal représente les années et les axes verticaux représentent le pourcentage de diagnostics et les recommandations d’antimicrobiens par 10 000 personnes.
Encadré 8 : Pratiques de prescription des médecins dans le traitement des infections des voies urinaires inférieures ou cystites au Canada Figure A : Antimicrobiens recommandés (par 10 000 femmes) pour le traitement des IVU inférieures ou cystites, au Canada, entre 2007 et 2014
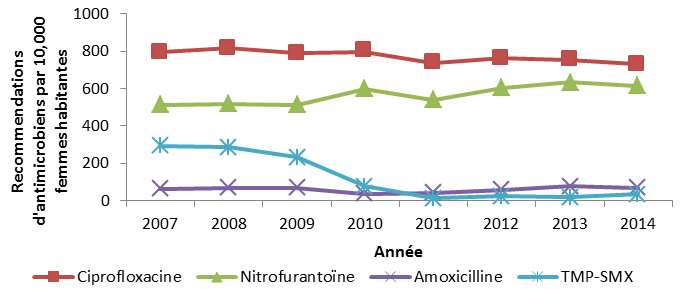
Équivalent textuel
- Zalmanovichi TA, Green H, Paul M, et al. Antimicrobial agents for treating uncomplicated urinary tract infections in women. Cochrane Database of Systematic Reviews 2010;10. Art. No: CD007182. DOI: 10.1002/14651858. CD007182.pub2.
- National Institute for Health and Care Excellence (NICE). Urinary tract infections in adults. London: NICE; 2015. https://www.nice.org.uk/guidance/qs90/resources/urinary-tract-infections-in-adults-2098962322117.
- Gupta K, Hooton TM, Naber KG, et al. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases. Clin Infect Dis 2011;52:e103-e120.
- Holmer HK, Elman MR, Evans CT, et al. Prescribing without guidance: Antibiotic prescribing for male urinary tract infection (UTI) in primary care. Poster session presented at: IDWeek; 2015 October 7-11; San Diego, CA, USA.
- Nicolle L, Anderson PAM, Conly J, et al. Uncomplicated urinary tract infection in women. Current practice and the effect of antibiotic resistance on empiric therapy. Can Fam Physician 2006;52:612-618.
- Nguyen D, Dickter J, Guo R, et al. The misuse of ciprofloxacin in outpatient treatment of acute uncomplicated cystitis (AUC) – a retrospective study. Poster session presented at: IDWeek; 2015 October 7-11; San Diego, CA, USA.
- National Guideline Clearinghouse (NGC). Guideline synthesis: Diagnosis and management of lower urinary tract infection. In: National Guideline Clearinghouse (NGC). Rockville MD: Agency for Healthcare Research and Quality (AHRQ); 2008 Jan (revised 2012 Mar). http://www.guideline.gov/syntheses/synthesis.aspx?id=35626&search=urinary+tract+infections.
- Dykehouse L, Dumkov L, Jameson A. Evaluating the need for antimicrobial stewardship efforts in the outpatient setting: A focus on appropriate prescribing for urinary tract infections. Poster session presented at: IDWeek; 2015 October 7-11; San Diego, CA, USA.
Achats et utilisation par les hôpitaux
En 2014, les hôpitaux canadiens ont acheté 38 340 kilogrammes d’antimicrobiens, à un coût de 104 millions de dollars. En rajustant ce chiffre en fonction du nombre de congés d’hôpital accordés en 2014, il équivaut à environ 6 DTQ d’antimicrobiens achetés par congé; ce chiffre est resté relativement stable au cours de la période de surveillance allant de 2002 à 2014 (Figure 47).
La ciprofloxacine était l’antimicrobien le plus fréquemment acheté en 2014 (10 % de toutes les DTQ d’antimicrobiens achetés), suivie par l’amoxicilline, l’azithromycine, la ceftriaxone et la doxycycline (7 % chacune) (Tableau 16). Bien que les achats d’amoxicilline et de ciprofloxacine soient demeurés stables entre 2002 et 2014, la ceftriaxone et la doxycycline présentaient la plus forte augmentation au cours de cette période. Les achats de ceftriaxone sont passés de 79 DTQ par 1 000 congés d’hôpital en 2002 à 440 DTQ par 1 000 congés d’hôpital en 2014, tandis que les achats de doxycycline sont passés de 124 à 417 DTQ par 1 000 congés d’hôpital au cours de la même période.
Comme dans le cas des variations observées dans les données relatives aux médicaments exécutés en pharmacie communautaire, nous observons d’importantes variations entre les provinces dans les achats d’antimicrobiens par les hôpitaux en 2014. Le Manitoba présentait le plus grand nombre de DTQ d’antimicrobiens achetés par congé d’hôpital que toute autre province depuis 2003, soit 49 % de plus qu’en Nouvelle-Écosse, la province présentant le deuxième taux d’achat le plus élevé.
Figure 47 : Doses thérapeutiques quotidiennes par congé d’hôpital pour des antimicrobiens achetés par les hôpitaux au Canada, par province, en 2014
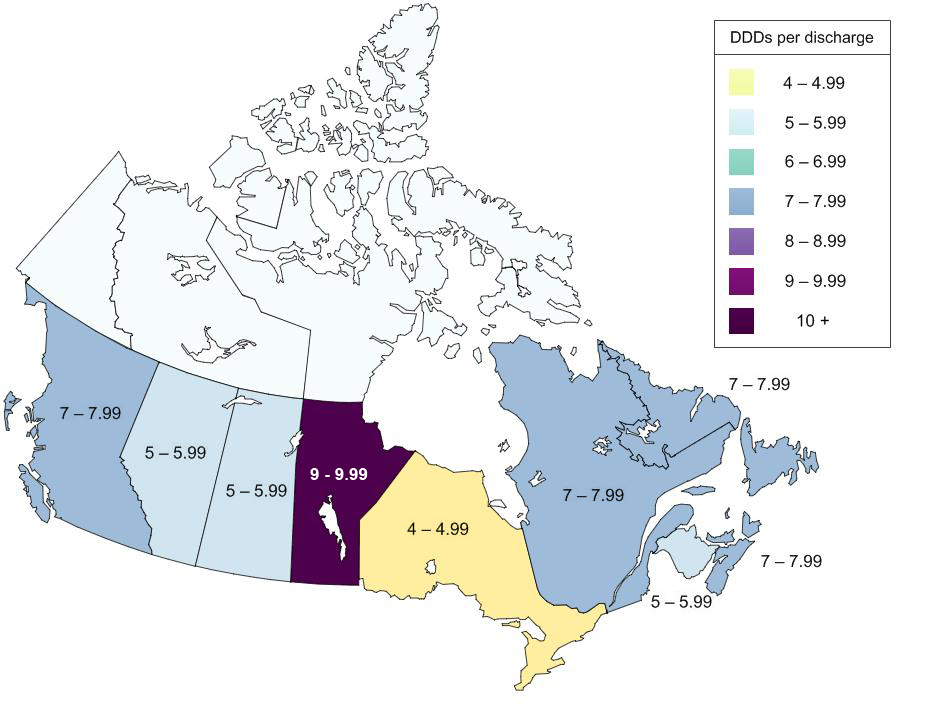
Équivalent textuel
| Province | DTQ par achats |
|---|---|
| Yukon | - |
| Territoires du Nord-Ouest | - |
| Nunavut | - |
| Colombie-Britannique | 7-7,99 |
| Alberta | 5-5,99 |
| Saskatchewan | 5-5,99 |
| Manitoba | 10+ |
| Ontario | 4-4,99 |
| Québec | 7-7,99 |
| Nouveau-Brunswick | 5-5,99 |
| Nouvelle-Écosse | 7-7,99 |
| Île-du-Prince-Édouard | 7-7,99 |
| Terre-Neuve-et-Labrador | 7-7,99 |
La carte Canadienne est utilisée pour représenter les variations dans les doses thérapeutiques quotidiennes par congé d'hôpital pour des antimicrobiens achetés par les provinces en 2014.
Des différences importantes dans les achats de certains antimicrobiens ont été observées au Manitoba comparativement aux autres provinces (Tableau 17), en particulier pour l’amoxicilline (2 302 DTQ par 1 000 congés d’hôpital par rapport à 225 DTQ par 1 000 congés d’hôpital en Nouvelle-Écosse), la céfoxitine (1 497 DTQ par 1 000 congés d’hôpital par rapport à 60 DTQ par 1 000 congés d’hôpital à Terre-Neuve-et-Labrador et à l’Îledu-Prince-Édouard) et la céfalexine (877 DTQ par 1 000 congés d’hôpital par rapport à 93 DTQ par 1 000 congés d’hôpital au Québec). De même, la Nouvelle-Écosse a acheté les plus grosses quantités d’imipénème et de cilastatine (54 DTQ par 1 000 congés d’hôpital) comparativement au Québec (17 DTQ par 1 000 congés d’hôpital), qui se situait au deuxième rang pour ce qui est des taux d’achat de ces antimicrobiens, et à la Saskatchewan (0,01 DTQ par 1 000 congés d’hôpital), qui affichait les plus faibles taux d’achat en 2014.
Contrairement aux données relatives aux médicaments exécutés en pharmacie communautaire ayant révélé des points communs entre les cinq principaux antimicrobiens exécutés dans l’ensemble des provinces, des différences importantes ont été observées en ce qui concerne les antimicrobiens achetés par les hôpitaux. La ceftriaxone était le seul médicament à se classer parmi les cinq principaux antimicrobiens achetés par les hôpitaux de toutes les provinces, à l’exception du Québec. Plus précisément, les principaux antimicrobiens achetés par les hôpitaux de chaque province variaient, l’Alberta ayant acheté le plus souvent la ceftriaxone, la Colombie-Britannique, la doxycycline, le Manitoba, Terre-NeuveetLabrador et l’ÎleduPrinceÉdouard, l’amoxicilline, la Saskatchewan, l’azithromycine, le NouveauBrunswick, la céfazoline, et l’Ontario, le Québec et la Nouvelle-Écosse, la ciprofloxacine. La nitrofurantoïne comptait parmi les dix principaux antimicrobiens achetés par les hôpitaux de la ColombieBritannique en 2014, mais ne figurait pas parmi les dix principaux antimicrobiens de toute autre province. Les raisons expliquant les différences en matière d’utilisation d’antimicrobiens entre les provinces ne sont pas bien comprises, mais sont probablement attribuables (du moins en partie) aux différentes listes de médicaments des hôpitaux et des différents protocoles de traitement.
| Antimicrobiens | RangTableau 16 Note de bas de page * | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|---|---|---|---|
| Amoxicilline | 2 | 351,2 | 376,5 | 392,9 | 407,4 | 415,2 | 433,6 | 455,6 |
| Amoxicilline et inhibiteur enzymatique | 7 | 149,9 | 173,5 | 174,1 | 210,1 | 236,5 | 238,6 | 314,2 |
| Azithromycine | 3 | 308,0 | 348,0 | 356,4 | 404,7 | 456,1 | 481,1 | 446,5 |
| Céfazoline | 6 | 549,8 | 584,4 | 546,3 | 535,7 | 541,7 | 448,2 | 399,1 |
| Céfoxitine | 8 | 514,9 | 621,7 | 468,4 | 456,5 | 361,6 | 264,0 | 312,4 |
| Céftriaxone | 4 | 219,3 | 270,3 | 272,9 | 335,0 | 366,0 | 413,0 | 440,0 |
| Ciprofloxacine | 1 | 664,8 | 649,0 | 569,4 | 557,4 | 599,9 | 690,6 | 643,5 |
| Doxycycline | 5 | 474,5 | 313,3 | 332,7 | 410,1 | 337,4 | 366,4 | 417,5 |
| Pipéracilline et inhibiteur enzymatique | 9 | 144,9 | 202,8 | 209,4 | 259,9 | 270,9 | 276,7 | 295,5 |
| Sulfaméthoxazole et triméthoprime | 10 | 293,1 | 302,6 | 278,2 | 279,1 | 274,9 | 269,8 | 260,3 |
| TOTAL | 0 | 3 670,4 | 3 842,1 | 3 600,7 | 3 855,9 | 3 860,2 | 3 882 | 3 984,6 |
|
||||||||
| Antimicrobial | RangTableau 17 Note de bas de page * | C,-B, | ALB | SASK | MAN | ONT | QC | N,-B, | N,-É, | T,-N, & Î,P,E |
|---|---|---|---|---|---|---|---|---|---|---|
| Amoxicilline | 2 | 609,5 | 405,1 | 518,1 | 2302,3 | 290,8 | 300,6 | 225,6 | 360,9 | 930,0 |
| Amoxicilline et inhibiteur enzymatique | 7 | 299,6 | 341,6 | 160,7 | 566,4 | 189,7 | 489,1 | 246,3 | 269,2 | 422,9 |
| Azithromycine | 3 | 583,2 | 387,1 | 721,7 | 706,0 | 328,3 | 522,8 | 313,2 | 277,8 | 420,5 |
| Céfazoline | 6 | 33,5 | 408,8 | 272,8 | 328,6 | 374,3 | 575,3 | 969,1 | 525,2 | 574,4 |
| Céfoxitine | 8 | 261,1 | 137,7 | 369,4 | 1 497,1 | 183,0 | 449,4 | 162,8 | 312,7 | 60,2 |
| Céftriaxone | 4 | 589,7 | 539,3 | 508,6 | 955,5 | 403,5 | 252,1 | 336,3 | 400,3 | 669,7 |
| Ciprofloxacine | 1 | 386,3 | 478,3 | 284,8 | 514,9 | 504,7 | 1 077,6 | 556,6 | 1482,9 | 680,7 |
| Doxycycline | 5 | 1 110,5 | 446,3 | 311,5 | 287,2 | 366,3 | 177,9 | 211,1 | 341,0 | 242,7 |
| Pipéracilline et inhibiteur enzymatique | 9 | 314,5 | 213,5 | 228,0 | 235,6 | 227,7 | 476,3 | 262,1 | 217,8 | 200,7 |
| Sulfaméthoxazole et triméthoprime | 10 | 296,1 | 279,7 | 257,5 | 716,8 | 215,1 | 211,5 | 157,2 | 284,1 | 440,3 |
| TOTAL | 0 | 4 484 | 3 637,4 | 3 633,1 | 8 110,4 | 3 083,4 | 4 532,6 | 3 440,3 | 4 471,9 | 4 642,1 |
|
||||||||||
Encadré 9 : Utilisation des antimicrobiens dans les hôpitaux participant au Programme canadien de surveillance des infections nosocomiales (PCSIN) – Projet pilote Figure A : Les dix antimicrobiens les plus couramment prescrits selon les doses thérapeutiques quotidiennes par 1 000 patients-jour déclarées par les hôpitaux participants du PCSIN au Canada, entre 2009 et 2013
Équivalent textuel
Programme canadien de surveillance des infections nosocomiales
Perspective internationale
L’European Surveillance of Antimicrobial Consumption Network (ESACNet) recueille des données des pays membres européens pour estimer la consommation totale d’antimicrobiens dans les secteurs hospitaliers et communautaires.
En 2014, un total de 30 pays européens ont fourni des renseignements à l’ESACNet sur les antimicrobiens consommés au sein de leurs collectivités. Lorsque ces données ont été comparées au taux de consommation d’antimicrobiens en milieu extrahospitalier au Canada en 2014, le Canada (17,8 DTQ par 1 000 habitants-jour) s’est classé au 12e rang sur 31 pays par ordre croissant d’utilisation d’antimicrobiens, le taux déclaré au Canada équivalant à près de la moitié de celui signalé par la Grèce (pays où l’utilisation est la plus élevée, soit 34 DTQ par 1 000 habitants-jour) (Figure 48)Note de bas de page bq.
Par ailleurs, 23 pays européens ont fourni des renseignements à l’ESACNet sur les quantités totales d’antimicrobiens achetées par leurs hôpitaux en 2014. Après comparaison de ces données, le Canada (1,4 DTQ par 1 000 congés d’hôpital par jour) s’est classé au 3e rang sur 24 pays par ordre croissant d’utilisation totale d’antimicrobiens dans les hôpitaux, la quantité d’antimicrobiens achetée par les hôpitaux du Canada équivalant à près de la moitié de celle achetée par les hôpitaux du Royaume-Uni (2,6 DTQ par 1 000 habitants-jour) (Figure 49)Note de bas de page bq.
En 2011, aux États-Unis, les fournisseurs de soins de santé ont prescrit 262,5 millions d’antibiothérapies (842 ordonnances par 1 000 personnes) en milieu communautaire. La plupart des ordonnances inappropriées d’antibiotiques rédigées dans les cliniques de consultation externe aux ÉtatsUnis se rapportent aux infections respiratoires aiguës. En 2010, 71 % de toutes les consultations externes pour une bronchite aiguë ont donné lieu à une ordonnance d’antibiotique. Par ailleurs, entre la moitié des années 1990 et 2008, les taux d’ordonnances d’antibiotiques en milieu extrahospitalier pour des enfants (≤ 14 ans) atteints d’une infection aiguë des voies respiratoires ont diminué de 11 %Note de bas de page br.
L’utilisation inappropriée d’antibiotiques est également observée dans les hôpitaux aux États-Unis où, en 2010, 55,7 % des patients de 323 hôpitaux, qui avaient obtenu leur congé, avaient reçu des antibiotiques pendant leur séjour à l’hôpital. Dans presque 37,2 % des cas d’ordonnances examinés, l’utilisation des antibiotiques aurait pu être amélioréeNote de bas de page br.
Figure 48 : Utilisation d’antimicrobiens en milieu extrahospitalier (DTQ par 1 000 habitants-jour) déclarée par 30 pays européens et le Canada
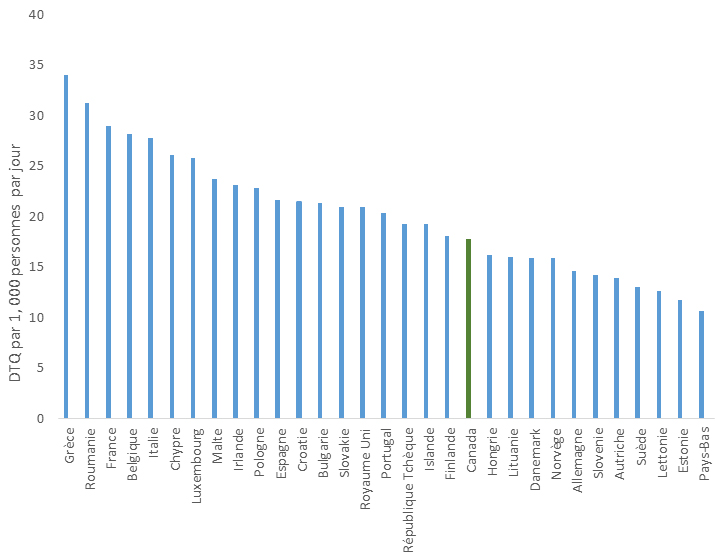
Équivalent textuel
| Pays | DTQ par 1 000 personnes par jour |
|---|---|
| Grèce | 34 |
| Roumanie | 31,2 |
| France | 29 |
| Belgique | 28,2 |
| Italie | 27,8 |
| Chypre | 26,1 |
| Luxembourg | 25,8 |
| Malte | 23,7 |
| Irelande | 23,1 |
| Pologne | 22,8 |
| Espagne | 21,6 |
| Croatie | 21,4 |
| Bulgarie | 21,3 |
| Slovakie | 20,9 |
| Royaume Uni | 20,9 |
| Portugal | 20,3 |
| République Tchèque | 19,3 |
| Islande | 19,3 |
| Finlande | 18,1 |
| Canada | 17,79 |
| Hongrie | 16,2 |
| Lithuanie | 16 |
| Danemark | 15,9 |
| Norvège | 15,9 |
| Allemagne | 14,6 |
| Slovenie | 14,2 |
| Austriche | 13,9 |
| Suède | 13 |
| Lettonie | 12,6 |
| Estonie | 11,7 |
| Pays-Bas | 10,6 |
Ce graphique à barres représente l’utilisation d’antimicrobiens ambulatoire du Canada et de 30 pays européens. L’utilisation d’antimicrobiens est mesurée à l’aide de doses quotidiennes définies par 1 000 personnes par jour. L’axe horizontal représente le pays et l’axe vertical représente les doses quotidiennes définies par 1 000 personnes par jour.
Figure 49 : Utilisation d’antimicrobiens en milieu hospitalier (DTQ par 1 000 habitants-jour) déclarée par 23 pays européens et le Canada
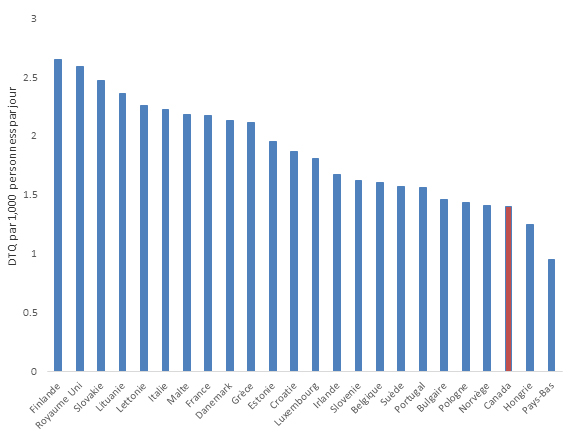
Équivalent textuel
| Pays | DTQ par 1 000 habitants-jour |
|---|---|
| Finlande | 2,65 |
| Royaume Uni | 2,59 |
| Slovakie | 2,47 |
| Lituanie | 2,36 |
| Lettonie | 2,26 |
| Italie | 2,22 |
| Malte | 2,18 |
| France | 2,17 |
| Danemark | 2,13 |
| Grèce | 2,11 |
| Estonie | 1,95 |
| Croatie | 1,87 |
| Luxembourg | 1,81 |
| Irlande | 1,67 |
| Slovenie | 1,62 |
| Belgique | 1,6 |
| Suède | 1,57 |
| Portugal | 1,56 |
| Bulgaire | 1,46 |
| Pologne | 1,43 |
| Norvège | 1,41 |
| Canada | 1,4 |
| Hongrie | 1,25 |
| Pays-Bas | 0,95 |
Ce graphique à barres présente l'utilisation d'antimicrobiens en milieu hospitalier en 2014 (DTQ par 1,000 personnes par jour) déclarée par 23 pays européens et le Canada. L'axe horizontal représente les pays et l'axe vertical DTQ par 1,000 personnes par jour.
Utilisation des antimicrobiens chez les animaux
Quantités totales d’antimicrobiens distribués pour la vente aux fins d’utilisation chez les animaux
L’Institut canadien de la santé animale (ICSA) fournit, sur une base volontaire, des renseignements sur les antimicrobiens distribués pour la vente et destinés aux animaux, depuis 2006. Ces données représentent les quantités d’antimicrobiens distribués pour la vente par les entreprises membres et ne prennent pas en compte les quantités d’antimicrobiens importés pour usage personnel ou comme ingrédients pharmaceutiques actifs destinés aux préparations.
En 2014, 1,5 million de kilogrammes d’ingrédients actifs d’antimicrobiens ont été distribués pour utilisation chez les animaux, soit 5 % de plus qu’en 2013 et 12 % de moins qu’en 2006. Au cours des cinq dernières années (20102014), il y a eu une augmentation de 1 %. Au Canada, 99 % des antimicrobiens distribués en 2014 visaient les animaux destinés à l’alimentation et moins de 1 % étaient destinés aux animaux de compagnie. De plus, la majorité (73 %) des antimicrobiens distribués appartenaient aux mêmes catégories que celles utilisées en médecine humaine. L’utilisation inappropriée des antimicrobiens chez les animaux destinés à l’alimentation est un problème de santé publique, car elle entraîne l’apparition de bactéries résistantes chez les animaux, qui peuvent être transmises aux humains par la chaîne alimentaireNote de bas de page 35.
Comme pour les années précédentes, les classes d’antimicrobiens distribués pour l’utilisation chez les animaux étaient, en ordre décroissant, les tétracyclines, les ionophores, les bêtalactamines, les « autres antimicrobiens »Note de bas de page 36 et les macrolides. La Direction des médicaments vétérinaires de Santé Canada classe les fluoroquinolones dans la catégorie « de très haute importance en médecine humaineNote de bas de page 37 ». L’utilisation de fluoroquinolones est homologuée pour certaines espèces animales au Canada et une mise en garde est inscrite sur leur étiquette contre une utilisation en dérogation des directives qui y sont prescrites en raison des préoccupations relatives à la résistance aux antimicrobiens. La quantité globale de fluoroquinolones vendues pour utilisation chez les animaux a augmenté de 14 % entre 2013 et 2014, bien qu’il y ait eu une augmentation de 40 % depuis 2010 (probablement attribuable en partie à l’approbation d’une nouvelle indication d’emploi des fluoroquinolones).
Les céphalosporines de troisième génération sont également considérées comme étant de très haute importance en médecine humaine, sont homologuées pour utilisation chez certaines espèces animales au Canada et leur étiquette porte la même mention de mise en garde au sujet de la résistance aux antimicrobiens. Les données de l’ICSA présentent un déclin de 60 % de la quantité de céphalosporines distribuées à usage vétérinaire entre 2011 et 2014. Note de bas de page 38
Des différences interprovinciales et provinciales ont été observées au fil du temps dans les quantités et les types d’antimicrobiens distribués. La Colombie-Britannique, l’Alberta, le Manitoba et l’Ontario ont déclaré une augmentation des quantités d’antimicrobiens distribués pour la vente entre 2013 et 2014, les augmentations les plus marquées ayant été observées en Ontario et en Alberta. Au Québec et dans les provinces de l’Atlantique, on a constaté une diminution des quantités d’antimicrobiens distribués pour la vente entre 2013 et 2014. Ces valeurs ne tiennent pas compte des variations des populations sous-jacentes ou de la pression exercée par les maladies. Il convient de noter qu’une distribution interprovinciale d’antimicrobiens est possible après la saisie des données de surveillance.
Figure 50 : Quantité d’antimicrobiens (kg) distribués pour la vente à usage vétérinaire, par province, 2011-2014
Source des données : Institut canadien de la santé animale (ICSA)
Les valeurs ne comprennent pas l’importation pour usage personnel et l’importation comme ingrédients pharmaceutiques actifs destinés aux préparations.
Il est possible que des antimicrobiens aient été redistribués dans d’autres provinces après leur distribution dans les cliniques vétérinaires.
Cette Figure ne tient pas compte des différences provinciales pour ce qui est du nombre ou du type d’animaux et de la pression exercée par les maladies.
Équivalent textuel
| 2011 | 2012 | 2013 | 2014 | |
|---|---|---|---|---|
| CB | 67 755 | 74 376 | 69 189 | 73 848 |
| ALB | 271 788 | 381 193 | 271 106 | 337 394 |
| SASK | 79 099 | 77 971 | 76 132 | 76 215 |
| MAN | 199 166 | 178 577 | 182 292 | 191 745 |
| ONT | 340 483 | 386 917 | 306 886 | 400 063 |
| QC | 543 135 | 440 364 | 513 266 | 438 297 |
| NÉ | 46 292 | 50 797 | 29 732 | 19 688 |
| NB | 8 329 | 7 959 | 7 180 | 6 526 |
| ÎPÉ | 7 465 | 3 781 | 4 164 | 1 103 |
| TN | 13 907 | 17 322 | 18 544 | 3 706 |
L’histogramme groupé présente la quantité d’antimicrobiens (kg) distribués pour la vente à usage vétérinaire, par province et année, de 2011 à 2014. L’axe horizontal représente les provinces et l’axe vertical la quantité d'ingrédients actif (kg).
Comme la quantité totale d'antimicrobiens distribués peut être fortement influencée par les nombres et les types d'animaux, des rajustements en fonction des nombres et des poids de la population animale ont été apportés aux quantités annuelles nationales. À l'aide de ces rajustements, la quantité totale d'antimicrobiens distribués est demeurée relativement stable au fil du temps, soit une augmentation de 3 % depuis 2006 et de 1 % depuis 2013. Au cours des cinq dernières années (2010 à 2014), il y a eu une augmentation de 16 %. Cependant, ni cette mesure corrigée ni le nombre de kilogrammes bruts d'ingrédients actifs ne tiennent compte des différentes puissances des antimicrobiens, qui est un facteur important à prendre en considération au moment d'évaluer les tendances en matière d'utilisation d'antimicrobiens au fil du temps.
Figure 51 : Antimicrobiens importants sur le plan médicalNote de bas de page 39 distribués pour utilisation chez les animaux au fil du temps, mesurés en kilogrammes et en milligrammes d’ingrédients actifs, rajustés en fonction des populations et des poids, de 2006 à 2014
Sources des données : ICSA, Statistique Canada, Agriculture et Agroalimentaire Canada et Canada Hippique.
*Excluent les antimicrobiens vendus destinés aux animaux de compagnie.
Les valeurs ne comprennent pas l'importation pour usage personnel et l'importation comme ingrédients pharmaceutiques actifs destinés aux préparations.
Le dénominateur a été calculé à l'aide des poids standard utilisé par le projet European Surveillance of Veterinary Antimicrobial Consumption (Surveillance européenne de la consommation d'antimicrobiens) (voir le chapitre 3 portant sur l'utilisation des antimicrobiens chez les animaux du Rapport annuel du PICRA de 2014 pour obtenir plus de détails).
Cette figure comprend les données de 2010 concernant les chevaux vivants.
Équivalent textuel
| Année | Total (kg) | Total mg ajusté en fonction des populations et des poids |
|---|---|---|
| 2006 | 1 310 373 | 159 |
| 2007 | 1 171 796 | 143 |
| 2008 | 1 143 187 | 140 |
| 2009 | 1 141 213 | 151 |
| 2010 | 1 037 313 | 141 |
| 2011 | 1 121 831 | 160 |
| 2012 | 1 117 457 | 161 |
| 2013 | 1 112 738 | 162 |
| 2014 | 1 121 297 | 162 |
Ce graphique linéaire représente deux lignes qui représentent les totaux d’antimicrobien importants sur le plan médical distribués pour utilisation chez les animaux au fil du temps, mesurés en kilogrammes et en milligrammes d’ingrédient actifs, ajustés en fonction des populations et des poids, de 2006 à 2014.
Pour la première fois en 2014, l’ICSA a présenté ses données de distribution selon la forme pharmaceutique ou la voie d’administration prévue (aliments, eau, injection, orale/topique, intramammaire). Dans l’ensemble, les antimicrobiens sont principalement distribués pour utilisation chez les animaux dans les aliments (Figure 52).
Figure 52 : Quantité d’antimicrobiens (% du poids total en kg) distribués à usage vétérinaire, par voie d’administration, 2014
Source des données : Institut canadien de la santé animale (ICSA)
Équivalent textuel
| Voie d’administration | Quantité d’antimicrobiens (% du poids total) |
|---|---|
| Orale/topique | 1,6% |
| Eau | 7,6% |
| Aliments | 84,4% |
| Intra-mammaire | 0,1% |
| Injection | 6,3% |
Chaque partie du diagramme circulaire représente la quantité d’antimicrobiens, en pourcentage du poids total en kg, distribués à usage vétérinaire, par voie d'administration au Canada en 2014.
Indication pour l’utilisation des antimicrobiens chez les animaux
Il existe trois raisons de recourir aux antimicrobiens chez les animaux au Canada : pour traiter la maladie, prévenir la maladie et pour améliorer l’indice de transformation ou stimuler la croissance (p. ex. production). Le recours à des antimicrobiens à des fins de stimulation de la croissance est interdit dans l’Union européenne. Au Canada et aux États-Unis, certaines mesures sont actuellement prises pour retirer les fins de production sur les étiquettes d’antimicrobiens importants sur le plan médical afin de promouvoir l’utilisation judicieuse des antimicrobiens chez les animaux et de limiter l’apparition d’agents pathogènes résistants chez les animaux ainsi que leur transmission aux humains par la chaîne alimentaireNote de bas de page 40. Des renseignements sur les raisons de recourir aux antimicrobiens chez les animaux d’élevage sont recueillis par le PICRA, grâce à la surveillance des sentinelles bénévoles dans les fermes d’élevage de porcs en croissance-finition et de poulets à griller.
Les conclusions de la composante Surveillance à la ferme du PICRA révèlent d’importantes différences dans les types et les quantités relatives d’antimicrobiens utilisés dans les différents secteurs de production d’aliments d’origine animale (Figure 53). En 2014, les vétérinaires et les agriculteurs participants, qui représentaient 9 % des élevages de porcs et 10 % des élevages de poulets à griller à l’échelle nationale, ont déclaré ne pas avoir utilisé d’antimicrobiens, toutes voies d’administration confondues. Parmi les fermes participantes, ces chiffres représentaient une légère baisse par rapport au taux d’utilisation de 12 % en 2013 dans les élevages de porcs et aucun changement par rapport au taux de 10 % pour 2013 et 2014 dans les élevages de poulets à griller. Comme dans le cas des données de l’ISCA, dans les fermes ayant déclaré utiliser des antimicrobiens, la majorité sont administrés par l’alimentation, plutôt que par injection ou par l’eau.
Dans l’ensemble, la plus grande quantité d’antimicrobiens utilisés (corrigée en fonction des populations et des poids) dans les fermes de porcs en croissance-finition et de poulets à griller échantillonnées visait la prévention de maladies, soit 47 % et 81 %, respectivement (Figure 54). Lorsque les données de 2014 ont été comparées à celles de 2013, la tendance observée dans les fermes de poulets à griller révélait une plus grande utilisation d’antimicrobiens pour la prévention des maladies et une plus faible utilisation de ces agents pour la stimulation de la croissance. Au cours de la même période, dans les fermes de porcs en croissance-finition, il y a eu une augmentation de la quantité totale d’antimicrobiens utilisés, avec une augmentation de leur utilisation pour la stimulation de la croissance – 38 % en 2014 comparativement à 28 % en 2013.
En 2014, dans les fermes de poulets à griller, 84 % de la quantité d’antimicrobiens utilisés dans les aliments (rajustée en fonction des populations et des poids) était destinée principalement à prévenir l’entérite nécrotique causée par Clostridium perfringens (macrolides, pénicillines, streptogramines, bacitracine et orthosomycine) et la coccidiose (ionophores et anticoccidiens chimiques). Quatorze pour cent des producteurs d’élevage ont déclaré avoir administré de la pénicilline, l’association triméthoprimesulfamide et des tétracyclines dans les aliments aux fins de traitement de maladies. Seulement 4 % des producteurs de poulets à griller ont affirmé avoir utilisé des antimicrobiens à des fins de production (bacitracine, virginiamycine et pénicilline), soit une baisse de 12 % par rapport à l’année précédente. Les producteurs ont déclaré une plus grande utilisation d’antimicrobiens dans l’eau; le taux d’utilisation qui était de 7 % en 2013 est maintenant passé à 14 %.
En ce qui concerne les fermes d’élevage de porcs en croissance-finition ayant déclaré avoir utilisé des antimicrobiens en 2014, 15 % de la quantité des antimicrobiens utilisés dans les aliments (rajustée en fonction des populations et des poids) était destinée au traitement des maladies, 47 % à la prévention des maladies et 38 % à des fins de production. La plupart des antimicrobiens utilisés dans les aliments pour la prévention des maladies visaient à prévenir les maladies respiratoires et les maladies entériques. Les tétracyclines et les lincosamides étaient les antimicrobiens les plus fréquemment utilisés pour la prévention des maladies respiratoires. Le taux d’utilisation déclarée des tétracyclines pour la prévention des maladies respiratoires a diminué, passant de 30 % en 2011 à 22 % en 2014, tandis que le taux de fréquence d’utilisation des lincosamides pour cette raison a augmenté chaque année, passant de 6 % en 2009 à 14 % en 2014. Aux fins de prévention des maladies entériques, 18 % des fermes ont déclaré avoir utilisé des macrolides et 17 %, des lincosamides en 2014.
Les décisions concernant le choix des antimicrobiens à utiliser par les fermes sont fondées sur la pression actuelle exercée par les maladies, la disponibilité des produits de remplacement autres que des antimicrobiens utilisés pour le contrôle et la prévention des maladies (p. ex. vaccins et bactérines), les mesures de biosécurité et d’autres facteurs opérationnels.
Figure 53 : Différences dans les quantités (kg) des classes d’antimicrobiens administrés dans les aliments, ajustées en fonction des populations et des poids, entre les secteurs de production ayant participé à la composante Surveillance à la ferme du PICRA, 2014
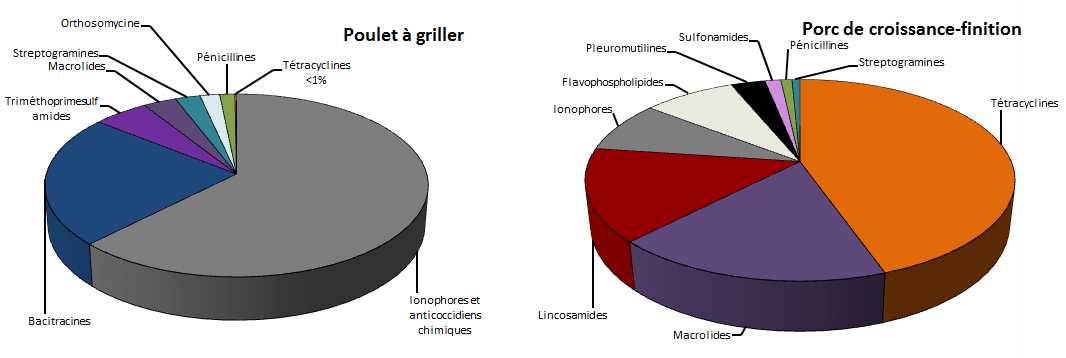
Source des données : Rapport annuel 2014 du PICRA.
Équivalent textuel
| Poulet à griller | Pourcentage |
|---|---|
| Ionophores et anticoccideins chimiques | 63% |
| Bacitracines | 23% |
| Triméthoprime sulfamides | 5% |
| Macrolides | 3% |
| Streptogramines | 2% |
| Orthosomycine | 2% |
| Pénicillines | 2% |
| Tétracyclines | <1% |
| Porc de croissance-finition | Pourcentage |
| Tétracyclines | 45% |
| Macrolides | 18% |
| Lincosamides | 15% |
| Ionophores | 8% |
| Flavophospholipides | 8% |
| Pleuromutilines | 3% |
| sulphonamides | 1% |
| Penicillin | 1% |
| Streptogramines | 1% |
Les deux diagrammes circulaires présentent les différences dans les quantités (kg), en pourcentage, des classes d’antimicrobiens administrés dans les aliments: Poulet à griller et Porc de croissance-finition, entre les secteurs de production ayant participé à la composant surveillance à la ferme du PICRA en 2014.
Figure 54 : Tendances de la proportion d’antimicrobiens utilisés dans les aliments, à l’exception des ionophores et des anticoccidiens chimiques, par raison d’utilisation – selon les quantités estimées utilisées (en milligrammes) et corrigées en fonction des populations et des poids, de 2009 à 2014
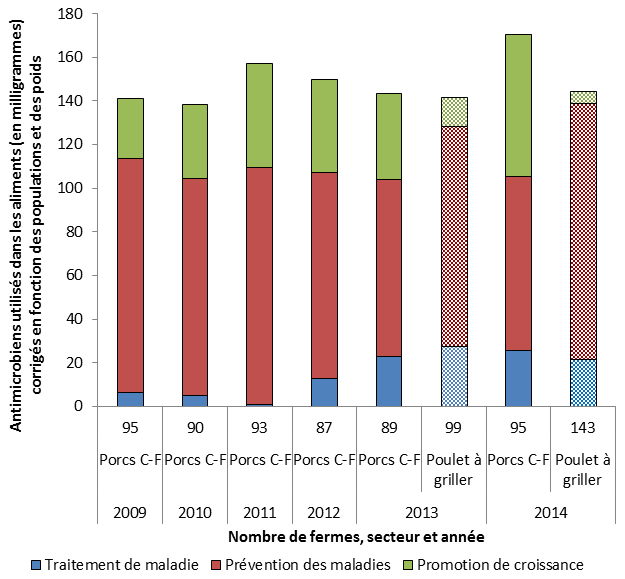
Source des données : Rapport annuel 2014 du PICRA.
Équivalent textuel
| Année | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | ||
|---|---|---|---|---|---|---|---|---|
| Secteur | Porc C-F | Porc C-F | Porc C-F | Porc C-F | G-F Swine | Poulet à griller | Porc C-F | Poulet à griller |
| Ferme | 95 | 90 | 93 | 87 | 89 | 99 | 95 | 143 |
| Tendances d’antimicrobiens utilisés dans les aliments (en milligrammes et corrigées en fonction des populations et des poids) | ||||||||
| Traitement de maladie | 6 | 5 | 1 | 13 | 23 | 28 | 26 | 22 |
| Prévention des maladies | 107 | 99 | 109 | 94 | 81 | 101 | 80 | 117 |
| Promotion de croissance | 27 | 34 | 48 | 43 | 40 | 13 | 65 | 5 |
L’histogramme empilé présente les tendances de la proportion d’antimicrobien utilisés dans les aliments, à l’exception des ionophores et des anticoccidiens chimique raison d’utilisation. L’axe horizontal représente les secteur et les fermes par année et l’axe vertical le antimicrobien utilisés dans les aliment en milligrammes et corrigées en fonction des populations et des poids.
Comparaisons à l’échelle internationale de l’utilisation des antimicrobiens chez les animaux
L’European Surveillance of Veterinary Antimicrobial Consumption (ESVAC) recueille des renseignements et fait rapport aux pays membres sur les agents antimicrobiens destinés aux fins d’utilisation chez les animauxNote de bas de page bs. En 2013, 26 pays membres ont participé à l’ESVAC. Comparativement aux pays participants du réseau de l’ESVAC, le Canada arrivait 21e sur 27 pays par ordre croissant de ventes d’antimicrobiens rajustées en fonction des populations et des poidsNote de bas de page 41 (Figure 55).
En milligrammes, les quantités totales rajustées par populations distribuées au Canada étaient 44 fois plus élevées qu’en Norvège (pays où les ventes sont les plus faibles) et moins de la moitié des quantités signalées à Chypre (pays où les ventes sont les plus élevées). À la suite d’une demande de l’industrie agroalimentaire canadienne, la colonne rouge pâle de la Figure 55 représente le classement relatif du Canada lorsque les calculs tiennent compte des poids moyens des animaux canadiens plutôt que des poids normalisés européens, puisque certaines espèces d’animaux d’élevage au Canada sont plus lourdes que leurs semblables en Europe. La position du Canada se déplacerait vers la gauche sur la Figure (nombre supérieur de mg ajustés en fonction des populations et des poids) si l’on pouvait tenir compte des importations actuellement non déclarées d’antimicrobiens en vertu des dispositions d’importation pour usage personnel et d’importation d’ingrédients actifs à usage pharmaceutique destinés aux préparations. Les derniers renseignements provenant d’une étude Ipsos/Impact Vet, menée pour l’ICSA, indiquent que les occasions manquées en raison de ces importations non déclarées sont estimées à 13 % du total des ventes de produits de santé animale, mais ce chiffre ne concerne pas seulement les antimicrobiens (communication personnelle avec l’ICSA).
Figure 55 : Ventes d’antimicrobiens à usage vétérinaire (quantités ajustées en fonction des populations et des poids) au Canada (2014) et dans les pays membres du réseau de l’European Surveillance of Veterinary Antimicrobial Consumption (2013)

Sources des données : Institut canadien de la santé animale, Statistique Canada, Agriculture et Agroalimentaire Canada, Canada Hippique et European Surveillance of Veterinary Antimicrobial Consumption (ESVAC).
Les importations pour usage personnel et les importations d’ingrédients actifs à usage pharmaceutique ne sont pas incluses dans les données canadiennes.
Sont exclus les ionophores et les anticoccidiens chimiques.
Le dénominateur a été harmonisé le plus possible avec l’ESVAC en tenant compte des différentes sources de donnée sur les populations d’animaux. L’approche de l’ESVAC exclut les animaux de compagnie du numérateur.
Toutes les données, provenant des pays représentés, tiennent comptent des mêmes poids moyens au moment du traitement. Cependant, au Canada, dans quelques classes de production, les poids moyens s’avèrent plus élevés que les poids moyens européens. À la demande des groupes d’intervenants et sur la base des analyses préliminaires, la colonne rouge clair indique où se positionnerait le Canada si on avait tenu compte dans les calculs des poids moyens canadiens au moment du traitement.
Équivalent textuel
| Pays | mg/PCU |
|---|---|
| Chypre | 426 |
| Espagne | 317 |
| Italie | 302 |
| Honogrie | 230 |
| Portugal | 187 |
| Allemagne | 179 |
| Canada | 163 |
| Belgique | 157 |
| Pologne | 151 |
| Canada (poids canadiens) | 140 |
| Bulgarie | 116 |
| France | 95 |
| République Tchèque | 82 |
| Pays-Bas | 70 |
| Slovakie | 63 |
| Estonie | 62 |
| Royaume-Uni | 62 |
| Austriche | 57 |
| Irelande | 57 |
| Luxembourg | 54 |
| Danemark | 45 |
| Lettoine | 37 |
| Lithuanie | 37 |
| Finlande | 24 |
| Slovénie | 22 |
| Suède | 13 |
| Island | 5 |
| Norvège | 4 |
L’histogramme groupé présente les ventes d’antimicrobiens à usage vétérinaire au Canada et dans les pays membres du réseau de surveillance européenne des antimicrobiens en médecine vétérinaire Consommation. L’axe horizontal représente les pays et l’axe vertical le mg/PCU ajustée en fonction des populations et des poids.
Intégration des données sur le recours aux antimicrobiens à usage humain et non humain
Le Canada est un important producteur d’animaux destinés à l’alimentation sur le marché national et international; il compte environ 19 fois plus d’animaux que de personnes, la majorité étant la volaille. En 2014, environ 1,4 million de kilogrammes d’antimicrobiens importants sur le plan médical ont été distribués ou vendus pour utilisation chez les humains, les animaux et dans les cultures au Canada. Pour ce qui est des antimicrobiens importants sur le plan médicalNote de bas de page 42, environ 82 % visaient les animaux destinés à l’alimentation, 18 % étaient pour les humains, moins de 1 % étaient destinés aux animaux de compagnie et moins de 1 % étaient consacrés aux culturesNote de bas de page 43. En tenant compte des populations sous-jacentes et des poids moyens, on comptait, en 2014, 1,7 fois plus d’antimicrobiens distribués pour utilisation chez les animaux que chez les humains.
Bien que des antimicrobiens semblables soient utilisés chez les humains et les animaux, certaines classes d’antimicrobiens sont vendues ou distribuées plus souvent aux fins d’utilisation chez les humains que chez les animaux et vice-versa. Chez les humains, les classes prédominantes (par kilogramme d’ingrédients actifs en ordre décroissant) étaient les bêta-lactamines, les céphalosporines et les fluoroquinolones (Figure 56). Chez les animaux, les classes prédominantes étaient les tétracyclines, les βlactamines et les « autres antimicrobiens »Note de bas de page 44.
Figure 56 : Kilogrammes d’antimicrobiens distribués ou vendus pour utilisation chez les animaux et les humains, par classe d’antimicrobiens, en 2014
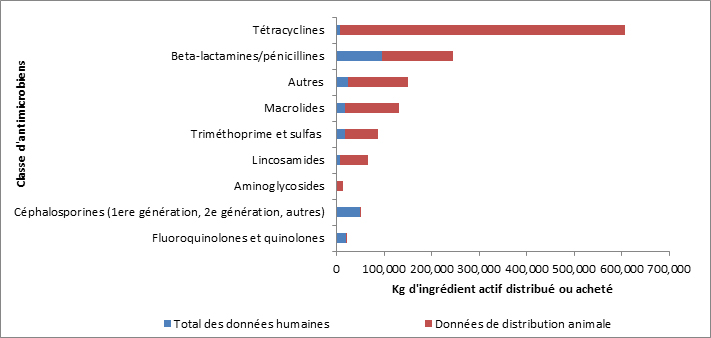
Sources des données : Institut canadien de la santé animale et Rapport sur l'utilisation des antimicrobiens chez les humains 2014 du gouvernement du Canada.
Équivalent textuel
| Classe d’antimicrobiens | Kg d’ingrédient actif distribué ou acheté | |
|---|---|---|
| Total des données humaines | Donnée de distribution animale | |
| Fluoroquinolones and quinolones | 19 895 | 533 |
| Céphalosporines (1ere génération, 2e génération autres) | 48 427 | 2 714 |
| Aminoglycosides | 128 | 13 276 |
| Lincosamides | 7 056 | 60 006 |
| Triméthoprime and sulfas (including all sulfas) | 18 362 | 68 762 |
| Macrolides | 18 447 | 112 340 |
| Autres | 24 446 | 125 230 |
| Beta-lactamines/pénicillines | 96 479 | 148 187 |
| Tétracyclines | 7 698 | 599 540 |
L’histogramme groupé présente le kilogramme total d’antimicrobiens distribués ou vendus pour utilisation chez les animaux et les humains, par classe d’antimicrobien, au Canada en 2014. L’axe horizontal représente kg d’ingrédient actif distribué ou acheté et l’axe vertical le taux d’infection.
Les résultats des données de 2014 sur l’utilisation des antimicrobiens chez les humains sont encourageants puisque le taux de prescription pour les enfants (de zéro à neuf ans) a diminué de nouveau cette année. Toutefois, dans le cas du traitement des infections urinaires, la ciprofloxacine était le médicament le plus souvent prescrit même si aucune étude n’a démontré la valeur ajoutée de l’utilisation de ce médicament de troisième intention. Les résultats des données sur l’utilisation des antimicrobiens chez les animaux suggèrent que plus de travail en matière de gestion de l’usage est nécessaire pour réduire les taux canadiens.