Système de Surveillance Incidents Transfusionnels 2011 - 2015 Rapport Sommaire
Télécharger le format de rechange
(Format PDF 1,03 Mo, 36 pages)
Organisation : Agence de la santé publique du Canada
Publiée : 2019-01-12
Cat. : HP40-247/2019F
ISBN : 978-0-660-29102-4
Pub. : 180706
Avant-propos
Le Centre de la lutte contre les maladies transmissibles et les infections (CLMTI) de l’Agence de la santé publique du Canada (ASPC) est heureux de présenter le Rapport sommaire sur le Système de surveillance des incidents transfusionnels (SSIT), de 2011 à 2015. Le présent rapport sommaire présente les données sur la surveillance des incidents transfusionnels envoyées par les hôpitaux canadiens qui participent au réseau du SSIT.
Le SSIT est un système de surveillance pancanadien mis sur pied par l’ASPC pour saisir des données non nominatives sur les réactions transfusionnelles indésirables dans les hôpitaux canadiens qui offrent des services de transfusion. Le but principal du SSIT consiste à améliorer la sécurité des patients dans les hôpitaux canadiens.
Le CLMTI, en partenariat avec les provinces et territoires participants, est responsable de la collecte, de la gestion et de l’analyse des données, et de la production de rapports pour appuyer les décisions en matière de santé publique fondées sur des données probantes.
Abréviation
- RHA
- Réaction hémolytique aiguë
- RTI
- Réaction transfusionnelle indésirable
- RHR
- Réaction hémolytique retardée
- RH
- Réaction hypotensive
- IgIV
- Immunoglobulines intraveineuses
- RAAG
- Réaction anaphylactique et anaphylactoïde grave
- SVPT
- Surcharge volémique post-transfusionnelle
- DAT
- Dyspnée associée à la transfusion
- LPAPT
- Lésions pulmonaires aiguës post-transfusionnelles
- SSIT
- Système de surveillance des incidents transfusionnels
Table des Matières
- Résumé
- Introduction
- Méthodes
- Définitions de Cas
- Résultats
- 1. Réactions transfusionnelles indésirables générales
- 2. Taux de réactions transfusionnelles indésirables
- 3. Niveau de l’imputabilité de réactions transfusionnelles indésirables (c.-à-d., la relation par rapport à la transfusion)
- 4. Gravité des réactions transfusionnelles indésirables
- 5. Issue des réactions transfusionnelles indésirables
- 6. Réactions transfusionnelles indésirables qui ont entraîné un décès
- Résumé
Résumé
Le Système de surveillance des incidents transfusionnels (SSIT) surveille les réactions indésirables liées à la transfusion de produits sanguins labiles et de produits stables (dérivés du plasma) au Canada depuis 2001. Tout au long du rapport, l’expression « produits stables» renvoie uniquement aux dérivés du plasma. Depuis 2007, toutes les provinces et tous les territoires, exception faite du Nunavut, fournissent des données au Système de surveillance des incidents transfusionnels (SSIT). En 2015, les hôpitaux participant au SSIT ont représenté plus de 90 % de tous les produits sanguins labiles transfusés au Canada.
En plus de présenter le nombre de réactions indésirables liées à la transfusion de produits sanguins labiles, le présent rapport présente également le taux de réactions indésirables associées aux produits sanguins labiles au cours de la période de 2011 à 2015. Cependant, en raison de l’absence de données utilisées en guise de dénominateur, le taux de réactions indésirables associées à des produits stables ne sera pas présenté. Les réactions allergiques mineures, les réactions non hémolytiques fébriles et les réactions sérologiques retardées sont également exclues en raison du manque d’uniformité dans la déclaration de ces événements.
Un nombre total de 3 610 cas de réactions transfusionnelles indésirables a été déclaré au SSIT entre 2011 et 2015. La gamme de ces réactions indésirables déclarées comprend la surcharge volémique post‑transfusionnelle (SVPT), les réactions anaphylactiques et anaphylactoïdes graves (RAAG), la réaction hypotensive, les réactions hémolytiques aiguës et retardées, les lésions pulmonaires aiguës post‑transfusionnelles (LPAPT), la dyspnée associée à la transfusion (DAT), les céphalées liées à l’IgIV, la méningite aseptique, les infections bactériennes ainsi que les réactions cliniques inhabituelles. En ce qui concerne les produits sanguins labiles, la réaction indésirable la plus commune était la SVPT (43,6 %), suivie des RAAG (12,6 %) et de la réaction hypotensive (9,2 %). En ce qui concerne les produits stables, la réaction indésirable la plus commune était les céphalées liées à l’IgIV (35,3 %), suivies de la réaction hémolytique retardée (13,9 %) et des RAAG (8,1 %).
Chaque réaction indésirable déclarée est catégorisée en fonction de sa gravité, qui est mesurée par le niveau des soins médicaux ou de l’intervention requis, ainsi que par son impact sur la santé du patient, par exemple une déficience physiologique ou physique à long terme ou le décès. La majorité des réactions indésirables de 2011 à 2015 ont causé un préjudice minime ou n’ont causé aucun préjudice aux bénéficiaires. Seulement 3,9 % (n=138) des cas ont entraîné des séquelles majeures ou à long terme, y compris 68 décès dont 47,1 % (n=32) étaient liés à une transfusion. La SVPT et les LPAPT étaient les réactions indésirables les plus fréquentes associées à un décès. Étant donné que la plupart des décès sont survenus chez des personnes plus âgées (> 70 ans) qui étaient atteintes d’autres maladies concomitantes, ces décès peuvent être imputables à une autre cause et, par conséquent, peuvent ne pas être directement liés aux transfusions. D’autres recherches sont requises pour préciser la relation entre les transfusions et les réactions indésirables graves, comme le décès.
Introduction
Établi dans le cadre d’un projet pilote en 2001, le Système de surveillance des incidents transfusionnels (SSIT) surveille les réactions indésirables liées à la transfusion. Les réactions indésirables sont définies comme des incidents indésirables et non intentionnels qui surviennent pendant et après la transfusion de produits sanguins labiles ou de produits stables. Le SSIT recueille des données non nominatives sur les réactions indésirables après la transfusion de produits sanguins labiles (p. ex., globules rouges, granulocytes, plaquettes, plasma et cryoprécipité) et de produits stables (p. ex., albumine, immunoglobuline, facteurs de coagulation, etc.). Les réactions indésirables sont déclarées volontairement par un réseau étendu d’hôpitaux offrant des services de transfusion à l’échelle de toutes les provinces et de tous les territoires, excluant le Nunavut.
Le Groupe de travail national sur le SSIT (GTN-SSIT) est composé de représentants de chaque province et territoire (PT) participant au SSIT, de deux fabricants de produits sanguins(la Société canadienne du sang et Héma-Québec), et de représentants d’office de la Direction des produits de santé commercialisés et de la Direction des produits biologiques et des thérapies génétiques de Santé Canada. Le Groupe de travail national fournit des conseils à l’équipe de projet quant à l’orientation et à la qualité ainsi qu’à son efficacité en tant que système national de surveillance.
L’objectif du SSIT consiste à cerner et à estimer le fardeau et les tendances des réactions défavorables suivant la transfusion de produits sanguins labiles et de produits stables afin d’aider à améliorer la sécurité des patients dans les hôpitaux canadiens. Le présent rapport résume les données nationales du SSIT pour la période de 2011 à 2015.
Méthodes
Traitement et Collecte des Données
Depuis 2007, tous les établissements participants ont fourni des données à l'Agence de la santé publique du Canada (ASPC). La couverture des produits sanguins labiles transfusés au Canada était supérieure à 90 % pour 2015. L’objectif éventuel est d’assurer une couverture de 100 % d’ici 2020.
Le SSIT a recours à des définitions de cas normalisés et à des formulaires de déclaration normalisés pour déclarer les réactions transfusionnelles indésirables, tel qu’il est indiqué dans le Manuel de l’utilisateur du SSITFootnote 1. Malgré le fait qu’il reçoit des données sur l’ensemble des réactions transfusionnelles indésirables, le SSIT déclare uniquement les réactions qui sont considérées comme définitivement, probablement ou possiblement liées à une transfusion.
Les renseignements inclus dans le formulaire de déclaration sont transférés par voie électronique à l’ASPC dans un format non nominatif. Ces renseignements comprennent la catégorisation des événements, à savoir s’ils peuvent être imputés à la transfusion (c.-à-d., l’imputabilité), le niveau d’intervention requis et/ou de l’invalidité subie (c.-à-d., la gravité) ainsi que la mesure de l’étendue de la réaction indésirable (c.-à-d., l’issue). Si l’issue de l’événement est le décès, une enquête approfondie est menée afin de déterminer dans quelle mesure le décès était relié à la transfusion (p. ex., certaine, probable, possible, lien douteux ou lien inexistant). Les définitions des cas ci-dessous décrivent les niveaux d’imputabilité, de gravité et l’issue des réactions indésirables.
Depuis 2014, le système Web centralisé de l’ASPC, le Réseau canadien de renseignements sur la santé publique (RCRSP), a été utilisé par les représentants PT aux fins de la saisie des données. La plate-forme du RCRSP comprend des boutons radio et des listes déroulantes incorporées à la plate-forme pour empêcher les erreurs dans la saisie des données. La plate‑forme comprend également une fonction de vérification systématique pour assurer la saisie de données dans les champs essentiels, donnant lieu à une déclaration complète. À l’heure actuelle, neuf des onze installations participantes saisissent des données dans le RCRSP. On prévoit que, d’ici 2020, l’ensemble des PT utiliseront la plate‑forme du RCRSP pour la saisie des données. L’ASPC reçoit généralement les données de l’année précédente à l’automne de l’année en cours pour faire l’objet d’un examen aux fins d’assurance de la qualité. Les demandes de précisions sont envoyées à chaque PT séparément. Les événements peuvent être reclassifiés pour qu’ils soient conformes aux définitions des cas normalisés ou être exclus de l’analyse des données nationales. Les fichiers de données PT sont ensuite combinés pour constituer une base de données nationale du SSIT.
Les réactions indésirables dont le lien avec une transfusion a été jugé douteux ou inexistant sont éliminées de l’analyse approfondie, tout comme celles pour lesquelles l’imputabilité n’a pas été déterminée ou était manquante au moment de la communication des données. Les réactions indésirables dans le SSIT comprennent les réactions anaphylactiques ou anaphylactoïdes graves (RAAG), la surcharge volémique post‑transfusionnelle (SVPT), les lésions pulmonaires aiguës post-transfusionnelles (LPAPT), ainsi que les LPAPT possibles, la dyspnée associée à la transfusion (DAT), les réactions hypotensives (RH), les céphalées liées à l’immunoglobuline intraveineuse (IgIV), les réactions hémolytiques aiguës et retardées, la méningite aseptique, la transfusion incompatible et les infections bactériennes. Les réactions allergiques mineures, les réactions non hémolytiques fébriles et les réactions sérologiques retardées sont exclues de l’analyse en raison du manque d’uniformité dans la déclaration de ces événements. Les réactions indésirables associées aux produits sanguins labiles et à des produits stables sont attribuées au type de produit reçu en premier.
Données Utilisées en Guise de Dénominateur
Le nombre annuel total d’unités de produits sanguins labiles transfusés dans les hôpitaux dans le réseau du SSIT déclaré par les PTs est utilisé en guise de dénominateur pour les taux et les risques de réactions indésirables à la transfusion de produits sanguins labiles. Les taux de réactions indésirables imputables à la transfusion de produits stables ne sont pas calculés, car les données de dénominateur appropriées ne sont pas disponibles présentement à l’échelle nationale.
Analyse statistique
Des analyses descriptives sont effectuées au moyen du logiciel SAS EG 5.1. Le nombre et les proportions de réactions indésirables précises sont calculés séparément pour les transfusions de produits sanguins labiles et de produits stables ainsi que pour les transfusions dans leur ensemble, pour chacune des cinq années de déclaration et pour la période de déclaration combinée. De manière semblable, des taux de réactions indésirables précises par 100 000 transfusions de produits sanguins labiles sont calculés par année et pour la période combinée. Le nombre et les proportions de réactions indésirables spécifiques sont également calculés par imputabilité, gravité et issue de la réaction, pour l’ensemble des transfusions ainsi que les transfusions liées aux produits
Définitions de Cas
| Gravité de l’Événement Indésirable | Définition |
|---|---|
| Niveau 1 (non grave) | Aucun dommage permanent ou aucune invalidité permanente d’une fonction corporelle. |
| Niveau 2 (grave) | Le patient a nécessité une hospitalisation ou une prolongation de l’hospitalisation directement imputable à la réaction; ou la réaction indésirable a donné lieu à une invalidité ou à une incapacité persistante ou importante; ou a nécessité une intervention médicale ou chirurgicale pour empêcher un dommage permanent ou important ou une déficience corporelle |
| Niveau 3 (menace à la vie) | Le patient a nécessité une intervention importante à la suite d’une transfusion (vasopresseurs, intubation, transfert aux soins intensifs). |
| Niveau 4 (décès) | On soupçonnait que le décès du patient était la conséquence de la réaction transfusionnelle. |
| Non déterminé | Les conséquences de la réaction transfusionnelle étaient incertaines. |
| Imputabilité (Relation avec l’Événement Indésirable) | Définition |
|---|---|
| Certaine | Un événement clinique et/ou de laboratoire est survenu à l’intérieur d’un délai compatible avec l’administration du sang, du produit sanguin labile ou du produit stable et il a été prouvé par une enquête qu’il a été causé par une transfusion. |
| Probable | Un événement clinique et/ou de laboratoire est survenu à l’intérieur d’un délai compatible avec l’administration du sang, du produit sanguin labile ou du produit stable et ne semble pas explicable par une autre cause. |
| Possible | Un événement clinique et/ou de laboratoire est survenu à l’intérieur d’un délai compatible avec l’administration du sang, du produit sanguin labile ou du produit stable, mais pourrait être expliqué par une maladie concomitante ou par l’administration d’un médicament ou d’un autre agent. |
| Lien douteux | Un événement clinique et/ou de laboratoire est survenu à l’intérieur d’un délai raisonnable par rapport à la transfusion, mais la prépondérance des données appuie une autre explication. |
| Lien inexistant | Un événement clinique et/ou laboratoire est survenu à l’intérieur d’un délai incompatible avec l’administration du sang, du produit sanguin labile ou du produit stable ou, s’il est survenu à l’intérieur d’un délai compatible, il a été prouvé qu’il n’avait aucun lien avec la transfusion. |
| Non déterminée | Il reste à déterminer si l’événement était lié à l’administration du sang, du produit sanguin labiles ou du produit stable. D’autres renseignements sont à venir, cependant, ils n’étaient pas disponibles au moment de la communication des données. |
| Issue de l’Événement Indésirable | Définition |
|---|---|
| Séquelles mineures | Le patient n’avait aucune séquelle ou invalidité permanente de la réaction ou a développé des anticorps aux antigènes de basse et moyenne fréquence (<95%). |
| Séquelles majeures | Le patient a développé une infection avec un agent infectieux persistant (VIH, virus de l’hépatite B ou virus de l’hépatite C), ou une réaction transfusionnelle présentant des séquelles majeures ou à long terme; ou l’anticipation de difficultés associées à des transfusions futures (p. ex., développement d’anticorps à antigènes présents dans plus de 95 % des dons). |
| Décès | |
| Non déterminée | L’issue de l’événement indésirable a été jugée incertaine. |
| Relation de la Transfusion avec le Décès du Bénéficiaire | Définition |
|---|---|
| Certaine | Le décès est survenu à l’intérieur d’un délai compatible avec l’administration du sang, du produit sanguin labile ou du produit stable et il a été prouvé par une enquête qu’il a été causé par une transfusion. |
| Probable | Le décès est survenu à l’intérieur d’un délai compatible avec l’administration du sang, du produit sanguin labile ou du produit stable et ne semble pas explicable par une autre cause. |
| Possible | Le décès est survenu à l’intérieur d’un délai compatible avec l’administration du sang, du produit sanguin labile ou du produit stable, mais pourrait être expliqué par une maladie concomitante ou par l’administration d’un médicament ou d’un autre agent. |
| Lien douteux | Le décès est survenu à l’intérieur d’un délai raisonnable par rapport à la transfusion, mais la prépondérance des données appuie une autre explication. |
| Lien inexistant | Le décès est survenu à l’intérieur d’un délai incompatible avec l’administration du sang, du produit sanguin labile ou du produit stable ou, s’il est survenu à l’intérieur d’un délai compatible, il a été prouvé qu’il n’avait aucun lien avec la transfusion. |
| Non déterminée | On n’a pas été en mesure de déterminer si le décès était lié à la transfusion. |
Résultats
Les résultats sont organisés en six sections, chacune comprenant les résultats généraux ainsi que les résultats distincts pour les produits sanguins labiles et les produits stables, lorsque cela est possible :
- La section 1 présente le nombre et les proportions de réactions indésirables, excluant les réactions indésirables dont le lien avec une transfusion a été jugé douteux ou inexistant, ou pour lesquelles cette information était manquante.
- La section 2 présente les taux de réactions indésirables associées à la transfusion de produits sanguins labiles. Comme il a été mentionné plus tôt, des taux analogues ne sont pas disponibles pour la transfusion de produits stables, car les données en guise de dénominateur appropriées ne sont pas accessibles à l’heure actuelle à l’échelle nationale.
- La section 3 présente le nombre et la proportion des réactions indésirables par imputabilité (c.-à-d., la relation par rapport à la transfusion) pour la période de déclaration combinée.
- La section 4 présente le nombre et la proportion des réactions indésirables par gravité de la réaction (c.-à-d., le niveau d’intervention nécessaire et/ou l’invalidité subie).
- La section 5 présente le nombre et la proportion des réactions indésirables par l’issue de la réaction (c.-à-d., la nature des séquelles de la réaction).
- La section 6 présente d’autres renseignements sur les réactions défavorables associées au décès, y compris son attribution à la transfusion et les circonstances particulières entourant les décès qui surviennent en 2015.
Réactions transfusionnelles indésirables générales
Présenté au tableau 1A, les réactions transfusionnelles indésirables les plus fréquemment déclarées pour la période de 2011 à 2015 étaient la SVPT (31,5 %), suivie des RAAG (11,2 %) et des céphalées liées à l’IgIV (11,1 %).
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Surcharge volémique post-transfusionnelle (SVPT) | 223 | 34,7 % | 220 | 28,7 % | 254 | 29,4 % | 212 | 32,4 % | 228 | 33,4 % | 1 137 | 31,5 % |
| Réaction hémolytique aiguë (RHA) | 24 | 3,7 % | 31 | 4,0 % | 51 | 5,9 % | 13 | 2,0 % | 16 | 2,3 % | 135 | 3,7 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 61 | 9,5 % | 87 | 11,4 % | 118 | 13,7 % | 71 | 10,8 % | 67 | 9,8 % | 404 | 11,2 % |
| Réaction hypotensive (RH) | 37 | 5,8 % | 66 | 8,6 % | 56 | 6,5 % | 35 | 5,3 % | 72 | 10,5 % | 266 | 7,4 % |
| Réaction hémolytique retardée (RHR) | 71 | 11,1 % | 84 | 11,0 % | 80 | 9,3 % | 43 | 6,6 % | 39 | 5,7 % | 317 | 8,8 % |
| Lésions pulmonaires aiguës post-transfusionnelles (LPAPT) | 13 | 2,0 % | 8 | 1,0 % | 3 | 0,3 % | 5 | 0,8 % | 5 | 0,7 % | 34 | 0,9 % |
| LPAPT possibles | 9 | 1,4 % | 13 | 1,7 % | 8 | 0,9 % | 8 | 1,2 % | 5 | 0,7 % | 43 | 1,2 % |
| Dyspnée associée à la transfusion (DAT) | 19 | 3,0 % | 24 | 3,1 % | 62 | 7,2 % | 33 | 5,0 % | 56 | 8,2 % | 194 | 5,4 % |
| Céphalées liées à l’IgIV | 54 | 8,4 % | 105 | 13,7 % | 146 | 16,0 9 % | 40 | 6,1 % | 54 | 7,9 % | 399 | 11,1 % |
| Méningite aseptique | 3 | 0,5 % | 13 | 1,7 % | 15 | 1,7 % | 2 | 0,3 % | 6 | 0,9 % | 39 | 1,1 % |
| Transfusion incompatible | 10 | 1,6 % | 10 | 1,3 % | 3 | 0,3 % | 0 | 0,0 % | 2 | 0,3 % | 25 | 0,7 % |
| Infection bactérienne | 9 | 1,4 % | 2 | 0,3 % | 0 | 0,0 % | 6 | 0,9 % | 4 | 0,6 % | 21 | 0,6 % |
| Footnote 1 Autre | 98 | 15,3 % | 76 | 9,9 % | 68 | 7,9 % | 187 | 28,5 % | 129 | 18,9 % | 558 | 15,5 % |
| Footnote 2Réactions inhabituelles | 11 | 1,7 % | 27 | 3,5 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 38 | 1,1 % |
| Total | 642 | 100 % | 766 | 100 % | 864 | 100 % | 655 | 100 % | 683 | 100 % | 3 610 | 100 % |
|
||||||||||||
2. Taux de réactions transfusionnelles indésirables
Le taux de réactions indésirables a pu être calculé uniquement pour les cas associés à la transfusion de produits sanguins labiles. Le taux d’incidence de réactions indésirables après la transfusion de produits stables n’a pas pu être calculé, car les données en guise de dénominateur appropriées ne sont pas accessibles à l’heure actuelle. Le tableau 2A résume le nombre d’unités de produits sanguins labiles transfusées par les hôpitaux du réseau SSIT dans chaque province/territoire de 2011 à 2015.
| Province/Territoire | 2011 | 2012 | 2013 | 2014 | 2015 | Total |
| Colombie-Britannique | 177 387 | 177 299 | 180 184 | 174 755 | 176 655 | 886 280 |
| Yukon | 499 | 422 | 809 | 733 | 597 | 3 060 |
| Alberta | 114 734 | 155 120 | 140 153 | 104 689 | 138 532 | 653 228 |
| Manitoba | 54 819 | 59 893 | 56 501 | 52 913 | 53 659 | 277 785 |
| Saskatchewan | 48 182 | 46 707 | 42 450 | 42 450 | 40 436 | 220 225 |
| Ontario | 378 422 | 365 591 | 357 568 | 396 285 | 352 613 | 1 850 479 |
| Québec | 310 047 | 346 565 | 325 995 | 316 994 | 299 217 | 1 598 818 |
| Nouveau‑Brunswick | 29 276 | 32 597 | 30 057 | 30 644 | 28 281 | 150 855 |
| Nouvelle‑Écosse | 42 893 | 43 205 | 37 685 | 38 972 | 35 468 | 198 223 |
| Île-du-Prince-Édouard | 4 607 | 4 400 | 4 378 | 3 995 | 3 553 | 20 933 |
| Terre-Neuve-et-Labrador | 23 464 | 23 856 | 22 254 | 22 005 | 20 827 | 112 406 |
| Territoires du Nord‑Ouest | 348 | 505 | 125 | 110 | 447 | 1 535 |
| Total | 1 184 678 | 1 256 160 | 1 198 159 | 1 184 545 | 1 150 285 | 5 973 827 |
Comme on peut le voir dans le tableau 2B et à la figure 1, la SVPT est demeurée la réaction indésirable la plus commune dans le réseau du SSIT. En 2015, sa fréquence correspondait à un cas pour chaque 5 229 unités de produits sanguins labiles transfusés. La transfusion incompatible était la réaction la moins commune, avec une fréquence d’un cas pour chaque 575 143 unités de produits sanguins labiles transfusés.
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | TauxFootnote 1 | RisqueFootnote 2 | Fréq. | Taux | Risque | Fréq. | Taux | Risque | Fréq. | Taux | Risque | Fréq. | Taux | Risque | Fréq. | Taux | Risque | |
| SVPT | 216 | 18,2 | 1:5 485 | 209 | 16,6 | 1:6 010 | 242 | 20,2 | 1:4 951 | 197 | 16,6 | 1:6 013 | 220 | 19,1 | 1:5 229 | 1 084 | 18,2 | 1:5 501 |
| RHA | 15 | 1,3 | 1:78 979 | 14 | 1,1 | 1:89 726 | 17 | 1,4 | 1:70480 | 7 | 0,6 | 1:169 221 | 10 | 0,9 | 1:115 029 | 63 | 1,1 | 1:94 656 |
| RAAG | 46 | 3,9 | 1:25 754 | 65 | 5,2 | 1:19 326 | 103 | 8,6 | 1:11 633 | 49 | 4,1 | 1:24 174 | 49 | 4,3 | 1:23 475 | 312 | 5,2 | 1:19 113 |
| RH | 30 | 2,5 | 1:39 489 | 63 | 5,0 | 1:19 939 | 48 | 4,0 | 1:24 962 | 30 | 2,5 | 1:39 485 | 59 | 5,1 | 1:19 496 | 230 | 3,9 | 1:25 9278 |
| RHR | 37 | 3,1 | 1:32 018 | 38 | 3,0 | 1:33 057 | 40 | 3,3 | 1:29 954 | 25 | 2,1 | 1:47 382 | 20 | 1,7 | 1:57 514 | 160 | 2,7 | 1:3 7270 |
| LPAPT | 12 | 1,0 | 1:98 723 | 8 | 0,6 | 1:157 020 | 3 | 0,3 | 1:399 386 | 5 | 0,4 | 1:236 909 | 5 | 0,4 | 1:230 057 | 33 | 0,6 | 1:180707 |
| LPAPT possibles | 8 | 0,7 | 1:148 085 | 13 | 1,0 | 1:96 628 | 8 | 0,7 | 1:149 770 | 7 | 0,6 | 1:169 221 | 5 | 0,4 | 1:230 057 | 41 | 0,7 | 1:145 447 |
| DAT | 18 | 1,5 | 1:65 815 | 20 | 1,6 | 1:62 808 | 46 | 3,8 | 1:26 047 | 30 | 2,5 | 1:39 485 | 47 | 4,1 | 1:24 474 | 161 | 2,7 | 1:37 039 |
| Transfusion incompatible | 8 | 0,7 | 1:148 085 | 10 | 0,8 | 1:125 616 | 3 | 0,3 | 1:399 386 | 0 | 0,0 | S.O. | 2 | 0,2 | 1:575 143 | 23 | 0,4 | 1:259 275 |
| Infection bactérienne | 9 | 0,8 | 1:131 631 | 2 | 0,2 | 1:628 080 | 0 | 0,0 | S.O. | 6 | 0,5 | 1:197 424 | 3 | 0,3 | 1:383 428 | 20 | 0,3 | 1:298 166 |
| Autre | 39 | 3,3 | 1:30 376 | 36 | 2,9 | 1:34 893 | 51 | 4,3 | 1:23 493 | 117 | 9,9 | 1:10 124 | 77 | 6,7 | 1:14 939 | 320 | 5,4 | 1:18635 |
| Réactions inhabituelles | 8 | 0,7 | 1:148 085 | 24 | 1,9 | 1:52 340 | 0 | 0,0 | S.O. | 0 | 0,0 | S.O. | 0 | 0,0 | S.O. | 32 | 0,5 | 1:186354 |
| Total | 446 | 37,6 | 1:2 656 | 502 | 40,0 | 1:2 502 | 561 | 46,8 | 1:2 136 | 473 | 39,9 | 1:2 504 | 497 | 43,2 | 1:2 314 | 2 479 | 41,5 | 1:2 405 |
|
||||||||||||||||||
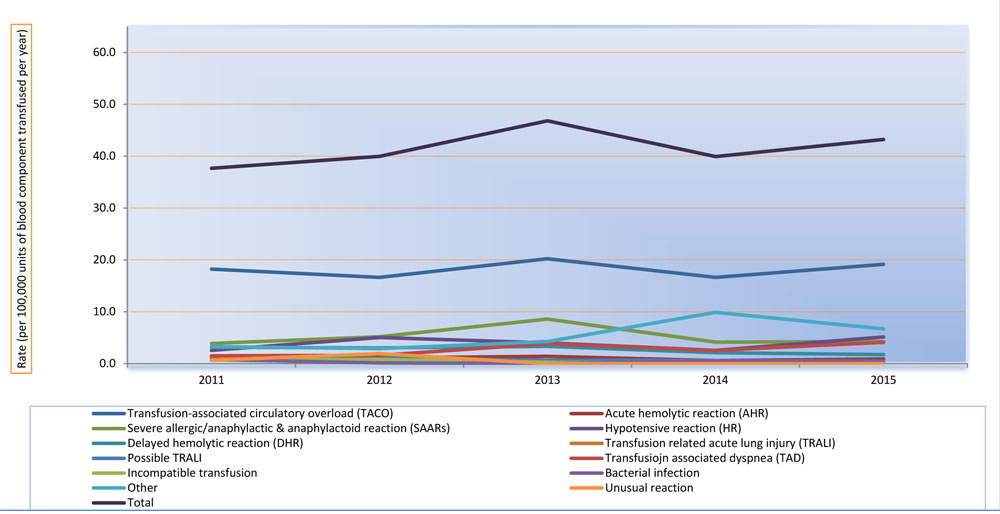
Équivalent textuel
Le nombre total d’unités de produits sanguins labiles administrés par les établissements qui ont participé aux SSIT (tableau 2A) est utilisé comme dénominateur pour calculer le taux de réactions transfusionnelles associées à ces produits. Le taux a été calculé au moyen du nombre total d’unités de produits sanguins labiles dans les établissements participants aux SSIT (tableau 2A) étant donné que le dénominateur et les résultats ont été communiqués en ce qui a trait (i) au nombre de réactions indésirables par 100 000 unités de produits sanguins labiles transfusés et (ii) au nombre d’unités transfusées pour l’occurrence d’une réaction indésirable (tableau 2B).
3. Niveau de l’imputabilité de réactions transfusionnelles indésirables (c.-à-d., la relation par rapport à la transfusion)
Parmi les réactions transfusionnelles indésirables signalées au SSIT (n=3 610) entre 2011 et 2015, 12,6 % (n=456) ont été jugées avoir un lien certain avec une transfusion, alors que 49,3 % (n=1 780) et 38,1 % (n=1 374) ont été jugées avoir un lien probable et possible à une transfusion, respectivement (tableau 3A). Un lien certain entre une transfusion et des réactions indésirables déclarées a été établi chez 10,5 % (n=260) des bénéficiaires de produits sanguins labiles et 17,3 % (n=196) des bénéficiaires de produits stables (tableau 3B et tableau 3C, respectivement).
| Réaction transfusionnelle indésirable | Certaine | Probable | Possible | Total | ||||
|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Surcharge volémique post-transfusionnelle (SVPT) | 68 | 6,0 % | 548 | 48,2 % | 521 | 45,8 % | 1 137 | 100 % |
| Réaction hémolytique aiguë (RHA) | 53 | 39,3 % | 55 | 40,7 % | 27 | 20,0 % | 135 | 100 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 53 | 13,1 % | 273 | 67,6 % | 78 | 19,3 % | 404 | 100 % |
| Réaction hypotensive (RH) | 8 | 3,0 % | 82 | 30,8 % | 176 | 66,2 % | 266 | 100 % |
| Réaction hémolytique retardée (RHR) | 166 | 52,4 % | 107 | 33,8 % | 44 | 13,9 % | 317 | 100 % |
| Lésions pulmonaires aiguës post-transfusionnelles (LPAPT) | 7 | 20,6 % | 16 | 47,1 % | 11 | 32,4 % | 34 | 100 % |
| LPAPT possibles | 1 | 2,3 % | 13 | 30,2 % | 29 | 67,4 % | 43 | 100 % |
| Dyspnée associée à la transfusion (DAT) | 3 | 1,5 % | 87 | 44,8 % | 104 | 53,6 % | 194 | 100 % |
| Céphalées liées à l’IgIV | 38 | 9,5 % | 268 | 67,2 % | 93 | 23,3 % | 399 | 100 % |
| Méningite aseptique | 3 | 7,7 % | 30 | 76,9 % | 6 | 15,4 % | 39 | 100 % |
| Transfusion incompatible | 20 | 80,0 % | 3 | 12,0 % | 2 | 8,0 % | 25 | 100 % |
| Infection bactérienne | 2 | 9,5 % | 5 | 23,8 % | 14 | 66,7 % | 21 | 100 % |
| Autre | 33 | 5,9 % | 285 | 51,1 % | 240 | 43,0 % | 558 | 100 % |
| Réactions inhabituelles | 1 | 2,6 % | 8 | 21,1 % | 29 | 76,3 % | 38 | 100 % |
| Total | 456 | 12,6 % | 1 780 | 49,3 % | 1 374 | 38,1 % | 3 610 | 100 % |
| Réaction transfusionnelle indésirable | Certaine | Probable | Possible | Total | ||||
|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Surcharge volémique post-transfusionnelle (SVPT) | 67 | 6,2 % | 534 | 49,3 % | 483 | 44,6 % | 1 084 | 100 % |
| Réaction hémolytique aiguë (RHA) | 27 | 42,9 % | 24 | 38,1 % | 12 | 19,0 % | 63 | 100 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 28 | 9,0 % | 222 | 71,2 % | 62 | 19,9 % | 312 | 100 % |
| Réaction hypotensive (RH) | 4 | 1,7 % | 74 | 32,2 % | 152 | 66,1 % | 230 | 100 % |
| Réaction hémolytique retardée (RHR) | 91 | 56,9 % | 48 | 30,0 % | 21 | 13,1 % | 160 | 100 % |
| Lésions pulmonaires aiguës post-transfusionnelles (LPAPT) | 7 | 21,2 % | 15 | 45,5 % | 11 | 33,3 % | 33 | 100 % |
| LPAPT possibles | 1 | 2,4 % | 11 | 26,8 % | 29 | 70,7 % | 41 | 100 % |
| Dyspnée associée à la transfusion (DAT) | 3 | 1,9 % | 72 | 44,7 % | 86 | 53,4 % | 161 | 100 % |
| Transfusion incompatible | 20 | 87,0 % | 1 | 4,3 % | 2 | 8,7 % | 23 | 100 % |
| Infection bactérienne | 2 | 10,0 % | 5 | 25,0 % | 13 | 65,0 % | 20 | 100 % |
| Autre | 10 | 3,1 % | 145 | 45,3 % | 165 | 51,6 % | 320 | 100 % |
| Réactions inhabituelles | 0 | 0,0 % | 7 | 21,9 % | 25 | 78,1 % | 32 | 100 % |
| Total | 260 | 10,5 % | 1 158 | 46,7 % | 1 061 | 42,8 % | 2 479 | 100 % |
| Réaction transfusionnelle indésirable | Certaine | Probable | Possible | Total | ||||
|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Surcharge volémique post-transfusionnelle (SVPT) | 1 | 1,9 % | 14 | 26,4 % | 38 | 71,7 % | 53 | 100 % |
| Réaction hémolytique aiguë (RHA) | 26 | 36,1 % | 31 | 43,1 % | 15 | 20,8 % | 72 | 100 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 25 | 27,2 % | 51 | 55,4 % | 16 | 17,4 % | 92 | 100 % |
| Réaction hypotensive (RH) | 4 | 11,1 % | 8 | 22,2 % | 24 | 66,7 % | 36 | 100 % |
| Réaction hémolytique retardée (RHR) | 75 | 47,8 % | 59 | 37,6 % | 23 | 14,6 % | 157 | 100 % |
| Lésions pulmonaires aiguës post-transfusionnelles (LPAPT) | 0 | 0,0 % | 1 | 100,0 % | 0 | 0,0 % | 1 | 100 % |
| LPAPT possibles | 0 | 0,0 % | 2 | 100,0 % | 0 | 0,0 % | 2 | 100 % |
| Dyspnée associée à la transfusion (DAT) | 0 | 0,0 % | 15 | 45,5 % | 18 | 54,5 % | 33 | 100 % |
| Céphalées liées à l’IgIV | 38 | 9,5 % | 268 | 67,2 % | 93 | 23,3 % | 399 | 100 % |
| Méningite aseptique | 3 | 7,7 % | 30 | 76,9 % | 6 | 15,4 % | 39 | 100 % |
| Transfusion incompatible | 0 | 0,0 % | 2 | 100,0 % | 0 | 0,0 % | 2 | 100 % |
| Infection bactérienne | 0 | 0,0 % | 0 | 0,0 % | 1 | 100,0 % | 1 | 100 % |
| Autre | 23 | 9,7 % | 140 | 58,8 % | 75 | 31,5 % | 238 | 100 % |
| Réactions inhabituelles | 1 | 16,7 % | 1 | 16,7 % | 4 | 66,7 % | 6 | 100 % |
| Total | 196 | 17,3 % | 622 | 55,0 % | 313 | 27,7 % | 1 131 | 100 % |
4. Gravité des réactions transfusionnelles indésirables
La gravité des réactions transfusionnelles indésirables est un indice de l’intervention nécessaire et/ou de l’invalidité subie, y compris le décès. Les réactions transfusionnelles indésirables déclarées réputées être d’une gravité de niveau 1 (c.-à-d., aucun dommage permanent ou aucune invalidité permanente d’une fonction corporelle) représentaient environ 62,7 % (n=2 253) de toutes les réactions transfusionnelles indésirables déclarées (tableau 4A). Les réactions d’une gravité de niveau 2 (grave) et de niveau 3 (menace à la vie, y compris le décès) représentaient 31,5 % (n=1 130) et 4,8 % (n=171) des réactions, respectivement, et sont décrites de manière plus détaillée ci-dessous.
| Gravité de la réaction indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Niveau 1 (non grave) | 332 | 53,1 % | 437 | 57,0 % | 596 | 69,0 % | 450 | 68,7 % | 438 | 64,1 % | 2 253 | 62,7 % |
| Niveau 2 (grave) | 247 | 38,5 % | 280 | 36,6 % | 234 | 27,1 % | 176 | 26,9 % | 193 | 28,3 % | 1 130 | 31,5 % |
| Niveau 3 (menace à la vie) | 40 | 6,2 % | 44 | 5,7 % | 23 | 2,7 % | 23 | 3,5 % | 41 | 6,0 % | 171 | 4,8 % |
| Non déterminée | 6 | 1,1 % | 5 | 0,7 % | 11 | 1,3 % | 6 | 0,9 % | 11 | 1,6 % | 39 | 1,1 % |
| Total | 625 | 100 % | 766 | 100 % | 864 | 100 % | 655 | 100 % | 683 | 100 % | 3 593 | 100 % |
a. Réactions indésirables graves (gravité de niveau 2 Footnote 2)
Le tableau 4.1A affiche les réactions indésirables d’une gravité de niveau 2 résultant de la transfusion de produits sanguins labiles. Les plus communes étaient la SVPT (45 %, n=379) et les RAAG (22,9 %, n=193).
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Surcharge volémique post-transfusionnelle (SVPT) | 93 | 50,3 % | 95 | 44,0 % | 75 | 44,9 % | 56 | 44,4 % | 60 | 40,3 % | 379 | 45,0 % |
| Réaction hémolytique aiguë (RHA) | 8 | 4,3 % | 6 | 2,8 % | 7 | 4,2 % | 2 | 1,6 % | 3 | 2,0 % | 26 | 3,1 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 35 | 18,9 % | 47 | 21,8 % | 47 | 28,1 % | 34 | 27,0 % | 30 | 20,1 % | 193 | 22,9 % |
| Réaction hypotensive (RH) | 8 | 4,3 % | 18 | 8,3 % | 7 | 4,2 % | 7 | 5,6 % | 9 | 6,0 % | 49 | 5,8 % |
| Réaction hémolytique retardée (RHR) | 8 | 4,3 % | 14 | 6,5 % | 11 | 6,6 % | 8 | 6,3 % | 7 | 4,7 % | 48 | 5,7 % |
| Lésions pulmonaires aiguës post-transfusionnelles (LPAPT) | 6 | 3,2 % | 3 | 1,4 % | 0 | 0,0 % | 2 | 1,6 % | 3 | 2,0 % | 14 | 1,7 % |
| LPAPT possible | 4 | 2,2 % | 10 | 4,6 % | 3 | 1,8 % | 2 | 1,6 % | 2 | 1,3 % | 21 | 2,5 % |
| Dyspnée associée à la transfusion (DAT) | 8 | 4,3 % | 6 | 2,8 % | 11 | 6,6 % | 3 | 2,4 % | 14 | 9,4 % | 42 | 5,0 % |
| Transfusion incompatible | 3 | 1,6 % | 4 | 1,9 % | 1 | 0,6 % | 0 | 0,0 % | 1 | 0,7 % | 9 | 1,1 % |
| Infection bactérienne | 4 | 2,2 % | 2 | 0,9 % | 0 | 0,0 % | 1 | 0,8 % | 1 | 0,7 % | 8 | 0,9 % |
| Autre | 7 | 3,8 % | 8 | 3,7 % | 5 | 3,0 % | 11 | 8,7 % | 19 | 12,8 % | 50 | 5,9 % |
| Réactions inhabituelles | 1 | 0,5 % | 3 | 1,4 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 4 | 0,5 % |
| Total | 185 | 100 % | 216 | 100 % | 167 | 100 % | 126 | 100 % | 151 | 100 % | 843 | 100 % |
Les cas d’une gravité de niveau 2 résultant de la transfusion de produits stables ont été principalement des réactions anaphylactiques et anaphylactoïdes graves (23,7 %, n=68) et des réactions hémolytiques aiguës (13,2 %, n=36) et retardées (21,6 %, n=62), représentant environ 58,5 % des cas déclarés (tableau 4.1B).
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Surcharge volémique post-transfusionnelle (SVPT) | 3 | 4,8 % | 6 | 9,4 % | 3 | 4,5 % | 4 | 8,0 % | 3 | 6,8 % | 19 | 6,6 % |
| Réaction hémolytique aiguë (RHA) | 7 | 11,3 % | 7 | 10,9 % | 18 | 26,9 % | 2 | 4,0 % | 2 | 4,5 % | 36 | 13,2 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 12 | 19,4 % | 19 | 29,7 % | 7 | 10,4 % | 17 | 34,0 % | 13 | 29,5 % | 68 | 23,7 % |
| Réaction hypotensive (RH) | 0 | 0,0 % | 0 | 0,0 % | 1 | 1,5 % | 1 | 2,0 % | 2 | 4,5 % | 4 | 1,4 % |
| Réaction hémolytique retardée (RHR) | 22 | 35,5 % | 9 | 14,1 % | 14 | 20,9 % | 10 | 20,0 % | 7 | 15,9 % | 62 | 21,6 % |
| Dyspnée associée à la transfusion (DAT) | 1 | 1,6 % | 1 | 1,6 % | 1 | 1,5 % | 0 | 0,0 % | 1 | 2,3 % | 4 | 1,4 % |
| Céphalées liées à l’IgIV | 3 | 4,8 % | 7 | 10,9 % | 7 | 10,4 % | 4 | 8,0 % | 2 | 4,5 % | 23 | 8,0 % |
| Méningite aseptique | 3 | 4,8 % | 9 | 14,1 % | 11 | 16,4 % | 1 | 2,0 % | 3 | 6,8 % | 27 | 9,4 % |
| Transfusion incompatible | 1 | 1,6 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 0,3 % |
| Autre | 10 | 16,1 % | 6 | 9,4 % | 5 | 7,5 % | 11 | 22,0 % | 11 | 25,0 % | 43 | 15,0 % |
| Total | 62 | 100 % | 64 | 100 % | 67 | 100 % | 50 | 100 % | 44 | 100 % | 287 | 100 % |
b. Réactions indésirables qui constituent une menace à la vie (gravité de niveau 3Footnote 3 )
Un total de 171 (tableau 4A) cas déclarés entre 2011 et 2015 étaient d’une gravité de niveau 3 (c.-à-d., réputée constituer une menace à la vie) après une transfusion sanguine. Environ 87,1 % (n=149) de ces 171 cas étaient les bénéficiaires de produits sanguins labiles (tableau 4.2A), et ceux qui ont reçu des produits stables (tableau 4.2B) représentaient 12,8 % (n=22). Parmi les transfusions de produits sanguins labiles, la SVPT était la réaction d’une gravité de niveau 3 la plus commune et constituait plus de 38,2 % (n=57) des cas déclarés, suivie des LPAPT et des LPAPT possibles, à 19,4 % (n=29) et des RAAG, à 14,8 % (n=22).
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Surcharge volémique post-transfusionnelle (SVPT) | 16 | 45,7 % | 15 | 37,5 % | 6 | 27,3 % | 8 | 40,0 % | 12 | 37,5 % | 57 | 38,2 % |
| Réaction hémolytique aiguë (RHA) | 0 | 0,0 % | 0 | 0,0 % | 4 | 18,2 % | 1 | 5,0 % | 1 | 3,1 % | 6 | 4,0 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 4 | 11,4 % | 10 | 25,0 % | 1 | 4,5 % | 2 | 10,0 % | 5 | 15,6 % | 22 | 14,8 % |
| Réaction hypotensive (RH) | 2 | 5,7 % | 3 | 7,5 % | 1 | 4,5 % | 0 | 0,0 % | 1 | 3,1 % | 7 | 4,7 % |
| Réaction hémolytique retardée (RHR) | 0 | 0,0 % | 0 | 0,0 % | 1 | 4,5 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 0,7 % |
| Lésions pulmonaires aiguës post-transfusionnelles (LPAPT) | 6 | 17,1 % | 3 | 7,5 % | 0 | 0,0 % | 1 | 5,0 % | 0 | 0,0 % | 10 | 6,7 % |
| LPAPT possibles | 3 | 8,6 % | 3 | 7,5 % | 5 | 22,7 % | 5 | 25,0 % | 3 | 9,4 % | 19 | 12,7 % |
| Dyspnée associée à la transfusion (DAT) | 0 | 0,0 % | 1 | 2,5 % | 1 | 4,5 % | 0 | 0,0 % | 0 | 0,0 % | 2 | 1,3 % |
| Transfusion incompatible | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 3,1 % | 1 | 0,7 % |
| Infection bactérienne | 2 | 5,7 % | 0 | 0,0 % | 0 | 0,0 % | 2 | 10,0 % | 0 | 0,0 % | 4 | 2,7 % |
| Autre | 1 | 2,9 % | 1 | 2,5 % | 3 | 13,6 % | 1 | 5,0 % | 9 | 28,1 % | 15 | 10,1 % |
| Réactions inhabituelles | 1 | 2,9 % | 4 | 10,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 5 | 3,4 % |
| Total | 35 | 100 % | 40 | 100 % | 22 | 100 % | 20 | 100 % | 32 | 100 % | 149 | 100 % |
Des 22 cas parmi les bénéficiaires de produits sanguins, 27,3 % (n=6) étaient imputables à des RAAG, 13,6 % (n=3) à la SVPT, 13,6 % (n=3) à une réaction hémolytique, et 9 % (n=2) aux LPATP ou aux LPAPT possibles (tableau 4.2B).
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Surcharge volémique post-transfusionnelle (SVPT) | 1 | 20,0 % | 1 | 25,0 % | 0 | 0,0 % | 1 | 33,3 % | 0 | 0,0 % | 3 | 13,6 % |
| Réaction hémolytique aiguë (RHA) | 0 | 0,0 % | 1 | 25,0 % | 0 | 0,0 % | 0 | 0,0 % | 2 | 22,2 % | 3 | 13,6 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 1 | 20,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 33,3 % | 4 | 44,4 % | 6 | 27,3 % |
| Réaction hémolytique retardée (RHR) | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 33,3 % | 0 | 0,0 % | 1 | 4,5 % |
| Lésions pulmonaires aiguës post-transfusionnelles (LPAPT) | 1 | 20,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 4,5 % |
| LPAPT possibles | 1 | 20,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 4,5 % |
| Dyspnée associée à la transfusion (DAT) | 0 | 0,0 % | 1 | 25,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 4,5 % |
| Autre | 1 | 20,0 % | 1 | 25,0 % | 1 | 100 % | 0 | 0,0 % | 3 | 33,3 % | 6 | 27,3 % |
| Total | 5 | 100 % | 4 | 100 % | 1 | 100 % | 3 | 100 % | 9 | 100 % | 22 | 100 % |
5. Issue des réactions transfusionnelles indésirables
L’issue des réactions transfusionnelles indésirables est une mesure de l’étendue des séquelles de la réaction. Environ 91,7 % (n=3 278) des réactions transfusionnelles indésirables déclarées entre 2011 et 2015 ont entraîné soit des séquelles mineures, soit aucune séquelle (tableau 5A). Les réactions qui ont entraîné des séquelles majeures ou à long terme représentaient 2 % (n=70) et la proportion des décès étaient de 1,9 % (n=68).
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Séquelles mineures ou aucune séquelle | 577 | 90,7 % | 715 | 93,3 % | 793 | 92,5 % | 600 | 92,9 % | 593 | 88,4 % | 3 278 | 91,7 % |
| Séquelles majeures ou à long terme | 14 | 2,2 % | 12 | 1,6 % | 17 | 2,0 % | 6 | 0,9 % | 21 | 3,1 % | 70 | 2,0 % |
| Décès | 10 | 1,6 % | 10 | 1,3 % | 7 | 0,8 % | 16 | 2,5 % | 25 | 3,7 % | 68 | 1,9 % |
| Non déterminée | 35 | 5,5 % | 29 | 3,8 % | 40 | 4,7 % | 24 | 3,7 % | 32 | 4,8 % | 160 | 4,5 % |
| Total | 636 | 100 % | 766 | 100 % | 857 | 100 % | 646 | 100 % | 671 | 100 % | 3 576 | 100 % |
|
Nota : Des renseignements sur l’issue des réactions indésirables déclarées n’étaient pas disponibles pour 34 cas. |
||||||||||||
Environ 4,7 % (n=115) des réactions indésirables déclarées à la suite de la transfusion de produits sanguins labiles ont entraîné une issue grave (p. ex., des séquelles majeures ou à long terme, ou décès) (tableau 5B). Parmi les réactions indésirables déclarées à la suite de la transfusion de produits sanguins, environ 2 % (n=23) ont entraîné une issue grave (tableau 5C).
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Séquelles mineures ou aucune séquelle | 392 | 88,5 % | 460 | 91,6 % | 507 | 90,9 % | 426 | 91,6 % | 425 | 86,9 % | 2 210 | 89,9 % |
| Séquelles majeures ou à long terme | 14 | 3,2 % | 8 | 1,6 % | 13 | 2,3 % | 4 | 0,9 % | 15 | 3,1 % | 54 | 2,2 % |
| Décès | 10 | 2,3 % | 8 | 1,6 % | 7 | 1,3 % | 15 | 3,2 % | 21 | 4,3 % | 61 | 2,5 % |
| Non déterminée | 27 | 6,1 % | 26 | 5,2 % | 31 | 5,6 % | 20 | 4,3 % | 28 | 5,7 % | 132 | 5,4 % |
| Total | 443 | 100 % | 502 | 100 % | 558 | 100 % | 465 | 100 % | 489 | 100 % | 2 457 | 100 % |
|
Nota : Des renseignements sur l’issue des réactions indésirables déclarées n’étaient pas disponibles pour 22 cas. |
||||||||||||
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Séquelles mineures ou aucune séquelle | 185 | 95,9 % | 255 | 96,6 % | 286 | 95,7 % | 174 | 96,1 % | 168 | 92,3 % | 1 068 | 95,4 % |
| Séquelles majeures ou à long terme | 0 | 0,0 % | 4 | 1,5 % | 4 | 1,3 % | 2 | 1,1 % | 6 | 3,3 % | 16 | 1,4 % |
| Décès | 0 | 0,0 % | 2 | 0,8 % | 0 | 0,0 % | 1 | 0,6 % | 4 | 2,2 % | 7 | 0,6 % |
| Non déterminée | 8 | 4,1 % | 3 | 1,1 % | 9 | 3,0 % | 4 | 2,2 % | 4 | 2,2 % | 28 | 2,5 % |
| Total | 193 | 100 % | 264 | 100 % | 299 | 100 % | 181 | 100 % | 182 | 100 % | 1 119 | 100 % |
|
Nota : Des renseignements sur l’issue des réactions indésirables déclarées n’étaient pas disponibles pour 12 cas. |
||||||||||||
Parmi les réactions indésirables qui ont entraîné des séquelles majeures ou à long terme à la suite de la transfusion de produits sanguins labiles, les réactions déclarées les plus communes ont été les réactions hémolytiques retardées, à 27,8 % (n=15), et la SVPT, à 16,7 % (n=9) (tableau 5D). Les données disponibles indiquent que le nombre de cas parmi les bénéficiaires de produits stables qui ont développé des séquelles majeures ou à long terme continue d’être très dispersé à l’échelle des différents types de réactions, ne dépassant pas cinq cas par année de 2011 à 2015 (tableau 5E).
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Surcharge volémique post-transfusionnelle (SVPT) | 1 | 7,1 % | 2 | 25,0 % | 2 | 15,4 % | 2 | 50,0 % | 2 | 13,3 % | 9 | 16,7 % |
| Réaction hémolytique aiguë (RHA) | 3 | 21,4 % | 0 | 0,0 % | 2 | 15,4 % | 0 | 0,0 % | 1 | 6,7 % | 6 | 11,1 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 1 | 7,1 % | 0 | 0,0 % | 2 | 15,4 % | 0 | 0,0 % | 2 | 13,3 % | 5 | 9,2 % |
| Réaction hémolytique retardée (RHR) | 7 | 50,0 % | 2 | 25,0 % | 5 | 38,5 % | 0 | 0,0 % | 1 | 6,7 % | 15 | 27,8 % |
| LPAPT possible | 1 | 7,1 % | 0 | 0,0 % | 1 | 7,7 % | 1 | 25,0 % | 1 | 6,7 % | 4 | 7,4 % |
| Dyspnée associée à la transfusion (DAT) | 1 | 7,1 % | 0 | 0,0 % | 1 | 7,7 % | 0 | 0,0 % | 1 | 6,7 % | 3 | 5,6 % |
| Autre | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 25,0 % | 7 | 46,6 % | 8 | 14,8 % |
| Réactions inhabituelles | 0 | 0,0 % | 4 | 50,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 4 | 7,4 % |
| Total | 14 | 100 % | 8 | 100 % | 13 | 100 % | 4 | 100 % | 15 | 100 % | 54 | 100 % |
| Réaction transfusionnelle indésirable | 2011 | 2012 | 2013 | 2014 | 2015 | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | Fréq. | % | |
| Réaction hémolytique aiguë (RHA) | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 16,7 % | 1 | 6,2 % |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 0 | 0,0 % | 1 | 25,0 % | 0 | 0,0 % | 1 | 50,0 % | 0 | 0,0 % | 2 | 12,5 % |
| Réaction hémolytique retardée (RHR) | 0 | 0,0 % | 0 | 0,0 % | 2 | 50,0 % | 1 | 50,0 % | 1 | 16,7 % | 4 | 25,0 % |
| Dyspnée associée à la transfusion (DAT) | 0 | 0,0 % | 1 | 25,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 6,2 % |
| Céphalées liées à l’IgIV | 0 | 0,0 % | 0 | 0,0 % | 1 | 25,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 6,2 % |
| Méningite aseptique | 0 | 0,0 % | 1 | 25,0 % | 0 | 0,0 % | 0 | 0,0 % | 0 | 0,0 % | 1 | 6,2 % |
| Autre | 0 | 0,0 % | 1 | 25,0 % | 1 | 25,0 % | 0 | 0,0 % | 4 | 66,6 % | 6 | 37,5 % |
| Total | 0 | 0,0 % | 4 | 100 % | 4 | 100 % | 2 | 100 % | 6 | 100 % | 16 | 100 % |
6. Réactions transfusionnelles indésirables qui ont entraîné un décès
Entre 2011 et 2015, un total de 68 cas de décès ont été déclarés chez les patients qui ont développé une réaction indésirable après la transfusion (tableau 6A). De ce nombre, cinq décès (7,4 %) ont été déclarés comme étant certainement liés à une transfusion et 15 (22,1 %) étaient certainement non liés à une transfusion (lien inexistant). Les cas qui sont jugés comme probablement ou possiblement liés à une transfusion représentaient 10,3 % (n=7) et 29,4 % (n=20), respectivement. La relation entre la transfusion pour les 30,9 % (n=21) restants était soit douteuse (n=11), ou n’a pas pu être déterminée (n=10).
| Décès lié à une transfusion | Certaine | Probable | Possible | Lien douteux | Lien inexistant | Non déterminée | Total |
| Surcharge volémique post-transfusionnelle (SVPT) | 0 | 1 | 8 | 5 | 8 | 7 | 29 (42,6%) |
| Réaction hémolytique aiguë (RHA) | 1 | 0 | 3 | 0 | 0 | 1 | 5 (7,4 %) |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 1 | 0 | 0 | 0 | 0 | 0 | 1 (1,5 %) |
| Réaction hémolytique retardée (RHR) | 0 | 0 | 1 | 0 | 1 | 0 | 2 (2,9 %) |
| Lésions pulmonaires aiguës post-transfusionnelles (LPAPT) | 0 | 1 | 1 | 0 | 0 | 0 | 2 (2,9 %) |
| LPAPT possibles | 0 | 3 | 4 | 3 | 2 | 1 | 13 (19,1 %) |
| Dyspnée associée à la transfusion (DAT) | 0 | 0 | 0 | 1 | 0 | 0 | 1 (1,5 %) |
| Transfusion incompatible | 0 | 0 | 0 | 0 | 1 | 0 | 1 (1,5 %) |
| Infection bactérienne | 0 | 1 | 1 | 1 | 0 | 0 | 3 (4,4 %) |
| Autre | 3 | 1 | 2 | 1 | 3 | 1 | 11 (16,2 %) |
| Total | 5 (7,4 %) | 7 (10,3 %) | 20 (29,4 %) | 11 (16,2 %) | 15 (22,1 %) | 10 (14,7 %) | 68 (100 %) |
Dans l’ensemble, un total de 32 décès jugés comme certainement, probablement ou possiblement liés à une transfusion ont été déclarés pour la période de 2011 à 2015 (tableau 6B). Vingt‑six décès étaient associés à des produits sanguins labiles et 6, avec des produits stables. La majorité de ces décès étaient associés à des LPAPT (n=2), à des LPAPT possibles (n=7) ou à une SVPT (n=9). Même si le nombre de décès en 2015 est supérieur aux années précédentes, il est trop tôt pour relever une tendance. Cependant, cela fera l’objet d’une surveillance au cours des prochaines années.
| Décès lié à une transfusion | 2011 | 2012 | 2013 | 2014 | 2015 | Total |
| Surcharge volémique post-transfusionnelle (SVPT) | 2 | 2 | 1 | 1 | 3 | 9 (28,1 %) |
| Réaction hémolytique aiguë (RHA) | 0 | 0 | 1 | 1 | 2 | 4 (12,5 %) |
| Réactions anaphylactiques et anaphylactoïdes graves (RAAG) | 0 | 0 | 0 | 0 | 1 | 1 (3,1 %) |
| Réaction hémolytique retardée (RHR) | 0 | 0 | 1 | 0 | 0 | 1 (3,1 %) |
| Lésions pulmonaires aiguës post-transfusionnelles (LPAPT) | 1 | 1 | 0 | 0 | 0 | 2 (6,3 %) |
| LPAPT possibles | 2 | 2 | 2 | 1 | 0 | 7 (21,9 %) |
| Infection bactérienne | 1 | 0 | 0 | 1 | 0 | 2 (6,3 %) |
| Autre | 0 | 1 | 1 | 0 | 4 | 6 (18,8 %) |
| Total | 6 (18,8 %) | 6 (18,8 %) | 6 (18,8 %) | 4 (12,5 %) | 10 (31,3 %) | 32 (100 %) |
Les dix décès indiqués dans le tableau 6B pour 2015 présentaient les caractéristiques suivantes :
- un homme âgé de 56 ans atteint de saignements gastro‑intestinaux a reçu une greffe de cellules souches dans le bloc opératoire, puis a développé une réaction hémolytique aiguë probable d’une gravité de niveau 3 à la suite d’une transfusion d’IgIV;
- un homme âgé de 86 ans qui a reçu une transfusion de globules rouges a développé une SVPT probable dans une unité de soins intensifs;
- une femme âgée de 80 ans qui a été admise aux soins chroniques a reçu une transfusion de globules rouges et a développé une SVPT probable;
- une femme âgée de 74 ans qui a été admise à un bloc opératoire avec une insuffisance rénale aiguë, un œdème pulmonaire, des épisodes d’hypotension transitoire et de syncope, une oligurie, une fibrillation auriculaire, des saignements gastro‑intestinaux et une pneumonie a développé une SVPT possible à la suite d’une transfusion de globule rouge;
- une nouveau-née prématurée et âgée d’un mois qui présentait un abdomen distendu et rigide ainsi que des vomissements bilieux à l’unité des soins intensifs a reçu une transfusion de globules rouges et a développé une autre réaction possible d’une gravité de niveau 3;
- un homme de 85 ans qui présentait une pneumonie de déglutition, une maladie cardiaque chronique, une insuffisance cardiaque congestive, un remplacement de la valve mitrale et de l’hypertension a été admis au bloc opératoire et, à la suite d’une transfusion de globules rouges, a développé une autre réaction possible;
- une femme de 71 ans qui présentait un purpura thrombopénique idiopathique et une anémie hémolytique dans le bloc opératoire a développé une réaction hémolytique aiguë possible à la suite d’une transfusion d’IgIV;
- une femme de 89 ans qui présentait une faiblesse progressive et une tachycardie dans le bloc opératoire a développé une autre réaction certaine à la suite d’une transfusion d’IgIV;
- un homme de 87 ans qui présentait un infarctus du myocarde avec une déficience acquise d’un facteur VIII dans le bloc opératoire a développé une autre réaction certaine à la suite de la transfusion de facteurs de coagulation;
- une femme de 71 ans a fait l’objet d’une déclaration d’un cas de gravité de niveau 4 (décès) qui était certainement lié à un choc anaphylactique (réaction anaphylactique et anaphylactoïde grave) à la suite d’une transfusion de globules rouges.
Résumé
Un total de 3 610 cas de réactions transfusionnelles indésirables a été déclaré au SSIT au cours de la période de 2011 à 2015, il n’y avait aucune tendance claire quant au nombre déclaré par année au cours de cette période. Les conclusions du présent rapport démontrent que, dans le cas des produits sanguins labiles, les réactions indésirables les plus communes étaient la SVPT, les RAAG et la réaction hypotensive, alors que, dans le cas des produits stables, les réactions indésirables les plus communes étaient les céphalées liées à l’IgIV, la réaction hémolytique retardée et les RAAG. Dans l’ensemble, environ une réaction indésirable sur dix était certainement liée à une transfusion et les neuf autres étaient probablement ou possiblement liées à une transfusion. Environ cinq pourcent des réactions indésirables ont nécessité une intervention majeure et, de celles‑ci, environ soixante‑dix pourcent étaient liées à trois types de réactions indésirables : la SVPT (35,1 %), les LPAPT et les LPAPT possibles (18,1 %) et les RAAG (16,4 %).
Des 68 décès déclarés entre 2011 et 2015, on a jugé que 32 étaient liés à une transfusion (26 décès associés à la transfusion de produits sanguins labiles et 6 associés à la transfusion de produits stables). La majorité des décès liés à une transfusion étaient associés à la SVPT (n=9) ou à des LPAPT ou à des LPAPT possibles (n=9), cependant, puisque la plupart des décès sont survenus chez des personnes âgées (60 % étaient âgées de plus de 73 ans), il peut y avoir certaines autres causes sous-jacentes (maladies concomitantes) de ces décès qui pourraient ne pas être directement liées à des transfusions. Veuillez prendre note que les changements au fil du temps concernant le nombre de décès déclarés devraient faire l’objet d’une interprétation prudente, compte tenu du petit nombre de rapports et des variations inhérentes dans les rapports annuels. D’autres recherches sont requises pour préciser la relation entre les transfusions et les réactions indésirables graves, comme le décès.
Footnotes
- 1ST Footnote *
-
Système de surveillance des incidents transfusionnels, Manuel de l’utilisateur, ver. 3.0 2007. Agence de la santé publique du Canada.
- 2ND Footnote *
-
Niveau 2 (grave) : Le patient a nécessité une hospitalisation ou une prolongation de l’hospitalisation directement imputable à la réaction; ou la réaction indésirable a donné lieu à une invalidité ou à une incapacité persistante ou importante; ou a nécessité une intervention médicale ou chirurgicale pour empêcher un dommage permanent ou important ou une invalidité permanente ou importante d’une fonction corporelle.
- 3RD Footnote *
-
Niveau 3 (menace à la vie) : Le patient a nécessité une intervention importante à la suite d’une transfusion (vasopresseurs, intubation, transfert aux soins intensifs).