Revue de la littérature du CCNI sur les effets de la prophylaxie par palivizumab sur la réduction des complications associées au virus respiratoire syncytial chez les nourrissons
Télécharger en format PDF
(1.26 Mo, 133 pages)
Organisation : Agence de la santé publique du Canada
Publiée : 2023-02-01
Publié : 1 février 2023
Sur cette page
- Sommaire
- Introduction
- Méthodologie
- Résultats
- Analyse/Résumé
- Population mixte
- Nourrissons prématurés sans maladie pulmonaire chronique infantile
- Nourrissons prématurés atteints d'une maladie pulmonaire chronique infantile
- Enfants présentant une cardiopathie congénitale hémodynamiquement significative
- Enfants résidant dans des communautés éloignées
- Children with CF
- Enfants atteints du syndrome de Down
- Manque de données
- Conclusion
- Liste des Abréviations
- Remerciements
- Annexe A : Stratégie et résultats de recherche
- Annexe B : Niveau de données probantes selon la méthodologie de la recherche et de la cote de qualité des données probantes (validité interne)
- Annexe C : Évaluation de la qualité de l'examen systématique initial de la littérature de l'INESSS par Amstar
- Annexe D : Diagramme de flux de Prisma
- Annexe E : Résumé des données probantes issues de l'examen actualisé de la littérature de l'INESSS concernant l'efficacité potentielle et réelle de la prophylaxie par palivizumab chez les nourrissons et les enfants
- Annexe F : Résumé des données probantes issues de l'examen initial de la littérature de l'INESSS concernant l'efficacité potentielle et réelle de la prophylaxie par palivizumab chez les nourrissons et les enfants
- Annexe G : Nombre de personnes à traiter avec palivizumab pour éviter une hospitalisation en raison du virus respiratoire syncytial, une admission à l'unité des soins intensifs ou une respiration sifflante récurrente
- Références
Préambule
Le Comité consultatif national de l'immunisation (CCNI) et un organisme consultatif externe qui donne à l'Agence de la santé publique du Canada (ASPC) des conseils indépendants, continus et à jour dans le domaine de la médecine, des sciences et de la santé publique liés aux questions de l'ASPC concernant l'immunisation.
En plus de la prise en compte du fardeau associé aux maladies et des caractéristiques vaccinales, l'ASPC a élargi le mandat du CCNI de façon à lui permettre d'inclure la revue systématique des facteurs liés aux programmes dans la formulation de ses recommandations axées sur des données probantes. Cette initiative devrait aider le CCNI à prendre des décisions en temps opportun en ce qui a trait aux programmes de vaccination financés par les fonds publics à échelle provinciale et territoriale.
Les nouveaux facteurs que le CCNI devra examiner de façon systématique sont les suivants : économie, équité, éthique, acceptabilité et faisabilité. Les déclarations du CCNI ne nécessiteront pas toutes une analyse approfondie de l'ensemble des facteurs programmatiques. Même si la revue systématique des facteurs liés aux programmes sera effectuée à l'aide d'outils fondés sur des données probantes afin de cerner les problèmes distincts susceptibles d'avoir une incidence sur la prise de décision pour l'élaboration des recommandations, seuls les problèmes distincts considérés comme étant propres au vaccin ou à la maladie pouvant être prévenue par un vaccin seront inclus.
La présente déclaration contient les conseils indépendants et les recommandations du CCNI, qui reposent sur les connaissances scientifiques les plus récentes et diffuse ce document aux fins d'information. Les personnes qui administrent le vaccin devraient également connaître le contenu de la monographie de produit pertinente. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait homologuer les vaccins et ont démontré leur innocuité et leur efficacité potentielle lorsqu'ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les membres de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, notamment déclarer chaque année les conflits d'intérêts possibles.
Sommaire
Depuis la publication de la Déclaration du Comité consultatif national de l'immunisation (CCNI) en 2003, une série de documents d'orientation actualisés sur le palivizumab (PVZ) ont été publiés par des comités d'experts, dont l'American Academy of Pediatrics (2014) Note de bas de page 1 Note de bas de page 2 et la Société canadienne de pédiatrie en 2015 Note de bas de page 3, lesquels ont formulé des recommandations sur la prophylaxie par PVZ qui diffèrent considérablement des orientations actuelles du CCNI; ce qui a amené le Comité à reconnaître la nécessité de réévaluer ses recommandations. En 2016, l'Institut national d'excellence en santé et en services sociaux (INESSS) du Québec a publié une recherche systématique de la littérature jusqu'au 22 décembre 2015 pour évaluer l'efficacité réelle (ER) de la prophylaxie par PVZ dans la réduction du risque de complications associées au virus respiratoire syncytial (VRS) chez les enfants afin d'éclairer les critères d'utilisation du PVZ au Québec Note de bas de page 4. La question de recherche étudiée dans l'examen de l'INESSS correspondait directement aux besoins du groupe de travail du CCNI sur le VRS (GT VRS). L'objectif du présent examen systématique de la littérature est de mettre à jour l'examen systématique publié en 2016 par l'INESSS et de synthétiser les nouveaux résultats avec ceux de l'examen initial afin d'éclairer les recommandations actualisées du Comité sur l'utilisation de la prophylaxie par PVZ chez les nourrissons.
L'examen de la littérature s'est penché sur les données probantes de l'ER de la prophylaxie par PVZ par rapport à l'administration d'un placebo ou à l'absence de prophylaxie pour réduire les complications associées à l'infection par le VRS chez les enfants. Les résultats d'intérêt comprenaient l'hospitalisation et sa durée, le séjour en soins intensifs, la durée du séjour en soins intensifs, l'utilisation de l'oxygénothérapie, la durée de l'utilisation de l'oxygénothérapie, l'utilisation de la ventilation mécanique (VM), la durée de l'utilisation de la VM, les séquelles à long terme (p. ex., respiration sifflante, asthme) et la mortalité.
Une stratégie de recherche utilisant la méthodologie de l'INESSS, conçue en collaboration avec un bibliothécaire de Santé Canada, a été utilisée pour interroger de multiples bases de données électroniques de décembre 2015 à février 2017 afin de repérer les articles d'intérêt publiés en anglais ou en français. En 2019 et 2020, des recherches répétées utilisant la même stratégie ont permis de repérer les publications de février 2017 au 29 juillet 2020. Deux (2) examinateurs ont indépendamment passé en revue les dossiers saisis par chaque recherche et ont évalué la qualité des études incluses. L'un (1) d'entre eux a extrait les données pertinentes des études recensées, l'exactitude de l'extraction des données étant vérifiée par le second examinateur. Un résumé narratif des résultats des études incluses a ensuite été créé, et les conclusions ont été compilées avec celles de l'examen initial de la littérature de l'INESSS.
L'examen actualisé de la littérature sur l'efficacité potentielle (EP) et l'ER de la prophylaxie par PVZ a cerné 3 examens systématiques de bonne (2) et moyenne (1) qualité, 2 essais contrôlés randomisés (ECR) dont la qualité est bonne et passable, 17 études d'observation de cohortes de qualité passable (13), bonne (2) ou faible (2) et 2 études cas-témoins de qualité passable.
L'examen actualisé a permis de relever des études portant sur des populations mixtes de nourrissons, sur des enfants nés prématurément sans maladie pulmonaire chronique (MPC) due à la prématurité, sur des nourrissons atteints de MPC, sur des nourrissons atteints de cardiopathie congénitale hémodynamiquement significative (CPCHS), sur des enfants atteints de fibrose kystique (FK) et sur des nourrissons atteints du syndrome de Down (SD). L'examen n'a pas relevé de nouvelles études concernant les enfants vivant dans des communautés éloignées. Comme dans l'examen initial de la littérature de l'INESSS, l'examen actualisé n'a pas relevé d'études sur l'ER de la prophylaxie par rapport au placebo ou à l'absence d'intervention chez les enfants atteints de troubles neuromusculaires graves affectant la fonction respiratoire, d'anomalies des voies aériennes supérieures affectant la fonction respiratoire, d'une maladie pulmonaire chronique autre que celle associée à la prématurité ou à la FK, d'une immunosuppression ou d'une maladie métabolique, ou chez les nourrissons en santé issus de naissances multiples dont un jumeau ou un triplé est admissible au traitement par PVZ.
Les conclusions de l'examen actualisé de la littérature étaient généralement conformes à celles de l'examen de la littérature de l'INESSS. En raison des différences de conception et de qualité des études, il est difficile de comparer directement les résultats des études et de tirer des conclusions définitives.
Le résultat le plus étudié était les hospitalisations associées au VRS (HVRS). La prophylaxie par PVZ a été associée à une réduction du risque d'hospitalisation dans des populations mixtes d'enfants susceptibles de faire une infection sévère par le VRS et chez les enfants prématurés sans MPC, bien que le degré de prématurité auquel le PVZ est le plus efficace ne soit pas clair. Le PVZ était efficace chez les nourrissons de 29 à 33 semaines d'âge gestationnel (sAG), mais les données sur les prématurés plus nombreux et ceux de plus de 33 sAG n'étaient pas définitives. Bien qu'un premier ECR ait mis en évidence une réduction du risque d'HVRS chez les nourrissons atteints de MPC, les études d'observation ultérieures ont donné des résultats contradictoires. Le PVZ s'est avéré efficace dans 2 études de plus grande envergure portant sur des nourrissons atteints de CPCHS, mais l'une d'entre elles n'a montré une protection que pour la cardiopathie acyanotique, tandis que l'autre n'a montré un effet que pour la cardiopathie cyanotique, et 2 études de plus petite taille n'ont montré aucun effet. La prophylaxie par PVZ a réduit de manière significative le risque d'HVRS chez les enfants inuits prématurés vivant au Nunavut et en Alaska. Le PVZ n'a eu aucun effet sur l'HVRS dans la plupart des études (5 sur 6) portant sur des nourrissons atteints de FK. Trois (3) études portant sur des enfants atteints du SD suggèrent que le PVZ pourrait ne pas être bénéfique aux enfants qui ne présentent pas d'autres affections à haut risque justifiant l'administration de PVZ, mais le nombre étudié était faible. Le nombre de sujets à traiter (NST) pour prévenir une HVRS variait considérablement et était influencé par la population de patients, le lieu, le nombre de participants et le taux d'HVRS chez les témoins. Le NST semble être le plus faible chez les nourrissons atteints de MPC et le plus élevé chez ceux atteints de CPCHS.
Les données probantes sont limitées quant à l'ERP sur d'autres résultats (durée de l'hospitalisation, admission et durée du séjour en soins intensifs, recours à la VM). Le PVZ n'a pas semblé influencer la sévérité de la maladie en cas d'infections contractées malgré l'administration de PVZ et nécessitant une hospitalisation, mais il est possible que les études aient été insuffisantes pour détecter un effet.
Les résultats sont contradictoires quant à l'effet du PVZ sur la mortalité toutes causes confondues, car la taille de l'échantillon dans la plupart des études est trop faible pour analyser ce résultat rare. Chez les prématurés, le PVZ peut avoir un effet chez les nourrissons nés à 32 sAG ou moins, mais pas chez les nourrissons plus matures. Aucun effet n'a été observé chez les nourrissons atteints de MPC ou de CPCHS. Cependant, ces résultats reposent sur un petit nombre d'études qui sont peut-être insuffisantes pour détecter un effet.
Des études sur les séquelles à long terme de l'infection par le VRS suggèrent que la prophylaxie par PVZ réduit le risque de sifflements récurrents au cours des premières années de vie, mais qu'elle n'a peut-être pas d'effet significatif sur la persistance des sifflements récurrents chez les enfants plus âgés. Le PVZ n'avait pas non plus d'ER significative sur les séquelles à long terme chez les enfants atteints de FK.
Introduction
I.1 Contexte
Le virus respiratoire syncytial (VRS) est la cause la plus fréquente des maladies des voies respiratoires inférieures chez les jeunes enfants dans le monde entier et infecte presque tous les nourrissons avant l'âge de 2 ans Note de bas de page 5 Note de bas de page 6. Au Canada, il provoque des épidémies annuelles chaque hiver. La saison du VRS commence généralement en octobre ou en novembre et dure jusqu'en avril ou en mai, la plupart des cas survenant entre décembre et mars Note de bas de page 7 Note de bas de page 8.
Les diagnostics les plus courants chez les jeunes enfants nécessitant une hospitalisation associée au VRS (HVRS) sont la bronchiolite et la pneumonie Note de bas de page 9. Les taux d'HVRS sont les plus élevés chez les enfants de moins d'un an et particulièrement au cours des premiers mois de vie Note de bas de page 5. Les taux d'HVRS par 1000 enfants par an dans les pays à revenu élevé sont de 26,3 (intervalle de confiance [IC] à 95 % : 22,8 à 30,2 %), de 11,3 (IC à 95 % : 6,1 à 20,9 %) et de 1,4 (IC à 95 % : 0,9 à 2,0 %) pour les groupes d'âge 0 à 5 mois, 6 à 11 mois et 12 à 59 mois, respectivement Note de bas de page 6. Au Canada, des taux similaires de 20, 10,2 et 4,8 par 1000 enfants par année sont signalés pour les enfants âgés de moins de 6 mois Note de bas de page 9, moins d'un an et de 1 à 3 ans Note de bas de page 10.
La plupart des enfants de moins de 2 ans hospitalisés ne présentent aucune comorbidité Note de bas de page 5 Note de bas de page 10, mais des taux et des durées d'hospitalisation plus élevés ainsi qu'un plus grand nombre d'admissions en unité de soins intensifs (USI) ont été constatés chez les prématurés et chez les enfants atteints d'une maladie pulmonaire chronique due à la prématurité (MPC) ou de cardiopathie congénitale hémodynamiquement significative (CPCHS) Note de bas de page 3 Note de bas de page 5 Note de bas de page 10 Note de bas de page 11. Les enfants atteints d'autres maladies pulmonaires non associées à la prématurité (p. ex., la FK), d'autres affections chroniques et les enfants autochtones peuvent également présenter un risque accru de maladie sévère liée au VRS Note de bas de page 3. Dans les pays à revenu élevé, la mortalité due au VRS est rare et survient généralement chez des enfants présentant des comorbidités importantes Note de bas de page 12.
En juin 2002, Santé Canada a approuvé le palivizumab (PVZ) [Synagis MC , Abbott Laboratories Ltd., Saint-Laurent, Québec], un anticorps monoclonal anti-VRS, pour la prévention des maladies graves des voies respiratoires inférieures causées par le VRS chez les nourrissons présentant un risque élevé de développer une forme grave de la maladie. En 2003, le Comité consultatif national de l'immunisation (CCNI) a publié des recommandations sur l'utilisation du PVZ pour la prévention de la maladie liée au VRS Note de bas de page 13.
À l'époque, il recommandait d'utiliser le PVZ pendant la saison du VRS chez les nourrissons prématurés de 32 semaines d'âge gestationnel (sAG) ou moins et âgés de moins de 6 mois pendant la saison du VRS, chez les enfants de moins de 24 mois atteints d'une MPC nécessitant une oxygénothérapie et/ou une thérapie médicale au cours des 6 mois précédents, ou d'autres troubles pulmonaires nécessitant une oxygénothérapie, et chez les enfants de moins de 24 mois atteints d'une CPCHS. La prophylaxie par PVZ pourrait également être envisagée pour les enfants nés à moins de 35 sAG qui ont moins de 6 mois pendant la saison du VRS et qui vivent dans des communautés nordiques éloignées Note de bas de page 13.
Depuis la déclaration de 2003, les recommandations du CCNI ont été modifiées dans le Guide canadien d'immunisation (GCI), mais aucune nouvelle déclaration n'a été publiée. Depuis 2013, en plus des recommandations ci-dessus, le GCI indique que la prophylaxie par PVZ peut être bénéfique pour certains nourrissons entre 33 et 35 sAG qui ont moins de 6 mois au début de la saison du VRS et qu'elle peut être envisagée pour les nourrissons de ce groupe d'âge gestationnel (AG) qui vivent dans des communautés rurales ou éloignées en fonction d'une évaluation de l'accès aux soins médicaux (p. ex., la nécessité d'un transport aérien vers les installations hospitalières) et d'autres facteurs connus pouvant augmenter le risque. De plus, la prophylaxie par PVZ devrait être envisagée pour tous les enfants inuits des communautés éloignées du Nord qui sont âgés de moins de 6 mois au début de la saison du VRS, quel que soit leur AG.
Depuis la publication de la Déclaration du CCNI en 2003, une série de documents d'orientation actualisés sur le PVZ ont été publiés par des comités d'experts, dont l'American Academy of Pediatrics (2014) Note de bas de page 1 Note de bas de page 2 et la Société canadienne de pédiatrie (2015) Note de bas de page 3, lesquels ont formulé des recommandations sur la prophylaxie du PVZ qui diffèrent considérablement des orientations du CCNI-GCI, ce qui suggère la nécessité de réévaluer les recommandations du Comité.
En 2016, l'Institut national d'excellence en santé et en services sociaux (INESSS) du Québec a réalisé un examen systématique de la littérature pour évaluer l'efficacité réelle (ER) de la prophylaxie par PVZ dans la réduction du risque de complications associées au VRS chez les enfants afin d'éclairer les critères d'utilisation du PVZ dans cette province Note de bas de page 4. La question de recherche étudiée dans l'examen de l'INESSS correspondait directement aux besoins du groupe de travail du CCNI sur le VRS (GT VRS).
I.2 Buts et objectifs
L'objectif du présent examen systématique de la littérature est de mettre à jour la recherche utilisée dans l'examen systématique de la littérature de l'INESSS de 2016 et de synthétiser les nouveaux résultats avec ceux de l'examen initial de la littérature de l'INESSS. Ces données seront utilisées pour éclairer les recommandations actualisées du CCNI sur l'utilisation de la prophylaxie par PVZ chez les nourrissons.
Méthodologie
II.1 Évaluation de l'examen systématique initial de la littérature de l'INESSS
Avant d'entreprendre une mise à jour de l'examen systématique initial de la littérature de l'INESSS, le GT VRS a évalué la qualité de l'examen initial afin de déterminer s'il fournissait une base de données probantes appropriée pour éclairer les recommandations du CCNI. L'examen systématique initial de la littérature de l'INESSS a été évalué indépendamment par 2 examinateurs à l'aide de l'outil AMSTAR (A Measurement Tool to Assess Systematic Reviews=outil d'évaluation des examens systématiques) Note de bas de page 14 et les résultats ont été présentés au GT VRS. De plus, on a évalué si la méthode d'évaluation de la qualité du CASP (Critical Appraisal Skills Programme=Programme de développement des compétences en évaluation critique) Note de bas de page 15 utilisée pour évaluer les études individuelles dans l'examen initial de l'INESSS était comparable à la méthode d'évaluation de la qualité du Comité.
II.2 Examen actualisé de la littérature : Question de recherche
Cet examen systématique actualisé se penche sur les données probantes de l'ER de la prophylaxie par PVZ par rapport à l'administration d'un placebo ou à l'absence de prophylaxie pour réduire les complications associées à l'infection par le VRS chez les enfants.
P – Population : Nourrissons et enfants (<18 ans)
I – Intervention : Prophylaxie par PVZ
C – Comparaison : Placebo ou sans prophylaxie
R – Résultats : Complications spécifiques au VRS, comme l'hospitalisation et sa durée, le séjour en USI, la durée du séjour en USI, le recours à l'oxygénothérapie, la durée de l'oxygénothérapie, le recours à la ventilation mécanique (VM), la durée de la VM, les séquelles à long terme (p. ex., respiration sifflante, asthme) et la mortalité
II.3 Stratégie de recherche
Les bases de données électroniques MEDLINE, la Cochrane Database of Systematic Reviews et Health Technology Assessment (qui est incluse dans MEDLINE) et EMBASE ont été consultées du 1 décembre 2015 au 17 février 2017 à l'aide de stratégies de recherche adaptées par un bibliothécaire de Santé Canada à partir de l'examen de la littérature de l'INESSS réalisé précédemment Note de bas de page 4. Les recherches ont été limitées aux articles publiés en anglais et en français. La recherche a été répétée, en utilisant la même stratégie, pour les publications du 1 février 2017 au 12 avril 2019 et à nouveau pour les publications d'avril 2019 au 29 juillet 2020. Les stratégies de recherche électronique complètes sont présentées à l'Annexe A.
II.4 Repérage des études admissibles
Les études extraites des recherches dans les bases de données ont été chargées dans RefWorks (ProQuest LLC, Ann Arbor, MI) et les dossiers en double ont été supprimés. La sélection des dossiers et l'évaluation de l'admissibilité ont été effectuées indépendamment par 2 examinateurs. Les dossiers retournés par suite des recherches dans les bases de données ont d'abord été triés en fonction du titre et du résumé pour vérifier leur admissibilité potentielle. Le texte intégral des études jugées potentiellement admissibles après avoir été triées en fonction du titre et du résumé, ou pour lesquelles les renseignements disponibles étaient insuffisants pour déterminer leur recevabilité (p. ex., aucun résumé), a été obtenu et examiné davantage pour en vérifier l'admissibilité. Les critères d'inclusion et d'exclusion pour le processus de repérage et de sélection de la littérature ont été adaptés des critères utilisés dans l'examen initial de la littérature de l'INESSS Note de bas de page 4.
Les études ont été incluses si elles répondaient aux critères décrits dans la Section II.2 ci-dessus et s'il s'agissait d'études de recherche primaire (essais contrôlés randomisés [ECR], études d'observation [cohorte, cas-témoins]) ou d'examens systématiques d'études primaires avec ou sans méta-analyse.
Les articles ont été exclus de l'examen s'ils satisfaisaient à au moins l'un des critères suivants :
- L'étude ne contenait aucun des résultats d'intérêt
- Les articles représentant des thèses de doctorat ou de maîtrise, des séries de cas, des études de cas, des résumés de conférences, des études économiques, des directives de pratique clinique, des conférences de concertation, des rapports d'évaluation des technologies de la santé
- Des publications dans une langue autre que l'anglais ou le français
Un examinateur a effectué une recherche manuelle dans les listes de références des articles inclus afin de repérer d'autres publications pertinentes. Les articles potentiels trouvés par la recherche manuelle ont ensuite été soumis à une vérification d'admissibilité par 2 examinateurs, comme il a été décrit ci-dessus.
II.5 Extraction des données
Un examinateur a extrait les données des études incluses dans l'examen dans un tableau de données probantes en utilisant un modèle d'abstraction de données mis à l'essai conçu pour saisir les renseignements sur la conception de l'étude, la population et les résultats d'intérêt. Un deuxième examinateur a validé de manière indépendante les données résumées, les désaccords ou divergences étant résolus par discussion et concertation.
II.6 Évaluation de la qualité méthodologique
La qualité méthodologique des études d'observation incluses a été évaluée indépendamment par 2 examinateurs à l'aide des critères spécifiques de Harris et al. adoptés par le CCNI pour évaluer la validité interne des études individuelles (Annexe B) Note de bas de page 16. Pour les examens systématiques inclus avec ou sans méta-analyse, la qualité des études a été évaluée à l'aide d'AMSTAR Note de bas de page 14.
II.7 Synthèse qualitative
Une synthèse narrative des renseignements extraits des études incluses a été utilisée pour explorer l'efficacité potentielle (EP) et l'ER de la prophylaxie par PVZ pour les résultats d'intérêt, y compris des résumés de la direction, de la taille et de la signification statistique des estimations d'effet signalées pour divers résultats définis par l'étude. Ces résultats ont ensuite été combinés aux conclusions de l'examen initial de l'INESSS dans la section Analyse du présent rapport. Les données extraites et l'évaluation de la qualité de chacune de ces études sont présentées dans le tableau des données probantes à l'Annexe E. Les résultats des études recensées dans l'examen initial de l'INESSS sont résumés à l'Annexe F.
Résultats
Sont résumées à la Section III.1 l'évaluation de la qualité de l'examen systématique initial de la littérature de l'INESSS et une évaluation de la comparabilité des méthodologies du CASP et du CCNI pour évaluer la qualité des études. Est résumé à la Section III.2 le processus de repérage et de sélection des études utilisé dans l'examen systématique actualisé de la littérature, y compris les détails des études et une évaluation de la qualité méthodologique. Sont résumées à la Section III.3 les données probantes relatives à l'EP et à l'ER de la prophylaxie par PVZ pour divers résultats relatifs au VRS recensés dans l'examen actualisé de la littérature, en fonction des populations incluses dans l'examen initial de la littérature de l'INESSS :
- population mixte (prématurité, MPC, cardiopathie congénitale [CPC]) [Section III.3.1], prématurés sans MPC (Section III.3.2), prématurés avec MPC (Section III.3.3),
- enfants atteints de CPCHS (Section III.3.4), enfants vivant dans des communautés éloignées (Section III.3.5), enfants atteints de FK (Section III.3.6) et enfants atteints du SD (Section III.3.7).
III.1 Évaluation de l'examen systématique initial de la littérature de l'INESSS
L'examen systématique initial de la littérature de l'INESSS a reçu un score AMSTAR de 7 sur 11 (Annexe C) et a été considéré comme étant de qualité acceptable par le GT VRS. En outre, la méthode d'évaluation de la qualité du CASP a été jugée comparable à celle du CCNI, de sorte que la qualité des études incluses dans l'examen initial de l'INESSS n'a pas été réévaluée. Vingt-six (26) études ont été retenues : 7 examens systématiques (dont 4 avec méta-analyse), 5 ECR, 13 études d'observation de cohorte et une (1) étude cas-témoins.
Les données extraites et l'évaluation de la qualité de chacune des études cernées dans l'examen initial de la littérature de l'INESSS ont été résumées dans un tableau de données probantes à l'Annexe F.
III.2 Examens actualisés de la littérature : Inclusion et caractéristiques des études
Le processus de repérage, de sélection et d'évaluation de l'admissibilité des études est résumé visuellement à l'Annexe D. Après l'élimination des doublons, les recherches dans les bases de données et les recherches manuelles subséquentes ont permis d'obtenir un total de 277 dossiers retenus et triés en fonction du titre et du résumé. Au total, 118 articles ont été examinés dans leur intégralité, et 24 études ont été retenues pour la synthèse qualitative. Toutes les études incluses étaient des publications en langue anglaise.
III.2.1 Examens systématiques
L'examen systématique de Robinson et al. Note de bas de page 17 est un examen actualisé des ECR portant sur l'EP et l'innocuité du PVZ chez les nourrissons et les enfants atteints de FK. Cet examen n'a retenu qu'une seule étude, mais a été jugé de bonne qualité. Un examen systématique ultérieur de l'EP et de l'innocuité du PVZ chez les enfants atteints de FK Note de bas de page 18, comportant 5 études pertinentes, a été jugé de bonne qualité. Un troisième examen systématique de l'EP et de l'innocuité du PVZ dans divers groupes de patients susceptibles de faire une infection sévère par le VRS comportait 18 études pertinentes et a été jugée moyenne Note de bas de page 19. Les données extraites de ces études ainsi que les évaluations de qualité sont présentées dans les tableaux de données probantes des Annexes E et F.
III.2.2 Études individuelles
Les 17 études d'observation de cohorte incluses dans le présent examen actualisé portaient sur des nourrissons et des enfants provenant d'établissements de soins tertiaires uniques aux États-Unis (É.-U.) Note de bas de page 20, en Israël Note de bas de page 21, à Taïwan Note de bas de page 22 et en Espagne Note de bas de page 23; des cohortes multicentriques de patients atteints de FK en Irlande du Nord Note de bas de page 24, en Alberta Note de bas de page 25 et aux É.-U. Note de bas de page 26; une cohorte de prématurés du Japon, dont les résultats initiaux avaient déjà été publiés Note de bas de page 27; des cohortes de prématurés d'Europe et du Canada Note de bas de page 28; des prématurés de 9 programmes de soins gérés par Medicaid aux É.-U. Note de bas de page 29; des cohortes multicentriques de prématurés de Hong Kong Note de bas de page 30, d'Espagne Note de bas de page 31 et d'Italie Note de bas de page 32, des cohortes multicentriques d'enfants atteints de CPCHS à Taïwan Note de bas de page 33 et en Argentine Note de bas de page 34; et des cohortes multicentriques d'enfants atteints du SD en Espagne Note de bas de page 35 et au Japon Note de bas de page 36. Les études d'observation de cohorte ont reçu une note passable (13), bonne (2) ou faible (2) pour la méthodologie de l'étude, sur la base de l'évaluation de la validité interne à l'aide des paramètres définis par Harris et al. Note de bas de page 16. Deux (2) ECR ont été recensés.
L'un d'entre eux, jugé bon Note de bas de page 37, présentait une analyse post-hoc de données sur des prématurés de différents sAG sans MPC provenant d'une étude multinationale qui avait déjà publié des données sur ces prématurés en tant que groupe Note de bas de page 38. Le second était une étude multicentrique des Pays-Bas évaluant l'EP de la PVZ dans la prévention de l'asthme qui a été jugée de qualité passable Note de bas de page 39. Il y avait 2 études cas-témoins, toutes 2 jugées passables, une étude portant sur une population mixte du Canada et des É.-U. Note de bas de page 40 et une étude portant sur des enfants atteints de FK provenant de 2 centres en France Note de bas de page 41.
Les données extraites et l'évaluation de la qualité de chacune de ces études sont présentées dans le tableau des données probantes de l'Annexe E.
III.3 Efficacité potentielle et réelle de la prophylaxie par palivizumab par population
III.3.1 Population mixte
L'examen actualisé de la littérature a recensé 5 études d'observation de cohortes, toutes de qualité passable, qui ont comparé l'ER du PVZ (ERP) dans des cohortes séparées dans le temps. Blake et al. ont étudié des nourrissons nés à 29 à moins de 32 sAG. Les nourrissons n'ont pas été décrits avec suffisamment de détails pour exclure la présence de comorbidités, comme la MPC et la CPCHS; par conséquent, l'étude est incluse dans la population mixte Note de bas de page 20.
L'étude de Prais et al. portait sur des enfants nés extrêmement prématurés (<29 sAG). L'étude excluait les enfants atteints de maladies cardiaques, mais certains membres souffraient de dysplasie broncho-pulmonaire (DBP) Note de bas de page 21. Dans une étude menée à Taïwan, où le VRS n'est pas saisonnier, le PVZ a été administré aux nourrissons de 28 sAG ou moins avec ou sans MPC et aux nourrissons de 35 sAG ou moins avec MPC sous forme de 6 doses mensuelles à partir du moment de la sortie initiale de l'hôpital. Les résultats ont été évalués à 6 mois de la première dose de PVZ, et à nouveau à 12 mois de la première dose de PVZ, afin de déterminer si le calendrier de 6 mois était approprié. La cohorte-témoin datait d'une époque antérieure, mais était appariée par score de propension Note de bas de page 22. Dans une étude portant sur les nourrissons nés à moins de 29 sAG avec ou sans MPC à Hong Kong, la cohorte-témoin datait d'avant le lancement d'un programme de PVZ Note de bas de page 30. Priante et al. ont étudié des nourrissons nés de 29 à 35 sAG, dont certains étaient atteints de MPC ou de CPCHS, avant et après une modification des critères d'utilisation du PVZ Note de bas de page 32.
Lacaze-Masmonteil et al., dans une étude d'observation de cohorte jugée passable, ont fait état de nourrissons nés à moins de 33 sAG avec ou sans MPC au cours d'une (1) seule saison de VRS Note de bas de page 31. Dans une étude portant sur des nourrissons admis à l'hôpital pour une bronchiolite, dont la méthodologie a été jugée faible, les proportions de nourrissons positifs au VRS dans les groupes avec PVZ et témoin ont été déterminées Note de bas de page 23.
Une étude cas-témoins à test négatif, dont la méthodologie a été jugée passable, a évalué des enfants nés à 35 sAG ou moins et âgés de 12 mois ou moins, ou moins de 24 mois atteints de CPCHS ou de MPC et hospitalisés pour une infection aigüe des voies respiratoires inférieures. L'administration de PVZ dans les 30 jours précédant l'admission chez les cas positifs au VRS et les témoins négatifs au VRS a été déterminée. L'ERP a été ajustée en utilisant une pondération par score de propension inverse. En outre, pour contrôler les risques de partialité, l'ERP contre le métapneumovirus humain (MPVh, un virus respiratoire contre lequel le PVZ n'offre aucune protection) a également été évaluée Note de bas de page 40.
III.3.1.1 Hospitalisations associées au VRS
Dans l'ensemble de la population de l'étude de Blake et al., les nourrissons nés de 29 à moins de 32 sAG et à qui l'on n'a pas prescrit de PVZ avaient plus tendance à être hospitalisés par suite d'un test VRS positif que les nourrissons ayant reçu du PVZ; toutefois, cette constatation était fondée sur un petit nombre d'HVRS avec test VRS positif (3 nourrissons dans la cohorte avant l'introduction du PVZ et 1 nourrisson dans la cohorte après l'introduction du PVZ) et n'était pas significative (p = 0,09) Note de bas de page 20.
L'étude de Priante et al. a signalé une augmentation non significative des HVRS après la limitation de la prophylaxie par PVZ, mais le nombre d'admissions était faible et la proportion de nourrissons atteints de MPC ou de CPCHS était plus élevée dans le groupe post-restriction Note de bas de page 32. Dans l'étude de Prais et al., l'administration de PVZ aux enfants nés à moins de 29 sAG a entraîné une réduction statistiquement significative des admissions à l'hôpital pour le VRS par rapport aux non-receveurs (20,0 %, n=2 contre 59,3 %, n=19, p = 0,033) Note de bas de page 21.
Dans l'étude de Taïwan, l'hospitalisation dans les 6 mois suivant la première dose de PVZ est survenue chez 1,6 % des receveurs, contre 10,2 % des témoins (p = 0,002), soit une réduction de 86 % (IC à 95 % : 36 à 97 %). Dans les 12 mois, les taux dans les groupes avec PVZ et témoin étaient de 3,9 % contre 15,7 % ( p = 0,004), soit une réduction de 78 % (IC à 95 % : 40 à 92 %). Pour les nourrissons de 28 sAG ou moins, la réduction était de 89 % (IC à 95 % : 36 à 99 %) [ p = 0,007] à 6 mois et de 80 % (IC à 95 % : 38 à 93 %) [ p = 0,005] à 12 mois.
Les auteurs ont conclu que dans une région où l'infection par le VRS n'est pas saisonnière, on peut envisager une protection de 6 mois à partir du moment de la sortie initiale de l'hôpital Note de bas de page 22. Une HVRS est survenue chez 7,4 % des receveurs du PVZ et 5,1 % des non-receveurs (p = 0,13) dans l'étude de Lacaze-Masmonteil et al. Les receveurs du PVZ avaient un AG plus bas et étaient plus nombreux à souffrir de MPC que les non-receveurs, et les résultats n'ont pas été ajustés pour tenir compte de ces facteurs de confusion Note de bas de page 31.
Lee et al. ont signalé une HVRS dans 5 % des cas chez les receveurs du PVZ et 15 % chez les non-receveurs (p = 0,096). Parmi ceux de moins de 27 sAG, la différence était significative (8,7 % contre 33,3 %, p = 0,046). Le poids à la naissance et l'AG étaient plus faibles et la proportion de cas de MPC plus élevée chez les receveurs du PVZ que chez les non-receveurs, et n'ont pas été contrôlés, et le nombre total d'HVRS était faible (2 avec PVZ et 15 sans) Note de bas de page 30. Dans l'étude sur les nourrissons admis à l'hôpital pour bronchiolite, la proportion de nourrissons positifs au VRS était de 35,5 % chez ceux qui avaient reçu du PVZ et de 57,3 % chez ceux qui n'en avaient pas reçu (p = 0,006). Les receveurs du PVZ avaient un AG plus bas à la naissance et un âge chronologique plus élevé que ceux qui n'ont pas reçu de PVZ Note de bas de page 23. Dans l'étude cas-témoins, l'ERP ajustée pour prévenir l'HVRS était de 58,0 % (IC à 95 % : 43,1 à 69,0 %). Le PVZ n'a pas eu d'ER significative contre l'hospitalisation dans l'analyse de contrôle du MPVh (34,7, IC à 95 % : -12,9 à 62,2 %) Note de bas de page 40.
III.3.1.2 Durée de l'hospitalisation associée au VRS
Dans l'étude de Blake et al., sur les 4 nourrissons nés de 29 à moins de 32 sAG admis à l'hôpital avec un test VRS positif, les nourrissons auxquels on n'a pas prescrit de prophylaxie par PVZ (n=3) avaient tendance à avoir une durée de séjour (DdS) à l'hôpital plus longue que le nourrisson (n=1) auquel on a prescrit du PVZ, bien que cela n'ait pas été statistiquement significatif (14,9 jours contre 2 jours, p = 0,08).
Dans les études de Prais et al. et de Lacaze-Masmonteil et al., la DdS des enfants hospitalisés en raison du VRS n'a pas été signalée. Dans l'étude de Chi et al., aucune différence significative n'a été notée dans la DdS pour les HVRS survenant dans les 6 premiers mois après la sortie de l'hôpital pour ceux qui ont reçu du PVZ (n=2) et ceux qui n'en ont pas reçu (n=13), médiane de 7,0 jours (écart interquartile [EIQ] 3,5 à 10,5) contre 13,0 jours (EIQ 8,0 à 21,0), respectivement (p = 0,31), ou dans les HVRS survenant dans les 12 mois, médiane de 7,0 jours (EIQ 3,5 à 10,5) contre 9,5 jours (EIQ 6,3 à 18,0), respectivement (p = 0,19) Note de bas de page 22.
Lee et al. n'ont pas non plus signalé de différence significative dans la DdS entre les receveurs du PVZ (n=2) et les témoins (n=15) (écart-type moyen [ETM] = 0,7 ± 3,7 jours pour les receveurs du PVZ contre 1,1 ± 1,1 jour pour les témoins [ p = 0,52]) Note de bas de page 30. Narbona-Lopez a signalé une DdS plus longue chez ceux qui ont reçu du PVZ (ETM = 9,2 ± 4,2 jours) que dans la cohorte entière (7,1 ± 4,1 jours) [ p = 0,006]; les nourrissons du groupe avec PVZ avaient un sAG plus faible.
III.3.1.3 Admission en unité de soins intensifs en raison du VRS
Dans l'étude de Chi et al., l'admission en USI en raison du VRS dans les 6 premiers mois après la dose initiale de PVZ s'est produite chez 0,8 % des receveurs du PVZ et 7,1 % des témoins (p = 0,024); à 12 mois les taux étaient de 0,8 % et de 7,9 % des receveurs du PVZ et des témoins, respectivement (p = 0,014) Note de bas de page 22. Les proportions d'admissions à l'USI chez les patients hospitalisés en raison du VRS ont été calculées à partir des données présentées.
En ce qui concerne les HVRS au cours des 6 premiers mois, 1 receveur du PVZ sur 2 et 9 témoins sur 13 ont été admis en USI, et au bout de 12 mois, les proportions étaient de 1 sur 5 et de 10 sur 20 (aucune différence significative). Lee et al. ont signalé des taux d'admission en USI de 2,5 % pour les receveurs du PVZ et de 7,4 % pour les témoins (p = 0,436) Note de bas de page 30. Un (1) des 2 receveurs du PVZ hospitalisés pour le VRS contre 7 des 15 témoins hospitalisés ont été admis à l'USI. Dans l'étude cas-témoins, l'ERP ajustée pour prévenir l'admission en USI était de 62,1 % (IC à 95 % : 35,1 à 77,9 %) Note de bas de page 40.
III.3.1.4 Durée du séjour à l'USI en raison du VRS
Dans l'étude de Chi et al., aucune différence significative n'a été notée dans la DdS à l'USI entre les receveurs du PVZ et les témoins à 6 mois (médiane de 8,0 jours [EIQ 8,0 à 8,0]) contre 10,0 jours, (EIQ 4,5 à 13,0, p =1,0) ou à 12 mois (médiane de 8,0 jours [EIQ 8,0 à 8,0] contre 9,0 jours, [EIQ 4,0 à 13,0 jours, p =1,0]).
III.3.1.5 Ventilation mécanique
Au cours des 6 premiers mois suivant l'inscription, aucun receveur du PVZ n'a eu besoin d'une VM dans l'étude de Chi et al. et seulement 3,1 % chez les témoins (p = 0,13). À 12 mois, aucun autre nourrisson n'a eu besoin d'une VM Note de bas de page 22. Les proportions de nourrissons hospitalisés nécessitant une VM étaient de 0 sur 5 pour les receveurs du PVZ contre 4 sur 20 pour les témoins. Lacaze-Masmonteil et al. ont signalé une VM chez 0,5 % des receveurs du PVZ et 0,4 % des témoins Note de bas de page 31. Deux (2) des 23 receveurs du PVZ hospitalisés et 9 des 17 témoins hospitalisés ont eu besoin d'une VM (différence non significative). Dans l'étude cas-témoins, l'ERP n'a pas été observée pour la VM (ERP ajustée 31,5 % [IC à 95 % : -41,2 à 66,8 %]) Note de bas de page 40.
III.3.1.6 Mortalité
Dans une étude, il y a eu 2 décès liés au VRS parmi les 2;370 personnes qui n'ont pas reçu de PVZ et aucun parmi les 376 qui en ont reçu Note de bas de page 31. Deux (2) autres études n'ont signalé aucun décès Note de bas de page 22 Note de bas de page 30.
III.3.1.7 Séquelles à long terme (respiration sifflante, asthme)
L'étude de Prais et al. a examiné les effets de la prophylaxie par PVZ sur la morbidité respiratoire au cours des 2 premières années de vie et sur la fonction pulmonaire et la réactivité bronchique à l'âge scolaire (7 à 10 ans) d'enfants nés à moins de 29 sAG. Ces résultats ont été analysés selon que les enfants avaient reçu ou non du PVZ, et non selon qu'ils avaient ou non des antécédents attestés d'admission pour une infection par le VRS.
D'après les réponses des parents à un questionnaire, la proportion d'enfants présentant des épisodes de respiration sifflante au cours des 2 premières années de vie était significativement plus faible chez ceux qui recevaient une prophylaxie par PVZ que chez ceux qui ne recevaient aucune prophylaxie (26,7 % contre 69,7 %, p = 0,008). En revanche, aucune différence significative n'a été constatée entre ces 2 groupes en ce qui concerne la proportion d'enfants ayant connu des épisodes de respiration sifflante à l'âge scolaire (4 sur 30, 13 % contre 6 sur 33, 18 %, p = 0,73) ou ayant utilisé des bronchodilatateurs et des corticostéroïdes inhalés (p = 0,71) au cours de l'année précédant les tests de fonction pulmonaire, ni en ce qui concerne les paramètres de fonction pulmonaire ou la réactivité bronchique à l'âge scolaire. Les résultats de la fonction pulmonaire étaient similaires lorsque l'analyse était limitée aux enfants nés à moins de 26 sAG, atteints de DBP, ou avec et sans antécédents familiaux ou personnels d'eczéma ou de rhinite allergique.
III.3.2 Nourrissons prématurés sans maladie pulmonaire chronique infantile
L'examen actualisé de la littérature a permis de recenser 7 études comparant l'ERP à celle d'un placebo ou à l'absence d'intervention chez les prématurés sans MPC. Notario et al. ont publié les données de l'ECR Impact de 1996 (méthodologie jugée bonne) sur les résultats chez les prématurés sans MPC par catégories d'AG Note de bas de page 37 Note de bas de page 38 Note de bas de page 38. Dans un autre ECR, dont la qualité a été jugée passable, les prématurés ayant reçu du PVZ ou un placebo ont fait l'objet d'une évaluation de leur asthme à l'âge scolaire Note de bas de page 39. Il y a eu 4 études d'observation de cohorte Footnote 22 Footnote 27 Footnote 28 Footnote 29.
L'étude de Farber et al., dont la qualité a été jugée passable, a examiné l'effet de la prophylaxie par PVZ sur les HVRS dans une cohorte de prématurés provenant de 9 programmes de soins gérés par Medicaid au Texas et a analysé les résultats en fonction des sAG des nourrissons (29 à 32 sAG et 33 à 36 sAG) Note de bas de page 29. L'étude de Chi et al., jugée passable, a porté sur des nourrissons de 28 sAG ou moins évalués à 6 et à 12 mois après la dose initiale d'un traitement de 6 mois par PVZ.
La cohorte-témoin provenait d'une période antérieure, mais était appariée par score de propension Note de bas de page 22. Dans l'étude de Simoes et al., jugée de bonne qualité, l'impact de la prophylaxie par PVZ sur le développement ultérieur d'une respiration sifflante récurrente diagnostiquée par un médecin lors du suivi à 24 mois a été examiné chez des enfants nés prématurément (<36 sAG) provenant de plusieurs centres en Europe et au Canada. Des sous-groupes a posteriori ont été déterminés en fonction des antécédents familiaux d'asthme et d'atopie Note de bas de page 28. Enfin, l'étude de Mochizuki et al., dont la qualité a été jugée passable, a examiné l'effet de la prophylaxie par PVZ sur l'incidence de l'asthme atopique et la croissance des enfants à l'âge de 6 ans, ainsi que sur les sifflements diagnostiqués par un médecin, lors d'une consultation externe ou d'une hospitalisation pour troubles respiratoires au cours des 6 premières années de vie.
L'étude a suivi une cohorte d'enfants nés entre 33 et 35 sAG dans l'un des 52 centres médicaux du Japon. Pour les besoins de l'analyse, la population étudiée a été divisée en 3 sous-populations : une population en intention de traiter composée de tous les enfants, une population en per-protocole qui a terminé le suivi de 6 ans et une sous-population d'asthme atopique qui a bénéficié d'un prélèvement sanguin pour la détermination des immunoglobulines E (IgE) lors du suivi de 6 ans. Les résultats ont été analysés selon que les enfants avaient reçu ou non du PVZ et non spécifiquement pour les enfants avec et sans antécédents attestés d'infection par le VRS Note de bas de page 27. Simoes et al. ont comparé les résultats chez les receveurs du PVZ, dont aucun n'avait subi une HVRS, chez un groupe témoin n'ayant pas reçu de PVZ et dont 33 % des membres ont subi une HVRS et chez un sous-groupe témoin qui n'a connu aucune HVRS Note de bas de page 28. Dans une étude cas-témoins à test négatif, les enfants nés à 35 sAG ou moins et âgés de 2 mois ou moins ont été étudiés. L'ERP a été ajustée à l'aide d'un poids de score de propension inverse Note de bas de page 40.
III.3.2.1 Hospitalisations dues au VRS
Dans l'ECR, une réduction significative du taux d'hospitalisation, laquelle a été associée au PVZ, a été constatée pour les nourrissons de 28 à 31 sAG : 6,7 % contre 1,8 %, réduction du risque relatif (RRR) 73,0 (IC à 95 % : 7,7 à 95,1 %); de 29 à 32 sAG : 7,7 % contre 1,6 %, RRR 79,7 (IC à 95 % : 35,7 à 96,9 %); de 29 à 33 sAG : 9,1 % contre 1,8 %, RRR 79,8 (IC à 95 % : 49,0 à 94,2 %); de 32-34 sAG : 10,8 % contre 2,0 %, RRR 81,8 (IC à 95 % : 45,4 à 96,5 %); de 32 à 35 sAG : 10,1 % contre 1,8 %, RRR 82,1 (IC à 95 % : 45,9 à 96,6 %). Il n'y a pas eu de réduction significative dans les groupes de moins de 29 sAG ou de 33 à 34 ou encore de 33 à 35 sAG Note de bas de page 37.
L'étude de Farber et al. a montré qu'il y avait moins d'HVRS chez les nourrissons de 29 à 32 sAG qui avaient reçu du PVZ que chez ceux qui n'avaient pas reçu de prophylaxie (3,1 % contre 5,0 %, p = 0,04). La majeure partie de cette différence a été expliquée par les nourrissons qui ont reçu de 80 à 100 % des doses recommandées de PVZ (rapport de cotes ajusté [RCa] = 0,30, IC à 95 % : 0,12 à 0,78 %). L'analyse des données par 4 groupes d'adhésion (0 à 25 %, 30 à 50 %, 60 à 75 %, 80 à 100 %) a révélé une dose-réponse statistiquement significative entre l'adhésion et la réduction des HVRS (p pour la tendance = 0,009).
En revanche, aucune différence statistiquement significative n'a été notée dans les HVRS chez les nourrissons de 33 à 36 sAG qui avaient reçu ou non une prophylaxie par PVZ (4,2 % contre 4,5 %, p = 0,70). Dans l'étude de Chi et al., aucune réduction significative du taux d'HVRS n'a été notée chez les nourrissons de 28 sAG ou moins sans MPC (réduction de 70 %, IC à 95 % : -18 à 99 % à 6 mois et de 70 %, IC à 95 % : -204 à 97 % à 12 mois) Note de bas de page 22. Dans l'étude cas-témoins, l'ERP ajustée était de 74,1 % (IC à 95 % : 56,2 % à 84,7 %) chez les prématurés de 29 à 35 sAG de moins de 6 mois. L'ERP n'a pas été observée chez les nourrissons de moins de 29 sAG, mais les nombres étaient faibles (n=33) Note de bas de page 40.
III.3.2.2 Séquelles à long terme (asthme atopique, respiration sifflante récurrente diagnostiquée par un médecin, paramètres de croissance)
Dans l'étude de Mochizuki et al., la prévalence de l'asthme atopique (défini par un taux élevé d'IgE sériques totales ou spécifiques et une respiration sifflante expiratoire récurrente) à l'âge de 6 ans chez les enfants nés entre 33 et 35 sAG était similaire chez les enfants qui avaient (31/202, 15,3 %) et n'avaient pas (12/66, 18,2 %) reçu une prophylaxie par PVZ (risque relatif [RR] = 0,82, IC 95 % : 0,39 à 1,70, p = 0,57). Dans la régression logistique multivariable, les résultats sont restés inchangés lorsque l'on a comparé les enfants avec et sans antécédents familiaux d'allergie Note de bas de page 27.
L'analyse multivariée de l'étude de Mochizuki et al. a également révélé que, par rapport à l'absence d'intervention, l'administration du PVZ était associée à des taux réduits de respiration sifflante récurrente diagnostiquée par un médecin au cours des 6 premières années de vie dans les 3 sous-populations de l'étude, mais uniquement dans les sous-groupes d'enfants ayant des antécédents familiaux d'allergie (intention de traiter, RCa = 0,48, IC à 95 % : 0,26 à 0,90 %; par protocole, RCa = 0,28, 0,13 à 0,60; asthme atopique, RCa = 0,54, 0,11 à 0,27) Note de bas de page 27.
En revanche, l'étude de Simoes et al., dans laquelle des sous-groupes a posteriori ont été déterminés en fonction des antécédents familiaux d'asthme et d'atopie, a montré que ce n'est que chez les enfants prématurés (<36 sAG) sans antécédents familiaux d'asthme (RCa = 0,32, IC à 95 % : 0,14 à 0,75 %) ou d'atopie (RCa = 0,20, IC à 95% : 0,07 à 0,59 %) dans laquelle la prophylaxie par PVZ au cours d'une saison respiratoire précédente a diminué l'incidence des sifflements diagnostiqués par un médecin lors du suivi de 24 mois après le début de l'étude.
Chez les enfants sans antécédents familiaux d'asthme ou d'atopie, l'analyse de régression logistique multiple a également révélé qu'une augmentation du poids à la naissance (RCa = 0,35, IC à 95 % : 0,15 à 0,81 %) et/ou une augmentation de l'AG (RCa = 0,82, IC à 95 % : 0,68 à 0,98 %) étaient associées à un risque réduit de respiration sifflante diagnostiquée par un médecin. L'étude de Simoes et al. a également utilisé une analyse de régression des risques proportionnels pour examiner le délai avant le troisième épisode de respiration sifflante diagnostiqué par un médecin. Dans cette analyse, la prophylaxie par PVZ a augmenté de manière significative le délai avant le troisième épisode de respiration sifflante diagnostiquée par un médecin, par rapport aux enfants n'ayant reçu aucune intervention (risque relatif instantané ajusté [RRia] = 0,33, IC à 95 % : 0,51 à 0,74 % et une RRia = 0,21, IC à 95 % : 0,08 à 0,59 %, respectivement), mais là encore uniquement chez les enfants sans antécédents familiaux d'asthme ou d'atopie. Chez ces enfants, un AG plus important était également associé à un délai plus long avant le troisième épisode de respiration sifflante diagnostiquée par un médecin Note de bas de page 28.
L'étude de Mochizuki et al. a également révélé que, uniquement dans la population globale, en intention de traiter, la réception de PVZ a entraîné un nombre significativement inférieur de consultations externes pour troubles respiratoires au cours des 6 premières années de vie par rapport aux enfants n'ayant reçu aucune intervention (19,0 contre 23,9 consultations/personne, p = 0,018). Cependant, l'étiologie de ces consultations n'a pas été déterminée. Aucune différence significative n'a été notée entre ces 2 groupes en ce qui concerne le nombre d'hospitalisations en raison d'une maladie respiratoire au cours de cette même période Note de bas de page 27.
L'étude de Mochizuki et al. n'a pas non plus constaté de différences significatives en ce qui concerne le poids (19,4 ± 3,46 kg contre 19,5 ± 2,66 kg, p = 0,83), la taille (112,0 ± 4,0 cm contre 112,7 ± 5,76 cm, p = 0,33) ou l'indice de masse corporelle (15,4 ± 1,85 contre 15,3 ± 1,26, p = 0,75) entre les enfants ayant reçu une prophylaxie par PVZ et les enfants n'en ayant pas reçu, lors de l'évaluation à l'âge de 6 ans Note de bas de page 27.
Scheltema et al. ont évalué à 6 ans l'asthme chez des nourrissons en bonne santé nés de 32 à 35 sAG qui avaient reçu soit du PVZ, soit un placebo lors de leur première saison de VRS. Les parents ont signalé la présence d'asthme, défini par une respiration sifflante ou l'utilisation de médicaments contre l'asthme au cours des 12 derniers mois, chez 14,1 % des receveurs du PVZ et 24,0 % des receveurs du placebo (réduction absolue du risque [RaR] de 9,9 %, IC à 95 % : 2,2 à 17,6 %).
Toutefois, la différence n'était significative que pour les personnes présentant une respiration sifflante peu fréquente (1 à 3 épisodes par année). Aucune différence significative n'était à noter dans l'utilisation de médicaments contre l'asthme (9,0 % contre 12,8 %, RaR 3,5 %, IC à 95 % : -2,4 à -9,9 %), ni dans l'asthme diagnostiqué par un médecin au cours des 12 mois précédents (10,3 % contre 9,9 %, RaR -0,4 %, IC à 95 % : -6,5 à 5,8 %). La fonction pulmonaire à l'âge de 6 ans ne différait pas entre les groupes. Le volume expiratoire forcé moyen (ETM en 0,5 seconde) était de 89,1 (10,6) avec le PVZ et de 90,1 (11,1) avec le placebo; plusieurs autres mesures ainsi que les résultats après administration d'un bronchodilatateur étaient tous similaires dans les 2 groupes Note de bas de page 39.
III.3.3 Nourrissons prématurés atteints d'une maladie pulmonaire chronique infantile
L'examen actualisé de la littérature a permis de recenser une étude d'observation de cohorte Note de bas de page 22 et une étude cas-témoins Note de bas de page 40, toutes 2 jugées passables, qui ont examiné la prophylaxie par PVZ chez les prématurés atteints de MPC. Dans l'étude de Chi et al., les nourrissons de 35 sAG ou moins atteints de MPC ont été évalués à 6 et à 12 mois après la dose initiale d'un traitement de 6 mois de PVZ. La cohorte-témoin provenait d'une période antérieure, mais a été appariée par score de propension Note de bas de page 22. L'étude cas-témoins à test négatif a évalué des enfants nés à 35 sAG ou moins et âgés de moins de 24 mois présentant une MPC Note de bas de page 40.
III.3.3.1 Hospitalisations en raison du VRS
Dans l'étude de Chi et al., le taux d'HVRS a été réduit de 86 % (IC à 95 % : 13 à 96 %, p = 0,039) chez les nourrissons de 35 sAG ou moins au cours des 6 premiers mois après la sortie initiale et de 79 % (IC à 95 % : 36 à 93 %, p = 0,006) à 12 mois. Lorsqu'on l'analyse en fonction de l'AG, la réduction du taux était significative chez ceux de 28 sAG ou moins (89 %, IC à 95 % : 8 à 99 %; p = 0,038) à 6 mois et 82 %, IC à 95 % : 34 à 95 %; p = 0,010 à 12 mois.
La réduction n'était pas significative chez les nourrissons âgés de 29 à 35 sAG (47 %, IC à 95 % : -534 à 96 %; p = 0,61 à 6 mois et 67 %, IC à 95 % : -252 à 97 %; p = 0,67 à 12 mois), mais les nombres de ce dernier groupe étaient faibles (19 receveurs du PVZ et 21 témoins) Note de bas de page 22. Dans l'étude cas-témoins, l'ERP n'a pas été observée chez les nourrissons atteints de MPC (33,8 %, IC à 95 % : -31,1 à 66,6 % à l'âge de moins de 12 mois et 63,8 %, IC à 95 % : -9,3 à 88 % à l'âge de 12 à 24 mois) Note de bas de page 40.
III.3.4 Enfants présentant une cardiopathie congénitale hémodynamiquement significative
L'examen actualisé de la littérature a recensé 2 études d'observation de cohorte et une étude cas-témoins, toutes jugées passables, qui ont examiné l'ERP chez les enfants atteints de CPCHS. Les 2 études d'observation de cohorte portaient sur des nourrissons atteints de CPCHS âgés de moins d'un an, et les cohortes PVZ et témoin dataient de périodes différentes. Dans l'un d'entre eux, les groupes avec PVZ et témoin ont été appariés par un score de propension Note de bas de page 33. Dans l'autre, disponibles uniquement sous la forme d'un résumé détaillé, les cas et les témoins ne différaient pas en fonction de l'AG, du poids à la naissance ou du sexe, mais le groupe témoin comptait moins de nourrissons présentant des formes plus sévères de CPCHS Note de bas de page 34. L'étude cas-témoins a porté sur des nourrissons atteints de CPCHS âgés de moins de 24 mois Note de bas de page 40.
III.3.4.1 Hospitalisations en raison du VRS
Dans l'étude de Chiu, les taux d'incidence des hospitalisations pour 1000 jours-personnes, après appariement par score de propension, étaient de 0,076 pour les receveurs du PVZ et de 0,145 pour les témoins. Le nombre d'hospitalisations a diminué de 49 % chez les receveurs du PVZ (rapport de taux de 0,51, IC à 95 % : 0,28 à 0,93 %, p < 0,05). La différence était significative pour les personnes atteintes d'une CPCHS cyanotique, avec un rapport de 0,35 (IC à 95 % : 0,14 à 0,90 %, p < 0,05), mais pas pour celles atteintes d'une CPCHS acyanotique, avec un rapport de 0,65 (IC à 95 % : 0,29 à 1,44 %) Note de bas de page 33.
Soraiz et al. ont signalé des taux d'hospitalisation de 6 % chez les receveurs du PVZ et de 20 % dans le groupe témoin, avec un risque relatif (RR) [ou rapport de risque] de 0,28 (IC à 95 % : 0,08 à 0,97 %, p = 0,04) Note de bas de page 34. Le NST pour éviter une hospitalisation était de 7. Dans l'étude cas-témoins, l'ERP n'a pas été observée à l'âge de moins de 12 mois (15,5 %, IC à 95 % : -141 à 44,6 %) ou à l'âge de 12 à 24 mois (69,2 %, IC à 95 % : -101,6 à 95,3 %) Note de bas de page 40.
III.3.4.2 Durée de l'hospitalisation associée au VRS
Une étude a porté sur la DdS à l'hôpital Note de bas de page 33. Aucune différence significative n'a été notée dans la DdS à l'hôpital, que ce soit pour l'ensemble des patients (risque de 0,640 contre 1,573 jour pour 1000 jours-personnes pour les receveurs du PVZ et les témoins, respectivement, rapport de taux de 0,396, IC à 95 % : 0,137 à 1,146 %) ou pour les sous-groupes avec une CPCHS acyanotique ou cyanotique.
III.3.4.3 Admission dans une unité de soins intensifs en raison du VRS
L'étude de Chiu et al. n'a signalé aucune différence significative dans l'admission en USI, que ce soit pour l'ensemble des patients (0,030 et 0,064 pour 1000 jours-personnes pour les receveurs du PVZ et les témoins, respectivement, rapport de taux de 0,426, IC à 95 % : 0,167 à 1,038 %) ou pour les sous-groupes présentant une CPCHS acyanotique ou cyanotique Note de bas de page 33. Parmi les personnes hospitalisées en raison du VRS, les proportions d'admissions en USI étaient de 7 sur 18 pour les receveurs du PVZ contre 15 sur 34 pour les témoins (aucune différence significative).
III.3.5 Enfants résidant dans des communautés éloignées
L'examen actualisé de la littérature n'a pas recensé d'études portant sur l'EP et l'ER de la prophylaxie au PVZ chez les enfants vivant dans des communautés éloignées.
III.3.6 Enfants atteints de fibrose kystique
L'examen actualisé de la littérature a recensé 1 examen systématique de bonne qualité Note de bas de page 17, 2 études d'observation rétrospectives de qualité passable Note de bas de page 24 Note de bas de page 25 de cohorte, une (1) étude d'observation de cohorte rétrospective de qualité faible Note de bas de page 26 et une (1) étude cas-témoin de qualité passable Note de bas de page 41 qui ont examiné l'effet de la prophylaxie par PVZ par rapport à l'absence d'intervention ou au placebo chez les enfants atteints de FK.
L'examen systématique de Robinson et al. est une mise à jour d'un examen systématique antérieur de la base de données Cochrane saisie dans l'examen initial de la documentation de l'INESSS Note de bas de page 42. Comme pour l'examen précédent, l'examen actualisé a recensé le même ECR multicentrique unique de Cohen et al. dont la qualité n'a pas pu être évaluée, car il a été publié sous forme de résumé de conférence et d'affiche, mais pas sous forme d'article complet. L'étude a examiné l'EP et l'innocuité de la prophylaxie par PVZ par rapport au placebo dans la prévention des hospitalisations et de la mortalité attribuables au VRS, ainsi qu'un certain nombre de résultats secondaires (événements indésirables liés au PVZ, état nutritionnel au suivi de 12 mois, colonisation par P. aeruginosa) chez les enfants atteints de FK Note de bas de page 43.
L'étude d'observation de Groves et al. a examiné l'effet de la prophylaxie par PVZ sur les taux d'HVRS et sur les résultats à long terme (fonction pulmonaire, paramètres de croissance, colonisation bactérienne) dans de petites cohortes historiques de patients atteints de FK en Irlande. La cohorte d'observation de Bjornson et al. a évalué les enfants atteints de FK âgés de moins de 24 mois en Alberta qui ont reçu ou non du PVZ Note de bas de page 25.
L'étude cas-témoins a signalé le résultat à long terme d'enfants atteints de FK âgés de 36 mois ou moins dans un centre en France qui utilisait systématiquement le PVZ et dans un centre qui n'utilisait pas le PVZ. Les receveurs du PVZ ont été appariés avec 3 témoins pour l'année et le mois de naissance, le sexe et le génotype de la FK. Tous ont été suivis jusqu'à l'âge de 3 ans Note de bas de page 41. L'étude d'observation de Fink et al. a fait état de la mortalité toutes causes confondues au cours des 2 premières années de vie et des résultats à long terme Note de bas de page 26.
Groves et al. ont fait état des résultats des tests de fonction pulmonaire à l'âge de 6 ans chez les personnes hospitalisées en raison du VRS et chez celles qui ne l'ont pas été Note de bas de page 24. Les autres résultats à long terme dans cette étude et tous les résultats à long terme dans les 4 autres études ont été analysés selon que les enfants avaient reçu ou non une prophylaxie par PVZ et non pas spécifiquement chez les enfants avec et sans antécédents attestés d'HVRS.
III.3.6.1 Hospitalisations en raison du VRS
Dans l'étude multicentrique ECR de Cohen et al., 13 (14,1 %) enfants atteints de FK (âge moyen de 12,8 mois) ont reçu une prophylaxie par PVZ et ont été hospitalisés, contre 14 (14,9 %) hospitalisations dans le groupe avec placebo, mais un (1) seul enfant dans chaque groupe a été identifié comme ayant été hospitalisé en raison du VRS (sur la base d'un test antigène VRS positif). Le RR calculé n'a révélé aucune différence significative entre les enfants qui ont reçu ou non une prophylaxie par PVZ en ce qui concerne le risque d'HVRS (RR=1,02, IC à 95 % : 0,06 à 16,09 %) Note de bas de page 43.
En revanche, dans l'étude de Groves et al., la cohorte historique d'enfants qui n'ont pas reçu de prophylaxie par PVZ (n=47) s'est avérée présenter un risque accru d'HVRS (RR=4,78, 1,1 à 20,7) et être significativement plus susceptible de subir une telle hospitalisation pour une infection des voies respiratoires inférieures que la cohorte d'enfants (n=45) qui ont reçu une prophylaxie par PVZ (10/47 contre 2/45, p = 0,027) Note de bas de page 24.
Dans l'étude de Bjornson et al., le taux d'HVRS était de 2,7 % dans le groupe avec PVZ (n=183) et de 6,0 % dans le groupe témoin (n=84) [ p = 0,20]. Les receveurs du PVZ avaient un AG en semaines et un poids inférieurs à la naissance, étaient moins susceptibles d'avoir des frères et sœurs et plus susceptibles de naître pendant la saison du VRS. Après ajustement pour ces facteurs de confusion, le groupe avec PVZ n'a pas non plus présenté une diminution du risque d'HVRS (Exp[B] = 0,43 [0,10 à 1,80], p = 0,25). Le groupe avec PVZ présentait un taux significativement plus faible d'hospitalisation en raison d'une maladie respiratoire (Exp[B] = 0,23 [0,11 à 0,49], p < 0,0005) et il a été noté que le taux général de dépistage du VRS était faible, à 53 % Note de bas de page 25. Dans l'étude cas-témoins, aucune différence significative dans le taux d'hospitalisation n'a été notée entre les receveurs du PVZ (2 sur 40, 5 %) et les témoins (4 sur 140, 2,9 %; p = 0,634) Note de bas de page 41.
III.3.6.2 Durée de l'hospitalisation associée au VRS
La DdS était plus courte pour les receveurs du PVZ (ETM = 5,66 ±2,41 jours) que pour les témoins (47,00 ±39,32 jours; p = 0,048) dans l'étude de Bjornson et al.25.
III.3.6.3 Admission dans une unité de soins intensifs en raison du VRS
Dans l'étude de Bjornson et al., aucun des 5 patients du groupe avec PVZ admis à l'hôpital n'a dû se retrouver à l'USI, contrairement à 2 des 5 patients du groupe témoin (p = 0,11). Sur l'ensemble des cohortes, 0/183 et 2/84 (2,4 %) ont nécessité une admission en USI (p> 0,05) Note de bas de page 25.
III.3.6.4 Durée du séjour dans une USI en raison du VRS
Dans l'étude de Bjornson et al., la DdS (ETM) en USI était de 5 ± 5,66 jours dans le groupe témoin. Aucun receveur du PVZ n'a été admis en USI Note de bas de page 25.
III.3.6.5 Utilisation de l'oxygénothérapie en raison du VRS
Dans l'étude de Cohen et al., 1 seul participant du groupe de prophylaxie par PVZ, et aucun du groupe d'intervention placebo, a eu besoin d'une oxygénothérapie, ce qui fait qu'il n'y a pas de différence significative entre les groupes quant au besoin d'oxygénothérapie Note de bas de page 43. Dans l'étude de Bjornson et al., une assistance respiratoire accrue, qu'il s'agisse de VM ou d'oxygène supplémentaire, a été nécessaire pour 4 patients (80 % des patients admis) dans le groupe avec PVZ et 1 (20 % des patients admis) dans le groupe témoin (p = 0,06). Sur l'ensemble des cohortes, 2,2 % du groupe avec PVZ et 1,2 % du groupe témoin ont nécessité une assistance respiratoire (p = 0,58) Note de bas de page 25. Aucun patient admis n'a eu besoin d'oxygène supplémentaire ou de VM dans l'étude de Buchs et al. Note de bas de page 41.
III.3.6.6 Mortalité
L'étude de Cohen et al. a examiné ce résultat et n'a signalé aucun décès dans les groupes avec PVZ ou placebo pendant les 6 mois de suivi de l'étude Note de bas de page 43. Dans l'étude de Fink et al., aucune différence dans la mortalité toutes causes confondues n'a été notée avant l'âge de 2 ans entre ceux qui avaient reçu ou non du PVZ, que ce soit tout au long de l'année ou en se limitant aux saisons du VRS Note de bas de page 26.
III.3.6.7 Séquelles à long terme (fonction pulmonaire, paramètres de croissance, colonisation par P. aeruginosa ou S. aureus)
L'étude de Groves et al. a évalué la fonction pulmonaire des enfants atteints de FK à l'âge de 6 ans. L'étude a évalué la fonction pulmonaire en mesurant le pourcentage du volume expiratoire maximal par seconde (VEM 1 ) prédit et n'a trouvé aucune différence significative entre les receveurs et les non-receveurs du PVZ (97,1 % contre 97,5 %, p = 0,92) ou entre ceux qui avaient été hospitalisés en raison du VRS et ceux qui ne l'avaient pas été Note de bas de page 24. Fink et al. n'ont signalé aucune différence dans le pourcentage du VEM 1 prédit à l'âge de 7 ans entre les enfants qui avaient ou n'avaient pas reçu de PVZ (98,2 %, IC à 95 % : 96,9 à 99,5 % contre 97,3 %, IC à 95 % : 96,1 à 98,5 %, respectivement) Note de bas de page 26.
Robinson et al. ont obtenu des renseignements supplémentaires sur l'état nutritionnel (gain de poids et rapport poids/taille) des enfants atteints de FK de l'étude de Cohen et al. lors du suivi à 12 mois. Aucune différence significative n'a été notée entre les groupes avec PVZ et placebo en ce qui concerne la prise de poids (2,7 kg, fourchette : 1.1 à 6,3 kg contre 2,7 kg; fourchette : 0,3 à 6,9 kg) ou le rapport poids/taille (données non fournies) Note de bas de page 17.
L'étude de Groves et al. n'a trouvé aucune différence significative, non plus, entre les enfants ayant reçu ou non une prophylaxie par PVZ en ce qui concerne le poids (22,1 kg contre 21,8 kg, p = 0,63), la taille (117,2 cm contre 116,6 cm, p = 0,60) ou l'indice de masse corporelle (16,0 contre 16,0, p = 0,95) à l'âge de 6 ans Note de bas de page 24. L'étude de Buchs et al. n'a pas, non plus, révélé de différence significative dans les paramètres de croissance (scores Z du poids) à l'âge de 1, 2 ou 3 ans entre les enfants qui avaient reçu ou non du PVZ Note de bas de page 41.
Les auteurs de l'examen systématique de Robinson et al. ont également obtenu des données supplémentaires des auteurs de Cohen et al. sur le nombre d'enfants colonisés par P. aeruginosa dans l'étude. Le nombre de cas de colonisation par P. aeruginosa était similaire dans le groupe de prophylaxie par PVZ (14, 15,2 %) et dans le groupe avec placebo (12, 12,8 %) (RR=1,19, IC à 95 % : 0,58 à 2,44 %) lors du suivi à 12 mois Note de bas de page 17. De même, l'étude de Groves et al. n'a trouvé aucune différence significative dans les taux de colonisation par P. aeruginosa entre les receveurs du PVZ et les non-receveurs à l'âge de 6 ans.
Toutefois, le délai médian avant l'apparition d'un premier isolat de P. aeruginosa était significativement plus court chez les receveurs du PVZ que chez les non-receveurs (57 mois contre 96 mois, p = 0,025), tout comme le RR d'apparition d'un premier isolat de P. aeruginosa au cours de la période d'étude (RR=2,5; 1,44-4,2, p = 0,001) Note de bas de page 24. Buchs et al. ont évalué l'âge de la première colonisation par S. aureus et par P. aeruginosa et le pourcentage de nourrissons colonisés par ces organismes à l'âge de 3 ans.
Aucune différence significative n'a été notée entre les receveurs du PVZ et les témoins en ce qui concerne l'âge de la première colonisation par l'un ou l'autre organisme, ou la proportion d'enfants colonisés par P. aeruginosa à l'âge de 3 ans. La proportion de personnes colonisées par S. aureus à l'âge de 3 ans était significativement plus élevée dans le groupe avec PVZ que dans le groupe témoin (97 % contre 85 %, p = 0,001).
Les auteurs ont supposé que les receveurs du PVZ ont pu être davantage exposés à S. aureus lors des consultations mensuelles à la clinique pour le PVZ, ou que les taux de colonisation de fond par S. aureus ont pu être différents dans les 2 villes distinctes où vivaient les receveurs du PVZ et les témoins Note de bas de page 41. Fink et al. n'ont signalé aucune différence dans le délai de première colonisation par P. aeruginosa entre ceux qui ont reçu ou non du PVZ (RR non ajusté de 1,1 (IC à 95 % : 1,0 à 1,2 %), après ajustement du score de propension 1,1 (IC à 95 % : 0,96 à 1,2 %) Note de bas de page 26.
III.3.7 Enfants atteints du syndrome de Down
L'examen actualisé de la littérature a permis de recenser 2 études d'observation qui ont examiné l'ERP chez les enfants atteints du SD. La première, jugée passable, portait sur des nourrissons nés à terme et âgés de moins d'un an, sans MPC ni CPCHS. Les cas ont été comparés à une cohorte-témoin de nourrissons nés à terme sans SD, sans MPC ni CPCHS, appariés par sexe et date de naissance Note de bas de page 35. La deuxième étude, jugée bonne, portait sur des enfants âgés de moins de 2 ans atteints du SD, avec ou sans comorbidités Note de bas de page 36.
III.3.7.1 Hospitalisations en raison du VRS
Dans l'étude de Sanchez-Luna et al., le taux d'HVRS était plus élevé chez les nourrissons atteints du SD que dans le groupe témoin Note de bas de page 35. Parmi les personnes atteintes du SD, 1 seul (3 %) des 33 receveurs du PVZ et 9/60 (15 %) sans PVZ ont été hospitalisés (p = 0,075). La prophylaxie par PVZ n'était pas un facteur prédictif indépendant de l'HVRS. Kimura et al. ont signalé une diminution du HVRS global après que la prophylaxie par PVZ a été approuvée pour tous les enfants atteints du SD, mais il n'y avait aucune différence dans le HVRS chez ceux qui ne présentaient aucun facteur de risque supplémentaire pour le VRS. Pour tous les enfants atteints du SD, le RCa pour ceux qui recevaient du PVZ était de 0,41 (IC à 95 % : 0,18 à 0,92 %, p = 0,03); pour le groupe sans CPCHS, le RCa était de 0,43, (IC à 95 % : 0,04 à 4,26 %, p = 0,47) et pour ceux qui ne présentaient aucun facteur de risque supplémentaire de HVRS, le RCa était de 0,68 (IC à 95 % : 0,06 à 7,73 %, p = 0,75) Note de bas de page 36.
Analyse / Résumé
L'examen actualisé de la littérature sur l'EP et l'ER de la prophylaxie par PVZ dans la réduction des complications associées aux infections par le VRS chez les nourrissons a recensé 3 examens systématiques, 2 ECR et 19 études d'observation. Les données probantes relatives à l'EP et à l'ER de la prophylaxie par PVZ pour divers résultats liés au VRS sont examinées ci-dessous en fonction des résultats de l'examen initial de la littérature de l'INESSS et sont résumées selon les populations à risque élevé incluses dans les études : population mixte (Section IV.1), prématurés sans MPC (Section IV.2), prématurés avec MPC (Section IV.3), enfants atteints de CPCHS (Section IV.4), enfants vivant dans des communautés éloignées (Section IV.5), enfants atteints de FK (Section IV.6) et enfants atteints du SD (Section IV.7). Les données issues de l'examen actualisé de la littérature et de l'examen initial de la littérature de l'INESSS sont résumées sous forme de tableaux à l'Annexe E et à l'Annexe F, respectivement.
IV.1 Population mixte
IV.1.1 Hospitalisations associées au VRS
L'examen actualisé de la littérature a permis de recenser 5 études d'observation de cohorte et une étude cas-témoin à test négatif, toutes jugées passables, qui présentaient des données sur des populations mixtes. Une étude d'observation de cohorte menée par Prais et al. a révélé que la prophylaxie par PVZ entraînait une réduction significative de 40 % des HVRS au cours des 2 premières années de vie chez les enfants de moins de 29 sAG, dont certains étaient atteints de MPC Note de bas de page 21. Dans une autre étude d'observation de cohorte, incluant des nourrissons de 28 sAG ou moins et de 35 sAG ou moins atteints de MPC, le PVZ a réduit de 86 % les HVRS Note de bas de page 22.
Deux (2) autres études d'observation de cohorte portant sur des prématurés, dont certains souffraient de MPC, n'ont pas révélé de réduction statistiquement significative d'HVRS avec le PVZ, mais les groupes avec PVZ comptaient plus de patients à haut risque que les groupes témoins et les taux n'ont pas été ajustés en fonction de ces facteurs de confusion Note de bas de page 30 Note de bas de page 31. La cinquième étude a fait état d'une augmentation non significative d'HVRS dans le groupe non traité, mais les admissions étaient peu nombreuses et les nourrissons à haut risque étaient plus nombreux à ne pas être traités Note de bas de page 32. Une étude cas-témoins à test négatif, dont la méthodologie est qualifiée de passable, a signalé une ER significative du PVZ pour prévenir l'HVRS de 58 % Note de bas de page 40.
En outre, une étude de qualité passable a révélé que les receveurs du PVZ étaient moins susceptibles d'avoir un test VRS positif à l'admission à l'hôpital pour une maladie respiratoire par rapport aux non-receveurs dans une population de nourrissons nés de 29 à moins de 32 sAG. Cependant, ce résultat n'était pas statistiquement significatif, peut-être parce que très peu de nourrissons (1 receveur du PVZ et 3 non-receveurs) ont eu un test VRS positif, et l'étude peut avoir été insuffisante pour détecter une telle différence Note de bas de page 20. Dans une autre étude, de qualité faible, les nourrissons admis pour bronchiolite qui avaient reçu du PVZ étaient significativement moins susceptibles d'avoir un test VRS positif que les non-receveurs Note de bas de page 23.
L'examen initial de la littérature de l'INESSS a révélé que la prophylaxie par PVZ était associée à une réduction de 50 à 65 % du risque d'HVRS, d'après les résultats de 2 examens systématiques et de méta-analyses de qualité moyenne à bonne portant sur des enfants de 35 sAG ou moins, dont certains souffraient de MPC ou de CPCHS Note de bas de page 44 Note de bas de page 45. De même, un ECR de bonne qualité portant sur des enfants nés à 35 sAG ou moins ou des enfants âgés de 24 mois ou moins atteints de MPC, a constaté que la prophylaxie par PVZ était associée à une réduction de 55 % du risque d'HVRS Note de bas de page 38.
Une étude d'observation de qualité faible portant sur des enfants nés à moins de 33 sAG ou de 33 à 35 sAG atteints de MPC ou nécessitant une oxygénation à domicile a montré que la prophylaxie par PVZ était associée à une réduction de 60 % des HVRS Note de bas de page 46. Enfin, une étude d'observation de qualité très faible portant sur des enfants nés soit à 28 sAG ou moins, soit de 29 à 32 sAG, dont certains souffraient de MPC, a montré que la prophylaxie par PVZ était associée à une réduction de 74 % et de 46 % des HVRS, respectivement Note de bas de page 47.
Les conclusions de l'examen actualisé de la littérature semblent conformes à celles de l'examen initial de la littérature de l'INESSS selon lesquelles la prophylaxie par PVZ est associée à une réduction du risque d'HVRS dans des populations mixtes de nourrissons à risque d'infection sévère par le VRS. Les différences dans les états de santé des populations mixtes, la conception et la qualité des études empêchent de tirer des conclusions définitives sur les avantages relatifs pour les différents groupes de patients.
IV.1.2. Autres résultats associés au VRS en matière d'hospitalisation
IV.1.2.1 Durée de l'hospitalisation associée au VRS
Dans l'étude de Blake et al., les nourrissons positifs au VRS qui avaient reçu une prophylaxie par PVZ avaient tendance à avoir une DdS à l'hôpital plus courte que les nourrissons qui n'avaient pas reçu de prophylaxie (2,0 contre 14,9 jours), mais ce résultat n'était pas statistiquement significatif. De même, la DdS n'était pas significativement plus courte chez les receveurs du PVZ que chez les non-receveurs dans les études de Chi et al. (7 contre 13 jours) et de Lee et al. (0,7 contre 1,1 jour). Le nombre d'hospitalisations dans chacune de ces études était faible. Dans l'étude de Narbona-Lopez, la DdS des receveurs du PVZ était significativement plus longue que celle de la cohorte entière de nourrissons admis pour une bronchiolite liée au VRS (9 contre 7 jours), mais les nourrissons qui ont reçu du PVZ étaient d'un AG inférieur Note de bas de page 23.
Dans l'examen initial de l'INESSS, la prophylaxie par PVZ a été associée à un nombre total de jours d'HVRS significativement inférieur à celui du placebo dans 1 seul ECR portant sur des enfants nés à 35 sAG ou moins ou âgés de 24 mois ou moins atteints de MPC (36,4 contre 62,6 jours pour 100 enfants). Comme le nombre de sujets et les taux d'admission différaient entre les 2 groupes, l'étude ne fournit pas d'information directe sur la DdS des personnes admises. La DdS réelle calculée à partir des données de la publication était de 7,58 jours pour le groupe avec PVZ et de 5,91 pour le groupe avec placebo (non significativement différent) Note de bas de page 38. Une étude d'observation de faible qualité portant sur des enfants nés soit à 28 sAG ou moins, soit de 29 à 32 sAG, dont certains présentaient une MPC (6 jours contre 8 jours), a révélé une diminution faible, mais significative de la DdS par rapport à l'absence d'intervention Note de bas de page 47.
Les résultats n'indiquent pas si le PVZ a une incidence importante sur la DdS des nourrissons hospitalisés en raison du VRS, mais il se peut qu'ils soient insuffisants pour détecter un tel effet.
IV.1.2.2 Admission et durée du séjour dans une unité de soins intensifs en raison du VRS
L'examen actualisé de la littérature a permis de recenser 3 études qui ont examiné l'effet de la prophylaxie par PVZ sur l'admission en USI ou la DdS à l'USI en raison du VRS. L'admission en USI s'est produite chez 0,8 % des receveurs du PVZ et 7,1 % des témoins (réduction de 89 %, p = 0,024) dans l'étude de Chi et al.; et chez 2,5 % des receveurs du PVZ et 7,4 % des témoins (p = 0,436) dans l'étude de Lee et al. Dans l'étude cas-témoins, l'ERP pour prévenir l'admission en USI était significative à 62 % Note de bas de page 40. Parmi les personnes hospitalisées en raison du VRS, les proportions d'admissions en USI étaient de 1 sur 2 et de 9 sur 13 dans les groupes avec PVZ et témoin, respectivement Note de bas de page 22, et de 1 sur 2 et de 7 sur 15, respectivement Note de bas de page 30.
L'examen initial de la littérature de l'INESSS a permis de recenser 3 études portant sur les taux d'admission en USI : 1 ECR de bonne qualité Note de bas de page 38, une (1) étude de cohorte historique de qualité très faible Note de bas de page 47, et 2 des études de haute qualité recensées dans un examen systématique et une méta-analyse de bonne qualité Note de bas de page 44. Selon la méta-analyse et l'ECR, la prophylaxie par PVZ est associée à un taux significatif de 50 % (RR = 0,50, IC à 95 % : 0,30 à 0,81 %) et de 57 % (RR = 0,43, IC à 95 % : 0,21 à 0,90 %), respectivement, du risque d'admission en USI en raison du VRS chez les receveurs du PVZ par rapport au placebo Note de bas de page 38 Note de bas de page 44. Dans l'étude Impact, la proportion d'enfants hospitalisés en raison du VRS qui ont été admis en USI était de 27 % dans le groupe avec PVZ et de 28 % dans le groupe avec placebo. L'étude d'observation de cohorte n'a révélé aucune différence significative dans la proportion d'enfants admis en USI en raison du VRS entre les enfants ayant reçu une prophylaxie par PVZ (9/71, 13 %) et les enfants n'ayant reçu aucune intervention (33/161, 20 %) [RR = 0,62, IC à 95 % : 0,31 à 1,22 %] Note de bas de page 47.
L'examen actualisé de la littérature a recensé une (1) cohorte d'observation qui a signalé la DdS en USI. Aucune différence significative n'a été notée dans la durée entre les receveurs du PVZ (8 jours, n=1) et les témoins (10 jours n=9) Note de bas de page 22. L'examen initial de la littérature de l'INESSS n'a pas permis de recenser les études qui faisaient état de la DdS en USI. L'étude Impact a signalé le nombre total de jours en USI pour 100 enfants chez les receveurs du PVZ et du placebo. Les receveurs du PVZ ont eu un nombre de jours en USI significativement plus élevé pour 100 enfants que les receveurs de placebo (13,3 contre 12,7 p = 0,023) Note de bas de page 38.
IV.1.2.3. Utilisation et durée d'utilisation de la ventilation mécanique en raison du VRS
L'examen actualisé de la littérature a recensé 3 études qui ont examiné l'effet de la prophylaxie par PVZ sur le recours à la VM en raison du VRS. Dans 2 études d'observation, aucune différence significative n'a été notée entre les receveurs du PVZ et les témoins en ce qui concerne les proportions des groupes totaux ou les proportions de patients hospitalisés pour une infection par le VRS qui ont eu besoin d'une VM, mais les nombres dans les 2 études étaient faibles Note de bas de page 22 Note de bas de page 31. Dans l'étude cas-témoins, le PVZ n'a pas été efficace pour prévenir le besoin de VM Note de bas de page 40.
L'examen initial de la littérature de l'INESSS a recensé 3 études portant sur l'utilisation de la VM en raison du VRS : 2 des études de haute qualité recensées dans l'examen systématique et la méta-analyse d'Andabaka et al., l'ECR Impact et l'étude de cohorte historique de Pedraz et al. Note de bas de page 38 Note de bas de page 44 Note de bas de page 47. Les résultats de ces 3 analyses n'ont révélé aucune différence significative dans le recours à la VM en raison du VRS chez les enfants ayant reçu une prophylaxie par PVZ par rapport aux enfants ayant reçu un placebo ou n'ayant reçu aucune intervention.
Aucune étude de l'examen actualisé ou de l'examen initial de la littérature de l'INESSS ne portait sur la durée de la VM. Une étude dans l'examen initial de l'INESSS, l'ECR Impact, a révélé que les enfants recevant une prophylaxie par PVZ avaient eu un total de 8,4 jours de VM/100 enfants contre 1,7 jour/100 enfants chez les receveurs d'un placebo, mais la différence n'était pas statistiquement significative (p = 0,210).
Rien ne prouve que le PVZ a un effet sur la nécessité d'une VM chez les enfants à haut risque atteints d'une infection par le VRS, mais il est possible que les études aient été insuffisantes pour détecter ce résultat.
IV.1.2.4 Durée de l'oxygénothérapie en raison du VRS
Aucune étude recensée dans l'examen actualisé de la littérature n'a examiné l'effet de la prophylaxie par PVZ sur la durée de l'oxygénothérapie en raison du VRS.
La seule étude recensée dans l'examen initial de la littérature de l'INESSS qui a examiné le besoin d'oxygénothérapie était encore une fois l'ECR Impact incluant des enfants nés à 35 sAG ou moins ou âgés de 24 mois ou moins avec une MPC. Cette étude a révélé que les enfants recevant une prophylaxie par PVZ ont nécessité un nombre total de jours d'oxygénothérapie pour 100 enfants significativement inférieur à celui des enfants recevant un placebo (30,3 contre 50,6, p < 0,001).
Ces résultats suggèrent que le PVZ a un effet significatif en réduisant le taux global d'admissions en USI de 50 à 60 % dans les populations à haut risque. Bien que les nombres soient faibles, il semble que, dans le cas d'une infection contractée par le VRS malgré l'administration du PVZ et nécessitant une hospitalisation, la sévérité de la maladie, telle qu'elle se manifeste par la nécessité d'une admission en USI, la DdS en USI et la nécessité d'une VM, n'est pas influencée par le PVZ.
IV.1.3 Mortalité
Trois (3) études recensées dans l'examen actualisé de la littérature ont fait état de la mortalité. Dans une étude, il y a eu 2 décès liés au VRS chez 2 370 patients du groupe témoin, mais aucun chez les 376 patients ayant reçu du PVZ Note de bas de page 31. Les 2 autres études n'ont signalé aucun décès Note de bas de page 22 Note de bas de page 30.
L'examen initial de la littérature de l'INESSS a recensé 4 études portant sur la mortalité toutes causes confondues qui aboutissent à des résultats contradictoires : – l'examen systématique et la méta-analyse d'Andabaka et al. qui incluaient les données de 3 ECR Note de bas de page 44; – l'examen systématique et la méta-analyse de Checchia et al. Note de bas de page 45 portant sur des enfants de 35 sAG ou moins, certains atteints de MPC ou de CPC, qui comprenait les données des mêmes 3 ECR plus 4 études de cohorte; – l'ECR portant sur des enfants nés à 35 sAG ou moins ou âgés de 24 mois ou moins atteints de DBP Note de bas de page 38; – l'étude de cohorte historique portant sur des enfants nés à 32 sAG ou moins, certains atteints de MPC Note de bas de page 47. Dans l'étude de cohorte historique, les décès toutes causes confondues étaient de 6 sur 1919 receveurs du PVZ et de 22 sur 1583 non-receveurs (p < 0,001) Note de bas de page 47.
Parmi les 3 autres analyses, seule la méta-analyse de Checchia et al. a révélé que la prophylaxie par PVZ était associée à une réduction significative de la mortalité toutes causes confondues par rapport aux enfants receveurs du placebo ou à l'absence d'intervention (RC = 0,30, IC à 95 % : 0,17 à 0,55 %, p < 0.001). En revanche, la méta-analyse d'Andabaka et l'ECR ont montré que la prophylaxie par PVZ était associée à des réductions non significatives du RR de mortalité toutes causes confondues de 0,69 (IC à 95 % : 0,42 à 1,15 %) et de 0,40 (IC à 95 % : 0,11 à 1,48 %), respectivement.
Checchia et al. ont également signalé des décès liés au VRS : 3 sur 6358 dans le groupe avec PVZ et 2 sur 6162 dans le groupe sans prophylaxie (RC, 1,22; IC à 95 % : 0,20 à 7,38 %). Dans l'ECR, 2 décès dans le groupe avec PVZ et aucun dans le groupe avec placebo sont survenus pendant une HVRS Note de bas de page 38. Dans l'étude de cohorte historique, il n'y a eu aucun décès lié au VRS chez les receveurs du PVZ, mais 1 décès lié au VRS dans le groupe témoin Note de bas de page 47.
Ces études indiquent des résultats contradictoires quant à l'effet du PVZ sur la mortalité toutes causes confondues chez les nourrissons à haut risque atteints de VRS. Les décès liés au VRS ont été rares tant chez les receveurs du PVZ que chez ceux qui n'en ont pas reçu.
IV.1.4 Séquelles à long terme
L'examen actualisé a recensé une (1) seule étude de qualité passable qui suggère que la prophylaxie par PVZ peut réduire la respiration sifflante à court terme (2 premières années de vie), mais n'a peut-être pas d'impact significatif sur les résultats à plus long terme Note de bas de page 21. L'étude a révélé que beaucoup moins d'enfants nés à moins de 29 sAG ayant reçu une prophylaxie par PVZ ont eu des épisodes de respiration sifflante au cours des 2 premières années de vie par rapport aux enfants similaires qui n'en ont pas reçu.
En revanche, lorsque ces enfants ont atteint l'âge scolaire (7 à 10 ans), aucune différence significative n'a été notée entre ces 2 groupes en ce qui concerne la proportion d'enfants présentant des épisodes de respiration sifflante, ou utilisant des bronchodilatateurs et des corticostéroïdes inhalés à l'âge scolaire, ou les paramètres de la fonction pulmonaire ou la réactivité bronchique à l'âge scolaire. Les résultats de la fonction pulmonaire étaient similaires lorsque l'analyse était limitée aux enfants nés à moins de 26 sAG, avec une MPC, ou avec et sans antécédents familiaux ou personnels d'eczéma ou de rhinite allergique.
L'examen initial de la littérature de l'INESSS n'a pas recensé d'études ayant examiné ce résultat dans une population mixte. Par conséquent, les données probantes démontrant l'effet de la prophylaxie par PVZ sur les séquelles à long terme de l'infection par le VRS dans une population mixte sont très limitées. Aucune conclusion claire ne peut être tirée.
IV.2 Nourrissons prématurés sans maladie pulmonaire chronique infantile
IV.2.1 Hospitalisations associées au VRS
L'examen actualisé a recensé 4 études qui ont examiné ce résultat. Une étude de cohorte rétrospective de qualité passable réalisée par Farber et al. a révélé une diminution du nombre d'HVRS au cours de la première saison du VRS chez les nourrissons de 29 à 32 sAG ayant reçu du PVZ par rapport aux nourrissons n'ayant reçu aucune prophylaxie; à cela s'ajoute une analyse supplémentaire permettant de penser que l'effet, en bonne partie, s'expliquait par une plus grande adhésion à la prophylaxie chez les nourrissons (doses recommandées reçues : de 80 à 100 %).
La même étude n'a trouvé aucune différence statistiquement significative dans l'HVRS chez les nourrissons de 33 à 36 sAG qui ont reçu ou non une prophylaxie par PVZ. Cependant, l'adhésion à la prophylaxie par PVZ et son utilisation chez les nourrissons nés de 33 à 36 sAG étaient assez faibles Note de bas de page 26. Notario et al. ont analysé les données de l'ECR Impact (jugé bon) pour les prématurés sans MPC et ont signalé que le PVZ a entraîné une réduction significative des taux d'HVRS chez les nourrissons de 28 à 31 sAG (73 %), de 29 à 32 sAG (80 %), de 32 à 34 sAG (82 %) et de 32 à 35 sAG (82 %), mais pas chez ceux de moins de 29 sAG ou de 33 à 35 sAG Note de bas de page 37.
Dans une étude d'observation jugée passable, la prophylaxie par PVZ n'a pas réduit de manière significative le taux d'HVRS chez les nourrissons de 28 sAG ou moins Note de bas de page 22. Dans une étude cas-témoins jugée bonne, l'ERP pour la prévention de l'HVRS était de 74 % chez les prématurés de 29 à 35 sAG. L'ERP n'a pas été observée chez les nourrissons de moins de 29 sAG, mais les nombres étaient faibles Note de bas de page 40.
L'examen initial de la littérature de l'INESSS a permis de recenser 7 études qui ont examiné l'effet du PVZ sur l'HVRS chez les prématurés sans MPC : 1 examen systématique et une (1) méta-analyse de qualité moyenne Note de bas de page 45, 3 ECR de bonne Note de bas de page 38 à moyenne Note de bas de page 48 Note de bas de page 49, et 3 études de cohorte dont la qualité est bonne Note de bas de page 50, moyenne Note de bas de page 51 ou faible Note de bas de page 52.
L'examen systématique et la méta-analyse ont révélé que, par rapport à l'absence de prophylaxie, l'utilisation de PVZ était associée à une réduction de 72 % des HVRS chez les nourrissons nés à 32 sAG ou moins et de 74 % chez les nourrissons nés de 32 à 35 sAG. Un effet protecteur significatif similaire à la prophylaxie par PVZ a été constaté dans les 3 ECR portant sur des nourrissons nés à 32 sAG ou moins (74, 47 %) Note de bas de page 38 Note de bas de page 48, de 32 à 35 sAG (72 %) Note de bas de page 38, et de 33 à 35 sAG (82 %) Note de bas de page 49.
Les études de cohorte historiques citées dans l'examen initial de l'INESSS présentaient des résultats contradictoires quant à l'effet de la prophylaxie par PVZ sur les HVRS chez les prématurés. On a constaté que cette prophylaxie réduisait significativement les HVRS dans les cohortes d'enfants nés à 30 sAG ou moins (1,1 % contre 13,6 % Note de bas de page 52 et de 32 à 34 sAG [réduction de 55 %]) Note de bas de page 51, mais qu'elle n'était pas significativement efficace dans les autres cohortes d'enfants nés de 32 à 34 sAG Note de bas de page 51 et de 32 à 35 sAG Note de bas de page 50.
La constatation d'une ERP significative dans la réduction des HVRS chez les nourrissons de 29 à 33 sAG dans les études recensées dans l'examen actualisé est cohérente avec les résultats de l'examen systématique et des ECR recensés dans l'examen initial de la littérature de l'INESSS. Trois (3) études ont suggéré une absence d'effet chez les nourrissons de moins de 29 sAG, mais cela peut être le résultat du petit nombre d'enfants sans MPC dans ce groupe de grands prématurés Note de bas de page 22 Note de bas de page 37 Note de bas de page 40.
Les résultats contradictoires concernant les nourrissons de plus de 33 sAG sont difficiles à interpréter, mais peuvent être en partie dus à des différences dans la conception et la méthodologie des études. Cependant, en général, il semble qu'il y ait des données probantes en faveur de l'ERP dans la réduction des HVRS chez les enfants nés prématurément, bien que le degré de prématurité auquel le PVZ est le plus efficace ne soit pas entièrement clair d'après les données actuelles.
IV.2.2 Mortalité
Aucune étude recensée dans l'examen actualisé de la littérature n'a examiné l'effet de la prophylaxie par PVZ sur la mortalité dans cette population.
La seule étude recensée dans l'examen initial de la littérature de l'INESSS qui a examiné la mortalité toutes causes confondues dans cette population est l'examen systématique et la méta-analyse de qualité moyenne de Checchia et al. Note de bas de page 45. Dans chaque groupe de prématurés, la méta-analyse comprenait les données de 3 études (2 d'entre elles étaient communes aux 2 groupes de sAG). Chez les nourrissons nés à 32 sAG ou moins, les receveurs du PVZ présentaient un risque significativement réduit de mortalité toutes causes confondues (RC = 0,25, IC à 95 % : 0,13 à 0,49 %, p < 0,001) par rapport aux receveurs du placebo ou à l'absence d'intervention, tandis que chez les nourrissons nés de 32 à 35 sAG, la différence n'était pas significative (RC = 0,22, IC à 95 % : 0,03 à 1,89 %, p = 0.085). La mortalité liée au VRS n'a pas été déterminée.
Il est donc possible que la prophylaxie par PVZ ait un effet sur la mortalité toutes causes confondues chez les nourrissons nés à 32 sAG ou moins, mais pas chez les prématurés de 32 à 35 sAG. Cependant, ces résultats reposent sur un petit nombre d'études qui sont peut-être insuffisantes pour détecter une différence de mortalité chez les enfants moins prématurés.
IV.2.3 Séquelles à long terme
IV.2.3.1 Respiration sifflante récurrente et asthme atopique
L'examen actualisé de la littérature a recensé 1 ECR Note de bas de page 39 de qualité passable et 2 études de cohorte de bonne qualité Note de bas de page 28 et de qualité passable Note de bas de page 27 qui ont examiné les taux de respiration sifflante diagnostiquée par un médecin chez les enfants qui avaient reçu ou non une prophylaxie par PVZ. L'ECR était un suivi de l'étude de Blanken et al. mentionnée ci-dessous. Des prématurés de 32 à 35 sAG, autrement en bonne santé, ont reçu du PVZ ou un placebo lors de leur première saison de VRS. À l'âge de 6 ans, aucune différence n'a été notée dans la prise de médicaments pour l'asthme ou l'asthme diagnostiqué par un médecin au cours de l'année précédente ni dans les résultats des tests de fonction pulmonaire.
Le nombre de sifflements signalés par les parents était significativement plus élevé dans le groupe avec placebo que dans le groupe avec PVZ, mais cela n'était significatif que pour ceux qui signalaient des sifflements peu fréquents (1 à 3 épisodes par année) Note de bas de page 39. Dans l'étude de Simoes et al., les enfants nés à moins de 36 sAG et de 36 mois ou moins au moment de l'inscription qui avaient reçu une prophylaxie par PVZ lors d'une saison respiratoire précédente présentaient une incidence significativement réduite de sifflements diagnostiqués par un médecin 24 mois après l'inscription à l'étude et un délai significativement plus long avant un troisième épisode de sifflements diagnostiqués par un médecin par rapport aux enfants n'ayant reçu aucune intervention, mais uniquement chez les enfants sans antécédents familiaux d'asthme ou d'atopie.
Aucune différence significative n'a été notée dans ces résultats chez les enfants ayant des antécédents familiaux d'asthme ou d'atopie Note de bas de page 28. L'étude de Mochizuki et al. portant sur des enfants nés de 33 à 35 sAG a révélé que les enfants qui avaient reçu une prophylaxie par PVZ présentaient des taux réduits de respiration sifflante récurrente diagnostiquée par un médecin au cours des 6 premières années de vie comparativement aux enfants qui n'en avaient pas reçu. Cependant, cette association n'a été trouvée que dans les sous-groupes d'enfants ayant des antécédents familiaux d'allergie. L'étude a également révélé que la prévalence de l'asthme atopique (défini par une respiration sifflante récurrente et un taux élevé d'IgE totales ou spécifiques) à l'âge de 6 ans était similaire chez les enfants ayant reçu du PVZ comparativement à ceux n'ayant reçu aucune intervention, indépendamment des antécédents familiaux d'allergie Note de bas de page 27.
L'examen initial de la littérature de l'INESSS a recensé 3 études qui ont examiné l'effet de la prophylaxie par PVZ sur le risque de respiration sifflante au cours de la première année de vie : 1 ECR de qualité moyenne Note de bas de page 49 et 2 études de cohorte de qualité faible Note de bas de page 53 à moyenne Note de bas de page 54. L'étude de Yoshihara était un rapport antérieur sur la cohorte décrite dans la publication de Mochizuki et al. mentionnée ci-dessus. Une étude (Blanken) s'est intéressée uniquement à la respiration sifflante signalée par les parents, tandis que les 2 autres ont examiné la respiration sifflante diagnostiquée par un médecin.
Ces 3 études ont montré que la prophylaxie par PVZ chez des prématurés par ailleurs en bonne santé, nés de 33 à 35 sAG Note de bas de page 49 Note de bas de page 53 ou à 35 sAG Note de bas de page 54 ou moins, entraînait une réduction significative (46 à 66 %) du risque de respiration sifflante récurrente chez les enfants au cours de la première année de vie Note de bas de page 49, de la deuxième année Note de bas de page 53 ou de la troisième année Note de bas de page 54. Dans l'étude de Blanken et al., la proportion réelle de jours marqués par une respiration sifflante au cours de la première année de vie était de 1,8 % avec le PVZ contre 4,5 % avec le placebo Note de bas de page 49.
Par conséquent, il semble que la prophylaxie par PVZ puisse avoir un effet sur la réduction de l'incidence des sifflements récurrents chez les jeunes enfants au cours des premières années de vie, mais cet effet peut ne pas persister. Les résultats sont contradictoires quant à l'impact relatif de la prophylaxie par PVZ par rapport aux antécédents familiaux d'atopie sur la persistance des sifflements récurrents chez les enfants plus âgés. On ne sait pas non plus si le PVZ peut être plus efficace pour avoir un effet à long terme chez les nourrissons ayant connu une prématurité plus extrême, car aucune donnée n'a été trouvée.
IV.2.3.2 Paramètres de croissance
L'examen actualisé n'a recensé qu'une (1) seule étude de qualité passable qui a évalué les paramètres de croissance (poids, taille, indice de masse corporelle) à l'âge de 6 ans chez des enfants nés de 33 à 35 sAG Note de bas de page 27. L'étude n'a révélé aucune différence significative dans ces résultats entre les enfants qui ont reçu du PVZ et ceux qui n'ont reçu aucune intervention. L'examen de la littérature de l'INESSS n'a pas fait état de ce résultat.
IV.3 Nourrissons prématurés atteints d'une maladie pulmonaire chronique infantile
IV.3.1 Hospitalisations associées au VRS
L'examen actualisé de la littérature a permis de recenser une (1) étude d'observation de cohorte Note de bas de page 22 et une (1) étude cas-témoin Note de bas de page 40, toutes 2 jugées passables, qui ont examiné l'effet de la prophylaxie par PVZ sur les hospitalisations associées au VRS chez les prématurés atteints de MPC. Dans l'étude de Chi, le taux d'HVRS a été réduit de 86 % chez les nourrissons nés à 35 sAG ou moins au cours des 6 premiers mois après la sortie initiale de l'hôpital. Selon l'AG, la réduction était significative pour ceux de 28 sAG ou moins (89 %) et non pour ceux de 29 à 35 sAG, mais les nombres dans ce dernier groupe étaient faibles Note de bas de page 22. Une réduction significative n'a pas été observée dans l'étude cas-témoins de nourrissons de 35 sAG ou moins et âgés de moins de 12 mois ou de 12 à 24 mois Note de bas de page 40.
L'examen de la littérature de l'INESSS a permis de recenser 3 études portant sur ce résultat : 1 ECR de bonne qualité Note de bas de page 38 et 2 études d'observation de qualité faible Note de bas de page 55 et très faible Note de bas de page 47. L'ECR portant sur des enfants nés à 35 sAG ou moins et âgés de 24 mois ou moins a révélé que les receveurs du PVZ présentaient un risque réduit d'HVRS comparativement aux nourrissons ayant reçu un placebo (RR = 0,60, IC à 95 % : 0,40 à 0,95 %) Note de bas de page 38. De même, les études d'observation de moindre qualité portant sur des enfants nés à 32 sAG ou moins ont toutes 2 constaté que la prophylaxie par PVZ était associée à un risque réduit d'HVRS : (RR = 0,15, IC à 95 % : 0,05 à 0,49 %, p < 0,01) Note de bas de page 55 et (RR = 0,28, IC à 95 % : 0,14 à 0,58 %, p < 0,007) Note de bas de page 47.
Les résultats suggèrent que la prophylaxie par PVZ peut permettre de réduire le risque d'HVRS dans cette population, mais les données probantes sont contradictoires et n'identifient pas clairement un degré de prématurité qui en tirerait un bénéfice.
IV.3.2 Mortalité
Aucune étude n'a été recensée dans l'examen actualisé de la littérature pour examiner l'effet de la prophylaxie par PVZ sur la mortalité des prématurés atteints de MPC.
Dans l'examen de l'INESSS, la méta-analyse de qualité moyenne de Checchia et al. n'a montré aucun effet observé du PVZ par rapport à l'absence d'intervention/placebo (0,22 % contre 0,34 %; RC de Peto, 0,83; IC à 95 % : 0,13 à 5,25 %), sur la mortalité toutes causes confondues, mais il n'y a eu que 3 événements dans le groupe avec prophylaxie et 2 événements dans le groupe avec placebo/sans intervention. La mortalité liée au VRS n'a pas été déterminée pour ce groupe Note de bas de page 45.
IV.4 Enfants présentant une cardiopathie congénitale hémodynamiquement significative
IV.4.1 Hospitalisations associées au VRS
Trois (3) études recensées dans l'examen actualisé de la littérature ont examiné l'ERP chez les enfants atteints de CPCHS, 2 études d'observation de cohorte de qualité passable chez les nourrissons de moins d'un an Note de bas de page 33 Note de bas de page 34 et une (1) étude cas-témoin de qualité passable chez les nourrissons de moins de 24 mois Note de bas de page 40. Chiu et al. ont observé des réductions significatives de 49 % pour tous les cas et de 65 % pour le sous-groupe présentant une CPCHS cyanotique, mais une réduction non significative de 35 % pour ceux présentant une maladie acyanotique Note de bas de page 33. Un RR significatif de 0,28 (réduction de 72 %) d'hospitalisation pour tous les cas de CPCHS a été signalé dans une petite étude de Soraiz Note de bas de page 34. L'étude cas-témoins n'a pas permis d'observer une ERP significative, que ce soit au cours de la première ou de la deuxième année de vie Note de bas de page 40.
L'examen initial de la littérature de l'INESSS a recensé 1 ECR de bonne qualité Note de bas de page 56 et une (1) étude de cohorte de qualité faible Note de bas de page 57 qui ont examiné ce résultat. Dans l'ECR, les enfants atteints de CPCHS et âgés de 24 mois ou moins au début de la saison du VRS qui ont reçu une prophylaxie par PVZ ont connu une diminution relative (DR) significative d'HVRS comparativement aux enfants recevant un placebo (DR=45 %, p = 0,003).
Cette diminution relative significative des hospitalisations a également été observée chez les enfants atteints de CPC acyanotique (DR=58 %, p = 0,003), mais pas chez les enfants atteints de CPC cyanotique (DR=29 %, p = 0,285). L'étude de cohorte de Harris et al. n'a pas trouvé que la prophylaxie par PVZ entraînait une réduction significative d'HVRS par rapport à l'absence d'intervention chez les enfants atteints de MPC qui étaient nés à 36 sAG ou moins et âgés de 24 mois ou moins au début de la saison du VRS (RR = 0,58, IC à 95 % : 0,21 à 1,65 %), mais le taux d'HVRS dans la population témoin était très faible (2,9 %) Note de bas de page 57.
Ces études montrent des résultats contradictoires quant à l'effet protecteur du PVZ sur l'HVRS chez les nourrissons atteints d'une CPCHS. Les 2 études qui n'ont pas montré d'effet significatif Note de bas de page 40 Note de bas de page 57 comptaient moins de participants que 2 études plus importantes qui ont montré une réduction du risque de 45 à 49 % Note de bas de page 33 Note de bas de page 56. Une de ces études a montré une protection significative chez les enfants atteints de CPC cyanogène, mais pas chez ceux atteints de CPC acyanotique Note de bas de page 33, tandis que l'autre a montré le contraire Note de bas de page 56. Les raisons de ces divergences ne sont pas évidentes.
IV.4.2 Autres résultats associés au VRS en matière d'hospitalisation
IV.4.2.1 Durée de l'hospitalisation associée au VRS
Dans l'étude de Chiu et al., la DdS n'était pas significativement différente entre les patients ayant reçu du PVZ et ceux n'en ayant pas reçu, que ce soit pour le groupe entier ou pour ceux qui présentaient une CPCHS cyanotique ou acyanotique Note de bas de page 33.
Dans l'examen initial de l'INESSS, l'ECR portant sur des enfants atteints de CPCHS et âgés de 24 mois ou moins au début de la saison du VRS a constaté que les receveurs du PVZ présentaient une diminution relative significative du nombre total de jours/100 enfants hospitalisés en raison du VRS comparativement aux receveurs de placebo (DR=56 %, p = 0,003) Note de bas de page 56. La durée de vie des personnes admises n'a pas été signalée. La DdS moyenne calculée à partir des données fournies était de 10,8 jours pour les receveurs du PVZ et de 13,3 jours pour le placebo, ce qui n'est pas significativement différent.
IV.4.2.2 Admission et durée du séjour dans une unité de soins intensifs en raison du VRS
Chiu et al. n'ont signalé aucune différence significative dans les taux d'admission en USI parmi ceux qui ont reçu du PVZ et ceux qui n'en ont pas reçu, que ce soit pour l'ensemble du groupe ou pour ceux qui présentaient une CPCHS cyanotique ou acyanotique Note de bas de page 33. Les proportions de personnes hospitalisées en raison du VRS qui ont dû être admises en USI n'étaient pas non plus significativement différentes.
Dans l'examen initial de l'INESSS, l'ECR de Feltes et al. et l'étude de cohorte de Harris et al. ont examiné les taux d'admission à l'USI. Chez les enfants atteints de CPCHS âgés de 24 mois ou moins, l'ECR a montré que par rapport aux receveurs d'un placebo, les receveurs du PVZ affichaient une diminution relative du nombre d'admissions à l'USI, sans que la réduction soit significative (DR=46 %, p = 0,094). Harris et al. ont également constaté que, par rapport à l'absence d'intervention, les enfants atteints de CPC nés à 36 sAG ou moins et âgés de 24 mois ou moins qui avaient reçu du PVZ présentaient une diminution relative des admissions en USI en raison du VRS (DR=86 %), sans que la réduction soit significative Note de bas de page 57. Dans les 2 études, les proportions de nourrissons hospitalisés admis à l'USI n'étaient pas significativement différentes dans les groupes ayant reçu du PVZ et ceux n'en ayant pas reçu.
Dans l'ECR, on a constaté une diminution relative du nombre total de jours/100 enfants en USI en raison du VRS; toutefois, la réduction n'était pas significative (DR=78 %, p = 0,80) Note de bas de page 56. Dans l'étude de cohorte, la DdS moyenne à l'USI est passée de 14,9 à 10 jours, sans que la différence soit significative Note de bas de page 57.
IV.4.2.3 Utilisation de la ventilation mécanique en raison du VRS
L'examen actualisé n'a trouvé aucune nouvelle étude portant sur ce résultat.
Dans l'examen initial de l'INESSS, l'ECR de Feltes et al. n'a pas trouvé de différence significative dans l'utilisation de la VM, signalée en nombre total de jours/100 enfants, entre les enfants atteints de la CPCHS et âgés de 24 mois ou moins au début de la saison du VRS qui ont reçu du PVZ et ceux qui ont reçu un placebo (DR=41 %, p = 0,282) Note de bas de page 56.
IV.4.2.4 Durée de l'oxygénothérapie en raison du VRS
L'examen actualisé n'a trouvé aucune nouvelle étude portant sur ce résultat.
Dans l'examen initial de l'INESSS, l'ECR de Feltes et al. a révélé que, comparativement au placebo, les enfants atteints de CPCHS et âgés de 24 mois ou moins au début de la saison du VRS qui ont reçu une prophylaxie au PVZ ont eu un nombre total de jours/100 enfants significativement moins élevé sous oxygénothérapie (DR=73 %, p = 0,014) Note de bas de page 56.
Ces résultats suggèrent que pour les enfants atteints de CPCHS hospitalisés en raison d'une infection par le VRS, le fait d'avoir reçu du PVZ n'a pas d'incidence sur la sévérité de la maladie, telle qu'elle se manifeste par la DdS à l'hôpital, l'admission et la DdS à l'USI, ou la nécessité de recourir à une VM, bien que le nombre d'études soit faible.
IV.4.3 Mortalité
L'examen actualisé n'a trouvé aucune nouvelle étude portant sur ce résultat.
Dans l'examen initial de l'INESSS, l'ECR de Feltes et al. et l'étude de cohorte de Harris et al. ont examiné la mortalité toutes causes confondues dans cette population Note de bas de page 56 Note de bas de page 57. Dans l'ECR, aucune différence significative n'a été notée dans la mortalité toutes causes confondues entre les enfants atteints de CPCHS et âgés de 24 mois ou moins au début de la saison du VRS qui ont reçu du PVZ par rapport aux receveurs de placebo (RR = 0,79, IC à 95 % : 0,45 à 1,38 %). Chez les enfants atteints de CPC nés à 36 sAG ou moins et âgés de 24 mois ou moins au début de la saison du VRS, l'étude de Harris et al. a signalé un décès dans le groupe sans intervention et aucun décès dans le groupe sous prophylaxie par PVZ. L'ECR a fait état de décès dus au VRS chez 2 des 639 receveurs du PVZ et 4 des 648 témoins (p = 0,46) Note de bas de page 56.
IV.5 Enfants résidant dans des communautés éloignées
IV.5.1 Hospitalisations associées au VRS
Aucune étude n'a été recensée dans l'examen actualisé de la littérature pour étudier l'EP et l'ER de la prophylaxie par PVZ chez les enfants vivant dans des communautés éloignées.
L'examen initial de la littérature de l'INESSS a recensé 2 études de cohorte de qualité faible qui ont examiné ce résultat Note de bas de page 58 Note de bas de page 59. L'étude de Banerji et al. portait sur des enfants inuits du Nunavut, au Canada, qui étaient nés à moins de 36 sAG et/ou qui présentaient une maladie cardiaque ou respiratoire importante et étaient âgés de moins de 6 mois au début de la saison du VRS. Les enfants qui ont reçu du PVZ ont eu significativement moins d'HVRS (2/91, 2,2 %) comparativement aux enfants admissibles au PVZ ne recevant aucune intervention (5/10, 50 %) [RC = 0,04, IC à 95 % : 0,008 à 0,26 %, p = 0,0005] Note de bas de page 58.
Comme tous les nourrissons admissibles au PVZ n'ont pas été recensés, le taux de réduction réel est probablement inférieur à celui signalé. Dans l'étude de Singleton et al., les HVRS ont été évaluées chez les enfants autochtones d'Alaska avant et après l'introduction d'un programme PVZ pour les nourrissons à haut risque. Il y avait une réduction significative des HVRS chez les nourrissons nés à 36 sAG ou moins (RR = 0,34, IC à 95 % : 0,17 à 0,68 %, p < 0.001).
Après l'introduction du programme PVZ, chez les nourrissons à haut risque, le taux de première HVRS était de 0,55 pour 1000 jours protégés par le PVZ et de 1,07 pour 1000 jours non protégés (taux relatif, 0,52; IC à 95 %, 0,28 à 0,93 %). Le NST pour prévenir une HVRS était de 3,4.
Bien que l'on sache que les enfants inuits résidant dans des communautés nordiques éloignées présentent un risque élevé d'HVRS Note de bas de page 59 Note de bas de page 60, les données sur l'ERP pour prévenir les hospitalisations dans ce groupe sont très limitées, et aucune donnée n'a été publiée sur les nourrissons à terme en bonne santé.
IV.6 Enfants atteints de fibrose kystique
IV.6.1 Hospitalisations associées au VRS
La revue actualisée de la littérature a recensé un examen systématique de bonne qualité Note de bas de page 17, qui comprenait 1 seul ECR multicentrique Note de bas de page 43 et 3 études d'observation rétrospectives de qualité passable Note de bas de page 24 Note de bas de page 25 Note de bas de page 41. L'étude de Cohen et al. n'a trouvé aucune différence significative dans les HVRS chez les enfants atteints de FK qui ont reçu soit une prophylaxie par PVZ, soit un placebo Note de bas de page 43. Cependant, il y a eu peu d'hospitalisations dans les 2 groupes (PVZ n=13; placebo n=14) et un (1) seul enfant dans chaque groupe a été hospitalisé en raison du VRS.
En revanche, l'étude de Groves et al. a révélé que les enfants qui n'avaient pas reçu de prophylaxie par PVZ présentaient un risque accru d'infection par le VRS et étaient beaucoup plus susceptibles de subir une HVRS que les enfants ayant reçu une prophylaxie par PVZ (21,3 % contre 4,4 %) Note de bas de page 24. Dans l'étude de Bjornson et al., le taux d'hospitalisation était de 2,7 % pour les receveurs du PVZ et de 6,0 % pour les témoins (p = 0,20).
Après ajustement des facteurs de confusion, le taux d'HVRS n'était toujours pas significativement inférieur chez les enfants ayant reçu du PVZ par rapport à ceux qui n'en avaient pas reçu. Cependant, le taux d'hospitalisation en raison d'une maladie respiratoire était significativement réduit chez les receveurs du PVZ, et le taux général de dépistage du VRS était faible, à 53 % Note de bas de page 25. Buchs et al., dans une étude cas-témoins, n'ont constaté aucune réduction significative des HVRS entre le groupe avec PVZ (5 %) et le groupe témoin (2,9 %) Note de bas de page 41.
L'examen initial de la littérature de l'INESSS a recensé 3 études qui ont examiné ce résultat. Un examen systématique de Robinson et al. jugé de bonne qualité, a recensé le même ECR multicentrique de Cohen et al. qui a été recensé dans l'examen systématique actualisé de Robinson en 2016 Note de bas de page 42. Les 2 autres études étaient des observations de cohorte de faible qualité Note de bas de page 61 Note de bas de page 62. Ces études d'observation ont révélé des avantages non significatifs de la prophylaxie par PVZ par rapport à l'absence d'intervention sur les HVRS ultérieures.
Les résultats de ces études ne permettent pas de tirer des conclusions définitives sur l'ERP pour réduire le risque d'HVRS chez les enfants atteints de FK. Seule l'étude d'observation de Groves et al. a trouvé un effet préventif significatif de la prophylaxie par PVZ sur les HVRS. Le taux d'HVRS dans le groupe témoin de cette étude était très élevé et le nombre de participants était faible.
IV.6.2 Autres résultats associés au VRS en matière d'hospitalisation
IV.6.2.1 Durée du séjour à l'hôpital en raison du VRS
Une étude recensée dans l'examen actualisé de la littérature a étudié l'effet du PVZ sur la durée de l'HVRS chez les enfants atteints de FK. La DdS moyenne était significativement moindre chez les receveurs du PVZ (5,7± 2,4 jours) que chez les témoins (47 ± 39 jours), p = 0,048 Note de bas de page 25.
L'examen initial de la littérature de l'INESSS a recensé une (1) étude de faible qualité qui a porté sur ce résultat Note de bas de page 61. La petite étude de cohorte historique (n=35-40 participants par groupe) d'enfants atteints de FK n'a pas trouvé de différence significative dans le nombre médian de jours d'HVRS chez les receveurs du PVZ (11, EIQ : 3 à 14) par rapport aux enfants recevant un placebo (13, EIQ : 2-14) [RC = 0,46, IC à 95 % : 0,16 à 1,31 %] Note de bas de page 61.
IV.6.2.2. Hospitalisation dans une unité de soins intensifs en raison du VRS
Dans l'examen actualisé de la littérature, une (1) étude a évalué ce résultat. Aucun des 183 receveurs du PVZ n'a été hospitalisé à l'USI en raison du VRS, tandis que 2 des 84 témoins l'ont été. Parmi les patients ayant été hospitalisés en raison du VRS, 2 des 5 patients du groupe témoin ont dû être admis à l'USI Note de bas de page 25.
IV.6.2.3 Utilisation de l'oxygénothérapie ou de la ventilation mécanique
L'étude de Cohen et al. recensée à la fois par l'examen initial de la littérature de l'INESSS et par l'examen actualisé de la littérature a analysé l'effet de la prophylaxie par PVZ sur l'utilisation de l'oxygénothérapie en raison du VRS chez les enfants atteints de FK. Aucune différence significative entre les groupes n'a été constatée en ce qui concerne la nécessité d'une oxygénothérapie; toutefois, le nombre de résultats était faible (groupe prophylaxie par PVZ, n=1; groupe placebo, n = 0) Note de bas de page 17. Dans l'étude de Bjornson, une assistance respiratoire accrue, qu'il s'agisse de VM ou d'oxygénothérapie, a été nécessaire pour 2,2 % des receveurs du PVZ et 1,2 % du groupe témoin (p = 0,58) Note de bas de page 25. Dans l'étude de Buchs, aucun patient n'a eu besoin d'oxygène supplémentaire ou de VM Note de bas de page 41.
IV.6.3 Mortalité toutes causes confondues
L'examen initial de la littérature de l'INESSS et l'examen actualisé ont tous deux recensé la même étude multicentrique ECR unique pourtant sur l'ERP pour réduire la mortalité toutes causes confondues chez les enfants atteints de FK Note de bas de page 43. Aucun décès n'a été recensé dans l'un ou l'autre groupe au cours des 6 mois de suivi de l'étude. Une autre étude n'a révélé aucune différence dans la mortalité toutes causes confondues au cours des 2 premières années de vie entre les enfants qui ont reçu ou non du PVZ Note de bas de page 26.
IV.6.4 Séquelles à long terme
IV.6.4.1 Fonction pulmonaire
L'examen actualisé de la littérature a recensé 2 études portant sur la fonction pulmonaire chez les enfants atteints de FK. Dans la petite étude de cohorte historique de Groves et al., aucune différence significative dans la fonction pulmonaire (évaluée par la mesure du VEM 1 ) entre les enfants atteints de FK qui avaient reçu ou non du PVZ n'a été constatée lors des évaluations de suivi à l'âge de 6 ans Note de bas de page 24. Une deuxième étude n'a trouvé aucune différence dans le VEM 1 à l'âge de 7 ans Note de bas de page 26. L'examen initial de la littérature de l'INESSS n'a pas recensé d'études examinant ce résultat.
IV.6.4.2 Paramètres de croissance
L'étude de Groves et al. n'a révélé aucune différence significative dans les paramètres de croissance (poids, taille, indice de masse corporelle) à l'âge de 6 ans entre les enfants qui avaient reçu ou non une prophylaxie par PVZ Note de bas de page 24. Cela est cohérent avec les résultats de l'étude de Cohen et al. recensée dans les examens initiaux et actualisés de la littérature, dans laquelle il n'y avait pas de différences significatives entre les groupes avec PVZ et placebo au suivi de 12 mois en ce qui concerne la prise de poids ou le rapport poids/taille Note de bas de page 43. L'étude cas-témoin de Buchs et al. n'a pas non plus trouvé de différence significative entre les receveurs du PVZ et les témoins en ce qui concerne la croissance au cours des 3 premières années de vie.
IV.6.4.3 Colonisation par P. aeruginosa et S. aureus
Dans l'examen actualisé de la littérature, l'étude de Cohen et al. n'a trouvé aucune différence statistiquement significative dans le nombre d'enfants présentant une colonisation des voies respiratoires par P. aeruginosa chez les enfants recevant du PVZ par rapport à ceux recevant un placebo après 12 mois de suivi Note de bas de page 43. Dans l'étude de Groves et al., le temps médian avant l'apparition d'un premier isolat de P. aeruginosa était significativement plus court chez les receveurs du PVZ que chez les non-receveurs et le RR d'apparition d'un premier isolat pendant la période d'étude était également significativement plus élevé chez les receveurs du PVZ.
Cependant, lors du suivi à l'âge de 6 ans, il n'y avait pas de différence significative entre les 2 groupes en ce qui concerne les taux de colonisation chronique par P. aeruginosa Note de bas de page 24. L'étude de Buchs et al. a signalé que la prophylaxie par PVZ n'avait aucun effet significatif sur l'âge de la première colonisation par P. aeruginosa ou S. aureus ni sur la proportion d'enfants colonisés par P. aeruginosa à l'âge de 3 ans. La proportion de nourrissons colonisés par S. aureus à l'âge de 3 ans était significativement plus élevée chez les receveurs du PVZ (97 %) que chez les témoins (85 %). Fink et al. n'ont signalé aucune différence dans l'âge de la première colonisation par P. aeruginosa chez les enfants qui ont reçu ou non du PVZ Note de bas de page 26.
Les résultats de ces études ne montrent aucune différence significative pour ce qui est des séquelles à long terme constatées entre les enfants atteints de FK ayant reçu une prophylaxie par PVZ et ceux n'en ayant pas reçu. Cependant, le nombre d'enfants étudiés est faible.
IV.7 Enfants atteints du syndrome de Down
IV.7.1 Hospitalisations associées au VRS
L'examen actualisé de la littérature a recensé 2 études sur la prophylaxie par PVZ chez les enfants atteints du SD. Une petite étude d'observation de cohorte de qualité passable a examiné l'effet de la prophylaxie par PVZ dans la réduction des HVRS chez les nourrissons atteints du SD et sans autres critères pour l'administration de PVZ. Le taux d'hospitalisation n'était pas significativement différent entre ceux qui ont reçu du PVZ et ceux qui n'en ont pas reçu, mais le nombre de patients dans chaque groupe était faible (PVZ n=33; contrôle n=60) Note de bas de page 35. La deuxième étude, de bonne qualité, a porté sur des enfants atteints du SD avec et sans comorbidités et n'a trouvé aucun effet significatif du PVZ chez les enfants sans comorbidités Note de bas de page 36.
L'examen initial de la littérature de l'INESSS a recensé une (1) seule étude de cohorte de qualité faible qui a porté sur l'ERP dans la réduction des HVRS Note de bas de page 63. Dans cette étude, des enfants âgés de moins de 24 mois et ayant reçu un diagnostic du SD ont été recensés à partir d'un registre canadien de PVZ et comparés à une cohorte d'enfants du même âge et diagnostiqués du SD recensés à partir d'un registre des naissances néerlandais (sans avoir reçu de PVZ).
Après ajustement en fonction de la CPCHS, de la CPC non significative, de l'AG et du poids à la naissance, l'analyse a révélé que, par rapport à l'absence d'intervention, la réception de PVZ était associée à une réduction statistiquement significative de 72 % des HVRS (ratio du taux d'incidence [RTI]=3,63, IC à 95 % : 1,52 à 8.67 %, p = 0.002). Une réduction significative des hospitalisations a également été constatée lorsque l'analyse a été restreinte aux enfants présentant au moins 1 critère de risque standard pour la prophylaxie du VRS (CPCHS, né à ≤35 sAG, MPC) [RTI 3,39 (1,02 à 11,25)].
Cependant, lorsque l'analyse a été restreinte aux enfants ne présentant aucun critère standard de risque lié au VRS, la différence en matière d'HVRS entre les enfants recevant une prophylaxie par PVZ et ceux ne recevant aucune intervention n'était pas significative (RTI=6,57 IC à 95 % : 0,70 à 62,16 %).
IV.7.2 Autres résultats associés aux VRS en matière d'hospitalisation
IV.7.2.1 Durée du séjour à l'hôpital en raison du VRS
L'étude de Yi et al. a révélé qu'il n'y avait pas de différence significative dans le nombre moyen de jours d'HVRS chez les receveurs du PVZ par rapport aux enfants ne recevant aucune intervention (6,4 contre 12,4 jours, p = 0,48) Note de bas de page 63.
IV.7.2.2 Admission et durée du séjour dans une unité de soins intensifs en raison du VRS
Dans l'étude de Yi et al., aucun des 532 enfants ayant reçu une prophylaxie par PVZ n'a été admis en USI, alors que chez les 233 enfants sans PVZ, il y a eu 4 admissions en USI pendant une moyenne de 10,3 jours. Les auteurs n'ont pas été en mesure de déterminer s'il y avait une différence significative dans le risque d'admission en USI et la DdS entre ces enfants et ceux qui n'ont reçu aucune intervention.
IV.7.2.3 Utilisation et durée d'utilisation de la ventilation mécanique en raison du VRS
Dans l'étude de Yi et al., aucun enfant ayant reçu une prophylaxie par PVZ n'a eu besoin d'une VM, alors que dans le groupe sans PVZ, 4 enfants ont eu besoin d'une VM pendant 10,3 jours en moyenne. Il n'a pas été possible de déterminer le risque de l'utilisation d'une VM et de sa durée entre ces enfants et ceux qui n'ont reçu aucune intervention.
IV.7.2.4 Utilisation et durée de l'oxygénothérapie en raison du VRS
L'étude de Yi et al. a révélé que les enfants ayant reçu une prophylaxie par PVZ avaient significativement moins eu besoin d'une oxygénothérapie complémentaire (2/532, 0,004 % contre 19/233, 0,08 %, p < 0,001) et un nombre moyen de jours d'utilisation de l'oxygénothérapie de ces enfants a également été inférieur (4 contre 13,7 jours, p = 0,046) par rapport à celui des enfants n'ayant pas reçu de PVZ.
La signification des résultats de ces études, l'une de qualité faible et l'autre portant sur un très petit nombre d'enfants, n'est pas claire, mais suggère que le PVZ peut ne pas être bénéfique aux enfants atteints du SD qui ne présentent pas d'autres affections pouvant justifier l'administration de PVZ. D'autres études sont nécessaires avant de pouvoir tirer des conclusions sur le bénéfice du PVZ pour cette population.
IV.8 Nombre de sujets à traiter
Une considération importante dans l'évaluation des études sur l'ERP est le NST (nourrissons) nécessaire pour éviter une hospitalisation, une admission à l'USI ou un décès. Le NST pour prévenir l'hospitalisation n'a été signalé que dans 3 études Note de bas de page 34 Note de bas de page 52 Note de bas de page 59. Il a été calculé pour toutes les études qui ont fourni suffisamment de données pour le faire s'il y avait un effet protecteur significatif du PVZ. Le NST pour prévenir l'hospitalisation, l'admission à l'USI ou la persistance d'une respiration sifflante pour diverses populations de patients dans les études signalées ci-dessus est présenté graphiquement dans la Figure 1 ci-dessous et sous forme de tableau dans l'Annexe G.
IV.8.1 Nombre de sujets à traiter pour prévenir l'hospitalisation
Dans les populations mixtes, le NST pour prévenir l'hospitalisation variait de 2 à 24 dans 8 estimations. Dans le seul ECR, une étude de 1996 portant sur des nourrissons âgés de 6 mois ou moins atteints de prématurité ou de moins de 24 mois atteints de MPC, le NST était de 18 (IC à 95 % : 11,3 à 35,7 %) Note de bas de page 38.
Quatre (4) estimations étaient de 10 ou moins, et 3 étaient de 4 ou moins. Le NST était de 3 dans une étude portant sur des nourrissons de 35 sAG ou moins ou atteints de MPC en Alaska Note de bas de page 59, 2 dans une étude portant sur les nourrissons de moins de 29 sAG avec ou sans MPC en Israël Note de bas de page 21 et 4 dans une étude sur les nourrissons de moins de 27 sAG avec ou sans MPC à Hong Kong Note de bas de page 30. Ces 3 études étaient de petite taille et présentaient des taux très élevés d'infection par le VRS dans les groupes témoins.
Le NST pour les prématurés sans MPC variait de 5 à 54 dans 11 estimations, dont 7 étaient de 17 ou moins. Les données de l'ECR Impact ont fourni un NST de 21 pour les nourrissons de 28 à 31 sAG, de 17 pour les 29 à 32 sAG, de 14 pour les 29 à 33 sAG, de 12 pour les 32 à 34 sAG et de 13 pour les 32-35 sAG Note de bas de page 37. Dans un ECR de 2009-2011 réalisé en Turquie chez des nourrissons de 28 sAG ou moins âgés de moins de 12 mois ou de 29 à 32 sAG âgés de moins de 6 mois, le NST était de 5.
Encore une fois, il s'agissait d'une petite étude avec un taux élevé de VRS chez les témoins Note de bas de page 48. Le NST était de 9 dans une étude réalisée en 2000-2004 sur les nourrissons de 30 sAG ou moins en France Note de bas de page 52. En revanche, le NST était de 54 dans une étude réalisée entre 2012 et 2014 sur des nourrissons de 29 à 32 sAG au Texas, qui utilisait des données provenant des bases de données Medicaid Note de bas de page 29.
Chez les enfants atteints de MPC, le NST dans 5 estimations variait de 3 à 21. Le NST était de 21 dans l'ECR Impact Note de bas de page 38. Tous les autres NST étaient de 13 ou moins, y compris un NST de 3 dans une petite étude réalisée en 1999-2002 en France sur des nourrissons de 32 sAG ou moins âgés de moins de 6 mois Note de bas de page 55.
Le NST pour les enfants atteints de CPCHS et âgés de moins de 24 mois était de 23 pour tous les cas et de 15 pour ceux atteints de CPC non cyanotique dans l'ECR 1998-2002 de Feltes et al. Note de bas de page 56. En revanche, dans une étude de cohorte menée de 2010 à 2016 sur des nourrissons âgés de moins d'un an à Taïwan, le NST était de 45 pour toutes les CPCHS et de 31 pour les CPC cyanotiques. Le NST était de 7 dans une étude portant sur des nourrissons de moins d'un an atteints de CPCHS en Argentine, où le taux de VRS est élevé chez les témoins Note de bas de page 34.
Dans une étude portant sur des nourrissons atteints du SD, avec ou sans autres comorbidités telles que la CPCHS, le NST était de 12 Note de bas de page 63. Dans la seule étude montrant que le PVZ était associé à une réduction des HVRS chez les nourrissons atteints de FK, une étude irlandaise réalisée entre 1997 et 2007, le NST était de 6. Le taux d'infection par le VRS dans le groupe témoin était très élevé.
Checchia et al. ont calculé le NST dans un examen systématique et une méta-analyse des données publiées jusqu'en 2007 Note de bas de page 45 . Le NST par PVZ pour éviter une (1) HVRS était de 11 (IC à 95 % : 8 à 259 %) pour les nourrissons atteints de MPC, de 16 (IC à 95 % : 14 à 20 %) pour tous les prématurés, de 14 (IC à 95 % : 13 à 16 %) pour les nourrissons de 32 sAG ou moins, de 18 (IC à 95 % : 15 à 35 %) pour ceux de 32 à 35 sAG et de 24 (IC à 95 % : 18 à 58 %) pour ceux de moins de 35 sAG, où il n'a pas été possible d'obtenir une distribution par AG plus poussée. Pour les nourrissons atteints de CPC, le NST était de 23 (IC à 95 % : 17 à 56 %).
IV.8.2 NST pour prévenir l'admission en soins intensifs
Le NST pour éviter une admission en USI pour VRS a été calculé pour 2 cas. Dans l'ECR Impact portant sur les nourrissons de 35 sAG ou moins et âgés de 6 mois ou moins ou sur ceux atteints de MPC âgés de moins de 24 mois, le NST était de 59, avec un IC à 95 % très large Note de bas de page 38. Dans une étude réalisée à Taïwan sur des nourrissons de 28 sAG ou moins ou de 35 sAG ou moins atteints de MPC, le NST pour prévenir l'admission à l'USI 6 mois après la sortie initiale était de 16 Note de bas de page 22.
IV.8.3 NST pour prévenir les sifflements récurrents
Pour prévenir 1 cas de respiration sifflante récurrente, le NST était compris entre 3 et 15 dans 10 estimations. Le NST pour prévenir la respiration sifflante au cours de la première année de vie chez les nourrissons en bonne santé de 33 à 35 sAG âgés de moins de 6 mois était de 11 dans un ECR de 2008-2010 Note de bas de page 49. Le NST de 3 pour prévenir la respiration sifflante au cours des 2 premières années de la vie provient d'une petite étude menée en Israël qui présentait un taux élevé de respiration sifflante dans le groupe témoin Note de bas de page 21. Le NST pour prévenir la respiration sifflante dans les 2 ans suivant la prophylaxie par PVZ variait de 8 à 15 dans différents groupes de sAG Note de bas de page 54. Chez les prématurés de moins de 36 sAG sans antécédents familiaux d'asthme ou d'atopie, le NST pour prévenir la respiration sifflante à l'âge de 2 à 5 ans était de 14 et 10, respectivement Note de bas de page 28. Le NST pour prévenir la respiration sifflante à l'âge de 3 ans et de 6 ans était de 8 et 7, respectivement, dans une étude japonaise Note de bas de page 27 Note de bas de page 53.
IV.8.4 NST pour prévenir la mortalité toutes causes confondues
Les données des études individuelles présentées dans cet examen ne permettent pas de calculer le NST pour prévenir la mortalité. Dans leur méta-analyse, Checchia et al. ont calculé le NST pour prévenir 1 décès (mortalité toutes causes confondues). Le NST était de 270 (IC à 95 % : 227 à 412 %) pour tous les prématurés et de 136 (IC à 95 % : 117 à 189 %) pour ceux de 32 sAG ou moins. Le NST pour les nourrissons de 32 à 35 sAG, les nourrissons atteints de MPC et les nourrissons atteints de CPC étaient, respectivement, de 987, de 1736 et de 113, mais l'IC à 95 % n'a pas pu être calculé.

Figure 1 : Texte descriptif
Cette figure est un « diagramme en boîte à moustaches » sommatif qui présente graphiquement la variation du nombre de personnes à traiter avec le PVZ pour prévenir l'hospitalisation, l'admission en soins intensifs et les sifflements récurrents pour diverses populations. L'information représente graphiquement le nombre nécessaire pour traiter et l'intervalle de confiance à 95 %.
Pour le résultat de la prévention de l'hospitalisation, il y a 31 études présentant le nombre nécessaire pour traiter et les intervalles de confiance à 95 %. Ces études sont regroupées en 6 groupes de population : population mixte, prématurés sans maladie pulmonaire chronique ou maladie cardiaque congénitale significative sur le plan hémodynamique, maladie pulmonaire chronique (MPC), cardiopathie congénitale, syndrome de Down et mucoviscidose.
Pour les populations mixtes, cela comprend : ≤ 35 sAG, âge ≤ 6 m ou BPD âge ≤ 24 m (18, 11,3-35,7), < 33 sAG ou 33-35 sAG avec MPC ou déchargé sur O2 et âge < 6 m (24, 13,9-74,4), ≤ 28 sAG âge < 12 m sans MPC (14, 8,3-32,4), 29-32 sAG < 6 m sans MPC (14, 10,8-18,1), ≤ 32 sAG, 32-35 sAG avec maladie chronique, ≤ 36 sAG avec maladie respiratoire significative en période néonatale, 1ère saison du VRS en Alaska (3, 2,1-8,9), < 29 sAG +/- BPD (2, 1,4-3,1), ≤ 28 sAG ou ≤ 35 sAG avec MPC, Appariement par score de propension (10, 6,2-23,7) et < 27 sAG +/- BPD (4, 2,2-29).
Pour les prématurés sans MPC, cela comprend : 28-31 sAG (21), 29-32 sAG (17, 8,9-93,6), ≤ 28 sAG âge < 12 m ou 29-32 sAG âge < 6 m, autrement en bonne santé (5, 2,7-8,9), 29-32 sAG sans maladie chronique (54, 27,9-547,6), 29-33 sAG (14, 8,3-43,6), ≤ 30 sAG sans BPD (9, 5.3-17,1), 32-34 sAG (12, 6,6-39,8), 32-35 sAG et ≤ 6 m sans BPD (22, 10,8-1246,3), 32-35 sAG (13, 7-42,4), 33-35 semaines < 6 m par ailleurs en santé (24, 13,5-103,4) et ≤ 35 sAG et ≤ 6 m sans BPD (16,10-37,6). Pour la population 28-31 sAG, intervalle de confiance inférieur à 95 % est de 10 et l'intervalle de confiance à 95 % pour la réduction du risque absolu s'étend d'un nombre négatif à un nombre positif.
Pour les MPC, cela comprend : MPC ≤ 24 m (21, 10,4-385,2), MPC < 24 m (8, 4,2-22,5), MPC sAG ≤ 32 âge < 6 m (3, 1,7-5,7), MPC ≤ 35 sAG VRS âge 6 m (13, 7-68,4), et MPC ≤ 28 sAG VRS âge 6 m (12, 6,3-56,6).
Pour les maladies coronariennes, cela comprend : MCV < âge 24 m (23, 13,8-65,3), MCV non cyanotique < âge 24 m (15, 8,9-41,3), hsMCV < âge 1 an (45, 23,6-327,2), MCV cyanotique < âge 1 an (31, 16-260,1), hsMCV âge < 1 an (7, 3,7-61,5).
Pour le syndrome de Down et la mucoviscidose, il n'existe qu'une seule étude chacun : pour le syndrome de Down (12, 8,1-22,7) et pour la mucoviscidose (6, 3,3-27,2).
Pour le résultat de la prévention de l'admission en soins intensifs, il existe deux études présentant le nombre nécessaire à traiter et les intervalles de confiance à 95 % avec les populations suivantes : ≤ 35 sAG, ≤ 6 m d'âge ou BPD ≤ 24 m d'âge (59, 29,8-1948,2) et ≤ 28 sAG ou ≤ 35 sAG avec MPC (16, 9,1-63,3).
Pour le résultat de la prévention des sifflements récurrents, il y a dix études présentant le nombre nécessaire pour traiter et les intervalles de confiance à 95 % avec les populations suivantes : ≤ 35 sAG sans MPC ou MCV pour prévenir les sifflements récurrents dans les 2 ans de la PVZ (13, 7-46,7), 32-35 sAG pour prévenir les sifflements récurrents dans les 2 ans de la PVZ (8, 5-17,2), 29-32 sAG pour prévenir les sifflements récurrents dans les 2 ans de la PVZ (10, 5.3-31,7), <29 sAG pour prévenir une respiration sifflante récurrente dans les 2 ans suivant la PVZ (15), < 36 sAG sans asthme F.H. pour prévenir une respiration sifflante récurrente dans les 2-5 ans suivant la PVZ (14, 7,3-117,1), < 36 sAG sans atopie F.H. pour prévenir une respiration sifflante récurrente dans les 2-5 ans de la PVZ (10, 5.2-36.9), < 29 semaines +/— BPD pour prévenir une respiration sifflante récurrente dans les 2 premières années de vie (3, 1.5-4.8), 33-35 sAG âge < 6 m autrement sain pour prévenir une respiration sifflante récurrente dans la première année de vie (11, 6-35.4), 33-35 ans sans MPC pour prévenir les sifflements récurrents à l'âge de 3 ans (8, 4,8-23,4), et 33-35 ans sans MPC pour prévenir les sifflements récurrents à l'âge de 6 ans (7, 3,6-19,2). Pour <29 sAG, l'IC inférieur à 95 % est de 4,1 et l'IC à 95 % pour la réduction du risque absolu passe d'un nombre négatif à un nombre positif.
Pour obtenir les détails des études, voir le Tableau 3 de l'Annexe G.
Manque de Données
Les données résumées dans ce rapport présentent des limites. Seules 5 des études recensées étaient des ECR, et les plus importantes d'entre elles ont été réalisées à la fin des années 1990. La charge de morbidité du VRS dans les groupes à haut risque a peut-être évolué depuis. La plupart des études étaient des observations de cohorte avec des témoins historiques, et les résultats peuvent avoir été influencés par les améliorations de la gestion de la prématurité et des CPC au fil du temps.
De nombreuses études ne comptaient qu'un petit nombre de participants et n'étaient peut-être pas suffisantes pour déceler des différences dans certains résultats, comme les admissions à l'USI ou les décès. Enfin, de nombreuses études ont été financées par les fabricants de PVZ, ce qui peut avoir influencé le choix des populations étudiées ou les questions posées.
Il a été démontré que le PVZ est bénéfique chez les prématurés de différents AG, mais il n'a pas été possible de déterminer s'il existe une ER différentielle selon le degré de prématurité.
Le bénéfice relatif du PVZ dans la prévention de l'infection par le VRS lors de la première saison du VRS de l'enfant par rapport à la deuxième n'a pas été étudié.
On ne connaît pas l'ER de la prophylaxie par PVZ chez les enfants atteints de troubles neuromusculaires graves affectant la fonction respiratoire, d'anomalies des voies aériennes supérieures affectant la fonction respiratoire ou de maladies pulmonaires chroniques autres que celles liées à la prématurité ou à la FK, ou chez les enfants immunodéprimés ou atteints de maladies métaboliques, ou encore chez les enfants en bonne santé issus de naissances multiples dont un jumeau ou un triplé est admissible au PVZ.
L'ER de la prophylaxie par PVZ pour prévenir l'asthme persistant plus tard dans la vie est inconnue, et le rôle du VRS dans le développement de l'asthme n'est pas clair.
L'ER de la prophylaxie par PVZ par le recours à d'autres calendriers posologiques (p. ex., moins de doses, intervalles d'administration plus longs, doses plus élevées) n'a pas été rigoureusement étudiée.
Conclusions
L'examen initial de la littérature de l'INESSS et l'examen actualisé du CCNI ont permis de recenser des études portant sur plusieurs catégories de sujets : populations mixtes de nourrissons, enfants nés prématurément sans MPC, prématurés atteints de MPC, nourrissons atteints de CPCHS, nourrissons nés dans des communautés nordiques éloignées, enfants atteints de FK et nourrissons atteints du SD. Le résultat le plus étudié est celui des HVRS.
- Dans des populations mixtes de nourrissons susceptibles de faire une infection sévère par le VRS, la prophylaxie par PVZ est associée à une réduction de 40 à 86 % du risque d'HVRS. Cependant, ces renseignements ne sont pas utiles pour déterminer les groupes à risque spécifiques pour lesquels une prophylaxie par PVZ pourrait être justifiée. Les résultats obtenus dans des populations mixtes n'indiquent pas que le PVZ a un effet important sur la DdS des nourrissons hospitalisés pour le VRS, mais il est possible qu'il soit insuffisant pour détecter un tel effet.
- Bien que les nombres soient faibles, il semble que, dans le cas d'une infection contractée par le VRS malgré l'administration du PVZ et nécessitant une hospitalisation, la sévérité de la maladie, telle qu'elle se manifeste par la nécessité d'une admission à l'USI, la DdS à l'USI et la nécessité d'une VM, n'est pas affectée par le PVZ. Les résultats sont contradictoires quant à l'effet de la PVZ sur la mortalité toutes causes confondues. Les décès liés au VRS ont été rares tant chez les receveurs du PVZ que chez ceux qui n'en ont pas reçu. La prophylaxie par PVZ peut réduire la respiration sifflante au cours des premières années de vie, mais n'a pas forcément d'effet significatif sur les résultats à plus long terme.
- Des données probantes soutiennent l'ERP dans la réduction des HVRS chez les enfants prématurés sans MPC, bien que le degré de prématurité auquel le PVZ est le plus efficace ne soit pas tout à fait clair. Les données suggèrent une ER de 72 à 80 % chez les nourrissons de 29 à 33 sAG, mais le PVZ pourrait ne pas être efficace chez les nourrissons plus prématurés; et les données sur les prématurés de plus de 33 sAG sont incohérentes. Le PVZ peut avoir un effet sur la mortalité toutes causes confondues chez les nourrissons nés à 32 sAG ou moins, mais pas à des niveaux moindres de prématurité (32 à 35 sAG).
- Cependant, ces résultats reposent sur un petit nombre d'études qui sont peut-être insuffisantes pour détecter une différence de mortalité chez les enfants moins prématurés. La prophylaxie par PVZ peut avoir un effet sur la réduction de l'incidence des sifflements récurrents chez les jeunes enfants au cours des premières années de vie, mais les résultats sont contradictoires quant à l'effet relatif de la prophylaxie par PVZ par rapport aux antécédents familiaux d'atopie sur la persistance des sifflements récurrents chez les enfants plus âgés.
- La prophylaxie par PVZ a réduit de 40 % le risque d'HVRS chez les nourrissons atteints de MPC dans un premier ECR, mais les données des études d'observation ultérieures sont incohérentes et n'identifient pas clairement un degré de prématurité qui en bénéficierait. Aucun effet n'a été observé sur la mortalité toutes causes confondues, mais le nombre de décès était très faible.
- Les études portant sur des nourrissons atteints de CPCHS montrent des résultats contradictoires quant à l'effet du PVZ sur l'HVRS, 2 études plus importantes montrant un effet et 2 études plus petites ne montrant aucun effet. Une (1) étude a montré une protection significative chez les enfants atteints de cardiopathie cyanotique uniquement, tandis qu'une (1) autre a montré un effet uniquement sur la CPC acyanotique. Pour les personnes admises en raison d'une infection par le VRS, le PVZ n'a pas eu d'incidence sur la DdS à l'hôpital, l'admission à l'USI, la DdS à l'USI ou la nécessité d'une VM. La mortalité toutes causes confondues n'était pas différente chez les personnes ayant reçu ou non du PVZ.
- La prophylaxie par PVZ a réduit de manière significative le risque d'HVRS chez les enfants inuits prématurés vivant au Nunavut et en Alaska, mais la qualité des études était faible et les données sont limitées.
- La plupart des études n'ont montré aucun effet de la prophylaxie par PVZ sur l'HVRS chez les nourrissons atteints de FK. Les résultats sont contradictoires en ce qui concerne l'effet sur la DdS et aucun effet sur l'admission à l'USI ou le recours à la VM ou à l'oxygénothérapie, mais très peu ont nécessité ces interventions. Le PVZ n'a pas non plus eu d'ER significative sur les résultats à long terme de la FK.
- Trois (3) études portant sur des enfants atteints du SD suggèrent que le PVZ pourrait ne pas être bénéfique aux enfants atteints du SD qui ne présentent pas d'autres affections à haut risque justifiant l'administration de PVZ, mais le nombre d'études était faible.
- Le NST pour prévenir une HVRS varie largement, influencé par la population de patients, le lieu, le nombre de participants et le taux d'HVRS chez les témoins. Le NST tendait à être le plus faible chez les nourrissons atteints de MPC et le plus élevé chez ceux atteints de CPCHS. Chez les prématurés sans MPC, les données d'un ECR indiquent un NST plus élevé avec l'augmentation du degré de prématurité, alors qu'une méta-analyse a montré le contraire.
- Les examens n'ont pas recensé d'études sur l'ERP par rapport au placebo ou à l'absence d'intervention chez les enfants atteints d'autres affections qui compromettent la fonction respiratoire ou la fonction immunitaire, ou qui peuvent les exposer à un risque accru d'infection grave par le VRS. Pour les affections plus rares, il est peu probable que des études sur l'ERP soient réalisables. Les considérations relatives à la prophylaxie par PVZ doivent être fondées sur la charge de la maladie par le VRS et l'extrapolation des avantages possibles à partir d'études menées dans d'autres populations.
Liste des abréviations
- AG
- Âge gestationnel
- AMSTAR
- Outil d'évaluation des examens systématiques
- CASP
- Programme de développement des compétences en évaluation critique
- CCNI
- Comité consultatif national de l'immunisation
- CPC
- Cardiopathie congénitale
- CPCHS
- Cardiopathie congénitale hémodynamiquement significative
- CVF
- Capacité vitale forcée
- DBP
- Dysplasie broncho-pulmonaire
- DdS
- Durée de séjour
- DR
- Diminution relative
- ECR
- Essai contrôlé randomisé
- EIQ
- Écart interquartile
- EIA
- Épreuve immuno-enzymatique
- ELISA
- Test immuno-enzymatique
- EP
- Efficacité potentielle
- ER
- Efficacité réelle
- ERP
- Efficacité réelle du palivizumab
- ETM
- Écart-type moyen
- É.-U.
- États-Unis
- FK
- Fibrose kystique
- GCI
- Guide canadien d'immunisation
- GT VRS
- Groupe de travail sur le VRS
- HVRS
- Hospitalisation associée au VRS
- IC
- Intervalle de confiance
- IgE
- Immunoglobuline E
- INESSS
- Institut national d'excellence en santé et en services sociaux
- MPC
- Maladie pulmonaire chronique due à la prématurité
- MPVh
- Métapneumovirus humain
- NST
- Nombre de sujets à traiter
- PVZ
- Palivizumab
- RCa
- Rapport de cotes ajusté
- RR
- Risque relatif (ou rapport de risque)
- RaR
- Réduction absolue du risque
- RRia
- Risque relatif instantané ajusté
- RRR
- Réduction du risque relatif
- RTI
- Ratio du taux d'incidence
- sAG
- Semaines d'âge gestationnel
- SD
- Symptôme de Down
- USI
- Unité de soins intensifs
- VEM 1
- Volume expiratoire maximal par seconde
- VM
- Ventilation mécanique
- VRS
- Virus respiratoire syncytial
Remerciements
Cette déclaration a été préparée par : D. Moore, R. Stirling, A Sinilaite, et approuvée par le CCNI.
Le CCNI tient à souligner la contribution de :
Membres du CCNI : S. Deeks (présidente), R. Harrison (vice-présidente), J. Bettinger, N. Brousseau, P. De Wals, E. Dubé, V. Dubey, K. Hildebrand, K. Klein, J. Papenburg, C. Rotstein, B. Sander, S. Smith et S. Wilson.
Anciens membres du CCNI : C. Quach (présidente)
Représentants de liaison : L.M. Bucci (Association canadienne de santé publique), E. Castillo (Société des obstétriciens et gynécologues du Canada), A. Cohn (Centers for Disease Control and Prevention, É.-U.), N. Dayneka, L. Dupuis (Association des infirmières et infirmiers du Canada), J. Emili (Collège des médecins de famille du Canada), D. Fell (Association canadienne de recherche et d'évaluation en matière de vaccination), M. Lavoie (Conseil des médecins hygiénistes en chef), D. Moore (Société canadienne de pédiatrie), M. Naus (Comité national de l'immunisation) et A. Pham-Huy (Association pour la microbiologie médicale et d'infectiologie Canada).
Anciens représentants de liaison :
Représentants d'office : D. Danoff (Direction des produits de santé commercialisés, Santé Canada), E. Henry (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI], ASPC), M. Lacroix (Groupe consultatif d'éthique en santé publique, ASPC), J. Pennock (CIMRI, ASPC), R. Pless (Direction des médicaments biologiques et radiopharmaceutiques, SC), G. Poliquin (Laboratoire national de microbiologie, ASPC), V. Beswick-Escanlar (Défense nationale et Forces armées canadiennes), et T. Wong (Direction générale de la santé des Premières Nations et des Inuits, SC).
Anciens représentants d'office :
Membres du groupe de travail sur le VRS du CCNI : D. Moore, R. Sterling, M. Salvadori, V. Dubey, J. Papenburg, J. Robinson, A. Sinilaite, M. Yeung, A. Sumner, S. Duschesne-Belanger, R. Pless, A. Killikelly, M. Tunis et M. L. Zhao.
Annexe A : Stratégie et résultats de recherche
Base(s) de données : Ovid MEDLINE(R) Epub Ahead of Print, In-Process & Other Non-Indexed Citations, Ovid MEDLINE(R) Daily, Ovid MEDLINE and Versions(R)
| N o | Recherches | Résultats |
|---|---|---|
1 |
Anticorps att., monoclonaux/ou agents antiviraux att./ou immunoglobulines att./ou (protéine d'anticorps ou agent antiviral* ou médicament antiviral* ou agent antiviral* ou médicament antiviral* ou substance antivirale ou antiviraux ou agent antiviral* ou médicament antiviral* ou anti-VRS ou anticorps clonal ou endobuline ou flebogamma ou flebogammadif ou gamastan ou gamimmune N ou gamimune ou gamma globuline* ou gamma-globuline* ou gammaglobuline* ou gammar ou gamuline ou globuman ou anticorps humanisé ou anticorps monoclonal humanisé ou anticorps d'hybridome ou Ig ou igam ou igc ou gammaglobuline ou immunoglobine ou immunoglobuline* ou immunoglobuline sérique* ou immuno gammaglobuline* ou immunogammaglobuline* ou immunoglobine* ou immunoglobuline* ou immunoprotéine* ou intragam ou intraglobine f ou isiven ou iveegam ou ivega ou AcM ou MEDI 493 ou anticorps monoclonaux ou anticorps monoclonal ou palivizumab ou panglobuline* ou immunisation passive ou sandoglobine* ou sandoglobuline* ou synagis ou tegelin* ou veinoglobuline* ou venoglobuline* ou inhibiteur viral ou agent virostatique* ou agent virucide* ou agent virulicide* ou vivaglobine).tw,kw,nm. |
1003897 |
2 |
infections par le virus respiratoire syncytial/pc |
1305 |
3 |
infections par le virus respiratoire syncytial/ou (vir* respiratoire syncytial* ou VRS*).tw. |
15925 |
4 |
prophylaxie/ou (contrôle ou protection de la santé ou immunoprophylaxie ou prévention ou mesures préventives ou médicament préventif ou thérapie préventive ou traitement préventif ou institution prophylactique ou gestion prophylactique ou médicament prophylactique ou thérapie prophylactique ou traitement prophylactique ou prophylaxie).tw. |
2563613 |
5 |
2 ou (3 et 4) |
3821 |
6 |
et/1,5 |
1597 |
7 |
Nourrisson att./ou enfant att./ou adolescent att/ou mineurs att./ou puberté att./ou pédiatrie att./ou écoles att./ou (nourrisson* ou petite enfance ou nouveau-né* ou bébé* ou bébés ou néonat* ou prématuré* ou prématur* ou postmatur* ou enfant ou enfants ou enfant d'âge scolaire* ou âge scolaire* ou préscolaire* ou enfant ou enfants ou tout-petit* ou adoles* ou ado* ou garçon ou garçons ou fille* ou mineurs* ou pubert* ou pubè* ou prépubè* ou pédiatrique* ou pédiatr* ou pédiatrie* ou garderie* ou matern* ou école primaire* ou école secondaire* ou école élémentaire*).tw. |
3841894 |
8 |
(lignes directrices comme sujet att./ou étude d'observation/ou étude comparative/ou lignes directrices pour la planification de la santé att./ou consensus att./ou « ;Revue de la littérature comme sujet; » att./ou voies critiques att./ou algorithmes att./ou méta-analyse comme sujet att./ou méta-analyse att./ou évaluation technologique, biomédicale att./ou (directive* ou ligne directrice* ou LDPC ou guidance ou guide pratique* ou paramètre de pratique* ou (best adj3 practice*) ou base de données probantes* ou consensus ou algorithme* ou (clinical adj3 pathway*) ou (critical adj3 pathway*) ou recommandation* ou étud* comparative* ou comparaison$ ou étud* non expérimentale ou étud* nonexpérimental ou étud* d'observation ou opinion de comité* ou énoncé de politique* ou énoncé de position* ou norme ou normes ou (systématique* adj3 (examen* ou vue d'ensemble* ou littérature ou recherche*) ou méta-analy* ou métaanaly* ou mét analy* ou métanaly* ou AEH ou évaluation de la technologie* ou aperçu de la technologie* ou analyse de la technologie*).tw.) pas (rapport de cas/ou éditorial/ou lettre/) |
4046816 |
9 |
et/6-8 |
359 |
10 |
(2015121* ou 2016* ou 2017*).dc. |
1615239 |
11 |
9 et 10 |
32 |
12 |
limite 11 à (anglais ou français) |
31 |
Base(s) de données : Embase
| N o | Recherches | Résultats |
|---|---|---|
1 |
agent antiviral/ou immunoglobuline/ou anticorps monoclonal/ou palivizumab/ou (abbosynagis ou protéine d'anticorps ou agent antiviral* ou médicament antiviral* ou agent antiviral* ou médicament antiviral* ou substance antivirale ou antiviraux ou agent antivirus* ou médicament antivirus* ou anti-VRS ou anticorps clonal ou endobuline ou flebogamma ou flebogammadif ou gamastan ou gamimmune N ou gamimune ou gammaglobuline* ou gamma immunoglobuline* ou gamma-globuline* ou gammage ou gammaglobuline* gammar ou gammimune ou gamulin ou globuman ou glovenin I ou anticorps humanisé ou anticorps monoclonal humanisé ou anticorps d'hybridome ou Ig ou igam ou igc ou immune gamma globuline ou immune globin* ou immune globulin* ou immune serum globulin* ou immuno gamma globulin* ou immuno globulin* ou immunogammaglobulin* ou immunoglobin* ou immunoglobulin* ou immunoprotéine* ou intragam ou intraglobine*f ou isiven ou iveegam ou ivega ou AcM ou MEDI493 ou MEDI 493 ou anticorps monoclonaux ou anticorps monoclonal ou palivizumab ou panglobuline* ou immunisation passive ou sandoglobine* ou sandoglobuline* ou synagis ou synagys ou tegelin* ou veinoglobuline* ou venoglobuline* ou inhibiteur viral ou agent virostatique* ou agent virucide* ou agent virulicide* ou répresseur de virus ou agent virustatique* ou vivaglobine).tw,kf. |
607418 |
2 |
infection par le virus respiratoire syncytial/pc |
605 |
3 |
infection par le virus respiratoire syncytial/ou (infection par le virus respiratoire syncytial* ou VRS*).tw. |
15757 |
4 |
prophylaxie/ou (contrôle ou protection de la santé ou immunoprophylaxie ou prévention ou mesures préventives ou médicament préventif ou thérapie préventive ou traitement préventif ou institution prophylactique ou gestion prophylactique ou médicament prophylactique ou thérapie prophylactique ou traitement prophylactique ou prophylaxie).tw. |
3294079 |
5 |
2 ou (3 et 4) |
4066 |
6 |
et/1,5 |
1602 |
7 |
Nourrisson att./ou enfant att./ou adolescent att/ou mineurs att./ou puberté att./ou pédiatrie att./ou écoles att./ou (nourrisson* ou petite enfance ou nouveau-né* ou bébé* ou bébés ou néonat* ou prématuré* ou prématur* ou postmatur* ou enfant ou enfants ou enfant d'âge scolaire* ou âge scolaire* ou préscolaire* ou enfant ou enfants ou tout-petit* ou préado* adoles* ou ado* ou garçon ou garçons ou fille* ou mineurs* ou pubert* ou pubè* ou prépubè* ou pédiatrique* ou pédiatr* ou pédiatrie* ou garderie* ou matern* ou école primaire* maternel* ou école primaire* ou école secondaire* ou école élémentaire*).mp. |
3972676 |
8 |
(lignes directrices att./ou planification des soins de santé/ou consensus/ou algorithme/ou revue systématique/ou examen systématique (sujet)/méta-analyse (sujet)/ou évaluation de la technologie biomédicale/ou étude biomédicale att./ou étude observationnelle/ou étude comparative/ou directive* ou ligne directrice* ou LDPC ou guidance ou guide pratique* ou paramètre de pratique* ou (best adj3 practice*) ou base de données probantes* ou consensus ou algorithme* ou (clinical adj3 pathway*) ou (critical adj3 pathway*) ou recommandation* ou opinion de comité* ou énoncé de politique* ou énoncé de position* ou norme ou normes ou (systématique* adj3 (examen* ou vue d'ensemble* ou littérature ou recherche*) ou méta-analy* ou métaanaly* ou mét analy* ou métanaly* ou AEH ou évaluation de la technologie* ou aperçu de la technologie* ou analyse de la technologie*) ou étud* comparative ou comparaison ou étud* non comparative ou étud* noncomparative ou étud* observation*).tw pas (rapport de cas/ou éditorial/ou lettre/) |
4142791 |
9 |
et/6-8 |
466 |
10 |
(2015121* ou 2016* ou 2017*).dc. |
1992030 |
11 |
et/9-10 |
57 |
12 |
limite 11 à (anglais ou français) |
56 |
Annexe B : Niveau de données probantes selon la méthodologie de la recherche et de la cote de qualité des données probantes (validité interne)
Tableau 1 : Niveaux de données probantes selon la méthodologie de recherche
I |
Données probantes provenant d'un ou de plusieurs essais contrôlés randomisés. |
II-1 |
Données probantes provenant d'un ou de plusieurs essais contrôlés sans randomisation. |
II-2 |
Données probantes obtenues au moyen d'études analytiques de cohorte ou cas-témoins, réalisées de préférence dans plus d'un centre ou par plus d'un groupe de recherche utilisant des indicateurs cliniques de résultats de l'efficacité potentielle du vaccin. |
II-3 |
Données probantes obtenues à partir de plusieurs séries chronologiques avec ou sans intervention. Les résultats spectaculaires obtenus dans un contexte non contrôlé (comme les résultats de l'introduction de la pénicilline dans les années 1940) pourraient aussi être considérés comme faisant partie de ce type de données probantes. |
III |
Opinions d'autorités respectées fondées sur des expériences cliniques, études descriptives et rapports de cas ou rapports de comités d'experts. |
Tableau 2 : Définition de la qualité globale de l'étude
Bonne |
Une étude (y compris les méta-analyses ou les examens systématiques) qui répond bien à tous les critères relatifs à la méthodologie*. |
Passable |
Une étude (y compris les méta-analyses ou les examens systématiques) qui ne répond pas (ou ne répond pas clairement) a au moins l'un des critères relatifs à la méthodologie, mais ne comportant aucune « ;lacune fatale; » connue. |
Faible |
Une étude (y compris les méta-analyses ou les examens systématiques) ayant au moins une « ;lacune fatale; » propre à la méthodologie ou une accumulation de lacunes moins importantes ne permettant pas de formuler des recommandations à partir des résultats de l'étude. |
* Les critères généraux propres à la méthodologie sont décrits dans l'article de Harris et al., 2001, avec des modifications très mineures.
Annexe C : Évaluation de la qualité de l'examen systématique initial de la littérature de l'INESSS par Amstar
| Évaluation de la qualité de l'examen systématique initial de la littérature de l'INESSS par AMSTAR | ||||
|---|---|---|---|---|
| Critères d'AMSTAR | Oui | Non | Je ne peux pas répondre | S.o. |
1. Un plan « ;a priori; » a-t-il été fourni? |
X |
|||
2. La sélection des études et l'extraction des données ont-elles été effectuées en double? |
√ |
|||
3. Une recherche complète de la littérature a-t-elle été effectuée? |
√ |
|||
4. Le statut de la publication (c.-à-d. la littérature grise) a-t-il été utilisé comme critère d'inclusion? |
√ |
|||
5. Une liste des études (incluses et exclues) a-t-elle été fournie? |
√ |
|||
6. Les caractéristiques des études incluses ont-elles été fournies? |
√ |
|||
7. La qualité scientifique des études incluses a-t-elle été évaluée et consignée? |
√ |
|||
8. La qualité scientifique des études incluses a-t-elle été utilisée de manière appropriée dans la formulation des conclusions? |
√ |
|||
9. Les méthodes utilisées pour combiner les résultats des études étaient-elles appropriées? |
X |
|||
10. La probabilité d'un biais de publication a-t-elle été évaluée? |
X |
|||
11. Le conflit d'intérêts a-t-il été inclus? |
X |
|||
Total (sur 10) |
7 |
|||
Annexe D : Organigramme de Prisma
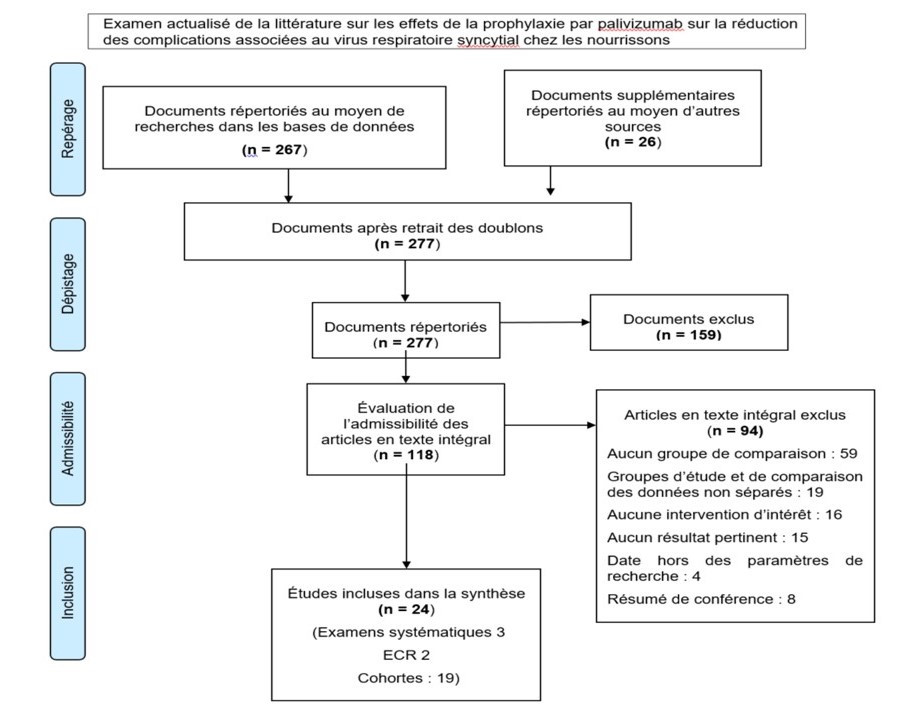
Annexe D : Texte descriptif
Le diagramme de flux PRISMA décrit le processus par lequel les articles ont été sélectionnés pour la revue de la littérature sur l'effet de la prophylaxie par PVZ sur la réduction des complications associées au VRS chez les nourrissons. Le processus se décompose en quatre étapes : Identification, dépistage, éligibilité et inclusion.
Étape 1 : Identification
- 267 enregistrements ont été identifiés par la recherche dans la base de données du 1er février 2017 au 12 avril 2019 et à nouveau pour les publications d'avril 2019 au 29 juillet 2020, 26 enregistrements ont été identifiés par une recherche manuelle.
- il restait 277 enregistrements après la suppression des doublons.
Étape 2 : Dépistage
- 277 enregistrements ont ensuite été examinés.
- Sur ces 277 enregistrements, 159 ont été exclus.
Étape 3 : Admissibilité
- 118 articles complets ont été évalués pour leur éligibilité.
- Sur ces 118 articles complets, 94 ont été exclus. La répartition des exclusions est la suivante : 59 n'avaient pas de groupe de comparaison, 19 l'étude des données et les groupes de comparaison n'étaient pas séparés, 16 n'incluaient pas l'intervention d'intérêt, 15 n'incluaient pas de résultats pertinents, 4 étaient en dehors de la plage de dates et 8 étaient des résumés de conférence.
Étape 4 : Inclus
- 24 articles ont été inclus.
3 revues systématiques.
Annexe E : Résumé des données probantes issues de l'examen actualisé de la littérature de l'INESSS concernant l'efficacité potentielle et réelle de la prophylaxie par palivizumab chez les nourrissons et les enfants
Ordre des références : Examens systématiques, par qualité, puis par ordre alphabétique. Études individuelles, par niveau de données probantes, puis la qualité, puis par ordre alphabétique
| Détails de l'étude | Résumé | ||||
|---|---|---|---|---|---|
| Étude | Plan de l'étude | Participants | Résumé des principaux résultats | Niveau de données probantes | Qualité |
Kua et Lee 2017 Note de bas de page 18 Non financée ou parrainée |
Examen systématique des essais contrôlés randomisés (ECR) et des études d'observation jusqu'au 31 janv. 2017 Efficacité réelle du palivizumab (ERP) dans la réduction de l'incidence des hospitalisations liées au virus respiratoire syncytial (HVRS) |
Nourrissons et enfants âgés de ≤2 ans atteints de fibrose kystique (FK) (3891 participants) |
Pour les examens systématiques sans méta-analyse, les études individuelles répondant aux critères d'inclusion pour l'examen actualisé de la littérature sont présentées séparément dans ce tableau ou dans l'Annexe F, par auteur. Voir ailleurs dans ce tableau ou à l'Annexe F les résultats des études suivantes : Bjornson et al. 2015 (résumé de la conférence; remplacé par la publication) Cohen et al. 2005 5 études exclues, car ne répondant pas aux critères (aucun groupe de comparaison ou données insuffisantes) (Données de l'examen systématique non utilisées) |
Pas d'évaluation selon les méthodes du Conseil consultatif national d'immunisation (CCNI) |
Bonne (évaluée à l'aide d'AMSTAR) |
Robinson et al. 2016 Note de bas de page 17 Financement : Cystic Fibrosis Foundation aux États-Unis (É.-U.), NIHR au Royaume-Uni (R.-U.) |
Examen systématique d'ECR (un ECR trouvé) Multicentrique É.-U. (40 centres) 1998-2001 Prophylaxie par palivizumab (PVZ) contre l'absence d'intervention ou placebo. Injections mensuelles de 15 mg/kg pendant les 5 mois d'une saison de VRS Hospitalisations, mortalité et événements indésirables évalués jusqu'à 6 mois après le début de l'étude État nutritionnel, nombre de cas de colonisation par P. aeruginosa et besoin d'oxygénothérapie évalués jusqu'à 12 mois après le début de l'étude La méthode de diagnostic du virus respiratoire syncytial (VRS) n'est pas précisée |
Enfants atteints de FK âgés de ≤24 mois (n=186) Âge moyen : 12,8 mois (0,4 à 24,4) PVZ : n=92 Placebo : n=94 |
Résultats primaires :
|
Pas d'évaluation selon les méthodes du CCNI |
Bonne (évaluée à l'aide d'AMSTAR [outil d'évaluation des examens systématiques]) Aucune mention explicite d'un plan d'étude a priori Une (1) seule étude non publiée a été recensée (présentation à une conférence, résumé disponible) Méthodes pour combiner les résultats et évaluation du biais de publication ne s'appliquent pas |
Simoes et al. 2018 Note de bas de page 19 Financement : AbbVie |
Examen systématique des études réalisées entre le 1 janv. 1995 et le 31 déc. 2017 Efficacité réelle (ER) des agents de la prophylaxie pour l'infection par le VRS |
Nourrissons et enfants de ≤18 ans Prophylaxie par PVZ : (15 407 participants) |
Pour les examens systématiques sans méta-analyse, les études individuelles répondant aux critères d'inclusion pour l'examen actualisé de la littérature sont présentées séparément dans ce tableau ou dans l'Annexe F, par auteur. Voir ailleurs dans ce tableau ou à l'Annexe F les résultats des études suivantes : Anderson et al. 2017 36 études exclues, car ne répondant pas aux critères (aucun groupe de comparaison ou données insuffisantes) (Données de l'examen systématique non utilisées) |
Aucune évaluation selon les méthodes du CCNI |
Moyenne (évaluée à l'aide d'AMSTAR) |
Notario et al. 2014 Note de bas de page 37 Soutenue par AbbVie Inc. |
ECR Multinationale Multicentrique (Canada : 9; R.-U. : 11; É.-U. : 119) Saison du VRS 1996-1997 PVZ contre placebo pour la prévention de l'HVRS Analyse post-hoc des données de l'étude IMpact-RSV 1998 Note de bas de page 38 PVZ 15 mg/kg par mois x 5 doses VRS diagnostiqué par un test antigénique |
Nourrissons prématurés nés à ≤35 semaines d'âge gestationel (sAG) et âgés de ≤6 mois sans maladie pulmonaire chronique due à la prématurité (MPC) PVZ : (n=494) Placebo : (n=230) |
Caractéristiques de base similaires pour les 2 groupes dans toutes les catégories d'âge gestationnel (AG). Incidence des HVRS pour les groupes de traitement avec PVZ contre placebo stratifiés par AG. Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) Placebo (n=230) PVZ (n=494) n/N = nombre d'hospitalisés/nombre dans le groupe. RRR, réduction du risque relatif avec le PVZ par rapport au placebo * Différence significative (p < 0,05). RRR significative dans les groupes de 28 à 31, 29 à 32, 29 à 33, 32 à 34 et 32 à 35 sAG |
I |
Bonne |
Scheltema et al. 2018 Note de bas de page 39 Financement : Abbvie |
ECR Multicentrique Pays-Bas 15 sites 2 saisons de VRS (2008 à 2010) PVZ contre placebo (15 mg/kg tous les 30 jours; total de 5 doses) Suivi à 6 ans pour l'asthme actuel et la fonction pulmonaire |
Enfants nés de 32 1/7 à 35 sAG et autrement en bonne santé, âgés de 6 mois au début de la saison du VRS Receveurs du PVZ (n=214) [suivi à 6 ans : n=199] Receveurs du placebo (n=215) [suivi à 6 ans : n=196] |
État à l'âge de 6 ans : Asthme actuel déclaré par les parents* PVZ : 14,1 % État à l'âge de 6 ans : Médicaments contre l'asthme PVZ : 9,0 % État à l'âge de 6 ans : Respiration sifflante PVZ : 11,6 % État à l'âge de 6 ans : Respiration sifflante peu fréquente (1 à 3 épisodes par année) PVZ : 6,0 % État à l'âge de 6 ans : Asthme diagnostiqué par un médecin au cours des 12 derniers mois PVZ : 10,3 % État à l'âge de 6 ans : VEM 0,5 % prédit † à l'âge de 6 ans PVZ : 89,1 (10,6) * Respiration sifflante ou utilisation de médicaments contre l'asthme au cours des 12 derniers mois VEM 0 , 5 = Volume expiratoire maximal en 0,5 seconde. † = Moyenne (déviation standard [DS]) Le VEM 0,5 , VEM 1 , VEM 25 à 75, rapport VEM, VEM 1 et rapport CVF étaient similaires dans les groupes avec PVZ et placebo, tout comme le VEM 0,5 et les autres résultats de la fonction pulmonaire après l'administration d'un bronchodilatateur. Le PVZ n'a eu aucun effet majeur sur l'asthme actuel ou la fonction pulmonaire à l'âge scolaire. |
1 |
Passable PVZ et placebo visuellement différents au moment de l'administration Parents à l'insu après la 1 année de suivi |
Kimura T et al. 2020 Note de bas de page 36 Source de financement non précisée |
Étude de cohorte rétrospective Multicentrique Japon; demandes de remboursement de frais médicaux provenant de la base de données du JMDC (Tokyo, Japon) 1 période : 2007 à 2012 2 période : 2013 à 2015 PVZ ≥1 dose enregistrée; quantité non précisée par rapport à l'absence de prophylaxie Diagnostic du VRS par les codes ICD-10 |
Enfants âgés de £24 mois atteints du syndrome de Down (SD) Critères élargis pour l'admissibilité des PVZ 2013 1 période n=268 PVZ n=81 Âge médian (écart interquartile [EIQ]), mois : 6 (3 à 13) Hommes (46 %) Absence de prophylaxie n=187 Âge médian (EIQ), mois : 13 (6 à 18) Hommes (56 %) 2 période n=364 PVZ n=303 Âge médian (EIQ), mois : 10 (4 à 16) Hommes (53 %) Absence de prophylaxie n=61 Âge médian (EIQ), mois : 16 (12-22) Hommes (57 %) |
Proportion de patients atteints d'affections particulières recevant du PVZ Population cible : Ensemble de la population 1 période : 81/268 (30 %) Population cible : Cardiopathie congénitale (CPC) 1 période : 79/184 (43 %) Population cible : Prématuré 1 période : 7/18 (39 %) Population cible : MPC 1 période : 0/0 (0 %) Population cible : Immunodéficience 1 période : 4/19 (21 %) Population cible : Anomalies du système respiratoire 1 période : 11/21 (52 %) Population cible : Hémopathies malignes ou tumeurs solides 1 période : 0/11 (0 %) Population cible : Antécédents d'hospitalisation pour infection respiratoire 1 période : 15/46 (33 %) HVRS chez enfants atteints SD avec ou sans PVZ Ensemble de la population PVZ : 12/384 (3 %) Nourrissons sans CPC PVZ : 1/94 (1 %) Nourrissons sans facteurs de risque supplémentaires PVZ : 1/53 (2 %) Lors de l'analyse de l'ensemble de la population étudiée, les facteurs suivants ont été inclus dans les modèles en tant qu'effets fixes : naissance prématurée et CPC. Lors de l'analyse des nourrissons atteints du SD sans CPC, le facteur suivant a été inclus dans les modèles en tant qu'effet fixe : la prématurité. Lors de l'analyse des nourrissons atteints du SD sans facteurs de risque supplémentaires, seuls les RC bruts dérivés des modèles de régression logistique à effets mixtes sont signalés, car aucun nourrisson de cette population ne présentait une affection de confusion définie (naissance prématurée et CPC). Conclusion : L'administration de PVZ a été associée à une réduction de l'HVRS chez les enfants atteints du SD, mais pas dans les sous-groupes sans cardiopathie congénitale hémodynamiquement significative (CPCHS) ou sans facteurs de risque d'infection sévère par le VRS. |
II-2 |
Bonne |
Simoes et al., 2010 Note de bas de page 28 Source de financement : Abbott |
Cohorte prospective Multicentrique Europe (Espagne, Allemagne, Pays-Bas, Pologne, Suède) et Canada (27 sites) 2001-2002 Prophylaxie par PVZ contre l'absence d'intervention Dose de PVZ non précisée Le groupe traité a été apparié au groupe combiné non traité en fonction des sAG (<28, 28 à 32, 29 à 35) et de l'âge (±3 mois) Méthode de diagnostic du VRS non précisée |
Enfants âgés de ≤36 mois à l'inscription et nés prématurément (<36 sAG) sans MPC (n=420) Âge moyen : 19 (1 à 40) mois Groupe traité : Enfants qui avaient reçu du PVZ au cours d'une saison respiratoire précédente et qui n'ont pas subi une HVRS (n=190) Groupe combiné non traité : Enfants n'ayant jamais reçu de PVZ (n=230) Aucun antécédent d'HVRS (n=154) HVRS consignée dans l'année précédant l'inscription (n=76) Critères d'exclusion : enfants sous ventilation mécanique (VM) au moment de l'inscription potentielle, espérance de vie de <6 mois, ou immunodéficience connue |
Résultat primaire
† Covariables ajustées dans la régression logistique multiple : âge, sexe, âge à l'inscription, AG à la naissance, poids à la naissance, état de naissance multiple, titres de référence des anticorps neutralisant le VRS, fréquentation de la garderie, nombre d'adultes et de frères et sœurs à la maison, nombre de frères et sœurs à la garderie, présence d'un poêle à bois à la maison et antécédents familiaux d'asthme, de dermatite atopique, de rhinite allergique ou d'allergies alimentaires Définitions : **Respiration sifflante récurrente diagnostiquée par un médecin : 3 épisodes de respiration sifflante ou plus au cours des 12 derniers mois, vérifiés par un médecin lors d'une consultation, d'une consultation au service des urgences ou d'une hospitalisation (épisode de respiration sifflante : 1 ou plusieurs jours consécutifs de respiration sifflante précédés et suivis d'une période saine sans respiration sifflante d'au moins une [1] semaine) #Antécédents familiaux d'atopie : antécédents d'asthme, de dermatite atopique ou de rhinite allergique |
Niveau II-2 |
Bonne Certains nourrissons pourraient avoir un résultat primaire avant l'inscription, mais cela s'appliquerait aux groupes d'intervention et de non-intervention Le petit nombre de nourrissons par sous-groupe pourrait limiter la capacité à trouver des différences statistiquement significatives entre les groupes |
Anderson et al. 2017 Note de bas de page 40 Parrainée par MedImmune |
Étude cas-témoins avec test négatif Multinationale Multicentrique (É.-U., Canada) Nombre de sites non précisé Nov.-avril 2002-2006 ERP pour prévenir l'HVRS : Probabilité de l'administration de PVZ dans les 30 jours précédant l'admission entre les cas de VRS et les témoins VRS diagnostiqué par réaction en chaîne de la polymérase (PCR) |
Enfants atteints de CPCHS ou de MPC à <24 mois ou nés à ≤35 sAG et âgés de ≤12 mois hospitalisés pour une infection des voies respiratoires inférieures (IVRI) aigüe 849 inscrits : Cas 403 446 témoins 434 ont reçu PVZ |
Cas : 403 VRS positifs. 150 ont reçu du PVZ (37,2 %) Témoins : 446 VRS négatifs. 284 ont reçu du PVZ (63,8 %) ERP non ajustée pour prévenir les hospitalisations : Pondération inverse du score de propension (PISP) créée à l'aide de facteurs de risque connus pour l'HVRS. Modèle de régression logistique multiple de la PISP utilisé pour ajuster l'ERP. ERP ajustée pour prévenir l'hospitalisation : ERP ajustée pour prévenir l'admission à l'unité de soins intensifs (USI) : L'ERP n'a pas été observée pour la VM : Analyse de sous-groupe Groupe d'étude : Nourrissons prématurés de 29-35 sAG sans CPCHS ou MPC et âgés de <6 mois Groupe d'étude : Nourrissons prématurés <29 sAG sans CPCHS ou MPC et âgés de <6 mois Groupe d'étude : Nourrissons prématurés âgés de <6 mois sans CPCHS ou MPC Groupe d'étude : Nourrissons prématurés âgés de 3 à <6 mois sans CPCHS ou MPC Groupe d'étude : Enfants atteints d'une CPCHS (pouvant inclure une MPC) et âgés de <12 mois au 1 novembre Groupe d'étude : Enfants atteints d'une CPCHS (peut inclure le MPC) et âgés de 12 à <24 mois au 1 novembre Groupe d'étude : Enfants atteints de MPC (sans CPCHS) et âgés de <12 mois au 1 novembre Groupe d'étude : Enfants atteints de MPC (sans CPCHS) et âgés de 12 à <24 mois au 1 novembre L'ERP n'a pas été observée dans le groupe de <29 sAG sans MPC, mais les nombres étaient faibles. L'ERP non observée dans les groupes avec MPC ou CPCHS. Le PVZ n'a pas eu d'efficacité significative contre l'hospitalisation en raison d'un métapneumovirus humain (testé pour contrôler le biais de l'étude) : ERP 34,7 % (IC à 95 % : -12,9 à 62,2 %). |
II-2 |
Passable |
Bjornson et al. Financée par AbbVie |
Cohorte d'observation rétrospective comparative Multicentrique Alberta, dans toute la province (2 centres) 2000 à 2017 PVZ contre l'absence de traitement pour prévenir l'HVRS (examen des dossiers médicaux) Dose de 15 mg/kg de PVZ par mois VRS diagnostiqué par PCR, test immuno-enzymatique (ELISA), test d'immuno-fluorescence (TIF) ou culture virale |
267 enfants de < 2 ans atteints de FK 183 receveurs du PVZ 84 sans intervention Moyenne 4,4 ± 1,5 injections PVZ |
HVRS : Résultat : Nombre de patients admis pour le VRS Résultat : Admissions pour le VRS Résultat : Durée de séjour (DdS) totale (jours) a Résultat : Admission à l'USI (% des admissions) b Résultat : DdS à l'USI (jours) a Résultat : Assistance respiratoire (VM ou oxygène supplémentaire) [% des admissions] c Résultat : Durée de l'assistance respiratoire (jours) a a moyenne ± DS b sur l'ensemble des cohortes, 0 % des receveurs du PVZ et 2,4 % des témoins ont dû être admis à l'USI (p > 0,05) c. sur l'ensemble des cohortes, 2,2 % des receveurs du PVZ et 1,2 % des témoins ont dû recourir à une assistance respiratoire (p = 0.58) Les receveurs du PVZ sont nés à un AG significativement plus jeune, avaient un poids de naissance plus faible, étaient moins susceptibles d'avoir des frères et sœurs, et étaient plus susceptibles de naître entre novembre et janvier. Après ajustement pour tenir compte des facteurs de confusion susmentionnés, la cohorte avec PVZ n'a pas présenté une diminution du risque d'HVRS(Exp[B] = 0,43 [0,10-1,80], p = 0,25). 26 (14,2 %) dans le groupe avec PVZ et 29 (34,5 %) dans le groupe témoin ont été hospitalisés pour une maladie respiratoire. Après ajustement pour les facteurs de confusion (Exp(B) = 0,23 [0,11-0,49], p < 0,0005). |
II-2 |
Passable Faible taux général de dépistage du VRS (53 % de l'ensemble); les taux de dépistage dans les groupes de receveurs du PVZ et les groupes témoins ne sont pas précisés |
Blake et al., 2017 Note de bas de page 20 Source de financement : non précisée |
Cohorte rétrospective Centre unique Caroline du Nord Pouponnières de soins intensifs (niv. IV) et de soins spéciaux (niv. II) – seule institution 2012-2016 Prophylaxie par PVZ contre l'absence d'intervention (dans l'analyse de la cohorte entière) Dose de PVZ non précisée Saisons du VRS déterminées avec données de surveillance au niveau national, régional et de l'État Test de dépistage du VRS à l'admission avec des symptômes respiratoires La méthode de diagnostic du VRS non précisée (renvoie aux « ;tests de VRS; ») |
Cohorte entière : nourrissons de 29 à <32 sAG et nés d'oct. 2012 à mars 2016 AVANT cohorte (sortie du 1 oct. 2012 au 30 avril 2013 ou du 1 oct. 2013 au 30 avril 2014) (n=98) APRÈS cohorte (sortie du 1 oct. 2014 au 30 avril 2015 ou du 1 oct. 2015 au 31 mars 2016) [n=75] Critères d'exclusion : nourrissons décédés lors de l'admission initiale; résultats survenant après la saison locale du VRS; résultats non associés au diagnostic respiratoire primaire |
Résultats primaires
Un plus grand nombre de nourrissons ne recevant aucune intervention avaient tendance à être positifs au VRS lors de l'hospitalisation pour symptômes respiratoires (p = 0,09). NST signalé comme 20. (3a) DdS à l'hôpital (pour admissions uniquement). Parmi les nourrissons (n=4) dont le test VRS était positif à l'admission, ceux qui n'ont bénéficié d'aucune intervention (n=3) ont eu tendance à avoir une DdS plus longue que le nourrisson (n=1) exposé au PVZ (14,9 contre 2 jours, p = 0,08). |
Niveau II-2 |
Passable Les comorbidités (p. ex., MPC, CPC, FK) ayant un effet potentiel sur les résultats du VRS ne sont pas décrites L'analyse ne tient pas compte des facteurs de confusion potentiels Conformité PVZ non évaluée Population hospitalisée en soins avancés; peut être biaisée par rapport à une population de prématurés plus sévèrement touchés |
Buchs et al. 2017 Note de bas de page 41 Financement non précisé |
Cas-témoin rétrospectif Centre unique (comparaison entre 2 centres) PVZ utilisé systématiquement dans un centre, non utilisé dans l'autre) France 2001 à 2012 Effet du PVZ sur l'infection par S. aureus (Sa) et P. aeruginosa (Pa) Dose de 15 mg/kg de PVZ par mois pendant la saison du VRS VRS diagnostiqué par TIF, test de diagnostic moléculaire ou culture virale |
Enfants atteints de FK nés entre le 1 janv. 2001 et le 30 juin 2012 et âgés de ≤36 mois Cas appariés avec 3 témoins (pour l'année et le mois de naissance, le sexe et le génotype FK) Suivi jusqu'à l'âge de 3 ans 40 avec PVZ 140 témoins |
Les nourrissons des 2 groupes présentaient des caractéristiques similaires. Les techniques de culture microbiologique sont similaires dans les 2 centres. Effet du PVZ sur la colonisation microbienne et l'hospitalisation pour maladie respiratoire Résultat : Âge au premier isolement Sa,mois, médiane (fourchette) PVZ (n=40) : 6,4 (2,0 à 59,0) Résultat : Âge au premier isolement Pa, mois, médiane (fourchette) Résultat : Isolement Sa à l'âge de 3 ans (%) a,b Résultat : Isolement de Pa à l'âge de 3 ans (%) b Résultat : Hospitalisation en raison d'une IVRI aigüe Résultat : Hospitalisation en raison d'une IVRI causée par le VRS Sa = S. aureus Aucun patient admis en raison du VRS n'a eu besoin d'oxygène supplémentaire ou de VM. a Un taux plus élevé d'infection par Sa avec le PVZ peut être lié à des expositions lors des consultations pour le PVZ ou à des taux différents de colonisation de Sa dans les 2 villes. b À titre de comparaison, les taux de colonisation microbienne à l'âge de 3 ans du Registre français de la mucoviscidose étaient de 74 % pour Sa et de 37 % pour Pa. Aucune différence entre les groupes en ce qui concerne les consultations externes au cours de la 1, 2 ou 3 année. Aucune différence entre les groupes en ce qui concerne les paramètres de croissance (écart Z du poids à l'âge de 1, 2 et 3 ans). |
II-2 |
Passable Cas et témoins provenant de différents centres; possibilité de biais dans les résultats |
Chi et al. 2014 Note de bas de page 22 Soutenue par des subventions de l'hôpital Mackay Memorial, Taipei |
Cohorte prospective avec témoins historiques Centre unique Taïwan Avril 2011 à mars 2013 (aucune saisonnalité du VRS) PVZ contre l'absence de traitement pour prévenir l'infection par le VRS Dose de 15 mg/kg de PVZ par mois x 6 doses à partir de la sortie initiale de l'hôpital VRS diagnostiqué par TIF ou culture virale Test pour le VRS si admis |
Nourrissons nés à ≤28 sAG et nourrissons nés à ≤35 sAG avec MPC PVZ : n=127 ≤28 sAG : 108 29 à 35 sAG avec MPC : 19 Témoins : (rétrospective; né en juillet 2000-juin 2008) n = 347 ≤28 sAG : 284 29 à 35 sAG avec MPC : 63 |
Suivi jusqu'à 12 mois pour déterminer l'ER globale de la prophylaxie de 6 mois HVRS chez les receveurs du PVZ et les témoins, 6 et 12 mois après la sortie initiale de l'hôpital Dans les 6 mois Résutat : Admission à l'USI n (%) Résutat : DdS (jours, médiane, EIQ) Résutat : DdS à l'USI (jours, médiane, EIQ) Dans les 12 mois Résutat : HVRS n (%) Résutat : Admission à l'USI n (%) Résutat : VM n (%) Résutat : DdS (jours, médiane, EIQ) Résutat : DdS à l'USI (jours, médiane, EIQ) Les receveurs du PVZ ont été appariés avec les témoins par score de propension afin de réduire le biais de confusion. a Réduction des HVRS à 6 mois : 86 % (IC 95 % : 36 à 97 %) b Réduction des HVRS à 12 mois : 78 % (IC 95 % : 40 à 92 %) Admission à l'USI en proportion des HVRS : à 6 mois, 1/2 avec le PVZ et 9/13 dans le groupe témoin; à 12 mois, 1/5 avec le PVZ et 10/20 dans le groupe témoin. VM : à 6 mois, 0/2 avec PVZ et 4/13 dans le groupe témoin; à 12 mois, 0/5 avec PVZ et 4/20 dans le groupe témoin. Réduction des HVRS par sous-groupe : Dans les 6 mois ≤28 sAG, MPC ≤28 sAG, sans MPC ≤28 sAG tous 29 à 35 sAG, MPC ≤35 sAG, MPC Dans les 12 mois ≤28 sAG, MPC ≤28 sAG, sans MPC ≤28 sAG tous 29 à 35 sAG, MPC ≤35 sAG, MPC * n/N = nombre de personnes hospitalisées en raison du VRS/nombre dans le sous-groupe Aucun décès n'a été signalé au cours de l'étude |
II-2 |
Passable Témoins historiques Divergences mineures dans les chiffres du texte et du tableau; les données du texte sont présentées ici |
Chiu et al. 2018 Note de bas de page 33 Soutenue par la Société taïwanaise de cardiologie pédiatrique |
Cohorte prospective/rétrospective Multicentrique Taïwan (4 sites) 2010 à 2016 PVZ remboursé à partir de 2013 HVRS avec PVZ contre absence de traitement Dose de 15 mg/kg de PVZ toutes les 4 semaines à partir du moment du diagnostic de la CPC x 6 doses VRS diagnostiqué par test antigénique ou culture Test de dépistage systématique du virus en cas d'hospitalisation en raison d'une IVRI avant l'âge de 1 an |
Nourrissons atteints d'une CPCHS <1 an PVZ : n=747 Témoins : n=809 Suivi jusqu'à l'âge de 1 an, receveurs du PVZ de manière prospective et témoins de manière rétrospective Appariement avec des scores de propension. Après l'appariement, 705 dans chaque groupe Doses moyennes de PVZ 3,9 Janv. 2010 à juin 2012 : sans PVZ Transition de juillet 2012 au 31 déc. 2013 : 44,3 % ont reçu du PVZ Janv. 2014 à déc. 2015 : 98,1 % a reçu du PVZ |
Caractéristiques des patients similaires dans les 2 groupes Taux d'incidence d'HVRS chez receveurs du PVZ et témoins Tous les cas Hospitalisation Admission à l'USI Jours d'hospitalisation CPC acyanotique Hospitalisation Admission à l'USI Jours d'hospitalisation CPC cyanotique Hospitalisation Admission à l'USI Jours d'hospitalisation * Taux d'incidence pour 1000 jours-personnes après appariement par score de propension Tous les cas Hospitalisation Admission à l'USI Jours d'hospitalisation Ratio des taux: 0,396 Acyanotic CHD Hospitalisation Admission à l'USI Jours d'hospitalisation Cyanotic CHD Hospitalisation Admission à l'USI Jours d'hospitalisation Ratio des taux: 0,269 † significatif à p < 0,05 La prophylaxie par PVZ est efficace dans le groupe entier et chez les personnes souffrant de CPC cyanotique, mais pas chez celles souffrant de CPC acyanotique. Pendant la période de PVZ : 12 admissions en raison du VRS. 5 n'ont pas obtenu de PVZ en raison d'un diagnostic tardif de CPC; 3 n'ont pas obtenu de PVZ pour cause de non-conformité et 3 ne répondaient pas aux critères de PVZ. Seulement 1 échec de PVZ. |
II-2 |
Passable Témoins historiques, peuvent être biaisés |
Farber et al., 2016 Note de bas de page 29 Aucun financement externe |
Cohorte rétrospective Multicentrique É.-U. 9 programmes de soins gérés par Medicaid 2012 à 2015 La saison du VRS est définie chaque année comme étant du 1 oct. au 30 mars Prophylaxie par PVZ contre l'absence d'intervention Dose de PVZ non précisée (quantités de PVZ dispensées signalées) Infection par le VRS recensée par les codes ICD-9 |
Nourrissons prématurés de 29 à 36 sAG âgés de ≤6 mois au début de la saison du VRS en 2012, 2013 et 2014, sans facteurs de risque d'infection sévère par le VRS autres que la prématurité (n=14 097) Nourrissons de 29 à 32 sAG (n=2031) PVZ (n=843; 41,5 %) Absence d'intervention (n=1188; 58,5 %) Nourrissons de 33 à 36 sAG : (n=12 066) PVZ : (n=442; 3,7 %) Absence d'intervention (n=11 624; 96,3 %) Critères d'exclusion : <29 sAG ou >36 sAG; nourrissons atteints d'une MPC, d'une CPCHS, d'une hypertension artérielle pulmonaire, d'une transplantation de cellules souches hématopoïétiques ou autre et d'un syndrome génétique sévère; nourrissons ayant fait l'objet d'une demande de remboursement de médicaments pour insuffisance cardiaque, MPC et hypertension pulmonaire; et nourrissons ayant été admissibles à un régime de soins de santé pendant <3 mois au cours de la saison du VRS durant la 1 re année de vie |
|
Niveau II-2 |
Passable Les diagnostics de VRS sont basés sur ceux de sortie d'hôpital; aucun accès aux données de laboratoire. Il est possible que certaines hospitalisations en raison d'une bronchiolite sans VRS aient eu lieu chez des enfants non testés pour le VRS. Doses et quantités de PVZ délivrées déterminées à partir des demandes de remboursement de la pharmacie ambulatoire. Les bénéficiaires de Medicaid peuvent ne pas être représentatifs d'autres populations. Ceux qui reçoivent le PVZ et ceux qui ne le reçoivent pas peuvent différer en ce qui concerne les facteurs de confusion non mesurés. |
Groves et al., 2016 Note de bas de page 24 Source de financement non précisée |
Cohorte rétrospective Centre régional unique Irlande du Nord Registre des patients du Centre régional pédiatrique de la fibrose kystique 1997 à 2007 Prophylaxie par PVZ contre l'absence d'intervention Dose de PVZ non précisée VRS diagnostiqué par PCR |
Enfants ayant reçu un diagnostic de FK au dépistage néonatal et nés en Irlande du Nord entre 1997 et 2007 (n=92) Cohorte avant l'initiation au PVZ (née de 1997 à 2002) [n=47] Cohorte après l'initiation au PVZ (née de 2003 à 2007) [n=45] Exclusion : enfants atteints de FK nés en dehors du pays |
Résultat primaire
|
Niveau II-2 |
Passable Ajustement minimal des facteurs de confusion potentiels dans l'analyse Cohortes séparées dans le temps avec changements possibles dans les pratiques cliniques et (ou) de prévention et de contrôle des infections Les petits nombres pourraient avoir un pouvoir d'étude limité |
Lacaze-Masmonteil et al. 2004 Note de bas de page 31 Financée par Abbott France |
Étude de cohorte prospective Multicentrique France 46 centres 2000 Facteurs de risque d'HVRS avec et sans PVZ VRS diagnostiqué par TIF |
Nourrissons nés à <33 sAG et nés entre avril et déc. 2000 Suivi jusqu'à la fin de la saison du VRS n= 2813 ≥ une dose de PVZ : 376 Aucun PVZ : 2370 État de PVZ incertain : 67 |
Les patients qui ont reçu du PVZ étaient significativement plus prématurés, avaient une incidence plus élevée de dysplasie bronchopulmonaire (DBP), étaient plus souvent sortis initialement au début de la saison du VRS et étaient plus susceptibles d'être hospitalisés en raison d'une IVRI 2256 sans DBP n'ont pas reçu de PVZ Résultat: Patients hospitalisés au moins une fois pour une IVRI Résultat: Hospitalisations pour une IVRI Résultat: Patients ayant subi au moins une fois une HVRS Résultat: HVRS * 4 avaient le VRS avant le début de l'administration du PVZ, donc 19 avec le PVZ (5,1 %) [ p= 0,13]. Aucune différence significative dans les taux d'HVRS entre le groupe avec PVZ et le groupe témoin, mais le groupe avec PVZ a enregistré plus d'admissions en raison d'une IVRI. 2 décès attribuables au VRS (sans prophylaxie) |
II-2 |
Passable Différences signalées dans les groupes avec PVZ et sans traitement, mais résultats non ajustés pour les facteurs de confusion Divergences mineures dans les chiffres du texte et des tableaux; les données des tableaux sont présentées ici |
Lee et al. 2018 Note de bas de page 30 Financement non précisé |
Rétrospective Multicentrique Hong Kong (2 centres) 2010 à 2014 Début du programme PVZ 2012 Rapport coût/efficacité du programme PVZ Dose de 15 mg/kg par mois pendant 5 doses Diagnostic du VRS par TIF ou culture virale |
Nourrissons nés à <29 sAG PVZ : n=40 Sans PVZ : n=95 Nourrissons suivis pour une HVRS dans l'année qui suit leur sortie initiale. |
HVRS chez les receveurs du PVZ et les témoins <29 sAG (tous): HVRS <29 sAG (tous): DdS (jours) moyenne ±DS <29 sAG (tous): Admission à l'USI pédiatrique (USIP) <29 sAG (tous): DdS à l'USIP (jours) moyenne ±DS <29 sAG (tous): Mortalité attribuable au VRS <27 sAG: HVRS Aucun décès associé au VRS n'a été signalé. |
II-2 |
Passable Le poids de naissance, l'AG et la DBP différaient entre les 2 groupes; facteurs de confusion non ajustés |
Mochizuki et al., 2017 Note de bas de page 27 Financement : ministère de la Santé, du Travail et des Affaires sociales, Japon |
Cohorte prospective Multicentrique Japon Nombre de centres non précisé Suivi de 6 ans de l'étude CREW déjà publiée qui examinait les résultats à l'âge de 3 ans Recrutement pendant la saison 2007-2008 du VRS Prophylaxie par PVZ contre l'absence d'intervention Dosage du PVZ non précisé Infection par le VRS n'est pas un résultat |
Intention de traiter la population Nourrissons prématurés (33 à 35 sAG) sans MPC (n=440) PVZ ≥3 doses (n=345) Absence d'intervention (n=95) Population par protocole Enfants ayant terminé le suivi de 6 ans (n=328) PVZ (n=249) Absence d'intervention (n=79) Sous-population d'asthme atopique Enfants dont le sang a été prélevé pour le dosage des IgE (n=268) PVZ (n=202) Absence d'intervention (n=66) Critères d'exclusion : petits pour l'AG, MPC, antécédents de maladies respiratoires nécessitant une VM sans égard à l'utilisation de surfactant, enfants ayant reçu <3 doses de PVZ les 6 premiers mois de vie |
Résultat primaire
|
Niveau II-2 |
Passable Les détails sur la représentativité et la dérivation de la cohorte ne sont disponibles que dans l'étude CREW originale. Les détails fournis sont insuffisants pour déterminer si l'évaluation a été faite à l'insu par rapport à l'état prophylactique de l'enfant. Certaines données sur l'exposition et les résultats (p. ex., respiration sifflante récurrente, consultation à la clinique ou à l'hôpital) sont recueillies à partir des déclarations des parents. L'analyse n'a contrôlé qu'un sous-ensemble des facteurs de confusion potentiels pour lesquels des données ont été recueillies. |
Prais et al., 2016 Note de bas de page 21 Source de financement : Abbott |
Cohorte rétrospective Israël Centre médical unique pour enfants à soins tertiaires 2000 à 2003 Prophylaxie par PVZ contre l'absence d'intervention Dosage du PVZ non précisé La prophylaxie systématique par PVZ présentée en 2001 pour nourrissons nés à <29 sAG Méthode de diagnostic du VRS non précisée |
Enfants d'âge scolaire (7 à 10 ans) nés très prématurés (<29 sAG) entre 2000 et 2003 (n=63) Certains enfants présentaient une DBP Âge moyen : 8.9 ans (SD : 0,68) Exposés : Enfants nés de 2001 à 2003 ayant reçu du PVZ (n=30) Non exposés : Enfants nés de 2000 à 2001 n'ayant pas reçu de PVZ (n=33) Critères d'exclusion : Sujets incapables de subir un test de fonction pulmonaire pour certaines raisons; sujets présentant une maladie systémique sévère, y compris une CPC |
Résultats à court terme (dans les 2 premières années de vie)
# Tests de la fonction pulmonaire effectués : Pourcentage de la capacité vitale forcée (CVF) prédite, pourcentage du volume expiratoire maximal par seconde (VEM 1 ) prédit, nombre et proportion de sujets avec un VEM 1 <80 % de la valeur prédite, rapport VEM 1 /CVF, pourcentage de changement du VEM 1 après bronchodilatation, nombre et proportion de sujets avec une réversibilité significative, pourcentage du volume expiratoire forcé (VEF) prédit à 50 % de la CVF, pourcentage du VEF prédit de 25 à 75 % de la CVF, pourcentage de variation du VEF 25 à 75 % après bronchodilatation, concentration provocatrice médiane entraînant une chute de 20 % du VEM 1 (PC 20 ), nombre et pourcentage de sujets ayant un test à la méthacholine positif, et nombre et pourcentage de sujets ayant une PC 20 <1 mg/mL. |
Niveau II-2 |
Passable Sujets recrutés dans un seul centre de soins tertiaires Les épisodes de respiration sifflante au cours des 2 premières années de vie dépendent des déclarations des parents et sont sujets à un biais de rappel. Le petit nombre de nourrissons dans chaque groupe pourrait réduire la force de l'étude. L'analyse ne tient compte que de l'âge et de la grande prématurité (bien que les groupes ne diffèrent pas en fonction d'un certain nombre de facteurs de confusion potentiels). Les résultats peuvent ne pas être généralisés aux nourrissons à terme ou aux nourrissons souffrant d'une maladie systémique sévère (p. ex., une CPC). |
Priante E et al., 2019 Note de bas de page 32 Source de financement non précisée |
Étude de cohorte rétrospective Multicentrique (3) Italie Saison 1 : 2015 à 2016 Saison 2 : 2016 à 2017 Changement des critères d'admissibilité pour le PVZ 2016 à 2017 Dose de 15 mg/kg de PVZ par mois x 5 doses contre l'absence de prophylaxie VRS confirmé par dosage immuno-enzymatique (DIE), TIF, PCR ou culture virale |
Nourrissons nés à 29-35 sAG Saison 1 (n=262) Moyenne sAG : 229±10,9 MPC 0 % CPCHS 2,3 PVZ : n=95 Sans prophylaxie : n=167 Saison 2 (n=274) Moyenne sAG (jours) : 228±11,6 MPC 4,4 % CPCHS 2,92 % PVZ : n=53 Sans prophylaxie : n=221) |
La proportion de nourrissons non exposés au PVZ a augmenté de manière significative, passant de 63,7 % (saison 1) à 80,6 % (saison 2) [valeur p < 0,0001]. HVRS pendant 2 saisons consécutives Tous les nourrissons Saison 1: 5/262 (1,91%) Saison 2: 14/274 (5,11%) RC (IC À 95%): 2,77 (0,98-7,80) PVZ (n/N) Saison 1: 2/95 (2,10%) Saison 2: 1/53 (1,88%) RC (IC À 95%): 1,09 (0,67-1,35) Sans PVZ (n/N) Saison 1: 3/167 (1,80%) Saison 2: 13/221 (5,88%) RC (IC À 95%): 3,42 (0,96-12,20) *n/N = nombre de personnes ayant subi une HVRS/Nombre dans le sous-groupe Au cours des 2 saisons, 3 des 148 nourrissons (2,03 %) recevant du PVZ et 16 des 388 nourrissons (4,12 %) sans prophylaxie ont subi une HVRS. Risque d'HVRS chez les nourrissons recevant du PVZ par rapport à ceux n'en recevant pas au cours des 2 saisons Saison 1 RC (IC à 95 %) : 1,18 (0,19 à 7,16 %) Saison 2 RC (IC à 95 %) : 0,31 (0,04 à 2,41 %) En général RC (IC à 95 %) : 0,57 (0,16 à 2,07 %) Calculé à l'aide de la fonction metabin du méta paquet du RStudio. L'estimation globale a été regroupée avec un modèle à effets fixes (I Note de bas de page 2 = 0 %). Conclusion : Les auteurs concluent que la restriction de l'admissibilité au remboursement de PVZ a conduit à une augmentation significative d'HVRS. En utilisant les données brutes signalées par les auteurs, nous avons constaté que le risque d'HVRS était réduit chez les personnes recevant du PVZ par rapport à celles ne recevant aucune prophylaxie, mais le résultat n'était pas statistiquement significatif [RC (IC à 95 %); 0,57 (0,16 à 2,07 %)]. |
II-2 |
Passable Les résultats ne sont pas analysés selon la présence ou l'absence de MPC ou de CPCHS. Plus de nourrissons à haut risque dans le groupe sans PVZ la 2 saison. La conclusion de l'auteur ne semble pas être soutenue par les données (hausse non significative; de plus, on n'a pas abordé la hausse du % d'HVRS chez ceux qui n'ont pas reçu de prophylaxie à la période 2 par rapport à la période 1). |
Sanchez-Luna et al. Financée par AbbVie |
Étude d'observation prospective Multicentrique Espagne : 50 sites D'oct. à mars 2012 à 2013 et de 2013 à 2014 Taux d'HVRS chez nourrissons à terme atteints du SD et nourrissons non SD Diagnostic du VRS par test de l'antigène rapide (+ culture ou technique moléculaire dans certains cas) |
Nourrissons nés à terme avec SD et âgés de <1 an Cohorte-témoin : nourrissons sans SD appariés par sexe et date de naissance Exclus si CPCHS, DBP, <35 sAG. SD : n=93 Non-SD : n=68 |
Incidence plus élevée d'HVRS dans le groupe SD par rapport au groupe non SD. Le groupe SD avait un poids plus faible au départ et un AG plus bas à la naissance; un pourcentage plus élevé de nourrissons précédemment hospitalisés pour une infection par le VRS ou pour d'autres raisons et un pourcentage plus élevé de personnes souffrant de maladies concomitantes et utilisant des médicaments concomitants. HVRS : 10 cas (9,7 %) [9 nourrissons] dans le groupe SD 1 cas (1,5 %) dans le groupe non SD (p = 0,03) PVZ dans 33 (35,5 %) du groupe SD et 0 du groupe non SD Groupe SD : Admission avec VRS : PVZ 1/33 (3,0 %) Sans PVZ 9/60 (15 %) p = 0,075 La prophylaxie par PVZ n'était pas un prédicteur indépendant de l'HVRS. |
II-2 |
Passable Un petit nombre de personnes du groupe SD ont reçu du PVZ. Les facteurs de confusion potentiels dans les groupes traités et non traités au PVZ n'ont pas été explorés. |
Soraiz et al. 2017 Note de bas de page 34 Financement non précisé |
Cohorte prospective avec témoin historique Centre unique Argentine 2014 à 2016 (prospective) 2007 à 2009 (témoins historiques) Effet du PVZ par rapport à l'absence de traitement sur l'HVRS Méthode de dépistage du VRS : non précisée |
CPCHS âgés de <1 an PVZ : n=53 Témoin : n=50 |
Aucune différence significative dans l'AG, le poids de naissance, le sexe, l'âge à l'hospitalisation. Moins de cas de CPC cyanotique, d'hypoplasie ventriculaire gauche et d'hypertension pulmonaire et plus de cas de CPC corrigée avec résidus mineurs dans le groupe témoin. Hospitalisation pour infection des voies respiratoires (IVR) IVR Hospitalisation PVZ (n=53): 10 (19%) Témoin (n=50): 15 (30%) RR (IC À 95%): 0,63 (0,21 à 1,27) p: 0,19 NST: n/a HVRS-IVR PVZ (n=53): 3 (6%) Témoin (n=50): 10 20%) RR (IC À 95%): 0,28 (0,08 à 0,97) p: 0,04 NST: 6,97 VM PVZ (n=53): 2 (4%) Témoin (n=50): 4 (8%) RR (IC À 95%) : 0,47 (0,09 à 2,46) p: 0,32 NST: n/a Aucune différence en ce qui concerne les infections des voies respiratoires ou la DdS pour ces infections; aucun décès d'origine respiratoire |
II-2 |
Passable Témoins historiques; différences dans les types et la sévérité de la CPC entre groupe avec PVZ et groupe non traité, mais les facteurs de confusion n'ont pas été ajustés. Résumé de conférence |
Fink et al., 2019 Note de bas de page 26 Aucun financement externe |
Étude de cohorte rétrospective É.-U. Multicentrique Registre des patients de la Cystic Fibrosis Foundation (CFFPR) 2008 à 2016 Prophylaxie par PVZ contre l'absence d'intervention Dose et nombre de doses de PVZ : non précisés VRS non diagnostiqué |
Nourrissons chez qui on a diagnostiqué une FK à < 6 mois et qui, à 2 ans, disposaient de ³1 an de données du CFFPR PVZ : n=1 588 à <32 sAG 1 % 32 à <37 sAG : 10 % Sans prophylaxie : n=2 679 <32 sAG 1 %; 32 à <37 sAG : 6 % |
Mortalité à court terme : toutes causes confondues avant l'âge de 2 ans au total et spécifiquement pendant la saison du VRS. Risque de décès chez les enfants de <2 ans qui ont reçu ou non du PVZ Avant l'âge de 2 ans PVZ: 0,1% Sans prophylaxie: 0,2% Valeur p : 0,5 Pendant la saison du VRS PVZ: 0,1% Sans prophylaxie: 0,1% Valeur p : 0,6 Taux annuel d'hospitalisations chez les enfants qui ont reçu ou non du PVZ Âge, ans : <1 RR (IC à 95 %) : 1,2 (0,98 à 1,3) RRa1 (IC à 95 %) : 0,94 (0,79 à 1,1) HR Note de bas de page 2 RR (IC À 95 %) : 0,91 (0,72 à 1,2) Âge, ans : 1 à <2 RR (IC à 95 %) : 1,2 (1,0 à 1,4) RRa1 (IC à 95 %) : 1,1 (0,92 à 1,3) HR Note de bas de page 2 RR (IC à 95 %) : 0,96 (0,77 à 1,2) Âge, ans : 2 à <3 RR (IC à 95 %) : 1,0 (0,87 à 1,3) RRa1 (IC à 95 %) : 0,91 (0,75 à 1,1) HR Note de bas de page 2 RR (IC à 95 %) : 0,85 (0,66 à 1,1) Âge, ans : 3 à <4 RR (IC à 95 %) : 1,2 (0,95 à 1,4) RRa1 (IC à 95 %) : 0,99 (0,81 à 1,2) HR Note de bas de page 2 RR (IC à 95 %) : 0,89 (0,66 à 1,2) Âge, ans : 4 à <5 RR (IC à 95 %) : 1,1 (0,86 à 1,3) RRa1 (IC à 95 %) : 0,91 (0,73 à 1,1) HR Note de bas de page 2 RR (IC à 95 %) : 1,0 (0,75 à 1,4) Âge, ans : 5 à <6 RR (IC à 95 %) : 1,2 (0,93 à 1,5) RRa1 (IC à 95 %) : 1,0 (0,82 à 1,3) HR Note de bas de page 2 RR (IC à 95 %) : 1,1 (0,83 à 1,6) Âge, ans : 6 à <7 RR (IC à 95 %) : 1,0 (0,79 à 1,3) RRa1 (IC à 95 %) : 0,96 (0,74 à 1,2) HR Note de bas de page 2 RR (IC à 95 %) : 1,1 (0,75 à 1,0) Âge, ans : 7 à <8 RR (IC à 95 %) : 0,81 (0,59 à 1,1) RRa1 (IC à 95 %) : 0,75 (0,54 à 1,0) HR Note de bas de page 2 RR (IC à 95 %) : 0,65 (0,40 à 1,0) Note de bas de page 1 Ajusté pour le score de propension. Variables incluses dans le modèle : saison de naissance, origine hispanique, groupe de classe de mutation, fumeur dans le ménage, vaccin antigrippal reçu, percentile de longueur, percentile de poids, résultats de culture positifs au SARM, traitement à la Dornase alfa, traitement au sérum salé hypertonique, traitement de substitution par enzyme pancréatique. Note de bas de page 2 HR : Les nourrissons à haut risque définis comme ayant un poids ou un percentile poids/longueur de <5 % ou une hospitalisation pour exacerbation pulmonaire ou autres complications pulmonaires avant leur 1 saison de VRS. Séquelles à long terme -- déficience/détérioration de la fonction pulmonaire : pourcentage annualisé du VEM 1 prédit (moyenne de la mesure maximale de chaque trimestre) au cours des 12 mois précédant le 7 anniversaire. Pourcentage moyen de VEM 1 (IC à 95 %) prédit à l'âge de 7 ans Tous (n=1,323) PVZ (n=593): 98,2 (96,9 à 99,5%) Sans prophylaxie (n=730): 97,3 (96,1 à 98,5%) p: NA Haut-risque (n=462) PVZ (n=593): 95,3% No prophylaxis (n=730): 95,0% p: 0,9 Délai avant la 1 culture de P. aeruginosa : Le RR non ajusté pour ce type d'infection était de 1,1 (IC à 95 % : 1,0 à 1,2 %); après ajustement du score de propension, le RR était de 1,1 (IC à 95 % : 0,96 à 1,2 %). Conclusion : Les auteurs n'ont trouvé aucune donnée probante d'avantages à long terme associés au PVZ chez les nourrissons atteints de FK. |
II-2 |
Faible Aucune documentation sur l'infection par le VRS ou l'HVRS |
Narbona-Lopez et al. 2018 Note de bas de page 23 Financement non mentionné (les auteurs déclarent ne pas avoir de conflit d'intérêts avec une quelconque organisation financière) |
Étude d'observation rétrospective Centre unique Espagne 2000 à 2012 Caractériser les patients admis en raison d'une bronchiolite et analyser séparément ceux qui ont reçu ou non du PVZ PVZ tous les mois pendant la saison du VRS, jusqu'à 5 doses Diagnostic du VRS par PCR |
Tous les nourrissons admis en raison d'une bronchiolite (n=952) Tous les nourrissons ayant reçu du PVZ (n=641) (Critères du PVZ : à <28 sAG et âgé de <12 mois au début de la saison du VRS; 29 à 32 sAG et âgé de <6 mois au début de la saison du VRS; âgé de <2 ans avec DBP, maladie neuromusculaire, anomalies chromosomiques ou CPC) |
Dans l'ensemble : 531/900 testés (59 %) des personnes admises à l'hôpital en raison d'une bronchiolite étaient VRS+. AG moyen 38,4 s (intervalle 25 à 43 semaines). VRS+ : âge moyen à l'admission 107±109 j; DdS moyenne 7,1 ± 4,1 j. (± non défini) Les receveurs du PVZ : 63/641 (9,8 %) ont été admis en raison d'une bronchiolite. 22/62 testés (3,4 % de la cohorte entière avec PVZ et 35,5 % de ceux admis en raison d'une bronchiolite) étaient VRS+. VRS+ : âge moyen à l'admission 121± 105 j; DdS moyenne 9,24 ±4,2 j. Âge moyen à l'admission pour le VRS plus élevé dans le groupe avec PVZ (p= 0,042) DdS des VRS+ significativement plus longue dans le groupe avec PVZ (p= 0,006) Proportion plus faible d'infection par le VRS chez les personnes admises en raison d'une bronchiolite si le PVZ a été administré (35,5 %) par rapport à tous les cas (59 %)*, mais les groupes ne sont pas appariés pour l'AG ou l'âge réel. * calcul pour le groupe sans PVZ : 952-63 = 889; VRS dans 531-22 = 509 (57,3 %) contre groupe avec PVZ (35,5 %) : p = 0,0056 |
II-2 |
Faible Le taux d'hospitalisation n'est précisé que pour le groupe avec PVZ. PVZ et groupes de comparaison ont des facteurs de confusion, mais aucun ajustement n'a été effectué. |
Pour les études individuelles, le niveau de données probantes et la qualité ont été évalués avec les méthodes de Harris 2001.
Abréviations : AG : âge gestationnel; AMSTAR : outil d'évaluation des examens systématiques; CCNI : Conseil consultatif national de l'immunisation; CPC : cardiopathie congénitale; CPCHS : cardiopathie congénitale hémodynamiquement significative; CVF : capacité vitale forcée; DBP : dysplasie bronchopulmonaire; DdS : durée du séjour; DIE : dosage immuno-enzymatique; DRA : diminution du risque absolu; DS : déviation standard; É.-U. : États-Unis; ECR : essai contrôlé randomisé; EIQ : écart interquartile; ERP : efficacité réelle du palivizumab; FK : fibrose kystique; HVRS : hospitalisation liée au virus respiratoire syncytial; IC : intervalle de confiance; IVR : infection des voies respiratoires; IVRI : infection des voies respiratoires inférieures; MPC : maladie pulmonaire chronique due à la prématurité; n/N : nombre d'hospitalisés/Nombre dans le groupe; NST : nombre de sujets à traiter; PCR : réaction en chaîne de la polymérase; PISP : pondération inverse du score de propension; PVZ : palivizumab; R.-U : Royaume-Uni; RC : rapport de cotes; RCa : rapport de cotes ajusté; RR : risque relatif; RRa : risque relatif ajusté (ou rapport du risque ajusté); RRR : réduction du risque relatif; sAG : semaines d'âge gestationnel; SD : syndrome de Down; TIF : test d'immunofluorescence; USI : unité de soins intensifs; USIP : unité de soins intensifs pédiatriques; VEF : volume expiratoire forcé; VEF : volume expiratoire forcé; VEM 1 :volume expiratoire maximal par seconde; VM : ventilation mécanique; VRS : virus respiratoire syncytial.
Annexe F : Résumé des données probantes issues de l'examen initial de la littérature de l'INESSS concernant l'efficacité potentielle et réelle de la prophylaxie par palivizumab chez les nourrissons et les enfants
| Détails de l'étude | Résumé | ||||
|---|---|---|---|---|---|
| Étude | Plan de l'étude | Participants | Résumé des principaux résultats | Niveau de données probantes | Qualité |
Examens systématiques |
|||||
Andabaka et al., 2013 Note de bas de page 44 Source de financement non précisée |
Examen systématique avec méta-analyse d'essais contrôlés randomisés (ECR) 1996 à 2012 Prophylaxie par palivizumab (PVZ) contre placebo |
Enfants nés à ≤35 semaines d'âge gestationnel (sAG) et âgés de ≤6 mois au début de la saison du virus respiratoire syncytial (VRS), ou de <24 mois avec maladie pulmonaire chronique due à la prématurité (MPC) ou cardiopathie congénitale hémodynamiquement significative (CPCHS) et de <24 mois au début de la saison du VRS (N=2831) |
Efficacité réelle (ER) de la prophylaxie par PVZ par rapport au placebo, chez les prématurés et les nourrissons atteints de MPC ou de CPCHS
*Les 3 études incluses dans la méta-analyse étaient les suivantes : Feltes et al., 2003; IMpact-RSV, 1998 et Subramanian et al. † Les 2 études incluses dans la méta-analyse sont Feltes et al. 2003 et IMpact-RSV 1998. |
Pas `d'évaluation selon les méthodes du Comité consultatif national de l'immunisation (CCNI) |
Bonne (évaluée à l'aide de R-AMSTAR) |
Robinson et al., 2014 Note de bas de page 42 Financement : Cystic Fibrosis Foundation, É.-U. |
Examen systématique d'ECR 1995 à 2014 Prophylaxie par PVZ contre placebo ou absence d'intervention |
Nourrissons et enfants (jusqu'à 18 ans) ayant reçu un diagnostic de fibrose kystique (FK) [N=186] |
Pour les examens systématiques sans méta-analyse, les études individuelles répondant aux critères d'inclusion de l'examen systématique de la littérature de l'Institut national d'excellence en santé et en services sociaux (INESSS) sont présentées séparément dans ce tableau, par auteur. Voir ailleurs dans ce tableau les résultats de l'étude suivante : · Cohen et al., 2005 |
Pas d'évaluation selon les méthodes du CCNI |
Bonne (évaluée à l'aide de R-AMSTAR) |
Checchia et al., 2011 Note de bas de page 45 Financée par MedImmune |
Examen systématique avec méta-analyse d'ECR et d'études d'observation 1990 à 2007 Prophylaxie par PVZ contre placebo ou absence d'intervention |
Enfants nés à ≤35 sAG ou avec MPC ou CPCHS (N≈15 000) |
ER de la prophylaxie par PVZ par rapport au placebo ou à l'absence d'intervention :
*Les 8 études incluses dans la méta-analyse étaient les suivantes : Mitchell et al., 2006; Grimaldi et al., 2004; Henckel et al., 2004; Perez et al., 2004; Wegner et al., 2004; Pedraz et al., 2003; IMpact-RSV, 1998 et Subramanian et al., 1998. Enfants prématurés sans MPC : ER de la prophylaxie par PVZ par rapport au placebo ou à l'absence d'intervention
**Les 3 études incluses dans la méta-analyse étaient celles de Henckel et al., 2004, de Pedraz et al., 2003 et d'IMpact-RSV, 1998 † Les 2 études incluses dans la méta-analyse sont celles de Wegner et al. 2004 et d'IMpact-RSV 1998 ¥ Les 3 études incluses dans la méta-analyse étaient celles de Wegner et al., 2004, de Pedraz et al., 2003 et d'IMpact-RSV, 1998 +Les 3 études incluses dans la méta-analyse sont celles de Kasuda et al. 2006, de Wegner et al. 2004 et d'IMpact-RSV 1998 |
Pas d'évaluation selon les méthodes du CCNI |
Moyenne (évaluée à l'aide de R-AMSTAR) |
Homaira et al., 2014 Note de bas de page 64 Financement non précisé |
Examen systématique des études d'observation 1999 à 2013 Prophylaxie par PVZ contre placebo ou absence d'intervention |
Nourrissons et enfants (≤2 ans) présentant un risque élevé de maladie sévère liée au VRS en raison de leur prématurité et/ou de toute affection congénitale chronique (N=89 469) |
Pour les examens systématiques sans méta-analyse, les études individuelles répondant aux critères d'inclusion de l'examen systématique de la littérature de l'INESSS sont présentées séparément dans ce tableau, par auteur. Voir ailleurs dans ce tableau les résultats des études suivantes :
(Les données de l'examen systématique ne sont pas utilisées) |
Pas d'évaluation selon les méthodes du CCNI |
Moyenne (évaluée à l'aide de R-AMSTAR) |
Morris et al., 2009 Note de bas de page 65 Financement non précisé |
Examen systématique avec méta-analyse d'ECR 1990 à 2009 Prophylaxie par PVZ contre placebo ou absence d'intervention; immunoglobuline VRS contre placebo ou absence d'intervention |
Enfants âgés de <48 mois présentant un risque élevé d'infection sévère par le VRS |
Les 3 ECR du PVZ par rapport au placebo (Feltes, 2003; IMpact-RSV, 1998; Subramanian, 1998) recensés dans cet examen systématique ont été inclus dans la méta-analyse d'Andabaka et al. Cette étude étant plus récente et de meilleure qualité méthodologique, elle seule a été prise en compte dans l'examen de la littérature de l'INESSS. |
Pas d'évaluation selon les méthodes du CCNI |
Moyenne (évaluée à l'aide de R-AMSTAR) |
Pons et al., 2010 Note de bas de page 66 Soutenue par le système national de santé espagnol |
Examen systématique avec méta-analyse d'ECR 1990 à 2009 Prophylaxie par PVZ et autres immunoprophylaxies (immunoglobuline, motavizumab) contre placebo |
Enfants présentant un risque élevé de contracter une infection par le VRS |
La méta-analyse a combiné les résultats des essais du PVZ et d'autres immunoprophylaxies (immunoglobuline, motavizumab) pour obtenir des estimations de l'effet global des résultats. Les résultats n'ont donc pas été pris en compte dans l'examen de la littérature de l'INESSS. Les 3 ECR du PVZ par rapport au placebo (Feltes, 2003; IMpact-RSV, 1998; Subramanian, 1998) ont été saisis dans l'examen systématique et la méta-analyse d'Andabaka et al. |
Pas d'évaluation selon les méthodes du CCNI |
Moyenne (évaluée à l'aide de R-AMSTAR) |
Wegzyn et al., 2014 Note de bas de page 67 Source de financement : AbbVie Inc |
Examen systématique d'ECR et d'études d'observation prospectives 1996 à 2013 Prophylaxie par PVZ contre placebo ou absence d'intervention |
Enfants nés à ≤35 sAG avec MPC ou CPCHS (N≈42 000) |
Pour les examens systématiques sans méta-analyse, les études individuelles répondant aux critères d'inclusion de l'examen systématique de la littérature de l'INESSS sont présentées séparément dans ce tableau, par auteur. Voir ailleurs dans ce tableau les résultats des études suivantes :
(Les données de l'examen systématique ne sont pas utilisées) |
Pas d'évaluation selon les méthodes du CCNI |
Moyenne (évaluée à l'aide de R-AMSTAR) |
Études individuelles |
|||||
Feltes et al., 2003 Note de bas de page 56 Soutenue par MedImmune |
ECR Multicentrique multinational Canada, É.-U., Suisse, Allemagne, Pologne, France, R.-U. (76 sites) 4 saisons de VRS (1998 à 2002) Prophylaxie par PVZ contre placebo Dose de 15 mg/kg de PVZ tous les 30 jours; total de 5 doses) VRS diagnostiqué par détection de l'antigène |
Enfants atteints de CPCHS et âgés de ≤24 mois au début de la saison du VRS Receveurs du PVZ (n=639) Receveurs du placebo (n=648) |
ER de la prophylaxie par PVZ par rapport au placebo
|
Niveau I |
Bonne (selon l'évaluation du Programme de développement des compétences en évaluation critique) [CASP] |
IMpact-RSV, 1998 Note de bas de page 38 Soutenue par MedImmune |
ECR (étude de phase III) Multicentrique multinational Canada, R.-U., É.-U. Sites : Canada : 9, Une (1) saison de VRS (1996 à 1997) Prophylaxie par PVZ contre placebo Dose de 15 mg/kg de PVZ tous les 30 jours; total de 5 doses) VRS diagnostiqué par un test antigénique |
Enfants nés à ≤35 sAG ET qui étaient âgés de ≤6 mois au début de la saison du VRS OU qui étaient âgés de ≤24 mois au début de la saison du VRS, qui ont reçu un diagnostic de dysplasie bronchopulmonaire (DBP) et qui ont reçu des stéroïdes, des bronchodilatateurs, des diurétiques ou de l'oxygène supplémentaire au cours des 6 mois précédents Receveurs du PVZ (n=1002) Receveurs de placebo (n=500) |
Nourrissons prématurés avec ou sans MPC Efficacité réelle du palivizumab (ERP) par rapport au placebo
Nourrissons prématurés atteints de MPC ERP par rapport au placebo
Nourrissons prématurés sans MPC ERP par rapport au placebo
Nourrissons prématurés selon l'AG (avec ou sans DBP) ERP par rapport au placebo
|
Niveau I |
Bonne (selon l'évaluation du CASP) |
Blanken et al., 2013 Note de bas de page 49 Financement : Laboratoires Abbott |
ECR Multicentrique Pays-Bas 15 sites 2 saisons de VRS (2008 à 2010) PVZ contre placebo (Dose de 15 mg/kg tous les 30 jours; total de 5 doses) Diagnostic du VRS déterminé au moyen du PCR par transcription inverse (RT-PCR) |
Enfants nés de 33 à 35 sAG sans MPC, et âgés de 6 mois au début de la saison du VRS Receveurs du PVZ (n=214) Receveurs du placebo (n=215) |
ER de la prophylaxie par PVZ par rapport au placebo
|
Niveau I |
Moyenne (selon l'évaluation du CASP) |
Tavsu et al., 2014 Note de bas de page 48 Financement non précisé |
ECR Centre unique Turquie 2 saisons de VRS (2009 à 2010, 2010 à 2011) Prophylaxie par PVZ par rapport à l'absence d'intervention Dose de 15 mg/kg de PVZ tous les 30 jours; total de 5 doses) Écouvillons nasaux testés par Respi-Strips |
Enfants nés à ≤32 sAG sans MPC ou CPCHS (Nés à <28 sAG et âgés de <12 mois au début de la saison du VRS OU nés de 29 à 32 sAG et âgés de <6 mois au début de la saison du VRS) Prophylaxie par PVZ (receveurs [n=39]) Receveurs sans intervention (n=41) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention HVRS RC = 0,26 (IC à 95 % : 0,10 à 0,68 %; p = 0,001) Aucune différence dans la croissance ou le développement à l'âge de 18 mois |
Niveau I |
Moyenne (selon l'évaluation du CASP) |
Cohen et al., 2005 Note de bas de page 43 Soutenue par l'industrie (source non précisée) |
ECR Multicentrique É.-U. (40 sites) 1998 à 2001 Prophylaxie par PVZ contre placebo 15 mg/kg tous les 30 jours; total de 5 doses La méthode de dépistage du VRS non précisée |
Nourrissons et enfants âgés de ≤24 mois avec un diagnostic de FK (n=186) Receveurs du PVZ (n=92) Receveurs du placebo (n=94) Âge moyen : 12,8 (0,4-24,4) mois |
ER de la prophylaxie par PVZ par rapport au placebo
RR=3,06 (IC à 95 % : 0,13 à 74,27 %) |
Niveau I |
Non évaluée dans l'examen de la littérature de l'INESSS* *La qualité de l'étude n'a pas été évaluée, car elle n'a été publiée que sous forme de résumé |
Wegner et al., 2004 Note de bas de page 50 Financement : AccessCare et Agency for Healthcare Research and Quality Centre de l'Université de Caroline du Nord pour l'éducation et la recherche sur les thérapies |
Cohorte historique Multicentrique Caroline du Nord Cohorte du programme Medicaid 2002 à 2003 Prophylaxie par PVZ par rapport à l'absence d'intervention Injections de PVZ mensuelles, jusqu'à 6 doses pendant la saison du VRS VRS diagnostiqué par un test antigénique rapide |
Enfants nés de 32 à 35 sAG sans MPC Receveurs du PVZ (n=185) Absence d'intervention (n=182) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention HVRS
*Régression logistique multivariée contrôlant les facteurs de confusion possibles |
Niveau II-2 |
Bonne (selon l'évaluation du CASP) |
Simoes et al., 2007 Note de bas de page 54 Financée par Abbott Laboratoires |
Étude de cohorte initiale Multinationale, multicentrique Canada, Allemagne, Pays-Bas, Pologne, Espagne, Suisse (27 sites) 2001-2002 Prophylaxie par PVZ par rapport à l'absence d'intervention Dosage du PVZ non précisé La méthode de diagnostic du VRS n'est pas précisée (l'infection par le VRS n'est pas un résultat) |
Enfants nés à ≤35 sAG sans MPC ni CPC Receveurs du PVZ (n=191) Absence d'intervention (n=230) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention Respiration sifflante récurrente dans les 24 mois suivant l'inscription
|
Niveau II-2 |
Moyenne (selon l'évaluation du CASP) |
Winterstein et al., 2013 Note de bas de page 51 Financement : Florida Agency of Healthcare Administration |
Étude de cohorte historique Multicentrique É.-U. Données de facturation de Medicaid (Floride, Texas) 1999 à 2004 Prophylaxie par PVZ par rapport à l'absence d'intervention Dosage du PVZ non précisé Infection par le VRS diagnostiquée par les codes de la Classification internationale des maladies (CIM-9) |
Enfants nés de 32 à 34 sAG sans MPC, CPCHS, FK ou immunosuppression Floride Receveurs de la prophylaxie par PVZ (n=461) Absence d'intervention (n=1853) Texas Receveurs de la prophylaxie par PVZ (n=671) Absence d'intervention (n=3015) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention sur HVRS
|
Niveau II-2 |
Moyenne (selon l'évaluation du CASP) |
Banerji et al., 2014 Note de bas de page 58 Financement non précisé |
Étude de cohorte Multicentrique Nunavut, Canada (Nombre de sites non précisé) 2 saisons de VRS (2009, 2010) Prophylaxie par PVZ par rapport à l'absence d'intervention Dose de 15 mg/kg de PVZ, 2 premières doses à 3 semaines d'intervalle, puis toutes les 4 semaines pendant la durée de la saison du VRS VRS diagnostiqué par épreuve immunoenzymatique (EIA) ou RT-PCR |
Enfants nés à <36 sAG ou atteints de MPC ou de CPCHS et âgés de <6 mois au début de la saison du VRS Receveurs de la prophylaxie par PVZ (n=91) Absence d'intervention (n=10) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention HVRS
|
Niveau II-2 |
Faible (selon l'évaluation du CASP) |
Giebels et al., 2008 Note de bas de page 61 Financement non précisé |
Étude de cohorte historique Centre unique Québec Clinique de FK d'un (1) seul centre de soins tertiaires 1997 à 2005 Prophylaxie par PVZ par rapport à l'absence d'intervention Dosage du PVZ non précisé VRS diagnostiqué par test immuno-enzymatique (ELISA) ou par culture virale |
Enfants nés entre 1997 et 2005 et chez qui une FK a été diagnostiquée avant l'âge de 18 mois Receveurs du PVZ (n=35) Absence d'intervention (n=40) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention
|
Niveau II-2 |
Faible (selon l'évaluation du CASP) Peu d'admissions, tests limités pour le VRS : Sans groupe d'intervention : 7 Hospitalisés pour une maladie respiratoire : 4 Testés pour le VRS, 3 positifs. PVZ : 3 personnes hospitalisées, aucune testée pour le VRS |
Grimaldi et al., 2004 Note de bas de page 55 Soutenue par l'Agence régionale de l'hospitalisation de Bourgogne |
Cohorte initiale (par rapport à la cohorte historique) Multicentrique France (12 sites) 3 saisons de VRS (1999 à 2000, 2000 à 2001, 2001 à 2002) Prophylaxie par PVZ par rapport à l'absence d'intervention 15 mg/kg de PVZ par dose VRS diagnostiqué par ELISA ou test rapide de l'antigène TIF (test d'immunofluorescence) |
Enfants nés à ≤32 sAG avec DBP et âgés de ≤6 mois au début de la saison du VRS Receveurs du PVZ (programme d'immunoprophylaxie 2000 à 2001 et 2001 à 2002) (n=43) Receveurs sans intervention (1999 à 2000, avant le programme d'immunoprophylaxie) (n=26) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention
|
Niveau II-2 |
Faible (selon l'évaluation du CASP) |
Grimaldi et al., 2007 Note de bas de page 52 Soutenue par l'Agence régionale de l'hospitalisation de Bourgogne |
Cohorte initiale (par rapport à la cohorte historique) Multicentrique France (12 sites) 5 saisons de VRS (1999 à 2000, 2000 à 2001, 2001 à 2002, 2002 à 2003, 2003 à 2004) Prophylaxie par PVZ par rapport à l'absence d'intervention 15 mg/kg de PVZ par dose VRS diagnostiqué par ELISA ou test rapide de l'antigène TIF |
Enfants nés à ≤30 sAG sans MPC Receveurs du PVZ (programme d'immunoprophylaxie 2002 à 2003 et 2003 à 2004) (n=88) Receveurs sans intervention (1999 à 2000, 2000 à 2001 et 2001 à 2002, avant le programme d'immunoprophylaxie) [n=118] |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention
|
Niveau II-2 |
Faible (selon l'évaluation du CASP) |
Harris et al., 2011 Note de bas de page 57 Rétribution de moins de 1 000 $ des Laboratoires Abbott |
Cohorte initiale (par rapport à la cohorte historique) Centre unique Colombie-Britannique 1998 à 2007 PVZ par rapport à l'absence de prophylaxie Dosage du PVZ non précisé La méthode de diagnostic du VRS n'est pas précisée |
Enfants nés à ≤36 sAG avec CPCHS et âgés de <24 mois au début de la saison du VRS Receveurs du PVZ (2003 à 2007) [n=292] Absence d'intervention (1998 à 2003) [n=412] |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention
|
Niveau II-2 |
Faible (selon l'évaluation du CASP) |
Mitchell et al., 2006 Note de bas de page 46 Parrainée par Laboratoires Abbott |
Étude de cohorte historique Centre unique Calgary, Canada 1995 à 2002 Prophylaxie par PVZ par rapport à l'absence d'intervention Dosage du PVZ non précisé Infection par le VRS diagnostiquée par les codes CIM-9 |
Risque élevé Enfants nés à <33 sAG OU Enfants nés de 33 à 35 sAG avec MPC OU Enfants nés de 33 à 35 sAG et nécessitant une oxygénothérapie à domicile ET âgés de ≤6 mois au début de la saison du VRS Receveurs du PVZ (1999 à 2002) [n=411] Absence d'intervention (1995 à 1998) [n=496] |
Risque élevé (<33 sAG ou de 33 à 35 sAG avec MPC) ER de la prophylaxie par PVZ par rapport à l'absence d'intervention
|
Niveau II-2 |
Faible (selon l'évaluation du CASP) |
Singleton et al., 2003 Note de bas de page 59 Aucun financement signalé |
Étude de cohorte historique Multicentrique Alaska, É.-U. (région du Yukon-Kuskokwim -Delta) 1993 à 2001 Prophylaxie par PVZ par rapport à l'absence d'intervention Dosage du PVZ non précisé VRS diagnostiqué par dosage immuno-enzymatique ou culture virale |
Enfants nés à <36 sAG et enfants nés à >36 sAG et âgés de <1 an Avant le programme de prophylaxie par PVZ, 1993 à 1996 : Naissances : <36 sAG n=41 >36 sAG n=1740 Après le programme de prophylaxie par PVZ, 1998-2001 : Naissances : <36 sAG n=60 >36 sAG n=1805 |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention HVRS
|
Niveau II-2 |
Faible (selon l'évaluation du CASP) |
Winterstein et al., 2013 Note de bas de page 62 Financement : Florida Agency of Healthcare Administration |
Cohorte historique Multicentrique É.-U. (27 États, programmes Medicaid) 1999 à 2006 Prophylaxie par PVZ par rapport à l'absence d'intervention Dosage du PVZ non précisé Infection par le VRS diagnostiquée par les codes CIM-9 |
Enfants de <24 mois ayant reçu un diagnostic de FK Receveurs de la prophylaxie par PVZ (n=575) Absence d'intervention (n=2300) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention HVRS
*Modélisation par régression de Cox ajustée pour les éventuelles variables de confusion |
Niveau II-2 |
Faible (selon l'évaluation du CASP) |
Yi et al., 2014 Note de bas de page 63 Aucun financement externe |
Cohorte de départ (registre) Multicentrique Canada Pays-Bas (nombre de sites non précisé) 2003 à 2012 Prophylaxie par PVZ par rapport à l'absence d'intervention Test de diagnostic du VRS : EIA, RT-PCR ou test d'antigène |
Enfants âgés de <24 mois atteints du syndrome de Down (SD) dans le registre CARESS (2005 à 2012) (Receveurs du PVZ, n=552) Enfants âgés de <24 mois atteints du SD dans le registre néerlandais de cohorte de naissances (2003 à 2005) (Absence d'intervention, n=233) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention
* Ajustée pour la CPCHS, les CPC bénignes, l'AG et le poids de naissance ** Facteurs de risque impliquant les indications standard de la prophylaxie du VRS : toute combinaison de CPCHS, MPC, prématurité (≤35 sAG) |
Niveau II-2 |
Faible (selon l'évaluation du CASP) |
Yoshihara et al., 2013 Note de bas de page 53 Financée par Abbott Japan Co, Ltd |
Étude de cohorte prospective Multicentrique Japon 2007 à 2008 Prophylaxie par PVZ par rapport à l'absence d'intervention Dosage du PVZ non précisé L'infection par le VRS n'est pas un résultat |
Enfants nés de 33 à 35 sAG sans MPC Receveurs de la prophylaxie par PVZ (n=345) Absence d'intervention (n=95) |
ER de la prophylaxie par PVZ par rapport à l'absence d'intervention Respiration sifflante au cours des 2 premières années de la vie
|
Niveau II-2 |
Faible (selon l'évaluation du CASP) |
Pedraz et al., 2003 Note de bas de page 47 Financement : Laboratoires Abbott |
Cohorte historique Multicentrique Espagne 1998 à 2002 Prophylaxie par PVZ par rapport à l'absence d'intervention Dosage du PVZ non précisé Test de diagnostic du VRS : ELISA ou test rapide TIF |
Enfants nés à ≤32 sAG, avec ou sans MPC et âgés de ≤6 mois au début de la saison du VRS Receveurs du PVZ (2000 à 2002) [n=1919] Absence d'intervention (1998 à 2000, avant le programme d'immunoprophylaxie) [n=1583] |
Cohorte entière par AG : ER de la prophylaxie par PVZ par rapport à l'absence d'intervention
Spécifique au VRS : Non estimable (0 décès dans le groupe avec PVZ et 1 dans le groupe sans intervention) Nourrissons prématurés atteints de MPC ER de la prophylaxie par PVZ par rapport à l'absence d'intervention
|
Niveau II-2 |
Très faible (selon l'évaluation du CASP) |
Abréviations : AG : âge gestationnel; CASP : Programme de développement des compétences en évaluation critique; CIM : Classification internationale des maladies; CPCHS : cardiopathie congénitale hémodynamiquement significative; DBP : dysplasie bronchopulmonaire; DdS : durée de séjour; DR : diminution relative; É.-U. : États-Unis; ECR : essai contrôlé randomisé; EIA : épreuve immuno-enzymatique; ELISA : test immuno-enzymatique; ER : efficacité réelle; ERP : efficacité réelle du palivizumab; FK : fibrose kystique; HVRS : hospitalisation associée au VRS; IC : intervalle de confiance; ICU : unité de soins intensifs; INESSS : Institut national d'excellence en santé et en services sociaux; IVR : infection des voies respiratoires; MPC : maladie pulmonaire chronique due à la prématurité; PCR : réaction en chaîne par polymérase; PVZ : palivizumab; R.-U. : Royaume-Uni; RaR : réduction absolue du risque; RC : rapport de cotes; RTI : Ratio du taux d'incidence; RR : risque relatif; RRI : Risque relatif instantané; RRR : réduction du risque relatif; RT-PCR : PCR par transcription inverse; SD : syndrome de Down; sAG : semaines d'âge gestationnel; TIF : test d'immunofluorescence; USI : unité de soins intensifs; VM : ventilation mécanique; VRS : virus respiratoire syncytial. |
|||||
Annexe G : Nombre de sujets à traiter avec palivizumab pour éviter une hospitalisation en raison du virus respiratoire syncytial, une admission à l'unité des soins intensifs ou une respiration sifflante récurrente
| Référence | Années d'études | Population | Pour éviter | NST * | IC à 95 % | ||
|---|---|---|---|---|---|---|---|
| Population mixte | |||||||
Impact 1998 Note de bas de page 38 Essai contrôlé randomisé (ECR) † |
1996 |
≤35 semaines d'âge gestationnel (sAG), et âgés de ≤6 mois ou de ≤24 m atteints de dysplasie brancho-pulmonaire (DBP) |
Hospitalisation en raison du virus respiratoire syncytial (HVRS) |
18 |
11,3 à 35,7 % |
||
Mitchell et al. 2006 Note de bas de page 46 |
1999 à 2002 |
<33 sAG ou 33-35 sAG avec maladie pulmonaire chronique (MPC) ou sortie sous oxygène et âgés <6 m |
HVRS |
24 |
13,9 à 74,4 % |
||
Pedraz et al. 2003 Note de bas de page 47 |
1998 à 2002 |
≤28 sAG et âgés de <12 mois sans MPC |
HVRS |
14 |
8,3 à 32,4 % |
||
Pedraz et al. 2003 Note de bas de page 47 |
1998 à 2002 |
29-32 sAG et âgés de <6 mois sans MPC |
HVRS |
14 |
10,8 à 18,1 % |
||
Singleton et al. 2003 Note de bas de page 59 |
1993 à 2001 |
≤32 sAG, 32-35 sAG avec maladie chronique, ≤36 sAG avec maladie respiratoire signifiante en période néonatale, 1 saison du VRS. Alaska |
HVRS |
2,1 à 8,9 % |
|||
Prais et al. 2016 Note de bas de page 21 |
2000 à 2003 |
<29 sAG +/- DBP |
HVRS au cours des 2 premières années de vie |
2 |
1,4 à 3,1 % |
||
Chi et al. 2014 Note de bas de page 22 |
2011 à 2013 |
≤28 sAG ou ≤35 sAG avec MPC, appariés par score de propension |
HVRS dans les 6 mois |
10 |
6,2 à 23,7 % |
||
Lee et al. 2018 Note de bas de page 30 |
2010 à -2014 |
<27 sAG +/-DBP |
HVRS |
4 |
2,2 à 29 % |
||
| 1. Prématurés sans maladie pulmonaire chronique | 2. | 3. | 4. | 5. | 6. | 7. | |
(Notario et al. 2014 Note de bas de page 37) Données d'IMpact ECR |
1996 |
28 à 31 sAG |
HVRS |
21 |
10 à ‡ |
||
(Notario Note de bas de page 37) ECR |
1996 |
29 à 32 sAG |
HVRS |
17 |
8,9 à 93,6 % |
||
Tavsu et al. 2014 Note de bas de page 48 ECR |
2009 à 2011 |
≤28 sAG et âgés <12 m ou de 29 à 32 sAG et âgés de <6 mois, autrement en bonne santé |
HVRS |
5 |
2,7 à 8,9 % |
||
Farber et al. 2016 Note de bas de page 29 |
2012 à 2014 |
29 à 32 sAG sans maladie chronique |
HVRS |
54 |
27,9 à 547,6 % |
||
(Notario Note de bas de page 37) ECR |
1996 |
29 à 33 sAG |
HVRS |
14 |
8,3 à 43,6 % |
||
Grimaldi et al. 2007 Note de bas de page 52 |
2000-2004 |
≤30 sAG sans DBP |
HVRS |
5,3 à 17,1 % |
|||
(Notario Note de bas de page 37) ECR |
1996 |
32 à 34 sAG |
HVRS |
12 |
6,6 à 39,8 % |
||
IMpact 1998 Note de bas de page 38 ECR |
1996 |
32 à 35 sAG et âgés de ≤6 mois sans DBP |
HVRS |
22 |
10,8 à 1246,3 % |
||
(Notario Note de bas de page 37) ECR |
1996 |
32 à 35 sAG |
HVRS |
13 |
7 à 42,4 % |
||
Blanken et al. 2013 Note de bas de page 49 ECR |
2008 à 2010 |
33 à 35 semaines âgés de <6 mois autrement en bonne santé |
HVRS |
24 |
13,5 à 103,4 % |
||
IMpact 1998 Note de bas de page 38 ECR |
1996 |
≤35 sAG et âgés de ≤6 mois sans DBP |
HVRS |
16 |
10 à 37,6 % |
||
| Maladie pulmonaire chronique (MPC) | |||||||
IMpact 1998 Note de bas de page 38 ECR |
1996 |
MPC âgés de ≤24 mois |
HVRS |
21 |
10,4 à 385,2 % |
||
Pedraz et al. 2003 Note de bas de page 47 |
1998 à 2002 |
MPC âgés de <24 mois |
HVRS |
8 |
4,2 à 22,5 % |
||
Grimaldi et al. 2004 Note de bas de page 55 |
1999 à 2002 |
MPC ≤32 sAG et âgés de <6 mois |
HVRS |
3 |
1,7 à 5,7 % |
||
Chi et al. 2014 Note de bas de page 22 |
2011 à 2013 |
MPC ≤35 sAG VRS et âgés de 6 mois |
HVRS dans les 6 mois |
13 |
7 à 68,4 % |
||
Chi et al. 2014 Note de bas de page 22 |
2011 à 2013 |
MPC ≤28 sAG VRS et âgés de 6 mois |
HVRS dans les 6 mois |
12 |
6,3 à 56,6 % |
||
| Cardiopathie congénitale (CPC) | |||||||
Feltes et al. 2003 Note de bas de page 56 ECR |
1998 à 2002 |
CPC âgés de <24 mois |
HVRS |
23 |
13,8 à 65,3 % |
||
Feltes et al. 2003 Note de bas de page 56 ECR |
1998 à 2002 |
CPC non cyanotique âgés de <24 mois |
HVRS |
15 |
8,9 à 41,3 % |
||
Chiu et al. 2018 Note de bas de page 33 |
2010 à 2016 |
CPC hémodynamiquement significative (CPCHS) âgés <1 an Appariée par score de propension |
HVRS |
45 |
23,6 à 327,2 % |
||
Chiu et al. 2018 Note de bas de page 33 |
2010 à 2016 |
CPC cyanotique âgés de <1 an Appariée par score de propension |
HVRS |
31 |
16 à 260,1 % |
||
Soraiz et al. 2017 Note de bas de page 34 |
1997 à 2016 |
CPCHS âgés de <1 an |
HVRS |
3,7 à 61,5 % |
|||
| Syndrome de Down (SD) | |||||||
Yi et al. 2014 Note de bas de page 63 |
2003 à 2012 |
SD |
HVRS |
12 |
8,1 à >22,7 % |
||
| Fibrose kystique (FK) | |||||||
Groves et al. 2016 Note de bas de page 24 |
1997 à 2007 |
FK (Palivizumb [PVZ] première année de vie) |
HVRS |
6 |
3,3 à 27,2 % |
||
| RÉSULTAT : ADMISSION À L'UNITÉ DE SOINS INTENSIFS (USI) | |||||||
IMpact 1998 Note de bas de page 38 ECR |
1996 |
≤35 sAG et âgés de ≤6 mois ou DBP ≤24 mois |
USI en raison du VRS |
59 |
29,8 à 1948,2 % |
||
Chi et al. 2014 Note de bas de page 22 |
2011 à 2013 |
≤28 sAG ou ≤35 sAG avec MPC Appariée par score de propension |
USI en raison du VRS dans les 6 mois |
16 |
9,1 à 63,3 % |
||
| RÉSULTAT : RESPIRATION SIFFLANTE RÉCURRENTE (RSR) | |||||||
Simoes et al. 2007 Note de bas de page 54 |
2001 à 2002 |
≤35 sAG sans MPC ou CPC |
RSR dans les 2 ans suivant PVZ |
13 |
7 à 46,7 % |
||
Simoes et al. 2007 Note de bas de page 54 |
2001 à 2002 |
32 à 35 sAG |
RSR dans les 2 ans suivant PVZ |
8 |
5 à 17,2 % |
||
Simoes et al. 2007 Note de bas de page 54 |
2001 à 2002 |
29 à 32 sAG |
RSR dans les 2 ans suivant PVZ |
10 |
5,3 à 31,7 % |
||
Simoes et al. 2007 Note de bas de page 54 |
2001 à 2002 |
<29 sAG |
RSR dans les 2 ans suivant PVZ |
15 |
4,1 à ‡ |
||
Simoes et al. 2010 Note de bas de page 28 |
Non précisé |
<36 sAG sans antécédents familiaux d'asthme |
RSR entre 2 et 5 ans |
14 |
7,3 à 117,1 % |
||
Simoes et al. 2010 Note de bas de page 28 |
Non précisé |
<36 sAG sans antécédents familiaux d'atopie |
RSR entre 2 et 5 ans |
10 |
5,2 à 36,9 % |
||
Prais et al. 2016 Note de bas de page 21 |
2000 à 2003 |
<29 s +/- DBP |
RSR au cours des 2 premières années de vie |
3 |
1,5 à 4,8 % |
||
Blanken et al. 2013 Note de bas de page 49 ECR |
2008 à 2010 |
33-35 sAG et âgés de <6 mois autrement en bonne santé |
RSR au cours de la première année de vie |
11 |
6 à 35,4 % |
||
Yoshihara et al. 2013 Note de bas de page 53 |
2007 à 2008 |
33 à 35 sAG sans MPC |
RSR à l'âge de 3 ans |
8 |
4,8 à 23,4 % |
||
Mochizuki et al. 2017 Note de bas de page 27 |
2007 à 2008 |
33 à 35 sAG sans MPC |
RSR à l'âge de 6 ans |
7 |
3,6 à 19,2 % |
||
* NST = nombre de sujets à traiter (réduction absolue du risque [RaR] = taux d'événements actuels - taux d'événements attendus; NST = 1/RaR x 100).
† ECR = essai contrôlé randomisé. Toutes les études non étiquetées ECR sont des études d'observation de cohorte.
‡ L'intervalle de confiance à 95 % pour la RaR s'étend d'un nombre négatif à un nombre positif.
1. Calcul de l'auteur : NST=3,4. Note de bas de page 2 Calcul de l'auteur : NST=6. Note de bas de page 3 Calcul de l'auteur : NST=7.
Les études ou groupes d'études pour lesquels aucun effet PVZ significatif n'a été trouvé ne sont pas inclus dans ce tableau.
Références
- Note de bas de page 1
-
American Academy of Pediatrics Committee on Infectious Diseases; American Academy of Pediatrics Bronchiolitis Guidelines Committee. Updated guidance for palivizumab prophylaxis among infants and young children at increased risk of hospitalization for respiratory syncytial virus infection. Pediatrics. Août 2014;134(2):415-20.
- Note de bas de page 2
-
American Academy of Pediatrics Committee on Infectious Diseases; American Academy of Pediatrics Bronchiolitis Guidelines Committee. Technical report. Updated guidance for palivizumab prophylaxis among infants and young children at increased risk of hospitalization for respiratory syncytial virus infection. Pediatrics. Août 2014;134(2):e620-38.
- Note de bas de page 3
-
Robinson J.L. et Le Saux N., Canadian Paediatric Society Infectious Diseases and Immunization Committee. Preventing hospitalizations for respiratory syncytial virus. Paediatr Child Health 2015;20(6):321.26.
- Note de bas de page 4
-
Breton M., Rossignol M., Tardif M. et al. Effet du palivizumab en prophylaxie sur la diminution des complications associées au virus respiratoire syncytial chez les enfants : revue systématique. Institut national d'excellence en santé et en services sociaux (INESSS). 2017. 65 p. http://www.santecom.qc.ca/Bibliothequevirtuelle/INESSS/9782550761891.pdf.
- Note de bas de page 5
-
Bont L., Checchia P.A., Fauroux B. et al. Defining the epidemiology and burden of severe respiratory syncytial virus infection among infants and children in western countries. Infect Dis Ther (2016) 5:271–298.
- Note de bas de page 6
-
Shi T., McAllister D.A., O'Brien K.L. et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in young children in 2015: a systematic review and modelling study. Lancet. 2 sept. 2017; 390(10098):946-958.
- Note de bas de page 7
-
Gouvernement du Canada. Détection de virus des voies respiratoires au Canada. 2014-2019:2020. https ://www.canada.ca/fr/sante-publique/services/surveillance/detection-virus-voies-respiratoires-canada.html.
- Note de bas de page 8
-
Butt M.L., Symington M., Janes M., Elliott L., Steele S. et Paes B.A. The impact of prophylaxis on paediatric intensive care unit admissions for RSV infection: a retrospective, single-centre study. Eur J Pediatr (2011) 170:907–913.
- Note de bas de page 9
-
Schanzer D.L., Langley J.M. et Tam T.W.S. Hospitalization attributable to influenza and other viral respiratory illnesses in Canadian children Pediatr Infect Dis J 2006;25:795–800.
- Note de bas de page 10
-
Pisesky A., Benchimol E.I., Wong C.A. et al. Incidence of hospitalization for respiratory syncytial virus infection amongst children in Ontario, Canada: A population-based study using validated health administrative data. PLOS ONE | DOI:10.1371/journal.pone.0150416, 9 mars 2016. http ://journals.plos.org/plosone/article?id=10.1371/journal.pone.0150416.
- Note de bas de page 11
-
Scheltema N.M., Gentile A., Lucion F. et al. Global respiratory syncytial virus-associated mortality in young children (RSV GOLD): a retrospective case series. Lancet Glob Health. Octobre 2017;5(10):e984-e991.
- Note de bas de page 12
-
Tam J., Papenburg J., Fanella S., Asner S.,Barton M., Bergeron C., Desai S. et al. Pediatric Investigators Collaborative Network on Infections in Canada study of respiratory syncytial virus-associated deaths in pediatric patients in Canada, 2003–2013. Clin Infect Dis 2019;68(1):113–9.
- Note de bas de page 13
-
Comité consultatif national de l'immunisation. Déclaration concernant l'usage recommandé de l'anticorps monoclonal anti-RSV antibody (palivizumab). RMTC 2003;29.ACS-7,8.
- Note de bas de page 14
-
Shea B.J., Grimshaw J.M., Wells G.A. et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Medical Research Methodology 2007, 7:10 https ://www.ncbi.nlm.nih.gov/pubmed/17302989 consulté en janvier 2018.
- Note de bas de page 15
-
CASP. Critical Appraisal Skills Programme. CASP checklists. http://www.casp-uk.net/#!casp-tools-checklists/c18f8.
- Note de bas de page 16
-
Harris R.P., Helfand M., Woolf S.H. et al. Current methods of the US Preventive Services Task Force: a review of the process. Am J Prev Med. 2001;20(3S):21-35.
- Note de bas de page 17
-
Robinson K.A., Odelola O.A. et Saldanha I.J. Palivizumab for prophylaxis against respiratory syncytial virus infection in children with cystic fibrosis. Cochrane Database of Systematic Reviews 2016, no 7, art. no CD007743. DOI: 10.1002/14651858.CD007743.pub6.
- Note de bas de page 18
-
18. Kua K.P. et Lee S.W.H. Systematic review of the safety and efficacy of palivizumab among infants and young children with cystic fibrosis. Pharmacotherapy 2017;37(6):755–769.
- Note de bas de page 19
-
Simoes E.A.F., Bont L., Manzoni P. et al. Past, present and future approaches to the prevention and treatment of respiratory syncytial virus infection in children. Infect Dis Ther 2018;7:87–120.
- Note de bas de page 20
-
Blake S.M., Tanaka D., Bendz L.M. et al. Evaluation of the financial and health burden of infants at risk for respiratory syncytial virus. Advances in Neonatal Care 2017;17(4):292-298.
- Note de bas de page 21
-
Prais D., Kaplan E., Klinger G. et al. Short- and long-term pulmonary outcome of palivizumab in children born extremely prematurely. Chest 2016;149(3): 802-8.
- Note de bas de page 22
-
Chi H., Hsu C.H., Chang J.H. et al. A novel six consecutive monthly doses of palivizumab prophylaxis protocol for the prevention of respiratory syncytial virus infection in high-risk preterm infants in Taiwan. PLOS ONE 2014; 9(6):e100981.
- Note de bas de page 23
-
Narbona-Lopez E., Uberos J., Checa-Ros A. et al. Prevention of syncytial respiratory virus infection with palivizumab: descriptive and comparative analysis after 12 years of use. Minerva Pediatrica 2018;70(6):513-8.
- Note de bas de page 24
-
Groves H.E., Jenkins L., Macfarlane M. et al. Efficacy and long-term outcomes of palivizumab prophylaxis to prevent respiratory syncytial virus infection in infants with cystic fibrosis in Northern Ireland. Pediatr Pulmon 2016;51:379–385.
- Note de bas de page 25
-
Bjornson C., Chan P., Li A. et al. Palivizumab prophylaxis for respiratory syncytial virus in infants with cystic fibrosis: is there a need? Eur J Clin Microbiol Infect Dis. Juin 2018;37(6):1113-1118.
- Note de bas de page 26
-
Fink A.K., Graff G., Byington C.L. et al. Palivizumab and long-term outcomes in cystic fibrosis. Pediatrics 2019;144(1):e20183495.
- Note de bas de page 27
-
Mochizuki H., Kusuda S., Okada K. et al., on behalf of the Scientific Committee for Elucidation of Infantile Asthma. Palivizumab prophylaxis in preterm infants and subsequent recurrent wheezing. Six-year follow-up study. Am J Respir Crit Care Med 2017;196 (1):29–38.
- Note de bas de page 28
-
Simoes E.A.F., Carbonell-Estrany X., Rieger C.H.L. et al., on behalf of the Palivizumab Long-Term Respiratory Outcomes Study Group. The effect of respiratory syncytial virus on subsequent recurrent wheezing in atopic and nonatopic children. J Allergy Clin Immunol 2010;126:256-62.
- Note de bas de page 29
-
Farber H.J., Buckwold F.J., Lachman B. et al. Observed effectiveness of palivizumab for 29–36-week gestation infants. Pediatrics.2016;138(2):e20160627
- Note de bas de page 30
-
Lee S.-Y.R., Kwok K.L., Ng D.K.K. et Hon K.L. Palivizumab for infants < 29 weeks in Hong Kong without a clear-cut season for respiratory syncytial virus infection—A cost-effectiveness analysis. J Trop Pediatr 2018;64:418–425.
- Note de bas de page 31
-
Lacaze-Masmonteil T., Truffert P., Pinquier D. et al. Lower respiratory tract illness and RSV prophylaxis in very premature infants. Arch Dis Child 2004;89:562–567.
- Note de bas de page 32
-
Priante E., Tavella E., Girardi E. et al. Restricted palivizumab recommendations and the impact on RSV hospitalizations among infants born at > 29 weeks of gestational age: An Italian multicenter study. Am J Perinatol 2019;36(suppl S2):S77–S82.
- Note de bas de page 33
-
Chiu S.N., Wang J.N., Fu Y.C. et al. Efficacy of a novel palivizumab prophylaxis protocol for respiratory syncytial virus infection in congenital heart disease: A multicenter study. J Pediatr 2018;195:108-14.
- Note de bas de page 34
-
Soraiz M.G., Andrés S.B., Castro S.B. et al. Palivizumab in infants less than 1 year with hemodynamically significant congenital heart disease in Argentina. A comparative study with historical control group. Cardiology in the Young: 2017 Suppl. 4, WCPCCS 2017 Abstract P2182 -S165-6
- Note de bas de page 35
-
Sánchez-Luna M., Medrano C. et Lirio J. au nom du groupe d'étude RISK-21. Down syndrome as risk factor for respiratory syncytial virus hospitalization: A prospective multicenter epidemiological study. Influenza Other Respi Viruses 2017; 11: 157–164.
- Note de bas de page 36
-
Kimura T., Takeuchi M. et Kawakami K. Utilization and efficacy of palivizumab for children with Down syndrome. Pediatrics International 2020; 62:677–682.
- Note de bas de page 37
-
Notario G., Vo P., Gooch K. et al. Respiratory syncytial virus-related hospitalization in premature infants without bronchopulmonary dysplasia: subgroup efficacy analysis of the IMpact-RSV trial by gestational age group. Pediatr Health Med Therapeut 2014:5:43–48.
- Note de bas de page 38
-
IMpact-RSV. Palivizumab, a humanized respiratory syncytial virus monoclonal antibody, reduces hospitalization from respiratory syncytial virus infection in high-risk infants. The IMpact-RSV Study Group. Pediatrics 1998;102(3):531-7.
- Note de bas de page 39
-
Scheltema N.M., Nibbelke E.E., Pouw J. et al. Respiratory syncytial virus prevention and asthma in healthy preterm infants: a randomised controlled trial. Lancet Respir Med 2018; 6: 257–64.
- Note de bas de page 40
-
Anderson E.J., Carosone-Link P., Yogev R., Yi J. et Simoes E.A.F. Effectiveness of palivizumab in high-risk infants and children. A propensity score weighted regression analysis. Pediatr Infect Dis J 2017;36 (8):699-704.
- Note de bas de page 41
-
Buchs C., Dalphin M-L., Sanchez S. et al. Palivizumab prophylaxis in infants with cystic fibrosis does not delay first isolation of Pseudomonas aeruginosa or Staphylococcus aureus. Eur J Pediatr 2017;176:891–897.
- Note de bas de page 42
-
Robinson K.A., Odelola O.A. et Saldanha I.J. Palivizumab for prophylaxis against respiratory syncytial virus infection in children with cystic fibrosis. Cochrane Database Syst Rev 2014;22(5):CD007743.
- Note de bas de page 43
-
Cohen A.H., Boron M.L. et Dingivan C. A phase IV study of the safety of Synagis®(Palivizumab) for prophylaxis of respiratory syncytial virus disease in children with cystic fibrosis [Affiche présentée dans le cadre de l'American Thoracic Society International Conference, 20 au 25 mai 2005 à San Diego, CA]. 2005.
- Note de bas de page 44
-
Andabaka T. et Rojas-Reyes M.X. Cochrane in context: Monoclonal antibody for reducing the risk of respiratory syncytial virus infection in children. Evid Based Child Health 2013;8(6):2377-9.
- Note de bas de page 45
-
Checchia P.A., Nalysnyk L., Fernandes A.W. et al. Mortality and morbidity among infants at high risk for severe respiratory syncytial virus infection receiving prophylaxis with palivizumab: A systematic literature review and meta-analysis. Pediatr Crit Care Med 2011;12(5):580-8.
- Note de bas de page 46
-
Mitchell I., Tough S., Gillis L. et Majaesic C. Beyond randomized controlled trials: A « real life » experience of respiratory syncytial virus infection prevention in infancy with and without palivizumab. Pediatr Pulmonol 2006;41(12):1167-74.
- Note de bas de page 47
-
Pedraz C., Carbonell-Estrany X., Figueras-Aloy J.et Quero J. Effect of palivizumab prophylaxis in decreasing respiratory syncytial virus hospitalizations in premature infants. Pediatr Infect Dis J 2003;22(9):823-7.
- Note de bas de page 48
-
Tavsu I., Gursoy T., Dirman S., Erbil N. et Ovali F. Palivizumab prophylaxis: Does it have any influence on the growth and development of the infants? Am J Perinatol 2014;31(8):667-72.
- Note de bas de page 49
-
Blanken M.O., Rovers M.M., Molenaar J.M. et al. Respiratory syncytial virus and recurrent wheeze in healthy preterm infants. N Engl J Med 2013;368(19):1791-9.
- Note de bas de page 50
-
Wegner S., Vann J.J., Liu G. et al. Direct cost analyses of palivizumab treatment in a cohort of at-risk children: Evidence from the North Carolina Medicaid Program. Pediatrics 2004;114(6):1612-9.
- Note de bas de page 51
-
Winterstein A.G., Knox C.A., Kubilis P. et Hampp C. Appropriateness of age thresholds for respiratory syncytial virus immunoprophylaxis in moderate-preterm infants: a cohort study. JAMA Pediatrics 2013;167 (12):1118-24.
- Note de bas de page 52
-
Grimaldi M., Gouyon B., Sagot P., Quantin C., Huet F. et Gouyon J.B. Palivizumab efficacy in preterm infants with gestational age < or = 30 weeks without bronchopulmonary dysplasia. Pediatr Pulmonol 2007;42(3):189-92.
- Note de bas de page 53
-
Yoshihara S., Kusuda S., Mochizuki H., Okada K., Nishima S. et Simoes E.A. Effect of palivizumab prophylaxis on subsequent recurrent wheezing in preterm infants. Pediatrics 2013;132(5):811-8.
- Note de bas de page 54
-
Simoes E.A., Groothuis J.R., Carbonell-Estrany X., Rieger C.H., Mitchell I., Fredrick L.M. et Kimpen J.L. Palivizumab prophylaxis, respiratory syncytial virus, and subsequent recurrent wheezing. J Pediatr 2007;151(1):34-42, 42.e1
- Note de bas de page 55
-
Grimaldi M., Gouyon B., Michaut F., Huet F. et Gouyon J.B. Severe respiratory syncytial virus bronchiolitis: epidemiologic variations associated with the initiation of palivizumab in severely premature infants with bronchopulmonary dysplasia. Pediatr Infect Dis J 2004;23(12):1081-5.
- Note de bas de page 56
-
Feltes T.F., Cabalka A.K., Meissner H.C., Piazza F.M., Carlin D.A,. Top F.H. jr et al. Palivizumab prophylaxis reduces hospitalization due to respiratory syncytial virus in young children with hemodynamically significant congenital heart disease. J Pediatr 2003;143(4):532-40.
- Note de bas de page 57
-
Harris K.C., Anis A.H., Crosby M.C., Cender L.M., Potts J.E. et Human D.G. Economic evaluation of palivizumab in children with congenital heart disease: A Canadian perspective. Can J Cardiol 2011;27(4):523.e11-5.
- Note de bas de page 58
-
Banerji A., Panzov V., Young M., Lee B.E., Mamdani M., Giles B.L. et al. The real-life effectiveness of palivizumab for reducing hospital admissions for respiratory syncytial virus in infants residing in Nunavut. Can Respir J 2014;21(3):185-9.
- Note de bas de page 59
-
Singleton R., Dooley L., Bruden D., Raelson S. et Butler JC. Impact of palivizumab prophylaxis on respiratory syncytial virus hospitalizations in high risk Alaska Native infants. Pediatr Infect Dis J 2003;22(6):540-5.
- Note de bas de page 60
-
Banerji A., Panzov V., Young M., Robinson J., Lee B., Moraes T., Mamdani M. et al. Hospital admissions for lower respiratory tract infections among infants in the Canadian Arctic: a cohort study. CMAJ OPEN 2016: 4(4);E615-622. DOI:10.9778/cmajo.20150051.
- Note de bas de page 61
-
Giebels K., Marcotte J.E., Podoba J., Rousseau C., Denis M.H., Fauvel V. et Laberge S. Prophylaxis against respiratory syncytial virus in young children with cystic fibrosis. Pediatr Pulmonol 2008;43(2):169-74.
- Note de bas de page 62
-
Winterstein A.G., Eworuke E., Xu D. et Schuler P. Palivizumab immunoprophylaxis effectiveness in children with cystic fibrosis. Pediatr Pulmonol 2013;48(9):874-84.
- Note de bas de page 63
-
Yi H., Lanctôt K.L., Bont L., Bloemers B.L., Weijerman M., Broers C. et al. Respiratory syncytial virus prophylaxis in Down syndrome: A prospective cohort study. Pediatrics 2014;133(6):1031-7.
- Note de bas de page 64
-
Homaira N., Rawlinson W., Snelling T.L. et Jaffe A. Effectiveness of palivizumab in preventing RSV hospitalization in high risk children: A real-world perspective. Int J Pediatr 2014;2014:571609.
- Note de bas de page 65
-
Morris S.K., Dzolganovski B., Beyene J. et Sung L. A meta-analysis of the effect of antibody therapy for the prevention of severe respiratory syncytial virus infection. BMC Infect Dis 2009;9:106.
- Note de bas de page 66
-
Pons J.M., Tebe C., Paladio N., Garcia-Altes A., Danes I. et Valls I.S.A. Meta-analysis of passive immunoprophylaxis in paediatric patients at risk of severe RSV infection. Acta Paediatr 2011;100(3):324-9.
- Note de bas de page 67
-
Wegzyn C., Toh.L.K., Notario G., Biguenet S., Unnebrink K. Park C. et al. Safety and effectiveness of palivizumab in children at high risk of serious disease due to respiratory syncytial virus infection: A systematic review. Infect Dis Ther 2014;3(2):133-58
