Utilisation recommandée du palivizumab pour réduire les complications de l’infection par le virus respiratoire syncytial chez les nourrissons

Télécharger le format de rechange
(Format PDF, 1.7 Mo, 182 pages)
Organisation : Agence de la santé publique du Canada
Date de publication : 1 juin 2022
Date de publication : 1 juin 2022
Sur cette page
- Préambule
- Sommaire de l'information contenue dans la présente déclaration du CCNI
- Introduction
- Méthodologie
- Épidémiologie
- III.1 Fardeau de la maladie dans certains groupes à haut risque
- III.2 Infection par le VRS et séquelles à long terme : respiration sifflante récurrente, asthme et fonction pulmonaire
- III.3 Réinfection par le VRS
- III.4 Risque d'infection par le VRS dans une fratrie avec naissances multiples
- III.5 Infections par le VRS liées aux soins de santé
- Produit
- Économie
- Facteurs d'éthique, d'équité, de faisabilité et d'acceptabilité à prendre en considération
- Recommandations
- Priorités de recherche
- Problèmes liés à la surveillance
- Abréviations
- Remerciements
- Annexe A : Critères actuels de réception du palivizumab dans les provinces et territoires du Canada et à l'échelle internationale
- Annexe B : Innocuité du palivizumab
- Annexe C : Efficacité réelle du palivizumab : Tableau des données supplémentaires
- Références
Préambule
Le Comité consultatif national de l'immunisation (CCNI) donne à l'Agence de la santé publique du Canada (ASPC) des conseils continus et à jour liés à l'immunisation dans le domaine de la médecine, des sciences et de la santé publique.
En plus de la prise en compte du fardeau associé aux maladies et des caractéristiques vaccinales, l'ASPC a élargi le mandat du CCNI de façon à lui permettre d'inclure l'étude systématique des facteurs liés aux programmes dans la formulation de ses recommandations axées sur des données probantes. Cette initiative devrait aider le CCNI à prendre des décisions en temps opportun en ce qui a trait aux programmes de vaccination à fonds publics à échelle provinciale et territoriale.
Les nouveaux facteurs que le CCNI devra examiner de façon systématique sont les suivants : économie, équité, éthique, acceptabilité et faisabilité. Les déclarations du CCNI ne nécessiteront pas toutes une analyse approfondie de l'ensemble des facteurs programmatiques. Même si l'étude systématique des facteurs liés aux programmes sera effectuée à l'aide d'outils fondés sur des données probantes afin de cerner les problèmes distincts susceptibles d'avoir une incidence sur la prise de décision pour l'élaboration des recommandations, seuls les problèmes distincts considérés comme étant propres au vaccin ou à la maladie évitable par la vaccination seront inclus.
L'ASPC confirme que les conseils et les recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes et diffuse ce document à des fins d'information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la monographie de produit pertinente. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait homologuer les vaccins et ont démontré leur innocuité et leur efficacité potentielle lorsqu'ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, notamment déclarer chaque année les conflits d'intérêts possibles.
Sommaire de l'information contenue dans la présente déclaration du CCNI
Le texte suivant résume l'information importante pour les vaccinateurs. Voir le reste de la Déclaration pour plus de précisions.
1. Quoi?
Maladie du virus respiratoire syncytial
Le virus respiratoire syncytial (VRS) provoque chaque année au Canada des éclosions de maladies des voies respiratoires (VR), de la fin de l'automne jusqu'au début du printemps. C'est la cause la plus fréquente des maladies des VR inférieures chez les jeunes enfants dans le monde entier. Si de nombreuses infections sont de simples rhumes, les enfants de moins de 2 ans risquent de contracter une maladie sévère comme la bronchiolite ou la pneumonie et peuvent être hospitalisés. Les problèmes de santé sous-jacents, notamment la naissance prématurée, les maladies pulmonaires chroniques et les cardiopathies congénitales (CPC), prédisposent aux maladies sévères attribuables au VRS. Les réinfections peuvent se produire tout au long de la vie, car l'infection ne produit qu'une immunité partielle et temporaire, bien que les réinfections soient généralement moins sévères que la maladie initiale.
Palivizumab
Il n'existe actuellement aucun vaccin pour prévenir l'infection par le VRS. Le seul moyen de prophylaxie est une protection passive temporaire avec la préparation d'anticorps monoclonaux palivizumab (SynagisMC). Le palivizumab (PVZ) a uniquement été étudié chez les enfants âgés de moins de 2 ans présentant des problèmes de santé sous-jacents. Son efficacité potentielle dans les premières études était de 38 à 78 % pour différents groupes de patients; les études ultérieures, principalement d'observation, ont montré une grande variation de l'effet, certaines études ne montrant aucun bienfait. Le PVZ est utilisé depuis plus de 2 décennies dans de nombreux pays et présente un bon bilan en matière d'innocuité, les très rares cas d'anaphylaxie constituant le principal évènement indésirable grave (ÉIG). Il s'agit d'un produit coûteux, dont les estimations du rapport coût/efficacité (ou du rapport qualité/prix) sont très variables. Les rapports coût/efficacité différentiels (RCED) estimés allaient de moins de 1 000 $ par année de vie ajustée par la qualité (AVAQ) à plus de 2 millions de dollars par AVAQ selon divers scénarios. Dans divers groupes à haut risque, de 64 à 100 % des estimations étaient inférieures à 50 000 $ par AVAQ. Dans de rares cas, il peut être dominant (c.-à-d. moins coûteux et plus efficient). Des vaccins contre le VRS sont actuellement à l'étude.
2. Qui?
Voici les recommandations du CCNI relatives au processus décisionnel à l'échelle des programmes de santé publique :
- Le PVZ devrait être proposé : aux nourrissons prématurés de moins de 30 semaines d'âge gestationnel (sAG) et qui sont âgés de moins de 6 mois au début de la saison du VRS ou pendant celle-ci; aux enfants âgés de moins de 24 mois qui souffrent d'une maladie pulmonaire chronique (MPC) due à la prématurité et qui ont besoin d'une oxygénothérapie continue dans les 6 mois précédant la saison du VRS ou pendant celle-ci; aux nourrissons de moins de 12 mois atteints d'une cardiopathie chronique hémodynamiquemment significative (CPCHS), mais non congénitale; aux enfants âgés de 12 à 24 mois qui attendent une transplantation cardiaque ou qui ont en subie une dans les 6 mois suivant le début de la saison du VRS; ainsi qu'aux nourrissons de moins de 36 sAG, qui sont âgés de moins de 6 mois, qui vivent dans des communautés inuites éloignées du Nord et qui nécessiteraient un déplacement en avion advenant une hospitalisation. Pour les enfants atteints à la fois d'une CPCHS et d'une MPC, il y a lieu de suivre les recommandations relatives à une MPC.
- Le PVZ peut être envisagé pour les nourrissons prématurés nés de 30 à 32 sAG, qui sont âgés de moins de 3 mois et qui présentent un risque élevé d'exposition au VRS; pour certains enfants de moins de 24 mois qui souffrent d'une MPC sévère due à la fibrose kystique (FK) ou à une autre étiologie et qui ont besoin d'une oxygénothérapie continue ou d'une ventilation assistée dans les 6 mois précédant la saison du VRS ou pendant celle-ci; pour les nourrissons de moins de 12 mois atteints d'une cardiopathie chronique autre que congénitale, importante sur le plan hémodynamique; pour les enfants de 12 à 24 mois en attente d'une transplantation cardiaque ou ayant subi une transplantation cardiaque dans les 6 mois précédant le début de la saison du VRS; et pour les enfants de moins de 24 mois présentant une immunodéficience sévère. Il peut également être envisagé pour les nourrissons nés à terme et âgés de moins de 6 mois vivant dans des communautés inuites éloignées présentant des taux élevés d'hospitalisation due au VRS parmi les nourrissons nés à terme; et pour les nourrissons de moins de 36 sAG, qui sont âgés de moins de 6 mois et qui vivent dans d'autres communautés éloignées présentant des taux d'hospitalisation liés au VRS élevés et où un déplacement par avion s'imposerait pour une hospitalisation. Le PVZ peut être envisagé en dernier recours pour le contrôle des éclosions de VRS dans les unités néonatales de soins intensifs (UNSI) en cas d'échec de toutes autres mesures.
- Le PVZ ne doit pas être proposé aux nourrissons par ailleurs en bonne santé nés à 33 sAG ou après; ni aux frères et sœurs d'une naissance multiple qui ne remplissent pas les conditions requises pour une prophylaxie. Il ne devrait pas être offert systématiquement aux enfants de moins de 24 mois atteints de FK; ni aux enfants de moins de 24 mois atteints du syndrome de Down sans autres critères pour le PVZ; ni aux nourrissons nés à terme et en bonne santé vivant dans des communautés inuites nordiques éloignées, à moins que le taux d'hospitalisation due au VRS y soit très élevé. Il ne devrait pas être utilisé pour prévenir une respiration sifflante récurrente ou l'asthme en l'absence d'autres indications.
- Le PVZ ne devrait pas être administré pour prévenir l'infection par le VRS associée à une hospitalisation chez les enfants admissibles qui demeurent hospitalisés. Il peut être envisagé pour le contrôle d'éclosions du VRS dans les UNSI en cas d'échec de toutes autres mesures.
Étant donné qu'au Canada, le PVZ n'est pas facilement disponible à l'achat, aucune recommandation particulière n'est faite pour le processus décisionnel à l'échelle individuelle.
3. Comment?
- La dose de PVZ est de 15 mg/kg par injection intramusculaire (IM), en commençant au début de la saison locale du VRS. Les enfants admissibles qui sont hospitalisés doivent recevoir leur première dose à leur sortie de l'hôpital (ou dans les 48 à 72 heures avant leur sortie pour faciliter l'échange des fioles). L'intervalle entre la première et la deuxième dose devrait être de 21 à 28 jours, et de 28 à 35 jours entre les doses suivantes, pour un maximum de 4 doses.
- Une dose supplémentaire devrait être administrée après un pontage cardiaque ou une oxygénation par membrane extracorporelle. Une dose supplémentaire peut être envisagée dans les régions nordiques éloignées où les éclosions de VRS peuvent durer plus longtemps qu'ailleurs.
- Le PVZ doit être arrêté pour le reste de la saison si un enfant est hospitalisé pour une infection par le VRS.
- Si possible, des cliniques ou des rendez-vous doivent être organisés pour faciliter l'échange des fioles, afin de réduire les coûts.
- Le PVZ est contre-indiqué chez les personnes présentant une réaction d'hypersensibilité importante connue au PVZ ou à tout composant du produit (anticorps monoclonal humanisé, glycine, histidine). Une maladie modérée à sévère, avec ou sans fièvre, est une raison de différer l'utilisation du PVZ, pour éviter de superposer des évènements indésirables (ÉI) du PVZ à la maladie sous-jacente, ou de déterminer par erreur une manifestation de la maladie sous-jacente comme une complication du PVZ. La décision de différer l'utilisation du PVZ dépend de la gravité et de l'étiologie de la maladie sous-jacente. Les maladies mineures telles que le rhume, avec ou sans fièvre, ne sont pas des contre-indications à l'utilisation du PVZ.
- Le PVZ contient uniquement des anticorps contre le VRS et peut être co-administré avec tout autre vaccin vivant ou inactivé.
4. Pourquoi?
Le PVZ est recommandé pour les nourrissons et les jeunes enfants présentant des problèmes de santé qui les rendent plus vulnérables à une maladie sévère liée au VRS nécessitant une hospitalisation et éventuellement une admission en unité de soins intensifs (USI) et une ventilation mécanique (VM).
Bien que le risque de maladie sévère liée au VRS soit réduit, le PVZ ne prévient pas toutes hospitalisations. On pense qu'il permet de prévenir de 40 à 80 % des hospitalisations, selon l'âge et l'état de santé sous-jacent. Par conséquent, sont également importants d'autres moyens de protection contre le VRS : comme limiter l'exposition des enfants à haut risque aux personnes souffrant d'une toux et d'un rhume, assurer une hygiène appropriée des mains et prévenir l'exposition à la fumée de cigarette.
Bien que tout jeune enfant puisse être hospitalisé en raison du VRS, la plupart d'entre eux ne développeront pas une forme sévère de la maladie. Le PVZ n'est pas recommandé pour les enfants présentant un risque moindre de maladie sévère, soit en raison de son coût, soit en raison du manque de renseignements sur son efficacité.
Introduction
Le virus respiratoire syncytial (VRS) est la cause la plus fréquente des maladies des voies respiratoires (VR) inférieures chez les jeunes enfants dans le monde entierNote de bas de page 1 Note de bas de page 2.
À l'heure actuelle, le seul agent immunisant existant pour la prévention des maladies graves liées au VRS est le palivizumab (PVZ), un anticorps monoclonal anti-VRS. Plusieurs vaccins candidats actifs font actuellement l'objet d'essais cliniques chez les nourrissons, les femmes enceintes et les adultesNote de bas de page 3. Les vaccins contre le VRS ne seront pas abordés dans cette déclaration.
En juin 2002, Santé Canada a approuvé le palivizumab (SynagisMC) pour la prévention des maladies graves des VR inférieures causées par le VRS chez les nourrissons présentant un risque élevé de développer une forme grave de la maladie. En 2003, le Comité consultatif national de l'immunisation (CCNI) a publié des recommandations sur l'utilisation du PVZ pour la prévention de la maladie liée au VRSNote de bas de page 4. À l'époque, il recommandait d'utiliser le PVZ pendant la saison du VRS chez les nourrissons prématurés (ceux de 32 sAG ou moins) âgés de moins de 6 mois au début de la saison du VRS, chez les enfants de moins de 24 mois atteints d'une maladie pulmonaire chronique (MPC) due à la prématurité ayant nécessité une oxygénothérapie ou une thérapie médicale au cours des 6 mois précédents, ou d'autres troubles pulmonaires nécessitant une oxygénothérapie, et chez les enfants de moins de 24 mois atteints d'une cardiopathie congénitale hémodynamiquement significative (CPCHS). La prophylaxie par PVZ pourrait également être envisagée pour les enfants nés à moins de 35 sAG, qui ont moins de 6 mois au début de la saison du VRS, et qui vivent dans des communautés nordiques éloignéesNote de bas de page 4. Depuis la Déclaration de 2003, les recommandations du CCNI ont été modifiées dans le Guide canadien d'immunisation (GCI), mais aucune nouvelle déclaration n'a été publiée. Depuis 2013, en plus des recommandations ci-dessus, le GCI indique que la prophylaxie par PVZ peut être bénéfique pour certains nourrissons de 33 à 35 sAG, qui ont moins de 6 mois au début de la saison du VRS, et qu'elle peut être envisagée pour les nourrissons de ce groupe d'âge gestationnel (AG) qui vivent dans des communautés rurales ou éloignées, en fonction d'une évaluation de l'accès aux soins médicaux (p. ex., nécessité d'un transport aérien vers les installations hospitalières) et d'autres facteurs connus pour augmenter le risque. De plus, la prophylaxie par PVZ devrait être envisagée pour tous les enfants inuits des communautés nordiques éloignées qui sont âgés de moins de 6 mois au début de la saison du VRS, peu importe l'AG.
Depuis la publication de la Déclaration du CCNI en 2003, une série de documents d'orientation actualisés sur le PVZ ont été publiés par des comités d'experts, dont l'American Academy of Pediatrics (AAP) en 2009 et en 2014Note de bas de page 5 Note de bas de page 6 Note de bas de page 7 et la Société canadienne de pédiatrie (SCP) en 2015Note de bas de page 8, lesquels ont formulé des recommandations sur la prophylaxie par PVZ qui diffèrent considérablement des orientations du CCNI de 2003, ce qui suggère la nécessité de réévaluer les recommandations du CCNI. On trouvera à l'Annexe A un résumé des critères actuels d'admissibilité au PVZ dans les provinces et territoires (PT) canadiens et dans 10 autres pays de l'hémisphère Nord, intitulé « Recommandations pour l'utilisation du palivizumab au Canada et à l'étranger ».
L'objectif du présent document est de mettre à jour les recommandations précédentes du CCNI concernant l'utilisation du PVZ, en tenant compte des données récentes sur le fardeau de la maladie (FdM) lié au VRS, de l'efficacité potentielle et réelle du PVZ chez les nourrissons à risque d'une maladie liée au VRS plus sévère, ainsi que des répercussions économiques associées à l'utilisation du PVZ.
Objectif des orientations
L'objectif de la présente déclaration d'un comité consultatif est de passer en revue les données probantes et d'élaborer des orientations en vue de stratégies visant à prévenir les conséquences sévères de l'infection par le VRS chez les enfants à haut risque d'une forme sévère de la maladie, par l'administration d'un anticorps monoclonal.
Méthodologie
Le processus d'élaboration des recommandations du CCNI est décrit en détail ailleursNote de bas de page 9.
En bref, voici les étapes générales de la préparation de la présente déclaration du comité consultatif du CCNI :
- Synthèse des connaissances;
- Synthèse du corpus de données sur les avantages et les risques, compte tenu de la qualité des données probantes synthétisées ainsi que de l'ampleur et de la certitude des effets observés dans l'ensemble des études;
- Transposition des données probantes en recommandations.
De plus amples renseignements sur les méthodes fondées sur des données probantes du CCNI sont disponibles dans le document suivant : Recommandations pour l'immunisation fondées sur des données probantes – Méthodes du CCNI, janvier 2009, RMTC.
Pour répondre à l'objectif de cette déclaration, 3 analyses systématiques de la littérature ont été réalisées avec la méthodologie standard du CCNI :
Le FdM lié au VRS chez les jeunes enfants de pays à revenu élevé comparables au Canada :
Une première recherche dans la littérature de 2000 à février 2017 a permis de récupérer 2389 documents. En raison du grand nombre de documents, l'évaluation ultérieure s'est limitée aux examens systématiques, avec l'outil AMSTAR (outil d'évaluation des examens systématiques)Note de bas de page 10. Six examens ont été retenus, affichant des notes de 6 à 7 en moyenne; et aucun n'a obtenu une note plus élevée. Ces examens ont porté sur la littérature de 1995 à 2015.
Une deuxième recherche dans la littérature de 2014 à septembre 2018 a permis de récupérer 1022 documents, dont 29 ont été retenus pour l'évaluation finale de la qualité et l'extraction des données. La date de début a été choisie de manière à pouvoir obtenir des données à partir du moment où l'AAP a modifié en 2014 sa recommandation concernant l'utilisation du PVZ. Deux examinateurs ont évalué de manière indépendante le risque de biais (RdB) pour chaque étude, en utilisant un outil modifié basé sur l'outil d'évaluation des études de cohortes observationnelles et des études transversales (Quality Assessment Tool for Observational Cohort and Cross-sectional Studies) et l'outil QUIPS (Quality in Prognostic Studies). Pour les comparaisons au sein d'une même étude, 2 examinateurs ont évalué de manière indépendante le degré de certitude des données probantes (CDP) pour chaque résultat (élevée, modérée, faible ou très faible), en utilisant les principes de la méthode GRADE (Grading of Recommendations Assessment, Development and Evaluation). Les désaccords ont été résolus par consensus. Les détails de la méthodologie et les résultats de cette recherche sont présentés dans le manuscrit de Wingert et al. 2021Note de bas de page 11 et résumés dans les Sections III.1 et III.2 de la présente déclaration.
Une troisième recherche de la littérature du 1 septembre 2018 au 29 juillet 2020, avec la même stratégie, a permis de récupérer 699 documents supplémentaires, dont 14 ont été retenus pour l'évaluation de la qualité et l'extraction des données.
La recherche de la littérature plus récente n'ayant pas fourni de données sur certaines questions pour lesquelles des recommandations étaient nécessaires, on a plutôt évalué les références antérieures pertinentes relevées dans les examens systématiques ou dans les articles acceptés à partir de la recherche 2014-2018. Quinze études ont été retenues pour l'évaluation de la qualité. Les renseignements provenant de ces études et de la recherche 2018-2020 sont présentées dans les Sections III.1 et III.2 du présent document.
L'efficacité de la prophylaxie par PVZ sur la réduction des complications associées au VRS chez les nourrissons :
Pour plus de détails sur la méthodologie et les résultats, dans le document « NACI Literature Review on the Effects of Palivizumab Prophylaxis on Reducing the Complications Associated with Respiratory Syncytial Virus in Infants » (en anglais seulement) qui sera bientôt disponible. Les données sont résumées à la Section IV.2 de la présente déclarationNote de bas de page 12.
Le rapport coût/efficacité de la prophylaxie par PVZ pour le VRS :
Pour plus de détails sur la méthodologie et les résultats, voir le document intitulé « Cost-Effectiveness of Palivizumab Prophylaxis for Respiratory Syncytial Virus (RSV) : A Systematic Review » (en anglais seulement). Les données sont résumées à la Section V.1 de la présente déclaration.
En plus de ces examens systématiques, d'autres recherches de la littérature ont été effectuées :
- Une analyse environnementale des recommandations relatives à l'utilisation du PVZ dans les PT canadiens et dans d'autres pays de l'hémisphère Nord;
- Une revue rapide de la littérature sur l'innocuité du PVZ;
- Des revues informelles de la littérature quand des renseignements étaient nécessaires pour répondre à des questions précises.
Les résultats des examens (4) et (5) sont ajoutés aux Annexes A et B du présent document. Les renseignements et les données tirés des examens informels (6) sont présentés dans le texte du présent document.
Afin d'élaborer des recommandations détaillées et appropriées au sujet des programmes d'immunisation, le CCNI tient compte d'un certain nombre de facteurs. Outre l'évaluation critique des données probantes relatives au FdM et aux caractéristiques vaccinales, telles que l'innocuité, l'efficacité potentielle, l'immunogénicité et l'efficacité réelle, le CCNI utilise un cadre publié et revu par des pairs ainsi que des outils fondés sur des données probantes pour s'assurer que les questions liées à l'éthique, à l'équité, à la faisabilité et à l'acceptabilité (EEFA) sont systématiquement évaluées et intégrées dans ses directivesNote de bas de page 13. Le secrétariat du CCNI a appliqué ce cadre et les outils d'accompagnement fondés sur des données probantes (filtres d'éthique intégrés, matrice d'équité, matrice de faisabilité, matrice d'acceptabilité) pour prendre systématiquement en compte ces facteurs programmatiques afin d'élaborer des recommandations claires et complètes pour une prise de décision rapide et transparente. Pour plus de détails sur l'élaboration et l'application du cadre EEFA du CCNI et des outils fondés sur des données probantes (y compris les filtres d'éthique intégrés, la matrice d'équité, la matrice de faisabilité et la matrice d'acceptabilité), voir le document https://doi.org/10.1016/j.vaccine.2020.05.051.
Pour la présente déclaration, le CCNI a passé en revue les principales questions pour les examens systématiques de la littérature telles que proposées par le groupe de travail sur le VRS. Après des recherches dans la littérature et une évaluation critique des différentes études, des recommandations ont été proposées pour l'utilisation du PVZ. Le président du groupe de travail sur le VRS et le médecin spécialiste de l'Agence de la santé publique du Canada (ASPC) ont présenté les données et les recommandations proposées au CCNI le 5 février 2020. Après un examen attentif des données et la tenue de consultations lors des réunions du CCNI du 5 février 2020, du 24 septembre 2020 et du 22 octobre 2021, les membres du comité ont voté certaines recommandations. On trouvera dans le texte une description des considérations pertinentes, des justifications des décisions et des lacunes dans les connaissances.
Épidémiologie
Le VRS est un virus à acide ribonucléique (ARN) enveloppé appartenant à la famille des Paramyxoviridae. Il existe 2 sous-groupes basés sur des différences dans la protéine de surface G, et de nombreux génotypes dans ces sous-groupes. L'humain est la seule source d'infection et la transmission se fait par exposition directe ou indirecte aux sécrétions respiratoires contenant le virusNote de bas de page 14.
Le VRS infecte presque tous les nourrissons avant l'âge de 2 ansNote de bas de page 1 Note de bas de page 2. Les présentations cliniques les plus courantes du VRS chez les jeunes enfants nécessitant une hospitalisation (HVRS) sont la bronchiolite (une infection aigüe des VR inférieures associée à une tachypnée, avec toux et respiration sifflante) et la pneumonieNote de bas de page 14 Note de bas de page 15. La primo-infection ne confère pas une immunité protectrice complète. Les réinfections se produisent tout au long de la vie, mais sont généralement moins sévères, et se présentent principalement comme une maladie des VR supérieures chez les enfants plus âgés et les adultesNote de bas de page 14.
Les taux d'HVRS sont les plus élevés chez les enfants de moins d'un an, et plus particulièrement au cours des 2 premiers mois de la vieNote de bas de page 16. Les taux d'HVRS par année par 1000 enfants dans les pays à revenu élevé sont de 26,3 (Intervalle de confiance [IC] à 95 % : 22,8 à 30,2 %); 11,3 (IC à 95 % : 6,1 à 20,9 %) et 1,4 (IC à 95 % : 0,9 à 2,0 %) pour les groupes d'âge 0 à 5 mois, 6 à 11 mois et 12 à 59 mois respectivementNote de bas de page 2. Au Canada, des taux similaires de 20; 10,2 et 4,8 par 1000 enfants par année sont signalés pour les enfants âgés de moins de 6 moisNote de bas de page 15, de moins d'un an, et de 1 à 3 ans, respectivement Note de bas de page 17. En Ontario, 9 % des admissions annuelles à l'hôpital pour des enfants âgés de moins d'un an ont été attribuées au VRSNote de bas de page 17. Le taux de létalité dans les pays à revenu élevé est généralement inférieur à 0,5 %, et des taux plus élevés figurent chez les nourrissons présentant des comorbiditésNote de bas de page 1 Note de bas de page 18. Un total de 82 % des décès dans une étude canadienne concernaient des enfants présentant des facteurs de risque sous-jacents de maladie sévère liée au VRSNote de bas de page 19.
La plupart des enfants de moins de 2 ans ayant subi une HVRS ne présentent aucune comorbiditéNote de bas de page 1 Note de bas de page 17, mais des taux d'HVRS et des durées d'hospitalisation plus élevés, ainsi qu'un plus grand nombre d'admissions en unité de soins intensifs (USI), ont été signalés chez les prématurés et chez les enfants atteints d'une MPC ou d'une cardiopathie congénitale (CPC)Note de bas de page 1 Note de bas de page 8 Note de bas de page 17. Les enfants atteints d'autres maladies pulmonaires non associées à la prématurité, comme la FKNote de bas de page 20, ou d'autres maladies chroniques, notamment l'immunodéficienceNote de bas de page 21 Note de bas de page 22, et les enfants vivant dans des communautés indigènes du Grand NordNote de bas de page 23 peuvent également présenter un risque accru de maladie sévère liée au VRS. Le VRS est de plus en plus reconnu comme une cause importante de morbidité et de mortalité chez les personnes âgéesNote de bas de page 24.
Dans les climats tempérés, le VRS provoque des épidémies chaque hiver. Au Canada, la saison du VRS commence généralement en octobre ou novembre et dure jusqu'en avril ou mai, la plupart des cas étant signalés entre décembre et marsNote de bas de page 25. Les études sur les tendances temporelles des taux d'HVRS ont donné des résultats contradictoires, probablement en raison de différences dans les politiques de dépistage, la sensibilité des tests de diagnostic utilisés et les critères d'hospitalisationNote de bas de page 1. Une étude américaine récente a fait état d'une diminution des taux d'HVRS de 1997 à 2012 pour tous les nourrissons, y compris pour ceux atteints d'une MPC et à risque élevé de CPCNote de bas de page 26.
III.1 Fardeau de la maladie dans certains groupes à haut risque
Les données issues de l'examen systématique du FdM (ESFdM) lié au VRS réalisé en vue de l'élaboration de la présente déclaration sont résumées et intégrées dans les sections pertinentes qui suivent. Compte tenu du petit nombre d'articles relevés et de l'hétérogénéité de la méthodologie utilisée ainsi que des résultats étudiés, l'interprétation des résultats doit être considérée avec prudence. Des renseignements provenant d'études antérieures et de la revue de la littérature 2018-2020 sont également présentés ici.
III.1.1 Nourrissons prématurés sans cardiopathie congénitale ou maladie pulmonaire chronique
III.1.1.1 Hospitalisation
Le risque d'HVRS augmente en fonction de la diminution de l'AG. Dans une étude prospective basée sur une population de jeunes enfants hospitalisés pour une maladie des VR inférieures liée au VRS et confirmée en laboratoire entre 2000-2005, Hall et al. ont signalé des taux d'HVRS par 1000 nourrissons de moins de 24 mois de 19,3; 18,7; 6,3; 6,9 et 5,3 pour les moins de 29 sAG, de 29 à 31 sAG, de 32 à 34 sAG et de 35 sAG ou plus, et des nourrissons à terme, respectivement. Dans leur étude, 38 % des nourrissons présentaient d'autres affections à haut risque et 20 % avaient reçu du PVZNote de bas de page 16.
L'ESFdM lié au VRS chez les jeunes enfants, limité aux publications allant de 2014 à septembre 2018, et la revue actualisée de 2020 n'ont pas permis de relever d'étude sur le FdM lié au VRS chez les prématurés de moins de 29 sAG. Les données issues d'études portant sur des nourrissons moins prématurés sont résumées ci-après.
Lors de comparaisons entre les études, une étude avec une CDP modérée à faible a révélé des taux similaires d'HVRS chez les nourrissons de 29 à 32 sAG et ceux de 33 à 36 sAG au cours de leur première saison du VRS (risque relatif [RR] de 1,20; IC à 95 % : 0,92 à 1,56 %)Note de bas de page 27. Une autre étude, présentant également une CDP modérée à faible, a révélé un RR d'HVRS de 2,05 (IC à 95 % : 1,89 à 2,22 %) pour les nourrissons de 33 à 36 sAG et les nourrissons à terme âgés de moins de 24 moisNote de bas de page 28. Une CDP très faible a été constatée pour le taux d'HVRS dans une étude portant sur les nourrissons de moins de 33 sAG comparativement aux nourrissons à terme lors de leur première saison du VRS (RR 3,88; IC à 95 % : 1,13 à 13,30 %)Note de bas de page 29.
Les proportions mises en commun de patients ayant subi une HVRS (Tableau 1) étaient de 5,1 %; 2,8 %; 3,3 % et 4,1 % pour les nourrissons de 29 à moins de 33 sAGNote de bas de page 27 Note de bas de page 29, de 32 à 34 sAGNote de bas de page 30, de 32 ou 33 à 35 sAGNote de bas de page 27 Note de bas de page 28 Note de bas de page 30 Note de bas de page 31 Note de bas de page 32 Note de bas de page 33 Note de bas de page 34 Note de bas de page 35 et de 35 sAGNote de bas de page 30, respectivement. Le taux d'HVRS chez les enfants à terme en bonne santé était de 1,2 %. Trois des quatre études de ce groupe ont fait état d'un taux d'HVRS pendant la première année de vie (0,8 % à 1,5 %)Note de bas de page 29 Note de bas de page 36 Note de bas de page 37, et une étude a fait état d'un taux d'HVRS jusqu'à l'âge de 24 mois (1,3 %)Note de bas de page 28.
| sAG | Taux d'HVRS | IC à 95 % | Nbre d'études | Risque de biais |
|---|---|---|---|---|
| 29 - <33Note de bas de page 27 Note de bas de page 29 | 5,1 | 4,0 à 6,3 | 2 | Modéré |
| 32 - 34Note de bas de page 30 | 2,8 | 1,6 à 4,0 | 1 | Élevé |
| 32/33 - 35 Note de bas de page 27 Note de bas de page 28 Note de bas de page 30 Note de bas de page 31 Note de bas de page 32 Note de bas de page 33 Note de bas de page 34 Note de bas de page 35 | 3,3 | 2,7 à 4,1 | 8 | Modéré (5), Élevé (3) |
| 35Note de bas de page 30 | 4,1 | 2,8 à 5,4 | 1 | Élevé |
| Naissance à terme, en bonne santé Note de bas de page 28 Note de bas de page 29 Note de bas de page 36 Note de bas de page 37 | 1,2 | 1,1 à 1,2 | 4 | Modéré |
Les comparaisons entre études utilisant des données regroupées (toutes évaluées avec la méthode GRADE avec une CDP très faible en raison de la nature indirecte des données probantes) ont révélé un RR pour le taux d'HVRS pour les prématurés par rapport aux enfants à terme de 4,3 (IC à 95 % : 3,7 à 4,8 %; p = 0,000) pour les nourrissons de 29 à 32 sAG jusqu'à moins de 33 sAG et de 2,8 (IC à 95 % : 2,5 à 3,1 %, p = 0,000) pour les nourrissons de 32 à 35 sAG. Les différences de risque réelles étaient respectivement de 3,9 % (IC à 95 % : 2,7 à 5,1 %) et de 2,1 % (IC à 95 % : 1,4 à 2,8 %).
La mise à jour de la littérature de 2020 a permis de relever 2 études qui ont fait état d'un taux d'HVRS chez des prématurés par ailleurs en bonne santé. Dans un essai contrôlé randomisé (ECR) multinational visant à évaluer l'efficacité du nirsevimab (un nouvel anticorps monoclonal actif contre le VRS), les taux d'HVRS dans les 150 jours suivant l'administration du placebo étaient de 4,3 % et de 4,0 % chez les nourrissons de 29 sAG ou plus à 32 sAG ou moins, et de plus de 32 sAG, respectivement (RdB faible)Note de bas de page 38. Le taux d'HVRS pendant la saison du VRS était de 3,4 % chez les nourrissons de 33 à 35 sAG dans une étude de cohorte rétrospective réalisée au Québec de 2015 à 2017 par Papenburg et al. (RdB modéré)Note de bas de page 39. En outre, un examen systématique, qualifié de moyen par AMSTAR, a fait état de 7 études prospectives observationnelles réalisées entre 2000 et 2008. Le taux regroupé d'HVRS pour les nourrissons autrement en bonne santé de 33 à moins de 35 sAG était de 3,4 % ou de 5,5 pour 100 patients-saisonsNote de bas de page 40.
La littérature antérieure a été examinée pour trouver des données sur des nourrissons plus sévèrement prématurés. Les taux d'HVRS pour les nourrissons pendant leur première saison du VRS dans le bras placebo d'un ECR mené en 1996-1997 sur le PVZ étaient (% et IC : 95 %) de 10,0 (2,8 à 23,7 %), de 7,7 (3,6 à 14,1 %), de 10,1 (5,1, à 17,3 %) et de 8,2 (3,1 à 17 %) pour les nourrissons de moins de 29 sAG, de 29 à 32 sAG, de 32 à 35 sAG et de 33 à 35 sAG respectivement (RdB faible)Note de bas de page 41. Dans une étude de cohorte historique de l'ère pré-PVZ, Stevens et al. ont rapporté des taux d'HVRS chez les nourrissons prématurés d'un an (âge corrigé) sans MPC de 10,2 %; de 8,6 %; de 6,8 % et de 4,3 % pour des nourrissons de 26 sAG ou moins, de 27 à 28 sAG, de plus de 28 à 30 sAG, et de plus de 30 à 32 sAG respectivement. Pour tous les nourrissons de 30 sAG ou moins, le taux d'HVRS était de 8,1 % (RdB modéré)Note de bas de page 42. Boyce et al., à partir des données Medicaid du Tennessee de 1989 à 1993, ont estimé les taux d'HVRS au cours des 6 premiers mois de vie à 93,8; 81,8 et 79,8 par 1000 enfants pour les nourrissons de 28 sAG ou moins, de 29 à moins de 33 sAG, et de 33 à moins de 36 sAG respectivement, et à 44,1 par 1000 enfants pour les nourrissons à faible risque (nourrissons à terme sans MPC ou CPC, ou autre maladie chronique). Les taux d'HVRS au cours des seconds 6 mois de vie étaient de 46,1; de 50 et de 34,5 par 1000 enfants pour ceux de 28 sAG ou moins, de 29 à moins de 33 sAG, et de 33 à 36 sAG respectivement, et de 15 pour les nourrissons à faible risque (RdB modéré)Note de bas de page 43. D'autres études d'observation, avec un RdB faibleNote de bas de page 44 ou modéréNote de bas de page 45 Note de bas de page 46 Note de bas de page 47, ont rapporté des taux d'HVRS de 10,4 %; de 7,7 %; de 13 % et de 13,5% au cours de la première année de vie pour les nourrissons nés à moins de 29 sAG, à moins de 28 sAG, à moins de 29 sAG ou à 30 sAG ou moins, sans autres comorbidités. Ces prématurés précoces reçoivent peu ou pas d'anticorps maternels et leurs VR plus étroites les rendent plus vulnérables aux effets d'une infection par le VRS.
Les nourrissons de 29 à 32 sAG courent également un risque accru d'HVRS par rapport aux nourrissons à terme en bonne santé, mais les taux d'HVRS sont inférieurs à ceux des nourrissons plus prématurés, soit de 5,7 à 9,9 % au cours de leur première saison du VRS (RdB modéré)Note de bas de page 45 Note de bas de page 46. Les nourrissons de 32 ou 33 à 35 sAG ont présenté des taux d'HVRS de 2,8 à 6,5 % au cours de leur première année de vie ou de leur première saison du VRS (RdB modéré)Note de bas de page 45 Note de bas de page 48. Dans l'étude de Boyce et al., les taux d'HVRS chez les prématurés au cours des seconds 6 mois de vie étaient similaires à ceux des nourrissons à terme à faible risque au cours des 6 premiers mois (RdB modéré)Note de bas de page 43. Dans une autre étude, les taux d'HVRS chez les prématurés de 32 à 34 sAG (dont 20 % ont reçu du PVZ) étaient similaires à ceux des nourrissons à terme âgés d'un mois à l'âge de 4,2 à 4,5 mois (RdB modéré)Note de bas de page 49.
L'âge chronologique est un facteur de risque important pour le taux d'HVRS (RdB modéré)Note de bas de page 16 Note de bas de page 43 Note de bas de page 49, les taux globaux d'HVRS étant les plus élevés à l'âge de moins de 3 moisNote de bas de page 16.
III.1.1.2 Durée de l'hospitalisation liée au VRS
D'après l'ESFdM, la comparaison de la durée du séjour à l'hôpital (DSH) était disponible dans 2 études. Dans l'une d'entre elles, présentant une CDP de modérée à faible, la différence moyenne de la DSH entre des nourrissons âgés de moins de 24 mois de 33 à 36 sAG et des nourrissons nés à terme était de 1,0 jour (IC à 95 % : 0,88 à 1,12 %)Note de bas de page 28, tandis que dans l'autre, présentant une CDP très faible, la différence moyenne de la DSH entre des nourrissons âgés de moins de 12 mois, de 29 à 32 sAG, et ceux de 33 à 35 sAG était de 4,0 jours (IC à 95 % : 1,54 à 6,46 %)Note de bas de page 50.
La moyenne de la DSH dans des études mises en commun (groupe unique) était de 10 jours, de 7,7 jours, de 5,5 jours, de 4,5 jours et de 7 jours, pour des nourrissons de 29 à 32 sAGNote de bas de page 50, de 29 à 34/35 sAGNote de bas de page 50 Note de bas de page 51, de 33 à 34 sAGNote de bas de page 28 Note de bas de page 50, de 32/33 à 35 sAGNote de bas de page 28 Note de bas de page 30 Note de bas de page 33 et de 35 sAGNote de bas de page 50 respectivement. La DSH des nourrissons nés à terme et en bonne santé était de 3,5 jours)Note de bas de page 28 Note de bas de page 37 Note de bas de page 52 Note de bas de page 53 (Tableau 2).
| sAG | DSH moyenne (en jours) | IC à 95 % | Nbre d'études | Risque de biais |
|---|---|---|---|---|
| 29 - 32Note de bas de page 50 | 10,0 | 7,7 à 12,3 | 1 | Modéré |
| 29 - 34/35Note de bas de page 50 Note de bas de page 51 | 7,7 | 6,1 à 9,2 | 2 | Modéré |
| 33 - 34Note de bas de page 28 Note de bas de page 50 | 5,5 | 0,6 à 10,4 | 2 | Modéré, faible |
| 32/33 - 35 Note de bas de page 28 Note de bas de page 30 Note de bas de page 33 | 4,5 | 2,3 à 6,8 | 3 | Modéré (1), faible (2) |
| 35Note de bas de page 50 | 7,0 | 4,9 à 9,1 | 1 | Modéré |
| Naissance à terme, en bonne santéNote de bas de page 28 Note de bas de page 37 Note de bas de page 52 Note de bas de page 53 | 3,5 | 2,3 à 4,7 | 4 | Élevé (1), modéré (2), faible (1) |
Les comparaisons entre les études (CDP très faible) à l'aide de données mises en commun ont montré des différences moyennes de la DSH entre les nourrissons prématurés et les nourrissons nés à terme de 6,5 jours (IC à 95 % : 3,9 à 9,1 %; p < 0,000), de 1,0 jour (IC à 95 % : 8,6 à 10,6 %) et de 4,2 jours (IC à 95 % : 5,3 à 13,7 %) pour les nourrissons nés entre 29 et 32 sAG, entre 32/33 et 35 sAG et entre 29 et 35 sAG, respectivement.
La mise à jour de la littérature de 2020 a répertorié 3 études ayant fait état de ce résultat. La DSH médiane était de 7,0 jours (fourchette : 2 - 20) chez les nourrissons nés entre 29 et moins de 36 sAG (RdB faible)Note de bas de page 38 et de 7,0 jours (écart interquartile [EIQ] : 3 - 12) chez les nourrissons nés entre 29 et 34 sAG (RdB modéré)Note de bas de page 54. Les auteurs Anderson et al. ont fait état d'une DSH médiane de 6 (EIQ : 3-11), 5 (EIQ : 3-10) et 5 jours (EIQ : 3-8) chez les nourrissons nés entre 29 et 32 sAG, entre 33 et 34 sAG et à 35 sAG, respectivement (RdB faible)Note de bas de page 55. En outre, et à titre de comparaison, 4 études ont fait état de la DSH de nourrissons nés à terme et en bonne santé. La DSH médiane était de 4 jours (fourchette : 1-23) [RdB modéré]Note de bas de page 56 et de 1,9 jour (EIQ : 1,1-2,9) [RdB faible]Note de bas de page 57. La DSH moyenne (écart-type) était de 5 jours (2,2) [RdB modéré]Note de bas de page 58 et de 5,9 (2,99); 5,4 (2,89) et 5,84 jours (3,13) pour différents génotypes du VRS dans une étude de Midulla et al. (RdB faible)Note de bas de page 59.
La littérature antérieure a également fait état de durées médianes d'hospitalisation plus longues chez les nourrissons prématurés que chez les nourrissons nés à termeNote de bas de page 60. Dans une étude de cohorte prospective réalisée en 2008-2009, les nourrissons nés entre 28 et 33 sAG hospitalisés pour un VRS confirmé présentaient une DSH moyenne de 7,2 ± 3,3 jours (RdB faible)Note de bas de page 61.
III.1.1.3. Admission en unité de soins intensifs et ventilation mécanique
Dans l'ESFdM, une étude portait sur l'admission en USI, la DSH en USI, la ventilation mécanique (VM) et sa durée chez les nourrissons nés entre 29 et 32 sAG par rapport aux nourrissons nés entre 33 et 35 sAG. Aucune différence significative n'a été constatée pour l'un ou l'autre de ces paramètres (CDP faible à très faible)Note de bas de page 50.
Les proportions mises en commun (groupe unique) de patients ayant subi une HVRS et admis en USI étaient de 51,7; 19,1; 31,5 et 13,9 pour les nourrissons nés entre 29 et 32 sAGNote de bas de page 50, 32 à 34 sAGNote de bas de page 30, 32 à 35 sAGNote de bas de page 30 Note de bas de page 35 Note de bas de page 50 et à 35 sAGNote de bas de page 30, respectivement. Le taux d'admission en USI des nourrissons hospitalisés nés à terme et en bonne santé était de 15,8 %Note de bas de page 37 Note de bas de page 52 Note de bas de page 53 (Tableau 3).
| sAG | % USI | IC à 95 % | Nombre d'études | Risque de biais |
|---|---|---|---|---|
| 29 - 32Note de bas de page 50 | 51,7 | 41,3; 62,1 | 1 | Modéré |
| 33 - 34Note de bas de page 30 | 19,1 | 2,3; 35,8 | 1 | Modéré |
| 32 - 35 Note de bas de page 30 Note de bas de page 35 Note de bas de page 50 | 31,5 | 13,1; 53,6 | 3 | Modéré (2), faible (1) |
| 35Note de bas de page 30 | 13,9 | 2,6; 25,2 | 1 | Modéré |
| Naissance à terme, en bonne santéNote de bas de page 37 Note de bas de page 52 Note de bas de page 53 | 15,8 | 5,4; 30,0 | 3 | Modéré (2), élevé (1) |
Les comparaisons entre les études (CDP très faible) à l'aide de données mises en commun ont montré que le RR concernant les admissions en USI chez les nourrissons prématurés hospitalisés par rapport aux nourrissons nés à terme était de 3,3 (IC à 95 % : 1,9 à 5,7 %; p = 0,000), de 2,0 (IC à 95 % : 1,0 à 4,0 %; p = 0,000) et de 3,3 (IC à 95 % : 1,9 à 5,6 %; p = 0,000) pour les nourrissons nés entre 29 et 32 sAG, entre 32 et 35 sAG et entre 29 et 35 sAG, respectivement. Les différences relatives aux risques réels étaient respectivement de 35,9 % (IC à 95 % : 19,8 à 52,0 %; p = 0,000), de 15,7 % (IC à 95 % : 8,0 à 39,4 %; p = 0,194) et de 36,2 % (IC à 95 % : 22,5 à 49,9 %; p = 0,000).
En ce qui concerne la DSH en USI, les données mises en commun (groupe unique) ont montré une DSH de 9,0; 7,0 et 6,7 jours pour les nourrissons nés entre 29 et 32 sAGNote de bas de page 50, entre 29 et 34/35 sAGNote de bas de page 50 Note de bas de page 51 et entre 33 et 35 sAGNote de bas de page 35 Note de bas de page 50, respectivement. Aucune étude ne portait sur la DSH en USI pour les nourrissons nés à terme et en bonne santé (Tableau 4).
| sAG | DSH moyenne (en jours) | IC à 95 % | Nombre d'études | Risque de biais |
|---|---|---|---|---|
| 29 - 32Note de bas de page 50 | 9,0 | 7,0; 11,0 | 1 | Modéré |
| 29 - 34/35Note de bas de page 50 Note de bas de page 51 | 7,0 | 4,7; 9,2 | 2 | Modéré |
| 32 - 35Note de bas de page 35 Note de bas de page 50 | 6,7 | 5,5; 8,0 | 2 | Modéré, faible |
Les proportions mises en commun de patients hospitalisés (groupe unique) placés sous VM étaient de 27,0 %; 22 % et 14,0 % pour les nourrissons nés entre 29 et 32 sAGNote de bas de page 50, entre 29 et 34/35 sAGNote de bas de page 50 Note de bas de page 51, entre 32/33 et 35 sAGNote de bas de page 30 Note de bas de page 35 Note de bas de page 50 respectivement. Le taux de nourrissons nés à terme et en bonne santé placés sous VM était de 14,0 %Note de bas de page 52 Note de bas de page 53 (Tableau 5).
| sAG | % sous VM | IC à 95 % | Nombre d'études | Risque de biais |
|---|---|---|---|---|
| 29 - 32Note de bas de page 50 | 27,0 | 17,8; 36,2 | 1 | Modéré |
| 29 - 34/35Note de bas de page 50 Note de bas de page 51 | 22,0 | 18,0; 26,0 | 2 | Modéré |
| 32/33 - 35Note de bas de page 30 Note de bas de page 35 Note de bas de page 50 | 14,0 | 10,0; 18,0 | -3 | Modéré (2), faible |
| Naissance à terme, en bonne santéNote de bas de page 52 Note de bas de page 53 | 14,0 | 9,0 - 21,0 | 2 | Modéré, élevé |
Les comparaisons entre les études (CDP très faible) à l'aide de données mises en commun ont montré que le RR concernant la VM chez les nourrissons prématurés hospitalisés par rapport aux nourrissons nés à terme était de 1,9 (IC à 95 % : 1,4 à 2,6 %; p < 0,000), de 2,3 (IC à 95 % : 1,8 à 2,9 %; p < 0,000) et de 1,0 (IC à 95 % : 0,76 à 1,32 %; p < 0,000) pour les nourrissons nés entre 29 et 32 sAG, entre 29 et 35 sAG et entre 33 et 35 sAG, respectivement. Les différences relatives aux risques réels étaient respectivement de 13,0 % (2,0; 24,0; p = 0,020), 18,0 % (9,9; 26,1; p = 0,000) et de 0,00 % (-7,2; 7,2; p = 1,000).
La durée moyenne de la VM observée dans des études mises en commun (groupe unique) était de 10 jours (IC à 95 % : 7,6 à 12,4 %); 8,6 jours (IC à 95 % : 7,3 à 9,8 %) et de 6,5 jours (IC à 95 % : 3,5 à 9,4 %) pour les nourrissons nés entre 29 et 32 sAG (une étude, RdB modéré)Note de bas de page 50, entre 29 et 35 sAG (2 études, RdB modéré)Note de bas de page 50 Note de bas de page 51 et entre 33 et 35 sAG (2 études, RdB modéré, faible)Note de bas de page 35,Note de bas de page 50, respectivement. Aucune étude n'a fait état de la durée de la VM chez les nourrissons nés à terme et en bonne santé.
La mise à jour des recherches dans la littérature de 2020 a permis de repérer 3 études portant sur les admissions en USI. La prise en charge en USI des nourrissons ayant subi une HVRS concernait 25 % des nourrissons nés entre 29 et 35 sAG (RdB faible)Note de bas de page 38; 64,2 % des nourrissons nés entre 29 et 34 sAG (RdB modéré)Note de bas de page 54 et 48 %, 46 % et 49 % des nourrissons nés entre 28 et 32 sAG, entre 33 et 34 sAG et à 35 sAG, respectivement (RdB faible)Note de bas de page 55. Six études portaient sur la prise en charge en USI de nourrissons nés à terme et en bonne santé. Les pourcentages étaient de 29 %Note de bas de page 57; 43,3 %Note de bas de page 62; 20 %Note de bas de page 63 et 9 %Note de bas de page 59 dans les études présentant un RdB faible et de 3,4 %Note de bas de page 56 et 2 %Note de bas de page 58 dans les études présentant un RdB modéré.
La DSH médiane en USI était de 6 jours pour les nourrissons nés entre 29 et 34 sAG (RdB modéré)Note de bas de page 54 et de 6 (3-11), 5 (3-10) et de 5 (3-6) jours pour les nourrissons nés entre 29 et 32 sAG, entre 33 et 34 sAG et à 35 sAG, respectivement (RdB faible)Note de bas de page 55. Pour les nourrissons nés à terme et en bonne santé, la DSH médiane en USI était de 4 jours (EIQ : 3; 7,6) [RdB faible]Note de bas de page 57 et de 0 jour (fourchette : 0 - 15) [RdB modéré]Note de bas de page 56.
La proportion de nourrissons ayant subi une HVRS placés sous VM était de 5 % pour les nourrissons nés entre 29 et 35 sAG (RdB faible)Note de bas de page 38; de 31,8 % pour les nourrissons nés entre 29 et 34 sAG (RdB modéré)Note de bas de page 54 et de 22 %; 20 % et 15 % pour les nourrissons nés entre 28 et 32 sAG, entre 33 et 34 sAG et à 35 sAG, respectivement (RdB faible)Note de bas de page 55.
La littérature antérieure a également révélé que les nourrissons prématurés présentaient un risque accru d'admission en USI par rapport aux nourrissons nés à termeNote de bas de page 60. Dans une étude de cohorte prospective réalisée en 2008-2009, 5,9 % des nourrissons nés entre 28 et moins de 33 sAG ont dû être admis en USI (RdB faible)Note de bas de page 61. Un examen systématique ultérieur d'études réalisées pendant la période 2000-2014, dont la qualité a été jugée moyenne par AMSTAR, portant sur des nourrissons nés entre 33 et 35 sAG sans comorbidité, a révélé que 22,2 % des nourrissons ont dû être admis en USI pendant une durée médiane de 8,3 jours et que 12,7 % ont eu besoin d'une VM pendant une durée médiane de 4,8 joursNote de bas de page 40. Plus les nourrissons étaient jeunes, plus les taux d'admission en USI étaient élevés. Dans un rapport sur les nourrissons nés entre 32 et 35 sAG, aucun nourrisson âgé de plus de 6 mois n'a eu besoin de soins intensifs, mais 14 % des nourrissons âgés de 3 à moins de 6 mois et 27 % de ceux âgés de moins de 3 mois ont été admis en USI (âges réels)Note de bas de page 64.
III.1.1.4 Mortalité
Dans une méta-analyse d'études réalisées pendant la période 1990-2007, la mortalité toutes causes confondues au cours de la première saison d'infections par le VRS était de 0,99 % et de 0,13 % pour les nourrissons nés à 32 sAG ou moins et entre 32 et 35 sAG, respectivement. La mortalité attribuable au VRS était de 0,03 % pour les 2 groupes combinés (qualité de l'examen jugée moyenne par AMSTAR)Note de bas de page 65. Dans un autre examen systématique de la littérature de 1975 à 2011, le taux de létalité moyen pondéré pour les nourrissons âgés de 24 mois maximum, ayant subi une HVRS, était de 1,2 % (fourchette : 0 - 8,3 %; médiane : 0 %; n = 10) pour les nourrissons prématurés nés à moins de 37 sAG, alors qu'il était de 0,2 % (fourchette : 0 - 1,5 %; médiane : 0,0 %; n = 6) pour les enfants ne présentant aucun facteur de risque d'infection sévère par le VRS (qualité de l'examen jugée faible par AMSTAR)Note de bas de page 66. Dans l'ESFdM, une étude présentant une CDP très faible a fait état d'un décès attribué au VRS chez les nourrissons nés entre 29 et 32 sAG et d'aucun décès dans le groupe de nourrissons nés entre 33 et 35 sAG, sans différence significativeNote de bas de page 50.
III.1.1.5 Scores d'évaluation des risques
Si la prématurité, quel que soit son degré, peut accroître dans une certaine mesure le risque d'HVRS, il n'est pas possible d'administrer une prophylaxie à l'ensemble des nourrissons concernés. Au Canada, de 7,7 à 8,0 % des nourrissons nés au cours d'une année sont des prématurés nés à moins de 37 sAGNote de bas de page 67, et on estime que 5 % des nourrissons de la cohorte de naissance sont nés entre 32 et 35 sAGNote de bas de page 34. Des scores d'évaluation des risques ont été mis au point pour tenter de déterminer les nourrissons prématurés par ailleurs en bonne santé nés entre 29 et 30 sAG ou plus, ou à plus de 32 sAG, qui présentent un risque considérablement accru de développer une infection sévère par le VRS; ils sont actuellement utilisés dans plusieurs PT du Canada et à l'échelle internationale (voir l'Annexe A). Les facteurs de risques définis comme significatifs et utilisés dans ces scores d'évaluation des risques varient considérablement. La validité de ces scores, en particulier des scores validés avec des données datant de plusieurs années ou issues de différents contextes géographiques, a été remise en questionNote de bas de page 7 Note de bas de page 34 Note de bas de page 68 Note de bas de page 69 Note de bas de page 70 Note de bas de page 71.
Le facteur de risque le plus fréquemment repéré est le jeune âge chronologique pendant la saison du VRS. D'autres facteurs, notamment des facteurs liés à l'environnement et à l'hôte, accroissent le risque d'exposition au VRS ou d'infection plus sévère par le VRS. Le risque d'HVRS associé à chaque facteur a été difficile à déterminer en raison de résultats irréguliers dans différentes études. La plupart des facteurs liés à l'environnement et à l'hôte n'augmentent que légèrement le risque d'HVRS; et la contribution de chaque facteur au FdM est limitéeNote de bas de page 7 Note de bas de page 70. Dans une analyse de régression logistique multiple des facteurs de risques, qui comprenaient le sexe masculin, la fréquentation d'une garderie, l'exposition à la fumée, l'absence d'allaitement et la présence d'autres enfants dans le foyer, seuls la prématurité et le jeune âge chronologique ont été corrélés de manière indépendante à une infection plus sévère par le VRS après la prise en compte d'autres covariablesNote de bas de page 69.
III.1.2 Maladie pulmonaire chronique due à la prématurité et autres maladies pulmonaires chroniques
La MPC a été définie par l'AAP comme « une naissance à moins de 32 semaines d'âge gestationnel avec une supplémentation nécessaire en O2 pendant au moins les 28 premiers jours suivant la naissance »Note de bas de page 6. Certaines études ont défini la MPC comme la nécessité d'une supplémentation en oxygène à 36 semaines d'âge post-conceptuel. L'ESFdM et les recherches actualisées dans la littérature de 2020 n'ont mis au jour aucune étude sur ce groupe de risque.
Dans un examen systématique des données jusqu'en décembre 2015, dont la qualité a été jugée moyenne par AMSTAR, les taux d'HVRS des enfants atteints d'une MPC dans les 2 premières années de leur vie, sans prophylaxie, étaient de 12 à 21 %, avec une moyenne pondérée de 16,8 %. La MPC était associée à un taux plus élevé d'HVRS que dans d'autres groupes à haut risque et constituait un facteur de risque indépendant significatif d'HVRS avec des rapports de cotes (RC) de 2,2 à 7,2Note de bas de page 72. Une déclaration de la SCP a fait état d'un taux d'HVRS de 6,0 à 22,6 % dans des études réalisées entre 1995 et 2009Note de bas de page 8.
Une étude de cohorte rétrospective menée de 1992 à 1996 a mis en évidence un taux d'HVRS de 16,8 % au cours de la première année de vie (RdB modéré)Note de bas de page 42. Le taux d'HVRS était de 12,8 % pour les enfants âgés de 24 mois ou moins présentant une MPC dans le groupe témoin d'un ECR sur le PVZ (RdB modéré)Note de bas de page 48 et de 15,7 % dans les 12 mois suivant la sortie initiale des enfants, dans le groupe témoin d'une étude d'observation sur le PVZ (RdB modéré)Note de bas de page 44. Une étude menée entre 1989 et 1993 a fait état de taux d'hospitalisation plus élevés au cours de la première année de vie qu'au cours de la deuxième (38,8 % contre 7,3 %) [RdB modéré]Note de bas de page 43. Les auteurs Winterstein et al. ont comparé les taux d'HVRS chez des nourrissons atteints d'une MPC et chez des nourrissons nés à terme, en bonne santé et ayant des frères et sœurs. Le taux maximal d'HVRS chez les nourrissons atteints d'une MPC était de 15,3/1 000 patients-saisons à l'âge de 9 mois. Le taux d'HVRS des nourrissons atteints d'une MPC à 18,5 mois était semblable à celui des nourrissons nés à terme et en bonne santé âgés d'un mois (9/1 000 patients-saisons)Note de bas de page 73. Dans cette étude, 42,7 % des nourrissons atteints d'une MPC avaient reçu du PVZ.
Il existe peu de données sur les résultats autres que l'hospitalisation. Dans l'examen systématique de Paes, dont la qualité a été jugée moyenne par AMSTAR, la moyenne de la DSH pour cause de VRS était de 4 à 11 jours, une étude ayant révélé que 29 % des nourrissons hospitalisés ont été admis en USI et que 24 % ont été placés sous VMNote de bas de page 72. Dans l'étude de cohorte rétrospective de Stevens et al. (RdB faible), la moyenne de la DSH était de 9,4 jours et 9,1 % des nourrissons ont été admis en USINote de bas de page 42. Une méta-analyse, dont la qualité a été jugée moyenne par AMSTAR, a fait état d'un taux de mortalité toutes causes confondues de 0,34 % pendant la première saison d'infections par le VRSNote de bas de page 74. Dans un examen systématique de la littérature de 1975 à 2011, le taux de létalité moyen pondéré chez les nourrissons âgés de 24 mois ou moins ayant subi une HVRS était de 4,1 % (fourchette : 0 - 10,5 %; médiane : 7,0 %; n = 6) chez les enfants atteints d'une MPC (qualité de l'analyse jugée faible par AMSTAR)Note de bas de page 66.
Les données sur le risque de VRS chez les enfants atteints d'une MPC dont l'étiologie est autre que la prématurité sont limitées. L'ESFdM a révélé 2 études. Des taux accrus d'HVRS ont été signalés chez des nourrissons de moins de 24 mois atteints d'une maladie pulmonaire kystique congénitale (MPKC) [8,3 %, IC à 95 % : 0,5 à 16,2 %]Note de bas de page 75 (RdB modéré) et chez des enfants atteints d'une maladie pulmonaire interstitielle chronique (MPIC) recevant des corticostéroïdes (30 %, IC à 95 % : 9,9 à 50,1 %)Note de bas de page 76 [RdB élevé]. Dans les comparaisons entre les études (CDP très faible), le RR concernant les HVRS par rapport aux nourrissons nés à termeNote de bas de page 28 Note de bas de page 29 Note de bas de page 36 Note de bas de page 37 (RdB modéré) était de 6,9 (IC à 95 % : 5,3 à 8,9 %; p = 0,000) pour la MPKC et de 25,0 (IC à 95 % : 14,3 à 43,6 %; p = 0,000) pour la MPIC. Les différences relatives aux risques réels étaient de 7,1 % (IC à 95 % : 1,5 à 12,7 %; p = 0,013) pour la MPKC et de 28,8 % (IC à 95 % : 8,7 à 48,9 %; p = 0,005) pour la MPIC.
La moyenne de la DSH était de 11,25 jours (IC à 95 % : 9,29 à 13,21 %) pour la MPKC (RdB faible) et de 6 jours (IC à 95 % : -0,6 à 12,6 %) pour la MPIC (RdB modéré). Dans les comparaisons entre les études (CDP très faible), les différences moyennes relatives à la DSH étaient, par rapport aux nourrissons nés à terme, de 7,8 jours (IC à 95 % : -1,8 à 17,3 %; p < 0,112) pour la MPKC et de 2,5 jours (IC à 95 % : -4,2 à 9,2 %; p = 0,465) pour la MPIC. Aucun des patients de ces 2 études n'a été admis en USI pour cause de VRS.
Dans un rapport antérieur, les auteurs Kristensen et al. ont fait état des taux d'HVRS suivants chez des enfants âgés de moins de 24 mois : 27,3 % pour la MPIC; 13,7 % pour les malformations pulmonaires congénitales; 8,3 % et 9,3 % pour d'autres anomalies congénitales des VR et de 9,9 à 15,9 % pour certaines affections neuromusculaires altérant la capacité à évacuer les sécrétions des VR. En revanche, le taux global dans ce groupe d'âge était de 2,8 % (RdB modéré)Note de bas de page 21.
III.1.3 Fibrose kystique
L'ESFdM a révélé 2 études portant sur des nourrissons atteints de fibrose kystique (FK). La proportion mise en commun de taux d'HVRS était de 12,3 % (IC à 95 % : 1,3 à 30,8 %) [RdB élevé]Note de bas de page 77 Note de bas de page 78. Dans les comparaisons entre les études, le RR concernant le taux d'HVRS par rapport aux nourrissons nés à terme était de 10,3 (IC à 95 % : 3,3 à 31,6 %; p < 0,000) et la différence relative aux risques réels était de 11,1 % (IC à 95 % : - 3,7 à 25,9 %; p = 0,140). Une étude ayant recensé un faible nombre d'admissions a fait état d'une moyenne de la DSH de 47,00 jours (12,53; 81,47) [RdB modéré], un chiffre beaucoup plus élevé que dans les études publiées précédemment, mais non commenté par les auteursNote de bas de page 77. L'autre étude (RdB modéré) a fait état d'une moyenne de la DSH de 10 joursNote de bas de page 78. En raison d'un manque de données (écart-type non communiqué par les auteurs Groves et al.), aucune mise en commun n'a été effectuée à partir de ces études pour ce résultat.
Dans l'étude de Bjornson, la proportion de la population à risque qui a été admise en USI pour cause de VRS était de 2,4 % (IC à 95 % : -0,9 à 5,6 %) [RdB modéré]Note de bas de page 77. Sur les 5 nourrissons admis à l'hôpital, 2 ont été admis en USI (40 %) et 1 nourrisson a eu besoin d'une VM. La durée moyenne de l'admission en USI était de 5,00 jours (IC à 95 % : -2,84 à 12,84 %) [RdB modéré]Note de bas de page 77. L'autre étude n'a pas fait état d'admissions en USINote de bas de page 78.
Des rapports antérieurs indiquent également que les HVRS sont plus fréquentes chez les enfants atteints de FK que chez les enfants en bonne santé. Dans un examen systématique dont la qualité a été jugée moyenne par AMSTAR, les taux d'HVRS étaient de 6,4 à 18,1 %, soit de 2,5 à 4,3 fois plus élevés que chez les enfants en bonne santé. La moyenne de la DSH était de 2 à 11 jours, et une admission en USI a été signalée chez 12,5 % des nourrissons (1 patient hospitalisé sur 8)Note de bas de page 22. Un autre examen systématique de la prophylaxie par PVZ en cas de FK, dont la qualité a été jugée bonne par AMSTAR, a signalé des taux d'HVRS chez des nourrissons n'ayant pas reçu de PVZ de 7,5 à 11,7 %Note de bas de page 20.
III.1.4 Cardiopathie congénitale
Les enfants atteints d'une CPCHS présentaient un risque élevé de morbidité et de mortalité dues au VRS à une époque où la chirurgie corrective était généralement retardée. Les chirurgies précoces étant devenues la norme, on s'attend à ce que le risque d'infection sévère par le VRS ait diminué, bien que les données permettant de l'affirmer soient rares. Une étude américaine a montré une diminution des taux d'HVRS avant que la prophylaxie par PVZ ne soit recommandée pour ce groupe de patientsNote de bas de page 79.
L'ESFdM a mis au jour une étude portant sur des enfants atteints d'une CPCHS. D'après les données combinées de 1997 et de 2000, l'incidence des HVRS pour 1 000 naissances de nourrissons atteints d'une CPCHS était de 23 (IC à 95 % : 20 à 26 %) [RdB modéré]Note de bas de page 79. Il n'a pas été possible d'effectuer une comparaison du taux d'HVRS entre les études pour les nourrissons nés à terme en bonne santé. Pour les autres résultats liés à l'hospitalisation, seules les données combinées, y compris les données publiées plusieurs années après la mise sur le marché du PVZ, ont été présentées, et ces résultats ont donc été exclus de l'analyse.
Dans les études antérieures, un examen systématique des données de 1995 à 2015, dont la qualité a été jugée moyenne par AMSTAR, a fait état de taux d'HVRS de 3,8 à 10,2 % chez les enfants âgés de moins de 2 ans atteints d'une CPCHSNote de bas de page 65. Une déclaration de la SCP a fait état de taux d'HVRS de 1,3 à 15 % dans des études réalisées entre 1992 et 2008Note de bas de page 8.
Le taux d'HVRS diminue avec l'âge. Dans le groupe placebo d'un ECR de 1998 à 2002, les taux étaient de 9,7 % pour tous les nourrissons (âgés de moins de 24 mois); de 12,2 % pour les nourrissons âgés de moins de 6 mois; de 7,3 % pour les nourrissons âgés de 6 à 12 mois et de 4,3 % pour ceux âgés de 1 à 2 ans (RdB faible)Note de bas de page 80. Dans les études d'observation, le taux d'HVRS chez les nourrissons atteints d'une CPCHS est également significativement plus élevé chez les nourrissons âgés de moins de 12 mois que chez ceux âgés de 12 à 24 mois. Dans l'étude mise au jour de l'ESFdM, portant sur les taux d'HVRS aux États-Unis de 1997 à 2012 et couvrant les périodes pré et post-PVZ, 85 % des hospitalisations sont survenues au cours de la première année de vieNote de bas de page 79. À Taïwan, pour la période 2005-2010, les auteurs Chiu et al. ont fait état de taux d'HVRS de 4,8 % et de 2,1 % avec une CPCHS cyanotique et acyanotique, respectivement, au cours de la première année de vie; ainsi que de 0,9 % et de 0,56 % au cours de la deuxième année (RdB modéré)Note de bas de page 81. L'auteur Resch a fait état d'un taux d'hospitalisation de 9,6 % dans une étude menée de 2004 à 2008 sur des enfants atteints d'une CPCHS et d'une CPC non hémodynamiquement significative, dont certains ont reçu du PVZ, 56 infections sur 58 étant survenues au cours de la première année de vieNote de bas de page 82. Dans une étude menée auprès d'enfants atteints d'une CPC (pas nécessairement hémodynamiquement significative) s'appuyant sur les données de l'assurance-maladie Medicaid de 1989 à 1993, le taux estimé d'HVRS était de 9,2 % la première année et de 1,8 % la deuxième année (RdB modéré)Note de bas de page 43.
Dans l'examen systématique de Checchia, la médiane de la DSH, en cas d'HVRS, des enfants atteints d'une CPCHS était de 7 à 9,7 jours. La proportion de patients hospitalisés admis en USI était de 30,4 à 46 %; la DSH médiane en USI était de 10 jours et la proportion de patients placés sous VM était de 30 %Note de bas de page 65. Dans le groupe placebo de l'ECR mené de 1998 à 2002, la moyenne de la DSH était de 13,3 jours; 38,1 % des patients hospitalisés ont été admis en USI pendant une durée moyenne de 19,2 jours et 22,2 % ont eu besoin d'une VM pendant une durée moyenne de 25,3 jours (RdB faible)Note de bas de page 80. Dans l'étude menée par PY Chu, les enfants atteints d'une CPCHS (avec ou sans prophylaxie par PVZ) ayant subi une HVRS présentaient une moyenne de DSH plus longue (12,1 contre 3,4 jours, p < 0,001), des taux plus élevés de VM (21,9 % contre 2,3 %, p < 0,001) et des taux plus élevés de mortalité associée au VRS (2,8 contre 0,1 %, p < 0,001) par rapport aux enfants ne présentant pas de CPCHSNote de bas de page 79.
Les auteurs Feltes et al. ont fait état d'un taux de décès liés au VRS chez des nourrissons hospitalisés atteints d'une CPCHS de 0,6 % (RdB faible)Note de bas de page 80. Dans une méta-analyse d'études réalisées entre 1990 et 2007, le taux de mortalité toutes causes confondues au cours de la première saison d'infections par le VRS était de 4,17 % et la mortalité attribuable au VRS était de 0,62 % (qualité de l'analyse jugée moyenne par AMSTAR)Note de bas de page 74. Dans le cadre d'un examen systématique de la littérature publiée de 1975 à 2011, le taux moyen pondéré de létalité chez les nourrissons âgés de 24 mois ou moins ayant subi une HVRS était de 5,2 % (fourchette : 2,0 – 37,0 %; médiane : 5,9 %; n = 7) chez les enfants atteints d'une CPC (qualité de l'examen jugée faible par AMSTAR)Note de bas de page 66.
III.1.5 Syndrome de Down
D'après des données probantes, les enfants atteints du syndrome de Down présentent un risque plus élevé de subir une HVRS que les enfants en bonne santé. Ce risque supérieur s'explique en partie par des comorbidités telles que la CPC, la MPC et la prématurité. Si l'on exclut les enfants présentant ces comorbidités, le risque reste accru. Parmi les explications possibles, citons les anomalies anatomiques des VR supérieures, une malacie des VR, des troubles de la déglutition, une hypotonie et un dysfonctionnement du système immunitaireNote de bas de page 83.
L'ESFdM n'a pas mis au jour d'études sur des enfants atteints du syndrome de Down se limitant à des enfants âgés de moins de 2 ans. On a relevé une seule étude d'observation présentant une CDP modérée et comparant les résultats relatifs au VRS chez des enfants atteints du syndrome de Down et chez des enfants en bonne santé âgés de moins de 3 ans. Chez les enfants atteints du syndrome de Down et ne présentant pas d'autres facteurs de risques d'infection sévère par le VRS, le taux d'HVRS observé était de 2 % contre 1,1 % chez les sujets témoins en bonne santé; mais les données relatives aux HVRS présentaient certaines incohérences et n'ont pas pu être évaluées davantage. La médiane de la DSH était de 5 jours contre 2 jours pour les sujets témoins en bonne santé (différence moyenne de 3,00 jours, IC à 95 % : 1,95 à 4,05 %) [CDP faible]Note de bas de page 84.
Une méta-analyse publiée en 2018 portant sur des études réalisées jusqu'en mai 2017, dont la qualité a été jugée moyenne par AMSTAR, a fait état d'un RC mis en commun, pour les HVRS, de 8,69 (IC à 95 % : 7,33 à 10,30 %) par rapport aux sujets témoins en bonne santé pour tous les cas de syndrome de Down et d'un RC mis en commun de 16,66 (IC à 95 % : 7,22 à 38,46 %) lorsque seules les études excluant les enfants présentant d'autres facteurs de risque connus d'infection sévère par le VRS étaient incluses (2 études). Les taux réels d'HVRS dans ce sous-groupe étaient de 7,6 et 9,7 %. Les enfants atteints du syndrome de Down, y compris ceux qui présentaient des facteurs de risque connus d'infection sévère par le VRS, présentaient une augmentation de la DSH (différence moyenne mise en commun de 4,73 jours; IC à 95 % : 2,12 à 7,33 %), des besoins en oxygène (RC mis en commun : 6,53; IC à 95 % : 2,22 à 19,19 %), des admissions en USI (RC mis en commun : 2,56; IC à 95 % : 1,17 à 5,59 %) et des besoins en VM (RC mis en commun : 4,56; IC à 95 % : 2,17 à 9,58 %), ainsi que du taux de mortalité associée au VRS (RC mis en commun : 9,4; IC à 95 % : 2,26 à 39,15 %) par rapport aux nourrissons du groupe témoin non atteints du syndrome de DownNote de bas de page 83. Les auteurs indiquent que, dans la seule étude incluant uniquement des nourrissons ne présentant aucun autre facteur de risque, aucun décès n'a été observé et la DSH, les besoins en oxygène, les admissions en USI et la VM ne différaient pas de ceux rapportés pour l'ensemble du groupe. Un examen systématique antérieur (1995-2015), dont la qualité a été jugée moyenne par AMSTAR, a fait état de taux d'HVRS de 3,6 à 13,5 % chez des nourrissons atteints du syndrome de Down et ne présentant aucun autre facteur de risque connu d'infection sévère par le VRS. Le rapport de risque par rapport aux nourrissons en bonne santé était de 3,5 à 10,5 et la moyenne de la DSH était de 4-5 joursNote de bas de page 22.
III.1.6. Enfants immunodéprimés
Le VRS peut donner lieu à une morbidité et une mortalité importantes chez les enfants immunodéprimés. Les anticorps sériques et sécrétoires jouent un rôle important dans la prévention de l'infection par le VRS. En outre, les lymphocytes T sont nécessaires pour éliminer efficacement le virus. Il existe très peu de données liées à la population concernant le FdM par le VRS dans ce groupe. Bien que la plupart des infections surviennent chez les jeunes enfants, les enfants plus âgés et les adultes immunodéprimés sont également exposés à un risque d'infection sévère et de décès liés au VRS. La morbidité varie selon la sévérité de l'immunodépressionNote de bas de page 22.
L'ESFdM a mis en évidence 2 études portant sur des enfants immunodéprimés. Une étude multicentrique menée aux États-Unis de 2004 à 2012 a fait état d'HVRS chez des receveurs de greffes hépatiques âgés de moins de 18 ansNote de bas de page 85. Des analyses multivariées ont défini l'âge de moins de 2 ans au moment de la greffe comme un facteur prédictif d'HVRS (p < 0,001). Le taux d'HVRS dans les 2 premières années suivant la greffe (pour tous les patients de moins de 18 ans) était de 5,3 % (IC à 95 % : 4,4 à 6,2 %) [RdB modéré]. Les comparaisons entre les études (CDP très faible) ont démontré un RR concernant les HVRS de 4,4 (IC à 95 % : 4,0 à 4,9 %; p < 0,000) par rapport aux nourrissons nés à terme en bonne santé. La différence relative aux risques réels était de 4,1 % (IC à 95 % : 3,2 à 5,04 %; p = 0,000). La proportion de patients hospitalisés qui ont été admis en USI était de 22,2 % (IC à 95 % : 15,2 à 29,2 %) [RdB faible]. Le RR concernant les admissions en USI chez les enfants ayant subi une HVRS était de 1,4 (IC à 95 % : 0,8 - 2,5 %; p = 0,242; CDP très faible) par rapport aux enfants nés à terme et en bonne santé. La différence relative aux risques réels était de 6,4 % (IC à 95 % : -7,8 à 20,6 %; p = 0,375; CDP très faible). Parmi les patients admis à l'hôpital, 10,4 % (IC à 95 % : 5,2 à 15,5 %) ont été placés sous VM (RdB faible). Le RR concernant la VM chez les enfants admis à l'hôpital était de 0,7 (IC à 95 % : 0,5 à 1,1 %; p = 0,156) par rapport aux nourrissons nés à terme et en bonne santé, avec une différence relative aux risques réels de -3,6 % (IC à 95 % : -11,5 à 4,3 %, p = 0,372; CDP très faible)Note de bas de page 85.
La deuxième étude portait sur les infections par le VRS chez les sujets de moins de 18 ans atteints de drépanocytose. Cette étude rétrospective monocentrique a fait état d'un taux d'HVRS de 63 pour 1 000 années-personnes (IC à 95 % : 44 à 87 %) pour les enfants de moins de 2 ans (RdB modéré). D'autres résultats (DSH, admission en USI, VM) ont été communiqués pour tous les sujets de moins de 18 ans uniquement et ne différaient pas significativement de ceux des nourrissons nés à terme et en bonne santé, âgés de moins de 2 ansNote de bas de page 86.
Un examen systématique antérieur, dont la qualité a été jugée moyenne par AMSTAR, a indiqué que la plupart des infections par le VRS chez les receveurs de cellules souches hématopoïétiques et de transplantations d'organes pleins surviennent au cours des 2 premières années suivant la transplantation. Les enfants immunodéprimés âgés de moins de 2 ans ayant subi une HVRS présentaient une DSH médiane de 7 et 10 jours, avec une admission en USI dans 13 et 19,1 % des cas et une intubation et/ou une VM dans 3 et 14,3 % des cas. Les taux globaux de létalité étaient de 0 et 4,8 %Note de bas de page 22. Dans une étude danoise portant sur des enfants de moins de 2 ans, réalisée entre 1997 et 2003, les taux de première HVRS étaient de 21,3 % chez ceux présentant une immunodéficience congénitale et de 8,4 % chez ceux atteints d'un cancer, tandis que le taux global dans ce groupe d'âge était de 2,8 %. La DSH n'a pas augmenté (RdB modéré)Note de bas de page 21.
Les auteurs El Saleeby et al. ont fait état d'infections par le VRS chez 58 patients de moins de 21 ans atteints d'un cancer, dans le Tennessee, entre 1997 et 2005. Dans l'analyse multivariée, un âge de 2 ans ou moins et une numération lymphocytaire absolue de moins de 100/mm3 au moment de leur infection se sont avérés des facteurs prédictifs indépendants de la survenue d'une infection aigüe des VR inférieures, avec un RC de 9,84 (IC à 95 % : 1,95 à 49,8 %) et de 7,17 (IC à 95 % : 1,17 à 44,03 %) respectivement. Ces facteurs étaient également associés de manière significative au décèsNote de bas de page 87. Dans une étude menée à Seattle portant sur des receveurs d'une greffe de cellules souches hématopoïétiques, dont la plupart étaient des adultes, une numération lymphocytaire absolue de 100/mm3 ou moins au moment de l'apparition des symptômes était un facteur de risque de progression de l'infection par le VRSNote de bas de page 88.
III.1.7 Enfants résidant dans des communautés éloignées
L'ESFdM a mis au jour 2 études sur des nourrissons vivant dans des communautés éloignées. Les données de ces études n'ont pas été mises en commun en raison de différences dans leur conception et dans les populations de patients.
Une étude réalisée en 2009 auprès de nourrissons vivant dans des communautés inuites du Nord du Canada (environ 20 % de la cohorte de naissance, avec ou sans prématurité ou comorbidités) a fait état d'un taux global d'HVRS de 66,9 admissions pour 1 000 naissances vivantes par an chez des enfants âgés de moins d'un an (RdB élevé), avec des taux régionaux d'HVRS de 2,0 % dans les Territoires du Nord-Ouest; de 7,5 % au Nunavut et de 17,6 % au Nunavik. Dans différentes régions du Nunavut, les taux étaient de 19,5 %; 9,1 % et 3,7 %Note de bas de page 23.
L'autre étude portait sur des nourrissons amérindiens nés à terme et en bonne santé, vivant dans des réserves du Sud-Ouest des États-UnisNote de bas de page 89. Le taux d'HVRS était de 12,8 % (IC à 95 % : 10,1 à 15,5 %) [RdB élevé]. Dans les comparaisons entre les études (CDP très faible), le RR concernant l'HVRS était de 10,7 (IC à 95 % : 9,4 à 12,1 %; p < 0,000). La différence relative aux risques réels était de 11,6 % (IC à 95 % : 8,9 à 14,3 %; p = 0,000). La moyenne de la DSH était de 4,7 jours (IC à 95 % : 4,2 à 5,2 %) [RdB modéré]. La différence moyenne relative à la DSH par rapport aux nourrissons nés à terme et en bonne santé était de 1,2 jour (IC à 95 % : -0,10 à 2,5 %; p < 0,802; CDP très faible). La proportion de patients hospitalisés admis en USI (RdB modéré) était de 6,3 % (IC à 95 % : 1,0 à 11,6 %). Le RR relatif aux admissions en USI était de 0,4 (IC à 95 % : 0,04 à 1,2 %; p = 0,091). La différence relative aux risques réels était de -9,5 % (IC à 95 % : -22,9 à 3,9 %; p = 0,164). La DSH moyenne en USI était de 5,2 jours (IC à 95 % : 2,1 à 8,3 %) [RdB modéré]. Une VM a été nécessaire pour 2,5 % des patients hospitalisés (IC à 95 % : 0,9 à 5,9 %) [RdB modéré] pour une durée moyenne de 6,5 jours (IC à 95 % : 3,6 à 9,4 %) [RdB modéré].
La mise à jour des recherches dans la littérature de 2020 n'a pas mis en évidence d'études sur les populations vivant dans des communautés éloignées. Après ces recherches, les résultats d'une étude d'observation récente menée au Nunavik (Québec) ont été publiés (RdB élevé)Note de bas de page 90. Pendant la période 2013-2019, le taux d'HVRS était de 5,0 % pour tous les nourrissons âgés de moins d'un an (7,3 % après prise en compte d'une éventuelle sous-détection du test expéditif d'antigène par rapport à la réaction de polymérisation en chaîne), un taux beaucoup plus faible que celui communiqué en 2009Note de bas de page 91.
D'après des études antérieures, les enfants vivant dans des communautés inuites nordiques éloignées présentent des taux élevés d'infection par le VRS. En 2002, 16,6 % des nourrissons de l'île de Baffin âgés de moins d'un an ont été admis à l'hôpital régional de Baffin pour cause de VRS (RdB modéré). Les taux variaient de 6,3 % pour les nourrissons d'Iqaluit à 34,9 % pour ceux des communautés rurales à haut risque. Pour les nourrissons âgés de moins de 6 mois, le taux global d'HVRS était de 25 %, et de 51 % dans les communautés à haut risqueNote de bas de page 91. Les auteurs Singleton et al. ont indiqué que le district du YK en Alaska présentait le taux le plus élevé d'HVRS au monde; 43,9 % des nourrissons prématurés et 14,8 % des enfants nés à terme âgés de moins d'un an ayant été hospitalisés chaque année avant la mise sur le marché du PVZ (RdB élevé)Note de bas de page 92. Ces taux sont plusieurs fois supérieurs aux taux globaux de 1 à 2 % pour les nourrissons nés à terme publiés dans les pays développés. En outre, les nourrissons infectés doivent souvent être transportés en avion vers des hôpitaux communautaires ou des établissements de soins tertiaires.
Les données sur le FdM par le VRS chez les enfants vivant dans d'autres communautés autochtones d'Amérique du Nord sont très limitéesNote de bas de page 93 et il n'existe aucune information sur les autres communautés éloignées.
III.1.8 Autres nourrissons présentant un risque élevé
L'ESFdM et la mise à jour des recherches dans la littérature de 2020 n'ont pas déterminé de groupes supplémentaires présentant un risque de développer une infection sévère par le VRS.
III.2 Infection par le VRS et séquelles à long terme : respiration sifflante récurrente, asthme et fonction pulmonaire
Plusieurs études ont montré que la survenue d'une infection aigüe des VR inférieures causée par le VRS dans la petite enfance est associée à une respiration sifflante récurrente dans l'enfance. D'après certaines études, la respiration sifflante récurrente survenant après une telle infection est passagère, la respiration sifflante diminuant et atteignant un niveau de fond au cours des 10 premières annéesNote de bas de page 94. On ignore si le VRS survenu dans la petite enfance prédispose au développement de l'asthme, ou si les nourrissons génétiquement prédisposés à l'asthme présentent un risque accru de développer une infection sévère par le VRS dans la petite enfanceNote de bas de page 95, mais il existe des preuves indirectes de cette dernière hypothèse. Dans une cohorte prospective de nourrissons nés à terme et en bonne santé, les nourrissons qui ont développé ultérieurement une infection sévère par le VRS et une respiration sifflante postérieure au VRS ont obtenu des résultats plus faibles aux tests de la fonction pulmonaire pendant la période néonatale que ceux qui n'ont pas développé d'infection ou de respiration sifflanteNote de bas de page 36, et une autre étude a montré une hyper-réactivité bronchique chez des nourrissons nés à terme par ailleurs en bonne santé ayant développé ultérieurement une bronchiolite sévèreNote de bas de page 96. Des facteurs génétiques prédisposant à une infection sévère par le VRS ont été décritsNote de bas de page 94 Note de bas de page 95. Une association entre l'infection précoce par le rhinovirus et l'asthme a été établieNote de bas de page 95, ainsi qu'une association entre l'asthme et la fréquence des infections virales respiratoires dans la petite enfance plutôt qu'une étiologie particulièreNote de bas de page 97. Un examen récent de l'Organisation mondiale de la santé a déterminé que des données probantes non concluantes ne permettent pas d'établir un lien de causalité entre l'infection des VR inférieures par le VRS et la respiration sifflante récurrente dans l'enfance ou l'asthme et que ces données ne définissent pas d'effet substantiel de l'anticorps monoclonal contre le VRS sur ces résultatsNote de bas de page 98.
L'ESFdM a mis en évidence 6 études portant sur les séquelles respiratoires à long terme de l'infection par le VRS chez le nourrisson.
Une étude portant sur des enfants nés entre 32 et 35 sAG, ayant subi ou non une HVRS à un âge de moins de 12 mois, a révélé de légères augmentations des proportions d'enfants présentant une respiration sifflante simple (moins de 3 épisodes en 12 mois) signalée par les parents ou le médecin (RR : 1,4; IC à 95 % : 1,15 à 1,60 %; augmentation absolue : 18 %), une respiration sifflante récurrente (3 épisodes ou plus en 12 mois) signalée par les parents ou le médecin (RR : 1,70; IC à 95 % : 1,27 à 2,29 %; augmentation absolue : 19 %), ou un sifflement sévère signalé par le médecin (une hospitalisation ou plus ou 3 épisodes ou plus médicalement assistés ou sous traitement médicamenteux pour le sifflement pendant 3 mois consécutifs ou 5 mois cumulés) [RR : 1,59; IC à 95 % : 1,13 à 2,24 %; augmentation absolue : 14 %] de l'âge de 2 à 6 ans. Il existait peu ou pas de différence dans la respiration sifflante au cours de la 6e année, avec un RR de 1,16 (IC à 95 % : 0,70 - 1,93 %), un RR de 1,28 (IC à 95 % : 0,71 à 2,32 %) et un RR de 0,91 (IC à 95 % : 0,44 à 1,88 %) pour la respiration sifflante simple, récurrente et sévère, respectivement. On a observé une légère augmentation de l'utilisation de bronchodilatateurs (RR : 1,48; IC à 95 % : 1,23 à 1,77 %; augmentation absolue : 8 %), de corticostéroïdes inhalés (RR : 1,65; IC à 95 % : 1,13 à 2,40 %; augmentation absolue : 10 %) et de corticostéroïdes par voie orale (RR : 1,71; IC à 95 % : 1,06 à 2,74 %; augmentation absolue : 8 %) et une augmentation plus importante de l'utilisation d'antagonistes des récepteurs des leucotriènes (RR : 2,52; IC à 95 % : 1,43 à 4,42 %; augmentation absolue : 10 %) de l'âge de 2 à 6 ans (CDP faible pour tous les résultats)Note de bas de page 32.
Une étude a comparé la respiration sifflante chez les nourrissons nés à moins de 33 sAG par rapport aux nourrissons nés à terme dans l'année suivant une HVRS. Il n'y avait pas de différence significative entre les 2 groupes en ce qui concerne les sifflements simples, récurrents ou sévères (RR : 0,54; IC à 95 % : 0,18 à 1,55 %; RR : 0,80; IC à 95 % : 0,04 à 16,14 %; RR : 0,00; IC à 95 % : -0,34 à 0,34 %, respectivement, mais les chiffres concernant le VRS étaient peu nombreux) [CDP très faible]Note de bas de page 29.
Une étude sur la respiration sifflante au cours de la première année de vie chez des nourrissons nés à terme et en bonne santé, infectés par le VRS, ayant subi ou non une HVRS, n'a révélé que peu ou pas de différence entre les 2 groupes en ce qui concerne le nombre de jours de respiration sifflante par mois, selon les parents (différence moyenne de 0,70; IC à 95 % : -0,94 à 2,34 %) (CDP très faible)Note de bas de page 36.
Le RR d'asthme diagnostiqué par un médecin à l'âge de 7 ans chez les nourrissons nés à terme et en bonne santé, dont la mère était asthmatique et qui avaient été atteints du VRS plutôt que par une autre infection respiratoire au cours de la première année de vie, était de 2,33 (IC à 95 % : 1,35 à 4,05 %; augmentation absolue de 15 %, RC 2,82; IC à 95 % : 1,38 à 5,77 %; p = 0,005). Après ajustement pour le nombre total d'infections respiratoires, le RC était de 1,26 (IC à 95 % : 0,54 à 2,91 %; p = 0,59 (CDP très faible)Note de bas de page 97.
Aucune différence n'était à noter en matière d'asthme diagnostiqué par un médecin entre 28 et 31 ans chez les personnes nées à terme selon qu'elles ont ou non subi une HVRS avant l'âge de 24 mois (RR 1,82; IC à 95 % : 0,84 à 3,94 %) (CDP très faible). On a constaté une augmentation de l'utilisation autodéclarée de bronchodilatateurs (RR 2,17; IC à 95 % : 1,08 à 4,34 %), mais aucune différence dans l'utilisation autodéclarée de corticostéroïdes inhalés (RR 1,56; IC à 95 % : 0,62 à 3,89 %) (CDP très faible)Note de bas de page 99.
Certaines études ont également abordé la fonction pulmonaire. On n'observait que peu ou pas de différence dans la proportion d'enfants nés entre 32 et 35 sAG et dont l'écart Z du volume expiratoire maximal par minute (VEM1) était de -2 ou -1 dans la 6e année de vie selon qu'ils aient ou non subi une HVRS avant l'âge de 12 mois (RR 0,83; IC à 95 % : 0,45 à 1,53 %) (CDP faible)Note de bas de page 32.
Les nourrissons ayant subi ou non une HVRS avant l'âge de 24 mois ont été évalués à l'âge de 17 à 20 ans ou de 28 à 31 ans. Avant l'administration du bronchodilatateur, on a observé une légère diminution du pourcentage moyen de la valeur prédite du VEM1 (différence moyenne de -7,63; IC à 95 % : -11,35 à -3,91 %) et du pourcentage moyen de la capacité vitale forcée (CVF) [différence moyenne de -4,74; IC à 95 % : -7,80 à -1,67 %] (CDP faible). On ne constatait que peu ou pas de différence dans le pourcentage moyen de la valeur prédite du VEM1/de la CVF (différence moyenne de -3,20; IC à 95 % : -9,07 à 2,67 %) ou le pourcentage moyen de la valeur prédite du volume expiratoire maximal après 50 % de la CVF expirée (DEM50) [différence moyenne de -4,00; IC à 95 % : -14,95 à 6,95 %] (CDP très faible)Note de bas de page 99 Note de bas de page 100. De même, peu ou pas de différence dans le changement du pourcentage moyen de la valeur prédite du VEM1 (différence moyenne de 0,81; IC à 95 % : -0,67 à 2,30 %) [CDP faible] après l'administration du bronchodilatateur. Les données sont très incertaines en ce qui concerne la modification du pourcentage moyen de la valeur prédite de la CVF (différence moyenne de 0,60; IC à 95 % : -0,67 à 1,87 %) [CDP très faible], le VEM1/la CVF (différence moyenne de -0,20; IC à 95 % : -2,71 à 2,31 %) et la modification du pourcentage moyen de la valeur prédite du DEM50 (différence moyenne de 3,70; IC à 95 % : -5,42 à 12,82 %) après l'administration d'un bronchodilatateur (CDP très faible). On n'a constaté que peu de différence, sinon aucune, pour la fraction d'oxyde d'azote dans l'air expiré entre les personnes ayant ou non subi une HVRS avant l'âge de 24 mois (différence moyenne de -1,00; IC à 95 % : -14,49 à 12,49 %) [CDP faible]Note de bas de page 99 Note de bas de page 100.
Les données d'une seule étude ont montré des taux de respiration sifflante récurrente après une HVRS dans la petite enfance de 12,4 % (IC à 95 % : 6,3 à 18,5 %; RdB modéré) pour la respiration sifflante récurrente signalée par les parents ou diagnostiquée par le médecin et de 8,0 % (IC à 95 % : 3,0 à 13,0 %) pour la respiration sifflante sévère diagnostiquée par le médecin à l'âge de 6 ansNote de bas de page 32. Dans d'autres études, les taux d'asthme diagnostiqué par un médecin après une HVRS au cours de la première année de vie étaient de 26,9 % (IC à 95 % : 14,9 à 39,0 %; RdB faible) à l'âge de 7 ansNote de bas de page 97; et de 23,3 % (IC à 95 % : 10,6 à 35,9 %; RdB modéré) à l'âge de 28 à 31 ansNote de bas de page 99.
La mise à jour de la revue de la littérature de 2020 a permis de repérer 2 études portant sur la respiration sifflante récurrente ou l'asthme à long terme. Dans une étude prospective de cohorte de naissance, des enfants prématurés nés entre 25 et 32 sAG ont fait l'objet d'un suivi à l'âge de 6 ans pour une respiration sifflante signalée par les parents au cours des 12 mois précédents. Une respiration sifflante a été signalée chez 27,7 % des enfants ayant subi une HVRS dans la petite enfance, contre 17,6 % de ceux qui ne l'ont pas été (RC 1,80; IC à 95 % : 1,11 à 2,85 %). Après ajustement pour la prise en compte des facteurs de confusion, le RC était de 1,89 (IC à 95 % : 1,06 à 3,32 %). Une fois stratifiée en fonction d'une prédisposition atopique (définie comme une affection atopique chez au moins un parent), la différence n'était significative que pour le groupe sans prédisposition atopique (RdB élevé)Note de bas de page 101.
Une étude de cohorte appariée rétrospective portant sur des nourrissons nés à terme et ne souffrant pas d'une CPCHS, d'une MPC, ni d'une anomalie des VR, ayant ou non été infectés par le VRS au cours de la première année de vie, a évalué l'asthme ou les troubles réactifs des VR, connus à partir de bases de données de réclamations administratives, au cours des 5 premières années de vie. L'incidence cumulative de l'asthme ou des troubles réactifs des VR chez les enfants avec ou sans antécédent d'infection par le VRS était, dans 3 bases de données administratives, respectivement de 25,2 % contre 11,4 % (RCa 2,6; IC à 95 % : 2,5 à 2,9 %; p < 0,0001); de 35,4 % contre 16,7 % (RCa 2,8 : 2,6 à 2,9 %; p < 0,0001), et de 24,4 % contre 12,7 % (RCa 2,2 : 2,0 à 2,4 %; p < 0,0001) [RdB élevé]Note de bas de page 102.
III.3 Réinfection par le VRS
Les réinfections par le VRS se produisent tout au long de la vie. L'immunité naturellement acquise ne protège pas contre une infection ultérieure, bien qu'elle puisse en modifier la sévérité, l'infection initiale étant généralement l'infection la plus sévère pendant l'enfanceNote de bas de page 103 Note de bas de page 104 Note de bas de page 105. En outre, 2 sous-groupes de VRS distincts sur le plan antigénique, A et B, peuvent circuler au cours de la même saisonNote de bas de page 105 Note de bas de page 106. Dans une étude portant sur 30 nourrissons de moins de 2 ans atteints de dysplasie broncho-pulmonaire (DBP), un enfant a connu 2 HVRS au cours de la même saison (3,3 %)Note de bas de page 107. Deux études prospectives menées en Espagne auprès d'enfants nés à 32 sAG ou moins ont fait état d'HVRS récurrentes au cours de la même saison chez 6/584 (1,0 %) et 9/999 (0,9 %) des patientsNote de bas de page 108 Note de bas de page 109. Pour ces raisons, les déclarations antérieures du CCNINote de bas de page 4 et de l'AAPNote de bas de page 5 recommandaient la poursuite du PVZ lorsqu'un nourrisson présentait une infection malgré l'administration d'une prophylaxie.
Cependant, des données plus récentes suggèrent que les infections répétées par le VRS au cours de la même saison sont rares. Une étude au Danemark portant sur 240 prématurés nés à moins de 28 sAG ou dont le poids de naissance était inférieur à 1 000 g n'a signalé qu'un seul enfant ayant subi 2 HVRS au cours de la même saison (0,4 %)Note de bas de page 110. Dans un essai du PVZ contrôlé par placebo chez des enfants atteints de CPC, seul 0,39 % des enfants (3 sur 648 dans le groupe placebo et 2 sur 639 ayant reçu le PVZ) a connu plus d'une HVRS au cours de la même saisonNote de bas de page 80. Dans une autre étude portant sur 429 nourrissons prématurés suivis pendant un an, aucune réinfection par le VRS n'a été constatéeNote de bas de page 111. Une étude menée en milieu ambulatoire a permis de recenser 726 infections des VR inférieures par le VRS chez des enfants de moins de 5 ans au cours de 8 saisons de VRS successives. On a dénombré 56 réinfections, une seule s'étant produite au cours de la même saisonNote de bas de page 112. Dans une autre étude en milieu ambulatoire portant sur des enfants de moins de 5 ans, sur 1 802 enfants présentant des infections des VR dues au VRS sur 2 saisons, un seul a connu 2 infections au cours de la même saison, l'une par le VRS-A et l'autre par le VRS-BNote de bas de page 113. En raison de la rareté des infections répétées au cours d'une même saison, l'AAP (2014)Note de bas de page 6 et la SCP (2015)Note de bas de page 8 recommandent maintenant d'interrompre la prophylaxie mensuelle si un enfant subit une HVRS malgré l'administration du PVZ.
III.4 Risque d'infection par le VRS dans une fratrie avec naissances multiples
Dans le cadre d'une étude cas-témoins portant sur des prématurés atteints de DBP,14 ensembles de jumeaux et 2 ensembles de triplés ont été appariés à 34 enfants uniques en fonction de la date de naissance et de l'AG. Le risque de développer une maladie due au VRS était significativement plus élevé chez les nourrissons issus de naissances multiples que chez les enfants uniques (53 % contre 24 %; p = 0,01), tout comme le taux d'HVRS (32 % contre 18 %; p = 0,05) et le taux de pneumonie liée au VRS (24 % contre 6 %, p = 0,05). Après prise en compte des facteurs de confusion dans une analyse de régression logistique multiple appariée, la naissance multiple n'était encore associée de façon significative qu'au développement d'une pneumonie (p = 0,048)Note de bas de page 114. Dans une autre étude, Resch et al. ont évalué rétrospectivement les taux d'hospitalisation pour cause de maladie respiratoire chez 435 prématurés nés entre 29 et 36 sAG sans MPC. Ils ont constaté que les naissances multiples étaient associées à une HVRS (55 % contre 15 %, p = 0,013). Aucune analyse multivariée visant à prendre en compte les facteurs de confusion n'a été effectuéeNote de bas de page 115.
En revanche, 2 études prospectives plus importantes sur les facteurs de risque liés à l'HVRS portant sur un total de 2 326 prématurés ont révélé des proportions similaires de nourrissons issus de naissances multiples dans les groupes ayant connu une HVRS et dans les groupes témoinsNote de bas de page 71 Note de bas de page 116.
Dans une étude rétrospective portant sur des nourrissons hospitalisés pour bronchiolite liée au VRS, les jumeaux représentaient 7,6 % (66/875) des hospitalisations. Sur les 53 paires de jumeaux dont au moins l'un d'entre eux avait subi une HVRS, si l'un des jumeaux était hospitalisé, l'autre avait 34 % de chances d'être également hospitalisé pour une bronchiolite (24 % de chances d'être hospitalisé pour une bronchiolite positive au VRS) pendant la même période. Cependant, les nourrissons du groupe de jumeaux étaient plus jeunes et avaient un AG inférieur à celui des enfants uniques. Dans l'analyse multivariée, le fait d'être né jumeau ne constituait pas un facteur de risque significatif pour la sévérité de la maladie liée au VRSNote de bas de page 117.
III.5 Infections par le VRS liées aux soins de santé
Le VRS se transmet fréquemment dans les hôpitaux, y compris dans les unités néonatales de soins intensifs (UNSI)Note de bas de page 118. Les données disponibles indiquent que les taux d'infection par le VRS au cours de l'hospitalisation à la naissance ne diffèrent pas entre les nourrissons qui reçoivent une prophylaxie par PVZ pendant leur séjour en UNSI et ceux qui reçoivent une PVZ à partir de la sortie de l'hôpitalNote de bas de page 119 Note de bas de page 120 Note de bas de page 121. Ces études ont été jugées de qualité passable (critères de Harris)Note de bas de page 122. La Déclaration du CCNI de 2003 sur le PVZ n'aborde pas la question de l'administration du PVZ aux patients hospitalisés.Note de bas de page 4 La Déclaration de l'AAP de 2014 indique que les nourrissons en UNSI qui remplissent les conditions requises pour une prophylaxie peuvent recevoir une dose entre 48 et 72 heures avant leur sortie de l'hôpital ou rapidement aprèsNote de bas de page 6. La SCP indique que pour les nourrissons admissibles qui rentrent à la maison pour la première fois au cours de la saison du VRS, l'administration du PVZ devrait commencer juste avant la sortieNote de bas de page 8. Le livre vert du Royaume-Uni indique que les nourrissons des UNSI qui appartiennent aux groupes de risque pertinents doivent commencer à recevoir le PVZ entre 24 et 48 heures avant leur sortieNote de bas de page 123. Pour éviter le gaspillage lorsque des flacons sont ouverts quotidiennement pour des nourrissons uniques qui vont bientôt sortir de l'hôpital, il a été suggéré de coordonner les administrations à 3 fois par semaineNote de bas de page 121.
Le PVZ a été fréquemment utilisé pour maîtriser les épidémies de VRS dans les UNSI. Dans certains cas, il a été administré à tous les nourrissons exposésNote de bas de page 118 Note de bas de page 124 Note de bas de page 125 Note de bas de page 126 Note de bas de page 127; dans d'autres, seulement à ceux qui auraient été admissibles au PVZ en tant que patients externesNote de bas de page 118 Note de bas de page 127 Note de bas de page 128. Le PVZ a été mis en place après l'échec d'autres mesures de maîtrise de l'infection dans certaines éclosionsNote de bas de page 118 Note de bas de page 124, et au moment de la reconnaissance de l'éclosion dans d'autresNote de bas de page 118 Note de bas de page 125 Note de bas de page 126 Note de bas de page 127 Note de bas de page 128. Le rôle supplémentaire joué par le PVZ dans la maîtrise de ces éclosions n'a pas pu être déterminéNote de bas de page 118. Le PVZ peut être utile lorsque d'autres mesures n'ont pas permis de maîtriser une éclosion ou lorsque l'on prévoit que l'observance des recommandations de maîtrise de l'infection sera faibleNote de bas de page 118 Note de bas de page 126.
Bien que le sujet ne soit pas abordé dans les déclarations de l'AAP 2014 ou de la SCP, la Déclaration de l'AAP 2009 sur le PVZ indique que les nourrissons qui ont commencé une prophylaxie au PVZ antérieurement dans la saison et qui sont hospitalisés au moment où une dose est prévue doivent recevoir cette dose comme prévuNote de bas de page 5. De même, un livre vert du Royaume-Uni indique que les nourrissons qui ont commencé un traitement au PVZ mais qui sont ensuite hospitalisés doivent continuer à le recevoir pendant leur séjour à l'hôpitalNote de bas de page 123.
Produit
IV.1 Préparation autorisée au Canada
Le seul produit dont l'usage soit actuellement autorisé au Canada pour la prévention des maladies graves liées au VRS est le PVZ (SynagisMD, AbbVie AstraZeneca, Mississauga, Ontario). Le PVZ est un anticorps monoclonal humanisé (IgG1κ) produit par la technologie de l'ADN recombinant, dirigé contre un épitope du site antigénique A de la protéine F du VRS, une protéine de surface qui est hautement conservée parmi les isolats du VRS. Il s'agit d'un composite de séquences d'acides aminés d'origine humaine à 95 % et d'origine murine à 5 %Note de bas de page 129. Son usage a été autorisé au Canada en 2002.
La solution injectable de PVZ est disponible en flacons à usage unique de 50 mg/0,5 ml et de 100 mg/1 ml. Les ingrédients non médicinaux qu'elle contient sont le chlorure, la glycine, l'histidine et l'eau aux fins d'injectionNote de bas de page 129.
IV.2 Efficacité potentielle et efficacité réelle
Les études sur l'efficacité potentielle et l'efficacité réelle du PVZ dans la prévention des conséquences sévères de l'infection par le VRS chez les enfants à haut risque de maladie sévère liée au VRS sont rapportées dans le document « NACI Literature Review on the Effects of Palivizumab Prophylaxis on Reducing the Complications Associated with Respiratory Syncytial Virus in Infants » (en anglais seulement) qui sera bientôt disponible. Les résultats en sont résumés ci-dessous. Dans des populations mixtes de nourrissons à risque d'infection sévère par le VRS, la prophylaxie par PVZ est associée à des réductions de 38 à 86 % du risque d'HVRS, le nombre de sujets à traiter (NST) pour prévenir une hospitalisation étant de 2 à 24. Les différences d'état de santé au sein des populations mixtes empêchent de tirer des conclusions définitives sur les avantages relatifs pour les différents groupes de patients. Les études portant sur des populations mixtes ne seront pas commentées plus avant ici, mais sont incluses dans la revue de la littérature.
IV.2.1 Nourrissons prématurés sans maladie pulmonaire chronique infantile
IV.2.1.1 Hospitalisations associées au VRS
Douze études ont examiné l'effet de la prophylaxie par PVZ sur l'HVRS chez les prématurés sans MPC : un examen systématique et une méta-analyse de qualité moyenneNote de bas de page 74, 4 rapports d'ECR de bonne qualitéNote de bas de page 41 Note de bas de page 48 ou de qualité moyenneNote de bas de page 111 Note de bas de page 130, 6 études de cohorte par observation dont la qualité était bonneNote de bas de page 131, moyenne ou passableNote de bas de page 27 Note de bas de page 44 Note de bas de page 49, ou faibleNote de bas de page 47 Note de bas de page 132, et une étude cas-témoin de qualité passableNote de bas de page 133.
L'examen systématique et la méta-analyse des études menées entre 1990 et 2007 ont révélé que, par rapport à l'absence de prophylaxie, l'utilisation du PVZ était associée à 72 % de moins d'HVRS chez les nourrissons nés à 32 sAG ou avant, et à 74 % de moins chez les nourrissons nés entre 32 et 35 sAGNote de bas de page 74. L'ECR IMpact réalisé en 1996 a indiqué une diminution de 78 % du taux d'HVRS chez les prématurés âgés de 6 mois ou moins sans MPC ayant reçu du PVZ, avec un NST de 16 Note de bas de page 48. La diminution était de 47 % pour les nourrissons nés à 32 sAG ou avant et de 72 % pour ceux nés entre 32 et 35 sAGNote de bas de page 48. L'étude de Notario et al. a analysé de façon plus approfondie les données de l'ECR IMpact par groupes d'AG. Le PVZ a permis des réductions significatives du taux d'hospitalisation pour les nourrissons nés entre 28 et 31 sAG (73 %), entre 29 et 32 sAG (80 %), entre 32 et 34 sAG (82 %) et entre 32 et 35 sAG (82 %), mais pas pour ceux nés à moins de 29 sAG ou entre 33 et 35 sAG. Les chiffres dans ces 2 derniers groupes étaient faiblesNote de bas de page 41. Le NST variait de 13 à 21 et diminuait avec l'augmentation de l'AG. Il a été constaté un effet protecteur significatif similaire à la prophylaxie par PVZ dans un ECR ultérieur portant sur des nourrissons nés entre 33 et 35 sAG suivis entre 2008 et 2010 (82 %, NST : 24)Note de bas de page 111 et un petit ECR portant sur des nourrissons nés à 32 sAG ou moins suivis entre 2009 et 2011 (RC 0,26; NST : 5)Note de bas de page 130.
Dans l'étude cas-témoins prospective jugée de qualité passable, menée de 2002 à 2006, l'efficacité réelle du PVZ pour la prévention d'une HVRS était de 74 % chez les nourrissons nés entre 29 et 35 sAG. L'efficacité n'a pas été observée chez les nourrissons nés à moins de 29 sAG, mais les effectifs étaient faiblesNote de bas de page 133.
Les études d'observation de cohorte ont donné des résultats contradictoires quant à l'incidence de la prophylaxie par PVZ sur l'HVRS chez les prématurés. Une étude de cohorte rétrospective de qualité passable portant sur des enfants nés entre 2012 et 2015 a révélé un taux d'HVRS de 38 % plus bas au cours de la première saison du VRS chez les nourrissons nés entre 29 et 32 sAG ayant reçu du PVZ par rapport aux nourrissons qui n'ont reçu aucune prophylaxie (NST : 53), mais aucune différence statistiquement significative dans les HVRS chez les nourrissons nés entre 33 et 36 sAG ayant ou non reçu une prophylaxie par PVZ. Cependant, le nombre d'enfants ayant effectivement reçu le PVZ qui leur avait été prescrit dans ce groupe était faibleNote de bas de page 27.
Dans une étude d'observation jugée de qualité passable, la prophylaxie par PVZ n'a pas réduit de manière significative le taux d'HVRS chez les nourrissons nés à 28 sAG ou avant sans MPC suivis entre 2011 et 2013 par rapport à un groupe témoin historique né entre 2000 et 2008Note de bas de page 44. Cependant, la taille des échantillons était faible.
Dans une étude jugée de bonne qualité, le PVZ n'était pas significativement efficace dans les cohortes d'enfants nés entre 32 et 35 sAG en 2002 et 2003Note de bas de page 131. Une autre étude de cohorte de nourrissons nés entre 32 et 34 sAG de 1995 à 2004, jugée de qualité passable, a indiqué une réduction significative d'HVRS au Texas (RC = 0,45; IC à 95 % : 0,26 à 0,78 %; p = 0,005), mais pas en Floride (RC = 0,81; IC à 95 % : 0,42 à 1,58 %; p = 0,54)Note de bas de page 49.
Dans une étude jugée de qualité faible, il a été constaté que la prophylaxie par PVZ réduisait significativement les HVRS dans une cohorte d'enfants nés à 30 sAG ou moins entre 1999 et 2004 (1,1 % contre 13,6 %, NST : 9)Note de bas de page 47.
En résumé, il existe de bonnes données probantes, basées sur des critères techniques cotés précoces, de l'efficacité du PVZ chez les prématurés nés entre 28 et 35 sAG. Les résultats contradictoires des études d'observation sur les nourrissons nés entre 32 et 36 sAG sont difficiles à expliquer, mais peuvent en partie être dus à des différences dans les plans des études, l'observance, le lieu et l'époque. Trois études, l'une de bonne qualité et deux de qualité passable, ont suggéré une absence d'effet chez les nourrissons nés à moins de 29 sAG, mais cela peut être le résultat du petit nombre de nourrissons sans MPC dans ce groupe de grands prématurésNote de bas de page 41 Note de bas de page 44 Note de bas de page 133. Une étude d'observation de faible qualité a étayé un effet protecteur chez les nourrissons nés à 30 sAG ou moins. En général, il semble qu'il existe des données probantes à l'appui de l'efficacité du PVZ dans la réduction des HVRS chez les enfants nés prématurément, bien que les données ne permettent pas de définir clairement le degré de prématurité auquel le PVZ est le plus efficace.
IV.2.1.2. Mortalité
La seule étude ayant examiné la mortalité toutes causes confondues consistait en un examen systématique et une méta-analyse de qualité moyenne, menés par Checchia et al. chez les nourrissons nés à 32 sAG ou avant. Pour les receveurs du PVZ, le risque de mortalité toutes causes confondues était significativement réduit (RC = 0,25; IC à 95 % : 0,13 à 0,49 %; p < 0,001) par rapport aux receveurs du placebo ou à l'absence d'intervention, tandis que chez les nourrissons nés entre 32 et 35 sAG, la différence n'était pas significative (RC = 0,22; IC à 95 % : 0,03 à 1,89 %; p = 0,085)Note de bas de page 74.
Il est possible qu'il y ait une incidence différentielle de la prophylaxie par PVZ sur la mortalité toutes causes confondues dans cette population, témoignant d'un effet protecteur chez les nourrissons nés à 32 sAG ou avant, mais pas à des niveaux de prématurité moindres (entre 32 et 35 sAG). Cependant, ces résultats reposent sur un petit nombre d'études qui sont peut-être insuffisantes pour détecter une différence de mortalité chez les enfants moins prématurés.
IV.2.1.3 Séquelles à long terme
IV.2.1.3.1. Respiration sifflante récurrente et asthme atopique
Six rapports ont examiné l'effet de la prophylaxie par PVZ sur le risque de respiration sifflante au cours des premières années de vie : 2 rapports de qualité moyenne ou passable issus d'un ECRNote de bas de page 111 Note de bas de page 134 et 4 rapports provenant de 2 études de cohorte dont la qualité était soit bonneNote de bas de page 135, soit moyenne ou passableNote de bas de page 136 Note de bas de page 137, soit faibleNote de bas de page 138. Une étudeNote de bas de page 111 s'intéressait uniquement à la respiration sifflante signalée par les parents, tandis que les 5 autres s'intéressaient à la respiration sifflante diagnostiquée par le médecin ou à la fois signalée par les parents et diagnostiquée par le médecin. Trois études ont révélé que la prophylaxie par PVZ chez des prématurés par ailleurs en bonne santé, nés entre 33 et 35 sAGNote de bas de page 111 Note de bas de page 138 ou à 35 sAG ou moinsNote de bas de page 136, a entraîné une réduction significative (de 46 à 66 %) du risque de respiration sifflante chez les enfants au cours de la première année de vieNote de bas de page 111, jusqu'à l'âge de 3 ansNote de bas de page 138, ou jusqu'à 2 ans après le suivi démarré au plus tard à l'âge de 36 moisNote de bas de page 136.
Dans un autre rapport issu de l'étude de cohorte de Simoes et al., les enfants qui avaient reçu une prophylaxie par PVZ présentaient une incidence significativement réduite de respiration sifflante diagnostiquée par un médecin 24 mois après l'inscription à l'étude, et un délai significativement plus long avant un troisième épisode de respiration sifflante diagnostiqué par un médecin par rapport aux enfants n'ayant reçu aucune intervention, mais uniquement chez les enfants sans antécédents familiaux d'asthme ou d'atopie. Il n'y avait pas de différence significative dans ces résultats chez les enfants ayant des antécédents familiaux d'asthme ou d'atopieNote de bas de page 135.
Un suivi de la cohorte d'enfants nés entre 33 et 35 sAG et examinés une première fois pour cause de respiration sifflante à l'âge de 3 ansNote de bas de page 138 a révélé des taux réduits de respiration sifflante récurrente diagnostiquée par un médecin au cours des 6 premières années de vie chez les enfants ayant reçu une prophylaxie par PVZ par rapport aux enfants n'en ayant pas reçu. Cependant, cette association n'a été trouvée que dans les sous-groupes d'enfants ayant des antécédents familiaux d'allergie. Les auteurs ont distingué l'asthme atopique (respiration sifflante récurrente et IgE élevées) de la simple respiration sifflante récurrente, et ont constaté que les taux d'asthme atopique étaient similaires chez les enfants ayant reçu du PVZ et ceux n'en ayant pas reçu, indépendamment des antécédents familiaux d'allergieNote de bas de page 137. Lors du suivi à l'âge de 6 ans des nourrissons ayant participé à l'ECR de Blanken et al., la différence entre les enfants ayant reçu le PVZ ou le placebo n'était significative que pour ceux dont les parents avaient signalé une respiration sifflante peu fréquente (de 1 à 3 épisodes par an). On ne notait pas de différence significative en ce qui concerne l'asthme diagnostiqué par un médecin ou le recours à des médicaments contre l'asthme au cours des 12 mois précédents, et la fonction pulmonaire à l'âge de 6 ans ne différait pas entre les groupesNote de bas de page 134.
Il semble que le PVZ puisse avoir un effet constant de réduction de l'incidence de la respiration sifflante récurrente chez les jeunes enfants au cours des premières années de vie, mais les résultats sont contradictoires quant à l'incidence relative du PVZ par rapport à des antécédents familiaux d'atopie sur la respiration sifflante récurrente ultérieure chez les enfants plus âgés. Ces études ne permettent pas non plus de savoir à quel niveau de prématurité le PVZ peut être le plus efficace pour avoir une incidence à long terme. Le NST pour prévenir un cas de respiration sifflante récurrente était de 7 à 8 chez les nourrissons nés entre 32 et 35 sAG ou entre 33 et 35 sAGNote de bas de page 111 Note de bas de page 136 Note de bas de page 137 Note de bas de page 138, de 10 chez les nourrissons nés entre 29 et 32 sAGNote de bas de page 136 et de 15 chez les nourrissons nés avant 29 sAGNote de bas de page 136.
IV.2.1.3.2. Paramètres de croissance
Une étude de cohorte de qualité passable a évalué les paramètres de croissance à l'âge de 6 ans chez des enfants nés entre 33 et 35 sAGNote de bas de page 137. L'étude n'a trouvé aucune différence significative en matière de poids, de taille ou d'indice de masse corporelle entre les enfants ayant reçu du PVZ et ceux n'en ayant pas reçu.
IV.2.2 Nourrissons prématurés atteints d'une maladie pulmonaire chronique infantile
IV.2.2.1 Hospitalisations associées au VRS
Cinq études ont examiné ce résultat. Un ECR de bonne qualité portant sur des enfants nés à 35 sAG ou avant et âgés de 24 mois maximum atteints de DBP, réalisé en 1996, a révélé un risque réduit d'HVRS pour les enfants receveurs de PVZ par rapport aux nourrissons ayant reçu un placebo (RR = 0,61; IC à 95 % : 0,40 à 0,95 %; NST : 21)Note de bas de page 48. Dans une étude d'observation jugée passable, la prophylaxie par PVZ a réduit le taux d'HVRS de 86 % (NST : 13) au cours des 6 premiers mois suivant la sortie initiale de l'hôpital pour les nourrissons atteints de MPC suivis entre 2011 et 2013, par rapport à un groupe témoin historique né entre 2000 et 2008. Selon l'AG, la réduction était significative pour les enfants nés à 28 sAG ou moins (89 %, NST : 12) et non pour ceux nés entre 29 et 35 sAG, mais les effectifs de ce dernier groupe étaient faiblesNote de bas de page 44.
Une étude d'observation de cohorte prospective antérieure de faible qualité portant sur des nourrissons nés à 32 sAG ou moins, réalisée entre 1999 et 2002, avait constaté que la prophylaxie par PVZ était associée à une réduction du risque d'HVRS (RR = 0,15; IC à 95 % : 0,05 à 0,49 %; p < 0,01; NST : 3) lors de la première infection par le VRSNote de bas de page 139. Une autre étude d'observation prospective de faible qualité qui portait sur des enfants âgés de 24 mois maximum atteints de MPC a également rapporté une réduction du risque d'HVRS (RR = 0,28; IC à 95 % : 0,14 à 0,58 %; p < 0,007; NST : 8)Note de bas de page 46. Dans une étude cas-témoins prospective, jugée de qualité passable, portant sur des nourrissons nés à 35 sAG ou moins et âgés de moins de 12 mois ou de 12 à 24 mois, menée entre 2002 et 2006, aucune réduction significative du taux d'hospitalisation n'a été observéeNote de bas de page 133.
Les résultats suggèrent que la prophylaxie par PVZ permet de réduire le risque d'HVRS dans cette population, mais l'influence de l'AG sur ce bienfait n'est pas claire.
IV.2.2.2 Mortalité
Une méta-analyse de qualité moyenne n'a pas montré d'effet du PVZ par rapport à l'absence d'intervention ou à l'administration d'un placebo sur la mortalité toutes causes confondues pour les prématurés atteints de MPC (0,22 % contre 0,34 %; RC de Peto : 0,83; IC à 95 % : 0,13 à 5,25 %), mais on ne dénombrait que 3 évènements dans le groupe avec prophylaxie et 2 évènements dans le groupe placebo/absence d'interventionNote de bas de page 74.
IV.2.3. Enfants atteints de fibrose kystique
IV.2.3.1. Hospitalisations associées au VRS
Six études ont examiné ce résultat. Un examen systématique jugé de bonne qualité a repéré un ECR mené entre 1998 et 2001. L'étude n'a trouvé aucune différence significative en matière d'HVRS chez les enfants atteints de FK ayant reçu soit une prophylaxie par PVZ, soit un placebo (RR : 1,02; IC à 95 % : 0,06 à 16,09 %). Cependant, un seul enfant de chaque groupe a subi une HVRSNote de bas de page 140 Note de bas de page 141. Une petite étude d'observation de qualité passable a révélé que les témoins historiques suivis entre 1997 et 2002 n'ayant pas reçu de PVZ présentaient plus de risque de subir une HVRS que les enfants ayant reçu du PVZ entre 2003 et 2007 (21,3 % contre 4,4 %, p = 0,027; NST : 6)Note de bas de page 78. Trois autres études d'observation n'ont trouvé aucune différence significative en matière d'HVRS entre les receveurs de PVZ et les témoins. Dans l'étude de Bjornson et al. réalisée entre 2000 et 2017 et jugée de qualité passable, le taux d'hospitalisation était de 2,7 % pour les receveurs de PVZ contre 6,0 % pour les témoins (p = 0,20). Après ajustement pour la prise en compte des facteurs de confusion, le taux d'HVRS n'était toujours pas significativement inférieur chez les enfants ayant reçu du PVZ par rapport à ceux qui n'en avaient pas reçu. Cependant, le taux d'hospitalisation pour maladie respiratoire était significativement réduit chez les enfants ayant reçu du PVZ, et le taux général de dépistage du VRS était faible (53 %)Note de bas de page 77. Une étude de grande envergure réalisée entre 1999 et 2006, de faible qualitéNote de bas de page 142, et une petite étude portant sur les enfants ayant reçu du PVZ réalisée entre 2001 et 2005 avec des témoins historiques entre 1997 et 2000, également de faible qualitéNote de bas de page 143, n'ont pas conclu à un bienfait significatif de la prophylaxie par PVZ par rapport à l'absence d'intervention en matière d'HVRS ultérieure. Une étude cas-témoins de qualité passable, menée entre 2001 et 2012, n'a pas trouvé de réduction significative du taux d'HVRS entre le groupe ayant reçu du PVZ (5 %) et le groupe témoin (2,9 %)Note de bas de page 144.
Les résultats de ces études ne permettent pas de tirer de conclusions sur l'efficacité de la prophylaxie par PVZ pour réduire le risque d'HVRS chez les enfants atteints de FK. Seule l'étude d'observation de Groves et al. a trouvé un effet préventif significatif de la prophylaxie par PVZ sur l'HVRSNote de bas de page 78. Le taux d'HVRS dans le groupe témoin de cette étude était très élevé, mais le nombre de participants était faible. La plupart des études étaient menées sur de petits effectifs et peut-être insuffisantes pour détecter un effet. L'exception est la grande étude de Winterstein et al., qui a utilisé une base de données administrative des professionnels de la santéNote de bas de page 142. Il se peut que certains enfants atteints de FK, par exemple ceux souffrant d'une MPC importante au cours de la première ou deuxième année de vie, en retirent un bienfait.
IV.2.3.2 Autres résultats dus au VRS en matière d'hospitalisation
IV.2.3.2.1. Durée de l'hospitalisation associée au VRS
Une étude d'observation de cohorte de qualité passable a examiné l'effet du PVZ sur la durée de l'HVRS chez les enfants atteints de FK. La moyenne de la DSH était significativement moindre chez les receveurs de PVZ (5,7 ± 2,4 jours) que chez les témoins (47 ± 39 jours), p = 0,048Note de bas de page 77. Une petite étude de cohorte historique antérieure de faible qualité n'a trouvé aucune différence significative dans le nombre médian de jours d'HVRS chez les receveurs de PVZ (11, EIQ : 3-14) par rapport aux enfants ayant reçu un placebo (13, EIQ : 2-14) [RC = 0,46; IC à 95 % : 0,16 à 1,31 %]Note de bas de page 143.
À l'heure actuelle, compte tenu des résultats d'une seule petite étude jugée de faible qualité et peut-être insuffisante pour détecter une différence, aucune conclusion ferme ne peut être tirée quant à l'effet de la prophylaxie par le PVZ sur la durée de l'HVRS chez les enfants atteints de FK.
IV.2.3.2.2. Hospitalisation dans une unité de soins intensifs en raison du VRS
Une étude a évalué ce résultat. Aucun des 183 receveurs de PVZ n'a été hospitalisé en USI en raison du VRS, tandis que 2 des 84 témoins l'ont été. Parmi les patients ayant subi une HVRS, 2 des 5 patients du groupe témoin ont dû être admis en USINote de bas de page 77.
IV.2.3.2.3. Besoin d'assistance respiratoire en raison du VRS
L'étude de Robinson et al. a examiné l'effet de la prophylaxie par PVZ sur le recours à l'oxygénothérapie en raison du VRS chez les enfants atteints de FK. Aucune différence significative entre les groupes n'a été constatée en ce qui concerne la nécessité d'une oxygénothérapie; toutefois, le nombre de résultats était faible (groupe prophylaxie par PVZ, n = 1; groupe placebo, n = 0)Note de bas de page 140. Dans l'étude de Bjornson, une assistance respiratoire accrue, sous forme soit de VM, soit d'oxygénothérapie, a été nécessaire pour 2,2 % des receveurs de PVZ et 1,2 % du groupe témoin (p = 0,58).Note de bas de page 77 Dans l'étude de Buchs, aucun patient n'a eu besoin d'oxygène supplémentaire ni de VMNote de bas de page 144.
IV.2.3.3 Mortalité toutes causes confondues
L'étude d'ECR a examiné l'efficacité de la prophylaxie par PVZ pour réduire la mortalité toutes causes confondues chez les enfants atteints de FK. Cependant, comme aucun décès n'a été recensé dans l'un ou l'autre groupe au cours des 6 mois de suivi de l'étude, aucune conclusion ne peut être tirée quant à l'effet de la prophylaxie par PVZ sur ce résultatNote de bas de page 140. Une étude de cohorte plus importante menée par Fink et al. n'a pas non plus signalé de différence dans la mortalité toutes causes confondues avant l'âge de 2 ans entre ceux qui ont reçu du PVZ et ceux qui n'en ont pas reçuNote de bas de page 145.
IV.2.3.4. Séquelles à long terme
IV.2.3.4.1. Fonction pulmonaire
Une petite étude de cohorte historique de qualité passable n'a révélé aucune différence significative dans la fonction pulmonaire (évaluée par la mesure du VEM1) à l'âge de 6 ans entre les enfants atteints de FK selon qu'ils avaient reçu ou non du PVZNote de bas de page 78. L'étude de cohorte de Fink et al., jugée de faible qualité, n'a pas non plus trouvé de différence dans le VEM1 à l'âge de 7 ans entre ceux qui avaient reçu du PVZ et ceux qui n'en avaient pas reçuNote de bas de page 145.
IV.2.3.4.2. Paramètres de croissance
L'ECR n'a révélé aucune différence significative entre les groupes PVZ et placebo lors du suivi de 12 mois en ce qui concerne la prise de poids ou le rapport poids/tailleNote de bas de page 140. Une petite étude de cohorte historique n'a trouvé aucune différence significative dans les paramètres de croissance (poids, taille, indice de masse corporelle) à l'âge de 6 ans entre les enfants, selon qu'ils aient reçu ou non une prophylaxie par PVZNote de bas de page 78. L'étude cas-témoin de Buchs et al. n'a pas non plus trouvé de différence significative entre les receveurs du PVZ et les témoins en ce qui concerne la croissance au cours des 3 premières années de vieNote de bas de page 144.
IV.2.3.4.3. Colonisation par P. aeruginosa et S. aureus
L'ECR n'a trouvé aucune différence statistiquement significative dans le nombre d'enfants présentant une colonisation des VR par P. aeruginosa chez les enfants ayant reçu du PVZ par rapport à ceux ayant reçu un placebo, après 12 mois de suiviNote de bas de page 140. Dans l'étude de Groves et al., le temps médian avant l'apparition d'un premier isolat de P. aeruginosa était significativement plus court chez les enfants ayant reçu du PVZ que chez les autres, et le RR d'apparition d'un premier isolat au cours de la période d'étude était également significativement plus élevé chez les enfants ayant reçu du PVZ. Cependant, lors du suivi à l'âge de 6 ans, il n'y avait pas de différence significative entre les 2 groupes en ce qui concerne les taux de colonisation chronique par P. aeruginosaNote de bas de page 78.
L'étude de Buchs et al. a rapporté que la prophylaxie par PVZ n'avait pas d'effet significatif sur l'âge de la première colonisation par P. aeruginosa ou S. aureus, ni sur la proportion d'enfants colonisés par P. aeruginosa à l'âge de 3 ans. En revanche, la proportion d'enfants colonisés par S. aureus à l'âge de 3 ans était significativement plus élevée chez les receveurs de PVZ (97 %) que chez les témoins (85 %)Note de bas de page 144. L'étude de Fink et al. n'a pas non plus signalé de différence dans le délai de première colonisation par P. aeruginosa entre les enfants ayant reçu ou non une prophylaxie par PVZNote de bas de page 145.
Les résultats de ces études ne montrent aucune différence significative pour ce qui est des séquelles à long terme constatées entre les enfants atteints de FK ayant reçu une prophylaxie par PVZ et ceux n'en ayant pas reçu. Cependant, le nombre d'enfants étudiés était faible.
IV.2.4 Enfants présentant une cardiopathie congénitale hémodynamiquement significative
IV.2.4.1. Hospitalisations liées au VRS
Cinq études ont examiné l'efficacité potentielle ou l'efficacité réelle de la prophylaxie par PVZ chez les enfants atteints de CPCHS. Un ECR de bonne qualité réalisé entre 1998 et 2002Note de bas de page 80 a montré que le ratio d'HVRS des enfants atteints de CPCHS âgés de 24 mois ou moins au début de la saison de VRS et ayant reçu une prophylaxie par PVZ diminuait de manière assez significative par rapport à celui des enfants ayant un placebo (RD = 45 %, p = 0,003; NST : 23). Ce résultat était statistiquement significatif chez les enfants atteints de coronaropathie acyanotique (RD = 58 %, p = 0,003; NST : 15), mais pas chez les enfants atteints de coronaropathie cyanotique (RD = 29 %, p = 0,285). Une étude de cohorte observationnelle de qualité passable portant sur des nourrissons âgés de moins d'un an, dont des receveurs de PVZ sur la période 2013-2015 suivis prospectivement et des témoins de la période 2010-2015 identifiés rétrospectivement, a permis de déceler une réduction significative de 49 % (NST : 45) pour tous les cas et de 65 % (NST : 31) pour le sous-groupe présentant une CPCHS cyanotique, ainsi qu'une réduction non significative de 35 % dans le sous-groupe des patients présentant une maladie acyanotiqueNote de bas de page 146. Un RR significatif de 0,28 (réduction de 72 %, NST : 7) d'hospitalisation pour tous les cas de CPCHS âgés de moins d'un an a été rapporté dans une petite étude observationnelle de qualité passable portant sur des receveurs de PVZ inscrits entre 2014 et 2016 et des témoins historiques nés dans la période 2007-2009Note de bas de page 147. Une étude de cohorte observationnelle antérieure de faible qualité, portant sur des receveurs de PVZ sur la période 2003-2007 et des témoins historiques nés entre 1998 et 2003 n'avait pas établi qu'une prophylaxie par PVZ entraînait une réduction significative des HVRS par rapport à l'absence d'intervention chez des enfants atteints de CPC nés à 36 sAG ou moins et âgés de 24 mois ou moins au début de la saison de VRS (RR=0,58; IC à 95 % : 0,21 à 1,65 %); cependant, le ratio de HVRS dans la population témoin s'est révélé très faible (2,9 %)Note de bas de page 148. Une étude prospective de cas-témoins de qualité passable, menée de 2002 à 2006, n'avait pas permis d'observer une efficacité réelle significative du PVZ, que ce soit au cours de la première ou de la deuxième année de vieNote de bas de page 133.
Ces études montrent des résultats contradictoires concernant l'effet protecteur du PVZ sur le ratio d'HVRS des nourrissons atteints de CPCHS. Les 2 études qui n'ont pas montré d'effet significatifNote de bas de page 133 Note de bas de page 148 comptaient moins de participants que 2 études plus importantes qui ont montré une réduction du risque comprise entre 45 et 49 %Note de bas de page 80 Note de bas de page 146. Une de ces études a montré une protection significative chez les enfants atteints de cardiopathie cyanogène, mais pas chez ceux atteints de cardiopathie acyanogèneNote de bas de page 146, tandis que l'autre a montré le contraireNote de bas de page 80. Les raisons de ces divergences ne sont pas évidentes, mais peuvent être dues à une taille d'échantillon insuffisante pour détecter une différence dans les sous-groupes.
IV.2.4.2. Autres résultats dus au VRS en matière d'hospitalisation
IV.2.4.2.1. Durée de l'hospitalisation associée au VRS
L'ECR portant sur des enfants atteints de CPCHS et âgés de 24 mois ou moins a constaté que les receveurs de PVZ présentaient une diminution relative significative du nombre total de jours de HVRS/100 enfants par rapport aux receveurs de placebo (RD = 56 %, p = 0,003)Note de bas de page 80. Pour ceux admis à l'hôpital en raison du VRS, la moyenne de la DSH était de 10,8 jours pour les receveurs de PVZ et de 13,3 jours pour les receveurs du placebo, ce qui ne constitue pas une différence significative. Dans l'étude de Chiu et al., la DSH n'était pas significativement différente entre les patients ayant reçu du PVZ et ceux n'en ayant pas reçu, tant à l'échelle du groupe entier que de chaque sous-groupe (patients présentant une CPCHS cyanotique et patients présentant une CPCHS acyanotique)Note de bas de page 146.
IV.2.4.2.2. Admission et durée du séjour en unité de soins intensifs en raison du VRS
L'ECR portant sur des enfants atteints de CPCHS âgés de 24 mois ou moins a signalé que par rapport aux receveurs d'un placebo, le groupe de patients ayant reçu du PVZ avait montré une diminution relative du nombre d'admissions en USI, sans que la réduction soit significative (RD = 46 %, p = 0,094)Note de bas de page 80. Dans les études de cohorte observationnelles, le rapport de Chiu et al. ne signale aucune différence significative dans les taux d'admission en USI chez les personnes ayant reçu du PVZ et celles n'en ayant pas reçu, que ce soit sur l'ensemble du groupe ou sur les sous-groupes (CPCHS cyanotique et acyanotique); et Harris et al., non plus, n'ont trouvé aucune différence significative dans le taux d'admission en USI. Dans les 3 études, les proportions de nourrissons ayant subi une HVRS et qui ont dû être admis en USI n'étaient pas non plus significativement différentes dans les groupes de patients qui avaient reçu du PVZ par rapport aux groupes qui n'en avaient pas reçuNote de bas de page 80 Note de bas de page 146 Note de bas de page 148.
Dans l'ECR, le nombre total de jours/100 enfants dans une USI en raison du VRS ne différait pas significativement entre les receveurs de PVZ et les receveurs de placeboNote de bas de page 80. Dans l'étude de cohorte de Harris, la DSH en USI est passée de 14,9 à 10 jours, mais la différence n'était pas significativeNote de bas de page 148.
IV.2.4.2.3 Utilisation de la ventilation mécanique liée au VRS
L'ECR de Feltes et al. n'a pas permis de déceler une différence significative dans l'utilisation de la VM, rapportée en nombre total de jours/100 enfants, entre les enfants atteints de CPCHS et âgés de 24 mois ou moins au début de la saison de VRS qui ont reçu du PVZ et ceux qui ont reçu un placebo (RD = 41 %, p = 0,282)Note de bas de page 80.
IV.2.4.2.4. Durée de l'oxygénothérapie due au VRS
L'ECR a révélé que, par rapport au placebo, les enfants ayant reçu la prophylaxie par PVZ affichaient un nombre total de jours/100 enfants sous oxygénothérapie (RD = 73 %, p = 0,014) significativement inférieurNote de bas de page 80.
Ces résultats suggèrent que pour les enfants atteints de CPCHS et ayant subi une HVRS, le fait d'avoir reçu du PVZ n'a pas d'incidence sur la sévérité de la maladie, telle qu'elle se manifeste par la DSH, l'admission en USI, la DSH en USI ou la nécessité de recourir à la VM, bien que le nombre d'études soit faible.
IV.2.4.3 Mortalité toutes causes confondues
L'ECR de Feltes et al. et l'étude de cohorte de Harris et al. ont tous deux examiné la mortalité toutes causes confondues dans cette populationNote de bas de page 80 Note de bas de page 148. L'ECR ne fait apparaître aucune différence significative dans la mortalité toutes causes confondues entre les enfants atteints de CPCHS et âgés de 24 mois ou moins au début de la saison de VRS qui ont reçu du PVZ par rapport à ceux qui ont reçu un placebo. L'étude de Harris et al. a rapporté un décès dans le groupe sans intervention et aucun décès dans le groupe avec prophylaxie par PVZ.
L'ECR fait état de décès dus au VRS chez 2 des 639 receveurs de PVZ et 4 des 648 patients témoins (p = 0,46)Note de bas de page 80.
IV.2.5 Enfants atteints du syndrome de Down
IV.2.5.1 Hospitalisations associées au VRS
Trois études ont examiné l'effet de la prophylaxie par PVZ sur la réduction des HVRS chez les nourrissons atteints du syndrome de Down. Une petite étude de cohorte observationnelle de qualité passable menée auprès d'enfants sur la période 2012-2014 a révélé que le ratio d'hospitalisation des enfants atteints du syndrome de Down sans autres critères justifiant une prophylaxie par PVZ n'était pas significativement différent entre ceux qui avaient reçu du PVZ et ceux qui n'en avaient pas reçu (3 % contre 15 %, p = 0,075)Note de bas de page 149. Une étude de cohorte antérieure plus importante, de faible qualité, a comparé des enfants canadiens atteints du syndrome de Down qui avaient reçu du PVZ sur la période 2005-2012 avec les données d'un registre néerlandais portant sur des enfants atteints du syndrome de Down, nés sur la période 2003-2005 et qui n'avaient pas reçu de PVZNote de bas de page 150. Après ajustement en fonction des données CPCHS, des CPC non significatives, d'AG et de poids de naissance, l'analyse a révélé que, par rapport à l'absence d'intervention, la réception de PVZ était associée à une réduction statistiquement significative de 72 % des HVRS (ratio du taux d'incidence [RTI]=3,63 IC à 95 % : 1,52 à 8,67 %; p = 0,002; NST : 12).
Une réduction significative des hospitalisations a également été constatée lorsque l'analyse a été restreinte aux enfants présentant au moins un critère de risque standard pour la prophylaxie VRS (CPCHS, naissance à ≤35 sAG, MPC) [RTI 3,39 (1,02-11,25)]. Cependant, lorsque l'analyse a été restreinte aux enfants ne présentant aucun critère standard de risque de VRS, la différence dans les ratios HVRS entre les enfants recevant une prophylaxie par PVZ et les enfants ne recevant aucune intervention n'était pas significative (RTI=6,57; IC à 95 % : 0,70 à 62,16 %). La troisième étude, classée de bonne qualité, a rapporté une diminution globale des HVRS après que la prophylaxie par PVZ eut été approuvée au Japon pour tous les enfants atteints du syndrome de Down. Pour tous les enfants, le rapport de cotes ajusté (RCa) des patients qui recevaient du PVZ était de 0,41 (IC à 95 % : 0,18 à 0,92 %; p = 0,03), mais il n'y avait pas de différence dans les ratios HVRS entre les groupes de patients non atteints de CPCHS (RCa 0,43; IC à 95 % : 0,04 à 4,26 %; p = 0,47) ou ne présentant pas de facteurs de risque supplémentaires d'HVRS (RCa 0,68; IC à 95 % : 0,06 à 7,73 %; p = 0,75)Note de bas de page 151.
IV.2.5.2 Autres résultats dus au VRS en matière d'hospitalisation
IV.2.5.2.1 Durée de l'hospitalisation associée au VRS
L'étude observationnelle de Yi et al. a révélé qu'il n'y avait pas de différence significative dans le nombre moyen de jours d'HVRS chez les receveurs de PVZ par rapport aux enfants ne recevant aucune intervention (6,4 contre 12,4 jours; p = 0,48)Note de bas de page 150.
IV.2.5.2.2. Admission et durée du séjour en unité de soins intensifs en raison du VRS
L'étude d'observation de Yi et al. a rapporté qu'aucun des 532 enfants ayant reçu une prophylaxie par PVZ n'a été admis dans une USI, alors qu'il y a eu 4 admissions en USI (p = 0,0085) parmi les 233 enfants n'ayant pas reçu de PVZ. La DSH en USI a été de 10,3 joursNote de bas de page 150.
IV.2.5.2.3 Utilisation et durée d'utilisation de la ventilation mécanique liée au VRS
Dans l'étude de Yi et al., aucun enfant ayant reçu une prophylaxie par PVZ n'a eu besoin d'une VM; 4 enfants ont eu besoin d'une VM (p = 0,0085) dans le groupe sans PVZ. La durée moyenne d'utilisation de la VM a été de 10,3 joursNote de bas de page 150.
IV.2.5.2.4 Utilisation et durée de l'oxygénothérapie en raison du VRS
L'étude de Yi et al. a révélé que les enfants ayant reçu une prophylaxie par PVZ avaient significativement moins eu besoin d'une oxygénothérapie complémentaire (2/532, 0,004 % contre 19/233; 0,08 %; p < 0,001); le nombre moyen de jours d'utilisation de l'oxygénothérapie de ces enfants a également été inférieur (4 contre 13,7 jours; p = 0,046) par rapport à celui des enfants n'ayant pas reçu de PVZNote de bas de page 150.
La signification des résultats de ces études, l'une de faible qualitéNote de bas de page 150 et l'autre portant sur un très petit nombre d'enfantsNote de bas de page 149, n'est pas claire; elle suggère cependant que le PVZ peut ne pas être bénéfique aux enfants atteints du syndrome de Down et qui ne présentent pas d'autres affections pouvant justifier l'administration de PVZ. D'autres études seraient nécessaires pour pouvoir tirer des conclusions sur les avantages du PVZ pour cette population.
IV.2.6 Nourrissons vivant dans des communautés éloignées
IV.2.6.1 Hospitalisations associées au VRS
Deux études de cohorte de faible qualité ont examiné ce résultatNote de bas de page 92 Note de bas de page 152. L'étude de Banerji et al. comprenait des enfants inuits du Nunavut, au Canada, qui étaient nés à moins de 36 sAG et/ou qui présentaient une maladie cardiaque ou respiratoire importante et étaient âgés de moins de 6 mois au début de la saison 2009-2010 du VRS. Le ratio d'HVRS chez les enfants ayant reçu du PVZ était significativement inférieur (2/91; 2,2 %) à celui des enfants pouvant recevoir l'administration de PVZ mais n'ayant reçu aucune intervention (5/10, 50 %) (RC=0,04; IC à 95 % : 0,008 à 0,26 %; p = 0,0005). Le NST pour prévenir une hospitalisation était de 2Note de bas de page 152. Comme tous les nourrissons admissibles au PVZ n'ont pas été recensés, le taux de réduction réel est probablement inférieur à celui rapporté. Dans l'étude de Singleton et al., le ratio des HVRS a été évalué chez les enfants autochtones d'Alaska avant et après l'introduction d'un programme de prophylaxie par PVZ pour les nourrissons à haut risque en 1998.On a constaté une réduction significative des HVRS chez les nourrissons nés à 36 sAG ou moins (taux relatif 0,34; IC à 95 % : 0,17 à 0,68 %; p < 0,001). Après l'introduction du programme PVZ, le taux de première hospitalisation parmi les nourrissons à haut risque était de 0,55 pour 1000 jours de protection par le PVZ et de 1,07 pour 1000 jours non protégés (taux relatif 0,52; IC à 95 % : 0,28 à 0,93 %). Le NST pour prévenir une HVRS était de 4Note de bas de page 92.
Bien que les nourrissons inuits vivant dans des communautés nordiques éloignées soient réputés présenter un risque élevé d'HVRSNote de bas de page 23, les données sur l'efficacité réelle du PVZ pour prévenir l'hospitalisation dans ce groupe sont très limitées. Après l'achèvement de la revue de littérature sur l'efficacité réelle du PVZ, les résultats d'un programme de prophylaxie par PVZ aux nourrissons nés à terme en bonne santé et âgés de moins de 3 mois pendant la saison du VRS au Nunavik (Québec) sont devenus disponiblesNote de bas de page 90. La qualité de l'étude a été jugée passable. Entre novembre 2016 et juin 2019, 73 % des 646 nourrissons nés à terme et en bonne santé admissibles ont reçu du PVZ; cependant, seuls 37 % d'entre eux ont reçu toutes les doses recommandées à temps.
L'efficacité réelle du PVZ a été évaluée 1) en comparant le taux d'HVRS chez les nourrissons qui ont reçu toutes les doses de PVZ à temps et ceux qui n'ont pas reçu de PVZ et 2) en comparant ce même taux pendant les périodes de protection et de non-protection. Le ratio d'HVRS est de 10/237 pour les nourrissons (4,2 %) qui ont reçu du PVZ et de 7/177 (4,0 %) pour ceux qui n'en ont pas reçu. L'efficacité réelle directe du PVZ a été calculée à -6,7 % avec un large IC à 95 % : de -174,8 à 85,5 %. Les ratios HVRS étaient de 37,6/100 000 jours protégés par le PVZ et de 39,1/100 000 jours non protégés, soit un effet protecteur direct de 3,8 % avec un IC à 95 % : de -1167,6 à 64,9 %. Les limites de l'étude comprennent de petits nombres d'HVRS, une grande variation des ratios HVRS au cours des différentes années et un taux élevé de co-infections avec d'autres virus respiratoires. Pour plus de détails, voir le Tableau des données à l'Annexe C.
IV.2.7. Impact des changements dans les recommandations pour la prophylaxie par PVZ
Plusieurs études ont été répertoriées dans la littérature sur le FdM lié au VRS, décrivant l'impact des recommandations révisées de l'AAP de 2014 concernant l'utilisation du PVZ sur le taux d'HVRS au travers d'analyses de périodes séquentielles avant et après la mise en œuvre de ces recommandations réviséesNote de bas de page 6. Ces études ne répondaient pas aux critères de la revue de la littérature, parce que les enfants qui ont reçu ou non du PVZ n'ont pas été recensés. Elles sont résumées ici.
Dans une étude monocentrique menée dans un centre tertiaire du Dakota du Nord, le ratio d'HVRS pour 1000 enfants de moins de 24 mois était de 5,37 dans la période ayant précédé la révision de 2014 (saisons 2012-2013 et 2013-2014) et de 5,78 dans la période l'ayant suivie (saison 2014-2015) [différence de +0,4; IC à 95 % : -1,2 à +2 %; p = 0,622]. Le nombre d'admissions liées au VRS était de 194. Le nombre de doses de PVZ administrées pour 1000 enfants de moins de 24 mois était de 21,7 pendant la période ayant précédé la révision de 2014 et de 10,3 doses pendant la période l'ayant suivie, soit une réduction de 11,4 doses (IC à 95 % : 14,3 à 8,4 %; p < 0,001)Note de bas de page 153.
Une autre étude monocentrique réalisée dans le Milwaukee s'est intéressée au ratio d'HVRS chez les nourrissons de moins d'un an nés à 29-35 sAG ou plus et aux proportions de toutes les admissions liées au VRS dans ce groupe d'AG 2 saisons avant et 2 saisons après la mise en œuvre des directives de l'AAP de 2014 (2012-2017). Le ratio d'HVRS était de 91. Il n'y a pas eu de différence significative dans le nombre d'admissions ou la proportion d'admissions dans ce groupe d'AG avant et après la mise en œuvre des nouvelles directives. La DSH a augmenté, passant d'une médiane de 5,86 jours avant à une médiane de 7,86 jours (p = 0,46) après la mise en œuvre, mais il n'y a eu aucune différence dans les admissions en USI, le recours à une oxygénothérapie ou à une VMNote de bas de page 154.
Une étude monocentrique réalisée en Ohio a examiné le taux HVRS chez les nourrissons de moins de 12 mois avant et après la mise en œuvre des directives de 2014. Sur 1063 HVRS, les nourrissons nés à 290/7-346/7 sAG représentaient 7,1 % (34/482) durant la saison 2013-2014 et 9,8 % (57/581) durant la saison 2014-2015 (une différence non significative). Les nourrissons nés à 29-34 sAG et âgés de moins de 6 mois constituaient 3,5 % (17/482) des HVRS en 2013-2014, contre 7,1 % (41/581) en 2014-2015 (p = 0,01). Parmi les nourrissons de 290/7-346/7 sAG autrement en bonne santé et âgés de moins de 3 mois, la fréquence d'administration d'oxygène (40,0 % contre 78,9 %; p = 0,05), celle des admissions en USI pédiatrique (30,0 % contre 68,4 %; p = 0,04), le recours à la VM (10,0 % contre 52,6 %; p = 0,04) et la moyenne de la DSH (1,8 contre 8,8 jours; p = 0,04) étaient tous plus élevés durant la saison 2014-2015. Aucun écart de morbidité n'a été observé entre les saisons 2013-2014 et 2014-2015 chez les prématurés âgés de 3 à moins de 6 mois ou de 6 à moins de 12 mois. L'admissibilité au PVZ a diminué de 32,3 % durant la saison 2013-2014, passant à 1,8 % en 2014-2015 (p < 0,001)Note de bas de page 51.
Une vaste étude a utilisé des bases de données commerciales et Medicaid pour évaluer des nourrissons nés entre le 1 juillet 2011 et le 30 juin 2016. Les nourrissons ont été classés comme prématurés ou à terme et les HVRS des nourrissons âgés de moins de 6 mois ont été recensés. Les ratios de comparaison des taux d'hospitalisation des prématurés et des enfants à terme ont été calculés. Avant la révision des directives, les ratios saisonniers entre prématurés et enfants nés à terme étaient compris entre 1,6 et 3,4. Après la révision, ils étaient compris entre 2,6 et 5,6. De 2014 à 2016, le risque associé à une prématurité de 29 à 34 sAG par rapport à une naissance à terme était significativement plus élevé que sur la période de 2012 à 2014 (2,00; p < 0,0001 pour les nourrissons assurés commercialement et 1,46; p < 0,0001 pour les nourrissons assurés par Medicaid, p < 0,0001). L'utilisation du PVZ a diminué de 74 à 97 % pour ce qui est des sAG et des différents groupes d'âgeNote de bas de page 155.
Une étude antérieure utilisant des bases de données similaires a évalué les taux d'utilisation de PVZ et d'HVRS chez les prématurés de 29 à 36 sAG pendant la saison 2014-2015 pour les comparer avec ceux de la saison 2013-2014. Le recours à la prophylaxie par PVZ chez les nourrissons de 29 à 34 sAG a diminué de 62 à 95 % (p < 0,01) au cours de la saison 2014-2015 par rapport à la saison 2013-2014. Par rapport à la saison 2013-2014, les ratios d'HVRS sur la saison 2014-2015 ont été multipliés par 2,7 (p = 0,02) et 1,4 (p = 0,03) chez les nourrissons nés entre 29 et 34 sAG, âgés de moins de 3 mois, et bénéficiant respectivement d'une assurance commerciale et de Medicaid. Aucune différence significative n'a été observée pour les enfants âgés de 3 à 6 moisNote de bas de page 156.
Une autre étude s'est penchée sur l'effet du changement des recommandations pour les enfants souffrant de CPCHS. Les directives 2014 de l'AAP recommandent la prophylaxie par PVZ pour les enfants dès leur première année de vie, alors que les directives précédentes la recommandaient pour les enfants de moins de 2 ans. Une base de données administrative de soins de santé nationale américaine a été examinée afin de recenser les enfants âgés de moins de 24 mois atteints de CPC et ayant subi une HVRS au cours des saisons 2012-2014 et 2014-2016 du VRS. Le nombre d'HVRS était de 644 durant les saisons 2012-2013 et 2013-2014, contre 625 au cours des saisons 2014-2015 et 2015-2016. Aucun changement n'a été observé au niveau de la DSH, du taux d'admission en USI ou de la mortalité à l'hôpital pour les enfants de 13 à 24 mois atteints de CHC après la modification des recommandations. Aucun décès n'a été enregistré chez les 13-24 mois, quelle que soit la saison. La population étudiée n'a pas été restreinte aux patients souffrant de CPCHSNote de bas de page 157.
Par suite de la publication des recommandations révisées de l'AAP en 2014, l'Italie a mis en place des limites similaires pour l'utilisation du PVZ chez des prématurés par ailleurs en bonne santé à l'automne 2016. Dans une population de 284 902 enfants âgés de moins de 2 ans dans une région du pays, le nombre d'HVRS était de 1729. À la suite du changement de politique, une réduction du nombre d'HVRS, de 6,3/1000 (IC à 95 % : 6,0 à 6,7 %) à 5,5/1000 (IC à 95 % : 5,0 à 5,9 %), a été observée. Il n'y avait pas de différence significative pour ce qui est des sAG ou de l'âge des enfants admis du fait du VRS durant les 2 saisons ayant précédé le changement de politique et la saison l'ayant suivi. Le nombre de prescriptions de PVZ a diminué de 48 % après le changement de politiqueNote de bas de page 158.
Une analyse rétrospective des HVRS d'enfants d'un an ou moins sur 3 saisons consécutives de VRS (2014-2015, 2015-2016, 2016-2017) a été réalisée dans un seul centre tertiaire en Italie. Le nombre total d'admissions dues au VRS pour les 3 saisons était de 366. La proportion de prématurés a augmenté au cours des 3 saisons, passant respectivement de 6,6 % à 7,3 %, puis à 9,2 % pour le groupe des 29 à moins de 36 sAG; et de 5,1 % à 6,4 % puis à 8,3 % pour le sous-groupe des 33 à moins de 36 sAG. Ces augmentations n'étaient pas statistiquement significatives, mais la taille de l'échantillon était faibleNote de bas de page 159.
Une autre étude de cohorte rétrospective du ratio d'HVRS chez les nourrissons nés de 29 à 35 sAG dans la saison ayant précédé (2015-2016) ou suivi (2016-2017) l'introduction des recommandations plus restreintes pour la prophylaxie par PVZ a été menée dans 3 UNSI en Italie. Au total, 262, puis 274 nourrissons ont été admis dans l'étude en 2015-2016 et 2016-2017, respectivement. L'HVRS est survenue chez 1,9 et 5,1 % des nourrissons durant les saisons 2015-2016 et 2016-2017, respectivement (RC : 2,77; IC à 95 % : 0,98 à 7,8 %; p = 0,045). La proportion de nourrissons ne recevant pas de PVZ a augmenté de manière significative, passant de 63,7 % en 2015-2016 à 80,6 % en 2016-2017 (p < 0,0001)Note de bas de page 160.
En résumé, il existe peu de données basées sur la population concernant l'effet du changement des recommandations de l'AAP de 2014 sur les HVRS de prématurés de 29 à 35/36 sAG. Une petite étude monocentrique n'a montré aucune différence dans les ratios HVRS globaux. Une vaste étude s'appuyant sur une base de données administrative a montré un ratio d'HVRS multiplié par 1,4 à 2,7 chez les prématurés âgés de moins de 3 mois. D'autres études ont examiné les proportions d'enfants nés de 29 à 35 sAG ayant subi une HVRS. Deux études monocentriques n'ont montré aucune différence dans cette proportion. Une d'entre elles n'a montré aucune différence au niveau de la morbidité des patients admis, tandis que l'autre a fait état d'une évolution vers un plus jeune âge, et d'une morbidité plus élevée chez les patients admis de moins de 3 mois, mais pas chez les nourrissons plus âgés. Une autre grande étude de base de données a comparé les ratios de prématurés et de nourrissons nés à terme parmi ceux admis en raison du VRS, concluant à une augmentation (multiplication par 1,5 à 2). Une étude portant sur des enfants atteints de CPC âgés de 13 à 24 mois n'a montré aucune augmentation de la morbidité chez ceux qui ont subi une HVRS. Un changement de politique similaire a eu lieu en Italie; aussi, deux études réalisées n'ont montré aucun impact significatif, tandis qu'une troisième montrait une multiplication par 2,7 du ratio d'HVRS chez les nourrissons de 29 à moins de 36 sAG. Cependant, on observe d'importantes variations dans les ratios HVRS d'une saison à l'autre, et ces études n'ont couvert qu'une ou deux saisons avant et après le changement de politique.
IV.3 Immunogénicité
IV.3.1 Niveaux de palivizumab
Le PVZ est un agent d'immunisation passive. Il a été démontré qu'une concentration sérique de PVZ de 30 ug/mL réduisait de 99 % la réplication du VRS dans les poumons de rats de laboratoireNote de bas de page 161. Sur la base de ces données, une concentration de 40 ug/mL ou plus a été choisie arbitrairement comme niveau cible privilégié dans les essais cliniques réalisés chez les nourrissonsNote de bas de page 48 Note de bas de page 80 Note de bas de page 162. Dans ces études, 5 doses de 15 mg/kg ont été administrées aux patients à des intervalles de 30 jours. Un modèle informatique pharmacocinétique basé sur les données de 22 essais cliniques a suggéré que ce schéma permettrait de fournir des niveaux supérieurs au niveau cible pendant une période de 6 moisNote de bas de page 163.
La demi-vie du PVZ est comprise entre 19 et 27 joursNote de bas de page 164. L'administration de doses successives permet d'accroître les creux sériques de PVZ. Les écarts-types entre les creux sériques moyens, 30 jours après l'administration des doses (une, deux, trois et quatre) de 15 mg/kg étaient respectivement de 37±21 ug/mL, 57±41 ug/mL, 68±51 ug/mL et 72±50 ug/mLNote de bas de page 165. Dans une étude du PVZ chez des enfants atteints de CPC, les concentrations sériques (écart-type moyen) avant la deuxième et la cinquième dose étaient de 55,5 ±19 ug/mL et 90,8 ±35 ug/mL. Chez 139 patients ayant subi un pontage cardiaque, les taux de PVZ mesurés juste avant et le jour suivant le pontage étaient respectivement de 98,0 ±52 ug/mL et 41,4 ±33 ug/mL, soit une diminution de 58 % (p = 0,0001)Note de bas de page 80. Conformément aux directives précédentes du CCNI et aux recommandations de l'AAP, les enfants atteints de CPC et devant continuer à recevoir une prophylaxie doivent se voir administrer une dose de 15 mg/kg de PVZ après le pontage cardiaqueNote de bas de page 4 Note de bas de page 6. L'AAP suggère également que si la prophylaxie est toujours indiquée, une dose supplémentaire de 15 mg/kg doit être envisagée à la fin de l'oxygénation par membrane extracorporelleNote de bas de page 6.
La possibilité d'administrer moins de 5 doses de PVZ a été explorée. Une récente étude de modélisation a prédit que des niveaux de 30 à 40 ug/mL seraient maintenus pendant 181 jours si les doses 1 et 2 étaient administrées à 29 jours d'intervalle, et les 3 doses suivantes à 38 jours d'intervalle. Avec seulement 4 doses, ces niveaux seraient maintenus pendant 143 joursNote de bas de page 166. La SCP recommande que les programmes administrent un maximum de 3 à 5 doses; 4 doses sont probablement suffisantes dans tous les groupes à risque si la prophylaxie par PVZ est commencée uniquement en cas de circulation du VRS dans le milieu, en particulier si les doses 2, 3 et 4 sont administrées à 38 jours d'intervalleNote de bas de page 8.
Cependant, l'administration à 38 jours d'intervalle est plus complexe à mettre en œuvre et peut entraîner plus de gaspillage; un intervalle de 35 jours peut être plus pratique. Dans le cadre d'un programme déployé en Colombie-Britannique, 4 doses de PVZ ont été administrées avec un intervalle de 21 à 28 jours entre les 2 premières doses et de 28 à 35 jours entre les doses suivantes. Dix des 666 nourrissons (1,5 %) ont nécessité une hospitalisation. Tous étaient des cas d'infection malgré l'administration du PVZ, à l'exception d'une paire de jumeaux qui ont été hospitalisés 65 jours après avoir reçu leur 4 dose. Un total de 18 autres patients (2,7 %) ont été hospitalisés pour bronchiolite alors qu'ils recevaient du PVZ, mais n'avaient pas été testés pour le VRS. Un schéma de 3 doses a été prévu pour 514 enfants à faible risque nés de 29 à moins de 35 sAG et ne présentant aucune maladie pulmonaire ni CPC. Un enfant a subi une HVRS alors qu'il recevait du PVZ, et un autre a été admis 58 jours après avoir reçu sa troisième doseNote de bas de page 167.
Une autre étude de cohorte portant sur 391 enfants atteints de CPC en Colombie-Britannique et ayant reçu 4 doses de PVZ de 2012 à 2016 a montré un taux d'admission pour infection avérée ou potentielle (non testée) des VR inférieures par le VRS de 6,2 pour 100 approbations de PVZNote de bas de page 168, un taux similaire aux 5,3 % observés chez les receveurs de PVZ dans une version d'essai clinique impliquant l'administration de 5 doses mensuelles chez des enfants atteints de CPC (les maladies respiratoires qui n'ont pas été testées pour le VRS ont été exclues)Note de bas de page 80. Un seul enfant a dû être hospitalisé plus de 30 jours après sa dernière dose de PVZ. Dans une autre étude, les niveaux d'anticorps neutralisants protecteurs (définis comme le titre de neutralisation [NT95] de ≥ 1 pour 12 dilutions) étaient présents en moyenne 55 jours (intervalle 28-105 jours) après la dernière dose de PVZ. Des niveaux d'anticorps neutralisants protecteurs ont également été trouvés chez 54 % des nourrissons témoins âgés de 4 à 11 mois qui n'avaient pas reçu de PVZ, ce qui donne à penser que la réponse humorale aux infections subcliniques par le VRS peut contribuer à atteindre des titres de neutralisation qui persistent après l'administration de PVZNote de bas de page 169.
Des inquiétudes ont été exprimées quant à l'importante variabilité inter et intra-individuelle des niveaux de PVZNote de bas de page 163 Note de bas de page 165 et aux implications pour la protection si moins de doses de PVZ ou des intervalles de dose plus longs devaient être utilisés. Des creux faibles après la première dose avaient conduit à suggérer la mise en place d'un intervalle plus court entre les première et deuxième dosesNote de bas de page 170. Des creux de moins de 40 ug/mL après la première dose ont été rapportés chez 33 % des receveursNote de bas de page 164. Dans un rapport, 46 % des infections contractées malgré le traitement sont survenues dans l'intervalle suivant la première doseNote de bas de page 171, mais ce taux élevé n'a pas pu être reproduit dans d'autres études. Une étude rétrospective sur 42 patients ayant subi une HVRS malgré l'administration de PVZ montre une corrélation entre des niveaux de PVZ plus faibles et l'admission en USI. Les niveaux moyens étaient de 47,2 ug/mL chez les patients ayant nécessité un séjour en USI et de 98,7 ug/mL chez les autres (p < 0,0001). Dans l'analyse multivariée de l'étude ci-dessus, incluant les facteurs de confusion potentiels, le seul paramètre associé à l'admission en USI était le niveau de PVZNote de bas de page 172.
IV.3.2. Schémas posologiques et saisonnalité du VRS
La « saison du VRS » annuelle est la période pendant laquelle le risque de contracter le VRS est suffisamment élevé pour justifier une prophylaxie des nourrissons à haut risque. La saison commence généralement en octobre ou novembre au Canada et se termine en avril ou mai, la plupart des cas se produisant entre les mois de décembre et mars. La durée de la saison annuelle du VRS varie en fonction de l'année et du lieu. Des études ont montré une variation de 13 à 23 semaines à divers endroits aux États-UnisNote de bas de page 7 et de 90 à 181 jours à Hamilton, en OntarioNote de bas de page 173. Comme 5 doses mensuelles doivent fournir des niveaux de protection pendant plus de 6 mois, l'AAP recommande un nombre maximal de 5 dosesNote de bas de page 6. Il est possible d'optimiser l'utilisation du PVZ en s'appuyant sur les données du laboratoire de virologie local afin de déterminer quand commencer la prophylaxieNote de bas de page 173.
Lorsque de telles données ne sont pas disponibles, la date de début peut être déterminée sur la base des données d'HVRS pédiatriques, ou des données des saisons précédentes. Dans certaines régions, 4 doses mensuelles peuvent suffireNote de bas de page 174. Au Canada, certains programmes commencent systématiquement en novembre ou décembre, tandis que d'autres s'appuient sur les données locales des laboratoires et les données d'hospitalisation pour définir les dates de début et de fin de la saison de VRS (voir l'Annexe A). Si cette dernière solution est plus compliquée à mettre en œuvre que l'utilisation de dates fixes, elle peut permettre une utilisation plus efficace du produit.
On peut s'attendre à des cas occasionnels d'HVRS avant ou après la saison principale dans certaines régions, mais le bienfait maximal de la prophylaxie sera obtenu pendant le pic de la saison.
IV. 4 Données sur l'innocuité
Le PVZ est généralement considéré comme un produit sûr. Depuis la description des évènements indésirables (ÉI) dans la Déclaration sur le PVZ du CCNI 2003Note de bas de page 4, il n'y a pas eu d'alertes de sécurité, mais le nombre de nourrissons exposés au PVZ a considérablement augmenté. Le CCNI a déterminé que cela justifiait une nouvelle évaluation des données sur l'innocuité du PVZ. Une recherche documentaire rapide des publications à partir de 2003 et un examen des données du Programme canadien de vigilance ont été effectués. Le rapport complet est joint au présent document à l'Annexe B.
IV.4.1 Revue rapide de la littérature
Ont été recensés : 9 ECR, 2 études de cohorte basées sur des populations, 26 rapports descriptifs de registres ou de cohortes et 2 études de cas. Les ÉI les plus fréquemment signalés et considérés comme liés au PVZ étaient les suivants : réactions au niveau du site d'injection, fièvre, nervosité ou irritabilité, toux, rhinite et diarrhée. Les ÉIG liés au PVZ ont été très rares : ils ont été signalés chez 1 % ou moins des receveurs, la plupart des études n'en signalant aucun. La plupart étaient des réactions d'hypersensibilité. Trois cas d'anaphylaxie ont été repérés. L'arrêt de l'administration du PVZ pour cause d'ÉI a été décidé pour 0 à 2,3 % des receveurs. Aucun décès n'a été attribuable au PVZ. Les injections répétées d'un anticorps monoclonal humanisé ont suscité des inquiétudes quant au développement d'une maladie à médiation immunitaire. Les études n'ont montré aucun risque accru de maladie auto-immune ou d'atopie chez les enfants exposés au PVZ.
IV.4.2 Données du Programme Canada Vigilance
Une analyse des ÉI signalés au Programme Canada Vigilance (anciennement Programme canadien de surveillance des effets indésirables des médicaments) de Santé Canada a permis de recenser 259 cas d'ÉI par suite de l'administration de PVZ, dont 237 ont été classés comme graves. Les ÉI les plus fréquents étaient d'ordre respiratoire (137 patients [53 %], dont 113 ont eu des infections), principalement rapportés en raison de l'échec du PVZ, suivis de réactions d'hypersensibilité (23 patients, 9 %). Les autres ÉI rapportés sont des complications attendues des affections sous-jacentes pour lesquelles le PVZ est recommandé, et sont conformes à ceux rapportés dans la monographie du produit. Le rôle du PVZ dans ces ÉI est inconnu, car la causalité n'a pas été évaluée.
IV.5 Administration du vaccin
Le PVZ est administré à raison de 15 mg/kg de poids corporel, par injection IM.
Pour les intervalles entre les doses et le nombre de doses, voir la Section IV.3 sur l'immunogénicité, ci-dessus.
IV.6 Conditions d'entreposage
Le PVZ doit être conservé entre +2 et +8 °C dans son emballage d'origine. Il ne doit pas être congelé. Les flacons sont à usage unique et ne contiennent pas d'agent de conservation.
Si un flacon entier (50 mg ou 100 mg) n'est pas nécessaire pour l'injection mensuelle d'un patient, les médecins prendront des dispositions pour que plusieurs patients reçoivent du PVZ dans les 6 heuresNote de bas de page 4 ou le même jour de cliniqueNote de bas de page 175, afin de réduire le plus possible le gaspillage du produit. Les flacons ouverts contenant du produit non utilisé dans les 6 heures doivent être jetés et non conservés. La mise en place de consultations hebdomadaires pour les nourrissons admissibles dans une localité particulière facilite une utilisation efficace et un gaspillage minimal.
IV.7 Administration simultanée d'autres vaccins
Le PVZ est un anticorps dirigé spécifiquement contre le VRS; il ne contient pas d'autres anticorps ni de sérum humain. En conséquence, il n'est pas censé interférer avec la réponse immunitaire aux vaccins vivants ou inactivésNote de bas de page 7 Note de bas de page 129. Les enfants recevant du PVZ doivent recevoir tous les vaccins infantiles d'usage et tout autre vaccin qui pourrait être indiqué en raison d'un état de santé sous-jacent, compte tenu des schémas recommandés.
IV.8 Contre-indications et précautions
Contre-indications
Une forte hypersensibilité à l'un des composants du PVZ constitue une contre-indication à l'utilisation de ce produit.
Précautions
Les maladies mineures telles que le rhume, avec ou sans fièvre, ne sont pas des contre-indications à l'utilisation du PVZ. Par contre, une maladie modérée à sévère, avec ou sans fièvre, est une raison d'envisager de différer l'utilisation du PVZ, pour éviter de superposer les ÉI du PVZ à la maladie sous-jacente, ou de déterminer par erreur une manifestation de la maladie sous-jacente comme une complication du PVZ. La décision de différer l'utilisation du PVZ dépend de la sévérité et de l'étiologie de la maladie sous-jacente.
Économie
V.1 Examen systématique
Un examen systématique du rapport coût/efficacité de la prophylaxie par PVZ pour le VRS a été réalisé. Des études menées dans les pays de l'OCDE et publiées entre 2000 et 2018 ont été examinées. L'examen original a été publiéNote de bas de page 176. Pour les besoins de la prise de décision du CCNI, des modifications ont été effectuées au rapport et à l'analyse concernant l'examen original, qui se trouve dans un supplément du CCNI intitulé « Rapport coût/efficacité du PVZ pour le virus respiratoire syncytial (VRS) : un examen systématique » qui sera bientôt disponible. Les changements incluent la devise en dollars canadiens, une section sur les études canadiennes, d'autres sous-groupes déclarés et des commentaires supplémentaires. Les résultats de ce supplément sont résumés ici. Sur les 28 études incluses dans l'analyse finale, 20 étaient des analyses coût/utilité et 8 des analyses coût/efficacité. Deux évaluations économiques étaient fondées sur des essaisNote de bas de page 177 Note de bas de page 178, et les autres étaient fondées sur des modèles.
Les études en question ont été menées aux États-Unis (n=6), au Canada (n=5), aux Pays-Bas (n=3), au Royaume-Uni (n=3), en Espagne (n=3), en Autriche (n=2), en Allemagne (n=2) ainsi qu'en Italie, au Mexique, en Nouvelle-Zélande et en Suède (1 chacun). Les analyses de cas de base ont été effectuées du point de vue du payeur du système de santé (n=15) ou du point de vue sociétal (n=13). Huit des études portant sur la perspective du payeur ont effectué des analyses supplémentaires d'un point de vue sociétal. La majorité des études étaient parrainées par l'industrie (n=17, 61 %). Les résultats du rapport coût/efficacité ont été produits sous forme de RCED, représentés principalement en tant que coût différentiel par AVAQ supplémentaire (n=20) et coût par HE (n=6). Les RCED ont été ajustés en dollars canadiens de 2017 (CAD).
La prophylaxie par PVZ a varié d'une stratégie dominante (c.-à-d. moins coûteuse et plus efficiente) à un RCED de 2 975 489 $ par AVAQ. La grande variation des RCED dépendait de la perspective, du cadre de l'étude, de la population, de l'épidémiologie locale du VRS, du système de santé et des principaux paramètres d'entrée du modèle, tels que le taux de réduction de l'HVRS (39 %-96 %), la mortalité estimée liée au VRS (1 %-8,1 %), le coût du PVZ (1 099 $-2 198 $ par flacon de 100 mg), les posologies et l'utilisation des flacons.
V.1.1 Évaluations économiques avec des résultats exprimés en coût par AVAQ
Les données sont résumées dans les Tableaux 1 et 2. En ce qui concerne les études présentant le rapport coût/efficacité en fait de coût par AVAQ du point de vue du payeur du système de santé, 22 estimations de ce rapport ont été réalisées pour les prématurés, allant de 6 216 $ à 938 623 $ par AVAQNote de bas de page 82 Note de bas de page 179 Note de bas de page 180 Note de bas de page 181 Note de bas de page 182 Note de bas de page 183 Note de bas de page 184 Note de bas de page 185 Note de bas de page 186 Note de bas de page 187 Note de bas de page 188. Les sous-groupes pour lesquels le nombre d'estimations est le plus élevé sont (i) les prématurés stratifiés en fonction des scores de facteurs de risqueNote de bas de page 185 Note de bas de page 186 Note de bas de page 189, (ii) les nourrissons atteints de CPCNote de bas de page 82 Note de bas de page 179 Note de bas de page 181 Note de bas de page 182 Note de bas de page 190 Note de bas de page 191 Note de bas de page 192, et (iii) les nourrissons atteints d'une MPCNote de bas de page 82 Note de bas de page 181 Note de bas de page 182 Note de bas de page 187 Note de bas de page 191. La proportion d'estimations du rapport coût/efficacité rapportées qui se situent en dessous de différents seuils est indiquée dans le Tableau 1. La plus grande concordance entre les estimations rapportées tombant sous le seuil communément utilisé de 50 000 $ par AVAQ concernait les nourrissons atteints d'une MPC (n =6 sur 6 études), les prématurés (n=18/22) et les nourrissons atteints de CPC (n=8/10). Pour les prématurés, aucune tendance particulière n'a été détectée entre l'AG en semaine et le RCED. D'un point de vue sociétal, la prophylaxie par PVZ a été considérée comme une stratégie dominante (c.-à-d. moins coûteuse et plus efficiente) dans certains cas pour les prématurésNote de bas de page 183 Note de bas de page 193 Note de bas de page 194 Note de bas de page 195, les nourrissons nés à terme dans l'Arctique canadienNote de bas de page 196 et les nourrissons atteints de CPCNote de bas de page 182. Cependant, une grande hétérogénéité a été observée dans la conception de l'étude et les paramètres du modèle parmi les études examinées, y compris celles qui ont indiqué que la prophylaxie par PVZ constituait une stratégie dominante. Il ne semble pas y avoir de facteur commun expliquant la dominance de la prophylaxie par PVZ. Dans d'autres scénarios, des RCED supérieurs à 2 000 000 $ par AVAQ ont été observés. D'une manière générale, on s'attendrait à ce que les RCED du point de vue sociétal soient inférieurs à ceux du point de vue du payeur, mais cette tendance n'a pas été observée. Les estimations du point de vue du payeur et du point de vue sociétal provenaient souvent d'études différentes et l'on a pu observer une hétérogénéité dans les conceptions de modèles et des différences entre les coûts relatifs au milieu et l'épidémiologie du VRS qui peuvent expliquer des RCED plus importants dans le cadre d'une perspective sociétale.
Douze de ces études étaient parrainées par l'industrie. Il a été noté que 50 % de toutes les estimations de moins de 200 000 $ par AVAQ et 19 % de toutes les estimations de plus de 200 000 $ par AVAQ provenaient d'études financées par l'industrie (S. Mac, communication personnelle, mars 2019).
| Problèmes de santé | ||||||||
|---|---|---|---|---|---|---|---|---|
| MPC | CPC | Prématuré | Prématuré présentant une MPC | Prématurés présentant des facteurs de risqueTableau 6 Note de bas de page * | FK | Arctique canadienTableau 6 Note de bas de page ** | ||
| Tous les nourrissons | Zones à haut risque | |||||||
| Perspective du payeur | ||||||||
| Nombre d'estimations | 6 | 10 | 22 | 4 | 14 | 2 | 6 | 2 |
| RCED (minimum) | 4 786 | 11 668 | 6 216 | 15 202 | 215 | 167 107 | Dominant | Dominant |
| RCED (maximum) | 46 821 | 164 946 | 938 623 | 131 874 | 205 563 | 693 105 | 178 057 | 391 |
| Proportion des estimations dominantes | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,17 | 0,50 |
| Nombre d'estimations du CE inférieures à 50 000 $/AVAQ | 1,00 | 0,80 | 0,82 | 0,75 | 0,64 | 0,0 | 0,67 | 1,00 |
| Nombre d'estimations du CE inférieures à 100 000 $/AVAQ | 1,00 | 0,90 | 0,86 | 0,75 | 0,86 | 0,0 | 0,67 | 1,00 |
| Nombre d'estimations du RCE inférieures à 200 000 $/AVAQ | 1,00 | 1,00 | 0,91 | 1,00 | 0,92 | 0,50 | 1,00 | 1,00 |
| Perspective sociétale | ||||||||
| Nombre d'estimations | 1 | 8 | 23 | 3 | 6 | 0 | 6 | 2 |
| RCED (minimum) | 28 529 | Dominant | Dominant | 18 717 | 21 931 | S.O. | Dominant | Dominant |
| RCED (maximum) | 28 529 | 209 666 | 2 975 489 | 138 282 | 635 172 | S.O. | 175 291 | Dominant |
| Proportion des estimations dominantes | 0,0 | 0,13 | 0,13 | 0,0 | 0,0 | S.O. | 0,17 | 1,00 |
| Nombre d'estimations du CE inférieures à 50 000 $/AVAQ | 1,00 | 0,63 | 0,39 | 0,67 | 0,17 | S.O. | 0,67 | 1,00 |
| Nombre d'estimations du CE inférieures à 100 000 $/AVAQ | 1,00 | 0,63 | 0,48 | 0,67 | 0,50 | S.O. | 0,67 | 1,00 |
| Nombre d'estimations du RCE inférieures à 200 000 $/AVAQ | 1,00 | 0,88 | 0,52 | 1,00 | 0,67 | S.O. | 1,00 | 1,00 |
Tous les RCED sont exprimés en dollars canadiens (CAD) de 2017 par AVAQ. Dominant = moins coûteux et plus efficient MPC, maladie pulmonaire chronique; CPC, cardiopathie congénitale; FK, fibrose kystique |
||||||||
| RCED : Prématuré par âge gestationnel en semaines | |||||||
|---|---|---|---|---|---|---|---|
| 26-28 | < 29 | 29-30 | 29-32 | < 32 | < 33 | 32-35 | |
| Perspective du payeur | |||||||
| Nombre d'estimations | N/D | 3 | N/D | 3 | 2 | 3 | 6 |
| RCED (minimum) | N/D | 6 216 | N/D | 9 989 | 12 710 | 16 434 | 26 170 |
| RCED (maximum) | N/D | 24 009 | N/D | 58 872 | 25 065 | 42 730 | 919 073 |
| Proportion des estimations dominantes | N/D | 0,00 | N/D | 0,00 | 0,00 | 0,00 | 0,00 |
| Nombre d'estimations du CE inférieures à 50 000 $/AVAQ | N/D | 1,00 | N/D | 0,67 | 1,00 | 1,00 | 0,67 |
| Nombre d'estimations du CE inférieures à 100 000 $/AVAQ | N/D | 1,00 | N/D | 1,00 | 1,00 | 1,00 | 0,67 |
| Nombre d'estimations du RCE inférieures à 200 000 $/AVAQ | N/D | 1,00 | N/D | 1,00 | 1,00 | 1,00 | 0,83 |
| Perspective sociétale | |||||||
| Nombre d'estimations | 4 | 5 | 2 | N/D | 3 | N/D | 4 |
| RCED (minimum) | 165 301 | 22 765 | 449 264 | N/D | Dominant | N/D | 32 390 |
| RCED (maximum) | 2 406 619 | 1 359 641 | 1 083 976 | N/D | Dominant | N/D | 338 823 |
| Proportion des estimations dominantes | 0,00 | 0,00 | 0,00 | N/D | 1,00 | N/D | 0,00 |
| Nombre d'estimations du CE inférieures à 50 000 $/AVAQ | 0,00 | 0,40 | 0,00 | N/D | 1,00 | N/D | 0,75 |
| Nombre d'estimations du CE inférieures à 100 000 $/AVAQ | 0,00 | 0,80 | 0,00 | N/D | 1,00 | N/D | 0,75 |
| Nombre d'estimations du RCE inférieures à 200 000 $/AVAQ | 0,25 | 0,80 | 0,00 | N/D | 1,00 | N/D | 0,75 |
Tous les RCED sont exprimés en dollars canadiens (CAD) de 2017 par AVAQ. Dominant = moins coûteux et plus efficient. N/D : non disponible |
|||||||
V.1.2 Évaluations économiques avec des résultats exprimés en coûts par hospitalisation évitée
Six études ont fait état du rapport coût/efficacité quant au coût par HENote de bas de page 179 Note de bas de page 197 Note de bas de page 198 Note de bas de page 199 Note de bas de page 200 Note de bas de page 201. Une étude portant sur des nourrissons nés à terme et en bonne santé dans différentes régions de l'Arctique canadien a comparé 2 scénarios de prophylaxie par PVZ pour les nourrissons âgés de moins de 6 mois, du point de vue du payeur. Le RCED allait d'une position dominante (c.-à-d. moins coûteuse et plus efficiente) dans certaines régions arctiques à 593 250 $/HE dans les Territoires du Nord-OuestNote de bas de page 197. Toujours du point de vue du payeur, une étude menée en Floride auprès de prématurés (moins de 32 sAG), de nourrissons nés à terme atteints d'une CPC, d'une MPC, auprès de ces 3 groupes et de nourrissons sans indication de PVZ, a fait état d'un RCED compris entre 413 127 $/HE (prématurés) et 2 924 911 $/HE (nourrissons sans indication)Note de bas de page 201.
D'un point de vue sociétal, une étude néerlandaise portant sur des prématurés (moins de 28 sAG) présentant des facteurs de risque supplémentaires (DBP, sexe masculin, poids de naissance inférieur à 2 500 grammes) a révélé des RCED compris entre 24 875 $/HE et 1 572 268 $/HE selon le mois de la prophylaxieNote de bas de page 198. Dans une étude allemande portant sur les prématurés (moins de 35 sAG) présentant des facteurs de risque supplémentaires, les RCED d'un point de vue sociétal étaient compris entre 11 821 $/HE et 364 462 $/HE pour les prématurés présentant une MPC et des facteurs de risque et les prématurés de sexe masculin sans MPC et sans frère ou sœur scolarisé, respectivementNote de bas de page 199. Une étude néo-zélandaise a analysé le rapport coût/efficacité de la prophylaxie chez les prématurés (moins de 28, 29-31 sAG) avec ou sans MPC d'un point de vue sociétal. Les RCED variaient de 33 376 $/HE pour les prématurés renvoyés à domicile sous oxygène, à 37 213 $/HE pour les nourrissons sans MPC, de 28 sAG ou moins, à 193 859 $/HE pour les prématurés (29 à 31 sAG) avec MPC Note de bas de page 200.
V.1.3 Évaluations économiques avec des résultats exprimés en rapports différents
Une évaluation économique portant sur des nourrissons nés à terme et atteints de CPC dans l'Ouest du Canada a montré que, d'un point de vue sociétal, le RCED du scénario de base était de 18 155 $ par jour d'HENote de bas de page 148. Une étude portant sur des prématurés (moins de 32 sAG) ou atteints de MPC ou de CPC significative en France a montré que, d'un point de vue sociétal, le RCED du scénario de base était de 43 856 $ par année de vie gagnée et de 33 450 $ par année de vie gagnée pour les prématurés atteints de MPC et les prématurés atteints de CPC, respectivement. Du point de vue du payeur, le RCED était de 16 368 $ par année de vie gagnée pour les nourrissons atteints de MPCNote de bas de page 202. Dans une étude sur les prématurés atteints de MPC aux États-Unis, le modèle a utilisé une réduction de l'incidence de l'infection par le VRS, allant de 50 % (66 494 $ par épisode d'infection par le VRS évité) à 83 % de réduction (la prophylaxie par PVZ est une stratégie dominante, c.-à-d. moins coûteuse et plus efficiente) du point de vue du payeurNote de bas de page 178.
V.1.4 Évaluations économiques dans des contextes canadiens
Cinq évaluations économiques ont été réalisées dans des contextes canadiensNote de bas de page 148 Note de bas de page 186 Note de bas de page 189 Note de bas de page 196 Note de bas de page 197. Les populations étudiées étaient les nourrissons nés à terme de l'Arctique canadienNote de bas de page 196 Note de bas de page 197, les prématurésNote de bas de page 186, les nourrissons atteints de FKNote de bas de page 189 et les nourrissons atteints de CPCNote de bas de page 148. Ces études supposent l'administration de 4,5 à 6 doses de PVZ par saison de VRS au coût de 1 599 $ à 1 718 $ (CAD de 2017) pour 100 mg de PVZ. Dans les études ci-dessus, l'efficacité réelle du PVZ a été mesurée relativement à la réduction du taux d'HVRS, qui se situait entre 42 et 96 %. Les taux de mortalité ont été incorporés dans 2 modèles, à 1 et 8,1 %Note de bas de page 186 Note de bas de page 196. Les séquelles ont été incorporées dans 2 modèles (dans l'un les séquelles de l'infection par le VRS, dans l'autre les séquelles associées à la FK)Note de bas de page 186 Note de bas de page 189. Les paramètres les plus influents sur les résultats du rapport coût/efficacité dans les 5 études canadiennes étaient les suivants : le taux d'HVRSNote de bas de page 196 Note de bas de page 197, le coût du PVZNote de bas de page 148 Note de bas de page 189 et le coût de l'hospitalisationNote de bas de page 196 Note de bas de page 197 qui comprend les coûts médicaux de l'hospitalisation et les coûts de transport vers le centre médical.
Dans l'Arctique canadien, la prophylaxie par PVZ a été considérée comme rentable pour certains sous-groupes de nourrissons, parce que le PVZ peut éviter les coûts élevés des hospitalisations liés aux frais de transport. C'était surtout le cas pour les milieux où les taux de base d'HVRS étaient élevés. Du point de vue du payeur, le PVZ peut être considéré comme rentable selon les seuils couramment utilisés pour tous les nourrissons nés à terme de l'île de Baffin âgés de moins d'un an (46 151 $/AVAQ) ou de moins de 6 mois (11 925 $/AVAQ), tous les nourrissons nés à terme âgés de moins d'un an en milieu rural (28 965 $/AVAQ), les nourrissons âgés de moins d'un an en milieu rural à haut risque (391 $/AVAQ) et les nourrissons âgés de moins de 6 mois en milieu rural ou dans des zones rurales à haut risque (dominant).
Toutefois, il n'était pas rentable pour les nourrissons de moins d'un an (178 057 $/AVAQ) ou de moins de 6 mois (120 817 $/AVAQ) résidant à IqaluitNote de bas de page 196. Les RCED n'étaient pas rentables en ville parce que le PVZ n'a pas permis d'éviter les coûts de transport associés à une HVRS. Du point de vue sociétal, les RCED étaient légèrement inférieurs, mais suivaient une tendance semblable. Banerji et al. ont inclus des nourrissons nés à terme dans 8 régions arctiques : les Territoires du Nord-Ouest, le Nunavut, le Nunavut sans Iqaluit, les 3 sous-régions du Nunavut (Kitikmeot, Kivalliq et Qikiqtaaluk), la région de Qikiqtaaluk sans Iqaluit, et le Nunavik (Nord du Québec); ils ont rapporté les coûts par HE dans 2 scénarios distincts : prophylaxie jusqu'à la fin de la saison du VRS (scénario A) et prophylaxie jusqu'à l'âge de 5 mois (scénario B).
La prophylaxie par PVZ était une stratégie dominante (c.-à-d. moins coûteuse et plus efficiente) à Kitikmeot (scénarios A et B) et à Kivalliq (scénario B); 24 981 $/HE à Kivalliq (scénario A); 5 042 $/HA (scénario B) et 31 104 $/HE (scénario A) au Nunavut sans Iqaluit; 15 829 $/HE (scénario B) et 45 060 $/HE (scénario A) au Nunavut; 16 979 $/HE (scénario B) et 32 899 $/HE (scénario A) au Nunavik. Dans toutes les autres régions, les RCED étaient supérieurs à 100 000 $/HENote de bas de page 197. Les RCED variaient beaucoup d'une région à l'autre. Le PVZ avait tendance à être rentable au seuil de 50 000 $ par AVAQ dans les régions où les taux d'HVRS étaient plus élevés (fourchette : de 97,8 à 296,1 admissions dues au VRS pour 1 000 au Nunavik, dans la région de Kivalliq, dans la région de Kitikmeot et au Nunavut), tandis que le PVZ n'était pas rentable au seuil de 100 000 $ par AVAQ dans les régions où les taux d'HVRS étaient plus faibles (fourchette : de 16,6 à 49,4 admissions dues au VRS pour 1 000 dans les Territoires du Nord-Ouest et la région de Qikiqtaaluk)Note de bas de page 197.
Du point de vue du payeur, le PVZ a été jugé rentable selon les seuils couramment utilisés pour les prématurés de 32 à 35 sAG (20 814 $/AVAQ incluant l'asthme comme conséquence de l'infection par le VRS et 35 119 $/AVAQ excluant l'asthme). En utilisant 2 ensembles de scores de facteurs de risque, les RCED étaient de 251 $ par AVAQ et de 5 906 $ par AVAQ pour les nourrissons ayant des scores élevés (risque élevé), de 29 901 $ par AVAQ et de 38 566 $ par AVAQ pour les scores moyens, et de plus de 50 000 $ par AVAQ (92 649 $ – 919 073 $) pour les scores inférieurs ou l'absence de facteurs de risqueNote de bas de page 186. Pour les nourrissons de moins de 24 mois atteints de FK, le PVZ a été jugé peu rentable du point de vue du payeur (693 105 $/AVAQ pour tous et 167 107 $/AVAQ pour les nourrissons à haut risque)Note de bas de page 189. Dans l'étude du rapport coût/efficacité du PVZ chez les enfants de moins de 24 mois atteints de CPC, du point de vue sociétal, le RCED était de 18 155 $ par jour d'HE et a été jugé peu rentableNote de bas de page 148.
Ces 3 dernières études peuvent être généralisées à la plupart des provinces canadiennes étant donné qu'elles ont utilisé des coûts de PVZ (1 468 $ – 1 505 $ par flacon de 100 mg, coûts originaux) semblables à ceux des autres provinces canadiennes, des posologies proches de 5 injections par saison (de 4,5 à 5,39 flacons par saison), des coûts de soins de santé de la Colombie-Britannique et de l'Ontario, et qu'elles ont inclus des paramètres de modèle pertinents pour le système de santé canadien. Il n'y avait pas d'études sur la rentabilité de la prophylaxie par PVZ pour les nourrissons des petites provinces canadiennes (p. ex., les provinces maritimes).
| Auteurs, année | Population | Posologie (par saison) | Coût par unité (non ajusté) | Hospitalisation | Mortalité | Séquelle liée au VRS incluse? | ||
|---|---|---|---|---|---|---|---|---|
| PVZ | Pas de PVZ | Réduction (%) | ||||||
| Tam et al., 2009Note de bas de page 196 | Nourrissons nés à terme, île de Baffin | 5 doses | Coût unitaire du flacon : NI; 220 $/kg du nourrisson | 1,4 – 11,4 % | 6,3 – 51,2 % | 78 %Tableau 8 Note de bas de page a | 1 % (les deux groupes) | Non |
| Banerji et al., 2016Note de bas de page 23 | Arctique canadien Nourrissons nés à terme | 6 doses (maximum) | Coût unitaire du flacon : NI; 226 $/kg du nourrisson | NI | NI | 96 % | NI | Non |
| Smart et al., 2010Note de bas de page 186 | Prématurés de 32-35 sAG | 5,39 flacons | 50 mg : 752 $ 100 mg : 1,505 $ | 1,8 % | 10,0 % | NI (82 % par rétrocalcul) | 3,9 % (les deux groupes)Tableau 8 Note de bas de page b | Oui / Non (asthme) |
| McGirr et al., 2017Note de bas de page 189 | FK, âge < 24 mois | 5 doses | 100 mg : 1 505 $ | 1,7 % (en supposant une réduction de 55 %)Tableau 8 Note de bas de page c | 3,8 % | 55 % | NI (décès lié à la FK utilisé) | Oui (progression de la FK) |
| Harris et al., 2011Note de bas de page 148 | CPC, âge < 24 mois | 4,5 doses | 100 mg : 1 468 $ | 1,7 % | 2,9 % | NI (42 % par rétrocalcul) | NI 0,2 % (1/41, pas de PVZ); 0 % (0/292, PVZ) | Non |
NI : non indiqué |
||||||||
V.1.5 Hétérogénéité des résultats : paramètres clés
Les paramètres influents les plus fréquemment rapportés touchant le RCED étaient les taux d'HVRS et le coût du PVZ utilisé. La réduction du taux d'HVRS a fortement varié entre 39 et 96 % selon la population concernée et la source des données. Le coût d'un flacon de 100 mg de PVZ se situait également entre 1 099 $ et 2 198 $ (CAD de 2017). Cependant, l'utilisation du flacon et la posologie n'ont eu une incidence sur les RCED que dans 4 étudesNote de bas de page 181 Note de bas de page 183 Note de bas de page 195 Note de bas de page 200 et 3 étudesNote de bas de page 185 Note de bas de page 187 Note de bas de page 200, respectivement. Dans les études portant sur le gaspillage de médicaments, les RCED ont fluctué jusqu'à 50 % en fonction de l'utilisation présumée des flacons.
Une étude néo-zélandaise émet l'hypothèse selon laquelle le non-partage des flacons (un flacon entier de 100 mg est utilisé par injection) a entraîné une augmentation du coût par cas évité allant jusqu'à 50 % (c.-à-d. un moins bon rapport qualité/prix)Note de bas de page 200, tandis qu'une autre étude en Espagne a conclu à un RCED inférieur (c.-à-d. un meilleur rapport qualité/prix) lorsque des flacons de 50 mg étaient utilisés au lieu de 100 mgNote de bas de page 183. La littérature a indiqué que l'efficience en matière d'utilisation des flacons peut être atteinte pour le PVZNote de bas de page 203. L'actualisation a également été souvent rapportée comme ayant une influence sur le RCED. Les taux d'actualisation variaient selon les études (3-5 %). À l'heure actuelle, les lignes directrices canadiennes recommandent un taux d'actualisation de 1,5 % pour les coûts et les résultatsNote de bas de page 204.
V.1.6 Application généralisée des études incluses au contexte canadien
La plupart des résultats des études peuvent être appliqués de façon générale au système de santé canadien, puisqu'il s'agissait d'évaluations économiques réalisées dans des pays de l'OCDE ayant des composantes de soins de santé semblables à celles du CanadaNote de bas de page 205. Les 6 études américaines constituent les seules exceptions. La perspective sociétale ou du payeur peut influencer les coûts et les bienfaits inclus dans l'analyse. Parmi les études qui ont utilisé une perspective sociétale, les coûts suivants, hors du système de soins de santé, ont été pris en compte : perte de temps de travail due à l'asthme; coûts indirects des infections nosocomiales; frais de déplacement (c.-à-d. hôtel, transport); perte de productivité (c.-à-d. soins, loisirs, productivité future des enfants) et absentéisme scolaire.
D'après 3 études canadiennes, le coût par flacon de 100 mg de PVZ utilisé dans les modèles se situait entre 1 599 $ et 1 718 $ (CAD de 2017). Les modèles du Royaume-Uni ont utilisé un coût inférieur pour le PVZ, soit de 1 099 $ à 1 240 $ par flacon de 100 mg, et les coûts des autres études (à l'exception de celles des États-Unis) se situaient entre 1 386 $ et 2 035 $ (CAD de 2017). Le nombre de doses par saison variait de 3,88 à 6 doses. Dans le sous-ensemble de pays dont la structure des soins de santé est semblable à celle du Canada, presque tous les modèles indiquaient 5 doses de PVZ par saison, à l'exception de Resch et al. (Autriche)Note de bas de page 82, Nuijten et al., Sanchez-Luna et al. et Schmidt et al. (tous provenant d'Espagne), où le nombre moyen de doses était de 4 par saisonNote de bas de page 183 Note de bas de page 185 Note de bas de page 195.
Malgré les similitudes dans le coût et la posologie de la prophylaxie par PVZ, les taux de réduction estimés concernant l'HVRS varient de 39 à 96 % selon la population de nourrissons et les ouvrages référencés. Un total de 68 % des études (S. Mac, communication personnelle, juin 2019) ont utilisé l'ECR IMpact-VRS pour certains des paramètres de leur modèle, un essai qui a inclus des enfants canadiens et a conclu que la réduction du taux d'HVRS était de 78 % pour les prématurés, de 39 % pour les enfants atteints de MPC et de 55 % dans l'ensemble. Bien que le sous-groupe de sujets canadiens de cette étude ait montré une réduction globale de 40 % du taux d'HVRS, la tendance était semblable à celle observée chez les sujets américains (56 %) et britanniques (64 %)Note de bas de page 48. Il est à noter que l'ECR IMpact-VRS a été réalisé en 1996 et qu'avec les changements dans la gestion de la prématurité, de la MPC et de la CPC, ainsi que de l'infection par le VRS, les paramètres du modèle basés sur cette étude peuvent ne plus convenir aujourd'hui.
V.2 Étude coût/efficacité au Nunavik (Québec)
En plus des études de l'examen systématique, les résultats préliminaires d'une étude coût/efficacité dans la région du Nunavik, dans le Nord du Québec, ont été communiqués au CCNI le 13 mars 2019 (R. Gilca, Institut national de santé publique du Québec, communication personnelle, 18 novembre 2020)Note de bas de page 206. À partir de la saison de 2016-2017, les nourrissons nés à terme en bonne santé âgés de moins de 3 mois au début de la saison du VRS ou nés pendant la saison du VRS sont devenus admissibles à un maximum de 3 doses de PVZ. Pour la saison de 2017-2018, les nourrissons répondant à ces critères pouvaient recevoir jusqu'à 5 doses. Les objectifs étaient d'estimer le coût des soins de santé de l'HVRS au sein de la population ciblée et le coût du programme de PVZ, et d'estimer le coût par HE.
L'analyse ci-dessous est basée sur les 2 premières années du programme. Elle est en cours de mise à jour pour inclure 4 années de données et sera publiée. Les conclusions restent inchangées.
| Date | Incidence pour 100 000 jours-patients du taux d'HVRS | EfficacitéTableau 9 Note de bas de page * | |
|---|---|---|---|
| Non protégé | PVZ - Protégé | ||
| 2017 | |||
| Du 1 janvier au 30 avril | 58,1 | 37,5 | 35,5 % |
| Du 1 janvier au 31 mai | 45,5 | 33,8 | 25,7 % |
| 2018 | |||
| Du 1 janvier au 31 mai | 22,5 | 14,5 | 35,6 % |
| Du 1 janvier au 30 juin | 17,8 | 13,0 | 27,3 % |
|
|||
| Scénarios / hypothèses | Coûts évités : (coût moyen en l'absence de programme, 2014-2016 = 156 914 $) |
2017 | 2018 | ||||
|---|---|---|---|---|---|---|---|
| coûts totaux du programme | ratio dépensé/avorté | RCI | coûts totaux du programme | ratio dépensé/avorté | RCI | ||
| 1. Efficacité du PVZ = 36 %Tableau 10 Note de bas de page *; la réduction des coûts est proportionnelle à l'efficacité. | $55 861 | $291 533 | 5 | 0,19 | $369 641 | 7 | 0,15 |
| 2. Toute réduction observée en 2017 est due au PVZ (réduction=89 %)Tableau 10 Note de bas de page ** | $139 395 | $291 533 | 2 | 0,48 | $369 641 | 3 | 0,38 |
| 3. Toute réduction observée en 2018 est due au PVZ (réduction=71 %)Tableau 10 Note de bas de page ** | $112 040 | $291 533 | 3 | 0,38 | $369 641 | 3 | 0,30 |
RCI : rendement du capital investi |
|||||||
Les coûts du programme ont largement dépassé les coûts d'hospitalisation et de transport. Pour être neutre quant aux coûts, le programme devrait éviter de 9 à 11 hospitalisations par an (coûts totaux du programme/coût moyen de 2014-2016 par hospitalisation = 33 600 $). Un nombre aussi élevé d'hospitalisations n'a pas été observé dans cette population (moyenne pour 2014-2016 = 7 hospitalisations).
Cette étude présente plusieurs limites, notamment la petite taille de la population, qui compte environ 220 nourrissons nés à terme et en bonne santé entre le 1 octobre et le 30 juin de chaque année et dispersés dans beaucoup de très petites collectivités. Le nombre d'hospitalisations de nourrissons de 0 à 2 mois nés à terme et en bonne santé au Nunavik était faible (inférieur aux prévisions) et très variable d'une année à l'autre. Les coûts totaux de l'hospitalisation et du transport sont donc également très variables. Le coût du programme est semblable d'une année à l'autre. Le coût du PVZ constitue la composante principale, mais le coût d'administration n'est pas négligeable (plus de 135 $ par dose). L'efficacité du PVZ permettant de prévenir l'HVRS était faible. De nombreux nourrissons hospitalisés présentaient des co-infections avec d'autres virus. Des problèmes d'acceptabilité sociale et de respect du programme PVZ étaient également observés.
Facteurs d'éthique, d'équité, de faisabilité et d'acceptabilité (EEFA) à prendre en considération
Le cadre EEFA, évalué par des pairsNote de bas de page 13, a été appliqué aux présentes directives pour garantir la prise en compte systématique des facteurs essentiels à la prise de décision globale en matière de programmes de vaccination et à la mise en œuvre réussie des recommandations. L'utilisation de ce cadre permet au CCNI d'examiner toutes les données disponibles, d'en faire le bilan et de résumer de manière transparente le raisonnement justifiant ses recommandations appropriées et opportunes. Les outils fondés sur des données probantes associés au cadre (filtres d'éthique intégrés, matrice d'équité, matrice de faisabilité, matrice d'acceptabilité) garantissent que les questions liées à l'EEFA découlant des conseils des comités d'experts sont systématiquement et adéquatement intégrées.
Considérations relatives à l'éthique
Pour soutenir la délibération et la prise de décision en matière d'éthique, les filtres d'éthique intégrés du CCNI pour les dimensions éthiques fondamentales (respect des personnes et des collectivités, bienfaisance et non-malfaisance, justice, confiance) et les dimensions éthiques procédurales (imputabilité, inclusion, responsabilité, réactivité, transparence) ont été appliqués. Le CCNI a suivi sa méthodologie établie, ses procédures d'opération normalisées et ses directives en matière de conflits d'intérêts afin de garantir une analyse solide des données probantes, avec une transparence sur les éléments connus et inconnus, ainsi que la CDP, et de maintenir la confiance des intervenants.
Afin de respecter le droit d'exercer un choix éclairé, le CCNI a examiné les meilleures données probantes actuelles pour les groupes de nourrissons et d'enfants à risque de VRS et les a résumées pour les intervenants tout au long de ce document d'orientation, y compris les données récentes sur le FdM lié au VRS, l'efficacité potentielle et l'efficacité réelle du PVZ chez les nourrissons risquant d'être atteints d'une maladie liée au VRS plus sévère et les répercussions économiques de l'utilisation du PVZ. Dans ses délibérations, le CCNI a également pris en compte les éléments permettant de réduire le plus possible le risque de préjudice et d'optimiser les bienfaits pour toutes les populations principales potentielles. Ces résultats doivent être interprétés avec prudence étant donné que certaines préoccupations potentielles ont été déterminées concernant la disponibilité des données probantes; un petit nombre d'articles a été déterminé pour certains groupes et situations à risque, et une forte hétérogénéité a été observée dans la méthodologie utilisée et les résultats étudiés.
De plus, en l'absence de données probantes indiquant une réduction des taux de mortalité due au VRS ou des bienfaits à long terme découlant du PVZ, le coût élevé des programmes de prophylaxie par PVZ doit également être équilibré par rapport aux coûts d'autres interventions de soins de santé si ces dernières peuvent être compromises par la fourniture de programmes de PVZ. Par conséquent, le CCNI continuera à surveiller les données probantes liées à l'utilisation du PVZ dans différents groupes, y compris le rapport coût/efficacité des programmes de PVZ et les autres posologies et produits plus récents qui pourraient être plus rentables, et mettra à jour la Déclaration et les recommandations au besoin.
Considérations relatives à l'équité
Le CCNI a examiné l'épidémiologie du VRS et les résultats de l'ESFdM lié au VRS chez les jeunes enfants dans les pays à revenu élevé comparables au Canada (résumé à la Section III) afin de déterminer les inégalités distinctes associées à la COVID-19, les raisons possibles de ces inégalités et les interventions proposées pour réduire les inégalités et améliorer l'accès au vaccin lorsqu'il sera disponible.
Le risque de maladie sévère due au VRS est influencé par l'AG à la naissance, les problèmes de santé sous-jacents et l'âge. Comme il n'est pas possible de fournir une prophylaxie par PVZ à tous les nourrissons présentant un certain risque accru de maladie liée au VRS, elle devrait en principe être fournie aux groupes à haut risque présentant un risque équivalent de maladie sévère. Des recommandations précises sont nécessaires pour une prophylaxie sélective par PVZ pour des sous-groupes à haut risque identifiables de nourrissons et d'enfants qui sont plus vulnérables que d'autres aux ÉI de l'infection par le VRS, et dont le risque d'issue sévère se situe dans une fourchette semblable et pour lesquels la prophylaxie par PVZ s'est avérée efficace. Cependant, la nature limitée et l'hétérogénéité des données disponibles rendent l'évaluation du degré de risque quelque peu arbitraire.
Pour certaines maladies très rares, le risque de maladie sévère due au VRS peut être élevé, mais les données épidémiologiques ne sont pas disponibles, et le nombre d'enfants atteints de certaines maladies rares peut ne pas être suffisant pour que l'efficacité réelle du PVZ soit étudiée. Dans ces circonstances, une extrapolation peut être faite à partir des données sur les conditions de similitude physiopathologique avec un risque accru recensé de VRS et où le PVZ s'est avéré efficace. Dans la plupart des PT, les médecins peuvent demander le PVZ par exception pour les enfants qui ne répondent pas aux critères précis pour recevoir le PVZ. Si une telle pratique permet une certaine souplesse d'utilisation pour les enfants atteints de maladies rares, cela peut également introduire des inégalités. Ceux qui font des demandes d'exception et ceux qui évaluent ces demandes doivent le faire de manière équitable, pour éviter toute iniquité.
Les nourrissons vivant dans des communautés inuites nordiques éloignées et dans d'autres communautés rurales isolées peuvent également présenter un risque accru de conséquences sévères résultant d'une infection par le VRS. L'accès local limité aux soins médicaux peut exiger des évacuations médicales nécessitant un transport aérien vers des installations hospitalières. Par conséquent, des ressources supplémentaires peuvent être nécessaires pour la fourniture de la prophylaxie par PVZ et pour la surveillance et le suivi des nourrissons vivant dans des endroits éloignés. La prophylaxie par PVZ doit également être fournie aussi près du domicile que possible, étant donné que le nombre et la fréquence des visites sur une courte période et les intervalles stricts entre les injections peuvent constituer un obstacle pour les familles en raison des frais à débourser si la famille doit parcourir une certaine distance pour recevoir le PVZ ou prendre un congé pour ces visites. Dans ces cas, il peut être nécessaire d'apporter une aide à certaines familles pour qu'elles puissent bénéficier du programme de prophylaxie par PVZ. Le CCNI continuera à surveiller les données probantes relatives à la sévérité de la maladie due au VRS chez les nourrissons atteints d'affections préexistantes et chez les nourrissons vivant dans des communautés inuites nordiques éloignées et d'autres communautés rurales éloignées.
Considérations relatives à la faisabilité
La fourniture de la prophylaxie par PVZ est complexe : son intégration dans les programmes de vaccination active existants n'est pas possible en raison du calendrier posologique et de la nature saisonnière de la maladie. En particulier, la nécessité de procéder à de multiples injections sur une courte période peut poser des problèmes de calendrier; jusqu'à 4 doses doivent être administrées à des intervalles de 28 à 35 jours pendant la période où l'épidémie annuelle locale de VRS est en cours. Contrairement aux vaccins, la dose de PVZ dépend du poids, et le moment précis des visites pour l'administration du PVZ est crucial pour une protection appropriée. Il n'est pas possible de combiner toutes les visites avec celles pour d'autres vaccins ou les soins d'usage aux enfants.
De plus, le PVZ est fourni en flacons multidoses qui, une fois ouverts, doivent être utilisés dans les 6 heures ou jetés et donc gaspillés. Le partage des flacons peut être difficile dans les petites communautés où très peu d'enfants sont candidats pour recevoir le PVZ, ce qui augmente encore le coût. Par conséquent, les considérations importantes pour la mise en œuvre d'un nouveau programme de prophylaxie par PVZ comprennent la limitation de la prophylaxie aux groupes présentant le plus grand risque de résultats sévères, la programmation de cliniques particulières d'administration du PVZ pendant la saison du VRS, la reconnaissance de l'impact potentiel sur les programmes locaux existants et la mobilisation des soignants locaux dans la planification de la mise en œuvre du programme.
Considérations relatives à l'acceptabilité
On dispose actuellement de données très limitées sur l'acceptabilité de la prophylaxie par PVZ et la perception de la maladie liée au VRS par les parents ou les tuteurs de nourrissons à haut risque. Les obstacles probables à l'acceptabilité et à l'observance des conditions de traitement sont les suivants :
- Le nombre et la fréquence des visites, en particulier si les familles doivent parcourir une certaine distance pour recevoir la prophylaxie et s'il n'est pas possible de combiner les visites pour recevoir le PVZ lors de visites pour d'autres vaccins ou les soins de santé d'usage.
- Les dépenses personnelles si les rendez-vous nécessitent un déplacement sur une longue distance vers le centre de traitement et un arrêt de travail.
- Le manque de connaissances sur le risque d'infection par le VRS chez les enfants à risque élevé.
Certaines données indiquent que les populations autochtones du Canada courent un risque plus élevé de non-observance que les populations non autochtones et que l'acceptation est plus faible dans les populations nordiques éloignéesNote de bas de page 207 Note de bas de page 208. Les infirmières et sages-femmes qui travaillent avec une population du Nord canadien ont également exprimé des préoccupations concernant le manque de données sur l'efficacité potentielle et l'innocuité du PVZ chez les nourrissons nés à terme et en santéNote de bas de page 207. La faible acceptabilité de la prophylaxie par le PVZ par les familles peut entraîner une diminution de l'adhésion au calendrier posologique du PVZ et ainsi en diminuer l'efficacitéNote de bas de page 209. Par conséquent, la mise en œuvre d'un nouveau programme doit prévoir une formation continue pour les professionnels de la santé locaux, les familles et tuteurs des nourrissons pour lesquels le PVZ est indiqué et les amener à participer activement à la planification de l'intervention. Sont également des considérations importantes : la fourniture du PVZ dans des cliniques locales aussi proches du domicile que possible et des ressources suffisantes pour fournir une aide aux familles qui peuvent avoir besoin d'un soutien supplémentaire pour pouvoir se rendre à la clinique.
Recommandations
Par suite de l'examen approfondi des données probantes disponibles, qui sont résumées ci-dessus, ainsi que de l'évaluation systématique des facteurs d'éthique, d'équité, de faisabilité et d'acceptabilité à prendre en considération au moyen du cadre EEFA, évalué par les pairs, le CCNI formule les recommandations suivantes fondées sur des données probantes.
Recommandations relatives au processus décisionnel à l'échelle des programmes de santé publique
(c.-à-d. les PT qui prennent des décisions concernant les programmes d'immunisation à fonds publics)
Dans l'examen de ces recommandations et aux fins de la mise en œuvre des programmes à fonds publics, les PT peuvent tenir compte de facteurs programmatiques locaux (p. ex., programmes en cours, ressources). Sachant qu'il existe des différences dans les contextes opérationnels au Canada, les administrations peuvent se référer au tableau des options de gestion ci-dessous pour un résumé des mérites relatifs de la vaccination de différents groupes à risque élevé, si des priorités doivent être établies pour la mise en œuvre des programmes d'immunisation ciblée.
1. Nourrissons prématurés sans cardiopathie congénitale ni maladie pulmonaire chronique
Recommandation 1.1 : Le CCNI recommande que le PVZ soit proposé aux nourrissons nés à moins de 30 sAG et 0 jour et âgés de moins de 6 mois au début de la saison du VRS ou pendant celle-ci. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie B).
Recommandation 1.2 : Le CCNI recommande que le PVZ puisse être envisagé pour les nourrissons nés entre 30 et 32 sAG et 6 jours et âgés de moins de 3 mois au début ou la saison du VRS ou pendant celle-ci, s'ils présentent un risque élevé d'exposition au VRS en raison de la fréquentation d'une garderie ou de la présence d'un autre enfant d'âge préscolaire ou d'autres enfants à la maison. (Recommandation discrétionnaire du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Recommandation 1.3 : Le CCNI recommande que le PVZ ne soit pas proposé aux nourrissons par ailleurs en bonne santé, nés à 33 sAG et 0 jour ou après. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes pour déconseiller l'utilisation du PVZ dans cette population (données probantes de catégorie C).
Sommaire des données probantes et justification :
- Il existe de bonnes données probantes indiquant que le risque d'HVRS est plus élevé chez les enfants prématurés d'un AG inférieur, avec des taux signalés de 7,7 à 13,6 % au cours de la première année de vie chez les enfants de moins de 28 ou 29 sAGNote de bas de page 41 Note de bas de page 42 Note de bas de page 43 Note de bas de page 44 Note de bas de page 45 Note de bas de page 46 Note de bas de page 47. Ces nourrissons reçoivent peu ou pas d'anticorps maternels et leurs VR plus étroites augmentent leur vulnérabilité aux effets de l'infection par le VRS.
- Il existe de bonnes données probantes indiquant que les nourrissons de 30 à 32 sAG sont également exposés à un risque accru d'HVRS par rapport aux nourrissons à terme, mais les taux d'HVRS sont plus faibles, soit de 5,1 dans l'ESFdM de 2014 à 2018 (voir la Section III.1.1), soit entre 5,7 et 9,9 % dans la littérature antérieureNote de bas de page 41 Note de bas de page 42 Note de bas de page 43 Note de bas de page 45 Note de bas de page 46 et de 4,3 % dans une étude plus récenteNote de bas de page 38. Il existe des données probantes suffisantes pour démontrer que les taux d'HVRS chez les nourrissons nés entre 29 et 32 et entre 33 et 35 sAG sont 4,6 et 2,8 fois plus élevés que chez les nourrissons à terme, respectivement (Section III.1.1). Des études antérieures ont montré des données contradictoires sur le risque d'HVRS chez les nourrissons de 32 à 35 sAG. Des taux de 2,85 à 6,5 % au cours de la première année de vie ou de la première saison du VRS ont été signalésNote de bas de page 40 Note de bas de page 45 Note de bas de page 48, tandis que 2 études plus récentes ont fait état de taux de 4,0 et 3,4 %Note de bas de page 38 Note de bas de page 39. Le taux d'HVRS pour les enfants à terme en bonne santé dans l'ESFdM était de 1,2 %.
- Il existe des données probantes suffisantes pour démontrer que les prématurés ayant subi une HVRS ont une DSH plus longue que les enfants nés à terme, la différence moyenne entre les prématurés et les enfants à terme étant de 7,97 jours pour les enfants de 29 à 32 sAG et de 1,06 jour pour les enfants de 32 et de 33 à 35 sAG. Il existe des données probantes suffisantes démontrant que les prématurés ayant subi une HVRS ont un taux d'admission en USI plus élevé que les enfants nés à terme, avec un RR de 4,0 pour les nourrissons de 29 à 32 sAG et de 3,0 pour ceux de 32 à 35 sAG. Il existe des données probantes suffisantes démontrant que les nourrissons prématurés de 29 à 35 sAG ayant subi une HVRS ont un taux d'utilisation de la VM plus élevé que les enfants nés à terme, avec un RR de 1,9 pour les nourrissons de 29 à 32 sAG et de 1,2 pour ceux de 33 à 35 sAG (Section III.1.1).
- Il existe des données probantes suffisantes démontrant que l'âge chronologique est un facteur de risque important pour l'HVRS, la plupart des infections se produisant dans les 2 ou 3 premiers mois de la vieNote de bas de page 16 Note de bas de page 49.
- Il n'existe pas de données probantes suffisantes pour démontrer l'efficacité réelle du PVZ pour réduire le risque d'HVRS chez les nourrissons prématurés de moins de 30 sAG. Trois études, deux qualifiées de bonnes et une de passable, n'ont pas montré d'effet significatif sur le taux d'HVRS dans ce groupe, mais le nombre de participants était faible (228 au total pour les 3 études). Une étude plus importante portant sur des nourrissons prématurés de 30 sAG ou moins, jugée de faible qualité, a montré une réduction de 92 % avec un NST de 9.
- Il existe de bonnes données probantes démontrant que le PVZ est efficace pour réduire le taux d'HVRS de 38 à 80 % chez les nourrissons prématurés de 32 sAG ou moins qui ne sont pas atteints d'une MPC ou d'une CPCHS (NST : 53, 5, 17).
- Il existe des données probantes contradictoires concernant l'effet du PVZ sur le taux d'HVRS chez les nourrissons prématurés de 32 à 35 sAG qui ne sont pas atteints d'une MPC ou d'une CPCHS. Deux ECR et une étude d'observation ont montré des réductions de 55 à 82 % (NST : 22, 24) ainsi que de 55 %, tandis que 3 études d'observation n'ont pas montré d'effet significatif.
- Il existe des données probantes suffisantes (un examen systématique) d'une association entre le traitement par le PVZ et une baisse de la mortalité toutes causes confondues chez les nourrissons de 32 sAG ou moins, mais pas de données probantes démontrant l'effet du PVZ sur la mortalité spécifique au VRSNote de bas de page 74.
- Chez les prématurés, les RCED étaient inférieurs à 50 000 $ par AVAQ dans 82 % des estimations (perspective du payeur) et étaient dominants (c.-à-d. moins coûteux et plus efficients) chez les nourrissons de moins de 32 sAG (perspective sociétale). Aucune tendance précise n'a été détectée entre les seuils de sAG et le RCED, mais le nombre d'estimations dans les groupes de sGA était faible. Les RCED étaient inférieurs à 50 000 $ par AVAQ dans 100 % des estimations pour les nourrissons de moins de 29 sAG, 67 % pour les nourrissons de 29 à 32 sAG, 100 % pour les nourrissons de moins de 32 sAG et de moins de 33 sAG ainsi que 67 % pour les nourrissons de 32 à 35 sAG (perspective du payeur). Dans une étude canadienne, les RCED étaient inférieurs à 50 000 $ par AVAQ pour les nourrissons de 32 à 35 sAG présentant un score de risque élevé ou modéré de VRS (perspective du payeur).
- Bien que le fardeau de la maladie soit plus élevé chez les nourrissons de 30 à 35 sAG que chez les nourrissons nés à terme et que l'efficacité réelle du PVZ soit bien démontrée chez les nourrissons de 30 à 32 sAG, le coût d'utilisation du PVZ dans ces groupes d'AG plus élevé est préoccupant. Au Canada, on estime que 8 % des nourrissons naissent prématurémentNote de bas de page 67 et que 5 % de la cohorte des naissances peut naître entre 32 et 35 sAGNote de bas de page 34. Les recommandations sont fondées sur l'administration d'une prophylaxie aux nourrissons prématurés les plus à risque.
Recommandation 1.4 : Le CCNI recommande que le PVZ ne soit pas proposé aux nourrissons ou aux frères et sœurs issus de naissances multiples, qui ne remplissent pas les conditions requises pour bénéficier d'une prophylaxie. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes pour déconseiller l'utilisation du PVZ dans cette population (données probantes de catégorie C).
Sommaire des données probantes et justification :
- La plupart des études sur les jumeaux et autres naissances multiples ont fait état de risques similaires d'HVRS chez les nourrissons issus de naissances multiples et de naissances uniques, que ce soit sansNote de bas de page 71 Note de bas de page 116 ou aprèsNote de bas de page 114 Note de bas de page 117 ajustement des facteurs de confusion.
- Une étude a signalé un taux d'HVRS plus élevé chez les nourrissons issus de naissances multiples, mais les facteurs de confusion potentiels n'ont pas été pris en compteNote de bas de page 115.
- Il n'existe pas de données sur l'utilisation du PVZ dans ce groupe.
- Les données probantes sont basées sur l'examen d'études clés, sans évaluation formelle de la qualité.
2. Maladie pulmonaire chronique due à la prématurité et autres maladies pulmonaires chroniques
Recommandation 2.1 : Le CCNI recommande que le PVZ soit proposé aux nourrissons atteints d'une maladie pulmonaire chronique associée à la prématurité (définie comme 32 sAG ou moins et un recours à une oxygénation complémentaire de plus de 21 % pendant au moins les 28 premiers jours après la naissance) qui sont âgés de moins de 24 mois au début de la saison du VRS et qui ont eu besoin d'une oxygénothérapie continue dans les 6 mois précédant le début de la saison du VRS ou pendant celle-ci. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe de bonnes données probantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie A).
Sommaire des données probantes et justification :
- Le taux d'HVRS chez les nourrissons atteints d'une MPC associée à la prématurité au cours des 2 premières années de vie est élevé (12 à 21 %)Note de bas de page 42 Note de bas de page 44 Note de bas de page 48 Note de bas de page 72. Pour les patients hospitalisés, des taux élevés d'admission en USI (29 %) et de VM (24 %) ont été rapportésNote de bas de page 72.
- Il existe de bonnes données probantes démontrant que le PVZ réduit le taux d'HVRS chez les nourrissons de 35 sAG ou moins atteints d'une MPC et âgés de moins de 24 mois (RD, 39 %, NST : 21)Note de bas de page 48. Il existe des données probantes suffisantes démontrant que le PVZ réduit le taux d'HVRS chez les nourrissons atteints d'une MPC pendant les 6 premiers mois suivant leur sortie initiale (RD, 86 %; NST : 13)Note de bas de page 44 et de faibles données probantes chez les nourrissons atteints d'une MPC âgés de moins de 6 mois au début de la saison du VRS (RD, 85 %, 72 %; NTS : 3, 8)Note de bas de page 46 Note de bas de page 139. Les données probantes portant sur l'effet du PVZ sont insuffisantes chez les nourrissons atteints d'une MPC âgés de moins de 12 mois ou de 6 à 12 mois. Il n'existe pas de données probantes concernant l'effet du PVZ sur d'autres résultats liés à l'hospitalisation ou sur les séquelles à long terme du VRS chez les nourrissons atteints d'une MPC. Il n'y a pas suffisamment de données probantes démontrant que le PVZ a un effet sur la mortalité toutes causes confondues ou sur la mortalité liée au VRS chez les enfants atteints d'une MPC, puisque les nombres étudiés sont insuffisants pour détecter un effetNote de bas de page 74.
- Les études sur le rapport coût/efficacité de la prophylaxie par PVZ ont fait état de RCED inférieurs à 50 000 $ par AVAQ dans toutes les estimations (du point de vue sociétal ou du payeur); les RCED pour les nourrissons renvoyés chez eux sous oxygène étaient inférieurs à 50 000 $ par HE et inférieurs à 50 000 $ par année de vie gagnée.
Recommandation 2.2 : Le CCNI recommande que le PVZ puisse être envisagé pour les enfants de moins de 24 mois atteints d'une maladie pulmonaire chronique sévère ou d'une autre étiologie (p. ex., une maladie pulmonaire kystique congénitale, une maladie pulmonaire interstitielle chronique, des malformations pulmonaires congénitales, des anomalies congénitales des voies respiratoires ou des affections neuromusculaires réduisant la capacité à évacuer les sécrétions des voies respiratoires) ou qui ont besoin d'une assistance respiratoire à domicile (p. ex., oxygénation complémentaire, ventilation mécanique, ventilation en pression positive continue, trachéotomie) s'ils ont besoin d'une oxygénation complémentaire ou d'une ventilation assistée dans les 6 mois précédant le début de la saison du VRS ou pendant celle-ci. (Recommandation discrétionnaire du CCNI).
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- Il existe des données probantes suffisantes pour démontrer l'augmentation des taux d'HVRS chez les nourrissons atteints d'une MPC dont l'étiologie est autre que la prématurité (MPKC : 8,3 %; MPIC : 30 %; malformations congénitales des poumons et des VR : 8,3 à 13,7 %; et certaines affections neuromusculaires qui réduisent la capacité à évacuer les sécrétions des VR : 9,9 à 15,9 %Note de bas de page 21 Note de bas de page 75 Note de bas de page 76).
- Il n'existe pas de données probantes concernant l'effet du PVZ sur le VRS dans ces affections.
- On présume que les nourrissons présentant une MPC de sévérité comparable à une MPC attribuable à la prématurité peuvent tirer des bienfaits du PVZ.
3. Fibrose kystique
Recommandation 3.1 : Le CCNI recommande que le PVZ ne soit pas proposé systématiquement aux enfants âgés de moins de 24 mois atteints de fibrose kystique. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes pour déconseiller l'utilisation systématique du PVZ dans cette population (données probantes de catégorie D).
Sommaire des données probantes et justification :
- L'HVRS est plus fréquente chez les enfants atteints de FK que chez les enfants en bonne santé. Le taux d'HVRS dans l'examen systématique était de 12,3 % (Section III.1.3). On dispose de données limitées sur les autres résultats liés aux hospitalisations.
- Les données probantes démontrant l'effet de l'administration systématique de PVZ aux nourrissons atteints de FK sur le taux d'HVRS sont contradictoires, toutes les études sauf une ne montrant aucun effetNote de bas de page 77 Note de bas de page 78 Note de bas de page 140 Note de bas de page 142 Note de bas de page 143 Note de bas de page 144.
- Il existe des données probantes suffisantes pour démontrer que l'administration systématique de PVZ aux nourrissons atteints de FK ne modifie pas de manière significative la fonction pulmonaire à long terme, la croissance ou la colonisation bactérienne des VRNote de bas de page 78 Note de bas de page 140 Note de bas de page 144 Note de bas de page 145.
- Une étude canadienne a estimé un RCED de plus de 600 000 $ par AVAQ (perspective du payeur) pour la prophylaxie systématique par le PVZ chez les nourrissons atteints de FKNote de bas de page 189.
Recommandation 3.2 : Le CCNI recommande d'envisager l'utilisation du PVZ chez les enfants âgés de moins de 24 mois atteints de fibrose kystique et présentant une maladie pulmonaire chronique sévère, définie par le recours à une oxygénation complémentaire permanente dans les 6 mois précédant le début de la saison du VRS ou pendant celle-ci. (Recommandation discrétionnaire du CCNI)
- Le CCNI conclut que les données sont insuffisantes pour en recommander l'utilisation dans cette population. (Données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- Il n'existe pas de données probantes sur le FdM lié au VRS dans le sous-groupe des nourrissons atteints de FK et présentant une MPC sévère dans la petite enfance.
- Il n'existe pas de données probantes concernant l'effet du PVZ sur le VRS dans ce sous-groupe.
- On présume que les nourrissons présentant une maladie pulmonaire liée à la FK de sévérité comparable à une MPC attribuable à la prématurité peuvent tirer des bienfaits du PVZ.
4. Cardiopathie congénitale et autres cardiopathies chroniques
Recommandation 4.1 : Le CCNI recommande que le PVZ soit proposé aux nourrissons atteints d'une cardiopathie congénitale hémodynamiquement significative (évaluée par un cardio-pédiatre) et âgés de moins d'un an au début de la saison du VRS. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe de bonnes données probantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie A).
Sommaire des données probantes et justification :
- Il existe de bonnes données probantes démontrant que les enfants âgés de moins de 2 ans atteints d'une CPCHS présentent un risque accru d'HVRS, les taux rapportés variant de 2,3 à 10,2 %Note de bas de page 65 Note de bas de page 79 Note de bas de page 80.
- Il existe de bonnes données probantes démontrant que le taux d'HVRS chez les nourrissons atteints de CPC est nettement plus élevé au cours de la première année de vie que de la deuxième année Note de bas de page 43 Note de bas de page 79 Note de bas de page 81.
- Il existe de bonnes données probantes démontrant que le PVZ réduit le risque d'HVRS chez les enfants atteints d'une CPCHS âgés de moins de 24 mois (RD, 45 %, NST : 23)Note de bas de page 80. Il existe de bonnes données probantes démontrant que le PVZ réduit le risque d'HVRS chez les enfants atteints d'une CPCHS âgés de moins de 6 mois (RD, 51 %, NST :16) et des données probantes suffisantes chez les enfants âgés de moins de 12 mois (RD, 49 % à 72 %, NST : 45, 7)Note de bas de page 44 Note de bas de page 80 Note de bas de page 147.
- Il existe de bonnes données probantes démontrant que le PVZ réduit le nombre total de jours d'HVRS chez les enfants atteints d'une CPCHSNote de bas de page 80, mais pas la DSH des enfants admis pour le VRSNote de bas de page 80 Note de bas de page 146, ainsi que de bonnes données probantes démontrant que le PVZ n'a pas d'incidence sur la proportion d'enfants hospitalisés admis en USI, la DSH en USI ou la proportion d'enfants nécessitant une VM Note de bas de page 80 Note de bas de page 146 Note de bas de page 148. Il n'existe pas de données probantes suffisantes concernant l'effet du PVZ sur la mortalité toutes causes confondues ou la mortalité due au VRS chez les enfants atteints de CPCHSNote de bas de page 80 Note de bas de page 148.
- Les études sur le rapport coût/efficacité de la prophylaxie par le PVZ ont fait état d'un RCED inférieur à 50 000 $ par AVAQ dans 80 % des estimations selon la perspective du payeur et 63 % des estimations selon la perspective sociétale. Un RCED de 18 155 $ par jour d'HE a été estimé dans une étude canadienneNote de bas de page 148.
Recommandation 4.2 : Le CCNI recommande que le PVZ puisse être envisagé pour les nourrissons âgés de moins d'un an au début de la saison du VRS qui présentent une cardiopathie chronique hémodynamiquement significative (évaluée par un cardio-pédiatre) d'une autre étiologie. (Recommandation discrétionnaire du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- Il n'existe pas de données probantes sur le FdM lié au VRS ou sur l'utilisation du PVZ dans ce groupe.
- On présume que les nourrissons présentant une dysfonction cardiaque d'une sévérité similaire à celle des enfants atteints de CPCHS peuvent tirer des bienfaits du PVZ.
Recommandation 4.3 : Le CCNI recommande que le PVZ puisse être envisagé pour les enfants âgés de 12 à 24 mois au début de la saison du VRS s'ils sont en attente d'une transplantation cardiaque ou s'ils ont reçu une transplantation cardiaque au cours des 6 derniers mois. (Recommandation discrétionnaire du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- Il n'existe pas de données probantes sur le FdM lié au VRS ni sur l'utilisation du PVZ dans ce groupe.
- On suppose que ces nourrissons auront un dysfonctionnement cardiaque sévère et recevront probablement un traitement immunosuppresseur pendant la saison du VRS et qu'ils pourraient tirer des bienfaits du PVZ.
Recommandation 4.4 : Le CCNI recommande que dans le cas des enfants présentant à la fois une cardiopathie congénitale hémodynamiquement significative et une maladie pulmonaire chronique, les recommandations relatives à la maladie pulmonaire chronique (ci-dessus) soient suivies. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour appuyer une recommandation pour cette population (données probantes de catégorie I).
Sommaire des données probantes et justification :
- Il n'existe pas de données probantes sur le FdM lié au VRS ni sur l'efficacité du PVZ pour ce groupe.
- Une MPC peut justifier une prophylaxie pour une deuxième saison de VRS, alors que la CPCHS seule ne le justifie généralement pas.
5. Syndrome de Down
Recommandation 5.1 : Le CCNI recommande que le PVZ ne soit pas proposé systématiquement aux enfants âgés de moins de 24 mois atteints du syndrome de Down. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes pour déconseiller l'utilisation systématique du PVZ dans cette population (données probantes de catégorie D).
Sommaire des données probantes et justification :
- Les HVRS sont plus fréquentes chez les enfants atteints du syndrome de Down qui ne sont pas atteints d'une CPCHS, d'une MPS ou ne sont pas nés prématurés par rapport aux enfants en bonne santé. On dispose de données limitées sur les autres résultats liés aux hospitalisationsNote de bas de page 22 Note de bas de page 83.
- Trois études sur la prophylaxie par le PVZ chez des nourrissons atteints du syndrome de Down et qui ne sont pas atteints d'une CPCHS, d'une MPS ou ne sont pas nés prématurés n'ont montré aucun effet sur le taux d'hospitalisationNote de bas de page 149 Note de bas de page 150 Note de bas de page 151.
Recommandation 5.2 : Le CCNI recommande que le PVZ soit proposé aux enfants atteints du syndrome de Down qui remplissent les conditions requises pour bénéficier d'une prophylaxie en raison d'une CPCHS, d'une maladie pulmonaire chronique, d'une prématurité ou d'une immunodéficience. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie B).
Sommaire des données probantes et justification :
- Voir les données probantes pour la CPCHS, la MPC, la prématurité ou l'immunodéficience, ci-dessus.
- Une étude a révélé une réduction des taux d'HVRS chez les nourrissons atteints du syndrome de Down qui répondaient aux critères standards pour recevoir le PVZNote de bas de page 150.
6. Enfants immunodéprimés
Recommandation 6.1 : Le CCNI recommande que le PVZ puisse être envisagé pour les enfants âgés de moins de 24 mois qui sont sévèrement immunodéprimés. (Recommandation discrétionnaire du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- Il existe peu de données liées à la population concernant le FdM associé au VRS chez les enfants immunodéprimés. Des taux accrus d'HVRS ont été signalés chez les enfants de moins de 2 ans atteints d'une immunodéficience primaire (21,3 %) et de cancer (8,4 %)Note de bas de page 21.
- Des données limitées suggèrent que les enfants âgés de 2 ans ou moins et ceux dont le nombre absolu de lymphocytes est moins de 100/mm3 sont les plus à risque de maladie sévère liée au VRSNote de bas de page 85 Note de bas de page 87 Note de bas de page 88.
- Aucune étude recensée n'a évalué l'efficacité réelle de la prophylaxie par le PVZ chez les enfants immunodéprimés.
7. Enfants résidant dans des communautés éloignées
Recommandation 7.1 : Le CCNI recommande que le PVZ soit proposé aux enfants de moins de 36 sAG et âgés de moins de 6 mois vivant dans des communautés inuites éloignées du Nord et qui auraient besoin d'un transport aérien pour être hospitalisés. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie B).
Sommaire des données probantes et justification :
- Il existe de bonnes données probantes démontrant que les prématurés vivant dans des communautés inuites éloignées du Nord présentent des taux très élevés d'HVRS et nécessitent fréquemment un transfert aérien vers des établissements de soins tertiairesNote de bas de page 23 Note de bas de page 91 Note de bas de page 92.
- Les données probantes démontrant l'efficacité du PVZ sur les taux d'HVRS chez les enfants inuits nés prématurés sont de faible qualité (NST : 4, 2)Note de bas de page 92 Note de bas de page 152.
Recommandation 7.2 : Le CCNI recommande que le PVZ ne soit pas systématiquement offert aux nourrissons nés à terme en bonne santé vivant dans les communautés inuites éloignées du Nord. (Forte recommandation du CCNI)
- Le CCNI conclut que les données probantes sont insuffisantes pour recommander une prophylaxie systématique par le PVZ dans cette population (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts. Le CCNI continuera à surveiller les données probantes au fil de leur évolution.
Sommaire des données probantes et justification :
- Les taux d'HVRS dans ces communautés sont très variables selon les communautés et les annéesNote de bas de page 23 Note de bas de page 90 Note de bas de page 91 Note de bas de page 92.
- Il existe une étude de qualité moyenne montrant l'absence d'effet de la prophylaxie par le PVZ sur les HRVS chez des nourrissons nés à terme et en bonne santé vivant dans une population inuite du Nord du Canada, où le taux d'HRVS est de 5 % chez tous les nourrissons âgés de moins d'un anNote de bas de page 90.
- Une étude qualitative sur la prophylaxie par le PVZ chez des nourrissons nés à terme et en bonne santé vivant dans une population inuite du Nord du Canada a mis en évidence d'importants problèmes d'acceptabilité et de faisabilitéNote de bas de page 207.
Recommandation 7.3 : Le CCNI recommande que la prophylaxie par le PVZ puisse être envisagée pour les nourrissons nés à terme et en bonne santé, âgés de moins de 6 mois au début de la saison du VRS ou pendant celle-ci, et vivant dans des communautés inuites éloignées du Nord où l'on a recensé des taux d'hospitalisation en raison du VRS très élevés pour les nourrissons nés à terme. (Recommandation discrétionnaire du CCNI)
- Le CCNI conclut que les données probantes sont insuffisantes pour formuler une recommandation en faveur ou à l'encontre de l'utilisation du PVZ chez les nourrissons nés à terme et en bonne santé qui vivent dans des communautés inuites éloignées du Nord où les taux d'HVRS sont très élevés (données probantes de catégorie I). Par conséquent, cette recommandation est fondée sur l'opinion d'experts, compte tenu du FdM élevé dans ces communautés et du besoin de transport aérien si une hospitalisation ou des soins ambulatoires spécialisés sont nécessaires. Le CCNI continuera à surveiller les données probantes au fil de leur évolution.
Sommaire des données probantes et justification :
- Les enfants nés à terme et vivant dans certaines communautés inuites éloignées du Nord sont associés à des taux très élevés d'HVRS et nécessitent fréquemment un transfert aérien vers des établissements de soins tertiairesNote de bas de page 23 Note de bas de page 91 Note de bas de page 92. Des taux d'HVRS atteignant de 20 à 50 % de toutes les naissances vivantes ont été signalés dans certaines communautés éloignées.
- Il n'existe aucune étude sur la prophylaxie par le PVZ chez les nourrissons à terme en bonne santé vivant dans des communautés inuites éloignées du Nord où les taux d'HVRS sont très élevés.
- Les études sur le rapport coût/efficacité de la prophylaxie par le PVZ ont estimé des RCED inférieurs à 50 000 $ par AVAQ pour les nourrissons nés à terme résidant dans certaines communautés de l'Est de l'Arctique canadien, où les taux d'HVRS sont élevés, alors que le PVZ était dominant (c.-à-d. moins coûteux et plus efficient) dans d'autres collectiviés sélectionnées. Cependant, ces estimations étaient fondées sur des données sur l'efficacité réelle du PVZ chez des nourrissons prématurés; l'efficacité réelle chez les nourrissons nés à terme reste donc à établirNote de bas de page 196.
- Une étude qualitative sur la prophylaxie par le PVZ chez des nourrissons nés à terme et en bonne santé vivant dans une population inuite du Nord du Canada a mis en évidence d'importants défis d'acceptabilité et de faisabilitéNote de bas de page 207.
Recommandation 7.4 : Le CCNI recommande que le PVZ soit envisagé pour les nourrissons de moins de 36 sAG et âgés de moins de 6 mois vivant dans d'autres communautés éloignées où l'on a observé des taux élevés d'hospitalisation en raison du VRS et qui auraient besoin d'un transport aérien pour être hospitalisés. (Recommandation discrétionnaire du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ dans cette population (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- Il existe peu de données probantes sur le FdM lié au VRS chez les nourrissons vivant dans d'autres communautés autochtones éloignées en Amérique du Nord et aucune donnée probante sur les nourrissons vivant dans d'autres communautés éloignées.
- Il n'existe pas de données probantes concernant l'effet du PVZ sur le VRS dans ces communautés. Une étude sur le motavizumab, un autre anticorps monoclonal agissant contre le VRS, a fait état d'une réduction relative de 87 % du risque d'HVRS chez des enfants amérindiens nés à terme et en bonne santé, vivant dans des réserves du Sud-Ouest des États-UnisNote de bas de page 89.
8. Prévention de la respiration sifflante récurrente
Recommandation 8.1 : Le CCNI recommande que le PVZ ne soit pas utilisé pour la prévention de la respiration sifflante récurrente ou de l'asthme en l'absence d'autres indications. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ pour prévenir ces affections (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- On ignore si le VRS survenu dans la petite enfance prédispose au développement de l'asthme, ou si les nourrissons génétiquement prédisposés à l'asthme présentent un risque accru d'infection sévère par le VRS nécessitant une hospitalisation dans la petite enfance.
- Une respiration sifflante récurrente dans l'enfance se produit chez les enfants nés à terme et en bonne santé ayant subi une HVRS dans l'enfance dans des proportions similaires à celles signalées chez les enfants à haut risque de VRS dans l'enfanceNote de bas de page 29.
- Bien que l'administration de PVZ aux nourrissons nés à moins de 36 sAG ait une incidence sur les sifflements récurrents diagnostiqués par un médecin au cours des 6 premières années de vie (NST : 3 à 15), les résultats sont contradictoires quant à l'efficacité réelle du PVZ en l'absence ou en présence d'antécédents familiaux d'atopieNote de bas de page 111 Note de bas de page 134 Note de bas de page 135 Note de bas de page 136 Note de bas de page 137 Note de bas de page 138.
- Il n'existe pas de données sur l'effet de la prise précoce de PVZ sur les sifflements ou l'asthme ultérieurs chez les enfants de plus de 7 ans ou chez les adultes.
9. Utilisation du PVZ chez les nourrissons hospitalisés
Recommandation 9.1 : Le CCNI recommande que le PVZ ne soit pas utilisé systématiquement pour maîtriser ou prévenir les infections par le VRS dans les unités néonatales de soins intensifs ou dans d'autres unités hospitalières. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes pour déconseiller l'utilisation du PVZ dans cette population (données probantes de catégorie D).
Sommaire des données probantes et justification :
- Des études ont montré que les taux d'infection par le VRS en UNSI ne différaient pas lorsque les nourrissons recevaient une prophylaxie par le PVZ en UNSI ou après la sortie de l'hôpitalNote de bas de page 119 Note de bas de page 120 Note de bas de page 121.
Recommandation 9.2 : Le CCNI recommande que la prophylaxie par le PVZ puisse être envisagée lorsque toutes les autres mesures de maîtrise d'une épidémie de VRS dans une UNSI ont échoué. (Recommandation discrétionnaire du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ dans cette situation (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- Le PVZ, en plus d'autres mesures de maîtrise des infections, a été utilisé pour maîtriser les épidémies dans les UNSI, mais le rôle précis joué par le PVZ n'est pas clairNote de bas de page 118 Note de bas de page 124 Note de bas de page 125 Note de bas de page 126 Note de bas de page 127 Note de bas de page 128.
Recommandation 9.3 : Le CCNI recommande que les nourrissons qui remplissent les conditions requises pour recevoir une prophylaxie par le PVZ et qui sortent de l'hôpital pendant la saison du VRS reçoivent leur première dose de 48 à 72 heures avant leur sortie de l'hôpital si possible, ou rapidement après. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ dans cette situation (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- L'administration de la première dose avant la sortie de l'hôpital évite la nécessité d'une visite dans un établissement de soins de santé peu après la sortie et peut améliorer l'observance.
- À l'hôpital, pour éviter le gaspillage lors de l'ouverture des flacons pour chaque nourrisson, l'administration peut être coordonnée à 3 fois par semaine.
Recommandation 9.4 : Le CCNI recommande qu'un nourrisson qui a commencé une prophylaxie par le PVZ plus tôt dans la saison et qui est réhospitalisé à la date à laquelle une dose doit être administrée reçoive cette dose comme prévu, à condition que l'établissement d'admission soit en mesure de fournir du PVZ à la date prévue. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il n'existe pas de données probantes suffisantes pour recommander l'utilisation du PVZ dans cette situation (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- Le fait de respecter le calendrier posologique du PVZ de l'enfant évite de devoir reporter les rendez-vous et peut améliorer l'observance.
10. Posologie du palivizumab
Recommandation 10.1 : Le CCNI recommande que le PVZ soit administré à une dose de 15 mg/kg par injection intramusculaire. La première dose doit être administrée au début de la saison en cours du VRS, telle que déterminée par les données de laboratoire locales ou les données sur les hospitalisations pédiatriques. Si ces données ne sont pas disponibles en temps voulu, la date de début peut être prédéterminée sur la base des dates des saisons locales précédentes du VRS. L'intervalle entre la première et la deuxième dose doit être de 21 à 28 jours et, entre les doses suivantes, de 28 à 35 jours. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes à l'appui de ce calendrier posologique du PVZ (données probantes de catégorie B).
Sommaire des données probantes et justification :
- Une dose de 15 mg/kg tous les 30 jours a permis d'obtenir des taux sériques cibles de PVZ que l'on présume être protecteurs sur la base d'études animalesNote de bas de page 162.
- Des intervalles plus longs entre les doses ont été utilisés sur la base de la demi-vie de 19 à 27 jours du PVZ et de l'accumulation observée du PVZ après la deuxième doseNote de bas de page 48 Note de bas de page 164 Note de bas de page 166 Note de bas de page 167.
- Les données probantes sont basées sur l'examen d'études clés, sans évaluation formelle de la qualité.
Recommandation 10.2 : Le CCNI recommande d'administrer un maximum de 4 doses, avec les exceptions suivantes : (Forte recommandation du CCNI)
- Si un enfant subit un pontage cardiaque et continue à avoir besoin de PVZ après l'opération, une dose doit être administrée dès que possible après le pontage.
- Si un enfant est soumis à une oxygénation par membrane extracorporelle et qu'il continue à avoir besoin de PVZ, une dose doit être administrée à la fin de la procédure.
- Une dose supplémentaire peut également être envisagée dans les régions nordiques éloignées où les éclosions de VRS peuvent durer plus longtemps qu'ailleurs.
- Le CCNI conclut que les données probantes sont insuffisantes pour déterminer le nombre optimal de doses de PVZ (données probantes de catégorie I). Cette recommandation est donc fondée sur l'avis d'experts.
Sommaire des données probantes et justification :
- Des études indiquent que 4 doses sont suffisantes pour assurer une protection pendant toute la saison habituelle du VRSNote de bas de page 166 Note de bas de page 167 Note de bas de page 168 Note de bas de page 169.
- Une étude portant sur des enfants subissant un pontage cardiaque a rapporté une diminution de 58 % du niveau de PVZ après le pontageNote de bas de page 80. On suppose que l'oxygénation par membrane extracorporelle puisse avoir un effet semblableNote de bas de page 6.
- On peut économiser les doses en faisant ce qui suit :
- Ne commencer le PVZ que lorsque la saison locale du VRS a débutéNote de bas de page 173 Note de bas de page 174;
- Favoriser un intervalle plus long entre les doses après la deuxième dose;
- Organiser des cliniques ou des rendez-vous pour l'administration de PVZ qui facilitent le partage des flacons.
- Les données probantes sont basées sur l'examen d'études clés, sans évaluation formelle de la qualité.
Recommandation 10.3 : Le CCNI recommande d'interrompre le traitement par PVZ pour la saison si un enfant est hospitalisé en raison d'une infection par le VRS. (Forte recommandation du CCNI)
- Le CCNI conclut qu'il existe des données probantes suffisantes indiquant que les infections sévères récurrentes par le VRS au cours d'une même saison sont rares (données probantes de catégorie B).
Sommaire des données probantes et justification :
- Les taux rapportés de seconds épisodes d'HVRS au cours de la même saison varient de 0 à 1,0 % de la cohorte étudiéeNote de bas de page 80 Note de bas de page 108 Note de bas de page 109 Note de bas de page 110 Note de bas de page 111, à l'exception d'un taux de 3,3 % dans le cadre d'une très petite étude en 1988Note de bas de page 107.
- Les données probantes sont basées sur l'examen d'études clés, sans évaluation formelle de la qualité.
Recommandations relatives au processus décisionnel à l'échelle individuelle
(c.-à-d. les personnes souhaitant prévenir la maladie du VRS ou un clinicien souhaitant conseiller des patients individuels souffrant d'affections non incluses actuellement dans les programmes de santé publique sur la prévention du VRS)
Le PVZ n'est pas facilement disponible à l'achat privé au Canada, il est coûteux et son coût peut ou non être remboursé par les régimes d'assurance privés. Aucune recommandation particulière n'est formulée pour le processus décisionnel à l'échelle individuelle.
Les recommandations ci-dessus relatives au processus décisionnel à l'échelle des programmes de santé publique peuvent s'appliquer.
Tableau des options de prise en charge
(Recommandations relatives au processus décisionnel à l'échelle des programmes de santé publique)
Il existe différentes options pour l'utilisation du PVZ, et la décision quant aux options à privilégier dépendra des facteurs à considérer énumérés ci-dessous :
| Choix | Facteurs à considérer | Points de décision |
|---|---|---|
Cohortes à risque : |
Le PVZ, un anticorps monoclonal qui assure une protection passive temporaire contre l'infection sévère par le VRS, est le seul traitement prophylactique actuellement disponible. Le PVZ n'a été étudié que chez les enfants âgés de moins de 24 mois présentant des pathologies sous-jacentes les exposant à un risque accru de maladie sévère liée au VRS. Il n'est pas recommandé pour les nourrissons nés à terme et en bonne santé, ni pour les personnes âgées de plus de 24 mois. |
Épidémiologie Le risque de maladie sévère due au VRS est influencé par l'AG à la naissance, les problèmes de santé sous-jacents et l'âge. Les nourrissons présentent le risque le plus élevé de maladie sévère due au VRS au cours de leur première saison de VRS et surtout avant l'âge de 3 mois.
Le VRS provoque des épidémies annuelles de l'hiver jusqu'au début du printemps.
Données sur l'innocuité Le PVZ est un produit sûr, avec peu d'ÉI autres que des réactions locales transitoires. Deux cas d'anaphylaxie ont été signalés après l'administration de plus de 2 millions de doses de PVZ. Économie Le PVZ est coûteux, et le principal coût des programmes de prophylaxie est le produit lui-même. Les études ont rapporté un large éventail de RCED en fonction de la population, du milieu, des taux d'hospitalisation de base, ainsi que de la structure du modèle et de la conception de l'étude. Des RCED estimés à moins de 50 000 $ par AVAQ ont été signalés dans certains scénarios, mais dominants (c.-à-d. moins coûteux et plus efficients) dans très peu d'entre eux. Contrairement aux vaccins, la dose de PVZ varie en fonction du poids. Une fois ouvert, un flacon doit être utilisé le jour même ou jeté.
En l'absence de données probantes indiquant une réduction des taux de mortalité dus au VRS ou des bienfaits à long terme découlant du PVZ, le coût élevé de la prophylaxie par PVZ doit être équilibré par rapport aux coûts d'autres interventions de soins de santé si ces dernières peuvent être compromises par la fourniture de programmes de PVZ. |
1. Les prématurés en bonne santé : |
Les prématurés en bonne santé présentent un risque accru d'infection sévère par le VRS par rapport aux enfants nés à terme. Le risque d'hospitalisation est le plus élevé chez les enfants de moins de 30 sAG (7,7 à 13 %), mais il augmente également chez les enfants entre 29 et 32 sAG et 33 et 35 sAG (4,6 et 2 à 3 fois plus que chez les enfants nés à terme). Le PVZ a été efficace pour prévenir l'hospitalisation dans des études portant sur des nourrissons de 32 sAG ou moins (diminution du taux de 38 à 74 %, NST : 9 à 54 dans différentes études). Pour les nourrissons entre 32 et 35 sAG, des diminutions de taux de 72 à 83 % avec un NST de 12 à 14 ont été rapportées, mais certaines études n'ont montré aucun effet. Les études portant sur les nourrissons de moins de 29 sAG n'ont pas montré d'effet, mais les nombres étudiés étaient très faibles. Au Canada, de 7,7 à 8 % des naissances ont lieu à moins de 37 sAG et environ 5 % entre 32 et 35 sAG. Les études coût/efficacité de la prophylaxie par PVZ chez les prématurés par ailleurs en bonne santé ont fait état de RCED allant de 6 216 $ par AVAQ à 938 623 $ par AVAQ, avec une tendance à des RCED plus importants par suite d'une augmentation de l'AG. Aucune estimation dominante n'a été déterminée (c.-à-d. moins coûteuse et plus efficiente) et 82 % des estimations ont montré des RCED de moins de 50 000 $ par AVAQ. |
|
2. Enfants atteints d'une MPC associée à la prématurité ou à une autre étiologie : L'utilisation du PVZ peut être personnalisée en fonction de la sévérité de la MPC (p. ex., la dépendance à l'oxygène). |
Les enfants atteints de MPC associée à la prématurité présentent un risque de 12 à 21 % de subir une HVRS. Le PVZ est efficace pour prévenir l'hospitalisation (réduction du taux de 39 % et NST : 21 au cours des 2 premières années de vie; et de 86 %, NST : 13 au cours de la première année). Il existe des données sur les taux accrus d'HVRS en ce qui concerne les MPC découlant d'autres étiologies, mais le PVZ n'a pas été étudié. Certaines données indiquent que les enfants atteints de FK présentent un risque accru d'HVRS, mais les études menées à ce jour indiquent que le PVZ n'offre pas de protection. Le rapport coût/efficacité de la prophylaxie par PVZ chez les enfants atteints de MPC associée à la prématurité fait état de RCED allant de 4 786 $ par AVAQ à 46 821 $ par AVAQ. Aucune estimation dominante n'a été déterminée (c.-à-d. moins coûteuse et plus efficiente). |
|
3. Enfants atteints d'une CPCHS ou d'une cardiopathie hémodynamiquement significative d'une autre étiologie : L'utilisation du PVZ peut être personnalisée en fonction de la sévérité de la dysfonction cardiaque. |
Les enfants atteints d'une CPCHS présentent un risque de 9,7 % de subir une HVRS, la quasi-totalité des infections survenant au cours de la première année de vie. Le PVZ est efficace pour prévenir l'hospitalisation (réduction du taux de 45 à 72 %, NST : 7 à 45) dans la plupart des études, bien que 2 petites études n'aient montré aucun effet. Il n'y a pas de données sur la maladie liée au VRS et l'utilisation du PVZ chez les enfants atteints d'une CPCHS d'une autre étiologie. Le rapport coût/efficacité de la prophylaxie par PVZ chez les enfants atteints de CPCHS a fait état de RCED allant de 11 668 $ par AVAQ à 164 946 $ par AVAQ. Aucune estimation dominante n'a été déterminée (c.-à-d. moins coûteuse et plus efficiente) et 80 % des estimations ont montré des coûts de moins de 50 000 $ par AVAQ. |
|
4. Syndrome de Down, immunodéprimés et autres maladies chroniques |
Les recommandations sont basées sur l'efficacité du PVZ et le risque de maladie sévère liée au VRS dans les différents groupes à risque. Pour certaines maladies très rares, le risque de maladie sévère liée au VRS peut être élevé, mais des données épidémiologiques ne sont pas disponibles. De même, le nombre d'enfants atteints de certaines maladies rares n'est pas suffisant pour que l'efficacité du PVZ soit étudiée. Dans ces circonstances, une extrapolation peut être faite à partir de données sur des conditions de similarité physiopathologique avec un risque accru attesté du VRS et une efficacité du PVZ. Aucune étude sur le rapport coût/efficacité de la prophylaxie par PVZ n'a été déterminée pour ces populations. |
|
5. Utilisation du PVZ pour les prématurés de moins de 37 sAG ou pour les nourrissons nés à terme vivant dans des communautés inuites éloignées. L'utilisation du PVZ chez les nourrissons nés à terme peut être basée sur les taux locaux d'hospitalisation des nourrissons nés à terme atteints du VRS et sur les coûts de transport vers des hôpitaux éloignés. |
Des études indiquent que les enfants vivant dans certaines communautés inuites éloignées, y compris les nourrissons nés à terme, présentent un risque élevé d'HVRS. Des données limitées indiquent que le PVZ réduit les HVRS chez les nourrissons de moins de 37 sAG vivant dans des communautés inuites éloignées (réduction du taux de 96 %, 66 %, NST : 2, 4). Une étude proposant le PVZ à des enfants inuits nés à terme dans une région où le taux de base d'HVRS n'était pas très élevé n'a montré aucun effet. Une modélisation canadienne a indiqué que la prophylaxie par PVZ pour les nourrissons nés à terme pourrait être dominante (c.-à-d. moins coûteuse et plus efficiente) dans les communautés inuites éloignées présentant des taux de base d'HVRS très élevés. Les RCED étaient inférieurs à 50 000 $ par AVAQ dans 75 % des estimations, mais l'efficacité était basée sur des études portant sur des prématurés. |
|
6. Utilisation du PVZ pour les nourrissons nés à terme et vivant dans d'autres communautés autochtones éloignées ou d'autres communautés éloignées. L'utilisation du PVZ chez les nourrissons nés à terme peut être basée sur les taux locaux d'HVRS des nourrissons nés à terme et sur les coûts de transport vers des hôpitaux éloignés. |
Des données limitées indiquent que les taux d'HVRS pourraient être plus élevés dans d'autres communautés autochtones isolées. Il n'y a pas de données en provenance du Canada. Il n'existe pas de données sur l'utilisation du PVZ dans ces communautés. |
Priorités de recherche
Il est recommandé de poursuivre la recherche afin d'éclaircir les points suivants :
- Corrélation sérologique de la protection :
- La détermination du niveau minimal d'anticorps requis pour protéger contre une infection sévère par le VRS chez les humains et la mise au point d'un test commercial de détection des anticorps anti-VRS permettraient une utilisation plus judicieuse des produits coûteux à base d'anticorps monoclonaux, car de nombreux nourrissons développeront des anticorps naturels au cours de leur première ou deuxième année de vie.
- Efficacité potentielle et réelle des anticorps monoclonaux anti-VRS chez les nourrissons vivant dans des communautés éloignées, en particulier chez les nourrissons inuits du Grand Nord :
- Il existe de (bonnes) données probantes indiquant un FdM élevé lié au VRS chez les nourrissons inuits du Grand Nord, mais les données sur l'efficacité réelle du PVZ pour prévenir l'hospitalisation et la nécessité d'un transfert aérien sont limitées.
- FdM lié au VRS chez les nourrissons atteints du syndrome de Down et efficacité potentielle et réelle de l'anticorps monoclonal anti-VRS pour prévenir l'hospitalisation chez cette population :
- La littérature indique que les nourrissons atteints du syndrome de Down sans critères cliniques reconnus pour une prophylaxie par PVZ peuvent présenter des taux élevés d'HVRS. Les raisons de cette susceptibilité ne sont pas claires, mais peuvent être liées à l'immunodéficience de cette population. Il existe très peu de données sur l'utilisation du PVZ chez les nourrissons atteints du syndrome de Down.
- Efficacité potentielle et réelle de l'anticorps monoclonal anti-VRS chez les prématurés par ailleurs en bonne santé, nés à moins de 29 sAG :
- Les études sur l'efficacité potentielle et réelle de la prophylaxie par PVZ chez les grands prématurés de moins de 29 sAG n'ont pas montré de protection, mais le nombre de nourrissons étudiés était très faible. Ce genre d'études n'a pas pu être réalisé dans les pays où le PVZ est désormais recommandé pour ces nourrissons. À noter que le Royaume-Uni et la Suisse ne recommandent pas le PVZ pour les prématurés en bonne santé.
Problèmes liés à la surveillance
Épidémiologie :
- La mise en place d'un système de surveillance du VRS avec des données pour chaque PT, analogue à la Surveillance de l'influenza, pourrait fournir des données opportunes permettant de déterminer quand les programmes de prophylaxie avec anticorps monoclonal anti-VRS devraient commencer et se terminer le plus efficacement possible.
- Études du fardeau de la maladie sévère liée au VRS dans les populations immunodéprimées, stratifiées par groupe d'âge (en se concentrant particulièrement sur les enfants âgés de 2 ans ou moins) et par sévérité de l'immunodépression (en se concentrant particulièrement sur les enfants présentant des déficits en anticorps, car ils pourraient ne pas bénéficier des vaccins contre le VRS à l'avenir et donc continuer à justifier une prophylaxie passive monoclonale contre le VRS).
Classement des études individuelles, poids des recommandations, catégorie des données probantes
| Niveau | Description |
|---|---|
| I | Données probantes provenant d'un ou de plusieurs essais contrôlés randomisés. |
| II-1 | Données probantes provenant d'un ou de plusieurs essais contrôlés sans randomisation. |
| II-2 | Données probantes obtenues au moyen d'études analytiques de cohortes ou cas-témoins, réalisées de préférence dans plus d'un centre ou par plus d'un groupe de recherche utilisant des indicateurs cliniques de résultats de l'efficacité potentielle du vaccin. |
| II-3 | Données probantes obtenues à partir de plusieurs séries chronologiques avec ou sans intervention. Les résultats spectaculaires obtenus dans un contexte non contrôlé (comme les résultats de l'introduction de la pénicilline dans les années 1940) pourraient aussi être considérés comme faisant partie de ce type de données probantes. |
| III | Opinions d'autorités respectées fondées sur des expériences cliniques, études descriptives et rapports de cas ou rapports de comités d'experts. |
| Cote de qualité | Description |
|---|---|
Bonne |
Une étude (y compris les méta-analyses ou les examens systématiques) qui répond bien à tous les critères relatifs à la méthodologieTableau 12 Note de bas de page *. |
Passable |
Une étude (y compris les méta-analyses ou les examens systématiques) qui ne répond pas (ou ne répond pas clairement) à au moins l'un des critères relatifs à la méthodologieTableau 12 Note de bas de page *, mais ne comportant aucune « lacune fatale » connue. |
Faible |
Étude (notamment les méta-analyses ou les recensions systématiques) ayant au moins une « lacune majeure » propre à la méthodologieTableau 12 Note de bas de page * ou une accumulation de lacunes moins importantes ne permettant pas de formuler des recommandations à partir des résultats de l'étude. |
|
|
| Force de la recommandation du CCNI | Catégorie des données probantes |
|---|---|
| D'après les facteurs ne se limitant pas à la force des données probantes (p. ex., besoin en matière de santé publique) | D'après l'évaluation de l'ensemble des données probantes (telles qu'elles sont résumées dans le tableau sommaire des données probantes, Tableau 1, où le niveau et la qualité des études individuelles sont évalués) |
| Forte « devrait/ne devrait pas être réalisée »
|
A – Données probantes suffisantes pour recommander l'immunisation |
| B – Données probantes acceptables pour recommander l'immunisation | |
| C – Données probantes contradictoires; cependant, d'autres facteurs peuvent influer sur la prise de décision | |
| D – Données probantes acceptables pour déconseiller l'immunisation | |
| E – Données probantes suffisantes pour déconseiller l'immunisation | |
| I – Données probantes insuffisantes (en quantité ou en qualité); cependant, d'autres facteurs peuvent influer sur la prise de décision | |
| Facultative « peut être pris en compte »
|
A – Données probantes suffisantes pour recommander l'immunisation |
| B – Données probantes acceptables pour recommander l'immunisation | |
| C – Données probantes contradictoires; cependant, d'autres facteurs peuvent influer sur la prise de décision | |
| D – Données probantes acceptables pour déconseiller l'immunisation | |
| E – Données probantes suffisantes pour déconseiller l'immunisation | |
| I – Données probantes insuffisantes (en quantité ou en qualité); cependant, d'autres facteurs peuvent influer sur la prise de décision |
Liste des abréviations
- AAP
- American Academy of Pediatrics
- AG
- Âge gestationnel
- ARN
- Acide ribonucléique
- ASPC
- Agence de la santé publique du Canada
- AVAQ
- Année de vie ajustée par la qualité
- CAD
- dollar canadien
- CCNI
- Comité consultatif national de l'immunisation
- CDP
- Certitude des données probantes
- CPC
- Cardiopathie congénitale
- CPCHS
- Cardiopathie congénitale hémodynamiquement significative
- CVF
- Capacité vitale forcée
- DBP
- Dysplasie broncho-pulmonaire
- DEM50
- Débit expiratoire maximal après 50 % de la CVF expirée
- DSH
- Durée de séjour à l'hôpital
- ECR
- Essai contrôlé randomisé
- EEFA
- Éthique, équité, faisabilité, acceptabilité
- ÉI
- Évènement indésirable
- ÉIG
- Évènement indésirable grave
- EIQ
- Écart interquartile
- ESFdM
- Examen systématique du fardeau de la maladie
- FdM
- Fardeau de la maladie
- FK
- Fibrose kystique
- GCI
- Guide canadien d'immunisation
- HE
- Hospitalisation évitée
- HVRS
- Hospitalisation due au VRS
- IC
- Intervalle de confiance
- IgE
- Immunoglobuline E
- IM
- Intramusculaire
- MPC
- Maladie pulmonaire chronique
- MPIC
- Maladie pulmonaire interstitielle chronique
- MPKC
- Maladie pulmonaire kystique congénitale
- NI
- Non indiqué
- NST
- Nombre de sujets à traiter
- PT
- Provinces et territoires
- PVZ
- Palivizumab
- RC
- Rapport de cotes
- RCa
- Rapport de cotes ajusté
- RCED
- Rapport coût/efficacité différentiel
- RCI
- Rendement du capital investi
- RD
- Diminution relative
- RdB
- Risque de biais
- RR
- Risque relatif
- RTI
- Ratio du taux d'incidence
- sAG
- Semaines d'âge gestationnel
- SCP
- Société canadienne de pédiatrie
- UNSI
- Unité néonatale de soins intensifs
- USI
- Unité de soins intensifs
- VEM1
- Volume expiratoire maximal par minute
- VM
- Ventilation mécanique
- VR
- Voies respiratoires
- VRS
- virus respiratoire syncytial
- VRS-A
- Virus respiratoire syncytial-A
- VRS-B
- Virus respiratoire syncytial-B
Remerciements
La présente déclaration a été préparée par : D. Moore, A. Sinilaite, R. Stirling, M. W. Yeung au nom du groupe de travail sur le VRS du CCNI et approuvée par le CCNI.
Le CCNI tient à souligner la contribution de : P. Doyon-Plourde, S. Duschesne-Belanger, E. Poirier, A. House, S. J. Ismail, A. Sumner, C. Tremblay, M. C. Tunis, V. Mouajou Feujio, L. Zhao, A. Killikelly et N. St-Pierre ainsi que l'équipe de recherche de l'Alberta Research Centre for Health Evidence (ARCHE), notamment J. Pillay, A. Wingert et L. Hartling.
Groupe de travail sur le VRS du CCNI
Membres : D. Moore (président), M. Salvadori, V. Dubey, J. Papenburg et J. Robinson.
Anciens membres : S. Gantt et W. Vaudry.
Participants de l'ASPC : S. Duschesne-Belanger, A. Killikelly, R. Pless, A. Sinilaite, R. Stirling, A. Sumner, M. C. Tunis, M.Y. Yeung et L. Zhao.
CCNI
Membres du CCNI : S. Deeks (présidente), R. Harrison (vice-présidente), N. Brousseau, P. De Wals, E. Dubé, V. Dubey, K. Hildebrand, K. Klein, J. Papenburg, C. Rotstein, B. Sander, S. Smith et S. Wilson.
Ancien membre : C. Quach (présidente).
Représentants de liaison : L. M. Bucci (Association canadienne de santé publique), E. Castillo (Société des obstétriciens et gynécologues du Canada), A. Cohn (Centers for Disease Control and Prevention, États-Unis), L. Dupuis (Association des infirmières et infirmiers du Canada), J. Emili (Collège des médecins de famille du Canada), D. Fell (Association canadienne pour la recherche et l'évaluation en matière de vaccination), M. Lavoie (Conseil des médecins hygiénistes en chef), D. Moore (SCP), M. Naus (Comité canadien sur l'immunisation), A. Pham-Huy (Association pour la microbiologie médicale et l'infectiologie Canada), P. Emberley (Association des pharmaciens du Canada), L. Bill (Association des infirmières et infirmiers autochtones du Canada) et Dre S. Funnell (Association des médecins indigènes du Canada).
Représentants d'office : K. Robinson (Direction des produits de santé commercialisés, Santé Canada [SC], E. Henry (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI], ASPC), M. Lacroix (Groupe consultatif en matière d'éthique en santé publique, ASPC), S. Ogunnaike-Cooke (CIMRI, ASPC), C. Lourenco (Direction des médicaments biologiques et radiopharmaceutiques, SC), G. Poliquin (Laboratoire national de microbiologie, ASPC), V. Beswick-Escanlar (Défense nationale et Forces armées canadiennes) et T. Wong (Direction générale de la santé des Premières Nations et des Inuits, Services autochtones Canada).
Annexe A : Critères actuels de réception du palivizumab dans les provinces et territoires du Canada et à l'échelle internationale
Les critères d'admissibilité à la prophylaxie par PVZ ont été obtenus de tous les PT canadiens et de 10 pays de l'hémisphère Nord. Les données sont résumées dans le tableau ci-dessous :
Le Canada :
Nourrissons prématurés sans maladie pulmonaire chronique ni cardiopathie congénitale hémodynamiquement significative
Le CCNI a recommandé en 2003 une prophylaxie par PVZ pour les nourrissons de 32 sAG ou moins et âgés de moins de 6 mois au début de la saison du VRS. Le GCI actuel indique que certains nourrissons de 33 à 35 sAG peuvent également en bénéficier, en fonction de considérations locales. La SCP a déclaré en 2015 qu'il est raisonnable, mais pas essentiel, de proposer une prophylaxie aux prématurés nés à moins de 30 sAG et âgés de moins de 6 mois.
Six PT ont suivi les recommandations actuelles du GCI pour les nourrissons de 32 sAG ou moins et ont sélectionné les nourrissons de de 33 à 35 sAG (Alb., Man., N.-B., T.N.-O., Ont., Sask.). Les 6 PT ont utilisé des scores de risque définis pour déterminer l'admissibilité à ce groupe mais les critères de risque et les systèmes de notation utilisés variaient d'un PT à l'autre. Deux PT ont proposé une prophylaxie pour les nourrissons de 29 sAG ou moins et pour ceux de 29 à 35 sAG présentant des facteurs de risque (C.-B., Yn). Un territoire a proposé le PVZ pour tous les nourrissons de moins de 36 sAG (Nt) et une seule province a suivi la recommandation du CCNI (Qc). Trois PT ont suivi la recommandation de la SCP concernant la prophylaxie pour les nourrissons de moins de 30 sAG (T.-N.-L., N.-É., Î.-P.-É.).
Maladie pulmonaire chronique due à la prématurité et autres maladies pulmonaires chroniques
En 2003, le CCNI recommandait le PVZ pour les enfants âgés de moins de 24 mois au début de la saison du VRS et présentant une MPC ayant nécessité un traitement au cours des 6 mois précédents ou d'autres troubles pulmonaires nécessitant une oxygénothérapie, alors que l'actuel GCI ne mentionne que les enfants présentant une MPC. La SCP recommande la prophylaxie pour les enfants atteints de MPC âgés de moins de 12 mois au début de la saison du VRS qui nécessitent un traitement continu mais pour leur deuxième saison du VRS seulement s'ils ont encore besoin d'oxygène supplémentaire ou s'ils ont été sevrés d'oxygène au cours des 3 mois précédents. Les enfants atteints de FK, d'obstruction des voies aériennes supérieures ou de troubles pulmonaires chroniques autres que la MPC ne devraient pas se voir proposer systématiquement une prophylaxie, mais celle-ci peut être envisagée pour ceux âgés de moins de 24 mois qui sont sous oxygène à domicile ou qui ont été hospitalisés de manière prolongée pour une maladie pulmonaire sévère.
Huit PT ont suivi la recommandation du CCNI concernant la prophylaxie pour les enfants atteints de MPC (Alb., Man., N.-B., N.-É., Ont., Î.-P.-É., Qc, Sask.), tandis que dans 3 PT, les nourrissons n'étaient admissibles que jusqu'à l'âge de 12 mois (C.-B., T.-N.-L., Yn). Dans un territoire, tous les nourrissons atteints de MPC et âgés de moins de 12 mois et ceux âgés de 12 à 24 mois ayant nécessité un traitement au cours des 3 mois précédents étaient admissibles (Nt), tandis que dans un autre territoire, certains nourrissons atteints de MPC et de moins de 36 sAG et âgés de moins de 24 mois n'étaient admissibles qu'au cas par cas (T.N.-O.).
Neuf PT ont fourni une prophylaxie pour d'autres maladies pulmonaires chroniques chez des nourrissons âgés de moins de 24 mois (8) ou de moins de 12 mois (1), certains PT nécessitant une évaluation individuelle. Les maladies comprenaient la FK (7), les anomalies congénitales des poumons ou des voies respiratoires (VR) (4) et les affections neuromusculaires affectant la capacité à évacuer les sécrétions des VR (5). Les autres pathologies incluses étaient la nécessité d'une assistance respiratoire à domicile (oxygénation, VM, trachéotomie, VPPC) et d'autres handicaps pulmonaires sévères.
Cardiopathie congénitale
Le CCNI en 2003 et le GCI actuel recommandent la prophylaxie pour les enfants atteints de CPCHS et âgés de moins de 24 mois. La SCP recommande la prophylaxie pour les enfants âgés de moins de 12 mois seulement.
Six PT proposaient une prophylaxie pour les enfants atteints de CPCHS et âgés de moins de 24 mois (Alb., N.-B., T.N.-O., N.-É., Î.-P.-É., Sask.), 4 PT pour les enfants âgés de moins de 12 mois et pour les 12 à 24 mois après avoir réalisé une évaluation individuelle (C.-B., Man., Ont., Yn). Trois PT ont limité la prophylaxie aux 12 premiers mois (T.-N.-L., Nt, Qc).
Autres pathologies cliniques
La SCP indique que la prophylaxie peut être envisagée pour les enfants de moins de 24 mois atteints du syndrome de Down ou d'une immunodéficience s'ils sont sous oxygène à domicile, s'ils ont été hospitalisés de façon prolongée pour une maladie pulmonaire sévère ou s'ils sont sévèrement immunodéprimés.
Dix PT ont énuméré d'autres critères cliniques pour la prophylaxie, certains nécessitant une évaluation individuelle. Sept d'entre eux proposaient une prophylaxie pour le syndrome de Down (un nécessitant une comorbidité supplémentaire); 8 pour l'immunodéficience (degré de sévérité variable) et un pour les affections neuromusculaires sans mention de la clairance des sécrétions respiratoires.
Dans 4 PT, la prophylaxie a été proposée à la fratrie d'une naissance multiple si l'un des enfants remplissait les conditions requises pour recevoir une prophylaxie (Alb., C.-B., Ont., Yn), dans tous les PT à l'exception d'une province (Ontario) uniquement si les nourrissons étaient prématurés. Dans une province, tous les nourrissons issus d'une naissance multiple (autres que des jumeaux), de 35 sAG ou moins 6/7 et âgés de moins de 3 mois étaient admissibles à une prophylaxie (Alb.). Dans un autre cas, le jumeau d'un enfant approuvé pouvait être admissible à la suite d'une évaluation (T.N.-O.).
Dans tous les PT, à l'exception de 2 (N.-B, Yn), les protocoles indiquaient que d'autres problèmes médicaux pouvaient être pris en compte sur demande après une évaluation individuelle.
Régions éloignées
Cinq provinces avaient des critères précis pour les enfants vivant dans des régions nordiques éloignées (Man., T.-N.-L., Ont., Qc, Sask.) tandis que 4 autres PT (Alb., C.-B., T.N.-O., Yn) ont tenu compte des régions éloignées dans les scores de risque. Un territoire a proposé le PVZ pour tous les nourrissons de moins de 36 sAG (Nt). La plupart ont inclus des nourrissons de 36 sAG ou moins et âgés de moins de 6 mois. L'un d'entre eux comprenait des enfants nés à terme et âgés de moins de 3 mois (Qc).
Définition de la saison du VRS et posologie du palivizumab
Dans 6 PT (Alb., C.-B., Ont., Sask., Yn, T.N.-O.), la période de prophylaxie liée au VRS était basée sur l'épidémiologie locale du VRS et dans 5 PT (T.-N.-L., N.-É., Î.-P.-É., Qc, Nt), des dates fixes ont été utilisées. Aucune information n'a été trouvée pour 2 PT.
L'intervalle recommandé entre les doses de PVZ était de 28 jours dans 6 PT (N.-É., Nt, T.N.-O., Î.-P.-É., Qc, Sask.) et d'un mois dans une province (N.-B.). En Alberta, les intervalles recommandés étaient de 28 jours dans le Nord de l'Alberta mais de 21 jours pour la deuxième dose et de 28 jours pour les doses suivantes dans le Sud de l'Alberta. En Colombie-Britannique et en Ontario, les intervalles recommandés étaient de 21 à 28 jours pour la deuxième dose et de 28 à 35 jours pour les doses suivantes, tandis qu'à Terre-Neuve-et-Labrador, l'intervalle recommandé pour la deuxième dose était de 28 jours et de 35 jours pour les doses suivantes. Au Yukon, l'intervalle pour la deuxième dose était de 18 à 24 jours et les doses suivantes de 28 à 30 jours. L'intervalle recommandé au Manitoba était de 28 jours jusqu'à la quatrième dose, de 35 jours entre les quatrième et cinquième doses et de 42 jours entre les cinquième et sixième doses.
Le nombre maximal de doses était de 5 dans 7 PT (Alb., N.-B., N.-É., Î.-P.-É., Ont., Qc, Sask.), de 6 dans une province (Man.), de 6 avec extension en fonction de l'épidémiologie locale dans un territoire (Nunavut) et de 4 dans une province (T.-N.-L.). En Colombie-Britannique, le nombre maximal de doses était de 4 pour les nourrissons de moins de 29 sAG et ceux atteints de MPC ou de CPCHS et de 3 pour les prématurés de 29 sAG ou moins et sans MPC ni CPCHS. Deux territoires n'ont pas déclaré de nombre maximal (Yn, T.N.-O.).
International :
Nourrissons prématurés sans maladie pulmonaire chronique ni cardiopathie congénitale hémodynamiquement significative
Trois pays ont utilisé l'AG seul avec des limites de sAG variables : moins de 26 (Suède), moins de 29 (É.-U.) et moins de 32 (Pays-Bas). Quatre pays (Autriche, Allemagne, Italie, Espagne) ont recommandé une prophylaxie pour tous les nourrissons en dessous d'un certain nombre de sAG (de moins de 28 à moins de 31) et pour les nourrissons moins prématurés (jusqu'à 34 à 36) en utilisant des scores de risque. Trois pays (France, Suisse, R.-U.) ne prévoyaient pas de prophylaxie pour la prématurité à elle seule.
Maladie pulmonaire chronique due à la prématurité et autres maladies pulmonaires chroniques
Les 10 pays ont recommandé une prophylaxie pour les nourrissons atteints de MPC due à la prématurité. Huit pays, tous sauf la Suisse et le R.-U., ont inclus les enfants âgés de moins de 24 mois ayant nécessité un traitement au cours des 6 mois précédents, 5 d'entre eux incluant tous les nourrissons de moins de 12 mois et un autre incluant tous les nourrissons de moins de 6 mois, quel que soit le traitement. La Suisse a recommandé la prophylaxie uniquement pour les enfants de moins d'un an. Le R.-U. a recommandé la prophylaxie en utilisant une grille d'AG et d'âge chronologique qui englobait les nourrissons de 34 sAG ou moins et âgés de 9 à 1,5 mois.
Huit pays, tous à l'exception de la France et de l'Espagne, ont également recommandé une prophylaxie pour les enfants âgés de moins d'un an ou de moins de 2 ans présentant d'autres pathologies pulmonaires, soit de manière systématique, soit sur évaluation individuelle. Il s'agissait notamment de la FK dans 5 pays, d'affections neuromusculaires interférant avec l'évacuation des sécrétions respiratoires dans 2 pays, d'anomalies congénitales des VR ou des poumons dans 4 pays, et d'autres conditions telles que les affections pulmonaires chroniques nécessitant une oxygénothérapie, une VM ou une trachéotomie à long terme.
Cardiopathie congénitale
Les 10 pays ont recommandé une prophylaxie pour les nourrissons atteints d'une CPC significative, jusqu'à l'âge de 2 ans en France, en Espagne et aux Pays-Bas, pendant la première année de vie seulement en Italie, en Suède et en Suisse et pendant la première année avec une possibilité d'extension à la deuxième année aux É.-U. L'Allemagne a recommandé une prophylaxie jusqu'à l'âge de 6 mois, avec une considération individuelle pour les enfants âgés de 6 à 12 mois. Le R.-U. a inclus les nourrissons de 26 sAG ou moins à 32 sAG ou moins et âgés de 1,5 à 6 mois sur la base d'une grille utilisant ces 2 paramètres. L'Autriche a recommandé une prophylaxie jusqu'à la correction chirurgicale ou la transplantation cardiaque, quel que soit l'âge.
Autres pathologies cliniques:
D'autres pathologies cliniques ont été prises en compte après évaluation individuelle dans 8 pays (tous sauf la France et l'Espagne). Il s'agissait d'immunodéficiences à des degrés divers dans les 8 pays, d'affections neurologiques ou neuromusculaires sans mention de la clairance des sécrétions respiratoires en Autriche, en Allemagne, en Suède et en Suisse, de trisomie 21 en Italie et en Suisse et d'anomalies chromosomiques ou de maladies de stockage en Suède.
Abréviations : Alb. Alberta; C.-B. Colombie-Britannique; Man. Manitoba; N.-B. Nouveau-Brunswick; T.-N.-L. Terre-Neuve-et-Labrador; T.N.-O. Territoires du Nord-Ouest; N.-É. Nouvelle-Écosse; Nt Nunavut; Ont. Ontario; Î.-P.-É. Île-du-Prince-Édouard; Qc Québec; Sask. Saskatchewan; Yn Yukon; É.-U. États-Unis; R.-U. Royaume-Uni
| Administration | Groupe | Autre Note de bas de page * | ||
|---|---|---|---|---|
| Nourrissons prématurés sans MPC | Enfants atteints d'une maladie respiratoire | Enfants atteints d'une cardiopathie | ||
CCNI (2003) |
« Recommandée » |
« Recommandée » |
« Recommandée » |
« Peut être pris en compte » |
GCI (2013) |
« Recommandée » Certains nourrissons nés entre 33 et 35 sAG et âgés de moins de 6 mois au début de la saison locale du VRS peuvent en bénéficier; la décision est fondée sur des considérations locales |
« Recommandée » |
« Recommandée » |
« Peut être pris en compte » « Devrait être envisagée » |
SCP (2015) |
« Il est raisonnable de la proposer, mais pas essentiel » : |
« Devrait recevoir » : Deuxième saison du VRS s'ils sont toujours sous oxygénation complémentaire ou s'ils ont été sevrés au cours des 3 derniers mois « Peut être pris en compte » |
« Devrait recevoir » Non indiqué au cours de la Deuxième saison du VRS |
« Devrait être offert » On ne sait pas si ces lignes directrices devraient s'appliquer uniquement aux Inuits, à tous les Autochtones ou à tous les nourrissons des communautés éloignées. Tenir compte de l'incidence locale des HVRS. « Peut être pris en compte » : « Peut être pris en compte » : |
Alberta |
≤ 286/7 sAG, nés après le 31 mai 2020 290/7-326/7 sAG, nés après le 30 septembre 2020 330/7-356/7 sAG, nés après le 31 octobre 2020 ET un score de risque >55 Prématurés : 330/7-356/7 sAG autrement en bonne santé ET jumeau/triplet/etc. du patient qui peut bénéficier d'une immunoprophylaxie contre le VRS Prématurés : Naissance multiple (à l'exclusion des jumeaux) ≤ 356/7 sAG et nés après le 30 septembre 2020 |
356/7 sAG ou moins et âgés de < 2 ans au 1 déc. 2020 avec MPC (O2 à domicile après le 31 mai 2020 ou sous prophylaxie à long terme ou exacerbation récente nécessitant des stéroïdes à action systémique) Trachéotomie et âgés de < 2 ans au 1 déc. 2020. Peut être envisagé pour un âge de < 4 ans au 1 décembre 2020 si le sujet a besoin d'un respirateur. « Peut être pris en compte » :
|
< 2 ans au 1 déc. 2020 avec une CPCHS sévère (liste des conditions admissibles et non admissibles fournie; les orientations sont examinées par un cardiologue) |
Trisomie 21 et âgés de < 1 an à partir du 1 décembre 2020 Immunodéficience importante :
Troubles neuromusculaires : Les autres enfants âgés de moins de 24 mois peuvent être pris en considération sur une base individuelle. |
Colombie-Britannique |
< 29 sAG et renvoyé à la maison le ou après le 1 septembre 2020 29-346/7 sAG et renvoyé à la maison le ou après le 1 octobre 2020 ET avec un score de facteur de risque de ≥42 points. < 35 sAG ET multiple d'un enfant approuvé ET né le 1 novembre 2019 ou après (c.-à-d. âgé de moins d'un an au début de la saison du VRS) |
Ex-prématuré avec DBP/MPC (oxygénation ou VPPC à > 28 jours d'âge) et né le ou après le 1 novembre 2019 ET nécessitant une oxygénation continue le ou après le 1 juillet 2020 Autre :
|
CPCHS et < 1 an le 1 novembre 2020 Invalidité cardiopulmonaire importante (c.-à-d. hypertension pulmonaire, palliation cardiaque, autre) et nés le ou après le 1 novembre 2018 (approbation nécessaire) |
Trisomie 21 et nés le ou après le 1 avril 2020 Nécessite une approbation :
|
Manitoba |
< 33 sAG et âgé de < 6 mois au début de la saison du VRS 33-35 sAG nés après le 31 octobre 2020 ET vivant ou résidant dans une communauté nordique éloignée Les sujets nés à 33-35 sAG et dont le score de risque est de ≥ 65 seront pris en considération. |
Âgés de < 24 mois, atteints de DBP et ayant reçu une oxygénothérapie dans les 6 mois précédant le début de la saison du VRS |
Âgés de < 12 mois et atteints d'une CPCHS évaluée par un cardio-pédiatre. Orientation par le cardio-pédiatre Les sujets âgés de 12-24 mois et atteints d'une CPCHS devraient être orientés vers un spécialiste, mais ils seront évalués au cas par cas. |
Les autres enfants âgés de moins de 24 mois peuvent être pris en considération sur une base individuelle. |
Nouveau-Brunswick (2020-21) |
Devrait être envisagé pour les nourrissons de < 320/7sAG et âgés de ≤ 6 mois au début de la saison du VRS (nés le ou après le 1 juin 2020) 321/7 à 35 sAG ET score de risque de > 49 |
Devrait être envisagé pour les enfants de ≤ 24 mois atteints d'une MPC/DBP ET qui ont eu besoin d'une oxygénation ou d'un traitement médical dans les 6 mois précédant la saison du VRS (c.-à-d. juin à novembre 2020) À déterminer au cas par cas : |
Devrait être envisagé pour les enfants âgés de moins de 24 mois atteints d'une CPCHS (nécessitant une chirurgie corrective ou sous traitement cardiaque pour des raisons hémodynamiques). |
À déterminer au cas par cas : |
Terre-Neuve-et-Labrador (2020-21) |
≤ 300/7 sAG et âgés de ≤ 6 mois au début de la saison du VRS (c.-à-d. nés le ou après le 1 juin 2020) |
≤ 300/7 sAG et âgés de ≤ 6 mois avec MPC/DBP au début de la saison du VRS (c.-à-d. nés le ou après le 1 juin 2020) ≤ 12 mois avec MPC/DBP ET ayant nécessité une oxygénation et/ou un traitement médical dans les 6 mois précédant la saison du VRS (c.-à-d. après le 1 juin 2020) |
≤ 12 mois et atteints d'une CPCHS cyanotique ou acyanotique (nécessitant une chirurgie corrective ou sous traitement cardiaque pour des raisons hémodynamiques), selon l'avis du cardio-pédiatre |
Les sujets ayant ≤ 360/7 sAG et < 6 mois d'âge au début de la saison du VRS ET qui vivent dans des communautés nordiques isolées ou éloignées devraient absolument être pris en considération pour la prophylaxie, sur la base de l'accès aux soins médicaux et d'autres facteurs connus pour augmenter le risque (doivent être nés le ou après le 1 juin 2020) D'autres enfants peuvent être pris en considération sur une base individuelle. |
Territoires du Nord-Ouest |
Prématurés ≤326/7 sAG et âgés de < 6 mois au 1 décembre 2020 (nés après le 31 mai 2020) Peuvent être admissibles, seront évalués : |
Peuvent être admissibles, seront évalués :
|
Peuvent être admissibles, seront évalués : |
Peuvent être admissibles, seront évalués :
D'autres enfants peuvent être pris en considération sur une base individuelle. |
Nouvelle-Écosse. I.-P.-É. |
≤ 300/7 sAG et âgés de ≤ 6 mois (c.-à-d. nés le ou après le 1 juin 2020) |
≤ 300/7 sAG avec DBP/MPC et âgés de ≤ 6 mois d'âge (c.-à-d. nés le ou après le 1 juin 2020) < 24 mois atteints de DBP/MPC qui ont eu besoin d'oxygénation et/ou d'un traitement médical dans les 6 mois précédant la saison du VRS (c.-à-d. du 1 juin à novembre 2020). Nécessitant une consultation :
|
≤ 24 mois atteints d'une CPCHS (shunt gauche-droit nécessitant des médicaments, CPC en attente d'une chirurgie, cyanose en cours) Déterminé par un cardio-pédiatre |
Nécessitant une consultation :
D'autres enfants peuvent être pris en considération sur une base individuelle. |
Nunavut |
≤ 356/7 sAG et âgés de ≤ 6 mois au début ou pendant la saison du VRS (nés le ou après le 1 juillet) |
< 12 mois au début de la saison du VRS et atteints d'une MPC (recours à une oxygénation à 36 sAG) nécessitant actuellement une oxygénation complémentaire et/ou un traitement médical (diurétiques, bronchodilatateurs, stéroïdes) < 24 mois au début de la saison du VRS et atteints d'une DBP nécessitant une oxygénation complémentaire continue OU sevrés de l'oxygénation complémentaire au cours des 3 derniers mois Peut être envisagé pour les enfants < 24 mois présentant :
seulement s'ils sont sous oxygénation à domicile ou s'ils ont été hospitalisés de façon prolongée pour une maladie pulmonaire sévère. |
CPCHS < 12 mois au début de la saison du VRS (CPC et besoin d'une oxygénation complémentaire et/ou d'un traitement médical continu) |
Peut être envisagé pour les enfants < 24 mois présentant les troubles suivants :
D'autres enfants peuvent être pris en considération sur une base individuelle. |
Ontario |
≤ 32 sAG et âgés de ≤ 6 mois au début de la saison locale du VRS ou pendant celle-ci 33–35 sAG révolues et âgés de ≤ 6 mois au début de la saison locale du VRS ou pendant celle-ci, qui ne vivent PAS dans des communautés isolées ET dont le score de risque se situe entre 49 et 100 33–35 sAG révolues et âgés de ≤ 6 m au début de la saison locale du VRS ou pendant celle-ci, et qui VIVENT DANS des communautés isolées définies par l'absence d'accès immédiat à des soins médicaux (< 30 min, hôpital de niveau I) et/ou l'incapacité d'accéder rapidement à des services pédiatriques (< 90 minutes). |
<24 mois atteints d'une DBP et ayant eu besoin d'oxygénation et/ou d'un traitement médical pour une MPC dans les 6 mois précédant la saison du VRS. |
<12 mois et présentant une CPCHS cyanotique ou acyanotique; nécessitant une chirurgie corrective ou sous traitement cardiaque pour insuffisance cardiaque congestive ou ayant reçu un diagnostic d'hypertension pulmonaire modérée à sévère Les enfants âgés de 12 à 24 mois souffrant d'une CPCHS en cours seront pris en compte au cas par cas. Consultation cardiaque requise |
Enfants < 24 mois atteints du syndrome de Down Frères et sœurs issus d'une naissance multiple si l'un des enfants remplit les conditions requises pour la prophylaxie D'autres enfants peuvent être pris en considération sur une base individuelle |
Québec |
< 33 sAG et âgé de < 6 mois au début de la saison du VRS |
Prématurés âgés de < 24 mois au début de la saison du VRS et atteints d'une DBP (définie par la nécessité d'une oxygénothérapie jusqu'à au moins 28 jours de vie et de 36 sAG ou plus) ET recours à une oxygénation au cours des 6 mois précédant ou durant la saison du VRS Nés à terme, âgés de < 24 mois au début de la saison du VRS ET sujets atteints d'une MPC autre que la DBP, définie par la nécessité d'une oxygénothérapie à la naissance ou persistante ET la nécessité d'une oxygénation au cours des 6 mois précédant ou durant la saison du VRS Âgés de < 24 mois au début de la saison du VRS ET
|
Âgés de < 1 an au début de la saison du VRS et atteints d'une CPC, d'une cardiomyopathie ou d'une myocardite entraînant des conséquences hémodynamiques cliniquement significatives Âgés de < 1 an au début de la saison du VRS et atteints d'une hypertension artérielle pulmonaire modérée ou sévère Doit être demandé par le cardio-pédiatre |
Âgés de < 24 mois au début de la saison du VRS et ayant subi une GCSH ou une greffe de cellules souches ou d'organes solides dans les 6 mois précédant ou durant la saison du VRS ≤ 36 sAG et âgés de < 6 mois au début ou pendant la saison du VRS, résidant au Nunavik Nourrissons nés à terme âgés de < 3 mois au début de la saison du VRS ou pendant celle-ci, résidant au Nunavik (en cours de révision) D'autres enfants peuvent être pris en considération sur une base individuelle. |
Saskatchewan (2020-2021) |
< 30 sAG et nés le ou après le 1 juin 2020 < 33 sAG et nés le ou après le 1 septembre 2020 < 36 sAG et nés pendant la saison actuelle du VRS (nov. à févr.), ET score de risque ≥ 60 < 36 sAG et nés pendant la saison actuelle du VRS et qui vivent à La Ronge ou au nord de cette ville. |
< 2 ans atteints de DBP/MPC ET ayant eu besoin d'une oxygénation dans les 6 mois précédant la saison du VRS < 1 an et atteints de FK |
< 2 ans et atteints d'une CPCHS évaluée par un cardio-pédiatre |
D'autres enfants peuvent être pris en considération sur une base individuelle. |
Yukon |
< 290/7 sAG et renvoyé à la maison le ou après le 1 septembre 2020 290/7-346/7 sAG et renvoyé à la maison le ou après le 1 octobre 2020 ET score des facteurs de risque > 41 Les sujets issus d'une naissance multiple dont un enfant est approuvé ET un jumeau admissible sont admissibles en raison de leur prématurité. |
Prématurés atteints de DBP/MPC (oxygène ou VPPC pendant plus de 28 jours) et nés le ou après le 1 novembre 2019 ET sous oxygénation continue le ou après le 1 juillet 2020 Trachéotomie / oxygénation continue à domicile / ventilation le ou après le 1 novembre 2020 et nés le ou après le 1 novembre 2018 Maladie neuromusculaire progressive avec incapacité à évacuer les sécrétions et nés le 1 novembre 2018 ou après (approbation nécessaire) Invalidité pulmonaire importante (malformations pulmonaires, DBP sévère FK symptomatique, autre) et nés le ou après le 1 novembre 2018 (approbation nécessaire). |
CPCHS et nés le ou après le 1 novembre 2019 (détails cliniques et cardiologue à l'appui requis) Handicap cardiopulmonaire important (hypertension pulmonaire, palliation cardiaque, autre) et nés le ou après le 1 novembre 2018 (approbation nécessaire) |
Trisomie 21 et nés le ou après le 1 avril 2020 Immunodéficience sévère |
CPCHS : cardiopathie congénitale hémodynamiquement significative; DBP : dysplasie broncho-pulmonaire; |
||||
| Facteurs de risque | Alberta (score > 55) |
Colombie-Britannique (score ≥ 42) |
Manitoba (score ≥ 65) |
Nouveau-Brunswick (score ≥ 49) |
Territoires du Nord-Ouest (score ≥ 55 |
Ontario (score ≥ 49) |
Saskatche-wan (score ≥ 60) |
Yukon (score > 41) |
|---|---|---|---|---|---|---|---|---|
| Mois de naissance | √ (Nov.-févr.) | N/D | √ (Nov.-mars) | √ (Nov.-janv.) 25 | N/D | √ (Nov.-janv.) 25 | √ (Nov.-févr.) 27 | N/D |
| Le nourrisson ou un frère/une sœur fréquente une garderie. | N/D | N/D | √ | √ 17 | N/D | N/D | N/D | N/D |
| Le nourrisson ou un frère/une sœur ≤ 4 ans fréquente une garderie. | √ | N/D | N/D | N/D | N/D | N/D | N/D | N/D |
| Le nourrisson ou un frère/une sœur ≤ 4 ans fréquente une garderie ≥ 3 demi-journées par semaine. | N/D | N/D | N/D | N/D | √ 19 | N/D | N/D | N/D |
| Le nourrisson ou les frères et sœurs fréquentent une garderie ≥ 20 h/semaine ou une maternelle ≥ 3 demi-journées/semaine. | N/D | N/D | N/D | N/D | N/D | N/D | √ 19 | N/D |
| Le nourrisson fréquentera régulièrement une garderie pendant les 3 premiers mois après son retour à la maison. | N/D | √ 22 | N/D | N/D | N/D | N/D | N/D | √ 22 |
| Le nourrisson fréquentera une garderie OU ses frères et sœurs fréquenteront une garderie ou une école maternelle pendant l'hiver. | N/D | N/D | N/D | N/D | N/D | √ 17 | N/D | N/D |
| Le nourrisson participe à un groupe à domicile ou dans un établissement. | N/D | N/D | N/D | N/D | N/D | N/D | N/D | N/D |
| > 5 personnes dans le foyer, y compris le demandeur et les multiples du demandeur | √ | √ 12 | √ | √ 13 | √ 15 | √ 13 | √ 15 | √ 12 |
| Autre enfant de moins de 5 ans dans le ménage (sans compter les multiples du demandeur) | N/D | √ 14 | N/D | N/D | N/D | N/D | N/D | √ 14 |
| Congé de l'hôpital en déc.-févr. | N/D | √ (mars dans les régions sanitaires du Nord) 20 | N/D | N/D | N/D | N/D | N/D | √ 20 |
| Congé de l'hôpital en nov. ou mars | N/D | √ (avr. dans les régions sanitaires du Nord) 10 | N/D | N/D | N/D | N/D | N/D | √ 10 |
| Congé de l'hôpital entre nov.-févr. | N/D | N/D | N/D | N/D | √ 27 | N/D | N/D | N/D |
| 29-306/7 sAG | N/D | √ 10 | N/D | N/D | N/D | N/D | N/D | √ 10 |
| Petit pour l'AG (poids de naissance < 10e percentile pour l'AG) | √ | N/D | √ | √ 12 | √ 14 | √ 12 | √ 14 | √ 8 |
| Petit pour l'AG (poids de naissance ≤ 10e percentile pour l'AG) | N/D | √ 8 | N/D | N/D | N/D | N/D | N/D | N/D |
| Sexe masculin | √ | N/D | √ | √ 11 | √ 13 | √ 11 | √ 13 | N/D |
| Sexe masculin (tous) ou sexe féminin ne recevant pas de lait maternel | N/D | √ 8 | N/D | N/D | N/D | N/D | N/D | √ 8 |
| Famille immédiate (mère, père, frères et sœurs) sans eczéma | N/D | N/D | √ | √ 12 | N/D | √ 12 | N/D | N/D |
| Deux fumeurs ou plus dans le ménage | √ | √ 8 | √ | √ 10 | N/D | N/D | N/D | √ 8 |
| Fumeur(s) dans le ménage | N/D | N/D | N/D | N/D | √ 13 | √ 10 | √ 12 | N/D |
| Vit à plus de 2 heures de l'hôpital le plus proche qui fournit un traitement contre la bronchiolite | √ | N/D | N/D | N/D | N/D | N/D | N/D | N/D |
| Vit à plus d'une heure de route de l'hôpital le plus proche qui fournit un traitement contre la bronchiolite | N/D | N/D | N/D | N/D | √ 20 | N/D | N/D | N/D |
| Emplacement éloigné, sans accès routier permanent | √ | N/D | N/D | N/D | N/D | N/D | N/D | N/D |
| Emplacement éloigné à 100 km ou 1 heure de transport terrestre de l'hôpital/centre de soins pédiatriques | N/D | √ 10 | N/D | N/D | N/D | N/D | N/D | N/D |
| Résidence éloignée (le Yukon est considéré comme étant éloigné) | N/D | N/D | N/D | N/D | N/D | N/D | N/D | √ 10 |
|
N/D : non disponible |
||||||||
| Administration | Groupe | |||
|---|---|---|---|---|
| Nourrissons prématurés | Enfants atteints d'une maladie pulmonaire | Enfants atteints d'une cardiopathie | Autre | |
Autriche |
< 28 sAG et âgés de ≤ 12 mois |
DBP, âgés de moins de 2 ans et ayant nécessité un traitement au cours des 6 derniers mois |
CPCHS jusqu'à la correction ou la transplantation |
Peut être pris en compte; |
France |
N/D | ≤ 32 sAG, âgés de < 6 mois au début de la saison du VRS et maladie respiratoire (nécessitant > 28 jours d'oxygénation en période néonatale) ≤ 32 sAG, âgés de < 24 mois au début de la saison du VRS et maladie respiratoire (nécessitant > 28 jours d'oxygénation en période néonatale) et DBP modérée ou sévère nécessitant un traitement au cours des 6 mois précédents |
< 2 ans et atteints d'une CPCHS |
N/D |
Allemagne |
Peut être administré : |
Devrait recevoir : Syndrome sous-jacent ou affection neurologique avec MPC |
Devrait recevoir : Âgés de < 6 mois et nécessitant une intervention chirurgicale, avec une hypertension artérielle pulmonaire, une congestion veineuse pulmonaire ou une cyanose, une insuffisance cardiaque sévère sous traitement médicamenteux Peut recevoir : |
« Peut être pris en compte » : Devrait recevoir : |
Italie |
< 29 sAG et âgés de ≤ 12 mois |
Âgés de ≤ 12 m avec DBP (définie comme étant le recours à une oxygénothérapie pendant ≥ 28 jours après la naissance) DBP, âgés de 1 à 2 ans et ayant nécessité un traitement au cours des 6 mois précédents. À prendre en considération : |
< 1 an avec une CPC sévère (cardiopathie cyanotique avant une intervention chirurgicale ou après une intervention palliative, sous traitement pour une insuffisance cardiaque congestive et devant subir une intervention chirurgicale, hypertension pulmonaire modérée à sévère, CPC réparée chirurgicalement nécessitant encore un traitement pour une insuffisance cardiaque congestive, nourrissons en attente d'une transplantation cardiaque ou en période post-transplantation |
À prendre en considération : |
Espagne |
≤ 286/7 sAG et âgés de < 9 mois 29-316/7 sAG et âgés de < 6 mois 321/7 à 346/7 sAG et âgés de < 6 mois si des facteurs de risque sont présents |
MPC, âgés de < 2 ans et ayant eu besoin d'un traitement au cours des 6 mois précédents |
CPCHS, âgés de < 2 ans et ayant nécessité un traitement au cours des 12 derniers mois |
N/D |
Suède |
< 26 sAG et âgés de < 6 mois |
DBP, âgés de < 12 mois et ayant nécessité une oxygénothérapie au cours des 6 derniers mois MPC sévère et âgés de < 12 mois (atrésie de l'œsophage, hernie diaphragmatique, malformations de la trachée, des bronches et/ou des poumons) |
CPC, âgés de < 12 mois et atteints d'une insuffisance cardiaque hémodynamiquement significative, d'une hypertension pulmonaire prononcée, d'une cardiomyopathie avec insuffisance cardiaque prononcée. |
Peut être considéré sur une base individuelle : |
Suisse |
Non recommandé |
DBP, âgés de < 1 an Âgés de < 24 mois avec FK; des malformations pulmonaires anatomiques peuvent être envisagées dans certains cas |
« Peut être pris en compte » : |
Autres : |
Pays-Bas |
< 32 sAG et âge < 6 mois |
<1 an avec DBP ou hypertension pulmonaire < 1 an avec une pathologie pulmonaire grave due à la FK |
CPCHS et âgés de < 2 ans |
Cas particuliers : |
Royaume-Uni |
Non justifié pour la prématurité à elle seule |
Nourrissons prématurés atteints de DBP modérée ou sévère (définis comme étant des prématurés qui présentent des modifications radiologiques compatibles et qui continuent à recevoir une oxygénation complémentaire ou une assistance respiratoire à 36 semaines d'âge post-menstruel. Les sujets suivants doivent se voir proposer une prophylaxie : b) Les nourrissons atteints de maladies respiratoires qui ne sont pas nécessairement prématurés mais qui reçoivent toujours une oxygénation au début de la saison du VRS, notamment :
|
Nourrissons prématurés avec CPCHS acyanotique aux âges chronologiques au début de la saison du VRS et aux AG à la naissance ci-dessous : 301/7
-320/7
sAG, âge < 1,5 m CPC cyanotique ou acyanotique plus comorbidités importantes, en particulier si plusieurs systèmes organiques sont concernés |
< 24 mois, ayant subi une immunodéficience combinée sévère et incapables de produire des réponses de lymphocytes T ou de produire des anticorps – jusqu'à ce que le système immunitaire soit reconstitué |
États-Unis 2014 |
« Peut être administré » dans le texte; le résumé indique « Recommandé ». < 290/7
sAG et âgés de < 12 mois au début de la saison du VRS |
« Peut être administré » dans le texte; le résumé indique « Recommandé ». <320/7 sAG avec MPC associée à la prématurité (définie comme étant la nécessité d'obtenir un apport de > 21 % en oxygène pendant au moins les 28 premiers jours après la naissance, 1 année de vie Deuxième année : À prendre en considération uniquement si ce qui précède est accompagné d'un besoin continu de soutien médical (stéroïdes, diurétiques, oxygène) dans les 6 mois précédant le début de la deuxième saison du VRS « Peut être pris en compte » : FK avec MPC ou compromission nutritionnelle au cours de la 1 année de vie; peut être envisagée au cours de la deuxième année de vie si le sujet a déjà été hospitalisé pour une exacerbation pulmonaire ou une radiographie ou une TDM thoracique anormale qui persiste alors que le sujet est stable; poids pour la longueur < 10e percentile |
« Peut tirer des bienfaits ». Le résumé indique qu'il « peut être administré » à certains nourrissons atteints d'une CPCHS. Âge < 1 an au début de la saison du VRS avec CPCHS (avec consultation d'un cardio-pédiatre) « Peut être pris en compte » : Âge < 2 ans et transplantation cardiaque pendant la saison du VRS. |
Autre : « Peut être pris en compte » : Données insuffisantes pour justifier : La sélection peut différer chez les enfants natifs de l'Alaska en fonction de l'épidémiologie locale. Non recommandé pour la prévention de l'asthme |
|
N/D : non disponible |
||||
Sources :
Canada
- CCNI. Déclaration concernant l'usage recommandé de l'anticorps monoclonal anti-VRS (palivizumab). RMTC. 2003;29. DCC-7, 8.
- ASPC. GCI : Partie 5 - Agents d'immunisation passive. Accès :
https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-5-agents-immunisation-passive.html - Robinson J.L., Le Saux N. et Comité des maladies infectieuses et d'immunisation de la SCP. « Prévenir les hospitalisations pour l'infection par le virus respiratoire syncytial ». Paediatr Child Health. 2015;20(6):327-333.
- Alberta Health Services. Accès : https://www.albertahealthservices.ca/assets/info/hp/rsv/if-hp-rsv-criteria.pdf; https://www.albertahealthservices.ca/frm-18957.pdf
- British Columbia Provincial Health Services Authority.
Accès : https://www.childhealthbc.ca/sites/default/files/b.c.-rsv-manual-2020-21v2.pdf - Manitoba Children's Hospital. Communication personnelle.
- Ministère de la Santé et du Mieux-être du Nouveau-Brunswick. Communication personnelle.
- Newfoundland and Labrador Eastern Health. Communication personnelle.
- Territoires du Nord-Ouest. Accès :
https://www.hss.gov.nt.ca/professionals/en/services/seasonal-rsv-prophylaxis-synagis%C2%AE-program-package-2020-2021 - IWK Health Centre de la Nouvelle-Écosse. Accès :
https://www.iwk.nshealth.ca/palivizumab/provincial-guidelines/indications-for-use - Ministère de la Santé du Nunavut. Accès :
https://www.gov.nu.ca/sites/default/files/11.0_specialized_and_annual_immunization_protocols_december_2020.pdf - Île-du-Prince-Édouard. Communication personnelle (utilisation du protocole de la Nouvelle-Écosse).
- Ministère de la Santé de l'Ontario. Accès :
https://www.health.gov.on.ca/en/pro/programs/drugs/funded_drug/pdf/rsv_season2020-2021.pdf - Héma-Québec. Accès : https://www.hema-quebec.qc.ca/userfiles/file/media/francais/hopitaux/20-030.pdf
- Saskatchewan Health Authority. Accès : https://www.saskatoonhealthregion.ca/locations_services/Services/Childrens-Services/RSV-Program/Pages/Forms.aspx
- Ministère de la Santé et des Affaires sociales du Yukon. Accès :
https://yukon.ca/sites/yukon.ca/files/hss/hss-imgs/section_5_-_immunization_of_special_populations_october_2020.pdf
International
Autriche, Austrian Society for Pediatrics and Adolescent Medicine :
- Resch B., Manzoni P., Lanari M. et al. « Severe respiratory syncytial virus (RSV) infection in infants with neuromuscular diseases and immune deficiency syndromes ». Paediatr Respir Rev. 2009;10:148-53.
- Österreichische Gesellschaft für Kinder- und Jugendheilkunde (ÖGKJ). « Konsensuspapier zur prophylaxe der RSV-infektion mit palivizumab und post-RSV-atemwegserkrankung ». Monatsschr Kinderheilkd. 2008;156:381-383. doi : https://doi.org/10.1007/s00112-008-1722-y
- Resch B., Bramreiter V.S., Kurath-Koller S., Freidl T. et Urlesberger B. « Respiratory syncytial virus associated hospitalizations in preterm infants of 29 to 32 weeks gestational age using a risk score tool for palivizumab prophylaxis ». Eur J Clin Microbiol Infect Dis. 2017;36:1057-1062.
France, Haute autorité de santé, Commission de la transparence :
- https://www.has-sante.fr/portail/upload/docs/evamed/CT-15884_SYNAGIS_QD_INS_Avis2_CT15884.pdf [consulté le 22 mars 2021].
Allemagne, German Society for Pediatric Infectiology :
- https://www.awmf.org/uploads/tx_szleitlinien/048-012l_S2k_Prophylaxe-von-schweren_RSV-Erkrankungen-Risikokindern-Palivizumab_2018-11.pdf [consulté le 22 mars 2021].
Italie, Italia Medicine Agency :
- Bollani L., Baraldi E., Chirico G. et al. « Revised recommendations concerning palivizumab prophylaxis for respiratory syncytial virus (RSV) ». Ital J Pediatr. 2015;15:97.
- Belleudi V., Trotta F., Pinnarelli L. et al. « Neonatal outcomes following new reimbursement limitations on palivizumab ». Italy Arch Dis Child. 2018;103:1163-1167.
Espagne, Standards Committee of the Spanish Neonatology Society :
- Figueras Aloy J., Quero J. et Comité de Estándares de la Sociedad Española de Neonatología. « Recommendations for the prevention of respiratory syncytial virus infections ». An Pediatr (Barc). 2005;63(4):357-62.
- Figueras Aloy J., Carbonell Estrany X. et Comité de Estándares de la Sociedad Española de Neonatología. « Recommendations for the use of palivizumab in the prevention of respiratory syncytial virus infection in late preterm infants (321 to 350 weeks of gestation) ». An Pediatr (Barc). 2010;73(2). doi : 2010:98.e1-98.e4.
- Figueras Aloy J., Carbonell Estrany X. et Comité de Estándares de la SENeo. « Update of recommendations on the use of palivizumab as prophylaxis in RSV infections ». An Pediatr (Barc). 2015;82(3). doi : 199.e1-199.e2.
Suède, Medical Products Agency :
- http://www.lakemedelsverket.se/malgrupp/Halso---sjukvard/Behandlings--rekommendationer/Behandlingsrekommendation---listan/RSV-infektioner/ [consulté le 22 mars 2021].
Suisse, Interdisciplinary Working Group :
- Agyemana P., Barazzoneb C., Hammerb J. et al. « Prävention von RSV-Infektionen mit dem humanisierten monoklonalen Antikörper Palivizumab ». Swiss Med Forum. 2017;17(28-29):611-614.
Pays-Bas, Dutch Association for Pediatrics; Ministry of Health :
- Ministère de la Santé, Wellness and Sport (remboursement). Accès : https://zoek.officielebekendmakingen.nl/stcrt-2006-218-p29-SC77527.pdf [consulté le 21 mars 2021].
- Whelan B., Musters E., Murray A., et al. « Review of the home care programmes for respiratory syncytial virus (RSV) prophylaxis in Ireland and The Netherlands ». Drugs Ther Perspect. 2016;32:119-130.
Royaume-Uni, Public Health England :
- https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/458469/Green_Book_Chapter_27a_v2_0W.PDF [consulté le 22 mars 2021].
États-Unis, American Academy of Pediatrics :
- Committee on Infectious Diseases and Bronchiolitis Guidelines Committee. « Updated guidance for palivizumab prophylaxis among infants and young children at increased risk of hospitalization for respiratory syncytial virus infection ». Pediatrics. 2014;134:415-420.
Annexe B : Innocuité du palivizumab
Table des matières
- Introduction
- Méthodes
- 3. Résultats
- 4. Résumé
- Tableau A : Stratégie et résultats de recherche
- Tableau B : Niveau de données probantes selon la méthodologie de la recherche et de la cote de qualité des données probantes (validité interne)
- Tableau C : Résumé des données probantes liées à l'innocuité du palivizumab
Introduction
Le PVZ est considéré comme étant un produit sûr. Depuis la description des ÉI dans la déclaration sur le PVZ du CCNI 2003Note de bas de page 4, il n'y a pas eu d'alertes de sécurité mais le nombre de nourrissons exposés au PVZ a considérablement augmenté. Le CCNI a déterminé que cela justifiait une nouvelle évaluation des données sur l'innocuité du PVZ et a indiqué qu'une recherche documentaire rapide et un examen des données du Programme Canada VigilanceNote de bas de page 210 seraient effectués.
Méthodologie
2.1 Revue rapide de la littérature
Une revue rapide de la littérature sur l'innocuité du PVZ a été réalisée à partir des sources suivantes :
- Un examen systématique de l'innocuité du PVZ publié en 2013 (dont la qualité a été jugée moyenne par AMSTAR) a été utilisé pour cibler les études publiées avant 2013Note de bas de page 211. Ces études ont été examinées.
- Une recherche documentaire, basée sur la question de recherche ci-dessous, a été effectuée. La stratégie de recherche, élaborée avec un bibliothécaire de Santé Canada (LG), tenait compte des publications à partir de 2013 et a été exécutée le 24 avril 2019. La stratégie de recherche détaillée est présentée ci-dessous. En raison de contraintes de temps, la recherche documentaire s'est limitée à 2 bases de données bibliographiques (MEDLINE et EMBASE).
- Les études citées dans les références obtenues lors de la recherche qui n'étaient pas incluses dans (1) ou (2) ont également été examinées.
La sélection, l'évaluation de l'admissibilité, l'extraction des données et l'évaluation de la qualité ont été effectuées par un seul examinateur. Un tableau récapitulatif des données avec des évaluations de la qualité des données probantes selon la méthodologie standard du CCNI (Tableau B) a été produit (Tableau C). Les résultats des études acceptées ont été synthétisés de manière narrative.
Question de recherche : Quelle est l'innocuité du PVZ chez l'humain?
P (population) : Humains (sans restriction liée à l'âge)
I (intervention) : PVZ administré par voie IM
C (comparaison) : Placebo, autre anticorps monoclonal ou aucun
R (résultats) : Évènements indésirables
Repérage des études admissibles :
Les articles extraits de la recherche documentaire de Santé Canada ont été chargés dans RefWorks (ProQuest LLC, Ann Arbor, MI) et téléchargés dans DistillerSR (Evidence Partners, Ottawa, Canada). Les articles en double ont été supprimés. Les enregistrements ont été triés en fonction du titre et du résumé. Les textes intégraux des articles qui étaient pertinents selon les critères d'inclusion et d'exclusion, ou qui ne contenaient pas suffisamment de données pour être exclus, ont été récupérés et leur admissibilité a été évaluée sur la base des textes intégraux.
Les études ont été incluses si elles satisfaisaient aux critères suivants :
- L'étude portait sur l'administration du PVZ par voie IM à des enfants.
- L'étude a présenté des données sur l'innocuité ou les ÉI. (Si le PVZ a été administré mais qu'il n'était pas mentionné dans le résumé, l'étude a néanmoins été incluse pour l'examen du texte intégral, car les études pouvaient inclure des données sur l'innocuité sans référence dans le résumé).
Les études ont été exclues si elles satisfaisaient à au moins l'un des critères suivants :
- L'étude n'a pas fourni de données sur les ÉI ou l'innocuité.
- Le PVZ n'a pas été administré par voie IM.
- L'étude était rédigée dans une langue autre que l'anglais ou le français.
- L'étude ne portait pas sur des humains.
- L'article était un éditorial ou une opinion.
- L'étude ne présentait que des recherches secondaires (les examens systématiques ont été acceptés).
2.2 Données du Programme Canada Vigilance
Le Programme Canada Vigilance (PCV) est le programme de surveillance post-commercialisation de Santé Canada au sein de la Direction des produits de santé commercialisés (DPSC) qui recueille et évalue les déclarations d'ÉI présumés des produits de santé. L'objectif du PCV est de détecter les éventuels signalements en matière d'innocuité des réactions indésirables associés aux produits de santé. Les déclarations de réactions indésirables sont des associations présumées qui reflètent l'opinion ou l'observation du déclarant et ne reflètent pas une évaluation de Santé Canada quant à l'association entre le produit de santé et la réaction. L'inclusion d'une réaction particulière ne signifie pas nécessairement qu'elle a été causée par le produit de santé suspecté. Un évènement indésirable grave (ÉIG) signifie qu'un évènement a nécessité une hospitalisation ou la prolongation d'une hospitalisation existante, a causé une malformation congénitale, a entraîné un handicap ou une incapacité persistante ou importante, a mis la vie en danger ou a entraîné la mort. D'autres évènements médicaux importants susceptibles de mettre le patient en danger ou de nécessiter une intervention peuvent également être considérés comme étant graves.
Les rapports au PCV jusqu'au 31 décembre 2018 ont été téléchargés le 5 avril 2019. De plus, la DPSC effectue des examens périodiques de l'innocuité si des signalements apparaissent (MedEffetMC Canada). Aucun examen de l'innocuité n'a été justifié.
3. Résultats
3.1 Revue de la littérature
3.1.1 Essais contrôlés randomisés
Neuf ECR à double insu ont été relevés. Quatre étaient contrôlés par placeboNote de bas de page 48 Note de bas de page 80 Note de bas de page 111 Note de bas de page 140 Note de bas de page 141, 2 comparaient les formes lyophilisées et liquides du PVZNote de bas de page 212 Note de bas de page 213 et 3 comparaient le PVZ au motavizumab (MVZ) (un autre anticorps monoclonal dirigé contre le virus respiratoire syncytial [VRS], qui n'a pas été autorisé)Note de bas de page 214 Note de bas de page 215 Note de bas de page 216. La qualité de 7 d'entre eux a été jugée bonne, tandis qu'unNote de bas de page 111 a été jugée passable. Le neuvième était un résumé de conférence évalué dans le cadre d'un examen systématique, qui comprenait des renseignements supplémentaires et dont la qualité a été jugée bonne.
Dans l'ECR IMpact initial sur le PVZ, qui portait sur des enfants de 35 sAG ou moins et âgés de 6 mois ou moins ou de 24 mois ou moins chez les sujets atteints de DBP, les taux d'ÉI signalés par l'investigateur à l'insu comme étant potentiellement liés au médicament à l'étude étaient similaires dans les groupes sous PVZ et sous placebo (11 % et 10 %, respectivement). Il n'y avait pas de différences significatives dans les types d'EI, y compris les réactions au point d'injection. Aucune ÉIG n'a été observée. Les cas d'arrêt du traitement par PVZ en raison d'un ÉI étaient rares (0,3 %). Il y a eu 4 (0,4 %) décès dans le groupe sous PVZ et 5 (1 %) dans le groupe placebo pour des raisons jugées non liées au médicament à l'étude. Le nombre de nourrissons ayant reçu du PVZ était de 1 002Note de bas de page 48.
Un ECR portant sur des enfants âgés de 24 mois ou moins atteints d'une CPCHS a fait état de taux globaux similaires d'ÉI (96 % contre 97 %) et d'ÉI jugés comme étant liés au médicament à l'étude par le chercheur en aveugle (7,2 % contre 6,9 %) dans les groupes sous PVZ et sous placebo, respectivement. Les ÉIG étaient plus nombreux dans le groupe placebo (63 % contre 55 %, p = 0,005) mais les HRSV étaient incluses dans les ÉIG. Les ÉIG jugés liés au médicament à l'étude étaient rares (0 et 0,5 % dans les groupes sous PVZ et sous placebo, respectivement). Aucun arrêt du traitement pour cause d'ÉI n'a été recensé. Des décès sont survenus dans 3,3 % des cas dans le groupe sous PVZ et dans 4,2 % des cas dans le groupe placebo mais aucun n'a été attribué aux médicaments à l'étude. Le nombre de nourrissons ayant reçu le PVZ était de 639Note de bas de page 80.
Les résultats d'un ECR mené sur le PVZ chez des enfants de moins de 2 ans atteints de FK ont été présentés sous forme d'un résumé de conférenceNote de bas de page 141 et constituaient la seule étude d'un examen systématique ultérieurNote de bas de page 140. Il n'existait pas de différences significatives dans les taux globaux d'ÉI, d'ÉIG, d'ÉI liés au médicament à l'étude (5,4 % contre 4,4 %) ou d'ÉIG liés au médicament à l'étude (0 contre 2,1 %) dans les groupes sous PVZ et sous placebo, respectivement. Le traitement par PVZ a été arrêté en raison d'un ÉIG dans un cas. Aucun décès n'a été recensé. Le nombre d'enfants ayant reçu le PVZ était de 92.
Un ECR portant sur des nourrissons prématurés autrement en bonne santé, nés à 33 à 35 sAG et âgés de 6 mois ou moins, n'a fait état que d'hospitalisations et de décès comme ÉI. Les taux d'hospitalisation étaient plus élevés avec le placebo qu'avec le PVZ (21,9 % contre 12,6 %, p = 0,04) mais lorsque les HRSV ont été retirées de ce taux, la différence n'était pas significative (19,1 % pour le placebo contre 14,0 % pour le PVZ). Aucun décès n'a été recensé. Le nombre de nourrissons ayant reçu du PVZ était de 214Note de bas de page 111.
Deux ECR comparant des préparations lyophilisées et liquides de PVZ administrées à des enfants atteints d'une MPC, âgés de 24 mois ou moins ou nés à 35 sAG ou moins et âgés de 6 mois ou moinsNote de bas de page 212, ou à des nourrissons nés à 35 sAG ou moinsNote de bas de page 213 n'ont déterminé aucune différence significative dans les taux globaux d'ÉINote de bas de page 213 ou d'ÉIGNote de bas de page 212 Note de bas de page 213. Des ÉIG sont survenus chez 5,9 % et 2,6 % des enfants ayant reçu du PVZ lyophilisé et chez 8,5 % et 3,3 % des enfants ayant pris du PVZ liquide dans les 2 études mais aucun n'a été jugé lié aux médicaments à l'étude. Un décès a été recensé chez un enfant ayant reçu du PVZ lyophilisé, décès jugé non lié au médicament à l'étudeNote de bas de page 212. Le nombre total de nourrissons exposés au PVZ était de 413Note de bas de page 212 et 305Note de bas de page 213.
Dans un ECR comparant le PVZ au MVZ chez des nourrissons prématurés nés à 35 sAG ou moins et âgés de 6 mois ou moins ou âgés de 24 mois ou moins atteints d'une MPC, les taux globaux d'ÉI et d'ÉIG étaient similaires. Les ÉI observés dans le groupe sous PVZ étaient des affections de la peau et du tissu sous-cutané dans 18,5 % des cas, des réactions au site d'injection dans 2,7 % des cas et des troubles psychiatriques (agitation, somnolence, instabilité, irritabilité) dans 2,9 % des cas. Des ÉI considérés comme étant des réactions d'hypersensibilité cutanée possibles sont survenus chez 0,2 % des nourrissons ayant reçu du PVZ. Aucun cas d'anaphylaxie n'a été recensé. Le taux d'ÉIG dans le groupe sous PVZ était de 15,3 %. Le lien entre les ÉI et le médicament à l'étude n'a pas été établi. Le traitement par PVZ a été interrompu en raison d'un ÉI dans 0,3 % des cas. Le taux de mortalité était de 0,1 % avec le PVZ et aucun décès n'a été considéré comme étant lié au PVZ. Le nombre d'enfants ayant reçu le PVZ était de 3 298Note de bas de page 214. Une deuxième étude comparant le PVZ au MVZ portait sur des enfants âgés de 24 mois ou moins atteints d'une CPCHS. Les taux globaux d'ÉI et d'ÉIG étaient similaires avec les 2 produits. Dans le groupe sous PVZ, des ÉI et des ÉIG jugés liés au médicament à l'étude sont survenus chez 8,8 % et 1,0 % des enfants, respectivement. Le traitement par PVZ a été interrompu chez un patient (0,2 %) en raison d'une éruption maculaire. Le taux de mortalité était de 1,6 %, aucun décès n'étant lié au médicament à l'étude. Le nombre d'enfants ayant reçu du PVZ était de 612Note de bas de page 216. Une troisième étude comparant le PVZ au MVZ chez des nourrissons prématurés nés à 35 sAG ou moins et âgés de 6 mois ou moins ou âgés de 24 mois ou moins et atteints d'une MPC, a utilisé un schéma d'expériences croisées, faisant état des ÉI pour chaque médicament avant et après le croisement. Le taux d'ÉI liés au PVZ était de 9,3 %. Aucun ÉIG lié au PVZ n'a été recensé. Le traitement par PVZ a été interrompu en raison d'un ÉI dans un cas (0,6 %). Aucun décès n'a été recensé. Le nombre d'enfants ayant reçu le PVZ était de 161Note de bas de page 215.
3.1.2. Études de cohorte basée sur une population
Deux études de cohorte représentatives de la population, jugées de bonne qualité, ont été menées en Suède et au Danemark à l'aide de registres nationaux de santé pour étudier des évènements spécifiques survenus chez des patients ayant reçu du PVZ par rapport au reste de la population. La population ajustée en fonction de l'âge était de 1 351 265 enfants dont 1 192 sous PVZ. La première étude s'est intéressée à l'incidence des maladies auto-immunes, qui n'était pas significativement accrue chez les enfants ayant reçu le PVZ, avec des taux de 0,54 % chez les enfants suédois et de 0,60 % chez les enfants danois non exposés au PVZ et de 0,76 % chez les enfants sous PVZ, avec un rapport de risque ajusté de 1,54, et un IC à 95 % : de 0,80 à 2,95 %Note de bas de page 217. La deuxième étude portait sur l'atopie. Un risque accru d'asthme a été observé avec l'exposition au PVZ (rapport de risque : 1,49; IC à 95 % : 1,32 à 1,68 %) mais après une analyse a posteriori utilisant un score de propension pour équilibrer les facteurs de confusion, ce risque n'était plus significatif (rapport de risque : 0,91; IC à 95 % : 0,56 à 1,48 %). Les chercheurs n'ont pas observé d'augmentation du risque de dermatite atopique (rapport de risque : 1,18; IC à 95 % : 0,94 à 1,48 %) ou de rhinoconjonctivite allergique (rapport de risque : 1,14; IC à 95 % : 0,92 à 1,42 %)Note de bas de page 218.
3.1.3 Registres prospectifs et études de cohorte
Le registre CARESS (Canadian RSV Evaluation Study of Palivizumab) a décrit les ÉIG signalés chez 13 025 enfants sous PVZ (nés à 35 sAG ou moins ou atteints d'une CPCHS ou d'une DBP ou d'autres affections médicales complexes) ayant reçu 57 392 doses de PVZ de 2008 à 2013. Les hospitalisations pour cause d'infections des voies respiratoires (VR) ont été exclues. Les chercheurs ont recensé 62 ÉIG chez 52 nourrissons. L'incidence des ÉIG considérés comme étant possiblement ou probablement liés au PVZ était de 2,8 pour 10 000 patients-mois ou de 2,4 pour 10 000 doses, 14 ÉIG étant survenus chez 6 patients (0,05 %). Toutes ces réactions évoquaient des réactions d'hypersensibilité et sont réapparues avec les doses suivantes chez les 4 enfants ayant bénéficié d'une nouvelle administration du traitement : érythème généralisé et bronchospasme après les 2 et 3 doses; urticaire généralisée peu après la 3 dose; érythème facial 5 minutes après l'injection; éruption cutanée localisée près du site d'injection après les 2e et 3 doses; et vomissements prolongés et congestion nasale après chacune des 4 doses chez 2 nourrissons. Le traitement par PVZ a été interrompu chez ces 6 patients et chez 14 autres, dont 3 ont été hospitalisés pour des IVR et 11 pour des ÉI n'ayant pas été qualifiés d'ÉIG (éruption cutanée sur la cuisse, troubles gastro-intestinaux, irritabilité et « malaise »). Les chercheurs ont recensé 5 décès, non liés au PVZNote de bas de page 170. Dans un rapport antérieur sur les données du registre CARESS sur la période 2005-2009, 5 286 enfants ont reçu 19 485 doses de PVZ. Soixante-et-un (61) ÉIG ont été dénombrés dont 56 hospitalisations pour des infections respiratoires. Les 5 autres ÉIG n'ont pas été décrits en détail. Le traitement par PVZ a été interrompu chez 1,7 % des enfants pour cause d'ÉI. Les chercheurs ont recensé 5 décès jugés probablement non liés ou non liés au PVZNote de bas de page 219. Un examen des données du registre CARESS jusqu'en 2010 a fait état de 8 décès dont aucun n'était lié au PVZNote de bas de page 220. Les données du registre CARESS combinées à une étude de cohorte prospective menée en Italie ont été présentées pour la période 2001-2014. Sur 14 468 enfants traités par PVZ, 15 ÉIG liés au PVZ ont été signalés chez 7 patients (0,05 %). Les 15 ÉIG étaient tous des réactions d'hypersensibilité. Ces résultats se recoupent avec ceux de l'auteur Chen ci-dessusNote de bas de page 221.
D'après les données du registre allemand du PVZ, datant de la période 2002-2007, 10 686 sujets ont reçu 49 608 doses de PVZ. Des ÉIG possiblement ou probablement liés au PVZ sont survenus chez 10 sujets (0,09 %), soit un taux de 2 pour 10 000 doses. Les ÉIG étaient les suivants : dyspnée ou cyanose avec ou sans fièvre (4), et éruption cutanée, thrombocytopénie, ostéomyélite, convulsions, hyporéactivité, fièvre avec agitation. Trois décès ont été recensés dont un non lié au PVZ et 2 non évaluablesNote de bas de page 222. Une publication ultérieure a présenté les données du même registre pour la période 2009-2016 au cours de laquelle 12 729 sujets ont reçu 63 572 doses. Des ÉIG probablement liés au PVZ ont été signalés dans 8 cas (0,06 %), soit 1,3 pour 10 000 doses. Ces évènements ont été décrits comme suit : arrêt respiratoire (2), éruption cutanée, éruption cutanée avec fièvre, urticaire, agitation, érythème au site d'injection et restriction aigüe de la mobilité des jambes (1 chacun). Neuf décès ont été recensés; aucun n'était lié au PVZNote de bas de page 223.
Une étude d'observation prospective internationale menée dans 15 pays de l'hémisphère Nord a porté sur 565 nourrissons prématurés (nés à 35 sAG ou moins) et âgés de 6 mois ou moins ou de 24 mois ou moins, atteints d'une DBP et ayant reçu du PVZ en 1998 et en 1999. Un total de 45 nourrissons ont présenté un ou plusieurs ÉI, parmi lesquels 39 ont développé 40 ÉI considérés comme étant liés au PVZ (7 %). Les ÉI liés au PVZ les plus fréquents étaient les réactions au site d'injection (12), la fièvre (8), la diarrhée (4) et la nervosité ou l'irritabilité (4). Aucun n'était un ÉIG. Le traitement par PVZ a été interrompu en raison d'ÉI dans 11 cas dont 3 ont été considérés comme étant possiblement ou probablement liés au PVZ : désaturation en oxygène immédiatement après l'injection, œdème abdominal et périphérique et gastro-entérite. Deux décès ont été recensés, sans lien avec le PVZNote de bas de page 224. Une étude d'observation prospective internationale menée dans 17 pays européens et en Arabie saoudite portait sur 285 nourrissons prématurés nés à 29 à 32 sAG, âgés de 6 mois ou moins et ayant reçu du PVZ en 2000 et en 2001. Sept ÉI (fièvre, entérite, bronchite, rhinite, toux, pneumonie bactérienne, conjonctivite) ont été jugés liés au PVZ chez 5 patients (2,5 %), dont un (pneumonie bactérienne) était un ÉIG (0,35 %). En outre, un cas de bronchiolite liée au VRS a été classé comme étant un ÉIG pouvant être lié au PVZ. Le traitement par PVZ a été interrompu dans 2 cas en raison d'ÉI, dont l'un (fièvre) a été considéré comme étant probablement lié au PVZ. Aucun décès n'a été recenséNote de bas de page 225. Une étude d'observation prospective internationale menée dans 7 pays d'Amérique latine a porté sur 459 patients sous PVZ (nés à 35 sAG ou moins ou atteints d'une DBP ou d'une CPCHS) en 2011 et en 2012. Les chercheurs ont dénombré 1 165 ÉI. Au total, 135 ÉIG sont survenus chez 102 patients mais aucun n'a été considéré comme étant lié au PVZ. Trois décès non liés au PVZ ont été recensésNote de bas de page 226.
Une étude d'observation prospective multicentrique réalisée en France a présenté les données de 516 enfants ayant reçu du PVZ pour une prématurité (nés à 32 sAG ou moins et atteints d'une DBP et âgés de 6 mois ou moins ou nés à 35 sAG ou moins et atteints d'une DBP et âgés de moins de 2 ans) en 1999 et en 2000. Quinze (15) ÉI jugés comme étant potentiellement liés au PVZ ont été recensés : apnée (n = 3), fièvre (n = 3), douleur au site d'injection (n = 2), hyperventilation (n = 2) et asthénie, vomissements, bronchite, toux, urticaire (1 cas chacun). Aucun ÉIG n'a été recensé. Les chercheurs ont dénombré 10 décès dont aucun n'a été attribué au PVZNote de bas de page 227. Une étude d'observation prospective multicentrique réalisée ultérieurement en France a fait état d'ÉIG chez 1 371 personnes ayant reçu 6 257 doses de PVZ. Aucun ÉIG n'a été jugé comme étant lié au PVZ. Six décès ont été recensés dont aucun n'était attribuable au PVZNote de bas de page 228. Une étude d'observation prospective multicentrique menée au Japon a suivi 304 enfants âgés de moins de 24 mois ayant reçu du PVZ de 2013 à 2015. Les enfants étaient immunodéprimés ou atteints du syndrome de Down. Au total, 220 ÉI sont survenus chez 99 enfants, dont 33 ÉI chez 25 enfants (8 %) ont été considérés comme étant éventuellement liés au PVZ : pneumonie (3), infection par le VRS (3), autres infections (11), inflammation des VR supérieures (5), asthme (1), diarrhée (2) et divers (8). En tout, 89 ÉIG sont survenus chez 53 patients. Parmi ceux-ci, 8 ÉIG survenus chez 7 patients (2,3 %) ont été considérés comme étant liés au PVZ (pneumonie [4], infection par le VRS [2] et bronchite et inflammation des VR supérieures [1 chacun]). Pour 5 autres ÉIG survenus chez 4 patients (choc septique, infection liée à un dispositif, asthme, lésion hépatique liée au médicament, néphroblastome), le lien avec le PVZ était considéré comme étant indéterminable. Le traitement par PVZ a été interrompu pour cause d'ÉI chez 7 patientsNote de bas de page 229. Une étude d'observation prospective multicentrique menée en Espagne auprès de 1 919 nourrissons prématurés nés à 32 sAG ou moins et âgés de 6 mois ou moins n'a signalé aucun décès lié au PVZNote de bas de page 46.
Dans 7 études d'observation prospectives de plus petite taille, un total de 560 nourrissons ont reçu du PVZ; aucun ÉIG lié au PVZ n'a été signaléNote de bas de page 44 Note de bas de page 230 Note de bas de page 231 Note de bas de page 232 Note de bas de page 233 Note de bas de page 234 Note de bas de page 235.
Une étude d'observation rétrospective multicentrique réalisée en Pologne a fait état de 3 241 doses de PVZ administrées à 1 021 enfants. Les chercheurs ont recensé 108 ÉI survenus chez 84 patients sous PVZ (8,2 %), les plus fréquents étant la nervosité (40), la fièvre (24), les réactions au site d'injection (15), la diarrhée (4) et les vomissements (4). Il n'a pas été précisé si les ÉI indiqués étaient des ÉIG, ni s'ils avaient un lien avec le PVZ. De même, les décès ou les arrêts du traitement par PVZ pour cause d'ÉI n'ont pas été précisésNote de bas de page 236. Une étude descriptive rétrospective/prospective monocentrique réalisée au Qatar n'a fait état d'aucun ÉI et d'aucun décès attribuable au PVZ chez 429 nourrissons prématurés nés à 35 sAG ou moins et âgés de 6 mois ou moins ou de 2 ans ou moins, et atteints d'une MPC ou d'une CPCHSNote de bas de page 237. Une étude rétrospective multicentrique menée au Canada, portant sur 187 enfants atteints de FK et âgés de moins de 2 ans, n'a fait état d'aucun ÉIG lié au PVZNote de bas de page 77. Une étude de cohorte rétrospective monocentrique menée en Corée, portant sur 75 nourrissons prématurés nés à 35 sAG ou moins et âgés de 2 ans ou moins, et atteints d'une MPC, a fait état de 3 réactions au site d'injection et d'aucun symptôme d'évènement systémique, respiratoire ou gastro-intestinaNote de bas de page 238.
Deux études portant sur des enfants ayant reçu du PVZ pendant une ou deux saisons n'ont observé aucune différence dans la fréquence ou les types d'ÉI entre la 1 et la 2 saison; toutefois, le nombre de sujets était faible (1 saison : 103; 2 saison : 119)Note de bas de page 231 Note de bas de page 232.
3.1.4. Études de cas d'évènements indésirables graves attribués au PVZ
Une étude de cas a décrit une anaphylaxie non mortelle survenue 20 minutes après l'administration d'une dose de PVZNote de bas de page 239. L'enfant avait reçu 5 doses de PVZ pendant la saison précédente et une dose antérieure pendant la saison en cours. Les cas d'anaphylaxie signalés sont rares. En 2002, les fabricants ont signalé 2 cas d'anaphylaxie après l'administration de 2 000 000 doses de PVZNote de bas de page 240.
Dans une autre étude de cas, un enfant a développé une apnée, une bradycardie et une désaturation en oxygène 8 heures après l'administration de la 1 dose de PVZ. D'après l'analyse de ses prélèvements réalisés à l'aide d'un écouvillon nasopharyngé, l'enfant était porteur du virus parainfluenza 1 et d'un rhinovirus/entérovirus. L'examen des données signalées à la Drug Commission of the German Medical Association de 1998 à 2017 a révélé 93 cas d'apnée/bradycardie, de désaturation ou d'évènements cardiorespiratoires après l'administration du PVZ, tous ayant été associés à une infection concomitante, sauf 29. Les chercheurs ont recensé 3 cas mortels d'évènements cardiorespiratoires dans les 48 heures suivant l'administration du PVZ, tous sans infection concomitante mais tous avec une CPC sévère. Les auteurs ont conclu que l'insuffisance des renseignements ne permettait pas d'évaluer l'association d'évènements cardiorespiratoires après l'administration du PVZNote de bas de page 241.
3.1.5. Détection et signification clinique des anticorps anti-palivizumab
Dans une étude antérieure, des anticorps anti-PVZ ont été décelés chez 1,2 % des patients sous PVZ et 2,8 % des patients sous placebo, ce qui indique que la liaison du PVZ aux anticorps n'était pas spécifiqueNote de bas de page 48. Dans des études ultérieures, des anticorps anti-PVZ ont été décelés chez 1,5 à 5,9 % des patients sous PVZNote de bas de page 212 Note de bas de page 213 Note de bas de page 216 Note de bas de page 230 Note de bas de page 231 Note de bas de page 232. Les anticorps étaient généralement présents de façon passagère et à de faibles niveaux et aucune augmentation n'a été observée lors de l'administration des doses ultérieures, ni aucune différence dans les réponses entre la 1 et la 2 année d'exposition au PVZNote de bas de page 231 Note de bas de page 232. Les anticorps anti-PVZ n'étaient pas associés à la présence ou au type d'ÉI, y compris les réactions potentiellement à médiation immunitaire, et n'ont pas influé sur les niveaux de PVZ.
3.2 Données du Programme Canada Vigilance
Au total, 259 cas uniques d'ÉI ont été recensés après l'administration du PVZ jusqu'au 31 décembre 2018, parmi lesquels 237 ont été considérés comme étant graves. Les évènements les plus fréquents étaient d'ordre respiratoire (137 patients, 53 % dont 113 ont eu des infections), principalement rapportés en raison de l'échec du PVZ, suivis de réactions d'hypersensibilité (23 patients, 9 %). Les autres évènements rapportés sont des complications attendues des affections sous-jacentes pour lesquelles le PVZ est recommandé et sont conformes à ceux rapportés dans la monographie du produit. Le rôle du PVZ dans ces ÉI est inconnu, car la causalité n'a pas été évaluée.
4. Résumé
Les ÉI les plus fréquemment signalés et considérés comme étant liés au PVZ étaient les suivantes : réactions au niveau du site d'injection, fièvre, nervosité ou irritabilité, toux, rhinite et diarrhée. Les ÉIG liés au PVZ étaient rares. Ils ont été signalés chez 1 % ou moins des patients, la plupart des études n'en ayant signalé aucun. La plupart étaient des réactions d'hypersensibilité. Trois cas d'anaphylaxie ont été identifiés. L'arrêt de l'administration du PVZ pour cause d'ÉI a été décidé pour 0-2,3 % des receveurs. Aucun décès n'a été attribuable au PVZ.
Les injections répétées d'un anticorps monoclonal humanisé suscitent des inquiétudes quant au développement d'une maladie à médiation immunitaireNote de bas de page 217 Note de bas de page 242. Les études n'ont montré aucune augmentation du risque de maladie auto-immune ou d'atopie chez les enfants exposés au PVZ.
Tableau A : Stratégie et résultats de recherche
Medline
Base(s) de données : Ovid MEDLINE(R) ALL, de 1946 au 23 avril 2019
Stratégie de recherche :
| Numéro | Recherches | Résultats |
|---|---|---|
| 1 | palivizumab/ | 688 |
| 2 | anticorps att., monoclonaux/ et (vaccins contre le virus respiratoire syncytial/ ou virus respiratoire syncytial, humain/ ou infections par le virus respiratoire syncytial/) | 863 |
| 3 | (palivizumab* ou MEDI 493 ou anticorps monoclonal MEDI-493 ou anticorps monoclonal MEDI 493 ou anticorps monoclonal MEDI493 ou MEDI-493 ou MEDI493 ou Synagis ou Abbosynagis ou Synagys ou ([virus respiratoire syncytial* ou VRS] adj5 monoclonal*).ti,kf,kw. | 600 |
| 4 | (palivizumab* ou MEDI 493 ou anticorps monoclonal MEDI-493 ou anticorps monoclonal MEDI 493 ou anticorps monoclonal MEDI493 ou MEDI-493 ou MEDI493 ou Synagis ou Abbosynagis ou Synagys ou ([virus respiratoire syncytial* ou vrs] adj5 monoclonal*).ab. /freq=2 | 556 |
| 5 | 1 ou 2 ou 3 ou 4 [palivizumab] | 1141 |
| 6 | décès/ ou « effets secondaires et réactions indésirables liés aux médicaments » att./ ou surveillance att. du produit, post-commercialisation/ ou évaluation des risques/ ou facteurs de risques/ ou innocuité/ anomalies att., induites par le médicament/ ou tests de toxicité/ ou allergènes/ ou hypersensibilité att./ ou mutagenèse att./ ou interactions aliments-médicaments att./ ou interactions herbes-médicaments att./ ou mortalité liée au médicament/ | 1755435 |
| 7 | (postcommercialisation ou post-commercialisation ou évènements indésirables ou anaphylaxie* ou complication? ou dermatite* ou hypersensibilité* ou préjudice ou préjudice ou nocif ou intolérance* ou tolérance* ou effets toxiques* ou urticaire ou poison* ou cardiotoxicité* ou cytotoxicité* ou dermatotoxicité* ou dermotox* ou embryotox* ou fetotox* ou genotox* ou hepatotox* ou immunotox* ou maternotox* ou nephrotox* ou neurotox* ou ototoxique* ou iatrogène* ou tératogène* ou mutagène* ou carcinome* ou décès* ou mortalité* ou danger* ou létal* ou « potentiellement mortel » ou mortel* ou sûr ou innocuité ou dangereux ou (secondaire ou involontaire ou non intentionnel ou indésirable ou inattendu ou indésirable ou grave* ou sévère ou allergique ou allergie) adj3 (effet* ou évènement* ou incidence* ou interaction* ou résultat* ou réaction* ou réponse*).ti,kf,kw. | 1746562 |
| 8 | (postcommercialisation ou post-commercialisation ou évènements indésirables ou anaphylaxie* ou complication? ou dermatite* ou hypersensibilité* ou préjudice ou préjudice ou nocif ou intolérance* ou tolérance* ou effets toxiques* ou urticaire ou poison* ou cardiotoxicité* ou cytotoxicité* ou dermatotoxicité* ou dermotox* ou embryotox* ou fetotox* ou genotox* ou hepatotox* ou immunotox* ou maternotox* ou nephrotox* ou neurotox* ou ototoxique* ou iatrogène* ou tératogène* ou mutagène* ou carcinome* ou décès* ou mortalité* ou danger* ou létal* ou « potentiellement mortel » ou mortel* ou sûr ou innocuité ou dangereux ou (secondaire ou involontaire ou non intentionnel ou indésirable ou inattendu ou indésirable ou grave* ou sévère ou allergique ou allergie) adj3 (effet* ou évènement* ou incidence* ou interaction* ou résultat* ou réaction* ou réponse*).ab. /freq=2 | 2287607 |
| 9 | 6 ou 7 ou 8 [évènements indésirables] | 4455565 |
| 10 | 5 et 9 | 398 |
| 11 | limite 10 à yr = « 2013-À présent » | 150 |
Embase
Base(s) de données : Embase, de 1974 au 23 avril 2019
Stratégie de recherche :
| Numéro | Recherches | Résultats |
|---|---|---|
| 1 | *palivizumab/ | 817 |
| 2 | *anticorps monoclonal/ et (*infection par le virus respiratoire syncytial/ ou *vaccin contre le virus respiratoire syncytial/ ou *virus respiratoire syncytial humain att./) | 48 |
| 3 | (palivizumab* ou MEDI 493 ou anticorps monoclonal MEDI-493 ou anticorps monoclonal MEDI 493 ou anticorps monoclonal MEDI493 ou MEDI-493 ou MEDI493 ou Synagis ou Abbosynagis ou Synagys ou (virus respiratoire syncytial* ou vrs) adj5 monoclonal*)).ti,kw. | 934 |
| 4 | (palivizumab* ou MEDI 493 ou anticorps monoclonal MEDI-493 ou anticorps monoclonal MEDI 493 ou anticorps monoclonal MEDI493 ou MEDI-493 ou MEDI493 ou Synagis ou Abbosynagis ou Synagys ou ([virus respiratoire syncytial* ou vrs] adj5 monoclonal*).ab. /freq=2 | 808 |
| 5 | 1 ou 2 ou 3 ou 4 [palivizumab] | 1317 |
| 6 | *Décès att./ ou *innocuité du médicament/ ou *surveillance post-commercialisation att./ ou *évaluation des risques/ ou *facteur de risque/ ou *innocuité/ ou *toxicité pour le développement/ ou *toxicité att. pour la reproduction/ ou *étude de toxicité att./ ou *tests de toxicité/ ou *toxicologie/ ou *« toxicité et intoxication att. »/ ou *paramètres toxicologiques att./ or *substance toxique att./ ou *allergénicité att./ ou *carcinogénicité att./ ou *mutagénicité att./ ou *mutagénèse/ ou *contre-indication médicamenteuse att./ or *effet des médicaments/ or *réaction indésirable des médicaments att./ ou *« toxicité et intoxication médicamenteuse » att./ ou *interaction aliments-médicaments/ ou *interactions herbes-médicaments/ ou *effet secondaire att./ | 1204250 |
| 7 | (postcommercialisation ou post-commercialisation ou évènements indésirables ou anaphylaxie* ou complication? ou dermatite* ou hypersensibilité* ou préjudice ou préjudice ou nocif ou intolérance* ou tolérance* ou effets toxiques* ou urticaire ou poison* ou cardiotoxicité* ou cytotoxicité* ou dermatotoxicité* ou dermotox* ou embryotox* ou fetotox* ou genotox* ou hepatotox* ou immunotox* ou maternotox* ou nephrotox* ou neurotox* ou ototoxique* ou iatrogène* ou tératogène* ou mutagène* ou carcinome* ou décès* ou mortalité* ou danger* ou létal* ou « potentiellement mortel » ou mortel* ou sûr ou innocuité ou dangereux ou (secondaire ou involontaire ou non intentionnel ou indésirable ou inattendu ou indésirable ou grave* ou sévère ou allergique ou allergie) adj3 (effet* ou évènement* ou incidence* ou interaction* ou résultat* ou réaction* ou réponse*).ti,kw. | 2146080 |
| 8 | (postcommercialisation ou post-commercialisation ou évènements indésirables ou anaphylaxie* ou complication? ou dermatite* ou hypersensibilité* ou préjudice ou préjudice ou nocif ou intolérance* ou tolérance* ou effets toxiques* ou urticaire ou poison* ou cardiotoxicité* ou cytotoxicité* ou dermatotoxicité* ou dermotox* ou embryotox* ou fetotox* ou genotox* ou hepatotox* ou immunotox* ou maternotox* ou nephrotox* ou neurotox* ou ototoxique* ou iatrogène* ou tératogène* ou mutagène* ou carcinome* ou décès* ou mortalité* ou danger* ou létal* ou « potentiellement mortel » ou mortel* ou sûr ou innocuité ou dangereux ou (secondaire ou involontaire ou non intentionnel ou indésirable ou inattendu ou indésirable ou grave* ou sévère ou allergique ou allergie) adj3 (effet* ou évènement* ou incidence* ou interaction* ou résultat* ou réaction* ou réponse*).ab. /freq=2 | 3293097 |
| 9 | 6 ou 7 ou 8 [évènements indésirables] | 4866691 |
| 10 | 5 et 9 | 302 |
| 11 | limite 10 à yr = « 2013-À présent » | 131 |
Figure 1 : Diagramme de flux PRISMA du processus de sélection des études pour la revue de la littérature sur la sécurité du PVZ
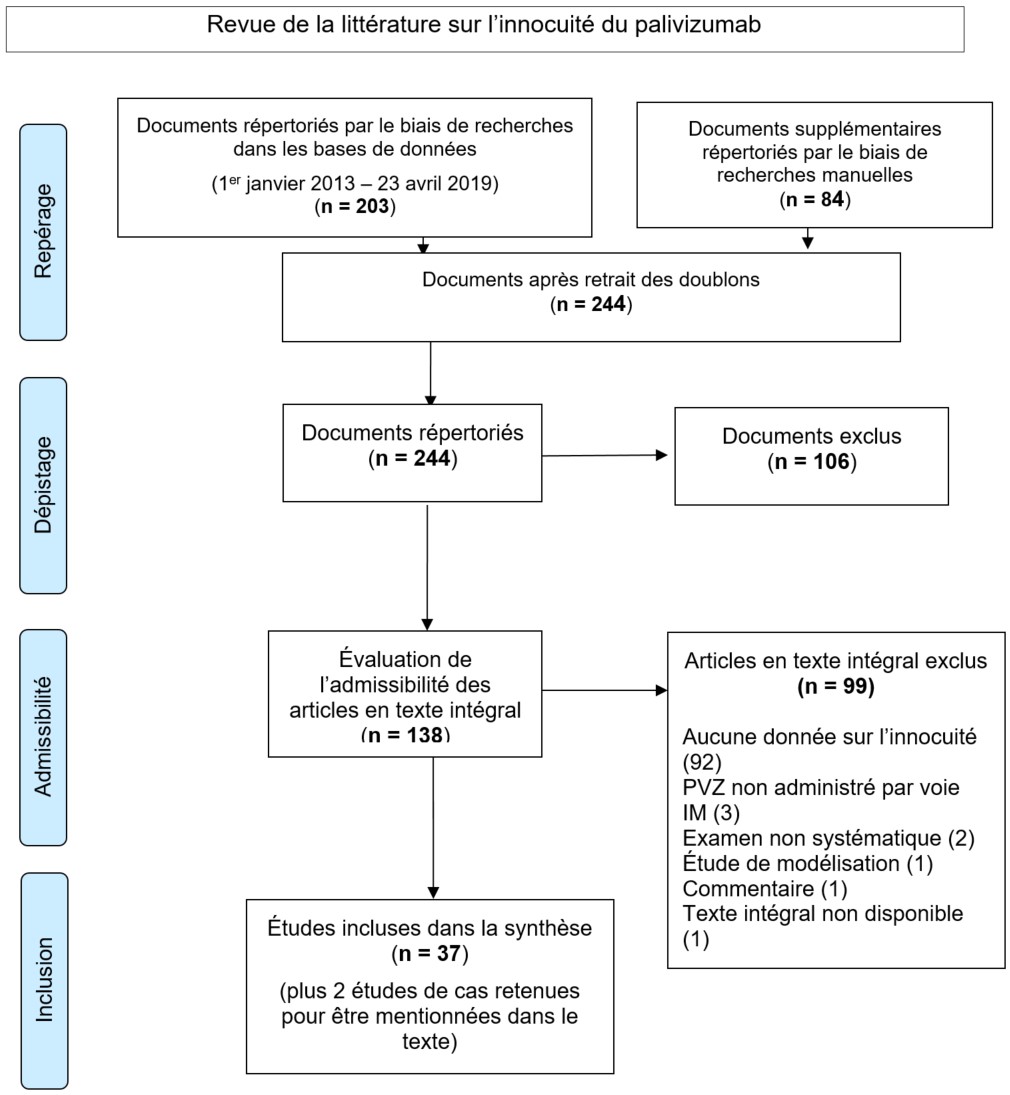
Figure 1 : Texte descriptif
Abréviations : PRISMA : preferred reporting items for systematic review and meta-analyses; PVZ : palivizumab; II : injection intramusculaire
Le diagramme de flux PRISMA décrit le processus par lequel les articles ont été sélectionnés pour la revue de la littérature sur la sécurité du PVZ. Le processus est composé de quatre étapes : Identification, examen, admissibilité et inclusion.
Étape 1 : Identification
- 203 enregistrements ont été identifiés par la recherche dans la base de données du 1er janvier 2013 au 23 avril 2019, 84 enregistrements ont été identifiés par la recherche manuelle.
- Il restait 244 enregistrements après la suppression des doublons.
Étape 2 : Examen
- 224 dossiers ont ensuite été examinés.
- Sur ces 224 enregistrements, 106 ont été exclus.
Étape 3 : Admissibilité
- 138 articles complets ont été évalués pour leur admissibilité.
- Sur ces 138 articles en texte intégral, 99 ont été exclus. La répartition des exclusions est la suivante : 92 ne portaient pas sur les données de sécurité, 3 ne portaient pas sur le PVZ administré par injection intramusculaire, 2 étaient des examens non systématiques, 1 était une étude de modélisation, 1 était un commentaire et pour 1 étude le texte intégral n'était pas disponible.
Étape 4 : Inclusion
- 37 articles ont été inclus.
- 2 rapports de cas ont été retravaillés pour être mentionnés dans le texte.
Tableau B : Niveau de données probantes selon la méthodologie de la recherche et de la cote de qualité des données probantes (validité interne)
| Niveau | Description |
|---|---|
| I | Données probantes provenant d'un ou de plusieurs essais contrôlés randomisés. |
| II-1 | Données probantes provenant d'un ou de plusieurs essais contrôlés sans randomisation. |
| II-2 | Données probantes obtenues dans le cadre d'études analytiques de cohortes ou cas-témoins, réalisées de préférence dans plus d'un centre ou par plus d'un groupe de recherche utilisant des indicateurs cliniques de résultats de l'efficacité potentielle du vaccin. |
| II-3 | Données probantes obtenues à partir de plusieurs séries chronologiques avec ou sans intervention. Les résultats spectaculaires obtenus dans un contexte non contrôlé (comme les résultats de l'introduction de la pénicilline dans les années 1940) pourraient aussi être considérés comme faisant partie de ce type de données probantes. |
| III | Opinions d'autorités respectées fondées sur des expériences cliniques, études descriptives et études de cas ou rapports de comités d'experts. |
| Cote de qualité | Description |
|---|---|
Bonne |
Une étude (y compris les méta-analyses ou les examens systématiques) qui répond bien à tous les critères relatifs à la méthodologieTableau B2 Note de bas de page *. |
Passable |
Une étude (y compris les méta-analyses ou les examens systématiques) qui ne répond pas (ou ne répond pas clairement) à au moins l'un des critères relatifs à la méthodologieTableau B2 Note de bas de page * , mais ne comporte aucune « lacune fatale » connue. |
Faible |
Une étude (y compris les méta-analyses ou les examens systématiques) ayant au moins une « lacune fatale » propre à la méthodologieTableau B2 Note de bas de page * ou une accumulation de lacunes moins importantes ne permettant pas de formuler des recommandations à partir des résultats de l'étude. |
|
|
Tableau C : Résumé des données probantes liées à l'innocuité du palivizumab
Ordre d'énumération : examens systématiques (par ordre alphabétique), suivis d'études individuelles par ordre décroissant selon le niveau de données probantes, puis la qualité des données probantes, puis par ordre alphabétique
| DÉTAILS DE L'ÉTUDE | RÉSUMÉ | ||||
|---|---|---|---|---|---|
| Étude | Plan de l'étude | Participants | Résumé des principaux résultats | Niveau des données probantes | Qualité |
Robinson et al. 2016Note de bas de page 140 Financement de l'ECR initial : Industrie Financement de l'examen : |
Examen systématique des ECR : un ECR répertorié 1998-2001 Répartition aléatoire selon un rapport 1:1 dans le groupe sous PVZ 15 mg/kg ou dans le groupe placebo tous les mois x 5 mois |
Enfants atteints de FK âgés de < 2 ans PVZ : 92 96 % ont reçu les 5 doses |
Un seul ECR répertorié : Cohen et al. 2005. Les auteurs de l'examen systématique ont obtenu des renseignements supplémentaires auprès des auteurs. Suivi jusqu'à 150 jours (30 jours après la dernière dose) Tout ÉI: ÉI connexes: Tout ÉIG: ÉIG connexes: Aucun détail fourni sur les évènements |
I |
Bonne Évaluée à l'aide d'AMSTAR (8/10) |
Wegzyn et al., 2014Note de bas de page 211 Financée par AbbVie Inc. |
Examen systématique d'ECR et d'études d'observation prospectives 1996-2013 Comparaison de la prophylaxie par PVZ à l'absence d'intervention |
Enfants nés à 35 sAG ou moins OU présentant une MPC ou une CPC |
Examen systématique sans méta-analyse. Chaque étude sur l'innocuité du PVZ répertoriée dans cet examen est présentée séparément dans ce tableau, par auteur. Les résultats des études suivantes sont présentés ailleurs dans ce tableau :
(données de l'examen systématique non utilisées) |
Pas d'évalua-tion selon les méthodes du CCNI |
Moyenne Évaluation à l'aide d'AMSTAR) |
Blanken et al., 2013Note de bas de page 111 Financement : |
ECR Avr. 2008 – Répartition aléatoire selon un rapport 1:1 dans le groupe sous PVZ (15 mg/kg) ou le groupe placebo pendant la saison hivernale |
Nourrissons prématurés autrement en bonne santé, nés à 33-35 sAG et âgés de ≤ 6 mois au début de la saison du VRS PVZ : 214 Injections médianes = 4 dans chaque groupe |
Suivi jusqu'à l'âge de 1 an (tenue, par les parents, d'un journal quotidien) Hospitalisations: Nombre d'enfants hospitalisés: Nombre d'hospitalisations: Infection par le VRS: Autre maladie respiratoire: Gastro-entérite: Chirurgie: Retard staturo-pondéral: Autre: Nombre d'hospitalisations hors VRS: 41 (19,1 %)** * p = 0,04 ** p = 0,16 |
I |
Passable (Vérification limitée des ÉI) |
Carbonell-Estrany et al. 2010Note de bas de page 214 Promoteur : MedImmune |
ECR Saisons du VRS : nov. 2004 - mai 2006 Répartition aléatoire selon un rapport 1:1 (15 mg/kg de PVZ ou MVZ) à 30 jours d'intervalle |
Nourrissons prématurés nés à 35 sAG ou moins et âgés de ≤ 6 mois OU PVZ : 3 298 MVZ : 3 315 |
Suivi pendant 150 jours après la randomisation (30 jours après la dernière dose prévue) Évènement: ≥ 1 ÉI: Troubles psychiatriques*: Affections de la peau et du tissu sous-cutané ***: Réaction au site d'injection: ≥ 1 ÉI, le niveau 3 correspondant à la sévérité maximale.: ≥ 1 ÉI de niveau 4: ≥ 1 ÉIG : ≥ 1 ÉI entraînant l'arrêt du traitement: * agitation, somnolence, instabilité et irritabilité; |
I |
Bonne Lien entre les ÉI et le médicament à l'étude non précisé |
Feltes et al. 2003Note de bas de page 80 Appuyée par MedImmune |
ECR 1998-2002 Répartition aléatoire selon un rapport 1:1 dans le groupe sous PVZ (15 mg/kg) ou dans le groupe placebo tous les 30 jours; total de 5 doses |
Nourrissons âgés de ≤ 24 mois présentant une PVZ : 639 Placebo : 648 |
Suivi jusqu'à 150 jours (30 jours après la dernière dose prévue). Toute modification défavorable de l'état de santé de l'enfant signalée et évaluée par un chercheur en aveugle afin de déterminer le lien avec le médicament à l'étude. Définition des ÉI et des ÉIG 3,3 % des enfants sous PVZ, 4,2 % des enfants sous placebo sont décédés; aucun décès n'a été attribué au PVZ. Catégorie d'ÉI: Nombre d'ÉI Catégorie d'ÉI: Nombre d'enfants présentant des ÉI Catégorie d'ÉI: Évènements cardiovasculaires Catégorie d'ÉI: Système respiratoire Catégorie d'ÉI: Intervention médicale nécessaire Catégorie d'ÉI: ÉIG Catégorie d'ÉI: Décès Catégorie d'ÉI: ÉI connexes Catégorie d'ÉI: ÉI connexe entraînant un arrêt définitif Catégorie d'ÉI: ÉIG connexes * Lorsque les ÉIG signalés pendant les HVRS ont été retirés de l'analyse, la valeur p était de 0,043. |
I |
Bonne |
Feltes et al. 2011Note de bas de page 216 Appuyée par MedImmune |
ECR Étude de non-infériorité comparant le MVZ au PVZ Répartition aléatoire selon un rapport 1:1 dans le groupe sous PVZ ou dans le groupe sous MVZ (15 mg/kg) tous les 30 jours; total de 5 doses |
Enfants âgés de ≤ 24 mois présentant une MVZ : 624 |
Suivi jusqu'à 150 jours (30 jours après la dernière dose). Toute modification défavorable de l'état de santé de l'enfant signalée et évaluée par un chercheur en aveugle afin de déterminer le lien avec le médicament à l'étude. Définition des ÉI et des ÉIG Résultat, n (%): ≥ 1 ÉI: ≥ 1 ÉI connexe: ≥ 1 ÉIG: ≥ 1 ÉIG connexe: ≥ 1 ÉI connexe entraînant l'arrêt du médicament à l'étude: Décès**: * Éruption cutanée maculopapulaire |
I |
Bonne |
Fernandez et al. 2010Note de bas de page 215 Financée par MedImmune |
ECR 2006-2007 MVZ (M) ou PVZ (P) |
Nourrisson prématuré né à 35 sAG ou moins et âgé de ≤ 6 mois OU MMPPP : 83 PPMMM : 84 MMMMM : 93 (les données du dernier groupe n'ont pas été extraites) |
Suivi de la randomisation jusqu'au jour 150 de l'étude ÉI (n) : MVZ Sujets présentant ≥ 1 ÉI: MVZ ≥ 1 ÉI connexe: MVZ ≥ 1 ÉIG: MVZ ≥ 1 ÉIG connexe: MVZ ÉI ayant entraîné l'arrêt du traitement: MVZ Décès: MVZ * Syndrome de Lyell staphylococcique |
I |
Bonne |
IMpact-RSV Study Group 1998Note de bas de page 48 Financement : non indiqué; contributions de MedImmune |
ECR Saison des infections par le VRS 1996-1997 Randomisés selon un rapport de 2:1 entre une dose de 15 mg/kg de PVZ ou un placebo tous les 30 jours; total de 5 doses |
Enfants nés à 35 sAG ou moins et âgés de ≤ 6 mois au début de la saison des infections par le VRS. |
Suivi pendant 150 jours à partir de la randomisation (30 jours après la dernière injection prévue) Nombre d'enfants ayant signalé un ÉI jugé par le chercheur en aveugle comme étant lié au médicament à l'étude : placebo (10 %), PVZ (11 %). L'interruption des injections en raison d'ÉI liés au PVZ a été rare (0,3 %). Les réactions au site d'injection étaient caractérisées par un érythème, une douleur, une induration et un gonflement et des ecchymoses. Elles étaient généralement légères et de courte durée; aucune n'était grave. Évènement: Fièvre: Nervosité: Réaction au site d'injection: Diarrhée: Éruption cutanée: Augmentation de l'AST: IVRS: Fonction hépatique anormale† : Augmentation de l'ALT: Vomissements: Toux: Rhinite: Abréviations : AST, aspartate aminotransférase; IVRS, infection des voies respiratoires supérieures; ALT, alanine aminotransférase † Se réfère principalement à l'élévation des taux d'AST et d'ALT |
I |
Bonne |
Makari et al. 2014Note de bas de page 212 Financement de MedImmune |
ECR 2005 à 2007 Randomisés selon un rapport de 1:1 avec une dose de 15 mg/kg de PVZ en formulation liquide ou lyophilisée tous les 30 jours pendant 5 mois |
Enfants atteints d'une MPC âgés de ≤ 24 mois OU nés à 35 sAG ou moins et âgés de ≤ 6 mois 211 ont reçu une formulation liquide |
Surveillé jusqu'au jour 150 (seuls les ÉIG ont été signalés) ÉIG (n, 9 %) Sujets avec ≥ 1 ÉIG: ÉIG: Bronchiolite: Détresse respiratoire: Autre maladie respiratoire: Infection virale: Autre infection: Gastro-entérite: Déshydratation: Malformations: Convulsions: Divers*: *Hernie inguinale (2), hernie ombilicale, retard staturo-pondéral, fissure anale, reflux gastro-œsophagien, hydronéphrose (1 chacun) |
I |
Bonne |
Robbie et al. 2014Note de bas de page 213 Appuyée par MedImmune |
Phase 2 de l'ECR avec schéma d'expériences croisées États-Unis (21 sites) Randomisés selon un rapport de 1:1 avec une dose de 15 mg/kg de PVZ en formulation liquide ou lyophilisée le jour 0; passage à l'autre formulation le 30 jour, une dose |
Nourrissons âgés de ≤ 6 mois nés à 35 sAG ou moins. PVZ en formulation liquide jour 0 : 75 |
Suivi 30 jours après chaque dose de l'étude (Après le 60e jour, les participants ont reçu le PVZ en formulation lyophilisée pour le reste de la saison). ÉI, n (%) Nourrissons avec ≥ d'ÉI: Nombre d'ÉI: ÉI liés au PVZ: Fièvre: Injection: Pneumonie: Nourrissons avec ≥ d'ÉIG: Nombre d'ÉIG: VRS: Fièvre: Gastro-intestinal: Pneumonie: Apnée: Déshydratation: IVU: ÉIG liés au PVZ: |
I |
Bonne |
Haerskjold et al. 2016Note de bas de page 217 Financée par AbbVie |
Étude de cohorte basée sur une population 1999 à 2010 |
1 351 265 en-fants Exposé au PVZ : (nouveau-né prématuré, enfants atteints de DBP, enfants atteints d'une CPCHS) Doses moyennes de PVZ : Suède 5,4 |
Suivi jusqu'au 31 déc. 2010 au Danemark et jusqu'au 31 déc. 2011 en Suède Le risque de maladie auto-immune n'a pas augmenté de manière importante après une exposition au PVZ (rapport de risque ajusté pour l'âge et le pays : 1,54; IC à 95 % : 0,80 à 2,95). Non exposés : 0,54 % des enfants suédois et 0,60 % des enfants danois ont développé une maladie auto-immune. Exposés : 9 enfants sur 1 192 ont développé une maladie auto-immune (0,76 %). Maladie cœliaque (4), diabète sucré (2), maladie inflammatoire de l'intestin (2), polyarthrite juvénile (1) |
II-2 |
Bonne |
Haerskjold et al. 2017Note de bas de page 218 Financée par AbbVie |
Étude de cohorte basée sur une population 1999 à 2010 Données des registres nationaux de santé |
1 351 265 en-fants Exposé au PVZ : (nouveau-né prématuré, enfants atteints de DBP, enfants atteints d'une CPCHS) Doses moyennes du PVZ : |
Suivi jusqu'à l'âge de 4 ans ou la fin de l'étude, selon la première éventualité |
II-2 |
Bonne |
Abushahin et al. 2018Note de bas de page 237 Financement non précisé |
Étude de cohorte descriptive à centre unique 3 à 5 doses de 15 mg/kg de PVZ par mois |
Enfants nés à 35 sAG ou moins et âgés de < 6 mois OU nés à 35 sAG ou moins et âgés de ≤ 2 ans et atteints de DBP ou d'une CPCHS. n = 429 |
Suivi mensuel pendant le traitement au PVZ et pendant 30 jours après la dernière dose Enregistrement des ÉI (anaphylaxie, fièvre, érythème, gonflement, éruption, toux, respiration sifflante, vomissements et/ou diarrhée) dans les 7 jours suivant l'injection Aucun ÉI et aucun décès lié au PVZ |
III |
S.O. |
al-Alaiyan et al. 2015Note de bas de page 230 Financée par AbbVie |
Étude d'observation prospective non comparative à centre unique Arabie saoudite 7 doses de 15 mg/kg de PVZ tous les 25 à 30 jours |
Enfants nés à 35 sAG ou moins et âgés de ≤ 6 mois OU enfants atteints d'une MPC et âgés de ≤ 24 mois n = 17 |
Suivi tous les 25 à 30 jours pendant 7 mois Total de 7 ÉI chez 5 patients (27,8 %); 6 ÉIG chez 4 patients ÉIG : bronchiolite : 3 (1 cas de VRS positif, 2 cas de VRS négatifs); pneumonie : 1; infection thoracique : 2 (VRS négatif dans les 2 cas) |
III |
S.O. |
Bjornson et al. 2018Note de bas de page 77 Financée par AbbVie |
Cohorte d'observation rétrospective comparative multicentrique À l'échelle de la province de l'Alberta (2 centres) 2000 à 2017 Une dose de 15 mg/kg de PVZ par mois |
267 enfants âgés de < 2 ans atteints de FK 183 receveurs du PVZ Moyenne de 4,4 ± 1,5 in-jections 84 participants n'ont pas reçu le PVZ. |
Examen des dossiers médicaux Aucun ÉIG n'a été lié au PVZ. |
III |
S.O. Les ÉI sont mentionnés dans le résumé et les méthodes mais pas dans les résultats. |
Borecka et al. 2016Note de bas de page 236 Financée par AbbVie |
Registre rétrospectif d'observation et multicentrique Pologne 2008-2009, 2009-2010 |
2008-2009 : 2009-2010 : 1 021 enfants 3 241 doses, moyenne de 3,2 ± 1,04 |
Examen des dossiers médicaux 75,5 % des enfants ont reçu toutes les injections prévues. Dans l'ensemble : 108 ÉI pour 3 241 doses (3,33 %) |
III |
S.O. Les méthodes de suivi des ÉI et leurs définitions ne sont pas précisées. |
Castillo et al. 2017Note de bas de page 226 Financée AbbVie |
Étude d'observation prospective non comparative à l'échelle internationale |
Enfants nés à 35 sAG ou moins OU atteints de DBP OU d'une CPCHS 458 enfants Total de 1 744 doses (moyenne de 3,8 ± 1,3 doses) |
Visites mensuelles pendant le traitement au PVZ; appels téléphoniques mensuels pendant un an après la première dose de PVZ 397 participants ont terminé le suivi d'un an. 1 165 ÉI |
III |
S.O. |
Chang et al. 2010Note de bas de page 238 Financement non précisé |
Cohorte rétrospective |
Enfants nés à 35 sAG ou moins atteints d'une MPC et âgés de < 2 ans n = 75 |
Aucun renseignement sur le suivi. Aucune définition des ÉI Enregistrement des ÉI dans les 7 jours suivant l'injection Un érythème et un gonflement au site d'injection ont été observés chez 3 patients et se sont résorbés dans les 3 jours. Aucun décès ni abandon signalés |
III |
S.O. |
Chen JJ et al. 2015Note de bas de page 170 Financée par AbbVie, MedImmune |
Registre d'observation prospective et multicentrique Canada Saisons des infections par le VRS 2008-2013 Doses de 15 mg/kg de PVZ à intervalles de 16 à 35 jours entre la 1 et la 2 dose et de 25 à 35 jours pour les doses suivantes |
Enfants prématurés nés à 35 sAG ou moins Total = 13 025 57 392 doses 92,7 % (±16,1 %) des injections prévues ont été administrées. |
Surveillance active des ÉIG, suivi mensuel jusqu'à 30 jours après la dernière dose de PVZ Nourrissons présentant un ÉIG lié au PVZ : Âge (m): 18 Âge (m): 0,7 Âge (m): 2,4 Âge (m): 7,3 Âge (m): 18 |
III |
S.O. |
Chi et al. 2014Note de bas de page 44 Financement : Subventions du Mackay Memorial Hospital de Taipei à Taïwan et de la Taïwan Foundation of Prematurity |
Étude d'observation prospective non comparative à centre unique Taïwan 2011- 2013 6 doses de 15 mg/kg de PVZ par mois |
Nourrissons nés à 28 sAG ou moins : 108 Total : 127 718 doses |
Suivi mensuel pendant le traitement au PVZ et par téléphone jusqu'à 12 mois après la première dose Évènements localisés : Érythème: Douleur: Évènements systémiques : Fièvre: Toux: Rhinorrhée: Vomissements: Diarrhée: Irritabilité: |
III |
S.O. |
Groothuis 2001Note de bas de page 224 Financée par les Laboratoires Abbott |
Étude d'observation prospective non comparative à l'échelle internationale 15 pays de l'hémisphère Nord Nov. 1998 à mars 1999 |
Enfants prématurés nés à 35 sAG ou moins, âgés de ≤ 6 mois OU atteints deDBP, âgés de ≤ 24 mois nécessitant une intervention médicale < dans les 6 derniers mois 565 participants inscrits, 530 ont terminé l'étude |
Suivi pendant un maximum de 150 jours (30 jours après la dernière dose) Abandon de l'étude pour cause d'ÉI : 11 cas. 3 cas possiblement ou probablement liés au PVZ : (désaturation en oxygène immédiatement après la 3 dose; gastro-entérite; œdème abdominal et périphérique) ≥ 1 ÉI:254 : ≥ 1 ÉI connexe:39 : Nombre d'ÉI connexe: Les ÉI connexes plus communs Réaction au site d'injection: Fièvre: Diarrhée: Nervosité/irritabilité: ÉIG connexes: |
III |
S.O. |
Groothuis 2003Note de bas de page 225 Appuyée par les Laboratoires Abbott |
Étude d'observation prospective non comparative à l'échelle internationale Europe (17 pays) et Arabie saoudite Oct. 2000 à avr. 2001 |
Enfants prématurés nés à 29-32 sAG sans MPC et âgés de < 6 mois au moment de l'inscription 285 partici-pants inscrits dont 24 n'ont pas terminé |
Suivi mensuel et 30 jours après la dernière dose Arrêt de l'administration du PVZ en raison d'ÉI chez 2 participants : trouble gastro-intestinal avec œdème périphérique et apnée, sévérité modérée, non lié au PVZ; fièvre durant 15 heures après la 3 dose de PVZ, sévérité modérée, probablement lié au PVZ ÉI les plus fréquents : rhinite (18 %), toux (10 %), fièvre (7 %), diarrhée, bronchiolite, pharyngite (5 % chacun). La majorité des ÉI étaient légers ou modérés. Évènement: Fièvre Évènement: Entérite Évènement: Bronchite et rhinite Évènement: Toux Évènement: Pneumonie bactérienne et conjonctivite Évènement: Bronchiolite, infection au VRS |
III |
S.O. |
Kashiwagi et al. 2018Note de bas de page 229 Financée par AbbVie |
Étude prospective multicentrique de surveillance postcommercia-lisation Déc. 2013 à déc. 2015 Une dose de 15 mg/kg de PVZ par mois pendant la saison des infections par le VRS |
Enfants âgés de < 24 mois recevant du PVZ |
Suivi jusqu'à 30 jours après la dernière dose ÉI : 220 (99 patients). 33 (25 patients) ont été considérés comme étant des effets indésirables des médicaments (EIM). EIM : 33 chez 25 patients (pneumonie 3, infection par le VRS 3, autres infections 11, inflammation des VR supérieures 5, asthme 1, diarrhée 2, divers 8) EIMG : 13 chez 11 patients Arrêt du traitement pour cause d'ÉI dans 7 cas. Un décès (choc septique) est mentionné mais le nombre total de décès n'est pas précisé. |
III |
S.O. |
Lacaze- Masmonteil et al. 2002Note de bas de page 227 Financement non précisé. Reconnu par Abbott France |
Étude d'observation prospective non comparative multicentrique France Sept. 1999 à janv. 2000 Une dose de 15 mg/kg de PVZ par mois pendant la saison des infections par le VRS |
Enfants prématurés nés à 32 sAG ou moins atteints de DBP et âgés de < 6 mois 547 inscrits; 516 ont reçu au moins 1 dose. |
Suivi jusqu'à 30 jours après la dernière dose de PVZ 10 décès (1,9 %) : insuffisance respiratoire aigüe chez les enfants atteints d'une MPC sévère du nouveau-né (5), obstruction de la canule de trachéotomie (2), arrêt cardiaque peropératoire, coqueluche, insuffisance cardiocirculatoire (1 chacun) Il y a eu 15 ÉI jugés par le médecin comme étant potentiellement liés au PVZ : Apnée: Fièvre: Douleur au site d'injection: Hyperventilation: Asthénie: Vomissements: Bronchite: Aggravation de la toux: Urticaire: Total des évènements: |
III |
S.O. |
Lacaze-Masmonteil et al. 2003Note de bas de page 231 Appuyée par les Laboratoires Abbott |
Étude d'observation prospective à l'échelle internationale Europe et Canada Saison des infections par le VRS 1999-2000 Une dose de 15 mg/kg de PVZ tous les 25 à 30 jours jusqu'à un maximum de 5 doses |
Enfants âgés de ≤ 2 ans nés à 35 sAG ou moins atteints de DBP ET nécessitant une prise en charge médicale au cours des 6 mois précédents OU jugés par le chercheur comme présentant un risque d'infection grave par le VRS |
Comparaison des évènements survenus au cours de la 1 saison et de la 2 saison du traitement au PVZ Aucun décès n'est survenu au cours de l'étude. Nombre de sujets ≥ 1 ÉI*:56 (41,8 %) ≥ 1 ÉIG**: ÉI ayant un lien probable ou possible avec le PVZ : Fièvre: Infection: Réaction au site d'injection: Diarrhée: Anorexie: Épistaxis: Ataxie: ÉIG: *La majorité des ÉI étaient d'une sévérité légère ou modérée (90 %) et sont considérés comme étant non liés au PVZ (92 %). |
III |
S.O. |
Manzoni et al. 2017Note de bas de page 221 Financée par AbbVie |
Registres d'observation prospective à l'échelle internationale Canada (CARESS) et Italie (nombre de sites non précisé) 2001 à 2014 Une dose de 15 mg/kg de PVZ par mois pendant la saison des infections par le VRS |
Nourrissons nés à 35 sAG ou moins et nourrissons atteints de maladies chroniques et admissibles au PVZ n = 14 468 |
Suivi mensuel 15 ÉIG chez 7 patients. Toutes des réactions d'hypersensibilité. ÉIG chez 49 autres patients non liés au PVZ Chevauchement considérable avec les données de CHEN ci-dessus |
III |
S.O. Chevauche-ment important avec les données de Chen et al. |
Mitchell et al. 2011Note de bas de page 219 Financement : Laboratoires Abbott |
Registre d'observation prospective et multicentrique Canada |
Enfants admissibles au PVZ : 5 286 Enfants prématurés seulement : 3 741 19 485 doses (3,7 ± 1,5) |
Suivi mensuel jusqu'à la fin de la saison des infections par le VRS 61 ÉIG, 56 = hospitalisations associées à une infection respiratoire |
III |
S.O. Peu de détails sur le suivi, pas de définition des ÉI, pas de détails sur les ÉI |
Mori et al. 2014Note de bas de page 234 Appuyée par AbbVie Inc. |
Étude prospective non comparative multicentrique Oct. 2011 à mars 2012 Une dose de 15 mg/kg de PVZ à intervalles de 30 jours pendant la saison des infections par le VRS, jusqu'à un maximum de 7 doses |
Enfants âgés de ≤ 24 mois présentant des états d'immunodé-pression 28 sujets Moyenne de 6,2 doses |
Suivi jusqu'à 30 jours après la dernière dose Les ÉI les plus fréquents, survenant chez ≥ 10 % des sujets, constituaient l'IVRS, la gastro-entérite et l'eczéma. La plupart des ÉIG ont été considérés comme étant légers ou modérés. Sujets présentant ≥ un ÉI : Sujets présentant ≥ un ÉIG: Bronchite: Gastro-entérite: Encéphalopathie, perforation gastrique: ÉIG au moins possiblement lié au PVZ : ÉI conduisant à l'arrêt du traitement: ÉI ayant entraîné le décès: *Encéphalopathie 104 jours (après la 4 dose de PVZ) |
III |
S.O. Peu de renseigne-ments sur le suivi |
Null et al. 2005Note de bas de page 232 Contributions de MedImmune |
Étude d'observation prospective des sujets d'un ECR antérieur É.-U., multicentrique (6) Saison des infections par le VRS 1997-1998 Une dose de 15 mg/kg de PVZ tous les 30 jours jusqu'à un maximum de 5 doses |
Participants : à partir de l'ECR IMpact de 1998 1 année 2 année |
Suivi ouvert de l'étude IMpact : prophylaxie de la deuxième saison Aucun décès Évènement: ÉI liés au PVZ Évènement: Douleur au site d'injection (légère) Évènement: Élévation légère ou modérée du taux d'AST ou d'ALT Évènement: Fièvre |
III |
S.O. |
Paes et al. 2012Note de bas de page 220 Financement : Laboratoires Abbott |
Registre prospectif et multicentrique Saisons des infections par le VRS 2006-2010 |
Nourrissons prématurés nés à 35 sAG ou moins sans maladie préexistante : 4 880 22 465 doses |
Des entretiens téléphoniques de suivi ont eu lieu tous les mois jusqu'à la fin de la saison des infections par le VRS. En cas d'hospitalisation, les dossiers hospitaliers ont été examinés. 8 nourrissons sont décédés au cours de l'étude pour des causes considérées comme étant non directement liées au PVZ. |
III |
S.O. Chevauche-ment avec les données de Chen |
Pedraz 2003Note de bas de page 46 Financement : Laboratoires Abbott |
Étude de cohorte d'observation prospective non interventionnelle et multicentrique Espagne 2000 à 2002 |
Enfants prématurés nés à 32 sAG ou moins et âgés de ≤ 6 mois n = 1 919 |
Suivi mensuel pendant le traitement au PVZ |
III |
S.O. |
Pinquier et al. 2009Note de bas de page 228 Financée par les Laboratoires Abbott |
Étude d'observation prospective non comparative multicentrique France Une dose de 15 mg/kg de PVZ tous les 31 jours ± 6 |
1 371 enfants : nés prématurés à 35 sAG ou moins : 878 6 257 doses |
Suivi un an après la première injection. Examen du dossier médical et appel téléphonique à 4,8 et 12 mois et visite à 12 mois 6 décès (affections cardio-respiratoires sous-jacentes [3], ENN [1], cause non précisée, tous 2 avec CPC [2]). Aucun décès attribué au PVZ 30 ÉIG signalés par les chercheurs comme étant probablement liés au PVZ (24 dans un seul centre). Principalement des symptômes respiratoires et ORL. L'examen anonyme de ces 30 ÉIG par le comité d'évaluation a conclu qu'il n'y avait pas de lien avec le PVZ. Aucun abandon pour cause d'ÉI |
III |
S.O. Les définitions des ÉI ne sont pas précisées, pas de détails sur les types d'ÉI. |
Saez-Llorens et al. 1998Note de bas de page 235 Financement non précisé |
Étude multinationale d'observation non comparative avec augmentation de la dose Année d'étude non précisée Une dose de 5 mg/kg, 10 mg/kg et 15 mg/kg de PVZ |
Nourrissons nés à 35 sAG ou moins et âgés de ≤ 6 mois OU atteints de DBP et âgés de ≤ 24 mois 5 mg/kg (11) (2 à 5 doses à 30 jours d'intervalle; total de 190 doses) |
Suivi aux jours 2, 14 et 30 après l'administration de la dose 2 décès non liés au PVZ 3 patients ont présenté des ÉI jugés par les chercheurs comme étant possiblement liés au médicament étudié : |
III |
S.O. |
Saji 2005Note de bas de page 243 Financement non mentionné |
Enquête multicentrique |
Nourrissons atteints de CPC Moyenne de 3,0 ± 1,4 doses |
Questionnaire aux institutions utilisant le PVZ Pas de détails sur le suivi ou les définitions des ÉI. Pas de classement en fonction de la sévérité ou de la gravité 9 ÉI chez 5 patients |
III |
S.O. Questionnaire non disponible; divergences dans les données des ÉI entre le texte et le tableau Données non incluses dans le texte ci-dessus |
Simon 2011Note de bas de page 222 Appuyée par Abbott GmbH et Co. Allemagne |
Registre d'observation prospective et multicentrique 2002 à 2007 Une dose de 15 mg/kg de PVZ par mois pendant la saison des infections par le VRS |
10 686 receveurs 49 608 doses |
Suivi jusqu'à 4 semaines après la dernière dose ÉIG signalés chez 22 patients (0,21 %) 3 décès : mort subite du nourrisson; fièvre avec diarrhée et détresse respiratoire; arrêt cardiaque chez un enfant souffrant d'une CPC complexe, évalué comme étant probablement non lié au PVZ (1) et non évaluable (2) |
III |
S.O. Aucune définition des ÉIG |
Simon 2018 (Klin Padiatr)Note de bas de page 223 Financée par AbbVie Deutschland GmbH & Co. |
Registre d'observation prospective et multicentrique Allemagne 2009 à 2016 Une dose de 15 mg/kg de PVZ par mois pendant la saison des infections par le VRS |
12 729 receveurs (enfants prématurés nés, atteints de DBP, atteints d'une CPCHS) Seules les données de la 1 saison pour chaque enfant ont été signalées. 63 572 doses Moyenne de 5,0 doses par patient |
Observé pendant le traitement au PVZ et jusqu'au 30 juin de cette saison des infections par le VRS 668 ÉIG signalés (105 pour 10 000 doses) Lien probable avec le PVZ : 8 cas (1,3 pour 10 000 doses) 9 décès. Aucun lié au PVZ |
III |
S.O. |
Simon et al. 2018 (Euro J Ped)Note de bas de page 244 Appuyée par AbbVie GmbH |
Registre prospectif et multicentrique 2009 à 2016 Une dose de 15 mg/kg de PVZ par mois pendant la saison des infections par le VRS |
Nourrissons atteints du syndrome de Down âgés de < 25 mois : 249 Moyenne de 5,0 doses |
Aucune description du suivi Syndrome de Down : En excluant les HVRS, la plupart des ÉIG (n = 20) constituaient hospitalisations liées à une infection des VR sans détection d'une infection au VRS. Aucun ÉIG n'a été lié de manière causale au PVZ. |
III |
S.O. La procédure de suivi n'est pas claire; données limitées sur les ÉIG. Données non incluses dans le texte ci-dessus |
Turti et al. 2012Note de bas de page 233 |
Étude prospective non comparative multicentrique Russie (19 sites) 2009-2010 |
100 enfants répondaient aux critères de haut risque d'infection sévère par le VRS. Total = 100 |
Suivi mensuel et 30 et 100 jours après la dernière dose de PVZ Un arrêt de traitement en raison d'une dermatite atopique non grave ÉI: ÉI possiblement liés au PVZ: Rhinite : Dermatite atopique (légère): ÉIG: ÉIG possiblement liés au PVZ: *chez 44 sujets |
III |
S.O. |
Annexe C : Efficacité réelle du palivizumab : Tableau des données supplémentaires
| DÉTAILS DE L'ÉTUDE | RÉSUMÉ | ||||
|---|---|---|---|---|---|
| Étude | Plan de l'étude | Participants | Résumé des principaux résultats | Niveau des données proban-tes | Qualité |
Gilca et al. 2020Annexe C Note de bas de page ‡ Appuyée par le Ministère de la Santé et des Services sociaux du Québec |
Étude de cohorte rétrospective Multicentrique (Nunavik, Québec); 3 centres Du 1 nov. 2013 au 31 juin 2019 Efficacité réelle du PZV pour prévenir les HVRS Une dose de PVZ tous les 28 jours jusqu'à un maximum de 3 doses la première saison d'intervention, jusqu'à 5 doses pour les 2 saisons suivantes L'infection par le VRS a été diagnostiquée par des RADT (97 % avant et pendant l'intervention) ou par test de polymérase en chaîne (PCR) (24 % avant l'intervention, 73 % pendant l'intervention). |
Cohorte complète de nourrissons âgés de moins d'un an (nés entre nov. 2012 et juin 2019) : Période d'intervention : Nourrissons en santé nés à terme âgés de < 3 mois au début de la saison des infections par le VRS ou nés pendant la saison des infections par le VRS, suivi jusqu'à l'âge de < 1 an : 469 (73 % des nourrissons admissibles) ont reçu du PVZ. |
Sur 6 saisons, le taux d'HVRS est de 50,2 sur 1 000 chez tous les nourrissons de moins d'un an (72,6 sur 1 000 après ajustement* pour la sous-détection). Période d'intervention : efficacité réelle directe du PVZ chez les nourrissons en santé nés à terme estimée en comparant l'incidence des HVRS : Il n'y avait pas de différence dans le taux d'HVRS chez les groupes qui ont reçu ou non du PVZ ou pendant les jours protégés ou non par le PVZ : Nourrissons qui n'ont pas reçu de PVZ: Nourrissons ayant reçu toutes les doses de PVZ à temps: Jours non protégés**: Jours protégés par le PVZ**: *1 - risque relatif (RR) protégé/non protégé x 100 % |
II-2 |
PassableAnnexe C Note de bas de page † Des analyses de sensibilité ont été effectuées en considérant la période d'élimination comme étant des jours avec protection par le PVZ ou comme étant des jours sans protection par le PVZ; l'efficacité réelle du PVZ était essentiellement inchangée. Petit nombre de cas, grande variation du taux d'HVRS selon les années Les co-infections avec d'autres virus respiratoires étaient fréquentes chez les nourrissons protégés et non protégés. |
|
|||||
Références
- Note de bas de page 1
-
Bont L, Checchia PA, Fauroux B, et al. « Defining the Epidemiology and Burden of Severe Respiratory Syncytial Virus Infection among Infants and Children in Western Countries ». Infectious Diseases and Therapy. 1 août 2016;5(3):271-98. doi: 10.1007/s40121-016-0123-0.
- Note de bas de page 2
-
Shi T, McAllister DA, O'Brien KL, et al. « Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in young children in 2015: a systematic review and modelling study ». The Lancet. 2 septembre 2017;390(10098):946-58. doi: 10.1016/S0140-6736(17)30938-8.
- Note de bas de page 3
-
Mazur NI, Higgins D, Nunes MC, et al. « The Respiratory Syncytial Virus Vaccine Landscape: lessons from the graveyard and promising candidates ». Lancet Infect Dis. octobre 2018;18(10):e295-311 doi: 10.1016/S1473-3099(18)30292-5.
- Note de bas de page 4
-
Comité consultatif national de l'immunisation. Déclaration concernant l'usage recommandé de l'anticorps monoclonal anti-VRS (palivizumab). Ottawa (ON): Agence de la santé publique du Canada; 15 septembre 2003 [cité 10 mai 2022]. Disponible: https://publications.gc.ca/collections/Collection/H12-21-2-29-7.pdf.
- Note de bas de page 5
-
Committee on Infectious Diseases. « From the American Academy of Pediatrics: Policy Statements--Modified Recommendations for Use of PVZ for Prevention of Respiratory Syncytial Virus Infections ». Pediatrics. décembre 2009;124(6):1694-701. doi: 10.1542/peds.2009-2345.
- Note de bas de page 6
-
American Academy of Pediatrics Committee on Infectious Diseases; American Academy of Pediatrics Bronchiolitis Guidelines Committee. « Updated Guidance for PVZ Prophylaxis among Infants and Young Children at Increased Risk of Hospitalization for Respiratory Syncytial Virus Infection ». Pediatrics. août 2014;134(2):415-20. doi: 10.1542/peds.2014-1666.
- Note de bas de page 7
-
American Academy of Pediatrics Committee on Infectious Diseases; American Academy of Pediatrics Bronchiolitis Guidelines Committee. « Technical Report. Updated Guidance for PVZ Prophylaxis among Infants and Young Children at Increased Risk of Hospitalization for Respiratory Syncytial Virus Infection ». Pediatrics. août 2014;134(2):e620-38. doi: 10.1542/peds.2014-1665.
- Note de bas de page 8
-
Robinson J.L., Saux N.L. « Preventing Hospitalizations for Respiratory Syncytial Virus Infection [Internet] ». Ottawa (ON): société canadienne de pédiatrie; Comité des maladies infectieuses et d'immunisation; 8 septembre 2015;20:321-6. [cité 10 mai 2022] Disponible: https://cps.ca/documents/position/preventing-hospitalizations-for-rsv-infections.
- Note de bas de page 9
-
Ismail SJ, Langley JM, Harris TM, et al. « Canada's National Advisory Committee on Immunization (NACI): Evidence-Based Decision-Making on Vaccines and Immunization ». Vaccine. 19 avril 2010;28:A58-A63. doi:10.1016/j.vaccine.2010.02.035.
- Note de bas de page 10
-
Shea BJ, Grimshaw JM, Wells GA, et al. « Development of AMSTAR: A Measurement Tool to Assess the Methodological Quality of Systematic Reviews. BMC Medical Research Methodology ». 15 février 2007;7. https://www.ncbi.nlm.nih.gov/pubmed/17302989.
- Note de bas de page 11
-
Wingert A, Pillay J, Moore DL, et al. « Burden of Illness in Infants and Young Children Hospitalised for Respiratory Syncythial Virus ». Can Commun Dis Rep. 10 septembre 2021;47(9):381-396. https://www.canada.ca/en/public-health/services/reports-publications/canada-communicable-disease-report-ccdr/monthly-issue/2021-47/issue-9-september-2021/infants-children-hospitalised-respiratory-syncytial-virus.html.
- Note de bas de page 12
-
Comité consultatif national de l'immunisation. « NACI Literature Review on the Effects of PVZ Prophylaxis on Reducing the Complications Associated with Respiratory Syncytial Virus in Infants ». 2021.
- Note de bas de page 13
-
Ismail SJ, Hardy K, Tunis MC, et al. « A Framework for the Systematic Consideration of Ethics, Equity, Feasibility, and Acceptability in Vaccine Program Recommendations ». Vaccine. 10 août 2020;38(36):5861. doi:10.1016/j.vaccine.2020.05.051.
- Note de bas de page 14
-
American Academy of Pediatrics, Committee on Infectious Diseases. « Red Book (2018): Report of the Committee on Infectious Diseases, 31st Edition [Internet] ». Itasca (IL): American Academy of Pediatrics 2018:2018:682-692 [cité 10 mai 2022]. Disponible en anglais: https://seciss.facmed.unam.mx/wp-content/uploads/2021/02/Red-Book-31th-Edition.pdf.
- Note de bas de page 15
-
Schanzer DL, Langley JM, Tam TW. « Hospitalization Attributable to Influenza and Other Viral Respiratory Illnesses in Canadian Children ». The Pediatric Infectious Disease Journal. 1 septembre 2006;25(9):795–800. doi: 10.1097/01.inf.0000232632.86800.8c.
- Note de bas de page 16
-
Hall C, Weinberg G, Blumkin A, et al. « Respiratory Syncytial Virus-Associated Hospitalizations among Children Less than 24 Months of Age ». Pediatrics. août 2013;132(2):e341-8 http://dx.doi.org/10.1542/peds.2013-0303.
- Note de bas de page 17
-
Pisesky A, Benchimol EI, Wong CA, et al. « Incidence of Hospitalization for Respiratory Syncytial Virus Infection amongst Children in Ontario, Canada: A Population-Based Study Using Validated Health Administrative Data ». PLoS ONE. 9 mars 2016;11(3):e0150416. doi: 10.1371/journal.pone.0150416.
- Note de bas de page 18
-
Scheltema NM, Gentile A, Lucion F, et al. « Global Respiratory Syncytial Virus-Associated Mortality in Young Children (RSV GOLD): A Retrospective Case Series. Lancet Glob Health 2017 ». 5 octobre 2017;5(10):e984-e991. doi: 10.1016/S2214-109X(17)30344-3.
- Note de bas de page 19
-
Tam J, Papenburg J, Fanella S, et al. « Pediatric Investigators Collaborative Network on Infections in Canada Study of Respiratory Syncytial Virus-Associated Deaths in Pediatric Patients in Canada, 2003-2013 ». Clin Infect Dis. 1 janvier 2019;68(1):113-9. http://dx.doi.org/10.1093/cid/ciy413.
- Note de bas de page 20
-
Kua KP, Lee S. « Systematic Review of the Safety and Efficacy of PVZ among Infants and Young Children with Cystic Fibrosis ». Pharmacotherapy. juin 2017;37(6):755-69. http://dx.doi.org/10.1002/phar.1936.
- Note de bas de page 21
-
Kristensen K., Hjuler T., Ravn H., et al. « Chronic Diseases, Chromosomal Abnormalities, and Congenital Malformations as Risk Factors for Respiratory Syncytial Virus Hospitalization: A Population-Based Cohort Study ». Clin Infect Dis. mars 2012;54(6):810-7. http://dx.doi.org/10.1093/cid/cir928.
- Note de bas de page 22
-
Manzoni P, Figueras-Aloy J, Simoes EAF, et al. « Defining the Incidence and Associated Morbidity and Mortality of Severe Respiratory Syncytial Virus Infection among Children with Chronic Diseases ». Infectious diseases and therapy. septembre 2017;6(3):383-411. doi: 10.1007/s40121-017-0160-3.
- Note de bas de page 23
-
Banerji A, Panzov V, Young M, et al. « Hospital Admissions for Lower Respiratory Tract Infections among Infants in the Canadian Arctic: A Cohort Study ». CMAJ Open. 18 octobre 2016;4(4):E615-22. https://dx.doi.org/10.9778/cmajo.20150051.
- Note de bas de page 24
-
Shi T, Denouel A, Tietjen AK, et al. « Global Disease Burden Estimates of Respiratory Syncytial Virus-Associated Acute Respiratory Infection in Older Adults in 2015: A Systematic Review and Meta-Analysis ». J Infect Dis. 7 octobre 2020;222:S577-S583. doi: 10.1093/infdis/jiz059.
- Note de bas de page 25
-
Le Centre de l'immunisation et des maladies respiratoires infectieuses (CIMRI) « Respiratory Virus Detections in Canada 2014-2021 [Internet] ». Ottawa (ON): Agence de la santé publique du Canada. [cité 10 mai 2022]. Disponible: https://www.canada.ca/en/public-health/services/surveillance/respiratory-virus-detections-canada.html.
- Note de bas de page 26
-
Doucette A, Jiang XH, Fryzek J, et al. « Trends in Respiratory Syncytial Virus and Bronchiolitis Hospitalization Rates in High-Risk Infants in a United States Nationally Representative Database, 1997-2012 ». PLoS ONE. 6 avril 2016;11(4):e0152208. doi: 10.1371/journal.pone.0152208.
- Note de bas de page 27
-
Farber HJ, Buckwold FJ, Lachman B, et al. « Observed Effectiveness of PVZ for 29-36-Week Gestation Infants ». Pediatrics. août 2016;138(2):e20160627. doi: 10.1542/peds.2016-0627.
- Note de bas de page 28
-
Helfrich AM, Nylund CM, Eberly MD, et al. « Healthy Late-Preterm Infants Born 33-36+6 Weeks Gestational Age have Higher Risk for Respiratory Syncytial Virus Hospitalization ». Early Hum Dev. septembre 2015;91(9):541-6. doi: 10.1016/j.earlhumdev.2015.06.009.
- Note de bas de page 29
-
Fauroux B, Gouyon JB, Roze JC, et al. « Respiratory Morbidity of Preterm Infants of Less Than 33 Weeks Gestation without Bronchopulmonary Dysplasia: A 12-Month Follow-Up of the CASTOR Study Cohort ». Epidemiol Infect. juillet 2014;142(7):1362-74. doi: 10.1017/S0950268813001738.
- Note de bas de page 30
-
Ambrose CS, Anderson EJ, Simoes EAF, et al. « Respiratory Syncytial Virus Disease in Preterm Infants in the US Born at 32-35 Weeks Gestation not Receiving Immunoprophylaxis ». Pediatr Infect Dis J. juin 2014;33(6):576-82. doi: 10.1097/INF.0000000000000219.
- Note de bas de page 31
-
Blanken MO, Korsten K, Achten NB, et al. « Population-Attributable Risk of Risk Factors for Recurrent Wheezing in Moderate Preterm Infants During the First Year of Life ». Paediatr Perinat Epidemiol. juillet 2016;30(4):376-85. doi:10.1111/ppe.12295.
- Note de bas de page 32
-
Carbonell-Estrany X, Perez-Yarza EG, Garcia LS, et al. « Long-Term Burden and Respiratory Effects of Respiratory Syncytial Virus Hospitalization in Preterm Infants-The SPRING Study ». PLoS ONE. 8 mai 2015;10(5):e0125422. doi:10.1371/journal.pone.0125422.
- Note de bas de page 33
-
Korsten K, Blanken MO, Nibbelke EE, et al. « Prediction Model of RSV-Hospitalization in Late Preterm Infants: An Update and Validation Study ». Early Hum Dev. avril 2016;95:35-40. doi: 10.1016/j.earlhumdev.2016.01.020.
- Note de bas de page 34
-
Ryan VMJ, Langley JM, Dodds L, et al. « Estimating Respiratory Syncytial Virus-Associated Hospitalization in the First Year of Life Among Infants Born at 32-35 Weeks of Gestation ». Pediatr Infect Dis J. août 2016;35(8):851-855. doi: 10.1097/INF.0000000000001186.
- Note de bas de page 35
-
Straňák Z, Saliba E, Kosma P, et al. « Predictors of RSV LRTI Hospitalization in Infants Born at 33 to 35 Weeks Gestational Age: A Large Multinational Study (PONI) ». PLoS ONE. 16 juin 2016;11(6):e0157446. doi: 10.1371/journal.pone.0157446.
- Note de bas de page 36
-
Zomer-Kooijker K, Uiterwaal CSPM, van der Gugten AC, et al. « Decreased Lung Function Precedes Severe Respiratory Syncytial Virus Infection and Post-Respiratory Syncytial Virus Wheeze in Term Infants ». Eur Respir J. septembre 2014;44(3):666-74. doi: 10.1183/09031936.00009314.
- Note de bas de page 37
-
McLaurin KK, Farr AM, Wade SW, et al. « Respiratory Syncytial Virus Hospitalization Outcomes and Costs of Full-Term and Preterm Infants ». J Perinatol. novembre 2016;36(11):990-6. doi: 10.1038/jp.2016.113.
- Note de bas de page 38
-
Griffin MP, Yuan Y, Takas T, et al. « Single-Dose Nirsevimab for Prevention of RSV in Preterm Infants ». N Engl J Med. juillet 2020;30(5);383:415-425. doi: 10.1056/NEJMoa1913556.
- Note de bas de page 39
-
Papenburg J, Defoy I, Massé E, et al. « Impact of the Withdrawal of PVZ Immunoprophylaxis on the Incidence of Respiratory Syncytial Virus (RSV) Hospitalizations Among Infants Born at 33 to 35 Weeks' Gestational Age in the Province of Quebec, Canada: The RSV-Quebec Study ». Pediatric Infect Dis Soc. 3 avril 2021;10(3):237-244. doi: 10.1093/jpids/piaa046.
- Note de bas de page 40
-
Anderson EJ, Carbonell-Estrany X, Blanken M, et al. « Burden of Severe Respiratory Syncytial Virus Disease among 33-35 Weeks' Gestational Age Infants Born During Multiple Respiratory Syncytial Virus Seasons ». Pediatr Infect Dis J. février 2017a;36(2):160-7. doi: 10.1097/INF.0000000000001377.
- Note de bas de page 41
-
Notario G, Vo P, Gooch K, et al. « Respiratory Syncytial Virus-Related Hospitalization in Premature Infants Without Bronchopulmonary Dysplasia: Subgroup Efficacy Analysis of the IMpact-RSV Trial by Gestational Age Group ». Pediatric Health Med Ther. 30 mai 2014;2014(5):43-48. https://doi.org/10.2147/PHMT.S59572.
- Note de bas de page 42
-
Stevens TP, Sinkin RA, Hall CB, et al. « Respiratory Syncytial Virus and Premature Infants Born at 32 Weeks' Gestation or Earlier: Hospitalization and Economic Implications of Prophylaxis ». Arch Pediatr Adolesc Med. janvier 2000;154:55-61. [cité 2022 May 10]. Disponible en anglais: https://jamanetwork.com/journals/jamapediatrics/fullarticle/348500.
- Note de bas de page 43
-
Boyce TG, Mellen BG, Mitchel EF J, et al. « Rates of Hospitalization for Respiratory Syncytial Virus Infection among Children in Medicaid ». J Pediatr. décembre 2000;137(6):865-70 doi:10.1067/mpd.2000.110531.
- Note de bas de page 44
-
Chi H, Hsu CH, Chang JH, et al. « A Novel Six Consecutive Monthly Doses of PVZ Prophylaxis Protocol for the Prevention of Respiratory Syncytial Virus Infection in High-Risk Preterm Infants in Taiwan ». PLoS One. 27 juin 2014;9(6):e100981. doi: 10.1371/journal.pone.0100981.
- Note de bas de page 45
-
Park HW, Lee BS, Kim AR, et al. « Epidemiology of Respiratory Syncytial Virus Infection in Infants Born at Less than Thirty-Five Weeks of Gestational Age ». Pediatr Infect Dis J. août 2012;31(8):e99-e104. doi: 10.1097/INF.0b013e318257f619.
- Note de bas de page 46
-
Pedraz C, Carbonell-Estrany X, Figueras-Aloy J, et al. « Effect of PVZ prophylaxis in decreasing respiratory syncytial virus hospitalizations in premature infants ». Pediatr Infect Dis J. septembre 2003;22(9):823-7. doi: 10.1097/01.inf.0000086403.50417.7c.
- Note de bas de page 47
-
Grimaldi M, Gouyon B, Sagot P, et al. « PVZ Efficacy in Preterm Infants with Gestational Age <30 Weeks without Bronchopulmonary Dysplasia ». Pediatr Pulmonol. mars 2007;42(3):189-92. doi: 10.1002/ppul.20503.
- Note de bas de page 48
-
IMpact-RSV. « PVZ, a Humanized Respiratory Syncytial Virus Monoclonal Antibody, Reduces Hospitalization from Respiratory Syncytial Virus Infection in High-Risk Infants ». The IMpact-RSV Study Group. Pediatrics. septembre 1998;102(3):531-537. [cité 10 mai 2022]. Disponible en anglais: https://pubmed.ncbi.nlm.nih.gov/9724660.
- Note de bas de page 49
-
Winterstein AG, Knox CA, Kubilis P, et al. « Appropriateness of Age Thresholds for Respiratory Syncytial Virus Immunoprophylaxis in Moderate-Preterm Infants - A Cohort Study ». JAMA Pediatr. décembre 2013;167(12):1118-24. doi: 10.1001/jamapediatrics.2013.2636.
- Note de bas de page 50
-
Anderson EJ, Krilov LR, DeVincenzo JP, et al. « SENTINEL1: An Observational Study of Respiratory Syncytial Virus Hospitalizations among U.S. Infants Born At 29 to 35 Weeks' Gestational Age Not Receiving Immunoprophylaxis ». Am J Perinatol. janvier 2017;34(1):51-51. doi: 10.1055/s-0036-1584147.
- Note de bas de page 51
-
Rajah B, Sánchez PJ, Garcia-Maurino C, et al. « Impact of the Updated Guidance for PVZ Prophylaxis against Respiratory Syncytial Virus Infection: A Single Center Experience ». J Pediatr. février 2017;181:183-8. doi: 10.1016/j.jpeds.2016.10.074.
- Note de bas de page 52
-
Luchsinger V, Ampuero S, Palomino MA, et al. « Comparison of Virological Profiles of Respiratory Syncytial Virus and Rhinovirus in Acute Lower Tract Respiratory Infections in Very Young Chilean Infants, According To Their Clinical Outcome ». J Clin Virol. septembre 2014;61(1):138-44. doi: 10.1016/j.jcv.2014.06.004.
- Note de bas de page 53
-
Caserta MT, Qiu X, Tesini B, et al. « Development of a Global Respiratory Severity Score for Respiratory Syncytial Virus Infection in Infants ». J Infect Dis. 1 mars 2017;215(5):750-6. doi: 10.1093/infdis/jiw624.
- Note de bas de page 54
-
Fergie J, Suh M, Jiang X, et al. « Respiratory Syncytial Virus and All-Cause Bronchiolitis Hospitalizations among Preterm Infants Using the Pediatric Health Information System (PHIS) ». J Infect Dis. 21 juillet 2020;225(7):1197-1204. doi: 10.1093/infdis/jiaa435.
- Note de bas de page 55
-
Anderson EJ, DeVincenzo JP, Simões EAF, et al. « SENTINEL1: 2-Season Study of Respiratory Syncytial Virus Hospitalizations among U.S. Infants Born at 29 to 35 Weeks' Gestational Age Not Receiving Immunoprophylaxis ». Am J Perinatol. mars 2020;37(4):421-9. doi: 10.1055/s-0039-1681014.
- Note de bas de page 56
-
Jang MJ, Kim YJ, Hong S, et al. « Positive Association of Breastfeeding on Respiratory Syncytial Virus Infection in Hospitalized Infants: A Multicenter Retrospective Study ». Korean J Pediatr. Avril 2020;63(4):135-40. doi: 10.3345/kjp.2019.00402.
- Note de bas de page 57
-
Garcia-Mauriño C, Moore-Clingenpeel M, Thomas J et al. « Viral Load Dynamics and Clinical Disease Severity in Infants with Respiratory Syncytial Virus Infection ». J Infect Dis. 19 avril 2019;219(8):1207-15. doi: 10.1093/infdis/jiy655.
- Note de bas de page 58
-
Oz-Alcalay L, Ashkenazi S, Glatman-Freedman A, et al. « Hospitalization for Respiratory Syncytial Virus Bronchiolitis in the PVZ Prophylaxis Era: Need for Reconsideration of Preventive Timing and Eligibility ». Isr Med Assoc J. 1 février 2019;21:110-5 [cité 10 mai 2022]. Disponible en anglais: https://www.semanticscholar.org/paper/Hospitalization-for-Respiratory-Syncytial-Virus-in-Oz-Alcalay- Ashkenazi/eb2d8bda758bc528cd2ffaeaaedb4d7145481905.
- Note de bas de page 59
-
Midulla F, Nenna R, Scagnolari C, et al. « How Respiratory Syncytial Virus Genotypes Influence the Clinical Course in Infants Hospitalized for Bronchiolitis ». J Infect Dis. 29 janvier 2019;219(4):526-34. doi: 10.1093/infdis/jiy496.
- Note de bas de page 60
-
Figueras-Aloy J, Manzoni P, Paes B, et al. « Defining the Risk and Associated Morbidity and Mortality of Severe Respiratory Syncytial Virus Infection Among Preterm Infants Without Chronic Lung Disease or CHD » (Disponible en anglais). Infect Dis Ther. décembre 2016;5(4):417-52. doi: 10.1007/s40121-016-0130-1.
- Note de bas de page 61
-
Gouyon JB, Roze JC, Guillermet-Fromentin C, et al. « Hospitalizations for Respiratory Syncytial Virus Bronchiolitis in Preterm Infants at <33 Weeks Gestation without Bronchopulmonary Dysplasia: The CASTOR Study » . Epidemiol Infect. avril 2013;141(4):816-26. Disponible en anglais: http://dx.doi.org/10.1017/S0950268812001069.
- Note de bas de page 62
-
Vu LD, Siefker D, Jones TL, et al. « Elevated Levels of Type 2 Respiratory Innate Lymphoid Cells In Human Infants with Severe Respiratory Syncytial Virus Bronchiolitis » . Am J Respir Crit Care Med. 27 novembre 2019;200(11):1414-23. Disponible en anglais: http://dx.doi.org/10.1164/rccm.201812-2366OC.
- Note de bas de page 63
-
Rodriguez-Gonzalez M, Perez-Reviriego AA, Castellano-Martinez A, et al. « Left Ventricular Dysfunction and Plasmatic NT-Probnp are Associated with Adverse Evolution in Respiratory Syncytial Virus Bronchiolitis » (Disponible en anglais). Diagn. 27 juillet 2019;9(3):85. doi: 10.3390/diagnostics9030085.
- Note de bas de page 64
-
Simões EAF, Ambrose CS, Wu X, et al. « Intensive Care Unit Admission Rates for Respiratory Syncytial Virus Infection as a Function of Age in Preterm Infants Born at 32-35-Week Gestation and Not Receiving Immunoprophylaxis » (Disponible en anglais). Pediatr Infect Dis J. mars 2015;34(3):331. doi: 10.1097/INF.0000000000000566.
- Note de bas de page 65
-
Checchia PA, Paes B, Bont L, et al. « Defining the Risk and Associated Morbidity and Mortality of Severe Respiratory Syncytial Virus Infection among Infants with Congenital Heart Disease » (Disponible en anglais). Infect Dis Ther. mars 2017;6(1):37-56. doi: 10.1007/s40121-016-0142-x.
- Note de bas de page 66
-
Szabo SM, Gooch KL, Bibby MM, et al. « The Risk of Mortality among Young Children Hospitalized for Severe Respiratory Syncytial Virus Infection » (Disponible en anglais). Paediatr Respir Rev. janvier 2013;13:Suppl 2:S1-S8. doi: 10.1016/S1526-0542(12)00095-4.
- Note de bas de page 67
-
Statistique Canada. Naissances vivantes, selon les semaines de gestation. Tableau 13-10-0425-01. Ottawa (ON) [cité 10 mai 2022]. Disponible: https://doi.org/10.25318/1310042501-eng.
- Note de bas de page 68
-
Pignotti MS, Leo MC, Pugi A, et al. « Consensus Conference on the Appropriateness of PVZ Prophylaxis in Respiratory Syncytial Virus Disease » (Disponible en anglais). Pediatr Pulmonol. octobre 2016;51(10):1088-96. doi: 10.1002/ppul.23561.
- Note de bas de page 69
-
Hall CB, Weinberg GA, Iwane MK, et al. « The Burden of Respiratory Syncytial Virus Infection in Young Children » (Disponible en anglais). N Engl J Med. 2009;360(6):588-98. doi: 10.1056/NEJMoa0804877.
- Note de bas de page 70
-
Meissner HC, Bocchini JA, Brady MT, et al. « The Role of Immunoprophylaxis in the Reduction of Disease Attributable to Respiratory Syncytial Virus » (Disponible en anglais). Pediatrics. décembre 2009;124(6):1676-9. doi: 10.1542/peds.2009-2346.
- Note de bas de page 71
-
Figueras-Aloy J, Carbonell-Estrany X, Quero-Jimenez J, et al. « Flip-2 Study: Risk Factors Linked to Respiratory Syncytial Virus Infection Requiring Hospitalization in Premature Infants Born in Spain at a Gestational Age of 32 to 35 Weeks » (Disponible en anglais). Pediatr Infect Dis J. septembre 2008;27(9):788-93. doi: 10.1097/INF.0b013e3181710990.
- Note de bas de page 72
-
Paes B, Fauroux B, Figueras-Aloy J, et al. « Defining the Risk and Associated Morbidity and Mortality of Severe Respiratory Syncytial Virus Infection Among Infants with Chronic Lung Disease » (Disponible en anglais). Infect Dis Ther. décembre 2016;5(4):453-471. doi: 10.1007/s40121-016-0137-7.
- Note de bas de page 73
-
Winterstein AG, Choi Y, Meissner HC. « Association of Age with Risk of Hospitalization for Respiratory Syncytial Virus in Preterm Infants with Chronic Lung Disease » (Disponible en anglais). JAMA Pediatr. 2018;172(2):154-60. doi: 10.1001/jamapediatrics.2017.3792.
- Note de bas de page 74
-
Checchia PA, Nalysnyk L, Fernandes AW, et al. « Mortality and Morbidity among Infants at High Risk for Severe Respiratory Syncytial Virus Infection Receiving Prophylaxis with PVZ: A Systematic Literature Review and Meta-Analysis » (Disponible en anglais). Crit Care Med. septembre 2011;12(5):580-8. doi: 10.1097/PCC.0b013e3182070990.
- Note de bas de page 75
-
Hama I, Takahashi S, Nakamura T, et al. « Risk of Respiratory Syncytial Virus Infection in Infants with Congenital Cystic Lung Disease » (Disponible en anglais). Pediatrics International. avril 2015;57(2):253-7. doi: 10.1111/ped.12544.
- Note de bas de page 76
-
Drummond D, Thumerelle C, Reix P, et al. « Effectiveness of PVZ in Children with Childhood Interstitial Lung Disease: The French Experience » (Disponible en anglais). Pediatr Pulmonol. juillet 2016;51(7):688-95. doi: 10.1002/ppul.23354.
- Note de bas de page 77
-
Bjornson C, Chan P, Li A, et al. « PVZ Prophylaxis for Respiratory Syncytial Virus in Infants with Cystic Fibrosis: Is there a Need? » (Disponible en anglais). Eur J Clin Microbiol Infect Dis. juin 2018;37(6):1113-8. doi: 10.1007/s10096-018-3225-7.
- Note de bas de page 78
-
Groves HE, Jenkins L, Macfarlane M, et al. « Efficacy and Long-Term Outcomes of PVZ Prophylaxis to Prevent Respiratory Syncytial Virus Infection in Infants with Cystic Fibrosis in Northern Ireland » (Disponible en anglais). Pediatr Pulmonol. avril 2016;51(4):379-85. doi: 10.1002/ppul.23376.
- Note de bas de page 79
-
Chu PY, Hornik CP, Li JS, et al. « Respiratory Syncytial Virus Hospitalisation Trends in Children with Haemodynamically Significant Heart Disease, 1997-2012 » (Disponible en anglais). Cardiol Young. janvier 2017;27(1):16-25. doi: 10.1017/S1047951116000470.
- Note de bas de page 80
-
Feltes TF, Cabalka AK, Meissner HC, et al. « PVZ prophylaxis reduces hospitalization due to respiratory syncytial virus in young children with hemodynamically significant congenital heart disease ». J Pediatr. octobre 2003;143(4):532-40. doi: 10.1067/s0022-3476(03)00454-2.
- Note de bas de page 81
-
Chiu SN, Shao PL, Chen HC, et al. « Risk of Respiratory Syncytial Virus Infection in Cyanotic Congenital Heart Disease in a Subtropical Area ». J Pediatr. avril 2016;171:25-30e1. doi: 10.1016/j.jpeds.2015.12.029.
- Note de bas de page 82
-
Resch B, Sommer C, Nuijten MJC, et al. « Cost-Effectiveness of PVZ for Respiratory Syncytial Virus Infection in High-Risk Children, Based On Long-Term Epidemiologic Data from Austria ». Pediatr Infect Dis J, janvier 2012;31(1):e1-8. doi: 10.1097/INF.0b013e318235455b.
- Note de bas de page 83
-
Beckhaus AA, Castro-Rodriguez JA. « Down syndrome and the Risk of Severe RSV Infection: A Meta-Analysis ». Pediatrics. 1 septembre 2018;142(3):e20180225. doi: 10.1542/peds.2018-0225.
- Note de bas de page 84
-
Stagliano DR, Nylund CM, Eide MB, et al. « Children with Down syndrome are High-Risk for Severe Respiratory Syncytial Virus Disease ». J Pediatr. mars 2015;166(3):703-9. doi: 10.1016/j.jpeds.2014.11.058.
- Note de bas de page 85
-
Feldman AG, Sundaram SS, Beaty BL, et al. « Hospitalizations for Respiratory Syncytial Virus and Vaccine-Preventable Infections in the First 2 Years after Pediatric Liver Transplant ». J Pediatr. mars 2017;182:232,238.e1. doi: 10.1016/j.jpeds.2016.12.021.
- Note de bas de page 86
-
Sadreameli SC, Reller ME, Bundy DG, et al. « Respiratory Syncytial Virus and Seasonal Influenza Cause Similar Illnesses in Children with Sickle Cell Disease ». Pediatr Blood Cancer. mai 2014;61(5):875-8. doi: 10.1002/pbc.24887.
- Note de bas de page 87
-
El Saleeby CM, Somes GW, DeVincenzo JP, et al. « Risk Factors for Severe Respiratory Syncytial Virus Disease in Children with Cancer: The Importance of Lymphopenia and Young Age ». Pediatrics. février 2008;121(2):235-243. doi: 10.1542/peds.2007-1102.
- Note de bas de page 88
-
Kim YJ, Guthrie KA, Waghmare A, et al. « Respiratory Syncytial Virus in Hematopoietic Cell Transplant Recipients: Factors Determining Progression to Lower Respiratory Tract Disease ». J Infect Dis. 15 avril 2014;209(8):1195-204. doi: 10.1093/infdis/jit832.
- Note de bas de page 89
-
O'Brien KL, Chandran A, Weatherholtz R, et al. « Efficacy of Motavizumab for the Prevention of Respiratory Syncytial Virus Disease in Healthy Native American Infants: A Phase 3 Randomised Double-Blind Placebo-Controlled Trial ». Lancet Infect Dis. décembre 2015;15(12):1398-408. doi: 10.1016/S1473-3099(15)00247-9.
- Note de bas de page 90
-
Gilca R, Billard MN, Zafack J, et al. « Effectiveness of PVZ Immunoprophylaxis to Prevent Respiratory Syncytial Virus Hospitalizations in Healthy Full-Term <6-Month-Old Infants from the Circumpolar Region of Nunavik, Quebec, Canada ». Prev Med Rep. décembre 2020;20:101180. doi: 10.1016/j.pmedr.2020.101180.
- Note de bas de page 91
-
Banerji A, Lanctot KL, Paes BA, et al. « Comparison of the Cost of Hospitalization for Respiratory Syncytial Virus Disease Versus PVZ Prophylaxis in Canadian Inuit Infants ». Pediatr Infect Dis J. août 2009;28(8):702-6. doi: 10.1097/INF.0b013e31819df78e.
- Note de bas de page 92
-
Singleton R, Dooley L, Bruden D, et al. « Impact of PVZ Prophylaxis on Respiratory Syncytial Virus Hospitalizations in High Risk Alaska Native Infants ». Pediatr Infect Dis J. juin 2003;22(6):540-5. http://dx.doi.org/10.1097/00006454-200306000-00010.
- Note de bas de page 93
-
Kim L, Rha B, Abramson JS, et al. « Identifying Gaps in Respiratory Syncytial Virus Disease Epidemiology in the United States Prior to the Introduction of Vaccines ». CID. 15 septembre 2017;65(6):1020-5. doi: 10.1093/cid/cix432.
- Note de bas de page 94
-
Fauroux B, Simoes EAF, Checchia PA, et al. « The Burden and Long-Term Respiratory Morbidity Associated with Respiratory Syncytial Virus Infection in Early Childhood ». Infect Dis Ther. juin 2017;6(2):173-97. doi:10.1007/s40121-017-0151-4.
- Note de bas de page 95
-
Groves HE SM. « Respiratory Syncytial Virus and Asthma Inception: Cause and Effect, or Shared Susceptibility? ». J Infect Dis. 19 juillet 2019;220(4):547-549. doi: 10.1093/infdis/jiy672.
- Note de bas de page 96
-
Chawes BLK, Poorisrisak P, Johnston SL, et al. « Neonatal Bronchial Hyperresponsiveness Precedes Acute Severe Viral Bronchiolitis in Infants ». J Allergy Clin Immunol. août 2012;130(2):354-61. doi: 10.1016/j.jaci.2012.04.045.
- Note de bas de page 97
-
Bonnelykke K, Vissing NH, Sevelsted A, et al. « Association Between Respiratory Infections in Early Life and Later Asthma is Independent of Virus Type ». J Allergy Clin Immunol. juillet 2015;136(1):81-6. doi: 10.1016/j.jaci.2015.02.024.
- Note de bas de page 98
-
Driscoll AJ, Arshad SH, Bont L, et al. « Does Respiratory Syncytial Virus Lower Respiratory Illness in Early Life Cause Recurrent Wheeze of Early Childhood and Asthma? Critical Review of the Evidence and Guidance for Future Studies from a World Health Organization-Sponsored Meeting ». Vaccine. 4 mars 2020;38(11):2435-48. doi: 10.1016/j.vaccine.2020.01.020.
- Note de bas de page 99
-
Backman K, Piippo-Savolainen E, Ollikainen H, et al. « Adults Face Increased Asthma Risk After Infant RSV Bronchiolitis and Reduced Respiratory Health-Related Quality of Life After RSV Pneumonia ». Acta Paediatr. août 2014;103(8):850-5. doi: 10.1111/apa.12662.
- Note de bas de page 100
-
Backman K, Ollikainen H, Piippo-Savolainen E, et al. « Asthma and Lung Function in Adulthood after a Viral Wheezing Episode in Early Childhood ». Clin Exp Allergy. février 2018;48(2):138-46. doi: 10.1111/cea.13062.
- Note de bas de page 101
-
Korsten K, Blanken MO, Buiteman BJM, et al. « RSV Hospitalization in Infancy Increases the Risk of Current Wheeze at Age 6 in Late Preterm Born Children without Atopic Predisposition ». Eur J Pediatr. avril 2019;178(4):455-62. doi: 10.1007/s00431-018-03309-0.
- Note de bas de page 102
-
Mejias A, Wu B, Tandon N, et al. « Risk of Childhood Wheeze and Asthma after Respiratory Syncytial Virus Infection in Full-Term Infants ». Pediatr Allergy Immunol. janvier 2020;31(1):47-56. doi: 10.1111/pai.13131.
- Note de bas de page 103
-
Henderson FW, Collier AM, Clyde WA Jr, et al. « Respiratory-Syncytial-Virus Infections, Reinfections and Immunity. A Prospective, Longitudinal Study in Young Children ». N Engl J Med. 8 mars 1979;300(10):530-4. doi: 10.1056/NEJM197903083001004.
- Note de bas de page 104
-
Glezen WP, Taber LH, Frank AL, et al. « Risk of Primary Infection and Reinfection with Respiratory Syncytial Virus ». Am J Dis Child. juin 1986;140(6):543-6. doi: 10.1001/archpedi.1986.02140200053026.
- Note de bas de page 105
-
Hall CB. « Respiratory Syncytial Virus and Parainfluenza Virus ». N Engl J Med. 21 juin 2001;344(25):1917-28. doi: 10.1056/NEJM200106213442507.
- Note de bas de page 106
-
Pangesti KNA, Abd El Ghany M, Walsh MG, et al. « Molecular Epidemiology of Respiratory Syncytial Virus ». Rev Med Virol. mars 2018;28(2):1002/rmv.1968. doi: 10.1002/rmv.1968.
- Note de bas de page 107
-
Groothuis JR, Gutierrez KM, Lauer BA. « Respiratory Syncytial Virus Infection in Children with Bronchopulmonary Dysplasia ». Pediatrics. août 1988;82(2):199-203. [cité 10 mai 2022]. Disponible en anglais: https://pubmed.ncbi.nlm.nih.gov/3399292/.
- Note de bas de page 108
-
Carbonell-Estrany X, Quero J, Bustos G, et al. « Rehospitalization Because of Respiratory Syncytial Virus Infection in Premature Infants Younger than 33 Weeks of Gestation: A Prospective Study ». Pediatr Infect Dis J. juillet 2000;19(7):592-7. doi: 10.1097/00006454-200007000-00002.
- Note de bas de page 109
-
Carbonell-Estrany X, Quero J, The IRIS Study Group. « Hospitalization Rates for Respiratory Syncytial Virus Infection in Premature Infants Born During Two Consecutive Seasons ». Pediatr Infect Dis J. septembre 2001;20(9):874-9. doi: 10.1097/00006454-200109000-00010.
- Note de bas de page 110
-
Pedersen O, Herskind AM, Kamper J, et al. « Rehospitalization for Respiratory Syncytial Virus Infection in Infants with Extremely Low Gestational Age or Birthweight in Denmark ». Acta Paediatr. 2003;92(2):240-2. doi: 10.1111/j.1651-2227.2003.tb00533.x.
- Note de bas de page 111
-
Blanken MO, Rovers MM, Molenaar JM, et al. « Respiratory Syncytial Virus and Recurrent Wheeze in Healthy Preterm Infants ». N Engl J Med. 9 mai 2013;368:1791-9. doi: 10.1056/NEJMoa1211917.
- Note de bas de page 112
-
Yamaguchi M, Sano Y, Dapat IC, et al. « High Frequency of Repeated Infections due to Emerging Genotypes of Human Respiratory Syncytial Viruses among Children During Eight Successive Epidemic Seasons in Japan ». J Clin Microbiol. mars 2011;49(3):1034-40. doi: 10.1128/JCM.02132-10.
- Note de bas de page 113
-
Okamoto M, Dapat CP, Sandagon AMD, et al. « Molecular Characterization of Respiratory Syncytial Virus in Children with Repeated Infections with Subgroup B in the Philippines ». J Infect Dis. 24 août 2018;218(7):1045-53. doi: 10.1093/infdis/jiy256.
- Note de bas de page 114
-
Simões EA, King SJ, Lehr MV, et al. « Preterm Twins and Triplets. A High-Risk Group for Severe Respiratory Syncytial Virus Infection ». Am J Dis Child. mars 1993;147(3):303-6. doi: 10.1001/archpedi.1993.02160270065020.
- Note de bas de page 115
-
Resch B, Pasnocht A, Gusenleitner W, et al. « Rehospitalisations for Respiratory Disease and Respiratory Syncytial Virus Infection in Preterm Infants Of 29-36 Weeks Gestational Age ». J Infect. juin 2005;50(5):397-403. doi:10.1016/j.jinf.2004.06.015.
- Note de bas de page 116
-
Figueras-Aloy J, Carbonell-Estrany X, Quero J, et al. « Case-Control Study of the Risk Factors Linked to Respiratory Syncytial Virus Infection Requiring Hospitalization in Premature Infants Born at a Gestational Age of 33-35 Weeks in Spain ». Pediatr Infect Dis J. septembre 2004;23(9):815-20. doi: 10.1097/01.inf.0000136869.21397.6b.
- Note de bas de page 117
-
Dotan M, Ashkenazi-Hoffnung L, Samra Z, et al. « Hospitalization for Respiratory Syncytial Virus Bronchiolitis and Disease Severity in Twins ». Isr Med Assoc J. 2013;15:701-4. [cité 10 mai 2022]. Disponible en anglais: https://www.ima.org.il/MedicineIMAJ/viewarticle.aspx?year=2013&month=11&page=701.
- Note de bas de page 118
-
Groothuis J, Bauman J, Malinoski F, et al. « Strategies for Prevention of RSV Nosocomial Infection ». J Perinatol. mai 2008;28(5):319-23. doi: 10.1038/jp.2008.37.
- Note de bas de page 119
-
Katz BZ, Sullivan C. « Respiratory Syncytial Virus Prophylaxis in a Tertiary Care Neonatal Intensive Care Unit ». Pediatr Infect Dis J. septembre 2009;28(9):842,844. doi: 10.1097/INF.0b013e3181a0ad01.
- Note de bas de page 120
-
Ohler KH, Pham JT. « Comparison of the Timing of Initial Prophylactic PVZ Dosing on Hospitalization of Neonates for Respiratory Syncytial Virus ». Am J Health Syst Pharm. 1 août 2013;70(15):1342-6. doi: 10.2146/ajhp120526.
- Note de bas de page 121
-
Zembles TN, Gaertner KM, Gutzeit MF, et al. « Implementation of American Academy of Pediatrics Guidelines for PVZ Prophylaxis in a Pediatric Hospital ». Am J Health-Syst Pharm. 15 mars 2016;73(6):405-8. doi:10.2146/ajhp150499.
- Note de bas de page 122
-
Harris RP, Helfand M, Woolf SH, et al. « Current Methods of the Us Preventive Services Task Force: A Review Of The Process ». Am J Prev Med. avril 2001;20:21-35. doi: 10.1016/s0749-3797(01)00261-6.
- Note de bas de page 123
-
Public Health England. « The Green Book Part 2: The Diseases, Vaccinations and Vaccines ». Chapter 27a: Respiratory Syncytial Virus. 2015. [cité 10 mai 2022]. Disponible en anglais: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/458469/Green_Book_Chapter_27a_v2_0W.PDF.
- Note de bas de page 124
-
Abadesso C, Almeida HI, Virella D, et al. « Use of PVZ to Control an Outbreak of Syncytial Respiratory Virus in a Neonatal Intensive Care Unit ». J Hosp Infect. septembre 2004;58(1):38-41. doi: 10.1016/j.jhin.2004.04.024.
- Note de bas de page 125
-
Silva CdeA, Dias L, Baltieri SR, et al. « Respiratory Syncytial Virus Outbreak in Neonatal Intensive Care Unit: Impact of Infection Control Measures plus PVZ Use. Antimicrob Resist Infect Control ». 2 mai 2012;1:16. doi:10.1186/2047-2994-1-16.
- Note de bas de page 126
-
Hammoud MS, Al-Taiar A, Raina A, et al. « Use of PVZ with Other Infection Control Measures to Control Respiratory Syncytial Virus Outbreaks in Neonatal Care Units ». J Trop Pediatr. octobre 2016;62(5):409-14. doi:10.1093/tropej/fmw025.
- Note de bas de page 127
-
Silva DG, Almeida FJ, Arnoni MV, et al. « First Report of Two Consecutive Respiratory Syncytial Virus Outbreaks by the Novel Genotypes On-1 and Na-2 in a Neonatal Intensive Care Unit ». J Pediatr. mars-avril 2020;96(2):233-9. doi: 10.1016/j.jped.2018.10.014.
- Note de bas de page 128
-
Dizdar EA, Aydemir C, Erdeve O, et al. « Respiratory Syncytial Virus Outbreak Defined by Rapid Screening in a Neonatal Intensive Care Unit ». J Hosp Infect. août 2010;75(4):292,294. doi: 10.1016/j.jhin.2010.01.013.
- Note de bas de page 129
-
AstraZeneca Canada Inc. SYNAGIS Product Monograph 2021. https://pdf.hres.ca/dpd_pm/00062121.PDF.
- Note de bas de page 130
-
Tavsu I, Gursoy T, Dirman S, et al. « PVZ Prophylaxis: Does it have Any Influence on the Growth and Development of the Infants? ». Am J Perinatol. septembre 2014;31(8):667-72. doi: 10.1055/s-0033-1356485.
- Note de bas de page 131
-
Wegner S, Vann JJ, Liu G, et al. « Direct Cost Analyses of PVZ Treatment in a Cohort of At-Risk Children: Evidence from the North Carolina Medicaid Program ». Pediatrics. décembre 2004;114(6):1612-9. doi: 10.1542/peds.2004-0959.
- Note de bas de page 132
-
Mitchell I, Tough S, Gillis L, et al. « Beyond Randomized Controlled Trials: A "Real Life" Experience of Respiratory Syncytial Virus Infection Prevention in Infancy with and without PVZ ». Pediatr Pulmonol. décembre 2006;41(12):1167-74. doi: 10.1002/ppul.20507.
- Note de bas de page 133
-
Anderson EJ, Carosone-Link P, Yogev R, et al. « Effectiveness of PVZ in High-Risk Infants and Children: A Propensity Score Weighted Regression Analysis ». Pediatr Infect Dis J. août 2017b;36(8):699-704. doi: 10.1097/INF.0000000000001533.
- Note de bas de page 134
-
Scheltema NM, Nibbelke EE, Pouw J, et al. « Respiratory Syncytial Virus Prevention and Asthma in Healthy Preterm Infants: A Randomised Controlled Trial ». Lancet Respir Med. avril 2018;6(4):257-64. doi: 10.1016/S2213-2600%2818%2930055-9.
- Note de bas de page 135
-
Simões EAF, Carbonell-Estrany X, Rieger CHL, et al. « The Effect of Respiratory Syncytial Virus on Subsequent Recurrent Wheezing in Atopic and Nonatopic Children ». J Allergy Clin Immunol. août 2010;126(2):256-62. doi: 10.1016/j.jaci.2010.05.026.
- Note de bas de page 136
-
Simões EA, Groothuis JR, Carbonell-Estrany X, et al. « PVZ Prophylaxis, Respiratory Syncytial Virus, and Subsequent Recurrent Wheezing ». J Pediatr. juillet 2007;151(1):34,42.e1. doi: 10.1016/j.jpeds.2007.02.032.
- Note de bas de page 137
-
Mochizuki H, Kusuda S, Okada K, et al. « PVZ Prophylaxis in Preterm Infants and Subsequent Recurrent Wheezing: Six-Year Follow-Up Study ». Am J Respir Crit Care Med. 1 juillet 2017;196(1):29-38. doi: 10.1164/rccm.201609-1812OC.
- Note de bas de page 138
-
Yoshihara S, Kusuda S, Mochizuki H, et al. « Effect of PVZ Prophylaxis on Subsequent Recurrent Wheezing in Preterm Infants ». Pediatrics. novembre 2013;132(5):811-8. doi: 10.1542/peds.2013-0982.
- Note de bas de page 139
-
Grimaldi M, Gouyon B, Michaut F, et al. « Severe Respiratory Syncytial Virus Bronchiolitis: Epidemiologic Variations Associated with the Initiation of PVZ in Severely Premature Infants with Bronchopulmonary Dysplasia ». Pediatr Infect Dis J. décembre 2004;23:1081-5. doi: 10.1097/01.inf.0000145406.74341.c7.
- Note de bas de page 140
-
Robinson KA, Odelola OA, Saldanha IJ. « PVZ for Prophylaxis against Respiratory Syncytial Virus Infection in Children with Cystic Fibrosis ». Cochrane Database Syst Rev. juillet 2016;2016(7):CD007743. doi: 10.1002/14651858.CD007743.pub6.
- Note de bas de page 141
-
Cohen AH, Boron ML, Dingivan C. « A Phase IV Study of the Safety of Synagis®(PVZ) for Prophylaxis of Respiratory Syncytial Virus Disease in Children with Cystic Fibrosis [Poster presented at the American Thoracic Society International Conference, May 20-25, 2005 in San Diego, CA] ». 2005.
- Note de bas de page 142
-
Winterstein AG, Eworuke E, Xu D, et al. « PVZ Immunoprophylaxis Effectiveness in Children with Cystic Fibrosis ». Pediatr Pulmonol. septembre 2013;48(9):874-84. doi:10.1002/ppul.22711.
- Note de bas de page 143
-
Giebels K, Marcotte JE, Podoba J. « Prophylaxis against Respiratory Syncytial Virus in Young Children with Cystic Fibrosis ». Pediatr Pulmonol. février 2008;43(2):169-74. doi:10.1002/ppul.20751.
- Note de bas de page 144
-
Buchs C, Dalphin ML, Sanchez S. « PVZ Prophylaxis in Infants with Cystic Fibrosis does not Delay First Isolation of Pseudomonas Aeruginosa or Staphylococcus Aureus ». Eur J Pediatr. 16 mai 2017;176(7):891-7. doi: 10.1007/s00431-017-2926-8.
- Note de bas de page 145
-
Fink AK, Graff G, Byington CL. « PVZ and Long-term Outcomes in Cystic Fibrosis ». Pediatrics. juillet 2019;144(1):e20183495. doi: 10.1542/peds.2018-3495.
- Note de bas de page 146
-
Chiu SN, Wang JN, Fu YC, et al. « Efficacy of a Novel PVZ Prophylaxis Protocol for Respiratory Syncytial Virus Infection in Congenital Heart Disease: A Multicenter Study ». J Pediatr. 2018;195:108,114.e1. doi: 10.1016/j.jpeds.2017.11.044.
- Note de bas de page 147
-
Soraiz MG, Andrés SB, Castro SB, et al. « PVZ in Infants Less than 1 Year with Hemodynamically Significant Congenital Heart Disease in Argentina a Comparative Study with Historical Control Group ». Cardiology in the Young: 2017 Supplement 4. WCPCCS 2017:Abstract P2182 -S165-6.
- Note de bas de page 148
-
Harris KC, Anis AH, Crosby MC, et al. « Economic Evaluation of PVZ in Children With Congenital Heart Disease: A Canadian Perspective ». Can J Cardiol. 2011;27:523.e11,523.e15. doi:10.1016/j.cjca.2010.12.064.
- Note de bas de page 149
-
Sanchez-Luna M, Medrano C, Lirio J, et al. « Down syndrome as Risk Factor for Respiratory Syncytial Virus Hospitalization: A Prospective Multicenter Epidemiological Study. Influenza Other Respiratory Viruses ». mars 2017;11(2):157-64. doi: 10.1111/irv.12431.
- Note de bas de page 150
-
Yi H, Lanctôt KL, Bont L, et al. « Respiratory Syncytial Virus Prophylaxis in Down syndrome: A Prospective Cohort Study ». Pediatrics. juin 2014;133(6):1031-7. doi: 10.1542/peds.2013-3916.
- Note de bas de page 151
-
Kimura T, Takeuchi M, Kawakami K. « Utilization and Efficacy of PVZ for Children with Down syndrome ». Pediatr Int. janvier 2020;62:677-82. doi: 10.1111/ped.14157.
- Note de bas de page 152
-
Banerji A, Panzov V, Young M, et al. « The Real-Life Effectiveness of PVZ for Reducing Hospital Admissions for Respiratory Syncytial Virus in Infants Residing in Nunavut ». Can Respir J. mai-juin 2014;21:185-9. doi: 10.1155/2014/941367.
- Note de bas de page 153
-
Grindeland CJ, Mauriello CT, Leedahl DD, et al. « Association between Updated Guideline-Based PVZ Administration and Hospitalizations for Respiratory Syncytial Virus Infections ». Pediatr Infect Dis J. juillet 2016;35(7):728-32. doi: 10.1097/INF.0000000000001150.
- Note de bas de page 154
-
Zembles TN, Bushee GM, Willoughby RE, et al. « Impact of American Academy of Pediatrics PVZ Guidance for Children >=29 and <35 Weeks of Gestational Age ». J Pediatr. juin 2019;209:125-9. doi: 10.1016/j.jpeds.2019.02.020.
- Note de bas de page 155
-
Goldstein M, Krilov LR, Fergie J, et al. « Respiratory Syncytial Virus Hospitalizations among US. Preterm Infants Compared with Term Infants before and after the 2014 American Academy of Pediatrics Guidance on Immunoprophylaxis: 2012-2016 ». Am J Perinatol. décembre 2018;35(14):1433-42. doi: 10.1055/s-0038-1660466.
- Note de bas de page 156
-
Kong AM, Krilov LR, Fergie J, et al. « The 2014-2015 National Impact of the 2014 American Academy of Pediatrics Guidance for Respiratory Syncytial Virus Immunoprophylaxis on Preterm Infants Born in the United States ». Am J Perinatol. janvier 2018;35(2):192-200. doi: 10.1055/s-0037-1606352.
- Note de bas de page 157
-
Walpert AS, Thomas ID, Lowe MC, et al. « RSV Prophylaxis Guideline Changes and Outcomes in Children with Congenital Heart Disease ». Congenital Heart Disease. mai 2018;13(3):428-31. doi: 10.1111/chd.12590.
- Note de bas de page 158
-
Belleudi V, Trotta F, Pinnarelli L, et al. « Neonatal Outcomes Following New Reimbursement Limitations on PVZ in Italy ». Arch Dis Child. décembre 2018;103(12):1163-7. doi: 10.1136/archdischild-2018-315349.
- Note de bas de page 159
-
Capizzi A, Silvestri M, Orsi A, et al. « The Impact of the Recent Aap Changes in PVZ Authorization on Rsv-Induced Bronchiolitis Severity and Incidence ». Italian J Pediatr. 14 août 2017;43:71. https://doi.org/10.1186/s13052-017-0390-8
- Note de bas de page 160
-
Priante E, Tavella E, Girardi E, et al. « Restricted PVZ Recommendations and the Impact on RSV Hospitalizations among Infants Born at > 29 Weeks of Gestational Age: An Italian Multicenter Study ». Am J Perinatol. juillet 2019;36(S 02):S77-82. doi: 10.1055/s-0039-1691771.
- Note de bas de page 161
-
Johnson S, Oliver C, Prince GA, et al. « Development of a Humanized Monoclonal Antibody (Medi-493) with Potent In Vitro and In Vivo Activity against Respiratory Syncytial Virus ». J Infect Dis. novembre 1997;176(5):1215-24. doi: 10.1086/514115.
- Note de bas de page 162
-
Subramanian KN, Weisman LE, Rhodes T, et al. « Safety, Tolerance and Pharmacokinetics of a Humanized Monoclonal Antibody to Respiratory Syncytial Virus in Premature Infants and Infants with Bronchopulmonary Dysplasia. MEDI-493 Study Group ». Pediatr Infect Dis J. février 1998;17(2):110-5. doi: 10.1097/00006454-199802000-00006.
- Note de bas de page 163
-
Robbie GJ, Zhao L, Mondick J, et al. « Population Pharmacokinetics of PVZ, a Humanized Anti-Respiratory Syncytial Virus Monoclonal Antibody, in Adults and Children [Published Correction Appears in Antimicrob Agents Chemother. octobre 2012;56(10):5431] ». Antimicrob Agents Chemother. 2012 Sep;56(9):4927-36. doi: 10.1128/AAC.06446-11.
- Note de bas de page 164
-
Fenton C, Scott LI, Plosker GL. « PVZ: A Review of Its Use as Prophylaxis for Serious Respiratnnory Syncytial Virus Infection ». Pediatr Drugs. 2004;6(3):177-97. doi: 10.2165/00148581-200406030-00004.
- Note de bas de page 165
-
La Via WV, Notario GF, Yu X-Qiang, et al. « Three Monthly Doses of PVZ are Not Adequate for 5-Month Protection: A Population Pharmacokinetic Analysis ». Pulm Pharmacol Ther. décembre 2013;26:666e-671. doi: 10.1016/j.pupt.2013.03.007.
- Note de bas de page 166
-
Gutfraind A, Galvani AP, Meyers LA, et al. « Efficacy and Optimization of PVZ Injection Regimens against Respiratory Syncytial Virus Infection ». JAMA Pediatr. avril 2015;169(4):341-8. doi: 10.1001/jamapediatrics.2014.3804.
- Note de bas de page 167
-
Lavoie PM, Solimano A, Taylor R, et al. « Outcomes of Respiratory Syncytial Virus Immunoprophylaxis in Infants Using an Abbreviated Dosing Regimen of PVZ ». JAMA Pediatr. février 2016;170(2):174-6. doi: 10.1001/jamapediatrics.2015.3235.
- Note de bas de page 168
-
Claydon J, Popescu CR, Shaiba L, et al. « Outcomes Related to Respiratory Syncytial Virus with an Abbreviated PVZ Regimen in Children with Congenital Heart Disease: A Descriptive Analysis ». CMAJ OPEN. 18 février 2019;7(1):E88-93. doi: 10.9778/cmajo.20180167.
- Note de bas de page 169
-
Claydon J, Sur A, Callejas A, et al. « Respiratory Syncytial Virus-Neutralizing Serum Antibody Titers in Infants Following PVZ Prophylaxis with an Abbreviated Dosing Regimen ». PLoS ONE. 24 avril 2017;12(4):e0176152. doi: 10.1371/journal.pone.0176152.
- Note de bas de page 170
-
Chen JJ, Chan P, Paes B, et al. « Serious Adverse Events in the Canadian Registry of Children Receiving PVZ (CARESS) for Respiratory Syncytial Virus Prevention ». PLoS ONE. 3 août 2015;10(8):e0134711. doi: 10.1371/journal.pone.0134711.
- Note de bas de page 171
-
Parnes C, Guillermin J, Habersang R, et al. « PVZ Prophylaxis of Respiratory Syncytial Virus Disease in 2000-2001: Results from the PVZ Outcomes Registry ». Pediatr Pulmonol. juin 2003;35(6):484-9. doi: 10.1002/ppul.10288.
- Note de bas de page 172
-
Forbes ML, Kumar VR, Yogev R, et al. « Serum PVZ Level is Associated with Decreased Severity of Respiratory Syncytial Virus Disease in High-Risk Infants ». Human Vaccines & Immunotherapeutics. 2014;10(10):2789-94. doi: 10.4161/hv.29635.
- Note de bas de page 173
-
Paes BA, Craig C, Pigott W, et al. « Seasonal Respiratory Syncytial Virus Prophylaxis Based on Predetermined Dates Versus Regional Surveillance Data ». Pediatr Infect Dis J. septembre 2013;32(9):e360-4. doi: 10.1097/INF0b013e31829479d3.
- Note de bas de page 174
-
Weinberger DM, Warren JL, Steiner CA, et al. « Reduced-Dose Schedule of Prophylaxis Based on Local Data Provides Near-Optimal Protection Against Respiratory Syncytial Virus ». Clin Infect Dis. 15 août 2015;61(4):506-14. doi: 10.1093/cid/civ331.
- Note de bas de page 175
-
« Key Immunization Information Storage and Handling of Immunizing Agents: Handling of vaccines: Canadian Immunization Guide, Part 1 [Internet] ». Ottawa (ON): Agence de la santé publique du Canada; 11 juin 2021 [cité 10 mai 2022]. Disponible en anglais: https://www.canada.ca/en/public-health/services/publications/healthy-living/canadian-immunization-guide-part-1-key-immunization-information/page-9-storage-handling-immunizing-agents.html#p1c8a2.
- Note de bas de page 176
-
Mac S, Sumner A, Duchesne-Belanger S, et al. « Cost-Effectiveness of PVZ for Respiratory Syncytial Virus: A Systematic Review ». Pediatrics. mai 2019;143(5):e20184064. doi: 10.1542/peds.2018-4064.
- Note de bas de page 177
-
Blanken MO, Frederix GW, Nibbelke EE, et al. « Cost-Effectiveness of Rule-Based Immunoprophylaxis Against Respiratory Syncytial Virus Infections in Preterm Infants ». Eur J Pediatr. janvier 2018;177(1):133-44. doi: 10.1007/s00431-017-3046-1.
- Note de bas de page 178
-
Lofland JH, O'Connor JP, Chatterton ML, et al. « PVZ for Respiratory Syncytial Virus Prophylaxis in High-Risk Infants: A Cost-Effectiveness Analysis ». Clin Ther. novembre 2000;22(11):1357-69. doi: 10.1016/s0149-2918(00)83032-5.
- Note de bas de page 179
-
Wang D, Cummins C, Bayliss S, et al. « Immunoprophylaxis Against Respiratory Syncytial Virus (RSV) with PVZ in Children: A Systematic Review and Economic Evaluation ». Health Technol Assess. décembre 2008;12(36):iii, ix-x, 1-86. doi: 10.3310/hta12360.
- Note de bas de page 180
-
Neovius K, Buesch K, Sandstrom K, et al. « Cost-Effectiveness Analysis of PVZ as Respiratory Syncytial Virus Prophylaxis in Preterm Infants in Sweden ». Acta Paediatr Int J Paediatr. octobre 2011;100(10):1306-14. doi: 10.1111/j.1651-2227.2011.02309.x.
- Note de bas de page 181
-
Nuijten MJC, Wittenberg W, Lebmeier M. « Cost Effectiveness of PVZ for Respiratory Syncytial Virus Prophylaxis in High-Risk Children: A UK Analysis ». Pharmacoeconomics. 2007;25(1):55-71. doi: 10.2165/00019053-200725010-00006.
- Note de bas de page 182
-
Nuijten M, Lebmeier M, Wittenberg W. « Cost Effectiveness of PVZ for RSV Prevention in High-Risk Children in the Netherlands ». J Med Econ. 2009;12(4):291-300. doi: 10.3111/13696990903316961.
- Note de bas de page 183
-
Nuijten MJ, Wittenberg W. « Cost Effectiveness of PVZ in Spain: An Analysis Using Observational Data ». Eur J Heal Econ. février 2010;11(1):105-15. doi: 10.1007/s10198-009-0206-x.
- Note de bas de page 184
-
Salinas-Escudero G, Martínez-Valverde S, Reyes-López A, et al. « Cost-Effectiveness Analysis of the Use of PVZ in the Prophylaxis of Preterm Patients in Mexico ». Salud Publica Mex. janvier-février 2012;54(1):47-59. [cité 10 mai 2022]. Disponible en anglais: https://pubmed.ncbi.nlm.nih.gov/22286828/.
- Note de bas de page 185
-
Sanchez-Luna M, Burgos-Pol R, Oyagüez I, et al. « Cost-Utility Analysis of PVZ for Respiratory Syncytial Virus Infection Prophylaxis in Preterm Infants: Update Based on the Clinical Evidence in Spain ». BMC Infect Dis. 17 octobre 2017;17(1):1-11. doi: 10.1186/s12879-017-2803-0.
- Note de bas de page 186
-
Smart KA, Paes BA, Lanctt KL. « Changing Costs and the Impact on RSV Prophylaxis ». J Med Econ. 2010;13(4):705-8. doi: 10.3111/13696998.2010.535577.
- Note de bas de page 187
-
Chirico G, Ravasio R, Sbarigia U. « Cost-Utility Analysis of PVZ in Italy: Results from a Simulation Model in the Prophylaxis of Respiratory Syncytial Virus Infection (RSV) Among High-Risk Preterm Infants ». Ital J Pediatr. 25 février 2009;35:1-12. doi: 10.1186/1824-7288-35-4.
- Note de bas de page 188
-
Elhassan NO, Sorbero MES, Hall CB, et al. « Cost-Effectiveness Analysis of PVZ in Premature Infants without Chronic Lung Disease ». Arch Pediatr Adolesc Med. octobre 2006;160(10):1070-6. doi: 10.1001/archpedi.160.10.1070.
- Note de bas de page 189
-
McGirr AA, Schwartz KL, Allen U, et al. « The Cost-Effectiveness of PVZ in Infants with Cystic Fibrosis in the Canadian Setting: A Decision Analysis Model ». Hum Vaccines Immunother. 4 mars 2017;13(3):599-606. doi: 10.1080/21645515.2016.1235670.
- Note de bas de page 190
-
Nuijten M, Lebmeier M, Wittenberg W. « Cost Effectiveness of PVZ in Children with Congenital Heart Disease in Germany ». J Med Econ. 2009b;12(4):301-8. doi: 10.3111/13696990903347172.
- Note de bas de page 191
-
Bentley A, Filipovic I, Gooch K, et al. « A Cost-Effectiveness Analysis of Respiratory Syncytial Virus (RSV) Prophylaxis in Infants in the United Kingdom ». Health Econ Rev 2013;3:1-12 doi:10.1136/thoraxjnl-2011-201054c.170.
- Note de bas de page 192
-
Yount LE, Mahle WT. « Economic Analysis of PVZ in Infants with Congenital Heart Disease ». Pediatrics. décembre 2004;114(6):1606-11. doi: 10.1542/peds.2004-0224.
- Note de bas de page 193
-
Weiner LB, Masaquel AS, Polak MJ, et al. « Cost-Effectiveness Analysis of PVZ among Pre-Term Infant Populations Covered By Medicaid in the United States ». J Med Econ. 2012;15(5):997-1018. doi: 10.3111/13696998.2012.672942.
- Note de bas de page 194
-
Mahadevia PJ, Masaquel AS, Polak MJ, et al. « Cost Utility of PVZ Prophylaxis among Pre-Term Infants in the United States: A National Policy Perspective ». J Med Econ. 10 mai 2012;15(5):987-96. doi: 10.3111/13696998.2012.690013.
- Note de bas de page 195
-
Schmidt R, Majer I, García Román N, et al. « PVZ in the Prevention of Severe Respiratory Syncytial Virus Infection in Children with Congenital Heart Disease; A Novel Cost-Utility Modeling Study Reflecting Evidence-Based Clinical Pathways in Spain ». Health Econ Rev. 19 décembre 2017;7:47. doi: 10.1186/s13561-017-0181-3.
- Note de bas de page 196
-
Tam DY, Banerji A, Paes BA, et al. « The Cost Effectiveness of PVZ in Term Inuit Infants in the Eastern Canadian Arctic ». J Med Econ. 2009;12(4):361-70. doi: 10.3111/13696990903442155.
- Note de bas de page 197
-
Banerji A, Ng K, Moraes TJ, et al. « Cost-Effectiveness of PVZ Compared to No Prophylaxis in Term Infants Residing in the Canadian Arctic ». CMAJ Open. octobre-décembre 2016;4(4):E623-33. doi: 10.9778/cmajo.20150052.
- Note de bas de page 198
-
Rietveld E, Steyerberg EW, Polder JJ, et al. « Passive Immunisation against Respiratory Syncytial Virus: A Cost-Effectiveness Analysis ». Arch Dis Child. juillet 2010;95(7):493-8. doi: 10.1136/adc.2008.155556.
- Note de bas de page 199
-
Roeckl-Wiedmann I, Liese JG, Grill E, et al. « Economic Evaluation of Possible Prevention of RSV-Related Hospitalizations in Premature Infants in Germany ». Eur J Pediatr. avril 2003;162(4):237-44. doi: 10.1007/s00431-002-1106-6.
- Note de bas de page 200
-
Vogel AM, McKinlay MJ, Ashton T, et al. « Cost-Effectiveness of PVZ in New Zealand ». J Paediatr Child Health. août 2002;38(4):352-7. doi: 10.1046/j.1440-1754.2002.00790.x.
- Note de bas de page 201
-
Hampp C, Kauf TL, Saidi AS, et al. « Cost-Effectiveness of Respiratory Syncytial Virus Prophylaxis in Various Indications. Arch Pediatr Adolesc Med ». juin 2011;165(6):498-505. doi: 10.1001/archpediatrics.2010.298.
- Note de bas de page 202
-
Hascoet JM, Fagnani F, Charlemagne A, et al. « Methodological Aspects of Economic Evaluation in Pediatrics: Illustration by RSV Infection Prophylaxis in the French Setting ». Arch Pediatr. décembre 2008;15(12):1739-48. doi: 10.1016/j.arcped.2008.09.024.
- Note de bas de page 203
-
Seeler RA, Schatz B. « PVZ (Synagis)--Cohorting Babies to Reduce Waste ». Pediatrics. novembre 1999;104(5 Pt 1):1170-1. doi: 10.1542/peds.104.5.1170.
- Note de bas de page 204
-
CADTH Lignes directrices en matière de méthodologie. « Guidelines for the Economic Evaluation of Health Technologies: Canada 4th Edition [Internet] ». Ottawa (ON): CADTH; mai 2017;1-76 [cité 10 mai 2022]. Disponible en anglais: https://www.cadth.ca/sites/default/files/pdf/guidelines_for_the_economic_evaluation_of_health_technologies_canada_4th_ed.pdf.
- Note de bas de page 205
-
Mossialos E, Wenzl M, et al. « 2015 International Profiles of Health Care Systems: [Internet] ». New York (NY): The Commonwealth Fund; janvier 2016;1-180 [cité 10 mai 2022]. Disponible en anglais: https://www.commonwealthfund.org/publications/fund-reports/2016/jan/international-profiles-health-care-systems-2015.
- Note de bas de page 206
-
Gilca R. Institut National de Santé Publique de Québec. Personal Communication.
- Note de bas de page 207
-
Lorcy A, Gilca R, Dubé E, et al. « Feasibility and Ethical Issues: Experiences and Concerns of Healthcare Workers Regarding a New RSV Prophylaxis Programme in Nunavik », Quebec. Int J Circumpolar Health. décembre 2020;79(1):1742564. doi: 10.1080/22423982.2020.1742564.
- Note de bas de page 208
-
Hui C, Paes B, Papenburg J, et al. « PVZ Adherence and Outcomes in Canadian Aboriginal Children ». Pediatr Infect Dis J. novembre 2016;35(11):1187-93. doi: 10.1097/INF.0000000000001282.
- Note de bas de page 209
-
Wong S.K., Li A., Lanctot K.L., et al. « Adherence and Outcomes: A Systematic Review of PVZ Utilization ». Expert Rev Respir Med. janvier 2018;12(1):27-42. doi: 10.1080/17476348.2018.1401926.
- Note de bas de page 210
-
« Canada Vigilance Program [Internet] ». Ottawa (ON): Santé Canada; 12 juillet 2018 [cité 5 avril 2019]. Disponible en anglais: https://www.canada.ca/en/health-canada/services/drugs-health-products/medeffect-canada/canada-vigilance-program.html.
- Note de bas de page 211
-
Wegzyn C, Toh LK, Notario G, et al. « Safety and Effectiveness of PVZ in Children at High Risk of Serious Disease Due to Respiratory Syncytial Virus Infection: A Systematic Review ». Infect Dis Ther. décembre 2014;3(2):133-58. doi: 10.1007/s40121-014-0046-6.
- Note de bas de page 212
-
Makari D, Jensen KM, Harris B, et al. « Randomized, Double-Blind Study of the Safety of the Liquid Versus Lyophilized Formulation of PVZ in Premature Infants and Children with Chronic Lung Disease of Prematurity ». Infect Dis Ther. décembre 2014;3(2):339-47. doi: 10.1007/s40121-014-0033-y.
- Note de bas de page 213
-
Robbie GJ, Makari D, Harris B. « Randomized, Double-Blind Study of the Pharmacokinetics and Safety of PVZ Liquid Formulation Compared with Lyophilized Formulation ». Infect Dis Ther. décembre 2014;3(2):203-14. doi: 10.1007/s40121-014-0042-x.
- Note de bas de page 214
-
Carbonell-Estrany X, Simões EAF, Dagan R, et al. « Motavizumab for Prophylaxis of Respiratory Syncytial Virus in High-Risk Children: A Noninferiority Trial ». Pediatrics. janvier 2010;125(1):e35-51. doi: 10.1542/peds.2008-1036.
- Note de bas de page 215
-
Fernandez P, Trenholme A, Abarca K, et al. « A phase 2, Randomized, Double-Blind Safety and Pharmacokinetic Assessment of Respiratory Syncytial Virus (RSV) Prophylaxis with Motavizumab and PVZ Administered in the Same Season ». BMC Pediatr. 3 juin 2010;10:38. doi: 10.1186/1471-2431-10-38.
- Note de bas de page 216
-
Feltes TF, Sondheimer HM, Tulloh RM, et al. « Randomized Controlled Trial of Motavizumab Versus PVZ for the Prophylaxis of Serious Respiratory Syncytial Virus Disease in Children with Hemodynamically Significant Congenital Heart Disease ». Pediatr Res. août 2011;70(2):186-91. doi: 10.1203/PDR.0b013e318220a553.
- Note de bas de page 217
-
Haerskjold A, Linder M, Henriksen L, et al. « PVZ Exposure and the Risk of Autoimmune Disease: A Cross-National Cohort Study ». Paediatr Drugs. décembre 2016;18(6):435-41. doi: 10.1007/s40272-016-0191-3.
- Note de bas de page 218
-
Haerskjold A, Stokholm L, Linder M, et al. « PVZ Exposure and the Risk of Atopic Dermatitis, Asthma and Allergic Rhinoconjunctivitis: A Cross-National, Population-Based Cohort Study ». Paediatr Drugs. avril 2017;19(2):155-64. doi: 10.1007/s40272-017-0215-7.
- Note de bas de page 219
-
Mitchell I, Paes BA, Li A, et al. « CARESS: The Canadian Registry of PVZ ». Pediatr Infect Dis J. février 2011;30:651-5. doi: 10.1097/INF.0b013e31821146f7.
- Note de bas de page 220
-
Paes B, Mitchell I, Li A, et al. « Respiratory Hospitalizations and Respiratory Syncytial Virus Prophylaxis in Special Populations ». Eur J Pediatr. mai 2012;171(5):833-41. doi: 10.1007/s00431-011-1654-8.
- Note de bas de page 221
-
Manzoni P, Paes B, Lanctôt KL, et al. « Outcomes of Infants Receiving PVZ Prophylaxis for Respiratory Syncytial Virus in Canada and Italy: An International, Prospective Cohort Study ». Pediatr Infect Dis J. janvier 2017;36(1):2-8. doi: 10.1097/INF.0000000000001340.
- Note de bas de page 222
-
Simon A, Nowak H, Sterz R. « Use of PVZ in Germany: Data from 2002-2007 ». Klin Padiatr. septembre 2011;223(5):292-8. doi: 10.1055/s-0030-1270515.
- Note de bas de page 223
-
Simon A, Gehrmann S, Wagenpfeil G, et al. « Use of PVZ in Germany - Report from the German SynagisTM Registry 2009 – 2016 ». Klin Padiatr. septembre 2018;230(5):263-9. doi: 10.1055/a-0595-7771.
- Note de bas de page 224
-
Groothuis JR. « Safety and Tolerance of PVZ Administration in a Large Northern Hemisphere Trial. Northern Hemisphere Expanded Access Study Group ». Pediatr Infect Dis J. juin 2001;20(6):628-30. doi: 10.1097/00006454-200106000-00018.
- Note de bas de page 225
-
Groothuis JR. « Safety of PVZ in Preterm Infants 29 to 32 Weeks' Gestational Age Without Chronic Lung Disease to Prevent Serious Respiratory Syncytial Virus Infection ». Eur J Clin Microbiol Infect Dis. juillet 2003;22(7):414-7. doi: 10.1007/s10096-003-0961-z.
- Note de bas de page 226
-
Castillo LM, Bugarin G, Arias JC. « One-Year Observational Study of PVZ Prophylaxis on Infants at Risk for Respiratory Syncytial Virus Infection in Latin America ». Eur J Clin Microbiol Infect Dis. septembre-octobre 2017;93(5):467-74. doi: 10.1016/j.jped.2016.11.006.
- Note de bas de page 227
-
Lacaze-Masmonteil T, Roze JC, Fauroux B. « Incidence of Respiratory Syncytial Virus-Related Hospitalizations in High-Risk Children: Follow-Up of a National Cohort of Infants Treated with PVZ as RSV Prophylaxis ». Pediatr Pulmonol. septembre 2002;34(3):181-8. doi: 10.1002/ppul.10175.
- Note de bas de page 228
-
Pinquier D, Gouyon JB, Fauroux B, et al. « Modalités d'Utilisation, Tolérance et Benefice du PVZ dans la Prévention des Infections à VRS en France : Saison 2005–2006 [PVZ Immunoprophylaxis: Use in Clinical Practice, Safety and Beneficial Effects in France] ». Arch Pediatr. novembre 2009;16(11):1443-52. doi: 10.1016/j.arcped.2009.08.008.
- Note de bas de page 229
-
Kashiwagi T, Okada Y, Nomoto K. « PVZ Prophylaxis against Respiratory Syncytial Virus Infection in Children with Immunocompromised Conditions or Down syndrome: A Multicenter, Post-Marketing Surveillance in Japan ». Pediatr Drugs. février 2018;20(1):97-104. doi: 10.1007/s40272-017-0264-y.
- Note de bas de page 230
-
Al-Alaiyan S, Pollack P, Notario GF. « Safety and Pharmacokinetics of Extended Use of PVZ in Saudi Arabian Infants and Children ». Drugs in Context. 27 février 2015;4:212270. doi: 10.7573/dic.212270.
- Note de bas de page 231
-
Lacaze-Masmonteil T, Seidenberg J, Mitchell I, et al. « Evaluation of the Safety of PVZ in the Second Season of Exposure in Young Children at Risk for Severe Respiratory Syncytial Virus Infection ». Drug Saf. 2003;26(4):283-91. doi: 10.2165/00002018-200326040-00005.
- Note de bas de page 232
-
Null D Jr, Pollara B, Dennehy PH, et al. « Safety and Immunogenicity of PVZ (Synagis) Administered for Two Seasons ». Pediatr Infect Dis J. novembre 2005;24(11):1021-3. doi: 10.1097/01.inf.0000183938.33484.bd.
- Note de bas de page 233
-
Turti TV, Baibarina EN, Degtiareva EA, et al. « A Prospective, Open-Label, Non-Comparative Study of PVZ Prophylaxis in Children at High Risk of Serious Respiratory Syncytial Virus Disease in the Russian Federation ». BMC Res Notes. 4 septembre 2012;5:484. doi: 10.1186/1756-0500-5-484.
- Note de bas de page 234
-
Mori M, Onodera M, Morimoto A, et al. « PVZ use in Japanese Infants and Children with Immunocompromised Conditions ». Pediatr Infect Dis J. novembre 2014;33(11):1183-5. doi: 10.1097/INF.0000000000000392.
- Note de bas de page 235
-
Sáez-Llorens X, Castaño E, Null D, et al. « Safety and Pharmacokinetics of an Intramuscular Humanized Monoclonal Antibody to Respiratory Syncytial Virus in Premature Infants and Infants with Bronchopulmonary Dysplasia ». The MEDI-493 Study Group. Pediatr Infect Dis J. septembre 1998;17(9):787-91. doi: 10.1097/00006454-199809000-00007.
- Note de bas de page 236
-
Borecka R, Lauterbach R, Helwich E. « Factors Related to Compliance with PVZ Prophylaxis for Respiratory Syncytial Virus (RSV) Infection - Data from Poland ». Med Wieku Rozwoj. 2016;20(3):181-90. [cité 10 mai 2022]. Disponible en anglais: https://pubmed.ncbi.nlm.nih. gov/27941187/.
- Note de bas de page 237
-
Abushahin A, Janahi I, Tuffaha A. « Effectiveness of PVZ Immunoprophylaxis in Preterm Infants against Respiratory Syncytial Virus Disease in Qatar ». Int J Gen Med. 31 janvier 2018;11:41-6. doi: 10.2147/IJGM.S156078.
- Note de bas de page 238
-
Chang SG, Park MS, Yu JE. « Outcomes of PVZ Prophylaxis for Respiratory Syncytial Virus Infection in Preterm Children with Bronchopulmonary Dysplasia at a Single Hospital in Korea from 2005 to 2009 ». J Korean Med Sci. février 2010;25(2):251-6. doi: 10.3346/jkms.2010.25.2.251.
- Note de bas de page 239
-
Savitz J, Geaney C, Banks TA. « A Case of Anaphylaxis to PVZ ». Ann Allergy Asthma Immunol. août 2014;113(2):236-7. doi: 10.1016/j.anai.2014.06.006.
- Note de bas de page 240
-
Resch B. « Product Review on the Monoclonal Antibody PVZ for Prevention of Respiratory Syncytial Virus Infection ». Hum Vaccin Immunother. 2 septembre 207;13(9):2138-49. doi: 10.1080/21645515.2017.1337614.
- Note de bas de page 241
-
Tenenbaum T, Drechsel-Bäuerle U, Oberle D. « Cardiorespiratory Events After Monoclonal Antibody Prophylaxis With PVZ ». Pediatr Infect Dis J. novembre 2018;37(11):e281-2. doi: 10.1097/INF.0000000000002017.
- Note de bas de page 242
-
Pérez-De-Lis M, Retamozo S, Flores-Chávez A, et al. « Autoimmune diseases induced by biological agents. A review of 12,731 cases (BIOGEAS Registry) ». Expert Opin Drug Saf. novembre 2017;16(11):1255-71. doi: 10.1080/14740338.2017.1372421.
- Note de bas de page 243
-
Saji T, Nakazawa M, Harada K. « Safety and Efficacy of PVZ Prophylaxis in Children with Congenital Heart Disease ». Pediatr Internat. août 2005;47(4):397-403. doi: 10.1111/j.1442-200x.2005.02089.x.
- Note de bas de page 244
-
Simon A, Gehrmann S, Wagenpfeil G, et al. « PVZ Use in Infants with Down syndrome - Report from the German SynagisTM Registry 2009-2016 ». Eur J Pediatr. juin 2018;177(6):903-11. doi: 10.1007/s00431-018-3142-x.