Déclaration supplémentaire - Afluria TetraMD - Une déclaration d’un comité consultatif (DCC)

Télécharger le format de rechange
(Format PDF, 412 Ko, 29 pages)
Organisation : Agence de la santé publique du Canada
Publiée : 2018-12-XX
Préambule
Le Comité consultatif national de l’immunisation (CCNI) donne à l’Agence de la santé publique du Canada (ASPC) des conseils continus et à jour liés à l’immunisation dans le domaine de la médecine, des sciences et de la santé publique.
En plus de la prise en compte du fardeau associé aux maladies et des caractéristiques vaccinales, l’ASPC a élargi le mandat du CCNI de façon à lui permettre d’inclure l’étude systématique des facteurs liés aux programmes dans la formulation de ses recommandations axées sur des données probantes. Cette initiative devrait aider le CCNI à prendre des décisions en temps opportun en ce qui a trait aux programmes de vaccination financés par les fonds publics à échelle provinciale et territoriale.
Les nouveaux facteurs que le CCNI devra examiner de façon systématique sont les suivants : économie, équité, éthique, acceptabilité et faisabilité. Au cours des années à venir, le CCNI s’emploiera à peaufiner ses approches méthodologiques dans le but de tenir compte de ces facteurs. Ce ne seront pas toutes ses déclarations qui exigeront une analyse approfondie de l’ensemble des facteurs programmatiques. Mais au fur et à mesure de la mise en œuvre de son mandat élargi, le CCNI produira des déclarations choisies qui incluront divers degrés d’analyses visant les programmes de santé publique.
L’ASPC confirme que les conseils et les recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes et diffuse ce document à des fins d’information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la monographie de produit pertinente. Les recommandations d’utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait homologuer les vaccins et ont démontré leur innocuité et leur efficacité lorsqu’ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l’ASPC régissant les conflits d’intérêts, notamment déclarer chaque année les conflits d’intérêts possibles.
Table des matières
- Sommaire de l’information contenue dans la présente déclaration du CCNI
- I. Introduction
- II. Méthodologie
- III. Vaccin
- IV. Recommandations
- Tableaux
- Liste des abréviations
- Remerciements
- Références
- Annexe A : Organigramme PRISMA
Sommaire de l’information contenue dans la présente Déclaration Supplémentaire du CCNI
Les faits saillants suivants font ressortir l’information importante pour les vaccinateurs. Veuillez consulter le reste de la Déclaration pour obtenir plus de précisions.
1. Quoi
AfluriaMD Tetra est un vaccin antigrippal quadrivalent inactivé à virion fragmenté dont l’utilisation a récemment été autorisée au Canada.
2. Qui
La présente déclaration supplémentaire aborde l’immunisation contre la grippe saisonnière chez des adultes et des enfants pour qui le vaccin antigrippal n’est pas contre-indiqué.
3. Comment
AfluriaMD Tetra peut faire partie des vaccins antigrippaux quadrivalents offerts aux adultes et enfants de cinq ans et plus pour leur vaccination annuelle contre la grippe.
4. Pourquoi
AfluriaMD Tetra est considéré comme sûr et immunogène chez les adultes et enfants de cinq ans et plus, et présente un profil d’innocuité et d’immunogénicité comparable aux vaccins antigrippaux déjà autorisés.
I. Introduction
La grippe est une infection virale et l’on estime qu’elle est la cause d’environ 12 200 hospitalisationsNote de bas de page 1 et 3 500 décèsNote de bas de page 2 au Canada par an. Chaque année, le CCNI publie une déclaration sur les vaccins antigrippaux saisonniers, laquelle comprend des recommandations sur l’utilisation des vaccins pour la saison grippale à venir. La grippe chez l’être humain est causée par deux types principaux de virus : les virus grippaux de type A, classés en sous-types en fonction de deux protéines de surface, soit l’hémagglutinine (HA) et la neuraminidase (NA); et les virus grippaux de type B, qui ont évolué en deux lignées antigéniquement distinctes, soit B/Yamagata et B/Victoria. Les vaccins antigrippaux saisonniers se présentent sous forme de préparations trivalentes ou quadrivalentes. Les vaccins trivalents contiennent deux souches grippales A et une souche grippale B, et les vaccins quadrivalents contiennent les trois souches comprises dans les vaccins trivalents ainsi qu’une souche grippale B supplémentaire provenant de l’autre lignée grippale B.
AfluriaMD Tetra (Seqirus Pty Ltd.) est un vaccin antigrippal quadrivalent inactivé (VAQ) à virion fragmenté dont l’utilisation a été autorisée en février 2018 au Canada chez les adultes et enfants de cinq ans et plus. Cette autorisation a déclenché la nécessité d’une déclaration supplémentaire, car le CCNI n’avait pas déjà formulé de recommandation quant à l’utilisation de ce vaccin dans quelque population que ce soit. AfluriaMD Tetra est la préparation quadrivalente d’AfluriaMD (Seqirus Pty Ltd), un vaccin antigrippal trivalent inactivé (VAT) à virion fragmenté. Le fabricant d’AfluriaMD (trivalent) n’avait pas fait autoriser son utilisation au Canada au moment de la publication de la présente déclaration supplémentaire.
Objectif des lignes directrices
L’objectif de la présente déclaration supplémentaire du Comité consultatif est d’examiner les données probantes disponibles en ce qui concerne l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité d’AfluriaMD Tetra et de fournir des lignes directrices quant à son utilisation chez les adultes et les enfants.
II. Méthodologie
Le Groupe de travail sur l’influenza (GTI) du CCNI a arrêté son choix sur un protocole d’examen a priori comprenant des questions d’examen, une stratégie de recherche, des critères d’inclusion et d’exclusion et une évaluation de la qualité. Pour orienter cet examen, il a élaboré la question de recherche et déterminé le modèle PICO suivant :
Quelles sont l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité d’AfluriaMD Tetra chez les adultes et les enfants?
- P (population) : Adultes et enfants (âgés d’au moins six mois)
- I (intervention) : AfluriaMD Tetra ou AfluriaMD (préparation à 1,5 % de taurodéoxycholate de sodium [TDOC])
- C (comparaison) : VAT comparateur, VAQ comparateur, placebo ou aucun comparateur
- O (résultat) : Efficacité potentielle, efficacité réelle, immunogénicité, innocuité
Puisque AfluriaMD Tetra est un nouveau vaccin, aucune étude post-commercialisation n’a été réalisée à ce jour. Afin de compléter les éléments probants en ce qui concerne AfluriaMD Tetra, le GTI a décidé d’inclure toute étude ayant évalué l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité d’AfluriaMD (la préparation trivalente) qui est fabriqué selon le même procédé qu’AfluriaMD Tetra. Ce procédé nécessite l’utilisation d’une préparation à 1,5 % de TDOC comme agent de fractionnement. Avant la saison 2017-2018 de l’hémisphère Nord, le procédé de fabrication d’AfluriaMD nécessitait une quantité égale ou inférieure à 1,5 % de TDOC. L’utilisation d’une préparation à 1,5 % de TDOC comme agent de fractionnement a été intégrée au procédé de fabrication d’AfluriaMD après qu’un signal d’innocuité dans la saison grippale de 2010 en Australie dans l’hémisphère Sud a montré qu’AfluriaMD nécessitant l’utilisation d’une quantité égale ou inférieure à 1,5 % de TDOC était associé à un taux accru de fièvre et de convulsions fébriles chez les enfants de moins de cinq ansNote de bas de page 3. Cette question est examinée avec plus de présicions dans la section III.4.2 du présent document.
De plus, le GTI a décidé d’inclure les études réalisées auprès d’enfants de 6 mois et plus afin de saisir l’ensemble des données probantes disponibles chez les enfants, bien que le fabricant ne tentait pas de découvrir une indication pour ce groupe d’âge lors de la publication de la présente déclaration supplémentaire.
La stratégie de recherche a été élaborée en fonction de la question de recherche et le modèle PICO, de concert avec une bibliothécaire de la Bibliothèque de la santé de Santé Canada (SC) et de l’ASPC (stratégie de recherche disponible sur demande). Deux évaluateurs ont examiné de manière indépendante les titres et résumés d’articles recueillis dans le cadre de la recherche et les textes intégraux admissibles aux fins d’inclusion. Deux évaluateurs ont également saisi des données de manière indépendante et déterminé la qualité des études au moyen des critères énoncés par Harris et coll.Note de bas de page 4. Tout désaccord ou écart a été résolu par voie de discussion et de consensus. La synthèse des connaissances a été effectuée par KY, LZ et KM, et supervisée par le GTI. À la suite de l’évaluation critique des études individuelles, des tableaux sommaires indiquant la qualité des éléments probants selon la hiérarchie méthodologique du CCNI (Tableaux 4 et 5) ont été préparés et des recommandations proposées sur l’utilisation des vaccins ont été formulées. Le 7 juin 2018, le président du GTI et le conseiller technique de l’ASPC ont présenté les données probantes et proposé des recommandations au CCNI. À la suite de l’examen exhaustif des données probantes et d’une consultation lors des réunions du CCNI des 6 et 7 juin 2018, le CCNI a adopté des recommandations précises. La description des facteurs pertinents, la justification des décisions précises et les lacunes en matière de connaissance sont présentées dans les sections suivantes.
III. Vaccin
III.1 Préparation vaccinale antigrippale AfluriaMD Tetra dont l’utilisation est approuvée au Canada
AfluriaMD Tetra est un VAQ à virion fragmenté. Autorisé pour l’injection intramusculaire, il est offert sous la forme de seringues préremplies à dose unique sans aiguille et de fioles multidoses de 5 ml. Pour obtenir de plus amples renseignements sur AfluriaMD Tetra, consulter la monographie de produitNote de bas de page 5.
| Voie d’administration | Dosage | Ingrédients non médicinaux |
|---|---|---|
Intramusculaire |
Chaque dose de 0,5 ml contient 15 μg d’HA de chacune des souches virales de la grippe. |
Chlorure de calcium, hydrogénophosphate de disodium (anhydre), dihydrogénophosphate de potassium, dihydrogénophosphate de sodium, chlorure de potassium, chlorure de sodium, thimérosal (fioles multidoses seulement) et eau pour injection. Chaque dose peut également contenir du TDOC, de l’ovalbumine (protéine présente dans les œufs) et les aliments suivants présents à l’état de trace : bêta-propiolactone, sulfate de néomycine, sulfate de polymyxine B et saccharose. |
III.2 Efficacité potentielle et réelle du vaccin
Aucune étude sur l’efficacité potentielle ou réelle d’AfluriaMD Tetra ou AfluriaMD (préparation à 1,5 % de TDOC) n’a été relevée dans le cadre de cette évaluation.
III.3 Immunogénicité
Les organismes de réglementation du Canada, des États-Unis et d’Europe acceptent les essais de non-infériorité en matière d’immunogénicité qui comparent la réponse anticorps à l’inhibition de l’hémagglutination (IH) du nouveau vaccin à celle d’un vaccin existant autorisé, ou les essais contrôlés par placebo en matière d’immunogénicité qui évaluent la réponse anticorps à l’IH du nouveau vaccin. Les essais de non-infériorité et contrôlés par placebo en matière d’immunogénicité sont souvent jugés suffisants par les autorités réglementaires lorsqu’il existe des données de rapprochement afin de faire corréler les résultats d’immunogénicité à la protection clinique, ou lorsque les nouveaux vaccins sont très similaires aux vaccins déjà autorisés. Les évaluations sérologiques fondées sur la moyenne des titres géométriques (MTG) des anticorps IH utilisées par les organismes réglementaires sont : le ratio de la MTG, le taux de séroprotection et le taux de séroconversion. La Food and Drug Administration (FDA) des États-Unis a publié les définitions en ce qui concerne ces évaluations sérologiques et les critères des données d’immunogénicité nécessaires en vue de l’autorisation des vaccins antigrippauxNote de bas de page 6. Ces définitions et les critères utilisés en ce moment sont indiqués dans le Tableau 2. Aucune corrélation de protection n’a été adéquatement observée qui ne soit pas fondée sur les titres d’anticorps IH.
III.3.1 Immunogénicité chez les adultes
Deux études répertoriées évaluent l’immunogénicité d’AfluriaMD Tetra ou d’AfluriaMD (préparation à 1,5 % de TDOC) chez les adultesNote de bas de page 7Note de bas de page 8. Elles examinaient le taux de séroprotection et le taux de séroconversion de l’HA 21 jours après la vaccination. Une seule d’entre elles a évalué le ratio de la MTG. Les vaccins comparateurs utilisés dans le cadre de ces deux études étaient les VAT fabriqués par Seqirus comprenant une souche grippale de lignée B/Victoria ou de lignée B/YamagataNote de bas de page 7 ou aucun comparateurNote de bas de page 8. Des renseignements supplémentaires sur les résultats d’immunogénicité chez les adultes sont indiqués dans le Tableau 6.
Le vaccin AfluriaMD Tetra s’est avéré tout aussi efficace que les VAT comparateurs d’après les ratios des MTG et les différences du taux de séroconversion chez les adultes de 18 à 64 ans et de 65 ans et plus, 21 jours après la vaccinationNote de bas de page 7Note de bas de page 8. AfluriaMD Tetra a aussi dépassé les seuils en ce qui a trait au taux de séroprotection pour ces deux groupes d’âge pour toutes les souches, à l’exception d’une souche de lignée B/Yamagata chez les adultes de 65 ans et plusNote de bas de page 7Note de bas de page 8.
III.3.2 Immunogénicité chez les enfants
Une seule étude ayant évalué l’immunogénicité d’AfluriaMD Tetra chez les enfantsNote de bas de page 9 a été répertoriée. Cette étude a comparé l’immunogénicité d’AfluriaMD Tetra à celle du VAQ comparateur (le vaccin FluarixMD Quadrivalent [GlaxoSmithKline], dont l’utilisation n’est pas autorisée au Canada). L’étude comparait le ratio de la MTG, le taux de séroprotection et le taux de séroconversion dans les groupes de contrôle et d’intervention, 28 jours après la vaccination. Des renseignements supplémentaires sur les résultats d’immunogénicité chez les enfants sont indiqués dans le Tableau 6.
La non-infériorité d’AfluriaMD Tetra par rapport à FluarixMD Quadrivalent a été démontrée chez les enfants de 5 à 17 ans, d’après les ratios des MTG et les différences de taux de séroconversion pour toutes les souches de grippeNote de bas de page 9. Les différences de taux de séroconversion n’ont pas été calculées pour les sous-groupes d’enfants de 5 à 8 ans et de 9 à 17 ans. Cependant, les taux de séroconversion semblaient similaires entre les deux groupes, car ils présentaient des intervalles de confiance (IC) se chevauchant largement. Le vaccin a également atteint le seuil de séroprotection pour toutes les souches, à l’exception d’une souche de lignée B/Yamagata chez le sous-groupe des enfants de 5 à 8 ansNote de bas de page 9.
III.4 Effets indésirables
III.4.1 Effets indésirables chez les adultes
L’examen a permis de répertorier deux études, dont une seule évaluée par les pairs, qui ont examiné l’innocuité d’AfluriaMD Tetra ou d’AfluriaMD (préparation à 1,5 % de TDOC) chez les adultesNote de bas de page 7Note de bas de page 8. L’étude évaluée par les pairs a procédé à une comparaison directe entre AfluriaMD Tetra et les VAT fabriqués par Seqirus comprenant une souche grippale de lignée B/Victoria ou de lignée B/YamagataNote de bas de page 7. L’étude non évaluée par les pairs a uniquement rendu compte de l’innocuité d’EnziraMD, qui est le nom de marque d’AfluriaMD au Royaume-Uni, et ne disposait pas de comparateurNote de bas de page 8. D’autres renseignements sur les données probantes en ce qui concerne l’innocuité d’AfluriaMD Tetra chez les adultes sont indiqués dans le Tableau 7.
Parmi les adultes ayant reçu AfluriaMD Tetra ou AfluriaMD (préparation à 1,5 % de TDOC), de 37,4 à 52,5 % ont connu des effets indésirables (EI) locaux sollicités; de 19,2 à 28,9 %, des EI systémiques sollicités; et de 20,5 à 44,2 %, des EI non sollicitésNote de bas de page 7Note de bas de page 8. Les EI les plus communs étaient de la douleur, et plus précisément une douleur ressentie au site d’injection. De façon globale, il n’y a eu aucune différence quant à la proportion de personnes ayant connu des EI locaux ou systématiques entre les groupes ayant reçu AfluriaMD Tetra et ceux ayant reçu les VAT comparablesNote de bas de page 7. La seule différence notable entre les deux groupes était que les participants ayant reçu AfluriaMD Tetra étaient plus susceptibles d’avoir des maux de tête comparativement aux participants ayant reçu un VAT contenant une lignée B/YamagataNote de bas de page 7.
La proportion des participants ayant reçu AfluriaMD Tetra ou AfluriaMD qui ont connu quelque effet indésirable grave (EIG) était de 0 à 2,3 % et la proportion de ceux qui sont décédés pendant l’étude était de 0 à 0,3 %Note de bas de page 7Note de bas de page 8. Les participants ayant reçu les VAT ont connu des proportions similaires d’EIGNote de bas de page 7Note de bas de page 8. Le chercheur de l’étude de Treanor et coll. s’est penché sur quatre EIG (un cas d’asthme, un cas de pancréatite aiguë, un cas d’hypoxie et un cas de pneumonie) et un décès (un cas de pneumonie chez un adulte de 65 ans et plus) en rapport avec AfluriaMD TetraNote de bas de page 7. Ces quatre EIG et le décès n’étaient pas considérés comme associés au vaccin par le demandeur de l’étude ou l’organisme réglementaire canadien.
III.4.2 Effets indésirables chez les enfants
Deux études répertoriées évaluent l’immunogénicité d’AfluriaMD Tetra ou d’AfluriaMD (préparation à 1,5 % de TDOC) chez les enfantsNote de bas de page 9Note de bas de page 10. Une étude évaluée par les pairs a comparé l’innocuité d’AfluriaMD Tetra à celle de FluarixMD Quadrivalent (GlaxoSmithKline, dont l’utilisation n’est pas autorisée au Canada)Note de bas de page 9, et une étude, non évaluée par les pairs, a comparé l’innocuité d’AfluriaMD (préparation à 1,5 % de TDOC) à FluzoneMD Quadrivalent (Sanofi Pasteur)Note de bas de page 10. Ces études ont évalué l’innocuité de ces vaccins chez les enfants de 5 à 17 ans. Aucune donnée sur l’innocuité n’a été déterminée pour les enfants de moins de cinq ans. Des renseignements supplémentaires sur les données probantes en ce qui concerne l’innocuité d’AfluriaMD Tetra chez les enfants sont indiqués dans le Tableau 7.
Des enfants de 5 à 8 ans ayant reçu AfluriaMD Tetra ou AfluriaMD, de 57,2 à 70,2 % ont connu des EI locaux; de 27,6 à 40,8 %, des EI systémiques; et 14,0 %, des EI non sollicitésNote de bas de page 9Note de bas de page 10. Une proportion comparativement plus petite d’enfants de 9 à 17 ans ont connu des EI, 54,9 % ayant connu des EI locaux et 34,1 %, des EI systémiquesNote de bas de page 9. L’EI local le plus courant connu par les enfants de 5 à 8 ansNote de bas de page 9Note de bas de page 10 et de 9 à 17 ansNote de bas de page 9 était une légère douleur; et l’EI systémique le plus courant connu par les enfants de 5 à 8 ansNote de bas de page 9Note de bas de page 10 et de 9 à 17 ansNote de bas de page 9 était un mal de tête. De façon globale, il n’y a pas de différence quant à la proportion des enfants ayant connu des EI locaux ou systémiques entre les groupes ayant reçu AfluriaMD Tetra ou AfluriaMD et ceux ayant reçu un VAQ comparateur. Les seules différences notables étaient que la proportion d’enfants chez qui on a observé des EI systémiques modérés sollicités et la proportion chez qui on a observé une enflure ont semblé moins importantes dans une étude pour les enfants qui ont reçu AfluriaMD par rapport à un VAQNote de bas de page 10, et que la proportion d’enfants chez qui on a observé une myalgie était considérablement plus grande dans l’étude des enfants ayant reçu AfluriaMD Tetra comparativement aux enfants ayant reçu FluarixMD QuadrivalentNote de bas de page 9.
La proportion globale d’enfants chez qui des EIG sollicités ont été observés était petite, soit 0,47 % des enfants de 5 à 17 ansNote de bas de page 9 et 0,003 % des enfants de 5 à 8 ansNote de bas de page 10 (tous EIG confondus). Les participants qui ont reçu un VAQ comparateur présentaient des proportions comparables d’EIG sollicités.
Fièvre et convulsions fébriles
Au cours de la surveillance de la saison grippale de 2010 dans l’hémisphère Sud en Australie de l’Ouest, un signal d’innocuité a été détecté pour l’utilisation d’AfluriaMD (préparation trivalente) chez les enfantsNote de bas de page 3. On a observé une association entre cette préparation trivalente d’AfluriaMD et un taux accru de fièvre et de convulsions fébriles chez les enfants de moins de 5 ansNote de bas de page 11. Une enquête menée par le fabricant a révélé que le procédé de fabrication d’AfluriaMD entraînait la diffusion de fragments dégradés d’acide ribonucléique (ARN) par des lipides résiduels, ce qui accroissait la dissémination de cytokines pro-inflammatoiresNote de bas de page 12. D’autres études ont démontré que la dissémination de telles cytokines était atténuée par une concentration accrue de l’agent de fractionnement de type TDOC; donc, le procédé de fabrication d’AfluriaMD a été modifié de façon à utiliser un poids/volume à 1,5 % de TDOC, plutôt que 0,9 % contre le virus de typeA (H1N1); 1,5 % contre le virus de type A (H3N2) et 0,5 % contre le virus de type B, soit les concentrations qui avaient été utilisées auparavantNote de bas de page 12. Ce procédé modifié de fabrication est utilisé pour AfluriaMD Tetra.
Dans les deux études mentionnées dans le cadre de cette évaluation, il a été question de la proportion des participants chez qui on a observé de la fièvre et des convulsions fébriles. Les données probantes n’indiquent aucune différence significative sur le plan statistique quant à la proportion d’enfants chez qui on a observé de la fièvre faible, modérée ou forteNote de bas de page 9Note de bas de page 10 entre les groupes ayant reçu AfluriaMD Tetra ou AfluriaMD (préparation à 1,5 % de TDOC) et ceux ayant reçu un VAQ comparateur. En outre, il n’a pas semblé y avoir de différence dans la proportion de ceux chez qui on a observé de la fièvre associée au vaccinNote de bas de page 10; cependant, aucune différence significative n’a été indiquée pour ce résultat. Aucun cas de convulsions ou de convulsions fébriles n’a été signalé dans l’une ou l’autre de ces études, et ce, pour tous les vaccins étudiésNote de bas de page 9Note de bas de page 10.
IV. Recommandations
1. Le CCNI recommande qu’AfluriaMD Tetra puisse être considéré comme faisant partie des VAQ offerts aux adultes et enfants de cinq ans et plus (recommandation discrétionnaire du CCNI).
Le CCNI est arrivé à la conclusion qu’il existe des données probantes passables pour recommander la vaccination d’adultes et d’enfants de cinq ans et plus (données probantes de catégorie B).
Il existe de bonnes données probantes qui démontrent l’innocuité du vaccin AfluriaMD Tetra, lequel ne présente pas une immunogénicité inférieure aux vaccins comparables, selon les données probantes directes observées chez les adultes et enfants de cinq ans et plus. Ces données sont considérées comme étant de catégorie B, car il n’existe aucune donnée probante directe quant à l’efficacité potentielle ou réelle d’AfluriaMD Tetra. Il n’existe aucune donnée probante en ce qui concerne l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité de l’utilisation d’AfluriaMD chez les enfants de moins de cinq ans, et l’utilisation d’AfluriaMD Tetra n’est pas autorisée pour ce groupe d’âge au Canada.
Tableaux
| Test sérologique | Définition | Seuil |
|---|---|---|
Ratio de la MTG |
Ratio de la MTG après la vaccination au moyen du vaccin autorisé par rapport aux MTG après la vaccination au moyen du nouveau vaccin |
Non-infériorité : La limite supérieure de l’IC bilatéral à 95 % du ratio de la MTG ne doit pas dépasser 1,5. |
Séroprotection |
Proportion des sujets ayant atteint un titre IH de ≥1:40 après la vaccination |
Contrôlé par placebo : La limite inférieure de l’IC bilatéral à 95 % pour le pourcentage de sujets devenant séroprotégés doit atteindre ou dépasser 70 % (chez les adultes de moins de 65 ans et les enfants) ou 60 % (chez les adultes de 65 et plus) |
Séroconversion |
Proportion des sujets présentant une augmentation du titre IH, passant de ≤1:10 avant la vaccination à ≥1:40 après la vaccination ou atteignant au moins une multiplication par quatre des titres IH. |
Non-infériorité : La limite supérieure de l’IC bilatéral à 95 % en ce qui a trait à la différence entre les taux de séroconversion (taux du vaccin autorisé – taux du nouveau vaccin) ne doit pas dépasser 10 points de pourcentage. Contrôlé par placebo : La limite inférieure de l’IC bilatéral à 95 % pour le pourcentage de sujets devenant séroprotégés doit atteindre ou dépasser 40 % (chez les adultes de moins de 65 ans et les enfants) ou 30 % (chez les adultes de 65 et plus) |
Abréviations – IC : intervalle de confiance, MTG : moyenne des titres géométriques, IH : inhibition de l’hémagglutination. |
||
| Force de la recommandation du CCNI | Code de qualité des données probantes |
|---|---|
| D’après des facteurs ne se limitant pas à la force des données probantes (p. ex., besoin en matière de santé publique) | Selon l’évaluation de l’ensemble des données probantes |
Forte « Devrait ou ne devrait pas être réalisée »
OU les désavantages connus ou prévus contrebalancent les avantages connus ou prévus (« ne devrait pas »)
|
A – Bonnes données probantes pour recommander l’immunisation |
B – Données probantes passables pour recommander l’immunisation |
|
C – Données probantes contradictoires; toutefois, d’autres facteurs peuvent influer sur la prise de décision |
|
D – Données probantes passables pour déconseiller l’immunisation |
|
E – Bonnes données probantes pour déconseiller l’immunisation |
|
I – Données probantes insuffisantes (en qualité ou en quantité); toutefois, d’autres facteurs peuvent influer sur la prise de décision |
|
Discrétionnaire « Peut être considérée »
|
A – Bonnes données probantes pour recommander l’immunisation |
B – Données probantes passables pour recommander l’immunisation |
|
C – Données probantes contradictoires; toutefois, d’autres facteurs peuvent influer sur la prise de décision |
|
D – Données probantes passables pour déconseiller l’immunisation |
|
E – Bonnes données probantes pour déconseiller l’immunisation |
|
I – Données probantes insuffisantes (en qualité ou en quantité); toutefois, d’autres facteurs peuvent influer sur la prise de décision |
| Niveau | Description |
|---|---|
| I | Données probantes provenant d’un ou de plusieurs essais cliniques comparatifs randomisés. |
| II–1 | Données probantes provenant d’essais contrôlés sans randomisation. |
| II–2 | Données probantes provenant d’études de cohortes ou d’études analytiques cas-témoins, réalisées de préférence dans plus d’un centre ou groupe de recherche avec des indicateurs cliniques de résultats de l’efficacité des vaccins. |
| II–3 | Données probantes obtenues à partir de plusieurs séries chronologiques avec ou sans intervention. Les résultats spectaculaires d’expériences non comparatives (comme les résultats de l’introduction de la pénicilline dans les années 1940) peuvent également être considérés à titre de données probantes. |
| III | Opinions d’autorités respectées fondées sur des expériences cliniques, études descriptives et rapports de cas ou rapports de comités d’experts. |
| Cote de qualité | Description |
|---|---|
| Bonne | Une étude (comprenant les méta-analyses ou les examens systématiques) qui répond bien à tous les critères relatifs à la méthodologieTableau 5 Note de bas de page *. |
| Passable | Une étude (comprenant les méta-analyses ou les examens systématiques) qui ne répond pas (ou ne répond pas clairement) à au moins un des critères relatifs à la méthodologieTableau 5 Note de bas de page *, mais ne comporte aucune « lacune fatale » connue. |
| Faible | Une étude (comprenant les méta-analyses ou les examens systématiques) qui comporte au moins une « lacune fatale » relative à la méthodologieTableau 5 Note de bas de page * ou une accumulation de lacunes moins importantes faisant en sorte que les résultats de l’étude sont jugés inadéquats en vue de l’élaboration des recommandations. |
|
|
| Détails des études | Résumé | |||||
|---|---|---|---|---|---|---|
| Étude | Vaccin | Méthodologie de l’étude | Participants | Résumé des principales conclusions | Niveau de preuve | Qualité |
Airey J, Albano FR, Sawlwin DC, Jones AG, Fromica N, Matassa V, Leong J. Immunogenicity and safety of a quadrivalent inactivated influenza virus vaccine compared with a comparator quadrivalent inactivated influenza vaccine in a pediatric population: A phase 3, randomized noninferiority study. Vaccine, 2017;35(20)Tableau 6 Note de bas de page 1 |
AfluriaMD Tetra |
ERC Étude américaine multiville Saison grippale 2015-2016 Financée par Seqirus |
Enfants en santé de 5 à 17 ans 47,9 % de filles Groupe 1 : 1 709 enfants ont reçu AfluriaMD Tetra Groupe 2 : 569 enfants ont reçu FluarixMD Quadrivalent |
Ratio de la MTG 28 jours après la vaccination (groupe 2/groupe 1) : Âge 5–17, estimation (IC à 95 %)
Différence du taux de séroconversion 28 jours après la vaccination (groupe 2/groupe 1) : Âge 5–17, estimation (IC à 95 %)
Taux de séroconversion 28 jours après la vaccination : Âge 5–17, Groupe 1 (IC à 95 %)
Âge 5–8, Groupe 1 (IC à 95 %)
Âge 9-17, Groupe 1 (IC à 95 %)
Âge 5–17, Groupe 2 (IC à 95 %)
Âge 5–8, Groupe 2 (IC à 95 %)
Âge 9-17, Groupe 2 (IC à 95 %)
Taux de séroprotection 28 jours après la vaccination (groupe 1) : Âge 5-17, estimation (IC à 95 %)
Âge 5-8, estimation (IC à 95 %)
Âge 9-17, estimation (IC à 95 %)
Aucune différence potentiellement importante n’a été observée entre les deux groupes en ce qui a trait au FAMTG. |
I |
Bonne |
Treanor JT, Albano FR, Sawlwin DC, Jones AG, Airey J, Formica N, Matassa V, Leong J. Immunogenicity and safety of a quadrivalent inactivated influenza vaccine compared with two trivalent inactivated influenza vaccines containing alternate B strains in adults: A phase 3, randomized noninferiority study, Vaccine, 2017;35(15)Tableau 6 Note de bas de page 2 |
AfluriaMD Tetra |
ERC Étude américaine multiville Saison grippale 2014-2015 Financée par Seqirus |
Adultes en santé de 18 ans et plus 57,2 % de femmes Groupe 1 : Groupe 2 : |
Ratio de la MTG 21 jours après la vaccination (groupe 2/groupe 1) : Âge ≥18, estimation (IC à 95 %)
Âge 18-64, estimation (IC à 95 %)
Âge ≥65, estimation (IC à 95 %)
Différence du taux de séroconversion 21 jours après la vaccination (groupe 2/groupe 1) : Âge ≥18, estimation (IC à 95 %)
Âge 18–64, estimation (IC à 95 %)
Âge 18–64, estimation (IC à 95 %)
Taux de séroprotection 21 jours après la vaccination (groupe 1) : Âge18–64, estimation (IC à 95 %)
Âge ≥65, estimation (IC à 95 %)
On a également rendu compte du FAMTG, lequel ne présentait aucune préoccupation; cependant, on n’a pas rendu compte de la différence du FAMTG. |
I |
Bonne |
ClinicalTrials.gov |
EnziraMD (AfluriaMD dans les autres pays) |
ERC Angleterre, Saison grippale 2013-2014 Commanditée par Seqirus |
Adultes en santé de 18 à 59 ans 52,5 % de femmes Groupe 1 : Aucun groupe contrôle |
Taux de séroprotection 21 jours après la vaccination (groupe 1) : Âge 18–59, estimation (IC à 95 %)
Taux de séroprotection 21 jours après la vaccination (groupe 1) : Âge 18–59, estimation (IC à 95 %)
Aucune différence potentiellement importante n’a été observée entre les deux groupes en ce qui a trait au FAMTG. |
I |
s.o. Étude de phase IV, non évaluée par les pairs et ne comportant pas de groupe controle |
Abréviations : IC, intervalle de confiance; FAMTG, facteur d’augmentation de la moyenne des titres géométriques; MTG, moyenne des titres géométriques; s.o., sans objet; ERC, essais randomisés contrôlés; VAT, vaccin antigrippal trivalent inactivé.
|
||||||
| Détails des études | Résumé | |||||
|---|---|---|---|---|---|---|
| Étude | Vaccin | Méthodologie de l’étude | Participants | Résumé des principales conclusions | Niveau de preuve | Qualité |
Airey J, Albano FR, Sawlwin DC, Jones AG, Fromica N, Matassa V, Leong J. Immunogenicity and safety of a quadrivalent inactivated influenza virus vaccine compared with a comparator quadrivalent inactivated influenza vaccine in a pediatric population: A phase 3, randomized noninferiority study. Vaccine, 2017;35(20)Tableau 7 Note de bas de page 1 |
AfluriaMD Tetra |
ERC Étude américaine multiville Saison grippale 2015-2016 Financée par Seqirus |
Enfants en santé de 5 à 17 ans 47,9 % de filles Groupe 1 : 1 709 enfants ont reçu AfluriaMD Tetra Groupe 2 : 569 enfants ont reçu le vaccin FluarixMD Quadrivalent |
Proportion d’enfants de 5 à 17 ans ayant connu des EI et des EIG : Âge 5–17, Groupe 1
Âge 5–17, Groupe 2
RR des EI (groupe 1/groupe 2) Âge 5–8, estimation (IC à 95 %)
Âge 9–17, estimation (IC à 95 %)
RR de fièvre (groupe 1/groupe 2)
L’EI local le plus courant chez les enfants de 5 à 17 ans était une douleur au site d’injection et les EI systémiques les plus courants étaient le mal de tête et la myalgie. Aucune convulsion ni de convulsion fébrile n’a été signalée dans l’un ou l’autre groupe. La myalgie est survenue en plus grande proportion chez les enfants du groupe 1 que chez ceux du groupe 2. |
I |
Bonne |
Treanor JT, Albano FR, Sawlwin DC, Jones AG, Airey J, Formica N, Matassa V, Leong J. Immunogenicity and safety of a quadrivalent inactivated influenza vaccine compared with two trivalent inactivated influenza vaccines containing alternate B strains in adults: A phase 3, randomized noninferiority study, Vaccine, 2017;35(15)Tableau 7 Note de bas de page 2 |
AfluriaMD Tetra |
ERC Étude américaine multiville Saison grippale 2014-2015 Financée par Seqirus |
Adultes en santé de 18 ans et plus 57,2 % de femmes Groupe 1 : 1 741 adultes ont reçu AfluriaMD Tetra Groupe 2 : 1 745 adultes ont reçu un VAT fabriqué par Seqirus contenant une souche B/Yamagata (n = 871) ou une souche B/Victoria (n = 872). |
Proportion d’adultes de 18 ans et plus ayant connu des EI et des EIG : Groupe 1
Groupe 2 (B/Yam)
Groupe 2 (B/Vic)
RR des EI sollicités (groupe 1/groupe 2, ayant reçu un VAT contenant une souche B/Yamagata seulement) : Âge ≥18, estimation (IC à 95 %)
Âge 18–64, estimation (IC à 95 %)
Âge ≥65, estimation (IC à 95 %)
RR des EI sollicités (groupe 1/groupe 2, ayant reçu un VAT contenant une souche B/Victoria seulement) : Âge ≥18, estimation (IC à 95 %)
Âge 18–64, estimation (IC à 95 %)
Âge ≥65, estimation (IC à 95 %)
L’EI local le plus courant chez les adultes de 18 à 64 ans et de 65 ans et plus était une douleur; les EI systémiques les plus courants étaient le mal de tête et la myalgie. Les participants du groupe 1 étaient plus susceptibles d’avoir des maux de tête comparativement à ceux du groupe 2 qui ont reçu un VAT contenant la souche B/Yamagata. |
I |
Bonne |
ClinicalTrials.gov |
AfluriaMD |
ERC Étude américaine multiville Saison grippale 2015-2016 Commanditée par Seqirus |
Enfants en bonne santé de 5 à 8 ans 48,0 % de filles Groupe 1 : 302 enfants ont reçu AfluriaMD Groupe 2 : 100 enfants ont reçu le vaccin FluzoneMD Quadrivalent |
Proportion d’enfants de 5 à 8 ans ayant connu des EI et des EIG :
Groupe 2
Proportion d’enfants de 5 à 8 ans ayant fait de la fièvre : Groupe 1
Groupe 2
Proportion d’enfants de 5 à 8 ans ayant fait de la fièvre associée au vaccin : Groupe 1
Groupe 2
L’EI local le plus commun était de la douleur. On n’a pas précisé si cette douleur était associée au site d’injection. L’EI systémique le plus commun était la myalgie. Un EI systémique, sollicité et modéré ainsi qu’une enflure a été observée chez une plus petite proportion des enfants du groupe 1 que ceux du groupe 2. |
I |
Bonne Étude de phase IV, non évaluée par les pairs |
ClinicalTrials.gov |
EnziraMD (AfluriaMD dans les autres pays) |
ERC Angleterre, Saison grippale 2013-2014 Commanditée par Seqirus |
Adultes en santé de 18 à 59 ans 52,5 % de femmes Groupe 1 : 120 adultes ont reçu le vaccin EnziraMD (autorisé en tant qu’AfluriaMD dans les autres pays) Aucun groupe contrôle |
Proportion d’adultes de 18 à 59 ans ayant connu des EI et des EIG :
L’EI local le plus commun chez les adultes était de la douleur et une douleur au site d’injection et les EI systémiques les plus courants étaient le mal de tête. |
I |
s.o. Étude de phase IV non évaluée par les pairs et ne comportant pas de groupe contrôle |
Abréviations : EI, effet indésirable; IC, intervalle de confiance; s.o., sans objet; ERC, essai randomisé contrôlé; RR, risque relatif; EIG, effet indésirable grave; VAT, Vaccin antigrippal trivalent inactivé.
|
||||||
Liste des abréviations
- ARN
- Acide ribonucléique
- ASPC
- Agence de la santé publique du Canada
- CCNI
- Comité consultatif national de l’immunisation
- EI
- Effet indésirable
- EIG
- Effet indésirable grave
- ERC
- Essai randomisé contrôlé
- FAMTG
- Facteur d’augmentation de la moyenne des titres géométriques
- FDA
- Food and Drug Administration (États-Unis)
- GTI
- Groupe de travail sur l’influenza
- HA
- Hémagglutinine
- IC
- Intervalle de confiance
- IH
- Inhibition de l’hémagglutination
- MTG
- Moyenne des titres géométriques
- RR
- Risque relatif
- SC
- Santé Canada
- s.o.
- Sans objet
- TDOC
- Taurodéoxycholate de sodium
- VAQ
- Vaccin antigrippal quadrivalent inactivé
- VAT
- Vaccin antigrippal trivalent inactivé
Remerciements
Cette déclaration a été rédigée par : Mme K. Young, Dr L. Zhao, Dr I. Gemmill et approuvée par le CCNI.
Membres du Groupe de travail sur l’influenza : Dr I. Gemmill (président), Dre C. Bancej (CIMRI, ASPC), Mme L. Cochrane, Dre N. Dayneka, Dre L. Grohskopf (CDC), Mme A. Lebans (Direction générale de la santé des Premières nations et des Inuits [DGSPNI], Services aux Autochtones Canada [SAC]), Dre D. Kumar, Dre J. Langley, Dr M. Lavoie, Dre J. McElhaney, Dre A. McGeer, Dre D. Moore, Dre B. Warshawsky, Dre J. Xiong (Direction des produits biologiques et des thérapies génétiques [DPBTG], SC).
Membres du CCNI : Dre C. Quach (présidente), Dre W. Vaudry (vice-présidente), Dre N. Dayneka, Dre S. Deeks, Dr P. De Wals, Dre V. Dubey, Dre R. Harrison, Dr M. Lavoie, Dre S. Marchant-Short, Dre M. Salvadori, Dre B. Sander, Dre N. Sicard, Dr R. Warrington, Dr C. Rotstein.
Anciens membres du CCNI : Dr R. Warrington
Représentants de liaison : Dr J. Brophy (Association canadienne pour la recherche et l’innovation en immunisation), Dre E. Castillo (Société des obstétriciens et gynécologues du Canada), Dre A. Cohn (CDC), Mme T. Cole (Comité canadien sur l’immunisation), Dre J. Emili (Collège des médecins de famille du Canada), Dre K. Klein (Conseil des médecins hygiénistes en chef), Dre C. Mah (Association canadienne de santé publique), Dre D. Moore (Société canadienne de pédiatrie), Dre A. Pham-Huy (Association pour la microbiologie médicale et l’infectiologie Canada).
Représentants d’office : Dre (Capc) K. Barnes (Défense nationale et Forces armées canadiennes), Mme G. Charos (CIMRI, ASPC), Dr R. Pless (DPBTG, SC), Dr J. Gallivan (Direction des produits de santé commercialisés [DPSC], SC), M. G. Poliquin (Laboratoire national de microbiologie [LNM], ASPC), Mme J. Pennock (CIMIR, ASPC), Dr T. Wong (DGSPNI, SAC).
Le CCNI tient à souligner la contribution de : Mme L. Glandon (Bibliothèque de la santé, SC), Mme A. House (Centre de l’immunisation et des maladies respiratoires infectieuses [CIMRI], ASPC), Mme M. Laplante (CIMRI, ASPC) et M. K. Moncion (CIMRI, ASPC).
Références
- Note de bas de page 1
-
Schanzer DL, Allison M, Kathleen M. Statistical estimates of respiratory admissions attributable to seasonal and pandemic influenza for Canada. Influenza and Other Respiratory Viruses. 2013;7(5):799-808.
- Note de bas de page 2
-
Schanzer DL, Sevenhuysen C, Winchester B, Mersereau T. Estimating influenza deaths in Canada, 1992–2009. PLOS ONE. 2013;8(11):e80481.
- Note de bas de page 3
-
Therapeutic Goods Administration (gouvernement d'Australie). Seasonal Flu Vaccine: Investigation into febrile reactions in young children following 2010 seasonal trivalent influenza vaccination [Internet]. 2010. Consultable en ligne : https://www.tga.gov.au/alert/seasonal-flu-vaccine-investigation-febrile-reactions-young-children-following-2010-seasonal-trivalent-influenza-vaccination.
- Note de bas de page 4
-
Harris RP, Helfand M, Woolf SH, Lohr KN, Mulrow CD, Teutsch SM, Atkins D. Current methods of the US Preventive Services Task Force: A review of the process. Am J Prev Med. 2001;20(3):21-35.
- Note de bas de page 5
-
Seqirus Pty Ltd. Product monograph: AFLURIAMD TETRA: Quadrivalent inactivated influenza vaccine (split virion). [Internet]. 2017. Consultable en ligne : https://pdf.hres.ca/dpd_pm/00044256.PDF.
- Note de bas de page 6
-
US Food and Drug Administration. Guidance for industry: Clinical data needed to support the licensure of seasonal inactivated influenza vaccines. [Internet]. 2007. Consultable en ligne : https://www.fda.gov/downloads/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/Guidances/Vaccines/ucm091990.pdf.
- Note de bas de page 7
-
Treanor JT, Albano FR, Sawlwin DC, Jones AG, Airey J, Formica N, Matassa V, Leong J. Immunogenicity and safety of a quadrivalent inactivated influenza vaccine compared with two trivalent inactivated influenza vaccines containing alternate B strains in adults: A phase 3, randomized noninferiority study. Vaccine. 2017;35(15):1856-64.
- Note de bas de page 8
-
ClinicalTrials.gov. A study to assess the immunogenicity and safety of a trivalent influenza vaccine containing the 2013/2014 formulation of Enzira vaccine in healthy volunteers. Identificateur NCT01863433. [Internet]. 2014. Consultable en ligne : https://clinicaltrials.gov/ct2/show/NCT01863433?term=NCT01863433&rank=1
- Note de bas de page 9
-
Airey J, Albano FR, Sawlwin DC, Jones AG, Formica N, Matassa V, Leong J. Immunogenicity and safety of a quadrivalent inactivated influenza virus vaccine compared with a comparator quadrivalent inactivated influenza vaccine in a pediatric population: A phase 3, randomized noninferiority study. Vaccine. 2017;35(20):2745-52.
- Note de bas de page 10
-
ClinicalTrials.gov. A study to evaluate the safety and tolerability of trivalent influenza virus vaccine in children aged 5 years to < 9 years. Identificateur NCT02212106. [Internet]. 2015. Consultable en ligne : https://clinicaltrials.gov/ct2/show/NCT02212106?term=NCT02212106&rank=1.
-
Armstrong PK, Dowse GK, Effler PV, Carcione D, Blyth CC, Richmond PC, Geelhoed GC, Mascaro F, Scully M, Weeramanthri TS. Epidemiological study of severe febrile reactions in young children in Western Australia caused by a 2010 trivalent inactivated influenza vaccine. BMJ Open. 2011;1(1):e000016.
- Note de bas de page 12
-
Rockman S, Becher D, Dyson A, Koernig S, Morelli AB, Barnden M, Camuglia S, Soupourmas P, Pearse M, Maraskovsky E. Role of viral RNA and lipid in the adverse events associated with the 2010 Southern Hemisphere trivalent influenza vaccine. Vaccine. 2014;32(30):3869-76.
Annexe A : Organigramme PRISMA
Efficacités potentielle et réelle, immunogénicité et innocuité d'AfluriaMD Tetra — 22-08-2017
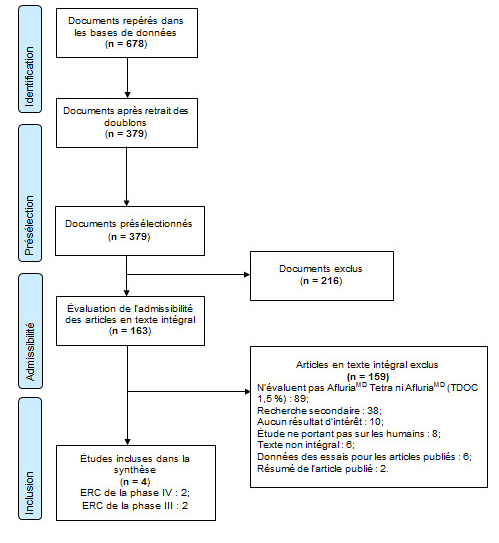
Équivalent textuel
À l’étape de l’identification, 678 documents ont été repérés lors de la recherche dans la base de données. De ces documents, il en restait 379 après élimination des doublons. Les 379 documents sont ensuite passés à l’étape de la présélection; 216 documents en ont été exclus et 163 articles en texte intégral ont fait l’objet d’une évaluation de l’admissibilité. Sur les 163 articles en texte intégral, 159 ont été exclus : 89 n’évaluaient pas Afluria® Tetra ou Afluria®, 38 étaient de la recherche secondaire, 10 n’avaient aucun résultat d’intérêt, 8 étaient des études ne portant pas sur les humains, 6 étaient en texte non intégral, 6 étaient des données des essais pour les articles publiés, et 2 étaient des résumés d’articles publiés. La synthèse finale comprenait 4 articles : 2 ERC de la phase IV, et 2 ERC de la phase III.