Effets secondaires suivant l'immunisation (ESSI) Rapport trimestriel pour 2014 – T2
Résumé de l'évaluation de l'innocuité pour ce trimestre :
- Aucune préoccupation concernant l'innocuité des vaccins n'a été soulevée au cours du deuxième trimestre de l'année 2014.
- Tous les cas graves ont été examinés et il a été établi que ceux-ci étaient soit prévisibles (en fonction des effets indésirables connus associés au vaccin), soit explicables par d'autres raisons, comme une infection acquise dans la collectivité ou des expositions à d'autres agents, tels les antibiotiques, ou encore des problèmes préexistants, comme une maladie cardiaque.
- Il semble y avoir une baisse du nombre de déclarations d'Effets secondaires suivant l'immunisation (ESSI) reçues au cours de ce trimestre, ce qui témoigne d'une lacune en matière de déclaration par les compétences qui mettent en œuvre de nouveaux systèmes de déclaration électroniques. Nous nous attendons à ce que le nombre de déclarations reçues augmente au cours des prochains trimestres afin de compenser cette lacune.
- Nous avons observé une augmentation du nombre de déclarations reçues au cours de ce trimestre en raison de l'intussusception qui découle de la vaccination antirotavirus. La croissance du nombre de déclarations témoigne probablement d'une utilisation accrue du vaccin. Consulter le tableau 5 et la discussion qui le précède pour obtenir plus de renseignements.
Les vaccins sont étroitement surveillés au Canada à toutes les phases du « cycle de vie » du produit vaccinal, depuis sa découverte jusqu'à l'autorisation de mise en marché (avant commercialisation) et au-delà, à mesure que les gens commencent à les utiliser (après commercialisation). De nombreux intervenants participent à diverses activités liées à l'évaluation et à la surveillance de l'innocuité des vaccins, y compris le gouvernement fédéral, les autorités de santé publique provinciales, territoriales et locales, les fournisseurs de soins de santé, l'industrie des vaccins et le public. L'Agence de la santé publique du Canada (l'Agence) assure une surveillance étroite de l'innocuité après commercialisation par l'intermédiaire d'un système national d'enregistrement, soit le Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI).
L'objet principal de la surveillance après commercialisation des vaccins est de déceler les préoccupations concernant leur innocuité. Ces préoccupations comprennent une possible augmentation de la gravité ou de la fréquence des réactions attendues, ou encore, la survenue d'un ou de plusieurs événements inattendus (c.-à-d. un effet secondaire qui ne correspond pas aux renseignements ou à l'étiquette sur le produit canadien). Cela permet aux vaccinateurs et aux fournisseurs de programme d'immunisation de santé publique de prendre des mesures dans le domaine de la santé publique :
- au niveau de la personne (p. ex. une enquête plus poussée afin de confirmer un diagnostic et de déterminer les causes possibles, une consultation en vue d'écarter la possibilité d'une allergie à un ou à plusieurs composants du vaccin, ou une décision d'administrer ou non des doses subséquentes du vaccin), ou
- au niveau du programme d'immunisation (p. ex. une enquête menée sur un ensemble d'effets secondaires, un examen des procédures pour s'assurer que les exigences relatives à l'entreposage des vaccins ont été rigoureusement suivies, ou encore un changement de politique permettant d'adopter un vaccin moins réactogène).
L'Agence partage aussi les données sur les effets secondaires suivant l'immunisation (ESSI) avec Santé Canada, soit l'organisme de réglementation des vaccins au Canada, pour mettre sur pied une mesure de réglementation liée aux vaccins qui sont offerts au Canada (p. ex. diffuser des communications aux vaccinateurs ou au public concernant la préoccupation ou exiger de l'information ou une enquête supplémentaire de la part du distributeur du vaccin).
En 2014, l'Agence introduisait la publication de rapports trimestriels réguliers sur la surveillance de l'innocuité des vaccins, résumant les données du SCSESSI. Le premier rapport trimestriel présentait un sommaire de toutes les déclarations d'effets secondaires suivant l'immunisation reçues par l'Agence en 2014 entre le 1er janvier et le 31 mars (premier trimestre), peu importe la date à laquelle le vaccin avait effectivement été administré. Le rapport du deuxième trimestre fournit un sommaire semblable de toutes les déclarations reçues entre le 1er avril et le 30 juin. Une nouvelle caractéristique de ce rapport et des rapports ultérieurs qui seront publiés en 2014 consistera à fournir des données cumulatives s'étendant sur toute l'année, soit entre le 1er janvier et la fin du trimestre sur lequel porte le rapport (le 30 juin pour le présent rapport). Cette façon de faire ciblera chaque trimestre tout en permettant le suivi des tendances, grâce à la compilation des rapports trimestriels au cours de l'année civile.
Les données trimestrielles actuelles (T2) et les données trimestrielles cumulatives (T1 et T2) sont comparées à une moyenne de toutes les déclarations reçues pendant les mêmes périodes de temps (au deuxième trimestre uniquement et cumulées entre le 1er janvier et le 30 juin pour la moyenne des trois dernières années [de 2011 à 2013]).
Remarques sur l'interprétation : Un effet secondaire suivant l'immunisation (ESSI) est défini comme étant tout événement médical fâcheux qui se produit à la suite de l'administration d'un vaccin et qui n'a pas nécessairement de lien causal avec celle-ci. Un effet secondaire peut donc correspondre à un signe défavorable ou non intentionnel, à un résultat de laboratoire anormal, à un symptôme ou à une affection. Les déclarations d'effets secondaires suivant l'immunisation soumises à l'Agence de la santé publique du Canada représentent un soupçon, une opinion ou une observation par le déclarant plutôt qu'une affirmation ou une preuve que le vaccin a pu causer l'événement. Pour la plupart des événements, il est difficile d'établir une relation de causalité précise. D'autres limites des données sur les déclarations d'effets secondaires suivant l'immunisation comprennent des normes de déclaration variées et la sous-déclaration, un manque de certitude quant à la validité du diagnostic d'un événement signalé, un manque de renseignements en ce qui concerne d'autres causes potentielles et d'autres biais de déclaration. Bref, ces renseignements ne doivent pas être utilisés pour estimer l'incidence des effets secondaires.
Résultats mis en évidence pour le deuxième trimestre de 2014
Le nombre cumulatif inclus dans le présent rapport trimestriel (T2) comprend les déclarations reçues entre le 1er avril et le 30 juin 2014 et des comparaisons sont faites par rapport au nombre moyen de déclarations reçues au cours du même trimestre lors des trois années civiles précédentes (2011-2013). Les déclarations analysées en 2014 ont été extraites de la base de données du Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) par l'Agence de la santé publique du Canada (l'Agence) le 28 août 2014, et le 29 avril 2014 pour la période 2011-2013.
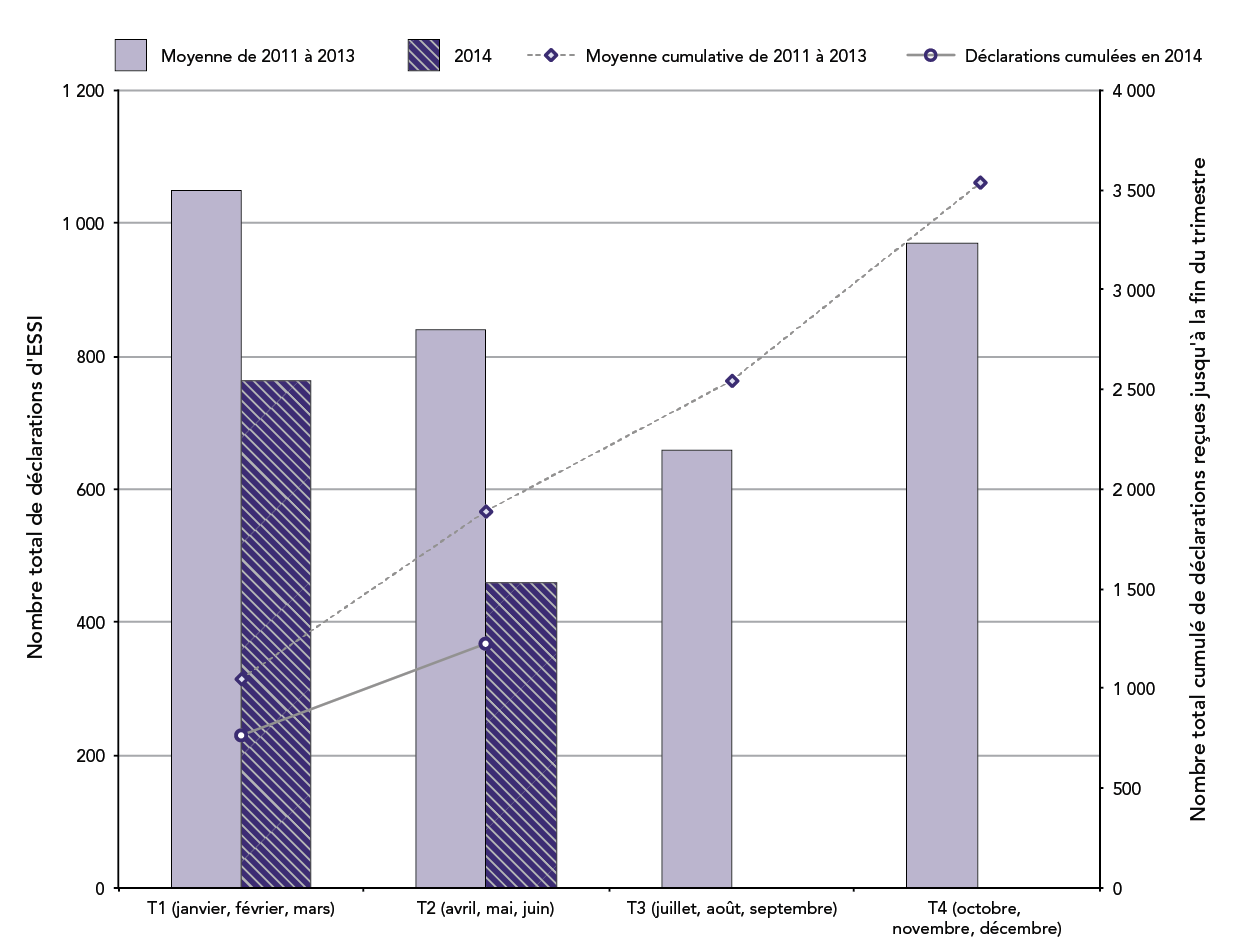
Figure 1 : Nombre total de déclarations d'ESSI par trimestre civil et cumulées jusqu'à la fin de chaque trimestre : année 2014 par rapport à la moyenne de 2011-2013
Au total, 459 déclarations d'effets secondaires suivant l'immunisation ont été reçues par l'Agence au T2 de 2014. Au cours des mêmes périodes en 2011, 2012 et 2013, l'Agence a reçu une moyenne de 841 (plage : 783-884) déclarations d'ESSI. Il n'est pas rare d'observer une diminution du nombre total de déclarations pour le T2 en 2014 par rapport aux années précédentes, cela faisant partie de la tendance établie au premier trimestre. De temps à autre, il y a des retards dans la transmission des déclarations de la part d'une ou plusieurs provinces et territoires à l'Agence, principalement pour des raisons techniques telles que la mise en œuvre d'un nouveau système électronique de déclaration des effets secondaires suivant l'immunisation. Dans de tels cas, la diminution apparente dans un trimestre se traduira par une augmentation du nombre de déclarations au cours des trimestres ultérieurs.
Équivalent textuel
Il s'agit d'une combinaison d'un graphique à barres et d'un graphique linéaire. Les barres représentent le nombre total de déclarations d'effets secondaires suivant l'immunisation (ESSI) reçues chaque trimestre civil (T); le premier trimestre (T1) comprend les mois de janvier, février et mars, le deuxième trimestre (T2) inclut les mois d'avril, mai et juin, le troisième trimestre (T3) comprend les mois de juillet, août et septembre et le quatrième trimestre (T4) inclut les mois d'octobre, novembre et décembre. La ligne montre le nombre total de déclarations accumulées à la fin de chaque trimestre. L'axe des y principal sur le côté gauche du graphique correspond au diagramme à barres et présente le nombre total pour chaque trimestre, qui est compris entre 0 et 1 200. L'axe des y secondaire à droite du graphique correspond au graphique linéaire et montre le nombre total accumulé à la fin de chaque trimestre, qui est compris entre 0 et 4 000. L'axe des x correspond au trimestre et va du premier trimestre au quatrième trimestre. Deux périodes sont représentées sur le graphique.
Les barres violet pâle indiquent la moyenne des déclarations totales chaque trimestre en 2011, 2012 et 2013 : 1 049 au T1, 841 au T2, 658 au T3 et 971 au T4. La ligne pointillée représente la moyenne cumulative des déclarations totales reçues avant la fin de chaque trimestre pour les trois mêmes années : 1 890 avant la fin du T2, 2 548 avant la fin du T3 et 3 519 avant la fin du T4.
Les barres hachurées violet foncé montrent les déclarations totales reçues chaque trimestre de 2014 : 764 au T1 et 459 au T2. La ligne pleine indique qu'un total cumulatif de 1 223 déclarations ont été reçues avant la fin du T2 de 2014.
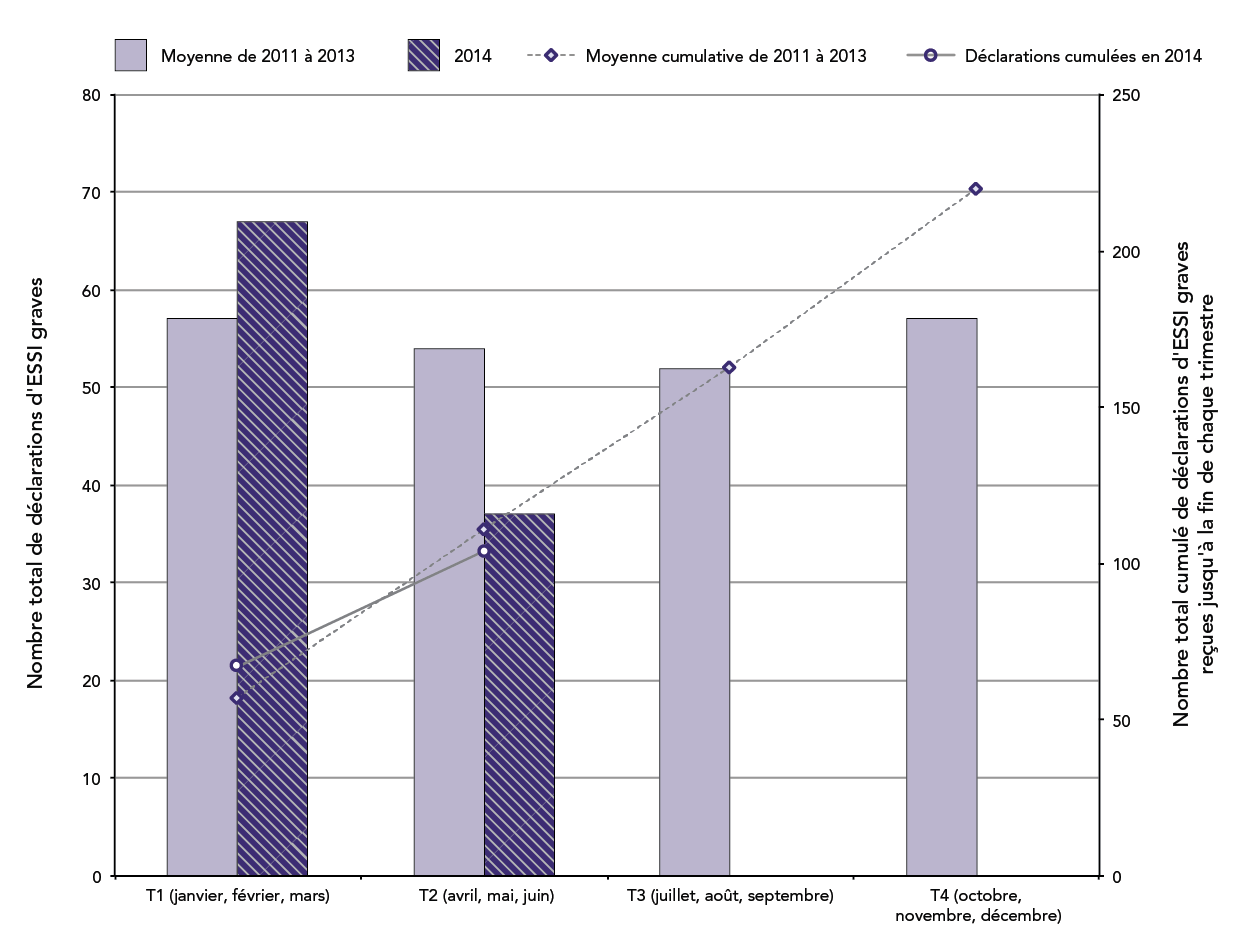
Figure 2 : Nombre total de déclarations d'ESSI graves par trimestre civil et cumulées jusqu'à la fin de chaque trimestre : année 2014 par rapport à la moyenne de 2011-2013
Au total, 37 déclarations d'effets secondaires graves suivant l'immunisation (8,1 % de l'ensemble des déclarations d'ESSI) ont été reçues par l'Agence au T2 de 2014. Au cours des mêmes périodes en 2011, 2012 et 2013, l'Agence a reçu une moyenne de 54 (plage : 49-59) déclarations d'effets secondaires graves suivant l'immunisation, ce qui représente entre 5,7 et 7,5 % de toutes les déclarations d'ESSI reçues au cours du même trimestre pour ces années.
Équivalent textuel
Il s'agit d'une combinaison d'un graphique à barres et d'un graphique linéaire. Les barres représentent le nombre total de déclarations d'effets secondaires suivant l'immunisation graves reçues chaque trimestre civil (T); le premier trimestre (T1) comprend les mois de janvier, février et mars, le deuxième trimestre (T2) inclut les mois d'avril, mai et juin, le troisième trimestre (T3) comprend les mois de juillet, août et septembre et le quatrième trimestre (T4) inclut les mois d'octobre, novembre et décembre. La ligne montre le nombre total de déclarations accumulées à la fin de chaque trimestre. L'axe des y principal sur le côté gauche du graphique correspond au diagramme à barres et présente le nombre total pour chaque trimestre, qui est compris entre 0 et 80. L'axe des y secondaire à droite du graphique correspond au graphique linéaire et montre le nombre total à la fin de chaque trimestre, qui est compris entre 0 et 250. L'axe des x correspond au trimestre et va du premier trimestre au quatrième trimestre. Deux périodes sont représentées sur le graphique.
Les barres violet pâle indiquent la moyenne des déclarations totales chaque trimestre en 2011, 2012 et 2013 : 57 au T1, 54 au T2, 52 au T3 et 57 au T4. La ligne pointillée montre la moyenne cumulative des déclarations totales reçues avant la fin de chaque trimestre pour les trois mêmes années : 111 avant la fin du T2, 163 avant la fin du T3 et 220 avant la fin du T4.
Les barres hachurées violet foncé montrent les déclarations totales reçues chaque trimestre de 2014 : 67 au T1 et 37 au T2. La ligne pleine indique qu'un total cumulatif de 104 déclarations ont été reçues avant la fin du T2 de 2014.
Fréquence des déclarations d'effets secondaires graves et non graves suivant l'immunisation, par groupe d'âge
La répartition selon l'âge pour toutes les déclarations d'ESSI graves reçues au T2 pour 2014 était semblable à celle observée au cours des années précédentes. Quant aux déclarations d'ESSI non graves, la proportion des enfants de moins de 7 ans serait plus faible au deuxième trimestre de l'année 2014 qu'au cours des années précédentes (39,6 % par rapport à 51,7 %), tandis que la proportion des adultes de 18 ans serait plus élevée (41,6 % par rapport à 30,6 %). Cette tendance est probablement artéfactuelle et liée aux enjeux relatifs aux déclarations mentionnés ci-dessus. Les provinces et les territoires qui ont accusé des retards (causés par des problèmes techniques) dans la production de leurs rapports ont aussi produit le taux de déclaration le plus élevé chez les jeunes enfants. La constance des effets indésirables graves (EIG) entre le T2 de l'année 2014 et les années précédentes chez les personnes de moins de 18 ans est attribuable au programme de surveillance active de l'immunisation (IMPACT) qui déclare ces effets directement de l'Agence.
| Groupe d'âge | Effets indésirables graves (EIG) | Effets indésirables non graves | ||
|---|---|---|---|---|
| 2014 (total en pourcentage) |
Moyenne pour 2011-2013 (total en pourcentage) | 2014 (total en pourcentage) |
Moyenne pour 2011-2013 (total en pourcentage) | |
| Inconnu | 1 (2,7) | 2 (3,6) | 2 (0,5) | 13 (1,7) |
| 65 ans et plus | 4 (10,8) | 3 (5,5) | 38 (9) | 44 (5,6) |
| 18 à < 65 ans | 4 (10,8) | 6 (10,9) | 137 (32,6) | 197 (25) |
| 7 à < 18 ans | 1 (2,7) | 5 (9,1) | 77 (18,3) | 126 (16) |
| 2 à < 7 ans | 3 (8,1) | 8 (14,5) | 46 (11) | 112 (14,2) |
| 1 à < 2 ans | 10 (27) | 18 (32,7) | 54 (12,9) | 156 (19,8) |
| 0 à < 1 an | 14 (37,8) | 13 (23,6) | 66 (15,7) | 139 (17,7) |
Le tableau 2 combine les données du T1 précédemment signalées avec celles du T2 en un résumé cumulatif pour 2014, par rapport aux années précédentes (2011-2013).
| Groupe d'âge | Effets indésirables graves (EIG) | Effets indésirables non graves | ||
|---|---|---|---|---|
| 2014 (total en pourcentage) |
Moyenne pour 2011-2013 (total en pourcentage) | 2014 (total en pourcentage) |
Moyenne pour 2011-2013 (total en pourcentage) | |
| Inconnu | 2 (1,9) | 2 (1,8) | 17 (1,5) | 35 (2) |
| 65 ans et plus | 6 (5,8) | 12 (10,6) | 126 (11,3) | 130 (7,3) |
| 18 à < 65 ans | 18 (17,3) | 14 (12,4) | 411 (36,8) | 525 (29,5) |
| 7 à < 18 ans | 6 (5,8) | 11 (9,7) | 179 (16) | 259 (14,6) |
| 2 à < 7 ans | 12 (11,5) | 14 (12,4) | 153 (13,7) | 238 (13,4) |
| 1 à < 2 ans | 25 (24) | 31 (27,4) | 119 (10,7) | 331 (18,6) |
| 0 à < 1 an | 35 (33,7) | 29 (25,7) | 112 (10) | 261 (14,7) |
Vaccins les plus courants mentionnés dans les déclarations d'effets secondaires suivant l'immunisation (ESSI)
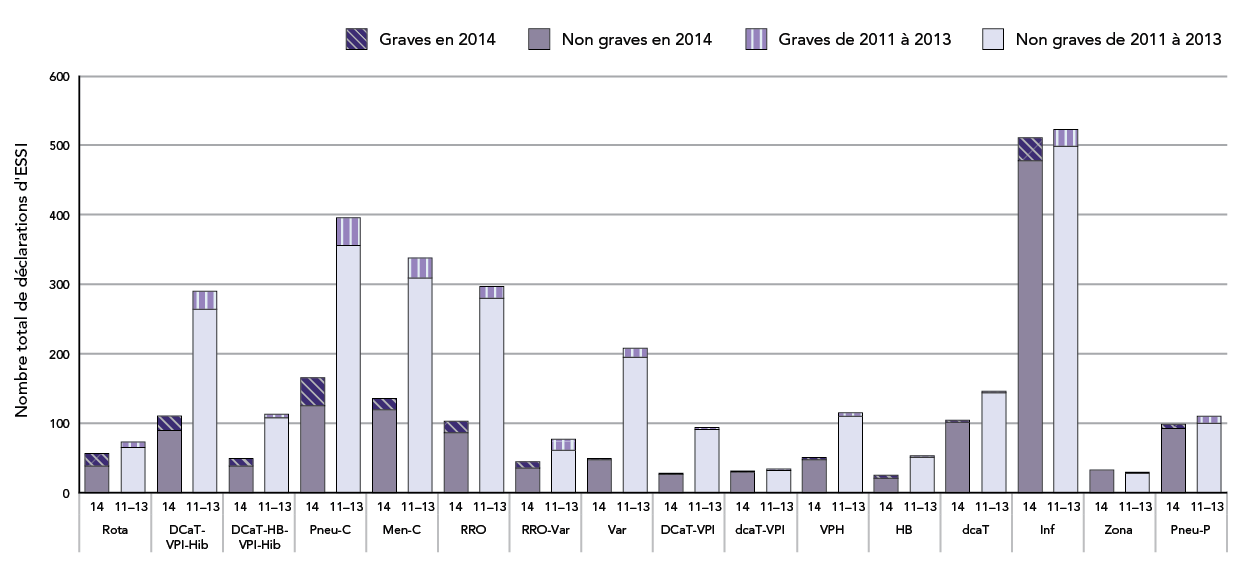
Le sommaire des vaccins les plus couramment mentionnés dans les déclarations d'ESSI est indiqué dans le tableau et le graphique ci-après. Le tableau 3 énumère les vaccins les plus fréquemment en cause dans les déclarations d'ESSI reçues au T2 de l'année 2014 par rapport au nombre moyen pour la période 2011-2013. La figure 3 présente un résumé cumulatif des mêmes données recueillies en 2014 (T1 et T2) par rapport à la moyenne de 2011-2013. Il convient de noter la fréquence moins élevée apparente des déclarations d'effets indésirables non graves au T2 par rapport à la moyenne de 2011-2013, pour les vaccins DCaT-VPI-Hib, Pneu-C, Men-C, RRO et Var. Ces résultats à la baisse pour les vaccins administrés aux enfants (par opposition à ceux donnés aux adultes) sont probablement attribuables aux retards quant à la soumission des déclarations et seront consignés dans les rapports trimestriels ultérieurs.
| Déclarations reçues quant au nombre d'effets indésirables graves | Déclarations reçues quant au nombre d'effets indésirables non graves | |||
|---|---|---|---|---|
| 2014 | Moyenne pour 2011-2013 |
2014 | Moyenne pour 2011-2013 |
|
| Rota | 8 | 5 | 24 | 37 |
| DTaP-IPV-Hib | 5 | 11 | 46 | 142 |
| DTaP-HB-IPV-Hib | 5 | 4 | 24 | 55 |
| Pneu-C | 17 | 20 | 72 | 166 |
| Men-C | 8 | 17 | 57 | 137 |
| MMR | 7 | 11 | 42 | 129 |
| MMR-Var | 5 | 9 | 18 | 33 |
| Var | 1 | 7 | 22 | 101 |
| DTaP-IPV | 0 | 2 | 6 | 55 |
| Tdap-IPV | 0 | 0 | 14 | 19 |
| HPV | 0 | 3 | 30 | 54 |
| HB | 2 | 1 | 14 | 23 |
| Tdap | 2 | 2 | 52 | 79 |
| Inf | 8 | 8 | 96 | 101 |
| Zos | 0 | 1 | 13 | 18 |
| Pneu-P | 3 | 5 | 37 | 36 |
Figure 3 : Vaccins les plus couramment mentionnés pour les ESSI déclarés entre le 1er janvier et la fin du deuxième trimestre : année 2014 par rapport à la moyenne de 2011-2013
Équivalent textuel
Il s'agit d'un diagramme à barres illustrant le nombre total de déclarations d'effets secondaires suivant l'immunisation graves et non graves reçues pour des vaccins spécifiques à l'Agence de la santé publique jusqu'à la fin du deuxième trimestre (30 juin) de 2014 par rapport à la moyenne des déclarations reçues jusqu'à la fin des deuxièmes trimestres de 2011, de 2012 et de 2013. L'axe des y montre le nombre de déclarations, qui est compris entre 0 et 600. L'axe des x présente des groupes de vaccins spécifiques d'après le contenu antigénique plutôt que d'après une marque précise.
Les groupes de vaccins présentés et le nombre de déclarations d'effets secondaires suivant l'immunisation graves et non graves reçues pour chacun jusqu'à la fin du 2e trimestre a) en 2014 par rapport à b) aux moyennes respectives de 2011, de 2012 et de 2013 sont : rotavirus : a) 38/19 par rapport à b) 65/8, DCaT-HB-VPI-Hib : a) 90/21 par rapport à b) 264/26; DCaT-HB-VPI-Hib : a) 38/11 par rapport à b) 108/5; vaccin conjugué contre le pneumocoque : a) 126/39 par rapport à b) 356/40; vaccin méningococcique conjugué C : a) 119/17 par rapport à b) 309/29; vaccin ROR : a) 87/16 par rapport à b) 280/17; RROV : a) 35/9 par rapport à b) 61/16; varicelle : a) 47/2 par rapport à b) 195/13; DCaT-VPI : a) 26/1 par rapport à b) 91/3; DCaT-VPI : a) 29/1 par rapport à b) 32/2; VPH : a) 48/3 par rapport à b) 110/5; HB : a) 20/5 par rapport à b) 51/2; DCaT : a) 102/3 par rapport à b) 144/2; grippe : a) 478/33 par rapport à b) 499/24; zona : a) 33/0 par rapport à b) 28/1; vaccin polysaccharidique contre le pneumocoque : a) 92/7 par rapport à b) 100/10.
Effets secondaires suivant l'immunisation (ESSI) déclarés en fonction de la principale raison et de la gravité
Classification des ESSI aux fins de rapport : Toutes les déclarations d'ESSI sont examinées chaque jour par des professionnels de la santé afin d'établir une principale raison de déclaration et la gravité connexe. La classification s'en tient étroitement au Formulaire de rapport des effets secondaires suivant l'immunisation national afin de permettre la communication d'une rétroaction significative aux autorités de santé publique, aux professionnels de la santé et au public concernant le profil de déclaration des effets secondaires. Les principales catégories utilisées au moment de déclarer un ESSI, et les événements figurant dans le graphique ci-dessous, sont définies comme suit :
- Réactions au niveau ou près du site de vaccination : La plupart des effets déclarés impliquent de l'inflammation au niveau ou près du site de vaccination. D'autres détails se trouvent à la section 9a) du formulaire de rapport.
- Événements allergiques ou de type allergique : L'événement allergique le plus grave, l'anaphylaxie, est rare (≤ 1 cas pour 100 000 doses administrées). D'autres détails se trouvent à la section 9b) du formulaire de rapport.
- Événements neurologiques : Les convulsions sont l'événement neurologique le plus souvent signalé, particulièrement chez les nourrissons et les tout-petits qui sont susceptibles de subir cet effet secondaire accompagné de fièvre. Ces événements sont déclarés assez fréquemment au Canada parce qu'ils sont activement recherchés et signalés par le réseau du Programme canadien de surveillance active de l'immunisation (IMPACT). D'autres détails se trouvent à la section 9c) du formulaire de rapport.
- Éruption cutanée seulement : Pour être classée comme une « éruption cutanée seulement », l'éruption cutanée doit être le seul signe ou symptôme déclaré. Cela comprend les urticaires qui apparaissent à n'importe quel moment après la vaccination, mais qui ne sont accompagnées d'aucun autre signe ou symptôme. Les urticaires surviennent souvent au cours de l'enfance et souvent, la cause demeure inconnue.
- Autres effets figurant sur le formulaire de rapport du SCSESSI : Ces événements peuvent comprendre des pleurs persistants (pleurs constants et inchangés ≥ 3 heures), invagination intestinale (intussusception), épisode hypotonique-hyporéactif. D'autres détails se trouvent à la section 9d) du formulaire de rapport.
Les événements qui ne s'inscrivent pas clairement dans l'une des catégories susmentionnées sont classés dans l'une des quatre catégories supplémentaires suivantes :
- Événements systémiques : Il s'agit principalement d'événements qui touchent de nombreux systèmes de l'organisme souvent accompagnés de fièvre. Tout syndrome reconnu est classé comme un effet systémique, notamment des maladies telles que le syndrome de Kawasaki, le syndrome de Stevens-Johnson, le purpura de Schönlein-Henoch, la fibromyalgie et la maladie sérique. De plus, toute preuve d'infection atteignant une ou plusieurs parties du corps (infection respiratoire, urinaire, etc.) est incluse dans cette catégorie, de même que les cas d'éruption cutanée d'origine non allergique et étant accompagnés d'autres signes et symptômes comme la fièvre, la toux et la conjonctivite. Les symptômes généraux tels que la fatigue, les malaises, la léthargie, les maux de tête, les douleurs musculaires, y compris les syndromes grippaux, sont considérés comme des effets systémiques. Enfin, la fièvre signalée comme unique effet secondaire est comprise dans cette catégorie.
- Événements liés à l'anxiété due à la vaccination : Ces effets comprennent l'évanouissement (syncope) avec ou sans mouvements convulsifs, qui peuvent accompagner brièvement un épisode d'évanouissement. D'autres effets inclus dans cette catégorie sont les groupes d'effets souvent observés dans les minutes qui suivent l'immunisation indiquant la présence d'anxiété tels que la pâleur, les tremblements, les sensations de froid, l'hyperventilation, etc.
- Autres événements divers : Tous les autres effets secondaires qui ne s'inscrivent dans aucune des catégories susmentionnées sont enregistrés comme des effets divers. Ces effets peuvent aussi être classés en fonction du système de l'organisme prédominant dont ils relèvent comme les systèmes gastro-intestinal, cardiaque, génito-urinaire, etc.
- Erreur de vaccination sans ESSI associé : À l'occasion, des déclarations sont soumises d'une erreur d'immunisation sans aucun effet secondaire inhérent. Parmi les exemples, mentionnons l'utilisation d'un produit périmé ou la mauvaise administration d'un produit (p. ex. l'administration d'un vaccin dans le tissu musculaire alors qu'il devait être injecté par voie sous-cutanée).
La principale raison pour la déclaration d'effets indésirables graves et non graves au T2 de l'année 2014 est présentée au tableau 4 et comparée à la moyenne de 2011-2013. La figure 4 présente un résumé cumulatif des mêmes données recueillies en 2014 (T1 et T2) par rapport à la moyenne de 2011-2013. Bien que le nombre total de cas déclarés présentant des effets indésirables non graves soit moindre au T1 et T2 de 2014 qu'au cours des années précédentes, la répartition par raison principale de déclaration est semblable. Les effets secondaires non graves les plus souvent signalés sont les réactions au niveau ou près du site de vaccination, l'éruption cutanée comme unique événement, les événements allergiques ou de type allergique et les effets systémiques. La majorité des déclarations ne sont pas graves.
| Principale raison de déclaration | Déclarations quant au nombre d'effets indésirables graves | Déclarations quant au nombre d'effets indésirables non graves | ||
|---|---|---|---|---|
| 2014 | Moyenne pour la période 2011-2013 | 2014 | Moyenne pour la période 2011-2013 | |
| Réaction au site de vaccination ou à proximité | 3 | 5 | 177 | 282 |
| Événements allergiques ou de type allergique | 1 | 2 | 43 | 89 |
| Événements neurologiques | 14 | 24 | 19 | 28 |
| Éruption cutanée seulement | 0 | 1 | 95 | 178 |
| Autres événements indiqués sur le formulaire du SCSESSI | 8 | 5 | 23 | 36 |
| Effets systémiques | 7 | 11 | 44 | 72 |
| Événements liés à l'anxiété due à la vaccination | 0 | 0 | 4 | 8 |
| Autres événements divers | 4 | 5 | 16 | 76 |
| Erreur de vaccination sans ESSI associé | 0 | 0 | 1 | 16 |
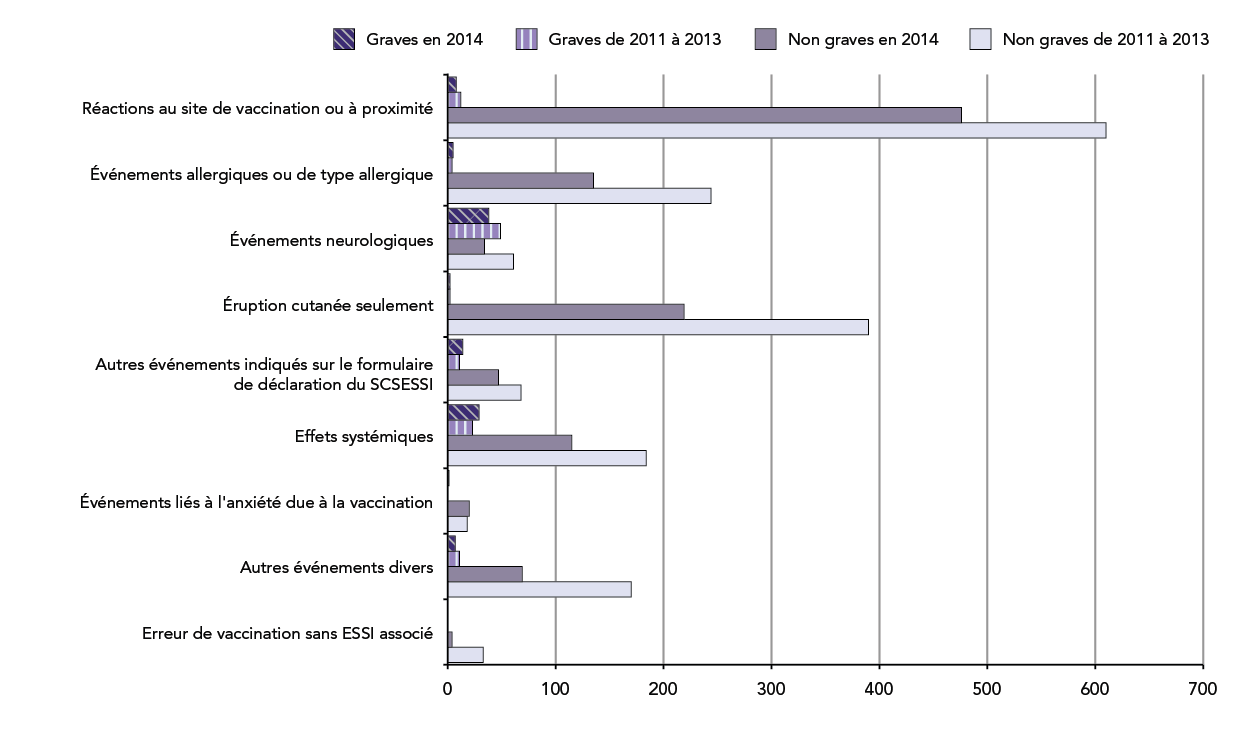
Figure 4 Nombre total de déclarations d'ESSI reçues entre le 1er janvier et la fin du deuxième trimestre par principale raison et par gravité : année 2014 par rapport à la moyenne de 2011-2013
Équivalent textuel
Il s'agit d'un diagramme à barres illustrant le nombre total de déclarations graves et non graves classées selon la principale raison de déclaration qui ont été reçues par l'Agence de la santé publique du Canada jusqu'à la fin du deuxième trimestre (le 30 juin) de 2014 par rapport à la moyenne des années 2011, 2012 et 2013 pour cette même période.
L'axe des y présente les neuf catégories différentes d'effets secondaires suivant l'immunisation et l'axe des x montre le nombre total de déclarations pour chaque catégorie qui varient de 0 à 700.
Le nombre total respectif de déclarations d'effets secondaires suivant l'immunisation graves et non graves reçues avant la fin du deuxième trimestre était : réactions au site de vaccination ou près de ce dernier : 2014 : 476/8; 2011-2013 : 610/12; événements allergiques ou de type allergique : 2014 : 135/5; 2011-2013 : 244/4; événements neurologiques : 2014 : 34/38; 2011-2013 : 61/49; éruption cutanée seulement (en d'autres termes, éruption cutanée sans d'autres signes ou symptômes) : 2014 : 219/2; 2011-2013 : 390/2; autres événements précisés sur le formulaire de déclaration du SCSESSI : 2014 : 47/14; 2011-2013 : 68/11; effets systémiques : 2014 : 115/29; 2011-2013 : 184/23; événements liés à l'anxiété due à la vaccination : 2014: 20/1; 2011-2013 : 18/0; autres événements divers : 2014 : 69/7; 2011-2013 : 170/11; erreur de vaccination sans ESSI associé : 2014 : 4/0; 2011-2013: 33/0.
Analyse des déclarations d'effets indésirables graves (EIG) suivant l'immunisation reçues par l'Agence
Les types d'effets indésirables graves (EIG) déclarés sont décrits ci-dessous. Le tableau 5 résume les types d'EIG déclarés au T2 de 2014, comparativement à la moyenne de 2011-2013. La figure 5 présente un résumé cumulatif des mêmes données recueillies en 2014 (T1 et T2) par rapport à la moyenne de 2011-2013.
Il y a eu en tout 37 cas graves déclarés au T2 de l'année 2014 (8,1 % des 459 déclarations totales). La moyenne pour le T2 de 2011 à 2013 était de 54 cas graves déclarés (6 % des 841 déclarations totales). Comme nous l'avons souligné au T1, la raison la plus courante des déclarations d'effets indésirables graves au T2 était les convulsions habituellement accompagnées de fièvre.Les convulsions fébriles sont activement recherchées par le réseau du programme de surveillance active de l'immunisation (IMPACT) dans les hôpitaux pédiatriques qui fournit régulièrement plus de la moitié de tous les effets secondaires graves suivant l'immunisation signalés à l'Agence chez les enfants. On sait que les convulsions fébriles surviennent après l'administration de vaccins vivants atténués, tels que le vaccin RRO ou RROV, aussi fréquemment qu'une fois par 2 600 vaccins. Les événements sont de courte durée et ne sont pas associés à des effets négatifs à long terme.
L'intussusception représente la seule catégorie déclarée beaucoup plus souvent en 2014 qu'au cours des années précédentes (cinq cas au T2 de 2014 par rapport à zéro à deux cas au cours des années précédentes). Les cinq cas déclarés étaient des nourrissons qui avaient reçu le vaccin contre le rotavirus seulement (n = 2), ou accompagné d'autres vaccins pour nourrissons (n = 3) régulièrement prévus. Dans les deux cas, les symptômes sont apparus de trois à quatre jours après la vaccination, à la suite de l'administration de la première dose. Quant aux trois autres cas, les symptômes sont apparus 54 jours après l'administration de la première dose, 19 jours après la deuxième dose et un intervalle inconnu après la deuxième dose. Les cinq nourrissons se sont complètement rétablis. Il y a un risque connu - quoique rare - d'intussusception suivant l'administration du vaccin antirotavirus (le nombre de cas varie d'un à sept pour 100 000 doses de vaccin). Toutefois, il y a de nombreuses autres causes d'intussusception, et l'avantage global du vaccin antirotavirus l'emporte sur les risques. Il est fort probable que le nombre accru de déclarations d'intussusception témoigne de l'augmentation de l'utilisation du vaccin antirotavirus par les programmes de santé publique au Canada. Quoi qu'il en soit, l'intussusception continue de faire l'objet d'une surveillance à l'échelle du pays.
| Types de déclarations d'EIG | 2011 | 2012 | 2013 | 2014 |
|---|---|---|---|---|
| Effets systémiques | 8 | 14 | 10 | 7 |
| Convulsions | 20 | 14 | 12 | 9 |
| Syndrome de Guillain-Barré | 2 | 4 | 1 | 0 |
| Encéphalite | 3 | 1 | 1 | 2 |
| Autres troubles neurologiques | 8 | 3 | 3 | 3 |
| Site de vaccination | 7 | 9 | 7 | 3 |
| Anaphylaxie | 0 | 0 | 1 | 1 |
| Autres réactions allergiques | 2 | 2 | 0 | 0 |
| EHH | 1 | 1 | 1 | 0 |
| Intussusception | 0 | 1 | 2 | 5 |
| Éruption cutanée | 0 | 1 | 2 | 0 |
| Arthrite | 0 | 0 | 1 | 0 |
| Thrombocytopénie | 5 | 0 | 1 | 3 |
| Paresthésie/anesthésie | 0 | 1 | 0 | 0 |
| Anxiété due à l'immunisation | 0 | 0 | 0 | 0 |
| Autres événements divers | 3 | 4 | 7 | 4 |
FIGURE 5 : Nombre total de déclarations d'ESSI reçues entre le 1er janvier et la fin du deuxième trimestre par type d'effet indésirable : année 2014 par rapport aux trois années précédentes
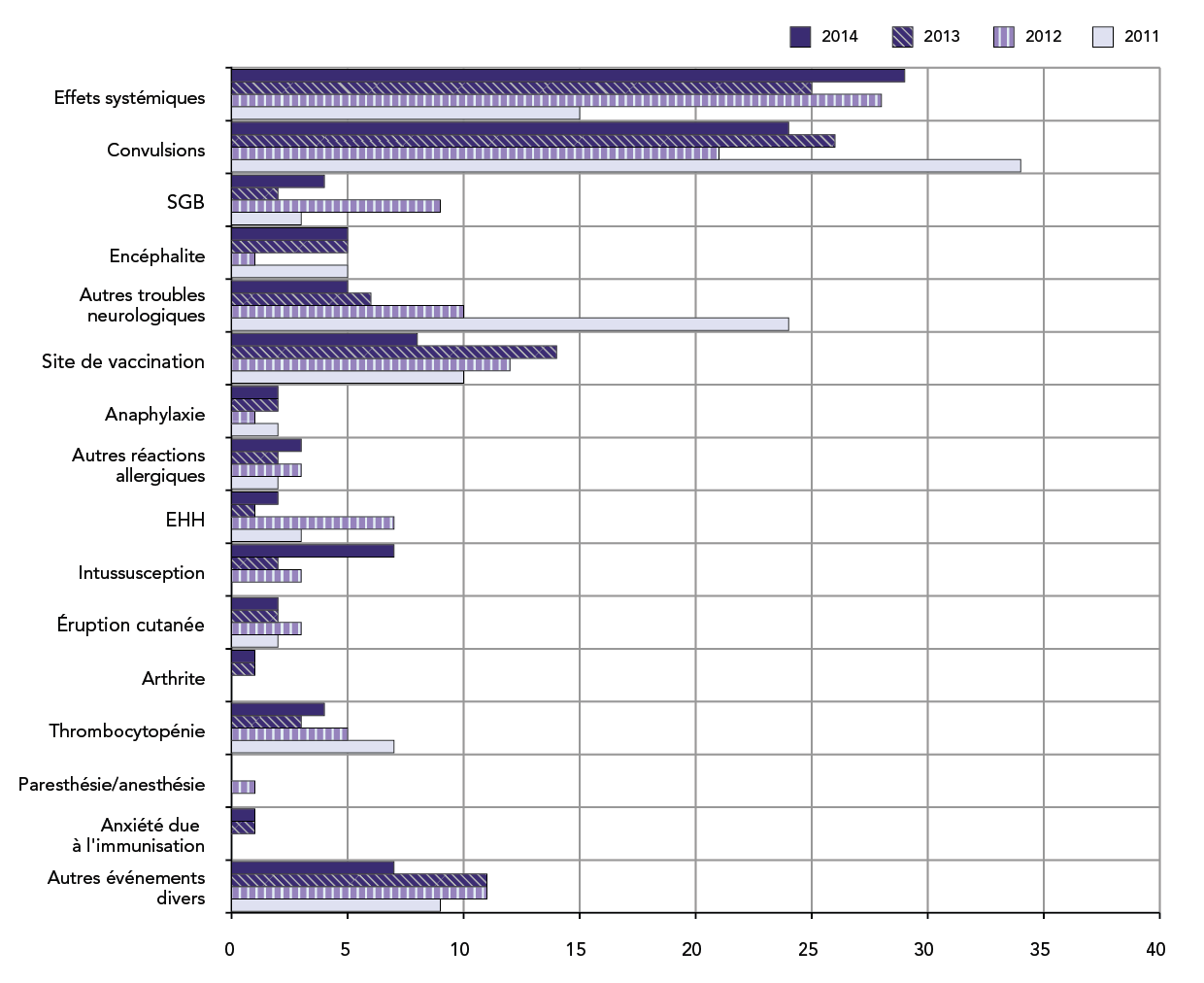
Équivalent textuel
Il s'agit d'un diagramme à barres illustrant le nombre total de déclarations d'effets secondaires suivant l'immunisation spécifiques reçues jusqu'à la fin du deuxième trimestre (le 30 juin) pour chacune des quatre années : 2011, 2012, 2013 et 2014. L'axe des y énumère les types d'effets secondaires suivant l'immunisation spécifiques, tel qu'il est décrit ci-dessous. L'axe des x montre le nombre total de déclarations allant de 0 à 40.
Pour chaque type d'effets secondaires suivant l'immunisation spécifiques, les déclarations reçues au cours du deuxième trimestre de 2011, de 2012, de 2013 et de 2014, respectivement, étaient les suivantes : effets systémiques : 15, 28, 25 et 29; convulsions : 34, 21, 26 et 24; syndrome de Guillain-Barré : 3, 9, 2 et 4; encéphalite : 5, 1, 5 et 5; autres effets neurologiques : 24, 10, 6 et 5; réactions au site de vaccination ou près de ce dernier : 10, 12, 14 et 8; anaphylaxie : 2, 1, 2 et 2; autres événements allergiques : 2, 3, 2 et 3; épisode hypotonique-hyporéactif : 3, 7, 1 et 2; intussusception : 0, 3, 2 et 7; éruption cutanée : 2, 3, 2 et 2; arthrite : 0, 0, 1 et 1; thrombocytopénie : 7, 5, 3 et 4; paresthésie/anesthésie : 0, 1, 0 et 0; anxiété due à l'immunisation : 0, 0, 1 et 1; autres événements divers : 9, 11, 11 et 7.
Détails de la page
- Date de modification :