Effets secondaires suivant l'immunisation (ESSI) Rapport trimestriel pour 2015 – T1
Résumé de l'évaluation de l'innocuité pour ce trimestre :
- Aucune préoccupation importante concernant l'innocuité des vaccins n'a été soulevée au cours du premier trimestre de l'année 2015.
- Tous les cas graves ont été examinés et l'on a établi que la plupart de ceux-ci étaient soit prévisibles (en fonction des effets indésirables connus associés au vaccin et énumérés dans le Guide canadien d'immunisation et les renseignements sur le produit) soit explicables par d'autres raisons et non liés à la vaccination.
- Comme les trimestres précédents, le nombre total de déclarations d'ESSI reçues était plus faible que celui des trimestres précédents, ce qui témoigne d'une lacune en matière de déclaration par les compétences qui mettent en œuvre de nouveaux systèmes de déclaration électroniques.
Les vaccins sont étroitement surveillés au Canada à toutes les phases du « cycle de vie » du produit vaccinal, depuis sa découverte jusqu'à l'autorisation de mise en marché (avant commercialisation) et au-delà, à mesure que les gens commencent à les utiliser (après commercialisation). De nombreux intervenants participent à diverses activités liées à l'évaluation et à la surveillance de l'innocuité des vaccins, y compris le gouvernement fédéral, les autorités de santé publique provinciales, territoriales et locales, les fournisseurs de soins de santé, l'industrie des vaccins et le public. L'Agence de la santé publique du Canada (l'Agence) assure une surveillance étroite de l'innocuité après commercialisation par l'intermédiaire d'un système national d'enregistrement, soit le Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI).
L'objet principal de la surveillance après commercialisation des vaccins est de déceler les préoccupations concernant leur innocuité. Ces préoccupations comprennent une possible augmentation de la gravité ou de la fréquence des réactions attendues, ou encore, la survenue d'un ou de plusieurs événements inattendus (c.-à-d. un effet secondaire qui ne correspond pas aux renseignements ou à l'étiquette sur le produit canadien). Cela permet aux vaccinateurs et aux fournisseurs de programme d'immunisation de santé publique de prendre des mesures dans le domaine de la santé publique :
- au niveau de la personne (p. ex. une enquête plus poussée afin de confirmer un diagnostic et de déterminer les causes possibles, une consultation en vue d'écarter la possibilité d'une allergie à un ou à plusieurs composants du vaccin, ou une décision d'administrer ou non des doses subséquentes du vaccin), ou
- au niveau du programme d'immunisation (p. ex. une enquête menée sur un ensemble d'effets secondaires, un examen des procédures pour s'assurer que les exigences relatives à l'entreposage des vaccins ont été rigoureusement suivies, ou encore un changement de politique permettant d'adopter un vaccin moins réactogène).
L'Agence partage aussi les données sur les effets secondaires suivant l'immunisation (ESSI) avec Santé Canada, soit l'organisme de réglementation des vaccins au Canada, pour mettre sur pied une mesure de réglementation liée aux vaccins qui sont offerts au Canada Il peut s'agir de diffuser des communications aux vaccinateurs ou au public concernant la préoccupation ou d'exiger de l'information ou une enquête supplémentaire de la part du distributeur du vaccin.
L'Agence publie systématiquement les résultats des rapports de surveillance de l'innocuité des vaccins résumant les données du SCSESSI. Les rapports trimestriels présentent un sommaire de toutes les déclarations d'effets secondaires suivant l'immunisation (ESSI) reçues par l'Agence du 1er janvier au 31 mars (premier trimestre), du 1er avril au 30 juin (deuxième trimestre), du 1er juillet au 30 septembre (troisième trimestre) et du 1er octobre au 31 décembre (quatrième trimestre), peu importe la date à laquelle le vaccin avait effectivement été administré. En outre, le rapport du quatrième trimestre fournit des données cumulatives s'étendant sur toute l'année et contient un examen détaillé des inquiétudes qui pourraient avoir été observées dans les rapports antérieurs.
Afin de comparer les données d'une année à l'autre, les données de chaque trimestre sont indiquées avec une moyenne des données trimestrielles de plusieurs années antérieures.
Remarques sur l'interprétation : Un effet secondaire suivant l'immunisation (ESSI) est défini comme étant tout événement médical fâcheux qui se produit à la suite de l'administration d'un vaccin et qui n'a pas nécessairement de lien causal avec celle-ci. Un effet secondaire peut donc correspondre à un signe défavorable ou non intentionnel, à un résultat de laboratoire anormal, à un symptôme ou à une affection. Les déclarations d'effets secondaires suivant l'immunisation soumises à l'Agence de la santé publique du Canada représentent un soupçon, une opinion ou une observation par le déclarant plutôt qu'une affirmation ou une preuve que le vaccin a pu causer l'événement. Pour la plupart des événements, il est difficile d'établir une relation de causalité précise. D'autres limites des données sur les déclarations d'effets secondaires suivant l'immunisation comprennent des normes de déclaration variées et la sous-déclaration, un manque de certitude quant à la validité du diagnostic d'un événement signalé, un manque de renseignements en ce qui concerne d'autres causes potentielles et d'autres biais de déclaration. Bref, ces renseignements ne doivent pas être utilisés pour estimer l'incidence des effets secondaires.
Résultats mis en évidence pour le premier trimestre de 2015
Le nombre cumulatif inclus dans le présent rapport trimestriel (T1) comprend les déclarations reçues du 1er janvier au 31 mars, et des comparaisons sont faites par rapport au nombre moyen de déclarations reçues au cours du même trimestre lors des quatre années civiles précédentes (2011-2014). Les déclarations analysées en 2015 ont été extraites de la base de données du SCSESSI par l'Agence de la santé publique du Canada (l'Agence) le 15 mai 2015, et le 29 avril 2014 pour la période 2011-2014.
Figure 1 : Nombre total de déclarations d'ESSI par trimestre civil et cumulées jusqu'à la fin de chaque trimestre : année 2015 par rapport à la moyenne de 2011-2014
Au total, 744 déclarations d'ESSI ont été reçues par l'Agence au T1 de 2015. Au cours de la même période en 2011, 2012, 2013 et 2014, l'Agence a reçu en moyenne 977 (plage : 760-1258) déclarations d'ESSI. Cette chute demeure principalement associée à la transmission tardive des déclarations de la part d'une ou de plusieurs provinces et territoires à l'Agence au cours des dernières années, pour des raisons techniques liées à la mise en service de nouvelles bases de données électroniques. Comme toujours, les déclarations qui n'ont pas encore été reçues par l'Agence en raison des retards dans la transmission sont néanmoins examinées et analysées dans le territoire de compétence qui effectue la déclaration. Toutes préoccupations sont transmises au Groupe de travail sur la vaccinovigilance pancanadien par l'intermédiaire des centres de liaison des provinces et des territoires.
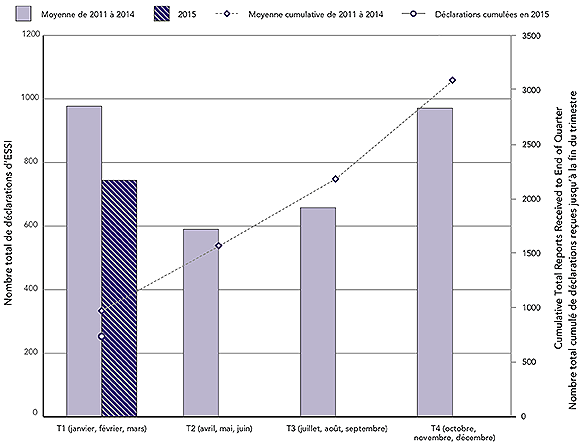
Équivalent textuel
Il s'agit d'une combinaison d'un graphique à barres et d'un graphique linéaire. Les barres représentent le nombre total de déclarations d'effets secondaires suivant l'immunisation (ESSI) reçues chaque trimestre civil (T); le premier trimestre (T1) comprend les mois de janvier, de février et de mars, le deuxième trimestre (T2) inclut les mois d'avril, de mai et de juin, le troisième trimestre (T3) comprend les mois de juillet, d'août et de septembre et le quatrième trimestre (T4) inclut les mois d'octobre, de novembre et de décembre. La ligne montre le nombre total de déclarations accumulées à la fin de chaque trimestre. L'axe des y principal sur le côté gauche du graphique correspond au diagramme à barres et présente le nombre total pour chaque trimestre, qui est compris entre 0 et 1 200. L'axe des y secondaire à droite du graphique correspond au graphique linéaire et montre le nombre total accumulé à la fin de chaque trimestre, qui est compris entre 0 et 3 500. L'axe des x correspond au trimestre et va du premier trimestre au quatrième trimestre. Deux périodes sont représentées sur le graphique.
Les barres pâles indiquent la moyenne des déclarations totales de chaque trimestre de 2011 à 2014 : 977 au T1, 590 au T2, 619 au T3 et 902 au T4. La ligne pointillée représente la moyenne cumulative des déclarations totales reçues avant la fin de chaque trimestre pour les quatre mêmes années : 977 au T1, 1 567 avant la fin du T2, 2 185 avant la fin du T3 et 3 087 avant la fin du T4.
Une deuxième barre foncée, réservée au T1, représente les déclarations totales reçues pour 2015 : 744. La ligne pleine qui commence par un point pour le T1 indique qu'un total cumulatif de 744 déclarations ont été reçues avant la fin du T1 de 2015.
Figure 2 : Nombre total de déclarations d'ESSI graves par trimestre civil et cumulées jusqu'à la fin de chaque trimestre : année 2015 par rapport à la moyenne de 2011-2014
Au total, 70 déclarations d'ESSI graves (9,4 % de l'ensemble des déclarations d'ESSI) ont été reçues par l'Agence au T1 de 2015. Au cours de la même période en 2011, 2012, 2013 et 2014, l'Agence a reçu en moyenne 58 (plage : 54-66) déclarations d'ESSI, ce qui représente de 4,3 à 8,7 % de toutes les déclarations d'ESSI reçues au cours du même trimestre pour ces années.
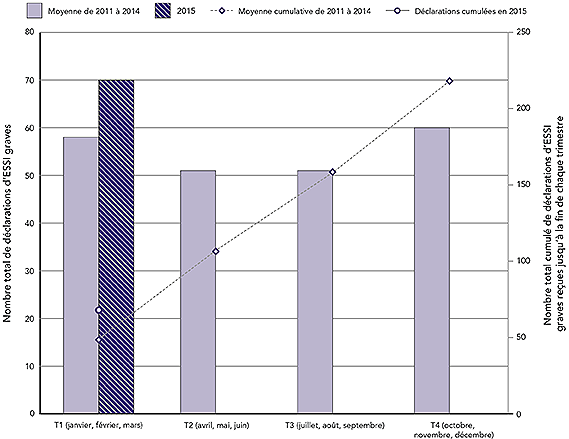
Équivalent textuel
Il s'agit d'une combinaison d'un graphique à barres et d'un graphique linéaire. Les barres représentent le nombre total de déclarations d'effets secondaires suivant l'immunisation graves reçues chaque trimestre civil (T); le premier trimestre (T1) comprend les mois de janvier, de février et de mars, le deuxième trimestre (T2) inclut les mois d'avril, de mai et de juin, le troisième trimestre (T3) comprend les mois de juillet, d'août et de septembre et le quatrième trimestre (T4) inclut les mois d'octobre, de novembre et de décembre. La ligne montre le nombre total de déclarations accumulées à la fin de chaque trimestre. L'axe des y principal sur le côté gauche du graphique correspond au diagramme à barres et présente le nombre total pour chaque trimestre, qui est compris entre 0 et 80. L'axe des y secondaire à droite du graphique correspond au graphique linéaire et montre le nombre total à la fin de chaque trimestre, qui est compris entre 0 et 250. L'axe des x correspond au trimestre et va du premier trimestre au quatrième trimestre. Deux périodes sont représentées sur le graphique.
Les barres pâles indiquent la moyenne des déclarations totales chaque trimestre de 2011 à 2014 : 58 au T1, 51 au T2, 51 au T3 et 60 au T4. La ligne pointillée montre la moyenne cumulative des déclarations totales reçues avant la fin de chaque trimestre pour les mêmes années : 58 au T1, 109 avant la fin du T2, 160 avant la fin du T3 et 220 avant la fin du T4. La barre foncée montre les déclarations totales reçues chaque trimestre de 2015 : dans ce cas, il n'y a qu'une barre indiquant 70 déclarations au T1. La ligne pleine, qui ne correspond qu'à un point dans ce cas-ci, indique qu'un total cumulatif de 58 déclarations ont été reçues avant la fin du T1 de 2015.
Fréquence des déclarations d'effets secondaires graves et non graves suivant l'immunisation, par groupe d'âge
Quelques légers changements ont été observés, en ce qui concerne la répartition selon l'âge des déclarations d'ESSI graves qui ont été reçues au T1 de l'année 2015, par rapport aux années précédentes. En particulier, comme le montre le tableau 1, le nombre total de toutes les déclarations d'effets indésirables graves pour les enfants âgés de 1 à moins de 2 ans était plus élevé au cours du premier trimestre de 2015 qu'au cours des quatre années précédentes en moyenne (26, par rapport à 13). Cette variation a été liée en partie à une utilisation accrue des nouveaux vaccins hexavalents (DCaT-VPI-HB-Hib). Les nouveaux vaccins sont habituellement associés à un taux de déclaration accru (voir le tableau 3).
Pour ce qui est des déclarations d'ESSI non graves, la répartition selon l'âge était semblable en 2015 à celle des années précédentes pour le T1.
| Groupe d'âge | Effets indésirables graves (EIG) | Effets indésirables non graves | ||
|---|---|---|---|---|
| 2015 | Moyenne pour 2011-2014 | 2015 | Moyenne pour 2011-2014 | |
| Inconnu | 0 | 0 | 2 | 20 |
| 65 ans et plus | 4 | 7 | 89 | 87 |
| 18 à < 65 ans | 9 | 9 | 277 | 316 |
| 7 à < 18 ans | 7 | 6 | 113 | 126 |
| 2 à < 7 ans | 7 | 6 | 73 | 121 |
| 1 à < 2 ans | 26 | 13 | 60 | 147 |
| 0 à < 1 an | 17 | 18 | 60 | 103 |
| Déclarations reçues quant au nombre d'effets indésirables graves | Déclarations reçues quant au nombre d'effets indésirables non graves | |||
|---|---|---|---|---|
| 2015 | Moyenne pour 2011-2014 | 2015 | Moyenne pour 2011-2014 | |
Tableau 3 Notes de bas de page
|
||||
| Rota | 7 | 5 | 16 | 24 |
| DTaP-IPV-Hib | 8 | 15 | 36 | 103 |
| DTaP-HB-IPV-Hib | 12 | 3 | 30 | 43 |
| Pneu-C | 27 | 21 | 54 | 143 |
| Men-C | 21 | 12 | 81 | 137 |
| MMR | 11 | 7 | 35 | 125 |
| MMR-Var | 8 | 6 | 45 | 25 |
| Var | 5 | 4 | 18 | 77 |
| DTaP-IPV | 0 | 1 | 14 | 32 |
| Tdap-IPVTableau 3 Note de bas de page * | 0 | 1 | 11 | 18 |
| HPV | 2 | 2 | 28 | 47 |
| HB | 2 | 4 | 41 | 51 |
| Tdap | 4 | 1 | 56 | 61 |
| Inf | 23 | 18 | 275 | 387 |
| Zos | 0 | 0 | 49 | 13 |
| Pneu-P | 2 | 5 | 61 | 65 |
Vaccins les plus courants mentionnés dans les déclarations d'effets secondaires suivant l'immunisation (ESSI)
Le tableau 3 énumère les vaccins les plus fréquemment en cause dans les déclarations d'ESSI reçues au T1 de l'année 2015, par rapport au nombre moyen pour le même trimestre durant la période de 2011 à 2014. Le changement le plus notable au premier trimestre de 2015, par rapport aux années précédentes, a été un plus grand nombre de déclarations d'ESSI graves à la suite de l'administration du vaccin hexavalent, ainsi que du vaccin contre le méningocoque et du vaccin contre la rougeole, les oreillons et la rubéole (ROR). Comme les vaccins hexavalents sont d'apparition récente, ils sont liés à un moins grand nombre historique de déclarations, et la distribution du vaccin ROR a probablement augmenté à la suite des récentes éclosions, ce qui attire l'attention sur l'importance du rattrapage à faire, concernant ce vaccin.
La figure 3 fournit un résumé cumulatif des vaccins les plus communément en cause parmi les déclarations d'ESSI reçues par l'Agence tout au long du premier trimestre de l'année 2015 (du 1er janvier au 31 mars), comparativement à la moyenne de 2011, 2012, 2013 et 2014 pour cette même période. Comme on l'a déjà été mentionné dans des rapports précédents, on observe une tendance de baisse de la fréquence, en ce qui concerne les déclarations d'effets secondaires non graves liés aux vaccins les plus communément administrés, par rapport aux quatre dernières années. Ces nombres plus faibles sont principalement attribuables à des retards de remise des rapports des provinces et des territoires qui poursuivent la mise en œuvre de nouvelles infrastructures électroniques de déclarations d'ESSI. Ces retards se traduiront par des augmentations des nombres subséquents de déclarations, et ces hausses seront expliquées en temps et lieu.
Figure 3 : Vaccins les plus couramment mentionnés pour les ESSI déclarés du 1er janvier à fin du premier trimestre : année 2015, par rapport à la moyenne de 2011-2014
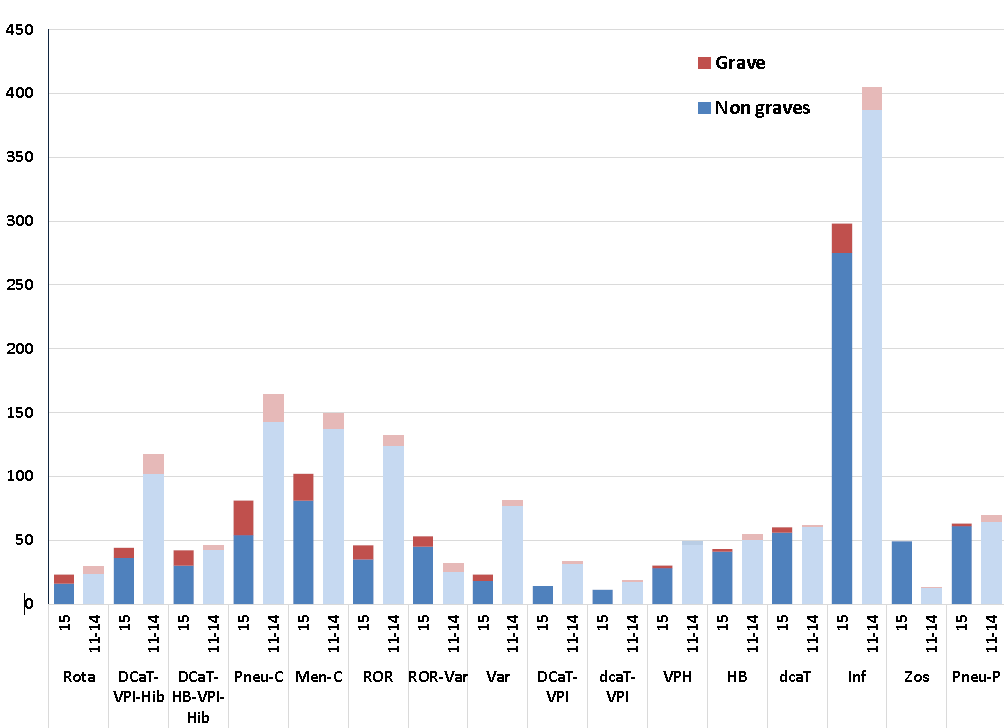
Équivalent textuel
Il s'agit d'un diagramme à barres illustrant le nombre total de déclarations d'effets secondaires suivant l'immunisation graves et non graves reçues pour des vaccins précis à l'Agence de la santé publique jusqu'à la fin du premier trimestre (le 31 mars) de 2015 par rapport à la moyenne des déclarations reçues jusqu'à la fin des premiers trimestres de 2011 à 2014. L'axe des y montre le nombre de déclarations, qui est compris entre 0 et 450. L'axe des x présente des groupes de vaccins précis d'après le contenu antigénique plutôt que d'après une marque précise.
Les groupes de vaccins présentés et le nombre de déclarations d'effets secondaires suivant l'immunisation graves et non graves reçues pour chacun jusqu'à la fin du premier trimestre a) en 2015 par rapport (barre pâle pour les déclarations non graves et barre foncée pour les déclarations graves) b) aux moyennes respectives de 2011 à 2014 (barre pâle pour les déclarations non graves et barre foncée pour les déclarations graves) sont : rotavirus : a) 16/7 par rapport à b) 24,3/4,8; DCaT-VPI-Hib : a) 36/8 par rapport à b) 102,5/14,8; DCaT-HB-VPI-Hib : a) 30/12 par rapport à b) 42,8/2,8; vaccin conjugué contre le pneumocoque : a) 54/27 par rapport à b) 142,8/21; vaccin méningococcique conjugué C : a) 81/21 par rapport à b) 137,3/12; vaccin ROR : a) 35/11 par rapport à b) 124,5/7,3; RROV : a) 45/8 par rapport à b) 25,3/6,3; varicelle : a) 18/5 par rapport à b) 76,8/4,3; DCaT-VPI : a) 14/0 par rapport à b) 32/1,3; DCaT-VPI : a) 11/0 par rapport à b) 17,7/1; VPH : a) 28/2 par rapport à b) 46,8/2,3; HB : a) 41/2 par rapport à b) 50,8/3,5; DCaT : a) 56/4 par rapport à b) 61/0,5; grippe : a) 275/23 par rapport à b) 387/17,5; zona : a) 49/0 par rapport à b) 12,8/0,3; vaccin polysaccharidique contre le pneumocoque : a) 61/2 par rapport à b) 64,5/4,8.
La principale raison pour la déclaration d'effets indésirables graves et non graves au T1 de l'année 2015 est présentée au tableau 4 et comparée à la moyenne de 2011-2014.
| Principale raison de déclaration | Déclarations quant au nombre d'effets indésirables graves | Déclarations quant au nombre d'effets indésirables non graves | ||
|---|---|---|---|---|
| 2015 | Moyenne pour 2011-2014 | 2015 | Moyenne pour 2011-2014 | |
| Réaction au site de vaccination ou à proximité | 7 | 4 | 300 | 320 |
| Événements allergiques ou de type allergique | 1 | 3 | 92 | 140 |
| Événements neurologiques | 23 | 24 | 21 | 29 |
| Éruption cutanée seulement | 1 | 1 | 111 | 188 |
| Autres événements indiqués sur le formulaire du SCSESSI | 7 | 6 | 18 | 30 |
| Effets systémiques | 25 | 15 | 76 | 108 |
| Événements liés à l'anxiété due à la vaccination | 0 | 0 | 13 | 12 |
| Autres événements divers | 6 | 5 | 41 | 79 |
| Erreur de vaccination sans ESSI associé | 0 | 0 | 2 | 13 |
La Figure 4 fournit un résumé cumulatif des déclarations reçues du début de l'année jusqu'à la fin du premier trimestre (du 1er janvier au 31 mars), par rapport à la moyenne de 2011-2014. Comme on l'a mentionné précédemment, les nombres totaux de déclarations d'effets secondaires non graves étaient inférieurs à ceux des années précédentes. Les effets secondaires non graves les plus souvent signalés sont les réactions au niveau ou près du site de vaccination, l'éruption cutanée comme unique événement, les événements allergiques ou de type allergique et les effets systémiques.
Figure 4 : Nombre total de déclarations d'ESSI reçues du 1er janvier à la fin du premier trimestre, par principale raison et par gravité : année 2015 par rapport à la moyenne de 2011-2014
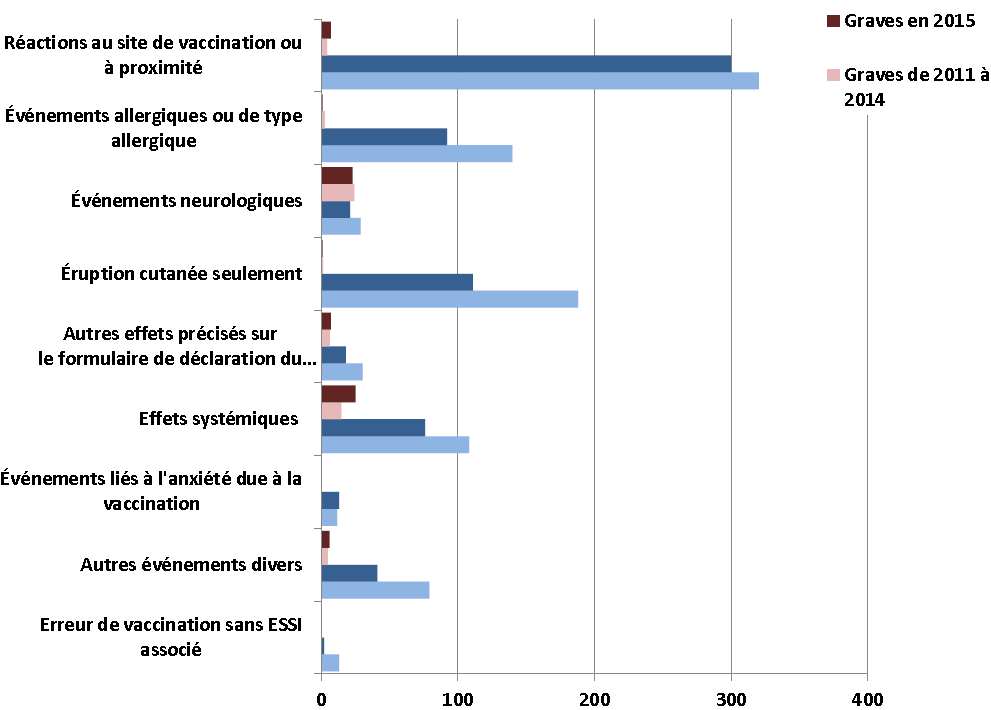
Équivalent textuel
Il s'agit d'un diagramme à barres illustrant le nombre total de déclarations graves et non graves classées selon la principale raison de déclaration qui ont été reçues par l'Agence de la santé publique du Canada jusqu'à la fin du premier trimestre (le 31 mars) de 2015 (barre pâle pour les déclarations non graves et barre foncée pour les déclarations graves), ainsi que la moyenne des années 2011 à 2014 pour la même période (barre pâle pour les déclarations non graves et barre foncée pour les déclarations graves).
L'axe des y présente les neuf catégories différentes d'effets secondaires suivant l'immunisation, et l'axe des x montre le nombre total de déclarations pour chaque catégorie, qui varient de 0 à 400
Le nombre total respectif de déclarations d'effets secondaires suivant l'immunisation graves et non graves reçues avant la fin du premier trimestre était : réactions au site de vaccination ou près de ce dernier : 2015 : 300/7; 2011-2014 : 320/4,2; événements allergiques ou de type allergique : 2015 : 92/1; 2011-2014 : 139/2,5; événements neurologiques : 2015 : 21/23; 2011-2014 : 28,75/24,25; éruption cutanée seulement (en d'autres termes, éruption cutanée sans d'autres signes ou symptômes) : 2015 : 111/1; 2011-2014 : 188/1.25; autres événements précisés sur le formulaire de déclaration du SCSESSI : 2015 : 18/7; 2011-2014 : 30,25/6,25; effets systémiques : 2015 : 76/25; 2011-2014 : 108/14,7; événements liés à l'anxiété due à la vaccination : 2015: 13/0; 2011-2014 : 11,5/0,25; autres événements divers : 2015 : 41/6; 2011-2014 : 79/4,75; erreur de vaccination sans ESSI associé : 2015 : 2/0; 2011-2014 : 13/0.
Déclarations d'effets indésirables graves suivant l'immunisation reçues
Les types d'effets indésirables graves (EIG) déclarés sont décrits ci-dessous. Le tableau 5 résume les types d'EIG déclarés au T1 de 2015, comparativement à la moyenne de 2011-2014. La figure 5 présente un résumé cumulatif des mêmes données recueillies en 2015 depuis le début de l'année jusqu'à la fin du trimestre (du 1er janvier au 31 mars), par rapport à la moyenne de 2011-2014.
Il y a eu en tout 70 cas d'EIG déclarés au T1 de l'année 2015 (9,4% des 744 déclarations totales). La moyenne pour le T1 de 2011 à 2014 était de 58 cas graves déclarés (7,2 % des 977 déclarations totales). Comme on l'a souligné dans des rapports antérieurs, la raison la plus courante des déclarations d'EIG au T4 était les convulsions habituellement accompagnées de fièvre. La seule augmentation observée par catégorie d'EIG touchait les effets généraux, mais une enquête n'a révélé aucune concentration de cas selon l'effet, l'âge ou le vaccin.
| Types de déclarations d'EIG | 2015 | Moyenne pour 2011-2014 (plage) |
|---|---|---|
| Effets systémiques | 25 | 14 (12-17) |
| Convulsions | 11 | 10 (6-13) |
| Syndrome de Guillain-Barré | 5 | 3 (0-5) |
| Encéphalite | 1 | 2 (0-2) |
| Autres troubles neurologiques | 6 | 4 (1-6) |
| Site de vaccination | 7 | 7 (2-12) |
| Anaphylaxie | 0 | 1 (1-3) |
| Autres réactions allergiques | 1 | 2 (0-4) |
| Épisode hypotonique-hyporéactif | 2 | 3 (1-6) |
| Intussusception | 0 | 1 (0-1) |
| Éruption cutanée | 1 | 1 (0-2) |
| Arthrite | 1 | 0 (0-1) |
| Thrombocytopénie | 4 | 3 (2-7) |
| Anxiété due à l'immunisation | 0 | 0 (0-1) |
| Autres événements divers | 6 | 10 (6-14) |
Figure 5 : Nombre total de déclarations d'ESSI graves reçues du 1er janvier à la fin du premier trimestre, par type d'effet indésirable : année 2015, par rapport aux quatre années précédentes
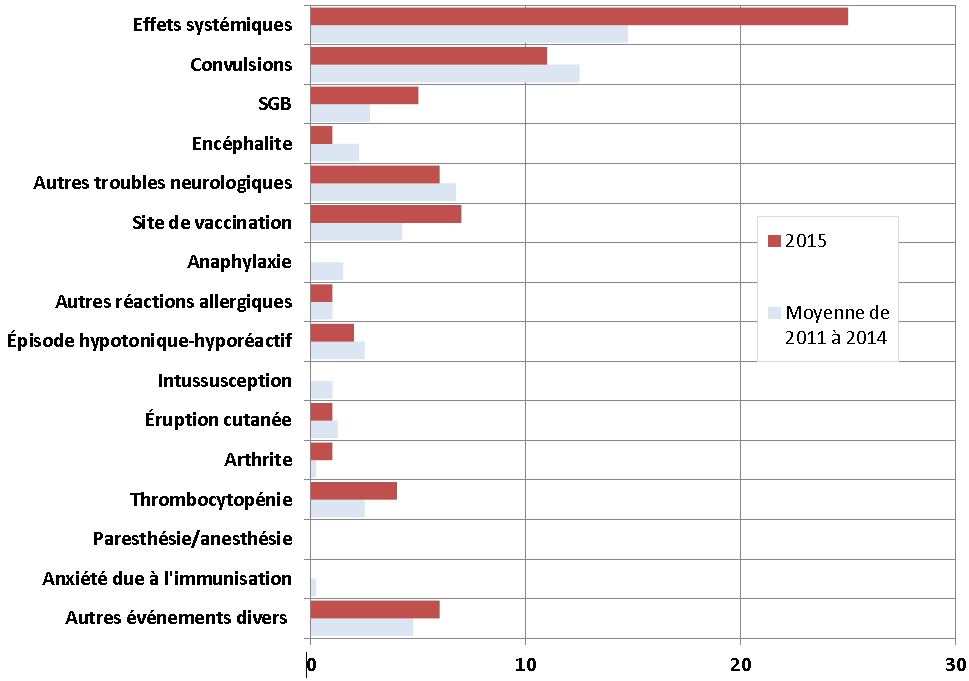
Équivalent textuel
Il s'agit d'un diagramme à barres illustrant le nombre total de déclarations d'effets secondaires suivant l'immunisation graves et précis reçues avant la fin du premier trimestre (le 31 mars) pour 2015 et la moyenne pour la période de 2011 à 2014. L'axe des y énumère les types d'effets secondaires suivant l'immunisation précis, tel qu'il est décrit ci-dessous. L'axe des x montre le nombre total de déclarations allant de 0 à 30.
Pour chaque type d'effets secondaires suivant l'immunisation précis, les nombres totaux de déclarations reçues jusqu'à la fin du premier trimestre de 2015 (barre foncée) et de 2011 à 2014 (barre pâle), respectivement, étaient les suivants : effets systémiques : 25 et 15; convulsions : 11 et 13; syndrome de Guillain-Barré : 5 et 3; encéphalite : 1 et 2; autres effets neurologiques : 6 et 7; réactions au site de vaccination ou près de ce dernier : 7 et 4; anaphylaxie : 0 et 2; autres événements allergiques : 1 et 1; épisode hypotonique-hyporéactif : 2 et 3; intussusception : 0 et 1; éruption cutanée : 1 et 1; arthrite : 1 et 0; thrombocytopénie : 4 et 3; paresthésie/anesthésie : 0 et 0; anxiété due à l'immunisation : 0 et 0; autres événements divers : 6 et 5.