Surveillance de Staphylococcus aureus résistant à la méthicilline dans les hôpitaux canadiens - Bilan du Programme canadien de surveillance des infections nosocomiales
Staphylococcus aureus résistant à la méthicilline (SARM) demeure un important pathogène nosocomial, bien que ce micro-organisme soit de plus en plus reconnu comme une cause importante d'infection d'origine communautaire dans le monde. Dans les hôpitaux sentinelles canadiens qui participent au Programme canadien de surveillance des infections nosocomiales (PCSIN), une surveillance de SARM est exercée depuis la création du programme en janvier 1995. Les premiers résultats ont déjà été publiés(1-3). Le présent rapport, qui concerne les années 1995 à 2003, fait le point sur les résultats du programme.
Méthodologie
Le PCSIN est le fruit de la collaboration d'hôpitaux disséminés un peu partout au pays qui sont membres du Comité canadien de l'épidémiologie hospitalière (sous-comité de l'Association pour la microbiologie médicale et l'infectiologie Canada) et de la Section des infections nosocomiales et professionnelles de l'Agence de la santé publique du Canada. Entre 1995 et 2003, le nombre d'hôpitaux participants est passé de 22 à 38, neuf provinces canadiennes étant représentées.
Les méthodes de surveillance employées ont déjà été décrites(3). Cette surveillance repose sur des données de laboratoire. Lorsqu'un nouveau cas d'infection à SARM est décelé chez un malade hospitalisé, on examine le dossier du patient pour recueillir des données cliniques et épidémiologiques. On utilise des définitions standard(4) pour déterminer la présence d'une infection due à SARM. La colonisation par SARM est définie comme la présence de SARM sans signes cliniques ni symptômes d'infection. On considère que l'infection à SARM a été contractée à l'hôpital si, de l'avis du professionnel en prévention des infections, il n'y a aucune preuve que l'organisme était présent au moment de l'admission à l'hôpital ou si les données montrent qu'il est probable que l'infection a été contractée au cours d'une hospitalisation antérieure. Les cas sont classés comme d'origine communautaire si rien n'indique que l'infection a été contractée à l'hôpital ou dans une maison de soins infirmiers.
Tous les isolats ont été confirmés comme étant positifs pour SARM s'ils possédaient le gène mecA mis en évidence par amplification par la polymérase (PCR)(5). La sensibilité aux antimicrobiens a été étudiée par la méthode de microdilution en bouillon conformément aux lignes directrices du National Committee for Clinical Laboratory Standards(6). Les isolats ont ensuite été caractérisés plus à fond par électrophorèse en champ pulsé (PFGE) après extraction de l'ADN et digestion par Smal(7). Les profils électrophorétiques d'ADN ont été numérisés et analysés à l'aide du logiciel Gel Compar, et les isolats possédant un profil particulier d'ADN ont été regroupés dans l'un des clones épidémiques canadiens déjà décrits ou récemment identifiés(2,8).
Résultats
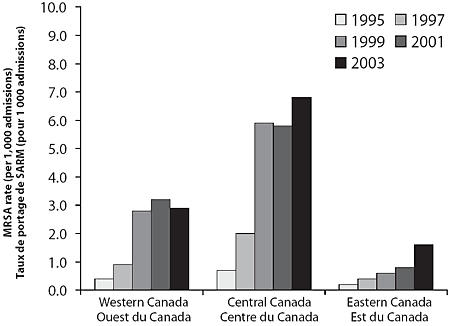
Entre 1995 et 2003, les taux de portage de SARM ont crû dans les hôpitaux membres du PCSIN, passant de 0,46 cas pour 1 000 admissions à 5,10 pour 1 000 admissions (p = 0,002) (tableau 1 et figure 1). Une bonne part de cette augmentation est survenue dans le centre du Canada (Ontario et Québec), bien qu'on ait également observé des hausses de l'incidence ailleurs au pays (figure 2).
Tableau 1. Incidence de SARM dans les hôpitaux canadiens, 1995-2003
Année |
Taux pour 100 isolats |
Taux pour 1 000 admissions |
PORTAGE DE SARM* |
||
1995 |
0,95 |
0,46 |
1996 |
1,97 |
1,07 |
1997 |
3,07 |
1,67 |
1998 |
3,90 |
2,50 |
1999 |
5,97 |
4,12 |
2000 |
6,96 |
3,87 |
2001 |
8,73 |
4,46 |
2002 |
8,62 |
4,81 |
2003 |
10,39 |
5,10 |
Infections à SARM |
||
1995 |
0,51 |
0,25 |
1996 |
0,85 |
0,46 |
1997 |
1,33 |
0,72 |
1998 |
1,52 |
0,98 |
1999 |
1,62 |
1,11 |
2000 |
1,70 |
1,09 |
2001 |
1,41 |
1,14 |
2002 |
1,71 |
1,38 |
2003 |
2,00 |
1,61 |
* infections et colonisations |
||
Figure 1. Taux de portage de SARM (infections et colonisations) dans les hôpitaux canadiens participant au PCSIN, 1995-2003
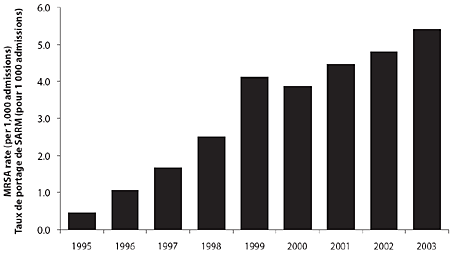
Dans l'ensemble, 57 % des patients porteurs de SARM étaient des hommes. L'âge médian était de 73 ans, et 63 % des patients avaient > 65 ans. Le tableau 2 montre les indications des cultures qui se sont par la suite révélées positives pour SARM. Entre 1995 et 2003, la proportion des cas identifiés par culture d'un échantillon prélevé pour une indication clinique (infection soupçonnée) est tombée de 71 % à 39 %, et la proportion de cas détectés à partir d'un échantillon soumis à un dépistage est passé de 20 % à 47 % (p < 0,001). En tout, 6 435 (38 %) patients étaient considérés comme atteints d'une infection à SARM. Les sièges d'infection les plus fréquents étaient la peau et les tissus mous (24 %), les voies respiratoires (23 %) et une plaie opératoire (21 %). L'infection était associée à une bactériémie dans 13 % des cas. Les taux d'infection à SARM sont passés de 0,25 à 1,61 pour 1 000 admissions entre 1995 et 2003 (p < 0,001).
Tableau 2. Indications des cultures de SARM dans les hôpitaux canadiens, 1995-2003
Raison de a culture |
Année | ||
1995 |
1999 |
2003 |
|
Indication clinique (infection soupçonnée) |
71 % |
52 % |
39 % |
Enquête sur une éclosion |
9 % |
15 % |
14 % |
Dépistage à l'admission |
0 |
19 % |
31 % |
Autre forme de dépistage |
20 % |
14 % |
16 % |
On estimait que l'infection à SARM avait été contractée dans un hôpital dans la majorité des cas (72 %), ou encore dans un établissement de soins de longue durée (7 %) ou dans la collectivité (8 %); dans 13 % des cas, la source d'infection à SARM ne pouvait être déterminée. Les taux d'infection nosocomiale à SARM ont progressé, passant de 0,91 cas pour 1 000 admissions en 1997 à 3,66 pour 1 000 admissions en 2001 et à 3,83 pour 1 000 admissions en 2003 (p < 0,001). Un lien épidémiologique entre le cas index et un autre patient dans l'hôpital touché par SARM a été établi pour un peu plus de la moitié des cas (52 %). La probabilité qu'un lien épidémiologique ait pu être identifié était plus grande en 2003 (51 %) qu'en 1995 (41 %) (p < 0,001).
L'étude de la sensibilité aux antimicrobiens de 4 033 isolats choisis au hasard entre 1995 et 2002 a mis en évidence une résistance uniforme aux antibiotiques de la famille des ß-lactamines. Les taux de résistance à d'autres agents antimicrobiens étaient les suivants : érythromycine (94 % des isolats), clindamycine (85 %), ciprofloxacine (90 %), triméthoprime-sulfaméthoxazole (46 %), tétracycline (28 %), acide fusidique (6 %), mupirocine (4 %) et rifampicine (2 %). Aucun des isolats ne présentait une sensibilité réduite à la vancomycine, mais cinq souches résistantes au linezolide (CIM = 8 µg/ml) ont été identifiées. Les isolats provenant des hôpitaux des provinces à l'ouest de l'Ontario étaient plus nombreux à être résistants à la tétracycline (63 % c. 8 %; p < 0,001) et au triméthoprime-sulfaméthoxazole (61 % c. 38 %; p < 0,001) que ceux qui ont été récupérés en Ontario, au Québec ou dans les provinces atlantiques. Les taux de résistance à la mupirocine (CIM > 128 µg/ml), qui étaient de 2 % avant 1998, ont atteint 6 % en 2002 (p < 0,001).
En tout, 4 033 isolats ont également été caractérisés par PFGE. De ce nombre, 91 % pouvaient être classés dans l'un des six clones «épidémiques» canadiens (SARMC-1, SARMC-2, etc.) (figure 3). Les clones les plus courants de SARM ont été détectés dans la plupart des régions du pays et ont été baptisés SARMC-1 (43 % des isolats) et SARMC-2 (16 % des isolats).
Figure 3. Distribution des clones épidémiques deSARM(déterminés par électrophorèse en champpulsé*) dans les hôpitaux canadiens

Analyse
La surveillance de SARM dans les hôpitaux membres du PCSIN a montré que les taux d'infection à SARM continuent de grimper dans les hôpitaux canadiens. Ils sont maintenant 10 fois plus élevés que lorsqu'une surveillance a commencé à être exercée en 1995. Ces augmentations ont été recensées dans tout le pays, bien que les taux les plus élevés soient enregistrés dans les hôpitaux du Québec et de l'Ontario. Les taux dans les provinces atlantiques demeurent faibles, mais semblent avoir crû considérablement au cours de l'année écoulée. Bien que la hausse observée du nombre d'échantillons positifs pour SARM puisse être attribuée pour une bonne part aux programmes de dépistage dans les hôpitaux, les taux d'infection à SARM ont aussi quintuplé. Les infections à SARM sont associées à une augmentation de la morbidité et de la mortalité, à un allongement de la durée d'hospitalisation et à une hausse des coûts(9,10).
Au cours des dernières années, les infections à SARM d'origine commu- nautaire sont devenues un problème de taille dans de nombreuses régions des États-Unis, étant associées à la transmission d'une souche du micro-organisme possédant une cassette chromosomique staphylococcique particulière (SCCmec type IV) et le déterminant génétique de la leucocidine de Panton-Valentine (PLV)(11). Au Canada, la plupart (environ 85 %) des infections à SARM sont encore contractées à l'hôpital, mais des souches d'origine communautaire ont été observées à l'occasion dans des hôpitaux membres du PCSIN, en particulier chez des Autochtones résidant dans les provinces de l'Ouest (données non fournies). Chez ces patients, SARM était associé à l'apparition d'infections de la peau et des tissus mous.
SARM est habituellement résistant à plusieurs classes d'antibiotiques. Les modalités thérapeutiques possibles pour la prise en charge des infections graves à SARM sont donc limitées. La vancomycine est généralement considérée comme le traitement de choix(12). À l'heure actuelle, < 3 % des infections à S. aureus dans les hôpitaux canadiens sont dues à SARM, de sorte que la vancomycine ne devrait pas être administrée systématiquement pour le traitement des infections à staphylocoque à moins qu'il n'y ait des facteurs de risque d'infection à SARM (p. ex. colonisation antérieure ou exposition connue). Cette recommandation devrait être réexaminée si les taux d'infection à SARM continuent de grimper. Il convient de noter que le nombre de cas signalés de bactériémie causée par SARM a progressé en Ontario, de telle sorte qu'en 2003, 11 % des isolats de S. aureus détectés dans des hémocultures dans la province étaient des souches de SARM(13).
Des souches de SARM présentant une sensibilité réduite aux glycopeptides ont été signalées par les États-Unis et d'autres pays, mais n'ont pas encore été détectées au Canada. On a observé cependant une augmentation de la résistance de haut niveau à la mupirocine (6 % en 2002), agent qui peut être utile pour la décolonisation des porteurs de SARM. Ces résultats semblent indiquer que la mupirocine devrait être utilisée de façon sélective (chez les patients les plus susceptibles d'en profiter) afin de prévenir une augmentation supplémentaire des taux de résistance à la mupirocine.
Bien que SARM fasse montre d'une importante diversité génétique, la caractérisation moléculaire par PFGE indique qu'il existe un nombre relativement restreint de clones épidémiques en circulation dans les hôpitaux canadiens. Bon nombre de ces clones ont déjà été décrits à l'échelle internationale(14) (tableau 3). On n'a pas encore identifié les facteurs de virulence associés à la facilité accrue de transmission des souches épidémiques de SARM.
Clones épidémiques de SARM au Canada |
Clones épidémiques de SARM aux États-Unis* |
Clones pandémiques, nomenclature |
Type MLST† |
SARMC-1 |
USA500 |
Ibériques, archaïques |
247 |
SARMC-2 |
USA100 |
NY, Japon |
5 |
SARMC-3 |
non baptisé |
Brésiliens, hongrois |
239 |
SARMC-4 |
USA200 |
EMRSA-16 |
36 |
* McDougal et coll., 200314 |
|||
Les résultats de ce programme de surveillance montrent qu'au cours de la dernière décennie, les hôpitaux canadiens n'ont qu'en partie réussi à limiter la transmission de SARM. La propagation continue de ce micro-organisme présente un risque important pour les patients et grève considérablement les ressources du système de santé. De nombreuses études ont maintenant confirmé la rentabilité des programmes de lutte qui comportent un dépistage et la prise de précautions de barrières pour empêcher la transmission par contact(15,16). Les hôpitaux devraient considérer la prévention de l'émergence et de la transmission de micro-organismes résistants aux antibiotiques et d'autres infections hospitalières comme un objectif prioritaire pour assurer la sécurité des patients et ils devraient affecter suffisamment de ressources au dépistage et à l'application d'autres mesures de prévention. Une surveillance continue est également essentielle si l'on veut suivre l'épidémiologie en constante évolution des micro-organismes antibiorésistants tels que SARM.
Références
-
Simor A, Ofner-Agostini M, Patin S et coll. The Canadian Nosocomial Infection Surveillance Program: Results of the first 18 months of surveillance for methicillin-resistant Staphylococcus aureus in Canadian hospitals. RMTC 1997;23:41-5.
-
Simor AE, Boyd D, Louie L et coll. Characterization and proposed nomenclature of epidemic strains of SARM in Canada. Can J Infect Dis 1999;10:333-6.
-
Simor AE, Ofner-Agostini M, Bryce E et coll. The evolution of methicillin-resistant Staphylococcus aureus in Canadian hospitals: 5 years of national surveillance. CMAJ 2001;165:21-6.
-
Garner JS, Jarvis WR, Emori TG et coll. CDC definitions for nosocomial infections, 1988. Am J Infect Control 1988;16:128-40.
-
Louie L, Matsumura SO, Choi E et coll. Evaluation of three rapid methods for detection of methicillin resistance in Staphylococcus aureus. J Clin Microbiol 2000;38:2170-3.
-
National Committee for Clinical Laboratory Standards. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically [approved standard M7-A6]. Sixth ed. Wayne, Pa., 2003.
-
Mulvey MR, Chui L, Ismail J et coll. Development of a Canadian standardized protocol for subtyping methicillin-resistant Staphylococcus aureus using pulsed-field gel electrophoresis. J Clin Microbiol 2001;39:3481-5.
-
Simor AE, Ofner-Agostini M, Bryce E et coll. Laboratory characterization of methicillin-resistant Staphylococcus aureus in Canadian hospitals: Results of 5 years of national surveillance, 1995-1999. J Infect Dis 2002;186:652-60.
-
Cosgrove SE, Sakoulas EN, Schwaber MJ et coll. Comparison of mortality associated with methicillin-resistant and methicillin-susceptible Staphylococcus aureus bacteremia: A meta-analysis. Clin Infect Dis 2003;36:53-9.
-
Kim T, Oh PI, Simor AE. The economic impact of methicillin-resistant Staphylococcus aureus in Canadian hospitals. Infect Control Hosp Epidemiol 2001;22:99-104.
-
Vandenesch F, Naimi T, Enright MC et coll. Community-acquired methicillin-resistant Staphylococcus aureus carrying Panton-Valentine leukocidin genes: Worldwide emergence. Emerg Infect Dis 2003;9:978-84.
-
Simor AE, Loeb M. The management of infection and colonization due to methicillin-resistant Staphylococcus aureus: A CIDS/CAMM position paper. Can J Infect Dis 2004;15:39-48.
-
McGeer A, Fleming CA, Green KA et coll. Antimicrobial resistance in Ontario - are we facing defeat? QMPLS News octobre 2004;83:1-10.
-
McDougal LK, Steward CD, Killgore GE et coll. Pulsed-field gel electrophoresis typing of oxacillin-resistant Staphylococcus aureus isolates from the United States: Establishing a national database. J Clin Microbiol 2003;41:5113-20.
-
Muto CA, Jernigan JA, Ostrowsky BE et coll. S HEA guideline for preventing nosocomial transmission of multidrug-resistant Staphylococcus aureus and Enterococcus. Infect Control Hosp Epidemiol 2003;24:362-86.
-
Boyce JM, Havill NL, Kohan C et coll. Do infection control measures work for methicillin-resistant Staphylococcus aureus? Infect Control Hosp Epidemiol 2004;25:395-401.
Source : Dr AE Simor, Sunnybrook & Women's College Health Sciences Centre, Toronto, Ont.; M Ofner-Agostini, BScN, MHSc, D Gravel, BScN, MSc, CIC; M Varia, BSc, MHSc, S Paton; MN, RN, Centre de prévention et de contrôle des maladies infectieuses, Agence de la santé publique du Canada, Ottawa; Dr A McGeer, Mount Sinai Hospital, Toronto, Ont.; Dr E Bryce, Vancouver General Hospital, Vancouver, C.-B.; Dr M Loeb, Université McMaster, Hamilton, Ont.; M Mulvey, PhD, Laboratoire national de microbiologie, Agence de la santé publique du Canada, Winnipeg, Man., pour le PCSIN.
Membres du Programme canadien de surveillance des infections nosocomiales (PCSIN) : Dre Elizabeth Bryce, Vancouver General Hospital, Vancouver, C.-B.; Dr John Conly, Foothills Medical Centre, Calgary, Alb.; Dr Gordon Dow, Hôpital de Moncton, Moncton, N.-B.; Dr John Embil, Centre des sciences de la santé, Winnipeg, Man.; Dre Joanne Embree, Centre des sciences de la santé, Winnipeg, Man.; Dr Michael Gardam, University Health Network, Toronto, Ont.; Mme Denise Gravel, Centre de prévention et de contrôle des maladies infectieuses, Agence de la santé publique du Canada; Dre Elizabeth Henderson, Peter Lougheed Centre, Calgary, Alb.; Dr James Hutchinson, Health Sciences Centre, St. John's, T.-N.; Dr Michael John, London Health Sciences Centre, London, Ont.; Dre Lynn Johnston, Queen Elizabeth II Health Sciences Centre, Halifax, N.-É.; Dre Pamela Kibsey, Victoria General Hospital, Victoria, C.-B.; Dre Joanne Langley, I.W.K. Grace Health Science Centre, Halifax, N.-É.; Dr Mark Loeb, Hamilton Health Sciences Corporation, Hamilton, Ont.; Dre Anne Matlow, Hospital for Sick Children, Toronto, Ont.; Dre Allison McGeer, Mount Sinai Hospital, Toronto, Ont.; Dre Sophie Michaud, CHUS-Hôpital Fleurimont, Sherbrooke, Qc; Dr Mark Miller, SMBD-Hôpital général juif, Montréal, Qc; Dre Dorothy Moore, Hôpital de Montréal pour enfants, Montréal, Qc; Dr Michael Mulvey, Laboratoire national de microbiologie, Agence de la santé publique du Canada; Mme Marianna Ofner-Agostini, Centre de prévention et de contrôle des maladies infectieuses, Agence de la santé publique du Canada; Mme Shirley Paton, Centre de prévention et de contrôle des maladies infectieuses, Agence de la santé publique du Canada; Dre Virginia Roth, Hôpital d'Ottawa, Ottawa, Ont.; Dr Andrew Simor, Sunnybrook and Women's College Health Sciences Centre, Toronto, Ont.; Dr Geoffrey Taylor, University of Alberta Hospital, Edmonton, Alb.; Mme Monali Varia, Centre de prévention et de contrôle des maladies infectieuses, Agence de santé publique du Canada; Dre Mary Vearncombe, Sunnybrook and Women's College Health Sciences Centre, Toronto, Ont.; Dre Alice Wong, Royal University Hospital, Saskatoon, Sask.; Dr Dick Zoutman, Kingston General Hospital, Kingston, Ont
Détails de la page
- Date de modification :