ARCHIVÉ - Surveillance accrue des méningococcies invasives au Canada :
Du 1er janvier 2004 au 31 décembre 2005
le 1er juini 2007 Volume 33 Numéro 10
La méningococcie invasive (MI) est une maladie à déclaration obligatoire à l’échelle nationale au Canada depuis 19241 . La Division de l’immunisation et des infections respiratoires du Centre de prévention et de contrôle des maladies infectieuses et le Laboratoire national de microbiologie (LNM) de l’Agence de santé publique du Canada (ASPC) publient des rapports de surveillance accrue de la méningococcie invasive depuis 19952-5. Le présent rapport fournit de l’information sur les MI pour la période allant du 1er janvier 2004 au 31 décembre 2005.
Méthodologie
Depuis le 1er janvier 2000, les cas cliniques de MI ne sont plus déclarés à l’échelle nationale. La définition de cas utilisée pour les cas signalés au cours de la période visée par le présent rapport est la suivante6 :
Cas confirmé : Maladie invasive* avec infection confirmée en laboratoire de l’une ou l’autre des façons suivantes :
isolement de Neisseria meningitidis à partir d’un prélèvement normalement stérile (sang, liquide céphalorachidien [LCR], liquide articulaire, pleural ou péricardique);
mise en évidence de l’antigène de N. meningitidis dans le LCR.
*La méningococcie invasive se présente habituellement sous forme de méningite et/ou de septicémie, quoique d’autres manifestations puissent être observées. La MI peut évoluer rapidement en purpura fulminans, et entraîner l’état de choc et le décès.
Les ministères provinciaux et territoriaux de la Santé fournissent à l’Agence de santé publique du Canada (ASPC) des données épidémiologiques non nominatives sur tous les cas de MI répondant à la définition de cas nationale. Les laboratoires provinciaux et territoriaux de santé publique et/ou d’hôpitaux font parvenir les isolats de N. meningitidis au Laboratoire national de microbiologie (LNM) à Winnipeg pour une confirmation du sérogroupe et des études bactériologiques plus poussées (sérotypage et sous-typage pour tous les isolats, et électrophorèse enzymatique multilocus pour toutes les souches appartenant au sérogroupe C). Une épreuve de compatibilité est effectuée pour relier les données épidémiologiques et les données de laboratoire. L’épreuve de compatibilité est réalisée à l’aide des variables suivantes: province/territoire, date de naissance (ou âge), sexe, date d’apparition de la maladie et sérogroupe. Les données sont entrées dans la base de données Access (v2000) et analysées à l’aide du logiciel Statistical Package for the Social Science (v12.0).
Les estimations démographiques pour les provinces et territoires, fondées sur le recensement de 20017, ont été fournies par Statistique Canada7. Ces estimations ont été utilisées pour calculer le taux d’incidence général, le taux d’incidence par groupe d’âge et le taux d’incidence par sérogroupe. Tous les taux d’incidence sont exprimés pour 100 000 habitants par année. Des tests du chi carré, des tests t ou le test H non paramétrique de Kruskal-Wallis ont été utilisés pour vérifier les associations entre les variables.
Au moment de la publication du présent rapport, l’ASPC ne disposait d’aucune méthode systématique pour recueillir de l’information sur les éclosions de MI à l’échelle nationale. Afin de décrire le nombre d’éclosions de MI au cours de la période de surveillance visée, des questionnaires électroniques ont été transmis en mai 2005 et en décembre 2006 aux responsables des MI de toutes les provinces et de tous les territoires.
Résultats
Nombre de cas
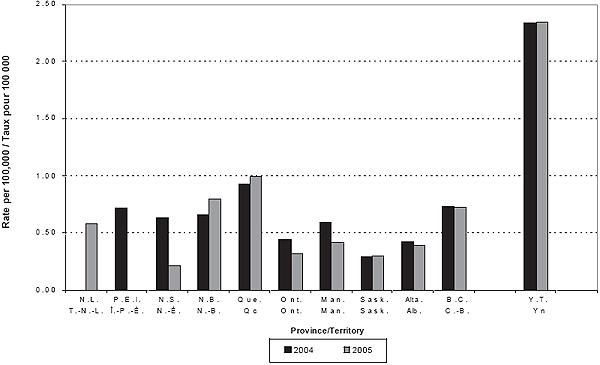
En 2004 et 2005, respectivement, les provinces et territoires ont déclaré un total de 190 et de 178 cas de MI. Quatre-vingt-dix pour cent de ces cas ont pu être appariés à des données de laboratoire, et ce, pour les deux années; respectivement 19 et 15 cas n’ont pas été appariés à des données de laboratoire. En 2004 et 2005, respectivement, le LNM a déclaré 5 et 3 cas additionnels qui n’ont pu être appariés aux cas déclarés par les provinces et territoires (3 par le Québec, 2 par l’Ontario, 1 par l’Alberta, 1 par l’Île‑du‑Prince‑Édouard et 1 par le Nouveau‑Brunswick). Par conséquent, le nombre total de cas inclus dans les rapports de 2004 et de 2005 était de 195 et de 181, respectivement. Les tableaux 1 et 2 présentent l’incidence détaillée, le taux de létalité et les données sur le sérogroupe, par groupe d’âge et par année. Les figures 1 et 2 indiquent le nombre annuel de cas et le taux d’incidence par province et par territoire pour 2004 et 2005. Ces taux peuvent être sujets à des fluctuations en raison du petit nombre de cas.
Tableau 1 : Données sur l’incidence, la létalité et le sérogroupe des cas de MI par groupe d’âge (Canada, 2004)
Groupe d’âge |
< 1 |
1-4 |
5-9 |
10-14 |
15-19 |
20-24 |
25-64 |
65+ |
Total |
Taux d’incidence général pour 100 000 habitants (nbre de cas) |
5.34 (18) |
1.97 (27) |
0.16 (3) |
0.28 (6) |
1.36 (29) |
1.12 (25) |
0.36 (64) |
0.55 (23) |
0.61 (195) |
Taux de létalité, % (nbre de cas) |
0 (0) |
3.7 (1) |
0 (0) |
16.7 (1) |
6.9 (2) |
4.0 (1) |
10.9 (7) |
21.7 (5) |
8.7 (17) |
Taux de mortalité pour 100 000 habitants |
0 |
0.07 |
0 |
0.05 |
0.09 |
0.04 |
0.04 |
0.12 |
0.05 |
Taux d’incidence du sérogroupe B pour 100 000 habitants (nbre de cas) |
3.26 (11) |
0.95 (13) |
0.05 (1) |
0.09 (2) |
0.94 (20) |
0.49 (11) |
0.12 (21) |
0.19 (8) |
0.27 (87) |
Taux d’incidence du sérogroupe C pour 100 000 habitants (nbre de cas) |
1.19 (4) |
0.44 (6) |
0.05 (1) |
0.09 (2) |
0.28 (6) |
0.45 (10) |
0.14 (24) |
0.07 (3) |
0.18 (56) |
Taux d’incidence du sérogroupe Y pour 100 000 habitants (nbre de cas) |
0 (0) |
0.22 (3) |
0.05 (1) |
0.05 (1) |
0.05 (1) |
0.09 (2) |
0.07 (12) |
0.17 (7) |
0.08 (27) |
Taux d’incidence du sérogroupe W135 pour 100 000 habitants (nbre de cas) |
0.59 (2) |
0.29 (4) |
0 (0) |
0 (0) |
0 (0) |
0.04 (1) |
0.01 (2) |
0.12 (5) |
0.04 (14) |
Nombre d’autres cas (p. ex. sérogroupes A, 29E, non groupables)* |
0 |
0 |
0 |
1 |
2 |
1 |
3 |
0 |
7 |
Nombre de cas dont le sérogroupe est manquant |
1 |
1 |
0 |
0 |
0 |
0 |
2 |
0 |
4 |
* Comprend 2 cas du sérogroupe A, 1 cas du sérogroupe 29E et 4 cas non groupables. |
|||||||||
Tableau 2 : Données sur l’incidence, la létalité et le sérogroupe des cas de MI par groupe d’âge (Canada, 2005)
Groupe d’âge |
< 1 |
1-4 |
5-9 |
10-14 |
15-19 |
20-24 |
25-64 |
65+ |
Total |
Taux d’incidence général pour 100 000 habitants (nbre de cas) |
5.03 (17) |
1.76 (24) |
0.74 (14) |
0.62 (13) |
1.21 (26) |
1.07 (24) |
0.27 (48) |
0.36 (15) |
0.56 (181) |
Taux de létalité, % (nbre de cas) |
0 (0) |
4.2 (1) |
0 (0) |
0 (0) |
7.7 (2) |
8.3 (2) |
6.3 (3) |
13.3 (2) |
5.5 (10) |
Taux de mortalité pour 100 000 habitants |
0 |
0.07 |
0 |
0 |
0.09 |
0.09 |
0.02 |
0.05 |
0.03 |
Taux d’incidence du sérogroupe B pour 100 000 habitants (nbre de cas) |
3.55 (12) |
1.17 (16) |
0.58 (11) |
0.43 (9) |
0.56 (12) |
0.40 (9) |
0.12 (22) |
0.12 (5) |
0.30 (96) |
Taux d’incidence du sérogroupe C pour 100 000 habitants (nbre de cas) |
0.30 (1) |
0.07 (1) |
0.11 (2) |
0.09 (2) |
0.28 (6) |
0.45 (10) |
0.08 (14) |
0.05 (2) |
0.12 (38) |
Taux d’incidence du sérogroupe Y pour 100 000 habitants (nbre de cas) |
0 (0) |
0.15 (2) |
0.05 (1) |
0.05 (1) |
0.33 (7) |
0.18 (4) |
0.03 (6) |
0.07 (3) |
0.07 (24) |
Taux d’incidence du sérogroupe W135 pour 100 000 habitants (nbre de cas) |
0.89 (3) |
0.29 (4) |
0 (0) |
0 (0) |
0.05 (1) |
0.04 (1) |
0.02 (3) |
0.09 (4) |
0.05 (16) |
Nombre d’autres cas (p. ex. sérogroupes, 29E, non groupables)* |
0 |
1 |
0 |
1 |
0 |
0 |
1 |
0 |
3 |
Nombre de cas dont le sérogroupe est manquant |
1 |
0 |
0 |
0 |
0 |
0 |
2 |
1 |
4 |
* Comprend 2 cas du sérogroupe 29E et 1 cas non groupable. |
|||||||||
Figure 1. Nombre de cas de MI par province/territoire et par année
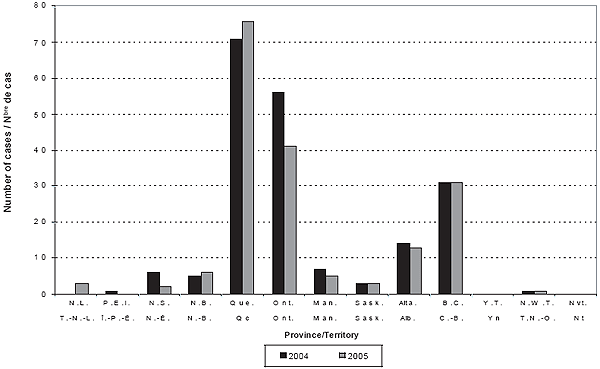
Figure 2. Incidence de la MI par province/territoire et par année
Incidence
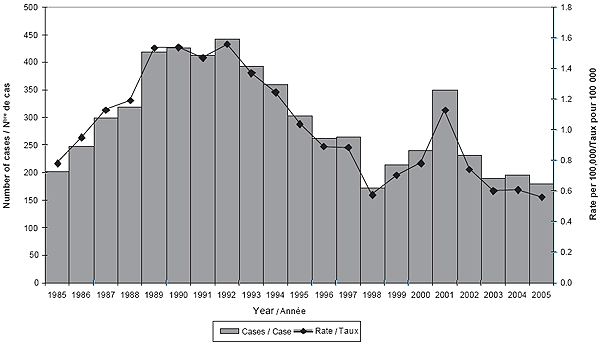
En 2004 et 2005, le taux d’incidence général de la MI était respectivement de 0,61 et de 0,56 pour 100 000 habitants. La figure 3 indique le nombre annuel de cas et les taux d’incidence depuis 1985, et illustre la nature cyclique des méningococcies.
Figure 3. Nombre de cas de MI et taux d’incidence de la MI au Canada (1985-2005)
Distribution selon l’âge et le sexe
En 2004, l’âge médian des cas de MI était de 22 ans (intervalle de 0 à 91 ans); 23 % des cas étaient âgés de moins de 5 ans, un groupe d’âge qui représente 5,3 % de la population canadienne. C’est chez les enfants que les taux d’incidence ont été les plus élevés; les bébés de moins de 1 an et les enfants de 1 à 4 ans ont connu des taux de 5,34 et de 1,97 pour 100 000 habitants, respectivement. Les adolescents de 15 à 19 ans arrivent au troisième rang, avec un taux de 1,36 pour 100 000 habitants.
En 2005, l’âge médian des cas de MI était de 19 ans (intervalle de 0 à 96 ans) et 23 % des cas étaient âgés de moins de 5 ans. Ce sont les bébés de moins de 1 an qui ont connu le taux d’incidence le plus élevé, soit 5,03 pour 100 000 habitants. Les enfants de 1 à 4 ans sont arrivés au deuxième rang, avec un taux d’incidence de 1,76 pour 100 000 habitants, tandis que les adolescents de 15 à 19 ans sont arrivés au troisième rang, avec un taux de 1,21 pour 100 000 habitants.
Les femmes ont représenté respectivement 56 % et 46 % des cas de MI en 2004 et en 2005. Aucune différence significative en ce qui concerne l’âge médian des cas n’a été observée entre les hommes et les femmes pour l’une ou l’autre de ces deux années.
Distribution saisonnière
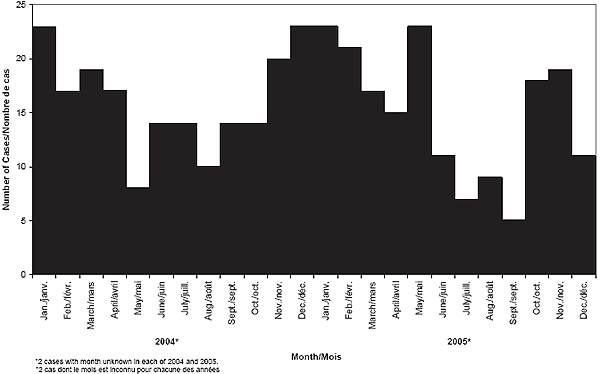
En 2004, la survenue des cas de MI a affiché une variation saisonnière typique, avec des points culminants au cours des mois d’hiver, soit de novembre à avril. Fait intéressant, les cas de MI en 2005 se sont prolongés au delà des pics hivernaux habituels, un grand nombre de cas ayant été enregistrés en mai. La figure 4 illustre la distribution des cas de MI selon la saison.
Figure 4. Distribution des cas de MI par mois (2004-2005)
Létalité et mortalité
La MI est associée à une létalité relativement élevée. Les taux de létalité étaient respectivement de 8,7 % et de 5,5 % en 2004 et en 2005 (tableau 1 et 2). L’âge médian des cas mortels était de 46 ans en 2004 et de 28 ans en 2005, et était donc supérieur à l’âge moyen de tous les cas pour chaque année respectivement. En 2004, ce sont les adultes de 65 ans et plus qui ont connu le taux de létalité le plus élevé, soit 21,7 %, suivis des enfants de 10 à 14 ans chez qui le taux était de 16,7 %; il faut cependant noter que ce taux de létalité est attribuable à un seul décès parmi le groupe d’âge, ce qui illustre l’instabilité de ces taux de létalité. En 2005, ce sont les adultes de 65 ans et plus qui ont connu le taux de létalité le plus élevé, soit 13,3 %, suivis du groupe des 20 à 24 ans chez qui le taux était de 8,3 %.
Le taux de mortalité lié à la MI était de 0,05 en 2004 et de 0,03 en 2005 (pour 100 000 habitants). En 2004, ce sont les adultes de 65 ans et plus qui ont connu le taux de mortalité le plus élevé, soit 0,12 pour 100 000 habitants. En 2005, ce sont les groupes d’âge des 15 à 19 ans et des 20 à 24 ans qui ont connu le taux de mortalité le plus élevé, soit 0,09 pour 100 000 habitants. Le taux de létalité et le taux mortalité peuvent être instables en raison du petit nombre de cas.
Sérogroupes
Les données relatives au sérogroupe étaient disponibles dans 98 % des cas confirmés, tant en 2004 (191/195) qu’en 2005 (177/181). Pour ces deux années, c’est le sérogroupe B qui a connu l’incidence la plus élevée (0,27 et 0,30 pour 100 000 habitants, respectivement). En 2004, les taux d’incidence des sérogroupes C, Y et W135 ont été respectivement de 0,18, 0,08 et 0,04 pour 100 000 habitants; en 2005, ils ont été respectivement de 0,12, 0,07 et 0,05 pour 100 000 habitants. La figure 5 illustre l’incidence annuelle des sérogroupes B, C, Y et W135 depuis 1993.
En 2004, l’âge médian des cas de MI liés aux sérogroupes B, C et Y était de 19, 23 et 49 ans, respectivement. Les âges médians étaient statistiquement différents pour ce qui est des cas liés aux sérogroupes B et Y (p=0,002) et des cas liés aux sérogroupes C et Y (p=0,008), mais pas pour ce qui est des sérogroupes B et C. En 2005, l’âge médian des cas liés aux sérogroupes B, C et Y était respectivement de 15, 22 et 22 ans. Les âges médians étaient statistiquement différents pour ce qui est des sérogroupes B et C (p=0,001) et des sérogroupes B et Y (p=0,009).
Bien qu’ils représentent 5,3 % de la population totale, les enfants de moins de 5 ans enregistrent la plus grande proportion (27,6 %) de cas liés au sérogroupe B. Ce sont les jeunes enfants qui connaissent l’incidence annuelle moyenne la plus élevée (pour 100 000 habitants) de cas liés au sérogroupe B; en 2004 et 2005, respectivement, les taux étaient de 3,26 et 3,55 dans le cas des nourrissons de moins de 1 an et de 0,95 et 1,17 dans le cas des enfants de 1 à 4 ans.
En 2004 et 2005, le taux d’incidence le plus élevé (pour 100 000 habitants) de cas liés au sérogroupe C a été enregistré chez les nourrissons de moins de 1 an (1,19 et 0,30, respectivement) et chez les adultes âgés de 20 à 24 ans (0,45 et 0,45, respectivement). Dans le cas du sérogroupe Y, le taux d’incidence annuel le plus élevé (pour 100 000 habitants) en 2004 a été enregistré chez les enfants de 1 à 4 ans (0,22) et chez les adultes de 65 ans et plus (0,17), tandis qu’en 2005, il a plutôt été enregistré chez les adolescents âgés de 15 à 19 (0,33) ans et chez les adultes de 20 à 24 ans (0,18).
Le sérogroupe C est responsable du taux de létalité le plus élevé pour ces deux années, suivi du sérogroupe B. Le taux de létalité lié aux sérogroupes C et B a été respectivement de 19,6 % et de 4,6 % en 2004, et de 10,5 % et de 6,3 % en 2005. Aucun décès lié au sérogroupe Y n’a été signalé en 2004 ou en 2005.
Sérotypes et sous-types
En 2004, sur les 72 cas liés au sérogroupe B accompagnés de données sur le sérotype, 25 % étaient du sérotype 17, 22 % étaient non sérotypables et 21 % étaient du sérotype 4. Les combinaisons de sérotype et de sous‑type les plus courantes pour ce qui est du sérogroupe B étaient B:17:P1.19 (18/72) et B:14:P1.14 (7/72). Quatre‑vingt pour cent des 46 cas liés au sérogroupe C accompagnés de données sur le sérotype étaient du sérotype 2a, et 15 % étaient non sérotypables. Les combinaisons les plus courantes en ce qui concerne le sérogroupe C étaient C:2a:P1.5 (17/46) et C:2a:P1.1,7 (13/46). Quatre‑vingt‑six pour cent des 24 cas liés au sérogroupe Y accompagnés de données sur le sérotype étaient du sérotype 14, et 29 % étaient non sérotypables. Les combinaisons de les plus courantes dans le cas du sérogroupe Y étaient Y:NT:P1.5 (5/24) et Y:14:P1.- (5/24).
En 2005, sur les 81 cas liés au sérogroupe B accompagnés de données sur le sérotype, 26 % étaient non sérotypables, 22 % étaient du sérotype 17 et 22 % étaient du sérotype 4. Les combinaisons de sérotype et de sous‑type les plus courantes en ce qui concerne les cas liés au sérogroupe B étaient B:17:P1.19 (18/81) et B:4:P1.4 (9/81). On disposait des données relatives au sérotype pour 36 des 38 cas liés au sérogroupe C (95 %). Parmi ces cas, 83 % étaient du sérotype 2a et 8 % étaient non sérotypables. Les combinaisons les plus courantes en ce qui concerne les cas liés au sérogroupe C étaient C:2a:P1.5 (11/36) et C:2a:P1.1,7 (10/36). Quarante‑huit pour cent des 21 cas liés au sérogroupe Y accompagnés de données sur le sérotype étaient du sérotype 14 et 33 % étaient du sérotype 2c. Les combinaisons les plus courantes en ce qui concerne les cas liés au sérogroupe Y étaient Y:14:P1.2,5 (6/21) et Y:2c:P1.2,5 (4/21).
Typage par électrophorèse enzymatique multilocus
Le LNM effectue un typage par électrophorèse enzymatique multilocus (EEML) des isolats du sérogroupe C reçus des provinces et territoires. En 2004, 70 % (39/56) des isolats du sérogroupe C provenant des cas de MI dont on disposait pour le typage par EEML appartenaient au clone hypervirulent ET-37, et tous étaient la variante ET-15. En ce qui concerne les isolats du sérogroupe C, 25 % (14/56) n’étaient pas accompagnés de données relatives au profil ET, 5 % (3/56) n’appartenaient ni à la variante ET-15 ni à d’autres membres du complexe clonal ET-37. En 2005, 68 % (26/38) des souches du sérogroupe C provenant de cas de MI dont on disposait pour le typage par EEML appartenaient au clone hypervirulent ET-37, dont 92 % (24/26) étaient la variante ET-15. On ne disposait pas de données sur le profil ET pour 29 % (11/38) des isolats.
Éclosions
Les treize provinces et territoires ont répondu à des questionnaires électroniques sur les éclosions de MI. Les résultats de l’enquête indiquent qu’il y a eu deux éclosions de MI au Canada entre le 1er janvier 2004 et le 31 décembre 2005. Les deux éclosions se sont produites dans la collectivité et mettaient en cause des méningocoques du sérogroupe C (sous‑type 2a, P1.5).
Une éclosion en Colombie‑Britannique touchant les hommes ayant des relations sexuelles avec d’autres hommes (HRSH) s’est déclarée en septembre 2004. Il y a eu 9 cas confirmés d’infection à méningocoque C (5 décès) et 1 cas confirmé de MI non typable (aucun décès). Tous les cas vivaient près de la vallée du Bas‑Fraser (Vancouver) ou avaient visité cette région. En réponse à l’éclosion, environ 8 000 doses de vaccin conjugué contre le méningocoque C ont été distribuées dans le cadre d’une campagne de vaccination ciblant les hommes gais et bisexuels de la province. L’éclosion a été déclarée terminée en août 2005 (Dr D. Patrick, British Columbia Centre for Disease Control, Vancouver : communication personnelle, décembre 2006).
L’éclosion liée au sérogroupe C à Moncton, au Nouveau‑Brunswick, est survenue entre mars et mai 2005. Elle a touché des personnes de 10 à 19 ans, dont 2 cas confirmés (1 décès). Dans le cadre de la stratégie de prévention et de lutte, un programme de vaccination antiméningococcique ciblant les personnes de la cinquième année jusqu’à l’âge de 19 ans a été mis en oeuvre. Au total, 15 993 doses de vaccin conjugué contre le méningocoque C ont été distribuées (X. Teng, ministère de la Santé du Nouveau‑Brunswick, Fredericton : communication personnelle, décembre 2006).
Analyse
Réaction en chaîne de la polymérase
On utilise de plus en plus la technique de la réaction en chaîne de la polymérase (PCR) comme méthode laboratoire alternative afin de détecter N. meningitidis. Bien que certaines provinces et certains territoires utilisent des techniques de PCR pour diagnostiquer la MI, les cas diagnostiqués à l’aide de cette méthode n’ont pas répondu à la définition de cas en 2004 et en 2005, et n’ont pas été intégrés aux données nationales. La définition de cas nationale a été modifiée en 2005 et comprend maintenant l’analyse par PCR. La définition de cas est la suivante depuis le 1er janvier 20068 :
Cas confirmé : Maladie invasive* avec infection confirmée en laboratoire de l’une ou l’autre des façons suivantes :
- isolement de Neisseria meningitidis à partir d’un prélèvement normalement stérile (sang, liquide céphalorachidien [LCR], liquide articulaire, pleural ou péricardique);
- mise en évidence de l’ADN de N. meningitidis au moyen d’un test des acides nucléiques (TAN)† convenablement validé et effectué à partir d’un échantillon normalement stérile.
Cas probable : Maladie invasive* accompagnée de purpura fulminans ou de pétéchies, sans autre cause apparente :
- pour laquelle une analyse a permis de mettre en évidence l’antigène de N. meningitidis dans le LCR; ou
- pour laquelle on n’est pas parvenu à isoler N. meningitidis ni à mettre en évidence l’ADN de N. meningitidis au moyen d’un TAN† convenablement validé et effectué à partir d’un échantillon normalement stérile.
*La méningococcie invasive se présente habituellement sous forme de méningite et/ou de septicémie, quoique d’autres manifestations puissent être observées. La MI peut évoluer rapidement en purpura fulminans, et entraîner l’état de choc et le décès. †Chaque province et territoire adoptera un processus de validation applicable au TAN mis en place.
Sérogroupes
Comme l’illustre la figure 5, il y a eu au fil du temps beaucoup de fluctuations en ce qui concerne les infections liées au sérogroupe C, ces dernières ayant culminé pour la dernière fois entre 2000 et 2001. La fluctuation a été moindre dans le cas des infections liées au sérogroupe B, ces dernières ayant tendance à prédominer pendant les années où aucune éclosion n’est enregistrée. Le sérogroupe B est le sérogroupe le plus courant au Canada depuis 2002. L’incidence du sérogroupe Y est demeurée relativement stable au Canada entre 1995 et 2005; les sérogroupes A et W135 sont tous deux rarement déclarés au Canada.
Figure 5. Incidence de la MI, sérogroupes B, C, Y et W135 (1993-2005, Canada)
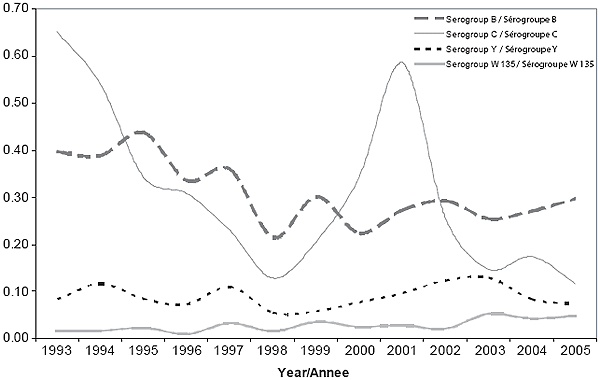
Les taux d’incidence du sérogroupe B observés en 2004 et en 2005 étaient comparables au taux annuel moyen enregistré entre 1993 et 2003 (0,32 pour 100 000 habitants). Depuis 2001, l’âge médian annuel des cas liés au sérogroupe B se situe chez les adolescents, ce qui représente une hausse par rapport à 1999 (4 ans) et à 2000 (5 ans)4,5. Malgré tout, l’incidence selon l’âge demeure plus élevée chez les nourrissons. Le méningocoque du sérogroupe B responsable de la maladie était génétiquement hétérogène dans la plupart des régions en 2004 et en 2005. Toutefois, une grappe de cas causée par un clone du méningocoque ST-269 appartenant au sérogroupe B (sérotype 17:P1.19) a été relevée dans une région du Québec entre octobre 2004 et mars 2005. L’analyse rétrospective a révélé que le clone est apparu pour la première fois dans la province en 20039. En 2004-2005, cette souche du sérogroupe B était la plus courante au Québec, mais elle n’a pas été détectée dans d’autres provinces et territoires au cours de la période de surveillance visée. Parmi tous les cas liés au sérogroupe B, c’est pour ce clone que la proportion de cas âgés de moins de 5 ans était la plus faible (32,7 % et 11,1 %, respectivement; p=0,01). Aucune autre différence significative n’a été décelée entre les cas liés à ce clone et tous les autres cas liés au sérogroupe B, pour ce qui est de la distribution selon le sexe ou de l’issue.
Le sérogroupe C a connu le deuxième taux d’incidence le plus élevé, des éclosions causées par la souche C:2a:P1.5 ayant été déclarées dans deux provinces en 2004 et en 2005. La souche associée à l’éclosion parmi les HRSH en Colombie‑Britannique s’est avérée avoir le même profil d’électrophorèse en champ pulsé que la souche responsable d’une éclosion parmi des adolescents d’Abbottsford (C.‑B.) en 200110.
L’incidence du sérogroupe Y a été légèrement plus faible en 2004 et 2005 qu’en 2001, 2002 et 2003 (0,10, 0,12 et 0,13 pour 100 000 habitants, respectivement). Cela donne à penser que la tendance à la hausse relevée précédemment en ce qui concerne le sérogroupe Y, en particulier en Ontario11, était peut‑être attribuable à la nature cyclique de la maladie plutôt qu’à un changement épidémiologique; une surveillance continue est toutefois nécessaire.
La proportion des cas déclarés pour lesquels on dispose des données sur le sérogroupe a augmenté au fil du temps, passant de 60 % en 1985, à 88 % en 1992 et à 98 % en 2005. Il y a eu 4 cas non groupables en 2004 et 1 cas non groupable en 2005. Un de ces cas, une jeune fille de 13 ans de la Colombie‑Britannique qui était par ailleurs en bonne santé, a été décrit récemment par Hoang et coll 12. Les méthodes de sérogroupage traditionnelles ont produit des résultats négatifs, mais le recours à des méthodes moléculaires additionnelles a permis de confirmer l’identité de la bactérie, soit une souche acapsulaire de N. meningitidis contenant le locus de la capsule nul (capsule null locus ou cnl) (souche cnl, sérotype 15, ST-198). Les souches non capsulées de N. meningitidis sont généralement présentes chez les porteurs. Il s’agissait du premier cas déclaré de méningococcie mortelle causée par une souche non capsulée contenant le locus de la capsule nul isolée à partir d’un échantillon provenant d’un hôte immunocompétent.
Programmes de vaccination
L’usage du vaccin conjugué contre le méningocoque C (men-C C) a été approuvé au Canada en 2001. Le Comité consultatif national de l’immunisation (CCNI) recommande la vaccination de tous les enfants de moins de 5 ans, des adolescents et des jeunes adultes13. Des programmes de vaccination systématique contre le méningocoque C à différents âges ont maintenant été adoptés partout au Canada : 2 provinces/territoires en 2002, 3 en 2003, 5 en 2004, 2 en 2005 et 1 en 200714.
La Conférence nationale de concertation sur les maladies évitables par la vaccination a eu lieu à Québec, du 12 au 14 juin 2005. Parmi les participants se trouvaient des représentants des gouvernements fédéral, provinciaux et territoriaux, des experts internationaux et des représentants de groupes non-gouvernementaux clés. Des groupes de travail s’intéressant à des maladies en particulier se sont penchés sur les données probantes actuelles, ont relevé les principaux enjeux et ont établi des objectifs nationaux et des recommandations en ce qui concerne la réduction de l’incidence de la maladie et les cibles de couverture vaccinale, lesquels ont été votés en séance plénière. En ce qui concerne la méningococcie invasive, l’objectif proposé est de réduire par la vaccination le nombre de cas et de décès attribuables au sérogroupe C. Les recommandations exprimées sont notamment les suivantes :
- Prévenir les éclosions de N. meningitidis du sérogroupe C chez les personnes âgées de moins de 25 ans d’ici 2015.
- Atteindre une réduction soutenue de 90 % de l’incidence de N. meningitidis du sérogroupe C chez les enfants de moins de 5 ans d’ici 2010.
- Atteindre une réduction soutenue de 95 % de l’incidence de N. meningitidis du sérogroupe C chez les adolescents âgés de 12 à 19 ans d’ici 2010.
- Atteindre une réduction soutenue de 70 % de l’incidence de N. meningitidis du sérogroupe C au Canada d’ici 2010.
- Atteindre et maintenir une couverture vaccinale adaptée à l’âge pour le vaccin conjugué contre le méningocoque du groupe C de 100 % chez les contacts étroits des cas de N. meningitidis du sérogroupe C d’ici 2010.
- Atteindre et maintenir une couverture vaccinale adaptée à l’âge pour le vaccin conjugué contre le méningocoque du groupe C de 95 % dans les groupes à risque élevé de contracter N. meningitidis du sérogroupe C.
- Atteindre et maintenir une couverture vaccinale adaptée à l’âge pour le vaccin conjugué contre le méningocoque du groupe C de 97 % chez les enfants avant leur 2e anniversaire d’ici 2010.
- Atteindre et maintenir une couverture vaccinale adaptée à l’âge pour le vaccin conjugué contre le méningocoque du groupe C de 90 % chez les adolescents avant leur 17e anniversaire d’ici 2012.
L’incidence moyenne du sérogroupe C au cours de la période de référence (1995-2001) et de la phase de mise en oeuvre du programme d’immunisation (2002-2005) a été respectivement de 0,31 et de 0,18 pour 100 000, ce qui représente une diminution de 43 % entre ces deux périodes. Les résultats initiaux donnent à penser que la recommandation nationale visant à réduire de façon durable l’incidence des cas attribuables au sérogroupe C d’ici 2010 pourrait être réalisable par la mise en place complète de programmes de vaccination systématique au Canada. On ignore toutefois si cette diminution est attribuable aux programmes universaux, aux campagnes de vaccination de masse mises en oeuvre pendant les éclosions ou à la nature cyclique de la MI; des données de surveillance accrues portant sur davantage d’années sont nécessaires.
Limites
Des déclarations étaient incomplètes, certains éléments de données ayant été omis, notamment : date de naissance (40 % d’omission), géo-références (6 % d’omission) et diagnostic clinique (68 % d’omission). L’information relative à l’état vaccinal était manquante dans 32 % des cas, et, lorsque cette information était fournie, les données n’avaient pas été consignées de façon uniforme (p. ex., oui/non; complète/incomplète pour l’âge). La consignation complète et uniforme des éléments de données est importante afin de surveiller les changements touchant l’épidémiologie de la maladie.
On ignore dans quelle mesure il y a eu sous‑déclaration. Toutefois, 2 % des cas confirmés de MI ont été déclarés par le LNM et n’ont pu être appariés à des rapports épidémiologiques provenant des provinces et territoires, ce qui offre une estimation minimale de l’importance de la sous‑déclaration. Les données épidémiologiques relatives à ces cas sont soit tirées de la demande d’analyse en laboratoire, soit manquantes. Depuis le 1er janvier 2006, les cas probables doivent être déclarés à l’échelle nationale(8). Le fait d’inclure les cas probables aura pour effet d’augmenter la sensibilité de la surveillance accrue de la MI. En raison de l’instabilité des résultats fondés sur de petits nombres de cas, il faut faire preuve de prudence au moment d’interpréter les résultats présentés dans ce rapport.
Remerciements
Nous souhaitons remercier nos collègues des ministères provinciaux et territoriaux de la Santé pour les données épidémiologiques qu’ils nous ont fournies, ainsi que les laboratoires de santé publique et les laboratoires hospitaliers du Canada qui ont envoyé des isolats au Laboratoire national de microbiologie pour que soient menées des études plus poussées. Nous tenons aussi à remercier Dennis Law, Jan Stoltz et Averil Henderson pour l’expertise technique qu’ils ont mise à profit dans la conduite des analyses de laboratoire effectuées à partir des isolats remis au Laboratoire national de microbiologie.
-
Agence de santé publique du Canada. Maladies à déclaration obligatoire en direct. <http://dsol-smed.phac-aspc.gc.ca/dsol-smed/ndis/index_f.html>.
-
Deeks S, Kertesz D, Ryan A et coll. Surveillance de la méningococcie invasive au Canada, 1995-1996. RMTC 1997;23(16):121-25.
-
Squires SG, Pelletier L, Mungai M et coll. Les méningococcies invasives au Canada, du 1er janvier 1997 au 31 décembre 1998. RMTC 2000;26(21):177-82.
-
Squires SG, Deeks SL, Tsang RSW. Surveillance accrue des méningococcies invasives au Canada : du 1er janvier 1999 au 31 décembre 2001. RMTC 2004;30(3): 17-28.
-
Watkins KW, Deeks SL, Medaglia A, Tsang RSW. Surveillance accrue des méningococcies invasives au Canada : 1er janvier 2002 au 31 décembre 2003. RMTC 2006;32(8): 97-107.
-
Agence de santé publique du Canada. Définitions de cas des maladies faisant l’objet d’une surveillance nationale. RMTC 2000;26S3:49.
-
Statistique Canada. Estimations de la population, estimations postcensitaires révisées pour 2004 et 2005. Ottawa : Division de la démographie, Statistique Canada.
-
Agence de santé publique du Canada. Lignes directrices pour la prévention et la lutte contre les atteintes méningococciques. RMTC 2005;31S1:1-20.
-
Law DKS, Lorange M, Ringuette L et coll. Invasive meningococcal disease in Québec, Canada, due to an emerging clone of ST-269 serogroup B meningococci with serotype antigen and serosubtype antigen P1.19 (B:17:P1.19). J Clin Microbiol 2006;44:2743-49.
-
David ST, Gilbert M, Patrick DM et coll. Outbreak of Neisseria meningitidis serogroup C in men who have sex with men, British Columbia. Journal canadien des maladies infectieuses et de la microbiologie médicale 2005;16:124 [P1.15].
-
Tsang RSW, Squires SG, Zollinger WD et coll. La distribution des sérogroupes de Neisseria meningitidis et la caractérisation antigénique des méningocoques de sérogroupe Y au Canada, entre le 1er janvier 1999 et le 30 juin 2001. Journal canadien des maladies infectieuses 2002;13:391-96.
-
Hoang LMN, Thomas E, Tyler S et coll. Rapid and fatal meningococcal disease due to a strain of Neisseria meningitidis containing the capsule null locus. Clin Infect Dis 2005;40:e38-42.
-
Vaccin contre le méningocoque. Dans : Comité consultatif national de l’immunisation. Guide canadien d’immunisation. 7e éd. Ottawa : Agence de santé publique du Canada, 2006:279-93. Catalogue no HP40-3/2006F.
-
Agence de santé publique du Canada. Programmes d’immunisation provinciaux et territoriaux. <http://www. phac-aspc.gc.ca/im/ptimprog-progimpt/index_f.html>.
Source : C Navarro, M.Sc., SL Deeks, M.D., M.H.Sc., A Medaglia, Division de l’immunisation et des infections respiratoires, Centre de prévention et de contrôle des maladies infectieuses, Agence de santé publique du Canada, Ottawa (Ontario). RSW Tsang, M.Med.Sc, Ph.D., Division des infections du système nerveux central, Laboratoire national de microbiologie, Agence de santé publique du Canada, Winnipeg (Manitoba).
Détails de la page
- Date de modification :
