Déclaration supplémentaire du Comité consultatif national sur l’immunisation

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 46–10 : Biosécurité en Laboratoire
Date de publication : 1er octobre 2020
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 46–10, le 1er octobre 2020 : Biosécurité en Laboratoire
Déclaration du comité consultatif
Résumé de la déclaration supplémentaire du CCNI sur les vaccins antigrippaux issus de cultures cellulaires de mammifères
Angela Sinilaite1, Ian Gemmill2,3, Robyn Harrison4,5 au nom du Comité consultatif national de l’immunisation (CCNI)
Affiliations
1 Centre de l’immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, Ottawa, ON
2 Président du Groupe de travail sur l’influenza du CCNI
3 Université Queen’s, Kingston, ON
4 Vice-président du Groupe de travail sur l’influenza du CCNI
5 Université de l’Alberta; Services de santé Alberta, Edmonton, AB
Correspondance
Citation proposée
Sinilaite A, Gemmill I, Harrison R au nom du Comité consultatif national de l’immunisation (CCNI). Résumé de la déclaration supplémentaire du CCNI sur les vaccins antigrippaux issus de cultures cellulaires de mammifères. Relevé des maladies transmissibles au Canada 2020;46(10):366–75. https://doi.org/10.14745/ccdr.v46i10a03f
Mots-clés : Comité consultatif national de l’immunisation, CCNI, mammifères, culture cellulaire, MDCK, vaccin antigrippal
Résumé
Contexte : La technologie de culture de cellules de mammifères est une technique novatrice pour la fabrication de vaccins antigrippaux qui pourrait être une solution très utile pour éliminer certains problèmes et certaines faiblesses qui sont associés à la production de vaccins antigrippaux à base d’œufs. FlucelvaxMD Quad (Seqirus, Inc.) est le premier et le seul vaccin antigrippal quadrivalent inactivé et sous-unitaire issu de cultures cellulaires de mammifères (VII4-cc) dont l’utilisation est autorisée chez les adultes et les enfants au Canada. Le Comité consultatif national de l’immunisation (CCNI) n’a jamais formulé de recommandation sur les vaccins antigrippaux issus de cultures cellulaires dans aucune population.
Objectifs : Examiner les données disponibles sur les données probantes dont on dispose sur l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité du VII4-cc, et résumer la recommandation du CCNI concernant l’utilisation de Flucelvax Quad au Canada chez les adultes et les enfants.
Méthodes : Une revue systématique de la littérature sur l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité du VII4-cc chez les personnes âgées de quatre ans et plus a été réalisée. La méthode d’examen systématique a été précisée a priori dans un protocole écrit. Le processus fondé sur des données probantes du CCNI a été utilisé pour évaluer la qualité des études admissibles, résumer et analyser les résultats et élaborer une recommandation concernant l’utilisation du Flucelvax Quad chez les adultes et les enfants. La recommandation proposée a ensuite été examinée et approuvée par le CCNI à la lumière des données probantes disponibles.
Résultats : Treize études admissibles ont été incluses dans la synthèse des données probantes. Dans les quatre études d’observation qui ont évalué l’efficacité réelle du VII4-cc, certaines données indiquent une protection potentiellement améliorée contre la grippe par rapport aux vaccins antigrippaux quadrivalents inactivés classiques à base d’œufs (VII4) ou au vaccin antigrippal trivalent inactivé (VII3), en particulier contre l’infection par le virus de la grippe A(H3N2). Il a également été démontré que le vaccin VII4-cc pourrait être plus efficace que les vaccins antigrippaux trivalents ou quadrivalents à base d’œufs contre les affections liées à la grippe non confirmées en laboratoire. Cependant, on ne dispose pas de données suffisantes sur les affections liées à la grippe confirmées en laboratoire. Deux essais contrôlés randomisés ont évalué l’immunogénicité et l’innocuité du VII4-cc par rapport au vaccin antigrippal trivalent inactivé, sous-unitaire, issu de cultures cellulaires de mammifères (VII3-cc). Le VII4-cc a été bien toléré et les réactions indésirables locales et systémiques signalées étaient généralement d’intensité légère à modérée, disparaissaient spontanément et n’entraînaient pas de séquelles. Un examen clinique de cas et six essais contrôlés randomisés révisés par des pairs (quatre chez des adultes et deux chez des enfants) qui ont produit un rapport sur l’innocuité du IIV3-cc ont été inclus dans l’examen. Les données sur l’immunogénicité et l’innocuité étaient uniformes dans toutes ces études et ont montré qu’il n’y avait pas de différence significative entre les adultes et les enfants de quatre ans et plus qui avaient reçu le VII3-cc ou un VII3 à base d’œufs.
Conclusion : Le CCNI a conclu qu’il existe des données probantes passables (données probantes de catégorie B) que Flucelvax Quad est efficace, sûr d’emploi et a une immunogénicité non inférieure à celle des vaccins comparables, d’après des données probantes directes recueillies chez des adultes et des enfants de neuf ans et plus. Le CCNI recommande que le Flucelvax Quad puisse être envisagé, en tant que vaccin quadrivalent contre la grippe, chez les adultes et les enfants âgés de neuf ans et plus (recommandation discrétionnaire du CCNI).
Introduction
La production d’un vaccin antigrippal utilisant la technologie de culture de cellules de mammifères est une technique novatrice qui permet d’améliorer l’évolutivité et la stérilité des processus de fabrication. Il s’agit donc d’une solution qui pourrait se révéler très utile pour éliminer certains problèmes et certaines faiblesses qui sont associés à la production de vaccins à base d’œufsNote de bas de page 1Note de bas de page 2Note de bas de page 3Note de bas de page 4. Lorsqu’ils sont cultivés dans des œufs, les virus de la grippe A(H3N2) peuvent subir une dérive antigénique les distinguant des virus circulants de type sauvage, et certaines mutations adaptatives survenues lors de la culture sur des œufs peuvent nuire à l’immunogénicité, à l’efficacité potentielle et à l’efficacité réelle des vaccins antigrippaux standard à base d’œufs, surtout pendant les saisons grippales dont le virus dominant est le virus de type A(H3N2)Note de bas de page 4Note de bas de page 5Note de bas de page 6Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10. Les vaccins antigrippaux issus de cultures cellulaires qui sont uniquement dérivés de virus vaccinaux candidats (VVC) issus de cultures cellulaires ne subissent pas les modifications adaptatives propres à la production en culture sur des œufs. De plus, pendant certaines saisons, ils peuvent conférer une meilleure protection que les vaccins antigrippaux à base d’œufs standardNote de bas de page 1Note de bas de page 4Note de bas de page 5. Flucelvax Quad (Seqirus, Inc.) est le premier et le seul vaccin antigrippal quadrivalent inactivé et sous-unitaire issu de cultures cellulaires de mammifères (VII4-cc) disponible à être autorisé au Canada chez les adultes et les enfants de neuf ans et plusNote de bas de page 11. Depuis que le vaccin est disponible, la formulation quadrivalente de Flucelvax (autorisée sous le nom de Flucelvax Quadrivalent ou FlucelvaxMD Tetra dans d’autres pays) est fabriquée au moyen de virus propagés dans des lignées cellulaires de mammifères (cellules rénales canines Madin-Darby [MDCK] 33016-PF) et adaptés de manière à pouvoir croître en suspension dans un milieu de culture. Toutefois, avant la saison grippale 2019 à 2020, certains des VVC fournis au fabricant avaient été initialement dérivés d’œufs. La formulation quadrivalente de Flucelvax pour la saison grippale 2019 à 2020 a été la première à être fabriquée à l’aide des VVC pour les quatre virus de la grippe qui ont été dérivés uniquement de lignées cellulaires de mammifères, de l’isolation initiale du virus à la fabrication complète du vaccin, ce qui rend le vaccin sans œufNote de bas de page 2.
Le Comité consultatif national de l’immunisation (CCNI) n’a jamais formulé de recommandation sur les vaccins antigrippaux issus de cultures cellulaires dans aucune population. L’objectif de cette déclaration du Comité consultatif est d’examiner les données probantes sur l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité disponibles pour Flucelvax Quad, et de fournir aux autorités sanitaires provinciales et territoriales et aux professionnels de la santé des conseils sur son utilisation chez les adultes et les enfants.
Méthodes
Une revue systématique de la littérature sur l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité du VII4-cc chez les personnes âgées de quatre ans et plus a été réalisée. L’utilisation des vaccins antigrippaux issus de cultures cellulaires de mammifères chez les adultes et les enfants de quatre ans ou plus ont été approuvés par la Food and Drug Administration des États-Unis depuis la saison grippale 2013 à 2014 et les données sur l’efficacité réelle, l’immunogénicité et l’innocuité des six dernières années sont actuellement disponibles pour ce groupe d’âge.
La méthodologie d’examen systématique a été précisée a priori dans un protocole écrit qui comprenait les questions d’analyse, la stratégie de recherche, les critères d’inclusion et d’exclusion et l’évaluation de la qualité. Le Groupe de travail sur l’influenza du CCNI a examiné et approuvé le protocole. Une stratégie de recherche fondée sur cet objectif a été élaborée en collaboration avec un bibliothécaire de la Bibliothèque de la santé de Santé Canada et de l’Agence de la santé publique du Canada. Les recherches ont été limitées aux études de recherche principales et aux études de cas publiés en anglais ou en français, dans les bases de données électroniques Embase, MEDLINE, Scopus, ProQuest Public Health et ClinicalTrials.gov depuis leur création jusqu’au 12 février 2019. Les essais cliniques enregistrés et la littérature grise des autorités internationales de santé publique et des Groupes techniques consultatifs nationaux pour la vaccination ont également été pris en compte.
Deux évaluateurs ont examiné indépendamment les titres et les résumés ainsi que les articles en texte intégral admissibles.
Les études retenues devaient satisfaire aux critères suivants :
- Population ou sous-population à l’étude comprenant des personnes âgées de quatre ans et plus
- Études évaluant l’efficacité potentielle et l’efficacité réelle, l’immunogénicité ou l’innocuité de Flucelvax Quad, ou l’innocuité de Flucelvax
- Études de recherche principales tirées de la littérature scientifique revue par des pairs
- Études de cas et série de cas
- Essais cliniques enregistrés et littérature grise des autorités internationales de santé publique
- Études publiées en anglais ou en français
Toute étude remplissant un ou plusieurs des critères suivants était exclue :
- Études ne présentant aucune donnée sur : l’efficacité potentielle, l’efficacité réelle, l’immunogénicité ou l’innocuité de Flucelvax Quad, ou sur l’innocuité de Flucelvax
- Études publiées dans une autre langue que l’anglais ou le français
- Études ne portant pas sur des humains ou études in vitro
- Articles non tirés d’études de recherche principales
- Éditoriaux, articles d’opinion, commentaires ou reportages
- Études économiques, lignes directrices de pratique clinique, conférences de concertation, rapport d’évaluation des technologies de la santé
- Thèses de doctorat, mémoires de maîtrise ou résumés de conférence
Flucelvax Quad possède des composantes communes à celles de Flucelvax, qui est un vaccin antigrippal trivalent sur culture cellulaire (VII3-cc) et qui est produit à l’aide de la même plateforme de fabrication de MDCKNote de bas de page 12Note de bas de page 13. Par conséquent, les études évaluant l’innocuité de Flucelvax ont également été incluses dans cet examen de la littérature a posteriori afin de compléter la base de données probantes sur les résultats d’innocuité. Les vaccins trivalents de spécialité (i.e. le [VII3-HD] et le vaccin trivalent inactivé contre l’influenza avec adjuvant [VII3-Adj]) ont aussi été ajoutés à titre de comparateurs a posteriori, car ces comparaisons auraient été exclues, à l’origine, puisqu’il n’existe actuellement aucune préparation quadrivalente comparable à ces vaccins.
Les données des études incluses ont été extraites dans des tableaux de données probantes à l’aide d’un modèle d’extraction des données mis à l’essai. La qualité (validité interne) des études incluses a été évaluée à l’aide des critères définis par Harris et al.Note de bas de page 14. L’extraction des données et l’évaluation de la qualité ont été effectuées par un examinateur et vérifiées par un deuxième examinateur. Les résultats des études incluses ont été synthétisés de manière narrative et analysés selon le processus fondé sur des données probantes du CCNINote de bas de page 15 afin d’élaborer une nouvelle recommandation. Après un examen approfondi des données probantes, le CCNI a approuvé la recommandation.
Résultats
L’examen systématique a permis de récupérer 827 articles uniques, dont 13 ont été retenus pour l’extraction et l’analyse des données. Quatre études ont fait état de l’efficacité réelle du VII4-cc. Deux études évaluées par des pairs (une chez les adultes et une chez les enfants) se sont penchées sur l’immunogénicité et l’innocuité du VII4-cc. Aucune étude évaluant l’immunogénicité de Flucelvax Quad par rapport au VII à base d’œufs (trivalent ou quadrivalent) n’a été identifiée. Un examen clinique de cas et six essais contrôlés randomisés évalués par des pairs (quatre chez les adultes et deux chez les enfants) ont fourni des données probantes de l’innocuité du VII3-cc. Aucune étude sur l’efficacité potentielle du VII4-cc n’a été repérée et les études évaluant l’efficacité potentielle du IIV3-cc n’entraient pas dans le cadre de l’examen systématique. Un diagramme du processus de sélection des études est présenté à la figure 1. Les principales caractéristiques de l’étude sont résumées dans le tableau 1 et le tableau 2.
Figure 1 : Diagramme PRISMA de processus de sélection des études pour l’examen systématique sur l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité de Flucelvax Quad
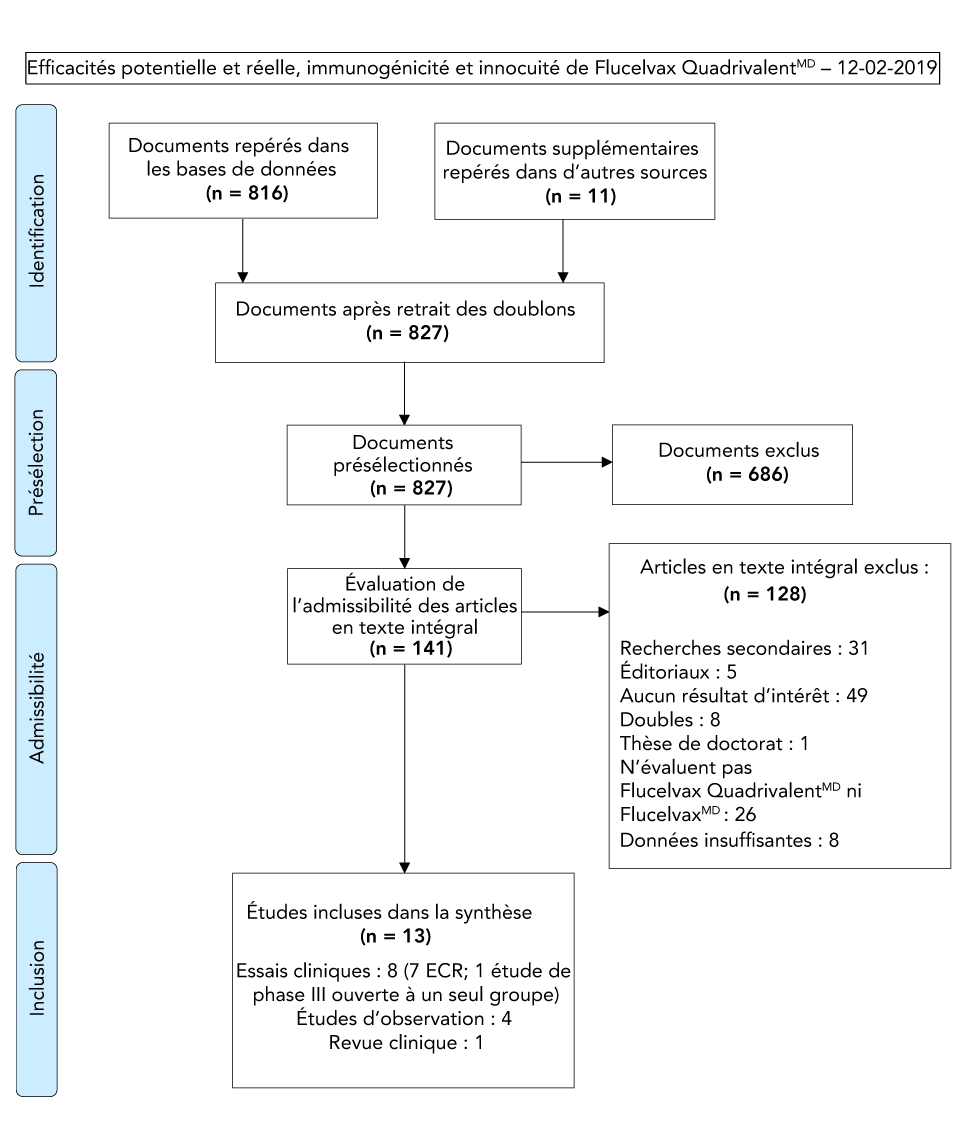
Description textuelle : Figure 1
Figure 1 : Diagramme PRISMA de processus de sélection des études pour l’examen systématique sur l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité de Flucelvax Quad
L’organigramme PRISMA décrit le processus par lequel les documents ont été sélectionnés pour la revue de la littérature. Le processus se divise en quatre étapes : l’identification, la présélection, l’admissibilité et l’inclusion.
Étape 1 : Identification
- 816 documents ont été repérés le 12 février 2019 lors de la recherche dans les bases de données et 11 documents ont été repérés dans d’autres sources
- De ces documents, il en restait 827 après l’élimination des doublons
Étape 2 : Présélection
- 827 documents sont ensuite passés à l’étape de la présélection
- 686 documents en ont été exclus
Étape 3 : Admissibilité
- 141 articles en texte intégral ont fait l’objet d’une évaluation de l’admissibilité
- Sur les 141 articles en texte intégral, 128 ont été exclus : 31 étaient des recherches secondaires, cinq étaient des éditoriaux, 49 ne comprenaient aucun résultats d’intérêt, huit étaient des doublons, une thèse de doctorat, 26 n’évaluaient pas Flucelvax QuadrivalentMD ni FlucelvaxMD et huit avaient des données insuffisantes
Étape 4 : Inclusion
La synthèse finale comprenait 13 articles: huit essais cliniques (sept essais contrôlés randomisés, une étude de phase III ouverte à un seul groupe), quatre études d’observation and un examen clinique
| Étude | Conception (vaccin) | Population de l’étude | Résultats |
|---|---|---|---|
| DeMarcus et al. (2019) |
|
|
|
| Izurieta et col. (2018) |
|
|
|
| Boikos et al. (2018) NCT01992094 |
|
|
|
| Klein et al. (2018) |
|
|
|
| Bart et al. (2016) |
|
|
|
| Hartvickson et al. (2015) NCT01992107 |
|
|
|
| Étude | Conception (vaccin) | Population de l’étude | Résultats |
|---|---|---|---|
| Ambrozaitis et al. (2009) |
|
|
|
| Szymczakiewicz-Multanowska et al. (2009) NCT00492063 |
|
|
|
| Nolan et al. 2016 |
|
|
|
| Vesikari et al. (2012) |
|
|
|
| Frey et al. (2010) NCT00630331 |
|
|
|
| Loebermann et al. (2019) NCT01880697 |
|
|
|
| Moro et al. (2015) |
|
|
|
Efficacité réelle et potentielle des vaccins
Quatre études d’observation, deux examinées par des pairs et deux non examinées par des pairs, ont été recensées. Elles évaluaient l’efficacité réelle du VII4-cc par rapport au VII à base d’œufs ajustée par rapport aux estimations du taux d’infection par le virus de la grippe confirmée en laboratoire pendant la saison grippale 2017 à 2018 aux États-UnisNote de bas de page 16Note de bas de page 17Note de bas de page 18Note de bas de page 19. De ces quatre études, deux étaient de bonne qualitéNote de bas de page 17Note de bas de page 18, selon les critères définis par Harris et al.Note de bas de page 14, alors que la qualité des deux autres étudesNote de bas de page 16Note de bas de page 19 n’a pas pu être évaluée puisque ces dernières ont été publiées sous forme de résumés de conférence ou d’affiches. Certaines données indiquent que le VII4-cc pourrait offrir une meilleure protection contre la grippe que le VII4 ou le VII3 classique à base d’œufs, en particulier contre l’infection par le virus de la grippe A(H3N2). Le VII4-cc pourrait également être plus efficace que les vaccins antigrippaux trivalents ou quadrivalents à base d’œufs contre les affections liées à la grippe non confirmées en laboratoire, y compris les interactions en matière de soins de santé attribuables à la grippe. Cependant, on ne dispose pas de données suffisantes sur les affections liées à la grippe confirmées en laboratoire. Bien que certaines données semblent indiquer que le VII4-cc pourrait être plus efficace que le VII à base d’œufs contre une infection par le virus de la grippe A(H3N2) confirmée en laboratoire, aucune différence constante et statistiquement significative en matière d’efficacité réelle n’a été observée chez les adultes et les enfants entre le VII4-cc et le VII à base d’œufs. Aucune conclusion ne peut donc être tirée pour le moment.
Immunogénicité
Deux études évaluées par des pairsNote de bas de page 20Note de bas de page 21 qui ont fait état de l’immunogénicité et de l’innocuité du Flucelvax quadrivalent par rapport à différentes formulations du VII3-cc ont été recensées dans cet examen. Une étude de Bart et al.Note de bas de page 20 a été menée auprès de sujets adultes âgés de 18 ans et plus, alors que l’autre étude, de Hartvickson et al.Note de bas de page 21 portait sur des enfants de quatre à 17 ans. Les résultats de l’immunogénicité évalués par ces études comprenaient l’augmentation de la moyenne géométrique des titres des essais d’hémagglutination (i.e. le rapport entre le titre moyen géométrique suivant la vaccination et préalable à celle-ci), le taux de séroprotection (i.e. la proportion de participants ayant des titres des essais d’hémagglutination d’au moins 40 après la vaccination) et le taux de séroconversion (i.e. la proportion de participants ayant au moins quatre fois plus de titres des essais d’hémagglutination après la vaccination, l’augmentation des titres des essais d’hémagglutination de moins de 10 avant la vaccination à au moins 40 après la vaccination, ou les deux). Dans les deux études, le VII4-cc a pu établir sa non-infériorité, selon le ratio de la moyenne géométrique des titres et des taux de séroconversion, et a atteint le seuil de séroprotection pour toutes les souches de grippe contenues dans les VII3-cc.
L’immunogénicité de Flucelvax Quad est en outre étayée par des données probantes issues du programme de développement clinique de Flucelvax qui a été autorisé aux États-Unis, mais pour lequel une autorisation n’a jamais été demandée au Canada. Flucelvax a établi la non-infériorité des comparateurs standard du VII3 à base d’œufs pour les réponses des anticorps d’inhibition de l’hémagglutination en général à toute souche chez les adultes de 18 ans et plus et pour les souches A(H1N1) et B en particulier, mais pas A(H3N2), pour les personnes de quatre à 17 ans, selon le ratio de la moyenne géométrique des titres suivant la vaccination et des taux de séroconversionNote de bas de page 22Note de bas de page 23Note de bas de page 24Note de bas de page 25. Notamment, le VII3-cc était fabriqué à partir de VVC dérivés d’œufs avant la mise en œuvre de méthodes de fabrication utilisant des VVC uniquement dérivés de cellules MDCK.
Innocuité
Deux études examinées par des pairs ont évalué l’innocuité du Flucelvax quadrivalent (VII4-cc) par rapport à différentes formulations de VII3-cc; l’une portait sur des adultes en bonne santéNote de bas de page 20 et l’autre sur des enfants en bonne santé âgés de quatre ans et plusNote de bas de page 21. Les paramètres d’innocuité évalués des deux études comprenaient les évènements indésirables locaux et systémiques signalés sur demande survenus entre les jours 1 et 7 après la vaccination, les évènements indésirables graves survenus dans les six mois suivant l’administration de la dernière dose de vaccin et les évènements indésirables signalés spontanément entre les jours 1 et 23 suivant la vaccination. Les évènements indésirables locaux et systémiques signalés sur demande chez les adultes et les enfants étaient généralement d’intensité légère à modérée, disparaissaient spontanément et n’entraînaient pas de séquelles. Les évènements indésirables graves étaient rares et de fréquence similaire entre les formulations quadrivalentes et trivalentes des vaccins issus de cultures cellulaires comparés. Aucune étude évaluant l’innocuité du VII4-cc par rapport au VII à base d’œufs (trivalent ou quadrivalent) n’a été recensée dans cet examen.
Flucelvax Quadrivalent est autorisé aux États-Unis pour une utilisation chez les adultes et les enfants de quatre ans ou plus depuis 2016. Depuis son autorisation, aucun problème d’innocuité n’a été décelé dans le cadre des activités de pharmacovigilance courantes. Un examen clinique de casNote de bas de page 26 et six essais contrôlés randomisés révisés par des pairsNote de bas de page 1Note de bas de page 27Note de bas de page 28Note de bas de page 29Note de bas de page 30Note de bas de page 31 (quatre chez des adultes et deux chez des enfants) qui ont produit un rapport sur l’innocuité du IIV3-cc ont été inclus dans l’examen afin de compléter la base de données probantes pour le résultat de l’innocuité. Les données sur l’innocuité étaient uniformes dans toutes ces études et ont montré qu’il n’y avait pas de différence significative entre les adultes et les enfants de quatre ans et plus qui avaient reçu le VII3-cc ou un VII3 à base d’œufs. En général, Flucelvax était sûr et bien toléré, avec des réactions locales et systémiques signalées sur demande ainsi que des évènements indésirables et des évènements indésirables graves spontanés comparables à ceux généralement observés avec d’autres VII3 injectables dérivés d’œufs. Le VII3-cc a également un dossier d’innocuité établi, et aucun nouveau problème d’innocuité n’a été relevé par la pharmacovigilance de routine aux États-Unis ou en Europe où le vaccin a été homologuéNote de bas de page 22Note de bas de page 23Note de bas de page 25.
Discussion
Flucelvax Quad est jugé efficace, immunogène et sans danger pour les adultes et les enfants âgés de neuf ans et plus, et il présente un profil d’immunogénicité et d’innocuité semblable à celui 1) des vaccins antigrippaux à base d’œufs déjà autorisés au Canada et 2) à Flucelvax, vaccin antigrippal trivalent issu de cultures cellulaires qui a été autorisé aux États-Unis et pour lequel l’autorisation n’a jamais été demandée au Canada. Le Flucelvax Quad peut conférer une plus vaste protection contre la grippe de type B, comparativement aux autres vaccins antigrippaux trivalents présentement offerts sur le marché. Il existe un doute théorique en ce qui concerne les réactions indésirables que pourraient causer les vaccins antigrippaux inactivés issus de cellules rénales canines (MDCK 33016-PF) chez les personnes allergiques aux chiens. Toutefois, les données probantes issues des études in vitro sur le potentiel allergène des vaccins à base de cellules MDCK chez les personnes souffrant d’allergies documentées associées aux chiens, ainsi que les essais cliniques VII-cc et la surveillance de l’innocuité après la mise sur le marché, ne suggèrent pas qu’il existe un risque élevé de réactions d’hypersensibilité par rapport aux vaccins antigrippaux à base d’œufsNote de bas de page 32Note de bas de page 33.
L’adoption de technologies de fabrication des vaccins antigrippaux fondées sur la culture de cellules et d’autres options de rechange aux méthodes à base d’œufs peut aussi permettre de diversifier les plateformes de fabrication des vaccins et, par conséquent, de prévenir les pénuries de stocks de vaccins antigrippaux, tout en augmentant la capacité de production de vaccins. Quoi qu’il en soit, l’adaptation des virus des vaccins antigrippaux issus de cultures cellulaires doit faire l’objet d’études plus poussées compte tenu du potentiel de mutations des segments génétiques d’hémagglutinine et de neuramidase entraînant le passage sériel sur les cellules MDCKNote de bas de page 34Note de bas de page 35. Des données probantes plus rigoureuses, exhaustives et uniformes, y compris des données sur les comorbidités, les femmes enceintes, l’état de santé et d’autres variables de confusion potentiellesNote de bas de page 36, doivent aussi être obtenues pour évaluer l’efficacité réelle relative et l’innocuité de Flucelvax Quad comparativement à celles d’autres vaccins antigrippaux injectables. Il sera donc important de surveiller en permanence l’efficacité réelle, l’immunogénicité et l’innocuité des vaccins afin de comparer les saisons précédentes et futures, entre les sous-types de grippe et l’efficacité globale de chaque type de vaccin.
Limites
Il existe actuellement peu d’études évaluées par des pairs sur l’efficacité, l’immunogénicité et l’innocuité de l’VII4-cc fabriqué à partir de VVC entièrement cellulaires. Toutes les études qui ont évalué l’efficacité ont été menées aux États-Unis au cours de la même saison (2017 à 2018), qui était dominée par la grippe A(H3N2). Comme les saisons grippales peuvent varier considérablement d’une année à l’autre, l’interprétation des données issues de ces études d’observation est limitée et il est nécessaire de disposer de données probantes supplémentaires de l’efficacité recueillies pendant les saisons grippales avec différents virus circulants avant de pouvoir tirer une conclusion sur l’efficacité relative. Deux des études d’observationNote de bas de page 16Note de bas de page 18 évaluant l’efficacité des vaccins ont utilisé des données de soins primaires du monde réel provenant des dossiers médicaux électroniques de patients individuels. L’utilisation d’ensembles de données de dossiers médicaux électroniques pour l’estimation de l’efficacité réelle des vaccins antigrippaux n’a pas encore été validée et les sources potentielles d’erreur et de confusion doivent encore être étudiées. En outre, la signification clinique et la simplicité des données probantes fournies par les résultats liés à la grippe, qui sont des mesures de substitution de l’activité grippale, restent incertaines.
Recommandation du CCNI pour la prise de décision individuelle
La recommandation suivante concernant le Flucelvax Quad complète la recommandation générale du CCNI pour la vaccination contre la grippe, qui est disponible dans la déclaration du CCNI sur le vaccin contre la grippe saisonnière. La recommandation générale du CCNI concernant la vaccination contre la grippe est qu’un vaccin antigrippal adapté à l’âge soit proposé chaque année à toute personne âgée de six mois et plus (recommandation forte du CCNI), en précisant les contre-indications propres au produit.
1. Le CCNI recommande que le Flucelvax Quad puisse être envisagé, en tant que vaccin quadrivalent contre la grippe, chez les adultes et les enfants âgés de neuf ans et plus (recommandation discrétionnaire du CCNI).
- Le CCNI conclut qu’il existe des données probantes passables pour recommander l’administration du vaccin Flucelvax Quad aux adultes et aux enfants de neuf ans et plus (données probantes de catégorie B)
Les conclusions détaillées de l’analyse documentaire, ainsi que la justification et les considérations pertinentes de cette recommandation, figurent dans la déclaration supplémentaire du CCNI - Déclaration supplémentaire – Vaccins antigrippaux issus de cultures cellulaires de mammifèresNote de bas de page 37.
Conclusion
Il existe des données probantes passables que Flucelvax Quad est efficace, sûr d’emploi et a une immunogénicité non inférieure à celle des vaccins comparables, d’après des données probantes directes recueillies chez des adultes et des enfants de neuf ans et plus. Le CCNI recommande que le Flucelvax Quad puisse être envisagé, en tant que vaccin quadrivalent contre la grippe, chez les adultes et les enfants âgés de neuf ans et plus. Le CCNI continuera de surveiller les données relatives aux vaccins antigrippaux issus de cultures cellulaires et mettra à jour cette déclaration supplémentaire selon les besoins et à mesure que s’accumuleront les données sur le Flucelvax Quad provenant de plusieurs saisons grippales différentes.
Déclaration des auteurs
- A. S. — Rédaction, version initiale, révision, édition
- I. G. — Révision, édition
- R. H. — Révision, édition
Le Chapitre sur la grippe du Guide canadien d’immunisation et Déclaration sur la vaccination antigrippale pour la saison 2020–2021 : Déclaration supplémentaire – Vaccins antigrippaux issus de cultures cellulaires de mammifères du Comité consultatif national de l’immunisation (CCNI) a été préparée par A. Sinilaite, J. Przepiorkowski, K. Young, I. Gemmill et R. Harrison au nom du Groupe de travail sur l’influenza du CCNI et a été approuvée par le CCNI.
Intérêts concurrents
Aucun.
Remerciements
Membres du Groupe de travail sur l’influenza : I. Gemmill (président), R. Harrison (vice-présidente), C. Bancej, L. Cochrane, N. Dayneka, L. Grohskopf, K. Klein, D. Kumar, J. Langley, P. Wolfe-Roberge, J. McElhaney, A. McGeer, D. Moore, S. Smith, B. Warshawsky et J. Xiong
Membres du CCNI : C. Quach (présidente), S. Deeks (vice-présidente), N. Dayneka, P. De Wals, V. Dubey, R. Harrison, K. Hildebrand, K. Klein, J. Papenburg, C. Rotstein, B. Sander et S. Smith
Anciennes membres du CCNI : M. Salvadori et N. Sicard
Représentants de liaison : L. M. Bucci (Association canadienne de santé publique), E. Castillo (Société des obstétriciens et gynécologues du Canada), A. Cohn (Centers for Disease Control and Prevention, États-Unis), J. Emili (Collège des médecins de famille du Canada), M. Naus (Comité canadien d’immunisation), D. Moore (Société canadienne de pédiatrie) et A. Pham-Huy (Association de microbiologie médicale et des maladies infectieuses du Canada)
Représentants d’office : J. Gallivan (Direction des produits de santé commercialisés, Santé Canada [SC]), E. Henry (Centre de l’immunisation et des maladies respiratoires infectieuses [CIMRI], Agence de la santé publique du Canada [l’Agence]), M. Lacroix (Groupe consultatif d’éthique en santé publique, l’Agence), J. Pennock (CIMRI, l’Agence), R. Pless (Direction des produits biologiques et des thérapies génétiques, SC), G. Poliquin (Laboratoire national de microbiologie, l’Agence) et T. Wong (Direction générale de la santé des Premières Nations et des Inuits, Services autochtones Canada)
Le Comité consultatif national de l’immunisation reconnaît et apprécie la contribution de A. House (CIMRI, l’Agence, M. Laplante (CIMRI, l’Agence), et K. Merucci (Bibliothèque de la santé, SC) à cette déclaration.
Financement
Le travail du Comité consultatif national de l’immunisation est financé par l’Agence de la santé publique du Canada.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International