Éclosion de Salmonella Typhimurium lié à une exposition à des hérissons de compagnie, 2017 à 2020

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 48-6, juin 2022 : Infections acquises par transmission vectorielle–partie 2 : faune & animaux de compagnie
Date de publication : juin 2022
ISSN : 1481-8531
Soumettre un article
À propos du RMTC
Naviguer
Volume 48-6, juin 2022 : Infections acquises par transmission vectorielle–partie 2 : faune & animaux de compagnie
Éclosion
Une éclosion multiprovinciale de Salmonella Typhimurium au Canada associée à une exposition à des hérissons de compagnie, 2017 à 2020
Katharine Fagan-Garcia1, Leann Denich2, Joanne Tataryn3, Rachelle Janicki2, Olivia Van Osch2, Ashley Kearney4, Cynthia Misfeldt4, Céline Nadon4, Colette Gaulin5, Victor Mah6, Raminderjeet Sandhu7, Michelle Waltenburg8, Bijay Adhikari9, Hanan Smadi10, Anne-Marie Lowe2
Affiliations
1 Programme canadien d’épidémiologie de terrain, Agence de la santé publique du Canada, Toronto, ON
2 Centre des maladies infectieuses d’origine alimentaire, environnementale et zoonotique, Agence de la santé publique du Canada, Guelph, ON
3 Centre des maladies infectieuses d’origine alimentaire, environnementale et zoonotique, Agence de la santé publique du Canada, Saskatoon, SK
4 Laboratoire national de microbiologie, Agence de la santé publique du Canada, Winnipeg, MB
5 Direction de la vigie sanitaire, ministère de la Santé et des Services sociaux du Québec, QC
6 Ministère de la santé, Edmonton, AB
7 Services de santé de l’Alberta, Calgary, AB
8 Division des maladies d'origine alimentaire, hydriques et environnementales, Centres de prévention et contrôle des maladies, Atlanta, GA
9 Gouvernement de la Saskatchewan, Regina, SK
10 Santé du Nouveau-Brunswick, Fredericton, NB
Correspondance
Citation proposée
Fagan-Garcia K, Denich L, Tataryn JR, Janicki R, Van Osch O, Kearney A, Misfeldt C, Nadon CA, Gaulin C, Mah V, Sandhu R, Waltenburg MA, Adhikari B, Smadi H, Lowe A-M. Une éclosion multiprovinciale de Salmonella Typhimurium au Canada associée à une exposition à des hérissons de compagnie, 2017 à 2020. Relevé des maladies transmissibles au Canada 2022;48(6):311–20. https://doi.org/10.14745/ccdr.v48i06a06f
Mots-clés : salmonelle, S. Typhimurium, hérisson, zoonotique, entérique, éclosion
Résumé
Contexte : En octobre 2020, une enquête a été ouverte au Canada sur une éclosion d’infections à Salmonella Typhimurium de la même souche qu’une éclosion concomitante aux États-Unis, liée à des hérissons de compagnie. L’objectif de cet article est d’identifier la source de l’éclosion, de déterminer s’il existe un lien entre les éclosions canadienne et américaine et de définir les facteurs de risque d’infection afin de guider les interventions de santé publique.
Méthodes : Les cas ont été établis par le séquençage du génome entier des isolats de S. Typhimurium. Des renseignements ont été recueillis sur les expositions des cas, y compris les contacts avec les animaux. Des spécimens de hérissons et de l’environnement ont été testés pour S. Typhimurium et une enquête de traçabilité a été menée.
Résultats : Il y avait 31 cas dans six provinces, avec des dates d’apparition de la maladie allant du 1er juin 2017 au 15 octobre 2020. L’âge médian des cas était de 20 ans et 52 % étaient des femmes. Les isolats ont été regroupés entre 0 et 46 différences d’allèles lors du typage de séquence du génome entier sur plusieurs locus. Sur les 23 cas pour lesquels on disposait de renseignements sur l’exposition, 19 (83 %) ont déclaré avoir été en contact avec des hérissons dans les sept jours précédant les symptômes; 15/18 (83 %) ont déclaré un contact direct et 3/18 (17 %) un contact indirect. L’enquête de traçabilité n’a pas permis d’établir une source commune de hérissons, mais a mis en évidence une industrie dotée d’un réseau de distribution complexe. La souche de l’éclosion a été détectée dans des échantillons prélevés sur un hérisson au domicile d’un des cas et sur un hérisson dans un zoo du Québec.
Conclusion : Le contact direct et indirect avec des hérissons a été établi comme la source de cette éclosion de S. Typhimurium. Les communications de santé publique visaient à sensibiliser aux risques de zoonoses liés aux hérissons et à faire connaître les principales pratiques d’hygiène permettant de réduire la transmission des maladies.
Introduction
Salmonella reste une cause majeure de maladies entériques humaines au Canada. Les symptômes de la salmonellose commencent généralement 6 à 72 heures après l’exposition et peuvent comprendre de la fièvre, des frissons, de la diarrhée, des crampes abdominales, des maux de tête, des nausées et des vomissements qui disparaissent généralement en 4 à 7 joursNote de bas de page 1. Bien que de nombreuses infections soient liées à la consommation d’aliments contaminés, on estime que 13 à 19 % d’entre elles sont associées au contact avec des animauxNote de bas de page 2Note de bas de page 3Note de bas de page 4. Les bactéries Salmonella colonisent le tube digestif d’un grand éventail d’espèces hôtes; les animaux peuvent présenter une maladie clinique à la suite de l’infection, mais la plupart du temps, aucun signe clinique n’est observé, avec une excrétion fécale et un portage intermittentNote de bas de page 5. De nombreuses éclosions de Salmonella Typhimurium aux États-Unis et au Canada ont été liées à un contact direct ou indirect avec divers petits animaux de compagnie et leurs aliments, notamment des rongeurs et autres petits mammifères (souris, rats, cochons d’Inde, hérissons), des reptiles et des amphibiens (grenouilles, tortues, serpents) ainsi que des chiens et des chatsNote de bas de page 6Note de bas de page 7Note de bas de page 8.
Les hérissons ont gagné en popularité comme petits animaux de compagnie au cours des dernières décennies, le hérisson pygmée africain (Atelerix albiventris) étant l’espèce la plus souvent vendue dans le commerce des petits animaux de compagnie en Amérique du NordNote de bas de page 9Note de bas de page 10Note de bas de page 11. L’élevage en captivité est en place au Canada et aux États-Unis, car l’importation directement d’Afrique est interdite en raison de leur potentiel de transmission de maladies graves, notamment la fièvre aphteuseNote de bas de page 10Note de bas de page 11Note de bas de page 12. Les hérissons peuvent être une source de plusieurs zoonoses, dont la salmonellose Note de bas de page 11Note de bas de page 13Note de bas de page 14. Les infections à Salmonella chez les hérissons peuvent entraîner une maladie clinique; cependant, beaucoup d’entre eux restent des porteurs asymptomatiques, la prévalence du portage de Salmonella dans les populations de hérissons sauvages variant de 0 à 96 %Note de bas de page 10Note de bas de page 11Note de bas de page 14Note de bas de page 15Note de bas de page 16.
Un certain nombre d’éclosions et de cas individuels de Salmonella liés à des hérissons de compagnie ou sauvages ont été signalés depuis les années 1990Note de bas de page 11, impliquant différents sérotypes, dont S. TileneNote de bas de page 17Note de bas de page 18Note de bas de page 19, S. TyphimuriumNote de bas de page 10Note de bas de page 16Note de bas de page 19Note de bas de page 20, S. EnteritidisNote de bas de page 21Note de bas de page 22 et S. StanleyNote de bas de page 23. Au Canada, de 1995 à 1997, il y a eu une éclosion multiprovinciale de 10 cas de S. Tilene associés à des hérissons et des phalangers du sucre de compagnieNote de bas de page 18. Les Centres de prévention et de contrôle des maladies (CDC) des États-Unis ont enquêté sur trois éclosions multi-états d’infections à S. Typhimurium liées à des hérissons de compagnie, survenues entre 2011 et 2013, en 2018–2019 et en juillet 2020Note de bas de page 10Note de bas de page 24Note de bas de page 25Note de bas de page 26Note de bas de page 27. Ces éclosions ont été causées par une souche de S. Typhimurium génétiquement similaire, comme l’a déterminé le séquençage du génome entier (SGE), ce qui suggère une large diffusion dans l’industrie américaine des hérissons de compagnieNote de bas de page 25Note de bas de page 26Note de bas de page 27.
En octobre 2020, une enquête canadienne a été lancée par l’Agence de la santé publique du Canada (l’Agence) et les responsables provinciaux de la santé publique lorsque des isolats de S. Typhimurium provenant d’humains ont été établis comme étant génétiquement liés par SGE à l’éclosion américaine de hérissons de compagnie Note de bas de page 26. Les objectifs de l’enquête sont de déterminer la source de la maladie et les facteurs de risque d’infection, de déterminer s’il existe un lien épidémiologique entre les éclosions américaine et canadienne, et de mettre en œuvre des interventions de santé publique, notamment des activités d’éducation et de sensibilisation.
Méthodes
Aperçu
À la suite de la notification par les CDC, le 19 septembre 2020, d’une éclosion d’infections à S. Typhimurium liée à un contact avec des hérissons de compagnieNote de bas de page 25, des isolats canadiens génétiquement apparentés ont été identifiés par le biais de PulseNet Canada (PNC)Note de bas de page 28. L’enquête sur l’éclosion canadienne a débuté le 28 octobre 2020, avec pour objectif de décrire les cas d’éclosion de S. Typhimurium, et d’établir et de retracer la source de l’éclosion.
Détection de l’éclosion et identification des cas
La salmonellose étant une maladie à déclaration obligatoire au Canada, les laboratoires cliniques envoient les isolats de Salmonella spp. aux laboratoires de santé publique provinciaux ou au Laboratoire national de microbiologie pour un sous-typage basé sur le SGE (mis en œuvre en 2017)Note de bas de page 29. L’équipe de la base de données nationale de PNC au Laboratoire national de microbiologie analyse toutes les données SGE canadiennes dans une base de données centralisée BioNumerics v7.6 (Applied Maths)Note de bas de page 30. Des agrégats multi-territoriaux de S. Typhimurium ont été établis en utilisant un seuil d’au moins trois isolats de S. Typhimurium liés par 0–10 différences d’allèles de typage de séquences multilocus du génome entier (wgMLST) où deux des trois isolats sont à moins de cinq allèles wgMLST. Les trois isolats doivent avoir été isolés au cours des 60 derniers jours et au moins un doit être clinique. Les gammes d’allèles peuvent s’étendre au cours d’une enquête sur la base des données de laboratoire, épidémiologiques et autres éléments pertinents disponibles. Une fois qu’un agrégat est établi, PNC attribue un code d’agrégat, et les isolats établis ultérieurement comme génétiquement apparentés sont ajoutés à l’agrégat de SGE. Les épidémiologistes des CDC et de l’Agence communiquent régulièrement au sujet d’enquêtes intéressant les deux pays. Par conséquent, des isolats représentatifs de l’enquête américaine ont été utilisés pour rechercher des isolats canadiens correspondants dans la base de données PNC.
Définitions des cas
La définition de cas incluait les résidents canadiens ou les visiteurs au Canada avec une confirmation en laboratoire de S. Typhimurium correspondant à l’agrégat de l’éclosion par SGE avec une date d’apparition des symptômes, de collecte des échantillons ou d’isolement le 1er décembre 2019 ou après. Les cas étaient liés par des différences d’allèles wgMLST de 0 à 46, ce qui a été confirmé par les données épidémiologiques et de traçabilité. Au fur et à mesure de la progression de l’enquête, des isolats cliniques historiques génétiquement apparentés provenant de cas dont la date d’apparition des symptômes, de prélèvement des échantillons ou d’isolement était le 1er juin 2017 ou après ont été ajoutés à l’enquête.
Enquête épidémiologique et enquête de traçabilité
Les cas d’infection à Salmonella confirmés en laboratoire ont été systématiquement interrogés par les autorités de santé publique locales ou régionales dans la plupart des territoires. Les questionnaires recueillent des renseignements sur l’exposition au cours des sept jours précédant l’apparition des symptômes et couvrent généralement les facteurs de risque cliniques, de voyage, alimentaires et autres, y compris l’exposition à des animaux. Le consentement pour un suivi futur a été recueilli au moment de l’entretien.
Les renseignements ont été recueillis lors des entretiens initiaux, et les cas ont été interrogés de nouveau par l’Agence ou les provinces individuelles à l’aide d’un questionnaire axé sur l’exposition aux hérissons, qui comprenait les questions suivantes :
- Lieu d’exposition au hérisson (i.e. domicile, résidence d’un parent/ami, animalerie)
- Où et quand les hérissons ont-ils été achetés?
- Type de contact avec le hérisson (i.e. contact direct, comme tenir, embrasser et nourrir le hérisson, ou contact indirect, comme faire partie d’un foyer où des hérissons sont élevés, ou contact avec l’environnement et/ou l’enclos du hérisson)
- Type de nourriture consommée par le hérisson
- Le hérisson semblait-il malade?
- Pratiques de nettoyage (i.e. laver le hérisson et les produits de nettoyage)
- Autres pratiques d’élevage mises en œuvre (e.g. désinfection, lavage des mains et isolement des hérissons malades ou nouvellement obtenus)
Les entretiens avec les fournisseurs de hérissons établis (qui comprenaient des animaleries, des grossistes et des éleveurs) ont permis de recueillir des détails sur les pratiques d’élevage des installations, l’historique de la santé des troupeaux, les protocoles de précaution contre la Salmonella et les pratiques d’éducation des clients. La collecte de données a également permis de déterminer si un fournisseur commun était associé aux cas d’éclosion.
Analyses épidémiologiques et statistiques
Les proportions de personnes malades ayant déclaré un contact quelconque avec des animaux et un contact précis avec des hérissons ont été comparées aux valeurs de référence correspondantes de l’étude Foodbook, une étude de population sur l’exposition des Canadiens à la nourriture, aux animaux et à l’eau sur une période de sept jours Note de bas de page 31. Le test de probabilité exacte a été utilisé pour mesurer la signification statistique de la proportion de cas ayant rapporté un contact avec un animal par rapport aux valeurs de référence du Foodbook.
Enquête en laboratoire
Des échantillons environnementaux et des échantillons de matières fécales de hérissons ont été prélevés au domicile des cas et chez les fournisseurs de hérissons. Les échantillons ont été soumis aux laboratoires de santé publique provinciaux pour le SGE, qui a été réalisé selon le protocole actuel PNC. En bref, l’ADN génomique a été extrait à l’aide de la trousse DNeasy pour le sang et les tissus (Qiagen) ou de la trousse Epicentre MasterPure Complete de purification de l’ADN et de l’ARN (Mandel). Les bibliothèques ont été préparées à l’aide de la trousse de préparation de bibliothèque Nextera XT (Illumina) et séquencées à l’aide de la plateforme MiSeq d’Illumina (Illumina), en utilisant la chimie V2 ou V3 pour obtenir une couverture moyenne du génome supérieure ou égale à 40x. L’analyse des données SGE a été réalisée en utilisant le schéma Salmonella wgMLST au sein de la plateforme BioNumerics v7.6 (BioMerieux). Un dendrogramme a été construit avec BioNumerics v7.6 en utilisant un coefficient de similarité catégorique (valeurs) et un algorithme de regroupement par groupes de paires non pondérés avec moyenne arithmétique (UPGMA). UPGMA est une méthode de regroupement hiérarchique utilisée pour générer un dendrogramme permettant de visualiser la parenté des isolats; elle permet de mettre rapidement à jour les analyses au fur et à mesure que des isolats sont ajoutés au cours d’une enquête.
Résultats
Enquête épidémiologique
Au total, 31 cas ont été établis dans six provinces (Colombie-Britannique = 3, Alberta = 6, Saskatchewan = 1, Ontario = 4, Québec = 16 et Nouveau-Brunswick = 1). Les dates d’apparition des symptômes ou de prélèvement ou d’isolement des échantillons s’échelonnaient du 1er juin 2017 au 15 octobre 2020 (figure 1).
Figure 1 : Nombre de cas avec la souche de Salmonella Typhimurium de l’éclosion par province et date d’apparition de la maladie ou de prélèvement de l’échantillon (n = 31)
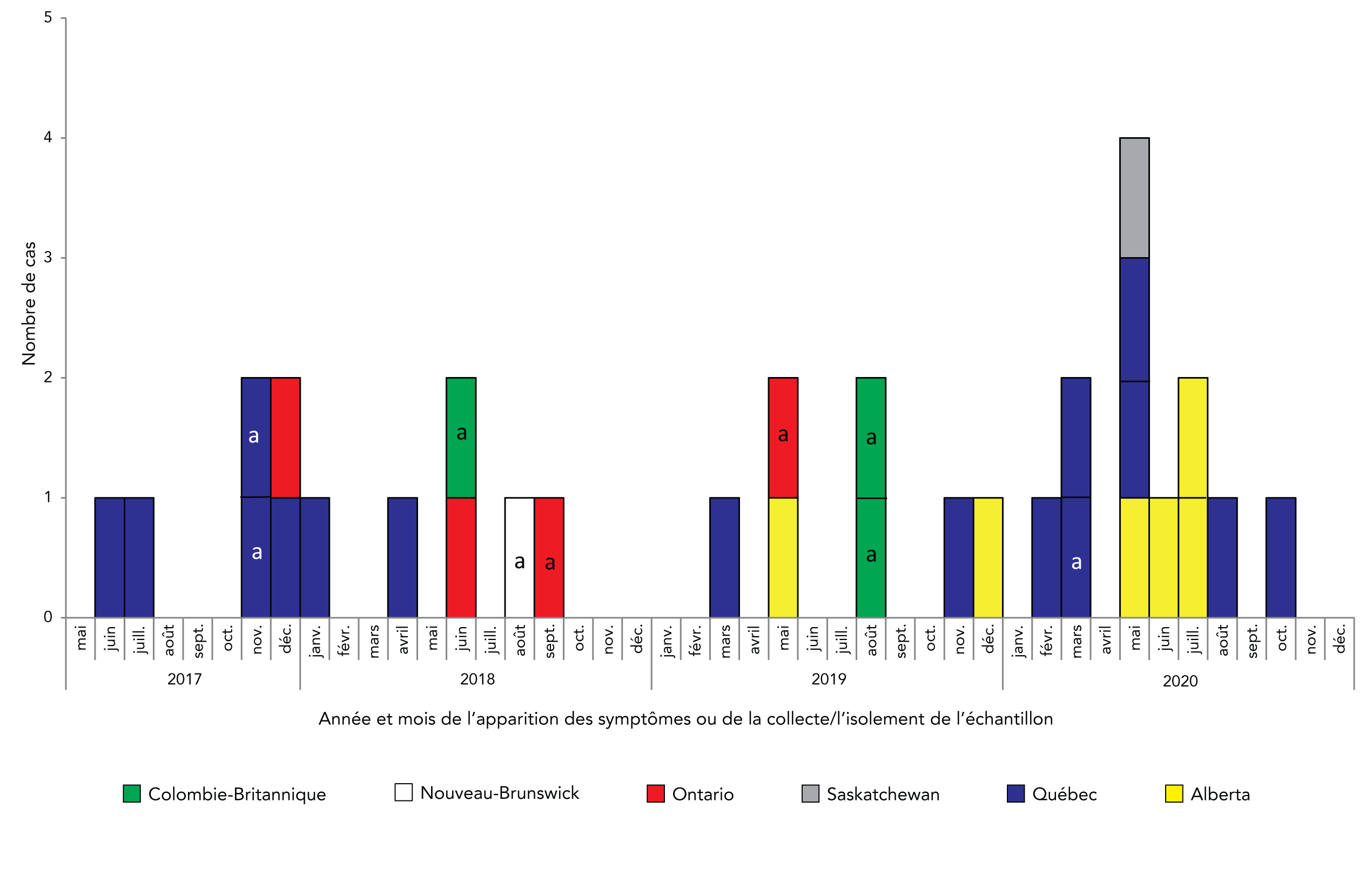
Description textuelle : Figure 1
La courbe épidémiologique montre le nombre de cas avec la souche d’éclosion de Salmonella Typhimurium rapportés par les provinces canadiennes, plus précisément la Colombie-Britannique, le Nouveau-Brunswick, l’Ontario, la Saskatchewan, le Québec et l’Alberta. Les cas sont illustrés par année et mois d’apparition des symptômes ou de collecte ou d’isolement des échantillons. Les cas se sont produits entre juin 2017 et octobre 2020. Le nombre de cas variait de 0 à 2 et était dispersé dans le temps entre octobre 2020 et novembre 2020. Ensuite, les cas ont été plus fréquemment signalés et en mai 2020, 4 cas ont été signalés. Le nombre de cas a ensuite diminué, le dernier inclus dans cette épidémie ayant été signalé en octobre 2020.
L’âge des cas allait de quatre mois à 79 ans, avec une médiane de 20 ans. Trente-deux pour cent (n = 10/31) étaient des enfants âgés de 10 ans ou moins; parmi ceux-ci, sept (70 %) étaient âgés de deux ans ou moins. Cinquante-deux pour cent des cas étaient des femmes. Quatre des huit (50 %) cas pour lesquels des renseignements étaient disponibles ont été hospitalisés et aucun décès n’a été signalé (tableau 1).
| Caractéristiques | Nombre de cas | Total des cas | % |
|---|---|---|---|
| Âge | |||
| 2 ans ou moins | 7 | 31 | 23 |
| 3 à 10 ans | 3 | 31 | 10 |
| 11 à 20 ans | 6 | 31 | 19 |
| 21 à 50 ans | 9 | 31 | 29 |
| Plus de 50 ans | 6 | 31 | 19 |
| Sexe | |||
| Femme | 16 | 31 | 52 |
| Résultat | |||
| Hospitalisations | 4 | 8 | 50 |
| Décès | 0 | 31 | 0 |
Des renseignements sur l’exposition aux animaux étaient disponibles pour 26 des 31 cas (84 %). La proportion de cas ayant déclaré avoir été en contact avec des petits animaux de compagnie était significativement plus élevée (p < 0,001) que celle de la population générale lorsque l’on compare avec l’étude Foodbook (tableau 2). Dix-neuf cas ont rapporté une exposition à des petits animaux de compagnie, qui étaient tous des hérissons. Quinze ont signalé un contact direct avec un hérisson et trois un contact indirect (tableau 3). La plupart des cas ont déclaré avoir lavé leur hérisson et nettoyé leurs fournitures dans un évier ou une baignoire également utilisés à d’autres fins, et trois cas ont déclaré avoir laissé leur hérisson se promener librement dans la maison; autant de voies potentielles de transmission indirecte. Aucun point commun n’a été observé entre les régimes alimentaires des hérissons.
| Exposition | Nombre de cas | % des cas | Valeur de référence (%) (Canada) | Valeur p |
|---|---|---|---|---|
| Contact avec les animaux | 26/26 | 100 | 63,4 | < 0,001 |
| Animaux de compagnieTableau 2 footnote b | 19/26 | 73 | 3,4 | < 0,001 |
| Expositions ou interactions | Nombre de cas n/NTableau 3 footnote a | % des cas |
|---|---|---|
| Type d'exposition du hérisson | ||
| Contact direct | 15/18 | 83 |
| Toucher et/ou tenir | 10/15 | 67 |
| Contact indirect | 3/18 | 17 |
| Historique de la maladie du hérisson | ||
| Malade avant l'apparition des symptômes du cas | 3/16 | 19 |
| Durée de possession du hérisson avant le cas de maladie | ||
| Un mois ou moins | 7/15 | 47 |
| Deux à trois mois | 6/15 | 40 |
| Environ un an | 2/15 | 13 |
| Pratiques d'hygiène du hérisson | ||
| Autorisé à se promener librement dans la maison | 3/16 | 19 |
| Lavage et nettoyage des fournitures dans la baignoire ou l'évier de la maison du cas dans la cuisine, la salle de bain ou la salle de lavage | 11/14 | 79 |
| Lavage et nettoyage des fournitures dans la maison du cas dans un évier ou un bac prévu à cet effet | 3/14 | 21 |
| Régime alimentaire du hérissonTableau 3 footnote b | ||
| Croquettes pour chatons/chats | 14/19 | 74 |
| Vers de farine | 11/19 | 58 |
| Fruits/légumes | 1/19 | 5 |
Enquête de traçabilité
Des fournisseurs de hérissons ont été établis pour 21/23 (91 %) cas : 4 animaleries; 5 grossistes; et 12 éleveurs (figure 2). Bien qu’aucune source unique n’ait été établie, des fournisseurs communs ont été signalés et un lien direct a été établi entre les enquêtes sur les foyers canadiens et américains, car un éleveur situé aux États-Unis a été signalé dans les deux enquêtes (figure 2). Six fournisseurs ont été interrogés et tous ont déclaré être conscients que les hérissons peuvent être porteurs de Salmonella et prendre des précautions pour prévenir la transmission zoonotique.
Figure 2 : Diagramme du réseau de traçage des hérissons associés aux personnes malades infectées par la souche de Salmonella TyphimuriumFigure 2 footnote a de l’éclosion
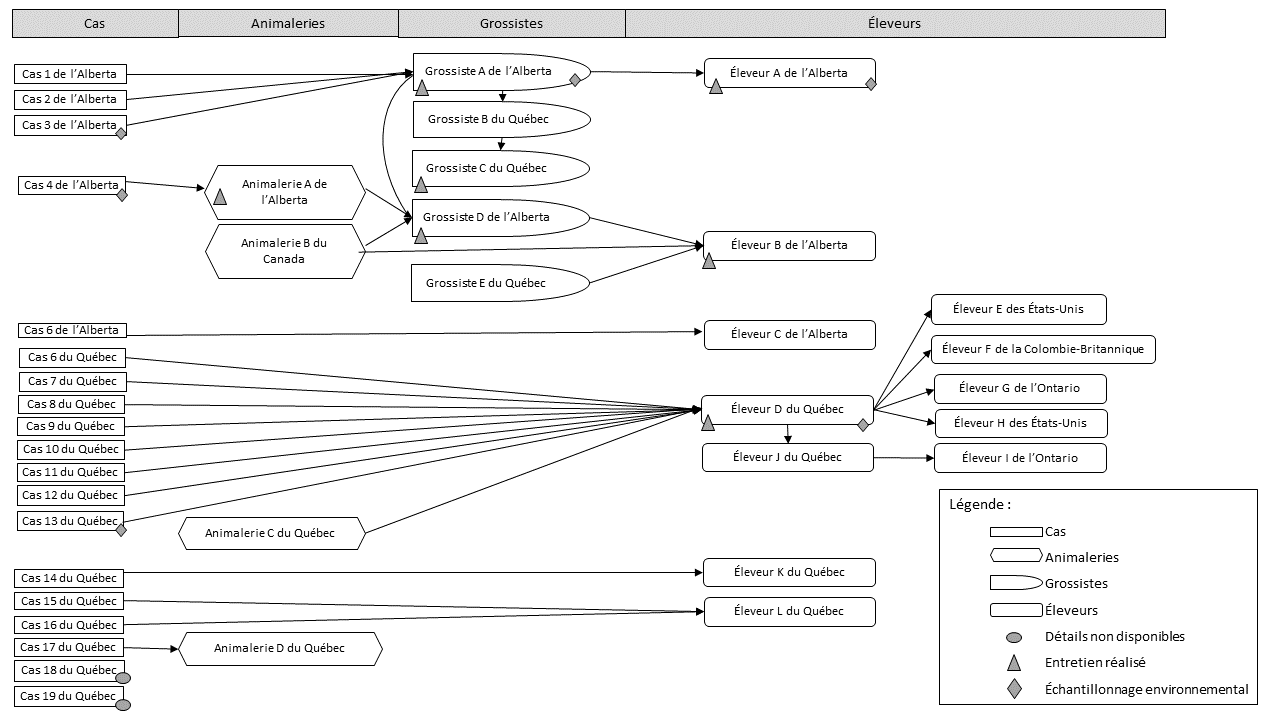
Description textuelle : Figure 2
Le diagramme de traçabilité affiche des flèches illustrant les liens signalés par les cas ou les fournisseurs, en lisant de gauche à droite. Les 19 cas d’épidémie de Salmonella Typhimurium qui ont déclaré avoir été exposés à des hérissons sont affichés dans une colonne, avec un lien vers l’endroit où ils ont obtenu leur hérisson (animaleries, grossistes, éleveurs, tous situés en Alberta, au Québec, en Colombie-Britannique et en Ontario, et aux États-Unis). Lorsque l’environnement d’un hérisson a été échantillonné, une étoile l’identifie dans le diagramme (cas 3 de l’Alberta, cas 4 de l’Alberta, grossiste A de l’Alberta, éleveur A de l’Alberta, cas 13 du Québec, éleveur D du Québec). Le diagramme montre qu’un fournisseur de hérissons du Québec a été lié à 5 éleveurs différents, dont un des États-Unis. Le diagramme indique que le réseau est complexe, avec des grossistes et des éleveurs de différentes provinces qui échangent des hérissons. Cependant, le diagramme illustre la convergence vers un éleveur commun (éleveur québécois D) observée uniquement pour les cas québécois.
Enquête en laboratoire
Des échantillons environnementaux provenant des habitats des hérissons et des échantillons fécaux ont été prélevés au domicile de trois cas, d’un grossiste et de deux éleveurs. Un échantillon de selles de hérisson prélevé au domicile d’un cas au Québec a été testé positif et était génétiquement lié à la souche de l’éclosion d’après le SGE. Tous les autres échantillons étaient négatifs pour Salmonella. Un autre isolat de selles de hérisson génétiquement lié à l’éclosion par SGE a été établi à partir d’un échantillon prélevé en juillet 2020 lors d’examens de quarantaine de routine dans un zoo du Québec; cependant, le fournisseur de ce hérisson était un éleveur du Québec sans lien établi avec les fournisseurs de hérissons signalés par les cas (communication personnelle ministère des Forêts, de la Faune et des Parcs).
Les 33 isolats se regroupaient avec des différences d’allèles wgMLST de 0 à 46, et étaient génétiquement liés à une enquête américaine simultanée associée aux hérissons. Dans l’enquête américaine, les isolats ont été regroupés en trois clades sur la base de leurs profils génétiques; les isolats canadiens étaient génétiquement liés aux trois clades des États-Unis (figure 3) Note de bas de page 26Note de bas de page 27. Notamment, neuf isolats du Québec (dont un animal) se sont regroupés dans le clade 1 et ont été liés à un éleveur précis. Une comparaison par paire entre l’isolat du cas 13 du Québec et l’isolat du hérisson a montré qu’ils étaient à moins de trois différences d’allèles wgMLST l’un de l’autre. Quatre isolats de l’Alberta se trouvaient également dans le clade 1, et étaient regroupés plus étroitement avec les isolats de la Saskatchewan, du Nouveau-Brunswick et de l’Ontario que les isolats du Québec. Neuf isolats du Québec (y compris un animal), ainsi que des isolats de l’Ontario et de la Colombie-Britannique, étaient dans le clade 2, et deux isolats de l’Alberta étaient dans le clade 3.
Figure 3 : Apparentement des isolats associés à une éclosion par typage de séquences multi-locus par séquençage du génome entierFigure 3 footnote a
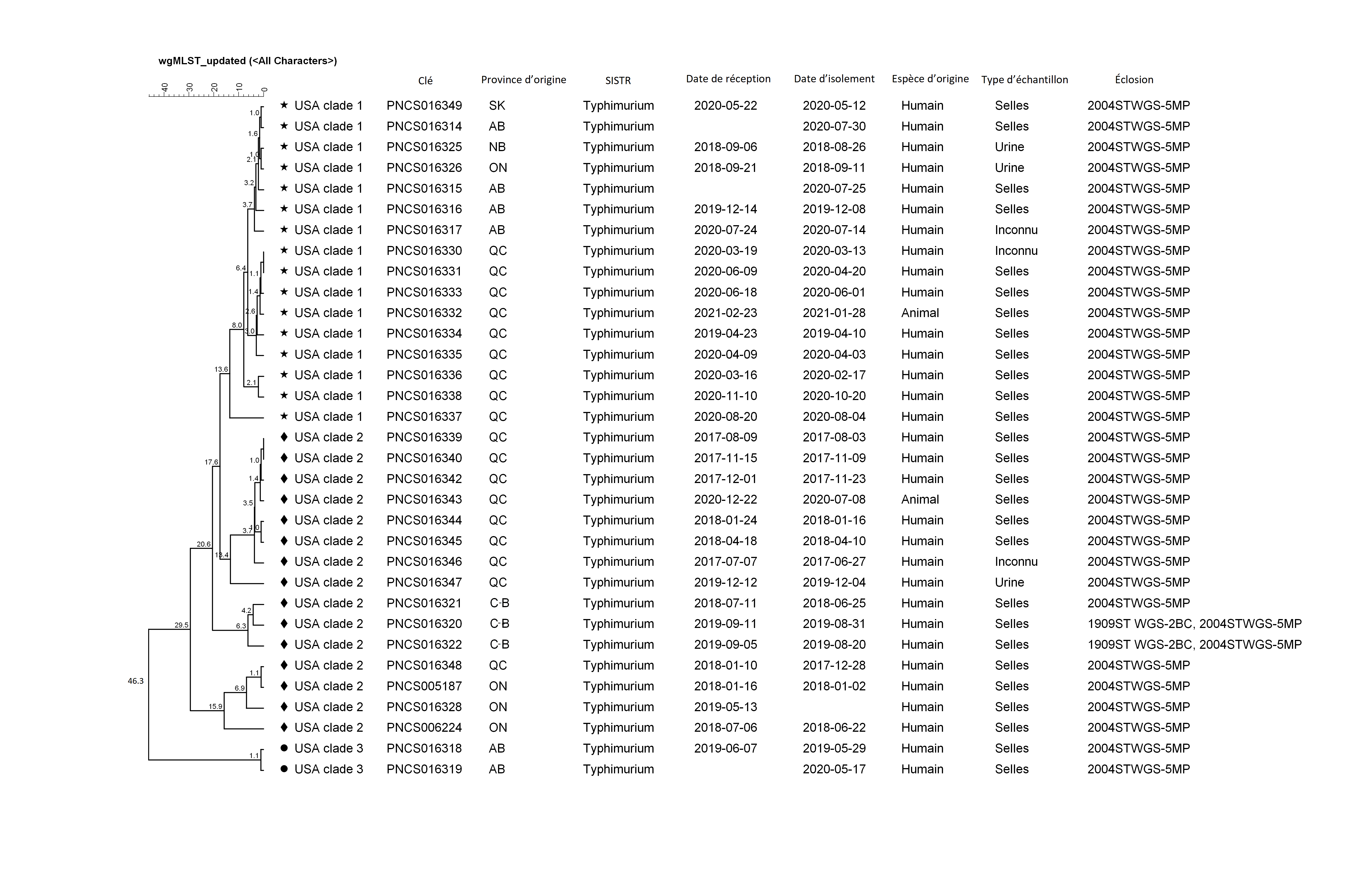
Description textuelle : Figure 3
Cette figure montre un dendrogramme, c’est-à-dire un diagramme qui montre la relation hiérarchique entre des objets, des isolats cliniques et des isolats de hérissons inclus dans l’enquête. Le champ clé indique l’identifiant de séquençage du génome entier d’un isolat qui est lié à son numéro d’accès dans le National Center for Biotechnology Information. Le dendrogramme UPMGA a été généré dans BioNumerics v7.6.3 sur la base de wgMLST en utilisant un coefficient de similarité catégorique. Les isolats se regroupent en 3 clades. Le clade 1 contient 15 isolats cliniques et 1 isolat de hérisson et est indiqué par un symbole d’étoile. Le clade 2 contient 14 isolats cliniques et 1 hérisson et est indiqué par un symbole de losange. Le clade 3 contient 2 isolats humains et est indiqué par un cercle.
Réponse et interventions en matière de santé publique
Un avis de santé publique a été émis par l’Agence le 6 novembre 2020 pour informer le public de l’éclosion et partager des conseils de prévention sur la façon d’interagir en toute sécurité avec les hérissons de compagnieNote de bas de page 7Note de bas de page 24. Des téléconférences ont été organisées par l’Agence et les CDC avec les membres de l’industrie des hérissons canadiens et américains pour les informer de l’éclosion et leur fournir des principes de prévention clés pour aider à réduire le risque de transmission de la maladie des hérissons aux humainsNote de bas de page 13Note de bas de page 14.
Discussion
Il s’agit de la deuxième éclosion de Salmonella liée à des hérissons de compagnie au Canada, et la première causée par S. TyphimuriumNote de bas de page 18. L’enquête a permis de déterminer 31 cas dans six provinces, de juin 2017 à octobre 2020. Avec 73 % des cas rapportant une exposition aux hérissons, les renseignements épidémiologiques ont fourni des preuves solides de la source de l’éclosion, renforcées par les enquêtes de laboratoire et de traçabilité. L’enquête a révélé un vaste réseau interrelié de fournisseurs de hérissons, les hérissons de certains cas étant liés à des fournisseurs communs, mais pas de source unique d’infections. Les résultats de cette enquête sur l’éclosion soulignent le risque de transmission de Salmonella des hérissons de compagnie à l’homme, comme décrit auparavantNote de bas de page 10Note de bas de page 18.
Comme dans le cas de cette éclosion, les enfants sont souvent touchés de manière disproportionnée dans les éclosions liées aux petits animaux de compagnieNote de bas de page 26Note de bas de page 32Note de bas de page 33Note de bas de page 34Note de bas de page 35Note de bas de page 36Note de bas de page 37. Les jeunes enfants présentent un risque plus élevé de développer une salmonellose plus grave, sont plus susceptibles de se faire tester et sont souvent plus susceptibles d’être exposés à la fois par un contact accru avec les animaux domestiques et par un lavage des mains moins vigilantNote de bas de page 5Note de bas de page 34Note de bas de page 35Note de bas de page 38Note de bas de page 39Note de bas de page 40Note de bas de page 41. Bien que la plupart des cas aient fait état d’un contact direct, seul un contact indirect a été signalé par 17 % des cas, dont deux enfants d’un an. Cela témoigne de la difficulté à prévenir la contamination croisée dans les foyers. Il n’est pas recommandé de garder des hérissons dans les foyers où vivent des enfants de moins de cinq ans et des pratiques d’hygiène strictes doivent être adoptées autour de ces animauxNote de bas de page 7.
L’analyse par SGE et les preuves épidémiologiques et de traçabilité ont permis de définir le cas et de caractériser la distribution de la souche de S. Typhimurium. La recherche des cas hautement apparentés des années précédentes a été limitée car l’analyse SGE des isolats de Salmonella a commencé en 2017. Néanmoins, des cas de 2017 à 2019 ont été établis, ce qui indique la présence de cette souche au Canada depuis au moins 2017. Cette souche a également provoqué des éclosions récurrentes d’infections humaines liées à des contacts avec des hérissons de compagnie aux États-Unis dès 2011–2013, ce qui suggère sa persistance dans l’industrie du hérissonNote de bas de page 6Note de bas de page 26Note de bas de page 27. Un lien direct avec le foyer américain concomitant a été établi au cours de l’enquête de traçabilité. Un éleveur de hérissons aux États-Unis a été lié à l’« éleveur D » du Québec, établi comme une source commune par huit cas, y compris le cas 13 du Québec dont l’isolat du hérisson était génétiquement lié à l’éclosion. Ce même éleveur américain était également lié à d’autres fournisseurs américains établis comme sources des hérissons des cas dans l’enquête américaineNote de bas de page 26.
L’élargissement de la définition de cas pour inclure des échantillons plus anciens de 2017 à 2019 a contribué à démontrer la persistance continue de cette souche chez les hérissons au Canada. Les échantillons plus anciens peuvent également tenir compte d’une base d’infections sporadiques pour cette éclosion de S. Typhimurium, avec 6 ou 7 cas par an, de 0 à 2 cas par mois et 0 à 5 mois entre les cas. La définition initiale des cas de l’éclosion, qui inclut les cas du 1er décembre 2019 ou après, serait donc plus précise, car entre cette date et octobre 2020, le nombre et la fréquence des cas ont dépassé l’incidence de référence. Les cas correspondant à la souche de l’éclosion ont ensuite diminué pour atteindre l’incidence mensuelle de référence prévue, et l’éclosion a été déclarée terminée le 18 décembre 2020. Étant donné que cette souche est un problème permanent chez les hérissons aux États-UnisNote de bas de page 26, et sur la base des renseignements épidémiologiques recueillis lors de cette éclosion, on peut confirmer que des cas sporadiques sont survenus et pourraient continuer à survenir au Canada avec une augmentation occasionnelle de l’incidence, ce qui pourrait signaler un événement d’éclosion. L’utilisation de SGE sera utile pour distinguer les maladies associées à des éclosions des maladies sporadiques. Dans le cas de cette éclosion, la communication par les États-Unis de leur éclosion et du signal précoce associé de contact avec le hérisson a également permis de renforcer les arguments en faveur d’un suivi épidémiologique supplémentaire des cas canadiens génétiquement apparentés et de mettre en évidence une source potentielle des maladies établies.
Les isolats provenant de cas dont les hérissons ont été retracés à une source commune se sont avérés être étroitement liés génétiquement. Par exemple, les isolats des huit cas et d’un hérisson associés au Québec « éleveur D » différaient par 16 allèles wgMLST ou moins, et les quatre isolats des cas associés au « grossiste A » de l’Alberta étaient à moins de quatre allèles de différence, contre 46 allèles de différence pour tous les isolats associés à l’éclosion. D’autres isolats associés à l’éclosion étaient également étroitement liés génétiquement, mais n’ont pas pu être rattachés à une source commune de hérissons, les résidences des cas étant réparties géographiquement dans tout le Canada et les dates d’apparition de la maladie couvrant un large éventail temporel. La proportion de cas par province a également varié dans le temps : des cas du Québec (52 % de tous les cas) ont été observés tout au long de la période de 2017 à 2020 alors que des cas de l’Alberta ont été observés en 2019–2020, ce qui suggère une introduction plus récente de la souche de l’éclosion en Alberta. Ces résultats pourraient s’expliquer par l’interconnexion et la dynamique du réseau de distribution des hérissons, mais des recherches supplémentaires seraient nécessaires pour les élucider.
Limites
Les limites de l’enquête comprennent 1) l’impossibilité d’interroger de nouveau tous les cas avec le questionnaire ciblé, car certains ont été liés rétrospectivement par SGE et 2) l’absence d’exposition au hérisson signalée par certains cas. Pour ces derniers, il est possible que ces cas aient eu une exposition indirecte inconnue aux hérissons. L’impossibilité d’interroger un plus grand nombre de fournisseurs de hérissons a également limité la compréhension complète de l’interconnexion dans le réseau de fournisseurs qui aurait pu fournir plus de détails sur les voies de transmission potentielles.
Conclusion
Cette enquête a bénéficié d’une bonne collaboration entre les partenaires canadiens de la santé publique et animale aux niveaux provincial et fédéral, l’industrie des petits animaux de compagnie, notamment le Conseil consultatif mixte de l’industrie des petits animaux de compagnie du Canada et les CDC. La communication entre ces groupes et avec le public avait pour but de sensibiliser et d’informer sur le risque d’infection à Salmonella par les hérissons et sur les bonnes pratiques d’hygiène, dans le but de prévenir la transmission de la maladie.
Bien que les taux de portage et la dynamique de transmission dans l’industrie des hérissons de compagnie ne soient pas bien caractérisés, l’extrapolation à partir de modèles de rongeurs indique que le portage de Salmonella peut être persistant et hétérogène, la majorité de la transmission se produisant par des supercontaminateurs fortement infectésNote de bas de page 42. Au cours de cette enquête, les membres de l’industrie des hérissons ont déclaré connaître la prévention de la transmission de Salmonella, mais un éleveur a déclaré avoir traité tous ses hérissons aux antibiotiques dès qu’il a appris l’existence de l’éclosion. On pense que les altérations du microbiote intestinal induites par les antibiotiques augmentent la probabilité de colonisation et d’excrétion; le traitement antibiotique est donc contre-indiqué dans les cas non cliniquesNote de bas de page 14Note de bas de page 42Note de bas de page 43. Une collaboration avec l’industrie des petits animaux de compagnie est nécessaire pour mieux comprendre la dynamique de la transmission et cibler les interventions visant à réduire les niveaux d’infection et les taux de transmission. Le secteur et ses clients doivent être sensibilisés aux méfaits de l’utilisation inconsidérée des antibiotiques, qui peut entraîner une augmentation de la transmission et la sélection de souches résistantes aux antibiotiques.
La forte proportion de jeunes enfants parmi les cas de cette éclosion souligne l’importance de fournir aux propriétaires potentiels de petits animaux de compagnie le matériel éducatif nécessaire pour qu’ils puissent prendre des décisions éclairées sur le choix de leur animal et appliquer les mesures de sécurité. Des rapports anecdotiques suggèrent une augmentation de la possession d’animaux de compagnie pendant la pandémie de maladie à coronavirus 2019Note de bas de page 44Note de bas de page 45, ce qui peut inclure les petits petits animaux de compagnie comme les hérissons. Tout en reconnaissant les avantages d’avoir un animal de compagnie, ce foyer de S. Typhimurium est un rappel opportun de l’importance de la sensibilisation et de l’éducation à la Salmonella parmi les fournisseurs et les propriétaires de petits animaux de compagnie, afin de prévenir la transmission de la maladie.
Déclaration des auteurs
- K. F. G. — Conceptualisation, analyse et interprétation des données, rédaction de l’article
- L. D. — Analyse et interprétation des données, rédaction de l’article, visualisation
- J. T. — Conceptualisation, interprétation des données, rédaction et révision de l’article
- R. J. — Enquête, révision de l’article
- O. V. O. — Enquête, révision de l’article
- A. K. — Investigation, méthodologie, révision de l’article
- C. M. — Investigation, méthodologie, révision de l’article
- C. N. — Enquête, révision de l’article
- C. G. — Enquête, révision de l’article
- V. M. — Enquête, révision de l’article
- R. S. — Enquête, révision de l’article
- M. W. — Enquête, révision de l’article
- B. A. — Enquête, révision de l’article
- H. S. — Enquête, révision de l’article
- A. M. L. — Conceptualisation, analyse et interprétation des données, rédaction et révision du document, supervision
Intérêts concurrents
Aucun conflit d’intérêts à déclarer.
Remerciements
Les auteurs tiennent à remercier tous les membres du Comité national de coordination des enquêtes sur les éclosions pour leur contribution à cette enquête (Centre de contrôle et de prévention des maladies de la Colombie-Britannique, ministère de la santé de l’Alberta, Services de santé de l’Alberta, ministère de la santé de la Saskatchewan, Santé publique Ontario, ministère de la Santé de l’Ontario, ministère de la Santé du Nouveau-Brunswick, le ministère de la Santé et des Services sociaux du Québec, le ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec, le ministère des Forêts, de la Faune et des Parcs et l’Agence de la santé publique du Canada). Les auteurs remercient également les Services de référence du Laboratoire national de microbiologie pour leur travail d’analyse SGE, le laboratoire provincial de la Saskatchewan, le laboratoire provincial de l’Alberta, le laboratoire provincial du Nouveau-Brunswick, le Laboratoire de santé publique du Québec, la Dre I. Langlois du Service de médecine zoologique du Centre universitaire de santé vétérinaire de l’Université de Montréal pour leur consultation et leurs conseils, et le Conseil consultatif mixte de l’industrie des petits animaux de compagnie des États-Unis et du Canada pour son aide dans l’organisation des appels avec l’industrie du hérisson.
Financement
Ce travail a été soutenu par l’Agence de santé publique du Canada.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International