Éclosion de Burkholderia stabilis associée à l’utilisation d’un gel à ultrasons

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 49-7/8, juillet/août 2023 : Les maladies entériques : un problème de santé important au Canada
Date de publication : juillet/août 2023
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 49-7/8, juillet/août 2023 : Les maladies entériques : un problème de santé important au Canada
Rapport d’éclosion
Éclosion de Burkholderia stabilis associée à l’utilisation d’un gel à ultrasons dans plusieurs centres de soins de santé à Montréal, Canada, de mai à octobre 2021
Christine Arsenault1,2, Josée Harel3, Florence Doualla-Bell3, Yiorgos Alexandros Cavayas1,4, Xavier Marchand-Sénécal2,5, Charles Frenette6,7, Yves Longtin7,8, Linda Lalande1,9, L Marie-Paule Diby1,9, Nadia Desmarais1,9
Affiliations
1 Hôpital du Sacré-Cœur-de-Montréal, Montréal, QC
2 Département de microbiologie, infectiologie et immunologie, Faculté de médecine, Université de Montréal, Montréal, QC
3 Laboratoire de santé publique du Québec/Institut national de santé publique du Québec, Sainte-Anne-de-Bellevue, QC
4 Département de médecine, Faculté de médecine, Université de Montréal, Montréal, QC
5 Hôpital Maisonneuve-Rosemont, Montréal, QC
6 Centre universitaire de santé McGill, Montréal, QC
7 Division des maladies infectieuses, Faculté de médecine et des sciences de la santé, Université McGill, Montréal, QC
8 Hôpital général juif, Montréal, QC
9 Service de prévention et contrôle des infections du CIUSSS du Nord de l’Île de Montréal, Montréal, QC
Correspondance
Citation proposée
Arsenault C, Harel J, Doualla-Bell F, Cavayas YA, Marchand-Sénécal X, Frenette C, Longtin Y, Lalande L, Diby LM-P, Desmarais N. Éclosion de Burkholderia stabilis associée à l’utilisation d’un gel à ultrasons dans plusieurs centres de soins de santé à Montréal, Canada, de mai à octobre 2021. Relevé des maladies transmissibles au Canada 2023;49(7/8):348–53. https://doi.org/10.14745/ccdr.v49i78a03f
Mots-clés : éclosion, Burkholderia stabilis, gel à ultrasons, Canada
Résumé
Contexte : Burkholderia stabilis est une bactérie à coloration Gram négatif non fermentaire qui a déjà été impliquée dans de nombreuses éclosions nosocomiales dues à l’utilisation de substances et de dispositifs médicaux contaminés. Cet article porte sur une éclosion d’infections et de colonisations par B. stabilis, impliquant 11 patients de cinq hôpitaux de soins aigus à Montréal, Canada.
Méthodes : Un échantillon n’était pas disponible pour analyse, mais les 10 isolats restants (91 %) ont été envoyés pour une analyse phylogénétique. Du matériel médical et l’environnement des patients ont également été échantillonnés et cultivés. Les isolats bactériens ont été analysés par pulsotypage et par typage génomique par séquençage.
Résultats : L’éclosion a été attribuée à l’utilisation d’un gel à ultrasons non stérile intrinsèquement contaminé. La parenté des souches de B. stabilis du gel et des patients a été démontrée par des analyses du pulsotypage et du typage génomique par séquençage. L’enquête s’est conclue par un rappel rapide du produit et l’éclosion s’est terminée à la fin du mois d’octobre 2021.
Conclusion : Le gel non stérile contaminé a provoqué des infections et des pseudo-infections chez plusieurs patients.
Introduction
Le 25 juillet 2021, l’équipe médicale chargée des consultations en maladies infectieuses a reçu un nombre inhabituellement élevé de demandes (n = 3) concernant des bactériémies à Burkholderia stabilis dans l’unité de soins intensifs de l’Hôpital du Sacré-Cœur-de-Montréal, un hôpital universitaire de 440 lits situé à Montréal, Canada. Ces demandes inhabituelles ont suscité des inquiétudes quant à l’éventualité d’une éclosion et ont donné lieu à une enquête officielle.
Burkholderia stabilis est un bacille à coloration de Gram négatif non fermentaire opportuniste et un saprophyte omniprésent dans l’environnement. Ce membre du complexe B. cepacia a été associé à des éclosions nosocomiales d’infections respiratoires chez des patients atteints de fibrose kystique, mais il peut également provoquer des infections non respiratoires dans d’autres populations par la contamination de divers dispositifs médicaux. Les gants de lavageNote de bas de page 1, la chlorhexidineNote de bas de page 2, le rince-bouche sans alcoolNote de bas de page 3 et les médicamentsNote de bas de page 4 se sont tous révélés être des sources de contamination lors d’éclosions nosocomiales antérieures dues au complexe B. cepacia. Même si le gel à ultrasons non stérile et à usage multiple est approprié pour une utilisation sur une peau intacte et sur des dispositifs non critiques, on sait qu’il favorise la croissance de bactéries pathogènesNote de bas de page 5 et a été associé à plusieurs éclosions du complexe B. cepacia dans différents contextesNote de bas de page 6Note de bas de page 7Note de bas de page 8.
L’étude épidémiologique de l’éclosion, l’analyse phylogénétique et la prise en charge ultérieure sont décrites afin de prévenir d’autres cas.
Méthode
Détection de l’éclosion
Le 25 juillet 2021, l’apparition d’une éclosion d’infections sanguines nosocomiales de source inconnue a été soupçonnée. Une enquête a été lancée par l’équipe de prévention et de contrôle des infections afin de trouver la source et d’éviter l’exposition d’autres patients. Tout d’abord, le système d’information du laboratoire a été interrogé sur les échantillons de culture positifs antérieurs à B. stabilis ou au complexe B. cepacia. Une hémoculture positive (un ou plusieurs flacons) antérieure pour la bactérie B. stabilis a été détectée le 30 mai 2021, mais l’isolat avait été éliminé entre-temps, conformément au protocole du laboratoire. On a considéré que ce premier cas faisait partie du foyer, même si son isolat n’avait pas contribué à l’analyse. Au total, quatre patients ont donc eu au moins une hémoculture positive à B. stabilis au cours des six semaines, dont trois isolats étaient disponibles pour une analyse plus poussée. Chez trois patients, la culture positive a été prélevée 48 heures ou plus après l’admission, et chez un patient, l’hémoculture positive a été prélevée le jour de l’admission. Une définition de cas préliminaire a été établie comme une hémoculture positive à B. stabilis prélevée le troisième jour après l’admission à l’hôpital ou plus tard au cours de la période de trois mois précédant le 25 juillet 2021. Cette définition a été utilisée pour cadrer avec la définition de cas d’une bactériémie nosocomiale par le programme de surveillance provincialNote de bas de page 9. La présence de symptômes ou un diagnostic d’infection n’étaient pas nécessaires aux fins d’inclusion. Lorsqu’aucun symptôme n’était attribué à la bactérie retrouvée dans un échantillon clinique, celle-ci était considérée comme un contaminant ou un colonisateur. Nous avons défini un contaminant comme un organisme détecté par culture, mais qui aurait été introduit dans le processus de prélèvement du liquide ou de l’organe, mais qui serait absent du liquide ou de l’organe lui-même. Un colonisateur est un organisme saprophyte détecté par culture, mais qui ne provoque pas de maladie.
La définition d’un cas possible incluait tout patient présentant une culture positive à B. stabilis ou au complexe B. cepacia, quel que soit le site (autre que le sang), qu’il s’agisse d’une infection nosocomiale ou acquise dans la collectivité, au cours de la période de trois mois précédant le 25 juillet 2021.
Enquêtes
Les premières observations ont été effectuées au service de soins intensifs, où les quatre cas avaient été recensés. Les 29 et 30 juillet, les conseillères en prévention des infections ont vérifié diverses techniques de soins prodigués aux patients et des procédures connexes, notamment le bain avec des gants à usage unique, l’hygiène buccale, l’utilisation de thermomètres, la manipulation de cathéters veineux centraux, l’utilisation d’eau stérile, la manipulation de flacons de gel à ultrasons à usage multiple et la désinfection d’appareils non critiques.
Par la suite, des échantillons de matériel propre et stérile ont été prélevés et envoyés aux fins de culture. Les sites d’insertion des cathéters centraux ont également fait l’objet d’un écouvillonnage. Le matériel échantillonné comprenait du gel à ultrasons non stérile ouvert et scellé, du gel à ultrasons stérile, des gants de lavage commerciaux à usage unique, des lingettes à la chlorhexidine, de l’eau stérile et du rince-bouche.
Les cultures ont été incubées sur une gélose au sang de mouton à 5 % et sur une gélose MacConkey pendant 48 heures à l’air ambiant à 37 °C. Les colonies morphologiquement compatibles ont été soumises aux fins d’identification à l’aide du système VITEK MS à l’aide de la base de données v3.1 (bioMérieux, France).
Analyses du pulstotypage et du typage génomique par séquençage
L’analyse du typage moléculaire des isolats de B. stabilis a été réalisée par pulsotypage (PFGE) et par typage génomique par séquençage (MLST)Note de bas de page 10Note de bas de page 11. Le pulsotypage a été réalisé au Laboratoire de santé publique du Québec. Le typage génomique par séquençage des isolats de B. stabilis a été effectué par le Laboratoire national de microbiologie du Canada selon le protocole et les amorces spécifiés dans une base de données publique de données de séquençage du MLSTNote de bas de page 10Note de bas de page 11Note de bas de page 12.
Interventions
Le 30 juillet, des cultures positives ont été obtenues à partir de contenants de gel à ultrasons ouverts et scellés provenant des unités de soins intensifs. L’utilisation de tous les produits semblables a immédiatement été interrompue dans les unités de soins intensifs de l’Hôpital du Sacré-Cœur-de-Montréal et des hôpitaux affiliés. Lorsque d’autres cultures positives ont été obtenues à partir de contenants de gel à ultrasons provenant d’autres unités, tous les flacons de gel ont été jetés et remplacés par un produit de remplacement, soit le 2 août.
La Santé publique de Montréal a été informée le 2 août d’une contamination présumée de contenants de gel à ultrasons. Un avis a été envoyé aux médecins et aux laboratoires, et des échantillons cliniques provenant d’autres hôpitaux de la région de Montréal ont été envoyés au laboratoire provincial de santé publique.
Le ministère provincial de la Santé a été informé le 4 août et Santé Canada le 6 août. Une plainte officielle a été déposée auprès du fabricant le 4 août et le produit a été rappelé le même jour. Afin de recenser d’autres cas liés à l’éclosion dans d’autres établissements de soins de santé de la province de Québec, une recherche dans la base de données microbiologiques a été effectuée dans plusieurs hôpitaux qui utilisaient la même marque de gel à ultrasons. Les cultures provenant de tout site stérile positif à B. stabilis et au complexe B. cepacia ont été répertoriées. Les dossiers médicaux des patients présentant des cultures positives ont été examinés par des consultants locaux en maladies infectieuses afin de déterminer si la culture positive représentait une véritable infection, un contaminant ou une colonisation. Les patients ont reçu des soins et un traitement antimicrobien en conséquence.
Résultats
Au cours de l’éclosion, un total de 11 cas d’infections et de pseudo-infections (détection d’un colonisateur ou d’un contaminant dans un échantillon envoyé aux fins de culture) ont été découverts dans cinq hôpitaux de Montréal, dont 10 isolats étaient disponibles aux fins d’analyse; huit échantillons ont été prélevés entre du 16 juillet au 24 août et les deux derniers ont été prélevés le 20 septembre et le 18 octobre 2021 (figure 1). Le 11e isolat avait été éliminé avant que l’éclosion soit déclarée.
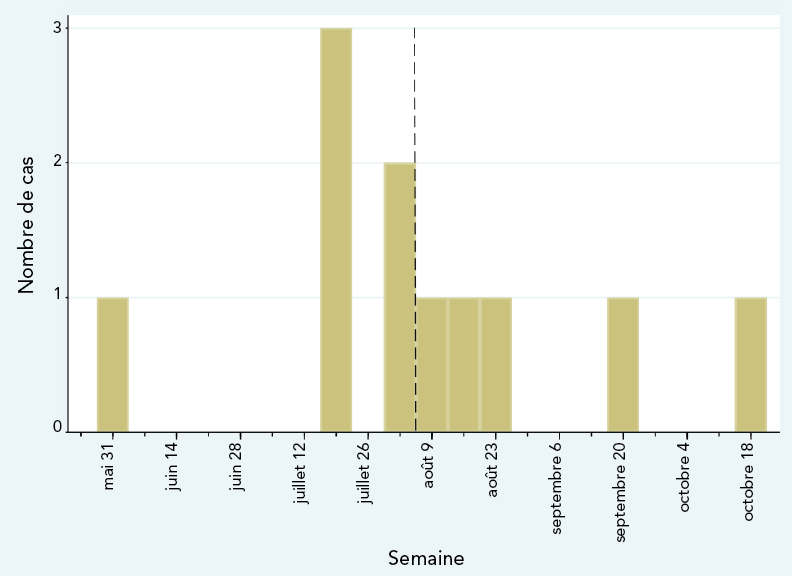
Figure 1 - Équivalent textuel
Le graphique montre le nombre de cas d’infection et de pseudo-infections par Burkholderia stabilis signalés par semaine de collecte du premier échantillon positif pour chaque cas. Le premier événement a eu lieu le 30 mai. Aucun autre cas n’a été recensé jusqu’à la semaine du 19 juin, au cours de laquelle trois cas ont été recensés, ce qui constitue le nombre le plus élevé de cas recensés en une seule semaine. La plupart des cas ont été regroupés en juillet et en août, avec seulement un cas supplémentaire par mois en septembre et en octobre. Le dernier cas a été signalé le 18 octobre.
On a considéré que l’éclosion était terminée à la fin du mois d’octobre 2021, car aucun autre cas n’a été signalé et que la source à l’origine de l’éclosion n’était plus en activité.
La définition de cas utilisée pour lancer l’enquête s’est avérée trop restrictive, car des échantillons génétiquement reliés à l’éclosion ont été prélevés dans des sites stériles et non stériles. Par conséquent, la définition de cas a été revue et mise à jour le 30 juillet afin d’inclure tous les cas d’infection et de pseudo-infections par une souche génétiquement reliée de B. stabilis récupérée à partir de n’importe quel type de spécimen corporel.
Parmi les 33 échantillons prélevés sur du matériel médical et dans l’environnement des patients, six échantillons prélevés dans différents flacons de gel à ultrasons étaient positifs à B. stabilis. Cinq de ces bouteilles étaient toujours scellées au moment de l’échantillonnage et une était ouverte et en usage. B. stabilis était la seule bactérie détectée en culture. Tous les autres échantillons étaient négatifs. Les isolats ont été envoyés au laboratoire de référence de la santé publique pour une analyse plus approfondie. Tous les isolats étaient clonaux après l’analyse de la séquence. On a considéré que tous les isolats, sauf un, étaient définitivement liés à l’issue de l’analyse PFGE, car ils présentaient un schéma PFGE unique pour l’enzyme de restriction Spel (pulsovar A). On a considéré que l’un d’entre eux était probablement relié à l’éclosion, car il présentait un schéma de Spel très similaire (pulsovar A2). En outre, tous les isolats présentaient le même profil MLST et ont été désignés comme étant de type MLST ST51, ce qui confirme leur parenté.
Aucun décès n’a été attribué à une infection associée à cette éclosion. Même s’il est possible que des épisodes de soins médicaux aient été compliqués par une hémoculture positive, il n’a pas été possible de vérifier ou de quantifier cet impact. Les patients présentaient des profils cliniques très variés. Les caractéristiques cliniques pertinentes sont présentées dans le tableau 1. Étant donné qu’aucune infection du site chirurgical n’a été signalée, les interventions chirurgicales ne sont pas incluses dans les données rapportées.
| Hôpital | Motif de l’admission |
Procédures impliquant l’utilisation d’un gel à ultrasons avant ou au moment des cultures positives |
Type de spécimens |
Signification du résultat de la culture selon le consultant en maladies infectieuses |
|---|---|---|---|---|
1 |
Traumatisme |
Insertion d’un cathéter veineux central Examen FAST |
Hémocultures |
Infection |
2 |
Arrêt cardiaque |
Cathéter veineux central inséré par voie périphérique, échocardiogramme par voie transthoracique |
Sécrétions endotrachéales |
Colonisation |
2 |
Naissance |
Surveillance fœtale externe |
Cultures du sang du cordon ombilical |
Contaminant |
2 |
Chute |
Cathéter veineux central inséré par voie périphérique |
Hémocultures |
Infection |
3 |
Traumatisme |
Insertion d’un cathéter veineux central Examen FAST |
Hémocultures |
Infection |
3 |
Affection neurologique |
Cathéter veineux central inséré par voie périphérique Cavographie veineuse (par échographie de surface) |
Hémocultures |
Infection |
3 |
Affection neurologique |
Échographie cardiaque par voie transthoracique |
Hémocultures |
Infection |
3 |
Traumatisme |
Échographie cardiaque par voie transthoracique |
Hémocultures |
Infection |
4 |
Affection orthopédique |
Échographie des articulations |
Liquide synovial |
Contaminant |
5 |
Insuffisance cardiaque congestive |
Insertion d’un cathéter veineux central, angiogramme mésentérique et embolisation, insertion d’un cathéter de dialyse |
Lavage broncho-alvéolaire |
Infection |
Discussion
Ce rapport fait état d’une éclosion de B. stabilis associée à l’utilisation d’un gel à ultrasons non stérile contaminé. Dix isolats cliniques et six isolats provenant de contenants de gel à ultrasons ouverts et scellés ont montré une parenté par les analyses PFGE et MLST, appuyant l’hypothèse selon laquelle le gel à ultrasons est à l’origine de l’éclosion. La plupart des patients étaient hospitalisés dans une unité de soins intensifs, et nombre d’entre eux avaient un cathéter veineux central en place ou étaient intubés.
Une enquête semblable faisant état de 119 cas d’infections à B. stabilis contractées à partir de gel à ultrasons produit par le même fabricant a été menée aux États-Unis au cours de la même période Note de bas de page 13; les résultats de cette enquête sont cohérents avec nos constats et étayent nos conclusions.
Dans cette éclosion, la contamination intrinsèque du produit s’est produite à l’étape de la fabrication, comme le montre la présence de souches bactériennes dans les flacons de gel scellés. Les organismes du complexe B. cepacia sont fréquemment impliqués dans les rappels de produits non stérilesNote de bas de page 14. Ces bactéries sont souvent résistantes aux biocides utilisés pour prévenir la prolifération bactérienne et peuvent survivre pendant des périodes prolongées dans des environnements pauvres en nutriments. Ils sont une cause fréquente de contamination des composés pharmaceutiques, qui peut se produire en raison de surfaces et de matériaux contaminés, mais le plus souvent par l’inclusion d’eau contaminéeNote de bas de page 14. Alors que les produits non stériles sont vulnérables à la contamination, les produits stériles sont fabriqués dans des environnements exempts de bactéries à l’aide de matériaux stériles et sont donc beaucoup moins susceptibles de donner lieu à un produit contaminé.
Le mécanisme exact permettant au gel contaminé non stérile d’entraîner une bactériémie n’est pas clair et est probablement multifactoriel. Les audits visuels n’ont pas révélé de non-respect des normes d’insertion des cathéters centrauxNote de bas de page 15 ou de désinfection des dispositifs non critiquesNote de bas de page 16, mais on a noté que le gel à ultrasons était parfois retiré rapidement à l’aide d’un chiffon sec après un examen au chevet du patient. Toutefois, ces audits sont, par leur nature, limités à un petit nombre d’observations. Même si le gel à ultrasons non stérile doit seulement être utilisé sur une peau intacteNote de bas de page 5, des éclosions semblables liées à un gel contaminé se sont produitesNote de bas de page 6Note de bas de page 7Note de bas de page 8. Nous formulons l’hypothèse que la contamination de la peau intacte des patients vulnérables entraîne des modifications du microbiome cutané et une colonisation par B. stabilis. Burkholderia stabilis est plus susceptible d’être un organisme causal si ces patients colonisés contractent ensuite une infection associée aux soins de santé. Cela suggère que le gel stérile devrait être privilégié avant une procédure invasive imminente, en tant qu’intervention simple qui devrait réduire la probabilité d’événements similaires.
La plupart des cas se sont produits sur une courte période, mais deux cas phylogénétiquement reliés à l’éclosion se sont produits après le mois d’août, le dernier s’étant produit le 18 octobre. Même s’il n’a pas été possible de prouver cette hypothèse, une explication probable est que certains flacons de gel n’ont pas été jetés immédiatement après le rappel et étaient encore utilisés lors du dernier cas. La mise en œuvre d’une surveillance prospective temporaire à la suite d’un rappel de produit pourrait contribuer à remédier à cette situation et à garantir le confinement de l’éclosion.
L’un des points forts de cette enquête a été l’identification rapide de la source, ce qui a permis de rappeler rapidement le produit contaminé. La relation de cause à effet entre les cas et le produit est étayée par la parenté des souches bactériennes, démontrée à l’aide de multiples techniques validées. Bien que cela ne prouve pas que le gel à ultrasons soit à l’origine de toutes les infections et pseudo-infections, il serait peu probable d’observer une telle similitude génétique entre les bactéries prélevées dans un produit utilisé sur la peau des patients et des spécimens cliniques due au seul hasard, compte tenu de la rareté de cet agent pathogène dans la pratique de l’infectiologie. Même si un nombre suffisant d’isolats a été récupéré pour confirmer l’association, l’isolat du cas le plus ancien n’était pas disponible pour être analysé. Aucune procédure systématique n’a été mise en place pour transmettre les isolats de B. stabilis au laboratoire de santé publique; par conséquent, nos échantillons ne témoignent pas l’ampleur de l’éclosion dans son ensemble. Nous avons estimé qu’un nombre suffisant de données confirmait l’association entre le gel à ultrasons et les cultures positives d’échantillons cliniques, de sorte qu’aucune étude cas-témoins n’a été réalisée.
Cet article décrit une éclosion d’infections et de pseudo-infections par B. stabilis, attribuée à un gel à ultrasons intrinsèquement contaminé. Le gel à ultrasons non stérile est vulnérable à la contamination par des agents pathogènes bactériens au moment de la fabrication et à la contamination croisée d’origine humaine après l’introduction dans l’utilisation clinique. Les centres de soins de santé doivent rester conscients du risque de contamination de ces produits qui pourrait provoquer des éclosions multicentriques. L’utilisation universelle de contenants stériles à usage unique pour les gels à ultrasons pourrait constituer un avantage théorique, mais notre étude ne permet pas de déterminer si le passage à des gels stériles pourrait améliorer les résultats pour les patients. Néanmoins, notre étude soutient la notion généralement acceptée selon laquelle les gels stériles à usage unique doivent être privilégiés aux gels non stériles à usage multiple dans les contextes à risque, tels que les procédures invasives, les procédures impliquant du matériel stérile et les procédures sur les muqueuses ou la peau non intacteNote de bas de page 5.
Déclaration des auteurs
- C. A. — Rédaction du projet original, enquête, rédaction, révision et édition
- J. H. — Enquête, rédaction, révision et édition
- F. D. B. — Enquête, rédaction, révision et édition
- Y. A. C. — Rédaction, révision et édition
- X. M. S. — Enquête, rédaction, révision et édition
- C. F. — Enquête, rédaction, révision et édition
- Y. L. — Enquête, rédaction, révision et édition
- L. L. — Enquête, rédaction, révision et édition
- L. M. P. D. — Enquête, rédaction, révision et édition
- N. D. — Enquête, rédaction, révision et édition
Le contenu et le point de vue exprimés dans cet article sont ceux des auteurs et ne reflètent pas nécessairement ceux du gouvernement du Canada.
Intérêts concurrents
Y. L. a reçu du soutien pour la recherche de Syneos Health pour des travaux non liés à la présente étude.
Remerciements
Nous sommes reconnaissants à l’Unité spéciale de bactériologie du Laboratoire national de microbiologie du Canada d’avoir fourni la spéciation et le typage de Burkholderia par MLST. Nous sommes également reconnaissants de l’excellente assistance technique des employés de laboratoire et des praticiens de la prévention des infections de tous les hôpitaux concernés.
Financement
Aucun.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International