Rapport sur l'hépatite B et l'hépatite C au Canada : 2016

Télécharger le format de rechange
(Format PDF, 2.9 Mo, 55 pages)
Organisation : Agence de la santé publique du Canada
Publiée : 2019-04-05
Table des matières
- Avant-propos
- Remerciements
- Abréviations
- Résumé
- 1.0 Méthodologie
- 2. Hépatite B
- 3.0 Hépatite C
- Références
- Annexe A : Définitions de cas
- Annexe B : Taux déclarés d'infection aiguë et chronique par le VHB au Canada, entre 2007 et 2016
- Annexe C : Déclaration des infections par le VHC au Canada, SCSMDO, entre 2007 et 2016
- Annexe D : Taux des cas déclarés d'infection par le VHC pour 100 000 personnes au Canada, selon le sexe et le groupe d'âge, SCSMDO, entre 2007 et 2016
Avant-propos
Le Centre de la lutte contre les maladies transmissibles et les infections de l'Agence de la santé publique du Canada (ASPC) a le plaisir de vous présenter le Rapport sur l'hépatite B et l'hépatite C au Canada : 2016. Le présent rapport vise à fournir de l'information sur les tendances relatives aux cas et aux taux de l'infection par le virus de l'hépatite B (VHB) et le virus de l'hépatite C (VHC) à toute personne qui requiert des données de surveillance, comme les gestionnaires de programmes, les responsables des politiques et les chercheurs, entre autres.
L'hépatite virale est une inflammation du foie causée par l'un des cinq virus de l'hépatite. L'hépatite B et l'hépatite C sont les virus de l'hépatite transmissibles par le sang les plus courants et font l'objet du présent rapport. Bien qu'elles soient distinctes, l'infection par le VHB et l'infection par le VHC peuvent toutes les deux causer une infection aiguë asymptomatique ou symptomatique. L'infection par l'un de ces deux virus peut progresser jusqu'à devenir une infection chronique, et elle peut entraîner une maladie grave et le décès prématuré.
L'infection par le VHB et l'infection par le VHC sont des maladies à déclaration obligatoire au Canada. Le Rapport sur l'hépatite B et l'hépatite C au Canada : 2016 est fondé sur les données de surveillance déclarées au Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO) par les autorités sanitaires provinciales et territoriales.
Tous les commentaires et toutes les suggestions susceptibles d'améliorer les publications à venir sont appréciés. Nous vous invitons d'ailleurs à les adresser au personnel du Centre de la lutte contre les maladies transmissibles et les infections, Agence de la santé publique du Canada, à l'adresse ccdic-clmti@phac-aspc.gc.ca.
Remerciements
La publication du présent rapport n'aurait pas été possible sans la collaboration des unités épidémiologiques de l'ensemble des provinces et des territoires. Nous leur sommes très reconnaissants de leur contribution continue à la surveillance nationale de l'infection par le VHB et de l'infection par le VHC.
Ce rapport a été préparé par le Centre de la lutte contre les maladies transmissibles et les infections de la Direction générale de la prévention et du contrôle des maladies infectieuses de l'Agence de la santé publique du Canada.
Abréviations
- ADN
- Acide désoxyribonucléique
- Alb.
- Alberta
- ARN
- Acide ribonucléique
- ASPC
- Agence de la santé publique du Canada
- C.-B.
- Colombie-Britannique
- CDC
- US Centres for Disease Control and Prevention
- CLMTI
- Centre de la lutte contre les maladies transmissibles et les infections
- ECMS
- Enquête canadienne sur les mesures de la santé
- EIA
- Épreuve immunoenzymatique
- É.-U.
- États-Unis
- Î.-P.-E.
- Île-du-Prince-Édouard
- Man.
- Manitoba
- N.-B.
- Nouveau-Brunswick
- N.-É.
- Nouvelle-Écosse
- Nt
- Nunavut
- Ont.
- Ontario
- PCSS
- Programme de contributions pour la sûreté du sang
- Qc
- Québec
- RCITO
- Registre canadien des insuffisances et des transplantations d'organes
- Sask.
- Saskatchewan
- SCS
- Société canadienne du sang
- SCSMDO
- Système canadien de surveillance des maladies à déclaration obligatoire
- SSIT
- Système de surveillance des incidents transfusionnels
- T.-N.-L.
- Terre-Neuve-et-Labrador
- T.N.-O.
- Territoires du Nord-Ouest
- VHB
- Virus de l'hépatite B
- VHC
- Virus de l'hépatite C
- VIH
- Virus de l'immunodéficience humaine
- Yn
- Yukon
Résumé
Le présent rapport résume les données de surveillance sur les cas et les taux de l'infection par le virus de l'hépatite B (VHB) et de l'infection par le virus de l'hépatite C (VHC) au Canada, qui ont été déclarés entre 2007 et 2016. Les cas d'infection par le VHB et le VHC sont déclarés au Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO) par les autorités sanitaires provinciales et territoriales. Les renseignements sur l'infection aiguë par le VHB donnent un aperçu utile des tendances et des profils actuels de transmission, tandis que les cas d'infection chronique par le VHB et par le VHC illustrent le fardeau possible de la maladie au Canada.
L'hépatite B et l'hépatite C dans un contexte mondial
Selon l'Organisation mondiale de la santé (OMS), l'hépatite virale, y compris les infections par le VHB et le VHC, constitue un lourd fardeau pour la santé publique mondiale et a une énorme incidence sur la morbidité et la mortalité. C'est dans ce contexte que l'OMS a publié, en 2016, la toute première Stratégie mondiale du secteur de la santé sur l'hépatite virale. Cette stratégie vise l'élimination de l'hépatite virale virale (incluant celles causées par le VHB et le VHC) comme menace à la santé publique d'ici 2030Référence 1Référence 2. Une surveillance robuste et renforcée contribuera de manière importante à relever ce défi et favorisera le suivi des progrès vers l'atteinte de l'élimination des hépatites virales.
Hépatite B
Infections aiguës
En 2016, 187 cas d'hépatite B aiguë ont été signalés au Canada. Le taux d'infections aiguës par le VHB déclarées a diminué; il est passé de 1,0 à 0,5 cas pour 100 000 personnes entre 2007 et 2016. Au cours de cette période de dix ans, le taux de cas déclarés a diminué autant chez les hommes que chez les femmes de tous les groupes d'âge. En 2016, les hommes ont constamment affiché des taux plus élevés d'infection aiguë par le VHB dans les groupes d'âge de 25 ans et plus. En 2016, des taux de cas déclarés supérieurs au taux national de 0,5 cas pour 100 000 personnes ont été observés au Nouveau-Brunswick, en Nouvelle-Écosse, au Manitoba et en Ontario (1,3, 1,1, 1,0 et 0,8 pour 100 000 personnes respectivement).
Infections chroniques
En ce qui concerne l'infection chronique par le VHB, le taux de cas déclarés a fluctué entre 2007 et 2016, sans qu'aucune tendance précise ne se dégage. En 2016, 4 196 cas d'infection chronique par le VHB ont été déclarés au Canada, ce qui équivaut à un taux national de 11,8 pour 100 000 personnes. Entre 2007 et 2016, le taux d'infection chronique par le VHB est demeuré plus élevé chez les hommes que chez les femmes.
En 2016, les taux d'infection chronique par le VHB étaient plus élevés chez les hommes que chez les femmes dans tous les groupes d'âge, à l'exception des 15 à 29 ans. Cette année-là, les hommes de 30 à 39 ans affichaient le taux le plus élevé d'infection chronique par le VHB (28,8 pour 100 000 personnes), suivis des femmes du même groupe d'âge (23,7 pour 100 000 personnes). De plus, la Colombie-Britannique, le Yukon, l'Alberta et l'Ontario ont déclaré des taux (23,4, 21,0, 13,5 et 12,1 pour 100 000 personnes respectivement) supérieurs au taux national de 11,8 pour 100 000 personnes.
Divers facteurs peuvent expliquer les tendances décrites dans le présent rapport. Ainsi, le programme universel canadien de vaccination ciblant les bébés et les enfants d'âge scolaire et, dans certaines provinces et certains territoires, les populations à risque élevé, a probablement contribué à la baisse des taux d'infection aiguë par le VHB. D'autres interventions axées sur le contrôle des infections et interventions en matière de santé publique visant à prévenir la transmission des infections transmissibles sexuellement et par le sang peuvent aussi avoir eu une incidence sur les tendances observées.
Il convient de noter que les taux nationaux d'infection par le VHB sont fortement influencés par les variations des pratiques de déclaration d'ordre géographique et temporel et devraient donc être interprétés avec prudence. Les provinces et les territoires n'ont pas la même capacité à distinguer les infections par le VHB selon leur état sérologique (aiguë ou chronique); par conséquent, la déclaration du VHB n'est pas uniforme dans l'ensemble du pays, et un grand nombre de cas d'hépatite B sont déclarés comme étant non précisés. Entre 2007 et 2016, environ 15 % de tous les cas d'hépatite B ont été déclarés comme non précisés. Ces cas non précisés ne sont pas inclus dans le présent rapport.
Hépatite C
La plupart des provinces et des territoires déclarent les cas d'infection par le VHC sans distinction entre les stades aigu et chronique. Par conséquent, pour les besoins du présent rapport, une telle distinction n'est pas faite, et tous les cas sont présentés comme infections non précisées par le VHC, ce qui inclut les cas aigus, chroniques et résolus. Il convient de noter que les infections chroniques par le VHC représentent probablement la majorité des cas déclarés au SCSMDO, car les infections aiguës sont habituellement asymptomatiques et moins susceptibles d'être diagnostiquées.
Entre 2007 et 2011, le taux de cas d'infection par le VHC déclarés a constamment diminué et semble augmenter légèrement depuis 2012. De 2007 à 2016, les taux déclarés d'infection par le VHC étaient constamment plus élevés chez les hommes que chez les femmes. Chez les hommes, de 2007 à 2016, le taux d'infection par le VHC a diminué de 15,7 % (de 46,4 à 39,1 pour 100 000 personnes), tandis que chez les femmes, il a diminué de 12,2 % (de 26,2 à 23,0 pour 100 000 personnes). En 2016, 11 265 cas d'infection par le VHC ont été déclarés au Canada, ce qui correspond à un taux national global de 31,1 pour 100 000 personnes. Le taux d'infection par le VHC le plus élevé a été observé chez les hommes dans le groupe d'âge des 25 à 29 ans (63,7 pour 100 000 personnes); chez les femmes, le taux d'infection par le VHC le plus élevé a également été observé dans le groupe d'âge des 25 à 29 ans (46,7 pour 100 000 personnes). La Saskatchewan, la Colombie-Britannique, le Yukon, l'Alberta, le Manitoba et la Nouvelle-Écosse ont tous affiché des taux plus élevés que la moyenne nationale de 31,1 pour 100 000 personnes (62,8, 48,5, 47,3, 39,3, 34,9 et 32,3 pour 100 000 personnes respectivement).
Les progrès réalisés dans le dépistage des dons de sang, les pratiques de contrôle des infections dans les milieux de soins de santé et les interventions médicales ont probablement contribué au déclin observé depuis 2007 des cas d'infection par le VHC déclarés au Canada. Il est également possible que les interventions en matière de santé publique visant à prévenir la transmission de l'infection chez les personnes qui s'injectent des drogues aient eu une incidence sur ces tendances.
En raison des difficultés liées à la détermination du stade d'infection (aigu ou chronique) par le VHC et des pratiques de déclaration, il est difficile de tirer des inférences précises sur les tendances dans la transmission de l'infection aiguë par le VHC ou le fardeau de l'infection chronique. De même, l'absence de données sur les facteurs de risque pour les cas d'infection par le VHC déclarés limite l'interprétation des constats présentés dans ce rapport.
Analyse comparative fondée sur le sexe et le genre +
Le sexe et le genre sont des déterminants importants de la santé. L'analyse comparative fondée sur le sexe et le genre plus (ACFSG+) est une approche systématique qui tient compte des besoins de divers groupes de garçons, de filles, d'hommes, de femmes et de personnes de diverses identités de genre. En matière de santé, le « plus » de l'ACFSG+ va au-delà du seul examen de la façon dont le sexe et le genre peuvent influer différemment sur l'état de santé et les résultats de santé pour inclure d'autres aspects de l'identité individuelle et des déterminants de la santé, comme la race, la religion, l'âge, l'appartenance ethnique, l'orientation sexuelle, la situation géographique, la culture, le handicap mental ou physique, le revenu et la scolarité.
Conformément à la Politique en matière d'analyse comparative fondée sur le sexe et le genre du portefeuille de la SantéNote de bas de page a et à son vaste engagement envers l'équité en santé dans l'ensemble de la société canadienne, l'ASPC prend des mesures pour faire progresser la mise en œuvre de l'ACFSG+ dans ses activités et programmes. Elle verra ainsi à intégrer plus systématiquement l'ACFSG+ dans ses activités de surveillance des maladies infectieuses, ainsi que dans les analyses et rapports connexes. Les travaux de l'ASPC en matière de surveillance de l'hépatite B et de l'hépatite C fournit, depuis de nombreuses années, des données et des analyses ventilées par sexe. À l'avenir, nous chercherons des occasions d'élargir ce travail pour inclure l'analyse du croisement du sexe avec d'autres facteurs de l'ACFSG+ qui pourraient avoir d'importantes répercussions sur les garçons, les filles, les hommes, les femmes et les personnes de diverses identités de genre touchées par ces maladies.
Conclusion
Les statistiques et les tendances nationales concernant les infections par le VHB et le VHC permettent de modeler les programmes, les lignes directrices et les recommandations en matière de santé publique. D'après les données disponibles, les taux d'infection par le VHB et le VHC et les tendances observés de 2007 à 2016 confirment la nécessité de poursuivre les efforts de prévention et de prise en charge au Canada. Puisque la déclaration des infections aiguës et chroniques par le VHB et le VHC deviendra de plus en plus harmonisée dans l'ensemble du pays au fil du temps, les données disponibles seront plus représentatives du fardeau réel de l'hépatite virale au Canada.1.0 Méthodologie
1.1 Définitions de cas
Les définitions de cas pour l'hépatite B (VHB) et l'hépatite C (VHC) utilisées au Canada à des fins de surveillance sont présentées à l'annexe A. L'infection par le VHB est à déclaration obligatoire au Canada depuis 1969, et la définition de cas nationale actuelleRéférence 3 définit l'infection aiguë, chronique ou non précisée. L'infection par le VHC est à déclaration obligatoire à l'échelle nationale depuis 1991. La surveillance des cas d'hépatite C s'est faite graduellement au fil du temps par les provinces et les territoires, mais ces derniers déclaraient tous ces cas en 1999. La définition des cas d'infection par le VHC actuellement utilisée pour la surveillance nationaleRéférence 4 définit le stade aigu de l'infection et l'infection non précisée (incluant l'infection chronique, résolue ou de nature indéterminée).
1.2 Collecte de données
Au Canada, la surveillance des maladies infectieuses à déclaration obligatoire est menée par l'Agence de la santé publique du Canada (ASPC), en coordination avec les gouvernements provinciaux et territoriaux, qui fournissent volontairement des données non nominatives à l'ASPC. La responsabilité de la collecte de données primaires sur les maladies à déclaration obligatoire relève des autorités de santé publique locales en vertu des lois provinciales et territorialesRéférence 5.
L'ASPC recueille et gère les données communiquées par les provinces et les territoires par l'intermédiaire du Système canadien de surveillance des maladies à déclaration obligatoire du Canada (SCSMDO). Le personnel du SCSMDO valide les données déclarées par une province ou un territoire au cours du traitement des données pour résoudre les erreurs ou les incohérences et maximiser l'exactitude des données. Les provinces et territoires fournissent des données sur les variables suivantes : âge au moment du diagnostic, année du diagnostic, province ou territoire où le diagnostic a été posé et sexe. Par conséquent, les rapports nationaux sont limités à l'analyse de ces variables. Les données extraites du SCSMDO servent de fondement aux rapports de surveillance nationale. Le présent rapport repose sur les données extraites en mai 2018.
1.3 Analyse des données
Jusqu'à récemment, les données de surveillance déclarées au SCSMDO par la plupart des provinces et des territoires ne faisaient pas de distinction entre les cas d'infection aiguë et d'infection chronique par le VHB. Un certain nombre de provinces et de territoires ont commencé à déclarer les cas d'infections aiguës par le VHB en 2005; toutefois, la déclaration des infections chroniques par le VHB n'est devenue plus systématique qu'en 2009. Afin d'examiner les tendances au fil du temps, seuls les provinces et territoires qui ont déclaré des cas d'infection aiguë ou chronique par le VHB au cours de la période étudiée ont été inclus dans le calcul des taux annuels. Les estimations de la population des provinces et territoires qui ne sont pas inclus dans une analyse particulière (cas aigu ou chronique) ont été retirées du dénominateur total utilisé pour calculer les taux nationaux correspondants.
Par conséquent, les taux annuels d'infection aiguë par le VHB déclarés de 2007 à 2016 comprennent les données de la Colombie-Britannique, de l'Alberta, de la Saskatchewan, de l'Ontario et du Québec et, pour certaines années, celles d'autres provinces et territoires comme le Yukon (2008-2016), le Nouveau-Brunswick (2009-2016), les Territoires du Nord-Ouest (2009-2016), le Manitoba (2009-2016) et la Nouvelle-Écosse (2009-2016). Les taux annuels d'infection chronique par le VHB déclarés de 2007 à 2016 comprennent des données de la Colombie-Britannique, de l'Alberta, du Québec, du Nouveau-Brunswick et, pour certaines années, celles d'autres provinces et territoires comme la Saskatchewan (2009-2016, sauf 2014), le Yukon (2008-2016), les Territoires du Nord-Ouest (2009-2016), la Nouvelle-Écosse (2009-2016), l'Ontario (2011-2016) et le Manitoba (2009-2016, sauf 2011). L'annexe B fournit des renseignements sur les années au cours desquelles les provinces et les territoires ont déclaré des cas d'infection par le VHB en précisant l'état aigu ou chronique.
La plupart des provinces et des territoires diagnostiquent les cas de VHC par test de dépistage des anticorps, ce qui ne permet pas de faire la distinction entre infection aiguë et infection chronique, ni entre une infection active et une infection résolue; ces cas sont déclarés comme des cas d'infection par le VHC au stade non précisé. Par conséquent, les données relatives au VHC présentées dans ce rapport sont des cas d'infection non précisée et regroupent donc les cas d'infection aiguë, chronique, résolue et indéterminée par le VHC. Certaines provinces et certains territories déclarent les cas d'infection par le VHC en faisant une distinction entre une infection aiguë et chronique (annexe C).
Une analyse descriptive de l'infection par le VHB et de l'infection par le VHC par année, par groupe d'âge et par sexe a été menée à partir des données déclarées au SCSMDO, sauf pour le Nouveau-Brunswick, qui est la source directe des données sur l'hépatite C pour les années 2007 à 2011. Les caractéristiques démographiques d'âge et de sexe ont été examinées pour les cas de VHB et de VHC déclarés en 2016 afin de fournir un portrait plus détaillé des toutes dernières données disponibles. Puisque les taux (indiqués pour 100 000 personnes), les pourcentages et le pourcentage de variation des taux ont été calculés à partir de valeurs non arrondies, il se peut que les valeurs présentées diffèrent des calculs fondés sur les valeurs arrondies. Les données démographiques utilisées découlent des estimations de juillet 2017 de Statistique Canada (Section des estimations démographiques de la Division de la démographie). Les taux calculés à l'aide de ces estimations à jour peuvent différer de ceux indiqués dans les précédents rapports.
1.4 Limites des données
Les tendances observées au fil du temps doivent être interprétées avec prudence, car les taux fondés sur de petits nombres de cas sont plus susceptibles de fluctuer. L'amélioration des capacités diagnostiques et du nettoyage et de la validation des données (élimination des doublons), la réduction des délais de déclaration et des changements dans les pratiques de déclaration à l'échelle des provinces et des territoires peuvent entraîner une fluctuation des tendances observées.
Une fois les données du présent rapport validées, les modifications apportées aux données des provinces et territoires par la suite peuvent ne pas être prises en compte dans les données nationales de cette année, mais seront mises à jour pour les rapports ultérieurs. Il pourrait donc y avoir de légers écarts entre les chiffres de l'ASPC et ceux des provinces ou territoires au moment de comparer ces bases de données dynamiques. Pour toute divergence entre notre rapport et celui des provinces et des territoires, le rapport des provinces et des territoires devrait être considéré comme le plus exact. Des écarts plus importants peuvent être constatés lorsque les provinces et les territoires utilisent une stratégie analytique différente de celle utilisée dans le présent rapport. Ainsi, certaines administrations choisissent de déclarer les infections chroniques et non précisées par le VHB en les regroupant en une seule catégorie, alors que les infections non précisées sont exclues de l'analyse à l'échelle nationale.
Enfin, on pourrait améliorer les données de surveillance du VHC en y incluant un plus grand nombre de variables (p. ex., les facteurs de risque), car ces informations permettraient une meilleure compréhension des tendances observées.
2. Hépatite B
2.1 Introduction
Le VHB est un virus à acide désoxyribonucléique (ADN) de la famille des hépadnavirus (Hepadnaviridae) qui infecte principalement les cellules du foie, mais qui se retrouve aussi dans divers tissus et organes, notamment les reins, le pancréas et les cellules mononucléairesRéférence 6Référence 7. Après avoir contracté une infection par le VHB, moins de 10 % des enfants et 30 % à 50 % des adultes présenteront des symptômes qui peuvent inclure la jaunisse, de la fatigue, une perte d'appétit, des nausées et des douleurs articulaires ou abdominalesRéférence 8. L'âge au moment de l'infection est un important déterminant de la probabilité de développer une infection chronique, laquelle survient chez environ 90 % des nourrissons infectés à la naissance, mais n'apparaît que chez 10 % des personnes infectées à un âge plus avancéRéférence 8. L'infection chronique par le VHB peut, au fil du temps, provoquer une cirrhose du foie, un carcinome hépatocellulaire, une hépatopathie décompensée et un décès prématuréRéférence 8.
La transmission du VHB se produit par contact avec du sang et des liquides organiques infectés, le plus souvent lors de relations sexuelles ou d'un contact étroit avec une personne infectée, lors de l'utilisation d'équipement d'injection de drogues contaminé et par transmission verticale (transmission de la mère à l'enfant) pendant la grossesse ou l'accouchementRéférence 8. Les profils de transmission du VHB sont un peu différents entre les pays en développement et les pays développés. En effet, dans les pays en voie de développement, la transmission verticale et l'exposition par contact familial étroit ont une grande incidence, tandis que la transmission sexuelle et l'utilisation de drogues injectables sont les profils prédominants dans les pays développés, comme le CanadaRéférence 9Référence 10. Le VHB peut survivre à l'extérieur du corps jusqu'à sept jours et a été observé dans des cas de transmission nosocomiale (par l'entremise du matériel médical ou dentaire contaminé) et d'exposition professionnelle chez les travailleurs de la santéRéférence 11.
Le diagnostic de l'infection par le VHB doit être confirmé en laboratoire par l'analyse d'un échantillon de sang destiné à différencier l'infection par le VHB d'autres types d'hépatites. Les marqueurs de l'infection présents dans le sang peuvent également permettre de différencier les infections aiguës par le VHB des infections chroniques. L'infection aiguë par le VHB se caractérise par la présence de l'antigène de surface de l'hépatite B (antigène HBs) et des anticorps immunoglobuline M de l'antigène capsidique de l'hépatite B (anticorps IgM anti-HBc)Référence 8. Une infection chronique se caractérise par la présence d'anticorps dirigés contre l'antigène capsidique de l'hépatite B (anticorps anti-HBc autre que l'anticorps IgM) et de l'antigène HBs pendant plus de six mois Référence 8. La présence de l'antigène HBe, antigène caractéristique de la phase initiale de l'infection aiguë pouvant aussi être présent pendant une infection chronique, indique que la personne infectée est extrêmement contagieuseRéférence 12Référence 13. En revanche, l'anticorps anti-HBe apparaît au cours du rétablissement suivant une infection aiguë et sa présence durant une infection chronique indique généralement une réplication virale réduite et un faible niveau d'infectiositéRéférence 13.
Un vaccin contre l'hépatite B est disponible à l'échelle mondiale depuis 1982Référence 11. Au Canada, l'ensemble des provinces et des territoires bénéficient d'un programme de vaccination universelle contre le VHB pour les nouveau-nés et les enfants depuis les années 1990, bien que ces programmes varient selon la province ou le territoire en ce qui concerne les doses et calendriers recommandés, ainsi que les groupes d'âge ciblésRéférence 13Référence 14. En outre, certaines administrations offrent un vaccin contre le VHB aux personnes à risque accru d'infection (p. ex., les personnes qui s'injectent des drogues ou les personnes ayant des relations sexuelles à haut risque)Référence 15. Le Comité consultatif national de l'immunisation recommande d'effectuer régulièrement des tests de dépistage de l'antigène HBs durant la grossesse et au moment de l'accouchement. Les bébés nés de mères infectées font immédiatement l'objet d'un programme de vaccination afin de réduire le risque d'infection par le VHBRéférence 16.
Il n'existe aucun traitement contre l'infection aiguë par le VHB; les soins sont axés sur l'atténuation des symptômes, la prévention des complications hépatiques et la réduction de la propagation de l'infection par un counselingRéférence 11Référence 13. Chez les personnes souffrant d'infection chronique par le VHB, les injections d'interférons et les médicaments antiviraux sont les traitements approuvés pour prévenir l'apparition de la cirrhose, de l'insuffisance hépatique et du cancer du foie. Toutefois, seules certaines personnes atteintes d'infection chronique par le VHB sont admissibles à un traitement, ce que l'on détermine en fonction de leur âge, des concentrations d'aminotransférase sérique et d'ADN du VHB, ainsi que de la gravité de la maladie du foie, entre autresRéférence 13.
2.2 Tendances nationales
2.2.1 Infection aiguë par le VHB
Cette section du rapport présente les taux et les tendances de l'infection aiguë par le VHB au Canada entre 2007 et 2016. Afin de fournir des tendances uniformes au fil du temps, seuls les provinces et territoires ayant fourni des données sur l'infection aiguë par le VHB durant cette période sont inclus dans les taux nationaux d'infection aiguë par le VHB, et les dénominateurs ont été ajustés en conséquence.
2.2.1.1 Tendances au fil du temps
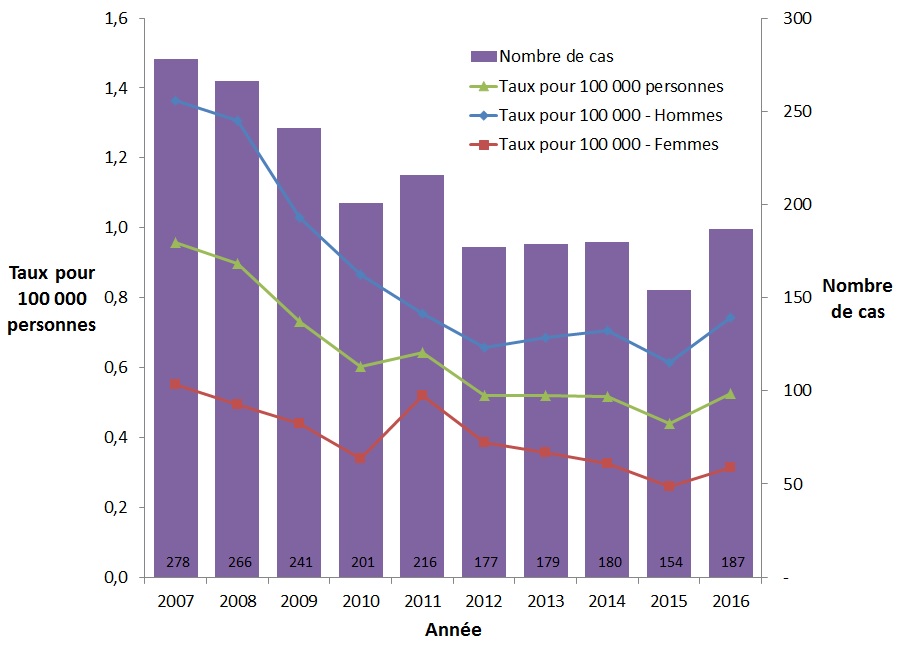
Le taux global des cas déclarés d'infection aiguë par le VHB a diminué régulièrement entre 2007 et 2015, mais a légèrement augmenté en 2016. En 2007, 278 cas d'infection aiguë par le VHB ont été signalés, ce qui correspond à un taux d'incidence global de 0,96 cas pour 100 000 personnes, comparativement au 187 cas signalés en 2016, ce qui correspondait à un taux de 0,53 cas pour 100 000 personnes (Figure 1).
Entre 2007 et 2016, le taux des cas déclarés d'infection aiguë par le VHB a constamment été plus élevé chez les hommes que chez les femmes. On a cependant constaté une baisse comparable de ce taux chez les hommes et les femmes (baisse de 45,5 % et 43,3 % respectivement) (Figure 1).
Figure 1. Nombre de cas déclarés et taux d'infection aiguë par le VHB au CanadaFigure 1 Note de bas de page 1 selon le sexe, SCSMDO, de 2007 à 2016
- Figure 1 Note de bas de page 1
-
Comprend des données de la C.-B., de l'Alb., de la Sask., de l'Ont. et du Qc (données de 2007 à 2016); pour le Yn : données de 2008 à 2016); pour le Man., le N.-B., T.-N.-O. et la N.-É. : données de 2009 à 2016.
Équivalent textuel
Ce graphique présente le nombre de cas ainsi que le taux global et le taux selon le sexe des cas déclarés d'infection aiguë par le VHB, entre 2007 et 2016 au Canada. L'axe horizontal montre les années 2007 à 2016. L'axe vertical montre le taux de cas déclarés d'infection aiguë par le VHB pour 100 000 personnes chez les hommes, les femmes et le taux global, ainsi que le nombre de cas déclarés d'infection aiguë par le VHB.
| Année | Nombre de cas | Taux pour 100 000 personnes | ||
|---|---|---|---|---|
| Homme | Femme | Global | ||
| 2007 | 278 | 1,4 | 0,6 | 1,0 |
| 2008 | 266 | 1,3 | 0,5 | 0,9 |
| 2009 | 241 | 1,0 | 0,4 | 0,7 |
| 2010 | 201 | 0,9 | 0,3 | 0,6 |
| 2011 | 216 | 0,8 | 0,5 | 0,6 |
| 2012 | 177 | 0,7 | 0,4 | 0,5 |
| 2013 | 179 | 0,7 | 0,4 | 0,5 |
| 2014 | 180 | 0,7 | 0,3 | 0,5 |
| 2015 | 154 | 0,6 | 0,3 | 0,4 |
| 2016 | 187 | 0,7 | 0,3 | 0,5 |
2.2.1.2 Taux de cas déclarés d'infection aiguë par le VHB par groupe d'âge et par sexe, 2016
En 2016, le taux le plus élevé de cas déclarés d'infection aiguë par le VHB chez les hommes a été observé dans les groupes d'âge de 25 à 59 ans (de 0,97 à 1,31 pour 100 000 personnes). Ces groupes d'âge présentaient également les taux les plus élevés d'infection aiguë par le VHB chez les femmes (de 0,41 à 0,45 pour 100 000 personnes) (Figure 2). Dans le groupe des 40 à 59 ans, le taux chez les hommes était plus de trois fois supérieur à celui des femmes. Dans le groupe des 25-39 ans, le taux chez les hommes était plus du double de celui des femmes. Dans les groupes d'âge plus jeunes (0-24 ans), le taux était semblable chez les hommes et les femmes (Figure 2).
Figure 2. Taux de cas déclarés d'infection aiguë par le VHB au CanadaFigure 2 Note de bas de page 1, par groupe d'âge et par sexe, SCSMDO, 2016

- Figure 2 Note de bas de page 1
-
Comprend des données de la C.-B., de l'Alb., de la Sask., du Man., de l'Ont., du Qc, du N.-B., de la N.‑É., du Yn et de T.‑N.‑L.
Équivalent textuel
Ce graphique présente le taux de cas d'infection aiguë par le VHB déclarés au Canada selon le sexe et le groupe d'âge, en 2016. L'axe horizontal montre les groupes d'âge de moins de 15 ans jusqu'à 60 ans et plus. L'axe vertical montre le taux de cas déclarés d'infection aiguë par le VHB pour 100 000 personnes chez les hommes et les femmes.
| Groupes d'âge | Taux pour 100 000 personnes | |
|---|---|---|
| Homme | Femme | |
| 0-14 ans | 0,03 | 0,04 |
| 15-19 ans | 0,10 | 0,00 |
| 20-24 ans | 0,24 | 0,34 |
| 25-29 ans | 0,97 | 0,41 |
| 30-39 ans | 1,11 | 0,45 |
| 40-59 ans | 1,31 | 0,42 |
| 60 ans et + | 0,58 | 0,32 |
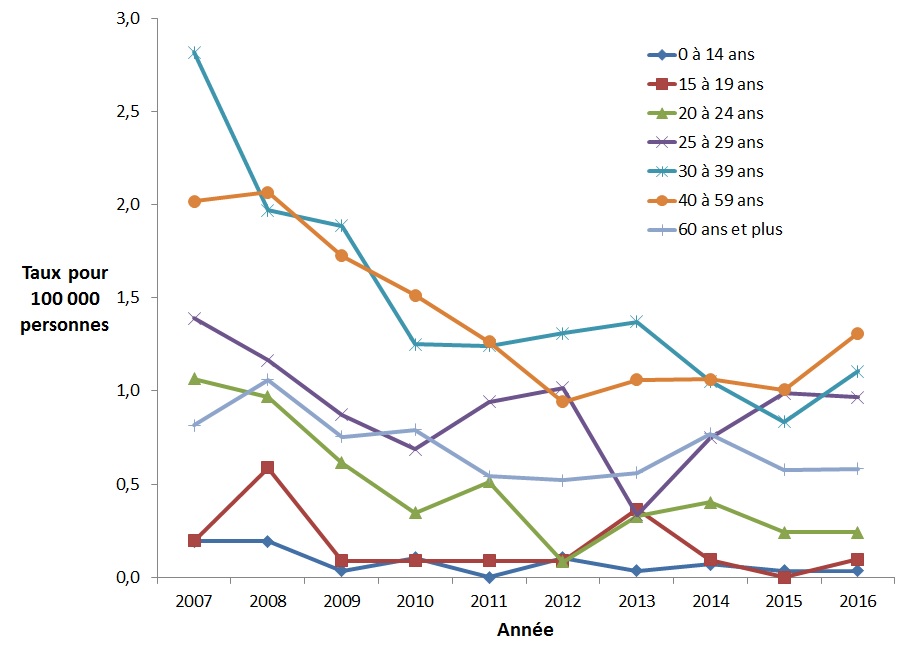
Entre 2007 et 2016, le taux des cas déclarés d'infection aiguë par le VHB chez les hommes a diminué dans tous les groupes d'âge, la diminution la plus importante (réduction de 82,4 %) étant dans le groupe d'âge de 0 à 14 ans, suivi des groupes d'âge de 20 à 24 ans (réduction de 77,4 %) et de 30 à 39 ans (réduction de 60,7 %) (Figure 3).
Figure 3. Taux de cas déclarés d'infection aiguë par le VHB chez les hommes canadiensFigure 3 Note de bas de page 1, par groupe d'âge et par année, SCSMDO, de 2007 à 2016
- Figure 3 Note de bas de page 1
-
Comprend des données de la C.-B., de l'Alb., de la Sask., de l'Ont. et du Qc (données de 2007 à 2016); pour le Yn : données de 2008 à 2016); pour le Man., le N.-B., T.-N.-O. et la N.-É. : données de 2009 à 2016.
Équivalent textuel
Ce graphique présente le taux de cas d'infection aiguë par le VHB déclarés au Canada par groupe d'âge chez les hommes, entre 2007 et 2016 au Canada. L'axe horizontal montre les années 2007 à 2016. L'axe vertical montre le taux de cas déclarés d'infection aiguë par le VHB pour 100 000 personnes pour tous les groupes d'âge.
| Année | Taux pour 100 000 personnes | ||||||
|---|---|---|---|---|---|---|---|
| <15 ans | 15-19 ans | 20-24 ans | 25-29 ans | 30-39 ans | 40-59 ans | 60 ans et + | |
| 2007 | 0,2 | 0,2 | 1,1 | 1,4 | 2,8 | 2,0 | 0,8 |
| 2008 | 0,2 | 0,6 | 1,0 | 1,2 | 2,0 | 2,1 | 1,1 |
| 2009 | 0,0 | 0,1 | 0,6 | 0,9 | 1,9 | 1,7 | 0,8 |
| 2010 | 0,1 | 0,1 | 0,3 | 0,7 | 1,3 | 1,5 | 0,8 |
| 2011 | 0,0 | 0,1 | 0,5 | 0,9 | 1,2 | 1,3 | 0,5 |
| 2012 | 0,1 | 0,1 | 0,1 | 1,0 | 1,3 | 0,9 | 0,5 |
| 2013 | 0,0 | 0,4 | 0,3 | 0,3 | 1,4 | 1,1 | 0,6 |
| 2014 | 0,1 | 0,1 | 0,4 | 0,7 | 1,1 | 1,1 | 0,8 |
| 2015 | 0,0 | 0,0 | 0,2 | 1,0 | 0,8 | 1,0 | 0,6 |
| 2016 | 0,0 | 0,1 | 0,2 | 1,0 | 1,1 | 1,3 | 0,6 |
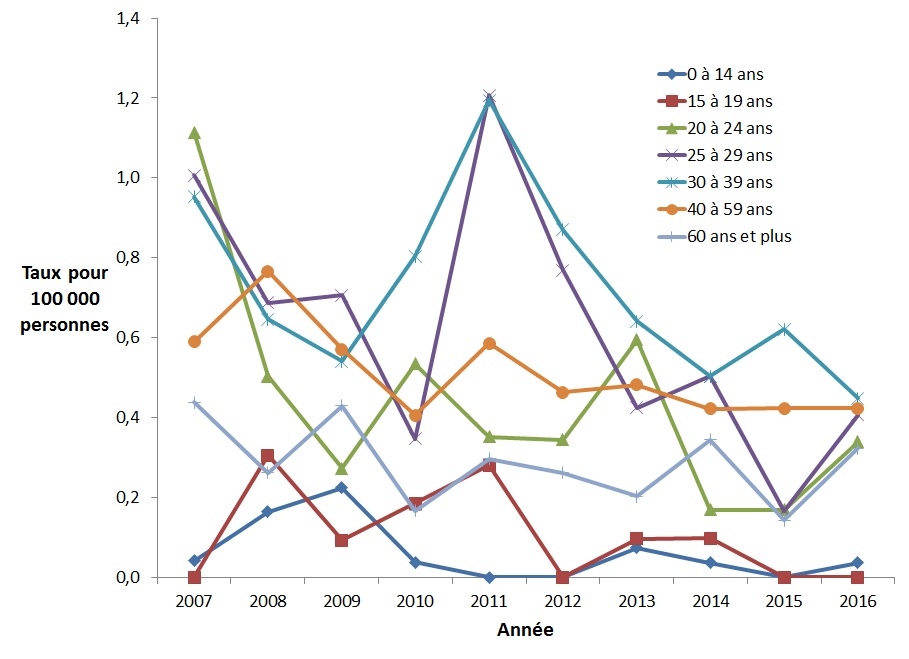
Chez les femmes, la baisse la plus importante du taux d'infection aiguë par le VHB est observée (Figure 4) dans le groupe d'âge de 20 à 24 ans (réduction de 69,6 %), suivi des 25 à 29 ans (réduction de 59,6 %) et des 30 à 39 ans (réduction de 53,0 %). En 2011, on observe une augmentation notable des taux chez les femmes dans les groupes d'âge de 25-39 ans, suivi d'une baisse en 2012 et 2013 (Figure 4).
Figure 4. Taux de cas déclarés d'infection aiguë par le VHB chez les femmes canadiennesFigure 4 Note de bas de page 1, par groupe d'âge et par année, SCSMDO, de 2007 à 2016
- Figure 4 Note de bas de page 1
-
Comprend des données de la C.-B., de l'Alb., de la Sask., de l'Ont. et du Qc (données de 2007 à 2016); pour le Yn : données de 2008 à 2016); pour le Man., le N.-B., T.-N.-O. et la N.-É.: données de 2009 à 2016.
Équivalent textuel
Ce graphique présente le taux de cas d'infection aiguë par le VHB déclarés au Canada par groupe d'âge chez les femmes, entre 2007 et 2016 au Canada. L'axe horizontal montre les années 2007 à 2016. L'axe vertical montre le taux de cas déclarés d'infection aiguë par le VHB pour 100 000 personnes pour tous les groupes d'âge.
| Année | Taux pour 100 000 personnes | ||||||
|---|---|---|---|---|---|---|---|
| <15 ans | 15-19 ans | 20-24 ans | 25-29 ans | 30-39 ans | 40-59 ans | 60 ans et + | |
| 2007 | 0,0 | 0,0 | 1,1 | 1,0 | 1,0 | 0,6 | 0,4 |
| 2008 | 0,2 | 0,3 | 0,5 | 0,7 | 0,6 | 0,8 | 0,3 |
| 2009 | 0,2 | 0,1 | 0,3 | 0,7 | 0,5 | 0,6 | 0,4 |
| 2010 | 0,0 | 0,2 | 0,5 | 0,3 | 0,8 | 0,4 | 0,2 |
| 2011 | 0,0 | 0,3 | 0,4 | 1,2 | 1,2 | 0,6 | 0,3 |
| 2012 | 0,0 | 0,0 | 0,3 | 0,8 | 0,9 | 0,5 | 0,3 |
| 2013 | 0,1 | 0,1 | 0,6 | 0,4 | 0,6 | 0,5 | 0,2 |
| 2014 | 0,0 | 0,1 | 0,2 | 0,5 | 0,5 | 0,4 | 0,3 |
| 2015 | 0,0 | 0,0 | 0,2 | 0,2 | 0,6 | 0,4 | 0,1 |
| 2016 | 0,0 | 0,0 | 0,3 | 0,4 | 0,4 | 0,4 | 0,3 |
2.2.1.3 Taux par province/territoire
En 2016, 187 cas d'infection aiguë par le VHB ont été déclarés au Canada. Les provinces ayant enregistré le plus grand nombre de cas sont l'Ontario (115 cas), l'Alberta (19 cas), le Manitoba (13 cas) et le Québec (12 cas). Les taux de cas déclarés d'infection aiguë par le VHB étaient bas dans l'ensemble des provinces et territoires, mais le Nouveau-Brunswick (1,3 pour 100 000 personnes), la Nouvelle-Écosse (1,1 pour 100 000 personnes), le Manitoba (1,0 pour 100 000 personnes) et l'Ontario (0,8 pour 100 000 personnes) ont déclaré des taux d'infection aiguë par le VHB supérieurs à la moyenne nationale de 0,5 pour 100 000 personnes (Tableau 1). Dans toutes les provinces et tous les territoires, les taux chez les hommes étaient systématiquement supérieurs à ceux des femmes, à l'exception du Yukon et des Territoires du Nord-Ouest qui n'ont rapporté aucun cas en 2016.
| Province/ territoire | Homme | Femme | Total | |||
|---|---|---|---|---|---|---|
| Nombre de cas | Taux pour 100 000 personnes | Nombre de cas | Taux pour 100 000 personnes | Nombre de cas | Taux pour 100 000 personnes | |
| Canada | 131 | 0,73 | 56 | 0,31 | 187 | 0,52 |
| C.-B. | 4 | 0,17 | 1 | 0,04 | 5 | 0,11 |
| Alb. | 13 | 0,61 | 6 | 0,29 | 19 | 0,45 |
| Sask. | 3 | 0,52 | 0 | 0,00 | 3 | 0,26 |
| Man. | 10 | 1,52 | 3 | 0,45 | 13 | 0,99 |
| Ont. | 77 | 1,12 | 38 | 0,53 | 115 | 0,82 |
| Qc | 8 | 0,19 | 4 | 0,09 | 12 | 0,14 |
| N.-B. | 10 | 2,67 | 0 | 0,00 | 10 | 1,32 |
| N.-É. | 6 | 1,29 | 4 | 0,83 | 10 | 1,05 |
| Î.-P.-É. | N.D. | N.D. | N.D. | N.D. | N.D. | N.D. |
| T.-N.-L. | N.D. | N.D. | N.D. | N.D. | N.D. | N.D. |
| Yn | 0 | 0,00 | 0 | 0,00 | 0 | 0,00 |
| T.N.-O. | 0 | 0,00 | 0 | 0,00 | 0 | 0,00 |
| Nt | N.D. | N.D. | N.D. | N.D. | N.D. | N.D. |
N.D. : Non Disponible |
||||||
2.2.2 Infection chronique par le VHB
Les provinces et les territoires n'ont pas tous commencé à déclarer les infections chroniques par le VHB la même année (annexe B). Les statistiques relatives à l'infection chronique par le VHB présentées dans ce rapport ont donc été ajustées pour tenir compte des différences liées à cet état de fait. C'est pourquoi nous recommandons d'interpréter ces statistiques avec prudence.
2.2.2.1 Tendances au fil du temps
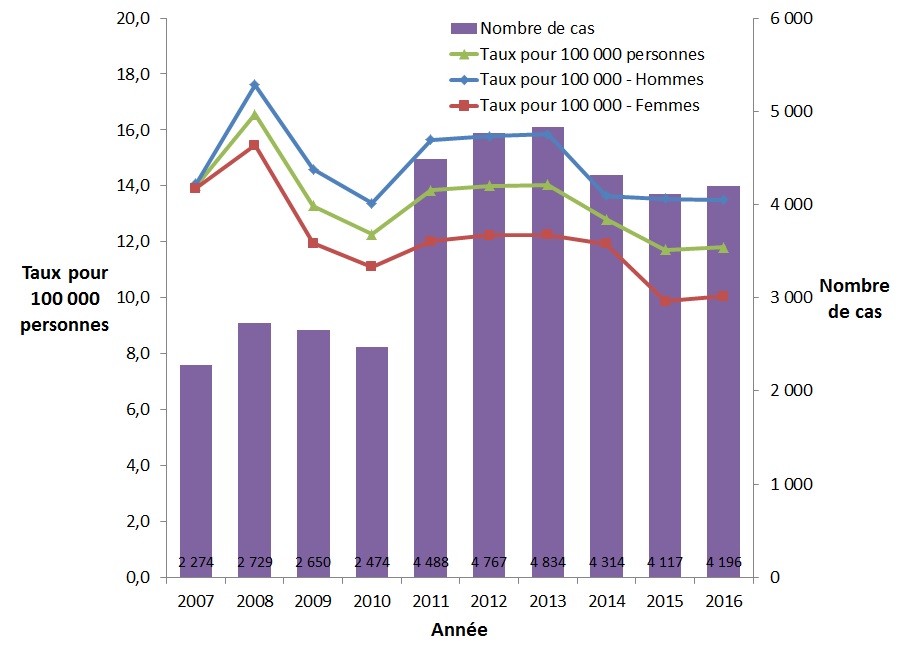
On a observé des variations du taux de cas déclarés d'infection chronique par le VHB entre 2007 et 2016. Cette variation peut être en partie liée au fait que des provinces et territoires présentant des taux différents ne se sont pas joints aux systèmes de surveillance la même année. Le taux global de cas déclarés d'infection chronique par le VHB a diminué de 16 %, passant de 14,0 à 11,8 pour 100 000 personnes (Figure 5). La diminution s'est produite tant chez les hommes que chez les femmes, mais était plus importante chez les femmes (diminution de 27,7 %) que chez les hommes (diminution de 4,0 %).
Figure 5. Nombre de cas déclarés et taux d'infection chronique par le VHB au CanadaFigure 5 Note de bas de page 1 selon le sexe, SCSMDO, de 2007 à 2016
- Figure 5 Note de bas de page 1
-
Comprend des données de l'Alb., de la C.-B., du Qc, du N.‑B. (données de 2007 à 2016), de la Sask. (données de 2009 à 2016, sauf pour 2014), du Yn (données de 2008 à 2016); de T.N.-O., de la N.‑É. (données de 2009 à 2016), du Man. (données de 2009 à 2016, sauf pour 2011), de l'Ont. (données de 2011 à 2016)
Équivalent textuel
Ce graphique présente le nombre de cas ainsi que le taux global et le taux selon le sexe des cas déclarés d'infection chronique par le VHB, entre 2007 et 2016 au Canada. L'axe horizontal montre les années 2007 à 2016. L'axe vertical montre le taux de cas déclarés d'infection chronique par le VHB pour 100 000 personnes chez les hommes, les femmes et le taux global, ainsi que le nombre de cas déclarés d'infection chronique par le VHB.
| Année | Nombre de cas | Taux pour 100 000 personnes | ||
|---|---|---|---|---|
| Homme | Femme | Global | ||
| 2007 | 2 274 | 14,0 | 13,9 | 14,0 |
| 2008 | 2 729 | 17,6 | 15,5 | 16,6 |
| 2009 | 2 650 | 14,6 | 11,9 | 13,3 |
| 2010 | 2 474 | 13,4 | 11,1 | 12,3 |
| 2011 | 4 488 | 15,7 | 12,0 | 13,8 |
| 2012 | 4 767 | 15,8 | 12,2 | 14,0 |
| 2013 | 4 834 | 15,8 | 12,2 | 14,0 |
| 2014 | 4 314 | 13,6 | 11,9 | 12,8 |
| 2015 | 4 117 | 13,5 | 9,9 | 11,7 |
| 2016 | 4 196 | 13,5 | 10,1 | 11,8 |
2.2.2.2 Taux de cas déclarés d'infection chronique par le VHB, selon le groupe d'âge et le sexe, en 2016
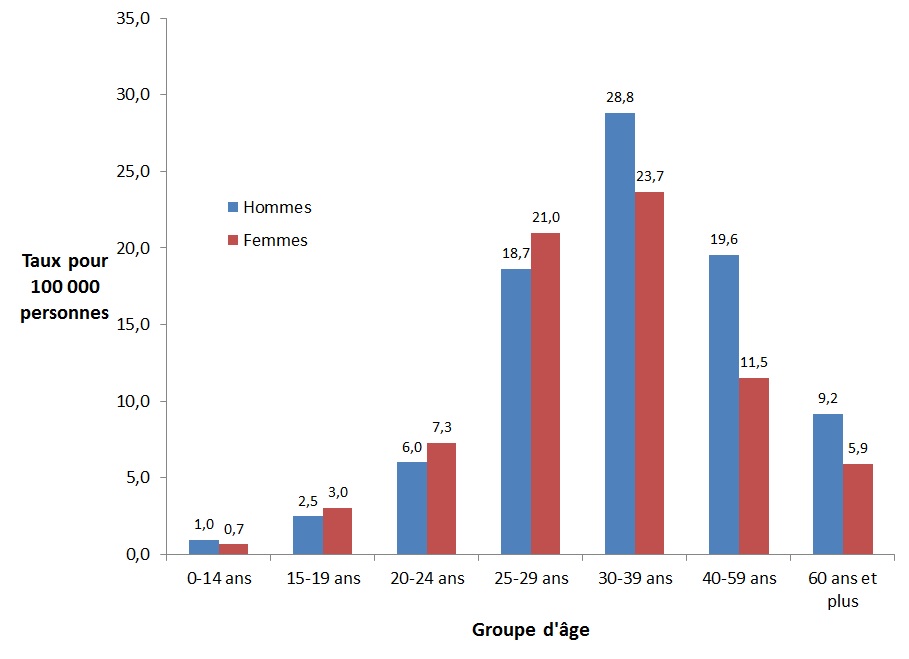
En 2016, les taux d'infection chronique par le VHB étaient plus élevés chez les hommes que chez les femmes dans tous les groupes d'âge, sauf les 15 à 29 ans. Tant chez les hommes que chez les femmes, les taux de cas déclarés d'infection chronique par le VHB les plus élevés en 2016 ont été observés dans le groupe d'âge des 30 à 39 ans (28,8 pour 100 000 personnes pour les hommes et 23,7 pour 100 000 personnes pour les femmes) (Figure 6).
Figure 6. Taux de cas déclarés d'infection chronique par le VHB au CanadaFigure 6 Note de bas de page 1, par groupe d'âge et par sexe, SCSMDO, 2016
- Figure 6 Note de bas de page 1
-
Comprend des données de la C.-B., de l'Alb., de la Sask., du Man., de l'Ont., du Qc, du N.-B., de la N.‑É., du Yn et des T‑N.‑O.
Équivalent textuel
Ce graphique présente le taux de cas d'infection chronique par le VHB déclarés au Canada selon le sexe et le groupe d'âge, en 2016. L'axe horizontal montre les groupes d'âge de moins de 15 ans à 60 ans et plus. L'axe vertical montre le taux de cas déclarés d'infection chronique par le VHB pour 100 000 personnes chez les hommes et les femmes.
| Groupes d'âge | Taux pour 100 000 personnes | |
|---|---|---|
| Homme | Femme | |
| 0-14 ans | 1,0 | 0,7 |
| 15-19 ans | 2,5 | 3,0 |
| 20-24 ans | 6,0 | 7,3 |
| 25-29 ans | 18,7 | 21,0 |
| 30-39 ans | 28,8 | 23,7 |
| 40-59 ans | 19,6 | 11,5 |
| 60 ans et + | 9,2 | 5,9 |
2.2.2.3 Taux de cas déclarés d'infection chronique par le VHB, par province et territoire, en 2016
Le nombre de cas déclarés d'infection chronique par le VHB et les taux selon le sexe par province/territoire pour 2016 sont présentés dans le tableau 2. En 2016, l'Ontario a déclaré le nombre le plus élevé de cas (1 691), suivie de la Colombie-Britannique (1 113). La Colombie-Britannique (23,4 pour 100 000 personnes), le Yukon (21,0 pour 100 000 personnes), l'Alberta (13,5 pour 100 000 personnes) et l'Ontario (12,1 pour 100 000 personnes) ont déclaré des taux d'infection chronique par le VHB supérieurs à la moyenne nationale de 11,8 pour 100 000 personnes. Les taux étaient systématiquement plus élevés chez les hommes que chez les femmes dans toutes les provinces et territoires, à l'exception des Territoires du Nord-Ouest qui n'ont rapporté aucun cas en 2016 (Tableau 2).
| Province/ territoire | Homme | Femme | Total | |||
|---|---|---|---|---|---|---|
| Nombre de cas | Taux pour 100 000 personnes |
Nombre de cas | Taux pour 100 000 personnes |
Nombre de cas | Taux pour 100 000 personnes |
|
| Canada | 2 382 | 13,5 | 1 802 | 10,1 | 4 196 | 11,8 |
| C.-B. | 577 | 24,4 | 536 | 22,4 | 1 113 | 23,4 |
| Alb. | 350 | 16,3 | 224 | 10,7 | 574 | 13,5 |
| Sask. | 83 | 14,3 | 46 | 8,1 | 129 | 11,2 |
| Man. | 77 | 11,7 | 59 | 8,9 | 136 | 10,3 |
| Ont. | 974 | 14,2 | 707 | 9,9 | 1 691 | 12,1 |
| Qc | 271 | 6,6 | 189 | 4,5 | 462 | 5,6 |
| N.-B. | 37 | 9,9 | 32 | 8,4 | 69 | 9,1 |
| N.-É. | 8 | 1,7 | 6 | 1,2 | 14 | 1,5 |
| Î.-P.-É. | N.D. | N.D. | N.D. | N.D. | N.D. | N.D. |
| T.-N.-L. | N.D. | N.D. | N.D. | N.D. | N.D. | N.D. |
| Yn | 5 | 25,8 | 3 | 16,0 | 8 | 21,0 |
| T.N.-O. | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Nt | N.D. | N.D. | N.D. | N.D. | N.D. | N.D. |
N.D. : Non Disponible |
||||||
2.3 Discussion
Dans l'ensemble, bien que le taux de cas déclarés d'infection par le VHB au Canada soit faible, il s'agit toujours d'une cause importante et évitable de maladie et de décès. Selon les registres de 2013 (la dernière année pour laquelle des données sur la mortalité étaient disponibles auprès de Statistique Canada), l'infection aiguë par le VHB a été la principale cause de 18 décès au Canada, et 50 autres décès ont été attribués à une infection chronique par le VHBRéférence 17. La véritable ampleur des décès liés au VHB est probablement plus élevée en raison d'une possible classification erronée sur les certificats de décèsRéférence 18.
Les cas d'infection aiguë par le VHB offrent de précieuses indications sur les tendances et les schémas actuels de transmission, car les cas diagnostiqués et déclarés comme une infection aiguë se rapprochent des cas incidents (c.-à-d. ceux qui ont été récemment contractés). Les données du SCSMDO indiquent une diminution du taux global de cas déclarés d'infection aiguë par le VHB entre 2007 et 2015 au Canada, mais une légère augmentation en 2016. Il est cependant trop tôt pour savoir si cette augmentation est réelle ou due à une fluctuation. Les taux ont été constamment plus élevés chez les hommes que chez les femmes au cours de cette période. En 2016, les taux de cas déclarés d'infection aiguë par le VHB étaient les plus élevés chez les hommes et les femmes des groupes d'âge des 25 à 59 ans.
Cette baisse des taux d'infection aiguë par le VHB au Canada peut s'expliquer par la mise en œuvre de programmes d'immunisation systématique dans l'ensemble des provinces et des territoires à partir du début des années 1990. Ces programmes sont offerts aux nourrissons et aux enfants d'âge scolaire et, dans certaines provinces et certains territoires, aux populations à risque élevéRéférence 15. On juge que les personnes ayant reçu le vaccin contre le VHB sont protégées d'une infection aiguë et chronique par le VHB. Puisqu'une proportion croissante de la population canadienne bénéficie d'une couverture vaccinale contre le VHB, on peut raisonnablement s'attendre à ce que les taux d'infection aiguë par le VHB continuent de baisser. En 2015, le taux de vaccination contre le VHB chez les enfants âgés de 2 ans était estimé à 69,2 % dans les provinces et les territoires bénéficiant d'un programme de vaccination des nourrissons en trois dosesRéférence 19. En 2015, la couverture vaccinale par l'administration d'au moins une dose du vaccin contre le VHB était de 88,1 % chez les jeunes de 17 ans en 2015Référence 19. En 2014, la couverture vaccinale contre le VHB à l'échelle nationale était estimée à 52,2 % parmi la population adulte âgée de 18 à 64 ans; par contre, environ 72,2 % des travailleurs de la santé avaient reçu au moins une dose du vaccin contre le VHBRéférence 20.
L'amélioration des tests sanguins ainsi que des pratiques de prévention et de contrôle des infections dans les milieux de soins de santé a probablement aussi contribué à la baisse des taux d'infection aiguë par le VHB au Canada. En vertu du Programme de contributions pour la sûreté du sang (PCSS) de l'ASPC par l'entremise du Système de surveillance des incidents transfusionnels (SSIT), aucun cas d'infection aiguë par le VHB liée à une transfusion sanguine n'a été déclaré. La surveillance des dons de sang reçus par la Société canadienne du sang en 2016 indique que le VHB a été détecté selon un taux de 55,6 cas pour 100 000 personnes faisant un don pour la première fois (les premiers dons représentent près de 10 % du nombre total de dons) et selon un taux de seulement 0,9 cas pour 100 000 personnes faisant un don répété (soit les dons de personnes qui avaient déjà donné du sang)Référence 21. Les dons qui ont eu un résultat positif à un test de dépistage du VHB provenaient plus souvent des hommes (8,7 pour 100 000 personnes faisant un don) que des femmes (3,6 pour 100 000 personnes faisant un don).
Les comparaisons des taux d'infection aiguë par le VHB entre le Canada et d'autres pays sont limitées en raison des différences dans les définitions de cas, les sources de déclaration, les interventions en santé publique et les programmes de dépistage. Cependant, une diminution semblable des taux a été observée dans la plupart des pays ayant une structure démographique, un état de santé et des infrastructures de santé publique comparables. Par exemple, les données issues de la surveillance de routine ou de la surveillance rehaussée en Angleterre indiquent que les taux annuels d'infection aiguë par le VHB dans ce pays diminuent au fil du temps Référence 22. Entre 2015 et 2016, le taux annuel de cas déclarés d'infection aiguë par le VHB est passé de 0,83 à 0,82 pour 100 000 personnesRéférence 22. En revanche, le nombre annuel de cas déclarés d'infection aiguë par le VHB a fluctué aux États-Unis entre 2012 et 2016, toute diminution observée au cours de cette période ayant été suivie d'une légère augmentation l'année suivanteRéférence 23. De 2015 à 2016, on a observé une diminution de 4,5 % du nombre de cas, lequel est passé de 3 370 (1,1 cas pour 100 000 personnes) à 3 218 (1,0 cas pour 100 000 personnes)Référence 23.
Il est important de comprendre l'ampleur de l'infection chronique par le VHB au Canada, car elle représente le fardeau potentiel de la maladie au pays en raison de l'incapacité prolongée à éliminer l'infection. Une infection chronique par le VHB peut entraîner des complications à long terme, comme la cirrhose et le cancer du foieRéférence 8. Les données du Registre canadien des insuffisances et des transplantations d'organes (RCITO) indiquent que le VHB était le principal diagnostic de 2.8 % des receveurs de transplantation du foie au Canada (excluant le Québec), de 2007 à 2016Référence 24. Par rapport aux personnes atteintes d'une infection aiguë par le VHB, les personnes ayant une infection chronique par le VHB sont plus susceptibles de transmettre le virus à d'autres, car la période de transmissibilité est relativement brève pendant une infection aiguëRéférence 25.
En raison de la déclaration variable des cas d'infection chronique par le VHB des provinces et des territoires entre 2007 et 2016, l'analyse des tendances d'infection chronique par le VHB au fil du temps doit être interprétée avec prudence. Les données du SCSMDO indiquent que les taux de cas déclarés d'infection chronique par le VHB ont diminué entre 2013 et 2015. En 2016, les taux les plus élevés ont été observés chez les femmes et chez les hommes de 30 à 39 ans.
Les taux des cas déclarés d'infection chronique par le VHB sont plus élevés que celui des infections aiguës par le VHB pour diverses raisons, notamment la plus longue durée de l'infection chronique et le sous-diagnostic probable des cas d'infection aiguë en raison de leur nature en grande partie asymptomatique. L'infection chronique par le VHB est plus susceptible d'être diagnostiquée chez les personnes qui n'ont pas été vaccinées pendant leur enfance, comme en témoignent les taux plus élevés de cas déclarés chez les personnes de 30 ans et plus, qui étaient plus âgées que les personnes pour qui le vaccin était recommandé au moment de la mise en œuvre des programmes d'immunisation universelle.
Les études de séroprévalence de la population peuvent fournir des renseignements supplémentaires sur le fardeau de l'infection par le VHB au Canada. L'Enquête canadienne sur les mesures de la santé (ECMS)Référence 26Référence 27 a révélé que la séroprévalence de l'infection par le VHB actuelle, incluant l'infection aiguë et chronique, était de 0,4 % sur une période de collecte de données allant de 2007 à 2011. Des preuves sérologiques d'une infection antérieure par le VHB ont été relevées chez 4,2 % des participants. Parmi les personnes ayant déjà été infectées par le VHB, 79 % ont démontré une résolution complète de l'infection et une immunité protectriceRéférence 28. De telles enquêtes fournissent des renseignements utiles et complètent le système de surveillance pour mieux caractériser le fardeau de la maladie due à l'infection par le VHB.
Certaines données indiquent que l'immigration de pays où le VHB est endémique contribue aussi probablement au fardeau du VHB dans l'ensemble du CanadaRéférence 29. Selon une étude menée en 2011, on a estimé qu'environ 3 % des immigrants au Canada au début des années 2000 avaient une infection par le VHB, tandis que seulement 0,5 % des personnes nées au Canada étaient infectées au cours de la même périodeRéférence 30. Toutefois, le pourcentage de personnes touchées par une infection chronique par le VHB parmi les immigrants au Canada pourrait en fait être supérieur à 3 %, tel que l'indique une étude de 2012 de l'Université McGill, selon laquelle 6,7 % des immigrants étaient touchés par une infection chronique par le VHBRéférence 31. Dans une étude menée en Colombie-Britannique, la majorité des cas d'infection chronique par le VHB décelés au cours des dernières années concernaient les personnes ayant immigré d'un pays où le VHB est endémiqueRéférence 32.
Bien que les taux d'infection par le VHB soient généralement faibles dans la population générale au Canada, des recherches antérieures ont démontré que certains facteurs sont fortement associés au risque d'infection, y compris une activité sexuelle à risque élevé, l'utilisation de drogues injectables, le fait d'avoir un contact avec un membre de la famille porteur de l'antigène HBs et des antécédents de transfusion sanguine, de tatouage et de perçage corporelRéférence 33Référence 34. En raison de tels facteurs de risque, certaines populations vulnérables connaissent des taux plus élevés que les taux moyens d'infection par le VHB, notamment les personnes qui s'injectent des drogues et les jeunes de la rue qui pourraient ne pas avoir bénéficié des programmes d'immunisation provinciaux et territoriaux même s'ils y étaient admissiblesRéférence 35Référence 36.
2.4 Limites
Il convient de mentionner qu'il existe des limites notables aux résultats présentés dans ce rapport. Les pratiques de déclaration ne sont pas toujours demeurées uniformes au cours de la période d'intérêt dans le présent rapport et, par conséquent, certaines provinces et certains territoires n'ont été inclus dans les analyses de données d'infections aiguës ou chroniques par le VHB pour certaines périodes. Contrairement à la déclaration des cas d'infection aiguë par le VHB, qui était plus uniforme au cours de la période de 2009 à 2016, la déclaration des infections chroniques par le VHB dans l'ensemble des provinces et territoires au cours de la même période était plus variable. Par ailleurs, l'Île-du-Prince-Édouard, Terre-Neuve-et-Labrador et le Nunavut n'ont pas précisé l'état sérologique pour les cas déclarés d'infection par le VHB au SCSMDO et ont toujours déclaré les cas d'hépatite B comme étant des cas non précisés. Parmi les provinces ayant déclaré des cas d'infection aiguë et chronique, certains de ces cas ont également été déclarés comme étant des cas non classés. En 2016 seulement, 578 cas d'infections par le VHB ont été déclarés comme étant non précisés et ne sont donc pas présentés dans ce rapport.
Les données ont été analysées uniquement en fonction de l'âge, du sexe et du stade d'infection. Pour le moment, le SCSMDO ne dispose d'aucun autre élément d'information pouvant permettre d'expliquer les tendances observées. Par conséquent, il est impossible d'établir avec certitude la proportion de cas déclarés d'infection par le VHB imputable aux cas importés des pays endémiques, à l'utilisation de drogues injectables ou à des pratiques sexuelles à risque élevé.
Les tendances observées au fil du temps peuvent également être attribuables à des changements dans les pratiques de dépistage ou à d'améliorations de la capacité diagnostique, entraînant ainsi une hausse de la détection des personnes atteintes du VHB, dont beaucoup ont probablement contracté l'infection bien avant le moment du diagnostic. En outre, ces tendances peuvent être liées à une capacité accrue à faire la distinction entre les infections aiguës et les infections chroniques, ainsi qu'à une amélioration de la surveillance et de la déclaration.
Les taux basés sur de petits nombres de cas sont davantage sujets à fluctuation au cours du temps, comme avec l'infection aigue au VHB, et doivent être interprétés avec prudence.
Enfin, les taux d'infection par le VHB présentés dans ce rapport sont sans doute une sous-estimation du fardeau réel des infections au Canada. Puisque l'infection aiguë par le VHB est asymptomatique chez plus de 90 % des enfants et chez 50 % à 70 % des adultes, la majorité des personnes nouvellement infectées ne consulteront pas un professionnel de la santé pour subir un test de dépistage et, par conséquent, ne seront pas déclarées au SCSMDO en tant que cas d'infection aiguë par le VHB. Les résultats de l'Enquête canadienne sur les mesures de la santé de 2007 à 2009 et de 2009 à 2011 laissent penser que plus de la moitié des participants à l'enquête ayant un VHB confirmé en laboratoire n'étaient pas au courant de leur infectionRéférence 28. De plus, l'infection par le VHB se produit souvent dans des populations difficiles à joindre qui n'ont pas nécessairement accès à un fournisseur de soins de santé ou qui ne vont pas chercher à obtenir des soins de santé.
Le fardeau de l'infection chronique par le VHB au Canada, en termes de nombre de cas, est sous-estimé dans le présent rapport en raison de la non-disponibilité des données sur l'infection chronique par le VHB dans différentes provinces pour la période présentée. Enfin, bien qu'un cas aigu déclaré puisse devenir plus tard le porteur d'une infection chronique dans certains cas, cette possibilité n'a pas été évaluée dans le présent rapport, et les données fournies à l'ASPC par les provinces et les territoires ont été jugées définitives pour l'année de déclaration respective.
2.5 Conclusion
Bien qu'il existe des limites aux données disponibles, les résultats présentés dans ce rapport comblent des lacunes importantes en matière de connaissances, et ils sont utiles pour déceler les principales tendances liées aux infections aiguës et chroniques par le VHB au Canada. Le Canada continue d'afficher une tendance à la baisse dans les taux de VHB, plus particulièrement pour les cas d'infection aiguë, et une tendance continue à la baisse dans les cas d'infection chronique par le VHB finira par découler des stratégies de vaccination, en particulier celles qui visent les populations à haut risque.
Puisqu'il est possible qu'une infection par le VHB entraîne de plus lourds problèmes de santé, comme la cirrhose, un carcinome hépatocellulaire et une décompensation hépatique, et risque d'exercer des pressions sur le système de soins de santé du Canada, une surveillance continue de l'infection par le VHB est essentielle. Les données de surveillance sont utilisées pour guider l'élaboration de lignes directrices, de recommandations et de programmes de santé publique. En 2013, l'ASPC a publié un guide de référence sur la prise en charge des soins primaires de l'hépatite BRéférence 13, et elle fournit des recommandations sur l'utilisation du vaccin contre le VHB dans le Guide canadien d'immunisationRéférence 15. À l'avenir, le fait de renforcer la capacité nationale à faire la distinction entre les cas d'infection aiguë et chronique de VHB et de standardiser les déclarations de cas permettra de générer davantage de données fiables, ce qui permettra de mieux cerner les tendances en matière d'infection au VHB au Canada, en plus de contribuer aux mesures de santé publique.
3.0 Hépatite C
3.1 Introduction
Le virus de l'hépatite C (VHC) est un virus enveloppé à acide ribonucléique (ARN) monocaténaire qui appartient à la famille des flavivirus (Flaviviridae). Six génotypes du VHC ont été identifiés, et le génotype 1 est la souche prédominante au Canada et dans toute l'Amérique du NordRéférence 37Référence 38. Les personnes atteintes d'une infection aiguë par le VHC sont souvent asymptomatiques, ce qui rend difficile le dépistage des nouveaux cas. Environ 15 % à 50 % des personnes connaîtront une résolution spontanée et se rétablirontRéférence 8. Il a été démontré que la résolution spontanée survient plus souvent chez les personnes qui présentent une infection par le VHC symptomatique, ce qui semble indiquer une réponse immunitaire plus robusteRéférence 39. Environ 50 % à 85 % des cas d'infection aiguë par le VHC doivent en infection chronique, mais demeurent asymptomatiques pendant des décenniesRéférence 40. L'infection chronique par le VHC peut entraîner une fibrose hépatique, une cirrhose et un hépatocarcinome. Elle est associée à des coûts élevés et à un fardeau important pour les personnes et pour le système de santé.
On estime qu'il y avait jusqu'à 246 000 personnes vivant avec l'infection par le VHC au Canada en 2011; 44 % d'entre elles ignoraient qu'elles étaient infectéesRéférence 41. De 2004 à 2010 au Canada, le nombre d'admissions à l'hôpital associées à l'hépatite C et aux maladies du foie a augmenté pour s'établir à un taux de 6,0 % par annéeRéférence 42. L'hépatite C chronique est également le principal facteur associé au besoin en transplantations hépatiques au CanadaRéférence 25. Cette maladie est également associée à la contribution relative la plus importante au fardeau des maladies infectieuses en Ontario, selon une étude de 2010Référence 43. Selon les données du Registre canadien des insuffisances et des transplantations d'organes (RCITO), l'hépatite C était le deuxième diagnostic primaire le plus fréquent, après le cancer, chez les receveurs d'une greffe du foie au Canada (à l'exception du Québec) de 2007 à 2016Référence 24. Le VHC a ainsi été le diagnostic primaire de 18,1 % des greffés du foie.
Le VHC est hautement contagieux; il se transmet par contact avec du sang contaminé. La majorité des infections par le VHC au Canada se produisent par le partage de matériel de préparation et d'injection de drogues (p. ex. cuiseur, eau, filtre)Référence 44. Dans le rapport de surveillance de 2011 sur le VHC au Canada, il était estimé qu'entre 54 % et 70 % des infections par le VHC déclarées entre 2005 et 2010 était dû à l'usage des drogues injectablesRéférence 44. Lors d'une enquête de surveillance menée par l'ASPC entre 2004 et 2008, 63 % des cas de VHC récemment diagnostiqués pour lesquels les facteurs de risques étaient connus ont été associés à la consommation de drogues injectablesRéférence 45.
Aujourd'hui, le risque d'être infecté par le VHC à la suite de transfusions sanguines au Canada est plus faible que celui d'être infecté par l'utilisation de drogues injectables. Au Canada, tous les dons de sang sont soumis à un test de dépistage du VHC avant toute transfusionRéférence 46. Dans son rapport de surveillance de 2016, la Société canadienne du sang a indiqué que le risque résiduel estimé de transmettre le VHC au Canada par une transfusion sanguine était de 1 pour 12,6 millions de donsRéférence 21. D'autres voies de transmission du VHC moins fréquentes comprennent la propagation par le partage avec une personne infectée de matériel d'hygiène personnelle et d'instruments pointus (p. ex. rasoirs, brosses à dents, ciseaux, coupe-ongles), de même que l'équipement pour renifler ou fumer des drogues (p. ex. pailles, pipes, etc.).
Les populations à risque élevé comprennent les personnes qui s'injectent des drogues, les populations incarcérées (par contact avec du sang infecté lors de l'injection de drogues, de bagarres ou de tatouages), les peuples autochtones (l'injection de drogues étant le principal facteur de risque) et les personnes nées à l'étranger originaires de pays endémiques (prévalence supérieure à 3%)Référence 47. Des taux élevés d'infection chronique par le VHC ont également été rapportés chez les personnes nées entre 1950 et 1970Référence 41.
Il semble que la transmission sexuelle soit rare en général, bien que les hommes séropositifs gais, bisexuels et autres ayant des relations sexuelles avec d'autres hommes semblent être à risque plus élevé de contracter le VHC par transmission sexuelleRéférence 48. En outre, les couples qui ont des relations sexuelles non protégées au cours du cycle menstruel de la femme courent un risque modéré d'être infectés par le VHC par transmission sexuelle si l'un des partenaires sexuels est infecté par le virusRéférence 49. La transmission verticale de la mère à l'enfant a également été documentéeRéférence 50Référence 51.
Bien qu'il n'existe aucun vaccin pour prévenir l'hépatite C, de nouveaux traitements appelés antiviraux à action directe (AAD) ont été approuvés par Santé Canada depuis 2014. En plus d'être très efficaces, ces médicaments nécessitent une durée de traitement plus courte que les traitements à base d'interféron utilisés auparavant et sont associés à moins d'effets secondaires.
La présente section du rapport résume les données de surveillance sur les cas et les taux d'infection par le VHC au Canada entre 2007 et 2016. Les données sur le VHC sont présentées comme des infections non précisées et incluent les infections aiguës, chroniques, résolues et indéterminées par le VHC.
3.2 Tendances nationales
3.2.1 Tendances au fil du temps
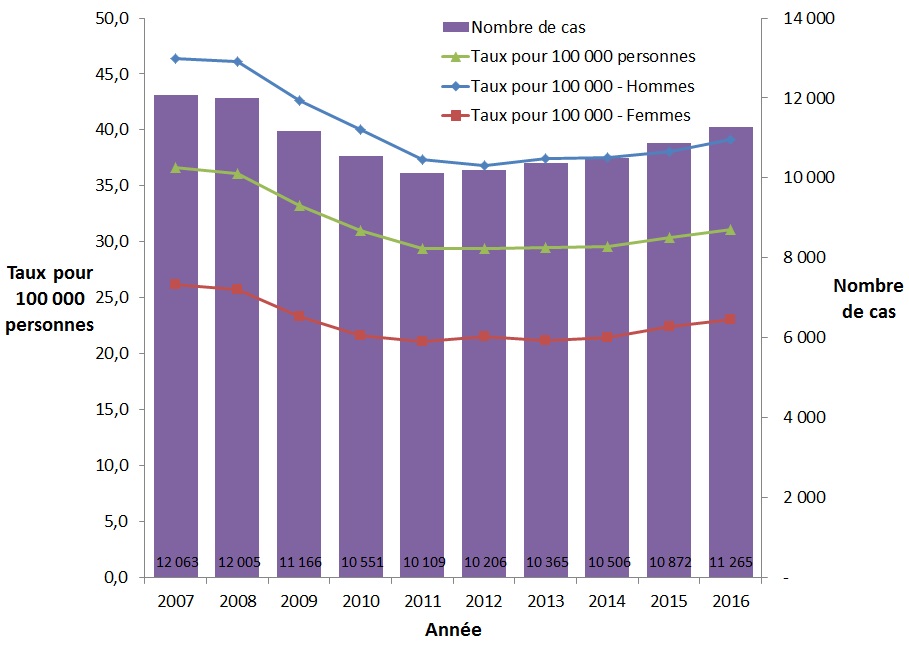
Entre 2007 et 2011, le taux global de cas déclarés d'infection par le VHC a constamment diminué et semble se stabiliser ou légèrement augmenter depuis 2012 (Figure 7). En 2007, 12 063 cas ont été déclarés, ce qui correspond à un taux de 36,7 cas pour 100 000 personnes; en comparaison, en 2016, 11 265 cas d'hépatite C ont été déclarés, ce qui correspond à un taux de 31,1 cas pour 100 000 personnes. Cela représente une diminution de taux de 15,3 % de 2007 à 2016. Le taux d'infection par le VHC déclaré était légèrement plus élevé en 2016 qu'en 2015 (31,1 contre 30,3 pour 100 000 personnes).
Entre 2007 et 2016, les taux d'infection par le VHC déclarés étaient constamment plus élevés chez les hommes que chez les femmes. Au cours de cette période, ce taux a diminué de 15,7 % chez les hommes (de 46,4 à 39,1 pour 100 000 personnes), alors qu'il a diminué de 12,2 % chez les femmes (de 26,2 à 23,0 pour 100 000 personnes) (Figure 7).
Figure 7. Nombre de cas déclarés et taux d'infection par le VHC au Canada selon le sexe, SCSMDO, de 2007 à 2016
Équivalent textuel
Ce graphique présente le nombre de cas ainsi que le taux global et le taux selon le sexe des cas déclarés d'infection par le VHC, entre 2007 et 2016 au Canada. L'axe horizontal montre les années 2007 à 2016. L'axe vertical montre le taux de cas déclarés d'infection par le VHC pour 100 000 personnes chez les hommes, les femmes et le taux global, ainsi que le nombre de cas déclarés d'infection par le VHC.
| Année | Nombre de cas | Taux pour 100 000 personnes | ||
|---|---|---|---|---|
| Homme | Femme | Global | ||
| 2007 | 12 063 | 46,4 | 26,2 | 36,7 |
| 2008 | 12 005 | 46,1 | 25,8 | 36,1 |
| 2009 | 11 166 | 42,6 | 23,3 | 33,2 |
| 2010 | 10 551 | 40,0 | 21,6 | 31,0 |
| 2011 | 10 109 | 37,4 | 21,1 | 29,4 |
| 2012 | 10 206 | 36,8 | 21,5 | 29,4 |
| 2013 | 10 365 | 37,4 | 21,2 | 29,5 |
| 2014 | 10 506 | 37,5 | 21,4 | 29,6 |
| 2015 | 10 872 | 38,0 | 22,4 | 30,3 |
| 2016 | 11 265 | 39,1 | 23,0 | 31,1 |
3.2.2 Taux de cas déclarés d'infection par le VHC au Canada par groupe d'âge et par sexe en 2016
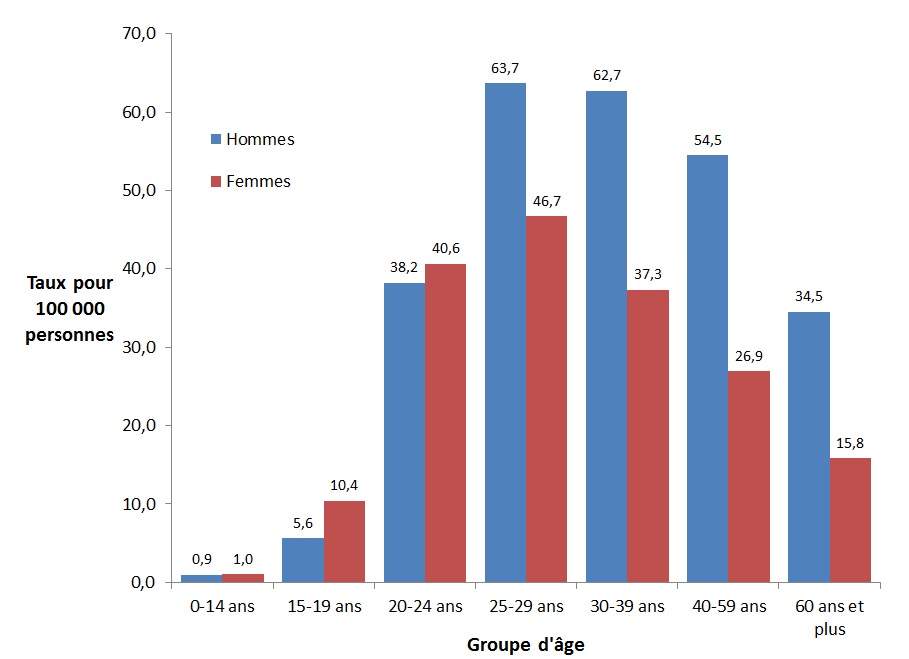
En 2016, 7 039 cas d'hépatite C (62,6 %) ont été signalés chez les hommes comparativement à 4 204 cas (37,4 %) chez les femmes. Les taux les plus élevés d'infection par le VHC chez les hommes ont été observés dans les groupes d'âge de 25 à 59 ans, allant de 54,5 (40 à 59 ans) à 63,7 (25-29 ans) pour 100 000 personnes. Chez les femmes, les taux étaient les plus élevés dans le groupe des 25-29 ans (46,7 pour 100 000 personnes), suivi du groupe des 20-24 ans (40,6 pour 100 000 personnes) et des 30-39 ans (37,3 pour 100 000 personnes) (Figure 8). Les taux d'infection par le VHC étaient les plus faibles chez les moins de 15 ans, soit 0,9 et 1,0 pour 100 000 personnes chez les garçons et les filles respectivement (Figure 8).
Figure 8. Taux de cas déclarés d'infection par le VHC au Canada, par groupe d'âge et par sexe, SCSMDO, 2016
Équivalent textuel
Ce graphique présente le nombre de cas ainsi que le taux global et le taux selon le sexe des cas déclarés d'infection par le VHC, entre 2007 et 2016 au Canada. L'axe horizontal montre les années 2007 à 2016. L'axe vertical montre le taux de cas déclarés d'infection par le VHC pour 100 000 personnes chez les hommes, les femmes et le taux global, ainsi que le nombre de cas déclarés d'infection par le VHC.
| Année | Nombre de cas | Taux pour 100 000 personnes | ||
|---|---|---|---|---|
| Homme | Femme | Global | ||
| 2007 | 12 063 | 46,4 | 26,2 | 36,7 |
| 2008 | 12 005 | 46,1 | 25,8 | 36,1 |
| 2009 | 11 166 | 42,6 | 23,3 | 33,2 |
| 2010 | 10 551 | 40,0 | 21,6 | 31,0 |
| 2011 | 10 109 | 37,4 | 21,1 | 29,4 |
| 2012 | 10 206 | 36,8 | 21,5 | 29,4 |
| 2013 | 10 365 | 37,4 | 21,2 | 29,5 |
| 2014 | 10 506 | 37,5 | 21,4 | 29,6 |
| 2015 | 10 872 | 38,0 | 22,4 | 30,3 |
| 2016 | 11 265 | 39,1 | 23,0 | 31,1 |
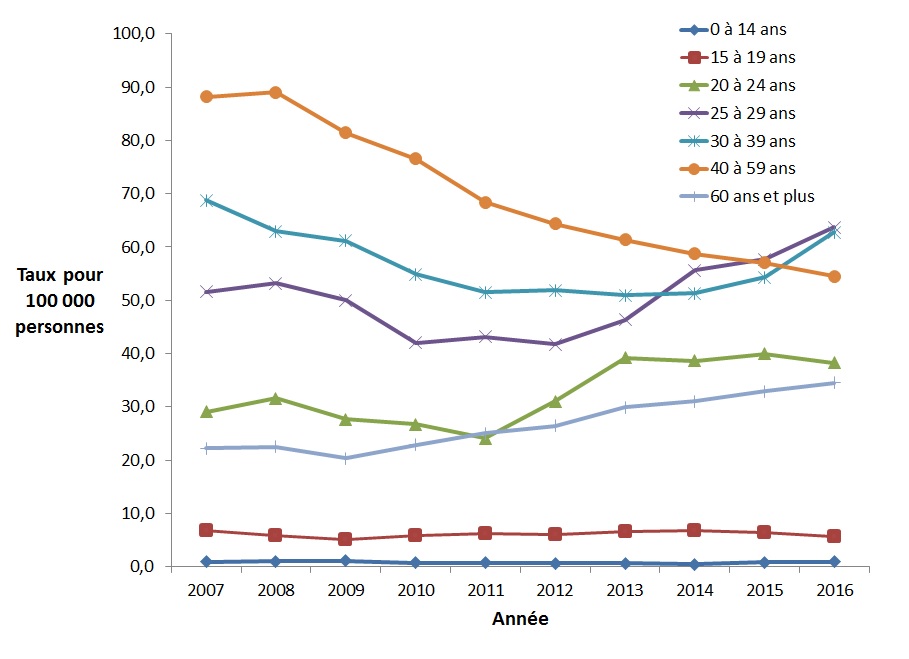
Entre 2007 et 2016, le taux de cas déclarés a diminué chez les hommes de 30 à 59 ans, ainsi que chez ceux de 15 à 19 ans (Figure 9). Les taux ont diminué de 38,2 % dans le groupe des 40 à 59 ans (de 88,2 à 54,5 pour 100 000 personnes), de 16,3 % dans celui des 15 à 19 ans (de 6,7 à 5,6 cas pour 100 000 personnes) et de 8,7 % dans le groupe des 30 à 39 ans (de 68,8 à 62,7 cas pour 100 000 personnes). De 2012 à 2016, le taux de cas déclarés d'infection par le VHC chez les hommes de moins de 15 ans semble avoir augmenté le plus (59,9 %, passant de 0,6 à 0,9 pour 100 000 personnes) (Figure 9). Entre 2007 et 2016, les hommes de 60 ans et plus ont connu la plus forte augmentation des taux déclarés (baisse de 55,6 %, passant de 22,2 à 34,5 pour 100 000 personnes).
Figure 9. Taux de cas déclarés d'infection par le VHC chez les hommes canadiens par groupe d'âge et par année, SCSMDO, de 2007 à 2016
Équivalent textuel
Ce graphique présente le taux de cas d'infection par le VHC déclarés au Canada par groupe d'âge chez les hommes, entre 2007 et 2016 au Canada. L'axe horizontal montre les années 2007 à 2016. L'axe vertical montre le taux de cas déclarés d'infection par le VHC pour 100 000 personnes pour tous les groupes d'âge.
| Année | Taux pour 100 000 personnes | ||||||
|---|---|---|---|---|---|---|---|
| <15 ans | 15-19 ans | 20-24 ans | 25-29 ans | 30-39 ans | 40-59 ans | 60 ans et + | |
| 2007 | 0,9 | 6,7 | 29,1 | 51,6 | 68,8 | 88,2 | 22,2 |
| 2008 | 1,0 | 5,8 | 31,6 | 53,2 | 63,0 | 89,0 | 22,5 |
| 2009 | 1,1 | 5,0 | 27,7 | 50,0 | 61,2 | 81,4 | 20,3 |
| 2010 | 0,7 | 5,8 | 26,7 | 42,0 | 54,8 | 76,6 | 22,8 |
| 2011 | 0,7 | 6,2 | 24,0 | 43,2 | 51,5 | 68,4 | 25,0 |
| 2012 | 0,6 | 6,0 | 31,0 | 41,7 | 51,9 | 64,4 | 26,5 |
| 2013 | 0,6 | 6,5 | 39,2 | 46,3 | 51,0 | 61,4 | 29,9 |
| 2014 | 0,5 | 6,7 | 38,6 | 55,6 | 51,3 | 58,7 | 31,1 |
| 2015 | 0,8 | 6,5 | 40,0 | 57,7 | 54,3 | 57,0 | 32,9 |
| 2016 | 0,9 | 5,6 | 38,2 | 63,7 | 62,7 | 54,5 | 34,5 |
La plus forte augmentation des taux de cas déclarés d'infection par le VHC chez les femmes entre 2007 et 2016 a été observée dans le groupe des 20 à 24 ans (29,1 %, de 31,5 à 40,6 cas pour 100 000 personnes) (Figure 10). Pour la même période, la plus forte diminution des taux chez les femmes a été observée dans le groupe d'âge des 40 à 59 ans (34,0 %, de 40,7 à 26,9 pour 100 000 personnes). Les taux par groupe d'âge et par sexe des cas déclarés d'hépatite C de 2007 à 2016 sont présentés à l'annexe D.
Figure 10. Taux de cas déclarés d'infection par le VHC chez les femmes canadiennes par groupe d'âge et par année, SCSMDO, de 2007 à 2016
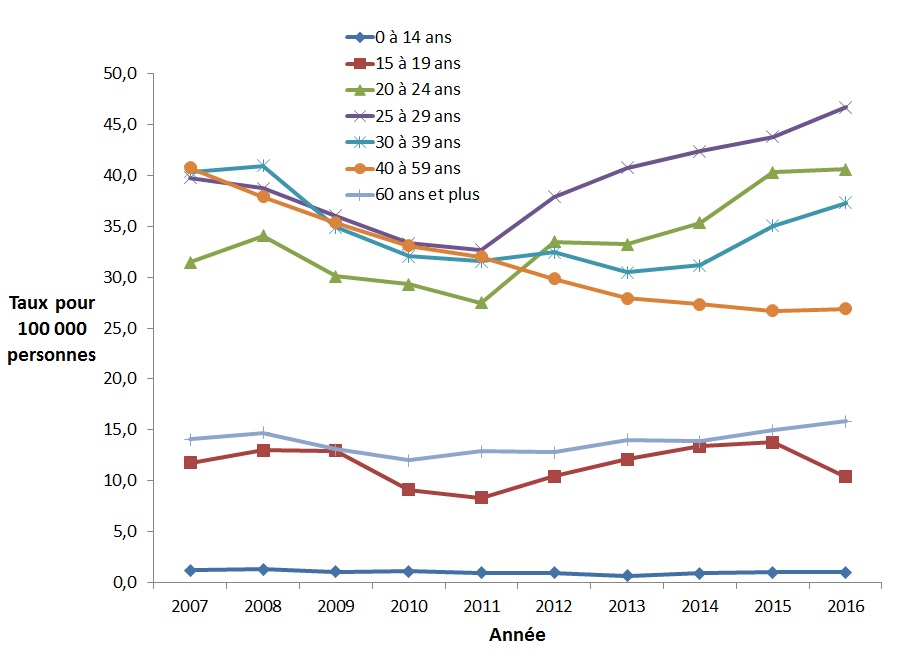
Équivalent textuel
Ce graphique présente le taux de cas d'infection par le VHC déclarés au Canada par groupe d'âge chez les femmes, entre 2007 et 2016 au Canada. L'axe horizontal montre les années 2007 à 2016. L'axe vertical montre le taux de cas déclarés d'infection par le VHC pour 100 000 personnes pour tous les groupes d'âge.
| Année | Taux pour 100 000 personnes | ||||||
|---|---|---|---|---|---|---|---|
| <15 ans | 15-19 ans | 20-24 ans | 25-29 ans | 30-39 ans | 40-59 ans | 60 ans et + | |
| 2007 | 1,2 | 11,7 | 31,5 | 39,8 | 40,4 | 40,7 | 14,1 |
| 2008 | 1,3 | 13,0 | 34,1 | 38,8 | 41,0 | 37,9 | 14,7 |
| 2009 | 1,0 | 12,9 | 30,1 | 36,0 | 34,9 | 35,3 | 13,1 |
| 2010 | 1,1 | 9,1 | 29,3 | 33,3 | 32,1 | 33,1 | 12,0 |
| 2011 | 0,9 | 8,3 | 27,5 | 32,7 | 31,6 | 32,0 | 12,9 |
| 2012 | 0,9 | 10,4 | 33,5 | 37,9 | 32,5 | 29,8 | 12,8 |
| 2013 | 0,7 | 12,1 | 33,2 | 40,8 | 30,5 | 27,9 | 14,0 |
| 2014 | 0,9 | 13,4 | 35,3 | 42,4 | 31,2 | 27,3 | 13,9 |
| 2015 | 1,0 | 13,7 | 40,3 | 43,8 | 35,1 | 26,7 | 14,9 |
| 2016 | 1,0 | 10,4 | 40,6 | 46,7 | 37,3 | 26,9 | 15,8 |
3.2.3 Nombre de cas déclarés et taux d'infection par le VHC selon le sexe et la province ou le territoire au Canada en 2016
En 2016, les taux les plus élevés de cas déclarés d'infection par le VHC ont été observés en Saskatchewan (62,8 pour 100 000 personnes) et en Colombie-Britannique (48,5 pour 100 000 personnes), suivis du Yukon (47,3 pour 100 000 personnes), de l'Alberta (39.3 par 100 000 personnes), du Manitoba (34,9 par 100 000 personnes) et de la Nouvelle-Écosse (32,3 par 100 000 personnes); ces provinces et territoires ont tous déclaré des taux supérieurs à la moyenne nationale de 31,1 par 100 000 personnes (Tableau 3).
Les taux chez les hommes étaient constamment plus élevés que ceux rapportés chez les femmes dans l'ensemble des provinces et des territoires, sauf au Nunavut, où aucun cas n'a été déclaré en 2016.
| Province/ territoire | Homme | Femme | TotalTableau 3 Note de bas de page 1 | |||
|---|---|---|---|---|---|---|
| Nombre de cas | Taux pour 100 000 personnes | Nombre de cas | Taux pour 100 000 personnes | Nombre de cas | Taux pour 100 000 personnes | |
| Canada | 7 039 | 39,1 | 4 204 | 23,0 | 11 265 | 31,1 |
| C.-B. | 1 488 | 63,0 | 819 | 34,2 | 2 307 | 48,5 |
| Alb. | 1 028 | 47,9 | 638 | 30,6 | 1 667 | 39,3 |
| Sask. | 439 | 75,8 | 282 | 49,5 | 721 | 62,8 |
| Man. | 250 | 38,1 | 209 | 31,6 | 460 | 34,9 |
| Ont. | 2 668 | 38,8 | 1 660 | 23,4 | 4 342 | 31,1 |
| Qc | 688 | 16,6 | 359 | 8,6 | 1 053 | 12,7 |
| N.-B. | 122 | 32,6 | 59 | 15,4 | 181 | 23,9 |
| N.-É. | 211 | 45,4 | 95 | 19,6 | 306 | 32,3 |
| Î.-P.-É. | 19 | 26,1 | 13 | 17,0 | 32 | 21,4 |
| T.-N.-L. | 107 | 40,9 | 58 | 21,6 | 165 | 31,1 |
| Yn | 11 | 56,8 | 7 | 37,4 | 18 | 47,3 |
| T.N.-O. | 8 | 35,0 | 5 | 22,9 | 13 | 29,1 |
| Nt | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
|
||||||
3.2.4 Nombre de cas déclarés et taux d'infection par le VHC selon le groupe d'âge et la province ou le territoire au Canada en 2016
La proportion de cas d'hépatite C par groupe d'âge est présentée au tableau 4 pour chaque province et territoire. En 2016, la proportion la plus élevée de cas a été observée dans le groupe des 20 à 39 ans au Canada. Bien que ce groupe d'âge représente 27 % de la population canadienne totale, il représente 43 % de tous les cas. Toutefois, si l'on additionne la proportion des cas chez les personnes de 40 ans et plus, il semble qu'en Alberta, en Colombie-Britannique, dans les Territoires du Nord-Ouest, en Ontario, au Québec et au Yukon, plus de 50 % des cas étaient âgés de 40 ans et plus. Cette proportion de cas chez les plus de 40 ans était de 54,8 % à l'échelle nationale.
| Province/territoire | Proportion des cas d'hépatite C par groupe d'âge (%)* |
|||
|---|---|---|---|---|
| 0-19 | 20-39 | 40-59 | 60+ | |
| Canada | 2,0 | 43,2 | 36,7 | 18,1 |
| C.-B. | 1,0 | 39,1 | 37,1 | 22,8 |
| Alb. | 1,6 | 38,7 | 41,5 | 18,2 |
| Sask. | 4,0 | 59,1 | 30,2 | 6,7 |
| Man. | 3,3 | 57,6 | 27,6 | 11,1 |
| Ont. | 2,2 | 44,3 | 35,3 | 18,1 |
| Qc | 0,9 | 25,6 | 49,4 | 24,1 |
| N.-B. | 3,3 | 53,6 | 30,9 | 12,2 |
| N.-É. | 2,6 | 61,8 | 26,8 | 8,8 |
| Î.-P.-É. | 3,1 | 75,0 | 21,9 | 0,0 |
| T.-N.-L. | 4,3 | 69,8 | 17,9 | 8,0 |
| Yn | 0,0 | 50,0 | 27,8 | 22,2 |
| T.N.-O. | 0,0 | 15,4 | 38,5 | 46,2 |
| Nt | N.D. | N.D. | N.D. | N.D. |
| N.D. : non disponible | ||||
3.3 Discussion
L'infection par le VHC est un problème de santé publique important qui touche certains segments de la population canadienne et qui a de nombreuses répercussions sur le traitement et les soinsRéférence 25.
Entre 2007 et 2016, le taux global des cas déclarés d'infection par le VHC a diminué de 15,3 % au Canada. Toutefois, si l'on considère les cinq dernières années (de 2012 à 2016), les taux semblent s'être stabilisés (de 29,5 en 2012 à 31,1 pour 100 000 personnes en 2016). La majorité des cas d'hépatite (62,6 %) ont été rapportés chez les hommes en 2016, comme les années précédentes. La tendance générale des taux consistant en une forte baisse dans les années 1990 et 2000 suivie d'une stabilisation au cours des dernières années a été observée tant chez les hommes que chez les femmes.
Dans un passé récent, les taux d'hépatite C ont augmenté chez les adultes âgés de 20 à 39 ans. Les taux chez les personnes âgées de 25 à 39 ans ont augmenté le plus chez les hommes et les femmes au cours des cinq dernières années. Il convient de noter que les taux chez les femmes âgées de 20 à 24 ans ont également augmenté de façon importante au cours des cinq dernières années. En 2016, les taux les plus élevés d'hépatite C ont été observés chez les hommes âgés de 25 à 59 ans et chez les femmes âgées de 20 à 39 ans.
Les taux dans les provinces et les territoires varient de 0,0 à 62,8 pour 100 000 personnes, six provinces et territoires affichant des taux supérieurs à la moyenne nationale de 31,1 pour 100 000 personnes.
Les Centers for Disease Control and Prevention (CDC) des États-Unis ont signalé une augmentation des cas aigus d'hépatite C depuis 2010, tant chez les hommes que chez les femmes; le taux global a plus que triplé entre 2010 et 2016 (3,5 fois supérieur), après avoir diminué de 48,2% entre 2001 et 2010Référence 52. Parmi les facteurs de risque connus, les personnes faisant usage de drogues injectables étaient les plus exposées au risque. Les raisons de la hausse des taux seraient liées à l'augmentation de l'usage de drogues injectables et, dans une moindre mesure, à l'amélioration de la détection des cas. L'usage de drogues injectables a également été signalé comme le facteur de risque le plus important d'infection par le VHC en FranceRéférence 53 et au Royaume-UniRéférence 54. Dans ce dernier cas, les hommes affichaient également des taux plus élevés que les femmes. En 2016 au Royaume-Uni, le nombre de cas le plus élevé a été signalé chez les personnes âgées de 25 à 49 ans. De même, le taux de déclaration le plus élevé a été enregistré dans le groupe des 25 à 39 ans en Australie en 2014Référence 55. À l'instar de la situation observée au Canada, le taux de déclaration de l'hépatite C en Australie est demeuré stable entre 2012 et 2015, après une baisse de 22 % entre 2006 et 2011. Une tendance similaire a été observée dans tous les groupes d'âge.
L'Enquête canadienne sur les mesures de la santé (ECMS) a estimé que la séroprévalence des anticorps contre le VHC (anti-VHC), indicateur de l'exposition à vie au virus, était de 0,5 % parmi la population vivant dans un ménage au Canada durant une période de collecte de données s'étalant de 2007 à 2011Référence 28. Toutefois, en 2011, les estimations modélisées de la prévalence tenant compte des populations vulnérables non interrogées par l'ECMS (comme les sans-abri, les détenus et les personnes nées à l'étranger qui ne parlent pas l'anglais ou le français) indiquent que le taux de l'anti-VHC au sein de la population canadienne pourrait être plus près de 1 % (intervalle de plausibilité de 0,6 % à 1,3 %) et qu'environ 42 % à 45 % de ces personnes ne sont pas au courant de leur état. La prévalence de l'infection chronique par le VHC a été estimée à 0,6 %Référence 41.
Dans une étude menée en 2014, on estimait que d'ici 2035, 23 % des patients atteints d'une infection chronique par le VHC au Canada présenteront des complications gravesRéférence 56. Entre 2013 et 2035, la cirrhose compensée devrait augmenter de 89 %, la cirrhose décompensée de 80 %, le carcinome hépatocellulaire de 205 % et les décès liés au foie de 160 %. Une autre étude publiée en 2016 indique qu'entre 1990 et 2013, le nombre d'années de vie corrigées du facteur invalidité dans les pays nord-américains à revenu élevé est passé de 89,2 pour 100 000 personnes à 177,2 pour 100 000 personnes dans le cas d'une infection par le VHC attribuable à l'injection de drogueRéférence 57.
Bien qu'aucun décès n'ait été signalé au Canada en raison d'une infection aiguë par le VHC en 2013 (comparativement à 33 en 2012 et 34 en 2011), 465 décès ont été attribués à une infection chronique par le VHC cette année-là (une augmentation par rapport aux 408 cas déclarés en 2012)Référence 17. Comme dans le cas du VHB, il y a probablement une sous-estimation considérable du nombre de décès liés au VHC en raison d'une mauvaise classification possible sur les certificats de décèsRéférence 58.
Les hommes ont toujours représenté une plus grande proportion des cas déclarés d'infection par le VHC, en particulier chez les personnes âgées de 25 ans et plus, bien que les différences entre les taux chez les hommes et les femmes se soient amoindries depuis 2007 en raison d'une diminution plus importante du nombre de cas déclarés d'infection par le VHC chez les hommes (15,7%) que chez les femmes (12,2%). Ces différences de taux entre les hommes et les femmes pourraient s'expliquer en partie par l'injection de drogue, qui est le mode de transmission du VHC le plus répandu au Canada. Des études menées auprès de personnes qui s'injectent des drogues au Canada entre 2010 et 2012 ont révélé que l'exposition à vie à l'hépatite C (telle que mesurée par les anticorps du VHC dans un échantillon de sang séché) était de 68 %Référence 59. La majorité des participants à ces études (et la majorité des personnes qui s'injectent des drogues en général) sont des hommes, ce qui peut expliquer en partie pourquoi les taux de cas déclarés de VHC sont plus élevés chez les hommes. Les différences entre les taux d'infections déclarées et les infections non diagnostiquées chez les hommes et les femmes peuvent également être le reflet de comportements différents en matière de dépistage, car les femmes sont plus susceptibles de demander des soins de santé et des testsRéférence 60.
Les tendances dans les taux d'infection par le VHC peuvent être influencées par les changements dans les pratiques de consommation de drogues. Par exemple, des études ont montré que l'usage de drogues fumées ou reniflées, comme le crack, à la place de celles administrées principalement par injection peut réduire le risque de transmission du VHC et d'autres infections transmises par le sangRéférence 61. Les interventions de santé publique visant à prévenir les conséquences néfastes de l'usage de drogues peuvent également avoir un effet important sur ces tendances en influant sur les taux de transmissionRéférence 62.
Comme dans le cas de l'infection par le VHB, des changements dans les pratiques de don de sang et de contrôle de l'infection peuvent aussi avoir contribué à la diminution des taux de VHC au Canada. Les données de la Société canadienne du sang de 2016 indiquent que le VHC a été détecté chez 43,4 pour 100 000 nouveaux donneurs et 0,5 pour 100 000 donneurs ayant déjà effectué un don auparavantRéférence 21.
Une autre source de cas de VHC peut être l'immigration au Canada en provenance de pays où le virus est endémique, particulièrement dans les régions où les mesures de prévention des infections transmissibles par le sang dans les établissements de soins de santé ne sont pas systématiquement mises en œuvre. En 2002, on estimait que les immigrants représentaient 20 % des cas d'hépatite C au CanadaRéférence 63.
De nouveaux traitements antiviraux à action directe (AAD) très efficaces font une différence et offrent la possibilité d'élargir la portée du traitement, car ils pourraient maintenant être plus acceptables pour les populations à risque élevé, comme les personnes qui s'injectent des drogues, étant donné la courte durée du traitement et l'absence d'effets secondaires, contrairement aux traitements précédents à base d'interféronRéférence 64Référence 65. L'un des défis soulevés par le traitement de l'hépatite C est la possibilité d'un risque accru de réinfection après des traitements plus courts et mieux tolérés si les comportements à risque se poursuivent, en particulier dans les populations à haut risque comme les personnes qui s'injectent des drogues et les hommes gais, bisexuels et autres qui ont des relations sexuelles avec des hommes séropositifsRéférence 66Référence 67Référence 68. Des stratégies simultanées de réduction des méfaits et des interventions comportementales et structurelles sont nécessaires, ainsi que l'élargissement de l'accès au traitement pour réduire le risque de réinfections.
La crise de santé publique actuelle causée par les surdoses d'opioïdes peut ajouter au fardeau de certaines populations, comme les personnes qui s'injectent des drogues et qui sont simultanément touchées par l'épidémie d'opioïdes et l'hépatite C. Les interventions mises en œuvre pour régler l'un de ces enjeux devraient également appuyer les efforts consentis pour régler le deuxième, dans la mesure du possible.
3.4 Limites
L'interprétation des résultats du présent rapport devrait tenir compte des diverses limites des données. Tout d'abord, la définition de cas d'infection par le VHC utilisée à des fins de surveillance nationale et les protocoles de déclaration utilisés par les provinces et les territoires ont évolué avec le temps, ce qui pourrait avoir eu une influence sur la déclaration de cas. La définition de cas a systématiquement permis de que les tests de confirmation soient effectués à l'aide d'un essai immunoenzymatique (EIA) d'un deuxième fabricant. Les niveaux de sensibilité et de spécificité plus faibles de ces tests de première et de seconde génération ont pu avoir des répercussions sur l'exactitude des données de la surveillance du VHCRéférence 69.
De plus, on ignore dans quelle mesure ces données reflètent l'incidence réelle du VHC. Les personnes atteintes d'une infection aiguë par le VHC sont souvent asymptomatiques et peuvent donc ne pas avoir subi un test ou reçu un diagnostic. Par conséquent, les données du SCSMDO peuvent refléter principalement les cas d'infection chronique. Selon les résultats de l'ECMS, seulement 30 % des répondants canadiens dont les tests avaient révélé la présence d'une infection par le VHC ont indiqué qu'ils avaient reçu un diagnostic d'infection par le VHCRéférence 28. De plus, en raison de la longue durée de l'infection et de la réinfection, il est possible qu'une personne ait subi un test de dépistage et reçu un diagnostic dans plus d'une province ou d'un territoire au fil du temps et, par conséquent, qu'elle ait été comptée plus d'une fois dans l'ensemble de données du SCSMDO.
D'autre part, les données accessibles depuis le SCSMDO ont été analysées uniquement en fonction de l'âge, du sexe et de la province ou du territoire. Pour le moment, le SCSMDO ne dispose d'aucun autre élément de données permettant d'expliquer les tendances observées. En conséquence, il est impossible d'établir avec certitude la proportion de cas déclarés d'infections par le VHC attribuables à la transmission par l'utilisation de drogues injectables, à d'autres comportements à risque ou si le virus affecte de façon disproportionnée certains groupes ou populations.
Enfin, les renseignements sur le caractère aigu ou chronique des cas déclarés d'infection par le VHC n'étaient pas accessibles pour la plupart des provinces et des territoires. Par conséquent, les données sont présentées sans précision du stade dans ce rapport et ne peuvent donc pas indiquer les tendances de l'infection aiguë (ou plus récente) par le VHC.
3.5 Conclusion
Le taux de cas déclarés d'infection par le VHC semble se stabiliser au Canada. Compte tenu de la possibilité qu'une infection par le VHC entraîne de lourdes conséquences sur la santé et exerce des pressions sur le système de soins de santé du Canada, une surveillance continue du VHC est essentielle.
Pour améliorer la capacité des données de surveillance à permettre le suivi des progrès du Canada en matière de prévention et de contrôle de l'infection par le VHC, des efforts supplémentaires sont entrepris pour harmoniser la déclaration des cas d'hépatite C selon le stade d'infection et pour améliorer la qualité des données sur l'infection par le VHC recueillies au moyen de la surveillance de routine. La surveillance, appuyée par des projets de recherche qui examinent les facteurs influant sur les tendances observées, peut permettre d'élaborer des interventions adaptées pour lutter contre les infections par le VHC au Canada.
Références
- Référence 1
-
Organisation mondiale de la Santé. Stratégie mondiale du secteur de la santé contre l'hépatite virale. 2016. Disponible à l'adresse http://apps.who.int/iris/bitstream/handle/10665/250577/WHO-HIV-2016.06-fre.pdf. Consulté le 26 mars 2018.
- Référence 2
-
Organisation mondiale de la Santé. La Soixante-Neuvième Assemblée mondiale de la Santé prend fin. 2016. Disponible à l'adresse http://www.who.int/fr/news-room/detail/28-05-2016-sixty-ninth-world-health-assembly-closes. Consulté le 26 mars 2018.
- Référence 3
-
Agence de la santé publique du Canada. Définitions nosologiques des maladies transmissibles faisant l'objet d'une surveillance nationale. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/rapports-publications/releve-maladies-transmissibles-canada-rmtc/numero-mensuel/2009-35/definitions-nosologiques-maladies-transmissibles-surveillance-nationale.html. Consulté le 20 juillet 2017.
- Référence 4
-
Agence de la santé publique du Canada. Système de surveillance des maladies à déclaration obligatoire, rapport canadien 2005-2008. 2012.
- Référence 5
-
Agence de la santé publique du Canada. Supplément - Définitions nosologiques des maladies transmissibles faisant l'objet d'une surveillance nationale - 2009. Relevés des maladies transmissibles au Canada 2009, vol. 35 (Supplément 2).
- Référence 6
-
Gitlin N. « Hepatitis B: diagnosis, prevention, and treatment ». Clin Chem, août 1997; vol. 43, no 8, pt 2, p. 1500-1506.
- Référence 7
-
Ganem D. et Prince A.M.. « Hepatitis B virus infection — natural history and clinical consequences ». N Engl J Med. 11 mars 2004; vol. 350, no 11, p. 1118-1129.
- Référence 8
-
Heymann D éditeur. Control of communicable diseases manual. 19e éd. États-Unis : American Public Health Association; 2008.
- Référence 9
-
Davis L.G., Weber D.J. et Lemon S.M. « Horizontal transmission of hepatitis B virus ». Lancet. 22 avril 1989; vol. 1, no 8643, p. 889-893.
- Référence 10
-
Modi A.A. et Feld J.J. « Viral hepatitis and HIV in Africa ». AIDS Rev. Janvier-mars 2007; vol 9, no 1, p. 25-39.
- Référence 11
-
Organisation mondiale de la Santé. Hépatite B. Avril 2017; Disponible à l'adresse http://www.who.int/fr/news-room/fact-sheets/detail/hepatitis-b. Consulté le 20 juillet 2017.
- Référence 12
-
Organisation mondiale de la Santé. « Hepatitis B vaccines ». Weekly Epidemiological Record. 2 octobre 2009; vol. 84, n‑ 40, p. 405-420.
- Référence 13
-
Agence de la santé publique du Canada. Sommaire exécutif : Soins primaires de l'hépatite B – Aide-Mémoire. 2013.
- Référence 14
-
Comité consultatif national de l'immunisation (CCNI). « Canadian national immunization report: program update ». Paediatr Child Health 1999; vol. 4 (Suppl. C), p. 30C.
- Référence 15
-
Agence de la santé publique du Canada. Page 7 : Guide canadien d'immunisation : Partie 4 - Agents d'immunisation active. Mars. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-7-vaccin-contre-hepatite-b.html. Consulté en mars 2017.
- Référence 16
-
Santé Canada. Guide canadien d'immunisation. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/guide-canadien-immunisation.html. Consulté le 20 juillet 2017.
- Référence 17
-
Statistique Canada. Tableau 102-0521 – Décès, selon la cause, Chapitre I : Certaines maladies infectieuses et parasitaires (A00 à B99), par groupe d'âge et sexe, Canada, annuel (nombre), CANSIM (base de données). Consulté le 28 juin 2017.
- Référence 18
-
Pohani G., Zou S. et Tepper M. « Trends of hepatitis B and hepatitis C mortality in Canada, 1979-1997 ». Can J Public Health. Juillet-août 2001; vol. 92, no 4, p. 250-254.
- Référence 19
-
Statistique Canada. Enquête sur la couverture vaccinale nationale des enfants, 2015. Disponible à l'adresse https://www150.statcan.gc.ca/n1/daily-quotidien/170628/dq170628a-fra.pdf. Consulté le 30 juin 2017.
- Référence 20
-
Agence de la santé publique du Canada. Couverture vaccinale des adultes canadiens : résultats de l'Enquête nationale sur la vaccination des adultes de 2014. 2016. Disponible à l'adresse https://www.canada.ca/en/public-health/services/publications/healthy-living/vaccine-uptake-canadian-adults-results-2014-adult-national-immunization-coverage-survey.html. Consulté le 30 juin 2017.
- Référence 21
-
Société canadienne du sang. Rapport de surveillance, 2016. Ottawa: SCS. Disponible à l'adresse https://blood.ca/sites/default/files/Surveillance_Report_2016_FINAL.pdf. Consulté le 11 juillet 2017.
- Référence 22
-
Public Health England. Acute hepatitis B (England): annual report for 2016. Public Health England, Public Health England. London: Public Health England, 2017. p. 1 – 6. Disponible à l'adresse https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/643558/hpr3117_hepB_ann.pdf. Consulté le 20 juillet 2018.
- Référence 23
-
Surveillance for Viral Hepatitis – United States, 2016. Centers for Disease Control and Prevention. États-Unis, 2018; Disponible à l'adresse https://www.cdc.gov/hepatitis/statistics/2016surveillance/index.htm. Consulté le 28 septembre 2018.
- Référence 24
-
Institut canadien d'information sur la santé. Statistiques annuelles du RCITO, 2007 à 2016. ICIS 2018 Ottawa, Ont. Disponible at https://www.cihi.ca/fr/statistiques-annuelles-du-rcito-transplantations-autres-que-renales-2007-a-2016. Consulté le 20 juillet 2018.
- Référence 25
-
Fondation canadienne du foie. Les maladies du foie au Canada : Une crise en devenir. Mars 2013. Disponible à l'adresse http://ps70.sb.marqui.com/files/PDF/Liver_Disease_Report_2013/Liver_Disease_in_Canada_-_F_-_2.pdf. Consulté le 26 mars 2018.
- Référence 26
-
Statistique Canada. Guide de l'utilisateur des données de l'Enquête canadienne sur les mesures de la santé (ECMS) : cycle 1. Avril 2011. Disponible à l'adresse http://www23.statcan.gc.ca/imdb-bmdi/pub/document/5071_D2_T1_V1-fra.htm. Consulté le 26 mars 2018.
- Référence 27
-
Statistique Canada. Liste d'autres documents de l'Enquête canadienne sur les mesures de la santé (ECMS) disponibles. 2016 Jun 3; Disponible à l'adresse http://www23.statcan.gc.ca/imdb-bmdi/document/5071_D4_T9_V1-fra.htm. Consulté le 18 décembre 2013.
- Référence 28
-
Rotermann M., Langlois K., Andonov A. et Trubnikov M. Seroprevalence of hepatitis B and C virus infections: Results from the 2007 to 2009 and 2009 to 2011 Canadian Health Measures Survey. Health Rep. Nov. 2013; vol. 24, no 11, p. 3-13.
- Référence 29
-
Greenaway C., Narasiah L., Plourde P., Ueffing E., Pottie K., Deschenes M. et coll. « Appendix 5: Hepatitis B: evidence review for newly arriving immigrants and refugees ». Canadian Medical Association Journal 2011; vol. 183, no 12.
- Référence 30
-
Pottie K., Greenaway C., Feightner J., Welch V., Swinkels H., Rashid M. et coll. « Evidence-based clinical guidelines for immigrants and refugees ». CMAJ. 6 sept. 2011; vol. 183, no 12, p. E824-E925.
- Référence 31
-
Rossi C., Shrier I., Marshall L., Cnossen S., Schwartzman K., Klein M.B. et coll. « Seroprevalence of Chronic Hepatitis B Virus Infection and Prior Immunity in Immigrants and Refugees: A Systematic Review and Meta-Analysis ». PloS One. 2012; vol. 7, no 9, p. e44611. Disponible à l'adresse http://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0044611&type=printable. Consulté le 12 avril 2017.
- Référence 32
-
BC Centre for Disease Control. British Columbia Annual Summary of Reportable Diseases, 2013. 3 sept. 2014. Disponible à l'adresse http://www.bccdc.ca/resource-gallery/Documents/Statistics%20and%20Research/Statistics%20and%20Reports/Epid/Annual%20Reports/2013CDAnnualReportFinal.pdf. Consulté le 26 mars 2018.
- Référence 33
-
Jafari S., Buxton J.A., Afshar K., Copes R. et Baharlou S. « Tattooing and risk of hepatitis B: a systematic review and meta-analysis ». Can J Public Health. Mai-juin 2012; vol. 103, no 3, p. 207-212.
- Référence 34
-
Zhang J., Zou S. et Giulivi A. « Epidemiology of hepatitis B in Canada ». Can J Infect Dis. Nov.-déc. 2001; vol. 12, no 6, p. 345-350.
- Référence 35
-
Moses S., Mestery K., Kaita K.D. et Minuk G.Y. « Viral hepatitis in a Canadian street-involved population ». Can J Public Health. Mars-avril 2002; vol. 93 no 2, p. 123-128.
- Référence 36
-
Huang L., Gilbert M.L., Rossi M.F., Haase D., Wright J., Sicard N. et coll. « Trends in vaccine-induced immunity to hepatitis B among Canadian street-involved youth ». J Urban Health. Mars 2010; vol. 87, no 2, p. 337-348.
- Référence 37
-
Joy J.B., McCloskey R.M., Nguyen T., Liang R.H., Khudyakov Y., Olmstead A. et coll. « The spread of hepatitis C virus genotype 1a in North America:a retrospective phylogenetic study ». Lancet Infect Dis. Juin 2016; vol. 16, no 6, p. 698-702.
- Référence 38
-
Messina J.P., Humphreys I., Flaxman A., Brown A., Cooke G.S., Pybus O.G. et coll. « Global distribution and prevalence of hepatitis C virus genotypes ». Hepatology. Janvier 2015; vol. 61, no 1, p. 77–87.
- Référence 39
-
Micallef J.M., Kaldor J.M. et Dore G.J. « Spontaneous viral clearance following acute hepatitis C infection: a systematic review of longitudinal studies ». J Viral Hepat. Janvier 2006; vol. 13, no 1, p. 34-41.
- Référence 40
-
Wong T. et Lee S.S. « Hepatitis C: a review for primary care physicians ». CMAJ. 20 février 2006; vol. 174, no 5, p. 649-659.
- Référence 41
-
Trubnikov M., Yan P. et Archibald C. « Estimated prevalence of Hepatitis C virus infection in Canada, 2011 ». CCDR. 8 déc. 2014; vol. 40, no 19, p. 429-436.
- Référence 42
-
Schanzer D.L., Paquette D. et Lix L.M. « Historical trends and projected hospital admissions for chronic hepatitis C infection in Canada: a birth cohort analysis ». CMAJ Open. 2014. DOI:10.9778/cmajo.20130087. Disponibleà l'adresse https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4183164/pdf/cmajo.20130087.pdf. Consulté le 26 mars 2018.
- Référence 43
-
Kwong J., Crowcroft N., Campitelli M., Ratnasingham S., Daneman N., Deeks S. et coll. Ontario Burden of Infectious Disease Study (ONBOIDS): An OAHPP/ICES Report 2010; Toronto: Ontario Agency for Health Protection and Promotion, Institute for Clinical Evaluative Sciences. Disponible à l'adresse https://www.publichealthontario.ca/en/eRepository/ONBoID_ICES_Report_ma18.pdf. Consulté le 20 juillet 2017.
- Référence 44
-
Agence de la santé publique du Canada. L'hépatite C au Canada : Rapport de surveillance de 2005-2010. Centre de la lutte contre les maladies transmissibles et les infections, Direction générale de la prévention et du contrôle des maladies infectieuses, Agence de la santé publique du Canada; 2011. Disponible à l'adresse http://publications.gc.ca/site/fra/9.640104/publication.html. Consulté le 12 avril 2017.
- Référence 45
-
Agence de la santé publique du Canada, Section sur la surveillance et l'épidémiologie de l'hépatite C et des ITS. Épidémiologie de l'infection aiguë par le virus de l'hépatite C au Canada : résultats du Système de surveillance accrue des souches de l'hépatite (SSASH). 2009. Disponible à l'adresse http://publications.gc.ca/site/fra/9.636422/publication.html. Consulté le 20 juillet 2017.
- Référence 46
-
Service canadien du sang. Sécurité transfusionnelle. 2017. Disponible à l'adresse https://blood.ca/fr/sang/securite-transfusionnelle. Consulté le 20 juillet 2017.
- Référence 47
-
Ha S., Totten S., Pogany L., Wu J. et Gale-Rowe M. « L'hépatite C au Canada et l'importance du dépistage fondé sur les risques ». RMTC. 2016; vol. 42, p. 57-62. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/rapports-publications/releve-maladies-transmissibles-canada-rmtc/numero-mensuel/2016-42/rmtc-volume-42-3-3-mars-2016/rmtc-volume-42-3-3-mars-2016-maladie-infectieuse-chronique-1.html. Consulté le 12 avril 2017.
- Référence 48
-
Totten S., McGuire M., Cox J., Lambert G., Fyfe M., Husbands W. et coll. Hepatitis C virus in men who have sex with men with no history of injection drug use - Evidence for sexual transmission? A Canadian perspective. http://sti.bmj.com/content/87/Suppl_1/A145.1.
- Référence 49
-
Fondation canadienne du foie. L'hépatite C. 2016. Disponible à l'adresse https://www.liver.ca/fr/patients-caregivers/liver-diseases/hepatitis-c/. Consulté le 20 juillet 2017.
- Référence 50
-
Bevilacqua E., Fabris A., Floreano P., Pembrey L., Newell M.L., Tovo P.A. et coll. « Genetic factors in mother-to-child transmission of HCV infection ». Virology. 20 juillet 2009; vol. 390, no 1, p. 64-70.
- Référence 51
-
Ngo-Giang-Huong N., Jourdain G., Sirirungsi W., Decker L., Khamduang W., Le Coeur S. et coll. « Human immunodeficiency virus-hepatitis C virus co-infection in pregnant women and perinatal transmission to infants in Thailand ». Int J Infect Dis. Juillet 2010; vol. 14, no 7, p. e602-607.
- Référence 52
-
US Centers for Disease Control and Prevention. Viral Hepatitis Surveillance –United States, 2016. Disponible à l'adresse https://www.cdc.gov/hepatitis/statistics/2016surveillance/pdfs/2016HepSurveillanceRpt.pdf
- Référence 53
-
Vaux S., Pioche C., Brouard C., Pillonel J., Bousquet V., et coll. Surveillance des hépatites B et C. Saint-Maurice : Santé publique France ; 2017. 28 p. Disponible à l'adresse http://invs.santepubliquefrance.fr/Publications-et-outils/Rapports-et-syntheses/Maladies-infectieuses/2017/Surveillance-des-hepatites-B-et-C
- Référence 54
-
Public Health England. Hepatitis C in England – 2018 report. Disponible à l'adresse https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/693917/HCV_in_England_2018.pdf
- Référence 55
-
The Kirby Institute. Hepatitis B and C in Australia Annual Surveillance Report Supplement 2016. The Kirby Institute, UNSW Australia, Sydney NSW 2052. Disponible à l'adresse https://kirby.unsw.edu.au/sites/default/files/kirby/report/SERP_HepBandC-Annual-Surveillance-Report-Supp-2016.pdf
- Référence 56
-
Myers R.P., Krajden M., Bilodeau M., Kaita K., Marotta P., Peltekian K. et coll. « Burden of disease and cost of chronic hepatitis C infection in Canada ». Can J Gastroenterol Hepatol. Mai 2014; vol. 28, no 5, p. 243-250.
- Référence 57
-
Degenhardt L., Charlson F., Stanaway J., Larney S., Alexander L.T., Hickman M. et coll. « Estimating the burden of disease attributable to injecting drug use as a risk factor for HIV, hepatitis C, and hepatitis B: findings from the Global Burden of Disease Study 2013 ». Lancet Infect Dis. Déc. 2016; vol. 16, no 12, p. 1385-1398.
- Référence 58
-
Mahajan R., Xing J., Liu S.J., Ly K.N., Moorman A.C., Rupp L. et coll. « Mortality among persons in care with hepatitis C virus infection: the Chronic Hepatitis Cohort Study (CHeCS), 2006-2010 ». Clin Infect Dis. Avril 2014; vol. 58, no 8, p. 1055-1061.
- Référence 59
-
Agence de la santé publique du Canada. Résumé des résultats clés de la phase 3 du système I-Track (2010 à 2012). Ottawa (Ont.): ASPC; 2014. Disponible à l'adresse https://www.canada.ca/fr/sante-publique/services/vih-sida/publications/resume-resultats-cles-phase-3-systeme-i-track-2010-a-2012.html.
- Référence 60
-
Galdas P.M., Cheater F. et Marshall P. « Men and health help-seeking behaviour: literature review ». J Adv Nurs. Mars 2005; vol. 49, no 6, p. 616-623.
- Référence 61
-
Strike C., Gohil H. et Watson T.M. « La distribution de matériel plus sécuritaire pour fumer le crack (cocaïne) : lignes directrices exhaustives pour des pratiques exemplaires ». Point de mire sur la prévention : Pleins feux sur les programmes et la recherche. 2014. Disponible à l'adresse https://www.catie.ca/fr/pdm/automne-2014/distribution-materiel-plus-securitaire-fumer-crack-cocaine-lignes-directrices-exhau.
- Référence 62
-
Grebely J., Lima V.D., Marshall B.D., Milloy M.J., DeBeck K., Montaner J. et coll. « Declining incidence of hepatitis C virus infection among people who inject drugs in a Canadian setting, 1996-2012 ». PLoS One. 4 juin 2014; vol. 9, no 6, p. e97726.
- Référence 63
-
Greenaway C., Thu Ma A., Kloda L.A., Klein M., Cnossen S., Schwarzer G. et coll. « The Seroprevalence of Hepatitis C Antibodies in Immigrants and Refugees from Intermediate and High Endemic Countries: A Systematic Review and Meta-Analysis ». PLoS One. 11 nov. 2015; vol. 10, no 11, p. e0141715. Disponible à l'adresse http://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0141715&type=printable. Consulté le 12 avril 2017.
- Référence 64
-
Roy E., Nonn E., Haley N. et Cox J. (2007). « Hepatits C meanings and preventive strategies among street-involved young injection drug users in Montreal ». International journal of drug policy, vol. 18, p. 397-340.
- Référence 65
-
Harris M. et Rhodes T. « Hepatitis C treatment access and uptake for people who inject drugs: a review mapping the role of social factors ». Harm Reduction Journal. Mai 2013; vol. 10, no 6, p. 7. doi:10.1186/1477-7517-10-7.
- Référence 66
-
Simmons B., Saleem J., Hill A., Riley R.D. et Cooke G.S. « Risk of Late Relapse or Reinfection With Hepatitis C Virus After Achieving a Sustained Virological Response: A Systematic Review and Meta-analysis », Clinical Infectious Diseases. Mars 2016, vol. 62, no 6, p. 683-694.
- Référence 67
-
Ingiliz P., Martin T.C., Rodger A., Stellbrink H.-J., Mauss S., Boesecke C. et coll. « HCV reinfection incidence and spontaneous clearance rates in HIV-positive men who have sex with men in Western Europe ». Journal of Hepatology. Février 2017; vol. 66, no 2, p. 282-287.
- Référence 68
-
Hajarizadeh B., Grebely J., Martinello M., Matthews G.V., Lloyd A.R. et Dore G.J. « Hepatitis C treatment as prevention: evidence, feasibility, and challenges ». The Lancet Gastroenterology & Hepatology. Déc. 2016; vol. 1, no 4, p. 317-327.
- Référence 69
-
Kesli R. « Evaluation of assay methods and false positive results in the laboratory diagnosis of hepatitis C virus infection ». Archives of Clinical Microbiology. 2011; vol. 2, no 4, p. 1-4.
Annexe A : Définitions de cas
| Stade de l'infection | Définition des casRéférence 3 |
|---|---|
Infection aiguë par le VHB |
Antigène HBs et anticorps IgM anti-HBc positifs, lorsqu'il existe des antécédents cliniques compatibles ou une probabilité d'exposition OU Élimination de l'antigène HBs chez un cas ayant été recensé comme positif pour l'antigène HBs au cours des six derniers mois, lorsqu'il existe des antécédents cliniques compatibles ou une probabilité d'exposition |
Cas confirmé d'infection chronique par le VHB |
Persistance de l'antigène HBs pendant plus de six mois OU Détection de l'antigène HBs en l'absence documentée d'anticorps IgM anti-HBc OU Détection de l'ADN du VHB pendant plus de six mois |
Infection par le VHB non préciséeTableau 5 Note de bas de page 1 |
Profil sérologique incompatible avec la définition de cas aigu ou chronique et antigène HBs détecté OU Détection de l'ADN du VHB |
|
|
| Stade de l'infection | Définition des casRéférence 4 |
|---|---|
Cas confirmé, sans distinction entre l'infection aiguë ou l'infection récente |
Détection d'anticorps dirigés contre le virus de l'hépatite C (antiVHC) ou d'ARN du virus de l'hépatite C (ARN du VHC) chez un sujet présentant une apparition discrète de symptômes, quels qu'ils soient, ou des signes d'une hépatite virale aiguë au cours des six mois précédant le premier test positif pour le virus de l'hépatite C ET réaction négative aux anticorps IgM anti-VHA, et résultat négatif au test de détection des anticorps IgM anti-HBc ou des antigènes HBs ET taux sériques d'alanine-aminotransférase (ALT) 2,5 fois supérieurs à la limite supérieure de la normale OU Détection d'anticorps contre le virus de l'hépatite C (anti-VHC) chez un sujet pour lequel un résultat négatif a été documenté suite à un test de dépistage des anticorps anti-VHC au cours des 12 mois précédents OU Détection de l'ARN du virus de l'hépatite C (ARN du VHC) chez un sujet pour lequel un résultat négatif a été documenté suite à un test d'ARN du VHC au cours des 12 mois précédents. |
Cas confirmé – Non spécifié (y compris une infection chronique ou résolue)Tableau 6 Note de bas de page 1 |
Détection d'anticorps dirigés contre le virus de l'hépatite C (antiVHC) OU Détection de l'ARN du virus de l'hépatite C (ARN du VHC) |
NOTE :
|
|
Annexe B : Taux déclarés d'infection aiguë et chronique par le VHB au Canada, entre 2007 et 2016
| P/T | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 |
|---|---|---|---|---|---|---|---|---|---|---|
| C.-B. | 0,91 | 0,71 | 0,59 | 0,25 | 0,29 | 0,29 | 0,24 | 0,39 | 0,17 | 0,11 |
| Alb. | 0,51 | 0,92 | 0,71 | 0,62 | 0,58 | 0,62 | 0,65 | 0,24 | 0,45 | 0,45 |
| Sask. | 0,70 | 1,38 | 0,77 | 1,05 | 1,22 | 0,83 | 0,63 | 0,80 | 0,88 | 0,26 |
| Man. | NP | NP | 0,33 | 0,16 | 0,49 | 0,16 | 0,40 | 0,31 | 0,23 | 0,99 |
| Ont. | 1,32 | 1,12 | 1,01 | 0,96 | 0,94 | 0,70 | 0,76 | 0,75 | 0,66 | 0,82 |
| Qc | 0,58 | 0,57 | 0,43 | 0,28 | 0,30 | 0,37 | 0,22 | 0,24 | 0,13 | 0,14 |
| N.-B. | ND | ND | 1,07 | 0,53 | 1,06 | 0,40 | 0,13 | 1,19 | 0,27 | 1,32 |
| N.-É. | NP | NP | 0,32 | 0,11 | 0,53 | 0,21 | 0,74 | 0,74 | 0,96 | 1,05 |
| Î.-P.-É. | NP | NP | NP | NP | NP | NP | NP | NP | NP | NP |
| T.-N.-L. | NP | NP | NP | NP | NP | NP | NP | NP | NP | NP |
| Yn | ND | 0,00 | 0,00 | 2,89 | 0,00 | 0,00 | 0,00 | 0,00 | 2,68 | 0,00 |
| T.N.-O. | ND | ND | 2,32 | 0,00 | 0,00 | 0,00 | 2,28 | 2,28 | 0,00 | 0,00 |
| Nt | NP | NP | NP | NP | NP | NP | NP | NP | NP | NP |
| P/T | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 |
|---|---|---|---|---|---|---|---|---|---|---|
| C.-B. | 32,00 | 29,98 | 26,73 | 25,95 | 22,94 | 21,95 | 24,36 | 21,39 | 21,53 | 23,39 |
| Alb. | 5,86 | 19,83 | 16,63 | 15,38 | 12,90 | 17,08 | 15,28 | 13,39 | 12,73 | 13,55 |
| Sask. | ND | ND | 7,83 | 8,18 | 6,85 | 12,52 | 9,14 | ND | 9,19 | 11,23 |
| Man. | NP | NP | 8,44 | 10,73 | ND | 4,16 | 4,66 | 5,39 | 9,34 | 10,32 |
| Ont. | ND | ND | ND | ND | 18,76 | 17,85 | 17,34 | 15,40 | 13,28 | 12,10 |
| Qc | 8,96 | 9,01 | 8,12 | 6,07 | 4,66 | 5,85 | 6,62 | 6,59 | 5,58 | 5,55 |
| N.-B. | 0,80 | 1,74 | 4,53 | 4,38 | 3,18 | 5,15 | 5,69 | 3,98 | 5,70 | 9,11 |
| N.-É. | UN | UN | 0,53 | 0,64 | 0,42 | 0,85 | 0,53 | 1,80 | 0,96 | 1,48 |
| Î.-P.-É. | NP | NP | NP | NP | NP | NP | NP | NP | NP | NP |
| T.-N.-L. | NP | NP | NP | NP | NP | NP | NP | NP | NP | NP |
| Yn | ND | 0,00 | 0,00 | 11,56 | 14,12 | 8,32 | 16,53 | 16,30 | 13,41 | 21,01 |
| T.N.-O. | ND | ND | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
| Nt | NP | NP | NP | NP | NP | NP | NP | NP | NP | NP |
| NP : Seuls des cas non précisés ont été déclarés. ND : Les provinces et les territoires n'ont pas déclaré de cas classés en tant qu'infections aiguës et chroniques par le VHB. |
||||||||||
Annexe C : Déclaration des infections par le VHC au Canada, SCSMDO, entre 2007 et 2016
| 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | |
|---|---|---|---|---|---|---|---|---|---|---|
| C.-B. | Infections par le VHC déclarées comme non précisées | Infections par le VHC déclarées comme aiguës ou chroniques | ||||||||
| Alb. | Infections par le VHC déclarées comme non précisées | Infections par le VHC déclarées comme chroniques | Infections par le VHC déclarées comme aiguës, chroniques ou non précisées | |||||||
| Sask. | Infections par le VHC déclarées comme non précisées | |||||||||
| Man. | Infections par le VHC déclarées comme non précisées | |||||||||
| Ont. | Infections par le VHC déclarées comme non précisées | |||||||||
| Qc | Infections par le VHC déclarées comme non précisées | Infections par le VHC déclarées comme aiguës et non précisées | ||||||||
| N.-B. | Infections par le VHC déclarées comme non précisées | |||||||||
| N.-É. | Infections par le VHC déclarées comme non précisées | |||||||||
| Î.-P.-É. | Infections par le VHC déclarées comme non précisées | |||||||||
| T.-N.-L. | Infections par le VHC déclarées comme non précisées | |||||||||
| Yn | Infections par le VHC déclarées comme non précisées | Infections par le VHC déclarées comme aiguës ou chroniques | ||||||||
| T.N.-O. | Infections par le VHC déclarées comme non précisées | |||||||||
| Nt | Infections par le VHC déclarées comme non précisées | |||||||||
Annexe D :Taux des cas déclarés d'infection par le VHC pour 100 000 personnes au Canada, selon le sexe et le groupe d'âge, SCSMDO, entre 2007 et 2016
| Année | Taux global | Groupes d'âge | ||||||
|---|---|---|---|---|---|---|---|---|
| 0-14 ans | 15-19 ans | 20-24 ans | 25-29 ans | 30-39 ans | 40-59 ans | 60 ans+ | ||
| 2007 | 46,4 | 0,9 | 6,7 | 29,1 | 51,6 | 68,8 | 88,2 | 22,2 |
| 2008 | 46,1 | 1,0 | 5,8 | 31,6 | 53,2 | 63,0 | 89,0 | 22,5 |
| 2009 | 42,6 | 1,1 | 5,0 | 27,7 | 50,0 | 61,2 | 81,4 | 20,3 |
| 2010 | 40,0 | 0,7 | 5,8 | 26,7 | 42,0 | 54,8 | 76,6 | 22,8 |
| 2011 | 37,4 | 0,7 | 6,2 | 24,0 | 43,2 | 51,5 | 68,4 | 25,0 |
| 2012 | 36,8 | 0,6 | 6,0 | 31,0 | 41,7 | 51,9 | 64,4 | 26,5 |
| 2013 | 37,4 | 0,6 | 6,5 | 39,2 | 46,3 | 51,0 | 61,4 | 26,2 |
| 2013 | 37,4 | 0,7 | 6,4 | 38,9 | 46,2 | 51,0 | 61,6 | 29,7 |
| 2015 | 38,0 | 0,8 | 6,5 | 40,0 | 57,7 | 54,3 | 57,0 | 32,9 |
| 2016 | 39,1 | 0,9 | 5,6 | 38,2 | 63,7 | 62,7 | 54,5 | 34,5 |
| Année | Taux global | Groupes d'âge | ||||||
|---|---|---|---|---|---|---|---|---|
| 0-14 ans | 15-19 ans | 20-24 ans | 25-29 ans | 30-39 ans | 40-59 ans | 60 ans+ | ||
| 2007 | 26,2 | 1,2 | 11,7 | 31,5 | 39,8 | 40,4 | 40,7 | 14,1 |
| 2008 | 25,8 | 1,3 | 13,0 | 34,1 | 38,8 | 41,0 | 37,9 | 14,7 |
| 2009 | 23,3 | 1,0 | 12,9 | 30,1 | 36,0 | 34,9 | 35,3 | 13,1 |
| 2010 | 21,6 | 1,1 | 9,1 | 29,3 | 33,3 | 32,1 | 33,1 | 12,0 |
| 2011 | 21,1 | 0,9 | 8,3 | 27,5 | 32,7 | 31,6 | 32,0 | 12,9 |
| 2012 | 21,5 | 0,9 | 10,4 | 33,5 | 37,9 | 32,5 | 29,8 | 12,8 |
| 2013 | 21,2 | 0,7 | 12,1 | 33,2 | 40,8 | 30,5 | 27,9 | 14,0 |
| 2014 | 21,4 | 0,9 | 13,4 | 35,3 | 42,4 | 31,2 | 27,3 | 13,9 |
| 2015 | 22,4 | 1,0 | 13,7 | 40,3 | 43,8 | 35,1 | 26,7 | 14,9 |
| 2016 | 23,0 | 1,0 | 10,4 | 40,6 | 46,7 | 37,3 | 26,9 | 15,8 |
Notes de bas de page
- Note de bas de page a
-
https://www.canada.ca/fr/sante-canada/organisation/transparence/rapports-gestion/portefeuille-sante-politique-matiere-d-analyse-comparative-fondee-sur-sexe-genre.html