Valeur préliminaire pour le perchlorate dans l’eau potable – Résumé technique
Une valeur préliminaire de 0,004 mg/L (4 µg/L) a été établie pour le perchlorate dans l’eau potable.
Valeurs préliminaires
Les valeurs préliminaires de Santé Canada représentent des valeurs seuil pour les contaminants présents dans l’eau qui pourrait servir comme source d’eau potable. Une exposition à vie à ces contaminants pouvant aller jusqu’à la valeur préliminaire, à la fois par la consommation d’eau potable et son utilisation durant la douche ou le bain, ne devrait pas augmenter les risques pour la santé des Canadiens, y compris des enfants.
Une valeur préliminaire est établie pour les contaminants qui ne sont pas fréquemment présents dans l’eau potable (qu’elle provienne d’une source ou qu’elle ait été traitée au préalable) au Canada, et donc des recommandations pour la qualité de l’eau potable au Canada ne sont pas instaurées. Santé Canada établit des valeurs préliminaires pour les contaminants à la demande des ministères fédéraux, des provinces ou des territoires. Ces autorités compétentes en font généralement la demande lorsqu’il existe des préoccupations pour la santé humaine attribuables à la présence soupçonnée d’un contaminant dans une source locale d’approvisionnement en eau ou à sa détection et qu’on n’a pas établi de valeur seuil dans l’eau potable pour cette substance. Depuis 2020, les résumés techniques pour les valeurs préliminaires sont publiés en ligne lorsque Santé Canada prévoit que ces valeurs préliminaires pourraient être nécessaires pour plus d’un partie intéressé ou d’une autorité compétente.
Les valeurs préliminaires ne remplacent pas les valeurs de la réglementation existante ou ne prévalent pas sur ces dernières. Toutefois, elles peuvent aider les autorités et la population à connaître les effets potentiels d’un contaminant sur la santé.
Les valeurs préliminaires ont été établies à la suite d’une recension des publications sur la recherche scientifique et des données réglementaires d’autres pays accessibles au moment de leur établissement. En outre, ces valeurs font l’objet d’un examen à l’externe par des pairs pour garantir l’intégrité scientifique.
Santé Canada s’engage à demeurer à l’affût des dernières connaissances scientifiques, dont celles portant sur les risques pour la santé associés aux contaminants n’étant pas habituellement présents dans l’eau potable et ne faisant pas partie des recommandations pour la qualité de l’eau potable au Canada. À cette fin, Santé Canada intègre les contaminants assortis d’une valeur préliminaire dans l’établissement périodique des priorités visant les contaminants dans le but d’élaborer des recommandations complètes.
Considérations liées à l’exposition
Propriétés et sources
Le perchlorate est utilisé dans diverses applications industrielles et militaires, dont les fertilisants à base de nitrate, les combustibles solides destinés aux fusées, les munitions, les explosifs, les feux d’artifice, les fusées éclairantes et les coussins gonflables (ATSDR, 2008; WHO, 2016). Le perchlorate est aussi présent de façon naturelle dans les dépôts de nitrate et les minerais de potasse mais généralement en faible concentration (ATSDR, 2008). Dans l’eau, les sels de perchlorate se dissolvent facilement et forment des anions stables et mobiles (tableau 1; Cal EPA, 2015). Dans le sol, les sels ne s’adsorbent pas aux particules du sol ou aux sédiments (CNRC, 2005; Cal EPA, 2015). On ne s’attend à aucune vaporisation des sels étant donné leur pression de vapeur (tableau 1). Cependant, les anions peuvent être présents dans l’air à la suite d’activités militaires (Cal EPA, 2015).
Propriété |
Perchlorate d’ammonium |
Perchlorate de sodium |
Perchlorate de potassium |
Acide perchlorique |
|---|---|---|---|---|
Numéro de registre du Chemical Abstract Service |
7790-98-9 |
7601-89-0 |
7778-74-7 |
7601-90-3 |
Poids moléculaire (g/mol) |
117,49 |
122,44 |
138,55 |
100,47 |
Solubilité dans l’eau (g/L à 25°C) |
249 |
2 100 |
20,9 |
Miscible dans l’eau |
Pression de vapeur (à 25°C) |
Très faible |
Très faible |
Très faible |
6,8 mm Hg |
log Kow |
-5,84 |
-7,18 |
-7,18 |
-4,63 |
ATSDR, 2008.
Exposition
La principale voie d’exposition au perchlorate est l’ingestion d’eau potable contaminée ou d’aliments cultivés avec de l’eau contaminée (Cal EPA, 2015). On estime que la contribution des aliments à l’exposition totale au perchlorate est plus importante que celle de l’eau potable (Cal EPA, 2015). On a décelé du perchlorate dans une vaste gamme d’aliments, dont les fruits, les légumes et les céréales ainsi que les produits laitiers et le lait maternel (Pearce et coll., 2007; Murray et coll., 2008; EFSA et coll., 2017). L’exposition peut aussi survenir par la consommation d’eau potable même si les concentrations de perchlorate sont habituellement faibles. Une étude sur les sources d’approvisionnement en eau potable au Canada a permis d’établir que plus de 99 % des échantillons présentaient des concentrations de perchlorate inférieures à 1 μg/L et pouvant aller jusqu’à 3,2 μg/L dans les puits domestiques (Environnement Canada, 2009).
Considérations liées à la santé
Cinétique
Chez l’humain et les animaux de laboratoire, le perchlorate ingéré est facilement absorbé dans le tractus gastrointestinal et rejoint la circulation générale (OMS, 2016). L’absorption du perchlorate par la peau est très faible (US EPA, 2009). Dans l’organisme, la substance chimique est distribuée dans les muqueuses gastriques, les glandes salivaires, la thyroïde, les glandes mammaires, le placenta, le plexus choroïde et les reins (Cal EPA, 2015; OMS, 2016). Le perchlorate peut aussi traverser la barrière placentaire (Zhang et coll., 2016). Le perchlorate n’est pas métabolisé et plus de 60 % à 90 % de la dose ingérée est principalement excrétée dans l’urine (Greer et coll., 2002; CNRC, 2005; Braverman et coll., 2006; OMS, 2016). La demi‑vie d’élimination du perchlorate ingéré chez l’humain varie de 6,0 à 9,3 heures (Lamm et coll., 1999; Greer et coll., 2002; CNRC, 2005).
Effets sur la santé
Le perchlorate bloque la fixation de l’iodure par la glande thyroïde chez l’humain et les animaux de laboratoire. Par conséquent, les principaux effets observés à la suite d’une exposition au perchlorate sont une fonction altérée de la thyroïde, dont une modification de la production d’hormones thyroïdiennes, et des effets neurologiques nocifs potentiels. Les données tirées d’études menées chez l’humain et chez des animaux ne semblent pas indiquer un risque accru du cancer après une exposition.
Les études cliniques réalisées chez l’humain révèlent qu’une exposition par voie orale au perchlorate inhibe la fixation de l’iodure dans la thyroïde (Brabant et coll., 1992; Lawrence et coll., 2000; Lawrence et coll., 2001; Greer et coll., 2002; Braverman et coll., 2006). L’étude la plus exhaustive a consisté à administrer plusieurs doses d’essais à des volontaires en bonne santé (Greer et coll., 2002). Dans cette étude, des doses orales quotidiennes de 0,007, 0,02, 0,1 et 0,5 mg de perchlorate/kg de poids corporel (p.c.) par jour dans l’eau potable ont été administrées à 37 hommes et femmes en bonne santé durant 14 jours. Quatre hommes et quatre femmes de chaque groupe ont été exposés à 0,02, 0,1 et 0,5 mg de perchlorate/kg p.c. par jour dilués dans 400 mL d’eau potable. Un autre homme et une autre femme de chacun des groupes ont été exposés aux mêmes doses à quatre moments prédéterminés de la journée (dans 100 mL d’eau potable chacun) et sept autres personnes (six femmes et un homme) ont été exposés à 0,007 mg de perchlorate/kg p.c. par jour. Les mesures de la fixation de l’iodure ont été prises avant (8 et 24 heures au préalable), durant (aux jours 2 et 14) et après (au jour 15) l’exposition au perchlorate. On a mesuré une diminution de la fixation de l’iodure par rapport aux valeurs de référence prises avant l’exposition au perchlorate, et ce, à toutes les doses, la baisse étant significative aux trois doses les plus élevées. Les effets ont été semblables aux jours 2 et 14, mais n’ont pas été significativement différents de la valeur de référence au jour 15. Les concentrations de thyroxine totale (T4), de T4 libre, de triiodothyronine (T3) totale et de thyréostinuline (TSH) mesurées tout au long des expériences se sont situées dans la fourchette des valeurs de référence, à l’exception d’une femme du groupe ayant reçu la dose d’exposition la plus faible.
Dans des études environnementales, on a établi des associations entre une diminution de la concentration de perchlorate dans l’urine et une augmentation de la TSH ou une diminution des hormones thyroïdiennes (T3, T4) (CNRC, 2005; SAB, 2013; Cal EPA, 2015). Des études sur l’exposition en milieu professionnel n’ont révélé aucun effet significatif de l’exposition au perchlorate et aucun effet significatif sur les marqueurs de la fonction thyroïdienne chez les travailleurs exposés à des concentrations pouvant aller jusqu’à 0,48 mg/kg p.c. par jour (Gibbs et coll., 1998; Lamm et coll., 1999).
Plusieurs études menées chez l’humain ont porté sur les effets chez les nouveau‑nés d’une exposition au perchlorate par l’ingestion d’eau potable par la mère en mesurant les concentrations d’hormones thyroïdiennes (CNRC, 2005; SAB, 2013; Cal EPA, 2015). Parmi ces études, Brechner et coll. (2000) ont fait mention d’effets observés aux concentrations les plus faibles se manifestant par une diminution significative de la concentration de T4 et une augmentation de 27 % de la TSH chez les nouveau‑nés exposés in utero à 4 à 6 ppb de perchlorate dans l’eau potable. Les conséquences à long terme d’une exposition au perchlorate in utero et au début de la vie ne sont pas connues. Cependant, une altération de l’hormone thyroïdienne chez les fœtus a été associée à des effets nocifs sur le développement cognitif (Pop et coll., 2003; Vermiglio et coll., 2004; Kooistra et coll., 2006).
La cancérogénicité du perchlorate a été examinée dans deux études menées chez des humains exposés par l’eau potable. Morgan et Cassady (2002) ont examiné l’apparition des cas de cancer dans la grande agglomération des Redlands entre 1988 et 1998, où l’on savait que l’eau potable était contaminée par du perchlorate (5 à 98 ppb) et du trichloroéthylène (0,09 à 97 ppb). On n’a constaté aucune différence significative entre le nombre total de cas de cancer observés par rapport aux cas de cancer attendus (taux d’incidence normalisé [TIN] = 0,97, intervalle de confiance à 99 % [IC] = 0,93 à 1,02). On a constaté une légère augmentation des cas de mélanome et de cancer de l’utérus, alors qu’un moindre nombre de cas de cancer des poumons et des bronches ainsi que des cancers du côlon et du rectum a été rapporté. Tous les autres cancers, notamment celui de la thyroïde, de la vessie, du sein, du col de l’utérus, des reins et de la prostate n’ont pas été affectés. Li et coll. (2001) ont examiné la prévalence des cas de cancer de la thyroïde dans le comté de Clark, où l’eau potable contenait entre 4 et 24 ppb de perchlorate, par rapport à une région sans contamination par le perchlorate (comté de Washoe). Le risque relatif a été de 0,75 (IC à 95 % = 0,35 à 1,59), ce qui n’indique aucune augmentation du risque de cancer de la thyroïde.
Les mécanismes en jeu dans le fonctionnement et la régulation de la thyroïde chez le rat sont relativement semblables à ceux des humains, mais des différences biochimiques et physiologiques modifient la réponse au perchlorate (Cal EPA, 2015). Par conséquent, les études menées chez le rat ne sont pas de bons modèles pour évaluer quantitativement les risques pour la santé humaine associés à une exposition au perchlorate et ne seront pas l’objet d’un exposé détaillé ici; elles offrent plutôt une évaluation qualitative des effets nocifs potentiels. L’exposition des animaux au perchlorate entraîne des effets nocifs sur la thyroïde (modification de la régulation des hormones, poids de la thyroïde, hyperplasie, hypertrophie et effets neurologiques); ces changements ne sont généralement pas associés à des effets carcinogènes ou sur la reproduction (CNRC, 2005; Cal EPA, 2015; OMS, 2016).
Mode d’action
À l’instar du thiocyanate et des cyanates de nitrate et de sélénium, le perchlorate se lie de façon compétitive au symporteur sodium‑iodure pour bloquer la fixation de l’iodure (Schlosser, 2016). Chez l’humain et les animaux, le mode d’action proposé de l’exposition au perchlorate est l’inhibition de la fixation de l’iodure qui entraîne une variation de la concentration des hormones thyroïdiennes (TSH, T3 et T4) et un risque d’effets neurodéveloppementaux, les fœtus et les nourrissons étant les plus vulnérables (CNRC, 2005; SAB, 2013; Cal EPA, 2015). Les autres populations vulnérables incluent les personnes atteintes d’une maladie thyroïdienne et celles qui ont besoin d’un surplus d’iode, notamment les femmes enceintes et allaitantes.
L’iodure est un élément constitutif essentiel des hormones thyroïdiennes, lesquelles sont nécessaires à la régulation du métabolisme basal et à une différenciation et développement adéquats des neurones; l’inhibition de la fixation de l’iodure est associée à une diminution de la production des hormones thyroïdiennes qui entraînent des effets nocifs sur le neurodéveloppement (SAB, 2013). Toutefois, il n’existe aucune étude menée chez l’humain qui a évalué le lien direct entre l’exposition environnementale au perchlorate et les effets nocifs sur le neurodéveloppement, bien que de rares données sur les rongeurs laissent croire que l’association serait inverse (SAB, 2013). Le recours à l’événement précurseur clé qu’est l’inhibition de la fixation d’iodure (plutôt que les effets neurologiques) est une démarche conservatrice permettant de calculer une valeur préliminaire.
Choix de l’étude clé
Les effets sur le neurodéveloppement sont les principaux effets préoccupants d’après l’information contenue dans la base de données sur les humains et les animaux de laboratoire exposés au perchlorate, et le risque de cancer est limité. Il n’existe aucune étude sur l’exposition directe au perchlorate et les effets sur le neurodéveloppement chez l’humain dans les populations vulnérables (fœtus et nourrissons). Cependant, d’après le mode d’action du perchlorate, l’étude de Greer et coll. (2002) a été choisie comme étude clé, car elle montre la modification d’un événement précurseur clé précoce (inhibition de la fixation d’iodure) qui pourrait entraîner des effets neurodéveloppementaux. Ce choix d’étude permet l’obtention d’un point de départ plus conservateur pour l’exposition au perchlorate que ceux associés à des événements clés plus tardifs ou des effets neurodéveloppementaux. Greer et coll. (2002) a aussi été l’étude clé choisie par d’autres organisations (CNRC, 2005; Cal EPA, 2015).
Calcul de la valeur préliminaire
L’apport quotidien tolérable (AQT) pour le perchlorate dans l’eau potable a d’abord été calculé en fonction de la baisse de fixation de l’iodure observée chez 37 adultes en bonne santé représentant un choix conservateur de l’événement précurseur menant à des effets sur le neurodéveloppement (Greer et coll., 2002). À l’aide des données sur la relation dose‑effet de Greer et coll. (2002), nous avons effectué une modélisation pour trouver une dose repère (benchmark dose ou BMD). Une réponse de référence (benchmark response ou BMR) de deux écarts‑types (standard deviation ou SD) pour des données continues (représentant une diminution de 20 % de la fixation de l’iodure par rapport à la valeur de base) a été choisie, puisque 20 % (1) représente une variation de la fixation de l’iodure intra‑individuelle chez l’humain significative du point de vue biologique laquelle est considéré comme une variabilité quotidienne inhérente, et des réponses de référence plus faibles seraient affectées par les variations naturelles, tel que déterminé dans l’analyse des études cliniques (Bruce et coll., 2018); (2) est une valeur plus conservatrice que l’inhibition de la réponse de référence de 50 % non associée à des changements de concentration des hormones thyroïdiennes (OMS, 2016); et (3) est une valeur située dans la fourchette observable des effets significatifs mentionnés dans Greer et coll. (2002). Une réponse de référence plus faible aurait donné un point de départ inférieur à la fourchette des effets significatifs, aurait été trop conservatrice et aurait été située en dehors de la puissance de l’étude. Une dose repère de 20 % de la réponse (BMD2SD) de 0,0297 mg/kg p.c. par jour et la limite inférieure de l’intervalle de confiance à 95 % de la BMD2SD (BMDL2SD) de 0,0109 mg/kg p.c. par jour ont été obtenues par modélisation (US EPA BMDS: version 2.7.0.4). L’apport quotidien tolérable a été calculé comme suit :
Équation 1
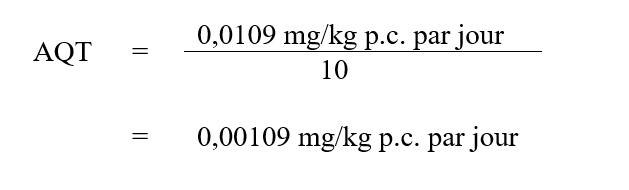
Équation 1 - Équivalent textuel
Cette équation permet de calculer la dose journalière admissible pour perchlorate. La dose journalière tolérable est calculée en divisant la dose minimale avec effet nocif observé pour la perchlorate (0,0109 microgramme par kilogramme de poids corporel par jour) par le facteur d'incertitude de 10, qui est égal à 0,00109 microgramme par kilogramme de poids corporel par jour.
où :
- 0,0109 mg/kg p.c. par jour et la BMDL2SD pour une diminution de la fixation de l’iodure chez l’adulte (Greer et coll., 2002).
- 10 est le facteur d’incertitude : X10 pour la variation intraespèces pour tenir compte des variations dans la population générale, y compris les populations vulnérables. Un facteur d’incertitude pour la durée de l’étude n’est pas nécessaire puisque la fixation d’iodure est inhibée relativement rapidement après le début de l’exposition et l’inhibition n’augmente pas ou augmente uniquement légèrement à mesure que l’exposition se poursuit (Greer et coll., 2002). Par ailleurs, s’il n’y a pas de réduction de la fixation de l’iodure dans la thyroïde, on ne constatera pas de réduction de l’iodure emmagasinée et une durée d’exposition prolongée n’aura probablement pas d’effets sur la fonction thyroïdienne. Il n’est pas nécessaire d’avoir un facteur d’incertitude pour les lacunes de la base de données puisque les données sur l’humain sont cohérentes dans plusieurs études et le point de départ est fondé sur un événement biochimique précurseur qui n’est pas nocif. Les études cliniques menées chez des adultes en bonne santé, les études sur le traitement à long terme de l’hyperthyroïdie à l’aide de perchlorate et les études sur l’exposition en milieu professionnel ou dans l’environnement renforcent la confiance vis-à-vis de la base des données. Comme les rats sont présentement de mauvais modèles pour l’évaluation quantitative, il serait bénéfique de mener d’autres études dans ces modèles.
D’après l’AQT obtenu ci‑dessus, on calcule la valeur préliminaire comme suit :

Équation 2 - Équivalent textuel
Cette équation permet de calculer la valeur préliminaire pour le perchlorate. La valeur préliminaire pour le perchlorate total est obtenue en multipliant l’apport quotidien tolérable (AQT) de 0,00109 mg/kg p.c./jour par le poids corporel moyen d’un nourrisson de 0 à 5 mois, soit 6,3 kg, et par 50 %, soit le facteur d’attribution, le tout divisé par 0,82 L, soit le volume quotidien estimé d'eau du robinet consommée par un nourrisson de 0 à 5 mois. Le résultat équivaut à une valeur de dépistage de 0,004187 mg/L (4,2 µg/L).
où :
- 0,00109 mg/kg p.c. par jour est l’apport quotidien tolérable, calculé ci‑dessus.
- 6,3 kg est le poids corporel moyen d’un nourrisson de 0 à 5 mois (Santé Canada, 2019).
- 0,50 est le facteur d’attribution : la proportion de l’exposition au perchlorate provenant de l’eau potable, comparativement à celle provenant d’autres milieux de l’environnement (c.‑à‑d. les aliments, l’air, le sol, les produits de consommation); un facteur d’attribution de 50 % est recommandé lorsqu’il existe seulement deux sources potentielles importantes d’exposition (Krishnan et Carrier, 2013). Pour le perchlorate, 50 % est une valeur adéquate puisque le potentiel d’exposition provient de deux grandes sources : l’eau potable et la consommation d’aliments ayant été cultivés avec de l’eau contaminée.
- 0,82 L/jour est le volume quotidien estimé d’eau du robinet consommée par un nourrisson de 0 à 5 mois (Santé Canada, 2019); dans une évaluation de l’exposition par plusieurs voies (Krishnan et Carrier, 2008), il a été établi que l’exposition par voie cutanée et par inhalation pendant la douche ou le bain représentent des voies négligeables d’exposition au perchlorate.
Santé Canada recommande une valeur préliminaire de 0,004 mg/L (4 µg/L) pour le perchlorate dans l’eau potable.
Considérations internationales
Les lignes directrices, les normes et/ou les valeurs recommandées pour la qualité de l’eau potable établies par des gouvernements étrangers ou des organisations internationales peuvent varier en raison des données scientifiques disponibles au moment de l’évaluation, ainsi que du recours à différentes politiques et approches, tels que le choix de l’étude clé et le recours à des taux de consommation, des poids corporels et des facteurs d’attribution différents. L’Organisation mondiale de la santé (OMS) a établi une valeur réglementaire alors que le United States (U.S.) et California (Cal) Environmental Protection Agencies (EPA) disposent de valeurs non réglementaires (Tableau 2). Toutes les valeurs sont basées sur une inhibition de la fixation de l’iodure chez des adultes en bonne santé (Greer et coll., 2002) et un facteur d’incertitude de 10, mais elles diffèrent dans le choix du point de départ (point of departure ou POD), des valeurs du poids corporel de l’adulte ou du nourrisson et celles de consommation ainsi que des valeurs de la contribution relative des sources (CRS; correspond au facteur d’attribution de Santé Canada).
Source |
Valeur (mg/L) |
Effet critique |
Point de départ (mg/kg par jour) |
FI |
Autres détails |
|---|---|---|---|---|---|
Réglementaire |
|||||
OMS, 2016 |
0,07 |
Inhibition de la fixation de l’iodure par la thyroïde chez l’humain (Greer et coll., 2002) |
BMR 50 % |
10x intraespèces (pour tenir compte des populations vulnérables) |
Recours au poids corporel de l’adulte et aux valeurs de consommation; CRS 0,20 |
Non réglementaire |
|||||
Cal EPA, 2015 |
0,001 (OSP) |
Idem |
BMR 5 % |
Idem |
Recours au poids corporel du nourrisson et aux valeurs de consommation; CRS 0,74 |
US EPA, 2009 |
0,015 (avis provisoire de santé publique) |
Idem |
NOEL |
Idem |
Recours au poids corporel chez l’adulte et à l’apport en eau potable; CRS 0,62 |
Réponse de référence (BMR); Contribution relative de la source (CRS); Facteur d’incertitude (FI); Dose sans effet observé (NOEL); Objectif de santé publique (OSP).
Coordonnées
Si vous souhaitez recevoir plus d’information, veuillez nous contacter à hc.water-eau.sc@canada.ca.
Références
ATSDR. (2008). Toxicological profile for perchlorates. Agency for Toxic Substances and Disease Registry. United States Department of Health and Human Services, Atlanta, GA.
Brabant, G., Bergmann, P., Kirsch, C.M., Kohrle, J., Hesch, R.D. and von zur Muhlen, A. (1992). Early adaptation of thyrotropin and thyroglobulin secretion to experimentally decreased iodine supply in man. Metabolism, 41(10): 1093-1096.
Braverman, L.E., Pearce, E.N., He, X., Pino, S., Seeley, M., Beck, B., Magnani, B., Blount, B.C. and Firek, A. (2006). Effects of six months of daily low-dose perchlorate exposure on thyroid function in healthy volunteers. J. Clin. Endocrinol. Metab., 91(7): 2721-2724.
Brechner, R.J., Parkhurst, G.D., Humble, W.O., Brown, M.B. and Herman, W.H. (2000). Ammonium perchlorate contamination of Colorado River drinking water is associated with abnormal thyroid function in newborns in Arizona. J. Occup. Environ. Med., 42: 777-772.
Bruce, G.M., Corey, L.M., Pearce, E.N., Braverman, L.E. and Pleus, R.C. (2018). Determination of thresholds of radioactive iodine uptake response with clinical exposure to perchlorate: A pooled analysis. J. Occup. Environ. Med., 60(4): e199-e206.
Cal EPA. (2015). Public health goal for perchlorate in drinking water. Office of Environmental Health Hazard Assessment. California Environmental Protection Agency, California, USA.
EFSA, Arcela, D., Marco, B. and Francesco, V. (2017). Dietary exposure assessment to perchlorate in the European population. EFSA journal: 15(10):5043. European Food Safety Authority. doi: 10.2903/j.efsa.2017.5043.
Environment Canada. (2009). National assessment of groundwater quality in Canada (Pre-release version for government review and comment). National Water Research Institute, Groundwater Assessment and Remediation Section and the University of Waterloo, Department of Earth Sciences. Pages: 1-54.
Gibbs, J.P., Ahmad, R., Crump, K.S., Houck, D.P., Leveille, T.S., Findley, J.E. and Francis, M. (1998). Evaluation of a population with occupational exposure to airborne ammonium perchlorate for possible acute or chronic effects on thyroid function. J. Occup. Environ. Med., 40: 1072-1082.
Greer, M.A., Goodman, G., Pleus, R.C. and Greer, S.E. (2002). Health effects assessment for environmental perchlorate contamination: The dose response for inhibition of thyroidal radioiodine uptake in humans. Environ. Health Perspect., 110(9): 927-937.
Health Canada. (in preparation). Canadian exposure factors used in human health risk assessments.
Kooistra, L., Crawford, S., van Baar, A.L., Brouwers, E.P. and Pop, V.J. (2006). Neonatal effects of maternal hypothyroxinemia during early pregnancy. Pediatrics, 117(1): 161-167.
Krishnan, K. and Carrier, R. (2008). Approaches for evaluating the relevance of multiroute exposures in establishing guideline values for drinking water contaminants. J. Environ. Sci. Health. C. Environ. Carcinog. Ecotoxicol. Rev., 26(3): 300-316.
Krishnan, K. and Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39-51.
Lamm, S.H., Braverman, L.E., Li, F.X., Richman, K., Pino, S. and Howearth, G. (1999). Thyroid health status of ammonium perchlorate workers: a cross-sectional occupational health study. J. Occup. Environ. Med., 41: 248-260.
Lawrence, J.E., Lamm, S.H., Pino, S., Richman, K. and Braverman, L.E. (2000). The effect of short-term low-dose perchlorate on various aspects of thyroid function. Thyroid, 10(8): 659-663.
Lawrence, J., Lamm, S. and Braverman, L.E. (2001). Low dose perchlorate (3 mg daily) and thyroid function. Thyroid, 11(3): 295-295.
Li, F.X., Squartsoff, L. and Lamm, S.H. (2001). Prevalence of thyroid diseases in Nevada counties with respect to perchlorate in drinking water. J. Occup. Environ. Med., 43: 630-634.
Morgan, J.W. and Cassady, R.E. (2002). Community cancer assessment in response to long-term exposure to perchlorate and trichloroethylene in drinking water. J. Occup. Environ. Med., 44(7): 616-621.
Murray, C.W., Egan, S.K., Kim, H., Beru, N. and Bolger, P.M. (2008). U. S. Food and Drug Administration's Total Diet Study: dietary intake of perchlorate and iodine. J. Expo. Sci. Environ. Epidemiol., 18(6): 571-580.
NRC. (2005). Health implications of perchlorate ingestion. National Academies Press, Washington, DC.
Pearce, E.N., Leung, A.M., Blount, B.C., Bazrafshan, H.R., He, X., Pino, S., Valentin-Blasini, L. and Braverman, L.E. (2007). Breast milk iodine and perchlorate concentrations in lactating Boston-area women. J. Clin. Endocrinol. Metab., 92(5): 1673-1677.
Pop, V.J., Brouwers, E.P., Vader, H.L., Vulsma, T., van Baar, A.L. and de Vijlder, J.J. (2003). Maternal hypothyroxinaemia during early pregnancy and subsequent child development: A 3-year follow-up study. Clin. Endocrinol. (Oxf), 59(3): 282-288.
SAB. (2013). SAB advice on approaches to derive a maximum contaminant level goal for perchlorate. Science advisory board. United States Environmental Protection Agency, EPA-SAB-13-004, Washington, D.C.
Schlosser, P.M. (2016). Revision of the affinity constant for perchlorate binding to the sodium-iodide symporter based on in vitro and human in vivo data. J. Appl. Toxicol., 36(12): 1531-1535.
US EPA. (2009). Interim drinking water health advisory for perchlorate. United States Environmental Protection Agency, Office of Water, Washington, D.C. EPA 822-R-08-025.
Vermiglio, F., Lo Presti, V.P., Moleti, M., Sidoti, M., Tortorella, G., Scaffidi, G., Castagna, M.G., Mattina, F., Violi, M.A., Crisa, A., Artemisia, A. and Trimarchi, F. (2004). Attention deficit and hyperactivity disorders in the offspring of mothers exposed to mild-moderate iodine deficiency: A possible novel iodine deficiency disorder in developed countries. J. Clin. Endocrinol. Metab., 89(12): 6054-6060.
WHO. (2016). Perchlorate in drinking-water. Background document for development of WHO guidelines for drinking-water quality. World Health Organization, WHO/SDE/FWC/16.46, Geneva, Switzerland.
Zhang, T., Ma, Y., Wang, D., Li, R., Chen, X., Mo, W., Qin, X., Sun, H. and Kannan, K. (2016). Placental transfer of and infantile exposure to perchlorate. Chemosphere, 144: 948-954.
