Ébauche d'évaluation préalable chlorocrésol
Titre officiel : ébauche d’évaluation préalable 4-Chloro-3-méthylphénol (chlorocrésol)
Numéro de registre du Chemical Abstracts Service 59-50-7
Environnement et changement climatique Canada
Santé Canada
Juillet 2019
Synopsis
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont mené une évaluation préalable sur le 4-chloro-3-méthylphénol, ci-après appelé le chlorocrésol. Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1 ) du chlorocrésol est le 59-50-7. Cette substance a été identifiée d’intérêt prioritaire pour une évaluation puisqu’elle répondait aux critères de catégorisation du paragraphe 73(1) de la LCPE.
Le chlorocrésol a été inclus dans une enquête menée conformément à un avis émis en vertu de l’article 71 de la LCPE. Aucune production de chlorocrésol au-delà du seuil de déclaration de 100 kg n’a été rapportée au Canada en 2011. L’importation au Canada d’une quantité totale de l’ordre de 100 à 1000 kg a été rapportée pour des utilisations commerciales comme adjuvant pour le béton. Parmi d’autres usages au Canada, il est utilisé comme composant dans certaines crèmes/lotions hydratantes pour le corps à des concentrations inférieures ou égales à 0,2 %. Le chlorocrésol a également été identifié en tant qu’ingrédient non médicinal dans des crèmes à base de produits de santé naturels homologués à des concentrations allant jusqu’à 0,2 % et dans un nombre limité de produits pharmaceutiques à des concentrations allant jusqu’à 0,1 %, ainsi qu’en tant qu’ingrédient actif dans un produit antiparasitaire homologué au Canada. Le chlorocrésol sous forme de sel de sodium est également homologué pour l’utilisation dans deux produits antiparasitaires.
Le risque pour l’environnement du chlorocrésol a été caractérisé à l’aide de la classification du risque écologique des substances organiques (CRE), une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de plusieurs éléments de preuve pour obtenir un classement du risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau tropique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte dans les profils d’exposition incluent le taux d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour assigner aux substances un potentiel faible, moyen ou élevé selon de leur profil de danger et d’exposition. D’après les résultats de l’analyse de la CRE, le chlorocrésol est considéré peu susceptible de causer des dommages écologiques.
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le chlorocrésol présente un faible risque d’effets nocifs sur l’environnement. Il est conclu que le chlorocrésol ne satisfait pas aux critères de l’alinéa 64a) ou b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique et qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
En se basant sur les faibles quantités de chlorocrésol rapportées dans le commerce au Canada et sur les niveaux rapportés de chlorocrésol détecté dans l’eau potable, les boues des systèmes de traitement des eaux usées et l’air intérieur au Canada, l’exposition de la population générale au chlorocrésol provenant des milieux de l’environnement devrait être minimale. Les consommateurs ne devraient pas être exposés au chlorocrésol utilisé à des fins commerciales en petites quantités dans certains matériaux de construction comme adjuvant pour le béton.
Au Canada, l’exposition au chlorocrésol peut être due à l’utilisation de certains cosmétiques, comme des crèmes/lotions hydratantes pour le corps ou des produits de santé naturels homologués ou pharmaceutiques topiques, dans lesquels il est présent à des concentrations pouvant atteindre 0,2 %. Les expositions les plus importantes ont été estimées pour l’utilisation de crèmes hydratantes chez les nourrissons (de la naissance à l’âge de 6 mois).
Une étude sur l’exposition chronique au chlorocrésol a permis d’identifier une diminution du poids des glandes surrénales comme effet critique sur la santé. L’exposition estimée au chlorocrésol due à son utilisation dans des produits cosmétiques, tels que des lotions pour le corps, a été comparée aux doses produisant un effet critique sur la santé. Cette comparaison a conduit à des marges d’exposition (ME) jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
En ce qui concerne l’exposition cutanée au chlorocrésol due à l’utilisation de produits de santé naturels homologués ou de produits pharmaceutiques topiques, une comparaison de l’exposition estimée à la dose avec effet critique a conduit à des ME considérées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
En se basant sur les renseignements présentés dans la présente ébauche d’évaluation préalable, il est conclu que le chlorocrésol satisfait aux critères de l’alinéa 64c) de la LCPE, car il pénètre ou peut pénétrer dans l’environnement en quantités ou concentrations ou dans des conditions qui constitue ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, il est conclu que le chlorocrésol répond à un ou plusieurs des critères de l’article 64 de la LCPE.
Il est également proposé que le chlorocrésol ne répond pas aux critères de persistance ni de bioaccumulation du Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada), les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du 4-chloro-3-méthylphénol afin de déterminer si cette substance présente ou peut présenter un risque pour l’environnement ou la santé humaine. Cette substance a été jugée d’intérêt prioritaire pour une évaluation, car elle répondait aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2017]).
Le risque pour l’environnement dû au chlorocrésol a été caractérisé à l’aide de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE décrit le danger d’une substance au moyen de paramètres clés, notamment le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique, et tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en fonction de facteurs comme les vitesses d’émission potentielles, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés pour déterminer les substances qui justifient une évaluation plus approfondie de leur potentiel d’effets nocifs sur l’environnement.
La présente ébauche d’évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, ainsi que de renseignements supplémentaires soumis par des parties prenantes. Des données pertinentes ont été recueillies jusqu’en mars 2018. Des données empiriques tirées d’études clés ainsi que des résultats obtenus au moyen de modèles ont été utilisés pour arriver aux conclusions proposées. Des renseignements présentés dans des évaluations d’autres juridictions ont été pris en compte selon leur disponibilité et leur pertinence.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et changement climatique Canada. Elle est basée sur une ébauche faite par le personnel de MTE Consultants Incorporated et contient des intrants d’autres programmes de ces ministères. La partie de la présente évaluation qui porte sur l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe et d’une période de commentaires du public de 60 jours. Les parties portant sur la santé humaine ont fait l’objet d’un examen et/ou de consultations externes. Des commentaires sur les parties techniques concernant la santé humaine ont été fournis par Judy Lakind (Université du Maryland), Lynne Haber (Toxicology Excellence for Risk Assessment (TERA) Center, Université de Cincinnati) et Howard Maibach (Université de Californie à San Francisco). Bien que des commentaires externes aient été pris en compte, le contenu final et la conclusion de la présente ébauche d’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable est centrée sur des renseignements critiques pour déterminer si la substance répond aux critères de l’article 64 de la LCPE, en examinant des renseignements scientifiques et en suivant une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 2 . La présente ébauche d’évaluation préalable, nous présentons les renseignements et les considérations critiques sur lesquels sont basées les conclusions proposées.
2. Identité de la substance
Le tableau 2‑1 contient le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 3 ), le nom figurant sur la Liste intérieure des substances (LIS) et le nom commun du 4‑chloro-3-méthylphénol, ci-après appelé chlorocrésol .
| no CAS | Nom sur la LIS (nom commun) | Structure chimique et formule moléculairea | Poids moléculaire (g/mol)a |
|---|---|---|---|
| 59-50-7 | 4-chloro-3-méthylphénol (Chlorocrésol ) | 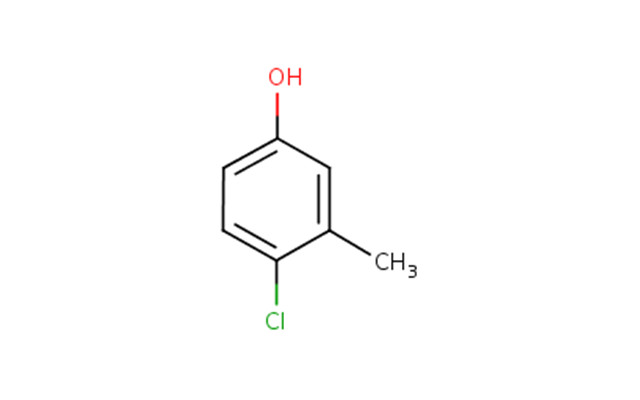 C7H7ClO C7H7ClO |
142,58 |
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques du chlorocrésol est présenté dans le tableau 3‑1. D’autres propriétés physico-chimiques sont décrites dans le document d’ECCC (2016b).
| Propriété | Valeur (ou gamme) | Référence(s) clé(s) |
|---|---|---|
| État physique | Cristaux blancs ou roses ou poudre cristalline | ChemSpider 2018, PISSC 1997, O’Neil 2006 |
| Point de fusion (°C) | 63–68 | ChemIDplus 2018, ChemSpider 2018, PISSC 1997 |
| Point d’ébullition (°C) | 234–236 | ChemIDPlus 2018, ChemSpider 2018, IPCS 1997 |
| Pression de vapeur (Pa) | 6,67 | ChemIDPlus 2018 |
| Constante de Henry (Pa·m3/mol) | 0,248 à 25 °C | ChemIDPlus 2018 |
| Solubilité dans l’eau (mg/L) | 3830 à 25 °C | ChemIDPlus 2018 |
| Autres solubilités | Soluble dans les alcalis, les solvants organiques, les graisses et les huiles | O'Neil 2006 |
| Constante de perméabilité cutanée (cm/h) | 2,85 × 10−2 | RAIS 2018 |
| log Koe (sans dimension) | 3,1 | ChemIDPlus 2018, PISSC 1997 |
| log Kco (sans dimension) | 2,69 | RAIS 2018 |
| pKa (sans dimension) | 9,55 | ChemIDPlus 2018 |
Abréviations : Koe, coefficient de partage octanol-eau, Koc, coefficient de partage carbone organique/eau ; pKa, constante de dissociation acide.
4. Sources et utilisations
Le chlorocrésol a été inclus dans une enquête menée conformément à un avis publié en vertu de l’article 71 de la LCPE (Canada 2012). Au cours de l’année civile 2011, aucune production de chlorocrésol en quantité supérieure au seuil de déclaration de 100 kg n’a été déclarée au Canada, tandis que la quantité totale importée était entre 100 et 1000 kg au cours de cette même période (Environnement Canada 2013) à des fins d’utilisations commerciales comme adjuvant au béton. Les autres utilisations du chlorocrésol au Canada sont énumérées au tableau 4‑1.
| Utilisation | Détails |
|---|---|
| Additif indirect | Composant des additifs indirects utilisés comme lubrifiants dans les installations de transformation des aliments et susceptibles d’entrer en contact avec les aliments. |
| Ingrédient médicinal ou non médicinal dans des produits pharmaceutiques, des désinfectants ou des médicaments vétérinairesb | Ingrédient médicinal dans un médicament vétérinaire et ingrédient non médicinal dans des crèmes topiques pour traiter des irritations temporaires de la peau. |
| Ingrédient médicinal ou non médicinal présent dans des produits de santé naturels homologués au Canadac | Ingrédient non médicinal dans des crèmes topiques utilisées pour traiter des irritations temporaires de la peau. |
| Présent dans des cosmétiques, d’après les déclarations soumises en vertu du Règlement sur les cosmétiquesd | Présence déclarée dans certaines crèmes/lotions hydratantes pour le corps. |
| Ingrédient actif dans des produits antiparasitaires homologuése | Ingrédient actif dans certains agents de conservation de matériaux. |
a Courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation des risques pour les substances existantes, Santé Canada, daté du 9 janvier 2018 - non référencée.
b Courriel de la Direction des produits thérapeutiques, Santé Canada, au Bureau d’évaluation des risques des substances existantes, Santé Canada, daté du 2 janvier 2018 - non référencée.
c BDPSNH (modifié en 2016).
d Courriel de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation des risques des substances existantes, Santé Canada, daté du 9 février 2018 - non référencée.
e Courriel de l’Agence de réglementation de la lutte antiparasitaire (Canada) au Bureau d’évaluation des risques pour les substances existantes, Santé Canada, 13 juillet 2016 - non référencée.
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche de classification du risque écologique des substances organiques (ECCC 2016a), le chlorocrésol devrait se dégrader et ne pas persister dans l’eau, l’air, les sédiments ni le sol.
5.2 Potentiel de bioaccumulation
Compte tenu de son faible Koe et de ses faibles facteurs de bioconcentration (ECCC 2016b), le chlorocrésol ne devrait pas se bioaccumuler de façon significative dans les organismes.
6. Potentiel d’effets nocifs sur l’environnement
6.1 Caractérisation du risque pour l’environnement
Le risque posé à l’environnement par le chlorocrésol a été caractérisé à l’aide de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE est une approche fondée sur le risque qui tient compte de multiples paramètres liés au danger et à l’exposition, sur la base d’un examen pondéré de multiples éléments de preuve pour déterminer la classification du risque. Les divers éléments de preuve sont combinés pour faire la distinction entre les substances plus ou moins puissantes et entre les substances susceptibles de créer plus ou moins d’exposition dans divers milieux. Cette approche réduit l’incertitude globale liée à la caractérisation des risques en comparaison avec une approche reposant sur une seule mesure dans un seul milieu (p. ex. caractérisation par la dose létale médiane [CL50]). Voici un résumé de l’approche, qui est décrite en détail dans le document (2016a) d’ECCC.
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons et les quantités de produits chimiques importées ou produites au Canada ont été tirées de la littérature scientifique, de bases de données empiriques (p. ex. [Q]SAR Toolbox de l’OCDE 2016) et de réponses aux enquêtes menées en vertu de l’article 71 de la LCPE. Autrement, elles proviennent de modèles sélectionnés (quantitatifs) de relation structure-activité ([Q]SAR) ou du devenir du bilan massique et de bioaccumulation. Ces données ont été utilisées comme intrants pour d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition de la substance.
Les profils de danger étaient basés principalement sur des paramètres représentant le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition étaient également basés sur de multiples paramètres, notamment la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faibles, modérés ou élevés. Des règles supplémentaires ont été appliquées (p. ex. cohérence de la classification, marge d’exposition) pour affiner les classifications préliminaires du danger ou de l’exposition.
Une matrice de risques a été utilisée pour attribuer une classification faible, modérée ou élevée des risques potentiels à chaque substance en fonction de ses classifications de danger et d’exposition. Les classifications des risques potentiels au moyen de la CRE ont été vérifiées au moyen d’une approche à deux étapes. La première étape consistait à réviser les résultats de la classification des risques de modéré ou élevé à faible pour les substances dont la vitesse d’émission dans l’eau après traitement des eaux usées était faible, car ces substances représentent un faible risque d’exposition. La deuxième étape consistait à examiner les résultats de la classification de faible potentiel de risque en utilisant des scénarios de risque à l’échelle locale (c.-à-d. dans la zone entourant une source ponctuelle de rejet) relativement prudents conçus pour être protecteur de l’environnement, afin de déterminer si la classification du risque potentiel devrait être augmentée.
La CRE est basée sur une approche pondérée pour réduire au minimum la probabilité de surclassification ou sous-classification du danger, de l’exposition et des risques subséquents. Les approches équilibrées pour traiter des incertitudes sont décrites plus en détail dans ECCC (2016a). Ce qui suit décrit deux des domaines d’incertitude les plus importants. Des erreurs dans les valeurs empiriques ou les valeurs modélisées de la toxicité aiguë pourraient entraîner une modification de la classification du danger, en particulier pour les paramètres basés sur les valeurs des résidus tissulaires (c.-à-d. le mode d’action toxique), dont bon nombre sont des valeurs prédites par des modèles (Q)SAR. Toutefois, l’impact de cette erreur est atténué par le fait que la surestimation de la létalité médiane conduira à une valeur prudente (protectrice) de résidus tissulaires pour l’analyse des résidus corporels critiques (RCC). Des erreurs de sous-estimation de la toxicité aiguë seront atténuées en utilisant d’autres paramètres de danger tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’estrogène. Des changements ou des erreurs dans la quantité de produits chimiques pourraient entraîner des différences dans la classification de l’exposition, les classifications de l’exposition et du risque étant très sensibles à la vitesse d’émission et à la quantité utilisée. Les classifications de la CRE reflètent donc l’exposition et le risque au Canada selon la quantité actuelle vraisemblablement utilisée, et peuvent ne pas refléter les tendances futures.
Les données et les éléments critiques pris en compte pour développer les profils propres au chlorocrésol, ainsi que les résultats de la classification du danger, de l’exposition et des risques, sont présentés dans ECCC (2016b).
En se basant sur son faible danger et son faible potentiel d’exposition déterminés à partir des données prises en compte pour la CRE, le chlorocrésol a été classé comme présentant un faible potentiel de risque pour l’environnement. Il est improbable que cette substance cause des préoccupations pour l’environnement au Canada.
7. Potentiel d’effets nocifs sur la santé humaine
7.1 Évaluation de l’exposition
Le chlorocrésol n’a pas été détecté dans les échantillons d’eau potable prélevés dans des usines de traitement de l’eau en Alberta en 2013 (Alberta Environment and Parks 2016). Un rapport annuel sur la qualité de l’eau de la Ville de Toronto de 2002 indique que le chlorocrésol n’a été détecté dans aucun des 19 échantillons d’eau potable prélevés trimestriellement (Toronto 2003). Le chlorocrésol a été analysé dans des échantillons de boues liquides provenant de 12 usines de traitement des eaux usées (UTEU) au Canada, de septembre 1993 et février 1994. Il n’a été détecté que dans une seule UTEU, à une concentration maximale de 0,1 mg/kg en poids sec. Dans tous les autres échantillons, la concentration était inférieure aux limites de détection de la méthode (Webber et Nichols 1995).
Selon des données du cycle 2 de l’Enquête canadienne sur les mesures de la santé (ECMS) (2012), le chlorocrésol dans l’air intérieur a souvent été non détecté ou détecté à des niveaux inférieurs à la limite de détection de la méthode. Il a été rapporté que le 99ème percentile des concentrations mesurées dans l’air intérieur était de 0,122 µg/m3, ce qui est inférieur à la limite de détection déclarée de 0,18 µg/m3, avec un taux de détection de 25 % (Patry-Parisien et al. 2013).
Compte tenu des faibles quantités de chlorocrésol rapportés dans le commerce au Canada et des niveaux de chlorocrésol rapportés dans l’eau potable, les boues d’UTEU et l’air intérieur au Canada, l’exposition de la population générale au chlorocrésol due aux milieux de l’environnement devrait être minimale.
D’après une enquête menée en vertu de l’article 71 de la LCPE, au Canada, le chlorocrésol est utilisé à des fins commerciales en petites quantités dans certains matériaux de construction comme adjuvant pour le béton (Environnement Canada 2013). Les consommateurs ne devraient pas être exposés au chlorocrésol en raison de cette utilisation.
Le chlorocrésol peut être utilisé comme composant pour la production d’additifs indirects (lubrifiants) utilisés dans des installations de traitement d’aliments en contact accidentel avec les aliments. L’exposition potentielle due à cette utilisation est jugée négligeable (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation des risques des substances existantes, Santé Canada, 9 janvier 2018 – non référencé).
L’exposition au chlorocrésol peut être due à l’utilisation de certaines crèmes/lotions hydratantes pour le corps dans lesquelles il est présent à des concentrations allant jusqu’à 0,2 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation des risques des substances existantes, Santé Canada, 6 juin 2018 - non référencé). Le chlorocrésol a été identifié dans des produits de santé naturels homologués (PSNH), en tant qu’ingrédient non médicinal dans huit crèmes anti-démangeaison à des concentrations allant jusqu’à 0,2 % (BDPSNH [modifiée en 2016]). Lorsqu’il est présent en tant qu’ingrédient non médicinal dans des produits pharmaceutiques pour traitement d’affections temporaires de la peau, telles que des champignons ou de l’eczéma, le chlorocrésol a été rapporté à des concentrations allant jusqu’à à 0,1 % (communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, au Bureau d’évaluation des risques des substances existantes, Santé Canada, 2 janvier 2018 – non référencé). Contrairement aux hydratants pour le corps qui peuvent être utilisés quotidiennement, les PSNH et les produits pharmaceutiques utilisés pour traiter des affections cutanées temporaires ont une durée d’utilisation recommandée plus courte (habituellement une à quatre semaines).
Dans des études sur des cobayes, de 0,2 % à 1,6 % des doses appliquées sont demeurées sous forme de chlorocrésol libre sur le site exposé (timbre) et 75 % du chlorocrésol en suspension aqueuse a pénétré dans la peau (Andersen et al., 1985). Un facteur d’absorption cutanée de 75 % a également été appliqué pour une évaluation des risques du chlorocrésol réalisée conformément au règlement (UE) n° 528/2012. Cette valeur a été adaptée des lignes directrices de l’Autorité européenne de sécurité des aliments (EFSA 2012). Toutefois, une absorption cutanée allant jusqu’à 100 % serait possible lors de l’application des produits sur une peau éraflée ou écorchée (p. ex. pour le traitement des champignons ou de l’eczéma) (Brown et coll. 2006).
Le tableau 7‑1 résume les scénarios d’exposition pour les produits disponibles pour les consommateurs contenant du chlorocrésol. Un facteur d’absorption cutanée de 75 % a été appliqué dans les scénarios servant à estimer l’exposition due à une lotion corporelle, en assumant que la peau en bonne santé.
Pour estimer l’exposition aux PSNH et aux produits pharmaceutiques contenant du chlorocrésol, un scénario d’utilisation de crèmes antifongiques a été choisi. Il est présumé que ces produits contenant du chlorocrésol sont appliqués de la même manière en suivant les directives. Le produit avec la concentration rapportée la plus élevée (0,2 %) a été utilisée pour estimer l’exposition. Pour ces scénarios, un facteur d’absorption cutanée n’a pas été appliqué, car les estimations sont comparées à un paramètre d’effet sur la santé cutanée.
| Scénario pour les produits de consommation | Concentration maximalea (%) | Estimation de l’exposition systémique (mg/kg pc/jour)b |
|---|---|---|
| Lait pour le corps (nourrisson) | 0,2 | 0,40 |
| Lait pour le corps (petit enfant) | 0,2 | 0,32 |
| Lait pour le corps (enfant) | 0,2 | 0,19 |
| Lait pour le corps (adolescent) | 0,2 | 0,18 |
| Lait pour le corps (adulte) | 0,2 | 0,21 |
| Crème antifongique (petit enfant) | 0,2 | 0,015 |
| Crème antifongique (adulte) | 0,2 | 0,011 |
a Lait pour le corps : courriel de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation des risques des substances existantes, Santé Canada, 6 juin 2018, non référencé - crème antifongique : BDPSNH (modifié en 2016). Il est présumé que les PSNH et les produits pharmaceutiques contenant du chlorocrésol sont appliqués en suivant les directives. Toutefois, la concentration maximale de chlorocrésol dans les PSNH a été choisie, car elle est supérieure à celle dans les produits pharmaceutiques.
b Pour la comparaison avec un paramètre par voie orale, l’estimation de l’exposition systémique dans les scénarios pour les lotions corporelles a été ajustée au moyen d’un facteur d’absorption cutanée. Un facteur d’absorption cutanée de 75 % a été appliqué dans les scénarios d’utilisation de lotion corporelle, présumant une peau en bonne santé. Dans les scénarios pour la crème antifongique, un facteur d’absorption cutanée n’a pas été appliqué, car les comparaisons sont faites avec un paramètre cutané.
7.2 Évaluation des effets sur la santé
7.2.1 Toxicocinétique
En général, les Chlorocrésols peuvent être absorbés par la peau, les voies respiratoires et le tube digestif. Après absorption, ils sont métabolisés par le foie, puis excrétés principalement par les reins ou en plus petites quantités par les poumons (Anderson 2006).
L’absorption, la distribution, le métabolisme et l’excrétion du chlorocrésol ont été caractérisés lors de certaines études en laboratoire. L’absorption cutanée du chlorocrésol a été évaluée lors d’une étude pour laquelle quatre groupes de cobayes albinos femelles ont été exposés à diverses concentrations de solutions de chlorocrésol pendant 24 heures au moyen de pansements occlusifs. Les solutions d’exposition de chlorocrésol (0,2 mL) suivantes ont été utilisées : suspension aqueuse à 5 % avec du Carbomer 941; solution aqueuse saturée à 0,38 %; solution huile/acétone (4/1) à 5 %; solution à 5 % dans du propylèneglycol. Après l’exposition, les cobayes ont été sacrifiés et leur peau au site d’exposition (pansement) a été enlevée pour analyse avec les pansements. Les résultats de l’étude ont indiqué que 25 % des solutions aqueuses et 46 % des solutions aqueuses saturées de chlorocrésol demeuraient sur les pansements. Seulement 0,2 % des solutions aqueuses de chlorocrésol et et 0,5 % des solutions aqueuses saturés de chlorocrésol demeuraient dans la peau au site du pansement. En comparaison, 65 % du chlorocrésol dans les solutions de propylène glycol et 66 % du chlorocrésol dans le mélange d’huile d’olive/acétone ont été trouvés dans le pansement, et respectivement 0,7 % et 1,6 % de la substance demeuraient dans la peau au site du pansement. Les résultats de cette étude suggèrent que le chlorocrésol des préparations aqueuses est plus biodisponible (Anderson et al. 1985).
L’absorption cutanée du chlorocrésol a été étudiée lors d’une étude in vitro avec de la peau abdominale de souris SKH-hr-1. De la peau entière et de la peau abrasée à répétition (pour enlever la couche cornée) de l’abdomen ont été montées dans une cellule de diffusion à deux compartiments, avec les deux demi-cellules remplies de solution saline normale. L’absorption a été mesurée à 245 nm à l’aide d’un spectrophotomètre et les coefficients de perméabilité ont été évalués. Le coefficient de perméabilité apparente du chlorocrésol pour la peau entière et la peau abrasée était respectivement de 119 ± 1,8 x 10-3 et 241 ± 22 x 10-3 cm/heure. Les coefficients de perméabilité estimés pour le chlorocrésol pour le tissu viable et la couche cornée étaient respectivement de 302 x 10-3 et de 235 x 10-3 cm/heure (Huq et al. 1986).
Chez des rats exposés à 300 mg/kg de chlorocrésol par voie orale, le chlorocrésol a été rapidement éliminé par les reins. Une étude correspondante n’a montré aucune accumulation de chlorocrésol dans les tissus graisseux et hépatiques des rats exposés par voie orale à des aliments contenant de 150 à 1500 ppm de chlorocrésol pendant 13 semaines (Paulus et Genth 1983).
L’ECHA (2016) a rapporté que le chlorocrésol est largement métabolisé chez le rat et cinq fractions métaboliques ont été observées dans l’urine. Toutefois, aucun détail spécifique sur les métabolites ou les processus métaboliques n’a été fourni.
7.2.2 Toxicité à dose répétée
Lors d’une étude de toxicité cutanée à court terme, des lapins blancs mâles et femelles de Nouvelle-Zélande (10 par sexe et par dose) ont été exposés à 0, 10, 40 ou 160 mg/kg pc/jour de chlorocrésol de qualité technique (99,9 %) par application cutanée cinq jours par semaine pendant trois semaines (Mobay Chemical Co. 1980). L’EPA des États-Unis (1997) a indiqué que l’information sur l’utilisation d’un vecteur n’était pas complète, mais qu’il semblait que le chlorocrésol ait été appliqué sans vecteur. En se basant sur cette étude, l’EPA (1997) a rapporté qu’une irritation cutanée a été observée chez tous les groupes traités, allant d’un léger érythème et d’un très léger œdème chez le groupe traité par 10 mg/kg pc/jour à un érythème grave et un léger œdème chez le groupe ayant reçu 160 mg/kg pc/jour. L’EPA (1997) a également rapporté qu’aucun effet systémique lié au chlorocrésol n’a été observé chez les groupes traités avec 10 et 40 mg/kg pc/jour. Toutefois, une augmentation non purulente de la péricholangite (mâles et femelles) liée au composé et une prolifération des voies biliaires (femelles seulement) dans le foie ont été observées chez le groupe ayant reçu 160 mg/kg pc/jour. L’EPA (1997) a rapporté une DSEO systémique de 40 mg/kg pc/jour et une DMEO de 160 mg/kg pc/jour basées sur les pathologies hépatiques accrues chez les mâles et les femelles. Santé Canada (ARLA 2013) a rapporté une DSENO de 160 mg/kg pc/jour basée sur l’absence d’effets indésirables systémiques à cette dose (la plus élevée des doses testées).
Lors d’une étude de toxicité orale subchronique menée par Madsen et ses collaborateurs (1986), 20 rats Wistar SPF (10 par sexe et par groupe) ont été exposés à 0, 50, 200 ou 400 mg/kg pc/jour de chlorocrésol dans de l’huile de soja de qualité alimentaire administrée par gavage pendant 28 jours. Après 21 jours d’administration, des échantillons de sang ont été prélevés chez huit rats mâles et huit rats femelles pour examiner la chimie hématologique et clinique. Les organes ont également été pesés et examinés au moment de l’autopsie à la fin de l’étude. Une diminution statistiquement significative du gain de poids corporel a été observée chez les rats mâles et femelles exposés à la dose de 400 mg/kg pc/jour (gain de poids corporel inférieur de 32 % et 41 % respectivement chez les rats mâles et femelles comparativement aux témoins). Aucun autre effet significatif lié au traitement n’a été rapporté (Madsen et al. 1986). Anderson (2006) a rapporté une DSEO de 200 mg/kg/jour. L’EPA (2009) a rapporté une DSEO de 200 mg/kg pc/jour et une DMENO de 400 mg/kg pc/jour basées sur la diminution du gain de poids corporel chez les rats exposés. Les auteurs considèrent que la diminution du gain de poids corporel est significative sur le plan toxicologique (EPA 2009).
Lors d’une autre étude de toxicité orale subchronique réalisée par Bayer AG (1992 [non publiée]), des rats Wistar mâles et femelles (20 par sexe par groupe) ont été exposés à 0, 150, 500 ou 1500 ppm de chlorocrésol (équivalant à environ 0, 12, 41 ou 120 mg/kg pc/jour chez les mâles et 0, 17, 54 ou 167 mg/kg pc/jour chez les femelles) pendant 13 semaines. Une diminution du gain de poids corporel (de 5 % à 6 %) par rapport aux témoins a été rapportée chez les rats mâles des groupes traités à 500 et 1500 ppm. Aucun autre effet lié au traitement n’a été observé. L’EPA (2009) a rapporté la DSENO de cet essai comme étant la dose testée la plus élevée (c.-à-d. 167 mg/kg pc/jour), puisque l’importance toxicologique de la diminution du gain de poids corporel chez les rats adultes est inconnue et que le protocole d’étude n’a pas été décrit.
Lors d’une étude sur l’exposition chronique par voie orale réalisée par Bayer AG (1993 [non publiée]), des rats Wistar mâles et femelles (60 animaux par sexe par groupe) ont reçu une alimentation contenant du chlorocrésol à des concentrations de 0, 400, 2000 ou 10 000 ppm (équivalant à environ 0, 21, 103,1 et 558,9 mg/kg pc/jour chez les mâles et 0, 27,7, 134,3 et 743,5 mg/kg pc/jour chez les femelles) pendant deux années. Les signes cliniques chez les rats ont été observés quotidiennement à la suite de l’exposition au chlorocrésol. Tous les principaux tissus et organes des rats euthanasiés et des rats morts ou moribonds avant la fin de l’étude ont été examinés (Bayer AG 1993 [non publié]). Mis à part le mauvais état général chez les femelles ayant reçu la dose élevée, aucun signe clinique de toxicité lié au traitement n’a été observé dans aucun des groupes. Le poids corporel des mâles ayant reçu la dose élevée était significativement plus faible (jusqu’à 8 %) que celui des témoins, tout au long de l’étude. Chez toutes les femelles traitées, le poids corporel a été significativement plus faible que chez les témoins tout au long de l’étude, mais cela n’a été considéré comme indésirable que chez les femelles ayant reçu la dose élevée puisque la diminution moyenne du poids corporel était supérieure à 10 %.
Bien que des diminutions statistiquement significatives du poids corporel aient été observées chez les femelles de tous les groupes traités, chez les mâles les diminutions du poids corporel n’étaient significatives qu’à la dose la plus élevée (8 %) (Bayer AG 1993 [non publié]). Chez les mâles, une diminution du poids des glandes surrénales a été observée à la dose moyenne, alors qu’aucune diminution statistiquement significative du poids corporel n’a été observée. Les diminutions du poids absolu des organes étaient significatives à la dose moyenne (26 %) et à la dose élevée (30 %), comparativement aux témoins. (Bayer AG 1993 [non publié]). Étant donné l’importance de la diminution du poids des glandes surrénales à la dose moyenne, en l’absence d’une diminution significative du poids corporel, ces changements sont considérés pertinents sur le plan toxicologique. La DSENO pour cette étude a été établie à 21 mg/kg pc/jour (400 ppm), avec une DMENO de 103,1 mg/kg pc/jour (2000 ppm), basées sur les diminutions significatives du poids absolu des glandes surrénales comparativement aux témoins.
Chez les rats mâles des groupes traités avec 2000 et 10 000 ppm, une augmentation statistiquement significative de l’incidence de dégénérescence unilatérale et de dégénérescence combinée unilatérale et bilatérale des tubules séminifères par rapport aux groupes témoins (Bayer 1993[non publié]) a été observée. Les rats mâles de ces deux groupes ont également exhibé une diminution statistiquement significative des spermatozoïdes unilatéraux et combinés unilatéraux-bilatéraux dans les épididymes par rapport aux témoins. Cette étude n’a pas fourni suffisamment d’information pour caractériser la pertinence de cet effet sur la reproduction. L’examen de l’étude de Bayer AG (1993) par l’EPA (2009) a indiqué qu’aucun effet statistiquement significatif lié au traitement n’a été rapporté en ce qui a trait à l’incidence des changements néoplasiques.
7.2.3 Toxicité pour le développement et la reproduction
Lors d’une étude réalisée par Miles Inc. (1992 [non publiée])), des groupes de 25 rates Wistar gravides ont été exposées par gavage à 0, 30, 100 ou 300 mg/kg pc/jour de Preventol CMK (chlorocrésol) dans de la méthylcellulose aqueuse à 0,5 %. Les rates ont reçu une dose par jour du sixième au quinzième jour de gestation et des examens pathologiques macroscopiques ont été effectués le vingtième jour de gestation (JG). Dans le groupe traité avec 300 mg/kg pc/jour, les signes cliniques de toxicité comprenaient la prostration et des convulsions, la respiration laborieuse et des exsudats nasaux sanglants. À cette dose, six mères sont mortes. Les résultats pathologiques chez ces mères comprenaient le ballonnement intestinal et le saignement vaginal chez trois animaux. On a observé une diminution de la prise d’aliments et d’eau ainsi qu’une diminution du gain de poids corporel moyen chez les mères exposées à 300 mg/kg pc/jour à divers stades du 6e au 20ème JG (EPA 2009). L’EPA (1997) a également indiqué que deux femelles du groupe recevant 300 mg/kg pc/jour ont totalement résorbé leurs portées. Au cours de la période de traitement, une diminution de la prise alimentaire et une diminution significative du poids corporel (25 %) ont été observées chez les mères exposées à 100 mg/kg pc/jour comparativement aux témoins. Une respiration laborieuse a été constatée après le traitement chez deux mères du groupe exposé à 100 mg/kg pc/jour. Aucun signe clinique ou pathologique de toxicité maternelle n’a été observé dans le groupe exposé à la faible dose (30 mg/kg pc/jour). Aucun effet significatif lié au traitement sur le nombre de corps jaunes, d’implantations, de foetus vivants et de fœtus vivants par sexe n’a été signalé dans les groupes. Des signes de fœtotoxicité n’ont été observés que dans le groupe exposé à la dose élevée (300 mg/kg pc/jour). Ceux-ci comprenaient une augmentation significative des résorptions précoces ainsi qu’une diminution significative du poids fœtal moyen en comparaison avec les témoins. Dans le groupe traité avec la dose de 100 mg/kg pc/jour, un biais significatif du rapport normal des sexes a été observé, passant de 55,6 % de mâles à 45,6 % de mâles. Aucune malformation fœtale liée au traitement n’a été observée à quelque dose que ce soit (EPA 2009). L’EPA (2009) a indiqué que la DSENO maternelle était de 30 mg/kg pc/jour et la DMENO maternelle de 100 mg/kg pc/jour, basées sur la respiration laborieuse et la diminution du poids corporel. L’EPA (2009) a également indiqué que la DSENO pour le développement était de 30 mg/kg pc/jour et la DMENO pour le développement était de 100 mg/kg pc/jour, basées sur les modifications du rapport des sexes, qui peuvent indiquer un effet œstrogénique/anti-androgénique de la substance, appuyé par les paramètres de reproduction mâles de l’étude de Bayer décrits ci-dessus (1993 [non publié]).
Dans une évaluation du chlorocrésol dans les produits biocides, l’Union européenne (ECHA 2016) a également fait état d’une étude sur la reproduction sur deux générations avec des rats Wistar exposés au chlorocrésol. Le schéma posologique de l’étude n’était pas précisé. Toutefois, l’auteur a rapporté trois DSENO distinctes basées sur cette étude. Une DSENO de 47 mg/kg pc/jour a été rapporté pour la toxicité pour la progéniture basée sur un effet non spécifié sur le poids des petits. Une DSENO de 90 mg/kg pc/jour a été rapporté chez les parents, basée sur la diminution significative du gain de poids corporel et sur des effets sur le foie et les reins chez le groupe exposé à 365 mg/kg/jour. Enfin, une DSENO de 288 mg/kg pc/jour pour la toxicité pour la fertilité a été rapportée, basée sur l’augmentation du poids des vésicules séminales chez le groupe exposé à 12 000 ppm. L’ECHA (2016) a également rapporté qu’une atrophie ovarienne, un métoestrus accru et une atrophie du dioestrus et de l’épithélium vaginal ont été observés chez les femelles des première et deuxième générations des groupes exposés à 12 000 ppm. L’ECHA (2016) a également rapporté que d’autres rapports et articles sur l’activité de perturbation endocrinienne potentielle du chlorocrésol, notamment in vitro, dont les résultats appuient la conclusion à l’effet que le chlorocrésol a « un léger potentiel de perturbation endocrinienne in vitro ». Toutefois, l’ECHA (2016) a rapporté que, en se basant sur les études subchroniques, les études de tératogénicité et les études chroniques/cancérigènes, aucun changement de la fonction endocrinienne n’a été observé, et que l’étude sur deux générations chez le rat n’a mis en évidence aucun signe d’activité endocrinienne du chlorocrésol. Aucun détail supplémentaire n’était disponible (ECHA 2016).
7.2.4 Génotoxicité et cancérogénicité
Diverses études de génotoxicité du chlorocrésol chez Salmonella typhimurium ont été réalisées et résumées dans la littérature, toutes les études ayant rapporté des résultats négatifs (Ames et al. 1975, Bayer AG 1980, Herbold 1991a, Herbold et Lorke 1980, Madsen et al. 1986, Rapson et al. 1980, Zeiger et al. 1992). Dans une épreuve de mutation unique, le chlorocrésol s’est révélé positif chez la souche TA97 de S. typhimurium avec activation métabolique, mais négatif dans les tests d’aberration chromosomique et de synthèse d’ADN non programmée, suggérant que le chlorocrésol n’est pas génotoxique (Durham et al. 2004). La génotoxicité du chlorocrésol a également été testée chez la souche PQ37 d’Escherichia coli et la synthèse de réparation de l’ADN-SOS a été induite sans activation métabolique (Malaveille et al. 1991).
Les études de génotoxicité in vitro et in vivo réalisées sur le chlorocrésol chez d’autres systèmes mammifères, y compris les hamsters, les rats et les souris, ont également donné des résultats généralement négatifs (Cifone 1988, Herbold 1990, 1991b, Lehn 1989, Van Goethem 1991).
Selon l’USEPA (1997, 2009), les données sont inadéquates pour permettre l’évaluation du potentiel cancérogène du chlorocrésol. Dans la classification du cancer de l’EPA (1997, 2009), l’étude sur l’exposition chronique par voie orale réalisée par Bayer AG (1993 [non publiée]) sur des rats Wistar mâles et femelles (60 animaux par sexe et par groupe), dont il a été question ci-dessus, était la seule mentionnée. Aucun effet statistiquement significatif lié au traitement sur l’incidence des changements néoplasiques n’a été rapporté. Une augmentation statistiquement significative de l’incidence des adénomes hypophysaires a été observée chez les femelles du groupe recevant la dose moyenne, mais pas chez celles du groupe recevant la dose élevée, sans qu’une tendance significative liée à la dose ait été établie. Chez les mâles, une tendance à la baisse statistiquement significative de l’incidence des adénomes hypophysaires a été observée (augmentation significative observée chez les mâles recevant la faible dose, mais pas chez les mâles recevant la dose moyenne ou élevée), et l’incidence se situait dans la gamme historique des témoins (EPA 1997, 2009). L’EPA (1997) note également que les analogues du chlorocrésol testés lors d’épreuves biologiques réalisés par le NTP ont donné des résultats négatifs.
7.3 Caractérisation des risques pour la santé humaine
Le chlorocrésol n’est pas une substance d’origine naturelle et n’a pas été détecté dans les milieux de l’environnement au Canada, tels que l’eau potable, l’air intérieur ou les boues d’UTEU, à des niveaux susceptibles d’entraîner une exposition significative de la population générale.
L’exposition de la population générale au chlorocrésol devrait être due à sa présence dans des cosmétiques, des produits de santé naturels homologués et des produits pharmaceutiques.
Comparativement aux produits de santé naturels ou aux produits pharmaceutiques contenant du chlorocrésol, le potentiel d’exposition au chlorocrésol due à son utilisation dans certaines crèmes/lotions hydratantes est plus élevé, car elles sont appliquées en quantité généralement plus grande et utilisées quotidiennement (par opposition à une utilisation intermittente pour traiter un problème de peau).
Pour calculer les marges d’exposition (ME) pour le chlorocrésol dans le cas des lotions corporelles, le paramètre toxicologique le plus approprié a été considéré être la DSENO de 21 mg/kg pc/jour tirée de l’étude de Bayer AG (1993 non publiée) sur l’exposition chronique par voie orale. L’effet critique de cette étude était une diminution significative du poids absolu des glandes surrénales, en l’absence d’une diminution significative du poids corporel, chez les mâles.
Pour calculer les ME pour le chlorocrésol dans le cas de l’utilisation à court terme de crèmes antifongiques, le niveau toxicologique le plus approprié a été considéré être la CSEO cutanée de 160 mg/kg pc/jour tirée de l’étude de la Mobay Chemical Co. (1980) sur la toxicité cutanée à court terme. Cette DSEO correspond également au seuil utilisé par Santé Canada dans l’évaluation des utilisations pesticides du chlorocrésol (ARLA 2013).
Dans le tableau 7‑2, nous donnons une comparaison de l’exposition systémique estimée (tirée du tableau 7‑1) et des doses avec effet critique sur la santé sélectionnées pour calculer les ME pour le chlorocrésol présent dans des lotions corporelles et des crèmes antifongiques.
| Scénario d’exposition | Exposition systémique (mg/kg p.c./jour)a | Dose avec effet critique (mg/kg p.c./jour) | Indicateur d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Lotions pour le corps (nourrisson) | 0,40 | DSENO orale de 21 | diminution du poids absolu des glandes surrénales | 53 |
| Lotions pour le corps (petit enfant) | 0,32 | DSENO orale de 21 | diminution du poids absolu des glandes surrénales | 66 |
| Lotions pour le corps (enfant) | 0,19 | DSENO orale de 21 | diminution du poids absolu des glandes surrénales | 111 |
| Lotions pour le corps (adolescent) | 0,17 | DSENO orale de 21 | diminution du poids absolu des glandes surrénales | 124 |
| Lotions pour le corps (adulte) | 0,21 | DSENO orale de 21 | diminution du poids absolu des glandes surrénales | 100 |
| Crème antifongique (tout-petit) | 0,015 | DSENO cutanée de 160 | aucune preuve d’effets systémiques | 10 667 |
| Crème antifongique (adulte) | 0,011 | DSENO cutanée de 160 | aucune preuve d’effets systémiques | 14 545 |
a Le calcul de l’exposition systémique comprend un ajustement pour l’absorption cutanée en fonction des scénarios d’utilisation de la lotion pour le corps. Un facteur d’absorption cutanée de 75 % a été appliqué dans les scénarios d’utilisation de lotion pour le corps, en présumant une peau en bonne santé. Aucun facteur d’absorption cutanée n’a été appliqué aux scénarios d’utilisation de la crème antifongique, car ils sont comparés à un indicateur d’effet sur la peau.
Les ME calculées pour le chlorocrésol utilisé dans des lotions corporelles sont jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Les expositions pourraient être plus élevées que les valeurs estimées si le produit était utilisé plus fréquemment en raison de la sécheresse ou la démangeaison de la peau, ou s’il était utilisé sur une peau écorchée ou craquée.
Les ME calculées pour l’utilisation topique à court terme de produits de santé naturels ou de produits pharmaceutiques homologués sont jugées adéquates pour tenir compte des incertitudes dans la base de données sur les effets sur la santé et l’exposition, pour tous les groupes d’âge.
7.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau 7‑3.
| Principale source d’incertitude | Impact |
|---|---|
| Un taux d’absorption cutanée de 75 % a été assumé pour les produits. topiques. Toutefois, il peut se rapprocher de 100 % si la peau est écorchée (p. ex. pour le traitement des champignons ou de l’eczéma). | - |
| Il n’existe pas d’études sur l’exposition cutanée chronique chez l’animal. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/risque, - = incertitude pouvant entraîner une sous-estimation du risque d’exposition, +/- = potentiel inconnu d’entraîner une surestimation ou une sous-estimation du risque.
8. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le chlorocrésol présente un risque faible d’effets nocifs sur l’environnement. Il est conclu que le chlorocrésol ne satisfait pas aux critères de l’alinéa 64a) ou b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
En se basant sur les renseignements présentés dans la présente ébauche d’évaluation préalable, il est conclu que le chlorocrésol répond aux critères de l’alinéa 64c) de la LCPE puisqu’il pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, il est conclu que le chlorocrésol satisfait à un ou plusieurs des critères de l’article 64 de la LCPE.
Il est proposé que le chlorocrésol ne satisfait pas aux critères de persistance ni de bioaccumulation du Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
[AGDH] Ministère de la Santé du gouvernement australien. 2018. Human health tier II assessment for chlorocresol and its sodium salt . Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS). Rapport d’évaluation de groupe sur l’évaluation et l’établissement des priorités à plusieurs niveaux de l’inventaire (IMAP). consulté le 21 février 2018] (disponible en anglais seulement).
Ames BN, McCann J, Yamasaki E. 1975. Methods for detecting carcinogens and mutagens with the Salmonella/mammalian microsome mutagenicity test. Mutat. Res. 31: 347-36431 : 347-364. [cité dans CIR 1997] (disponible en anglais seulement).
Anderson KE, Carlsen L, Egsgaard H, Larsen E. 1985. . Contact sensitivity and bioavailability of chlorocresol. Contact Dermatitis, 13 : 246-251 [cités dans Anderson 2006] (disponible en anglais seulement).
Anderson KE. 2006. Final report on the safety assessment of sodium p-chloro-m-cresol, p-chloro-m-cresol, chlorothymol, mixed cresols, m-cresol, o-cresol, p-cresol, isopropyl cresols, thymol, o-cymen-5-ol, and carcacro . International Journal of Toxicology. 25:29-127 (disponible en anglais seulement).
ARLA. Agence de réglementation de la lutte antiparasitaire. 2013. Proposed Re-evaluation Decision: p-Choro-m-cresol and Sodium p-chloro-m-cresolate [pdf] . PRVD2013-03. 6 novembre 2013 (disponible en anglais seulement).
Bayer AG. 1980. Salmonella/microsome test with PCMC. Données non publiées (Rapport n° 9122) soumises par le COLIPA (1 page). cités dans CIR 1997 et Anderson 2006] ( disponible en anglais seulement)
Bayer AG. 1992. Chronic toxicity and carcinogenicity study in Wistar administration in feed for 104 weeks – interim report) avec lettre d’accompagnement datée du 27 mars 1992. Rapport NTIS n° OTS053535962. [cités dans CIR 1997, Anderson 2006, USEPA 1997, USEPA 1997, USEPA 2009] (disponible en anglais seulement).
Bayer AG. 1993. Preventol CMK : chronic toxicity and carcinogenicity study in Wistar rats: lab project number: T9030673: 22168. Étude non publiée préparée par Bayer AG Institute of Industrial Toxicology. MRID 427848801 (disponible en anglais seulement).
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. modifié le 10 août 2016]. Ottawa (ON) : Gouvernement du Canada. consulté le 24 janvier 2018].
Bomhard E. 1988, CMK untersuchung zur akuten oralen toxizität an männlichen und weiblichen Wistar-ratten. Date : 18 août 1988 Bayer AG, Institut de toxicologie, Wuppertal, Allemagne Rapport n° 17062 [cité dans ECHA 2015] (disponible en allemand seulement).
Bomhard E, Loser E. 1978 et 1992, Preventol CMK undersuchung zur akuten oralen toxizitat an mannlichen und weiblichen Wistar-ratte. Bayer AG, Institut de toxicologie, Wuppertal, Allemagne, rapport n° 21862 [cité dans ECHA 2015] (disponible en allemand seulement).
Brown MB, Martin GP, Jones SA, Akomeah FK. 2006. Dermal and transdermal drug delivery systems: Current and future prospects. Drug Delivery, 13 (3): 175-187 (disponible en anglais seulement).
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no. 3.
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure. Gazette du Canada, Partie I, vol. 146, no. 48, Supplément.
ChemIDPlus [base de données]. 1993- . Bethesda (MD) : US National Library of Medicine. Résultats de recherche pour no CAS 59-50-7. [consulté le 14 février 2018] (disponible en anglais seulement).
ChemSpider [base de données]. 2018. Royal Society of Chemistry. [consulté le 13 février 2018] (disponible en anglais seulement).
Cifone M, 1988. Parachlorometacresol (Preventol CMK) in the rat primary hepatocyte unscheduled dna synthesis assay : Étude HLA n° 10285-0-447 : étude du promoteur n° T3027707. Étude non publiée préparée par Hazelton Laboratories America, Inc. 30 p. [cité dans USEPA 1997 et USEPA 2009] (disponible en anglais seulement).
[ConsExpo] Consumer Exposure Web Model. 2016. Bilthoven (NL) : Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement] (disponible en anglais seulement).
[CIR] Cosmetic Ingredient Review. 1997. Final report on the safety assessment of p-chloro-m-cresol. International Journal of Toxicology, 16:235-268 (disponible en anglais seulement).
Durham J, Bhat VS, Ball GL, Mclellan CJ. 2004. Human health risk assessment for p-chloro-m-cresol to determine drinking water action levels. The Toxicologist. 43e réunion annuelle de la Society of Toxicology, Baltimore, Maryland (disponible en anglais seulement).
[ECCC] Environnement et changements climatiques Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Ottawa (ON) : Gouvernement du Canada.
[ECCC] Environnement et changements climatiques Canada. 2016b. Données utilisées pour créer des profils de danger et d’exposition propres à une substance et classer des risques selon la Classification du risque écologique des substances organiques. Gatineau (QC). Disponible à l’adresse suivante : substances@ec.gc.ca.
[ECCC, SC] Environnement et changements climatiques Canada, Santé Canada. modifié le 12 mars 2017]. Catégorisation. Ottawa (ON) : Gouvernement du Canada. [consulté le 9 août 2017].
[CE] Commission européenne. 2018. Base de données sur les ingrédients cosmétiques (COSING). Substance : chlorocrésol [consulté le 23 février 2018] (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques. 2015. Committee for Risk Assessment RAC, Annex 1, background document to the opinion proposing harmonised classification and labelling at EU level of chlorocresol; 4-chloro-m-cresol; 4-chloro-3-methylphenol [PDF] (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques. 2016. Regulation (EU) No 528/2012 concerning the making available on the market and use of biocidal products. Evaluation of active substances, Assessment Report: Chlorocresol (CMK). Product-type PT 2 (Private area and public health area disinfectants and other biocidal products) [PDF] Avril 2016. France (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques. c2007-2017. Base de données des substances enregistrées. résultats de recherche pour no CAS RN 59-50-7 . Helsinkki (FI) : ECHA. Renseignements sur la substance : chlorocrésol. mis à jour le 4 février 2018 [consulté le 12 février 2018] (disponible en anglais seulement) .
[EFSA] Autorité européenne de sécurité des aliments. 2012. Guidance on Dermal Absorption. EFSA Journal : 10(4) : 2665 (disponible en anglais seulement).
[EMPODAT] Programme européen de surveillance et d’évaluation, réseau de laboratoires de référence, de centres de recherche et d’organisations connexes pour la surveillance de la base de données sur les nouvelles substances environnementales . 2013. consulté le 14 février 2018] (disponible en anglais seulement).
Environnement Canada. 2013. Données de mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada, Santé Canada - Programme des substances existantes.
[EPA] Agence de protection de l’environnement des États-Unis. [1997. Reregistration Eligibility Decision (RED) [PDF] . P-chloro-m-cresol. Prevention, Pesticides and Toxic Substances (7508W). EPA-738-R-96-008 (disponible en anglais seulement) .
[EPA] Agence de protection de l’environnement des États-Unis. 2009. V Provisional peer-reviewed toxicity values for 4-chloro-3-methylphenol (p-chloro-m-cresol) (No CAS 59-50-7) [PDF] . Superfund Health Risk Technical Support Center. Centre national pour l’évaluation environnementale. Office of Research and Development, Cincinnati, OH 45268 (disponible en anglais seulement).
[EPA] Agence de protection de l’environnement des États-Unis. 2015a. Recherche de produits chimiques pesticides. Office of Pesticide Programs, Washington, DC. [consulté le 22 février 2018] (disponible en anglais seulement).
[EPA] Agence de protection de l’environnement des États-Unis. 2015b. Update of human health ambient water quality criteria: 3-methyl-4-chlorophenol 59-50-7 [PDF] . EPA 820-R-15-092. Office of Water. Office of Science and Technology (disponible en anglais seulement).
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC, 2015. Consumption of cosmetic products by the French population. First part: Frequency data . Food and Chemical Toxicology 78 : 159-169(disponible en anglais seulement).
Gomez-Berrada MP, Gautier F, Parent-Massin D, Ferret PJ. 2013. Retrospective exposure data for baby and children care products: An analysis of 48 clinical studies. Food and Chemical Toxicology 57 : 185-194(disponible en anglais seulement).
[HSDB] Banque de données sur les substances dangereuses [base de données]. 1983- . Bethesda (MD) : National Library of Medicine (É.-U.). mis à jour le 14 février 2012, consulté le 21 février 2018 (disponible en anglais seulement).
Herbold B. 1990. Preventol CMK : micronucleus test on the mouse:: Numéro de projet du laboratoire : T 3033061. Étude non publiée préparée par Bayer Ag. 45 p. [cité dans USEPA 1997] (disponible en anglais seulement).
Herbold B. 1991a. Preventol CMK : salmonella/microsome test: Numéro de projet du laboratoire : T 4038030. Étude non publiée préparée par Bayer AG. 45p. cité dans USEPA 1997] (disponible en anglais seulement).
Herbold B. 1991b. Preventol CMK : micronucleus test on the mouse: Lab Project Number: T 3033061. Étude non publiée préparée par Bayer Ag. 12 p. [cité dans USEPA 1997] (disponible en anglais seulement).
Huq AS, Ho NFH, Husari N, Flynn GL, Jetzer WE, Condie L. Permeation of Water Contaminative Phenols Through Hairless Mouse Skin. Archives of Environmental Contamination and Toxicology. 15:557-556 (disponible en anglais seulement).
[IPCHEM] Plate-forme d’information de la Commission européenne pour le contrôle des produits chimiques [base de données] . 2016. [consulté le 14 février 2018] (disponible en anglais seulement).
Kretschik, O. 2009. PCMC - The classic preservative for metalworking fluids and lubricants. Tribology and Lubricant Technology (disponible en anglais seulement).
Lehn, H. 1989. Parachlorometacresol (Preventol CMK): mutagenicity study for the detection of induced forward mutations in the CHO-HGPRT assay in vitro : Rapport de laboratoire no T1029785 ; 17755. Étude non publiée préparée par Bayer AG, Département de toxicologie. 36 p.[cité dans USEPA 1997] (disponible en anglais seulement).
Lopardo L, Cumming A, Rydevik A, Kaspryzyk-Hordern B. 2017. New analytical framework for verification of biomarkers of exposure to chemicals combining human biomonitoring and water fingerprinting. Analytical Chemistry. 89:7232-7239 (disponible en anglais seulement).
Madsen C, Andersen PH, Meyer O, et al. 1986. 4-Chloro-3-methylphenol: Salmonella/mammalian microsome mutagenicity test and subacute toxicity test in rats [pdf]. Bull. Environ. Contam. Toxicol. 37 : 651-654. cités dans Anderson 2006, CIR 1997, USEPA 2009] (disponible en anglais seulement).
Malaveille C, Brun G, Bartsch H. 1991. Genotoxicity of ochratoxin A and structurally related compounds in Escherichia coli strains: studies on their mode of action. Monographies du CIRC 115 : 261-266. cités dans Anderson 2006, CIR 1997, USEPA 2009] (disponible en anglais seulement).
Miles Inc. 1992. . Initial Submission from Miles Inc to US EPA submitting an enclosed embryotoxicity report on p-chloro-m-cresol with attachments. TSCA Section 8E Submission. US EPA Doc. No. 88-92000000850. Fiche. No. OTS053333951. cité dans USEPA 1997, 2009] (disponible en anglais seulement).
Ministère de l’Environnement et des Parcs de l’Alberta. 2016. Data (ESRD) - ambient water sampling results from July 2-5, 2013 [XLS]. [consulté le 13 février 2018] (disponible en anglais seulement).
[Mobay Chemical Corporation]. Herbold B, Lorke, D. 1980. Preventol CMK: salmonella/microsome test for detection of point mutagenic effects : Rapport n° 9122. Une traduction de : Preventol CMK : salmonella/mikrosomen-test zur utersuchung auf punktmutagen wirkung (étude non publiée, y compris le texte allemand, reçue le 1er juillet 1981 sous 39967-1 ; préparé par Bayer, AG, RFA, soumis par Mobay Chemical Corp, Pittsburgh, Pa ; CDL : 245551-C). [cité dans USEPA 1997] (disponible en anglais seulement).
Mobay Chemical Corporation. 1980. Subchronic dermal study in rabbits. Données non publiées soumises par le COLIPA. (1 page). [cité par Anderson 2006, CIR 1997, USEPA 1997] (disponible en anglais seulement).
Mobay Chemical Corporation. 1981. Acute oral toxicity to rats. Étude no 80-001-14. Données non publiées soumises par COLIPA (1 page). [cité par Anderson 2006, CIR 1997, ECHA 2015, USEPA 1997] (disponible en anglais seulement).
O’Neil, M.J. (éd.). The Merck Index - an encyclopedia of chemicals, drugs, and biologicals. Whitehouse Station, NJ : Merck and Co, Inc, 2006, p. 353 [cité dans HSDB 1983- ] (disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques. 2004. Série de l’OCDE sur les documents relatifs aux scénarios d’émissions, numéro 10. Document sur les scénarios d’émissions de lubrifiants et d’additifs pour lubrifiants [consulté le 12 février 2018] (disponible en anglais seulement).
Patry-Parisien, J, Zhu J, Wong SL. 2013. Implementation of the indoor air component of cycle 2 of the Canadian Health Measures Survey (CHMS) [pdf] . Composantes du catalogue no 82-003-X de Statistique Canada Rapports sur la santé (disponible en anglais seulement).
Paulus W, Genth H. 1983. Microbiocidal phenolic compounds - a critical examination. Dans : Biodeterioration, Vol. 5, ed. T.A. Oxley et S. Barry, 701-702. New York : John Wiley & Sons. cité par Anderson 2006, CIR 1997] (disponible en anglais seulement).
Pepe RC, Wenninger JA et McEwen Jr GN, éd. 2002. International cosmetic ingredient dictionary and handbook, 9th ed, Vols 1-2, Washington, DC ; CTFA. [cité dans ECHA 2006] (disponible en anglais seulement).
[PICS] Programme international sur la sécurité chimique. 1997. ICSC : 0131, 4-chloro-m-cresol. Genève (CH) : Programme des Nations Unies pour l’environnement ; Organisation internationale du Travail ; Organisation mondiale de la santé. [consulté le 18 février 2018] (disponible en anglais seulement).
Rapson WH, Nazar MA, Butsky VV. 1980. Mutagenicity produced by aqueous chlorination of organic compounds. Bull. Environ. Contam. Toxicol.24 : 590-596 [pdf] . [cité dans Anderson 2006, CIR 1997] (disponible en anglais seulement).
[RIVM] Institut national de la santé publique et de l’environnement du Pays-Bas, ministère de la Santé publique et des Sports. 2006. Cosmetic fact sheet to assess the risk for the consumer [pdf] . Version mise à jour pour ConsExpo 4. Rapport RIVM 320104001001/2006 [consulté le 14 février 2018] (disponible en hollandais seulement).
[RAIS] Système d’information sur l’évaluation des risques [base de données]. 2018. Résultats de recherche pour no CAS 59-50-7. Washington (DC) : Département de l’énergie des États-Unis [consulté le 21 février 2018] (disponible en anglais seulement).
Robenek H, Meiss R, Gehling J, Thermann H. 1980. Alterations in the rat liver induced by p-chloro-m-cresol with emphasis on the intracellular junctions. A thin-section and freeze-fracture study. J. Sous-microsc. Cytol. 12:635-646. [cité dans Anderson 2006, CIR 1997] (disponible en anglais seulement).
Rutter et coll. 1979. Acute dermal administration study in male and female rabbits. Preventol CMK. Hazleton Laboratories America, Inc. en Virginie, USA Projet n° 339-108. [cité dans ECHA 2015] (disponible en anglais seulement).
Santé Canada. 1995. Investigating human exposure to contaminants in the environment: A handbook for exposure calculations [pdf] . Ottawa (ON) : Les Grands Lacs : Impact sur la santé, Direction générale de la protection de la Santé, Santé Canada (disponible en anglais seulement).
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu (disponible en anglais seulement).
Sturdivant DW. 1999. Acute dermal toxicity study with Preventol CMK Pastillen in rats. Bayer Corporation, Agricultural Division, Toxicology, Stilwell, KS, É.-U. Rapport no 99-A22-FN, 1990-10-29 (non publié). [cité dans ECHA 2015] (disponible en anglais seulement).
Toronto. 1990. The Quality of Drinking Water in Toronto. A Review Of: Tap Water, Bottled Water and Water Treated by a Point-Of-Use Devic. Rapport sommaire. Département de santé publique de la ville de Toronto (disponible en anglais seulement).
Toronto. 2003. Water Quality Quarterly Report. Services des travaux et d’urgences de Toronto, Services des eaux et eaux usées (disponible en anglais seulement) .
Van Goethem D. 1991. Mutagenicity test on Preventol CMK in the rat primary hepatocyte unscheduled DNA synthesis assay: Numéro de projet du laboratoire : 10285-0-447 : T3027707. Étude non publiée préparée par Hazleton Labs America, Inc. 6p. [cité dans USEPA 1997] (disponible en anglais seulement).
Webber MD, Nichols JA. 1995. Organic and metal contaminants in Canadian municipal sludges and a sludge compost. Centre technique des eaux usées, Rockcliffe Research Management Inc. Burlington (Ontario). 168 p (disponible en anglais seulement).
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K, Hertz-Picciotto I. 2010. Profil d’utilisation des produits de soins personnels dans les ménages californiens . Food Chem Toxicol 48 : 3109-3119 disponible en anglais seulement).
Zeiger E, Andersen B, Haworth S, et. al. 1992. Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals [pdf]. Environnement. Mol. Mutagène. 19 : 2-141. [cité dans Anderson 2006, CIR 1997] (disponible en anglais seulement).
Annexes
Annexe A - Paramètres d’exposition pour estimer l’exposition au chlorocrésol.
L’exposition cutanée aux produits contenant du chlorocrésol a été estimée à l’aide de l’équation suivante,
DAE = (C × Q × F × A) ÷ PC
DAE : dose absorbée estimée (mg/kg pc/jour)
C : Concentration de chlorocrésol dans le produit (%)
Q : Quantité de produit appliqué par utilisation (mg par utilisation)
F : Fréquence d’utilisation par jour (utilisations par jour)
A : Absorption cutanée (%) (le cas échéant)
PC : Poids corporel (kg)
Les valeurs choisies pour les paramètres de cette équation ont été tirées de la littérature publiée et sont décrites dans le tableau A-1.
Les scénarios d’exposition pour les crèmes antifongiques sont basés sur le mode d’emploi imprimé sur les étiquettes et les emballages des produits. Les consommateurs sont instruits à cesser d’utiliser ces types de produits après plusieurs semaines (détails décrits dans le tableau A-1).
Sauf indication contraire, les valeurs des paramètres sont extraites des fiches techniques pertinentes de ConsExpo (RIVM 2006) pour le scénario présenté.
| Scénario d’exposition | Paramètre d’entrée du modèle |
|---|---|
| Lotion pour le corps (nourrisson) | Fréquence d’utilisation : 0,8 application par jour (Ficheux et al. 2015) Quantité de produit : 2,5 g/application (Ficheux et al. 2015). Comprend un rajustement par un facteur de 0,637 pour tenir compte de la différence de surface de la peau entre les nourrissons et les petits enfants (Santé Canada 1995). Valeur d’absorption cutanée : 75% (Andersen et al. 1985, EFSA 2012) Poids corporel : 7,5 kg (Santé Canada 1998) |
| Lotion pour le corps (petit enfant) | Fréquence d’utilisation : 0,8 application par jour (Ficheux et al. 2015) Quantité de produit : 4,1 g/application (Ficheux et al. 2015) Valeur d’absorption cutanée : 75% (Andersen et al. 1985, EFSA 2012) Poids corporel : 15,5 kg (Santé Canada 1998) |
| Lotion pour le corps (enfant) | Fréquence d’utilisation : 0,8 application par jour (Wu et al. 2010) Quantité du produit : 5,0 g/application (Ficheux et al. 2015). Comprend un rajustement par un facteur de 0,531 pour tenir compte de la différence de surface de la peau entre l’enfant et l’adulte (Santé Canada 1995). Valeur d’absorption cutanée : 75% (Andersen et al. 1985, EFSA 2012) Poids corporel : 31 kg (Santé Canada 1998) |
| Lotion pour le corps (adolescent) | Fréquence d’utilisation : 0,8 application par jour (Wu et al. 2010) Quantité du produit : 8,7 g/application (Ficheux et al. 2015). Comprend un rajustement par un facteur de 0,890 pour tenir compte de la différence de surface de la peau entre l’adolescent et l’adulte (Santé Canada 1995). Valeur d’absorption cutanée : 75% (Andersen et al. 1985, EFSA 2012) Poids corporel : 59,4 kg (Santé Canada 1998) |
| Lotion pour le corps (adulte) | Fréquence d’utilisation : 1,0 application par jour (Ficheux et al. 2015; Wu et al. 2010) Quantité du produit : 10 g/application (Ficheux et al. 2015) Valeur d’absorption cutanée : 75% (Andersen et al. 1985, EFSA 2012) Poids corporel : 70,9 kg (Santé Canada 1998) |
| Crème antifongique (petit enfant) | Fréquence d’utilisation : 4 applications par jour pendant 7 jours (utiliser selon les directives sur l’étiquette du produit, sans référence). Quantité du produit : 0,03 g/application (RIVM 2006). Comprend un rajustement par un facteur de 0,314 pour tenir compte de la différence de surface de la peau entre le nourrisson et le tout-petit (Santé Canada 1995). Poids corporel : 15,5 kg (Santé Canada 1998) |
| Crème antifongique (adulte) | Fréquence d’utilisation : 4 applications par jour pendant 7 jours (utiliser selon les directives sur l’étiquette du produit, sans référence). Quantité du produit : 0,1 g/application (RIVM 2006) Poids corporel : 70,9 kg (Santé Canada 1998) |
