Ébauche d'évaluation préalable N-(4-Éthoxyphényl)acétamide (Phénacétine)
Numéro de registre du Chemical Abstracts Service 62-44-2
Table des matières
- Synopsis
- 1. Introduction
- 2. Identité de la substance
- 3. Propriétés physiques et chimiques
- 4. Sources et utilisations
- 5. Potentiel d'effets nocifs sur l'environnement
- 6. Potentiel d'effets nocifs sur la santé humaine
- 7. Conclusion
- Références
- Annexes
Liste de tableaux
- Tableau 2-1 - Identité de la substance
- Tableau 3-1 - Valeurs expérimentales ou estimées des propriétés physiques et chimiques de la phénacétine (aux conditions standards de température et de pression)
- Tableau 6-1 - Charge superficielle dermale maximale due à l'utilisation de colorants capillaires contenant de la phénacétine
- Tableau 6-2 - Exposition systémique par voie dermale estimée due à l'utilisation de produits colorants capillaires contenant de la phénacétine
- Tableau 6-3 - Estimatios limite supérieure de l'exposition et marge d'exposition résultante
Synopsis
En vertu de l'article 74 de la Loi canadienne sur la protection de l'environnement 1999 (LCPE), les ministres de l'Environnement et de la Santé ont procédé à une évaluation préalable du N-(4-éthoxyphényl)acétamide, aussi dénommé phénacétine, dont le numéro de registre du Chemical Abstracts Service (NE CASNote de bas de page1) est le 62-44-2. Cette substance fait partie de celles identifiées comme d'intérêt prioritaire pour une évaluation car elle satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE.
En 2008, il n'y a eu aucune déclaration de production ni d'importation au Canada de ce composé supérieure au seuil de déclaration de 100 kg. Néanmoins, des déclarations d'importation au Canada en quantités inférieures ou égales à ce seuil ont été faites. La phénacétine était auparavant utilisée comme analgésique et antipyrétique, mais n'est plus utilisée au Canada comme médicament sur ordonnance ou en vente libre depuis 1973. Elle est principalement utilisée comme réactif en laboratoire et dans un petit nombre de préparations oxydantes pour coloration capillaire, où elle sert d'agent stabilisant pour le peroxyde d'hydrogène.
Les risques posés à l'environnement par la phénacétine ont été caractérisés au moyen de la Classification des risques écologiques des substances organiques (CRE). La CRE est une approche basée sur les risques, qui tient compte de plusieurs paramètres liés au danger et à l'exposition et basés sur une pondération des éléments de preuve. Les profils de danger sont établis principalement en se basant sur des paramètres liés au mode d'action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l'activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d'exposition, on retrouve la vitesse d'émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour assigner aux substances un potentiel faible, moyen ou élevé, basé sur leurs profils de danger et d'exposition. La CRE a permis de déterminer que la phénacétine a un faible potentiel d'effets nocifs sur l'environnement.
Compte tenu de tous les éléments de preuve disponibles avancés dans la présente ébauche d'évaluation préalable, nous avons déterminé que la phénacétine pose un faible risque d'effets nocifs sur les organismes et l'intégrité plus large de l'environnement. Nous proposons de conclure que la phénacétine ne satisfait à aucun des critères du paragraphe 64(a) ou 64(b) de la LCPE, car elle ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
Pour la population générale du Canada, nous avons estimé que les expositions potentielles à la phénacétine sont dues au contact dermique avec le crâne lors de l'utilisation de colorants capillaires.
Nous avons déterminé que l'effet critique pour la caractérisation des risques est la carcinogénicité, en se basant principalement sur la conclusion du Centre international de recherches sur le cancer à l'effet qu'il existe assez de preuves de la carcinogénicité de la phénacétine pour les humains ou les animaux de laboratoire. Des effets non cancéreux, y compris la néphropathie et l'hématotoxicité, ont aussi été observés chez des humains et des animaux en laboratoire. Les marges entre les estimations d'exposition et les niveaux d'effet critique observés lors d'études avec des animaux sont considérées adéquates pour tenir compte des incertitudes des bases de données sur les paramètres, liés ou non au cancer, ayant trait aux effets sur la santé et à l'exposition.
En nous basant sur les renseignements présentés dans la présente ébauche d'évaluation préalable, nous proposons de conclure que la phénacétine ne satisfait à aucun des critères du paragraphe 64(c) de la LCPE, car elle ne pénètre pas dans l'environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la santé ou la vie humaine.
Nous proposons de conclure que la phénacétine ne satisfait à aucun des critères de l'article 64 de la LCPE.
1. Introduction
En vertu de l'article 74 de la Loi canadienne sur la protection de l'environnement 1999 (LCPE) (Canada 1999), les ministres de l'Environnement et de la Santé ont procédé à une évaluation préalable du N-(4-éthoxyphényl)acétamide, appelé ci-après phénacétine. Cette substance a été identifiée comme d'intérêt prioritaire pour une évaluation dans le cadre du Plan de gestion des produits chimiques (PGPC) du Canada, car elle satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC et SC [modifié en 2007]).
Les risques pour l'environnement posés par la phénacétine ont été caractérisés au moyen de la Classification des risques écologiques des substances organiques (CRE) (ECCC 2016a). Pour la CRE, on décrit les risques posés par une substance en utilisant des paramètres clés parmi lesquels le mode d'action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l'activité chimique et biologique. Elle tient compte de l'exposition possible des organismes dans des environnements terrestres ou aquatiques, basée sur des facteurs incluant les taux d'émission potentiels, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés afin d'identifier les substances nécessitant une évaluation plus poussée de leur potentiel d'effets nocifs sur l'environnement ou présentant une faible probabilité d'effets nocifs sur l'environnement.
La substance faisant l'objet de la présente évaluation a déjà été évaluée au niveau international dans le cadre du Programme des monographies du Centre international de recherches sur le cancer (CIRC), et une monographie récente du CIRC (2012) est disponible.Ces évaluations sont soumises à un examen rigoureux par des autorités gouvernementales internationales. Santé Canada considère que ces évaluations sont fiables. La monographie 100A du CIRC sur la phénacétine a été utilisée pour étayer notre évaluation. L'EPA des États-Unis (2002) a aussi évalué la phénacétine et a conclu que cette substance est probablement cancérigène pour les humains. De même, le National Toxicology Programdes États-Unis a conclu que la phénacétine est raisonnablement considérée comme cancérigène pour les humains (NTP 2014).
Pour la présente ébauche d'évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir dans l'environnement, les dangers, les utilisations et l'exposition, y compris des renseignements soumis par des parties intéressées. Des données pertinentes ont été identifiées et une recherche bibliographique a été réalisée jusqu'en mars 2016. Nous avons utilisé des données empiriques tirées d'études clés ainsi que des résultats de modélisation pour tirer nos conclusions. Quand ils étaient disponibles et pertinents, nous avons tenu compte de renseignements présentés dans des évaluations faites par d'autres juridictions.
La présente ébauche d'évaluation préalable a été préparée par le personnel du Programme de sécurité des produits de Santé Canada et du Programme d'évaluation des risques de la LCPE d'Environnement et Changement climatique Canada. Elle inclut des intrants d'autres programmes de ces ministères. Des commentaires sur l'approche de CRE et les résultats ont été soumis par la Dre Jon Arnot (ARC Arnot Research and Consulting) et Mr Geoff Granville (GCGranville Consulting Corp.). De plus, le document sur la CRE a été le sujet d'une période de commentaires du public de 60 jours. Le volet santé humaine de la présente évaluation a fait l'objet d'un examen et/ou de consultations externes. Des commentaires sur les parties techniques ayant trait à la santé humaine ont été faits par le Dr John Reichard (Department of Environmental Health, College of Medicine, University of Cincinnati), la Dre Jennifer Sahmel (Cardno Chemrisk) et la Dre Patricia McGinnis (York & Associates). Bien que des commentaires de l'extérieur aient été pris en compte, Environnement et Changement climatique Canada et Santé Canada restent responsables du contenu final et des conclusions de la présente ébauche d'évaluation préalable.
La présente ébauche d'évaluation préalable est centrée sur des renseignements critiques afin de déterminer si la substance visée satisfait aux critères de l'article 64 de la LCPE. À cette fin, nous avons examiné les renseignements scientifiques et suivi une approche basée sur une pondération des éléments de preuve et le principe de précautionNote de bas de page2. Nous présentons dans la présente ébauche d'évaluation préalable les renseignements critiques et les considérations à partir desquels notre conclusion a été tirée.
2. Identité de la substance
Nous donnons dans le tableau 2-1 le numéro de registre du Chemical Abstracts Service(no CASNote de bas de page3), le nom sur la Liste intérieure des substances (LIS) et le commun de cette substance.
| No CAS | Nom sur la LIS [nom commun] |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 62-44-2 | Phénacétine [N-(4-éthoxyphényl)acétamide] | 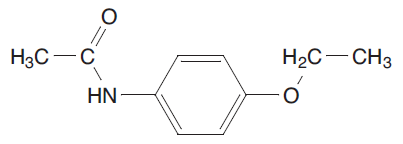 C10H13NO2 |
179,2 |
Autres noms : p-acétophénétidide; 4'-éthoxyacétanilide; 4-(acétylamino)phénétole; 4-éthoxy-1-acétylaminobenzène; 4-éthoxyacétanilide; acéto-4-phénétidine; acétophénétidine; acétophénétine; acetparaphénétidine; N-acétyl-4-éthoxyaniline; N-acétyl-p-éthoxyaniline; N-acétyl-p-phénétidine; p-éthoxyacétanilide; 1-acétamido-4-éthoxybenzène; Acet-p-phénalide; acéto-para-phénalide; acéto-para-phénétidide; acétylphénétidine; N-acétyl-para-phénétidine; N-para-éthoxyphénylacétamide; p-acétophénétide; para-acétophénétidide; para-acétophénétidine; para-éthoxyacétanilide; para-phénacétine; phénacet; phénacitine.
3. Propriétés physiques et chimiques
Nous donnons dans le tableau 3-1 un résumé des propriétés physiques et chimiques de la phénacétine. Quand des données expérimentales sur une propriété étaient limitées ou inexistantes, les données provenant de modèles (Q)SAR (quantitative structure-activity relationship) ont été utilisées pour générer des valeurs estimées. D'autres propriétés physiques et chimiques sont décrites dans le document d'ECCC (2016b).
| Propriété | Valeur | Référence clé |
|---|---|---|
| État physique | Cristaux inodores, blancs, brillants, habituellement sous forme de paillettes ou de fine poudre critalline blanche | Osol (1980) |
| Point de fusion (°C) |
134-135 | O'Neil (2001) |
| Pression de vapeur (mm Hg) |
6,29 x 10-7 à 25 °C | Wiedemann (1972) |
| Constante de Henry (atm·m3/mol) |
2,13 x 10-10 | EPISuite exp database |
| Hydrosolubilité | 766 mg/L à 25 °C | Seidell (1941) |
| Autres solubilités (mg/L) |
1 g se dissout dans 1310 mL d'eau froide, 82 mL d'eau bouillante, 15 mL d'alcool froid, 2,8 mL d'alcool bouillant, 14 mL de chloroforme, 90 mL d'éther; soluble dans le glycérol | O'Neil (2001) |
| log Koe (sans dimension) |
1,58 | Nakagawa et al. (1992) |
| log Koc (sans dimension) |
1,699 | Estimé PCKOCWIN v1.66 |
| pKa (sans dimension) |
26,5 | Estimé – plusieurs cas |
Abbréviations : Koe = coefficient de partage octanol–eau; Koc = coefficient de partage carbone organique–eau; pKa = constante de dissociation acide
4. Sources et utilisations
La phénacétine a été visée par une enquête menée en vertu de l'article 71 de la LCPE. Pour l'année civile 2008, aucune déclaration de production ni d'importation au Canada de quantités supérieures au seuil de déclaration de 100 kg n'a été faiteNote de bas de page4. Ce composé a toutefois été déclaré importé au Canada en quantités inférieures ou égales à ce seuil. Les résultats de l'enquête pour l'année civile 2008 indiquent que de la phénacétine est utilisée au Canada dans des laboratoires (Environnement Canada 2009), mais cette utilisation ne devrait pas conduire à une exposition de la population générale.
La phénacétine est inscrite dans la Base de données d'ingrédients de produits de santé naturels (BDIPSN) en tant que non-PSN (comme pour sa présence sur la Liste des drogues avec ordonnace) ainsi qu'en tant que substance homéopathique (en tant que phénacétinum). Elle est inscrite dans la Base de données des produits de santé naturels homologués (BDPSNH) comme étant présente dans un nombre limité de drogues homéopathiques homologuées comme produits de santé naturels (BDIPSN 2016; BDPSNH 2016).
Des déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques ont indiqué que de la phénacétine est présente dans des produits cosmétiques. La phénacétine est inscrite dans le dictionnaire de la nomenclature internationale d'ingrédients de cosmétiques (INCI) du Personal Care Products Council (PCPC), sans fonction établie, bien qu'elle soit rapportée ailleurs comme étant utilisée comme agent stabilisant pour le peroxyde d'hydrogène (CIRC 2012). Parmi les catégories de produits mentionnées, on retrouve des décolorants capillaires, des préparations colorantes capillaires, des shampooings (colorants) et des produits pour permanente (PCPC 2016).
La phénacétine a un long historique en tant qu'analgésique et antipyrétique avant son retrait du marché en raison d'indications de néphropathie et de risque accru de certains cancers chez des utilisateurs chroniques de fortes doses. Au Canada, la phénacétine a été retirée du marché en juin 1973 (Lexchin 2005), bien qu'elle soit toujours inscrite sur la Liste des drogues avec ordonnace à usage humain ou vétérinaire (date d'effet 19 décembre 2013) (Santé Canada 2015). Il n'y a actuellement aucune drogue sur ordonnace contenant de la phénacétine vendue au Canada.
Le Code of Federal Regulations Title 21 (21 CFR) des États-Unis indique que les drogues contenant de la phénacétine ont été retirées du marché américain à dater du 4 novembre 1983, pour des raisons de sécurité et d'efficacité (21 CFR 216.24) (FDA 1983). La justification de ce retrait est le haut potentiel de mauvaise utilisation de la phénacétine et son rapport bénéfice/risque défavorable quand elle est incorporée dans des combinaisons analgésiques, qui sont sujettes à une utilisation chronique excessive.
5. Potentiel d'effets nocifs sur l'environnement
5.1 Caractérisation des risques environnementaux
Les risques posés à l'environnement par la phénacétine ont été caractérisés au moyen de la Classification des risques écologiques des substances organiques (CRE) (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l'exposition basés sur la pondération de plusieurs éléments de preuve. Les divers éléments de preuve sont combinés afin de faire la différence entre des substances présentant une puissance plus ou moins élevée et un potentiel d'exposition plus ou moins élevé dans divers milieux. Cette approche réduit l'incertitude globale de la caractérisation des risques comparativement à une approche qui reposerait sur un seul paramètre dans un seul milieu (p. ex. CL50). Dans la présente section, nous résumons l'approche suivie, qui est décrite en détail dans le document ECCC 2016a.
Des données sur les propriétés physico-chimiques, le devenir (demi-vie chimique dans divers milieux et biotes, coefficients de partage et bioconcentration dans le poisson), l'écotoxicité aiguë pour le poisson et les quantités produites et importées au Canada ont été collectées dans la littérature scientifique, dans des bases de données empiriques (p. ex. boîte à outils QSAR de l'OCDE) et dans les réponses à des enquêtes menées en vertu de l'article 71 de la LCPE. D'autres données ont été obtenues en utilisant des modèles de type QSAR (Quantitative Structure-Activity Relationship) ou de bioaccumulation et de devenir du bilan massique. Ces données ont été utilisées comme intrants dans d'autres modèles de bilan massique ou pour compléter les profils d'exposition et de danger de la substance.
Les profils de danger ont été établis en se basant principalement sur des paramètres liés au mode d'action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l'activité chimique et biologique. Les profils d'exposition ont aussi été élaborés à partir de plusieurs paramètres dont la vitesse d'émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d'exposition ont été comparés aux critères de décision afin de classer les potentiels de risque et d'exposition de chaque substance comme faible, moyen ou élevé. D'autres règles ont été appliquées (p. ex. constance de la classification, marge d'exposition) afin de raffiner les classifications préliminaires du danger et de l'exposition.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque potentiel faible, moyen ou élevé, basé sur la classification de son danger et de son exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées en suivant une approche en deux étapes. La première étape servait à ajuster les résultats de la classification du risque de moyen ou élevé à faible pour les substances présentant une faible vitesse d'émission estimée dans l'eau après traitement des eaux usées, représentant un faible potentiel d'exposition. La deuxième étape servait à revoir les résultats d'une classification du potentiel de risque faible ou moyen de scénarios de risque relativement prudents, d'échelle locale (c.-à-d. dans la zone à proximité du point de rejet), conçus pour protéger l'environnement, afin de déterminer si la classification du risque potentiel devrait être accrue.
La CRE est basée sur une approche pondérée afin de réduire au minimum toute surclassification ou sousclassification du danger et de l'exposition et du risque subséquent. Les approches équilibrées pour tenir compte des incertitudes sont décrites en plus de détails dans le document ECCC 2016a. Nous décrivons ci-après deux des zones d'incertitude les plus importantes. Les erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des changements de la classification du danger, en particulier en ce qui a trait aux paramètres reposant sur des valeurs de résidus dans les tissus (c.-à-d. mode d'action toxique), dont de nombreux sont des valeurs prédites à partir de modèles QSAR. Cependant, l'impact de cette erreur est atténué par le fait qu'une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) pour les résidus dans les tissus pour l'analyse des résidus corporels critiques (RCC). L'erreur de sousestimation de la toxicité aiguë sera atténuée par l'utilisation d'autres paramètres de risque comme le profilage structurel du mode d'action, la réactivité et/ou l'affinité de liaison à l'estrogène. Les changements dans les quantités chimiques ou les erreurs dans ces quantités pourraient conduire à des classifications différentes de l'exposition, la classification de l'exposition et du risque étant hautement sensible à la vitesse d'émission et aux quantités utilisées. Les résultats de la CRE reflètent donc l'exposition et le risque au Canada basés sur les quantités actuellement utilisées et pourraient ne pas refléter des tendances futures.
Les données critiques et les paramètres pris en compte pour développer les profils spécifiques à la phénacétine et les résultats de la classification du danger, de l'exposition et du risque sont présentés dans le document ECCC 2016b.
Étant donné les classifications de faible danger et de faible exposition pour la phénacétine obtenues au moyen de la CRE, cette substance a été classée comme présentant un faible potentiel de risque pour l'environnement. Il est donc improbable que cette substance soit préoccupante pour les organismes ou l'intégrité plus large de l'environnement au Canada.
6. Potentiel d'effets nocifs sur la santé humaine
6.1 Évaluation de l'exposition
Entre janvier 2013 et janvier 2016, la présence de phénacétine a été déclarée dans 11 cosmétiques au Canada. Ce sont tous des produits colorants capillaires (1 temporaire, 10 permanents) dans lequel cet ingrédient est présent à une concentration de 0,3 % ou moins. En assumant une concentration maximale de phénacétine de 0,3 %, une surface de peau exposée correspondant à la surface du crâne d'un adulte et un coefficient de rétention de 10 % pour tenir compte du fait que la plupart du produit n'entrera pas en contact avec la peau quand il est utilisé tel que prévuNote de bas de page5, nous avons estimé une charge superficielle maximale de 30 µg/cm2 de phénacétine (tableau 6-1).
| Scénario avec produit de consommation | Conc. max. (%) |
Fréquence (x/an) |
Surface exposée (cm2) |
Quantité de produit appliqué (g) |
Coefficient de rétention (%) |
Charge superficielle (dose externe) |
|---|---|---|---|---|---|---|
| Application de colorant capillaire | 0.3 | 12 | 565 | 50 | 10 | 30 μg/cm2 par application |
a La concentration maximale a été déterminée sur la base de déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques. La fréquence, la surface exposée et la quantité de produit appliquée sont tirées de la fiche de données du RIVM (RIVM 2006). Le coefficient de rétention est celui recommandé par le SCCNFP (2000.
Étant donné qu'aucune étude sur la pénétration dermale de la phénacétine n'a pu être identifiée, une exposition systémique par voie dermale a été estimée en utilisant un algorithme prédictif établi pour calculer le flux maximal au travers de la peau, Jmax (Williams et al. 2016). Jmax est considéré être une approche prudente pour estimer la dose interne, le flux maximal avec lequel un composés chimique peut passer au travers d'une unité de surface de peau (théoriquement obtenu en tant que solutiuon saturée ou sous forme de produit chimique absolu) définissant le risque d'exposition potentiel le plus élevé pour un produit chimique (IPCS 2006). Afin d'estimer Jmax, nous avons utilisé le modèle de Potts et Guy (1992) pour calculer le coefficient de perméabilité de la peau, kp (en cm.h-1), suivi de la modification de Cleek et Bunge (1993) (voir l'annexe A pour plus de détails). Jmax a été établi à 2,01 μg/cm2/h, conduisant à une exposition systémique par application de 0,011 mg/kg pc (tableau 6-2). La phénacétine ayant une très faible pression de vapeur (6,29 x 10-7 mm Hg à 25 °C), l'exposition par inhalation lors d'une application de colorant capillaire est considérée négligeable par rapport à l'exposition par voie dermale.
| Scénarion avec produit de consommation | Hypothèsea | Exposition systémique estimée |
|---|---|---|
| Application de colorant capillaire | L'utilisation de colorant capillaire est considérée épisodique (environ 12 fois par an). Exposition dermique : surface de peau exposée = 565 cm2, durée de l'exposition = 40 min, Jmax = 2,01 µg/cm2/h, pc d'un adulte assumé être de 70,9 kg. On asume que des gants sont utilisés pendant l'application et que le contact cutané ne concerne que le crâne. |
Dermale par application : 10,7 µg/kg pc Dermal chronique : 0,35 µg/kg pc/j |
a Basé sur la fiche de données du RIVM (RIVM 2006) et Santé Canada (1998).
Aucune donnée empirique sur les concentrations de phénacétine dans les milieux de l'environnement au Canada n'a été identifiée, mais ces concentrations devraient être négligeables. La phénacétine ne devrait pas être présente dans des aliments ni dans des boissons.
En raison du nombre limité de produits de santé naturels homologués et de leur nature en tant que drogues homéopathiques, l'exposition de la population générale du Canada due à l'utilisation de ces produits devrait être minimale. La puissance homéopatique minimale actuellement autorisée dans des drogues homéopathiques homologuées comme produits de santé naturels, basée sur la Homeopathic Pharmacopoeia des États-Unis, tel que souligné dans la BDIPSN, est 6X, ce qui est équivalent à une concentration maximale d'environ 10-6 g/mL (BDIPSN 2016).
6.2 Évaluation des effets sur la santé
6.2.1 Toxicocinétique
Le métabolisme de la phénacétine a été très bien caractérisé tant chez les humains que chez des animaux de laboratoire (voir par exemple Brodie et Axelrod 1949, Smith et Timbrell 1974, Nelson et al. 1981, Hinson 1983, Veronese et al. 1985, Fukami et Yokoi 2012). Le métabolisme de premier passage est profond, la biodisponibilité du composé parent étant facile par voie orale (Krieger Research Center 2012). Les voies métaboliques de la phénacétine mettent en jeu la déséthylation, la N-désacétylation et l'hydroxylation du cycle. Bien que la phénacétine soit biotransformée en au moins 12 métabolites différents, la principale voie métabolique est celle de la déséthylation oxydative principalement par l'intermédiaire de CYP1A2, conduisant au métabolite pharmacologiquement actif N-(4-hydroxyphényl)éthanamide (acétaminophène). Chez les rats, les lapins, les cobayes et les furrets ayant reçu une dose de 125 mg/kg pc de phénacétine par voie orale, respectivement 63, 57, 81 et 47 % de la dose était excrétée sous forme d'acétaminophène (libre ou conjugué sous forme de sulfate ou de glucuronide) (CIRC 1980). Chez les humains, on estime que de 75 à 80 % de la phénacétine administrée par voie orale est rapidement métabolisée en acétaminophène chez des sujets normaux, moins de 1 % du composé parent étant excrété tel quel dans l'urine (Insel 1993).
Une voie métabolique secondaire de la phénacétine met en jeu l'hydrolyse en 4-éthoxyaniline par l'arylacétamide-désacétylase (AADAC), une sérine-estérase microsomale exprimée dans le foie et les tissus gastrointestinaux. La 4-éthoxyaniline peut à son tour être métabolisée en N-hydroxy-4-éthoxyaniline, une arylhydroxylamine, qui est sensée être le métabolite mutagène immédiat qui médie aussi la néphrotoxicité et l'hématotoxicité du composé parent. Le CYP1A2 a une bien plus grande affinité pour la phénacétine que l'AADAC (Km = 31 µM pour CYP1A2 et 1,82 mM pour AADAC) (Venkatakrishnan et al. 1998; Watanabe et al.2010), bien que l'expression de l'ARN dans le foie soit similaire pour ces deux enzymes. En conséquence, les niveaux pics inférieurs de phénacétine favoriseraient généralement la voie métabolique de haute affinité (CYP1A2), alors que les niveaux pics supérieurs sanguins pourraient favoriser une plus grande contribution de la voie de faible affinité (AADAC). Le CYP1A2 suit une cinétique de type Michaelis-Menten, pour laquelle on a fait l'hypothèse : 1) d'un simple site de liaison pour le substrat au niveau du site actif de l'enzyme; 2) d'une formation de métabolite suivant un modèle empirique saturant suivant une hyperbole. Kmest la concentration de substrat à laquelle on atteint la moitié de la vitesse maximale de la réaction (Vmax ou le point auquel CYP1A2 devient saturé en phénacétine). Canney et al (1976) ont montré que chez des volontaires normaux, une dose orale de 900 mg de phénacétine conduit à des concentrations pics moyennes dans le plasma de 1628 ng/mL (équivalent à 9,1 µM), ce qui est bien inférieur à la Km de 31 µM, indiquant que cette dose est insuffisante pour saturer l'enzyme. On a estimé que, même à une concentration de substrat de 100 µM, CYP1A2 représenterait 86 % de la vitesse nette de réaction (Venkatakrishnan et al. 1998). D'autres isoformes du cytochrome P450, comme CYP2E1, peuvent aussi oxyder la phénacétine, mais avec une affinité moindre que celle de CYP1A2.
Chez les humains, suite à une administration de phénacétine par voie orale, les concentrations pics d'acétaminophène dans le plasma provenant de la déséthylation de la phénacétine ont lieu dans les 1 à 2 heures (Insel 1993). Nous n'avons trouvé aucune donnée sur la disponibilité systémique de la phénacétine par voie dermale. En raison de ses propriétés physico-chimiques, dont sa masse moléculaire, son log Koe et son hydrosolubilité, la phénacétine devrait être un agent pénétrant « moyen élevé » d'après les critères de Kroes et al. (2007). Toutefois, la peau humaine exhibe un manque d'expression significative du CYP1A2, le principal cytochrome P450 responsable du métabolisme de la phénacétine par voie orale (Yengi et al. 2003), ainsi que d'AADAC, l'enzyme qui génère le métabolite toxique N-hydroxy-4-éthoxyaniline (Kobayashi et al. 2012). En conséquence, puisque l'exposition percutanée ne conduit pas au métabolisme de premier passage, nous anticipons des différences dans la toxicocinétique spécifique de la voie d'exposition.
Certains individus sont reconnus comme de mauvais métaboliseurs de la phénacétine par CYP1A2, bien que dans la population générale l'incidence de ce phénotype devrait être inférieure à 1 % (Parkinson 2001). Il existe aussi une énorme variabilité des niveaux de CYP1A2 d'un individu à l'autre, et les hommes tendent à en avoir des niveaux plus élevés que les femmes. Bien que les défauts génétiques soient extrêmement rares (Parkinson et al. 2013), les personnes dont la capacité à métaboliser la phénacétine en acétoaminophène au moyen du CYP1A2 en convertissent une plus grande fraction en arylhydroxylamine, un métabolite toxique (Insel 1993). Les personnes souffrant d'une déficience en glucose-6-phosphate déshydrogénase (G6PD) constituent une autre sous-population potentiellement sensible. Les globules rouges des patients souffrant de ce défaut enzymatique sont plus susceptibles à un stress oxydatif, et les drogues oxydantes comme la phénacétine peuvent donc conduire à une hémolyse aiguë ou chronique (OMS 1989).
6.2.2 Toxicité aiguë
La phénacétine a une toxicité aiguë faible à modérée par voie orale chez le rat, avec une DL50 estimée allant de 1650 à 4000 mg/kg pc (Boyd 1959; Hart 1947; Boyd et Hottenroth 1968). Des doses importantes, mais de toxicité aiguë sublétale, peuvent provoquer une méthémoglobinémie et une anémie hémolytique chez les humains et les rats, bien que ces paramètres soient plus généralement associés à une surdose chronique (Jensen et Jollow 1991; Gilman et al. 1990). L'anémie hémolytique aiguë peut être sévère et accompagnée d'une hémolyse intravasculaire, d'une hémoglobinurie et d'une anurie aiguë, en particulier chez les personnes souffrant d'une déficience en G6PD (de Leeuw et al. 1963). La phénacétine peut aussi entraîner des des changements dans le niveau d'énergie et le degré de lucidité, et elle est connue pour avoir des propriétés psychotropes similaires à celles de la caféine, un facteur pouvant contribuer à un risque de dépendance (Margetts 1976; Kincaid Smith 1988).
Nous n'avons trouvé aucune étude sur la toxicité aiguë de la phénacétine par voie dermale.
6.2.3 Toxicité à dose répétée
La phénacétine a été introduite en médecine clinique en 1887, et une surdose chronique a depuis longtemps été associée à des effets toxiques, en particulier sur les systèmes hématopoiétique et rénal. Un lien étiologique entre la consommation chronique de phénacétine et des maladies rénales a commencé à émerger en Europe quand, suite à la pandémie de grippe de 1918, l'ingestion de phénacétine est devenue routinière pour de nombreuses personnes (Rennke et Denker 2007). Des dommages aux globules rouges, dont la méthémoglobine et la formation de corps de Heinz, ainsi qu'une anémie hémolytique, ont aussi été reconnus comme séquelles communes d'une utilisation ou d'un abus prolongé de phénacétine (Brodie et Axelrod 1949; Davidson 1971). La première description de la néphropathie due à une absorption chronique de phénacétine a été faite par Spühler et Zollinger en 1953, qui ont inventé le terme « néphrite interstitielle chronique primaire » pour décrire ces lésions rénales caractéristiques (tel que rapporté dans Sanerkin et Weaver 1964). L'image classique de la néphropathie analgésique due à la phénacétine comprend une fibrose et une néphrite interstitielles médulaires, des dommages aux tubules papillaires et proximaux et une défaillance rénale chronique avec perte de la capacité de concentration (HSDB 2016).
Il est difficile de faire des estimations précises des doses de phénacétine conduisant à une néphropathie analgésique, car elles sont largement basées sur un rappel des patients pendant une période couvrant des années ou des décennies, dont de nombreux ne sont pas coopératifs. Dans les années 1960, Gault et al. (1968), tout en notant que seule une petite partie de la population abusait grossièrement des analgésiques, ont estimé que la consommation annuelle par habitant de phénacétine était de l'ordre de 40 g en Australie, de 25 g au Danemark, de 23 g en Suisse et de 6 à 7 g au Canada. Il a été estimé qu'une capacité de concentration moindre ou une faible réduction de la vitesse de filtration glomérulaire peut être observée suite à l'absorption cumulative d'aussi peu que 1 kg de phénacétine, alors qu'une maladie rénale franche nécessite une absorption minimale de 2 à 3 kg, généralement pendant une période de 6 à 8 ans (Rennke et Denker 2007). Une estimation de pire cas de 10 mg/kg pc/j de phénacétine peut donc être faite pour le développement d'une néphropathie analgésique (en faisant l'hypothèse d'un pc d'adulte de 70,9 kg et une ingestion de 2 kg en 8 ans), bien que l'incertitude associée à cette estimation soit élevée.
La toxicité de la phénacétine pour des animaux de laboratoire a aussi été largement étudiée. La description qui suit n'est pas exhaustive, mais est plutôt centrée sur les doses les plus faibles publiées associées à une toxicité. En se basant sur la formation réversible de méthémoglobine et de corps de Heinz et sur une augmentation des réticulocytes périphériques chez le rat suite à une administration de 500 mg de phénacétine par kg pc par gavage orale, 5 fois par semaine pendant 4 semaines (Boelsterli et al. 1983), la dose minimale avec effet observé (DMEO) pour la phénacétine lors d'études à dose répétée avec des animaux semble être de 350 mg/kg pc/j. Les modèles animaux montrent aussi une similarité étonnante avec les modifications des fonctions rénales associées à une utilisation chronique d'analgésique chez les humains (Bach et Hardy 1985). Angervall et Bengtsson (1968) ont administré 450 mg/kg pc/j de phénacétine à des rates SD dans leur alimentation pendant 40 semaines, la dose qu'ils estimaient être la « dose la plus élevée possible qui ne produirait pas d'effets toxiques généraux » (aujourd'hui appelé dose maximale tolérée ou DMT). La dose utilisée semblait avoir un effet stimulant similaire à celui observé chez des humains qui absorbaient de grandes doses, bien que les auteurs aient noté qu'en utilisant des doses plus élevées avec des animaux, un effet dépressif était observé. Après 34 semaines, une perte de la capacité de concentration de l'urine cohérente avec une déficience tubulaire rénale ait été observée, perte qui était rapidement réversible en arrêtant la prise de la drogue (Angervall et Bengtsson 1968). Plus récemment, lors d'une étude sur des biomarqueurs toxicogénomiques de blessure papillaire rénale chez des rats, Uehara et al. (2013) ont utilisé la phénacétine comme témoin positif. Les rats SD mâles ont reçu par gavage oral 2000 mg/kg pc de phénacétine (simple dose) ou 1000 mg/kg pc/j (quotidiennement pendant 3, 7, 14 ou 28 jours), puis le tissu rénal a été collecté et utilisé pour une analyse d'expression génique 24 heures après l'administration lors de l'étude à simple dose et les jours 4, 8, 15 et 29 lors de l'étude à dose répétée. Les modifications des biomarqueurs génomiques induites par la phénacétine associées à une blessure papillaire rénale se manifestaient après une seule dose et ont été observées une journée après l'exposition, avec des modifications histopathologiques apparentes quatre jours après la dose.
Nous n'avons trouvé aucune étude à dose répétée par voie dermale.
6.2.4 Toxicité pour la reproduction et le développement
Les études avec des animaux ont apporté peu de preuves à l'effet qu'une exposition continue à la phénacétine puisse être associée à une toxicité pour la reproduction chez les rongeurs. On a rapporté que l'administration de phénacétine par voie orale à raison de 600 à 1200 mg/kg pc/j pendant les jours de gestation 0 à 20 était associée à un poids fœtale moindre, bien que l'amplitude de cet effet n'est pas été mentionnée (Baethke et Muller 1965, cité dans CIRC 1980). Bien qu'il n'existe aucune preuve de tératogénicité, une croissance du squelette retardée et une augmentation des cotes surnumérairesNote de bas de page6 ont été observées à des doses de 150 mg/kg pc et plus lors de la même étude (aucun autre détail rapporté).
Chez les humains, 5546 paires mère/enfant ayant été exposées pendant le premier trimestre à de la phénacétine ont été surveillées lors du Collaborative Perinatal Project basé aux États-Unis (Briggs et al. 2011). Rien ne suggérait une association entre l'exposition à la phénacétine in utero et de grandes catégories de malformations mineures ou majeures, bien que des associations possibles avec certains défauts spécifiques aient été notées : craniosynostose (six cas); syndrômes adrénaux (cinq cas); atrésie anale (sept cas); rate accessoire (cinq cas). Toutefois, on ne sait pas si ces associations sont statistiquement significatives, et il manque une confirmation indépendante (Briggs et al. 2011). De plus, le fait que la phénacétine soit rarement utilisée seule, mais plutôt en combinaison avec d'autres agents (habituellement l'acide acétylsalicylique et la caféine) rend en core plus difficile l'interprétation de ces résultats.
Lors d'une enquête portant sur 229 101 grossesses menées à terme auprès de patientes du Michigan Medicaid, entre 1985 et 1992, une exposition à de la phénacétine pendant le premier trimestre a été rapportée dans 368 cas. Un total de 24 anomalies congénitales majeures a été rapporté alors que 16 étaient attendues pour une telle cohorte. Il a été conclu que ces données ne permettent pas d'associer l'exposition à la phénacétine à ces anomalies congénitales (Briggs et al. 2011). La FDA des États-Unis à placé la phénacétine dans le groupe Pregnancy Risk Category B, qui indique que les études sur la reproduction des animaux n'ont pas permis de démontrer un risque pour le fœtus, mais qu'il n'existe pas d'étude adéquate et bien contrôlée dans le cas de femmes enceintes.
6.2.5 Génotoxicité et carcinogénicité
La phénacétine est mutagène chez Salmonella typhimurium TA100 en présence de fractions S9 (surnageant à 9000 g) de foie de hamsters traités avec des biphényles polychlorés (BPC), mais pas dans le cas des rats (Nohmi et al. 1983). On pense que ceci est le résultat de différences entres espèces de l'activité de désacétylation des microsomes hépatiques du hamster et du rat, la phénacétine étant désacétylée pour former des mutagènes agissant directement à des vitesses 9 à 150 fois plus grandes chez le hamster que chez le rat (Nohmi et al. 1983)Note de bas de page7. De même, Camus et al. (1982) ont montré que l'urine de hamsters traités avec de la phénacétine est mutagène chez S. typhimurium TA100, mais pas celle de rats, et que la N-hydroxyphénacétine est un métabolite mutagène immédiat de la phénacétine suite à la N-désacétylation.
Il existe aussi des preuves à l'effet que la phénacétine provoque des altérations chromosomales ou des dommages à l'ADN lors de tests in vivo. Un test de micronoyaux avec des souris a permis de montrer que des doses relativement élevées de phénacétine (600 mg/kg pc et plus) conduisaient à des augmentations de micronoyaux chez des érythrocytes de moelle osseuse, que ces doses soient administrées par voir orale ou intrapéritonéale (Hayashi et al. 1989). Des résultats similaires ont été observés chez des rats auxquels on a administré de la phénacétine par gavage oral pendant 14 jours à raison de 500 mg/kg pc et plus (Asanami et al. 1995). Chez le rat gptdelta, une lignée transgénique qui possède des gènes rapporteurs pour des mutations ponctuelles in vivo, un traitement de 52 semaines avec de la phénacétine (0,5 % dans les aliments, estimé représenté respectivement 202 et 246 mg/kg pc/j pour les mâles et les femelles) a induit une augmentation de la fréquence de mutants gpt dans les reins des mâles, mais pas chez les femelles, alors qu'aucun changement significatif de la fréquence de mutant gpt n'avait été observé après 26 semaines chez l'un ou l'autre sexe (Kawamura et al. 2014). Bien qu'il n'existe aucune preuve directe de génotoxicité, une augmentation liée à la dose de la prolifération cellulaire dans l'urothélium de la vessie et du rein a été observée chez des rats SD mâles exposés à de la phénacétine pendant 6 semaines, à raison de 1,0 % ou plus dans leur alimentation (Johansson et al. 1989). L'induction d'une hyperplasie régénérative résultant d'une cytotoxicité est associée à une augmentation de la vitesse de mutation/accumulation dans l'organe cible et peut être avoir une influence sur le développement de tumeurs.
Lors d'études de carcinogénicité à long terme, la phénacétine s'est avérée être un carcinogène pour les deux sexes, en plusieurs sites et pour plusieurs espèces. Chez le rat, elle induit des tumeurs aux reins, dans la cavité nasale, à l'estomac et à la vessie des mâles, aux glandes de Zymbal (oreilles), aux glandes mammaires, à la cavité nasale et à la vessie des femelles. Chez la souris, les sites cibles comprennent les reins chez les mâles et la vessie chez les femelles (CPDB 2007). La DT50, ou la dose quotidienne pour induire des tumeurs chez la moitié des animaux testés qui resteraient exempts de tumeurs à la dose zéro, est de 1250 mg/kg pc/j chez le rat et de 2140 mg/kg pc/j chez la souris (CPDB 2007). Lors d'évaluations du risque carcinogène, on suit généralement une approche de dose de référence basée sur la limite inférieure de confiance à 95 % de la dose qui induit des tumeurs chez 10 % des animaux (la DTM10). Une estimation fiable de la DTM10 peut être obtenue en utilisant la DT50, et sa limite inférieure de confiance de 99 % en suivant la méthode de Gold et al. (2003). Pour la phénacétine, la moyenne harmonique de DLT10 pour le site cible le plus réceptif lors de chaque expérience positive de la Carcinogenic Potency Database (CPDB) est de 115 mg/kg pc/j chez le rat et de 248 mg/kg pc/j chez la souris (CPDB 2007).
L'extrapolation de la DTM10 où d'une autre dose estimée proche de la limite inférieure de la gamme observable peut aussi être utilisée pour calculer un facteur de pente ou un facteur de risque unitaire afin d'estimer le risque de cancer au cours d'une vie. En utilisant le logiciel BMDS 2.6 (EPA 2015) et les résultats pour tous les mâles atteints de tumeurs, un modèle de cancer à plusieurs étapes a été adapté aux données d'Isaka et al. (1979). L'étude chronique par voie alimentaire avec le rat a été retenue en raison de sa sensibilité en termes de nombre adéquat d'animaux par groupe, de nombre adéquat de groupes pour le modèle dose-réponse et de la multiplicité des tissus examinés à des fins de détection de transformation néoplastique. Seules les données sur les mâles ont été modélisées car elles étaient plus sensibles aux effets carcinogènes de la phénacétine que celles des femelles. La BMDL10 résultante de 13,75 mg/kg pc/j (voir l'annexe B pour plus de détails) est un ordre de grandeur inférieur à l'estimation de la DTM10 basée sur les moyennes harmoniques des valeurs extrapolées de DT50 de toutes les études (deux sexes) de la CPDB, tel que susmentionné. Le facteur de pente du cancer basé sur ce modèle a été calculé à 7,27 [ug/kg/j]-1 qui, en suivant une mise à l'échelle allométrique à la puissance 2/3 du poids corporel, correspond à une valeur équivalente pour les humains de 1,13 [ug/kg/j]-1.
Dans la littérature clinique et épidémiologique, des cas de tumeur du bassinet du rein et d'autres tumeurs urothéliales chez des patients qui étaient de grands utilisateurs d'analgésiques contenant de la phénacétine sont bien documentés, bien que la phénacétine soit généralement utilisée en combinaison avec d'autres analgésiques, ce qui rend difficile l'estimation de la contribution de la phénacétine seule. Malgré cette limite, il a été publié un très grand nombre d'études qui suggèrent de manière constante des associations fortes à modérées entre une utilisation régulière d'analgésiques contenant de la phénacétine et des cancers du bassinet du rein et de l'urètre (pour étude consulter CIRC 2012 et Conseil de la santé des Pays-Bas 2012). Dans son évaluation de la phénacétine, le groupe de travail du CIRC (2012) a conclu ce qui suit :
Il existe assez de preuves de la carcinogénicité de la phénacétine chez les humains. La phénacétine cause le cancer du bassinet du rein et de l'urètre.
Il existe assez de preuves de la carcinogénicité de la phénacétine chez des animaux de laboratoire.
La phénacétine est carcinogène pour les humains (groupe 1).
En ce qui concerne l'évaluation globale de la phénacétine, le groupe de travail a tenu compte du fait que les tumeurs du bassinet du rein et de l'urètre ne sont pas connues pour être causées par d'autres composants des mélanges analgésiques utilisés dans la plupart des pays; à savoir l'aspirine, le phosphate de codéine et la caféine.
Il a été estimé que la quantité totale de phénacétine absorbée par de grands utilisateurs chroniques se situait dans la gamme de 1,1 à 10,0 kg, avec une période de latence à partir du commencement de l'utilisation au diagnostic de tumeur en moyenne de 24 ans (Schmähl et Bunk 1991). La dose quotidienne chronique conduisant à la formation d'une tumeur chez les humains peut être grossièrement estimée à 1,8 à 16.1 mg/kg pc/j, bien que la fiabilité des ces estimations soit faible. Il est bon de noter que la dose habituelle de phénacétine dans un remède contre la douleur ou la fièvre sans ordonnace était de 300 mg quatre à six fois par jour (CIRC 1977), soit une dose de 16,9 à 25,4 mg/kg pc/j pour un adulte pesant 70,9 kg.
6.3 Caractérisation des risques pour la santé humaine
L'exposition des consommateurs à la phénacétine devrait se limiter à l'utilisation d'un petit nombre de préparations capillaires, pour lesquelles la principale voie d'exposition est le contact dermal. Étant donné qu'aucune donnée pertinente n'ait été identifiée dans les études par voie dermale, une estimation prudente de la dose systémique par voie dermale a été calculée en utilisant le flux maximal prédit, qui définit le potentiel d'exposition théorique le plus élevé atteignable pour un composé chimique donné. L'exposition systémique par application a été estimée à 0,011 mg/kg pc. On estime que les produits colorants capillaires sont utilisés jusqu'à 12 fois par an, conduisant à une exposition chronique pondérée en fonction de la dose de 0,00035 mg/kg pc/j.
D'après les évaluations faites par le CIRC (2012), l'EPA (2002) et le NTP (2014), l'effet critique pour la caractérisation du risque posé par la phénacétine à la santé humaine est la carcinogénicité. La phénacétine est carcinogène pour les humains et les animaux et, bien que le mécanisme d'induction des tumours n'ait pas encore été pleinement élucidé, la preuve disponible indique que cette substance ou ses métabolites peuvent avoir un potentiel génotoxique. Le rat semble être plus sensible que la souris et les mâles semblent plus sensibles que les femelles. Le niveau d'effet critique a donc été déterminé comme étant la limite inférieure de confiance à 95 % en la dose de référence (BMDL10) pour une augmentation de 10 % de l'incidence de tous les types de tumeurs chez des rats mâles traités par rapport à des rats témoins, observée lors de l'étude d'Isaka et al. (1979). Le point de départ pour la caractérisation des risques est donc la BMDL10 pour le rat de 13,75 mg/kg pc/j.
La comparaison du niveau d'exposition systémique chronique dû à l'utilisation de colorant capillaire avec la BMDL10 orale pour le rat conduit à une ME supérieure à 39 000 (tableau 6-3), suggérant un faible niveau d'inquiétude. Bien que la ME soit une approche utile pour caractériser l'ampleur d'un risque, elle ne peut pas être utilisée pour quantifier directement la probabilité accrue d'un effet nocif sur la santé. Une valeur de potentiel cancérogène de la phénacétine pour l'humain a donc été calculée en utilisant un modèle de cancer en plusieurs étapes et une mise à l'échelle allométrique. Le facteur de pente oral de 1,13 [ug/kg/j]-1 peut être utilisé pour calculer le risque supplémentaire de cancer durant la durée de vie posé par la phénacétine lors de l'utilisation de produits colorants capillaires (voir l'annexe B). Le risque carcinogène est estimé à 4,6 x 10-7, une valeur largement considérée négligeable.
En ce qui concerne les paramètres non cancéreux, une néphropathie et une hématotoxicité ont aussi été associées à une exposition prolongée à la phénacétine ainsi qu'à de grandes doses aiguës. La DMEO la plus faible pour la phénacétine tirée d'études à dose répétée avec des animaux semble être de 350 mg/kg pc/j, basée sur la formation réversible de méthémoglobine et de corps de Heinz et à une augmentation de réticulocytes périphériques chez des rats suite à une administration par gavage oral pendant 4 semaines (Boelsterli et al. 1983). Une comparaison de ce niveau d'effet critique avec la dose systémique estimée par application de 0,0107 mg/kg pc/j due à l'utilisation de préparations capillaires contenant de la phénacétine conduit à une ME d'environ 33 000 pour l'exposition à court terme (tableau 6-3).
| Produit | Exposition systémique estimée | Niveau d'effet critique | Paramètre de danger critique | ME |
|---|---|---|---|---|
| Préparation colorante capillaire (chronique) |
0,35 µg/kg pc/j | 13,75 mg/kg pc/j (BMDL10 pour tous les mâles porteurs de tumeurs, tirée d'Isaka et al. 1979) |
Carcinogénicité | ~ 39 000 |
| Préparation colorante capillaire (par application) |
10,7 µg/kg pc | 350 mg/kg pc/j (DMENO basée sur une étude par gavage oral de 4 semaines avec des rats) |
Formation réversible de méthémoglobine et de corps de Heinz et augmentation des réticulocytes périphériques | ~ 33 000 |
Les marges entre les estimations limites supérieures de l'exposition et les niveaux d'effet critique observés lors d'études avec des animaux sont considérées adéquates pour tenir compte des effets cancéreux et non cancéreux et de toute incertitude dans les bases de données toxicologiques et sur l'exposition.
Bien que l'exposition de la population générale à la phénacétine ne soit pas préoccupante aux niveaux actuels, cette substance est considérée avoir un effet inquiétant sur la santé en raison de son potentiel carcinogène. Elle pourrait donc être préoccupantre si les niveaux venaient à augmenter.
6.4 Incertitudes de l'évaluation des risques pour la santé humaine
La confiance dans la base de données sur l'exposition est considérée modérée, bien que des données canadiennes sur les cosmétiques aient été disponibles pour permettre de calculer des estimations limites supérieures de l'exposition. Aucune donnée expérimentale sur l'absorption dermale n'a été trouvée pour la phénacétine, et l'exposition systémique par voie dermale a été estimée en utilisant un algorithme prédictif pour la perméabilité de la peau. La confiance dans la base de données sur le danger est élevée, les effets nocifs associés à une exposition à cette substance ayant été largement documentés.
Il existe une incertitude sur la validité scientifique de l'extrapolation de la voie orale à la voie dermale. En raison de sa courte durée de vie et de la vitesse et de l'ampleur du métabolisme présystémique suite à une exposition orale, la phénacétine n'est pas un candidat idéal pour une extrapolation de sa toxicité par voie entérale à la voie parentérale. Toutefois, cette extrapolation est considérée très prudente, le ou les métabolites toxiques étant le produit d'un effet de premier passage. Cette source d'incertitude ne nuit donc pas à la confiance portée à la conclusion proposée. Même en considérant la dosimétrie interne équivalente en termes de surface sous la courbe, la concentration pic (Cmax) du ou des métabolites réactifs devrait être inférieure par voie dermale et, donc, il est moins probable qu'elle sature les mécanismes de détoxification ou de réparation.
Enfin, il existe une incertitude quant à l'utilisation d'une dose moyenne pour amortir des doses reçues de façon intermittente pendant une période d'exposition chronique, en particulier dans le cas d'une substance ayant une durée de vie biologique relativement courte. Le principe de la dose moyenne est basé sur la règle de Haber et l'hypothèse que la toxicité est liée à l'exposition combinée totale. Bien que le concept de base soit appliqué de manière routinière pour les évaluations des risques de cancer posés par des carcinogènes génotoxiques, il existe une incertitude sur l'ampleur avec laquelle une exposition moyenne calculée à partir d'une dose moyenne reflète une mesure pertinente de l'exposition en termes toxicologiques. Néanmoins, la comparaison des niveaux d'effet tirés des études en laboratoire mettant en jeu une exposition chronique pendant une vie avec une exposition intermittente d'humains est considérée très prudente.
7. Conclusion
En tenant compte de tous les éléments de preuve avancés dans la présente ébauche d'évaluation préalable, il existe un faible risque d'effets nocifs posés par la phénacétine aux organismes et à l'intégrité plus large de l'environnement. Nous proposons de conclure que la phénacétine ne satisfait à aucun des critères du paragraphe 64(a) ou (b) de la LCPE, car elle ne pénètre pas dans l'environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l'environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l'environnement nécessaire à la vie.
En se basant sur les renseignements présentés dans la présente ébauche d'évaluation préalable, nous proposons de conclure que la phénacétine ne satisfait à aucun des critères du paragraphe 64(c) de la LCPE, car elle ne pénètre pas dans l'environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Nous proposons donc de conclure que la phénacétine ne satisfait à aucun des critères de l'article 64 de la LCPE.
Références
Angervall L. et Bengtsson U.; 1967; Impairment of renal concentrating capacity in albino rats induced by phenacetin and acetylsalicylic acid; Acta Pharmacologica et Toxicologica, 26, p. 105–112.
Asanami S., Shimono K., Sawamoto O., Kurisu K. et Uejima M.; 1995; The suitability of rat peripheral blood in suchronic studies for the micronucleus assay; Mutation Research Letters, 347, p. 73–78.
Bach P.H. et Hardy T.L.; 1985; Relevance of animal models to analgesic-associated renal papillary necrosis in humans; Kidney Int., 28, p. 605–613.
Baethke R. et Müller B.; 1965; Embryotoxic activity of phenacetin during chronic studies on rats (Ger.); Klin. Wochenschr., 43, p. 364–368.
Boelsterli U.A., Shie K.P., Brändle E. et Zbinden G.; 1983; Toxicological screening models: Drug-induced oxidative hemolysis; Toxicology Letters, 15, p. 153–158.
Boyd E.M.; 1959; The acute oral toxicity of phenacetin; Toxicology and Applied Pharmacology, 1, p. 240-249.
Boyd E.M. et Hottenroth S.M.; 1968; The toxicity of phenacetin at the range of the oral LD50 (100 days) in albino rats; Toxicology and Applied Pharmacology, 12, p. 80–93.
Briggs G.G., Freeman R.K. et Yaffe S.J.; 2011; Drugs in pregnancy and lactation: A reference guide to fetal and neonatal risk; Philadelphia (PA): Lippincott Williams & Wilkins, p. 1149.
Brodie B.B. et Axelrod J.; 1949; The fate of acetophenetidin (phenacetin) in man and methods for the estimation of acetophenetidin and its metabolites in biological material; Journal of Pharmacology and Experimental Therapeutics, 97, p. 58–67.
Broséus J., Gentile N. et Esseiva P.; 2016; The cutting of cocaine and heroin: A critical review; Forensic Science International, 262, p. 73–83.
[Cal/EPA] Environmental Protection Agency de la Californie; 1992; Expedited cancer potency values and proposed regulatory levels for certain proposition 65 carcinogens.(disponible en anglais seulement)
Camus A.M., Friesen M., Croisy A. et Bartsch H.; 1982; Species-specific activation of phenacetin into bacterial mutagens by hamster liver enzymes and identification of N-hydroxyphenacetin O-glucuronide as a promutagen in the urine; Cancer Research, 42, p. 3201–3208.
Canada; 1999; Loi canadienne sur la protection de l'environnement, 1999, L.C. 1999, ch. 33; Gazette du Canada Partie III, vol. 22, no 3.
Canney A.H., Pantuck E.J., Hsiao K.C., Garland W.A., Anderson K.E., Alvares A.P. et Kappas A.; 1976; Enhanced phenacetin metabolism in human subjects fed charcoal-broiled beef; Clinical Pharmacology & Therapeutics, 20, p. 633–642.
ChemIDplus [base de données]; 1993– ; Bethesda (MD): US National Library of Medicine; recherche sur le no CAS 62-44-2 [consultée le 27 janvier 2016].
Cleek R.L. et Bunge A.L.; 1993; A new method for estimating dermal absorption from chemical exposure. 1. General approach; Pharm. Res., 10, p. 497–506.
Cole C., Jones L., McVeigh J., Kicman A., Syed Q. et Bellis M.; 2011; Adulterants in illicit drugs: a review of empirical evidence; Drug Testing and Analysis, 3, p. 89–96.
[CPDB] Carcinogenic Potency Database; 2007; Phenacetin [mise à jour le 3 octobre 2007].(disponible en anglais seulement)
Davidson R.J.L.; 1971; Phenacetin-induced haemolytic anaemia; Journal of Clinical Pathology, 24, p. 537–541.
de Leeuw N.K., Shapiro L. et Lowenstein L.; 1963; Drug-induced hemolytic anemia; Annals of Internal Medicine, 58, p. 592–607.
[BDPP] Base de données sur les produits pharmaceutiques; 2010; Ottawa (ON) : Santé Canada.
[ECCC] Environnement et Changement climatique Canada; 2016a; Documents sur l'approche scientifique : Classification des risques écologiques des substances organiques.
[ECCC] Environnement et Changement climatique Canada; 2016b; Gatineau (QC) : Data used to create substance-specific hazard and exposure profiles and assign risk classifications.
Environnement Canada; 2009; Données collectées lors de la mise à jour de l'inventaire de la LIS en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement, 1999 : Avis concernant certaines substances inanimées (substances chimiques) inscrite sur la Liste intérieure; données préparées par : Environnement Canada, Santé Canada ; Programme des substances existantes.
Environnement Canada, Santé Canada; 2007; Catégorisation; Ottawa (ON) : gouvernement du Canada [mise à jour le 20 avril 2007].
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d'estimation]; c2000-2010; ver. 4.10; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Fukami T. et Yokoi T.; 2012; The emerging role of human esterases; Drug Metabolism and Pharmacokinetics, 27, p. 466–477.
Gault M.H., Rudwal T.C. et Redmond N.I.; 1968; Analgesic habits of 500 veterans: incidence and complications of abuse; Canadian Medical Association Journal, 98, p. 619.
Gilman A.G., Rall T.W., Nies A.S. et Taylor P. éditeurs; 1990; Goodman and Gilman's The pharmacological basis of therapeutics, 8èmeédition, New York (NY): Pergamon Press.
Gold L.S., Gaylor D.W. et Slone T.H.; 2003; Comparison of cancer risk estimates based on a variety of risk assessment methodologies; Regul. Toxicol. Pharmacol., 37, p. 45–53.
Halevy S.; 1979; Drug sensitivity of the neonate; dans Marx G.F. (éd.), Clinical management of mother and newborn, New York (NY): Springer-Verlag; p. 101.
Hart E.R.; 1947; The toxicity and analgetic potency of salicylamide and certain of its derivatives as compared with established analgetic-antipyretic drugs; Journal of Pharmacology and Experimental Therapeutics, 89, p. 205–209.
Hayashi M., Sutou S., Shimada H., Sato S., Sasaki Y.F. et Wakata A.; 1989; Difference between intraperitoneal and oral gavage application in the micronucleus test: the 3rd collaborative study by CSGMT/JEMS· MMS; Mutation Research/Genetic Toxicology, 223, p. 329–344.
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié; Ottawa (ON) : Santé Canada, Direction de la santé du milieu.
Santé Canada; 2015b; Liste des drogues sur ordonnace [consultée le 28 janvier 2016].
Conseil de la santé des Pays-Bas; 2012; Phenacetin - Evaluation of the carcinogenicity and genotoxicity; Sous-comité sur la classification des substances carcinogènes du Comité d'experts néerlandais sur la sécurité au travail, La Haye (Pays-Bas), no 2012/21; https://www.gezondheidsraad.nl/sites/default/files/Phenacetin201221.pdf.
Hinson J.A.; 1983; Reactive metabolites of phenacetin and acetaminophen: a review; Environmental Health Perspectives, 49, p. 71.
[HSDB] Hazardous Substances Data Bank [base de données sur l'Internet]; 1983– ; Bethesda (MD): National Library of Medicine (US) [consultée en février 2016]; http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?HSDB.
[CIRC] Centre international de recherches sur le cancer; 1977; Some miscellaneous pharmaceutical substances; IARC Monogr Eval Carcinog Risks Hum., 13, p. 1–255.
[CIRC] Centre international de recherches sur le cancer; 1980; Some pharmaceutical drugs; IARC Monogr Eval Carcinog Risks Hum, 24, p. 1–337.
[CIRC] Centre international de recherches sur le cancer; 2012; Pharmaceuticals, IARC Monogr Eval Carcinog Risks Hum., 100A, p. 377–398.
Insel P.A.; 1993; Analgesic-antipyretics and anti-inflammatory agents. Drugs employed in the treatment of rheumatoid arthritis and gout; dans : Sanford L. et Gilman A. éditeurs, Goodman and Gilman's the pharmacological basis of therapeutics, 8ème édition, McGraw-Hill, Inc. Health Professions Division.
[IPCS] International Programme on Chemical Safety; 2006; Dermal Absorption; Environmental Health Criteria 235.(disponible en anglais seulement)
Isaka H., Yoshii H., Otsuji A., Koike M., Nagai Y., Koura M., Sugiyasu K. et Kanabayashi T.; 1979; Tumors of Sprague-Dawley rats induced by long-term feeding of phenacetin; Gan., 70, p. 29–36.
Jensen C.B. et Jollow D.J.; 1991; The role of N-hydroxyphenetidine in phenacetin-induced hemolytic anemia; Toxicology and Applied Pharmacology, 111, p. 1–2.
Johansson S.L., Radio S.J., Saidi J. et Sakata T.; 1989; The effects of acetaminophen, antipyrine and phenacetin on rat urothelial cell proliferation; Carcinogenesis, 10, p. 105–111.
Kawamura Y., Hayashi H., Masumura K., Numazawa S. et Nohmi T.; 2014; Genotoxicity of phenacetin in the kidney and liver of Sprague-Dawley gpt delta transgenic rats in 26-week and 52-week repeated-dose studies; Toxicology, 324, p. 10–17.
Kincaid Smith P.; 1988; Analgesic nephropathy; Australian and New Zealand Journal of Medicine, 18, p. 251–254.
Kobayashi Y., Fukami T., Nakajima A., Watanabe A., Nakajima M. et Yokoi T.; 2012; Species differences in tissue distribution and enzyme activities of arylacetamide deacetylase in human, rat, and mouse; Drug Metabolism and Disposition, 40, p. 671–679.
Kriger Research Center; 2012; Kriger's Textbook of Pharmacology; Altaspera Publishing and Literary Agency Inc., 278 p.
Kroes R., Renwick A.G., Feron V., Galli C.L., Gibney M., Greim H., Guy R.H., Lhuguenot J.C., Van de Sandt J.J.M.; 2007; Application of the threshold of toxicological concern (TTC) to the safety evaluation of cosmetic ingredients; Food and Chemical Toxicology, 45, p. 2533–2562.
Lexchin J.; 2005; Drug withdrawals from the Canadian market for safety reasons, 1963–2004; Canadian Medical Association Journal, 172, p. 765–767 (annexe en ligne).
Li W.W., Li B.G. et Chen Y.Z.; 1999; A new nor-sesquiterpene from Tripterygium wilfordii[J]; Chin. J. Appl. Environ. Biol., 5, p. 267–274.
[BDPSNH] Base de données des produits de santé naturels homologués[modifiée le 27 février 2014]; Ottawa (ON) : Santé Canada [consultée le 10 mai 2016].
Margetts G.; 1976; Phenacetin and paracetamol; Journal of International Medical Research, 4, p. 55–70.
Nakagawa Y., Izumi K., Oikawa N., Sotomatsu T., Shigemura M. et Fujita T.; 1992; Analysis and prediction of hydrophobicity parameters of substituted acetanilides, benzamides and related aromatic compounds; Environmental Toxicology and Chemistry, 11, p. 901–916.
Nelson S.D., Forte A.J., Vaishnav Y., Mitchell J.R., Gillette J.R. et Hinson J.A.; 1981; The formation of arylating and alkylating metabolites of phenacetin in hamsters and hamster liver microsomes; Molecular Pharmacology, 19, p. 140–145.
[BDIPSN] Base de données d'ingrédients de produits de santé naturels[modifiée le 18 avril 2016]; Ottawa (ON) : Santé Canada [consultée le 10 mai 2016].
Nohmi T., Yoshikawa K., Nakadate M. et Ishidate M.; 1983; Species difference in the metabolic activation of phenacetin by rat and hamster liver microsomes; Biochemical and Biophysical Research Communications, 110, p. 746–752.
[NTP] National Toxicology Program (États-Unis); 2014; Report on Carcinogens, 13th ed. Research Triangle Park (NC): US Department of Health and Human Services, Public Health Service.(disponible en anglais seulement)
O'Neil M.J. (éd.); 2001; The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals, 13th ed., Whitehouse Station (NJ): Merck and Co. Inc., p. 1292.
Osol A. (éd.); 1980; Remington's pharmaceutical sciences, 16th ed. Easton (PA): Mack Publishing Co, p. 1060.
Parkinson A.; 2001; Biotransformation of xenobiotics; dans Casarett L.J., Klaassen C.D. et Doull J., éd, Casarett and Doull's toxicology: the basic science of poisons, 6th ed, McGraw-Hill Medical Pub. Division, p. 182.
Parkinson A., Ogilvie B.W., Buckley D.B., Kazmi F., Czerwinski M. et Parkinson O.; 2013; Biotransformation of xenobiotics; dans Klaassen C.D. éd., Casarett and Doull's toxicology: the basic science of poisons, 8th ed. McGraw-Hill Medical Pub. Division, p. 1274.
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d'estimation]; 2008; version 2.00; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (disponible en anglais seulement)
[PCPC] Personal Care Products Council; 2016; Phenacetin, monograph 2286; Cosmetic Ingredient Identification Database: International Nomenclature of Cosmetic Ingredients (INCI) Dictionary [consulté le 27 janvier 2016]. (disponible en anglais seulement)
Potts R.O. et Guy R.H.; 1992; Predicting skin permeability; Pharm. Res.; 9, p. 663–669.
Rennke H.G. et Denker B.M.; 2007; Analgesic abuse nephropathy; dans Renal pathophysiology: the essentials, 2nd ed, Lippicott, Williams and Wilkins, p. 351.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu; 2006; Cosmetics Fact Sheet: To assess the risks for the consumer; RIVM report 320104001/2006.
Sanerkin N.G. et Weaver C.M.; 1964; Chronic phenacetin nephropathy ("chronic interstitial nephritis" with papillary necrosis); British Medical Journal, 1(5378), p. 288.
[SCCNFP] Scientific Committee on Cosmetic Products and Non-Food Products Intended For Consumers; 2000; Notes of guidance for testing of cosmetic ingredients for their safety evaluation; 4th revision; SCCNFP/0321/00.
Schmähl D. et Bunk B.; 1991; Carcinogenic drugs and their relevance in risk assessment; dans Schettler G., Schmähl D. et Klenner T. editors, Risk assessment in chemical carcinogenesis, Springer Berlin Heidelberg, p. 56–63.
Seidell A.; 1941; Solubilities of inorganic and metal organic compounds: a compilation of quantitative solubility data from the periodical literature, volume 2; van Nostrand.
Smith R.L. et Timbrell J.A.; 1974; Factors affecting the metabolism of phenacetin - I. Influence of dose, chronic dosage, route of administration and species on the metabolism of [1-14C-acetyl] phenacetin; Xenobiotica, 4, p. 489–501.
Uehara T., Kondo C., Morikawa Y., Hanafusa H., Ueda S., Minowa Y., Nakatsu N., Ono A., Maruyama T., Kato I. et Yamate J.; 2013; Toxicogenomic biomarkers for renal papillary injury in rats; Toxicology, 303, p. 1–8.
[EPA] Environmental Protection Agency des États-Unis; 2002; Evaluation of the potential carcinogenicity of phenacetin; EPA/600/8-91/173.
[EPA] Environmental Protection Agency des États-Unis; 2015; Benchmark dose modelling software (BMDS), version 2.6.
[FDA] Food and Drug Administration des États-Unis; 1983; Human Drugs, Prescription and Over-the-Counter Drug Products Containing Phenacetin, Withdrawal of Approval of New Drug Application; Federal Register 48 194; [consulté le 16 février 2016].
Velázquez F., Manríquez R., Maya L., Barrientos L. et López-Dellamary F.; 2009; Phenacetin isolated from Bursera grandifolia, a herbal remedy with antipyretic properties; Natural Product Communications, 4, p. 1575.
Venkatakrishnan K., Moltke L.L. et Greenblatt D.J.; 1998; Human cytochromes P450 mediating phenacetin O-deethylation in vitro: Validation of the high affinity component as an index of CYP1A2 activity; Journal of Pharmaceutical Sciences, 87, p. 1502–1507.
Veronese M.E., McLean S., D'souza C.A. et Davies N.W.; 1985; Formation of reactive metabolites of phenacetin in humans and rats; Xenobiotica, 15, p. 929–940.
Watanabe A., Fukami T., Takahashi S., Kobayashi Y., Nakagawa N., Nakajima M. et Yokoi T.; 2010; Arylacetamide deacetylase is a determinant enzyme for the difference in hydrolase activities of phenacetin and acetaminophen; Drug Metab. Dispos., 38(9), p. 1532-1537.
[OMS] Organisation mondiale de la santé; 1989; Glucose-6-phosphate dehydrogenase deficiency; Bull. World Health Organ., 67, p. 601–611.
Wiedemann H.G.; 1972; Applications of thermogravimetry for vapor pressure determination; Thermochimica Acta, 3, p. 355–366.
Williams F.M., Rothe H., Barrett G., Chiodini A., Whyte J., Cronin M.T., Monteiro-Riviere N.A., Plautz J., Roper C., Westerhout J., Yang C. et Guy R.H.; 2016; Assessing the safety of cosmetic chemicals: Consideration of a flux decision tree to predict dermally delivered systemic dose for comparison with oral TTC (Threshold of Toxicological Concern); Regulatory Toxicology and Pharmacology, 76, p. 174–186.
Yengi L.G., Xiang Q., Pan J., Scatina J., Kao J., Ball S.E., Fruncillo R., Ferron G. et Wolf C.R.; 2003; Quantitation of cytochrome P450 mRNA levels in human skin; Analytical Biochemistry, 316, p. 103–110.
Annexes
Annexe A - Exposition limite supérieure estimée due à l'utilisation de produits colorants capillaires
Calcul de l'exposition systémique basée sur le flux maximal
Avec le modèle de Potts et Guy (1992), on calcule le coefficient de perméabilité de la peau (Kp, en cm/h) en se basant sur la taille du composé perméant (exprimée en tant que masse moléculaire) et la lipophilie (exprimée en tant que logarithme du coefficient de partage octanol/eau). Étant donné que Koe = 1,58 et que la masse moléculaire de la phénacétine est de 179,2 g/mole, log Kp est calculé ainsi :
log Kp (cm/h) = -2,72 + 0.71 log Koe - 0,0061* MM
log Kp (cm/h) = -2,691
Kp (cm/h) = 2,03 x 10-3
On applique ensuite la correction de Cleek et Bunge (1993) pour tenir compte des perméabilités relatives de la couche cornée et de l'épiderme :
Kp,mod (cm/h) = Kp / {1 + (Kp * √-------MM) / 2.6}
Kp,mod (cm/h) = 2,01 x 10-3
Le flux maximal (Jmax) peut ensuite être calculé à partir du coefficient de perméabilité de la peau modifié et de l'hydrosolubilité du composé (Csat ≈ 1 mg/mL), comme suit :
Jmax (μg/cm2/h) = 1000 μg/mg * Kp,mod (cm/h) * Csat (mg/cm3)
Jmax (μg/cm2/h) = 2.01
En utilisant le flux maximal prédit, la surface exposée et la durée de l'exposition, on peut estimer la dose systémique maximale.
| Scénario | Paramètres du modèlea | Exposition estimée |
|---|---|---|
| Hair dye |
|
Dermal par application : 0,013 mg/kg pc Dermal chronique : 0,00041 mg/kg pc/j |
a. Les hypothèses sont basées sur les documents RIVM (2006) et Santé Canada (1998).
Exposition systémique par application = 2,01 μg/cm2/h * 565 cm2* 40/60 h / 70,9 kg
Dose systémique chronique = dose par application * 12/365
Annexe B - Calcul du risque de cancer
Calcul de la BMDL10 de la phénacétine
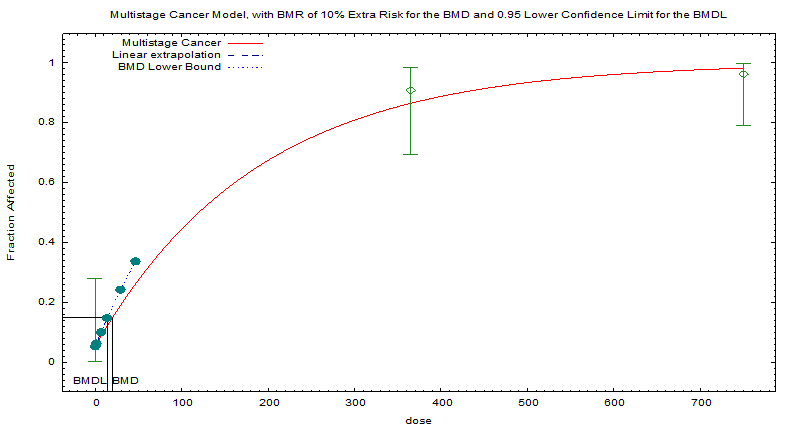
Les calculs des doses de référence ont été faits en utilisant le logiciel BMDS 2.6 (EPA). Ce modèle en plusieurs étapes pour le cancer a été adapté aux données d'Isaka et al. (1979) en utilisant tous les cas de tumeurs chez des mâles qui avaient été déterminés comme étant des « animaux efficaces » (tableau B-1). Les auteurs ont défini un animal efficace comme un animal ayant survécu plus de 24 mois ou étant mort à cause de tumeurs s'étant développées dans les 24 mois. Une réponse de référence (RR) égale à une augmentation de 10 % de l'incidence de tumeurs par rapport à des témoins (BMD0,1) a été calculée ainsi que la limite inférieure de confiance à 95 % (BMDL10).
| Dose (mg/kg pc/j) |
Nombre total d'animaux | Nombre d'animaux atteints de tumeurs |
|---|---|---|
| 0 | 19 | 1 |
| 365 | 22 | 20 |
| 750 | 27 | 26 |
Le modèle à plusieurs étapes pour le cancer est le modèle par défaut utilisé par l'EPA pour les données sur les bioépreuves de cancer. Bien que d'autres modèles soient disponibles pour s'ajuster à des données dichotomiques, aucun n'offre une prudence ou un ajustement aussi bon (tableau B-2). En conséquence, la BMDL10 de 13,75 mg/kg pc/j calculée avec le modèle à plusieurs étapes a été retenue comme point de départ pour l'évaluation des risques (figure B-1).
| Modèle | BMD0,1 | BMDL10 | chi carré | p-value | AICa | Résiduelb |
|---|---|---|---|---|---|---|
| Gamma | 19,74 | 13,75 | 0,99 | 0,3207 | 34,67 | -0,8 à 0,6 |
| Logistique | 72,05 | 44,03 | 8,75 | 0,0031 | 38,29 | -2,7 à 1,0 |
| Cancer – plusieurs étapes | 19,74 | 13,75 | 0,99 | 0,3207 | 34,67 | -0,8 à 0,6 |
| Probit | 67,81 | 46,54 | 11,11 | 0,0009 | 40,96 | -2,7 à 1,6 |
| Weinbull | 19,74 | 13,75 | 0,99 | 0,3207 | 34,67 | -0,8 à 0,6 |
| Quantal-Linear | 19,74 | 13,75 | 0,99 | 0,3207 | 34,67 | -0,8 à 0,6 |
a. AIC est le critère d'information Akaike, défini de la manière suivante AIC= -2 x (LL-p), LL étant le log du rapport de vraisemblance pour les estimations maximales de vraisemblance et p étant les degrés de liberté. Tous les autres paramètres étant égaux, un AIC faible est préféré.
b. [(Valeur observée – valeur attendue)/écart-type]
Longue description pour la figure B-1
Ajustement du modèle pour le cancer à plusieurs étapes aux données combinées pour tous les mâles atteints de cancer, tirées d'Isaka et al. (1979)
Risque supplémentaire estimé de cancer au cours de la vie basé sur le pouvoir cancérigène de la phénacétine
Le pouvoir cancérigène est proportionnel à la pente de la courbe dose-réponse aux faibles doses. Un modèle pour le cancer en plusieurs étapes a été ajusté aux données sur les bioépreuves animales d'Isaka et al. (1979). Cette approche comporte une hypothèse intrinsèque à l'effet que les données collectées aux fortes doses sont aussi pertinentes aux très faibles doses ou que le modèle permet d'extrapoler le pouvoir cancérigène en dehors de la gamme des observations expérimentales afin de calculer des estimations de pouvoir à faible dose (Cal/EPA 1992).
Pour estimer le pouvoir cancérigène, la réponse de référence (RR) de 0,1 est divisée par la limite inférieure de confiance à 95 % sur la dose qui induit des tumeurs chez 10 % des animaux (BMDL10).
Facteur de pente du cancer = BMR/ BMDL10 = 0,1/13,75 mg/kg bw/d = 7,27 [μg/kg/d]-1
Ce facteur calculé à partir des données de bioépreuves peut être mis à l’échelle allométriquement à la puissance 2/3 du poids corporel afin d’obtenir un facteur de pente équivalent pour les humains :
Facteur de pente équivalent pour les humains = facteur de pente pour les animaux [μg/kg/d]-1 × (bw animal / bw human) ^ (1- b),
b = 0,667 (mise à l'échelle à la puissance 2/3)
Facteur de pente équivalent pour les humains = 7,27 [μg/kg/d]-1 × (0,267 kg / 70,9 kg) ^ 0,333 = 1,13 [μg/kg/d]-1
Cette valeur peut être multipliée par la dose d'exposition chronique afin de calculer une estimation du risque suplémantaire de cancer durant la vie.
0,00113 [mg/kg/d]-1 × 0,00041 mg/kg bw/d = 4,6 x 10-7