Ébauche d’évaluation préalable - N-cyclohexylsulfamate de sodium et cyclohexanamine
Titre officiel : Ébauche d’évaluation préalable - N-Cyclohexylsulfamate de sodium et cyclohexanamine
Numéros de registre du Chemical Abstracts Service 139-05-9, 108-91-8
Environnement et Changement climatique Canada
Santé Canada
Décembre 2019
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont mené une évaluation préalable de deux substances : le N-cyclohexylsulfamate de sodium (N-cyclohexylsulfamate de sodium) et la cyclohexanamine (cyclohexylamine). Ces substances ont été identifiées d’intérêt prioritaire pour une évaluation puisqu’elles satisfaisaient aux critères de catégorisation du paragraphe 73 (1) de la LCPE. Leurs numéros de registre du Chemical Abstracts Service (no CASNote de bas de page 1), leurs noms sur la Liste intérieure des substances (LIS) et leurs noms communs sont présentés dans le tableau ci-dessous. Pour son évaluation, la cyclohexanamine a été transférée du groupe des amines aliphatiques à celui du N-cyclohexylsulfamate de sodium, car la cyclohexanamine est un métabolite du N-cyclohexylsulfamate de sodium chez des mammifères et que les données sur la cyclohexanamine peuvent être utilisées pour la caractérisation des effets des deux substances sur la santé humaine.
| No CAS | Nom sur la LIS | Nom chimique |
|---|---|---|
| 139-05-9 | Cyclamate de sodium | N-Cyclohexylsulfamate de sodium |
| 108-91-8 | Cyclohexylamine | Cyclohexanamine |
Le N-cyclohexylsulfamate de sodium et la cyclohexanamine ne sont pas naturellement présents dans l’environnement. Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE, aucune quantité de N-cyclohexylsulfamate de sodium ni de cyclohexanamine supérieure au seuil de déclaration de 100 kg n’a été déclarée produite au Canada au cours de l’année de déclaration 2011. Les quantités importées déclarées étaient de 100 000 à 1 000 000 kg pour le N-cyclohexylsulfamate de sodium et de 871 518 kg au total pour la cyclohexanamine.
Au Canada, le N-cyclohexylsulfamate de sodium est principalement utilisé comme édulcorant de table et comme ingrédient non médicinal dans des produits de santé naturels et des drogues. Ce n’est pas un additif alimentaire autorisé au Canada et il n’a pas été identifié comme étant utilisé dans des matériaux d’emballage alimentaire. La cyclohexanamine est principalement utilisée pour prévenir la corrosion dans des systèmes de traitement de l’eau, mais est aussi utilisée comme agent de nettoyage des chaudières. Elle peut être utilisée dans des cosmétiques, comme formulant dans des pesticides, des matériaux d’emballage alimentaire, des additifs indirects utilisés dans des installations de préparation alimentaire et d’autres produits disponibles pour les consommateurs.
Les risques pour l’environnement dus au N-cyclohexylsulfamate de sodium et à la cyclohexanamine ont été caractérisés à l’aide de la classification du risque écologique des substances organiques (CRE), une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de plusieurs éléments de preuve pour déterminer le classement. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, au seuil de toxicité interne dérivée du réseau tropique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte dans les profils d’exposition incluent la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour assigner aux substances un potentiel faible, moyen ou élevé selon leurs profils de danger et d’exposition. D’après les résultats de la CRE, il est improbable que le N‑cyclohexylsulfamate de sodium et la cyclohexanamine soient nocifs pour l’environnement.
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le N-cyclohexylsulfamate de sodium et la cyclohexanamine présentent un faible risque d’effet nocif sur l’environnement. Nous concluons que ces substances ne répondent pas aux critères de l’alinéa 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
L’exposition de la population générale du Canada au N-cyclohexylsulfamate de sodium peut être due à son utilisation comme édulcorant de table ou à sa présence dans l’eau potable. Une exposition peut également être due à son utilisation comme ingrédient non médicinal dans des produits de santé naturels (y compris des sirops de supplément de calcium et de la vitamine D) et des drogues (y compris des rince-bouche, des solutions respiratoires pour traiter les bronchospasmes, des sirops contre la congestion pulmonaire et des solutions anesthésiques).
L’exposition de la population générale à la cyclohexanamine peut être due à la consommation d’eau potable et d’aliments. Bien qu’il n’y ait pas de risque de contact direct avec les aliments associé à son utilisation dans des matériaux d’emballage alimentaire, il existe un risque d’exposition alimentaire due à son utilisation comme additif pour l’eau de cyclohexanamineudière dans des installations de préparation alimentaire. La population générale peut également être exposée à la cyclohexanamine lors de l’utilisation de cosmétiques tels que des laques pour cheveux en aérosol et de cartouches de gel combustible pour foyer.
Les études en laboratoire sur le N-cyclohexylsulfamate de sodium étaient de qualité limitée, mais ont mis en évidence des effets potentiels sur les testicules après la prise de fortes doses quotidiennes par voie orale toute la vie. Étant donné la qualité limitée de ces études, les données sur le métabolite du N-cyclohexylsulfamate de sodium, la cyclohexanamine, ou sur son analogue, le chlorhydrate de cyclohexanamine, ont été utilisées pour identifier certains effets critiques du N-cyclohexylsulfamate de sodium sur la santé.
Dans le cas du N-cyclohexylsulfamate de sodium et de la cyclohexanamine, les comparaisons des niveaux d’exposition par voie orale, cutanée et par inhalation de la population générale avec les niveaux auxquels des effets critiques sur la santé ont été observés ont permis de calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
Sur la base des renseignements présentés dans la présente ébauche d’évaluation préalable, il est conclu que le N-cyclohexylsulfamate de sodium et la cyclohexanamine ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, il est conclu que le N-cyclohexylsulfamate de sodium et la cyclohexanamine ne satisfont à aucun des critères de l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada), les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du N-cyclohexylsulfamate de sodium et de la cyclohexanamine (cyclohexylamine), afin de déterminer si ces substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. La cyclohexanamine a été transférée du groupe des amines aliphatiques à celui du N‑cyclohexylsulfamate de sodium puisque chez des mammifères la cyclohexanamine est un métabolite du N‑cyclohexylsulfamate de sodium, et les données sur la cyclohexanamine ont été utilisées pour caractériser les effets des deux substances sur la santé humaine. Ces substances ont été identifiées d’intérêt prioritaire pour une évaluation puisqu’elles satisfaisaient aux critères de catégorisation du paragraphe 73 (1) de la LCPE (ECCC, SC [modifié en 2017]).
Les risques pour l’environnement dus au N-cyclohexylsulfamate de sodium et à la cyclohexanamine ont été caractérisés à l’aide de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE décrit le danger d’une substance au moyen de paramètres clés, notamment le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique, et tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en se basant sur des facteurs comme les vitesses d’émission potentielles, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés pour déterminer les substances qui justifient une évaluation plus approfondie de leur potentiel d’effets nocifs sur l’environnement ou dont la probabilité d’effet nocif sur l’environnement est faible.
Le N‑cyclohexylsulfamate de sodium en association avec le N‑cyclohexylsulfamate et ses sels ont été évalués par le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA). Le N-cyclohexylsulfamate et ses sels ont également été évalués par le Centre international de recherche sur le cancer (CIRC). Les documents de ces deux organisations comportent également une évaluation de la cyclohexanamine, car il s’agit d’un métabolite important des N-cyclohexylsulfamates et de ses sels. Ces évaluations font l’objet d’un examen rigoureux. Santé Canada et Environnement et Changement climatique Canada considèrent que ces évaluations sont fiables. Le N‑cyclohexylsulfamate de sodium a également été évalué par le Comité scientifique européen de l’alimentation humaine (CSAH).
La présente ébauche d’évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, ainsi que de renseignements soumis par des parties prenantes. Des données pertinentes sur le N-cyclohexylsulfamate de sodium et la cyclohexanamine ont été recueillies jusqu’en octobre 2018. Des données empiriques tirées d’études clés ainsi que des résultats de modélisations ont été utilisées pour tirer nos conclusions. Des renseignements pertinents présentés dans des évaluations faites par d’autres juridictions ont été pris en compte.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle intègre des intrants d’autres programmes de ces ministères. Les parties de la présente évaluation qui portent sur l’environnement et la santé humaine ont fait l’objet d’un examen et/ou de consultations externes. Des commentaires sur les parties techniques relatives à la santé humaine ont été faits par les Dre Lynne Haber, Jennifer Seed, et Pamela Williams du Risk Science Center de l’Université de Cincinnati. La partie de la présente évaluation qui porte sur l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe et d’une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en compte, le contenu final et la conclusion de la présente ébauche d’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable est centrée sur des renseignements critiques pour déterminer si les substances examinées satisfont aux critères de l’article 64 de la LCPE, en examinant des renseignements scientifiques et en suivant une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 2 . Dans la présente ébauche d’évaluation préalable, nous présentons les renseignements et les considérations critiques sur lesquels sont basées nos conclusions.
2. Identité des substances
Les numéros de registre du Chemical Abstracts Service (no CASNote de bas de page 3 ), les noms sur la Liste intérieure des substances (LIS) et les noms chimiques du N-cyclohexylsulfamate de sodium et de la cyclohexanamine sont présentés dans le tableau 2‑1.
| No CAS | Nom sur la LIS (nom chimique) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|
| 139-05-9 | Cyclamate de sodium (N-cyclohexylsulfamate de sodium) | ![C1CCC(CC1)NS(=O)(=O)[O-].[Na+]](/content/dam/eccc/images/pded/sodium-cyclamate-cyclohexylamine/20190930-table21a.jpg) C6H12NNNaO3S (en anglais seulement) C6H12NNNaO3S (en anglais seulement) |
201,2 |
| 108-91-8 | Cyclohexylamine (cyclohexanamine) | 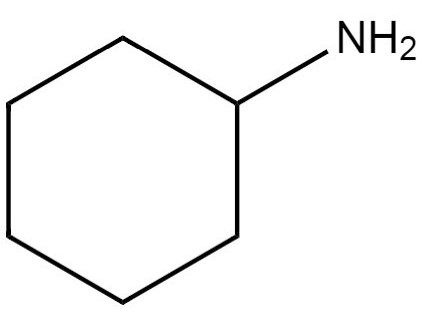 C6H13N C6H13N |
99,2 |
N-Cyclohexylsulfamate peut faire référence à l’acide N-cyclohexylsulfamique (no CAS 100-88-9), au N-cyclohexylsulfamate de sodium (no CAS 139-05-9) ou au N‑cyclohexylsulfamate de calcium (no CAS 139-06-0) (Lawrence 2003). Pour la présente évaluation, N-cyclohexylsulfamate désigne l’entité N-cyclohexylsulfamate du N-cyclohexylsulfamate de sodium ou l’anion N-cyclohexylsulfamate qui se forme lors de la dissociation du N-cyclohexylsulfamate de sodium (la dissociation donne lieu principalement à un anion N-cyclohexylsulfamate et un cation sodium).
2.1 Sélection d’analogues
Une approche de lecture croisée basée sur des données provenant d’analogues a été utilisée pour étayer les évaluations ayant trait à la santé humaine.
Les analogues ont été choisis en fonction de leur similarité structurelle et/ou fonctionnelle (propriétés physico‑chimiques, toxicocinétique similaires) et étaient associés à des données empiriques pertinentes pouvant être utilisées pour une lecture croisée avec les substances de la présente évaluation, sur lesquelles des données empiriques étaient limitées.
Spécifiquement, le chlorhydrate de cyclohexanamine (no CAS 4998 -76-9) a été utilisé pour étayer l’évaluation des effets de la cyclohexanamine sur la santé (les détails sont fournis à l’annexe A). Les renseignements sur les effets sur la santé de la cyclohexanamine et du chlorhydrate de cyclohexanamine ont également été utilisés pour étayer la caractérisation des effets critiques du N-cyclohexylsulfamate de sodium sur la santé.
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques du N-cyclohexylsulfamate de sodium et de la cyclohexanamine est donné dans le tableau 3‑1. D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016 b).
| Propriété | N-Cyclohexylsulfamate de sodium | Cyclohexanamine |
|---|---|---|
| État physique | Cristaux blancsa | Liquide |
| Point de fusion (°C) | 300b | -17,7f |
| Pression de vapeur (Pa) | 7,08 × 10−5 [modélisée]c | 1430g |
| Constante de Henry (atm-m3/mol) | 1,70 × 10−8 [modélisée]c | 4,16 x 10-6g |
| Solubilité dans l’eau (mg/L) | 1,0 × 106 [modélisée]c | 1,0 × 106g (miscible) |
| log Koe (sans dimension) | -1,61 [modélisé]c | 3,7e,h |
| pKa (sans dimension) | 1,71 modélisé]d | 10,68e |
| log Kco (sans dimension) | 1079 [modélisé]d | 1606 [modélisé]i |
Abréviations : Koe, coefficient de partage octanol-eau; pKa, constante de dissociation acide; Kco, coefficient de partage carbone organique-eau.
a PubChem 2004-
b EPA [mise à jour 2018]
c EPI Suite c2000-2012
d HSDB 2012
e ECHA c2007-2017-2017
f Carswell et Morrill 1937
g HSDB 2005
h À une température de 25 °C et un pH de 6,8
i ChemSpider 2015 : log Kco est prédit par EPISuite
4. Sources et utilisations
Le N-cyclohexylsulfamate de sodium et la cyclohexanamine ne sont pas naturellement présents dans l’environnement.
Le N-cyclohexylsulfamate de sodium et la cyclohexanamine ont été inclus dans une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012). Nous présentons dans le tableau 4‑1 un résumé des données sur la production totale et les quantités totales importées déclarées de N-cyclohexylsulfamate de sodium et de cyclohexanamine.
| Substance | Production totalea | Importations totalesa (kg) | Année de déclaration |
|---|---|---|---|
| N-cyclohexylsulfamate de sodium | ND | 100 000 à 1 000 000 | 2011 |
| Cyclohexanamine | ND | 871 518 | 2011 |
Abréviations : ND, non déclaré au-delà du seuil de déclaration de 100 kg.
a Les valeurs reflètent les quantités déclarées lors d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012). Voir l’enquête pour les inclusions et exclusions spécifiques (annexes 2 et 3).
Un résumé des principales utilisations du N-cyclohexylsulfamate de sodium et de la cyclohexanamine selon les renseignements déclarés dans le cadre d’une enquête en vertu de l’article 71 de la LCPE (Environnement Canada 2013) est présenté dans le tableau 4-2.
| Principales utilisationsa | N-Cyclohexylsulfamate de sodium | Cyclohexanamine |
|---|---|---|
| Aliments et boissons | O | N |
| Traitement de l’eau | N | O |
| Produits de soins personnels | N | O |
Abréviations : O – cette substance a été déclarée utilisée ; N - aucune utilisation n’a été déclarée pour cette substance.
a Utilisations non confidentielles rapportées dans le cadre d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012). Voir l’enquête pour les inclusions et exclusions spécifiques (annexes 2 et 3).
| Utilisation | N-Cyclohexylsulfamate de sodium | Cyclohexanamine |
|---|---|---|
| Utilisations alimentaires autres que dans des additifsa | O | N |
| Additif indirecta | N | O |
| Matériaux d’emballage alimentairea | N | O |
| Ingrédients médicinaux ou non médicinaux dans des désinfectants, des drogues pour usage humain ou vétérinaireb | O | N |
| Ingrédients médicinaux ou non médicinaux dans des produits de santé naturels homologuésc | O | N |
| Déclaré présent dans des cosmétiques en vertu du Règlement sur les cosmétiquesd | N | O |
| Principe actif ou produit de formulation dans des produits antiparasitaires homologuése | N | O |
Abréviations : O – cette substance a été déclarée utilisée ; N - aucune utilisation n’a été déclarée pour cette substance.
a Cyclamate de sodium, communication personnelle, courriels de la Direction des aliments (DA) de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada (BERSE), 11 septembre et 23 octobre 2018 (non référencé) ; Santé Canada a établi une dose journalière admissible (DJA) de 11 mg/kg pc/jour, exprimée en acide cyclique (communication personnelle, courriel de DA, SC au BERSE, SC, 24 octobre 2018 (non référencé). CHA, communication personnelle, courriel de la DA, SC au BERSE, SC, 10 janvier 2017 (non référencé).
b Le cyclamate de sodium est un ingrédient non médicinal des drogues ; communications personnelles, courriels de la Direction des produits thérapeutiques (DPT), SC au BERSE, SC, du 3 mai au 17 septembre 2018 (non référencé).
c Le cyclamate de sodium est un ingrédient non médicinal dans des produits de santé naturels, communications personnelles, courriels de la Direction des produits de santé naturels et sans ordonnance (DPSNSO), de SC au BERSE, SC, du 3 mai au 18 septembre 2018 (non référencé).
d CHA, communication personnelle, courriels de la Direction de la sécurité des produits de consommation (DSPC), SC, au BERSE, SC, datés du 14 décembre 2016 et du 14 décembre 2017 (non référencé).
e Chlorhydrate de sodium, communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire (ARLA), SC au BERSE, SC, 5 avril 2018 (non référencé). La CHA est un produit de formulation, courriel de l’ARLA, SC au BERSE, SC au BERSE, SC, 21 décembre 2016 (non référencé).
Au Canada, le N-cyclohexylsulfamate de sodium est principalement utilisé comme édulcorant de table (Environnement Canada 2013). En vertu de la partie E du Règlement sur les aliments et drogues, l’acide cyclohexylsulfamique ou un de sels quelconque (p. ex. le N-cyclohexylsulfamate de sodium) peut être vendu comme édulcorant pour usage personnel pourvu que son étiquette porte la mention qu’il doit être utilisé uniquement sur l’avis du médecin et donne sa valeur énergétique (communication personnelle, courriel de la DA de SC au BERSE de SC, 9 novembre 2018 [non référencé]). Le N-cyclohexylsulfamate de sodium est un ingrédient non médicinal de médicaments et de produits de santé naturels (communication personnelle, courriels de la DPSNH et de la DPT de SC au BERSE de SC, 3 mai au 18 septembre 2018 [non référencé]).
Au Canada, la cyclohexanamine est utilisée comme inhibiteur de corrosion dans le traitement de l’eau, agent de nettoyage des chaudières, adjuvant de traitement, ainsi que dans des cosmétiques (Environnement Canada 2013). Plus précisément, de la cyclohexanamine est présente dans des laques pour cheveux en aérosol (communication personnelle, courriels de la DSPC de SC au BERSE de SC, 14 décembre 2016 et 14 décembre 2017; non référencés) et des cartouches de gel combustible (p. ex. pour un foyer, une coupe de feu ou une lanterne) (FS 2018). La cyclohexanamine peut être utilisée dans des matériaux d’emballage alimentaire, comme composant dans la couche externe de tubes destinés au transfert de boissons et dans la couche de papier/carton enduit de polyéthylène n’entrant pas en contact avec les aliments utilisée pour le conditionnement de boissons au Canada. La cyclohexanamine est un additif indirect en raison de son utilisation comme additif pour l’eau de chaudière et peut être présente dans la vapeur produite pouvant entrer en contact avec les aliments (communication personnelle, courriel de la DA de SC au BERSE de SC, daté du 10 janvier 2017; non référencé). La cyclohexanamine est un produit de formulation de pesticides (communication personnelle, courriel de l’ARLA de SC au BERSE de SC, 21 décembre 2016; non référencé).
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques posés à l’environnement par le N-cyclohexylsulfamate de sodium et la cyclohexanamine ont été caractérisés à l’aide de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les divers éléments de preuve sont combinés afin de pouvoir distinguer les substances présentant un pouvoir faible ou élevé et un potentiel d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex. les concentrations létales médianes [CL50]). Cette approche est résumée dans les paragraphes suivants et elle est décrite en détail dans un document d’ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons et les quantités de ces produits chimiques importés ou produits au Canada ont été tirées de la littérature scientifique, de bases de données empiriques (p. ex. Boîte à outils [Q]SAR de l’OCDE [2016]) et de réponses à des avis publiés en vertu de l’article 71 de la LCPE. Elles ont aussi été obtenues à partir de modèles de type QSAR (relation quantitative structure-activité), de devenir du bilan massique ou de bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition de la substance.
Les profils de danger ont été principalement établis en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faible, moyen ou élevé. D’autres règles ont été suivies (p. ex. constance du classement, marge d’exposition) pour améliorer le classement préliminaire du danger ou de l’exposition.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque faible, moyen ou élevé basé sur le classement de son danger et de son exposition. Le classement du risque potentiel obtenu grâce à la CRE a été vérifié en suivant une approche en deux étapes. La première étape consistait à faire passer le classement du risque de moyen ou élevé à faible dans le cas des substances à faible vitesse d’émission estimée dans l’eau après traitement des eaux usées, représentant un faible potentiel d’exposition. La deuxième étape consistait à revoir les résultats du classement du potentiel de risque au moyen de scénarios de risque relativement prudents à l’échelle locale (c.‑à‑d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si le classement du risque potentiel devrait être reclassé à un niveau supérieur.
La CRE est basée sur une approche pondérée pour réduire au minimum tout risque de surclassification ou sous-classification du danger et de l’exposition, et du risque subséquent. Les approches équilibrées suivies pour traiter des incertitudes sont décrites plus en détail dans ECCC (2016a). Nous décrivons ci-après deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient entraîner une modification de la classification du danger, en particulier dans le cas des paramètres basés sur des valeurs de résidus dans les tissus (c.-à-d. mode d’action toxique), dont un grand nombre sont prédites à partir de modèles (Q)SAR. Toutefois, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) de résidus dans les tissus pour l’analyse des résidus corporels critiques (RCC). Des erreurs de sous-estimation de la toxicité aiguë seront atténuées en recourant à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’estrogène. Les changements ou les erreurs touchant les quantités de produits chimiques pourraient entraîner un classement différent de l’exposition, les classifications de l’exposition et du risque étant très sensibles à la vitesse d’émission et aux quantités utilisées. Les classifications obtenues au moyen de la CRE reflètent donc l’exposition et le risque au Canada, compte tenu des quantités actuellement utilisées, mais pourraient ne pas rendre compte de tendances futures.
Les données et les éléments critiques pris en compte pour développer les profils spécifiques au N-cyclohexylsulfamate de sodium et à la cyclohexanamine, ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016 b).
D’après les renseignements pris en compte pour la CRE, le N-cyclohexylsulfamate de sodium et la cyclohexanamine présentent un faible potentiel d’exposition et une faible potentiel de danger. Par conséquent, le N-cyclohexylsulfamate de sodium et la cyclohexanamine ont été classés comme présentant un faible potentiel de risque pour l’environnement. Compte tenu des profils d’utilisation actuels, il est peu probable que ces substances soient préoccupantes pour l’environnement au Canada.
6. Potentiel d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
6.1.1 Milieux de l’environnement et aliments
N-Cyclohexylsulfamate de sodium dans les milieux de l’environnement
Le N-cyclohexylsulfamate de sodium devrait se dissocier dans l’environnement et être présent sous forme d’anion N-cyclohexylsulfamate et de cation sodium, comme l’indique sa valeur de pKa. Étant donné sa faible pression de vapeur, l’anion N‑cyclohexylsulfamate ne devrait pas se la volatiliser à partir de l’eau et des surfaces du sol. De plus, en raison de son Kco estimé (HSDB 2012), l’anion N-cyclohexylsulfamate ne devrait pas s’adsorber plus fortement sur les sols que ses homologues neutres, ni s’adsorber sur des solides en suspension dans l’eau ou des sédiments.
Aucune concentration mesurée de N-cyclohexylsulfamate de sodium dans l’air, le sol ou la poussière n’a été identifiée au Canada. Des concentrations ont été modélisées dans des milieux de l’environnement à l’aide de ChemCAN (2003) à partir des quantités commerciales de N-cyclohexylsulfamate de sodium déclarées au Canada dans le cadre d’une enquête menée conformément à l’article 71 de la LCPE 1999 (Environnement Canada 2013). Les absorptions journalières totales de N-cyclohexylsulfamate de sodium dues à l’air ambiant, à l’air intérieur, au sol et à la poussière ont été estimées et conduisent à une exposition jugée négligeable.
Le N-cyclohexylsulfamate de sodium a été détecté sous forme d’anion N‑cyclohexylsulfamate dans l’eau potable et des eaux de surface au Canada. Les concentrations d’anion N-cyclohexylsulfamates dans l’eau sont des estimations des niveaux de N-cyclohexylsulfamate de sodium dissocié dans l’eau. Toutefois, ces concentrations peuvent également comprendre des anions N-cyclohexylsulfamates d’autres sels, comme le N-cyclohexylsulfamate de calcium.
En 2011, du N-cyclohexylsulfamate a été mesuré à des concentrations allant de 0,09 à 4,1 µg/L, avec une valeur médiane de 0,17 µg/L, dans des échantillons d’eaux souterraines (fréquence de détection de 8 %) prélevés dans 59 puits domestiques situés dans la partie sud du bassin de la rivière Nottawasaga en Ontario (Spoelstra et al. 2017). Spoelstra et al. (2013) ont également mesuré du N-cyclohexylsulfamate à une concentration moyenne de 0,2 µg/L et une concentration maximale de 0,88 µg/L dans 57 échantillons d’eaux de surface prélevés dans le bassin versant de la rivière Grand en Ontario entre 2007 et 2009. La concentration maximale de N-cyclohexylsulfamate au Canada rapportée par Spoelstra et al (2017) (4,1 µg/L) a été retenue pour caractériser l’exposition au N-cyclohexylsulfamate de sodium due à l’eau potable. L’absorption journalière de N-cyclohexylsulfamate de sodium la plus importante due à l’eau potable est estimé à 5,4 x 10-4 mg/kg pc/jour chez des nourrissons de 0 à 5 mois nourris au lait maternisé (annexe B).
Le N-cyclohexylsulfamate de sodium (basé sur les niveaux d’anions du N‑cyclohexylsulfamate) a été mesuré dans l’air ambiant, le sol, la poussière et les eaux de surface dans d’autres pays (Gan et al. 2014, Berset et al. 2012, Scheurer et al. 2009, Arbeláez et al. 2015, Lange et al. 2012, Sang et al. 2014, Tran et al. 2014, Watanabe et al. 2016, Gan et al. 2013, Edwards et al. 2017, Yang et al. 2018). Ces mesures ne devraient pas être représentatives des concentrations dans l’environnement canadien en raison de différences entre les activités de production et les conditions environnementales.
Cyclohexanamine dans les milieux de l’environnement
La cyclohexanamine devrait être présente sous forme de cation protoné dans l’environnement, comme l’indique son pKa. Par conséquent, son adsorption aux sols et aux sols en suspension dans l’eau est probable (PhysProp c2013). La cyclohexanamine est associée à une pression de vapeur élevée et sera présente sous forme de vapeur dans l’atmosphère si elle est rejetée dans l’air (PhysProp c2013). La cyclohexanamine devrait exister sous forme cationique dans les eaux de surface, et sa volatilisation à partir de la surface de ces eaux ne devrait pas avoir lieu étant donné que sa forme cationique ne devrait pas être volatile. Toutefois, la cyclohexanamine peut se volatiliser à partir des surfaces sèches du sol étant donné sa pression de vapeur (HSDB 2005).
Aucune concentration de cyclohexanamine mesurée dans l’air, le sol ou la poussière n’a été identifiée au Canada. Les concentrations ont été modélisées dans ces matrices environnementales à l’aide de ChemCAN (2003) et d’après les quantités commerciales de cyclohexanamine déclarées au Canada en vertu de l’article 71 (Environnement Canada 2013). Les absorptions journalières totales estimées de cyclohexanamine dues à l’air ambiant, l’air intérieur, le sol et la poussière ont résulté en une exposition jugée négligeable.
Aucune donnée canadienne sur les concentrations de cyclohexanamine dans l’eau potable ou les eaux de surface n’a été identifiée. Les concentrations estimées dans les eaux de surface ont été calculées à l’aide du Cahier de travail pour l’eau potable de l’Unité d’évaluation environnementale (UEE) du Bureau d’évaluation et du contrôle des substances nouvelles (BECSN) en utilisant le scénario de rejet industriel (Santé Canada, modèle interne non publié; voir le tableau B-1 de l’annexe B pour plus de détails). La concentration environnementale prédite au 50ème percentile était de 13 µg/L, ce qui conduit à une absorption journalière prudente de 1,7 x 10-3 mg/kg pc pour des nourrissons âgés de 0 à 5 mois nourris au lait maternisé.
N-Cyclohexylsulfamate de sodium dans les aliments
Les données sur la consommation alimentaire provenant de l’Enquête sur la santé dans les collectivités canadiennes (ESCC) (Statistique Canada 2015) et d’une enquête nationale de rappel de 24 heures sur les aliments ont servi à évaluer l’exposition de la population générale au N-cyclohexylsulfamate de sodium. Plus de 20 000 répondants ont été interrogés lors du premier rappel de 24 heures, et environ un tiers d’entre eux ont été interrogés un deuxième jour non consécutif afin de fournir un moyen de mesurer la variabilité quotidienne de la consommation, qui est nécessaire pour calculer la consommation habituelle.
Les répondants comprenaient des enfants, des personnes atteintes et non atteintes de diabète, ainsi que des femmes enceintes et allaitantes. Environ 2 % des adultes interrogés d’un âge médian de 62 ans ont déclaré consommer des édulcorants de table contenant du N-cyclohexylsulfamate de sodium. Aucun individu âgé de moins de 19 ans ni aucune femme enceinte (n=114) n’a déclaré avoir consommé du N‑cyclohexylsulfamate de sodium. Une seule des 187 femmes allaitantes interrogées a déclaré consommer des édulcorants de table contenant du N-cyclohexylsulfamate. Par conséquent, les expositions alimentaires quotidiennes ont été estimées seulement pour les consommateurs adultes de 19 ans et plus qui ont déclaré avoir consommé des édulcorants de table à base de N-cyclohexylsulfamate de sodium pendant au moins une journée au cours du sondage ESCC.
L’évaluation a été faite en assumant une teneur 32 % en N‑cyclohexylsulfamate de sodium dans l’édulcorant de table. Cette valeur a été basée sur les teneurs des trois marques d’édulcorant les plus couramment utilisées contenant de 30 % à 34 % de N‑cyclohexylsulfamate de sodium (communication personnelle, courriel de la DA de SC au BERSE de SC, 9 novembre 2018). Comme la dose journalière admissible (DJA) de Santé Canada associée à ce composé est définie sur une base d’acide N‑cyclohexylsulfamique, la quantité de N-cyclohexylsulfamate de sodium a été convertie en une quantité d’acide N‑cyclohexylsulfamique à partir de leurs poids moléculaires respectifs.
L’exposition alimentaire à l’acide N‑cyclohexylsulfamique n’a été estimée que pour les « consommateurs », en multipliant la concentration de N-cyclohexylsulfamate de sodium (32 %) par la quantité d’édulcorants consommés par chacun des répondants (communication personnelle, courriel de la DA de SC au BERSE de HC, 2 novembre 2018; non référencé) et en appliquant ensuite le rapport des poids moléculaires pour convertir cette concentration en acide N‑cyclohexylsulfamique. Cela a permis d’obtenir une distribution complète des expositions estimées à l’acide N‑cyclohexylsulfamique pour chacune des sous-populations ciblées. Un ajustement des « apports usuels » a ensuite été fait afin de produire des expositions estimées qui reflètent mieux l’exposition alimentaire typique à long terme à l’acide N‑cyclohexylsulfamique. Des détails sur les paramètres utilisés et la méthode d’ajustement se trouvent à l’annexe C.
Les estimations moyennes et au 90ème percentile pour les consommateurs et l’exposition alimentaire usuelle au N-cyclohexylsulfamate de sodium (en tant qu’acide N‑cyclohexylsulfamique) sont présentées au tableau 6‑1. L’exposition usuelle a été estimée pour la population générale (y compris les personnes atteintes de diabète) et pour les personnes atteintes de diabète en tant que sous-population dont la consommation d’édulcorants de table est supposée être plus élevée. En général, les femmes consommaient environ 19 à 22 % plus de N-cyclohexylsulfamate que les hommes sur la base du poids corporel.
| Population | Exposition alimentaire moyenne des hommes (mg/kg pc/jour) | Exposition alimentaire moyenne des femmes (mg/kg pc/jour) | Exposition alimentaire des hommes au 90e percentile (mg/kg pc/jour) | Exposition alimentaire des femmes au 90e percentile (mg/kg pc/jour) |
|---|---|---|---|---|
| Population générale (adultes de 19 ans et plus) | 6,53 | 8,00 | 12,63 | 14,98 |
| Population atteinte de diabète (adultes de 19 ans et plus) | 6,28 | 7,67 | 12,15 | 14,57 |
Pour la population générale de 19 ans et plus, 2,14 % des répondants ont déclaré avoir consommé du N-cyclohexylsulfamate le jour du rappel ou l’autre. Parmi la sous‑population des répondants diabétiques, 9,68 % ont déclaré consommé du N‑cyclohexylsulfamate. Toutefois, les expositions habituelles estimées des personnes atteintes de diabète étaient quantitativement similaires ou légèrement inférieures à celles de la population générale, suggérant que même si un plus grand nombre de personnes atteintes de diabète peuvent consommer du N-cyclohexylsulfamate, la quantité qu’elles consomment par jour n’est pas plus élevée.
Cyclohexanamine dans les aliments
Au Canada, de la cyclohexanamine peut être présente dans certains matériaux d’emballage alimentaire en raison de son utilisation comme composant dans la couche externe de tubes (à une concentration maximale de 25 ppm) destinés au transfert de boissons et dans la couche n’entrant pas en contact avec les aliments de papier/carton devant entrer en contact avec les boissons. Il n’y a aucun risque de contact direct avec les aliments associé à ces utilisations puisque la cyclohexanamine est présente en tant qu’impureté dans la couche externe de ces tubes et que dans le papier/carton un revêtement de polyéthylène agit comme barrière contre le contact direct avec les aliments (Communication personnelle, courriel de DC de SC au BERSE de HC, 10 janvier 2017; non référencé).
Au Canada, de la cyclohexanamine peut également être présente à titre d’additif indirect en raison de son utilisation comme additif dans l’eau des chaudières (AEC) d’installations alimentaires. La concentration maximale de cyclohexanamine permise dans les systèmes d’eau de chaudière est de 10 ppm dans la vapeur. L’utilisation de la vapeur traitée à la cyclohexanamine pour la transformation du lait et de produits laitiers n’est pas acceptable. Santé Canada n’avait aucune objection quant à l’utilisation de mélanges de produits chimiques d’usage restreint, y compris la cyclohexanamine en tant qu’AEC, pourvu que la concentration totale en amine de la vapeur ne dépasse pas 25 ppm (Santé Canada 2010). Cette utilisation entraîne un contact direct avec les aliments avec une dose quotidienne probable de 5,7 µg/kg pc/jour pour les adultes (communication personnelle, courriel de la DA de SC au BERSE de SC, 10 janvier 2017; non référencé).
6.1.2 Produits disponibles pour les consommateurs
N-Cyclohexylsulfamate de sodium
L’exposition potentielle au N-cyclohexylsulfamate de sodium due à l’utilisation de produits de santé naturels et de drogues a été estimée en faisant des hypothèses prudentes dont les détails sont présentés à l’annexe D. Les estimations pour des scénarios entraînant le niveau le plus élevé d’exposition potentielle par voie orale, cutanée ou respiratoire (appelés scénarios sentinelles) pour les groupes d’âge pertinents sont présentées dans le tableau 6‑2.
| Durée et voie d’exposition | Scénario pour le produit | Groupe d’âge | Concentration maximale | Exposition estimée (mg/kg pc/jour) |
|---|---|---|---|---|
| Quotidienne orale | Supplément de calcium en siropa | Adultes (19 ans et plus) | 70 mg/dose (1,4 %) | 2,84 |
| Quotidienne orale | Vitamine Da | Tout-petits (1 an) | 1,5 % | 1,36 |
| Quotidienne buccale | Rince-bouche | Adolescents (14 à18 ans) | 0,5 % | 0,69 |
| Quotidienne respiratoire | Solution respiratoire pour le traitement des bronchospasmesb, c, d | Enfants (5 à 8 ans) | 3 mg/dose | 0,034 |
| Intermittente orale | Sirop pour soulager la congestion thoracique b | Enfants (12 à13 ans) | 1,5 % | 14,3 |
| Intermittente Buccale | Solution anesthésique buccaleb | Tout-petits (2-3 ans) | 2 % | 7,2 |
| Intermittente cutanée | Solution anesthésique topique pour le soulagement de la douleur cutanéeb | Enfants (3-8 ans) | 2 % | 0,38 |
a Communication personnelle, courriels de la DPSNH de SC au BERSE de SC, 3 mai au 18 septembre 2018; non référencé.
b Communication personnelle, courriels de la DPT de SC au BERSE de SC, 3 mai au 17 septembre 2018; non référencé.
c Les expositions estimées par inhalation indiquées ici indiquent la dose interne le jour de l’exposition (mg/kg pc/jour) calculée à l’aide de ConsExpo Web (2018) et des paramètres décrits à l’annexe D. La dose interne a été choisie pour comparaison avec les paramètres de danger par voie orale.
d Solution respiratoire pour le traitement des bronchospasmes sévères associés à des exacerbations de la bronchite chronique et de l’asthme bronchique. Une solution préparée est administrée à l’aide d’un respirateur ou d’un nébuliseur.
Cyclohexanamine
Au Canada, de la cyclohexanamine est présente dans des laques pour cheveux en aérosol à des concentrations allant jusqu’à 0,3 % (communication personnelle, courriels de la DSPC de SC au BERSE de SC, 8 et 14 décembre 2016; non référencé). Elle est également présente dans des cartouches de gel combustible pour foyer à une concentration maximale de 0,3 % (FS 2018). Les estimations de l’exposition par inhalation et par voie cutanée due à des laques pour cheveux en aérosol et celles de l’exposition par inhalation due à des cartouches de gel combustible pour foyer ont été calculées au moyen de ConsExpo Web (2018). Les estimations pour les scénarios entraînant le niveau d’exposition potentielle le plus élevé (appelés scénarios sentinelles) pour les groupes d’âge pertinents sont présentées au tableau 6‑3. Les détails sont présentés à l’annexe D.
| Scénario pour le produit (groupe d’âge) | Concentration maximale | Exposition par inhalation (mg/kg pc/jour)b | Exposition cutanée (mg/kg pc/jour)c | Exposition estimée (mg/kg pc/jour)j |
|---|---|---|---|---|
| Utilisation quotidienne de la laque pour cheveux en aérosol (adultes, 19 ans et plus)a | 0,3 % | 0,00075 | 0,013 | 0,014 |
| Utilisation occasionnelle de la laque pour cheveux en aérosol (enfants 4 à 8 ans)a | 0,3 % | 0,0011 | 0,016 | 0,017 |
| Utilisation occasionnelle de cartouches de gel combustible pour foyer (tout‑petits, 1 an)e, f | 0,3 % | 3 | S.O. | S.O |
Abréviation : s.o. - sans objet
a Communication personnelle, courriel de la PCDS de SC au BERSE de SC, 14 décembre 2016; non référencé.
b Les estimations de l’exposition par inhalation indiquées ici indiquent la dose interne le jour de l’exposition (mg/kg pc/jour) calculée à l’aide de ConsExpo Web (2018) et des paramètres décrits à l’annexe D. La dose interne a été choisie pour comparaison avec les paramètres de danger par voie orale.
c L’exposition cutanée a été calculée en tant que dose (mg/kg pc/j) en utilisant les paramètres décrits à l’annexe D.
d Dose combinée (mg/kg pc/jour) pour exposition cutanée et respiratoire.
e FS (2018).
f Lorsque ce produit est utilisé à l’intérieur (p. ex. par un adulte), les tout-petits peuvent être exposés à la cyclohexanamine libérée dans l’air intérieur.
Bien que l’exposition par voie cutanée et l’exposition par inhalation devraient se produire lors de l’utilisation de la laque pour cheveux, la pression de vapeur élevée de la cyclohexanamine peut entraîner une courte période de rétention sur la peau. La prise en compte de l’exposition par inhalation et par voie cutanée est donc une approche prudente.
6.2 Évaluation des effets sur la santé
Le N-cyclohexylsulfamate de sodium en association avec le N-cyclohexylsulfamate et ses sels a été examiné par le Comité scientifique européen de l’alimentation humaine (CSAH 2000), le JECFA (1970, 1982) et la FDA (1980). Les N-cyclohexylsulfamates et leurs sels, y compris le N-cyclohexylsulfamate de sodium, ne sont pas classables au niveau de leur cancérogénicité chez les humains (groupe 3 ; données insuffisantes chez les humains et données insuffisantes chez les animaux) (CIRC 1999). Les renseignements tirés de ces examens et de la littérature supplémentaire ont été pris en compte pour la présente évaluation.
L’étude de la cyclohexanamine en tant que métabolite du N-cyclohexylsulfamate et de ses sels a également été documentée dans ces documents. La cyclohexanamine a également été évaluée par l’Union européenne (ECHA 2017) et l’EPA (1988). La Commission européenne classe la cyclohexanamine en tant que substance toxique pour la reproduction (Repr 2) (UE 2008).
Il existe un nombre limité d’études sur le N-cyclohexylsulfamate de sodium. Les données sur la cyclohexanamine, le principal métabolite chez les humains qui peuvent convertir le N-cyclohexylsulfamate de sodium en cyclohexanamine (Bopp et al. 1986), et sur le chlorhydrate de cyclohexanamine (cyclohexanamine.HCl) ont été utilisées pour étayer l’évaluation des effets du N-cyclohexylsulfamate de sodium et de la cyclohexanamine sur la santé.
Toxicocinétique du N-cyclohexylsulfamate de sodium
La toxicocinétique du N-cyclohexylsulfamate de sodium a été étudiée par Bopp et al (1986). Lorsque du N-cyclohexylsulfamate de sodium était administré par voie orale à des humains, les concentrations plasmatiques maximales sont apparues entre 6 et 8 heures suivant l’administration. La demi-vie a été établie à 8 heures, ce qui correspond aux demi-vies respectives de 6,6 et 8,8 heures déterminées chez le rat et le chien. Selon des renseignements non publiés soumis à SC, chez l’humain, 37 % de la quantité de N-cyclohexylsulfamates ingérée est absorbée par les voies gastro-intestinales, laissant 63 % non absorbé (communication personnelle, courriel de la DA de SC au BERSE de HC, 20 novembre 2018; non référencé). L’absorption du N‑cyclohexylsulfamate par les voies gastro-intestinales est similaire chez le rat et le chien (33 à 40 %) et est supérieure chez les singes (62 à 66 %) (Parekh et al. 1970 ; Bopp et al. 1986).
L’administration de N-cyclohexylsulfamate de sodium par voie orale à des rats et des chiens a mis en évidence que le N-cyclohexylsulfamate se distribue dans la plupart des tissus de l’organisme, les concentrations les plus élevées étant mesurées dans les reins et les plus faibles dans le cerveau. Le N-cyclohexylsulfamate peut également traverser le placenta et pénétrer dans les fœtus des rats, des singes et des humains. Il a également été trouvé dans le lait de rats, de chiens et de porcs (Bopp et al. 1986).
L’administration orale ou sous-cutanée de N-cyclohexylsulfamate de sodium conduit à la présence de N-cyclohexylsulfamate dans l’environnement gastro-intestinal du porc (Collings 1989), ce qui suggère que le N-cyclohexylsulfamate de sodium se dissocie en N-cyclohexylsulfamate dans les voies gastro-intestinales des mammifères. Le N‑cyclohexylsulfamate présent dans les voies gastro-intestinales des mammifères peut ensuite être biotransformé microbiologiquement par une enzyme bactérienne, la sulfamatase, par hydrolyse du N-cyclohexylsulfamate en cyclohexanamine (Bopp et al. 1986). Selon plusieurs études publiées, la plupart des humains étaient incapables de convertir le N-cyclohexylsulfamate en cyclohexanamine. Environ 10 à 30 % des plus de 1000 sujets humains étudiés ont pu convertir de 0,1 à 8 % du N-cyclohexylsulfamate en cyclohexanamine, une minorité d’entre eux en convertissant jusqu’à 60 % (CIRC 1980). De même, lors d’une étude limitée par voie alimentaire avec des singes, la plupart des quelques singes testés n’ont pas converti le N-cyclohexylsulfamate en cyclohexanamine après 12 ans d’administration alimentaire répétée, une minorité en convertissant jusqu’à 1 % (Thorgeirsson et al. 1994). Par contre, lors de plusieurs études par voie orale (alimentation, gavage, eau potable), la plupart des rats (jusqu’à 92 %) ont converti jusqu’à 35 % du N-cyclohexylsulfamate en cyclohexanamine, ce qui est proche des 30 % observés chez les humains (Wallace et al. 1970, Renwick et Williams 1972a, Bickel et al. 1974, Bopp et al. 1986). Chez les humains qui peuvent convertir le N-cyclohexylsulfamate en cyclohexanamine, la cyclohexanamine est le principal métabolite (Bopp et al. 1986).
Individuellement, l’absence de conversion chez l’humain demeure généralement inchangée (Renwick et al. 2004), mais les taux de conversion pourraient augmenter avec l’absorption répétée de N-cyclohexylsulfamate ou diminuer avec l’arrêt de l’absorption (Buss et al. 1992, Renwick et al. 2004). Dans l’ensemble, le JECFA (1982) a estimé à 30 % le taux de formation de la cyclohexanamine par biotransformation microbienne du N-cyclohexylsulfamate dans les voies gastro-intestinales de toutes les espèces de mammifères étudiées, y compris les humains (CIRC 1999, SCF 1985 cité dans SCF 2000). Malgré l’écart entre les taux de conversion du N-cyclohexylsulfamate en cyclohexanamine parmi les différentes espèces, l’estimation de la conversion complète de tous les N-cyclohexylsulfamates absorbés en cyclohexanamine est une hypothèse prudente. Si chez les humains, il est assumé que 63 % du N‑cyclohexylsulfamate de sodium n’est pas absorbé par le système gastro-intestinal, 63 % du N-cyclohexylsulfamate dissocié peut être converti à 30 % en cyclohexanamine (SCF 1985 cité dans SCF 2000, Baines et DiNovi 2010), et donc jusqu’à 19 % de la dose absorbée de N-cyclohexylsulfamate de sodium peut être convertie en cyclohexanamine.
Chez les animaux de laboratoire ayant reçu du N-cyclohexylsulfamate de sodium par voie orale, le N-cyclohexylsulfamate absorbé par les voies gastro-intestinales est excrété principalement dans l’urine, et moins de 1 % est sécrété dans la bile des rats et des chiens (Bopp et al. 1986). Vingt-quatre hommes ayant absorbé entre 70,5 et 226 mg/kg pc/jour de N-cyclohexylsulfamate de sodium (capsules administrées avec les repas 3 fois par jour) pendant 30,4 semaines ont présenté un grand écart parmi leurs taux individuels d’excrétion urinaire de la cyclohexanamine, avec une moyenne de 17,2 % (0,25 à 75,4 %). Les analyses faites sur un sujet ayant reçu 141 mg/kg pc/jour pendant l’étude ont mis en évidence un taux d’excrétion urinaire de cyclohexanamine variant de 0,21 à 19 %, sans relation constante entre l’excrétion de cyclohexanamine et le N-cyclohexylsulfamate (Wills et al. 1981). Cela peut indiquer que la conversion du N‑yclohexylsulfamate de sodium en cyclohexanamine varie d’un humain à l’autre et chez le même individu, et appuie le taux estimé de 19 % comme portion de la dose absorbée de N-cyclohexylsulfamate de sodium qui peut être convertie en cyclohexanamine chez les humains.
Toxicocinétique de la cyclohexanamine
Lorsque de la cyclohexanamine est administrée par voie orale à des humains, des rats et des chiens, les concentrations sanguines et plasmatiques maximales apparaissent entre 1 et 2 heures suivant l’administration et la demi-vie se situe entre 3 et 5 heures (ECHA 2017). Après administration d’une dose unique de cyclohexanamine radiomarquée par voie orale, la plus grande partie du composé parent a été excrétée inchangée dans l’urine des animaux (90 % ou plus) et des humains (86 à 95 %) (Bopp et al. 1986, Renwick et Williams 1972b, Eichelbaum et al. 1974, ECHA 2017).
Lorsque de la cyclohexanamine est administrée par voie orale à des rats, les concentrations les plus élevées se retrouvent dans les poumons, la rate, le foie, les glandes surrénales, le cœur, les voies gastro-intestinales et les reins (rapport non publié cité dans Bopp et al. 1986 et ECHA 2017).
Dans le rein du rat, la cyclohexanamine est métabolisée principalement par hydroxylation du cycle cyclohexane, et dans le rein humain elle est métabolisée par désamination. Dans les deux cas, la cyclohexanamine forme des métabolites secondaires, dont la cyclohexanone, le cyclohexanol, le trans-cyclohexane-1,2-diol et la N-hydroxycyclohexanamine (Gaunt et al. 1974, Golberg et al. 1969, CIRC 1999). Il a été montré que la cyclohexanamine diffuse à travers la membrane placentaire chez des singes enceintes et des femmes ayant reçu une dose intraveineuse de cyclohexanamine (ECHA 2017, Pitkin et al. 1969, Pitkin et al. 1970). Par conséquent, le fœtus en développement peut être exposé à la cyclohexanamine maternelle chez les femmes enceintes qui peuvent convertir le N-cyclohexylsulfamate en cyclohexanamine.
La cyclohexanamine est excrétée dans l’urine sous une forme essentiellement inchangée (CIRC 1999). Les métabolites de la cyclohexanamine sont également excrétés dans l’urine (Golberg et al. 1969, CIRC 1999, Renwick et Williams 1972b, Gaunt et al. 1974).
Études des effets du N-cyclohexylsulfamate de sodium sur la santé
Lors d’une étude de deux ans sur la toxicité chronique et la cancérogénicité, bien qu’une augmentation des carcinomes papillaires dans la vessie a été observée chez des rats ayant reçu 2500 mg/kg pc/jour de mélange 10/1 de N-cyclohexylsulfamate de sodium et de saccharine sodique (Oser et al. 1975), le rôle du N-cyclohexylsulfamate de sodium n’était pas clair en raison de l’utilisation de ce mélange et ce type de tumeur a été jugé toxicologiquement non pertinent pour des humains (NTP 2016).
Dans le cadre d’une étude portant sur toute la vie, des singes (cynomolgus, rhésus et vert d’Afrique) ont reçu du N-cyclohexylsulfamate de sodium dans un mélange de vitamines appliqué dans des sandwichs à des doses de 0, 100 ou 500 mg/kg pc/jour (rapport mâles/femelles de 11/5, 5/5, 8/3) cinq fois par semaine entre les jours suivant leur naissance et l’âge de 24 ans. Chez les femelles, aucun effet lié au traitement n’a été observé à aucune des doses. La plupart des singes traités sont morts au cours des 10 dernières années de l’étude en raison de circonstances non liées au traitement. Après 23 ans (deux ans après la durée de vie moyenne de 21,3 ans chez les singes témoins), des effets sur les testicules ont été observés chez 2 mâles sur 5 ayant reçu des doses de 500 mg/kg pc/jour (aplasie germinale focalisée ou tubules spécifique aux cellules de Sertoli chez les deux singes accompagnés de zones présentant une spermatogenèse normale et inflammation chronique des testicules chez l’un d’entre eux). À 12 ans, qui est considéré l’âge de procréation chez les singes, les mesures de la taille et de la morphologie des testicules, l’analyse du sperme et les taux sériques de testostérone et de gonadotrophine n’ont montré aucune différence entre les singes traités et les singes témoins (tel que rapporté dans Thorgeirsson et al., 1994). De plus, les biopsies testiculaires à 12 ans n’ont montré aucune différence histologique entre les singes traités et les singes témoins (Takayama et al. 2000). Malheureusement, l’analyse détaillée des effets sur les testicules n’a été effectuée qu’en fin de vie. Les auteurs de l’étude n’ont pas attribué ces effets au N-cyclohexylsulfamate seul, mais n’ont pas exclu un rôle de la cyclohexanamine basé sur la corrélation entre les concentrations de cyclohexanamine dans le plasma, les testicules et l’urine plus élevées et les effets sur les testicules chez un singe (les niveaux de cyclohexanamine n’ont pas été mesurés chez l’autre singe présentant le même effet). Aucune preuve de cancérogénicité n’a été relevée chez l’un ni l’autre sexe lors des nécropsies complètes et des analyses histopathologiques des principaux organes et tissus (Takayama et al. 2000). Bien que cette étude ait mis en évidence des effets pertinents du N‑cyclohexylsulfamate de sodium sur les testicules, elle n’a pas été retenue comme étude critique en raison de facteurs de confusion, incluant le nombre limité d’animaux, l’analyse limitée des effets sur les testicules à 12 ans, et une infection à varicelle d’une durée d’1 an (selon Thorgeirsson et al. 1994), causant 2 décès.
Les résultats d’études de génotoxicité in vitro avec le N-cyclohexylsulfamate de sodium étaient mitigés. Un essai de mutation génétique à médiation par hôte utilisant le Salmonella (S.) Typhimurium (souris injectée avec avec S. typhimurium par voie intrapéritonéale ont été exposées au N-cyclohexylsulfamate de sodium par injection sous-cutanée) a donné de résultats négatifs. Des études de clastogénicité sur les cellules pulmonaires menées chez le hamster chinois, et des essais d’aberrations chromosomiques de fibroblastes de la peau humaine ont donné des résultats positifs. Des essais de clastogénicité sur des lymphocytes humains ont donné des résultats équivoques. Des tests de dégradation/réparation de l’ADN ont donné des résultats positifs lors d’une étude de transformation cellulaire utilisant des cellules de vessie de rat (CIRC 1999). Toutefois, des résultats négatifs ont été obtenus lors d’un essai de dégradation/réparation d’ADN sur des hépatocytes de rat (Jeffrey et William 2000 cité dans HSDB 2012). Une analyse des comètes effectuée sur des lignées de cellules cancéreuses du côlon humain et des cellules rénales embryonnaires humaines a révélé des dommages minimes, voire inexistants, à l’ADN (van Eyk 2015).
Cependant, toutes les études de génotoxicité in vivo avec du N-cyclohexylsulfamate de sodium ont donné des résultats négatifs. Des études de mutation in vivo ont donné des résultats négatifs chez des hamsters et des souris chinois (CIRC 1999). HSDB (2012) a également rapporté une absence d’aberration chromosomique établie lors d’une étude in vivo sur des hamsters chinois. Chez des humains ayant reçu 70 mg/kg pc/jour de N‑cyclohexylsulfamate de sodium par voie orale pendant 4 jours, les lymphocytes périphériques du sang n’ont présenté aucune aberration chromosomique (CIRC 1999).
Lors d’une étude limitée de toxicité pour la reproduction sur plusieurs générations, des rats (12 femelles et 6 mâles/groupe) ont reçu 0 ou 3 % de N-cyclohexylsulfamate de sodium dans leur alimentation, soit 0 ou 1500 mg/kg pc/jour. Les adultes F2 ont été accouplés à deux reprises, les mères ont accouché après le premier accouplement, mais elles ont été sacrifiées avant l’accouchement après le deuxième accouplement (Ferrando et Huchet 1968). La fertilité n’a pas été affectée lors cette étude sur deux générations. Après le premier accouplement F2, il y a eu une diminution du nombre de petits F2 survivants au 10e jour postnatal et au sevrage (2 contre 14 dans le groupe témoin). Cela peut être dû à la dose excessive administrée aux animaux. Aucun effet sur le développement n’a été noté après le deuxième accouplement. Cependant, les mâles F2 traités présentaient une diminution du poids corporel et une dégénérescence testiculaire (4 mâles sur 6). Les deux mâles F3 survivants (1500 mg/kg pc/jour) présentaient une atrophie testiculaire (âge au sacrifice non rapporté). Dans deux autres groupes de dose, le N-cyclohexylsulfamate de sodium a été administré dans l’eau potable à des doses de 0,8 ou 1,6 %, mais les effets dans ces groupes n’ont pas été pris en compte en raison d’incohérences dans le protocole posologique (il n’est pas connu si l’eau potable traitée et non traitée étaient administrées séparément ou simultanément) (JECFA 1970, Bopp et al. 1986, HSDB 2012). Il n’a pas été possible d’établir une DSENO dans le cadre de cette étude.
Les études de toxicité pour le développement pour lesquelles des lapins et des rats ont reçu du N-cyclohexylsulfamate de sodium par voie orale à des doses allant jusqu’à 250 mg/kg pc/jour n’ont mis en évidence aucun effet embryotoxique ou tératogène (Bein et al. 1967, Fritz et Hess 1968, US Food and Drug Research Laboratories 1969 cité dans JECFA 1970). D’autres études sur le développement par gavage aigu chez la souris et le rat n’ont pas été utilisées en raison de doses excessives (équivalant à 2150 mg/kg pc et plus) (Tanaka 1964a, 1964b cités dans JECFA 1970, Bopp et al. 1986).
Lors d’une étude menée chez des volontaires humains pendant 30,4 semaines (7 mois), des hommes (âgés de 25 à 39 ans, 8/groupe) ont absorbé des capsules contenant du N-cyclohexylsulfamate de sodium à raison de 0 (vecteur de sucrose), 5, 10 ou 16 g/jour (équivalent à 0, 71, 141 ou 226 mg/kg pc/jour, selon Santé Canada [1994]). La forte dose initiale a été ramenée à un niveau inférieur non spécifié inférieur à 141 mg/kg pc/jour dû à d’une diminution du dosage pendant la période de l’étude en raison d’une diarrhée persistante. Des selles molles (diarrhée persistante) sont apparues au cours des deux premières semaines chez 2 hommes sur 8 ayant reçu 141 mg/kg pc/jour et chez 7 hommes sur 8 ayant reçu 226 mg/kg pc/jour. Les paramètres hématologiques et de chimie clinique, ainsi que les paramètres du sperme (concentration et motilité dans le sperme mesurées toutes les deux semaines) n’ont pas été affectés lors de cette étude (Wills et al. 1981).
Lors d’une autre étude menée chez des volontaires humains, limitée par la déclaration volontaire de l’apport alimentaire (non mesuré), il a été suggéré que les paramètres du sperme et la fertilité n’étaient pas corrélés à l’absoeprtion de N-cyclohexylsulfamate, établie en se basant sur l’excrétion urinaire de la cyclohexanamine (Serra-Majem et al. 2003).
Aucune étude portant sur les effets d’exposition par voie cutanée ou par inhalation n’a été identifiée.
Globalement, des effets sur les testicules ont été identifiés lors d’une étude limitée de 24 ans chez le singe après l’administration de doses quotidiennes répétées de 500 mg/kg pc/jour sur une durée dépassant la durée moyenne de vie. Ils ont également été identifiés lors d’une étude limitée sur la reproduction chez la deuxième génération à 1500 mg/kg pc/jour, cette dernière suggérant que la fertilité ne serait pas affectée pendant deux générations. De plus, sur la base d’une étude de 7 mois menée chez des volontaires humains au cours de laquelle une diarrhée persistante commençait dans les deux premières semaines de consommation quotidienne de 141 mg/kg pc/jour, il est jugé improbable que des humains consommeraient continuellement de quantités quotidiennes plus importantes de N-cyclohexylsulfamate de sodium pendant une durée relativement prolongée pour provoquer ces changements. Les études limitées sur le N‑cyclohexylsulfamate de sodium administré par voie orale suggèrent qu’il ne devrait pas être génotoxique ni cancérogène.
Études des effets de la cyclohexanamine sur la santé
Au cours d’une étude spécialisée de 13 semaines par voie alimentaire portant spécifiquement sur les effets testiculaires, des rats Sprague-Dawley (100 mâles/groupe) ont reçu des doses de 0, 68,5, 137, 274 ou 411 mg/kg p.c./jour de cyclohexanamine HCL dans leur alimentation équivalent à 0, 50, 100, 200 ou 300 mg/kg pc/jour (Brune et al. 1978 [rapport non publié], cité dans Bopp et al. 1986). Deux groupes témoins ont été inclus : ad libitum et nourris ensemble. Les groupes témoins nourris ensemble ont été inclus pour aider à séparer les effets testiculaires des effets sur le poids corporel. À la fin de l’étude, le poids corporel des rats mâles de tous les groupes traités par la cyclohexanamine était significativement plus faible que celui des animaux témoins ad libitum. Au cours des 14 premiers jours de l’étude, une diminution du gain de poids corporel a été observée dans les groupes recevant 200 et 300 mg/kg pc/jour comparativement aux groupes nourris ensemble. Toutefois, chez le groupe recevant 300 mg/kg, cette diminution a continué pendant toute la durée de l’étude. Les chercheurs ont effectué une analyse détaillée des résultats testiculaires de tous les animaux de l’étude. Ces résultats ont indiqué des signes histopathologiques dans les testicules (changements dégénératifs dans les tubules, formation de cellules géantes, atrophie testiculaire chez certains animaux), dont les changements tubulaires étaient statistiquement significatifs chez les groupes recevant des doses de 200 et 300 mg/kg pc/jour comparativement aux groupes témoins nourris à volonté et ensemble. Le poids des testicules dans les groupes recevant 200 et 300 mg/kg pc/jour était également significativement plus faible que dans le groupe témoin nourri à volonté. Toutefois, comparativement au groupe témoin nourri ensemble, un effet significatif a été observé seulement à la dose la plus élevée. Les auteurs de l’étude ont établi une dose sans effet nocif observé (DSENO) de 100 mg/kg pc/jour sur la base des effets testiculaires observés à des doses plus élevées. Santé Canada retient cette DSENO à l’issue de l’examen du rapport original non publié. Aucune autre mesure de toxicité n’a été réalisée dans le cadre de cette étude.
Lors d’une autre étude de 13 semaines par voie alimentaire portant spécifiquement sur l’examen détaillé des effets testiculaires, des doses de 0 ou 400 mg/kg pc/jour de cyclohexanamine HCl ont été administrées à des rats Wistar mâles (15 traités et 10 témoins) pendant 1, 3, 7, 9 ou 13 semaines. Aucun témoin dans cette étude n’a été nourri ensemble (Creasy et al., 1990). Pendant toute la durée de l’étude, la consommation d’aliments et le poids corporel ont diminué. L’analyse histologique ultérieure n’a révélé aucun effet testiculaire après la semaine 1, mais pendant le reste de l’étude, les auteurs ont observé des lésions graduelles et persistantes du tissu testiculaire à la dose de 400 mg/kg pc/jour. Après 3 semaines, 4 mâles sur 15 ont présenté une vacuolisation du cytoplasme des cellules de Sertoli ainsi qu’une perte localisée de spermatocytes et de spermatogonies dans les testicules. Aussi, tous les mâles ont présenté une vacuolisation des cellules de Sertoli. Après 7 semaines et les populations de cellules germinales dans certains tubules ont présenté une dégénérescence et une déplétion légères à modérées. Après 9 semaines, une déplétion des cellules germinales avec perturbation de l’épithélium germinal a été observée dans 75 % des tubules testiculaires. Après 13 semaines, 10 mâles sur 15 présentaient une dégénérescence et une déplétion généralisées des cellules germinales. Dans ce groupe, certains tubules étaient rétrécis par des cellules de Sertoli restant dans la muqueuse alors que certaines spermatides étaient multinucléées et présentaient une morphologie ronde dégénérée. Les auteurs ont également réalisé des cultures de cellules primaires à partir du tissu testiculaire isolé chez des rats Wistar âgés de 28 jours et ont exposé les cellules in vitro à 0, 0,1, 1, 3 ou 10 mM de cyclohexanamine HCl pendant 24, 48 ou 72 heures. L’analyse des cellules au microscope a montré qu’à des doses de 3 mM ou plus la vacuolisation des cellules de Sertoli et des cellules germinales augmentait avec le temps. En se basant sur l’ensemble de ces résultats, les auteurs ont conclu que les effets spermatogoniaux étaient secondaires aux lésions des cellules de Sertoli médiées par la cyclohexanamine (Creasy et al. 1990).
Une autre évaluation du tissu testiculaire a été effectuée par Roberts et al. (1989) chez des souris MF1 et des rats Wistar et agouti sombres (DA) ayant reçu du chlorhydrate de cyclohexanamine à des doses de 0 ou 400 mg de cyclohexanamine/kg pc/jour pendant 3, 7 ou 13 semaines. Le traitement à la cyclohexanamine n’a pas eu d’effet sur la consommation alimentaire, le poids corporel, le poids testiculaire, la morphologie des tissus ou la morphologie des spermatozoïdes des souris. Une diminution significative de la consommation alimentaire et du gain de poids corporel, une diminution du poids testiculaire et une légère dégénérescence et déplétion des cellules germinales ont été observées chez les rats après 3 semaines. Cependant, de 75 à 100 % des tubules séminifères étaient affectés à 13 semaines, alors que 15 rats DA mâles sur 15 ont montré des effets plus étendus (plus grande proportion de tubules affectés) contre 6 sur 15 chez les Wistar. Au cours des 13 semaines, la cyclohexanamine non marquée mesurée dans le plasma et les testicules chez les souris était plus faible que chez les rats (0,5 µg/g dans le plasma des souris contre 6 µg/g ou 3,5 µg/ml chez les rats Wistar ou DA et 6 µg/g dans les testicules des souris contre 40 µg/g ou 30 µg/g chez les rats Wistar ou DA). Creasy et al. (1990), susmentionnés, ont aussi examiné les mêmes rats Wistar de cette étude. Ils ont également effectué des évaluations à 1 et 9 semaines et réalisé une histopathologie détaillée des testicules.
Au cours d’une étude de 13 semaines par voie alimentaire, des rats (15/sexe/groupe) ont reçu une alimentation contenant 0, 600, 2000 ou 6000 ppm de cyclohexanamine HCl pendant 13 semaines, équivalant à 0, 41, 143 ou 468 mg/kg pc/jour (0, 30, 105 ou 342 mg/kg pc/jour de cyclohexanamine) (Gaunt et al. 1974). À des doses égales ou supérieures à 143 mg de cyclohexanamine HCl/kg pc/jour, le gain de poids corporel a été significativement réduit (de 9 à 20 % et de 26 à 34 % mesurés aux doses moyennes et élevées par rapport aux témoins) et accompagné d’une réduction significative de la consommation de nourriture et d’eau. Cet effet était dû en partie à l’alimentation ad libitum, puisque la diminution du gain de poids corporel chez un groupe satellite d’animaux nourris ensemble (5/sexe/témoin et dose élevée seulement) était moins importante (diminution de 14 à 26 % par rapport aux témoins) à la dose élevée. Le seul résultat histologique potentiellement relié au traitement était la réduction de la spermatogenèse et de l’atrophie tubulaire à 143 et 468 mg/kg pc/jour (chez 4 mâles sur 11 et 18 mâles sur 20), qui était accompagnée d’une diminution significative du poids relatif des testicules (0 et 17 %). Dans le groupe nourri ensemble, le poids relatif des testicules a diminué significativement de 49 % à 468 mg/kg pc/jour, mais aucune analyse histopathologique n’a été effectuée chez les animaux nourris ensemble. Les auteurs et l’ECHA (2017) ont établi une DSENO de 41 mg de cyclohexanamine HCl/kg pc/jour (30 mg de cyclohexanamine/kg pc/jour) sur la base des effets sur les testicules observés aux doses plus élevées.
Au cours d’une étude par voie alimentaire de deux ans sur la toxicité chronique et la cancérogénicité, des rats (48/sexe/groupe) ont reçu des aliments contenant 0, 600, 2000 ou 6 000 ppm de cyclohexanamine HCl, équivalant à 0, 24, 82 ou 300 mg/kg pc/jour pour les mâles et 0, 35, 120 ou 400 mg/kg p/jour pour les femelles (0, 18, 60 ou 219 mg/kg/jour de cyclohexanamine chez les mâles et 0, 26, 88 ou 322 mg/kg par jour de cyclohexanamine chez les femelles) (Gaunt et al. 1976). À toutes les doses, des réductions statistiquement significatives du poids corporel ont été observées en proportion à la dose et attribuables à une réduction significative de la consommation d’aliments et d’eau tout au long de l’étude. Chez les femelles, le poids relatif du cerveau et des ovaires a augmenté de façon significative à toutes les doses. Le poids relatif de la thyroïde a également augmenté à toutes les doses (significatif aux doses moyennes et élevées). Chez les mâles le poids relatif du cerveau, a augmenté de façon non significative dans les doses moyenne et élevée, tandis que les concentrations d’albumine sérique ont augmenté de façon significative et proportionnelle à la dose, les concentrations d’urée sérique ont diminué de façon significative et les leucocytes totaux ont diminué de façon significative à toutes les doses. À la dose la plus élevée, les femelles présentaient une légère anémie et une réduction de la production urinaire de concentration normale, tandis que les mâles présentaient des changements testiculaires significativement accrus (atrophie, tubules avec quelques spermatides, dépôts de calcium dans les tubules). Le nombre de « tubules avec quelques spermatides » a également augmenté significativement à la dose moyenne. De plus, une incidence accrue de changements histopathologiques dans les poumons (alvéoles avec macrophages mousseux) a également été observée chez les deux sexes à la dose la plus élevée. L’ECHA (2017) a établi la dose minimale avec effet nocif observé (DMENO) à 18 mg/kg pc/jour sur la base de la diminution du poids corporel et de l’augmentation du poids relatif des ovaires, de la thyroïde et du cerveau chez les femelles. Cependant, la réduction du poids corporel et les changements associés du poids des organes ont été attribués à la diminution de la consommation alimentaire. Aux fins de la présente évaluation, la DSENO tirée de cette étude a été établie à 60 mg/kg pc/jour sur la base de l’augmentation significative de changements testiculaires (atrophie, tubules avec peu de spermatides, dépôts de calcium dans les tubules) à 219 mg cyclohexanamine/kg pc/jour.
Au cours d’une étude par voie alimentaire de 80 semaines, des souris (48 mâles et 50 femelles par dose) ont reçu des doses de 0, 300, 1000 ou 3000 ppm de cyclohexanamine HCl, équivalant à 0, 40, 140 ou 400 mg/kg pc/jour (0, 29, 102 ou 293 mg/kg pc/jour de cyclohexanamine). Aucun effet sur la consommation d’aliments et d’eau, l’hématologie, la mortalité et l’histopathologie des testicules n’a été identifié (Hardy et al. 1976). Aux doses égales ou supérieures à 140 mg/kg pc, une diminution significative du gain de poids corporel a été observée chez les mâles. Les changements histopathologiques statistiquement significatifs et potentiellement liés au traitement étaient une augmentation de l’incidence de vacuolisation/polyploïdie des cellules hépatiques et d’infiltration/dépôt de leucocytes pulmonaires chez les femelles recevant 400 mg/kg pc/jour. Les auteurs ont établi la DSENO à 140 mg/kg pc/jour (102 mg/kg pc/jour de cyclohexanamine) sur la base des effets sur le foie chez les femelles à la dose la plus élevée. L’ECHA (2017) a rapporté la même DSENO, mais a jugé l’information contenues dans le dossier d’enregistrement insuffisante pour établir une DSENO.
Sur la base des renseignements disponibles, l’ECHA (2017) a déterminé qu’il est improbable que la cyclohexanamine soit génotoxique. Dans des conditions in vitro, la cyclohexanamine n’a pas fait augmenter la fréquence des aberrations chromosomiques dans des cellules ovariennes de hamsters chinois ni dans des cellules de moelle osseuse de rats (Brusick et al. 1989, Dick et al. 1974, ECHA 2017), ni n’a fait augmenter les dommages/réparation/synthèse d’ADN dans les hépatocytes des rats (Brusick et al. 1989). Bien que certains résultats des essais in vivo d’aberration chromosomique soient équivoques (dans les ovules, les spermatogonies ou les cellules de moelle osseuse après administration à des hamsters, rats et souris chinois par voie orale ou intrapéritonéale), la plupart des essais avec la cyclohexanamine ont produit des résultats négatifs pour des doses allant de 50 à 68 mg/kg pc (ECHA 2017, JECFA 1982).
Au cours d’une étude de toxicité pour la reproduction d’une durée de 2 ans sur plusieurs générations, des doses de cyclohexanamine HCL équivalentes à 0, 15, 50, 100 ou 150 mg de cyclohexanamine/kg pc/jour ont été administrées par voie alimentaire à des rats (30/sexe/groupe) (Oser et al. 1976). Les animaux parents (F0) ont été accouplés six fois pour produire six portées (L1-L6), avec une période de repos d’une semaine entre chaque accouplement. Après une période de 13 semaines après le sevrage, 15 paires de rats de la première portée (L1) de chaque génération (F1-F4) ont été accouplées deux fois pour produire la génération suivante. Quinze paires de rats de la deuxième portée (L2) ont également été accouplées et la moitié de la progéniture a été examinée pour relever des signes de malformations congénitales pendant que l’autre moitié a été gardée jusqu’au sevrage. À la fin d’une période de 2 ans, une diminution du poids corporel a été observée chez les femelles à la dose de 50 mg/kg pc/jour et aux doses supérieures (13 à 25 %) et chez les mâles (19 à 23 %) à la dose de 100 mg/kg p.c./jour et aux doses supérieures chez la génération des parents. Cependant, les auteurs ont attribué ces différences aux variations de la consommation alimentaire puisque durant les 12 premières semaines d’analyse de croissance des 5 générations de parents, il n’y a pas eu de changement dans l’efficacité alimentaire (les analyses statistiques n’ont pas été rapportées pour le reste de l’étude). Aucune autre information n’a été fournie sur le poids corporel des générations parentales F1 à F4 après 12 semaines. Aucun changement histopathologique significatif n’a été observé. À la dose de 150 mg/kg pc/jour, des effets testiculaires ont été observés (mâles F0, épithélium germinatif anormal et atrophie) ainsi qu’une diminution de la fertilité (mères F0, 4e et 5e accouplements), une réduction de la taille des portées (moyenne de 5 portées successives chez les mères F0), une réduction du poids corporel de petits sevrés au JPN28 (moyenne des premières portées de cinq générations successives). Une augmentation des résorptions a également été observée (F4). Il n’y a eu aucune malformation. L’ECHA (2017) a établi une DSENO de 15 mg/kg pc/jour pour la toxicité systémique sur la base de la diminution du poids corporel chez les femelles à la DMENO de 50 mg/kg pc/jour. L’importance de la diminution du poids corporel observée lors de cette étude est incertaine en raison de l’absence de contrôle de la consommation alimentaire. L’ECHA (2017) a également établi une DSENO pour la toxicité pour la reproduction de 100 mg/kg pc/jour sur la base du « retard de croissance dû à une consommation alimentaire plus faible », une légère réduction de la taille de la portée et du poids au sevrage, et une incidence significativement plus élevée d’atrophie testiculaire chez les mâles adultes à la DMENO de 150 mg/kg pc/jour.
Plusieurs des études mentionnées ci-dessus ont montré des effets sur les testicules tels que la diminution du poids des testicules, l’atrophie testiculaire, la dégénérescence des tubules et la réduction de la spermatogenèse, bien que certaines d’entre elles n’aient pas suivi les lignes directrices sur les essais normalisés. Les données montrent toutefois une préoccupation pour la fécondité, qui fait l’objet de la classification de l’UE comme Repr. Cat. 2. (ECHA 2017).
Lors d’une étude de toxicité pour le développement, du chlorhydrate de cyclohexanamine a été administré par gavage à des groupes de 25 rats ou souris du 6e au 15e jour de gestation à des doses de 0, 14, 42, 140 mg/kg pc/jour (équivalent environ de 0, 10, 30 ou 100 mg/kg pc/jour de cyclohexanamine) (Lorke et Machemer 1983). Aucun effet n’a été signalé chez les souris. Chez les rates ayant reçu 100 mg de cyclohexanamine/kg pc/jour, une diminution du poids placentaire (16 %) et du poids fœtal (16 %) a été observée en présence d’une diminution du gain de poids corporel de la mère (30 % pendant le traitement, 8 % pendant la toute la période de gestation). Il n’y a eu aucun effet sur les implantations, le taux de résorption ou d’autres paramètres fœtaux (rapport des sexes, variations et malformations). L’ECHA (2017) a établi une DSENO de 30 mg/kg pc/jour pour la toxicité maternelle et la toxicité pour le développement.
Aucune étude d’exposition par voie cutanée n’a été identifiée. Pour l’inhalation, une étude à court terme a été identifiée, qui a fait état de l’absence d’effets neurocomportementaux chez les hommes et les femmes après une exposition pendant trois à quatre heures à diverses concentrations de cyclohexanamine (jusqu’à 10 ppm ou 41 mg/m3) (Juran et al. 2012), mais elle n’a pas servi pour caractériser les risques, car aucune autre mesure de toxicité n’a été effectuée. Des études sur l’inhalation à dose répétée chez des animaux de laboratoire étaient disponibles (p. ex. Watrous et Schulz 1950, Lomonova 1965), mais elles étaient associées à des limites méthodologiques ou ne contenaient pas suffisamment de détails sur leur conception.
6.3 Caractérisation des risques pour la santé humaine
La base de données sur le N-cyclohexylsulfamate de sodium est limitée et, bien que des effets testiculaires aient été observés lors d’une étude de 24 ans avec des singes, cette étude n’a pas été considérée critique pour diverses raisons, dont le nombre limité d’animaux (3 à 8 animaux par sexe par dose). Chez l’humain, la cyclohexanamine étant un métabolite du N-cyclohexylsulfamate de sodium, avec des effets potentiels sur les testicules après des durées plus courtes et des doses plus faibles que celles observées pour le N-cyclohexylsulfamate de sodium, une meilleure absorption et une distribution plus large dans le sang et les tissus du corps humain, les études faites avec la cyclohexanamine ou son analogue, le chrohydrate de cyclohexanamine, ont été utilisées pour l’évaluation des risques associés au N-cyclohexylsulfamate de sodium.
Pour les expositions quotidiennes, l’étude de 13 semaines par absorption de cyclohexanamine par voie orale avec des rats réalisée par Brune et al. (1978) a été choisie comme étude de toxicité critique en raison de la taille importante de l’échantillon (100 mâles/groupe), du contrôle de la consommation alimentaire, incluant des groupes témoins nourris ensemble et des groupes traités aux quatre doses de traitement, et des analyses détaillées des résultats testiculaires chez les animaux dans l’ensemble des études. Une DSENO de 100 mg/kg pc/jour a été établie sur la base des effets testiculaires observés à 200 mg/kg pc/jour et plus, à l’issue de l’examen du rapport original non publié par Santé Canada.
L’étude de 13 semaines par voie alimentaire avec la cyclohexanamine avec des rats réalisée par Gaunt et al. (1974) suggère une DSENO et une DMENO inférieures (30 et 105 mg/kg pc/jour) sur la base des effets testiculaires, mais elle a été faite avec moins d’animaux/dose (15/sexe/groupe), l’analyse des effets testiculaires n’était pas aussi détaillée que celle de l’étude de Brune et al. (1978) et la partie de cette étude portant sur les groupes nourris ensemble comprenait l’analyse d’une dose beaucoup plus élevée (342 mg/kg pc/jour par rapport aux témoins) que celle de Brune et al (1978). L’étude par voie alimentaire de deux ans chez le rat menée par Gaunt et al. (1976) n’a pas été retenue comme étude critique, car la consommation alimentaire n’était pas contrôlée et que la répartition des doses dans cette étude a conduit à une DMENO (219 mg/kg pc/jour) et une DSENO (60 mg/kg pc/jour) supérieures à celles de l’étude de Brune et al. (1978) pour des changements testiculaires semblables.
La DSENO de 400 mg/kg pc/jour établie après la première semaine de l’étude par voie alimentaire de 13 semaines avec des rats réalisée par Creasy et al. (1990) a été jugée appropriée comme paramètre critique pour la caractérisation du risque lié à une exposition intermittente. Cette étude a été effectuée avec un nombre adéquat d’animaux par groupe par période (15 mâles/groupe plus 10 témoins) et comprenait une analyse histopathologique de l’organe le plus sensible (testicules) à 5 périodes différentes (1, 3, 7, 9 ou 13 semaines) pendant l’étude, dont la période de 1 semaine était jugée applicable plus étroitement aux estimations d’exposition intermittente. (La dose de 400 mg/kg pc/jour a été établie comme DMENO après 3 à 13 semaines).
Bien que l’étude de toxicité pour le développement chez des rats gavés avec de la cyclohexanamine HCl (Lorke et Machemer 1983, ECHA 2017) ait mis en évidence une diminution du poids corporel maternel, du poids placentaire et du poids fœtal à 100 mg cyclohexanamine/kg pc/jour, tous les autres paramètres du développement n’étaient pas affectés. Cette étude n’a pas été choisie pour les expositions intermittentes, car il n’est pas certain qu’on puisse s’attendre à une diminution des poids après une ou quelques expositions.
Les paramètres critiques pour les effets sur la santé identifiés lors des études menées sur la cyclohexanamine ont été convertis en dose équivalente d’acide N‑cyclohexylsulfamique (le N-cyclohexylsulfamate de sodium se dissociant en acide N‑cyclohexylsulfamique dans les voies gastro-intestinales). La formule de conversion tenait compte des poids moléculaires relatifs et du fait que chez les humains, 63 % du N-cyclohexylsulfamate disponible est converti en cyclohexanamine avec un taux de conversion présumé dans l’intestin de 30 %. Ceci correspond à l’approche suivie par le JECFA (1982) et Santé Canada pour le calcul de la DJA de 11 mg/kg pc/jour d’acide N‑cyclohexylsulfamique.
Le tableau 6‑4 contient toutes les valeurs pertinentes d’exposition et de danger du N‑cyclohexylsulfamate de sodium, ainsi que les marges d’exposition (ME) en résultant pour la détermination du risque.
| Scénario d’exposition (groupe d’âge avec l’estimation la plus élevée) | Exposition systémiquea | Niveau d’effet critique | Paramètre critique d’effet sur la santé | ME |
|---|---|---|---|---|
| Absorption quotidienne par voie orale provenant de l’eau potable (nourrissons de 0 à 5 mois) | 0,00054 mg/kg pc/jour | DSENO aj.b = 1058 mg/kg pc/jour d’acide N‑cyclohexyl-sulfamique tirée de l’étude de 13 semaines chez le rat. | DSENO de 100 mg/kg pc/jour choisie sur la base des effets testiculaires observés à 200 et 300 mg cyclohexanamine /kg pc/jour. | 1 960 000 |
| Absorption quotidienne par voie orale provenant d’édulcorants de table, consommateurs seulement (hommes adultes, 19 ans et plus) | 6,53 mg/kg pc/jour (moyenne) ; 12,63 mg/kg pc/jour (90e percentile) | DSENO aj.b = 1058 mg/kg pc/jour d’acide N‑cyclohexyl-sulfamique tirée de l’étude de 13 semaines chez le rat. | DSENO de 100 mg/kg p.c./jour choisie sur la base des effets testiculaires observés à 200 et 300 mg cyclohexanamine /kg p.c./jour. | 162 (moyenne) ; 84 (90e percentile) |
| Absorption quotidienne par voie orale provenant de suppléments de calcium en sirop (adultes, 19 ans et plus) | 2,84 mg/kg pc/jour | DSENO aj.b = 1058 mg/kg pc/jour d’acide N‑cyclohexyl-sulfamique tirée de l’étude de 13 semaines chez le rat. | DSENO de 100 mg/kg pc/jour choisie sur la base des effets testiculaires observés à 200 et 300 mg cyclohexanamine /kg pc/jour. | 373 |
| Absorption quotidienne par voie orale provenant de vitamine D (tout-petits, 1 an) | 1,36 mg/kg pc/jour | DSENO aj.b = 1058 mg/kg pc/jour d’acide N‑cyclohexyl-sulfamique tirée de l’étude de 13 semaines sur le rat. | DSENO de 100 mg/kg pc/jour choisie sur la base des effets testiculaires observés à 200 et 300 mg cyclohexanamine /kg pc/jour. | 778 |
| Exposition buccale quotidienne provenant de rince-bouche (adolescents, 14-18 ans) | 0,69 mg/kg pc/jour | DSENO aj.b = 1058 mg/kg pc/jour d’acide N‑cyclohexyl-sulfamique tirée de l’étude de 13 semaines sur le rat. | DSENO de 100 mg/kg pc/jour choisie sur la base des effets testiculaires observés à 200 et 300 mg cyclohexanamine /kg pc/jour. | 1530 |
| Exposition quotidienne par inhalation due à des solutions respiratoires pour traitement du bronchospasme (enfants, 5-8 ans) | 0,034 mg/kg pc/jour | DSENO aj.b = 1058 mg/kg pc/jour d’acide N‑cyclohexyl-sulfamique tirée de l’étude étude de 13 semaines sur le rat. | DSENO de 100 mg/kg pc/ choisie sur la base des effets testiculaires observés à 200 et 300 mg cyclohexanamine /kg pc/jour. | 31 100 |
| Exposition intermittente par voie orale due à des sirops contre la congestion pulmonaire (enfants de 12 à 13 ans) | 14,3 mg/kg pc/jour | DSENO aj.c = 4230 mg/kg pc/jour d’acide N‑cyclohexyl-sulfamique, aucun effet observé après 1 semaine lors d’une étude sur le rat. | DSENO de 400 mg/kg pc/jour de cyclohexanamine choisie sur la base de l’absence d’effets testiculaires chez les mâles après 1 semaine. | 296 |
| Exposition buccale intermittente due de solutions anesthésiques buccales (tout-petits, 2-3 ans) | 7,2 mg/kg pc/jour | DMENO aj.c = 4230 mg/kg pc/jour d’acide N‑cyclohexyl-sulfamique, aucun effet observé après 1 semaine lors d’une étude sur le rat. | DSENO de 400 mg/kg pc/jour de cyclohexanamine choisie sur la base de l’absence d’effets testiculaires chez les mâles après 1 semaine. | 588 |
| Exposition intermittente par voie cutanée due à des solutions anesthésiques topiques pour le soulagement de la douleur cutanée (enfants, 3-8 ans) | 0,38 mg/kg pc/jour | DSENO aj.c = 4230 mg/kg pc/jour d’acide N‑cyclohexyl-sulfamique, aucun effet observé après 1 semaine lors d’une étude sur le rat. | DSENO de 400 mg/kg pc/jour de cyclohexanamine choisie sur la base de l’absence d’effets testiculaires chez les mâles après 1 semaine. | 11 100 |
Abréviation : ME = marge d’exposition.
a Les expositions estimées sont calculées sur une base de N-cyclohexylsulfamate de sodium (seul l’absorption par voie orale quotidien provenant des aliments est calculé pour l’acide N-cyclohexylsulfamique). Toutefois, la comparaison des expositions estimées au N-cyclohexylsulfamate de sodium et des DSENO ajustées n’a pas d’effet significatif sur les calculs de la ME, car le poids moléculaire de l’acide N-cyclohexylsulfamique (179,2 g/mol) est proche de celui du N-cyclohexylsulfamate de sodium (201,2 g/mol).
b La DSENO ajustée de 1058 mg/kg pc/jour a été calculée à partir de la DSENO de 100 mg/kg pc/jour au moyen de la formule suivante : 100 mg/kg pc par jour X 2 [nombre entier arrondi de 179,2 (PM de l’acide N‑cyclohexylsulfamique ÷ 99,2 (PM de la cyclohexanamine)] ÷ [0,63 (car 63 % du N-cyclohexylsulfamate peut être converti en cyclohexanamine) ÷ 0,3 (taux de conversion du N-cyclohexylsulfamate en cyclohexanamine)] = 1058 mg/kg pc/jour.
c La DSENO ajustée de 4230 mg/kg pc/jour a été calculée à partir de la DSENO de 400 mg/kg pc/jour au moyen de la formule suivante : 400 mg/kg pc par jour X 2 [nombre entier arrondi de 179,2 (PM de l’acide N‑cyclohexylsulfamique ÷ 99,2 (PM de la cyclohexanamine)] ÷ [0,63 [car 63 % du N-cyclohexylsulfamate peut être converti en cyclohexanamine] ÷ 0,3 [taux de conversion du N-cyclohexylsulfamate en cyclohexanamine] = 4230 mg/kg pc/jour.
d Absorption cutanée assumée à 100 %.
Les ME pour le N-cyclohexylsulfamate de sodium calculées pour les édulcorants de table sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Le niveau d’exposition moyen de la population masculine adulte [6,53 mg/kg pc/jour] est inférieur à la DJA et donne une ME de 162. Bien que la ME pour le 90e percentile des consommateurs masculins de N‑cyclohexylsulfamate de sodium âgés de 19 ans et plus soit de 84, elle est jugée adéquate pour de multiples raisons. Les facteurs pris en compte comprennent : i) les édulcorants de table contenant du N-cyclohexylsulfamate de sodium doivent être étiquetés de manière à indiquer qu’ils ne doivent être utilisés que sur l’avis d’un médecin; ii) aucune preuve d’effets sur les paramètres du sperme (y compris la motilité) n’a été observée lors de diverses études sur le N-cyclohexylsulfamate de sodium et la cyclohexanamine; iii) aucune toxicité pour la reproduction ni pour le développement n’a été observée chez des animaux recevant jusqu’à 250 mg/kg pc/jour de N‑cyclohexylsulfamate de sodium par voie orale; iv) l’absorption quotidienne répétée de N-cyclohexylsulfamate de sodium à des doses supérieures ou égales à 140 mg/kg pc/jour peut entraîner une diarrhée persistante chez les mâles humains dans les deux semaines, ce qui devrait les dissuader d’en consommer beaucoup ou longtemps; v) les données disponibles sur la part de marché des édulcorants à base de N‑cyclohexylsulfamate de sodium indiquent une baisse considérable au cours de la dernière décennie (voir annexe C). Par conséquent, les ME pour le N‑cyclohexylsulfamate de sodium sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
L’absorption maximale pour l’exposition par voie orale due aux rince-bouche, aux sirops de calcium et aux suppléments de vitamine D va de 0,69 àt 2,84 mg/kg pc/jour, tandis que l’absorption maximale pour l’exposition par inhalation due à des solutions respiratoires pour le traitement des bronchospasmes était de 0,0342 mg/kg pc/jour. Ces valeurs sont inférieures à la dose journalière admissible (DJA) de 11 mg/kg pc/jour calculée pour le N-cyclohexylsulfamate de sodium par Santé Canada et le JECFA (1982) (et inférieure aux 7 mg/kg pc/jour calculés par le SCF 2000) (voir Annexe E). La DJA est basée sur un facteur d’incertitude de 100 fois appliqué à la DSENO ajustée de 1058 mg/kg pc/jour, utilisée dans le tableau ci-dessus. Ainsi, sur la base d’une comparaison avec la DJA et d’une comparaison avec les niveaux d’effet critique tirés d’une étude de 13 semaines chez le rat (utilisant la cyclohexanamine avec conversion en dose équivalente de N-cyclohexylsulfamate de sodium), les marges ainsi obtenues sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Pour l’exposition intermittente par voie orale due à des sirops contre la congestion pulmonaire et l’exposition intermittente par voie orale ou cutanée due à des anesthésiants topiques, la comparaison de la DSENO tirée d’une étude d’une semaine chez le rat (utilisant la cyclohexanamine avec conversion en N-cyclohexylsulfamate de sodium) aux estimations prudentes de l’exposition due à ces produits contenant du N‑cyclohexylsulfamate de sodium conduit à calculer des gammes de ME allant de 296 à 11 000. Les marges ainsi obtenues sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Les ME pour le N-cyclohexylsulfamate de sodium provenant d’édulcorants de table sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Un grand nombre d’études ont été menées avant la mise en place de lignes directrices normalisées et certaines d’entre elles ne comportaient pas plusieurs paramètres ayant une incidence sur la qualité des études. Une discussion sur la sélection des études critiques pour la cyclohexanamine suit.
Le tableau 6‑5 contient toutes les valeurs pertinentes de l’exposition et du danger pour la cyclohexanamine, ainsi que les marges d’exposition (ME) en résultant, pour la détermination du risque.
| Scénario d’exposition (groupe d’âge avec l’estimation la plus élevée) | Exposition systémique | Niveau d’effet critique | Paramètre critique pour les effets sur la santé | ME |
|---|---|---|---|---|
| Absorption quotidienne par voie orale due aux aliments et boissons (adultes, 19 ans et plus) | 0,0057 mg/kg pc/jour | DSENO = 100 mg/kg pc/jour de cyclohexanamine tirée de l’étude de 13 semaines sur les rats. | DSENO de 100 mg/kg pc/jour choisie sur la base des effets testiculaires observés à 200 et 300 mg de cyclohexanamine/kg pc/jour. | 17 500 |
| Absorption quotidienne par voie orale due à l’eau potable (nourrissons de 0 à 5 mois) | 0,0017 mg/kg pc/jour | DSENO = 100 mg/kg pc/jour de cyclohexanamine tirée de l’étude de 13 semaines sur les rats. | DSENO de 100 mg/kg pc/jour choisie sur la base des effets testiculaires observés à 200 et 300 mg de cyclohexanamine/kg pc/jour. | 58 800 |
| Exposition quotidienne par inhalation et par voie cutanée due à des laques pour cheveux en aérosol (adultes, 19 ans et plus) | 0,014 mg/kg pc/jour | DSENO = 100 mg/kg pc/jour tirée de l’étude de 13 semaines sur les rats. | DSENO de 100 mg/kg pc/jour choisie sur la base des effets testiculaires observés à 200 et 300 mg de cyclohexanamine/kg pc/jour. | 7140 |
| Exposition par inhalation et par voie cutanée par évènement due à des laques pour cheveux en aérosol (enfants de 4 à 8 ans) | 0,017 mg/kg pc | DSENO = 400 mg/kg pc/jour de cyclohexanamine durant la première semaine tirée de l’étude de 1 à 13 semaines sur les rats. | DSENO de 400 mg/kg pc/jour choisie sur la base de l’absence d’effets testiculaires chez les mâles après 1 semaine. | 23 500 |
| Exposition par inhalation par évènement due à des cartouches de gel combustible pour foyer (tout-petits, 1 an) a | 3 mg/kg pc | DSENO = 400 mg/kg pc/jour de cyclohexanamine durant la première semaine tirée de l’étude de 1 à 13 semaines sur les rats. | DSENO de 400 mg/kg pc/jour choisie sur la base de l’absence d’effets testiculaires chez les mâles après 1 semaine. | 133 |
Abréviation : ME = marge d’exposition
a Lorsque ce produit est utilisé à l’intérieur (p. ex. par un adulte), les tout-petits peuvent être exposés à la cyclohexanamine rejetée dans l’air intérieur.
Tel qu’indiqué dans le tableau 6‑5, les marges obtenues pour les expositions quotidienne et par évènement par inhalation et par voie cutanée dues à des laques pour cheveux en aérosol ou à des cartouches de gel combustible sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Bien que l’exposition de la population générale à la cyclohexanamine ne soit pas préoccupante aux niveaux actuels, cette substance est jugée préoccupante pour la santé sur la base de son danger potentiel dû à sa classification Repr 2 (substance susceptible d’être toxique pour la reproduction humaine) dans le Système général harmonisé (ECHA 2017). Le N-cyclohexylsulfamate de sodium est source des mêmes préoccupations, compte tenu de l’utilisation de la cyclohexanamine comme analogue. Par conséquent, il pourrait poser un risque pour la santé humaine si l’exposition venait à augmenter.
6.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| Aucune donnée canadienne sur les niveaux de N-cyclohexylsulfamate de sodium ni de cyclohexanamine dans l’eau potable, l’air, le sol ou la poussière. | +/- |
| La fidélité des consommateurs à des marques ou à des types particuliers d’édulcorants artificiels au Canada est inconnuea. | +/- |
| L’exposition combinée aux produits contenant du N-cyclohexylsulfamate de sodium n’a pas été estimée, car ces produits (y compris les produits alimentaires) ne devraient pas représenter une part de marché importante au Canada. | +/- |
| Étant donné que peu de consommateurs ont déclaré consommer du N‑cyclohexylsulfamate de sodium, l’utilisation de « consommateurs seuls » a une influence significative sur les estimations alimentaires du N‑cyclohexylsulfamate de sodium. | + |
| Les quantités élevées de N-cyclohexylsulfamate de sodium consommées par certains répondants ont une influence significative sur les expositions estimées au 90e percentile. | + |
| Le pourcentage d’absorption et le taux de conversion du N‑cyclohexylsulfamate en cyclohexanamine diffèrent d’un individu à l’autre. | +/- |
| Absence de données sur l’absorption cutanée du N-cyclohexylsulfamate de sodium ou la cyclohexanamine. | + |
| Absence d’étude de toxicité à dose répétée par voie cutanée ou par inhalation sur le N-cyclohexylsulfamate de sodium ou la cyclohexanamine. | +/- |
| Absence d’étude fiable par voie orale sur la cancérogénicité ou la toxicité pour la reproduction et le développement du N-cyclohexylsulfamate de sodium absorbé. | +/- |
+ = incertitude pouvant causer une surestimation de l’exposition/risque, +/- = potentiel inconnu de surestimation ou de sous-estimation du risque.
a La fidélité à une marque donnée n’a pu être évaluée dans le cadre de l’ESCC, car les marques n’ont pas été déclarées. Cependant, seulement 8 % des répondants ont déclaré consommer deux édulcorants de table différents (p. ex. sucralose et N-cyclohexylsulfamate) et moins de 1 % des répondants ont déclaré en consommer plus de deux.
7. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le risque d’effets nocifs sur l’environnement dus au N‑cyclohexylsulfamate de sodium et à la cyclohexanamine est jugé faible. Nous concluons que le N-cyclohexylsulfamate de sodium et la cyclohexanamine ne satisfont pas aux critères de l’alinéa 64a) ou 64 b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
Sur la base des renseignements présentés dans la présente ébauche d’évaluation préalable, nous concluons que le N-cyclohexylsulfamate de sodium et la cyclohexanamine ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, puisqu’ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, nous concluons que le N-cyclohexylsulfamate de sodium et la cyclohexanamine ne satisfont à aucun des critères de l’article 64 de la LCPE.
Références
Arbeláez P., Borrull F., Pocurull E., Marcé R.M.; 2015; Determination of high-intensity sweeteners in river water and wastewater by solid-phase extraction and liquid chromatography-tandem mass spectrometry; J. Chromatogr. A., 1393, p. 106-14. (disponible en anglais seulement)
Association canadienne des fabricants de produits chimiques. 2003. Reducing emissions 2003 emissions inventory and five year projections. Rapport No 12. (disponible en anglais seulement)
Baines J., DiNovi M.; 2010. Cyclamic acid and its salts: Dietary exposure assessment. Pp. 29-56 in JECFA (2010). (disponible en anglais seulement)
Banque de données sur les substances dangereuses [base de données]. 2005. Cyclohexylamine, CASRN : 108-91-9. Bethesda (MD) : National Library of Medicine (États-Unis). révisé le 23 août 2005 ; consulté le 4 octobre 2018]. Recherchez « cyclohexylamine ».
Berset J.D., Ochsenbein N. ; 2012. Stability considerations of aspartame in the direct analysis of artificial sweeteners in water samples using high-performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). Chemosphere. 88(5):563-9. (disponible en anglais seulement)
Bickel M.H., Burkard B., Meier-strasser E., Van Den Broek-Boot M.; 1974. Entero-bacterial formation of cyclohexylamine in rats ingesting cyclamate. Xenobiotica 4(7):425-439. (disponible en anglais seulement)
Boîte à outils QSAR de l’OCDE. [lecture transversale de l’outil]. 2017. Ver. 4.1. Paris (FR) : Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique. (disponible en anglais seulement)
Bopp B.A., Sonders R.C., Kesterson J.W. ; 1986. Toxicological aspects of cyclamate and cyclohexylamine. CRC Critical Reviews in Toxicology 16(3):213-306. (disponible en anglais seulement)
Brusick D., Cifone M., Young R., Benson S. ; 1989. Assessment of the genotoxicity of calcium cyclamate and cyclohexylamine. Environmental and Molecular Mutagenesis 14(3):188-199. (disponible en anglais seulement)
Buss N.E., Renwick A.G., Donaldson K.M., George C.F. ; 1992. The metabolism of cyclamate to cyclohexylamine and its cardiovascular consequences in human volunteers. Toxicology and Applied Pharmacology 115(2):199-210. (disponible en anglais seulement)
Calorie Control Council. 2013. International regulatory status: Worldwide status of cyclamate. Atlanta, GA. (disponible en anglais seulement)
Canada. 1978b. Règlement sur les aliments et drogues, C.R.C., ch. 870.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, No 3.
Canada. 2012. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Ministère de l'Environnement, gouvernement du Canada. Gazette du Canada, Partie I, Vol. 146, No 48, Supplément.
Carswell T.S., Morrill H.L. ; 1937. Cyclohexylamine and dicyclohexylamine. Ind. Eng. Chem. 29(11), 1247-1251. DOI: 10.1021/ie50335a011 (disponible en anglais seulement)
ChemCAN. 2003. Level III fugacity model of 24 regions of Canada. Version 6.00. Peterborough (ON). Université Trent, Canadian Centre for Environmental Modelling and Chemistry.(disponible en anglais seulement)
ChemSpider [base de données]. 2015. Londres (Royaume-Uni) : Royal Society of Chemistry. (disponible en anglais seulement)
Codex Alimentarius. 2018. General Standard for Food Additives Online. CODEX STAN 192-1995. Dernière révision 2018. (disponible en anglais seulement)
[CIRC] Centre international de recherche sur le cancer. 1980. Cyclamates (acide cyclamique, cyclamate de sodium, cyclamate de sodium, cyclamate de calcium, cyclohexylamine et dicyclohexylamine), pp. 55-110 des IARC Monographs on the evaluation of carcinogenic risk of chemicals to humans, Volume 22: Some Non-nutritive sweetening agents. Groupe de travail du CIRC sur l’évaluation du risque cancérogène des produits chimiques pour l’homme. Lyon, France. (disponible en anglais seulement)
Centre international de recherche sur le cancer (CIRC). 1999. Cyclamates. pp. 195-222 in IARC Monographs on the evaluation of carcinogenic risks to humans, Volume 73: Some chemicals that cause tumours of the kidney or urinary bladder in rodents and some other substances. Groupe de travail du CIRC sur l’évaluation des risques cancérogènes pour l’homme. Lyon, France. (disponible en anglais seulement)
Collings A.J. ; 1989. Metabolism of cyclamate and its conversion to cyclohexylamine. Diabetes Care 12(1), Suppl. 1:50-55. (disponible en anglais seulement)
Conseil national de recherches du Canada. 2007. Cyclohexylamine. In : Acute exposure guideline levels for selected airborne chemicals, Volume 5. Washington (DC) : National Academies Press. P 92-144. (disponible en anglais seulement)
Conseil néerlandais de la santé. 2001. Comité de mise à jour des limites d’exposition professionnelle. Cyclohexylamine; Health-based Reassessment of Administrative Occupational Exposure Limits. La Haye : Conseil néerlandais de la santé. 35 pages. No. 2000/15OSH/021. (disponible en anglais seulement)
[ConsExpo Web] Consumer Exposure Web Model. 2018. Bilthoven (NL) : Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement]. (disponible en néerlandais seulement)
Creasy D.M., Ford G.R., Gray TJ. ; 1990. The morphogenesis of cyclohexylamine-induced testicular atrophy in the rat: in vivo and in vitro studies. Experimental and Molecular Pathology 52(2):155-169. (disponible en anglais seulement)
Dick C.E., Schniepp M.L., Sonders R.C., Wiegand R.G. ; 1974. Cyclamate and cyclohexylamine: lack of effect on the chromosomes of man and rats in vivo. Mutation Research 26(3):199-203. (disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (ON) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Documentation à l’appui : data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (QC) : ECCC. Renseignements à l’appui du document sur l’approche scientifique : classification du risque écologique des substances organiques. Disponible à l’adresse : substances@ec.gc.ca. (disponible en anglais seulement)
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modifié le 12 mars 2017]. Catégorisation des substances chimiques. Ottawa (ON) : gouvernement du Canada.
[ECHA] Agence européenne des produits chimiques. c2007-2017. Registered substances database ; résultats de recherche pour no CAS 108-91-8 [base de données]. Helsinki (FI) : ECHA. [mis à jour le 15 août 2018 ; consulté le 4 octobre 2018]. (disponible en anglais seulement)
[ECHA] Agence européenne des produits chimiques. 2017. ECHA CORAP Substance evaluation conclusion and evaluation report for cyclohexylamine. Substance Evaluation Conclusion document prepared by the Belgian Federal Public Service Health, Food Chain Safety and Environment Risk Management Service. 56 pp. (disponible en anglais seulement)
Edwards Q.A., Kulikov S.M., Garner-O'Neale L.D., Metcalfe C.D., Sultana T. ; 2017. Contaminants of emerging concern in surface waters in Barbados, West Indies. Environ Monit Assess. 189(12):636. (disponible en anglais seulement)
Eichelbaum M., Hengstmann J.H., Rest H.D., Brecht T., Dengler H.J. ; 1974. Pharmacokinetics, cardiovascular and metabolic actions of cyclohexylamine in man. Arch Toxicol. 31:243-263.
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Notice with respect to certain substances on the Domestic Substances List. Données préparées par : Environnement Canada, Santé Canada ; Programme des substances existantes. (disponible en anglais seulement)
[EPI Suite] Estimation Program Interface SuiteTM [estimation model]. c2000-2012. Estimation Program Interface for Microsoft Windows Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (disponible en anglais seulement)
États-Unis d’Amérique. 1970. Federal Register, 35, 13644, 27 août 1970. (disponible en anglais seulement)Ferrando MR, Huchet B. 1968. Étude de l’activité possible du cyclamate de sodium sur le rat au cours de trois générations. Bulletin de L'Académie Nationale de Médecine 153:36-41.
Ficheux A.S., Chevillotte G., Wesolek N., Morisset T., Dornic N., Bernard A., Bertho A., Romanet A., Leroy L., Mercat A.C., Creusot T., Simon E., Roudot A.C. ; 2016. Consumption of cosmetic products by the French population. Second part: Amount data. Food Chem. Toxicol. 90:130-141. (disponible en anglais seulement)
[FS]. Fiche signalétique 2018. SunJel Fume-free Firespace gel fuel canister, pure gel. Utah (US): Thatcher Company, Inc. Utah (États-Unis) [consulté le 18 novembre 2018]. (disponible en anglais seulement)
Gan Z., Sun H., Feng B., Wang R., Zhang Y. ; 2013. Occurrence of seven artificial sweeteners in the aquatic environment and precipitation of Tianjin, China. Water Res. 47(14):4928-37. (disponible en anglais seulement)
Gan Z., Sun H., Yao Y., Zhao Y., Li Y., Zhang Y., Hu H., Wang R. ; 2014. . Distribution of artificial sweeteners in dust and soil in China and their seasonal variations in the environment of Tianjin. Sci. Total. Environ. 488-489:168-75. (disponible en anglais seulement)
Gaunt I.F., Sharratt M., Grasso P., Landsdown A.B., Gangolli S.D. 1974. Short-term toxicity of cyclohexylamine hydrochloride in the rat. Food and Cosmetic Toxicology 12(5-6):609-624. (disponible en anglais seulement)
Gaunt I.F., Hardy P., Gangolli S.D., Butterworth K.R. ; 1976. Long-term toxicity of cyclohexylamine hydrochloride in the rat. Food and Cosmetic Toxicology 14(4):255-67. (disponible en anglais seulement)
Golberg L., Parekh C., Patti A., Soike K. ; 1969 Cyclamate degradation in mammals and in vitro. Toxicology and Applied Pharmacology. 14:654. (disponible en anglais seulement)
Gomez-Berrada M.P., Ficheux A.S., Rakotomalala S., Roudot A.C., Ferret P.J. ; 2017. Probabilistic exposure assessment of sun care products. Food Chem. Toxicol. 108:314-325. (disponible en anglais seulement)
Hardy J., Gaunt I.F., Hooson J., Hendy R.J., Butterworth K.R. ; 1976. Long-term toxicity of cyclohexylamine hydrochloride in mice. Food and Cosmetic Toxicology 14(4):269-276. (disponible en anglais seulement)
[HSDB] Hazardous Substances Data Bank [base de données]. 2012. Cyclamate, No CAS : 100-88-9 (comprend des données sur le cyclamate de sodium, No CAS 139-05-9). [révisé le 6 janvier 2012] [consulté le 25 avril 2018 et le 18 septembre 2018]. Rechercher « cyclamate » (disponible en anglais seulement)
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 1970. Toxicological evaluation of some extraction solvents and certain other substances. Série de rapports des réunions de la FAO sur la nutrition No 48A ; WHO/FOOD ADD/70.39 11 pp. (disponible en anglais seulement)
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 1982. Evaluation of certain food additives and contaminants. Rapport n° TRS 683-JECFA 26/27. 52 p. (disponible en anglais seulement)
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2010. Safety evaluation of certain food additives. Préparé par la 71ème réunion du JECFA. Série 62 de l’OMS sur les additifs alimentaires. Organisation mondiale de la Santé, Genève. 284 p. (disponible en anglais seulement)
Juran S.A., van Thriel C., Kleinbeck S., Schaper M., Falkenstein M., Iregren A., Johanson G. 2012. Neurobehavioral performance in human volunteers during inhalation exposure to the unpleasant local irritant cyclohexylamine. Neurotoxicology 33(5):1180-1187. (disponible en anglais seulement)
Lange F.T., Scheurer M., Brauch H.J. 2012. Artificial sweeteners-a recently recognized class of emerging environmental contaminants: a review. Anal. Bioanal. Chem. 403(9):2503-18. (disponible en anglais seulement)
Lawrence J.F. ; 2003. Cyclamates. Encyclopedia of Food Sciences and Nutrition (second Edition). Academic Press. P 1712-1714. (disponible en anglais seulement).
Lomonova G.V. ; 1965. Toxicity of cyclohexylamine and dicyclohexylamine. Fed Proc 24: T96-8. (traduction de Gig Trud Prof Zabol 1963 ; 7 (11) : 51-6). cité dans Health Council of the Netherlands 2001]. (disponible en anglais seulement)
Lorke D., Machemer L. ; 1983. The effect of cyclohexylamine on the embryo following oral administration to rats and mice. Toxique. Lettres 17:137-143. (disponible en anglais seulement)
[Nielsen] AC Nielsen Company of Canada. 2005-2017. Rapports de classement des éléments de 2005, 2010, 2014, 2015 et 2017. (disponible en anglais seulement)
Orlando R.A., Lao Y.J. ; 1993. An assessment of exposure to cyclohexylamine arising from steam humidification of indoor air. Journal of Environmental Health. 56(5), 6-9. (disponible en anglais seulement)
Oser B.L., Carson S., Cox G.E., Vogin E.E., Sternberg S.S. ; 1975. Chronic toxicity study of cyclamate: saccharin (10:1) in rats. Toxicology 4(3):315-30. (disponible en anglais seulement)
Oser B.L., Carson S., Cox G.E., Vogin E.E., Sternberg S.S. ; 1976. Long-term and multigeneration toxicity studies with cyclohexylamine hydrochloride. Toxicology 6(1):47–65. (disponible en anglais seulement)
Parekh C., Goldberg E.K., Goldberg L. ; 1970. Fate of Sodium Cyclamate-14C in the Rhesus Monkey (M. mulatta). Abstract no. 26 in Abstracts of papers for the ninth annual meeting of The Society of Toxicology, Atlanta, Georgia; March 15-19, 1970. Toxicol. App. Pharmacol. 10:282. (disponible en anglais seulement).
[PhysProp] Interactive PhysProp Database [base de données]. c2013. Syracuse (NY): SRC, Inc. [consulté le 4 octobre 2018]. L’une des nombreuses bases de données disponibles à l’adresse suivante (disponible en anglais seulement)
Pitkin R.M., Reynolds W.A., Filer L.J. ; 1969. Cyclamate and cyclohexylamine: transfer across the hemochorial placenta. Proceedings of the Society of Experimental Biology and Medicine 132(3):993-995. (disponible en anglais seulement)
Pitkin R.M., Reynolds W.A., Filer L.J. ; 1970. Placental transmission and fetal distribution of cyclamate in early human pregnancy. American Journal of Obstetrics and Gynecology. 108(7):1043-1050. (disponible en anglais seulement)
PubChem [base de données]. 2004-. Bethesda (MD) : US National Library of Medicine, National Center for Biotechnology Information. [consulté le 4 septembre 2018]. (disponible en anglais seulement)
Renwick A.G., Thompson J.P., O'Shaughnessy M., Walter E.J. ; 2004. The metabolism of cyclamate to cyclohexylamine in humans during long-term administration. Toxicology and Applied Pharmacology 196(3):367-80. (disponible en anglais seulement)
Renwick A.G., Williams R.T. ; 1972a. The fate of cyclamate in man and other species. Biochem J. 129:869-879. (disponible en anglais seulement)
Renwick A.G., Williams R.T. 1972b. The metabolites of cyclohexylamine in man and certain animals. Biochem. J. 129: 857-867. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement (NL)]. 2006. Cosmetics fact sheet: to assess the risks for the consumer: updated version for ConsExpo 4. Bilthoven (NL) : RIVM. Rapport n° 320104001/2006. consulté le 4 octobre 2018]. (disponible en anglais seulement)
Roberts A., Renwick A.G., Ford G., Creasy D.M., Gaunt I. ; 1989. The metabolism and testicular toxicity of cyclohexylamine in rats and mice during chronic dietary administration. Toxicology and Applied Pharmacology 98(2):216-29. (disponible en anglais seulement)
Sang Z., Jiang Y., Tsoi Y.K., Leung K.S. ; 2014. Evaluating the environmental impact of artificial sweeteners: a study of their distributions, photodegradation and toxicities. Water Res. 52:260-74. (disponible en anglais seulement)
Santé Canada. 1994. Human health risk assessment for priority substances. Ottawa (ON) : Santé Canada. (disponible en anglais seulement)
Santé Canada. 2010. Directives relatives aux demandes d’autorisation concernant les additifs indirects - Directive no 4. Direction générale des produits de santé et des aliments, Direction des aliments. Ottawa (ON) : Santé Canada.
Santé Canada. 2015. Tableau de la consommation alimentaire tiré de l’Enquête sur la santé dans les collectivités canadiennes de Statistique Canada, cycle 2.2, Nutrition (2004), fichier partagé. Ottawa.
Santé Canada. 2017. Tableau de consommation d’eau tiré de l’Enquête sur la santé dans les collectivités canadiennes de Statistique Canada, cycle 2.2, Nutrition (2004). Partager le fichier. Ottawa.
Santé Canada. 2018a. Ébauche d’un document d’information sur les valeurs par défaut des apports en lait maternel et en préparations pour nourrissons. Rapport non publié. Ottawa (ON) : gouvernement du Canada.
Santé Canada. 2018b. Draft backgrounder document on updated default body surface areas for use in ESRAB assessments. Rapport non publié. Ottawa (ON) : gouvernement du Canada. (disponible en anglais seulement)
[SCCS] Comité scientifique européen pour la sécurité des consommateurs. 2015. The SCCS's notes of guidance for the testing of cosmetic ingredients and their safety evaluation, 9ème révision. Version révisée du 25 avril 2016. Rapport n° SCCS/1564/15. 151 p. (disponible en anglais seulement)
[SCF] Comité scientifique européen de l’alimentation humaine. 2000. Revised opinion on cyclamic acid and its sodium and calcium salts. Report No. SCF/CS/EDUL/192 final. 13 March 2000. Commission européenne, Direction générale Santé et protection des consommateurs. 8 pp. (disponible en anglais seulement)
Scheurer M., Brauch H.J., Lange F.T. ; 2009. Analysis and occurrence of seven artificial sweeteners in German waste water and surface water and in soil aquifer treatment (SAT). Anal Bioanal Chem. 394(6):1585-94. (disponible en anglais seulement)
Serra-Majem L., Bassas L., García-Glosas R., Ribas L., Inglés C., Casals I., Saavedra P., Renwick A.G. ; 2003. Cyclamate intake and cyclohexylamine excretion are not related to male fertility in humans. Food Additives and Contaminants 20(12):1097-104. (disponible en anglais seulement)
Spoelstra J., Schiff S.L., Brown S.J. ; 2013. Artificial sweeteners in a large Canadian river reflect human consumption in the watershed. PLoS. One. 8(12):e82706. (disponible en anglais seulement)
Spoelstra J., Senger N.D., Schiff S.L. 2017. Artificial Sweeteners Reveal Septic System Effluent in Rural Groundwater. J. Environ. Qual. 46(6):1434-1443. (disponible en anglais seulement)
Statistique Canada 2015. Enquête sur la santé dans les collectivités canadiennes (ESCC) 2015 - Fichier partagé. Ottawa, ON. Canada. Estimations générées à l’aide de SAS 9.3 [GRID] à SAS EG 5.1.
Takayama S., Renwick A.G., Johansson S.L., Thorgeirsson U.P., Tsutsumi M., Dalgard D.W., Sieber S.M. ; 2000. Long-term toxicity and carcinogenicity study of cyclamate in nonhuman primates. Toxicol Sci. 53:33-39. (disponible en anglais seulement).
Thorgeirsson U.P., Dalgard D.W., Reeves J., Adamson R.H. ; 1994. Tumor incidence in a chemical carcinogenesis study of nonhuman primates. Reg Tox Pharm. 19:130-151. (disponible en anglais seulement)
Tran N.H., Hu J., Li J., Ong S.L. ; 2014. Suitability of artificial sweeteners as indicators of raw wastewater contamination in surface water and groundwater. Water Res. 48:443-56. (disponible en anglais seulement)
[UE] Union européenne. 2008. Regulation (EC) No. 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006. Off J Eur. Union L 353:1–1355. (disponible en anglais seulement)
Agence de protection de l’environnement des États-Unis. 1988. Integrated Risk Information System (IRIS) Cyclohexylamine; CASRN 108-91-8 [PDF]. Washington (DC) : Office of Research and Development. (disponible en anglais seulement)
[EPA] Agence de protection de l’environnement des États-Unis. Chemistry Dashboard [base de données]. [mis à jour le 13 septembre 2018]. Sodium cyclamate. consulté le 18 septembre 2018]. (disponible en anglais seulement)
[FDA] Food and Drug Administration des États-Unis. 1980. Cyclamate, Commissioner's Decision. Federal Register, Volume 45, No. 181, FR 61474, 16 septembre 1980. (disponible en anglais seulement)
[NTP] Programme national de toxicologie des États-Unis. 2016. Report on Carcinogens, Fourteenth Edition. ; Research Triangle Park, NC : Department of Health and Human Services, Public Health Service. (disponible en anglais seulement)
van Eyk A.D. ; 2015. The effect of five artificial sweeteners on Caco-2, HT-29 and HEK-293 cells. Drug and Chemical Toxicology 38(3):318-327. (disponible en anglais seulement)
Wallace W.C., Lethco E.J., Brouwer E.A. ; 1970. The metabolism of cyclamates in rats. J Pharmacol Exp. Therapeutics 175(2):325-330. (disponible en anglais seulement)
Watanabe Y., Bach L.T., Van Dinh P., Prudente M., Aguja S., Phay N., Nakata H. ; 2016. Ubiquitous detection of artificial sweeteners and iodinated X-ray contrast media in aquatic environmental and wastewater treatment plant samples from Vietnam, the Philippines, and Myanmar. Arch Environ Contam Toxicol. 70(4):671-81. (disponible en anglais seulement.
Watrous R.M., Schulz H.N. ; 1950. Cyclohexylamine, p-chloronitrobenzene, 2-aminopyridine: toxic effects in industrial use. Ind. Med. Surg. 19: 317-320. [cité dans Conseil national de recherches du Canada 2007]. (disponible en anglais seulement)
Wills J.H., Serrone D.M., Coulston F. ; 1981. A 7-month study of ingestion of sodium cyclamate by human volunteers. Reg Tox Pharm 1:163-176. (disponible en anglais seulement)
Yang Y.Y., Zhao J.L., Liu Y.S., Liu W.R., Zhang Q.Q., Yao L., Hu L.X., Zhang J.N., Jiang Y.X., Ying G.G. ; 2018. Pharmaceuticals and personal care products (PPCPs) and artificial sweeteners (ASs) in surface and ground waters and their application as indication of wastewater contamination. Sci Total Environ. 616-617:816-823. (disponible en anglais seulement)
Annexes
Annexe A. Résumé des effets sur la santé et approche de lecture croisée pour le N-cyclohexylsulfamate de sodium et la cyclohexanamine
| Nom chimique | Chlorhydrate de cyclohexanamine | Cyclohexanamine | N-cyclohexylsulfamate de sodium |
|---|---|---|---|
| Rôle | Analogue | Substance analogue et cible | Substance cible |
| No CAS | 4998 -76-9 | 108-91-8 | 139-05-9 |
| Structure chimique |  |
 |
![C1CCC(CC1)NS(=O)(=O)[O-].[Na+]](/content/dam/eccc/images/pded/sodium-cyclamate-cyclohexylamine/20190930-table21a.jpg) |
| Poids moléculaire (g/mol) | 135,6 | 99,2 | 201,2 |
| Pression de vapeur (Pa à 25 °C) | Aucune donnée | 1430 | 1,70 x 10-8 [modélisé] |
| Solubilité dans l’eau (mg/L) | 8,3 x 105 (17℃) | « miscible » | 1,0 x 106 [modélisé] |
| log Koe (sans dimension) | Aucune donnée | 3,7 | -1,61 [modélisé] |
| Toxico-cinétique et métabolisme | Aucune donnée | La cyclohexanamine est mieux absorbée par les voies gastro‑intestinales et plus largement répartie dans les tissus du corps que le N-cyclohexylsulfamate (Bopp et al. 1986, HSDB 2012). La cyclohexanamine est métabolisée dans les reins pour former des métabolites mineurs tels que la cyclohexanone, le cyclohexanol, le trans-cyclohexane-1, 2-diol et la N‑hydroxycyclohexanamine, excrétés dans l’urine (Gaunt et al. 1974, Golberg et al. 1969, CIRC 1999). Les taux d’excrétion urinaire chez les hommes ayant absorbé du N-cyclohexylsulfamate de sodium pendant 7 mois étaient de 88 % pour le N-cyclohexylsulfamate et de 17 % pour la cyclohexanamine (pourcentages moyens relatifs) (Wills et al. 1981). |
Chez le rat, le N‑cyclohexylsulfamate de sodium se décompose en N‑cyclohexylsulfamate dont une partie est absorbée par les voies gastro-intestinales (GI) de tous les mammifères (Collings 1989). Le N‑cyclohexylsulfamate peut ensuite être transformé en cyclohexanamine par des microbes présents dans les voies GI de tous les mammifères (CIRC 1999). Le N‑cyclohexylsulfamate et la cyclohexanamine, y compris les métabolites secondaires, excrétés dans l’urine (Gaunt et al. 1974 ; Golberg et al. 1969 ; CIRC 1999). Les taux d’excrétion urinaire chez les hommes ayant ingéré du N-cyclohexylsulfamate de sodium pendant 7 mois étaient de 88 % pour le N-cyclohexylsulfamate et de 17 % pour la cyclohexanamine (pourcentages moyens relatifs) (Wills et al. 1981). |
| Toxicité à dose répétée (orale) | DSENO = 137 mg/kg pc/jour; sur la base des effets testiculaires observés à 274 et à 411 mg/kg pc/jour lors de l’étude de 13 semaines sur les rats (Brune et al. 1978 [rapport non publié], tel que cité dans ECHA 2017, Bopp et al. 1986). DSENO = 546,8 mg/kg pc/jour (DEE) sur la base de l’absence d’effets testiculaires chez les mâles à 1 semaine observée lors de l’étude de 1 à 13 semaines sur les rats (Creasy et al. 1990). | Lecture croisée à partir du cyclohexanamine HCl | Lecture croisée à partir de la cyclohexanamine |
| Toxicité (orale) à long terme | DSENO = 82 mg/kg pc/jour sur la base d’effets testiculaires (atrophie, tubules à peu de spermatides, dépôts de calcium dans les tubules) à 300 mg/kg pc/jour observés lors de l’étude de 2 ans sur les rats (Gaunt et al. 1976 cité dans Bopp et al. 1986). | Lecture croisée à partir de cyclohexanamine HCl : (Gaunt et al. 1976 cité dans Bopp et al. 1986). | DSENO = 100 mg/kg pc/jour sur la base des effets testiculaires observés à 500 mg/kg pc/jour après 23 ans lors de l’étude de 24 ans sur les singes (Takayama et al. 2000). DSENO = 1120 mg/kg pc/jour sur la base des carcinomes de la vessie observés à 2500 mg/kg pc/jour lors de l’étude de 2 ans sur les rats. Les carcinomes de la vessie peuvent avoir été liés au traitement à la saccharine (NTP 2016). a |
| Toxicité pour la reproduction (orale) | DSENO = 100 mg/kg pc/jour sur la base du « retard de croissance dû à une consommation alimentaire plus faible », d’une légère baisse de la taille de la portée et du poids au sevrage et d’une incidence d’atrophie testiculaire considérablement plus élevée chez les mâles adultes à la DMENO de 150 mg/kg pc/jour lors de l’étude de 2 ans sur plusieurs générations de rats (Oser et al. 1976, ECHA 2017). | Lecture croisée à partir du cyclohexanamine HCl | DMENO = 1500 mg/kg pc/jour (EDD) sur la base de dégénérescence testiculaire chez les mâles adultes F2 et F3 et sur les effets sur la progéniture F3 (diminution de la survie des petits de la naissance au sevrage) observée lors de l’étude sur 3 générations de rats (Ferrando et Huchet 1968). |
| Toxicité pour le développement (orale) | DSENO = 42 mg/kg pc/jour sur la base de la réduction des poids placentaire et fœtal en présence de gain de poids corporel moindre de la mère à 140 mg/kg pc/jour observée lors de l’étude sur le développement avec des rats (Lorke et Machemer 1983 cité dans ECHA 2017). | Lecture croisée à partir du cyclohexanamine HCl | DSENO = 250 mg/kg pc/jour observée lors d’études de toxicité pour le développement chez le rat et le lapin (Bein et al. 1967, Fritz et Hess 1968 et US Food and Drug Research Laboratories cité dans JECFA 1970). |
| Toxicité génétique | NR | Résultats d’essais in vitro et in vivo négatifs (études sur les aberrations chromosomiques et la létalité dominante chez le rat, la souris et le hamster chinois à des doses orales ou intrapéritonéales de 50 à 150 mg/kg pc ont produit des résultats essentiellement négatifs [JECFA 1982, Bopp et al. 1986, ECHA 2017]). | Résultats d’essais in vitro équivoques ; résultats d’essais in vivo négatifs |
| Cancérogénicité (orale) | NR | Aucune preuve d’effets cancérogènes sur la base des données disponibles. | Inclassable (Groupe 3 du CIRC) (CIRC 1999). |
Abréviation : NR = Lecture croisée non requise pour la caractérisation des risques ; DEE = dose d’essai la plus élevée ; DPF = dose d’essai la plus faible ; SDE = la seule dose d’essai ; h = heure, se = semaine.
a Les rats ont reçu un mélange 10/1 de N-cyclohexylsulfamate de sodium et de saccharine sodique dans leur alimentation.
Annexe B. Estimations de l’exposition humaine journalière au N‑cyclohexylsulfamate de sodium et à la cyclohexanamine dans l’eau potable
Le tableau B-1 résume les estimations de l’absorption journalière de N‑cyclohexylsulfamate de sodium et de cyclohexanamine due à l’eau potable, ainsi que les paramètres utilisés pour l’estimation. L’exposition due à d’autres milieux de l’environnement comme l’air, la poussière ou le sol devrait être négligeable.
| Substance | Voie d’exposition | 0 à 5 moisa (nourri au lait maternisé) b | 6 à 11 moisc | 1 and | 2 à 3 anse | 4 à 8 ansf | 9 à 13 ansg | 14 à 18 ansh | 19 ans et plusi |
|---|---|---|---|---|---|---|---|---|---|
| N-cyclohexyl sulfamate de sodium | Eau potablej | 0,54 | 0,34 | 0,13 | 0,12 | 0,09 | 0,07 | 0,07 | 0,08 |
| Cyclohexanamine | L’eau potable | 1,70 | 1,09 | 0,43 | 0,37 | 0,30 | 0,23 | 0,23 | 0,27 |
a Assumé peser 6,3 kg (Santé Canada 2015)
b Uniquement pour les nourrissons nourris au lait maternisé, assumé boire 0,826 L d’eau par jour (Santé Canada 2018 a), l’eau étant utilisée pour reconstituer la préparation. Pour plus de détails sur l’eau potable, voir la note de bas de page.
c Assumé peser 9,1 kg (Santé Canada 2015) et boire 0 L d’eau par jour (Santé Canada 2017). Pour les nourrissons nourris au lait maternisé, assumé boire 0,764 L d’eau par jour (Santé Canada 2018 a), l’eau étant utilisée pour reconstituer la préparation. Pour plus de détails sur l’eau potable, voir la note de bas de page.
d Assumé peser 11,0 kg (Santé Canada 2015) et boire 0,36 L d’eau par jour (Santé Canada 2017)
e Assumé peser 15 kg (Santé Canada 2015) et boire 0,43 L d’eau par jour (Santé Canada 2017).
f Assumé peser 23 kg (Santé Canada 2015) et boire 0,53 L d’eau par jour (Santé Canada 2017).
g Assumé peser 42 kg (Santé Canada 2015) et boire 0,74 L d’eau par jour (Santé Canada 2017).
h Assumé peser 62 kg (Santé Canada 2015) et boire 1,09 L d’eau par jour (Santé Canada 2017).
i Assumé peser 74 kg (Santé Canada 2015) et boire 1,53 L d’eau par jour (Santé Canada 2017).
j L’absorption due à l’eau potable a été estimée en utilisant la concentration maximale mesurée de N‑cyclohexylsulfamate de sodium (4,1 µg/L) dans les eaux souterraines des puits domestiques de la partie sud du bassin hydrographique de la rivière Nottawasaga en Ontario, Canada (Spoelstra et al. 2017). La concentration minimale et la concentration médiane mesurées du N-cyclohexylsulfamate de sodium étaient de 0,09 µg/L et de 0,17 µg/L (estimation à partir de figures) avec une fréquence de détection de 8 % dans 59 échantillons.
k Aucune donnée de surveillance de l’eau potable au Canada n’a été trouvée. La concentration environnementale estimée (CEE) de 13 µg/L a été calculée à l’aide d’un outil interne de modélisation environnementale basé sur la quantité totale déclarée de cyclohexanamine importée (Environnement Canada 2013) et en assumant un taux d’élimination de 83,13 % par le système de traitement des eaux usées tirée de CRE d’ECCC et d’un taux rejet quotidien dans les eaux usées de 4 % (3 % provenant de contenants à résidus et 1 % provenant de résidus dans les lignes de transfert ou les récipients de traitement). Cette CEE a été choisie pour estimer l’absorption journalière due à l’eau potable (Santé Canada, BECSN, Cahier de travail de l’Unité d’évaluation environnementale, modèle interne non publié).
Annexe C. Détails supplémentaires concernant l’estimation de l’exposition humaine quotidienne à l’acide N-cyclohexylsulfamique due à la consommation d’édulcorants de table contenant du N‑cyclohexylsulfamate de sodium
Les données sur la consommation alimentaire tirées de l’Enquête sur la santé dans les collectivités canadiennes (ESCC) (Statistique Canada 2015) ont été utilisées pour évaluer l’exposition. Cette enquête fait la différence entre cinq édulcorants de table différents : aspartame, sucralose, saccharine, glycosides de stéviol et N‑cyclohexylsulfamate. Les estimations de consommation ont été générées spécifiquement à partir de « l’édulcorant N-cyclohexylsulfamate » (code alimentaire 403802). Tel que décrit à la section 6.1.1, la quantité consommée d’édulcorant de table contenant du N-cyclohexylsulfamate de sodium a été convertie en quantité de N-cyclohexylsulfamate de sodium consommée sur la base de sa présence à 32 % en poids, puis convertie en quantité d’acide N-cyclohexylsulfamique en utilisant leurs poids moléculaires relatifs (équation 1).
Acide N-cyclohexylsulfamique = édulcorant (g) × 32 % × 1000 mg/g × (179,234/201,216) ÷ poids corporel (kg)
Équation 1 : Calcul de l’exposition à l’acide N-cyclohexylsulfamique (mg/kg pc par jour) basé sur la consommation d’édulcorant de table à base de N-cyclohexylsulfamate de sodium (g/jour)
Sur environ six mille répondants âgés de moins de 19 ans, personne n’a déclaré avoir consommé du N-cyclohexylsulfamate de sodium. Les expositions estimées n’ont été faites que pour les adultes de 19 ans et plus, parmi lesquels environ 2 % ont déclaré avoir consommé des édulcorants de table contenant du N-cyclohexylsulfamate de sodium. Comme l’inclusion des non-consommateurs, qui représentent plus de 98 % des répondants adultes, aurait fait baisser fortement les expositions estimées, ils n’ont pas été pris en compte dans l’évaluation de l’exposition.
Les estimations de la consommation journalière tirées d’une enquête de rappel de 24 heures sur les aliments donnent un aperçu de l’exposition le jour même de l’enquête. Ces valeurs sont souvent jugées appropriées pour tirer des conclusions sur l’importance de cette exposition pour la santé. Toutefois, certaines évaluations exigent l’adoption d’une procédure d’ajustement pour produire des estimations de l’exposition alimentaire typique plus représentatives à long terme. Environ un tiers des répondants à l’ESCC ont été interrogés un deuxième jour non consécutif afin de pouvoir mesurer la variabilité quotidienne de la consommation, qui est nécessaire pour calculer les apports usuels.
Il existe deux sources de variation dans les données de l’enquête : La variation « intrapersonnelle », la différence de ce qu’une personne donnée mange d’un jour à l’autre, et la variation « entre personnes », la différence entre ce que deux personnes différentes mangent. Il est souhaitable de retenir cette dernière. Par exemple, il est nécessaire d’examiner l’exposition chez les grands consommateurs, c’est-à-dire le 90e percentile de l’exposition dans la présente évaluation. Afin d’estimer les apports usuels sur une plus longue période de temps, il est nécessaire d’éliminer la variation intrapersonnelle tout en préservant la variation entre personnes.
Les absorptions usuelles ont été calculées à l’aide de la méthode d’ajustement du National Cancer Institute (NCI) des États-Unis, qui est implémentée au moyen du langage de programmation SAS (Statistical Analysis System, version 9.3, accessible par SAS Enterprise Guide 5.1, SAS Institute). Cette méthode statistique de détermination d’absorptions usuelles peut être utilisée pour les aliments consommés fréquemment et occasionnellement.
Les estimations de l’exposition alimentaire au N-cyclohexylsulfamate de sodium (sous forme d’acide cyclamique), moyenne et au 90e percentile pour les consommateurs uniquement, ont été calculées à la fois pour la « population générale » (y compris les diabétiques) et pour les personnes atteintes de diabète en tant que sous-population qui, vraisemblablement, consomme des quantités supérieures d’édulcorants de table. Ces estimations et les taux de consommation des édulcorants de table à base de N‑cyclohexylsulfamate de sodium sont présentés dans le tableau C-1. Les données disponibles indiquent que la part du marché des édulcorants de table contenant du N‑cyclohexylsulfamate de sodium a diminué significativement au cours de la dernière décennie (Nielsen 2005-2017).
| Estimations | Groupe d’âge | Moyenne (homme) | Moyenne (femme) |
90e percentile (homme) |
90e percentile (femme) |
|---|---|---|---|---|---|
| Consommation d’édulcorantb (g/jour) | 19 ans et plus (général) | 2,14 | 2,10 | 4,07 | 3,81 |
| Consommation d’édulcorantb (g/jour) | 19 ans et plus (diabète) | 2,06 | 2,06 | 3,88 | 3,81 |
| Consommation d’édulcorants (sachets/jour) c | 19 ans et plus (général) | 2 ou 3 | 2 ou 3 | 5 | 4 ou 5 |
| Consommation d’édulcorants (sachets/jour) c | 19 ans et plus (diabète) | 2 ou 3 | 2 ou 3 | 4 ou 5 | 4 ou 5 |
| Exposition à l’acide N‑cyclohexylsulfamique (mg/kg pc par jour)d | 19 ans et plus (général) | 6,53 | 8,00 | 12,63 | 14,98 |
| Exposition à l’acide N‑cyclohexylsulfamique (mg/kg pc par jour)d | 19 ans et plus (diabète) | 6,28 | 7,67 | 12,15 | 14,57 |
a La teneur assumée de 32 % en N-cyclohexylsulfamate est basée sur la moyenne de trois marques d’édulcorants à base de N-cyclohexylsulfamate en contenant de 30 à 34 %.
b Édulcorant' désigne ici la masse totale de l’édulcorant, y compris les 32 % de N-cyclohexylsulfamate de sodium, ainsi que la masse du vecteur qui comprend le reste.
c Le nombre de sachets d’édulcorant représentant la consommation est fourni pour faciliter la conceptualisation de la quantité. Le poids des paquets est assumé être de 0,8 gramme, ce qui s’est avéré typique parmi les produits disponibles.
d Les poids corporels sont des valeurs déclarées par les répondants à l’enquête, ils varient donc selon les individus.
Annexe D. Paramètres utilisés pour l’estimation de l’exposition humaine au N-cyclohexylsulfamate de sodium et à la cyclohexanamine due à l’utilisation des produits disponibles pour les consommateurs
L’exposition due à l’utilisation des produits disponibles pour les consommateurs a été estimée à l’aide d’algorithmes internes (pour les voies orale, buccale et cutanée) ou de ConsExpo Web (2018) (pour l’inhalation). Les estimations de l’exposition ont été calculées sur la base d’un poids corporel respectif par défaut de 74, 62, 42, 23, 15, 11, 9,1 et 6,3 kg pour les adultes (19 ans et plus), les adolescents (14 à 18 ans), les enfants (9 à 13 ans), les jeunes enfants (4 à 8 ans), les tout-petits âgés de 2 à 3 ans, les enfants de 1 an et de 6 à 11 mois, les enfants de 0 à 5 mois (Santé Canada 2015). Une absorption cutanée de 100 % a été assumée en l’absence de données. Les paramètres utilisés pour l’estimation de l’exposition due à l’utilisation de produits de santé naturels et de drogues sont décrits au tableau D-1.
Scénario de produit |
Paramètres et hypothèses du modèlea |
|---|---|
Supplément de calcium en sirop |
Concentration : 70 mg/dose (1,4 %)b Quantité de la dose : 5 ml (1 c. à table)b Fréquence d’utilisation : 3 fois par jourb Groupe d’âge : adultes uniquement (19 ans et plus)b |
Vitamine D |
Concentration : 1,5 %b Quantité de la dose : 1 mLb Fréquence d’utilisation : 1 fois par jourb Groupe d’âge : 1 à 18 ansb |
Bain de bouche |
Concentration : 0,5%c Quantité de produit ingérée par application : 1 700 mg/utilisation chez les adultes et les adolescents et 1 000 mg/utilisation chez les enfants (9 à 13 ans) (sur la base de la quantité moyenne du produit selon Ficheux et al. 2016 et le facteur d’ingestion de 10 % selon le Scientific Committee on Consumer Safety [SCCS [2015]] Fréquence d’utilisation : 5 fois par jour pour les adultes, les adolescents et les enfants [en fonction du jugement professionnel et de la description du produit] c Groupe d’âge : 9 à 19 ans et plus c |
Sirop contre la congestion pulmonaire |
Concentration : 1,5 %c Quantité de la dose : 10 ml [étiquettes des produits] Fréquence d’utilisation : 4 fois par jour [jusqu’à 7 jours selon les étiquettes de produits similaires]. Groupe d’âge : 12 à 19 ans et plus [étiquettes des produits] |
Solution anesthésique buccale |
Sauf indication contraire, le scénario d’exposition due au rince‑bouche [buccale] a été assumé, sauf indication contraire, basé sur la description du produit et les renseignements généraux d’utilisation. Concentration : 2 %c Fréquence d’utilisation [basée sur un produit similaire] : 8 fois/jour pour les adultesc et 6 fois/jour pour les adolescents, les enfants et les tout-petits [2 à 18 ans]
Quantité de la dose [basée sur un produit similaire] : Adultes et adolescents : 15 mL [4,5 mg/kg pc ou maximum de 300 mg par dose unique]c Enfants [4 à 13 ans] et tout-petits [2 et 3 ans] : 1 mL par 5 kg pc [4 mg/kg pc]
Taux d’ingestion [TI] : Adultes, adolescents et enfants : 10 % de la dose [en assumant le scénario d’exposition buccale due au rince-bouche ; SCCS [2015]] Tout-petits [2 et 3 ans] : 30 % de la dose [en assumant une application d’un produit similaire avec un coton-tige]; TI estimé en fonction du % de produit cosmétique transféré sur la peau à partir de lingettes ; Ficheux et al [2016])
Groupe d’âge : 2 à 19 ans et plus (étiquettes de produits similaires) |
Solution anesthésique topique pour le soulagement de la douleur cutanée |
Scénario d’exposition cutanée due au lait après-soleil assumé en se basant sur la description du produit et les utilisations générales (soulagement temporaire de la douleur associée aux brûlures mineures, aux coups de soleil, aux coupures mineures, aux éraflures, aux piqûres d’insectes et aux irritations mineures de la peauc). Concentration : 2%c
Surface : la moitié de la surface des avant-bras en assumant des coups de soleil sur une petite surface (valeur ajustée de Santé Canada 2018b ; basée sur la mention « Ne pas utiliser en grandes quantités ») sur l’étiquette du produit. Adultes (19 ans et plus) : 637,5 cm2 Adolescents (14 à 18 ans) : 622,5 cm2 Enfants (9 à 13 ans) : 475 cm2 Enfants plus jeunes (3 à 8 ans) : 312,5 cm2
Quantité de produit utilisée par jour par cm2 (Gomez-Berrada et al. 2017) Adultes et adolescents : 0,64 mg/jour/cm2 Enfants (10 à 14 ans) : 1,05 mg/jour/cm2 Enfants plus jeunes (3 à 9 ans) : 1,41 mg/jour/cm2
|
Solution respiratoire pour le traitement des bronchospasmes
|
Quantité d’ingrédient par dose : 3 mg/dosec
Modèle d’exposition : à la vapeur - rejet instantané (RIVM 2006) Fréquence d’utilisation : 4 fois par jour Groupe d’âge : 5 à 19 ans et plus Durée d’exposition : 10 minutes pour chaque traitementc
Volume de la pièce : 1 m³ (le produit est administré à l’aide d’un respirateur ou d’un nébuliseur) Vitesse de ventilation : 2 par heure Taux d’inhalation : 15,1 m³/jour pour les adultes, 15,9 m³/jour pour les adolescents, 13,9 m³/jour pour les enfants (9 à 13 ans) et 11,1 m³/jour pour les enfants (4 à 8 ans). Taux d’absorption : 100 %. |
a Sauf indication contraire, un facteur de rétention de 1 a été utilisé.
b Communication personnelle, courriels de la DPSNSO de SC au BERSE de SC, des 3 mai, 14 mai, 27 juillet , 8 août et 18 septembre 2018; non référencé.
c Communication personnelle, courriels de la DPT de SC au BERSE de SC, datés des 3 mai, 27 juillet, 8 août et 17 septembre 2018; non référencé.
Les paramètres utilisés pour l’estimation de l’exposition par inhalation et par voie cutanée due à l’utilisation de produits disponibles pour les consommateurs sont présentés dans le tableau D-2. Les expositions ont été estimées à l’aide de ConsExpo Web (2018) ou d’autres algorithmes (voir ci-dessous pour plus de détails).
Produit |
Hypothèsesa |
|---|---|
Produit coiffant pour cheveux - laque en aérosol |
Concentration de cyclohexanamine : 0,3 %c Poids moléculaire : 99,2 g/mole Pression de vapeur : 1,3 x 103 Pa
Fréquence d’utilisation : 1,49 fois par jour (19 ans et plus) (Loretz et coll. 2008), 0,63 fois par jour (14 à 18 ans) et 0,64 fois par jour (9 à 13 ans et 4 à 8 ans) (Wu et al. 2010)
Inhalation : Exposition à la vapeur, libération instantanée (RIVM 2006) Durée d’exposition : 5 minutes Quantité du produit : 2,6 g (19 ans et plus) (Loretz et al. 2006), 2,3 (4 à 8, 9 à 13 et 14 à 18 ans) (Ficheux et al. 2016) Volume de la pièce : 10 m3 Vitesse de ventilation : 2 par heure Coefficient de transfert de masse : 10 m/h Concentration limitée à la concentration de saturation dans l’air : oui Température d’application : 20 °C Modèle d’absorption : fraction fixe Fraction d’absorption : 100 %.
Cutanée : Contact direct - application instantanée Zone exposée : 585 cm² (19 ans et plus), 370 cm² (14 à 18 ans), 350 cm² (9 à 13 ans) et 305 cm² (4 à 8 ans) (Santé Canada 2018b) Quantité de produit : 2,6 g (19 ans et plus) (Loretz et al. 2006), (4 à 8, 9 à 13 et 14 à 18 ans) (Ficheux et al. 2016) Facteur de rétention : 0,085 |
Réservoir de gel combustible pour foyer |
Concentration de cyclohexanamine : 0,3 %d
Sauf indication contraire, les valeurs par défaut du scénario d’exposition par huiles essentielles ou désodorisants ont été utilisées (RIVM 2006).
Fréquence d’utilisation : 168 par an
Par inhalation : Exposition à la vapeur, libération instantanée (approche de niveau 1) Durée d’exposition : 4 heures (valeur par défaut scénario d’exposition par huiles essentielles ou désodorisants du RIVM 2006) Quantité de produit : 1107 g (trois cartouches de gel combustible) d Volume de la pièce : 58 m3 (salon) Vitesse de ventilation : 0,5 par heure Vitesse d’inhalation : 15,1 m³/jour pour les adultes, 15,9 m³/jour pour les adolescents, 13,9 m³/jour pour les enfants (9 à 13 ans), 11,1 m³/jour pour les enfants (4 à 8 ans), 9,2 m³/jour (2 à 3 ans) et 3,7 m³/jour (0 à 5 mois). Durée d’émission : 3 heures
Concentration limitée à la concentration de saturation dans l’air : oui Température d’application : 20 °C Modèle d’absorption : fraction fixe Fraction d’absorption : 100 %. |
a Sauf indication contraire, le facteur de rétention est assumé à 1.
b Surface totale de la moitié de la tête.
c Communication personnelle, courriel de la DSPC de SC au BERSE de SC, 14 décembre 2016 (non référencé).
d FS (2018).
Annexe E. Dose journalière admissible (DJA) de N‑cyclohexylsulfamate de sodium
À la suite d’un examen interne de l’acide N-cyclohexylsulfamique et de ses sels, le Canada a adopté un règlement sur les édulcorants à base de N-cyclohexylsulfamate (Canada 1978a), y compris le N-cyclohexylsulfamate de sodium (voir Canada 1978b pour les règlements actualisés sur les édulcorants à base de N-cyclohexylsulfamate). Santé Canada a établi une dose journalière admissible (DJA) de 11 mg/kg pc/jour pour l’acide N-cyclohexylsulfamique (communication personnelle, courriel de la DA de SC au BERSE de SC, 24 octobre 2018; non référencé).
La DJA pour le N-cyclohexylsulfamate de sodium était basée sur l’étude de 13 semaines pour laquelle de la cyclohexanamine a été administrée à des rats et sur l’utilisation de la DSENO établie pour les effets testiculaires (Brune et al. 1978). La conversion en acide N-cyclohexylsulfamique (due au fait que dans les voies gastro‑intestinales le N-cyclohexylsulfamate de sodium se dissocie en anion acide N‑cyclohexylsulfamique et cation de sodium) a été calculée en fonction des poids moléculaires relatifs (PM) de l’acide N-cyclohexylsulfamique et de la cyclohexanamine, ainsi que d’autres facteurs. Le JECFA (1982) a calculé une DJA de 11 mg//kg pc/jour au moyen de la formule [100 mg/kg pc/jour X 2 (poids moléculaire [PM] de l’acide N-cyclohexylsulfamique ÷ PM de la cyclohexanamine) arrondi à 2] ÷ [0,63 (car 63 % du N‑cyclohexylsulfamate est disponible pour conversion en cyclohexanamine) ÷ 0,3 (le taux de conversion du N-cyclohexylsulfamique en cyclohexanaine)] = 1058 mg/kg pc/jour et en appliquant un facteur d’incertitude (FI) de 100. Dans son interprétation des données, le JECFA a supposé que 18,9 % du N-cyclohexylsulfamate est converti en cyclohexanamine par les bactéries intestinales. Il s’agit d’une estimation prudente, car la plupart des études ont montré un taux de conversion inférieur à 10 % dans les modèles animaux et humains. Il est à noter que Santé Canada a calculé la même DJA DQA à partir des données disponibles en 1976 (communication personnelle, courriels de la DA de SC au BERSE de SC, 18 et 24 octobre 2018; non référencé).
Le SCF [2000] a calculé une DJA de 7 mg/kg pc/jour au moyen de la formule suivante : [DSENO X PM] ÷ [taux de conversion X FI] = [100 mg/kg pc/jour X 2] ÷ [32 X 0,85] = 7,35 mg/kg pc/jour. Le SCF [2000] a augmenté le taux de conversion présumé de 18,9 % utilisé par le JECFA [1982] et l’a remplacé par un taux d’absorption et de conversion global de 85 %. En tenant compte de la variabilité entre personnes avec le taux élevé de conversion/absorption, le SCF [2000] a ensuite appliqué un facteur d’incertitude plus faible, le réduisant de 100 à 32.
