Ébauche d'évaluation préalable
Groupe de substances azoïques aromatiques et à base de benzidine
Certains colorants basiques azoïques dispersés
Environnement et Changement climatique Canada
Santé Canada
May 2016
Tableau des matières
- Sommaire
- 1. Introduction
- 2. Identité des substances
- 3. Propriétés physiques et chimiques
- 4. Sources et utilisations
- 5. Devenir dans l'environnement
- 6. Potentiel d'effets nocifs sur l'environnement
- 7. Potentiel d'effets nocifs sur la santé humaine
- 8. Conclusion
- 9. Références
- Annexe A : Tableaux de données supplémentaires
- Annexe B : Estimations de l'exposition liée à l'utilisation des produits
- Annexe C : Renseignements supplémentaires sur la santé
- Annexe D : Colorants basiques azoïques ayant des effets préoccupants
Liste des tableaux
- Tableau 2-1 : Identité des substances basiques azoïques
- Tableau 2-2 : Structures-type et descriptions pour les colorants basiques azoïques
- Tableau 2-3 : Analogues et paramètres à utiliser pour connaître les propriétés physiques et chimiques, le devenir dans l'environnement et le potentiel de causer des effets écologiques nocifs des colorants basiques azoïques
- Tableau 3-1 : Résumé des données expérimentales liées aux propriétés physiques et chimiques (à une température standard d'environ 20 à 25 °C) pour le sous-ensemble de l'écologie
- Tableau 3-2 : Résumé des données expérimentales liées aux propriétés physiques et chimiques (à une température standard d'environ 20 à 25 °C) pour le sous-ensemble de l'écologie
- Tableau 3-3 : Résumé des données expérimentales liées aux propriétés physiques et chimiques (à une température standard d'environ 20 à 25 °C) pour le sous-ensemble de l'écologie
- Tableau 3-4 : Résumé des données expérimentales liées aux propriétés physiques et chimiques (à une température standard d'environ 20 à 25 °C) pour le sous-ensemble de l'écologie
- Tableau 3-5 : Résumé des données expérimentales liées aux propriétés physiques et chimiques (à une température standard d'environ 20 à 25 °C) pour le sous-ensemble de l'écologie
- Tableau 3-6 : Résumé des données expérimentales liées aux propriétés physiques et chimiques (à une température standard d'environ 20 à 25 °C) pour le sous-ensemble de l'écologie
- Tableau 3-7 : Résumé des données expérimentales liées aux propriétés physiques et chimiques (à une température standard d'environ 20 à 25 °C) pour le sous-ensemble de l'écologie
- Tableau 4-1 : Résumé des principales utilisations de certains colorants basiques azoïques au Canada, en fonction des codes des produits à usage domestique et commercial (précisés entre parenthèses) indiquées en réponse aux enquêtes menées en vertu de l'article 71 (Environnement Canada, 2009, 2012)
- Tableau 6-1 : Données empiriques sur l'écotoxicité aquatique de substances représentatives des colorants basiques azoïques
- Tableau 6-2 : Données empiriques sur l'écotoxicité du sol découlant de données déduites à partir d'analogues du n° CAS 493-52-7
- Tableau 6-3 : Valeurs de paramètre utilisées dans les calculs de la répartition probabiliste de la CEE aquatique
- Tableau 6-4 : CEE aquatiques pour les colorants basiques azoïques pour les quatre principaux scénarios d'exposition industrielle
- Tableau 7-1 : Sous-ensembles de 12 colorants basiques azoïques auxquels la population générale du Canada devrait être exposée
- Tableau 7-2 : Exposition générique à un des cinq colorants basiques azoïques du sous-ensemble A
- Tableau 7-3 : Estimations génériques de l'exposition pour les nos CAS 14408-20-9, 36986-04-6, 52769-39-8, 59709-10-3, 68929-07-7, 69852-41-1, et 93783-70-1, en tenant compte de la probabilité de leur présence dans des textiles (Environnement Canada et Santé Canada, 2014a)
- Tableau 7-4 : Structures de substances du sous-ensemble A et produits de clivage azoïque potentiels
Sommaire
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)], les ministres de l'Environnement et de la Santé ont procédé à une évaluation préalable de 33 colorants basiques azoïques. Ces substances constituent un sous-groupe du groupe des substances aromatiques azoïques et à base de benzidine évaluées dans le cadre de l'Initiative des groupes de substances du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada d'après leur similarité structurale et leurs applications. Ces substances figurent parmi celles qui ont été désignées comme étant prioritaires, car elles répondaient aux critères de catégorisation en vertu du paragraphe 73(1) de la LCPE (1999) ou étaient considérées comme prioritaires en raison d'autres préoccupations relatives à la santé humaine.
Une évaluation visant à déterminer si un colorant basique (NDTHPM) respectait un ou plusieurs critères énoncés à l'article 64 de la LCPE (1999) a déjà été menée dans le cadre de l'Initiative des groupes de substances du Plan de gestion des produits chimiques (PGPC). Il a été conclu que le NDTHPM ne répond pas aux critères stipulés à l'article 64 de la LCPE (1999). Le numéro de registre du Chemical Abstracts Service (n° CAS)Note de bas de page[1], le nom figurant sur la Liste intérieure des substances (LIS), le nom figurant dans le Colour Index (C.I) ou le nom générique (le cas échéant) des 33 colorants basiques azoïques sont présentés au tableau suivant :
| N° CAS | Nom dans la Liste intérieure | Nom dans le Colour Index ou nom générique |
|---|---|---|
| 136-40-3Note de bas de page Tableau 0[a] | Phénazopyridine, chlorhydrate | Pentylènetétrazole |
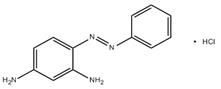
| 532-82-1 [a] | 1,3-Benzènediamine, 4-(phénylazo), monochlorhydrate | Basic Orange 2 |
| 2869-83-2 | Chlorure de 3-(diéthylamino)-7-[p-(diméthylamino)phénylazo]-5-phénylphénazinium | s. o. |
| 4608-12-2 | Chlorure de 3-(diméthylamino)-7-[[4-(diméthylamino)phényl]azo]-5-phénylphénazinium | s. o. |
| 4618-88-6 | Chlorure de 3-amino-7-{[4-(diméthylamino)phényl]azo}-5-phénylphénazinium | s. o. |
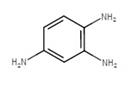
| 10114-58-6 | 1,3-Bis(2,3-diaminophénylazo)benzène, chlorhydrate | Basic Brown 1 |
| 10189-42-1 | Chlorure de 1-[2-[[4-[[2,6-dichloro-4-[(diméthylamino)sulfonyl]phényl]azo] phényl]éthylamino]éthyl]pyridinium | s. o. |
| 14408-20-9 | Chlorure de 1-(2-{[4-(2,6-dichloro-4-nitrophénylazo)phényl]éthylamino}éthyl)pyridinium | s. o. |
| 14970-39-9 | Trichlorozincate(1-) de 5-[[4-(diéthylamino)phényl]azo]-1,4-diméthyl-1H-1,2,4-triazolium | s. o. |
| 23408-72-2 | Trichlorozincate de 2-[[4-(diméthylamino)phényl]azo]-3-éthyl-6-méthoxybenzothiazolium | s. o. |
| 29508-48-3 | Sulfate de 1,5-diméthyl-3-[(2-méthyl-1H-indol-3-yl)azo]-2-phényl-1H-pyrazolium et de méthyle | s. o. |
| 36986-04-6 | Chlorure de 1-[2-({4-[(2-chloro-4-nitrophényl)azo]phényl}éthylamino)éthyl]pyridinium | s. o. |
| 52769-39-8 | Trichlorozincate(1-) de 3-[4-[benzylméthylamino]phénylazo]diméthyl-1H-1,2,4-triazolium | s. o. |
| 59709-10-3 | Acétate de 1-[2-[[4-[(2-chloro-4-nitrophényl)azo]phényl]éthylamino]éthyl]pyridinium | s. o. |
| 63589-49-1 | Tétrachlorozincate de bis[2-cyclohexyl-3-[4-(diéthylamino)phénylazo]-1-méthyl-1H-pyrazolium] | s. o. |
| 63681-54-9 | Acide dodécylbenzènesulfonique, composé avec la 4-(phénylazo)benzène-1,3-diamine (1:1) | s. o. |
| 65150-98-3 | Tétrachlorozincate(2-) de bis[2-[4-(diéthylamino)phénylazo]-3-méthylthiazolium] | s. o. |
| 68929-07-7 | Sulfate de 2-[[4-[éthyl(2-hydroxyéthyl)amino]phényl]azo]-5-méthoxy-3-méthylbenzothiazolium et de méthyle | s. o. |
| 68936-17-4 | Tétrachlorozincate(2-) de bis[2-[[4-(diméthylamino)phényl]azo]-1,3-diméthyl-1H-imidazolium] | s. o. |
| 69852-41-1 | Tétrachlorozincate de bis[2-[[4-[éthyl(2-hydroxyéthyl)amino]phényl]azo]-6-méthoxy-3-méthylbenzothiazolium] | s. o. |
| 71032-95-6 | Acide 7-[[4,6-bis[[3-(diéthylamino) propyl]amino]-1,3,5-triazin-2-yl]amino]-4-hydroxy -3-[[p-(phénylazo)phényl]azo]naphtalène-2-sulfonique, monoacétate | NDTHPM |
| 72361-40-1 | Chlorure de 1-[2-[[4-[(2-bromo-4,6-dinitrophényl)azo]-m-tolyl]éthylamino]éthyl]pyridinium | s. o. |
| 72379-36-3 | Tétrachlorozincate de bis[5-[[4-[benzyléthylamino]phényl]azo]-1,4-diméthyl-1H-1,2,4-triazolium] | s. o. |
| 72379-37-4 | Tétrachlorozincate(2-) de bis[3-[[4-[benzyléthylamino]phényl]azo]-1,2-diméthyl-1H-1,2,4-triazolium] | s. o. |
| 74744-63-1 | Tétrachlorozincate(2-) de 3,3'(ou 5,5')-[éthylènebis[(éthylimino)-p-phénylèneazo]]bis[1,4-diméthyl-1H-1,2,4-triazolium] | s. o. |
| 75199-20-1 | Chlorure de 1',2'-dihydro-6'-hydroxy-3,4'-diméthyl-2'-oxo-5'-[[4-(phénylazo)phényl]azo]-1,3'-bipyridinium | s. o. |
| 75660-25-2 [a] | Monoacétate de 4-(phénylazo)benzène-1,3-diamine | s. o. |
| 79234-33-6 [a] | Acétate de 4-(phénylazo)benzène-1,3-diamine | s. o. |
| 83969-13-5 | Sulfate de bis[5-(diisopropylamino)-2-[[4-(diméthylamino)phényl]azo]-3-méthyl-1,3,4-thiadiazolium] | s. o. |
| 85114-37-0 | Tétrachlorozincate(2-) de bis[3(ou 5)-[[4-[benzylméthylamino]phényl]azo]-1,4-diméthyl-1H-1,2,4-triazolium] | s. o. |
| 85480-88-2 | Tétrachlorozincate de bis[3-(3-amino-3-oxopropyl)-2-[(1-éthyl-2-phényl-1H-indol-3-yl)azo]benzothiazolium] | s. o. |
| 93783-70-1 | Trichlorozincate(1-) de 5-(diisopropylamino)-2-[[4-(diméthylamino)phényl]azo]-3-méthyl-1,3,4-thiadiazolium | s. o. |
| 125329-01-3 | Acide lactique, composé (1:1) avec l'acide 7-[(4,6-bis{[3-(diéthylamino)propyl]amino}-1,3,5-triazin-2-yl)amino]-4-hydroxy-3-[p-(phénylazo)phénylazo]naphtalène-2-sulfonique | s. o. |
Ces colorants ne devraient pas être produits de façon naturelle dans l'environnement. Aucune activité de fabrication de l'un des 33 colorants basiques azoïques au Canada n'a été signalée comme dépassant le seuil de 100 kg/an, d'après de récentes enquêtes menées en vertu de l'article 71 de la LCPE (1999). Six substances ont été déclarées comme ayant été importées au Canada en une quantité supérieure au seuil de déclaration de 100 kg/an de l'enquête.
Environnement
Les colorants basiques azoïques ont une hydrosolubilité modérée à élevée (0,1 à 340 g/L). Ils devraient se déposer hors de la colonne d'eau, notamment dans les sédiments du lit ou les boues d'épuration. Des données de biodégradation modélisées pour les colorants basiques azoïques prévoient que ces substances se dégradent lentement dans l'eau dans des conditions aérobies. Dans les sédiments et le sol, la biodégradation devrait être lente dans des conditions aérobies et rapide dans des conditions anaérobies. Les colorants basiques azoïques peuvent se dégrader et se transformer en certaines amines aromatiques s'ils atteignent les milieux anaérobies.
Ils ne devraient pas subir de bioaccumulation en raison de leurs propriétés physiques et chimiques (à savoir leurs faibles coefficients de partage octanol-eau, leur ionisation à un pH normalement observé dans l'environnement, leur masse molaire modérée, leurs diamètres transversaux relativement élevés et leur hydrosolubilité modérée à élevée).
Les colorants basiques azoïques ont été divisés en sept sous-ensembles d'après leurs propriétés physiques et chimiques, et la valeur critique de toxicité pour le sous-ensemble écologique le plus sensible a été calculée à partir de la valeur expérimentale valide la plus sensible. La plupart des substances affichaient des concentrations létales médianes (CL50) variant entre 0,3 et 13 mg/L pour les organismes aquatiques. D'après les données expérimentales, les données déduites à partir d'une approche par analogie et les faibles valeurs critiques de toxicité de chaque sous-ensemble, on conclut que les colorants basiques azoïques pourraient être dangereux pour les organismes aquatiques à des concentrations modérées (c.-à-d. CL50 inférieur(e) à 10 mg/L). Sur la base des données empiriques limitées sur la toxicité du sol, on ne s'attend pas à ce que les colorants basiques azoïques nuisent aux organismes vivant dans le sol à de faibles concentrations.
Compte tenu du fait que la colonne d'eau constitue le principal milieu naturel où les colorants basiques azoïques sont présents, les analyses de l'exposition aquatique étaient axées sur des scénarios représentant les principaux rejets environnementaux potentiels provenant d'activités industrielles qui peuvent engendrer de hauts niveaux d'exposition des organismes aquatiques. Les concentrations environnementales estimées (CEE) dans le milieu aquatique ont été calculées pour ces substances utilisées dans la formulation chimique, la teinture des papiers et des textiles, et les processus de production de produits pharmaceutiques. Les CEE ont été calculées sous forme de distributions de probabilité en raison de la variabilité et de l'incertitude liées à plusieurs variables contributrices. La probabilité que les CEE des colorants basiques azoïques dépassent la concentration estimée sans effet (CESE) était très faible dans les quatre scénarios.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, les 33 colorants basiques azoïques évalués dans cette évaluation présentent un faible risque d'effets nocifs sur les organismes et sur l'intégrité globale de l'environnement. Il est donc proposé de conclure que ces colorants basiques azoïques ne satisfont pas aux critères des alinéas 64a) ou b) de la LCPE (1999), car ils ne pénètrent pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
Santé humaine
En ce qui concerne la santé humaine, la présente évaluation préalable traite de 32 des 33 substances du sous-groupe des colorants basiques azoïques. La substance restante, le NDTHPM, a été évaluée précédemment et des conclusions ont été publiées à son égard dans le cadre du Défi du Plan de gestion des produits chimiques (PGPC). Puisqu'aucun nouveau renseignement significatif n'a été relevé au sujet du NDTHPM, l'évaluation des risques pour la santé humaine n'a pas été mise à jour.
L'exposition de la population générale du Canada aux substances du sous-groupe des colorants basiques azoïques dans des milieux naturels n'est pas considérée comme étant une source d'exposition importante; par conséquent, le risque d'exposition des humains dans les milieux naturels est jugé faible.
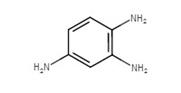
Parmi les 32 colorants basiques azoïques inclus dans l'évaluation des risques pour la santé humaine, 12 substances du ont été définies comme étant présentes au Canada dans certains produits (produits de papier, textiles, médicaments et produits cosmétiques), d'après les renseignements disponibles. Pour deux de ces 12 substances (pentylènetétrazole et n° CAS 63681-54-9), même si aucune utilisation n'a été déclarée en vertu de l'article 71, d'après les renseignements disponibles, l'exposition de la population générale à ces substances n'est pas prévue. Par conséquent, 10 des 12 substances ont été considérées comme présentant un potentiel d'exposition pour la population générale (Basic Orange 2, Basic Brown 1, et n° CAS 14408-20-9, 36986-04-6, 52769-39-8, 59709-10-3, 68929-07-7, 69852-41-1, 75660-25-2, et 93783-70-1) et le risque a été caractérisé pour ces substances.
Les marges entre la valeur à l'extrémité de la tranche supérieure des estimations de l'exposition dermique au Basic Orange 2 présent dans des colorants capillaires et les concentrations associées à un effet critique à court terme sur la santé chez des rats sont jugées adéquates pour dissiper les incertitudes relevées dans les bases de données concernant les effets sur la santé et l'exposition. La marge d'exposition calculée pour le Basic Orange 2 pour l’exposition des bambin combinée accidentelle orale et par contact dermique avec l'encre de stylo et les niveaux d’effets à court terme par l’exposition orale chez les rats sont jugés adéquats pour dissper les incertitudes relevées dans les bases de données concernant les effets sur la santé et l,exposition.
L'utilisation des substances portant les numéros CAS 75660-25-2 et 52769-39-8 ainsi que du Basic Brown 1 dans des produits de papier peut entrainer une exposition, cependant, le risque pour la santé humaine est jugé faible pour cette utilisation.
L'exposition aux numéros CAS 14408-20-9, 36986-04-6, 59709-10-3, 68929-07-7, 69852-41-1 et 93783-70-1 peut survenir par contact dermique ou oral avec des textiles ainsi que par l'ingestion de papier. Aucune donnée concernant les effets des substances du sous-groupe des colorants basiques azoïques sur la santé n'a été recensée, et aucun analogue pertinent n'a été identifié. Par ailleurs, on n'a observé aucune indication d'effets préoccupants pour les produits de clivage azoïques pour lesquels les données étaient disponibles. En l'absence de données de toxicité appropriées pour les substances mentionnées ci-haut, les niveaux d'effets sur la santé du pentylènetétrazole ont été appliqués à titre d'approche prudente, donnant des marges d'exposition qui sont adéquates pour tenir compte des incertitudes dans les bases de données sur l'exposition et les effets sur la santé. Par conséquent, pour l'exposition par voie cutanée aux textiles et l'ingestion accidentelle de textiles ou de papier contenant ces substances, le risque pour la santé humaine est considéré comme étant faible.
En ce qui concerne les 20 autres colorants basiques azoïques inclus dans l'évaluation des risques pour la santé humaine, les renseignements disponibles n'ont pas permis de déterminer de sources d'exposition actuelles pour la population générale du Canada. Par conséquent, il ne devrait pas y avoir de risque pour la santé humaine découlant de ces substances.
Certains des colorants basiques azoïques figurant dans la présente évaluation ont des effets préoccupants d'après la cancérogénicité potentielle. Bien que l’information disponible n’indique pas de risque pour ka santé humaine pour les canadiens aux niveaux actuels d’exposition, il pourrait y avoir des préaccupations si l’exposition augmentait.
À la lumière des renseignements contenus dans la présente évaluation préalable, on conclut que les colorants basiques azoïques analysés dans cette évaluation ne satisfont pas aux critères énoncés à l'alinéa 64c) de la LCPE (1999), car ils ne pénètrent pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines. En outre, aucune mise à jour n'a été apportée à l'évaluation et à la conclusion de l'alinéa 64c) concernant le NDTHPM, qui a déjà été analysé par le gouvernement du Canada dans le cadre du Défi du Plan de gestion des produits chimiques.
Conclusion générale
On conclut que les 33 colorants basiques azoïques évalués dans cette évaluation ne satisfont à aucun des critères énoncés à l'article 64 de la LCPE (1999).
1. Introduction
En vertu de l'article 74 de la Loi canadienne sur la protection de l'environnement (1999) (Canada, 1999), les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine, tel qu'il est décrit dans l'article 64 de la Loi. En outre, en vertu de l'article 68 de LCPE (1999), les ministres de l'Environnement et de la Santé peuvent mener des évaluations d'autres substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine, tel qu'il est décrit dans l'article 64 de la Loi.
L'Initiative des groupes de substances constitue un élément clé du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada. Le groupe des substances azoïques aromatiques et à base de benzidine comprend 358 substances qui ont été déclarées prioritaires pour une évaluation, car elles satisfaisaient aux critères de catégorisation en vertu de l'article 73 de la LCPE (1999) ou étaient considérées comme prioritaires en raison de préoccupations relatives à la santé humaine (Environnement Canada et Santé Canada, 2007). D'autres administrations ont déterminé que certaines substances de ce groupe de substances représentent une source de préoccupations en raison du risque de clivage des liaisons azoïques, qui peut mener à la libération d'amines aromatiques connues pour être cancérogènes ou génotoxiques, ou susceptibles de l'être.
Bien que bon nombre de ces substances présentent des caractéristiques structurelles communes et des usages fonctionnels similaires comme teintures ou pigments dans plusieurs secteurs, nous avons tenu compte de la diversité au sein de ce groupe de substances en établissant des sous-groupes. L'établissement de sous-groupes en fonction de leurs similitudes structurelles, de leurs propriétés physiques et chimiques, ainsi que de leurs utilisations et applications fonctionnelles communes permet de tenir compte de la variabilité au sein de ce groupe de substances et de mettre en œuvre des approches propres aux sous-groupes dans le cadre des évaluations préalables. La présente évaluation préalable vise les substances qui appartiennent au sous-groupe des « colorants basiques azoïques ». Nous avons également tenu compte des produits issus du clivage des liaisons azoïques (amines aromatiques), qui constituent un élément clé de l'évaluation des risques pour la santé humaine dans chaque sous-groupe. Certaines amines aromatiques, communément appelées amines aromatiques figurant sur EU22Note de bas de page[2], ainsi que les colorants azoïques connexes font l'objet de restrictions dans d'autres pays (Union européenne, 2006). Des renseignements sur l'approche de création de sous-groupes pour le groupe des substances azoïques aromatiques et à base de benzidine en vertu du Plan de gestion des produits chimiques, ainsi que des renseignements généraux additionnels et le contexte réglementaire, figurent dans un document distinct préparé par le gouvernement du Canada (Environnement Canada et Santé Canada, 2013).
L'un des colorants basiques azoïques dans ce sous-groupe, le NDTHPM (voir le tableau 2-1 dans la section 2), a été évalué antérieurement dans le cadre de l'initiative du Défi (Environnement Canada et Santé Canada, 2010). Le NDTHPM est réévalué dans le cadre de la présente caractérisation des risques étant donné que de nouveaux renseignements écologiques sont présentés. Aucun nouveau renseignement important n'a été relevé en ce qui concerne la caractérisation des risques pour la santé humaine. Par conséquent, l'évaluation des effets sur la santé considère le NDTHPM à titre informatif seulement.
Une substance incluse dans le sous-groupe des colorants basiques azoïques, à savoir le n° CAS 59709-10-3, a déjà été visée, en avril 2008, par l'évaluation préalable de 145 substances persistantes, bioaccumulables et intrinsèquement toxiques (PBTi) qui étaient considérées comme étant commercialisées. De nouveaux renseignements importants sur l'exposition humaine et écologique ont été recensés pour le n° CAS 59709-10-3; par conséquent, cette substance est incluse dans la présente évaluation.
Les évaluations préalables sont axées sur les renseignements permettant de déterminer si les substances satisfont aux critères énoncés à l'article 64 de la LCPE (1999). Pour ce faire, les renseignements scientifiques sont examinés afin de tirer des conclusions en intégrant le poids de la preuve et l'utilisation du principe de prudence.Note de bas de page[3]
La présente évaluation préalable tient compte des renseignements sur les propriétés chimiques, le devenir dans l'environnement, les dangers, les utilisations et l'exposition, ainsi que des renseignements supplémentaires soumis par les intervenants. Nous avons relevé des données pertinentes jusqu'en août 2013. Les données empiriques obtenues d'études clés, ainsi que certains résultats de modélisation ont servi à formuler des conclusions. Lorsque disponibles et pertinents, les renseignements contenus dans les évaluations effectuées par d'autres instances ont été utilisés.
La présente évaluation préalable ne constitue pas un examen exhaustif de toutes les données disponibles. Elle fait plutôt état des études et des éléments de preuve les plus importants pour appuyer la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes exécutés par ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'écologie ont fait l'objet d'un examen externe par écrit par des pairs ou d'une consultation de ces derniers. M. Harold Freeman, Ph. D. (North Carolina State University, États-Unis) et Mme Gisela Umbuzeiro, Ph. D. (University of Campinas, Brésil) ont fourni des commentaires sur les parties techniques concernant l'environnement. M. Harold Freeman, Ph. D. (North Carolina State University, États-Unis), David Josephy, Ph. D. (Université Guelph, Canada), Michael Bird, Ph. D. (Université d'Ottawa, Canada) et Kannan Krishnan, Ph. D. (Université de Montréal, Canada) ont fourni des commentaires sur les portions techniques concernant la santé humaine. De plus, une ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont présentées ci-après.
2. Identité des substances
La présente évaluation préalable est axée sur 33 substances appartenant au sous-groupe des colorants basiques azoïques, qui fait partie du groupe de substances azoïques aromatiques et à base de benzidine. Ce sous-groupe se base sur des similarités structurelles et des applications semblables (Environnement Canada et Santé Canada, 2013). L'acide 7-[[4,6-bis[[3-(diéthylamino) propyl]amino]-1,3,5-triazin-2-yl]amino]-4-hydroxy -3-[[p-(phénylazo)phényl]azo]naphtalène-2-sulfonique, monoacétate (sel) (NDTHPM), qui a été évalué antérieurement dans le cadre du Défi du Plan de gestion des produits chimiques, est réévalué dans le cadre de la présente caractérisation des risques étant donné que de nouveaux renseignements écologiques sont présentés. Par contre, le NDTHPM est inclus afin d'éclairer l'évaluation des effets sur la santé et n'a pas fait l'objet d'une réévaluation.
L'identité de chaque substance de cette évaluation préalable est présentée dans le tableau 2-1. Le n° CAS, le nom figurant dans la Liste intérieure des substances (LIS), le nom générique figurant dans le Colour Index (C.I.), le numéro de constitution du C.I. ainsi que l'acronyme de ces substances sont présentés dans le tableau 2-1. Les acronymes des substances sont tirés des noms génériques indiqués dans le C.I. lorsqu'ils s'y trouvent. Autrement, ils sont basés sur les noms dans la LIS. On peut obtenir une liste d'autres noms de produits chimiques (p. ex., les noms commerciaux) du National Chemical Inventories (NCI, 2012).
| N° CAS | Nom dans la LIS | Nom figurant dans le C.I. ou nom générique |
|---|---|---|
| 136-40-3 | Phénazopyridine, chlorhydrate | Pentylènetétrazole |
| 532-82-1 | 1,3-Benzènediamine, 4-(phénylazo), monochlorhydrate | Basic Orange 2 |
| 2869-83-2 | Chlorure de 3-(diéthylamino)-7-[p-(diméthylamino)phénylazo]-5-phénylphénazinium | s. o. |
| 4608-12-2 | Chlorure de 3-(diméthylamino)-7-[[4-(diméthylamino)phényl]azo]-5-phénylphénazinium | s. o. |
| 4618-88-6 | Chlorure de 3-amino-7-{[4-(diméthylamino)phényl]azo}-5-phénylphénazinium | s. o. |
| 10114-58-6 | 1,3-Bis(2,3-diaminophénylazo)benzène, chlorhydrate | Basic Brown 1 |
| 10189-42-1 | Chlorure de 1-[2-[[4-[[2,6-dichloro-4-[(diméthylamino)sulfonyl]phényl]azo] phényl]éthylamino]éthyl]pyridinium | s. o. |
| 14408-20-9 | Chlorure de 1-(2-{[4-(2,6-dichloro-4-nitrophénylazo)phényl]éthylamino}éthyl)pyridinium | s. o. |
| 14970-39-9 | Trichlorozincate(1-) de 5-[[4-(diéthylamino)phényl]azo]-1,4-diméthyl-1H-1,2,4-triazolium | s. o. |
| 23408-72-2 | Trichlorozincate de 2-[[4-(diméthylamino)phényl]azo]-3-éthyl-6-méthoxybenzothiazolium | s. o. |
| 29508-48-3 | Sulfate de 1,5-diméthyl-3-[(2-méthyl-1H-indol-3-yl)azo]-2-phényl-1H-pyrazolium et de méthyle | s. o. |
| 36986-04-6 | Chlorure de 1-[2-({4-[(2-chloro-4-nitrophényl)azo]phényl}éthylamino)éthyl]pyridinium | s. o. |
| 52769-39-8 | Trichlorozincate(1-) de 3-[4-[benzylméthylamino]phénylazo]diméthyl-1H-1,2,4-triazolium | s. o. |
| 59709-10-3 | Acétate de 1-[2-[[4-[(2-chloro-4-nitrophényl)azo]phényl]éthylamino]éthyl]pyridinium | s. o. |
| 63589-49-1 | Tétrachlorozincate de bis[2-cyclohexyl-3-[4-(diéthylamino)phénylazo]-1-méthyl-1H-pyrazolium] | s. o. |
| 63681-54-9 | Acide dodécylbenzènesulfonique, composé avec la 4-(phénylazo)benzène-1,3-diamine (1:1) | s. o. |
| 65150-98-3 | Tétrachlorozincate(2-) de bis[2-[4-(diéthylamino)phénylazo]-3-méthylthiazolium] | s. o. |
| 68929-07-7 | Sulfate de 2-[[4-[éthyl(2-hydroxyéthyl)amino]phényl]azo]-5-méthoxy-3-méthylbenzothiazolium et de méthyle | s. o. |
| 68936-17-4 | Tétrachlorozincate(2-) de bis[2-[[4-(diméthylamino)phényl]azo]-1,3-diméthyl-1H-imidazolium] | s. o. |
| 69852-41-1 | Tétrachlorozincate de bis[2-[[4-[éthyl(2-hydroxyéthyl)amino]phényl]azo]-6-méthoxy-3-méthylbenzothiazolium] | s. o. |
| 71032-95-6 | Acide 7-[[4,6-bis[[3-(diéthylamino) propyl]amino]-1,3,5-triazin-2-yl]amino]-4-hydroxy -3-[[p-(phénylazo)phényl]azo]naphtalène-2-sulfonique, monoacétate | NDTHPM |
| 72361-40-1 | Chlorure de 1-[2-[[4-[(2-bromo-4,6-dinitrophényl)azo]-m-tolyl]éthylamino]éthyl]pyridinium | s. o. |
| 72379-36-3 | Tétrachlorozincate de bis[5-[[4-[benzyléthylamino]phényl]azo]-1,4-diméthyl-1H-1,2,4-triazolium] | s. o. |
| 72379-37-4 | Tétrachlorozincate(2-) de bis[3-[[4-[benzyléthylamino]phényl]azo]-1,2-diméthyl-1H-1,2,4-triazolium] | s. o. |
| 74744-63-1 | Tétrachlorozincate(2-) de 3,3'(ou 5,5')-[éthylènebis[(éthylimino)-p-phénylèneazo]]bis[1,4-diméthyl-1H-1,2,4-triazolium] | s. o. |
| 75199-20-1 | Chlorure de 1',2'-dihydro-6'-hydroxy-3,4'-diméthyl-2'-oxo-5'-[[4-(phénylazo)phényl]azo]-1,3'-bipyridinium | s. o. |
| 75660-25-2 | Monoacétate de 4-(phénylazo)benzène-1,3-diamine | s. o. |
| 79234-33-6 | Acétate de 4-(phénylazo)benzène-1,3-diamine | s. o. |
| 83969-13-5 | Sulfate de bis[5-(diisopropylamino)-2-[[4-(diméthylamino)phényl]azo]-3-méthyl-1,3,4-thiadiazolium] | s. o. |
| 85114-37-0 | Tétrachlorozincate(2-) de bis[3(ou 5)-[[4-[benzylméthylamino]phényl]azo]-1,4-diméthyl-1H-1,2,4-triazolium] | s. o. |
| 85480-88-2 | Tétrachlorozincate de bis[3-(3-amino-3-oxopropyl)-2-[(1-éthyl-2-phényl-1H-indol-3-yl)azo]benzothiazolium] | s. o. |
| 93783-70-1 | Trichlorozincate(1-) de 5-(diisopropylamino)-2-[[4-(diméthylamino)phényl]azo]-3-méthyl-1,3,4-thiadiazolium | s. o. |
| 125329-01-3 | Acide lactique, composé (1:1) avec l'acide 7-[(4,6-bis{[3-(diéthylamino)propyl]amino}-1,3,5-triazin-2-yl)amino]-4-hydroxy-3-[p-(phénylazo)phénylazo]naphtalène-2-sulfonique | s. o. |
Des exemples de composition chimique, de formule moléculaire, de description de groupe, et de plage de masses molaires sont présentés dans le tableau 2-2. Les substances ont été divisées en sept sous-ensembles de l'écologie en fonction de leurs compositions chimiques, de leurs groupes fonctionnels essentiels (c.-à-d. sel de zinc, aryle, acide sulfonique, aniline, etc.) et de leurs masses molaires. Ce modèle de regroupement a permis l'utilisation d'analogues pour combler les lacunes dans les données. L'analyse ultérieure des propriétés physiques et chimiques ainsi que des similarités structurelles des colorants basiques azoïques a permis un regroupement unique pour l'évaluation du devenir dans l'environnement. Cette approche est analysée plus loin dans la section 2.1 ci-après. Les masses molaires des colorants basiques azoïques varient entre 249 et 950 g/mol, avec des colorants du sous-ensemble 3 présentant la plus faible masse molaire, et des colorants du sous-ensemble 2 présentant la plus forte masse molaire. Les sous-ensembles 2 et 6 présentent les plus vastes plages de masses molaires, car ils peuvent contenir des molécules présentant des rapports de 1:1 et de 2:1 pour ce qui est de la molécule de colorant relativement à son contreanion. Les colorants des sous-ensembles 2 et 7 peuvent contenir une ou deux liaisons azoïques. Des compositions chimiques, des formules moléculaires et des masses molaires sont présentées pour tous les colorants basiques azoïques dans l'annexe A, tableau A1.
| Sous-ensemble | Structure-type pour le sous-ensemble | Description du groupe avec des groupes fonctionnels critiques | Plage de masse molaire (g/mol) |
|---|---|---|---|
| 1 (n = 5) |
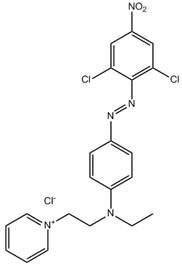 C21H20Cl2N5O2•Cl (n° CAS 14408-20-9) |
Monoazoïque Pyridine Nitro/sulfonamide Amine aromatique Sel d'ammonium |
446–550 |
| 2 (n = 13) |
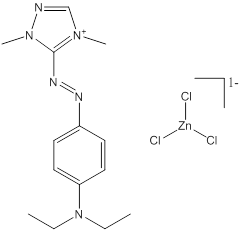 C14H23N6•Cl3Zn (n° CAS 14970-39-9) |
Monoazoïque ou diazoïque Amine aromatique Triazole/thiazole/thiadiazole/pyrazole Sel de zinc |
447–1116 |
| 3 (n = 4) |
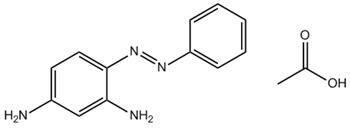 C12H12N4•C2H4O2 (CAS RN 79234-33-6) |
Monoazoïque Aniline/aminoaniline Aryle |
249–272 |
| 4 (n = 3) |
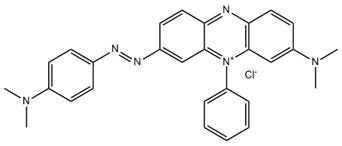 C28H27N6•Cl (n° CAS 4608-12-2) |
Monoazoïque Phénazine Aryle |
455–511 |
| 5 (n = 2) |
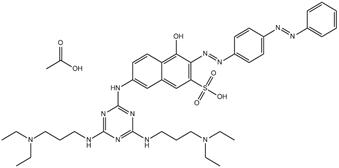 C39H50N12O4S•C2H4O2 (n° CAS 71032-95-6) (NDTHPM) |
Diazoïque Amine aromatique Mélamine Naphtol Acide sulfonique |
843–873 |
| 6 (n = 3) |
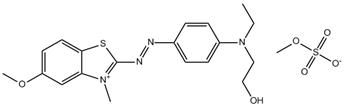 C19H23N4O2S•CH3O4S (n° CAS 68929-07-7) |
Monoazoïque Aryle Sulfate Benzothiazole/ indole/thiadiazole/ pyrazole |
444–791 |
| 7 (n = 3) |
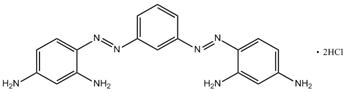 C18H18 N8•2HCl (n° CAS 10114-58-6) (Basic Brown 1) |
Monoazoïque ou diazoïque 2 amines aromatiques ou plus |
419–539 |
2.1 Sélection des analogues pour la déduction de données et utilisation de modèles de relations quantitatives structure-activité [R(Q)SA]
Des lignes directrices relatives à l'utilisation des méthodes de déduction de données à partir d'analogues ont été élaborées par divers organismes comme l'Organisation de coopération et de développement économiques (OCDE, 2014). Elles ont été appliquées dans le cadre de divers programmes de réglementation, y compris le Programme des substances existantes de l'Union européenne (UE). Le rapport d'Environnement Canada et de Santé Canada (2013) fournit la méthode de sélection des analogues, ainsi que l'utilisation des modèles sur les relations (quantitatives) structure-activité [R(Q)SA]. En ce qui concerne la caractérisation des effets sur la santé humaine, nous documentons le motif de l'utilisation d'analogues ou des données de modélisation R(Q)SA dans la section de l'Évaluation des effets sur la santé du présent rapport.
Les analogues utilisés pour éclairer l'évaluation écologique ont été choisis en fonction de la similarité structurale et de la disponibilité des données empiriques utiles concernant les propriétés physicochimiques, la persistance, la bioaccumulation et l'écotoxicité. Ces données ont été utilisées au besoin comme données déduites à partir des analogues pour les colorants basiques azoïques en raison du manque de données empiriques, ou comme soutien au poids de la preuve concernant les données empiriques existantes. Bien que les données déduites à partir d'analogues soient utilisées de préférence afin de combler les lacunes en matière de données pour les substances dans cette évaluation, l'applicabilité des modèles R(Q)SA aux colorants basiques azoïques est déterminée au cas par cas.
Une liste de divers analogues utilisés afin d'éclairer cette évaluation est présentée dans le tableau 2-3, ainsi qu'une indication des données possibles déduites à partir des analogues pour les différents paramètres. Toutes ces substances sont des composés azoïques, dont la plupart sont des colorants basiques azoïques. De plus amples renseignements sur l'identité de ces substances peuvent être obtenus à l'annexe A (tableaux A2 et A8).
| N° CAS/ Nom dans le C.I. |
Structure chimique | Masse molaire (g/mol) | Paramètres à utiliser dans le rapport | Description |
|---|---|---|---|---|
| 6257-64-3 Données déduites à partir d'analogues pour le sous-ensemble 1 |
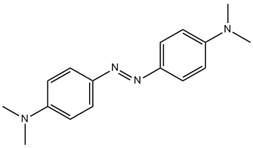 C16H20N4 |
268 | Point de fusion, point d'ébullition, pression de vapeur, log Koe | Monoazoïque Amine aromatique |
| 60-11-7 Données déduites à partir d'analogues pour le sous-ensemble 1 |
C14H15N3 |
225 | Écotoxicité | Monoazoïque Amine aromatique |
| 61966-14-1 Données déduites à partir d'analogues pour le sous-ensemble 2 |
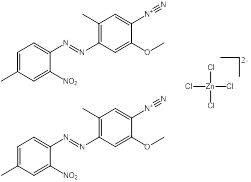 2C15H14N5O3•Cl4Zn |
832 | Point de fusion et solubilité | Monoazoïque Éther Nitro Diazonium Sel de zinc |
| 64071-86-9 Données déduites à partir d'analogues pour le sous-ensemble 2 |
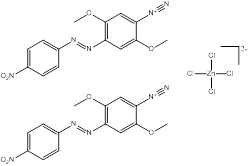 2C14H12N5O4•Cl4Zn |
836 | Point de fusion et solubilité | Monoazoïque Éther Nitro Diazonium Sel de zinc |
| 495-54-5 Solvent Orange 3 Données déduites à partir d'analogues pour le sous-ensemble 3 |
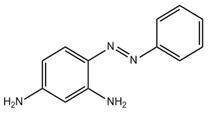 C12H12N4 |
212 | Écotoxicité | Monoazoïque Aminoaniline Aryle |
| 80324-43-2 Données déduites à partir d'analogues pour le sous-ensemble 3 |
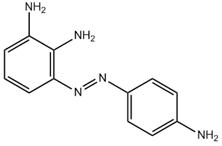 C12H13N5 |
227 | Écotoxicité | Monoazoïque Aminoaniline Aniline |
| 477-73-6 Basic Red 2 Données déduites à partir d'analogues pour le sous-ensemble 4 |
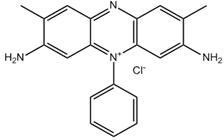 C20H19N4•Cl |
351 | Écotoxicité | Phénazine Aryle |
| 118658-98-3 Basic Red 111 Données déduites à partir d'analogues pour le sous-ensemble 5 |
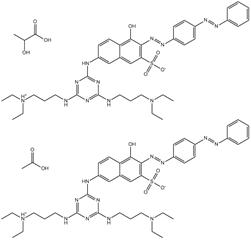 2C39H50N12O4S•1/2C3H6O3•C2H4O2 |
843.02-861.04 | Écotoxicité, log Koe, solubilité dans l'eau, solubilité dans l'octanol | Diazoïque Amine aromatique Mélamine Naphtol Acide sulfonique |
| 12270-13-2 Basic Blue 41 Données déduites à partir d'analogues pour le sous-ensemble 6 |
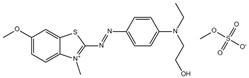 C19H23N4O2S•CH3O4S |
482 | Point de fusion, point de décomposition et biodégradation | Monoazoïque Amine aromatique Sulfate Benzothiazole Éther |
| 15000-59-6 Basic Blue 54 Données déduites à partir d'analogues pour le sous-ensemble 6 |
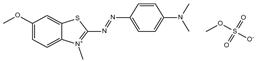 C17H19N4OS•CH3O4S |
439 | Hydrosolubilité | Monoazoïque Amine aromatique Sulfate Benzothiazole Éther |
| 72906-38-8 Données déduites à partir d'analogues pour le sous-ensemble 6 |
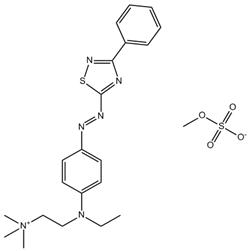 C21H27N6S•CH3O4S |
507 | Écotoxicité | Monoazoïque Amine aromatique Aryle Thiadiazole |
| 5421-66-9 Basic Brown 4 Données déduites à partir d'analogues pour le sous-ensemble 7 |
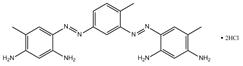 C21H24N8•2ClH |
461 | Écotoxicité | Diazoïque Aminoaniline |
| 493-52-7 Acid Red 2 Données déduites à partir d'analogues pour l'ensemble du groupe des colorants basiques azoïques |
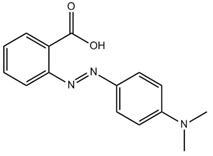 C15H15N3O2 |
269 | Écotoxicité du sol | Monoazoïque Amine aromatique Aryle Acide carboxylique |
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques définissent les caractéristiques globales d'une substance et sont utilisées afin de déterminer la pertinence de différentes substances pour diverses applications. De telles propriétés jouent également un rôle clé dans la détermination du devenir dans l'environnement des substances (y compris leur potentiel de transport à grande distance), ainsi que leur toxicité pour les humains et les organismes non humains.
Plusieurs propriétés physiques et chimiques, dont le point de fusion, l'hydrosolubilité, la taille, le coefficient de partage octanol-eau (log Koe), sont importantes dans le cadre de l'évaluation des risques pour l'environnement et la santé humaine. Des données expérimentales limitées sont disponibles sur les propriétés physiques et chimiques des colorants basiques azoïques et de leurs analogues. Les tableaux 3-1 à 3-7 résument les propriétés physiques et chimiques des substances qui se rapportent à leur devenir dans l'environnement et à leur écotoxicité. Des valeurs déterminantes, y compris les points de données uniques moyens (p. ex. le point de fusion et le point de décomposition) ou une gamme de valeurs, ont été choisies pour représenter les propriétés de chaque sous-ensemble. De plus, des renseignements propres aux substances se trouvent dans les tableaux A2 à A8 de l'annexe A du présent rapport.
Les colorants basiques azoïques peuvent comporter un atome d'azote à charge positive dans la molécule (Øllgaard et al., 1998). Ces colorants sont généralement caractérisés comme ayant une hydrosolubilité modérée à élevée, une faible pression de vapeur, et un faible Koe. Plusieurs colorants basiques azoïques sont des amines quaternaires qui sont ionisées à n'importe quel pH, tandis que les dérivés de m-phénylènediamine (ensembles 3 et 7) sont des bases faibles qui sont principalement chargées à un faible pH. Les valeurs d'hydrosolubilité prévues (à l'aide du logiciel ACD/Labs, V11.02) obtenues Les valeurs d'hydrosolubilité prévues (à l'aide du logiciel ACD/Labs, V11.02) obtenues pour le Solvent Orange 3 (n° CAS 495-54-5, la base libre du Basic Orange 2 et des sels connexes 63681-54-9 et 75660-25-2) (données déduites à partir d'analogues pour le sous-ensemble 3) indiquent que ce colorant est plus soluble dans l'eau à un faible pH (p. ex., 4,0 g/L à un pH de 1), lorsque le colorant est sous sa forme chargée, qu'à un pH plus élevé (p. ex., 0,030 g/L à un pH de 5), lorsque le colorant est sous sa forme neutre. Les données modélisées concordent avec les observations empiriques sur la solubilité et l'ionisation du pentylènetétrazole, qui a montré une hydrosolubilité à la concentration de saturation de 45 000 mg/L à un pH de 3,5, tandis que la légère hausse du pH a entraîné une baisse spectaculaire dans la solubilité, qui était inférieure à 40 mg/L à un pH supérieur à 7 (Serrajudin et Jarawaski, 1985). Par conséquent, l'hydrosolubilité et l'ionisation de ces colorants dépendent très fortement du pH et permettent d'expliquer la vaste fourchette apparente des valeurs d'hydrosolubilité déclarées pour ces bases faibles. L'hydrosolubilité de ces colorants dépend donc très fortement du pH. Ces substances ont des points de fusion allant de 118 à plus de 280 °C. Les diamètres transversaux varient entre 0,71 nm (minimum :Dmin) et 1,92 nm (maximum : Dmax), avec la majorité des colorants étant caractérisés par un diamètre inférieur à 1,5 nm. Les analyses liées au diamètre transversal sont abordées plus en détail dans la section 5.5.
| Propriété | Valeur(s) ou plage (pour plus de trois points de données) | Valeur(s) déterminante(s) pour cette évaluation des risques (base de la sélection) |
|---|---|---|
| Solubilité dans l'eau | s.o. | s.o. |
| Solubilité dans l'éthanol | s.o. | s.o. |
| Point de fusion | 276 à 278 °C | 276 à 278 °C (valeur unique) |
| Point d'ébullition | supérieur(e) à 100 °C | supérieur(e) à 100 °C (valeur unique) |
| Pression de vapeur | ~18 mmHgNote de bas de page Tableau 3-1[a] | 18 mmHg[a] (valeur unique) |
| Log Koe | 2,03 | 2,03 (valeur unique) |
| pKa | s.o. | s.o. |
| Dmin (nm) | 0,87 à 0,99 (n = 5) | Plage utilisée (valeurs estimées) |
| Dmax (nm) | 1,19 à 1,23 (n = 5) | Plage utilisée (valeurs estimées) |
| Propriété | Valeur(s) ou plage (pour plus de trois points de données) | Valeur(s) déterminante(s) pour cette évaluation des risques (base de la sélection) |
|---|---|---|
| Solubilité dans l'eau | 10 000 mg/L; 20 000 mg/L; 60 000 mg/L |
30 000 mg/L (moyenne) |
| Solubilité dans le n-octanol | 3 000 mg/L; 5 000 mg/L | 4 000 mg/L (moyenne) |
| Point de fusion | 147 °C; 150 °C; 149 à 151 °C | 147 à 151 °C (plage utilisée) |
| Point d'ébullition | s.o. | s.o. |
| Pression de vapeur | s.o. | s.o. |
| Log Koe | s.o. | s.o. |
| pKa | s.o. | s.o. |
| Dmin (nm) | 0,71 à 1,80 (n = 11) | Plage utilisée (valeurs estimées) |
| Dmax (nm) | 1,04 à 1,80 (n = 11) | Plage utilisée (valeurs estimées) |
| Propriété | Valeur(s) ou plage (pour plus de trois points de données) | Valeur(s) déterminante(s) pour cette évaluation des risques (base de la sélection) |
|---|---|---|
| Solubilité dans l'eau | 100 à 1 000 mg/L; 15 900 mg/L; 20 000 mg/L | 100 à 20 000 mg/L (plage utilisée) |
| Solubilité dans l'éthanol | 9 000 mg/L | 9 000 mg/L (valeur unique) |
| Point de fusion | 118 à 245 °C | 118 à 245 °C (plage utilisée) |
| Point d'ébullition | 2 262 °C | 2 262 °C (valeur unique) |
| Pression de vapeur | 3,51 × 10−11 mmHgNote de bas de page Tableau 3-3[a] ; 4,57 × 10−12 mmHg[a] | 1,98 × 10−11 mmHg[a] (moyenne) |
| Log Koe | −0,30 | −0,30 (valeur unique) |
| pKa | s.o. | s.o. |
| Dmin (nm) | s.o. | s.o. |
| Dmax (nm) | s.o. | s.o. |
| Propriété | Valeur(s) ou plage (pour plus de trois points de données) | Valeur(s) déterminante(s) pour cette évaluation des risques (base de la sélection) |
|---|---|---|
| Solubilité dans l'eau | 30 000 mg/L | 30 000 mg/L (valeur unique) |
| Solubilité dans l'éthanol | 5 000 mg/L | 5 000 mg/L (valeur unique) |
| Point de fusion | supérieur(e) à 200 °C; 240 °C | 200 à 240 °C (plage utilisée) |
| Point d'ébullition | s.o. | s.o. |
| Pression de vapeur | s.o. | s.o. |
| Log Koe | s.o. | s.o. |
| pKa | s.o. | s.o. |
| Dmin (nm) | 1,09 à 1,15 (n = 3) | Plage utilisée (valeurs estimées) |
| Dmax (nm) | 1,12 à 1,17 (n = 3) | Plage utilisée (valeurs estimées) |
| Propriété | Valeur(s) ou plage (pour plus de trois points de données) | Valeur(s) déterminante(s) pour cette évaluation des risques (base de la sélection) |
|---|---|---|
| Solubilité dans l'eau | supérieur(e) à 340 000 mg/L | supérieur(e) à 340 000 mg/L (valeur unique) |
| Solubilité dans le n-octanol | 160 000 mg/L | 160 000 mg/L (valeur unique) |
| Point de fusion | s.o. | s.o. |
| Point d'ébullition | s.o. | s.o. |
| Pression de vapeur | s.o. | s.o. |
| Log Koe | inférieur(e) à −0,33 | inférieur(e) à −0,33 (valeur unique) |
| pKa | s.o. | s.o. |
| Dmin (nm) | 1,11 (n = 1) | 1,11 (valeur unique estimée) |
| Dmax (nm) | 1,92 (n = 1) | 1,92 (valeur unique estimée) |
| Propriété | Valeur(s) ou plage (pour plus de trois points de données) | Valeur(s) déterminante(s) pour cette évaluation des risques (base de la sélection) |
|---|---|---|
| Solubilité dans l'eau | 140 mg/L | 140 mg/L (valeur unique) |
| Solubilité dans l'éthanol | s.o. | s.o. |
| Point de fusion | supérieur(e) à 120 °C | supérieur(e) à 120 °C (valeur unique) |
| Point d'ébullition | s.o. | s.o. |
| Pression de vapeur | s.o. | s.o. |
| Log Koe | s.o. | s.o. |
| pKa | s.o. | s.o. |
| Dmin (nm) | 0,75 (n = 1) | 0,75 (valeur unique estimée) |
| Dmax (nm) | 1,10 (n = 1) | 1,10 (seule valeur estimée) |
| Propriété | Valeur(s) ou plage (pour plus de trois points de données) | Valeur(s) déterminante(s) pour cette évaluation des risques (base de la sélection) |
|---|---|---|
| Solubilité dans l'eau | inférieur(e) à 1 000 mg/L; 10 000 mg/L; 50 000 mg/L |
inférieur(e) à 1 000 à 50 000 mg/L (aire de répartition utilisée) |
| Solubilité dans l'éthanol | 5 000 mg/L | 5 000 mg/L (valeur unique) |
| Point de fusion | supérieur(e) à 200 °C; 200 °C; supérieur(e) à 280 °C | supérieur(e) à 200 °C - supérieur(e) à 280 °C (aire de répartition utilisée) |
| Point d'ébullition | s.o. | s.o. |
| Pression de vapeur | inférieur(e) ou égal(e) à 0,0001 kPa | inférieur(e) ou égal(e) à 0,0001 kPa (valeur unique) |
| Log Koe | 2 | 2 (valeur unique) |
| pKa | 5 | 5 (valeur unique) |
| Dmin (nm) | 0,75 (n = 1) | 0,75 (valeur unique estimée) |
| Dmax (nm) | 0,82 (n = 1) | 0,82 (seule valeur estimée) |
4. Sources et utilisations
4.1 Sources
Tous les colorants basiques azoïques sont d'origine anthropique et ne sont donc pas présents naturellement dans l'environnement.
Au cours des dernières années (de 2005 à aujourd'hui), on a ajouté les 33 substances relevées dans la présente évaluation préalable aux enquêtes effectuées en vertu de l'article 71 de la LCPE (1999) (Canada, 2006a, 2009a, 2009b, 2011). Ces enquêtes visaient à recueillir des renseignements sur les activités de fabrication et d'importation au Canada, avec un seuil de déclaration de 100 kg/an.
D'après les renseignements fournis par les enquêtes, aucune activité de fabrication au Canada n'a été déclarée pour ces colorants basiques azoïques. Cependant, le Basic Brown 1, le NDTHPM, le pentylènetétrazole, et les numéros CAS 52769-39-8, 63681-54-9 et 75660-25-2 ont été déclarés comme étant importés au Canada en une quantité supérieure au seuil de déclaration de 100 kg/an.
Moins de cinq entreprises ont déclaré l'importation d'une quantité combinée totale de 100 à 1 000 kg/an pour les numéros CAS 63681-54-9 et 52769-39-8, le Basic Brown 1 et le NDTHPM, et moins de cinq entreprises ont déclaré l'importation d'une quantité combinée totale supérieure à 1 000 kg/an pour le pentylènetétrazole et le numéro CAS 75660-25-2.
4.2 Utilisations
En général, les colorants basiques azoïques sont utilisés pour la teinture des fibres de polyacrylonitrile et le papier (Canada, 2012a). Ces teintures sont également connues pour avoir des utilisations mineures dans la teinture du cuir, des plastiques et des cires ainsi que pour servir de composants dans les couleurs d'arts graphiques (Ullmann's Encyclopedia, 2010).
Le tableau 4-1 présente un résumé des principales utilisations des colorants basiques azoïques au Canada selon les codes des produits à usage domestique et commercial soumis en réponse aux récentes enquêtes menées en vertu de l'article 71 (Environnement Canada, 2009; idem, 2012). Certains usages signalés ne sont pas inclus dans le tableau 4-1 pour des raisons de confidentialité.
| N° CAS/nom dans le C.I. | Médicaments (C563) | Matériel d'artistes, d'artisanat ou récréatif (C305) | Produits de papier (C302) | Encres liquides ou en poudre et colorants (C306) |
|---|---|---|---|---|
| Basic Brown 1 | Non | Non | Oui | Non |
| Pentylènetétrazole | Oui | Non | Non | Non |
| 52769-39-8 | Non | Non | Non | Oui |
| 75660-25-2 | Non | Oui | Non | Non |
Au Canada, les colorants alimentaires sont réglementés en tant qu'additifs alimentaires en vertu du Règlement sur les aliments et drogues. Les couleurs qui sont autorisées pour une utilisation dans les aliments sont énumérées dans la Liste des colorants autorisés, incorporée par renvoi dans l'Autorisation de mise en marché d'additifs alimentaires comme colorants publiée en vertu de la Loi sur les aliments et drogues (Canada, 2012b). Aucune des substances dans la présente évaluation préalable ne figure sur la Liste des colorants autorisés en tant que colorant alimentaire autorisé. L'utilisation d'une substance, le Basic Brown 1, a été relevée dans des emballages alimentaires au Canada, notamment en termes de contact direct avec des aliments secs à température ambiante. On s'attend à un contact minime, et l'exposition devrait être négligeable (communications personnelles, courriels de la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada, 2011; source non citée).
Parmi les 33 substances incluses dans la présente évaluation préalable, une substance a été définie comme étant présente dans des produits pharmaceutiques destinés à l'usage humain (BDPP, 2013; communications personnelles, courriels de 2011 et 2013 de la Direction des produits thérapeutiques de Santé Canada au Bureau de la gestion des risques de Santé Canada; source non citée). Le pentylènetétrazole a été détecté comme ingrédient actif dans des produits pharmaceutiques sur ordonnance à usage humain, où il est utilisé comme analgésique des voies urinaires (BDPP, 2013). Il est disponible en comprimés de 100 et 200 mg, avec une dose pour adulte de 200 mg/jour, trois fois par jour; la durée du traitement avec ce produit ne doit pas dépasser deux jours (Erfa Canada Inc., 2010). L'utilisation de pentylènetétrazole sous forme de produit pharmaceutique au Canada représente au moins de 0,10 kg de la substance par année d'après les données de 2011 et 2012 (MIDAS, 2013). Aucune des 33 substances incluses dans la présente évaluation n'est définie comme étant présente dans des produits biologiques (communication personnelle, courriel de la Direction des produits biologiques et thérapies génétiques de Santé Canada au Bureau de la gestion du risque de Santé Canada, 2011; source non citée) ou des médicaments vétérinaires au Canada (communication personnelle, courriel de la Direction des médicaments vétérinaires de Santé Canada au Bureau de gestion du risque de Santé Canada, 2011; source non citée). Aucune des 33 substances incluses dans la présente évaluation ne figure dans la base de données sur les ingrédients des produits de santé naturels (BDIPSN) en tant qu'ingrédient dans les produits de santé naturels (BDIPSN, 2011). De plus, selon la base de données des produits de santé naturels homologués (BDPSNH), ils ne sont pas présents dans les produits de santé naturels actuellement homologués (BDPSNH, 2008).
Sur la base des notifications soumises aux termes du Règlement sur les cosmétiques à Santé Canada, le Basic Orange 2 est utilisé dans certains produits cosmétiques au Canada comme les colorants capillaires (communications personnelles, courriels de 2011 et 2013 de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation des risques des substances existantes de Santé Canada; source non citée). Les 33 substances décrites la présente évaluation préalable ne sont pas incluses sur la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques (Santé Canada, 2011b), laquelle constitue un outil administratif dont Santé Canada se sert pour faire savoir aux fabricants et aux autres que certaines substances, si elles sont présentes dans un cosmétique, peuvent contrevenir à : a) l'interdiction générale qui se trouve à l'article 16 de la Loi sur les aliments et drogues ou b) une disposition du Règlement sur les cosmétiques. Toutefois, un sel connexe du Basic Orange 2, le citrate de chrysoïdine, chlorhydrate (n° CAS 5909-04-6) est inclus dans la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques (Santé Canada, 2011b).
Le Basic Orange 2 a également été défini comme un ingrédient dans les stylos à bille vendus au Canada. Il a été déterminé sur la base de renseignements soumis par l'Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers (ETAD) que dix substances analysées dans le cadre de la présente évaluation préalable (Basic Brown 1, Basic Orange 2 et numéros CAS 14408-20-9, 36986-04-6, 52769-39-8, 59709-10-3, 68929-07-7, 69852-41-1, 75660-25-2 et 93783-70-1) étaient utilisées au Canada (communication personnelle, courriel de 2010 de l'ETAD à Environnement Canada; source non citée). Aucune utilisation particulière de ces substances n'a été relevée.
5. Devenir dans l'environnement
Le devenir dans l'environnement des substances chimiques décrit le processus par lequel les produits chimiques sont répartis et sont transformés dans l'environnement. Dans cette section, certaines caractéristiques générales des substances faisant l'objet de la présente évaluation préalable sont traitées afin de déterminer le devenir environnemental de ces substances dans différents milieux, et ce, dans le but de comprendre comment les organismes entrent en contact avec elles dans un milieu donné, leur persistance dans les milieux naturels, ainsi que leurs produits de dégradation, leur distribution dans les différents milieux, leur migration dans les eaux souterraines, leur élimination des effluents par des méthodes usuelles de traitement des eaux usées et leur bioaccumulation dans les organismes.
Tel qu'il est expliqué dans le rapport d'Environnement Canada et de Santé Canada (2013a), des modèles de devenir dans l'environnement avec bilan massique, comme le nouveau modèle Equilibrium Criterion (nouveau EQC, 2011) ne sont pas applicables pour les colorants positivement chargés, car ces derniers n'entrent pas dans le domaine du modèle. Par conséquent, nous examinerons le devenir dans l'environnement et la compartimentalisation de ces substances de façon qualitative à l'aide de données sur leurs propriétés physiques et chimiques.
5.1 Eau et sédiments
Lorsqu'ils sont rejetés dans le milieu aquatique, les colorants basiques azoïques devraient se retrouver principalement dans la colonne d'eau en raison de leur solubilité. S'ils sont rejetés dans des eaux naturelles ou usées dans un état non transformé, les colorants basiques azoïques positivement chargés devraient avoir une affinité avec les substrats ionisés, comme les matières organiques dissoutes, en raison de la présence d'acides humiques et fulviques et de matières argileuses qui ont une charge négative nette à la surface (ETAD, 1995; Environnement Canada et Santé Canada, 2013). Les colorants basiques azoïques devraient finalement se déposer hors de la colonne d'eau, notamment dans les sédiments du lit ou, lorsqu'ils sont rejetés dans les eaux usées, dans les boues d'épuration. Certains colorants ioniques peuvent également se lier à des matières organiques au moyen de l'hydrogène et des forces de Van der Waals (Oster, 1955).
On pense que d'autres facteurs, tels que l'augmentation de la taille moléculaire, la dureté de l'eau et la salinité, ainsi que la baisse du pH, favorisent la sorption des colorants azoïques aux matières en suspension (HSDB, 1983- ; Øllgaard et al., 1998). En général, il a été établi que, en raison de la nature récalcitrante des colorants azoïques dans les milieux aérobies, ceux-ci finissent par se retrouver dans des sédiments anaérobies, dans des aquifères peu profonds et dans l'eau souterraine (Razo-Flores et al., 1997). Certains colorants basiques azoïques peuvent ne pas être définitivement liés aux sédiments ou aux boues d'épuration et peuvent donc être réintroduits dans l'eau interstitielle ou la colonne d'eau, tandis que d'autres colorants se lieront définitivement et demeureront séquestrés.
5.2 Sol
Les colorants basiques azoïques peuvent être indirectement rejetés dans le sol par l'épandage de biosolides produits par les eaux usées sur les terres agricoles ou leur dépôt dans des sites d'enfouissement. Les colorants ioniques devraient avoir un niveau de mobilité dans le sol élevé à modéré en raison des faibles coefficients d'adsorption sol-eau (Kd) (Øllgaard et al., 1998); cette constatation est toute relative du fait que les colorants ioniques peuvent également subir des processus d'échange d'ions avec l'argile du sol, ce qui retarderait la lixiviation (HSDB, 1983- ).
5.3 Air
Les colorants basiques azoïques ne devraient pas être rejetés dans l'air et ne devraient pas se répartir dans ce milieu en raison leurs pressions de vapeur très faibles et de leurs hydrosolubilités élevées (HSDB, 1983- ; Øllgaard et al., 1998). Les colorants hydrosolubles, comme les colorants basiques azoïques sont destinés à une utilisation dans les traitements à base d'eau, ce qui limite également leur rejet, étant donné qu'ils sont hydrophiles. Tandis que les colorants prémélangés à l'état solide peuvent avoir une capacité de dispersion limitée dans l'atmosphère en tant que grosses particules, on ne considère pas l'atmosphère comme un milieu de transport pour les colorants, étant donné la volatilité faible ou négligeable que présentent ces substances (ETAD, 1995; Øllgaard et al., 1998).
Compte tenu des faibles niveaux de volatilité et de la préférence physique et chimique pour la répartition dans d'autres milieux, les colorants basiques azoïques ne devraient pas faire l'objet d'un transport atmosphérique à grande distance.
5.4 Persistance dans l'environnement
Pour caractériser la persistance dans l'environnement des colorants basiques azoïques, des données empiriques et modélisées pour ces substances dans des conditions aérobies et anaérobies ont été examinées.
5.4.1 Données empiriques sur la persistance
Peu de données empiriques de biodégradation liées à la persistance des colorants basiques azoïques. Des données sur la biodégradation n'étaient disponibles que pour une substance dans la présente évaluation. Une étude portait sur la biodégradation intrinsèque du n° CAS 71032-95-6 (NDTHPM) par les bactéries dans les eaux usées (sans adaptation préalable) à l'aide d'un essai modifié de 28 jours du ministère du Commerce international et de l'Industrie du Japon (MITI) (Présentation de projet, 2006). La demande biochimique d'oxygène a été mesurée et la biodégradation a été estimée à l'aide du rapport de demande biochimique d'oxygène par rapport à la demande chimique ou théorique en oxygène lorsque le composé est complètement oxydé. L'étendue de la biodégradation varie entre 125 % et 226 % après 28 jours. Une certaine dégradation (20 %) a également été observée dans les fioles sans inoculum après 28 jours. L'étude est basée sur des essais de biodégradation intrinsèque qui fournissent généralement des conditions favorables à la biodégradation comparativement aux essais de biodégradation immédiate.
Des données empiriques sur la biodégradation ont été recensées pour deux analogues similaires sur le plan structurel et peuvent donc être utilisées comme des données déduites à partir d'analogues. Une étude a signalé la biodégradation intrinsèque du Basic Red 111 (pureté à 72 %) à l'aide d'un essai modifié de Zahn-Wellens et des microorganismes d'une usine publique de traitement des eaux usées (présentation de projet, 2009a). Les résultats ont montré que la substance d'essai n'était pas complètement dissoute au début de l'essai et, après sept jours, l'important moussage des solutions d'essai a entraîné le dépôt sur le revêtement des récipients. Les valeurs du carbone organique dissous ont diminué de 87 % après l'observation de l'important moussage au septième jour d'exposition. Par conséquent, il n'était pas clair si la substance d'essai s'est biodégradée ou si elle a été adsorbée par le revêtement de vitre.
Dans le cadre d'une étude menée par Huren et al. (1994), un système de boues activées a été utilisé pour évaluer la biodégradabilité aérobie du Basic Blue 41. Les résultats de l'essai de biodégradabilité aérobie ont montré que le taux d'élimination du colorant était supérieur à 70 % et que la substance était facilement biodégradable. Les colorants basiques, qui sont cationiques, sont facilement adsorbés aux surfaces négativement chargées (c.-à-d. les boues), ce qui explique pourquoi ces substances ont un taux d'élimination élevé.
5.4.2 Modélisation de la persistance
En plus des données expérimentales, on a utilisé une méthode du poids de la preuve basée sur le R(Q)SA (Environnement Canada, 2007b) avec des modèles de biodégradation. Ces modèles se fondent en effet sur la structure chimique des molécules, et comme la structure azoïque est représentée dans les ensembles de données d'entraînement de tous les modèles BIOWIN utilisés, la fiabilité des prévisions s'en trouve accrue. Étant donné la pertinence écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et que les colorants basiques azoïques devraient être libérés dans ce milieu, nous avons principalement étudié la biodégradation aérobie dans l'eau.
Le tableau A9 de l'annexe A résume les résultats des modèles RQSA disponibles sur la dégradation dans divers milieux naturels. Les modèles de dégradation utilisés dans cette analyse étaient HYDROWIN (2010), les sous-modèles 3 - 6 de BIOWIN (BIOWIN, 2010), DS TOPKAT (©2005-2009), AOPWIN (2010) et CATALOGIC (2012).
Les données de sortie des modèles pour les colorants basiques azoïques ont constamment prédit que ces substances subiraient une biodégradation lente dans l'eau dans des conditions aérobies (voir l'annexe A, tableau A9). Ces résultats concordent avec les renseignements inclus dans le rapport d'Environnement Canada et de Santé Canada (2013), qui donne un aperçu général de la persistance des colorants azoïques dans les milieux aérobies.
Les demi-vies modélisées de 0,025 à 1,081 jour pour les colorants basiques azoïques indiquent que ces substances subissent une photooxidation rapide à la suite de réactions avec les radicaux hydroxyles (AOPWIN, 2010). Le seul composé pour lequel la persistance était importante dans l'air est le pentylènetétrazole, avec une demi-vie modélisée de 4,273 jours.
5.4.3 Biodégradation aérobie
Même si les données expérimentales sur la persistance des colorants basiques azoïques étaient non concluantes, les données modélisées sur la persistance de ces substances montrent peu ou pas de biodégradation dans l'échelle chronologique des études. Cette constatation concorde avec les faits que les colorants doivent être stables afin d'être efficaces dans leurs applications et que la plupart de ces colorants sont généralement jugés non dégradables dans des conditions aérobies pertinentes sur le plan environnemental (Pagga et Brown, 1986; ETAD, 1995; Øllgaard et al., 1998).
5.4.4 Biodégradation anaérobie
Dans des conditions anaérobies et anoxiques, de nombreux colorants azoïques sont vulnérables au clivage de leur liaison azoïque assistée par des bactéries (Brown et Laboureur, 1983; Baughman et Weber, 1994; Weber et Adams, 1995). Toutefois, la dégradation complète des substances aromatiques azoïques et à base de benzidine ne se produit pas toujours, étant donné que les métabolites résultant du clivage de la liaison azoïque peuvent persister dans des conditions anaérobies (Pinheiro et al., 2004).
5.4.5 Hydrolyse
La majorité des colorants basiques azoïques ne contiennent pas de groupes fonctionnels pouvant subir une hydrolyse. Cette interprétation est cohérente avec les études publiées qui soulignent que l'hydrolyse est un facteur négligeable dans le clivage de composés azoïques (Baughman et Perenich, 1988). Toutefois, le n° CAS 75199-20-1 contient un groupe fonctionnel amide qui a été signalé par EPISuite (2012) comme ayant le potentiel de subir un certain degré d'hydrolyse.
5.4.6 Résumé de la persistance
En raison de la persistance des colorants basiques azoïques dans les milieux aérobies en association avec leur hydrosolubilité modérée à élevée, ces substances devraient avoir un temps de résidence relativement long dans l'eau. Puisque ces substances devraient rester dans l'eau pendant de longues périodes, elles peuvent largement se disperser à partir de sources ponctuelles de rejet. Finalement, en raison de leurs interactions électrostatiques avec des matières particulaires négativement chargées, ces substances se déposeront dans des sédiments, où elles persisteront dans des conditions aérobies et demeureront une source d'exposition pour les organismes jusqu'à ce qu'elles soient enfouies à cause de la sédimentation. Des couches plus profondes de sédiments sont susceptibles d'être présentes dans des conditions anaérobies, ce qui transformera (réduira) les colorants par l'entremise de l'hydrolyse azoïque. L'exposition à des benthos dans des conditions anaérobies ne devrait pas être importante. Certains temps de résidence dans l'air devraient donner lieu à un faible potentiel de transport atmosphérique à grande distance.
5.5. Potentiel de bioaccumulation
Dans la présente évaluation, une gamme d'éléments d'information a servi pour déterminer le potentiel de bioaccumulation des colorants basiques azoïques. Les données expérimentales pour les mesures de bioaccumulation traditionnelles, telles que le facteur de bioconcentration (FBC), pour ces substances sont minimes et majoritairement limitées au milieu aquatique. En outre, nous n'avons pas retenu l'utilisation des modèles R(Q)SA relatifs à la modélisation de la bioaccumulation pour les colorants basiques azoïques, étant donné que ces substances se trouvaient à l'extérieur du domaine d'applicabilité des modèles.
5.5.1 Coefficient de partage octanol-eau
Tel qu'il est indiqué dans les tableaux 3-1 à 3-7, les colorants basiques azoïques ont une hydrosolubilité modérée à élevée (100 à 60 000 mg/L); seules les données déduites à partir d'analogues pour le sous-ensemble de l'écologie 5 montrent une très forte hydrosolubilité, notamment supérieure à 340 000 mg/L. Les valeurs expérimentales limitées de log Koe (de moins de −0,33 à 2,03) laissent supposer un faible potentiel de bioaccumulation selon la théorie du partage à l'équilibre. Cette interprétation est cohérente avec l'opinion générale provenant d'autres sources, selon laquelle les colorants ioniques ont un très faible potentiel de bioaccumulation (ETAD, 1995).
5.5.2 Facteur de bioconcentration (FBC) aquatique
Aucune donnée expérimentale n'était disponible pour les colorants basiques azoïques inclus dans la présente évaluation. Cependant, des données d'Anliker et al. (1981) montrent que les colorants ioniques très solubles ont tendance à afficher de très faibles valeurs de facteur de bioconcentration allant de −1 à 1 environ. On a émis l'hypothèse selon laquelle ce faible potentiel de bioaccumulation découlerait de l'adhérence des colorants à la surface extérieure de poissons ou des intestins. En effet, en raison de leur hydrosolubilité, ces colorants devraient difficilement traverser les bicouches hydrolipidiques des cellules.
5.5.3 Autres facteurs pour évaluer le potentiel de bioaccumulation
Comme le souligne la section sur le potentiel de bioaccumulation du rapport d'Environnement Canada et de Santé Canada (2013), en raison de l'absence de données empiriques sur la bioaccumulation pour les colorants basiques azoïques, nous tiendrons compte des données disponibles sur l'hydrosolubilité, la masse molaire et le diamètre transversal pour démontrer le potentiel de bioaccumulation. Étant donné leur hydrosolubilité relativement élevée, leur nature ionique et leur degré élevé de dissociation dans des conditions environnementales normales, la tendance au fractionnement lipidique de ces substances devrait être limitée. De plus, les données sur la bioaccumulation découlant de l'exposition des organismes à ces substances dans le sol et les sédiments sont rares et limitées, ce qui s'explique en grande partie par l'hydrosolubilité modérée à élevée de ces substances (Environnement Canada et Santé Canada, 2013).
En général, les colorants basiques azoïques sont relativement hydrophiles, car ils sont constitués de molécules plus ou moins grosses ayant une masse molaire relativement élevée (249 à 950 g/mol). Les diamètres transversaux minimaux et maximaux des colorants basiques azoïques varient de 0,71 nm (Dmin) à 1,92 nm (Dmax) (tableaux 3-1 à 3-7). Ces caractéristiques laissent entendre que les dimensions moléculaires peuvent également limiter le taux de captage de ces substances lorsqu'elles traversent les membranes cellulaires des poissons à partir de l'eau, réduisant ainsi le potentiel de bioaccumulation.
5.5.4 Résumé du potentiel de bioaccumulation
Les colorants basiques azoïques devraient avoir un faible potentiel de bioaccumulation en raison de la faible bioconcentration observée lors des essais empiriques avec d'autres colorants ioniques. Cette hypothèse, appuyée par les propriétés physiques et chimiques de ces colorants (c.-à-d. faibles valeurs de log Koe, ionisés à un pH environnemental pertinent, masses molaires modérées, diamètres transversaux plus ou moins grands, hydrosolubilité modérée à élevée), ainsi que leur niveau probablement élevé de biotransformation par les organismes, concorde avec ces facteurs. Il est également possible que ces colorants soient facilement métabolisés dans les organismes par des mécanismes de phase I et II, étant donné que ces colorants sont connus comme subir une hydrolyse azoïque in vivo.
6. Potentiel d'effets nocifs sur l'environnement
6.1 Évaluation des effets sur l'environnement
En général, les teintures cationiques sont connues pour avoir des niveaux élevés d'écotoxicité qui dépassent ceux des colorants acides et directs (Øllgaard et al., 1998). Afin d'évaluer le potentiel d'effets sur l'environnement des colorants basiques azoïques, seules des données empiriques (sur des substances spécifiques dans les sous-ensembles ainsi que des analogues) ont été prises en compte, étant donné le haut niveau d'incertitude lié à la modélisation de l'écotoxicité de ces substances.
6.1.1 Études empiriques pour le milieu aquatique
Nous ne disposions par contre que de peu d'études empiriques pour les colorants basiques azoïques (tableau 6-1). La plupart des substances offraient peu ou pas de données empiriques, avec des concentrations létales médianes (CL50) variant généralement entre 0,3 et 13 mg/L. La majorité des études étaient de courte durée, et la plupart des essais de toxicité ont été menés sur des espèces de poisson.
Une CL50 de 0,6 mg/L (48 heures) pour le poisson medaka (Oryzias latipes) exposé au n° CAS 60-11-7 (Tonogai et al., 1982) a servi de donnée déduite à partir d'analogues pour le sous-ensemble de l'écologie 1.
Une étude menée par Güngördü et al.(2013) a évalué l'écotoxicité du colorant no CAS 52769-39-8 (sous-ensemble de l'écologie 2). Des groupes de 15 têtards Xenopus laevis au stade 46 ont été exposés à diverses concentrations de colorant pendant sept jours (168 heures). Les résultats ont montré des CL50 de 1,57 mg/L après une exposition de 72 heures et de 0,35 mg/L après une exposition de 168 heures. L'étude a également signalé une hausse des activités enzymatiques de la carboxy-estérase et de la glutathion S-transférase.
Deux études empiriques étaient disponibles pour trois composés du sous-ensemble de l'écologie 3. Tonogai et al. (1982) ont signalé une CL50 de 0,3 mg/L (48 heures) pour le Solvent Orange 3 et des CL50 de 0,8 mg/L (24 heures) et 0,5 mg/L (48 heures) pour le no CAS 80324-43-2 (données déduites à partir d'analogues). La deuxième étude, menée par Brown et al. (1981), a mesuré le taux de respiration de boues activées afin de déterminer l'effet inhibiteur potentiel de divers colorants, y compris Basic Orange 2, sur des bactéries d'eaux usées aérobies. La concentration inhibitrice médiane (CI50) variait de 10 à 100 mg/L.
Une CL50 de 7 mg/L (48 heures) pour le poisson medaka (Oryzias latipes) exposé au Basic Red 2 (Tonogai et al., 1982) a servi de donnée déduite à partir d'analogues pour le sous-ensemble de l'écologie 4. Il est à noter que le Basic Red 2 ne comporte pas de liaison azoïque; toutefois, sur la base de sa similarité structurelle générale avec d'autres composés dans le sous-ensemble de l'écologie 4, cette substance devrait exprimer des propriétés comparables.
Des études de l'écotoxicité étaient disponibles pour les deux substances incluses dans le sous-ensemble de l'écologie 5. Une étude empirique a exposé la truite arc-en-ciel au NDTHPM (mélangé à du Tween 80) pendant une période de 96 heures dans un système statique (Présentation de projet, 2006). Aucune mortalité n'a été observée dans le groupe témoin avec le Tween 80 à une concentration de 0,1 mg/L ou 1 mg/L, tandis qu'un taux de mortalité de 10 % a été observé à 10 mg/L. Tous les organismes d'essai sont décédés à la plus forte concentration testée (100 mg/L). L'étude a également montré une concentration inhibitrice de la respiration des bactéries d'eaux usées (CI50) supérieure à 100 mg/L. Des études empiriques sur le Basic Red 111, utilisées à titre de données déduites à partir d'analogues dans le sous-ensemble de l'écologie, ont aussi signalé des effets écotoxiques sur le poisson zèbre (Danio rerio), le cladocère (Daphnia magna) et la truite arc-en-ciel (Oncorhynchus mykiss) (Présentation de projet 2009b, 2009c, 2009d).
Des données empiriques sur l'écotoxicité étaient disponibles pour deux des substances incluses dans le sous-ensemble de l'écologie 6. Des algues vertes (Selenastrum capricornutum) exposées au n° CAS 68929-07-7 affichaient une concentration efficace médiane sur 96 heures (CE50) de 0,025 mg/L (Greene et Baughman, 1996). Knacker et al. (1995) ont mené des essais de l'écotoxicité aiguë sur le poisson zèbre (Brachydanio rerio), des essais de l'immobilisation aiguë sur le cladocère (Daphnia magna), et des tests de l'inhibition de la croissance des algues sur Scenedesmus subspicatus à l'aide du n° CAS 72906-38-8 (données déduites à partir d'analogues). Des données issues de ces essais ont été utilisées pour estimer la concentration létale médiane, la concentration efficace médiane, et la concentration inhibitrice 50 % à l'aide de la transformation arc-sinus. Deux autres études ont testé l'écotoxicité du no CAS 7290638-8 sur le protozoaire Tetrahymena thermophila. Les concentrations efficaces variaient de 0,5 à 30 mg/L, et une concentration sans effet observé (CSEO) de 4 mg/L pour une exposition sur 48 heures a été signalée (Pauli et al., 1993, 1994). Il est à noter que le n° CAS 72906-38-8 contient un groupe fonctionnel d'ammoniac quaternaire qui peut le rendre plus toxique que les colorants du sous-ensemble de l'écologie 6, qui ne comprend pas ce groupe.
Des études empiriques étaient disponibles pour le Basic Brown 4, une substance analogue pour le sous-ensemble de l'écologie 7. Ericson (1977) a mené des essais sur des algues fondés sur la mesure d'adénosine triphosphate (ATP) et l'inhibition de la reproduction cellulaire déclarée de Selenastrum capricornutum à une concentration de 10 mg/L, ainsi que sur une inhibition importante de la luciférase avec une hausse accrue du colorant. L'écotoxicité du Basic Brown 4 a également été testée par Little et Lamb (1972, 1974) qui ont déclaré une CL50 de 5,6 mg/L pour le tête-de-boule (Pimephales promelas) exposé pendant 96 heures. Brown et al. (1981) ont aussi signalé que la concentration inhibitrice 50 % (CI50) du Basic Brown 4 relativement aux bactéries d'eaux usées aérobies était supérieure à 100 mg/L. Une fiche signalétique du colorant basique no CAS 63681-54-9 a déclaré une CL50 de 1 à 10 mg/L pour le poisson zèbre (Brachydanio rerio) après une exposition de 96 heures, une CE50 de 1 à 10 mg/L pour Daphnia magna après une exposition de 48 heures, et une CE10 supérieure à 10 mg/L pour l'inhibition de bactéries dans des effluents après 16 heures (BASF Canada, 2004), mais l'étude empirique qui appuyait ces données n'a pu être obtenue.
Même si peu d'essais sur des algues ont été recensés précédemment, les résultats d'études écotoxicologiques pour des substances colorées comme des colorants ne sont pas considérés comme étant représentatifs des effets sur l'écosystème. L'essai d'inhibition de croissance des algues est l'un des essais les plus utilisés afin de déterminer la toxicité pour les organismes aquatiques. Il mesure les changements du taux de croissance en réponse à une exposition aux produits chimiques à l'essai dans l'eau. Dans le cadre d'essais sur des substances colorées, on a observé qu'elles étaient en mesure d'atténuer la pénétration de la lumière dans le milieu d'essai en absorbant et en réfléchissant la lumière. Si des solvants ou des émulsifiants sont utilisés pour obtenir une dispersion homogène dans l'eau, il est probable que l'atténuation de la lumière soit proportionnelle à la quantité de la substance ajoutée. L'inhibition de la croissance des algues en raison de l'atténuation de la lumière peut se traduire par une diminution de la croissance de la population d'algues, laquelle est liée à la quantité de la substance ajoutée dans le milieu d'essai. Cependant, une telle inhibition n'est pas considérée comme un véritable effet écotoxicologique des produits chimiques à l'essai (Rufli et al., 1998; Cleuvers et Weyers, 2003).
Des recommandations ont été formulées pour gérer l'atténuation de la lumière dans les essais sur les algues avec des substances colorées. Il a été proposé que les algues soient remises dans un milieu d'essai sans la substance après la période d'exposition afin de faire la distinction entre un effet algistatique et un effet algicide (Whitehouse et Mallet, 1993). Un trajet réduit de la lumière à travers la solution a également été proposé afin que le taux de croissance des algues ne soit pas influencé (Comber et al., 1995). Toutefois, les études recensées portant sur l'évaluation des effets écologiques des colorants basiques azoïques et des analogues sur les algues ne font pas état d'une atténuation de la lumière. Il n'y a donc pas d'indication quant à savoir si cet effet a été influencé. Par conséquent, on doute que l'écotoxicité rapportée dans les études sur les algues représente les « véritables » effets des colorants à l'essai sur les organismes.
| Sous-ensemble | Organisme d'essai | Type d'essai (durée) | Paramètre | Valeur (mg/L) No CAS/nom dans le C.I. |
Référence |
|---|---|---|---|---|---|
| 1 | Poisson (Oryzias latipes) | Toxicité aiguë (48 h) | CL50 | 0,6 (60-11-7) |
Tonogai et al., 1982 |
| 2 | Têtards (Xenopus laevis) | Toxicité chronique (168 h) | CL50 | 0,35 (52769-39-8) |
Güngördü et al., 2013 |
| 3 | Poisson (Oryzias latipes) | Toxicité aiguë (48 h) | CL50 | 0,3 495-54-5 |
Tonogai et al., 1982 |
| 3 | Poisson (Oryzias latipes) | Toxicité aiguë (48 h) | CL50 | 0,5 (80324-43-2) |
Tonogai et al., 1982 |
| 4 | Poisson (Oryzias latipes) | Toxicité aiguë (48 h) | CL50 | 7 (477-73-6) |
Tonogai et al., 1982 |
| 5 | Poisson (Oncorhynchus mykiss) | Toxicité aiguë (96 h) | CL50 | supérieur(e) à 10 et inférieur(e) à 100 (71032-95-6; NDTHPM |
Présentation de projet 2006 |
| 5 | Bactéries dans les eaux usées | Test d'inhibition respiratoire | CI50 | supérieur(e) à 100 (71032-95-6; NDTHPM |
Présentation de projet 2006 |
| q | Poissons Danio rerio) |
Toxicité aiguë (96 h) | CL50 | 16,7 (118658-98-3) |
Présentation de projet 2009b |
| 5 | Poissons Danio rerio) |
Toxicité aiguë (96 h) | CSEO | 10 (118658-98-3) |
Présentation de projet 2009b |
| 5 | Daphnia magna | Toxicité aiguë (48 h) | CE50 | 109 (118658-98-3) |
Présentation de projet 2009c |
| 5 | Daphnia magna | Toxicité aiguë (48 h) | CSEO | 32 (118658-98-3) |
Présentation de projet 2009c |
| 5 | Poisson (Oncorhynchus mykiss) | Toxicité chronique (21 jours) | CL50 | 13 (118658-98-3) |
Présentation de projet 2009d |
| 5 | Poisson (Oncorhynchus mykiss) | Toxicité chronique (21 jours) | CMEO | 6 (118658-98-3) |
Présentation de projet 2009d |
| 5 | Poisson (Oncorhynchus mykiss) | Toxicité chronique (21 jours) | CSEO | 2,7 (118658-98-3) |
Présentation de projet 2009d |
| 6 | Algue verte (Selenastrum capricornutum) | Toxicité chronique (96 h) | CE50 | 0,025 (68929-07-7) |
Greene et Baughmanm, 1996 |
| 6 | Poisson (Brachydanio rerio) | Toxicité aiguë (96 h) | CL50 | 12,6 (72906-38-8) |
Knacker et al., 1995 |
| 6 | Daphnia magna | Toxicité aiguë (48 h) | CE50 | 13,4 (72906-38-8) |
Knacker et al., 1995 |
| 6 | Algues (Scenedesmus subspicatus) | Inhibition de la croissance des algues (96 h) | CI50 | 1,48 (72906-38-8) |
Knacker et al., 1995 |
| 7 | Algue (Selenastrum capricornutum) |
Toxicité chronique (7 jours) | Régénération des cellules | 10 (5421-66-9) |
Ericson, 1977 |
| 7 | Poisson (Pimephales promelas) | Toxicité aiguë (96 h) | CL50 | 5,6 (5421-66-9) |
Little et Lamb, 1972, 1974 |
| 7 | Bactéries dans les eaux usées | Test d'inhibition respiratoire | CI50 | supérieur(e) à 100 (5421-66-9) |
Brown et al., 1981 |
| 7 | Poisson (Brachydanio rerio) | Toxicité aiguë (96 h) | CL50 | de 1 à 10 (63681-54-9) |
BASF Canada, 2004 |
| 7 | Daphnia magna | Toxicité aiguë (48 h) | CE50 | de 1 à 10 (63681-54-9) |
BASF Canada, 2004 |
6.1.2 Études empiriques concernant d'autres milieux naturels
Des données écotoxicologiques liées au sol ont été recensées pour l'Acid Red 2 (Sharma et al., 2009), un colorant partageant des similarités structurelles avec les colorants basiques azoïques. Une CE50 sur huit jours a donné une valeur de toxicité modérée de 56 mg/kg de sol pour la laitue (Lactuca sativa) (tableau 6-2). Nous ne disposions d'aucune donnée empirique sur la toxicité des colorants basiques azoïques dans les sédiments. En outre, on n'a relevé aucun analogue approprié pour lequel il existait des données de toxicité dans les sédiments.
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/kg de sol) | Référence |
|---|---|---|---|---|
| Laitue (Lactuca sativa) | Toxicité chronique (8 jours) | CE50 (reproduction) (sol) | 56 | Sharma et al.,2009 |
6.2 Calcul de la concentration estimée sans effet (CESE)
6.2.1 Calcul de la concentration estimée sans effet (CESE) dans le milieu aquatique
En raison de toxicités similaires parmi les sept sous-ensembles écologiques, une seule valeur critique de toxicité (VCT) dans le milieu aquatique a été choisie pour représenter le sous-groupe.
La valeur critique de toxicité dans l'eau choisie pour les colorants basiques azoïques a été obtenue à partir de la substance analogue, soit le Solvent Orange 3, car il s'agissait de l'une des valeurs expérimentales valides les plus sensibles. Un essai de la toxicité chronique de 168 heures a affiché une CL50 de 0,35 mg/L pour des têtards Xenopus laevis (Güngördü et al., 2013). La CE50 dans les algues de 0,025 mg/L (Greene et Baughman 1996) et la CL50 dans les poissons de 0,3 mg/L (Tonogai et al., 1982) n'ont pas été prises en compte pour la valeur critique de toxicité, étant donné que l'étude sur les algues peut ne pas représenter les « réels » effets des colorants d'essai sur les organismes en raison de la légère atténuation possible et du fait que Güngördü et al. (2013) ont utilisé une plus longue durée d'exposition (c.-à-d. plus sensible) que Tonogai et al. (1982). La CESE aquatique a ensuite été calculée en divisant la valeur critique de toxicité (0,35 mg/L) par un facteur d'évaluation de 10 (pour tenir compte de la variabilité interspécifique et intraspécifique de la sensibilité et extrapoler des effets létaux médians à l'absence d'effets). Par conséquent, nous avons calculé une PNEC de 0,035 mg/L pour les colorants basiques azoïques.
6.2.2 Calcul de la concentration estimée sans effet (CESE) dans d'autres milieux naturels
En raison du manque général d'études empiriques liées à la toxicité des colorants basiques azoïques relativement aux organismes vivant dans le sol et les sédiments, aucune CESE dans le sol ou les sédiments n'a été calculée pour la présente évaluation.
6.2.3 Résumé des effets sur l'environnement
D'après les éléments de preuve sur les données empiriques et les données déduites à partir d'analogues de l'écotoxicité aquatique ainsi que la faible valeur critique de toxicité choisie, on pense que les colorants basiques azoïques peuvent causer des effets nocifs sur les organismes aquatiques à des concentrations faibles à modérées (c.-à-d., les CL50 sont inférieures à 10 mg/L). Sur la base des données empiriques limitées sur l'écotoxicité du sol, on ne s'attend pas à ce que les colorants basiques azoïques aient des effets nocifs sur les organismes endogés à de faibles concentrations.
6.3 Évaluation de l'exposition de l'environnement
6.3.1 Rejets sur place dans l'environnement
Comme aucune donnée sur les concentrations environnementales mesurées (dans l'eau, le sol ou les sédiments) des colorants basiques azoïques au Canada n'a été relevée, on a donc estimé les concentrations environnementales sur la base des renseignements disponibles.
Les rejets anthropiques d'une substance dans l'environnement dépendent de différentes pertes qui surviennent pendant la fabrication, l'utilisation industrielle, l'utilisation commerciale et par les consommateurs,Note de bas de page[4] ainsi que l'élimination d'une substance. Afin d'estimer les rejets dans l'environnement à différentes étapes du cycle de vie des colorants basiques azoïques, Environnement Canada a compilé des renseignements sur les secteurs pertinents et les gammes de produits ainsi que les facteurs d'émissionNote de bas de page[5] dans les eaux usées, le sol et l'air à différentes étapes du cycle de vie en vue de déterminer celles qui contribuent le plus aux concentrations environnementales. Nous avons également tenu compte des activités de recyclage et de transfert vers les sites d'élimination des déchets (sites d'enfouissement, incinération). Cependant, les rejets dans l'environnement à partir de ces sources n'ont pas été pris en compte sur le plan quantitatif, sauf lorsque des renseignements précis et fiables sur le taux (ou le potentiel) de rejets à partir des sites d'enfouissement ou des incinérateurs étaient disponibles.
En général, les eaux usées constituent une source de point d'entrée usuelle d'une substance dans l'eau par les effluents des systèmes de traitement des eaux usées ainsi qu'un point d'entrée potentiel dans le sol durant l'épandage subséquent des biosolides. Cette information est utilisée pour développer davantage les scénarios d'exposition afin d'estimer les concentrations environnementales qui en découlent.
6.3.2 Détermination des scénarios d'exposition importants
Les facteurs liés aux étapes du cycle de vie de ces substances ont été étudiés. Les incertitudes ont été mises en lumière et des hypothèses ont été formulées en fonction des renseignements disponibles. Des scénarios d'exposition pour les utilisations ou les milieux préoccupants ont été élaborés, y compris la détermination des concentrations environnementales estimées (CEE) qui sont applicables.
Les colorants basiques azoïques ne sont pas fabriqués au Canada, d'après les données collectées à partir d'une enquête réglementaire de 2011 sur les substances azoïques aromatiques et à base de benzidine (Canada, 2011) et d'une mise à jour de la Liste intérieure des substances de 2009 (Canada, 2009a). Six ont été importés et utilisés dans la production de substances appartenant aux catégories suivantes d'après les utilisations indiquées au tableau 4.1 :
- Papiers (teinture et désencrage)
- Textiles
- Produits pharmaceutiques
- Encres d'imprimerie
D'après ce profil d'utilisation, les quatre scénarios suivants pertinents pour l'évalution écologique sont présentés comme les principales sources potentielles de rejets dans l'environnement :
- Production de produits pharmaceutiques
- Formulation chimique
- Teinture de papiers
- Teinture de textiles
Plusieurs scénarios supplémentaires sont associés aux produits indiqués ci-dessus, comme le désencrage, l'impression, la fabrication d'encre d'impression, et l'utilisation par les consommateurs de textiles et de produits pharmaceutiques. La caractérisation de l'exposition quantitative n'est pas présentée pour les raisons suivantes :
- Désencrage lié au papier : Les colorants contenus dans le papier recyclé sont facilement rejetés à partir des fibres de papier dans l'eau de traitement durant le désencrage, puis dégradés pendant la lixiviation des pâtes désencrées (Hannuksela et Rosencrance, 2008; Huber et Carré, 2012). Le rejet des colorants à partir d'installations de désencrage devrait être négligeable.
- Impression et fabrication d'encre d'impression (toutes les deux liées aux encres d'impression) : Il ne devrait pas y avoir de rejets d'eau par des installations d'impression ou des installations de fabrication d'encre d'impression selon l'Environmental Protection Agency des États-Unis (1994). Cela a été confirmé par une installation de fabrication d'encre d'impression (communication personnelle, courriel de l'entreprise à l'intention d'Environnement Canada daté du 9 avril 2013, source non citée).
- Utilisation par les consommateurs de textiles et de produits pharmaceutiques : Étant donné que l'utilisation par les consommateurs de produits pharmaceutiques est plus dispersive que leur production industrielle, les concentrations dans l'environnement découlant de cette utilisation devraient être inférieures à celles qui proviennent d'installations de production.
6.3.3 Calcul des concentrations environnementales estimées (CEE)
La colonne d'eau est considérée comme un milieu naturel important pour la présence de colorants basiques azoïques après leur rejet par suite d'opérations industrielles et leur rejet dans des eaux réceptrices par l'entremise de systèmes de traitement des eaux usées industrielles ou de systèmes publics de traitement des eaux usées. Ces colorants ont une hydrosolubilité modérée à élevée qui se situe dans une plage allant de 0,1 à 340 g/L et ils devraient, par conséquent, être présents dans la colonne d'eau lors de leur rejet dans l'eau de surface. Les coefficients de partage carbone organique-eau des colorants basiques azoïques ont été estimés comme étant modérés à élevés, avec des valeurs (estimées) de log Kco dans une plage allant de 3 à 5. Une répartition dans les sédiments ou une élimination par la sorption des boues dans les systèmes de traitement des eaux usées industrielles ou dans les systèmes publics de traitement des eaux usées devrait donc se produire dans une certaine mesure. Néanmoins, la colonne d'eau demeure un milieu important; ainsi, l'eau a été choisie comme milieu principal pour le calcul des CEE. Les CEE dans le sol découlant de l'épandage de biosolides et celles dans les sédiments découlant de la répartition dans les sédiments à partir de l'eau n'ont pas été calculées.
Chacun des quatre scénarios définis est de nature générique et s'appuie sur plusieurs installations situées sur divers sites. Ces installations sont désignées comme des utilisateurs industriels de colorants dans diverses sources, y compris les données d'enquête. Elles comprennent des installations utilisant des colorants basiques ainsi que des installations utilisant d'autres colorants. L'inclusion de ces dernières dans chaque scénario vise à tenir compte de la variabilité dans l'ensemble du secteur (pas uniquement pour la période pour laquelle les données d'enquête ont été glanées), de l'incertitude associée aux données incomplètes et de la probabilité d'assister à un changement dans les colorants utilisés (passant d'autres colorants à des colorants basiques).
Les CEE dans le milieu aquatique pour les quatre scénarios ou secteurs sont estimées pour les eaux réceptrices qui se trouvent à proximité des points de rejet. La méthode utilisée pour l'estimation est axée sur chaque secteur dans son ensemble et tient compte de toutes les valeurs réelles et possibles pour chaque variable qui est connue pour varier dans une plage donnée. À l'aide de cette méthode, les CEE dans le milieu aquatique sont calculées en tant que répartition probabiliste. Pour un secteur donné, une CEE selon le centile fournit une estimation du pourcentage de CEE qui sont inférieures à la CEE selon le centile pour l'ensemble du secteur. Par exemple, la CEE au 95e centile pour le scénario de teinture du papier est estimée à 4,84 µg/L dans les eaux réceptrices près des points de rejet, et 95 % des CEE découlant de tous les sites de teintures du papier seraient inférieures à cette valeur (voir le tableau 6-4 ci-dessous).
Il est à noter que la quantité d'utilisation quotidienne et le facteur d'émission pour le scénario de la teinture du papier sont basés sur des données relatives aux colorants utilisés dans la fabrication du papier. Pour les scénarios de formulation chimique et de production de produits chimiques, les valeurs des deux paramètres ne sont pas disponibles; on utilise donc les valeurs génériques pour l'industrie chimique trouvées dans les publications.
En ce qui concerne la teinture de textiles, la formulation chimique et la production de produits chimiques, l'équation utilisée pour calculer les CEE dans le milieu aquatique est la suivante :
CEE = (Q × E × (1-R) × 109) / V
Où :
- CEE :
- concentration environnementale estimée dans l'eau (μg/L)
- Q :
- quantité de colorants basiques azoïques utilisée quotidiennement dans une installation (kg/jour)
- E :
- facteur d'émission des colorants basiques azoïques dans les eaux usées de procédé avant tout traitement de ces dernières (%)
- R :
- élimination des colorants basiques azoïques par les systèmes de traitement des eaux usées industrielles ou les systèmes publics de traitement des eaux usées (%)
- V :
- volume d'eau de dilution par jour à proximité du point de rejet d'un système de traitement des eaux usées industrielles ou d'un système public de traitement des eaux usées (L/jour)
- 10 9 :
- facteur de conversion de kg en μg
En ce qui concerne la teinture de papiers, l'équation utilisée pour calculer les CEE dans le milieu aquatique est la suivante :
CEE = (A × E × (1-R) × 109)/(F × B × D)
Où :
- CEE :
- concentration environnementale estimée dans l'eau (μg/L)
- A :
- taux d'utilisation des colorants basiques azoïques (kg de colorants par tonne de papier produite, ou kg/t)
- E :
- facteur d'émission des colorants basiques azoïques dans les eaux usées de procédé avant tout traitement de ces dernières (%)
- R :
- élimination des colorants basiques azoïques par les systèmes de traitement des eaux usées industrielles ou les systèmes publics de traitement des eaux usées (%)
- F :
- taux de production d'effluents des fabriques (L/t de papier)
- B :
- facteur de dilution des eaux usées des systèmes publics de traitement = débit des eaux usées des systèmes publics de traitement/débit des effluents des usines de traitement (B = 1 pour le déversement direct et B supérieur(e) à 1 pour le déversement indirect)
- D :
- facteur de dilution des eaux réceptrices
- 10 9 :
- facteur de conversion de kg en μg
Pour un secteur/scénario donné, on détermine que la quantité utilisée quotidiennement (Q) ou le taux d'utilisation (A) et le facteur d'émission (E) sont tous compris dans une certaine plage de valeurs qui vise à être applicable à toutes les installations dudit secteur ainsi qu'à toutes les conditions d'exploitation au sein d'une même installation. L'élimination par les systèmes de traitement des eaux usées (R) résulte des mesures d'atténuation de la pollution sur place et hors site (ou les deux) mises en œuvre avant le rejet des eaux usées traitées dans le milieu aquatique. Le volume d'eau de dilution par jour (V) ou le volume d'eau de dilution par tonne (F × B × D) se calcule avec plusieurs paramètres, notamment le volume quotidien d'eaux usées rejetées par une installation industrielle, le débit d'eaux usées d'un système public de traitement des eaux usées et le facteur de dilution des eaux réceptrices à proximité du point de rejet d'un système de traitement des eaux usées industrielles ou d'un système public de traitement des eaux usées.
L'élimination par le traitement des eaux usées (R) et le volume d'eau de dilution par jour ou par tonne (V ou F × B × D) sont caractéristiques d'un site qui affiche un certain niveau d'atténuation pour les substances présentes dans les eaux usées et un certain degré de dilution pour les substances rejetées dans le milieu aquatique. En général, un secteur/scénario comprend plusieurs sites; l'élimination et le volume d'eau de dilution par jour ou par tonne sont calculés comme des répartitions distinctes (ensembles de points de données).
Le tableau 6-3 fournit un résumé des plages de valeurs pour les différents paramètres calculées pour chacun des quatre secteurs/scénarios recensés.
| Paramètre | Formulation chimique | Teinture de papiers | Teinture de textiles | Production de produits pharmaceutiques |
|---|---|---|---|---|
| Nombre de sites | 3 | 15 | 24 | 2 |
| Nombre d'installations | 3 | 17 | 42 | 2 |
| Quantité de colorant utilisée quotidiennement (kg/j) | 5-650 | s. o. | 9,1-36,3 | 5-100 |
| Taux d'utilisation des colorants (kg/t) | s. o. | 0,0031-0,031 | s. o. | s. o. |
| Facteur d'émission dans les eaux usées (%) | 0,3-2 | 2-10 | 0-4 | 0,3-2 |
| Élimination par le traitement des eaux usées (%) | 46,4 | 53,1-74,9 | 30,8-46,4 | 30,8-33,4 |
| Volume d'eau de dilution par jour (millions de litres par jour) | 298-4 970 | s. o. | 7,4-3 934 | 4,0-27 860 |
| Volume d'eau de dilution par tonne (millions de litres par tonne) | s. o. | 0,06-64 | s. o. | s. o. |
Le logiciel commercial Crystal Ball est utilisé pour calculer une répartition probabiliste de la CEE aquatique à partir de l'équation des plages de valeurs déterminées pour chaque paramètre. En principe, bon nombre de CEE sont calculées en faisant varier chaque paramètre au sein de la plage déterminée (20 000 à 100 000 points de données utilisés pour chaque plage). Ces CEE représentent différents niveaux d'exposition découlant de diverses conditions dans l'ensemble des sites d'un secteur/scénario. Les CEE calculées sont ensuite triées en fonction de leur ampleur et représentées sur un tracé en tant que fonction du pourcentage cumulé ou de la probabilité d'occurrence (c.à-d. la répartition probabiliste).
Les quatre distributions de probabilité sont présentées au tableau 6-4. Les valeurs de CEE plus faibles dans le tableau 6-4 correspondent aux valeurs plus faibles concernant la quantité utilisée quotidiennement, le taux d'utilisation ou le facteur d'émission et aux valeurs plus élevées concernant l'élimination et le volume d'eau de dilution par jour ou par tonne. L'inverse entraîne des valeurs de CEE plus élevées.
Le tableau 6-4 montre que la probabilité que les CEE soient inférieures à la CESE (35 μg/L) est de 95 % ou plus pour chacun des quatre scénarios. Cette probabilité élevée indique que les chances de dépasser la CESE sont très faibles lorsque les conditions dans les installations et les sites connexes se trouvent dans les limites indiquées au tableau 6-3. Les quatre répartitions probabilistes présentées dans le tableau 6-4 sont étroitement liées à ces conditions.
| CEE selon le centile | Production de produits pharmaceutiques (µg/L) | Teinture de textiles (μg/L) | Formulation chimique (µg/L) |
Teinture de papiers (µg/L) |
|---|---|---|---|---|
| 0e | 0,03 | 0,00 | 0,00 | 0,02 |
| 5e | 0,21 | 0,02 | 0,10 | 0,11 |
| 10e | 0,34 | 0,04 | 0,18 | 0,17 |
| 25e | 0,71 | 0,11 | 0,49 | 0,35 |
| 50e | 1,52 | 0,43 | 2,30 | 0,73 |
| 75e | 3,16 | 1,35 | 6,57 | 1,45 |
| 90e | 7,28 | 3,56 | 11,1 | 2,81 |
| 95e | 12,8 | 8,28 | 14,1 | 4,84 |
| 100e | 154,8 | 46,1 | 22,7 | 19,2 |
6.4 Caractérisation des risques pour l'environnement
La démarche utilisée dans le cadre de cette évaluation écologique préalable visait à examiner les divers renseignements pertinents afin d'élaborer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence, conformément aux dispositions de la LCPE (1999). Les éléments de preuve retenus comprennent des renseignements sur les propriétés physiques et chimiques, le devenir dans l'environnement, l'écotoxicité et les sources des substances, ainsi que les résultats des analyses du risque décrites ci-dessous.
6.4.1 Analyses probabilistes des risques pour le milieu aquatique
Les analyses des risques comparent les concentrations environnementales estimées avec les valeurs appropriées de la CESE (concentration estimée sans effet) afin d'évaluer les risques potentiels.
Pour le milieu aquatique, une CESE de 35 µg/L calculée pour les colorants basiques azoïques (voir la section 6.2 ci-dessus) a été comparée avec les CEE décrites à la section précédente (voir le tableau 6-4 dans la section 6.3.3 ci-dessus) pour les sites utilisant des colorants basiques azoïques pour la teinture de papiers et de textiles et la production de produits pharmaceutiques.
La probabilité que les CEE soient inférieures à la CESE pour tous les scénarios est élevée, ce qui indique que les chances de dépasser la CESE sont très faibles (de moins de 5 % pour la formulation chimique et improbable pour la production pharmaceutique et la teinture de textiles) lorsque les conditions dans les installations et les sites connexes se trouvent dans les limites indiquées au tableau 6-3.
6.4.2 Analyse des risques pour le sol
Aucune analyse des risques n'a été menée pour les autres milieux, car les données étaient insuffisantes pour déterminer une CESE pour le sol ou les sédiments. Par ailleurs, aucune CEE n'a été déterminée, car aucune donnée de surveillance n'était disponible et ces substances n'entrent pas dans le domaine d'applicabilité du modèle d'exposition pour le partage à l'équilibre.
6.4.3 Examen des éléments de preuve et conclusion de la caractérisation des risques pour l'environnement
Les éléments de preuve pris en considération comprennent les résultats de calculs prudents du quotient de risque ainsi que des données sur la persistance, la bioaccumulation, les effets écologiques, les sources et le devenir des substances, de même que sur leur présence et leur répartition dans l'environnement. Nous avons résumé ci-dessous les divers éléments de preuve tirés du sous-ensemble de colorants basiques azoïques ainsi que les incertitudes pertinentes ayant mené à des conclusions générales.
Les colorants basiques azoïques sont d'origine anthropique et ils ne devraient donc pas être produits de façon naturelle dans l'environnement. Nous n'avons trouvé aucune donnée sur les concentrations de ces substances dans l'environnement canadien. Les colorants basiques azoïques sont des molécules cationiques complexes qui ont une hydrosolubilité modérée à élevée et devraient se dissocier à des pH pertinents sur le plan environnemental. Les substances ont été divisées en sept sous-ensembles de l'écologie en fonction de leurs propriétés physiques et chimiques et de leur écotoxicité. Ce modèle de regroupement a permis l'utilisation d'analogues pour combler les lacunes dans les données. L'analyse ultérieure des propriétés physiques et chimiques ainsi que de la similarité structurelle des colorants basiques azoïques a permis un regroupement pour l'analyse du devenir dans l'environnement.
En raison de leur hydrosolubilité modérée à élevée et de leur affinité pour les particules organiques de charge opposée, nous nous attendons à ce que les colorants basiques azoïques se trouvent dans l'eau, les sédiments et le sol. Compte tenu de leurs très faibles pressions de vapeur, ces colorants sont peu susceptibles de rester dans l'air si rejetés dans ce milieu. Par conséquent, le potentiel de transport atmosphérique à grande distance ne devrait pas constituer une source de préoccupation. Étant donné leur hydrophilicité et leur charge, les colorants basiques azoïques affichent de faibles valeurs expérimentales de log Koe ( inférieur(e) à 2,03).
Les colorants basiques azoïques n'ont pas de potentiel de bioconcentration en raison de leurs masses molaires élevées ( supérieur(e) à 250 g/mol), de leurs diamètres transversaux minimaux et maximaux relativement grands, et de leurs faibles valeurs de log Koe, ce qui laisse entendre un faible potentiel d'absorption. La bioaccumulation découlant de l'exposition des organismes à ces substances dans le sol et les sédiments est mal comprise en raison de données minimes et limitées, ce qui est dû en grande partie à l'hydrosolubilité modérée à élevée de ces substances.
Selon les données modélisées, on s'attend à ce que les colorants basiques azoïques se biodégradent très lentement dans les milieux aérobies et on les considère donc comme persistants dans l'eau, les sédiments et le sol. Cependant, les colorants basiques azoïques peuvent se dégrader et se transformer en certaines amines aromatiques dans des milieux anaérobies.
Sur la base d'éléments de preuve incluant des données empiriques sur l'écotoxicité aquatique des colorants basiques azoïques et de leurs analogues, il est conclu que ces colorants peuvent être dangereux pour les organismes aquatiques à de faibles concentrations (c.-à-d. entre 0,3 et 13 mg/L). On dispose de données limitées sur la toxicité pour le milieu terrestre et d'aucune donnée pour les organismes vivant dans les sédiments.
On a effectué une analyse conservatrice de l'exposition liée aux processus de formulation chimique, de teinture des papiers et des textiles, et de production de produits pharmaceutiques, car ces secteurs devaient présenter le plus grand potentiel de risque écologique lié aux rejets industriels dans l'environnement pour ces substances. À l'aide d'une approche probabiliste, les CEE ont été comparées à la CESE dans l'eau. La probabilité que les CEE des colorants basiques azoïques dépassent la CESE s'est avérée très faible.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, les colorants basiques azoïques présentent un faible risque d'effets nocifs sur les organismes et sur l'intégrité globale de l'environnement. Ainsi, on conclut que les 33 colorants basiques azoïques inclus dans la présente évaluation ne répondent pas aux critères énoncés à l'alinéa 64a) ou b) de la Loi canadienne sur la protection de l'environnement (1999), car ils ne pénètrent pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ni à mettre en danger l'environnement essentiel pour la vie.
6.4.4 Incertitudes
De manière générale, le sous-groupe des colorants basiques azoïques analysés dans le présent rapport fournit peu de données écologiques. Par conséquent, une méthode déduite à partir d'analogues utilisant des données provenant d'analogues sélectionnés constituait la meilleure solution pour estimer les propriétés physiques et chimiques. Cela donne lieu à certaines incertitudes, car il existe toujours un certain degré de variation structurelle entre les substances évaluées et les analogues.
Disposer d'autres données sur la toxicité chronique à long terme permettrait de mieux évaluer ces substances en raison de leur possible persistance dans l'environnement, mais la documentation disponible est rare. L'utilisation de facteurs d'évaluation pour déterminer une CESE vise à tenir compte de cette incertitude. Tandis que l'eau a été déterminée comme étant le principal milieu d'intérêt, le sol et les sédiments présentaient également une certaine importance en raison de leur adsorption potentielle et des interactions électrostatiques. Par conséquent, le peu de données disponibles sur les effets des colorants basiques azoïques dans le sol et les sédiments constitue une source d'incertitude.
Le manque de concentrations environnementales mesurées pour ces substances (p. ex. données de surveillance) au Canada a mis en lumière la nécessité d'évaluer le risque en fonction des concentrations prévues dans l'eau près des sources industrielles ponctuelles. Des hypothèses prudentes ont été réalisées dans l'utilisation des modèles pour estimer les concentrations dans les plans d'eau récepteurs.
En raison de l'utilisation de certaines de ces substances dans d'autres pays, il se peut qu'elles entrent sur le marché canadien comme composants d'articles manufacturés ou de produits de consommation. Cependant, nous prévoyons que les quantités de ces substances déversées dans les divers milieux naturels ne différeront pas de façon significative des quantités estimées ici, compte tenu de l'utilisation d'hypothèses prudentes dans l'analyse de l'exposition.
7. Potentiel d'effets nocifs sur la santé humaine
En ce qui concerne la santé humaine, la présente évaluation préalable aborde 32 substances dans le sous-groupe des colorants basiques azoïques. Le NDTHPM, qui a été antérieurement évalué dans le cadre du Plan de gestion des produits chimiques, est pris en compte uniquement afin d'éclairer l'évaluation des effets sur la santé. En outre, l'évaluation actuelle est axée sur les substances pour lesquelles les sources d'exposition de la population générale sont définies. Aux fins de l'évaluation des effets sur la santé humaine, les substances auxquelles la population générale risquait d'être exposée ont été classées dans des sous-groupes en fonction de leur similarité structurale, comme le montre le tableau 7-1 ci-dessous.
| Sous-ensemble | Nom dans le C.I. ou n° CAS |
|---|---|
| A | Pentylènetétrazole, Basic Orange 2 et sels connexesNote de bas de page Tableau 7-1[a] 63681-54-9 et 75660-25-2, Basic Brown 1 |
| B | 14408-20-9, 36986-04-6 et 59709-10-3 |
| C | 68929-07-7 et 69852-41-1 |
| s. o. | 93783-70-1 |
| s. o. | 52769-39-8 |
7.1 Évaluation de l'exposition
7.1.1 Milieux naturels
Aucune donnée empirique sur les concentrations des colorants basiques azoïques dans les milieux naturels au Canada ou ailleurs n'a été retracée. Tel qu'il est expliqué à la section 4.1, cinq colorants basiques azoïques (Basic Brown 1, pentylènetétrazole et n° CAS 52769-39-8, 63681-54-9 et 75660-25-2) sont importés au Canada en des quantités qui ne devraient pas constituer une source importante d'exposition dans l'environnement (le NDTHPM n'a pas été évalué dans la présente évaluation préalable, car il avait déjà été évalué dans le cadre du Défi du PGPC et la conclusion établie en vertu de l'alinéa 64(c) n'a pas été mise à jour dans cette évaluation) (Environnement Canada, Santé Canada, 2010). En outre, on ne disposait pas de renseignements liés à l'utilisation de volumes des sept colorants basiques azoïques définis comme étant utilisés au Canada. En raison de la très faible volatilité et des quantités commerciales limitées des colorants basiques azoïques, les milieux environnementaux ne sont pas considérés comme étant une importante source d'exposition de ces substances pour la population générale au Canada.
Le potentiel d'exposition indirecte de la population générale canadienne au pentylènetétrazole, qui découle de son utilisation comme produit pharmaceutique, devrait être minime en raison de la faible quantité utilisée au Canada ( inférieur(e) à 0,10 kg par an) qui a été déclarée en 2011 et 2012 (MIDAS, 2013).
7.1.2 Produits de consommation et produits cosmétiques
Un certain nombre de scénarios d'exposition présentent un intérêt pour l'exposition de la population générale au Canada, y compris l'utilisation de colorants capillaires, de papier, de textiles et d'encre de stylos à bille, ou le contact avec ces produits. Lorsque des renseignements propres aux substances étaient disponibles, des estimations de l'exposition ont été calculées pour chaque substance. Par ailleurs, les renseignements obtenus dans le cadre d'évaluations antérieures (NDTHPM, colorants de groupe azoïque et à base de benzidine) et les paramètres génériques par défaut ont été utilisés pour caractériser l'exposition durant l'utilisation de ces produits ou le contact avec ces produits (voir l'annexe B). Les estimations de l'exposition sont présentées sommairement au tableau 7-2 et plus en détail à l'annexe B.
Sous-ensemble A (pentylènetétrazole, Basic Orange 2 et sels connexes (n° CAS 63681-54-9 et 75660-25-2) et Basic Brown 1)
Trois des cinq substances du sous-ensemble A sont considérées comme ayant un potentiel d'exposition sur la base des données disponibles; l'exposition au Basic Orange 2 a été quantifiée pour les colorants capillaires et de l'encre de stylo, tandis que l'exposition potentielle découlant de l'utilisation dans du papier a été caractérisée de manière qualitative pour le Basic Brown 1 et le n° CAS 75660-25-2. Pour deux substances du sous-ensemble A, le pentylènetétrazole et le n° CAS 63681-54-9, l'exposition de la population générale découlant de produits de consommation est peu probable. De plus amples renseignements sont disponibles dans les sections suivantes.
L'exposition cutanée au Basic Orange 2 présent dans les colorants capillaires a été estimée et elle est résumée dans le tableau 7-2 (voir l'annexe B pour plus de détails). L'utilisation de colorants capillaires contenant du Basic Orange 2 est très limitée compte tenu de la vaste gamme de colorants capillaires offerts aux consommateurs au Canada. L'exposition par inhalation devrait être négligeable en raison de la très faible pression de vapeur de ces substances. On considère que l'exposition par inhalation aux gouttelettes des vaporisateurs est minime par rapport à l'exposition par voies cutanée et orale.
Il a également été déterminé que le Basic Orange 2 était un ingrédient de l'encre des stylos à bille vendus au Canada (Smoothline Writing Instruments, 2010). L'exposition accidentelle par voie orale et l'exposition par voie cutanée ont été estimées et sont résumées au tableau 7-2 (voir l'annexe B pour plus de détails).
| Produit de consommation ou produit cosmétique | Groupe d'âge | Substance | Plage de concentration ( % p/p) | Exposition orale par événement (mg/kg p.c.) | Exposition cutanée par événement (mg/kg p.c.) |
|---|---|---|---|---|---|
| Colorant capillaire semi-permanent | Adulte | Basic Orange 2 | 0,3–1Note de bas de page Tableau 7-2[a] | -- | 0,15–0,49 |
| Colorant capillaire permanent | Adulte | Basic Orange 2 | 0,3–1[a] | -- | 0,42–1,4 |
| Encre à écrire | Tout-petit | Basic Orange 2 | 1,5 | 0,002Note de bas de page Tableau 7-2[b] | 0,002[b] |
On a déclaré l'utilisation du n° CAS 75660-25-2 dans du papier dans une enquête menée en vertu de l'article 71, et le mâchonnement de produits de papier est considéré comme étant une source potentielle de la pire exposition (selon les scénarios d'exposition indicateurs) pour ce type d'utilisation. Bien que les tout-petits puissent être exposés accidentellement à la substance en se mettant du papier dans la bouche, on ne sait pas exactement quelle quantité est en fait ingérée et on ne connaît pas la résistance du colorant sur le papier suivant l'ingestion. Les colorants basiques azoïques ont une grande affinité pour la pâte écrue et la pâte de bois du papier (Hunger, 2003). Lors de l'évaluation du NDTHPM (un colorant classé dans le sous-groupe des colorants basiques azoïques ayant déjà été évalué dans le cadre du Défi du Plan de gestion des produits chimiques), l'exposition orale par ingestion accidentelle de papier a été estimée à 0,6 mg/kg p.c. par épisode chez les enfants âgés de 0,5 à 4 ans (Environnement Canada, Santé Canada, 2010). Dans l'ensemble, le mâchonnement de papier par des tout-petits est considéré comme étant accidentel et faible. Même si le Basic Brown 1 a également été défini comme étant utilisé dans des produits de papier, il ne devrait pas être présent dans des produits accessibles aux enfants, d'après le suivi effectué à la suite des renseignements fournis au cours de l'enquête menée en vertu de l'article 71 (Environnement Canada, 2012); par conséquent, l'exposition par voie orale des tout-petits découlant du mâchonnement de papier ne devrait pas se produire pour cette substance. Dans l'ensemble, l'utilisation du Basic Brown 1 et du n° CAS 75660-25-2 dans du papier ne devrait pas constituer une source importante d'exposition pour la population générale.
Pour deux des cinq autres substances du sous-ensemble A (pentylènetétrazole et n° CAS 63681-54-9), il ne devrait pas y avoir d'exposition de la population générale.
Les médicaments contenant du pentylènetétrazole en tant qu'ingrédient ont déjà été évalués en vertu de la Loi sur les aliments et drogues (Canada, 1985) en ce qui concerne leur sécurité, leur efficacité et leur qualité. D'après les renseignements disponibles, aucune autre utilisation potentielle du pentylènetétrazole dans des produits de consommation n'a été relevée. Ainsi, il ne devrait pas y avoir d'expositions non médicamenteuses pour cette substance.
Même s'il a été déterminé que des produits contenant le numéro CAS 63681-54-9 étaient importés au Canada pour y être utilisés, on a indiqué en réponse à une enquête menée en vertu de l'article 71 de la LCPE (1999) que ces produits n'étaient plus présents sur le marché canadien et donc qu'une exposition à la substance était peu probable (Canada, 2009; idem, 2012).
Sous-ensembles B (nos CAS 14408-20-9, 36986-04-6 et 59709-10-3) et C (nos CAS 68929-07-7 et 69852-41-1), nos CAS 52769-39-8 et 93783-70-1
Même si le n° CAS 52769-39-8 a été défini comme étant utilisé dans une encre liquide, une encre en poudre ou un colorant, tel qu'il est indiqué dans la section 4.2, la préparation commerciale a été définie comme un colorant de textiles. Par conséquent, l'exposition de la population générale canadienne à cette substance a été caractérisée sur la base des contacts de la population avec les textiles. Pour ce qui est des six autres substances (numéros CAS 14408-20-9, 36986-04-6, 59709-10-3, 68929-07-7, 69852-41-1 et 93783-70-1), aucun renseignement n'était disponible sur leurs préparations commerciales, bien qu'il ait été déterminé que celles-ci étaient utilisées au Canada (communication personnelle, courriel de 2010 de l'ETAD à Environnement Canada; source non citée). En l'absence de renseignements propres aux utilisations des colorants, et en tenant compte de l'utilisation générique des colorants basiques dans la teinture des textiles et des papiers (Hunger, 2003; Canada, 2012a), il a été possible de faire une estimation de la limite supérieure d'exposition en fonction de leur utilisation dans les teintures des textiles. Tel qu'il est indiqué ci-dessus dans la discussion liée au sous-ensemble A, l'exposition potentielle à la substance par contact avec le papier est considérée comme étant accidentelle et faible. Pour ce qui est des textiles, étant donné que les facteurs d'exposition étaient les mêmes pour le numéro CAS 52769-39-8 et les six autres substances, les estimations d'exposition présentées au tableau 7-3 s'appliquent donc aux sept substances, y compris au numéro CAS 52769-39-8. Ces estimations sont basées sur des scénarios génériques intégrant un facteur d'ajustement de 10 % pour la détection des amines aromatiques ne figurant pas sur EU22 dans des textiles, qui est généralement inférieure à 10 % pour les colorants connexes (Environnement Canada et Santé Canada, 2014a).
| Produit de consommation ou produit cosmétique | Groupe d'âge | Plage de concentration ( % p/p) | Exposition orale par événement (mg/kg p.c.) | Exposition orale quotidienne (mg/kg p.c. par jour) | Exposition cutanée quotidienne (mg/kg p.c. par jour)Note de bas de page Tableau 7-3[b] |
|---|---|---|---|---|---|
| Textiles | Adulte | 1Note de bas de page Tableau 7-3[a] | -- | 2,7 × 105 | 0,0026 |
| Textiles | Nourrisson | 1a | -- | 0,0003 | 0,0040 |
7.1.3 Incertitude
L'exposition estimée au Basic Orange 2 dans les colorants capillaires est basée sur des hypothèses prudentes (voir l'annexe B), y compris celle avançant une absorption cutanée de 100 % en tant que valeur par défaut du niveau 1, bien que l'absorption cutanée de ces substances soit jugée limitée. Il se pourrait que l'absorption augmente si la liaison azoïque est brisée, ce qui libérerait des amines aromatiques pouvant être plus facilement absorbées.
Les facteurs d'exposition utilisés pour calculer les estimations sont basés sur des hypothèses génériques liées aux colorants, mais qui ne sont pas propres aux colorants basiques azoïques. De même, des doutes persistent quant à l'exposition aux colorants dont l'utilisation est définie par l'ETAD, étant donné que les préparations commerciales potentielles sont inconnues. L'exposition aux colorants basiques azoïques pouvant être présents dans des textiles et des produits du papier (no CAS 14408-20-9, 36986-04-6, 59709-10-3, 68929-07-7, 69852-41-1, 93783-70-1 et 52769-39-8) a été estimée de façon prudente sur la base des utilisations générales de ces colorants, et les estimations génériques ne sont pas propres aux colorants basiques azoïques.
En ce qui concerne le scénario d'exposition orale par l'ingestion accidentelle de papier par les tout-petits, on ne sait pas exactement la quantité de papier qu'un tout-petit peut ingérer lors d'un épisode de mâchonnement et on ne connaît pas la biodisponibilité du colorant dans le papier traité.
7.2 Évaluation des effets sur la santé humaine
L'évaluation des effets sur la santé des colorants basiques azoïques a mis l'accent sur 12 substances auxquelles une exposition de la population générale du Canada est attendue (voir la section 7.1). Le NDTHPM a été évalué antérieurement dans le cadre du Plan de gestion des produits chimiques (Environnement Canada, Santé Canada, 2010). On peut conclure que cette substance ne satisfait pas aux critères de l'article 64c) de la LCPE (1999). Toutefois, elle a été déterminée comme ayant des effets préoccupants sur la santé en raison du risque qu'elle subisse un clivage réducteur des liaisons azoïques à l'amine aromatique cancérogène figurant sur EU22, à savoir le p-aminoazobenzène. Aucun nouveau renseignement important lié aux conclusions sur la santé n'a été recensé pour le NDTHPM. Par conséquent, la conclusion précédente sur la santé n'a pas été mise à jour pour cette substance.
Dans le cas des 20 substances pour lesquelles une exposition de la population générale du Canada n'est pas prévue, la caractérisation des effets sur la santé de ces substances et de leurs métabolites du clivage azoïque était principalement axée sur les données disponibles concernant la cancérogénicité et la génotoxicité.
La cancérogénicité et la génotoxicité sont généralement considérées comme étant des effets critiques sur la santé potentiellement préoccupants en ce qui a trait aux substances azoïques aromatiques et à base de benzidine (Environnement Canada et Santé Canada, 2013). L'un des principaux mécanismes par lequel les substances azoïques aromatiques exercent leur toxicité comprend le clivage réducteur des liaisons azoïques et la libération subséquente d'amines aromatiques libres. Par la suite, ces amines aromatiques peuvent se convertir en produits intermédiaires électrophiles réactifs par oxydation métabolique (Environnement Canada et Santé Canada, 2013). D'après les renseignements disponibles pour deux colorants basiques azoïques et des considérations impliquant des données déduites à partir d'analogues pour les dix autres substances (voir la section 7.2.1), les colorants basiques azoïques sont considérés comme ayant un certain potentiel de subir un clivage réducteur. Par conséquent, nous avons évalué en partie les effets sur la santé des colorants basiques azoïques en examinant leur capacité de subir un clivage réducteur ainsi que le potentiel de risque des métabolites d'amines aromatiques correspondants.
En outre, les substances azoïques qui sont plus lipophiles peuvent être absorbées dans le tractus gastro-intestinal en tant que substance d'origine avec la liaison azoïque intacte, tel qu'il est observé pour plusieurs colorants avec solvant azoïques (Environnement Canada, Santé Canada, 2015). Compte tenu du fait que les colorants basiques azoïques du type de base faible (p. ex., sous-ensemble A) montrent une ionisation dépendant du pH (se reporter à la section 3 Propriétés physiques et chimiques), ces substances ont tendance à être non chargées et lipophiles à un pH neutre et, par conséquent, peuvent aussi être absorbées en tant que substance d'origine avec une liaison azoïque intacte. On a déclaré l'absorption de certains colorants basiques azoïques avant le clivage de la liaison azoïque (CIRC, 1980; Holahan et al., 2010), y compris l'un des colorants basiques azoïques inclus dans la présente évaluation, notamment le pentylènetétrazole, en se fondant sur des études in vivo menées sur des modèles humains et animaux (voir la section 7.2.1). Si la substance azoïque d'origine absorbée possède une ou plusieurs amines aromatiques libres, elle peut être métabolisée rapidement en produits intermédiaires électrophiles, et ce, sans clivage de la liaison azoïque. Les données in vitro ont montré que la substance azoïque d'origine peut être directement métabolisée en produits intermédiaires électrophiles, et ce, par l'entremise d'amines aromatiques libres sur la substance d'origine (Sandhu et Chipman, 1991b), et elle est considérée comme étant la voie d'activation pour certains colorants avec solvant azoïques, tels que le p-aminoazobenzène et le Solvent Yellow 2 (Environnement Canada, Santé Canada, 2015). Ainsi, en plus de la toxicité potentielle des métabolites d'amines aromatiques du clivage de la liaison azoïque, l'oxydation directe de la partie d'amines aromatiques libres sur la substance azoïque d'origine peut également constituer une voie d'activation potentielle pour certains des colorants basiques azoïques ayant cette caractéristique structurale (p. ex., les substances du sous-ensemble A; voir la section 7.2.2).
Dans l'ensemble, des données empiriques limitées ont été relevées sur les effets sur la santé des 12 colorants basiques azoïques. En raison du peu de données disponibles sur ces substances, des données toxicologiques sur des substances analogues ont été prises en compte pour éclairer l'évaluation des effets sur la santé. Les sous-ensembles ont été déterminés pour appuyer les données déduites à partir d'analogues parmi des substances similaires, sur la base de la structure chimique et des propriétés physiques et chimiques, lorsqu'elles étaient disponibles. À ce titre, les sels connexes ont été considérés comme des équivalents toxicologiques et regroupés dans le même sous-ensemble (p. ex., le Basic Orange 2 et des sels connexes de numéros CAS 63681-54-9 et 75660-25-2 sont regroupés dans le sous-ensemble A). Certaines de ces substances ont été définies à l'aide de la boîte à outils de l'OCDE RQSA (2013), de la base de données internationale du C.I. (CII, 2011) et de recherches documentaires avec TOXLINE et SciFinder, de même qu'à l'aide de paramètres jugés pertinents, y compris la catégorie d'application des colorants, la similarité structurelle (présence de liaisons azoïques et du groupe fonctionnel aryle), les propriétés physiques et chimiques (taille moléculaire et solubilité), et le mode d'action (potentiel de rejet des mêmes produits réactifs du clivage réducteur).
7.2.1 Absorption, métabolisme et potentiel de clivage de la liaison azoïque
Peu de données ont été relevées sur l'absorption, le métabolisme et le potentiel de clivage azoïque pour les substances incluses dans l'évaluation des colorants basiques azoïques et elles se limitaient à plusieurs études in vivo sur une seule substance, notamment le pentylènetétrazole, ainsi qu'à des études in vitro examinant le potentiel de clivage de la liaison azoïque pour le Basic Brown 1. Cette information est résumée ci-après.
Données in vivo
Des études in vivo sont considérées comme fournissant les données les plus pertinentes pour caractériser l'absorption, le métabolisme et le clivage de la liaison azoïque des substances azoïques, et ce type de données a été défini pour un seul colorant basique azoïque du sous-ensemble A, à savoir le pentylènetétrazole. Ce colorant est considéré comme étant absorbé, puis conjugué ou réduit lorsqu'il est administré par voie orale aux humains; la plus grande quantité de la substance est éliminée dans l'urine (CIRC, 1980). En outre, il est considéré comme étant absorbé sur la base des preuves liées à des rats ayant reçu la substance radiomarquée par gavage à raison de 100 mg/kg de poids corporel (kg-p.c.) (Thomas et al., 1993).
On a noté que l'absorption du pentylènetétrazole était rapide à partir du tube digestif de rats, avec une répartition ultérieure dans le foie et les reins. La bile a été définie comme étant la majeure voie d'excrétion; un plus faible pourcentage était excrété dans l'urine (Thomas et al., 1993). La monographie des produits pharmaceutiques contenant du pentylènetétrazole comme ingrédient actif mentionne que la décoloration de l'urine, des matières fécales, de la sclérotique ou de la peau chez les humains est un effet secondaire possible de la prise de ce médicament (Erfa Canada Inc., 2010).
Les principaux métabolites de pentylènetétrazole éliminés dans l'urine des humains 36 heures après l'administration par voie orale étaient le pentylènetétrazole d'origine non modifié ou à cycle hydroxylé ainsi que le produit du clivage de la liaison azoïque, à savoir l'aniline et ses métabolites hydroxylés et N-acétylés (p-aminophénol et acétaminophène (NAPA) (Johnson et Chartrand, 1976; Thomas et al., 1990).
D'autres études concernant le métabolisme et l'élimination du pentylènetétrazole ont été relevées pour d'autres espèces d'animaux de laboratoire; dans ces études, la voie d'excrétion principale et le produit (métabolite ou conjugué) sont différents selon les espèces (Johnson et Chartrand 1976; Bailey et al., 1983; Thomas et al., 1993, 1990; Jurima-Romet et al., 1993). Le principal composé de l'excrétion biliaire après administration par voie orale de pentylènetétrazole chez des rats comprend de la 2,6-diamino-3-(4-hydroxyphenylazo)pyridine (4′-OH-PAP) et un conjugué glucuronide (Thomas et al., 1993). Les principaux métabolites urinaires chez des rats, des souris ou des cochons d'Inde incluent le NAPA, le p-aminophénol, la 2,6-diamino-5-hydroxy-3-(4-hydroxyphenylazo)pyridine (5,4′-diOH-PAP), la 4′-OH-PAP et la 5-OH-PAP (Johnson et Chartrand, 1976; Bailey et al., 1983; Thomas et al., 1990, 1993). On constate des différences entre les espèces en termes de voie principale d'élimination (Thomas et al., 1993, 1990) et de portée du clivage des liaisons azoïques, qui est élevé chez les souris et les cochons d'Inde, modéré chez les rats, et faible chez les humains exposés au pentylènetétrazole (Thomas et al., 1990). En résumé, les données disponibles sur le pentylènetétrazole indiquent qu'il est absorbé par la voie orale en tant que substance d'origine avec une liaison azoïque intacte, et il peut également subir un clivage de la liaison azoïque aux métabolites d'amines aromatiques.
Deux études in vivo studies sur le Basic Orange 2 ne fournissent que des renseignements limités sur le métabolisme de cette substance. En bref, on a découvert que le colorant était excrété dans l'urine après son administration par voie orale à des rats (Cambel et al., 1954), et que la réduction du Basic Orange 2 dépend du système digestif et de la microflore lorsque la substance est administrée à des chiens (Sisley et Porcher, 1911). Par ailleurs, lorsque la substance a été administrée à des souris, on en a relevé une petite quantité liée à des protéines hépatiques (Piekarski et Marciszewski, 1966). Malgré ces données limitées, on s'attend à ce que l'absorption et le clivage azoïque du Basic Orange 2 et des sels connexes portant les numéros CAS 63681-54-9 et 75660-25-2 dans le tractus gastro-intestinal se comportent de façon similaire à celle observée pour le pentylènetétrazole, sur la base de leur structure, de leurs propriétés physicochimiques, de leur ionisation dépendant du pH modélisée, et de leur solubilité similaires (voir la section 3 Propriétés physiques et chimiques).
Données in vitro
Une étude in vitro sur le métabolisme était disponible pour le Basic Brown 1, dans laquelle le colorant a été incubé dans du contenu intestinal, des matières fécales et des extraits de foie d'espèces mammifères (BRI, 2013). Dans le cadre de cette étude, la disparition du composé d'origine du Basic Brown 1 de la période d'incubation moyenne au cours des quatre à huit premières heures de la période d'incubation de 24 heures indique le clivage réducteur de la liaison azoïque rapide de cette substance.
Des résultats positifs obtenus dans le test d'Ames, uniquement lorsqu'il était mené dans des conditions réductrices, peuvent également être pris en compte pour déduire le potentiel de clivage réducteur lorsque la substance d'origine azoïque est négative ou faiblement mutagène dans des conditions standard (Environnement Canada et Santé Canada, 2013). Le n° CAS 75660-25-2 et le n° CAS 68929-07-7 ont produit des résultats positifs dans la souche de Salmonella typhimurium TA98 dans des conditions réductrices (BioReliance, 2012). Des résultats négatifs dans la souche de S. typhimurium TA100 dans des conditions réductrices ont été observés pour le Basic Orange 2, le n° CAS 75660-25-2 et le n° CAS 68929-07-7 (Sandhu et Chipman, 1991b; BioReliance, 2012). Toutefois, étant donné que les deux substances ont également été déclarées positives dans des conditions non réductrices standard dans le cadre de cette étude, il est probable que les renseignements limités sur le potentiel de clivage azoïque de la substance d'origine puissent être déduits dans la souche TA100 pour ces substances.
En résumé, les données disponibles sur les deux substances du sous-ensemble A (pentylènetétrazole et Basic Brown 1) laissent entendre que ces substances peuvent être absorbées en tant que substance azoïque d'origine et qu'elles présentent un potentiel de subir un clivage de la liaison azoïque par voie orale. En l'absence de données sur les colorants basiques azoïques restants dans le cadre de la présente évaluation, on considère qu'un potentiel similaire peut également exister pour ces substances et qu'il concorde avec l'ensemble des connaissances disponibles pour la plupart des substances azoïques aromatiques en général (Environnement Canada, Santé Canada, 2013).
7.2.2 Données relatives aux effets sur la santé pour le sous-ensemble A (pentylènetétrazole, Basic Orange 2 et sels connexes portant les numéros CAS 63681-54-9 et 75660-25-2, et Basic Brown 1)
Les substances du sous-ensemble A partagent plusieurs caractéristiques chimiques et structurelles. Ces substances partagent au moins un métabolite commun du clivage de la liaison azoïque (tableau 7-4). Le pentylènetétrazole et le Basic Orange 2 (et ses sels connexes) sont les deux substances monoazoïques contenant la même partie aniline jointe par une liaison azoïque à des polyamines aromatiques ayant une structure similaire, soit la 2,3,6-triaminopyridine et le 1,2,4-triaminobenzène, respectivement. Le Basic Brown 1 est une substance disazoïque qui accueille également deux parties de 1,2,4-triaminobenzène liées au benzène-1,3-diamine. Les données sur les effets sur la santé des substances du sous-ensemble A sont décrites dans les sections suivantes.
| Substance d'origine | Produits potentiels du clivage de la liaison azoïque |
|---|---|
Pentylènetétrazole
|
Aniline (n° CAS 62-53-3)
2,3,6-triaminopyridine (n° CAS 4318-79-0)
|
Basic Orange 2 et sels connexesNote de bas de page Tableau 7-4[a]
|
Aniline (n° CAS 62-53-3)
1,2,4-triaminobenzène (n° CAS 615-71-4)
|
Basic Brown 1
|
1,2,4-triaminobenzène (n° CAS 615-71-4)
1,3-Bis(2,3-diaminophénylazo)benzène (n° CAS 108-45-2)
|
Pentylènetétrazole
Cancérogénicité et génotoxicité
Le pentylènetétrazole, qui est utilisé comme analgésique des voies urinaires dans des produits pharmaceutiques sur ordonnance (voir la section 4.2 utilisations), a été examiné et classé par le Centre international de recherche sur le cancer (CIRC) comme un produit cancérogène du groupe 2B (substances pouvant être cancérogènes pour l'homme) (CIRC, 1975b, 1980, 1987a). Dans le deuxième et douzième rapport sur les substances cancérogènes, le National Toxicology Program (NTP) a inscrit le pentylènetétrazole parmi les substances dont « on peut raisonnablement présumer qu'elles sont cancérogènes pour les humains, d'après les éléments suffisants dont il dispose sur la cancérogénicité chez des animaux de laboratoire ». (NTP, 1981, 2011). Le Centre international de recherche sur le cancer (CIRC) et le National Toxicology Program (NTP) ont utilisé la même étude sur le cancer (NCI, 1978), qui est mentionnée à la section précédente, comme base pour leurs conclusions sur le pentylènetétrazole.
Dans une étude épidémiologique, aucune incidence excessive importante de cancer n'a été relevée chez 2 214 patients traités avec du pentylènetétrazole et suivis pendant au moins 3 ans (Friedman et Ury, 1980); CIRC, 1975). L'évaluation du CIRC a cité des limites de l'étude en raison du manque de détails sur la répartition par âge par sexe des sujets exposés et doses et durées d'utilisation du pentylènetétrazole. Tandis qu'une publication ultérieure sur la même cohorte soumise à une autre période de suivi de 12 ans continue d'indiquer une absence de lien entre le risque de cancer et le traitement au pentylènetétrazole (Van den Eeden et Friedman, 1995; Habel et Friedman, 2006), les limites initialement signalées par le CIRC continuent de s'appliquer. Toutefois, l'absence d'un lien évident dans cette cohorte prouve que cette substance n'est vraisemblablement pas un puissant cancérogène dans les conditions d'exposition de la population à l'étude.
Une étude sur la cancérogénicité a été menée pour le pentylènetétrazole sur des rats F344 et des souris B6C3F1 par voie alimentaire (NCI, 1978). Des groupes de 35 animaux par sexe ont été traités avec 3 700 ou 7 500 ppm (180 et 415 mg/kg p.c. par jour pour les mâles; 228 et 613 mg/kg p.c. par jour pour les femelles) pendant 78 semaines, puis les rats ont été observés pendant 26 ou 27 semaines. Les souris ont reçu 600 ou 1 200 ppm (65 et 137 mg/kg p.c. par jour pour les mâles; 67 et 150 mg/kg p.c. par jour pour les femelles) pendant 80 semaines, avec une période d'observation de 25 à 27 semaines. Des groupes de 15 rats et souris non traités de chaque sexe ont été utilisés comme témoins appariés. Les rats ont été sacrifiés à 104 et 105 semaines, et les souris, entre 105 et 107 semaines. La diminution du poids corporel chez les rats et les souris, comparativement au groupe témoin, a été considérée comme un effet lié à la dose, tandis que la mortalité chez les rats et les souris n'a pas été jugée comme une tendance liée à la dose (NCI, 1978).
Les effets cancérogènes observés chez les rats comprennent une tendance statistiquement significative et liée à la dose pour la formation d'adénomes et d'adénocarcinomes du gros intestin (côlon et rectum) chez des rats F344 mâles, mais pas chez les femelles (mâles : témoins, faible, élevée = 0/14, 4/34, 8/35; femelles : témoins, faible, élevée = 0/15, 3/33, 5/32). Cependant, en comparaison avec la faible incidence d'adénomes et d'adénocarcinomes du gros intestin chez les rats du groupe témoin historique de ce laboratoire (0/260 chez les femelles; 1 polype chez 260 mâles), le NTP a considéré les tumeurs du gros intestin dans cette étude comme étant liées à l'exposition pentylènetétrazole. On a déterminé que la diminution observée de l'incidence (de tumeurs à cellules interstitielles dans les testicules des rats mâles exposés à la dose élevée, de fibroadénomes des glandes mammaires chez les femelles) était attribuable à l'incidence accrue chez les témoins et non liée au traitement avec lepentylènetétrazole (NCI, 1978).
Chez les souris B6C3F1 femelles, une tendance statistiquement significative liée à la dose a été signalée pour les carcinomes hépatocellulaires (p = 0,01) ainsi que pour les adénomes ou les carcinomes hépatocellulaires combinés (p = 0 002) par rapport aux témoins. Une augmentation statistiquement significative de l'incidence combinée d'adénomes ou de carcinomes hépatocellulaires a été signalée chez les souris femelles ayant reçu la dose élevée comparativement aux témoins (témoins, faible, élevée = 2/15, 11/34, 19/32). Chez les souris mâles, on n'a signalé aucune réaction significative lorsque les mêmes types de tumeurs ont été pris en compte, seuls ou avec d'autres (témoins, faible, élevé = 2/15, 11/34, 19/32), ni aucune métastase déclarée (NCI, 1978). L'étude a été considérée comme étant « négative » pour la cancérogénicité du pentylènetétrazole chez les souris mâles.
D'autres études de cancérogénicité du pentylènetétrazole chez les souris (Allen et al., 1957; Stoner et al.,1957; Stoner et al.1973) n'ont pas été incluses dans la présente évaluation préalable en raison de limitations (CIRC, 1975b; idem, 1980) et du fait que les voies d'administration (injection intrapéritonéale, implantation dans la vessie) n'étaient pas considérées comme étant adaptées aux scénarios d'exposition précédemment caractérisés.
D'après les études présentées ci-dessus, le pentylènetétrazole est considéré comme ayant un potentiel de cancérogénicité dû à l'incidence accrue de différents types de tumeurs chez deux espèces, notamment des adénomes et des adénocarcinomes du colon chez les rats mâles et femelles et une incidence combinée d'adénomes et de carcinomes hépatocellulaires chez les souris femelles (NCI, 1978). Et, par conséquent, ces données indiquent un risque de cancérogénicité après une exposition répétée à long terme au pentylènetétrazole.
Des dommages à l'ADN in vivo ont été observés en effectuant un essai de Comet, ainsi que dans l'estomac, le côlon et le foie de souris ddY mâles après une seule exposition par voie orale au pentylènetétrazole à 400 mg/kg p.c., valeur qui a été jugée par les auteurs comme étant la dose maximale tolérée dans un essai préliminaire de toxicité aiguë (Tsuda et al., 2000). Une réaction clastogène a été observée pour le pentylènetétrazole, découlant d'une hausse de la formation de micronoyaux dans le foie de rats et la moelle osseuse de souris CD-1 femelles (Morita et al., 1997; Shirotori et Miyagawa, 1997). Des essais de la mutagénicité chez des espèces non mammaliennes, comme l'essai de mutation létale récessive liée au sexe chez Drosophila, ont affiché des résultats équivoques pour le pentylènetétrazole (Woodruff et al., 1985; Mason et al., 1992).
Les résultats pour la mutagénicité in vitro étaient mitigés, car le pentylènetétrazole a entrainé une mutation du locus thymidine kinase (tk) dans des cellules de lymphomes de souris (McGregor, 1991), mais a affiché des résultats équivoques avec l'activation métabolique, ou des résultats négatifs avec l'activation dans diverses souches de S. typhimurium dans le test d'Ames (Mortelmans et al., 1986). Des résultats positifs ont été signalés pour la réparation de l'ADN, tel qu'il a été constaté au cours de la synthèse d'ADN non programmée dans des hépatocytes de rats mâles traités avec du pentylènetétrazole (Selden et al., 1994), ainsi que pour la clastogénicité par l'induction d'aberrations chromosomiques et d'échanges de chromatides sœurs dans des cellules ovariennes de hamster chinois (Galloway et al., 1987).
D'après les données disponibles, on considère que le pentylènetétrazole a un potentiel carcinogène après une exposition chronique. On note également un potentiel de génotoxicité, notamment au vu des dommages à l'ADN et des réactions clastogènes in vivo et in vitro; toutefois, on relève des résultats mitigés quant à la mutagénicité.
Autres effets sur la santé
Des effets non cancérogènes ont été observés avec le pentylènetétrazole dans l'étude de cancérogénicité menée chez des rats F344 et des souris B6C3F1 (NCI, 1978). Tel qu'il est résumé ci-dessus, on a administré à des rats mâles et femelles (35 de chaque sexe par groupe de traitement; 15 de chaque sexe dans le groupe témoin) lepentylènetétrazole, à raison de 3 700 ou 7 500 ppm pour les rats (180 et 415 mg/kg p.c. par jour pour les mâles; 228 et 613 mg/kg p.c. par jour pour les femelles) pendant 78 semaines, puis on les a observés pendant 26 ou 27 semaines. Les animaux survivants ont été sacrifiés à 104 ou 105 semaines. On a constaté que les poids corporels moyens étaient significativement plus faibles dans les groupes de traitement, mais que la mortalité observée dans ces groupes n'était pas liée à la dose. Les auteurs de l'étude ont noté que nombre des effets observés dans les groupes de traitement et le groupe témoin pourraient être liés à l'âge. Le niveau de traitement à faible dose de 180 mg/kg p.c. par jour été déterminé comme étant la dose minimale avec effet nocif observé (DMENO) pour les rats mâles, en raison d'une hausse accrue de l'incidence de l'inflammation du myocarde. Des effets similaires ont été observés chez des rats femelles aux deux niveaux de doses. L'incidence d'une hyperplasie des cellules C de la thyroïde et d'adénomes a été combinée en raison de la difficulté à établir une distinction entre les types de lésions ayant une apparence similaire. Chez les rats mâles, l'incidence combinée à la forte dose peut également s'avérer préoccupante. Par ailleurs, on a observé une incidence accrue de l'atrophie de la moelle osseuse chez les rats femelles à la forte dose de traitement (NCI, 1978).
Des souris mâles et femelles ont reçu du pentylènetétrazole à raison de 600 ou 1 200 ppm (65 et 137 mg/kg-p.c. par jour pour les mâles; 67 et 150 mg/kg-p.c. par jour pour les femelles) pendant 80 semaines, avec une période d'observation supplémentaire de 25 à 27 semaines. Les souris restantes ont été sacrifiées entre 105 et 107 semaines. On a relevé une baisse importante du poids corporel moyen, mais on a jugé que la mortalité déterminée n'était pas liée à la dose. Similairement aux rats traités dans la même étude, les auteurs ont noté que nombre des effets observés dans les groupes de traitement et le groupe témoin pourraient être liés à l'âge (NCI, 1978). Une dose sans effet observé (DSEO) de 150 mg/kg p.c. par jour, soit la plus forte dose testée, a été déterminée pour les souris.
Des études de toxicité à court terme et de reproduction chez des rats et des lapins ont été recensées pour le pentylènetétrazole administré avec de la sulfacytine, un antibiotique sulfamide (Erfa Canada Inc., 2010). Cependant, on a jugé qu'elles étaient peu utiles en raison de la combinaison de substances administrées et du manque de pertinence des effets observés pour les humains.
Produits potentiels du clivage de la liaison azoïque
Les produits prévus du clivage réducteur des liaisons azoïques du pentylènetétrazole sont l'aniline (n° CAS 62-53-3) et la 2,3,6-triaminopyridine (n° CAS 4318-79-0). Voir le tableau 7-4 et également l'annexe C (tableaux C1 et C2).
L'aniline a été auparavant évaluée par Santé Canada (2011); ainsi, seule une brève description des effets sur la santé est présentée ci-après. La génotoxicité de l'aniline dans divers essais biologiques in vitro ou in vivo était mixte, mais on l'observait généralement à des doses élevées. Dans des études sur la cancérogénicité, l'aniline a induit un spectre de tumeurs rares dans la rate de rats Fischer 344 mâles à des concentrations très élevées, concentrations qui ont également entraîné des effets importants sur les globules rouges et la toxicité non néoplasique de la rate comme conséquence de la méthémoglobinémie. Des renseignements supplémentaires sur l'aniline sont fournis dans Santé Canada (2011).
Aucune classification par d'autres organismes nationaux ou internationaux n'a été déterminée pour la 2,3,6-triaminopyridine (n° CAS 4318-79-0) et aucune donnée de toxicité chronique ou de génotoxicité n'a été recensée pour cette substance. Les données limitées disponibles laissent entendre que cette substance subit une autoxydation in vivo pour produire des espèces réactives à l'oxygène, ce qui pourrait être à l'origine de la toxicité observée chez des rats exposés à cette substance, y compris la nécrose des muscles squelettiques et cardiaques (Munday et Manns, 1998).
L'observation d'une augmentation de l'hématopoïèse dans la rate de rats des deux sexes exposés à des concentrations de pentylènetétrazole, bien qu'elle ne soit pas liée à la dose (NCI, 1978), est le signe d'une réponse de type aniline et prouve qu'un certain degré de clivage de la liaison azoïque a eu lieu. En outre, l'inflammation du myocarde chez les rats exposés à une dose de pentylènetétrazole (NCI, 1978) concorde également avec la toxicité de l'autre métabolite du clivage azoïque, à savoir la 2,3,6-triaminopyridine. Toutefois, les types de tumeurs observés à la suite d'une exposition au pentylènetétrazole (c.-à-d. le colon chez les rats, et le foie chez les souris) ne sont pas caractéristiques d'une exposition à l'aniline (sarcomes de la rate chez les rats), ce qui indique que l'aniline n'est pas le principal élément contributif à la cancérogénicité du pentylènetétrazole. En l'absence de données sur la toxicité chronique de la 2,3,6-triaminopyridine, la contribution potentielle de cette substance à la cancérogénicité du pentylènetétrazole est inconnue.
Basic Orange 2 et sels connexes portant les numéros CAS 63681-54-9 et 75660-25-2
Remarque : La forme à base libre du Basic Orange 2 et des sels connexes est le 1,3-Benzènediamine, 4-(phénylazo), monochlorhydrate, connu sous le nom CI Solvent Orange 3 (n° CAS 495-54-5). Ces substances devraient former la même espèce chimique in vivo et sont considérées comme étant des équivalents toxicologiques. Par conséquent, les données sur les effets sur la santé de toutes les substances sont évaluées ensemble. Le Solvent Orange 3 a été évalué précédemment dans le cadre de l'évaluation des colorants avec solvant azoïques (Environnement Canada, Santé Canada, 2015), et des renseignements supplémentaires sur les effets sur la santé pour ces substances ont également été déclarés dans cette évaluation.
Le Basic Orange 2, sous le nom de « chrysoïdine », a été examiné par le CIRC et il est considéré comme cancérogène chez les souris, sur la base de preuves limitées, tandis que les preuves de cancérogénicité chez l'homme étaient inadéquates (groupe 3 « inclassable quant à sa cancérogénicité pour l'homme ») (CIRC, 1975a, 1987b). En outre, le Basic Orange 2 et les sels connexes portant les numéros CAS 63681-54-9 et 75660-25-2 ont été classés comme agents mutagènes de catégorie 2 (« soupçonnés de causer des défauts génétiques ») par l'Union européenne à titre de groupe (y compris les numéros CAS 79234-33-6, 83968-67-6 et 84196-22-5) (Commission européenne, 2009).
Plusieurs rapports de cas et études cas-témoins de cancer de la vessie chez des pêcheurs amateurs au Royaume-Uni exposés par voie orale à des asticots colorés avec du Basic Orange 2 ont été examinés par le CIRC (Searle et Teale, 1982; Cartwright et al., 1983; Sole et Sorahan, 1985); ils ont été considérés comme des preuves de cancérogénicité inadéquates chez l'homme (CIRC, 1975, 1987b).
Des études de cancérogénicité du Basic Orange 2 ont été menées dans des expériences uniques chez des souris et des rats. Des souris C57BL mâles et femelles (60 de chaque sexe) ont été nourries avec un régime alimentaire faible en vitamines contenant du Basic Orange 2 à raison de 2 000 mg/kg par jour (260 mg/kg-p.c. par jour) pendant 13 mois, puis elles ont été nourries avec des aliments du groupe témoin et observées jusqu'à leur mort naturelle. Deux autres groupes (50 à 70 de chaque sexe) servaient de groupes témoins. Des tumeurs au foie ont été signalées chez des souris après 10 à 11 mois d'observation (groupe témoin = 1/89, 2/117; groupe de traitement = 75/104), en plus des métastases dans les poumons de trois animaux traités. Des leucémies et des tumeurs des cellules du réticulum ont également été signalées (groupe témoin = 9/89, 12/117; groupe de traitement = 28/104) (Albert, 1956). Bien que des questions aient été soulevées au sujet de l'âge de l'étude, de la pureté de la substance d'essai et de la méthodologie de l'étude, le CIRC a considéré que l'étude fournissait des preuves que « cette substance est cancérogène chez les souris après son administration par voie orale, entrainant des tumeurs des cellules du foie, une leucémie et des sarcomes des cellules du réticulum » (CIRC, 1975, 1987b). Dans une étude par voie alimentaire chez 10 rats nourris avec du Basic Orange 2 (à des concentrations de 1 000 mg/kg dans l'alimentation, équivalant à environ 50 mg/kg p.c. par jourNote de bas de page[6]), pour une période allant jusqu'à 366 jours, aucune tumeur n'a été signalée (Maruya, 1938); cependant, le CIRC (1975, 1987b) n'a pas considéré l'étude comme ayant été adéquatement déclarée. Avec un seul groupe de dose et un manque d'animaux témoins, une efficacité statistique limitée due au faible nombre d'animaux, et un nombre moindre de périodes d'observation et d'exposition tout au long de la vie, l'étude n'a peut-être pas complètement exploré le potentiel carcinogène chez les rats, tandis qu'elle peut fournir des preuves que la substance n'est pas un puissant cancérogène dans les conditions de l'étude dans l'ensemble. Par ailleurs, bien que les données disponibles sur la cancérogénicité du Basic Orange 2 chez les animaux soient limitées, le CIRC a considéré cette substance comme étant cancérogène chez les souris (CIRC, 1975, 1987b).
Des dommages à l'ADN in vivo (synthèse d'ADN non programmée dans des hépatocytes de rats) ont été observés lorsque des rats F344 mâles ont consommé du Basic Orange 2 à des doses allant jusqu'à 2 000 mg/kg-p.c. (BASF, 1991). Aux doses allant jusqu'à 300 mg/kg de poids corporel, on a observé des résultats de clastogénicité négatifs dans le test du micronoyau sur des souris (BASF, 1988). De même, dans des essais de la mutagénicité chez des espèces non mammaliennes, comme l'essai de mutation létale récessive liée au sexe chez Drosophila, on a obtenu des résultats négatifs (Foureman et al., 1994).
Le Basic Orange 2 présentait des résultats mitigés en matière de mutagénicité dans diverses souches du S. typhimurium soumises au test d'Ames (Garner et Nutman, 1977; Sole et Chipman, 1986; Zeiger et al., 1987; Sandhu et Chipman, 1990, 1991a; NTP, 1993). On a signalé des résultats positifs in vitro pour la réparation de l'ADN (synthèse d'ADN non programmée) dans des hépatocytes de rats (Sandhu et Chipman, 1990) et la recombinaison mutatique chez Saccharomyces cerevisiae (Zimina et Pavlenko, 1990).
La mutagénicité in vitro du n° CAS 75660-25-2 (sel d'acétate) a montré des résultats mitigés selon la souche et les conditions d'essai. On a obtenu des résultats positifs pour le n° CAS 75660-25-2 dans un test d'Ames modifié Prival lors de l'exposition de souches de S. typhimurium TA100 dans des conditions standard (sans induction de la fraction de S9 de foie de hamster) et de l'exposition de souches TA98 dans des conditions standard et réductrices (mononucléotide flavine). On a obtenu des résultats négatifs dans des souches TA100 dans des conditions réductrices (BioReliance, 2012).
Aucune donnée empirique relative aux effets sur la santé n'a été recensée pour le n° CAS 63681-54-9 (dodécylbenzènesulfonate de sodium).
Dans l'ensemble, sur la base du peu de données disponibles, cette substance est signalée comme étant cancérogène chez les souris (CIRC, 1975, 1987b) et, par conséquent, le Basic Orange 2 et les sels connexes portant les numéros CAS 63681-54-9 et 75660-25-2 sont définis dans la présente évaluation comme ayant un pouvoir cancérogène. Sur la base de l'évaluation des données de génotoxicité disponibles, on considère que le Basic Orange 2 et les sels connexes sont mutagènes et qu'ils pourraient réparer l'ADN endommagé ou altéré, tel qu'on l'a observé dans des essais in vivo et in vitro.
Autres effets sur la santé
Des rats mâles et femelles albinos Sprague-Dawley-Holtzman (5 de chaque sexe par dose) ont reçu une dose unique de 0,1 % (un total de 670 mg par rat ou environ 160 mg/kg p.c. par jour) de Basic Orange 2 dans de l'eau potable pendant 21 jours (Cambel et al., 1954). Les animaux ont été sacrifiés après la période de traitement. Une baisse statistiquement significative du nombre de globules rouges (27 % chez les femelles, 10 % chez les mâles) et de petites baisses du taux d'hémoglobine ont été observées à la seule dose testée (160 mg/kg p.c. par jour). Les effets observés incluaient une hausse importante des cellules pariétales binucléées de l'estomac ainsi qu'une pigmentation du préestomac, des sécrétions de l'estomac glandulaire et de l'intestin grêle (Cambel et al., 1954). Cette pigmentation est l'indication d'une exposition locale due à la présence observée du colorant. Le changement de couleur observé de l'urine, quant à lui, laisse entendre une exposition systémique après l'exposition orale. Cette étude avait une portée limitée et était axée sur le sang et l'estomac, où les effets n'ont pas été jugés graves. Un niveau d'effet de 160 mg/kg p.c. par jour a été déterminé dans cette étude, d'après l'hématotoxicité et la pigmentation.
Produits prévus du clivage réducteur des liaisons azoïques
Les produits prévus du clivage des liaisons azoïques pour le Basic Orange 2 ainsi que les sels connexes sont l'aniline (n° CAS 62-53-3) et du 1,2,4-triaminobenzène (n° CAS 615-71-4).
Les données sur les effets sur la santé pour l'aniline ont déjà été décrites dans la section précédente sur les produits du clivage de la liaison azoïque pour le pentylènetétrazole et ne sont donc pas répétées dans la présente section.
Aucune classification par d'autres organismes nationaux ou internationaux n'a été relevée pour le 1,2,4-triaminobenzène et aucune donnée sur la toxicité chronique ou la génotoxicité n'a été relevée pour cette substance. Le 1,2,4-triaminobenzène a été mis à l'essai dans le cadre d'une étude à court terme chez des rats (n = 6-7) exposés par voie orale à des doses de 50, 60, 75 ou 100 mg/kg p.c. par jour, cinq jours par semaine, pendant deux semaines. Cette substance s'est avérée très toxique avec une létalité observée pour les deux doses les plus élevées après les trois doses. Les animaux exposés aux doses plus faibles ont révélé une pigmentation du cœur et une nécrose cardiaque. La pigmentation est considérée comme étant probablement un produit d'oxydation insoluble du 1,2,4-triaminobenzène et elle a également été observée chez des animaux exposés au colorant Brown FK, dont le 1,2,4-triaminobenzène est l'un des métabolites (JECFA, 1977).
L'étude à court terme chez des rats exposés à du Basic Orange 2 a montré des signes d'hématotoxicité (Cambel et al., 1954) concordant avec ceux liés à l'aniline, ce qui laisse entendre qu'un clivage de la liaison azoïque a eu lieu dans le cadre de cette étude. Toutefois, les types de tumeurs observées après une exposition chronique au Basic Orange 2 (c.-à-d. le foie chez les souris) ne sont pas typiques d'une exposition à l'aniline (sarcomes de la rate chez les rats), ce qui indique que la toxicité du métabolite d'aniline seule n'est pas suffisante pour expliquer la cancérogénicité du Basic Orange 2. En l'absence de données sur la toxicité chronique de l'autre produit de clivage azoïque, soit le 1,2,4-triaminobenzène, la contribution potentielle de cette substance à la cancérogénicité du Basic Orange 2 est inconnue.
Basic Brown 1
Le Basic Brown 1 n'a été évalué par aucun programme ou organisme national ou international. Par ailleurs, aucune donnée de toxicité pour les animaux n'a été recensée pour cette substance. On a observé des résultats positifs dans le test d'Ames dans des souches de S. typhimurium TA98 avec et sans activation (Matsushima et al., 1978; NTP, 1992a), mais des résultats mitigés ont été signalés lors d'essais dans des souches TA100 (Sole et Chipman, 1986; NTP, 1992a).
Les produits prévus du clivage des liaisons azoïques du Basic Brown 1 sont le 1,2,4-triaminobenzène (décrit dans la section précédente concernant le Basic Orange 2) et le 1,3-Bis(2,3-diaminophénylazo)benzène (n° CAS 108-45-2). Le 1,3-Bis(2,3-diaminophénylazo)benzène a été évalué dans le cadre l'évaluation de certaines amines aromatiques (Environnement Canada, Santé Canada, 2015c) et les détails des données concernant les effets sur la santé de cette substance se trouvent dans cette évaluation. En bref, le 1,3-Bis(2,3-diaminophénylazo)benzène a été classé par l'Union européenne, en vertu du Système de classification harmonisé, comme agent mutagène de catégorie 2 (soupçonné de causer des défauts génétiques (Commission européenne, 2009) et a également été classé comme substance cancérogène du groupe 3 (inclassables quant à leur cancérogénicité pour l'homme) par le CIRC (1987c).
Justification pour les données déduites à partir d'analogues, du pentylènetétrazole au Basic Orange 2 et aux sels connexes
Dans l'ensemble, les données disponibles indiquent que le pentylènetétrazole a un potentiel de cancérogénicité, car des rats F344 mâles et femelles à qui l'on a administré la substance par la voie de leur alimentation pendant 78 semaines affichaient une incidence accrue d'adénomes ou d'adénocarcinomes du colon, ce que l'on a considéré comme statistiquement significatif à la plus forte dose testée (c.-à-d. 7 500 ppm) par rapport aux témoins historiques. Chez des souris B6C3F1 femelles à qui l'on a administré la substance par la voie de leur alimentation pendant 80 semaines, on a relevé une incidence combinée d'adénomes et de carcinomes hépatocellulaires qui a été jugée statistiquement significative par rapport aux témoins de l'étude (NCI, 1978). D'après des données limitées, le Basic Orange 2 a également été considéré comme cancérogène dans le foie de souris femelles (Albert, 1956; CIRC, 1975, 1987b).
Pour le pentylènetétrazole et le Basic Orange 2, les tumeurs observées étaient différentes de celle de prévue pour le métabolite d'aniline issu du clivage de la liaison azoïque commune (sarcomes de la rate). La cancérogénicité observée du pentylènetétrazole et du Basic Orange 2 peut être expliquée par leurs autres produits de clivage azoïque respectifs, notamment la 2,3,6-triaminopyridine et le 1,2,4-triaminobenzène. Bien qu'il ait été proposé que le 1,2,4-triaminobenzène et la 2,3,6-triaminopyridine peuvent provoquer un stress oxydatif et qu'ils sont associés à la toxicité musculaire ou cardiaque (JECFA, 1977; Munday et Fowke, 1994; Munday, 1986, 1987), le manque de données de toxicité chronique liées aux métabolites du clivage azoïque empêche la détermination de leur potentiel cancérogène. Étant donné que le pentylènetétrazole et le Basic Orange 2 sont vraisemblablement absorbés par voie orale en tant que colorant d'origine avec une liaison azoïque intacte, les parties d'amines libres de ces substances peuvent aussi être directement oxydées en produits intermédiaires réactifs. Cette voie d'activation est connue pour d'autres colorants avec solvant monoazoïques à structure similaire, soit le p-aminoazobenzène et le Solvent Yellow 2, qui contiennent aussi une partie aniline jointe, par liaison azoïque, à un noyau aromatique portant une amine libre et une diméthylamine, respectivement (Environnement Canada, Santé Canada, 2015). Pour le p-aminoazobenzène et le Solvent Yellow 2, les tumeurs induites sont différentes de celles prévues à partir de leurs produits de clivage azoïque correspondants, ce qui indique que la cancérogénicité n'est pas due au clivage de la liaison azoïque, mais plutôt à l'activation de la substance d'origine. Par conséquent, il est raisonnable de supposer que la cancérogénicité du pentylènetétrazole et du Basic Orange 2 peut également être due à l'activation des parties d'amines libres des substances d'origine absorbées.
Bien que les données de cancérogénicité du Basic Orange 2 soient plus limitées que celles du pentylènetétrazole, les structures similaires de ces substances, y compris leurs parties d'amines aromatiques libres, leurs propriétés physiques et chimiques, leur absorption et métabolisme prévus, et leurs métabolites du clivage azoïque communs (aniline) et polyaminés étroitement apparentés (1,2,4-triaminobenzène et 2,3,6-triaminopyridine), de même que l'observation de tumeurs du foie chez des souris découlant des deux substances, appuient une approche de données déduites à partir d'analogues, du pentylènetétrazole au Basic Orange 2. Ainsi, en plus de l'étude limitée sur la cancérogénicité du Basic Orange 2 chez des souris (Albert, 1956; CIRC, 1975, 1987b), le potentiel de cancérogénicité du Basic Orange 2 est également appuyé par des données déduites à partir d'analogues du pentylènetétrazole et est considérée comme s'appliquant également aux sels connexes du Basic Orange 2 (n° CAS 63681-54-9, 75660-25-2, et 79234-33-6 Note de bas de page[7]) en plus de la forme à base libre, soit le Solvent Orange 3Note de bas de page[8].
7.2.3 Données sur les effets sur la santé pour les sous-ensembles B (nos CAS 14408-20-9, 36986-04-6 et 59709-10-3) et C (nos CAS 68929-07-7 et 69852-41-1), les numéro CAS 52769-39-8 et CAS RN 93783-70-1
Aucune des sept substances n'a été classée pour les effets sur la santé humaine par un organisme national ou international. En outre, aucun des produits prévus du clivage des liaisons azoïques découlant de ces substances n'a été défini comme étant classé relativement aux effets sur la santé humaine. Aucune étude n'a été définie relativement à la cancérogénicité et la génotoxicité, sauf la génotoxicité in vitro pour le n° CAS 68929-07-7. On a obtenu des résultats positifs pour cette substance dans le test d'Ames modifié Prival dans des conditions standard (sans induction de la fraction de S9) et réductrices (mononucléotide flavine) dans des souches de S. typhimurium TA98, tandis que les résultats étaient négatifs dans les souches TA100 (BioReliance, 2012).
Parmi les produits prévus du clivage des liaisons azoïques découlant de ces sept substances, qui sont présentés à l'annexe C, tableau C1, 6 des 12 pourraient être définis aux fins d'évaluation. Plusieurs études animales sur la cancérogénicité de la 2,6-dichloro-4-nitroaniline (n° CAS 99-30-9) et de la N,N-Diméthyl-p-phénylènediamine (no CAS 99-98-9) ont donné des résultats négatifs (FAO/OMS, 1998; BG Chemie, 1998). Les données sur la génotoxicité in vivo de la 2,6-dichloro-4-nitroaniline ont toutes été jugées négatives (FAO/WHO 1998), même si les résultats de la génotoxicité in vitro pour la 2,6-dichloro-4-nitroaniline, la N,N-Diméthyl-p-phénylènediamine et la 2-chloro-4-nitroaniline (n° CAS 121-87-9) étaient positifs et négatifs dans divers essais (annexe C, tableau C3).
Les résultats pour les produits prévus du clivage réducteur des liaisons azoïques n'indiquaient pas de réponse cancérogène et n'étaient pas clairement génotoxiques (les résultats positifs in vitro n'ont pas été observés in vivo). Par conséquent, d'autres méthodes pour la caractérisation ont été utilisées, et les produits prévus du clivage réducteur des liaisons azoïques n'ont pas été pris en compte pour la caractérisation des risques.
Prise en compte des analogues
En raison du manque de données disponibles pour les sept substances, on a utilisé la boîte à outils de l'OCDE RQSA (2013) et la base de données internationale du C.I. (CII, 2011) pour définir les substances à structure similaire. D'autres recherches ont été menées par la suite avec TOXLINE (2013) et SciFinder (2013) en vue de définir des données empiriques aux fins de lecture croisée. La similarité structurelle ainsi que les propriétés physiques et chimiques ont été considérées pour les substances présentant des données définies aux fins de lecture croisée par l'entremise de ces stratégies de recherche.
La boîte à outils de l'OCDE RQSA (2013) a été utilisée pour les groupes fonctionnels suivants : amine aromatique, aryle, azoïque, aminoaniline, ortho (sous-ensemble A); nitrobenzène, pyridine, halogénures d'aryle (sous-ensemble B); benzothiazole/benzoisothiazole, éther, alcool (sous-ensemble C); amidine, isopropyle, thiadiazole (no CAS 93783-70-1); benzyle, triazole (n° CAS 52769-39-8). Cette recherche a défini 44 substances, dont trois présentaient des données définies dans des recherches ultérieures avec TOXLINE (2013) et SciFinder (2013). Parmi ces trois substances, deux ont été déterminées comme présentant des données adéquates, à savoir le n° CAS 83969-12-4 (sel de sulfate de diméthyle) et le n° CAS 66693-25-2 (sel de sulfate). Le n° CAS 83969-12-4 était similaire au no CAS 93783-70-1, tandis que le n° CAS 66693-25-2 était similaire au n° CAS 68929-07-7 (sous-ensemble C), tel qu'il a été déterminé par les valeurs de coefficient Tanimoto atteignant 100 % (boîte à outils de l'OCDE RQSA, 2013). Le n° CAS 66693-25-2 était un dimère qui donnait une masse molaire plus élevée, et un isomère du no CAS 68929-07-7, où l'emplacement du substitut méthoxy sur le cycle benzothiazolium est différent. Le n° CAS 83969-12-4 est un sel de sulfate de diméthyle, tandis que le n° CAS 93783-70-1 est un sel de chlorure de zinc. Cette différence devrait avoir une incidence sur l'hydrosolubilité de ces substances. D'après leurs propriétés physiques et chimiques, comme la masse molaire et l'hydrosolubilité, les substances définies par la recherche avec la boîte à outils de l'OCDE RQSA (2013) n'ont pas été considérées comme étant appropriées pour une utilisation en tant que substances similaires aux fins de lecture croisée.
On a également effectué des recherches dans la base de données internationale du C.I. (CII, 2011) pour les colorants basiques azoïques, puis une vérification manuelle de la structure chimique pour une liaison azoïque aromatique ou son tautomère structural. Cette recherche a cerné 31 substances, dont 11 ont été définies comme présentant des données de toxicité par l'entremise de recherches ultérieures menées dans TOXLINE (2013) et SciFinder (2013). Parmi ces 11 substances, seulement deux, à savoir le Basic Brown 17 (n° CAS 68391-32-2) et le Basic Brown 16 (n° CAS 26381-41-9), ont été définies comme présentant des données pertinentes. Toutefois, ces substances n'ont pas été considérées comme ayant une structure suffisamment similaire à l'une des sept substances, avec des valeurs de coefficient Tanimoto variant de 12 % à 32 % uniquement (boîte à outils de l'OCDE RQSA, 2013) La vérification visuelle a également indiqué des différences notables dans la structure chimique de base ainsi que dans les groupes fonctionnels.
Dans l'ensemble, aucune des substances définies ci-dessus n'a été jugée adéquate pour préciser le sous-ensemble B ou C, ou chacune des sept substances par l'entremise de données déduites à partir d'analogues.
Des données empiriques limitées étaient disponibles pour les substances du sous-ensemble B ou C, ou le nos CAS 93783-70-1 et 52769-39-8. Une recherche d'analogues a été effectuée à l'aide de la boîte à outils RQSA de l'OCDE (2013) ainsi que dans la base de données internationale du C.I. (CII, 2011), dans TOXLINE (2013) et dans SciFinder (2013) aux fins de lecture croisée lorsque les similarités structurelles et les propriétés physiques et chimiques étaient prises en considération, mais aucun analogue approprié n'a été trouvé. Il n'y a pas d'indication d'effets préoccupants, comme des classifications liées à la cancérogénicité et à la génotoxicité par des organismes nationaux et internationaux, pour les produits du clivage réducteur des liaisons azoïques découlant des six substances. Étant donné que l'objectif lié au groupe des substances aromatiques azoïques et à base de benzidine était généralement axé sur la génotoxicité et la cancérogénicité, on n'a pas tenu compte des effets potentiels signalés pour d'autres paramètres d'après l'exposition à des produits potentiels du clivage réducteur des liaisons azoïques découlant des sept substances. En raison du peu de données empiriques et du peu de données déduites à partir d'analogues disponibles pour les sous-ensembles B et C et les numéros CAS 52769-39-8 et 93783-70-1, on considère de façon prudente que le risque global pour ces substances est similaire à celui du sous-ensemble A.
7.2.4 Données liées aux effets sur la santé pour les 20 colorants basiques azoïques restants
Aucun examen ni aucune évaluation antérieure menée par d'autres administrations nationales ou internationales n'ont été relevées pour les 20 colorants basiques azoïques. Parmi les produits du clivage des liaisons azoïques découlant de ces 20 substances, il a été déterminé qu'une amine EU22, le p-aminoazobenzène (numéro CAS 60-09-3), était le produit prévu du clivage des liaisons azoïques des numéros CAS 75199-20-1 et 125329-01-3. Les nos CAS 63681-54-9, 75199-20-1, 79234-33-6 et 125329-01-3 ont été définis comme rejetant de l'aniline (n° CAS 62-53-3) en tant que produit prévu du clivage des liaisons azoïques; ce point a été évalué antérieurement par le gouvernement du Canada (Santé Canada, 2011a). Les effets de l'aniline sont résumés à la section 7.2.2 et au tableau C2 de l'annexe C.
7.2.5 Incertitudes dans l'évaluation des effets sur la santé
Dans l'ensemble, les données étaient limitées. Des données déduites à partir d'analogues découlant des substances pour lesquelles on disposait de données, ont été appliquées pour le sous-ensemble A, tandis qu'on manquait de renseignements pour les sous-ensembles B et C et les nos CAS 93783-70-1 et 52769-39-8 comparativement au sous-ensemble A. La prise en compte d'analogues pour les sous-ensembles B et C et les nos CAS 93783-70-1 et 52769-39-8 n'était pas appropriée à cause du manque de similarité structurelle. Ce manque de données fait augmenter le niveau d'incertitude et diminuer le niveau de confiance de manière significative pour ces évaluations des effets sur la santé comparativement à l'évaluation du sous-ensemble A. Parmi les études recensées, on a aussi noté certaines limites telles que l'absence d'indication quant à la pureté et à l'identité (fournisseur) de la substance d'essai, l'ancienneté de l'étude et la méthodologie utilisée. En outre, il existe des préoccupations concernant la qualité et la reproductibilité de l'étude d'Albert (1956) (Searle et Teale, 1984, BAuA, 2003 ). Dans une lettre adressée à Lancet, Searle et Teale (1984), il est indiqué qu'Albert n'a pas été en mesure de reproduire ses résultats précédents (1956) lors de l'utilisation d'une nouvelle quantité de Basic Orange 2 (provenant d'une usine ou préparée par un chimiste), toutefois, aucun renseignement supplémentaire n'était disponible aux fins d'évaluation dans le cadre de cette étude.
Il y a peu de renseignements pour expliquer plus en détail le clivage potentiel des liaisons azoïques des colorants basiques azoïques. Le clivage réducteur des colorants basiques azoïques est principalement basé sur les résultats de deux substances à des fins de lecture croisée avec un certain nombre de substances de structure différente. Étant donné qu'il n'y a pas de groupes fonctionnels similaires ou de ressemblance structurelle entre les colorants basiques azoïques, le niveau de confiance lié à la conclusion obtenue pour tous les colorants basiques azoïques est faible.
Même si les études disponibles sont limitées, on a observé des différences entre les types de néoplasmes et les effets non néoplasiques chez les mêmes espèces ainsi qu'un manque de réplication entre les espèces lorsque des animaux de laboratoire sont traités avec du pentylènetétrazole. Ces différences peuvent être attribuables aux différences entre les espèces ou au traitement. Une étude recensée compare le métabolisme du pentylènetétrazole entre les espèces, y compris les humains, les rats, les souris, et les hamsters (Thomas et al., 1990). Même au niveau métabolique, des différences doivent être prises en compte. En ce qui concerne les effets non cancérogènes du sous-ensemble A, l'étude à court terme de Cambel et de ses collaborateurs (1954) sur les effets du Basic Orange 2 sur l'eau potable portait uniquement sur le sang et l'estomac après l'administration d'une dose unique, tandis que la méthodologie de l'étude chronique à doses orales (alimentation) multiples ne comprenait pas d'essais chimiques cliniques, y compris des paramètres hématologiques (NCI, 1978). L'absence de données comparables dans ces études, en plus de la durée différente d'exposition et de la matière de charge (eau c. nourriture), présente des défis en termes d'évaluation des renseignements disponibles.
7.3 Caractérisation des risques pour la santé humaine
En ce qui concerne les 20 autres colorants basiques azoïques inclus dans l'évaluation des risques pour la santé humaine, les renseignements disponibles n'ont pas permis de déterminer de sources d'exposition actuelles pour la population générale du Canada. Par conséquent, il ne devrait pas y avoir de risque pour la santé humaine découlant de ces substances. Par conséquent, la caractérisation des risques met l'accent sur les 12 autres colorants basiques azoïques qui ont été définis comme étant commercialisés au Canada.
L'exposition aux 12 (des 32) colorants basiques azoïques issus de milieux naturels ne devrait pas être importante pour la population générale canadienne d'après les propriétés physiques et chimiques et les quantités d'importation de ces substances. Parmi les 12 substances, si l'on se fie aux rejets découlant de l'utilisation thérapeutique du pentylènetétrazole dans les préparations pharmaceutiques, l'exposition de la population générale à la substance présente dans l'environnement devrait être négligeable. Par conséquent, le risque pour la santé humaine découlant d'une exposition dans les milieux naturels est considéré comme faible pour les 12 substances.
La source principale d'exposition de la population générale canadienne à ces 12 colorants basiques azoïques est par l'utilisation de produits cosmétiques ou de consommation, notamment les colorants capillaires, le papier, l'encre des stylos et les textiles. Le risque pour la santé humaine découlant de l'exposition par l'intermédiaire de ces utilisations a été caractérisé pour ces 12 substances dans les sections suivantes.
Sous-ensemble A (pentylènetétrazole, Basic Orange 2 et sels connexes (n° CAS 63681-54-9 et 75660-25-2) et Basic Brown 1)
Trois des cinq substances du sous-ensemble A (Basic Brown 1, Basic Orange 2 et n° CAS 75660-25-2) ont été considérées comme présentant un potentiel d'exposition par l'utilisation de produits de consommation, d'après les données disponibles, et les risques pour la santé humaine découlant de ces expositions ont été caractérisés ci-dessous.
La cancérogénicité est considérée comme étant l'effet critique sur la santé pour certaines des substances du sous-ensemble A, sur la base des données empiriques déduites à partir d'analogues pour le pentylènetétrazole. Cependant, aucune des utilisations de ces trois substances du sous-ensemble A (Basic Brown 1, Basic Orange 2 et n° CAS 75660-25-2) n'a été définie comme entrainant des scénarios d'exposition chronique; ainsi, aucune marge d'exposition pour la cancérogénicité n'a été calculée pour ces substances. Étant donné que l'exposition de la population générale du Canada à ces trois substances est prévue, découlant notamment de l'utilisation de produits qui sont utilisés par intermittence plutôt que fréquemment ou quotidiennement, la caractérisation des risques pour le sous-ensemble A est basée sur la comparaison avec des effets non cancérogènes.
L'exposition par voie cutanée au Basic Orange 2 dans des colorants capillaires pour la population générale canadienne a été estimé comme variant de 0,15 à 1,4 mg/kg p.c. par événement. Étant donné qu'aucune des deux études sur les effets sur la santé n'a été réalisée avec la voie d'administration cutanée, les effets consignés lors de l'étude à court terme et à dose orale unique (160 mg/kg p.c. par jour) sur le Basic Orange 2 ont été considérés comme un point initial de protection approprié pour la caractérisation des risques associés aux expositions par voie cutanée, et ce, sur la base de l'hypothèse prudente selon laquelle l'absorption par voie cutanée et l'absorption par voie orale sont équivalentes. La comparaison des estimations pour l'exposition par voie cutanée au Basic Orange 2 présent dans les colorants capillaires avec le niveau d'effets néfastes observés chez des rats après une exposition orale à court terme permet d'obtenir des marges d'exposition (ME) comprises entre 114 et 1 066. Elles ont été obtenues d'après l'approche prudente selon laquelle l'absorption cutanée et orale est équivalente. Ces marges sont considérées comme adéquates pour rendre compte des incertitudes liées aux bases de données concernant l'exposition et les effets sur la santé.
L'exposition combinée orale et cutanée accidentelle des tout-petits de la population générale canadienne au Basic Orange 2 que l'on retrouve dans l'encre des stylos à bille a été estimée à 0,002 mg/kg p.c. par épisode (annexe B). La comparaison entre les estimations de l'exposition par voie orale au Basic Orange 2 présent dans l'encre des stylos à bille et le niveau d'effets après une exposition à court terme par voie orale chez des rats permet d'obtenir une marge d'exposition de 80 000. Cette marge est considérée comme adéquate pour rendre compte des incertitudes liées aux bases de données concernant l'exposition et les effets sur la santé.
Pour le Basic Brown 1 et le n° CAS 75660-25-2, l'exposition par leur utilisation dans les produits de papier est prévue. Pour le n° CAS 75660-25-2, le mâchonnement par des tout-petits est défini comme un scénario d'exposition prudent relativement à l'utilisation de papier. Cependant, en raison de l'incertitude liée à la quantité réelle ingérée, la résistance du colorant sur le papier suivant l'ingestion par voie orale, et de la nature fortuite du scénario, l'exposition est considérée comme faible. Le Basic Brown 1 a également été signalé comme étant présent dans des produits de papier, mais sa présence n'est pas prévue dans les produits accessibles aux enfants; par conséquent, l'exposition par voie orale pour les tout-petits découlant de cette substance ne devrait pas se produire. Dans l'ensemble, l'utilisation du Basic Brown 1 et du n° CAS 75660-25-2 dans du papier ne devrait pas constituer une source importante d'exposition pour la population générale et, par conséquent, le risque pour la santé humaine est jugé faible pour cette utilisation.
Pour deux des cinq autres substances du sous-ensemble A (pentylènetétrazole et no CAS 63681-54-9), il ne devrait pas y avoir d'exposition de la population générale. Pour le pentylènetétrazole, les utilisations de cette substance évaluées antérieurement en vertu de la Loi sur les aliments et drogues ne sont pas prises en compte dans la présente évaluation, et aucune autre exposition de la population générale à cette substance n'a été relevée. Pour le n° CAS 63681-54-9, l'utilisation déclarée en vertu de l'article 71 a été définie comme n'étant plus présente sur le marché canadien. Étant donné que les renseignements disponibles n'ont pas permis de déterminer les sources de l'exposition actuelle de la population générale du Canada à ces substances, le risque pour la santé humaine n'est pas prévu pour ces substances.
Sous-ensembles B (nos CAS 14408-20-9, 36986-04-6 et 59709-10-3) et C (nos CAS 68929-07-7 et 69852-41-1), nos 52769-39-8 et 93783-70-1
L'exposition de la population générale canadienne aux colorants basiques azoïques des sous-ensembles B et C ainsi qu'aux numéros CAS 52769-39-8 et 93783-70-1 devrait se produire par ingestion accidentelle de papier et par mâchonnement de textiles pour les tout-petits, et par contact cutané avec des textiles pour les adultes et les nourrissons. En outre, il existe peu de données empiriques et de données déduites à partir d'analogues pour les sous-ensembles B et C et les numéros CAS 52769-39-8 et 93783-70-1. Même s'il y a une trop grande incertitude quant à l'application de données déduites à partir d'analogues du sous-ensemble A aux sous-ensembles B et C ainsi qu'aux numéros CAS 52769-39-8 et 93783-70-1, en l'absence de données relatives à ces substances., les niveaux d'effets sur la santé du sous-ensemble A ont été appliqués à titre d'approche prudente pour calculer des estimations des risques.
Concernant l'utilisation de ces substances dans des produits de papier, on considère que le risque pour la santé humaine pour les sous-ensembles B et C ainsi que les numéros CAS 52769-39-8 et 93783-70-1 ne devrait pas être plus important que le risque lié au sous-ensemble A. Ainsi, l'utilisation de ces substances dans le papier ne devrait pas constituer une importante source d'exposition de la population générale et, par conséquent, le risque pour la santé humaine est considéré comme faible pour cette utilisation.
Dans le cadre de l'évaluation de l'exposition par voie cutanée d'adultes et de nourrissons à des colorants basiques azoïques des sous-ensembles B et C ainsi qu'aux numéros CAS 52769-39-8 et 93783-70-1 par l'entremise de textiles, une comparaison des concentrations associées à un effet critique du sous-ensemble A (c.-à-d. pentylènetétrazole) a été appliquée. Sur la base de la dose la plus faible pour la formation de tumeurs découlant de l'administration de pentylènetétrazole (150 mg/kg p.c. par jour pour la formation de tumeurs du foie chez les souris exposées à la substance) et de l'exposition chronique par voie cutanée par l'entremise de textiles (2,6 à 4,0 µg/kg p.c. par jour) (Environnement Canada et Santé Canada, 2014a), on a défini un scénario théorique prudent. Les marges obtenues (37 500 à 57 700) sont jugées adéquates pour rendre compte des incertitudes liées aux bases de données concernant l'exposition et les effets sur la santé. De la même manière, comme l'estimation du mâchonnement par des nourrissons se traduit par des expositions inférieures à celle du scénario d'exposition par voie cutanée présentée ci-dessus (2,7 × 10−2 µg/kg p.c. par jour) (Environnement Canada et Santé Canada, 2014a), les marges d'exposition pour ce scénario sont également jugées adéquates.
Incertitudes
Dans l'ensemble, il y a peu de données sur les effets sur la santé des colorants basiques azoïques. Il y a également peu de données sur les propriétés physiques et chimiques de ces colorants, et sur le clivage réducteur de leurs liaisons azoïques.
On a appliqué des données déduites à partir d'analogues dans le sous-ensemble A, découlant de plusieurs substances riches en données, à des substances présentant des données de toxicité limitées, en se fondant sur les similarités structurelles et les propriétés physiques et chimiques.
Le peu de données pour les sous-ensembles A et B, et pour les numéros CAS 93783-70-1 et 52769-39-8 combiné au manque de substances adéquatement similaires, offrant des données déduites à partir d'analogues, a donné lieu à d'importantes incertitudes quant au potentiel de risque de ces substances et, par conséquent, à un niveau de confiance plus faible pour les ensembles de données liés au sous-ensemble A.
En outre, les estimations de l'exposition pour ces substances sont basées sur le peu de données indiquant que ces substances sont utilisées dans des produits de papier et des textiles. Toutefois, un niveau de confiance raisonnable est associé au fait que l'utilisation de niveaux d'effets sur la santé découlant du sous-ensemble A représente une approche prudente pour estimer le risque lié à ces substances.
En ce qui concerne l'ingestion de papier par les tout-petits, les hypothèses formulées dans le scénario sont incertaines, par exemple en ce qui concerne la quantité de papier ingérée par un tout-petit durant un épisode de mâchonnement et la biodisponibilité des substances contenues dans le papier. Cependant, on considère que, compte tenu des incertitudes liées à la quantité réelle ingérée, de la résistance du colorant sur le papier après l'ingestion, et de la nature fortuite du scénario, l'exposition est faible pour ce scénario.
Parmi les 12 colorants basiques azoïques auxquels l'exposition de la population générale canadienne est attendue, l'exposition par voie cutanée au Basic Orange 2 peut survenir par l'utilisation de colorants capillaires. Étant donné qu'aucune étude appropriée sur la toxicité par absorption cutanée n'a été recensée, les marges d'exposition ont été calculées à l'aide d'une approche d'extrapolation voie-à-voie. Une incertitude supplémentaire, probablement de nature prudente, est associée à l'utilisation de données d'études à court terme pour calculer les marges d'exposition des scénarios d'exposition par épisode.
En outre, on relève des incertitudes liées aux impuretés, aux résidus et aux compositions variables de ces colorants lorsque ceux-ci sont signalés comme matériaux d'essai d'études toxicologiques sans spécifications non ambiguës de pureté.
Colorants basiques azoïques ayant des effets préoccupants
Dans l'ensemble, les risques que posent les substances visées par cette évaluation pour la santé humaine sont faibles compte tenu des niveaux actuels d'exposition. Toutefois, comme cela est indiqué ci-dessus, certains colorants basiques azoïques figurant dans la présente évaluation ont des effets préoccupants d'après la cancérogénicité potentielle. Une liste de ces substances est présentée à l'annexe D.
Dans la version préliminaire de l'évaluation de certains colorants basiques azoïques, sept colorants basiques ont été déterminées comme ayant des effets préoccupants pour la santé humaine. Depuis la publication de l'ébauche, des considerations plus précise fondées principalement sur des éléments de preuve concernant le potentiel carcinogène ont été appliqués en vue de cerner les substances considérées comme ayant des effets préoccupants (annexe D). À ce titre, un des sept colorants basiques précédemment signalées dans l'ébauche d'évaluation, le Basic Brown 1, n'est plus prise en compte confirmer les éléments de preuve liés à la cancérogénicité potentielle à cause d’un manque de données sur la toxicité chronique et les incertitudes relatives à la lecture croisée. De plus, la substance portant le CAS NE 79234-33-6 (le sel d’acétate lié au Basic Orange 2) est maintenant considérée comme ayant des effets préoccupants pour la santé humaine, en se fondant sur les mêmes éléments de preuves que le Basic Orange 2 (voir l’annexe D). Cette substance n’était pas considérée comme ayant des effets préoccupant dans l’ébauche d’évaluation.
8. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, les 33 colorants basiques azoïques évalués dans cette évaluation présentent un faible risque d'effets nocifs sur les organismes et sur l'intégrité globale de l'environnement. Il est donc proposé de conclure que les 33 colorants basiques azoïques ne satisfont pas aux critères des alinéas 64a) ou b) de la LCPE (1999), car ils ne pénètrent pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, on conclut que 32 colorants basiques azoïques analysés dans cette évaluation ne satisfont pas aux critères énoncés à l'alinéa 64c) de la LCPE (1999), car ils ne pénètrent pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
En outre, aucune mise à jour n'a été apportée à l'évaluation et à la conclusion de l'alinéa 64c) concernant le NDTHPM, qui a déjà été analysé par le gouvernement du Canada dans le cadre du Défi du Plan de gestion des produits chimiques.
On conclut que les 33 colorants basiques azoïques évalués dans cette évaluation ne satisfont à aucun des critères énoncés à l'article 64 de la LCPE (1999).
9. Références
ACD/Percepta [module de prévision]. c1997-2012. Toronto (Ont.) : Advanced Chemistry Development. [consulté le 9 octobre 2013]. Accès : www.acdlabs.com/products/percepta/
Albert, Z. 1956. [Effect of prolonged feeding with chrysoidine on the formation of adenoma and cancer of liver in mice]. Arch. Immunol. Ther. Exp. (Warsz) 4:189-242. [article en polonais]. [cité dans CIRC, 1975a].
Alfa Aesar. 2007. Fiche signalétique : 3-Phanylazo-2,6-diaminopyridine hydrochloride[en ligne]. Ward Hill (MA) : Alfa Aesar. [consulté en septembre 2013]. Accès : www.msdsonline.com [réserve de consultation].
Allen, M.J., Boyland, E., Dukes, C.E., Horning, E.S., Watson, J.G. 1957. Cancer of the urinary bladder induced in mice with metabolites of aromatic amines and tryptophan. Br. J. Cancer 11(2):212-228.
Anliker, R., Clarke, E.A., Moser, P. 1981. Use of the partition coefficient as an indicator of bioaccumulation tendency of dyestuffs in fish. Chemosphere 10(3):263-274.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'évaluation]. 2010. Version 1.92a. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Ashby, J., Lefevre, P.A., Callander, R.D. 1983. The possible role of azoreduction in the bacterial mutagenicity of 4-dimethylaminoazobenzene (DAB) and 2 of its analogues (6BT and 5I). Mutat. Res. 116:271-279. [cité dans BG Chemie, 1998].
Avocado Research Chemicals Ltd. 1998. Fiche signalétique : 17430 [en ligne]. Ward Hill (MA) : Avocado Research Chemicals Ltd. [consulté en septembre 2013]. Accès : www.msdsonline.com [réserve de consultation].
Bailey, K., Thomas, B.H., Vézina, M., Whitehouse, L.W., Zeitz, W., Solomonraj, G. 1983. 2,6-Diamino-5-hydroxy-3-(phenylazo)pyridine, a novel metabolite of phenazopyridine in the rat. Drug Metab. Dispos. 11(3):277-278.
[BASF] BASF Corporation. 1988. Department of Toxicology, données inédites; novembre 1988. [cité dans BAuA, 2003].
[BASF] BASF Corporation. 1991. Initial submission from BASF Corporation to US EPA regarding information concerning in vivo genotoxicity results of 2,4-diamino-5-methylazobenzene, monohydrochloride; 08/15/91. EPA Doc. No. 88-910000248. Fiche No. OTS0533678. [cité dans HSDB, 1983- ].
BASF Canada. 2004. Fiche signalétique : Basonyl Orange 204 [en ligne]. Toronto (Ont.) : BASF Canada. [consulté en septembre 2013]. Accès : www.msdsonline.com [réserve de consultation].
[BAuA] Federal Institute for Occupational Safety and Health (Allemagne). 2003. 4-(Phenylazo)benzol-1,3-diamin; 4-Phenylazophenylen-1,3-diaminmonohydrochlorid. Accès : http://www.baua.de/cae/servlet/contentblob/665398/publicationFile/48033/905-4-phenylazobenzol-engl.pdf
Baughman, G.L., Bannerjee, S., Perenich, T.A. 1996. Dye solubility. In: Peters, A.T., Freeman, H.S. (éd.) Physico-chemical principles of color chemistry. Advances in Color Chemistry Series, vol. 4. Glasgow (Royaume-Uni) : Blackie Academic and Professional Publishers. p. 145-195.
Baughman, G.L., Perenich, T.A. 1988. Investigating the fate of dyes in the environment. Am. Dyest. Rep. 7(2):19-20, 22, 47-48. [cité dans Øllgaard et al., 1998].
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [base de données sur Internet]. 2011. Version 2.1. Ottawa (Ont.) : Santé Canada. [consulté le jour/mois/année]. Accès : http://webprod.hc-sc.gc.ca/nhpid-bdipsn/search-rechercheReq.do?url=&lang=fra
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2010. Ottawa (Ont.) : Santé Canada. [consulté en août 2013]. Accès : http://www.hc-sc.gc.ca/dhp-mps/prodpharma/databasdon/index-fra.php
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [base de données sur Internet]. 2011. Version 2.1. Ottawa (Ont.) : Santé Canada. [consulté en octobre 2011]. Accès : http://webprod.hc-sc.gc.ca/nhpid-bdipsn/search-rechercheReq.do?url=&lang=fra
[BDPSNH] Base de données des produits de santé naturels homologués [base de données sur Internet]. 2008. Version 1.0. Ottawa (Ont.) : Santé Canada. [consulté en novembre 2013]. Accès : http://webprod5.hc-sc.gc.ca/lnhpd-bdpsnh/language-langage.do?lang=fra&url=Search-Recherche
Baughman, G.L., Weber, E.J. 1994. Transformation of dyes and related compounds in anoxic sediment: kinetics and products. Environ. Sci. Technol. 28(2):267-276.
Becker, B.A., Swift, J.G. 1959. Effective reduction of the acute toxicity of certain pharmacologic agents by use of synthetic ion exchange resins. Toxicology 1:42-54.
Ben Mansour, H., Barillier, D., Corroler, D., Ghedira, K., Chekir-Ghedira, L., Mosrati, R. 2009. In vitro study of DNA damage induced by Acid Orange 52 and its biodegradation derivatives. Environ. Toxicol. Chem. 28(3):489-495. [cité dans CCRIS, 2012].
[BfR] Institut fédéral allemand d’évaluation des risques (Allemagne). 2007. Introduction to the problems surrounding garment textiles. BfR Information No. 018/2007, 1er juin 2007. Disponible sur demande.
BG Chemie. 1998. N,N-Dimethyl-p-phenylenediamine. In: Toxicological evaluations 14: Potential health hazards of existing chemicals. Springer Verlag. p. 85-101.
BioReliance. 2012. Rapport final : Bacterial reverse mutation assay of selected azo dyes. [rapport confidentiel].
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’évaluation]. 2010. Version 4.10. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Boîte à outils QSAR de l’OCDE [outil de déduction à partir d’analogues]. 2013. Version 3.1. Paris (France) : Organisation de coopération et de développement économiques, Direction de l’environnement. [consulté en octobre 2013]. Accès : http://www.oecd.org/fr/env/ess/risques/projetdelocdesurlesrelationsquantitativesdestructure-activiteqsars.htm
[BRI] Biopharmaceutical Research Inc. 2013. Final report (Amendment 1): Determination of the metabolic reduction potential of selected aromatic azo- and benzidine-based substances: in vitro anaerobic fecal bacterial cultures of the human gastrointestinal tract. [rapport confidentiel].
Brown, D., Hitz, H.R., Schafer, L. 1981. The assessment of the possible inhibitory effect of dyestuffs on aerobic waste-water bacteria, experience with a screening test. Chemosphere 10(3):245-261.
Brown, D., Laboureur, P. 1983. The degradation of dyestuffs: Part I - Primary biodegradation under anaerobic conditions. Chemosphere 12(3):397-404.
Budavari, S. (éd.) 1996. The Merck index - Encyclopedia of chemicals, drugs and biologicals. 12e éd. Whitehouse Station (NJ) : Merck & Co. Inc.
Cambel, P., Breidenbach, A.W., Ray, F.E. 1954. A physio-pathological study of the rat’s stomach and blood after administration of chrysoidine Y and alphaazurine. Am. J. Physiol. 178(3):493-498.
Canada. 1985. emsupérieur à Loi sur les aliments et drogues. L.R.C., 1985, ch. F-27. Accès : http://www.canlii.org/fr/ca/legis/lois/lrc-1985-c-f-27/derniere/lrc-1985-c-f-27.html
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C., 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada. Ministère de l’Environnement. 2006a. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances considérées comme priorités pour suivi. Gazette du Canada, Partie I, vol. 140, no 9, p. 435-459. Accès : http://publications.gc.ca/gazette/archives/p1/2006/2006-03-04/pdf/g1-14009.pdf#page=11&file=.pdf
Canada. Ministère de l’Environnement. 2008. Loi canadienne sur la protection de l’environnement (1999) : Arrêté 2008-87-01-01 modifiant la Liste intérieure. Gazette du Canada, Partie II, vol. 142, no 13, p. 1429-1435. Accès : www.canadagazette.gc.ca/rp-pr/p2/2008/2008-06-25/pdf/g2-14213.pdf
Canada. Ministère de l'Environnement. 2009a. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Gazette du Canada, Partie I, vol. 143, no 40. Accès : http://www.gazette.gc.ca/rp-pr/p1/2009/2009-10-03/html/notice-avis-fra.html
Canada. Ministère de l’Environnement. 2011. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques. Gazette du Canada, Partie I, vol. 145, no 51, supplément. Accès : www.gazette.gc.ca/rp-pr/p1/2011/2011-12-17/pdf/g1-14551.pdf
Canada. Ministère de l’Environnement, ministère de la Santé. 2006b. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, no 49, p. 4109-4117.
Canada. Ministère de l’Environnement, ministère de la Santé. 2009b. Loi canadienne sur la protection de l’environnement (1999) : Avis de neuvième divulgation d’information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 143, no 11, p. 558-562. Accès : www.gazette.gc.ca/rp-pr/p1/2009/2009-03-14/pdf/g1-14311.pdf
Canada. Ministère de l’Environnement, ministère de la Santé. 2010. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention pour l’évaluation et la gestion des risques pour la santé des Canadiens et leur environnement liés aux substances azoïques aromatiques qui peuvent se transformer en certaines amines aromatiques, en certaines benzidines et en amines aromatiques ou benzidines dérivées. Gazette du Canada, Partie I, vol. 144, no 23, p. 1402-1405. Accès : www.canadagazette.gc.ca/rp-pr/p1/2010/2010-06-05/html/notice-avis-fra.html#d101
Canada. 2012a. Initiative des groupes de substances du Plan de gestion des produits chimiques. Substances aromatiques azoïques et à base de benzidine. Ébauche du document d’information technique. Juillet 2012. Environnement Canada, Santé Canada. Accès : www.ec.gc.ca/ese-ees/9E759C59-55E4-45F6-893A-F819EA9CB053/Azo_Technical%20Background_FR.pdf
Canada. 2012b. Autorisation de mise en marché d’additifs alimentaires comme colorants. DORS/2012-204. Loi sur les aliments et drogues. Accès : http://laws-lois.justice.gc.ca/fra/reglements/DORS-2012-204/page-1.html
Cartwright, R.A., Robinson, M.R.G., Glashan, R.W., Gray, B.K., Hamilton-Stewart, P., Cartwright, S.C., Barham-Hall, D. 1983. Does the use of stained maggots present a risk of bladder cancer to coarse fishermen?Carcinogenesis 4:111-113. [cité dans CIRC, 1987b].
CATALOGIC [modèle informatique]. 2012. Version 5.11.6. Bourgas(Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : www.oasis-lmc.org/?section=software&swid=1
[CCRIS] Chemical Carcinogenesis Research Information System [base de données sur Internet]. 2012. Bethesda (MD) : National Library of Medicine (États-Unis). [consulté le 28 octobre 2013]. Accès : toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?CCRIS
ChemIDplus [système de recherche des produits chimiques en ligne]. 1993- . Bethesda (MD) : National Library of Medicine (États-Unis). [consulté en septembre 2013]. Accès : http://chem.sis.nlm.nih.gov/chemidplus [cité dans NTP, 2011].
Chung, K.T., Fulk, G.E., Andrews, A.W. 1978. The mutagenicity of methyl orange and metabolites produced by intestinal anaerobes. Mutat. Res. 58:375-379. [cité dans BG Chemie, 1998].
[CII] Colour Index International [base de données sur Internet]. 2011. 4e éd. [en ligne]. Research Triangle Park (NC) : Society of Dyers and Colourists and American Association of Textile Chemists and Colorists. Accès : www.colour-index.com
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1975a. Chrysoidine. In: Some aromatic azo compounds. IARC Monogr. Eval. Carcinog. Risks Hum. 8:91-96.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1975b. 2,6-Diamino-3-(phenylazo)pyridine (hydrochloride). In: Some aromatic azo compounds.IARC Monogr. Eval. Carcinog. Risks Hum. 8:117-123.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1980. Phenazopyridine and phenazopyridine hydrochloride. In: Some pharmaceutical drugs. IARC Monogr. Eval. Carcinog. Risks Hum. 24:163-173.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1987a. Phenazopyridine hydrochloride. In: Overall evaluations of carcinogenicity: an updating of IARC Monographs Volumes 1 to 42. IARC Monogr. Eval. Carcinog. Risks Hum. Suppl. 7:312.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1987b. Chrysoidine. In: Overall evaluations of carcinogenicity: an updating of IARC Monographs Volumes 1 to 42. IARC Monogr. Eval. Carcinog. Risks Hum. Suppl. 7:169.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1987c. Meta-phenylenediamine. In: Overall evaluations of carcinogenicity: an updating of IARC Monographs Volumes 1 to 42. IARC Monogr. Eval. Carcinog. Risks Hum. Suppl. 7:70.
Cleuvers, M., Weyers, A. 2003. Algal growth inhibition test: does shading of coloured substances really matter? Water. Res. 37(11):2718-2722.
Columbus Chemical Industries, Inc. 2012. Fiche signalétique : Bismarck Brown. Columbus (WI) : Columbus Chemical Industries, Inc. [consulté en septembre 2013]. Accès : www.msdsonline.com [réserve de consultation].
Comber, M.H.I., Smyth, D.V., Thompson, R.S. 1995. Assessment of the toxicity to algae of coloured substances.Bull. Environ. Contam. Toxicol. 55:922-928. [cité dans Cleuvers et Weyers, 2003].
Commission européenne. 2006. Règlement (CE) no 1907/2006 du Parlement européen et du Conseil du 18 décembre 2006 concernant l’enregistrement, l’évaluation et l’autorisation des substances chimiques, ainsi que les restrictions applicables à ces substances (REACH), instituant une agence européenne des produits chimiques, modifiant la directive 1999/45/CE et abrogeant le règlement (CEE) no 793/93 du Conseil et le règlement (CE) no 1488/94 de la Commission ainsi que la directive 76/769/CEE du Conseil et les directives 91/155/CEE, 93/67/CEE, 93/105/CE et 2000/21/CE de la Commission [en ligne]. Journal officiel de l’Union européenne L 396:1-849. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=oj:l:2006:396:0001:0849:fr:pdf
Commission européenne. 2009. Règlement (CE) No 790/2009 de la Commission du 10 août 2009 modifiant, aux fins de son adaptation au progrès technique et scientifique, le règlement (CE) no 1272/2008 du Parlement européen et du Conseil relatif à la classification, à l’étiquetage et à l’emballage des substances et des mélanges. Annexe 1. Journal officiel de l’Union européenne L 235:199. Accès : eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2009:235:0001:0439:FR:PDF
[CSPC] Comité scientifique des produits de consommation. 2011. The SCCS’s notes of guidance for the testing of cosmetic ingredients and their safety evaluation. 7e rév. Commission européenne, Direction générale de la santé et des consommateurs, Comité scientifique des produits de consommation. Report No.: SCCS/1416/11. [consulté le 27 juillet 2012]. Accès : ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_s_004.pdf
[DS TOPKAT] Discovery Studio TOxicity Prediction by Komputer Assisted Technology [module de prévision]. ©2005-2009. Version 2.5.0.9164. San Diego (CA) : Accelrys Software Inc. Accès : www.accelrys.com/products/
Environnement Canada. 2007a. Catégorisation écologique des substances inscrites sur la liste intérieure des substances (LIS) [en ligne]. [mise à jour le 28 mai 2007]. Accès : https://www.ec.gc.ca/lcpe-cepa/default.asp?lang=Fr&n=5F213FA8-1&wsdoc=D031CB30-B31B-D54C-0E46-37E32D526A1F
Environnement Canada. 2007b. Guidance for conducting ecological assessments under CEPA, 1999: Science resource technical series, technical guidance module: QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada. 2009. Données sur certaines substances inanimées (chimiques) recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données préparées par Environnement Canada, Santé Canada, Programme des substances existantes.
Environnement Canada. 2012. Données sur certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques. Données préparées par Environnement Canada, Division de la mobilisation et de l’élaboration des programmes.
Environnement Canada, Santé Canada. 2007. Substances chimiques : Catégorisation [en ligne]. Ottawa (Ont.) : Gouvernement du Canada. [mis à jour le 20 avril 2007; consulté le 10 juin 2014]. Accès : http://www.chemicalsubstanceschimiques.gc.ca/approach-approche/categor-fra.php
Environnement Canada, Santé Canada. 2008. Rapport d’évaluation préalable final des 145 substances PBTi [en ligne]. Ottawa (Ont.) : Environnement Canada, Santé Canada. [consulté le 20 janvier 2014]. Accès : http://www.ec.gc.ca/lcpe-cepa/default.asp?lang=Fr&n=EE479482-1&wsdoc=1488280E-96A6-6994-1B09-5F98BF3F9014
Environnement Canada, Santé Canada. 2010. Ébauche d’évaluation préalable pour le Défi concernant l’acide 7-[[4,6-bis[[3-(diéthylamino) propyl]amino]-1,3,5-triazin-2-yl]amino]-4-hydroxy-3-[[p-(phénylazo)phényl]azo]naphtalène-2-sulfonique, monoacétate. Numéro de registre du Chemical Abstracts Service 70132-95-6 [en ligne]. Ottawa (Ont.) : Environnement Canada, Santé Canada. [consulté le 12 décembre 2013]. Accès : www.ec.gc.ca/ese-ees/A5510503-C974-446A-B525-D99AEA9B88BB/batch9_71032-95-6_fr.pdf
Environnement Canada, Santé Canada. 2013. The Chemicals Management Plan Substance Grouping Initiative. Subgrouping Approach and Background Information for the Screening Assessment of Aromatic Azo and Benzidine-Based Substances. Mai 2013. Environnement Canada, Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/9E759C59-55E4-45F6-893A-F819EA9CB053/Azo_Technical%20Background_FR.pdf
Environnement Canada, Santé Canada. 2014a. Évaluation préalable : Groupe des substances azoïques aromatiques et à base de benzidine, Certains colorants et dérivés à base de benzidine. Novembre 2014. Environnement Canada, Santé Canada.
Environnement Canada. 2014b. Examen préalable rapide des substances de la phase un de la mise à jour de l'inventaire de la Liste intérieure. Mars 2014. Environnement Canada, Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/7340E1B7-1809-4564-8C49-F05875D511CB/FSAR_RSII_FR.pdf
Environnement Canada, Santé Canada. 2015. Évaluation préalable : Groupe de substances azoïques aromatiques et à base de benzidine. Certains colorants avec solvant azoïques [en ligne]. Ottawa (Ont.) : Environnement Canada, Santé Canada.
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows[modèle d’évaluation]. 2012. Version 4.1. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Erfa Canada Inc. 2010. Monographie de produit : Pyridium®. Phenazopyridine hydrochloride tablets USP 100 and 200 mg, urinary tract analgesic [en ligne]. Montréal (Qc) : Erfa Canada Inc. [consulté le 26 septembre 2013].
Ericson, J.W. 1977. Applicability of ATP measurements for the determination of dye toxicity in short term algal assays. In: Proceedings of the Bi-Annual ATP Methodology Symposium. San Diego (CA) : SAI Technology Co. p. 415-439.
[ETAD] Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers. 1983. Final report on extractability of dyestuffs from textiles. Bâle (Suisse) : Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers. Project A 4007.
[ETAD] Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers. 1995. Health & environmental information on dyes used in Canada. An overview to assist in the implementation of the New Substances Notification Regulations under the Canadian Environmental Protection Act. Préparé par les associations canadiennes affiliées de l’ETAD. Report No.: 7/21/95.
[FAO/OMS] Réunion conjointe FAO/OMS sur les résidus de pesticides. 1998. Dicloran. In: Pesticide residues in food – 1998. Part II – Toxicological evaluations. Genève (Suisse) : Organisation mondiale de la Santé. Accès : www.inchem.org/documents/jmpr/jmpmono/v098pr05.htm
Foureman, P., Mason, J.M., Valencia, R., Zimmering, S. 1994. Chemical mutagenesis testing in Drosophila. IX. Results of 50 coded compounds tested for the National Toxicology Program. Environ. Mol. Mutagen. 23:51-63.
Freeman, H.S., Esancy, J.F., Esancy, M.K., Mills, K.P., Whaley, W.M., Dabney, B.J. 1987. An approach to the design of non-mutagenic azo dyes: 1. The identification of non-mutagenic precursors and potential metabolites. Dyes Pigm. 8:417-430. [cité dans BG Chemie, 1998].
Friedman, G.D., Ury, H.K. 1980. Initial screening for carcinogenicity of commonly used drugs. J. Natl. Cancer Inst. 65(4):723-733. [cité dans CIRC, 1980].
Galloway, S.M., Armstrong, M.J., Reuben, C., Colman, S., Brown, B., Cannon, C., Bloom, A.D., Nakamura, F., Ahmed, M., Duk, S., et al. 1987. Chromosome aberrations and sister chromatid exchanges in Chinese hamster ovary cells: evaluations of 108 chemicals. Environ. Mol. Mutagen. 10(Suppl 10):1-175.
Galloway, S.M., Sofuni, T., Shelby, M.D., Thilagar, A., Kumaroo, V., Kaur, P., Gulati, D., Putman, D.L., Murli, H., Marshall, R., et al. 1997. Multilaboratory comparison of in vitro tests for chromosome aberrations in CHO and CHL cells tested under the same protocols. Environ. Mol. Mutagen. 29(2):189-207. [cité dans CCRIS, 2012].
Garner, R.C., Nutman, C.A. 1977. Testing of some azo dyes and their reduction products for mutagenicity using Salmonella typhimurium TA 1538. Mutat. Res. 44:9-19.
Greene, J.C., Baughman, G.L. 1996. Effects of 46 dyes on population growth of freshwater green alga Selenastrum capricornutum. Text. Chem. Color 28(4):23-30.
Green, F.J. 1990. The Sigma-Aldrich handbook of stains, dyes and indicators. Milwaukee (WI) : Aldrich Chemical Company. 776 p.
Güngördü, A., Birhanli, A., Ozmen, M. 2013. Biochemical response to exposure to six textile dyes in early developmental stages of Xenopus laevis. Environ. Sci. Pollut. Res. 20:452-460.
Habel, L.A., Friedman, G.D. 2006. Chapter 25: Pharmaceuticals Other Than Hormones (pages 489-506). In: Cancer Epidemiology and Prevention. Schottenfeld, D., Searle, J.G. 2006 (éd.). 3e édition. Oxford University Press, 2006.
Hannuksela, F., Rosencrance, S. 2008. Deinking chemistry [en ligne]. Kemira Germany GmbH et Kemira Chemicals Inc. [consulté le 4 novembre 2013]. Accès : www.cost-e46.eu.org/files/Deinking%20primer/Deinking%2°hemistry-FINAL.pdf
Hayashi, M., MacGregor, J.T., Gatehouse, D.G., Blakey, D.H., Dertinger, S.D., Abramsson-Zetterberg, L., Krishna, G., Morita, T., Russo, A., Asano, N., et al. 2007.In vivo erythrocyte micronucleus assay. III. Validation and regulatory acceptance of automated scoring and the use of rat peripheral blood reticulocytes, with discussion of non-hematopoietic target cells and a single dose-level limit test. Mutat. Res. 627:10-30.
Herbold, B.A., Arni, P., Engelhardt, G., Gericke, D., Longstaff, E. 1981. Comparative Ames test study with dyes. Mutat. Res. 85:260. [cité dans Environnement Canada et Santé Canada, 2015a].
Herbold, B.A., Arni, P., Engelhardt, G., Gericke, D., Longstaff, E. 1982. Comparative Ames-test study with dyes. Mutat. Res. 97:429-435. [cité dans Environnement Canada et Santé Canada, 2015a].
Holahan, M.L., Littman, M.P., Hayes, C.L. 2010. Presumptive hepatotoxicity and rhabdomyolysis secondary to phenazopyridine toxicity in a dog. J Vet Emerg Crit Care 20(3):352-358.
[HSDB] Hazardous Substances Data Bank [base de données sur Internet]. 1983- . Bethesda (MD) : National Library of Medicine(États-Unis). [révisé le 14 février 2003; consulté en 2012 et le 1er novembre 2013]. Accès : toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?HSDB
Huber, P., Carré, B. 2012. Decolorization of process waters in deinking mills and similar applications: a review. BioResources 7(1):1366-1382.
Hunger, K. 2003. Industrial dyes: Chemistry, properties, applications. Weinheim (Allemagne) : WILEY-VCH Verlag GmbH & Co. KGaA.
Huren, A., Yi, Q., Xiasheng, G. 1994. A way for water pollution control in dye manufacturing industry. In: 49th Purdue Industrial Waste Conference Proceedings. Boca Raton (FL) : Lewis Publishers. p. 775.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’évaluation]. 2010. Version 2.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Institute of Paper Science Technology Inc. 2009. Fiche signalétique : SPI #02511-AB Green & Yorston (Azo) Stain. Atlanta (GA) : Institute of Paper Science Technology Inc. [consulté en septembre 2013]. Accès : www.msdsonline.com [réserve de consultation].
[JECFA] Comité mixte FAO/OMS d'experts des additifs alimentaires. 1977. Summary of toxicological data of certain food additives. WHO food additives series, n° 12. Accès : http://www.inchem.org/documents/jecfa/jecmono/v12je07.htm
[JETOC] Japan Chemical Industry Ecology-Toxicology & Information Center. 1996. Mutagenicity test data of existing chemical substances based on the toxicity investigation of the industrial safety and health law. Tokyo (Japon) : Japan Chemical Industry Ecology-Toxicology & Information Center. [cité dans CCRIS, 2012].
Johnson, W.J., Chartrand, A. 1976. The metabolism and excretion of phenazopyridine hydrochloride in animals and man. Toxicol. Appl. Pharmacol. 37(2):371-376.
Jurima-Romet, M., Thomas, B.H., Solomonraj, G., Paul, C.J., Huang, H. 1993. Metabolism of phenazopyridine by isolated rat hepatocytes. Biopharm. Drug Dispos. 14(2):171-179.
Kawai, A., Goto, S., Matsumoto, Y., Matsushita, H. 1987. [Mutagenicity of aliphatic and aromatic nitro compounds. Industrial materials and related compounds]. Jpn. J. Ind. Health 29(1):34-54. [article en japonais].
Kawalek, J.C., Hallmark, R.K., Andrews, A.W. 1983. Effect of lithocholic acid on the mutagenicity of some substituted aromatic amines. J. Natl. Cancer Inst. 71(2):293-298. [cité dans BG Chemie, 1998].
Knacker, T., Schallnass, H., Klaschka, U., Ahlers, J. 1995. Application of the criteria for classification of existing chemicals as dangerous for the environment. Environ. Sci. Pollut. Res. 2(3):179-187.
Kornbrust, D.J., Barfknecht, T.R. 1984. Comparison of 7 azo dyes and their azo reduction products in the rat and hamster hepatocyte primary culture/DNA-repair assays. Mutat. Res. 136:255-266. [cité dans BG Chemie, 1998].
Lide, D.R. (éd.) 1995-1996. CRC handbook of chemistry and physics. 76e éd. Boca Raton (FL) : CRC Press Inc. p. 3-37.
Little, L.W., Lamb, J.C. III. 1972. Acute toxicity of 46 selected dyes to the fathead minnow, Pimephales promelas. Chapel Hill (NC) : Université de la Caroline du Nord, Department of Environmental Sciences and Engineering, School of Public Health, UNC Wastewater Research Center. Préparé pour l’Ecology Committee, American Dye Manufacturers, Inc., septembre. 126 p.
Little, L.W., Lamb, J.C. III. 1974. Acute toxicity of selected commercial dyes to the fathead minnow and evaluation of biological treatment for reduction of toxicity. In: Proceedings of the 29th Industrial Waste Conference. Conférence tenue à l’Université Purdue, West Lafayette (IN). p. 524-534.
Mallinckrodt Baker Inc. 2010. Fiche signalétique : Bismark Brown Y(C.I. 21000). Phillipsburg (NJ) : Mallinckrodt Baker Inc. [consulté en septembre 2013]. Accès : www.msdsonline.com [réserve de consultation].
Maruya, M. 1938. On the renal changes of albino rats induced by the oral administration of 14 azo-compounds and 5 aromatic amino-compounds. Tr. Soc. Pathol. Jpn. 28:541-547. [cité dans CIRC, 1975a].
Mason, J.M., Valencia, R., Zimmering, S. 1992. Chemical mutagenesis testing in Drosophila: VIII. Reexamination of equivocal results. Environ. Mol. Mutagen. 19:227-234.
Matsushima, T., Hayashi, M., Matsuoka, A., Ishidate, M. Jr, Miura, K.F., Shimizu, H., Suzuki, Y., Morimoto, K., Ogura, H., Mure, K., et al. 1999. Validation study of the in vitro micronucleus test in a Chinese hamster lung cell line (CHL/IU). Mutagenesis 14(6):569-580.
Matsushima, T., Teichmann, B., Sawamura, M., Sugimura, T. 1978. Mutagenicity of azo-compounds - Improved method for detecting their mutagenicities by the Salmonella mutation test.Mutat. Res. 54:220-221. [résumé].
McGregor, D.B., Brown, A.G., Howgate, S., McBride, D., Riach, C., Caspary, W.J. 1991. Responses of the L5178Y mouse lymphoma cell forward mutation assay. V: 27 coded chemicals.Environ. Mol. Mutagen. 17(3):196-219.
M. Dohmen USA Inc. 2009. Fiche signalétique : Doracryl Blue X3GL 300%. Greenville (SC) : M. Dohmen USA Inc. [consulté en septembre 2013]. Accès : www.msdsonline.com [réserve de consultation].
[MIDAS] Multinational Integrated Data Analysis [base de données sur CD-ROM]. 2013. Cham (Suisse) : IMS AG.
Morita, T., Asano, N., Awogi, T., Sasaki, Y.F., Sato, S., Shimada, H., Sutou, S., Suzuki, T., Wakata, A., Sofuni, T., et al. 1997. Evaluation of the rodent micronucleus assay in the screening of IARC carcinogens (Groups 1, 2A and 2B): the summary report of the 6th collaborative study by CSGMT/JEMS·MMS. Mutat. Res. 389:3-122.
Mortelmans, K., Haworth, S., Lawlor, T., Speck, W., Tainer, B., Zeiger, E. 1986. Salmonella mutagenicity tests: II. Results from the testing of 270 chemicals. Environ. Mutagen. 6(Suppl. 7):1-119.
MP Biomedicals. 2006. Fiche signalétique : Bismarck Brown Y. Solon (OH) : MP Biomedicals. [consulté en septembre 2013]. Accès : www.msdsonline.com [réserve de consultation].
Munday R. 1986. Generation of superoxide radical and hydrogen peroxide by 1,2,4-triaminobenzene, a mutagenic and myotoxic aromatic amine. Chem Biol Interact 60(2):171-81.
Munday R. 1987. Oxidation of glutathione and reduced pyridine nucleotides by the myotoxic and mutagenic aromatic amine, 1,2,4-triaminobenzene. Chem Biol Interact 62(2):131-41.
Munday, R., Fowke, E.A. 1994. Generation of superoxide radical and hydrogen peroxide by 2,3,6-triaminopyridine, a metabolite of the urinary tract analgesic phenazopyridine. Free Radic Res 21(2):67-73.
Munday, R., Manns, E. 1998. 2,3,6-triaminopyridine, a metabolite of the urinary tract analgesic phenazopyridine, causes muscle necrosis and renal damage in rats. J Appl Toxicol. 18(2):161-5.
[NCI] National Cancer Institute (États-Unis). 1978. Bioassay of phenazopyridine hydrochloride for possible carcinogenicity. CAS No. 136-40-3. Bethesda (MD) : US Department of Health, Education, and Welfare, Public Health Service, National Institutes of Health, National Cancer Institute. Technical Report Series No. 99. DHEW Publication No. (NIH) 78-1349. 96 p. [consulté en septembre 2013]. Accès : ntp.niehs.nih.gov/ntp/htdocs/LT_rpts/tr099.pdf
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2012. 2e éd. Columbus (OH) : American Chemical Society, Chemical Abstracts Service. [consulté en août 2012]. Accès : http://www.cas.org/products/other-cas- products/nci-on-cd
[New EQC] New Equilibrium Criterion Model. 2011. Version 1.00. Peterborough (Ont.) : Université Trent, Canadian Centre for Environmental Modelling and Chemistry. Accès : www.trentu.ca/academic/aminss/envmodel/models/NewEQCv100.html
New Jersey Department of Health and Senior Services. 2001. Hazardous substance fact sheet - Phenazopyridine hydrochloride. Trenton (NJ) : New Jersey Department of Health and Senior Services, Occupational Health Service. 6 p. [consulté en septembre 2013]. Accès : nj.gov/health/eoh/rtkweb/documents/fs/1485.pdf
[NTP] National Toxicology Program (États-Unis). 1981. Phenazopyridine hydrochloride. In: Report on carcinogens. 2e éd. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. [cité dans NTP, 2011].
[NTP] National Toxicology Program (États-Unis). 1992a.Genetic toxicity evaluation of Bismark Brown Y in Salmonella/E. coli mutagenicity test or Ames study. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. Report No.: 905758. Accès : tools.niehs.nih.gov/cebs3/ntpViews/?studyNumber=905758
[NTP] National Toxicology Program. 1992b. National Toxicology Program Chemical Repository Database. Research Triangle Park (NC) : US Department of Health and Human Services, National Institutes of Health, National Toxicology Program.
[NTP] National Toxicology Program (États-Unis). 1993. Genetic toxicity evaluation of C.I. Basic Orange 2 in Salmonella/E. coli mutagenicity test or Ames study. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. Report No.: 020505. Accès : tools.niehs.nih.gov/cebs3/ntpViews/?activeTab=detail&studyNumber=020505
[NTP] National Toxicology Program (États-Unis). 2011. Phenazopyridine hydrochloride. In: Report on carcinogens. 12e éd. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. p. 341-342. [consulté en septembre 2013]. Accès : ntp.niehs.nih.gov/ntp/roc/twelfth/roc12.pdfAccès : ntp.niehs.nih.gov/ntp/roc/twelfth/roc12.pdf
[OCDE] Organisation de coopération et de développement économiques. 2014. Guidance on Grouping of Chemicals. Second Edition. Series on Testing & Assessment, No. 194. Accès : http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/? cote=env/jm/mono(2014)4&doclanguage=en
Øllgaard, H., Frost, L., Galster, J., Hansen, O.C. 1998. Survey of azo-colorants in Denmark: consumption, use, health and environmental aspects. (Miljøprojekt No. 509). Copenhague (Danemark) : Ministry of Environment and Energy, Environmental Protection Agency du Danemark. Accès : www2.mst.dk/udgiv/publications/1999/87-7909-548-8/pdf/87-7909-546-1.pdf
Oster, G. 1955. Dye binding to high polymers. J. Polym. Sci. 16:235-244.
Pagga, U., Brown, D. 1986. The degradation of dyestuffs: Part II. Behavior of dyestuffs in aerobic biodegradation tests. Chemosphere 15(4):479-491.
Palus, J., Schwarz, L., Frank, C., Andrae, U. 1995. DNA repair synthesis induced by azo dyes in primary rat hepatocyte cultures using the bromodeoxyuridine density-shift method.Int. J. Occup. Med. Environ. Health 8(2):123-130.
Pauli, W., Berger, S., Jaskulka, L., Schmitz, S. 1993. A case for the inclusion of a protozoan test in aquatic toxicity assessment using Tetrahymena. Sci. Total Environ. Suppl. 1:779-786.
Pauli, W., Berger, S., Schmitz, S., Jaskulka, L. 1994. Chemosensory responses of ciliates: a sensitive end point in xenobiotic hazard assessment. Environ. Toxicol. Water Qual. 9(4):341-346.
Piekarski, L., Marciszewski, H. 1966. Affinity of carcinogenic chrysoidine for proteins of mice liver. Rocz. Panstw. Zakl. Hig. 17:485-489. [cité dans CIRC, 1975a].
Pinheiro, H.M., Touraud, E., Thomas, O. 2004. Aromatic amines from azo dye reduction: status review with emphasis on direct UV spectrophotometric detection in textile industry wastewaters. Dyes Pigm. 61:121-139.
Présentation d’étude. 2006. Étude confidentielle non publiée et présentée à Environnement Canada dans le cadre du Défi en vertu du Plan de gestion des produits chimiques. Studies on the inherent biodegradability and aquatic toxicity of CAS RN 71032-95-6. Gatineau (Qc) : Environnement Canada, Programme des substances existantes.
Présentation d'étude. 2009a. Étude confidentielle non publiée et présentée à Environnement Canada dans le cadre du Défi en vertu du Plan de gestion des produits chimiques. Study on the inherent biodegradability of CAS RN 118658-98-3. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Présentation d’étude. 2009b. Étude confidentielle non publiée et présentée à Environnement Canada dans le cadre du Défi en vertu du Plan de gestion des produits chimiques. 96-hour acute toxicity study in the zebra fish(CAS RN 118658-98-3). Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation d’étude. 2009c. Étude confidentielle non publiée et présentée à Environnement Canada dans le cadre du Défi en vertu du Plan de gestion des produits chimiques. Acute toxicity study in Daphnia magna(CAS RN 118658-98-3). Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Présentation d’étude. 2009d. Étude confidentielle non publiée et présentée à Environnement Canada dans le cadre du Défi en vertu du Plan de gestion des produits chimiques. Prolonged toxicity study with rainbow trout in a flow-through system (CAS RN 118658-98-3). Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes. Disponible en tant que Sommaire de rigueur d’étude, no 13365Submission034.
Présentation d’étude. 2009e. Étude confidentielle non publiée et présentée à Environnement Canada dans le cadre du Défi en vertu du Plan de gestion des produits chimiques. Determination of the partition coefficient for CAS RN 118658-98-3. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes.
Razo-Flores, E., Luijten, M., Donlon, B., Lettinga, G., Field, J. 1997. Biodegradation of selected azo dyes under methanogenic conditions. Water Sci. Technol. 36(6-7):65-72.
Rufli, H., Fisk, P.R., Girling, A.E., King, M.H., Lange, R., Lejeune, X., Stelter, N., Stevens, C., Suteau, P., Tapp, J., et al. 1998. Aquatic toxicity testing of sparingly soluble, volatile, and unstable substances and interpretation and use of data. Ecotoxicol. Environ. Saf. 39(2):72-77.
Sabnis, R.W. 2008. Handbook of acid-base indicators. Boca Raton (FL) : CRC Press Inc. 398 p.
Sabnis, R.W. 2010. Handbook of biological dyes and stains: synthesis and industrial applications. Hoboken (NJ) : John Wiley & Sons Inc. 521 p.
Sandhu, P., Chipman, J.K. 1990.Bacterial mutagenesis and hepatocyte unscheduled DNA synthesis induced by chrysoidine azo-dye components. Mutat. Res. 240:227-236.
Sandhu, P., Chipman, J.K. 1991a. Lack of release from hepatocytes in vitro or excretion in vivo of mutagenic chrysoidine metabolites. Toxicol. Lett. 58:43-50.
Sandhu, P., Chipman, J.K. 1991b. Role of oxidation and azo reduction in the activation of chrysoidine dyes to genotoxic products. In: Hlavica, P., Damani, L.A., Gorrod, J.W. (éd.) Progress in pharmacology and clinical pharmacology, vol. 8/3. Proceedings of the 4th International Conference on Biological Oxidation of Nitrogen in Organic Molecules, Munich, 1989. Munich (Allemagne) : Gustav Fischer Verlag.
Santa Cruz Biotechnology Inc. 2013a. Fiche signalétique : Fast Black K salt. Dallas (TX) : Santa Cruz Biotechnology Inc. [consulté en septembre 2013]. Accès : www.scbt.com/datasheet-206041-fast-black-k-salt.html
Santa Cruz Biotechnology Inc. 2013b. Fiche signalétique : Bismarck Brown Y. Dallas (TX) : Santa Cruz Biotechnology Inc. [consulté en septembre 2013]. Accès : www.scbt.com/datasheet-214611-bismarck-brown-y.html
Santé Canada. 1994. L'évaluation du risque à la santé humaine des substances d'intérêt prioritaire. Ottawa (Ont.) : Santé Canada. Accès : http://www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/contaminants/approach/approche-fra.pdf
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada. 2009. Catégorisation des substances figurant sur la Liste intérieure des substances [en ligne]. [modifié le 8 septembre 2009]. Ottawa (Ont.) : Santé Canada. Accès : http://www.hc-sc.gc.ca/ewh-semt/contaminants/existsub/categor/index-fra.php
Santé Canada. 2011a. Loi canadienne sur la protection de l’environnement (1999) : Rapport de suivi sur une substance inscrite à la LSIP - Aniline, Numéro de registre du Chemical Abstracts Service 62-53-3. Ottawa (Ont.) : Santé Canada. Accès : http://www.ec.gc.ca/ese-ees/CCDA73CC-13BC-4835-AA8D-966C159B56F2/Aniline_Follow-up_FR.pdf
Santé Canada. 2011b. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques – Mars 2011 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation. [consulté en août 2011]. Accès : http://www.hc-sc.gc.ca/cps-spc/cosmet-person/indust/hot-list-critique/hotlist-liste-fra.php
SciFinder [base de données sur Internet]. 2013. Columbus (OH) : Chemical Abstracts Service. Accès : scifinder.cas.org
Searle, C.E., Teale, J. 1984. Carcinogenic risks of fishermen’s dyes. Lancet 323(8376):563.
Selden, J.R., Dolbeare, F., Clair, J.H., Miller, J.E., McGettigan, K., DiJohn, J.A., Dysart, G.R., DeLuca, J.G. 1994. Validation of a flow cytometric in vitro DNA repair (UDS) assay in rat hepatocytes. Mutat. Res. 315(2):147-167.
Serajuddin, A.T., Jarowski, C.I. 1985 Effect of diffusion layer pH and solubility on the dissolution rate of pharmaceutical bases and their hydrochloride salts. I: Phenazopyridine. J Pharm Sci. 74(2):142-7.
Sharma, S., Sharma, S., Upreti, N., Sharma, K.P. 2009. Monitoring toxicity of an azo dye methyl red and a heavy metal Cu, using plant and animal bioassays. Toxicol. Environ. Chem. 91(1):109-120.
Shimizu, H., Takemura, N. 1984. Mutagenicity of some aniline derivatives. In: Proceedings of the 11th International Congress on Occupational Health in the Chemical Industry. Congrès tenu du 26 au 29 septembre 1983, à Calgary (Alb.) p. 497-506. [cité dans Environnement Canada et Santé Canada, 2013d].
Shirotori, T., Miyagawa, M. 1997. Early detection of liver carcinogens by hepatocytes micronucleus test with juvenile/young rats. In: Proceeding of the 26th JEMS Meeting, Hatano. p. 83. [résumé]. [cité dans Hayashi et al., 2007].
Sigma-Aldrich. 2009. Fiche signalétique :N,N,N′,N′-Tetramethyl-4,4′-azodianiline[en ligne]. Saint Louis (MO) : Sigma-Aldrich. [consulté en septembre 2013]. Accès : www.msdsonline.com [réserve de consultation].
Sisley, P., Porcher, C.N. 1911. Physiologie - Du sort des matières colorantes dans l’organisme animal. C. r. hebd. séances Acad. Sci. 152:1062-1064.
Smoothline Writing Instruments. 2010. Fiche signalétique : Zebra Z-Grip Flight Black [en ligne]. Navi Mumbai (Inde). [consulté en octobre 2013]. Accès : https://www.officemaxcanada.com/corporatepages/PlayVendorMSDS.aspx?sku=21910
Sofuni, T., Matsuoka, A., Sawada, M., Ishidate, M. Jr, Zeiger, E., Shelby, M.D. 1990. A comparison of chromosome aberration induction by 25 compounds tested by two Chinese hamster cell (CHL and CHO) systems in culture. Mutat. Res. 241:175-213. [cité dans BG Chemie, 1998].
Sole, G.M., Chipman, J.K. 1986. The mutagenic potency of chrysoidines and Bismark brown dyes. Carcinogenesis 7(11):1921-1923.
Sole, G., Sorahan, T. 1985. Coarse fishing and risk of urothelial cancer. Lancet 325(8444):1477-1479. [cité dans CIRC, 1987b].
Statistique Canada. 2012. Enquête canadienne sur les mesures de la santé (ECMS) - Cycle 1. Ottawa (Ont.) : Statistique Canada. Disponible sur demande.
Stoner, G.D., Shimkin, M.B., Kniazeff, A.J., Weisburger, J.H., Weisburger, E.K., Gori, G.B. 1973. Test for carcinogenicity of food additives and chemotherapeutic agents by the pulmonary tumor response in strain A mice. Cancer Res. 33(12):3069-3085.
Thomas, B.H., Whitehouse, L.W., Solomonraj, G., Paul, C.J. 1990. Excretion of phenazopyridine and its metabolites in the urine of humans, rats, mice, and guinea pigs. J. Pharm. Sci. 79(4):321-325.
Thomas, B.H., Whitehouse, L.W., Solomonraj, G., Paul, C.J. 1993. Metabolism and disposition of phenazopyridine in rat. Xenobiotica 23(2):99-105.
Tonogai, Y., Ogawa, S., Ito, Y., Iwaida, M. 1982. Actual survey on TLm (median tolerance limit) values of environmental pollutants, especially on amines, nitriles, aromatic nitrogen compounds and artificial dyes. J. Toxicol. Sci. 7:193-203.
[TOXLINE] Toxicology Literature Online [base de données sur Internet]. 2013. Bethesda (MD) : National Library of Medicine (États-Unis). [consulté le 23 octobre 2013]. Accès : toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?TOXLINE
Tsuda, S., Matsusaka, N., Madarame, H., Ueno, S., Susa, N., Ishida, K., Kawamura, N., Sekihashi, K., Sasaki, Y.F. 2000. The comet assay in eight mouse organs: results with 24 azo compounds. Mutat. Res. 465:11-26.
[Ullmann’s Encyclopedia] Ullmann’s Encyclopedia of Industrial Chemistry [en ligne]. 2010. John Wiley & Sons, Inc. Accès : onlinelibrary.wiley.com/book/10.1002/14356007
[USEPA] Environmental Protection Agency des États-Unis. 1994. Manufacture and use of printing ink. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics, Chemical Engineering Branch.
[USEPA] Environmental Protection Agency des États-Unis. 2012. Standard operating procedures for residential pesticide exposure assessment. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Chemical Safety and Pollution Prevention, Office of Pesticide Programs, Health Effects Division. Accès : www.epa.gov/opp00001/science/USEPA-OPP-HED_Residential%20SOPs_Oct2012.pdf
Van den Eeden, S.K., Friedman, G.D. 1995. Prescription drug screening for subsequent carcinogenicity. Pharmacoepidemiology and Drug Safety 4(5):275-287.
Weber, E.J., Adams, R.L. 1995. Chemical- and sediment-mediated reduction of the azo dye Disperse Blue 79. Environ. Sci. Technol. 29(5):1163-1170.
Whitehouse, P., Mallett, M. 1993. Aquatic toxicity testing for notification of new substances. An advisory document on dealing with difficult substances. Rapport présenté à la Chemical Notification Unit, Department of the Environment. Medmenham, Marlow, Buckinghamshire (Royaume-Uni) : WRc plc., Publications Unit. [cité dans Rufli et al., 1998; Cleuvers et Weyers, 2003].
Woodruff, R.C., Mason, J.M., Valencia, R., Zimmering, S. 1985. Chemical mutagenesis testing in Drosophila: V. Results of 53 coded compounds tested for the National Toxicology Program. Environ. Mutagen. 7:677-702.
Yoshikawa, K., Nohmi, T., Harada, R., Ishidate, M.J.R., Inokawa, Y. 1979. Differential mutagenicities of triamino benzenes against Salmonella typhimurium TA98 in the presence of S9 fractions from polychlorinated biphenyls, phenobarbital or 3-methylcholanthrene-pretreated rats, hamsters and mice. J. Toxicol. Sci. 4(4):317-326.
Yoshimi, N., Sugie, S., Iwata, H., Niwa, K., Mori, H., Hashida, C., Shimizu, H. 1988. The genotoxicity of a variety of aniline derivatives in a DNA repair test with primary cultured rat hepatocytes. Mutat. Res. 206(2):183-191.
Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K., Speck, W. 1987. Salmonella mutagenicity tests: III. Results from the testing of 255 chemicals.Environ. Mutagen. 9(9):1-110.
Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K. 1992.Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals. Environ. Mol. Mutagen. 19(Suppl. 21):2-141. [cité dans BG Chemie, 1998].
Zeilmaker, M.J., Kroese, E.D., van Haperen, P., van Veen, M.P., Bremmer, H.J., van Kranen, H.J., Wouters, M.F.A., Janus, J.A. 1999. Cancer risk assessment of azo dyes and aromatic amines from garment and footwear. Rapport RIVM 601503 014. Bilthoven (Pays-Bas) : Rijkinstituut voor Volkgezondheid en Milieu (Institut national néerlandais pour la santé publique et l’environnement). Accès : www.rivm.nl/bibliotheek/rapporten/601503014.html
Zeilmaker, M.J., van Kranen, H.J., van Veen, M.P., Janus, J.A. 2000. Cancer risk assessment of azo dyes and aromatic amines from tattoo bands, folders of paper, toys, bed clothes, watch straps and ink. Rapport RIVM 601503 019. Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néerlandais pour la santé publique et l’environnement). 45 p. Accès : www.rivm.nl/bibliotheek/rapporten/601503019.html
Zimina, T.A., Pavlenko, V.V. 1990. Toxicogenetic effects of azo- and arylmethane dyes.Genetika 26(12):2246-2249.
Annexe A : Tableaux de données supplémentaires
| Sous-ensemble de l'écologie | N° CAS/nom dans le C.I. | Structure chimique | Formule chimique (masse molaire, g/mol) |
|---|---|---|---|
| 1 | 14408-20-9 |  |
C21H2°l2N5O2·Cl (481) |
| 1 | 10189-42-1 |  |
C23H26Cl2N5O2S·Cl (543) |
| 1 | 59709-10-3 |  |
C21H21ClN5O2·C2H3O2 (470) |
| 1 | 36986-04-6 | 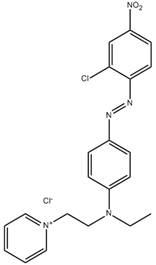 |
C21H21ClN5O2·Cl (446) |
| 1 | 72361-40-1 | 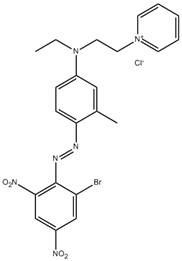 |
C22H22BrN6O4·Cl (550) |
| 2 | 85114-37-0 |  |
2C18H21N6·Cl4Zn (854) |
| 2 | 52769-39-8 |  |
C18H21N6·Cl3Zn (493) |
| 2 | 72379-36-3 | 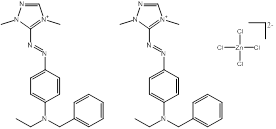 |
2C19H23N6·Cl4Zn (878) |
| 2 | 72379-37-4 | 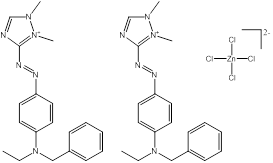 |
2C19H23N6·Cl4Zn (878) |
| 2 | 14970-39-9 | 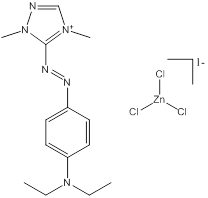 |
C14H21N6·Cl3Zn (447) |
| 2 | 68936-17-4 | 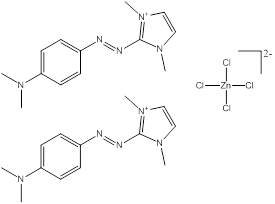 |
2C13H18N5·Cl4Zn (696) |
| 2 | 63589-49-1 | 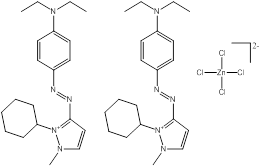 |
2C20H30N5·Cl4Zn (888) |
| 2 | 65150-98-3 | 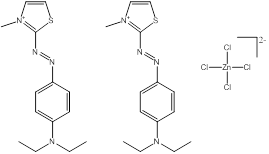 |
2C14H19N4S·Cl4Zn (760) |
| 2 | 74744-63-1 | 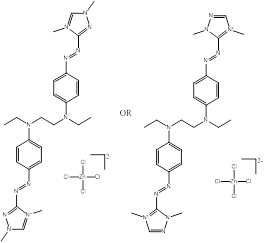 |
C26H36N12·Cl4Zn (724) |
| 2 | 23408-72-2 | 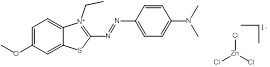 |
C18H21N4OS·Cl3Zn (513) |
| 2 | 69852-41-1 | 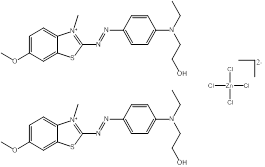 |
2C19H23N4O2S·Cl4Zn (950) |
| 2 | 93783-70-1 | 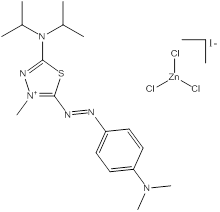 |
C17H27N6S·Cl3Zn (519) |
| 2 | 85480-88-2 | 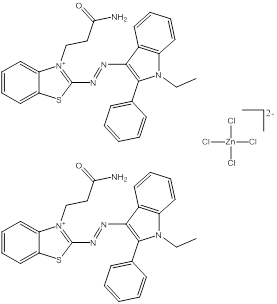 |
C52H48N10O2S2·Cl4Zn (1 116,33) |
| 3 | 532-82-1 Basic Orange 2 |
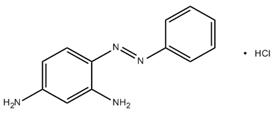 |
C12H12N4·ClH (249) |
| 3 | 79234-33-6 | 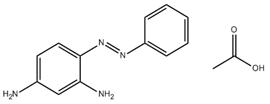 |
C12H12N4·C2H4O2 (272) |
| 3 | 75660-25-2 | 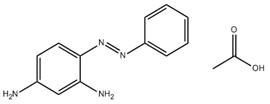 |
C12H12N4·C2H4O2 (272) |
| 3 | Pentylènetétrazole |  |
C11H12ClN5 (250) |
| 4 | 4608-12-2 |  |
C28H27N6·Cl (483) |
| 4 | 4618-88-6 | 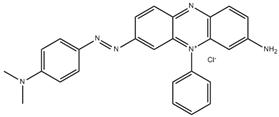 |
C26H23N6·Cl (455) |
| 4 | 2869-83-2 | 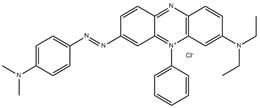 |
C30H31N6·Cl (511) |
| 5 | 125329-01-3 |  |
C39H50N12O4S·C3H6O3 (873) |
| 5 | 71032-95-6 NDTHPM |
 |
C39H50N12O4S·C2H4O2 (843) |
| 6 | 68929-07-7 | 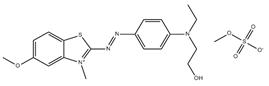 |
C19H23N4O2S·CH3O4S (483) |
| 6 | 83969-13-5 |  |
2C17H27N6S·O4S (791) |
| 6 | 29508-48-3 |  |
C20H20N5·CH3O4S (444) |
| 7 | 75199-20-1 |  |
C24H21N6O2·Cl (462) |
| 7 | 10114-58-6 Basic Brown 1 |
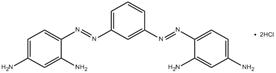 |
C18H18N8·2ClH (419) |
| 7 | 63681-54-9 | 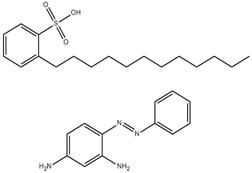 |
C18H30O3S·C12H12N4 (539) |
| N° CAS | Propriété | Valeur | Référence |
|---|---|---|---|
| 6257-64-3 (données déduites à partir d'analogues pour le point de fusion, le point d'ébullition, la pression de vapeur, et le log Koe) |
Point de fusion | 276 à 278 °C | Sigma-Aldrich, 2009 |
| 6257-64-3 (données déduites à partir d'analogues pour le point de fusion, le point d'ébullition, la pression de vapeur, et le log Koe) |
Point d'ébullition | supérieur(e) à 100 °C | Institute of Paper Science Technology Inc., 2009 |
| 6257-64-3 (données déduites à partir d'analogues pour le point de fusion, le point d'ébullition, la pression de vapeur, et le log Koe) |
Pression de vapeur | ~18 mmHgNote de bas de page Annexe A Tableau 2[a] à 20 °C | Institute of Paper Science Technology Inc., 2009 |
| 6257-64-3 (données déduites à partir d'analogues pour le point de fusion, le point d'ébullition, la pression de vapeur, et le log Koe) |
Log Koe | 2,03 | Tonogai et al., 1982 |
| N° CAS | Propriété | Valeur | Référence |
|---|---|---|---|
| 64071-86-9 (données déduites à partir d'analogues pour le point de fusion et la solubilité) |
Solubilité dans l'eau | 10 000 mg/L | Santa Cruz Biotechnology Inc., 2013a |
| 64071-86-9 (données déduites à partir d'analogues pour le point de fusion et la solubilité) |
Solubilité dans l'eau | 60 000 mg/L | Green, 1990 |
| 64071-86-9 (données déduites à partir d'analogues pour le point de fusion et la solubilité) |
Solubilité dans l'éthanol | 3 000 mg/L | Green, 1990 |
| 64071-86-9 (données déduites à partir d'analogues pour le point de fusion et la solubilité) |
Point de fusion | 150 °C | Green, 1990 |
| 64071-86-9 (données déduites à partir d'analogues pour le point de fusion et la solubilité) |
Point de fusion | 149-151 °C | Avocado Research Chemicals Ltd., 1998 |
| 61966-14-1 (données déduites à partir d'analogues pour le point de fusion et la solubilité) |
Solubilité dans l'eau | 20 000 mg/L | Green, 1990 |
| 61966-14-1 (données déduites à partir d'analogues pour le point de fusion et la solubilité) |
Solubilité dans l'éthanol | 5 000 mg/L | Green, 1990 |
| 61966-14-1 (données déduites à partir d'analogues pour le point de fusion et la solubilité) |
Point de fusion | 147 °C | Green, 1990 |
| N° CAS/nom dans le C.I. | Propriété | Valeur | Référence |
|---|---|---|---|
| Basic Orange 2 | Point de fusion | 118,00-118,50 °C | Budavari, 1996 |
| Basic Orange 2 | Point de fusion | 118,00-118,50 °C | Sabnis, 2008 |
| Basic Orange 2 | Point de fusion | 235 °C | Green, 1990 |
| Basic Orange 2 | Point d'ébullition | 2 262 °C | Lide, 1995-1996 |
| Basic Orange 2 | Point d'ébullition | 2 262 °C | Sabnis, 2008 |
| Basic Orange 2 | Solubilité dans l'eau | 20 000 mg/L | Green, 1990 |
| Basic Orange 2 | Solubilité dans l'eau | 5,5 % à 15 °C | Budavari, 1996 |
| Basic Orange 2 | Solubilité dans l'éthanol absolu | 47 500 mg/L | Budavari, 1996 |
| Basic Orange 2 | Solubilité dans l'éthanol | 9 000 mg/L | Green, 1990 |
| Pentylènetétrazole | Point de fusion | 244-245 °C | NCI, 1978 |
| 136-40-3 | Point de fusion | 235 °C | CIRC, 1975b |
| 136-40-3 | Solubilité dans l'eau | 100-1000 mg/L à 20 °C | NTP, 1992b |
| 136-40-3 | Solubilité dans l'eau | 15,9 g/L à 25 °C | ChemIDplus, 1993- |
| 136-40-3 | Solubilité dans l'eau froide | 3 mg/L | Budavari, 1996 |
| 136-40-3 | Solubilité dans l'eau bouillante | 50 mg/L | Budavari, 1996 |
| 136-40-3 | Log Koe | -0,30 | ChemIDplus, 1993- |
| 136-40-3 | Pression de vapeur | 3,51 × 10−11 mmHgNote de bas de page Annexe A Tableau 4[a] à 25 °C | ChemIDplus, 1993- |
| 136-40-3 | Pression de vapeur | 4,57 × 10−12 mmHg[a] à 25 °C | New Jersey Department of Health and Senior Services, 2001 |
| N° CAS | Propriété | Valeur | Référence |
|---|---|---|---|
| 2869-83-2 | Solubilité dans l'eau | 30 000 mg/L | Green, 1990 |
| 2869-83-2 | Solubilité dans l'éthanol | 5 000 mg/L | Green, 1990 |
| 2869-83-2 | Point de fusion | 240 °C | Alfa Aesar, 2007 |
| 2869-83-2 | Point de fusion | supérieur(e) à 200 °C | Sabnis, 2010 |
| N° CAS/nom dans le C.I. | Propriété | Valeur | Référence |
|---|---|---|---|
| 71032-95-6 NDTHPM |
Solubilité dans l'alcool et l'acétone | Soluble | Présentation de projet 2006 |
| 118658-98-3 Basic Red 111 (données déduites à partir d'analogues pour la solubilité et la biodégradation pour le log Koe) |
Solubilité dans le n-octanol | 160 000 mg/L | Présentation de projet 2009e |
| 118658-98-3 Basic Red 111 (données déduites à partir d'analogues pour la solubilité et la biodégradation pour le log Koe) |
Solubilité dans l'eau | supérieur(e) à 340 000 mg/L | Présentation de projet 2009e |
| 118658-98-3 Basic Red 111 (données déduites à partir d'analogues pour la solubilité et la biodégradation pour le log Koe) |
Log Koe | inférieur(e) à −0,33 | Présentation de projet 2009e |
| N° CAS/nom dans le C.I. | Propriété | Valeur | Référence |
|---|---|---|---|
| 12270-13-2 Basic Blue 41 (données déduites à partir d'analogues pour le point de décomposition, le point de fusion et la biodégradation) |
Point de décomposition | supérieur(e) à 250 °C | M. Dohmen USA Inc., 2009 |
| 12270-13-2 Basic Blue 41 (données déduites à partir d'analogues pour le point de décomposition, le point de fusion et la biodégradation) |
Point de fusion | supérieur(e) à 120 °C | M. Dohmen USA Inc., 2009 |
| 15000-59-6 Basic Blue 54 (données déduites à partir d'analogues pour la solubilité) |
Solubilité dans l'eau | 140 mg/L | Baughman et al., 1996 |
| N° CAS/nom dans le C.I. | Propriété | Valeur | Référence |
|---|---|---|---|
| Basic Brown 1 | Log Koe | 2 | Tonogai et al., 1982 |
| Basic Brown 1 | Solubilité dans l'eau | 1 000-10 000 mg/L à 20 °C | NTP, 1992b |
| Basic Brown 1 | Solubilité dans l'eau | 50 000 mg/L | Green, 1990 |
| Basic Brown 1 | Solubilité dans l'eau | 10 000 mg/L | Santa Cruz Biotechnology Inc., 2013b |
| Basic Brown 1 | Solubilité dans l'éthanol | 5 000 mg/L | Green, 1990 |
| Basic Brown 1 | pKa | 5 | Sabnis, 2010 |
| Basic Brown 1 | Point de fusion | supérieur(e) à 200 °C | Sabnis, 2010 |
| Basic Brown 1 | Point de fusion | 220 °C | NTP, 1992b |
| Basic Brown 1 | Point de fusion | 220 °C (décomposition) | Columbus Chemical Industries, Inc., 2012 |
| Basic Brown 1 | Point de fusion | supérieur(e) à 280 °C | MP Biomedicals. 2006 |
| Basic Brown 1 | Pression de vapeur | inférieur(e) ou égal(e) à 0,0001 kPa à 25 °C | Mallinckrodt Baker Inc., 2010 |
| 63681-54-9 | Point de décomposition | supérieur(e) à 350 °C | BASF Canada, 2004 |
| 63681-54-9 | Solubilité dans l'eau | inférieur(e) à 1 000 mg/L à 20 °C | BASF Canada, 2004 |
| Processus du devenir (milieu) |
Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Oxydation atmosphérique (air) |
AOPWIN, 2010Note de bas de page Annexe A Tableau 9[b] | t½ = 0,025–1,081 jour (valeur aberrante pour le pentylènetétrazole, t½ = 4,273 jours) | inférieur(e) à 2 |
| Réaction avec l'ozone (air) |
AOPWIN, 2010[b] | s.o.Note de bas de page Annexe A Tableau 9[c] (sauf le n° CAS 75199-20-1, t½ = 0,02 jour) | s. o. |
| Hydrolyse (eau) |
HYDROWIN, 2010[b] | Non inclus dans la base de calibration (sauf le n° CAS 75199-20-1; voir la section sur la persistance) | s. o. |
| Biodégradation primaire : Biodégradation (aérobie) (eau) |
BIOWIN, 2010[b] Sous-modèle 4 : Enquête d'expert (résultats qualitatifs) |
1,94-3,35Note de bas de page Annexe A Tableau 9[d] (se biodégrade lentement; limite n = 9) |
supérieur(e) ou égal(e) à 182 |
| Biodégradation ultime : Biodégradation (aérobie) (eau) |
BIOWIN, 2010[b] Sous-modèle 3 : Enquête d'expert (résultats qualitatifs) |
0,08-2,24[d] (se biodégrade très lentement; limite n = 4) |
supérieur(e) ou égal(e) à 182 |
| Biodégradation ultime : Biodégradation (aérobie) (eau) |
BIOWIN, 2010[b] Sous-modèle 5 : Probabilité linéaire MITI |
-0,99 à -0,17Note de bas de page Annexe A Tableau 9[e] (biodégradation très lente) |
supérieur(e) ou égal(e) à 182 |
| Biodégradation ultime : Biodégradation (aérobie) (eau) |
BIOWIN, 2010[b] Sous-modèle 6 : Probabilité non linéaire MITI |
0[e] (biodégradation très lente) |
supérieur(e) ou égal(e) à 182 |
| Biodégradation ultime : Biodégradation (aérobie) (eau) |
DS TOPKAT ©2005-2009 Probabilité |
s. o. | ? |
| Biodégradation ultime : Biodégradation (aérobie) (eau) |
CATALOGIC, 2012 Pourcentage de la DBO |
% DBO = 0,29-19,78Note de bas de page Annexe A Tableau 9[f] (se biodégrade lentement) |
supérieur(e) ou égal(e) à 182 |
Annexe B : Estimations de l'exposition liée à l'utilisation des produits
Les expositions liées à l'utilisation de produits ont été estimées pour différents groupes d'âge en fonction des poids corporels tirés du rapport sur les facteurs d'exposition de Santé Canada pour évaluer l'absorption quotidienne de substances d'intérêt prioritaire par la population générale du Canada (Santé Canada, 1998) :
- Nourrisson (de 0 à 6 mois) : 7,5 kg
- Tout-petit (de 0,5 à 4 ans) : 15,5 kg
- Enfant (de 5 à 11 ans) : 21 kg
- Adolescent (de 12 à 19 ans) : 59,4 kg
- Adulte (de 20 à 59 ans) : 70,9 kg
- Personne âgée (60 ans et plus) : 72 kg
| Scénario pour le produit cosmétique | Concentration (%) | Exposition quotidienne (mg/kg p.c. par jour) | Exposition par événement (mg/kg p.c.) |
|---|---|---|---|
| Colorant capillaire (semi-permanent) | 0,3-1 | 0,02-0,07 | 0,15-0,49 |
| Colorant capillaire permanent | 0,3-1 | 0,009-0,031 | 0,42-1,4 |
| Scénario pour le produit | HypothèsesNote de bas de page Annexe B Tableau 1[a] |
|---|---|
| Colorant capillaire - sans vaporisateur/lavable; permanent | Fréquence d'exposition : 0,02/jour, soit 7,99/an (Statistique Canada, 2012) Quantité de produit : 100 g/application Facteur de rétention global : 0,10 (SCCS, 2011) |
| Colorant capillaire - sans vaporisateur/lavable; semi-permanent | Fréquence d'exposition : 0,14 (1/semaine) (SCCS, 2011) Quantité de produit : 35 g/application (SCCS, 2011) Facteur de rétention global : 0,1 (jugement professionnel) |
Estimations de l'exposition orale et cutanée accidentelle au Basic Orange 2 provenant de l'encre de stylos à bille
Ce scénario couvre l'exposition dermique et orale accidentelle en raison du contact main-bouche par un nourrisson. Le Art and Creative Materials Institute, de la Duke University, à Durham, en Caroline du Nord, a fait état de l'hypothèse selon laquelle un enfant absorbe une ligne d'encre de 25 cm quotidiennement, par exposition dermique ou orale accidentelle (renseignements obtenus en 2009 de la part du Creative Materials Institute au Bureau de l'évaluation des risques des substances existantes de Santé Canada; source non citée). Un taux de couverture par défaut de l'encre de 100 µg/cm (90e percentile de couverture d'encre du matériel pour écrire; renseignements obtenus en 2009 de la part du Creative Materials Institute au Bureau de l'évaluation des risques des substances existantes de Santé Canada; source non citée) a été utilisé. On a supposé une valeur d'absorption cutanée par défaut de 100 %. De façon générale, l'estimation de l'exposition devrait être prudente.
Exposition estimée par événement par voie cutanée
= [Trait d'encre quotidien × Taux de couverture de l'encre × Concentration × Absorption cutanée] / P.C.
Trait d'encre quotidien : 25 cm
Taux de couverture de l'encre : 100 µg/cm
Concentration (Conc) : 1,5 % p/p (Smoothline Writing Instruments, 2010)
Fraction absorbée par voie cutanée (Absorption cutanée) : 100 % (par défaut)
Poids corporel (BW) : 15,5 kg (tout-petits)
Exposition cutanée estimée par événement = 2,4 × 10−3mg/kg p.c.
Exposition orale estimée par événement = 2,4 × 10−3mg/kg p.c.
Annexe C : Renseignements supplémentaires sur la santé
| Sous-ensemble | Substance (nom dans le C.I. ou n° CAS) | Produit prévu du clivage des liaisons azoïques | Produit prévu du clivage des liaisons azoïques (n° CAS) |
|---|---|---|---|
| A | Pentylènetétrazole | Aniline | 62-53-3 |
| A | Pentylènetétrazole | 2,3,6-triaminopyridine | 4318-79-0 |
| A | Basic Orange 2 | Aniline | 62-53-3 |
| A | Basic Orange 2 | 1,2,4-triaminobenzène | 615-71-4 |
| A | 63681-54-9 | Aniline | 62-53-3 |
| A | 63681-54-9 | 1,2,4-triaminobenzène | 615-71-4 |
| A | 63681-54-9 | Solvent Orange 3 | 495-54-5 |
| A | 75660-25-2 | Aniline | 62-53-3 |
| A | 75660-25-2 | 1,2,4-triaminobenzène | 615-71-4 |
| A | Basic Brown 1 | m-Phénylènediamine | 108-45-2 |
| A | Basic Brown 1 | 1,2,4-triaminobenzène | 615-71-4 |
| B | 14408-20-9 | 2,6-dichloro-4-nitroaniline | 99-30-9 |
| B | 14408-20-9 | Substance inconnue 72 | -- |
| B | 36986-04-6 | 2-Chloro-4-nitroaniline | 121-87-9 |
| B | 36986-04-6 | Substance inconnue 72 | -- |
| B | 59709-10-3 | 2-Chloro-4-nitroaniline | 121-87-9 |
| B | 59709-10-3 | Substance inconnue 20 | -- |
| C | 68929-07-7 | 2-(4-amino-N-éthylanilino)éthanol | 92-65-9 |
| C | 69852-41-1 | 2-(4-amino-N-éthylanilino)éthanol | 92-65-9 |
| Produit individuel 1 | 93783-70-1 | N,N-Diméthyl-p-phénylènediamine | 99-98-9 |
| Produit individuel 1 | 93783-70-1 | Substance inconnue 18 | -- |
| Produit individuel 2 | 52769-39-8 | Substance inconnue 10 | -- |
| Produit individuel 2 | 52769-39-8 | Substance inconnue 3 | -- |
| Substance (nom dans le C.I. ou n° CAS) | Produit prévu du clivage des liaisons azoïques (n° CAS) | Données sur la génotoxicité et la cancérogénicité de l'amine aromatique |
|---|---|---|
| Pentylènetétrazole Basic Orange 2 63681-54-9 75660-25-2 |
aniline 62-53-3 |
Cancérogénicité : positive chez les rats mâles; négative chez les rats et les souris femelles Génotoxicité : In vivo, certains résultats positifs; in vitro, certains résultats positifs (Santé Canada, 2011) |
| Pentylènetétrazole | 2,3,6-triaminopyridine 4318-79-0 |
Cancérogénicité : aucune donnée Génotoxicité : |
| Basic Orange 2 63681-54-9 75660-25-2 Basic Brown 1 |
1,2,4-triaminobenzène 615-71-4 |
Cancérogénicité : aucune donnée Génotoxicité : Mutagène chez deux souches de Salmonella typhimurium qui détectent les mutagènes induisant des changements de phase (Garner et Nutman, 1977; Yoshikawa et al., 1979). |
| Basic Brown 1 | m-Phénylènediamine 108-45-2 | Cancérogénicité : Adénomes pituitaires et fibrosarcomes équivoques au site d'injection à la suite d'une injection sous-cutanée; aucune relation entre l'exposition par voie orale, cutanée ou sous-cutanée, et la cancérogénicité. Génotoxicité : In vivo-- résultats équivoques (certains positifs, certains négatifs); in vitro--mutagénicité (résultats positifs dans le test d'Ames); clastogénicité équivoque. |
| Substance (n° CAS) | Produit prévu du clivage des liaisons azoïques (n° CAS) | Données sur la génotoxicité et la cancérogénicité de l'amine aromatique |
|---|---|---|
| 14408-20-9 | 99-30-9 | Cancérogénicité : résultats négatifs pour de multiples essais de cancérogénicité chez des animaux de laboratoire et pour des essais de génotoxicité in vivo et in vitro (FAO/OMS, 1998) Génotoxicité : Résultats principalement négatifs pour les essais de la génotoxicité in vitro (FAO/OMS, 1998) |
| 36986-04-6 59709-10-3 | 121-87-9 | Génotoxicité : Résultats positifs pour la mutagénicité dans les bactéries et dans un essai des aberrations chromosomiques in vitro; résultats négatifs pour la mutagénicité dans des essais de cellules mammaliennes, de micronoyaux et de dommages et de réparation de l'ADN. (Shimizu et Takemura, 1984; Kawai et al., 1987; Yoshimi et al., 1988; Palus et al., 1995; JETOC, 1996; Matsushima et al., 1999) |
| 68929-07-7 69852-41-1 |
92-65-9 | Aucune donnée |
| 93783-70-1 | 99-98-9 | Cancérogénicité : Aucune indication du potentiel carcinogène (BG Chemie, 1998). Génotoxicité : Résultats positifs pour la mutagénicité dans des bactéries et in vitro pour les aberrations chromosomiques; réaction faiblement positive dans la synthèse d'ADN non programmée; résultats négatifs pour la mutagénicité dans des bactéries et in vitro pour les aberrations chromosomiques (Chung et al. 1978; Ashby et al., 1983; Kawalek et al., 1983; Kornbrust et Barfknecht,1984; Freeman et al., 1987; Sofuni et al., 1990; Zeiger et al., 1992; Galloway et al., 1997; Ben Mansour et al., 2009 |
| Substance (n° CAS) | Produit prévu du clivage des liaisons azoïques | Produit prévu du clivage des liaisons azoïques (n° CAS) |
|---|---|---|
| 2869-83-2 | N,N-Diméthyl-p-phénylènediamine | 99-98-9 |
| 4608-12-2 | Chlorure de 3-(diméthylamino)-7-[[4-(diméthylamino)phényl]azo]-5-phénylphénazinium | 2390-56-9 |
| 4608-12-2 | N,N-Diméthyl-p-phénylènediamine | 99-98-9 |
| 4618-88-6 | Chlorure de 3-amino-7-{[4-(diméthylamino)phényl]azo}-5-phénylphénazinium | 81-93-6 |
| 4618-88-6 | N,N-Diméthyl-p-phénylènediamine | 99-98-9 |
| 10189-42-1 | Chlorure de 1-[2-[[4-[[2,6-dichloro-4-[(diméthylamino)sulfonyl]phényl]azo] phényl]éthylamino]éthyl]pyridinium |
14408-19-6 |
| 10189-42-1 | 4-amino-3,5-dichloro-N,N-diméthyl-benzènesulfonamide | 17418-80-3 |
| 14970-39-9 | N,N-Diéthyl-1,4-benzènediamine | 93-05-0 |
| 23408-72-2 | N,N-Diméthyl-p-phénylènediamine | 99-98-9 |
| 23408-72-2 | Substance inconnue 76 | s. o. |
| 29508-48-3 | Substance inconnue 67 | s. o. |
| 29508-48-3 | Substance inconnue 68 | s. o. |
| 63589-49-1 | N,N-Diéthyl-1,4-benzènediamine | 93-05-0 |
| 65150-98-3 | N,N-Diéthyl-1,4-benzènediamine | 93-05-0 |
| 68936-17-4 | N,N-Diméthyl-p-phénylènediamine | 99-98-9 |
| 72361-40-1 | 2-Bromo-4,6-dinitroaniline | 1817-73-8 |
| 72361-40-1 | Substance inconnue 26 | s. o. |
| 72379-36-3 | Substance inconnue 130 | s. o. |
| 72379-36-3 | Substance inconnue 27 | s. o. |
| 72379-37-4 | Substance inconnue 130 | s. o. |
| 72379-37-4 | Substance inconnue 131 | s. o. |
| 74744-63-1 | Substance inconnue 170 | s. o. |
| 74744-63-1 | Substance inconnue 171 | s. o. |
| 75199-20-1 | p-phénylènediamine | 106-50-3 |
| 75199-20-1 | 4-Aminoazobenzène | 60-09-3 |
| 75199-20-1 | Aniline | 62-53-3 |
| 75199-20-1 | Substance inconnue 118 | s. o. |
| 79234-33-6 | 1,2,4-triaminobenzène | 615-71-4 |
| 79234-33-6 | Aniline | 62-53-3 |
| 83969-13-5 | N,N-Diméthyl-p-phénylènediamine | 99-98-9 |
| 83969-13-5 | Substance inconnue 148 | s. o. |
| 85114-37-0 | Substance inconnue 10 | s. o. |
| 85114-37-0 | Substance inconnue 173 | s. o. |
| 85480-88-2 | Substance inconnue 176 | s. o. |
| 85480-88-2 | Substance inconnue 177 | s. o. |
| 125329-01-3 | p-phénylènediamine | 106-50-3 |
| 125329-01-3 | 4-Aminoazobenzène | 60-09-3 |
| 125329-01-3 | Aniline | 62-53-3 |
Annexe D : Colorants basiques azoïques ayant des effets préoccupants
Certains des colorants basiques azoïques figurant dans la présente évaluation ont des effets préoccupants d'après la cancérogénicité potentielle. Les détails à l'appui de la cancérogénicité potentielle de ces substances sont décrits à la section 7.2 « Évaluation des effets sur la santé » (voir les paragraphes pertinents), et sont généralement basés sur un ou plusieurs des éléments de preuve suivants :
- Classifications établies par des organismes nationaux ou internationaux quant à la cancérogénicité (il peut s'agir d'une classification de groupe).
- Preuve de cancérogénicité selon les études sur les animaux ou l'épidémiologie humaine pour une substance donnée.
- Potentiel de libération d'une ou plusieurs amines aromatiques figurant sur EU22 par clivage de la liaison azoïque.
- Données déduites à partir d'analogues des substances connexes pour lesquelles un ou plusieurs des éléments de preuve ci-dessus s'appliquent.
| Nom ou acronyme de la substance et n° CAS | Classification de la cancérogénicitéNote de bas de page Annexe D Tableau 1[b] | Preuve de cancérogénicité selon les études sur les animaux ou l'épidémiologie humaine | Libération d'amines aromatiques figurant sur EU22 par clivage de la liaison azoïque | Données déduites à partir d'analogues |
|---|---|---|---|---|
| Pentylènetétrazole 136-40-3 |
Groupe 2B selon le CIRC Substance dont on peut raisonnablement présumer qu'elle est cancérogène pour l'humain selon le NTP |
X (NCI, 1978) |
- | - |
| Basic Orange 2 532-82-1 et sels connexes : 63681-54-9 (acide dodécylbenzènesulfonique) 75660-25-2 (monoacétate de 4-(phénylazo)benzène-1,3-diamine) 79234-33-6 (acétate) |
- | X (Albert, 1956; CIRC, 1975, 1987b) |
- | Données déduites à partir d'analogues du pentylènetétrazole (consulter la section 7.2.2) |
| Chlorure de 1',2'-dihydro-6'-hydroxy-3,4'-diméthyl-2'-oxo-5'-[[4-(phénylazo)phényl]azo]-1,3'-bipyridinium 75199-20-1 Note de bas de page Annexe D Tableau 1[a] |
- | - | p-Aminoazobenzène | - |
| Acide lactique, composé (1:1) avec l'acide 7-[(4,6-bis{[3-(diéthylamino)propyl]amino}-1,3,5-triazin-2-yl)amino]-4-hydroxy-3-[p-(phénylazo)phénylazo]naphtalène-2-sulfonique 125329-01-3[a] |
- | - | p-Aminoazobenzène | - |