Évaluation préalable benzophénone
Titre officiel : Évaluation préalable - Benzophénone
Numéro de registre du Chemical Abstracts Service : 119-61-9
Environnement et Changement climatique Canada
Santé Canada
Janvier 2021
No de cat. : En14-429/2021F-PDF
ISBN 978-0-660-36337-0
Résumé
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], les ministres de l’Environnement et de la Santé ont procédé à l’évaluation préalable de la benzophénone. L’évaluation de cette substance a été jugée prioritaire, car elle satisfait aux critères de catégorisation formulés au paragraphe 73(1) de la LCPE. Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1) de cette substance est le 119-61-9.
La benzophénone existe naturellement dans l’environnement et est aussi produite artificiellement. Au Canada, on l’utilise dans un éventail varié d’utilisations, notamment dans les cosmétiques, les peintures, les enduits, les teintures, les adhésifs, les produits d’étanchéité, les produits antiparasitaires, les encres liquides ou en poudre et les colorants. Elle peut également être utilisée dans les encres employées dans certains emballages alimentaires, et comme aromatisant alimentaire. D’après les renseignements déclarés en réponse à une enquête menée en vertu de l’article 71 de la LCPE, moins de 1000 kg de benzophénone ont été déclarés comme étant fabriqués au Canada en 2008, et de 35 000 kg à 135 000 kg ont été déclarés comme étant importés au Canada cette même année.
Les risques occasionnés par la benzophénone à l’environnement ont été caractérisés au moyen de la Classification des risques écologiques posés par les substances organiques (CRE), une approche axée sur le risque qui utilise de nombreuses mesures du danger et de l’exposition et qui se fonde sur la prise en compte pondérée de multiples sources de données déterminant la classification du risque. On détermine les profils de risques principalement en se basant sur les mesures liées au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne basés sur les réseaux trophiques, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, on retrouve le taux d’émission potentiel, la persistance globale et le potentiel de transport sur de grandes distances. Une matrice du risque est utilisée pour attribuer un niveau de préoccupation potentielle faible, modéré ou élevé pour ces substances en fonction de leurs profils de danger et d’exposition. D’après les résultats de l’analyse de la CRE, il serait peu probable que la benzophénone cause des effets nocifs pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, la benzophénone présente un faible risque d’effets nocifs sur l’environnement. Il a été conclu que la benzophénone ne satisfait pas aux critères énoncés aux alinéas 64a) et 64b) de la LCPE, car elle ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Au palier international, le Centre international de recherche sur le cancer (CIRCC) et l’Autorité européenne de sécurité des aliments (EFSA) ont étudié la benzophénone. Le CIRC a classé la benzophénone dans le groupe 2B (« possible cancérogène pour l’humain ») grâce à une quantité suffisante de données probantes obtenues chez les animaux de laboratoire sur la cancérogénicité de cette substance. L’exposition chronique à la benzophénone par voie orale a causé un cancer chez les rats et les souris. La benzophénone n’était pas génotoxique dans les essais biologiques in vitro et in vivo. Parmi les effets non cancéreux de la benzophénone, l’effet critique induit par l’administration orale dans les études de laboratoire était les effets sur les reins et les effets sur la mère.
La population générale du Canada pourrait être exposée à la benzophénone par la poussière et l’air intérieurs, des aliments et des biberons. Des produits disponibles pour les consommateurs, notamment les cosmétiques, les teintures, les peintures et les enduits sont d’autres sources d’exposition de la population générale au Canada.
Une comparaison entre les concentrations estimées d’exposition à la benzophénone associées au milieu environnemental et aux aliments, notamment l’exposition à la benzophénone présente dans des biberons, et celles causant un effet critique se traduit par des marges d’exposition qui sont jugées suffisantes pour tenir compte des incertitudes relatives aux effets sur la santé et aux données sur l’exposition. Cependant, une comparaison entre les concentrations estimées d’exposition à la benzophénone associées à l’utilisation de certains produits disponibles pour les consommateurs (p. ex., vernis à ongles, peinture extérieure et intérieure, et teintures) et les concentrations causant un effet critique dégage des marges d’exposition qui sont considérées comme insuffisantes pour tenir compte des incertitudes des ensembles de données sur les effets sur la santé et l’exposition.
À la lumière des renseignements contenus dans la présente évaluation préalable, il a été conclu que la benzophénone satisfait au critère énoncé à l’alinéa 64c) de la LCPE, car elle pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il a donc été conclu que la benzophénone satisfait à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il a également été déterminé que la benzophénone répond au critère de persistance, mais pas à celui de bioaccumulation, lesquels sont énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE, Canada 1999], les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de la benzophénone pour déterminer si cette substance présente ou pourrait présenter un risque pour l’environnement ou la santé humaine. On a considéré que l’évaluation de la benzophénone était prioritaire puisqu’elle satisfait aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE (Environnement Canada et Santé Canada [modifié en 2017]).
Les risques occasionnés par la benzophénone à l’environnement ont été caractérisés au moyen de l’approche de Classification des risques écologiques (CRE) posés par les substances organiques (ECCC 2016a). La CRE caractérise les risques posés par une substance en utilisant des paramètres clés parmi lesquels le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique. Elle tient compte de l’exposition possible des organismes dans des environnements terrestres ou aquatiques, basée sur des facteurs incluant les taux d’émission potentiels, la persistance globale et le potentiel de transport atmosphérique sur de grandes distances. Les divers éléments de preuve sont groupés pour repérer les substances qui nécessitent une évaluation approfondie en raison de leurs risques pour l’environnement ou celles dont la probabilité de nuire à l’environnement est faible.
La benzophénone a été examinée au palier international par le Centre international de recherche sur le cancer (IARC) et une monographie de l’IARC est disponible. Ces évaluations subissent un examen rigoureux et un processus d’approbation scrupuleux, et Santé Canada et Environnement et Changement climatique Canada les considèrent comme étant fiables. Le groupe scientifique de l’Autorité européenne de sécurité des aliments (EFSA 2009, 2017) a fait l’évaluation toxicologique de la benzophénone. Dans la présente ébauche d’évaluation préalable, nous avons utilisé la monographie de l’lARC et l’examen de l’EFSA pour éclairer la caractérisation des effets sur la santé.
Pour la présente évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, y compris d’autres renseignements présentés par des parties intéressées. Les données pertinentes ont été relevées jusqu’en mars 2019. Les données empiriques obtenues d’études clés et certains résultats provenant de modèles ont servi à formuler les conclusions. Quand ils étaient disponibles et pertinents, nous avons tenu compte de renseignements présentés dans des évaluations faites par d’autres instances.
La benzophénone a été décelée dans des produits de vapotage (aussi appelés cigarettes électroniques), lesquels peuvent représenter une autre source d’exposition à la benzophénone. L’évaluation des risques pour la population générale découlant de cette utilisation, dont les risques relatifs à cette utilisation associés aux cigarettes ordinaires, et les solutions possibles visant à atténuer les risques liés à ces produits, serait abordée au moyen d’un cadre législatif et réglementaire distinct.
Le personnel du programme d’évaluation des risques de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] de Santé Canada et d’Environnement et Changement climatique Canada a rédigé cette évaluation préalable qui comprend la contribution d’autres programmes de ces deux ministères. La partie de cette évaluation portant sur l’environnement repose sur le document de la CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe par des pairs et d’une consultation publique de 60 jours. Les parties de la présente évaluation portant sur la santé humaine ont fait l’objet d’une évaluation par les pairs et de consultation externes. Nous avons reçu des commentaires de Theresa Lopez, Jennifer Flippin et Joan Garey (TetraTech Inc.) sur les portions techniques pertinentes pour la santé humaine. En outre, l’ébauche de la présente évaluation préalable (publiée le 4 août 2018) a été soumise à une consultation publique de 60 jours. Si les commentaires externes ont été pris en considération, Santé Canada et Environnement et Changement climatique Canada assument toutefois la responsabilité du contenu final et des résultats de l’évaluation préalable.
La présente évaluation préalable repose sur des renseignements permettant de déterminer si la substance satisfait aux critères énoncés à l’article 64 de la LCPE. Pour ce faire, les renseignements scientifiques ont été examinés et intégrés à une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 2. Nous présentons dans la présente évaluation préalable les renseignements critiques et les considérations à partir desquels notre conclusion a été tirée.
2. Identité de la substance
La présente évaluation préalable s’intéresse à la benzophénone. Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 3), le nom dans la Liste intérieure des substances (LIS) et les noms communs et abréviation de la benzophénone figurent au tableau 2‑1. Cette évaluation ne s’intéresse pas aux dérivés connus ou nouveaux de la benzophénone, habituellement connus sous les noms de benzophénone‑1 à benzophénone‑12, ni aux autres dérivés moins connus de la benzophénone.
| Nº CAS | Nom dans la LIS(abréviation, noms communs, autres noms) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|
| 119-61-9 | Benzophénone, PB; benzoylbenzène; diphénylcétone; phénylcétone; diphénylméthanone; methanone, diphényl-; benzène, benzoyl-) | 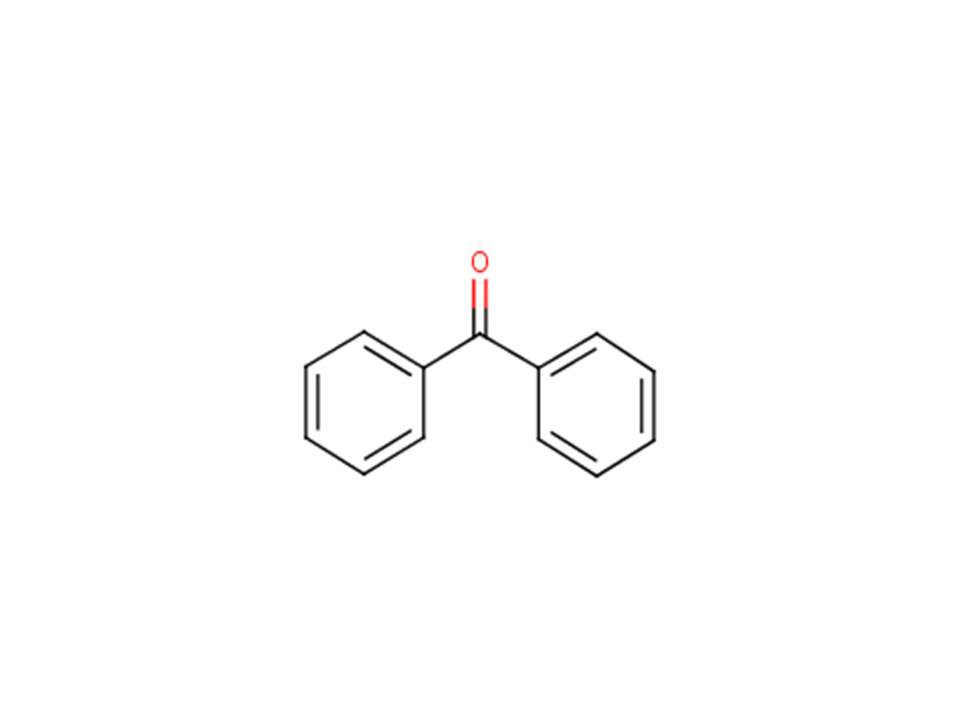 C13H10O C13H10O |
182,22 |
3. Propriétés physiques et chimiques
La benzophénone est une cétone aromatique. Elle est modérément soluble dans l’eau et librement soluble dans les solvants organiques. C’est un composé organique semi‑volatil (EFSA 2009). Le tableau 3-1 en résume les propriétés physiques et chimiques. On trouvera d’autres propriétés physiques et chimiques dans ECCC (2016b).
| Propriété | Valeur | Références importantes |
|---|---|---|
| État physique | Cristaux blancs émettant une odeur florale | IPCS 2010 |
| Point d’ébullition (°C) | 304,5 | IARC 2013 |
| Point de fusion (°C) | 48,5 | IARC 2013, ECHA 2014 |
| Pression de vapeur (Pa) | 0,257 | EFSA 2009, ECHA 2014 |
| Hydrosolubilité (mg/L) | 137 | EFSA 2009 |
| log Koe (sans dimension) | 3,18 | LOGKOW 2010, cité par IARC 2013 |
4. Sources et utilisations
Dans l’environnement, la benzophénone est produite naturellement par un petit nombre de fruits et plantes. Elle est aussi synthétisée artificiellement (IARC 2013).
Une enquête menée en vertu de l’article 71 de la LCPE (Canada 2009) a permis d’obtenir des informations sur la benzophénone, notamment. On a déclaré qu’en 2008, moins de 1000 kg de benzophénone avait été synthétisée au Canada et entre 35 000 et 135 000 kg y avait été importéeNote de bas de page 4. Les utilisations non confidentielles de la benzophénone divulguées lors de l’enquête comprennent sa fonction comme additif dans les peintures et enduits, adhésifs et produits d’étanchéité, ingrédient dans les parfums, substance photosensible des encres liquides, encres en poudre et colorants, substance de laboratoire utilisée dans des dispositifs médicaux et photoamorceur industriel (Environnement Canada 2009).
Selon les avis communiqués à Santé Canada en vertu du Règlement sur les cosmétiques, la benzophénone est utilisée dans certains produits cosmétiques au Canada, tel que les vernis à ongles, les parfums, les nettoyants pour le corps, le maquillage et les produits pour les cheveux aux concentrations entre 0,01 à 5 % (communication personnelle, courriels de la Direction de la sécurité des produits disponibles pour les consommateurs et des produits dangereux de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada; envoyés de septembre 2016 à mars 2019, sans référence). Elle ne figure pas dans la Liste des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques (Santé Canada 2015).
Au Canada, la benzophénone est également utilisée comme composant de certaines encres utilisées sur un petit nombre de matériaux d’emballage alimentaire qui n’entrent pas en contact avec les aliments. On utilise aussi la benzophénone comme aromatisant pour les aliments. Le Food Chemicals Codex des États-Unis (FCC‑USP 2016) indique que la benzophénone sert d’agent aromatisant. Elle est aussi mentionnée dans le Fenaroli’s Handbook of Flavor Ingredients (Burdock 2010). L’Union européenne permet l’utilisation de la benzophénone comme aromatisant dans les aliments (base de données des arômes dans les aliments de l’Union européenne, 2019) et le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) a conclu qu’il n’était pas préoccupant pour la santé d’ingérer actuellement de la benzophénone lorsqu’elle est utilisée comme aromatisant (OMS 2001). L’utilisation de la substance a déjà été permise comme aromatisant aux États‑Unis (comme le mentionne le titre 21 CFR 172.515 du Code des règlements fédéraux), mais, en 2018, la Food and Drug Administration des États‑Unis (USFDA) a accepté une demande d’interdire certains aromatisants alimentaires synthétiques, dont la benzophénone, en modifiant le règlement sur les additifs alimentaires qui n’autorise plus l’utilisation de ces substances comme aromatisants synthétiques à usage alimentaire. Même si l’analyse scientifique de la FDA a établi que la benzophénone ne pose pas de risque pour la santé publique dans les conditions d’utilisation prévues, la substance est retirée du règlement sur les additifs alimentaires en vertu de la disposition Delaney, laquelle exige que la FDA ne puisse approuver l’utilisation de tout additif alimentaire s’étant révélé induire le cancer chez les humains ou les animaux, quelle que soit la dose (USFDA 2016, 2017, 2018). Aucune information définitive n’est disponible relativement à l’utilisation potentielle de la benzophénone comme aromatisant au Canada (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, décembre 2016, sans référence). La benzophénone figure dans la Base de données sur les ingrédients des produits de santé naturels, avec un rôle non médicinal pour utilisation orale comme exhausteur de goût seulement accompagné d’une dose journalière admissible de 0,03 mg/kg p.c./jour en accord avec EFSA (2009, 2017). Bien que la Base de données des produits de santé naturels homologués mentionne qu’un nombre réduit de produits de santé naturels contiennent de la benzophénone (BDPSNH 2016, BDIPSN 2016, communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada; septembre 2017; sans référence), les communications avec les titulaires de permis nous indiquent que ces produits contiennent plutôt un dérivé de la benzophénone (c.‑à‑d. la benzophénone‑1, la benzophénone‑2 ou la benzophénone‑3). On utilise aussi la benzophénone comme formulant dans les produits antiparasitaires au Canada (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, septembre 2016, sans référence).
Les fiches signalétiques (FS) publiées indiquent que la benzophénone pourrait être aussi présente dans les peintures pour l’extérieur et pour l’intérieur, les teintures pour patio, les bouche-fentes pour patio et les produits de nettoyage de voitures vendus à la population générale du Canada (p. ex., FS 2014a, FS 2014b, FS 2015, FS 2016).
Au plan international, outre les utilisations susmentionnées, on utilise la benzophénone dans la synthèse des dérivés de la benzophénone. On ajoute de la benzophénone à des emballages de plastiques ou à leur contenu pour empêcher la photodégradation du plastique d’emballage ou de son contenu (NTP 2006 et HSDB 2010, cités par IARC 2013). On a prouvé que la benzophénone pouvait être présente ou pouvait migrer des pellicules de polyéthylène de faible densité servant à l’emballage des aliments (Maia et coll. 2016, Paseiro-Cerrato et coll. 2016), des jouets sexuels en plastique (Nilsson et coll. 2006) et des biberons (Mertens et coll. 2016, Onghena et coll. 2016, Simoneau et coll. 2012). Lehner et coll. (2011) en ont détecté dans l’encre noire de tatouage et Hutzler et coll. (2014) en ont retrouvé dans les liquides pour cigarettes électroniques. On a également déterminé qu’elle était utilisée dans des produits d’assainissement de l’air, des produits nettoyants, des produits chimiques industriels et pour l’automobile, des produits de polissage et des produits d’entretien pour les planchers (DCIP 2019).
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
D’après les modèles utilisés dans la CRE (ECCC2016b), la benzophénone devrait persister dans l’air, mais pas dans l’eau, les sédiments ou le sol.
5.2 Potentiel de bioaccumulation
La benzophénone ne devrait pas se bioaccumuler fortement dans les organismes, étant donné son Koe peu élevé et ses faibles facteurs de bioconcentration (ECCC 2016b).
6. Risque d’effets nocifs sur l’environnement
6.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement posés par la benzophénone ont été caractérisés au moyen de la Classification des risques écologiques (CRE) posés par les substances organiques (ECCC 2016a). La CRE est une méthodologie fondée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et pondère plusieurs éléments de preuve pour attribuer un classement au risque. Elle combine les divers éléments de preuve pour discerner les substances plus ou moins dangereuses et leur potentiel d’exposition plus ou moins important dans divers milieux. Elle réduit l’incertitude globale de la caractérisation des risques relativement à une approche qui reposerait sur un seul paramètre dans un seul milieu (p. ex. la concentration létale médiane [CL50]). La méthodologie, qui est décrite en détail par ECCC (2016a), est résumée plus bas.
Nous avons colligé les données sur les propriétés physicochimiques, le devenir (demi‑vie chimique dans divers milieux et biotes, coefficient de partition et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons, et les quantités de ces produits importés ou fabriqués au Canada à partir des publications scientifiques, des bases de données empiriques disponibles (p. ex. la boîte à outils RQSA de l’OCDE 2014) et des réponses à une enquête menée conformément à l’article 71 de la LCPE. Nous avons produit d’autres données à l’aide des relations quantitatives structure-activité (RQSA) ou des modèles du devenir du bilan massique ou de la bioaccumulation. Ces informations ont servi de données d’entrée à d’autres modèles de bilan massique ou pour compléter les profils de risque et d’exposition à cette substance.
Les profils de danger reposent surtout sur des paramètres liés au mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique. Les profils d’exposition proviennent de plusieurs paramètres dont le taux potentiel d’émission, la persistance globale et le potentiel de transport sur de grandes distances. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de catégoriser les potentiels de risque et d’exposition de chaque substance comme faibles, moyens ou élevés. D’autres règles ont été appliquées (p. ex. la constance de la classification ou la marge d’exposition) pour raffiner les classifications préliminaires du danger et de l’exposition.
Une matrice de classification du risque a été utilisée pour classer chaque substance selon le risque faible, modéré ou élevé de préoccupation qu’elle suscite à la lumière de ses classes de danger et d’exposition. Nous avons vérifié les classifications de la CRE sur le niveau de risque potentiel en suivant une démarche en deux étapes. La première consistait à ajuster la classification du risque posé par les substances de modérée ou élevée à bas pour celles qui présentaient un faible taux estimé de rejet dans l’eau après le traitement des eaux usées, ce qui constitue un faible potentiel d’exposition. La seconde consistait à revoir les résultats de classement faible ou moyen à la lumière de scénarios de risque relativement prudents à l’échelle locale (c.-à-d. dans la zone rayonnant à partir du point de rejet), conçus pour protéger l’environnement, pour déterminer si le classement du risque devrait être reclassé à un niveau supérieur.
La CRE utilise une approche pondérée visant à réduire au minimum toute surestimation ou sous-estimation de la classe de danger, d’exposition et du risque subséquent. ECCC (2016a) présente en détail les méthodes équilibrées de traitement des incertitudes. Nous décrivons ci-après deux des zones d’incertitude les plus importantes. Les erreurs affectant la valeur empirique ou modélisée de la toxicité aiguë peuvent modifier le classement du danger, en particulier, les paramètres dépendant des valeurs de résidus dans les tissus (le mode d’action toxique), dont plusieurs sont des valeurs prédites par les modèles QSAR. L’incidence d’une telle erreur sera cependant atténuée, puisque toute surestimation de la létalité médiane se traduira par une valeur prudente (protectrice) pour les résidus dans les tissus utilisés pour l’analyse des résidus corporels critiques. L’erreur de sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de risque tels que le profil structurel du mode d’action, la réactivité ou l’affinité pour les récepteurs d’œstrogène. Des changements ou des erreurs dans les quantités chimiques pourraient produire des écarts pour le classement de l’exposition puisque les classements de l’exposition et du risque sont très sensibles aux taux d’émission et aux quantités utilisées. Les résultats de la CRE reflètent donc l’exposition et le risque au Canada établis d’après les quantités estimatives actuellement utilisées et pourraient donc ne pas refléter des tendances futures.
Le document d’ECCC (2016b) présente les données essentielles et les éléments pris en compte pour produire les profils et les classements de la benzophénone sur les plans de l’exposition, du danger et du risque.
Étant donné les classements de faible danger et de faible exposition découlant de l’information prise en compte dans la CRE, nous catégorisons la benzophénone comme présentant un faible potentiel de risque pour l’environnement. Ainsi, il est peu probable que cette substance entraîne des préoccupations pour l’environnement au Canada.
7. Potentiel d’être nocif pour la santé humaine
7.1 Évaluation de l’exposition
7.1.1 Milieux naturels et aliments
Milieux naturels
Nous avons trouvé peu de données sur la surveillance environnementale au Canada. La benzophénone a été considérée lors d’une étude du Conseil national de recherches du Canada (Won et Lusztyk 2011) sur la qualité de l’air intérieur et des émissions des matériaux de construction et l’ameublement dans les maisons canadiennes. Lors de leur étude sur le terrain, Won et Lusztyk (2011) ont détecté dans la poussière de 49 de 50 maisons de Québec, de la benzophénone en des concentrations entre 0,50 et 225,85 µg/g, avec une moyenne (arithmétique) de 10,4 µg/g. Or, l’étude ne visait pas la benzophénone dans l’air, Won et Lusztyk (2011) n’ont pas analysé les échantillons d’air intérieur collectés dans ces maisons. Cependant, puisqu’elle est un composé organique semi-volatil et étant donné le grand nombre de sources de benzophénone et sa présence dans la poussière, elle devrait se retrouver dans l’air intérieur. Le ministère de l’Environnement du Japon (2006, cité par l’IARC 2013) a mesuré la benzophénone dans le cadre d’une enquête de surveillance de l’air intérieur et trouvé des concentrations entre 0,96 et 98 ng/m3. (Voir la section sur les produits disponibles pour les consommateurs pour l’évaluation des expositions dans l’air.)
Nous n’avons pas relevé de données sur les concentrations de benzophénone dans l’eau potable au Canada. Toutefois, aux États-Unis, Loraine et Pettigrove (2006) ont mesuré la benzophénone et d’autres contaminants de déchets organiques dans l’eau brute et l’eau traitée (moyenne de 0,26 µg/L, dans l’eau traitée; n = 1/15, en 2001–2002). On en a aussi mesuré les concentrations dans l’eau potable dans d’autres pays, notamment le Japon, où Shinohara et coll. 1981 (cités par IARC 2013) ont trouvé des concentrations allant jusqu’à 8,8 µg/L. Pour finir, dans le cadre d’une étude en Corée du Sud, Jeon et coll. (2006) ont détecté de la benzophénone dans des échantillons de sol prélevés en avril et mai 2003 et mesuré des concentrations de 0,82 à 16,55 µg/kg (poids sec) avec une moyenne de 4,55 µg/kg (fréquence de détection de 97 %).
Aliments
Nous n’avons pas trouvé de données canadiennes sur les concentrations potentielles de benzophénone dans les aliments, mais dans les publications scientifiques d’autres pays, nous avons recensé plusieurs sources de benzophénone d’origine alimentaire. Ce sont notamment sa présence naturelle dans certains aliments, son utilisation comme aromatisant alimentaire, sa migration depuis les matériaux d’emballage, sa présence dans l’eau potable (tel que discuté plus haut) et les poissons, ainsi que sa migration depuis les biberons détectée (Mertens et coll. 2016, Onghena et coll. 2016, Simoneau et coll. 2014).
L’IARC (2013) mentionne que la benzophénone existe naturellement dans certains aliments, dont les raisins à vin (muscat), les fruits tropicaux et les thés noirs. Elle peut aussi être utilisée comme aromatisant alimentaire. La comparaison des volumes de production indique que la consommation de la benzophénone comme agent aromatisant dans les aliments pourrait surpasser celle découlant des aliments où cette substance se trouve naturellement (cité par l’OMS 2002). Au palier international, le JECFA a estimé que sa consommation individuelle par les Américains sous la forme d’aromatisant alimentaire se montait à 11 µg/jour (International Organization of the Flavor Industry 1995, Lucas et coll. 1999, cités par l’OMS 2002). En utilisant la technique d’exposition par dose unique mise au point par le JECFA, l’IARC (2013) a calculé que l’absorption de la substance se montait à 6 mg/jour selon les niveaux d’utilisation raffinés divulgués à la Commission européenne en 2008 par l’industrie, à 40 µg/jpur selon les données du Conseil de l’Europe (2000) et à 170 µg/jour selon les quantités utilisées signalées par l’U.S. Flavor and Extract Manufacturers’ Association en 1994. Selon Burdock et coll. (2010), aux États-Unis, la teneur moyenne de benzophénone utilisée se situe de 0,57 ppm dans les boissons non alcoolisées, à 1,57 ppm dans les pâtisseries avec une teneur maximale de 3,27 ppm dans les produits laitiers congelés.
Nous avons trouvé au Canada que la benzophénone avait une utilisation limitée dans certains matériaux d’emballage alimentaire, mais dans ceux qui n’entrent pas en contact direct avec des aliments. À l’échelle mondiale, on utilise la benzophénone (à 5 % ou 10 %) comme photoamorceur pour le durcissement par exposition aux ultraviolets des encres appliquées sur la face externe des emballages alimentaires en carton (EFSA 2009; 2017, IARC 2013). On a démontré que la benzophénone pouvait migrer vers les aliments directement ou dans sa phase vapeur. Plus récemment, deux études ont tenté d’améliorer la prédiction de la migration de la benzophénone à partir de pellicule d’emballage de polyéthylène de faible densité. Les résultats de Paseiro-Cerrato et coll. (2016) montrent que la modélisation de la benzophénone basée sur les coefficients de diffusion et partition dans des éléments réels prédisait une migration supérieure à celle prédite antérieurement par Maia et coll. (2016), et que le prédicteur le plus fiable était le Koe des aliments (c.-à-d. préférence de la migration vers les aliments à forte teneur en gras).
En 2000, 2006 et 2011, l’agence de sécurité des aliments du Royaume-Uni (UKFSA) a réalisé trois enquêtes exhaustives sur les denrées emballées dans du plastique imprimé, du papier imprimé ou du carton imprimé. La benzophénone a été détectée dans 14 %, 17 % et 11 %, respectivement, des 350 aliments échantillonnés pour chaque enquête (UKFSA 2011). Les résultats de 2006 ont démontré que la benzophénone était plus fréquemment détectée dans les aliments emballés dans du papier ou du carton imprimé (20 %) que dans du plastique imprimé (3 %). L’UKFSA a produit une gamme d’apports alimentaires potentiels à partir des données de 2006 pour les « grands consommateurs » se situant entre 1,2 et 1,5 µg/kg p.c./jour pour un adulte de 60 kg (UKFSA 2006, cité par IARC 2013). Aucune estimation n’a été faite pour les enfants. Or, ce groupe d’âge pourrait être plus fortement exposé aux aliments emballés, puisque les nourrissons et les enfants consomment beaucoup plus d’aliments par kilogramme de poids corporel que les adultes, et les jeunes enfants reçoivent notamment une variété moins grande de produits alimentaires. De plus, on commercialise les aliments pour enfants dans des petits emballages spécialement conçus qui ont un rapport surface/volume plus élevé ce qui favorise une plus forte migration par kilogramme d’aliment (Foster 2010, Muncke 2011). Dans sa plus récente enquête, l’UKFSA (2011) a détecté la benzophénone dans un petit nombre (11 %) de denrées emballées dans des cartons extensivement imprimés, y compris plusieurs marques de céréales pour petit-déjeuner, de mélanges pour crêpes, de chocolats et de bonbons, de frites, de produits du poulet et de croquettes de poisson, et cette agence a trouvé des concentrations allant de moins de 10 µg/kg à 2460 µg/kg pour des aliments consommés probablement par des enfants. En Amérique du Nord, la benzophénone n’a été signalée que comme un des composants des encres utilisées à l’extérieur des boîtes ou des contenants en polyéthylène et ces encres n’entrent pas en contact direct avec les aliments. Nous avons toutefois utilisé les données de l’enquête de l’UKFSA (2011) sur les denrées dans le cadre de laquelle cette agence a mesuré la benzophénone pour produire une estimation prudente de l’exposition alimentaire potentielle des Canadiens depuis toutes les sources potentielles.
Des données supplémentaires existent sur la présence de benzophénone dans des denrées d’autres pays, notamment les gâteaux (12 000 µg/kg) en Espagne (Rodriguez-Bernaldo de Quiros et coll. 2009, cité par IARC 2013) et les céréales pour petit-déjeuner (jusqu’à 4210 µg/kg) en Belgique (Comité scientifique de l’Agence fédérale pour la sécurité de la chaîne alimentaire de Belgique 2009, cité par IARC 2013). Les résultats d’une étude réalisée en Union européenne par Koivikko et coll. (2010, cité par IARC 2013) semble indiquer que les matériaux multicouches dans l’emballage peuvent limiter ou empêcher la migration, ce que Pastorelli et coll. (2008, cité par IARC 2013) avaient aussi trouvé. Ainsi, le comité permanent pour l’alimentation de l’Union européenne souscrit donc à la limite de 0,6 mg/kg pour la migration totale de benzophénone et de (4‑méthylphényl)(phényl)méthanone depuis l’emballage vers les aliments et il signale aux associations industrielles de l’encre et du carton de l’Union que les encres contenant de la benzophénone sont inappropriées pour l’impression d’emballage alimentaire, hormis les cas où une barrière fonctionnelle bloque le transfert de ces substances dans les aliments par contact direct et sous forme gazeuse (EU 2009, cité par IARC 2013).
On a démontré que la benzophénone migrait depuis les biberons, achetés en Belgique, fabriqués de substances de remplacement des polycarbonates (Mertens et coll. 2016, Onghena et coll. 2016), ainsi que depuis ceux commercialisés en Union européenne en provenance de différents pays, dont le Canada (les détails particuliers aux échantillons canadiens ne sont toutefois pas donnés) [Simoneau et coll. 2012].
Dans le cadre de l’étude belge, les chercheurs ont stérilisé 24 biberons considérés être représentatifs du marché conformément aux recommandations du fabricant (c.‑à‑d. remplis d’eau bouillante laissée 10 min). Ils y ont ensuite versé du lait maternisé simulé à une température de 70 °C et l’ont laissé reposer 2 h, conformément aux « conditions normalisées de remplissage de liquide chaud » prescrites par le règlement 10/2011 de l’Union européenne (UE 2011). Cette méthode exige aussi que les essais de migration soient effectués trois fois sur des aliments frais simulés afin de reproduire l’utilisation répétée de biberons (Mertens et coll. 2016, Onghena et coll. 2016). La substance a été détectée dans quatre biberons (de polypropylène et de silicone) à une concentration moyenne pour la troisième migration entre 9 et 97 µg par kilogramme de lait maternisé, ce qui est au-dessous de la limite de migration propre à l’Union européenne de 600 µg/kg pour les plastiques utilisés à répétition (Mertens et coll. 2016, Onghena et coll. (2016). Onghena et coll. (2016) ont ensuite soumis un sous-ensemble de six biberons à une variété d’essais de différente durée (p. ex. micro-ondes, stérilisation à la vapeur et essais au lave-vaisselle). La substance n’a été détectée que dans le biberon de silicone, à des concentrations allant de moins de 3,6 µg/kg (neuvième migration pendant l’essai aux micro-ondes) à 58 µg/kg (première migration pendant l’essai de stérilisation par cuisson). La plus haute concentration à la dixième répétition de tout traitement était de 22 µg/kg pour l’essai de nettoyage au lave-vaisselle. En général, les migrations maximales de benzophénone ont été observées lors des premières migrations pendant les essais, c’est-à-dire avec des biberons neufs.
Dans le cadre de l’étude de l’Union européenne de Simoneau et coll. (2012), on a analysé 277 biberons achetés dans 26 pays de l’Union, au Canada, en Suisse et aux États-Unis. Suivant les protocoles prescrits par le Règlement 10/2011 de l’Union européenne (UE 2011), les premiers résultats de migration ont été présentés comme une méthode de dépistage. On a constaté que la migration de benzophénone était associée aux biberons fabriqués de polypropylène, silicone, polyamide et polyéthersulfone. La concentration de benzophénone se situait entre 1 et 286 µg/kg, avec une moyenne de 43 µg/kg pour les biberons de polypropylène (39 détections sur 149), et entre 11 et 637 µg/kg avec une moyenne de 184 µg/kg pour ceux de silicone (5 détections sur 5), et 2 µg/kg pour deux biberons de polyamide sur 28. Les auteurs ont noté que la présence de notices en papier ou en carton dans les biberons pourrait expliquer les concentrations plus élevées trouvées dans une marque de biberons de polyéthersulfone et dans ceux de silicone.
Absorptions estimées
Pour nous éclairer sur l’exposition de la population générale du Canada, nous avons déterminé l’absorption par des adultes et les enfants à partir des données internationales. En nous fondant principalement sur les données de surveillance, nous avons déterminé que l’absorption totale à partir des milieux de l’environnement (poussière, air intérieur et eau potable) et les aliments était de 1,1 µg/kg p.c./jour pour les adultes et 4,5 µg/kg p.c./jour pour les tout-petits. (On trouvera plus de détails dans l’annexe A.) Les estimations prudentes de l’absorption associée à la migration de la benzophénone à partir de biberons se traduit par des absorptions par voie orale se situant entre 1,5 et 51 µg/kg p.c./jour pour les nourrissons âgés de zéro à un mois. (On trouvera plus de détails dans l’annexe B.)
7.1.2 Produits disponibles pour les consommateurs
La benzophénone est présente dans plusieurs produits disponibles pour les consommateurs au Canada, dont des cosmétiques, des peintures pour l’extérieur et pour l’intérieur et des teintures (voir la section sur les Sources et utilisations). Selon les déclarations transmises à Santé Canada en vertu du Règlement sur les cosmétiques, la benzophénone est présente dans des produits cosmétiques au Canada (p. ex., les vernis à ongles, les parfums et les nettoyants pour le corps). Dans l’étude susmentionnée du Conseil national de recherches du Canada, Won et Lusztyk (2011) n’ont détecté des émissions de benzophénone que dans un unique échantillon de matière sur les 58 échantillons prélevés – une peinture à l’eau pour l’intérieur – et ont mesuré des concentrations de 11,7 µg/m3 dans l’air d’une petite chambre environnementale. Nous avons obtenu des estimations de l’exposition découlant de l’utilisation de cosmétiques, de teintures et de peintures en utilisant les modèles d’exposition ConsExpo (RIVM 2006) avec les profils d’utilisation prévus de la population générale du Canada (tableau 7‑1). Ces expositions estimatives ont été déterminées pour des produits sentinelles qui représentent les expositions les plus élevées lorsqu’on les compare à des produits similaires. Les expositions estimatives à la benzophénone dans les produits d’assainissement de l’air, les nettoyants, les agents de polissage et les produits d’entretien pour les planchers étaient plus faibles que celles déterminées pour les parfums et les nettoyants pour le corps. Nous avons estimé les expositions pour différentes durées (par événement ou exposition chronique), groupes d’âge (adultes et enfants) et voies (cutanée et par inhalation).
Nous prévoyons que la benzophénone sera rapidement absorbée par toutes les voies d’exposition (IARC 2013). Une étude in vivo réalisée sur des singes a déterminé que l’absorption cutanée de la benzophénone était de 69 % de la dose appliquée sur la peau recouverte pendant 24 h. Dans des conditions de peau non recouverte, l’absorption cutanée a été réduite à 44 % vraisemblablement à cause de l’évaporation (Bronaugh et coll. 2010, cités par IARC 2013). Nous avons appliqué aux estimations d’exposition la valeur de 44 % pour l’absorption cutanée dans des conditions de peau non recouverte et nous jugeons que cette valeur est plus représentative des scénarios d’exposition cutanée présentés ici que les valeurs d’exposition pour une peau recouverte. À cause de la possibilité d’évaporation, les expositions cutanées et par inhalation pourraient se produire simultanément et nous avons combiné les valeurs d’exposition estimatives par voie cutanée et par inhalation afin d’estimer l’exposition. L’annexe A‑3 donne des précisions et les paramètres par défaut appliqués à chaque scénario d’exposition.
| Scénario de produit (durée)a | Conc. (%)b | Groupe d’âge | Estimation de l’exposition cutanée (mg/kg p.c./j ou mg/kg/événe-ment)c,d | Estimation de l’exposition par inhalation (mg/kg p.c./jour ou mg/kg/événe-ment)c,e | Estimation des expositions combinées (mg/kg p.c./j ou mg/kg/événe-ment) |
|---|---|---|---|---|---|
| Vernis à ongles (par événe-ment) | 5 | Adulte | 0,072 | 0,0047 | 0,076 |
| Vernis à ongles (par événe-ment) | 5 | Ado | 0,085 | 0,0055 | 0,091 |
| Vernis à ongles (par événe-ment) | 5 | Enfant | 0,043 | 0,0059 | 0,049 |
| Parfum (quotidien) | 0,3 | Adulte | 0,010 | 0,00016 | 0,010 |
| Nettoyant pour le corps (quotidien) | 0,3 | Adulte | 0,0029 | Non quantifiée | 0,0029 |
| Nettoyant pour le corps (quotidien) | 0,3 | Ado | 0,0024 | Non quantifiée | 0,0024 |
| Peinture pour l’intérieur (par événement.)e | 0,3 | Adulte | 0,067 | 0,00122 | 0,068 |
| Teinture (par événe-ment) | 0,3 | Adulte | 0,067 | Non quantifiée | 0,067 |
Abréviation : Conc. : concentration, ado : adolescent
a L’absorption pour les scénarios « par événement » est en mg/kg/événement et pour les scénarios « quotidiens », en mg/kg/jour.
b Les concentrations pour les produits cosmétiques proviennent d’une communication personnelle, des courriels, de la Direction de la sécurité des produits disponibles pour les consommateurs et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, datées du 19 septembre 2016, du 25 mai 2017 et du 25 mars 2019 (sans référence). Les concentrations pour les peintures proviennent des fiches signalétiques (2015, 2019); les concentrations pour les teintures, des fiches signalétiques de 2018.
c Seules les estimations associées à la limite supérieure de la concentration sont présentées.
d En supposant une absorption par inhalation de 44 %.
e En supposant une absorption par inhalation de 100 %.
7.2 Évaluation des effets sur la santé
Le Centre international de recherche sur le cancer (IARC 2013) et l’Autorité européenne de sécurité des aliments (EFSA 2009, 2017) ont évalué la benzophénone. Ces études forment la base de la caractérisation des effets sur la santé de la présente ébauche d’évaluation préalable. L’IARC (2013) a évalué le risque de cancer occasionné par la benzophénone et, à partir d’études d’exposition orale chronique de rats et de souris, a conclu « qu’il existait suffisamment de preuves de la cancérogénicité de la benzophénone pour les animaux de laboratoire » et il a catégorisé la substance comme étant « possiblement cancérogène pour l’humain » (groupe 2B). Nous avons réalisé des recherches dans les publications scientifiques à partir d’une année avant la date de publication de la monographie de l’IARC (juillet 2013) jusqu’à mai 2018, mais nous n’avons relevé aucune étude sur les effets sur la santé qui pourrait avoir une incidence sur la caractérisation des risques (c.-à-d. aboutir à différents paramètres critiques ou à des points de référence inférieurs à ceux indiqués dans les documents de l’IARC [2013] et de l’EFSA [2009]). Il n’existe pas de données sur les effets sur la santé par inhalation.
Toxicocinétique et métabolisme
Selon l’IARC (2013), la benzophénone peut être absorbée par exposition orale, cutanée ou par inhalation. Les métabolites de la benzophénone suivant son administration dans la diète d’animaux de laboratoire sont le diphénylméthanol et la (4‑hydroxyphényl)(phényl) méthanone, probablement avec les conjugués sulfate et glucuronide qui peuvent subir une circulation entéro-hépatique (Jeon et coll. 2008, Nakagawa et coll. 2000, Nakagawa et Tayama 2002, Robinson 1958). Chez les lapins, le diphénylméthanol a été excrété dans l’urine, dans une proportion entre 41 % et 61 % de la benzophénone administrée dans la diète (NTP 2006), alors que chez les rats, seulement 1 % de la benzophénone administrée oralement a été excrétée dans l’urine sous la forme de (4-hydroxyphényl) (phényl)méthanone, détectée dans les échantillons d’urine traitée par des enzymes (NTP 2000). L’élimination de la benzophénone semble plus rapide chez les souris que chez les rats, puisque le National Toxicology Program des États-Unis (NTP 2006) a observé que lorsque des souris avaient reçu six fois plus de benzophénone que des rats par une seule administration intraveineuse ou par gavage, la surface de la courbe de la concentration de la benzophénone dans le plasma en fonction du temps était significativement plus petite pour les souris que pour les rats. Jeon et coll. (2008) ont trouvé que la concentration de benzophénone et de ses métabolites culminait dans le plasma des rats 4 h après une dose simple administrée par gavage et que la demi-vie d’élimination du composé parent était d’environ 19 h. Les détails concernant les études d’adsorption cutanée sont fournis à la section 7.1.2.
Les métabolites (4-hydroxyphényl)(phényl)méthanone et (3‑hydroxyphényl)(phényl) méthanone sont aussi formés par irradiation à la lumière ultraviolette ou visible dans de solutions aqueuses de benzophénone (IARC 2013).
Cancérogénicité et génotoxicité
Les principales cibles de l’exposition à la benzophénone administrée par voie orale sont le foie, les reins et le système hématopoïétique (EFSA 2009, 2017, IARC 2013).
Le National Toxicology Program (NTP 2006) a réalisé des études de la cancérogénicité chez le rat et la souris, découlant de l’exposition alimentaire par voie orale. Pendant 105 semaines, le NTP (2006) a exposé des rats F344/N à la substance à raison de 0, 15, 30 et 60/65 mg/kg p.c./jour (mâles/femelles) et des souris B6C3F1 à raison de 0, 35/40, 70/80 et 150/160 mg/kg p.c./jour (mâles/femelles). La survie des rats mâles ayant reçu des doses élevées était significativement inférieure à celle du groupe témoin, alors que la survie des femelles exposées était semblable à celle du groupe témoin. On a trouvé chez les rats mâles une tendance positive de l’incidence d’adénomes dans les tubules rénaux (importante pour les groupes ayant reçu des doses moyennes à élevées), accompagnée par une hausse significative de l’incidence de l’hyperplasie des tubules rénaux et, chez tous les groupes traités, une hausse dépendant de la dose de la gravité de la néphropathie. On a observé une hausse importante de la gravité de la néphropathie chez les femelles des groupes ayant reçu des doses moyennes et élevées. Une hausse significative de l’incidence de l’hypertrophie d’hépatocytes centrolobulaires a été observée chez tous les groupes de rats exposés. L’incidence de la leucémie à cellules mononucléées s’est considérablement accrue chez les rats mâles ayant reçu des doses moyennes ou élevées (l’incidence dans les deux groupes a excédé la gamme des données historiques sur les sujets témoins). Chez les rats femelles, on a observé une hausse significative de l’incidence de leucémie à cellules mononucléées par rapport aux témoins pour le groupe ayant reçu une dose moyenne (l’incidence de tous les groupes de dose, dont le groupe témoin dépassait les valeurs observées chez les témoins antérieurs de référence). On a observé une hausse marginale de l’incidence des sarcomes histiocytaires chez les rattes ayant reçu une forte dose (dépassement par rapport aux données historiques sur les sujets témoins). Or, le NTP (2006) considère les leucémies à cellules mononucléées et les sarcomes histiocytaires observés chez les rattes comme des preuves ambiguës de l’activité cancérogène de la benzophénone. La survie des groupes de souris exposées était analogue à celles de groupes témoins, sauf dans le cas des femelles ayant reçu une forte dose qui avaient un taux réduit de survie à la fin de l’étude. Une hausse de l’incidence d’adénomes hépatocellulaires chez les groupes ayant reçu des doses moyennes à élevées a été observée chez les souris des deux sexes. Toutefois, les écarts par rapport au groupe témoin n’étaient importants que pour les souris mâles (dépassement par rapport aux données historiques sur les sujets témoins). On a observé chez les souris femelles une tendance positive de l’incidence des sarcomes histiocytaires et une hausse significative de l’incidence de ces sarcomes chez le groupe ayant reçu une dose moyenne (dépassement par rapport à la gamme des données historiques sur les sujets témoins). L’incidence de la néphropathie chez les souris femelles exposées et la gravité de la néphropathie chez les souris mâles exposées étaient en hausse significative. Les souris femelles de tous les groupes exposés ont montré une incidence accrue de la prolifération de cellules hématopoïétiques de la rate.
Puisque l’EFSA (2009, 2017) a considéré que la benzophénone était non génotoxique, elle a utilisé les effets hépatiques, cancéreux et non cancéreux observés chez les rats mâles lors de l’étude sur la cancérogénicité pour calculer la limite de dose-repère pour une hausse de 10 % des effets (LDR10). Elle a déterminé que la valeur la plus basse de LDR10 pour les effets non cancéreux était de 3,1 mg/kg p.c./jour et la limite inférieure de la gamme de LDR10 pour le cancer du rein était de 19 mg/kg p.c./jour. En conséquence, l’EFSA (2009, 2017) a adopté une LDR10 de 3,1 mg/kg p.c./jour, comme étant le paramètre de départ le plus approprié pour leur calcul de la dose journalière tolérable.
Nous avons trouvé peu de comptes rendus de la cancérogenèse potentielle de la benzophénone par voie cutanée chez la souris Swiss femelle (Stenbäck et Shubik 1974) et le lapin albinos de Nouvelle-Zélande (Stenbäck 1977). Dans le cadre des essais, des solutions de benzophénone dans l’acétone à des concentrations de 0 %, 5 %, 25 % et 50 % ont été appliquées en doses de 0,02 ml sur des carrés de 1 po2 (6,5 cm2) de peau dorsale de souris pendant 120 semaines ou dans les oreilles internes de lapins pendant 160 semaines (conditions d’application non précisées). Un nombre semblable de tumeurs de la peau chez les souris traitées ou témoins a été observé. L’IARC (2013) a conclu que l’application cutanée de benzophénone n’était pas cancérogène pour la peau des souris. Chez les lapins, la benzophénone n’a pas eu d’effet sur l’incidence de lésions cancéreuses ou non cancéreuses. Les auteurs ont donc conclu que les études n’avaient pas trouvé que l’exposition cutanée à la benzophénone avait un effet cancérogène ou non cancérogène potentiel. Dans son examen, l’IARC a appuyé cette conclusion pour la souris, toutefois l’examen n’a pas considéré l’étude sur les lapins. Selon l’EFSA (2009, 2017), « les résultats négatifs obtenus lors des études de la cancérogénicité de l’exposition cutanée à la benzophénone étaient en accord avec le mode d’action présumé non génotoxique de ce composé ». Le lecteur devrait noter que lors des deux études sur les effets cutanés, les examens histologiques n’ont été réalisés que sur les échantillons de peau et les tumeurs ou lésions manifestement visibles. De plus, les auteurs ne donnent que des informations limitées sur les résultats ainsi que les doses administrées, mais ils notent que les doses d’essais du composé pourraient avoir été trop basses lors de l’étude sur le lapin. En outre, le nombre de lapins de chaque groupe de dose était petit (n = 5), ce qui limite la puissance de cette étude pour la détection des effets toxicologiques.
Des études d’absorption chronique par voie orale ont montré que la benzophénone induisait des cancers chez les rats et les souris, et ce, dans plusieurs sites. Toutefois, le mode d’action de la cancérogénicité de la benzophénone dans les études d’absorption par voie orale reste incertain. En se fondant sur les résultats des essais biologiques du NTP et la preuve de ses effets sur le système endocrinien (voir plus bas), l’IARC (2013) suspecte que plusieurs mécanismes, tels que la génération de dérivés réactifs de l’oxygène et l’interférence avec le système endocrinien par plusieurs récepteurs, pourraient contribuer à la cancérogénicité de la benzophénone. De plus, le NTP (2006) n’a pas établi la pathogenèse du cancer des tubulures rénales induites par la benzophénone. L’IARC (2013) a attribué la faible espérance de vie des rats mâles ayant reçu une forte dose, à la gravité accrue de la néphropathie progressive chronique, mais n’a pas conclu que cette dernière était un mécanisme de développement de tumeurs hépatiques.
Le NTP (2006) n’a pas trouvé que la benzophénone était mutagène in vitro pour les souches de Salmonella typhimurium (TA98, TA100, TA1535 ou TA1537) ou dans les cellules de lymphomes L5178Y/tk+/- de souris, en l’absence ou non d’activation métabolique. Ni la benzophénone ni ses métabolites le diphénylméthanol ou la (4‑hydroxyphényl)(phényl)méthanone n’ont provoqué l’expression du gène umu dans la souche TA1535 de S. typhimurium en présence ou en absence d’activation métabolique provenant de rats, de souris ou d’humains. Toutefois, dans les mêmes études, l’expression du gène umu a été provoquée par la présence de cytochromes recombinants P450 humains (Takemoto et coll. 2002).
Dans les essais in vivo réalisés par le NTP (2006), la benzophénone n’a pas accru la fréquence des micronoyaux dans les érythrocytes de la moelle osseuse ou du sang périphérique des souris, à la suite d’injections intrapéritonéales de 200 à 500 mg/kg p.c./jour pendant trois jours ou une exposition alimentaire de 200 à 4200 mg/kg p.c./jour pendant 14 semaines (NTP 2006). (Ces doses sont supérieures à celles associées au développement de tumeurs dans les études à long terme chez les souris et les rats.)
Se fondant sur les renseignements résumés plus haut, l’EFSA (2009) a conclu que la benzophénone n’avait pas de potentiel génotoxique.
Cependant, une étude d’Amar et coll. (2015) a montré que la combinaison de la benzophénone et de lumière solaire endommageait l’ADN d’une lignée cellulaire de kératinocytes humains dans le test des comètes.
Toxicité subchronique et à court terme
(Burdock et coll. (1991) ont ajouté de la benzophénone à raison 0, 20, 100 ou 500 mg/kg p.c./jour à l’alimentation de rats Sprague-Dawley (SD) des deux sexes. Le groupe de bas dosage reçut le traitement pendant 90 jours, alors que les groupes de dosage moyen à haut furent traités pendant 28 jours. Les changements liés au traitement, incluant les paramètres hématologiques et de biochimie clinique modifiés, le poids du foie et celui des reins, et la hausse d’hypertrophie hépatocellulaire sont survenus chez les rats des deux sexes, aux dosages moyens et élevés. À partir de cette étude, l’Agence de protection de l’environnement du Danemark (2015) a calculé une dose sans effet nocif observé de 20 mg/kg p.c./jour. Le NTP (2000) a rapporté une hausse du poids du foie et des reins, une augmentation de l’hypertrophie hépatocellulaire et des changements aux tubules rénaux chez des rats F344 lors d’une étude alimentaire de 14 semaines à la dose d’essai la plus faible de 75 mg/kg p.c./jour ou aux doses plus élevées.
Toxicité pour la reproduction et le développement
Le NTP (1992, 1993 et 1999, cités par NTP 2004) a réalisé quelques études de détermination des doses menant à la toxicité de la benzophénone lors du développement des rats et des lapins dans le cadre desquelles les effets sur les fœtus furent seulement observés en présence de toxicité pour la mère. Dans des études de suivi, on en a administré par gavage des doses de 0, 100, 200 ou 300 mg/kg p.c./jour à des rattes aux jours 6 à 19 de leur gestation (NTP, 2002 cité par NTP, 2004), et des doses de 0, 5, 25, ou 45 mg/kg p.c./jour à des lapines aux jours 6 à 29 de la gestation (NTP, 2004). Chez les rattes, le poids du foie et celui des reins des mères de tous les groupes de dosage se sont fortement accrus, phénomène accompagné par une baisse réversible du poids corporel. Le NTP a noté une baisse du poids corporel fœtal au dosage le plus élevé et, pour toutes les doses, ce qui fut perçu comme « de légers retards du développement présentant une forte probabilité de récupération au cours des premiers stades de développement postnatal ». Le NTP a publié une dose minimale avec effet nocif observé (DMENO) pour la toxicité maternelle de 100 mg/kg p.c./jour (aucune DSENO calculée). Chez les lapins, les hausses en fonction de la dose de l’incidence d’avortement ou de naissances précoces ont été signalées pour les groupes ayant reçu des doses moyennes à élevées, ainsi que des réductions liées à la dose du poids de la mère (sans rétablissement) et du poids du fœtus. On considère que la DMENO est de 25 mg/kg p.c./jour pour la toxicité maternelle et la fin précoce de la gestation et on a déterminé la DSENO de 5 mg/kg p.c./jour.
Aucune toxicité pour la reproduction ou pour le système endocrinien n’a été observée lors d’une étude sur deux générations des deux sexes de rats SD exposés à la benzophénone dans leur diète à raison de 0, 6/9, 29/40 et 130/170 mg/kg p.c./jour (mâles/femelles) [Hoshino et coll. 2005, Yamasaki et coll. 2005]. Toutefois, chez les parents F0 et F1 des deux sexes, ils ont observé pour les groupes de dosages moyens et élevés, une inhibition du gain de poids corporel et de la consommation alimentaire, des poids rénaux légèrement élevés et les changements dans les tubules rénaux et une hausse importante du poids du foie et de l’hypertrophie des hépatocytes centrolobulaires. Bien que la hausse de l’hypertrophie des hépatocytes centrolobulaires ait été observée chez les parents ayant reçu une dose peu élevée, elle n’était pas accompagnée par une hausse du poids du foie, l’EFSA (2009, 2017) l’a donc considérée comme étant un changement adaptatif vital. L’inhibition du gain de poids corporel chez la progéniture a été observée chez les deux sexes des générations F1 et F2 des groupes à hauts dosages de cette étude.
Il n’existe pas d’études sur l’absorption de benzophénone par les humains. Une enquête prospective de cohorte sur le (4‑hydroxyphényl)(phényl)méthanone a révélé que les concentrations de celle-ci dans l’urine des parents mâles étaient associées à une baisse de fécondité (Buck Louis et coll. 2014) et un léger excès de naissances masculines (Bae et coll. 2016) D’autres études de cohorte n’ont pas trouvé d’association de la concentration de (4‑hydroxyphényl)(phényl)méthanone dans l’urine avec des incidences sur l’endométriose, les léiomyomes de l’utérus ou la qualité du sperme (Kunisue et coll. 2012, Pollack et coll. 2015, Buck Louis et coll. 2015). Toutefois, il n’est pas clair si la benzophénone était la source de la (4‑hydroxyphényl)(phényl)méthanone dans l’urine des sujets humains, car la source n’était pas indiquée.
L’activité œstrogénique in vivo de la benzophénone et de son métabolite, la (4‑hydroxyphényl)(phényl)méthanone a été confirmée lors de multiples essais utérotrophiques (IARC 2013, ECHA 2015). Chez des rattes ovariectomisées, on a rapporté une hausse des poids de l’utérus après l’administration pendant trois jours de benzophénone par gavage à raison de 400 mg/kg p.c./jour (Nakagawa et Tayama 2002) ou à raison de 300 mg/kg p.c./jour par injections intrapéritonéales (Suzuki et coll. 2005). Chez les rattes immatures, toutefois, on a trouvé que seul le métabolite (4‑hydroxyphényl)(phényl)méthanone causait des hausses du poids de l’utérus après des injections sous-cutanées. (Nakagawa et Tayama 2001; Hayashi et coll. 2006). Les preuves suggèrent que les effets œstrogéniques de la benzophénone pourraient être dus à son métabolite, la 4‑hydroxyphényl)(phényl)méthanone (Nakagawa et Tayama 2001 et 2002, IARC 2013).
Lors des essais in vitro, le métabolite (4-hydroxyphényl)(phényl)méthanone a suscité des activités œstrogéniques et anti-androgéniques (IARC 2013, ECHA 2015). La benzophénone n’avait montré aucune activité œstrogénique lors d’essais antérieurs (Nakagawa et coll. 2000, Yamasaki et coll. 2002, Hayashi et coll. 2006, Suzuki et coll. 2005). Des études récentes ont montré que la benzophénone pouvait susciter de fortes réactions sur les récepteurs d’œstrogène dans les lignées de cellules cancéreuses d’ovaires et de seins humains (Simon et coll. 2016) et une baisse de l’activité de la peroxydase thyroïdienne des lignées de cellules folliculaires de la thyroïde humaine cancéreuses (Song et coll. 2011, 2012).
7.3 Caractérisation des risques pour la santé humaine
À l’aide de données canadiennes et/ou étrangères, nous avons estimé de façon prudente l’exposition chronique de la population générale du Canada par les milieux environnementaux (poussière, air intérieur et eau potable) et les aliments, à 0,0011 mg/kg p.c./jour chez les adultes et à 0,0045 mg/kg p.c./jour chez les tout-petits. L’absorption par exposition associée à la migration de la benzophénone depuis les biberons se traduit par une absorption orale se situant entre 0,0015 et 0,051 mg/kg/jour pour les nourrissons de zéro à un mois. Nous avons aussi calculé l’absorption par exposition à des produits disponibles pour les consommateurs pour les cosmétiques, les teintures et les peintures comme des scénarios représentatifs. Le tableau 7-2 présente toutes les valeurs estimées.
Les essais in vitro et in vivo ont montré que la benzophénone n’était pas génotoxique. L’exposition chronique par voie orale à la benzophénone provoque des adénomes du rein et la leucémie chez le rat mâle, ainsi que des tumeurs hépatiques chez les souris mâles et possiblement les femelles (non statistiquement significatif chez les femelles) et des sarcomes histiocytaires chez la souris femelle. On considère que les effets sur les reins sont les paramètres non cancéreux les plus sensibles.
L’EFSA (2009, 2017) a calculé une LDR10 de 3,1 mg/kg p.c./jour pour les effets non cancéreux sur les reins et de 19 mg/kg p.c./jour pour le cancer du rein comme points de référence à partir d’une étude de cancérogénicité. Dans la présente évaluation préalable, nous utilisons ces valeurs pour caractériser le risque découlant de l’exposition chronique à la benzophénone par voie orale.
Les études sur la cancérogénicité cutanée de la benzophénone réalisées sur des souris et de petits groupes de lapins n’ont montré aucun potentiel cancérogène. La qualité des études ne peut toutefois pas être confirmée, car les publications contenaient peu d’informations et qu’il semble que l’étendue des examens histologiques ait été limitée. Ainsi, pour caractériser les risques que fait courir une exposition cutanée quotidienne, nous avons utilisé les LDR10 de 3,1 et 19 mg/kg p.c./jour tirées de l’étude de la cancérogénicité orale chronique.
Pour caractériser le risque posé par l’exposition cutanée à court terme à la benzophénone, nous avons choisi pour les adultes et les adolescents une DSENO de 5 mg/kg p.c./jour pour les effets sur la santé maternelle associée avec une fin précoce de la gestation et une réduction du poids corporel maternel tirée de l’étude sur la toxicité par voie orale pour le développement. Faute de recherches sur la toxicité à court terme, nous avons sélectionné, pour les enfants, les adolescents et les adultes, la DSENO de 20 mg/kg p.c./jour obtenue par l’étude de toxicité par voie orale de 28 jours. Afin d’extrapoler d’une voie à l’autre, soit de la voie cutanée à la voie orale, nous avons choisi la valeur de 44 % de l’absorption cutanée de la benzophénone, tirée de l’étude d’application sur la peau non recouverte de singes (voir la section 7.1.2).
| Sources | Groupe d’âge | Voie | Estimation de l’exposition (mg/kg p.c./jour ou mg/kg p.c./évén.)a | Niveau d’effet critique par voie orale (mg/kg pc/jour) | Marge d’exposition |
|---|---|---|---|---|---|
| Milieux environne-mentaux et aliments (par jour) | tout-petits | orale | 0,0045 | 3,1 (effets non cancéreux sur les reins) | 688 |
| Milieux environne-mentaux et aliments (par jour) | adultes | orale | 0,0011 | 3,1 (effets non cancéreux sur les reins) | 2800 |
| Milieux environne-mentaux et aliments (par jour) | tout-petits | orale | 0,0045 | 19 (cancer du rein) | 4210 |
| Milieux environne-mentaux et aliments (par jour) | adultes | orale | 0,0011 | 19 (cancer du rein) | 17200 |
| Biberons | nourrissons | orale | 0,0015–0,051 | 20 (effets non cancéreux sur les reins et le foie) | 393–13 500 |
| Vernis à ongles (par événement) |
adulte adolescent |
cutanée et par inhalation |
0,076 0,091 |
5 (toxicité maternelle dans les études sur le développement) 20 (effets non cancéreux sur les reins et le foie) |
55-65 220-263 |
| Vernis à ongles (par évén.) | enfant | cutanée et par inhalation | 0,049 | 20 (effets non cancéreux sur les reins et le foie) | 409 |
| Parfum (par jour) | adulte | cutanée et par inhalation | 0,01 | 3,1 (effets non cancéreux sur les reins) | 310 |
| Parfum (par jour) | adulte | cutanée et par inhalation | 0,01 | 19 (cancer du rein) | 1900 |
| Nettoyant pour le corps (par jour) | adulte | cutanée | 0,0029 | 3,1 (effets non cancéreux sur les reins) | 1069 |
| Nettoyant pour le corps (par jour) | adulte | cutanée | 0,0029 | 19 (cancer du rein) | 6552 |
| Nettoyant pour le corps (par jour) | adolescent | cutanée | 0,0024 | 3,1 (effets non cancéreux sur les reins) | 1292 |
| Nettoyant pour le corps (par jour) | adolescent | cutanée | 0,0024 | 19 (cancer du rein) | 7917 |
| Peinture d’intérieur (par événement, peu fréquent) | adulte | cutanée et par inhalation | 0,068 | 5 (toxicité maternelle dans les études sur le développement) | 74 |
| Peinture et teinture d’extérieur (par événe-ment) | adulte | cutanée | 0,067 | 5 (toxicité maternelle dans les études sur le développement) | 75 |
a Seules les estimations associées à la limite supérieure de la concentration sont présentées pour les produits disponibles pour les consommateurs.
Nous considérons que les marges d’exposition (ME) calculées, associées aux milieux environnementaux et aux aliments, sont suffisantes pour tenir compte des incertitudes dans les ensembles de données sur les effets de l’exposition sur la santé. De même, nous considérons également que les marges d’exposition calculées pour la migration de benzophénone à partir de biberons sont suffisantes. Dans le cas des produits disponibles pour les consommateurs contenant de la benzophénone, seules les expositions potentielles par voie cutanée et par inhalation ont été combinées pour une caractérisation quantitative des risques. Nous considérons que les ME calculées pour les scénarios d’utilisation du vernis à ongles et de peinture d’intérieur sont insuffisantes pour tenir compte des incertitudes dans les ensembles de données sur l’exposition et les effets sur la santé (tableau 7-2).
7.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Bien qu’il existe des incertitudes dans l’ensemble de données sur les effets sur la santé (p. ex. aucune étude sur l’inhalation n’est disponible, peu de détails sont donnés dans les études d’exposition par voie cutanée chronique et le mode d’action pour la cancérogénicité est inconnu), il y a une forte assurance que la cancérogénicité et les effets sur les reins et le foie sont les critères d’effets critiques de la benzophénone. Il existe des incertitudes relatives au métabolisme de la benzophénone absorbée par voie cutanée et l’extrapolation des niveaux d’effets critiques depuis les études sur l’exposition par voie orale à la voie cutanée. Toutefois, l’extrapolation de la voie orale à la voie cutanée est considérée être adéquate. Il existe également des incertitudes quant au potentiel de danger de l’exposition à la benzophénone par voie cutanée combinée à l’exposition à la lumière solaire qui pourrait entraîner une plus forte production de métabolites toxiques. Il existe des incertitudes dans l’ensemble de données sur l’exposition, y compris les paramètres utilisés dans les modèles ainsi que les possibles expositions cumulées.
8. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, la benzophénone présente un faible risque d’effets nocifs sur l’environnement. Il a été conclu que la benzophénone ne satisfait pas aux critères énoncés aux alinéas 64a) et 64b) de la LCPE, car elle ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements exposés dans la présente évaluation préalable, il a été conclu que la benzophénone satisfait au critère énoncé à l’alinéa 64c) de la LCPE, car elle pénètre ou pourrait pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il a été conclu que la benzophénone satisfait à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il a été déterminé que la benzophénone répond aux critères de persistance, mais pas à ceux de la bioaccumulation, critères énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
Agence de protection de l’environnement du Danemark. 2015. Survey and health assessment of UV filters. Enquête no 142 sur les substances chimiques des produits de consommation [PDF]. [Consulté le 18 nov. 2016]. [Disponible en anglais seulement.]
Amar SK, Goyal S, Mujtaba SF, Dwivedi A, Kushwaha HN, Verma A, Chopra D, Chaturvedi RK et Ray RS. 2015. « Role of type I & type II reactions in DNA damage and activation of caspase 3 via mitochondrial pathway induced by photosensitized benzophenone ». Toxicol Lett. vol. 235, no 2, p. 84-95. [Disponible en anglais seulement.]
Bae J, Kim S, Kannan K et Buck GM. 2016. « Couples’ urinary concentrations of benzophenone-type ultraviolet filters and the secondary sex ratio ». Sci Total Envir. vol. 543, p. 28-36. ]. [Disponible en anglais seulement.]
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels. Ottawa (Ontario), Santé Canada. [Consulté en déc. 2016].
[BDPSNH] Base de données des produits de santé naturels homologués. Ottawa (Ontario), Santé Canada. [Consulté en déc. 2016].
Buck Louis GM, Chen Z, Kim S, Sapra KJ, Phil M, Bae J et Kannan K. 2015. « Urinary concentrations of benzophenone-type ultraviolet light filters and semen quality ». Fertil Steril. vol. 104, no 4, p. 989–996. [Disponible en anglais seulement.]
Buck Louis GM, Kannan K, Sapra KJ, Maisog J et Sundaram R. 2014. « Urinary concentrations of benzophenone-type ultraviolet radiation filters and couples’ fecundity ». Am J Epidemiol. Vol. 180, no 12, p. 1168–1675. [Disponible en anglais seulement.]
Burdock G.A. 2010. Fenaroli’s Handbook of Flavor Ingredients. 6e éd. Boca Raton (Floride), CRC Press, p. 141. [Disponible en anglais seulement.]
Burdock GA, Pence DH et Ford RA. 1991. « Safety evaluation of benzophenone ». Food Chem Toxicol. vol. 29, p. 741-750. [Disponible en anglais seulement.]
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999) L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada. 2000. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, DORS/2000-107.
Canada. Ministère de l’Environnement. 2009. Loi canadienne sur la protection de l’environnement (1999). Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure [PDF]. Gazette du Canada, partie I, vol. 143, no 40, p. 2945-2956.
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. [Disponible en langue étrangère seulement.]
[CPID] Consumer Product Ingredients Database. 2019. Search results for benzophenone. Household & Commercial Products Association. [consulté le 8 juillet 2019]. [Disponible en anglais seulement.]
[CSC] Chemical Substances Council. 2002. Hazard assessment of benzophenone. Hazard assessment of some chemical substances which have been “suspected to be endocrine disrupters”. Ministère de l’Économie, du Commerce et de l’Industrie du Japon. [Consulté le 18 sept. 2016]. [Disponible en anglais seulement.]
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.) : gouvernement du Canada. Gatineau, Qc. : ECCC. Données à l’appui du document sur l’approche scientifique : classification du risque écologique des substances organiques. Accessible sur demande : substances@ec.gc.ca.
[ECCC] Environnement et Changement climatique Canada. 2016b. Gatineau (Québec) : Données utilisées pour créer des profils de danger et d’exposition particuliers à une substance et attribuer les classifications du risque pour la classification du risque écologique des substances organiques. Gatineau (Québec). Accessible sur demande : substances@ec.gc.ca.
[ECCC et SC] Environnement et changement climatique Canada et Santé Canada. [Modifié le 12 mars 2017]. Catégorisation. Ottawa (Ontario), gouvernement du Canada. [Consulté le 5 février 2019.].
[ECHA] Agence européenne des produits chimiques. 2015. Decision on substance evaluation pursuant to article 46(1) of regulation (EC) No 1907/2006 for Benzophenone, CAS No 119-61-9 (EC No 204-337-6). [Consulté le 19 sept. 2016]. [Disponible en anglais seulement.]
[ECHA] Agence européenne des produits chimiques. 2016. Registered Substances database. Résultats de recherche portant sur le no CAS [119-61-9]. Numéro CE : 204-3376 Helsinki (Finlande) : ECHA. [Mise à jour en 2016]. [Disponible en anglais seulement.]
[EFSA] Autorité européenne de sécurité des aliments. 2009. Toxicological evaluation of benzophenone. Scientific opinion of the panel on food contact materials, enzymes, flavourings and processing aids (CEF). Question N° EFSA-Q-2009–411. Adopté le 14 mai 2009. The European Food Safety Authority Journal. vol. 1104, p. 1–30. [Consulté le 8 sept. 2016]. [Disponible en anglais seulement.]
[EFSA] Autorité européenne de sécurité des aliments. 2017. Safety of benzophenone to be used as flavouring. Scientific opinion of the panel on food contact materials, enzymes, flavourings, and processing aids (CEF). Question No EFSA-Q-2016-00425. Adopté le 20 septembre 2017. The European Food Safety Authority Journal. 15(11):5013. [Consulté le 8 janv. 2018]. [Disponible en anglais seulement.]
Environnement Canada. 2009. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données préparées par Environnement Canada, Santé Canada, Programme des substances existantes.
[FCC-USP] Food Chemicals Codex, 10e édition. 2016-2017. [Disponible en anglais seulement.]
Ficheux AS, Morriset T, Chevillotte G, Postic C et AC Roudot. 2014. Probabilistic assessment of exposure to nail cosmetics in French consumers. Food Chem Toxicol. vol. 66, p. 36-43. [Disponible en anglais seulement.]
Ficheux AS, Wesolek N, Chevillotte G, et AC Roudot. 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78:159-169. [Disponible en anglais seulement.]
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, et AC Roudot. 2016. Consumption of cosmetic products by the French population second part: Amount data. Food Chem Toxicol. 90:130-141. [Disponible en anglais seulement.]
Foster E, Mathers JC et Adamson AJ. 2010. “Packaged food intake by British children aged 0 to 6 years ”. Food Addit Contam, Part A, Chem Anal Control Expo Risk Assess. vol. 27, no 3, p. 380-388. [Disponible en anglais seulement.]
[FS] Fiche signalétique. 2014. Meguiar’s Gold Class Rich Leather Wipes. Mitchell South, Irvine (Californie) 92614. Meguiar’s, Inc. [Consulté le 30 sept. 2016]. [Disponible en anglais seulement.]
[FS] Fiche signalétique. 2015. Valspar. Signature Series Indoor Paint [PDF]. Minneapolis (Minnesota) 55440 The Valspar Corporation [Consulté le 30 sept. 2016]. [Disponible en anglais seulement.]
[FS] Fiche signalétique. 2018. Valspar Cabot Deck Stain. Wheeling (Illinois) 60090. The Valspar Corporation [Consulté le 8 mars 2019]. [Disponible en anglais seulement.]
[FS] Fiche signalétique. 2019. Floor & Porch Interior/Exterior Latex Semi-Gloss Enamel White Base. Cleveland, OH 44115: Martin Senour Paints. [Consulté le 5 févr. 2019]. [Disponible en anglais seulement.]
Hayashi T, Okamoto Y, Ueda K et Kojima N. 2006. « Formation of estrogenic products from benzophenone after exposure to sunlight ». Toxicol Lett. vol. 167, p. 1–7. [Disponible en anglais seulement.]
Hoshino N, Tani E, Wako Y et Takahashi K. 2005. “A two-generation reproductive toxicity study of benzophenone in rats ”. J Toxicol Sci. vol. 30, p. 5-20. [Disponible en anglais seulement.]
Hutzler C, Paschke M, Kruschinski S, Henkler F, Hahn J. et Luch A, 2014. « Chemical hazards present in liquids and vapors of electronic cigarettes ». Arch Toxicol. vol. 88, no 7, p.1295-1308. [Disponible en anglais seulement.]
[IARC] Centre international de recherche sur le cancer. 2013. « Benzophenone ». Monographie du CIRC sur l’évaluation des risques de cancérogénicité pour l’homme. no 101, p. 285-304. [Consulté le 30 sept. 2016]. [Disponible en anglais seulement.]
[INSPQ] Institut national de Santé Publique du Québec. 2001. Mieux vivre avec notre enfant de la grossesse à deux ans. [Disponible en anglais seulement.]
Jeon H, Chung Y, Ryu J. 2006. Simultaneous determination of benzophenone-type UV filters in water and soil by gas chromatography–mass spectrometry. J Chromatogr A vol. 1131, p. 192–202. [Disponible en anglais seulement.]
Jeon H, Sarma SM, Kim Y et Ryu J. 2008. « Toxicokinetics and metabolisms of benzophenone-type UV filters in rats ». Toxicology. vol. 248, p. 89–95. [Disponible en anglais seulement.]
Kawaguchi M, Ito R, Honda H, Koganei Y, Okanouchi N, Saito K, Seto Y et Nakazawa H. 2009. « Miniaturized hollow fiber assisted liquid-phase microextraction and gas chromatography–mass spectrometry for determination of benzophenone and derivates in human urine sample ». J Chromatogr B. vol. 877, p. 298–302. [Disponible en anglais seulement.]
Ko A, Kang HS, Park JH, Kwon JE, Moon GI, Hwang MS et Hwang IG. 2016. « The association between urinary benzophenone concentrations and personal care product use in Korean adults ». Arch Environ Contam Toxicol. vol. 70, no 4, p. 640-646. [Disponible en anglais seulement.]
Kunisue T, Chen Z, Buck Louis GM, Sundaram R, Hediger ML, Sun L et Kannan K. 2012. “Urinary Concentrations of benzophenone-type UV filters in US women and their association with endometriosis ”. Environ Sci Technol. vol. 46, no 8, p. 4624-4632. [Disponible en anglais seulement.]
Kunisue T, Wu Q, Tanabe S, Aldous KM et Kannan K. 2010. « Analysis of five benzophenone-type UV filters in human urine by liquid chromatography-tandem mass spectrometry ». Anal Methods. vol. 2, p. 707-713. [Disponible en anglais seulement.]
Lehner K, Santarelli F, Vasold R, König B, Landthaler M et Bäumler W, 2011. “Black tattoo inks are a source of problematic substances such as dibutyl phthalate/. Contact Dermatitis, vol. 65, no 4, p. 231‑238. [Disponible en anglais seulement.]
Loraine GA. et Pettigrove ME. 2006 “Seasonal variations in concentrations of pharmaceuticals and personal care products in drinking water and reclaimed wastewater in southern California.” Environ Sci Technol. vol. 40, no 3 p. 687-695. [Disponible en anglais seulement.]
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, et C Sewall. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol. vol. 43, p. 279-291. [Disponible en anglais seulement.]
Loretz L, Api AM, Barraj L, Burdick J, Davis DA, Dressler W, Gilberti E, Jarrett G, Mann S, Pan YHL, Re T, Renskers K, Scrafford C et Vater S. 2006. « Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. » Food Chem Toxicol vol. 44, p. 2008-2018. [Disponible en anglais seulement.]
Maia J, Rodríguez-Bernaldo de Quirós A, Sendón R, Cruz JM, Seiler A, Franz R, Simoneau C, Castle L, Driffield M, Mercea P et Oldring P. 2016. “Determination of key diffusion and partition parameters and their use in migration modelling of benzophenone from low-density polyethylene (LDPE) into different foodstuffs”. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, vol. 33, no 4, p. 715-724. [Disponible en anglais seulement.]
Mertens B, Van Hoeck E, Blaude MN, Simon C, Onghena M, Vandermarken T, Van Langenhove K, Demaegdt H, Vandermeiren K, Covaci A, Scippo ML, Elskens M et Van Loco J. 2016. « Evaluation of the potential health risks of substances migrating from polycarbonate replacement baby bottle ». Food Chem Toxicol. vol. 97, p. 108-119. [Disponible en anglais seulement.]
Mottaleb MA, Usenko S, O’Donnell JG, Ramirez AJ, Brooks BW et Chambliss CK. 2009. « Gas chromatography–mass spectrometry screening methods for select UV filters, synthetic musks, alkylphenols, an antimicrobial agent, and an insect repellent in fish ». J Chromatogr A. vol. 1216, no 5, p. 815-823. [Disponible en anglais seulement.]
Muncke J. 2011. “Endocrine disrupting chemicals and other substances of concern in food contact materials: An updated review of exposure, effect and risk assessment ”. J Steroid Biochem Mol Biol. vol. 127, p. 118–127. [Disponible en anglais seulement.]
Nakagawa Y et Tayama K. 2001. « Estrogenic potency of benzophenone and its metabolites in juvenile female rats ». Arch Toxicol. vol. 75, p. 74-79. [Disponible en anglais seulement.]
Nakagawa Y et Tayama K. 2002. « Benzophenone-induced estrogenic potency in ovariectomized rats ». Arch Toxicol. vol. 76, no 12, p. 727-731. [Disponible en anglais seulement.]
Nakagawa Y, Suzuki T et Tayama S. 2000. « Metabolism and toxicity of benzophenone in isolated rat hepatocytes and estrogenic activity of its metabolites in MCF-7 cells ». Toxicology. vol. 156, p. 27-36. [Disponible en anglais seulement.]
[NCHS] National Center for Health Statistics, 2000 CDC. Growth Charts [sur Internet]. Hyattsville (Maryland), US Department of Health and Human Services, Center for Disease Control and Prevention. [Mise à jour du 7 mars 2008, cité le 13 mars 2008]. [Disponible en anglais seulement.]
Nilsson NH, Malmgren-Hansen B, Bernth N, Pedersen E et Pommer K. 2006. Survey and health assessment of chemicals substances in sex toys [PDF]. Enquête sur les substances chimiques dans les produits de consommation no 77. Agence de protection de l’environnement du Danemark, Copenhague. [Disponible en anglais seulement.]
[NTP] National Toxicology Program. 1993. Range finding studies: Developmental toxicity of benzophenone when administered via gavage in New Zealand White rabbits. Research Triangle Park (Caroline du Nord), US Department of Health and Human Services, National Toxicology Program. Rapport technique du NTP no TRP92062.
[NTP] National Toxicology Program. 1999. Developmental Toxicity Screen for Benzophenone (CAS 119-61-9) Administered by Gavage to SpragueDawley (CD®) Rats on Gestational Days 6 through 19. Research Triangle Park (Caroline du Nord), US Department of Health and Human Services, National Toxicology Program. Étude du NTP no TRP-98- 005, Rapport d’étude final. [Disponible en anglais seulement.]
[NTP] National Toxicology Program. 2000. NTP Technical Report on the Toxicity Studies of Benzophenone (CAS No. 119-61-9) Administered in Feed to F344/N Rats and B6C3F1 Mice [PDF]. Série de rapport sur la toxicité du NTP no 61. Publication du NIH no 00-3943. Research Triangle Park (Caroline du Nord), National Toxicology Program, National Institutes of Health, US Department of Health and Human Services. [Consulté le 30 sept. 2016]. [Disponible en anglais seulement.]
[NTP] National Toxicology Program. 2002. Developmental Toxicity Evaluation for Benzophenone (CAS No. 119-61-9) Administered by Gavage to Sprague-Dawley (CD®) Rats on Gestational Days 6 through 19. Research Triangle Park (Caroline du Nord), US Department of Health and Human Services, National Toxicology Program. Étude du NTP no TER-98-005, Rapport d’étude final. [Disponible en anglais seulement.]
[NTP] National Toxicology Program. 2004. Developmental Toxicity Evaluation for Benzophenone (CAS No. 119-61-9) Administered by Gavage to New Zealand White Rabbits on Gestational Days 6 through 29. Rapport d’étude final. Étude du NTP no TER-99-001. National Institute of Environmental Health Sciences, Research Triangle Park (Caroline du Nord) [Consulté le 30 sept. 2016]. [Disponible en anglais seulement.]
[NTP] National Toxicology Program. 2006. NTP Technical Report on the Toxicology and Carcinogenesis Studies of benzophenone (CAS No. 119-61-9) in F344/N Rats and B6C3F1 Mice (Feed Studies) [PDF]. Research Triangle Park (Caroline du Nord), US Department of Health and Human Services, National Toxicology Program.NTP TR 533, Publication du NIHA no 06-4469. [Consulté le 30 sept. 2016]. [Disponible en anglais seulement.]
[NTP] National Toxicology Program.1992. Range finding studies: Developmental toxicity of benzophenone when administered via gavage in CD Sprague-Dawley rats. Research Triangle Park (Caroline du Nord), US Department of Health and Human Services, National Toxicology Program. Rapport technique du NTP no TRP92053. [Disponible en anglais seulement.]
[OMS] Organisation mondiale de la santé. 2001. « JECFA. Safety Evaluation of certain food additives and contaminants – Aromatic substituted secondary alcohols, ketones, and related esters ». WHO Food Additives Series, no 48. [Disponible en anglais seulement.]
[OMS] Organisation mondiale de la santé. 2001. Evaluation of certain food additives and contaminants: fifty-seventh report of the Joint FAO/WHO Expert Committee on Food Additives [PDF]. WHO Technical Report Series, 909. Geneva (CH): World Health Organization. [Consulté le 23 août 2019]. [Disponible en anglais seulement.]
Onghena M, Van Hoeck E, Negreira N, Quirynen L, Van Loco J et Covaci, A. 2016. « Evaluation of the migration of chemicals from baby bottles under standardised and duration testing conditions ». Food Addit Contam Part A Chem Anal Control Expo Risk Assess. vol. 33, no 5, p. 893-904. [Disponible en anglais seulement.]
Paseiro-Cerrato R, Tongchat C et Franz R, 2016. « Study of the partition coefficients K p/f of seven model migrants from LDPE polymer in contact with food simulants ». Food Addit Contam Part A Chem Anal Control Expo Risk Assess. vol. 33, no 5, p. 885-892. [Disponible en anglais seulement.]
Pollack AZ, Buck Louis GM, Chen Z, Sun L, Trabert B, Guo Y et Kannan K. 2015. “Bisphenol A, benzophenone-type ultraviolet filters, and phthalates in relation to uterine leiomyoma ”. Environ Res. vol. 137, p. 101-107. [Disponible en anglais seulement.]
Ramirez AJ, Mottaleb MA, Brooks BW et Chambliss C.K. 2007. « Analysis of pharmaceuticals in fish using liquid chromatography-tandem mass spectrometry ». Anal Chem. vol. 79, no 8, p. 3155‑3163. [Disponible en anglais seulement.]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national néerlandais de la santé publique et de l’environnement (Pays-Bas)]. 2006. Cosmetics fact sheet: To assess the risks for the consumer. Updated version for ConsExpo 4 [PDF] [Internet]. Bilthoven (Pays-Bas): Rapport du RIVM no 320104001/2006. [Disponible en anglais seulement.]
[RIVM] Rijksintituut voor Volksgezondheid en Milieu [Institut national néerlandais de la santé publique et de l’environnement (Pays-Bas)]. 2007. Paint products fact sheet: to assess the risks for the consumer. Updated version for ConsExpo 4. [Internet]. Bilthoven (Pays-Bas): Rapport du RIVM no 320104008/2007. [Disponible en anglais seulement.]
Robinson D. 1958. “Studies in detoxification. The metabolism of benzhydrol, benzophenone and p-hydroxybenzophenone ”. Biochem J. vol. 68, p. 584–586. [Disponible en anglais seulement.]
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (Ontario), Santé Canada, Direction de l’hygiène du milieu. [Disponible en anglais seulement.]
Santé Canada. 2015. Liste critique des ingrédients de cosmétiques − Liste des ingrédients dont l’usage est interdit dans les cosmétiques. Ottawa (Ontario), Santé Canada, Direction de la sécurité des produits de consommation et des produits dangereux. [Consultée le 8 sept. 2016].
Simoneau C, Van den Eede L et Valzacchi S. 2012. « Identification and quantification of the migration of chemicals from plastic baby bottles used as substitutes for polycarbonate ». Food Addit Contam: Part A Chem Anal Control Expo Risk Assess. vol. 29, no 3, p. 469-480. [Disponible en anglais seulement.]
Song M, Kim YJ, Park YK et Ryu JC. 2012. “Changes in thyroid peroxidase activity in response to various chemicals ”. J Environ Monit. vol. 14, no 8, p. 2121-6. [Disponible en anglais seulement.]
Song M, Kim YJ, Song MK, Choi HS, Park YK et Ryu JC. 2011. “Identification of classifiers for increase or decrease of thyroid peroxidase activity in the FTC-238/hTPO recombinant cell line ”. Environ Sci Technol. vol. 45, no 18, p. 7906-14. [Disponible en anglais seulement.]
Stenbäck F et Shubik P. 1974. « Lack of toxicity and carcinogenicity of some commonly used cutaneous agents ». Toxicol Appl Pharmacol. vol. 30, p. 7-13. [Disponible en anglais seulement.]
Stenbäck F. 1977. “Local and systemic effects of commonly used cutaneous agents: lifetime studies of 16 compounds in mice and rabbits ”. Acta Pharmacol et Toxicol. vol. 41, p. 417- 431. [Disponible en anglais seulement.]
Suzuki T, Kitamura S, Khota R. Sugihara K, Fujimoto N et Ohta S. 2005. « Estrogenic and antiandrogenic activities of 17 benzophenone derivatives used as UV stabilizers and sunscreens ». Toxicol Appl Pharmacol. vol. 203, p. 9–17. [Disponible en anglais seulement.]
Takemoto K, Yamazaki H, Nakajima M et Yokoi T. 2002. “Genotoxic activation of benzophenone and its two metabolites by human cytochrome P450s in SOS/umu assay ”. Mutat. Res. vol. 519, p. 199-204. [Disponible en anglais seulement.]
[UE] Union européenne. 2011. Règlement (UE) no 10/2011 de la Commission du 14 janvier 2011 concernant les matériaux et objets en matière plastique destinés à entrer en contact avec des denrées alimentaires. [Consulté le 8 sept. 2016].
[UE] EU Food Flavourings Database. 2019. Search results for Benzophenone, internal ref no.: 00663. DG Santé, Bruxelles. Application version : 3.21 [Disponible en anglais seulement.]
[UKEA] United Kingdom Environment Agency. 2008. “UV-filters in cosmetics – prioritisation for environmental assessment [PDF]. SCHO1008BPAY-E-P. [Consulté le 30 sept. 2016]. [Disponible en anglais seulement.]
[UKFSA] United Kingdom Food Safety Agency. 2011. “Food survey information sheet. A 4-year rolling programme of surveys on chemical migrants from food packaging materials and articles [PDF]. Food survey information sheet, numéro 03/11. [Disponible en anglais seulement.]
[USEPA] U.S. Environmental Protection Agency. 2008. Child-Specific Exposure Factors Handbook (Final Report). Washington (DC), EPA/600/R-06/096F. [Disponible en anglais seulement.]
[US FDA] United States Food and Drug Administration 2016.Code of Federal Register [PDF] / vol. 81, No. 1 / Monday, January 4, 2016 / Proposed Rules. [Disponible en anglais seulement.]
[US FDA] United States Food and Drug Administration. 2017. Food Additive and Color Additive Petitions Under Review or Held in Abeyance. FAP 5A4810. [Mise à jour du 31 août 2017; consulté le 25 sep 2017]. [Disponible en anglais seulement.]
[US FDA]. United States Food and Drug Administration. 2018. Food Additive Regulations; Synthetic Flavoring Agents and Adjuvants. [Consulté le 20 février 2019] [Disponible en anglais seulement.]
Wang L et Kannan K. 2013. “Characteristic profiles of benzophenone 3 and its derivatives in urine of children and adults from the United States and China ”. Environmental science & technology. vol. 47, no 21, p. 12532-12538. [Disponible en anglais seulement.]
Wilson R, Jones-Otazo H, Petrovic S, Mitchell I, Bonvalot Y, Williams D et Richardson GM. 2013. « Revisiting dust and soil ingestion rates based on hand-to-mouth transfer. » Human and Ecological Risk Assessment vol. 19, no 1, p. 158-188. [Disponible en anglais seulement.]
Won D et Lusztyk E. 2011. Data gathering on chemicals released to indoor air of residences from building materials and furnishings. Rapport final, Ottawa (Ontario) CNRC, 158 p. Rapport no B3332.2. [Disponible en anglais seulement.]
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K, et I Hertz-Picciotto. 2010. Usage pattern of personal care products in California households. Food Chem Toxicol. 48:3109-3119. [Disponible en anglais seulement.]
Yamasaki K, Takeyoshi M et Yasuda M. 2005. !Two-generation reproductive toxicity studies in rats with extra parameters for detecting endocrine disrupting activity: introductory overview of results for nine chemicals ”. J Toxicol Sci. vol. 30, p. 1-4. [Disponible en anglais seulement.]
Yamasaki K, Takeyoshi M, Yakabe Y, Sawaki M, Imatanaka N et Takatsuki M. 2002. « Comparison of reporter gene assay and immature rat uterotrophic assay of twenty-three chemicals ». Toxicology. vol. 170, no 1-2, p. 21-30. [Disponible en anglais seulement.]
Annexes
Annexe A. Estimations de l’absorption quotidienne (µg/kg p.c./jour) de benzophénone par divers groupes d’âge au sein de la population générale du Canada
| Voie d’exposition | 0 à 6 moisa (allaitement)b | 0 à 6 moisa (lait maternisé)c | 0 à 6 moisa (sans lait maternisé)d | 0,5 à 4 anse | 5 à 11 ansf | 12 à 19 ansg | 20 à 59 ansh | 60 ans et plusi |
|---|---|---|---|---|---|---|---|---|
| Air intérieurj | 0,02 | 0,02 | 0,02 | 0,05 | 0,04 | 0,02 | 0,02 | 0,02 |
| Eau potablek | S.O. | 0,03 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 | 0,01 |
| Alimentsl | A.D. | A.D. | 1,30 | 3,85 | 3,04 | 1,90 | 1,07 | 0,71 |
| Poussièrem | 1,14 | 1,14 | 1,14 | 0,60 | 0,23 | 0,01 | 0,01 | 0,01 |
| Total | 1,17 | 1,20 | 2,48 | 4,51 | 3,31 | 1,94 | 1,11 | 0,74 |
Abréviations – s.o. : sans objet, A.D. : aucune donnée trouvée dans les publications
a Nous présumons que le nourrisson pèse 7,5 kg et que, par jour, il respire 2,1 m3 d’air (Santé Canada, 1998) et ingère 38 mg de poussière et 0 mg de sol (Wilson et coll. 2013).
b Nous n’avons pas trouvé de données de surveillance de la benzophénone dans le lait maternel.
c Nous présumons que les nourrissons exclusivement nourris au lait maternisé consomment 0,8 L d’eau par jour utilisée pour reconstituer la préparation (Santé Canada 1998). Nous n’avons trouvé aucune donnée de surveillance de la benzophénone dans le lait maternisé; par conséquent, l’absorption par la voie alimentaire ne reflète que celle occasionnée par l’eau. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
d Seulement les nourrissons ne recevant pas de lait maternisé. Nous présumons que ceux-ci consomment 0,7 L d’eau par jour (Santé Canada, 1998) et à environ 50 % des nourrissons ne recevant pas du lait maternisé ont commencé à manger des aliments solides à 4 mois et 90 % à 6 mois (NHW, 1990).
e Nous présumons que l’enfant pèse 15,5 kg et que, par jour, il respire 9,3 m3 d’air, boit 0,7 L d’eau, mange 54,7 g de poisson (Santé Canada 1998) et ingère 41 mg de poussière et 14 mg de de sol (Wilson et coll. 2013).
f Nous présumons que l’enfant pèse 31,0 kg et que, par jour, il respire 14,5 m3 d’air, boit 1,1 L d’eau, mange 89,8 g de poisson (Santé Canada 1998) et ingère 31 mg de poussière et 21 mg de sol (Wilson et coll. 2013).
g Nous présumons que l’adolescent pèse 59,4 kg et que, par jour, il respire 15,8 m3 d’air, boit 1,2 L d’eau, mange 97,3 g de poisson (Santé Canada 1998) et ingère 2,2 mg de poussière et 1,4 mg de sol (Wilson et coll. 2013).
h Nous présumons que l’adulte pèse 70,9 kg et que, par jour, il respire 16,2 m3 d’air, boit 1,5 L d’eau, mange 111,7 g de poisson (Santé Canada 1998) et ingère 2,5 mg de poussière et 1,6 mg de sol (Wilson et coll. 2013).
i Nous présumons que la personne pèse 72,0 kg et que, par jour, elle respire 14,3 m3 d’air, boit 1,6 L d’eau, mange 72,9 g de poisson (Santé Canada 1998) et ingère 2,5 mg de poussière et 1,5 mg de sol (Wilson et coll. 2013).
j Nous n’avons trouvé aucune donnée de surveillance de l’air intérieur au Canada et, donc, avons utilisé les données du Japon (maximum de 98 ng/m3) comme démarche prudente pour le calcul des estimations de la limite supérieure de l’exposition quotidienne due à l’air intérieur. Nous n’avons pas trouvé de donnée de surveillance de l’air extérieur.
k Des données de surveillance de l’eau potable traitée aux États-Unis (moyenne de 0,26 µg/L, Loraine et Pettigrove 2006) nous ont servi à calculer des estimations de l’absorption quotidienne due à l’eau potable.
l Aucune donnée de surveillance canadienne pour les matériaux d’emballage alimentaire n’a été trouvée, donc la surveillance des aliments dans le cadre de l’enquête exhaustive de l’UKFSA (2011) a servi au calcul des estimations prudentes de l’absorption quotidienne de benzophénone en tenant compte des articles alimentaires et des taux d’ingestion trouvés par l’Enquête Nutrition Canada de 1970-1972 (Santé Canada 1998). Puisque ce sont des données tirées de mesures, nous supposons que ces valeurs tiendront compte de la benzophénone de toutes les sources potentielles (c.-à-d. agents aromatisants, emballage, présence naturelle, dans une moindre mesure, et présence dans l’environnement).
m Nous avons utilisé les données canadiennes sur la surveillance de la poussière (maximum de 225,8 µg/g, Won et Luszyk 2011) pour obtenir des estimations de la limite supérieure de l’absorption quotidienne de poussière par ingestion.
Annexe B. Estimations de l’absorption quotidienne de benzophénone par les nourrissons à partir des biberons
La concentration maximale de benzophénone dans le lait maternisé simulé a été trouvée lors de l’utilisation de nouveaux biberons et elle semble diminuer considérablement avec l’utilisation ou la migration répétée (Onghena et coll. 2016, Simoneau et coll. 2012). Bien que de nouveaux biberons peuvent être introduits en tout temps pendant la petite enfance, nous avons créé un scénario pour la première enfance – c.-à-d. de 0 à 1 mois – comme approche prudente en supposant (1) que les concentrations de benzophénone dans le lait maternisé atteindraient la plus haute moyenne signalée dans les publications scientifiques (184 µg/g) provenant de la première migration depuis les nouvelles bouteilles à 70 °C pendant deux heures (Simoneau et coll. 2012), et (2) que ce groupe d’âge ne serait nourri qu’au biberon. Nous prévoyons que conserver les concentrations associées avec la première migration dans de nouveaux biberons pour toutes les tétées pendant un mois entier serait une démarche prudente étant donné la fréquence d’utilisation (boires moyens par jour) pour ce groupe d’âge (USEPA 2008) par rapport au mode de migration (en concentration décroissante) découlant de l’utilisation répétée.
| Groupe d’âge | p.c. (kg) | Gamme de conc. moyennes (µg/kg) | Taux d’absorption moyen kg/jour) | Taux maximal d’absorption (kg/jour) | Absorption inférieure (absorp. moyenne et plus basse conc.) (µg/kg p.c./jour) | Absorption supérieure (absorp. maximale et plus haute conc.) (µg/kg p.c./jour) |
|---|---|---|---|---|---|---|
| 0 à 1 moisa | 3,9 | 9–184b | 0,644 | 1,08 | 1,5 | 51 |
Abréviations : p.c. = poids corporel; conc. = concentrations.
a D’après la masse moyenne d’un nourrisson de sexe féminin pesant 3,9 kg (NCHS 2000) et une absorption moyenne de lait maternisé de 644 g/jour et une absorption maximale de lait maternisé de 1080 g/jour (INSPQ 2001).
b Gamme des concentrations moyennes des premières migrations depuis les biberons, publiée par Mertens et coll. 2016 et Simoneau et coll. 2012.
Annexe C. Paramètres et détails des scénarios d’utilisation de produits disponibles pour les consommateurs
Nous avons estimé les expositions pour différents groupes d’âge en utilisant les facteurs d’exposition de Santé Canada (1998) pour la population générale du Canada :
- Enfants (de 5 à 11 ans) : 31,0 kg, taux d’inhalation de 14,5 m3/jour
- Adolescents (de 12 à 19 ans) : 59,4 kg, taux d’inhalation de 15,8 m3/jour
- Adultes (de 20 à 59 ans) : 70,9 kg, taux d’inhalation de 16,2 m3/jour
Nous avons dérivé les scénarios d’exposition à l’aide de ConsExpo sur le Web (2016). Le tableau C-1 donne les valeurs par défaut et les hypothèses. Pour les scénarios d’utilisation de cosmétique et de peinture, toutes les hypothèses et les valeurs par défaut proviennent de différentes références et des hypothèses par défaut de ConsExpo (RIVM 2006). Un facteur global de rétention de 1 a été utilisé, sauf mention particulière, et les fréquences sont des événements journaliers, sauf mention particulière.
| Produit et conc. | Groupe d’âge | Scénario par voie cutanée | Scénario par inhalation |
|---|---|---|---|
| Vernis à onglesa 5% |
Adulte Adolescent |
Quantité de produit sur la peau = 0,23g (0,16g sur la peau depuis 2 couches de couleur et 0,07 g depuis 1 couche supérieure) |
Quantité de produit appliquée (total, 2 couches de couleur, 1 couche supérieure) = 1,13g Durée de l’exposition ou de l’application = 53 min Surfaceb = 78,8 cm2 |
| Vernis à ongles 5% | Enfant |
Quantité de produit sur la peau = 0,06g (2 couches de couleur) |
Quantité de produit appliquée = 0,27g Durée de l’exposition = 35 min Surface = 17,6cm2 |
| Parfum 0,3%c | Adulte |
Quantité de produit sur la peau = 0,33g Fréquence (x/j) = 1,7 |
Quantité de produit appliquée = 0,33g Fréquence (x/j) = 1,7 |
| Nettoyant pour le corps 0,3%d |
Adulte Adolescent |
Quantité de produit sur la peau = 11g (adultes et adolescents) Fréquence (x/j) = 1,4 (adultes), 1,0 (ados) Facteur de rétention = 0,01 |
Non quantifiése |
| Peinture d’intérieurf 0,1 à 0,3%e | Adulte |
Taux de contact = 30mg/min Durée de libération = 120 min |
Durée de l’exposition = 132 min Quantité de produit = 3750g Surface peinte = 15m2 Durée de l’application = 120 min Taux d’inhalation = 36,7m3/jour (Exercice léger) |
| Peinture d’extérieur 0,1 à 0,3% | Adulte |
Taux de contact = 30mg/min Durée de libération = 120 min |
Comme elle est utilisée à l’extérieur, le scénario par inhalation n’est pas pris en compteg |
| Teinture 0,1 à 0,3% | Adulte |
Taux de contact = 30mg/min Durée de libération = 120 min |
Comme elle est utilisée à l’extérieur, le scénario par inhalation n’est pas pris en compteg |
a Pour les adultes, les adolescents, et les enfants, on présume que la quantité de produit sur la peau est appliquée seulement aux ongles des doigts et des orteils. On présume, également, que l’absorption se produit seulement de façon cutanée à travers la peau autour des ongles et non à travers les ongles. Les quantités de produit proviennent de Ficheux et coll. (2014), et la zone exposée a été tirée de Ficheux et coll. (2014) et RIVM (2006). Le mode de libération par évaporation et le coefficient de transfert de masse par défaut de 10 m/h, pour une matrice de poids moléculaire de 124 g/mol et une surface s’agrandissant avec le temps, ont été choisis pour l’inhalation, alors que toutes les valeurs par défaut étaient conformes à RIVM (2006) pour le vernis à ongles.
b Les surfaces de libération tiennent compte de l’aire des doigts et les orteils et la surface de chaque couche (avec un séchage entre les couches) (conformément à Ficheux et coll. (2014) et le jugement professionnel).
c Les fréquences et les quantités de produit proviennent de Loretz et coll. (2006).
d Les fréquences et les quantités de produit pour les adultes proviennent de Loretz et coll. (2006) et pour les adolescents, de Ficheux et coll. (2015).
e En raison de la courte durée d’utilisation du produit et du rinçage subséquent, l’exposition par inhalation ne devrait pas être importante.
f Les valeurs par défaut proviennent du scénario par défaut « peinture au pinceau ou au rouleau, peinture murale à l’eau » de ConsExpo’s (RIVM 2006). Le mode de libération par évaporation et le coefficient de transfert de masse par défaut de 10 m/h, avec une matrice de poids moléculaire de 120 g/mol, et une surface s’agrandissant avec le temps, et toutes les autres valeurs par défaut sont semblables au scénario par défaut d’inhalation de ConsExpo. Nous avons trouvé une concentration moyenne par événement, modélisée dans l’air, de 25,7 µg/m3 qui est supérieure à celle de 11,7 µg/m3 mesurée dans l’enceinte à air lors de l’étude du CNRC (Won et Lusztyk 2011).
g La concentration prévue dans l’air extérieur n’a pas été estimée. Les conditions météorologiques, qui peuvent être très variables et influer sur le taux de renouvellement d’air ainsi que sur la température et le volume non défini de l’endroit (infiniment grand) empêchent la quantification des expositions raisonnables par inhalation par l’air extérieur (RIVM 2007b).
