Évaluation préalable bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice (TMSS)
Titre officiel : Évaluation préalable - Bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice (TMSS)
Numéro de registre du Chemical Abstracts Service
68909-20-6
Environnement et Changement climatique Canada
Santé Canada
Mai 2022
No de cat. : En84-290/2022F-PDF
ISBN 978-0-660-42808-6
Sommaire
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministères de l’Environnement et de la Santé ont procédé à une évaluation préalable du bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice, nommé ci-après TMSS. Le numéro de registre du Chemical Abstracts Service (no CAS Note de bas de page 1 ) pour le TMSS est 68909-20-6. Cette substance est considérée comme devant être évaluée en priorité en raison de préoccupations pour la santé humaine.
Le TMSS fait partie des substances de composition inconnue ou variable, produits de réaction complexe ou matières biologiques (UVCB). Cette substance est produite par le traitement en surface de la silice amorphe synthétique pyrogénée (no CAS 112945-52-5) à l’aide de l’hexaméthyldisilazane (no CAS 999-97-3). Dans la présente évaluation, le TMSS est représenté par son principal composant (plus de 99 %), à savoir la silice amorphe synthétique pyrogénée traitée en surface.
Le TMSS n’est pas présent à l’état naturel dans l’environnement. Selon les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, la quantité importée totale déclarée au Canada en 2011 était de 212 498 kg et aucune quantité produite supérieure au seuil de déclaration de 100 kg n’a été déclarée.
Au Canada, le TMSS est principalement utilisé dans la fabrication de cosmétiques, de colles multiusages pour ciment, de peintures, de caoutchoucs de silicone, d’encres liquides ou en poudre pour imprimantes et d’appareils médicaux, ainsi que dans l’industrie, notamment dans les secteurs de l’automobile, de l’électricité et de l’électronique. Le TMSS peut être utilisé dans la fabrication de matériaux d’emballage alimentaire et entrer dans la composition d’un additif indirect utilisé dans les établissements de transformation alimentaire. Il entre aussi dans la composition de produits antiparasitaires et se retrouve, comme ingrédient non médicinal, dans des produits de santé naturels et des médicaments sans ordonnance.
Le risque que représente le TMSS pour l’environnement a été caractérisé à l’aide de la classification des risques écologiques (CRE) des substances organiques, une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de plusieurs éléments de preuve pour obtenir un classement du risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne induite par le réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte dans les profils d’exposition comprennent le taux d’émission potentiel, la persistance globale et le potentiel de transport à longue distance. Une matrice de risque permet d’attribuer aux substances un niveau de préoccupation potentielle faible, moyen ou élevé, selon leurs profils de danger et d’exposition. À la lumière des résultats de la CRE, le TMSS est considéré comme étant peu susceptible de causer des effets nocifs pour l’environnement.
Compte tenu de tous les éléments de preuve décrits dans la présente évaluation préalable, le TMSS présente un faible risque d’effets nocifs pour l’environnement. Il est conclu qu’il ne satisfait pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
D’après les renseignements disponibles concernant les effets du TMSS sur la santé et la lecture croisée des données sur les substances présentant une structure chimique et des propriétés physico-chimiques similaires, aucun effet critique n’a été constaté à la suite d’expositions par voie orale ou cutanée. Par conséquent, l’exposition par voie orale ou cutanée au TMSS, par l’intermédiaire des milieux environnementaux, des aliments ou des produits de consommation, n’est pas préoccupante.
D’après des études de laboratoire, l’exposition répétée par inhalation au TMSS peut avoir des effets nocifs sur les poumons. L’exposition par inhalation dans les milieux environnementaux devrait être minime. L’évaluation est axée sur l’exposition par inhalation au TMSS lors de l’utilisation de produits en poudre libre contenant du TMSS. En comparant l’exposition estimée au TMSS par inhalation due à l’utilisation de shampoing sec pour cheveux et de fard à joues à un niveau d’effet critique, on a pu établir des marges d’exposition jugées suffisantes pour lever les incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que le TMSS ne satisfait pas aux critères de l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que le TMSS ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada, 1999), les ministères de l’Environnement et de la Santé ont réalisé une évaluation préalable du bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice, nommé ci-après TMSS, afin de déterminer si cette substance présentait ou pouvait présenter un risque pour l’environnement ou la santé humaine. Cette substance a été jugée d’intérêt prioritaire en raison de préoccupations pour la santé humaine (ECCC, SC [modifié en 2017]).
Les nanomatériaux manufacturés composés de TMSS ou en contenant ne sont pas explicitement pris en compte dans les scénarios d’exposition pour la présente évaluation, mais les produits de consommation examinés pour la caractérisation de l’exposition peuvent comprendre une fraction de ces nanosubstances. De plus, les effets sur la santé associés au TMSS à l’échelle nanométrique peuvent ne pas être explicitement pris en compte par la présente évaluation. Tout risque posé par le TMSS à l’échelle nanométrique pourrait faire l’objet d’un examen séparé à une date ultérieure.
Le risque environnemental associé au TMSS a été caractérisé à l’aide de l’approche de la classification des risques écologiques (CRE) des substances organiques (ECCC, 2016a). La CRE décrit le danger associé à une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne induite par le réseau trophique, la biodisponibilité et l’activité biologique et chimique, et tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en fonction de facteurs tels que le taux d’émissions potentielles, la persistance globale et le potentiel de transport à grande distance dans l’atmosphère. La combinaison des divers éléments de preuve permet de déterminer les substances nécessitant une évaluation approfondie de leur potentiel d’effets nocifs pour l’environnement ou présentant une faible probabilité d’effets nocifs pour l’environnement.
La présente évaluation préalable tient compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, ainsi que des renseignements supplémentaires soumis par les intervenants. Des données pertinentes relatives au TMSS ont été trouvées jusqu’en février 2019. Des données additionnelles ont été présentées par des intervenants jusqu’en avril 2019. Les données empiriques provenant d’études clés ainsi que les résultats de la modélisation ont servi à tirer les conclusions proposées. Quand ils étaient disponibles et pertinents, nous avons tenu compte de renseignements présentés dans des évaluations menées par d’autres autorités.
Les responsables du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada ont rédigé la présente évaluation préalable qui intègre la contribution d’autres programmes menés par ces deux ministères. Les parties de la présente évaluation portant sur la santé humaine ont fait l’objet d’un examen ou de consultations externes. Des commentaires sur les aspects techniques pertinents pour la santé humaine ont été reçus de Christine F. Chaisson, Judy S. LaKind et Claudia Fruijtier-Pölloth, de Risk Sciences International inc. Le volet écologique de cette évaluation est basé sur le document de la CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe et d’une consultation publique de 60 jours. De plus, l’ébauche de la présente évaluation préalable (publiée le 19 septembre 2020) a été soumise à une consultation publique de 60 jours. Bien que les commentaires de l’extérieur aient été pris en compte, le contenu définitif et les résultats de la présente évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente évaluation préalable repose sur des renseignements permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. Pour ce faire, les renseignements scientifiques ont été étudiés et intégrés à une approche fondée sur le poids de la preuve et le principe de prudence. Note de bas de page 2 Cette évaluation préalable présente les informations et considérations essentielles sur lesquelles se fonde la conclusion proposée.
2. Identité de la substance
Aux fins du présent document, cette substance est appelée TMSS, et elle figure sur la Liste intérieure des substances (LIS) sous le nom « bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice ». Le Tableau 2-1 présente le no CAS de la substance, son nom dans la LIS et son nom commun (TMSS).
| No CAS | Nom dans la LIS (nom commun) | Structure chimique représentativea | Masse moléculaire (g/mol) |
|---|---|---|---|
| 68909-20-6 | Bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice (TMSS) | 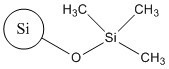 |
S. o. |
Abréviation : S. o. = sans objet.
a Le TMSS fait partie des substances de composition inconnue ou variable, produits de réaction complexe ou matières biologiques (UVCB).
Le TMSS fait partie des UVCBNote de bas de page 3 ; il est produit par traitement en surface de la silice amorphe synthétique pyrogénée (no CAS 112945-52-5) avec de l’hexaméthyldisilazane (no CAS 999-97-3) (Becker et coll., 2013; SCCS 2015). Dans la présente évaluation, cette substance est représentée par son principal composant (plus de 99 %), à savoir la silice amorphe synthétique pyrogénée traitée en surface (Santé Canada, 2019).
La silice amorphe synthétique (SAS) se distingue de la silice cristalline et de la silice amorphe naturelle, mais partage le même no CAS avec ces dernières (7631-86-9) (Martin, 2007; Fruijtier-Pölloth, 2016). En général, la SAS peut désigner diverses formes non traitées de silice amorphe synthétique, produites par la méthode humide (c.-à-d. la SAS colloïdale et précipitée) ou la méthode thermique (c.-à-d. la SAS pyrogénée), ou leurs dérivés traités en surface (ECETOC, 2006; Environnement Canada, Santé Canada, 2013a). Toutefois, dans le cadre de la présente évaluation, l’acronyme SAS en lui-même ne désigne que la silice amorphe synthétique non traitée (c’est-à-dire la SAS colloïdale, précipitée et pyrogénée).
2.1 Choix des analogues et utilisation de modèles QSAR
Une approche par lecture croisée utilisant des données relatives à des analogues a permis d’évaluer les effets sur la santé humaine. On a sélectionné des analogues qui étaient structurellement similaires aux substances de ce groupe (c.-à-d. de propriétés physico-chimiques et toxicocinétiques similaires) et pour lesquels on disposait de données empiriques pertinentes pouvant être utilisées pour effectuer une lecture croisée avec des substances pour lesquelles les données empiriques sont limitées.
Les données de lecture croisée utilisées pour éclairer l’évaluation des effets du TMSS sur la santé humaine sont décrites plus en détail dans les sections pertinentes du présent rapport. Le Tableau 2-2 présente des renseignements sur l’identité et les structures chimiques des analogues utilisés pour éclairer l’évaluation des effets sur la santé humaine.
| No CAS | Nom dans la LIS (nom commun) | Formule empirique générale ou structure représentative | Masse moléculaire (g/mol) |
|---|---|---|---|
| 112926-00-8 | Gel de silice, précipité, exempt de cristaux (SAS colloïdale et SAS précipitée) | nSiO2 | 60,08a |
| 112945-52-5 | Silice, amorphe, sublimée, exempte de cristaux (SAS pyrogénée) | nSiO2 | 60,08a |
| 68611-44-9b | Produits de réaction du dichlorodiméthylsilane et de la silice (silice de diméthyle silylate) | 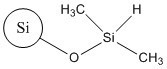 |
S. o. |
Abréviation : S. o. = sans objet.
a Masse moléculaire du SiO2
b La silice de diméthyle silylate fait partie des UVCB et n’est pas un produit chimique distinct. Elle peut donc être caractérisée par une variété de structures. Le tableau ci-dessus présente la structure représentative de sa surface où certains des groupes hydroxyles de la surface sont remplacés par des groupes diméthylsilyles.
Les analogues comprennent la SAS colloïdale non traitée et la SAS précipitée, ainsi que la SAS pyrogénée non traitée. Cette dernière est un composé précurseur du TMSS (substance cible) et de la silice de diméthyle silylate (analogue). La silice de diméthyle silylate est un dérivé de la silice dans lequel la surface de la silice pyrogénée a été modifiée par l’ajout de groupes diméthylsilyles, contrairement au TMSS (substance cible) dont la surface a été modifiée par l’ajout de groupes triméthylsiloxys (Becker et coll., 2013).
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques du TMSS et de ses analogues est présenté dans le Tableau 3-1. D’autres propriétés physiques et chimiques sont présentées dans un document d’ECCC (2016b).
Le traitement en surface de la SAS ne modifie pas ses propriétés solides, dont la taille des particules primaires. Toutefois, le traitement en surface modifie ses propriétés physiques et chimiques, notamment l’hydrophobie et la réduction de l’absorption d’humidité, en fonction du type et de l’importance du traitement en surface (ECETOC, 2006; Langer et coll., 1958). Le niveau de traitement du TMSS peut varier et entraîner une modification d’une plage de propriétés physico-chimiques, y compris l’accroissement ou la diminution du caractère hydrophobe de la substance. Par conséquent, l’utilisation d’analogues qui couvrent cette plage permet une caractérisation plus complète des propriétés physiques et chimiques du TMSS ainsi que de son devenir et de son comportement dans l’environnement. Les propriétés physiques et chimiques ainsi que les données toxicologiques de ces analogues figurent à l’annexe A.
| Propriété | TMSS | SAS non traitée | Silice de diméthyle silylate | Principales références |
|---|---|---|---|---|
| Point de fusion (°C) | 1700 | 1700 | 1700 | Environnement Canada, Santé Canada, 2013a; OCDE, 2004 |
| Point d’ébullition (°C) | 2300 | 2230 | N. d. | Environnement Canada, Santé Canada, 2013a; ESIS, c1995–2009 |
| Pression de vapeur (mm Hg à 20 °C) | Négligeable | Négligeable | Négligeable | SCCS, 2015; OCDE, 2004; US EPA, 2011 |
| Solubilité dans l’eau (mg/L) | < 0,01 (négligeable) | 15 – 68 (à 20 °C et à pH compris entre 5,5 et 6,6) | < 0,0001 (négligeable) | Becker et coll., 2013; OCDE, 2004; US EPA, 2011 |
| Masse volumique (kg/m3 à 20 °C) | 2200 | 2200 | 2000 | Environnement Canada, Santé Canada, 2013a; OCDE, 2004; ESIS, c1995–2009 |
| Masse volumique apparente (substance tassée; en kg/m3) | 100 – 300 | 50 – 320 | 30 – 50 | Environnement Canada, Santé Canada, 2013a; OCDE, 2004; ESIS, c1995–2009 |
| Taille des particules primaires (nm) | 5 – 20a | 5 – 50 (pyrogénée) 5 – 100 (précipitée) | 10 – 50b | Fruijtier-Pölloth, 2012; ECETOC, 2006; SCCS, 2015 |
| Taille des agrégats (nm) | 100 – 1000a | 100 – 1000 | < 5000b | Fruijtier-Pölloth, 2012; ECETOC, 2006; SCCS, 2015 |
| Taille des agglomérats (nm) | Pour la plupart > 125 000a | 1 000 - 250 000 | N. d. | Fruijtier-Pölloth, 2012; ECETOC, 2006 |
Abréviation : n. d. = non disponible
a Taille des particules primaires de la SAS traitée en surface (Fruijtier-Pölloth, 2012). La taille des particules primaires de TMSS peut également se situer dans la plage de 6,9 à 8,6 nm (ECHA, 2016), ce qui correspond à la plage de tailles générique pour les particules primaires de SAS traitée en surface (5 – 20 nm).
b Plage des tailles des particules de silice pyrogénée hydrophobe (SCCS, 2015).
La taille des particules primaires de SAS traitée en surface varie de 5 nm à 20 nm (Fruijtier-Pölloth, 2012). Toutefois, les particules primaires devraient former des agrégats (100 - 1 000 nm) ou des agglomérats (principalement > 125 000 nm) lors des processus de fabrication et de modification de la surface (Fruijtier-Pölloth, 2012; Environnement Canada, Santé Canada, 2013a).Note de bas de page 4 Note de bas de page 5 Ainsi, le TMSS devrait exister principalement sous forme d’agrégats ou d’agglomérats après sa fabrication.
4. Sources et utilisations
Le TMSS n’est pas présent à l’état naturel dans l’environnement. Selon les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE, la quantité totale importée déclarée au Canada en 2011 était de 212 498 kg et aucune quantité produite n’a été déclarée (Environnement Canada, 2013).Note de bas de page 6 Au Canada, le TMSS est principalement utilisé comme charge, agent de suspension, émollient et additif dans la fabrication de cosmétiques, d’écrans solaires, de colles multiusages pour ciment, de peintures, de caoutchoucs de silicone, d’encres liquides ou en poudre pour imprimantes et d’appareils médicaux (Environnement Canada, 2013; MSDS, 2016; CosIng, 2019). On l’utilise également dans diverses industries, notamment dans les secteurs de l’automobile, de l’électricité et de l’électronique (Environnement Canada, 2013). Le TMSS est un agent d’épaississement utilisé dans les pâtes et pommades pour empêcher la séparation des composants et maintenir la fluidité des produits en poudre (OCDE, 2004).
Le Tableau 4-1 présente un résumé des autres utilisations du TMSS au Canada.
| Utilisation | TMSS |
|---|---|
| Additif indirectab | Oui |
| Matériaux d’emballage alimentaireba | Oui |
| Ingrédient non médicinal dans les désinfectants et les médicaments à usage humain ou vétérinairec | Oui |
| Ingrédient non médicinal dans les produits de santé naturelsd | Oui |
| Avis de présence possible dans les cosmétiques en vertu du Règlement sur les cosmétiquese | Oui |
| Produit de formulation dans des produits antiparasitaires homologuésf | Oui |
a Bien qu’ils ne soient pas définis dans la Loi sur les aliments et drogues (LAD), les additifs indirects peuvent être considérés, à des fins administratives, comme des substances utilisées dans les usines de transformation des aliments et susceptibles de devenir des résidus fortuits dans les aliments (p. ex., nettoyants, désinfectants).
b Communication personnelle; courriels de la Direction des aliments, Santé Canada (SC), adressés au Bureau de l’évaluation des risques des substances existantes (BERSE), SC, et datés du 8 octobre 2018 et du 11 février 2019; sans référence.
c Communication personnelle; courriels de la Direction des produits thérapeutiques (DPT), SC, adressés au BERSE, SC, et datés du 1er octobre 2018 et du 14 février 2019; sans référence.
d Communication personnelle; courriels de la Direction des produits de santé naturels et sans ordonnance (DPSNSO), SC, adressés au BERSE, SC, et datés du 5 octobre 2018 et du 25 février 2019; sans référence.
e Communication personnelle; courriels de la Direction de la sécurité des produits de consommation et des produits dangereux (DSPCPD), SC, adressés au BERSE, SC, et datés du 9 octobre 2018 et du 14 février 2019; sans référence.
f Communication personnelle; courriel de l’Agence de réglementation de la lutte antiparasitaire (ARLA), de SC, adressé au BERSE, de SC, et daté du 22 octobre 2018; sans référence.
Le TMSS peut servir à fabriquer des matériaux d’emballage alimentaire. Le TMSS peut également entrer dans la composition d’un additif indirect (lubrifiant) utilisé dans les établissements de transformation alimentaire (communication personnelle; courriels de la Direction des aliments, SC, adressés au BERSE, SC, et datés du 8 octobre 2018 et du 11 février 2019; sans référence). Le TMSS est utilisé comme ingrédient non médicinal dans les écrans solaires en tant qu’agent de protection solaire (communication personnelle; courriels de la DPT, SC, adressés au BERSE, SC, et datés du 1er octobre 2018 et du 14 février 2019; sans référence) et comme agent antimousse, de gonflement, de conditionnement de la peau et de suspension (communication personnelle; courriels de la DPSNSO, SC, adressés au BERSE, SC, et datés du 5 octobre 2018 et du 25 février 2019; sans référence). D’après les avis présentés conformément au Règlement sur les cosmétiques à Santé Canada, le TMSS est également utilisé dans certains cosmétiques au Canada, principalement dans les maquillages, les hydratants, les produits de coiffure ou de shampoing et les vernis à ongles. Les principaux types de formulation comprennent les poudres libres, les poudres comprimées, les pains solides, les onguents/baumes semi-solides, les lotions, les gels, les crèmes et les formulations liquides (communication personnelle; courriels de la DSPCPD, SC, adressés au BERSE, SC, et datés du 9 octobre 2018 et du 14 février 2019; sans référence).
5. Risque d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Le risque environnemental associé au TMSS a été caractérisé à l’aide de l’approche de la classification des risques écologiques (CRE) des substances organiques (ECCC, 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de plusieurs éléments de preuve pour classer les risques. Les divers éléments de preuve sont rassemblés pour que l’on puisse distinguer des autres substances celles qui présentent une toxicité faible ou élevée et un risque d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude globale liée à la caractérisation des risques par rapport à une approche reposant sur un seul paramètre mesuré dans un seul milieu (p. ex. la concentration létale médiane [CL50]). Les paragraphes suivants résument l’approche, décrite en détail dans un document d’ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et fabriqués au Canada proviennent de publications scientifiques, de bases de données empiriques accessibles (p. ex., la boîte à outils QSAR de l’OCDE, 2014), et des réponses aux enquêtes menées conformément à l’article 71 de la LCPE, ou ont été produites à l’aide de modèles QSAR (relation quantitative structure-activité) ou de modélisations du devenir du bilan massique ou de la bioaccumulation. Ces données ont été utilisées soit pour alimenter d’autres modèles de bilan massique, soit pour compléter les profils des risques et de l’exposition des substances.
Les profils de danger ont été principalement basés sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne induite par le réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont également été basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à longue distance. La comparaison des profils de danger et d’exposition avec les critères de décision a permis de classer le danger et le risque d’exposition associé à chaque substance selon qu’ils étaient faibles, moyens ou élevés. D’autres règles ont été appliquées (p. ex. constance du classement, marge d’exposition) pour affiner les classements préliminaires du risque et de l’exposition.
Une matrice de risque a permis d’attribuer à chaque substance un niveau de risque faible, moyen ou élevé, selon son profil de danger et d’exposition. Les classifications du risque au moyen de la CRE ont été vérifiées à l’aide d’une approche à deux étapes. La première étape a consisté à modifier à la baisse la classification du risque (qui passe de modéré ou élevé à faible) des substances présentant une valeur estimée faible du taux d’émission dans l’eau après traitement des eaux usées, ce qui représente un faible risque d’exposition. La deuxième étape a consisté à revoir les résultats de classification faible à la lumière de scénarios de risque relativement prudents à l’échelle locale (c. à d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si la classification du risque devrait être reclassée à un niveau supérieur.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’une surclassification ou d’une sous-classification du danger, de l’exposition et du risque subséquent. Les approches équilibrées utilisées pour réduire les incertitudes sont décrites en détail dans un document d’ECCC (2016a). Deux des domaines d’incertitude les plus importants sont décrits ci-dessous. Une erreur dans les valeurs de toxicité aiguë empiriques ou modélisées peut modifier la classification du danger, notamment si les paramètres sont fondés sur les valeurs de résidus dans les tissus (c.-à-d. le mode d’action toxique), dont bon nombre sont des valeurs estimées à l’aide de modèles QSAR (boîte à outils QSAR de l’OCDE, 2014). Les répercussions de ce type d’erreur sont toutefois atténuées par le fait qu’une surestimation de la CL50 donnera une valeur prudente (protectrice) de résidus dans les tissus qui servira à l’analyse des résidus corporels critiques. L’erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres du danger tels que la structure associée au mode d’action, la réactivité ou l’affinité de liaison aux œstrogènes. Les changements ou erreurs touchant les quantités de substances chimiques peuvent conduire à des classifications différentes de l’exposition, car la classification de l’exposition et du risque est très sensible au taux d’émission et aux quantités utilisées. Les classifications obtenues au moyen de la CRE reflètent donc l’exposition et le risque au Canada, compte tenu des quantités vraisemblablement utilisées actuellement, mais pourraient ne pas rendre compte des tendances futures.
Les données et les éléments critiques pris en compte pour développer les profils propres au TMSS, ainsi que les résultats de la classification du danger, de l’exposition et des risques sont présentés dans ECCC (2016b).
Selon les informations prises en compte dans le cadre de la CRE, le TMSS a été classé comme substance à potentiel d’exposition élevé en raison de sa forte persistance globale (somme des demi-vies d’un produit chimique dans tous les milieux, pondérée selon la fraction massique de la substance déterminée à l’aide d’une modélisation multimédia du devenir) et des grandes quantités importées annuellement, selon les renseignements soumis lors d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). Le TMSS a été classé comme substance présentant un faible potentiel de danger et un faible risque pour l’environnement. Bien que les modes d’utilisation actuels donnent lieu à un potentiel d’exposition élevé, et compte tenu du faible potentiel de danger, il est peu probable que le TMSS suscite des préoccupations environnementales au Canada.
6. Potentiel d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
La présente évaluation de l’exposition porte sur les voies d’exposition pour lesquelles des effets critiques ont été constatés (c.-à-d. l’inhalation). Aucun effet critique sur la santé pour des expositions orales et cutanées au TMSS n’a été observé et celles-ci n’ont donc pas été quantifiées.
6.1.1 Milieux naturels et alimentation
Aucune donnée sur les concentrations mesurées de TMSS n’a été trouvée dans les aliments ou les milieux environnementaux pertinents au Canada ou ailleurs. D’après ses propriétés physiques et chimiques, le TMSS devrait être présent principalement dans les sols et les sédiments lorsqu’il est rejeté dans l’environnement (OCDE, 2004). Lorsqu’il est rejeté dans l’air, le TMSS devrait se déposer dans les eaux de surface et les sols en raison de sa masse volumique élevée et de sa pression de vapeur négligeable. S’il est rejeté dans les eaux de surface ou dans l’environnement terrestre, il devrait se répartir dans les sédiments ou rester dans les sols, respectivement, en raison de sa solubilité négligeable dans l’eau, de sa masse volumique élevée et de sa stabilité chimique (Environnement Canada, Santé Canada, 2013a). Ainsi, l’exposition au TMSS par l’intermédiaire de l’air ambiant et de l’eau potable ne devrait pas être importante.
Le TMSS peut être utilisé dans la fabrication de matériaux d’emballage alimentaire, ce qui induit un risque de contact direct avec les aliments. Le risque d’exposition au TMSS qui en résulte est censé être négligeable. Le TMSS peut également entrer dans la composition d’un additif indirect (lubrifiant) utilisé dans les établissements de transformation alimentaire, sans être directement en contact avec les aliments; il ne devrait donc pas y avoir de risque d’exposition (communication personnelle; courriels de la Direction des aliments, SC, adressés au BERSE, SC, et datés du 8 octobre 2018 et du 11 février 2019; sans référence).
6.1.2 Produits de consommation
L’exposition de la population générale au TMSS peut résulter de son utilisation, notamment dans les cosmétiques, les produits de santé naturels et médicaments sans ordonnance, les colles multiusages pour ciment et les peintures. Il existe un risque d’exposition orale résultant de l’utilisation de brillant à lèvres. De même, il existe un risque de contact cutané avec le TMSS en raison de l’utilisation de cosmétiques, de produits de santé naturels et médicaments sans ordonnance, de colles multiusages pour ciment et de peintures. Cependant, l’exposition par les voies orale et cutanée n’est pas quantifiée, car aucun effet critique sur la santé n’a été constaté pour le TMSS par ces voies d’exposition.
La caractérisation de l’exposition est axée sur les produits de consommation qui présentent un potentiel d’inhalation de TMSS inhalable insoluble, par exemple les cosmétiques formulés sous forme de poudres libres (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 9 octobre 2018 et 14 février 2019; sans référence).
L’utilisation de shampoing sec et de fard à joues a été considérée comme un scénario sentinelle, car ces produits contiennent la plus forte concentration de TMSS parmi les cosmétiques disponibles au Canada, et ils sont formulés sous forme de poudres libres. Les produits sous forme de poudres comprimées (p. ex., le maquillage pour visage) n’ont pas été considérés comme étant des sources potentielles d’exposition préoccupantes, car leur utilisation n’est pas censée entraîner la formation d’un « nuage de poussière » inhalable. Ces produits contiennent des particules plus grossières et des liants tels que des huiles ou des cires, qui aident à retenir les particules entre elles (Kogel et coll., 2006). En outre, les produits sous forme liquide ou pâteuse (p. ex., les adhésifs et les peintures pour pinceau ou rouleau) n’ont pas été considérés comme étant associés à un risque d’exposition par inhalation, car le TMSS n’est pas censé s’évaporer de la surface sur laquelle les produits sont appliqués, en raison de sa pression de vapeur négligeable. En outre, les peintures pour pinceau ou rouleau ne produisent pas de grandes quantités de gouttelettes de pulvérisation, et la plupart des gouttelettes ne seraient pas inhalables (Environnement Canada, Santé Canada, 2013b).
Anderson et coll. (2017) et Rasmussen (2019) ont mesuré les concentrations atmosphériques de particules d’un diamètre aérodynamique moyen de 4 μm ou moins (PM4) lors de l’utilisation de poudre pour le visage ou le corps contenant du talc. Cette étude a été considérée comme une étude de substitution appropriée pour estimer l’exposition au TMSS. Elle a été jugée appropriée en raison de la pertinence du type d’application du produit et de la similarité des propriétés physiques et chimiques du TMSS et du talc, p. ex., le point de fusion, la pression de vapeur et la solubilité dans l’eau.
Anderson et coll. (2017) ont mené une étude pour caractériser les concentrations de poussière inhalable en suspension dans l’air lors de l’utilisation de produits de talc durant les années 1960 et 1970. Des dispositifs d’échantillonnage de l’air à cyclone capturant les particules PM4 étaient fixés dans la zone de respiration de cinq volontaires. Les concentrations moyennes de PM4 au cours de la simulation d’exposition de 48 minutes ont été calculées à partir de la masse totale mesurée (correspondant à 8 applications) et du volume d’air sur toute la période d’échantillonnage. Les concentrations de PM4 inhalables variaient de 0,26 à 5,03 mg/m3, la moyenne étant de 1,46 mg/m3. La concentration moyenne dans l’air par sujet était comprise entre 0,44 et 3,28 mg/m3.
En 2018, Santé Canada a mené une petite étude afin de mesurer les concentrations de particules dans l’air de la zone respiratoire de volontaires adultes pendant qu’ils appliquaient des produits de soins personnels contenant du talc (Rasmussen et coll., 2019). Des moniteurs de zone de respiration personnelle à lecture directe et en continu (placés à côté du nez) ont mesuré des concentrations moyennes de PM4 de 0,48 ± 0,18 mg/m3 et 1,80 ± 0,82 mg/m3 chez deux volontaires s’appliquant respectivement de la poudre sur le corps (sujet A) et de la poudre libre sur le visage (sujet B). Les sujets se sont appliqué de la poudre à trois reprises. Ces concentrations moyennes se situent dans la plage des concentrations mesurées par Anderson et coll. (2017). Les concentrations moyennes dans l’air par sujet, obtenues par Anderson et coll. (2017), ont été combinées avec les données pour les poudres corporelle et faciale obtenues parallèlement par Rasmussen et coll. (2019), ce qui a donné une concentration moyenne globale dans l’air de 1,36 ± 0,97 mg/m3 pouvant être inhalée pendant l’utilisation des cosmétiques (annexe B, tableau B-1).
La valeur moyenne de la concentration dans l’air de 1,36 mg/m3 a été utilisée pour estimer les concentrations dans l’air ajustées, lors de l’utilisation de shampoing sec et de fard à joues contenant du TMSS. Le Tableau 6-1 présente un résumé des résultats. Les intrants et les facteurs d’ajustement pour ces scénarios sont décrits à l’annexe B (tableau B-1). Ces estimations de l’exposition sont jugées prudentes, car, en raison de la taille des particules de TMSS dans les cosmétiques, elles peuvent ne pas être entièrement inhalables (communication personnelle; courriels de la DSPCPD, SC, adressés au BERSE, SC, et datés du 27 mai 2019; sans référence). La plage granulométrique des particules de TMSS dans les poudres libres peut aller des particules inhalables aux particules non inhalables, en raison de leur agglomération.
| Scénario | Concentration maximale | Concentration dans l’air par événement (mg/m3)b | Concentration d’exposition ajustée (mg/m3)c | Concentration d’exposition ajustée de niveau supérieur (mg/m3)d |
|---|---|---|---|---|
| Shampoing sec | 100 %a | 1,36 | 0,019 (MPT de six heures) | 0,0011 (exposition continue) |
| Fard à joues | 30 %a | 0,408 | 0,0057 (MPT de six heures) | 0,0014 (exposition continue) |
Abréviation : MPT = moyenne pondérée dans le temps
a Communication personnelle; courriels de la DSPCPD, SC, adressés au BERSE, SC, et datés du 9 octobre 2018 et du 14 février 2019; sans référence.
b Valeur moyenne de la concentration dans l’air mesurée en mg/m3 (Anderson et coll., 2017; Rasmussen et coll., 2019) × concentration maximale de TMSS (%) dans le produit.
c Les estimations de l’exposition par inhalation, par événement, ont été amorties sur une période de six heures en multipliant la valeur « durée de l’exposition/6 heures » afin de l’aligner avec la durée du traitement par jour (par inhalation) dans l’étude de toxicité. La durée de l’exposition dans les deux scénarios est de cinq minutes.
d Les estimations de l’exposition par inhalation, par événement, pour le TMSS ont été ajustées pour donner une estimation de l’exposition continue (24 heures/jour, 7 jours/semaine) pour le scénario d’exposition chronique conformément aux lignes directrices de l’EPA sur l’évaluation des risques par inhalation (US EPA, 2009; voir l’annexe B pour en savoir plus).
6.2 Évaluation des effets sur la santé
Les données toxicologiques sont limitées pour le TMSS. L’évaluation des effets du TMSS sur la santé s’est également appuyée sur la lecture croisée des données relatives aux analogues, à la silice de diméthyle silylate et à la SAS (colloïdale, précipitée et pyrogénée). Entre autres critères d’effet, ces analogues ont été utiles pour estimer la toxicité potentielle du TMSS par voie orale et cutanée, ainsi que l’élimination et la toxicité à court terme du TMSS par inhalation.
La SAS et la SAS traitée en surface, y compris le TMSS, ont été évaluées par le Centre européen d’écotoxicologie et de toxicologie des produits chimiques (ECETOC 2006). Les effets de la silice de diméthyle silylate sur la santé ont été caractérisés par l’EPA (US EPA 2011). Au niveau international, la SAS et la SAS traitée en surface ont fait l’objet d’un rapport d’évaluation initiale (SIAR) sur des ensembles de données d’évaluation (SIDS) (OCDE, 2004) rédigé par les responsables du Programme d’évaluation coopérative des produits chimiques de l’Organisation pour la coopération et le développement économiques (OCDE) et ont été étudiées par le Comité scientifique pour la sécurité des consommateurs de la Commission européenne (SCCS, 2015). La silice de diméthyle silylate est l’analogue qui ressemble le plus au TMSS, car ces deux substances sont toutes deux des SAS pyrogénées traitées en surface, mais la base de données connexe est limitée (p. ex., il n’y a pas d’étude de la toxicité cutanée). La SAS colloïdale, la SAS précipitée et la SAS pyrogénée ont également été utilisées comme analogues.
TMSS
Dans une étude d’exposition par inhalation (corps entier ou nez seulement – non indiqué) de 13 semaines, des rats Wistar (10/sexe/groupe) ont été exposés au TMSS (taille moyenne des particules de 2,8 à 4,5 µm) à une concentration de 0, 0,51, 2,05 ou 10,01 mg/m3 six heures par jour et cinq jours par semaine (Wacker, 1998 a, b; cité dans ECETOC, 2006). À 10,01 mg/m3, on a constaté une augmentation des niveaux de protéines totales, d’aspartate-aminotransférase et de phosphatase alcaline dans le liquide de lavage des poumons, une augmentation des neutrophiles, des macrophages/monocytes et des lymphocytes. L’exposition à 10,01 mg/m3 de TMSS a également augmenté le poids absolu et relatif des poumons et des ganglions lymphatiques trachéobronchiques. L’examen histologique a révélé une accumulation de macrophages alvéolaires avec peu de cellules polymorphonucléaires, une hyperplasie épithéliale bronchiolaire-alvéolaire, des infiltrations de cellules inflammatoires interstitielles dans les poumons, et une augmentation de l’histiocytose et des agrégats de macrophage dans les ganglions lymphatiques médiastinaux dans le groupe ayant reçu 10,01 mg/m3. Le traitement n’a pas provoqué de fibrose interstitielle. À la dose de 2,05 mg/m3, les effets étaient limités à une augmentation du nombre relatif de neutrophiles avec une diminution du nombre relatif de macrophages/monocytes sans affecter le nombre absolu de cellules. Cela n’a pas été jugé important sur le plan toxicologique. Une concentration sans effet nocif observé (CSENO) de 2,05 mg/m3 a été déterminée dans la présente évaluation.
Dans une étude d’exposition par inhalation à doses répétées avec peu de détails, des rats et des singes cynomolgus ont été exposés au TMSS à des concentrations de 0, 10, 50 ou 150 mg/m3 (taille des particules non indiquée) six heures par jour et cinq jours par semaine, pendant une période allant jusqu’à 12 mois [Dow Corning, 1972, cité dans ECETOC, 2006]. Aucun effet n’a été observé à 10 mg/m3. L’exposition à 50 et 150 mg/m3 a provoqué une agrégation de macrophages mousseux dans les alvéoles chez le rat et une fibrose interstitielle chez le singe.
Le TMSS n’était pas génotoxique dans les essais de mutation bactérienne in vitro ou d’aberration chromosomique in vitro (Cabot, 1994a, b, c, 1995; cité dans ECETOC, 2006).
Silice de diméthyle silylate
Les études toxicocinétiques se sont limitées à des études d’élimination des substances chez le rat. Les études d’élimination de la silice de diméthyle silylate (Degussa, 1964; cité dans Becker et coll., 2013) ont été menées chez des rats exposés à de la silice de diméthyle silylate en aérosol (200 mg/m3, taille des particules non indiquée), cinq heures par jour pendant 3 jours (Degussa, 1964; cité dans Becker et coll., 2013). Du silicium dans les poumons a été détecté 24 heures après la dernière exposition, mais aucune trace de silicium n’a été détectée un mois après l’exposition. La substance d’essai a été détectée dans les ganglions lymphatiques médiastinaux, mais elle a diminué progressivement un à trois mois après l’exposition. Au bout de trois mois, 81 % de la substance d’essai avait été éliminé des poumons.
Dans une étude de six mois par voie orale, des rats Wistar (40/sexe/dose) ont reçu de la silice de diméthyle silylate dans le régime alimentaire à raison de 0 ou 500 mg/kg p.c./j (US EPA, 2011). Des signes cliniques et les poids corporels ont été consignés pendant toute l’étude. Des prélèvements sanguins ont été effectués chaque mois sur 10 rats/sexe et les paramètres hématologiques ont été examinés. Tous les rats ont fait l’objet d’une autopsie et un examen histopathologique a été effectué à la fin de l’étude. La dose sans effet nocif observé (DSENO) a été considérée par l’US EPA (2011) comme étant la seule dose testée, soit 500 mg/kg p.c./j.
Dans une étude d’exposition par inhalation de 2 semaines, des rats Wistar (10/sexe/groupe) ont été exposés à un aérosol de silice de diméthyle silylate (taille des particules inférieure à 10 μm) par inhalation (corps entier) aux concentrations de 0, 31, 87 ou 209 mg/m3 six heures par jour et cinq jours par semaine (US EPA, 2011). Des changements pathologiques (granulomes, cellularité focale accrue du septum et accumulation de macrophages alvéolaires) dans les poumons ont été observés dans tous les groupes traités. Une diminution de la prise de poids corporel et des modifications des paramètres hématologiques (augmentation du nombre de globules rouges, du volume de cellules entassées et de l’hémoglobine) ont été observées chez les animaux à 87 et 209 mg/m3. La concentration minimale entraînant un effet nocif observé (CMENO) de 31 mg/m3 a été établie par l’EPA à partir des observations histopathologiques effectuées dans les poumons.
Dans une étude d’exposition par inhalation de 13 semaines, des rats Wistar (10/sexe/groupe) ont été exposés à un aérosol de silice de diméthyle silylate (taille des particules inférieure à 10 μm) par inhalation (corps entier) aux concentrations de 0 ou 35 mg/m3 six heures par jour et cinq jours par semaine (US EPA, 2011). À la dose de 35 mg/m3, on a observé des modifications dans les poumons, notamment des lésions (tissus spongieux et surfaces tachetées) et des changements histopathologiques (granulomes, fibrose interstitielle). Ces modifications étaient plus graves que les effets pulmonaires observés dans l’étude d’exposition par inhalation de deux semaines à la silice de diméthyle silylate, ce qui semble indiquer une réponse de longue durée.
Dans une étude de toxicité pour la reproduction sur une génération par voie orale, des rats Wistar (10 femelles et deux mâles/groupe préaccouplement, cinq femelles pour un mâle/groupe ayant reçu une dose) ont reçu de la silice de diméthyle silylate dans le régime alimentaire à raison de 0 ou 500 mg/kg p.c./j pendant 8 ou 17 semaines avant l’accouplement, lors de l’accouplement, pendant la gestation (femelles seulement) et la lactation (femelles seulement) (US EPA, 2011). Le traitement n’a eu aucun effet sur l’apparence, le comportement, la prise de poids corporel et la consommation alimentaire des animaux parents. Les animaux des groupes traités (aussi bien ceux issus d’un accouplement après huit semaines de dose que ceux issus d’un accouplement après 17 semaines de dose) n’ont présenté aucune différence sur le plan de la performance de la reproduction, du poids des organes reproducteurs ou de la fertilité par rapport aux témoins. Aucun effet n’a été observé chez les descendants.
La silice de diméthyle silylate n’était pas génotoxique in vitro dans les essais de mutation bactérienne ou d’aberration chromosomique (US EPA, 2011). Dans une étude limitée de deux ans sur la cancérogénicité par voie orale (il n’y a pas eu de témoins concurrents; dose unique), la silice de diméthyle silylate a été administré dans le régime alimentaire de rats Wistar (20/sexe) à raison de 100 mg/kg p.c./j. Les résultats ont été comparés aux données historiques sur les témoins, et aucun effet de cancérogénicité ou autre lié au traitement n’a été observé (US EPA, 2011).
SAS (SAS colloïdale, précipitée et pyrogénée)
Les données de toxicocinétique sur la SAS étaient limitées. L’absorption de SAS précipitée (15 μm) et de SAS pyrogénée (sans cristaux, dont la taille des particules était comprise entre 0,010 et 0,040 μm) par voie orale a été examinée chez les humains (Langendorf et Lang, 1967; cité dans EFSA, 2018). Des volontaires (cinq hommes et une femme, 22 à 28 ans, sans régime témoin) ont ingéré 2 500 mg de SAS dans du jus de pomme. Les urines totales ont été recueillies pendant trois jours avant l’application (valeurs témoins) et pendant quatre jours après l’application pour chaque personne, et la teneur en silicium dans les urines a été déterminée. Il n’y a pas eu de changement significatif de la teneur en silicium dans l’urine entre la préapplication et la postapplication, ce qui semble indiquer une absence d’absorption du silicium après l’ingestion de la SAS. L’élimination de la SAS dans les poumons après exposition par inhalation a été décrite dans deux études réalisées par Arts et coll. (2007) et Reuzel et coll. (1991).
Dans une étude d’exposition par inhalation de 5 jours, des rats Wistar (10/sexe/groupe) ont inhalé par le nez seulement trois types de SAS (SAS colloïdale, précipitée et pyrogénée; la taille des particules pour chaque type était de 1 à 4 μm), à raison de 0, 1, 5 ou 25 mg/m3 six heures par jour pendant cinq jours (Arts et coll., 2007). À la suite de l’exposition aux trois types de SAS, on a constaté une augmentation du poids absolu et relatif des poumons et des ganglions lymphatiques trachéobronchiques à 25 mg/m3. L’examen histopathologique a révélé une accumulation intra-alvéolaire de macrophages et de granulocytes, ainsi qu’une hypertrophie bronchique/bronchiolaire à 5 et 25 mg/m3. Aucune modification du poids des organes et aucune hypertrophie bronchique ou bronchiolaire n’ont été observées à 5 et 25 mg/m3 après trois mois durant la période de récupération. La teneur en silicium s’est avérée sensiblement réduite dans les poumons après 1 mois d’exposition par rapport à un jour post-exposition, et le silicium n’a pas été détecté après trois mois d’exposition pour tous les types de SAS. L’OCDE (2004) a établi une CSENO de 1 mg/m3.
Dans une étude d’exposition par inhalation à doses répétées de 13 semaines, des rats Wistar (10/sexe/groupe) ont été exposés à des particules de SAS pyrogénée (taille des particules non indiquée) à 0, 1,3, 5,9 ou 31 mg/m3 par inhalation (corps entier) pendant 6 heures par jour, 5 jours par semaine, et les rats ont été observés pendant des périodes post-récupération de 13, 26, 39 et 52 semaines (Reuzel et coll., 1991). L’inhalation de 1,3 mg/m3 de SAS a entraîné une légère prolifération réversible de cellules pro-inflammatoires, plutôt que des changements pathologiques pertinents. Chez les rats exposés à 5,9 et 31 mg/m3, des lésions pulmonaires macroscopiques (tissus spongieux et surfaces tachetées) et des modifications histopathologiques pulmonaires (notamment l’accumulation de macrophages alvéolaires et la fibrose interstitielle) ont été observées. Des lésions granulomateuses du poumon ont également été observées chez les rats exposés à 31 mg/m3. Au cours de l’observation post-exposition, on a constaté quelques changements dans les poumons (notamment l’accumulation de macrophages alvéolaires). Les lésions granulomateuses n’étaient pas progressives (c.-à-d. qu’aucun nodule silicogène ne s’est formé). De la silice a été détectée dans les poumons à la fin de la période d’exposition dans les groupes ayant reçu 31 mg/m3, mais on n’en a récupéré chez aucun animal pendant l’observation post-exposition. La CSENO de 1,3 mg/m3 a été établie sur la base des effets inflammatoires observés dans les poumons à la CMENO de 5,9 mg/m3.
Dans une étude d’exposition par voie cutanée à doses répétées de 13 semaines, des rats Sprague-Dawley (10/sexe/groupe) ont été traités par voie topique avec des particules colloïdales de SAS (0,020 μm) à 0 (eau), 500, 1 000 ou 2 000 mg/kg p.c./j sur le dos, sous un pansement semi-occlusif (Ryu et coll., 2014). Aucune toxicité systémique n’a été observée chez les animaux traités à la lumière des observations cliniques et des examens hématologiques, biochimiques et histologiques.
La toxicité de la SAS (SAS colloïdale et précipitée) pour le développement a été étudiée chez quatre espèces animales (rat, souris, hamster et lapin) à des doses de gavage oral atteignant 1 600 mg/kg p.c./j (Food and Drug Research Laboratories, 1973; cité dans OCDE, 2004). Aucun signe significatif d’effet toxique sur la maternité ou le développement n’a été observé chez les espèces étudiées.
La SAS (SAS colloïdale et précipitée) s’est également révélée négative lors d’essais de génotoxicité in vitro et in vivo (OCDE, 2004). Dans une étude de cancérogénicité, la SAS (colloïdale et précipitée) a été administrée à des souris pendant 93 semaines et à des rats pendant 103 semaines à raison de 5 % dans le régime alimentaire (équivalant à 6 500 mg/kg p.c./j chez la souris et à 2 500 mg/kg p.c./j chez le rat; la taille des particules n’a pas été indiquée). Aucun effet cancérogène ou autre effet systémique lié au traitement n’a été observé (Takizawa et coll., 1988; cité dans OCDE, 2004).
6.3 Caractérisation des risques pour la santé humaine
Aucun effet critique n’a été constaté lors de l’exposition au TMSS ou à ses analogues par voie orale ou cutanée. Par conséquent, l’exposition par voie orale ou cutanée au TMSS, par l’intermédiaire des milieux environnementaux, des aliments ou des produits de consommation, n’est pas préoccupante.
Les réponses inflammatoires observées dans les poumons des animaux de laboratoire semblaient être fonction à la fois de la concentration et de la durée d’exposition, plutôt que de la concentration maximale d’exposition. Ceci est corroboré par l’observation de changements histopathologiques, dont la fibrose interstitielle, plus graves dans l’étude de 13 semaines (Reuzel et coll., 1991) que dans l’étude de cinq jours (Arts et coll., 2007) pour la SAS pyrogénée analogue. Cependant, les CSENO et les CMENO (environ 1 mg/m3 et 5 mg/m3, respectivement) déterminées dans l’étude de cinq jours et celle de 13 semaines étaient similaires, ce qui laisse entendre qu’un mécanisme d’élimination a permis d’éviter les lésions pulmonaires à 1 mg/m3 lors d’expositions plus longues.
Le Tableau 6-2 présente les valeurs d’exposition et de danger pertinentes pour le TMSS, ainsi que les marges d’exposition résultantes, aux fins de détermination des risques. Dans la présente évaluation, la CSENO de 2,05 mg/m3 (ajustée à 0,37 mg/m3 en raison de la poursuite de l’exposition), qui a été trouvée dans l’étude d’exposition par inhalation de 13 semaines au TMSS, a été utilisée comme niveau d’effet critique pour la caractérisation des risques.
| Scénario d’exposition | Estimation de l’exposition | Dose critique | Paramètre d’effet critique | Marge d’exposition |
|---|---|---|---|---|
| Exposition quotidienne par inhalation – shampoing sec (19 ans et +) | 0,0011 mg/m3 (exposition continue)a | CSENO[adj]b = 0,37 mg/m3 | Réponse inflammatoire dans les poumons des rats exposés au TMSS à 10,01 mg/m3 dans une étude d’exposition par inhalation de 13 semaines (six heures/jour, cinq jours/semaine) | 340 |
| Exposition quotidienne par inhalation – fard à joues (19 ans et +) | 0,0014 mg/m3 (exposition continue)a | CSENO[adj]b = 0,37 mg/m3 | Réponse inflammatoire dans les poumons des rats exposés au TMSS à 10,01 mg/m3 dans une étude d’exposition par inhalation de 13 semaines (6 heures/jour, 5 jours/semaine) | 264 |
Abréviations : ME = marge d’exposition; adj = valeur ajustée.
a Pour tenir compte des différences d’exposition entre l’étude sur les effets dangereux et le profil d’emploi réel, la CSENO et l’estimation de l’exposition pour le TMSS ont toutes deux été ajustées selon un scénario d’exposition continue (24 heures/jour, 7 jours/semaine), conformément aux lignes directrices de l’EPA sur l’évaluation des risques par inhalation (US EPA, 2009).
b La CSENO a été ajustée à 0,37 mg/m3 [= 2,05 mg/m3 x (6 heures/24 heures) x (5 jours/7 jours)] pour un scénario d’exposition continue.
Pour l’exposition quotidienne par inhalation au shampoing sec et au fard à joues, on a obtenu les ME de 340 et 264 en comparant la CSENO[adj] de 0,37 mg/m3 aux estimations de l’exposition de 0,0011 mg/m3 et 0,0014 mg/m3, respectivement. Ces estimations de l’exposition sont jugées prudentes, car les particules de TMSS présentes dans les cosmétiques peuvent ne pas toutes être inhalables en raison de leur taille (communication personnelle; courriels de la DSPCPD, SC, adressés au BERSE, SC, et datés du 27 mai 2019; sans référence), par rapport aux résultats obtenus dans l’étude d’exposition par inhalation de 13 semaines (OCDE, 2004).
En raison de la réponse inflammatoire induite par les particules de silice sans cristaux dans les poumons, qui dépend de la charge des particules totales inhalées, le scénario d’inhalation journalière est jugé prudent et couvre le scénario des expositions ponctuelles. Il a donc été jugé inutile de caractériser quantitativement le risque associé aux scénarios d’inhalation ponctuelle (par événement).
Les marges calculées sont jugées suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
6.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitudes | Incidence |
|---|---|
| La répartition de la taille des particules, leur forme et les propriétés de surface du TMSS dans les produits ne sont pas disponibles. | +/− |
| On a utilisé une étude de substitution pour ce qui est des scénarios d’exposition au shampoing sec et au fard à joues. La concentration atmosphérique mesurée de PM4 due à l’utilisation de poudre pour le corps et de poudre pour le visage a été utilisée comme donnée de substitution pour le TMSS, en raison de la similitude de ces substances en termes de propriétés physiques et chimiques et de mode d’application. | +/− |
7. Conclusion
Compte tenu de tous les éléments de preuve décrits dans la présente évaluation préalable, le TMSS présente un faible risque d’effets nocifs pour l’environnement. Il est conclu qu’il ne satisfait pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est conclu que le TMSS ne satisfait pas aux critères de l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que le TMSS ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
Bibliographie
Anderson EL, Sheehan PJ, Kalmes RM, Griffin JR. 2017. Assessment of Health Risk from Historical Use of Cosmetic Talcum Powder. Risk Anal. 37(5):918-928. (disponible en anglais seulement)
Arts JHE, Muijser H, Duistermaat E, Junker K, Kuper CF. 2007. Five-day inhalation toxicity study of three types of synthetic amorphous silicas in Wistar rats and post-exposure evaluations for up to 3 months. Food Chem Toxicol. 45(10):1856-67. (disponible en anglais seulement)
Becker LC, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Liebler D, Marks JG Jr, Shank RC, Slaga TJ, Snyder PW, Andersen FA. 2013. Safety assessment of silylates and surface-modified siloxysilicates. Int J Toxicol.32(3 Suppl):5S-24S. (disponible en anglais seulement)
Cabot. 1994a. Inhalation toxicity in rats, [Cab-O-Sil] TS-530, laboratory project MB 94-3664 E. Unpublished report. Moreno T. MB Research Laboratories, Spinnerstown, PA, USA. Cabot, Tuscola, Illinois, USA. (disponible en anglais seulement)
Cabot. 1994b. Cab-O-Sil TS-530, Salmonella plate incorporation mutagenicity assay (Ames test), laboratory study G94AZ74.501. Unpublished report. San RHC and Klug ML. Microbiological Associates, Rockville, Maryland, USA. Cabot, Tuscola, Illinois, USA. (disponible en anglais seulement)
Cabot. 1994c. Cab-O-Sil TS-530, chromosome aberrations in Chinese hamster ovary (CHO) cells, laboratory study G94AZ74.330. Unpublished report. Curry PT and Schadly E. Microbiological Associates, Rockville, Maryland, USA. Cabot, Tuscola, Illinois, USA. (disponible en anglais seulement)
Cabot. 1995. Cab-O-Sil TS-500, chromosome aberrations in Chinese hamster ovary (CHO) cells, laboratory study G94BN14.330. Unpublished report. Curry PT and Schadly E. Microbiological Associates, Rockville, Maryland, USA. Cabot, Tuscola, Illinois, USA. (disponible en anglais seulement)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada Partie III, vol. 22, no 3.
Canada, Min. de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : avis concernant certaines substances de la Liste intérieure. Gazette du Canada, Partie I, vol. 146, no 48, supplément.
ConsExpo Web [Consumer Exposure Web Model]. 2018. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. (disponible en anglais seulement)
[CosIng] Cosmetic Ingredients & Substances [database]. Brussels (BE): European Commission. [Consulté le 24 mai 2019]. (disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1983. Summary for the Results of Surveys of the amount and Frequency of use of cosmetic products by Women. Report Prepared by Pitkin B, Rodericks JV, Turnbull D. Washington (DC): CTFA Inc. (disponible en anglais seulement)
Degussa AG. 1964. Gewerbehygienisch-toxicologische Untersuchung der Wesselinger hydrophoben « reaction products of dichlorodimethyl silane with silica"; 1964. Study submitted to the High Production Volume Information System of the US EPA. (disponible en anglais seulement)
Dement JM, Mangin JH, Wallingfor KM, Shuler PJ, Sumwalde RD. 1972. Fiber Exposure During Use of Baby Powders. Preliminarily Report. Cincinnati(OH): Enviornmental Investigations Branch, National Institute for Occupational Safety and Health. (disponible en anglais seulement)
Dow Corning. 1972. One-year chronic dust inhalation toxicity study with J-DCA in albino rats and cynomolgus monkeys. Unpublished report. Industrial Bio-Test Laboratories, Northbrook, Illinois, USA. Dow Corning, Midland, Michigan, USA [Summary]. (disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC): ECCC. Information in support of the science approach document: ecological risk classification of organic substances. substances@ec.gc.ca (disponible en anglais seulement)
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modified 2017 Mar 12]. Catégorisation. Ottawa (Ont.), gouvernement du Canada.
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals. 2006. Synthetic Amorphous Silica (CAS No. 7631-86-9). ECETOC Joint Assessment of Commodity Chemicals (JACC) No. 51. Brussels, Belgium. (disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2016. Opinion on the application for approval of the active substance pyrogenic, synthetic amorphous silicon dioxide, nano, surface treated, Product type: 18. ECHA/BPC/122/2016. Helsinki (FI): ECHA. [Consulté le 1er février 2019]. (disponible en anglais seulement)
EFSA Panel on Food Additives and Nutrient Sources added to Food (ANS), 2018. Scientific Opinion on Re-evaluation of silicon dioxide (E 551) as a food additive [PDF]. EFSA Journal 2018;16(1):5088. [Consulté le 27 mai 2019] (disponible en anglais seulement)
Environnement Canada. Données de la Mise à jour de l’inventaire de la LIS 2013 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada et Santé Canada; Programme des substances existantes.
Environnement Canada, Santé Canada. 2013a. Évaluation préalable pour le Défi concernant la bis(triméthylsilyl)amine, produits de réaction avec l’ammoniac, l’octaméthylcyclotétrasiloxane et la siliceNuméro de registre du Chemical Abstracts Service 68937-51-9 [PDF]. Ottawa (Ont.), gouvernement du Canada. [Consulté le 4 février 2019].
Environnement Canada, Santé Canada. 2013b. Évaluation préalable pour le Défi concernant : le quartz (NR CAS 14808-60-7) et la cristobalite (NR CAS 14464-46-1). Ottawa (Ont.), gouvernement du Canada. [Consulté le 28 juin 2019].
Environmental Health Perspectives. 120(6): 885 – 892 nanotechnology-based cosmetic powders: a quantitative assessment. J Nanopart Res 14(11) doi:10.1007/s11051-012-1229-2. (disponible en anglais seulement)
[ESIS] European Chemical Substances Information System [database on the Internet]. c1995–2009. European Chemical Bureau (ECB). [cité en octobre 2010]. (disponible en anglais seulement)
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78:159-169. (disponible en anglais seulement)
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, Roudot AC. 2016. Consumption of cosmetic products by the French population. Second part: Amount data. Food Chem Toxicol. 90:130-141. (disponible en anglais seulement)
Food and Drug Research Laboratories, Inc. 1973: Teratologic Evaluation of FDA 71-48 (Syloid; silica aerogel). Prep. for: FDA, U. S. Food and Drug Administration; NTIS, National Technical Information Service, U. S. Department of Commerce, USA, PB-223 808. (disponible en anglais seulement)
Fruijtier-Pölloth C. 2012. The toxicological mode of action and the safety of synthetic amorphous silica-a nanostructured material. Toxicology 294(2-3):61-79 (disponible en anglais seulement)
Fruijtier-Pölloth C. 2016. The safety of nanostructured synthetic amorphous silica (SAS) as a food additive (E 551). Arch Toxicol. 90(12): 2885–2916. (disponible en anglais seulement)
Hallegot P and Grégoire S. 2011. Synthetic Amorphous Silica - L’Oréal Study No. PH/OD/11.0273/Si (disponible en anglais seulement)
Haz-Map [database]. [mis à jour en octobre 2018]. Bethesda (MD): US National Library of Medicine. [Consulté le 1er mars 2019]. (disponible en anglais seulement)
Heylings J. 2013. Silica overview: Skin Penetration of Synthetic Amorphous Silica: analytical (quantitative) approach [PDF]. January 15, 2013. (disponible en anglais seulement)
[ISO] Organisation internationale de normalisation. 2007. Air des lieux de travail — Particules ultrafines, nanoparticules et aérosols nanostructurés — Caractérisation et évaluation de l’exposition par inhalation. Genève (CH) : ISO 27628:2007.
IUCLID. 2003. Data set for ID 68611-44-9, EC No. 271-893-4, U.S. Environmental Protection Agency. (disponible en anglais seulement)
Johnson IR. 2013. Synthetic Amorphous Silica - In vitro Absorption of Silica from Three Formulations through Dermatomed Human Skin. Dermal Technology Laboratory Study No. JV2218. (disponible en anglais seulement)
Kogel JE, Trivedi NC, Barker JM, Krukowski ST, editors. 2006. Industrial Minerals & Rocks. 7th ed: Commodities, Markets, and Uses. Littleton (Colorado): Society for Mining, Metallurgy, and Exploration, Inc. p. 1190-1191. (disponible en anglais seulement)
Langendorf H, Lang K. 1967. Der Einfluss polymerer Kieselsaeuren auf die renale SiO2-Ausscheidung beim Menschen. Zeitschrift Ernaehrungswissenschaft, 8, 27–32. (non disponible en français)
Langer SH, Connell S, Wender I. 1958. Preparation and properties of trimethylsilyl ethers and related compounds. J Org Chem 23(1): 50-58. (disponible en anglais seulement)
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, Sewall C. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol 43:279-291. (disponible en anglais seulement)
Martin KR. 2007. The chemistry of silica and its potential health benefits. The Journal of Nutrition, Health & Aging. 11 (2): 94-97. (disponible en anglais seulement)
[MSDS] Material Safety Data Sheet. 2013. Valspar paint 502 DARK GREEN/AQUA 6UC. Medina (OH): The Valspar Corporation. [Consulté le 10 janvier 2019]. (disponible en anglais seulement)
[MSDS] Material Safety Data Sheet. 2015a. Silicon dioxide, amorphous, hexamethyldisilazane treated, CAS RN 68909-20-6. Morrisville (PA): Gelest, Inc. [Consulté le 1er février 2019]. (disponible en anglais seulement)
[MSDS] Material Safety Data Sheet. 2015b. Elmer’s Stix-All. Westerville (OH): Elmer’s Products, Inc. [Consulté le 10 janvier 2019]. (disponible en anglais seulement)
[MSDS] Material Safety Data Sheet. 2016. AEROSIL® R 812 S. Parsippany (NJ): Evonik Corporation USA. [Consulté le 24 mai 2019]. (disponible en anglais seulement)
Nazarenko Y, Zhen H, Han T, Lioy PJ, Mainelis G. 2012. Potential for Inhalation Exposure to Engineered NanoparticlesNanomaterial inhalation exposure from Nanotechnology-Based Cosmetic Powders.(disponible en anglais seulement)
[OCDE] Organisation for Economic Co-operation and Development. 2004. SIDS Dossier on Synthetic Amorphous Silica and Silicates. [Consulté le 27 mai 2019] (disponible en anglais seulement)
OCDE QSAR Toolbox [outil de lecture croisée]. 2014 Version 3.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (disponible en anglais seulement)
Rasmussen PE, Levesque C, Niu J, Gardner HD, Nilsson G, Macey K. 2019. Characterization of airborne particles emitted during application of cosmetic talc products. Int. J. Environ. Res. Public Health 2019, 16(20), 3830; DOI: 10.3390/ijerph16203830. (disponible en anglais seulement)
Reuzel PGJ, Bruijntjes JP, Feron VJ, Woutersen RA. 1991. Subchronic inhalation toxicity of amorphous silicas and quartz dust in rats. Food Chem. Toxicol. 29,341–354. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2006. Cosmetics fact sheet: to assess the risks for the consumer: version mise à jour pour ConsExpo 4 [PDF]. Bilthoven (NL): RIVM. Report No.: 320104001/2006. [Consulté le 17 juin 2019]. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2007a. Paint products fact sheet: to assess the risks for the consumer. Updated version for ConsExpo 4. Bilthoven (NL): RIVM. Report No.: 320104008/2007. [Consulté le 13 mai 2019] (PDF). (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2007b. Do-it-yourself products fact sheet: to assess the risks for the consumer [PDF]. Bilthoven (NL): RIVM. Report No.: 320104007/2007. [Consulté le 13 mai 2019] (PDF). (disponible en anglais seulement)
Ryu HJ, Seong NW, So BJ, Seo HS, Kim JH, Hong JS, Park MK, Kim MS, Kim YR, Cho KB, Seo MY, Kim MK, Maeng EH, Son SW. 2014. Evaluation of silica nanoparticle toxicity after topical exposure for 90 days. Int J Nanomedicine. 9 Suppl 2:127-36. (disponible en anglais seulement)
Santé Canada (2015). Tableau de la consommation des aliments fondé sur l’Enquête sur la santé dans les collectivités canadiennes, cycle 2.2, Nutrition (2004) réalisée par Statistique Canada, fichier partagé.
Santé Canada. 2017. Document sur l’approche scientifique concernant les substances présentant un faible danger pour la santé humaine. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2018a. Inhalation Risk Assessment Guidance. October 2018. Internal Draft. Unpublished report. Ottawa (ON): Existing Substances Risk Assessment Bureau, Health Canada. (disponible en anglais seulement)
Santé Canada. 2018b. Personal Care Products Workbook August 2018. Internal Draft. Unpublished report. Ottawa(ON): Existing Substances Risk Assessment Bureau, Health Canada. (disponible en anglais seulement)
Santé Canada. 2019. Data collected from a targeted information gathering initiative for assessments under the Chemicals Management Plan (March – May 2019). Données recueillies par le Programme des substances existantes ECCC, Santé Canada.
[SCCS] Scientific Committee on Consumer Safety. 2015. Opinion on Silica, Hydrated Silica, and Silica Surface Modified with Alkyl Silylates (nano form). Adopted by the SCCS on 20 March 2015, Revision of 29 September 2015. Report no. SCCS/1545/15 (disponible en anglais seulement)
Science Direct [database]. [mise à jour 2019]. Search results for silicone rubber. Elsevier B.V. [Consulté le 6 juin 2019]. (disponible en anglais seulement)
Statistics Canada. 2017. Custom tabulation of grooming products data from the Canadian Health Measures Survey Cycle 2 (2010-2011). Prepared for Existing Substances Risk Assessment Bureau, Health Canada by Statistics Canada. Unpublished.(disponible en anglais seulement)
Takizawa, Y; Hirasawa, F.; Noritomi, E.; Aida, M; Tsunoda, H.; Uesugi, S. 1988. Oral ingestion of syloid to mice and rats and its chronic toxicity and carcinogenicity. Acta Medica et Biologica, 36, 27-56 (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2009. Risk Assessment Guidance for Superfund Volume I: Human Health Evaluation Manual (Part F, Supplemental Guidance for Inhalation Risk Assessment). Washington (D.C.): U.S. EPA, Office of Superfund Remediation and Technology Innovation. (disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2011. Screening-level hazard characterization: Silane, Dichlorodimethyl-, Reaction Product with Silica (CAS RN 68611-44-9). Washington (DC): US EPA, Office of Pollution Prevention and Toxics. (disponible en anglais seulement)
Villota R and Hawkes JG. 1986. Food Applications and the Toxicological and Nutritional Implications of Amorphous Silicon Dioxide. Crit Rev Food Sci and Nutr 23(4): 289-321. (disponible en anglais seulement)
Wacker. 1998a. Sub-chronic (13-week) inhalation toxicity study with Wacker HDK SKS300 in rats, additional parameters: Annex 5, silicon content determination in lungs and tracheobronchial lymph nodes. Appendix 4.1, individual data pathology main study. Unpublished report V98.684. Arts JHE and Kuper CF, TNO Nutrition and Food Research Institute, Zeist, Netherlands. Wacker Chemie, Burghausen, Germany. (disponible en anglais seulement)
Wacker. 1998b. Sub-chronic (13-week) inhalation toxicity study with Wacker HDK SKS 300 in rats. Unpublished report V98.497. Arts JHE and Kuper CF, Part 1, 2 and 3. TNO Nutrition and Food Research Institute, Zeist NL. Wacker-Chemie, Burghausen, Germany. (disponible en anglais seulement)
Annexe A. Données obtenues par lecture croisée pour le TMSS
| Rôle | Analogue | Analogue | Cible |
|---|---|---|---|
| No CAS (nom commun ou abréviation) | 68611-44-9 (silice de diméthyle silylate) | 112926-00-8 (SAS colloïdale); 112926-00-8 (SAS précipitée); 112945-52-5 (SAS pyrogénée) | 68909-20-6 (TMSS) |
| Structure représentative | 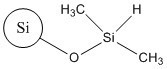 |
SiO2 | 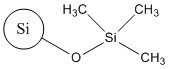 |
| Solubilité dans l’eau (mg/L) | < 0,0001 (négligeable) | Environ 15 – 68 à 20 °C (pH 5,5 – 6,6) | Négligeable |
| Log Koe | S. o. | S. o. | S. o. |
| Pression de vapeur (mm Hg) | Négligeable | Négligeable | Négligeable |
| Taille des particules primaires (nm) | 10 – 50b | 5 – 50 (SAS pyrogénée) 5 – 100 (SAS précipitée) | 5 – 20a |
| Taille des agrégats (nm) | < 5000b | 100 – 1000 | 100 – 1000a |
| Toxicocinétique | Chez les rats exposés à la substance aérosolisée à 200 mg/m3, cinq heures par jour pendant trois jours, du silicium a été détecté dans les poumons après 24 heures d’exposition, mais pas après un mois d’exposition (Degussa AG, 1964; cité dans Becker et coll., 2013). | Les volontaires qui avaient reçu des particules de SAS (précipitée et pyrogénée) par voie orale n’ont pas absorbé de silicium. Chez les rats exposés à 25 mg/m3 de tous les types de SAS non traitée six heures par jour pendant cinq jours, la teneur en silicium dans les poumons a diminué de manière significative après un mois d’exposition (par rapport à la variation de la teneur après une journée d’exposition) et aucune trace de silicium n’a été détectée après trois mois d’exposition, et ce pour tous les types de SAS. Chez les rats exposés à 31 mg/m3 de silice pyrogénée pendant 13 semaines, la silice a pu être détectée dans les poumons à la fin de la période d’exposition, mais n’a été retrouvée chez aucun animal pendant les 13, 26, 39 et 52 semaines d’observation post-exposition (OCDE, 2004). | N. d. |
| Toxicité à dose répétée (voie orale) | Aucun effet lié au traitement chez les rats ayant reçu 500 mg/kg p.c./j dans leur alimentation pendant six mois (US EPA, 2011) | Aucun effet systémique chez les souris ayant reçu 6 500 mg/kg p.c./j dans leur alimentation pendant 93 semaines (OCDE, 2004) | N. d. |
| Toxicité à dose répétée (voie cutanée) | N. d. | Aucun effet nocif constaté à la dose maximale d’essai de 2 000 mg/kg p.c./j pendant 90 jours, chez les rats traités avec la SAS colloïdale par voie topique (Ryu et coll., 2014). | N. d. |
| Toxicité à dose répétée (inhalation) | CMENO = 31 mg/m3 (rats, 2 semaines d’inhalation, corps entier, 6 h/j, 5 j/semaine, changements pathologiques dans les poumons à la plus faible concentration d’essai [US EPA, 2011]) CMENO = 35 mg/m3 (13 semaines d’inhalation, corps entier, 6 h/j, 5 j/semaine, changements pathologiques dans les poumons chez les rats ayant reçu la plus faible concentration d’essai [US EPA, 2011]) | CSENO = 1 mg/m3 (inhalation pendant 5 jours, 6 h/j, légers changements pathologiques dans les poumons des rats exposés à la SAS [colloïdale, précipitée ou pyrogénée] à 5 mg/m3 [Arts et coll., 2007]) CSENO = 1,3 mg/m3 (13 semaines d’inhalation, corps entier, 6 h/j, 5 j/semaine, changements pathologiques dans les poumons chez les rats exposés à la SAS pyrogénée à 5,9 mg/m3 [OCDE, 2004]) | CSENO = 2,05 mg/m3, CMENO = 10,01 mg/m3 (13 semaines d’inhalation, 6 h/j, 5 j/semaine, changements pathologiques dans les poumons chez les rats exposés au TMSS à 10,01 mg/m3 [ECETOC, 2006]). |
| Toxicité pour la reproduction ou le développement (voie orale) | Aucun effet nocif ou indésirable n’a été observé chez les rats traités avec 500 mg/kg p.c./jour (étude de reproduction sur une génération, Pr-B, 1965) | Aucun effet sur les mères ou pour le développement observé aux doses atteignant 1 600 mg/kg p.c./j de SAS (SAS colloïdale et SAS précipitée) chez les rats, les souris, les hamsters et les lapins (OCDE, 2004). | N. d. |
| Génotoxicité | Résultat négatif (US EPA, 2011) | Résultat négatif (OCDE, 2004) | Résultat négatif (ECETOC, 2006) |
| Cancérogénicité | Aucun effet cancérogène observé chez les rats ayant reçu 100 mg/kg p.c./j dans leur alimentation pendant deux ans (US EPA, 2011) | Aucun effet cancérogène observé chez les souris ayant reçu 6 500 mg/kg p.c./j dans leur alimentation pendant 93 semaines (OCDE, 2004). | N. d. |
Abréviations : h = heure; CMENO/D = concentration minimale entraînant un effet nocif observé/dose; n. d. = non disponible; s. o. = sans objet; CSENO/D = concentration sans effet nocif observé/dose; Koe = coefficient de partage octanol-eau; pKa = constante de dissociation dans l’acide.
a Taille des particules primaires de la SAS traitée en surface (Fruijtier-Pölloth, 2012).
b Plage des tailles des particules de silice pyrogénée hydrophobe (SCCS, 2015).
Annexe B. Paramètres utilisés pour l’estimation de l’exposition humaine au TMSS
Le tableau B-1 présente les intrants et facteurs d’ajustement pour le scénario d’exposition par inhalation au shampoing sec et au fard à joues.
| Scénario | Conc. dans le produita | Conc. moyenne dans l’étude (mg/m3)b | CA de niveau 1 (mg/m3)b | DEj (h/j)c | CE ajustée de niveau 2 (mg/m3)d | FE (j/an)e | DEa (an)f | CE ajustée de niveau supérieur (mg/m3)g |
|---|---|---|---|---|---|---|---|---|
| Shampoing sec | 100 % | 1,36 | 1,36 | 0,083 | 0,019 | 84 | 68 | 0,0011 |
| Fard à joues | 30 % | 1,36 | 0,408 | 0,083 | 0,0057 | 365 | 68 | 0,0014 |
Abréviations : Conc. = concentration; CA = concentration dans l’air par événement; j = jour; DEj = durée de l’exposition journalière; FE = fréquence de l’exposition; DEa = durée de l’exposition annuelle; CE = concentration de l’exposition, valeur ajustée; h = heure; a = année.
a Concentration maximale de TMSS trouvée dans les shampoings secs (concentration la plus élevée parmi tous les produits sous forme de poudre libre) et dans le fard à joues, d’après les avis soumis en vertu du Règlement sur les cosmétiques à Santé Canada pour le TMSS (communication personnelle; courriels de la DSPCPD, SC, adressés au BERSE, SC, et datés du 9 octobre 2018 et du 14 février 2019; sans référence).
b CA = concentration moyenne pendant l’étude × concentration maximale de TMSS dans le produit. La concentration moyenne de l’étude est la concentration moyenne de PM4 mesurée dans l’air, par sujet, d’après Anderson et coll. (2017) et Reuzel et coll. (2019).
c DEj = durée de l’exposition × nombre d’applications/j = 5 minutes/application × 1 application/j × 1 heure/60 minutes. Une durée d’exposition de 5 minutes/application est basée sur le temps médian passé dans la salle de bain après une douche ou un bain (US EPA, 2011; RIVM, 2006) et on a supposé qu’il y avait 1 application/j pour le shampoing sec et le fard à joues. L’estimation de la durée de l’exposition est également basée sur un certain nombre de facteurs, notamment la durée d’existence du nuage de particules mesuré dans Rasmussen et coll. (2019) (environ une minute), la durée moyenne d’échantillonnage de 6 minutes selon Anderson et coll. (2017), la formation de nuages secondaires de particules tel qu’observé par Rasmussen et coll. (2019) et par le NIOSH dans une étude antérieure (Dement et coll., 1972). Il est donc nécessaire de tenir compte du temps passé à proximité du lieu où la personne exerce ces activités.
d Concentration d’exposition de niveau 2 = CA x heures exposition/heures d’exposition selon l’étude sur les animaux (Santé Canada, 2018a). La durée de l’exposition dans les deux scénarios est de cinq minutes.
e La FE pour le shampoing sec est de 0,23 fois/j ou 84 jours/année (Ficheux et coll., 2015; Santé Canada, 2018b) et la FE pour le fard à joues est présumée être quotidienne (Ficheux et coll., 2015; Santé Canada, 2018b), car ces valeurs présentaient la tendance centrale la plus élevée de l’étude de la plus haute qualité qui était disponible pour chaque type de produit.
f Durée d’exposition présumée d’un adulte à un shampoing sec et à un fard à joues (durée de vie de 80 ans – 12 années d’enfance = 68 ans de vie d’adulte).
g CE ajustée = (CA × DEj × FE × DEa)/TM, où TM (temps moyen) est calculé comme suit : DEa × 365 j/an × 24 h/j. La concentration d’exposition ajustée est calculée selon l’équation 8 des lignes directrices de l’US EPA publiées en 2009 sous le titre « Risk Assessment Guidance for Superfund Volume I: Human Health Evaluation Manual ».
