Évaluation préalable benzoates
Titre officiel : Évaluation préalable benzoates
Numéros d’enregistrement du Chemical Abstracts Service
93-58-3, 93-89-0, 120-50-3, 120-55-8, 136-60-7, 614-33-5, 8024-05-3, 27138-31-4, 68052-23-3
Environnement et Changement climatique Canada Santé Canada
Février 2019
No de cat. : En14-356/2019F-PDF
ISBN 978-0-660-27793-6
Résumé
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE), la ministre de l’Environnement et la ministre de la Santé ont procédé à une évaluation préalable de 9 des 10 substances appelées collectivement « groupe des benzoates » dans le Plan de gestion des produits chimiques. Ces 9 substances ont été considérées comme prioritaires pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été déclarées d’intérêt prioritaire en raison d’autres préoccupations liées à la santé humaine. Il a subséquemment été déterminé que la dixième substance présentait un risque peu préoccupant pour l’environnement ou la santé humaine, et il a été décidé que cette substance ferait l’objet d’un rapport distinctNote de bas de page 1 . Par conséquent, la présente évaluation préalable porte sur les 9 substances décrites dans le tableau ci-dessous, ci-après appelées substances du groupe des benzoates.
| No CASa | Nom figurant sur la Liste intérieure des substances | Nom commun |
|---|---|---|
| 93-58-3 | Benzoate de méthyle | Benzoate de méthyle |
| 93-89-0b | Benzoate d’éthyle | Benzoate d’éthyle |
| 120-50-3b | Benzoate d’isobutyle | Benzoate d’isobutyle |
| 120-55-8 | Dibenzoate d’oxydiéthylène | Dibenzoate du diéthylèneglycol |
| 136-60-7 | Benzoate de butyle | Benzoate de butyle |
| 614-33-5 | Tribenzoate de glycérol | Tribenzoïne |
| 8024-05-3c | Huiles de tubéreuse | Huiles de tubéreuse |
| 27138-31-4 | Dibenzoate d’oxydipropyle | Dibenzoate de dipropylèneglycol |
| 68052-23-3 | Dibenzoate de 2,2,4-triméthylpentane-1,3-diyle | Dibenzoate de triméthylpentanediyle |
a Le numéro d’enregistrement de CAS (NE CAS) est la propriété de l’American Chemical Society. Toute utilisation ou redistribution, sauf lorsqu’elle est requise en vertu des exigences réglementaires et/ou pour des rapports destinés au gouvernement lorsque l’information ou des rapports sont exigés selon la loi ou une politique administrative, est interdite sans le consentement écrit de l’American Chemical Society.
b Cette substance n’a pas été identifiée en vertu du paragraphe 73(1) de la LCPE, mais est visée par la présente évaluation, car elle est considérée comme prioritaire en raison d’autres préoccupations liées à la santé humaine.
c Cette substance est un UVCB (sigle désignant les substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
Les 9 substances visées par la présente évaluation ont fait l’objet d’une enquête menée conformément à l’avis soumis en vertu de l’article 71 de la LCPE. Les quantités importées et déclarées variaient de 1 000 à 10 000 000 kg pour 5 de ces substances. Les activités de fabrication et d’importation n’ont pas été déclarées pour les 4 substances restantes.
La tribenzoïne, les huiles de tubéreuse et les benzoates de méthyle, d’éthyle, de butyle et d’isobutyle sont utilisés partout dans le monde comme aromatisants et sont présents dans les produits de consommation au Canada. Ces substances sont également utilisées comme agents parfumants dans les produits d’entretien ménager et les cosmétiques. En plus de provenir de sources anthropiques, les benzoates de méthyle, d’éthyle, de butyle et d’isobutyle sont naturellement présents dans des aliments comme les pommes, les bananes, les cerises douces, les papayes, la bière, le cidre et le cacao.
Le dibenzoate de diéthylèneglycol, le dibenzoate de dipropylèneglycol et le dibenzoate de triméthylpentanédiyle ont été décelés dans divers produits, notamment les agents de calfeutrage, les peintures et les adhésifs, ainsi que dans les cosmétiques et les produits de santé naturels. Le dibenzoate de diéthylèneglycol et le dibenzoate de dipropylèneglycol ont également été identifiés comme composants entrant dans la fabrication de matériaux d’emballage alimentaire.
Les risques environnementaux associés aux 9 benzoates visés par la présente évaluation préalable ont été caractérisés selon la méthode dite de Classification du risque écologique (CRE) des substances organiques, une approche fondée sur les risques et qui emploie plusieurs paramètres de danger et d’exposition, en tenant compte de plusieurs sources de données pondérées, pour classer les risques. Les profils de risque sont établis principalement sur la base de plusieurs paramètres, dont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité, ainsi que l’activité biologique et chimique. Parmi les paramètres pris en compte pour les profils d’exposition, mentionnons les taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour assigner aux substances un potentiel faible, moyen ou élevé, basé sur leurs profils de danger et d’exposition. L’approche CRE a permis de déterminer que les 9 benzoates en question présentent un faible potentiel de risque pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, les 9 benzoates visés par cette évaluation présentent un faible risque de causer des effets nocifs pour l’environnement. Il a été conclu que les substances faisant partie du groupe des benzoates ne satisfont pas aux critères énoncés à l’alinéa 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Dans la présente évaluation, la caractérisation des effets sur la santé tient compte des données empiriques indiquant que les benzoates s’hydrolysent facilement en acide benzoïque, lequel est ensuite métabolisé en acide hippurique, puis éliminé. Par conséquent, l’évaluation des esters de benzoate dans la présente évaluation porte sur les données concernant les effets sur la santé de l’acide benzoïque et des dérivés benzyliques présumés se métaboliser en acide benzoïque. Compte tenu des évaluations faites par diverses autorités compétentes qui ont conclu que ces substances et d’autres substances similaires présentent une faible toxicité, et étant donné que les substances visées dans la présente évaluation se métabolisent en acide benzoïque, le risque potentiel pour la santé humaine est jugé faible.
À la lumière des renseignements contenus dans la présente évaluation préalable, il a été conclu que les substances du groupe des benzoates ne satisfont pas au critère de l’alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il a été conclu que les substances du groupe des benzoates ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE), les ministres de l’Environnement et de la Santé ont procédé à une évaluation préalable de 9 des 10 substances appelées collectivement « groupe des benzoates » dans le Plan de gestion des produits chimiques, afin de déterminer si elles présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Il a été jugé prioritaire d’évaluer ces 9 substances, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été déclarées d’intérêt prioritaire en raison d’autres préoccupations liées à la santé humaine (ECCC et SC [modifié 2017]).
L’autre substance, l’acide benzène -1,3-dicarboxylique (ou acide isophtalique) (no CASNote de bas de page 2 121-91-5), a été évaluée selon les documents « Classification du risque écologique (CRE) des substances organiques » et « l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances » (ECCC 2016a; Santé Canada 2016), et a été considérée comme peu préoccupante pour la santé humaine et pour l’environnement. Par conséquent, la présente évaluation ne traite pas cette substance plus en profondeur. Les conclusions tirées pour cette substance figurent dans l’ébauche d’évaluation préalable « Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances » (ECCC, SC, 2018).
Les 9 autres substances évaluées ci-après dans la présente évaluation préalable sont désignées collectivement sous le nom de « groupe des benzoates ».
Le risque environnemental des 9 substances du groupe des benzoates a été caractérisé selon l’approche CRE (ECCC 2016a). Cette approche consiste à décrire les risques posés par une substance en utilisant des paramètres clés, dont le mode d’action, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique. Elle tient compte de l’exposition possible des organismes dans des environnements terrestres ou aquatiques, basée sur des facteurs incluant les taux d’émission potentielle, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés afin d’identifier les substances nécessitant une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement ou présentant une faible probabilité d’effets nocifs sur l’environnement.
Les substances du groupe des benzoates sont toutes des esters de l’acide benzoïque. Aux fins de l’évaluation des effets sur la santé, le groupe des benzoates a été séparé en trois sous-groupes : les benzoates d’alkyle simples, les dibenzoates et les tribenzoates. La caractérisation des dangers des trois sous-groupes est fortement liée à la preuve empirique que les membres des trois sous-groupes s’hydrolysent rapidement en acide benzoïque, qui est ensuite métabolisé en acide hippurique, puis éliminé (JECFA 1997; JECFA 2002a; OCDE SIDS 2001; US EPA 2010; EFSA 2012; REACH 2016). Par conséquent, l’évaluation toxicologique des esters de benzoate dans la présente évaluation suit l’approche adoptée par d’autres autorités compétentes : pour déterminer les études clés et les critères d’effet critiques, l’évaluation met l’accent sur les données toxicologiques pertinentes pour l’acide benzoïque et les dérivés benzyliques censés se transformer facilement in vivo en acide benzoïque.
Certaines substances du groupe des benzoates, ainsi que l’acide benzoïque et les dérivés benzyliques pertinents ont fait l’objet d’un examen international dans le cadre du Programme d’évaluation coopérative des produits chimiques de l’Organisation de coopération et de développement économiques (OCDE) et du Comité mixte FAONote de bas de page 3 /OMSNote de bas de page 4 d’experts des additifs alimentaires (JECFA). Ces évaluations sont soumises à un examen rigoureux (évaluation par les pairs) et à des processus d’approbation par diverses autorités gouvernementales de par le monde. Santé Canada et Environnement et Changement climatique Canada participent activement à ces processus d’évaluation et considèrent que les résultats sont fiables. Des évaluations ont également été effectuées par un certain nombre d’autres organismes internationaux, dont l’OMS, le JECFA, l’Autorité européenne de sécurité des aliments (EFSA) et le Comité scientifique des produits de consommation de la Commission européenne (CSPC). Ces évaluations (p. ex., le Rapport d’évaluation initiale des ensembles de données de dépistage de l’OCDE [document SIAR], les Résumés succincts internationaux sur l’évaluation des risques chimiques de l’OMS [documents CICAD], les rapports du JECFA) seront utilisées pour mieux comprendre la caractérisation des effets sur la santé dans la présente évaluation préalable.
Compte tenu des évaluations réalisées par d’autres autorités compétentes (p. ex., JECFA, OCDE), qui ont conclu que ces substances et d’autres substances similaires présentent une faible toxicité, et étant donné que les substances de ce groupe se métabolisent en acide benzoïque, le risque potentiel pour la santé humaine est jugé faible.
Pour la présente évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, y compris des renseignements soumis par des parties intéressées. Nous avons relevé des données pertinentes jusqu’en mars 2017. Nous avons utilisé les données empiriques provenant des études clés pour formuler les conclusions. Lorsqu’ils étaient disponibles et pertinents, des renseignements contenus dans des évaluations effectuées par d’autres autorités compétentes ont été utilisés.
Le personnel du Programme d’évaluation des risques en vertu de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada a rédigé la présente évaluation préalable qui inclut la contribution d’autres programmes de ces deux ministères. Le volet de l’évaluation portant sur l’environnement est basé sur le document décrivant l’approche CRE (publié le 20 juillet 2016), qui a fait l’objet d’une évaluation par les pairs et a été soumis à une période de consultation publique de 60 jours. Les parties de la présente évaluation préalable portant sur la santé humaine ont fait l’objet d’examens ou de consultations externes. Des commentaires touchant les aspects techniques pertinents pour la santé humaine ont été reçus de Tetra Tech Inc. (Jennifer Flippin, Theresa Lopez et Katherine Super). En outre, l’ébauche de la présente évaluation préalable (publiée le 30 décembre 2017) a été soumise à une période de consultation publique de 60 jours. Bien que des commentaires de l’extérieur aient été pris en compte, Environnement et Changement climatique Canada et Santé Canada restent responsables du contenu final et des conclusions de la présente ébauche d’évaluation préalable.
La présente évaluation préalable repose sur des renseignements essentiels servant à déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. À cette fin, des renseignements scientifiques ont été examinés et une approche basée sur une pondération des éléments de preuve et le principe de précaution a été adoptéeNote de bas de page 5 . Dans le présent document, nous présentons ces renseignements essentiels et les éléments sur lesquels se fonde la conclusion.
2. Identité des substances
Les nos CAS, les noms figurant sur la LIS et les noms communs de chaque substance du groupe des benzoates sont présentés dans le tableau 2‑1. Une liste d’autres noms chimiques (p. ex., noms commerciaux) est disponible auprès du National Chemical Inventories (NCI 2015).
| No CAS (abréviation) | Nom dans la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 93-58-3 | Benzoate de méthyle (benzoate de méthyle) | 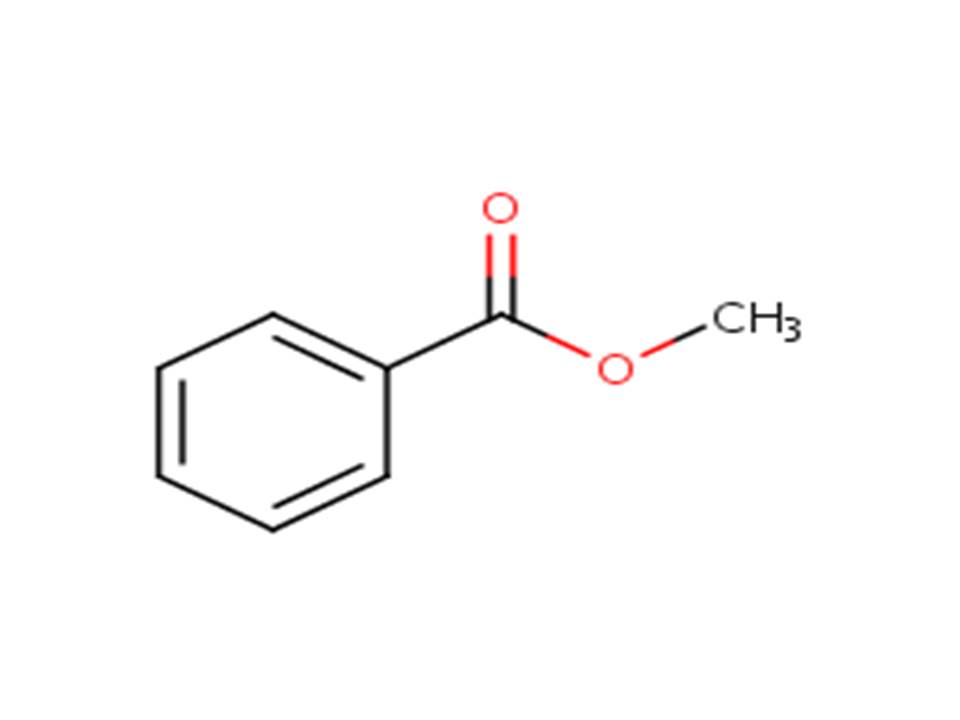 |
136,15 |
| 93-89-0 | Benzoate d’éthyle (benzoate d’éthyle) | 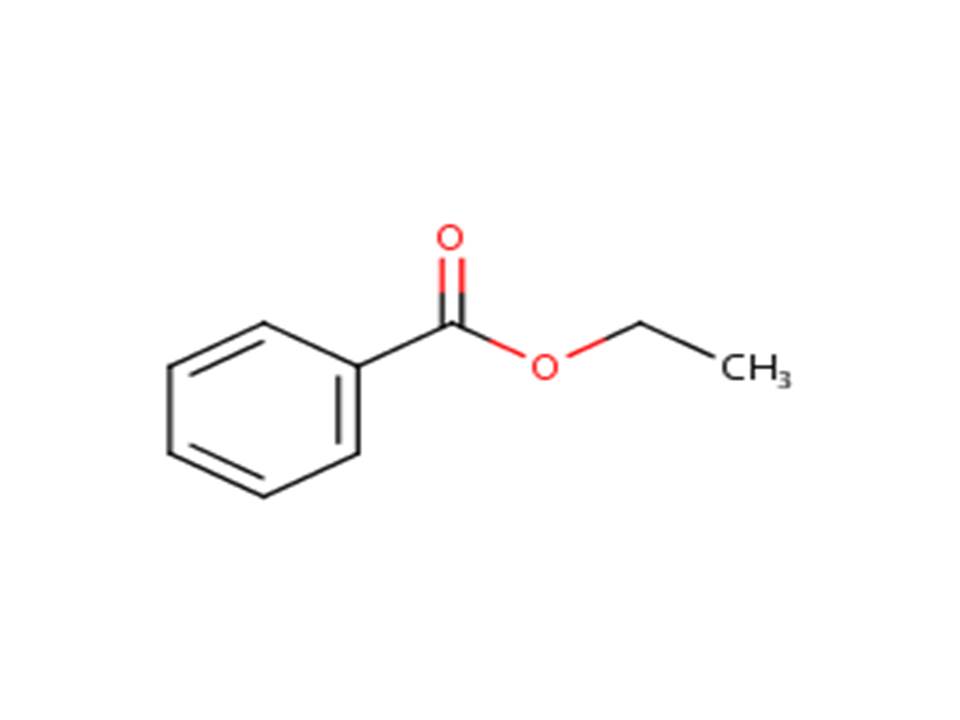 |
150,18 |
| 136-60-7 | Benzoate de butyle (benzoate de butyle) | ![Representative chemical structure of [substance name], with SMILES notation: CCCCOC(=O)c1ccccc1](/content/dam/eccc/images/pded/benzoates/benzo_3.jpg) |
178,23 |
| 120-50-3 | Benzoate d’isobutyle (benzoate d’isobutyle) | 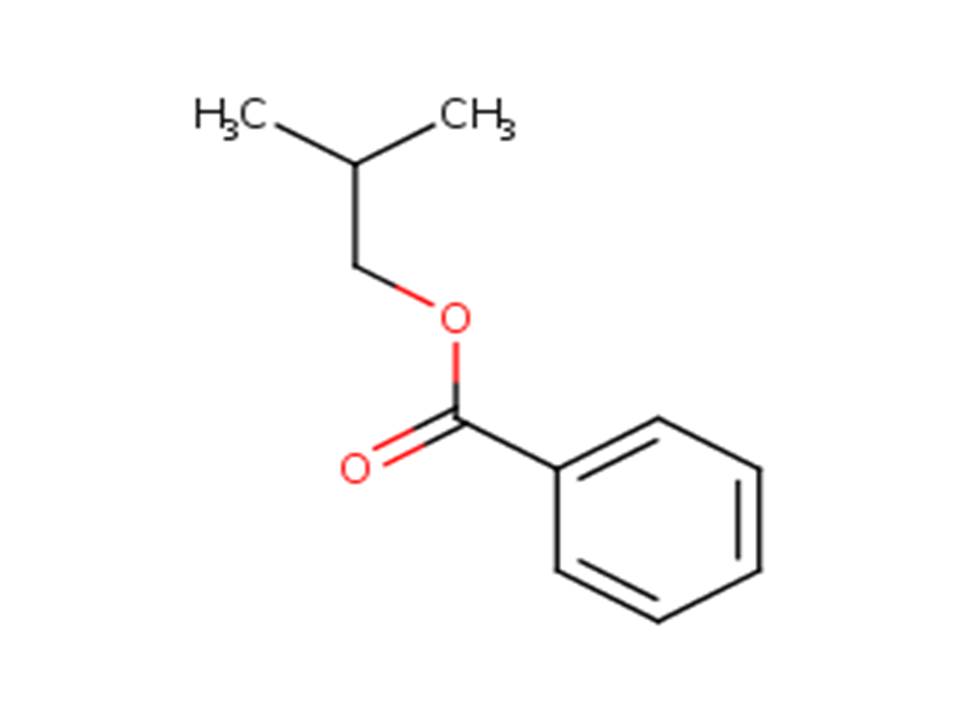 |
178,23 |
| 120-55-8 (DEGDB) | Dibenzoate d’oxydiéthylène (dibenzoate du diéthylèneglycol) | 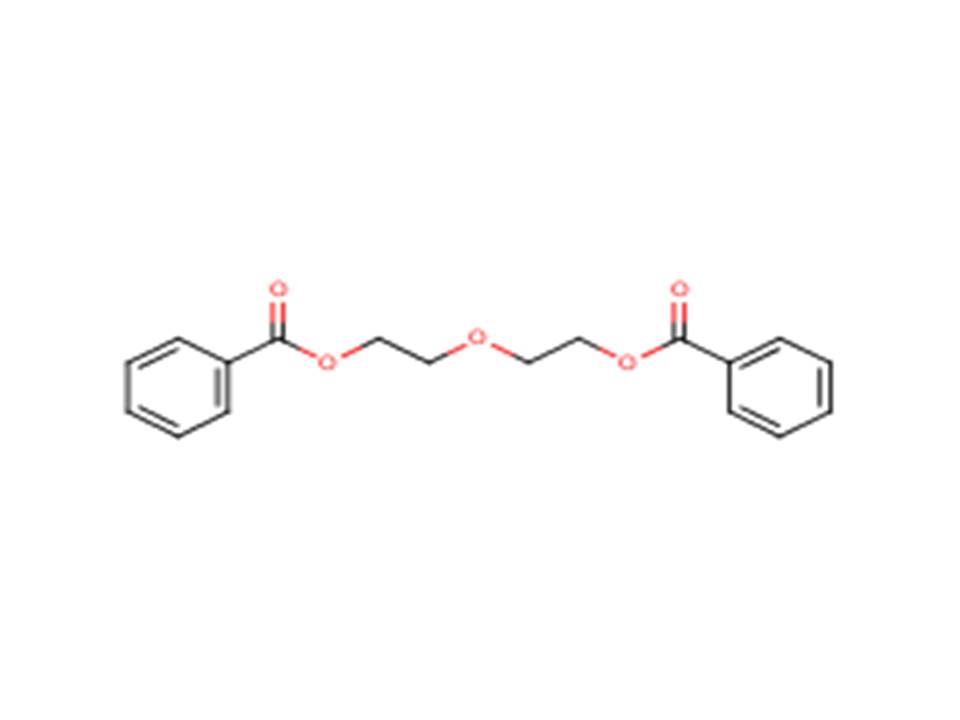 |
314,34 |
| 614-33-5 | Tribenzoate de glycérol (tribenzoïne) | 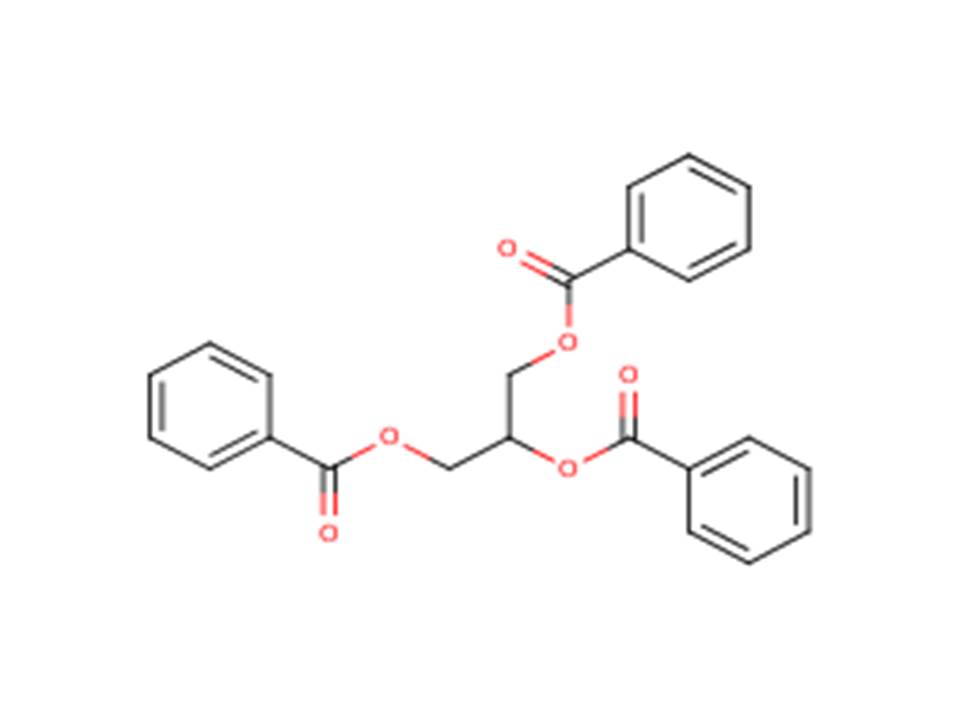 |
404,42 |
| 8024-05-3 | Huiles de tubéreuse (huiles de tubéreuse) | 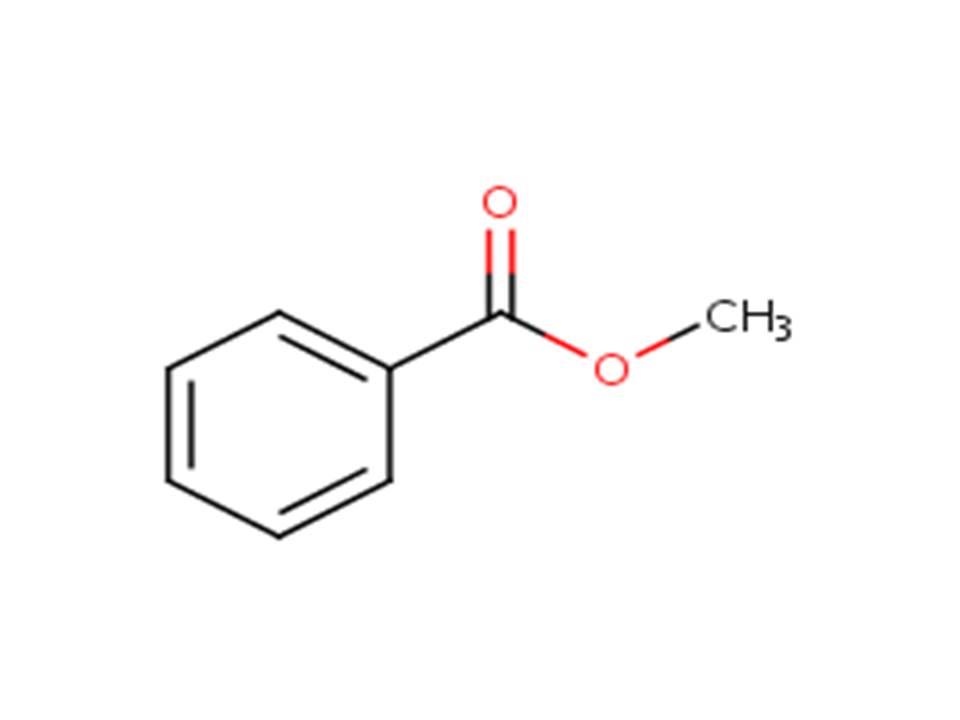 |
S. O. |
| 27138-31-4 (DPGDB) | Dibenzoate d’oxydipropyle (dibenzoate de dipropylèneglycol | 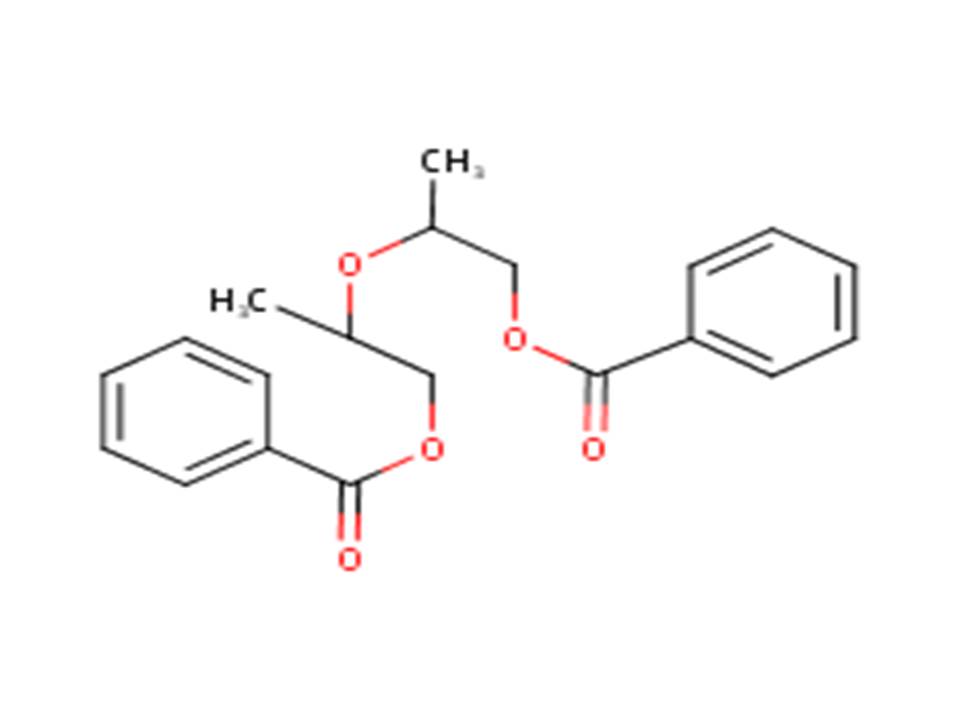 |
342,39 |
| 68052-23-3 (TMPD) | Dibenzoate de 2,2,4-triméthylpentane-1,3-diyle (dibenzoate de triméthylpentanediyle) | 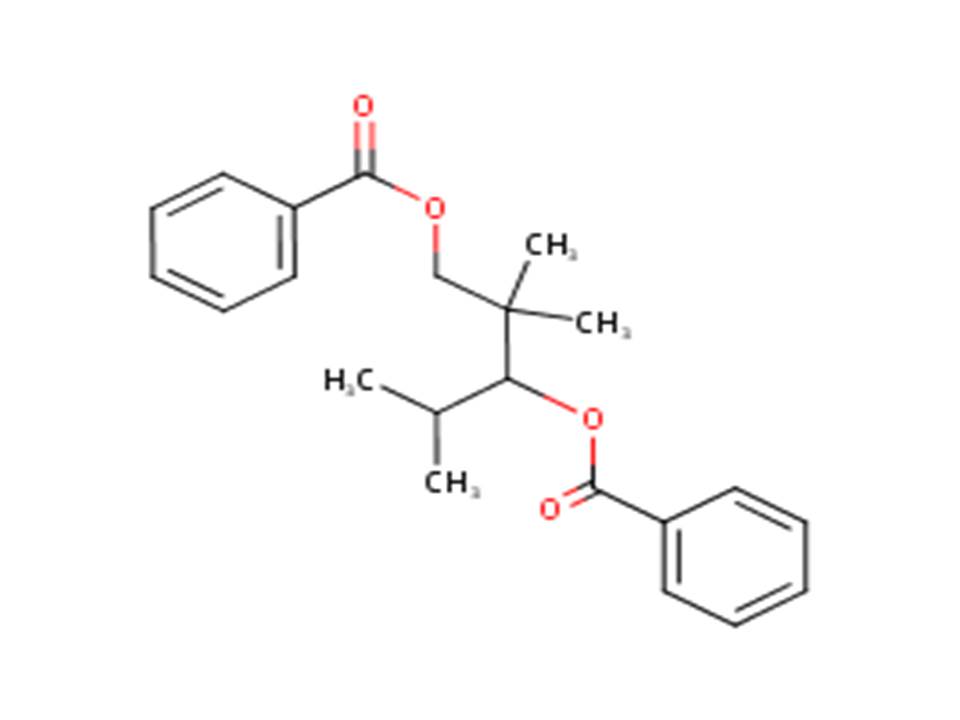 |
354,44 |
Abréviation : S. O. = sans objet.
Aux fins de l’évaluation, le groupe des benzoates a été séparé en 3 sous-groupes : les benzoates d’alkyle simples, les dibenzoates et les tribenzoates. Le sous-groupe des benzoates d’alkyle simples se compose de substances qui contiennent un ester alkyle simple (c.-à-d. méthyle, éthyle, butyle et isobutyle) de l’acide benzoïque. Les dibenzoates couverts dans la présente évaluation sont des benzoates dérivés de glycols d’éthylène ou de propylène, et le tribenzoate est un triester du glycérol et de l’acide benzoïque. Les 3 sous-groupes et leurs substances sont présentés dans le tableau 2‑2.
| No CAS (sigle) | Nom commun | Sous-groupe |
|---|---|---|
| 93-58-3 | Benzoate de méthyle | Benzoate d’alkyle simple |
| 93-89-0 | Benzoate d’éthyle | Benzoate d’alkyle simple |
| 120-50-3 | Benzoate d’isobutyle | Benzoate d’alkyle simple |
| 136-60-7 | Benzoate de butyle | Benzoate d’alkyle simple |
| 8024-05-3 | Huiles de tubéreuse | Benzoate d’alkyle simple |
| 120-55-8 (DEGDB) | Dibenzoate du diéthylèneglycol | Dibenzoate |
| 27138-31-4 (DPGDB) | Dibenzoate de dipropylèneglycol | Dibenzoate |
| 68052-23-3 (TMPD) | Dibenzoate de triméthylpentanédiyle | Dibenzoate |
| 614-33-5 | Tribenzoïne | Tribenzoate |
Une substance du groupe des benzoates, dite « huile de tubéreuse » (no CAS 8024‑05‑3), est considérée comme une substance UVCB (substance de composition inconnue ou variable, de produits de réaction complexes ou de matières biologiques). Les renseignements disponibles sur la composition des huiles de tubéreuse, bien que très limités, indiquent qu’elles sont composées de nombreux produits chimiques potentiels, et très peu des produits chimiques identifiés étaient présents en concentrations supérieures à plus de 5 % à 10 % (F&CT 2000; COE 2007; Rakthaworn et coll. 2009). Rakthaworn et coll. (2009) ont examiné la production des huiles de tubéreuse à partir d’extraits de la tubéreuse obtenus par diverses techniques d’extraction et ont analysé leur composition. Les principaux composants détectés étaient les esters de l’acide benzoïque, en particulier du benzoate de méthyle, en concentrations allant de 30 % à 44 %. De même, Surburg et Panten (2016) ont constaté que le benzoate de méthyle est utilisé dans les bases parfumées des extraits de tubéreuse et que le benzoate de benzyle a été identifié comme constituant chimique à des concentrations relativement élevées dans des concrets et des absolues de la tubéreuse. Selon Surburg et Panten (2016), les principaux constituants de l’absolue de la tubéreuse sont les esters de l’acide benzoïque.
Le sous-groupe des 9 substances de benzoates est fondé sur la similarité structurale et soutient la caractérisation des effets de ce groupe sur la santé. Plus précisément, les données sur l’acide benzoïque (voir le tableau 2‑3), un métabolite obtenu par hydrolyse du benzoate, ont servi à caractériser les risques pour la santé humaine.
| No CAS | Nom dans la LIS | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
| 65-85-0 | Acide benzoïque | 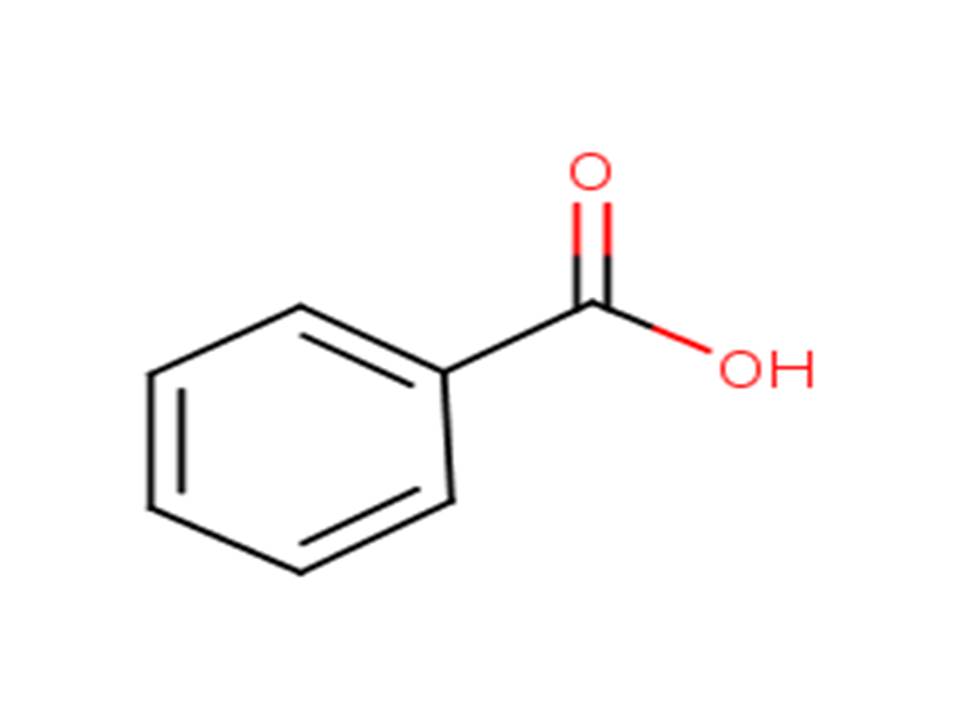 |
122,12 |
2.1 Sélection d’analogues et utilisation de modèles RQSA
Une approche de lecture croisée tirant parti des données sur les analogues et des résultats de modèles de relation quantitative structure-activité (RQSA) a été employée, au besoin, pour les volets environnement et santé humaine de l’évaluation. On a choisi des analogues dont la structure et/ou les fonctions étaient semblables à celles des substances de ce groupe (p. ex., d’après les propriétés physiques et chimiques et la toxicocinétique), et pour lesquelles on disposait de données empiriques pertinentes pouvant être utilisées en lecture croisée pour caractériser les dangers liés aux substances pour lesquelles les données empiriques étaient limitées ou inexistantes. Ainsi, on a déterminé l’applicabilité des modèles RQSA au cas par cas. Les détails des données de lecture croisée et des modèles RQSA choisis pour évaluer les effets du groupe des benzoates sur la santé humaine et l’environnement, le cas échéant, sont décrits dans les sections pertinentes du présent rapport.
3. Propriétés physiques et chimiques
Les tableaux 3-1 à 3-3 présentent un résumé des propriétés physiques et chimiques des substances du groupe des benzoates, ainsi que les fourchettes des valeurs pour chaque propriété. Quand les données expérimentales sur une substance étaient limitées ou indisponibles, nous avons utilisé les valeurs prévues pour la substance en question. Des données additionnelles sur les propriétés physiques et chimiques sont présentées dans ECCC 2016b.
| Propriété | Plage | Principales références |
|---|---|---|
| Point de fusion (°C) | -34 à 11 | ChemIDplus 1993-a,b, EPI Suite 2000 |
| Pression de vapeur (Pa) | 1,3 – 51 | ChemIDplus 1993-a,b, EPI Suite 2000 |
| Constante de la loi d’Henry (Pa·m3/mol) | 3,28 – 10,1 | ChemIDplus 1993-a,b, EPI Suite 2000 |
| Solubilité dans l’eau (mg/L) | 59 – 2100 | ChemIDplus 1993-a,b, EPI Suite 2000 |
| Log Koe (sans dimension) | 2,1 – 3,8 | ChemIDplus 1993-a,b, EPI Suite 2000 |
Abréviation : Koe = coefficient de partage octanol–eau.
| Propriété | Plage | Principales références |
|---|---|---|
| Point de fusion (°C) | 11 – 57 | ChemIDplus 1993-c,d, EPI Suite 2000 |
| Pression de vapeur (Pa) | 6,1 × 10−5 – 11 | ChemIDplus 1993-c,d, EPI Suite 2000 |
| Constante de la loi d’Henry (Pa·m3/mol) | 3,04 × 10−7 – 5,53 | ChemIDplus 1993-c,d, EPI Suite 2000 |
| Solubilité dans l’eau (mg/L) | 0,21 – 68 | ChemIDplus 1993-c,d, EPI Suite 2000 |
| Log Koe (sans dimension) | 3,0 – 6,0 | ChemIDplus 1993-c,d, EPI Suite 2000 |
Abréviation : Koe = coefficient de partage octanol–eau.
| Propriété | Valeur | Principales références |
|---|---|---|
| Point de fusion (°C) | 76 | ChemIDplus 1993e |
| Pression de vapeur (Pa) | 4,0 × 10−6 | EPI Suite 2000 |
| Constante de la loi d’Henry (Pa·m3/mol) | 6,18 × 10−3 | EPI Suite 2000 |
| Solubilité dans l’eau (mg/L) | 0,26 | EPI Suite 2000 |
| Log Koe (sans dimension) | 4,73 | EPI Suite 2000 |
Abréviation : Koe = coefficient de partage octanol–eau.
4. Sources et utilisations
Les benzoates d’alkyle simples sont naturellement présents dans les aliments tels que les pommes, les bananes, les cerises douces, les papayes, la bière, le cidre et le cacao (FooDB 2004). Les huiles de tubéreuse sont extraites de la tubéreuse, Polianthes tuberosa, et raffinées pour être utilisées en parfumerie comme source de composés aromatiques (Rakthaworn et coll. 2009). L’approvisionnement mondial en huiles de tubéreuse semble provenir entièrement des extraits de Polianthes tuberosa.
Les quatre substances des groupes de dibenzoates et de tribenzoates sont commercialement produites et ne sont pas présentes naturellement dans l’environnement.
Les 9 substances visées par la présente évaluation ont été incluses dans une enquête menée conformément à l’avis émis en vertu de l’article 71 de la LCPE (Canada 2012), et les quantités fabriquées et importées totales déclarées de ces substances en 2011 sont résumées dans le tableau 4‑1.
| Nom commun | Quantité fabriquée totalea (kg) | Quantité importée totalea,b (kg) |
|---|---|---|
| Benzoate de méthyle | A.D. | A.D. |
| Benzoate d’éthyle | A.D. | A.D. |
| Benzoate de butyle | A.D. | 1 000 – 10 000 |
| Benzoate d’isobutyle | A.D. | A.D. |
| Huiles de tubéreuse | A.D. | A.D. |
| Dibenzoate du diéthylèneglycol | A.D. | 1 000 000 – 10 000 000 |
| Dibenzoate de dipropylèneglycol | 1 500 | 1 100 000 |
| Dibenzoate de triméthylpentanédiyle | A.D. | 10 000 – 100 000 |
| Tribenzoïne | A.D. | 1 000 – 10 000 |
Abréviations : A.D. – Aucune déclaration. Dans le cadre de l’enquête menée en vertu de l’article 71 de la LCPE, aucune déclaration n’a été reçue concernant les quantités fabriquées ou importées.
a Les valeurs proviennent des quantités déclarées lors d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Voir les enquêtes pour les inclusions et exclusions spécifiques (annexes 2 et 3).
b Les quantités importées sont présentées de façon intentionnelle sous forme de plages afin de protéger des renseignements commerciaux confidentiels.
Benzoates d’alkyle simples
Bien qu’il n’existe aucune information définitive concernant la présence des benzoates d’alkyle simples comme aromatisants au Canada, ces substances peuvent être présentes dans les aliments vendus au Canada en raison de leur présence naturelle ou de leur utilisation possible comme aromatisants (communication personnelle de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence). Les États-Unis autorisent l’utilisation des benzoates de méthyle, d’éthyle et d’isobutyle comme aromatisants et additifs alimentaires synthétiques (21 CFR 172.515; US FDA 2016a). Les huiles de tubéreuse sont également considérées comme huile essentielle, oléorésine et extrait naturel, et elles sont généralement reconnues comme sans danger dans l’alimentation (US FDA 2016d). L’Union européenne autorise l’utilisation des benzoates de méthyle, d’éthyle, de butyle et d’isobutyle comme aromatisants dans les denrées alimentaires (EFSA 2012).
D’après les déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiques, le benzoate de méthyle, le benzoate d’éthyle et les huiles de tubéreuse sont utilisés dans certains produits cosmétiques au Canada (voir le résumé dans le tableau 4‑2) (communication personnelle de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence).
Les benzoates de méthyle, d’éthyle et d’isobutyle ont également été identifiés comme produits de formulation dans les produits antiparasitaires, y compris les insectifuges, les insecticides, les arachnicides et les assainisseurs (communication personnelle de l’Agence de réglementation de la lutte antiparasitaire au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence).
Toutes les substances du sous-groupe des benzoates d’alkyle simples peuvent être utilisées comme agents parfumants dans les produits d’entretien ménager, mais les types et les concentrations des produits utilisés ne sont pas indiqués (Clorox 2017; IFRA 2011). Le benzoate de butyle peut également être utilisé comme véhiculeur pour la teinture des textiles (HSDB 1983- ). Cependant, aucune information n’a été relevée qui permettrait de déterminer dans quelle mesure cette utilisation a cours au Canada. Le tableau 4‑2 présente un résumé des utilisations potentielles au Canada des benzoates d’alkyle simples.
Le benzoate de méthyle est répertorié dans la Base de données sur les produits de santé naturels homologués (BDPSNH) comme ingrédient non médicinal dans deux produits de santé naturels à application topique actuellement homologués, dont la production a cessé (communication personnelle de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, juin 2018; sans référence).
| Utilisation | 93-58-3 | 93-89-0 | 120-50-3 | 136-60-7 | 8024-05-3 |
|---|---|---|---|---|---|
| Produits de nettoyagea | O | O | O | N | N |
| Aromatisantsb | O | O | O | O | O |
| Déclarés présents dans les cosmétiques, en vertu du Règlement sur les cosmétiquesc | O | O | N | N | O |
| Agent de préparation dans les produits antiparasitaires homologuésd | O | O | O | N | N |
| Textilese | N | N | N | O | N |
Abréviations : O = Utilisation déclarée pour cette substance; N = Utilisation non déclarée pour cette substance.
a Les produits de nettoyage comprennent les catégories de code de produit de consommation pour les produits de nettoyage, d’ameublement, de lessive et de lavage de vaisselle (Canada 2012; Clorox 2017; Environnement Canada 2013; IFRA 2011).
b Communication personnelle de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence.
c D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques (communications personnelles, courriels de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, février 2017; sans référence.
d Communications personnelles, courriels de l’Agence de réglementation de la lutte antiparasitaire au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence.
e HSDB 1983- .
Dibenzoates
Au Canada, le DPGDB et le DEGDB ont été identifiés comme composants d’adhésifs utilisés dans la fabrication de cartons et de boîtes en carton ondulé pour l’emballage de certains aliments (communication personnelle de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence).
D’après les déclarations présentées en vertu du Règlement sur les cosmétiques, le DPGDB et le TMPD sont utilisés dans certains produits cosmétiques au Canada (communication personnelle de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence).
Le DEGDB et le DPGDB ont été identifiés comme produits de formulation dans les produits antiparasitaires destinés à la préservation du bois (communication personnelle de l’Agence de réglementation de la lutte antiparasitaire au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence).
Tous les dibenzoates ont été trouvés comme plastifiants dans les produits de consommation, y compris les adhésifs, agents d’étanchéité, peintures et enduits, et dans des matières en plastique et en caoutchouc (SDS 2011; SDS 2014a; SDS 2014b; SDS 2015a; TDS 2015), ainsi que dans des encres, des encres en poudre et des colorants disponibles dans le commerce (Environnement Canada 2013; Pubchem 1988; TDS 2015). En particulier, le DPGDB et le DEGDB étaient présents dans les agents de calfeutrage et d’étanchéité à des concentrations atteignant 10 % (SDS 2014c; SDS 2015b), et le TMPD est utilisé dans les procédés de fabrication du secteur automobile (Environnement Canada 2013). Le DPGDB peut également être utilisé comme additif dans les peintures et les enduits destinés à assurer l’imperméabilisation à l’intérieur (concentration de 6 %) et dans les peintures trouvées dans les trousses d’artisanat destinées aux enfants, à des concentrations atteignant 7 % (Environnement Canada 2013; SDS 2011; SDS 2014b). La présence du TMPD a été signalée dans les peintures non destinées au consommateur (Environnement Canada 2013) et l’utilisation du DEGDB a été constatée dans les enduits pour dessous de caisse de véhicules (Eastman 2016; SDS 2014a).
Le DEGDB et le DPGDB ont également été identifiés comme composants dans les lubrifiants et les graisses, mais on n’a pas trouvé trace de leur présence dans les produits de consommation (Environnement Canada 2013). Le DPGDB a également été identifié comme plastifiant dans certains agents de resurfaçage des sols en ciment et comme antiadhésif dans les résines de moulage. Cependant, ces utilisations sont limitées aux milieux industriels (Environnement Canada 2013).
Le DPGDB figure dans la BDPSNH en tant qu’ingrédient non médicinal dans un nombre limité de produits d’écran solaire topique au Canada (communication personnelle de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence). Le tableau 4‑3 présente un résumé des utilisations potentielles des dibenzoates au Canada.
| Utilisation | 120-55-8 | 27138-31-4 | 68052-23-3 |
|---|---|---|---|
| Matériaux d’emballage alimentairea | O | O | N |
| Ingrédients médicinaux ou non médicinaux dans des produits de santé naturels homologuésb | N | O | N |
| Déclarés présents dans les cosmétiques en vertu du Règlement sur les cosmétiquese | N | O | O |
| Produits de formulation dans des produits antiparasitaires homologuésd | O | O | N |
| Produits de consommatione | O | O | O |
Abréviations : O = Utilisation déclarée pour cette substance; N = Utilisation non déclarée pour cette substance.
a Communications personnelles, courriel de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence.
b Communications personnelles, courriel de la Direction des produits thérapeutiques, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence.
c D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques (communications personnelles, courriels de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016 et février 2017; sans référence.
d Communications personnelles, courriels de l’Agence de réglementation de la lutte antiparasitaire au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence.
e Environnement Canada 2013, Eastman 2016, SDS 2011, SDS 2014a, SDS 2015-a,b, TDS 2013, TDS 2015.
Tribenzoates
L’Union européenne autorise l’utilisation de la tribenzoïne comme aromatisant dans les aliments (EFSA 2012). Aucune information n’est disponible concernant son utilisation potentielle comme aromatisant au Canada (communication personnelle de la Direction des aliments, Santé Canada au Bureau d’évaluation du risque des substances existantes, Santé Canada, février 2017; sans référence).
D’après les déclarations présentées en vertu du Règlement sur les cosmétiques, la tribenzoïne est utilisés dans certains produits au Canada (communication personnelle de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, mars 2017; sans référence).
La tribenzoïne ne figure pas comme produit de formulation ou principe actif dans les produits antiparasitaires homologués au Canada (communication personnelle de l’Agence de réglementation de la lutte antiparasitaire au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence).
La tribenzoïne ne figure pas dans la base de données interne de la Direction des produits thérapeutiques comme ingrédient médicinal ou non médicinal des désinfectants et des médicaments pour usage humain ou vétérinaire au Canada (communications personnelles de la Direction des produits thérapeutiques, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence). Elle n’est pas non plus répertoriée dans la BDPSNH comme substance présente dans les produits de santé naturels actuellement homologués au Canada (communication personnelle de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence).
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés aux 9 substances du groupe des benzoates, selon la présente évaluation préalable, ont été caractérisés d’après l’approche dite de classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE est une approche qui tient compte de plusieurs paramètres liés au danger et à l’exposition et qui pondère plusieurs éléments de preuve pour obtenir un classement du risque. Les divers éléments de preuve sont combinés afin de faire la différence entre des substances présentant une puissance plus ou moins élevée et un potentiel d’exposition plus ou moins élevé dans divers milieux. Cette approche réduit l’incertitude globale de la caractérisation des risques comparativement à une approche qui reposerait sur un seul paramètre dans un seul milieu (p. ex., CL50) pour la caractérisation. Puisque l’huile de tubéreuse est une substance UVCB et qu’on ne pourrait la représenter convenablement par une seule structure chimique, on a utilisé une approche manuelle fondée sur le jugement pour la classification. La méthode, décrite en détail par ECCC (2016a), est résumée ci-dessous.
Des données sur les propriétés physico-chimiques, le devenir (demi-vie chimique dans divers milieux et biotes, coefficients de partage, bioconcentration dans le poisson), l’écotoxicité aiguë pour le poisson et les quantités produites et importées au Canada ont été relevées dans la littérature scientifique, dans des bases de données empiriques (p. ex., boîte à outils RQSA de l’OCDE) et dans les réponses à des enquêtes menées conformément à l’avis émis en vertu de l’article 71 de la LCPE. D’autres données ont été obtenues en utilisant des modèles RQSA, le devenir du bilan massique ou la bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils d’exposition et de danger de la substance.
Les profils de danger ont été principalement établis d’après le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité, ainsi que l’activité chimique et biologique. Les profils d’exposition ont aussi été calculés à partir de plusieurs paramètres, dont les taux de rejet potentiels, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance comme faible, moyen ou élevé. D’autres règles ont été appliquées (p. ex., constance de la classification, marge d’exposition) afin de raffiner les classifications préliminaires du danger et de l’exposition. Cependant, dans le cas de l’huile de tubéreuse, il n’a pas été possible d’établir le profil de danger et d’exposition en raison de l’absence de structure représentative pour estimer les propriétés nécessaires et l’absence de données empiriques pour ces propriétés. Par conséquent, on a procédé à une classification manuelle du danger et de l’exposition au moyen d’un examen des constituants UVCB et de l’information obtenue au moyen d’enquêtes menées conformément à l’avis soumis en vertu de l’article 71 de la LCPE, et on a fondé les décisions sur l’examen de substances similaires et l’application du jugement de spécialistes.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque potentiel faible, moyen ou élevé, basé sur la classification de son danger et de son exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées selon une approche en deux étapes. La première étape servait à ajuster les résultats de la classification du risque de moyen/élevé à faible pour les substances affichant une faible vitesse d’émission estimée dans l’eau après traitement des eaux usées, ce qui indique un faible potentiel d’exposition. La deuxième étape consistait à réexaminer les résultats de la classification des risques potentiels faibles. À cette fin, on a employé des scénarios de risque relativement prudents, d’échelle locale (c.-à-d. valables dans la zone proche du point de rejet), élaborés pour protéger l’environnement, afin de déterminer si un risque potentiel devait être classé à un niveau supérieur.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’une sur-classification ou d’une sous-classification du danger, de l’exposition et du risque subséquent. Les approches équilibrées pour tenir compte des incertitudes sont décrites en plus de détails dans le document ECCC 2016a. Nous décrivons ci-après deux des incertitudes les plus importantes. Les erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des changements de la classification du danger, en particulier en ce qui a trait aux paramètres reposant sur les concentrations des résidus dans les tissus (c.-à-d. mode d’action toxique), dont bon nombre sont prévues par les modèles RQSA. Toutefois, l’impact de cette erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) des concentrations de résidus dans les tissus utilisées pour l’analyse critique des résidus corporels. Les erreurs dans la sous-estimation de la toxicité aiguë seront atténuées par l’utilisation d’autres paramètres de risque comme le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison aux œstrogènes. Des changements ou des erreurs dans les quantités chimiques pourraient produire des différences dans le classement de l’exposition, puisque les scores d’exposition et de risque sont très sensibles aux taux d’émission et aux quantités utilisées. Les résultats de la CRE reflètent donc l’exposition et le risque au Canada d’après les quantités actuellement utilisées et pourraient ne pas refléter des tendances futures.
Les données critiques et les facteurs pris en compte pour produire les profils spécifiques de chacune des 9 substances du groupe des benzoates, ainsi que les résultats de la classification du danger, de l’exposition et du risque, sont présentés dans ECCC (2016b).
La classification des 9 substances du groupe des benzoates, en termes de danger et d’exposition, est résumée dans le tableau 5-1.
| Nom commun | Classification du danger selon la CRE | Classification de l’exposition selon la CRE | Classification du risque selon la CRE |
|---|---|---|---|
| Benzoate de méthyle | faible | faible | faible |
| Benzoate d’éthyle | faible | faible | faible |
| Benzoate d’isobutyle | faible | faible | faible |
| Dibenzoate du diéthylèneglycol | faible | faible | faible |
| Benzoate de butyle | faible | faible | faible |
| Tribenzoïne | faible | faible | faible |
| Huiles de tubéreuse | faible | faible | faible |
| Dibenzoate de dipropylèneglycol | faible | faible | faible |
| Dibenzoate de triméthylpentanédiyle | faible | modérée | faible |
La tribenzoïne a été classée comme substance présentant un faible potentiel de risque, bien que les données modélisées indiquent un potentiel élevé de réactivité avec les tissus biologiques. Cependant, ces résultats modélisés ne sont pas étayés par les données tirées d’études empiriques indiquées dans le volet santé humaine de la présente évaluation. Ces données indiquent que la tribenzoïne est métabolisée en acide benzoïque, une substance qui présente peu de propriétés dangereuses chez les humains. Il subsiste une certaine incertitude quant aux différences métaboliques entre les systèmes aquatiques et les humains. Toutefois, compte tenu des renseignements ci-dessus et des données qui caractérisent la tribenzoïne et les dérivés benzyliques présentées dans la section sur les effets sur la santé, il est peu probable que les fluctuations du profil d’utilisation entraînent une augmentation importante du risque.
Selon les renseignements pris en compte dans l’approche de CRE, on a déterminé que les huiles de tubéreuse ont un potentiel élevé d’exposition en raison des grandes quantités utilisées et de la longue persistance globale. En ce qui concerne le dibenzoate de triméthylpentanediyle, il aurait un potentiel d’exposition modéré en raison des quantités modérées utilisées et de sa longue persistance globale. Le benzoate de méthyle, le benzoate d’éthyle, le benzoate d’isobutyle, le dibenzoate du diéthylèneglycol, le benzoate de butyle et le dibenzoate de dipropylèneglycol ont, quant à eux, un faible potentiel d’exposition. Ces huit substances ont un potentiel de danger faible et donc, un faible potentiel de risque global pour l’environnement. Il est par conséquent peu probable que ces substances suscitent des préoccupations pour l’environnement au Canada.
6. Potentiel de causer des effets nocifs pour la santé humaine
6.1 Évaluation de l’exposition
Milieux naturels et aliments
Aucune donnée canadienne ou internationale récente sur les concentrations dans l’air ambiant, l’eau potable, les aliments ou le sol n’a été relevée pour les 9 substances visées par la présente évaluation.
Dans le cadre du Cycle 2 de l’Enquête canadienne sur les mesures de la santé (Patry-Parisien et coll. 2013), des mesures empiriques de l’air intérieur ont été faites pour les benzoates de méthyle, d’éthyle et d’isobutyle dans les résidences partout au Canada. Ces substances ont été détectées peu fréquemment et à de faibles concentrations dans l’air intérieur (les concentrations maximales allaient de 0,18 à 0,54 µg/m3 et les fréquences de détection allaient de 0,03 % à 6 %). Par conséquent, les personnes peuvent être exposées à des benzoates d’alkyle simples en raison de leur présence dans l’air intérieur. Dans le cas des dibenzoates, le DEGDB n’a pas été détecté dans une étude canadienne portant sur les résidences où se trouvaient des enfants asthmatiques (CNRC 2011).
Certains des benzoates d’alkyle simples inclus dans cette évaluation sont présents naturellement dans certains aliments (voir la section Sources et utilisations). De plus, tous les benzoates d’alkyle simples et la tribenzoïne peuvent être ajoutés aux aliments en tant qu’aromatisants. Cependant, aucune information exacte n’est disponible sur l’utilisation potentielle de ces substances en tant qu’aromatisants au Canada. Il y a donc un risque d’exposition alimentaire aux benzoates d’alkyle simples et à la tribenzoïne en raison de leur utilisation possible en tant qu’aromatisants ou de la consommation d’aliments qui en contiennent naturellement.
Au Canada, le DPGDB et le DEGDB ont été identifiés en tant que composants dans des adhésifs utilisés pour la fabrication de cartons et de boîtes en carton ondulé pour emballer certains aliments. Cependant, il n’y a pas de contact direct de l’adhésif d’emballage avec ces aliments (communication personnelle de la Direction des aliments, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, novembre 2016; sans référence).
Produits de consommation
D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, le benzoate de méthyle, le benzoate d’éthyle, les huiles de tubéreuse, le DPGDB, le TMPD et la tribenzoïne sont présents dans les cosmétiques au Canada (communication personnelle de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation du risque des substances existantes, Santé Canada, mars 2017; sans référence). Il existe donc un potentiel d’exposition par voie cutanée aux substances susmentionnées lors de l’utilisation de certains produits cosmétiques.
Les produits de bricolage offerts aux consommateurs canadiens pouvant contenir des substances du sous-groupe de dibenzoates comprennent les agents de calfeutrage et les peintures destinés à l’usage intérieur (Environnement Canada 2013; SDS 2015b; SDS 2014c; SDS 2014b). Le DPGDB est également présent dans les peintures offertes dans les trousses d’artisanat à l’intention des enfants, à une concentration de 7 % (Environnement Canada 2013; SDS 2011). Les benzoates de méthyle, d’éthyle, de butyle et d’isobutyle sont utilisés comme agents parfumants dans des produits d’entretien ménager non spécifiés (Clorox 2017; IFRA 2011). Il existe donc un risque d’exposition par voie cutanée et/ou par inhalation de la population générale du Canada subséquent à l’utilisation de ces types de produits.
Les autres produits, décrits dans la section Sources et utilisations (encres, encres en poudre, colorants, etc.), qui contiennent des substances du groupe des benzoates sont surtout utilisés en milieu industriel ou dans des produits commerciaux et ne devraient pas entraîner l’exposition des consommateurs (Environnement Canada 2013; HSDB 1983- ; SDS 2014a; TDS 2015b).
Par ailleurs, deux des composés de benzoate (benzoate d’isobutyle et benzoate d’éthyle) ont été décelés dans une faible proportion de liquides de cigarette électronique dans une étude allemande (Hutzler et coll. 2014).
6.2 Évaluation des effets sur la santé
En ce qui concerne l’évaluation des effets du groupe des benzoates sur la santé, ce groupe a été séparé en trois sous-groupes. Cependant, la caractérisation des dangers concorde avec les preuves empiriques selon lesquelles les membres des trois sous-groupes s’hydrolysent facilement en acide benzoïque, lequel est subséquemment métabolisé en acide hippurique, puis éliminé (JECFA 1997; JECFA 2002a; OCDE SIDS 2001; US EPA 2010; EFSA 2012; ECHA 2000a). Par conséquent, la présente évaluation des esters de benzoate porte sur les données relatives aux effets sur la santé de l’acide benzoïque et des dérivés benzyliques censément métabolisés en acide benzoïque. Compte tenu des évaluations réalisées par d’autres instances (JECFA, OCDE), qui ont conclu que ces substances et d’autres substances similaires présentent une faible toxicité, et également que les substances de ce groupe se métabolisent en acide benzoïque, le risque potentiel pour la santé humaine est jugé faible.
Toxicocinétique
L’absorption, la distribution, le métabolisme et l’élimination (ADME) des esters de benzoate ont été décrits dans un certain nombre d’évaluations menées dans le mondeNote de bas de page 6, ainsi que dans des études sur les ingrédients cosmétiques (Cosmetic Ingredient Reviews – CIR) (Becker et coll. 2012) et les examens des ingrédients généralement considérés comme sécuritaires (Generally Recognized as Safe – GRAS) de la Flavor and Extract Manufacturers Association (FEMA) (p. ex., Adams et coll. 2005).
Ces évaluations portent souvent sur les dérivés benzyliques de façon plus générale, y compris l’alcool benzylique, le benzaldéhyde, l’acétate de benzyle et l’acide benzoïque et ses sels (p. ex., le benzoate de sodium). Les dérivés benzyliques, qui comprennent les esters de benzoate, sont rapidement absorbés par l’intestin et hydrolysés dans le foie. Ces substances sont fréquemment regroupées dans les évaluations, car il est généralement admis qu’elles se métabolisent toutes en acide benzoïque et en alcool correspondant (p. ex., le benzoate de méthyle se métabolise en acide benzoïque et en méthanol) (JECFA 1997; JECFA 2001; JECFA 2002a; Becker et coll. 2012). L’acide benzoïque est ensuite conjugué avec la glycine, surtout dans le foie, et éliminé dans les 24 heures, principalement sous forme d’acide hippurique (JECFA 2001). L’EFSA (2012) a examiné la toxicocinétique des dérivés benzyliques et a conclu qu’après l’administration par voie orale, plus de 95 % de l’acide benzoïque est absorbé, métabolisé et éliminé rapidement. Les principaux métabolites identifiés comprennent l’acide hippurique (70,2 % à 84,2 %), l’acide benzoïque (0,4 % à 12,8 %) et le glucuronide de benzoyle (0,7 % à 1,8 %) (OCDE 2011; EFSA 2012).
En ce qui concerne les benzoates, les preuves empiriques de l’absorption cutanée et du métabolisme cutané, bien que limitées, indiquent que les benzoates seront systématiquement disponibles et seront hydrolysés par des mécanismes enzymatiques (Xia et coll. 2007; Becker et coll. 2012; ECHA 2015a).
Dibenzoates et tribenzoates
La toxicocinétique de certains membres des groupes de dibenzoates et de tribenzoates a également été évaluée. La tribenzoïne (no CAS 614-33-5) devrait s’hydrolyser rapidement en acide benzoïque (JECFA 2001; JECFA 2002a). Les substances du sous-groupe des dibenzoates n’ont pas été explicitement examinées par le JECFA ou l’EFSA, car on ne les emploie pas comme additifs alimentaires. Cependant, on a estimé qu’une substance connexe, le dibenzoate de propylèneglycol (no CAS 19224-26-1), présente les mêmes voies métaboliques que les autres esters de benzoate (JECFA 2002a; JECFA 2002b; EFSA 2012). De plus amples renseignements sur la toxicocinétique des dibenzoates sont présentés ci-dessous.
Dans le cadre d’une présentation faite selon le règlement REACH (enregistrement, évaluation, autorisation et restriction des substances chimiques) pour le DEGDB et le DPGDB (ECHA 2000a), la toxicocinétique du DEGDB a été observée chez des rats CD-1 qui avaient reçu une dose unique faible par gavage oral de 50 mg/kg et une dose élevée de 750 mg/kg. Selon l’étude, les principaux métabolites identifiés étaient l’acide hippurique, l’acide benzoïque et le monobenzoate de diéthylèneglycol. Le principal métabolite dans l’urine était l’acide hippurique, qui représentait 94 % à 97 % de la dose de 50 mg/kg et 85 % à 88 % de la dose de 750 mg/kg. À la dose faible, un glucuronide de l’acide benzoïque a été identifié à 1 %, tandis qu’à la dose élevée, il a été observé entre 6 % et 9 %. Les auteurs ont conclu que la métabolisation du DEGDB s’était faite par hydrolyse pour former de l’acide benzoïque qui a été conjugué à la glycine (production de l’acide hippurique, un métabolite) et, dans une moindre mesure, par l’acide glucuronique (ECHA 2000a). Une étude plus ancienne sur la toxicocinétique du DPGDB (c.-à-d. le plastifiant de qualité technique Benzoflex 9-88 administré à des rats) a également démontré que la substance est rapidement métabolisée et éliminée, 70 % de la dose ayant été éliminée dans l’urine (dans les 48 heures) sous forme d’acide hippurique et 10 % par les matières fécales (Butz et coll. 1982).
Pour le TMPD, aucune donnée toxicocinétique n’était disponible. Cependant, à l’aide du simulateur métabolique OASIS TIMES (TIMES 2016), on a prévu, dans une simulation in vivo chez le rat, que cette substance suivrait des voies métaboliques similaires à celles des autres dibenzoates (c.-à-d. DEGDB et DPGDB) dans ce sous-groupe, et avec la classe des composés benzoates de façon plus générale. Le simulateur OASIS TIMES a identifié les deux principaux métabolites, à savoir l’acide hippurique et les dérivés de glucuronide de l’acide benzoïque (p. ex., glucuronide de benzoyle). La modélisation réalisée pour le DEGDB à l’aide du simulateur OASIS TIMES a révélé un profil métabolique similaire pour cette substance.
6.2.1 Caractérisation des dangers de l’acide benzoïque
Les effets de l’acide benzoïque sur la santé ont été examinés et évalués, avec la substance seule et avec d’autres dérivés benzyliques, par plusieurs organisations internationales, dont le JECFA (1996, 2001), l’OMS (2005) et l’OCDE (2001). En outre, l’EPA, le Comité scientifique pour l’alimentation humaine (CSAH) et le Comité scientifique des produits de consommation (CSPC), tous deux de la Commission européenne, ont tous réalisé des évaluations de l’acide benzoïque et du benzoate de sodium (US EPA 2010; SCF 1994; SCF 2002; CSPC 2005).
Une étude de toxicité par voie cutanée de 21 jours chez le lapin blanc de Nouvelle-Zélande (4 mâles et 4 femelles par groupe, exposés 5 jours par semaine pendant 3 semaines) avec de l’acide benzoïque administré à raison de 0, 100, 500 ou 2 500 mg/kg p.c./j, a permis d’établir une DSE(N)O à la dose maximale d’essai, c.-à-d. 2 500 mg/kg p.c./j. Hormis une irritation cutanée mineure observée chez un lapin du groupe ayant reçu la dose élevée, aucun effet lié au traitement n’a été observé (IRDC 1981). D’après les données disponibles (OCDE 2001), on prévoit que ces composés ont une faible toxicité aiguë par voie cutanée et par inhalation. L’EFSA (2016) a également procédé à une réévaluation de l’acide benzoïque et de ses sels, et a constaté que l’acide benzoïque présentait une faible toxicité aiguë et que les résultats des études disponibles de toxicité subchronique et à court terme par voie orale « indiquaient que la toxicité de l’acide benzoïque et de ses sels est faible et qu’il n’y a pas de toxicité marquée pour les organes cibles ». L’acide benzoïque est légèrement irritant pour la peau et irritant pour les yeux, mais il n’est pas considéré comme un sensibilisant cutané (OCDE 2001; CSPC 2005; OMS 2005).
Dans des études chroniques à doses répétées, on a observé que la toxicité de l’acide benzoïque est faible. Dans une étude sur quatre générations, réalisée par Kieckebusch et Lang (1960), et signalée comme une étude clé par diverses organisations internationales (p. ex., OCDE 2001; SCF 2005; OMS 2005), 20 rats de chaque sexe par groupe avaient été nourris selon un régime alimentaire contenant 0,5 % ou 1,0 % d’acide benzoïque. L’apport estimé, d’après ce régime alimentaire contenant 0,5 % et 1 % d’acide benzoïque, était de 375 mg/kg/j et 750 mg/kg/d, respectivement. Dans cette étude, la DSENO a été établie à 750 mg/kg/j (1,0 % d’acide benzoïque dans le régime alimentaire). Cependant, d’autres examinateurs (p. ex., SCF 2005; OMS 2005; EFSA 2016) ont indiqué que cette valeur de 750 mg/kg/j représente une DSENO de 500 mg/kg p.c./j, sur la base du poids corporel par jour. Le rapport de l’OCDE traitant de cette étude indique que dans les quatre générations, aucun effet sur la croissance ou le poids des organes n’a été constaté, et qu’il n’y avait aucun signe histopathologique chez les animaux de la troisième génération (OCDE 2001)Note de bas de page 7. Dans l’ensemble, l’OCDE (2001) a déterminé qu’une DSENO de 800 mg/kg/j pouvait être établie sur la base des résultats d’une variété d’études de toxicité chronique à doses répétées par voie orale, études qui étaient disponibles dans son groupe d’évaluation SIAR pour le benzoate. Une DSENO de > 1 000 mg/kg/j a été jugée appropriée pour les sels de l’acide benzoïque. En conclusion, l’OCDE (2001) a indiqué que « ... l’acide benzoïque et ses sels présentent une toxicité très faible à doses répétées ».
L’OCDE (2001) a conclu son évaluation des benzoates, y compris l’acide benzoïque, en indiquant que « … les composés ne présentent aucun signe de cancérogénicité ». Le JECFA (1996, 2001) a examiné les résultats d’études de toxicité chronique et de cancérogénicité par voie orale chez la souris et le rat pour un certain nombre de dérivés benzyliques (avec l’hypothèse que tous étaient rapidement métabolisés en acide benzoïque in vivo) et a déterminé que « … les données examinées étaient suffisantes pour démontrer l’absence de cancérogénicité » (JECFA 2001).
Un certain nombre d’organismes (p. ex., SCF 1994; JECFA 1996; JECFA 2001; OCDE 2001; CSPC 2005; OMS 2005; EFSA 2016) ont réalisé plusieurs examens des données sur la génotoxicité in vivo et in vitro de l’acide benzoïque et de ses dérivés benzyliques connexes. Pour ces substances, l’OCDE (2001) a indiqué que tous ces produits chimiques ne présentaient pas d’activité mutagène dans les tests in vitro d’Ames et les réponses chromosomiques mixtes/équivoques in vitro. Toutefois, aucun signe de génotoxicité n’a été observé dans un certain nombre d’essais in vivo, et il a été conclu, sur la base des renseignements disponibles, que les substances ne sont pas mutagènes ou clastogènes dans les essais in vitro et in vivo (OCDE 2001). Le JECFA (2001) a également noté que l’acide benzoïque n’était pas mutagène dans l’essai d’Ames, mais qu’un certain degré de clastogénicité (faible) avait été observé. Cependant, ce résultat n’avait pas été reproduit dans des essais in vivo. L’EFSA a réévalué les données de génotoxicité, en particulier les résultats d’une clastogénicité faiblement positive, et a également examiné des études qui ne l’avaient pas été dans les évaluations précédentes. Elle a conclu que l’acide benzoïque et ses sels ne présentent pas d’effets génotoxiques (EFSA 2016).
L’EFSA (2016) a examiné les renseignements disponibles sur la toxicité de l’acide benzoïque et de ses sels pour la reproduction et le développement et a estimé que l’étude de toxicité pour la reproduction sur quatre générations (Kieckebusch et Lang, 1960), mentionnée précédemment, était l’étude clé. La DSE(N)O établie par cette étude était de 500 mg/kg p.c./j, soit la dose maximale d’essai, chez les parents et les descendants, sans effet sur la croissance, la fertilité, la lactation ou la survie observé à cette dose (EFSA 2016). L’OCDE (2001), le CSPC (2005) et l’OMS (2005) ont également considéré qu’il s’agissait de l’étude clé pour ce qui est de la toxicité pour la reproduction et le développement, et l’OCDE a noté qu’à la dose faible, l’administration entraînait une prolongation de la vie par rapport aux témoins. L’OCDE (2011) a conclu que les données disponibles étaient suffisantes pour « démontrer l’absence de potentiel reprotoxique » des benzoates. De même, l’OMS (2005) a estimé que les renseignements disponibles « étayent la notion selon laquelle l’acide benzoïque n’est pas susceptible d’avoir des effets nocifs sur la reproduction à des doses non toxiques pour la mère ».
L’OMS (2005) a conclu que les effets sur le développement, y compris la toxicité embryonnaire et fœtale, ainsi que les malformations, n’ont été observés qu’à des doses entraînant une grave toxicité maternelle. Des études portant sur des rats, des souris, des hamsters et des lapins, ayant reçu de l’acide benzoïque et des substances apparentées par voie orale dans le régime alimentaire ou par gavage, ont fait état de valeurs DSENO allant jusqu’à 1 400 mg/kg p.c./j. Toutes ces études ont indiqué que la DSENO pour les effets sur le développement était la même que la DSENO pour la toxicité maternelle. L’OCDE (2001) a conclu que les « composés ne présentent aucune toxicité pour le développement » et a indiqué qu’une DSEO de 500 mg/kg/j pour ce critère d’effet était appropriée.
Sur la base des données probantes concernant l’acide benzoïque et les substances apparentées, la toxicité subchronique et à court terme est faible. Une étude de toxicité par voie cutanée sur 21 jours a permis d’établir une DSE(N)O de 2 500 mg/kg p.c./j, soit la dose maximale d’essai.
En résumé, sur la base des données disponibles, la toxicité systémique (chronique) et pour la reproduction et le développement de ces substances est également considérée comme faible. En utilisant les données pour l’acide benzoïque et sa toxicité à long terme à doses répétées et sa toxicité pour la reproduction et le développement, la DSENO pour l’acide benzoïque, ses sels et les substances apparentées, a été établie à 500 mg/kg p.c./j. Cette valeur est basée sur l’étude de quatre générations réalisée par Kieckebusch et Lang (1960), une étude pivot utilisée et évaluée par un certain nombre d’organisations internationales (p. ex., JECFA 2001; OCDE 2001; CSPC 2005; EFSA 2016). Il convient également de noter que la DSENO de 500 mg/kg p.c./j dans cette étude représente la dose maximale d’essai. De plus, le poids de la preuve indique que ces substances ne sont pas génotoxiques et qu’elles ne présentent pas de potentiel cancérogène.
Enfin, le JECFA a indiqué, dans le cadre de son évaluation de l’innocuité des dérivés benzyliques dans la série de rapports techniques de l’OMS (909), que les substances sont rapidement métabolisées en acide benzoïque, qui est considéré comme endogène chez l’humain, et « ne devraient donc pas présenter des problèmes d’innocuité » (JECFA 2002a).
6.2.2 Benzoates d’alkyle simples
La caractérisation des effets sur la santé des benzoates d’alkyle simples faisant partie de ce groupe est basée principalement sur les données concernant les effets sur la santé présentées pour l’acide benzoïque et ses substances apparentées à la section précédente (6.2.1). Cependant, certaines données propres à des substances de ce sous-groupe (principalement le benzoate de méthyle et le benzoate de sodium) corroborent davantage l’utilisation et l’application de la lecture croisée à partir de l’acide benzoïque.
Le benzoate de méthyle a été évalué dans le cadre de la caractérisation préalable des dangers des dérivés benzyliques (esters de benzyle et de benzoate) par l’EPA. Dans cette évaluation, l’EPA a indiqué que la toxicité aiguë par voie orale, par inhalation ou par voie cutanée était faible et que le benzoate de méthyle n’était pas considéré comme génotoxique. Le JECFA (2001) et l’EFSA (2012) ont également obtenu des résultats négatifs pour le benzoate de méthyle dans des essais de génotoxicité in vitro. D’après les résultats de lecture croisée pour cette sous-catégorie, la toxicité à doses répétées a également été considérée comme faible, les valeurs DSENO étant habituellement de 500 mg/kg p.c./j ou plus (jusqu’à la dose maximale d’essai) pour ce qui est des effets systémiques (changements du poids corporel à la dose plus élevée suivante) (US EPA 2010).
Des renseignements limités sont disponibles pour les huiles de tubéreuse. Comme il est mentionné à la section 2.0, les esters de l’acide benzoïque sont considérés comme des composants importants des huiles de tubéreuse, et par conséquent ont été pris en compte dans la caractérisation des effets sur la santé de l’acide benzoïque et des substances apparentées. Le Conseil de l’Europe (2007) a évalué les huiles de tubéreuse en tant qu’aromatisants de source naturelle et a indiqué que le benzoate de méthyle était l’un des principaux constituants. Le Conseil n’a relevé aucune donnée toxicologique pour les huiles de tubéreuse elles-mêmes, mais a plutôt indiqué que les décisions du JECFA concernant un nombre de constituants importants « ne présentaient aucune préoccupation en matière d’innocuité aux niveaux actuels d’absorption, lorsqu’ils sont utilisés comme aromatisants » (COE 2007). Le Conseil a classé les huiles de tubéreuse comme aromatisant de catégorie 5, qui « contiennent des intrants qui n’ont pas été entièrement évalués en raison du manque de données, mais qui ont été temporairement classés comme substances acceptables sur la base des renseignements disponibles » (COE 2007). Les huiles de tubéreuse figurent expressément dans la liste Part 182- SUBSTANCES GENERALLY RECOGNIZED AS SAFE- Sec. 182.20, de la FDA des États-Unis, qui porte sur les huiles essentielles, les oléorésines (sans solvant) et les extraits naturels (y compris les distillats) (US FDA 2016d).
6.2.3 Dibenzoates
La caractérisation des effets sur la santé de l’acide benzoïque et de ses substances apparentées, présentée à la section 6.2.1, est jugée pertinente pour ces substances. Le DPGDB et le DEGDB figurent actuellement dans le Plan d’action continue communautaire (CoRAP) de l’Union européenne comme « substance reprotoxique présumée » pour 2018. Le document de justification indique que cette classification est basée sur certaines déclarations dans l’inventaire de classification et d’étiquetage (ECHA 2015b). Les études de toxicité pour la reproduction et le développement qui ont été examinées dans le document de justification sont également examinées dans la section suivante, ainsi que d’autres données pertinentes disponibles.
DPGDB
Des renseignements ont été soumis au programme américain High Production Volume (HPV) concernant le DPGDB, à l’aide de données sur le Benzoflex 9-88, qui, avait-on indiqué, contenait environ 90 % de DPGDB, les 10 % restants étant composés de dérivés de dibenzoate et de monobenzoate de propylèneglycol. D’après les données soumises à l’EPA en 2001, dans le cadre de son programme HPV Challenge, le DPGDB présentait une faible toxicité aiguë par voies orale et cutanée. De plus, le DPGDB n’a pas été jugé génotoxique dans les essais de mutagénicité et de clastogénicité in vitro (US EPA 2017; ECHA 2016).
Dans une étude à doses répétées, on a obtenu une DSENO de 1 000 mg/kg p.c./j chez des rats auxquels on avait administré du Benzoflex 9-88 par voie orale pendant 13 semaines. Cela représente une dose moyenne dans l’étude, et des doses plus élevées de 1 750 mg/kg p.c./j et de 2 500 mg/kg p.c./j ont été tolérées. Cependant, la baisse de poids corporel a été plus marquée par rapport aux témoins (Huntingdon Life Sciences 1999). Dans une étude de toxicité pour la reproduction sur deux générations menée conformément à la ligne directrice 416 de l’OCDE, des doses de 0, 1 000, 3 300 ou 10 000 ppm (50, 165 ou 500 mg/kg p.c./j) ont été administrées par voie orale dans les aliments à des rats mâles et femelles pendant 38 semaines (HC 1994). Une DSEO de 500 mg/kg p.c./j (dose élevée) a été observée chez les parents (F0) et les descendants (F1), selon les auteurs de l’étude. À la dose élevée, on a observé une diminution statistiquement significative du poids de la rate, tant pour le poids absolu que le poids relatif au poids corporel, chez la génération F2, ainsi qu’une légère diminution du gain de poids corporel chez les générations F1 et F2. Cependant, les auteurs de l’étude n’ont pas jugé que ces effets étaient significatifs sur le plan toxicologique. Les auteurs font état d’une DSENO pour la survie et la croissance des descendants de 10 000 ppm (500 mg/kg p.c./j) (Huntingdon Life Sciences 2001). Bien que les effets sur le poids absolu et relatif de la rate, chez les deux sexes, étaient statistiquement significatifs à la dose élevée et qu’ils pouvaient donc indiquer une DMENO pour cette étude, aucun effet n’a été observé à cette dose. Les examens microscopiques des descendants des générations F1 et F2 n’ont révélé aucun effet lié au traitement. En outre, l’évaluation pathologique et l’analyse du sperme des adultes F0 et F1 n’ont révélé aucun effet indésirable du traitement sur le cycle œstral, la performance de l’accouplement, la fertilité ou la fécondité (Huntingdon Life Sciences 2001). Par conséquent, une DSENO de 500 mg/kg p.c./j est jugée appropriée pour cette étude.
Dans une étude sur la toxicité pour le développement soumise en 2001 à l’EPA dans le cadre de son programme HPV et prise en compte dans la justification du programme CoRAP de l’ECHA (ECHA 2015b), des rats ont été exposés quotidiennement au DPGDB (substance d’essai contenant 94,84 % de DPGDB), pendant les jours de gestation 6 à 19. Le DPGDB a été administré par gavage à des doses de 0, 250, 500 ou 1 000 mg/kg p.c./j et une DSEO de 1 000 mg/kg p.c./j a été observée pour la toxicité maternelle. En ce qui concerne les descendants, les auteurs de l’étude ont signalé une augmentation des côtes cervicales, observée à la dose de 1 000 mg/kg p.c./j, ce qui a donné une DSENO de 500 mg/kg p.c./j pour la toxicité pour le développement. Les auteurs de l’étude ont également estimé que l’augmentation des côtes cervicales observée à la dose de 500 mg/kg p.c./j se situait à l’intérieur des données de référence récentes pour les témoins, et ils ont constaté qu’à la dose de 1 000 mg/kg p.c./j, le nombre de fœtus présentant cet effet était faible (10/155). En plus de la fréquence d’une augmentation des côtes cervicales à la faible dose (2/155) et à la dose moyenne (2/155), considérées par les auteurs de l’étude comme se situant dans la fourchette des données historiques récentes, aucune relation dose-réponse claire n’a été observée. Par conséquent, la fréquence de cet effet n’a pas été considérée comme liée au traitement. On n’a observé aucune augmentation des côtes cervicales dans le groupe témoin (Huntingdon Life Sciences 2000).
Dans les résumés du rapport de l’étude d’Huntingdon Life Sciences (2000), fournis à l’EPA (2017) et à REACH (ECHA 2000b), les auteurs ont également indiqué qu’un plus grand nombre de fœtus présentaient une ossification incomplète des 5e et 6e sternèbres à des doses moyenne et élevée. Les auteurs n’ont pas pu écarter la possibilité qu’il s’agisse d’un effet potentiellement lié au traitement. Cependant, les résumés d’études disponibles n’ont pas fourni d’autres renseignements sur la fréquence ou la signification de cet effet dans les groupes traités. Les auteurs ont estimé que ces effets étaient de nature transitoire et qu’ils ne représentaient pas un changement structurel permanent, et qu’ils étaient donc moins importants sur le plan toxicologique à long terme. Les auteurs ont estimé que l’ossification incomplète des sternèbres à la dose de 500 mg/kg p.c./j n’était pas préjudiciable, et par conséquent, ils ont fait état d’une DSEO de 250 mg/kg p.c./j (Huntingdon Life Science 2000, ECHA 2000b).
D’après les renseignements disponibles, la fréquence accrue du nombre de fœtus présentant une ossification incomplète, dans l’étude, est représentative d’une DMEO de 500 mg/kg p.c./j, avec une DSEO de 250 mg/kg p.c./j. Cet effet, examiné en tenant compte des autres renseignements disponibles, n’est pas jugé important sur le plan toxicologique, surtout en l’absence de preuves d’effets nocifs observés chez les descendants dans une étude de toxicité pour la reproduction sur deux générations à ces doses. D’après les valeurs DSENO et DMENO obtenues dans les études de toxicité chronique et pour la reproduction à doses répétées, établies à 1 000 mg/kg p.c./j, respectivement, et en tenant compte des preuves que le DPGDB est rapidement métabolisé et éliminé par la voie menant de l’acide benzoïque à l’acide hippurique (et ses dérivés), une DSENO de 500 mg/kg p.c./j est jugée à la fois appropriée et compatible avec les niveaux d’effet critique pour l’acide benzoïque.
DEGDB
Le DEGDB n’a pas été non plus trouvé génotoxique dans les essais de mutagénicité et de clastogénicité in vitro, dans les études soumises en vertu du règlement REACH. Dans les essais à doses répétées, la toxicité était faible. Dans une étude par voie orale de 13 semaines portant sur des doses de 0, 250, 1 000, 1 750 ou 2 500 mg/kg p.c./j, on a déterminé une DSENO de 1 000 mg/kg p.c./j en se fondant sur l’absence d’observations toxicologiques importantes à cette dose ou en deçà. Des doses de 1 750 ou 2 500 mg/kg p.c./j ont été tolérées, mais on a observé des modifications des paramètres sanguins liées au traitement, une pathologie mineure liée au traitement et/ou des effets indésirables sur le gain de poids corporel (ECHA 1999). Une étude de toxicité pour la reproduction sur deux générations a également été menée conformément à la ligne directrice 416 de l’OCDE, avec l’administration par voie orale de doses de 0, 1 000, 3 300 ou 10 000 ppm (50, 165 ou 500 mg/kg p.c./j) dans l’alimentation de rats mâles et femelles. Les auteurs de l’étude ont conclu à une DSENO de 10 000 ppm (500 mg/kg p.c./j) pour la génération parentale (F0). Les auteurs de l’étude ont également indiqué qu’aucun résultat anormal n’était apparu à la nécropsie chez les animaux des générations F0, F1 ou F2, et qu’aucun effet indésirable n’avait été observé lors de l’examen histopathologique détaillé des tissus des mâles et des femelles. De plus, aucun effet lié au traitement n’a été observé pour ce qui est des paramètres de la portée chez les deux générations de descendants, et de leur survie au sevrage ni dans l’évaluation du poids des organes des animaux parents F0 et F1. Les évaluations de la spermatogénèse et de l’histopathologie chez les parents des générations F0 et F1 n’ont pas, non plus, révélé d’effets liés au traitement sur les testicules ou d’autres organes reproducteurs (ECHA 2001). Bien que les effets liés au traitement comprennent des changements statistiquement significatifs du poids de la rate chez les femelles de la génération F2 à la dose élevée, en plus des effets potentiels sur le poids corporel des animaux F2, une DSENO de 500 mg/kg p.c./j est, d’après les données disponibles, jugée appropriée en l’absence de toute autre preuve d’effets indésirables liés au traitement, d’après l’étude.
Dans une étude sur la toxicité pour le développement, citée dans le dossier REACH (ECHA 2000c) pour le DEGDB, des rats Sprague-Dawley femelles ont reçu des doses de 0, 250, 500 ou 1 000 mg/kg p.c./j par gavage oral quotidien entre les jours 6 et 19 de la gestation. Les résultats pour le DEGDB étaient très semblables à ceux de l’étude sur le régime alimentaire pour le DPGDB, car aucun effet indésirable n’a été observé pour la toxicité maternelle à la dose maximale (1 000 mg/kg p.c./j). Les effets liés au traitement à la dose de 500 mg/kg p.c./j comprenaient une augmentation de la fréquence de l’ossification incomplète. Toutefois, les auteurs de l’étude ont estimé que la fréquence de cet effet était semblable à ce que l’on retrouve dans les données historiques pour les témoins, et ils n’ont pas jugé qu’il s’agissait d’un effet indésirable lié au traitement. De plus, les auteurs ont indiqué qu’il y avait eu « une augmentation plus marquée de la fréquence de l’ossification incomplète, touchant principalement les centres crâniens, les arcs vertébraux sacro-caudaux, les centres des sternèbres 5 et 6 et les os pelviens » à la dose élevée, par rapport au groupe témoin dans cette étude. Une légère augmentation de la fréquence des côtes cervicales a également été observée dans le groupe ayant reçu la dose élevée. Aux doses de 250 et 500 mg/kg p.c./j, la fréquence et la répartition des anomalies squelettiques n’ont pas révélé d’effets indésirables évidents liés au traitement. Les auteurs de l’étude ont conclu qu’une DSENO de 500 mg/kg p.c./j convenait pour la croissance et le développement du fœtus, et ils ont établi une DSENO de 1 000 mg/kg p.c./j pour la toxicité maternelle (ECHA 2000c).
D’après les renseignements disponibles, on a observé une augmentation de la fréquence du nombre de fœtus présentant une ossification incomplète à la dose de 500 mg/kg p.c./j. Cependant, l’occurrence de cet effet est prise en compte dans les taux d’occurrence historiques chez les témoins. Une DMEO de 1 000 mg/kg p.c./j est jugée appropriée en raison d’une fréquence accrue des effets squelettiques liés au traitement, par rapport au groupe témoin dans cette étude, observée dans le groupe ayant reçu la dose élevée. De plus, lorsque l’on tient compte des autres renseignements disponibles, l’effet n’est pas jugé important sur le plan toxicologique, surtout en l’absence d’effets indésirables observés chez les descendants dans une étude de toxicité pour la reproduction sur deux générations à la dose moyenne. Les valeurs DSENO et DMENO pour le DEGDB dans les études de toxicité chronique et pour la reproduction à doses répétées ont été établies à 1 000 mg/kg p.c./j, respectivement, données qui sont très similaires à celles du DPGDB. Ces observations, jumelées au fait que le DEGDB est rapidement métabolisé et éliminé par la voie menant de l’acide benzoïque à l’acide hippurique (et à ses dérivés), indiquent qu’une DSENO de 500 mg/kg p.c./j est jugée appropriée et compatible avec les niveaux d’effet critique observés pour l’acide benzoïque.
6.2.4 Tribenzoates
La tribenzoïne (no CAS 614-33-5) a été incluse dans l’évaluation des dérivés benzyliques par le JECFA, qui a conclu que, en tant qu’ester de benzoate, elle serait hydrolysée et produirait de l’acide benzoïque. Par conséquent, la toxicité de l’acide benzoïque et de ses substances apparentées est jugée appropriée pour caractériser les effets de la tribenzoïne sur la santé (JECFA 1997). Le JECFA (2002b) a finalisé l’évaluation du JECFA (1997) et a conclu qu’il n’y avait aucun problème d’innocuité concernant son utilisation comme aromatisants. En outre, on a signalé que l’acide benzoïque était identifié comme produit d’hydrolyse, en plus du glycérol (JECFA 2002b).
Les données toxicologiques sur la tribenzoïne disponibles dans la littérature sont limitées. Une étude non publiée par Carson (1972), présentée à l’OMS et évaluée par le JECFA (2001), était disponible, et dans celle-ci 15 rats mâles sevrés et 15 rats femelles sevrés avaient reçu de la tribenzoïne dans l’alimentation à raison d’une dose quotidienne moyenne de 0, 120, 600 ou 2 600 mg/kg p.c./j, pendant 90 jours. D’après les mesures hebdomadaires du poids corporel et de la consommation alimentaire, on a observé que le taux de croissance et l’efficacité de la consommation alimentaire des mâles du groupe ayant reçu la dose élevée étaient plus faibles. Aucun effet lié au traitement n’a été observé (p. ex., les paramètres hématologiques et les valeurs chimiques du sang étaient normaux), et il n’y avait aucun signe de lésions macroscopiques ou histologiques liées au traitement (JECFA 2001).
6.3 Caractérisation des risques pour la santé humaine
Les renseignements disponibles sur la toxicocinétique des benzoates d’alkyle simples, des dibenzoates et des tribenzoates indiquent qu’ils sont rapidement métabolisés et éliminés du corps par les mêmes voies que les autres dérivés benzyliques (c.-à-d. qu’ils sont métabolisés en acide benzoïque). De plus, plusieurs sources de données ont établi que la DSE(N)O de 500 mg/kg p.c./j (dose maximale d’essai) pour l’acide benzoïque s’appliquait aux autres substances de benzoates dans la présente évaluation. Ce résultat corrobore un certain nombre d’études avec doses répétées à court et à long terme, ainsi que des études sur la toxicité des dérivés benzyliques apparentés pour la reproduction et le développement.
Dans le cas des dibenzoates, bien qu’il existe des études de toxicité pour le développement qui indiquent un potentiel d’ossification incomplète à la dose de 500 mg/kg p.c./j, et lorsque l’on tient compte d’autres renseignements disponibles, cet effet n’est pas considéré comme significatif sur le plan toxicologique, particulièrement en l’absence de preuve d’effets indésirables observés chez les descendants dans une étude de toxicité pour la reproduction sur deux générations à ces doses. Par conséquent, dans le cas des dibenzoates, et tout comme les autres benzoates de ce groupe, les études de toxicité pour la reproduction et à doses répétées à long terme donnent une DSENO de 500 mg/kg p.c./j ou plus.
Le JECFA a conclu que les benzoates de méthyle, d’éthyle et d’isobutyle, ainsi que la tribenzoïne, ne poseraient pas de problème d’innocuité aux doses d’utilisation estimées comme aromatisants (JECFA 2002a). L’EFSA (2009) a procédé à un examen critique de l’approche du JECFA et a approuvé sa conclusion : « Il n’y a aucun problème d’innocuité avec les doses estimées d’absorption de benzoate d’éthyle, de benzoate de méthyle et de benzoate d’isobutyle utilisés en tant qu’aromatisants ». Le comité de l’EFSA n’a pas présenté de conclusion sur la tribenzoïne, en l’absence de données sur les volumes de production en Europe.
Compte tenu de tous les renseignements susmentionnés (indication de la métabolisation en acide benzoïque pour toutes les substances de ce groupe, DSE(N)O de 500 mg/kg p.c./j à la dose maximale d’essai, conclusions formulées par les organisations internationales), il est manifeste que les substances de ce groupe présentent un faible danger, et que le risque potentiel pour la santé humaine est faible.
6.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les plus importantes sources d’incertitude sont présentées au tableau suivant.
| Source clé d’incertitude | Incidence |
|---|---|
| La caractérisation des effets des substances de ce groupe sur la santé se fonde principalement sur les données toxicologiques pour l’acide benzoïque et les dérivés benzyliques apparentés, et tient compte des voies métaboliques et des produits de transformation courants. | +/- |
| La disponibilité d’études de toxicité par voie cutanée à plus long terme est limitée. | +/- |
| L’évaluation des effets des huiles de tubéreuse sur la santé s’appuie sur des données toxicologiques pour les benzoates (c.-à-d. l’acide benzoïque), et les esters de l’acide benzoïque ont été identifiés comme étant les principaux composants de cette substance. | +/- |
7. Conclusions
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, les substances du groupe des benzoates présentent un faible risque de causer des effets nocifs pour l’environnement. Il a été conclu que les substances du groupe des benzoates ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, il a été conclu que les substances du groupe des benzoates ne satisfont pas au critère de l’alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il a été conclu que les substances du groupe des benzoates ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Références
Adams, T.B. et al. 2005. Review: The FEMA GRAS assessment of benzyl derivatives used as flavor ingredients. Food and Chemical Toxicology 43: 1207-1240. [En anglais seulement]
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. [Modifiée le 6 février 2018]. Ottawa (Ont.) : Santé Canada. [Consultée le 28 juin 2018].
Butz RG, Atallah YH, Yu CC, Calo CJ. 1982. Environmental Safety Assessment of Dipropylene Glycol Dibenzoate. Environ Toxicol Chem. 1(4):337-346. [En anglais seulement]
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure. [PDF] Gazette du Canada, Partie I, vol. 146, no 48, supplément.
Carson S. 1972. 90-Day studies with glyceryl tribenzoate in rats. Food and Drug Research Laboratories, Inc. Lab. No. 0732. 10 avril 1972. Rapport non publié présenté à l’OMS par Flavor and Extracts Manufacturers Association (FEMA) des États‑Unis. Études décrites dans JECFA 2001. [En anglais seulement]
ChemIDplus [base de données]. 1993-a. Bethesda (MD) : US National Library of Medicine. Résultats de recherche pour CAS 93-58-3. [consulté le 22 février 2016]. [En anglais seulement]
ChemIDplus [base de données]. 1993-b. Bethesda (MD) : US National Library of Medicine. Résultats de recherche pour CAS 93-89-0. [consulté le 22 février 2016]. [En anglais seulement]
ChemIDplus [base de données] 1993-c. Bethesda (MD) : US National Library of Medicine. Résultats de recherche pour CAS 120-55-8. [consulté le 22 février 2016]. [En anglais seulement]
ChemIDplus [base de données]. 1993-d. Bethesda (MD) : US National Library of Medicine. Résultats de recherche pour CAS 614-33-5. [consulté le 22 février 2016]. [En anglais seulement]
ChemIDplus [base de données]. 1993-e. Bethesda (MD) : US National Library of Medicine. Résultats de recherche pour CAS 27138-31-4. [consulté le 22 février 2016]. [En anglais seulement]
[Clorox] The Clorox Company. 2017. Ingrédients de parfumerie. Oakland (CA), The Clorox Company. [consulté le 17 janvier 2017].
[CNRC] Conseil national de recherches du Canada. 2011. Collecte de données sur les produits chimiques rejetés dans l’air intérieur des habitations par les matériaux de construction et l’ameublement. Rapport inédit. Ottawa (Ont.) : Conseil national de recherches du Canada.
[COE] Council of Europe. 2007. Natural Sources of Flavourings- Report No. 2. The Committee of Experts on Flavouring Substances. Council of Europe Publishing, Belgium. pp. 147-148. [En anglais seulement]
[CSAH] Comité scientifique de l’alimentation humaine. 1994. Opinion sur l’acide benzoïque et ses sels. Présenté le 24 février 1994. Rapports du Comité scientifique de l’alimentation humaine : Trente-cinquième série. CEC, Luxembourg, 1996, p. 33-39.
[CSAH] Comité scientifique de l’alimentation humaine. 2002. Opinion du Comité scientifique de l’alimentation humaine sur l’acide benzoïque et ses sels. SCF/CS/ADD/CONS/48 Final. p. 1-13.
[CSPC] Comité scientifique des produits de consommation. 2005. Opinion sur l’acide benzoïque et le benzoate de sodium [PDF]. SCCP/0891/05.
[DFC] Dictionary of Food Compounds [base de données]. 2004- . Boca Raton (FL) : CRC Press LLC. [consulté le 3 mars 2017]. [En anglais seulement]
Eastman. 2016. Eastman non-phthalate plasticizers [product portfolio]. [PDF] Kingsport (TN): Eastman Chemical Company. [Consulté le 12 mars 2017]. [En anglais seulement]
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Ottawa (Ont,.) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Gatineau (QC). Données utilisées pour créer des profils de dangers et d’exposition propres à une substance et classer les risques selon la Classification du risque écologique des substances organiques. Disponible sur demande à l’adresse : substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2007]. Catégorisation de substances chimiques. Ottawa (Ont.), gouvernement du Canada. [Site consulté le 3 mars 2017].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015. Ottawa (Ont.) : gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018. Évaluation préalable : Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT). Ottawa (Ont.) : gouvernement du Canada.
[ECHA] Agence européenne des produits chimiques. 1999. DEGDB, CAS RN 120-55-8. Présentation de l’industrie à l’ECHA, mise à jour le 6 janvier 2016. Exp Key Repeated dose toxicity: oral. 001. [consulté en mai 2017]. [En anglais seulement]
[ECHA] Agence européenne des produits chimiques. 2000a. DEGDB, CAS RN 120-55-8. Présentation de l’industrie à l’ECHA, mise à jour le 6 janvier 2016. Basic Toxicokinetics. [consulté en mai 2017]. [En anglais seulement]
[ECHA] Agence européenne des produits chimiques. 2000b. DPGDB, CAS RN 27138-31-4. Présentation de l’industrie à l’ECHA, mise à jour le 6 janvier 2016. Exp Key Developmental toxicity/teratogenicity : oral (gavage). 001. [consulté en mai 2017] [En anglais seulement]
[ECHA] Agence européenne des produits chimiques. 2000c. DEGDB, CAS RN 120-55-8. Présentation de l’industrie à l’ECHA, mise à jour le 6 janvier 2016. Exp Key Developmental toxicity/teratogenicity : oral (gavage). 001. [consulté en mai 2017]. [En anglais seulement]
[ECHA] Agence européenne des produits chimiques. 2001. DEGDB, CAS RN 120-55-8. Présentation de l’industrie à l’ECHA, mise à jour le 6 janvier 2016. Toxicity to reproduction. [consulté en mai 2017]
[ECHA] Agence européenne des produits chimiques. 2009. Données sur la fabrication, l’importation, l’exportation, les utilisations et les rejets de phtalate de benzyle et de butyle (PBB) ainsi que des renseignements sur les solutions de rechange à son utilisation.
[ECHA] Agence européenne des produits chimiques. 2015a. Ethyl benzoate, CAS RN 93-89-0. Présentation de l’industrie à l’ECHA, mise à jour le 6 janvier 2016. Basic Toxicokinetics. [consulté en mai 2017].
[ECHA] Agence européenne des produits chimiques. 2015b. Justification for the selection of a substance for CoRAP inclusion: oxydipropyl dibenzoates. [En anglais seulement]
[ECHA] Agence européenne des produits chimiques. 2016. DPGDB, CAS RN 27138-31-4. Présentation de l’industrie à l’ECHA, [mise à jour le 6 janvier 2016]. Genetic Toxicity- Endpoint summary [consulté en mai 2017].
[EFSA] Autorité européenne de sécurité des aliments. 2016. Scientific opinion on the re-evaluation of benzoic acid (E 210), sodium benzoate (E 211), potassium benzoate (E 212) and calcium benzoate (E 213) as food additives. EFSA Panel on Food Additives and Nutrient Sources. EFSA Journal 14(3):4433, 110 p. doi:10.2903/j.efsa.2016.4433. [En anglais seulement]
[EFSA] Autorité européenne de sécurité des aliments. 2012. Scientific opinion on Flavouring Group Evaluation 20, Revision 4 (FGE.20Rev4): Benzyl alcohols, benzaldehydes, a related acetal, benzoic acid, and related esters from chemical group 23 and 30. EFSA Panel on Food Contact Materials, Enzymes, Flavourings and Processing Aids. EFSA Journal 10(12):2994, 140 p. doi:10.2903/j.efsa.2012.2994. [En anglais seulement]
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS 2012 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure. Données préparées par Environnement Canada et Santé Canada; Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [En anglais seulement]
[F&CT] Food and Chemical Toxicology. Fragrance Materials Monograph: Tuberose Concrete. Volume 38, Supplement 3 ,2000, p. s231-s233. [En anglais seulement]
FooDB [base de données]. 2004. Edmonton (AB) : Wishart Research Group, University of Alberta. Résultats de recherche combinés en fonction du no CAS. [Consulté le 22 février 2016]. [En anglais seulement]
[HSDB] Hazardous Substances Data Bank [base de données]. 1983- . Bethesda (MD) : National Library of Medicine (États-Unis). [Mise à jour en septembre 2016; consulté le 22 janvier 2017]. [En anglais seulement]
Huntingdon Life Sciences. 1999. Benzoflex 9-88. Toxicity to rats by Dietary Administration for 13 weeks with Subsequent 4-Week Recovery Period for Selected Animals. [Renvoi à la conception des essais et aux sommaires rigoureux des études présentés à l’US EPA en 2001.] [En anglais seulement]
Huntingdon Life Sciences. 2000. Benzoflex 9-88. Study of Prenatal Development in the CD Rat by Oral Gavage Administration. [Renvoi à la conception des essais et aux sommaires rigoureux des études présentés à l’US EPA en 2001.] [En anglais seulement]
Huntingdon Life Sciences. 2001. Benzoflex 9-88. Study of Reproductive Performance in CD Rats Treated Continuously through Two Successive Generations by Dietary. [Renvoi aux sommaires rigoureux et à la conception d’étude présentés à l’US EPA en 2001] [En anglais seulement]
Hutzler C, Paschke M, Kruschinski S, Henkler F, Han J, Luch A. 2014. Chemical hazards present in liquids and vapors of electronic cigarettes. Arch Toxicol. 88:1295-1308. [En anglais seulement]
[IFRA] Association internationale des matières premières pour la parfumerie. c2011–2017. List of ingredients [webpage]. Genève : Association internationale des matières premières pour la parfumerie. [Consulté le 17 janvier 2017]. [En anglais seulement]
IRDC. 1981. 21-Day Dermal Toxicity Study in Rabbits. IRDC #163-675 (Étude inédite). [Mentionnée dans OCDE SIAR (2000)]. [En anglais seulement]
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 1996. Toxicological evaluation of certain food additives. Préparé par la 46e réunion du Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA). Benzyl acetate, benzyl alcohol, benzaldehyde and benzoic acid and its salts. Série de l’OMS sur les additifs alimentaires, no 37. OMS, Genève. [En anglais seulement]
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 1997. Evaluation of certain food additives and contaminants. Quarante-sixième réunion du Comité mixte FAO/OMS d’experts des additifs alimentaires. Série de rapports techniques de l’OMS, no 868, pp. 41-43.
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2001. Safety evaluation of certain food additives and contaminants: Benzyl derivatives. Série de l’OMS sur les additifs alimentaires, no 48. [En anglais seulement]
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2002a. Evaluation of certain food additives and contaminants [PDF]. Cinquante-septième rapport du Comité mixte FAO/OMS d’experts des additifs alimentaires. Série de rapports techniques de l’OMS, no 909, p. 73–84. [En anglais seulement]
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2002b. Evaluation of certain food additives [PDF]. Cinquante-neuvième rapport du Comité mixte FAO/OMS d’experts des additifs alimentaires. Série de rapports techniques de l’OMS, No. 913, pp. 118-122. [En anglais seulement]
Kieckebusch W, Lang K. 1960. Tolerance of benzoic acid in chronic feeding. Arzneim-Forsch 10 : 1001-1003. [Mentionné dans OCDE, 2001; CSAH, 2005; OMS, 2005] [En allemand seulement]
[OCDE] Organisation de la coopération et du développement économiques. 2001. Screening Information DataSet - Benzoates. [En anglais seulement]
[OMS] Organisation mondiale de la santé. 2005. Benzoic acid and sodium benzoate (Rev. 1) [PDF]. Concise International Chemical Assessment Document 26, p. 1-48. [En anglais seulement]
Patry-Parisien J, Zhu J, Wong SL. 2013. Mise en œuvre de la composante sur l’air intérieur du cycle 2 de l’Enquête canadienne sur les mesures de la santé [PDF]. Composante du produit no 82-003-X au catalogue de Statistique Canada, Rapports sur la santé.
PubChem [base de données]. 1988- . Bethesda (MD): US National Library of Medicine, National Centre for Biotechnology Information. [Mise à jour le 18 mars 2017; consultée le 21 mars 2017] [En anglais seulement]
Rakthaworn P, Dilokkunanant U, Sukkatta U, Vajrodaya S, Haruethaitanasan V, Pitpiangchan P, Punjee P. 2009. Extraction methods for tuberose oil and their chemical components. Kasetsart Journal - Natural Science 43:204-211. [En anglais seulement]
Santé Canada. 2016. Document sur l’approche scientifique. Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.) : gouvernement du Canada
[SDS] Safety Data Sheet. 2011. Stencil / project pain – red. Warren (NJ): Horizon Group USA, Inc. [Consulté le 12 mars 2017] [En anglais seulement]
[SDS] Safety Data Sheet. 2014a. Benzoflex™ 354 Plasticizer. Kingston (TN): Eastman Chemical Company. [Consulté le 12 mars 2017] [En anglais seulement]
[SDS] Safety Data Sheet. 2014b. DRYLOK Clear Masonry Waterproofer [PDF]. Dunmore (PA) United Gilsonite Laboratories. [Consulté le 12 mars 2017] [En anglais seulement]
[SDS] Safety Data Sheet. 2014c. Titebond no-run, no-drip wood glue [PDF]. Columbus (OH): Franklin International. [Consulté le 12 mars 2017] [En anglais seulement]
[SDS] Safety Data Sheet. 2015a. Benzoflex™ 425 Plasticizer [PDF]. Kingston (TN): Eastman Chemical Company. [Consulté le 12 mars 2017] [En anglais seulement]
[SDS] Safety Data Sheet. 2015b. Dynaflex 230 caulking [PDF]. Baltimore (MD): DAP Products Inc. [Consulté le 12 mars 2017] [En anglais seulement]
Smyth HF, Carpenter P. 1948. Further experience with the range-finding test in the industrial toxicology laboratory. J Ind Hyg Toxicol. 30:63-68. [En anglais seulement]
Surberg H, Panten J. 2016. Common Fragrance and Flavor Materials: Preparation, Properties and Uses, 6th ed. Weinheim (Allemagne): Wiley-VCH. Avril 2016. 392 p. [En anglais seulement]
[TDS] Technical Data Sheet. 30 août 2013. Uniplex 260 plasticizer [PDF]. Leverkusen (DE): LANXESS Deutschland GmbH. [Consulté le 12 mars 2017] [En anglais seulement]
[TDS] Technical Data Sheet. 2015a. K-FLEX 500P® Dibenzoate Plasticizer [PDF]. Kalama (WA): Emerald Kalama Chemical. [Consulté le 12 mars 2017] [En anglais seulement]
[TDS] Technical Data Sheet. 2015b. K-Flex 975® Dibenzoate Plasticizer [PDF]. Kalama (WA): Emerald Kalama Chemical. [Consulté le 12 mars 2017] [En anglais seulement]
[TIMES] TIssue MEtabolism Simulator [module de prévision]. 2016. Ver. 2.27.19. Bourgas (BG) : University Prof. Dr. Assen Zlatarov, Laboratory of Mathematical Chemistry. [Accès restreint] [En anglais seulement]
[TURI] Toxics Use Reduction Institute. 2006. Five chemicals alternatives assessment study. [PDF] Lowell (MA). University of Massachusetts Lowell, Toxics Use Reduction Institute. [En anglais seulement]
[US EPA] US Environmental Protection Agency. 2010. Screening-Level Hazard Characterization: Benzyl Derivatives Category. Hazard Characterization Document. U.S. Environmental Protection Agency. [En anglais seulement]
[US EPA] US Environmental Protection Agency. 2017. High Production Volume Information System. Washington (DC): US Environmental Protection Agency. [Consulté le 24 avril 2017] [En anglais seulement]
[US FDA] US Food and Drug Administration. 2016a. Code of Federal Regulations. Title 21. Food additives permitted for direct addition to food for human consumption. Subpart F–Flavoring agents and related substances. [Consulté le 20 février 2017] [En anglais seulement]
[US FDA] US Food and Drug Administration. 2016b. Code of Federal Regulations. Title 21. Indirect food additives: Adhesives and components of coatings. Subpart B–Substances for use only as components of adhesives. [Consulté le 20 février 2017] [En anglais seulement]
[US FDA] US Food and Drug Administration. 2016c. Code of Federal Regulations. Title 21. Indirect food additives: Paper and paperboard components. Subpart B–Substances for use only as components of paper and paperboard. [Consulté le 20 février 2017] [En anglais seulement]
[US FDA] US Food and Drug Administration. 2016d. Code of Federal Regulations. Title 21. Substances generally recognized as safe. Subpart A- General provisions. Sec. 182.20 Essential Oils, oleoresins (solvent-free), and natural extractives (including distillates). [révisé le 1er avril 2016; consulté le 27 mars 2017] [En anglais seulement]
Xia XR, Baynes RE, Monteiro-Riviere NA, Riviere JE. 2007. An experimentally based approach for predicting skin permeability of chemicals and drugs using membrane-coated fiber array. Toxicol Appl Pharmacol. 221:320-8. Mentionné dans le dossier ECHA REACH pour le benzoate de méthyle (CAS 93-58-3). [Consulté en mai 2017] [En anglais seulement]
