Évaluation préalable - Groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone
Titre Officiel : Évaluation préalable - Groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone
Environnement et Changement climatique Canada
Santé Canada
Juillet 2019
No de cat. : En14-382/2019F-PDF
ISBN 978-0-660-31522-5

Évaluation-préalable-groupe-lactones-cétones-macrocycliques-ionones-cyclohexanone.pdf [PDF - 973 Ko]
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’’Environnement et de la Santé ont réalisé une évaluation préalable de 11 des 13 substances désignées collectivement dans le Plan de gestion des produits chimiques sous le nom de « groupe des muscs (macrocycliques et polycycliques) ». L’évaluation de ces 11 substances a été jugée prioritaire, car elles répondent aux critères de catégorisation du paragraphe 73(1) de la LCPE. Deux des 13 substances ont été jugées peu préoccupantes, par d’autres approches, et les décisions concernant ces substances sont présentées dans un rapport distinctNote de bas de page 1. Par conséquent, la présente d’évaluation préalable porte sur les 11 substances décrites dans le tableau ci‑dessous. Les 11 substances dont il est fait état dans la présente ébauche d’évaluation préalable sont désignées ci-après par l’appellation « groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ». Nous donnons dans le tableau ci-dessous le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 2), le nom sur la Liste intérieure des substances (LIS), le ou les noms communs et le sous-groupe de ces substances.
| N° CAS | Nom sur la LIS | Nom commun | Sous-groupe |
|---|---|---|---|
| 106-02-5 | Pentadécan-15-olide | Exaltolide | Lactones et cétones macrocycliques |
| 109-29-5 | Oxacycloheptadécan-2-one | Hexadécanolide | Lactones et cétones macrocycliques |
| 502-72-7 | Cyclopentadécanone | Exaltone | Lactones et cétones macrocycliques |
| 541-91-3 | 3-Méthylcyclopentadécan-1-one | Muscone | Lactones et cétones macrocycliques |
| 542-46-1 | (Z)-9-Cycloheptadécén-1-one | Civettone | Lactones et cétones macrocycliques |
| 7779-50-2 | Oxacycloheptadéc-7-én-2-one | Hexadécènelactone / Ambrettolide | Lactones et cétones macrocycliques |
| 28645-51-4 | Oxacycloheptadéc-10-én-2-one | Isoambrettolide | Lactones et cétones macrocycliques |
| 37609-25-9 | 5-Cyclohexadécén-1-one | Ambérol de musc / ambrettone | Lactones et cétones macrocycliques |
| 1335-94-0 | Irone | Irone | Ionones |
| 7779-30-8 | 1-(2,6,6-Triméthyl-2-cyclohexén-1-yl)pent-1-én-3-one | 1-Méthyl-α-ionone | Ionones |
| 108-94-1 | Cyclohexanone | Cyclohexanone | Cyclohexanone |
L’exaltolide, l’isoambrettolide, la 1-méthyl-α-ionone et la cyclohexanone ont été importés au Canada en quantités totales atteignant 166 810 kg en 2011. Au cours de la même année, l’exaltolide et l’isoambrettolide n’ont pas été fabriqués au Canada, tandis que la 1-méthyl-α-ionone et la cyclohexanone l’ont été en quantités atteignant 950 kg. Aucune quantité n’a été déclarée pour les autres substances de ce groupe au-delà du seuil de déclaration de 100 kg pour l’année civile 2011.
Les substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone sont principalement utilisées comme parfums ou ingrédients en parfumerie. L’exaltolide, la muscone, la civettone et la cyclohexanone sont présents naturellement dans l’environnement. Au Canada, les substances de ce groupe sont utilisées dans diverses applications, notamment les cosmétiques (y compris des lotions pour le corps et des eaux de toilette), des écrans solaires et des produits de bricolage (y compris la peinture pour mur).
Les risques écologiques des substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ont été caractérisés selon la Classification du risque écologique (CRE) des substances organiques, qui est une approche fondée sur les risques et qui emploie de multiples mesures du danger et de l’exposition afin de tenir compte d’une façon pondérée de multiples sources de données pour établir la classification des risques. Les profils de danger sont basés principalement selon des paramètres concernant le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, citons le taux d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. Une matrice des risques est utilisée pour attribuer à ces substances un degré faible, modéré ou élevé de préoccupation potentielle, en fonction de leurs profils de danger et d’exposition. En se basant sur les conclusions de la CRE, il est conclu qu’il est improbable que ces substances aient des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, le risque est faible que ces 11 substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone aient des effets néfastes sur l’environnement. Il est donc conclu que les 11 substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ne répondent pas aux critères des alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Pour ce qui est de l’évaluation des risques pour la santé humaine, les 11 substances du groupe ont été séparées comme suit : sous-groupe des lactones et cétones macrocycliques, sous-groupe des ionones et une substance (cyclohexanone). Les substances du sous-groupe des lactones et cétones macrocycliques sont considérées comme ayant un faible potentiel de danger. Sur la base de renseignements disponibles sur les effets sur la santé de substances de structure apparentée, les substances du sous‑groupe des ionones ont des effets néfastes, y compris des changements rénaux à la suite d’expositions répétées par voie orale ou cutanée. À la lumière de cette évaluation, la cyclohexanone présente un faible potentiel d’effets nocifs par voie orale ou par inhalation.
Nous avons déterminé que les milieux de l’environnement et les aliments ne représentent pas des sources significatives d’exposition pour les Canadiens. Pour tous les sous-groupes, les estimations de l’exposition ont été calculées en fonction des concentrations de substances présentes dans les produits disponibles pour les consommateurs, comme les cosmétiques. Sur la base de ces estimations de l’exposition par rapport aux niveaux d’effet critique relevés lors d’études de laboratoire, les marges d’exposition sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Compte tenu des renseignements présentés dans la présente évaluation préalable, il est conclu que les 11 substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ne répondent pas aux critères de l’alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, il est conclu que les 11 substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ne répondent à aucun des critères de l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de 11 des 13 substances désignées collectivement dans le Plan de gestion des produits chimiques sous le nom de « groupe des muscs (macrocycliques et polycycliques) », pour déterminer si ces 11 substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Ces 11 substances ont été évaluées en priorité, car elles répondent aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC et SC [modifié en 2017]).
Les deux autres substances (no CASNote de bas de page 3 8001-04-5 (muscs) et 68140‑48‑7 (1‑(2,3-dihydro-1,1,2,6-tétraméthyl-3-(propane-2-yl)-1H-indène-5-yl)éthane-1-one) ont été prises en compte dans le document sur l’Approche scientifique pour la Classification du risque écologique (CRE) des substances organiques (ECCC 2016a) et dans le document sur l’Approche scientifique pour l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada 2016a), et ont été jugées peu préoccupantes pour la santé humaine et l’environnement. C’est la raison pour laquelle elles ne seront pas traitées dans le présent rapport. Les conclusions pour ces deux substances sont données dans l’évaluation préalable Substances jugées comme étant peu préoccupantes au moyen de l'approche de la Classification du risque écologique des substances organiques et de l'Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (ECCC, SC 2018).
La présente évaluation préalable traite de ces 11 substances, qui sont désignées ci‑après par l’appellation « groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ».
Les risques écologiques des substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ont été caractérisés en utilisant l’approche de CRE (ECCC 2016a). La CRE établit les dangers selon des paramètres concernant le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique, et elle tient compte de l’exposition possible des organismes des milieux terrestres ou aquatiques en se fondant sur des facteurs tels que la vitesse d’émission potentielle, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés afin de déterminer si les substances nécessitent une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement ou si elles présentent un faible risque de tels effets.
Les substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone présentement évaluées ont fait l’objet d’un examen au niveau international dans le cadre du Programme d’évaluation coopérative des produits chimiques de l’Organisation de coopération et de développement économiques (OCDE), et un SIDS (Screening Information Data Set) et des SIAR (Initial Assessment Reports) sont disponibles (OCDE 2012). Ces évaluations sont soumises à un examen rigoureux (y compris par des pairs) et reçoivent l’aval d’autorités gouvernementales. Santé Canada et Environnement et Changement climatique Canada sont des participants actifs à ces processus et considèrent ces évaluations fiables. De plus, les effets sur la santé des substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ont fait l’objet d’un examen dans le cadre du programme des Monographies sur le cancer du Centre international de recherche sur le cancer (CIRC), de la Toxicological Review de l’Integrated Risk Information System (IRIS) de l’Environmental Protection Agency (EPA) des États-Unis, du Comité mixte FAO/OMS d’experts sur les additifs alimentaires et de l’Autorité européenne de sécurité des aliments (EFSA). Des évaluations sont disponibles et elles ont été utilisées pour étayer la caractérisation des effets sur la santé de la présente évaluation.
Pour la présente évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, y compris d’autres renseignements soumis par les parties intéressées. Nous avons colligé les données pertinentes jusqu’en juin 2017. Toutefois, des études ou des renseignements plus récents obtenus auprès d’organisations homologues nationales ou étrangères peuvent aussi être cités. Nous avons utilisé des données empiriques tirées d’études clés ainsi que des résultats de modélisation pour tirer nos conclusions. Lorsqu’ils étaient disponibles et pertinents, des renseignements contenus dans des évaluations effectuées par d’autres autorités compétentes ont été utilisés.
La présente évaluation préalable a été préparée par le personnel des programmes d’évaluation des risques de la LCPE travaillant à Santé Canada et Environnement et Changement climatique Canada. Elle inclut des intrants d’autres programmes de ces ministères. Des parties de la présente évaluation préalable ayant trait à la santé ont fait l’objet d’un examen et/ou de consultations externes par des pairs. Des commentaires sur les parties techniques pertinentes pour la santé humaine ont été reçus de Herman Gibb, Theresa Lopez, Katherine Super, Jennifer Flippin et Gary Drendel de Tetra Tech. La partie ayant trait à l’environnement de la présente évaluation est basée sur le document de CRE (publié le 30 juillet 2016), document qui a été soumis à un examen externe ainsi qu’à une période de commentaires du public de 60 jours. Bien que des commentaires de l’extérieur aient été pris en compte, Environnement et Changement climatique Canada et Santé Canada restent responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable est centrée sur des renseignements critiques pour déterminer si ces substances satisfont aux critères de l’article 64 de la LCPE. À cette fin, nous avons examiné les renseignements scientifiques et suivi une approche basée sur une pondération des éléments de preuve et le principe de précautionNote de bas de page 4. Nous présentons dans cette évaluation préalable les renseignements critiques et les considérations sur lesquels nous fondons nos conclusions.
2. Identité des substances
Les numéros de registre du CAS, les noms figurant dans la Liste intérieure des substances (LIS) et les noms communs des substances individuelles du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone sont présentés dans les tableaux 2‑1, 2-2 et 2-3. Une liste d’autres noms chimiques (p. ex., les noms commerciaux) est disponible dans les National Chemical Inventories (NCI 2014).
Aux fins de la présente évaluation préalable, les 11 substances susmentionnées sont divisées en deux sous-groupes et une substance individuelle : huit lactones et cétones macrocycliques (tableau 2-1), deux ionones (tableau 2-2) et la cyclohexanone (tableau 2-3). Les huit substances du sous-groupe des lactones et cétones macrocycliques sont caractérisées par un noyau macrocyclique à 15 à 17 liaisons, qui comprend un groupe cétone ou ester comme partie du noyau. Les deux substances du sous-groupe des ionones sont caractérisées par un noyau de six atomes de carbone avec une double liaison (cycloalcène) et possédent quatre substituants alkyles, dont un à 5 atomes de carbone incluant un groupe cétone. La cyclohexanone est une structure cyclique à six atomes de carbone, avec un groupe cétone.
| No CAS | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 106-02-5 | Pentadécan-15-olide (Exaltolide) |
C15H28O2 |
240,39 |
| 109-29-5 | Oxacycloheptadécan-2-one (Hexadécanolide) |
C16H30O2 |
254,42 |
| 502-72-7 | Cyclopentadécanone (Exaltone) |
C15H28O |
224,39 |
| 541-91-3 | 3-Méthylcyclopentadécan-1-one (Muscone) |
C16H30O |
238,42 |
| 542-46-1 | (Z)-9-Cycloheptadécén-1-one (Civettone) |
C17H30O |
250,43 |
| 7779-50-2 | Oxacycloheptadéc-7-én-2-one (Hexadécènelactone/ Ambrettolide) |
C16H28O2 |
252,4 |
| 28645-51-4 | Oxacycloheptadéc-10-én-2-one (Isoambrettolide) |
C16H28O2 |
252,4 |
| 37609-25-9 | 5-Cyclohexadécén-1-one (Ambérol de musc / ambrettone) |
C16H28O |
236,4 |
a Sauf pour les noms figurant dans la LIS, la majeure partie de l’information provient de McGinty et coll. (2011a,b,c,d,e,f,g,h).
| No CAS | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 1335-94-0a | Irone (Irone) |
C14H22O |
206,33 |
| 7779-30-8b | 1-(2,6,6-Triméthyl-2-cyclohexén-1-yl)pent-1-én-3-one (1-Méthyl-α-ionone) |
C14H22O |
206,33 |
a Information tirée de ChemIDplus (2016).
b Sauf indication contraire, toute l’information provient de Scognamiglio et coll. (2013).
| No CAS | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 108-94-1a | Cyclohexanone (Cyclohexanone) |
C6H10O |
98,14 |
a Toute l’information provient de l’OCDE (2002).
2.1 Sélection des analogues
Une approche de lecture croisée utilisant des données provenant d’analogues a été utilisée pour éclairer l’évaluation des effets des substances du sous-groupe des ionones sur la santé humaine. Les analogues choisis étaient de structure ou de fonctionnalité similaires aux substances de ce groupe (toxicocinétique et propriétés physico-chimiques similaires) et il existait des données empiriques pertinentes pouvant être utilisées pour une lecture croisée pour des substances pour lesquelles il existait peu de données empiriques.
Les renseignements sur l’identité et la structure chimique des analogues utilisés pour évaluer le sous-groupe des ionones sont présentées dans le tableau 2-4.
| No CAS de l’analogue | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 14901-07-6 | 4-(2,6,6-triméthylcyclohex-1-èn-1-yl)but-3-én-2-one (β-ionone) |
C13H20O |
192,30 |
| 127-41-3 | (E)-(1)-4-(2,6,6-Triméthyl-2-cyclohexèn-1-yl)-3-butèn-2-one (α-ionone) |
C13H20O |
192,3 |
| 8013-90-9 | Ionone |
(mélange 60/40 de α- et β-ionone) C13H20O |
192,3 |
| 1335-46-2 | (1E)-1-(2,6,6-triméthylcyclohex-1-en-1-yl)pent-1-en-3-one (Ionone, méthyl-) |
C14H22O |
206,32 |
| 127-51-5 | 3-Méthyl-4-(2,6,6-triméthyl-2-cyclohexén-1-yl)-3-butén-2-one)- (α-iso-méthylionone) |
C14H22O |
206,33 |
Justification des analogues :
Deux des substances analogues (β-ionone, α-ionone) pour le sous-groupe des ionones sont des isomères (α-ionone et β-ionone) et le troisième (ionone) est un mélange à 60/40 d’α-ionone et de β-ionone. Elles possèdent des propriétés physico-chimiques similaires et sont utilisées comme ingrédients en parfumerie (ECHA 2017d,e,f). Deux autres analogues (méthylionone et α-iso-méthylionone) ont été utilisés pour le sous‑groupe des ionones, en raison de leur similarité structurale (c.-à-d. elles sont caractérisées par un noyau à six atomes de carbone, comprenant une double liaison (cycloalcène), avec quatre substituants alkyles dont un à 5 atomes de carbone avec un groupe cétone), ainsi que des propriétés physico-chimiques et des utilisations similaires (ECHA 2017g,h). Les données toxicologiques sur ces analogues se trouvent à l’annexe B.
3. Propriétés physiques et chimiques
Un résumé des principales propriétés physiques et chimiques des substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone est présenté dans les tableaux 3-1, 3-2 et 3-3. Quand les données expérimentales sur une propriété étaient limitées ou inaccessibles, des données sur les analogues ont été utilisées pour obtenir des données croisées et/ou des modèles (Q)SAR ont été utilisés pour générer des valeurs prédites pour la substance. Les propriétés des substances analogues sont présentées dans le tableau 3-4. Des renseignements supplémentaires sur les propriétés physiques et chimiques sont présentés dans le document d’ECCC (2016b).
| No CAS | Nom commun | Solubilité dans l’eau (mg/L) | log Koe | Pression de vapeur (Pa) |
|---|---|---|---|---|
| 106-02-5 | Exaltolide | 37,51 | 6,15 | 0,0069 |
| 109-29-5 | Hexadécanolide | 18,54 | 6,65 | 0,0033 |
| 502-72-7 | Exaltone | 105,97 | 5,55 | 0,056 |
| 541-91-3 | Muscone | 34,086 | 5,96 | 0,063 |
| 542-46-1 | Civettone | 22,063 | 6,31 | 0,045 |
| 7779-50-2 | Hexadécènelactone / Ambrettolide | 15,74 | 5,37 | 0,0030 |
| 28645-51-4 | Isoambrettolide | 15,74 | 5,37 | 0,0030 |
| 37609-25-9 | Ambérol de musc / Ambrettone | 44,61 | 5,82 | 0,032 |
Abréviations : Koe = coefficient de partage octanol–eau.
a Les données sont estimées d’après la suite EPI de l’EPA (c2000-2012).
| No CAS | Nom commun | Solubilité dans l’eau (mg/L) | log Koe | Pression de vapeur (Pa) |
|---|---|---|---|---|
| 1335-94-0 | Irone | 4,23 | 4,78 | 0,87 |
| 7779-30-8 | 1-Méthyl-α-ionone | 4,23 | 4,78 | 0,087 |
Abréviation : Koe = coefficient de partage octanol–eau.
a Les données sont estimées d’après la suite EPI de l’EPA (c2000-2012).
| No CAS | Nom commun | Solubilité dans l’eau (mg/L) | log Koe | Pression de vapeur (Pa) |
|---|---|---|---|---|
| 108-94-1 | Cyclohexanone | 24 000a | 1,13a | 670b |
Abréviations : Koe = coefficient de partage octanol–eau.
a Les données sont estimées d’après la suite EPI de l’EPA (c2000-2012).
b OCDE (2002).
| No CAS | Nom commun | Solubilité dans l’eau (mg/L) | log Koe | Pression de vapeur (Pa) |
|---|---|---|---|---|
| 14901-07-6a | β-ionone | 160 | 1,903 | 3,03 |
| 127-41-3a | α-ionone | 400 | 3,85 | 3,61 |
| 8013-90-9a | Ionone | S.O. | S.O. | S.O. |
| 1335-46-2a | méthyl-ionone | > 21 – < 44 | > 4,5 – < 5 | 0,4 |
| 127-51-5a | α-iso-méthyl-ionone | > 21 – < 44 | 4,7 | 0,22 |
Abréviations : S.O. = sans objet; Koe = coefficient de partage octanol-eau.
a Données tirées de ECHA (2017d,e,f, g, h).
4. Sources et utilisations
Les lactones et cétones macrocycliques, les ionones et la cyclohexanone de ce groupe de substances sont utilisées principalement comme parfums ou ingrédients en parfumerie. Quatre de ces substances, l’exaltolide, la muscone, la civétone et la cyclohexanone sont d’origine naturelle.
Toutes les substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ont été visées par une enquête réalisée en vertu de l’article 71 de la LCPE (Canada 2012). Les données compilées à partir des réponses à cette enquête sont résumées dans le tableau 4-1.
| Sous-groupe | Nom commun | Quantité produite totalea (kg) | Importations totalesa (kg) |
|---|---|---|---|
| Lactones et cétones macrocycliques | Exaltolide | 0b | 1 000 – 10 000 |
| Lactones et cétones macrocycliques | Hexadécanolide | ND | ND |
| Lactones et cétones macrocycliques | Exaltone | ND | ND |
| Lactones et cétones macrocycliques | Muscone | ND | ND |
| Lactones et cétones macrocycliques | Civettone | ND | ND |
| Lactones et cétones macrocycliques | Hexadécènelactone/ Ambrettolide | ND | ND |
| Lactones et cétones macrocycliques | Isoambrettolide | 0b | 100-1000 |
| Lactones et cétones macrocycliques | Ambérol de musc / ambrettone | ND | ND |
| Ionones | Irone | ND | ND |
| Ionones | 1-Méthyl-α-ionone | 151 | 180 |
| Cyclohexanone | Cyclohexanone | 950 | 166 809 |
Abréviations : ND = aucune valeur déclarée au-delà du seuil de déclaration de 100 kg (Canada 2012).
a Les valeurs proviennent des quantités déclarées lors d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour en connaître les inclusions et exclusions spécifiques (annexes 2 et 3).
b La valeur déclarée était de 0 kg (Environnement Canada 2013).
Aux États-Unis, le site Web Chemical Data Access Tool (CDAT) indiquait que la production nationale (année de déclaration 2012) d’exaltolide et de cyclohexanone était respectivement de 1 à 10 millions de livres (~ 450 000 – 4 500 000 kg) et > 2 milliards de livres (> 900 millions kg) (EPA 2016). En Europe, l’exaltolide, l’isoambrettolide et la cyclohexanone sont importés ou produits respectivement à raison de 1 à 10, de 100 à 1000 et de 1 million à 10 millions de tonnes par année (ECHA 2017a,b,c).
Nous présentons dans les tableaux 4‑2 et 4-3 un résumé des principales utilisations au Canada des substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone, d’après les renseignements déclarés en réponse à une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). D’autres utilisations canadiennes sont présentées dans les tableaux 4-4, 4-5 et 4-6. Selon les fiches signalétiques (FS) des produits accessibles au public, certaines substances de ce groupe peuvent également être présentes dans des assainisseurs d’air pour véhicules (FS 2015a, FS 2013b), des produits d’entretien automobile (FS 2013a) et des adhésifs à base de ciment (FS 2014) au Canada.
| Principales utilisationsa | Exaltolide | Hexadécanolide | Exaltone | Muscone |
|---|---|---|---|---|
| Lubrifiants et graisses | N | N | N | N |
| Nettoyage et entretien de l’ameublement | N | N | N | N |
| Lessive et lavage de vaisselle | N | N | N | N |
| Soins personnels | O | O | O | O |
| Assainissement de l’air | O | N | N | N |
| Vêtements et chaussures | N | N | N | N |
| Soins des animaux | N | N | N | N |
| Entretien d’automobile | N | N | N | N |
| Médicaments | O | N | N | N |
| Produits de santé naturels | O | N | N | N |
| Encre, toner et colorants | N | N | N | N |
| Peintures et revêtements | N | N | N | N |
| Matériaux de construction | N | N | N | N |
| Adhésifs et produits d’étanchéité | N | N | N | N |
| Automobiles, aéronefs et transport | N | N | N | N |
| Réactifs chimiques | N | N | N | N |
| Appareils électriques et électroniques | N | N | N | N |
Abréviations : O = oui, utilisation rapportée pour cette substance; N = non, utilisation non rapportée pour cette substance
a Utilisations déclarées en réponse à une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour en connaître les inclusions et exclusions spécifiques (annexes 2 et 3).
| Utilisations principales principalesa | Isoambrettolide | Ambérol de musc / ambrettone | 1-Méthyl-α-ionone | Cyclohexanone |
|---|---|---|---|---|
| Lubrifiants et graisses | N | N | O | O |
| Nettoyage et entretien de l’ameublement | N | N | O | N |
| Lessive et lavage de vaisselle | N | N | O | N |
| Produits de soins personnels | N | N | O | N |
| Produits d’entretien d’automobile | N | N | O | N |
| Drogues | O | N | N | N |
| Produits de santé naturels | N | N | N | N |
| Encre, toner et colorants | N | N | N | O |
| Peintures et revêtements | N | N | N | O |
| Matériaux de construction | N | N | N | O |
| Automobile, aéronef et transport | N | N | N | O |
| Adhésifs et produits d’étanchéité | N | N | N | O |
| Réactifs chimiques | N | N | N | O |
| Appareils électriques et électroniques | N | N | N | O |
Abréviations : O = oui, utilisation rapportée pour cette substance; N = non, utilisation non rapportée pour cette substance
a Utilisations déclarées en réponse à une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour en connaître les inclusions et exclusions spécifiques (annexes 2 et 3).
| Utilisation | Exaltolide | Hexadecanolide | Exaltone | Muskone/Muscone |
|---|---|---|---|---|
| Base de données interne sur les produits de drogue en tant qu’ingrédient médicinal ou non médicinal dans des désinfectants et des drogues à usage humain ou vétérinaire au Canadaa | O | N | N | N |
| Base de données d’ingrédients de produits de santé naturelsb | O | N | N | O |
| Base de données sur les produits de santé naturels homologuésc | O | N | N | N |
| Déclaré présent dans des cosmétiques, basé sur des déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiquesd | N | O | O | N |
| Formulant dans des produits antiparasitaires homologues au Canadae | O | O | O | O |
Abréviations : O = oui, utilisation rapportée pour cette substance; N = non, utilisation non rapportée pour cette substance
a BDPD [modifiée en 2016]
b BSIPSN [modifiée en 2018]
c BDPSNH [modifiée en 2018]
d Communication personnelle de la Direction de la sécurité des produits de consummation au Bureau d’évaluation du risqué des substances existantes, nov. 2016; non référencé
e Communication personnelle avec l’Agence de réglementation de la lutte antiparasitaire de Santé Canada, nov. 2016; non référencé
| Utilisation | Civétone | Hexadecenlactone / Ambrettolide | Isoambrettolide | Musk amberol / Ambrettone |
|---|---|---|---|---|
| Base de données d’ingrédients de produits de santé naturelsa | N | O | N | N |
| Formulant dans des produits antiparasitaires homologues au Canadab | O | O | O | O |
Abréviations : O = oui, utilisation rapportée pour cette substance; N = non, utilisation non rapportée pour cette substance
a BDIPSN [modifiée en 2018]
b Communication personnelle avec l’Agence de réglementation de la lutte antiparasitaire de Santé Canada, nov. 2016; non référencé
| Utilisation | Irone | 1-Methyl-α-ionone | Cyclohexanone |
|---|---|---|---|
| Matériaux d’emballage alimentairea | N | N | O |
| Base de données d’ingrédients de produits de santé naturelsb | N | O | O |
| Déclaré présent dans des cosmétiques, basé sur des déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiquesc | O | O | N |
| Formulant dans des produits antiparasitaires homologues au Canadad | N | O | O |
Abréviations : O = oui, utilisation rapportée pour cette substance; N = non, utilisation non rapportée pour cette substance
a Communication personnelle de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes, nov. 2016; non référencé
b BDIPSN [modifiée en 2018]
c Communication personnelle de la Direction de la sécurité des produits de consommation au Bureau d’évaluation du risque des substances existantes, nov. 2016; non référencé
d Communication personnelle avec l’Agence de réglementation de la lutte antiparasitaire de Santé Canada, nov. 2016; non référencé
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques posés à l’environnement par les substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ont été caractérisés en suivant l’approche de Classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition basés sur la pondération de plusieurs éléments de preuve. Les divers éléments de preuve sont rassemblés pour que l’on puisse distinguer les substances présentant un pouvoir faible ou élevé et un risque d’exposition faible ou élevé dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation des risques comparativement à une approche reposant sur un seul paramètre dans un seul milieu (p. ex., dose létale médiane, CL50). Les paragraphes suivants résument l’approche, qui est décrite en détail dans le document d’ECCC (2016a).
Nous avons colligé les données sur les propriétés physico-chimiques, le devenir (demi‑vie chimique dans divers milieux et biotes, coefficients de partition, bioconcentration dans le poisson), l’écotoxicité aiguë chez le poisson et les quantités de ces produits importés ou produits au Canada, à partir de la littérature scientifique, des bases de données empiriques disponibles (p. ex. boîte à outils [Q]SAR de l’OCDE 2016) et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE. Nous avons produit d’autres données à partir de la relation quantitative structure-activité ([Q]SAR) ou les modèles du devenir du bilan massique ou de bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils d’exposition et de danger de ces substances.
Les profils de danger ont été basés principalement sur des paramètres concernant le d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition ont aussi été élaborés à partir de plusieurs paramètres dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de risque et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de risque et d’exposition de chaque substance comme faible, moyen ou élevé. D’autres règles ont été appliquées (p. ex., constance de la classification, marge d’exposition) afin de raffiner les classifications préliminaires du danger et de l’exposition.
Une matrice de risques a été utilisée pour assigner à chaque substance un risque potentiel faible, moyen ou élevé, basé sur la classification de son danger et de son exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées selon une approche en deux étapes. La première étape servait à ajuster les résultats de la classification du risque – moyen ou élevé à faible – pour les substances présentant une faible vitesse d’émission estimée dans l’eau après traitement des eaux usées, ce qui représentait un faible potentiel d’exposition. La deuxième étape consistait à revoir les résultats d’une classification du potentiel de risque faible à l’aide de scénarios de risque relativement prudents, à l’échelle locale (c.-à-d. dans la zone à proximité du point de rejet), conçus pour protéger l’environnement, afin de déterminer si la classification du risque potentiel devrait être accrue.
La CRE est basée sur une approche pondérée afin de réduire au minimum toute surclassification ou sous-classification du danger, de l’exposition et du risque subséquent. Les approches équilibrées pour tenir compte des incertitudes sont décrites en plus de détails dans le document ECCC 2016a. Nous décrivons ci-après deux des zones d’incertitude les plus importantes. Les erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des changements de la classification du danger, en particulier en ce qui a trait aux paramètres reposant sur les concentrations des résidus dans les tissus (c.-à-d. le mode d’action toxique), dont bon nombre sont prévues à l’aide de modèles (Q)SAR. Cependant, l’impact de cette erreur est atténué par le fait qu’une sur-estimation de la létalité médiane conduira à une valeur prudente (protectrice) pour les résidus dans les tissus employée dans l’analyse des résidus corporels critiques (RCC). L’erreur de sous-estimation de la toxicité aiguë sera atténuée par l’utilisation d’autres paramètres de risque comme le profilage structural du mode d’action, la réactivité et/ou l’affinité de liaison à l’estrogène. Comme la classification de l’exposition et du risque est très sensible au taux de rejet et à la quantité utilisée, les modifications ou les erreurs de quantité de composés chimiques pourraient se traduire par des classifications différentes de l’exposition. Les classifications de la CRE reflètent donc l’exposition et le risque au Canada, basés sur ce que nous pensons être la quantité actuellement utilisée, mais pourraient ne pas refléter des tendances futures.
Les données et considérations critiques utilisées pour élaborer les profils propres aux substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentés dans ECCC (2016b).
Les classifications du danger et de l’exposition pour les substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone sont résumées dans le tableau 5-1.
| Substance | Classification CRE du danger | Classification CRE de l’exposition | Classification CRE du risque |
|---|---|---|---|
| Exaltolide | Faible | Faible | Faible |
| Hexadécanolide | Faible | Faible | Faible |
| Exaltone | Faible | Faible | Faible |
| Muscone | Faible | Faible | Faible |
| Civétone | Faible | Faible | Faible |
| Hexadécènelactone / Ambrettolide | Faible | Faible | Faible |
| Isoambrettolide | Faible | Faible | Faible |
| Ambérol de musc / ambrettone | Faible | Faible | Faible |
| Irone | Modérée | Faible | Faible |
| 1-Méthyl-α-ionone | Modérée | Faible | Faible |
| Cyclohexanone | Faible | Faible | Faible |
En se basant sur les classifications de faible danger et de faible exposition de la CRE, l’exaltolide, l’hexadécanolide, l’exaltone, la muscone, la civétone, l’hexadécènelactone / ambrettolide, l’isoambrettolide, l’ambérol de musc / ambrettone, et la cyclohexanone ont été classés comme ayant un faible potentiel global de risque pour l’environnement. Il est donc improbable que ces substances suscitent des préoccupations pour l’environnement au Canada.
Selon les renseignements pris en compte pour la CRE, la 1-méthyl-α-ionone et l’irone ont été classées comme ayant un potentiel d’exposition. La 1-méthyl-α-ionone et l’irone ont aussi été classées comme ayant un potentiel de danger modéré en raison de leur mode d’actionNote de bas de page 5 réactif. Note de bas de page 5 réactif. La 1-méthyl-α-ionone et l’irone ont aussi été suspectées d’avoir un potentiel modéré d’effets nocifs sur des réseaux trophiques aquatiques, compte tenu de leur potentiel de bioaccumulation. Des alertes structurales provenant de la boîte à outils (Q)SAR de l’OCDE (Boîte à outils QSAR de l’OCDE 2016) ont indiqué que ces substances sont des liants protéiques potentiels. La 1-méthyl-α-ionone et l’irone ont été classées comme ayant un faible potentiel de risque pour l’environnement en raison de leur faible potentiel d’exposition. Les effets potentiels et la façon dont ils peuvent se manifester dans l’environnement n’ont pas été étudiés plus à fond en raison de la faible exposition à ces substances. Compte tenu des profils d’utilisation actuels, il est improbable que ces substances suscitent des préoccupations pour l’environnement au Canada.
6. Risque d’effets nocifs pour la santé humaine
6.1 Évaluation de l’exposition
6.1.1 Milieux de l’environnement et aliments
Nous avons relevé des données limitées de surveillance environnementale pertinentes pour les niveaux d’exposition actuels aux substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone au Canada. La présence d’exaltolide a été signalée dans des eaux de surface au Portugal, mais n’a pas été détectée dans l’eau de robinet lors de la même étude (Homem et coll. 2016). Sa présence a également été rapportée dans des eaux de surface en Espagne (Montes‑Grajales et coll. 2017).
L’utilisation de la cyclohexanone dans de l’emballage alimentaire a été rapportée au Canada (communication personnelle de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes, novembre 2016; non référencé).
Certaines substances de ce groupe sont connues pour être utilisées comme aromatisants alimentaires aux États-Unis, en Europe, en Australie et en Nouvelle‑Zélande. Il est donc possible que ces substances soient présentes comme agents aromatisants dans des aliments vendus au Canada (communication personnelle de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes, novembre 2016, non référencé). Le JECFA a évalué de nombreux groupes d’aromatisants, dont 6 substances (exaltolide, cyclohexanone, muscone, civettone, hexadécènelactone / ambrettolide, isoambrettolide) font partie du présent groupe (JECFA 1998, 2000, 2003, 2006, 2011). Le JECFA a conclu qu’il n’y avait « aucun problème de sécurité aux niveaux d’ingestion estimés » pour ces 6 substances, lorsqu’elles sont utilisées comme aromatisant alimentaire.
Dans l’ensemble, en raison de leurs quantités commerciales limitées au Canada, de l’exposition potentielle limitée aux aliments vendus au Canada et des valeurs faibles à modérées de la volatilité et de la solubilité dans l’eau de ces substances, l’exposition aux substances de ce groupe due aux milieux de l’environnement ou aux aliments est jugée minime.
6.1.2 Produits disponibles pour les consommateurs
Les scénarios d’utilisation des produits qui entraînent les niveaux d’exposition potentielle les plus élevés pour chaque substance par inhalation, par voie orale et par voie cutanée (le cas échéant) sont présentés dans le tableau 6-1. Les expositions potentielles ont été estimées en faisant des hypothèses prudentes et en utilisant des valeurs par défaut provenant de scénarios d’exposition sentinels; voir l’annexe A pour plus de détails. D’autres scénarios d’utilisation potentielle (produits de santé naturels, produits de nettoyage, adhésifs à base de ciment pour les tuyaux en poly(chlorure de vinyle) [PVC], assainisseurs d’air pour véhicules) ont été pris en compte, mais ils ont donné lieu à des taux d’exposition inférieurs à ceux qui sont présentés dans le tableau 6-1 ou n’ont pas été jugés pertinents pour la population générale du Canada.
Aucune donnée sur l’absorption cutanée n’a été relevée pour les 8 lactones et cétones macrocycliques ni pour les 2 ionones (irone et 1-méthyl-α-ionone). Belsito et coll. (2013) ont obtenu des taux d’absorption cutanée chez les humains de 11 et 15 % pour deux substances de musc polycycliques, soit l’acétylcédrène et la 1‑(2,3-dihydro-1,1,2,6-tétraméthyl-3-(propane-2-yl)-1H-indène-5-yl)éthane-1-one (OTNE). À la lumière des données probantes pour ces deux substances polycycliques, un taux d’absorption cutanée maximal de 15 % est considéré approprié pour le sous-groupe des lactones et cétones macrocycliques.
La 1-méthyl-α-ionone, mais non l’irone, faisait partie du groupe des « cétones alkylées cycliques »Note de bas de page 6 de 23 substances qui comprenait l’acétylcédrène et l’OTNE (Belsito et coll. 2013). De plus, Lalko et coll. (2007a) ont fourni des données sur la méthyl‑ionone, qui est utilisé comme analogue pour le sous-groupe des ionones. Une membrane de peau de porc a été exposée à 10 % de méthyl-ionone dans de l’éthanol pendant 6 heures, avec un taux d’absorption de 10 %. Le même protocole et la même concentration de méthyl-ionone ont été utilisés sur la peau intacte de rat nue, et le taux d’absorption était respectivement de 22 et 48 % après 1 et 16 heures. Même si que le taux d’absorption était élevé sur la peau de rat « nue », la peau de porc est considérée comme étant plus proche de la peau humaine en termes de composition et de fonction. Le taux d’absorption de 10 % de méthyl-ionone sur la peau de porc peut être analogue à une absorption de 15 % d’OTNE sur la peau humaine. À la lumière des données combinées pour la 1-méthyl-α-ionone et de l’analogue méthyl-ionone, un taux d’absorption cutanée maximal de 15 % est jugé approprié pour le sous-groupe des ionones.
Un taux d’absorption cutanée de 0,1 à 2 % a été observé chez des humains exposés à de la cyclohexanone liquide pure (CIRC 1999, JECFA 2003). Par conséquent, le taux d’absorption cutanée maximal a été établi de façon prudente à 2 % pour la cyclohexanone.
| Sous-groupe ou substance | Scénario pour le produit | Voie d'exposition | Exposition par événement (mg/kg p.c.) | Concentration moyenne par événement (mg/m3) | Exposition systémique quotidienne (mg/kg p.c./j) |
|---|---|---|---|---|---|
| Lactones et cétones macrocycliquesc et iononesd | Lotion pour le corps | Cutanée | 0,062 (externe); 0,0093 (interne)b |
S.O. | 0,068 (externe); 0,01 (interne) |
| Lactones et cétones macrocycliquesc et iononesd | Lotion pour le corps | Par inhalation | 0,0035 | 0,045 | [0,017 mg/m3] |
| Lactones et cétones macrocycliques (exaltolide) | Rouge à lèvres | Voie orale | S.O. | S.O. | 0,00056 |
| Lactones et cétones macrocycliques (exaltolide) | Écran solaire (visage) | Voie cutanée | 0,46 (externe); 0,069 (interne) |
S.O. | 0,033 0,71-2,1 (interne) |
| Lactones et cétones macrocycliques (exaltolide) | Eau de toilette | Voie cutanée | 0,14 (externe); 0,021 (interne) |
S.O. | 0,036 (interne) |
| Lactones et cétones macrocycliques (exaltolide) | Eau de toilette | Par inhalation | 0,000036 | 0,046 | S.O. |
| Iononesd | Parfum corporel | Voie cutanée | 0,0047 (externe); 0,0007 (interne) |
S.O. | 0,0012 (interne) |
| Iononesd | Parfum corporel | Par inhalation | 0,00039 | 0,49 | S.O. |
| Ionones (1‑Méthyl-α‑ionone) | Colorant capillaire permanent | Voie cutanée | 0,42 (externe); 0,063 (interne) |
S.O. | 0,00062 (interne) |
| Ionones (1‑Méthyl-α‑ionone) | Colorant capillaire permanent | Par inhalation | 0,062 | 6,5 | S.O. |
| Cyclohexanone | Peinture pour mur (peinture à l’eau, pinceau et rouleau) | Voie cutanée | 0,051 (externe); 0,001 (interne) |
S.O. | S.O. |
| Cyclohexanone | Peinture pour mur (peinture à l’eau, pinceau et rouleau) | Par inhalation | 0,11 | 6,72 | S.O. |
Abréviation : S.O. = sans objet.
a L’exposition directe due à l’utilisation des produits par les adultes a été évaluée. Aux fins de l’enquête, on avait indiqué que ces produits sentinelles avaient fait l’objet d’un avis de non-utilisation par les enfants (Environnement Canada 2013).
b Les estimations de l’exposition externe sont des estimations des dépôts cutanés. Les estimations de l’exposition systémique sont des estimations de l’exposition systémique basée sur les valeurs d’absorption cutanée de chaque substance.
c Exaltolide; hexadécanolide; exaltone; muscone; civettone; hexadécènelactone / ambrettolide; isoambrettolide; ambérol de musc / ambrettone.
d Irone; 1-méthyl-α-ionone.
6.2 Évaluation des effets sur la santé
Les résumés des données sur les effets critiques pour chaque sous-groupe sont présentés dans les sections qui suivent.
6.2.1 Sous-groupe des lactones et cétones macrocycliques
Des études à dose répétée par voie orale n’ont été relevées que pour une seule des 8 substances. La dose sans effet nocif observé (DSENO) à courte durée pour la muscone est estimée à 1000 mg/kg p.c./j, basée sur l’absence d’effet nocif chez le rat à des doses orales atteignant 1000 mg/kg p.c./j par gavage pendant quatre semaines (McGinty et coll. 2011d). Plusieurs études à dose répétée par voie orale ont porté sur les effets bénéfiques de la muscone lorsqu’elle était administrée après une intervention sur des animaux de laboratoire, par exemple pour la modélisation du diabète ou de lésions aux organes ou à la colonne vertébrale. Dans tous les cas, les études étaient de courte durée et utilisaient des doses inférieures à 100 mg/kg p.c./j (Liang et coll. 2010, Meng et coll. 2014, Wang et coll. 2014, Jiang et coll. 2016, Kailiang et coll. 2016).
Aucune étude à dose répétée par voie cutanée n’a été trouvée pour l’une ou l’autre des 8 substances de ce sous-groupe. Des études à dose répétée par inhalation ont été trouvées pour une seule des 8 substances. Pour l’exaltone, une dose minimale avec effet observé (DMEO) par inhalation de 1,6 x 10-3 µg/m3 a été établie, basée sur la dégénérescence des cellules mitrales dans le bulbe olfactif chez des rats exposés à de l’exaltone par inhalation pendant 4 à 7 semaines (Pinching et Doving 1974). Il n’y avait pas suffisamment d’information pour déterminer si cet effet était nocif.
Aucune étude de toxicité pour la reproduction ou le développement n’a été trouvée pour aucune des 8 substances. Cependant, des études in vitro ont donné des résultats négatifs pour ce qui est de l’activité des récepteurs des androgènes dans les cellules ovariennes modifiées de hamsters chinois lors de tests avec l’exaltolide (Araki et coll. 2005). Bien qu’une prolifération accrue des cellules MCF-7 ait été observée lors de tests avec la muscone, cette prolifération se produisait à une dose très élevée de 2384 mg/L (Bitsch et coll. 2002).
Les études de mutagénicité in vitro sur des cellules bactériennes, disponibles pour six des huit substances, ont toutes donné des résultats négatifs. Les études de dommages à l’ADN chez E. coli, avec l’exaltolide, l’hexadécanolide et l’ambérol de musc / ambrettone, ainsi que les épreuves d’aberration chromosomique dans les lymphocytes humains, avec l’hexadécanolide et l’exaltone, ont également donné des résultats négatifs (McGinty et coll. 2011a,b,c,h). Pour ce qui est de l’exaltolide, des études in vivo des micronoyaux chez la souris ont donné des résultats négatifs (deux études ont été trouvées, McGinty et coll. 2011a,i). Bien qu’aucune étude à long terme n’ait été trouvée pour aucun des lactones ou cétones macrocycliques, des études in vitro portant sur l’activité cancérostatique ont été réalisées avec l’exaltone, la muscone et la civettone; une de ces trois substances (la civettone) présentait l’activité anti-invasive la plus élevée et l’activité cancérostatique la plus élevée également (tetst réalisés en culture avec déplacement au travers d’une membrane synthétique poreuse), par rapport aux autres cétones macrocycliques étudiés (nos CAS 502-72-7, 541-91-3 et 3100-36-5). Les auteurs ont affirmé que ces études démontraient un potentiel anticancéreux (Asada et coll. 2011). Les données de génotoxicité in vitro et in vivo disponibles indiquent que les lactones et les cétones macrocycliques ne sont pas génotoxiques, et les épreuves in vitro portant sur les marqueurs de cancérogénicité pour trois des huit substances ont donné des résultats négatifs.
Toutes les substances ont été étudiées pour ce qui est de la sensibilisation cutanée chez les humains et les cobayes. La plupart des substances ont donné des résultats négatifs en termes de sensibilisation lors de tests à des concentrations allant de 0,05 à 10 %, et certaines, à des concentrations plus élevées (25 à 75 %) donnaient également des résultats négatifs chez les cobayes ou les humains (McGinty et coll. 2011a,b,c,d,e,f,g,h,i). Cinq substances – l’hexadécanolide, l’exaltone, l’hexadécènelactone / ambrettolide, l’isoambrettolide et l’ambérol de musc / ambrettone – ont été étudiées chez un grand nombre de patients sensibles au parfum ou atteints de dermatite de contact à des concentrations allant de 0,2 à 10 % dans du pétrolatum et, de nouveau, des résultats négatifs ou présentant une faible fréquence (0,6 à 3,4 %) de sensibilisation positive ont été observés lors de ces études (McGinty et coll. 2011b,c,f,g,h).
6.2.2 Sous-groupe des ionones
Aucune sensibilisation cutanée n’a été observée chez des humains ayant reçu 10 % d’irone (Greif 1967, anonyme 1975). Les études de sensibilisation cutanée ont été réalisées avec les quatre analogues chez des animaux de laboratoire et chez les humains. Aucune sensibilisation n’a été observée chez le lapin ou le cobaye à des concentrations atteignant 100 %, selon la substance, et une sensibilisation négative a été observée chez des humains ayant reçu des concentrations d’amorce allant de 1 à 10 %, selon la substance (Lalko et coll. 2007a,b,c,d).
Les épreuves de mutagénicité in vitro sur S. typhimurium, avec et sans activation métabolique, ont donné des résultats négatifs avec la 1-méthyl-alpha ionone (NTP [date inconnue], EFSA 2015).
Comme il existe peu d’études pour l’irone et la 1-méthyl-α-ionone, les quatre analogues ont fourni des données additionnelles sur les études à dose répétée par voie orale et cutanée, ainsi que des données toxicocinétiques limitées obtenues par l’administration de dose par voie orale chez des animaux de laboratoire. Pour ce qui est de l’α‑iso‑méthyl-ionone, une étude par gavage oral de 2 semaines chez le rat a entraîné une augmentation de la salivation et des reins pâles à la dose de 1000 mg/kg p.c./j, la seule dose étudiée (Politano et coll. 2012). Pour l’α-ionone et la β-ionone, des études par voie orale d’une durée de 13 semaines menées chez le rat ont permis d’établir une DSENO identique (10 mg/kg p.c./j), d’après des effets presque identiques observés à la même dose minimale entraînant un effet nocif observé (DMENO) (100 mg/kg p.c./j), par exemple une diminution de la prise de poids corporel, de la consommation alimentaire et des concentrations de glucose sérique (les effets additionnels de la β-ionone comprenaient une augmentation de l’absorption d’eau et de légères modifications des fonctions rénales) (JECFA 1984, Lalko et coll. 2007b,c). Dans une étude par alimentation de 17 semaines chez le rat par voie orale, réalisée avec le mélange d’ionone, on n’a pas relevé d’effet nocif et on a estimé que la DSENO correspondait à la dose maximale d’essai de 500 mg/kg p.c./j (Lalko et coll. 2007d). Dans une étude par voie cutanée de 13 semaines chez le rat réalisée avec l’α-iso-méthyl-ionone, la DSENO pour la toxicité systémique était de 50 mg/kg p.c./j, d’après une augmentation du poids relatif des reins chez les deux sexes, et une augmentation significative de l’albuminurie dans l’urine des mâles à 170 mg/kg p.c./j. À la dose de 50 mg/kg p.c./j et plus, on a constaté une augmentation proportionnelle à la dose de la gravité de l’érythème et de la formation d’escarres au site d’application. En raison des effets sur la peau, Lapczynski et coll. (2007) ont déclaré qu’il n’était pas possible d’établir une DSENO pour les effets locaux.
Des rates gravides ont reçu par gavage 0, 3, 10 ou 30 mg/kg p.c./j d’α-iso-méthyl-ionone dans de l’huile de maïs aux jours de gestation (JG) 7 à 17 et elles ont été sacrifiées au JG 21. Aucun effet n’a été observé d’après divers paramètres : signes cliniques, pathologie globale, poids maternel et fœtal, et utérin, portée et développement (Lapczynski et coll. 2007, Politano et coll. 2007). Dans le cas d’une autre substance analogue, deux études de toxicité pour le développement ont été réalisées, pour lesquelles de la β-ionone a été administrée une fois pendant la gestation. Des hamsters en gestation ont reçu par gavage 0, 48, 240 ou 480 mg/kg p.c. de β-ionone dans un mélange de Tween 20/acétone (95/5) au JG 8 et ont été sacrifiées au JG 14. Aucun effet n’a été observé d’après les signes cliniques, le poids des mères ou les paramètres de développement. Dans l’autre étude, les rates gravides avaient reçu par gavage 250, 500, 750 ou 1000 mg/kg p.c. de β-ionone dans de l’huile de maïs au JG 11 et avaient été sacrifiées au JG 21. La DSENO pour la toxicité pour le développement a été établie à 750 mg/kg p.c. Les effets observés chez les rats ayant reçu 1000 mg/kg p.c. étaient les suivants : augmentation du nombre de résorptions/implantation, de résorptions, d’implantation, de portée, et diminution du poids de l’utérus et du nombre de fœtus vivants, d’implantations et de portée (Gomes-Carneiro et coll. 2003, Lalko et coll. 2007c). Des études par voie orale d’une durée de 8 semaines chez le rat ont également été réalisées avec le mélange d’ionone, mais elles étaient insuffisantes pour déterminer les niveaux d’effet critique en raison des protocoles limités de ces études (administration d’une dose tous les deux jours et évaluation limitée des critères d’effet, p. ex., les homogénats hépatiques ou des paramètres spécifiques des cellules sanguines et des glandes surrénales) (Lalko et coll. 2007d). De même, une étude par inhalation comportant des périodes d’exposition d’une et de cinq semaines a été réalisée chez le rat avec de la β-ionone, mais elle était insuffisante pour déterminer un niveau d’effet critique (une seule dose a été étudiée) (Lalko et coll. 2007b).
| Voies d'exposition | Durée | Espèce | Niveau d’effet critique | Paramètre d’effet critique pour la santé |
|---|---|---|---|---|
| Voie orale (alimentation) | 13 semaines (α-ionone) |
Rats | DSENO = 10 mg/kg p.c./j | Légère diminution de la prise de poids corporel et de la consommation alimentaire chez les deux sexes et diminution des concentrations de glucose sérique chez les femelles à 100 mg/kg p.c./j. |
| Voie orale (alimentation) | 13 semaines (β-ionone) |
Rats | DSENO = 10 mg/kg p.c./j | diminution de la prise de poids corporel, de la consommation alimentaire et des concentrations de glucose sérique, augmentation de l’absorption d’eau et légères modifications des fonctions rénales à 100 mg/kg p.c./j. |
| Voie orale (alimentation) | 17 semaines (ionone) |
Rats | DSENO = 500 mg/kg p.c./j | Aucun effet (dose maximale). |
| Voie cutanée | 13 semaines (α-iso-méthyl-ionone) |
Rats | DSENO = 50 mg/kg p.c./j | Augmentation du poids relatif des reins chez les deux sexes et augmentation significative de l’albuminurie dans l’urine des mâles à 170 mg/kg p.c./j. |
Abréviations : DSENO = dose sans effet nocif observé
6.2.3 Cyclohexanone
La cyclohexanone a fait l’objet d’un examen au niveau international par l’OCDE (2002), l’EFSA (2016), le JECFA (2003) et le CIRC (1999). L’EPA a également réalisé un examen IRIS (EPA 1987). La majeure partie des renseignements présentés dans cette section sont basés sur l’examen réalisé par l’OCDE (2002), qui était parrainé par le Canada, ainsi que sur les renseignements à jour fournis par d’autres examens internationaux. Nous présentons ici un sommaire des effets et des niveaux d’effet critiques pour cette substance.
Plusieurs études à dose répétée par voie orale ont été réalisées chez le rat et la souris pendant des périodes allant de 25 jours à 25 semaines. Ces études ont permis de déterminer des DSENO de 720 mg/kg p.c./j chez le rat et de 1600 mg/kg p.c./j chez la souris (d’après une diminution de la prise de poids corporel à 910 et 2600 mg/kg p.c./j, respectivement). Des études par voie cutanée de 5 jours chez le lapin et de 3 à 8 semaines chez le cobaye ont permis de déterminer une DSENO de 242 mg/kg p.c./j chez le cobaye (dose maximale d’essai). Des études par inhalation d’une durée de 10 semaines chez le lapin et de 6 mois chez le rat ont permis de déterminer une concentration sans effet nocif observé (CSENO) de 762 mg/m3 chez le lapin (d’après l’irritation des yeux à 1236 mg/m3) (Treon et coll. 1943, OCDE 2002).
Deux études de toxicité pour la reproduction par inhalation réalisées chez le rat ont permis de déterminer une CSENO pour la reproduction et le développement de 2000 mg/m3 (basée sur la diminution de la fertilité masculine de la génération F1 et la diminution de la survie et du poids corporel des petits à 5600 mg/m3), selon l’OCDE (2002). Deux études de toxicité pour le développement par inhalation ont été réalisées chez le rat. Dans la première, une CSENO maternelle de 400 mg/m3 a été établie (basée sur la marbrure grise des poumons à 1000 mg/m3, qui a été jugé nocive) et une CSENO pour le développement de 2000 mg/m3 (dose maximale testée). Dans l’autre étude de toxicité pour le développement par inhalation, les CSENO pour le développement et pour la toxicité maternelle ont été établies toutes deux à 2609 mg/m3, basée sur une diminution de la prise de poids corporel chez les mères et une diminution du poids corporel ainsi qu’une augmentation de la fréquence des variations squelettiques chez les fœtus à 5620 mg/m3 (OCDE 2002). Une étude de toxicité pour le développement par voie orale réalisée chez la souris a donné une DSENO maternelle de 1100 mg/kg p.c./j (basée sur une diminution de la prise de poids corporel, des signes cliniques de toxicité et une mortalité accrue à 2200 mg/kg p.c./j), ainsi qu’une DMENO pour le développement de 1100 mg/kg p.c./j (d’après la diminution du poids des petits) (OCDE 2002, JECFA 2003).
La génotoxicité globale in vitro et in vivo de la cyclohexanone est considérée négative. Plusieurs études de génotoxicité in vitro ont été réalisées sur des cellules bactériennes et mammifères, y compris des fibroblastes et des lymphocytes humains. Les études in vivo disponibles comprenaient deux épreuves d’aberration chromosomique chez le rat, une épreuve de létalité dominante chez la souris, une épreuve de létalité récessive liée au sexe chez Drosophila melanogaster et une étude des phénocopies de mutations tumorales chez D. melanogaster (OCDE 2002, JECFA 2003, Piesova et coll. 2003, EFSA 2016).
Des études de cancérogénicité par voie orale sur deux ans ont été réalisées chez le rat et la souris par ajout de cyclohexanone dans l’eau potable. Bien que des néoplasmes dans différents organes aient été observés chez les deux espèces, l’absence de relation dose-réponse dans les deux études a incité les auteurs à conclure que les signes de cancérogénicité étaient faibles (OCDE 2002, JECFA 2003). Le CIRC (1999) a examiné les mêmes études de cancérogénicité et a conclu que la cyclohexanone ne peut être classée comme substance cancérogène chez les humains (Groupe 3).
Aucune sensibilisation cutanée n’a été observée chez les animaux de laboratoire ayant reçu de la cyclohexanone à 100 % (OCDE 2002).
Les niveaux d’effet critique sont indiqués dans le tableau ci-dessous.
| Voie d'exposition | Durée | Espèce | Niveau d’effet critique | Paramètre d’effet critique pour la santé |
|---|---|---|---|---|
| Cutanée | 3 à 8 semaines | Cobaye | DSENO = 242 mg/kg p.c./j | Aucun effet (dose maximale d’essai) |
| Inhalation | Jours de gestation 5-20 (16 jours, 7 h/j) | Rats | CSENO maternelle = 400 mg/m3, CSENO pour le développement = 2 000 mg/m3. |
Toxicité maternelle : Marbrure grise des poumons. Développement : Aucun effet à la dose maximale d’essai. |
| Orale | Jours de gestation 8-12 (5 jours) | Souris | DSENO maternelle = 1 100 mg/kg p.c./j DMENO pour le développement = 1 100 mg/kg p.c./j |
Toxicité maternelle : Diminution de la prise de poids corporel, signes cliniques de toxicité et mortalité accrue. Développement : Diminution du poids des petits. |
Abréviations : DMENO = dose minimale avec effet nocif observé; CSENO = concentration sans effet nocif observe; DSENO = dose sans effet nocif observé.
6.3 Caractérisation des risques pour la santé humaine
Comme il est indiqué à la section 6.1, les milieux de l’environnement et les aliments ne devraient pas être des sources significatives d’exposition aux substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone. L’exposition devrait se produire surtout lors de l’utilisation de cosmétiques dans le cas des lactones et cétones macrocycliques et des ionones, et lors de l’utilisation de produits de bricolage dans le cas de la cyclohexanone.
6.3.1 Sous-groupe des lactones et cétones macrocycliques
Nous présentons dans le tableau 6-5 toutes les valeurs pertinentes d’exposition et de danger pour le sous-groupe des lactones et cétones macrocycliques, ainsi que les marges d’exposition qui en résultent, pour la détermination des risques.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critiquea | Paramètre d’effet critique pour la santé | Marge d’exposition (ME) |
|---|---|---|---|---|
| Exposition cutanée quotidienne : lotion pour le corps | 0,01 mg/kg p.c./j (interne) | DSENO orale = 1 000 mg/kg p.c./j dans une étude de 4 semaines chez le rat | Aucun effet (dose maximale) |
100 000 |
| Exposition par inhalation quotidienne : lotion pour le corps | 0,017 mg/m3 | DSENO orale = 1 000 mg/kg p.c./j dans une étude de 4 semaines chez le rat (équivalant à 3 226 mg/m3)b | Aucun effet (dose maximale) |
189 800 |
| Exposition cutanée quotidienne : écran solaire | 0,033 mg/kg p.c./j (interne) | DSENO orale = 1 000 mg/kg p.c./j dans une étude de 4 semaines chez le rat | Aucun effet (dose maximale) |
30 300 |
| Exposition par voie cutanée par événement : eau de toilette | 0,021 mg/kg p.c. (interne) | DSENO orale = 1 000 mg/kg p.c./j dans une étude de 4 semaines chez le rat | Aucun effet (dose maximale) |
47 600 |
| Exposition par inhalation par événement : eau de toilette | 0,046 mg/m3 | DSENO orale = 1 000 mg/kg p.c./j dans une étude de 4 semaines chez le rat (équivalant à 3 226 mg/m3)b | Aucun effet (dose maximale) |
70 100 |
Abréviations : DSENO = dose sans effet nocif observé
a Basé sur la muscone (no CAS 541-91-3).
b Selon Santé Canada (1994).
La présence de substances du sous-groupe des lactones et cétones macrocycliques a été identifiée dans des lotions pour le corps, des écrans solaires, de rouges à lèvres et des eaux de toilette au Canada. À la lumière des paramètres prudents utilisés pour la modélisation de l’exposition à ces produits, les marges calculées sont jugées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
Bien qu’aucune étude par voie cutanée adéquate n’ait été trouvée pour ce sous-groupe, les études de sensibilisation de la peau humaine réalisées avec les 8 substances du sous-groupe n’ont montré aucune sensibilisation dans la majeure partie des tests (les concentrations étudiées allaient de 0,5 à 30 %, selon la substance). Une estimation quantitative de la sensibilisation chez les humains était disponible pour l’exaltolide, et montrait que l’exaltolide à 10 % (0,4 mg/kg p.c.) n’était pas irritant pour les humains. La concentration maximale d’exaltolide trouvée était de 2,6% dans les écrans solaires pour le visage, valeur qui a été utilisée pour estimer l’exposition par les écrans solaires, tel qu’indiqué dans le tableau ci-dessus.
6.3.2 Incertitudes de l’évaluation des risques pour la santé humaine, pour le sous-groupe des lactones et cétones macrocycliques
Les plus importantes sources d’incertitude sont présentées dans le tableau suivant.
| Principales sources d’incertitude | Incidence |
|---|---|
| Exposition | |
| Absence de données sur la présence au Canada de toutes les substances dans les milieux de l’environnement et les produits disponibles pour les consommateurs. | + |
| Extrapolation d’une voie à une autre des résultats des études de toxicité par voie orale pour les expositions par voie cutanée et par inhalation. | + |
| Danger | |
| Base de données limitée sur les effets sur la santé (absence d’études toxicocinétiques, d’études de toxicité à dose répétée et pour la reproduction et le développement par voie cutanée et par inhalation; absence d’études de toxicité chronique chez des animaux de laboratoire par inhalation, par voie cutanée et par voie orale). | +/- |
Abréviations : + = incertitude pouvant causer une surestimation de l’exposition ou du risque; +/- = potentiel inconnu pouvant causer une surestimation ou une sous-estimation du risque.
6.3.3 Sous-groupe des ionones
Nous présentons dans le tableau 6-7 toutes les valeurs pertinentes d’exposition et de danger pour le sous-groupe des ionones, ainsi que les marges d’exposition qui en résultent pour la détermination des risques. Les niveaux d’effet critique déterminés pour ce sous-groupe sont tous basés sur les données sur les effets sur la santé pour quatre substances analogues (α-ionone, α-iso-méthyl-ionone, β-ionone et ionone).
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique | Paramètre d’effet critique pour la santé | Marge d’exposition (ME) |
|---|---|---|---|---|
| Exposition cutanée quotidienne : lotion pour le corps | 0,068 mg/kg p.c./j (externe) | DSENO cutanée = 50 mg/kg p.c./j dans une étude par voie cutanée de 13 semaines chez le rat (α-iso-méthyl-ionone) | Augmentation du poids relatif des reins chez les deux sexes et augmentation significative de l’albuminurie dans l’urine des mâles à 170 mg/kg p.c./j. | 735 |
| Exposition par inhalation quotidienne : lotion pour le corps | 0,017 mg/m3 | DSENO orale = 10 mg/kg p.c./j dans une étude par alimentation de 13 semaines chez le rat (équivalant à 32,3 mg/m3)a (β‑ionone) | Diminution de la prise de poids corporel, de la consommation alimentaire et des concentrations de glucose sérique, augmentation de l’absorption d’eau et légères modifications des fonctions rénales à 100 mg/kg p.c./j. | 1900 |
| Exposition par inhalation quotidienne : lotion pour le corps | 0,017 mg/m3 | DSENO orale = 10 mg/kg p.c./j dans une étude par alimentation de 13 semaines chez le rat (équivalant à 32,3 mg/m3)a (α‑ionone) | Légère diminution de la prise de poids corporel et de la consommation alimentaire chez les deux sexes et diminution des concentrations de glucose sérique chez les femelles à 100 mg/kg p.c./j. | 1900 |
Abréviations : DSENO = dose sans effet nocif observé
a Selon Santé Canada (1994).
Au Canada, la présence d’irone et de 1-méthyl-α-ionone a été identifiée dans des lotions pour le corps et des parfums corporels et celle de la 1-méthyl-α-ionone dans des teintures capillaires. Nous présentons dans le tableau ci-dessous les ME, comprises entre 735 et 1 900, basées sur le scénario d’utilisation avec les estimations de l’exposition les plus élevées (lotions pour le corps) avec des DSENO de 10 mg/kg p.c./j pour les deux études sur les effets critiques par voie orale sélectionnées, et une DSENO de 50 mg/kg p.c./j pour l’étude sur les effets critiques par voie cutanée sélectionnée. Une autre étude sur les effets critiques portant sur la substance ayant le no CAS 8013-90-9 (mélange d’ionones) a donné une DSENO par voie orale de 500 mg/kg p.c./j, basée sur une exposition de 17 semaines chez le rat (voir le tableau 6‑3). L’utilisation de cette étude aurait donné une ME beaucoup plus élevée, d’après l’exposition quotidienne aux lotions pour le corps. À la lumière des paramètres prudents utilisés dans la modélisation de l’exposition à ces produits, les ME calculées sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur l’exposition et la santé pour le sous-groupe des ionones.
6.3.4 Incertitudes de l’évaluation des risques pour la santé humaine pour le sous-groupe des ionones
Les plus importantes sources d’incertitude sont présentées dans le tableau suivant.
| Principales sources d’incertitude | Incidence |
|---|---|
| Exposition | |
| Absence de données sur la présence au Canada de toutes les substances dans les milieux de l’environnement et les produits disponibles pour les consommateurs. | + |
| Extrapolation d’une voie à une autre des résultats des études de toxicité par voie orale pour les expositions par voie cutanée et par inhalation. | + |
| Danger | |
| Absence d’études toxicocinétiques, d’études de toxicité à dose répétée (y compris chronique) et pour la reproduction et le développement par inhalation, par voie cutanée et par voie orale. | +/- |
Abréviations : + = incertitude pouvant causer une surestimation de l’exposition ou du risque; +/- = potentiel inconnu de causer une surestimation ou une sous-estimation du risque.
6.3.5 Cyclohexanone
Nous présentaons dans le tableau 6-9 toutes les valeurs pertinentes d’exposition et de danger pour la cyclohexanone, ainsi que les marges d’exposition qui en résultent, pour la détermination des risques. Les niveaux d’effet critique déterminés pour cette substance sont tous établis en se basant sur les données sur les effets sur la santé pour la cyclohexanone.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique | Paramètre d’effet critique pour la santé | Marge d’exposition (ME)a |
|---|---|---|---|---|
| Exposition par voie cutanée par événement : peinture à l’eau pour mur (pinceau et rouleau) | 0,051 mg/kg p.c. (externe) | DSENO = 242 mg/kg p.c./j dans une étude de 3 à 8 semaines chez le cobaye | Aucun effet (dose maximale) | 4750 |
| Exposition par voie cutanée par événement : peinture à l’eau pour mur (pinceau et rouleau) | 0,001 mg/kg p.c. (interne) | DMENO pour le développement par voie orale = 1 100 mg/kg p.c./j chez des souris gravides exposées pendant les JG 8-12 (5 jours) | Diminution du poids des petits | 1 100 000 |
| Exposition par inhalation par événement : peinture à l’eau pour mur (pinceau et rouleau) | 6,72 mg/m3 | CSENO maternelle par inhalation = 400 mg/m3 chez des rates gravides exposées pendant les JG 5-20 (16 jours) CSENO pour le développement = 2 000 mg/m3. | Toxicité maternelle : Marbrure grise des poumons à 1 000 mg/m3 Aucun effet sur le développement : dose maximale | 60a – 300 |
Abréviations : DSENO = dose sans effet nocif observé; CSENO = concentration sans effet nocif observé
a Cette ME a été jugée adéquate compte tenu des incertitudes, notamment la pertinence de l’effet potentiel pour ce scénario d’exposition, ainsi que l’importance relative de l’effet (les effets sur les poumons n’ont pas été observés chez le rat dans d’autres études de toxicité pour le développement et la reproduction par inhalation).
De la cyclohexanone a été détectée dans des peintures pour mur au Canada. À la lumière des paramètres prudents utilisés pour la modélisation de l’exposition aux produits, les marges calculées de 4750 à 1 100 000 pour l’exposition par voie cutanée et la plage de 60 à 300 pour l’exposition par inhalation sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. La majeure partie des examens internationaux ont porté sur le danger et n’ont pas conduit à des évaluations de l’exposition pour la cyclohexanone, à l’exception d’une évaluation de son utilisation comme substance aromatisante réalisée par le JECFA (2003) et l’EFSA (2016). Il est à noter que ce document consiste en une caractérisation de l’exposition et des risques associés à l’utilisation de la cyclohexanone dans des produits disponibles pour les consommateurs par voie cutanée ou par inhalation.
7. Conclusion
Compte tenu de tous les éléments de preuve avancés présentés dans la présent évaluation préalable, le risque d’effet nocif posé par les substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone est faible pour l’environnement. Il est donc conclu que les 11 substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ne répondent pas aux critères des alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Compte tenu des renseignements présentés dans la présente évaluation préalable, il est conclu que les 11 substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ne répondent pas aux critères de l’alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, il est conclu que les 11 substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone ne répondent à aucun des critères de l’article 64 de la LCPE.
Références
Anonyme. 1975. « Fragrance raw materials monographs - Methyl ionone ». Food and Cosmetics Toxicology, vol. 13, p. 863.
Araki N., Ohno K, Nakai M, Takeyoshi M et Lida M. 2005. « Screening for androgen receptor activities in 253 industrial chemicals by in vitro reporter gene assays using AR-EcoScreenTM cells ». Toxicology in Vitro, vol. 19, p. 831–842.
Asada R, Kageyama K, Tanaka H, Saitoh Y et Miwa N. 2011. « Antitumor and anti-invasive effects of diverse musk-fragrant macrocyclic ketones and their enhancement by hyperthermia ». Molecular Medicine Reports, vol. 5, p. 148-152.
[BDIPSN] Base de données d'ingrédients de produits de santé naturels. [Modifiée le 1er août 2017]. Ottawa (Ontario), Santé Canada. [Consultée le 9 août 2018].
[BDPP] Base de données sur les produits pharmaceutiques. [Modifiée le 17 juillet 2016]. Ottawa (Ontario), Santé Canada. [Consultée le 9 août 2018].
[BDPSNH] Base de données sur les produits de santé naturels homologués, [modifiée le 10 août 2016]. Ottawa (Ontario), Santé Canada. [Consulté le 9 août 2018].
Belsito D, Bickers D, Bruze M, Calow P, Dagli ML, Fryer AD, Greim H, Miyachi Y, Saurat JH et Sipes IG. 2013. « A toxicological and dermatological assessment of alkeyl cyclic ketones when used as fragrance ingredients ». Food Chem Toxicol p. 62, p. S1-S44.
Bitsch N, Dudas C, Korner W, Failing K, Biselli S, Rimkus G et Brunn H. 2002. « Estrogenic activity of musk fragrances detected by the E-screen assay using human MCF-7 cells ». Arch Environ Contam Toxicol vo. 43, p. 257-264.
Boîte à outils QSAR de l’OCDE. [outil de lesture croisée]. 2016. Paris (FR): Organisation de cooperation et de développement économiques, Laboratoire de chimie mathématique. (en anglais seulment)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch.33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Lise intérieure. Gazette du Canada, Partie I, vol. 146, no 48, supplément.
ChemIDplus [base de données]. 2016. Bethesda (MD): US National Library of Medicine. [Mise à jour non précisée, consultée le 2 août 2016]. (en anglais seulment)
[CIRC] Centre International de Recherche sur le Cancer, Groupe de travail sur l’évolution des risques de cancérogénicité pour l’Homme 1999. « Cyclohexanone ». Monogr. CIRC Éval. Risque Cancer Homme. vol. 71, no 1359-1364.
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (Pays-Bas): Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. (en anglais seulment)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l'approche scientifique : classification du risque écologique des substances organiques. Gatineau (Québec) : ECCC.
[ECCC] Environnement et Changement climatique Canada. 2016b. Data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (Québec). Disponible à l’adresse : substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada et Santé Canada [Modifié le 20 avril 2007]. Catégorisation de substances chimiques. Ottawa (Ontario), gouvernement du Canada. [Consulté le 1er juin 2017].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018. Évaluation préalable substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT). [Consulté en novembre 2018].
[ECHA] Agence européenne des produits chimiques. 2017a. Pentadecan-15-olide (CAS RN 106-02-5). [Consulté le 9 août 2018].
[ECHA] Agence européenne des produits chimiques. 2017b. Oxacycloheptadec-10-en-2-one (CAS RN 28645-51-4). [Consulté le 9 août 2018].
[ECHA] Agence européenne des produits chimiques. 2017c. Cyclohexanone (CAS RN 108-94-1). [Consulté le le 9 août 2018].
[ECHA] Agence européenne des produits chimiques. 2017d. Beta-ionone (CAS RN 14901-07-6). [Consulté le le 9 août 2018] https://echa.europa.eu/substance-information/-/substanceinfo/100.035.412.
[ECHA] Agence européenne des produits chimiques. 2017e. Alpha-ionone (CAS RN 127-41-3). [Consulté le 9 août 2018].
[ECHA] Agence européenne des produits chimiques. 2017f. Ionone (CAS RN 8013-90-9). [Consulté le 9 août 2018].
[ECHA] Agence européenne des produits chimiques. 2017g. Methyl-ionone (CAS RN 1335-46-2). [Consulté le 1er août 2017].
[ECHA] Agence européenne des produits chimiques. 2017h. 3-methyl-4-(2,6,6-trimethyl-2-cyclohexen-1-yl)-3-buten-2-one (CAS RN 127-51-5). [Consulté le 9 août 2018].
[EFSA] Autorité européenne de sécurité des aliments. 2015. « Scientific opinion on flavouring group evaluation 210 revision 2 (FGE.210Rev2): Consideration of genotoxic potential for α,β-unsaturated alicyclic ketones and precursors from chemical subgroup 2.4 of FGE.19 ». EFSA Panel on Food Contact Materials, Enzymes, Flavourings and Processing Aids (CEF). EFSA Journal, vol. 13, no 7, p. 4172-4204.
[EFSA] Autorité européenne de sécurité des aliments. 2016. « Scientific opinion on Flavouring Group Evaluation 51, Revision 2 (FGE.51Rev2): Consideration of alicyclic ketones and secondary alcohols and related esters evaluated by JECFA (59th meeting) structurally related to alicyclic ketones secondary alcohols and related esters in FGE.09 » Rev6 (2015). EFSA Panel on Food Contact Materials, Enzymes, Flavourings and Processing Aids (CEF). EFSA Journal vol. 14, no 1, p. 4338-4394.
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
[EPA] Environmental Protection Agency des États-Unis. 1987 (mise à jour en 2002). Integrated Risk Information System (IRIS) chemical assessment summary: Cyclohexanone; CASRN 108-94-1. Dernière version : 1987. On a ajouté en 2002, le message sur les conclusions de revue des publications d’évaluation préalable. (en anglais seulment)
[EPA] Environmental Protection Agency des États-Unis. 2014. E-FAST-Exposure and Fate Assessment Screening Tool Version 2014. [Mis à jour le 8 septembre 2016]. Consulté le 24 août 2017. (en anglais seulment)
[EPA] Environmental Protection Agency des États-Unis. 2016. Chemical Data Access Tool (CDAT) [Base de données dans l’ Internet]. Mise à jour le 4 avril 2016. [Cité le 25 janvier 2017]. (en anglais seulment)
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows c2000-2012. [modèle d’estimation]. Ver. 4.11. Washington (DC), US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (New-York): Syracuse Research Corporation. (en anglais seulment)
[FS] Fiche signalétique. 2013a. Wynn’s signature series engine tune up. Mississauga (Ontario), Wynn’s Canada Ltd. 20 janvier . 2015. [Consulté le 19 juillet 2016]. [Accès restreint].
[FS] Fiche signalétique. 2013b. Glade membrane. Compton (Californie) Auto Expressions, LLC. 30 juillet 2013. [Consulté le 19 juillet 2016]. [Accès restreint].
[FS] Fiche signalétique. 2014. IPEX SYS 636 GRY Low VOC Cement for PVC Plastic Pipe. Gardena (Californie) IPS Corporation. Novembre 2014. [Consulté le 19 juillet 2016]. [Accès restreint].
[FS] Fiche signalétique. 2015a. Armor All Air Fresheners Pure Linen Scented Oil Vent Clip. Danbury (Connecticut), The Armor All/STP Products Company. 7 janvier 2015. [Consulté le 19 juillet 2016]. [Accès restreint].
[FS] Fiche signalétique. 2015b. Covergirl Lip Perfection lipstick, BlastFlipstick, Colorlicious lipstick. Cincinnati (Ohio), The Procter & Gamble Company. 25 février 2015. [Consulté le 19 juillet 2016]. [Accès restreint].
[FS] Fiche signalétique. 2015c. Red Door EDT Spray Naturel. Stamford (États-Unis), Elizabeth Arden Inc. 20 janvier 2015. [Consulté le 19 kuillet 2016]. [Accès restreint].
Gomes-Carneiro MR, De-Oliveira, ACAX, De-Carvalho RR, Araujo IB, Souza CAM, Kuriyama SN et Paumgartten FJR. 2003. « Inhibition of cyclophosphamide-induced teratogenesis by β-ionone ». Toxicology Letters. vol. 138, p. 205–213.
Greif N 1967. « Cutaneous safety of fragrance material as measured by the maximization test ». Am. Perfumer and Cosmetics vol. 82, p. 54-57.
Homem V, Alves A, Alves A et Santo L. 2016. « Ultrasound-assisted dispersive liquid–liquid microextraction for the determination of synthetic musk fragrances in aqueous matrices by gas chromatography–mass spectrometry ». Talanta vol. 148, p. 84-93.
[JECFA] Comité mixte FAO/OMS d’experts sur les additifs alimentaires. 1984. « Ionone (alpha- and β-ionone). Safety evaluation of certain food additives and contaminants. » WHO Food Additive Series vol. 19. Organisation mondiale de la santé, Genève (Suisse), (en anglais seulment)
[JECFA] Comité mixte FAO/OMS d’experts sur les additifs alimentaires. 1998. Aliphatic lactones. Safety evaluation of certain food additives and contaminants. WHO Food Additive Series vol. 40. Rédigé à la 49e réunion du Comité mixte FAO/OMS d’experts sur les additifs alimentaires. Organisation mondiale de la santé, Genève (Suisse). (en anglais seulment)
[JECFA] Comité mixte FAO/OMS d’experts sur les additifs alimentaires. 2000. Safety evaluation of certain food additives and contaminants: aliphatic primary alcohols, aldehydes, carboxylic acids, acetals, and esters containing additional oxygenated functional groups. Rédigé à la 53e réunion du Comité mixte FAO/OMS d’experts sur les additifs alimentaires. WHO Food Additive Series vol. 44. Organisation mondiale de la santé, Genève (Suisse). Sur la couverture: Première ébauche produite par PJ Abbott (Australia New Zealand Food Authority, Canberra, Australie). (en anglais seulment)
[JECFA] Comité mixte FAO/OMS d’experts sur les additifs alimentaires, 2003. Safety evaluation of certain food additives: alicyclic ketones, secondary alcohols and related esters. Rédigé à la 50e réunion du Comité mixte FAO/OMS d’experts sur les additifs alimentaires. WHO Food Additives Series vol. 50. Organisation mondiale de la santé, Genève (Suisse). Sur la couverture : première ébauche produite par I.G. Sipes (University of Arizona, Tucson, États-Unis) et A.G. Renwick (University of Southampton, Southampton, Royaume-Uni). (en anglais seulment)
[JECFA] Comité mixte FAO/OMS d’experts sur les additifs alimentaires, 2006. Safety evaluation of certain food additives. Rédigé à la 63e réunion du Comité mixte FAO/OMS d’experts sur les additifs alimentaires WHO Food Additives Series, vol. 54. Organisation mondiale de la santé, Genève (Suisse). (en anglais seulment)
[JECFA] Comité mixte FAO/OMS d’experts sur les additifs alimentaires. 2011. Evaluation of certain food additives and contaminants. WHO Technical Report Series vol. 960. 63e rapport du Comité mixte FAO/OMS d’experts sur les additifs alimentaires du Comité mixte FAO/OMS d’experts sur les additifs alimentaires. Organisation mondiale de la santé, Genève (Suisse). (en anglais seulment)
Jiang T, Huang L, Zhou S, Cui J et YE Q. 2016. « Brain protection of muscone in rats with brain injury ». Zhongguo Zhong Xi Yi Jie He Za Zhi [Journal chinois de l’intégration des médecines traditionnelle et occidentale] vol. 36, no 6, p. 724-728. [En chinois, résumé anglais].
Kailiang Z, Yihui Z, Dingsheng L et Xianyao T. 2016. « Effects of muscone on random skin flap survival in rats ». J Reconstr Microsurg. vol. 32, no 3, p. 200-207.
Lalko J, Lapczynski A, McGinty D, Bhatia S, Letizia CS et Api AM. 2007a. « Fragrance material review on methyl ionone (mixture of isomers) ». Food Chem Tox. vol. 45, p. S300-S307.
Lalko J, Lapczynski A, McGinty D, Bhatia S, Letizia CS et Api AM. 2007c. « Fragrance material review on β-ionone ». Food Chem Tox. vol. 45, p. S241-S247.
Lalko J, Lapczynski A, McGinty D, Bhatia S, Letizia CS et Api AM. 2007d. « Fragrance material review on ionone ». Food Chem Tox. vol. 45, p. S251-S257.
Lalko J, Lapczynski A, Politano VT, McGinty D, Bhatia S, Letizia CS et Api AM. 2007b. « Fragrance material review on α-ionone ». Food Chem Tox. vol. 45, p. S235-S240.
Lapczynski A, Lalko J, Politano VT, McGinty D, Bhatia S, Letizia CS et Api AM. 2007. « Fragrance material review on alpha-iso-ionone ». Food Chem Tox. vol. 45, p. S281-S288.
Liang QQ, Zhang M, Zhou Q, Shi Q et Wang YJ. 2010. « Muscone protects vertebral end-plate degeneration by antiinflammatory property ». Clin Orthop Relat Res. vol. 46, no 8, p. 1600–1610.
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG et Sewall C. 2005. « Exposure data for cosmetic products: lipstick, body lotion, and face cream ». Food Chem Toxicol vol. 43, p. 279-291.
McGinty G, Letizia CS et Api AM. 2011a. « Fragrance material review on omega-pentadecalactone ». Food Chem Toxicol vol. 49, p. S193-S201.
McGinty D, Letizia CS et Api AM. 2011b. « Fragrance material review on hexadecanolide ». Fd Chem Toxicol vol. 49, p. S183-188.
McGinty D, Letizia CA et Api AM. 2011c. « Fragrance material review on cyclopentadecanone ». Food and Chemical Toxicology vol. 49, p. S142–S148.
McGinty D, Letizia CS et Api AM. 2011d. « Fragrance material review on 3-methyl-1-cyclopentadecanone ». Food and Chemical Toxicology, vol. 49, p. S120–S125.
McGinty D, Letizia CS et Api AM. 2011e. « Fragrance material review on cycloheptadeca-9-en-1-one ». Food and Chemical Toxicology, vol. 49, p. S93–S97.
McGinty D, Letizia CS et Api AM. 2011f. « Fragrance material review on omega-6-hexadecenlactone ». Food and Chemical Toxicology, vol. 49, p. S207–S211.
McGinty D, Letizia CS et Api AM. 2011g. « Fragrance material review on oxacycloheptadec-10-ene-2-one ». Food and Chemical Toxicology, vol. 49, p. S189-S192.
McGinty D, Letizia CS et Api AM. 2011h. « Fragrance material review on 5-cyclohexadecen-1-one ». Food and Chemical Toxicology, vol. 49, p. S98–S103.
Meng Y, Xiao Q, Bai J, Xiao X, Zhang S, Zhu X, Cheng G et Yin D. 2014. « Resolution and chiral recognition of muscone as well as actions on neural system ». Journal of Asian Natural Products Research vol. 16, no 12, p. 1166-1170.
Montes-Grajales D, Fennix-Agudelo M et Miranda-Castro W. 2017. « Occurrence of personal care products as emerging chemicals of concern in water resources: A review ». Science of the Total Environment, vol. 595, p. 601-614.
[NCI] National Chemical Inventories [base de données sur cédérom]. 2014. Columbus (Ohio): American Chemical Society, Chemical Abstracts Service. [consulté en 2014]. https://www.cas.org/products/nciglobal.
[NTP] National Toxicology Program des États-Unis. [Date inconnue]. 1(2,6,6-Trimethyl-2-cyclohexene-1-yl) 1penten-3-one M910033. (en anglais seulment)
[OCDE] Organisation pour la coopération et le développement économiques. 2002. Cyclohexanone; CAS No. 108-94-1. Cyclohexanone; CAS No. 108-94-1. OECD SIDS (Screening Information Data Set) Initial Assessment Report. 2e réunion d’évaluation initiale en 1994 et organisée par le Canada. 165 p. (en anglais seulment)
Piesova ES, Dianovsky L et Holeckova B. 2003. « The induction of micronuclei into bovine lymphocyte cultures exposed to cyclohexanone ». Folia Veterinaria vol. 47, no 3, p. 161-163.
Pinching AJ et Doving KB. 1974. « Selective degeneration in the rat olfactory bulb following exposure to different odours ». Brain Research vol. 82, p. 195-204.
Politano VT, Lapczynski AA, Ritacco G et Api AM. 2012. « Ninety-day toxicity study of alpha-iso-methylionone in rats ». Int J Toxicol. vol. 31, no 6, p. 595-601.
Politano VT, Lewis EM, Hoberman AM, Christian MS, Diener RM et Api AM. 2007. « Evaluation of the developmental toxicity of alpha-iso-methylionone in rats ». Int J Toxicol. vol. 26, p. 271-276.
Santé Canada. 1994. L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire. Ottawa (Ontario), ministre des Approvisionnements et Services Canada. No de cat. : En40-215/41F.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (Ontario), Gouvernement du Canada.
Santé Canada. [Modifié le 14 déc. 2015]. Liste critique des ingrédients de cosmétiques : Liste des ingrédients dont l'usage est interdit dans les cosmétiques. Ottawa (Ontario), Santé Canada, Direction de la sécurité des produits de consommation. [Consulté le 9 août 2018].
Santé Canada. 2016. Document sur l'approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Septembre 2016. 54 p.
SCCS [Scientific Committee on Consumer Safety]. 2012. The SCCS’s Notes of Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation, 8e révision.
Scognamiglio J, Letizia CS et Api AM. 2013. « Fragrance material review on 1-(2,6,6-trimethyl-2-cyclohexen-1-yl) pent-1-en-3-one ». Food and Chemical Toxicology vol. 62, p. S115-S119.
Statistique Canada. 2012. Enquête canadienne sur les mesures de la santé, cycle 2, 2009 à 2011.
Treon JF, Crutchfield WE Jr et Kitzmiller KV. 1943. « The physiological response of animals to cyclohexane, methylcyclohexane, and certain derivatives of these compounds: II. Inhalation ». J Ind Hyg Tox. vol. 25, no 8, p. 323-347.
Wang X, Meng H, Chen P, Yang N, Lu X, Wang Z, Gao W, Zhou N, Zhang M, Xu Z et coll. 2014. « Beneficial effects of muscone on cardiac remodeling in a mouse model of myocardial infarction ». International Journal of Molecular Medicine vol. 34, p. 103-111.
Wild D, King MT, Gocke E et Eckhard K, 1983. « Study of artificial flavouring substances for mutagenicity in the Salmonella/microsome, BASC and micronucleus tests ». Food and Chemical Toxicology. vol. 21, no 6, p. 707-719.
Annexes
Annexe A. Expositions potentielles estimées aux substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone
Des scénarios d’exposition avec des substances sentinelles ont été utilisés pour estimer l’exposition potentielle aux substances du groupe des lactones et cétones macrocycliques, des ionones et de la cyclohexanone. Les hypothèses pour ces scénarios sont résumées dans le tableau A-1. Pour les substances étudiées, ces produits sentinelles avaient fait l’objet d’un avis de non-utilisation par les enfants (Environnement Canada 2013). Les expositions ont été estimées en se basant sur le poids présumé (70,9 kg) d’un adulte (Santé Canada 1998), un taux d’inhalation pour un adulte (16,2 m³/j) et des comportements d’utilisation par un adulte. Les expositions ont été estimées à l’aide de la version Web du modèle ConsExpo (ConsExpo Web 2016), et l’exposition par inhalation de peinture pour mur a été estimée à l’aide du modèle EFAST Consumer Exposure Module de l’EPA (EPA 2014). Les paramètres par défaut de la version Web de ConsExpo ont été utilisés, sauf indication contraire. Pour ce qui est de l’exposition potentielle estimée par la voie cutanée, il a été présumé que l’absorption cutanée était de 15 % pour les lactones et cétones macrocycliques et les ionones, et de 2 % pour la cyclohexanone. Sauf indication contraire, un facteur de rétention global de 1 a été utilisé.
| Scénario | Substances (nom commun) | Hypothèses |
|---|---|---|
| Lotion pour le corps | Exaltolide; hexadécanolide; exaltone; muscone; civettone; hexadécènelactone / ambrettolide; isoambrettolide; ambérol de musc / ambrettone |
Concentration de chaque substance : 0,1 % (jugement expert) Fréquence = 1,1 fois par jour (Loretz et coll. 2005)) Exposition par voie cutanée : Contact direct du produit, application instantanée Quantité de produit : 4,4 g/application (Loretz et coll. 2005) Superficie : 16 925 cm2 (Santé Canada, 1998) Inhalation : Exposition à la vapeur, taux constant Durée de l’exposition : 8 heures (jugement expert) Quantité de produit : 4,4 g/application (Loretz et coll. 2005) Volume de la pièce : 20 m³ (ConsExpo Web 2016) Taux de ventilation : 0,6/h (ConsExpo Web 2016) Taux d’inhalation, adulte : 16,2 m³/j (Santé Canada 1998) |
Rouge à lèvres |
Exaltolide |
Exposition par voie orale : Concentration : 0,1 % (MSDS 2015b) Fréquence : 4 fois par jour (ConsExpo Web 2016) Contact direct du produit, absorption directe par voie orale Quantité ingérée : 0,01 g (ConsExpo Web 2016) |
Écran solaire (visage) |
Exaltolide |
Exposition par voie cutanée : Concentration : 2,56 % (communication personnelle de la au Bureau d’évaluation du risque des substances existantes, novembre 2016; sans référence.) Fréquence : 177 fois par année (jugement expert) Direction des produits de santé naturels et sans ordonnance de Santé Canada Contact direct du produit, application instantanée Superficie : 637 cm2 (Santé Canada, 1998) Quantité de produit : 1,27 g (jugement expert) |
Eau de toilette |
Exaltolide |
Concentration : 3 % (MSDS 2015c) Fréquence : 1,7 fois par jour (Loretz et coll. 2005) Inhalation : Exposition aux brouillards, pulvérisation Taux d’inhalation, adulte : 16,2 m³/j (Santé Canada 1998) Exposition par voie cutanée : Contact direct du produit, application instantanée Superficie : 100 cm2 (ConsExpo Web 2016) Quantité de produit : 0,33 g/application (Loretz et coll., 2005) |
Parfum corporel |
Irone; 1-méthyl-α-ionone |
Concentration : 0,1 % (jugement expert) Fréquence : 1,7 fois par jour (Loretz et coll. 2005) Inhalation : Exposition aux brouillards, pulvérisation, pulvérisation vers une personne Taux d’inhalation, adulte : 16,2 m³/j (Santé Canada 1998) Diamètre limite, inhalation : 49 µm Exposition par voie cutanée : Contact direct du produit, application instantanée Superficie : 100 cm2 (ConsExpo Web 2016) Quantité de produit : 0,33 g (Loretz et coll. 2005) |
Colorant capillaire permanent |
1-Méthyl-α-ionone |
Concentration : 0,1-0,3 % (communication personnelle de la Direction de la Sécurité des produits de consommation au Bureau d’évaluation du risque des substances existantes, novembre 2016) Fréquence : 3,57 fois par année (Statistique Canada 2012) Inhalation : Exposition à la vapeur, libération instantanée Durée de l’exposition : 60 min. (jugement expert) Quantité de produit : 100 g (ConsExpo Web 2016) Volume de la pièce : 20 m³ (ConsExpo Web 2016) Taux de ventilation : 2/h (ConsExpo Web 2016) Taux d’inhalation, adulte : 16,2 m³/j (Santé Canada 1998) Exposition par voie cutanée : Contact direct du produit, application instantanée Quantité de produit : 100 g (ConsExpo Web 2016) Facteur de rétention : 0,1 % (SCCS 2012) |
Peinture pour mur (peinture à l’eau, pinceau et rouleau) |
Cyclohexanone |
Concentration maximale des additifs dans la peinture à l’eau : 2 % (ConsExpo Web 2016) Fréquence : 2 fois par année (ConsExpo Web 2016) Exposition par voie cutanée : Contact direct du produit, taux constant Superficie exposée : 2 190 cm2 (ConsExpo Web 2016) Taux de contact : 30 mg/min. (ConsExpo Web 2016) Durée de la libération : 120 min. (ConsExpo Web 2016) Inhalation (USEPA 2014) : Durée de l’exposition : 132 min. (ConsExpo Web 2016) Volume de la pièce : 36 m³ (USEPA 2014) Volume global de la résidence : 523 m³ (USEPA 2014) Quantité de produit : 3 750 g (ConsExpo Web 2016) Taux de ventilation : 0,6/h (ConsExpo Web 2016) Taux d’inhalation, adulte : 16,2 m³/j (Santé Canada 1998) |
Annexe B. Lecture croisée avec le sous-groupe des ionones
Les données physico-chimiques des substances cibles et des analogues figurent à la section 3.0.
| Nom chimique | α-ionone | β-ionone | Ionone (mélange d’α- et de β-ionone) | α-iso-méthyl-iononeb | Ionones (irone et 1-méthyl-α-ionone) |
|---|---|---|---|---|---|
| Rôle | Analogue | Analogue | Analogue | Analogueb | Groupe cible |
| N° CAS | 127-41-3 | 14901-07-6 | 8013-90-9 | 127-51-5b | 2 nos CAS : (1335-94-0; 7779-30-8) |
| Structure chimique | C)\C=C\C(C)=O)(C)C](/content/dam/eccc/images/pded/musks/20190517AppenixB1.jpg) |
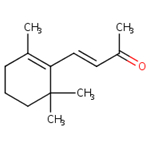 |
C)\C=C\C(C)=O)(C)C](/content/dam/eccc/images/pded/musks/20190517AppenixB3.jpg) |
=O)C)C(=CCC1)C)(C)C](/content/dam/eccc/images/pded/musks/20190517AppenixB4.jpg) |
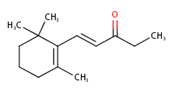 |
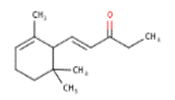 |
|||||
| Données toxicologiques | |||||
| Toxicocinétique et métabolisme | Principaux métabolites urinaires identifiés : 5-oxo-cis-tétrahydro-ionone chez le lapin ayant reçu de l’α‑ionone pure (Lalko et coll. 2007b).a | Métabolites urinaires : β‑ionone, dérivés de la β‑ionone et β‑ionol et glucuronides de ces dérivés chez le chien et le lapin (Lalko et coll. 2007c). | S.O. | S.O. | S.O. |
| Toxicité à dose répétée (voie orale) | DSENO = 10 mg/kg p.c./j (étude par alimentation de 13 semaines chez le rat; légère diminution de la prise de poids corporel et de la consommation alimentaire chez les deux sexes à 100 mg/kg p.c./j). | DSENO = 10 mg/kg p.c./j (étude par alimentation de 13 semaines chez le rat; diminution de la prise de poids corporel et de la consommation alimentaire chez les deux sexes à 100 mg/kg p.c./j). | DSENO = 500 mg/kg p.c./j (dose maximale; étude par alimentation de 17 semaines). | DMENO = 1 000 mg/kg p.c./j (dose unique; étude par gavage de 14 jours chez le rat; augmentation de la salivation et reins pâles). | S.O. |
| Toxicité à dose répétée (voie cutanée) | S.O. | S.O. | S.O. | DSENO = 50 mg/kg p.c./j (étude par voie cutanée de 13 semaines chez le rat; augmentation du poids relatif des reins chez les deux sexes à 170 mg/kg p.c./j). | S.O. |
| Toxicité à dose répétée (inhalation) | SD | DMEO = 1,6 x 10-9 M dans (études de 1 et 5 semaines chez le rat; dégénérescence des cellules mitrales dans le bulbe olfactif) (Lalko et coll. 2007c). | SD | SD | SD |
| Toxicité pour la reproduction ou le développement (voie orale) | SD | DSENO pour le développement = 750 mg/kg p.c./j chez les rats exposés au JG 11 (1 journée); nombre accru de résorptions / implantation et de résorptions / implantation / portée à 1 000 mg/kg p.c./j. | Aucune toxicité dans une étude non standard de toxicité pour la reproduction par voie orale chez le rat, jusqu’à la génération F2 (8-10 mg/kg p.c./j F0; 15 mg/kg p.c./j F1). | DSENO pour le développement = 30 mg/kg p.c./j chez les rats exposés aux JG 7-17 (11 jours). Dose maximale. | SD |
| Génotoxicité | Génotoxicité in vitro ambiguë (aberration chromosomique positive; mutagénicité négative). Résultat négatif de l’essai sur les micronoyaux de la souris in vivo (Lalko et coll. 2007b). | Mutagénicité in vitro négative (Lalko et coll. 2007c). | Génotoxicité in vitro ambiguë (résultat positif pour les dommages et la réparation de l’ADN; mutagénicité négative) (Lalko et coll. 2007d). | Mutagénicité in vitro négative (Lapczynksi et coll. 2007). | Une ou deux (1/2) substances (1-méthyl-α-ionone) étudiée. Mutagénicité in vitro négative (Wild et coll. 1983 citée dans EFSA 2015).c |
Abréviations : DMEO = dose minimale avec effet observé; DMENO = dose minimale avec effet nocif observé; SD = sans donnée; DSENO = dose sans effet nocif observé.
a. Une ou plusieurs références sont citées si l’information n’était pas déjà mentionnée dans le texte du rapport.
b. Un autre analogue, la méthyl-ionone (no CAS 1335-46-0), est un isomère structural des deux substances du sous-groupe des ionones. Il a la même masse moléculaire que les deux substances et celle de l’α-iso-méthyl-ionone, et il a des valeurs log Koe et de pression de vapeur dans la même plage que les deux substances et que l’α-iso-méthyl-ionone, mais il existe très peu de données toxicologiques. Cependant, des données sur l’absorption cutanée étaient disponibles pour cette substance, comme il est indiqué à la section « Évaluation de l’exposition ».
c. L’EFSA (2015) cite les résultats d’études de génotoxicité utilisant la méthyl-α-ionone et lui assigne le numéro de registre CAS 7779-30-8. Une vérification de l’article original (Wild et coll. 1983), cité dans EFSA (2015), montre que ces substances sont identifiées par leurs numéros FEMA (Flavor et Extract Manufacturers' Association) et CE (Conseil de l’Europe) seulement. On ne voit pas clairement si les données citées dans EFSA (2015) s’appliquent au no CAS 7779-30-8 ou au no CAS 127-42-4, car les deux substances figurent sous le numéro 2711 de la FEMA, tandis que le numéro 143 du CE s’applique seulement au no CAS 7779-30-8. Cependant, ChemIDplus associe la méthyl-α-ionone aux nos CAS 127-42-4, 79-69-6 et 93302-56-8.
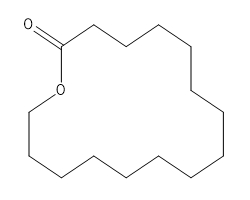
C](/content/dam/eccc/images/pded/musks/20190517Figure2-1-4.jpg)
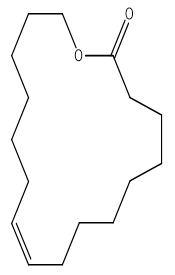
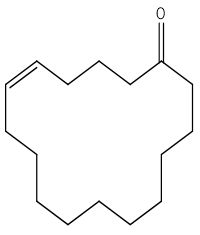
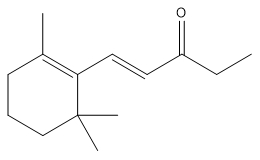
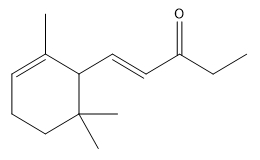
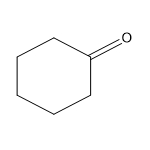
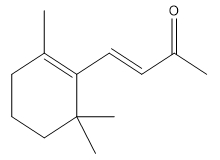
C)\C=C\C(C)=O)(C)C](/content/dam/eccc/images/pded/musks/20190517Figure2-4-2.jpg)
![O=C(CC)\C=C\[C@@H]1C(C)=CCCC1(C)C](/content/dam/eccc/images/pded/musks/20190517Figure2-4-4.jpg)
=O)C)C(=CCC1)C)(C)C](/content/dam/eccc/images/pded/musks/20190517Figure2-4-5.jpg)