Évaluation préalable - Groupe des muscs nitrés
Titre officiel : Évaluation préalable - Groupe des muscs nitrés
Numéros de registre du Chemical Abstracts Service
- 81-14-1
- 81-15-2
Environnement et Changement climatique Canada
Santé Canada
Août 2020
No de cat. : En14-394/2019F-PDF
ISBN 978-0-660-33095-2
Sommaire
En vertu de l’article 68 ou 74 de la Loi canadienne pour la protection de l’environnement 1999 (LCPE), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de deux substances appelées collectivement groupe des muscs nitrés. Les substances de ce groupe ont été identifiées d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73 (1) de la LCPE ou sont considérées d’intérêt prioritaire en raison d’autres inquiétudes ayant trait à la santé humaine. Nous donnons dans le tableau ci-après le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1), le nom sur la Liste intérieure des substances (LIS), le ou les noms communs et l’abréviation de ces substances.
| No CAS | Nom sur la LIS | Nom commun (abréviation) |
|---|---|---|
| 81-14-1 | 4’-tert-Butyl-2’,6’-diméthyl-3’,5’-dinitroacétophénone | Musc cétonique (MC) |
| 81-15-2a | 5-tert-Butyl-2,4,6-trinitro-m-xylène | Musc xylénique (MX) |
a Cette substance n’a pas été identifiée en vertu du paragraphe 73 (1) de la LCPE, mais a été incluse dans la présente évaluation, car elle est considérée d’intérêt prioritaire en raison d’autres inquiétudes ayant trait à la santé humaine.
Le musc cétonique et le musc xylénique ne sont pas présents naturellement dans l’environnement. Ils sont principalement utilisés comme fragrances ou ingrédients de fragrance. Au Canada, le musc cétonique est présent dans certains cosmétiques et le musc xylénique dans certains assainisseurs d’air, produits de soins personnels et produits de nettoyage. Selon les réponses à une enquête menée en vertu de l’article 71 de la LCPE pour l’année 2008, le musc cétonique et le musc xylénique sont tous deux importés au Canada en quantités situées entre 1000 et 10 000 kg. Cette même année, le musc cétonique a été produit en quantité inférieure à 100 kg et le musc xylénique en quantité située entre 100 et 1000 kg.
Le musc cétonique et le musc xylénique sont principalement rejetés dans les eaux usées après l’utilisation de produits disponibles pour les consommateurs. Ils peuvent donc pénétrer dans l’environnement lors du rejet d’eaux usées dans des eaux de surface. Des rejets dans les eaux de surface dus à la décharge d’effluents d’usines de traitement des eaux usées pourraient être le résultat de la formulation de produits de nettoyage ou de produits de soins personnels ou d’opérations industrielles comme le nettoyage. Des rejets dans le sol peuvent être le résultat de l’épandage sur le sol de biosolides provenant du traitement des eaux usées.
Le musc cétonique et le musc xylénique ont une faible solubilité dans l’eau et sont très persistants dans l’environnement, avec une persistance globale de plusieurs années. Quand ils sont rejetés dans l’eau – leur principal mode d’introduction dans l’environnement – ils se biodégradent et s’hydrolysent lentement. La présence de métabolites de ces muscs dans les effluents d’usines de traitement des eaux usées indique qu’une biodégradation lors du traitement pourrait avoir lieu. Ces muscs sont persistants dans l’air, mais aucun rejet significatif dans ce milieu ne devrait avoir lieu. Le musc cétonique et le musc xylénique ont respectivement un potentiel de bioaccumulation dans des organismes aquatiques modéré et élevé.
Des données empiriques et des données de modélisation suggèrent que ces deux muscs sont dangereux pour les organismes aquatiques à des concentrations relativement faibles. Les quelques études sur le sol indiquent que le musc cétonique n’est pas dangereux pour les organismes vivant dans le sol. Aucune étude avec le musc xylénique n’était disponible, mais étant donné la similarité de sa structure et de ses propriétés physico-chimiques, nous avons assumé que ses effets sur les organismes vivant dans le sol sont similaires.
Lors de plusieurs études, les concentrations de musc cétonique et de musc xylénique dans les systèmes de traitement des eaux usées au Canada ont été rapportées faibles, mais mesurables dans les influents, les effluents et les biosolides. En se basant sur les utilisations et les quantités de musc cétonique et de musc xylénique rapportées pour l’année 2008, ainsi que sur leurs voies de rejet et leurs devenirs prévus, nous avons élaboré trois scénarios d’exposition dans l’environnement : rejets industriels dans des eaux usées par des installations de formulation qui les utilisent; rejets à l’égout de produits qui en contiennent et qui sont disponibles pour les consommateurs; épandage sur le sol de biosolides qui en contiennent. Les quotients de risque pour le scénario de rejet industriel ainsi que les analyses quantitatives de risque pour les deux autres scénarios indiquent que les niveaux de musc cétonique et de musc xylénique dans l’environnement sont inférieurs aux niveaux pouvant être inquiétants pour les organismes aquatiques ou ceux vivant dans les sols.
Étant donné tous les éléments de preuve avancés dans la présente évaluation préalable, il existe un faible risque d’effet nocif sur l’environnement dû au musc cétonique et au musc xylénique. Nous concluons que le musc cétonique et le musc xylénique ne satisfont pas aux critères de l’alinéa 64 a) ou 64 b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
En termes d’effets potentiels sur la santé humaine, une croissance et une consommation d’aliments moindres et/ou des effets sur le foie ont été observés lors d’études en laboratoire à dose répétée par voie orale ou dermique avec le musc cétonique ou le musc xylénique.
Ces deux substances ont été mesurées dans des milieux de l’environnement au Canada. Les estimations d’exposition des Canadiens ont été faites sur la base des niveaux de ces muscs dans les milieux de l’environnement et dans les produits utilisés par les consommateurs, tels que des cosmétiques, des assainisseurs d’air et des produits de nettoyage. En se basant sur une comparaison des estimations d’exposition au musc cétonique et au musc xylénique avec les niveaux d’effets critiques identifiés lors d’études en laboratoire, les marges d’exposition sont considérées comme adéquates pour tenir compte des incertitudes des données sur les effets sur la santé et l’exposition utilisées pour caractériser le risque.
Sur la base des renseignements présentés dans la présente évaluation préalable, nous concluons que le musc cétonique et le musc xylénique ne satisfont pas aux critères de l’alinéa 64 c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Nous concluons donc que le musc cétonique et le musc xylénique ne satisfont à aucun des critères de l’article 64 de la LCPE.
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement, 1999 (LCPE), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de deux substances formant le groupe des muscs nitrés, afin de déterminer si elles présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Les deux substances de ce groupe ont été jugées d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73 (1) de la LCPE ou l’ont été en raison d’autres préoccupations pour la santé humaine (ECCC, SC [modifié en 2017]). Étant donné que les deux muscs nitrés évalués possèdent des structures, des propriétés physico-chimiques, des utilisations et des applications similaires, ils ont tous deux été inclus dans le groupe des muscs nitrés, mais évalués individuellement pour déterminer leur risque potentiel pour l’environnement et la santé humaine. Le musc cétonique et le musc xylénique ont fait l’objet d’un examen à l’étranger, par la Commission européenne (CE 2005a, b, c). Le musc xylénique a également été étudié par le Centre international de recherche sur le cancer (CIRC) (1996). Ces évaluations ont été soumises à un examen et à un processus d’approbation rigoureux réalisés par des autorités gouvernementales internationales. Environnement et Changement climatique Canada et Santé Canada sont des participants actifs ou des observateurs de ce processus et considèrent que ces évaluations sont fiables. Les documents de la Commission européenne ont été utilisés pour étayer les sections sur les effets sur l’environnement et les effets sur la santé de la présente évaluation préalable. Le document du CIRC a également utilisé pour étayer la section sur les effets sur la santé.
La présente évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, ainsi que de renseignements supplémentaires soumis par des parties intéressées. Nous avons recensé des données pertinentes jusqu’en octobre 2017. Cependant, des études ou des données plus récentes fournies lors de consultations internes et externes avec des pairs peuvent également être citées. Des données empiriques tirées d’études clés, ainsi que certains résultats de modélisations ont été utilisés pour tirer nos conclusions. Étant donné le potentiel de ces substances à être utilisées de manière et dans des applications similaires, le risque potentiel a été évalué en faisant des hypothèses d’exposition similaires pour tout le groupe.
La présente évaluation préalable a été préparée par le personnel du programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle comprend des intrants provenant d’autres programmes de ces ministères. Le volet environnement de la présente évaluation préalable a fait l’objet d’un examen externe. Des commentaires sur le volet technique portant sur l’environnement ont été reçus de l’Environmental Protection Agency des États‑Unis (EPA), de l’Australian National Industrial Chemicals Notification and Assessment Scheme (NICNAS) et du Research Institute for Fragrance Materials (RIFM). De plus, l’ébauche de la présente évaluation préalable (publiée le 14 septembre 2018) a fait l’objet d’une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en compte, Santé Canada et Environnement et Changement climatique Canadaassument l’entière responsabilité du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable est axée sur des renseignements critiques pour déterminer si ces substances satisfont aux critères de l’article 64 de la LCPE. Pour ce faire, nous avons étudié les renseignements scientifiques et suivi une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 2. Dans la présente évaluation préalable, nous présentons les renseignements critiques et les considérations sur lesquels reposent nos conclusions.
2. Identité des substances
Nous donnons dans le tableau 2-1, le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 3), le nom sur la Liste intérieure des substances (LIS), le nom commun et l’abréviation de chaque substance du groupe des muscs nitrés. Dans la présente évaluation, les substances seront ci-après désignées par leur abréviation MC et MX, ou, dans certains cas, par leurs noms communs (musc cétonique et musc xylénique).
Le terme « muscs nitrés » utilisé dans le présent document comprend des substances supplémentaires (musc ambrette, no CAS 83-66-9; musc moskène, no CAS 116-66-5; musc tibetène, no CAS 145-39-1). Cependant, ces autres substances ne sont pas visées par la présente évaluation et « muscs nitrés » n’est utilisé dans ce document qu’en référence à l’examen du NICNAS (2016).
| No CAS | Nom sur la LIS (nom commun; abréviation) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 81-14-1 | 4’-tert-Butyl-2’,6’-diméthyl-3’,5’-dinitroacétophénone (musc cétonique; MC) | 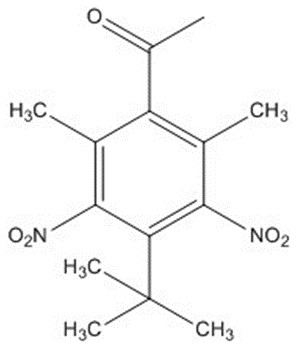 C14H18N2O5 C14H18N2O5 |
294,30 |
| 81-15-2 | 5-tert-Butyl-2,4,6-trinitro-m-xylène (musc xylénique; MX) | 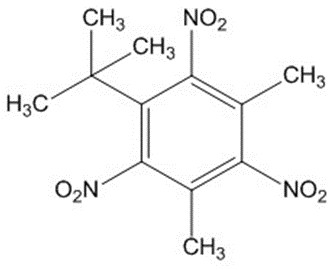 C12H15N3O6 C12H15N3O6 |
297,3 |
3. Propriétés physiques et chimiques
Nous présentons dans le tableau 3-1 un résumé des données sur les propriétés physiques et chimiques des substances du groupe des muscs nitrés. Lorsque les données expérimentales pour une propriété étaient limitées ou inexistantes, nous avons utilisé des données de modélisation R(Q)SA (relation quantitative structure-activité) pour obtenir des valeurs prédites pour la substance.
| Propriétéa | MC | MX | Références (MC; MX) |
|---|---|---|---|
| État physique | Cristaux jaunes | Solide en poudre | Lide 2007, CE 2005b |
| Point de fusion (°C) | 135,5 | 112-114 | Lide 2007, CE 2005b |
| Solubilité dans l’eau (mg/L) | 0,46 | 0,15 | Schramm et al. 1996 |
| Pression de vapeur (Pa) | 7,78 × 10-5 | 7,87 × 10-5 (rapportée en tant que 6,35 × 10-7 mm Hg) | EPI Suite c2000-2012c, MPBPWIN 2010c |
| Constante de Henry (Pa.m3/mol) | 1,92 × 10-4 | 7,84 × 10-4 (rapportée en tant que 7,7 × 10-9 atm.m3/mol) | EPI Suite c2000-2012 |
| log Koe (sans dimension) | 4,3 | 4,9 | Schramm et al. 1996, CE 2005b |
| log Kco (sans dimension) | 3,94 | 4,07 | KOCWIN 2010b |
| log Kae (sans dimension) | -7,07 | -7,37 | EPI Suite c2000-2012 |
| Constante de dissociation (pKa, sans dimension) | s.o.c | s.o.c | s.o. |
Abréviations : Koe = coefficient de partage octanol-eau; Kco = coefficient de partage carbone organique-eau; Kae = coefficient de partage air-eau; s.o. = sans objet.
a Toutes les valeurs sont issues de modélisation, sauf pour le point de fusion, la solubilité dans l’eau et le log Koe.
b Calculé avec les intrants des utilisateurs (méthode d’ajustement de la valeur expérimentale).
c Les molécules de MC et de MX ne comportent aucun groupe ionisant.
4. Sources et utilisations
Le MC et le MX ne sont pas présents naturellement dans l’environnement. Ils sont principalement utilisés comme fragrances ou ingrédients de fragrances.
Les deux substances du groupe de muscs nitrés ont été visées par une enquête menée en vertu d’un avis émis au titre de l’article 71 de la LCPE (Environnement Canada 2009). Nous présentons dans le tableau 4-1 un résumé des renseignements soumis sur les quantités totales du groupe des muscs nitrés produites et importées en 2008. Des renseignements plus récents indiquent que les quantités dans le commerce ont diminué depuis 2008 (communication personnelle, courriels de parties intéressées à la Division de l’évaluation écologique d’Environnement et Changement climatique Canada; novembre et décembre 2017; non référencé).
| Nom commun | Production totale (kg)a | Importation totale (kg)a |
|---|---|---|
| Musc cétonique | < 100 | 1000 – 10 000 |
| Musc xylénique | 100 – 1000 | 1000 – 10 000 |
a Les valeurs représentent les quantités déclarées lors d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter les enquêtes pour connaître les inclusions et exclusions spécifiques (annexes 2 et 3).
Aux États‑Unis, la production du MC était de 25 000 à 100 000 livres en 2014 et inférieure à 25 000 livres en 2015, selon la base de données Chemview (EPA 2018). Plusieurs juridictions, dont l’UE et le Japon, ont pris des mesures pour restreindre ou interdire l’utilisation du MC et du MX. Par exemple, depuis 2005, aucune quantité de MC ou de MX n’a été produite dans l’UE (CE 2005a, 2005b).
Les résultats d’une enquête pour l’année civile 2008 indiquent que du MX est utilisé au Canada pour la production de produits pour la lessive et la vaisselle, d’agents odorants, de produits de nettoyage et d’entretien du mobilier, de produits de soins personnelsNote de bas de page 4 et d’ingrédient pour des fragrances/parfums (Environnement Canada 2009). Selon les fiches signalétiques de produits (FS) accessibles au public, du MC est présent dans certains parfums et du MX dans certains assainisseurs d’air au Canada (FS 2015a, 2015b). D’autres utilisations du MC et du MX au Canada sont énumérées dans le tableau 4-2.
| Utilisation | MC | MX |
|---|---|---|
| Présent dans les cosmétiques, sur la base des déclarations faites en vertu du Règlement sur les cosmétiquesa | Oui | Non |
| Produits de formulation dans des produits antiparasitaires homologués au Canadab | Oui | Oui |
a Communication personnelle du Direction de la sécurité des produits de consommation au Bureau d’évaluation du risque des substances existantes, novembre 2016; non référencé.
b Communication personnelle avec l’Agence de réglementation de la lutte antiparasitaire de Santé Canada, novembre 2016; non référencé.
Dans le monde, du MC et du MX sont utilisés comme ingrédients de fragrances dans des cosmétiques, des détergents, des assouplisseurs, des produits de nettoyage domestiques et d’autres produits parfumés (CE 2005a, 2005b, Nakata et al. 2015). Leurs concentrations dans les produits finaux sont rapportées être jusqu’à 1 %, les concentrations typiques allant de 0,02 à 0,6 % dans les cosmétiques, y compris les parfums, étant de 0,02 % dans les détergents et de 0,07 % dans les assainisseurs d’air (NICNAS 2016). En 2009, l’Union européenne a établi des concentrations maximales autorisées de MC et de MX dans les cosmétiques (jusqu’à 1,4 % de MC et jusqu’à 1,0 % de MX, selon le produit cosmétique) (Parlement européen 2009).
5. Rejets dans l’environnement
Du MC et du MX sont rejetés dans les eaux usées après l’utilisation de produits disponibles pour les consommateurs et, par conséquent, peuvent pénétrer dans l’environnement lors de déversements d’eaux usées dans des eaux de surface ou de l’épandage de biosolides sur les sols (Smyth et al. 2007). Des activités de formulation de produits de nettoyage et de soins personnels ou des activités industrielles de nettoyage pourraient également conduire à leur rejet dans les eaux de surface suite au rejet d’effluents d’eaux usées.
6. Devenir et comportement dans l’environnement
6.1 Distribution dans l’environnement et potentiel de transport à grande distance
Dans le tableau 6-1, nous présentons les résultats de la modélisation de la fugacité de niveau III pour les substances du groupe des muscs nitrés.
| Rejet dans | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | 0,84 – 1,00 | 4,33 – 4,46 | 94,4 – 94,7 | 0,12 – 0,16 |
| Eau (100 %) | Négligeable | 96,40 – 97,40 | Négligeable | 2,60 – 3,60 |
| Sol (100 %) | Négligeable | Négligeable à 0,15 | 99,8 – 100 | Négligeable |
Il est prédit que le MC et le MX devraient rester principalement dans l’eau lorsqu’ils sont rejetés dans ce milieu. Ce comportement concorde avec leur faible pression de vapeur. La répartition dans les sédiments, à partir de l’eau, pourrait être plus élevée que la valeur prédite par EQC, étant donné leurs valeurs élevées de log Koe et de log Kco et leur faible solubilité dans l’eau. La répartition dans l’air, à partir de l’eau, devrait être négligeable, compte tenu de la valeur du coefficient de partage air-eau (log Kae) modélisé de -7,07 pour le MC et de -7,37 pour le MX (EPI Suite c2000-2012).
Le modèle de transport et de persistance de niveau III (TaPL3, 2003) peut être utilisé pour prédire le transport à grande distance dans l’eau, un concept élaboré par Beyer et al. (2000). La distance de parcours caractéristique (DPC) est définie comme la distance maximale parcourue par 63 % de la substance une fois rejetée dans l’environnement. Zarfl et al. (2011) ont proposé un seuil de DPC de 5 200 km pour classifier les substances organiques présentant un potentiel de transport à grande distance dans l’eau. À l’aide du modèle TaPL3, les DPC du MC et du MX dans l’eau ont été calculées. Elles sont respectivement de 19 400 km et de 15 800 km, en présumant un cours d’eau avec un courant de 3,6 km/h et une profondeur de 5 mètres. Ces valeurs indiquent que le MC et le MX rejetés dans un cours d’eau pourraient être entraînés sur toute la longueur du cours d’eau et que la dilution, plutôt que la dégradation, sera le principal facteur influant sur les concentrations d’exposition. Par conséquent, des expositions chroniques pourraient être à prévoir loin de la source du rejet.
Le modèle TaPL3 peut également servir à prédire les DPC du MC et du MX dans l’air. Beyer et al. (2000) ont proposé une DPC supérieure à 2 000 km représentant un potentiel de transport atmosphérique à grande distance (PTAGD) élevé, une DPC de 700 à 2 000 km représentant un PTAGD modéré et une DPC inférieure à 700 km représentant un PTAGD faible. Les DPC estimées pour le MC et le MX dans l’air au moyen du modèle TaPL3 sont respectivement de 10 et 39 km. Même si les demi-vies dans l’air sont supérieures à deux jours pour le MC et le MX, les DPC faibles sont dues à des taux de transfert élevés de l’air vers l’eau et le sol, mais non l’inverse. Les valeurs de la DPC indiquent que le MC et le MX ne devraient pas être transportés dans l’atmosphère à une distance significative de leurs sources d’émission.
6.2 Persistance dans l’environnement
6.2.1 Dégradation abiotique
En ce qui concerne le MC et le MX, des expériences de laboratoire indiquent que la photolyse dans l’eau est possible (Butte et al. 1999). Les résultats de modélisation indiquent que le MX et le MC ne se dégradent pas rapidement par photodégradation en présence de radicaux OH. Dans le tableau 6-2, nous présentons les données clés sur la dégradation abiotique des substances du groupe des muscs nitrés.
| Nom commun | Processus du devenir | Paramètres de dégradation ou prédiction | Demi-vie extrapolée (t1/2, jour) | Référence |
|---|---|---|---|---|
| Musc cétonique | Photo-dégradation en présence de radicaux OH | Demi-vie | 8,27 | AOPWIN 2010 |
| Musc xylénique | Photo-dégradation en présence de radicaux OH | Demi-vie | 12,87 | AOPWIN 2010 |
| Musc cétonique et musc xylénique | Réaction avec l’ozone | s.o.a | s.o. | AOPWIN 2010 |
| Musc cétonique et musc xylénique | Hydrolyse | Demi-vieb | s.o. | N.D. |
Abréviations : s.o. = sans objet; N.D. = non disponible
a AOPWIN ne donne pas d’estimation pour ce type de substance.
b Aucune étude n’a été trouvée pour l’hydrolyse du MC et du MX, mais étant donné leur structure, leur hydrolyse devrait être très lente (CE 2005a).
6.2.2 Biodégradation
Nous avons résumé dans les tableaux 6-3 et 6-4 les principales données expérimentales et modélisées sur la biodégradation aérobie des substances du groupe des muscs nitrés. Ces données confirment que le MC et le MX ne sont pas facilement biodégradables. Il existe certaines données probantes à l’effet que le MX se dégrade en milieu anaérobie (Kafferlein et al. 1998).
Des études ont révélé que des quantités significatives de MC (62 à 92 %) et de MX (95 à 99 %) sont éliminées lors du traitement des eaux usées (Simonich et al. 2000, Sabiliunas et al. 2001, Smyth et al. 2007). L’élimination est le résultat d’une adsorption sur des boues et d’une transformation métabolique.
Lorsque le MC et le MX sont transformés dans des usines de traitement des eaux usées (UTEU)Note de bas de page 5, les principaux produits (métabolites) sont le 4-aminoMX (4-MX), le 2‑aminoMX (2-MX) et le 2-aminoMC (2-MC). Lors d’une étude réalisée en 1998 (Gatermann et al.), les auteurs ont constaté que la concentration de 4-MX dans les effluents d’UTEU était jusqu’à 10 fois supérieures à celles du composé parent et que celles de 2-MC était jusqu’à 40 fois plus élevées que celles du composé parent. Lors d’une étude de 1999, les concentrations des trois métabolites de MC et de MX susmentionnés, ainsi que celles des composés parents, ont été déterminées dans plusieurs milieux en Allemagne. Dans les effluents de deux UTEU, les concentrations de MC et de MX étaient faibles, et celles des métabolites comparativement élevées (Rimkus et al. 1999).
| Nom commun | Processus du devenir | Conditions du test | Paramètres de dégradation ou prédiction | Référence |
|---|---|---|---|---|
| Musc cétonique | Biodégradation aérobie (intrinsèque), eaux usées | MITI II (Ligne directrice 302C de l’OCDE) | 0 % DBO | Calame et Ronchi 1989 |
| Musc xylénique | Biodégradation aérobie (immédiate), eaux usées | MITI I (Ligne directrice 301C de l’OCDE) | 0 % DBO | Calame et Ronchi, 1989 |
| Musc xylénique | Biodégradation aérobie, eaux usées | ThCO2 (essai de Sturm modifié) | 0 % ThCO2 | Marks et Marks, 1987 |
Abréviations : DBO (demande biologique en oxygène) = quantité d’oxygène dissous requise par les organismes biologiques aérobies pour dégrader la matière organique présente dans un échantillon d’eau donné, à une certaine température pendant une période précise; ThCO2 (quantité théorique de dioxyde de carbone produit) = quantité de CO2 produite par des organismes biologiques aérobies lorsqu’ils dégradent la matière organique présente dans l’eau.
| Substance | Processus du devenir | Dégradation prédite | Référence |
|---|---|---|---|
| Musc cétonique | Biodégradation aérobie primaire, eaux usées | semaines - mois (se dégrade lentement) | BIOWIN 2008 : sous‑modèle 4 (enquête d’expert) |
| Musc cétonique | Biodégradation aérobie (immédiate), eaux usées | 0 % DBO | CATALOGIC 2014 |
| Musc xylénique | Biodégradation aérobie primaire, eau | semaines - mois (se dégrade lentement) | BIOWIN 2008 : sous‑modèle 4 (enquête d’expert) |
| Musc xylénique | Biodégradation aérobie (immédiate), eaux usées | 0 % DBO | CATALOGIC 2014 |
Abréviation : DBO (demande biologique en oxygène) = quantité d’oxygène dissous requise par les organismes biologiques aérobies pour dégrader la matière organique présente dans un échantillon d’eau donné, à une certaine température, pendant une période précise.
Le MC et le MX sont persistants dans tous les milieux. D’après les données expérimentales et modélisées, les demi-vies estimées du MC et du MX sont de 6 mois dans l’eau et de 9 à 13 jours dans l’air. Pour déterminer les demi-vies dans le sol et les sédiments, des estimations ont été faites en se basant sur des tets de biodégradabilité immédiate et intrinsèque et un jugement scientifique (EPA 2000). Les demi-vies du MC et du MX ainsi obtenues sont de 6 mois dans le sol et de 2 ans dans les sédiments.
6.3 Potentiel de bioaccumulation
Dans le tableau 6-5, nous donnons un résumé des données sur la bioconcentration du groupe des muscs nitrés dans les organismes aquatiques. Ces données indiquent que le MC et le MX ont, respectivement, un potentiel de bioaccumulation modéré et élevé.
| Nom commun | Organisme testé | Concentration expérimentale (durée) | FBC (L/kg) | Référence |
|---|---|---|---|---|
| Musc cétonique | Truite arc-en-ciel (Onchorhynchus mykiss) | 5 – 47 µg/L (8 jours) | 1380a | Van Dijk et Burri 1995 |
| Musc cétonique | Carpe (Cyprinus carpio) | Non rapportée | 1100b | Yamagishi et al. 1983 |
| Musc xylénique | Crapet arlequin (Lepomis macrochirus) | 0,98 – 13 µg/L (16 jours) | 1600c | Paradice et Suprenent 1984 |
| Musc xylénique | Carpe (Cyprinus carpio) | Non rapportée | 4100d | Yamagishi et al. 1983 |
| Musc xylénique | Carpe (Cyprinus carpio) | 1 µg/L (10 semaines) | 1440 à 6740e | MITI 1992 |
| Musc xylénique | Truite arc-en-ciel (Onchorhynchus mykiss) | 0,023 µg/L (plusieurs mois) | 4200 à 5100f | Kuhlmann et al.1997 |
a Cette valeur vaut pour le parent radiomarqué (MC) et les métabolites polaires. La valeur pour le composé parent seul sera plus faible.
b On ignore si l’état d’équilibre a été atteint.
c Basé sur le résidu radiomarqué dans le poisson.
d On ignore si l’état d’équilibre a été atteint. En outre, les nouveaux calculs avec les données originales n’ont pas donné les mêmes résultats (CE 2005b).
e On ignore si l’état d’équilibre a été atteint. En outre, la variabilité relativement vaste des valeurs de FBC ne fait aucun doute.
f D’après une communication personnelle entre les auteurs de l’étude et l’Union européenne, l’étude satisfait à toutes les exigences pour une estimation fiable du FBC (CE 2005b).
Nous n’avons trouvé que quelques données expérimentales sur le facteur de bioconcentration (FBC) du MC, des résultats de modélisation ont donc été obtenus. Les valeurs de FBC modélisées pour le MC sont de 920 L/kg sans biotransformation et de 72 L/kg avec biotransformation (BCFBAF 2010). Les valeurs du facteur d’accumulation biote‑sédiments (FABS) pour le MC dans les bivalves d’eau douce et de milieux côtiers (eau et sédiments) en Corée allaient de 0,04 à 0,09, indiquant que le MC a un faible potentiel de bioaccumulation dans les organismes vivant dans les sédiments (Lee et al. 2014). Un facteur de bioamplification (FBAm) de 1 pour le MC a été proposé pour la voie aquatique, car le log Koe est inférieur à 4,5 et le FBC (poisson) est inférieur à 2000, indiquant que son potentiel de bioamplification est faible dans les organismes aquatiques (CE 2005a).
Le FBC estimé du MC pour les organismes vivant dans le sol (lombric) est de 3,6 kgsol/kglombric (CE 2005b). Aucune valeur de FABS n’a été trouvée pour le MX. Les données sur le FBAm du MX sont mitigées. Le guide technique de l’Union européenne (CE 2003) prescrit l’utilisation du FBAm pour la voie aquatique. Le MX entre dans la catégorie où un FBAm de 2 est applicable (log Koe de 4,5 à moins de 5 et un FBC [poisson] de 2000 à 5000). Cependant, dans une étude de 2012 (Inoue et al.), les auteurs ont développé une régression linéaire entre le FBC normalisé à 5 % en lipides (FBCL) et le FBAm corrigé pour tenir compte de la teneur en lipides (FBAmL) et ont obtenu un FBAmL expérimental de 0,38 pour le MX.
7. Potentiel d’effets nocifs sur l’environnement
7.1 Évaluation des effets sur l’environnement
7.1.1 Mode/mécanisme d’action
Le mode d’action (MA) du MC et du MX est incertain. Bien qu’il existe certaines preuves à l’effet que le MC et le MX pourraient avoir un mécanisme d’action narcotique non polaire (CE 2005a, 2005b), les MA prédits par l’outil de profilage de Verhaar (Verhaar et al. 1992) et par l’outil de profilage OASIS (boîte à outils RQSA de l’OCDE 2016) indiquent respectivement que le MA ne pourrait pas être classé ou qu’il consiste en un MA réactif non spécifié. L’ASTER (1999) indique que le MC et le MX sont deux composés dinitroaromatiques, qui ont généralement été associés à un syndrome d’intoxication qui concorde avec un MA basé sur la réactivité chimique. Cette réactivité pourrait entraîner un stress oxydatif.
La liaison à une protéine est un mécanisme moléculaire pouvant présenter un danger plus important qu’une narcose chez les organismes aquatiques. Bien qu’il n’existe aucune preuve définitive indiquant que le MC et le MX se lient à des protéines, les prédictions du modèle ACD/Percepta pour la liaison à une protéine indiquent que des substances telles que le MC et le MX ont tendance à se lier aux lipoprotéines dans le plasma et, dans une moindre mesure, à l’albumine. Les modèles ACD/Percepta indiquent des propriétés de liaison aux protéines du plasma dues au caractère lipophile et aux descripteurs structuraux des composés (ACD/Percepta c1997-2012).
L’outil de profilage de liaison à l’ADN de l’OCDE et celui appelé OASIS (boîte à outils RQSA de l’OCDE 2016, CATALOGIC 2014) suggèrent que le MC et le MX ne se lient pas à l’ADN.
Aucun effet du MC ni du MX n’a été observé sur le système endocrinien d’après les résultats d’activités de criblage à haut débit (EPA [mis à jour en 2016]) et d’autres sources (CE 2005a, 2005b)). Des effets sur le système endocriniens ont été constatés avec les métabolites de MC et de MX (Chou et Dietrich 1999). La liaison aux récepteurs des œstrogènes (RO) a été observée avec le 2-MC, le 2-MX et le 4-MX chez la truite arc-en-ciel (Oncorhynchus mykiss) et le xénope lisse (Xenopus laevis). L’affinité de liaison aux RO de ces métabolites était jusqu’à 375 fois plus faible que celle de l’œstradiol et jusqu’à 150 fois plus faible que celle du bisphénol A (Taylor et al. 2014). En outre, la liaison chez les deux espèces a eu lieu après exposition à ces substances pendant 20 heures à des concentrations de 10−6 à 10−3 M (0,265 mg/L à 265 mg/L) dans le milieu environnant, ce qui est bien plus élevé que les concentrations qui devraient être observées dans les eaux de surface au Canada (voir la section 7.2, ci‑après).
Des prédictions de liaison aux RO du modèle ACD/Percepta (ACD/Percepta c1997‑2012) ont été obtenues pour les principaux métabolites du MC et du MX (2-MC, 2-MX et 4-MX). Les résultats indiquent que la probabilité de liaison au récepteur alpha des œstrogènes est faible.
7.1.2 Effets sur les organismes aquatiques
Des résumés sur les résultats expérimentaux sur la toxicité de MC et de MX pour les organismes aquatiques sont présentés dans le document de la CE (2005a, 2005b) et dans l’annexe A (tableaux A-1 et A-2) de la présente évaluation. Nous avons trouvé trois autres études plus récentes que celles citées en référence dans l’évaluation de l’Union européenne (Luckenbach et Epel 2005, Mottaleb et al. 2008, Schnell et al. 2009).
En ce qui concerne les effets du MC sur les poissons, aucune donnée fiable sur la létalité aiguë (c.‑à‑d. la CL50) n’a été trouvée. Les valeurs de toxicité chronique pour les poissons et les invertébrés, dont les concentrations sans effet observé (CSEO) et les concentrations minimales avec effet observé (CMEO), allaient de 0,01 à 0,68 mg/L. La valeur critique de toxicité (VCT) pour les effets sur les organismes aquatiques est la CE10 de 0,01 mg/L basée sur l’inhibition du développement des larves chez le copépode marin Acartia tonsa (Wollenberger et al. 2001), qui est la valeur la plus faible de l’ensemble de données provenant d’une étude fiable. Dans ce cas, comme la VCT correspond déjà à un effet non létal faible, aucune extrapolation de la toxicité aiguë à la toxicité chronique n’a été nécessaire. Un facteur d’évaluation (FE) de 5 a été utilisé pour tenir compte de la variation interespèce, étant donné que l’ensemble de données est relativement grand, portant sur six espèces de trois catégories (poissons, invertébrés, algues). Après avoir divisé la VCT par le FE de 5, la concentration estimée sans effet (CESE) aquatique obtenue pour le MC est 0,002 mg/L, indiquant une toxicité aquatique élevée.
En ce qui concerne le MX, la plupart des CL50 expérimentales se situaient dans la gamme de 0,4 à 3,75 mg/L. Cependant, une CL50 à 96 heures de plus de 1 000 mg/L chez la truite arc-en-ciel a été rapportée lors d’une étude (Boleas et al. 1996). Les valeurs de toxicité chronique, la plupart des CSEO et des CMEO, allaient de 0,01 à 1,00 mg/L. Leur faible solubilité dans l’eau, en particulier celle du MX, constitue un problème pour la détermination de la toxicité des muscs nitrés. Les études expérimentales sur le MX sont toutes peu fiables. En conséquence, aucune des VCT rapportées n’a été retenue. L’analogue le plus proche du MX est le MC, mais sa solubilité dans l’eau est plus élevée que celle du MX. Aucun analogue ne peut donc être utilisé pour la sélection d’une VCT expérimentale pour les effets du MX sur les organismes aquatiques. Pour cette raison, nous avons retenu une valeur modélisée, à savoir la CL50 à 96 heures de 0,2 mg/L chez les poissons (EPISuite c2000-2012). Dans ce cas, un facteur de 10 a été appliqué pour l’extrapolation de la VCT d’un effet létal médian à court terme à une concentration non létale faible à long terme. Un autre facteur de 10 a été appliqué pour tenir compte de la variation interespèce, car il n’existe des données modélisées que pour trois espèces appartenant à trois catégories (poissons, invertébrés, algues). Après avoir divisé la VCT par le FE de 100, la CESE aquatique obtenue pour le MX est 0,002 mg/L, indiquant une toxicité aquatique élevée.
7.1.3 Effets sur les organismes vivant dans le sol
Les données limitées sur les effets sur les organismes vivant dans le sol (collembole, lombric) sont présentées dans un rapport d’évaluation des risques de l’Union européenne (CE 2005a). La VCT pour les effets du MC sur les organismes vivant dans le sol est la concentration maximale acceptable de toxiques (CMAT) basée sur la CSEO à 8 semaines (32 mg/kg) et la CMEO (100 mg/kg) pour les effets sur la reproduction chez le lombric (Goßman et Petto 1997). La CMAT calculée est de 57 mg/kg. Aucune extrapolation de la toxicité aiguë à la toxicité chronique n’est nécessaire, la VCT étant pour des effets sublétaux faibles à long terme. Cependant, puisque l’ensemble de données ne couvre que deux espèces, deux invertébrés, un facteur de variation entre espèces de 50 a été appliqué pour tenir compte de la variation interespèce. Après avoir divisé la VCT par le FE de 50, la CESE dans le sol obtenue pour le MC est 1,14 mg/kg, indiquant que le MC est modérément toxique pour les organismes vivant dans le sol.
7.1.4 Effets sur la faune et les organismes vivant dans les sédiments
Nous n’avons trouvé aucune étude sur les effets du MC ou du MX sur des oiseaux, des mammifères non utilisés en laboratoire et des organismes vivant dans les sédiments. Par conséquent, aucune CESE n’a été établie pour ces types d’organismes.
7.1.5 Métabolites
Nous n’avons trouvé aucune donnée expérimentale sur les métabolites du MC. Il existe une étude expérimentale fiable (Giddings et al. 2000) pour un métabolite du MX (4-MX), réalisée pour le compte du Research Institute for Fragrance Materials (RIFM). Les auteurs ont rapporté une CE10 à 48 heures basée sur l’immobilisation de Daphnia magna à une concentration de 4-MX située entre 0,27 et 0,3 mg/L. Faute de données expérimentales, des résultats de modélisation ont été produits et sont présentés dans l’Annexe A (tableau A-3).
Étant donné la grande variabilité des résultats de la modélisation, la valeur critique de toxicité (VCT) retenue pour les effets du 4-MX sur les organismes aquatiques est la CE10 expérimentale à 48 heures de 0,27 mg/L pour le 4-MX. Un facteur d’évaluation (FE) de 5 a été utilisé, car la VCT correspond à un effet faible de courte durée et l’immobilisation est considérée comme un effet de substitution de la létalité chez la daphnie. Un facteur additionnel de 10 est appliqué pour tenir compte de la variation interespèce, étant donné que l’ensemble de données est très petit et ne couvre que trois espèces appartenant à deux catégories (poissons et invertébrés). Après avoir divisé la VCT par le FE de 50, la CESE aquatique obtenue pour le 4-MX est 0,005 4 mg/L, indiquant que le 4‑MX a une toxicité aquatique élevée.
7.2 Évaluation de l’exposition de l’environnement
Il existe peu de données sur les concentrations de MC et de MX dans l’environnement au Canada. Dans une étude de 1999 (Gatermann et al.), les auteurs ont fait état des concentrations de MC et de MX dans le biote aquatique canadien. Les concentrations rapportées les plus élevées étaient dans les myes (normalisées pour les lipides) : 0,11 µg/g pour le MC et 17,7 µg/g pour le MX. Lors d’une étude réalisée par des chercheurs d’ECCC, des concentrations de muscs nitrés ont été mesurées dans l’air sur le site de quatre UTEU en Ontario. Les résultats préliminaires indiquent que les concentrations de MC et de MX dans l’air sont très faibles : la concentration la plus élevée de MC trouvée hors site (à environ 100 à 150 m de la zone active sur le site de l’UTEU) était de 22 pg/m3 et les concentrations de MX, hors site, étaient toutes inférieures à la limite de détection (communication personnelle; données non publiées reçues en 2017 par la Division de l’évaluation écologique d’ECCC, provenant de la Division de la recherche sur la qualité de l’air d’ECCC; non référencé). Ces résultats indiquent que l’air ne devrait probablement pas être une voie d’exposition significative pour le MC et le MX.
Plusieurs études de surveillance ont été menées entre 1997 et 2005 au Canada, aux États‑Unis et en Europe pour mesurer les concentrations de muscs nitrés dans les influents et les effluents d’UTEU, ainsi que les taux d’élimination (Simonich et al. 2000, Smyth et al. 2007, 2008). Il existe également plusieurs études de surveillance réalisées entre 1997 et 2000 aux États‑Unis et en Europe au cours desquelles les concentrations et les taux d’élimination du MC et du MX ont été spécifiquement mesurés dans les effluents de 17 UTEU (Simonich et al. 2002). Les concentrations dans les influents et les effluents et les taux d’élimination rapportés dans ces études ont été utilisés pour le calcul d’expositions de la présente évaluation afin d’estimer les concentrations environnementales estimées (CEE) de MC et de MX.
En se basant sur les utilisations et les quantités de MC et de MX rapportées lors de l’enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2009), ainsi que sur leurs voies de rejet et leur devenir prévus, nous avons élaboré trois scénarios d’exposition. Pour une description détaillée des scénarios, ainsi que des calculs de CEE, veuillez consulter le document d’ECCC de 2017.
7.2.1 Formulation de produits
Des estimations prudentes ont été établies pour les CEE du MC et du MX en milieu aquatique dans le cas de la formulation des produits. Les estimations des CEE sont basées sur des rejets industriels dans les eaux usées par des formulateurs qui utilisent du MC et du MX comme ingrédients de fragrance pour la production de produits de consommation et de produits commerciaux pour le nettoyage. Plusieurs installations représentatives ont été sélectionnées. Ces installations ont été déterminées représentatives, car elles ont indiqué qu’elles manipulaient directement ces substances. Les caractéristiques spécifiques au site ainsi que des hypothèses génériques ont été utilisées pour définir les conditions du site et déterminer les CEE dans le milieu aquatique. La limite supérieure des quantités de MC et de MX rapportée lors de l’enquête a été utilisée pour le calcul de l’exposition. En outre, certaines hypothèses génériques sur le processus de formulation et de mélange ont été utilisées. Par exemple, comme ces procédés sont hautement variables, nous avons assumé que les concentrations de MC et de MX utilisées pendant le processus de formulation et de mélange de tous les produits étaient de 3,5 %. Cette valeur a été tirée du document de l’UE (2005a) et représente la concentration maximale de MC pour mélanger ou formuler des composés de fragrance. Elle est également utilisée pour le MX, car il n’existe aucune donnée sur la concentration du MX dans le mélange. Les CEE du MC et du MX dans les eaux réceptrices (eaux de surface) ont été estimées à partir des quantités rejetées par les effluents de traitement des eaux usées (après l’élimination par l’UTEU), du débit quotidien des eaux usées et du taux de dilution dans les eaux réceptrices. Bien que des caractéristiques spécifiques au site aient été utilisées pour définir les conditions du site, certaines hypothèses ont été faites à propos des conditions de rejet. Par exemple, la taille des entreprises du secteur de la formulation de produits est très variable, mais nous avons supposé que le pourcentage de MC et de MX rejeté dans les eaux usées lors du processus nettoyage dans toutes les installations est de 0,3 %. Cette valeur constitue le facteur de rejet générique pour les opérations industrielles à grande échelle typiques et est tirée du document de la CE de 2003. Les CEE de MC et de MX calculées sont respectivement de 0,000065 et 0,00053 mg/L.
7.2.2 Utilisation et élimination des produits
La principale voie d’introduction du MC et du MX dans l’environnement est l’utilisation et le rejet de produits disponibles pour les consommateurs (Simonich 2002). L’exposition due aux rejets à l’égout a été étudiée à l’aide des concentrations mesurées de MC et de MX dans les influents et les effluents. Ces concentrations ont été mesurées dans six UTEU en Ontario de 2003 à 2004 (Smyth et al. 2008). Les résultats sont résumés dans le tableau 7-1. Ces concentrations dans les effluents, en tant que représentations prudentes des niveaux d’exposition, ont été comparées aux CESE aquatiques afin d’estimer le risque potentiel pour les organismes aquatiques.
| Influents/effluents | Concentration de MC (mg/L) | Concentration de MX (mg/L) |
|---|---|---|
| Influents | 0,00003 – 0,0004 (30 – 400 ng/L) | 0,00002 – 0,00022 (20 – 220 ng/L) |
| Effluents | 0,000005 – 0,00015 (5 – 150 ng/L) | 0,000002 – 0,00003 (2 – 30 ng/L) |
7.2.3 Épandage de biosolides
L’exposition due à l’épandage sur les sols de biosolides provenant d’UTEU a été étudiée à l’aide des concentrations mesurées de MC et de MX dans les biosolides provenant d’UTEU canadiennes. Au Canada, les UTEU produisent plus de 660 000 tonnes de biosolides par an, dont 33 % sont épandus sur des terres agricoles ou forestières (Kim et al. 2013). Dans deux études, les concentrations dans les biosolides provenant d’UTEU au Canada sont rapportées (Lee et al. 2003, Guerra et al. 2015). Dans l’étude de Lee, les concentrations de MC et de MX dans les biosolides provenant de 19 UTEU à travers le Canada entre 1996 et 2002 sont rapportées. Les valeurs rapportées sont beaucoup plus faibles que celles de l’étude de Guerra. Par conséquent, pour être prudent, nous avons retenu les concentrations médianes de MC et de MX dans les biosolides indiquées dans l’étude de Guerra. Dans le tableau 7-2, nous donnons un résumé des concentrations médianes de MC et de MX dans les biosolides, selon le type de traitement des boues (aérobie ou anaérobie). Comme scénario d’exposition prudent, ces concentrations dans les biosolides ont été comparées avec la CESE pour les organismes vivant dans le sol.
| Substance | Concentration médiane dans les biosolides : système aérobie (mg/kg) | Concentration médiane dans les biosolides : système anaérobie (mg/kg) |
|---|---|---|
| MC | 0,066 | 0,098 |
| MX | 0,063 | Non détecté |
7.3 Caractérisation des risques pour l’environnement
Pour la présente évaluation préalable ayant trait à l’environnement, nous avons examiné les renseignements sur l’évaluation et tiré nos conclusions en suivant une approche basée sur le poids de la preuve et le principe de précaution. Nous avons réuni des données pour déterminer le potentiel du MC et du MX à causer des effets nocifs sur l’environnement au Canada. Les éléments de preuve avancés comprennent ceux évalués dans la présente évaluation qui étayent la caractérisation des risques pour l’environnement au Canada. Sont également pris en compte, des éléments de preuves secondaires ou indirects disponibles, dont des décisions réglementaires et la classification du danger ou les caractéristiques du devenir déterminées par d’autres organismes de réglementation.
7.3.1 Analyses des quotients de risque et autres analyses quantitatives des risques
Des analyses des quotients de risque ont été réalisées en comparant les diverses estimations d’exposition réalistes en cas de pire éventualité (CEE; voir la section Évaluation de l’exposition de l’environnement) avec les données d’écotoxicité (CESE; voir la section Évaluation des effets sur l’environnement) en vue de déterminer s’il existe un potentiel d’effets nocifs sur l’environnement au Canada. Les quotients de risque (QR) ont été calculés en divisant la CEE par la CESE pour les milieux de l’environnement pertinents et les scénarios d’exposition associés.
Pour le scénario de formulation de produits, les QR pour les effets sur les organismes aquatiques sont de 0,033 pour le MC et de 0,27 pour le MX.
| Composé | CEE (mg/L) | CESE (mg/L) | QR |
|---|---|---|---|
| MC | 0,000 065 | 0,002 | 0,033 |
| MX | 0,000 53 | 0,002 | 0,27 |
Pour le scénario d’utilisation et d’élimination de produits, une approche prudente a été suivie en comparant les concentrations mesurées dans les effluents avec les CESE aquatiques. Les concentrations de MC et de MX les plus élevées mesurées dans des effluents sont de plusieurs ordres de grandeur inférieurs aux CESE aquatiques du MC (0,002 mg/L) et du MX (0,002 mg/L). Comme les concentrations de MC et de MX dans l’environnement (CEE) seraient encore plus faibles, aucune autre analyse approfondie de ce scénario n’a été réalisée.
De même, pour l’épandage de biosolides, la concentration la plus élevée dans les biosolides (0,098 mg/kg) a été comparée directement avec la CESE sol (1,14 mg/kg). Comme ces concentrations seraient encore plus faibles une fois appliquées au sol, aucune autre analyse approfondie de ce scénario n’a été réalisée.
Métabolites
L’hypothèse d’une concentration de 4-MX dans les effluents d’UTEU quatre fois plus élevée que celle du composé parent (MX) a été faite, en se basant sur une étude de surveillance réalisée par Gatermann et al. (1998).
Par conséquent, la CEE du 4-MX dans les eaux de surface, résultant de la formulation de produits, est de 0,0021 mg/L (4 × 0,00053 mg/L) et le QR est de 0,4 (0,0021/0,0054). La concentration la plus élevée de 4-MX dans les effluents due à l’utilisation et l’élimination de produits est de 0,00012 mg/L (0,00003 mg/L × 4), soit un ordre de grandeur inférieur à la CESE du 4-MX de 0,0054 mg/L.
7.3.2 Examen des éléments de preuve
Afin de caractériser les risques pour l’environnement dus au MC et au MX, les renseignements techniques sur divers éléments de preuve (tel que discuté dans les sections pertinentes du présent rapport) et leurs poids qualitatifs ont été examinés. Les éléments de preuve clés ayant servi à tirer la conclusion de la présente évaluation sont présentés dans le tableau 7-4, accompagnés d’une analyse globale du poids de la preuve fournie à la section 7.3.3. Le niveau de confiance fait référence à l’influence combinée de la qualité et de la variabilité des données, aux lacunes dans les données, à la causalité, à la plausibilité et à toute extrapolation requise pour l’élément de preuve. La pertinence fait référence à l’impact d’un élément de preuve sur le potentiel d’effets nocifs sur l’environnement au Canada. Les facteurs de qualification utilisés pour l’analyse vont de faible à élevé, et la pondération de chaque donnée varie sur une échelle de cinq possibilités.
| Élément de preuve | Niveau de confiancea | Pertinence pour l’évaluationb | Pondération assignéec |
|---|---|---|---|
| Persistance dans l’environnement | élevé | élevée | élevée |
| Transport à grande distance | modéré | faible | faible à modérée |
| Bioaccumulation dans les organismes aquatiques | modéré | élevée | modérée à élevée |
| Mode d’action et autres données non observablesd | faible à modéré | modérée | faible à modérée |
| CESE pour les organismes aquatiques | modéré | élevée | Modérée à élevée |
| CESE pour les organismes vivant dans le sol (MC uniquement) | faible | élevée | modérée |
| Biotransformation (métabolites) | faible | modérée | faible à modérée |
| Données de surveillance pour les concentrations dans les influents et les effluents d’eaux usées | élevé | élevée | élevée |
| Données pour les concentrations dans les biosolides des eaux usées | élevé | élevée | élevée |
| CEE dans l’eau | modéré | élevée | Modérée à élevée |
| Quotient de risque pour l’eau | modéré | modérée | modérée |
| Analyse des risques pour le sol (s’applique à MC uniquement) | modéré | modérée | modérée |
a Le niveau de confiance est déterminé en fonction de la qualité des données, de la variabilité des données et des lacunes dans les données, c.‑à‑d. les données sont-elles adaptées ou conviennent-elles à la caractérisation du paramètre ou de la propriété.
b La pertinence fait référence à l’impact global de la preuve sur l’évaluation.
c Une pondération est assignée à chaque élément de preuve, selon le niveau de confiance combiné à la pertinence pour l’évaluation.
d Les prarmètres non observables font référence aux paramètres autres que la mortalité, la croissance et la reproduction (p. ex., les paramètres identifiés comme ayant des effets sur la population.)
7.3.3 Pondération pour la détermination du potentiel d’effets nocifs sur l’environnement au Canada
Les preuves avancées dans la présente évaluation indiquent que le MC et le MX sont légèrement solubles dans l’eau et très persistants dans l’environnement. Les données sur la structure et les données empiriques, ainsi que les résultats de modélisation, corroborent l’affirmation à l’effet que le MC et le MX ont une persistance globale dans l’environnement de l’ordre de plusieurs années. Lorsqu’ils sont rejetés dans l’eau, leur principal mode d’introduction dans l’environnement, il est probable qu’ils demeurent dans la colonne d’eau et soient soumis à un transport à grande distance dans l’eau, se retrouvant ainsi dans tout le réseau hydrographique. Par conséquent, la dilution par les plans d’eau de surface devient le facteur déterminant régulant les concentrations environnementales auxquelles les organismes sont exposés.
Étant donné leur devenir dans plusieurs milieux, le MC et le MX devraient tous deux être principalement éliminés dans les UTEU. Par conséquent, ces substances devraient être éliminées en fort pourcentage des effluents d’eaux usées et elles devraient être transférées au milieu terrestre lors de l’épandage de biosolides. Des études ont montré que, quand le MC et le MX sont dégradés dans les UTEU, des produits de transformation (métabolites) sont formés. Il n’existe cependant pas de données sur la concentration de ces métabolites dans les eaux de surface au Canada et presque aucune donnée sur leur écotoxicité. Par conséquent, la présence et les effets des métabolites du MC et du MX ne sont que modérément pertinents pour la présente évaluation.
Il existe des preuves relativement cohérentes indiquant que le MC et le MX ont, respectivement, un potentiel de bioaccumulation modéré et élevé dans les espèces aquatiques. Le MC et le MX ne devraient pas être amplifiés de manière significative dans les organismes aquatiques.
Il existe de nombreuses études empiriques sur le MC et le MX indiquant qu’ils causent des effets aigus et chroniques chez les organismes aquatiques. Toutefois, seules quelques-unes sont considérées fiables. Les données empiriques et les données de la modélisation suggèrent que le MC et le MX sont dangereux pour les organismes aquatiques. Les quelques études réalisées sur le sol indiquent que le MC n’est pas dangereux pour les organismes vivant dans le sol. Aucune étude sur le sol n’a été trouvée pour le MX mais, étant donné ses similitudes de structure et de propriétés physicochimiques avec celles du MC, nous avons assumé que ses effets sur les organismes vivant dans le sol seraient semblables.
Un certain nombre de juridictions ont pris des mesures pour restreindre ou interdire l’utilisation du MX. Le MX est désigné comme substance extrêmement préoccupante par l’Union européenne et est classé parmi les substances très persistantes et très bioaccumulables. Il figure à l’annexe XIV du Règlement sur l’enregistrement, l’évaluation, l’autorisation et les restrictions relatifs aux substances chimiques (REACH), et une autorisation doit être obtenue avant de pouvoir l’utiliser dans l’Union européenne. Au Japon, le MX est une substance chimique à surveiller (Monitoring Chemical Substance) en vertu de l’Act on the Evaluation of Chemical Substances and Regulation of Their Manufacture, etc., parce qu’il a été identifié comme produit chimique persistant et très bioaccumulable, dont la toxicité à long terme pour les humains et les prédateurs des niveaux trophiques les plus élevés n’est pas entièrement élucidée. En Australie, le MX a été classé parmi les produits chimiques toxiques, bioaccumulables et persistants et a été classé en priorité pour une évaluation de niveau III dans le cadre de l’Inventory Multi‑tiered Assessment and Prioritisation (IMAP) du NICNAS (communication personnelle : courriel du NICNAS à la Division de l’évaluation écologique d’ECCC, daté du 28 novembre 2017; non référencé).
Le manque de données expérimentales fiables sur les effets aigus et chroniques du MC, du MX et de leurs métabolites, et la variabilité des données de la modélisation a réduit la confiance dans les CESE calculées pour le MC, le MX et le métabolite 4‑MX. De même, les incertitudes associées aux analyses d’exposition ont affecté le niveau de confiance dans les CEE. Toutefois, nous avons fait des hypothèses prudentes pour déterminer les CEE, de sorte que, bien qu’il existe certaines incertitudes quant au calcul des CEE, les concentrations environnementales réelles sont probablement plus faibles que celles prédites. Une comparaison des CEE résultant de la formulation de produits et des niveaux préoccupants n’est pas indicatrice du risque. Une approche prudente utilisée pour évaluer l’exposition au MC et au MX due à l’utilisation et à l’élimination de produits ou à l’épandage de biosolides, au moyen de laquelle les concentrations de MC et de MX dans les effluents ou les biosolides d’UTEU étaient comparées aux niveaux qui causeraient des effets nocifs, a montré que les concentrations dans l’environnement dues à ces sources seraient bien inférieures aux niveaux préoccupants.
Ces renseignements indiquent que le MC et le MX ont un potentiel faible d’effets nocifs sur l’environnement au Canada. Bien que l’exposition de l’environnement au MC et au MX ne soit pas préoccupante aux niveaux actuels, ces substances sont considérées comme présentant des effets préoccupants sur l’environnement étant donné leur potentiel à causer, à de faible concentration, des effets nocifs chez les organismes aquatiques. Par conséquent, la présence de ces substances pourrait être préoccupante pour l’environnement si l’exposition venait à augmenter.
7.3.4 Sensibilité de la conclusion à l’égard des principales incertitudes
Pour l’évaluation de l’exposition, il existe une incertitude quant aux renseignements sur le profil d’utilisation. Les quantités produites et importées déclarées pour 2008 lors de l’enquête menée en vertu de l’article 71 de la LCPE pourraient ne pas représenter la situation actuelle. D’après la tendance observée, l’utilisation du MC et du MX a chuté de façon constante depuis plusieurs années (communication personnelle; courriel du Research Institute for Fragrance Materials adressé à la Division de l’évaluation écologique d’ECCC, daté du 10 mars 2017; non référencé), ce qui signifie que les QR calculés à l’aide des quantités actuelles utilisées seraient plus faibles que ceux calculés pour la présente évaluation.
Il existe des incertitudes quant au devenir du MC et du MX rejetés dans les eaux de surface. Les résultats de la modélisation EQC indiquent que seul un faible pourcentage se retrouvera dans les sédiments, mais, étant donné les valeurs modérément élevées de log Kco du MC et du MX, un pourcentage de répartition plus élevé est possible. Cependant, comme aucune donnée de toxicité pour les organismes vivant dans les sédiments n’a été trouvée, l’impact d’une augmentation de la répartition de ces substances dans les sédiments n’est pas certain.
Il existe des incertitudes sur le mode d’action, ainsi que sur les effets aigus et chroniques causés par le MC et le MX. Plusieurs études ont été menées, principalement sur les effets aigus, mais peu d’entre elles sont fiables. Des FE ont été appliqués aux VCT pour réduire l’incertitude en prenant en compte des facteurs comme la variation interespèce. Il existe des preuves de l’occurrence de certains effets systémiques (p. ex., liaison aux protéines) à des concentrations inférieures à celles rapportées lors des études sur les effets chroniques. Toutefois, ces données sont limitées (c.‑à‑d. résultats d’un modèle) et ne permettent pas de tirer de conclusion.
Faute de données sur certains aspects du processus de formulation de produits, nous avons fait des hypothèses pour l’élaboration des scénarios d’exposition. Pour la formulation de produits, les incertitudes sur les éléments suivants existent : les concentrations exactes de MC et de MX dans les produits et les concentrations ultérieures dans les rejets provenant de la formulation de produits; la concentration de MC et de MX utilisée pour la formulation et le mélange de tous les produits; le nombre de jours d’activités et les quantités utilisées quotidiennement; le pourcentage de MC et de MX perdus dans les eaux usées lors du nettoyage à l’étape de la formulation. Dans le scénario d’utilisation et d’élimination des produits, une incertitude est associée à la variabilité potentiellement élevée des concentrations de MC et de MX utilisées dans différentes régions du Canada. L’utilisation des concentrations des muscs nitrés mesurées dans les effluents de six UTEU en Ontario pourrait ne pas être représentative de la situation pour l’ensemble du Canada. Concernant l’épandage de biosolides sur les sols, les incertitudes concernent les concentrations estimées de MC et de MX dans les biosolides, qui pourraient ne pas être représentatives ou qui pourraient être influencées par d’autres facteurs inconnus, comme les conditions d’exploitation de l’UTEU produisant les biosolides.
Il existe assez de preuves expérimentales et tirées de la modélisation pour étayer l’affirmation que le MC et le MX sont, respectivement, modérément dangereux et très dangereux pour les organismes aquatiques. Les preuves, pour la plupart issues de modélisation, indiquent que les effets non systémiques, comme la liaison aux RO, ne sont pas significatifs. Par conséquent, d’autres études sur la persistance, le potentiel de bioaccumulation et la toxicité de ces substances pour ces organismes aquatiques ne devraient probablement pas avoir d’incidence sur la conclusion de la présente évaluation. Étant donné qu’il ne devrait pas y avoir de rejets significatifs dans l’air et les sédiments, les études sur le devenir et les effets de ces substances dans l’air, sur les organismes vivant dans le sol, sur les sédiments et sur les organismes vivant dans les sédiments ne devraient probablement pas avoir d’impact sur la conclusion de la présente évaluation. Des rejets dans le sol étant prévus, d’autres études sur le devenir et les effets du MC et du MX dans le sol et sur les organismes vivant dans le sol pourraient, suivant leurs résultats, avoir un impact sur la conclusion de la présente évaluation.
La plupart des incertitudes de la présente évaluation concernent l’évaluation de l’exposition due à la formulation de produits. La réduction des incertitudes associées à ce scénario d’exposition pourrait avoir un impact sur le QR et sur la conclusion de la présente évaluation. Compte tenu de la prudence des approches suivies pour les deux autres scénarios, les incertitudes sont moins nombreuses et, par conséquent, tout renseignement additionnel sur l’exposition due à ces sources ne devrait probablement pas avoir d’impact sur la conclusion de la présente évaluation.
Bien que les profils d’utilisation actuels et les quantités actuellement dans le commerce soient indicatifs d’une faible préoccupation, des inquiétudes pourraient se manifester si les quantités de MC et de MX venaient à augmenter au Canada.
8. Potentiel d’effets nocifs sur la santé humaine
8.1 Évaluation de l’exposition
Milieux de l’environnement et aliments
Il n’existe aucune donnée de surveillance du MC et du MX dans l’environnement au Canada, en dehors de celles d’une étude pour laquelle des concentrations dans le biote ont été rapportées. Du MC a été mesuré et détecté dans de la poussière domestique collectée dans 13 villes à travers le Canada entre 2007 et 2010 (Kubwabo et al. 2012). Aucun rapport sur la présence de l’une ou l’autre de ces substances dans les aliments au Canada n’a été trouvé.
À l’étranger, du MC a été mesuré dans le sol à Lubbock, au Texas (Chase et al. 2012), et la présence de MC et de MX a été rapportée dans l’air ambiant en Iowa et au Wisconsin, ainsi qu’au-dessus des lacs Ontario, Érié et Michigan aux États-Unis (Peck et Hornbuckle 2004, 2006), dans de l’air intérieur en Turquie (Sofuoglu et al. 2010) et dans de la poussière d’habitations et de motels aux États-Unis (Peck et al. 2007). Homem et al. (2016) n’ont détecté aucune trace de ces deux substances dans l’eau potable en Espagne. Cependant, ces deux substances ont été détectées dans les eaux de surface du lac Michigan, ainsi que dans des cours d’eau ou des eaux de surface de lacs en Europe (Peck et Hornbuckle 2004, Rimkus 1999). Ces deux substances ont été mesurées dans des poissons, des moules et des crustacés en Europe (Rimkus 1999, Hajslova et Setkova 2004, Deudahl-Olesen et al. 2005). Peck et al. (2007) ont analysé deux échantillons uniques de tissu de touladi des Grands Lacs, un échantillon de tissu de moule et un échantillon du pannicule adipeux prélevé sur un globicéphale au Massachusetts, mais aucune des deux substances n’a été détectée. Aguirre et al. (2014) ont également mesuré du MC dans de la laitue en Espagne, mais cette substance n’a pas été détectée dans les échantillons de carottes et de poivrons.
Biosurveillance
Les concentrations totales mesurées de ces substances dans le sang humain peuvent fournir une mesure de l’exposition intégrée chez l’humain due à toutes les voies (orale, dermique et inhalation) et à toutes les sources (y compris les milieux de l’environnement, les aliments et l’utilisation fréquente ou quotidienne de produits auxquels les personnes ont été exposées). Au Canada, une étude préliminaire réalisée avec des femmes atteintes d’un cancer du sein a révélé des concentrations de MC allant de plus de 0,05 (limite de détection) à 1,52 µg/L dans le sérum sanguin de 8 des 10 femmes (médiane = 0,46 µg/L), alors que chez 4 des 20 femmes en bonne santé les concentrations allaient de plus de 0,05 à 0,76 µg/L (médiane inférieure à 0,05 µg/L). Du MX n’a été détecté chez aucune des femmes indifféremment de leur état de santé. Les échantillons sanguins ont été prélevés entre 2004 et 2016 (communication personnelle de la Division de l’exposition et de la biosurveillance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, février 2017; non référencé).
À l’étranger, des concentrations de MC et de MX ont été mesurées dans le lait maternel lors de nombreuses études en Europe depuis le début des années 1990, et plus récemment aux États‑Unis et en Chine (Hajslova et Setkova 2004, CE 2005a, 2005b, Reiner et al. 2007, Lignell et al. 2008, Raab et al. 2008, Zhang et al. 2011, 2015, Zhou et al. 2012, Yin et al. 2012, 2016). Pendant les années 2000, en Europe et aux États‑Unis, les concentrations maximales de MC et de MX allaient respectivement de 6,0 à 212 ng/g de lipides et de 150 à 240 ng/g de lipides (Hajslova et Setkova 2004, Reiner et al. 2007, Raab et al. 2008). De plus, du MC et du MX ont été mesurés dans le tissu adipeux en Allemagne, en Suisse et en Corée (CE 2005a, 2005b, Moon et al. 2002), dans le plasma sanguin en Allemagne et au Vietnam (CE 2005a, Hutter et al. 2009) et le sang de cordon ombilical en Chine (Zhang et al. 2015).
Estimations de l’absorption due aux milieux de l’environnement et aux aliments
Les estimations de l’absorption quotidienne de MC et de MX due aux milieux de l’environnement, y compris les aliments et le lait maternel, sont données dans l’Annexe B (tableaux B ‑1 et B ‑2). D’après les valeurs maximales ou au 95e percentile pour chaque milieu, l’absorption de MC allait de 0,00003 (adultes de 60 ans et plus) à 0,00087 mg/kg pc/jour (nourrissons de 0 à 6 mois allaités) et celle de MX de 0,000004 (adultes de 60 ans et plus) à 0,00062 mg/kg pc/jour (nourrissons de 0 à 6 mois allaités) dans la population générale.
Produits disponibles pour les consommateurs
Le MC et le MX sont principalement utilisés comme fragrance ou ingrédient de fragrance. Au Canada, le MC est présent dans certains cosmétiques (revitalisants et eaux de toilette) et le MX est présent dans certains assainisseurs d’air, produits de soins personnelsNote de bas de page 6 (lotion pour le corps), produits de nettoyage, détergents pour la lessive et la vaisselle et agents aromatiques.
Les scénarios avec produits entraînant les niveaux d’exposition potentielle les plus élevés à chacune de ces substances par inhalation et par voie dermique (si applicable) sont présentés dans les tableaux 8-1 et 8-2. Les expositions potentielles ont été estimées en faisant des hypothèses prudentes et en utilisant des valeurs par défaut provenant de scénarios d’exposition sentinelles (pour plus de détails, veuillez consulter l’Annexe C). Les expositions directes dues à l’utilisation de produits ont été évaluées chez les adultes ainsi que chez les enfants quand il existait des preuves à l’effet que ceux‑ci pouvaient être exposés à certains des produits. Concernant les expositions potentielles estimées par voie dermique, l’absorption dermique était de 14 % pour le MC et de 10 % pour le MX, d’après des données expérimentales (voir ci-dessous).
Potentiel d’absorption dermique
Chez l’humain, des taux d’absorption dermique de 14 % pour le MC et de 10 % pour le MX ont été estimés en se basant sur les résultats d’une étude réalisée in vivo chez l’humain et d’expériences in vitro effectuées sur de la peau humaine et de la peau de rat, qui ont révélé que même après élimination de la substance testée, la peau agit comme un site de stockage qui continue de libérer systématiquement du MC ou du MX (CE 2005a, 2005b).
Au moyen d’un simple calcul (10 % d’absorption par voie dermique/50 % d’absorption par voie orale), la CE (2005a, 2005b, 2005c) avait estimé antérieurement que la biodisponibilité dermique du MX représentait 20 % de la biodisponibilité par voie orale. Les résultats obtenus avec un modèle pharmacocinétique récent pour le MX, développé par Hays et al. (2017), indiquent également que la biodisponibilité par voie dermique n’est pas aussi importante qu’on le pensait. À l’aide de données de toxicocinétique sur le MX chez le rat et l’humain, ces auteurs ont développé un modèle à deux compartiments qui était cohérent avec les scénarios d’administration par les voies orale et dermique. La biodisponibilité par voie dermique représentait 2 % de la biodisponibilité par voie orale et concordait avec la différence relative des biodisponibilités calculées par Riedel et Dekant (1999) lors de leur étude pharmacocinétique du MX chez l’humain. La biodisponibilité par voie dermique plus faible estimée par Hays et al. (2017) suggère que l’absorption dermique in vivo du MX chez l’humain pourrait être inférieure à 10 %.
| Substance | Scénario de produit | Voie d’expo-sition | Exposition par utilisation (mg/kg pc) | Concen-tration moyenne par utilisation (mg/m3) | Exposition systémique quotidienne (mg/kg pc/jour) |
|---|---|---|---|---|---|
| MC | Revitalisant | Dermique | 0,018 | N.A. | 0,0028a |
| MC | Fragrance (eau de toilette) | Dermique | 0,0047 | N.A. | 0,00011a |
| MC | Fragrance (eau de toilette) | Inhalation | 0,0000012 | 0,0015 | 0,0000012 |
Abréviation : N.A. = non applicable
a Valeurs corrigées pour tenir compte d’une absorption dermique de 14 % chez l’humain (CE 2005a).
| Substance | Scénario de produit | Voie d’exposition | Exposition par utilisation (mg/kg pc) | Concen-tration moyenne par utilisation (mg/m3) | Exposition générale quotidienne (mg/kg pc/jour) |
|---|---|---|---|---|---|
| MX | Lotion pour le corps | Dermique | 0,068 | N.A. | 0,0068a |
| MX | Assainis-seur d’air -Adulte | Inhalation | 0,003 | 0,013 | 0,003 |
| MX | Assainis-seur d’air -Enfant | Inhalation | 0,008 | 0,013 | 0,008 |
Abréviation : N.D. = non applicable
a Valeurs corrigées pour tenir compte d’une absorption dermique de 10 % chez l’humain (CE 2005b).
8.2 Évaluation des effets sur la santé
Le MC et le MX ont été évalués à l’étranger par la Commission européenne (CE 2005a, b, c, d). Le MX a également été examiné par le CIRC (1996). Il existe aussi un article de Taylor et al. (2014) sur l’exposition humaine aux muscs nitrés et l’évaluation de leur toxicité potentielle. Le NICNAS (2016) australien a fait un résumé des renseignements sur les muscs nitrés à partir des examens plus détaillés de la Commission européenne, du CIRC et de Taylor et al. (2014). Les renseignements pertinents et les niveaux d’effet critique déterminés à partir des évaluations de la Commission européenne et de l’article de Taylor et al. (2014) sont présentés ci‑dessous.
Absorption, distribution, métabolisme et excrétion
Chez le rat et l’humain, le métabolisme du MC fait intervenir la conjugaison des glucuronides (CE 2005c). Lors d’une étude in vivo chez l’humain, seulement 0,5 % de la dose appliquée a été excrétée dans l’urine et les matières fécales dans les 120 heures suivant l’application. Toutefois, 14 % de la dose n’a jamais été récupérée (CE 2005c). Les études sur le métabolisme du MX chez le rat font intervenir la réduction d’un groupe nitré en amine et l’hydroxylation de groupes méthyles. L’hydroxyméthyl-MX est le principal métabolite trouvé dans la bile. Chez l’humain, l’urine contenait un seul métabolite dont la signature chromatographique était distincte de celles du MX et de l’hydroxyméthyl-MX, ou du p-NH2-MX (CE 2005d).
Sur le plan du potentiel de sensibilisation, il a été déterminé que le MC et le MX n’étaient pas des sensibilisants dermiques (pour une concentration allant jusqu’à 5 %) et sont considérés comme des photoallergènes faibles par la CE (CE 2005a,b).
Toxicité subchronique
Des souris (10/sexe/groupe) ont reçu une nourriture contenant de 0,0375 à 0,6 % de MX pendant 17 semaines (équivalant à 54 à 857 mg/kg pc/jour). Huit des 10 mâles et toutes les femelles ayant reçu la dose de 429 mg/kg pc/jour, ainsi que toutes les souris ayant reçu la dose de 857 mg/kg pc/jour sont mortes pendant l’étude. Une hypertrophie et une irrégularité des cellules hépatiques ont été observées chez les deux sexes à la dose de 214 mg/kg pc/jour. À partir de ces résultats, les doses de 0,075 et de 0,15 % (équivalant à 107 et 214 mg/kg pc/jour) ont été retenues comme doses appropriées pour l’étude sur la cancérogénicité. Étant donné qu’aucun autre paramètre n’a été étudié (p. ex. chimie clinique ou hématologie), aucune DSENO n’a pu être calculée (CE 2005b).
Des rats (15/sexe/dose) ont reçu par application dermique 7,5, 24, 75 ou 240 mg/kg pc/jour de MC ou de MX dans du 2-phényléthanol pendant 13 semaines. Avec le MC, les femelles ont manifesté une diminution significative liée à la dose du gain de poids corporel aux doses de 75 et de 240 mg/kg pc/jour et les mâles une diminution significative à la dose maximale, malgré une consommation d’aliments similaire ou plus grande que celle des sujets du groupe témoin. Le poids relatif du foie a augmenté à la dose de 240 mg/kg pc/jour chez les mâles (résultat non significatif statistiquement) et chez les femelles (résultat statistiquement significatif). Avec le MX, le poids relatif du foie a augmenté de façon statistiquement significative à la dose de 75 mg/kg pc/jour chez les femelles et à la dose de 240 mg/kg pc/jour chez les mâles (Ford et al. 1990). Aucun changement macroscopique ni microscopique n’a été observé, y compris dans les paramètres neuropathologiques étudiés, pour les deux substances. La DSENO a été établie à 24 mg/kg pc/jour pour le MC et le MX, basée sur une diminution du gain de poids corporel et une augmentation du poids relatif du foie aux doses de 75 et 240 mg/kg pc/jour (CE 2005a, 2005b).
Aucune étude d’exposition par inhalation n’a été trouvée pour le MC en dehors d’une étude de 13 semaines avec des rats et des hamsters femelles auxquelles le MC a été administré dans un mélange de fragrances. Cette étude n’a pas été utilisée pour la caractérisation du risque en raison de la faible concentration de MC dans le mélange (CE 2005a).
Cancérogénicité/toxicité chronique
Le CIRC (1996) a classé le MX comme carcinogène du groupe 3 (inclassable quant à sa cancérogénicité pour l’humain) en se basant sur des preuves limitées chez des animaux de laboratoire et inappropriées chez l’humain. En 2004, l’Union européenne a classé le MX comme carcinogène de catégorie 3 en se basant sur des preuves limitées d’effet cancérogène (CE 2005d). Ce classement a été basé sur sa similitude avec le phénobarbital à produire des tumeurs hépatiques. En suivant une approche décrite dans le document de la CE (2005b), le Comité scientifique pour la sécurité des consommateurs (CSSC) de l’Union européenne (2004) a jugé que les preuves pour établir un seuil n’étaient pas suffisantes. En s’appuyant sur l’opinion du CSSC (2004), le MX et le MC ont été classés comme carcinogènes de catégorie 2 (soupçonné être cancérogène) en 2009 par l’Union européenne (CE 2009, ECHA 2016).
En ce qui concerne le MX, une DMENO orale de 70 mg/kg pc/jour pour la cancérogénicité a été déterminée à partir d’une étude de 80 semaines chez la souris, en se basant sur une augmentation de l’incidence de tumeurs hépatiques chez les deux sexes (l’incidence de carcinomes hépatiques était liée, sur le plan mécanisme, à l’induction des enzymes microsomales) et à une augmentation de l’incidence de tumeurs de la glande de Harder chez les mâles. On ignore la pertinence des tumeurs de la glande de Harder pour l’humain, car cette glande n’est pas présente chez l’humain. La cancérogénicité du MX n’a pas été étudiée chez le rat (CE 2005b).
Bien qu’il n’existe aucune donnée sur la cancérogénicité du MC, la CE (2005c) a déclaré qu’il est préoccupant que le MC puisse être hépatocancérogène chez la souris également. Tout comme le MX, le MC est un inducteur des enzymes hépatiques de type phénobarbital, mais la CE (2005c) le juge légèrement moins puissant que le MX. La CE (2005c) a pensé qu’en raison de la similarité du MC et du MX en termes de propriétés physicochimiques, de propriétés toxicocinétiques et de la méthode d’induction des enzymes hépatiques, les données sur la cancérogénicité du MX peuvent être utilisées en toute sécurité pour la caractérisation des risques de cancer associés au MC chez l’humain.
Génotoxicité
Les données indiquent que le MC n’est pas génotoxique. Plusieurs tests in vitro ont donné des résultats négatifs pour le MC (tests bactériens de mutation génique, chromotests SOS [Gene Box], test de mutation génique sur cellules de mammifères, test d’induction de micronoyaux, test d’échange des chromatides sœurs [ECS] sur cellules de mammifères et test de synthèse non programmée de l’ADN [SNPA], alors qu’un test d’aberration chromosomique sur cellules de mammifères a donné des résultats équivoques. Toutefois, un test in vivo de micronoyaux chez la souris s’est révélé négatif dans les érythrocytes polychromatiques jusqu’à l’administration intrapéritonéale d’une dose de 1 000 mg/kg pc (CE 2005c).
D’après les données, le MX n’est pas génotoxique. Les résultats de plusieurs tests in vitro ont été négatifs pour le MX (tests bactériens de mutation génique, chromotests SOS, test de mutation génique sur cellules de mammifères, tests d’aberration chromosomique et d’ECS sur cellules de mammifères, test de micronoyaux sur cellules de mammifères et test de SNPA). Des résultats négatifs ont également été observés lors d’un essai de SNPA sur des hépatocytes de rat in vivo et in vitro (CE 2005d).
Toxicité pour la reproduction/développement
Lors d’études de toxicité périnatale/postnatale par voie orale, au protocole similaire à celui d’études sur la neurotoxicité pour le développement, du MX ou du MC administré par gavage dans de l’huile de maïs à des doses de 0, 2,5, 7,5 ou 25 mg/kg pc/jour à des rats (28 femelles/dose), du jour de gestation 14 (fin de l’organogenèse) au jour post‑natal 21 (exposition de 28 ou 29 jours). Pour le MC, la DSENO pour la toxicité maternelle était de 7,5 mg/kg pc/jour, basée sur une diminution du gain de poids corporel et de la consommation de nourriture à la dose de 25 mg/kg pc/jour. La DSENO pour la toxicité pour le développement était de 2,5 mg/kg pc/jour, basée sur des gains de poids corporel moindres jusqu’à la semaine post‑natale 20 chez les mâles de la génération F1 de mères de génération F0 ayant reçu des doses de 7,5 (en l’absence de toxicité maternelle) et 25 mg/kg pc/jour. Pour le MX, la DSENO pour la toxicité maternelle était de 7,5 mg/kg pc/jour, basée sur une légère diminution du gain de poids corporel et de la consommation de nourriture (résultat non significatif statistiquement) à la dose de 25 mg/kg pc/jour. La DSENO pour la toxicité pour le développement était de 7,5 mg/kg pc/jour, basée sur des gains de poids corporel moindres jusqu’au sevrage (résultat non significatif statistiquement) et un effet comportemental ultérieur d’acquisition des réflexes de redressement en situation de chuteNote de bas de page 7 chez les petits des mères de génération F0 ayant reçu 25 mg/kg pc/jour (en présence de toxicité maternelle) (CE 2005a, 2005b). La CE (2005b) a établi que la DSENO maternelle et la DSENO pour le développement dans le cas du MX sont prudentes, compte tenu du fait que les effets observés à 25 mg/kg pc/jour n’étaient pas statistiquement significatifs, mais que les effets chez les petits pourraient être biologiquement pertinents, les mêmes effets (gains de poids corporel moindres) ayant été observés avec le MC (CE 2005a).
Lors d’une étude de toxicité pour le développement par voie orale, des rates en gestation (25 femelles/groupe) ont reçu par gavage du MC dans de l’huile de maïs à une dose de 0, 15, 45 ou 150 mg/kg pc/jour, pendant les jours de gestation 7 à 17 (exposition de 11 jours), puis ont été sacrifiées au jour de gestation 20. La DSENO pour la toxicité maternelle était de 15 mg/kg pc/jour, basée sur une diminution liée à la dose de la consommation de nourriture et du poids corporel aux doses de 45 et de 150 mg/kg pc/jour. La DSENO pour la toxicité pour le développement était de 45 mg/kg pc/jour, basée sur une augmentation une perte post-implantation et une diminution du poids corporel fœtal à 150 mg/kg pc/jour (en présence de toxicité maternelle) (CE 2005a).
Lors d’une étude de toxicité pour le développement par voie orale, des rates en gestation (25/dose) ont reçu par gavage du MX dans de l’huile de maïs à une dose de 0, 20, 60 ou 200 mg/kg pc/jour aux jours de gestation 7 à 17 (exposition de 11 jours), puis ont été sacrifiées au jour de gestation 20. La DSENO pour la toxicité maternelle a été établie à 20 mg/kg pc/jour, basée sur une diminution du gain de poids corporel et de la consommation de nourriture aux doses de 60 et de 200 mg/kg pc/jour. L’une des 3 femelles ayant reçu 60 mg/kg pc/jour et 12 des 25 femelles ayant reçu 200 mg/kg pc/jour ont été prises de tremblements pendant un ou plusieurs jours au cours des quatre premiers jours d’administration. La DSENO pour la toxicité pour le développement était de 60 mg/kg pc/jour, basée sur une augmentation de l’incidence d’effets sur le squelette (côtes thoraciques surnuméraires et ossification accrue) chez les fœtus à la dose de 200 mg/kg pc/jour (en présence de toxicité maternelle) (CE 2005b).
8.3 Caractérisation des risques pour la santé humaine
Nous présentons dans les tableaux 8-3 et 8-4 toutes les valeurs pertinentes d’exposition et de danger pour le MC et le MX, ainsi que les marges d’exposition (ME) résultantes, pour la détermination des risques.
| Scénario d’exposition | Concentration d’exposition | Niveau d’effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Milieux de l’environnement et nourriture, exposition quotidienne | 0,00087 mg/kg pc/jour | DMENO orale = 70 mg/kg pc/jour, d’après une étude de 80 semaines chez la souris (avec le MX) | Augmentation de l’incidence des tumeurs hépatiques chez les deux sexes | 80500 |
| Exposition dermique à du revitalisanta (adulte) | 0,018 mg/kg pc | DSENO dermique = 24 mg/kg pc/jour, d’après une étude de 90 jours chez le rat | Diminution du gain de poids corporel à la dose de 75 mg/kg pc/jour | 1300 |
| Exposition dermique à la fragrance d’une eau de toilette (adulte) | 0,0047 mg/kg pc | DSENO dermique = 24 mg/kg pc/jour, d’après une étude de 90 jours chez le rat | Diminution du gain de poids corporel à la dose de 75 mg/kg pc/jour | 5100 |
| Exposition par inhalation par utilisation à la fragrance d’une eau de toilette (adulte) | 0,0015 mg/m3 | DSENO orale maternelle = 15 mg/kg pc/jour (équivalant à 48,4 mg/m3)b, d’après une étude sur la toxicité pour le développement chez le rat (jours de gestation 7 à 17) | Diminution du poids corporel et de la consommation de nourriture chez les mères à la dose de 45 mg/kg pc/jour | 32300 |
a L’exposition à du shampoing a donné une concentration d’exposition similaire.
b 1 mg/m3 dans l’air est égal à 0,31 mg/kg pc/jour chez le rat (Santé Canada 1994).
| Scénario d’exposition | Concentration d’exposition | Niveau d’effet critique | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|
| Milieux de l’environnement et nourriture, exposition quotidienne | 0,00063 mg/kg pc/jour | DMENO orale = 70 mg/kg pc/jour, d’après une étude de 80 semaines chez la souris | Augmentation de l’incidence des tumeurs hépatiques chez les deux sexes | 111100 |
| Exposition dermique à de la lotion pour le corps | 0,068 mg/kg pc | DSENO dermique = 24 mg/kg pc/jour, d’après une étude de 90 jours chez le rat | Augmentation du poids relatif du foie à la dose de 75 mg/kg pc/jour | 350 |
| Exposition par inhalation, par utilisation, à un assainisseur d’air (enfants et nourrissons) | 0,013 mg/m3 | DSENO orale = 7,5 mg/kg pc/jour (équivalant à 24,2 mg/m3)a, d’après une étude de toxicité périnatale et postnatale chez le rat (jour de gestation 14 au jour post-natal 21) | Diminution du gain de poids corporel et retard de l’acquisition du réflexe de redressement chez les petits de mères ayant reçu 25 mg/kg pc/jour (en présence de toxicité maternelle) | 1860 |
a 1 mg/m3 dans l’air est égal à 0,31 mg/kg pc/jour chez le rat (Santé Canada 1994).
Pour les scénarios d’exposition due aux milieux de l’environnement et à la nourriture, étant donné le potentiel d’incidence accrue des tumeurs hépatiques dues au MC et au MX, tel que discuté par la CE (2005a, 2005b), les résultats négatifs aux tests de génotoxicité pour les deux substances, les ME indiquées dans les tableaux 8-3 et 8-4 sont jugées appropriées pour tenir compte des incertitudes des données sur les effets sur la santé et l’exposition utilisées pour caractériser le risque. Les ME de tous les autres scénarios énumérés dans les tableaux 8-3 et 8-4 sont également considérées appropriées pour tenir compte des incertitudes des données sur les effets sur la santé et l’exposition utilisées pour caractériser le risque.
8.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les sources clés d’incertitudes sont présentées dans le tableau ci-dessous (tableau 8‑5).
| Source clé d’incertitude | Impact |
|---|---|
| Manque de données canadiennes pour les deux substances dans les milieux de l’environnement | +/- |
| Manque d’études d’exposition chronique pour le MC, quelle que soit la voie d’exposition | +/- |
| Manque d’études d’exposition à dose répétée pour le MC et le MX par inhalation | +/- |
+/- = potentiel inconnu de surestimation ou de sous-estimation des risques.
9. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, le musc cétonique et le musc xylénique présentent un faible risque d’effets nocifs sur l’environnement. Nous concluons que ces substances ne satisfont à aucun des critères de l’alinéa 64 a) ou 64 b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
En nous basant sur les renseignements présentés dans la présente évaluation préalable, nous concluons aussi que le musc cétonique et le musc xylénique ne satisfont à aucun des critères de l’alinéa 64 c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
En conséquence, nous concluons que le musc cétonique et le musc xylénique ne satisfont à aucun des critères de l’article 64 de la LCPE.
Références
ACD/Percepta [module de prédiction]; c1997-2012; Toronto (ON) : Advanced Chemistry Development Inc. [Seulement disponible en anglais]
Adema D.M.M. et Langerwerf J.S.A.; 1985; The subchronic (14-d exposure) toxicity of E-2642.01 (musk xylene) to Brachydanio rerio; Private communication to RIFM. TNO, Delft.Report R 85/127 [cité dans CE 2005b]. [Seulement disponible en anglais]
Aguirre J., Bizkarguenaga E., Iparraguirre A., Fernández L.A., Zuloaga O. et Prieto A.; 2014; Development of stir-bar sorptive extraction–thermal desorption–gas chromatography–mass spectrometry for the analysis of musks in vegetables and amended soils; Anal. Chim. Acta, 812, p. 74-82. [Seulement disponible en anglais]
[AIEPS] Artificial Intelligence Expert Predictive System; c2010-2012; ver. 3.0; Gatineau (QC) : Environnement Canada; modèle mis au point par Stephen Niculescu. [Seulement disponible en anglais]
[AOPWIN] Atmospheric Oxidation Program for Microsoft Windows [modèle d’estimation]; 2010; ver. 1.92a; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Seulement disponible en anglais]
[ASTER] Assessment Tools for the Evaluation of Risk; 1999; Duluth (MN) : Environmental Protection Agency des États‑Unis, Mid-Continent Ecology Division. [Seulement disponible en anglais]
[BCFBAF] Bioaccumulation Program for Microsoft Windows [modèle d’estimation]; 2010; ver. 3.01; Washington (DC) : Environmental Protection Agency des États‑Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Seulement disponible en anglais]
Beyer A., Mackay D., Matthies M., Wania F. et Webster E.; 2000; Assessing long-range transport potential of persistent organic pollutants; Environ. Sci. Technol., 34, p. 699-703. [Seulement disponible en anglais]
[BIOWIN] Biodegradation Probability Program for Microsoft Windows [modèle d’estimation]; 2008; ver. 4.10; Washington (DC): Environmental Protection Agency des États‑Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Seulement disponible en anglais]
Boîte à outils QSAR de l’OCDE outil de consultation; 2016; ver. 3.4; Paris (FR) : Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique. [Seulement disponible en anglais]
Boleas S., Fernandez C. et Tarazona J.V.; 1996; Toxicological and kinetic study of musk xylene in rainbow trout, Onchorhynchus mykiss; Bull. Environ. Contamin. Toxicol., 57, p. 217-222 [cité dans Tas et al. 1997]. [Seulement disponible en anglais]
Breitholtz M., Wollenberger L. et Dinan L.; 2003; Effects of four synthetic musks on the life cycle of the harpacticoid copepod Nitocra spinipes; Aquatic. Toxicol., 63, p. 103-118. [Seulement disponible en anglais]
Butte W., Schmidt S. et Schmidt A.; 1999; Photochemical degradation of nitrated musk compounds; Chemosphere, 38(6), p. 1287-1291. [Seulement disponible en anglais]
Calame R. et Ronchi W.; 1989; Musk xylene: determination of ready biodegradability; Communication personnelle adressée au RIFM; Givadan-Roure, Suisse., rapport d’essai 33-89 [cité dans CE 2010]. [Seulement disponible en anglais]
Canada; 1999; Loi canadienne sur la protection de l’environnement 1999, L.C. 1999, ch. 33; Gazette du Canada, Partie III, vol. 22, nº 3; ministère de l’Environnement, 2009, Gazette du Canada, Partie I, vol. 143, nº 40, p. 2945-2956.
Canada, Dept. of the Environment. 2009. Loi canadienne sur la protection de l’environnement 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure [PDF]. Canada Gazette, Part I, vol. 143, no. 40, p. 2945-2956.
Carlsson G. et Norrgren L.; 2004; Synthetic musk toxicity to early life stages of zebrafish (Danio rerio); Arch. Environ. Contam. Toxicol., 46, p. 102–105. [Seulement disponible en anglais]
CATALOGIC [modèle sur l’écotoxicité et le sdevenir dans l’environnement]; 2014; ver. 5.11.15; Bourgas (BG) University, Prof. Dr Assen Zlatarov, Laboratoire de chimie mathématique. [Seulement disponible en anglais]
[CE] Commission européenne; 2003; Technical guidance document on risk assessment: Part II [PDF]; Luxembourg : Office des publications officielles des Communautés européennes. [Seulement disponible en anglais]
[CE] Commission européenne; 2005a; European Union Risk Assessment Report. CAS RN 81-14-1 : 4’-tert-butyl-2’,6’-dimethyl-3’,5’- dinitroacetophenone (musk ketone); Luxembourg : Office des publications officielles des Communautés européennes, rapport EUR 21507 EN, 128 p. [Seulement disponible en anglais]
[CE] Commission européenne; 2005b; European Union Risk Assessment Report. CAS RN 81-15-2: 5-tert-butyl-2,4,6-trinitro-m-xylene (musk xylene); Luxembourg : Office des publications officielles des Communautés européennes, rapport EUR 21506 EN, 151 p. [Seulement disponible en anglais]
[CE] Commission européenne; 2005c; Summary Risk Assessment Report. CAS RN 81-14-1: 4’-tert-butyl-2’,6’-dimethyl-3’,5’- dinitroacetophenone (musk ketone); Special Publication I.05.14; Joint Research Centre, European Chemicals Bureau, Ispra, Italie, 27 p. [Seulement disponible en anglais]
[CE] Commission européenne; 2005d; Summary Risk Assessment Report. CAS RN 81-15-2: 5-tert-butyl-2,4,6-trinitro-m-xylene (musk xylene); Special Publication I.05.15; Joint Research Centre, European Chemicals Bureau, Ispra, Italie, 30 p. [Seulement disponible en anglais]
[CE] Commission européenne; 2009; Règlement (CE) nº 790/2009 de la Commision du 10 août 2009 modifiant, aux fins de son adaptation au progrès technique et scientifique, le règlement (CE) nº 1272/2008 du Parlement européen et du Conseil relatif à la classification, à l’étiquetage et à l’emballage des substances et des mélanges; Journal officiel de l’Union européenne, L235/1, p. 1-443. [consulté le 7 juin 2017]. [Seulement disponible en anglais]
[CE] Commission européenne; 2010; PBT assessment of musk xylene: addendum to the final report (2005) of the risk assessment. [Seulement disponible en anglais]
Chase D.A., Karnjanapiboonwong A., Fang Y., Cobb G.P., Morse A.N. et Anderson T.A.; 2012; Occurrence of synthetic musk fragrances in effluent and non-effluent impacted environments; Sci. Total Environ., 416, p. 253–260. [Seulement disponible en anglais]
Chou Y.-J. et Dietrich D.R.; 1999; Interactions of nitromusk parent compounds and their amino-metabolites with the estrogen receptors of rainbow trout (Oncorhynchus mykiss) and the South African clawed frog (Xenopus laevis); Toxicol. Lett., 111, p. 27–36. [Seulement disponible en anglais]
[CIRC] Centre international de recherche sur le cancer; 1996; IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Musk ambrette and musk xylene; IARC Monogr. Eval. Carcinog. Risks Hum., 65, p. 477-.495. [Seulement disponible en anglais]
ConsExpo Web [modèle d’expoition des consommateurs pour le Web]; 2016; Bilthoven (P.-B.) : Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. [Seulement disponible en anglais]
[CSSC] Comité scientifique pour la sécurité des consommateurs. 2004. Opinion of the scientific committee on cosmetic products and non-food products intended for consumers concerning musk xylene and musk ketone. Adoptée par le SCCNFP lors de la 28e réunion plénière du 25 mai 2004. Rapport no. SCCNFP/0817/04. 22 p. [Seulement disponible en anglais]
[CSSC] Comité scientifique pour la sécurité des consommateurs; 2012; The SCCS’s Notes of Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation, 8ème révision. [Seulement disponible en anglais]
Duedahl-Olesen L., Cederberg T., Pedersen K.H. et Hojgard A.; 2005; Synthetic musk fragrances in trout from Danish fish farms and human milk; Chemosphere, 61, p. 422–431. [Seulement disponible en anglais]
[ECCC] Environnement et Changement climatique Canada; 2017; Documentation connexe : groupe des muscs nitrés : information à l’appui de l’évaluation préalable; Gatineau (QC), Environnement et Changement climatique Canada; substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada; [modifié en 2017]; Catégorisation; Ottawa (ON), gouvernement du Canada [consulté le 25 septembre 2015].
[ECHA] Bureau européen des substances chimiques; 2016; Base de données de l’inventaire C&L; résultats de recherche pour les no CAS 81-14-1 et 81-15-2; Helsinki (FI), ECHA [consultée en décembre 2016]. [Seulement disponible en anglais]
[ECOSAR] ECOlogical Structure Activity Relationships Class Program [modèle d’estimation]; 2012; ver. 1.11; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Seulement disponible en anglais]
Environnement Canada; 2009; Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure; données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
Environnement Canada; 2013; Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure; données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.[EPA] Environmental Protection Agency des États-unis; 2000; Interim Guidance for Using Ready and Inherent Biodegradability Tests to Derive Input Data for Multimedia Models and Wastewater Treatment Plants (WWT) Models (9/1/2000) [PDF]. [Seulement disponible en anglais]
[EPA] Environmental Protection Agency des États-unis; [mis à jour le 18 août 2016]; Endocrine Disruption Screening Program for the 21st Century (EDSP21) [consulté le 16 mai 2017]. [Seulement disponible en anglais]
[EPA] Environmental Protection Agency des États-unis; 2018; Chemview, Chemical Data Reporting [base de données sur l’Internet] [mise à jour le 10 janvier 2018] [consultée le 10 janvier 2018]. [Seulement disponible en anglais]
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d’estimation]; c2000-2012; ver. 4.11; Washington (DC) : Environmental Protection Agency des États‑Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Seulement disponible en anglais]
Ford R.A., Api A.M. et Newberne P.M.; 1990; 90-Day dermal toxicity study and neurotoxicity of nitromusks in the albino rat; Food Chem. Toxicol., 28, p. 55-61. [Seulement disponible en anglais]
[FS] Fiche signalétique; 2015a; Red Door EDT Spray Naturel; Stamford (CT) : Elizabeth Arden Inc. [consultée le 19 juillet 2016] [accès restreint]. [Seulement disponible en anglais]
[FS] Fiche signalétique; 2015b; Coronado Cherry Odor Eliminator Gel. Air freshener; Irvine (CA) : California Scents [consultée le 19 juillet 2016] [accès restreint]. [Seulement disponible en anglais]
Gatermann R., Hüfhnerfuss H., Rimkus G., Attar A. et Kettrup A.; 1998; Occurrence of musk xylene and musk ketone metabolites in the aquatic environment; Chemosphere, 36(11), p. 2535-2547. [Seulement disponible en anglais]
Gatermann R., Hellou J., Hüfhnerfuss H., Rimkus G. et Zitko V.; 1999; Polycyclic and nitro musks in the environment: a comparison between Canadian and European aquatic biota; Chemosphere, 38(14), p. 3431-3441. [Seulement disponible en anglais]
Giddings J.M., Salvito D. et Putt A.E.; 2000; Acute toxicity of 4-amino musk xylene to Daphnia magna in laboratory water and natural water; Wat. Res., 34(14), p. 3686-3689. [Seulement disponible en anglais]
Goßman A. et Petto R.; 1997; Effects of musk ketone on reproduction and growth of earthworms in Eisenia fetida (Savigny 1826) in artificial soil; rapport au RIFM, Ibacon, Allemagne, projet no 2092022 [cité dans CE 2005a]. [Seulement disponible en anglais]
Guerra P., Kleywegt S., Payne M., Svoboda M.L., Lee H.-B., Reiner E., Kolic T., Metcalfe C. et Smyth S.A.; 2015; Occurrence and fate of trace contaminants during aerobic and anaerobic sludge digestion and dewatering; J. Environ. Qual., 44, p. 1193-1200. [Seulement disponible en anglais]
Hajslova J. et Setkova L.; 2004; Synthetic musks in bioindicators: Monitoring data of fish and human milk samples from the Czech Republic; Handbook Environ. Chem., 3 (Part X), p. 151–188. [Seulement disponible en anglais]
Hays S.M., Aylward L.L. et Kirman C.; 2017; Biomonitoring equivalents for musk xylene; rapport préparé dans le cadre du marché no 4600001169 conclu avec Santé Canada, 15 février 2017, 24 p. [accès restreint]. [Seulement disponible en anglais]
Homem V., Alves A., Alves A. et Santo L.; 2016; Ultrasound-assisted dispersive liquid–liquid microextraction for the determination of synthetic musk fragrances in aqueous matrices by gas chromatography–mass spectrometry; Talanta, 148, p. 84-93. [Seulement disponible en anglais]
Hughes JS, Krishnaswami SK. 1985. The toxicity of B0817.01 to Microcystis aeruginosa. Private communication to RIFM. Malcolm Pirnie, New York. Project 165-06-1100-2. [Seulement disponible en anglais]
Hutter H.-P., Wallner P., Moshammer H., Hartl W., Sattelberger R., Lorbeer G. et Kundi M.; 2009; Synthetic musks in blood of healthy young adults: Relationship to cosmetics use; Sci. Total Environ., 407, p. 4821-4825. [Seulement disponible en anglais]
Hutter H.-P., Wallner P., Hartl W., Uhl M., Lorbeer G., Gminski R., Mersch-Sundermann V. et Kundi M.; 2010; Higher blood concentrations of synthetic musks in women above fifty years than in younger women; Int. J. Hyg. Environ. Health, 213, p. 124–130. [Seulement disponible en anglais]
[IFRA] International Fragrance Association; 2012; REACH exposure scenarios for fragrance substances; IFRA Operations [PDF], Bruxelles, Belgique, 126 p. [Seulement disponible en anglais]
Inoue Y., Hashizume N., Yoshida T., Murakami H., Suzuki Y., Koga Y.,Takeshige R., Kikushima E., Yakata N. et Otsuka M.; 2012; Comparison of bioconcentration and biomagnification factors for poorly water-soluble chemicals using common carp (Cyprinus carpio L.); Arch. Environ. Contam. Toxicol., 63, p. 241–248. [Seulement disponible en anglais]
Kim M., Guerra P., Theocharides M., Barclay K., Smyth S.A. et Alaee M.; 2013; Polybrominated diphenyl ethers in sewage sludge and treated biosolids: effect factors and mass balance; Wat. Res., 47, p. 6496‑6505. [Seulement disponible en anglais]
[KOCWIN] Organic Carbon Partition Coefficient Program for Microsoft Windows [modèle d’estimation]; 2010; ver. 2.00; Washington (DC) : Environmental Protection Agency des États‑Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Seulement disponible en anglais]
Kubwabo C., Fan X. et Rasmussen P.E.; 2012; Determination of synthetic musk compounds in indoor dust by gas chromatography-ion trap mass spectrometry; Anal. Bioanal. Chem., 404, p. 467-477. [Seulement disponible en anglais]
Kuhlmann H., Rimkus G.G. et Butte W.; 1997; Long-term bioconcentration and bioaccumulation of musk xylene and bromocyclen in rainbow trouts (Oncorhynchus mykiss); communication privée à l’Institut vétérinaire et des alients du Schleswig-Holstein, résultats non publiés [cité dans Kafferlein et al. 1998]. [Seulement disponible en anglais]
Lee H-B, Peart TE, Sarafin K. 2003. Occurrence of polycyclic and nitro musk compounds in Canadian sludge and wastewater samples. Water Qual. Res. J. Canada . 38(4): 683–702. [Seulement disponible en anglais]
Lee I.-S., Kim U.-J., Oh J.-E., Choi M. et Hwang D.-W.; 2014; Comprehensive monitoring of synthetic musk compounds from freshwater to coastal environments in Korea: With consideration of ecological concerns; Sci. Total Environ., 470-471, p. 1502-1508. [Seulement disponible en anglais]
Lide D.R.; 2007; CRC Handbook of Chemistry and Physics, 88ème édition, Boca Raton (FL) : CRC Press, Taylor & Francis, p. 3-78. [cité dans HSDB, 2012]. [Seulement disponible en anglais]
Lignell et al. 2008. Temporal trendsTrends of synthetic musk compoundsSynthetic Musk Compounds in motherMother′s milkMilk and associationsAssociations with personal usePersonal Use of perfumed products.Perfumed Products. Environ Sci Technol. 42:6743-6748. [Seulement disponible en anglais]
Loretz L.G., Api A.M., Barraj L.M., Burdick J., Dressler W.E., Gettings S.D., Han Hsu H., Pan Y.H.L., Re T.A., Renskers K.J., Rothenstein A., Scrafford C.G. et Sewall C.; 2005; Exposure data for cosmetic products: lipstick, body lotion, and face cream; Food Chem. Toxicol., 43, p. 279-291. [Seulement disponible en anglais]
Luckenbach T. et Epel D.; 2005; Nitromusk and polycyclic musk compounds as long-term inhibitors of cellular xenobiotic defense systems mediated by multidrug transporters; Enviro. Health Persp., 113(1), p. 17‑24. [Seulement disponible en anglais]
Marks K. et Marks P.; 1987; Biodegradation of test substances (X0438.01R, musk xylene) and controls in activated sludge; communication privée au RIFM, Weston (É.-U.), projet no 87-009 [cité CE 2010]. [Seulement disponible en anglais]
[MITI] Ministry of International Trade and Industry; 1992; MITI-List,Tokyo (Japon) [cité dans CE 2005b]. [Seulement disponible en anglais]
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [estimation model]. 2010. Ver. 1.43. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Seulement disponible en anglais]
Moon H.-B., Lee D.-H., Lee Y.S. et Kannan K.; 2012; Occurrence and accumulation patterns of polycyclic aromatic hydrocarbons and synthetic musk compounds in adipose tissues of Korean females; Chemosphere, 86, p. 485-490. [Seulement disponible en anglais]
Mottaleb M.A., Zimmerman J.H. et Moy T.W.; 2008; Biological transformation, kinetics and dose-response assessments of bound musk ketone hemoglobin adducts in rainbow trout as biomarkers of environmental exposure; J. Environ. Sci,. 20, p. 878–884. [Seulement disponible en anglais]
Nakata H., Hinosaka M. et Yanagimoto H.; 2015; Macrocyclic-, polycyclic-, and nitro musks in cosmetics, household commodities and indoor dusts collected from Japan: Implications for their human exposure; Ecotoxicol. Environ. Saf., 111, p. 248–255. [Seulement disponible en anglais]
[New EQC] New Equilibrium Criterion Model; 2011; ver. 1.00 (Beta) Peterborough (ON) : Université Trent, Canadian Centre for Environmental Modelling and Chemistry. [Seulement disponible en anglais]
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme; 2016; Human Health Tier II Assessment for nitromusks. CAS RNs 81-14-1; 81-15-2; 116-66-5; 145-39-1. Inventory multi-tiered assessment and prioritisation (IMAP); gouvernement de l’Australie, ministère de la santé et du vieillissement [consulté en juillet 2016]. [Seulement disponible en anglais]
Paradice A.P. et Suprenant D.C.; 1984; Accumulation and elimination 14C-residues by bluegill (Lepomis macrochirus) exposed to P1618.01R (musk xylene); communication personnelle au RIFM [cité dans Tas et al. 1997]. [Seulement disponible en anglais]
Parlement européen; 2009; Règlement (CE) nº 1223/2009 du Parlment européen et du Conseil du 30 novembre 2009 relatif aux produits cosmétiques [PDF]; Journal officiel de l’Union européenne, L342, p. 59‑209 [consulté le 7 juin 2017].
Payne AG, Hall RN. 1979. A method for measuring algal toxicity and its application to the safety assessment of new chemicals. In: Marking LL, Kimerle RA, editors. Aquat Toxicol. ASTM STP 667. p. 171–180. [Seulement disponible en anglais]
Peck A.M. et Hornbuckle K.C.; 2004; Synthetic musk fragrances in Lake Michigan; Environ. Sci. Technol., 38, p. 367-372. [Seulement disponible en anglais]
Peck A.M. et Hornbuckle K.C.; 2006; Synthetic musk fragrances in urban and rural air of Iowa and the Great Lakes; Atmos. Environ., 40, p. 6101-6111. [Seulement disponible en anglais]
Peck A.M., Kucklick J.R. et Schantz M.M.; 2007; Synthetic musk fragrances in environmental Standard Reference Materials; Anal. Bioanal. Chem., 387, p. 2381–2388. [Seulement disponible en anglais]
Pubchem; 2016a; Musk ketone. National Center for Biotechnology Information. PubChem Compound Database; CID=6669 [consulté le 19 juillet 2016]. [Seulement disponible en anglais]
Pubchem; 2016b; Musk xylene. National Center for Biotechnology Information. PubChem Compound Database; CID=62329 [consulté le 19 juillet 2016]. [Seulement disponible en anglais]
Raab U., Preiss U., Albrecht M., Shahin N., Parlar H. et Fromme H.; 2008; Concentrations of polybrominated diphenyl ethers, organochlorine compounds and nitro musks in mother’s milk from Germany (Bavaria); Chemosphere, 72, p. 87-94. [Seulement disponible en anglais]
RCC (Swiss). 1995. Influence of musk ketone on the reproduction of Daphnia magna. Report to RIFM (NJ). 41 p. Study Project No.: 380676. [accès restreint]. [Seulement disponible en anglais]
RCC (Swiss). 1996a. Musk ketone: 21-day prolonged toxicity study in the rainbow trout under flow-through conditions. Report to RIFM (NJ). 48 p. Study Project No.: 380700. [accès restreint]. [Seulement disponible en anglais]
RCC (Swiss). 1996b. Acute toxicity of musk ketone to Pseudokirchneriella subcapitata. Report to RIFM (NJ). 41 p. Study Project No.: 380643. [accès restreint]. [Seulement disponible en anglais]
Reiner J.L., Wong C.M., Arcaro K.F. et Kannan K.; 2007; Synthetic musk fragrances in human milk from the United States; Environ. Sci. Technol., 41(11), p. 3815-3820. [Seulement disponible en anglais]
Riedel J. et Dekant W.; 1999; Biotransformation and toxicokinetics of musk xylene in humans; Toxicol. Appl. Pharmacol., 157(2), p. 145-55. [Seulement disponible en anglais]
[RIFM] Research Institute for Fragrance Materials; 2001; RIFM/FEMA database, Hackensack NJ 07601. [Seulement disponible en anglais]
Rimkus G.G.; 1999; Polycyclic musk fragrances in the aquatic environment; Toxicol. Lett., 111, p. 37-56. [Seulement disponible en anglais]
Santé Canada; 1994; L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire; Ottawa (ON) : ministère des Approvisionnements et Services Canada; no cat. : En40-215/41F. Disponible sur demande.
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié; Ottawa (ON), gouvernement du Canada. [Seulement disponible en anglais]
Santé Canada [modifié le 14 décembre 2015]; Liste critique des ingrédients de cosmétiques : liste des ingrédients dont l’usage est interdit dans les cosmétiques; Ottawa (ON) : Santé Canada, Direction de la sécurité des produits de consommation. [consultée en janvier 2017].
Schnell S., Bols N.C., Barata C. et Porte C.; 2009; Single and combined toxicity of pharmaceuticals and personal care products(PPCPs) on the rainbow trout liver cell line RTL-W1; Aquat. Toxicol., 93, p. 244‑252. [Seulement disponible en anglais]
Schramm K.W., Kaune A., Beck B., Thumm W., Behechti A., Kettrup A. et Nickolova P.; 1996; Acute toxicities of five nitromusk compounds in daphnia, algae and photoluminescent bacteria; Wat. Res., 30(10), p. 2247-2250. [Seulement disponible en anglais]
Simonich S.L., Begley W.M., Debaere G. et Eckoff W.S.; 2000; Trace analysis of fragrance materials in wastewater and treated wastewater; Environ. Sci. Technol., 34, p. 954-965. [Seulement disponible en anglais]
Simonich S.L., Federle T.W., Rottiers A., Webb S., Sabaliunas D. et Wolf W.; 2002; Removal of fragrance materials during US and European wastewater treatment; Environ. Sci. Technol., 36, p. 2839-2847. [Seulement disponible en anglais]
Smyth S.A., Lishman L.A., McBean E.A., Kleywegt S., Yang J.-J., Svoboda M.L., Ormonde S., Pileggi V., Lee H.‑B. et Seto P.; 2007; Polycyclic and nitromusks in Canadian municipal wastewater: occurrence and removal in wastewater treatment; Water Qual. Res. J. Canada, 42(3), p. 138-152. [Seulement disponible en anglais]
Smyth S.A., Lishman L.A., McBean E.A., Kleywegt S., Yang J.-J., Svoboda M.L., Lee H.-B. et Seto P.; 2008; Seasonal occurrence and removal of polycyclic and nitromusks from wastewater treatment plants in Ontario, Canada; Environ. Eng. Sci., 7, p. 299-317. [Seulement disponible en anglais]
Sofuoglu A., Kiymet N., Kavcar P. et Sofuoglu S.C.; 2010; Polycyclic and nitro musks in indoor air: a primary school classroom and a women's sport center; Indoor Air, 20, p. 515-522. [Seulement disponible en anglais]
Sousa V. et Suprenant D.C.; 1984; Acute toxicity of P1618.02 (musk xylene) to bluegill (Lepomis macrochirus); communication privée avec le RIFM; Bionomics, États-Unis; rapport no BW-84-2-1549 [cité dans CE 2005b]. [Seulement disponible en anglais]
[TaPL3] Long Range Transport and Persistence Level III Model; 2003; ver. 3.00; Peterborough (ON) : Université Trent; Canadian Centre for Environmental Modelling and Chemistry. [Seulement disponible en anglais]
Tas J.W., Balk F., Ford R.A. et van de Plassche E.J.; 1997; Environmental risk assessment of musk ketone and musk xylene in the Netherlands in accordance with the EU-TGD; Chemosphere, 35(12), p. 2973-3002. [Seulement disponible en anglais]
Taylor M., Weisskopf M. et Shine J.; 2014; Human exposure to nitro musks and the evaluation of their potential toxicity: an overview; Environ. Health, 13(14). [Seulement disponible en anglais]
Van Dijk A. et Burri R.; 1995; Accumulation and elimination of 14C-musk ketone by rainbow trout in a dynamic flow-through system; rapport au RIFM; RCC Switzerland Project 379664 [cité dans Tas et al. 1997]. [Seulement disponible en anglais]
Verhaar H.J.M., Van Leeuven C. et Hermens J.L.M.; 1992; Classifying environmental pollutants. 1: Structure-activity relationships for prediction of aquatic toxicity; Chemosphere, 25(4), p. 471-491. [Seulement disponible en anglais]
Wilson R., Jones-Otazo H., Petrovic S., Mitchell I., Bonvalot Y., Williams D. et Richardson G.M.; 2013; Revisiting dust and soil ingestion rates based on hand-to-mouth transfer.;Human Ecolog. Risk Assess., 19(1), p. 158-188. [Seulement disponible en anglais]
Wollenberger L., Breitholtz M., Kusk K.O. et Bengtsson B.-E.; 2001; Inhibition of larval development of the marine copepod Acartia tonsa by four synthetic musk substances; Sci. Total Environ., 305, p. 53–64. [Seulement disponible en anglais]
Yamagishi T., Miyazaki T., Horii S. et Akiyama K.; 1983; Synthetic musk residues in biota and water from Tama River and Tokyo Bay (Japan); Arch. Environ. Contam. Toxicol., 12, p. 83-89. [Seulement disponible en anglais]
Yin J., Wang H., Li J., Wu Y. et Shao B.; 2016; Occurrence of synthetic musks in human breast milk samples from 12 provinces in China; Food Addi. Contamin., Part A 33(7), p. 1219–1227. [Seulement disponible en anglais]
Yin J., Wang H., Zhang J., Zhou N., Gao F.,Wu Y., Xiang J. et Shao B.; 2012; The occurrence of synthetic musks in human breast milk in Sichuan, China; Chemosphere, 87, p. 1018–1023. [Seulement disponible en anglais]
Zarfl C., Scheringer M. et Matthies M.; 2011; Screening criteria for long-range transport potential of organic substances in water; Environ. Sci. Technol., 45, p. 10075–10081. [Seulement disponible en anglais]
Zhang X., Jing Y., Ma L., Zhou J., Fang X., Zhang X. et Yu Y.; 2015; Occurrence and transport of synthetic musks in paired maternal blood, umbilical cord blood, and breast milk; Int. J. Hyg. Environ. Health, 218, p. 99‑106. [Seulement disponible en anglais]
Zhang X., Liang G., Zeng X., Zhou J., Sheng G. et Fu J.; 2011; Levels of synthetic musk fragrances in human milk from three cities in the Yangtze River Delta in Eastern China; J. Environ. Sci., 23, p. 983‑990. [Seulement disponible en anglais]
Zhou J., Zeng X., Zheng K., Zhu X., Ma L., Xu Q., Zhang X., Yu Y., Sheng G. et Fu J.; 2012; Musks and organochlorine pesticides in breast milk from Shanghai, China: Levels, temporal trends and exposure assessment; Ecotoxicol. Environ. Saf., 84, p. 325–333. [Seulement disponible en anglais]
Annexe A. Données sur la toxicité aquatique du MC, du MX et de leurs principaux métabolites
| Organisme testé | Paramètre | Valeura (mg/L) | Référence |
|---|---|---|---|
| Truite arc-en-ciel (Oncorhynchus mykiss) | CL50 21 j | > 0,50 | RCC 1996a |
| Truite arc-en-ciel (O. mykiss) | CSEO 21 j (signes cliniques) | 0,063 | RCC 1996a |
| Truite arc-en-ciel (O. mykiss) | CMEO 21 j (signes cliniques) | 0,13 | RCC 1996a |
| Poisson-zèbre (Danio rerio) : (larve-embryon) | CSEO 48 h (fréquence cardiaque) | 0,003 | Carlsson et Norrgren 2004 |
| Poisson-zèbre (Danio rerio) : (larve-embryon) | CMEO 48 h (fréquence cardiaque) | 0,01 | Carlsson et Norrgren 2004 |
| Daphnie (Daphnia magna) | CE50 48 h | > 0,46 | Schramm et al. 1996 |
| Daphnie (Daphnia magna) | CE50 21 j (immobilisation) | 0,34–0,68 | RCC 1995 |
| Daphnie (Daphnia magna) | CE50 21 j (reproduction) | 0,17–0,34 | RCC 1995 |
| Daphnie (Daphnia magna) | CSEO 21 j (reproduction) | 0,17 | RCC 1995 |
| Daphnie (Daphnia magna) | CMEO 21 j (reproduction) | 0,34 | RCC 1995 |
| Copépode marin (Acartia tonsa) | CE50 5 j (inhibition du développement larvaire) | 0,066 | Wollenberger et al. 2001 |
| Copépode marin (Acartia tonsa) | CE10 5 j (inhibition du développement larvaire) | 0,01 | Wollenberger et al. 2001 |
| Copépode harpacticoïde (Nitocra spinipes) | CSEO 22 j (vitesse du développement larvaire) | 0,01 | Breitholtz et al. 2003 |
| Copépode harpacticoïde (Nitocra spinipes) | CMEO 22 j (vitesse du développement larvaire) | 0,03 | Breitholtz et al. 2003 |
| Algue verte (Selenastrum capricornutum) | CSEO 72 h | 0,088 | RCC 1996b |
| Algue verte (Selenastrum capricornutum) | CEb50 72 h | 0,12 | RCC 1996b |
| Algue verte (Selenastrum capricornutum) | CEr50 72 h | 0,24 | RCC 1996b |
| Algue verte d’eau douce (Scenedesmus subspicatus) | CEb50 72 h | > 0,46 | RCC 1996b |
Abréviations : CL50 = concentration létale requise pour tuer 50 % de la population; j = jour; CE = concentration entraînant un effet; CE50 = concentration qui induit une réaction à mi-chemin entre la concentration de référence et la concentration maximale; CEb50 = concentration à laquelle on observe une réduction de 50 % de la biomasse algale; CEr50 = concentration à laquelle on observe une inhibition de 50 % de la vitesse de croissance des algues; h = heure; CI = concentration inhibitrice; CMEO = concentration minimale entraînant un effet observé; CSEO = concentration sans effet observé.
a Dans certaines études, les valeurs des paramètres sont exprimées en ppm, en ppb ou en µM/L. Par souci d’uniformité, nous les avons converties en mg/L.
| Organisme testé | Paramètre | Valeura (mg/L) | Référence |
|---|---|---|---|
| Truite arc-en-ciel (Oncorhynchus mykiss) : alevins | CL50 96 h | > 1000 | Boleas et al. 1996 |
| Truite arc-en-ciel (Oncorhynchus mykiss) | CE50 24 h (lignée de cellules du foie RTL-W1 : cytotoxicité) | 40,9–62,2 | Schnell et al. 2009 |
| Poisson-zèbre (Danio rerio) : larve-embryon | CSEO 48 h (fréquence cardiaque) | 0,01 | Carlsson et Norrgren 2004 |
| Poisson-zèbre (Danio rerio) : larve-embryon | CMEO 48 h (fréquence cardiaque) | 0,033 | Carlsson et Norrgren 2004 |
| Poisson-zèbre (Danio rerio) | CL50 96 h | > 0,4 | Chou et Deitrich 1999 |
| Poisson-zèbre (Danio rerio) | CL50 48 h | 3,75 | MITI 1992 |
| Poisson-zèbre (Danio rerio) | CL50 14 j | 0,40 | Adema et Langerwerf 1985 |
| Poisson-zèbre (Danio rerio) | CE50 (malformations embryonnaires) | > 0,4 | Chou et Deitrich 1999 |
| Poisson-zèbre (Danio rerio) | CE50 (inhibition de la croissance) | > 0,4 | Chou et Deitrich 1999 |
| Crapet arlequin (Lepomis macrochirus) | CL50 24–72 h (calculée) | > 0,78 | Sousa et Surprenant 1984 |
| Crapet arlequin (Lepomis macrochirus) | CL50 96 h (calculée) | 1,2 | Sousa et Surprenant 1984 |
| Carpe (Cyprinus carpio) | CI50 (interférence avec l’enzyme métabolisant CYP1A : activité de l’EROD) | 11 | Schnell et al. 2009 |
| Xénope lisse (Xenopus laevis) | CL50 96 h | > 0,4 | Chou et Deitrich 1999 |
| Xénope lisse (Xenopus laevis) | CE50 96 h (inhibition de la croissance) | > 0,4 | Chou et Deitrich 1999 |
| Xénope lisse (Xenopus laevis) | CE50 96 h (malformations embryonnaires) | > 0,4 | Chou et Deitrich 1999 |
| Xénope lisse (Xenopus laevis) | CE50 11 j (inhibition de la croissance) | > 0,4 | Chou et Deitrich 1999 |
| Xénope lisse (Xenopus laevis) | CE50 11 j (malformations embryonnaires) | > 0,4 | Chou et Deitrich 1999 |
| Daphnie (Daphnia magna) | CL50 48 h (estimé) | 0,68 | Adema et Langerwerf 1985 |
| Daphnie (Daphnia magna) | CE50 48 h | > 0,79 | Schramm et al. 1996 |
| Daphnie (Daphnia magna) | CE50 48 h | > 1,0 | Adema et Langerwerf 1985 |
| Daphnie (Daphnia magna) | CSEO 48 h (réflexe de nage) | 0,32 | Adema et Langerwerf 1985 |
| Daphnie (Daphnia magna) | CSEO 48 h (réflexe de nage) | 0,32 | Adema et Langerwerf 1985 |
| Daphnie (Daphnia magna) | CL50 21 j | 0,68 | Adema et Langerwerf 1985 |
| Daphnie (Daphnia magna) | CSEO 21 j (rep.) | 0,056 | Adema et Langerwerf 1985 |
| Algue verte (Selenastrum capricornutum) | CEb50 5 j | > 10,0 | Payne et Hall 1979 |
| Algue verte (Selenastrum capricornutum) | CSEO 5 j | > 1,0 | Payne et Hall 1979 |
| Algue verte (Scenedesmus subspicarus) | ECb50 72 h | > 0,15 | Schramm et al. 1996 |
| Algue bleu-vert (Microcystis aeruginosa) | CSEO 5 j | > 10,0 | Hughes et Krishnaswami 1985 |
| Algue bleu-vert (Microcystis aeruginosa) | CEb50 5 j | > 1,0 | Hughes et Krishnaswami 1985 |
Abréviations : CL50 = concentration létale requise pour tuer 50 % de la population; j = jour; CE = concentration entraînant un effet; CE50 = concentration qui induit une réaction à mi-chemin entre la concentration de référence et la concentration maximale; CEb50 = concentration à laquelle on observe une réduction de 50 % de la biomasse algale; CEr50 = concentration à laquelle on observe une inhibition de 50 % de la vitesse de croissance des algues; h = heure; CI = concentration inhibitrice; CMEO = concentration minimale entraînant un effet observé; CSEO = concentration sans effet observé.
a Dans certaines études, les valeurs des paramètres sont exprimées en ppm, en ppb ou en µM/L. Par souci d’uniformité, nous les avons converties en mg/L.
| Abréviation du métabolite | Espèce | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| 2-MC | Tête-de-boule | CL50 96 h | 6,0 | ACD/Percepta c1997-2012 |
| 2-MC | Daphnie | CL50 48 h | 0,931 | ECOSAR 2012 |
| 2-MC | Poisson | CL50 96 h | 2 883 | ECOSAR 2012 |
| 2-MC | Poisson | CL50 14 j | 0,133 | ECOSAR 2012 |
| 2-MC | Tête-de-boule | CL50 96 h | 29,34 | AIEPS c2010-2012 |
| 2-MC | Daphnia | CL50 48 h | 18,35 | AIEPS c2010-2012 |
| 2-MC | Tetrahymena pyriformis | CIC50 | 103 | AIEPS c2010-2012 |
| 2-MX | Tête-de-boule | CL50 96 h | 2,3 | ACD/Percepta c1997-2012 |
| 2-MX | Poisson | CL50 96 h | 0,587 | ECOSAR 2012 |
| 2-MX | Tête-de-boule | CL50 96 h | 323 | AIEPS c2010-2012 |
| 2-MX | Daphnia | CL50 | 8,58 | AIEPS c2010-2012 |
| 2-MX | Tetrahymena pyriformis | CIC50 | 178 | AIEPS c2010-2012 |
| 2-MX and 4-MX | Daphnie | CL50 48 h | 0,489 | ECOSAR 2012 |
| 4-MX | Tête-de-boule | CL50 96 h | 2,3 | ACD/Percepta c1997-2012 |
| 4-MX | Tête-de-boule | CL50 96 h | 29,34 | AIEPS c2010-2012 |
| 4-MX | Daphnia | CL50 48 h | 8,58 | AIEPS c2010-2012 |
| 4-MX | Tetrahymena pyriformis | CIC50 | 178 | AIEPS c2010-2012 |
Abréviations : CL50 = concentration létale requise pour tuer 50 % de la population; j = jour; h = heure; CIC50 = concentration requise pour inhiber la croissance de la population de 50 %.
Annexe B. Limite supérieure des estimations d’absorption quotidienne (µg/kg pc/j) de MC et de MX en fonction du groupe d’âge dans la population générale du Canada
| Exposition | 0-6 moisa (nourris au lait mater-nel)b | 0-6 moisa (nourris aux prépa-rations pour nourris-sons)c | 0-6 moisa (non nourris aux prépa-rations pour nourris-sons)d | 6 mois- 4 anse | 5-11 ansf | 12-19 ansg | 20-59 ansh | 60 ans et plusi |
|---|---|---|---|---|---|---|---|---|
| Air ambiantj | 0,000 7 | 0,000 7 | 0,000 7 | 0,001 5 | 0,001 2 | 0,000 7 | 0,000 6 | 0,000 5 |
| Air intérieurk | 0,000 1 | 0,000 1 | 0,000 1 | 0,000 2 | 0,000 2 | 0,000 1 | <0,000 1 | <0,000 1 |
| Eau potablel | N.D. | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 |
| Alimentsm | 0,86 | N.D. | 0,0004 | 0,10 | 0,082 | 0,047 | 0,045 | 0,029 |
| Poussièren | 0,002 8 | 0,002 8 | 0,002 8 | 0,001 5 | 0,000 6 | <0,000 1 | <0,000 1 | <0,000 1 |
| Solo | N.D. | N.D. | N.D. | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 |
| Absorption totale | 0,870 | 0,004 | 0,004 | 0,100 | 0,084 | 0,047 | 0,045 | 0,029 |
Abréviations : N.D. = non déterminé.
a Nourrissons présumés peser 7,5 kg, respirer 2,1 m3 d’air par jour, boire 0,8 L d’eau par jour (pour ceux qui sont nourris aux préparations pour nourrissons) ou 0,3 L/jour (pour ceux qui ne sont pas nourris aux préparations pour nourrissons) (Santé Canada 1998) et ingérer 38 et 0 mg de poussière et de sol par jour (Wilson et al. 2013).
b Exclusivement pour les nourrissons nourris au lait maternel, qui sont présumés boire 0,742 L de lait maternel par jour (Santé Canada 1998) et n’être nourris que de lait maternel. La concentration de lait entier (maternel) de 8,73 µg/L est basée sur la valeur maximale de 212 ng/g de masse lipide × 4 % de lipides (concentration moyenne de lipides dans le lait maternel) × 1,03 g/mL (masse volumique du lait maternel) déterminée dans 39 échantillons de lait maternel recueilli en 2004 chez des femmes allaitantes du Massachusetts, aux États‑Unis (Reiner et al. 2007).
c Exclusivement pour les nourrissons nourris aux préparations pour nourrissons, qui sont présumés boire 0,8 L d’eau par jour (Santé Canada 1998), où l’eau est utilisée pour reconstituer les préparations. Comme aucune donnée de surveillance sur le musc cétonique dans les préparations pour nourrissons n’a été trouvée, les apports alimentaires ne sont que ceux provenant de l’eau. Voir la note de bas de page pour des précisions.
d Exclusivement pour les nourrissons non nourris aux préparations pour nourrissons, présumés boire 0,7 L d’eau par jour (Santé Canada 1998) et environ 50 % des nourrissons non nourris aux préparations pour nourrissons commencent à manger de la nourriture solide vers l’âge de 4 mois et 90 % vers l’âge de 6 mois (NHW 1990).
e Présumés peser 15,5 kg, respirer 9,3 m3 d’air par jour, boire 0,7 L d’eau par jour, consommer 54,7 g de poisson et 162,2 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 41 et 14 mg de poussière et de sol par jour (Wilson et al. 2013).
f Présumés peser 31,0 kg, respirer 14,5 m3 d’air par jour, boire 1,1 L d’eau par jour, consommer 89,8 g de poisson et 290,1 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 31 et 21 mg de poussière et de sol par jour (Wilson et al. 2013).
g Présumés peser 59,4 kg, respirer 15,8 m3 d’air par jour, boire 1,2 L d’eau par jour, consommer 97,3 g de poisson et 320,9 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 2,2 et 1,4 mg de poussière et de sol par jour (Wilson et al. 2013).
h Présumés peser 70,9 kg, respirer 16,2 m3 d’air par jour, boire 1,5 L d’eau par jour, consommer 111,7 g de poisson par jour et 248,4 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 2,5 et 1,6 mg de poussière et de sol par jour (Wilson et al. 2013).
I Présumés peser 72,0 kg, respirer 14,3 m3 d’air par jour, boire 1,6 L d’eau par jour, consommer 72,9 g de poisson et 229,0 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 2,5 et 1,5 mg de poussière et de sol par jour (Wilson et al. 2013).
j Aucune donnée de surveillance de l’air ambiant n’a été trouvée pour le Canada. La valeur maximale enregistrée à Milwaukee au Wisconsin (0,000141 phase gazeuse + 0,020 phase particulaire µg/m3 = 0,0201 µg/m3) a été utilisée pour la limite supérieure des estimations de l’absorption quotidienne due à l’air ambiant. La concentration de musc cétonique dans ce lieu urbain a été considérée représentative de celle au Canada. Les Canadiens sont présumés passer 3 heures à l’extérieur chaque jour (Santé Canada 1998).
k Aucune donnée de surveillance de l’air au Canada n’a été trouvée. La concentration au 95e percentile du musc cétonique (0,00044 µg/m3), mesurée dans les échantillons d’air intérieur d’une classe dans une école en Turquie (Sofuoglu et al. 2011) a été retenue pour la limite supérieure des estimations d’absorption quotidienne pour l’exposition due à l’air intérieur. Les Canadiens sont présumés passer 21 heures par jour à l’intérieur (Santé Canada 1998).
l Aucune donnée de surveillance de l’eau potable au Canada n’a été trouvée. La concentration au 95e percentile du musc cétonique (0,000133 µg/L) mesurée dans l’eau de surface du lac Michigan en 1999 et en 2000 (Peck et Hornbuckle 2004) a été retenue pour calculer la limite supérieure de l’absorption quotidienne pour l’exposition due à l’eau potable.
m Aucune donnée de surveillance sur les aliments commercialisés au Canada n’a été trouvée. Nous avons cependant trouvé des données environnementales suffisantes sur le poisson et des données limitées sur les légumes en provenance de l’Europe. La concentration de 28,34 µg/kg (en poids « frais » ou « humide ») est basée sur une concentration moyenne maximale de 659 µg/kg de lipides × 4,3 % de lipides dans 9 échantillons regroupés de barbeaux (rivère Moldau., République tchèque) de 1998 à 2000. Les gammes pour toutes les espèces échantillonnées n’ont pas été mentionnées dans l’article de Hajslova et Setkova (2004), mais la valeur pour les barbeaux était la valeur moyenne la plus élevée de toutes les espèces échantillonnées de 1997 à 2000 (dorade : 412 µg/kg de lipides × 3,2 % de lipides = 13,18 µg/kg; chevaine : 222 µg/kg de lipides × 1,9 % de lipides = 4,22 µg/kg; truite : 200 µg/kg de lipides × 1,6 % de lipides = 3,20 µg/kg; perche : 296 µg/kg de lipides × 0,7 % de lipides = 2,07 µg/kg). Une valeur au 95e percentile de 0,036 µg/kg dans une laitue provenant d’un supermarché à Bilbao (Espagne) en 2013, ou avant, a également été incluse. Une analyse effectuée sur des carottes et des poivrons provenant du même supermarché n’a pas permis de détecter de musc cétonique (Aguirre et al. 2014). La quantité d’aliments consommés quotidiennement par chaque groupe d’âge pour plus de 12 groupes d’aliments a été tirée de l’Enquête Nutrition au Canada 1970‑1972 (Santé Canada 1998).
n La concentration maximale de musc cétonique (559 ng/g) dans la poussière domestique prélevée dans 13 villes canadiennes entre 2007 et 2010 (Kubwabo et al. 2012) a été retenue pour l’estimation de la limite supérieure d’absorption quotidienne due à l’exposition à la poussière.
o Aucune concentration dans le sol n’a été trouvée. La concentration maximale de 1,57 µg/kg dans le sol, provenant des effluents d’UTEU appliqués par irrigation sur un site terrestre à Lubbock (Texas) en 2009 et en 2010 (Chase et al. 2012), a été retenue pour le calcul de la limite supérieure des estimations d’absorption quotidienne due à l’exposition au sol.
| Exposition | 0-6 moisa (nourris au lait mater-nel)b | 0-6 moisa (nourris aux prépa-rations pour nourris-sons)c | 0-6 moisa (non nourris aux prépa-rations pour nourris-sons)d | 6 mois- 4 anse | 5-11 ansf | 12-19 ansg | 20-59 ansh | 60 ans et plusi |
|---|---|---|---|---|---|---|---|---|
| Air ambiantj | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 |
| Air intérieurk | 0,003 8 | 0,003 8 | 0,003 8 | 0,008 1 | 0,006 3 | 0,003 6 | 0,003 1 | 0,002 7 |
| Eau de boissonl | N.D. | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 |
| Alimentsm | 0,61 | ND. | N.D. | 0,004 6 | 0,003 8 | 0,002 1 | 0,002 0 | 0,001 3 |
| Poussièren | 0,011 | 0,011 | 0,011 | 0,005 6 | 0,002 1 | <0,000 1 | <0,000 1 | <0,000 1 |
| Seul | N.D. | N.D. | N.D. | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 | <0,000 1 |
| Absorption totale | 0,630 | 0,015 | 0,015 | 0,018 | 0,012 | 0,006 | 0,005 | 0,004 |
Abréviations : N.D. = non déterminé.
a Présumés peser 7,5 kg, respirer 2,1 m3 d’air par jour, boire 0,8 L d’eau par jour (nourris aux préparations pour nourrissons) ou 0,3 L/jour (non nourris aux préparations pour nourrissons) (Santé Canada 1998) et ingérer 38 et 0 mg de poussière et de sol par jour (Wilson et al. 2013).
b Exclusivement pour les nourrissons nourris au lait maternel, présumés consommer 0,742 L de lait maternel par jour (Santé Canada 1998), et le lait maternel est censé être la seule source de nourriture. La concentration du lait entier (maternel) de 6,18 µg/L est fondée sur la valeur maximale de 150 ng/g de lipides × 4 % de lipides (concentration moyenne de lipides dans le lait maternel) × 1,03 g/mL (masse volumique du lait maternel), déterminée dans 39 échantillons de lait maternel recueillis en 2004 chez des femmes allaitantes du Massachusetts, aux États‑Unis (Reiner et al. 2007).
c Exclusivement pour les nourrissons nourris aux préparations pour nourrissons, présumés boire 0,8 L d’eau par jour (Santé Canada 1998), où l’eau est utilisée pour reconstituer les préparations. Comme aucune donnée de surveillance sur le musc xylénique dans les préparations pour nourrissons n’a été trouvée, l’absorption alimentaire ne provient que de l’eau. Voir la note de bas de page pour des précisions.
d Exclusivement pour les nourrissons non nourris aux préparations pour nourrissons, présumés boire 0,7 L d’eau par jour (Santé Canada 1998) et environ 50 % des nourrissons non nourris aux préparations pour nourrissons commencent à manger de la nourriture solide vers l’âge de 4 mois, et 90 % vers l’âge de 6 mois (NHW 1990).
e Présumés peser 15,5 kg, respirer 9,3 m3 d’air par jour, boire 0,7 L d’eau par jour, consommer 54,7 g de poisson et 162,2 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 41 et 14 mg de poussière et de sol par jour (Wilson et al. 2013).
f Présumés peser 31,0 kg, respirer 14,5 m3 d’air par jour, boire 1,1 L d’eau par jour, consommer 89,8 g de poisson et 290,1 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 31 et 21 mg de poussière et de sol par jour (Wilson et al. 2013).
g Présumés peser 59,4 kg, respirer 15,8 m3 d’air par jour, boire 1,2 L d’eau par jour, consommer 97,3 g de poisson et 320,9 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 2,2 et 1,4 mg de poussière et de sol par jour (Wilson et al. 2013).
h Présumés peser 70,9 kg, respirer 16,2 m3 d’air par jour, boire 1,5 L d’eau par jour, consommer 111,7 g de poisson et 248,4 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 2,5 et 1,6 mg de poussière et de sol par jour (Wilson et al. 2013).
I Présumés peser 72,0 kg, respirer 14,3 m3 d’air par jour, boire 1,6 L d’eau par jour, consommer 72,9 g de poisson et 229,0 g de produits céréaliers par jour (Santé Canada 1998) et ingérer 2,5 et 1,5 mg de poussière et de sol par jour (Wilson et al. 2013).
j Aucune donnée de surveillance de l’air ambiant au Canada n’a été trouvée. La valeur maximale enregistrée à Iowa City en Iowa (0,00013 µg/m3 en phase gazeuse) a été utilisée pour le calcul de la limite supérieure des estimations d’absorption quotidienne due à l’air ambiant. La concentration de musc xylénique dans ce lieu urbain a été considérée comme représentative de celle du Canada. Les Canadiens sont présumés passer trois heures à l’extérieur chaque jour (Santé Canada 1998).
k Aucune donnée de surveillance de l’air intérieur au Canada n’a été trouvée. La concentration au 95e percentile du musc xylénique (0,01541 µg/m3 en phase gazeuse + 0,00009 µg/m3 en phase particulaire = 0,0155 µg/m3), mesurée dans des échantillons d’air intérieur d’une classe dans une école en Turquie (Sofuoglu et al. 2011) a été retenue pour le calcul de la limite supérieure des estimations d’absorption quotidienne due à l’air intérieur. Les Canadiens sont présumés passer 21 heures à l’intérieur chaque jour (Santé Canada 1998).
l Aucune donnée de surveillance de l’eau potable au Canada n’a été trouvée. La concentration au 95e percentile du musc xylénique (0,00007 µg/L) mesurée dans l’eau de surface du lac Michigan en 1999 et en 2000 (Peck et Hornbuckle 2004) a été retenue pour le calcul de la limite supérieure des estimations d’absorption quotidienne due à l’eau potable.
m Aucune donnée de surveillance d’aliments commercialisés au Canada n’a été trouvée. Il existait cependant des données environnementales suffisantes sur le poisson provenant d’Europe. La concentration de 1,3 µg/kg en poids « frais » ou « humide » était basée sur la concentration maximale dans 87 échantillons regroupés de truite prélevés au Danemark en 2003 et en 2004 (Duedahl-Olesen et al. 2005). Une valeur au 95e percentile de 0,036 µg/kg dans une laitue provenant d’un supermarché à Bilbao (Espagne) en 2013 ou avant a également été incluse. Des échantillons de carottes et de poivrons provenant du même supermarché ont également été analysés, mais le musc cétonique n’y a pas été détecté (Aguirre et al. 2014). Bien que Aguirre et al. (2014) aient dosé le musc cétonique dans trois différents légumes provenant d’Espagne, ils n’ont pas dosé le musc xylénique dans ces légumes. La quantité d’aliments, choisis parmi 12 groupes d’aliments, consommés quotidiennement par chaque groupe d’âge a été tirée de l’Enquête Nutrition Canada de 1970‑1972 (Santé Canada 1998).
n La concentration maximale de musc xylénique (2130 ng/g) dans des échantillons de poussière domestique de 13 villes canadiennes prélevés entre 2007 et 2010 (Kubwabo et al. 2012) a été retenue pour le calcul de la limite supérieure des estimations d’absorption quotidienne due à la poussière.
o Aucune donnée de concentration dans le sol n’a été trouvée pour le Canada. Le musc xylénique n’a pas été détecté dans le sol sur lequel des effluents d’UTEU ont été appliqués par irrigation à Lubbock (Texas) en 2009 et en 2010 (Chase et al. 2012). La moitié de la limite de détection de cette étude (0,015 ng/g) a été retenue pour calculer la limite supérieure des estimations d’absorption quotidienne due au sol.
Annexe C. Expositions potentielles estimées des humains aux substances du groupe des muscs nitrés
Des scénarios d’exposition sentinelle ont été utilisés pour estimer l’exposition potentielle aux substances du groupe des muscs nitrés. Les hypothèses des scénarios sont résumées dans le tableau C‑1. Les expositions ont été estimées en fonction du poids présumé (70,9 kg) d’un adulte (Santé Canada 1998), de la vitesse d’inhalation d’un adulte (16,2 m3/jour) et du comportement d’un adulte, sauf indication contraire. Les expositions ont été estimées à l’aide de la version Web de ConsExpo ou d’algorithmes de ce modèle (ConsExpo Web 2016). Pour les expositions potentielles estimées par voie dermique, l’absorption dermique était de 14 % pour le MC et de 10 % pour le MX (voir la section 8.1). Un facteur de rétention global de 1 a été utilisé, sauf indication contraire.
Scénario d’exposition |
Hypothèses |
|---|---|
Assainisseur d’air – adulte (20 ans et plus) et enfant (de 6 mois à 4 ans) |
Concentration de MX : 0,07 % (NICNAS 2016) Exposition à la vapeur, rejet instantané Durée d’exposition : 24 h (jugement d’expert) Quantité de produit : 5,4 g (jugement d’expert) Volume de la pièce : 20 m3 (IFRA 2012) Taux de ventilation : 0,6/heure (version Web de ConsExpo 2016) Taux d’inhalation : 16,2 m3/jour (adulte; Santé Canada 1998) et 9,3 m3/jour (enfant; Santé Canada 1998) Poids corporel d’un enfant : 15,5 kg (Santé Canada 1998) |
Revitalisant |
Concentration de MC : 1 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation [DSPC] de Santé Canada au Bureau d’évaluation du risque des substances existantes [BERSE] de Santé Canada, daté de novembre 2016; non référencé) Contact direct avec le produit, application instantanée Quantité de produit : 13,13 g (Loretz et al. 2005) Fréquence : 1,1 fois par jour (Loretz et al. 2005) Superficie : 1092,5 cm2 (Santé Canada 1998) Facteur de rétention : 0,01 (CSSC 2012) |
Fragrance (eau de toilette) |
Concentration de MC : 0,1 % (jugement d’expert) Inhalation : Exposition à la pulvérisation Fréquence : 1,7 fois par jour (Loretz et al. 2006) Vitesse d’inhalation : 16,2 m3/jour (Santé Canada 1998) Voie dermique : Contact direct avec le produit, application instantanée Superficie : 100 cm2 (site Web de ConsExpo 2016) Quantité de produit : 0,33 g (Loretz et al. 2006) |
Lotion pour le corps |
Concentration de MX : 0,1 % (jugement d’expert) Fréquence : 1,1 fois par jour (Loretz et al. 2005) Voie dermique : Contact direct avec le produit, application instantanée Quantité de produit : 4,4 g (Loretz et al. 2005) Superficie : 16 925 cm2 (Santé Canada 1998) |
