Évaluation préalable
Groupe de substances azoïques aromatiques et à base de benzidine
Certains colorants azoïques dispersés
Table des matières
Liste des tableaux
- Tableau 1-1. Liste des 24 colorants azoïques dispersés du sous-groupe qui ont été évalués dans le cadre du Défi
- Tableau 1-2. Liste des 33 colorants azoïques dispersés qui faisaient partie de l'évaluation préalable des 145 substances PBTi
- Tableau 2-1. Identité de huit colorants azoïques dispersés faisant partie du groupe structurel 1, possédant deux liaisons azoïques et trois cycles aromatiques sans structure naphtalénique ni halogénée
- Tableau 2-2. Identité de trois colorants azoïques dispersés faisant partie du groupe structurel 2, possédant deux liaisons azoïques, deux cycles aromtiques et une structure naphtalénique
- Tableau 2-3. Identité de dix colorants azoïques dispersés du groupe structurel 3, possédant une liaison azoïque, un cycle aromatique et une structure hétéroaromatique (benzotriazole ou thiazole)
- Tableau 2-4. Identité de 40 colorants azoïques dispersés faisant partie du groupe structurel 4 présentant une liaison azoïque et deux noyaux aromatiques avec divers groupes substituants
- Tableau 2-5. Identité de sept colorants azoïques dispersés du groupe structurel 5, possédant une liaison azoïque, un cycle aromatique et une structure de pyridine-3-carbonitrile avec divers groupes substituants
- Tableau 2-6. Identité de deux colorants azoïques dispersés du groupe structurel 6, possédant une liaison azoïque, un cycle aromatique et une structure de 1H-benz[d,e]isoquinoline-1,3(2H)-dione
- Tableau 2-7. Identité des trois colorants azoïques dispersés ayant une structure chimique unique
- Tableau 2-8. Identité de la substance n° CAS 2832-40-8.
- Tableau 2-9. Analogues pour lesquels des données expérimentales existent, pris en compte afin d'ontenir des renseignements sur les propriétés physiques et chimiques et sur le devenir des colorants azoïques dispersés dans l'environnement, ainsi que sur leur potentiel à entraîner des effets nocifs sur l'environnement
- Tableau 3-1. Résumé des principales propriétés physicochimiques des 73 colorants azoïques dispersés
- Tableau 4-1. Quatorze substances visées par la présente évaluation, dont le Disperse Yellow 3, qui ont été identifiées comme ayant été importées au Canada depuis 2005 en une quantité supérieure au seuil de déclaration de 100 kg/an lors d'enquêtes réalisées en vertu de l'article 71
- Tableau 5-1. Résumé des données expérimentales sur la biodégradation de colorants azoïques dispersés et de leurs analogues dans le milieu aquatique
- Tableau 5-2. Résumé des données expérimentales sur la dégradation abiotique des colorants azoïques dispersés et de leurs analogues dans les milieux non aquatiques
- Tableau 5-3. Données empiriques sur la bioaccumulation des colorants azoïques dispersés et de leurs analogues chez les poissons
- Tableau 6-1. Résumé des données sur la toxicité aquatique aiguë des colorants azoïques dispersés et de leurs analogues en fonction de leur masse moléculaire et de leur taille moléculaire
- Tableau 6-2. Résumé des données sur la toxicité aquatique chronique des colorants azoïques dispersés et de leurs analogues en fonction de leur masse méculolaire et à leur taille moléculaire
- Tableau 6-3. Gammes de tailles moléculaires correspondant aux masses moléculaires de 73 colorants azoïques dispersés et leurs analogues avec données empiriques
- Tableau 6-4. Concentrations avec effets externes aigus (CL50) calculées en suivant l'approche reposant sur la charge corporelle critique pour les colorants azoïques dispersés et leurs analogues
- Tableau 6-5. Résumé des données sur l'écotoxicité chronique d'autres classes de colorants et de pigments dans le sol
- Tableau 6-6. Résumé des données sur l'écotoxicologie chronique du Solvent Red 1* (ou Sudan Red G*) dans les sédiments (Milani et Intini 2013)
- Tableau 6-7. CEE aquatique probabiliste dans les sédiments et le sol découlant de l'utilisation industrielle des colorants azoïques dispersés pour la coloration de textiles
- Tableau 7-1. Gammes d'expositions quotidiennes estimées pour les substances suivantes : Disperse Blue 79:1, Disperse Orange 30, Disperse Blue 79, ANAM, Disperse Brown 1:1, Disperse Brown 1, Disperse Red 167, BANAP, n° CAS 52697-38-8, Disperse Orange 61, n° CAS 63833-78-3 et ANMOM
- Tableau 7-2. Métabolites de type amine aromatique résultant de la métabolisation des colorants azoïques dispersés auxquels il est probable que les Canadiens soient exposés
- Tableau 7-3. Gammes de marges d'exposition relatives à la cancérogénicité due à l'exposition quotidienne aux colorants dispersés
- Tableau 7-4. Autres gammes de marges d'exposition pour une exposition quotidienne à des colorants dispersés
Sommaire
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l'environnement 1999 [LCPE (1999)], les ministres de l'Environnement et de la Santé ont procédé à une évaluation préalable de 74 colorants azoïques dispersés. Ces substances constituent un sous-groupe du groupe des substances aromatiques azoïques et à base de benzidine évaluées dans le cadre de l'Initiative des groupes de substances du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada, d'après leur similarité structurale et leurs applications. Ces substances figurent parmi celles jugées d'intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73. ( 1) de la LCPE 1999 ou soulèvent d'autres préoccupations relatives à la santé humaine. Le numéro de registre du Chemical Abstracts ServiceNote de bas de page1(n° CAS), le nom figurant dans la Liste intérieure des substances (LIS) et le nom générique figurant dans le Colour Index (C.I.) ou l'acronyme des colorants azoïques dispersés de ce sous-groupe sont présentés dans le tableau ci-après.
| N° CAS | Nom sur la LIS | Nom dans le Colour Index ou acronyme |
|---|---|---|
| 2537-62-4 | N-[2-(2-Bromo-6-cyano-4-nitrophénylazo)-5-(diéthylamino)phényl]acétamide | n.d. |
| 2832-40-8a | N-[4-(2-Hydroxy-5-tolylazo)phényl]acétamide | Disperse Yellow 3 (Solvent Yellow 77) |
| 3618-72-2b | Diacétate de 2,2'-{[5-acétamido-4-(2-bromo-4,6-dinitrophénylazo)-2-méthoxyphényl]imino}diéthyle | Disperse Blue 79:1 |
| 5261-31-4c | Acétate de 2-{N-(2-cyanoéthyl)-4-[(2,6-dichloro-4-nitrophényl)azo]anilino}éthyle | Disperse Orange 30 |
| 6232-56-0c | 2-[[4-[(2,6-Dichloro-4-nitrophényl)azo]phényl]méthylamino] éthanol | Disperse Orange5 |
| 6250-23-3c | p-[[p-(Phénylazo)phényl]azo]phénol | Disperse Yellow 23 |
| 6253-10-7c | p-[[4-(Phénylazo)-1-naphtyl]azo]phénol | Disperse Orange 13 |
| 6300-37-4c | 4-[[p-(Phénylazo)phényl]azo]-o-crésol | Disperse Yellow 7 |
| 6465-02-7 | [4-[[4-[(4-Hydroxyphényl)azo]-2-méthylphényl]azo]phényl]-carbamate de méthyle | n.d. |
| 6657-00-7 | 4-[[2-Méthoxy-5-méthyl-4-(phénylazo)phényl]azo]phénol | n.d. |
| 12239-34-8c | Diacétate de 2,2'-[[5-acétamido-4-(2-bromo-4,6-dinitrophényl)azo]-2-éthoxyphényl]imino]diéthyle | Disperse Blue 79 |
| 15958-27-7 | Carbanilate de 2-[(2-cyanoéthyl)[p-[(p-nitrophényl)azo]phényl]amino]éthyle | n.d. |
| 16421-40-2c | Acétate de 2-[[5-acétamide-4-[(2-chloro-4,6-dinitrophényl)azo]-2-méthoxyphényl]benzylamino]éthyle | ANAMd |
| 16421-41-3c | Acétate de 2-[[5-acétamido-4-[(2,4-dinitrophényl)azo]-2-méthoxyphényl]benzylamino]éthyle | n.d. |
| 16586-42-8c | 3-[Éthyl[3-méthyl-4-[(6-nitrobenzothiazol-2-yl)azo]phényl] amino]propiononitrile | Disperse Red 179c |
| 17464-91-4c | 2,2'-[[4-[(2-Bromo-6-chloro-4-nitrophényl)azo]-3-chlorophényl]imino]biséthanol | Disperse Brown 1:1 |
| 19745-44-9 | 3-[4-[(5-Nitrothiazol-2-yl)azo](2-phényléthyl)amino]propiononitrile | n.d. |
| 19800-42-1d | 4-[[2-Méthoxy-4-[(4-nitrophényl)azo]phényl]azo)]phénol | Disperse Orange 29 |
| 21811-64-3c | p,p'-[p-Phénylènebis(azo)]bisphénol | Disperse Yellow 68 |
| 23355-64-8c | 2,2'-[[3-Chloro-4-[(2,6-dichloro-4-nitrophényl)azo]phényl]imino]biséthanol | Disperse Brown 1 |
| 24610-00-2 | 2-[[4-[(2-Cyanoéthyl)(2-phényléthyl)amino]phényl]azo]-5-nitrobenzonitrile | n.d. |
| 25150-28-1 | 3-[[4-[(6,7-Dichlorobenzothiazol-2-yl)azo]phényl]éthylamino]propiononitrile | n.d. |
| 25176-89-0c | 3-[[4-[(5,6-Dichlorobenzothiazol-2-yl)azo]phényl] éthylamino]propiononitrile | DAPEPd |
| 26021-20-5 | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-5-[(2-cyanoéthyl)(2-hydroxyéthyl)amino]-4-méthoxyphényl]acétamide | Disperse Blue 94 |
| 26850-12-4c | Acétate de 2-[N-(2-acétoxyéthyl)-4-chloro-2-nitro-5-[2-(propionamido)anilino]anilino]éthyle | Disperse Red 167 |
| 27184-69-6 | 4,4'-[p-Phénylènebis(azo)]di-m-crésol | n.d. |
| 28824-41-1 | 3-{[p-(4,6-Dibromobenzothiazol-2-ylazo)-N-éthylanilino]}propiononitrile | n.d. |
| 29765-00-2c | Diacétate de 3-benzamido-4-[(p-nitrophényl)azo]phényliminodiéthyle | BANAPd |
| 31030-27-0 | 4-[(2-Chloro-4-nitrophényl)azo]-N-éthyl-N-(2-phénoxyéthyl)aniline | n.d. |
| 33979-43-0 | 3-{N-(2-Acétoxyéthyl)-[4-(5,6-dichlorobenzothiazol-2-ylazo)aniline}propionitrile | n.d. |
| 41362-82-7 | 3-[[4-[(5,6-Dichlorobenzothiazol-2-yl)azo]phényl]méthylamino]propiononitrile | n.d. |
| 42357-98-2 | 6-Hydroxy-5-[(2-méthoxy-4-nitrophényl)azo]-2-méthyl-1H-benzo[de]isoquinoléine-1,3(2H)-dione | n.d. |
| 42358-36-1 | 2-Éthyl-6-hydroxy-5-[(2-méthoxy-4-nitrophényl)azo]-1H-benzo[de]isoquinoléine-1,3(2H)-dione | n.d. |
| 42852-92-6 | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-4-méthoxy-5-[(phénylméthyl)allylamino]phényl]acétamide | n.d. |
| 51249-07-1 | 1-(2-Éthylhexyl)-1,2-dihydro-6-hydroxy-4-méthyl-5-(2-nitrophénylazo)-2-oxonicotinonitrile | n.d. |
| 52697-38-8c | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-5-(diéthylamino)phényl]acétamide | n.d. |
| 53950-33-7b | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-5-[(2-cyanoéthyl)amino]-4-méthoxyphényl]acétamide | n.d. |
| 55252-53-4 | N-[2-[2-Cyano-6-iodo-4-nitrophénylazo]-5-(diéthylamino)phényl]acétamide | n.d. |
| 55281-26-0c | 3-[[4-(2,6-Dibromo-4-nitrophénylazo)phényl]éthylamino] propiononitrile | Disperse Orange 61 |
| 55290-62-5 | 4-[(1-Butyl-5-cyano-1,6-dihydro-2-hydroxy-4-méthyl-6-oxo-3-pyridyl)azo]-N-(2-éthylhexyl)benzènesulfonamide | n.d. |
| 55619-18-6c | Diacétate de 2,2'-[[4-[2,6-dibromo-4-nitrophénylazo]phényl]imino]diéthyle | n.d. |
| 56532-53-7 | N-[2-[(2,6-Dicyano-4-nitrophényl)azo]-5-(dipropylamino)phényl]acétamide | n.d. |
| 58104-55-5 | 6-Hydroxy-N-(2-hydroxyéthyl)-N-méthyl-5-[[4-(phénylazo)phényl]azo]naphtalène-2-sulfonamide | n.d. |
| 59709-38-5 | N-[4-[(2-Bromo-6-chloro-4-nitrophényl)azo]phényl]-N-(3-méthoxy-3-oxopropyl)-β-alaninate de méthyle | ANMOMd,e |
| 61799-13-1 | 5-[(2-Cyano-4-nitrophényl)azo]-2-[(2-hydroxyéthyl)amino]-4-méthyl-6-{[3-(2-phénoxyéthoxy)propyl]amino}-3-pyridinecarbonitrile | n.d. |
| 63133-84-6 | 6-(2-Chloro-4,6-dinitrophénylazo)-3,4-dihydro-2,2,4,7-tétraméthyl-2H-quinoléine-1-éthanol | n.d. |
| 63134-15-6 | N-[5-(Dipropylamino)-2-[[5-(éthylthio)-1,3,4-thiadiazol-2-yl]azo]phényl]acétamide | Disperse Red 338 |
| 63833-78-3 | 5-[(2-Cyano-4-nitrophényl)azo]-6-[(2-hydroxyéthyl)amino]-4-méthyl-2-[[3-(2-phénoxyéthoxy)propyl]amino]nicotinonitrile | n.d. |
| 65122-05-6 | [(1,3-Dihydro-1,1,3-triméthyl-2H-indén-2-ylidène)méthane]azo(2-méthoxybenzène) | n.d. |
| 66693-26-3 | N-[5-[Bis[2-(2-cyanoéthoxy)éthyl]amino]-2-[(2-chloro-4,6-dinitrophényl)azo]-4-méthoxyphényl]propionamide | Disperse Blue 125 |
| 67905-67-3 | 3-[Butyl[4-[(6-nitro-2-benzothiazolyl)azo]phényl]amino]propiononitrile | n.d. |
| 68214-63-1 | 5-[(3,4-Dichlorophényl)azo]-1,2-dihydro-6-hydroxy-4-méthyl-2-oxo-1-anilinonicotinonitrile | n.d. |
| 68214-66-4 | [2-[(2-Chloro-4-nitrophényl)azo]-5-(diéthylamino)phényl]carbamate de 2-éthoxyéthyle | n.d. |
| 68516-64-3 | Acétate de 2-[4-[(2-chloro-4-nitrophényl)azo]-N-(2-cyanoéthyl)-3-méthylanilino]éthyle | n.d. |
| 68877-63-4 | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-5-[(2-cyanoéthyl)allylamino]-4-méthoxyphényl]acétamide | n.d. |
| 68992-01-8 | 1-(2-Éthylhexyl)-1,2-dihydro-6-hydroxy-5-[(4-méthoxy-2-nitrophényl)azo]-4-méthyl-2-oxonicotinonitrile | n.d. |
| 69472-19-1 | 3-[Butyl[4-[(4-nitrophényl)azo]phényl] amino]propiononitrile | n.d. |
| 70210-08-1 | N-(2-Acétoxyéthyl)-6-hydroxy-N-méthyl-5-[[4-(phénylazo)phényl]azo]naphtalène-2-sulfonamide | Disperse Red 151 |
| 70660-55-8 | 4-[(2-Bromo-4,6-dinitrophényl)azo]-N-(3-méthoxypropyl)naphtalén-1-amine | n.d. |
| 72828-63-8 | Acétate de 2-[[4-[(5-bromo-2-cyano-3-nitrophényl)azo]-3-méthylphényl]butylamino]éthyle | n.d. |
| 72828-64-9 | Acétate de [[4-[(2,6-dicyano-4-nitrophényl)azo]-3-méthylphényl]amino]hexyle | Disperse Blue 287 |
| 72927-94-7c | 4-[(2,6-Dichloro-4-nitrophényl)azo]-N-(4-nitrophényl)aniline | n.d. |
| 72968-82-2c | N-[2-[(2,6-Dicyano-p-tolyl)azo]-5-(dipropylamino)phényl]méthanesulfonamide | DADMd |
| 73003-64-2 | 7-[4-[(2,6-Dichloro-4-nitrophényl)azo]-3-oxo-m-tolyl-2,4,10-trioxa-7-azaundécan-11-oate de méthyle | n.d. |
| 73398-96-6 | 5-[(9,10-Dihydro-9,10-dioxo-1-anthryl)azo]-2,6-bis[(2-méthoxyéthyl)amino]-4-méthylnicotinonitrile | Disperse Brown 21 |
| 79542-46-4 | N-[4-Chloro-2-[2-(2-chloro-4-nitrophényl)azo]-5-[(2-hydroxy-3-phénoxypropyl)amino]phényl]acétamide | Disperse Red 349 |
| 83249-47-2 | N-[2-[(2-Bromo-6-cyano-4-nitrophényl)azo]-5-(dipropylamino)phényl]acétamide | n.d. |
| 83249-49-4 | 3-Bromo-2-[[4-(diéthylamino)-o-tolyl]azo]-5-méthylbenzonitrile | n.d. |
| 83249-53-0 | N-[2-[(2-Bromo-6-cyano-p-tolyl)azo]-5-(diéthylamino)phényl]méthanesulfonamide | n.d. |
| 83249-54-1 | N-[2-[(2-Bromo-6-cyano-p-tolyl)azo]-5-(dipropylamino)phényl]méthanesulfonamide | n.d. |
| 90729-40-1 | 1-Butyl-5-[[4-(4-chlorobenzoyl)-2-nitrophényl]azo]-1,2-dihydro-6-hydroxy-4-méthyl-2-oxonicotinonitrile | n.d. |
| 93805-00-6c | p-[[2-Méthoxy-4-[(2-méthoxyphényl)azo]-5-méthylphényl]azo]phénol | n.d. |
| 106276-78-2c | 2,3,4,5-Tétrachloro-6-cyanobenzoate de méthyle, produits de réaction avec la 4-[(p-aminophényl)azo]-3-méthylaniline et le méthylate de sodium | MATCBd |
| 127126-02-7 | 3-[N-(2-Acétoxyéthyl)-p-(6,7-dichlorobenzothiazol-2-ylazo)anilino]propionitrile | n.d. |
Abréviation : n.d. = non disponible
aLa substance n° CAS 2832-40-8 (Disperse Yellow 3) est incluse dans la présente évaluation portant sur les préoccupations écologiques. La substance, connue sous le nom de Solvent Yellow 77, faisait partie de l'évaluation des colorants azoïques avec solvant.
bCette substance n’a pas été identifiée en vertu du paragraphe 73(1) de la LCPE mais a été incluse dans la présente évaluation car elle était prioritaire étant donné d’autres inquiétudes ayant trait à la santé humaine.
c Substances évaluées précédemment dans le cadre de l'initiative du Défi du Plan de gestion des produits chimiques (PGPC) et pour lesquelles des conclusions ont été formulées.
d Acronyme utilisé précédemment pour la substance dans le cadre de l'initiative du Défi.
e La substance ANMOM (n° CAS 59709-38-5) a été incluse dans l'initiative du Défi; toutefois, aucune conclusion en vertu de l'article 64 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] n'a été publiée pour cette substance.
Parmi les 74 substances visées par la présente évalution, on retrouve le Disperse Yellow 3 (n° CAS 2832-40-8, aussi connu en tant que Solvent Yellow 77), qui devrait être utilisé comme colorant dispersé et comme colorant avec solvant. En tant que tel, le Disperse Yellow 3 ne faisait pas partie initialement des 73 substances visées par l'ébauche de l'évaluation préalable des colorants azoïques dispersés, mais avait au lieu de cela été évalué comme colorant azoïque avec solvant sous le nom de Solvent Yellow 77.
Les colorants azoïques dispersés ne devraient pas être produits de façon naturelle dans l'environnement. Aucune production de substance en quantité supérieure au seuil de déclaration de 100 kg/an n'a été déclarée dans les réponses aux enquêtes menées récemment en application de l'article 71 de la LCPE 1999. Treize substances de ce sous-groupe ont été déclarées comme ayant été importées en quantité supérieure au seuil de déclaration de 100 kg/an de l'enquête, avec des quantités totales situées entre 10 000 et 100 000 kg/an. La quantité de Disperse Yellow 3 importée se situait entre 100 et 1 000 kg/an. Trois autres substances ont été identifiées comme substance utilisée au Canada en 2010, en se basant sur les renseignements soumis par l'Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers (ETAD). Aucune concentration mesurée dans l'environnement au Canada n'a été relevée pour l'une de ces substances depuis 1987.
Environnement
La partie écologique de la présente évaluation préalable porte sur les 74 colorants azoïques dispersés : les 73 colorants azoïques dispersés inclus dans ce sous-groupe et l'utilisation du Disperse Yellow 3 pour la formulation de colorants pour textiles et la coloration de textiles.
En raison de leurs similarités structurelles et du fait que les colorants azoïques dispersés devraient agir de façon semblable dans l'environnement, ces substances ont été regroupées en fonction de leur devenir dans l'environnement.
En se basant sur les données expérimentales disponibles, les colorants azoïques dispersés ont une faible solubilité dans l'eau (inférieur(e) à 1 mg/L) et une solubilité modérée à élevée dans le n-octanol (10 à 1 000 mg/L). Ils ont également des pressions de vapeur faibles (inférieur(e) à 4,53 × 10-7 Pa), des masses volumiques supérieures à celle de l'eau (1,19 à 1,55 g/cm3) et des coefficients de partage octanol-eau modérés à élevés (log Koe de 3,4 à 5,7).
Des données empiriques indiquent que, dans des conditions aérobies, les colorants azoïques dispersés ne devraient pas se dégrader rapidement dans l'eau, le sol ou les sédiments. S'ils sont rejetés dans des eaux usées, ces colorants devraient être retenus par les filtres à boues ou adsorbés pendant le processus de traitement des eaux usées, plutôt que de rester en phase aqueuse. Si ces substances sont rejetées dans l'eau, un pourcentage accru de celles-ci devrait se retrouver dans les sédiments et subir une dégradation réductrice dans des sédiments anaérobies. La biodisponibilité de ces substances devrait être faible étant donné leur faible solubilité dans l'eau et leur faible absorption due à leur grande dimension. Les résultats des études expérimentales suggèrent qu'il est peu probable que ces substances s'accumulent dans des organismes pélagiques. Les colorants azoïques dispersés devraient avoir un mode d'action commun en ce qui concerne leur écotoxicité, étant donné la similarité de leurs éléments structurels. En raison de la rupture potentielle des liaisons azoïques de ces substances, des produits de dégradation contenant des groupes fonctionnels amines, aniline ou phénol peuvent être libérés.
Les données disponibles sur la toxicité des colorants azoïques dispersés pour les organismes aquatiques ont indiqué des effets très variables sur différents taxons et entre la toxicité aiguë et la toxicité chronique. Des tests de toxicité aiguë sur des poissons, des crustacés et des bactéries n'ont indiqué aucun effet à des concentrations proches des limites d'hydrosolubilité connues. Cependant, les études de toxicité chronique disponibles montrent que les poissons et les invertébrés aquatiques sont sensibles aux colorants azoïques dispersés, plus particulièrement aux substances ayant les masses moléculaires et les sections les plus faibles, indiquant que les colorants azoïques dispersés de plus petite taille sont plus susceptibles d'être biodisponibles que ceux de plus grande taille.
Une concentration estimée sans effet (CESE) dans l'environnement aquatique de 0,0025 mg/L a été calculée, en se basant sur la valeur de toxicité la plus faible obtenue lors d'une étude sur la toxicité chronique chez des poissons (tête-de-boule) exposés au Disperse Yellow 7 (n° CAS 6300-37-4). Cette CESE a été utilisée pour représenter un sous-ensemble de colorants azoïques dispersés de masse moléculaire inférieure à 360 g/mol. Étant donné le risque d'importants rejets dans l'environnement dus à des activités industrielles (formulation pour textiles et coloration de textiles), les concentrations environnementales estimées (CEE) pour les colorants de ce sous-groupe sont susceptibles d'être supérieures à leur CESE. Ce sous-groupe actuel comprend huit colorants azoïques dispersés de masse moléculaire inférieure à 360 g/mol qui n'ont pas été identifiés comme étant commercialisés au Canada. Par conséquent, à l'heure actuelle, ces huit colorants azoïques dispersés ne posent pas de risque pour l'environnement. Toutefois, l'utilisation future d'un colorant azoïque dispersé de masse moléculaire inférieure à 360 g/mol dans des textiles pourrait avoir des effets préoccupants en raison de leur toxicité pour les organismes aquatiques.
En ce qui concerne les substances de masse moléculaire égale ou supérieure à 360 g/mol (y compris les 13 colorants azoïques dispersés de ce sous-groupe qui sont commercialisés au Canada), la CESE, si elle était calculée, serait supérieure à la limite d'hydrosolubilité pour la plupart de celles-ci, suggérant qu'il n'y aurait aucun effet à long terme, même à leurs limites d'hydrosolubilité.
Pour le Disperse Yellow 3, la CESE a été calculée à 0,0023 mg/L, à partir de données croisées de toxicité aiguë basées sur des données pour le Solvent Yellow 1 (n° CAS 60-09-3, CL50 après 96 heures). La CEE aquatique pour un scénario de formulation de textiles propre au site a été estimée à 0,011 mg/L. Le résultat de l'analyse de quotient de risque était de 4,7, suggérant une situation préoccupante pour les organismes aquatiques. De plus, le Disperse Yellow 3 ayant une masse moléculaire de 269 g/mol, il représenterait également une source de préoccupation pour les organismes aquatiques s'il devait être utilisé pour la coloration de textiles.
Lors d'études préliminaires sur la toxicité dans le sol ou les sédiments d'autres substances azoïques, aucun effet n'a été observé à une concentration de 1 000 mg/kg de sol (poids sec). Toutefois, une concentration analogue a mis en évidence une toxicité modérée pour les organismes vivant dans les sédiments. En appliquant ces données aux substances de ce groupe, on constate que les colorants azoïques dispersés ne devraient pas nuire aux organismes vivant dans le sol ou les sédiments.
Compte tenu de tous les éléments de preuve disponibles avancés dans la présente évaluation préalable, 73 des 74 colorants azoïques dispersés constituant ce sous-groupe posent un faible risque d'effets nocifs sur les organismes et l'intégrité globale de l'environnement. Il est donc conclu que ces 73 colorants azoïques dispersés ne satisfont pas au paragraphe 64 a) ou b) de la LCPE 1999, car ils ne pénètrent pas dans l'environnement en une quantité, à une concentration ou dans des conditions ayant ou pouvant avoir un effet nocif immédiat ou à long terme sur l'environnement ou sur la diversité biologique, ou mettant ou pouvant mettre en danger l'environnement essentiel à la vie.
L'utilisation de la substance de n° CAS 2832-40-8 (Disperse Yellow 3) dans la formulation de colorants et pour la coloration de textiles a fait l'objet d'une évaluation portant sur des préoccupations écologiques. Compte tenu des éléments de preuve avancés dans la présente évaluation préalable et dans l'évaluation préalable des colorants azoïques avec solvant, il est conclu que la substance de n° CAS 2832-40-8, le Disperse Yellow 3 (aussi connu sous le nom de Solvent Yellow 77), satisfait aux critères du paragraphe 64 a) de la LCPE 1999, car elle pénètre ou peut pénétrer dans l'environnement en une quantité, à une concentration ou dans des conditions ayant ou pouvant avoir un effet nuisible immédiat ou à long terme sur l'environnement ou sa diversité biologique. Toutefois, cette substance ne satisfait pas aux critères du paragraphe 64 b) de la LCPE 1999, car elle ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions qui constituent ou peuvent constituer un danger pour l'environnement essentiel à la vie.
Santé humaine
En ce qui concerne l'évaluation des risques pour la santé humaine, la présente évaluation préalable porte sur 64 des 74 substances, dont le Disperse Yellow 3. Treize de ces 64 substances ont déjà été évaluées dans le cadre de l'initiative du Défi du PGPC et de nouveaux renseignements ayant trait à la santé humaine ont été recueillis pour ces substances. Une autre substance (ANMOM, n° CAS 59709-38-5) faisait partie de l'initiative du Défi du PGPC, mais aucune conclusion n'avait été tirée pour ce composé. Pour 10 des 74 substances de la présente évaluation, des conclusions avaient été tirées dans le cadre de l'Initiative du Défi et comme aucun renseignement significatif pertinent pour la santé humaine n'a été identifié les conclusions ayant trait à la santé humaine n'ont pas été mises à jour pour ces 10 substances.
La cancérogénicité et la génotoxicité des substances azoïques aromatiques et à base de benzidine sont considérées comme des effets critiques sur la santé potentiellement préoccupants, en raison de la rupture potentielle des liaisons azoïques et de la libération d'amines aromatiques. Par conséquent, les effets sur la santé des colorants azoïques dispersés ont été évalués en examinant leur potentiel de risque (y compris leur capacité de rupture réductrice et le risque potentiel de production d'amines aromatiques) et le potentiel d'exposition directe et prolongée de la population générale.
Un potentiel d'exposition directe et prolongée de la population générale due aux textiles était attendu pour 13 des 64 colorants azoïques dispersés étudiés dans le cadre de la présente évaluation préalable : Disperse Blue 79:1, Disperse Orange 30, Disperse Blue 79, ANAM, Disperse Brown 1:1, Disperse Brown 1, Disperse Red167, BANAP, n° CAS 52697-38-8, Disperse Orange 61, n° CAS 63833-78-3, ANMOM et Disperse Yellow 3. En dehors du Disperse Yellow 3, seules des données limitées sur les effets sur la santé de ces 13 substances étaient disponibles. Les niveaux d'effet critique retenus ont donc été basés sur celui du Disperse Yellow 3 et sur des données croisées provenant d'autres colorants azoïques dispersés ne faisant pas formellement partie de la présente évaluation, à savoir le Disperse Yellow 97 (Sudan I/Solvent Yellow 14) et le Disperse Red 17.
Les niveaux d'effet critique basés sur des données disponibles sur les risques ont été utilisés pour caractériser le risque posé par les 13 substances auxquelles la population générale du Canada pourrait être exposée. Les marges entre les estimations de l'exposition par contact direct et prolongé avec des textiles contenant ces colorants et le niveau d'effet critique ont été jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l'exposition.
En ce qui concerne la présente évaluation, aucun renseignement sur les sources actuelles d'exposition de la population générale aux 51 autres colorants azoïques dispersés évalués et sur leurs des effets sur la santé humaine n'a pu être relevé on ne s’attend pas à ce que la population générale du Canada soit exposée à ces substances. Par conséquent, il ne devrait pas y avoir de risque pour la population générale du Canada exposée à ces substances.
En se basant sur leur cancérogénicité potentielle, certains des colorants azoïques dispersés étudiés pour la présente évaluation s'avèrent préoccupants. Bien que les renseignements disponibles sur les niveaux d'exposition actuels à ces substances ne suggèrent aucun risque pour la santé des Canadiens, ces substances pourraient s'avérer inquiétantes si ces expositions venaient à augmenter.
En se basant sur les renseignements contenus dans la présente évaluation préalable et sur les renseignements sur le Disperse Yellow 3 (Solvent Yellow 77) contenus dans l'évaluation préalable des colorants azoïques avec solvant, on peut conclure que 64 de 74 substances de la présente évaluation préalable, y compris les 13 substances ayant déjà été évaluées et pour lesquelles de nouveaux renseignements importants sont disponibles, ainsi que l'ANMOM (n° CAS 59709-38-5), ne satisfont pas aux critères du paragraphe 64 c) de la LCPE 1999, car ils ne pénètrent pas dans l'environnement en une quantité, à une concentration ou dans des conditions constituant ou pouvant constituer un danger au Canada pour la vie ou la santé humaines. De plus, aucune mise à jour n'a été apportée aux conclusions formulées relativement au paragraphe 64 c) pour 10 substances précédemment étudiées par le gouvernement du Canada dans le cadre du Défi du PGPC.
Conclusion générale
Il est conclu que 73 des 74 colorants azoïques dispersés identifiés dans la présente évaluation ne satisfont à aucun des critères de l'article 64 de la LCPE 1999.
Il est conclu que la substance ayant le n° CAS 2832-40-8 (Disperse Yellow 3) satisfait à un ou plusieurs des critères de l'article 64 de la LCPE 1999. Les renseignements utilisés pour l'évaluation des risques pour la santé humaine posés par cette substance (sous le nom de Solvent Yellow 77) sont contenus dans l'évaluation préalable des colorants azoïques avec solvant.
Il a été déterminé que le Disperse Yellow 3 (n° CAS 2832-40-8) satisfait aux critères de persistance, mais pas à ceux de bioaccumulation, du Règlement sur la bioaccumulation et la persistance de la LCPE 1999.
1. Introduction
En vertu de l'article 68 ou 74 de la Loi canadienne sur la protection de l'environnement, 1999 [LCPE 1999] (Canada, 1999), le ministre de l'Environnement et le ministre de la Santé ont réalisé des évaluations préalables de substances afin de déterminer si elles présentent ou peuvent présenter un risque pour l'environnement ou la santé humaine.
L'Initiative des groupes de substances constitue un élément clé du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada. Le groupe des substances aromatiques azoïques et à base de benzidine comprend 358 substances qui ont été déclarées d'intérêt prioritaire pour une évaluation, car elles satisfaisaient aux critères de catégorisation en vertu de l'article 73 de la LCPE 1999 et/ou étaient considérées comme d'intérêt prioritaire en raison de préoccupations relatives à la santé humaine (Environnement Canada et Santé Canada, 2007). D'autres juridictions ont déterminé que certaines des substances de ce groupe étaient préoccupantes en raison du risque de rupture de leurs liaisons azoïques, qui peut entraîner la libération d'amines aromatiques connues pour être cancérogènes ou susceptibles de l'être.
Bien que bon nombre de ces substances aient des caractéristiques structurelles communes et des usages fonctionnels similaires comme colorants ou pigments dans plusieurs secteurs, nous avons tenu compte de la diversité de ces substances au sein de ce groupe en établissant des sous-groupes. L'établissement de sous-groupes en fonction de similitudes de structure, de propriétés physiques et chimiques et d'utilisations et applications fonctionnelles communes permet de tenir compte de la variabilité au sein de ce groupe de substances et de mettre en œuvre des approches propres à ces sous-groupes dans le cadre d'évaluations préalables. La présente évaluation préalable porte sur 74 substances, y compris :
- 73 colorants azoïques dispersés identifiés initialement dans ce sous-groupe, et
- la substance de n° CAS 2832-40-8 (ci-après appelée Disperse Yellow 3). Les préoccupations écologiques associées à l'exposition de l'environnement et aux effets sur l'environnement du Disperse Yellow 3 ont été étudiées dans le cadre de la présente évaluation en ce qui a trait à la formulation des colorants pour textiles et la coloration de textiles. D'autres renseignements (p. ex. les propriétés physiques et chimiques, les potentiels de persistance et de bioaccumulation, etc.) ont été présentés lors de l'évaluation préalable des colorants azoïques avec solvant. D'autres utilisations de cette substance, de même que les préoccupations relatives à la santé humaine, ont été étudiées dans le cadre de l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada, 2015). Les conclusions relatives à l'article 64 de la LCPE 1999 pour cette substance sont incluses dans la présente évaluation.
Pour chaque sous-groupe, la prise en compte des produits résultant de la rupture potentielle des liaisons azoïques (amines aromatiques) constitue un élément clé de l'évaluation des risques pour la santé humaine. Certaines amines aromatiques, communément appelées amines aromatiques inscrites sur la liste EU22Note de bas de page2, ainsi que des colorants azoïques connexes, font l'objet de restrictions dans d'autres pays (UE 2006). Des renseignements sur l'approche suivie pour l'établissement du sous-groupe des substances azoïques aromatiques et à base de benzidine dans le cadre du PGPC du Canada, ainsi que des renseignements de base additionnels et le contexte réglementaire, figurent dans un document distinct préparé par le gouvernement du Canada (Environnement Canada, Santé Canada, 2013).
Parmi les 74 substances étudiées pour la présente évaluation, 24 ont déjà fait l'objet d'une évaluation dans le cadre du Défi (tableau 1-1), et des soumissions relatives à leurs propriétés, à leur persistance, aux risques qu'elles posent et à leurs utilisations ont été reçues à ce moment-là (Canada 2006, 2008a, 2008b et 2008c). Étant donné qu'il existe de nouvelles données sur leur écotoxicité, le risque écologique posé par ces 24 substances a été évalué dans le cadre du sous-groupe des colorants azoïques dispersés. Par conséquent, les conclusions ayant trait à l'environnement ont été mises à jour au besoin.
De la même manière, des conclusions relatives aux risques pour la santé humaine posés par 14 de ces 24 substances du Défi seront tirées dans le cadre de la présente évaluation. Les conclusions de la présente évaluation porteront aussi sur les colorants azoïques dispersés pour lesquels de nouveaux renseignements significatifs ayant trait à la santé humaine ont été identifiés (Disperse Orange 30, Disperse Orange 5, Disperse Blue79, ANAM, n° CAS 16421-41-3, Disperse Brown 1:1, Disperse Brown 1, Disperse Red 167, BANAP, n° CAS 52697-38-8, Disperse Orange 61, n° CAS 55619-18-6, n° CAS 72927-94-7), et sur une autre substance, ANMOM (n° CAS 16421-40-2), qui avait été évaluée dans le cadre du Défi, mais pour laquelle aucune conclusion n'avait été avancée.
| N° CAS | Nom générique du C.I. ou acronymea |
|---|---|
| 5261-31-4 | Disperse Orange 30b |
| 6232-56-0 | Disperse Orange 5b |
| 6250-23-3 | Disperse Yellow 23c |
| 6253-10-7 | Disperse Orange 13c |
| 6300-37-4 | Disperse Yellow 7c |
| 12239-34-8 | Disperse Blue 79b |
| 16421-40-2 | ANAMb |
| 16421-41-3 | s.ob |
| 16586-42-8 | Disperse Red 179c |
| 17464-91-4 | Disperse Brown 1:1b |
| 19800-42-1 | Disperse Orange 29c |
| 21811-64-3 | Disperse Yellow 68c |
| 23355-64-8 | Disperse Brown 1b |
| 25176-89-0 | DAPEPc |
| 26850-12-4 | Disperse Red 167b |
| 29765-00-2 | BANAPb |
| 52697-38-8 | NAb |
| 55281-26-0 | Disperse Orange 61b |
| 55619-18-6 | NAb |
| 59709-38-5 | ANMOMd |
| 72927-94-7 | NAb |
| 72968-82-2 | DADMc |
| 93805-00-6 | NAc |
| 106276-78-2 | MATCBc |
Abréviation : s.o. = sans objet
a Acronyme utilisé précédemment pour la substance dans le cadre du Défi
b Évaluations des effets sur l'environnement et la santé mises à jour
c Évaluation des effets sur l'environnement mise à jour seulement
d L'ANMOM a été évalué, mais aucune conclusion n'a été avancée lors du lot 12 du Défi
De plus, 33 colorants azoïques dispersés (tableau 1-2) ont déjà été visés, en avril 2008, par l'évaluation préalable de 145 substances persistantes, bioaccumulables et intrinsèquement toxiques (PBTi) qui n'étaient pas considérées commercialisées. Certains renseignements sur ces substances, y compris des soumissions ayant trait à leurs utilisations, reçues à cette époque, sont utilisés dans la présente évaluation pour étayer l'évaluation du sous-groupe de certains colorants azoïques dispersés (Environnement Canada et Santé Canada 2009, 2010, 2011). En se basant sur ces nouveaux renseignements significatifs relatifs à l'évaluation écologique des colorants azoïques dispersés, ces 33 substances ont fait l'objet d'une évaluation visant à déterminer les risques qu'elles posent à l'environnement. De la même manière, aux fins de la présente évaluation des risques pour la santé humaine, ces 33 substances ont été évaluées et des conclusions ont été tirées.
| Nom de la substance | Nom générique dans le C.I. |
|---|---|
| 2537-62-4 | s.o. |
| 6465-02-7 | s.o. |
| 15958-27-7 | s.o. |
| 19745-44-9 | s.o. |
| 24610-00-2 | s.o. |
| 25150-28-1 | s.o. |
| 28824-41-1 | s.o. |
| 31030-27-0 | s.o. |
| 33979-43-0 | s.o. |
| 41362-82-7 | s.o. |
| 42852-92-6 | s.o. |
| 55252-53-4 | s.o. |
| 56532-53-7 | s.o. |
| 61799-13-1 | s.o. |
| 63133-84-6 | s.o. |
| 63134-15-6 | Disperse Red 338 |
| 63833-78-3 | s.o. |
| 68214-66-4 | s.o. |
| 68516-64-3 | s.o. |
| 68877-63-4 | s.o. |
| 70210-08-1 | Disperse Red 151 |
| 70660-55-8 | s.o. |
| 72828-63-8 | s.o. |
| 72828-64-9 | Disperse Blue 287 |
| 73003-64-2 | s.o. |
| 73398-96-6 | Disperse Brown 21 |
| 79542-46-4 | Disperse Red 349 |
| 83249-47-2 | s.o. |
| 83249-49-4 | s.o. |
| 83249-53-0 | s.o. |
| 83249-54-1 | s.o. |
| 90729-40-1 | s.o. |
| 127126-02-7 | s.o. |
Abréviation : s.o. = sans objet
Les évaluations préalables sont centrées sur des renseignements critiques permettant de déterminer si les substances satisfont aux critères de l'article 64 de la LCPE 1999. Pour ce faire, les renseignements scientifiques sont examinés afin de pouvoir tirer des conclusions en intégrant une approche basée sur le poids de la preuve et le principe de prudenceNote de bas de page3.
La présente évaluation préalable tient compte de considérations ayant trait aux propriétés chimiques, au devenir dans l'environnement, aux dangers, aux utilisations et à l'exposition, y compris des renseignements supplémentaires soumis par les parties prenantes. Nous avons relevé des données pertinentes jusqu'en août 2014. Des données empiriques provenant d'études clés, ainsi que certains résultats de modélisation, ont servi à formuler des conclusions. Lorsqu'ils étaient disponibles et pertinents, des renseignements contenus dans les évaluations effectuées par d'autres juridictions ont été prises en compte.
L'évaluation préalable constitue un examen critique des données disponibles importantes. Elle fait état des études et des éléments de preuve pertinents pour la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada et elle intègre des données d'autres programmes de ces ministères. Les parties de la présente évaluation préalable portant sur la santé humaine et l'écologie ont fait l'objet d'un examen et/ou de consultations externes par écrit par des pairs. Des commentaires sur les parties techniques ayant trait à l'environnement ont été reçus du Dr Harold Freeman (Université d'état de la Caroline du Nord, États-Unis) et du Dr Gisela Umbuzeiro (Université de Campinas, Brésil). Le Dr Harold Freeman (Université d'état de la Caroline du Nord, États-Unis), le Dr David Josephy (Université de Guelph, Canada), le Dr Michael Bird (Université d'Ottawa, Canada) et le Dr Kannan Krishnan (Université de Montréal, Canada) ont fourni des commentaires sur les parties techniques concernant la santé humaine. De plus, l'ébauche de la présente évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Bien que les commentaires externes soient pris en compte, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de la présente évaluation préalable.
Les renseignements et considérations critiques sur lesquels repose la présente évaluation préalable sont présentés ci-après.
2. Identité des substances
La présente évaluation préalable est centrée sur 73 substances appartenant au sous-groupe des colorants azoïques dispersés, sous-groupe faisant partie du groupe de substances azoïques aromatiques et à base de benzidine. Les 73 colorants azoïques dispersés de ce sous-groupe sont tous des produits chimiques définis dont la masse moléculaire va de 302 à 639 g/mol. De ces 73 substances, 62 sont des colorants monoazoïques et 11 des colorants diazoïques.
La partie de la présente évaluation préalable sur l'environnement porte sur 74 substances, sur les 73 du groupe des colorants azoïques dispersés ainsi que sur les utilisations du Disperse Yellow 3 pour la formulation de colorants pour textiles et pour la coloration de textiles.
Dans la présente évaluation préalable, nous utilisons le nom des colorants azoïques dispersés se retrouvant dans le Colour Index, s'il est disponible, ou leur acronyme utilisé dans le cadre du Défi. Autrement, le n° CAS de la substance est utilisé.
Aux fins de la présente évaluation, les colorants azoïques dispersés sont divisés en six groupes de composés de structure similaire dans le but de faciliter la caractérisation de leurs propriétés physiques et chimiques. Ces groupes structurels sont fondés sur 1) le nombre de liaisons azoïques, 2) le nombre de cyles aromatiques et d'autres cycles hétérocycliques et 3) une variété de fragments structurels présents dans les structures chimiques. L'identité des substances de ces six groupes, y compris la dimension maximale de leur section (Dmax) et leur diamètre efficace (Deff), sont donnés dans les tableaux 2-1 à 2-6. Trois autres substances qui possèdent une structure chimique unique sont répertoriées séparément dans le tableau 2-7. Les structures chimiques de ces 73 colorants azoïques dispersés sont présentées à l'annexe A, classées en fonction de chaque groupe structurel. L'identité du Disperse Yellow 3 est donnée dans le tableau 2-8.
| N° CAS | Nom dans la LIS | Nom générique du C.I. | Masse moléculaire (g/mol) |
Dmax minimum-maximum (nm) |
Deff (nm) |
|---|---|---|---|---|---|
| 6250-23-3 | p-[[p-(Phénylazo)phényl]azo] phénol | Disperse Yellow 23 | 302 | 1,53-2,07 | 0,77 |
| 6300-37-4 | 4-[[p-(Phénylazo)phényl]azo]-o-crésol | Disperse Yellow 7 | 316 | 1,34-2,07 | 0,86 |
| 6465-02-7 | [4-[[4-[(4-Hydroxyphényl)azo]-2-méthylphényl]azo]phényl]-carbamate de méthyle | s.o. | 389 | 1,40-2,50 | 1,02 |
| 6657-00-7 | 4-[[2-Méthoxy-5-méthyl-4-(phénylazo)phényl]azo] phénol | s.o. | 346 | 1,24-2,06 | 0,99 |
| 19800-42-1 | 4-[[2-Méthoxy-4-[(4-nitrophényl)azo]phényl]azo)]phénol | Disperse Orange 29 | 377 | 1,26-2,19 | 0,99 |
| 21811-64-3 | p,p′-[p-Phénylènebis(azo)]bisphénol | Disperse Yellow 68 | 318 | 1,64-2,13 | 0,81 |
| 27184-69-6 | 4,4'-[p-Phénylènebis(azo)]di-m-crésol | s.o. | 346 | 1,21-2,14 | 0,86 |
| 93805-00-6 | p-[[2-Méthoxy-4-[(2-méthoxyphényl)azo]-5-méthylphényl]azo]phénol | s.o. | 376 | 1,29-2,06 | 1,01 |
Abréviation : s.o. = sans objet
a En se basant sur une gamme de diamètres maximums (Dmax) pour les conformères, calculés au moyen des modèles CPOP (2008)
| N° CAS | Nom dans la LIS | Nom générique du C.I. | Masse moléculaire (g/mol) | Dmax minimum-maximum (nm) | Deff (nm) |
|---|---|---|---|---|---|
| 6253-10-7 | p-[[4-(Phénylazo)-1-naphtyl]azo]phénol | Disperse Orange 13 | 352 | 1,22-2,07 | 1,02 |
| 58104-55-5 | 6-Hydroxy-N-(2-hydroxyéthyl)-N-méthyl-5-[[4-(phénylazo)phényl]azo] naphtalène-2-sulfonamide | s.o. | 490 | 1,39-2,50 | 1,13 |
| 70210-08-1 | N-(2-Acétoxyéthyl)-6-hydroxy-N-méthyl-5-[[4-(phénylazo)phényl]azo] naphtalène-2-sulfonamide | Disperse Red 151 | 532 | 1,55-2,76 | 1,20 |
Abréviation : s.o. = sans objet
| N° CAS | Nom dans la LIS | Nom générique du C.I ou acronyme. | Masse moléculaire (g/mol) | Dmax minimum-maximum (nm) | Deff (nm) |
|---|---|---|---|---|---|
| 16586-42-8 | 3-[Éthyl[3-méthyl-4-[(6-nitrobenzothiazol-2-yl)azo]phényl] amino]propiononitrile | Disperse Red 179 | 394 | 1,58-2,13 | 1,01 |
| 19745-44-9 | 3-[4-[(5-Nitrothiazol-2-yl)azo](2-phényléthyl)amino]propiononitrile | s.o. | 406 | 1,46-2,14 | 1,06 |
| 25150-28-1 | 3-[[4-[(6,7-Dichlorobenzothiazol-2-yl)azo]phényl]éthylamino] propiononitrile | s.o. | 404 | 1,52-2,06 | 0,93 |
| 25176-89-0 | 3-[[4-[(5,6-Dichlorobenzothiazol-2-yl)azo]phényl] éthylamino]propiononitrile | DAPEP | 404 | 1,52-2,13 | 0,93 |
| 28824-41-1 | 3-{[p-(4,6-Dibromobenzothiazol-2-ylazo)-N-éthylanilino]}propiononitrile | s.o. | 493 | 1,47-2,52 | 0,97 |
| 33979-43-0 | 3-{N-(2-Acétoxyéthyl)[4-(5,6-dichlorobenzothiazol-2-ylazo)]anilino}propiononitrile | s.o. | 462 | 1,60-2,25 | 1,11 |
| 41362-82-7 | 3-[[4-[(5,6-Dichlorobenzothiazol-2-yl)azo]phényl]méthylamino] propiononitrile | s.o. | 390 | 1,58-2,13 | 1,11 |
| 63134-15-6 | N-[5-(Dipropylamino)-2-[[5-(éthylthio)-1,3,4-thiadiazol-2-yl]azo]phényl]acétamide | Disperse Red 338 | 407 | 1,37-2,09 | 1,11 |
| 67905-67-3 | 3-[Butyl[4-[(6-nitro-2-benzothiazolyl)azo]phényl]amino]propiononitrile | s.o. | 408 | 1,58-2,23 | 1,03 |
| 127126-02-7 | 3-[N-(2-Acétoxyéthyl)-p-(6,7-dichlorobenzothiazol-2-ylazo)anilino]propionitrile | s.o. | 462 | 1,65-2,30 | 1,04 |
Abréviation : s.o. = sans objet
| N° CAS | Nom dans la LIS | Nom générique du C.I. ou acronyme | Masse moléculaire (g/mol) | Dmax minimum-maximum (nm) | Deff (nm) |
|---|---|---|---|---|---|
| 2537-62-4 | N-[2-(2-Bromo-6-cyano-4-nitrophénylazo)-5-(diéthylamino)phényl]acétamide | s.o. | 459 | 1,36-1,81 | 1,11 |
| 3618-72-2 | Diacétate de 2,2'-{[5-acétamido-4-(2-bromo-4,6-dinitrophénylazo)-2-méthoxyphényl]imino}diéthyle | Disperse Blue 79:1 | 625 | 1,43-2,03 | 1,23 |
| 5261-31-4 | Acétate de 2-{N-(2-cyanoéthyl)-4-[(2,6-dichloro-4-nitrophényl)azo]anilino}éthyle | Disperse Orange 30 | 450 | 1,43-2,12 | 1,04 |
| 6232-56-0 | 2-([4-[(2,6-Dichloro-4-nitrophényl)azo]phényl]méthylamino) éthanol | Disperse Orange 5 | 369 | 1,33-1,85 | 0,88 |
| 12239-34-8 | Diacétate de 2,2′-{[5-acétamido-4-(2-bromo-4,6-dinitrophénylazo)-2-méthoxyphényl]imino}diéthyle | Disperse Blue 79 | 639 | 1,57-2,08 | 1,29 |
| 15958-27-7 | Carbanilate de 2-[(2-cyanoéthyl)[p-[(p-nitrophényl)azo]phényl]amino]éthyle | s.o. | 458 | 1,57-2,54 | 1,21 |
| 16421-40-2 | Acétate de 2-[[5-acétamide-4-[(2-chloro-4,6-dinitrophényl)azo]-2-méthoxyphényl]benzylamino] éthyle | ANAM | 585 | 1,55-2,14 | 1,27 |
| 16421-41-3 | Acétate de 2-[[5-acétamido-4-[(2,4-dinitrophényl)azo]-2-méthoxyphényl]benzylamino] éthyle | s.o. | 551 | 1,55-2,13 | 1,22 |
| 17464-91-4 | 2,2′-([4-[(2-Bromo-6-chloro-4-nitrophényl)azo]-3-chlorophényl]imino)biséthanol | Disperse Brown 1:1 | 478 | 1,41-1,84 | 0,95 |
| 23355-64-8 | 2,2′-[[3-chloro-4-[(2,6-dichloro-4-nitrophényl)azo]phényl]imino] biséthanol | Disperse Brown 1 | 434 | 1,39-1,85 | 0,81 |
| 24610-00-2 | 2-[[4-[(2-Cyanoéthyl)(2-phényléthyl)amino]phényl]azo]-5-nitrobenzonitrile | s.o. | 424 | 1,38-2,16 | 1,11 |
| 26021-20-5 | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-5-[(2-cyanoéthyl)(2-hydroxyéthyl)amino]-4-méthoxyphényl]acétamide | Disperse Blue 94 | 550 | 1,45-1,95 | 1,17 |
| 26850-12-4 | Acétate de 2-[N-(2-acétoxyéthyl)-4-chloro-2-nitro-5-[2-(propionamido)anilino]anilino]éthyle | Disperse Red 167 | 520 | 1,49-2,11 | 1,21 |
| 29765-00-2 | Diacétate de 3-benzamido-4-[p-nitrophényl)azo]phényliminodiéthyle | BANAP | 534 | 1,57-2,13 | 1,30 |
| 31030-27-0 | 4-[(2-Chloro-4-nitrophényl)azo]-N-éthyl-N-(2-phénoxyéthyl)aniline | s.o. | 425 | 1,53-2,31 | 1,08 |
| 42852-92-6 | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-4-méthoxy-5-[(phénylméthyl)allylamino]phényl]acétamide | s.o. | 583 | 1,39-2,13 | 1,19 |
| 52697-38-8 | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-5-(diéthylamino)phényl]acétamide | s.o. | 479 | 1,33-1,81 | 1,08 |
| 53950-33-7 | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-5-[(2-cyanoéthyl)(2-hydroxyéthyl)amino]-4-méthoxyphényl]acétamide | s.o | 506 | 1,43-1,98 | 1,14 |
| 55252-53-4 | N-[2-[2-Cyano-6-iodo-4-nitrophénylazo]-5-(diéthylamino)phényl]acétamide | s.o | 506 | 1,41-1,81 | 1,13 |
| 55281-26-0 | 3-[[4-(2,6-Dibromo-4-nitrophénylazo)phényl]éthylamino] propiononitrile | Disperse Orange 61 | 481 | 1,42-1,91 | 0,94 |
| 55619-18-6 | Diacétate de 2,2′-[[4-[2,6-dibromo-4-nitrophénylazo]phényl]imino] diéthyle | s.o. | 572 | 1,50-2,10 | 1,16 |
| 56532-53-7 | N-[2-[(2,6-Dicyano-4-nitrophényl)azo]-5-(dipropylamino)phényl]acétamide | s.o. | 433 | 1,48-1,92 | 1,15 |
| 59709-38-5 | N-[4-[(2-Bromo-6-chloro-4-nitrophényl)azo]phényl]-N-(3-méthoxy-3-oxopropyl)-β-alaninate de méthyle | ANMOM | 528 | 1,37-2,15 | 1,14 |
| 63133-84-6 | 6-(2-Chloro-4,6-dinitrophénylazo)-3,4-dihydro-2,2,4,7-tétraméthyl-2H-quinoléine-1-éthanol | s.o. | 462 | 1,39-1,89 | 1,01 |
| 66693-26-3 | N-[5-[Bis[2-(2-cyanoéthoxy)éthyl]amino]-2-[(2-chloro-4,6-dinitrophényl)azo]-4-méthoxyphényl]propionamide | Disperse Blue 125 | 617 | 1,74-2,34 | 1,34 |
| 68214-66-4 | [2-[(2-Chloro-4-nitrophényl)azo]-5-(diéthylamino)phényl]carbamate de 2-éthoxyéthyle | s.o. | 464 | 1,33-2,05 | 1,23 |
| 68516-64-3 | Acétate de 2-[4-[(2-chloro-4-nitrophényl)azo]-N-(2-cyanoéthyl)-3-méthylanilino]éthyle | s.o. | 430 | 1,43-2,15 | 1,10 |
| 68877-63-4 | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-5-[(2-cyanoéthyl)allylamino]-4-méthoxyphényl]acétamide | s.o. | 546 | 1,46-1,94 | 1,18 |
| 69472-19-1 | 3-[Butyl[4-[(4-nitrophényl)azo]phényl] amino]propiononitrile | s.o. | 351 | 1,78-2,05 | 0,97 |
| 72828-63-8 | Acétate de 2-[[4-[(5-bromo-2-cyano-3-nitrophényl)azo]-3-méthylphényl]butylamino]éthyle | s.o. | 502 | 1,41-2,07 | 1,16 |
| 72828-64-9 | Acétate de [[4-[(2,6-dicyano-4-nitrophényl)azo]-3-méthylphényl]amino]hexyle | Disperse Blue 287 | 448 | 1,77-2,12 | 1,13 |
| 72927-94-7 | 4-[(2,6-Dichloro-4-nitrophényl)azo]-N-(4-nitrophényl)aniline | s.o. | 432 | 1,43-2,10 | 0,94 |
| 72968-82-2 | N-[2-[(2,6-Dicyano-p-tolyl)azo]-5-(dipropylamino)phényl]méthanesulfonamide | DADM | 439 | 1,51-1,90 | 1,17 |
| 73003-64-2 | 7-[4-[(2,6-Dichloro-4-nitrophényl)azo]-3-oxo-m-tolyl-2,4,10-trioxa-7-azaundécan-11-oate de méthyle | s.o. | 529 | 1,34-2,21 | 1,19 |
| 79542-46-4 | N-[4-Chloro-2-[2-(2-chloro-4-nitrophényl)azo]-5-[(2-hydroxy-3-phénoxypropyl)amino]phényl]acétamide | Disperse Red 349 | 518 | 1,47-2,43 | 1,22 |
| 83249-47-2 | N-[2-[(2-Bromo-6-cyano-4-nitrophényl)azo]-5-(dipropylamino)phényl]acétamide | s.o. | 487 | 1,42-1,93 | 1,13 |
| 83249-49-4 | 3-Bromo-2-[[4-(diéthylamino)-o-tolyl]azo]-5-méthylbenzonitrile | s.o. | 385 | 1,39-1,77 | 0,96 |
| 83249-53-0 | N-[2-[(2-Bromo-6-cyano-p-tolyl)azo]-5-(diéthylamino)phényl]méthanesulfonamide | s.o. | 464 | 1,41-1,76 | 1,09 |
| 83249-54-1 | N-[2-[(2-Bromo-6-cyano-p-tolyl)azo]-5-(dipropylamino)phényl]méthanesulfonamide | s.o. | 492 | 1,40-1,90 | 1,13 |
| 106276-78-2 | 2,3,4,5-Tétrachloro-6-cyanobenzoate de méthyle, produits de réaction avec la 4-[(p-aminophényl)azo]-3-méthylaniline et le méthylate de sodium | MATCB | 493 | 1,24-2,20 | 1,03 |
Abréviation : s.o. = sans objet
| N° CAS | Nom dans la LIS | Nom générique du C.I. | Masse moléculaire (g/mol) | Dmax minimum-maximum (nm) | Deff (nm) |
|---|---|---|---|---|---|
| 51249-07-1 | 1-(2-Éthylhexyl)-1,2-dihydro-6-hydroxy-4-méthyl-5-(2-nitrophénylazo)-2-oxonicotinonitrile | s.o. | 411 | 1,34-1,92 | 1,14 |
| 55290-62-5 | 4-[(1-Butyl-5-cyano-1,6-dihydro-2-hydroxy-4-méthyl-6-oxo-3-pyridyl)azo]-N-(2-éthylhexyl)benzènesulfonamide | s.o. | 502 | 1,45-2,43 | 1,18 |
| 61799-13-1 | 5-[(2-Cyano-4-nitrophényl)azo]-2-[(2-hydroxyéthyl)amino]-4-méthyl-6-{[3-(2-phénoxyéthoxy)propyl]amino}-3-pyridinecarbonitrile | s.o. | 545 | 1,64-2,41 | 1,37 |
| 63833-78-3 | 5-[(2-Cyano-4-nitrophényl)azo]-6-[(2-hydroxyéthyl)amino]-4-méthyl-2-[[3-(2-phénoxyéthoxy)propyl]amino]nicotinonitrile | s.o. | 545 | 1,77-2,81 | 1,25 |
| 68214-63-1 | 5-[(3,4-Dichlorophényl)azo]-1,2-dihydro-6-hydroxy-4-méthyl-2-oxo-1-anilinonicotinonitrile | s.o. | 414 | 1,28-1,81 | 1,14 |
| 68992-01-8 | 1-(2-Éthylhexyl)-1,2-dihydro-6-hydroxy-5-[(4-méthoxy-2-nitrophényl)azo]-4-méthyl-2-oxonicotinonitrile | s.o. | 441 | 1,31-1,93 | 1,16 |
| 90729-40-1 | 1-Butyl-5-[[4-(4-chlorobenzoyl)-2-nitrophényl]azo]-1,2-dihydro-6-hydroxy-4-méthyl-2-oxonicotinonitrile | s.o. | 494 | 1,43-2,26 | 1,15 |
Abréviation : s.o. = sans objet
| N° CAS | Nom dans la LIS | Nom générique du C.I. | Masse moléculaire (g/mol) | Dmax minimum-maximum (nm) | Deff (nm) |
|---|---|---|---|---|---|
| 42357-98-2 | 6-Hydroxy-5-[(2-méthoxy-4-nitrophényl)azo]-2-méthyl-1H-benzo[de]isoquinoléine-1,3(2H)-dione | s.o. | 406 | 1,46-1,78 | 1,01 |
| 42358-36-1 | 2-Éthyl-6-hydroxy-5-[(2-méthoxy-4-nitrophényl)azo]-1H-benzo[d,e]isoquinoléine-1,3(2H)-dione | s.o. | 420 | 1,41-1,84 | 1,04 |
Abréviation : s.o. = sans objet
| N° CAS | Nom dans la LIS | Nom générique du C.I. | Masse moléculaire (g/mol) | Dmax minimum-maximum (nm) | Deff (nm) |
|---|---|---|---|---|---|
| 65122-05-6 | [(1,3-Dihydro-1,1,3-triméthyl-2H-indén-2-ylidène)méthane]azo(2-méthoxybenzène) | s.o. | 306 | 1,34-1,61 | 0,88 |
| 70660-55-8 | 4-[(2-Bromo-4,6-dinitrophényl)azo]-N-(3-méthoxypropyl)naphtalén-1-amine | s.o. | 488 | 1,33-2,15 | 1,09 |
| 73398-96-6 | 5-[(9,10-Dihydro-9,10-dioxo-1-anthryl)azo]-2,6-bis[(2-méthoxyéthyl)amino]-4-méthylnicotinonitrile | Disperse Brown 21 | 499 | 1,59-2,02 | 1,25 |
Abréviation : s.o. = sans objet
| N° CAS | Nom dans la LIS | Nom générique du C.I. | Masse moléculaire (g/mol) | Dmax minimum-maximum (nm) | Deff (nm) |
|---|---|---|---|---|---|
| 2832-40-8 | N-[4-(2-Hydroxy-5-tolylazo)phényl]acétamide | Disperse Yellow 3 (Solvent Yellow 77) | 269.3 | 1,27-1,71 | 0,84 |
Abréviation : s.o. = sans objet
a Substance évaluée en raison de préoccupations écologiques ayant trait seulement à la formulation de colorants pour textiles et la coloration de textiles
2.1 Sélection des analogues et utilisation de modèles de relation quantitative structure-activité [R(Q)SA]
Un document d'orientation sur l'utilisation d'approches de lecture croisée a été préparé par divers organismes, comme l'Organisation de coopération et de développement économiques (OCDE 2014). Il a été utilisé dans divers programmes de réglementation, dont le Programme sur les substances existantes de l'union européenne (UE). La méthode générale pour la sélection des analogues et l'utilisation de modèles de relation (quantitative) structure-activité (R(Q)SA) sont données dans le document d'Environnement Canada et Santé Canada de 2013. En ce qui concerne la caractérisation des effets sur la santé humaine, les éléments sur lesquels repose l'utilisation d'analogues et/ou des données de modélisation R(Q)SA sont donnés dans la section « Évaluation des effets sur la santé » du présent document.
Les analogues utilisés pour obtenir des renseignements pour l'évaluation écologique ont été choisis en fonction de la disponibilité de données empiriques pertinentes sur les propriétés physicochimiques, la persistance, la bioaccumulation et l'écotoxicité. De telles données ont été utilisées pour obtenir des données croisées sur les colorants azoïques dispersés pour lesquels il y avait des lacunes de données ou pour étayer le poids de la preuve fournie par des données empiriques existantes. Bien que les données sur des analogues soient utilisées de préférence pour combler les lacunes de données sur les substances visées par la présente évaluation, l'applicabilité des modèles de R(Q)SA aux colorants azoïques dispersés a été déterminée au cas par cas.
Les analogues sélectionnés pour les substances de ce sous-groupe sont indiqués dans le tableau 2-8 et sont marqués d'un astérisque (*) placé à la fin du nom générique du C.I. ou du n° CAS, lorsqu'ils sont mentionnés dans la présente évaluation. En ce qui a trait à l'estimation des propriétés physiques et chimiques, les analogues pour lesquels des données expérimentales existent sont indiqués avec les colorants azoïques dispersés dans les groupes structurels (voir l'annexe 1). Dans le cas de l'évaluation du potentiel de persistance et de bioaccumulation, ainsi que de la caractérisation des effets écologiques des colorants azoïques dispersés, les analogues pour lesquels des données expérimentales existent sont présentés dans les sections correspondantes.
| N° CASa | Nom chimique | Nom générique du C.I.a | Données expérimentales prises en compte dans le rapport |
|---|---|---|---|
| 85-83-6* | 1-(2-Méthyl-4-(2-méthylphénylazo)phénylazo)napht-2-ol | Solvent Red 24* | Écotoxicité |
| 842-07-9* | 1-Phénylazonapht-2-ol | Disperse Yellow 97 (Sudan I/Solvent Yellow 14) | Risque pour la santé humaine |
| 1533-74-0* | Diacétate de 2,2'-[[3-acétamide-4-[(4-nitrophényl)azo] phényl]imino]diéthyle | Disperse Red 74:1* | Bioconcentration |
| 12222-69-4* | 2,2'-[[4-[(4-Aminophényl)azo]phényl]imino]biséthanol | Disperse Black 9* | Risque pour la santé humaine |
| 2581-69-3* | 4-(4-Nitrophénylazo)-N-phénylaniline | Disperse Orange 1* | Propriétés physicochimiques et écotoxicité (avec impureté) |
| 2872-52-8* | 2-{Éthyl[4-(4-nitrophénylazo)phényl]amino}éthanol | Disperse Red 1* | Propriétés physicochimiques, demi-vie dans les sédiments et écotoxicité |
| 3025-52-3* | N,N-Diéthyl-4-[(4-nitrophényl)azo]aniline | s.o. | Propriétés physicochimiques |
| 3179-89-3* | 2,2'-{[3-Méthyl-4-(4-nitrophénylazo)phényl]imino}diéthanol | Disperse Red 17* | Écotoxicité et risques pour la santé humaine |
| 3180-81-2* | 2-{[4-(2-Chloro-4-nitrophénylazo)phényl]éthylamino}éthanol | Disperse Red 13* | Propriétés physicochimiques et écotoxicité (avec impureté) |
| 3769-57-1* | 2,2'-{[4-(2-Chloro-4-nitrophénylazo)-m-tolyl]imino}diéthanol | Disperse Red 5* | Propriétés physicochimiques et demi-vie dans les sédiments |
| 6657-33-6* | 3-[4-[(2-Chloro-4-nitrophényl)azo]phényl](2-hydroxyéthyl)amino]propiononitrile | s.o. | Propriétés physicochimiques et bioconcentration |
| 13301-61-6* | 3-({4-[(2,6-Dichloro-4-nitrophényl)azo]phényl}éthylamino)propiononitrile | Disperse Orange 37* | Écotoxicité |
| 16889-10-4* | 2-[[4-[(2-Cyanoéthyl)éthylamino]phényl]azo]-5-nitrobenzonitrile | Disperse Red 73* | Écotoxicité |
| 26630-87-5* | Benzamide, N-[5-[bis[2-(acétyloxy)éthyl]amino]-2-[2-(6-chloro-2-benzothiazolyl)diazényl]phényl]- | s.o. | Biodégradation, bioconcentration et écotoxicité |
| 30449-81-1* | p-[(5-Cyano-1,6-dihydro-2-hydroxy-1,4-diméthyl-6-oxo-3-pyridyl)azo]-N-(2-éthylhexyl)benzamide | s.o. | Propriétés physicochimiques et bioconcentration |
| 31482-56-1* | 3-[Éthyl[4-[(4-nitrophényl)azo]phényl]amino]propiononitrile | Disperse Orange 25* | Écotoxicité |
| 40690-89-9* | Benzoate de 2-{-N-(2-cyanoéthyl)-4-[(p-nitrophényl)azo]anilino}éthyle | Disperse Orange 73* | Propriétés physicochimiques, biodégradation et écotoxicité |
| 41642-51-7* | N-[2-[(2,6-dicyano-4-nitrophényl)azo]-5-(diéthylamino)phényl]acétamide | Disperse Blue 165* | Propriétés physicochimiques |
| 51248-73-8* | N-[3-(acétylamino)-4-[(2-chloro-4-nitrophényl)azo]phényl]-N-(2-cyanoéthyl)-β-alaninate de 2-méthoxyéthyle | s.o. | Propriétés physicochimiques (calculées) et bioconcentration |
| 51249-07-1* | 1-(2-Éthylhexyl)-1,2-dihydro-6-hydroxy-4-méthyl-5-(2-nitrophénylazo)-2-oxonicotinonitrile | s.o. | Bioaccumulation |
| 56548-64-2* | N-[2-[(2-Bromo-4,6-dinitrophényl)azo]-5-(diéthylamino)-4-méthoxyphényl]acétamide | Disperse Blue 291* | Écotoxicité |
| 58528-60-2* | 2,2'-[[4-[(2,6-Dichloro-4-nitrophényl)azo]-3-méthylphényl]imino]biséthanol | s.o. | Propriétés physicochimiques |
| 58979-46-7* | N-[5-(Diéthylamino)-2-[(3,5-dinitro-2-thiényl)azo]phényl]acétamide | Disperse Green 9* | Bioconcentration |
| 61038-97-9* | 4-[[2-(Acétylamino)-4-[bis(3-méthoxy-3-oxopropyl)amino]phényl]azo]benzoate de méthyle | s.o. | Bioconcentration |
| 62072-81-5* | N-[5-(Acétylamino)-4-[(2,4-dinitrophényl)azo]-2-méthoxyphényl]-N-(3-méthoxy-3-oxopropyl)-β-alaninate de méthyle | s.o. | Bioconcentration |
| 63134-15-6* | N-[5-(Dipropylamino)-2-[[5-(éthylthio)-1,3,4-thiadiazol-2-yl]azo]phényl]acétamide | Disperse Red 338* | Risque pour la santé humaine |
| 63439-92-9* | Ce no CAS n'est pas indiqué dans la LIS, la LES ou ChemID. Aucun nom chimique n'était indiqué dans les NCI. | Disperse Yellow 198* | Bioaccumulation |
| 65125-87-3* | Ce no CAS n'est pas indiqué dans la LIS, la LES, les NCI ou ChemID. | s.o. | Propriétés physicochimiques |
| 67923-43-7* | 3,3'-[[4-[(2,6-Dichloro-4-nitrophényl)azo]phényl]imino]dipropiononitrile | Disperse Yellow 163* | Propriétés physicochimiques, biodégradation, bioconcentration et écotoxicité |
| 68110-29-2* | Diacétate de 2,2'-[[4-[(3,5-dinitro-2-thiényl)azo]-3-méthylphényl]imino]diéthyle | s.o. | Bioconcentration |
| 68133-69-7* | Acétate de 2-[(2-cyanoéthyl)[4-[(6-nitrobenzothiazol-2-yl)azo]phényl]amino]éthyle | Disperse Red 177* | Propriétés physicochimiques et bioconcentration |
| 70198-17-3* | Acétate de 2-[[4-[(6-chlorobenzothiazol-2-yl)azo]phényl]éthylamino]éthyle (LES) | s.o. | Écotoxicité |
| 70528-90-4* | 5-[(4-Chloro-2-nitrophényl)azo]-1-éthyl-1,2-dihydro-6-hydroxy-4-méthyl-2-oxonicotinonitrile | Disperse Yellow 211* | Propriétés physicochimiques |
| 71617-28-2* | N-[4-Chloro-2-[(2-chloro-4-nitrophényl)azo]-5-[(2-hydroxypropyl)amino]phényl]acétamide | s.o. | Propriétés physicochimiques et bioconcentration |
| 73384-66-4* | 2-Cyano-4-nitro-2'-chloro-4'-[bis(2-éthoxycarbonyloxyéthyl)amino]azobenzene | s.o. | Bioconcentration |
| 129710-76-5* | Ce no CAS n'est pas indiqué dans la LIS, la LES, les NCI ou ChemID. | Disperse Red 206* | Risque pour la santé humaine |
| NA | Analogue pour le Disperse Brown 21. Le nom chimique n'a pu été identifié d'après la recherche par structure dans ChemID; par conséquent, cette substance est appelée « analogue pour le Disperse Brown 21 » dans l'évaluation. La structure chimique est indiquée au tableau A-7 à l'annexe A. |
s.o. | Propriétés physicochimiques |
Abréviation : s.o. = sans objet
a Un astérisque (*) après le nom générique du C.I. ou le n° CAS indique que le produit chimique en question est un analogue.
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques définissent les caractéristiques globales d'une substance et sont utilisées afin de déterminer la pertinence de différentes substances pour différentes applications. De telles propriétés jouent également un rôle critique dans la détermination du devenir des substances dans l'environnement (y compris leur potentiel de transport à grande distance), ainsi que leur toxicité pour les humains et les organismes non humains.
Un sous-ensemble de propriétés physiques et chimiques des 73 colorants azoïques dispersés, à savoir le point de fusion, la solubilité dans l'eau et le coefficient de partage octanol-eau (log Koe), s'avère important dans le cadre de l'évaluation des risques pour l'environnement ou la santé humaine. Un résumé des données expérimentales sur les propriétés physiques et chimiques des substances du sous-groupe des colorants azoïques dispersés qui se rapportent à leur devenir dans l'environnement et à leur écotoxicité est présenté dans le tableau 3-1 et à l'annexe A. Un sous-ensemble des renseignements sur les propriétés physiques et chimiques du Disperse Yellow 3 est aussi présenté dans le Tableau 3-1, de l'information plus détaillée est disponible dans l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada, 2015).
| Propriété physicochimique | Gamme des valeurs expérimentales pour 73 colorants azoïques dispersés | Gamme des valeurs expériementales pour le Disperse Yellow 3 |
|---|---|---|
| Masse moléculaire (g/mol) | 302 à 639 | 182-269 |
| Point de fusion (°C) | 132 à 152 | 67-195 |
| Masse volumique (g/cm3) | 1,19 à 1,55 | 1,2 |
| Pression de vapeur (Pa à 25 °C) | 3,40 × 10-9 à 4,53 × 10-7 | 1,87 x 10-4–0,048 |
| Log Koe (à 25 °C) | 3,4 à 5,7 | 1,5–4,6 |
| Solubilité dans l'eau (mg/L à 25 °C) | 1 × 10-6 à 0,45 | less than 1–34 |
| Solubilité dans le n-octanol (mg/L) | 14,1 à 5 056 | s.o |
| Dmax-min (nm) | 1,21 à 1,78 | s.o |
| Dmax-max (nm) | 1,61 à 2,81 | s.o |
| Deff-min (nm) | 0,67 à 1,14 | 0,65–0,79 |
| Deff-max (nm) | 0,96 à 1,70 | 0,71–0,88 |
Abréviation : s.o. = sans objet
Solubilité dans l'eau et le n-octanol
Tel qu'indiqué dans le tableau 3-1, 73 colorants azoïques dispersés de ce sous-groupe ont une faible solubilité dans l'eau à la température ambiante, soit de 1 × 10-6 mg/L (Disperse Brown 21) à 0,45 mg/L (Disperse Brown 1:1 et Disperse Brown 1). La majorité des 16 valeurs de solubilité dans l'eau sont inférieures ou bien inférieures à 0,1 mg/L (annexe A). De nouvelles études, qui reposent sur des techniques d'analyse plus précises, ont également montré que la solubilité dans l'eau des colorants azoïques dispersés était bien inférieure à 0,1 mg/L, soit 2,2 × 10-4 mg/L pour le Disperse Orange 13 et 0,027 mg/L pour le Disperse Yellow 7 (Balakrishnan 2013).
À des températures de 60 °C ou plus, la solubilité dans l'eau peut être nettement plus élevée, atteignant 10 mg/L ou plus (Bird 1954, Patterson et Sheldon 1960; Datyner 1978a, 1978b).
Il n'y a pas de tendance évidente suggérant que les substances d'un quelconque des groupes structurels ont une solubilité dans l'eau plus élevée ou plus faible que celles d'un autre groupe structurel. En raison de leur faible solubilité dans l'eau, ces colorants, qui sont des particules solides fines à l'état brut (Bardi et Marzona 2010), se retrouvent habituellement mélangés à divers agents auxiliaires dans les produits commerciaux (Koh 2011). Ces agents (p. ex. des vecteurs, des surfactants, des dispersants) peuvent affecter le devenir de ces substances dans l'environnement en augmentant leur solubilité. Il est également possible qu'ils augmentent leur biodisponibilité dans le milieu aquatique (eau et sédiments). La présente évaluation est centrée sur des produits chimiques spécifiques identifiés par leur no CAS plutôt que par la formulation de colorant, dont la composition peut varier et renfermer des agents auxiliaires ou des impuretés. Toutefois, l'effet des agents auxiliaires est traité tout au long de l'évaluation étant donné que les données disponibles sont souvent associées à des formulations particulières.
La solubilité de ces substances est beaucoup plus élevée dans le n-octanol que dans l'eau à la température ambiante (Sijm et al. 1999, ETAD 2005). Il existait des données sur la solubilité dans le n-octanol pour 14 colorants azoïques dispersés et analogues : 4 de ces solubilités se situaient entre 10 et 100 mg/L, 6 entre 100 et 1 000 mg/L et 4 à plus de 1 000 mg/L.
Le Disperse Yellow 3 est plus soluble que les 73 autres colorants azoïques dispersés de vette évaluation.
Coefficient de partage octanol-eau
D'après les données expérimentales recueillies, ces 73 substances ont un coefficient de partage octanol-eau allant de modéré à élevé (valeurs de log Koe), allant 3,4 (Disperse Yellow 211*) à 5,7 (n° CAS 55290-62-5). La plupart des valeurs de ce paramètre pour les colorants azoïques dispersés ont été obtenues au moyen de tests en laboratoire. Toutefois, quelques-unes ont été calculées (voir l'annexe A). Les valeurs de logKoe sont pertinentes pour la bioaccumulation de ces substances et sont traitées de façon plus approfondie dans la section « Potentiel de bioaccumulation ».
Aucune donnée n'a été trouvée sur le coefficient de partage carbone organique-eau (log Kco) pour une quelconque des substances de ce sous-groupe ou de leurs analogues.
Point de fusion et pression de vapeur
Le point de fusion de ces 73 colorants azoïques dispersés est de 132 °C ou plus. Il peut aussi être décrit comme le point de décomposition puisque les colorants dispersés sont censés carboniser à des températures élevées avant de fondre complètement. Par exemple, un test de stabilité dans l'eau après 2 heures à 127 °C a révélé que le Disperse Yellow 23 n'avait pas subi de décomposition significative après évaporation totale (Datyner, 1978a). Étant donné leurs très faibles pressions de vapeur, les colorants azoïques dispersés ne devraient pas être volatils dans des conditions environnementales.
Masse moléculaire et masse volumique
La masse moléculaire de ces 73 colorants azoïques dispersés va de modérée à élevée, soit de 302 à 639 g/mol. La masse volumique de ces substances se situe dans une gamme relativement étroite, de 1,19 à 1,55 g/cm3, ce qui supérieure à celle de l'eau.
Diamètre de la section calculé
Pour caractériser leur taille moléculaire, nous avons calculé le diamètre de leur section au moyen de CPOP (2012). Leur diamètre maximal (Dmax) se situe entre 1,21 et 2,81 nm, et leur diamètre effectif (Deff) entre 0,67 et 1,70 nm. La taille moléculaire est importante pour la perméance d'une substance à travers des membranes biologiques. Le diamètre de la section de ces substances est traité de façon plus approfondie dans les sections « Potentiel de bioaccumulation » et « Potentiel d'effets nocifs sur l'environnement ».
4. Sources et utilisations
4.1 Sources
Les colorants azoïques dispersés sont d'origine anthropique et ils ne devraient donc pas être se retrouver naturellement dans l'environnement.
Depuis 2005, les 74 substances visées par la présente évaluation, y compris le Disperse Yellow 3, ont été inclus dans au moins une enquête effectuée en vertu de l'article 71 de la LCPE 1999. Ces enquêtes visaient à recueillir des renseignements sur les activités de production et d'importation au Canada, sur la base d'un seuil de déclaration de 100 kg/an. Cinquante-cinq de ces substances ont été visées lors d'une enquête réalisée pendant l'année civile 2005 (Canada 2006). Des enquêtes ont également été menées sur 24 de ces substances pendant l'année civile 2006 dans le cadre du Défi (Canada 2008a, 2008b, 2008c, 2009b). Des 24 substances étudiées en 2006, 22 faisaient également partie de l'enquête menée pendant l'année civile 2005, et deux n'avaient jamais été évaluées. Le Disperse Yellow 3 a été inclus dans la première phase de l'enquête pour la mise à jour de l'inventaire de la LIS (Canada 2009a). Enfin, 16 substances du sous-groupe qui n'avaient pas encore été évaluées ont été incluses dans une enquête réalisée pendant l'année civile 2010 et centrée sur le groupe de substances azoïques aromatiques et à base de benzidine (Canada 2011). Les résultats de ces enquêtes ont montré qu'aucune des 74 substances visées par la présente évaluation, dont le Disperse Yellow 3, n'avait été produite en quantité supérieure au seuil de déclaration de 100 kg/an. Cependant, 14 substances visées par la présente évaluation, dont le Disperse Yellow 3, ont été identifiées lors d'une ou plusieurs enquêtes comme ayant été importées en une quantité supérieure au seuil, tel qu'indiqué dans le tableau 4-1.
| Nom générique du C.I., acronyme ou n° CAS | Quantité annuelle importée (kg) identifiée lors de l'enquête menée en 2005 en vertu de l'article 71a | Quantité annuelle importée (kg) identifiée lors de l'enquête menée en 2006 en vertu de l'article 71b | Quantité annuelle importée (kg) identifiée lors de l'enquête menée en 2009 en vertu de l'article 71c | Quantité annuelle importée (kg) identifiée lors de l'enquête menée en 2010 en vertu de l'article 71d |
|---|---|---|---|---|
| Disperse Blue 79:1 | s.o. | s.o. | s.o. | 100 à 1 000 |
| Disperse Orange30e | 1 001 à 100 000 | 1 000 à 10 000 | s.o. | s.o. |
| Disperse Blue79e | s.o. | 1 000 à 10 000 | s.o. | s.o. |
| ANAMe | Non déclarée | 100 à 1 000 | s.o. | s.o. |
| Disoerse Red179f | 100 à 1 000 | 100 à 1 000 | s.o. | s.o. |
| Disperse Orange29f | 1 001 à 100 000 | 1 000 à 10 000 | s.o. | s.o. |
| DAPEPf | Non déclarée | 100 à 1 000 | s.o. | s.o. |
| Disperse Red167e | 100 à 1 000 | 1 000 à 10 000 | s.o. | s.o. |
| BANAPe | 1 001 à 100 000 | 100 à 1 000 | s.o. | s.o. |
| 52697-38-8e | 100 à 1 000 | 10 000 à 100 000 | s.o. | s.o. |
| Disperse Orange61e | 1 001 à 100 000 | 1 000 à 10 000 | s.o. | s.o. |
| ANMOMg | 1 001 à 100 000 | Non déclarée | s.o. | s.o. |
| MATCBf | Non indiqué | 100 à 1 000 | s.o. | s.o. |
| Disperse Yellow 3 | Non déclarée | s.o. | 100 à 1 000 | s.o. |
Abréviations : s.o., substance non visée par l'enquête
a Canada (2006).
b Canada (2008a, 2008b, 2008c, 2009b).
c Canada (2009a).
d Canada (2011).
e Substance évaluée lors du Défi pour laquelle les conclusions sur la santé et l'environnement sont mises à jour.
f Substance évaluée lors du Défi pour laquelle seule une conclusion sur l'environnement est mise à jour.
g Substance assessed in the Challenge Initiative but was not previously concluded on.
Trois autres substances, le Disperse Brown 1:1, le Disperse Brown 1 et le n° CAS 63833-78-3, ont été identifiées comme ayant été utilisées au Canada en 2010 d'après les renseignements fournis par l'Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers (ETAD) [courriel de 2010 de l'ETAD à Environnement Canada, non référencé].
4.2 Utilisations
Les colorants dispersés sont principalement utilisés pour colorer le polyester, les mélanges de polyester, le nylon et les matériaux acryliques (ETAD 1995b, Bardi et Marzona 2010). Historiquement, les colorants dispersés ont d'abord été utilisés pour colorer l'acétate de cellulose. Les propriétés communes des colorants dispersés, notamment leur masse moléculaire moyenne à élevée, leur caractère neutre et leur faible solubilité dans l'eau en font des colorants appropriés pour les fibres synthétiques (Ullmann's Encyclopedia 2010).
D'après les enquêtes récentes menées en vertu de l'article 71 (Canada 2006, 2008a, 2008b, 2008c, 2009a, 2009b, 2011), 14 substances visées par la présente évaluation, dont le Disperse Yellow 3 (voir le tableau 4-1), ont été importées afin d'être utilisées dans le secteur textile canadien comme « colorant - pigment, teinture ou encre ». Dans l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada 2015), le Disperse Yellow 3 est traité sous un autre nom, le Solvent Yellow 77.
Au Canada, les colorants alimentaires sont réglementés en tant qu'additifs alimentaires en vertu du Règlement sur les aliments et drogues. Les colorants qui sont autorisés dans les aliments sont inscrits dans la Liste des colorants autorisés, incorporée en renvoi dans l'Autorisation de mise en marché d'additifs alimentaires comme colorants publiée en vertu de la Loi sur les aliments et drogues. Aucun des 73 colorants azoïques dispersés visés par la présente évaluation ne figure sur la Liste des colorants autorisés. De plus, aucune de ces substances n'est utilisée dans des applications d'emballage alimentaire (courriels de 2011 de la Direction des aliments de Santé Canada adressé au Bureau de gestion du risque de Santé Canada; non référencé).
Les colorants autorisés dans la fabrication de médicaments au Canada sont régis en vertu du titre 1 de la partie C du Règlement sur les aliments et drogues (Canada, 1978). Aucune des substances de ce sous-groupe n'est répertoriée à titre de colorant alimentaire autorisé ou n'est présente dans les médicaments destinés à l'usage humain (courriel de 2011 de la Direction des produits thérapeutiques de Santé Canada adressé au Bureau de la gestion des risques de Santé Canada; non référencé), les médicaments vétérinaires (courriel de 2011 de la Direction des médicaments vétérinaires de Santé Canada adressé au Bureau de gestion du risque de Santé Canada; non référencé) ou les produits biologiques au Canada (courriel de 2011 de la Direction des produits biologiques et thérapies génétiques de Santé Canada adressé au Bureau de gestion du risque de Santé Canada; non référencé).
Aucun des colorants azoïques dispersés ne figure dans la base de données sur les ingrédients pour utilisation dans des produits de santé naturels (BDIPSN 2015) à titre d'ingrédient utilisé dans de tels produits. De plus, selon la base de données des produits de santé naturels homologués (BDPSNH 2015), aucun n'est présent dans les produits de santé naturels actuellement homologués.
D'après les notifications soumises à Santé Canada en vertu du Règlement sur les cosmétiques, aucun des colorants azoïques dispersés ne devrait être utilisé au Canada (courriels de 2011 et de 2013 de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation des risques des substances existantes de Santé Canada; non référencé). De plus, ces substances ne figurent pas sur la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques (communément appelée « liste critique »), un outil administratif que Santé Canada utilise pour avertir les fabricants et d'autres intervenants que les produits contenant certaines de ces substances ne sont probablement pas classés en tant que cosmétique en vertu de la Loi sur les aliments et drogues et que, de plus, quand ces substances sont présentes à une certaine concentration dans un cosmétique elles peuvent contrevenir à l'interdiction générale stipulée à l'article 16 de la Loi sur les aliments et drogues ou à une disposition du Règlement sur les cosmétiques (Santé Canada 2011).
Aucune utilisation de colorants azoïques dispersés comme formulant dans des produits homologués au Canada pour la lutte antiparasitaire n'a été répertoriée (courriel de 2011 de l'Agence de réglementation de la lutte antiparasitaire de Santé Canada adressé au Bureau de gestion du risque de Santé Canada; non référencé).
De plus, aucune utilisation de colorants azoïques dispersés pour des applications militaires n'a été recensée au Canada (courriel de 2011 du ministère de la Défense nationale adressé au Bureau de gestion du risque de Santé Canada; non référencé).
Trois substances, le Disperse Brown 1:1, le Disperse Brown 1 et le composé de n° CAS 63833-78-3, ont été utilisées au Canada en 2010 d'après des renseignements fournis par l'ETAD (courriel de 2010 de l'ETAD à Environnement Canada, non référencé). Aucune utilisation spécifique n'a été établie. Toutefois, puisque les utilisations rapportées pour tous les colorants azoïques dispersés (y compris le Disperse Yellow 3) visés par la présente évaluation préalable étaient la coloration de textiles et puisque les colorants dispersés ont été précisément conçus pour une telle utilisation, on suppose que les activités déclarées par l'ETAD concernaient la coloration de textiles.
5. Rejets dans l'environnement
Le devenir dans l'environnement des substances chimiques décrit les processus par lesquels les produits chimiques se déplacent et sont transformés dans l'environnement. Dans la présente section, nous discuterons de certaines caractéristiques générales des substances faisant l'objet de la présente évaluation préalable en ce qui a trait à leur devenir environnemental dans différents milieux, dans le but de comprendre comment les organismes entrent en contact avec ces substances dans un milieu donné, leur persistance dans les milieux de l'environnement, ainsi que leur dégradation, leur distribution dans les différents milieux, leur migration vers les eaux souterraines, leur élimination des effluents par des méthodes usuelles de traitement des eaux usées et leur bioaccumulation dans les organismes.
Des renseignements sur les rejets dans l'environnement du Disperse Yellow 3 sont disponibles dans l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada, 2015).
5.1 Eau et sédiments
Si elles sont rejetées dans des eaux naturelles ou des eaux usées dans un état non transformé, ces substances devraient demeurer sous forme neutre en raison de l'absence de groupes ionisables et elles ne devraient pas se dissocier de façon importante dans les conditions environnementales (pH 6 à 9). Aucune évaporation à partir de la surface de l'eau ne devrait se produire, et l'hydrolyse devrait être négligeable. On ne s'attend pas non plus à ce qu'elles se dégradent rapidement dans des conditions aérobies.
S'ils sont rejetés dans des eaux usées, ces colorants devraient, en raison de leurs faibles solubilités dans l'eau, de leurs masses volumiques supérieures à celle de l'eau et de leurs associations avec la matière organique, être piégés dans les filtres à boues ou adsorbés pendant le processus de traitement des eaux usées au lieu de rester en phase aqueuse. En raison de leur nature persistante dans des conditions aérobies, les particules restantes de colorants azoïques dispersés devaient finir par se retrouver dans les sédiments anaérobies par gravité après leur rejet dans l'environnement (Razo-Flores et al. 1997). Après s'être répartis dans les sédiments ou les boues d'épuration, certains colorants azoïques peuvent se lier de manière réversible et se remettre en suspension, alors que d'autres se lieront de manière irréversible et resteront enfouis. Tel que mentionné dans le document sur l'Approche pour la création de sous-groupes et sur les renseignements de base (Environnement Canada et Santé Canada 2013), la sorption est un processus important du devenir des colorants dans l'eau et les sédiments.
Dans le cadre d'un récent projet de surveillance de l'environnement, quatre colorants azoïques dispersés (le Disperse Orange 5, le Disperse Orange 13, le Disperse Yellow 7 et le Disperse Blue 79) ont été inclus dans l'analyse d'échantillons prélevés dans les effluents d'un total de 26 usines publiques de traitement des eaux usées à travers le Canada entre 2009 et 2012 (courriel de 2012 de la Division de la recherche sur la protection des écosystèmes aquatiques, Direction des sciences et de la technologie de l'eau d'Environnement Canada, adressé à la Division des évaluations environnementales, Direction des sciences et de l'évaluation des risques d'Environnement Canada; non référencé). Aucun de ces colorants n'a été détecté dans les échantillons prélevés. Il serait bon de noter qu'une seule des substances susmentionnées (le Disperse Blue 79) a été identifiée comme étant commercialisée lors de récentes enquêtes. De plus, divers procédés de traitement ont été employés (traitement primaire, traitement secondaire et lagunage) selon l'usine de traitement des eaux usées échantillonnée, et il n'a pas été possible de confirmer si les activités industrielles liées à ces colorants azoïques dispersés rejetaient des effluents dans un de ces systèmes.
Si les colorants azoïques dispersés sont rejetés dans l'eau, une partie d'entre eux devrait demeurer dans la colonne d'eau (jusqu'à leur limite de solubilité dans l'eau). Au fil du temps, un pourcentage plus important de ces substances se déposera dans les sédiments. Les colorants azoïques dispersés devraient subir une dégradation réductrice dans des conditions anaérobies, par rupture des liaisons azoïques (-N=N-), et produire des amines aromatiques.
5.2 Sol
Les colorants azoïques dispersés peuvent être indirectement rejetés dans le sol lors de l'épandage sur des terres agricoles ou du dépôt dans des sites d'enfouissement de biosolides provenant d'eaux usées. Étant donné que les colorants azoïques dispersés ont une faible solubilité dans l'eau et qu'il est peu probable qu'ils se dissocient, on s'attend à ce que leur mobilité soit faible et qu'ils demeurent dans le sol après leur rejet dans ce milieu naturel.
5.3 Air
En raison de leur très faible pression de vapeur (10-7 Pa ou moins), il est peu probable que les colorants azoïques dispersés soient rejetés dans l'atmosphère ou se retrouvent de manière significative dans ce milieu (HSDB 1983, Øllgaard et al. 1998). Bien que les colorants prémélangés à l'état solide puissent avoir une capacité de dispersion limitée dans l'atmosphère en tant que grosses particules, l'atmosphère n'est pas considérée comme un milieu de transport pour les colorants, car ils ont une volatilité faible, voire négligeable (Brown et Hamburger 1987, ETAD 1995b, Øllgaard et al. 1998).
S'ils sont rejetés dans l'atmosphère, les colorants azoïques dispersés devraient principalement se retrouver sous forme de particules et être éliminés de ce milieu sous forme de dépôt humide ou sec à proximité de la source.
Compte tenu de ces caractéristiques, il est peu probable que les colorants azoïques dispersés soient transportés dans l'atmosphère à grande distance.
5.4 Persistance dans l'environnement
Afin de caractériser la persistance dans l'environnement des colorants azoïques dispersés, des données empiriques et modélisées disponibles sur la dégradation biotique et abiotique ont été examinées. Les données expérimentales et modélisées de biodégradation des colorants azoïques dispersés ont été analysées dans des conditions aérobies et anaérobies. L'oxydation atmosphérique devrait être un important processus régissant le devenir de ces substances si elles sont rejetées dans l'atmosphère. L'hydrolyse ne devrait pas être un facteur important dans le milieu aquatique, ces substances ne contenant pas de groupes hydrolysables. De plus, le processus de biotransformation dans l'environnement a été pris en compte en ce qui a trait au potentiel de dégradation des colorants azoïques dispersés en amines aromatiques suite à la rupture de la liaison azoïque dans des conditions anaérobies ou réductrices.
Des renseignements supplémentaires sur la persistance dans l'environnement du Disperse Yellow 3 sont disponibles dans l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada, 2015).
5.4.1 Données empiriques sur la persistance
Tel qu'indiqué dans le document d'Environnement Canada et de Santé Canada (2013), les colorants sont conçus de façon à être stables sur le plan chimique et sur le plan photolytique afin qu'ils offrent la performance attendue lors d'applications de coloration et qu'ils conservent leur couleur dans les produits finis (Pagga et Brown 1986, Øllgaard et al. 1998, CPMA 2003, Bafana et al. 2011). L'hydrolyse de certaines classes de colorants (colorants réactifs) a été observée. Toutefois, elle est considérée comme une voie de dégradation négligeable pour les colorants azoïques dispersés.
Aucune donnée expérimentale sur la dégradation atmosphérique des colorants azoïques dispersés n'a été trouvée. En raison de leur très faible pression de vapeur, leur répartition dans l'air est négligeable. Pour cette raison, l'air n'est pas un milieu préoccupant en ce qui concerne la persistance de ces substances.
Les données expérimentales identifiées dans la boîte à outils RQSA de l'OCDE (OCDE 2012) ainsi que les soumissions faites par des intervenants montrent que les taux de biodégradation des substances testées étaient toujours inférieurs à 20 % lors d'études de 28 jours, donc inférieurs à la limite de dégradation rapide. Ces résultats semblent indiquer que les colorants azoïques dispersés sont persistants dans l'eau dans des conditions aérobies. Ces données sont résumées dans le tableau 5-1. On estime que la plupart d'entre elles sont de grande qualité, malgré le fait que des détails de certaines études ne soient pas disponibles.
Par exemple, la biodégradabilité intrinsèque du Disperse Red 179 et du DAPEP dans des conditions aérobies dans un milieu aqueux de boues activées a été évaluée lors d'études expérimentales de biodégradation (BMG 2001, 2003a). Le degré de biodégradation a été calculé en tant que pourcentage de l'évolution théorique du dioxyde de carbone, qui représente le calcul de la quantité totale de dioxyde de carbone rejetée à partir du contenu en carbone connu ou mesuré pour les substances testées lorsqu'elles sont complètement minéralisées. Les taux de biodégradation du Disperse Red 179 et du DAPEP après 28 jours étaient inférieurs à 20 %, indiquant qu'il n'y avait pas de biodégradation rapide dans ces conditions expérimentales.
| Nom générique du C.I., acronyme ou n° CAS | Milieu d'essai ou inoculum | Paramètre et valeur de dégradation | Référence |
|---|---|---|---|
| Disperse Blue 79:1 | Boues activées | COD inférieur(e) à 20 % après 28 jours | Environnement Canada 2012 |
| Disperse Blue 79 | Boues activées | Aucune dégradation importante | USEPA 1990 |
| Disperse Red 179 | Boues activées | ThCO2 inférieur(e) à 20 % après 28 jours | BMG 2001 |
| DAPEP | Boues activées | ThCO2 inférieur(e) à 20 % après 28 jours | BMG 2003a |
| Disperse Red 167 | Microorganismes | DBO = 0 % après 28 jours | OCDE 2012 (valeur originale rapportée par JETOC 1992) |
| Disperse Red 167 | s.o. | Non biodégradablea | CHRIP, ©2008 |
| 26630-87-5*b | Microorganismes | DBO = 0 % après 28 jours | OCDE 2012 (valeur originale rapportée par JETOC 1992) |
| Disperse Orange 73* | Microorganismes | DBO = 7 % après 28 jours | OCDE 2012 (valeur originale rapportée par JETOC 1992) |
| Disperse Orange 73* | s.o. | Non biodégradable | CHRIP ©2008 |
| Disperse Yellow 163* | Microorganismes | DBO = 0 % après 28 jours | OCDE 2012 (valeur originale rapportée par JETOC 1992) |
Abréviations : DBO, demande biochimique en oxygène; COD, carbone organique dissous; ThCO2, dioxyde de carbone théorique
a Aucune valeur n'est rapportée dans CHRIP (©2008); toutefois, la conclusion est fondée sur les critères de la Chemical Substances Control Law du Japon.
b Un astérisque (*) après le nom générique du C.I. ou le n° CAS indique que le produit chimique en question est un analogue.
Compte tenu de leur faible solubilité dans l'eau et de leur très faible pression de vapeur, les colorants azoïques dispersés devraient principalement pénétrer dans le milieu aquatique sous forme de dispersion de fines particules en suspension, finissant éventuellement par se déposer dans les couches aérobies des sédiments de surface, où ils resteront jusqu'à leur enfouissement graduel dans les sédiments plus profonds où existent des conditions réductrices. Le taux de dépôt dans les sédiments et l'ampleur de la bioturbation varient d'un site à l'autre. De ce fait, il est très difficile de déterminer le temps de résidence de ces colorants dans des couches de sédiments aérobies. Il est toutefois probable qu'il dépasse 365 jours dans bien des cas.
D'après l'ETAD (1995b), les colorants, à quelques exceptions près, sont considérés essentiellement non biodégradables dans des conditions aérobies. Ceci a été confirmé au moyen d'évaluations répétées de la biodégradabilité immédiate et intrinsèque lors de tests de criblage acceptés respectant les lignes directrices de l'Organisation de coopération et de développement économiques (OCDE) (Pagga et Brown 1986, ETAD 1992). En se basant sur la structure chimique commune de cette classe de colorants, les colorants azoïques dispersés devraient également avoir un faible potentiel de biodégradation dans des conditions aérobies.
5.4.2 Dégradation et transformation des colorants azoïques dispersés
Comme cela est résumé dans l'Approche pour la création de sous-groupes et le document sur les renseignements de base (Environnement Canada et Santé Canada, 2013), on a observé une photodécomposition des colorants exposés aux rayons ultraviolets (UV). La vitesse de réaction dépend de plusieurs facteurs, dont les niveaux d'oxygène, le pH et l'intensité de la lumière. La structure des colorants est également liée à leur tendance à se décomposer. Chu et Ma (1997) ont rapporté une décoloration du Disperse Yellow 79* et du Disperse Blue 142* après une irradiation UV. La perte de couleur pour ces colorants était respectivement de 18 et 8 % après une exposition de 10 heures.
Dans des conditions anaérobies, de nombreux colorants azoïques dispersés sont vulnérables à une rupture de leurs liaisons azoïques induite chimiquement et médiée par des bactéries (Brown et Laboureur 1983, Baughman et Weber 1994, Weber et Adams 1995). Quelques études de dégradation ont été menées sur le Disperse Blue 79:1 et le Disperse Blue 79, qui ont une structure similaire. Les résultats d'une étude semblent indiquer que le Disperse Blue 79 peut subir une décomposition réductrice rapide dans des sédiments benthiques anoxiques, conduisant à la libération d'amines aromatiques dans la colonne d'eau (Weber et Adams 1995). Dans une autre étude, une dégradation du Disperse Blue 79:1 de 98,2 % a été rapportée après 15 jours dans des conditions anaérobies (EPA des États-Unis 1990). De plus, Yen et al. (1991) ont rapporté des demi-vies allant de 2,9 heures à 3 jours pour trois colorants dispersés dans des sédiments anaérobies (voir le tableau 5-2). Ces résultats confirment également la dégradation rapide de ces substances dans des conditions anaérobies.
| Nom générique du C.I. | Paramètre et valeur de dégradation | Référence |
|---|---|---|
| Disperse Red 1* | Demi-vie = 2,9 h | Yen et al., 1991 |
| Disperse Red 5* | Demi-vie = 4,5 h | Yen et al., 1991 |
| Disperse Red 177* | Demi-vie = 2 jours | Yen et al., 1991 |
5.4.3 Résumé de la persistance
Les colorants azoïques dispersés ne se dégraderont pas rapidement dans des conditions aérobies et auront tendance à persister dans l'eau, les sédiments et le sol. Toutefois, certains colorants azoïques dispersés sont connus pour se dégrader rapidement et libérer des amines aromatiques dans des conditions anaérobies, par exemple lorsqu'ils sont enfouis dans les sédiments aquatiques.
5.5 Potentiel de bioaccumulation
Afin d'évaluer le potentiel de bioaccumulation de colorants azoïques dispersés dans l'environnement, des données empiriques ont été obtenues pour ces substances et leurs analogues grâce à une recherche bibliographique. Les indicateurs liés à la taille moléculaire ont été pris en compte pour la caractérisation du potentiel de bioaccumulation de cette classe de colorants.
Des renseignements supplémentaires sur le potentiel de bioaccumulation du Disperse Yellow 3 sont disponibles dans l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada, 2015).
5.5.1 Données empiriques sur la bioaccumulation
Des données empiriques ont été recensées pour certains colorants azoïques dispersés et leurs analogues, elles sont résumées dans le tableau 5-3. Toutes les données disponibles (environ 30 résultats) indiquent que le potentiel de bioaccumulation des colorants azoïques dispersés est limité.
Anliker et al. (1981) ont rapporté des valeurs expérimentales de bioaccumulation chez les poissons pour 18 colorants monoazoïques dispersés mesurées lors de tests réalisés en suivant des méthodes prescrites par le ministère du Commerce international et de l'Industrie du Japon (MITI). Le facteur de bioconcentration (FBC) mesuré, exprimé en fonction du poids corporel humide, est inférieur à 57,54 L/kg (la valeur originale rapportée en tant que log FBC était de 0 à 1,76). Ces résultats indiquent un faible potentiel de bioaccumulation. Cependant, il faut user de prudence dans l'interprétation de cette étude, car l'identité spécifique des substances testées n'a pas pu être établie d'après les renseignements fournis dans la publication.
Brown (1987) n'a pas non plus observé de bioaccumulation importante pour 12 colorants dispersés chez la carpe lors d'une étude de 8 semaines. D'après les résultats, aucun facteur de bioaccumulation (FBA) ni aucun FBC supérieur à 5 000 n'a été rapporté, indiquant que les colorants dispersés n'ont pas de potentiel de bioaccumulation important chez les espèces aquatiques.
Anliker et al. (1988) ont recueilli des données sur la bioconcentration de quelques colorants azoïques dispersés et analogues qui mettent en évidence un potentiel de bioaccumulation limité. Les données rapportées sont résumées dans le tableau 5-3.
| Nom générique du C.I. ou n° CASa | Organisme testé | Paramètre et valeur de bioaccumulation (L/kg) | Référence(s) |
|---|---|---|---|
| Disperse Red 74:1* | Poisson | FBC = 19,95 (valeur originale rapportée en tant que logFBC = 1,30) Masse moléculaire = 471 g/mol |
Anliker et al. 1988 |
| Disperse Orange 30 | Poisson zèbre (Brachydanio rerio) | FBC inférieur(e) à 100 après 28 jours | Shen et Hu 2008 |
| 6657-33-6* | Poisson | FBC = 2,0 (la valeur originale rapportée était un log du FBC = 0,30) Masse moléculaire = 374 g/mol |
Anliker et Moser 1987 |
| 26630-87-5* | Carpe commune (Cyprinus carpio) | FBC après 42 jours = 2 à 6,6 (à 0,2 mg/L) FBC après 42 jours = 8 à 25 (à 0,02 mg/L) |
OCDE 2012 (valeur originale rapportée par JETOC 1992) |
| 26630-87-5* | s.o. | FBC = 16,52 (la valeur originale rapportée était un log du FBC = 1,218) |
CPOP 2012 |
| 26630-87-5* | s.o. | Faible bioconcentrationb | CHRIP© 2008 |
| Disperse Red 167 | Ide dorée (Leuciscus idus) | FBC après 72 h = 3 150 (valeur originale rapportée en tant que logFBC = 3,5) |
OCDE 2012 (valeur originale rapportée par Freitag et al. 1984) |
| Disperse Red 167 | Carpe commune (Cyprinus carpio) |
FBC après 42 jours = 0,699 (la valeur originale rapportée était un log du FBC = -0,155) Masse moléculaire = 520 g/mol |
OCDE 2012 (valeur originale rapportée par JETOC 1992) |
| Disperse Red 167 | s.o. | Faible bioconcentrationb | CHRIP© 2008 |
| Disperse Red 167 | s.o. | FBC = 6,26 | CPOP 2012 |
| Disperse Yellow 198* | Poisson | FBC inférieur(e) à 1 (valeur originale rapportée en tant que log FBC inférieur(e) à 0) |
Anliker et Moser 1987 |
| Disperse Yellow 198* | Poisson | FBA = 0 (valeur originale rapportée en tant que log FBC = 0) |
Anliker et al. 1988 |
| Disperse Orange 73* | Carpe commune (Cyprinus carpio) |
FBC après 42 jours = 11 à 14 | OCDE 2012 (valeur originale rapportée par JETOC 1992) |
| Disperse Orange 73* | s.o. | Faible bioconcentrationb | CHRIP ©2008 |
| Disperse Orange 73* | s.o. | FBA après 42 jours = 0,8 à 14 (à 0,1 mg/L) FBA après 42 jours inférieur(e) à 2,5 à 11 (à 0,02 mg/L) |
MITI 1992 |
| Disperse Orange 73* | s.o. | FBC = 6,75 | CPOP 2012 |
| 51248-73-8* | Poisson | FBC = 3,98 (valeur originale rapportée en tant que logFBC = 0,60) |
Anliker et al.1988 |
| 51249-07-1* | Poisson | FBA = 7,94 (valeur originale rapportée en tant que logFBA = 0,90) |
Anliker et Moser 1987 |
| 55290-62-5 | Poisson | FBC = 5,01 (valeur originale rapportée en tant que log FBC = 0,70) |
Anliker et al. 1988 |
| Disperse Green 9* | Poisson | FBC = 6,31 (valeur originale rapportée en tant que log FBA = 0,80) |
Anliker et al. 1988 |
| 61038-97-9* | Poisson | FBC = 19,95 (valeur originale rapportée en tant que log FBC = 1,30) |
Anliker et al. 1988 |
| 62072-81-5* | Poisson | FBC = 19,95 (valeur originale rapportée en tant que log FBC = 1,30) |
Anliker et al. 1988 |
| Disperse Yellow 163* | s.o. | FBC = 36,48 | CPOP 2012 |
| Disperse Yellow 163* | Carpe commune (Cyprinus carpio) |
FBC après 42 jours = 47 L/kg p.h. (à 0,01 mg/L) FBC après 42 jours = 49 L/kg p.h. (à 0,1 mg/L) |
OCDE 2011 (valeur originale rapportée par JETOC 1992) |
| Disperse Yellow 163* | Carpe commune (Cyprinus carpio) |
FBC après 42 jours = 2,65 à 38,1 L/kg p.h. | OCDE 2011 (valeur originale rapportée par JETOC 1992) |
| Disperse Yellow 163* | s.o. | Faible bioconcentrationb | CHRIP© 2008 |
| Disperse Yellow 163* | s.o. | FBC après 42 jours = 30 à 49 L/kg (à 0,0001 mg/L) FBC après 42 jours = 26 à 47 L/kg (à 0,00001 mg/L) |
MITI 1992, ETAD 2005 |
| 68110-29-2* | Poisson | FBC = 3,98 L/kg (valeur originale rapportée en tant que log FBC = 0,60) |
Anliker et al. 1988 |
| 68110-29-2* | Poisson | FBC = 3,02 L/kg (valeur originale rapportée en tant que log FBC = 0,48) |
Anliker et Moser 1987 |
| 71617-28-2* | Poisson | FBC = 57,54 L/kg (valeur originale rapportée en tant que log FBC = 1,76) |
Anliker et Moser 1987 |
| 73384-66-4* | Poisson | FBC = 2,09 L/kg (valeur originale rapportée en tant que log FBC = 0,32) |
Anliker et al. 1988 |
Abréviations : FBA = facteur de bioaccumulation; FBC = facteur de bioconcentration; p.h., poids humide
a Un astérisque (*) après le nom générique du C.I. ou le n° CAS indique que le produit chimique en question est un analogue.
b Aucune valeur n'est rapportée dans CHRIP (©2008); toutefois, la conclusion est fondée sur les critères de la Chemical Substances Control Law du Japon.
Le coefficient de partage octanol-eau est habituellement utilisé comme indicateur secondaire du potentiel de bioaccumulation. Dans le cas présent, les valeurs modérées à élevées du logKoe (3,4 à 5,7) associées aux colorants azoïques dispersés ne concordent pas avec les données expérimentales sur la bioaccumulation et la bioconcentration, ces dernières sont préférées comme indicateurs primaires. Cela est peut-être attribuable au fait que les colorants azoïques dispersés sont moins biodisponibles sous forme de particules ou de grosses molécules et, par conséquent, ils ne sont pas absorbés aussi rapidement ou facilement par les organismes. Ce phénomène est expliqué dans la prochaine section sur les indicateurs liés à la taille.
Une autre possibilité est qu'après leur absorption par les organismes (p. ex. par ingestion directe), certains colorants azoïques dispersés sont métabolisés, conjugués ou excrétés, de sorte qu'on n'observe pas de bioaccumulation. Une rupture enzymatique des liaisons azoïques et d'autres réactions réductrices/oxydatives des fragments devraient avoir lieu. On discute de cette rupture métabolique plus en détail dans l'Approche pour la création de sous-groupes et le document sur les renseignements de base (Environnement Canada et Santé Canada, 2013). Les métabolites (p. ex. amines aromatiques) peuvent avoir des effets additionnels (mutagènes ou cytotoxiques) sur les organismes et seront évalués séparément dans le cadre du groupe de substances azoïques aromatiques et à base de benzidine.
Aucune donnée sur le potentiel de bioaccumulation des colorants azoïques dispersés ou de leurs analogues dans les organismes vivant dans le sol ou les sédiments n'a pu être identifiée. Toutefois, en raison de leur très faible capacité de bioaccumulation dans l'eau et leur potentiel de métabolisation, ces substances ne devraient pas se bioaccumuler dans les organismes vivant dans le sol ou les sédiments.
5.5.2 Indicateurs liés à la taille
Les colorants azoïques dispersés devraient souvent exister sous forme de particules soit isolées soit en dispersion. Sous cette forme particulaire, leur biodisponibilité devrait être faible. En ce qui a trait à la proportion de colorants azoïques dispersés qui existent sous forme moléculaire ou de fraction soluble, la taille moléculaire est un autre facteur qui varie selon la substance chimique et qui affecte leur transport passif à travers des membranes cellulaires, en particulier à travers les membranes des branchies depuis l'eau, ce qui atténue leur bioaccumulation globale dans les organismes (DeVito 2000, Muller et Nendza 2007).
La taille moléculaire peut être caractérisée par le diamètre moléculaire maximal (Dmax). Le diamètre maximal d'une molécule peut être calculé principalement comme la plus grande distance entre deux atomes basée sur leurs rayons de Van der Waals. Différentes conformations d'un même composé peuvent exister, et le diamètre maximal peut varier considérablement si le composé en question est une molécule flexible. Dans bien des cas, le diamètre effectif (Deff) peut également être calculé comme le deuxième diamètre effectif en importance. Dans le cadre d'une comparaison entre le Dmax et le Deff de molécules ayant différentes stabilités de conformation, on a observé que le Deff était moins sensible aux changements de conformation, tandis que le Dmax en dépendait fortement (Muller et Nendza 2007).
Les mesures du Dmax et du Deff des colorants azoïques dispersés ont été obtenues au moyen du modèle CPOP v1.1.18 (CPOP 2012) et sont résumées dans le tableau 3-1 dans la section « Propriétés physiques et chimiques ».
De récentes études faisant le lien entre les données sur le FBC chez les poissons et les paramètres de taille moléculaire (Dimitrov et al. 2002, 2005) laissent entendre que la probabilité qu'une molécule traverse des membranes cellulaires par diffusion passive diminue de façon importante lorsque le Dmaxaugmente. Ainsi, la probabilité diminue de façon notable lorsque le Dmax est supérieur à environ 1,5 nm et de façon beaucoup plus importante lorsque le Dmax est supérieur à 1,7 nm. Sakuratani et al. (2008) ont également étudié l'effet du diamètre de la section sur la diffusion passive lors de tests sur le FBC d'environ 1 200 substances chimiques nouvelles ou existantes. Ils ont observé que les substances dont le potentiel de bioconcentration n'était pas très élevé (FBC inférieur à 5 000) avaient souvent un Dmax supérieur à 2,0 nm et un Deff supérieur à 1,1 nm.
De plus, des chercheurs (Muller et Nendza 2007, Arnot et al. 2010) ont fait remarquer qu'il n'existe pas de relation claire pour l'établissement de limites strictes sur la taille moléculaire pour évaluer le potentiel de bioaccumulation. Le présent rapport ne met toutefois pas en cause la notion selon laquelle une réduction du taux d'absorption pourrait être associée à l'augmentation du diamètre de la section, tel que démontré par Dimitrov et al. (2002, 2005). Tel que discuté ci-dessus, l'effet de la taille moléculaire sur la diffusion passive semble indiquer que pour ces colorants il existe un potentiel de réduction importante de l'absorption à partir de l'eau et de diminution de la biodisponibilité in vivo.
Dans une étude récente, Arnot et al. (2010) ont relevé qu'il existe des incertitudes associées aux seuils proposés par Dimitrov et al. (2002, 2005) et Sakuratani et al. (2008), étant donné que les études sur le FBC utilisées pour calculer ces seuils n'ont pas fait l'objet d'évaluations critiques. Comme l'ont souligné Arnot et al. (2010), la taille moléculaire a un effet sur la solubilité et la capacité de diffusion dans les phases aqueuse et organique (membranes), et les plus grosses molécules peuvent présenter un taux d'absorption plus lent. Toutefois, ces mêmes contraintes cinétiques s'appliquent aux voies de diffusion de l'élimination chimique (c.-à-d. absorption lente = élimination lente). Un potentiel significatif de bioaccumulation peut donc s'appliquer à des substances qui sont sujettes à des processus d'absorption lent, si elles sont biotransformées ou éliminées lentement par d'autres processus. Par conséquent, lorsqu'on évalue le potentiel de bioaccumulation ainsi que les effets sur les organismes, les données sur la taille moléculaire doivent être utilisées avec discernement et de pair avec d'autres éléments de preuve pertinents dans le cadre d'une approche basée sur le poids de la preuve.
5.5.3 Résumé du potentiel de bioaccumulation
Il est mentionné que les colorants azoïques dispersés ont un coefficient de partage octanol-eau allant de modéré à élevé (log Koe allant de 3,4 à 5,7), ce qui est le seul élément de preuve semblant indiquer un potentiel de bioaccumulation élevée. Malgré cela, les données expérimentales sur un certain nombre de produits chimiques et d'analogues n'indiquent pas de potentiel significatif de bioconcentration à partir de l'eau. Bien que les données sur le partage octanol-eau indiquent un certain potentiel de bioaccumulation, d'autres facteurs indiquent un potentiel global de bioaccumulation faible. Par exemple, la nature particulaire des colorants azoïques dispersés et leur grand diamètre moléculaire sont susceptibles de diminuer le taux d'absorption de ces colorants par les membranes des branchies, permettant ainsi à d'autres processus internes d'élimination d'atténuer la charge corporelle totale.
Compte tenu des données expérimentales disponibles sur la bioaccumulation et la bioconcentration ainsi que des facteurs liés à la taille, les colorants azoïques dispersés ne devraient pas se bioaccumuler de façon importante chez les organismes présents dans l'environnement.
6. Potentiel d'effets nocifs sur l'environnement
6.1 Évaluation des effets sur l'environnement
Les effets des colorants azoïques dispersés sur l'environnement ont été caractérisés à l'aide des données empiriques disponibles sur ces substances. Des données empiriques sur les analogues ont également été prises en compte dans le cadre de la présente évaluation. Aucun modèle n'a été utilisé pour prédire l'écotoxicité d'une quelconque de ces substances, car elles sont hors de leur domaine d'applicabilité. Une approche basée sur la charge corporelle critique a également été prise en compte dans le cadre de l'établissement du poids de la preuve.
6.1.1 Milieu aquatique
6.1.1.1 Données empiriques sur la toxicité
Des données sur la toxicité aquatique et chronique des colorants azoïques dispersés ont été recueillies et sont résumées dans les tableaux 6-1 et 6-2. D'autres détails sont présentés à l'annexe C. Des valeurs exactes des paramètres tirées de chaque étude sur l'écotoxicité ont été rapportées lorsqu'un effet létal ou sublétal était observé chez 50 % des organismes testés ou si aucun effet n'avait été observé aux concentrations les plus élevées. Dans bien des cas, les effets létaux ou sublétaux ont été observés chez moins de 50 % des organismes testés aux concentrations les plus élevées. Par conséquent, l'écotoxicité a été caractérisée au moyen de gammes plutôt que de valeurs exactes des paramètres.
Les colorants azoïques dispersés sont peu solubles dans l'eau et il est difficile de les tester dans ce milieu, car ils ne se dissolvent pas naturellement à forte concentration. Des vecteurs, des solvants ou des dispersants sont souvent utilisés dans les expériences pour faciliter leur dissolution et aider au maintien de dispersions stables. Par conséquent, l'exposition aux produits chimiques testés peut avoir lieu à un niveau supérieur à leur limite de solubilité dans l'eau. Nombre des concentrations les plus élevées utilisées lors de tests sur la toxicité de colorants azoïques dispersés ne sont vraisemblablement pas réalistes en ce qui concerne leurs solubilités dans l'eau prévues dans l'environnement au Canada. Toutefois, d'autres facteurs (p. ex. la température, la pression, des cosolvants) présents dans le milieu ambiant peuvent accroître légèrement la solubilité de ces produits chimiques dans l'eau.
Tel qu'indiqué dans un rapport de l'ECETOC (1996), l'utilisation de tout agent auxiliaire à faible concentration ne devrait pas causer d'effets toxiques additionnels sur les organismes testés. Si des effets écotoxiques sont constatés, ils devraient être identifiés et pris en compte dans les résultats en utilisant un groupe témoin exposé uniquement au solvant. Il a également été noté que la toxicité à des concentrations supérieures à la solubilité dans l'eau peut être attribuable à des artéfacts dans les procédures de test, comme l'ingestion de particules qui a été observée lors de certains tests de toxicité sur des colorants dispersés, ou pourrait être attribuée à des impuretés ou des produits de transformation (ECETOC 1996).
De plus, lorsque les concentrations d'une substance testée sont bien supérieures à sa solubilité dans l'eau, des impuretés solubles peuvent aussi être présentes avec des effets qui pouvent compliquer l'interprétation de la toxicité réelle de la substance (Weyman et al. 2012). Weyman et al. (2012) ont également indiqué que, lorsqu'un solvant est utilisé et que la substance testée n'est pas complètement dissoute, toute matière non dissoute présente dans le milieu testé peut potentiellement avoir des effets (physiques) nocifs sur les organismes testés, comme le blocage de membranes des branchies de poissons, l'encapsulation ou le piégeage des daphnies, ou la réduction de l'intensité de la lumière lors de tests sur des algues. Tous ces facteurs perturbent les résultats des tests de toxicité et doivent être pris en compte lors de l'interprétation et de l'évaluation des données. Compte tenu de ces facteurs qui compliquent les tests de toxicité aquatique des colorants azoïques dispersés, il est prudent de se fier davantage aux études menées avec des niveaux d'exposition faibles, réalistes et proches ou dans les limites connues de solubilité dans l'eau.
Des tests d'écotoxicité aiguë de colorants azoïques dispersés ont été menés sur une variété d'organismes aquatiques. Alors qu'il n'est pas toujours possible d'obtenir des détails spécifiques, on suppose que la plupart, voire la totalité, des études ont été menées en utilisant un produit chimique dont la pureté était inférieure à 100 % et qui était mélangé à un agent auxiliaire afin de faire en sorte que le produit chimique se dissolve dans l'eau. Les données rapportées sur la toxicité à court terme des colorants azoïques dispersés sont résumées dans le tableau 6-1.
Les tests de toxicité sur les algues n'ont pas été inclus dans les tableaux ci-dessous. Dans le cadre des études d'écotoxicité utilisant des algues, le test d'inhibition aiguë de croissance est l'un des tests les plus utilisés afin de déterminer la toxicité pour les organismes aquatiques en mesurant les changements du taux de croissance en réponse à une exposition aux produits chimiques testés dans l'eau. Dans le cadre de tests sur des substances colorées, on a observé qu'elles étaient en mesure d'atténuer la pénétration de la lumière dans le milieu testé en absorbant et en réfléchissant la lumière. Si des solvants ou des émulsifiants sont utilisés pour obtenir une dispersion homogène dans l'eau, il est probable que l'atténuation de la lumière soit proportionnelle à la quantité de la substance ajoutée. L'inhibition de la croissance des algues en raison de l'atténuation de la lumière peut se traduire par une diminution de la croissance de la population d'algues, laquelle est liée à la quantité de la substance ajoutée dans le milieu testé. Cependant, une telle inhibition n'est pas considérée comme un véritable effet écotoxicologique des produits chimiques testés (Rufli et al. 1998, Cleuvers et Weyers 2003).
Des recommandations ont été formulées sur les mesures à prendre pour traiter le problème de l'atténuation de la lumière lors de tests en présence de substances colorées. Il a été suggéré que les algues soient remises dans un milieu exempt de la substance testée à la fin de la période d'exposition afin de pouvoir faire la distinction entre un effet algistatique et un effet algicide (Whitehouse et Mallet 1993). Un trajet réduit de la lumière à travers la solution testée a également été proposé afin que le taux de croissance des algues ne soit pas affecté (Comber et al. 1995, Cleuvers et Weyers 2003). Toutefois, les études recensées portant sur l'évaluation des effets écotoxicologiques des colorants azoïques dispersés et des analogues sur les algues ne font pas état d'une atténuation de la lumière. Il n'y a donc pas d'indication quant à savoir si cet effet a été minimisé. Par conséquent, on suspecte que l'écotoxicité rapportée lors d'études sur les algues puisse ne pas représenter les « véritables » effets des colorants testés sur les organismes.
| Nom générique du C.I. | Masse molé-culaire (g/mol) | Deff (nm) | Organisme | Paramètre de toxicité et valeur (mg/L) | Référence(s) |
|---|---|---|---|---|---|
| Disperse Red 1* | 314 | 0,86 | Daphnia similis | CE50 = 0,13 après 48 h | Ferraz et al. 2011b, Vacchi et al. 2013 |
| Disperse Red 1* | 314 | 0,86 | Hydra attenuata | CE50 = 1,9 après 48 h | Vacchi et al. 2013 |
| Disperse Orange 1* | 318 | 0,87 | Daphnia similis | CSEO = 0,1 après 48 h | Ferraz et al. 2011a |
| Disperse Red 13* | 349 | 0,89 | Daphnia similis | CE50 = 0,019 après 48 h | Ferraz et al. 2011b |
| Disperse Orange 29 | 0,99 | Crustacé (Daphnia magna ) | CE50 = 70 après 48 h | Brown 1992 | |
| Disperse Red 179 | 394 | 1,01 | Poisson arc-en-ciel (Poecilia reticulata) | CL50 = 10 à 100 après 96 h | BMG 2003b |
| DAPEP | 404 | 0,93 | Poisson arc-en-ciel (Poecilia reticulata) | CSEO supérieur(e) u égal(e) à 100 après 96 h | BMG 2000b |
| DADM | 439 | 1,17 | Poisson zèbre (Brachydanio rerio) | CL0 supérieur(e) à 1 000 après 96 h | Présentation de projet 2008b |
| Disperse Orange 30 | 450 | 1,04 | Crustacé (Daphnia magna) | Brown 1992 | |
| 52697-38-8 | 479 | 1,08 | Truite arc-en-ciel (Oncorhynchus mykiss) | CL50 supérieur(e) à 100 après 96 h | SafePharm 1990a |
| MATCB | 493 | 1,03 | Carpe commune (Cyprinus carpio) | CL50 supérieur(e) à 100 après 96 h | Kremer 2003 |
| Disperse Blue 791 | 625 | 1,23 | Crustacé (Daphnia magna) | CE50 = 16 après 24 h | Brown 1992 |
| Disperse Blue 79 | 639 | 1,29 | Crustacé (Daphnia magna) | CE50 = 4.5 après 48 h | Brown 1992 |
Ferraz et al. (2011b) et Vacchi et al. (2013) ont mené des études d'écotoxicité sur le Disperse Red 1* et le Disperse Red 13*. Les résultats indiquent que ces deux substances présentent une toxicité élevée pour Daphnia similis. La CE50 après 48 h pour le Disperse Red 1* (0,127 mg/L) est légèrement inférieure à sa solubilité dans l'eau connue (0,16 mg/L). Toutefois, la CE50 après 48 h pour le Disperse Red 13* (0,019 mg/L) est légèrement supérieure à sa solubilité dans l'eau (0,012 mg/L) (Ferraz et al. 2011b). Vacchi et al. (2013) ont également publié une étude sur l'écotoxicité du Disperse Red 1* et ont rapporté une CE50 similaire pour Daphnia similis après 48 h. Toutefois, tel qu'indiqué dans la publication, le produit chimique testé est un colorant commercial composé de 60 % de Disperse Red 1*, de 20 % de colorants secondaires et de 20 % d'un agent de dispersion utilisé comme auxiliaire de coloration. Le Disperse Red 1* a été extrait du colorant commercial et étudié séparément. Les auteurs suggèrent que l'écotoxicité du colorant commercial provient du composant principal (le Disperse Red 1*). Par contre, l'impact des composants de la formulation sur la biodisponibilité n'a pas été évalué ni traité en profondeur.
D'après les données présentées au tableau 6-1, les colorants azoïques dispersés et leurs analogues ayant une masse moléculaire plus petite (314 à 349 g/mol) semblent avoir une toxicité aquatique plus élevée. Quant aux colorants azoïques dispersés ayant une masse moléculaire plus grande (377 à 639 g/mol), ils semblent présenter une toxicité aquatique moins importante. Des tests d'écotoxicité chronique ou à long terme de colorants azoïques dispersés ont été menés sur un nombre relativement faible d'organismes aquatiques. Alors qu'il n'est pas toujours possible d'obtenir des détails spécifiques, on suppose que la plupart, voire la totalité, des études ont été menées au moyen d'un produit chimique dont la pureté était inférieure à 100 % et qui était mélangé à un agent auxiliaire afin que le produit chimique se dissolve dans l'eau. Les données rapportées sur la toxicité chronique des colorants azoïques dispersés sont résumées dans le tableau 6-2.
| Nom générique du C.I. | Masse moléculaire (g/mol) | Deff (nm) | Organisme | Paramètre de toxicité et valeur (mg/L) | Référence |
|---|---|---|---|---|---|
| Disperse Yellow 7 | 316 | 0,86 | Tête-de-boule (Pimephales promelas) | CL50 = 0,025 après 20 joursa | Parrott et al. 2013 |
| Disperse Yellow 7 | 316 | 0,86 | Crustacé (Hyalella azteca) | CL50 = 0,16 après 14 jours CL50 = 0,12 après 28 jours |
Bartlett 2013 |
| Disperse Orange 13 | 1,02 | Crustacé (Hyalella azteca) | CL50 = 1,41 après 14 jours CL50 = 0,61 après 28 jours | Bartlett 2013 | |
| Disperse Blue 79:1 | 625 | 1,23 | Truite arc-en-ciel (Oncorhynchus mykiss) | CSEO supérieur(e) u égal(e) à 0,0048 après 122 jours | ABC 1991 |
a La période de test de 20 jours commençait à être comptée depuis l'exposition des œufs moins de 24 heures après la fécondation, avec une éclosion 4-5 jours après la fécondation, et finissait 14 jours après l'éclosion.
Lors d'une étude sur la toxicité chronique du Disperse Yellow 7 (Parrott et al. 2013), on a observé une toxicité élevée pendant les premiers stades de la vie de la tête-de-boule (Pimephales promelas). On a utilisé le méthanol comme vecteur. Une réponse toxique retardée a été observée, la létalité pour les larves de poissons survenant 4 à 5 jours après leur éclosion. Lors d'une autre étude sur la toxicité chronique du Disperse Blue 79:1, des œufs de truite arc-en-ciel (Oncorhynchus mykiss) nouvellement fécondés ont été exposés à la substance testée pendant 122 jours après l'éclosion (ABC 1991). Aucun effet sur la survie ni sur la croissance des organismes testés n'a été rapporté à une concentration proche de la solubilité maximale de la substance. La CSEO était égale ou supérieure à la concentration testée la plus élevée de 0,0048 mg/L (ABC 1991).
Des différences significatives observées dans les toxicités aquatiques associées aux substances testées pourraient être liées à la biodisponibilité chez les organismes testés (Parrott et al. 2013, Bartlett 2013, ABC 1991). La masse moléculaire du Disperse Blue 79:1 est de 625 g/mol, soit presque le double de celle du Disperse Yellow 7 (316 g/mol). Le Disperse Blue 79:1 a aussi un diamètre de section efficace (Deff) [1,23 nm] bien plus grand que celui du Disperse Yellow 7 (0,86 nm). Tel que discuté dans la section sur la bioaccumulation (5.5.2), la taille du Disperse Blue 79:1 est susceptible de limiter son absorption comparativement à celle du Disperse Yellow 7. Combinée à la biotransformation et à l'élimination, la concentration interne des substances les plus grandes dans l'organisme aquatique ne semble pas suffisamment élevée pour entraîner un effet, même pendant une période d'exposition beaucoup plus longue à un niveau égal à sa limite de solubilité dans l'eau.
La relation entre la masse moléculaire, la taille moléculaire (Deff) et la toxicité a pu également être observée lors d'études de toxicité chronique menées chez la même espèce d'invertébré aquatique (Hyalella azteca) exposée au Disperse Yellow 7 et au Disperse Orange 13 pendant 28 jours (Bartlett 2013). Les données préliminaires ont indiqué une toxicité légèrement plus élevée pour le Disperse Yellow 7 que pour le Disperse Orange 13, qui a une masse moléculaire plus faible et un Deff plus petit que ce dernier (tableau 6-2).
Le diamètre de section et la masse moléculaire des colorants azoïques dispersés ayant fait l'objet d'une analyse semblent correspondre assez bien (tableau 6-3). Dans la plupart des cas, les substances dont la masse moléculaire était de 352 g/mol ou moins avaient un diamètre de section efficace plus petit que celui des substances qui avaient une masse moléculaire se situant entre 377 et 639 g/mol. En ce qui concerne le reste de la partie de l'évaluation portant sur l'environnement, les colorants azoïques dispersés seront répartis en deux classes en fonction de leurs tailles; une classe de substances dont la masse moléculaire est inférieure à 360 g/mol et une catégorie de substances dont la masse moléculaire est supérieure à 360 g/mol.
| Nombre de substances | Gamme de masses moléculaires (g/mol) | Gamme de diamètres de section efficace (Deff) (nm) |
|---|---|---|
| 8 | 302 à 352 | 0,77 à 1,02 |
| 65 | 377 à 639 | 0,99 à 1,29 |
Aucune donnée empirique sur la toxicité n'était disponible pour le Disperse Yellow 3. On s'attend à ce que le Disperse Yellow 3 présente une toxicité comparable à celle du Disperse Yellow 7. Le Disperse Yellow 3 a un petit diamètre de section efficace (Deff = 0,84 nm), une plus petite masse moléculaire (269 g/mol) et est plus soluble dans l'eau (1 800 mg/L) que les 73 substances de ce sous-groupe, indiquant qu'il pourrait être plus biodisponible que les autres substances visées par la présente évaluation.
Dans l'évaluation des colorants azoïques avec solvant, la toxicité de ces substances allaient d'une concentration sans effet observé après 21 jours de 0,0071 mg/L pour la reproduction de Daphnia magna à une CL50 supérieure à 100 mg/L après 48 h chez Oryzias latipes. Des renseignements supplémentaires sur la toxicité des colorants azoïques avec solvant sont disponibles dans l'évaluation de ceux-ci (Environnement Canada, Santé Canada, 2015). Une CL50 de 0,23 mg/L après 96 heures chez le poisson (Oryzias latipes) a été choisie comme valeur critique de toxicité (VCT) pour le Disperse Yellow 3 (voir l'évaluation des colorants azoïques avec solvant pour de plus amples renseignements) [Environnement Canada, Santé Canada, 2015].
D'après les renseignements disponibles, il semble que les organismes aquatiques sont sensibles aux colorants azoïques dispersés de plus petite taille (p. ex. ceux dont la masse moléculaire est inférieure à 360 g/mol). Quant aux substances plus grandes (c.-à-d. celles dont la masse moléculaire est égale ou supérieure à 360 g/mol), des effets seraient observés à des concentrations supérieures à leur solubilité dans l'eau. Il serait bon de noter l'absence de données sur la toxicité des colorants azoïques dispersés de plus grande taille (dont la masse moléculaire est supérieure à 360 g/mol).
6.1.1.2 Charge corporelle critique (CCC) estimée chez le poisson
Compte tenu de leurs propriétés physiques et chimiques, on estime que les colorants azoïques dispersés sont peu solubles dans l'eau, ont un faible potentiel de bioaccumulation chez les organismes vivant dans les milieux naturels et ont une faible toxicité aiguë pour les poissons à leur concentration de saturation dans l'eau. Toutefois, il reste encore à déterminer les effets de ces substances sur les organismes aquatiques en fonction de leur solubilité dans l'eau. En effet, il est possible que les colorants azoïques dispersés aient à l'état brut une solubilité, une biodisponibilité et une toxicité intrinsèque différentes de celles sous une forme contenant des impuretés, dans des formulations ou en présence de produits chimiques auxiliaires utilisés lors de tests de toxicité aquatique.
Pour répondre à cette question, une approche reposant sur la charge corporelle critique ou la concentration critique interne peut être suivie en tant que mécanisme de vérification, pour lequel les concentrations à effets externes aigus des substances causant la mortalité des organismes peuvent être calculées, puis comparées aux résultats des études d'écotoxicité indiquant des effets biologiques prononcés (p. ex. des tests avec des solvants et des dispersants) et à des schémas de classification de l'écotoxicité (c.-à-d. des valeurs de CL50/CE50 reflétant des niveaux de toxicité aquatique faibles, modérés ou élevés).
Cette approche est décrite en détail à l'annexe D du présent document, alors que les concentrations avec effets externes aigus calculées pour deux colorants azoïques dispersés et deux analogues (pour lesquels le FBC et la teneur en lipides des organismes testés ont été indiqués) sont résumées dans le tableau 6-4.
| Nom générique du C.I. | Masse moléculaire (g/mol) |
FBCp.h. (L/kg) |
Teneur en lipides (%) |
FBCL (L/kg) | Concentration avec effet externe aigu (CL50) (mg/L) |
|---|---|---|---|---|---|
| Disperse Orange 30 | 450 | 8,43 | 0,83 | 50,78 | 44 |
| Disperse Red 167 | 520 | 1,68 | 4,3 | 1,95 | 1 333 |
| Disperse Yellow163*a | 417 | 36,6 | 3,9 | 47,31 | 44 |
| Disperse Orange 73* | 443 | 4,12 | 4,3 | 4,79 | 462 |
Abréviations : FBCp.h., FBC pour le corps entier sur la base du poids humide; FBCL, FBC normalisé pour le contenu en lipides;
a Un astérisque (*) après le nom générique du C.I. ou le n° CAS indique que la substance en question est un analogue.
Les données calculées indiquent que pour atteindre les seuils de charge corporelle critique et entraîner le décès de 50 % des organismes testés, le niveau d'exposition aux substances doit être d'au moins 44 mg/L (CL50 supérieur(e) u égal(e) à 44 mg/L). Cette estimation laisse supposer que ces substances présentent une toxicité modérée pour les poissons, ce qui concorde avec le faible potentiel de bioaccumulation chez les poissons, comme cela est mentionné dans la section « Potentiel de bioaccumulation », où est formulée l'hypothèse selon laquelle la biodisponibilité ne devrait pas être élevée pour les substances de ce sous-groupe. En effet, les FBC très faibles (c.-à-d. faible absorption) de ces substances, qui ont une faible solubilité dans l'eau, signifient que leur risque de causer des effets toxiques aigus est faible, ce qui est confirmé par les concentrations mentionnées précédemment qui entraînent un effet externe aigu selon l'approche reposant sur la charge corporelle critique et par l'absence d'effets nocifs importants observée dans les tests de bioconcentration. Même si les résultats de l'approche de la charge corporelle critique sont relativement compatibles avec les résultats expérimentaux de toxicité aiguë pour les poissons, ils ne tiennent pas compte de la biodisponibilité des substances individuelles, qui est associée à l'hydrosolubilité ainsi qu'à la masse et à la taille moléculaires. En outre, aucune donnée n'était disponible pour calculer le seuil de la charge corporelle critique pour les substances dont la masse moléculaire était inférieure à 360 g/mol, y compris le Disperse Yellow 3.
6.1.1.3 Concentrations estimées sans effet (CESE) dans le milieu aquatique
Pour prédire la concentration sans effet dans l'environnement qui sera utilisée aux fins de la caractérisation des risques dans la présente évaluation, un facteur d'évaluation peut être utilisé afin de tenir compte de l'extrapolation des données de laboratoire aux données de terrain, des incertitudes liées aux variations entre les espèces, de la sensibilité différente des paramètres bilogiques et de l'extrapolation d'un test en laboratoire sur une seule espèce aux écosystèmes.
La CL50 de 0,025 mg/L après 20 jours pour le Disperse Yellow 7 (Parrott et al. 2013) a été choisie à titre de valeur de toxicité représentative pour les colorants azoïques dispersés de masse moléculaire inférieure à 360 g/mol. Cette valeur de toxicité est inférieure à l'hydrosolubilité de cette substance. De plus, d'autres études ont fait état de valeurs de toxicité à environ la même concentration sur d'autres substances ou organismes testés. En utilisant un facteur d'application de 10 afin de procéder à une extrapolation du laboratoire aux conditions sur le terrain, on a calculé une CESE à 0,0025 mg/L pour les colorants azoïques dispersés de masse moléculaire inférieure à 360 g/mol.
Les substances de masse moléculaire égale ou supérieure à 360 g/mol ne devraient pas avoir d'effets sur les organismes aquatiques pendant toute exposition à long terme à un niveau égal ou inférieur à leur limite d'hydrosolubilité. Si elle était calculée, la CESE serait probablement supérieure à l'hydrosolubilité de ces substances. Par conséquent, aucune CESE n'a été calculée pour les substances de masse moléculaire égale ou supérieure à 360 g/mol.
Le Disperse Yellow 3 a une hydrosolubilité plus importante que celles des 73 autres colorants azoïques dispersés visés par la présente évaluation. Par conséquent, la CESE pour le Disperse Yellow 3 dans l'eau a été estimée séparément de celle des 73 autres colorants azoïques dispersés de ce sous-groupe. D'après les éléments de preuve, dont des données empiriques et des données croisées sur l'écotoxicité aquatique, une CL50 de 0,23 mg/L après 96 heures chez le poisson (Oryzias latipes) a été retenue comme valeur critique de toxicité (VCT) pour le Disperse Yellow 3 (voir l'évaluation des colorants azoïques avec solvant pour de plus amples renseignements) [Environnement Canada, Santé Canada, 2015]. En utilisant un facteur d'application de 100 afin d'extrapoler la concentration sans effet à long terme provenant d'un paramètre de toxicité aiguë et d'extrapoler les données de laboratoire aux conditions sur le terrain, on a calculé pour cette substance une CESE de 0,0023 mg/L pour le milieu aquatique.
6.1.2 Sol
Il existe peu de renseignements sur les effets de ces 73 colorants azoïques dispersés et du Disperse Yellow 3 dans le sol. Dans une évaluation préalable réalisée dans le cadre du Défi, on donne des données sur la toxicité d'un analogue structurel dans le sol (n° CAS 70198-17-3*). Une CL50 de 32 mg/L (96 h) a été rapportée pour les plathelminthes (Health, Safety, and Human Factors Laboratory 1978). Toutefois, la fiabilité de cette information ne peut être évaluée en raison du manque de détails dans la présentation originale.
Bien que les données sur la toxicité dans le sol des analogues des colorants dispersés soient limitées, on a recensé quelques substances de structure similaire pour lesquelles il existe des données d'écotoxicologie pertinentes. Ces données sont utilisées pour estimer l'effet des colorants azoïques dispersés sur les organismes vivant dans le sol (voir le tableau 6-5).
| Nom générique du C.I.a | Structure chimique | Organisme, valeur du paramètre et référence |
|---|---|---|
| Solvent Red 1* | 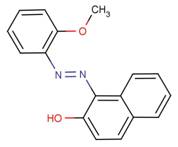 |
Embryons de tortue (Chelydra serpentina) CSEO supérieur(e) à 625 mg/kg de sol (poids sec) après 21 jours (Milani et Intini 2013) |
| Pigment Yellow 1* | 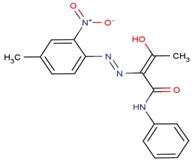 |
Lombric (Eisenia fetida) CSEO = 1 000 mg/kg de sol (poids sec) après 56 jours (Étude présentée 2012a) Avoine (Avena sativa); colza (Brassica napus); soja (Glycine max) CSEO = 1 000 mg/kg de sol (poids sec) après 21 jours (Étude présentée 2012b) |
| Pigment Red 112* | 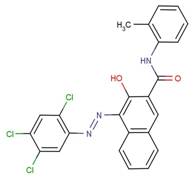 |
Avoine (Avena sativa); colza (Brassica napus); soja (Glycine max) CSEO = 1 000 mg/kg de sol (poids sec) après 21 jours (ECHA 2012) |
a Un astérisque (*) après le nom générique du C.I. indique que la substance est un analogue.
Milani et Intini (2013) ont réalisé une étude de détermination des doses et ont fait état des données écotoxicologiques sur le Solvent Red 1* pour les embryons de tortue (Chelydra serpentina). Dans une série de six groupes de concentrations, on a constaté un succès d'éclosion de 100 % dans les groupes exposés à des concentrations de 0, 5 et 124 mg/kg de sol (poids sec). Dans les groupes exposés à des concentrations de 1, 25 et 625 mg/kg de sol (poids sec), le succès d'éclosion était respectivement de 92,5, 90 et 97,5 %. L'évaluation des malformations potentielles nécessite une analyse plus approfondie, mais ces résultats préliminaires indiquent une très faible toxicité chez les tortues (Milani et Intini 2013).
Trois autres études sur la toxicité dans le sol ont été recensées pour le Pigment Yellow 1* et Pigment Red 112*, des substances qui ont une structure semblable à celles des colorants azoïques dispersés. Les études indiquent qu'avec une charge de 1 000 mg/kg de sol, aucun effet nocif (mortalité, reproduction et biomasse des organismes pour les lombrics; taille/poids des pousses, taux d'émergence et effets phytotoxiques visibles pour les plantes cultivées) n'a été observé à la suite d'une exposition chronique.
Aucune CESE n'a été calculée pour le sol. En se basant sur les renseignements susmentionnés, ces 73 colorants azoïques dispersés ne devraient pas être nocifs pour les organismes vivant dans le sol, ce qui peut probablement s'expliquer par la faible biodisponibilité de ces substances dans du sol en vrac.
En ce qui concerne le Disperse Yellow 3, les données préliminaires sur sa toxicité dans le sol ont été déterminées dans le cadre de l'évaluation préalable du groupe de colorants azoïques avec solvant (Environnement Canada, Santé Canada, 2015). Une CSEO supérieure à 625 mg/kg p.s. a été observée après 21 jours pour les embryons de tortue (Chelydra serpentina) avec le Solvent Red 1. Ces données sont préliminaires, ce qui laisse entendre qu'il est peu probable que le Disperse Yellow 3 soit nocif pour les organismes vivant dans le sol. De plus, elles ne sont pas considérées comme étant appropriées pour une utilisation en tant que VCT. Par conséquent, la CESE de cette substance pour le sol n'a pas été déterminée.
6.1.3 Sédiments
Aucune donnée d'écotoxicologie pour les organismes vivant dans les sédiments n'a été répertoriée pour les colorants azoïques dispersés. Toutefois, Milani et Intini (2013) ont mené des études préliminaires sur les effets du Solvent Red 1* (ou Sudan Red G*), un colorant azoïque de faible solubilité (7,8 × 10-3 mg/L), sur les éphémères (Hexagenia spp.) lors d'un test de 21 jours et sur un oligochète (Tubifex tubifex) lors d'un test de 28 jours. Au cours de ces tests, les organismes ont été exposés à diverses concentrations de Solvent Red 1* dans des sédiments (voir le tableau 6-6). Pour les éphémères, une CL50 supérieure à 1 000 μg/g de poids sec et une CI50 (croissance) supérieure à 1 000 μg/g de poids sec ont été rapportées (concentrations nominales). On a noté une légère diminution de la croissance à la concentration le plus forte testée (1 000 μg/g). Tubifex tubifex était plus sensible, avec une CL25 de 56,3 μg/g et une CL50 de 70,5 μg/g. Les paramètres de reproduction de Tubifex tubifex étaient plus sensibles que les paramètres de survie, avec une CI25 variant de 1,0 à 3,3 μg/g. Toutes les concentrations rapportées étaient nominales, et le vecteur utilisé était l'acétone. Pendant les tests, on a rapporté qu'une couche spongieuse de produits chimiques et de solvants s'était formée au-dessus des sédiments, couche qui pourrait avoir eu des effets physiques sur T. tubifex en limitant sa capacité à creuser. Il est possible que ce facteur ait accru la toxicité et qu'il ajoute un élément d'incertitude pour l'interprétation des résultats de ces tests préliminaires.
Aucune CESE n'a été calculée pour ce milieu, mais les résultats préliminaires sur un colorant avec solvant indiquent que les colorants azoïques dispersés pourraient être dangereux pour des espèces sensibles vivant dans les sédiments.
| Organisme | Type d'essai | Paramètre (μg/g)a |
|---|---|---|
| Oligochète (Tubifex tubifex) | CL25 après 28 jours | 56,3 |
| Oligochète (Tubifex tubifex) | CL50 après 28 jours | 70,5 |
| Oligochète (Tubifex tubifex) | CI25 après 28 jours (reproduction) | 1,0 à 3,3 |
| Éphémère (Hexagenia spp.) | CL50 après 21 jours | supérieur(e) à 1 000 |
| Éphémère (Hexagenia spp.) | CI50 après 21 jours (croissance) | supérieur(e) à 1 000 |
a Concentrations nominales; les concentrations finales seront confirmées lorsque les résultats seront finalisés.
Tel qu'indiqué dans la section « Persistance dans l'environnement », les colorants azoïques dispersés peuvent être biodégradés dans les sédiments (Yen et al. 1991). Toutefois, dans les sédiments profonds anoxiques, les produits de la biodégradation ne devraient pas présenter un degré élevé d'exposition potentielle pour la plupart des organismes, en partie parce que le contact des organismes avec les sédiments anoxiques sera probablement limité et aussi parce que les produits de dégradation, des amines, devraient être solidement liés aux sédiments, conduisant à une très faible biodisponibilité (Weber et al. 2001, Colón et al. 2002). Par conséquent, il est peu probable que les colorants azoïques dispersés soient préoccupants dans des conditions anaérobies de l'environnement.
Les données préliminaires sur la toxicité dans les sédiments indiquent qu'il est improbable que le Disperse Yellow 3 soit nocif pour les organismes vivant dans le sol. Cependant, aucune VCT pour cette substance n'a été déterminée dans le milieu sédimentaire.
6.2 Évaluation de l'exposition dans l'environnement
En raison de difficultés à doser différentes classes de colorants présents au niveau de traces dans des échantillons prélevés dans l'environnement, on possède peu de données sur la présence, la persistance ou le devenir des colorants utilisés pour le traitement au mouillé des textiles (Maguire et Tkacz 1991). Tel que précédemment indiqué dans l'Approche pour la création de sous-groupes et dans le document sur les renseignements de base (Environnement Canada et Santé Canada 2013), une seule enquête sur la présence des colorants dans l'environnement au Canada a été publiée (Maguire et Tkacz 1991, Maguire 1992). Lors d'une étude environnementale menée en 1987, aucun colorant dispersé n'a été détecté dans des échantillons d'eau prélevés dans la rivière Yamaska, au Québec, dans laquelle pourraient être déversés des effluents provenant d'usines de textile situées à proximité (Canada 2001). De plus, aucun colorant dispersé n'a été détecté dans plus de 100 échantillons de poissons prélevés dans cette rivière au cours de la même année (Canada 2001). Cela pourrait être attribuable à l'installation de systèmes de traitement des eaux usées dans les grandes villes du bassin hydrographique de cette rivière où l'échantillonnage a été effectué ou bien au fait que l'échantillonnage ne portait pas sur les colorants dispersés utilisés.
Entre 2009 et 2012, des échantillons ont été prélevés dans des usines de traitement des eaux usées à travers le Canada (courriel de 2012 de la Division de la recherche sur la protection des écosystèmes aquatiques, Direction des sciences et de la technologie de l'eau, Environnement Canada, adressé à la Division des évaluations environnementales, Direction des sciences et de l'évaluation des risques, Environnement Canada; non référencé) et analysés afin de détecter la présence de quatre colorants azoïques dispersés (le Disperse Orange 5, le Disperse Orange 13, le Disperse Yellow 7 et le Disperse Blue 79). Aucun de ces colorants n'a été détecté. D'après des enquêtes récentes, parmi ces quatre colorants seul le Disperse Blue 79 est commercialisé.
Étant donné les données limitées existant sur des concentrations de colorants azoïques dispersés mesurées dans l'environnement (dans l'eau, le sol ou les sédiments) au Canada, les concentrations dans l'environnement ont été estimées sur la base des renseignements disponibles.
6.2.1 Rejets dans l'environnement
Les rejets anthropiques d'une substance dans l'environnement dépendent de différentes pertes lors de la fabrication, de l'utilisation industrielle, de l'utilisation commerciale ou par les consommateursNote de bas de page4, ainsi que lors de l'élimination d'une substance. Afin d'estimer les rejets dans l'environnement à différentes étapes du cycle de vie des colorants azoïques dispersés, Environnement Canada a compilé des renseignements sur les secteurs pertinents et les gammes de produits ainsi que sur les facteurs d'émissionNote de bas de page5 dans les eaux usées, le sol et l'air à différentes étapes du cycle de vie en vue de déterminer celles qui contribuent le plus aux concentrations dans l'environnement. Nous avons également tenu compte des activités de recyclage et de transfert vers les sites d'élimination des déchets (sites d'enfouissement, incinération). Cependant, les rejets dans l'environnement à partir de ces sources n'ont pas été pris en compte sur le plan quantitatif, à moins que des renseignements spécifiques et fiables sur le taux (ou le potentiel) de rejets à partir des sites d'enfouissement ou des incinérateurs soient disponibles
Les facteurs pertinents pour les différentes étapes du cycle de vie de ces substances ont été pris en compte. Des incertitudes ont été mises en évidence et des hypothèses ont été faites en fonction de la disponibilité des renseignements. Des scénarios d'exposition pour les utilisations et les milieux préoccupants ont été élaborés, y compris la détermination des concentrations environnementales estimées (CEE) qui sont applicables.
6.2.2 Identification des scénarios d'exposition importants
La caractérisation de l'exposition est centrée sur les scénarios d'exposition importants. Ces scénarios sont représentatifs des rejets importants dans l'environnement et des niveaux d'exposition relativement élevés. En général, l'ampleur des rejets est directement liée à la quantité d'une substance produite ou utilisée, ainsi qu'à ses facteurs d'émission applicables. Quand une quantité de rejets industriels est similaire à une quantité totale de rejets par des consommateurs et/ou des activités commerciales, elle conduit à des niveaux plus élevés d'exposition de l'environnement. Cela est dû à la concentration des rejets industriels dans un nombre limité d'installations, alors que les rejets des consommateurs ou les rejets commerciaux sont dispersés à travers le pays.
Deux scénarios ont été déterminés comme conduisant à des rejets importants de colorants azoïques dispersés commercialisés dans l'environnement. Ces scénarios étaient la formulation de produits chimiques pour textiles et la coloration de textiles. Les données provenant d'enquêtes récentes menées en vertu de l'article 71 de la LCPE 1999 [Canada 2006, 2008a, 2008b, 2008c, 2009a, 2009b, 2011] ont révélé que 13 colorants azoïques dispersés de ce sous-groupe, ainsi que le Disperse Yellow 3, avaient été déclarés comme ayant été importés en quantité supérieure au seuil de déclaration de 100 kg/an et qu'ils étaient utilisés pour la formulation de produits chimiques pour textiles ou la coloration de textiles. Ces enquêtes ont aussi indiqué qu'aucun de ces 13 colorants azoïques dispersés, ni le Disperse Yellow 3, n'étaient produits au Canada. La quantité totale importée de ces 13 colorants azoïques dispersés et du Disperse Yellow 3 se situait entre 10 000 et 100 000 kg/an. Les facteurs d'émission dans les eaux usées étaient élevés, soit entre 0,74 et 12 % pour les colorants dispersés utilisés dans la formulation de produits chimiques pour textiles ou la coloration de textiles (communications téléphoniques de 2013 entre l'installation de formulation et Environnement Canada; non référencé; OCDE 2004). Ces facteurs d'émission, combinés à la quantité totale importée, indiquent que la formulation de produits chimiques pour textiles et la coloration de textiles représentent des sources importantes de rejets dans l'environnement.
Par comparaison aux rejets de colorants provenant d'utilisations industrielles, l'exposition résultant du lavage de produits textiles devrait être relativement faible, car les rejets provenant du lavage des textiles sont dispersés à travers le Canada et la quantité par site de rejet est beaucoup plus faible que celle d'un petit nombre d'installations industrielles. Par conséquent, les utilisations commerciales ou par les consommateurs n'ont pas été prises en compte comme source de rejets importante et n'ont donc pas été retenues pour la caractérisation de l'exposition quantitative.
6.2.3 Estimation des concentrations environnementales estimées (CEE)
On a estimé l'exposition aux colorants azoïques dispersés sous forme de CEE pour des scénarios de formulation de produits chimiques pour textiles et de coloration de textiles. Ces concentrations sont basées sur les renseignements disponibles sur les quantités de colorants azoïques dispersés, les facteurs d'émission dans les eaux usées, les caractéristiques des systèmes de traitement des eaux usées et les caractéristiques du milieu récepteur.
D'après les renseignements obtenus lors d'enquêtes récentes menées en vertu de l'article 71 de la LCPE 1999 [Canada, 2006, 2008a, 2008b, 2008c, 2009a, 2009b, 2011], moins de quatre installations ont été recensées comme utilisant du Disperse Yellow 3 pour la formulation de produits chimiques pour textiles, et 39 installations ont été identifiées comme utilisant 13 colorants azoïques dispersés de ce sous-groupe ainsi que le Disperse Yellow 3 pour la coloration des textiles. Une installation de coloration de textiles a confirmé à Environnement Canada qu'elle n'utilisait plus de colorants azoïques dispersés pour ses activités après les achats initiaux (courriel de 2013 de l'usine de coloration de textiles adressé à Environnement Canada; non référencé). Par conséquent, moins de 4 installations de formulation de produits chimiques pour textiles et 38 installations de coloration de textiles ont été retenues pour l'évaluation de l'exposition due à l'utilisation industrielle de colorants azoïques dispersés. Toutes ces installations étaient situées dans trois provinces (Nouvelle-Écosse, Ontario et Québec).
6.2.4 CEE en milieu aquatique
La CEE en milieu aquatique pour les installations de formulation (moins de 4) et chacune des 38 installations de coloration a été estimée à l'aide de plusieurs paramètres, dont la quantité estimée de colorants azoïques dispersés utilisés quotidiennement , le facteur d'émission dans les eaux usées, le débit de traitement et d'élimination des eaux usées et le facteur de dilution dans les eaux réceptrices. Les calculs détaillés se trouvent à l'annexe E.
6.2.4.1 Formulation de produits chimiques pour textiles
On comptait moins de quatre installations qui utilisaient le Disperse Yellow 3 pour la formulation de produits chimiques pour textiles. D'après les renseignements fournis par les entreprises concernées (communications téléphoniques de 2013 entre l'entreprise et Environnement Canada; non référencé), la quantité maximale de Disperse Yellow 3 utilisée quotidiennement était de 440 kg. En tenant compte d'un facteur d'émission dans les eaux usées de 1,1 %, d'un taux d'élimination pour le traitement des eaux usées sur place et hors site de 26,2 %, d'un débit du système de traitement des eaux usées hors site de 24 375 000 L/jour et d'une capacité de dilution élevée dans les eaux réceptrices, la CEE en milieu aquatique du Disperse Yellow 3 est estimée à 0,011 mg/L.
6.2.4.2 Coloration de textiles
La quantité quotidienne des 13 colorants azoïques dispersés de ce sous-groupe et de Disperse Yellow 3 utilisée dans chaque installation de coloration de textiles a été déterminée en se basant sur des données bibliographiques ou des données fournies par les installations. Parmi les 38 installations de coloration de textiles, une seule en Ontario a fourni une quantité utilisée quotidiennement inférieure à 15 kg (courriels de 2013 de l'usine de textile à Environnement Canada; non référencé). En ce qui concerne les 37 autres installations, la quantité utilisée quotidiennement demeure inconnue et, par conséquent, elle été estimée à 36 kg/jour en se basant sur des données bibliographiques (EPA des États-Unis 1994, Cai et al. 1999).
Le facteur d'émission dans les eaux usées pour les colorants dispersés était donné dans la gamme 1-12 % pour la coloration de textiles (OCDE 2004), et la limite supérieure de cette gamme (12 %) a été utilisée comme quantité utilisée quotidiennement, conduisant à des quantités rejetées quotidiennement dans les eaux usées prudentes.
On a également présumé que ces rejets quotidiens prudents pénétraient dans les systèmes d'égouts locaux sans passer par une usine de traitement sur place dans les installations de coloration de textiles. Bon nombre de ces installations possèdent un système de traitement des eaux usées sur place, bien que le type de traitement soit inconnu pour chacune des installations évaluées. Afin d'obtenir une estimation prudente, on a présumé que les colorants étaient rejetés dans le système d'égouts sans traitement sur place des eaux usées. Cette hypothèse s'est traduite par une estimation prudente des rejets quotidiens dans le système d'égouts, qui correspondaient aux rejets quotidiens dans les eaux usées.
La CEE aquatique pour chaque installation a ensuite été calculée en se basant sur les caractéristiques du système local de traitement des eaux usées hors site et des eaux réceptrices. Premièrement, la concentration de colorants dans les influents a été déterminée à partir de la quantité quotidienne rejetée dans le système d'égouts et du débit du système de traitement des eaux usées hors site. Deuxièmement, la concentration de colorants des effluents a été calculée en se basant sur l'efficacité d'élimination du système de traitement des eaux usées hors site, qui a été estimée à l'aide du modèle ASTreat (2006) pour les systèmes de traitement primaire dans la gamme 21,7-47,1 % et pour les systèmes secondaires dans la gamme 26,2-61,1 % ou à l'aide du modèle STP-EX (2008) pour les lagunes dans la gamme 8,3-67,3 %. Les limites inférieures de chaque gamme ont été utilisées pour calculer des concentrations dans les effluents prudentes. Enfin, la CEE en milieu aquatique a été calculée en appliquant à la concentration des effluents un facteur de dilution approprié dans les eaux réceptrices.
Les CEE en milieu aquatique obtenues pour les 38 installations sont présentées sur le plan statistique. Elles vont de 1,2 × 10-4 à 0,11 mg/L (tableau 6-4). Il serait bon de noter que ces CEE sont des estimations prudentes en raison de l'utilisation du facteur d'émission dans les eaux usées le plus élevé, de l'absence de toute élimination par le traitement des eaux usées sur place et des taux d'élimination les plus faibles pour les systèmes de traitement des eaux usées hors site. Ces CEE ne reflétaient pas non plus nécessairement le niveau réel d'exposition, car il n'existait pas de données sur la coloration de textiles propres aux installations pouvant être utilisées pour les calculs, à l'exception d'une installation de coloration en Ontario. Néanmoins, les CEE en milieu aquatique estimées étaient indicatives d'un niveau d'exposition prudent pour l'utilisation industrielle de 13 colorants azoïques dispersés de ce sous-groupe et du Disperse Yellow 3.
6.2.5 CEE dans les sédiments
Une approche de partage eau-sédiment à l'équilibre décrite par l'Agence européenne des produits chimiques (ECHA 2010) a été suivie afin d'estimer les CEE des colorants azoïques dispersés dans les sédiments. Cette approche présume que la concentration dans les sédiments benthiques est en équilibre avec la concentration dans l'eau sus-jacente. Selon Gobas (2007), la concentration dans l'eau sus-jacente devrait correspondre à la concentration dans la phase aqueuse et ne devrait pas comprendre les quantités adsorbées par les sédiments en suspension. La concentration dans la phase aqueuse peut être estimée à partir de la CEE en milieu aquatique, ce qui représente la concentration totale dans l'eau. Ainsi, les CEE dans les sédiments pour chaque installation ont été établies à partir de leur CEE respective en milieu aquatique et ont été normalisées en fonction d'une teneur en carbone organique (CO) de 3 % pour les sédiments benthiques.
Les CEE probabilistes dans les sédiments pour les 38 installations sont résumées statistiquement dans le tableau 6-4. Les calculs détaillés de ces CEE dans les sédiments sont expliqués à l'annexe E.
Les CEE probabilistes dans les sédiments figurant au tableau 6-4 sont prudentes, étant donné que les concentrations dans la phase aqueuse sont des estimations prudentes. Dans la colonne d'eau, la concentration totale de colorants azoïques dispersés ou la CEE en milieu aquatique associée à une installation donnée avait une valeur fixe. Elle a été répartie entre la phase aqueuse et la phase solide (sédiments en suspension). La concentration dans la phase solide dépend de la teneur en carbone organique de la phase solide, et cette dernière variait d'un minimum de 0,1 kg/kg à un maximum de 0,2 kg/kg (Gobas, 2010). Le choix de la valeur minimale de 0,1 kg/kg a permis d'obtenir une concentration minimale dans la phase solide et, ainsi, une concentration maximale dans la phase aqueuse. Cette concentration maximale a ensuite permis d'obtenir une CEE maximale dans les sédiments.
Une approche de partage eau-sédiment à l'équilibre décrite par l'Agence européenne des produits chimiques (ECHA 2010) a été suivie afin d’estimer les CEE du Disperse Yellow 3 dans les sédiments. Cette approche présume que la concentration dans les sédiments benthiques est en équilibre avec la concentration dans l'eau sus jacente. Selon Gobas (2007), la concentration dans l'eau sus-jacente devrait correspondre à la concentration dans la phase aqueuse et ne devrait pas comprendre les quantités adsorbées par les sédiments en suspension. La concentration dans la phase aqueuse peut être estimée à partir de la CEE en milieu aquatique, ce qui représente la concentration totale dans l'eau. Ainsi, les CEE dans les sédiments pour chaque installation ont été établies à partir de leur CEE respective en milieu aquatique et ont été normalisées en fonction d’une teneur en carbone organique (CO) de 3 % pour les sédiments benthiques.
Une CEE dans les sédiments de 25,3 mg/kg a été calculée pour la formulation de produits chimiques pour les textiles. Des informations plus détaillées sont disponibles dans l’évaluation de certains colorants avec solvant azoïques (Environnement Canada, Santé Canada, 2015).
6.2.6 CEE dans le sol
Une approche décrite par l'Agence européenne des produits chimiques (ECHA 2010) a été suivie afin de déterminer les CEE dans le sol des colorants azoïques dispersés résultant de l'épandage sur les terres de biosolides des eaux usées. En suivant cette approche, les quantités de biosolides accumulés dans la couche supérieure de 20 cm du sol au cours de dix années consécutives ont été estimées et utilisées comme valeur de base pour les CEE dans le sol. Une hypothèse sous-jacente de cette approche était qu'il n'y avait aucune perte par dégradation, volatilisation ou lixiviation ni dans les eaux de ruissellement. En général, cette hypothèse a conduit à des CEE dans le sol prudentes.
En suivant la méthode susmentionnée, on a estimé les CEE probabilistes dans le sol pour les 38 installations de coloration de textiles; elles sont résumées statistiquement dans le tableau 6-4 et expliquées en détail à l'annexe E. D'après leurs CEE en milieu aquatique, la CEE dans le sol associée à l'utilisation du Disperse Yellow 3 pour la formulation de produits chimiques pour colorants se situe dans la gamme de CEE probabilistes dans le sol associées à des utilisations de ces colorants pour la coloration de textiles et, en conséquence, elle n'est pas présentée séparément.
Ces CEE dans le sol ont été déterminées en se basant sur les quantités de colorants azoïques dispersés adsorbés par les biosolides. Ces quantités adsorbées ont été estimées de façon prudente en utilisant l'adsorption maximale par les biosolides, déterminée à l'aide de modèles numériques. Deux modèles ont été utilisés : ASTreat (2006) pour les systèmes de traitement primaire ou secondaire; STP-EX (2008) pour les lagunes. L'utilisation de l'adsorption maximale a permis de calculer de façon plus prudente les CEE dans le sol.
Les CEE dans les sols calculées étaient également fonction de la production quotidienne de biosolides par un système de traitement des eaux usées hors site donné ainsi que du taux d'épandage de ces biosolides. La production quotidienne de biosolides a été établie à partir de la population desservie par le système de traitement et la production de boues par habitant relevées dans la littérature. La production de boue par habitant était de 0,080 kg/jour et personne pour les systèmes de traitement primaire des eaux usées et de 0,195 kg/jour et personne pour les systèmes de traitement secondaire (Droste, 1997). Dans le cas des lagunes, la production de boues par habitant n'a pu être trouvée, mais on présume qu'elle est identique à celle des systèmes de traitement primaire en raison de la similarité des mécanismes d'évacuation des boues de ces deux types de traitement. Le taux d'épandage des biosolides variait selon la province ou le territoire, soit de 1,6 tonne par année en Ontario (ministère de l'Environnement de l'Ontario et ministère de l'Agriculture, de l'Alimentation et des Affaires rurales de l'Ontario, 1996) à 8,3 tonnes par année en Alberta (ministère de l'Environnement de l'Alberta, 2009). Un taux approprié a été utilisé pour les calculs selon l'emplacement d'une installation donnée.
Pour les calculs des CEE dans le sol, on a présumé que l'épandage de biosolides était effectué au taux maximal permis par la province ou le territoire où l'installation se trouvait. On a aussi assumé pour ces calculs que les boues produites étaient converties en biosolides, qui étaient ensuite épandus. Cette hypothèse pourrait entraîner une surestimation de l'épandage de biosolides, car ce ne sont pas toutes les boues, en particulier les boues de lagunes, qui sont converties en biosolides, et ce ne sont pas tous les biosolides qui sont épandus.
| Centile | CEE aquatique (mg/L) | CEE dans les sédiments (mg/kg) | CEE dans le sol (mg/kg) |
|---|---|---|---|
| 0e (minimum) | 0,00012 | 0,15 | 0,05 |
| 5e | 0,00012 | 0,15 | 0,20 |
| 10e | 0,000012 | 0,15 | 0,29 |
| 20e | 0,00012 | 0,15 | 0,29 |
| 30e | 0,00012 | 0,15 | 0,29 |
| 40e | 0,00052 | 0,63 | 0,29 |
| 50e | 0,0045 | 5,5 | 1,2 |
| 60e | 0,0062 | 7,5 | 4,6 |
| 70e | 0,021 | 25,1 | 5,1 |
| 80e | 0,035 | 42,8 | 13,8 |
| 90e | 0,056 | 68 | 132,7 |
| 95e | 0,097 | 118 | 136,9 |
| 100e (maximum) | 0,11 | 131,4 | 505,1 |
6.3 Caractérisation des risques pour l'environnement
L'approche suivie pour la présente évaluation préalable des colorants azoïques dispersés ayant trait à l'environnement visait à examiner divers renseignements pertinents afin d'élaborer des conclusions fondées sur le poids de la preuve et le principe de prudence. Les éléments de preuve retenus comprennent les données expérimentales disponibles sur les propriétés physicochimiques, les potentiels de persistance et de bioaccumulation, les sources, les rejets, le devenir dans l'environnement et l'écotoxicité des colorants azoïques dispersés, ainsi que les résultats d'une analyse prudentes de quotient de risque, décrits ci-après.
En se basant sur les résultats d'enquêtes récentes, 13 des 73 colorants azoïques dispersés faisant partie de la présente évaluation ont été identifiés comme étant commercialisés au Canada. La quantité totale de ces 13 substances importée au Canada se situe entre 10 000 et 100 000 kg/an. De plus, le Disperse Yellow 3, qui a été aussi été évalué dans le cadre de l'évaluation des colorants azoïques avec solvant (sous le nom de Solvent Yellow 77) a également été identifié comme étant commercialisé.
En règle générale, les colorants azoïques dispersés ont une faible hydrosolubilité (de l'ordre du nanogramme ou du microgramme par litre), mais ont une solubilité plus élevée dans l'octanol. Étant donné leur importation et leur utilisation au Canada, les rejets potentiels dans les milieux aquatiques et terrestres (par le biais des boues d'épuration) ont été estimés. Les colorants azoïques dispersés ne sont pas volatils et il est probable qu'ils finiront par se déposer dans les sédiments s'ils sont rejetés dans les eaux. Ils peuvent toutefois être encore présents dans la colonne d'eau à faible concentration. S'ils sont rejetés dans le sol, ils devraient y demeurer.
Les données expérimentales montrent que les colorants azoïques dispersés sont persistants dans des conditions aérobies, mais qu'ils devraient se dégrader dans des milieux anaérobies (p. ex. des sédiments profonds). Les études sur la bioaccumulation et la bioconcentration montrent toutes que les colorants azoïques dispersés présentent un faible potentiel de bioaccumulation chez les organismes aquatiques.
Des études sur l'écotoxicité des colorants azoïques dispersés ont été menées avec quatre principaux taxons d'organismes aquatiques. En raison de la faible solubilité de ces substances dans l'eau, divers agents auxiliaires ont été utilisés lors de ces études afin de faciliter leur dissolution et assurer des dispersions stables. Par conséquent, l'exposition aux produits chimiques étudiés pourrait être plus élevée dans de telles conditions expérimentales, et la plupart des valeurs de toxicité aiguë rapportées excèdent leur solubilité connue dans l'eau.
Au nombre des organismes testés pour lesquels on disposait de données sur la toxicité aiguë, Daphnia spp. s'est avérée l'espèce la plus sensible. Toutefois, des tests de toxicité chronique à faible concentration dans les limites d'hydrosolubilité sont préférables et existent pour l'Hyalela spp. et quelques espèces de poissons (tête-de-boule et truite arc-en-ciel). Les données sur la toxicité chronique indiquent différents niveaux de risque pour les organismes aquatiques à de faibles concentrations et laissent entendre que des effets sont observés à des concentrations plus faibles pour les substances ayant une petite masse moléculaire (moins de 360 g/mol). Le paramètre de toxicité chronique de 0,025 mg/L a été retenu à titre de valeur critique de toxicité pour le Disperse Yellow 7, représentant les colorants azoïques dispersés de masse moléculaire inférieure à 360 g/mol. En utilisant un facteur d'application de 10 afin de procéder à une extrapolation des conditions en laboratoire aux conditions sur le terrain, on a calculé une CESE de 0,0025 mg/L. Aucune CESE n'a été calculée pour les colorants azoïques dispersés de masse moléculaire égale ou supérieure à 360 g/mol, car elle serait probablement supérieure à la solubilité maximale des substances. La CESE pour le Disperse Yellow 3 a été calculée à 0,0023 mg/L d'après des données de toxicité croisées obtenues à partir du Solvent Yellow 1 (n° CAS 60-09-3, CL50 de 0,023 mg/L après 96 h) chez le poisson (Oryzias latipes) et un facteur d'application de 100 afin d'extrapoler la concentration sans effet à long terme provenant d'un paramètre de toxicité aiguë et d'extrapoler les effets en laboratoire aux effets sur le terrain.
Bien que les données sur la toxicité portaient surtout sur l'exposition dans un milieu pélagique, le sol et les sédiments peuvent également constituer des milieux importants en raison du devenir prévu de ces substances dans l'environnement. Les données pour les sédiments et le sol sont limitées et incertaines. Il existe quelques indications de toxicité à de faibles concentrations dans les sédiments d'après des données préliminaires sur T. tubifex, mais des substances similaires n'exhibent pas de niveau de toxicité élevé dans le sol. Aucune CEE n'a été calculée pour les sédiments ni pour le sol.
Une analyse de quotient de risque a été effectuée en comparant la valeur de CEE en milieu aquatique (obtenue à partir du scénario d'exposition pertinent) à la CESE en milieu aquatique (extrapolée à partir des données écotoxicologiques). L'analyse de l'exposition aquatique pour le scénario de coloration de textiles a été réalisée à l'aide de méthodes probabilistes. La probabilité que ces CEE dépassent les CESE pour les colorants azoïques dispersés de masse moléculaire inférieure à 360 g/mol a été jugée élevée (55 %). Cependant, la masse moléculaire des 13 colorants azoïques dispersés commercialisés au Canada est égale ou supérieure à 377 g/mol. Par conséquent, puisque aucun des 73 colorants azoïques dispersés ayant une masse moléculaire inférieure à 360 g/mol n'est utilisé présentement au Canada, le risque que ces substances présentent pour les organismes aquatiques est faible compte tenu des niveaux d'exposition actuels. L'utilisation du Disperse Yellow 3 pour la coloration de textiles s'avère toutefois préoccupante pour le milieu aquatique, puisque sa masse moléculaire est en-dessous de 360g/mol et qu’il a été rapporté qu’il est utilisé au Canada selon les enquêtes en vertu de l’article 71 de la LCPE. De plus, tel qu'indiqué précédemment, les 73 colorants azoïques dispersés parmi les 73 visés par la présente évaluation dont la masse moléculaire est inférieure à 360 g/mol pourraient être nocifs pour les organismes aquatiques en raison de leurs propriétés dangereuses. Une liste de ces substances préoccupantes pour la santé de l'environnement en raison de leurs propriétés dangereuses est présentée à l'annexe F. Il serait bon de noter que l'utilisation de tout colorant azoïque dispersé de masse moléculaire inférieure à 360 g/mol pourrait probablement s'avérer préoccupante pour le milieu aquatique en raison de la biodisponibilité accrue de ces substances.
On a élaboré un scénario de formulation pour textiles spécifique du site pour le Disperse Yellow 3. La CEE en milieu aquatique pour ce scénario était de 0,011 mg/L. Une analyse de quotient de risque a été effectuée en comparant la CEE à la CESE en milieu aquatique de 0,0023 mg/L. Le quotient de risque obtenu à la suite de cette analyse est de 4,7. L'utilisation du Disperse Yellow 3 dans des formulations pour textiles s'avère préoccupante pour les organismes aquatiques.
Étant donné que les données sur les sédiments ou le sol sont limitées et incertaines, aucune CESE n'a été calculée pour ces milieux et aucune analyse de quotient de risque n'a été effectuée. Les 73 colorants azoïques dispersés et le Disperse Yellow 3 sont associés à une faible toxicité dans le sol ou les sédiments et ne devraient pas avoir d'effets nocifs sur les organismes vivant dans ces deux milieux.
6.3.1 Incertitudes dans l'évaluation des risques pour l'environnement
Il existe une zone importante d'incertitude dans l'évaluation du risque pour l'environnement en raison du manque de données expérimentales pour la plupart des colorants azoïques dispersés visés par la présente évaluation préalable. Afin de caractériser les propriétés physiques et chimiques clés des colorants azoïques dispersés, notamment leur solubilité dans l'eau et leur coefficient de partage octanol-eau (log Koe), une approche fondée sur des données croisées a été suivie. En ce qui concerne l'application de cette approche basée sur des similarités structurelles, ces substances ont été séparées en quelques groupes similaires de ce point de vue. Par conséquent, une caractérisation fondée sur une propriété physicochimique donnée est plus fiable. L'évaluation du potentiel de persistance et de bioaccumulation des colorants azoïques dispersés est basée sur un nombre limité de données. Des données empiriques provenant d'analogues ont été utilisées pour l'évaluation quand cela était possible. D'autres facteurs structurels connexes, comme les diamètres de section importants et les masses moléculaires allant de modérée à élevée, ont également été pris en compte pour l'évaluation du potentiel de bioaccumulation. Le diamètre de section et la masse moléculaire semblent également influencer la biodisponibilité ainsi que la toxicité des colorants azoïques dispersés. Les données sur la toxicité ont indiqué que les organismes semblaient être plus sensibles aux substances de masse moléculaire égale ou inférieure à 360 g/mol. Toutefois, il existe peu de données sur la toxicité pour les substances de masse moléculaire supérieure à 360 g/mol, ce qui nous permet de confirmer cette valeur.
Tel que discuté auparavant dans la présente évaluation, les colorants azoïques dispersés devraient avoir une faible solubilité dans l'eau. Par conséquent, pour améliorer leur performance de coloration lors d'opérations industrielles, ces substances peuvent être vendues et utilisées en combinaison avec des surfactants, de sorte que la distribution des colorants commerciaux dans l'environnement (entre le milieu aquatique et les sédiments) peut être différente que celle découlant des hypothèses portant sur des substances pures. Quand cela était possible, la pureté chimique a été indiquée et prise en compte pour la détermination de la fiabilité d'une étude.
De nombreuses valeurs rapportées pour les paramètres d'écotoxicité dépassent la solubilité des colorants azoïques dispersés et de leurs analogues dans l'eau. De telles concentrations environnementales sont obtenues en utilisant des agents auxiliaires pour augmenter la solubilité des substances testées. En raison de leur faible solubilité, les colorants étaient mélangés avec un agent solubilisant pour réaliser le test. Cette façon de faire peut augmenter les valeurs de solubilité, qui sont artificiellement élevées, et influer sur les résultats des tests de toxicité pour les organismes aquatiques. Les efforts visant à rendre les colorants plus solubles peuvent accroître leur biodisponibilité, mais des facteurs dans le milieu ambiant peuvent exercer un effet similaire. Toutefois, la façon dont ceci est relié avec les facteurs dans milieu ambiant est inconnue.
De plus, en ce qui concerne l'écotoxicité, en se basant sur le comportement de répartition prédit pour ces produits chimiques, il n'est pas bien tenu compte de l'importance du sol et des sédiments comme milieux d'exposition importants en raison du manque de données sur les effets. Bien que la colonne d'eau puisse ne pas être le milieu le plus inquiétant à long terme, les seules données sur les effets identifiées portent principalement sur des expositions d'organismes pélagiques. Les données sur les organismes du sol exposés à des substances ayant une structure similaire ont été prises en compte pour caractériser l'écotoxicité des colorants azoïques dispersés.
L'écotoxicité des colorants azoïques dispersés a été évaluée d'après leurs effets écologiques sur la survie globale, la croissance et la reproduction. Toutefois, des données sur la génotoxicité et la cytotoxicité d'analogues ont été obtenues lors de tests en laboratoire. La mutation des cellules germinales peut avoir une incidence sur la valeur sélective des espèces aquatiques. Les données empiriques sont insuffisantes pour évaluer la génotoxicité ou la cytotoxicité des colorants azoïques dispersés de ce sous-groupe.
Il existe une autre source d'incertitude reliée à la dégradation des colorants azoïques dispersés, en particulier au taux de dégradation dans les sédiments anaérobies, à l'ampleur de la dégradation dans ces sédiments et à la biodisponibilité des produits de dégradation (p. ex. les amines aromatiques). Néanmoins, il apparaît clairement que la dégradation anaérobie de la partie biodisponible des colorants azoïques dans les sédiments en amines constitutives est beaucoup plus rapide (demi-vies de l'ordre de quelques jours) que la biodégradation aérobie. La faible solubilité dans l'eau des colorants azoïques dispersés de ce sous-groupe peut limiter la réduction biotique générant des produits de dégradation. Par contre, les amines aromatiques produites lors de la dégradation ne devraient pas être biodisponibles étant donné qu'elles se forment seulement dans des sédiments anoxiques relativement profonds et qu'elles peuvent se lier aux sédiments de façon irréversible. L'évaluation écologique des amines aromatiques sera traitée séparément dans le cadre du groupe de substances azoïques aromatiques et à base de benzidine.
Le manque de données sur la surveillance des colorants synthétiques (y compris les colorants azoïques dispersés) dans l'environnement représente une autre source d'incertitude. Celle-ci est en partie attribuable aux difficultés à déterminer les différentes classes de colorants azoïques présents à l'état de traces dans les échantillons prélevés dans l'environnement. De plus, certains facteurs clés pour le calcul des rejets de colorants dans l'environnement par des installations demeurant inconnus, certains facteurs ont été estimés.
6.3.2 Colorants azoïques dispersés ayant des effets préoccupants pour l'environnement
Dans l'ensemble, les risques que posent les substances visées par la présente évaluation pour l'environnement sont faibles compte tenu des niveaux actuels d'exposition. Toutefois, tel que susmentionné, certains des colorants azoïques dispersés peuvent avoir des effets préoccupants en raison de leur toxicité aquatique. Parmi ceux-ci, on retrouve huit colorants azoïques dispersés de ce sous-groupe, ainsi que d'autres colorants du même type ayant une masse moléculaire inférieure à 360 g/mol. Une liste des substances ayant des effets préoccupants pour l'environnement en raison de leur toxicité aquatique est présentée à l'annexe F.
7. Potentiel d'effets nocifs sur la santé humaine
En ce qui concerne l'évaluation des risques pour la santé humaine, la présente évaluation préalable porte sur 64 des 74 substances, dont le Disperse yellow 3, 13 substances précédemment évaluées dans le cadre du Défi du PGPC pour lesquelles de nouveaux renseignements significatifs pertinents pour la santé humaine sont devenus disponibles, et une autre substance (ANMOM, n° CAS 59709-38-5) qui faisait partie du Défi mais pour laquelle aucune conclusion n'avait été tirée. Pour 10 des 74 substances visées par la présente évaluation, les conclusions pour la santé humaine n'ont pas été mises à jour puisque pour ces 10 substances, des conclusions avaient été formulées dans le cadre du Défi et aucun renseignement nouveau significatif pertinent pour la santé humaine n'a pu être identifié.
7.1 Évaluation de l'exposition
Parmi les 64 substances prises en compte pour la partie sur la santé humaine de la présente évaluation, 13 sont considérées comme ayant un potentiel d'exposition directe et prolongée de la population générale due aux textiles, à savoir : Disperse Blue 79:1, Disperse Orange 30, Disperse Blue 79, ANAM, Disperse Brown 1:1, Disperse Brown 1, Disperse Red 167, BANAP, n° CAS 52697-38-8, Disperse Orange 61, n° CAS 63833-78-3, ANMOM et Disperse Yellow 3. Les utilisations du Disperse Yellow 3 et la caractérisation de son exposition, sous le nom de Solvent Yellow 77, sont résumées dans l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada 2015).
7.1.1 Milieux de l'environnement et nourriture
En raison de la très faible pression de vapeur de ces substances, l'inhalation de la fraction volatile dans l'air ne devrait pas constituer une voie d'exposition importante. De même, en raison de leur volatilité et de leur solubilité dans l'eau très faibles, les colorants azoïques dispersés devraient être sorbés dans le sol et les sédiments lorsqu'ils sont rejetés dans l'environnement. Par conséquent, l'exposition de la population générale aux colorants azoïques dispersés due à la consommation d'eau potable devrait être beaucoup plus faible que celle basée sur des CEE estimées pour le milieu aquatique (voir la section « Évaluation de l'exposition dans l'environnement »). De plus, les valeurs de CEE dans le sol ont été dérivées de valeurs pour l'épandage de biosolides sur les terres, étant donné que des colorants azoïques dispersés peuvent être présents dans des biosolides résultant du traitement des eaux usées. Globalement, les milieux de l'environnement ne sont pas considérés comme source importante d'exposition aux colorants azoïques dispersés.
Tel que résumé dans la section « Utilisations », aucun des 74 colorants azoïques dispersés n'est utilisé dans des emballages alimentaires. L'Agence canadienne d'inspection des aliments (ACIA) a réalisé des tests sur la présence de colorants alimentaires synthétiques dans les aliments, dont celle du Disperse Yellow 7. Lors des enquêtes sur des aliments ciblés menées en 2009-2010 et en 2010-2011, l'ACIA a analysé des échantillons d'aliments nationaux et importés, dont des épices, qui ont été choisis en raison de leur probabilité élevée à contenir des colorants alimentaires (ACIA 2010, 2011). Le Disperse Yellow 7 n'a été décelé dans aucun des plus de 1 600 échantillons analysés lors de ces deux enquêtes. Dans l'ensemble, on ne s'attend pas à une exposition aux colorants azoïques dispersés due à la nourriture.
7.1.2 Produits de consommation
Tel que susmentionné, les effets potentiels de 64 des 74 substances de la présente évaluation ont été évalués. On considère que 13 de ces 64 substances présentent, pour la population générale, un potentiel d'exposition directe et prolongée due aux textiles. Pour 10 de ces 13 substances, les renseignements utilisés pour appuyer une exposition potentielle due aux textiles sont basés sur les résultats d'une enquête menée en vertu de l'article 71 de la LCPE 1999, qui indiquent leur utilisation pour la coloration de textiles au Canada (voir le tableau 4-1 de la section 4.1 sur les sources : ANAM, ANMOM, BANAP, Disperse Blue 79:1, Disperse Blue 79, Disperse Orange 30, Disperse Orange 61, Disperse Red 167, Disperse Yellow 3 et n° CAS 52697-38-8), Pour trois autres de ces 13 substances (Disperse Brown 1, Disperse Brown1 :1, n° CAS 63833-78-3), d'autres renseignements fournis par l'ETAD (2010, courriel de l'ETAD à Environnement Canada, non référencé) ont indiqué des utilisations au Canada pour la coloration de textiles (voir la section 4.2 sur les utilisations). En se basant sur ces renseignements, 13 de ces 64 substances visées par la présente évaluation sont donc considérées comme présentant un potentiel d'exposition directe et prolongée de la population générale due aux textiles.
Aucun renseignement sur les concentrations de ces 13 substances dans les produits textiles commercialisés au Canada n'a été soumis dans le cadre de l'enquête menée en vertu de l'article 71 ni n'a été soumis par l'ETAD. En conséquence, l'exposition à ces 13 substances a été caractérisée en se basant sur un scénario d'exposition générique aux produits textiles pour la population générale du Canada. La caractérisation de l'exposition à 12 de ces 13 substances est présentée dans les sections ci-après. L'exposition potentielle au Disperse Yellow 3 a été caractérisée, sous le nom de Solvent yellow 77, lors de l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada 2015). Elle n'est donc pas présentée dans le présent document.
L'utilisation de produits textiles (p. ex. vêtements, literie, etc.) qui sont colorés à l'aide de colorants azoïques dispersés devrait entraîner une exposition directe et prolongée par voie orale et/ou cutanée. Un résumé des estimations de l'exposition par voie orale et cutanée aux 12 colorants azoïques dispersés (excluant le Disperse Yellow3) due aux textiles est donné dans le tableau 7-1. Pour les matériaux textiles, l'exposition orale est estimée sur la base des objets en textile (p. ex. jouets et couvertures) que les bébés (de 0 à 6 mois) portent à leur bouche, tandis que l'exposition cutanée est estimée sur la base des vêtements portés par les adultes (20 à 59 ans) et des grenouillères portées par les bébés (0 à 6 mois), en supposant une couverture corporelle complète. Ces scénarios d'exposition devraient représenter les principales sources d'exposition dues aux utilisations prévues des produits de textile et conduire à des estimations prudentes en utilisant des facteurs d'exposition appropriés. Par exemple, l'hypothèse d'une couverture corporelle complète est faite pour tenir compte des expositions dues au port de plusieurs vêtements contenant une substance. De plus, le lessivage des colorants peut être accéléré par le lavage et l'usure. Le taux de migration après 28 heures de cycles simulés de lavage et d'usure s'est avéré inférieur à un dixième de la valeur mesurée pour la première migration. La fraction de migration de 0,0005, qui représente un dixième de la migration initiale maximale (0,5 %), a été utilisée pour refléter l'exposition après les premiers lavages.
Ces substances ne devraient pas être présentes dans tous les produits de consommation en textiles en vente au Canada. Par conséquent, les niveaux d'exposition ont été calculés en supposant, sur la base d'un jugement professionnel, qu'il y a 10 % de probabilité qu'un colorant donné soit utilisé dans la coloration de produits textiles au Canada. Le facteur d'ajustement de 10 % utilisé dans la présente évaluation est comparable à celui de 8 % utilisé dans l'évaluation danoise pour estimer les expositions aux amines aromatiques et aux colorants azoïques dues aux vêtements en textile sur le marché de vêtements hollandais (Zeilmaker et al., 1999). Consulter l'annexe G pour obtenir plus de détails sur le scénario d'exposition et les algorithmes.
Absorption cutanée
On s'attend à ce que le potentiel d'absorption cutanée des colorants azoïques dispersés soit variable en raison de la large gamme de tailles moléculaires et de propriétés physicochimiques associées (p. ex. solubilité dans l'eau et dans l'octanol) à ces substances. Aucune donnée empirique sur l'absorption cutanée n'a été trouvée pour les substances suivantes : Disperse Blue 79:1, Disperse Orange 30, Disperse Blue 79, ANAM, Disperse Brown 1:1, Disperse Brown 1, Disperse Red 167, BANAP, n° CAS 52697-38-8, Disperse Orange 61, n° CAS 63833-78-3 et ANMOM. Toutefois, des données pertinentes concernant d'autres colorants azoïques dispersés similaires ont été prises en compte pour déterminer le degré d'absorption cutanée de ces substances. Les hypothèses faites pour l'absorption cutanée du Disperse Yellow 3 sous le nom de Solvent yellow 77 sont présentées dans l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada 2015) et ne sont donc pas présentées dans la présente évaluation.
Pour estimer l'exposition aux produits chimiques présents dans les vêtements, le groupe de travail « Textiles » de l'Institut fédéral allemand d'évaluation des risques (BfR 2007) a recommandé l'utilisation d'une fraction absorbée par voie cutanée de 0,01 et de 0,02 dans les zones de forte transpiration, à titre d'hypothèses prudentes. Cette recommandation est basée sur l'analyse d'études réalisées par l'ETAD (1994, 1995a) sur l'absorption cutanée de plusieurs colorants dispersés, y compris trois colorants azoïques dispersés (Disperse Red 17, Disperse Yellow 3, Disperse Blue165), au moyen de tests sur de la peau de porc et de la peau humaine. Les flux allaient respectivement de moins de 0,007 à 2,59 μg/cm2 par heure et de moins de 0,001 à 0,219 μg/cm2 par heure pour une période de 55 heures, indiquant une faible absorption cutanée. Bien que la conception de ces études ne tenait pas compte des résidus liés à la peau, les données semblent indiquer un relativement faible degré d'absorption cutanée pour ces trois colorants azoïques.
D'autres renseignements sur l'absorption cutanée de deux colorants azoïques dispersés apparentés proviennent d'évaluations faites par le Comité scientifique des produits de consommation de l'Union européenne (CSPC). L'absorption cutanée du Disperse Black 9 a été étudiée grâce à un système de cellules de diffusion in vitro dans le verre conforme à la ligne directrice no 428 de l'OCDE. Des échantillons de dermatome de 400 µm d'épaisseur ont été prélevés sur cinq donneuses. Du Disperse Black 9 (1 %) radiomarqué dans la formulation de crème de coloration capillaire a été appliqué pendant 30 minutes et l'échantillonnage s'est poursuivi pendant 48 heures après l'application. La quantité moyenne récupérée était de 104 %, et les lavages de la peau représentaient plus de 103 %. La quantité moyenne biodisponible totale et le pourcentage étaient respectivement de 0,128 μg/cm2 et de 0,122 % (P&G juin 2005), indiquant une absorption minimale.
L'absorption cutanée du Disperse Red 17 a été également étudiée par DeLigt (2005) au moyen d'un système de cellules de diffusion in vitro à flux continu conforme à la ligne directrice no 428 de l'OCDE. Des échantillons de dermatome humain de 400 µm d'épaisseur ont été prélevés sur trois donneuses. Du Disperse Red 17 radiomarqué dans les formulations de colorant capillaire non oxydatives à 0,2 % (p/p) et dans des formulations de colorant capillaire oxydatives à 2 % (p/p) a été appliqué pendant 60 minutes et l'échantillonnage s'est poursuivi pendant 23 heures après l'application. Le taux de récupération moyen déclaré dans les préparations oxydatives et non oxydatives était supérieur à 98 %. Les quantités biodisponibles moyennes totales et les pourcentages (conditions non oxydatives et oxydatives) étaient respectivement de 0,41 μg/cm2 (0,89 %) et de 0,50 μg/cm2(0,11 %).
La faible absorption orale du Disperse Blue 79:1 indique un potentiel d'absorption cutanée tout aussi faible. Une étude du métabolisme in vivo du Disperse Blue 79:1 chez des rats Sprague-Dawley CD mâles et femelles a indiqué une biodisponibilité orale limitée. Les animaux ont reçu une dose de Disperse Blue 79:1 marqué au C14 de 50 ou de 500 mg/kg p.c., administrée par gavage dans de l'huile de maïs. Le taux de récupération du composé radioactif était supérieur à 90 % pour les deux doses, la majorité de la substance étant éliminée par voie fécale. Quarante-huit heures après l'administration de la dose, la biodisponibilité systémique était d'environ 6 % (Union Carbide Corp. 1991a). L'absorption cutanée du Disperse Blue 79:1 n'est pas jugée supérieure à l'absorption par voie orale, et elle est probablement moins élevée (c.-à-d. égale ou inférieure à 6 %).
Contrairement aux colorants azoïques dispersés susmentionnés, l'absorption cutanée du Disperse Yellow 97 (Solvent Yellow 14, aussi connu sous le nom de Sudan I) a été rapportée comme étant plus importante. L'absorption cutanée du Disperse Yellow 97, dont la taille moléculaire est relativement plus petite, a été évaluée au moyen d'un système de cellules de diffusion in vitro à flux continu et d'échantillons de peau prélevés sur des femmes. Une dose de 5 μg/cm2 de Disperse Yellow 97 radiomarquée au C14 a été appliquée. La période d'observation a duré 24 heures. Bien que le taux de récupération total n'ait pas été rapporté, le pourcentage d'absorption total était de 26,4 %. Environ 16 % de la dose absorbée était associée à des résidus cutanés et moins de 10 % ont été détectés dans le liquide récepteur (Collier et al. 1993).
Les données disponibles laissent entendre que la biodisponibilité orale ou cutanée des colorants azoïques dispersés visés par la présente évaluation est faible à modérée. En s'appuyant sur le pourcentage d'absorption cutanée de 2 % recommandé par le BfR dans les zones à forte transpiration et le taux d'absorption cutanée du Disperse Yellow 97 de 26,4 %, une gamme d'absorption cutanée allant de 2 à 27 % a été utilisée pour estimer l'exposition cutanée à 12 colorants azoïques dispersés (Disperse Blue 79:1, Disperse Orange 30, Disperse Blue 79, ANAM, Disperse Brown 1:1, Disperse Brown 1, Disperse Red 167, BANAP, n° CAS 52697-38-8, Disperse Orange61, n° CAS 63833-78-3 et ANMOM).
| Scénario d'exposition | Groupe d'âge | Exposition quotidienne estimée par voie orale (mg/kg p.c. par jour) | Exposition quotidienne estimée par voie cutanée (mg/kg p.c. par jour) |
|---|---|---|---|
| Textiles - vêtements | Adultes (de 20 à 59 ans) | s.o. | 5,2 x 10-5 à 7,0 x 10-4 |
| Textiles - grenouillères | Bébés (de 0 à 6 mois) | s.o. | 8 x 10-5 à 1,1 x 10-3 |
| Textiles - mise en bouche | Bébés (de 0 à 6 mois) | 1,35 × 10-3 | s.o. |
Les gammes estimées d'exposition cutanée à ces substances (c.-à-d. : Disperse Blue79:1, Disperse Orange 30, Disperse Blue 79, ANAM, Disperse Brown 1:1, Disperse Brown 1, Disperse Red 167, BANAP, n° CAS 52697-38-8, Disperse Orange61, n° CAS 63833-78-3 et ANMOM) due au contact direct et prolongé entre la peau et les produits textiles contenus dans les vêtements et les grenouillères sont de 5,2 x 10-5 à 7 x 10-4 et de 8 x 10-5 à 1,1 x 10-3 mg/kg p.c. par jour, respectivement. L'exposition orale liée au mâchonnement de textiles par les bébés a été estimée à 1,35 x 10-3 mg/kg p.c. par jour (voir l'annexe F). La caractérisation de l'exposition à 12 de ces 13 substances est présentée dans les sections ci-après. L'exposition potentielle au Disperse Yellow 3 a été caractérisée lors de l'évaluation des colorants azoïques avec solvant, sous le nom de Solvent Yellow 77 (Environnement Canada, Santé Canada 2015). Elle n'est donc pas présentée dans le présent document.
7.2 Évaluation des effets sur la santé
La cancérogénicité et la génotoxicité constituent les effets critiques sur la santé potentiellement préoccupants en ce qui a trait aux substances azoïques aromatiques et à base de benzidine (Environnement Canada et Santé Canada, 2013). Toutefois, des niveaux d'effets non cancérogènes sont également pris en compte. En dehors du Disperse Yellow 3, seules des données limitées sur les effets sur la santé ont été identifiées pour la plupart des colorants dispersés visés par la présente évaluation. En conséquence, des données pertinentes sur la toxicité d'autres colorants dispersés apparentés ont été prises en compte afin d'obtenir des données croisées. Parmi ces substances, on retrouve : Disperse Red 338, Disperse Red 206, Disperse Black 9, Disperse Red 17 et Disperse Yellow 97 (Sudan I/Solvent Yellow 14). Les substances utilisées pour obtenir des données croisées pour l'évaluation des effets sur la santé des colorants azoïques dispersés sont identifiés dans le tableau 2-8.
Étant donné que les données sur les effets sur la santé du Disperse Yellow 3 (Solvent Yellow 77) et que la substance utilisée pour obtenir des données croisées, le Disperse Yellow 97 (Sudan I/Solvent Yellow 14) ont déjà été caractérisées lors de l'évaluation des colorants azoïques avec solvant (Environnement Canada, Santé Canada 2015), seul un résumé des données sur les risques posés par ces substances est présenté dans la présente section.
Les colorants dispersés visés par la présente évaluation exhibent une variabilité considérable en ce qui a trait à leur structure moléculaire et à leurs propriétés physiques et chimiques (section 3.0). Leurs hydrosolubilités vont de négligeable (0,000001 mg/L) à faible (2,92 mg/L), tandis que leurs masses moléculaires vont de 238 à 639 g/mol. Il est probable que ces différences aient un impact sur la biodisponibilité orale ou cutanée, ainsi que sur le potentiel de rupture des liaisons azoïques de ces différents colorants. Afin de traiter de manière prudente cette variabilité, les niveaux d'effets sur la santé les plus sensibles pour des colorants parents et de leurs métabolites de rupture de la liaison azoïque sont utilisés pour l'ensemble du groupe.
Potentiel de rupture des liaisons azoïques
La rupture réductrice de la liaison azoïque et la libération subséquente d'amines aromatiques constituent un mécanisme important conduisant à la toxicité des substances azoïques aromatiques ou à base de benzidine. Ces amines aromatiques peuvent être converties en intermédiaires électrophiles réactifs lors d'une oxydation métabolique (Environnement Canada et Santé Canada, 2013). Bien que les données empiriques soient trop limitées pour pouvoir décrire le potentiel de rupture de tous les colorants dispersés visés par la présente évaluation, celui-ci sera déduit à partir de données sur des substances étroitement apparentées pour lesquelles il existe des données de tests de rupture in vitro (Environnement Canada et Santé Canada, 2013).
En l'absence de données empiriques, le potentiel de rupture des liaisons azoïques in vitro a été mis en évidence pour 10 colorants azoïques dispersés dans les échantillons de matières fécales et pour quatre de ces colorants dans les bactéries de la peau. Dix colorants azoïques dispersés dans des bactéries anaérobies (dans des matières fécales) et huit de ces 10 colorants dans des bactéries aérobies ont fait l'objet d'une étude (Staphylococcus epidermidis et Micrococcus luteus, deux espèces cutanées communes). Le métabolisme de quatre colorants dispersés a été démontré chez l'une ou l'autre de ces espèces bactériennes de la peau. Le métabolite de réduction azoïque prévu, la 2-bromo-6-cyano-4-nitroaniline, obtenu à partir du colorant n° CAS 2537-62-4, a augmenté au fil de l'incubation avec les matières fécales. Cependant, les métabolites de réduction azoïque prévus pour les autres substances testées n'ont pas pu être facilement identifiés (BRI 2012, 2013). Les substances testées lors de l'étude in vitro sur le métabolisme représentent une variété de structures, y compris quatre colorants diazoïques et six colorants monoazoïques.
7.2.1 Cancérogénicité et génotoxicité
Génotoxicité
Des données sur la génotoxicité ont été identifiées pour 20 des 74 substances visées par la présente évaluation. Des études in vitro étaient disponibles pour ces 20 substances, alors que des données in vivo n'existaient que pour quatre d'entre elles. Les résultats des études in vivo n'ont pas permis, en général, de corroborer les résultats positifs des tests de mutagénicité in vitro menés sur des bactéries ou des cellules de mammifères. Aucune autre donnée in vivo n'a pu être trouvée pour les autres substances, pour lesquelles seuls des résultats positifs in vitro étaient disponibles. En ce qui concerne les deux autres colorants dispersés pris en compte pour évaluer le potentiel de génotoxicité des colorants dispersés, des données de test Ames in vitro et sur des cellules de mammifères existaient pour le Disperse Black 9 et le Disperse Red 17. Les renseignements concernant le potentiel génotoxique du Disperse Yellow 3 (Solvent Yellow 77) et du Disperse Yellow 97 (Sudan I/Solvent Yellow 14) sont résumés séparément dans l'évaluation de certains colorants azoïques avec solvant (Environnement Canada et Santé Canada, 2015).
Douze substances ont fait l'objet de tests Ames modifiés selon la méthode Prival. Onze de ces substances ont donné des réponses positives pour au moins une souche, avec ou sans mononucléotide flavine. Seul le n° CAS 19745-44-9 a donné des réponses négatives pour toutes les souches et dans toutes les conditions testées (Seifried et al. 2006, BioReliance 2012, ILS 2011, 2012). Quatre des 73 colorants dispersés, ainsi que le Disperse Black 9 et le Disperse Red 17, ont donné un résultat positif lors de tests Ames effectués dans des conditions normales, pour au moins une souche (Mishra et al. 1981, Clariant Corporation 1982, NTP 1983, 1984, 1988, 1993, Ciba Specialty Chemicals Corp. 1997a, P&G 2005, Sokolowski 2005, Umbuzeiro et al. 2005).
Des essais in vitro sur des cellules de mammifères n'ont pas permis d'obtenir des résultats cohérents à l'échelle du groupe. Le Disperse Brown 1:1 a induit des mutations dans des cellules du lymphome de souris L5178Y (Seifried et al. 2006), contrairement au Disperse Black 9 (P&G 2005). On a obtenu des résultats négatifs pour le Disperse Blue 79 et le Disperse Red 17 avec des cellules de hamster chinois V79 (Clarient 1996, Wollny 2005). Toutefois, le Disperse Black 9 a induit des aberrations chromosomiques dans les cellules WBL ovariennes de hamster chinois (P&G 2005). Le Disperse Red 17 n'a pas non plus réussi à faire augmenter significativement le nombre de micronoyaux dans les lymphocytes périphériques prélevés sur deux donneurs non-fumeurs en santé (Whitwell 2005). Lors d'un test bactériologique umu, le Disperse Brown 1:1 n'a pas induit de dommages à l'ADN (Kosaka et Nakamura 1990, 1991).
Quant au Disperse Blue79:1, il a donné un résultat négatif lors du test in vivo de mutation létale récessive associée au sexe chez la drosophile (Foureman 1990). Le Disperse Blue 79, le Disperse Red 17 et le Disperse Black 9 ont tous donné des résultats négatifs lors d'un test du micronoyau mené chez des souris (Honarvar 1982, Clariant 1996, P&G 2005). Ni le Disperse Black 9 ni le Disperse Red 17 n'ont induit une synthèse d'ADN non programmée dans les cellules hépatiques de rats (P&G 2005, Harlan 2010). Le Disperse Orange 30 n'a pas non plus induit d'aberrations chromosomiques dans les cellules de la moelle osseuse des souris (Baraänski et al. 1992).
Cancérogénicité
En dehors du Disperse Yellow 3, seules des données limitées étaient disponibles pour les 74 colorants azoïques dispersés visés par la présente évaluation, tandis qu'il n'existait aucune donnée épidémiologique liée au potentiel de cancérogénicité chez les humains. Afin de mieux comprendre et caractériser le potentiel cancérogène de ces substances, une recherche bibliographique approfondie a été effectuée en vue d'inclure des renseignements sur d'autres colorants azoïques dispersés dans le but de faire des lectures croisées. Des données sur le cancer ont été relevées pour le Disperse Yellow 3 (Solvent Yellow 77) ainsi que des données croisées sur des utilisations connues du Disperse Yellow 97 (Sudan I/Solvent Yellow 14) en tant que colorant azoïque dispersé. Les données sur les risques posés par ces deux substances ont déjà été caractérisées lors de l'évaluation des colorants azoïques avec solvant (Environnement Canada et Santé Canada, 2015), et elles ne seront discutées que brièvement.
Il a été montré que le Disperse Yellow 3 (Solvent Yellow 77) et le Disperse Yellow 97 (Sudan I/Solvent Yellow 14) induisaient tous deux une néoplasie hépatique chez les rats. La gamme des plus faibles niveaux de dose de référence entraînant des effets nocifs critiques (BMDL10s) va de 5,54 à 51,29 mg/kg p.c. par jour pour le Disperse Yellow 97 (Sudan I/Solvent Yellow 14) et le Disperse Yellow 3 (Solvent Yellow 77).
Bien que le Disperse Yellow97 (Sudan I/Solvent Yellow 14) ait été classé par le CIRC en 1975 dans le groupe 3, inclassable quant à sa cancérogénicité pour l'homme, un essai biologique du NTP (1982a) a clairement démontré son potentiel cancérogène. Dans le cadre de l'étude du NTP, des groupes de 50 rats F344/N mâles et femelles ont reçu des doses de colorant, répertorié sous le nom de Solvent Yellow 14, à raison de 0,250 ou de 500 ppm chaque jour, dans de la nourriture à volonté pendant 103 semaines. (Les doses faibles et élevées étaient respectivement de 14 et de 28 mg/kg p.c. par jour chez les mâles et de 16 et de 33 mg/kg p.c. par jour chez les femelles). On a constaté chez les rats traités une diminution du poids corporel, en comparaison de celui d'animaux du groupe témoin. Toutefois, on n'a relevé aucune différence dans le taux de survie. Alors que diverses tumeurs se sont développées chez les animaux du groupe témoin et les animaux traités, on a observé une augmentation considérable des nodules néoplasiques dans le foie (p inférieur(e) à 0,001) chez les mâles ayant reçu la dose élevée 30/50 (60 %, p inférieur(e) à 0,001), mais pas chez ceux ayant reçu la dose faible 10/50 (20 %, négligeable), par rapport aux groupes témoins, 5/50 (10 %). De même, on a noté une augmentation des nodules néoplasiques hépatiques chez les femelles ayant reçu la dose élevée 10/48 (21 %, p = 0,011), mais pas chez celles ayant reçu la dose faible 3/49 (6 %, négligeable), par rapport aux groupes témoins, 2/50 (4 %) [NTP 1982a]. La concentration associée à un effet critique représente une limite inférieure d'un intervalle de confiance de 95 % sur la dose repère (BMDL10), ce qui indique une incidence de tumorigenèse hépatique de 10 %, soit 5,54 mg/kg p.c. par jour. Cette valeur a été calculée à partir de cet ensemble de données. Des renseignements supplémentaires concernant le calcul de cette BMBL10 sont résumés séparément dans l'évaluation du gouvernement du Canada sur certains colorants azoïques avec solvant (Environnement Canada et Santé Canada, 2015).
Le Disperse Yellow 3 (Solvent Yellow 77) a été évalué dans le cadre d'une épreuve biologique sur le cancer (NTP 1982b). Ce colorant a été administré à des rats mâles et femelles dans de la nourriture à volonté, à une dose de 0 ou 5 000 ppm (mâles - 297; femelles - 348 mg/kg p.c. par jour) et de 10 000 ppm (mâles - 672; femelles - 820 mg/kg p.c. par jour) pendant 103 semaines. La présence de nodules néoplasiques hépatiques ou de carcinomes hépatiques était particulièrement élevée chez les mâles ayant reçu la dose faible 15/50 (30 %; p inférieur(e) à 0,001) et chez ceux ayant reçu la dose élevée 11/50 (22 %; p = 0,004), par rapport aux groupes témoins 2/49 (4 %). Cependant, cet effet n'a pas été observé chez les femelles (NTP, 1982b). La concentration associée à un effet critique représente la limite inférieure d'un intervalle de confiance de 95 % sur la dose repère (BMDL10), ce qui indique une incidence de tumorigenèse hépatique de 10 %, soit 51,29 mg/kg p.c. par jour. Cette valeur a été calculée à partir de cet ensemble de données. Des renseignements supplémentaires concernant le calcul de cette BMBL10sont résumés séparément dans l'évaluation de certains colorants azoïques avec solvant (Environnement Canada et Santé Canada 2015).
Les auteurs de l'étude du NTP ont également signalé d'importantes réductions des lymphocytes et des leucémies, des carcinomes des cellules C (cellules secrétant de la calcitonine) de la thyroïde et des mésothéliomes dans plusieurs organes chez des rats traités avec du Disperse Yellow 3 (Solvent Yellow 77). Ce colorant a également entraîné une importante diminution liée à la dose de l'incidence des polypes du stroma de l'endomètre chez les rats femelles. De plus, on a observé une augmentation de la durée d'apparition de la tumeur (latence) chez tous les animaux (NTP, 1982a,b). Ces observations ne sont pas propres aux études mentionnées dans la présente évaluation. On a également constaté une diminution similaire du taux d'incidence de leucémie lymphocytaire spontanée chez les animaux traités lors d'autres études de toxicité chronique menées par le NTP. En fait, il a été proposé que les effets anticancérigènes signalés pourraient être liés aux diminutions du poids corporel chez les animaux traités, à la concomitance de toxicité pour la rate ou à la baisse du taux de survie chez les animaux ayant été exposés à la dose. De plus, le stock et la souche des animaux ont également été suggérés comme facteurs influençant la latence des tumeurs (Haseman et Johnson 1996).
Cancérogénicité et génotoxicité des produits résultant de la rupture des liaisons azoïques
La rupture des liaisons azoïques, une voie métabolique potentielle pour les colorants azoïques dispersés, conduit à la libération subséquente de métabolites de type amine aromatique. Étant donné que la variabilité des propriétés physiques et chimiques des 73 colorants dispersés pourrait avoir une influence sur le potentiel de rupture des liaisons azoïques, on a suivi une approche prudente qui tient compte de tous les produits de type amine aromatique résultant de cette rupture. Toutes les données disponibles sur la cancérogénicité et la génotoxicité des produits postulés résultant de la rupture des liaisons azoïques des 12 colorants azoïques dispersés auxquels il est probable que les Canadiens soient exposés, ont été prises en compte pour l'évaluation des effets sur la santé des colorants azoïques dispersés.
Les analyses des métabolites résultant de la rupture des liaisons azoïques des 74 substances visées par la présente évaluation ont permis de déterminer qu'une des deux amines aromatiques figurant sur EU22, considérées comme étant potentiellement cancérogènes, pourrait être libérée par 6 des 74 substances (Environnement Canada et Santé Canada 2013). La 2-méthoxyaniline (n° CAS 90-04-0, amine aromatique figurant sur EU22) peut être libérée par les composés de n° CAS 93805-00-6 et 65122-05-6, tandis que la 4-(phényldiazényl)aniline (n° CAS 60-09-3, amine aromatique figurant sur EU22) peut être libérée par le Disperse Yellow 23, le Disperse Yellow 7, le n° CAS 58104-55-5 et le Disperse Red 151. Pour trois substances (n° CAS 93805-00-6, Disperse Yellow 23 et Disperse Yellow 7), les effets préoccupants sur la santé ont été communiqués dans de précédentes évaluations (Environnement Canada, Santé Canada, 2009). Des renseignements supplémentaires sur la 4-(phényldiazényl)aniline (Solvent Yellow 1) sont résumés séparément dans l'évaluation de certains azoïques colorants avec solvant (Environnement Canada et Santé Canada, 2015).
Une recherche bibliographique a été effectuée pour répertorier les données empiriques sur la génotoxicité et la cancérogénicité des métabolites postulés de type amine aromatique, pour lesquels il existait un n° CAS. Aucun autre métabolite de type amine aromatique n'a reçu de classification relative au cancer par un organisme national ou international.
La plupart des données empiriques sur la génotoxicité disponibles pour les produits résultant de la rupture des liaisons azoïques comprenaient des paramètres in vitro, tandis que des données in vivo n'ont été relevées que pour un nombre limité de métabolites de type amine aromatique ne figurant pas sur EU22. Un résumé des données empiriques disponibles sur la cancérogénicité et la génotoxicité des produits résultant de la rupture de type amine aromatique est présenté dans le tableau 7-2. Les données sur les risques posés par le Disperse Yellow 3 (Solvent Yellow 77), y compris les métabolites potentiels résultant des liaisons azoïques ont été caractérisés lors de l'évaluation des colorants azoïques avec solvant (Envieonnement Canada, Sant. Canada 2015). Elles ne sont donc pas présentées dans le présent document.
| Nom générique du colorant azoïque dispersé dans le C.I. ou n° CAS | No CAS du métabolite de type amine aromatiquea | Données disponibles sur la génotoxicité et la cancérogénicité et la génotoxicité du métabolite de type amine aromatique |
|---|---|---|
| Disperse Blue 79:1; Disperse Blue 79; 52697-38-8 |
1817-73-8 | in vitro : résultats positifs pour la mutagénicité chez les bactéries et les cellules mammaliennes (Kawai et al. 1987; Zeiger et al. 1987; Seifried et al. 2006) |
| Disperse Orange 30; Disperse Brown 1 |
99-30-9 | in vivo : résultats négatifs pour de multiples essais de cancérogénicité chez des animaux de laboratoire in vitro : résultats négatifs pour des essais sur la génotoxicité (OMS 1998) |
| ANAM | 3531-19-9 | in vitro : résultats positifs pour la mutagénicité chez les bactéries et les aberrations chromosomiques (Kawai et al. 1987; JETOC 1997) |
| Disperse Brown 1:1 | 99-29-6 | Aucune donnée |
| Disperse Red 167 | 121-87-9 | in vitro : résultats positifs pour la mutagénicité chez les bactéries et les aberrations chromosomiques; résultats négatifs pour la mutagénicité chez les cellules mammaliennes, le micronoyau ainsi que les dommages à l'ADN et la réparation de l'ADN (Shimizu et Takemura 1984; Kawai et al. 1987; Yoshimi et al. 1988; Palus 1995; JETOC 1996; Matsushima et al. 1999) |
| BANAP | 100-01-6 | in vivo : résultats négatifs pour les essais biologiques sur le cancer chez les rats et les souris femelles. Preuve équivoque chez les souris mâles; résultats négatifs pour tous les essais de génotoxicité. in vitro : résultats mitigés pour les essais de génotoxicité. Considéré comme étant probablement non génotoxique par l'USEPA. (Nair et al. 1990; NTP 1993; EPA des États-Unis 2009) |
| Disperse Orange 61 | 827-94-1 | Aucune donnée |
| 63833-78-3 | 17420-30-0 | in vitro : résultats positifs pour la mutagénicité chez les bactéries et les aberrations chromosomiques (JETOC 1997) |
a Seuls les métabolites ayant un n° CAS sont indiqués. Chaque colorant possède aussi une seconde amine aromatique.
Bien que plusieurs métabolites résultant de la rupture des liaisons azoïques aient des effets génotoxiques positifs in vitro, tous les résultats in vivo disponibles étaient négatifs. Des résultats négatifs et équivoques pour la cancérogénicité ont respectivement été rapportés pour les métabolites de n° CAS 100-01-6 et 99-30-9 (OMS 1998). L'EPA des États-Unis (2009) estime que le n° CAS 100-01-6 est probablement non génotoxique. Compte tenu des données disponibles, il n'y a aucune preuve appuyant la cancérogénicité ou le potentiel génotoxique in vivo des métabolites résultant de la rupture des liaisons azoïques libérés par les colorants dispersés auxquels la population générale pourrait être exposée.
7.2.2 Autres effets sur la santé
En dehors du Disperse Yellow 3, les données décrivant les effets sur la santé non cancérogènes des substances visées par la présente évaluation sont limitées, et aucune donnée épidémiologique n'a été répertoriée. Pour caractériser les effets non cancérogènes potentiels sur la santé des colorants azoïques dispersés, une recherche bibliographique approfondie a été réalisée afin d'inclure d'autres colorants dispersés, soit le Disperse Black 9, le Disperse Red 17, le Disperse Red 338, le Disperse Red 206 et le Disperse Yellow 97 (Sudan I/Solvent Yellow 14). Des renseignements supplémentaires sur les effets nocifs non cancérogènes du Disperse Yellow 3 (Solvent Yellow 77) et du Disperse Yellow 97 (Sudan I/Disperse Yellow 14) chez des animaux sont résumés séparément dans l'évaluation de certains colorants azoïques avec solvant (Environnement Canada et Santé Canada 2015).
Reproduction et développement
Le Disperse Blue 79:1 n'a entraîné aucune toxicité pour la reproduction ou le développement chez les rats (Tyl et al. 1990; Union Carbide Corp. 1991b) à des doses allant jusqu'à 2 500 mg/kg p.c. par jour. On a constaté une diminution du poids corporel de la mère en gestation et du fœtus (secondaire à l'effet chez la mère) chez des lapins blancs néo-zélandais causée par le Disperse Blue 79:1 (ETAD 1991). Le Disperse Black 9 a produit des effets similaires chez les rats (P&G 2005), tandis que le traitement au Disperse Red 17 a entraîné seulement une diminution du poids corporel de la mère et de la consommation d'aliments (Chandler 1997). L'effet le plus sensible était la présence de dépôts d'hémosidérine dans la rate des rats femelles; la DSENO (formulation ajustée) est de 10 (3,1) mg/kg p.c. par jour (Ehling 2005).
Dans le cadre de cette étude conforme à la ligne directrice 415 de l'OCDE, 28 rats mâles et 28 rats femelles Sprague Dawley HSD:SD (SPF) par dose ont été traités au Disperse Red 17 (formulation à 31 %), à raison de 0, 10, 30 ou de 200 mg/kg p.c. par jour par gavage oral, pendant 10 semaines chez les mâles et deux semaines chez les femelles avant l'accouplement. Les mâles ayant reçu une dose de 30 mg/kg p.c. par jour et tous les animaux ayant reçu des doses de 200 mg/kg p.c. par jour présentaient une fourrure et une urine tachées. On a observé une diminution du poids corporel, mais pas de la consommation alimentaire, chez les animaux exposés à la dose élevée. Les mères exposées à 200 mg/kg p.c. présentaient une diminution du nombre d'implantations et de petits vivants/portée. Toutefois, les indices de fertilité n'ont pas été fortement affectés. On a noté des dépôts d'hémosidérine dans la rate des femelles ayant reçu des doses de 30 et de 200 mg/kg p.c. par jour (Ehling 2005).
Effets à court terme
Des changements structurels et/ou fonctionnels de la glande thyroïde, du foie, des reins et du sang ont été rapportés chez des rats soumis à un traitement à court terme aux colorants dispersés. Le Disperse Red338 a entraîné une légère hyperplasie et un épaississement de l'épithélium folliculaire de la thyroïde après 11 jours d'exposition (Eastman Kodak Co. 1992). Le Disperse Black 9 a entraîné des lésions et des dysfonctionnements hépatiques et rénaux, mis en évidence par une hausse des concentrations d'azote uréique et de créatinine dans le sang, un déséquilibre électrolytique, une augmentation du SGOT (sérum glutamo-oxalacétique transaminase), de l'ALAT (alanine aminotransférase) et du GGT (gamma-glutamyl-transférase) chez les animaux traités pendant 16 jours (P&G 2004). Après une exposition de 28 jours, on a noté que le Disperse Red 206 avait diminué l'hématocrite et la teneur corpusculaire moyenne en hémoglobine (MHLW 2012).
Des renseignements supplémentaires sur d'autres analogues de colorants dispersés analogues viennent appuyer les résultats sur les effets de la dose répétée à court terme dans les tissus hépatiques, rénaux et hématopoïétiques, y compris : augmentations du SGOT et de l'ALAT dans le sérum, dégénérescence et nécrose des tubules rénaux, formation de gouttelettes hyalines et diminution des érythrocytes, de l'hémoglobine et de l'hématocrite en circulation (communication personnelle, courriel du Bureau de l'évaluation et du contrôle des substances nouvelles [Santé Canada] au Bureau de l'évaluation des risques des substances existantes [Santé Canada], daté du 18 septembre 2014; non référencé).
Effets à long terme
On a constaté que les traitements chroniques au Disperse Yellow 3 (Solvent Yellow 77) ou au Disperse Yellow 97 (Sudan I/Solvent Yellow 14) avaient des répercussions sur le foie et les reins chez des souris; une dégénérescence et une hémosidérose hépatiques ainsi qu'une hémosidérose rénale ont été observées (NTP 1982a,b). On a observé une nécrose de l'épithélium des tubules rénaux corticaux suivie d'une régénération de l'épithélium chez les souris traitées au Disperse Yellow 97 (Sudan I/Solvent Yellow 14) [NTP 1982a].
Il a été montré que certains colorants dispersés avaient des impacts sur la rate, secondaires à la surcharge de fer dans la rate découlant de l'augmentation du renouvellement des érythrocytes. Le Disperse Yellow 97 (Sudan I/Solvent Yellow 14) et le Disperse Yellow 3 (Solvent Yellow 77) ont entraîné une hémosidérose chez les souris (NTP 1982 a,b). De plus, on a noté une augmentation du poids de la rate chez les rats traités au Disperse Red 17 (Brownlie 1998).
L'effet chronique non cancérogène le plus sensible relevé dans le cadre d'une étude conforme à la ligne directrice 408 de l'OCDE était une augmentation du poids de la rate chez les rats mâles Sprague Dawley à qui on avait administré du Disperse Red 17 dans de l'eau purifiée pendant 13 semaines; la DSENO (formulation ajustée) est de 10 (4) mg/kg p.c. par jour. Dix rats mâles et 10 rats femelles Sprague Dawley et Crl:CD(SD)BR ont reçu des doses de colorant à 41,2 %, à raison de 0, 10 ou 30 mg/kg p.c. par jour. On a signalé deux décès dans le groupe exposé à la dose élevée aux jours 14 et 43. Le poids de la rate avait augmenté seulement chez les mâles du groupe ayant reçu la dose élevée.
7.3 Caractérisation des risques pour la santé humaine
Des 74 substances visées par la présente évaluation, 64 ont été prises en compte pour ce qui a trait à la santé humaine, alors que 10 substances avaient été précédemment évaluées dans le cadre du Défi. Les conclusions sur la santé tirées à ce moment-là n'ont pas été mises à jour, car aucun renseignement nouveau pertinent pour la santé humaine n'a été identifié pour ces 10 substances. Parmi les 64 substances évaluées, on considère qu'il existe un potentile d'exposition directe et prolongée due aux textiles pour 13 de ces substances. Ceci est basé sur des données soumises lors d'enquêtes récentes menées en vertu de l'article 71 de la LCPE 1999 (voir le tableau 4-1 de la section 4.1 Sources : ANAM, ANMOM, BANAP, Disperse Blue 79, Disperse Blue 79, Disperse Orange 30, Disperse Orange 61, Disperse Red 167, Disperse Yellow 3 et n° CAS 52697-38-8), ainsi que sur des renseignements fournis par l'industrie (courriel de 2010 de l'ETAD à Environnement Canada, non référencé : Disperse Brown 1, Disperse Brown1 :1, n° CAS 63833-78-3). L'utilisation de textiles (p. ex. dans les vêtements et autres produits) colorés avec ces substances pourrait entraîner une exposition directe et prolongée de la population générale. Les gammes estimées d'exposition cutanée aux colorants azoïques dispersés due à un contact direct et prolongé de la peau avec des produits textiles présents dans les vêtements (adultes) et les grenouillères (bébés) sont respectivement de 5,2 x 10-5 à 7 x 10-4 et de 8 x 10-5 à 1,1 x 10-3 mg/kg p.c. par jour. L'exposition par voie orale des bébés par la mise en bouche de textiles a été estimée à 1,35 × 10-3 mg/kg p.c. par jour. La population générale du Canada ne devrait pas être exposée aux autres substances visées par la présente évaluation.
Note : la caractérisation de l'exposition et des risques pour le Disperse Yellow 3 se trouve dans l'évaluation des colorants azoïques avec solvant (sous le nom de Solvent Yellow 77) et, en conséquence, seul un bref résumé des renseignements sur le Disperse Yellow 3 est présenté afin de contribuer à la caractérisation des risques posés par les autres colorants azoïques dispersés visé par la présente évaluation.
Puisqu'il n'existe pas de données empiriques sur les effets sur la santé pour la plupart des 74 substances visés par la présente évaluation préalable, les données sur d'autres colorants dispersés ne faisant pas partie de ce groupe ont été incluses afin contribuer à la caractérisation des risques et de remédier à la variabilité des propriétés physiques et chimiques de ces 74 substances de façon prudente. Les niveaux d'effets sur la santé les plus sensibles rapportés pour certains des 74 colorants azoïques dispersés et d'autres substances apparentées sont utilisés pour représenter la gamme de risques potentiels pour tout le groupe. Aucune étude sur la toxicité d'une exposition cutanée n'a été identifiée pour les 74 colorants azoïques dispersés.
Les niveaux d'effet nocif critique les plus faibles pour la cancérogénicité sont basés sur une gamme de BMDL10allant de 5,54 à 51,29 mg/kg p.c. par jour pour la substance apparentée Disperse Yellow 97 (Sudan I/Solvent Yellow 14) et le Disperse Yellow 3 (Solvent Yellow 77). Les deux niveaux d'effet critique sont basés sur les résultats d'études chroniques qui ont montré une incidence nettement supérieure des tumeurs du foie chez des rats mâles ayant reçu ces deux colorants dans leur nourriture.
La comparaison de la gamme d'exposition cutanée quotidienne estimée des adultes due aux vêtements en textiles et de gamme des niveaux de doses entraînant des effets nocifs critiques permet d'obtenir une marge d'exposition allant de 7 900 à 986 300. La comparaison de la gamme d'exposition cutanée quotidienne estimée due à un contact du bébé avec les textiles compris dans les grenouillères avec les mêmes valeurs critiques a permis d'obtenir une marge d'exposition allant de 5 000 à 641 100. La comparaison de l'exposition orale quotidienne estimée des bébés avec les mêmes valeurs critiques a permis d'obtenir une marge d'exposition allant de 4 100 à 38 000. En ce qui concerne la cancérogénicité, toutes les gammes de marges d'exposition sont considérées adéquates pour teneir compte des incertitudes des bases de données sur l'exposition et les effets sur la santé (tableau 7-3).
| Voie d'exposition | Scénario d'exposition (groupe d'âge) | Exposition quotidienne estimée par voie orale (mg/kg p.c. par jour) | Gamme de niveaux d'effet critique : BMDL10 (mg/kg p.c. par jour) | Gamme de marges d'exposition |
|---|---|---|---|---|
| Cutanée | Textiles - Vêtements personnels (adultes) | 5,2 x 10-5 à 7,0 x 10-4 | 5,54 à 51,29 | 7 900 à 986 300 |
| Cutanée | Textiles - Grenouillère (nourrissons) | 8 x 10-5 à 1,1 x 10-3 | 5,54 à 51,29 | 5 000 à 641 100 |
| Orale | Mise en bouche d'objets en textile (nourrissons) | 1,35 x 10-3 | 5,54 à 51,29 | 4 100 à 38 000 |
Le plus faible niveau d'effet critique dû à des colorants dispersés protégeant contre des effets non concérogènes associés à un contact cutané quotidien entre un bébé et une grenouillère est une DSENO chronique de 10 (formulation ajustée, 4) mg/kg p.c. par jour. Ceci est basé sur les résultats d'une étude de toxicité chronique par voie orale qui a mis en évidence une augmentation du poids de la rate chez les rats mâles traités avec du Disperse Red 17 à raison de 30 (formulation ajustée, 12,4) mg /kg p.c. par jour.
Le plus faible niveau d'effet critque dû à des colorants dispersés protégeant contre des effets non cancérogènes associés à un contact dermique quotidien entre un adulte et des vêtements en textile est une DSENO chronique de 3,1 mg/kg p.c. par jour. Ceci est basé sur la toxicité pour la reproduction chez des rats femelles. Chez les mères, on a constaté la présence de dépôts d'hémosidérine dans la rate après l'administration par voie orale d'une dose de Disperse Red 17 de 30 (formulation ajustée, 9,3) mg/kg p.c. par jour.
La comparaison de la gamme d'exposition cutanée quotidienne estimée due à un contact entre un adulte et des textiles présents dans des vêtements avec le niveau d'effet critique du Disperse Red 17 associée à à des dépôts d'hémosidérine dans la rate a permis d'obtenir une marge d'exposition allant de 4 400 à 59 600. La comparaison de la gamme d'exposition cutanée quotidienne estimée causée par un contact entre un bébé et des textiles présents dans une grenouillère avec la concentration de Disperse Red 17 associée à une augmentation du poids de la rate a permis d'obtenir une marge d'exposition allant de 3 600 à 50 000. La comparaison de la gamme d'exposition quotidienne par voie orale estimée causée par une mise en bouche de produits textiles par un bébé avec la concentration de Disperse Red 17 associée à une augmentation du poids de la rate a permis d'obtenir une marge d'exposition de 3 000. Ces marges d'exposition (gammes), pour des effets non cancérogènes, sont considérées adéquates pour tenir compte des incertitudes des bases de données sur l'exposition et les effets sur la santé (tableau 7-4).
| Voie d'exposition | Scénario d'exposition (groupe d'âge) | Gamme d'exposition par voie oral quotidienne estimée (mg/kg p.c. par jour) | Concentration associée à un effet critique : DSENO (mg/kg p.c. par jour) | Gamme de marges d'exposition |
|---|---|---|---|---|
| Voie cutanée | Textiles - Vêtements personnels (adultes) | 5,2 x 10-5 à 7.0 x 10-4 | 3,1 | 4 400 à 59 600 |
| Voie cutanée | Textiles - Grenouillère (bébés) | 8.0 x 10-5 à 1.1 x 10-3 | 4,0 | 3 600 à 50 000 |
| Voie orale | Mise en bouche d'objets en textile (bébés) | 1.35 x 10-3 | 4,0 | 3 000 |
De plus, comme qu'il est indiqué dans l'évaluation des colorants azoïques avec solvant pour le n° CAS 2832-40-8, Disperse Yellow 3 (Solvent Yellow 77), les marges d'exposition ayant trait à l'exposition chronique orale ou cutanée due aux utilisations de textile sont considérées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l'exposition et le risque d'exposition orale due à une ingestion accidentelle de papier coloré est considéré faible. Consulter l'évaluation des colorants azoïques acec solvant pour obtenir de plus amples détails (Environnement Canada, Santé Canada 2015).
7.3.1 Incertitudes liées à la caractérisation des risques pour la santé humaine
Il existe des incertitudes quant aux estimations de l'exposition aux textiles, car elles sont basées sur des hypothèses génériques sur la teneur en colorant des textiles qui ne sont pas spécifiques à aucun des colorants azoïques dispersés évalués. Cependant, le niveau de confiance est élevé quant au fait que les hypothèses faites sont prudentes et, par conséquent, ne conduisent pas à une sous-estimation de l'exposition.
Les biodisponibilités orale et cutanée in vivo des colorants dispersés visés par la présente évaluation ne sont pas connues, mais il est probable qu'elles soient assez différentes en raison de la variabilité des propriétés physiques et chimiques (p. ex., masse moléculaire). Cela représente une source d'incertitude pour l'évaluation des colorants azoïques dispersés. Des résultats obtenus in vivo et in vitro mettent en évidence une biodisponibilité cutanée allant de mauvaise à modeste (de moins de 1 % à 27 %) dans le cas de trois colorants azoïques dispersés, ainsi qu'une absorption orale limitée (6 %) dans le cas d'un colorant de masse moléculaire relativement plus élevée. Toutefois, des études à court terme sur la toxicité chronique et la cancérogénicité ont mis en évidence des effets biologiques néfastes suite à une exposition à des colorants de masse moléculaire relativement plus faible, indiquant ainsi indirectement une biodisponibilité orale toxicologiquement significative.
Enfin, puisque l'on a utilisé des données croisées pour estimer les effets sur la santé, il existe certaines incertitudes quant au type et au degré de tels effets qui pourraient résulter de l'exposition à chacun des colorants dispersés ou de leurs métabolites. Néanmoins, le niveau de confiance est élevé quant au fait que l'approche actuelle a permis d'identifier les niveaux d'effets sur la santé les plus sensibles à partir des données disponibles.
7.3.2 Colorants azoïques dispersés ayant des effets potentiellement préoccupants pour la santé humaine
Dans l'ensemble, les risques pour la santé humaine posés par les substances visées par la présente évaluation sont faibles compte tenu des niveaux actuels d'exposition. Toutefois, tel qu'indiqué dans la présente évaluation, on soupçonne que certains colorants azoïques dispersés ont des effets préoccupants d'après leur cancérogénicité potentielle (annexe F).
8. Conclusion
Compte tenu de tous les éléments de preuve apportés par la présente évaluation préalable, il apparaît que 73 des 74 colorants azoïques dispersés visés présentent un faible risque d'effets nocifs sur les organismes ou l'intégrité globale de l'environnement. Il est donc conclu que ces colorants azoïques dispersés ne satisfont pas aux critères du paragraphe 64 a) ou 64 b) de la LCPE 1999, car ils ne pénètrent pas dans l'environnement en une quantité ou une concentration ou dans des conditions ayant ou pouvant avoir un effet nocif immédiat ou à long terme sur l'environnement ou sur sa diversité biologique ou constituant ou pouvant constituer un danger pour l'environnement essentiel à la vie.
Un autre colorant azoïque dispersé, le n° CAS 2832-40-8 (Disperse Yellow 3), a été évalué en raison de préoccupations pour l'environnement dues à son utilisation pour la formulation de colorants pour textiles ou la coloration de textiles. Compte tenu de tous les éléments de preuve disponibles apportés dans la présente évaluation préalable et dans l'évaluation préalable des colorants azoïques avec solvant (dans laquelle cette substance était appelée Solvent Yellow 77), il est conclu que la substance n° CAS 2832-40-8 satisfait aux critères du paragraphe 64 a) de la LCPE 1999, car elle pénètre ou peut pénétrer dans l'environnement en une quantité, à une concentration ou dans des conditions ayant ou pouvant avoir un effet nuisible immédiat ou à long terme sur l'environnement ou sur sa diversité biologique. Toutefois, cette substance ne satisfait pas aux critères du paragraphe 64 b) de la LCPE 1999, car elle ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions constituant ou pouvant constituer un danger pour l'environnement essentiel à la vie.
En se basant sur les renseignements contenus dans la présente évaluation préalable et sur les renseignements sur le Disperse Yellow 3 (Solvent Yellow 77) présenté dans l'évaluation préalable des colorants azoïques avec solvant, il est conclu que 64 des 74 substances visées par la présente évaluation ne satisfont pas aux critères du paragraphe 64 c) de la LCPE 1999, car ils ne pénètrent pas dans l'environnement en une quantité, une concentration ou dans des conditions constituant ou pouvant constituer un danger au Canada pour la vie ou la santé humaines. De plus, aucune mise à jour n'a été apportée aux conclusions déjà formulées pour 10 substances précédemment évaluées par le gouvernement du Canada dans le cadre du Défi du PGPC.
De plus, il est conclu que 73 des 74 colorants azoïques dispersés identifiés précédemment ne satisfont à aucun des critères de l'article 64 de la LCPE 1999.
Il est conclu que le n° CAS 2832-40-8 (Disperse Yellow 3) satisfait à un ou plusieurs des critères stipulés à l'article 64 de la LCPE (1999). Les données utilisées pour l'évaluation de cette substance, sous le nom Solvent Yellow 77, en ce qui concerne la santé humaine se trouvent dans l'évaluatiion préalable des colorants azoïques avec solvant.
Ona aussi déterminé que le n° CAS 2832-40-8 (Disperse Yellow 3) satisfait aux critères de persistance, mais à ceux de bioaccumulation, stipulés dans le Règlement sur la persistance et la bioaccumulation de la LCPE (1999.
Références
ACIA (Agence canadienne d'inspections des aliments); 2010; Rapport du Plan d'action pour assurer la sécurité des produits alimentaires 2009-2010, Études ciblées Chimie,. Utilisation de colorants alimentaires pour la production d'aliments transformés, Ottawa (Ont.) : Agence canadienne d'inspections des aliments, Rapport n° : TS-CHEM-09/10-05.
Alberta, Ministère de l'Environnement; 2009; Guidelines for the application of municipal wastewater sludges to agricultural lands, Mars 2001 (mis à jour en 2009), Edmonton (Alb.) : Ministère de l'Environnement de l'Alberta.
Anliker R. et Moser P.; 1987; The limits of bioaccumulation of organic pigments in fish: Their relation to the partition coefficient and the solubility in water and octanol; Ecotoxicol. Environ. Saf., 13, p. 43-52.
Anliker R., Clarke E.A. et Moser P.; 1981; Use of the partition coefficient as an indicator of bioaccumulation tendency of dyestuffs in fish; Chemosphere, 10(3), p. 263-274.
Anliker R., Moser P. et Poppinger D.; 1988; Bioaccumulation of dyestuffs and organic pigments in fish. Relationships to hydrophobicity and steric factors; Chemosphere, 17(8), p. 1631-1644.
Arnot J.A., Arnot M., Mackay D., Couillard Y., MacDonald D., Bonnell M. et Doyle P.; 2010; Molecular size cut-off criteria for screening bioaccumulation potential: fact or fiction?; Integr. Environ. Assess. Manag., 6(2), p. 210-224.
ASTreat [modèle sur l'élimination des usines de traitement des eaux usées]; 2006; Version 1.0; Cincinnati (OH) : Procter & Gamble Company; disponible auprès de Procter & Gamble Company, C.P. 538707, Cincinnati (OH), 45253-8707, États-Unis.
Bafana A., Devi S.S. et Chakrabarti T.; 2011; Azo dyes: past, present and the future; Environ. Rev., 19, p. 350-370.
Balakrishnan V.; 2013; Determining the solubility of azo and benzidine dyes; étude non publiée d'Environnement Canada.
Baraänski B., Przybojewska B., Spiechowicz E., Wyszyänska K. et Zimnicki J.; 1992; Identification of potential carcinogenic dyes and intermediates on the basis of their genotoxicity; Med. Pr., 43(6), p. 469-477 [article en polonais].
Bardi L. et Marzona M.; 2010; Factors affecting the complete mineralization of azo dyes; dans Erkurt H.A. (éd.), Biodegradation of azo dyes; The Handbook of Environmental Chemistry, vol. 9. Berlin (Allemagne), Springer-Verlag; p. 195-210.
Bartlett A.; 2013; Toxicity summary: effects of Disperse Yellow 7, Sudan Red G, Disperse Orange 13, Acid Red 97, and Bismarck Brown Y on the survival and growth of the freshwater amphipod Hyalella azteca in chronic, water-only exposures; étude non publiée d'Environnement Canada.
BASF; 1990; Bericht uber die Prufung der akuten Toxizitit an der Goldorfe (Leuciscus idus L.,. Goldvariante); soumission par courriel de l'ETAD à Environnement Canada le 13 août 2008.
Baughman G.L. et Perenich T.A.; 1988; Fate of dyes in aquatic systems: I. Solubility and partitioning of some hydrophobic dyes and related compounds; Environ. Toxicol. Chem., 7(3), p. 183-199.
Baughman G.L. et Perenich T.A.; 1989; Measuring the Solubility of Disperse Dyes. Sourde d'information non disponible.
Baughman G.L. et Weber E.J.; 1991; Estimation of water solubility and octanol/water partition coefficient of hydrophobic dyes. Part I: Relationship between solubility and partition coefficient; Dyes Pigments, 16, p. 261-271.
Baughman G.L. et Weber E.J.; 1994; Transformation of dyes and related compounds in anoxic sediment: kinetics and products; Environ. Sci. Technol., 28(2), p. 267-276.
Baughman G.L., Bannerjee S. et Perenich T.A.; 1996; Dye solubility; dans Peters A.T. et Freeman H.S. (éd.), Physico-chemical principles of color chemistry, Advances in Color Chemistry Series, vol. 4. Glasgow (Grande-Bretagne) : Blackie Academic and Professional Publishers; p. 145-195.
BDIPSN (Base de données sur les ingrédients des produits de santé naturels) [base de données sur Internet]; 2015; version 2.1. Ottawa (Ont.) : Santé Canada; consulté en juin 2015.
BDPSNH (Base de données des produits de santé naturels homologués) [base de données sur Internet]; 2015; version 1.0. Ottawa (Ont.) : Santé Canada; consulté en juin 2015.
BfR (Institut fédéral allemand d'évaluation des risques); 2007; Introduction to the problems surrounding garment textiles, Berlin (Allemagne) : Institut fédéral allemand d'évaluation des risques (BfR), rapport no : BfR Information No. 018/2007, 1er juin 2007.
Biedermann W. et Datyner A.; 1981; The interaction of nonionic dyestuffs with sodium dodecyl sulfate and its correlation with lipophilic parameters; J. Colloid Interface Sci., 82, p. 276-285 [cité dans Baughman et Perenich, 1988].
BioReliance; 2012; Bacterial reverse mutation assay of selected azo dyes; rapport non publié préparé pour Santé Canada, Rockville (MD) : BioReliance. Study Report No.: AD46RB-RL.502.BTL.
Bird C.L.; 1954; The dyeing of acetate rayon with disperse dyes: I. Aqueous solubility and the influence of dispersing agents; J. Soc. Dyers Colourists, 70(2), p. 68-77 [cité dans Baughman et Perenich, 1988].
BMG; 2000a; C.I. Disperse Red 153, test for inhibition of oxygen consumption by activated sludges: respiration inhibition test; rapport du BMG no 800/b-00.
BMG; 2000b; 96-hour acute toxicity to Poecilia reticulata (guppy): limit test (100 mg/L); rapport du BMG no 800/a-00.
BMG; 2001; C.I. Disperse Red 153, inherent biodegradability - Evaluation of the aerobic biodegradability in an aqueous medium: Zahn-Wellens/EMPA test; rapport du BMG no 800/c-00.
BMG; 2003a; Inherent biodegradability - Evaluation of the aerobic biodegradability in an aqueous medium: Zahn-Wellens/EMPA test; rapport du BMG no 709/c-03.
BMG; 2003b; Test for inhibition of oxygen consumption by activated sludges: respiration inhibition test; rapport du BMG no 709/a-03.
BMG; 2003c; 96-hour acute toxicity to Poecilia reticulata (guppy): screening test; rapport du BMG no 709/b-03.
Boethling R.S., Howard P.H., Beauman J.A. et Larosche M.E.; 1995; Factors for intermedia extrapolations in biodegradability assessment; Chemosphere, 30(4), p. 741-752.
BRI (Biopharmaceutical Research Inc.); 2012; Testing the Metabolism Potential of Selected Aromatic Azo and Benzidine Dyes In Vitro in Two Representative Human Skin Bacterial Cultures Under Aerobic Conditions; Rapport non publié préparé pour Santé Canada, Vancouver (C.-B.); rapport d'étude de Biopharmaceutical Research Inc. no HEA-2011-002.
BRI (Biopharmaceutical Research Inc.); 2013; Determination of the metabolic reduction potential of selected aromatic azo- and benzidine-based substances: in vitro anaerobic fecal bacterial cultures of the human gastrointestinal tract; rapport non publié préparé pour Santé Canada, Vancouver (C.-B.); rapport d'étude de Biopharmaceutical Research Inc. no HEA-2012-001 et HEA-2012-002.
Brown D.; 1987; Effects of colorants in the aquatic environment; Ecotoxicol. Environ. Saf., 13, p. 139-147.
Brown D.; 1992; Environmental assessment of dyestuffs, ETAD Ecological Sub-committee Project E3020; préparé pour l'Ecological and Toxicological Association of the Dyes and Organic Pigments Manufacturers, Bâle (Suisse), par ICI Group Environmental Laboratory, Brixham (Royaume-Uni); soumis à Environnement Canada.
Brown D. et Hamburger B.; 1987; The degradation of dyestuffs: Part III - Investigations of their ultimate degradability; Chemosphere, 16(7), p. 1539-1553.
Brown D. et Laboureur P.; 1983; The degradation of dyestuffs: Part I. Primary biodegradation under anaerobic conditions; Chemosphere, 12(3), p. 397-404.
Brownlie SA.; 1998; Disperse red 17 - 13 week oral (gavage) toxicity study in the rat; Quintiles England Ltd. [cité dans SCCS 2013].
Cai Y., Pailthorpe M.T. et David C.K.; 1999; A new method for improving the dyeability of cotton with reactive dyes; Textile Res. J., 69, p. 440-446.
Canada; 1978; Règlement sur les aliments et drogues, C.R.C., ch. 870.
Canada; 1999; Loi canadienne sur la protection de l'environnement 1999; L.C. 1999, ch. 33; Gazette du Canada, Partie III, vol. 22, no 3.
Canada; 2000; Loi canadienne sur la protection de l'environnement 1999 : Règlement sur la persistance et la bioaccumulation; C.P. 2000-348, 23 mars 2000, DORS/2000-107; Gazette du Canada, Partie II, vol. 134, no 7, p. 607-612.
Canada; 2001; Effluents des usines de textile [en ligne]; Liste des substances d'intérêt prioritaire - Rapport d'évaluation, Ottawa (Ont.) : Environnement Canada; Santé Canada.
Canada; 2007; Règlement sur les cosmétiques, C.R.C., ch. 869.
Canada; ministère de l'Environnement; 2006; Loi canadienne sur la protection de l'environnement 1999 : Avis concernant certaines substances considérées comme priorité pour suivi; Gazette du Canada, Partie I, vol. 140, n° 9, p. 435-459.
Canada; ministère de l'Environnement; 2008a; Loi canadienne sur la protection de l'environnement 1999 : Avis concernant les substances du groupe 5 du Défi; Gazette du Canada, Partie I, vol. 142, no 7, p. 311-327.
Canada; ministère de l'Environnement; 2008b; Loi canadienne sur la protection de l'environnement 1999 : Avis concernant les substances du groupe 6 du Défi; Gazette du Canada, Partie I, vol. 142, no 22, p. 1644-1662.
Canada; ministère de l'Environnement; 2008c; Loi canadienne sur la protection de l'environnement 1999 : Avis concernant les substances du groupe 7 du Défi; Gazette du Canada, Partie I, vol. 142, no 35, p. 2501-2517.
Canada; ministère de l'Environnement; 2009a; Loi canadienne sur la protection de l'environnement 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure; Gazette du Canada, vol. 143, n° 40.
Canada; ministère de l'Environnement; 2009b; Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du groupe 12 du Défi; Gazette du Canada, Partie I, vol. 143, n° 52, p. 3813-3836.
Canada; ministère de l'Environnement; 2011; Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines; Gazette du Canada, Partie I, vol. 145, n° 51.
CCRIS(Chemical Carcinogenesis Research Information System) [base de données sur Internet]; 2012; Bethesda (MD) : National Library of Medicine (États-Unis); consulté le 8 novembre 2012.
Chandler L.; 1997; Disperse red 17 - oral (gavage) rat developmental toxicity study; Quintiles England Ltd; cité dans SCCS 2013.
ChemBlink; 2012; An online database of chemicals; consulté en septembre 2012.
ChemIDplus Advance [système de recherche des produits chimiques en ligne]; 1993; Bethesda (MD) : National Library of Medicine (États-Unis).
ChemNet; 2012; base de données en ligne sur les produits chimiques; consulté en septembre 2012.
CHRIP (Chemical Risk Information Platform) [base de données sur Internet]; ©2008; Tokyo (Japon) : National Institute of Technology and Evaluation, Chemical Management Centre; consulté en novembre 2012.
Chu W. et Ma C.; 1997; Effects of UV-decolouring of aromatic dyes with different chemical structures; Toxicol. Environ. Chem., 63, p. 247-255.
Ciba Specialty Chemicals Corp.; 1997a; Présentation initiale : Salmonella typhimurium reverse mutation assay with FAT 36'141/c, avec letter de presentation datée du 15 décembre 1997; Doc ID: 88980000060. Microfiche No.: OTS0559212.
Ciba Specialty Chemicals Corp.; 1997b; Présentation initiale : Contact hypersensitivity to FAT 36'141/c in albino guinea pigs maximization test, avec letter de présentation datée du 15 décembre 1997; Doc ID: 88980000059. Microfiche No.: OTS0559211.
Clariant; 1996; IUCLID Dataset for C.I. Disperse Blue 79 (CAS 12239-34-8); cite dans HPVIS 2012.
Clariant Corporation; 1982; Données inédites pour Foron Navy S-2GRL (C.I. Disperse Blue79:1); cité dans HPVIS 2012.
Cleuvers M. et Weyers A.; 2003; Algal growth inhibition test: does shading of coloured substances really matter?; Water Res., 37, p. 2718-2722.
Cohle P. et Mihalik R.; 1991; Early life stage toxicity of C.I. Disperse Blue 79:1 purified preecake to rainbow trout (Oncorhynchus mykiss) in a flow-through system. Final report; ABC Laboratories Inc, Columbia (MO).
Collier S.W., Storm J.E. et Bronlaugh R.L.; 1993; Recution of azo dyes during in vitro percutaneous absorption; Toxicology and Applied Pharmacology, 118, p. 73-79.
Colón D., Weber E.J. et Baughman G.L.; 2002; Sediment-associated reactions of aromatic amines. 2. QSAR development; Environ. Sci. Technol., 36, p. 2443-2450.
Comber M.H.I., Smyth D.V. et Thompson R.S.; 1995; Assessment of the toxicity to algae of coloured substances; Bull. Environ. Contam. Toxicol., 55, p. 922-928.
CPMA (Color Pigments Manufacturers Association Inc.); 2003; Comments of the Color Pigments Manufacturers Association, Inc. on the draft guidance manual for the categorization of organic and inorganic substances on Canada's Domestic Substances List (DSL) and Environment Canada's computer generated estimates and empirical data on approximately 12,000 discrete organic chemicals on the DSL; Division des substances existantes, Environnement Canada; disponible sur demande.
CPOP (Modèle de polluants organiques persistants canadien); 2012; version 1.1.18; Gatineau (Qc); Environnement Canada, Division des substances existantes; Bourgas (Bulgarie) : Prof. Assen Zlatarov, Université de Bourgasy, Laboratoire de cjimie mathématique; modèle basé sur celui de Mekenyan et al., 2005.
CSPC (Comité scientifique des produits de consommation); 2013; Opinion on Disperse Red 17, Colipa No. B5, rapport n° SCCS/1522/13.
CSPC (Comité scientifique des produits de consommation); 2010; Opinion on Disperse Black 9, Colipa No. C106, rapport n° SCCS/1233/09.
Datyner A.; 1978a; The solubilization of disperse dyes by dispersing agents at 127°C; J. Soc. Dyers Colourists, 94(6), p. 256-260.
Datyner A.; 1978b; The solubilization of nonionic dyestuffs at elevated temperatures in aqueous solutions of sodium dodecyl sulfate; J. Colloid Interface Sci., 65(3), p. 527-532.
DeLigt R.A.F.; 2005; In vitro percutaneous absorption of disperse red 17 through human skin membrane using flow-through diffusion cells; TNO, 2005 [cité dans SCCS 2013].
DeVito S.C.; 2000; Absorption through cellular membranes; dans Boethling R.S. et Mackay D. éditeurs, Handbook of property estimation methods for chemicals: environmental and health science; Boca Raton (FL), CRC Press.
Dimitrov S.D., Dimitrova N.C., Walker J.D., Veith G.D. et Mekenyan O.G.; 2002; Predicting bioconcentration factors of highly hydrophobic chemicals. Effects of molecular size; Pure Appl. Chem., 74(10), p. 1823-1830.
Dimitrov S., Dimitrova N., Parkerton T., Comber M., Bonnell M. et Mekenyan O.; 2005; Base-line model for identifying the bioaccumulation potential of chemicals. SAR QSAR; Environ. Res., 16(6), p. 531-554.
Droste R.; 1997; Theory and practice of water and wastewater treatment; New York (NY), John Wiley & Sons.
Dupont Chem.; 1992; soumission initiale : letter de Dupont Chem à l'Environmental Protection Agency des États-Unis au sujet d'études de sensibilisation dermique sur le Disperse Yellow 23 chez des humains, avec letter de presentation datée du 15 octobre 1992; Doc ID: 88-920009566. Microfiche No.: OTS0571223.
Eastman Kodak Co.; 1992; soumission initiale : toxicité de base du 4(5′-éthylthiothiadiazol-2-ylazo)-3-acétamido-N,N-dipropylaniline, ave letter de presentation datée du 27 août 1992; Doc ID: 88-920009179. Microfiche No.: OTS0546461.
ECETOC (Centre européen d'écotoxicologie et de toxicologie des produits chimiques); 1996; Monograph No. 26 Aquatic Toxicity Testing of Sparingly Soluble, Volatile and Unstable Substances; Centre européen d'écotoxicologie et de toxicologie des produits chimiques, monographie n° 16.
ECHA (Agence européenne des produits chimiques); 2010; Guidance on information requirements and chemical safety assessment; Chapter R.16: Environmental exposure estimation, version 2. Helsinki (Finlande); Agence européenne des produits chimiques.
ECHA (Agence européenne des produits chimiques); 2012; Registered substances database. Helsinki (Finlande); Agence européenne des produits chimiques [mis à jour le 27 novembre 2012; consulté janvier-novembre 2012].
Ehling G.; 2005; Disperse red 17 (sedona red, WR18044) one-generation reproduction toxicity study in the rat; SANOFI AVENTIS [cité dans SCCS 2013].
Environnement Canada; 2006a; Données pour certaines substances recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement 1999 : Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement; Données préparées par Environnement Canada, Santé Canada, Programme des substances existantes.
Environnement Canada; 2006b; Données pour certaines substances recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement 1999 : Avis concernant certaines substances considérées comme priorités pour suivi; Données préparées par Environnement Canada, Santé Canada, Programme des substances existantes.
Environnement Canada; 2008a; Données sur les substances du lot 5 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement 1999 : Avis concernant les substances du groupe 5 du Défi; données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada; 2008b; Données sur les substances du lot 6 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement 1999 : Avis concernant les substances du groupe 6 du Défi; données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada; 2009; Données sur les substances du lot 7 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement 1999 : Avis concernant les substances du groupe 7 du Défi; données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada; 2010; Données sur les substances du lot 12 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement 1999 : Avis concernant les substances du groupe 12 du Défi; données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada; 2012; Données sur certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement 1999 : Avis concernant certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques; données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environment Canada; 2014; Données soumises en vertu de l'article 70 de la Loi canadienne sur la protection de l'environnement 1999 : le logPoe mesuré pour le n° CAS 55290-62-5.
Environnement Canada, Santé Canada; 2007; Substances chimiques : Catégorisation [en ligne]; Ottawa (Ont.) : Gouvernement du Canada [mis à jour le 20 avril 2007; consulté le 10 juin 2014].
Environnement Canada, Santé Canada. 2011. Évaluation préalable du Défi concernant le 2,2'-[(3,3'-diméthoxy[1,1'-biphényl]-4,4'-diyl)bisazo]bis[N-(2-méthylphényl)-3-oxobutanamide], numéro de registre du Chemical Abstracts Service 7147-42-4 [en ligne]; Ottawa (Ont.) : Environnement Canada, Santé Canada; disponible à l'adresse suivante :
Environnement Canada, Santé Canada; 2013; The Chemicals Management Plan Substance Grouping Initiative. Subgrouping Approach and Background Information for the Screening Assessment of Aromatic Azo and Benzidine-based Substancese; mai 2013; Environnement Canada, Santé Canada, disponible sur demande.
Environnement Canada, Santé Canada; 2014; Rapid Screening of Substances from Phase One of the Domestic Substances List Inventory Update; mars 2014; Environnement Canada, Santé Canada.
Environnement Canada, Santé Canada; 2015; Screening assessment: Aromatic Azo and Benzidine-based Substance Grouping. Certain Solvent Dyes; Ottawa (Ont.) : Environnement Canada, Santé Canada.
EPI Suite; Estimation Programs Interface Suite for Microsoft Windows [modèle d'évaluation]; 2012; version 4.1; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
EQC Equilibrium Criterion Model; 2011; version 1.0 (bêta); Peterborough (Ont) : Université Trent, Canadian Centre for Environmental Modelling and Chemistry.
ETAD Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers; 1983; Final report on extractability of dyestuffs from textiles; Bâle (Suisse) : ETAD Project A 4007.
ETAD Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers; 1991; Developmental toxicity evaluation of C.I. Disperse Blue 79:1 administered by gavage to New Zealand White rabbits (final report), avec letter de presentation datée du 2 mai 1991; Doc ID: 40-91105140. Microfiche No.: OTS0533199.
ETAD Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers; 1992; Draft guidelines for the assessment of environmental exposure to dyestuffs; Bâle (Suisse) : ETAD.
ETAD Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers; 1994; In vitro absorption of various dyes through human and pig epidermis; Bâle (Suisse) : ETAD Project T 2030, Part 1.
ETAD Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers; 1995a; In vitro absorption of two disperse dyes from synthetic perspiration and five formulations; Bâle (Suisse) : ETAD Project T 2030, Part 2.
ETAD Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers; 1995b; Health and environmental information on dyes used in Canada. An overview to assist in the implementation of the New Substances Notification Regulation under the Canadian Environmental Protection Act; Bâle (Suisse) : ETAD.
ETAD Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers; 2005; ETAD data for DSL categorization and screening, soumis à Environnement Canada le 27 octobre 2005; rapport d'étude préparé par Intertek ASG., référence du dossier : 2005/CC0157-001/REGIS.
Ferraz E.R.A., Grando M.D. et Oliveira D.P.; 2011ª; The azo dye Disperse Orange 1 induces DNA damage and cytotoxic effects but does not cause ecotoxic effects in Daphnia similis and Vibrio fischeri; J. Hazard. Mater., 192. P. 628-633.
Ferraz E.R.A., Umbuzeiro G.A., de-Almeida G., Caloto-Oliveira A., Chequer F.M.D., Zanoni M.V.B., Dorta D.J. et Oliveira D.P.; 2011b; Differential toxicity of Disperse Red 1 and Disperse Red 13 in the Ames test, HepG2 cytotoxicity assay, and Daphnia acute toxicity test; Environ. Toxicol., 26(5), p. 489-497.
Fletcher T., Holdway D., Simmons D., Dutton M. et Burridge L.E. éditeurs; 2011; Comptes rendus du 37e atelier annuel sur la toxicologie aquatique : du 3 au 6 octobre 2010, Toronto, Ontario (Rapport technique canadien des sciences halieutiques et aquatiques 2949); St. Andrews (N.-B.) : Pêches et Océans Canada.
Foureman P.; 1990; Drosophila melanogaster sex-linked recessive lethal assay of C.I. Disperse Blue 79:1 purified press cake; Rapport final, Madison (WI) : Université du Wisconsin, département de zoologie; lettre avec annexes de C. Auer, Environmental Protection Agency des États-Unis, adressée à T. Helmes, Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers, 11 janvier 1993 [cité dans HPVIS, 2012].
Freitag D., Lay J.P. et Korte F.; 1984; Environmental hazard profile - Test results as related to structures and translation into the environment; dans Kaiser K.L.E. (éd.), QSAR in environmental toxicology: Proceedings of the Workshop on Quantitative Structure-Activity Relationships (QSAR) in Environmental Toxicology; Atelier tenu du 16 au 18 août 1983, à l'Université McMaster, Hamilton (Ont.); Dordrecht (Pays-Bas) : D. Reidel Publishing Company. p. 111-136 [cité dans OCDE, 2011].
Gobas F.; 2007; Development and review of a generic water-sediment modelling framework for organic chemicals; préparé pour la Division des évaluations écologiques, Environnement Canada.
Gobas F.; 2010; Comments on approach to predict the envioronmental concentration in sediment; préparé pour la Division des évaluations écologiques, Environnement Canada.
Gray P.S., Hunter R. Jr et Patterson; 1979; Chromosomal aberrations induced by Dispersion Yellow 3 in Rana clamitans larvae during tail regeneration; Cytobios, 99-100, p. 175-182 [cité dans OECD 2012].
Guidechem; 2012; Base de données en ligne pour des renseignements sur les produits chimiques; consulté en 2013.
Harlan; 2010; In vivo unscheduled DNA synthesis in rat hepatocytes with Sedona Red; WR 18044; Study #1240801; P&G Reference No. DIC08WR18044-65298; 8 janvier 2010 [cité dans SCCS 2013].
Haseman J.K. et Johnson F.M.; 1996; Analysis of national toxicology program rodent bioassay data for anticarcinogenic effects; Mutation Research, 350, p. 131-141.
Health, Safety, and Human Factors Laboratory; 1978; Basic Toxicity of 2-[4-[(6-chloro-2-benzothiazolylazo)phenyl]-ethylamino]ethyl acetate; Toxicology Section, Health, Safety, and Human Factors Laboratory; rapport soumis à l'Environmental Protection Agency Registration and Agreement des États-Unis pour le TSCA 8(a) Compliance Audit Program par la Eastman Kodak Company en 1992.
Honarvar N.; 2005; Micronucleus assay in bone marrow cells of the mouse with disperse red17; WR 18044; RCC-CCR [cité dans SCCS 2013].
Hou M., Baughman G.L. et Perenich T.A.; 1991; Estimation of water solubility and octanol/water partition coefficient of hydrophobic dyes. Part II: Reverse-phase high performance liquid chromatography; Dyes Pigments, 16, p. 291-297.
HPVIS (High Production Volume Information System); 2012; Washington (DC) : Environmental Protection Agency des États-Unis [consulté le 26 juin 2012].
HSDB (Hazardous Substances Data Bank), base de données sur Internet; 1983; Bethesda (MD) : National Library of Medicine (États-Unis); consulté en 2012.
ILS (Integrated Laboratory Systems, Inc.); 2011; Final report: Assessment of mutagenicity of twenty aromatic azo substances in the Ames mutagenicity assay using the Prival modification with and without FMN; rapport non publié préparé pour Santé Canada; Durham (NC) : Integrated Laboratory Systems, Inc. Study Report No.: C191-006.
ILS (Integrated Laboratory Systems, Inc.); 2012; Final report: Assessment of mutagenicity of fifteen aromatic azo substances in the Ames mutagenicity assay using the Prival modification with and without FMN; rapport non publié préparé pour Santé Canada; Durham (NC) : Integrated Laboratory Systems, Inc. Study Report No.: C191-009.
IUCLID (International Uniform Chemical Information Database); 2001; IUCLID Dataset: Substance ID: 3168-72-2.
JETOC (Japan Chemical Industry Ecology-Toxicology & Information Center); 1992; Biodegradation data on Disperse Yellow 163 (CAS RN 71767-67-4); Tokyo (Japon); Japan Chemical Industry Ecology-Toxicology & Information Center [cité dans OCDE, 2011].
JETOC (Japan Chemical Industry Ecology-Toxicology & Information Center); 1996; Mutagenicity test data of existing chemical substances based on the toxicity investigation of the industrial safety and health law; Tokyo (Japon); Japan Chemical Industry Ecology-Toxicology & Information Center [cité dans CCRIS, 2012].
JETOC (Japan Chemical Industry Ecology-Toxicology & Information Center); 1997; Mutagenicity test data of existing chemical substances based on the toxicity investigation system of the industrial safety and health law, supplement; Tokyo (Japon); Japan Chemical Industry Ecology-Toxicology & Information Center [cité dans CCRIS, 2012].
Karickhoff S.; 1981; Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils; Chemosphere, 10, p. 833-846.
Kawai A., Goto S., Matsumoto Y. et Matsushita H.; 1987; Mutagenicity of aliphatic and aromatic nitro compounds. Industrial materials and related compounds; Jpn J. Ind. Health, 29(1), p. 34-54 [article en japonais].
Koh J., 2011; Dyeing with disperse dyes; dans Hauser P.J. (éd.), Textile dyeing, InTech, 392 p.
Kojima H. et Iijima T.; 1975; Concentration dependence of the diffusion coefficients of disperse dyes in polyethylene terephthalate; JSDC, 91(4), p. 103-105.
Kosaka H. et Nakamura S.; 1990; Genotoxicity of synthetic dyes in umu test using Salmonella typhimurium TA1535/pSK1002 (1). Results of examination for acid dyes, direct dyes, disperse dyes and reactive dyes; Sangyo Igaku, 32(2), p. 89-104 [article en japonais].
Kosaka H. et Nakamura S.; 1991; Genotoxic components of synthetic dyes separated by thin layer chromatography; Chem Express, 6(4), p. 257-260.
Kremer; 2003; Material Safety Data Sheet; Isoindol Orange PO 61, CAS RN: 40716-47-0.
Kuroiwa S. et Ogasawara S.; 1973; Dispersed state of dyes and their dyeing properties. VIII. Solubilities of disperse dyes in water; Nippon Kagaku Kaishi, 9. P. 1738-1743 [cité dans EPI Suite, 2012].
Kuz'menko N.M. et Petrovskaia O.G.; 1983; Experimental study of the blastomogenic properties of the disperse dye Fast Yellow 4K; Gig. Sanit., 7, p. 6-8 [article en russe].
Little L.W. et Lamb J.C. III; 1972; Acute toxicity of 46 selected dyes to the fathead minnow, Pimephales promelas; dans Dyes and the environment - Reports on selected dyes and their effects, vol. 1. New York (NY) : American Dye Manufacturers Institute Inc., p. 130.
LookChem; 2012; Base de données en ligne pour des renseignements sur les produits chimiques; consulté en 2013.
Maguire R.J.; 1992; Occurrence and persistence of dyes in a Canadian river; Water Sci. Technol., 25(11), p. 265-270.
Maguire R.J. et Tkacz R.J.; 1991; Occurrence of dyes in the Yamaska River, Quebec; Water Pollut. Res. J. Can., 26(2), p. 145-161.
Matsushima T., Hayashi M., Matsuoka A., Ishidate M. Jr, Miura K.F., Shimizu H., Suzuki Y., Morimoto K., Ogura H., Mure K., Koshi K. et Sofuni T.;1999; Validation study of the in vitro micronucleus test in a Chinese hamster lung cell line (CHL/IU); Mutagenesis, 14(6), p. 569-580.
McCarty L.S.; 1986; The relationship between aquatic toxicity QSARs and bioconcentration for some organic chemicals; Environ. Toxicol. Chem., 5, p. 1071-1080.
McCarty L.S.; 1987a; Relationship between toxicity and bioconcentration for some organic chemicals: I Examination of the relationship; dans Kaiser K.L.E. (éd.), QSAR in Environmental Toxicology-II; Dordecht (Pays-Bas) : D Reidel Publishing Co. p. 207-220.
McCarty L.S.; 1987b; Relationship between toxicity and bioconcentration for some organic chemicals: II Application of the relationship; dans Kaiser K.L.E. (éd.), QSAR in Environmental Toxicology-II; Dordecht (Pays-Bas) : D Reidel Publishing Co. p. 221-229.
McCarty L.S.; 1990; A kinetics-based analysis of quantitative structure-activity relationships in aquatic toxicity and bioconcentration bioassays with organic chemicals; thèse de doctorat de l'Université de Waterloo, Waterloo (Ont.), Canada.
McCarty L.S., Hodson P.V., Craig G.R. et Kaiser K.L.E.; 1985; The use of quantitative structure-activity relationships to predict the acute and chronic toxicities of organic chemicals to fish; Environ. Toxicol. Chem., 4, p. 595-606.
McCarty L.S., Mackay D., Smith A.D., Ozburn G.W. et Dixon D.G.; 1991; Interpreting aquatic toxicity QSARs: the significance of toxicant body residues at the pharmacologic endpoint; Science of the Total Environment, Special Issue: QSAR in Environmental Toxicology, 109, p. 515-525.
McCarty L.S. et Mackay D.; 1993; Enhancing ecotoxicological modeling and assessment: body residues and modes of toxic action; Environ. Sci. Technol.; 27. P. 1719-1728.
McDougall R. et Van Ham M.D.; 2002; Best management practice guidelines for the land application of managed organic matter in British Columbia; Victoria (C.-B.) : ministère de la Protection de l'eau, des terres et de l'air.
Mekenyan G., Dimitrov S.D., Pavlov T.S. et Veith G.D.; 2005; POPs: A QSAR System for Developing Categories for Persistent, Bioacculative and Toxic Chemicals and their Metabolites; SAR QSAR Environ. Res., 16(1-2), p. 103-133.
MENV (ministère de l'Environnement du Québec); 2004; Guide sur la valorisation des matières résiduelles fertilisantes; février 2004.
MHLW (Ministry of Health, Labour and Welfare (Japon)); 2012; Disperse Red 206[en ligne] [consulté le 26 février 2013].
Milani D. et Intini K.; 2013; Toxicity of disperse dyes to the mayfly Hexagenia spp. and oligochaete worm Tubifex tubifex in spiked sediment exposures; étude non publiée d'Environnement Canada.
Mishra N.K., Bell S.J., Gomez Y.P. et Prival M.J.; 1981; Mutagenicity of synthetic hair implant components: biocompatibility study of leachates using Salmonella; Environ. Mutagen., 3, p. 351.
MITI (Ministry of International Trade & Industry (Japon), Basic Industries Bureau, Chemical Products Safety Division); 1992; Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan; Tokyo (Japon) : Japan Chemical Industry Ecology-Toxicology & Information Centre.
Muller M. et Nendza M.; 2007; Literature study: effects of molecular size and lipid solubility on bioaccumulation potential; Schmallenberg (Allemagne) : Fraunhofer Institute for Molecular Biology and Applied Ecology.
Nair R.S., Auletta C.S., Schroeder R.E. et Johannsen F.R.; 1990; Chronic toxicity, oncogenic potential, and reproductive toxicity of p-nitroaniline in rats; Fundam. Appl. Toxicol., 15(3), p. 607-621.
Nakamura S., Kosaka H. et Ugawa M.; 1993; Genotoxicity of chemical synthetic dyes. Results of umu test using Salmonella typhimurium TA1535/pSK1002; Hen'igensei Shiken, 2(3), p. 162-174 [article en japonais].
NCI (National Chemical Inventories) [base de données sur CD-ROM]; 2012; 2e éd. Columbus (OH) : American Chemical Society, Chemical Abstracts Service.
NTP (National Toxicology Program des États-Unis); 1982a; Carcinogenesis bioassay of C.I. Solvent Yellow 14 (CAS No. 842-07-9) in F344/N rats and B6C3F1 mice (feed study); Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program; Technical Report Series No. 226.
NTP (National Toxicology Program des États-Unis); 1982b; Carcinogenesis bioassay of Disperse Yellow 3 (CAS No. 2832-40-8) in F344 rats and B6C3F1 mice (feed) study; Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program; Technical Report Series No. 222.
NTP (National Toxicology Program des États-Unis); 1993; Toxicology and carcinogenesis studies of p-nitroaniline in B6C3F1 mice (gavage studies); Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. Report No.: 418.
OCDE (Organisation de coopération et de développement économiques); 2004; Emission scenario document on textile finishing industry [en ligne], Paris (France) : Organisation de coopération et de développement économiques, Direction de l'environnement; rapport no ENV/JM/MONO(2004)12, JT00166691.
OCDE (Organisation de coopération et de développement économiques); 2012; Direction de l'environnement; QSAR Application Toolbox, version 2.3; développé par : Bourgas (Bulgarie) : Prof. Assen Zlatarov de l'Université de Bourgas, Laboratoire de chimie mathématique.
OCDE (Organisation de coopération et de développement économiques); 2014; Guidance on Grouping of Chemicals. Second Edition. Series on Testing & Assessment, No. 194.
Øllgaard H., Frost L., Galster J. et Hansen O.C.; 1998; Survey of azo-colorants in Denmark: Consumption, use, health and environmental aspects; Copenhague (Danemark) : ministère de l'Environnement et de l'Énergie, Agence de protection de l'environnement du Danemark.
MOE, OMAFRA (Ontario, ministère de l'Environnement, ministère de l'Agriculture, de l'Alimentation et des Affaires rurales); 1996; Guidelines for the utilization of biosolids and other wastes on agricultural land.
Pagga U. et Brown D.; 1986; The degradation of dyestuffs: Part II - Behaviour of dyestuffs in aerobic biodegradation tests; Chemosphere, 15(4), p. 479-491.
Palus J., Schwarz L., Frank C. et Andrae U.; 1995; DNA repair synthesis induced by azo dyes in primary rat hepatocyte cultures using the bromodeoxyuridine density-shift method; Int. J. Occup. Med. Environ. Health, 8(2), p. 123-130.
Parrott J. et Balakrishnan V.; 2011; Sublethal toxicity of CMP dyes to fish; poster présenté au 37e atelier annuel sur la toxicologie aquatique; atelier tenu du 3 au 6 octobre 2011 à Toronto (Ont.) [résumé cité dans Fletcher et al., 2011].
Parrott J., Bartlett A. et Balakrishnan V.; 2013; Sublethal toxicity of CMP dyes to fish; étude non publiée d'Environnement Canada.
Patterson D. et Sheldon R.P.; 1960; The solubilities and heats of solution of disperse dyes in water; J. Soc. Dyers Colourists, 76(3), p. 178-181.
P&G (Proctor and Gamble); 2005; Bacterial mutation test (ames), Disperse black 9, P&G Study #2656-53776; octobre 2005 [cité dans SCCS 2010].
P&G (Proctor and Gamble); 2005; Disperse black 9: in vitro penetration from a formulation through human skin; P&G Study #2656-53774; juin 2005 [cité dans SCCS 2010].
P&G (Proctor and Gamble); 2005; Disperse black 9: in vitro mouse lymphoma (L5167Y/TK+/-) mutation assay; P&G Study #2656-53773; octobre 2005 [cité dans SCCS 2010].
P&G (Proctor and Gamble); 2005; Disperse black 9: in vitro chromosome aberration assay; P&G Study #2656-53771; octobre 2005 [cité dans SCCS 2010].
P&G (Proctor and Gamble); 2005; Disperse black 9: in vivo micronucleus assay; P&G Study #2656-53768; octobre 2005 [cité dans SCCS 2010].
P&G (Proctor and Gamble); 2005; Disperse black 9: in vivo unscheduled DNA synthesis assay; P&G Study #2656-54978; octobre 2005 [cité dans SCCS 2010].
P&G (Proctor and Gamble); 2005; Disperse black 9: oral (gavage) developmental toxicity study of GTS03872 in rats; P&G Study #2656-53767; octobre 2005 [cité dans SCCS 2010].
PhysProp (Interactive PhysProp Database), base de données sur Internet; 2006; Syracuse (NY) : Syracuse Research Corporation; [consulté en 2013].
Présentation de projet; 2005a; Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes; n° d'identification 158.
Présentation de projet; 2005b; Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes; disponible en tant que Sommaire de rigueur d'étude, n° d'identification 169.
Présentation de projet; 2005c; Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes; disponible en tant que Sommaire de rigueur d'étude, n° d'identification 171.
Présentation de projet; 2007a; Projet non publié et confidentiel présenté à la Division des substances existantes d'Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Pigment Orange 5, no CAS 3468-63-1, n° d'identification : 13365Submission015.
Présentation de projet; 2007b; Projet non publié et confidentiel présenté à la Division des substances existantes d'Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Pigment Red 2 (no CAS 6041-94-7), n° d'identification : 13365Challenge006.
Présentation de projet; 2008a; Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes; n° d'identification : 11887Challenge006.
Présentation de projet; 2008b; Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes; Batch 7 Challenge Submission ID: #12890.
Présentation de projet; 2012a; Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes; DocID39.
Présentation de projet; 2012b; Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes; DocID40.
Présentation de projet; 2012c; Projets non publiés et confidentiels présentés à Environnement Canada dans le cadre du Plan de gestion des produits chimiques; Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes; pour le Groupe des substances azoïques aromatiques et à base de benzidine.
Razo-Flores E., Luijten M., Donlon B., Lettinga G. et Field J.; 1997; Biodegradation of selected azo dyes under methanogenic conditions; Water Sci. Technol., 36(6-7), p. 65-72.
Rufli H., Fisk P.R., Girling A.E., King M.H., Lange R., Lejeune X., Stelter N., Stevens C., Suteau P. , Tapp J., Thus H.J., Vertsteeg D.J. et Niesen H.J.; 1998; Aquatic toxicity testing of sparingly soluble, volatile, and unstable substances and interpretation and use of data; Ecotoxicol. Environ. Saf., 39, p. 72-77.
SafePharm (SafePharm Laboratories Ltd); 1990a; Acute toxicity to rainbow trout. Project No. 47/781; n° de déclaration dans le cadre du Défi : 11347.
SafePharm (SafePharm Laboratories Ltd); 1990b; Activated sludge respiration inhibition test. Project number 47/922; n° de déclaration dans le cadre du Défi : 11347; soumis à Environnement Canada le 30 juillet 2008.
Sakuratani Y., Noguchi Y., Kobayashi K., Yamada J. et Nishihara T.; 2008; Molecular size as a limiting characteristic for bioconcentration in fish; J. Environ. Biol., 29(1), p. 89-92.
Sandoz; 1975; soumission volaontaire de données dans le cadre de l'article 71; Disperse Orange 30 dans le lot 5 du Défi.
Sandoz Chemicals; 1989; Fiche signalétique pour Foron Navy S-2GRL Purified presscakes.
SCCNFP (Scientific Committee on Cosmetic Products and Non-Food Products Intended for Consumers); 2003; Opinion of the Scientific Committee on Cosmetic Products and Non-Food Products Intended for Consumers concerning Disperse Red 17; Colipa No B5; rapport no SCCNFP/0677/03, final.
Santé Canada; 1995; Enquête sur l'exposition des êtres humains aux contaminants dans le milieu : Un guide pour le calcul de l'exposition; Ottawa (Ont.) : Santé Canada, Direction générale de la protection de la santé; Les Grands Lacs : Impact sur la santé.
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié, Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada; 2009; Catégorisation des substances figurant sur la Liste intérieure des substances [en ligne] [modifié en septembre 2009]; Ottawa (Ont.) : Santé Canada.
Santé Canada; 2011; Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques - Mars 2011 [en ligne]; Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation [consulté le 30 avril 2013].
Santé Canada; 2012; Liste des colorants autorisés (Listes des additifs alimentaires autorisés); Ottawa (Ont.) : Santé Canada [consulté le 8 mai 2013].
SDC (Système de déclaration des cosmétiques) [base de données exclusive]; 2011; Ottawa (Ont.) : Santé Canada [consulté le 19 février 2013] [réserve de consultation].
Seifried H.E., Seifried R.M., Clarke J.J., Junghans T.B. et San R.H.; 2006; A compilation of two decades of mutagenicity test results with the Ames Salmonella typhimurium and L5178Y mouse lymphoma cell mutation assays; Chem. Res. Toxicol., 19(5), p. 627-644.
Seth R., Webster E. et Mackay D.; 2008; Continued development of a mass balance model of chemical fate in a sewage treatment plant; Water Res., 42, p. 595-604.
Shen G. et Hu S.; 2008; Bioconcentration test of C.I. Disperse Orange 30 in fish; préparé pour Dystar au nom de l'Ecological and Toxicological Association of the Dyes and Organic Pigments Manufacturers (ETAD), Bâle (Suisse); rapport no S-070-2007; soumis à Environnement Canada; no de déclaration dans le cadre du Défi : 8351.
Shimizu H. et Takemura N.; 1984; Mutagenicity of some aniline derivatives; dans Proceedings of the 11th International Congress on Occupational Health in the Chemical Industry; congrès tenu du 26 au 29 septembre 1983, à Calgary (Alb.), Canada; p. 497-506.
Sijm D.T.H.M. et Hermens J.L.M.; 2000; Internal effect concentration: link between bioaccumulation and ecotoxicity for organic chemicals; dans The Handbook of Environmental Chemistry, vol. 2, partie J; Bioaccumulation (Beek B. éd.), Springer-Verlag (Berlin, Heidelberg (Allemagne)) : p. 167-199.
Sijm D.T.H.M., Schuurmann G., deVries P.J. et Opperhuizen A.; 1999; Aqueous solubility, octanol solubility, and octanol/water partition coefficient of nine hydrophobic dyes; Environ. Toxicol. Chem., 18(6), p. 1109-1117.
Sokolowski A.; 2005; Salmonella typhimurium reverse mutation assay with disperse red 17; WR 18044. RCC-CCR [cité dans SCCS 2013].
STP-EX (Sewage Treatment Plant Expanded Model); 2008; Windsor (Ont.) : Université de Windsor, département de génie civil et environnemental [Modèle décrit dans Seth et al., 2008].
Tyl R.W., Marr M.C. et Myers C.B.; 1990; Developmental toxicity evaluation of C.I. Disperse Blue 79:1 administered by gavage to CD (Sprague-Dawley) rats; rapport final; Research Triangle Park (NC) : Research Triangle Institute; lettre avec annexes de C. Auer, Environmental Protection Agency des États-Unis, adressée à T. Helmes, Ecological and Toxicological Association of Dyes and Organic Pigments Manufacturers, 11 janvier 1993 [cité dans HPVIS, 2012].
Ullmann's Encyclopedia (Ullmann's encyclopedia of industrial chemistry); 2010; John Wiley & Sons, Inc. [consulté le 11 décembre 2012] [réserve de consultation].
Umbuzeiro G.A., Freeman H.S., Warren S.H., Oliveira D.P., Terao Y., Watanabe T. et Claxton L.D.; 2005; The contribution of azo dyes to the mutagenic activity of the Cristais River; Chemosphere, 60(1), p. 55-64.
Union Carbide Corp.; 1991a; C.I. Disperse Blue 79:1 (DB79): disposition and metabolite characterization following peroral dose administration to male and female Sprague-Dawley rats (final report), avec letter de presentation datée du 11 janvier 1991; Doc ID: 40-91105141, microfiche No.: OTS0533201.
Union Carbide Corp; 1991b; Ninety-day gavage toxicity study with C.I. Disperse Blue 79:1(DB79) in Sprague-Dawley rats (final report), avec letter de presentation datée du 20 février 1991; Doc ID: 40-91105121, microfiche No.: OTS0529347.
Union européenne; 2006; Règlement (CE) n° 1907/2006 du Parlement européen et du Conseil du 18 décembre 2006 concernant l'enregistrement, l'évaluation et l'autorisation des substances chimiques, ainsi que les restrictions applicables à ces substances (REACH), instituant une agence européenne des produits chimiques, modifiant la directive 1999/45/CE et abrogeant le règlement (CEE) no 793/93 du Conseil et le règlement (CE) no 1488/94 de la Commission ainsi que la directive 76/769/CEE du Conseil et les directives 91/155/CEE, 93/67/CEE, 93/105/CE et 2000/21/CE de la Commission [en ligne]; Journal officiel de l'Union européenne L 396:1-849; disponible à l'adresse suivante :
USEPA (Environmental Protection Agency des États-Unis); 1990; Aerobic and anaerobic treatment of C.I. Disperse Blue 79, Project summary; rapport no EPA/600/2-89/051A.
USEPA (Environmental Protection Agency des États-Unis); 1994; Generic scenario - fabric finishing; Washington (DC) : Environmental Protection Agency des États-Unis, Chemical Engineering Branch.
USEPA (Environmental Protection Agency des États-Unis); 2009; Screening-level hazard characterization - mononitroanilines category: 2-nitrobenzenamine (CASRN 88-74-4), 4-nitrobenzenamine (CASRN 100-01-6) [en ligne]; Washington (DC) : Environmental Protection Agency des États-Unis.
USEPA (Environmental Protection Agency des États-Unis); 2012; Standard operating procedures for residential pesticide exposure assessment; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pesticide Programs, Health Effects Division.
Vacchi F.I., Albuquerque A.F., Vendemiatti J.A., Morales D.A., Ormond A.B., Freeman H.S., Zocolo G.J., Zanoni M.V.B. et Umbuzeiro B.; 2013; Chlorine disinfection of dye wastewater: implications for a commercial azo dye mixture; Sci. Total Environ., 442, p. :02-309.
Van Hoogen G. et Opperhuizen A.; 1988; Toxicokinetics of chlorobenzenes in fish; Environ. Toxicol. Chem., 7, p. 213-219.
Weber E.J. et Adams R.L.; 1995; Chemical- and sediment-mediated reduction of the azo dye Disperse Blue 79; Environ. Sci. Technol., 29(5), p. 1163-1170.
Weber E.J., Colón D. et Baughman G.L.; 2001; Sediment-associated reactions of aromatic amines. 1. Elucidation of sorption mechanisms; Environ. Sci. Technol., 35(12), p. 2470-2475.
Weyman G.S., Rufli H., Weltje L., Salinas E.R. et Hamitou M.; 2012; Aquatic toxicity tests with substances that are poorly soluble in water and consequences for environmental risk assessment; Environ. Toxicol. Chem., 31(7), p. 1662-1669.
Whitehouse P. et Mallett M.; 1993; Aquatic Toxicity Testing for Notification of New Substances. An advisory document on dealing with "difficult" substances; rapport présenté à la Chemical Notification Unit, Department of the Environment, CP 722; Publications Unit, WRc plc., Henley Road, Medmenham, C.P. 16, Marlow, Buckinghamshire SL7 2HD, Royaume-Uni.
Whitwell J.; 2005; Disperse red 17: induction of micronuclei in cultured human peripheral blood lymphocytes; WR 18044. COVANCE [cité dans SCCS 2013].
Williams J.H.; 1999; Regulations on additions of sludge-borne metals to soil and their adaptation to local conditions; dans L'Hermite P. (éd.), Treatment and use of sewage sludge and liquid agricultural wastes; Londres (Grande-Bretagne) : Commission des Communautés européennes; Elsevier Applied Science, p. 243-250.
Wollny H.E.; 2005; Gene mutation assay in chinese hamster v79 cells in vitro (V79/HPRT) with disperse red 17; WR 18044. RCC-CCR [cité dans SCCS 2013].
Yen C.C., Perenich T.A. et Baughman G.L.; 1989; Fate of dyes in aquatic system II. Solubility and octanol/water partition coefficients of disperse dyes; Environ. Toxicol. Chem., 8, p. 981-986.
Yen C.C., Perenich T.A. et Baughman G.L.; 1991; Fate of commercial disperse dyes in sediments; Environ. Toxicol. Chem., 10, p. 1009-1017.
Yoshimi N., Sugie S., Iwata H., Niwa K., Mori H., Hashida C. et Shimizu H.; 1988; The genotoxicity of a variety of aniline derivatives in a DNA repair test with primary cultured rat hepatocytes; Mutat. Res., 206(2), p. 183-191.
Zeiger E., Anderson B. et Haworth S.; 1987; Salmonella mutagenicity tests: III. Results from the testing of 255 chemicals; Environ. Mutagen., 9(suppl. 9), p. 1-110.
Zeilmaker M.J., Kroese E.D., van Haperen P., van Veen M.P., Bremmer H.J., van Kranen H.J., Wouters M.F.A. et Janus J.A.; 1999; Cancer risk assessment of azo dyes and aromatic amines from garment and footwear; Bilthoven (Pays-Bas) : Institut national néerlandais de la santé publique et de l'environnement (RIVM); rapport du RIVM n° 601503 014.
Zhibo Z., Meihua C. et Jianhua M.; 1984; Thermodynamic analysis of stability of crystal of Disperse Blue 79; Huadong Fangzhi Gongxueyuan Xuebao, 10, p. 35-40. [cité dans Baughman et Perenich, 1988].
Annexes
- Annexe A : Résumé des propriétés physiques et chimiques - Partie 1 : Hydrosolubilité et coefficient de partage octanol-eau
- Annexe B : Propriétés physiques et chimiques des 73 colorants dispersés et de leurs analogues structurels - Partie 2 : renseignements additionnelle sur d'autres paramètres
- Annexe C : Données expérimentales sur l'écotoxicité des colorants azoïques dispersés et de leurs analogues pour les espèces aquatiques
- Annexe D : Approche de la charge corporelle critique pour les colorants azoïques dispersés
- Annexe E : Calculs de l'exposition dans l'environnement pour les colorants azoïques dispersés
- Annexe F : Colorants azoïques dispersés ayant des effets préoccupants
- Annexe G : Estimations prudentes de l'exposition aux colorants azoïques dispersés en raison de l'utilisation de produits textiles et en cuir