Évaluation préalable pour le Défi concernant le
Archivée
4,4'-bis(diméthylamino)benzophénone
(cétone de Michler)
Numéro de registre du Chemical Abstracts Service
90-94-8
Environnement Canada
Santé Canada
Mars 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Limite supérieure estimée de l’exposition à la cétone de Michler à partir de l’ingestion de papier par des enfants âgés de 6 mois à 4 ans
- Annexe 2 : Limite supérieure estimée de l’exposition cutanée et orale à la cétone de Michler à partir de stylos à bille et de marqueurs chez les enfants âgés de 6 mois à 4 ans
- Annexe 3 : Résumé des données relatives aux effets de la cétone de Michler sur la santé
Conformément à l'article 74 de la Loi canadienne sur la protection de l'environnement, 1999 (LCPE 1999), les ministres de l'Environnement et de la Santé ont effectué une évaluation préalable du 4,4'bis(diméthylamino)benzophénone (cétone de Michler), dont le numéro de registre du Chemical Abstracts Service est 90-94-8. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance durant la catégorisation visant la Liste intérieure des substances (LIS) dans le cadre du Défi lancé par les ministres. La cétone de Michler a été jugée hautement prioritaire, car elle a été reconnue comme une substance présentant un risque d’exposition intermédiaire pour les particuliers au Canada et a été classée par la Commission européenne et le National Toxicology Program des États-Unis en fonction de sa cancérogénicité. Cette substance répond aux critères environnementaux de la catégorisation relatifs à la persistance, mais elle ne répond pas à ceux du potentiel de bioaccumulation et de la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation sur la cétone de Michler est donc axée sur les risques pour la santé humaine.
La cétone de Michler est une substance organique que l’on trouve au Canada et dans le monde principalement sous forme résiduelle dans les matières colorantes, à la suite d'une réaction intermédiaire au cours de la fabrication, et dans les produits de consommation finals. En 2006, on a importé 800 kg de cétone de Michler au Canada, alors qu’aucune fabrication de cette substance n’a été déclarée au pays pendant l’année. De 1 000 à 10 000 kg de cétone de Michler ont été utilisés au Canada en 2006. Au pays, la cétone de Michler est principalement utilisée dans les produits de papier; on s’en sert aussi dans une moindre mesure à des fins industrielles pour la fabrication de feuils secs et de matériel électronique.
Les quantités de cétone de Michler importées et utilisées au pays ainsi que les types d’utilisation de cette substance laissent entendre qu’elle pourrait être rejetée dans l’environnement. L’exposition de la population générale à cette substance à partir des milieux environnementaux est considérée comme négligeable. À la lumière des données obtenues sur les usages actuels de la cétone de Michler au Canada, l’exposition de l’ensemble de la population à cette substance dans l’environnement devrait être très faible et se limiter à l’utilisation des produits de papier qui contiennent cette substance sous forme de résidu de fabrication dans la matière colorante pour papier. Il est peu probable que la population générale soit exposée à cette substance dans d’autres produits de consommation.
En s’appuyant principalement sur des évaluations reposant sur le poids de la preuve qui sont réalisées par des organismes internationaux ou d’autres organismes nationaux, on a déterminé que la cancérogénicité représente un effet critique de la cétone de Michler aux fins de la caractérisation des risques pour la santé humaine. Dans le cadre d’études de cancérogénicité standard, réalisées sur des rats et des souris au cours d’une période de deux ans, on a observé une augmentation de l’incidence des carcinomes hépatocellulaires chez les rats des deux sexes et chez les souris femelles ainsi que des hémangiosarcomes chez les souris mâles, à la suite d’une exposition à la cétone de Michler par voie alimentaire (orale). La substance s’est avérée génotoxique dans un éventail d’essais in vivo et in vitro. De plus, elle se liait à l’acide désoxyribonucléique (ADN) du foie des animaux de laboratoire et l’endommageait. Bien que les modes d’induction des tumeurs par la cétone de Michler n’aient pas été établis ni élucidés, on juge que les tumeurs observées chez les animaux de laboratoire résultent d’une interaction directe avec le matériel génétique.
L’effet critique (autre que le cancer) signalé aux fins de la caractérisation des risques de la cétone de Michler pour la santé humaine est la diminution du gain de poids corporel. Toutefois, on a noté des tumeurs à la dose minimale avec effet nocif observé établie pour le paramètre lié aux effets autres que le cancer. Les marges d’exposition ne sont donc pas calculées pour cette substance.
Compte tenu de la cancérogénicité possible de la cétone de Michler, qui pourrait causer des effets nocifs à tout niveau d’exposition, et des signes de tumeurs observées aux plus petites doses administrées, on conclut que la cétone de Michler est une substance pouvant pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D’après ses propriétés physiques et chimiques, la cétone de Michler devrait être persistante dans l’eau, le sol et les sédiments, mais elle ne devrait pas persister dans l’air ni se bioaccumuler dans l’environnement. Cette substance répond donc aux critères de la persistance et non à ceux de la bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation. En outre, les données modélisées indiquent que la substance peut avoir un potentiel de toxicité aiguë moyen à élevé pour les organismes aquatiques. Après comparaison des concentrations estimées sans effet et des concentrations estimées raisonnables d’une exposition selon le scénario de la pire éventualité, on conclut que la cétone de Michler ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
Compte tenu des données disponibles, il est conclu que la cétone de Michler répond à un critère ou plus de l’article 64 de la LCPE (1999).
La Loi canadienne sur la protection de l’environnement, 1999 [LCPE (1999)] (Canada, 1999) exige que les ministres de l’Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l’industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l’évaluation des risques, ainsi qu’à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
La cétone de Michler est une substance dont l’évaluation des risques pour la santé humaine a été jugée hautement prioritaire, car on considère qu’elle présente un REI et elle a été classée par d’autres organismes en fonction de sa cancérogénicité. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 30 août 2008 (Canada, 2008). En même temps a été publié le profil de cette substance qui présentait l’information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements sur les utilisations de la substance ont été reçus en réponse au Défi.
Même s’il a été jugé hautement prioritaire d’évaluer les risques que présente la cétone de Michler pour la santé humaine et que cette substance réponde aux critères environnementaux de la catégorisation applicables à la persistance, elle ne répond pas aux critères définissant le potentiel de bioaccumulation ou la toxicité intrinsèque pour les organismes aquatiques.
Les évaluations préalables mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques au sens de l’article 64 de la Loi. Elles visent à examiner les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable de la cétone de Michler sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu'en mai 2009 (sections du document concernant l'exposition et les effets sur la santé humaine ainsi que l'environnement) et jusqu'en février 2009 (propriétés physiques et chimiques, exposition et effets sur l'environnement). Les études les plus importantes ont fait l’objet d’une évaluation critique; il est possible que les résultats de modélisation aient servi à formuler des conclusions.
L’évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers et les risques pour la santé (principalement d’après les évaluations s’appuyant sur la méthode du poids de la preuve effectuées par d’autres organismes, lesquelles ont servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l’effet critique retenu ou sur la marge entre les valeurs prudentes de concentration donnant lieu à des effets et les estimations de l’exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, et ce, dans le contexte d’une évaluation préalable. L’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. II s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères.
Les parties de la présente évaluation préalable qui portent sur la santé humaine et l’envirionnement ont fait l’objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de la part d’experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment Mmes Lynne Haber, Ph. D. (TERA), Pam Williams, Ph. D. (E Risk Sciences) et Harlee Strauss, Ph. D. (Strauss Associates).
De plus, l’ébauche de la présente évaluation préalable a fait l’objet d’une période de commentaires du public de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l’évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Aux fins du présent document, la substance est appelée « cétone de Michler », qui est son nom commun (tableau 1).
Tableau 1. Identité de la substance – cétone de Michler
| Numéro de registre du Chemical Abstracts Service (no CAS) | 90-94-8 |
| Nom dans la LIS | 4,4'-bis(diméthylamino)benzophénone |
| Noms relevés dans les NCI | Benzophenone, 4,4'-bis(dimethylamino)- (PICCS) 4,4'-Bis(dimethylamino)benzophenone (ECL) 4,4'-bis(diméthylamino)benzophénone(EINECS) 4,4'-Bis (dimethylamino) benzophenone (ENCS) Methanone, bis[4-dimethylamino)phenyl]- (AICS, ASIA-PAC, NZIoC, PICCS, TSCA) |
| Autres noms | 4,4'-Bis(N,N-dimethylamino)benzophenone; p,p'-bis(dimethylamino)benzophenone; Bis(4-dimethylaminophenyl) ketone; bis[p-(N,N-dimethylamino)phenyl] ketone; bis[(4dimethylamino)phenyl]methanone; DABP; di(pdimethylamino)benzophenone; Michler’s ketone; cétone de Michler; Nisso Cure MABP; NSC 9602; S 112; S 112 (ketone); 4,4'-tetramethyldiaminobenzophenone; N,N,N',N'-tetramethyl-4,4'-diaminobenzophenone; p,p'-tetramethyldiaminobenzophenone |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Cétones |
| Principale sous-classe chimique | Benzophénones |
| Formule chimique | C17H20N2O |
| Structure chimique |  |
| SMILES | O=C(c(ccc(N(C)C)c1)c1)c(ccc(N(C)C)c2)c2 |
| Masse moléculaire | 268,36 g/mol |
| Abréviations : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique; ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); LIS (Liste intérieure des substances); NCI (National Chemical Inventories); no CAS (numéro de registre du Chemical Abstracts Service); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); SMILES (simplified molecular input line entry specification); SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). Source : NCI, 2006. |
|
Le tableau 2 présente les données physiques et chimiques (valeurs expérimentales et modélisées) de la cétone de Michler qui se rapportent à son devenir dans l’environnement.
Tableau 2. Propriétés physiques et chimiques de la forme neutre de la cétone de Michler
| Propriété | Type | Valeur1 | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Kco, coefficient de partage carbone organique-eau; Koe, coefficient de partage octanol-eau; pKa, constante de dissociation acide. 1 Les valeurs entre parenthèses représentent les valeurs originales signalées par les auteurs ou estimées à l’aide des modèles. 2 La cétone de Michler se décompose à une température de plus de 360 °C (Merck, 2006). 3 La méthode de l’indice de connectivité moléculaire (ICM) a été utilisée. 4 Une incertitude existe à propos de la valeur expérimentale de solubilité dans l'eau. Une valeur de 400 mg/L a été trouvée dans la base de données EPISuite 2009; toutefois, l’expérience a été effectuée il y a de nombreuses années (Dehn, 1917), et la valeur est supérieure de plus de deux ordres de grandeur à la valeur modélisée. |
||||
| Point de fusion (°C) | Expérimental | 179,0 | PhysProp, 2006 | |
| Modélisé | 128,7 | MPBPWIN, 2008 | ||
| Point d’ébullition (°C) | Modélisé | 373,92 | MPBPWIN, 2008 | |
| Pression de vapeur (Pa) | Expérimental | 2,8 × 10-4 (2,1 × 10-6 mm Hg) |
GEMS, 1987 | |
| Modélisé | 1,2 × 10-4 (8,9 × 10-7 mm Hg) |
25 | MPBPWIN, 2008 | |
| Constante de la loi de Henry (Pa·m3/mol) | Expérimental | 5,7 × 10-7 (5,6 × 10-12 atm·m3/mol) |
Hine et Mookerjee, 1975 | |
| Modélisé | 5,0 × 10-5 (4,91 × 10-10 atm·m3/mol) |
25 | HENRYWIN, 2008 | |
| Log Koe (sans dimension) | Expérimental | 3,9 | Hansch et al., 1995 | |
| Modélisé | 3,5 | KOWWIN, 2008 | ||
| Log Kco (sans dimension) | Modélisé | 2,53 | PCKOCWIN, 2009 | |
| Solubilité dans l'eau (mg/L) | Expérimental | Pratiquement insoluble4 | 20 | Merck, 2006 |
| Modélisé | 1,4 | 25 | WSKOWWIN, 2008 |
|
| pKa (sans dimension) | Modélisé | 2,6 (sous forme basique) | ACD/pKaDB, 2005 | |
Les modèles fondés sur les relations quantitatives structure-activité (RQSA) ont servi à produire des données pour certaines propriétés physiques et chimiques de la cétone de Michler. Ces modèles (sauf WSKOWWIN, 2008) s’appuient principalement sur des méthodes d’ajout de fragments, c’est-à-dire qu’elles reposent sur la structure d’un produit chimique. Puisque ces modèles n’acceptent que la forme neutre d’un produit chimique comme entrée (sous forme SMILES), les valeurs modélisées indiquées dans le tableau 2 s’appliquent à la forme neutre de la cétone de Michler. Aux pH enregistrés dans l’environnement (6 à 9), la cétone de Michler est neutre dans l’eau et elle est considérée comme non ionisante. La substance s’ionise dans l’eau comme une base. Selon le module de prévision pKa DB de ACD (2005), sa constante de dissociation acide primaire devrait être pKa1 = 2,55 et sa constante de dissociation acide secondaire devrait être pKa2 = 1,11. Étant donné que la constante de dissociation acide secondaire est bien inférieure à 5, la forme basique LH+ l’emportera sur la forme acide LH22+. De la même manière, la constante de dissociation acide primaire (pKa1 = 2,55) est bien inférieure à 5, ce qui indique que la forme basique L l’emportera sur la forme acide LH+. Dans l’ensemble, la forme neutre L l’emportera sur les formes ioniques LH+ et LH22+.
La cétone de Michler est une substance anthropique qui ne se trouve pas naturellement dans l’environnement. Elle peut être produite par la condensation de la diméthylaniline avec du phosgène en présence de chlorure de zinc (Gessner et Mayer, 2000; Röper et al., 2000). Elle peut aussi être produite à partir de diméthylaniline, de chlorure d'aluminium et de tétrachlorure de carbone (Merck, 2006; Lewis, 2007; HSDB, 2009). Une autre méthode implique l’oxydation catalytique de bis(diméthylaminophényl) méthane (Gessner et Mayer, 2000). La cétone de Michler est un produit de dégradation important du violet cristallisé. Elle peut également être desmethylée en (N,N-diméthylaminophényl) (Nméthylaminophényl)benzophénone (Chen et al., 2008).
D’après les renseignements recueillis dans le cadre d’une enquête effectuée en application de l’article 71 de la LCPE (1999), 800 kg de cétone de Michler ont été importés au Canada en 2006 et aucune fabrication n'a été signalée cette année-là (Environnement Canada, 2008).
Selon les renseignements précédemment reçus pour les années 1984 à 1986 après l’inscription de la substance sur la Liste intérieure des substances (LIS), la quantité totale de cétone de Michler déclarée comme ayant été importée, fabriquée ou commercialisée au Canada au cours de l'année civile 1986 s’élevait à 1 000 000 kg (Environnement Canada, 1988). Ainsi, la production et l’importation de cétone de Michler ainsi que l’utilisation de la substance ont diminué de façon importante depuis les années 1980. De plus, la cétone de Michler a été reconnue par l’Union européenne comme une substance chimique produite en faibles quantités (ESIS, 2009).
Selon les renseignements présentés en application de l’article 71 de la LCPE (1999) et les réponses au questionnaire du Défi (Environnement Canada, 2008), de 1 000 à 10 000 kg de cétone de Michler ont été utilisés au Canada en 2006.
La plus grande part de la cétone de Michler utilisée au Canada peut se retrouver sous forme résiduelle dans la matière colorante pour papier (c.-à-d. colorant, pigment, teinture, encre) à une concentration de 0,009 à 4,5% en poids (principalement = 1%). La cétone de Michler est présente sous forme résiduelle dans des colorants et des pigments à la suite d’une réaction intermédiaire au cours de la fabrication. Elle peut être présente dans des industries impliquées dans la fabrication de papier ou la conversion de papier fabriqué en différentes formes, comme des usines de papier ou de papier journal (Environnement Canada, 2008). Parmi les colorants pour papier pouvant contenir des résidus de cétone de Michler figurent le violet cristallisé, le Basazol Violet, le Basic Brown C2, le Basic Purple 48 et le Methyl Violet DAW (Environnement Canada, 2008). De plus, une recherche documentaire a révélé que la cétone de Michler se trouve dans des colorants et des pigments dérivés de l’auramine (NTP, 2005). Les colorants à l’auramine sont utilisés pour teindre le papier, les textiles et le cuir, pour colorer les pâtes et les encres pour stylos à bille et comme fongicide antiseptique (National Cancer Institute, 1979; Gessner et Mayer, 2000; Thetford, 2000; NTP, 2005; Merck, 2006; Cheminfo, 2008; HSDB, 2009).
La présence de cétone de Michler dans les encres pour stylos a été confirmée au Canada par la Direction de la Sécutité de produits de consommation de Santé Canada. A ce jour, la cétone de Michler n’a été relevé dans aucun marché d’enfants; d’autres analyses sont en cours (2010 Direction de la Sécutité de produits de consommation de Santé Canada, au Bureau des substances existantes, Santé Canada référence non citée). La présence de cétone de Michler dans des textiles n'a pas été confirmée au Canada.
La cétone de Michler est utilisée au Canada à un pourcentage maximum de 0,2 % en poids pour faire du violet de gentiane (Harleco), un colorant biologique certifié (FS, 2004a; id., 2006a; Environnement Canada, 2008). Elle est également utilisée dans l’industrie de la fabrication de matériel électronique comme produit chimique de traitement pour la fabrication de circuits imprimés à une concentration de 0,24 % (Chiang et Kuo, 2002; Environnement Canada, 2008) et comme composant dans des produits pour films secs (à des concentrations inférieures à 1 % en poids).
Au Canada, la cétone de Michler ne figure ni dans la Base de données sur les produits pharmaceutiques, ni dans la Base de données sur les ingrédients de produits de santé naturels ni dans la Base de données des produits de santé naturels homologués. Aucune utilisation de la cétone de Michler dans les produits thérapeutiques n’a été signalée dans les renseignements reçus aux termes de l’article 71 de la LCPE (1999). On ne s’attend donc pas à ce que cette substance soit présente dans des produits pharmaceutiques ou de santé naturels fabriqués au Canada. Toutefois, la cétone de Michler peut se retrouver en quantités infimes dans des produits pharmaceutiques importés au Canada, car il est connu qu’à l'extérieur du Canada, elle peut être utilisée comme produit chimique intermédiaire dans la fabrication de produits pharmaceutiques (Techrainbow, 2009; communication personnelle de la Direction des produits thérapeutiques de Santé Canada adressée au Bureau des substances existantes de Santé Canada, 2009, source non citée dans les références).
Au Canada, la cétone de Michler est très rarement déclarée dans les encres utilisées pour les emballages alimentaires (communication personnelle de la Direction des aliments de Santé Canada adressée au Bureau des substances existantes de Santé Canada, 2009; source non citée dans les références). La cétone de Michler peut se trouver en quantités infimes sous forme résiduelle dans certains concentrés de couleur pour carton, bien qu’il n'y ait aucune migration vers les aliments puisque cette application n’est destinée qu’aux aliments secs. À l'extérieur du Canada, on a signalé que la cétone de Michler était utilisée dans des encres d’impression à séchage ultraviolet pour cartons où elle agit comme catalyseur servant à durcir l’encre lorsqu’elle est exposée à la lumière UV pendant le processus d’impression (Castle et al., 1997; Salafranca et Franz, 2000). Comme l’encre d’impression est généralement appliquée à l’extérieur des matériaux d’emballage alimentaire, elle n’entre donc pas en contact direct avec les aliments. Aujourd’hui, d’autres amines aromatiques (par exemple la 4,4'-bis-(diéthylamino)-benzophénone [DEAB] et la 2-amino-4-méthylbenzophénone [AMB]) ont remplacé la cétone de Michler dont l’utilisation n’est plus recommandée par l’industrie de l’imprimerie au Japon et en Europe (Castle et al., 1997; Nagarajan et al., 2000; Salafranca et Franz, 2000).
Un certain nombre d’utilisations supplémentaires de la cétone de Michler a été signalé à l’extérieur du Canada. Elle peut ainsi servir d’absorbeur de lumière (Yasuda et al., 2008) et être utilisée dans la préparation de résines photosensibles (Fan 2004) ainsi que dans la production de polymères (Emmett et al., 1977; Pillai et al., 1982; Shen et al., 1984; Tanaka et al., 1993; Granchak et al., 1995; Huang et al., 1999; Onen, 2001; Fan, 2004) et de produits chimiques (Dikusar, 2003; DTIRP, 2004). Elle peut également être utilisée pour rechercher les polarités des milieux liquides et solides (Spange et al., 2002; Zimmermann et al., 2002; Zimmermann et Spange, 2002a; id., 2002b) et comme contrôle colorimétrique pour les nitrites, les nitrates et les solutions de trinitration I de glycéryle dans de l’eau distillée (Munch et al., 1964; Gessner et Mayer, 2000; Dikusar, 2003).
D’après les renseignements recueillis lors d’une enquête réalisée conformément à l’article 71 de la LCPE (1999), une installation qui produit des matières colorantes a rejeté dans l’air de petites quantités de cétone de Michler, issues du mélange de colorants sur mesure. L’installation n’a pris aucune mesure ni estimé ses émissions pour cette substance, car celles-ci n’ont pas été jugées importantes. La quantité de colorants mélangés à l’installation a été réduite depuis 2006. Quelques autres installations utilisent un système de traitement des eaux usées pour minimiser les rejets et limiter l’exposition du milieu naturel (Environnement Canada, 2008).
La cétone de Michler (et ses sels) peut faire l’objet d’une déclaration à l’Inventaire national des rejets de polluants (INRP, 2008), mais aucun rejet n’y figure. De plus, aucun rejet récent n’a été déclaré dans le Toxics Release Inventory (TRI) des États-Unis (inventaire américain des rejets de substances toxiques), car la cétone de Michler n’est plus suivie; cependant, 182 kg de cette substance ont été émis dans l’air en 1997 (TRI, 1997). Si l’INRP et le TRI répertorient tous deux les rejets dans l’air, l’eau et le sol, des données propres aux milieux n’ont cependant été fournies que pour l’air.
D’après ses propriétés physiques et chimiques (tableau 2), les résultats de la modélisation de la fugacité de niveau III (tableau 3) semblent indiquer que la cétone de Michler réside surtout dans le sol si elle est rejetée dans l’air ou dans le sol, et reste principalement dans l’eau si elle y est rejetée.
Tableau 3. Résultats de la modélisation de la fugacité de niveau III (EQC, 2003) pour la cétone de Michler
| Substance rejetée dans : | Pourcentage de la substance se répartissant dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 0,01 | 2,00 | 97,60 | 0,44 |
| l’eau (100 %) | 0,0 | 82 | 0,0 | 18 |
| le sol (100 %) | 0,0 | 0,2 | 99,70 | 0,05 |
Persistance dans l'environnement
Aucune donnée expérimentale sur la dégradation de la cétone de Michler n’a été recensée. Étant donné l’importance écologique du milieu aquatique et puisque la plupart des modèles disponibles s’appliquent à l'eau et que la cétone de Michler devrait être libérée dans ce milieu, la persistance dans l'eau a été examinée essentiellement à l’aide de modèles prévisionnels RQSA sur la biodégradation.
Le tableau 4 résume les résultats des modèles RQSA disponibles sur la dégradation dans divers milieux naturels.
Tableau 4. Données modélisées sur la dégradation de la cétone de Michler
| Processus du devenir | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade & Industry (ministère du Commerce international et de l’Industrie), Japon; t½, demi-vie. 1 Le modèle ne précise pas d'estimation pour ce type de structure. 2 Le résultat s’exprime par une valeur numérique. 3 Le résultat s’exprime par un taux de probabilité. |
|||
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2008 | t½ = 0,052 jour | = 2 |
| Réaction à l'ozone | AOPWIN, 2008 | s.o1 | s.o. |
| Eau | |||
| Hydrolyse | HYDROWIN, 2008 | s.o. | s.o. |
| Biodégradation (aérobie) | BIOWIN, 2009 Sous-modèle 3 : enquête d’expert (biodégradation ultime) |
2,12 « se biodégrade lentement » |
= 1823 |
| Biodégradation (aérobie) | BIOWIN, 2009 Sous-modèle 4 : enquête d’expert (biodégradation primaire) |
2,92 « peut se biodégrader rapidement » |
= 182 |
| Biodégradation (aérobie) | BIOWIN, 2009 Sous-modèle 5 : MITI, probabilité linéaire |
-0,13 « se biodégrade très lentement » |
= 182 |
| Biodégradation (aérobie) | BIOWIN, 2009 Sous-modèle 6 : MITI, probabilité non linéaire |
0,0073 « se biodégrade très lentement » |
= 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 Probabilité |
0,03 « se biodégrade très lentement » |
= 182 |
| Biodégradation (aérobie) | CATABOL, c2004-2008 % DBO |
% DBO = 0,10 « se biodégrade très lentement » |
= 182 |
Dans l’air, la valeur prévue de 0,052 jour pour la demi-vie liée à l’oxydation atmosphérique (tableau 4) démontre que cette substance est susceptible de s’oxyder rapidement. La substance ne devrait pas réagir avec d’autres espèces, comme l’ozone, par photooxydation dans l’atmosphère et elle n’est pas susceptible de se dégrader par photolyse directe. En conséquence, des réactions avec des radicaux hydroxyles devraient donc constituer le plus important processus du devenir pour la cétone de Michler dans l’atmosphère. Avec une demi-vie de 0,052 jour sous l’effet des réactions avec ces radicaux, la cétone de Michler est considérée comme non persistante dans l’air.
Dans l’eau, on ne pouvait estimer une valeur prévue de demi-vie par hydrolyse pour la structure de la cétone de Michler. Cependant, d’autres processus du devenir dans l’eau devaient être pris en compte pour déterminer son degré global de persistance dans ce milieu.
Les résultats du modèle de biodégradation ultime semblent indiquer que la cétone de Michler ne se dégrade pas rapidement. Les quatre modèles de biodégradation immédiate (sous-modèles BIOWIN 3, 5 et 6, TOPKAT et CATABOL) prédisent que la biodégradation ultime serait très lente et que la demi-vie dans l’eau devrait être bien supérieure à 182 jours. Comme les prévisions de CATABOL et TOPKAT se situent dans tous les domaines d’applicabilité des deux modèles, elles sont donc considérées comme les plus fiables. Selon la prévision de biodégradabilité immédiate de BIOWIN, la cétone de Michler n’est pas facilement biodégradable. Le modèle d’enquête de biodégradation primaire de BIOWIN prédit que la dégradation primaire pourrait se produire assez rapidement en comparaison de la minéralisation complète; toutefois, l’identité des produits de dégradation primaire est inconnue. La substance possède des caractéristiques structurelles associées à des produits chimiques qui ne sont pas facilement biodégradés (p. ex.,les cétones). Par conséquent, à la lumière de tous les résultats des modèles (particulièrement ceux sur la dégradation ultime) et des caractéristiques structurelles, il existe suffisamment de preuves laissant entendre que la demi-vie de biodégradation de la cétone de Michler est supérieure ou égale à 182 jours dans l’eau.
En utilisant un rapport d’extrapolation de 1 : 1 : 4 pour la demi-vie associée à la biodégradation dans l’eau, le sol et les sédiments (Bœthling et al., 1995), on obtient également une demi-vie de biodégradation ultime d’au moins 182 jours dans le sol et une demi-vie d’au moins 365 jours dans les sédiments. La cétone de Michler devrait donc être persistante dans le sol et les sédiments.
En conclusion, d’après les données modélisées (voir le tableau 4), la cétone de Michler répond aux critères de la persistance dans l’eau et le sol (demi-vie = 182 jours) et dans les sédiments (demi-vie = 365 jours), mais elle ne répond pas au critère de la persistance dans l’air (demi-vie ³ 2 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Les valeurs faibles à modérées (tant expérimentales que modélisées) du log Koe pour la cétone de Michler (voir le tableau 2 plus haut) laissent entendre que cette substance possède un potentiel de bioaccumulation relativement faible.
Le tableau 5a présente les valeurs empiriques du facteur de bioconcentration (FBC) chez les poissons.
Tableau 5a. Données empiriques sur la bioaccumulation de la cétone de Michler
| Organisme d'essai | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|
| Poisson (Cyprinus carpio) | FBC | 25-54 | MITI, 2002 |
Même si les données expérimentales sur le FBC de la cétone de Michler étaient disponibles, on a également effectué des prévisions en utilisant les modèles sur le FBC et le facteur de bioaccumulation (FBA) disponibles, comme il est indiqué dans le tableau 5b.
Tableau 5b. FBA et FBC de la cétone de Michler chez les poissons, prévus à l’aide du modèle cinétique d’Arnot et de Gobas (2003) sans métabolisme
| Organisme d'essai | Log Koe | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|---|
| 1 Le modèle cinétique d’Arnot et de Gobas (2003) a été appliqué sans métabolisme. | ||||
| Poissons | 3,87 | FBA | 83,431 | Arnot et Gobas, 2003 (modèle modifié de Gobas sur le FBA, niveau trophique intermédiaire) |
| Poissons | 3,87 | FBC | 83,361 | Arnot et Gobas, 2003 (modèle modifié de Gobas sur le FBC, niveau trophique intermédiaire) |
| Poissons | 3,5 | FBC | 25,12 | OASIS Forecast, 2005 |
| Poissons | 3,87 | FBC | 43,18 | BCFBAF, 2009 |
Selon le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si son FBC ou son FBA est supérieur ou égal à 5 000. Toutefois, le FBC est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances. En effet, le FBC ne prend pas correctement en compte le potentiel de bioaccumulation des substances par l’alimentation, lequel est généralement un facteur important pour les substances dont le log Koe est supérieur à environ 4,0 (Arnot et Gobas, 2003). La modélisation cinétique du bilan massique est en principe considérée comme la méthode de prévision la plus fiable pour prévoir le potentiel de bioaccumulation, car elle permet une correction du métabolisme dans la mesure où le log Koe de la substance est similaire à celui du modèle. Toutefois, si le log Koe est inférieur à 4,0, comme c’est le cas pour la cétone de Michler, l’assimilation dans les poissons se fait principalement par les branchies; par conséquent, le métabolisme par l’intestin n’est pas important.
Le modèle modifié de Gobas sur le FBA pour le niveau trophique intermédiaire a prévu un facteur de bioaccumulation de 83,43 L/kg chez les poissons, ce qui indique que la cétone de Michler ne présente aucun potentiel de bioaccumulation chez les poissons ni de bioamplification dans les chaînes alimentaires. Les résultats des calculs du modèle sur les facteurs de bioconcentration fournissent une preuve supplémentaire qui appuie le faible potentiel de bioconcentration de cette substance.
Ainsi, d’après les valeurs empiriques disponibles et les valeurs cinétiques modélisées, la cétone de Michler ne satisfait pas aux critères de la bioaccumulation (FBA ou FBC = 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La démarche suivie dans cette évaluation a consisté à examiner les diverses données scientifiques disponibles et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprenaient les résultats d’un calcul prudent du quotient de risque ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité, les sources et le devenir de la substance dans l’environnement.
Comme il est décrit plus haut, la cétone de Michler a une courte demi-vie dans l’air, mais est persistante dans l’eau, le sol et les sédiments; elle devrait également présenter un faible potentiel de bioaccumulation. Les données expérimentales concernant les effets sur l’environnement sont résumées dans le tableau 6a.
Tableau 6a. Données empiriques sur la toxicité de la cétone de Michler pour les organismes aquatiques
| Organisme d'essai | Type de test | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50, concentration d’une substance qu’on estime causer certains effets toxiques sublétaux chez 50 % des organismes d’essai. | ||||
| Daphnia magna | Toxicité aiguë | CE50 | > 100 | Étude présentée, 2005 |
Au cours d’une étude sur la toxicité aiguë de la cétone de Michler en milieu aquatique fondée sur la ligne directrice no 202 de l’Organisation de coopération et de développement économiques (OCDE) pour les essais de produits chimiques, on obtenu une CE50 supérieure à 100 mg/L chez Daphnia magna (Étude présentée, 2005) (tableau 6a). Cette valeur laisse supposer que la cétone de Michler possède une toxicité aiguë faible et ne devrait pas avoir d’effets nocifs sur les organismes aquatiques à des concentrations relativement faibles.
Une plage de valeurs de toxicité pour les organismes aquatiques a été obtenue à l'aide des modèles RQSA (tableau 6b). Les prévisions des modèles indiquaient généralement une toxicité supérieure au résultat mesuré. En effet, la plupart des valeurs de toxicité modélisées sont en deçà d’un facteur de 10 de la solubilité modélisée de la substance (1,4 mg/L). Les résultats des modèles sont jugés acceptables comme ils se situent dans leur domaine d’applicabilité. Dans l’ensemble, ces résultats permettent de croire que la cétone de Michler pourrait présenter une toxicité aigüe modérée à élevée pour les organismes aquatiques.
Tableau 6b. Données modélisées sur la toxicité de la cétone de Michler pour les organismes aquatiques
| Organisme d'essai | Log Koe | Type d’essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|---|
| Abréviations : CE50, concentration d’une substance qu’on estime causer certains effets toxiques sublétaux chez 50 % des organismes d’essai; CL50, concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai. 1 Valeur critique de toxicité. |
|||||
| Poissons | 3,5 | Toxicité aiguë (96 h) | CL50 | 0,89 | TOPKAT, 2004 |
| 3,87 | 9,85 | ECOSAR, 2009 (composés organiques neutres) | |||
| s.o. | 4,42 | ASTER, 1999 | |||
| 3,5 | 142 | AIES, 2003-2005 | |||
| Daphnies | 3,5 | Toxicité aiguë (48 h) | CE50 | 3,8 | TOPKAT, 2004 |
| Daphnies | 3,5 | Toxicité aiguë (48 h) | CE50 | 7,32 | AIES, 2003-2005 |
| Daphnies | 3,87 | Toxicité aiguë (48 h) | CE50 | 6,94 | ECOSAR, 2009 (composés organiques neutres) |
| Mysis effilée | 3,87 | Toxicité aiguë (96 h) | CL50 | 3,36 | ECOSAR, 2009 (composés organiques neutres) |
On n’a trouvé aucune étude concernant les effets de cette substance sur l’environnement dans d’autres milieux que l'eau.
On utilise la cétone de Michler principalement à des fins industrielles (voir la section « Utilisations »ci-dessus); en conséquence, il peut y avoir des rejets industriels dans l’eau. En l’absence de données de surveillance environnementale, un scénario générique a été utilisé pour estimer une concentration raisonnable de cétone de Michler dans la pire éventualité par suite d’un rejet industriel, à l’aide de l’outil d’exposition générique industriel – milieu aquatique (Industrial Generic Exposure Tool – Aquatic, ou IGETA) d’Environnement Canada. La concentration environnementale estimée (CEE) a été calculée d’après la quantité maximale utilisée dans une installation, la fraction rejetée vers une usine de traitement des eaux usées, le taux d’élimination de l’usine et le débit de ses effluents ainsi que la capacité de dilution du cours d’eau récepteur (dont la superficie est supposée petite). Les principales données d’entrée étaient la fraction de la substance rejetée vers l’usine de traitement des eaux usées (0,3 % d’après Great Western Containers, 2005), résultant du nettoyage de conteneurs semi-vrac ou de bacs de manutention apparemment utilisés pour le transport de la substance, et la proportion éliminée par cette usine (43,7% d’après Environnement Canada, 2009). Une CEE de 0,0035 mg/L a été calculée. Les détails concernant les données utilisées pour estimer cette concentration et le résultat du modèle sont décrits dans le rapport IGETA d’Environnement Canada (2009).
Comme la valeur empirique de toxicité est relativement élevée (> 100 mg/L d’après l’Étude présentée, 2005) et ne constitue qu’une limite inférieure, la valeur RQSA prudente de 0,89 mg/L, qui représente la concentration létale médiane (CL50) sur 96 heures chez les poissons (TOPKAT, 2004), a été sélectionnée comme valeur critique de toxicité (VCT) pour estimer la toxicité de la cétone de Michler chez les organismes aquatiques sensibles.
Une concentration estimée sans effet (CESE) prudente a ensuite été calculée à l'aide de la VCT de 0,89 mg/L. Cette dernière valeur a été divisée par un facteur d’évaluation de 100 pour tenir compte des incertitudes liées à la variabilité interspécifique et intraspécifique de sensibilité et de l’extrapolation d’une valeur sans effet mesurée sur le terrain à partir d'une CL50 mesurée en laboratoire. Ce calcul a permis d’obtenir une CESE de 0,0089 mg/L.
Le quotient minimal de risque (CEE/CESE) qui en découle est de 0,39, ce qui indique que les expositions ne sont pas susceptibles d’avoir un effet nocif sur les organismes aquatiques. Comme il est indiqué dans la section Devenir dans l’environnement, la substance sera rejetée principalement dans l’eau et y demeurera. L’exposition d’organismes à d'autres endroits ou dans des milieux autres que l’eau est moins probable.
Comme on l’a indiqué précédemment, la cétone de Michler répond aux critères de la persistance dans l’eau, le sol et les sédiments, mais elle ne répond pas au critère de la persistance dans l’air, tel qu’il est stipulé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000). Par ailleurs, la substance ne répond pas aux critères de la bioaccumulation énoncés dans le Règlement. Les valeurs modélisées de toxicité disponibles indiquent que la cétone de Michler a un potentiel moyen à élevé de posséder une toxicité aiguë pour les organismes aquatiques. Toutefois, d’après les estimations raisonnables d’une exposition selon le scénario de la pire éventualité et d’après les concentrations sans effet, on considère qu’il est peu probable que la cétone de Michler soit présente dans les milieux naturels au Canada à des concentrations suffisantes pour avoir un effet nocif sur l’environnement. Par conséquent, d’après les renseignements disponibles, il est conclu que la cétone de Michler ne représente pas de risque pour l’environnement au Canada.
Incertitudes dans l’évaluation des risques pour l’environnement
Une incertitude est liée à l’absence de données sur les concentrations dans les milieux naturels au Canada. On a tenu compte de cette incertitude en prédisant une concentration raisonnable dans l’eau en fonction de la pire éventualité, à l’aide d’un modèle d’exposition générique industriel. Il existe également une incertitude associée à la CESE ayant servi au calcul du quotient de risque, en raison de la quantité limitée de données empiriques disponibles sur la toxicité et de la nécessité d’avoir recours à des données RQSA. Or, le facteur d’évaluation de 100 utilisé pendant le calcul de la CESE en milieu aquatique a permis en partie de tenir compte de ces incertitudes.
Il existe également des incertitudes liées à l’utilisation de modèles RQSA pour estimer la persistance et la bioaccumulation. Toutefois, comme les propriétés de la substance font partie des domaines d’applicabilité des modèles RQSA et que les divers modèles utilisés ont donné des résultats semblables, les conclusions concernant le potentiel de persistance et de bioaccumulation de la cétone de Michler sont jugées crédibles.
Évaluation de l’exposition
À la lumière des propriétés chimiques et physiques de la substance, les principales voies d’exposition à la cétone de Michler sont probablement l’exposition orale et cutanée. Une faible pression de vapeur et une faible constante de la loi de Henry indiquent que la cétone de Michler n'est pas volatile. Il est donc peu probable que la voie d’exposition par inhalation soit aussi pertinente que les voies d'exposition orale et cutanée.
Milieux naturels et alimentation
Comme on n’a repéré aucune étude de surveillance dans le cadre de laquelle on aurait mesuré les concentrations de cétone de Michler dans l’air, l’eau, le sol ou les sédiments, au Canada ou ailleurs, on a utilisé ChemCAN, un modèle d’exposition de l’environnement propre au Canada, pour prévoir les concentrations dans les milieux naturels en fonction de la quantité de la substance utilisée au Canada (ChemCAN, 2003). Le modèle prévoyait de très faibles concentrations en cétone de Michler dans ces milieux (ChemCAN, 2003). Dans ChemCAN, on a entré le volume total de cétone de Michler utilisée au Canada (de 1 000 à 10 000 kg) pour estimer les rejets au pays. Les paramètres par défaut ont servi à la modélisation. On a déterminé les estimations de la limite supérieure d’absorption de cétone de Michler pour divers groupes d’âge dans la population générale du Canada, d’après les concentrations maximales dans les milieux naturels pertinents (air, eau potable, sol) obtenues à partir de ChemCAN. L’estimation de la limite supérieure d’absorption quotidienne pour tous les groupes d’âge de la population canadienne générale était inférieure à 0,01 µg/kg de poids corporel par jour (p.c./j).
Au Canada, la cétone de Michler se trouve en quantités infimes sous forme résiduelle dans certains concentrés de matière colorante pour carton. Toutefois, comme ces applications ne sont destinées qu’aux aliments secs, il ne devrait y avoir aucune migration vers les aliments. Certains chercheurs ont étudié la possibilité que la cétone de Michler soit également présente sous forme résiduelle dans certains matériaux d’emballage alimentaire en fibres recyclées (Castle et al., 1997; Ozaki et al., 2004; id., 2006). Dans l’étude de 1997, les trois échantillons d’aliments, dans lesquels on a mesuré les concentrations les plus fortes en cétone de Michler, ont été analysés par couplage entre la chromatographie en phase gazeuse et la spectrométrie de masse après extraction et épuration. Il n’y a eu aucune migration mesurable de la cétone de Michler à une limite de détection de 2 µg/kg d’aliment (Castle et al., 1997). Dans une étude plus récente (Ozaki et al., 2004), de très faibles niveaux (1,7 à 12 µg/g) de cétone de Michler ont été trouvés dans des produits de papier recyclé, mais pas dans des produits de papier vierge. Dans une étude de suivi, Ozaki et al. (2006) ont effectué des études de migration en utilisant des solvants simulant les aliments. Lorsqu’on a utilisé de l’alcool à 95 %, une migration a alors été observée à partir de carton contenant des fibres recyclées, bien qu’à des concentrations extrêmement faibles (< 10 ng/mL) (Ozaki et al., 2006). Toutefois, puisque les produits de carton recyclé destinés à l’emballage d’aliments ont un revêtement de protection ou sont utilisés pour des aliments préemballés (c.-à-d. qu’une barrière fonctionnelle serait présente), il n’y aurait aucun contact direct avec les aliments. Par conséquent, il n’y aurait aucune exposition à la cétone de Michler à partir des aliments.
La base de données sur l’exposition à partir des milieux naturels est considérée comme peu fiable. La majorité des renseignements disponibles ne sont pas propres au Canada. On considère ces renseignements comme peu fiables parce que les données des études, les données de surveillance ou les données sur les émissions ou rejets industriels sont insuffisantes pour la modélisation des concentrations dans les milieux pertinents. La quantité de cétone de Michler utilisée dans le commerce a servi à estimer les concentrations dans les milieux pertinents.
Produits de consommation
Bien qu’il existe un certain nombre d’usages industriels de la cétone de Michler, on n’a cerné qu’un nombre limité d’applications pour les produits de consommation, plus particulièrement dans les encres, les colorants, les pigments et les teintures (Environnement Canada, 2008). L’exposition à la cétone de Michler résiduelle dans les matières colorantes des produits de papier est la forme d’exposition la plus probable de la population générale canadienne, suivie de l’exposition dans d’autres produits contenant des pigments.
Des concentrations résiduelles de cétone de Michler peuvent être présentes dans certains colorants et produits finis de consommation (Environnement Canada, 1988; NTP, 2005). En effet, la cétone de Michler peut se trouver sous forme résiduelle dans des encres d’impression ou des adhésifs à des concentrations de 0,1 à 1,6 % (FS, 2000; id., 2003b; id., 2004a; Aurela, 2001; Commission européenne, 2008), dans des rubans d’imprimante à des concentrations allant de moins 0,1 % en poids (FS, 2001a; id., 2004b; id., 2006b) à 7,2 % (ruban d’imprimante violet) (FS, 2007), dans des cartouches de ruban en nylon à moins de 0,30 % en poids (FS, 2004b), dans l’encre de stylos (à < 1 % dans des stylos à bille) (Bâle-Ville, 2003; FS, 2003a) et dans du colorant de triarylméthane (Solvant Blue 4) à 4,5 % (FS, 2001b).
On a envisagé un scénario prudent relatif aux produits de consommation pour estimer l’exposition orale à la cétone de Michler résiduelle dans des matières colorantes pour papier par suite de l’ingestion possible de papier par des enfants (annexe 1). Pour les enfants âgés de 0,5 à 4 ans, l’exposition orale par événement a été estimée à 8 × 104 mg/kg de poids corporel (p.c.). S’il est plus probable que des enfants âgés de 0,5 à 4 ans ingèrent des produits de papier que des bébés de moins de 6 mois ou des populations plus âgées, il pourrait arriver que des bébés ingèrent du papier. L’inhalation et les expositions cutanées possibles à la cétone de Michler à partir de produits de papier n’ont pas été modélisées en raison du manque de modèles disponibles. Cependant, l’exposition par ces voies est probablement très limitée en raison des propriétés physiques et chimiques de la cétone de Michler et de l’imprégnation de la matière colorante dans le papier.
L’Art and Creative Materials Institute (ACMI) de l’Université Duke a présenté des données sur l’utilisation de la cétone de Michler dans l’encre de stylos à bille et de marqueurs permanents (communication personnelle adressée à Santé Canada, 2009; source non citée dans les références). La cétone de Michler n’a été trouvée que dans l’encre de stylos à bille et de marqueurs permanents. En effet, on a découvert de la cétone de Michler dans sept encres pour stylos à bille, utilisées dans quatre traits de stylos, à des concentrations allant de 0,0023 à 0,11 %. La cétone de Michler a également été détectée dans 18 encres pour marqueurs permanents utilisées dans sept traits de marqueurs, à des concentrations allant de 0,00024 à 0,13 %.
Une quantité suffisante de données étaient disponibles pour prédire l’exposition orale et cutanée à partir de stylos à bille. Bien qu’elles soient basées sur des renseignements disponibles sur des profils d’utilisation au Canada, cette voie d’exposition est peu probable au pays (annexe 2) (Hansen et al., 2008). La valeur prudente estimée d’exposition cutanée ou orale à l’encre de stylos était de 4 × 10-3 mg/kg p.c. par événement chez les enfants âgés de 0,5 à 4 ans. Bien que dans le cadre de l’enquête effectuée en application de l’article 71 de la LCPE (1999) aucune information n’ait été reçue confirmant la présence de cétone de Michler dans les stylos vendus au Canada, l’usage de cette substance dans ce type d’encre a été signalé dans la littérature. La présence de cétone de Michler dans les encres pour stylos a été confirmée au Canada par la Direction de la Sécutité de produits de consommation de Santé Canada. A ce jour, la cétone de Michler n’a été relevé dans aucun marché d’enfants; d’autres analyses sont en cours (2010 Direction de la Sécutité de produits de consommation de Santé Canada, au Bureau des substances existantes, Santé Canada référence non citée).
D’après les données sur l’utilisation qui ont été recensées, les estimations obtenues par modélisation à partir de produits de consommation sont peu fiables. Il existe des données sur certains types de produits contenant de la cétone de Michler trouvés au Canada, mais les paramètres chimiques nécessaires pour estimer les expositions aux produits de consommation sont limités. L’exposition de la population générale à la cétone de Michler est restreinte principalement à l’utilisation de produits de papier. Toutefois, il existe une incertitude par rapport à l’ampleur de l’exposition à partir de cette source, car peu de données sont disponibles sur l’exposition à la cétone de Michler sous forme résiduelle dans la matière colorante pour produits de papier au Canada. Il existe également peu de modèles d’exposition disponibles pour ce scénario. Puisque l’exposition réelle est intermittente dans la nature, on considère que les scénarios s’appuient sur des estimations prudentes de la limite supérieure d’exposition.
Évaluation des effets sur la santé
L’annexe 3 comporte un résumé des renseignements disponibles relatifs aux effets de la cétone de Michler sur la santé.
Le National Toxicology Program des États-Unis a classé la cétone de Michler parmi les agents que l’on peut raisonnablement présumer cancérogènes pour les humains, d’après des preuves suffisantes de cancérogénicité chez des animaux de laboratoire (National Cancer Institute, 1979; NTP, 2005). De son côté, la Commission européenne a classé la cétone de Michler parmi les substances cancérogènes de catégorie 2 (substances devant être assimilées à des substances cancérogènes pour l’homme) avec la mention de risque R45 (peut causer le cancer), d’après des tumeurs observées au foie observées chez les rats et les souris (Commission européenne, 2002; id., 2004; ESIS, 2009). De plus, la Commission européenne a classé la cétone de Michler comme substance mutagène de catégorie 3 avec mention de risque R68 (possibilité d’effets irréversibles), d’après une génotoxicité in vivo dans les cellules somatiques (Commission européenne, 2002; id., 2004; ESIS, 2009). Récemment, le Centre International de Recherche sur le Cancer a classé la cétone de Michler comme cancérogène du groupe 2B (peut être cancérogène pour l’homme), d’après l’observation de tumeurs à plusieurs endroits chez les rongeurs (Baan et al., 2008).
Lorsqu’elle était administrée oralement par voie alimentaire, la cétone de Michler a induit une augmentation des cas de tumeurs au foie chez les rats mâles et femelles et chez les souris femelles, et de tumeurs des vaisseaux sanguins des souris mâles. Dans des études de cancérogénicité du National Cancer Institute (1979), les cas de carcinome hépatocellulaire ont augmenté de manière importante proportionnellement à la dose administrée chez les rats Fischer 344 mâles (0/20, 9/50 et 40/50, respectivement pour 0, 12,5 et 25 mg/kg p.c./j; p < 0,05 pour la dose faible) et chez les rats Fischer 344 femelles (0/20, 41/47 et 44/49, respectivement pour 0, 25 et 50 mg/kg p.c./j; p < 0,01 pour la dose faible) après exposition à la cétone de Michler dans l’alimentation pendant 78 semaines, suivies d’une période d’observation de 28 ou 29 semaines. Les cas de lésions néoplasiques combinées (carcinome hépatocellulaire et nodules néoplasiques) ont également augmenté de façon importante aux deux doses et chez les deux sexes (National Cancer Institute, 1979). De plus, au cours d’un test biologique de cancérogénicité sur des souris B6C3F1, les cas de carcinome hépatocellulaire ont augmenté de façon importante proportionnellement à la dose administrée (0/19, 16/49 et 38/50, respectivement pour 0, 179 et 357 mg/kg p.c./j; p < 0,01 pour la dose faible) chez les souris femelles exposées à la cétone de Michler dans l’alimentation pendant 78 semaines, suivies d’une période d’observation de 13 semaines. Chez les souris mâles, aucune augmentation notable des cas de carcinome hépatocellulaire n’a été observée, mais on a noté une augmentation importante des cas d’hémangiosarcome à la dose élevée (0/19, 5/50 et 20/50, respectivement pour 0, 179 et 357 mg/kg p.c./j; p < 0,01 pour la dose élevée) (National Cancer Institute, 1979).
La cétone de Michler s’est avérée être génotoxique dans un certain nombre de tests in vivo sur des animaux de laboratoire et de tests in vitro sur des cellules de mammifères et chez certaines souches de Salmonella (annexe 3). Lors de tests biologiques in vivo, la cétone de Michler a provoqué une augmentation importante des échanges de chromatides sœurs dans la moelle osseuse de souris Swiss ayant reçu la substance en perfusion intrapéritonéale (Parodi et al., 1982). De plus, la cétone de Michler s’est liée à l’acide désoxyribonucléique (ADN) du foie ou du rein des rats après injection intrapéritonéale (Scribner et al., 1980; Struck et al., 1981). Par ailleurs, la cétone de Michler a provoqué des dommages à l’ADN du foie qu’on a évalués au moyen du dosage par élution alcaline chez des rats Sprague-Dawley après administration par injection intrapéritonéale (Parodi et al., 1982) et par gavage (Kitchin et Brown, 1994). Elle a également induit une synthèse non programmée de l’ADN chez des rats gavés à la substance (Mirsalis et al., 1989). Lors de tests biologiques in vitro sur des cellules de mammifères, la cétone de Michler a provoqué une augmentation proportionnelle à la dose de la fréquence des mutations dans les cellules de lymphome L5178Y des souris, en présence ou en l’absence d’activateur S9 dérivé du foie (Mitchell et al., 1988; Myhr et Caspary, 1988). La cétone de Michler a engendré des aberrations chromosomiques dans les cellules d’ovaire de hamster chinois (CHO) (NTP, 1990) et dans les cellules d’embryon de hamster chinois CHE-3N (Lafi et al., 1986). La cétone de Michler a également induit un échange de chromatides sœurs dans des cellules CHO (NTP, 1990) et a provoqué une transformation des cellules Balb/c 3T3 (Tennant et al., 1986). Lors de tests bactériologiques, la cétone de Michler s’est avérée mutagène pour Salmonella typhimurium TA98 en présence d’activateur S9 (Dunkel et al., 1985; Tennant et al., 1986; Zeiger et al., 1992) et pour la souche TA1538, qui détecte les mutations de cadre de lecture (Dunkel et Simmon, 1980). Elle n’était pourtant pas mutagène pour les souches TA97, TA100, TA1535 et TA1537, qui détectent une substitution des paires de base (Scribner et al., 1980; McCarthy et al., 1983; Tennant et al., 1986) ou pour TA98 sans activateur S9 (Zeiger et al., 1992). Tous les éléments de preuve de mutagénicité, de cytogénicité et de dommages à l’ADN appuient la conclusion selon laquelle la cétone de Michler est génotoxique pour les cellules somatiques des mammifères in vitro et in vivo, ce que confirme la classification de la Commission européenne comme substance mutagène de catégorie 3, d’après sa génotoxicité in vivo pour les cellules somatiques (Commission européenne, 2002; id., 2004; ESIS, 2009).
Aucun autre organisme de réglementation n’a proposé ni déterminé les modes d’action détaillés des carcinomes hépatocellulaires et des hémangiosarcomes. De plus, l’élaboration et l’analyse des modes d’action ne s’inscrivent pas normalement dans le champ de l’évaluation préalable des risques. D’après le poids de la preuve de cancérogénicité observée chez les deux sexes des deux espèces au cours d’études sur des animaux de laboratoire menées sur deux ans, comprenant des carcinomes hépatocellulaires observés aux doses expérimentales les plus faibles, et d’après la génotoxicité démontrée de la cétone de Michler dans le cadre d’une gamme de tests in vivo et in vitro, indiquée notamment par la liaison à l’ADN du foie et les dommages à celui-ci, on conclut raisonnablement que les tumeurs observées chez les animaux de laboratoire résultent probablement de l’interaction directe avec le matériel génétique.
En ce qui concerne la toxicité chronique et la toxicité en doses répétées à court terme, l’effet critique autre que le cancer constituant le paramètre plus sensible qui a été signalé pour la caractérisation des risques que présente la cétone de Michler pour la santé humaine est la diminution du gain de poids corporel. Dans une étude sur la toxicité à court terme, une dose minimale avec effet nocif observé (DMENO) de 68 mg/kg p.c./j a été déterminée d’après un gain de poids corporel considérablement réduit (moins de 40 % du poids du témoin) chez des rats F344 exposés à 0, 68, 147, 316, 680 ou 1 467 mg/kg p.c./j de cétone de Michler dans l’alimentation pendant 4 semaines, suivies de 2 semaines d’observation. En outre, les taux de survie ont diminué à des doses supérieures (c.-à-d. deux animaux morts sur cinq à 316 mg/kg p.c./j) (National Cancer Institute, 1979). Dans une étude sur la toxicité chronique, la plus faible DMENO par voie orale était de 12,5 mg/kg p.c./j chez les rats mâles, d’après une diminution du gain de poids corporel (National Cancer Institute, 1979). Toutefois, à cette DMENO, on a également observé d’importantes tumeurs induites. L’ensemble des données ne comportait aucune étude effectuée à des niveaux d’exposition inférieurs à 12,5 mg/kg p.c./j.
Une étude toxicocinétique limitée a montré que la déméthylation, la N-hydroxylation et la Nacétylation semblaient être les principales voies de transformation de la cétone de Michler chez les rats (Struck et al., 1981). Les principaux métabolites identifiés dans la bile (après injection intraveineuse) étaient les dérivés di-déméthylés et tri-déméthylés et le composé N-acétylé tétra-déméthylé. On conclut donc qu’après la déméthylation de la cétone de Michler, les métabolites des amines aromatiques pourraient subir une Nhydroxylation ou une N-acétylation pour former des métabolites actifs pouvant se lier aux macromolécules et entraîner la cancérogénicité de la cétone de Michler (Struck et al., 1981).
La base de données sur la toxicité de la cétone de Michler est considérée comme assez fiable pour la présente évaluation préalable. Des études de dosages oraux (cancérogénicité et génotoxicité à court terme) sont disponibles. Toutefois, on n’a relevé aucune étude sur la toxicité pour la reproduction ou le développement. En outre, on a noté des effets, y compris la cancérogénicité, aux niveaux d’exposition testés les plus faibles. La plupart des études expérimentales sur des animaux de laboratoire examinaient l’exposition orale (dans l’alimentation), et aucune étude expérimentale sur l’exposition d’animaux de laboratoire à la substance par inhalation ou par voie cutanée n’était disponible. Par ailleurs, les modes d’action pour la cancérogénicité observée de la cétone de Michler n’ont pas été précisés.
Caractérisation des risques pour la santé humaine
Suivant principalement les évaluations basées sur le poids de la preuve faites par des organismes internationaux ou d’autres organismes nationaux (Commission européenne, 2002; id., 2004; NTP, 2005; Baan et al., 2008), la cancérogénicité constitue l’un des effets critiques aux fins de la caractérisation des risque de la cétone de Michler pour la santé humaine. Les cas de carcinomes hépatocellulaires chez les rats mâles et femelles et chez les souris femelles ont augmenté proportionnellement à la dose administrée, et on a noté une augmentation des cas d’hémangiosarcome chez les souris mâles. On a observé des niveaux importants de carcinome hépatocellulaire aux doses administrées les plus faibles. La cétone de Michler était génotoxique dans divers essais in vivo et in vitro. Bien que les modes d’action détaillés liés à l’augmentation des cas de carcinome hépatocellulaire et d’hémangiosarcome n’aient pas été déterminés, on estime que les tumeurs observées chez les animaux de laboratoire résultent de l’interaction directe avec le matériel génétique, et ce, d’après le poids de la preuve de cancérogénicité et de génotoxicité de la cétone de Michler.
Parmi les effets critiques autres que le cancer, le paramètre le plus sensible est la réduction du gain de poids corporel des rats mâles notée dans une étude sur la toxicité chronique (National Cancer Institute, 1979), à une DMENO par voie orale de 12,5 mg/kg p.c./j. Toutefois, à cette DMENO, on a également observé des tumeurs; par conséquent, la marge d’exposition n’est pas calculée pour les effets autres que le cancer dans la présente évaluation préalable.
On s’attend à ce que l’exposition de la population générale à la cétone de Michler dans les milieux naturels (air, eau potable et sol) soit négligeable. Ainsi, la limite supérieure d’absorption quotidienne estimée pour tous les groupes d’âge de l’ensemble de la population canadienne était de moins de 0,01 µg/kg p.c./j.
D’après les renseignements obtenus sur l’utilisation actuelle de la cétone de Michler au Canada, l’exposition de la population générale devrait être très faible et limitée à l’utilisation de produits de papier non liés à l’alimentation, contenant de la cétone de Michler sous forme résiduelle dans les matières colorantes pour papier. On s’attend à ce que l’exposition de la population générale à la cétone de Michler à partir d’autres produits de consommation comme des stylos à bille soit moins préoccupante, car la plus grande partie de la cétone de Michler au Canada est utilisée dans les produits de papier. On a élaboré un scénario sur l’exposition orale de consommateurs à partir de produits de papier pour calculer l’ingestion maximale. La limite maximale ingérée par un enfant (âgé de 0,5 à 4 ans) était de 8 × 104 mg/kg p.c. par événement. De même, on a élaboré un scénario sur l’exposition orale et cutanée de consommateurs à partir de stylos à bille pour calculer l’ingestion et l’absorption maximales. Dans ce cas, la limite maximale ingérée ou absorbée par un enfant (âgé de 0,5 à 4 ans) était de 4 × 103 mg/kg p.c. par événement.
Incertitudes dans l’évaluation des risques pour la santé humaine
Cette évaluation préalable ne prend pas en compte les différences possibles entre les humains et les espèces d’animaux de laboratoire en ce qui concerne la sensibilité aux effets de cette substance, notamment en raison du peu de données disponibles concernant les effets sur les humains et de l’absence de modèles pharmacocinétiques basés sur la physiologie pour la cétone de Michler applicables aux animaux de laboratoire ou aux humains. On suppose que les effets observés chez les deux espèces de rongeurs peuvent s’appliquer aux humains. De plus, les modes d’induction des tumeurs n’ont pas été analysés ou élucidés. Il existe peu de données toxicologiques sur les paramètres liés aux effets autres que le cancer, y compris la toxicité pour le développement et la reproduction. L’absence de DMENO pour un paramètre lié à un effet autre que le cancer, laquelle est inférieure aux doses entraînant l’induction de tumeurs, ne permet pas de calculer la marge d’exposition pour les effets autres que le cancer. En outre, les études sur des animaux de laboratoire visent uniquement l’exposition par voie orale et non l’exposition par inhalation ou par voie cutanée
Des incertitudes ont été relevées dans l’estimation de l’exposition de la population, en raison de l’utilisation de modèles et du manque de données canadiennes. Des incertitudes ont également été relevées dans les hypothèses intégrées aux modèles de scénario pour les produits de consommation, y compris les paramètres utilisés, les types exacts de produits contenant de la cétone de Michler, et la quantité et la fréquence de son utilisation au Canada. Les valeurs exprimant l’exposition des enfants de 0,5 à 4 ans à la cétone de Michler par contact oral avec du papier sont considérées comme des surestimations, puisque les hypothèses intégrées sont prudentes et que les produits de papier utilisés dans ce scénario peuvent ne pas correspondre au papier généralement utilisé par les enfants. Des incertitudes sont associées au scénario concernant les stylos à bille, car il a été adapté d’un scénario pour les marqueurs à pointe de feutre. Des incertitudes sont en outre associées à l’utilisation de stylos à bille et de marqueurs permanents par les enfants, qui devrait être limitée. En effet, peu de renseignements figuraient dans la littérature à propos de l’utilisation de la cétone de Michler dans les marqueurs, et les scénarios disponibles pour les produits de consommation étaient limités. Il subsiste une incertitude à propos de la présence possible de cétone de Michler sous forme résiduelle dans les textiles au Canada. Une entreprise ayant fourni des renseignements en vertu de l’article 71 a confirmé qu’elle n’utilisait pas de matières colorantes pour textile (communication personnelle de l’industrie adressée au Bureau des substances existantes de Santé Canada, 2009; source non citée dans les références). Toutefois, une recherche documentaire a permis d’établir la détection de la cétone de Michler dans des textiles à l’étranger. Les lacunes associées aux données sur l’exposition par voie orale sont probablement plus critiques que celles associées aux données sur l’exposition par voie cutanée et par inhalation, car il s’agit de la principale voie d’exposition. Les rejets dans l’environnement dans des milieux autres que l’air sont une autre source d’incertitude. De plus, il est possible qu’une augmentation de l’exposition à la cétone de Michler soit due à l’utilisation de violet cristallisé avec dégradation du colorant. Toutefois, la quantité totale de cétone de Michler importée et utilisée au Canada tend à indiquer que l’exposition devrait être faible
D’après les renseignements contenus dans la présente évaluation préalable, la cétone de Michler ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie. De plus, la cétone de Michler répond aux critères de la persistance définis dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000), mais non à ceux du potentiel de bioaccumulation précisés dans le Règlement.
Compte tenu de la cancérogénicité de la cétone de Michler, qui pourrait entraîner des effets nocifs à tout niveau d’exposition, et des signes de tumeurs observés aux plus petites doses administrées, il est conclu que la cétone de Michler est une substance pouvant pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est conclu que la cétone de Michler répond à au moins un des critères prévus à l’article 64 de la LCPE (1999).
De plus, s'il y a lieu, des activités de recherche et de surveillance viendront appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable. Le cas échéant, l’efficacité des mesures de contrôle possibles déterminées à l’étape de la gestion des risques.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. Accès : http://www.acdlabs.com/products/phys_chem_lab/pka
[AIES] Artificial Intelligence Expert System. 2003-2005. Version 1.25. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Disponible auprès de la Division des substances nouvelles et de la Division des substances existantes, Environnement Canada
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]. 2008. Version 1.92a. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Arnot, J.A., Gobas, F.A. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. [en ligne] 22(3):337-345. Accès : http://www3.interscience.wiley.com/journal/104557877/home [réserve de consultation]
[ASTER] Assessment Tools for the Evaluation of Risk [en ligne]. 1999. Duluth (MN) : U.S. Environmental Protection Agency, Mid-Continent Ecology Division. [consulté le 24 avril 2009]. Accès : http://www.epa.gov/med/Prods_Pubs/aster.htm[réserve de consultation].
Aurela, B. 2001. Migration of substances from paper and board food packaging materials [thèse]. Helsinki (Finlande) : University of Helsinki, Faculty of Science, KCL. Accès : http://ethesis.helsinki.fi/julkaisut/mat/kemia/vk/aurela/migratio.pdf
Baan, R., Straif, K., Grosse, Y., Secretan, B., El Ghissassi, F., Bouvard, V., Benbrahim-Tallaa, L., Cogliano, V. 2008. Carcinogenicity of some aromatic amines, organic dyes, and related exposures. Lancet Oncol. 9(4):322-323.
Bâle-Ville. 2003. Ballpoint ink / tetramethyldiaminobenzophenone (Michler’s ketone). State Laboratory of the Canton Basel City. Accès : http://www.kantonslabor-bs.ch/files/berichte/Report62.pdf
[BCFBAF] BioConcentration Factor Program for Windows [modèle d’estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2009. Version 4.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Canada. 1988. Liste de divulgation des ingrédients [en ligne]. DORS/88-64. [consultée le 9 septembre 2008]. Accès : http://laws.justice.gc.ca/fr/showdoc/cr/DORS-88-64/sc:1/20090911/fr?page=1
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C. 1999, ch. 33. Accès : http://canadagazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, le 23 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l’Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://canadagazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l’Environnement, ministère de la Santé. 2008. Loi canadienne sur la protection de l’environnement (1999) : Avis de septième divulgation d’information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 142, no 35, p. 2501-2517. Accès : http://www.gazette.gc.ca/rp-pr/p1/2008/2008-08-30/pdf/g1-14235.pdf
Castle, L., Damant, A.P., Honeybone, C.A., Johns, S.M., Jickells, S.M., Sharman, M., Gilbert, J. 1997. Migration studies from paper and board food packaging materials. Part 2. Food Addit. Contam. 14(1):45-52.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
ChemCAN [Level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/CC600.html
Cheminfo [base de données en ligne]. 2008. Michler’s Ketone. Hamilton (Ont.) : Centre canadien d’hygiène et de sécurité au travail. [consultée le 13 janvier 2009]. Accès : http://ccinfoweb.ccohs.ca/cheminfo/search.html [réserve de consultation]
Chen, C.H., Chang, C.F., Ho, C.H., Tsai, T.L., Liu, S.M. 2008. Biodegradation of crystal violet by a Shewanella sp. NTOU1. Chemosphere 72(11):1712-1720.
Chiang, W.Y., Kuo, H.T. 2002. Preparation of trimethylsilyl group containing copolymer for negative-type photoresists that enable stripped by an alkaline solution [sic]. Eur. Polym. J. 38(9):1761-1768.
Commission européenne. 2002. Summary Record: Commission Working Group on the Classification and Labelling of Dangerous Substances. ECB Ispra, 30 May–1 June 2001. Commission européenne, Direction générale du Centre commun de recherche, Institut pour la santé et la protection des consommateurs, Bureau européen des substances chimiques, ECBI/42/01 – Rev. 4. Accès : http://ecb.jrc.it/classlab/SummaryRecord/4201r4_sr_CMR0501.doc
Commission européenne. 2004. 4,4'bis(diméthylamino)benzophénone. Directive de la Commission 2004/73/CE du 29 avril 2004. Annexe 1B. Journal officiel de l’Union européenne. 16.6.2004. L 216/116. Commission européenne. 29e APT [adaptation au progrès technique]. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2004:216:0003:0310:fr:PDF
Commission européenne. 2008. Règlement (CE) no 1272/2008 du Parlement européen et du Conseil du 16 décembre 2008 relatif à la classification, à l’étiquetage et à l’emballage des substances et des mélanges, modifiant et abrogeant les directives 67/548/CEE et 1999/45/CE et modifiant le règlement (CE) no 1907/2006. Journal officiel de l’Union européenne. 31.12.2008. L 121/1. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2008:353:0001:1355:fr:PDF
Dehn, W.M. 1917. Comparative solubilities in water, in pyridine and in aqueous pyridine. J. Am. Chem. Soc. 39:1399-1404.
Dikusar, E.A. 2003. Tertiary acetylenic alcohols and peroxides derived from 4,4'bis(dimethylamino) benzophenone. J. Gen. Chem. 73(9):1406-1409.
[DTIRP] Defense Treaty Inspection Readiness Program. 2004. Guide to scheduled chemicals [en ligne]. [consulté en février 2009]. Accès : http://dtirp.dtra.mil/products/CWC/129p.htm
Dunkel, V.C., Simmon, V.F. 1980. Mutagenic activity of chemicals previously tested for carcinogenicity in the National Cancer Institute bioassay program. IARC Sci. Publ. 27:283-302.
Dunkel, V.C., Zeiger, E., Brusick, D., McCoy, E., McGregor, D., Mortelmans, K., Rosenkranz, H.S., Simmon, V.F. 1985. Reproducibility of microbial mutagenicity assays, II. Testing of carcinogens and noncarcinogens in Salmonella typhimurium and Escherichia coli. Environ. Mutagen. 7(Suppl. 5):1-248.
[ECOSAR] Ecological Structure Activity Relationships [en ligne]. 2009. Version 1.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Emmett, E.A., Taphorn, B.R., Kominsky, J.R. 1977. Phototoxicity occurring during the manufacture of ultraviolet-cured ink. Arch Dermatol 113(6):770-775.
Environnement Canada. 1988. Données relatives à la Liste intérieure des substances (LIS) de 1984-1986, recueillies en vertu du paragraphe 25(1) de la LCPE (1988) et conformément à la Liste intérieure des substances : guide du déclarant, 1988. Données produites par Environnement Canada.
Environnement Canada. 2008. Données sur les substances du lot 7 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances identifiées dans le septième lot du Défi. Données produites par la Division des substances existantes, Environnement Canada.
Environnement Canada. 2009. IGETA report: CAS RN 90-94-8, 2009-06-22. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
[EPISuite] Estimation Programs Interface for Microsoft Windows [suite de modèles d’estimation]. 2008. Version 4.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
[ESIS] European Chemical Substances Information System [base de données en ligne]. 2009. No CAS 90-94-8, 4,4'-bis(diméthylamino)benzophénone. Développée par le Bureau Européen des Substances Chimiques. [consultée en mars 2009]. Accès : http://ecb.jrc.it/esis/
Étude présentée. 2005. Robust study summary of confidential categorization voluntary data submission. Based on data collected in 1988. Gatineau (Qc) : Environnement Canada, Division des substances existantes. No d’identification de l’étude : 51CVDS. Disponible sur demande.
Fan, M. 2004. Synthesis and characterization of novel negative-working aqueous base developable photosensitive polyimide precursors. Polymer 45(4):1101-1109.
[FS] Fiche signalétique : ERC-33 (Purple) [en ligne]. 2000. Nagano-Ken (Japon) : Seiko Epson Corporation, SD Design & Engineering Support Group. Accès : http://pos.epson.com/pos/pdf/ERC33P.pdf
[FS] Fiche signalétique : Lexmark 4227 Series Printer Ribbon [en ligne]. 2001a. Lexington (KY) : Lexmark International, Inc. Accès : http://www.officeworld.com/msds/LEX13L0034.pdf
[FS] Fiche signalétique : Solvent Blue 4 [en ligne]. 2001b. Suzhou (Chine) : Suzhou Lintong Dyestuff Chemical Co., Ltd. Accès : http://www.lintong.com/msds/msds-9.htm
[FS] Fiche signalétique : Ball pen ink [en ligne]. 2003a. Consumer Information Sheet #1388. Lincoln (RI) : A.T. Cross Company. Accès : http://www.oppictures.com/MSDS/BB1388.pdf
[FS] Fiche signalétique : 7005 Ink, 7005C Ink, Ink-Type 507C [en ligne]. 2003b. London (Ont.) : Sterling Marking Products Inc. Accès : http://www.sterling.ca/7005C_Ink.pdf
[FS] Fiche signalétique : Harleco Crystal Violet [en ligne]. 2004a. Gibbstown (NJ) : EMD Chemicals Inc. Accès : http://www.vwrsp.com/msds/10/EM-/EM-192-29.pdf
[FS] Fiche signalétique : IP636: Endless Ribbon Cassette [en ligne]. 2004b. Cinnaminson (NJ) : The Turbon Group. Accès : http://www.imagestar.com/msds/65480.pdf
[FS] Fiche signalétique : Crystal Violet [en ligne]. 2006a. Fort Washington (PA) : Electron Microscopy Sciences. Accès : http://www.emsdiasum.com/microscopy/technical/msds/12785.pdf
[FS] Fiche signalétique : NK Panasonic KX-P1124 [en ligne]. 2006b. Rochester (NY) : Nukote International Inc. Accès : http://www.sprproductinformation.com/manu_folders/NUK/bm251ms.pdf
[FS] Fiche signalétique : Purple Ribbon [en ligne]. 2007. Mount Laurel (NJ) : Oki Data Americas, Inc. Accès :
http://my.okidata.com/MSDS_Down.nsf/9586d74f44109124852571
b600520157/5093783f49e0abe28525723d00549cad/$FILE/
58308301.pdf
[GEMS] Graphical Exposure Modeling System. 1987. PCCHEM [méthode d’estimation de la solubilité dans l’eau]. Washington (DC) : U.S. Environmental Protection Agency, Office of Pesticides and Toxic Substances (HSDB/1316).
Gessner, T., Mayer, U. 2000. Triarylmethane and diarylmethane dyes. In: Ullmann’s encyclopedia of industrial chemistry, vol. 37. p. 445-499. Accès : http://mrw.interscience.wiley.com/emrw/9783527306732/ueic/article/
a27_179/current/abstract
Granchak, V.M., Kotsyuba, T.S., Chemerskaya, Z.F., Dlung, I.I. 1995. The role of oxygen in the origin of the synergistic effect of benzophenone and Michler’s ketone in the initiation of radical polymerization. Theor. Exp. Chem. 31(2):91-94.
Great Western Containers. 2005. Standard for return of empty intermediate bulk containers (IBC). Accès : http://www.gwcontainers.com/Portals/0/Return%20Standards.pdf
Hansch, C., Leo, A., Hoekman, D. 1995. Exploring QSAR?Hydrophobic, electronic, and steric constants. Washington (DC) : American Chemical Society.
Hansen, P.L., Tønning, K., Malmgren-Hansen, B. 2008. Survey and health assessment of chemical substances in hobby products for children. Danish Ministry of the Environment, Environmental Protection Agency (Danish EPA). Survey of Chemical Substances in Consumer Products, no 93. Accès : http://www2.mst.dk/common/Udgivramme/Frame.asp?http://www2.mst.dk/udgiv/publications/
2008/978-87-7052-763-7/html/default_eng.htm
Heidelberger, C., Freeman, A.E., Pienta, R.J., Sivak, A., Bertram, J.S., Casto, B.C., Dunkel, V.C., Francis, M.W., Kakunaga, T., Little, J.B., et al. 1983. Cell transformation by chemical agents?a review and analysis of the literature. A report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutat. Res. 114:283-385.
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Version 3.20. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Hine, J., Mookerjee, P.K. 1975. Structural effects on rates and equilibriums. XIX. Intrinsic hydrophobic character of organic compounds. Correlations in terms of structural contributions. J. Org. Chem. 40:292-298.
[HSDB] Hazardous Substances Data Bank [base de données en ligne]. 1983-. Bethesda (MD) : National Library of Medicine (États-Unis). [consultée en avril 2009]. Accès : http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?HSDB
Huang, J., Zaijun, L., Sheng, C. 1999. Preparation and characterization of a novel star ABC triblock copolymer of styrene, ethylene oxide, and methacrylic acid. Macromol. Rapid Commun. 20(7):394-400.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2008. Gatineau (Qc) : Environnement Canada. [consultée en décembre 2008]. Accès : http://www.ec.gc.ca/pdb/querysite/query_e.cfm
Kitchin, K.T., Brown, J.L. 1994. Dose response relationship for rat liver DNA damage caused by 49 rodent carcinogens. Toxicology 88:31-49.
[KOWWIN] Octanol–Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.67a. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006 ]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Lafi, A., Parry, J.M., Parry, E.M. 1986. The effect of Michler’s ketone on cell division chromosome number and structure in culture Chinese hamster cells. Mutagenesis 1(1):17-20.
Lewis, R.J. Sr. 2007. Tetramethyldiaminobenzophenone. In : Hawley’s condensed chemical dictionary. 15e éd. New York (NY) : Wiley-Interscience/John Wiley & Sons. p. 1225-1226.
McCarthy, D.J., Suling, W.J., Hill, D.L. 1983. A comparison of the mutagenicity and macromolecular binding of the carcinogens Michler’s ketone and reduced Michler’s ketone. Mutat. Res. 119(1):7-14.
[Merck] The Merck Index: An encyclopedia of chemicals, drugs, and biologicals. 14e éd. 2006. Whitehouse Station (NJ) : Merck and Co., Inc. p. 1065.
Mirsalis, J.C., Tyson, C.K., Steinmetz, K.L., Loh, E.K., Hamilton, C.M., Bakke, J.P., Spalding, J.W. 1989. Measurement of unscheduled DNA synthesis and S-phase synthesis in rodent hepatocytes following in vivo treatment: testing of 24 compounds. Environ. Mol. Mutagen. 14:155-164.
Mitchell, A.D., Rudd, C.J., Caspary, W.J. 1988. Evaluation of the L5178Y mouse lymphoma cell mutagenesis assay: intralaboratory results for sixty three coded chemicals tested at SRI International. Environ. Mol. Mutagen. 12(Suppl. 13):37-101.
[MITI] Ministry of International Trade & Industry (Japon). 2002. Biodegradation and bioaccumulation: data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Ministry of International Trade & Industry, Basic Industries Bureau, Chemical Products Safety Division, Chemicals Inspection & Testing Institute.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.43. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 22 juin 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Munch, J.C., Franco, M., Friedland, B. 1964. Sensitivity of color tests for nitrites, nitrates, and glyceryl trinitrate. I. Solutions in distilled water. J Pharm Sci 54(7):832-833.
Myhr, B.C., Caspary, W.J. 1988. Evaluation of the L5178Y mouse lymphoma cell mutagenesis system: intralaboratory results for sixty-three coded chemicals tested at Litton Bionetics, Inc. Environ. Mol. Mutagen. 12(Suppl. 13):103-194.
Nagarajan, R., Bowers, J.S., Cui, H., Muller, A.J., Eubanks, J.R.I., Wu, Z., Geiger, C.C. 2000. A novel initiator for curing pigmented coatings. Surface Coatings Int. 83(4):181-184.
National Cancer Institute (États-Unis). 1979. Bioassay of Michler’s ketone for possible carcinogenicity. CAS No. 90-94-8. (Technical Report Series No. 181). Rockville (MD) : U.S. Department of Health, Education, and Welfare, Public Health Service, National Institutes of Health. Accès : http://ntp-apps.niehs.nih.gov/ntp_tox/index.cfm
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Columbus (OH) : American Chemical Society. [consultée le 11 décembre 2006]. Accès : http://www.cas.org/products/cd/nci/index.html
[NTP] National Toxicology Program (États-Unis). 1983. Michler’s ketone. Chromosome aberration study. Study ID 242025. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Accès : http://ntp-apps.niehs.nih.gov/ntp_tox/index.cfm
[NTP] National Toxicology Program (États-Unis). 1990. Michler’s ketone. Chromosome aberration study. Study ID 913588. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Accès : http://ntp-apps.niehs.nih.gov/ntp_tox/index.cfm
[NTP] National Toxicology Program (États-Unis). 2005. Substance profile: Michler’s ketone (4,4'-(dimethylamino)benzophenone). In : Report on carcinogens. 11e éd. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. [consulté le 20 avril 2009]. Accès : http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s113mich.pdf
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [consulté le 27 avril 2009]. Accès : http://oasis-lmc.org/?section=software
Onen, A. 2001. Synthesis of a novel addition-fragmentation agent based on Michler’s ketone and its use as photo-initiator for cationic polymerization. Polymer 42(16):6681-6685.
Ozaki, A., Yamaguchi, Y., Fujita, T., Kuroda, K., Endo, G. 2004. Chemical analysis and genotoxicological safety assessment of paper and paperboard used for food packaging. Food Chem. Toxicol. 42:1323-1337.
Ozaki, A., Kawasaki, C., Kawamura, Y., Tanamoto, K. 2006. Migration of bisphenol A and benzophenones from paper and paperboard products used in contact with food. Food Hyg. Soc. Jpn 47(3):99-104.
Parodi, S., Santi, L., Russo, P., Albini, A., Vecchio, D., Pala, M., Ottaggio, L., Carbone, A. 1982. DNA damage induced by auramine O in liver, kidney, and bone marrow of rats and mice and in a human cell line (alkaline elution assay and SCE induction). J Toxicol Environ Health 9(5-6):941-952.
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d’estimation]. 2009. Version 2.0. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 22 juin 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[PhysProp] Interactive PhysProp Database [base de données en ligne]. 2006. Syracuse (NY) : Syracuse Research Corporation [consultée en mars 2006]. Accès : http://www.syrres.com/what-we-do/databaseforms.aspx?id=386
Pillai, P.K.C., Tripathi, A.K., Narula, G.K., Mendiratta, R.G. 1982. Electrophotographic characteristics of Michler’s ketone in polycarbonate binder layers. J. Mater. Sci. 17(10):3013-3020.
Röper, M., Gehrer, E., Narbeshuber, T., Siegel, W. 2000. Acylation and alkylation. In : Ullmann’s encyclopedia of industrial chemistry, vol. 1. Wiley-VCH. p. 337-382.
[RTECS] Registry of Toxic Effects of Chemical Substances. 2008. Record for benzophenone, 4,4'-bis(dimethylamino)-. [mis à jour en novembre 2008; consulté le 15 mai 2009]. Hamilton (Ont.) : Centre canadien d’hygiène et de sécurité au travail. Accès : http://ccinfoweb.ccohs.ca/rtecs/search.html [réserve de consultation]
Salafranca, J., Franz, R. 2000. Study into the suitability of several food simulating matrices for migration testing of Michler’s ketone and related aromatic amines from food packaging cardboard materials. Dtsch Lebensmitt Rundsch 96(10):355-363.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu.
Schafer, E.W. Jr, Bowles, W.A. Jr, Hurlbut, J. 1983. The acute oral toxicity, repellency, and hazard potential of 998 chemicals to one or more species of wild and domestic birds. Arch. Environ. Contam. Toxicol. 12(3):355-382. [cité dans RTECS, 2008].
Scribner, J.D., Koponen, G., Fisk, S.R., Woodworth, B. 1980. Binding of the dye intermediates Michler’s ketone and methane base to rat liver nucleic acids and lack of mutagenicity in Salmonella typhimurium. Cancer Lett. 9(2):117-121.
Shen, W.H., Yo, A.J., Gong, B.M. 1984. Deep-ultraviolet characteristics of a photosensitive polyimide. In : Mittal, K.L., éd. Proceedings of the first technical conference on polyimides, Ellenville (NY), November 10–12, vol. 2. New York (NY) : Plenum. p. 947-954.
Spange, S., El-Sayed, M., Muller, H., Rheinwald, G., Lang, H., Poopitz, W. 2002. Solid-state structures of N-substituted Michler’s ketones and their relation to solvatochromism. Eur. J. Org. Chem. 2002(24):4159-4168.
Struck, R.F., Shih, T.W., Johnston, T.P., Kirk, M.C., Hill, D.L. 1981. Metabolism and macromolecular binding of the carcinogen Michler’s ketone in rats. Xenobiotica 11(8):569-577.
Tanaka, J., Kikkawa, H., Shoji, F., Satou, H., Katoaoka, F. 1993. Photosensitive polyamic acids developable with aqueous alkaline solutions. Mater. Res. Soc. 305:79-94.
Techrainbow. 2009. Narucure-CS (Tetra-ethyl Michler’s ketone). Fiche d’information [en ligne]. Gaithersburg (MD) : Techrainbow. Accès : http://www.techrainbow.com/html/fine_chemicals.html
Tennant, R.W., Stasiewicz, S., Spalding, J.W. 1986. Comparison of multiple parameters of rodent carcinogenicity and in vitro genetic toxicity. Environ. Mutagen. 8:205-227.
Thetford, D. 2000. Triphenylmethane and related dyes. In : Kirk-Othmer encyclopaedia of chemical technology, 2001. John Wiley & Sons, Inc. [consulté le 26 juin 2007]. Accès : http://www.mrw.interscience.wiley.com/emrw/9780471238966/home]
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. [consulté le 6 mars 2006]. Accès : http://www.accelrys.com/products/topkat/index.html
[TRI] Toxics Release Inventory Program [en ligne]. 1994. Washington (DC) : U.S. Environmental Protection Agency. Accès : http://www.epa.gov/triexplorer/
[TRI] Toxics Release Inventory Program [en ligne]. 1997. Washington (DC) : U.S. Environmental Protection Agency. Accès : http://www.epa.gov/triexplorer/
[US EPA] U.S. Environmental Protection Agency. 2008. Child-specific exposure factors handbook [en ligne]. Washington (DC) : U.S. Environmental Protection Agency. Accès : http://cfpub.epa.gov/ncea/cfm/recordisplay.cfm?deid=199243
von der Hude, W., Behm, C., Gurtler, R., Basler, A. 1988. Evaluation of the SOS chromotest. Mutat. Res. 203:81-94.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.41a. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 22 juin 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Yasuda, K., Sata, H., Hirakata, J. 2008. Liquid crystal display device [demande de brevet]. Alexandria (VA) : Fujifilm Corporation. Accès : http://www.faqs.org/patents/app/20080212003
Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K. 1992. Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals. Environ. Mol. Mutagen. 19(Suppl. 21):2-141.
Zimmermann, Y., Spange, S. 2002a. Probing surface acidity, basicity, and dipolarity/polarizability of 12-tunstophosphoric acid by means of solvatochromic dyes. New J. Chem. 23:1179-1184.
Zimmermann, Y., Spange, S. 2002b. Solvent influence on the catalytic activity and surface polarity of inorganic solid acids. J Phys Chem 106(48):12524-12530.
Zimmermann, Y., Anders, S., Hofmann, K., Spange, S. 2002. Influence of chemical solvent properties on the external and internal surface polarity of silica particles in a slurry. Langmuir 18(24):9578-9586.
Annexe 1 : Limite supérieure estimée de l’exposition à la cétone de Michler à partir de l’ingestion de papier par des enfants âgés de 6 mois à 4 ans
| Produits de consommation | Hypothèses | Exposition estimée (mg/kg p.c. par événement) |
|---|---|---|
| 1 La plus forte concentration de cétone de Michler dans du papier a été trouvée grâce à une recherche bibliographique. Selon cette source, la cétone de Michler a été uniquement décelée dans des matières en papier recyclé et non dans des produits de papier vierge (Ozaki et al., 2004). 2 Le poids corporel supposé était de 15,5 kg (Santé Canada, 1998). |
||
| Papier (à usage multiple) | Pour le papier à usage multiple standard, 500 feuilles (de dimensions 17 × 22 pouces) pèsent ~ 9 kg; une feuille pèse donc (9 kg)/500 = 0,018 kg. Comme les dimensions d’une feuille de papier standard sont de 8,5 × 11 pouces, une telle feuille de papier pèse (0,018 kg) × [(8,5 × 11)/(17 × 22)] ou ~ 0,0045 kg (~ 45 g). On a supposé de façon prudente que le quart de toute la cétone de Michler contenue dans une feuille de papier avait été ingéré (~ 1 g de papier). La plus forte concentration de cétone de Michler détectée dans le papier ou le carton recyclé est de 12,0 µg/g (1,2 × 10-2 mg/g).1 On a supposé que la cétone de Michler a été complètement absorbée. Ingestion orale estimée : Ingestion = [Concentration (en poids) de cétone de Michler dans le papier × poids de papier ingéré] / poids corporel Pour les enfants de 0,5 à 4 ans2 : Ingestion = [(1,2 × 10-2 mg/g) × (1 g)] / 15,5 kg = 8 × 10-4 mg/ kg p.c. |
Exposition orale, pour les enfants de 0,5 à 4 ans : 8 × 10-4 mg/kg p.c. par événement |
Annexe 2 : Limite supérieure estimée de l’exposition cutanée et orale à la cétone de Michler à partir de stylos à bille et de marqueurs chez les enfants âgés de 6 mois à 4 ans
| Produits de consom-mation | Exposition quotidienne orale ou cutanée estimée1 | Estimation de l’exposition (mg/kg p.c. par événement) |
|---|---|---|
| 1 Ce scénario prudent englobe à la fois l’exposition cutanée et l’exposition orale accidentelle en suçant l’objet ou en portant la main à la bouche. Comme il est fondé sur une exposition quotidienne pendant toute la vie de l’enfant ou de l’adulte, l’exposition réelle sera probablement plus faible. On suppose une absorption de 100 % (pour englober l’exposition résultant d’un geste de la main à la bouche et d’un contact direct avec l’objet). Toutefois, selon les propriétés de la substance, l’exposition cutanée et orale chez les adultes sera surestimée (apparemment négligeable). 2 Concentration à 0,124 % obtenue auprès de la bibliothèque cantonale du canton de Bâle-Ville. Cette concentration est basée sur un extrait d’HCl, avec lequel l’ingestion par l’estomac a été simulée (Bâle-Ville, 2003). 3 Cette tranche d’âge est considérée comme la plus exposée à la substance par l’utilisation de marqueurs ou de stylos, particulièrement en ce qui concerne la voie orale (US EPA, 2008). 4 Cette hypothèse a été examinée et considérée comme prudente par la Direction des sciences de la santé de la Commission de surveillance des produits de consommation des États-Unis et du département des services de santé de Californie (communication personnelle de l’ACMI adressée à Santé Canada, 2009; source non citée dans les références). 5 Communication personnelle de l’ACMI adressée à Santé Canada, 2009; source non citée dans les références. |
||
| Stylos à bille et marqueurs | Exposition aiguë ou à court terme : On a supposé qu’une aire correspondant à deux paumes de main d’enfant de 5 × 5 cm (50 cm2) pouvait être couverte d’encre (Hansen et al., 2008). La quantité d’encre transférée sur 50 cm2 a été estimée à 50 mg pour les marqueurs (Hansen et al., 2008). Ingestion/absorption = [concentration de cétone de Michler dans l’encre du stylo (en poids) × quantité d’encre estimée par exposition (50 mg) × fraction absorbée] / poids corporel (kg) Paramètres utilisés : concentration maximale de cétone de Michler : 0,124 %2(fraction de 0,00124 en poids); poids corporel de 15,5 kg pour des enfants de 0,5 à 4 ans (Santé Canada, 1998)3 Ingestion/absorption = (0,00124 × 50 mg × 1) / 15,5 kg = 4 × 103 mg/kg p.c. Exposition chronique : L’Art and Creative Materials Institute (ACMI) de l’Université Duke a émis l’hypothèse qu’un enfant absorbe quotidiennement l’encre d’un trait de 25 cm par exposition cutanée ou orale accidentelle1, 4 (communication personnelle adressée à Santé Canada, 2009; source non citée dans les références). On a détecté de la cétone de Michler dans des stylos (à des concentrations allant de 0,0023 à 0,11 %) ayant un taux de couverture de l’encre de 2 à 7 µg/cm et dans des marqueurs (à des concentrations allant de 0,00024 à 0,13 %) ayant un taux de couverture de l’encre de 100 à 352 µg/cm5. Enfants de 0,5 à 4 ans Ingestion/absorption= [(concentration de cétone de Michler dans l’encre de stylo ou de marqueur (en poids) × taux de couverture de l’encre (µg/cm) × 25 cm de trait d’encre par jour / 1000] / 15,5 kg Ingestion/absorption à partir de stylos (faible à élevée) = 7,42 × 108 à 1,24 × 105 mg/kg p.c. Ingestion/absorption à partir de marqueurs (faible à élevée) = 3,87 × 107 à 7,38 × 104 mg/kg p.c. |
Exposition orale et cutanée chez des enfants de 0,5 à 4 ans : Aiguë ou à court terme : 4 × 10-3 mg/kg p.c. par événement Chronique : |
| Paramètre | Concentrations ou doses minimales avec effet1/Résultats |
|---|---|
| 1 DL50, dose létale médiane; DMENO, dose minimale avec effet nocif observé. | |
| Animaux de laboratoire et cellules | |
| Toxicité aiguë | DL50 orale (oiseau sauvage) = 100 mg/kg p.c. (Schafer et al., 1983) |
| Toxicité à court terme en doses répétées | Plus faible DMENO par voie orale : 68 mg/kg p.c./j, selon un gain de poids corporel réduit (-40 %) chez les rats mâles F344 (5 par sexe et par groupe) exposés à la cétone de Michler par voie alimentaire à une concentration de 0, 680, 1 465, 3 155, 6 800 ou 14 665 mg/kg (équivalant à 0, 68, 147, 316, 680 ou 1 467 mg/kg p.c./j) pendant 4 semaines, suivies de 2 semaines d’observation. Deux rats femelles sur cinq sont morts à 316 mg/kg p.c./j (National Cancer Institute, 1979). Autre DMENO par voie orale : 600 mg/kg p.c./j, selon un gain de poids corporel réduit chez les souris B6C3F1 (5 par sexe par groupe) exposées à la cétone de Michler par voie alimentaire à une concentration de 0, 440, 1 390, 3 000, 6 400 ou 13 900 mg/kg (équivalant à 0, 88, 275, 600, 1 280 ou 2 780 mg/kg p.c./j) pendant 4 semaines, suivies de 2 semaines d’observation (National Cancer Institute, 1979) Aucune étude sur l’exposition par inhalation ou par voie cutanée n’a été recensée. |
| Toxicité chronique/ cancérogénicité |
Cancérogénicité par voie orale chez les rats : Un groupe de 50 rats Fischer 344 mâles (20 témoins) s’est vu administrer de la cétone de Michler dans l’alimentation à une concentration de 0, 250 ou 500 mg/kg p.c. (correspondant à 0, 12,5 et 25 mg/kg p.c./j) pendant 78 semaines, suivies d’une période d’observation de 28 semaines. Les cas de carcinome hépatocellulaire ont augmenté de manière importante proportionnellement à la dose administrée (0/20, 9/50 et 40/50, respectivement pour 0, 12,5 et 25 mg/kg p.c./j). De la même façon, un groupe de 50 rats Fischer 344 femelles (20 témoins) s’est vu administrer de la cétone de Michler par voie alimentaire à une concentration de 0, 500 ou 1 000 mg/kg (correspondant à 0, 25 et 50 mg/kg p.c./j) pendant 78 semaines, suivies d’une période d’observation de 28 à 29 semaines. Les cas de carcinome hépatocellulaire ont aussi augmenté de manière importante proportionnellement à la dose administrée chez les rats femelles (0/20, 41/47 et 44/49, respectivement pour 0, 25 et 50 mg/kg p.c./j). Les cas combinés de lésions néoplasiques (carcinomes hépatocellulaires et nodules néoplasiques) ont augmenté de manière importante aux deux doses et chez les deux sexes (National Cancer Institute, 1979). Cancérogénicité par voie orale chez les souris : Des groupes de 50 souris mâles et 50 souris femelles B6C3F1 se sont vu administrer de la cétone de Michler par voie alimentaire à une concentration de 0, 1 250 ou 2 500 mg/kg (correspondant à 0, 179 et 357 mg/kg p.c./j) pendant 78 semaines, suivies d’une période d’observation de 13 semaines. Chez les souris femelles, les cas de carcinome hépatocellulaire ont augmenté de manière importante proportionnellement à la dose administrée (0/19, 16/49 et 38/50, respectivement pour 0, 179 et 357 mg/kg p.c./j). Chez les souris mâles, on n’a observé aucune augmentation substantielle des cas de carcinome hépatocellulaire, mais on a noté une augmentation importante des cas d’hémangiosarcome dans le système circulatoire à la dose élevée (0/19, 5/50 et 20/50, respectivement pour 0, 179 et 357 mg/kg p.c./j) (National Cancer Institute, 1979). Effets non néoplasiques : Dans les mêmes études décrites ci-dessus menées sur des rats et des souris des deux sexes, une chute du poids corporel proportionnelle à la dose administrée a été constatée tout le long du test biologique. On a notéun taux de survie proportionnel à la dose administrée chez les rats et un taux de survie réduit chez les souris mâles à la dose maximale. On a établi la DMENO à 12,5 mg/kg p.c./j chez les rats mâles et à 179 mg/kg p.c./j chez les souris mâles, d’après un gain réduit de poids corporel (National Cancer Institute, 1979). Cependant, à ces DMENO, des tumeurs ont aussi été observées. Aucune étude sur l’exposition par inhalation ou par voie cutanée n’a été recensée. |
| Génotoxicité et paramètres connexes : bactéries in vitro | Mutagénicité Résultats positifs : Chez Salmonella typhimurium (souche TA98) en présence d’activateur S9 dérivé du foie de rat ou de hamster. Les doses allaient de 0 à 10 mg/plaque (Dunkel et al., 1985; Tennant et al., 1986; Zeiger et al., 1992). Un résultat positif a aussi été observé chez TA1538 (Dunkel et Simmon, 1980). Résultats négatifs : Chez Salmonella typhimurium (souches TA97, TA100, TA1535 et TA1537) en présence ou en l’absence d’activation métabolique par un activateur S9 dérivé du foie de rat ou de hamster (Tennant et al., 1986). Des résultats négatifs ont aussi été observés pour TA98 sans activateur S9 (Zeiger et al., 1992), TA1538 et TA100 (Scribner et al., 1980; McCarthy et al., 1983). Résultats négatifs : Chez Escherichia coli (souche WP2 uvrA)à des concentrations allant jusqu’à 3,3 mg/plaque, avec ou sans activation métabolique par un activateur S9 dérivé du foie de rat ou de hamster (Dunkel et al., 1985) Dommages à l’ADN Résultats négatifs : Aucune inhibition de croissance observée lors de l’essai de recombinaisonsur les souches M45 (rec-) et H17 (rec+) de Bacillus subtilis jusqu’à 1 mg/disque (Ozaki et al., 2004) Résultats négatifs : Dans le chromotest SOS sur la souche PQ37 d’Escherichia coli, avec ou sans activation métabolique S9 (von der Hude et al., 1988) |
| Génotoxicité et paramètres connexes : cellules de mammifères in vitro | Mutagénicité Résultats positifs : Une augmentation proportionnelle à la dose des fréquences de mutation a été observée dans les cellules de lymphome L5178Y de souris, en présence ou en l’absence d’activation métabolique par un activateur S9 dérivé du foie (Mitchell et al., 1988; Myhr et Caspary, 1988). Aberrations chromosomiques Résultats positifs : Dans les cellules d’ovaire de hamster chinois (CHO) exposées à des concentrations de cétone de Michler de 65 à 300 µg/ml, en présence d’activateur S9, avec un temps de récolte de 16,5 à 20,5 h (NTP, 1990) Résultats positifs : Dans les cellules d’embryon de hamster chinois CHE-3N exposées à une concentration de cétone de Michler allant jusqu’à 1,5 µg/mL (Lafi et al., 1986) Résultats négatifs : Dans les cellules CHO exposées à des concentrations de cétone de Michler de 65 à 300 µg/mL, en l’absence d’activateur S9 (NTP, 1990), ou allant jusqu’à 5 mg/mL, en présence ou en l’absence d’activateur S9 avec un temps de récolte de 12 à 14 h (NTP, 1983) Échange de chromatides sœurs Résultats positifs : Dans les cellules CHO exposées à une concentration de cétone de Michler allant jusqu’à 300 µg/mL, en présence ou en l’absence d’activateur S9 (NTP, 1990) Aneuploïdie Résultats positifs : Dans les cellules d’embryon de hamster chinois CHE-3N exposées à une concentration de cétone de Michler de 0,75 ou 1,5 µg/mL (Lafi et al., 1986) Test de transformation cellulaire Résultats positifs : Dans les cellules Balb/c 3T3, sans activateur S9 (Tennant et al., 1986) Résultats positifs : Dans les cellules d’embryon de rats infectés par le RLV (Heidelberger et al., 1983) Dommages à l’ADN Résultats négatifs : Aucun dommage à l’ADN (par essai comète) observé dans les cellules HL60 (cellules présentant des signes de leucémie promyélocytaire chez l’humain) exposées à des concentrations de cétone de Michler allant jusqu’à 25 µg/mL (Ozaki et al., 2004) |
| Génotoxicité et paramètres connexes : in vivo | Échange de chromatides sœurs Résultats positifs : Échange de chromatides sœurs induit par la cétone de Michler dans la moelle osseuse de souris Swiss ayant reçu par injection intrapéritonéale une dose de 7,5, 15 ou 30 mg/kg p.c. (Parodi et al., 1982) Liaison à l’ADN Résultats positifs : Liaison de la cétone de Michler à l’ADN du foie chez les rats Fischer 344 mâles ayant reçu par injection intrapéritonéale des matières radiomarquées à une dose de 0,009, 0,9 ou 9 mg/rat (Scribner et al., 1980) Résultats positifs : Liaison à l’ADN du foie et des reins de rats Osborne-Mendel prétraités au phénobarbital et ayant reçu par injection intrapéritonéale de la cétone de Michler marquée au carbone 14, à une dose de 2,5 mg/rat (Struck et al., 1981) Dommages à l’ADN Résultats positifs : Synthèse non programmée de l’ADN induite par la cétone de Michler chez les rats Fischer 344 mâles exposés par gavage à une dose de 200 ou de 1 000 mg/kg p.c. (Mirsalis et al., 1989) Résultats positifs : Dommages à l’ADN du foie causés par la cétone de Michler, évalués au moyen du test d’élution alcaline, chez des rats Sprague-Dawley ayant reçu par injection intrapéritonéale une dose de 7,5 ou 15 mg/kg p.c. (Parodi et al., 1982) Résultats positifs : Dommages à l’ADN du foie causés par la cétone de Michler, évalués au moyen du test d’élution alcaline, chez des rats Sprague-Dawley ayant reçu par gavage une dose de 150 mg/kg p.c. (Kitchin et Brown, 1994) |
| Humains | |
| Aucune donnée épidémiologique n’était disponible. | |
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
4,4'-bis(diméthylamino)benzophénone
(cétone de Michler)
Numéro de registre du Chemical Abstracts Service
90-94-8
Environnement Canada
Santé Canada
Mars 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Limite supérieure estimée de l’exposition à la cétone de Michler à partir de l’ingestion de papier par des enfants âgés de 6 mois à 4 ans
- Annexe 2 : Limite supérieure estimée de l’exposition cutanée et orale à la cétone de Michler à partir de stylos à bille et de marqueurs chez les enfants âgés de 6 mois à 4 ans
- Annexe 3 : Résumé des données relatives aux effets de la cétone de Michler sur la santé
Conformément à l'article 74 de la Loi canadienne sur la protection de l'environnement, 1999 (LCPE 1999), les ministres de l'Environnement et de la Santé ont effectué une évaluation préalable du 4,4'bis(diméthylamino)benzophénone (cétone de Michler), dont le numéro de registre du Chemical Abstracts Service est 90-94-8. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance durant la catégorisation visant la Liste intérieure des substances (LIS) dans le cadre du Défi lancé par les ministres. La cétone de Michler a été jugée hautement prioritaire, car elle a été reconnue comme une substance présentant un risque d’exposition intermédiaire pour les particuliers au Canada et a été classée par la Commission européenne et le National Toxicology Program des États-Unis en fonction de sa cancérogénicité. Cette substance répond aux critères environnementaux de la catégorisation relatifs à la persistance, mais elle ne répond pas à ceux du potentiel de bioaccumulation et de la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation sur la cétone de Michler est donc axée sur les risques pour la santé humaine.
La cétone de Michler est une substance organique que l’on trouve au Canada et dans le monde principalement sous forme résiduelle dans les matières colorantes, à la suite d'une réaction intermédiaire au cours de la fabrication, et dans les produits de consommation finals. En 2006, on a importé 800 kg de cétone de Michler au Canada, alors qu’aucune fabrication de cette substance n’a été déclarée au pays pendant l’année. De 1 000 à 10 000 kg de cétone de Michler ont été utilisés au Canada en 2006. Au pays, la cétone de Michler est principalement utilisée dans les produits de papier; on s’en sert aussi dans une moindre mesure à des fins industrielles pour la fabrication de feuils secs et de matériel électronique.
Les quantités de cétone de Michler importées et utilisées au pays ainsi que les types d’utilisation de cette substance laissent entendre qu’elle pourrait être rejetée dans l’environnement. L’exposition de la population générale à cette substance à partir des milieux environnementaux est considérée comme négligeable. À la lumière des données obtenues sur les usages actuels de la cétone de Michler au Canada, l’exposition de l’ensemble de la population à cette substance dans l’environnement devrait être très faible et se limiter à l’utilisation des produits de papier qui contiennent cette substance sous forme de résidu de fabrication dans la matière colorante pour papier. Il est peu probable que la population générale soit exposée à cette substance dans d’autres produits de consommation.
En s’appuyant principalement sur des évaluations reposant sur le poids de la preuve qui sont réalisées par des organismes internationaux ou d’autres organismes nationaux, on a déterminé que la cancérogénicité représente un effet critique de la cétone de Michler aux fins de la caractérisation des risques pour la santé humaine. Dans le cadre d’études de cancérogénicité standard, réalisées sur des rats et des souris au cours d’une période de deux ans, on a observé une augmentation de l’incidence des carcinomes hépatocellulaires chez les rats des deux sexes et chez les souris femelles ainsi que des hémangiosarcomes chez les souris mâles, à la suite d’une exposition à la cétone de Michler par voie alimentaire (orale). La substance s’est avérée génotoxique dans un éventail d’essais in vivo et in vitro. De plus, elle se liait à l’acide désoxyribonucléique (ADN) du foie des animaux de laboratoire et l’endommageait. Bien que les modes d’induction des tumeurs par la cétone de Michler n’aient pas été établis ni élucidés, on juge que les tumeurs observées chez les animaux de laboratoire résultent d’une interaction directe avec le matériel génétique.
L’effet critique (autre que le cancer) signalé aux fins de la caractérisation des risques de la cétone de Michler pour la santé humaine est la diminution du gain de poids corporel. Toutefois, on a noté des tumeurs à la dose minimale avec effet nocif observé établie pour le paramètre lié aux effets autres que le cancer. Les marges d’exposition ne sont donc pas calculées pour cette substance.
Compte tenu de la cancérogénicité possible de la cétone de Michler, qui pourrait causer des effets nocifs à tout niveau d’exposition, et des signes de tumeurs observées aux plus petites doses administrées, on conclut que la cétone de Michler est une substance pouvant pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D’après ses propriétés physiques et chimiques, la cétone de Michler devrait être persistante dans l’eau, le sol et les sédiments, mais elle ne devrait pas persister dans l’air ni se bioaccumuler dans l’environnement. Cette substance répond donc aux critères de la persistance et non à ceux de la bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation. En outre, les données modélisées indiquent que la substance peut avoir un potentiel de toxicité aiguë moyen à élevé pour les organismes aquatiques. Après comparaison des concentrations estimées sans effet et des concentrations estimées raisonnables d’une exposition selon le scénario de la pire éventualité, on conclut que la cétone de Michler ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
Compte tenu des données disponibles, il est conclu que la cétone de Michler répond à un critère ou plus de l’article 64 de la LCPE (1999).
La Loi canadienne sur la protection de l’environnement, 1999 [LCPE (1999)] (Canada, 1999) exige que les ministres de l’Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l’industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l’évaluation des risques, ainsi qu’à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
La cétone de Michler est une substance dont l’évaluation des risques pour la santé humaine a été jugée hautement prioritaire, car on considère qu’elle présente un REI et elle a été classée par d’autres organismes en fonction de sa cancérogénicité. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 30 août 2008 (Canada, 2008). En même temps a été publié le profil de cette substance qui présentait l’information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements sur les utilisations de la substance ont été reçus en réponse au Défi.
Même s’il a été jugé hautement prioritaire d’évaluer les risques que présente la cétone de Michler pour la santé humaine et que cette substance réponde aux critères environnementaux de la catégorisation applicables à la persistance, elle ne répond pas aux critères définissant le potentiel de bioaccumulation ou la toxicité intrinsèque pour les organismes aquatiques.
Les évaluations préalables mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques au sens de l’article 64 de la Loi. Elles visent à examiner les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable de la cétone de Michler sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu'en mai 2009 (sections du document concernant l'exposition et les effets sur la santé humaine ainsi que l'environnement) et jusqu'en février 2009 (propriétés physiques et chimiques, exposition et effets sur l'environnement). Les études les plus importantes ont fait l’objet d’une évaluation critique; il est possible que les résultats de modélisation aient servi à formuler des conclusions.
L’évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers et les risques pour la santé (principalement d’après les évaluations s’appuyant sur la méthode du poids de la preuve effectuées par d’autres organismes, lesquelles ont servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l’effet critique retenu ou sur la marge entre les valeurs prudentes de concentration donnant lieu à des effets et les estimations de l’exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, et ce, dans le contexte d’une évaluation préalable. L’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. II s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères.
Les parties de la présente évaluation préalable qui portent sur la santé humaine et l’envirionnement ont fait l’objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de la part d’experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment Mmes Lynne Haber, Ph. D. (TERA), Pam Williams, Ph. D. (E Risk Sciences) et Harlee Strauss, Ph. D. (Strauss Associates).
De plus, l’ébauche de la présente évaluation préalable a fait l’objet d’une période de commentaires du public de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l’évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Aux fins du présent document, la substance est appelée « cétone de Michler », qui est son nom commun (tableau 1).
Tableau 1. Identité de la substance – cétone de Michler
| Numéro de registre du Chemical Abstracts Service (no CAS) | 90-94-8 |
| Nom dans la LIS | 4,4'-bis(diméthylamino)benzophénone |
| Noms relevés dans les NCI | Benzophenone, 4,4'-bis(dimethylamino)- (PICCS) 4,4'-Bis(dimethylamino)benzophenone (ECL) 4,4'-bis(diméthylamino)benzophénone(EINECS) 4,4'-Bis (dimethylamino) benzophenone (ENCS) Methanone, bis[4-dimethylamino)phenyl]- (AICS, ASIA-PAC, NZIoC, PICCS, TSCA) |
| Autres noms | 4,4'-Bis(N,N-dimethylamino)benzophenone; p,p'-bis(dimethylamino)benzophenone; Bis(4-dimethylaminophenyl) ketone; bis[p-(N,N-dimethylamino)phenyl] ketone; bis[(4dimethylamino)phenyl]methanone; DABP; di(pdimethylamino)benzophenone; Michler’s ketone; cétone de Michler; Nisso Cure MABP; NSC 9602; S 112; S 112 (ketone); 4,4'-tetramethyldiaminobenzophenone; N,N,N',N'-tetramethyl-4,4'-diaminobenzophenone; p,p'-tetramethyldiaminobenzophenone |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Cétones |
| Principale sous-classe chimique | Benzophénones |
| Formule chimique | C17H20N2O |
| Structure chimique | 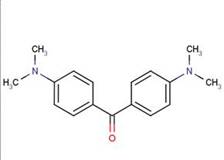 |
| SMILES | O=C(c(ccc(N(C)C)c1)c1)c(ccc(N(C)C)c2)c2 |
| Masse moléculaire | 268,36 g/mol |
| Abréviations : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique; ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); LIS (Liste intérieure des substances); NCI (National Chemical Inventories); no CAS (numéro de registre du Chemical Abstracts Service); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); SMILES (simplified molecular input line entry specification); SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). Source : NCI, 2006. |
|
Le tableau 2 présente les données physiques et chimiques (valeurs expérimentales et modélisées) de la cétone de Michler qui se rapportent à son devenir dans l’environnement.
Tableau 2. Propriétés physiques et chimiques de la forme neutre de la cétone de Michler
| Propriété | Type | Valeur1 | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Kco, coefficient de partage carbone organique-eau; Koe, coefficient de partage octanol-eau; pKa, constante de dissociation acide. 1 Les valeurs entre parenthèses représentent les valeurs originales signalées par les auteurs ou estimées à l’aide des modèles. 2 La cétone de Michler se décompose à une température de plus de 360 °C (Merck, 2006). 3 La méthode de l’indice de connectivité moléculaire (ICM) a été utilisée. 4 Une incertitude existe à propos de la valeur expérimentale de solubilité dans l'eau. Une valeur de 400 mg/L a été trouvée dans la base de données EPISuite 2009; toutefois, l’expérience a été effectuée il y a de nombreuses années (Dehn, 1917), et la valeur est supérieure de plus de deux ordres de grandeur à la valeur modélisée. |
||||
| Point de fusion (°C) | Expérimental | 179,0 | PhysProp, 2006 | |
| Modélisé | 128,7 | MPBPWIN, 2008 | ||
| Point d’ébullition (°C) | Modélisé | 373,92 | MPBPWIN, 2008 | |
| Pression de vapeur (Pa) | Expérimental | 2,8 × 10-4 (2,1 × 10-6 mm Hg) |
GEMS, 1987 | |
| Modélisé | 1,2 × 10-4 (8,9 × 10-7 mm Hg) |
25 | MPBPWIN, 2008 | |
| Constante de la loi de Henry (Pa·m3/mol) | Expérimental | 5,7 × 10-7 (5,6 × 10-12 atm·m3/mol) |
Hine et Mookerjee, 1975 | |
| Modélisé | 5,0 × 10-5 (4,91 × 10-10 atm·m3/mol) |
25 | HENRYWIN, 2008 | |
| Log Koe (sans dimension) | Expérimental | 3,9 | Hansch et al., 1995 | |
| Modélisé | 3,5 | KOWWIN, 2008 | ||
| Log Kco (sans dimension) | Modélisé | 2,53 | PCKOCWIN, 2009 | |
| Solubilité dans l'eau (mg/L) | Expérimental | Pratiquement insoluble4 | 20 | Merck, 2006 |
| Modélisé | 1,4 | 25 | WSKOWWIN, 2008 |
|
| pKa (sans dimension) | Modélisé | 2,6 (sous forme basique) | ACD/pKaDB, 2005 | |
Les modèles fondés sur les relations quantitatives structure-activité (RQSA) ont servi à produire des données pour certaines propriétés physiques et chimiques de la cétone de Michler. Ces modèles (sauf WSKOWWIN, 2008) s’appuient principalement sur des méthodes d’ajout de fragments, c’est-à-dire qu’elles reposent sur la structure d’un produit chimique. Puisque ces modèles n’acceptent que la forme neutre d’un produit chimique comme entrée (sous forme SMILES), les valeurs modélisées indiquées dans le tableau 2 s’appliquent à la forme neutre de la cétone de Michler. Aux pH enregistrés dans l’environnement (6 à 9), la cétone de Michler est neutre dans l’eau et elle est considérée comme non ionisante. La substance s’ionise dans l’eau comme une base. Selon le module de prévision pKa DB de ACD (2005), sa constante de dissociation acide primaire devrait être pKa1 = 2,55 et sa constante de dissociation acide secondaire devrait être pKa2 = 1,11. Étant donné que la constante de dissociation acide secondaire est bien inférieure à 5, la forme basique LH+ l’emportera sur la forme acide LH22+. De la même manière, la constante de dissociation acide primaire (pKa1 = 2,55) est bien inférieure à 5, ce qui indique que la forme basique L l’emportera sur la forme acide LH+. Dans l’ensemble, la forme neutre L l’emportera sur les formes ioniques LH+ et LH22+.
La cétone de Michler est une substance anthropique qui ne se trouve pas naturellement dans l’environnement. Elle peut être produite par la condensation de la diméthylaniline avec du phosgène en présence de chlorure de zinc (Gessner et Mayer, 2000; Röper et al., 2000). Elle peut aussi être produite à partir de diméthylaniline, de chlorure d'aluminium et de tétrachlorure de carbone (Merck, 2006; Lewis, 2007; HSDB, 2009). Une autre méthode implique l’oxydation catalytique de bis(diméthylaminophényl) méthane (Gessner et Mayer, 2000). La cétone de Michler est un produit de dégradation important du violet cristallisé. Elle peut également être desmethylée en (N,N-diméthylaminophényl) (Nméthylaminophényl)benzophénone (Chen et al., 2008).
D’après les renseignements recueillis dans le cadre d’une enquête effectuée en application de l’article 71 de la LCPE (1999), 800 kg de cétone de Michler ont été importés au Canada en 2006 et aucune fabrication n'a été signalée cette année-là (Environnement Canada, 2008).
Selon les renseignements précédemment reçus pour les années 1984 à 1986 après l’inscription de la substance sur la Liste intérieure des substances (LIS), la quantité totale de cétone de Michler déclarée comme ayant été importée, fabriquée ou commercialisée au Canada au cours de l'année civile 1986 s’élevait à 1 000 000 kg (Environnement Canada, 1988). Ainsi, la production et l’importation de cétone de Michler ainsi que l’utilisation de la substance ont diminué de façon importante depuis les années 1980. De plus, la cétone de Michler a été reconnue par l’Union européenne comme une substance chimique produite en faibles quantités (ESIS, 2009).
Selon les renseignements présentés en application de l’article 71 de la LCPE (1999) et les réponses au questionnaire du Défi (Environnement Canada, 2008), de 1 000 à 10 000 kg de cétone de Michler ont été utilisés au Canada en 2006.
La plus grande part de la cétone de Michler utilisée au Canada peut se retrouver sous forme résiduelle dans la matière colorante pour papier (c.-à-d. colorant, pigment, teinture, encre) à une concentration de 0,009 à 4,5% en poids (principalement = 1%). La cétone de Michler est présente sous forme résiduelle dans des colorants et des pigments à la suite d’une réaction intermédiaire au cours de la fabrication. Elle peut être présente dans des industries impliquées dans la fabrication de papier ou la conversion de papier fabriqué en différentes formes, comme des usines de papier ou de papier journal (Environnement Canada, 2008). Parmi les colorants pour papier pouvant contenir des résidus de cétone de Michler figurent le violet cristallisé, le Basazol Violet, le Basic Brown C2, le Basic Purple 48 et le Methyl Violet DAW (Environnement Canada, 2008). De plus, une recherche documentaire a révélé que la cétone de Michler se trouve dans des colorants et des pigments dérivés de l’auramine (NTP, 2005). Les colorants à l’auramine sont utilisés pour teindre le papier, les textiles et le cuir, pour colorer les pâtes et les encres pour stylos à bille et comme fongicide antiseptique (National Cancer Institute, 1979; Gessner et Mayer, 2000; Thetford, 2000; NTP, 2005; Merck, 2006; Cheminfo, 2008; HSDB, 2009).
La présence de cétone de Michler dans les encres pour stylos a été confirmée au Canada par la Direction de la Sécutité de produits de consommation de Santé Canada. A ce jour, la cétone de Michler n’a été relevé dans aucun marché d’enfants; d’autres analyses sont en cours (2010 Direction de la Sécutité de produits de consommation de Santé Canada, au Bureau des substances existantes, Santé Canada référence non citée). La présence de cétone de Michler dans des textiles n'a pas été confirmée au Canada.
La cétone de Michler est utilisée au Canada à un pourcentage maximum de 0,2 % en poids pour faire du violet de gentiane (Harleco), un colorant biologique certifié (FS, 2004a; id., 2006a; Environnement Canada, 2008). Elle est également utilisée dans l’industrie de la fabrication de matériel électronique comme produit chimique de traitement pour la fabrication de circuits imprimés à une concentration de 0,24 % (Chiang et Kuo, 2002; Environnement Canada, 2008) et comme composant dans des produits pour films secs (à des concentrations inférieures à 1 % en poids).
Au Canada, la cétone de Michler ne figure ni dans la Base de données sur les produits pharmaceutiques, ni dans la Base de données sur les ingrédients de produits de santé naturels ni dans la Base de données des produits de santé naturels homologués. Aucune utilisation de la cétone de Michler dans les produits thérapeutiques n’a été signalée dans les renseignements reçus aux termes de l’article 71 de la LCPE (1999). On ne s’attend donc pas à ce que cette substance soit présente dans des produits pharmaceutiques ou de santé naturels fabriqués au Canada. Toutefois, la cétone de Michler peut se retrouver en quantités infimes dans des produits pharmaceutiques importés au Canada, car il est connu qu’à l'extérieur du Canada, elle peut être utilisée comme produit chimique intermédiaire dans la fabrication de produits pharmaceutiques (Techrainbow, 2009; communication personnelle de la Direction des produits thérapeutiques de Santé Canada adressée au Bureau des substances existantes de Santé Canada, 2009, source non citée dans les références).
Au Canada, la cétone de Michler est très rarement déclarée dans les encres utilisées pour les emballages alimentaires (communication personnelle de la Direction des aliments de Santé Canada adressée au Bureau des substances existantes de Santé Canada, 2009; source non citée dans les références). La cétone de Michler peut se trouver en quantités infimes sous forme résiduelle dans certains concentrés de couleur pour carton, bien qu’il n'y ait aucune migration vers les aliments puisque cette application n’est destinée qu’aux aliments secs. À l'extérieur du Canada, on a signalé que la cétone de Michler était utilisée dans des encres d’impression à séchage ultraviolet pour cartons où elle agit comme catalyseur servant à durcir l’encre lorsqu’elle est exposée à la lumière UV pendant le processus d’impression (Castle et al., 1997; Salafranca et Franz, 2000). Comme l’encre d’impression est généralement appliquée à l’extérieur des matériaux d’emballage alimentaire, elle n’entre donc pas en contact direct avec les aliments. Aujourd’hui, d’autres amines aromatiques (par exemple la 4,4'-bis-(diéthylamino)-benzophénone [DEAB] et la 2-amino-4-méthylbenzophénone [AMB]) ont remplacé la cétone de Michler dont l’utilisation n’est plus recommandée par l’industrie de l’imprimerie au Japon et en Europe (Castle et al., 1997; Nagarajan et al., 2000; Salafranca et Franz, 2000).
Un certain nombre d’utilisations supplémentaires de la cétone de Michler a été signalé à l’extérieur du Canada. Elle peut ainsi servir d’absorbeur de lumière (Yasuda et al., 2008) et être utilisée dans la préparation de résines photosensibles (Fan 2004) ainsi que dans la production de polymères (Emmett et al., 1977; Pillai et al., 1982; Shen et al., 1984; Tanaka et al., 1993; Granchak et al., 1995; Huang et al., 1999; Onen, 2001; Fan, 2004) et de produits chimiques (Dikusar, 2003; DTIRP, 2004). Elle peut également être utilisée pour rechercher les polarités des milieux liquides et solides (Spange et al., 2002; Zimmermann et al., 2002; Zimmermann et Spange, 2002a; id., 2002b) et comme contrôle colorimétrique pour les nitrites, les nitrates et les solutions de trinitration I de glycéryle dans de l’eau distillée (Munch et al., 1964; Gessner et Mayer, 2000; Dikusar, 2003).
D’après les renseignements recueillis lors d’une enquête réalisée conformément à l’article 71 de la LCPE (1999), une installation qui produit des matières colorantes a rejeté dans l’air de petites quantités de cétone de Michler, issues du mélange de colorants sur mesure. L’installation n’a pris aucune mesure ni estimé ses émissions pour cette substance, car celles-ci n’ont pas été jugées importantes. La quantité de colorants mélangés à l’installation a été réduite depuis 2006. Quelques autres installations utilisent un système de traitement des eaux usées pour minimiser les rejets et limiter l’exposition du milieu naturel (Environnement Canada, 2008).
La cétone de Michler (et ses sels) peut faire l’objet d’une déclaration à l’Inventaire national des rejets de polluants (INRP, 2008), mais aucun rejet n’y figure. De plus, aucun rejet récent n’a été déclaré dans le Toxics Release Inventory (TRI) des États-Unis (inventaire américain des rejets de substances toxiques), car la cétone de Michler n’est plus suivie; cependant, 182 kg de cette substance ont été émis dans l’air en 1997 (TRI, 1997). Si l’INRP et le TRI répertorient tous deux les rejets dans l’air, l’eau et le sol, des données propres aux milieux n’ont cependant été fournies que pour l’air.
D’après ses propriétés physiques et chimiques (tableau 2), les résultats de la modélisation de la fugacité de niveau III (tableau 3) semblent indiquer que la cétone de Michler réside surtout dans le sol si elle est rejetée dans l’air ou dans le sol, et reste principalement dans l’eau si elle y est rejetée.
Tableau 3. Résultats de la modélisation de la fugacité de niveau III (EQC, 2003) pour la cétone de Michler
| Substance rejetée dans : | Pourcentage de la substance se répartissant dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 0,01 | 2,00 | 97,60 | 0,44 |
| l’eau (100 %) | 0,0 | 82 | 0,0 | 18 |
| le sol (100 %) | 0,0 | 0,2 | 99,70 | 0,05 |
Persistance dans l'environnement
Aucune donnée expérimentale sur la dégradation de la cétone de Michler n’a été recensée. Étant donné l’importance écologique du milieu aquatique et puisque la plupart des modèles disponibles s’appliquent à l'eau et que la cétone de Michler devrait être libérée dans ce milieu, la persistance dans l'eau a été examinée essentiellement à l’aide de modèles prévisionnels RQSA sur la biodégradation.
Le tableau 4 résume les résultats des modèles RQSA disponibles sur la dégradation dans divers milieux naturels.
Tableau 4. Données modélisées sur la dégradation de la cétone de Michler
| Processus du devenir | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade & Industry (ministère du Commerce international et de l’Industrie), Japon; t½, demi-vie. 1 Le modèle ne précise pas d'estimation pour ce type de structure. 2 Le résultat s’exprime par une valeur numérique. 3 Le résultat s’exprime par un taux de probabilité. |
|||
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2008 | t½ = 0,052 jour | = 2 |
| Réaction à l'ozone | AOPWIN, 2008 | s.o1 | s.o. |
| Eau | |||
| Hydrolyse | HYDROWIN, 2008 | s.o. | s.o. |
| Biodégradation (aérobie) | BIOWIN, 2009 Sous-modèle 3 : enquête d’expert (biodégradation ultime) |
2,12 « se biodégrade lentement » |
= 1823 |
| Biodégradation (aérobie) | BIOWIN, 2009 Sous-modèle 4 : enquête d’expert (biodégradation primaire) |
2,92 « peut se biodégrader rapidement » |
= 182 |
| Biodégradation (aérobie) | BIOWIN, 2009 Sous-modèle 5 : MITI, probabilité linéaire |
-0,13 « se biodégrade très lentement » |
= 182 |
| Biodégradation (aérobie) | BIOWIN, 2009 Sous-modèle 6 : MITI, probabilité non linéaire |
0,0073 « se biodégrade très lentement » |
= 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 Probabilité |
0,03 « se biodégrade très lentement » |
= 182 |
| Biodégradation (aérobie) | CATABOL, c2004-2008 % DBO |
% DBO = 0,10 « se biodégrade très lentement » |
= 182 |
Dans l’air, la valeur prévue de 0,052 jour pour la demi-vie liée à l’oxydation atmosphérique (tableau 4) démontre que cette substance est susceptible de s’oxyder rapidement. La substance ne devrait pas réagir avec d’autres espèces, comme l’ozone, par photooxydation dans l’atmosphère et elle n’est pas susceptible de se dégrader par photolyse directe. En conséquence, des réactions avec des radicaux hydroxyles devraient donc constituer le plus important processus du devenir pour la cétone de Michler dans l’atmosphère. Avec une demi-vie de 0,052 jour sous l’effet des réactions avec ces radicaux, la cétone de Michler est considérée comme non persistante dans l’air.
Dans l’eau, on ne pouvait estimer une valeur prévue de demi-vie par hydrolyse pour la structure de la cétone de Michler. Cependant, d’autres processus du devenir dans l’eau devaient être pris en compte pour déterminer son degré global de persistance dans ce milieu.
Les résultats du modèle de biodégradation ultime semblent indiquer que la cétone de Michler ne se dégrade pas rapidement. Les quatre modèles de biodégradation immédiate (sous-modèles BIOWIN 3, 5 et 6, TOPKAT et CATABOL) prédisent que la biodégradation ultime serait très lente et que la demi-vie dans l’eau devrait être bien supérieure à 182 jours. Comme les prévisions de CATABOL et TOPKAT se situent dans tous les domaines d’applicabilité des deux modèles, elles sont donc considérées comme les plus fiables. Selon la prévision de biodégradabilité immédiate de BIOWIN, la cétone de Michler n’est pas facilement biodégradable. Le modèle d’enquête de biodégradation primaire de BIOWIN prédit que la dégradation primaire pourrait se produire assez rapidement en comparaison de la minéralisation complète; toutefois, l’identité des produits de dégradation primaire est inconnue. La substance possède des caractéristiques structurelles associées à des produits chimiques qui ne sont pas facilement biodégradés (p. ex.,les cétones). Par conséquent, à la lumière de tous les résultats des modèles (particulièrement ceux sur la dégradation ultime) et des caractéristiques structurelles, il existe suffisamment de preuves laissant entendre que la demi-vie de biodégradation de la cétone de Michler est supérieure ou égale à 182 jours dans l’eau.
En utilisant un rapport d’extrapolation de 1 : 1 : 4 pour la demi-vie associée à la biodégradation dans l’eau, le sol et les sédiments (Bœthling et al., 1995), on obtient également une demi-vie de biodégradation ultime d’au moins 182 jours dans le sol et une demi-vie d’au moins 365 jours dans les sédiments. La cétone de Michler devrait donc être persistante dans le sol et les sédiments.
En conclusion, d’après les données modélisées (voir le tableau 4), la cétone de Michler répond aux critères de la persistance dans l’eau et le sol (demi-vie = 182 jours) et dans les sédiments (demi-vie = 365 jours), mais elle ne répond pas au critère de la persistance dans l’air (demi-vie ³ 2 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Les valeurs faibles à modérées (tant expérimentales que modélisées) du log Koe pour la cétone de Michler (voir le tableau 2 plus haut) laissent entendre que cette substance possède un potentiel de bioaccumulation relativement faible.
Le tableau 5a présente les valeurs empiriques du facteur de bioconcentration (FBC) chez les poissons.
Tableau 5a. Données empiriques sur la bioaccumulation de la cétone de Michler
| Organisme d'essai | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|
| Poisson (Cyprinus carpio) | FBC | 25-54 | MITI, 2002 |
Même si les données expérimentales sur le FBC de la cétone de Michler étaient disponibles, on a également effectué des prévisions en utilisant les modèles sur le FBC et le facteur de bioaccumulation (FBA) disponibles, comme il est indiqué dans le tableau 5b.
Tableau 5b. FBA et FBC de la cétone de Michler chez les poissons, prévus à l’aide du modèle cinétique d’Arnot et de Gobas (2003) sans métabolisme
| Organisme d'essai | Log Koe | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|---|
| 1 Le modèle cinétique d’Arnot et de Gobas (2003) a été appliqué sans métabolisme. | ||||
| Poissons | 3,87 | FBA | 83,431 | Arnot et Gobas, 2003 (modèle modifié de Gobas sur le FBA, niveau trophique intermédiaire) |
| Poissons | 3,87 | FBC | 83,361 | Arnot et Gobas, 2003 (modèle modifié de Gobas sur le FBC, niveau trophique intermédiaire) |
| Poissons | 3,5 | FBC | 25,12 | OASIS Forecast, 2005 |
| Poissons | 3,87 | FBC | 43,18 | BCFBAF, 2009 |
Selon le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si son FBC ou son FBA est supérieur ou égal à 5 000. Toutefois, le FBC est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances. En effet, le FBC ne prend pas correctement en compte le potentiel de bioaccumulation des substances par l’alimentation, lequel est généralement un facteur important pour les substances dont le log Koe est supérieur à environ 4,0 (Arnot et Gobas, 2003). La modélisation cinétique du bilan massique est en principe considérée comme la méthode de prévision la plus fiable pour prévoir le potentiel de bioaccumulation, car elle permet une correction du métabolisme dans la mesure où le log Koe de la substance est similaire à celui du modèle. Toutefois, si le log Koe est inférieur à 4,0, comme c’est le cas pour la cétone de Michler, l’assimilation dans les poissons se fait principalement par les branchies; par conséquent, le métabolisme par l’intestin n’est pas important.
Le modèle modifié de Gobas sur le FBA pour le niveau trophique intermédiaire a prévu un facteur de bioaccumulation de 83,43 L/kg chez les poissons, ce qui indique que la cétone de Michler ne présente aucun potentiel de bioaccumulation chez les poissons ni de bioamplification dans les chaînes alimentaires. Les résultats des calculs du modèle sur les facteurs de bioconcentration fournissent une preuve supplémentaire qui appuie le faible potentiel de bioconcentration de cette substance.
Ainsi, d’après les valeurs empiriques disponibles et les valeurs cinétiques modélisées, la cétone de Michler ne satisfait pas aux critères de la bioaccumulation (FBA ou FBC = 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La démarche suivie dans cette évaluation a consisté à examiner les diverses données scientifiques disponibles et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprenaient les résultats d’un calcul prudent du quotient de risque ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité, les sources et le devenir de la substance dans l’environnement.
Comme il est décrit plus haut, la cétone de Michler a une courte demi-vie dans l’air, mais est persistante dans l’eau, le sol et les sédiments; elle devrait également présenter un faible potentiel de bioaccumulation. Les données expérimentales concernant les effets sur l’environnement sont résumées dans le tableau 6a.
Tableau 6a. Données empiriques sur la toxicité de la cétone de Michler pour les organismes aquatiques
| Organisme d'essai | Type de test | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50, concentration d’une substance qu’on estime causer certains effets toxiques sublétaux chez 50 % des organismes d’essai. | ||||
| Daphnia magna | Toxicité aiguë | CE50 | > 100 | Étude présentée, 2005 |
Au cours d’une étude sur la toxicité aiguë de la cétone de Michler en milieu aquatique fondée sur la ligne directrice no 202 de l’Organisation de coopération et de développement économiques (OCDE) pour les essais de produits chimiques, on obtenu une CE50 supérieure à 100 mg/L chez Daphnia magna (Étude présentée, 2005) (tableau 6a). Cette valeur laisse supposer que la cétone de Michler possède une toxicité aiguë faible et ne devrait pas avoir d’effets nocifs sur les organismes aquatiques à des concentrations relativement faibles.
Une plage de valeurs de toxicité pour les organismes aquatiques a été obtenue à l'aide des modèles RQSA (tableau 6b). Les prévisions des modèles indiquaient généralement une toxicité supérieure au résultat mesuré. En effet, la plupart des valeurs de toxicité modélisées sont en deçà d’un facteur de 10 de la solubilité modélisée de la substance (1,4 mg/L). Les résultats des modèles sont jugés acceptables comme ils se situent dans leur domaine d’applicabilité. Dans l’ensemble, ces résultats permettent de croire que la cétone de Michler pourrait présenter une toxicité aigüe modérée à élevée pour les organismes aquatiques.
Tableau 6b. Données modélisées sur la toxicité de la cétone de Michler pour les organismes aquatiques
| Organisme d'essai | Log Koe | Type d’essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|---|
| Abréviations : CE50, concentration d’une substance qu’on estime causer certains effets toxiques sublétaux chez 50 % des organismes d’essai; CL50, concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai. 1 Valeur critique de toxicité. |
|||||
| Poissons | 3,5 | Toxicité aiguë (96 h) | CL50 | 0,89 | TOPKAT, 2004 |
| 3,87 | 9,85 | ECOSAR, 2009 (composés organiques neutres) | |||
| s.o. | 4,42 | ASTER, 1999 | |||
| 3,5 | 142 | AIES, 2003-2005 | |||
| Daphnies | 3,5 | Toxicité aiguë (48 h) | CE50 | 3,8 | TOPKAT, 2004 |
| Daphnies | 3,5 | Toxicité aiguë (48 h) | CE50 | 7,32 | AIES, 2003-2005 |
| Daphnies | 3,87 | Toxicité aiguë (48 h) | CE50 | 6,94 | ECOSAR, 2009 (composés organiques neutres) |
| Mysis effilée | 3,87 | Toxicité aiguë (96 h) | CL50 | 3,36 | ECOSAR, 2009 (composés organiques neutres) |
On n’a trouvé aucune étude concernant les effets de cette substance sur l’environnement dans d’autres milieux que l'eau.
On utilise la cétone de Michler principalement à des fins industrielles (voir la section « Utilisations »ci-dessus); en conséquence, il peut y avoir des rejets industriels dans l’eau. En l’absence de données de surveillance environnementale, un scénario générique a été utilisé pour estimer une concentration raisonnable de cétone de Michler dans la pire éventualité par suite d’un rejet industriel, à l’aide de l’outil d’exposition générique industriel – milieu aquatique (Industrial Generic Exposure Tool – Aquatic, ou IGETA) d’Environnement Canada. La concentration environnementale estimée (CEE) a été calculée d’après la quantité maximale utilisée dans une installation, la fraction rejetée vers une usine de traitement des eaux usées, le taux d’élimination de l’usine et le débit de ses effluents ainsi que la capacité de dilution du cours d’eau récepteur (dont la superficie est supposée petite). Les principales données d’entrée étaient la fraction de la substance rejetée vers l’usine de traitement des eaux usées (0,3 % d’après Great Western Containers, 2005), résultant du nettoyage de conteneurs semi-vrac ou de bacs de manutention apparemment utilisés pour le transport de la substance, et la proportion éliminée par cette usine (43,7% d’après Environnement Canada, 2009). Une CEE de 0,0035 mg/L a été calculée. Les détails concernant les données utilisées pour estimer cette concentration et le résultat du modèle sont décrits dans le rapport IGETA d’Environnement Canada (2009).
Comme la valeur empirique de toxicité est relativement élevée (> 100 mg/L d’après l’Étude présentée, 2005) et ne constitue qu’une limite inférieure, la valeur RQSA prudente de 0,89 mg/L, qui représente la concentration létale médiane (CL50) sur 96 heures chez les poissons (TOPKAT, 2004), a été sélectionnée comme valeur critique de toxicité (VCT) pour estimer la toxicité de la cétone de Michler chez les organismes aquatiques sensibles.
Une concentration estimée sans effet (CESE) prudente a ensuite été calculée à l'aide de la VCT de 0,89 mg/L. Cette dernière valeur a été divisée par un facteur d’évaluation de 100 pour tenir compte des incertitudes liées à la variabilité interspécifique et intraspécifique de sensibilité et de l’extrapolation d’une valeur sans effet mesurée sur le terrain à partir d'une CL50 mesurée en laboratoire. Ce calcul a permis d’obtenir une CESE de 0,0089 mg/L.
Le quotient minimal de risque (CEE/CESE) qui en découle est de 0,39, ce qui indique que les expositions ne sont pas susceptibles d’avoir un effet nocif sur les organismes aquatiques. Comme il est indiqué dans la section Devenir dans l’environnement, la substance sera rejetée principalement dans l’eau et y demeurera. L’exposition d’organismes à d'autres endroits ou dans des milieux autres que l’eau est moins probable.
Comme on l’a indiqué précédemment, la cétone de Michler répond aux critères de la persistance dans l’eau, le sol et les sédiments, mais elle ne répond pas au critère de la persistance dans l’air, tel qu’il est stipulé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000). Par ailleurs, la substance ne répond pas aux critères de la bioaccumulation énoncés dans le Règlement. Les valeurs modélisées de toxicité disponibles indiquent que la cétone de Michler a un potentiel moyen à élevé de posséder une toxicité aiguë pour les organismes aquatiques. Toutefois, d’après les estimations raisonnables d’une exposition selon le scénario de la pire éventualité et d’après les concentrations sans effet, on considère qu’il est peu probable que la cétone de Michler soit présente dans les milieux naturels au Canada à des concentrations suffisantes pour avoir un effet nocif sur l’environnement. Par conséquent, d’après les renseignements disponibles, il est conclu que la cétone de Michler ne représente pas de risque pour l’environnement au Canada.
Incertitudes dans l’évaluation des risques pour l’environnement
Une incertitude est liée à l’absence de données sur les concentrations dans les milieux naturels au Canada. On a tenu compte de cette incertitude en prédisant une concentration raisonnable dans l’eau en fonction de la pire éventualité, à l’aide d’un modèle d’exposition générique industriel. Il existe également une incertitude associée à la CESE ayant servi au calcul du quotient de risque, en raison de la quantité limitée de données empiriques disponibles sur la toxicité et de la nécessité d’avoir recours à des données RQSA. Or, le facteur d’évaluation de 100 utilisé pendant le calcul de la CESE en milieu aquatique a permis en partie de tenir compte de ces incertitudes.
Il existe également des incertitudes liées à l’utilisation de modèles RQSA pour estimer la persistance et la bioaccumulation. Toutefois, comme les propriétés de la substance font partie des domaines d’applicabilité des modèles RQSA et que les divers modèles utilisés ont donné des résultats semblables, les conclusions concernant le potentiel de persistance et de bioaccumulation de la cétone de Michler sont jugées crédibles.
Évaluation de l’exposition
À la lumière des propriétés chimiques et physiques de la substance, les principales voies d’exposition à la cétone de Michler sont probablement l’exposition orale et cutanée. Une faible pression de vapeur et une faible constante de la loi de Henry indiquent que la cétone de Michler n'est pas volatile. Il est donc peu probable que la voie d’exposition par inhalation soit aussi pertinente que les voies d'exposition orale et cutanée.
Milieux naturels et alimentation
Comme on n’a repéré aucune étude de surveillance dans le cadre de laquelle on aurait mesuré les concentrations de cétone de Michler dans l’air, l’eau, le sol ou les sédiments, au Canada ou ailleurs, on a utilisé ChemCAN, un modèle d’exposition de l’environnement propre au Canada, pour prévoir les concentrations dans les milieux naturels en fonction de la quantité de la substance utilisée au Canada (ChemCAN, 2003). Le modèle prévoyait de très faibles concentrations en cétone de Michler dans ces milieux (ChemCAN, 2003). Dans ChemCAN, on a entré le volume total de cétone de Michler utilisée au Canada (de 1 000 à 10 000 kg) pour estimer les rejets au pays. Les paramètres par défaut ont servi à la modélisation. On a déterminé les estimations de la limite supérieure d’absorption de cétone de Michler pour divers groupes d’âge dans la population générale du Canada, d’après les concentrations maximales dans les milieux naturels pertinents (air, eau potable, sol) obtenues à partir de ChemCAN. L’estimation de la limite supérieure d’absorption quotidienne pour tous les groupes d’âge de la population canadienne générale était inférieure à 0,01 µg/kg de poids corporel par jour (p.c./j).
Au Canada, la cétone de Michler se trouve en quantités infimes sous forme résiduelle dans certains concentrés de matière colorante pour carton. Toutefois, comme ces applications ne sont destinées qu’aux aliments secs, il ne devrait y avoir aucune migration vers les aliments. Certains chercheurs ont étudié la possibilité que la cétone de Michler soit également présente sous forme résiduelle dans certains matériaux d’emballage alimentaire en fibres recyclées (Castle et al., 1997; Ozaki et al., 2004; id., 2006). Dans l’étude de 1997, les trois échantillons d’aliments, dans lesquels on a mesuré les concentrations les plus fortes en cétone de Michler, ont été analysés par couplage entre la chromatographie en phase gazeuse et la spectrométrie de masse après extraction et épuration. Il n’y a eu aucune migration mesurable de la cétone de Michler à une limite de détection de 2 µg/kg d’aliment (Castle et al., 1997). Dans une étude plus récente (Ozaki et al., 2004), de très faibles niveaux (1,7 à 12 µg/g) de cétone de Michler ont été trouvés dans des produits de papier recyclé, mais pas dans des produits de papier vierge. Dans une étude de suivi, Ozaki et al. (2006) ont effectué des études de migration en utilisant des solvants simulant les aliments. Lorsqu’on a utilisé de l’alcool à 95 %, une migration a alors été observée à partir de carton contenant des fibres recyclées, bien qu’à des concentrations extrêmement faibles (< 10 ng/mL) (Ozaki et al., 2006). Toutefois, puisque les produits de carton recyclé destinés à l’emballage d’aliments ont un revêtement de protection ou sont utilisés pour des aliments préemballés (c.-à-d. qu’une barrière fonctionnelle serait présente), il n’y aurait aucun contact direct avec les aliments. Par conséquent, il n’y aurait aucune exposition à la cétone de Michler à partir des aliments.
La base de données sur l’exposition à partir des milieux naturels est considérée comme peu fiable. La majorité des renseignements disponibles ne sont pas propres au Canada. On considère ces renseignements comme peu fiables parce que les données des études, les données de surveillance ou les données sur les émissions ou rejets industriels sont insuffisantes pour la modélisation des concentrations dans les milieux pertinents. La quantité de cétone de Michler utilisée dans le commerce a servi à estimer les concentrations dans les milieux pertinents.
Produits de consommation
Bien qu’il existe un certain nombre d’usages industriels de la cétone de Michler, on n’a cerné qu’un nombre limité d’applications pour les produits de consommation, plus particulièrement dans les encres, les colorants, les pigments et les teintures (Environnement Canada, 2008). L’exposition à la cétone de Michler résiduelle dans les matières colorantes des produits de papier est la forme d’exposition la plus probable de la population générale canadienne, suivie de l’exposition dans d’autres produits contenant des pigments.
Des concentrations résiduelles de cétone de Michler peuvent être présentes dans certains colorants et produits finis de consommation (Environnement Canada, 1988; NTP, 2005). En effet, la cétone de Michler peut se trouver sous forme résiduelle dans des encres d’impression ou des adhésifs à des concentrations de 0,1 à 1,6 % (FS, 2000; id., 2003b; id., 2004a; Aurela, 2001; Commission européenne, 2008), dans des rubans d’imprimante à des concentrations allant de moins 0,1 % en poids (FS, 2001a; id., 2004b; id., 2006b) à 7,2 % (ruban d’imprimante violet) (FS, 2007), dans des cartouches de ruban en nylon à moins de 0,30 % en poids (FS, 2004b), dans l’encre de stylos (à < 1 % dans des stylos à bille) (Bâle-Ville, 2003; FS, 2003a) et dans du colorant de triarylméthane (Solvant Blue 4) à 4,5 % (FS, 2001b).
On a envisagé un scénario prudent relatif aux produits de consommation pour estimer l’exposition orale à la cétone de Michler résiduelle dans des matières colorantes pour papier par suite de l’ingestion possible de papier par des enfants (annexe 1). Pour les enfants âgés de 0,5 à 4 ans, l’exposition orale par événement a été estimée à 8 × 104 mg/kg de poids corporel (p.c.). S’il est plus probable que des enfants âgés de 0,5 à 4 ans ingèrent des produits de papier que des bébés de moins de 6 mois ou des populations plus âgées, il pourrait arriver que des bébés ingèrent du papier. L’inhalation et les expositions cutanées possibles à la cétone de Michler à partir de produits de papier n’ont pas été modélisées en raison du manque de modèles disponibles. Cependant, l’exposition par ces voies est probablement très limitée en raison des propriétés physiques et chimiques de la cétone de Michler et de l’imprégnation de la matière colorante dans le papier.
L’Art and Creative Materials Institute (ACMI) de l’Université Duke a présenté des données sur l’utilisation de la cétone de Michler dans l’encre de stylos à bille et de marqueurs permanents (communication personnelle adressée à Santé Canada, 2009; source non citée dans les références). La cétone de Michler n’a été trouvée que dans l’encre de stylos à bille et de marqueurs permanents. En effet, on a découvert de la cétone de Michler dans sept encres pour stylos à bille, utilisées dans quatre traits de stylos, à des concentrations allant de 0,0023 à 0,11 %. La cétone de Michler a également été détectée dans 18 encres pour marqueurs permanents utilisées dans sept traits de marqueurs, à des concentrations allant de 0,00024 à 0,13 %.
Une quantité suffisante de données étaient disponibles pour prédire l’exposition orale et cutanée à partir de stylos à bille. Bien qu’elles soient basées sur des renseignements disponibles sur des profils d’utilisation au Canada, cette voie d’exposition est peu probable au pays (annexe 2) (Hansen et al., 2008). La valeur prudente estimée d’exposition cutanée ou orale à l’encre de stylos était de 4 × 10-3 mg/kg p.c. par événement chez les enfants âgés de 0,5 à 4 ans. Bien que dans le cadre de l’enquête effectuée en application de l’article 71 de la LCPE (1999) aucune information n’ait été reçue confirmant la présence de cétone de Michler dans les stylos vendus au Canada, l’usage de cette substance dans ce type d’encre a été signalé dans la littérature. La présence de cétone de Michler dans les encres pour stylos a été confirmée au Canada par la Direction de la Sécutité de produits de consommation de Santé Canada. A ce jour, la cétone de Michler n’a été relevé dans aucun marché d’enfants; d’autres analyses sont en cours (2010 Direction de la Sécutité de produits de consommation de Santé Canada, au Bureau des substances existantes, Santé Canada référence non citée).
D’après les données sur l’utilisation qui ont été recensées, les estimations obtenues par modélisation à partir de produits de consommation sont peu fiables. Il existe des données sur certains types de produits contenant de la cétone de Michler trouvés au Canada, mais les paramètres chimiques nécessaires pour estimer les expositions aux produits de consommation sont limités. L’exposition de la population générale à la cétone de Michler est restreinte principalement à l’utilisation de produits de papier. Toutefois, il existe une incertitude par rapport à l’ampleur de l’exposition à partir de cette source, car peu de données sont disponibles sur l’exposition à la cétone de Michler sous forme résiduelle dans la matière colorante pour produits de papier au Canada. Il existe également peu de modèles d’exposition disponibles pour ce scénario. Puisque l’exposition réelle est intermittente dans la nature, on considère que les scénarios s’appuient sur des estimations prudentes de la limite supérieure d’exposition.
Évaluation des effets sur la santé
L’annexe 3 comporte un résumé des renseignements disponibles relatifs aux effets de la cétone de Michler sur la santé.
Le National Toxicology Program des États-Unis a classé la cétone de Michler parmi les agents que l’on peut raisonnablement présumer cancérogènes pour les humains, d’après des preuves suffisantes de cancérogénicité chez des animaux de laboratoire (National Cancer Institute, 1979; NTP, 2005). De son côté, la Commission européenne a classé la cétone de Michler parmi les substances cancérogènes de catégorie 2 (substances devant être assimilées à des substances cancérogènes pour l’homme) avec la mention de risque R45 (peut causer le cancer), d’après des tumeurs observées au foie observées chez les rats et les souris (Commission européenne, 2002; id., 2004; ESIS, 2009). De plus, la Commission européenne a classé la cétone de Michler comme substance mutagène de catégorie 3 avec mention de risque R68 (possibilité d’effets irréversibles), d’après une génotoxicité in vivo dans les cellules somatiques (Commission européenne, 2002; id., 2004; ESIS, 2009). Récemment, le Centre International de Recherche sur le Cancer a classé la cétone de Michler comme cancérogène du groupe 2B (peut être cancérogène pour l’homme), d’après l’observation de tumeurs à plusieurs endroits chez les rongeurs (Baan et al., 2008).
Lorsqu’elle était administrée oralement par voie alimentaire, la cétone de Michler a induit une augmentation des cas de tumeurs au foie chez les rats mâles et femelles et chez les souris femelles, et de tumeurs des vaisseaux sanguins des souris mâles. Dans des études de cancérogénicité du National Cancer Institute (1979), les cas de carcinome hépatocellulaire ont augmenté de manière importante proportionnellement à la dose administrée chez les rats Fischer 344 mâles (0/20, 9/50 et 40/50, respectivement pour 0, 12,5 et 25 mg/kg p.c./j; p < 0,05 pour la dose faible) et chez les rats Fischer 344 femelles (0/20, 41/47 et 44/49, respectivement pour 0, 25 et 50 mg/kg p.c./j; p < 0,01 pour la dose faible) après exposition à la cétone de Michler dans l’alimentation pendant 78 semaines, suivies d’une période d’observation de 28 ou 29 semaines. Les cas de lésions néoplasiques combinées (carcinome hépatocellulaire et nodules néoplasiques) ont également augmenté de façon importante aux deux doses et chez les deux sexes (National Cancer Institute, 1979). De plus, au cours d’un test biologique de cancérogénicité sur des souris B6C3F1, les cas de carcinome hépatocellulaire ont augmenté de façon importante proportionnellement à la dose administrée (0/19, 16/49 et 38/50, respectivement pour 0, 179 et 357 mg/kg p.c./j; p < 0,01 pour la dose faible) chez les souris femelles exposées à la cétone de Michler dans l’alimentation pendant 78 semaines, suivies d’une période d’observation de 13 semaines. Chez les souris mâles, aucune augmentation notable des cas de carcinome hépatocellulaire n’a été observée, mais on a noté une augmentation importante des cas d’hémangiosarcome à la dose élevée (0/19, 5/50 et 20/50, respectivement pour 0, 179 et 357 mg/kg p.c./j; p < 0,01 pour la dose élevée) (National Cancer Institute, 1979).
La cétone de Michler s’est avérée être génotoxique dans un certain nombre de tests in vivo sur des animaux de laboratoire et de tests in vitro sur des cellules de mammifères et chez certaines souches de Salmonella (annexe 3). Lors de tests biologiques in vivo, la cétone de Michler a provoqué une augmentation importante des échanges de chromatides sœurs dans la moelle osseuse de souris Swiss ayant reçu la substance en perfusion intrapéritonéale (Parodi et al., 1982). De plus, la cétone de Michler s’est liée à l’acide désoxyribonucléique (ADN) du foie ou du rein des rats après injection intrapéritonéale (Scribner et al., 1980; Struck et al., 1981). Par ailleurs, la cétone de Michler a provoqué des dommages à l’ADN du foie qu’on a évalués au moyen du dosage par élution alcaline chez des rats Sprague-Dawley après administration par injection intrapéritonéale (Parodi et al., 1982) et par gavage (Kitchin et Brown, 1994). Elle a également induit une synthèse non programmée de l’ADN chez des rats gavés à la substance (Mirsalis et al., 1989). Lors de tests biologiques in vitro sur des cellules de mammifères, la cétone de Michler a provoqué une augmentation proportionnelle à la dose de la fréquence des mutations dans les cellules de lymphome L5178Y des souris, en présence ou en l’absence d’activateur S9 dérivé du foie (Mitchell et al., 1988; Myhr et Caspary, 1988). La cétone de Michler a engendré des aberrations chromosomiques dans les cellules d’ovaire de hamster chinois (CHO) (NTP, 1990) et dans les cellules d’embryon de hamster chinois CHE-3N (Lafi et al., 1986). La cétone de Michler a également induit un échange de chromatides sœurs dans des cellules CHO (NTP, 1990) et a provoqué une transformation des cellules Balb/c 3T3 (Tennant et al., 1986). Lors de tests bactériologiques, la cétone de Michler s’est avérée mutagène pour Salmonella typhimurium TA98 en présence d’activateur S9 (Dunkel et al., 1985; Tennant et al., 1986; Zeiger et al., 1992) et pour la souche TA1538, qui détecte les mutations de cadre de lecture (Dunkel et Simmon, 1980). Elle n’était pourtant pas mutagène pour les souches TA97, TA100, TA1535 et TA1537, qui détectent une substitution des paires de base (Scribner et al., 1980; McCarthy et al., 1983; Tennant et al., 1986) ou pour TA98 sans activateur S9 (Zeiger et al., 1992). Tous les éléments de preuve de mutagénicité, de cytogénicité et de dommages à l’ADN appuient la conclusion selon laquelle la cétone de Michler est génotoxique pour les cellules somatiques des mammifères in vitro et in vivo, ce que confirme la classification de la Commission européenne comme substance mutagène de catégorie 3, d’après sa génotoxicité in vivo pour les cellules somatiques (Commission européenne, 2002; id., 2004; ESIS, 2009).
Aucun autre organisme de réglementation n’a proposé ni déterminé les modes d’action détaillés des carcinomes hépatocellulaires et des hémangiosarcomes. De plus, l’élaboration et l’analyse des modes d’action ne s’inscrivent pas normalement dans le champ de l’évaluation préalable des risques. D’après le poids de la preuve de cancérogénicité observée chez les deux sexes des deux espèces au cours d’études sur des animaux de laboratoire menées sur deux ans, comprenant des carcinomes hépatocellulaires observés aux doses expérimentales les plus faibles, et d’après la génotoxicité démontrée de la cétone de Michler dans le cadre d’une gamme de tests in vivo et in vitro, indiquée notamment par la liaison à l’ADN du foie et les dommages à celui-ci, on conclut raisonnablement que les tumeurs observées chez les animaux de laboratoire résultent probablement de l’interaction directe avec le matériel génétique.
En ce qui concerne la toxicité chronique et la toxicité en doses répétées à court terme, l’effet critique autre que le cancer constituant le paramètre plus sensible qui a été signalé pour la caractérisation des risques que présente la cétone de Michler pour la santé humaine est la diminution du gain de poids corporel. Dans une étude sur la toxicité à court terme, une dose minimale avec effet nocif observé (DMENO) de 68 mg/kg p.c./j a été déterminée d’après un gain de poids corporel considérablement réduit (moins de 40 % du poids du témoin) chez des rats F344 exposés à 0, 68, 147, 316, 680 ou 1 467 mg/kg p.c./j de cétone de Michler dans l’alimentation pendant 4 semaines, suivies de 2 semaines d’observation. En outre, les taux de survie ont diminué à des doses supérieures (c.-à-d. deux animaux morts sur cinq à 316 mg/kg p.c./j) (National Cancer Institute, 1979). Dans une étude sur la toxicité chronique, la plus faible DMENO par voie orale était de 12,5 mg/kg p.c./j chez les rats mâles, d’après une diminution du gain de poids corporel (National Cancer Institute, 1979). Toutefois, à cette DMENO, on a également observé d’importantes tumeurs induites. L’ensemble des données ne comportait aucune étude effectuée à des niveaux d’exposition inférieurs à 12,5 mg/kg p.c./j.
Une étude toxicocinétique limitée a montré que la déméthylation, la N-hydroxylation et la Nacétylation semblaient être les principales voies de transformation de la cétone de Michler chez les rats (Struck et al., 1981). Les principaux métabolites identifiés dans la bile (après injection intraveineuse) étaient les dérivés di-déméthylés et tri-déméthylés et le composé N-acétylé tétra-déméthylé. On conclut donc qu’après la déméthylation de la cétone de Michler, les métabolites des amines aromatiques pourraient subir une Nhydroxylation ou une N-acétylation pour former des métabolites actifs pouvant se lier aux macromolécules et entraîner la cancérogénicité de la cétone de Michler (Struck et al., 1981).
La base de données sur la toxicité de la cétone de Michler est considérée comme assez fiable pour la présente évaluation préalable. Des études de dosages oraux (cancérogénicité et génotoxicité à court terme) sont disponibles. Toutefois, on n’a relevé aucune étude sur la toxicité pour la reproduction ou le développement. En outre, on a noté des effets, y compris la cancérogénicité, aux niveaux d’exposition testés les plus faibles. La plupart des études expérimentales sur des animaux de laboratoire examinaient l’exposition orale (dans l’alimentation), et aucune étude expérimentale sur l’exposition d’animaux de laboratoire à la substance par inhalation ou par voie cutanée n’était disponible. Par ailleurs, les modes d’action pour la cancérogénicité observée de la cétone de Michler n’ont pas été précisés.
Caractérisation des risques pour la santé humaine
Suivant principalement les évaluations basées sur le poids de la preuve faites par des organismes internationaux ou d’autres organismes nationaux (Commission européenne, 2002; id., 2004; NTP, 2005; Baan et al., 2008), la cancérogénicité constitue l’un des effets critiques aux fins de la caractérisation des risque de la cétone de Michler pour la santé humaine. Les cas de carcinomes hépatocellulaires chez les rats mâles et femelles et chez les souris femelles ont augmenté proportionnellement à la dose administrée, et on a noté une augmentation des cas d’hémangiosarcome chez les souris mâles. On a observé des niveaux importants de carcinome hépatocellulaire aux doses administrées les plus faibles. La cétone de Michler était génotoxique dans divers essais in vivo et in vitro. Bien que les modes d’action détaillés liés à l’augmentation des cas de carcinome hépatocellulaire et d’hémangiosarcome n’aient pas été déterminés, on estime que les tumeurs observées chez les animaux de laboratoire résultent de l’interaction directe avec le matériel génétique, et ce, d’après le poids de la preuve de cancérogénicité et de génotoxicité de la cétone de Michler.
Parmi les effets critiques autres que le cancer, le paramètre le plus sensible est la réduction du gain de poids corporel des rats mâles notée dans une étude sur la toxicité chronique (National Cancer Institute, 1979), à une DMENO par voie orale de 12,5 mg/kg p.c./j. Toutefois, à cette DMENO, on a également observé des tumeurs; par conséquent, la marge d’exposition n’est pas calculée pour les effets autres que le cancer dans la présente évaluation préalable.
On s’attend à ce que l’exposition de la population générale à la cétone de Michler dans les milieux naturels (air, eau potable et sol) soit négligeable. Ainsi, la limite supérieure d’absorption quotidienne estimée pour tous les groupes d’âge de l’ensemble de la population canadienne était de moins de 0,01 µg/kg p.c./j.
D’après les renseignements obtenus sur l’utilisation actuelle de la cétone de Michler au Canada, l’exposition de la population générale devrait être très faible et limitée à l’utilisation de produits de papier non liés à l’alimentation, contenant de la cétone de Michler sous forme résiduelle dans les matières colorantes pour papier. On s’attend à ce que l’exposition de la population générale à la cétone de Michler à partir d’autres produits de consommation comme des stylos à bille soit moins préoccupante, car la plus grande partie de la cétone de Michler au Canada est utilisée dans les produits de papier. On a élaboré un scénario sur l’exposition orale de consommateurs à partir de produits de papier pour calculer l’ingestion maximale. La limite maximale ingérée par un enfant (âgé de 0,5 à 4 ans) était de 8 × 104 mg/kg p.c. par événement. De même, on a élaboré un scénario sur l’exposition orale et cutanée de consommateurs à partir de stylos à bille pour calculer l’ingestion et l’absorption maximales. Dans ce cas, la limite maximale ingérée ou absorbée par un enfant (âgé de 0,5 à 4 ans) était de 4 × 103 mg/kg p.c. par événement.
Incertitudes dans l’évaluation des risques pour la santé humaine
Cette évaluation préalable ne prend pas en compte les différences possibles entre les humains et les espèces d’animaux de laboratoire en ce qui concerne la sensibilité aux effets de cette substance, notamment en raison du peu de données disponibles concernant les effets sur les humains et de l’absence de modèles pharmacocinétiques basés sur la physiologie pour la cétone de Michler applicables aux animaux de laboratoire ou aux humains. On suppose que les effets observés chez les deux espèces de rongeurs peuvent s’appliquer aux humains. De plus, les modes d’induction des tumeurs n’ont pas été analysés ou élucidés. Il existe peu de données toxicologiques sur les paramètres liés aux effets autres que le cancer, y compris la toxicité pour le développement et la reproduction. L’absence de DMENO pour un paramètre lié à un effet autre que le cancer, laquelle est inférieure aux doses entraînant l’induction de tumeurs, ne permet pas de calculer la marge d’exposition pour les effets autres que le cancer. En outre, les études sur des animaux de laboratoire visent uniquement l’exposition par voie orale et non l’exposition par inhalation ou par voie cutanée
Des incertitudes ont été relevées dans l’estimation de l’exposition de la population, en raison de l’utilisation de modèles et du manque de données canadiennes. Des incertitudes ont également été relevées dans les hypothèses intégrées aux modèles de scénario pour les produits de consommation, y compris les paramètres utilisés, les types exacts de produits contenant de la cétone de Michler, et la quantité et la fréquence de son utilisation au Canada. Les valeurs exprimant l’exposition des enfants de 0,5 à 4 ans à la cétone de Michler par contact oral avec du papier sont considérées comme des surestimations, puisque les hypothèses intégrées sont prudentes et que les produits de papier utilisés dans ce scénario peuvent ne pas correspondre au papier généralement utilisé par les enfants. Des incertitudes sont associées au scénario concernant les stylos à bille, car il a été adapté d’un scénario pour les marqueurs à pointe de feutre. Des incertitudes sont en outre associées à l’utilisation de stylos à bille et de marqueurs permanents par les enfants, qui devrait être limitée. En effet, peu de renseignements figuraient dans la littérature à propos de l’utilisation de la cétone de Michler dans les marqueurs, et les scénarios disponibles pour les produits de consommation étaient limités. Il subsiste une incertitude à propos de la présence possible de cétone de Michler sous forme résiduelle dans les textiles au Canada. Une entreprise ayant fourni des renseignements en vertu de l’article 71 a confirmé qu’elle n’utilisait pas de matières colorantes pour textile (communication personnelle de l’industrie adressée au Bureau des substances existantes de Santé Canada, 2009; source non citée dans les références). Toutefois, une recherche documentaire a permis d’établir la détection de la cétone de Michler dans des textiles à l’étranger. Les lacunes associées aux données sur l’exposition par voie orale sont probablement plus critiques que celles associées aux données sur l’exposition par voie cutanée et par inhalation, car il s’agit de la principale voie d’exposition. Les rejets dans l’environnement dans des milieux autres que l’air sont une autre source d’incertitude. De plus, il est possible qu’une augmentation de l’exposition à la cétone de Michler soit due à l’utilisation de violet cristallisé avec dégradation du colorant. Toutefois, la quantité totale de cétone de Michler importée et utilisée au Canada tend à indiquer que l’exposition devrait être faible
D’après les renseignements contenus dans la présente évaluation préalable, la cétone de Michler ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie. De plus, la cétone de Michler répond aux critères de la persistance définis dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000), mais non à ceux du potentiel de bioaccumulation précisés dans le Règlement.
Compte tenu de la cancérogénicité de la cétone de Michler, qui pourrait entraîner des effets nocifs à tout niveau d’exposition, et des signes de tumeurs observés aux plus petites doses administrées, il est conclu que la cétone de Michler est une substance pouvant pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est conclu que la cétone de Michler répond à au moins un des critères prévus à l’article 64 de la LCPE (1999).
De plus, s'il y a lieu, des activités de recherche et de surveillance viendront appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable. Le cas échéant, l’efficacité des mesures de contrôle possibles déterminées à l’étape de la gestion des risques.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. Accès : http://www.acdlabs.com/products/phys_chem_lab/pka
[AIES] Artificial Intelligence Expert System. 2003-2005. Version 1.25. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Disponible auprès de la Division des substances nouvelles et de la Division des substances existantes, Environnement Canada
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]. 2008. Version 1.92a. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Arnot, J.A., Gobas, F.A. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. [en ligne] 22(3):337-345. Accès : http://www3.interscience.wiley.com/journal/104557877/home [réserve de consultation]
[ASTER] Assessment Tools for the Evaluation of Risk [en ligne]. 1999. Duluth (MN) : U.S. Environmental Protection Agency, Mid-Continent Ecology Division. [consulté le 24 avril 2009]. Accès : http://www.epa.gov/med/Prods_Pubs/aster.htm[réserve de consultation].
Aurela, B. 2001. Migration of substances from paper and board food packaging materials [thèse]. Helsinki (Finlande) : University of Helsinki, Faculty of Science, KCL. Accès : http://ethesis.helsinki.fi/julkaisut/mat/kemia/vk/aurela/migratio.pdf
Baan, R., Straif, K., Grosse, Y., Secretan, B., El Ghissassi, F., Bouvard, V., Benbrahim-Tallaa, L., Cogliano, V. 2008. Carcinogenicity of some aromatic amines, organic dyes, and related exposures. Lancet Oncol. 9(4):322-323.
Bâle-Ville. 2003. Ballpoint ink / tetramethyldiaminobenzophenone (Michler’s ketone). State Laboratory of the Canton Basel City. Accès : http://www.kantonslabor-bs.ch/files/berichte/Report62.pdf
[BCFBAF] BioConcentration Factor Program for Windows [modèle d’estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2009. Version 4.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Canada. 1988. Liste de divulgation des ingrédients [en ligne]. DORS/88-64. [consultée le 9 septembre 2008]. Accès : http://laws.justice.gc.ca/fr/showdoc/cr/DORS-88-64/sc:1/20090911/fr?page=1
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C. 1999, ch. 33. Accès : http://canadagazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, le 23 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l’Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://canadagazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l’Environnement, ministère de la Santé. 2008. Loi canadienne sur la protection de l’environnement (1999) : Avis de septième divulgation d’information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 142, no 35, p. 2501-2517. Accès : http://www.gazette.gc.ca/rp-pr/p1/2008/2008-08-30/pdf/g1-14235.pdf
Castle, L., Damant, A.P., Honeybone, C.A., Johns, S.M., Jickells, S.M., Sharman, M., Gilbert, J. 1997. Migration studies from paper and board food packaging materials. Part 2. Food Addit. Contam. 14(1):45-52.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
ChemCAN [Level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/CC600.html
Cheminfo [base de données en ligne]. 2008. Michler’s Ketone. Hamilton (Ont.) : Centre canadien d’hygiène et de sécurité au travail. [consultée le 13 janvier 2009]. Accès : http://ccinfoweb.ccohs.ca/cheminfo/search.html [réserve de consultation]
Chen, C.H., Chang, C.F., Ho, C.H., Tsai, T.L., Liu, S.M. 2008. Biodegradation of crystal violet by a Shewanella sp. NTOU1. Chemosphere 72(11):1712-1720.
Chiang, W.Y., Kuo, H.T. 2002. Preparation of trimethylsilyl group containing copolymer for negative-type photoresists that enable stripped by an alkaline solution [sic]. Eur. Polym. J. 38(9):1761-1768.
Commission européenne. 2002. Summary Record: Commission Working Group on the Classification and Labelling of Dangerous Substances. ECB Ispra, 30 May–1 June 2001. Commission européenne, Direction générale du Centre commun de recherche, Institut pour la santé et la protection des consommateurs, Bureau européen des substances chimiques, ECBI/42/01 – Rev. 4. Accès : http://ecb.jrc.it/classlab/SummaryRecord/4201r4_sr_CMR0501.doc
Commission européenne. 2004. 4,4'bis(diméthylamino)benzophénone. Directive de la Commission 2004/73/CE du 29 avril 2004. Annexe 1B. Journal officiel de l’Union européenne. 16.6.2004. L 216/116. Commission européenne. 29e APT [adaptation au progrès technique]. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2004:216:0003:0310:fr:PDF
Commission européenne. 2008. Règlement (CE) no 1272/2008 du Parlement européen et du Conseil du 16 décembre 2008 relatif à la classification, à l’étiquetage et à l’emballage des substances et des mélanges, modifiant et abrogeant les directives 67/548/CEE et 1999/45/CE et modifiant le règlement (CE) no 1907/2006. Journal officiel de l’Union européenne. 31.12.2008. L 121/1. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2008:353:0001:1355:fr:PDF
Dehn, W.M. 1917. Comparative solubilities in water, in pyridine and in aqueous pyridine. J. Am. Chem. Soc. 39:1399-1404.
Dikusar, E.A. 2003. Tertiary acetylenic alcohols and peroxides derived from 4,4'bis(dimethylamino) benzophenone. J. Gen. Chem. 73(9):1406-1409.
[DTIRP] Defense Treaty Inspection Readiness Program. 2004. Guide to scheduled chemicals [en ligne]. [consulté en février 2009]. Accès : http://dtirp.dtra.mil/products/CWC/129p.htm
Dunkel, V.C., Simmon, V.F. 1980. Mutagenic activity of chemicals previously tested for carcinogenicity in the National Cancer Institute bioassay program. IARC Sci. Publ. 27:283-302.
Dunkel, V.C., Zeiger, E., Brusick, D., McCoy, E., McGregor, D., Mortelmans, K., Rosenkranz, H.S., Simmon, V.F. 1985. Reproducibility of microbial mutagenicity assays, II. Testing of carcinogens and noncarcinogens in Salmonella typhimurium and Escherichia coli. Environ. Mutagen. 7(Suppl. 5):1-248.
[ECOSAR] Ecological Structure Activity Relationships [en ligne]. 2009. Version 1.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Emmett, E.A., Taphorn, B.R., Kominsky, J.R. 1977. Phototoxicity occurring during the manufacture of ultraviolet-cured ink. Arch Dermatol 113(6):770-775.
Environnement Canada. 1988. Données relatives à la Liste intérieure des substances (LIS) de 1984-1986, recueillies en vertu du paragraphe 25(1) de la LCPE (1988) et conformément à la Liste intérieure des substances : guide du déclarant, 1988. Données produites par Environnement Canada.
Environnement Canada. 2008. Données sur les substances du lot 7 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances identifiées dans le septième lot du Défi. Données produites par la Division des substances existantes, Environnement Canada.
Environnement Canada. 2009. IGETA report: CAS RN 90-94-8, 2009-06-22. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
[EPISuite] Estimation Programs Interface for Microsoft Windows [suite de modèles d’estimation]. 2008. Version 4.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
[ESIS] European Chemical Substances Information System [base de données en ligne]. 2009. No CAS 90-94-8, 4,4'-bis(diméthylamino)benzophénone. Développée par le Bureau Européen des Substances Chimiques. [consultée en mars 2009]. Accès : http://ecb.jrc.it/esis/
Étude présentée. 2005. Robust study summary of confidential categorization voluntary data submission. Based on data collected in 1988. Gatineau (Qc) : Environnement Canada, Division des substances existantes. No d’identification de l’étude : 51CVDS. Disponible sur demande.
Fan, M. 2004. Synthesis and characterization of novel negative-working aqueous base developable photosensitive polyimide precursors. Polymer 45(4):1101-1109.
[FS] Fiche signalétique : ERC-33 (Purple) [en ligne]. 2000. Nagano-Ken (Japon) : Seiko Epson Corporation, SD Design & Engineering Support Group. Accès : http://pos.epson.com/pos/pdf/ERC33P.pdf
[FS] Fiche signalétique : Lexmark 4227 Series Printer Ribbon [en ligne]. 2001a. Lexington (KY) : Lexmark International, Inc. Accès : http://www.officeworld.com/msds/LEX13L0034.pdf
[FS] Fiche signalétique : Solvent Blue 4 [en ligne]. 2001b. Suzhou (Chine) : Suzhou Lintong Dyestuff Chemical Co., Ltd. Accès : http://www.lintong.com/msds/msds-9.htm
[FS] Fiche signalétique : Ball pen ink [en ligne]. 2003a. Consumer Information Sheet #1388. Lincoln (RI) : A.T. Cross Company. Accès : http://www.oppictures.com/MSDS/BB1388.pdf
[FS] Fiche signalétique : 7005 Ink, 7005C Ink, Ink-Type 507C [en ligne]. 2003b. London (Ont.) : Sterling Marking Products Inc. Accès : http://www.sterling.ca/7005C_Ink.pdf
[FS] Fiche signalétique : Harleco Crystal Violet [en ligne]. 2004a. Gibbstown (NJ) : EMD Chemicals Inc. Accès : http://www.vwrsp.com/msds/10/EM-/EM-192-29.pdf
[FS] Fiche signalétique : IP636: Endless Ribbon Cassette [en ligne]. 2004b. Cinnaminson (NJ) : The Turbon Group. Accès : http://www.imagestar.com/msds/65480.pdf
[FS] Fiche signalétique : Crystal Violet [en ligne]. 2006a. Fort Washington (PA) : Electron Microscopy Sciences. Accès : http://www.emsdiasum.com/microscopy/technical/msds/12785.pdf
[FS] Fiche signalétique : NK Panasonic KX-P1124 [en ligne]. 2006b. Rochester (NY) : Nukote International Inc. Accès : http://www.sprproductinformation.com/manu_folders/NUK/bm251ms.pdf
[FS] Fiche signalétique : Purple Ribbon [en ligne]. 2007. Mount Laurel (NJ) : Oki Data Americas, Inc. Accès :
http://my.okidata.com/MSDS_Down.nsf/9586d74f44109124852571
b600520157/5093783f49e0abe28525723d00549cad/$FILE/
58308301.pdf
[GEMS] Graphical Exposure Modeling System. 1987. PCCHEM [méthode d’estimation de la solubilité dans l’eau]. Washington (DC) : U.S. Environmental Protection Agency, Office of Pesticides and Toxic Substances (HSDB/1316).
Gessner, T., Mayer, U. 2000. Triarylmethane and diarylmethane dyes. In: Ullmann’s encyclopedia of industrial chemistry, vol. 37. p. 445-499. Accès : http://mrw.interscience.wiley.com/emrw/9783527306732/ueic/article/
a27_179/current/abstract
Granchak, V.M., Kotsyuba, T.S., Chemerskaya, Z.F., Dlung, I.I. 1995. The role of oxygen in the origin of the synergistic effect of benzophenone and Michler’s ketone in the initiation of radical polymerization. Theor. Exp. Chem. 31(2):91-94.
Great Western Containers. 2005. Standard for return of empty intermediate bulk containers (IBC). Accès : http://www.gwcontainers.com/Portals/0/Return%20Standards.pdf
Hansch, C., Leo, A., Hoekman, D. 1995. Exploring QSAR?Hydrophobic, electronic, and steric constants. Washington (DC) : American Chemical Society.
Hansen, P.L., Tønning, K., Malmgren-Hansen, B. 2008. Survey and health assessment of chemical substances in hobby products for children. Danish Ministry of the Environment, Environmental Protection Agency (Danish EPA). Survey of Chemical Substances in Consumer Products, no 93. Accès : http://www2.mst.dk/common/Udgivramme/Frame.asp?http://www2.mst.dk/udgiv/publications/
2008/978-87-7052-763-7/html/default_eng.htm
Heidelberger, C., Freeman, A.E., Pienta, R.J., Sivak, A., Bertram, J.S., Casto, B.C., Dunkel, V.C., Francis, M.W., Kakunaga, T., Little, J.B., et al. 1983. Cell transformation by chemical agents?a review and analysis of the literature. A report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutat. Res. 114:283-385.
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Version 3.20. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Hine, J., Mookerjee, P.K. 1975. Structural effects on rates and equilibriums. XIX. Intrinsic hydrophobic character of organic compounds. Correlations in terms of structural contributions. J. Org. Chem. 40:292-298.
[HSDB] Hazardous Substances Data Bank [base de données en ligne]. 1983-. Bethesda (MD) : National Library of Medicine (États-Unis). [consultée en avril 2009]. Accès : http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?HSDB
Huang, J., Zaijun, L., Sheng, C. 1999. Preparation and characterization of a novel star ABC triblock copolymer of styrene, ethylene oxide, and methacrylic acid. Macromol. Rapid Commun. 20(7):394-400.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2008. Gatineau (Qc) : Environnement Canada. [consultée en décembre 2008]. Accès : http://www.ec.gc.ca/pdb/querysite/query_e.cfm
Kitchin, K.T., Brown, J.L. 1994. Dose response relationship for rat liver DNA damage caused by 49 rodent carcinogens. Toxicology 88:31-49.
[KOWWIN] Octanol–Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.67a. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006 ]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Lafi, A., Parry, J.M., Parry, E.M. 1986. The effect of Michler’s ketone on cell division chromosome number and structure in culture Chinese hamster cells. Mutagenesis 1(1):17-20.
Lewis, R.J. Sr. 2007. Tetramethyldiaminobenzophenone. In : Hawley’s condensed chemical dictionary. 15e éd. New York (NY) : Wiley-Interscience/John Wiley & Sons. p. 1225-1226.
McCarthy, D.J., Suling, W.J., Hill, D.L. 1983. A comparison of the mutagenicity and macromolecular binding of the carcinogens Michler’s ketone and reduced Michler’s ketone. Mutat. Res. 119(1):7-14.
[Merck] The Merck Index: An encyclopedia of chemicals, drugs, and biologicals. 14e éd. 2006. Whitehouse Station (NJ) : Merck and Co., Inc. p. 1065.
Mirsalis, J.C., Tyson, C.K., Steinmetz, K.L., Loh, E.K., Hamilton, C.M., Bakke, J.P., Spalding, J.W. 1989. Measurement of unscheduled DNA synthesis and S-phase synthesis in rodent hepatocytes following in vivo treatment: testing of 24 compounds. Environ. Mol. Mutagen. 14:155-164.
Mitchell, A.D., Rudd, C.J., Caspary, W.J. 1988. Evaluation of the L5178Y mouse lymphoma cell mutagenesis assay: intralaboratory results for sixty three coded chemicals tested at SRI International. Environ. Mol. Mutagen. 12(Suppl. 13):37-101.
[MITI] Ministry of International Trade & Industry (Japon). 2002. Biodegradation and bioaccumulation: data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Ministry of International Trade & Industry, Basic Industries Bureau, Chemical Products Safety Division, Chemicals Inspection & Testing Institute.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.43. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 22 juin 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Munch, J.C., Franco, M., Friedland, B. 1964. Sensitivity of color tests for nitrites, nitrates, and glyceryl trinitrate. I. Solutions in distilled water. J Pharm Sci 54(7):832-833.
Myhr, B.C., Caspary, W.J. 1988. Evaluation of the L5178Y mouse lymphoma cell mutagenesis system: intralaboratory results for sixty-three coded chemicals tested at Litton Bionetics, Inc. Environ. Mol. Mutagen. 12(Suppl. 13):103-194.
Nagarajan, R., Bowers, J.S., Cui, H., Muller, A.J., Eubanks, J.R.I., Wu, Z., Geiger, C.C. 2000. A novel initiator for curing pigmented coatings. Surface Coatings Int. 83(4):181-184.
National Cancer Institute (États-Unis). 1979. Bioassay of Michler’s ketone for possible carcinogenicity. CAS No. 90-94-8. (Technical Report Series No. 181). Rockville (MD) : U.S. Department of Health, Education, and Welfare, Public Health Service, National Institutes of Health. Accès : http://ntp-apps.niehs.nih.gov/ntp_tox/index.cfm
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Columbus (OH) : American Chemical Society. [consultée le 11 décembre 2006]. Accès : http://www.cas.org/products/cd/nci/index.html
[NTP] National Toxicology Program (États-Unis). 1983. Michler’s ketone. Chromosome aberration study. Study ID 242025. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Accès : http://ntp-apps.niehs.nih.gov/ntp_tox/index.cfm
[NTP] National Toxicology Program (États-Unis). 1990. Michler’s ketone. Chromosome aberration study. Study ID 913588. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Accès : http://ntp-apps.niehs.nih.gov/ntp_tox/index.cfm
[NTP] National Toxicology Program (États-Unis). 2005. Substance profile: Michler’s ketone (4,4'-(dimethylamino)benzophenone). In : Report on carcinogens. 11e éd. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. [consulté le 20 avril 2009]. Accès : http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s113mich.pdf
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [consulté le 27 avril 2009]. Accès : http://oasis-lmc.org/?section=software
Onen, A. 2001. Synthesis of a novel addition-fragmentation agent based on Michler’s ketone and its use as photo-initiator for cationic polymerization. Polymer 42(16):6681-6685.
Ozaki, A., Yamaguchi, Y., Fujita, T., Kuroda, K., Endo, G. 2004. Chemical analysis and genotoxicological safety assessment of paper and paperboard used for food packaging. Food Chem. Toxicol. 42:1323-1337.
Ozaki, A., Kawasaki, C., Kawamura, Y., Tanamoto, K. 2006. Migration of bisphenol A and benzophenones from paper and paperboard products used in contact with food. Food Hyg. Soc. Jpn 47(3):99-104.
Parodi, S., Santi, L., Russo, P., Albini, A., Vecchio, D., Pala, M., Ottaggio, L., Carbone, A. 1982. DNA damage induced by auramine O in liver, kidney, and bone marrow of rats and mice and in a human cell line (alkaline elution assay and SCE induction). J Toxicol Environ Health 9(5-6):941-952.
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d’estimation]. 2009. Version 2.0. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 22 juin 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[PhysProp] Interactive PhysProp Database [base de données en ligne]. 2006. Syracuse (NY) : Syracuse Research Corporation [consultée en mars 2006]. Accès : http://www.syrres.com/what-we-do/databaseforms.aspx?id=386
Pillai, P.K.C., Tripathi, A.K., Narula, G.K., Mendiratta, R.G. 1982. Electrophotographic characteristics of Michler’s ketone in polycarbonate binder layers. J. Mater. Sci. 17(10):3013-3020.
Röper, M., Gehrer, E., Narbeshuber, T., Siegel, W. 2000. Acylation and alkylation. In : Ullmann’s encyclopedia of industrial chemistry, vol. 1. Wiley-VCH. p. 337-382.
[RTECS] Registry of Toxic Effects of Chemical Substances. 2008. Record for benzophenone, 4,4'-bis(dimethylamino)-. [mis à jour en novembre 2008; consulté le 15 mai 2009]. Hamilton (Ont.) : Centre canadien d’hygiène et de sécurité au travail. Accès : http://ccinfoweb.ccohs.ca/rtecs/search.html [réserve de consultation]
Salafranca, J., Franz, R. 2000. Study into the suitability of several food simulating matrices for migration testing of Michler’s ketone and related aromatic amines from food packaging cardboard materials. Dtsch Lebensmitt Rundsch 96(10):355-363.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu.
Schafer, E.W. Jr, Bowles, W.A. Jr, Hurlbut, J. 1983. The acute oral toxicity, repellency, and hazard potential of 998 chemicals to one or more species of wild and domestic birds. Arch. Environ. Contam. Toxicol. 12(3):355-382. [cité dans RTECS, 2008].
Scribner, J.D., Koponen, G., Fisk, S.R., Woodworth, B. 1980. Binding of the dye intermediates Michler’s ketone and methane base to rat liver nucleic acids and lack of mutagenicity in Salmonella typhimurium. Cancer Lett. 9(2):117-121.
Shen, W.H., Yo, A.J., Gong, B.M. 1984. Deep-ultraviolet characteristics of a photosensitive polyimide. In : Mittal, K.L., éd. Proceedings of the first technical conference on polyimides, Ellenville (NY), November 10–12, vol. 2. New York (NY) : Plenum. p. 947-954.
Spange, S., El-Sayed, M., Muller, H., Rheinwald, G., Lang, H., Poopitz, W. 2002. Solid-state structures of N-substituted Michler’s ketones and their relation to solvatochromism. Eur. J. Org. Chem. 2002(24):4159-4168.
Struck, R.F., Shih, T.W., Johnston, T.P., Kirk, M.C., Hill, D.L. 1981. Metabolism and macromolecular binding of the carcinogen Michler’s ketone in rats. Xenobiotica 11(8):569-577.
Tanaka, J., Kikkawa, H., Shoji, F., Satou, H., Katoaoka, F. 1993. Photosensitive polyamic acids developable with aqueous alkaline solutions. Mater. Res. Soc. 305:79-94.
Techrainbow. 2009. Narucure-CS (Tetra-ethyl Michler’s ketone). Fiche d’information [en ligne]. Gaithersburg (MD) : Techrainbow. Accès : http://www.techrainbow.com/html/fine_chemicals.html
Tennant, R.W., Stasiewicz, S., Spalding, J.W. 1986. Comparison of multiple parameters of rodent carcinogenicity and in vitro genetic toxicity. Environ. Mutagen. 8:205-227.
Thetford, D. 2000. Triphenylmethane and related dyes. In : Kirk-Othmer encyclopaedia of chemical technology, 2001. John Wiley & Sons, Inc. [consulté le 26 juin 2007]. Accès : http://www.mrw.interscience.wiley.com/emrw/9780471238966/home]
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. [consulté le 6 mars 2006]. Accès : http://www.accelrys.com/products/topkat/index.html
[TRI] Toxics Release Inventory Program [en ligne]. 1994. Washington (DC) : U.S. Environmental Protection Agency. Accès : http://www.epa.gov/triexplorer/
[TRI] Toxics Release Inventory Program [en ligne]. 1997. Washington (DC) : U.S. Environmental Protection Agency. Accès : http://www.epa.gov/triexplorer/
[US EPA] U.S. Environmental Protection Agency. 2008. Child-specific exposure factors handbook [en ligne]. Washington (DC) : U.S. Environmental Protection Agency. Accès : http://cfpub.epa.gov/ncea/cfm/recordisplay.cfm?deid=199243
von der Hude, W., Behm, C., Gurtler, R., Basler, A. 1988. Evaluation of the SOS chromotest. Mutat. Res. 203:81-94.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.41a. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 22 juin 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Yasuda, K., Sata, H., Hirakata, J. 2008. Liquid crystal display device [demande de brevet]. Alexandria (VA) : Fujifilm Corporation. Accès : http://www.faqs.org/patents/app/20080212003
Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K. 1992. Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals. Environ. Mol. Mutagen. 19(Suppl. 21):2-141.
Zimmermann, Y., Spange, S. 2002a. Probing surface acidity, basicity, and dipolarity/polarizability of 12-tunstophosphoric acid by means of solvatochromic dyes. New J. Chem. 23:1179-1184.
Zimmermann, Y., Spange, S. 2002b. Solvent influence on the catalytic activity and surface polarity of inorganic solid acids. J Phys Chem 106(48):12524-12530.
Zimmermann, Y., Anders, S., Hofmann, K., Spange, S. 2002. Influence of chemical solvent properties on the external and internal surface polarity of silica particles in a slurry. Langmuir 18(24):9578-9586.
Annexe 1 : Limite supérieure estimée de l’exposition à la cétone de Michler à partir de l’ingestion de papier par des enfants âgés de 6 mois à 4 ans
| Produits de consommation | Hypothèses | Exposition estimée (mg/kg p.c. par événement) |
|---|---|---|
| 1 La plus forte concentration de cétone de Michler dans du papier a été trouvée grâce à une recherche bibliographique. Selon cette source, la cétone de Michler a été uniquement décelée dans des matières en papier recyclé et non dans des produits de papier vierge (Ozaki et al., 2004). 2 Le poids corporel supposé était de 15,5 kg (Santé Canada, 1998). |
||
| Papier (à usage multiple) | Pour le papier à usage multiple standard, 500 feuilles (de dimensions 17 × 22 pouces) pèsent ~ 9 kg; une feuille pèse donc (9 kg)/500 = 0,018 kg. Comme les dimensions d’une feuille de papier standard sont de 8,5 × 11 pouces, une telle feuille de papier pèse (0,018 kg) × [(8,5 × 11)/(17 × 22)] ou ~ 0,0045 kg (~ 45 g). On a supposé de façon prudente que le quart de toute la cétone de Michler contenue dans une feuille de papier avait été ingéré (~ 1 g de papier). La plus forte concentration de cétone de Michler détectée dans le papier ou le carton recyclé est de 12,0 µg/g (1,2 × 10-2 mg/g).1 On a supposé que la cétone de Michler a été complètement absorbée. Ingestion orale estimée : Ingestion = [Concentration (en poids) de cétone de Michler dans le papier × poids de papier ingéré] / poids corporel Pour les enfants de 0,5 à 4 ans2 : Ingestion = [(1,2 × 10-2 mg/g) × (1 g)] / 15,5 kg = 8 × 10-4 mg/ kg p.c. |
Exposition orale, pour les enfants de 0,5 à 4 ans : 8 × 10-4 mg/kg p.c. par événement |
Annexe 2 : Limite supérieure estimée de l’exposition cutanée et orale à la cétone de Michler à partir de stylos à bille et de marqueurs chez les enfants âgés de 6 mois à 4 ans
| Produits de consom-mation | Exposition quotidienne orale ou cutanée estimée1 | Estimation de l’exposition (mg/kg p.c. par événement) |
|---|---|---|
| 1 Ce scénario prudent englobe à la fois l’exposition cutanée et l’exposition orale accidentelle en suçant l’objet ou en portant la main à la bouche. Comme il est fondé sur une exposition quotidienne pendant toute la vie de l’enfant ou de l’adulte, l’exposition réelle sera probablement plus faible. On suppose une absorption de 100 % (pour englober l’exposition résultant d’un geste de la main à la bouche et d’un contact direct avec l’objet). Toutefois, selon les propriétés de la substance, l’exposition cutanée et orale chez les adultes sera surestimée (apparemment négligeable). 2 Concentration à 0,124 % obtenue auprès de la bibliothèque cantonale du canton de Bâle-Ville. Cette concentration est basée sur un extrait d’HCl, avec lequel l’ingestion par l’estomac a été simulée (Bâle-Ville, 2003). 3 Cette tranche d’âge est considérée comme la plus exposée à la substance par l’utilisation de marqueurs ou de stylos, particulièrement en ce qui concerne la voie orale (US EPA, 2008). 4 Cette hypothèse a été examinée et considérée comme prudente par la Direction des sciences de la santé de la Commission de surveillance des produits de consommation des États-Unis et du département des services de santé de Californie (communication personnelle de l’ACMI adressée à Santé Canada, 2009; source non citée dans les références). 5 Communication personnelle de l’ACMI adressée à Santé Canada, 2009; source non citée dans les références. |
||
| Stylos à bille et marqueurs | Exposition aiguë ou à court terme : On a supposé qu’une aire correspondant à deux paumes de main d’enfant de 5 × 5 cm (50 cm2) pouvait être couverte d’encre (Hansen et al., 2008). La quantité d’encre transférée sur 50 cm2 a été estimée à 50 mg pour les marqueurs (Hansen et al., 2008). Ingestion/absorption = [concentration de cétone de Michler dans l’encre du stylo (en poids) × quantité d’encre estimée par exposition (50 mg) × fraction absorbée] / poids corporel (kg) Paramètres utilisés : concentration maximale de cétone de Michler : 0,124 %2(fraction de 0,00124 en poids); poids corporel de 15,5 kg pour des enfants de 0,5 à 4 ans (Santé Canada, 1998)3 Ingestion/absorption = (0,00124 × 50 mg × 1) / 15,5 kg = 4 × 103 mg/kg p.c. Exposition chronique : L’Art and Creative Materials Institute (ACMI) de l’Université Duke a émis l’hypothèse qu’un enfant absorbe quotidiennement l’encre d’un trait de 25 cm par exposition cutanée ou orale accidentelle1, 4 (communication personnelle adressée à Santé Canada, 2009; source non citée dans les références). On a détecté de la cétone de Michler dans des stylos (à des concentrations allant de 0,0023 à 0,11 %) ayant un taux de couverture de l’encre de 2 à 7 µg/cm et dans des marqueurs (à des concentrations allant de 0,00024 à 0,13 %) ayant un taux de couverture de l’encre de 100 à 352 µg/cm5. Enfants de 0,5 à 4 ans Ingestion/absorption= [(concentration de cétone de Michler dans l’encre de stylo ou de marqueur (en poids) × taux de couverture de l’encre (µg/cm) × 25 cm de trait d’encre par jour / 1000] / 15,5 kg Ingestion/absorption à partir de stylos (faible à élevée) = 7,42 × 108 à 1,24 × 105 mg/kg p.c. Ingestion/absorption à partir de marqueurs (faible à élevée) = 3,87 × 107 à 7,38 × 104 mg/kg p.c. |
Exposition orale et cutanée chez des enfants de 0,5 à 4 ans : Aiguë ou à court terme : 4 × 10-3 mg/kg p.c. par événement Chronique : |
| Paramètre | Concentrations ou doses minimales avec effet1/Résultats |
|---|---|
| 1 DL50, dose létale médiane; DMENO, dose minimale avec effet nocif observé. | |
| Animaux de laboratoire et cellules | |
| Toxicité aiguë | DL50 orale (oiseau sauvage) = 100 mg/kg p.c. (Schafer et al., 1983) |
| Toxicité à court terme en doses répétées | Plus faible DMENO par voie orale : 68 mg/kg p.c./j, selon un gain de poids corporel réduit (-40 %) chez les rats mâles F344 (5 par sexe et par groupe) exposés à la cétone de Michler par voie alimentaire à une concentration de 0, 680, 1 465, 3 155, 6 800 ou 14 665 mg/kg (équivalant à 0, 68, 147, 316, 680 ou 1 467 mg/kg p.c./j) pendant 4 semaines, suivies de 2 semaines d’observation. Deux rats femelles sur cinq sont morts à 316 mg/kg p.c./j (National Cancer Institute, 1979). Autre DMENO par voie orale : 600 mg/kg p.c./j, selon un gain de poids corporel réduit chez les souris B6C3F1 (5 par sexe par groupe) exposées à la cétone de Michler par voie alimentaire à une concentration de 0, 440, 1 390, 3 000, 6 400 ou 13 900 mg/kg (équivalant à 0, 88, 275, 600, 1 280 ou 2 780 mg/kg p.c./j) pendant 4 semaines, suivies de 2 semaines d’observation (National Cancer Institute, 1979) Aucune étude sur l’exposition par inhalation ou par voie cutanée n’a été recensée. |
| Toxicité chronique/ cancérogénicité |
Cancérogénicité par voie orale chez les rats : Un groupe de 50 rats Fischer 344 mâles (20 témoins) s’est vu administrer de la cétone de Michler dans l’alimentation à une concentration de 0, 250 ou 500 mg/kg p.c. (correspondant à 0, 12,5 et 25 mg/kg p.c./j) pendant 78 semaines, suivies d’une période d’observation de 28 semaines. Les cas de carcinome hépatocellulaire ont augmenté de manière importante proportionnellement à la dose administrée (0/20, 9/50 et 40/50, respectivement pour 0, 12,5 et 25 mg/kg p.c./j). De la même façon, un groupe de 50 rats Fischer 344 femelles (20 témoins) s’est vu administrer de la cétone de Michler par voie alimentaire à une concentration de 0, 500 ou 1 000 mg/kg (correspondant à 0, 25 et 50 mg/kg p.c./j) pendant 78 semaines, suivies d’une période d’observation de 28 à 29 semaines. Les cas de carcinome hépatocellulaire ont aussi augmenté de manière importante proportionnellement à la dose administrée chez les rats femelles (0/20, 41/47 et 44/49, respectivement pour 0, 25 et 50 mg/kg p.c./j). Les cas combinés de lésions néoplasiques (carcinomes hépatocellulaires et nodules néoplasiques) ont augmenté de manière importante aux deux doses et chez les deux sexes (National Cancer Institute, 1979). Cancérogénicité par voie orale chez les souris : Des groupes de 50 souris mâles et 50 souris femelles B6C3F1 se sont vu administrer de la cétone de Michler par voie alimentaire à une concentration de 0, 1 250 ou 2 500 mg/kg (correspondant à 0, 179 et 357 mg/kg p.c./j) pendant 78 semaines, suivies d’une période d’observation de 13 semaines. Chez les souris femelles, les cas de carcinome hépatocellulaire ont augmenté de manière importante proportionnellement à la dose administrée (0/19, 16/49 et 38/50, respectivement pour 0, 179 et 357 mg/kg p.c./j). Chez les souris mâles, on n’a observé aucune augmentation substantielle des cas de carcinome hépatocellulaire, mais on a noté une augmentation importante des cas d’hémangiosarcome dans le système circulatoire à la dose élevée (0/19, 5/50 et 20/50, respectivement pour 0, 179 et 357 mg/kg p.c./j) (National Cancer Institute, 1979). Effets non néoplasiques : Dans les mêmes études décrites ci-dessus menées sur des rats et des souris des deux sexes, une chute du poids corporel proportionnelle à la dose administrée a été constatée tout le long du test biologique. On a notéun taux de survie proportionnel à la dose administrée chez les rats et un taux de survie réduit chez les souris mâles à la dose maximale. On a établi la DMENO à 12,5 mg/kg p.c./j chez les rats mâles et à 179 mg/kg p.c./j chez les souris mâles, d’après un gain réduit de poids corporel (National Cancer Institute, 1979). Cependant, à ces DMENO, des tumeurs ont aussi été observées. Aucune étude sur l’exposition par inhalation ou par voie cutanée n’a été recensée. |
| Génotoxicité et paramètres connexes : bactéries in vitro | Mutagénicité Résultats positifs : Chez Salmonella typhimurium (souche TA98) en présence d’activateur S9 dérivé du foie de rat ou de hamster. Les doses allaient de 0 à 10 mg/plaque (Dunkel et al., 1985; Tennant et al., 1986; Zeiger et al., 1992). Un résultat positif a aussi été observé chez TA1538 (Dunkel et Simmon, 1980). Résultats négatifs : Chez Salmonella typhimurium (souches TA97, TA100, TA1535 et TA1537) en présence ou en l’absence d’activation métabolique par un activateur S9 dérivé du foie de rat ou de hamster (Tennant et al., 1986). Des résultats négatifs ont aussi été observés pour TA98 sans activateur S9 (Zeiger et al., 1992), TA1538 et TA100 (Scribner et al., 1980; McCarthy et al., 1983). Résultats négatifs : Chez Escherichia coli (souche WP2 uvrA)à des concentrations allant jusqu’à 3,3 mg/plaque, avec ou sans activation métabolique par un activateur S9 dérivé du foie de rat ou de hamster (Dunkel et al., 1985) Dommages à l’ADN Résultats négatifs : Aucune inhibition de croissance observée lors de l’essai de recombinaisonsur les souches M45 (rec-) et H17 (rec+) de Bacillus subtilis jusqu’à 1 mg/disque (Ozaki et al., 2004) Résultats négatifs : Dans le chromotest SOS sur la souche PQ37 d’Escherichia coli, avec ou sans activation métabolique S9 (von der Hude et al., 1988) |
| Génotoxicité et paramètres connexes : cellules de mammifères in vitro | Mutagénicité Résultats positifs : Une augmentation proportionnelle à la dose des fréquences de mutation a été observée dans les cellules de lymphome L5178Y de souris, en présence ou en l’absence d’activation métabolique par un activateur S9 dérivé du foie (Mitchell et al., 1988; Myhr et Caspary, 1988). Aberrations chromosomiques Résultats positifs : Dans les cellules d’ovaire de hamster chinois (CHO) exposées à des concentrations de cétone de Michler de 65 à 300 µg/ml, en présence d’activateur S9, avec un temps de récolte de 16,5 à 20,5 h (NTP, 1990) Résultats positifs : Dans les cellules d’embryon de hamster chinois CHE-3N exposées à une concentration de cétone de Michler allant jusqu’à 1,5 µg/mL (Lafi et al., 1986) Résultats négatifs : Dans les cellules CHO exposées à des concentrations de cétone de Michler de 65 à 300 µg/mL, en l’absence d’activateur S9 (NTP, 1990), ou allant jusqu’à 5 mg/mL, en présence ou en l’absence d’activateur S9 avec un temps de récolte de 12 à 14 h (NTP, 1983) Échange de chromatides sœurs Résultats positifs : Dans les cellules CHO exposées à une concentration de cétone de Michler allant jusqu’à 300 µg/mL, en présence ou en l’absence d’activateur S9 (NTP, 1990) Aneuploïdie Résultats positifs : Dans les cellules d’embryon de hamster chinois CHE-3N exposées à une concentration de cétone de Michler de 0,75 ou 1,5 µg/mL (Lafi et al., 1986) Test de transformation cellulaire Résultats positifs : Dans les cellules Balb/c 3T3, sans activateur S9 (Tennant et al., 1986) Résultats positifs : Dans les cellules d’embryon de rats infectés par le RLV (Heidelberger et al., 1983) Dommages à l’ADN Résultats négatifs : Aucun dommage à l’ADN (par essai comète) observé dans les cellules HL60 (cellules présentant des signes de leucémie promyélocytaire chez l’humain) exposées à des concentrations de cétone de Michler allant jusqu’à 25 µg/mL (Ozaki et al., 2004) |
| Génotoxicité et paramètres connexes : in vivo | Échange de chromatides sœurs Résultats positifs : Échange de chromatides sœurs induit par la cétone de Michler dans la moelle osseuse de souris Swiss ayant reçu par injection intrapéritonéale une dose de 7,5, 15 ou 30 mg/kg p.c. (Parodi et al., 1982) Liaison à l’ADN Résultats positifs : Liaison de la cétone de Michler à l’ADN du foie chez les rats Fischer 344 mâles ayant reçu par injection intrapéritonéale des matières radiomarquées à une dose de 0,009, 0,9 ou 9 mg/rat (Scribner et al., 1980) Résultats positifs : Liaison à l’ADN du foie et des reins de rats Osborne-Mendel prétraités au phénobarbital et ayant reçu par injection intrapéritonéale de la cétone de Michler marquée au carbone 14, à une dose de 2,5 mg/rat (Struck et al., 1981) Dommages à l’ADN Résultats positifs : Synthèse non programmée de l’ADN induite par la cétone de Michler chez les rats Fischer 344 mâles exposés par gavage à une dose de 200 ou de 1 000 mg/kg p.c. (Mirsalis et al., 1989) Résultats positifs : Dommages à l’ADN du foie causés par la cétone de Michler, évalués au moyen du test d’élution alcaline, chez des rats Sprague-Dawley ayant reçu par injection intrapéritonéale une dose de 7,5 ou 15 mg/kg p.c. (Parodi et al., 1982) Résultats positifs : Dommages à l’ADN du foie causés par la cétone de Michler, évalués au moyen du test d’élution alcaline, chez des rats Sprague-Dawley ayant reçu par gavage une dose de 150 mg/kg p.c. (Kitchin et Brown, 1994) |
| Humains | |
| Aucune donnée épidémiologique n’était disponible. | |