Évaluation préalable pour le Défi concernant le
Archivée
1,4-Dioxane
Numéro de registre du Chemical Abstracts Service
123-91-1
Environnement Canada
Santé Canada
Mars 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs écologiques nocifs
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Limites supérieures des estimations de l'absorption quotidienne de 1,4-dioxane par la population générale du Canada
- Annexe 2 : Estimations de l'absorption de 1,4-dioxane présent dans les additifs alimentaires
- Annexe 3 : Scénarios de calculs pour les échantillons selon le ConsExpo
- Annexe 4 : Résumé des renseignements sur les effets du 1,4-dioxane
- Annexe 5 : Sommaire des marges d'exposition pour le 1,4-dioxane
En application de l'article 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE(1999)], les ministres de l'Environnement et de la Santé ont effectué une évaluation préalable du 1,4-dioxane, dont le numéro de registre du Chemical Abstracts Service est 123-91-1. Une priorité élevée a été accordée à l’évaluation préalable de cette substance inscrite au Défi lancé par les ministres, car elle présente un risque d’exposition intermédiaire pour les particuliers au Canada et a été classée par d'autres organismes en fonction de sa cancérogénicité. La substance ne répondait pas aux critères environnementaux de la catégorisation relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation sur le 1,4-dioxane est donc axée sur les risques pour la santé humaine.
Selon les renseignements déclarés conformément à l'article 71 de la LCPE(1999), entre 10 000 et 100 000 kg de 1,4dioxane ont été importés et fabriqués au Canada en 2006. De plus, les entreprises canadiennes ont déclaré avoir utilisé entre 10 000 et 100 000 kg de cette substance. En ce qui a trait aux rejets dans l'environnement, entre 10 000 et 100 000 kg de 1,4-dioxane y ont été rejetés en 2006, la plus grande partie ayant pénétré dans l'eau et dans l'air. Au Canada, le 1,4-dioxane est principalement utilisé comme solvant dans la recherche et le développement. Toutefois, on le trouve également sous la forme d'une impureté dans les substances éthoxylées, qui sont utilisées dans de nombreuses industries (produits de soins personnels, détergents, matériaux d'emballage des aliments, etc.).
D'après les renseignements disponibles sur les concentrations présentes dans l’environnement et les résultats d’une enquête réalisée en application de l’article 71 de la LCPE(1999), les sources d'exposition de la population générale au 1,4-dioxane seraient les milieux environnementaux (air ambiant, air intérieur, aliments et eau potable) ainsi que l'utilisation par les consommateurs de produits (produits de soins personnels et produits ménagers) contenant cette substance.
En s’appuyant principalement sur les évaluations de plusieurs organismes internationaux et nationaux réalisées selon la méthode du poids de la preuve et des données toxicologiques disponibles, les effets critiques associés à l’exposition au 1,4-dioxane suivant une exposition orale ou par inhalation à la substance, mais non après une exposition par voie cutanée, sont des tumorigenèses ainsi que d’autres effets systémiques, principalement des dommages aux reins et au foie, et ce, par toutes les voies d’exposition (orale, cutanée et inhalation). L'ensemble des données indique que le 1,4-dioxane n'est pas une substance mutagène et qu'elle présentait, dans certains essais, une faible clastogénicité à des niveaux d'exposition élevés, et non dans d'autres essais souvent associés à la cytotoxicité. Compte tenu des données toxicologiques, toxicocinétiques et toxicodynamiques disponibles, une approche fondée sur le seuil d'innocuité a été utilisée pour évaluer le risque pour la santé humaine. Une dose sans effet nocif observé pour les effets nocifs chroniques, ainsi qu'une concentration à laquelle aucune tumeur n’a été observée, a été établie chez des rats exposés au 1,4-dioxane dans l'eau potable sur une période de deux ans.
Les marges entre les limites supérieures estimatives de l’exposition dans les milieux naturels et l'utilisation de produits de consommation, à la lumière de la fréquence et du profil d'utilisation de la substance, des expositions mises en commun ainsi que des concentrations associées aux effets chez les animaux de laboratoire, sont considérées comme suffisamment protectrices pour tenir compte des données manquantes et des incertitudes inhérentes à l'évaluation des risques pour la santé humaine.
Compte tenu de la pertinence des marges d’exposition entre les estimations prudentes de l’exposition au 1,4-dioxane et des niveaux d’effet critique chez les animaux de laboratoire, il est conclu que le 1,4-dioxane est considéré comme une substance ne pénétrant pas dans l’environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un danger pour la vie ou la santé humaine.
D’après les valeurs empiriques disponibles, le 1,4-dioxane devrait se dégrader seulement dans l’air, et non dans l’eau, le sol ou les sédiments. Il ne devrait pas exister de risque de bioaccumulation dans l'environnement. Cette substance répond donc aux critères de la persistance, mais non à ceux de la bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation. En outre, les données empiriques de la toxicité en milieu aquatique indiquent que la substance représente un faible danger pour les organismes aquatiques. Selon une comparaison de la concentration estimée sans effet et de la concentration estimée raisonnable de la pire exposition dans l’environnement dans l’eau de surface du Canada, il est conclu que le 1,4-dioxane ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou encore à mettre en danger l’environnement essentiel pour la vie.
Compte tenu des renseignements disponibles, il est conclu que le 1,4-dioxane ne répond pas aux critères de l’article 64 de la LCPE(1999).
Cette substance sera considérée pour inclusion dans la prochaine initiative de mise à jour de l'inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
La Loi canadienne sur la protection de l'environnement, 1999 [LCPE(1999)] exige que les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l'on croit être commercialisées au Canada ou;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada(Canada, 2006) qui exigeait à l'industrie et aux autres intervenants de fournir, dans des délais précis, des renseignements spécifiques qui pourraient servir à étayer l'évaluation des risques, à élaborer et à préciser des bonnes pratiques de gestion des risques et de l'intendance des substances jugées hautement prioritaires.
Une priorité élevée a été donnée à l'évaluation du risque que comporte le 1,4-dioxane pour la santé humaine étant donné le risque d'exposition des Canadiens, qui a été jugé le PFRE, et la classification de la substance par d'autres organismes en ce qui a trait à la cancérogénicité. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canadale 30 août 2008 (Canada, 2008). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle reposait sa catégorisation. Des renseignements sur la substance ont été communiqués en réponse au Défi.
Même s’il a été jugé hautement prioritaire d’évaluer les risques que présente le 1,4-dioxane pour la santé humaine et que cette substance répond aux critères écologiques de la catégorisation pour la persistance, la substance ne répondait pas aux critères relatifs au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est centrée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées aux termes de la LCEP (1999) mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de l’article 64 de la Loi. Les évaluations préalables visent à étudier les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
L’évaluation préalable finale prend en considération les renseignements sur les propriétés des substances, les dangers, les utilisations et l’exposition, y compris ceux fournis dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable de cette substance sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu’en avril 2009 (exposition et écologie) et jusqu’en février 2009 (effets sur la santé). Au cours de la période de commentaires publics relatifs l’évaluation préalable finale, une étude sur l’exposition par inhalation de deux ans a été déterminée et incluse dans l’ensemble des données toxicologiques. Il est possible que les résultats de modélisation aient servi à formuler des conclusions.
L'évaluation des risques pour la santé humaine comprend l'examen de données pertinentes pour l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble ainsi que de l'information sur les dangers pour la santé (surtout fondée sur des évaluations réalisées par d'autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur l'écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, cela dans le contexte d'une évaluation préalable. L’évaluation préalable finale ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion proposée.
La présente évaluation préalable finale a été préparée par le personnel du Programme des substances existantes d’Environnement Canada et de Santé Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l’écologie ont fait l’objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment Michael Jayjock (The Lifeline Group), Glenn Talaska (University of Cincinnati) et Chris Bevan (CJB Consulting LLC). Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable des risques.
Les principales données et considérations sur lesquelles repose la présente évaluation finale sont résumées ci-après.
Aux fins du présent document, la substance est appelée 1,4-dioxane. Le tableau 1 présente un résumé de l'identité de la substance.
Tableau 1 . Identité de la substance 1,4-dioxane
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 123-91-1 |
| Nom dans la LIS | 1,4-Dioxane |
| Noms relevés dans les National Chemical Inventories (NCI) | Dioxyde de diéthylène-1,4 (ECL, PICCS) Ether de diéthylène (PICCS) Oxyde de diéthylène (PICCS) 1,4-dioxane (anglais et français) (AICS, ASIA-PAC, LIS, EINECS, ENCS, NZIoC, PICCS, SWISS, TSCA) Dioxane (PICCS) Dioxane, para- (PICCS) p-dioxane (PICCS) |
| Autres noms | Dioxyde de diéthylène; oxyde de diéthylène-1,4; 1,4dioxacyclohexane; 1,4dioxane; dioxane; p-dioxane; 1,4-dioxane; dioxyéthylène ether de dioxane; 1,4-dioxine, tétrahydro-; NE 220; NSC 8728; UN 1165; UN 1165 (DOT) |
| Groupe chimique (Groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Produits chimiques organiques hétérocycliques |
| Principale sous-classe chimique | Composés organiques hétérocycliques (oxygène) |
| Formule chimique | C4H8O2 |
| Structure chimique |  |
| SMILES1 | C1OCCOC1 |
| Masse moléculaire | 88,11 g/mol |
| Abréviations : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique); N° CAS, Numéro de registre du Chemical Abstracts Service; LIS, liste intérieure des substances; ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); NCI (National Chemical Inventories); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); SMILES, simplified molecular input line entry specification; SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse) et TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). Source : NCI, 2006 1Simplified Molecular Input Line Entry Specification |
|
Le tableau 2 présente les données physiques et chimiques du 1,4-dioxane qui se rapportent à son devenir dans l'environnement.
Tableau 2. Propriétés physiques et chimiques du 1,4-dioxane
| Propriété | Type | Valeur1 | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Koe, cœfficient de partage octanol-eau; pKa, constante de dissociation acide 1 Les valeurs indiquées entre parenthèses représentent les valeurs initiales signalées par les auteurs. |
||||
| Point de fusion (°C) | Expérimental | 11,8 | O'Neil et al., 2001 | |
| Point d'ébullition (°C) | Expérimental | 101,5 | PhysProp, 2006 | |
| 101,1 | O'Neil et al., 2001 | |||
| Masse volumique (kg/m3) | Expérimental | 1 032,9 (1,0329 g/cm3) |
4 | O'Neil et al., 2001 |
| Pression de vapeur (Pa) | Expérimental | 5 080 (38,1 mmHg) |
25 | Daubert et Danner, 1989 |
| 4 000 (30 mmHg) |
Verschueren, 1983 | |||
| Constante de la loi de Henry (Pa·m3/mol) | Expérimental | 0,49 (4,80 × 10-6 atm·m3/mol) |
25 | Glozier et al., 1987 |
| Log Koe (sans dimension) |
Expérimental | -0,27 | Hansch et al., 1995 | |
| -0,42 | Verschueren, 1983 | |||
| Solubilité dans l'eau (mg/L) |
Expérimental | 1 000 000 (miscible) |
20 | Fent et al., 1986 |
| Solubilité dans d'autres solvants (g/L) |
Expérimental | miscible avec la plupart des solvants organiques | O'Neil et al., 2001 | |
| pKa | Expérimental | -2,92 | 25 | Perrin, 1965 |
Aucune source naturelle du 1,4-dioxane n'a été décelée. Cependant, dans le cas des aliments, peu de données suggèrent que le 1,4-dioxane est un constituant naturel de la fraction volatile produite en faibles concentrations dans certains aliments (Chung et al., 1983; Hartung, 1989). Bien que ces études démontrent sa présence, nous ignorons si cette occurrence est due à la production naturelle ou à une contamination car le 1,4-dioxane est une impureté contenue dans les additifs alimentaires et pesticides éthoxylés et peut se trouver dans divers milieux naturels (NICNAS 1998, communication personnelle de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada en 2009; source non citée; communication personnelle adressée en 2009 par la Direction des aliments de Santé Canada; source non citée).
Des émissions anthropogéniques du 1,4-dioxane peuvent se réaliser lors de sa production ou de sa transformation. Comme autre source principale au Canada, le 1,4-dioxane est formé non intentionnellement comme sous-produit de l'éthoxylation où l'oxyde d'éthylène (OEt) ou l'éthylèneglycol est condensé, lors de la création de polymères éthoxylés utilisés dans diverses applications industrielles et applications de consommation (Figure 1) (Robinson et Ciurczak, 1980; NICNAS, 1998; Black et al., 2001). En dépit de l'extraction sous vide, des traces du 1,4-dioxane sont toujours présentes (Robinson et Ciurczak, 1980).
![Figure 1. Mécanisme général de formation du 1,4-dioxane par éthoxylation (Robinson et Ciurczak, 1980). [OEt = oxyde d'éthylène; EFA = acide gras éthoxylé; 1,4-D = 1,4-dioxane]](/content/canadasite/fr/environnement-changement-climatique/services/evaluation-substances-existantes/evaluation-prealablele-defi-concernant-le-23/_jcr_content/par/img_0_0/image.img.jpg/1514996347845.jpg)
Figure 1. Mécanisme général de formation du 1,4-dioxane par éthoxylation (Robinson et Ciurczak, 1980). [OEt = oxyde d'éthylène; EFA = acide gras éthoxylé; 1,4-D = 1,4-dioxane]
D'après les renseignements soumis en vertu de l'article 71 de la LCPE (1999), entre 10 000 et 100 000 kg du 1,4-dioxane ont été fabriqués au Canada en 2006. En outre, entre 10 000 et 100 000 kg ont été importés au cours de la même année. Des entreprises canadiennes ont également déclaré avoir utilisé entre 10 000 et 100 000 kg du 1,4dioxane en 2006 (Environnement Canada, 2008).
Du point de vue historique, le 1,4-dioxane a été utilisé principalement comme stabilisant pour le 1,1,1-trichloroéthane. Cette fonction a été éliminée graduellement en raison de mesures de contrôle de l'utilisation du 1,1,1-trichloréthane imposées en vertu du Protocole de Montréal (Canada, 1998). À présent, le 1,4-dioxane est très utilisé comme solvant dans la fabrication de produits pharmaceutiques, la recherche et le développement ainsi que comme réactif analytique dans les laboratoires (Environnement Canada, 2009a). Le 1,4-dioxane est utilisé comme solvant de support dans la fabrication de produits pharmaceutiques, de médicaments vétérinaires et de produits de santé naturels. Dans les produits pharmaceutiques, il est classé comme solvant résiduel de catégorie 2 avec une concentration maximale de 380 mg/kg si l’exposition quotidienne maximale du produit contenant du 1,4-dioxane ne dépasse pas 10 g; pour les produits administrés en doses supérieures à 10 g/jour, l’exposition quotidienne permise ne doit pas dépasser 3,8 mg/jour. Une limite de concentration identique et une exposition quotidienne permise ont été définies pour le 1,4-dioxane résiduel contenu dans les produits de santé naturels et les produits pour animaux (communication personnelle de la Direction des produits de santé naturels de Santé Canada en 2009; source non citée; communication personnelle adressée en 2009 par la Direction des produits thérapeutiques de Santé Canada; source non citée). En outre, le 1,4-dioxane est une composante d'agents chimiques industriels utilisés comme inhibiteurs de corrosion, antioxydants et dégraisseurs d'équipement lourd (Environnement Canada, 2008).
Comme il a déjà été mentionné, le 1,4-dioxane résiduel est formé lors de la production de substances éthoxylées utilisées dans diverses applications, notamment les produits cosmétiques, l'emballage d'aliments, des produits agricoles et des processus industriels (EURAR, 2002). Au Canada, les substances éthoxylées contenant du 1,4dioxane comme sous-produit sont produites et utilisées comme surfactants, agents émulsifiants, agents mouillants et agents de gonflement dans de nombreuses industries (Environnement Canada, 2009a). Le 1,4-dioxane se trouve également comme impureté dans un formulant dans 168 pesticides ayant des utilisations alimentaires et non alimentaires (communication personnelle, Agence de réglementation de la lutte antiparasitaire, Santé Canada, 2009, source non citée). Par ailleurs, le 1,4-dioxane se trouve à l’état d’impureté dans les solvants utilisés dans la préparation d’ingrédients et d’auxiliaires technologiques employés dans la fabrication des matériaux d’emballage alimentaire tels que le papier et les films rétrécissables, même si l’exposition au 1,4-dioxane issue de ces matériaux a été jugée minime (communication personnelle adressée en 2009 par la Direction des aliments de Santé Canada; source non citée). Le 1,4-dioxane peut également se trouver à l’état d’impureté dans les additifs alimentaires polysorbate 80, polysorbate 65, polysorbate 60 et polyéthylène glycol, à une limite résiduelle maximale de 10 mg/kg conformément aux spécifications de ces produits chimiques indiquées dans le Food Chemicals Codex (FCC, 6e éd., 2008) (communication personnelle adressée en 2009 par la Direction des aliments de Santé Canada; source non citée). Les additifs alimentaires cités ci-dessus dans lesquels pourrait se trouver du 1,4-dioxane à l’état d’impureté, peuvent uniquement se trouver dans les aliments pour lesquels une disposition existe relative à l’utilisation de ces additifs conformément au Règlement sur les aliments et drogues(communication personnelle adressée en 2009 par la Direction des aliments de Santé Canada; source non citée).
À présent, le 1,4-dioxane est présent sur la « Liste critique » des ingrédients des cosmétiques de Santé Canada qui interdit son utilisation intentionnelle comme ingrédient dans les produits cosmétiques. Il peut, toutefois, se retrouver comme impureté de fabrication (Santé Canada, 2007).
Les renseignements déclarés en vertu de l'article 71 de la LCPE (1999) indiquent qu'en 2006, de 10 000 kg à 100 000 kg de 1,4dioxane ont été rejetés dans l'environnement. La majorité des rejets ont été observés dans l'eau et l'air, et une fraction minime a été observée dans le sol (Environnement Canada, 2008). En 2006, les quantités de 1,4dioxane rejetées dans l'air et l'eau variaient de 10 000 à 100 000 kg. Au cours de cette même année, les rejets relevés dans l'Inventaire national des rejets polluants (INRP) indiquent que 13 800 kg de 1,4dioxane ont été rejetés dans l'air et 6 500 kg dans l'eau. Par contre, les rejets dans le sol n'ont pas été révélés (INRP, 2006).
En 2006, le Toxics Release Inventory Program (TRI) des États-Unis (TRI) a déclaré des rejets dans l'air de 56 tonnes et dans l'eau de 22 tonnes, alors que 64 tonnes auraient été rejetés dans le sol par injection (TRI, 2006). Les grandes quantités de rejets sont probablement dues à la croissance d'utilisation du 1,4dioxane aux États-Unis comparativement au Canada.
En plus des rejets dans l'environnement, les renseignements soumis en vertu de l'article 71 de la LCPE (1999) indiquent qu'entre 100 et 1000 kg de 1,4dioxane ont été transférés à des installations de traitement de déchets dangereux, tandis que moins de 100 kg ont été transférés à des installations de déchets inoffensifs (Environnement Canada, 2008).
D’après les propriétés physiques et chimiques du 1,4-dioxane (tableau 2), cette substance se caractérise par une hydrosolubilité élevée (1 000 000 mg/L), une pression de vapeur élevée (5 080 Pa), un faible log Koe(-0,42 à -0,27) et une constante de la loi de Henry moyenne (0,49 Pa·m3/mol). Les résultats de la modélisation de la fugacité de niveau III (tableau 3) suggèrent que les fractions massiques importantes de la substance dépendent du milieu du rejet et que la répartition du 1,4dioxane dans l'eau peut être considérable, tandis que la répartition de la substance dans les sédiments est négligeable.
Tableau 3. Résultats de la modélisation de la fugacité de niveau III (EQC, 2003) pour le 1,4dioxane
| Substance rejetée dans : | Fraction de la substance se répartissant dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| Air (100 %) | 44,8 | 34,4 | 20,8 | 0,1 |
| Eau (100 %) | 0,1 | 99,6 | 0,1 | 0,2 |
| Sol (100 %) | 0,4 | 40,4 | 59,2 | 0,1 |
Persistance dans l'environnement
Le tableau 4a présente des données empiriques tirées d’un essai de biodégradation immédiate qui indique une biodégradation de 0 % du 1,4-dioxane sur une période de 14 jours (Ministry of International Trade and Industry [MITI], 1992). Cette étude a signalé une valeur négative pour la biodégradation, indiquant donc que la substance pourrait être perdue au cours du test. Ainsi, la fiabilité des données rapportées est faible. D’après EURAR (2002), une étude antérieure menée par BUA (1991) a aussi révélé une absence de biodégradation dans les deux conditions d’essai standard (Organisation de coopération et de développement économiques) et non standard. Ce résultat est appuyé par les experts en assainissement des lieux contaminés qui signalent une biodégradation limitée du 1,4-dioxane (Steffan, 2007).
La substance ne contient pas de groupements fonctionnels pouvant subir une hydrolyse ou une photolyse directe dans les milieux aquatiques. Elle est également résistante à la biodégradation dans l’eau à condition ambiante (CCME, 2008).
Le tableau 4a présente également une donnée empirique indiquant une demi-vie atmosphérique inférieure à un jour par photooxydation avec des radicaux hydroxyles (OH-), considérés comme le mécanisme de perte principal dans l’air (Atkinson, 1989).
Tableau 4a. Données empiriques sur la dégradation du 1,4-dioxane
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre et unités de la dégradation | Référence |
|---|---|---|---|---|
| Eau | Biodégradation | 0 | Biodégradation immédiate en 14 jours/% | MITI, 1992 |
| Air | Oxydation atmosphérique | 0,981 | Demi-vie/jours | Atkinson, 1989 |
Bien que les données expérimentales sur la dégradation du 1,4-dioxane soient limitées, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) (Environnement Canada, 2007) a aussi été utilisée avec les modèles de biodégradation présentés au tableau 4b. Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et qu'on estime que le 1,4dioxane est libéré dans ce milieu, la biodégradation dans l'eau a fait l'objet principal de cette étude.
Tableau 4b. Données modélisées sur la dégradation du 1,4-dioxane
| Processus du devenir | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade & Industry, Japon; t½, demi-vie 1 Le résultat est numérique. 2 Le résultat est une probabilité. |
|||
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2000 | t½ = 0,38 jour | <2 |
| Eau | |||
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 3 : enquête d'expert (biodégradation ultime) | 2,991 « se biodégrade rapidement » | <182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 4 : enquête d'expert (biodégradation primaire) | 3,701 « se biodégrade rapidement » | <182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 5 : MITI, probabilité linéaire | 0,532 Se biodégrade rapidement | <182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 6 : MITI, probabilité non linéaire | 0,672 « se biodégrade très rapidement » | <182 |
| Biodégradation (aérobie) | TOPKAT, 2004 probabilité | 0,02 « se biodégrade très lentement » | >182 |
| Biodégradation (aérobie) | CATABOL ©2004-2008 % DBO | % DBO = 9,5 « se biodégrade très lentement » | >182 |
Dans l'air, la demi-vie prévue par oxydation atmosphérique de 0,38 jour (voir le tableau 4a) indique que cette substance devrait s'oxyder rapidement. Le composé peut aussi être assujetti à la photolyse et réagir avec d'autres espèces photooxydantes dans l'atmosphère comme l'ozone (EURAR, 2002). Les données empiriques indiquant une demi-vie de 0,98 jour et une demi-vie estimée de 0,38 jour résultant de réactions avec des radicaux hydroxyles permettent d'affirmer que le 1,4-dioxane est non persistant dans l'air.
Dans l’eau, les données modélisées permettent d’aboutir à diverses conclusions. Les données modélisées du temps et de la probabilité de biodégradation obtenues par BIOWIN (voir le tableau 4b) permettent de conclure que la substance a une demi-vie inférieure à 182 jours. Toutefois, les données modélisées de TOPKAT et CATABOL indiquent une demi-vie dans l’eau d’au moins 182 jours (tableau 4b). Pour tirer les conclusions relatives à la persistance, un poids plus important a été donné aux données empiriques (tableau 4a; EURAR, 2002; Staffen, 2007; CCEM, 2008) indiquant que d’après les prévisions de TOPKAT et CATABOL, la demi-vie du 1,4-dioxane est d’au moins 182 jours. Ainsi, il est considéré que le 1,4-dioxane est persistant dans l’eau.
Il est possible d'extrapoler la demi-vie dans le sol et les sédiments à partir de la demi-vie dans l'eau à l'aide des facteurs de Bœthling : t1/2 eau : t1/2 sol : t1/2 sédiments = 1 : 1 : 4 (Bœthling et al., 1995). Donc, comme la donnée empirique cidessus indique une demi-vie dans l'eau d'au moins 182 jours et un facteur d'extrapolation applicable de 1, la demi-vie de la substance dans le sol devrait également être d'au moins 182 jours. Ainsi estimée, la demi-vie dans les sédiments devrait être quatre fois plus élevée (c.àd. = 728 jours). On peut donc conclure que le 1,4-dioxane est persistant dans le sol et les sédiments.
De ce fait, les données empiriques et les prévisions modélisées montrent que le 1,4-dioxane répond aux critères de la persistance dans l’eau, le sol et les sédiments (demi-vie dans le sol et l’eau = 182 jours et demi-vie dans les sédiments = 365 jours), mais il n’est pas considéré comme étant persistant dans l’air (demi-vie = 2 jours), selon le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
De plus, le potentiel de transport à grande distance (PTGD) du 1,4-dioxane à partir de son point de rejet dans l'air est estimé faible. Le modèle TaPL3 (2000) a été utilisé pour estimer la distance de transport caractéristique (définie comme la distance maximale parcourue par 63 % de la substance) de 95 km pour le 1,4-dioxane. Beyer et al., (2000) ont proposé de considérer le PTGD comme étant élevé si la distance de transport caractéristique est supérieure à 2 000 km, moyen si elle est de 700 à 2 000 km et faible si elle est inférieure à 700 km. Selon l’estimation du modèle, le 1,4-dioxane devrait surtout avoir un faible potentiel de transport à grande distance et se retrouver à proximité de ses sources d’émission.
Potentiel de bioaccumulation
Les valeurs expérimentales du log Koe du 1,4-dioxane semblent indiquer que cette substance chimique n’est pas bioaccumulable dans les organismes (tableau 2 ci-dessus). Le facteur de bioconcentration (FBC) chez le poisson serait compris dans la plage de 0,2 à 0,7 L/kg poids humide (MITI, 1992).
Comme il existe peu de données expérimentales sur la bioaccumulation du 1,4-dioxane, une méthode du poids de la preuve reposant sur des relations quantitatives structureactivité (RQSA) a également été utilisée avec les modèles du facteur de bioaccumulation (FBA) et du facteur de bioconcentration (FBC) indiqués au tableau 5.
Tableau 5. Données modélisées sur la bioaccumulation du 1,4dioxane
| Organisme d'essai | Paramètre ultime | Valeur en poids humide (L/kg) | Références |
|---|---|---|---|
| Poissons | FBA | 0,96 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBA) |
| Poissons | FBC | 0,97 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBC) |
| Poissons | FBC | 10,4 | OASIS Forecast, 2005 |
| Poissons | FBC | 3,2 | BCFWIN, 2000 |
Le modèle modifié du facteur de bioaccumulation de Gobas pour le niveau trophique intermédiaire chez le poisson a estimé un facteur de bioaccumulation à 0,96 L/kg, ce qui indique que le 1,4-dioxane ne présente aucun potentiel de bioconcentration ou de bioamplification dans l’environnement. Les valeurs du FBCcalculées à l’aide de modèles (tableau 5) confirment, aux fins de l’établissement du poids de la preuve, le faible potentiel de bioconcentration de cette substance.
D’après les valeurs modélisées et empiriques disponibles, le 1,4-dioxane ne répond pas aux critères de la bioaccumulation (FBA ou FBC = 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La démarche suivie dans cette évaluation écologique préalable consistait à examiner les renseignements scientifiques disponibles et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence exigé en vertu de la LCPE(1999). Les éléments de preuve pris en compte comprennent les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Il existe des preuves modélisées et expérimentales confirmant que le 1,4dioxane ne nuit pas aux organismes aquatiques à de faibles concentrations (tableaux 6a et 6b).
Tableau 6a. Données empiriques sur la toxicité aquatique du 1,4-dioxane
| Organisme d'essai | Type d'essai | Paramètre ultime | Valeur (mg/L) | Références |
|---|---|---|---|---|
| Abréviations : CE50, concentration d’une substance qu’on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d’essai; CL50, concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai; CMEO, concentration minimale d’une substance ayant un effet nocif sur les organismes d’essai; CMAT, concentration maximale d’une substance n’exerçant aucun effet nocif sur les organismes d’essai; CSEO, concentration la plus élevée ne causant pas d’effet statistiquement significatif par rapport aux témoins dans un essai de toxicité. 1 Résultat anormal (sujet à caution). Voir l'explication dans le texte. 2 Valeur critique de toxicité (VCT). |
||||
| Poisson (Pimephales promelas) | Toxicité aiguë (96 heures) | CL50 | 9 850 | Geiger et al., 1990 |
| Daphnia magna | Toxicité aiguë (24 heures) | CE50 | 4 700 | Bringmann et Kühn, 1977 |
| Ceriododaphnia dubia | Toxicité aiguë (48 heures) | CE50 | 1631 | TSCATS, 1989 |
| Ceriodaphnia dubia | Toxicité chronique (7 jours) | CSEO | 625 | Springborn Laboratories Inc., 1989 |
| Orchestie (Gammarus pseudolimnaeus) | Toxicité aiguë (96 heures) | CL50 | 2 274 | Brooke, 1987 |
| Algue (Microcystis aeruginosa) | Toxicité chronique (8 jours) | CE50 | 575 | Bringmann et Kühn, 1976 |
| Tête-de-boule (Pimephales promelas) | Chronique (32 jours) | CMAT | 145 | BUA, 1991 |
| Medaka (Oryzias latipes) | Chronique (28 jours) | CMEO | 6 933 | Johnson et al., 1993 |
| Ceriodaphnia dubia | Chronique (7 jours) | CSEO CMEO | 635 1 250 | Dow, 1995 |
Tableau 6b. Données modélisées sur la toxicité aquatique du 1,4-dioxane
| Organisme d'essai | Type d'essai | Paramètre ultime | Valeur (mg/L) | Références |
|---|---|---|---|---|
| Abréviations : CE50, concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50, concentration létale pour 50 % des organismes d'essai. | ||||
| Poissons | Toxicité aiguë (96 heures) | CL50 | 5 300 | TOPKAT, 2004 |
| 6 750 | ECOSAR, 2004 | |||
| 14 371 | ASTER, 1999 | |||
| 1 397 | AIES, 2003-2005 | |||
| Poissons | Toxicité aiguë (14 jours) | CL50 | 6 580 | ECOSAR, 2004 |
| Daphnie | Toxicité aiguë (48 heures) | CE50 | 2 721 | ECOSAR, 2004 |
| 35,4 | TOPKAT, 2004 | |||
| Algue | Toxicité aiguë (96 heures) | CE50 | 482 | ECOSAR, 2004 |
Un ensemble plus complet des données sur la toxicité aquatique est disponible dans l’International Uniform Chemical Information Database (IUCLID) (BESC, 2000) et l’évaluation des risques réalisée par l’Union européenne (EURAR, 2002). Ces données se situent dans la même plage que celles présentées au tableau 6a. La base de données AQUIRE (ECOTOX, 2006) fait état de valeurs médianes pour la toxicité aquatique aiguë allant de 2 274 à 12 326 mg/L.
La valeur expérimentale la plus faible de la toxicité aquatique est de 163 mg/L, selon une concentration efficace moyenne (CE50) sur 48 heures pour le Ceriodaphnia dubia (TSCATS, 1989). Cette valeur peut toutefois être mise en question étant donné les autres niveaux de toxicité déclarés et le fait qu'il a été impossible d'obtenir un exemplaire de l'étude initiale et d'en évaluer la qualité. Lorsque le Ceriodaphnia dubia a été soumis à un essai statique à long terme, la concentration sans effet observé (CSEO) chronique signalée était beaucoup plus élevée (~630 mg/L). (Springborn Laboratories, 1989; DOW, 1995). Ainsi, comme dans l’évaluation de l’Union européenne (EURAR, 2002), ce résultat n’a pas été utilisé comme mesure des effets pour la caractérisation des risques. La deuxième valeur de la toxicité la plus faible (575 mg/L dans le tableau 6a) a été sélectionnée comme valeur de la toxicité critique (VTC), indiquant ainsi le potentiel pour les effets écologiques sur les espèces sensibles.
Le tableau 6b présente les prévisions d'écotoxicité qui ont été jugées fiables et qui ont été utilisées avec la méthode du poids de la preuve reposant sur des RQSA pour la toxicité aquatique (Environnement Canada, 2007).
La gamme de données empiriques sur la toxicité ainsi que les prévisions de la toxicité aquatique obtenues à l’aide des modèles RQSA indiquent que la substance n’est pas très dangereuse pour les organismes aquatiques (CL50 ou CE50 aiguë > 1,0 mg/L).
On a déterminé une valeur prudente de la concentration estimée sans effet (CESE) à partir de la valeur de la toxicité critique relevée dans les données empiriques. En appliquant, aux fins de l’évaluation, un facteur de 10 à la plus faible valeur empirique à effet chronique, soit 575 mg/L, cela pour tenir compte des variations interspécifiques et intraspécifiques en matière de sensibilité, et pour extrapoler un critère d’effet aigu obtenu en laboratoire à une valeur d’effet chronique obtenue sur le terrain, on obtient une valeur prudente pour la CESE de 57,5 mg/L.
D'après les renseignements de l'enquête menée conformément à l'article 71 de la LCPE (1999), la majorité des rejets du 1,4dioxane se retrouvent dans l'eau et l'air. Si elle est rejetée dans l'eau, la substance devrait demeurer dans l'eau principalement (tableau 3). Le 1,4dioxane n'a pas été décelé dans l'eau de surface dans les régions à l'Est du Canada (CCME, 2008). Pour les besoins de la présente évaluation écologique, deux scénarios prudents d’exposition dans l’eau ont été créés pour estimer les rejets dans l’environnement aquatique provenant d’activités industrielles et de l’utilisation par les consommateurs, ainsi que les concentrations résultantes dans l’eau.
Le scénario est basé sur la plus grande quantité totale fabriquée à une seule usine, supposant qu’une fraction prudente a été rejetée dans l’eau (5 %), qu’aucune quantité n’a été transférée à une usine de traitement des eaux usées et qu’un cours d’eau relativement petit a été contaminé. La concentration environnementale estimée (CEE) est de 0,39 mg/L pour ce scénario prudent créé au moyen de l’outil d’exposition générique industriel – Milieu aquatique d’Environnement Canada. Le quotient de risque (concentration environnementale estimée/concentration estimée sans effet) qui en résulte est 0,007, ce qui révèle l’improbabilité que le 1,4-dioxane cause des dommages écologiques au Canada (Environnement Canada, 2009a).
Comme on trouve du 1,4-dioxane dans les produits de consommation, Mega Flush, outil d’Environnement Canada, a été utilisé pour estimer les rejets à l’égout issus des produits de consommation. Mega Flush estime la concentration environnementale estimée maximale à 0,004 mg/L et le quotient de risque (concentration environnementale estimée/concentration estimée sans effet) qui en résulte à 0,0008, ce qui révèle l’improbabilité que le 1,4-dioxane cause des dommages écologiques au Canada (Environnement Canada, 2009b).
Même si aucune étude convenable n'a été retrouvée sur les effets écologiques de ce composé dans des milieux autres que l'eau, il est peu probable que l'exposition au 1,4dioxane rejeté dans l'air (l'autre milieu principal où il serait rejeté) ait des effets en raison de sa faible toxicité aquatique et de sa courte demivie dans l'air.
Il est à noter que cette conclusion a été tirée malgré les hypothèses prudentes prononcées en réaction aux incertitudes soulignées dans le cadre de l'évaluation. Un certain degré d’incertitude est associé au fait que le 1,4-dioxane n’a pas été décelé dans l’environnement aquatique au Canada, et qu’un modèle d’exposition a été employé pour prévoir une concentration de cette substance dans l’eau dans le pire des cas. En outre, un certain degré d’incertitude est associé à l’utilisation de la valeur de toxicité critique et de la concentration estimée sans effet dans le calcul du quotient de risque. La valeur critique de la toxicité chronique a été divisée par un facteur d'évaluation de 10.
Évaluation de l'exposition
Milieu environnemental
Les limites supérieures estimées de l'absorption quotidienne de 1,4dioxane dans l'air ambiant, l'air intérieur, le sol et l'eau potable ont été calculées. Ces limites sont résumées pour tous les groupes d'âge à l'annexe 1. La plage des limites supérieures totales estimées varie de 0,19 µg/kg-p.c. (kg-p.c.) par jour pour les enfants allaités de moins de six mois à 1,26 µg/kg-p.c. par jour pour les enfants nourris de lait maternisé de moins de six mois. Les enfants allaités et les enfants nourris de lait maternisé ont été exposés au 1,4-dioxane notamment par l’absorption d’air et d’eau potable (le 1,4-dioxane n’a pas été décelé dans le lait maternel et le lait maternisé). L'eau potable représentait la contribution prédominante au total de l'absorption quotidienne estimative pour tous les groupes d'âge, suivie de l'air intérieur.
Plusieurs études menées aux États-Unis et au Canada révèlent des concentrations décelables du 1,4dioxane dans l'air ambiant (maximum de 0,646 µg/m3) et dans l'air intérieur (maximum de 0,85 µg/m3) respectivement à partir de toutes les données recueillies (Harkov, 1984; Brown et al., 1994; Fellin et Otson, 1997; Singhvi, 1999). Les données canadiennes ont été utilisées pour estimer l'absorption des deux sources d'air : 0,646 µg/m3 (air ambiant) et 0,685 µg/m3 (air intérieur) (Fellin et Otson, 1997). Les études du sol sont limitées; les données sont issues de seulement quelques études menées au Japon et au Canada (Golder Associates, 1987; gouvernement du Japon, 2004). Le 1,4dioxane n'a pas été décelé dans les sols au Canada, la limite de détection étant de 100 µg/kg pour l'exposition estimée (Golder Associates, 1987).
Plusieurs études menées au Japon révèlent des concentrations décelables du 1,4dioxane (maximum de 16 µg/L) dans l'eau de surface (Abe, 1999; Kawata et al., 2003; Simazaki et al., 2006). Cependant, le 1,4-dioxane n'a pas été décelé dans l'eau de surface dans les régions à l'Est du Canada (CCME, 2008). Des données canadiennes sur l'eau potable ont été utilisées pour estimer l'absorption. Otson (1987) a démontré que le 1,4dioxane n'a pas été décelé dans 42 échantillons bruts et 42 échantillons traités provenant d'une usine municipale de traitement des eaux usées dans la région des Grands Lacs. Dans ce cas, la limite de détection de 10 µg/L a été utilisée pour estimer l'exposition.
Même si aucune étude sur la présence du 1,4dioxane dans les aliments au Canada n'a été retrouvée, les données du Japon suggèrent que le 1,4dioxane était présent dans plusieurs groupes alimentaires (Nishimura et al., 2004). Cependant, après une consultation avec la Direction des aliments de Santé Canada, une deuxième analyse des concentrations publiées a indiqué que les concentrations observées étaient toutes inférieures à la limite de détection de 2 µg/kg citée dans l'étude (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). Dans le cadre d’une étude subséquente, le même groupe de recherche a mis à l’essai des repas complets et a décelé le 1,4-dioxane dans 1 de 27 échantillons (Nishimura et al., 2005). En considérant le fait que les absorptions alimentaires varient entre le Japon et le Canada, les différences éventuelles dans les concentrations du 1,4-dioxane dans l’eau (servant à la préparation et à la cuisson) entre le Canada et le Japon, les différences d’utilisation d’additifs alimentaires entre les deux pays au moment où ces études japonaises ont été menées et les limites des deux études déjà mentionnées, les données alimentaires tirées de ces études n’ont pas été incluses dans les estimations de l’absorption quotidienne des milieux environnementaux (annexe 1).
Une étude a examiné la présence probable du 1,4-dioxane dans le lait maternel (à l’aide d’un modèle pharmacocinétique à base physiologique (PBPK)), notamment sur des femmes ayant un potentiel d’exposition à cette substance en milieu de travail (Fisher et al., 1997). Dans cette étude, un coefficient de partage lait/sang de 0,89 a été observé; indiquant qu’une quantité plus importantede 1,4-dioxane devrait être présente dans le sang que dans le lait. Une étude du Center for Disease Control and Prevention (CDC) a examiné les échantillons de sang de plus de 2 000 personnes tirés d’une étude de surveillance biologique américaine du NHANES (2008-2008) et indiqué que le 1,4-dioxane n’était décelé dans aucun des échantillons de sang prélevés (Blount et al., 2008). Ainsi, selon le modèle PBPK une quantité encore plus faible est envisagée dans le lait. Ceci est vérifé par les propriétés physiques et chimiques du 1,4 Dioxane. En général, les produits chimiques lipophiles sont préférablement assimilés dans le lait maternel en raison de leurs teneurs supérieures en graisse. Toutefois, le 1,4-dioxane est très hydrophile (log Koe : de -0,27 à -0,42), En conséquence, l’exposition au 1,4-dioxane à partir du lait maternel n’est pas prévu.
Le 1,4-dioxane peut se trouver à l’état d’impureté dans les additifs alimentaires, tels que les polysorbates 80, 65 et 60 et le polyéthylène glycol. Ainsi, des quantités infimes de 1,4-dioxane peuvent être transportées dans les aliments pouvant contenir ces additifs ou dans l’utilisation de préparations pouvant contenir ces additifs (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). Les estimations de l’absorption quotidienne de 1,4-dioxane comme impuretés dans les additifs alimentaires permis (polysorbates 80, 65 et 60 et le polyéthylène glycol) ont été calculées en fonction de la limite maximale de résidus de 10 mg/kg du 1,4-dioxane dans les additifs, selon le Food Chemicals Codex (FCC, 6e éd., 2008) et de la concentration maximale d’utilisation pour les aliments où les additifs sont permis, d’après les tableaux IV et VIII du Règlement sur les aliments et drogues (voir l’annexe 2). Ces estimations sont considérées comme étant très prudentes; on présumait que les additifs alimentaires (polysorbates et polyéthylène glycol) et les résidus du 1,4-dioxane étaient présents à leurs concentrations maximales permises dans les aliments (Règlement sur les aliments et drogues) et les concentrations de résidus dans les additifs alimentaires (Food Chemicals Codex), respectivement (Canada [1978]) (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). De plus, les concentrations résiduelles du 1,4dioxane dans les aliments devraient être faibles en raison de sa volatilité et, de ce fait, elles devraient être encore inférieures dans les aliments qui sont transformés et cuits à des températures élevées. L’annexe 2 fournit des renseignements complémentaires relatifs à la nature prudente de ces estimations. Il faudrait noter, par contre, que les estimations de l'absorption de 1,4dioxane provenant de l'utilisation d'additifs alimentaires sont inférieures au total de l'absorption des milieux environnementaux, l'estimation la plus élevée étant de 0,335 µg/kg-p.c. par jour pour les enfants de 1 à 4 ans, et si ces estimations sont ajoutées à celles de l'absorption des milieux environnementaux, elles n'exercent aucune incidence sur l'estimation la plus faible et la plus élevée d'absorption des milieux environnementaux.
Les produits de consommation
Le 1,4dioxane a été retrouvé dans divers produits de soins personnels, à différentes concentrations (tableau 7a).
Tableau 7a. Concentration du 1,4-dioxane dans divers produits de soins personnels
| Type de produit | Concentration du 1,4dioxane (mg/kg) | Références |
|---|---|---|
| * Nota – Il se peut que certains produits ne soient pas disponibles au Canada. | ||
| Shampooing pour les cheveux | non déterminé à 45,5 11,5 à 41,1 5,5 à 41 0,05 à 33 1,2 à 10 | Scalia, 1991 Fuh et al., 2005 Makino et al., 2006 Tanabe et Kawata, 2008 OCA, 2009 |
| Shampooing pour les cheveux (bébés) | 1,6 à 10 0,69 à 1,1 | OCA, 2009 CSC, 2009 |
| Revitalisant capillaire | 0,05 à 0,14 | Tanabe et Kawata, 2008 |
| Savon liquide pour les mains | 0,2 à 18 0,05 à 7,2 non déterminé à 7,5 < 5 | OCA, 2009 Tanabe et Kawata, 2008 Scalia, 1991 Makino et al., 2006 |
| Nettoyant pour le corps | 0,9 à 23 15,7 0,05 à 1,5 | OCA, 2009 Scalia, 1991 Tanabe et Kawata, 2008 |
| Nettoyant pour le corps (bébé) | 0,63 à 5,3 0,6 à 4,6 | OCA, 2009 CSC, 2009 |
| Hydratant pour la peau | non déterminé à 75 | VCCEP, 2007 |
| Lotion (bébé) | 11 | Scalia et al., 1992 |
| Enquête sur des produits multiples (1981-1997) | 2 à 279 (1981) 6 à 34 (1997) | Black et al., 2001 |
Des concentrations maximales signalées dans les produits (tableau 7a) ont été utilisées pour dériver l'exposition estimée causée par l'utilisation de produits de soins personnels (tableau 7b). En l’absence de concentrations canadiennes précises dans les produits, des données non canadiennes ont été utilisées pour estimer les expositions. Il n’existe aucune indication selon laquelle le processus d’éthoxylation (source des niveaux résiduels de 1,4-dioxane dans les produits) est différent dans les pays dans lesquels les données ont été choisies. Plusieurs produits de ces enquêtes peuvent tout aussi bien être disponibles sur le marché canadien. L'exposition a été modélisée au moyen du logiciel ConsExpo 4.1 (ConsExpo, 2006). Le Système de déclaration des cosmétiques (SDC) de Santé Canada a servi à déterminer si les types de produits autres que ceux résumés au tableau 7b contenaient des ingrédients qui pourraient contenir du 1,4dioxane comme sousproduit. Le colorant capillaire a été identifié comme type de produit contenant des sulfates d'alkyles éthoxylés. Étant donné que les concentrations mesurées du 1,4-dioxane dans le colorant capillaire ne sont pas disponibles, les mesures de 1,4dioxane dans les ingrédients cosmétiques tirées d'une récente enquête de la Food and Drug Administration (FDA) ont été utilisées pour estimer l'exposition de l'utilisation de ce type de produit. Black et al., 2001 ont signalé des concentrations de 45 à 1 102 ppm dans les sulfates d'alkyles éthoxylés, et si on multiplie cette concentration maximale du sousproduit par la valeur de composition signalée dans le Système de déclaration des cosmétiques pour le colorant capillaire, on obtient une estimation de la concentration de 1,4dioxane.
Il a été démontré que le 1,4-dioxane n'est pas absorbé facilement par la peau (3,4 % : transport de lotion pour la peau) sur l'avantbras de singes (Marzulli et al., 1981), ce qui suggère une fonction d'évaporation (NICNAS, 1998; EURAR, 2002; VCCEP, 2007). De plus, lorsqu'il est ajouté à un matériel semblable à une lotion, le 1,4-dioxane est reconnu pour s'évaporer rapidement (90 % en 15 minutes) dans des conditions de non occlusion (Bronaugh, 1982). Par conséquent, en caractérisant l'exposition, on a présumé que 90 % du 1,4dioxane est disponible pour l'inhalation, alors que 10 % est disponible pour l'exposition dermique. On a également fait une distinction entre les produits qui doivent être rincés et ceux qui ne le sont pas. Par conséquent, divers facteurs de protection de la peau ont été utilisés dans l'analyse (voir l'annexe 3).
Tableau 7b. Exposition estimée de la femme adulte1 au 1,4-dioxane à partir de produits de soins personnels
| Produit de soins personnels | Concentration (%) (témoin) | Concentration moyenne par événement – (mg/m3) | Inhalation (mg/kg-p.c. par jour) | Dermique (mg/kg-p.c. par jour) | ||||
|---|---|---|---|---|---|---|---|---|
| 1 Poids du corps estimé : 70,9 kg. 2 Absorption par inhalation à 100 % 3 Absorption cutanée de 3,4 % (Marzulli et al., 1981) |
||||||||
| Revitalisant capillaire | 0,000 014 (Tanabe et Kawata, 2008) | 1,7 × 10-5 | 6,9 × 10-9 | 7,9 × 10-8 | ||||
| Shampooing capillaire | 0,004 55 (Scalia et al., 1992) | 0,0078 | 8,0 × 10-6 | 9,1 × 10-5 | ||||
| Lotion hydratante pour la peau (crème pour la peau) | 0,0075 (VCCEP, 2007) | 0,0023 | 0,0012 | 0,0017 | ||||
| Nettoyant pour le corps | 0,0023 (OCA, 2009) | 0,0017 | 2,2 × 10-6 | 2,5 × 10-6 | ||||
| Total | 0,0118 | 0,0012 | 0,0018 | |||||
| Total absorbé | – | 0,00122 | 6,1 × 10-5 3 | |||||
| Colorant capillaire (mg/kg-p.c.) | 0,033 à 0,11 (SDC, 2009) | 1,39 à 4,64 | 0,0200 à 0,06672 | 0,0002 à 0,00053 | ||||
L’exposition au 1,4-dioxane à partir de produits de soins personnels a été estimée pour les femmes, les hommes et les enfants (poids corporel de 7,5 kg). Cependant, après l’analyse, il était évident qu’en raison de facteurs comme la fréquence d’utilisation, les femmes étaient le groupe ayant la plus grande incidence d’exposition. Pour assurer la clarté, seulement les estimations d'exposition pour les femmes et les enfants sont présentées dans le présent rapport.
En utilisant les concentrations du 1,4-dioxane de produits pour enfants (tableau 7a), l'exposition a été estimée pour les enfants de moins de six mois (tableau 7c). L'exposition globale pour trois produits est estimée à 4,2 x 10-5 mg/kg/jour.
Tableau 7c. Estimation d'exposition des enfants1 au 1,4dioxane par l'intermédiaire de produits de soins personnels
| Produits de soins personnels | Concentration (%) | Concentration moyenne par événement – mg/m3 | Inhalation (mg/kg-p.c. par jour) | Par voie cutanée (mg/kg-p.c. par jour) |
|---|---|---|---|---|
| 1 Poids corporel présumé des enfants de moins de six mois de 7,5 kg 2 Absorption par inhalation à 100 % 3 Absorption par voie cutanée de 3,4 % (Marzulli et al., 1981) |
||||
| Hydratant pour la peau | 0,0011 % (Scalia, 1992) | 5,8 x 10-5 | 2,7 x 10-5 | 4,1 x 10-4 |
| Shampooing pour les cheveux | 0,001 % (SCC, 2009) | 1,0 x 10-4 | 1,4 x 10-7 | 2,9 x 10-6 |
| Nettoyant pour le corps | 0,00053 % (OCA, 2009) | 1,5 x 10-4 | 4,9 x 10-7 | 9,9 x 10-7 |
| Total | 3,1 x 10-4 | 2,8 x 10-5 | 4,1 x 10-4 | |
| Total absorbé | --- | 2,8 x 10-5 2 | 1,4 x 10-5 3 | |
Le 1,4-dioxane a aussi été décelé dans le détergent à vaisselle, des détergents et d'autres produits ménagers (Fuh et al., 2005; Tanabe et Kawata, 2008). Étant donné le potentiel d'exposition quotidienne à la substance dans le détergent à vaisselle manuelle, l'exposition a été estimée pour un adulte qui pèse 70.9 kg. En utilisant des données sur des produits de consommation du Système de déclaration des cosmétiques (concentration maximale : 0,033 %; SDC, 2009), l'exposition a été analysée en utilisant le logiciel ConsExpo 4.1 et a été estimée comme minime (inhalation : 2,2 × 10-4 mg/kg-p.c. par jour; par voie cutanée : 6,5 × 10-5 mg/kg-p.c. par jour).
La confiance en les estimations d'exposition pour les milieux environnementaux et les produits de consommation est élevée. Toutes les données sur le sol, l'air et l'eau sont canadiennes et considérées comme adéquates pour permettre de quantifier l'exposition au 1,4dioxane. La confiance en les estimations d’absorption à partir de sources alimentaires est faible, les données de contrôle canadiennes sur les concentrations du 1,4-dioxane dans les aliments n’étant pas disponibles, et donc pas incluses dans les estimations d’absorption. Néanmoins, telles qu’elles ont été discutées précédemment, les expositions estimées à certains additifs alimentaires sont considérées comme étant surestimées, les niveaux réels dans les aliments devant être très faibles (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). Même s'il existe un certain degré d'incertitude à l'égard des concentrations du 1,4dioxane dans certains produits disponibles au Canada, étant donné les renseignements limités sur la présence ou les concentrations de la substance dans les produits de consommation disponibles au Canada, les estimations d'exposition à partir de l'utilisation de produits contenant du 1,4dioxane étaient fondées sur des hypothèses prudentes. Par conséquent, on est confiant que les estimations d'exposition sont des estimations supérieures prudentes.
Évaluation des effets sur la santé
Les renseignements disponibles concernant les effets sur la santé du 1,4dioxane sont résumés à l'annexe 4.
D'après les résultats d'enquêtes menées sur des animaux de laboratoire, le Centre international de recherche sur le cancer (CIRC) a classé le 1,4dioxane dans le groupe 2B, soit comme « possiblement cancérogène pour l'humain » (CIRC, 1999), la Commission européenne l'a classé dans la Catégorie 3, soit comme « substance préoccupante en raison d'effets cancérogènes possibles mais à l'égard desquels l'information disponible ne permet pas d'établir une évaluation satisfaisante » (Commission européenne, 2000; ESIS, 2009), la U.S. Environmental Protection Agency (EPA) l'a classé comme cancérogène du groupe B2, soit comme « substance probablement cancérogène pour les humains » (US EPA, 1990) et le National Toxicology Program des États-Unis l'a classé parmi les « substances dont on peut raisonnablement présumer qu'elles sont cancérogènes pour l'homme » (NTP, 2005). Ces classifications se fondent sur des observations d'adénomes hépatocellulaires et de carcinomes chez des souris, de tumeurs dans les fosses nasales, dans les tissus souscutanés du foie, dans les glandes mammaires et dans les mésothéliomes péritonéaux de rats et de tumeurs dans le foie et la vésicule biliaire de cobayes ayant été exposés oralement au 1,4-dioxane (US EPA, 1990; CIRC, 1999).
Lorsque le 1,4dioxane a été administré par l'eau potable dans le cadre d'essais biologiques de la cancérogénicité chronique, une importante augmentation de l'incidence d'adénomes hépatocellulaires et de carcinomes a été observée de façon répétée chez les deux sexes de diverses souches de rats et de souris et chez des cobayes mâles (des cobayes femelles n'ont pas été soumises aux essais), alors que des tumeurs des fosses nasales ont été observées seulement chez les rats des deux sexes exposés à des concentrations de 1,4dioxane de 0,5 % (240 à 398 mg/kg-p.c. par jour) et à des doses supérieures dans l'eau potable pendant deux ans. Une importante croissance du nombre d’incidences de tumeurs du foie a été observée chez les souris et les rats auxquels on a administré de 0,05 à 1 % (77 à 1 070 mg/kg p.c. par jour) de 1,4-dioxane et des doses supérieures dans l’eau potable pendant deux ans (Kociba et al., 1974; National Cancer Institute, 1978; Yamazaki et al. 1994; JBRC, 1998c), tandis qu'un nombre croissant d'incidences de mésothéliomes péritonéaux observées chez les rats mâles et de tumeurs des glandes mammaires chez les rats femelles ont été observées chez les rats exposés à des concentrations 1,4dioxane de 0,5 % (398 à 514 mg/kg-p.c. par jour) dans l'eau potable pendant deux ans (Yamazaki et al., 1994; JBRC, 1998c). À une dose de 1,4dioxane de 0,01 % (9,6 à 19 mg/kg-p.c. par jour) dans l'eau potable pendant deux ans, aucune formation de tumeurs et aucun effet d'exposition n'a été observé chez les rats exposés (Kociba et al., 1974). En outre, des tumeurs du foie et des fosses nasales ont été observées chez des rats exposés au 1,4dioxane à des concentrations de 0,75 à 1,8 % (environ l'équivalent de 770 à 1 850 mg/kg-p.c. par jour) dans l'eau potable pendant des périodes relativement plus courtes, soit de 13 mois (Hoch-Ligeti et al., 1970; Argus et al., 1973) ou de 63 semaines (Argus et al., 1965); aucun résultat d'analyse statistique n'a été fourni. Lors d'un essai biologique sur la cancérogénicité effectué chez des cobayes mâles, 22 animaux ont été exposés à des doses du 1,4dioxane variant de 0,5 à 2 % (1 200 à 4 800 mg/kg-p.c. par jour) dans l'eau potable pendant 23 mois; trois animaux ont développé des hépatomes, un a développé des adénomes rénaux et deux ont développé des carcinomes de la vésicule biliaire (Hoch-Ligeti et Argus, 1970).
Une étude ancienne de l’exposition chronique par inhalation n’a fourni aucune preuve de la cancérogénicité ou autres effets nocifs sur les rats des deux sexes, exposés au 1,4-dioxane à 400 mg/m3 pendant deux ans (Torkelson et al., 1974). Toutefois, au cours de la période de commentaires publics relatifs à cette évaluation, une étude de deux ans sur l’exposition par inhalation sur des rats mâles F344 a été publiée (Kasai et al., 2009). Une augmentation attribuable à la dose et significative de l’incidence de carcinomes malphigiens et d’adénomes hépatocellulaires a été constatée principalement sur les rats exposés à 1 250 ppm (4500 mg/m3) et une augmentation significative de l’incidence de mésothéliomes péritonéaux a été observée à 250 ppm (900 mg/m3) et supérieur. L’incidence d’hypernéphromes, de fibroadénomes mammaires et d’adénomes dans la glande de Zymbal a également augmenté avec la dose, mais ne s’est pas révélée statistiquement significative. Des lésions prénéoplasiques dans la cavité nasale, notamment l’augmentation significative de l’incidence de l’élargissement nucléaire, une atrophie et des métaplasies respiratoires ont été constatées à 50 ppm (180 mg/m3) et supérieur.
L’application cutanée du 1,4-dioxane seul n’a pas provoqué de tumeurs cutanées liées à l’exposition ou d’autre nature sur les souris (King et al., 1973; Perone et al., 1976). Cependant, dans le cadre d'un essai visant à favoriser la croissance de tumeurs par voie cutanée, dans le cas où les souris ont été exposées au diméthylbenzanthracène avant de recevoir la dose de 1,4dioxane, on a observé des tumeurs cutanées ainsi que des tumeurs dans les poumons, les reins, la rate et le foie (King et al., 1973). Des tumeurs pulmonaires provoquées par le 1,4-dioxane ont également été observées chez les souris mâles, mais pas chez les femelles, lorsque la substance a été administrée par injection intrapéritonéale (Maronpot et al., 1986; Stoner et al., 1986).
En ce qui a trait aux humains, même si plusieurs études épidémiologiques n'ont pas fourni de preuves de formation de tumeurs induites par le 1,4dioxane dans le milieu de travail (Thiess et al., 1976, 1981; NIOSH, 1977; Buffler et al., 1978; Kramer et al., 1978), une étude comparative d'envergure sur la mortalité fondée sur des données tirées du Danish Cancer Registry a révélé que les rapports d'incidence normalisée proportionnels pour les tumeurs du foie des travailleurs mâles exposés au 1,4dioxane et à d'autres produits chimiques dans le milieu de travail étaient considérablement supérieurs aux rapports attendus, alors qu'une augmentation de 50 % de l'incidence du cancer du foie a été observée dans les milieux de travail où le 1,4dioxane était la seule substance utilisée (Hansen, 1993; Hansen et al., 1993).
La génotoxicité du 1,4dioxane a été évaluée par une gamme d'essais in vitro et in vivo. Tous les essais de mutagénicité étaient négatifs, y compris ceux effectués dans des cellules bactériennes et mammaliennes ainsi que dans des cellules de levures, un essai visant à induire une mutation létale dominante chez des souris et un essai pour induire une mutation létale récessive chez le Drosophila (BASF, 1977, 1979a, b, c, 1991; Stott et al., 1981; Haworth et al., 1983; Nestmann et al., 1984; Yoon et al., 1985; Khudoley et al., 1987; Kwan et al., 1990; McGregor et al., 1991; Morita et Hayashi, 1998). En outre, tous les essais de mutagénicité utilisant l'un des métabolites du 1,4-dioxane, soit le 1,4dioxan-2-one, ont aussi donné des résultats négatifs (Goldsworthy et al., 1991; EURAR, 2002). En ce qui concerne les enquêtes sur la clastogénicité, y compris l'aberration chromosomique, l'induction micronucléaire et l'échange de chromatides sœurs, la majorité des résultats des essais in vitro étaient négatifs, un résultat positif étant faible, et les résultats des essais d'induction micronucléaire in vivo étaient mixtes pour les deux souches de souris CD-1 et C57BL/6 (Galloway et al., 1987; McFee et al., 1994; Mirkova, 1994; Tinwell et Ashby, 1994; Morita et Hayashi, 1998; Roy et al., 2005). Une augmentation considérable du nombre d'aberrations chromosomiques a été observée chez 11 travailleurs exposés aux oxydes d'alkylène, y compris le 1,4dioxane, pendant plus de 20 ans dans le milieu de travail. Cependant, les travailleurs ont également été exposés à des mutagènes connus comme l'oxyde d'éthylène et l'oxyde de propylène (Thiess et al., 1981). Une importante augmentation du degré d'aneuploïdie a été observée chez le Drosophila (Muñoz et Barnett, 2002), mais non dans les levures (Zimmermann et al., 1985) qui ont été exposés au 1,4-dioxane. L'incidence de 1,4-dioxane était positive dans certains essais, mais non dans d'autres, dans le cadre de l'examen des effets sur l'acide désoxyribonucléique (ADN) comme des cassures de brins d'ADN, l'amélioration des processus de réparation d'ADN ou la prolifération de cellules (mesurées comme synthèse réplicative de l'ADN) et la transformation des cellules. Toutefois, ces effets étaient généralement importants seulement à des doses plus élevées ou après une exposition prolongée et souvent, en présence de cytotoxicité (Stott et al., 1981; Heidelberger et al., 1983; Sina et al., 1983; Sheu et al., 1988; Sai et al., 1989; Kitchin et Brown, 1990; Goldsworthy et al., 1991; Hellmer et Bolcsfoldi, 1992; Uno et al., 1994; Miyagawa et al., 1999; Sasaki et al., 2000). La Commission européenne a conclu que le total du poids de la preuve indique que le 1,4-dioxane est un composé non génotoxique (EURAR, 2002). L'Agency for Toxic Substances and Disease Registry (ATSDR) a déclaré que « collectivement, les renseignements disponibles suggèrent que le 1,4-dioxane est un composé non génotoxique, au mieux, un composé faiblement génotoxique » (ATSDR, 2007). Le gouvernement de l'Australie a conclu que « dans l'ensemble, le poids de la preuve des essais in vitro et in vivo indique une faible probabilité que le 1,4dioxane soit mutagène » (NICNAS, 1998).
Même si les mécanismes de cancérogénicité du 1,4-dioxane ont été examinés par d'autres organismes, ils n'ont pas été élucidés entièrement car les données sur la réaction aux doses et le progrès de la réaction en fonction du temps pour caractériser et déterminer les événements clés de la formation de tumeurs induites par le 1,4dioxane, et de ce fait, pour appuyer toute hypothèse liée au mécanisme de cancérogénicité, sont insuffisantes, incohérentes ou inexistantes. Par contre, l'ensemble des preuves indique que le 1,4dioxane n'est pas génotoxique. Ainsi, même si le mode d'induction de tumeurs n'a pas été élucidé entièrement, on ne considère pas que les tumeurs observées sont causées par une interaction directe avec le matériel génétique (NICNAS, 1998; EURAR, 2002; ATSDR, 2007; VCCEP, 2007). Certains ont laissé entendre que la formation de tumeurs dans les fosses nasales de rats exposés au 1,4-dioxane dans l’eau potable est causée par l’inspiration d’eau dans les fosses nasales lorsqu’ils prennent de l’eau de leur bouteille, causant l’exposition directe des fosses nasales à des doses élevées, puis la cytotoxité (Reitz et al., 1990; Goldsworthy et al, 1991; Stickney et al., 2003; Sweeney et al., 2008), les causes étant liées à l'anatomie nasale du rat et à la méthodologie expérimentale. Toutefois, une étude récente de deux ans sur les rats (Kasai et al., 2009) a permis de constater des lésions prénéoplasiques et néoplasiques dans les fosses nasales des rats par inhalation; par conséquent, la pertinence pour les humains des tumeurs nasales provoquées par le 1,4-dioxane ne peut pas être exclue. Par ailleurs, le 1,4-dioxane n’est pas un carcinogène complet car il n’a présenté qu’une activité de promotion des tumeurs, et non pas une activité d’initiation des tumeurs (Pereira et al., 1982; Bull et al., 1986; Stoner et al., 1986; Lundberg et al., 1987).
Plusieurs études ont indiqué que le 1,4dioxane était absorbé rapidement et complètement après une exposition orale ou une exposition par inhalation chez les humains et les rats, alors qu'une incidence d'absorption beaucoup moins grande (3,4 % en général) s'est produite lors de l'exposition par voie cutanée chez les singes et sur la peau humaine in vitro (Young et al., 1976, 1977, 1978; Marzulli et al., 1981; Bronaugh, 1982). Après une injection intrapéritonéale, le 1,4-dioxane a été réparti rapidement et décelé dans tous les tissus examinés (Woo et al., 1977; Mikheev et al., 1990). Le métabolite primaire du 1,4dioxane, l'acide ß-hydroxyéthoxyacétique (HEAA), a été décelé dans l'urine de rats et d'humains (Young et al., 1976, 1977, 1978; Braun et Young, 1977). Le 1,4-dioxan-2-one a également été décelé dans l'urine de rats, selon le pH et la température des conditions analytiques. À un pH élevé, le HEAA est décelé, et à un pH faible, le HEAA est converti au 1,4-dioxan-2-one (Braun et Young, 1977; Woo et al., 1977, 1978). À des doses plus faibles, l'élimination rapide (demivie d'environ une heure) du 1,4dioxane a été observée chez des humains exposés à 50 ppm (180 mg/m3) de 1,4dioxane par inhalation. Une demivie semblable a été observée chez des rats ayant reçu des doses orales ou intraveineuses du 1,4-dioxane (moins de 10 mg/kg-p.c.). Cependant, la toxicocinétique non linéaire du 1,4dioxane a été démontrée chez des rats lorsque l'oxydation du 1,4dioxane à ses métabolites primaires, le HEAA et le 1,4-dioxan-2-one, a atteint un point de saturation à des doses supérieures à 50 ppm (180 mg/m3) dans l'air ou à 10 mg/kg-p.c. administrées oralement et l'accumulation du 1,4dioxane a été observée (Young et al., 1976, 1977, 1978; Stickney et al., 2003). En outre, le métabolisme amélioré dans le foie n'a pas eu pour effet d'accroître l'hépatotoxicité du 1,4dioxane mesurée par le contenu en glutathione hépatique ou en enzymes sériques de l'alanine transaminase, ce qui révèle que les métabolites n'ont pas joué un rôle majeur dans l'hépatotoxicité du 1,4-dioxane (Nannelli et al., 2005). Dans l'ensemble, les preuves suggèrent qu'il peut exister un seuil de toxicité et de cancérogénicité à des doses où le métabolisme du 1,4-dioxane devient saturé (VCCEP, 2007).
Plusieurs modèles pharmacocinétiques et pharmacodynamiques à base physiologique (MPBP) ont été créés pour prévoir l'absorption, la répartition, le métabolisme et l'élimination du 1,4dioxane chez les rongeurs et les humains (Young et al., 1977, 1978; Leung et Paustenbach, 1990; Reitz et al., 1990; Fisher et al., 1997; Sweeney et al., 2008). Le modèle de Fisher et al. (1997) indique que le 1,4-dioxane peut aussi être éliminé dans le lait maternel humain, comme il est indiqué dans la partie d’évaluation de l’exposition. Toutefois, cette élimination du 1,4-dioxane dans le lait maternel n’a été ni évaluée ni prévue par d’autres modèles pharmacocinétiques à base physiologique (MPBP). Comme il est décrit dans la partie d’évaluation de l’exposition, l’exposition au 1,4-dioxane dans le lait maternel n’est pas envisagée.
Les effets primaires non néoplastiques induits par le 1,4dioxane sont les dommages au foie et aux reins, lesquels sont généralement associés à une exposition à de fortes doses du 1,4dioxane et à la citotoxicité, qui ont été observés par tous les mécanismes d'exposition faisant objet de l'étude chez les humains et les animaux de laboratoire. Parmi les autres effets nocifs induits par le 1,4dioxane, on compte des effets sur le système nerveux central, les systèmes respiratoires et sanguins ainsi que l'estomac.
La dose minimale avec effet nocif observé (DMENO) reçue oralement pour les effets non néoplastiques fondés sur des lésions au foie a été observée à 16 mg/kg-p.c. par jour chez des rats exposés au 1,4-dioxane par l'eau potable pendant deux ans (Yamazaki et al., 1994; JBRC, 1998c). De plus, les DME(N)O reçues oralement qui ont été décelées dans le cadre d'études subchroniques, de courte durée et aiguës sont de 130 mg/kg-p.c. par jour (Kano et al., 2008), de 400 mg/kg-p.c. par jour (la seule dose faisant objet de l'essai; Nannelli et al., 2005) et de 1 050 mg/kg-p.c. par jour (Kanada et al., 1994), respectivement (annexe 4). Une donnée pratique, la dose sans effet nocif observé (DSENO) pour les effets chroniques et la plus faible dose dans les études disponibles où des tumeurs n'ont pas été observées chez les rats est de 0,01 % dans l'eau potable (équivalent à 9,6 et à 19 mg/kg-p.c. par jour pour les mâles et les femelles, respectivement), selon l'étude de deux ans qui a déjà été mentionnée (Kociba et al., 1974).
Des effets non néoplasiques induits à la vapeur du 1,4-dioxane comme des changements histopathologiques dans les fosses nasales et le foie ont été observés chez des rats à des concentrations de 100 ppm (360 mg/m3) et supérieur dans une étude de 13 semaines (Kasai et al., 2008) et à 50 ppm (180 mg/m3) et supérieur dans une étude de deux ans (Kasai et al., 2009), même si dans d’autres études sur l’inhalation, aucun effet lié à un traitement n’a été observé chez des rats à des concentrations de vapeur du 1,4-dioxane de 111 ppm (400 mg/m3) sur deux ans (Torkelson et al., 1974). En outre, on a observé l'activation de la glutathione-peroxydase dans le cerveau et les ovaires des rats femelles observées qui ont été exposées à une concentration de vapeur de 1,4dioxane de 100 mg/m3pendant un mois (Burmistrov et al., 2001). On a également observé l'irritation des yeux et du système respiratoire après une exposition par inhalation aiguë chez des humains et des animaux de laboratoire. La dépression du système nerveux central et des lésions sur le foie et les reins ont été observées chez les animaux exposés à de fortes concentrations de vapeur du 1,4-dioxane. En matière d’exposition aiguë, une concentration sans effet nocif observé (CSENO) de 20 ppm (72 mg/m3) a été déterminée chez les humains (Ernstgård et al., 2006), tandis que de faibles effets, tels qu’une modification de l’activité des enzymes sériques, ont été observés chez les rats exposés à des concentrations de vapeur du 1,4-dioxane de 1 000 ppm (3 600 mg/m3, concentration minimale avec effet observé [CMEO] aiguë la plus faible) sur quatre heures (Drew et al., 1978).
En ce qui a trait à l'exposition par contact cutané, même si des lésions importantes n'ont pas été observées chez les souris ayant été exposées par voie cutanée à des concentrations du 1,4dioxane de 0,2 mL trois fois par semaine pendant 60 semaines ou de 0,05 mL trois fois par semaine pendant 78 semaines (King et al., 1973; Perone et al., 1976), ces données ne sont pas considérées comme adéquates pour dériver une DSENO car il se peut que l'application par contact cutané dans ces études n'ait pas eu lieu dans des conditions d'occlusion, et par conséquent, les doses appliquées par contact cutané peuvent avoir été réduites considérablement par l'évaporation rapide du 1,4dioxane.
Les effets induits du 1,4-dioxane sur la reproductivité et le développement ont été observés seulement à des doses élevées, d'après le peu de données qui sont disponibles. Les effets sur les organes reproducteurs mâles, par exemple, la réduction du taux de minéralisation des testicules, ont été observés chez des souris exposées au 1,4dioxane à des concentrations de 2 000 mg/L dans l'eau potable (250 mg/kg-p.c. par jour) pendant deux ans, mais non chez les rats qui ont été exposés oralement au 1,4dioxane à des doses de jusqu'à 1 015 mg/kg-p.c. par jour ou à 400 mg/m3 dans l'air pendant deux ans (Kociba et al., 1974; Torkelson et al., 1974; Yamazaki et al., 1994; JBRC, 1998c). On a également observé une baisse considérable du poids corporel moyen de fœtus vivants et un retard de l'ossification des sternèbres chez des rats exposés à une dose du 1,4dioxane de 1 035 mg/kg-p.c. par jour durant la période d'organogenèse (Giavini et al., 1985). En outre, des effets immunologiques comme la suppression de la production de lymphocytes T et l'augmentation de la production de cellules B ont été observés en réaction au 1,4dioxane dans des lymphocytes murins et humains in vitro, et une réaction des lymphocytes un peu plus faible aux mitogènes a été observée chez des souris exposées au 1,4dioxane par injection intrapéritonéale (1 670 mg/kg-p.c. par jour pendant 7 jours) (Thurman et al., 1978).
Le niveau de confiance accordé à la base de données sur la toxicité est élevé car on dispose de données sur la toxicité aiguë, la cancérogénicité, la toxicité par doses répétées, la génotoxicité et la toxicité pour le développement, mais les données liées aux effets sur la peau et la reproductivité sont limitées et il demeure une incertitude quant au mode d’induction de tumeurs..
Caractérisation du risque pour la santé humaine
En s’appuyant principalement sur des évaluations fondées sur le poids de la preuve de plusieurs organismes internationaux (Centre international de recherche sur le cancer, Union européenne, U.S. Environmental Protection Agency et National Toxicology Program des États-Unis) et sur les données disponibles, les effets critiques associés à l’exposition au 1,4-dioxane suivant une exposition orale à la substance et par inhalation, sont des tumorigenèses ainsi que d’autres effets systémiques, principalement des dommages aux reins et au foie, et ce, par toutes les voies d’exposition (orale, cutanée et inhalation). L'ensemble des preuves indique que le 1,4-dioxane n'est pas une substance mutagène et qu'elle présentait, dans certains essais, une faible clastogénicité à des niveaux d'exposition élevés, et non dans d'autres essais souvent associés à la cytotoxicité. Une considération des données disponibles concernant la génotoxicité et les conclusions d'autres organismes indiquent que le 1,4dioxane n'est probablement pas génotoxique. La toxicocinétique non linéaire du 1,4dioxane a été observée chez des rats, et on a suggéré l'existence d'un seuil de toxicité et de cancérogénicité où le métabolisme du 1,4dioxane devient saturé. Des voies métaboliques semblables pour le 1,4-dioxane ont été observées chez des humains et des animaux de laboratoire, quoique les données épidémiologiques disponibles n’aient pas fourni de preuves suffisantes sur la cancérogénicité du 1,4-dioxane chez les humains et la pertinence pour les humains de la cancérogénicité du 1,4-dioxane, notamment l’induction des tumeurs du foie. Ainsi, même si le mode d’induction de tumeurs n’a pas été clairement établi, les chercheurs n’estiment pas que les tumeurs observées soient le résultat d’un contact direct avec un matériel génétique. Un seuil d'exposition a donc été utilisé pour caractériser le risque pour la santé humaine. En conséquence, les marges d’exposition sont dérivées entre le niveau auquel aucune tumeur ou aucun effet nocif n’a été observé dans le cadre d’études expérimentales, la plus faible dose d’exposition associée aux effets nocifs induits par le 1,4-dioxane et les estimations prudentes de l’exposition de la population générale au 1,4-dioxane (annexe 5).
On estime que les principales voies d'exposition de la population générale au 1,4dioxane sont leur environnement (c.àd., l'air ambiant, l'air intérieur et l'eau potable), leur nourriture et leur utilisation de produits de consommation contenant la substance. La comparaison des limites supérieures de l'absorption quotidienne totale de l'environnement à la dose à laquelle aucune tumeur et aucun effet nocif n'a été observé et à la DMENO pour les effets non cancéreux a permis de créer la marge d'exposition variant de 7 000 à 84 000. Par ailleurs, en matière d’exposition par inhalation, une comparaison de la concentration la plus élevée de 1,4-dioxane dans l’air intérieur mesurée dans la région du Grand Toronto pendant trois mois en 1996 avec la concentration minimale avec effet nocif observé (CMENO) pour les effets non cancéreux sur les rats ou l’irritation chez les humains, conduit à des marges d’exposition de cinq ordres d’importance. Ces marges d’exposition sont considérées comme adéquates pour tenir compte des incertitudes dans l’ensemble de données sur l’évaluation des risques pour la santé humaine des effets cancéreux et non cancéreux.
En outre, une série de produits de soins personnels contenant le 1,4dioxane comme sousproduit de fabrication ont été identifiés. L'inhalation et le contact cutané par l'utilisation de ces produits contribuerait à l'exposition au 1,4dioxane. Pour les produits pouvant être utilisés tous les jours par les consommateurs collectivement, les estimations globales des limites supérieures de l’exposition au 1,4-dioxane de divers produits de soins personnels (p. ex., le shampooing, le revitalisant, le gel de douche et la lotion hydratante) par inhalation et par contact cutané sont comparées à la concentration à laquelle aucune tumeur et aucun effet nocif n’a été observé et à la DMENO pour les effets non cancéreux. Cette approche est considérée comme prudente car les données disponibles sur le contact cutané ne sont pas suffisantes pour dériver une DMENO cutanée, et le faible taux d’absorption cutanée a été considéré dans les estimations d’exposition cutanée. Les marges d'exposition résultantes se situent entre 8 000 et 13 300. L'utilisation d'un seul produit de soins personnels, de savon liquide pour lavevaisselle ou de produits pour enfants (tableau 7c) génère des doses d'exposition plus faibles et entraînerait même de plus grandes marges d'exposition. Pour les produits utilisés moins fréquemment comme le colorant capillaire, les estimations supérieures d’exposition par contact cutané et par inhalation sont comparées à la concentration minimale avec effet observé (CMEO) par voie orale aiguë, d’après les effets sur le système nerveux central observés chez des rats (Kanada et al., 1994), ce qui donne une marge d’exposition de 15 630 à 52 000. Par conséquent, la marge d’exposition pour l’absorption par inhalation et par contact cutané lors de l’utilisation de produits de consommation est considérée comme suffisamment protectrice.
En matière d’exposition par inhalation des produits, une comparaison de la somme prudente des estimations supérieures de l’exposition par inhalation lors de l’utilisation quotidienne de produits de soins personnels, qui pourrait être utilisée successivement avec la CMENO, d’après les effets sur les fosses nasales de rats, permet de créer une marge d’exposition de 15 250. L’estimation de la limite supérieure de la concentration moyenne liée à l’utilisation de colorant capillaire est comparée à la CMEO aiguë, d’après la modification des enzymes sériques chez des rats et avec l’irritation des yeux chez les humains permet de créer une marge d’exposition d’environ 40 (irritation chez les humains) à 780 (rats). Étant donné que ces estimations sont pour une limite supérieure très prudente (c.-à-d. de 100 % pour le sulfate d’alkyle éthoxylé dans le produit final, ce qui représente assurément une surestimation), la marge d’exposition par l’utilisation de produits de consommation est considérée comme étant suffisamment protectrice.
Incertitudes de l'évaluation des risques pour la santé humaine
Une grande confiance sévit à l'égard des concentrations du 1,4-dioxane dans les milieux environnementaux au Canada. Toutes les données sur le sol, l'air et l'eau proviennent du Canada et sont considérées comme adéquates pour permettre la quantification de l'exposition au 1,4dioxane. Des incertitudes existent concernant l’estimation de l’absorption de sources alimentaires car les données canadiennes sur le contrôle des doses du 1,4-dioxane dans les aliments n’étaient pas disponibles et par conséquent, elles n’ont pas été incluses dans les estimations de l’absorption. Les expositions à certains additifs alimentaires sont considérées comme étant surestimées, les niveaux réels dans les aliments devant être très faibles (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). Même s'il existe un certain degré d'incertitude en raison des renseignements limités sur la présence ou les concentrations de la substance dans les produits de consommation disponibles au Canada, les estimations d'exposition par l'utilisation de produits contenant du 1,4dioxane sont fondées sur des hypothèses prudentes.
Il existe une incertitude autour du niveau à laquelle le 1,4-dioxane, présent dans les produits de santé (pharmaceutiques, médicaments vétérinaires et produits de santé naturels), sous forme de résidus de solvants puisse contribuer à l’exposition de la population en générale (voir la section Utilisations)
Les chercheurs sont incertains à l'égard du mécanisme de la tumorigenèse induite par le 1,4dioxane car les données sur la réaction à la dose et le progrès de la réaction en fonction du temps permettant de caractériser et d'identifier les événements clés dans la formation de différents types de tumeurs induites par le 1,4dioxane, ainsi que d'appuyer tout mécanisme hypothétique de cancérogenèse sont insuffisantes, incohérentes ou non disponibles. Cependant, l’ensemble des preuves indique que cette substance peut ne pas avoir un lien direct avec le matériel génétique, et par conséquent, il est considéré comme justifiable d’utiliser une marge d’exposition dans l’évaluation préalable pour caractériser les risques. De plus, il existe un certain degré d’incertitude concernant la pertinence pour les humains de la cancérogénicité du 1,4-dioxane car les études épidémiologiques n’ont pas fourni de preuves concluantes. Toutefois, la pertinence éventuelle n’a pas été éliminée de l’évaluation. Quant aux effets non néoplasiques, certaines incertitudes demeurent à l’égard des concentrations d’exposition critiques associées à ces effets par exposition par contact cutané au 1,4-dioxane, étant donné que l’ensemble de données sur le contact cutané est limité De plus, les données sur la toxicité pour la reproduction associées à l'exposition au 1,4dioxane sont limitées car il n'existe aucune étude multigénérationnelle.
D’après les renseignements contenus dans la présente évaluation préalable finale, le 1,4-dioxane ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions qui ont pu ou peuvent avoir un effet nuisible immédiat ou à long terme sur l’environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
Compte tenu de l’adéquation des marges d’exposition entre les estimations prudentes de l’exposition au 1,4-dioxane et des doses à effet critique, il est conclu que le 1,4-dioxane est considéré comme une substance ne pénétrant pas dans l’environnement en quantités, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un danger pour la vie ou la santé humaine au Canada.
Il est conclu que le 1,4-dioxane ne répond à aucun des critères énoncés à l’article 64 de la LCPE(1999). Même si le 1,4dioxane répond aux critères de la persistance, il ne répond pas aux critères du potentiel de bioaccumulation tels qu'ils sont énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Cette substance sera considérée pour inclusion dans la prochaine initiative de mise à jour de l'inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
Abe, A. 1999. Distribution of 1,4-dioxane in relation to possible sources in the water environment. Sci. Total. Environ. 227:41-47.
Adams, R.M. 1983. Solvents and plasticizers. In : Adams, R.M. (éd.) Occupational skin disease. New York (NY) : Grune & Stratton USA. p. 279-297. [cité dans NICNAS, 1998].
[AIES] Artificial Intelligence Expert System. 2003-2005. Version 1.25. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Disponible auprès de la Division des substances nouvelles, Division des substances existantes, Environnement Canada
Ailamazian, E.K. 1990. Effect of ecological factors on the course of pregnancy. Vestn. Akad. Med. Nauk. SSSR 7:23-25 (en russe). [cité dans NICNAS, 1998].
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Argus, M.F., Arcos, J.C., Hoch-Ligeti, C. 1965. Studies on the carcinogenic activity of the protein-denaturing agents: hepatocarcinogenicity of dioxane. J. Natl. Cancer Inst.35:949-958.
Argus, M.F., Sohal, R.S., Bryant, G.M., Hoch-Ligeti, C., Arcos, J.C. 1973. Dose–response and ultrastructural alterations in dioxane carcinogenesis. Influence of methylcholanthrene on acute toxicity. Eur. J. Cancer 9:237-243.
Arnot, J.A., Gobas, F.A. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. [en ligne] 22(3):337-345. Accès : http://www3.interscience.wiley.com/journal/104557877/home[réserve de consultation]
[ASTER] Assessment Tools for the Evaluation of Risk [en ligne]. 1999. Duluth (MN) : U.S. Environmental Protection Agency, Mid-Continent Ecology Division. Accès : http:www.epa.gov/med/Prods_Pubs/aster.htm. [réserve de consultation]
Atkinson, R. 1989. Kinetics and mechanisms of the gas-phase reactions of the hydroxyl radical with organic compounds.J. Phys. Chem. Ref. Data. Monogr. 1:1-246.
[ATSDR] Agency for Toxic Substances and Disease Registry. 2007. Draft toxicological profile for 1,4-dioxane. Washington (DC) : U.S. Department of Health and Human Services, Public Health Service, ATSDR. [consulté le 3 mai 2009]. Accès : http://www.atsdr.cdc.gov/toxprofiles/tp187.pdf
Barber, H. 1934. Hemorrhagic nephritis and necrosis of the liver from dioxane poisoning. Guy’s Hosp. Rep. 84:267-280. [cité dans NICNAS, 1998].
BASF. 1973. Rapport inédit daté du 4 mai 1973. [cité dans EURAR, 2002].
BASF. 1977. Bericht über die Prüfung von 1,4-Dioxan auf mutagene Wirkung an männlichen Mäusen nach einmaliger intraperitonealer Applikation. Dominanter Letaltest. Rapport inédit de BASF Medizinisch-Biologische Forschunglaboratorien, Gewerbehygiene und Toxikologie, daté du 21 mars 1977. [cité dans EURAR, 2002].
BASF. 1979a. Bericht über die Prüfung von 1,4-Dioxan (stabilisiert mit 25 ppm 2,6-Di-tert.-butyl-p-kresol) im Ames-Test. Rapport inédit (79/135) de BASF, Gewerbehygiene und Toxikologie, daté du 2 avril 1979. [cité dans EURAR, 2002].
BASF. 1979b. Bericht über die Prüfung von 1,4-Dioxan (Peroxid-haltig) im Ames-Test. Rapport inédit (79/133) de BASF, Gewerbehygiene und Toxikologie, daté du 2 avril 1979. [consulté par l'EURAR, 2002].
BASF. 1979c. Bericht über die Prüfung von 1,4-Dioxan (Peroxid-frei) im Ames-Test. Rapport inédit (79/134) de BASF, Gewerbehygiene und Toxikologie, daté du 3 avril 1979. [consulté par l'EURAR, 2002].
BASF. 1980. Prüfung auf ein akutes Inhalationsrisiko (Ratte). Inhalationsrisikotest. Rapport inédit de BASF, Gewerbehygiene und Toxikologie, daté du 29 décembre 1980. [cité dans lEURAR, 2002].
BASF. 1991. Report on a point mutation test carried out on CHO cells (HGPRT locus) with the test substance 1,4-dioxane (substance no. 79/471). Rapport inédit. Ludwigshafen/Rhein (Allemagne) : BASF Aktiengesellschaft, Département de toxicologie. [cité dans EURAR, 2002].
BASF. 1993. Report on the maximization test for the sensitizing potential of 1,4-dioxane in guinea pigs. Projet no 30H0066/922030. Rapport inédit. Ludwigshafen/Rhein (Allemagne) : BASF Aktiengesellschaft, Département de toxicologie [cité dans EURAR, 2002].
[BCFWIN] BioConcentration Factor Program for Windows [modèle d'estimation]. 2000. Version 2.15. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BESC] Bureau européen des substances chimiques. 2000. IUCLID dataset for 1,4-dioxane (no CAS123-91-1). Accès : http://ecb.jrc.it/esis/
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ. Sci. Technol.34(4):699-703.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Black, R.E., Hurley, F.J., Havery, D.C. 2001. Occurrence of 1,4-dioxane in cosmetic raw materials and finished cosmetic products. J. AOAC. Int. 84(3):666-670.
Blount, B., Chambers, D., McElprang, D., Skinner, C., Wang, R. 2008. Measuring 1,4 dioxane in blood as a biomarker of exposure. Proceedings from Society of Toxicology meeting. Centre for Disease Control and Prevention.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere. 30(4):741-752.
Braun, W.H., Young, J.D. 1977. Identification of beta-hydroxyethoxyacetic acid as the major urinary metabolite of 1,4-dioxane in the rat. Toxicol. Appl. Pharmacol.39:33-38.
Bringmann, G., Kühn, R. 1976. Befunde der Schadwirkung wassergefahrdender Stoffe gegen Daphnia magna. Z Wasser Abwasser Forschung 10:161-166. [cité dans EURAR, 2002].
Bronaugh, R. 1982. Percutaneous absorption of cosmetic ingredients. In : Frost P, éd. Principles of cosmetics for the dermatologist. Minneapolis (MN) : University of Minnesota Press. p. 277284.
Brooke, L. 1987. Report of the flow-through and static acute test comparisons with fathead minnows and acute tests with an amphipod and a cladoceran. Superior (WI) : University of Wisconsin-Superior, Center for Lake Superior Environmental Studies. p. 24. [cité dans HSDB, 2009].
Brown, S.K., Sim, M.R., Abramson, M.J., Gray, C.N. 1994. Concentration of volatile organic compounds in indoor air – A review. Indoor Air 4:123-134.
[BUA] German Chemical Society Advisory Committee on Existing Chemicals of Environmental Relevance. 1991. 1,4-Dioxane. BUA Report 80. [Traduction par R. Brown.] Stuttgart (Allemagne) : BUA.
Buffler, P.A., Wood, S.M., Suarez, L., Kilian, D.J. 1978. Mortality follow-up of workers exposed to 1,4-dioxane. J. Occup. Med. 20:255-259.
Bull, R.J., Robinson, M., Laurie, R.D. 1986. Association of carcinoma yield with early papilloma development in SENCAR mice. Environ. Health Perspect. 68:11-17.
Burmistrov, S.O., Arutyunyan, A.V., Stepanov, M.G., Oparina, T.I., Prokopenko, V.M. 2001. Effect of chronic inhalation of toluene and dioxane on activity of free radical processes in rat ovaries and brain. Bull. Exp. Biol. Med. 132:832-836.
Canada. [1978]. Règlement sur les aliments et drogues, C.R.C., c. 870, a. C.01.040.2. Accès : http://laws.justice.gc.ca/PDF/Regulation/C/C.R.C.,_c._870.pdf??
Canada. 1998. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur les substances appauvrissant la couche d'ozone (1998), C.P. 1998-2251, le 16 décembre 1998, DORS/99-7. Accès : http://www.ec.gc.ca/NOPP/DIVISION/FR/detail.cfm
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, c. 33. Accès : http://canadagazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement : Règlement sur la persistence et la bioaccumulation. C.P. 2000-348, le 23 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l'Environnement, Ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures de gestion et d’évaluation des risques que certaines substances présentent pour la santé des Canadiens et leur environnement.Gazette du Canada. Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://canadagazette.gc.ca/partI/2006/20061209/pdf/g1-14049.pdf
Canada, Ministère de l'Environnement, Ministère de la Santé. 2008. Loi canadienne sur la protection de l'environnement (1999) : Avis de septième divulgation d'information technique concernant les substances identifiées dans le Défi.Gazette du Canada. Partie I, vol. 142, no 35, p. 2501-2517. Accès : http://www.gazette.gc.ca/rp-pr/p1/2008/2008-08-30/pdf/g1-14235.pdf
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
[CCME] Conseil canadien des ministres de l'environnement. 2008. Recommandations pour la qualité de l'eau en vue de la protection de la vie aquatique : 1,4-dioxane. In : Recommandations canadiennes pour la qualité des eaux. Winnipeg (MB) : Environnement Canada, CCME.
Chung, T., Hayase, F., Kato, H. 1983. Volatile components of ripe tomatoes and their juices, purees and pastes. Agric. Biol. Chem. 47(2):343.
Commission européenne. 2000. Summary Record. Commission Meeting of the Commission Working Group on the Classification and Labelling of Dangerous Substances. Rencontre au Bureau européen des substances chimiques à Ispra, du 19 au 21 janvier 2000. Direction générale du CCR de la Commission européenne, Centre commun de recherche, Institute for Health and Consumer Protection. Bureau européen des substances chimiques. ECBI/19/00 – Rev. 1. Accès : http://ecb.jrc.it/documents/Classification-Labelling/ADOPTED_SUMMARY_RECORDS/1900r1_cmr0100.pdf
[ConsExpo] Consumer Exposure Model [en ligne]. 2006. Version 4.1, Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais de la santé publique et de l'environnement). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
[CSC] Campaign for Safe Cosmetics. 2009. No more toxic tub: Getting contaminants out of children’s bath and personal care products. Safe Cosmetics Action Network (États-Unis). [consulté en mars 2009]. Accès : http://www.safecosmetics.org/
[CSFII] Continuing Survey of Food Intakes by Individuals 1994-96, 1998 and Diet and Health Knowledge Survey 1994-96. 1994-1996, 98. U.S. Department of Agriculture, Agricultural Research Service, Beltsville Human Nutrition Research Center, Food Surveys Research Group. Beltsville (MD). Accès : http://www.ars.usda.gov/
Daubert, T.E., Danner, R.P. 1989. Physical and thermodynamic properties of pure chemicals data compilation. Washington (DC) : Taylor and Francis. [cité dans HSDB, 2009]
DeRosa, C.T., Wilbur, S., Holler, J., Richter, P., Stevens, Y.W. 1996. Health evaluation of 1,4dioxane. Toxicol. Ind. Health 12:1-43.
Dow. 1995. Toxicity and environmental references for 1,4-dioxane. Communication personnelle. [Cité dans NICNAS, 1998].
Drew, R.T., Patel, J.M., Lin, F.N. 1978. Changes in serum enzymes in rats after inhalation of organic solvents singly and in combination. Toxicol. Appl. Pharmacol. 45:809-819.
[ECOSAR] Ecological Structure Activity Relationships [en ligne]. 2004. Version 0.99h. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[ECOTOX] ECOTOXicology database [base de données en ligne]. 2006. Version 4. Washington (DC) : U.S. Environmental Protection Agency, Office ofResearch and Development; National Health and Environmental Effects Research Laboratory, Mid-Continent Ecology Division. [consulté en avril 2007]. Accès : http://cfpub.epa.gov/ecotox
Environnement Canada. 2007. Review of the limitations and uncertainties associated with use for molecular size information when assessing bioaccumulation potential. Rapport final inédit. Gatineau (Qc) : Environnement Canada, Division des substances existantes. Disponible sur demande.
Environnement Canada. 2008. Données sur les substances du lot 7 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du lot 7 du Défi. Données préparées par Environnement Canada, Santé Canada, Programme des substances existantes.
Environnement Canada. 2009g. Rapport IGETA : 1,4-Dioxane. Avril 2009. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques..
Environnement Canada. 2009b. Mega Flush report : 1,4-Dioxane. Avril 2009. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry (consulté en avril 2009). Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
Ernstgård, L., Iregren, A., Sjögren, B., Johanson, G. 2006. Acute effects of exposure to vapours of dioxane in humans. Hum. Exp. Toxicol. 25:723-729.
[ESIS] European Chemical Substances Information System [base de données en ligne]. 2009. Base de données préparée par le Bureau européen des substances chimiques [consultée en mai 2009]. Accès : http://ecb.jrc.it/esis/
[EURAR] European Union risk assessment report. No CAS: 123-91-1: 1,4-dioxane [Internet]. 2002. Luxembourg : Office des publications officielles des Communautés européennes. Rapport final, le 16 octobre 2002. En page couverture : Centre commun de recherche de l'Union européenne [consulté en mars 2009]. Accès : http://ecb.jrc.ec.europa.eu/DOCUMENTS/ExistingChemicals/RISK_ASSESSMENT/
REPORT/dioxanereport038.pdf
Fairley, A., Linton, E.C., Ford-Moore, A.H. 1934. The toxicity to animals of 1:4 dioxan. J. Hyg. 34:486-501.
[FCC] Food Chemicals Codex. 2008. Food Chemicals Codex 6e édition, U.S. Pharmacopeia. The United States Pharmacopeial Convention, 12601, Twinbrook Parkway, Rockville (MD) 20852.
Fellin, P., Otson, R. 1997. Emissions of VPOC from residences in the metropolitan Toronto area. In : Proceedings of the Air and Waste Management Association’s 90th Annual Meeting. Pittsburgh (PA) : AWMA.
Fisher, J., Mahle, D., Bankston, L., Greene, R., Gearhart, J. 1997. Lactational transfer of volatile chemicals in breast milk. Am. Ind. Hyg. Assoc. J. 58:425-431.
Frantík, E., Hornychová, M., Horváth, M. 1994. Relative acute neurotoxicity of solvents: isoeffective air concentrations of 48 compounds evaluated in rats and mice. Environ. Res.66:173185.
Fuh, C., Lai, M., Tsai, H.Y., Chang, C.M. 2005. Impurity analysis of 1,4-dioxane in nonionic surfactants and cosmetics using headspace solid phase microextraction coupled with gas. J. Chromatogr. A 1071(1-2):141.
Galloway, S.M., Armstrong, M.J., Reuben, C., Colman, S., Brown, B., Cannon, C., Bloom, A.D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, B.H., Resnick, M.A., Anderson, B., Zeiger, E. 1987. Chromosome aberrations and sister chromatid exchanges in Chinese hamster ovary cells: evaluations of 108 chemicals. Environ. Mol. Mutagen. 10(Suppl. 10):1-37.
Geiger, D.L., Brooke, L.T., Call, D.J. 1990. Acute toxicities of organic chemicals to fathead minnows (Pimephales promelas), vol. 5. Superior (WI) : University of Wisconsin-Superior, Center for Lake Superior Environmental Studies. 332 p.
Giavini, E., Vismara, C., Broccia, M.L. 1985. Teratogenesis study of dioxane in rats. Toxicol. Lett. 26:85-88.
Gingell, R., Boatman, R.J., Bus, J.S., Cawley, T.J., Knack, J.B., Krasavage, W.J., Skoulis, H.P., Stack, C.R., Tyler, T.R. 1994. Glycol ethers and other selected glycol derivatives. In : Clayton, G.D., Clayton, F.E. (éd.) Patty’s industrial hygiene and toxicology, vol. 2 (Part D). 4e éd. New York (NY) : John Wiley & Sons Inc. p. 2761-2966.
Goldberg, M.E., Johnson, H.E., Pozzani, U.C., Smyth, H.F. 1964. Effect of repeated inhalation of vapors of industrial solvents on animal behavior. I. Evaluation of nine solvent vapors on poleclimb performance in rats. Am. Ind.Hyg. Assoc. J. 25:369-375.
Golder Associates. 1987. Testing of specific organic compounds in soils in background in urban areas. Oakville (Ont.) : Golder Associates.
Goldsworthy, T.L., Monticello, T.M., Morgan, K.T., Bermudez, E., Wilson, D.M., Jäckh, R., Butterworth, B.E. 1991. Examination of potential mechanisms of carcinogenicity of 1,4-dioxane in rat nasal epithelial cells and hepatocytes. Arch. Toxicol.65:1-9.
Gouvernement du Japon. 2004. Chemicals in the environment [en ligne]. Tokyo (Japon) : Gouvernement du Japon, ministère de l'Environnement, Département de la santé environnementale. [consulté en mars 2009].
Gross, E. 1938. The individual solvents: dioxane (diethylene dioxide). In : Lehmann, K.B., Flury, F. (éd.) Toxicology and hygiene of industrial solvents. [traduction par King, E., Smyth, H.F. Jr]. Berlin (Allemagne) : Springer. p. 263-307.
Hansch, C., Leo, A., Hoekman, D. 1995. Exploring QSAR – Hydrophobic, electronic, and steric constants. Washington (DC) : American Chemical Society. [cité dans HSDB, 2009].
Hansen, J. 1993. The industrial use of selected chemicals and risk of cancer 1970-1984. Copenhagen (Danemark) : At-salg (en danois). [cité dans NICNAS, 1998].
Hansen, J., Schneider, T., Olsen, J.H., Laursen, B. 1993. Availability of data on humans potentially exposed to suspected carcinogens in the working environment. Pharmacol. Toxicol. 72(Suppl.):77-85.
Harkov, R., Kebbekus, B., Bozzelli, J.W., Lioy, P.J. 1984. Measurement of selected volatile organic compounds at three locations in New Jersey during the summer season. J. Air Pollut. Control Assoc. 33:1177-1183.
Hartung, R. 1989. Health and environmental effects assessment for 1,4-dioxane. Ann Arbor (MI) : Gelman Sciences Inc.
Haworth, S., Lawlor, T., Mortelmans, K., Speck, W., Zeiger, E. 1983. Salmonella mutagenicity test results for 250 chemicals. Environ. Mutagen. Supp. 1:1-10.
Heidelberger, C., Freeman, A.E., Pienta, R.J., Sivak, A., Bertram, J.S., Casto, B.C., Dunkel, V.C., Francis, M.W., Kakunaga, T., Little, J.B., Schechtman, L.M. 1983. Cell transformation by chemical agents – a review and analysis of the literature. Mutat. Res. 114:283-385.
Heil, J., Reifferscheid, G. 1992. Detection of mammalian carcinogens with an immunological DNA synthesis-inhibition test.
Hellmer, L., Bolcsfoldi, G. 1992. An evaluation of the E. coli K-12 uvrB/recA DNA repair host-mediated assay. I. In vitro sensitivity of the bacteria to 61 compounds. Mutat. Res. 272:145-160.
Hoch-Ligeti, C., Argus, M.F. 1970. Effect of carcinogens on the lung of guinea pigs. In : Nettesheim, P., Hanna, M.G. Jr, Deatherage, J.W. Jr (éd.) Morphology of experimental respiratory carcinogenesis. AEC Symposium Series No. 21 (CONF-700501). Springfield (VA) : National Technical Information Service. p. 267-279.
Hoch-Ligeti, C., Argus, M.F., Arcos, J.C. 1970. Induction of carcinomas in the nasal cavity of rats by dioxane. Br. J. Cancer 24:164-167.
[HSDB] Hazardous Substances Data Bank [base de données en ligne]. 1983. Bethesda (MD) : National Library of Medicine (US). [mise à jour en 1998; consultée en février 2009]. Accès : http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?HSDB
[IARC] International Agency for Cancer Research. 1999. 1,4-Dioxane. IARC Monogr. Eval. Carcinog. Risks. Hum.71:589-602.
Igarashi, H., Northover, A.N. 1987. Increases in opacity and thickness induced by surfactants and other chemicals in the bovine isolated cornea. Toxicol. Lett. 39:249-254.
[JBRC] Japan Bioassay Research Center. 1998a. Two-week studies of 1,4-dioxane in F344 rats and BDF1 mice (drinking water studies). Kanagawa (Japon) : JBRC. [cité dans EURAR, 2002].
[JBRC] Japan Bioassay Research Center. 1998b. Thirteen-week studies of 1,4-dioxane in F344 rats and BDF1 mice (drinking water studies). Kanagawa (Japon) : JBRC. [cité dans EURAR, 2002].
[JBRC] Japan Bioassay Research Center. 1998c. Two-year studies of 1,4-dioxane in F344 rats and BDF1 mice (drinking water studies). Kanagawa (Japon) : JBRC. [addendum dans Yamazaki et al.publié 1994]. [cité dans EURAR, 2002].
Johnson, R., Tietge, J., Stokes, G., Lothenbach, D. 1993. The Medaka Carcinogenesis Model. In: Tech. Rep. 9306, Compendium of the FY1988 & FY1989 Res. Ft. Frederick (MD) : Rev. for the Res. Methods Branch, US Army Biomedical Res. & Dev. Lab, p. 147-172 (US NTIS AD-A272667). [Cité dans ECOTOX, 2007]
Johnstone, R.T. 1959. Death due to dioxane? AMA Arch. Ind. Health. 20:445-447.
Kanada, M., Miyagawa, M., Sato, M., Hasegawa, H., Honma, T. 1994. Neurochemical profile of effects of 28 neurotoxic chemicals on the central nervous system in rats. (1) Effects of oral administration on brain contents of biogenic amines and metabolites. Ind. Health 32:145-164.
Kano, H., Umeda, Y., Saito, M., Senoh, H., Ohbayashi, H., Aiso, S., Yamazaki, K., Nagano, K., Fukushima, S. 2008. Thirteen-week oral toxicity of 1,4-dioxane in rats and mice. J. Toxicol. Sci. 33:141-153.
Kasai, T., Saito, M., Senoh, H., Umeda, Y., Aiso, S., Ohbayashi, H., Nishizawa, T., Nagano, K., Fukushima, S. 2008. Thirteen-week inhalation toxicity of 1,4-dioxane in rats. Inhal. Toxicol. 20:961-971.
Kasai, T., Kano, H., Umeda, Y., Sasaki, T., Ikawa, N., Nishizawa, T., Nagano, K., Arito, H., Nagashima, H., Fukushima, S. 2009. Two-year inhalation study of carcinogenicity and chronic toxicity of 1,4-dioxane in male rats. Inhal. Toxicol.21:889-897.
Kawata, K., Ibaraki, T., Tanabe, A., Yasuhara, A. 2003. Distribution of 1,4-dioxane and N,N-dimethylformamide in river water from Niigata, Japan. Environ. Contam. Toxicol.70:876-882.
Khudoley, V.V., Mizgireuv, I., Pliss, G.B. 1987. The study of mutagenic activity of carcinogens and other chemical agents with Salmonella typhimurium assays: testing of 126 compounds. Arch. Geschwulstforsch 57:453-462.
King, M.E., Shefner, A.M., Bates, R.R. 1973. Carcinogenesis bioassay of chlorinated dibenzodioxins and related chemicals. Environ. Health Perspect. 5:163-170.
Kitchin, K.T., Brown, J.L. 1990. Is 1,4-dioxane a genotoxic carcinogen? Cancer Lett. 53:67-71.
Kociba, R.J., McCollister, S.B., Park, C., Torkelson, T.R., Gehring, P.J. 1974. 1,4-Dioxane. I. Results of a 2-year ingestion study in rats. Toxicol. Appl. Pharmacol. 30:275-286.
Kramer, C.G., Ott, M.G., Fulkerson, J.E., Hicks, N., Imbus, H.R. 1978. Health of workers exposed to 1,1,1-trichloroethane: a matched-pair study. Arch. Environ. Health 33:331-342.
Kurl, R.N., Poellinger, L., Lund, J., Gustafsson, J.A. 1981. Effects of dioxane on RNA synthesis in the rat liver. Arch. Toxicol. 49:29-33.
Kwan, K.K., Dutka, B.J., Rao, S.S., Liu, D. 1990. Mutatox test: a new test for monitoring environmental genotoxic agents. Environ. Pollut. 65:323-332.
Lane, R.W., Riddle, B.L., Borzelleca, J.F. 1982. Effects of 1,2-dichloroethane and 1,1,1-trichloroethane in drinking water on reproduction and development in mice. Toxicol. Appl. Pharmacol. 63:409-421.
Leung, H., Paustenbach, D.J. 1990. Cancer risk assessment for dioxane based upon a physiologically-based pharmacokinetic approach. Toxicol. Lett. 51:147-162.
Lundberg, I., Högberg, J., Kronevi, T., Holmberg, B. 1987. Three industrial solvents investigated for tumor promoting activity in the rat liver. Cancer Lett. 36:29-33.
Makino, R., Kawasaki, H., Gamo, M., Nakanishi, J. 2006. Estimating health risk from exposure to 1,4-dioxane in Japan. Environ. Sci. 13:43-58.
Maronpot, R.R., Shimkin, M.B., Witschi, H.P., Smith, L.H., Cline, J.M. 1986. Strain A mouse pulmonary tumor test results for chemicals previously tested in the National Cancer Institute carcinogenicity tests. J. Natl. Cancer Inst.6:1101-1112.
Marzulli, F.N., Anjo, D.M., Maibach, H.I. 1981. In vivoskin penetration of 2,4-toluenediamine, 2,4-diaminoanisole, 2-nitro-p-phenylenediamine, p-dioxane and n-nitrosodiethanolamine in cosmetics. Cosmet. Toxicol. 19:743-747.
McFee, A.F., Abbott, M.G., Gulati, D.K., Shelby, M.D. 1994. Results of mouse bone marrow micronucleus studies on 1,4-dioxane. Mutat. Res. 322:145-148.
McGregor, D.B., Brown, A.G., Howgate, S., McBride, D., Riach, C., Caspary, W.J. 1991. Responses of the L5178Y mouse lymphoma cell forward mutation assay. V: 27 coded chemicals. Environ. Mol. Mutagen. 17:196-219.
Mikheev, M.I., Minkina, N.A., et al. 1979. Occupational health questions in the electronics industry. In : Proceedings from the Erisman Institute of Hygiene. p. 33-38 (en russe). [cité dans NICNAS, 1998].
Mikheev, M.I., Gorlinskaya, Y.E.P., Solovyova, T.V. 1990. The body distribution and biological action of xenobiotics. J. Hyg. Epidemiol. Microbiol. Immunol. 34:329-336.
Mirkova, E.T. 1994. Activity of the rodent carcinogen 1,4-dioxane in the mouse bone marrow micronucleus assay. Mutat. Res. 322:142-144.
[MITI] Ministry of International Trade & Industry (JP). 1992. Biodegradation and bioaccumulation: data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Ministry of International Trade & Industry, Basic Industries Bureau, Chemical Products Safety Division, Chemicals Inspection & Testing Institute.
Miyagawa, M., Shirotori, T., Tsuchitani, M., Yoshikawa, K. 1999. Repeat-assessment of 1,4-dioxane in a rat hepatocyte replicative DNA synthesis (RDS) test: evidence for stimulus of hepatocyte proliferation. Exp. Toxicol. Pathol. 51:555-558.
Morita, T., Hayashi, M. 1998. 1,4-Dioxane is not mutagenic in five in vitro assays and mouse peripheral blood micronucleus assay, but is in mouse liver micronucleus assay. Environ. Mol. Mutagen. 32:269-280.
Mungikar, A.M., Pawar, S.S. 1978. Induction of the hepatic microsomal mixed function oxidase system in mice by p-dioxane. Bull. Environ. Contam. Toxicol.20:797-804.
Muñoz, E.R., Barnett, B.M. 2002. The rodent carcinogens 1,4-dioxane and thiourea induce meiotic nondisjunction in Drosophila melanogaster females. Mutat. Res.517:231-238.
Nannelli, A., De Rubertis, A., Longo, V., Gervasi, P.G. 2005. Effects of dioxane on cytochrome P450 enzymes in liver, kidney, lung and nasal mucosa of rat. Arch. Toxicol.79(2):74-82.
National Cancer Institute (États-Unis). 1978. Bioassay of 1,4-dioxane for possible carcinogenicity. NCI-CG-TR-80 (PB 285 711). Rockville (MD) : U.S. Department of Health, Education and Welfare, Public Health Service, National Institutes of Health, National Cancer Institute.
[NCI] National Chemical Inventories (base de données sur cédérom). 2006. Columbus (OH) : American Chemical Society. Accès : http://www.cas.org/products/cd/nci/index.html
Nestmann, E.R., Otson, R., Kowbel, D.J., Bothwell, P.D., Harrington, T.R. 1984. Mutagenicity in a modified Salmonella assay of fabric protecting products containing 1,1,1-trichloroethane. Environ. Mutagen. 6:71-80.
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 1998. 1,4-Dioxane. Priority Existing Chemical No. 7. Full public report [en ligne]. Australie. [consulté en mars 2009]. Accès : http://www.nicnas.gov.au/Publications/CAR/PEC/PEC7/PEC7_Full_Report_PDF.pdf
[NIOSH] National Institute for Occupational Safety and Health. 1977. Occupational exposure to dioxane: criteria for an occupational standard. DHEW Publication No. 77-226. Cincinnati (OH) : NIOSH. p. 193. [cité dansNICNAS, 1998].
Nishimura, T., Iizuka, S., Kibune, N., Ando, M. 2004. Study of 1,4-dioxane intake in the total diet using the market-basket method. J. Health Sci. 50(1):101-107.
Nishimura, T., Iizuka, S., Kibune, N., Ando, M., Magara, Y. 2005. Study of 1,4-dioxane intake in the total diet. J. Health Sci. 51:514-517.
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2006. Gatineau (Qc) : Environnement Canada. [consulté le 20 avril 2009]. Accès : http://www.ec.gc.ca/inrp-npri/
[NTP] National Toxicology Program (États-Unis). 2005. Substance profile for chromium hexavalent compounds. In : Report on carcinogens. 11e éd. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Accès : http://ntp.niehs.nih.gov/index.cfm?objectid=32BA9724-F1F6-975E-7FCE50709CB4C932
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software
[OCA] Organic Consumer Association. 2009. Results of testing for 1,4-dioxane by gas chromatography/mass spectrometry. [consulté en mars 2009]. Accès : http://www.organicconsumers.org/bodycare/DioxaneResults09.pdf
O’Neil, M.J., Smith, A., Heckelman, P.E., Budavari, S. (éd.) 2001. The Merck index: an encyclopedia of chemicals, drugs, and biologicals. 13e éd. Hoboken (NJ) : John Wiley & Sons. [cité dans HSDB, 2009].
Otson, R. 1987. Purgeable organics in Great Lakes raw and exposed water. Int. J. Environ. Anal. Chem. 31(1):41.
Park, J.H., Abul, H., Pascal, C., David, F., Carr, P.W. 1987. Experimental reexamination of selected partition coefficients from Rohrschneider’s data set. Anal. Chem. 59:1970-1976. [cité dans HSDB, 2009].
Pawar, S.S., Mungikar, A.M. 1978. Dioxane toxicity & hepatic mixed function oxidase enzymes in mice. Ind. J. Exp. Biol. 16:54-56.
Pereira, M.A., Herren, S.L., Britt, A.L., Khourg, M.M. 1982. Initiation/promotion bioassay in rat liver: use of gamma glutamyltranspeptidase-positive foci to indicate carcinogenic activity. Toxicol. Pathol. 10:11-18. [cité dans ATSDR, 2007].
Perone, V.B., Scheel, L.D., Tolos, W.P. 1976. Dioxane toxicity. Rapport inédit. Cincinnati (OH) : National Institute for Occupational Safety and Health. [cité dans NICNAS, 1998].
Perrin, D.D. 1965. Dissociation constants of organic bases in aqueous solution. London (Royaume-Uni) : Butterworths.
[PhysProp] Interactive PhysProp Database [base de données en ligne]. 2006. Syracuse (NY) : Syracuse Research Corporation [consultée en avril 2009]. Accès : http://www.syrres.com/what-we-do/databaseforms.aspx?id=386
Reitz, R.H., McCroskey, P.S., Park, C.N., Andersen, M.E., Gargas, M.L. 1990. Development of a physiologically based pharmacokinetic model for risk assessment with 1,4-dioxane. Toxicol. Appl. Pharmacol. 105:37-54.
Riddick, J.A., Bunger, W.B., Sakano, T.K. 1986. Techniques of chemistry. Vol. II, Organic solvents. 4th ed. New York (NY) : John Wiley and Sons. [cité dans HSDB, 2009].
Robinson, J., Ciurczak, E. 1980. Direct gas chromatographic determination of 1,4-dioxane in ethoxylated surfactants. J. Soc. Cosmetic. Chem. 31:329-337.
Roy, S.K., Thilagar, A.K., Eastmond, D.A. 2005. Chromosome breakage is primarily responsible for the micronuclei induced by 1,4-dioxane in the bone marrow and liver of young CD-1 mice. Mutat. Res. 586:28-37.
Sai, K., Takagi, A., Umemura, T., Kurokawa, Y., Kasai, H. 1989. Detection of 8-hydroxydeoxyguanosine in rat kidneys exposed with renal carcinogens. Mutat. Res. 216:373.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada. 2007. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques – mars 2007 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation [consulté en 2009]. Accès : http://www.hc-sc.gc.ca/cps-spc/person/cosmet/info-ind-prof/_hot-list-critique/hotlist-liste-fra.php
Santé et Bien-être social Canada. 1990. L'allaitement maternel au Canada : pratiques et tendances. Ottawa (Ont.) : chez l'auteur. No de catalogue H39-199/1990F. [consulté dans Santé Canada, 1998].
Sasaki, Y.F., Sekihashi, K., Izumiyama, F., Nishidate, E., Saga, A., Ishida, K., Tsuda, S. 2000. The comet assay with multiple mouse organs: comparison of comet assay results and carcinogenicity with 208 chemicals selected from the IARC monographs and U.S. NTP Carcinogenicity Database. Crit. Rev. Toxicol.30:629-799.
Scalia, S. 1991. Assay of 1,4-dioxane in commercial cosmetic products by HPLC. Farmaco 46(11):1365-1670.
Scalia, S., Testoni, F., Frisina, G., Guarneri, M. 1992. Assay of 1,4-dioxane in cosmetic products by solid-phase extraction and GC-MS. J. Soc. Cosmet. Chem. 43(4):207-213. [cité dans VCCEP, 2007].
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2009. Disponible auprès de Santé Canada, Division des cosmétiques.
Sekizawa, J., Yasuhara, K., Suyama, Y., Yamanaka, S., Tobe, M., Nishimura, M. 1994. A simple method for screening assessment of skin and eye irritation. J. Toxicol. Sci. 19:25-35.
Sheu, C.W., Moreland, F.M., Lee, J.K., Dunkel, V.C. 1988. In vitro BALB/3T3 cell transformation assay of nonoxynol-9 and 1,4-dioxane. Environ. Mol. Mutagen. 11:41-48.
Silverman, L., Schulte, H.F., First, M.W. 1946. Further studies of sensory response to certain industrial solvent vapors. J. Ind. Hyg. Toxicol. 28:262-266.
Simazaki, D., Asami, M., Nishimura, T., Kunikane, S., Aizawa, T., Magara, Y. 2006. Occurrence of 1,4-dioxane and MTBE in drinking water sources in Japan. Water Supply 6(2):47-53.
Sina, J.F., Bean, C.L., Dysart, G.R., Taylor, V.L., Bradley, M.O. 1983. Evaluation of the alkaline elution/rat hepatocyte assay as a predictor of carcinogenic/ mutagenic potential. Mutat. Res. 113:357-391.
Singhvi, R., Magriples, N., Schuetz, S., McGuire, N. 1999. Indoor air monitoring in homes built on a former wood treating facility. Proceeding of the 8th International Conference on Indoor air Quality and Climate. Du 8 au 13 août 1999. Edinburgh (Écosse) : Construction Research Communications, Inc.
Sonneck, H.J. 1964. Kontaktekzem durch Dioxan in überwiegender lineärer Anordnung. Dermatol. Wochenschr 1:24-27. [cité dans EURAR, 2002].
Springborn Laboratories Inc. 1989. 1,4-Dioxane – Chronic toxicity to Ceriodaphnia dubia under static renewal conditions. SLI Report 89-9-3089. Le 15 septembre 1989. Wareham (MA) : Springborn Laboratories Inc. [cité dans EURAR, 2002].
Steffan, R.J. 2007. Biodegradation of 1,4-Dioxane. Shaw Environmental, Inc.. Accès : http://stinet.dtic.mil/cgi-bin/GetTRDoc? AD=ADA479704&Location=U2&doc=GetTRDoc.pdf
Stickney, J.A., Sager, S.L., Clarkson, J.R., Smith, L.A., Locey, B.J., Bock, M.J., Hartung, R., Olp, S.F. 2003. An updated evaluation of the carcinogenic potential of 1,4-dioxane. Regul. Toxicol. Pharmacol. 38:183-195.
Stoner, G.D., Conran, P.B., Greisiger, E.A., Stober, J., Morgan, M., Pereira, M.A. 1986. Comparison of two routes of chemical administration on the lung adenoma response in strain A/J mice. Toxicol. Appl. Pharmacol. 82:19-31.
Stott, W.T., Quast, J.F., Watanabe, P.G. 1981. Differentiation of the mechanisms of oncogenicity of 1,4-dioxane and 1,3-hexachlorobutadiene in the rat. Toxicol. Appl. Pharmacol. 60:287-300.
Sullivan, L.J. 1994. Construction fatality: application of a concrete sealant. Appl. Occup. Environ. Hyg.9:681-682.
Sweeney, L.M., Thrall, K.D., Poet, T.S., Corley, R.A., Weber, T.J., Locey, B.J., Clarkson, J., Sager, S., Gargas, M.L. 2008. Physiologically based pharmacokinetic modeling of 1,4-dioxane in rats, mice and humans. Toxicol. Sci. 101:32-50.
Tanabe, A., Kawata, K. 2008. Determination of 1,4-dioxane in household detergents and cleaners. J. AOAC Int.91(2):439-444.
[TaPL3] Long Range Transport and Persistence Level III model [en ligne]. 2000. Version 2.10. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/TaPL3.html
Thiess, A.M., Tress, E., Fleig, I. 1976. Arbeitsmedizinische Untersuchungsergebnisse von Dioxan-exponierten Mitarbeitern. Arbeitsmed. Sozialmed. Präventivmed. 11:36-46. [cité dans EURAR, 2002].
Thiess, A.M., Schwegler, H., Fleig, I., Stocker, W.G. 1981. Mutagenicity study of workers exposed to alkylene oxides (ethylene oxide/propylene oxide) and derivatives. J. Occup. Med.23:343-347.
Thurman, G.B., Simms, B.G., Goldstein, A.L., Kilian, D.J. 1978. The effects of organic compounds used in the manufacture of plastics on the responsivity of murine and human lymphocytes. Toxicol. Appl. Pharmacol. 44:617-641.
Tinwell, H., Ashby, J. 1994. Activity of 1,4-dioxane in mouse bone marrow micronucleus assays. Mutat. Res. 322:148-150.
[TOPKAT] Toxicity Prediction Program by Komputer Assisted Technology. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. Accès : http://www.accelrys.com/products/topkat/index.html
Torkelson, T.R., Leong, B.K.J., Kociba, R.J., Richter, W.A., Gehring, P.J. 1974. 1,4-Dioxane. II. Results of a 2-year inhalation study in rats. Toxicol. Appl. Pharmacol. 30:287-298.
[TRI] Toxics Release Inventory Program [en ligne]. 2006. Washington (DC) : U.S. Environmental Protection Agency. [consulté en mars 2009]. Accès : http://www.epa.gov/triexplorer/
[TSCATS] Toxic Substances Control Act Test Submission. 1989. OTS0000719. No d'ID du nouveau document FYI-OTS-1089-0719, le 17 octobre 1989, Dow Chemical Co., D004057, 0158-0179. [cité dans EURAR, 2002].
Uno, Y., Takasawa, H., Miyagawa, M., Inoue, Y., Murata, T., Yoshikawa, K. 1994. An in vivo-in vitro replicative DNA synthesis (RDS) test using rat hepatocytes as an early prediction assay for nongenotoxic hepatocarcinogens screening of 22 known positives and 25 noncarcinogens. Mutat. Res.320:189-205.
[US EPA] US Environmental Protection Agency. 1990. 1,4-Dioxane (CAS RN 123-91-1). Washington (DC) : US EPA, Integrated Risk Information System (IRIS). [consulté en mai 2009]. Accès : http://www.epa.gov/ncea/iris/subst/0326.htm
[VCCEP] Voluntary Children’s Chemical Evaluation Program. 2007. Tiers 1, 2, and 3 pilot submission for 1,4-dioxane (no CAS 123-91-1) [en ligne]. Washington (DC) : U.S. Environmental Protection Agency. [consulté en mars 2009]. Accès : http://www.tera.org/peer/VCCEP/p-Dioxane/p-Dioxane%20Submission.pdf
Verschueren, K. 1983. Handbook of environmental data on organic chemicals. 2e éd. New York (NY) : Van Nostrand Reinhold Co.
Wirth, W., Klimmer, O. 1937. On the toxicology of organic solvents. 1,4-Dioxane (diethylene dioxide). Arch. Gewerbepathol. Gewerbehyg. 17:192-206. [cité dans EURAR, 2002].
Woo, Y., Arcos, J.C., Argus, M.F. 1977. Metabolism in vivo of dioxane: identification of p-dioxane-2-one as the major urinary metabolite. Biochem. Pharmacol.26:1535-1538.
Woo, Y., Argus, M.F., Arcos, J.C. 1978. Effect of mixed-function oxidase modifiers on metabolism and toxicity of the oncogen dioxane. Cancer Res. 38:1621-1625.
Yamazaki, K., Ohno, H., Asakura, M., Narumi, A., Ohbayashi, H., Fujita, H., Ohnishi, M., Katagiri, T., Senoh, H., Yamanouchi, K., Nakayama, E., Yamamoto, S., Noguchi, T., Nagano, K., Enomoto, M., Sakabe, H. 1994. Two-year toxicological and carcinogenesis studies of 1,4-dioxane in F344 rats and BDF1 mice – drinking studies. In : Sumino, K., Sato, S. (éd) Proceedings of the Second Asia-Pacific Symposium on Environmental and Occupational Health, du 22 au 24 juillet 1993, Kobe. Kobe (Japon) : University School of Medicine, International Center for Medical Research. p. 193-198.
Yant, W.P., Schrenk, H.H., Waite, C.P., Patty, F.A. 1930. Acute response of guinea pigs to vapors of some new commercial organic compounds. VI. Dioxan. Public Health Rep. 45:2023-2032. [cité dans EURAR, 2002].
Yoon, J.S., Mason, J.M., Valencia, R., Woodruff, R.C., Zimmering, S. 1985. Chemical mutagenesis testing in Drosophila. IV. Results of 45 coded compounds tested for the National Toxicology Program. Environ. Mutagen.7:349-367.
Young, J.D., Braun, W.H., Gehring, P.J., Horvath, B.S., Daniel, R.L. 1976. Short communication. 1,4-Dioxane and ß-hydroxyethoxyacetic acid excretion in urine of humans exposed to dioxane vapors. Toxicol. Appl. Pharmacol. 38:643-646.
Young, J.D., Braun, W.H., Rampy, L.W., Chenoweth, M.B., Blau, G.E. 1977. Pharmacokinetics of 1,4-dioxane in humans. J. Toxicol. Environ. Health 3:507-520.
Young, J.D., Braun, W.H., Gehring, P.J. 1978. The dose-dependent fate of 1,4-dioxane in rats. J. Environ. Pathol. Toxicol.2:263-282.
Zimmermann, F.K., Mayer, V.W., Scheel, I., Resnick, M.A. 1985. Acetone, methyl ethyl ketone, ethyl acetate, acetonitrile and other polar aprotic solvents are strong inducers of aneuploidy in Saccharomyces cerevisiae. Mutat. Res. 149:339-351.
Annexe 1 : Limites supérieures des estimations de l'absorption quotidienne de 1,4dioxane par la population générale du Canada
| Voie d'exposition | Absorption estimée (µg/kg-p.c. par jour) de 1,4dioxane par divers groupes d'âge | |||||||
|---|---|---|---|---|---|---|---|---|
| 0 à 6 mois1 | 0,5 à 4 ans4 | 5 à 11 ans5 | 12 à 19 ans6 | 20 à 59 ans7 | Plus de 60 ans8 | |||
| Lait maternel2 | Lait maternisé3 | Pas nourris au lait maternisé | ||||||
| 1 Par hypothèse, poids de 7,5 kg, absorption de l'air de 2,1 m3 par jour, absorption d'eau de 0,8 L par jour (lait maternisé) ou de 0,3 L par jour (autres que lait maternisé), ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998). 2 Aucune donnée n'a été signalée sur les doses de 1,4-dioxane dans le lait maternel. 3 Pour les poupons nourris au lait maternisé, l'absorption d'eau est la quantité exigée pour reconstituer le lait maternisé. Aucune donnée n'a été signalée sur les doses de 1,4dioxane dans le lait maternisé, mais la limite de détection pour le 1,4dioxane dans l'eau potable a été utilisée dans ce modèle (Otson, 1987). Environ 50 % des enfants non nourris au lait maternisé ont commencé à manger des aliments solides à 4 mois, et 90 % ont commencé à 6 mois (SNBS, 1990). 4 Par hypothèse, poids de 15,5 kg, absorption de l'air de 9,3 m3 par jour, absorption d'eau de 0,7 L par jour et ingestion de 100 mg de particules de sol par jour (Santé Canada, 1998). 5 Par hypothèse, poids de 31 kg, absorption de l'air de 14,5 m3 par jour, absorption d'eau de 1,1 L par jour et ingestion de 65 mg de particules de sol par jour (Santé Canada, 1998). 6 Par hypothèse, poids de 59,4 kg, absorption de l'air de 15,8 m3 par jour, absorption d'eau de 1,2 L par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998). 7 Par hypothèse, poids de 70,9 kg, absorption de l'air de 16,2 m3 par jour, absorption d'eau de 1,5 L par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998). 8 Par hypothèse, poids de 72,0 kg, absorption de l'air de 14,3 m3 par jour, absorption d'eau de 1,6 L par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998). 9 Le 1,4-dioxane a été mesuré dans l'air ambiant au Canada et aux ÉtatsUnis à proximité de sources ponctuelles. La concentration la plus élevée mesurée ailleurs qu'à proximité d'une source ponctuelle, soit de 0,646 µg/m3 dans la région du Grand Toronto sur une période de trois mois, a été utilisée pour mesurer la dose de 1,4dioxane dans l'air ambiant (Fellin et Otson, 1997). L'hypothèse selon laquelle les Canadiens passent 3 heures par jour à l'extérieur a été utilisée (Santé Canada, 1998). 10 Le 1,4-dioxane a été mesuré dans les habitations au Canada et aux ÉtatsUnis. En 1996, il a été décelé dans 44 habitations dans la région du Grand Toronto au cours d'une période de trois mois. La concentration maximale mesurée de 1,4-dioxane était de 0,685 µg/m3 (Fellin et Otson, 1997). L'hypothèse selon laquelle les Canadiens passent 21 heures par jour à l'intérieur a été utilisée (Santé Canada, 1998). 11 Le 1,4-dioxane a été décelé dans des sources d'eau potable de dix communautés différentes dans la région des Grands Lacs au Canada. Les concentrations de 1,4dioxane mesurées dans des échantillons d'eau potable prélevés de 42 sources d'eau potable municipale non traitée et de 42 sources d'eau potable municipale exposée étaient inférieures à la limite de détection de 10 µg/L, selon l'approche la plus prudente employée (Otson, 1987). 12 Aucune concentration de 1,4dioxane n'a été décelée dans les aliments au Canada. Des études japonaises avaient signalé des doses de 1,4-dioxane dans les aliments, mais on a estimé que l’inclusion de ces données était inutile en raison des différences entre les absorptions alimentaires au Canada et au Japon, des différences d’utilisation d’additifs alimentaires au moment de ces études et des concentrations éventuelles de 1,4-dioxane dans l’eau, ainsi que des limites de ces études. Le 1,4-dioxane peut exister dans certains produits alimentaires comme impuretés issues des additifs alimentaires (voir l’annexe 2), mais le présent rapport n’inclut pas une telle donnée dans son calcul d’absorption de 1,4-dioxane. 13 Des traces de 1,4-dioxane ont été mesurées dans le sol au Canada et au Japon. Des concentrations de 30 échantillons prélevés au sudest de l'Ontario étaient inférieures à la limite de détection, donc la limite de détection de 100 µg/kg a été utilisée pour calculer l'absorption de la substance à partir du sol (Golder Associates, 1987). |
||||||||
| Air ambiant9 | 0,2 | 0,05 | 0,04 | 0,02 | 0,02 | 0,02 | ||
| Air intérieur10 | 0,17 | 0,36 | 0,28 | 0,16 | 0,14 | 0,12 | ||
| Eau potable11 | 0,00 | 1,07 | 0,40 | 0,45 | 0,35 | 0,20 | 0,21 | 0,22 |
| Nourriture et beuvrages12 | – | – | – | – | – | – | – | – |
| Sol13 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | ||
| Absorption totale | 0,19 | 1,26 | 0,59 | 0,86 | 0,67 | 0,38 | 0,37 | 0,36 |
| Groupe d'âge (ans) | Sexe | Estimation de l'absorption moyenne de 1,4-dioxane par personne (µg/kg-p.c. par jour)3, 4, 5, 6 |
|---|---|---|
| 1 Communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée. 2 L’estimation de l’absorption est pour le 1,4-dioxane comme impureté dans les additifs alimentaires autorisés (polysorbates 80, 65 et 60 et polyéthylène glycol) pour lesquels il existe actuellement une disposition dans le Règlement sur les aliments et drogues(Canada, 1978), selon la limite maximale de résidus (maximum de 10 mg/kg) de 1,4-dioxane dans ces additifs alimentaires établie dans le Food Chemicals Codex (FCC, 6e éd., 2008) et les données sur la consommation des aliments de la Continuing Survey of Food Intakes by Individuals (CSFII, 1994-1996, 1998). Les données du CSFII ont été utilisées car les catégories d’aliments correspondant aux aliments dans lesquels les polysorbates et le polyéthylène glycol sont permis comme additifs alimentaires conformément au Règlement sur les aliments et droguesétaient facilement accessibles, permettant ainsi d’estimer l’exposition éventuelle au 1,4-dioxane en raison de sa rémanence possible dans les aliments causée par sa présence à l’état d’impureté dans ces additifs alimentaires. Ces données sont considérées comme pertinentes pour estimer l'absorption selon le régime canadien. 3 Le secteur industriel n'a pas été consulté pour déterminer les concentrations actuelles de polysorbates ou de polyéthylène glycol dans les aliments pour lesquels il existe une disposition dans le Règlement sur les aliments et drogues. Par conséquent, toutes les estimations sont basées sur la dose maximale autorisée pour l'utilisation de polysorbates et de polyéthylène glycol dans chaque produit alimentaire et chaque catégorie d'aliments, selon le Règlement sur les aliments et drogues. 4 Le Règlement sur les aliments et droguesdresse la liste des additifs alimentaires de rechange (stabilisants) pouvant être utilisés dans certains aliments pour lesquels il existe une disposition pour l’utilisation de polysorbates. Par ailleurs, les additifs alimentaires, tels que les polysorbates et le polyéthylène glycol ne seront pas toujours utilisés dans les aliments pour lesquels ils sont autorisés (c’est-à-dire en cas de besoin technologique et de discrétion du fabricant). 5 Les polysorbates peuvent être utilisés dans des applications liées aux agents antimousses pouvant servir aux additifs alimentaires ou aux auxiliaires technologiques. Cependant, leur contribution à l’absorption de 1,4-dioxane à partir d’aliments dans ces utilisations est considérée comme beaucoup plus faible, même presque négligeable, relativement à celle de l’estimation d’absorption prudente faite pour les utilisations de polysorbates énumérées au titre 16 du Règlement sur les aliments et drogues. 6 Les estimations de l'absorption du 1,4-dioxane dans les aliments ne tiennent pas compte des pertes par volatilisation et du faible point d'ébullition du 1,4dioxane. Certains aliments transformés, par exemple, sont exposés à des températures plus élevées lors de la transformation des aliments, donc les doses résiduelles du 1,4dioxane devraient être inférieures dans ces conditions. |
||
| 1 à 4 | – | 0,335 |
| 5 à 11 | – | 0,287 |
| 12 à 18 | Hommes | 0,162 |
| 12 à 18 | Femmes | 0,125 |
| 31 à 50 | Mâles | 0,105 |
| 31 à 50 | Femmes | 0,088 |
Scénarios relatifs aux produits d'hygiène personnelle pour femmes
| Scénario basé sur des produits de consommation | Hypothèses | Estimation de l'exposition |
|---|---|---|
| Revitalisant capillaire | Inhalation (débit constant)
|
Concentration moyenne par événement = 1,68 × 10-5mg/m3 Dose chronique = 6,90 x 10-9 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 7,87 × 10-8 mg/kg-p.c. par jour | |
| Shampooing pour les cheveux | Inhalation (débit constant)
|
Concentration moyenne par événement = 0,00782 mg/m3 Dose chronique = 8,01 x 10-6 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 9,14 × 10-5 mg/kg-p.c. par jour | |
| Lotion hydratante pour la peau (crème pour le corps) | Inhalation (débit constant)
|
Concentration moyenne par événement = 2,25 × 10-3 mg/m3 Dose chronique = 1,16 x 10-3 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 1,69 x 10-3 mg/kg-p.c. par jour | |
| Gel de douche | Inhalation (débit constant)
|
Concentration moyenne par événement = 1,72 × 10-3 mg/m3 Dose chronique = 2,23 x 10-6 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 2,54 × 10-6 mg/kg-p.c. par jour | |
| Colorant capillaire | Inhalation (débit constant)
|
Concentration moyenne par événement = 1,39 à 4,64 mg/m3 Dose aiguë = 2,00 × 10-2 – 6,67 × 10-2mg/kg-p.c. |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose aiguë = 4,65 × 10-3 – 1,55 × 10-2mg/kg-p.c. |
Scénarios relatifs aux produits ménagers
| Scénario basé sur des produits de consommation | Hypothèses | Estimation de l'exposition |
|---|---|---|
| 1 RIVM, 2006 2 D'après Bronaugh, 1982 |
||
| Savon liquide pour lave-vaisselle | Inhalation (exposition à la vapeur par évaporation)
|
Concentration moyenne par événement = 8,89 × 10-3 mg/m3 Dose chronique = 2,24 x 10-4 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 6,51 x 10-5 mg/kg-p.c. par jour | |
| Paramètre ultime | Doses minimales avec effet1/Résultats |
|---|---|
| 1 CL50 = concentration létale médiane; DL50 = dose létale médiane; CME(N)O = concentration minimale avec effet (nocif) observé; DME(N)O = dose minimale avec effet (nocif) observé; CSE(N)O = concentration sans effet (nocif) observé; DSE(N)O = dose sans effet (nocif) observé | |
| Essais sur des animaux de laboratoire et in vitro | |
| Toxicité aiguë | DL50 la plus faible, par voie orale(lapin, chat) = 2 000 mg/kg-p.c. (NICNAS, 1998). [études supplémentaires : Argus et al., 1973; Pawar et Mungikar, 1978; NICNAS, 1998; EURAR, 2002; ATSDR, 2007] DMEO par voie orale la plus faible (rat) = 1 050 mg/kg-p.c., d'après des effets subtils sur le système nerveux central par perturbation de certains neurotransmetteurs chez des rats mâles (Kanada et al., 1994). [études supplémentaires : Kitchin et Brown, 1990; DeRosa et al., 1996] DL50 par voie cutanée la plus faible (lapin) = 7 600 mg/kg-p.c. (NICNAS, 1998). [études supplémentaires : NICNAS, 1998] CL50 la plus faible par inhalation(souris, 2 h) = 37 000 mg/m3 (EURAR, 2002). [études supplémentaires : NICNAS, 1998; EURAR, 2002] CMEO la plus faible par inhalation (rat, 4 h) = 1 000 ppm (36 000 mg/m3), d'après un accroissement considérable de l'activité d'enzymes sériques comme la transaminase glutamique oxaloacétique, la transaminase glutamique/pyruvique et l'ornithine carbamyl transférase chez des rats mâles CD (Drew et al., 1978). [études supplémentaires : Frantík et al., 1994] |
| Dose toxique à court terme pour l'exposition répétée | DMEO orale la plus faible = 400 mg/kg-p.c. par jour (seule dose à l'essai); fondée sur un accroissement de l'activité enzymatique du cytochrome P450 dans le foie, les reins et la muqueuse nasale des rats mâles Sprague-Dawley (SD) ayant reçu du 1,4dioxane à une dose de 1,5 % (vol/vol) dans l'eau potable, ce qui correspond à 400 mg/kg-p.c. par jour pendant 10 jours (Nannelli et al., 2005). [études supplémentaires : Fairley et al., 1934; Mungikar et Pawar, 1978; Pawar et Mungikar, 1978; Lundberg et al., 1987; Goldsworthy et al., 1991; JBRC, 1998a; NICNAS, 1998; Roy et al., 2005] Au cours d'une étude limitée en temps sur l'exposition par voie cutanée, quatre lapins et quatre cobayes ont été exposés à des solutions de 1,4dioxane-eau appliquées sur la peau rasée de la nuque. Chaque lapin a reçu 10 gouttes et chaque cobaye a reçu 5 gouttes de la solution de 1,4dioxane 11 fois par semaine pendant 48, 65, 76 et 100 jours (un animal par groupe). Des lésions au cortex rénal, des hémorragies au médullaire rénal et la dégénérescence du foie ont été observés chez les deux espèces (Fairley et al., 1934). Une DMENO par voie cutanée ne peut pas être déterminée en raison des limites dans le plan de l'expérience et de présentation des données. [Aucune autre étude sur l'exposition par voie cutanée n'a été recensée.] CMEO la plus faible, par inhalation = 100 mg/m3 (rats femelles, 4 h/jour, 5 jours/semaine, 4 semaines), fondée sur un accroissement considérable de l'activité de la glutathion-peroxydase dans le cerveau et les ovaires; CSE(N)O = 10 mg/m3 (Burmistrov et al., 2001). [études supplémentaires : Fairley et al., 1934; Goldberg et al., 1964; NICNAS, 1998] |
| Toxicité subchronique | DMENO la plus faible, par voie orale (rats) = 1 600 mg/L dans l'eau potable (équivalent à 130 mg/kg-p.c. par jour), fondée sur un accroissement du poids relatif du foie et des reins et sur des modifications histopathologiques observées dans les fosses nasales (dilatation des noyaux de l'épithélium de type respiratoire) et le foie (inflammation centrilobulaire). Dans la présente étude, des rats F344/DuCrj et des souris Crj:BDF1, 10 par sexe par groupe, ont été exposés au 1,4-dioxane dans l'eau potable à des concentrations de 0, 640, 1600, 4000, 10 000 et 25 000 mg/L (soit de 0, 52, 130, 325, 813 et 2031 mg/kg-p.c. par jour pour les rats et de 0, 170, 425, 1063, 2656 et 6641 mg/kg-p.c. par jour pour les souris) pendant 13 semaines. Des lésions histopathologiques ont été observées dans les voies respiratoires supérieures et inférieures, le foie, les reins et le cerveau des rats exposés, alors que seulement les deux premiers organes mentionnés ont été endommagés chez les souris exposées. Les foyers modifiés au niveau du foie ont réagi positivement à l'anticorps glutathion-S-transférase de forme placentaire (lésion prénéoplastique) chez les rats exposés (les souris n'ont pas été examinées). Les poids relatifs des reins et des poumons des rats et des souris exposées ont augmenté en fonction de la dose, tandis que les poids relatifs du foie ont augmenté seulement chez les rats exposés. Des changements aux paramètres hématologiques ont été observés chez les rats et les souris exposés seulement à la dose plus élevée. On a déterminé une DSENO à 640 mg/L pour les rats et les souris (équivalent à 52 mg/kg-p.c. par jour chez les rats et à 170 mg/kg-p.c. par jour chez les souris) (JBRC, 1998b; Kano et al., 2008). [études supplémentaires : King et al., 1973; Scott et al., 1981; Stoner et al., 1986] Au cours de l'étude limitée en temps sur l'exposition par voie cutanée (sous le titre « Dose toxique à court terme pour l'exposition répétée »), des lésions au cortex rénal, des hémorragies au médullaire rénal et la dégénérescence du foie ont été observés chez des lapins et des cobayes exposés au 1,4dioxane par voie cutanée pendant jusqu'à 100 jours (Fairley et al., 1934). Une DMENO par voie cutanée ne peut pas être établie en raison des limites dans le plan de l'expérience et de présentation des données. [Aucune autre étude sur l'exposition par voie cutanée n'a été recensée.] CMENO la plus faible, par inhalation (rats) = 100 ppm (plus faible concentration à l'essai, équivalente à 360 mg/m3), fondée sur une dilatation du noyau des cellules épithéliales de type respiratoire dans les fosses nasales chez les rats mâles et femelles exposées au 1,4-dioxane sous forme de vapeur. Dans le cadre de cette étude, des rats F344 ont été exposés à une vapeur de 1,4dioxane aux concentrations de 0, 100, 200, 400, 800, 1 600, 3 200 et 6 400 ppm à raison de 6 h/j, 5 jours par semaine, pendant 13 semaines. La diminution du poids corporel et l'accroissement du poids relatif du foie, des reins et des poumons ont été observés aux concentrations de 200 ppm et plus. Des modifications aux paramètres hématologiques et des lésions au foie (nécrose de cellules isolées et inflammation centrilobulaire) et aux reins (changements hydropiques aux tubules proximaux du rein) ont été observées à la concentration de 3200 ppm de 1,4dioxane. La dilation des noyaux et des changements aux vacuoles ont été observés dans l'épithélium olfactif aux concentrations de 200 ppm et plus de même que dans les bronches aux concentrations de 1 600 ppm et plus chez les mâles et de 3 200 chez les femelles. La dilatation des noyaux dans les trachées s'est produite à 1 600 ppm et plus. Des foyers au niveau du foie ont réagi positivement au glutathion-S-transférase de forme placentaire aux concentrations de 1 600 ppm et plus chez les femelles exposées et de 3 200 ppm chez les mâles exposés. Tous les rats exposés à une vapeur de 1,4dioxane de 6 400 ppm sont décédés au cours de la première semaine d'exposition (Kasai et al., 2008). [études supplémentaires : Fairley et al., 1934; Torkelson et al., 1974] |
| Toxicité chronique et cancérogénicité | Essai de cancérogénicité par voie orale (eau potable) chez le rat Des rats mâles Wistar, 26 par groupe d'essai et 9 témoins, ont été exposés tous les jours à de l'eau potable contenant 1 % de 1,4-dioxane (équivalent à 860 mg/kg-p.c. par jour) pendant 63 semaines. Six des 26 animaux exposés ont développé des tumeurs au foie, dont un avait aussi des carcinomes dans le bassinet et les reins, et la leucémie myéloïde. Un animal témoin a développé des lymphosarcomes. On a également observé chez les animaux exposés de graves problèmes rénaux comme des effets à l'épithélium tubulaire et glomérulaire ainsi que des changements histopathologiques au foie comme des groupes de cellules ayant des noyaux hépatiques hyperchromatiques dilatés et des groupes de cellules larges ayant une basophilie cytoplasmique (Argus et al., 1965). Des rats Charles River CD, 30 mâles par groupe, ont été exposés à 0, 0,75, 1,0, 1,4 et 1,8 % de 1,4-dioxane par l'eau potable (équivalent à environ 0, 770, 1 000, 1 430 et 1 850 mg/kg-p.c. par jour) pendant 13 mois. Deux des animaux dans chaque groupe ayant reçu la substance aux doses de 1,4 % et 1,8 % ont développé des carcinomes hépatocellulaires. En fonction de la dose, on a observé une augmentation de l'incidence de nodules hépatiques (0 chez les témoins, et 4, 9, 13 et 11 nodules chez les groupes ayant reçu une dose de 0,75 %, 1,0 %, 1,4 % et 1,8 %, respectivement). Des cellules d'hépatomes ont été observées chez trois rats ayant reçu une dose 1,4 % de 1,4dioxane et 12 rats ayant reçu une dose de 1,8 % de 1,4-dioxane. Des tumeurs n'ont pas été observées dans les fosses nasales des 30 témoins, mais ils étaient présents chez 1/30, 1/30, 2/30 et 2/30 des rats ayant reçu des concentrations de 1,4dioxane de 0,75 %, 1,0 %, 1,4 % et 1,8 %, respectivement. Tous les animaux exposés ont présenté de graves problèmes rénaux (Hoch-Ligeti et al., 1970; Argus et al., 1973). Des rats Sherman, 60 par sexe par groupe, ont été exposés à 0 %, 0,01 %, 0,1% et 1,0 % de 1,4-dioxane dans l'eau potable (équivalent à 0, 9,6, 94 et 1 015 mg/kg-p.c. par jour chez les mâles et à 0, 19, 148 et 1 599 mg/kg-p.c. par jour chez les femelles) pendant 716 jours. Des carcinomes du foie (10/66) et des cholangiomes (2/66) ainsi que des carcinomes malpighiens dans les fosses nasales (3/66) ont été observés dans le groupe ayant la plus forte dose (mâles et femelles combinés). Des carcinomes hépatiques ont également été retrouvés chez les témoins (1/106) et dans les groupes ayant reçu 0,1 % de 1,4dioxane (1/106). La dégénérescence, la nécrose hépatiques et des problèmes rénaux ont été observés dans les groupes ayant reçu la plus forte dose. Une réduction considérable du taux de survie et du poids corporel, de même qu'une augmentation absolue et relative du poids du foie ont été observés dans le groupe ayant reçu la plus forte dose. Aucun effet sur l'hématologie et les organes reproducteurs n'a été observé chez les animaux exposés. À la concentration de 0,01 % de 1,4dioxane (équivalent à 9,6 et à 19 mg/kg-p.c. par jour pour les mâles et les femelles, respectivement), il n'y avait aucune indication de formation de tumeurs ni d'effets toxiques considérés comme étant liés à l'exposition (DSENO) (Kociba et al., 1974). Des rats Osborne-Mendel, 35 par sexe par groupe, ont été exposés au 1,4dioxane à des doses de 0 %, 0,5 % et 1,0 % dans l'eau potable pendant 110 semaines (équivalent aux doses de 0, 240 et 530 mg/kg-p.c. par jour pour les mâles et de 0, 350 et 640 mg/kg-p.c. par jour pour les femelles, respectivement). Le taux de survie des deux groupes a diminué considérablement, mais un nombre suffisant d'animaux de chaque sexe étaient vivants à la 52e semaine. On a observé une importante augmentation de l'incidence d'adénomes hépatocellulaires chez les femelles (0/31, 10/33 et 11/32 aux doses de 0 %, 0,5 % et 1,0 %, respectivement), et aucune incidence chez les mâles. Une augmentation considérable de l'incidence de carcinomes malpighiens a été observée dans les fosses nasales des rats des deux sexes (0/33, 12/33 et 16/34 chez les rats mâles ayant reçu des doses de 0 %, 0,5 % et 1,0 % ainsi que 0/34, 10/35 et 8/35 chez les rats femelles ayant reçu des doses de 0 %, 0,5 % et 1,0 %, respectivement). En outre, des mésothéliomes dans la région des testicules ont été observés plus souvent chez les animaux ayant reçu une dose (2/33, 4/33 et 5/34 chez les mâles ayant été exposés à des doses de 0 %, 0,5 % et 1,0 %, respectivement). Des effets non néoplastiques ont été observés dans les reins (dégénérescence des tubules), le foie (cytomégalie) et l'estomac (ulcération). En outre, une plus grande incidence de pneumonie a été observée chez les rats ayant reçu une dose (Institut national du cancer du Canada, 1978). Des rats F344/DuCrj, 50 par sexe par groupe, ont été exposés au 1,4dioxane à des concentrations de 0, 200, 1 000 et 5 000 mg/L (équivalent à 0, 16, 81 et 398 mg/kg-p.c. par jour pour les mâles et à 0, 21, 103 et 514 mg/kg-p.c. par jour pour les femelles, respectivement) dans l'eau potable pendant 104 semaines. On a observé une réduction considérable du taux de survie dans les deux sexes chez le groupe exposé aux plus fortes doses. Les incidences combinées d'adénomes et de carcinomes hépatocellulaires observées chez les mâles étaient de 0/50, 2/50, 4/50 et 38/50 pour les groupes ayant reçu des doses de 0, 200, 1 000 et 5 000 mg/L, respectivement. Les incidences correspondantes chez les femelles étaient de 1/50, 0/50, 5/50 et 48/50. Chez les deux sexes, les incidences de tumeurs au foie dans les groupes ayant été exposés à une concentration de 1,4dioxane de 5 000 mg/L ont augmenté considérablement. Des néoplasmes malins dans les cavités nasales se sont produites seulement dans le groupe exposé à 5 000 mg/L. Des carcinomes malpighiens (3/50 et 7/50 parmi les mâles et les femelles, respectivement), des sarcomes (2/50 parmi les mâles seulement), des esthésioneuroépithéliomes (1/50 parmi les mâles et les femelles) et des rhabdomyosarcomes (1/50 parmi les mâles seulement) ont été observés. En outre, chez le groupe exposé à une concentration de 5 000 mg/L de 1,4dioxane, les incidences de mésothéliomes péritonéaux, de fibromes de l'hypoderme et de fibroadénomes de la glande mammaire ont augmenté considérablement chez les mâles, et les incidences d'adénomes de la glande mammaire ont augmenté considérablement chez les femelles. Des lésions non néoplastiques ont été observées dans les fosses nasales (dilatation du noyau et atrophie de l'épithélium olfactif, métaplasie et hyperplasie des cellules malpighiennes de l'épithélium de type respiratoire, changements hydropiques et sclérose dans les protéines laminines, adhésion, inflammation et prolifération de la glande nasale), le foie (spongiose et hyperplasie) et les reins (dilatation du noyau des tubules proximaux) des rats mâles exposés à des concentrations de 1,4dioxane de 200 mg/L et plus ainsi que des rats femelles exposées à des concentrations de 1 000 mg/L et plus (Yamazaki et al., 1994; JBRC, 1998c). Essai de cancérogénicité par voie orale (eau potable) chez la souris Des souris B6C3F1, 50 par sexe par groupe, ont été exposées à des doses de 0 %, 0,5 % et 1,0 % de 1,4-dioxane dans l'eau potable (équivalent à 0, 720 et 830 mg/kg-p.c. par jour pour les mâles et à 0, 380 et 860 mg/kg-p.c. par jour pour les femelles, respectivement) pendant 90 semaines. Une augmentation considérable de l'incidence de carcinomes hépatocellulaires a été observée chez les deux sexes des animaux exposés (2/49, 18/50 et 24/47 pour les mâles ainsi que 0/50, 12/48 et 29/37 pour les femelles qui ont été exposés aux concentrations de 1,4dioxane de 0 %, 0,5 % et 1,0 %, respectivement). L'incidence combinée des adénomes et des carcinomes hépatocellulaires a aussi augmenté (8/49, 19/50 et 28/47 pour les mâles ainsi que 0/50, 21/48 et 35/37 pour les femelles exposées aux concentrations de 1,4dioxane de 0 %, 0,5 % et 1,0 %, respectivement). Parmi les lésions non néoplastiques, la hausse de l'incidence de pneumonie et de rhinite était considérable. Des inclusions cytomégaliques ont été observées couramment chez les animaux exposés (Institut national du cancer du Canada, 1978). Des souris Crj:BDF1, 50 par sexe par groupe, ont été exposées au 1,4dioxane à des concentrations de 0, 500, 2 000 et 8 000 mg/L dans l'eau potable (équivalent à 0, 66, 250 et 770 mg/kg-p.c. par jour pour les mâles ainsi qu'à 0, 77, 320 et 1 070 mg/kg-p.c. par jour pour les femelles, respectivement) pendant 104 semaines. Le taux de survie chez les femelles exposées au 1,4dioxane aux concentrations de 2 000 et de 8 000 mg/L et les mâles exposés à la concentration de 8 000 mg/L a diminué en raison de tumeurs au foie. Une augmentation considérable du nombre d'incidences de carcinomes hépatocellulaires a été observée chez les mâles exposés au 1,4dioxane à une concentration de 8 000 mg/L (15/50, 20/50, 23/50 et 36/50 pour les groupes exposés aux concentrations de 0, 500, 2 000 et 8 000 mg/L, respectivement) et chez toutes les femelles exposées (0/50, 6/50, 30/50 et 45/50 pour les groupes exposés aux concentrations de 0, 500, 2 000 et 8 000 mg/L, respectivement). Une importante augmentation de l'incidence d'adénomes hépatocellulaires a été observée chez les deux sexes aux concentrations de 500 et 2 000 mg/L (7/50, 16/50, 22/50 et 8/50 chez les mâles et 4/50, 30/50, 20/50 et 2/50 chez les femelles pour les groupes exposés aux concentrations de 0, 500, 2 000 et 8 000 mg/L, respectivement). Des lésions non néoplastiques ont été observées dans les fosses nasales, les trachées, les poumons et les reins aux concentrations de 2 000 mg/L et plus chez les deux sexes. Chez les mâles, des lésions ont également été observées dans le foie (angiectasie) à la concentration de 8 000 mg/L et sur les testicules (minéralisation réduite) aux concentrations de 2 000 mg/L et plus. On a observé les effets du 1,4dioxane aux concentrations de 2 000 mg/L et plus, soit la réduction du poids corporel ainsi que des effets sur les paramètres hématologiques et biochimiques et sur la composition de l'urine (Yamazaki et al., 1994; JBRC, 1998c). Essai de cancérogénicité par voie orale (eau potable) chez le cobaye Des cobayes mâles, 22 par groupe d'essai et 10 témoins, ont été exposés à des concentrations de 1,4dioxane de 0,5 à 2 % dans l'eau potable (1 200 à 4 800 mg/kg-p.c. par jour) pendant 23 mois. Chez les animaux exposés, trois ont développé des hépatomes, un a développé des adénomes rénaux et deux ont développé des carcinomes de la vésicule biliaire. De plus, 9/22 animaux exposés ont développé l'hyperplasie épithéliale bronchique (1/10 chez les témoins) et l'infiltration de cellules mononucléaire dans les poumons (4/10 chez les témoins) (Hoch-Ligeti et Argus, 1970). Essai de cancérogénicité par inhalation chez le rat Des rats Wistar, 288 par sexe dans le groupe d'essai et 192 par sexe dans le groupe témoin, ont été exposés par inhalation à 400 mg/m3 (111 ppm) de 1,4dioxane (pureté de 99,9 %) à raison de 7 h/j, 5 jours par semaine, pendant 2 ans. Le groupe témoin a été exposé à de l'air filtrée dans une salle. La moitié des animaux ont survécu pendant une période de 20 à 24 mois. Aucune augmentation statistiquement considérable n'a été observée dans l'incidence de tumeurs chez les 525 rats exposés qui ont été examinés, comparativement aux 347 témoins. On n'a observé aucun effet lié à l'exposition sur les valeurs hématologiques et les valeurs de chimie clinique, la croissance, le taux de mortalité, le comportement, aucun changement de poids des organes, notamment le foie, les reins et la rate, et aucun changement histopathologique dans les organes comme le foie, les reins, la rate, les poumons, la trachée, les ganglions lymphatiques thoraciques, le cœur, le pancréas, l'estomac, les intestins, la glande thryroïde, les ganglions lymphatiques mésentériques, la vessie, l'hypophyse, les glandes surrénales, les testicules, les ovaires, l'oviducte, l'utérus, les glandes mammaires, les glandes lacrymales, les ganglions lymphatiques, le cerveau, le vagin et la moelle osseuse (Torkelson et al., 1974). Des rats F344/DuCrj mâles, 50 par sexe par groupe, ont été exposés au 1,4dioxane à des concentrations de 0, 50, 250 et 1 250 ppm (équivalent à 0, 180, 900 et 4 500 mg/m3) 6 heures par jour et 5 jours par semaine, pendant 104 semaines. Une augmentation attribuable à la dose et significative de l’incidence de carcinomes malphigiens et d’adénomes hépatocellulaires a été constatée principalement sur les rats exposés à 1 250 ppm. Une augmentation significative de l’incidence de mésothéliomes péritonéaux a été observée sur les groupes exposés à 250 et 1 250 ppm. L’incidence d’hypernéphromes, de fibroadénomes mammaires et d’adénomes dans la glande de Zymbal a également augmenté avec la dose, mais ne s’est pas révélée statistiquement significative. Des lésions prénéoplasiques sont apparues dans les fosses nasales et sur le foie des groupes exposés au 1,4-dioxane. L’augmentation significative de l’incidence de l’élargissement nucléaire, une atrophie et des métaplasies respiratoires ont été constatées dans les fosses nasales à 50 ppm et supérieur. Par ailleurs, un décrément statistiquement important mais marginal des poids corporels finaux, une large augmentation de la concentration de SGOT, de GPT, de PhoA et de gGTP, une baisse importante du niveau d’hémoglobine, un volume corpusculaire moyen et une hémoglobine corpusculaire moyenne, ainsi qu’une augmentation importante du poids relatif du foie, ont été décelés chez le groupe exposé à 1 250 ppm. Bien que des augmentations importantes du poids relatif des poumons aient été constatées chez le groupe exposé à 1 250 ppm, les auteurs ont indiqué que cette modification n’était pas biologiquement importante en raison de l’absence de lien entre la dose et la réponse pour le poids relatif des poumons. Un CMENO non cancéreux a été établi à 50 ppm (180 mg/m3) pour ses effets sur les fosses nasales (Kasai et al., 2009). Essai de cancérogénicité par voie cutanée et essai de production de tumeurs chez la souris Le 1,4-dioxane dissout dans l’acétone (0,2 mL, concentration non précisée) a été appliqué au dos rasé de souris Swiss-Webster, 30 par sexe par groupe, 3 fois par semaine, pendant 60 semaines. L'une parmi les 25 souris femelles exposées a développé des carcinomes cutanés, et l'une parmi les 22 souris mâles a développé des tumeurs souscutanées. Aucune lésion significative n'a été observée. Aucune tumeur n'a été observée chez les animaux ayant reçu un traitement à l'acétone. Un essai visant à produire des tumeurs a aussi été exécuté, où 50 µg de diméthylbenzanthracène a été administré aux souris une semaine avant d'être exposées au 1,4dioxane. Parmi les mâles exposés, 2/4, 3/4 et 2/4 ont développé des papillomes cutanés, des carcinomes et des tumeurs souscutanées, respectivement. Parmi les femelles exposées, 2/5 et 3/5 ont développé des papillomes cutanés et des carcinomes, respectivement. Des carcinomes malpighiens de la cloison nasale ont été observés chez un animal qui affichait des papillomes cutanés. Neuf parmi les animaux exposés ont développé des tumeurs pulmonaires. Des tumeurs aux reins, à la rate et au foie ainsi que des lésions non néoplastiques sur le foie et la peau ont été observées chez les animaux exposés (King et al., 1973). Le 1,4-dioxane (0,05 mL; quatre doses dans quatre groupes, respectivement) a été administré par voie cutanée à des souris C3h/HeJAgouti, 30 mâles par groupe, à raison de 3 fois par semaine, pendant 78 semaines. Les témoins ont été exposés à l'éthanol. Cinq néoplasmes hépatiques et un néoplasme pulmonaire ont été observés chez les animaux exposés; ces néoplasmes ont été signalés comme étant dans les limites normales. Aucun effet clinique n'a été observé. Parmi les animaux faisant objet de l'essai, seulement 40/120 ont survécu jusqu'à la fin de l'étude. Les chercheurs n'ont pas mentionné s'il s'agissait d'une application cutanée dans des conditions d'occlusion (Perone et al., 1976). Autres essais de cancérogénicité IInduction de tumeurs par injection intrapéritonéale Le 1,4dioxane (pureté non précisée) a été administré à des souris A/J, 30 mâles par groupe, par injection intrapéritonéale 3 fois par semaine, pendant 8 semaines, à des concentrations totales de 0, 400, 1 000 et 2 000 mg/kg-p.c. Les concentrations élevées ont accru la multiplicité des tumeurs pulmonaires à 0,97 par souris (p < 0,05) comparativement à 0,28 par souris chez les témoins traités avec l'excipient seulement (Maronpot et al., 1986). Dans le cadre d'un essai sur des adénomes pulmonaires chez des souris A/J, 16 par sexe par groupe d'essai, le 1,4-dioxane a induit une importante augmentation de l'incidence de tumeurs pulmonaires chez les mâles ayant reçu une concentration intrapéritonéale intermédiaire (dose totale de 12 000 mg/kg-p.c., huit injections au cours de 24 semaines). Une telle augmentation n'a pas été observée chez les mâles ayant reçu une dose intrapéritonéale inférieure ou supérieure (dose totale de 4 800 ou de 24 000 mg/kg-p.c., respectivement, huit injections au cours de 24 semaines) chez les femelles ayant reçu les mêmes doses intrapéritonéales ou chez les mâles et les femelles ayant reçu le 1,4dioxane par voie orale (dose totale de 24 000 mg/kg-p.c., 8 fois au cours de 24 semaines) (Stoner et al., 1986). Essai de promotion de tumeurs par voie orale (gavage) Des rats SD, de 8 à 11 mâles par groupe et 19 témoins, ont été partiellement hépatectomisés et ont reçu une injection intrapéritonale avec une seule dose de 30 mg/kg-p.c. de N-Nitrosodiéthylamine (NDEA) afin d'initier l'hépatocancérogenèse. Cinq jours plus tard, ces animaux ont été exposés par gavage au 1,4dioxane (pureté de 99,5 %) à des concentrations de 0, 100 et 1 000 mg/kg-p.c. une fois par jour, 5 jours par semaine, pendant 7 semaines. La concentration de 1,4dioxane de 1 000 mg/kg-p.c. a augmenté considérablement le nombre et le volume total de foyers qui réagissent positivement au ?glutamyltranspeptidase (GGT) au niveau du foie. Chez les deux autres groupes de rats n'étant pas été exposés au NDEA, l'administration de seulement le 1,4dioxane aux concentrations de 100 et 1 000 mg/kg-p.c. par jour n'a pas induit la réaction positive de foyers au GGT (Lundberg et al., 1987). Essai d'initiation de tumeurs Des souris femelles SENCAR, de 20 à 40 par groupe, ont été exposées au 1,4dioxane à une concentration de 1 000 mg/kg-p.c. par voie orale, souscutanée et cutanée comme initiateur de tumeurs, puis au 12-O-tétradécanoylphorbol-13acétate (TPA) à une concentration de 1 µg par voie cutanée comme promoteur de tumeurs, 3 fois par semaine, pendant 20 semaines. L'expérience a pris fin après 52 semaines. Aucune augmentation significative de formation de papillomes n'a été observée comparativement aux témoins exposés à l'acétone comme initiateur et au TPA comme promoteur de tumeurs (Bull et al., 1986). Des rats mâle SD, 10 par groupe, ont reçu une dose intrapéritonéale de 881 mg/kg-p.c. de 1,4-dioxane, après l'administration de 500 mg/L de phénobarbital de sodium dans l'eau potable pendant 49 jours. Aucune augmentation du nombre de foyers qui réagissent positivement au GGT n'a été observée au niveau du foie, ce qui indique un manque d'initiation (Pereira et al., 1982). Paramètres non néoplastiques DMENO la plus faible, par voie orale, pour les effets non néoplastiques = 200 mg/L (16 mg/kg-p.c. par jour), d'après un effet sur le foie (spongiose) chez les rats mâles exposés à 200 mg/L de 1,4dioxane dans l'eau potable pendant deux ans (Yamazaki et al., 1994; JBRC, 1998c). EURAR a déclaré que, même si l'accroissement de l'incidence de spongiose du foie n'était pas statistiquement significatif à la dose de 200 ppm, on a observé une croissance dans la tendance liée à la dose qui était associée à cet effet et par conséquent, on peut établir que 200 ppm est la DMENO (EURAR, 2002). La DSENO par voie orale est de 9,6 mg/kg-p.c. par jour chez les rats mâles et de 19 mg/kg-p.c. par jour chez les rats femelles exposées au 1,4dioxane à une concentration de 0,01 % dans l'eau potable pendant deux jours (Kociba et al., 1974). CSENO par inhalation = 50 ppm (180 mg/m3) (rats mâles F344/DuCrj (SPF) exposés à des doses de 0, 50, 250 ou 1 250 ppm de 1,4-dioxane (équivalent à 0, 180, 900 et 4 500 mg/m3) 7 heures par jour et 5 jours par semaine, pendant 104 semaines), pour constater les effets sur les fosses nasales (Kasai et al., 2009) (voir ci-dessus pour de plus amples renseignements). CSENO par inhalation = 400 mg/m3(rats exposés au 1,4-dioxane 7 h/j, 5 jours/semaine, pendant 2 ans), aucun effet non néoplastique lié à l'exposition n'a été observé (Torkelson et al., 1974). Application par voie cutanée de 0,05 mL de 1,4dioxane, équivalent à 700 à 1 000 mg/kg-p.c. par jour (souris exposées au 1,4-dioxane 3 fois par semaine pendant 78 semaines), aucun effet non néoplastique lié à l'exposition n'a été observé (Perone et al., 1976). |
| Toxicité pour la reproduction | DMENO la plus faible, par voie orale (souris exposées au 1,4-dioxane dans l'eau potable pendant deux ans) = 2 000 mg/L (250 mg/kg-p.c. par jour), fondée sur la minéralisation réduite des testicules observée au cours de l'étude à long terme mentionnée cidessus (JBRC, 1998c). Cependant, cet effet n'a pas été signalé par Yamazaki et al. (1994). [étude supplémentaire : Lane et al., 1982 (il s'agit d'une étude menée sur trois générations où des souris ont été exposées au 1,1,1-trichloroéthane aux concentrations de 0,58 à 5,83 mg/mL contenant le 1,4dioxane à une concentration de 3 % dans l'eau potable, un groupe témoin a été exposé au 1,4dioxane et à l'Emulphor; aucun effet n'a été observé sur les paramètres de reproductivité des adultes, le taux de survie, la croissance, le développement et la pathologie en général.] Aucune étude sur la reproductivité par voie cutanée ou par inhalation n'a été observée. Autre voie d'exposition Aucun effet sur le taux de conception, le nombre moyen d'implantations, le pourcentage de fœtus vivants ou l'indice de mutagénicité n'a été observé chez les souris mâles après une seule injection intrapéritonéale de 2 500 mg/kg-p.c. (BASF, 1977). |
| Toxicité pour le développement | DMENO la plus faible, par voie orale (gavage)(rats femelles SD gravides, 17 à 20 par groupe, exposées au 1,4dioxane aux concentrations de 0, 0,25, 0,5 et 1,0 mL/kg-p.c. par jour par gavage du jour 6 au jour 15 de la gestation) = 1,0 mL/kg-p.c. par jour (1 035 mg/kg-p.c. par jour), d'après la réduction considérable du poids moyen des fœtus vivants et le retard de l'ossification fœtale des sternèbres. On a également observé une réduction considérable du poids maternel à la concentration de 1,4dioxane de 1,0 mL/kg-p.c. par jour. DSENO = 0,5 mL/kg-p.c. par jour (517 mg/kg-p.c. par jour) (Giavini et al., 1985). [Aucune autre étude sur la toxicité par voie orale n'a été recensée.] Aucune étude sur le développement dans le cadre de l'exposition par voie cutanée ou par inhalation n'a été recensée. Autre voie d'exposition Aucun effet sur le taux de conception, le nombre moyen d'implantations, le pourcentage de fœtus vivants ou l'indice de mutagénicité n'a été observé chez les souris mâles après une seule injection intrapéritonéale de 2 500 mg/kg-p.c. (BASF, 1977). |
| Génotoxicté et paramètres connexes : in vivo | Essai de létalité dominante Résultats négatifs : Aucun effet sur le taux de conception, le nombre moyen d'implantations, le pourcentage de fœtus vivants ou l'indice de mutagénicité n'a été observé chez les souris mâles après une seule injection intrapéritonéale de 2 500 mg/kg-p.c. (BASF, 1977). Essai de létalité récessive liée au sexe Résultats négatifs : Le Drosophila melanogaster exposé au 1,4-dioxane par alimentation (35 000 ppm) ou par injection (50 000 ppm) (Yoon et al., 1985). Induction de micronoyaux Résultats positifs : Des augmentations significatives au taux d'induction de micronoyaux liées à la dose ont été observées dans la moelle osseuse et le foie de jeunes souris CD-1 après une administration par voie orale (gavage) de 1,4dioxane de 1 500, 2 500 et 3 500 mg/kg-p.c. par jour pendant 5 jours; les micronoyaux étaient issus principalement de bris chromosomiques (Roy et al., 2005). Des preuves d'augmentations du taux d'induction de micronoyaux liées à l'exposition au 1,4dioxane ont été observées chez des souris mâles et femelles C57BL/6 après une seule administration par voie orale (gavage) de 1,4dioxane aux concentrations de 900 mg/kg-p.c. et plus (Mirkova, 1994). Une augmentation significative du nombre de micronoyaux a été observée chez des hépatocytes de souris mâles CD-1 après une seule administration par gavage aux concentrations de 2 000 mg/kg-p.c. et plus (Morita et Hayashi, 1998). Résultats négatifs : Aucune preuve d'augmentation de micronoyaux liée à l'exposition au 1,4dioxane n'a été observée dans la moelle osseuse de souris mâles BALB/c après une seule administration par voie orale (gavage) de 5 000 mg/kg-p.c. (Mirkova, 1994). Aucune augmentation considérable en fonction de la dose n'a été observée dans le nombre de micronoyaux dans la moelle osseuse de souris mâles B6C3F1 après une seule injection intrapéritonéale ou après trois injections quotidiennes intrapéritonéales de 1,4dioxane (jusqu'à 4 000 mg/kg-p.c.) (McFee et al., 1994). Aucune augmentation considérable du nombre de micronoyaux n'a été observée dans la moelle osseuse de souris CBA (1 800 mg/kg-p.c.) ou de souris C57BL/6 (jusqu'à 3 600 mg/kg-p.c.) après une seule administration par voie orale (Tinwell et Ashby, 1994). Aucune augmentation considérable du nombre de micronoyaux n'a été observée dans les cellules rouges périphériques de souris mâles CD-1 après des doses par gavage uniques de jusqu'à 3 000 mg/kg-p.c. (Morita et Hayashi, 1998). Essai de réparation de l'ADN (synthèse non programmée d'ADN) Résultats positifs : Une hausse significative de la synthèse de l'ADN hépatique a été observée chez des rats mâles SD exposés au 1,4dioxane à une concentration de 1 000 mg/kg-p.c. par jour dans l'eau potable pendant 11 semaines, ainsi qu'une augmentation considérable du poids relatif du foie (Stott et al., 1981). Résultats négatifs : Aucune augmentation significative de la réparation de l'ADN n'a été observée dans les hépatocytes de rats mâles F344 après une seule administration par voie orale de 1,4-dioxane de 1 000 mg/kg-p.c. par gavage pendant 2 et 12 heures ou après une exposition au 1,4dioxane à une concentration de 1 % ou 2 % dans l'eau potable pendant une semaine (Goldsworthy et al., 1991). Aucune synthèse non programmée d'ADN n'a été observée dans les cellules épithéliales des fosses nasales des rats mâles F344 exposés à une concentration de 1 % de 1,4dioxane dans l'eau potable pendant 8 jours après une seule dose par gavage de jusqu'à 1 000 mg/kg-p.c. (Goldsworthy et al., 1991). Aucune augmentation significative de la réparation de l'ADN hépatique n'a été observée chez des rats mâles Sprague-Dawley (SD) auxquels on a administré une seule dose de 1,4dioxane à une concentration de 1 000 mg/kg-p.c. par gavage (Stott et al., 1981). Essai de prolifération de cellules (synthèse réplicative de l'ADN) Résultats positifs : Une hausse significative de la prolifération des cellules hépatiques (mesurée comme étant l'indice de marquage hépatique) a été observée chez des rats mâles F344 exposés au 1,4dioxane à une concentration de 1 % dans l'eau potable pendant 2 semaines (Goldsworthy et al., 1991). Une augmentation importante de la synthèse réplicative de l'ADN a été observée chez des rats mâles F344 24 heures après avoir été exposés à une seule dose de 2 000 mg/kg-p.c. de 1,4-dioxane; aucun changement histopathologique n'a été observé (la voie d'exposition n'a pas été déclarée) (Miyagawa et al., 1999). Résultats équivoques : Une induction de la synthèse réplicative de l'ADN a été observée chez les hépatocytes de rats mâles F344 24 heures après avoir été exposés par gavage à une seule dose de 2 000 mg/kg-p.c. de 1,4-dioxane, mais non 39 ou 48 heures après l'administration; on n'a pas réussi à reproduire les résultats après les 24 heures au cours de la même étude; par conséquent, on a déclaré que dans l'ensemble, les résultats étaient négatifs (Uno et al., 1994). Résultats négatifs : L'indice de marquage hépatique a augmenté ni aux 24 heures ni aux 48 heures après une seule dose de 1 000 mg/kg-p.c. de 1,4-dioxane chez les rats mâles F344 (Goldsworthy et al., 1991). Aucune augmentation de la prolifération des cellules n'a été observée dans les cellules épithéliales des fosses nasales (mesurée comme l'indice de marquage de la longueur par unité) des rats mâles F344 exposés au 1,4dioxane à une concentration de 1 % dans l'eau potable pendant 2 semaines (Goldsworthy et al., 1991). Essai de dommages à l'ADN Résultats positifs : Une augmentation liée à la dose des dommages à l'ADN hépatique a été observée chez des rats femelles SD après l'administration par voie orale de 1,4-dioxane (168 à 4 200 mg/kg-p.c.) 21 heures et 4 heures avant le sacrifice. Les résultats étaient significatifs aux concentrations de 2 550 mg/kg-p.c. et plus (Kitchin et Brown, 1990). Résultats négatifs : Aucune indication de dommages à l'ADN (essai de Comet) n'a été observée dans l'estomac, le côlon, le foie, les reins, la vessie, les poumons, le cerveau ou la moelle osseuse chez les souris mâles ddY après une seule dose par gavage de jusqu'à 3 200 mg/kg-p.c. (Sasaki et al., 2000). Aucune hausse des concentrations de 8-hydroxydésoxyguanosine n'a été observée dans l'ADN de rats F344 ayant reçu une seule dose de 1,4dioxane par gavage à la moitié de la DL50 (Sai et al., 1989). Essai d'alkylation de l'ADN Résultats négatifs : Aucune hausse significative de l'alkylation de l'ADN hépatique n'a été observée chez des rats mâles SpragueDawley (SD) ayant reçu une seule dose de 1 000 mg/kg-p.c. de 1,4-dioxane par gavage (Stott et al., 1981). Essai d'aneuploïdie Résultats positifs : Une induction considérable de non-disjonction méiotique a été observée dans les ovocytes matures de Drosophila melanogaster femelles ayant reçu une dose orale de 1,4-dioxane à une concentration de 2 % et plus, et dans les ovocytes immatures à une concentration de 1 % et plus, avant l'accouplement (Muñoz et Barnett, 2002). Essai de synthèse de l'acide ribonucléique (ARN) Une diminution de l'activité de l'ARN polymérase A et B a été observée chez des rats mâles SD exposés au 1,4dioxane à une concentration de 10 mg par rat (29 mg/kg-p.c.) et plus (Kurl et al., 1981). |
| Génotoxicté et paramètres connexes : in vitro | Essai de mutagénicité Résultats négatifs : Tests Ames chez des souches de Salmonella typhimuriumTA98, TA100, TA102, TA1530, TA1535, TA15337 et TA1538, avec et sans activation métabolique (BASF, 1979a, b, c; Stott et al., 1981; Haworth et al., 1983; Nestmann et al., 1984; Khudoley et al., 1987). Essais de mutation ponctuelle observés chez le Saccharomyces cerevisiae D61M (Zimmermann et al., 1985); chez le Photobacterium phosphoreum, sans activation métabolique (Kwan et al., 1990); dans les cellules ovariennes de hamsters chinois (CHO), avec et sans activation métabolique (BASF, 1991); et dans les cellules de lymphomes chez des souris, avec et sans activation métabolique (McGregor et al., 1991; Morita et Hayashi, 1998). Essai d'aberration chromosomique Résultats négatifs : CHCellules CHO W-B1 (Galloway et al., 1987) et cellules CHO K1 (Morita et Hayashi, 1998), avec et sans activation métabolique. Essai d'induction de micronoyaux Résultats négatifs : Cellules CHO K1, avec et sans activation métabolique (Morita et Hayashi, 1998). Essai d'échange de chromatides sœurs Résultats négatifs : Cellules CHO W-B1, avec activation métabolique (Galloway et al., 1987), et cellules CHO K1, avec et sans activation métabolique (Morita et Hayashi, 1998). Résultats faiblement positifs : Cellules CHO W-B1, sans activation métabolique (Galloway et al., 1987). Essai d'aneuploïdie Résultats négatifs : Saccharomyces cerevisiae D61M (Zimmermann et al., 1985) Essai de dommages à l'ADN Résultats positifs : Induction de ruptures des brins simples de l'ADN dans les hépatocytes de rats; une cytotoxicité a été observée (Sina et al., 1983). Résultats négatifs : Essai de réparation de l'ADN différentiel chez l'Escherichia coli K-12, avec et sans activation métabolique (Hellmer et Bolcsfoldi, 1992). Réparation de l'ADN dans les principaux hépatocytes fraîchement isolés de rats mâles F344 avec ou sans activation du métabolisme du 1,4-dioxane. Pour être en mesure d'activer le métabolisme du 1,4-dioxane, certains rats ont été exposés au 1,4dioxane à une concentration de 1 % dans l'eau potable pendant une semaine avant l'isolement des cellules (Goldsworthy et al., 1991). Essai de liaison covalente de l'ADN Aucune liaison par microsomes entre le 1,4-dioxane et l'ADN n'a été décelée dans l'essai in vitro (Woo et al., 1977). Transformation cellulaire Résultats positifs : Transformation par le 1,4-dioxane des cellules BALB/3T3; une cytotoxicité a été observée (Sheu et al., 1988). Résultats négatifs : Le 1,4-dioxane n'a pas augmenté la transformation induite par l'adénovirus SA7 des cellules embryonnaires de hamsters syriens (SHE) (Heidelberger et al., 1983). Essai d'inhibition de la synthèse d'ADN Résultats positifs : Cellules HeLaS3 (de nombreuses autres substances chimiques non génotoxiques ont donné des résultats positifs dans le cadre de cet essai) (Heil et Reifferscheid, 1992). |
| Immunotoxicité | Une inhibition de la réaction des lymphocytes T par le 1,4dioxane (sur les lymphocytes) en augmentant la réaction des cellules B (dans les cellules de la rate et des ganglions lymphatiques) a été observée dans les lymphocytes murins et humains in vitro et une réaction un peu plus faible des lymphocytes aux mitogènes a été observée chez des souris CBA/J exposées au 1,4-dioxane par injection intrapéritonéale (1670 mg/kg-p.c. par jour). Des souris CBA/J ont reçu 0,5 mL de 1,4dioxane à des concentrations de 0,1 à 10 % par injection intrapéritonéale pendant 7 jours (Thurman et al., 1978). |
| Sensibilisation | Négative pour la peau des cobayes (BASF, 1993). |
| Irritation | Irritation cutanée Une solution non diluée de 1,4-dioxane a été appliquée au dos rasé de lapins (une dose par sexe par groupe) pour des périodes de 1, 5 et 15 minutes et de 20 heures ainsi qu'à l'oreille pendant 20 heures dans des conditions d'occlusion. On a observé un érythème très léger 24 heures après des applications de 1 à 15 minutes, et un peu d'écailles après 8 jours. Un érythème très léger et des œdèmes ont été observés sur le dos d'un animal 24 heures après l'application sur 20 heures. Un érythème très léger a été observé sur l'oreille 24 heures après l'application sur 20 heures (BASF, 1973). Une irritation de la peau a été observée chez des rats Wister (trois par sexe par groupe), des souris ddY (trois par sexe par groupe) et des cobayes Hartley (trois femelles) dans des conditions de non-occlusion une semaine après l'application de 20 mg/kg-p.c. et plus de 1,4dioxane (Sekizawa et al., 1994). |
Irritation oculaire Deux lapins mâles White Vienna ont reçu une instillation de 0,05 mL de 1,4dioxane non dilué. Une légère opacification de la cornée, une conjonctive rouge et un léger chémosis ont été observés après 24 heures, et des dépôts de taches ont été observés après une application pendant 8 jours (BASF, 1973). On a observé une augmentation significative de l'opacité et de l'épaisseur de la cornée bovine et du stroma isolés après une incubation avec le 1,4dioxane à des concentrations de 5 à 10 % (vol/vol) pendant 30 minutes et 4,5 heures (Igarashi et Northover, 1987). |
|
Voie respiratoire Une irritation de la voie respiratoire a été observée chez des rats, des souris, des cobayes et des lapins exposés au 1,4-dioxane sous forme de vapeur (Yant et al., 1930; Gross, 1938; BASF, 1980). |
|
| Humains | |
| Toxicité aiguë | Dans le cadre d'une étude d'inhalation aiguë, six femelles et six mâles, tous des bénévoles en santé, ont été exposés au 1,4dioxane aux concentrations de 0 (témoin) et 20 ppm (72 mg/m3) pendant 2 heures au repos. Aucune différence significative n'a été observée dans la catégorisation des symptômes sur une échelle analogique visuelle, la fréquence de clignotement, le fonctionnement pulmonaire, l'inflammation des fosses nasales et les marqueurs d'inflammation dans le plasma entre les bénévoles exposés et les témoins. Les auteurs ont suggéré que 20 ppm est une CSENO, quoiqu'ils ont déclaré qu'à cette concentration, on ne peut pas exclure la possibilité d'effets souscliniques sur le système nerveux central (Ernstgård et al., 2006). |
| Toxicité chronique et cancérogénicité | Plusieurs études de cas ont révélé des décès parmi des travailleurs exposés au 1,4dioxane dans le milieu de travail. Les indications cliniques de toxicité sont de graves douleurs au niveau de l'épigastre, des convulsions et le coma. Une étude histologique a révélé des lésions hépatiques et rénales. On a également observé la néphrite hémorragique ainsi que la démyélination et la perte de fibres nerveuses dans le système nerveux central (Barber, 1934; Johnstone, 1959; Sullivan, 1994). Les niveaux d'exposition ne pouvaient pas être déterminés précisément et il se peut que la coexposition à d'autres substances chimiques et la consommation d'alcool étaient des facteurs de confusion. Dans le cadre d'une étude transversale, 74 travailleurs ont été exposés au 1,4dioxane à des concentrations estimées de 0,02 à 48 mg/m3 pendant environ 25 ans. Douze décès ont été signalés, y compris deux en raison du cancer. Le groupe n'a affiché aucune indication de dommages hépatiques et rénaux et il n'a pas présenté une incidence plus élevée de décès dus au cancer comparativement à la population en général. Chez six travailleurs actifs, aucune hausse de l'incidence d'aberrations chromosomiques dans les lymphocytes n'a été observée (Thiess et al., 1976). Dans le cadre d'une autre étude, une augmentation significative de la fréquence moyenne d'aberrations chromosomiques dans les lymphocytes a été observée chez 11 travailleurs exposés à des oxydes d'alkylène, y compris le 1,4dioxane, pendant plus de 20 ans. L'exposition aux mutagènes connus comme l'oxyde d'éthylène et l'oxyde de propylène rend difficile la tâche donner une conclusion sur les causes des effets observés (Thiess et al., 1981). Dans le cadre d'une étude de cohorte, 80 travailleurs peuvent avoir été exposés au 1,4dioxane à des concentrations de 0,18 à 184 mg/m3. Quatre cancers ont été signalés : cancer du colon, carcinomes pulmonaires, lymphosarcomes et glioblastomes. Les décès observés n'ont pas révélé une différence significative relativement à l'incidence attendue de décès dus au cancer (NIOSH, 1977). Lors d'une étude de cohorte rétrospective, 165 travailleurs (Texas) ont été exposés au 1,4dioxane (< 25 ppm, équivalent à 90 mg/m3) de 1954 à 1975 pendant des périodes d'un mois à 10 ans et plus. Trois décès dus au cancer ont été déclarés : carcinomes de l'estomac et des cellules alvéolaires. Aucune différence significative n'a été décelée entre le taux de mortalité totale observé et les décès dus à des tumeurs malignes et le taux de mortalité attendu chez les hommes du Texas. Cependant, les auteurs ont affirmé que la cohorte était peu nombreuse, et que tous les auraient été exposés à de faibles doses de 1,4-dioxane pendant des durées relativement courtes; les résultats n'étaient pas concluants (Buffler et al., 1978). Dans le cadre d'une étude de paires appariées sur 151 travailleurs exposés pendant 1 à 6 ans à des concentrations atmosphériques de jusqu'à 1,4 mg/L de 1,1,1trichloroéthane mélangé avec le stabiliseur 1,4dioxane à une concentration de 4 %, aucun effet nocif sur le foie et le cœur n'a été signalé (Kramer et al., 1978). Dans le cadre d'une étude comparative du taux de mortalité de plus de 19 000 cas dans le Danish Cancer Registry, un ratio standardisé d'incidence proportionnelle (RISP) de 1,64 a été déterminé pour le cancer hépatique chez des travailleurs mâles dans une compagnie qui a utilisé le 1,4dioxane de 1970 à 1984. Le RISP était beaucoup plus élevé que le taux attendu (p = 0,04), et les facteurs de confusion, en particulier la consommation d'alcool, ne pouvaient pas causer cette hausse. Cependant, lorsqu'une période de latence (minimum de 10 ans) est intégrée dans l'analyse des données, le RISP est réduit à 1,15. Du point de vue statistique, l'intervalle de confiance (1,03 à 2,48) indique la possibilité d'un effet réel. Par contre, des facteurs ne pouvant pas être contrôlés comme la possibilité d'exposition à d'autres produits chimiques cancérogènes, en particulier le 1,1,1trichloroéthane, et le manque de données d'exposition quantitatives pour le 1,4dioxane, rendent difficile la tâche de donner une conclusion sur une association de cause du cancer du foie dans le cadre de cette étude. Une augmentation de 50 % de l'incidence du cancer du foie a été signalée dans un milieu de travail où seulement le 1,4-dioxane était utilisé. La consommation d'alcool ne pouvait pas causer cette hausse. Les mêmes auteurs ont mené une enquête sur l'exposition dans le milieu de travail (1983 à 1991) et ont déclaré que la majorité des concentrations de 1,4dioxane mesurées étaient inférieures à 10 mg/m3. Cependant, ces données n'étaient pas suffisantes pour permettre aux auteurs de spéculer sur les concentrations d'exposition dans le milieu de travail dans le cadre de l'étude comparative sur le taux de mortalité (Hansen, 1993; Hansen et al., 1993). |
| Génotoxicité et paramètres connexes | Dans le cadre de l'étude transversale mentionnée cidessus, 74 travailleurs ont été exposés à des concentrations estimées de 0,02 à 48 mg/m3 de 1,4dioxane sur une période moyenne de presque 25 ans. Chez six travailleurs actifs, aucune augmentation du taux d'aberrations chromosomiques dans les lymphocytes n'a été signalée (Thiess et al., 1976). Dans une étude plus poussée, une augmentation importante de la fréquence moyenne d'aberration chromosomique des lymphocytes a été observée chez 11 travailleurs exposés à des oxydes d'alkylène, y compris le 1,4dioxane, pendant une période de plus de 20 ans. Les travailleurs ont également été exposés à d'autres mutagènes connus comme l'oxyde d'éthylène et l'oxyde de propylène (Thiess et al., 1981). |
| Toxicité pour la reproduction et le développement | Dans l'industrie électronique, une augmentation de l'incidence des fausses couches, des naissances prématurées, de toxicose, d'ossification fœtale et de réduction du poids de naissance ainsi que des effets gonadotoxiques sur la progéniture ont été observés chez les femmes travailleuses exposées à des produits chimiques, y compris le 1,4-dioxane dans le milieu de travail (Mikheev et al., 1979; Ailamazian, 1990). |
| Irritation | L'irritation des yeux, du nez et de la gorge a été signalée chez les bénévoles exposés au 1,4-dioxane sous forme de vapeur à une concentration de 50 ppm (180 mg/m3) pendant 6 heures et à des concentrations plus élevées pendant de plus courtes périodes (Yant et al., 1930; Wirth et Klimmer, 1937; Silverman et al., 1946; Young et al., 1977; Gingell et al., 1994). En outre, le 1,4dioxane est un solvant de graisses. L'irritation de la peau a été observée après des expositions répétées et de longue durée (Sonneck, 1964; Adams, 1983). La Commission européenne a conclu que le 1,4-dioxane irrite les yeux et les voies respiratoires, mais non la peau (EURAR, 2002). |
| Scénario d'exposition | Concentration ou dose | Dose avec effet critique | Effet critique | Marge d'exposition |
|---|---|---|---|---|
| 1 Voir l'annexe 1 pour obtenir les détails sur les concentrations environnementales. 2 Voir le tableau 7b pour obtenir les détails sur les estimations actuelles d'exposition à partir de produits de soins personnels et les estimations d'exposition à partir des produits dérivés du SDC. |
||||
| Milieu environnemental | ||||
| Dose quotidienne estimée provenant du milieu environnemental1 | 0,19 à 1,26 µg/kg-p.c. par jour | 9,6 mg/kg-p.c. par jour | Dose d'exposition orale à laquelle aucune formation de tumeurs n'a été observée et DSENO orale pour les effets non néoplastiques (toxicité hépatique) chez les animaux de laboratoire (Kociba et al., 1974) | 7 620 à 50 530 |
| 16 mg/kg-p.c. par jour | DMENO orale pour les lésions hépatiques chez les animaux de laboratoire (Yamazaki et al., 1994; JBRC, 1998c) | 12 700 à 84 200 | ||
| Estimation d’exposition par inhalation à partir de l’air intérieur | 0,685 µg/m3 (Fellin et Otson, 1997) | 180 mg/m3 | Toxicité nasale chronique chez les rats (2 ans) (Kasai et al., 2009) | 262 770 |
| 180 mg/m3 | Irritation des yeux, du nez et de la gorge (6 heures, humains) (Young et al., 1977). | |||
| Dose estimée issue de l'utilisation quotidienne de produits de soins personnels | ||||
| Données actuelles sur le produit fini : Estimation globale de la plage d'exposition à partir des produits utilisés quotidiennement (dose de l'exposition cutanée et par inhalation)2 | 0,0012 mg/kg-p.c. par jour | 9,6 mg/kg-p.c. par jour | Dose d'exposition orale à laquelle aucune formation de tumeurs n'a été observée et DSENO orale pour les effets non néoplastiques (toxicité hépatique) chez les animaux de laboratoire (Kociba et al., 1974) | 8 000 |
| 16 mg/kg-p.c. par jour | DMENO orale pour les lésions hépatiques chez les animaux de laboratoire (Yamazaki et al., 1994; JBRC, 1998c) | 13 300 | ||
| Estimation d'exposition par inhalation issue de l'utilisation quotidienne des produits de soins personnels | ||||
| Données actuelle sur le produit fini : Estimation moyenne globale des concentrations atmosphériques issues de l'utilisation quotidienne de produits2 | 0,0118 mg/m3 | 180 mg/m3 | Toxicité nasale chronique chez les rats (2 ans) (Kasai et al., 2009). | 15 250 |
| Estimation d'exposition issue de l'utilisation aiguë de produits de soins personnels | ||||
| Colorant capillaire : Plage d'estimations d'exposition issues des données tirées du SDC (absorption par exposition cutanée et par inhalation)2 | 0,0202 à 0,0672 mg/kg-p.c. | 1 050 mg/kg-p.c. | DMEO orale aiguë fondée sur les effets subtils sur le système nerveux central (neurotransmetteurs) chez les rats (Kanada et al., 1994) | 15 630 à 52 000 |
| Colorant capillaire : Estimations de la concentration atmosphérique moyenne tirée du SDC2 | 1,39 à 4,64 mg/m3 | 180 mg/m3 | Irritation des yeux, du nez et de la gorge (6 heures, humains) (Young et al., 1977) | 40 à 130 |
| 3 600 mg/m3 | CMEO aiguë fondée sur des modifications aux activités des enzymes sériques (4 heures, rats) (Drew et al., 1978) | 780 à 2 590 | ||
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
1,4-Dioxane
Numéro de registre du Chemical Abstracts Service
123-91-1
Environnement Canada
Santé Canada
Mars 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs écologiques nocifs
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Limites supérieures des estimations de l'absorption quotidienne de 1,4-dioxane par la population générale du Canada
- Annexe 2 : Estimations de l'absorption de 1,4-dioxane présent dans les additifs alimentaires
- Annexe 3 : Scénarios de calculs pour les échantillons selon le ConsExpo
- Annexe 4 : Résumé des renseignements sur les effets du 1,4-dioxane
- Annexe 5 : Sommaire des marges d'exposition pour le 1,4-dioxane
En application de l'article 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE(1999)], les ministres de l'Environnement et de la Santé ont effectué une évaluation préalable du 1,4-dioxane, dont le numéro de registre du Chemical Abstracts Service est 123-91-1. Une priorité élevée a été accordée à l’évaluation préalable de cette substance inscrite au Défi lancé par les ministres, car elle présente un risque d’exposition intermédiaire pour les particuliers au Canada et a été classée par d'autres organismes en fonction de sa cancérogénicité. La substance ne répondait pas aux critères environnementaux de la catégorisation relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation sur le 1,4-dioxane est donc axée sur les risques pour la santé humaine.
Selon les renseignements déclarés conformément à l'article 71 de la LCPE(1999), entre 10 000 et 100 000 kg de 1,4dioxane ont été importés et fabriqués au Canada en 2006. De plus, les entreprises canadiennes ont déclaré avoir utilisé entre 10 000 et 100 000 kg de cette substance. En ce qui a trait aux rejets dans l'environnement, entre 10 000 et 100 000 kg de 1,4-dioxane y ont été rejetés en 2006, la plus grande partie ayant pénétré dans l'eau et dans l'air. Au Canada, le 1,4-dioxane est principalement utilisé comme solvant dans la recherche et le développement. Toutefois, on le trouve également sous la forme d'une impureté dans les substances éthoxylées, qui sont utilisées dans de nombreuses industries (produits de soins personnels, détergents, matériaux d'emballage des aliments, etc.).
D'après les renseignements disponibles sur les concentrations présentes dans l’environnement et les résultats d’une enquête réalisée en application de l’article 71 de la LCPE(1999), les sources d'exposition de la population générale au 1,4-dioxane seraient les milieux environnementaux (air ambiant, air intérieur, aliments et eau potable) ainsi que l'utilisation par les consommateurs de produits (produits de soins personnels et produits ménagers) contenant cette substance.
En s’appuyant principalement sur les évaluations de plusieurs organismes internationaux et nationaux réalisées selon la méthode du poids de la preuve et des données toxicologiques disponibles, les effets critiques associés à l’exposition au 1,4-dioxane suivant une exposition orale ou par inhalation à la substance, mais non après une exposition par voie cutanée, sont des tumorigenèses ainsi que d’autres effets systémiques, principalement des dommages aux reins et au foie, et ce, par toutes les voies d’exposition (orale, cutanée et inhalation). L'ensemble des données indique que le 1,4-dioxane n'est pas une substance mutagène et qu'elle présentait, dans certains essais, une faible clastogénicité à des niveaux d'exposition élevés, et non dans d'autres essais souvent associés à la cytotoxicité. Compte tenu des données toxicologiques, toxicocinétiques et toxicodynamiques disponibles, une approche fondée sur le seuil d'innocuité a été utilisée pour évaluer le risque pour la santé humaine. Une dose sans effet nocif observé pour les effets nocifs chroniques, ainsi qu'une concentration à laquelle aucune tumeur n’a été observée, a été établie chez des rats exposés au 1,4-dioxane dans l'eau potable sur une période de deux ans.
Les marges entre les limites supérieures estimatives de l’exposition dans les milieux naturels et l'utilisation de produits de consommation, à la lumière de la fréquence et du profil d'utilisation de la substance, des expositions mises en commun ainsi que des concentrations associées aux effets chez les animaux de laboratoire, sont considérées comme suffisamment protectrices pour tenir compte des données manquantes et des incertitudes inhérentes à l'évaluation des risques pour la santé humaine.
Compte tenu de la pertinence des marges d’exposition entre les estimations prudentes de l’exposition au 1,4-dioxane et des niveaux d’effet critique chez les animaux de laboratoire, il est conclu que le 1,4-dioxane est considéré comme une substance ne pénétrant pas dans l’environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un danger pour la vie ou la santé humaine.
D’après les valeurs empiriques disponibles, le 1,4-dioxane devrait se dégrader seulement dans l’air, et non dans l’eau, le sol ou les sédiments. Il ne devrait pas exister de risque de bioaccumulation dans l'environnement. Cette substance répond donc aux critères de la persistance, mais non à ceux de la bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation. En outre, les données empiriques de la toxicité en milieu aquatique indiquent que la substance représente un faible danger pour les organismes aquatiques. Selon une comparaison de la concentration estimée sans effet et de la concentration estimée raisonnable de la pire exposition dans l’environnement dans l’eau de surface du Canada, il est conclu que le 1,4-dioxane ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou encore à mettre en danger l’environnement essentiel pour la vie.
Compte tenu des renseignements disponibles, il est conclu que le 1,4-dioxane ne répond pas aux critères de l’article 64 de la LCPE(1999).
Cette substance sera considérée pour inclusion dans la prochaine initiative de mise à jour de l'inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
La Loi canadienne sur la protection de l'environnement, 1999 [LCPE(1999)] exige que les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l'on croit être commercialisées au Canada ou;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada(Canada, 2006) qui exigeait à l'industrie et aux autres intervenants de fournir, dans des délais précis, des renseignements spécifiques qui pourraient servir à étayer l'évaluation des risques, à élaborer et à préciser des bonnes pratiques de gestion des risques et de l'intendance des substances jugées hautement prioritaires.
Une priorité élevée a été donnée à l'évaluation du risque que comporte le 1,4-dioxane pour la santé humaine étant donné le risque d'exposition des Canadiens, qui a été jugé le PFRE, et la classification de la substance par d'autres organismes en ce qui a trait à la cancérogénicité. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canadale 30 août 2008 (Canada, 2008). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle reposait sa catégorisation. Des renseignements sur la substance ont été communiqués en réponse au Défi.
Même s’il a été jugé hautement prioritaire d’évaluer les risques que présente le 1,4-dioxane pour la santé humaine et que cette substance répond aux critères écologiques de la catégorisation pour la persistance, la substance ne répondait pas aux critères relatifs au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est centrée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées aux termes de la LCEP (1999) mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de l’article 64 de la Loi. Les évaluations préalables visent à étudier les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
L’évaluation préalable finale prend en considération les renseignements sur les propriétés des substances, les dangers, les utilisations et l’exposition, y compris ceux fournis dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable de cette substance sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu’en avril 2009 (exposition et écologie) et jusqu’en février 2009 (effets sur la santé). Au cours de la période de commentaires publics relatifs l’évaluation préalable finale, une étude sur l’exposition par inhalation de deux ans a été déterminée et incluse dans l’ensemble des données toxicologiques. Il est possible que les résultats de modélisation aient servi à formuler des conclusions.
L'évaluation des risques pour la santé humaine comprend l'examen de données pertinentes pour l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble ainsi que de l'information sur les dangers pour la santé (surtout fondée sur des évaluations réalisées par d'autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur l'écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, cela dans le contexte d'une évaluation préalable. L’évaluation préalable finale ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion proposée.
La présente évaluation préalable finale a été préparée par le personnel du Programme des substances existantes d’Environnement Canada et de Santé Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l’écologie ont fait l’objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment Michael Jayjock (The Lifeline Group), Glenn Talaska (University of Cincinnati) et Chris Bevan (CJB Consulting LLC). Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable des risques.
Les principales données et considérations sur lesquelles repose la présente évaluation finale sont résumées ci-après.
Aux fins du présent document, la substance est appelée 1,4-dioxane. Le tableau 1 présente un résumé de l'identité de la substance.
Tableau 1 . Identité de la substance 1,4-dioxane
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 123-91-1 |
| Nom dans la LIS | 1,4-Dioxane |
| Noms relevés dans les National Chemical Inventories (NCI) | Dioxyde de diéthylène-1,4 (ECL, PICCS) Ether de diéthylène (PICCS) Oxyde de diéthylène (PICCS) 1,4-dioxane (anglais et français) (AICS, ASIA-PAC, LIS, EINECS, ENCS, NZIoC, PICCS, SWISS, TSCA) Dioxane (PICCS) Dioxane, para- (PICCS) p-dioxane (PICCS) |
| Autres noms | Dioxyde de diéthylène; oxyde de diéthylène-1,4; 1,4dioxacyclohexane; 1,4dioxane; dioxane; p-dioxane; 1,4-dioxane; dioxyéthylène ether de dioxane; 1,4-dioxine, tétrahydro-; NE 220; NSC 8728; UN 1165; UN 1165 (DOT) |
| Groupe chimique (Groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Produits chimiques organiques hétérocycliques |
| Principale sous-classe chimique | Composés organiques hétérocycliques (oxygène) |
| Formule chimique | C4H8O2 |
| Structure chimique | 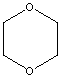 |
| SMILES1 | C1OCCOC1 |
| Masse moléculaire | 88,11 g/mol |
| Abréviations : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique); N° CAS, Numéro de registre du Chemical Abstracts Service; LIS, liste intérieure des substances; ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); NCI (National Chemical Inventories); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); SMILES, simplified molecular input line entry specification; SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse) et TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). Source : NCI, 2006 1Simplified Molecular Input Line Entry Specification |
|
Le tableau 2 présente les données physiques et chimiques du 1,4-dioxane qui se rapportent à son devenir dans l'environnement.
Tableau 2. Propriétés physiques et chimiques du 1,4-dioxane
| Propriété | Type | Valeur1 | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Koe, cœfficient de partage octanol-eau; pKa, constante de dissociation acide 1 Les valeurs indiquées entre parenthèses représentent les valeurs initiales signalées par les auteurs. |
||||
| Point de fusion (°C) | Expérimental | 11,8 | O'Neil et al., 2001 | |
| Point d'ébullition (°C) | Expérimental | 101,5 | PhysProp, 2006 | |
| 101,1 | O'Neil et al., 2001 | |||
| Masse volumique (kg/m3) | Expérimental | 1 032,9 (1,0329 g/cm3) |
4 | O'Neil et al., 2001 |
| Pression de vapeur (Pa) | Expérimental | 5 080 (38,1 mmHg) |
25 | Daubert et Danner, 1989 |
| 4 000 (30 mmHg) |
Verschueren, 1983 | |||
| Constante de la loi de Henry (Pa·m3/mol) | Expérimental | 0,49 (4,80 × 10-6 atm·m3/mol) |
25 | Glozier et al., 1987 |
| Log Koe (sans dimension) |
Expérimental | -0,27 | Hansch et al., 1995 | |
| -0,42 | Verschueren, 1983 | |||
| Solubilité dans l'eau (mg/L) |
Expérimental | 1 000 000 (miscible) |
20 | Fent et al., 1986 |
| Solubilité dans d'autres solvants (g/L) |
Expérimental | miscible avec la plupart des solvants organiques | O'Neil et al., 2001 | |
| pKa | Expérimental | -2,92 | 25 | Perrin, 1965 |
Aucune source naturelle du 1,4-dioxane n'a été décelée. Cependant, dans le cas des aliments, peu de données suggèrent que le 1,4-dioxane est un constituant naturel de la fraction volatile produite en faibles concentrations dans certains aliments (Chung et al., 1983; Hartung, 1989). Bien que ces études démontrent sa présence, nous ignorons si cette occurrence est due à la production naturelle ou à une contamination car le 1,4-dioxane est une impureté contenue dans les additifs alimentaires et pesticides éthoxylés et peut se trouver dans divers milieux naturels (NICNAS 1998, communication personnelle de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada en 2009; source non citée; communication personnelle adressée en 2009 par la Direction des aliments de Santé Canada; source non citée).
Des émissions anthropogéniques du 1,4-dioxane peuvent se réaliser lors de sa production ou de sa transformation. Comme autre source principale au Canada, le 1,4-dioxane est formé non intentionnellement comme sous-produit de l'éthoxylation où l'oxyde d'éthylène (OEt) ou l'éthylèneglycol est condensé, lors de la création de polymères éthoxylés utilisés dans diverses applications industrielles et applications de consommation (Figure 1) (Robinson et Ciurczak, 1980; NICNAS, 1998; Black et al., 2001). En dépit de l'extraction sous vide, des traces du 1,4-dioxane sont toujours présentes (Robinson et Ciurczak, 1980).
Figure 1. Mécanisme général de formation du 1,4-dioxane par éthoxylation (Robinson et Ciurczak, 1980). [OEt = oxyde d'éthylène; EFA = acide gras éthoxylé; 1,4-D = 1,4-dioxane]
D'après les renseignements soumis en vertu de l'article 71 de la LCPE (1999), entre 10 000 et 100 000 kg du 1,4-dioxane ont été fabriqués au Canada en 2006. En outre, entre 10 000 et 100 000 kg ont été importés au cours de la même année. Des entreprises canadiennes ont également déclaré avoir utilisé entre 10 000 et 100 000 kg du 1,4dioxane en 2006 (Environnement Canada, 2008).
Du point de vue historique, le 1,4-dioxane a été utilisé principalement comme stabilisant pour le 1,1,1-trichloroéthane. Cette fonction a été éliminée graduellement en raison de mesures de contrôle de l'utilisation du 1,1,1-trichloréthane imposées en vertu du Protocole de Montréal (Canada, 1998). À présent, le 1,4-dioxane est très utilisé comme solvant dans la fabrication de produits pharmaceutiques, la recherche et le développement ainsi que comme réactif analytique dans les laboratoires (Environnement Canada, 2009a). Le 1,4-dioxane est utilisé comme solvant de support dans la fabrication de produits pharmaceutiques, de médicaments vétérinaires et de produits de santé naturels. Dans les produits pharmaceutiques, il est classé comme solvant résiduel de catégorie 2 avec une concentration maximale de 380 mg/kg si l’exposition quotidienne maximale du produit contenant du 1,4-dioxane ne dépasse pas 10 g; pour les produits administrés en doses supérieures à 10 g/jour, l’exposition quotidienne permise ne doit pas dépasser 3,8 mg/jour. Une limite de concentration identique et une exposition quotidienne permise ont été définies pour le 1,4-dioxane résiduel contenu dans les produits de santé naturels et les produits pour animaux (communication personnelle de la Direction des produits de santé naturels de Santé Canada en 2009; source non citée; communication personnelle adressée en 2009 par la Direction des produits thérapeutiques de Santé Canada; source non citée). En outre, le 1,4-dioxane est une composante d'agents chimiques industriels utilisés comme inhibiteurs de corrosion, antioxydants et dégraisseurs d'équipement lourd (Environnement Canada, 2008).
Comme il a déjà été mentionné, le 1,4-dioxane résiduel est formé lors de la production de substances éthoxylées utilisées dans diverses applications, notamment les produits cosmétiques, l'emballage d'aliments, des produits agricoles et des processus industriels (EURAR, 2002). Au Canada, les substances éthoxylées contenant du 1,4dioxane comme sous-produit sont produites et utilisées comme surfactants, agents émulsifiants, agents mouillants et agents de gonflement dans de nombreuses industries (Environnement Canada, 2009a). Le 1,4-dioxane se trouve également comme impureté dans un formulant dans 168 pesticides ayant des utilisations alimentaires et non alimentaires (communication personnelle, Agence de réglementation de la lutte antiparasitaire, Santé Canada, 2009, source non citée). Par ailleurs, le 1,4-dioxane se trouve à l’état d’impureté dans les solvants utilisés dans la préparation d’ingrédients et d’auxiliaires technologiques employés dans la fabrication des matériaux d’emballage alimentaire tels que le papier et les films rétrécissables, même si l’exposition au 1,4-dioxane issue de ces matériaux a été jugée minime (communication personnelle adressée en 2009 par la Direction des aliments de Santé Canada; source non citée). Le 1,4-dioxane peut également se trouver à l’état d’impureté dans les additifs alimentaires polysorbate 80, polysorbate 65, polysorbate 60 et polyéthylène glycol, à une limite résiduelle maximale de 10 mg/kg conformément aux spécifications de ces produits chimiques indiquées dans le Food Chemicals Codex (FCC, 6e éd., 2008) (communication personnelle adressée en 2009 par la Direction des aliments de Santé Canada; source non citée). Les additifs alimentaires cités ci-dessus dans lesquels pourrait se trouver du 1,4-dioxane à l’état d’impureté, peuvent uniquement se trouver dans les aliments pour lesquels une disposition existe relative à l’utilisation de ces additifs conformément au Règlement sur les aliments et drogues(communication personnelle adressée en 2009 par la Direction des aliments de Santé Canada; source non citée).
À présent, le 1,4-dioxane est présent sur la « Liste critique » des ingrédients des cosmétiques de Santé Canada qui interdit son utilisation intentionnelle comme ingrédient dans les produits cosmétiques. Il peut, toutefois, se retrouver comme impureté de fabrication (Santé Canada, 2007).
Les renseignements déclarés en vertu de l'article 71 de la LCPE (1999) indiquent qu'en 2006, de 10 000 kg à 100 000 kg de 1,4dioxane ont été rejetés dans l'environnement. La majorité des rejets ont été observés dans l'eau et l'air, et une fraction minime a été observée dans le sol (Environnement Canada, 2008). En 2006, les quantités de 1,4dioxane rejetées dans l'air et l'eau variaient de 10 000 à 100 000 kg. Au cours de cette même année, les rejets relevés dans l'Inventaire national des rejets polluants (INRP) indiquent que 13 800 kg de 1,4dioxane ont été rejetés dans l'air et 6 500 kg dans l'eau. Par contre, les rejets dans le sol n'ont pas été révélés (INRP, 2006).
En 2006, le Toxics Release Inventory Program (TRI) des États-Unis (TRI) a déclaré des rejets dans l'air de 56 tonnes et dans l'eau de 22 tonnes, alors que 64 tonnes auraient été rejetés dans le sol par injection (TRI, 2006). Les grandes quantités de rejets sont probablement dues à la croissance d'utilisation du 1,4dioxane aux États-Unis comparativement au Canada.
En plus des rejets dans l'environnement, les renseignements soumis en vertu de l'article 71 de la LCPE (1999) indiquent qu'entre 100 et 1000 kg de 1,4dioxane ont été transférés à des installations de traitement de déchets dangereux, tandis que moins de 100 kg ont été transférés à des installations de déchets inoffensifs (Environnement Canada, 2008).
D’après les propriétés physiques et chimiques du 1,4-dioxane (tableau 2), cette substance se caractérise par une hydrosolubilité élevée (1 000 000 mg/L), une pression de vapeur élevée (5 080 Pa), un faible log Koe(-0,42 à -0,27) et une constante de la loi de Henry moyenne (0,49 Pa·m3/mol). Les résultats de la modélisation de la fugacité de niveau III (tableau 3) suggèrent que les fractions massiques importantes de la substance dépendent du milieu du rejet et que la répartition du 1,4dioxane dans l'eau peut être considérable, tandis que la répartition de la substance dans les sédiments est négligeable.
Tableau 3. Résultats de la modélisation de la fugacité de niveau III (EQC, 2003) pour le 1,4dioxane
| Substance rejetée dans : | Fraction de la substance se répartissant dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| Air (100 %) | 44,8 | 34,4 | 20,8 | 0,1 |
| Eau (100 %) | 0,1 | 99,6 | 0,1 | 0,2 |
| Sol (100 %) | 0,4 | 40,4 | 59,2 | 0,1 |
Persistance dans l'environnement
Le tableau 4a présente des données empiriques tirées d’un essai de biodégradation immédiate qui indique une biodégradation de 0 % du 1,4-dioxane sur une période de 14 jours (Ministry of International Trade and Industry [MITI], 1992). Cette étude a signalé une valeur négative pour la biodégradation, indiquant donc que la substance pourrait être perdue au cours du test. Ainsi, la fiabilité des données rapportées est faible. D’après EURAR (2002), une étude antérieure menée par BUA (1991) a aussi révélé une absence de biodégradation dans les deux conditions d’essai standard (Organisation de coopération et de développement économiques) et non standard. Ce résultat est appuyé par les experts en assainissement des lieux contaminés qui signalent une biodégradation limitée du 1,4-dioxane (Steffan, 2007).
La substance ne contient pas de groupements fonctionnels pouvant subir une hydrolyse ou une photolyse directe dans les milieux aquatiques. Elle est également résistante à la biodégradation dans l’eau à condition ambiante (CCME, 2008).
Le tableau 4a présente également une donnée empirique indiquant une demi-vie atmosphérique inférieure à un jour par photooxydation avec des radicaux hydroxyles (OH-), considérés comme le mécanisme de perte principal dans l’air (Atkinson, 1989).
Tableau 4a. Données empiriques sur la dégradation du 1,4-dioxane
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre et unités de la dégradation | Référence |
|---|---|---|---|---|
| Eau | Biodégradation | 0 | Biodégradation immédiate en 14 jours/% | MITI, 1992 |
| Air | Oxydation atmosphérique | 0,981 | Demi-vie/jours | Atkinson, 1989 |
Bien que les données expérimentales sur la dégradation du 1,4-dioxane soient limitées, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) (Environnement Canada, 2007) a aussi été utilisée avec les modèles de biodégradation présentés au tableau 4b. Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et qu'on estime que le 1,4dioxane est libéré dans ce milieu, la biodégradation dans l'eau a fait l'objet principal de cette étude.
Tableau 4b. Données modélisées sur la dégradation du 1,4-dioxane
| Processus du devenir | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade & Industry, Japon; t½, demi-vie 1 Le résultat est numérique. 2 Le résultat est une probabilité. |
|||
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2000 | t½ = 0,38 jour | <2 |
| Eau | |||
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 3 : enquête d'expert (biodégradation ultime) | 2,991 « se biodégrade rapidement » | <182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 4 : enquête d'expert (biodégradation primaire) | 3,701 « se biodégrade rapidement » | <182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 5 : MITI, probabilité linéaire | 0,532 Se biodégrade rapidement | <182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 6 : MITI, probabilité non linéaire | 0,672 « se biodégrade très rapidement » | <182 |
| Biodégradation (aérobie) | TOPKAT, 2004 probabilité | 0,02 « se biodégrade très lentement » | >182 |
| Biodégradation (aérobie) | CATABOL ©2004-2008 % DBO | % DBO = 9,5 « se biodégrade très lentement » | >182 |
Dans l'air, la demi-vie prévue par oxydation atmosphérique de 0,38 jour (voir le tableau 4a) indique que cette substance devrait s'oxyder rapidement. Le composé peut aussi être assujetti à la photolyse et réagir avec d'autres espèces photooxydantes dans l'atmosphère comme l'ozone (EURAR, 2002). Les données empiriques indiquant une demi-vie de 0,98 jour et une demi-vie estimée de 0,38 jour résultant de réactions avec des radicaux hydroxyles permettent d'affirmer que le 1,4-dioxane est non persistant dans l'air.
Dans l’eau, les données modélisées permettent d’aboutir à diverses conclusions. Les données modélisées du temps et de la probabilité de biodégradation obtenues par BIOWIN (voir le tableau 4b) permettent de conclure que la substance a une demi-vie inférieure à 182 jours. Toutefois, les données modélisées de TOPKAT et CATABOL indiquent une demi-vie dans l’eau d’au moins 182 jours (tableau 4b). Pour tirer les conclusions relatives à la persistance, un poids plus important a été donné aux données empiriques (tableau 4a; EURAR, 2002; Staffen, 2007; CCEM, 2008) indiquant que d’après les prévisions de TOPKAT et CATABOL, la demi-vie du 1,4-dioxane est d’au moins 182 jours. Ainsi, il est considéré que le 1,4-dioxane est persistant dans l’eau.
Il est possible d'extrapoler la demi-vie dans le sol et les sédiments à partir de la demi-vie dans l'eau à l'aide des facteurs de Bœthling : t1/2 eau : t1/2 sol : t1/2 sédiments = 1 : 1 : 4 (Bœthling et al., 1995). Donc, comme la donnée empirique cidessus indique une demi-vie dans l'eau d'au moins 182 jours et un facteur d'extrapolation applicable de 1, la demi-vie de la substance dans le sol devrait également être d'au moins 182 jours. Ainsi estimée, la demi-vie dans les sédiments devrait être quatre fois plus élevée (c.àd. = 728 jours). On peut donc conclure que le 1,4-dioxane est persistant dans le sol et les sédiments.
De ce fait, les données empiriques et les prévisions modélisées montrent que le 1,4-dioxane répond aux critères de la persistance dans l’eau, le sol et les sédiments (demi-vie dans le sol et l’eau = 182 jours et demi-vie dans les sédiments = 365 jours), mais il n’est pas considéré comme étant persistant dans l’air (demi-vie = 2 jours), selon le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
De plus, le potentiel de transport à grande distance (PTGD) du 1,4-dioxane à partir de son point de rejet dans l'air est estimé faible. Le modèle TaPL3 (2000) a été utilisé pour estimer la distance de transport caractéristique (définie comme la distance maximale parcourue par 63 % de la substance) de 95 km pour le 1,4-dioxane. Beyer et al., (2000) ont proposé de considérer le PTGD comme étant élevé si la distance de transport caractéristique est supérieure à 2 000 km, moyen si elle est de 700 à 2 000 km et faible si elle est inférieure à 700 km. Selon l’estimation du modèle, le 1,4-dioxane devrait surtout avoir un faible potentiel de transport à grande distance et se retrouver à proximité de ses sources d’émission.
Potentiel de bioaccumulation
Les valeurs expérimentales du log Koe du 1,4-dioxane semblent indiquer que cette substance chimique n’est pas bioaccumulable dans les organismes (tableau 2 ci-dessus). Le facteur de bioconcentration (FBC) chez le poisson serait compris dans la plage de 0,2 à 0,7 L/kg poids humide (MITI, 1992).
Comme il existe peu de données expérimentales sur la bioaccumulation du 1,4-dioxane, une méthode du poids de la preuve reposant sur des relations quantitatives structureactivité (RQSA) a également été utilisée avec les modèles du facteur de bioaccumulation (FBA) et du facteur de bioconcentration (FBC) indiqués au tableau 5.
Tableau 5. Données modélisées sur la bioaccumulation du 1,4dioxane
| Organisme d'essai | Paramètre ultime | Valeur en poids humide (L/kg) | Références |
|---|---|---|---|
| Poissons | FBA | 0,96 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBA) |
| Poissons | FBC | 0,97 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBC) |
| Poissons | FBC | 10,4 | OASIS Forecast, 2005 |
| Poissons | FBC | 3,2 | BCFWIN, 2000 |
Le modèle modifié du facteur de bioaccumulation de Gobas pour le niveau trophique intermédiaire chez le poisson a estimé un facteur de bioaccumulation à 0,96 L/kg, ce qui indique que le 1,4-dioxane ne présente aucun potentiel de bioconcentration ou de bioamplification dans l’environnement. Les valeurs du FBCcalculées à l’aide de modèles (tableau 5) confirment, aux fins de l’établissement du poids de la preuve, le faible potentiel de bioconcentration de cette substance.
D’après les valeurs modélisées et empiriques disponibles, le 1,4-dioxane ne répond pas aux critères de la bioaccumulation (FBA ou FBC = 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La démarche suivie dans cette évaluation écologique préalable consistait à examiner les renseignements scientifiques disponibles et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence exigé en vertu de la LCPE(1999). Les éléments de preuve pris en compte comprennent les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Il existe des preuves modélisées et expérimentales confirmant que le 1,4dioxane ne nuit pas aux organismes aquatiques à de faibles concentrations (tableaux 6a et 6b).
Tableau 6a. Données empiriques sur la toxicité aquatique du 1,4-dioxane
| Organisme d'essai | Type d'essai | Paramètre ultime | Valeur (mg/L) | Références |
|---|---|---|---|---|
| Abréviations : CE50, concentration d’une substance qu’on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d’essai; CL50, concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai; CMEO, concentration minimale d’une substance ayant un effet nocif sur les organismes d’essai; CMAT, concentration maximale d’une substance n’exerçant aucun effet nocif sur les organismes d’essai; CSEO, concentration la plus élevée ne causant pas d’effet statistiquement significatif par rapport aux témoins dans un essai de toxicité. 1 Résultat anormal (sujet à caution). Voir l'explication dans le texte. 2 Valeur critique de toxicité (VCT). |
||||
| Poisson (Pimephales promelas) | Toxicité aiguë (96 heures) | CL50 | 9 850 | Geiger et al., 1990 |
| Daphnia magna | Toxicité aiguë (24 heures) | CE50 | 4 700 | Bringmann et Kühn, 1977 |
| Ceriododaphnia dubia | Toxicité aiguë (48 heures) | CE50 | 1631 | TSCATS, 1989 |
| Ceriodaphnia dubia | Toxicité chronique (7 jours) | CSEO | 625 | Springborn Laboratories Inc., 1989 |
| Orchestie (Gammarus pseudolimnaeus) | Toxicité aiguë (96 heures) | CL50 | 2 274 | Brooke, 1987 |
| Algue (Microcystis aeruginosa) | Toxicité chronique (8 jours) | CE50 | 575 | Bringmann et Kühn, 1976 |
| Tête-de-boule (Pimephales promelas) | Chronique (32 jours) | CMAT | 145 | BUA, 1991 |
| Medaka (Oryzias latipes) | Chronique (28 jours) | CMEO | 6 933 | Johnson et al., 1993 |
| Ceriodaphnia dubia | Chronique (7 jours) | CSEO CMEO | 635 1 250 | Dow, 1995 |
Tableau 6b. Données modélisées sur la toxicité aquatique du 1,4-dioxane
| Organisme d'essai | Type d'essai | Paramètre ultime | Valeur (mg/L) | Références |
|---|---|---|---|---|
| Abréviations : CE50, concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50, concentration létale pour 50 % des organismes d'essai. | ||||
| Poissons | Toxicité aiguë (96 heures) | CL50 | 5 300 | TOPKAT, 2004 |
| 6 750 | ECOSAR, 2004 | |||
| 14 371 | ASTER, 1999 | |||
| 1 397 | AIES, 2003-2005 | |||
| Poissons | Toxicité aiguë (14 jours) | CL50 | 6 580 | ECOSAR, 2004 |
| Daphnie | Toxicité aiguë (48 heures) | CE50 | 2 721 | ECOSAR, 2004 |
| 35,4 | TOPKAT, 2004 | |||
| Algue | Toxicité aiguë (96 heures) | CE50 | 482 | ECOSAR, 2004 |
Un ensemble plus complet des données sur la toxicité aquatique est disponible dans l’International Uniform Chemical Information Database (IUCLID) (BESC, 2000) et l’évaluation des risques réalisée par l’Union européenne (EURAR, 2002). Ces données se situent dans la même plage que celles présentées au tableau 6a. La base de données AQUIRE (ECOTOX, 2006) fait état de valeurs médianes pour la toxicité aquatique aiguë allant de 2 274 à 12 326 mg/L.
La valeur expérimentale la plus faible de la toxicité aquatique est de 163 mg/L, selon une concentration efficace moyenne (CE50) sur 48 heures pour le Ceriodaphnia dubia (TSCATS, 1989). Cette valeur peut toutefois être mise en question étant donné les autres niveaux de toxicité déclarés et le fait qu'il a été impossible d'obtenir un exemplaire de l'étude initiale et d'en évaluer la qualité. Lorsque le Ceriodaphnia dubia a été soumis à un essai statique à long terme, la concentration sans effet observé (CSEO) chronique signalée était beaucoup plus élevée (~630 mg/L). (Springborn Laboratories, 1989; DOW, 1995). Ainsi, comme dans l’évaluation de l’Union européenne (EURAR, 2002), ce résultat n’a pas été utilisé comme mesure des effets pour la caractérisation des risques. La deuxième valeur de la toxicité la plus faible (575 mg/L dans le tableau 6a) a été sélectionnée comme valeur de la toxicité critique (VTC), indiquant ainsi le potentiel pour les effets écologiques sur les espèces sensibles.
Le tableau 6b présente les prévisions d'écotoxicité qui ont été jugées fiables et qui ont été utilisées avec la méthode du poids de la preuve reposant sur des RQSA pour la toxicité aquatique (Environnement Canada, 2007).
La gamme de données empiriques sur la toxicité ainsi que les prévisions de la toxicité aquatique obtenues à l’aide des modèles RQSA indiquent que la substance n’est pas très dangereuse pour les organismes aquatiques (CL50 ou CE50 aiguë > 1,0 mg/L).
On a déterminé une valeur prudente de la concentration estimée sans effet (CESE) à partir de la valeur de la toxicité critique relevée dans les données empiriques. En appliquant, aux fins de l’évaluation, un facteur de 10 à la plus faible valeur empirique à effet chronique, soit 575 mg/L, cela pour tenir compte des variations interspécifiques et intraspécifiques en matière de sensibilité, et pour extrapoler un critère d’effet aigu obtenu en laboratoire à une valeur d’effet chronique obtenue sur le terrain, on obtient une valeur prudente pour la CESE de 57,5 mg/L.
D'après les renseignements de l'enquête menée conformément à l'article 71 de la LCPE (1999), la majorité des rejets du 1,4dioxane se retrouvent dans l'eau et l'air. Si elle est rejetée dans l'eau, la substance devrait demeurer dans l'eau principalement (tableau 3). Le 1,4dioxane n'a pas été décelé dans l'eau de surface dans les régions à l'Est du Canada (CCME, 2008). Pour les besoins de la présente évaluation écologique, deux scénarios prudents d’exposition dans l’eau ont été créés pour estimer les rejets dans l’environnement aquatique provenant d’activités industrielles et de l’utilisation par les consommateurs, ainsi que les concentrations résultantes dans l’eau.
Le scénario est basé sur la plus grande quantité totale fabriquée à une seule usine, supposant qu’une fraction prudente a été rejetée dans l’eau (5 %), qu’aucune quantité n’a été transférée à une usine de traitement des eaux usées et qu’un cours d’eau relativement petit a été contaminé. La concentration environnementale estimée (CEE) est de 0,39 mg/L pour ce scénario prudent créé au moyen de l’outil d’exposition générique industriel – Milieu aquatique d’Environnement Canada. Le quotient de risque (concentration environnementale estimée/concentration estimée sans effet) qui en résulte est 0,007, ce qui révèle l’improbabilité que le 1,4-dioxane cause des dommages écologiques au Canada (Environnement Canada, 2009a).
Comme on trouve du 1,4-dioxane dans les produits de consommation, Mega Flush, outil d’Environnement Canada, a été utilisé pour estimer les rejets à l’égout issus des produits de consommation. Mega Flush estime la concentration environnementale estimée maximale à 0,004 mg/L et le quotient de risque (concentration environnementale estimée/concentration estimée sans effet) qui en résulte à 0,0008, ce qui révèle l’improbabilité que le 1,4-dioxane cause des dommages écologiques au Canada (Environnement Canada, 2009b).
Même si aucune étude convenable n'a été retrouvée sur les effets écologiques de ce composé dans des milieux autres que l'eau, il est peu probable que l'exposition au 1,4dioxane rejeté dans l'air (l'autre milieu principal où il serait rejeté) ait des effets en raison de sa faible toxicité aquatique et de sa courte demivie dans l'air.
Il est à noter que cette conclusion a été tirée malgré les hypothèses prudentes prononcées en réaction aux incertitudes soulignées dans le cadre de l'évaluation. Un certain degré d’incertitude est associé au fait que le 1,4-dioxane n’a pas été décelé dans l’environnement aquatique au Canada, et qu’un modèle d’exposition a été employé pour prévoir une concentration de cette substance dans l’eau dans le pire des cas. En outre, un certain degré d’incertitude est associé à l’utilisation de la valeur de toxicité critique et de la concentration estimée sans effet dans le calcul du quotient de risque. La valeur critique de la toxicité chronique a été divisée par un facteur d'évaluation de 10.
Évaluation de l'exposition
Milieu environnemental
Les limites supérieures estimées de l'absorption quotidienne de 1,4dioxane dans l'air ambiant, l'air intérieur, le sol et l'eau potable ont été calculées. Ces limites sont résumées pour tous les groupes d'âge à l'annexe 1. La plage des limites supérieures totales estimées varie de 0,19 µg/kg-p.c. (kg-p.c.) par jour pour les enfants allaités de moins de six mois à 1,26 µg/kg-p.c. par jour pour les enfants nourris de lait maternisé de moins de six mois. Les enfants allaités et les enfants nourris de lait maternisé ont été exposés au 1,4-dioxane notamment par l’absorption d’air et d’eau potable (le 1,4-dioxane n’a pas été décelé dans le lait maternel et le lait maternisé). L'eau potable représentait la contribution prédominante au total de l'absorption quotidienne estimative pour tous les groupes d'âge, suivie de l'air intérieur.
Plusieurs études menées aux États-Unis et au Canada révèlent des concentrations décelables du 1,4dioxane dans l'air ambiant (maximum de 0,646 µg/m3) et dans l'air intérieur (maximum de 0,85 µg/m3) respectivement à partir de toutes les données recueillies (Harkov, 1984; Brown et al., 1994; Fellin et Otson, 1997; Singhvi, 1999). Les données canadiennes ont été utilisées pour estimer l'absorption des deux sources d'air : 0,646 µg/m3 (air ambiant) et 0,685 µg/m3 (air intérieur) (Fellin et Otson, 1997). Les études du sol sont limitées; les données sont issues de seulement quelques études menées au Japon et au Canada (Golder Associates, 1987; gouvernement du Japon, 2004). Le 1,4dioxane n'a pas été décelé dans les sols au Canada, la limite de détection étant de 100 µg/kg pour l'exposition estimée (Golder Associates, 1987).
Plusieurs études menées au Japon révèlent des concentrations décelables du 1,4dioxane (maximum de 16 µg/L) dans l'eau de surface (Abe, 1999; Kawata et al., 2003; Simazaki et al., 2006). Cependant, le 1,4-dioxane n'a pas été décelé dans l'eau de surface dans les régions à l'Est du Canada (CCME, 2008). Des données canadiennes sur l'eau potable ont été utilisées pour estimer l'absorption. Otson (1987) a démontré que le 1,4dioxane n'a pas été décelé dans 42 échantillons bruts et 42 échantillons traités provenant d'une usine municipale de traitement des eaux usées dans la région des Grands Lacs. Dans ce cas, la limite de détection de 10 µg/L a été utilisée pour estimer l'exposition.
Même si aucune étude sur la présence du 1,4dioxane dans les aliments au Canada n'a été retrouvée, les données du Japon suggèrent que le 1,4dioxane était présent dans plusieurs groupes alimentaires (Nishimura et al., 2004). Cependant, après une consultation avec la Direction des aliments de Santé Canada, une deuxième analyse des concentrations publiées a indiqué que les concentrations observées étaient toutes inférieures à la limite de détection de 2 µg/kg citée dans l'étude (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). Dans le cadre d’une étude subséquente, le même groupe de recherche a mis à l’essai des repas complets et a décelé le 1,4-dioxane dans 1 de 27 échantillons (Nishimura et al., 2005). En considérant le fait que les absorptions alimentaires varient entre le Japon et le Canada, les différences éventuelles dans les concentrations du 1,4-dioxane dans l’eau (servant à la préparation et à la cuisson) entre le Canada et le Japon, les différences d’utilisation d’additifs alimentaires entre les deux pays au moment où ces études japonaises ont été menées et les limites des deux études déjà mentionnées, les données alimentaires tirées de ces études n’ont pas été incluses dans les estimations de l’absorption quotidienne des milieux environnementaux (annexe 1).
Une étude a examiné la présence probable du 1,4-dioxane dans le lait maternel (à l’aide d’un modèle pharmacocinétique à base physiologique (PBPK)), notamment sur des femmes ayant un potentiel d’exposition à cette substance en milieu de travail (Fisher et al., 1997). Dans cette étude, un coefficient de partage lait/sang de 0,89 a été observé; indiquant qu’une quantité plus importantede 1,4-dioxane devrait être présente dans le sang que dans le lait. Une étude du Center for Disease Control and Prevention (CDC) a examiné les échantillons de sang de plus de 2 000 personnes tirés d’une étude de surveillance biologique américaine du NHANES (2008-2008) et indiqué que le 1,4-dioxane n’était décelé dans aucun des échantillons de sang prélevés (Blount et al., 2008). Ainsi, selon le modèle PBPK une quantité encore plus faible est envisagée dans le lait. Ceci est vérifé par les propriétés physiques et chimiques du 1,4 Dioxane. En général, les produits chimiques lipophiles sont préférablement assimilés dans le lait maternel en raison de leurs teneurs supérieures en graisse. Toutefois, le 1,4-dioxane est très hydrophile (log Koe : de -0,27 à -0,42), En conséquence, l’exposition au 1,4-dioxane à partir du lait maternel n’est pas prévu.
Le 1,4-dioxane peut se trouver à l’état d’impureté dans les additifs alimentaires, tels que les polysorbates 80, 65 et 60 et le polyéthylène glycol. Ainsi, des quantités infimes de 1,4-dioxane peuvent être transportées dans les aliments pouvant contenir ces additifs ou dans l’utilisation de préparations pouvant contenir ces additifs (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). Les estimations de l’absorption quotidienne de 1,4-dioxane comme impuretés dans les additifs alimentaires permis (polysorbates 80, 65 et 60 et le polyéthylène glycol) ont été calculées en fonction de la limite maximale de résidus de 10 mg/kg du 1,4-dioxane dans les additifs, selon le Food Chemicals Codex (FCC, 6e éd., 2008) et de la concentration maximale d’utilisation pour les aliments où les additifs sont permis, d’après les tableaux IV et VIII du Règlement sur les aliments et drogues (voir l’annexe 2). Ces estimations sont considérées comme étant très prudentes; on présumait que les additifs alimentaires (polysorbates et polyéthylène glycol) et les résidus du 1,4-dioxane étaient présents à leurs concentrations maximales permises dans les aliments (Règlement sur les aliments et drogues) et les concentrations de résidus dans les additifs alimentaires (Food Chemicals Codex), respectivement (Canada [1978]) (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). De plus, les concentrations résiduelles du 1,4dioxane dans les aliments devraient être faibles en raison de sa volatilité et, de ce fait, elles devraient être encore inférieures dans les aliments qui sont transformés et cuits à des températures élevées. L’annexe 2 fournit des renseignements complémentaires relatifs à la nature prudente de ces estimations. Il faudrait noter, par contre, que les estimations de l'absorption de 1,4dioxane provenant de l'utilisation d'additifs alimentaires sont inférieures au total de l'absorption des milieux environnementaux, l'estimation la plus élevée étant de 0,335 µg/kg-p.c. par jour pour les enfants de 1 à 4 ans, et si ces estimations sont ajoutées à celles de l'absorption des milieux environnementaux, elles n'exercent aucune incidence sur l'estimation la plus faible et la plus élevée d'absorption des milieux environnementaux.
Les produits de consommation
Le 1,4dioxane a été retrouvé dans divers produits de soins personnels, à différentes concentrations (tableau 7a).
Tableau 7a. Concentration du 1,4-dioxane dans divers produits de soins personnels
| Type de produit | Concentration du 1,4dioxane (mg/kg) | Références |
|---|---|---|
| * Nota – Il se peut que certains produits ne soient pas disponibles au Canada. | ||
| Shampooing pour les cheveux | non déterminé à 45,5 11,5 à 41,1 5,5 à 41 0,05 à 33 1,2 à 10 | Scalia, 1991 Fuh et al., 2005 Makino et al., 2006 Tanabe et Kawata, 2008 OCA, 2009 |
| Shampooing pour les cheveux (bébés) | 1,6 à 10 0,69 à 1,1 | OCA, 2009 CSC, 2009 |
| Revitalisant capillaire | 0,05 à 0,14 | Tanabe et Kawata, 2008 |
| Savon liquide pour les mains | 0,2 à 18 0,05 à 7,2 non déterminé à 7,5 < 5 | OCA, 2009 Tanabe et Kawata, 2008 Scalia, 1991 Makino et al., 2006 |
| Nettoyant pour le corps | 0,9 à 23 15,7 0,05 à 1,5 | OCA, 2009 Scalia, 1991 Tanabe et Kawata, 2008 |
| Nettoyant pour le corps (bébé) | 0,63 à 5,3 0,6 à 4,6 | OCA, 2009 CSC, 2009 |
| Hydratant pour la peau | non déterminé à 75 | VCCEP, 2007 |
| Lotion (bébé) | 11 | Scalia et al., 1992 |
| Enquête sur des produits multiples (1981-1997) | 2 à 279 (1981) 6 à 34 (1997) | Black et al., 2001 |
Des concentrations maximales signalées dans les produits (tableau 7a) ont été utilisées pour dériver l'exposition estimée causée par l'utilisation de produits de soins personnels (tableau 7b). En l’absence de concentrations canadiennes précises dans les produits, des données non canadiennes ont été utilisées pour estimer les expositions. Il n’existe aucune indication selon laquelle le processus d’éthoxylation (source des niveaux résiduels de 1,4-dioxane dans les produits) est différent dans les pays dans lesquels les données ont été choisies. Plusieurs produits de ces enquêtes peuvent tout aussi bien être disponibles sur le marché canadien. L'exposition a été modélisée au moyen du logiciel ConsExpo 4.1 (ConsExpo, 2006). Le Système de déclaration des cosmétiques (SDC) de Santé Canada a servi à déterminer si les types de produits autres que ceux résumés au tableau 7b contenaient des ingrédients qui pourraient contenir du 1,4dioxane comme sousproduit. Le colorant capillaire a été identifié comme type de produit contenant des sulfates d'alkyles éthoxylés. Étant donné que les concentrations mesurées du 1,4-dioxane dans le colorant capillaire ne sont pas disponibles, les mesures de 1,4dioxane dans les ingrédients cosmétiques tirées d'une récente enquête de la Food and Drug Administration (FDA) ont été utilisées pour estimer l'exposition de l'utilisation de ce type de produit. Black et al., 2001 ont signalé des concentrations de 45 à 1 102 ppm dans les sulfates d'alkyles éthoxylés, et si on multiplie cette concentration maximale du sousproduit par la valeur de composition signalée dans le Système de déclaration des cosmétiques pour le colorant capillaire, on obtient une estimation de la concentration de 1,4dioxane.
Il a été démontré que le 1,4-dioxane n'est pas absorbé facilement par la peau (3,4 % : transport de lotion pour la peau) sur l'avantbras de singes (Marzulli et al., 1981), ce qui suggère une fonction d'évaporation (NICNAS, 1998; EURAR, 2002; VCCEP, 2007). De plus, lorsqu'il est ajouté à un matériel semblable à une lotion, le 1,4-dioxane est reconnu pour s'évaporer rapidement (90 % en 15 minutes) dans des conditions de non occlusion (Bronaugh, 1982). Par conséquent, en caractérisant l'exposition, on a présumé que 90 % du 1,4dioxane est disponible pour l'inhalation, alors que 10 % est disponible pour l'exposition dermique. On a également fait une distinction entre les produits qui doivent être rincés et ceux qui ne le sont pas. Par conséquent, divers facteurs de protection de la peau ont été utilisés dans l'analyse (voir l'annexe 3).
Tableau 7b. Exposition estimée de la femme adulte1 au 1,4-dioxane à partir de produits de soins personnels
| Produit de soins personnels | Concentration (%) (témoin) | Concentration moyenne par événement – (mg/m3) | Inhalation (mg/kg-p.c. par jour) | Dermique (mg/kg-p.c. par jour) | ||||
|---|---|---|---|---|---|---|---|---|
| 1 Poids du corps estimé : 70,9 kg. 2 Absorption par inhalation à 100 % 3 Absorption cutanée de 3,4 % (Marzulli et al., 1981) |
||||||||
| Revitalisant capillaire | 0,000 014 (Tanabe et Kawata, 2008) | 1,7 × 10-5 | 6,9 × 10-9 | 7,9 × 10-8 | ||||
| Shampooing capillaire | 0,004 55 (Scalia et al., 1992) | 0,0078 | 8,0 × 10-6 | 9,1 × 10-5 | ||||
| Lotion hydratante pour la peau (crème pour la peau) | 0,0075 (VCCEP, 2007) | 0,0023 | 0,0012 | 0,0017 | ||||
| Nettoyant pour le corps | 0,0023 (OCA, 2009) | 0,0017 | 2,2 × 10-6 | 2,5 × 10-6 | ||||
| Total | 0,0118 | 0,0012 | 0,0018 | |||||
| Total absorbé | – | 0,00122 | 6,1 × 10-5 3 | |||||
| Colorant capillaire (mg/kg-p.c.) | 0,033 à 0,11 (SDC, 2009) | 1,39 à 4,64 | 0,0200 à 0,06672 | 0,0002 à 0,00053 | ||||
L’exposition au 1,4-dioxane à partir de produits de soins personnels a été estimée pour les femmes, les hommes et les enfants (poids corporel de 7,5 kg). Cependant, après l’analyse, il était évident qu’en raison de facteurs comme la fréquence d’utilisation, les femmes étaient le groupe ayant la plus grande incidence d’exposition. Pour assurer la clarté, seulement les estimations d'exposition pour les femmes et les enfants sont présentées dans le présent rapport.
En utilisant les concentrations du 1,4-dioxane de produits pour enfants (tableau 7a), l'exposition a été estimée pour les enfants de moins de six mois (tableau 7c). L'exposition globale pour trois produits est estimée à 4,2 x 10-5 mg/kg/jour.
Tableau 7c. Estimation d'exposition des enfants1 au 1,4dioxane par l'intermédiaire de produits de soins personnels
| Produits de soins personnels | Concentration (%) | Concentration moyenne par événement – mg/m3 | Inhalation (mg/kg-p.c. par jour) | Par voie cutanée (mg/kg-p.c. par jour) |
|---|---|---|---|---|
| 1 Poids corporel présumé des enfants de moins de six mois de 7,5 kg 2 Absorption par inhalation à 100 % 3 Absorption par voie cutanée de 3,4 % (Marzulli et al., 1981) |
||||
| Hydratant pour la peau | 0,0011 % (Scalia, 1992) | 5,8 x 10-5 | 2,7 x 10-5 | 4,1 x 10-4 |
| Shampooing pour les cheveux | 0,001 % (SCC, 2009) | 1,0 x 10-4 | 1,4 x 10-7 | 2,9 x 10-6 |
| Nettoyant pour le corps | 0,00053 % (OCA, 2009) | 1,5 x 10-4 | 4,9 x 10-7 | 9,9 x 10-7 |
| Total | 3,1 x 10-4 | 2,8 x 10-5 | 4,1 x 10-4 | |
| Total absorbé | --- | 2,8 x 10-5 2 | 1,4 x 10-5 3 | |
Le 1,4-dioxane a aussi été décelé dans le détergent à vaisselle, des détergents et d'autres produits ménagers (Fuh et al., 2005; Tanabe et Kawata, 2008). Étant donné le potentiel d'exposition quotidienne à la substance dans le détergent à vaisselle manuelle, l'exposition a été estimée pour un adulte qui pèse 70.9 kg. En utilisant des données sur des produits de consommation du Système de déclaration des cosmétiques (concentration maximale : 0,033 %; SDC, 2009), l'exposition a été analysée en utilisant le logiciel ConsExpo 4.1 et a été estimée comme minime (inhalation : 2,2 × 10-4 mg/kg-p.c. par jour; par voie cutanée : 6,5 × 10-5 mg/kg-p.c. par jour).
La confiance en les estimations d'exposition pour les milieux environnementaux et les produits de consommation est élevée. Toutes les données sur le sol, l'air et l'eau sont canadiennes et considérées comme adéquates pour permettre de quantifier l'exposition au 1,4dioxane. La confiance en les estimations d’absorption à partir de sources alimentaires est faible, les données de contrôle canadiennes sur les concentrations du 1,4-dioxane dans les aliments n’étant pas disponibles, et donc pas incluses dans les estimations d’absorption. Néanmoins, telles qu’elles ont été discutées précédemment, les expositions estimées à certains additifs alimentaires sont considérées comme étant surestimées, les niveaux réels dans les aliments devant être très faibles (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). Même s'il existe un certain degré d'incertitude à l'égard des concentrations du 1,4dioxane dans certains produits disponibles au Canada, étant donné les renseignements limités sur la présence ou les concentrations de la substance dans les produits de consommation disponibles au Canada, les estimations d'exposition à partir de l'utilisation de produits contenant du 1,4dioxane étaient fondées sur des hypothèses prudentes. Par conséquent, on est confiant que les estimations d'exposition sont des estimations supérieures prudentes.
Évaluation des effets sur la santé
Les renseignements disponibles concernant les effets sur la santé du 1,4dioxane sont résumés à l'annexe 4.
D'après les résultats d'enquêtes menées sur des animaux de laboratoire, le Centre international de recherche sur le cancer (CIRC) a classé le 1,4dioxane dans le groupe 2B, soit comme « possiblement cancérogène pour l'humain » (CIRC, 1999), la Commission européenne l'a classé dans la Catégorie 3, soit comme « substance préoccupante en raison d'effets cancérogènes possibles mais à l'égard desquels l'information disponible ne permet pas d'établir une évaluation satisfaisante » (Commission européenne, 2000; ESIS, 2009), la U.S. Environmental Protection Agency (EPA) l'a classé comme cancérogène du groupe B2, soit comme « substance probablement cancérogène pour les humains » (US EPA, 1990) et le National Toxicology Program des États-Unis l'a classé parmi les « substances dont on peut raisonnablement présumer qu'elles sont cancérogènes pour l'homme » (NTP, 2005). Ces classifications se fondent sur des observations d'adénomes hépatocellulaires et de carcinomes chez des souris, de tumeurs dans les fosses nasales, dans les tissus souscutanés du foie, dans les glandes mammaires et dans les mésothéliomes péritonéaux de rats et de tumeurs dans le foie et la vésicule biliaire de cobayes ayant été exposés oralement au 1,4-dioxane (US EPA, 1990; CIRC, 1999).
Lorsque le 1,4dioxane a été administré par l'eau potable dans le cadre d'essais biologiques de la cancérogénicité chronique, une importante augmentation de l'incidence d'adénomes hépatocellulaires et de carcinomes a été observée de façon répétée chez les deux sexes de diverses souches de rats et de souris et chez des cobayes mâles (des cobayes femelles n'ont pas été soumises aux essais), alors que des tumeurs des fosses nasales ont été observées seulement chez les rats des deux sexes exposés à des concentrations de 1,4dioxane de 0,5 % (240 à 398 mg/kg-p.c. par jour) et à des doses supérieures dans l'eau potable pendant deux ans. Une importante croissance du nombre d’incidences de tumeurs du foie a été observée chez les souris et les rats auxquels on a administré de 0,05 à 1 % (77 à 1 070 mg/kg p.c. par jour) de 1,4-dioxane et des doses supérieures dans l’eau potable pendant deux ans (Kociba et al., 1974; National Cancer Institute, 1978; Yamazaki et al. 1994; JBRC, 1998c), tandis qu'un nombre croissant d'incidences de mésothéliomes péritonéaux observées chez les rats mâles et de tumeurs des glandes mammaires chez les rats femelles ont été observées chez les rats exposés à des concentrations 1,4dioxane de 0,5 % (398 à 514 mg/kg-p.c. par jour) dans l'eau potable pendant deux ans (Yamazaki et al., 1994; JBRC, 1998c). À une dose de 1,4dioxane de 0,01 % (9,6 à 19 mg/kg-p.c. par jour) dans l'eau potable pendant deux ans, aucune formation de tumeurs et aucun effet d'exposition n'a été observé chez les rats exposés (Kociba et al., 1974). En outre, des tumeurs du foie et des fosses nasales ont été observées chez des rats exposés au 1,4dioxane à des concentrations de 0,75 à 1,8 % (environ l'équivalent de 770 à 1 850 mg/kg-p.c. par jour) dans l'eau potable pendant des périodes relativement plus courtes, soit de 13 mois (Hoch-Ligeti et al., 1970; Argus et al., 1973) ou de 63 semaines (Argus et al., 1965); aucun résultat d'analyse statistique n'a été fourni. Lors d'un essai biologique sur la cancérogénicité effectué chez des cobayes mâles, 22 animaux ont été exposés à des doses du 1,4dioxane variant de 0,5 à 2 % (1 200 à 4 800 mg/kg-p.c. par jour) dans l'eau potable pendant 23 mois; trois animaux ont développé des hépatomes, un a développé des adénomes rénaux et deux ont développé des carcinomes de la vésicule biliaire (Hoch-Ligeti et Argus, 1970).
Une étude ancienne de l’exposition chronique par inhalation n’a fourni aucune preuve de la cancérogénicité ou autres effets nocifs sur les rats des deux sexes, exposés au 1,4-dioxane à 400 mg/m3 pendant deux ans (Torkelson et al., 1974). Toutefois, au cours de la période de commentaires publics relatifs à cette évaluation, une étude de deux ans sur l’exposition par inhalation sur des rats mâles F344 a été publiée (Kasai et al., 2009). Une augmentation attribuable à la dose et significative de l’incidence de carcinomes malphigiens et d’adénomes hépatocellulaires a été constatée principalement sur les rats exposés à 1 250 ppm (4500 mg/m3) et une augmentation significative de l’incidence de mésothéliomes péritonéaux a été observée à 250 ppm (900 mg/m3) et supérieur. L’incidence d’hypernéphromes, de fibroadénomes mammaires et d’adénomes dans la glande de Zymbal a également augmenté avec la dose, mais ne s’est pas révélée statistiquement significative. Des lésions prénéoplasiques dans la cavité nasale, notamment l’augmentation significative de l’incidence de l’élargissement nucléaire, une atrophie et des métaplasies respiratoires ont été constatées à 50 ppm (180 mg/m3) et supérieur.
L’application cutanée du 1,4-dioxane seul n’a pas provoqué de tumeurs cutanées liées à l’exposition ou d’autre nature sur les souris (King et al., 1973; Perone et al., 1976). Cependant, dans le cadre d'un essai visant à favoriser la croissance de tumeurs par voie cutanée, dans le cas où les souris ont été exposées au diméthylbenzanthracène avant de recevoir la dose de 1,4dioxane, on a observé des tumeurs cutanées ainsi que des tumeurs dans les poumons, les reins, la rate et le foie (King et al., 1973). Des tumeurs pulmonaires provoquées par le 1,4-dioxane ont également été observées chez les souris mâles, mais pas chez les femelles, lorsque la substance a été administrée par injection intrapéritonéale (Maronpot et al., 1986; Stoner et al., 1986).
En ce qui a trait aux humains, même si plusieurs études épidémiologiques n'ont pas fourni de preuves de formation de tumeurs induites par le 1,4dioxane dans le milieu de travail (Thiess et al., 1976, 1981; NIOSH, 1977; Buffler et al., 1978; Kramer et al., 1978), une étude comparative d'envergure sur la mortalité fondée sur des données tirées du Danish Cancer Registry a révélé que les rapports d'incidence normalisée proportionnels pour les tumeurs du foie des travailleurs mâles exposés au 1,4dioxane et à d'autres produits chimiques dans le milieu de travail étaient considérablement supérieurs aux rapports attendus, alors qu'une augmentation de 50 % de l'incidence du cancer du foie a été observée dans les milieux de travail où le 1,4dioxane était la seule substance utilisée (Hansen, 1993; Hansen et al., 1993).
La génotoxicité du 1,4dioxane a été évaluée par une gamme d'essais in vitro et in vivo. Tous les essais de mutagénicité étaient négatifs, y compris ceux effectués dans des cellules bactériennes et mammaliennes ainsi que dans des cellules de levures, un essai visant à induire une mutation létale dominante chez des souris et un essai pour induire une mutation létale récessive chez le Drosophila (BASF, 1977, 1979a, b, c, 1991; Stott et al., 1981; Haworth et al., 1983; Nestmann et al., 1984; Yoon et al., 1985; Khudoley et al., 1987; Kwan et al., 1990; McGregor et al., 1991; Morita et Hayashi, 1998). En outre, tous les essais de mutagénicité utilisant l'un des métabolites du 1,4-dioxane, soit le 1,4dioxan-2-one, ont aussi donné des résultats négatifs (Goldsworthy et al., 1991; EURAR, 2002). En ce qui concerne les enquêtes sur la clastogénicité, y compris l'aberration chromosomique, l'induction micronucléaire et l'échange de chromatides sœurs, la majorité des résultats des essais in vitro étaient négatifs, un résultat positif étant faible, et les résultats des essais d'induction micronucléaire in vivo étaient mixtes pour les deux souches de souris CD-1 et C57BL/6 (Galloway et al., 1987; McFee et al., 1994; Mirkova, 1994; Tinwell et Ashby, 1994; Morita et Hayashi, 1998; Roy et al., 2005). Une augmentation considérable du nombre d'aberrations chromosomiques a été observée chez 11 travailleurs exposés aux oxydes d'alkylène, y compris le 1,4dioxane, pendant plus de 20 ans dans le milieu de travail. Cependant, les travailleurs ont également été exposés à des mutagènes connus comme l'oxyde d'éthylène et l'oxyde de propylène (Thiess et al., 1981). Une importante augmentation du degré d'aneuploïdie a été observée chez le Drosophila (Muñoz et Barnett, 2002), mais non dans les levures (Zimmermann et al., 1985) qui ont été exposés au 1,4-dioxane. L'incidence de 1,4-dioxane était positive dans certains essais, mais non dans d'autres, dans le cadre de l'examen des effets sur l'acide désoxyribonucléique (ADN) comme des cassures de brins d'ADN, l'amélioration des processus de réparation d'ADN ou la prolifération de cellules (mesurées comme synthèse réplicative de l'ADN) et la transformation des cellules. Toutefois, ces effets étaient généralement importants seulement à des doses plus élevées ou après une exposition prolongée et souvent, en présence de cytotoxicité (Stott et al., 1981; Heidelberger et al., 1983; Sina et al., 1983; Sheu et al., 1988; Sai et al., 1989; Kitchin et Brown, 1990; Goldsworthy et al., 1991; Hellmer et Bolcsfoldi, 1992; Uno et al., 1994; Miyagawa et al., 1999; Sasaki et al., 2000). La Commission européenne a conclu que le total du poids de la preuve indique que le 1,4-dioxane est un composé non génotoxique (EURAR, 2002). L'Agency for Toxic Substances and Disease Registry (ATSDR) a déclaré que « collectivement, les renseignements disponibles suggèrent que le 1,4-dioxane est un composé non génotoxique, au mieux, un composé faiblement génotoxique » (ATSDR, 2007). Le gouvernement de l'Australie a conclu que « dans l'ensemble, le poids de la preuve des essais in vitro et in vivo indique une faible probabilité que le 1,4dioxane soit mutagène » (NICNAS, 1998).
Même si les mécanismes de cancérogénicité du 1,4-dioxane ont été examinés par d'autres organismes, ils n'ont pas été élucidés entièrement car les données sur la réaction aux doses et le progrès de la réaction en fonction du temps pour caractériser et déterminer les événements clés de la formation de tumeurs induites par le 1,4dioxane, et de ce fait, pour appuyer toute hypothèse liée au mécanisme de cancérogénicité, sont insuffisantes, incohérentes ou inexistantes. Par contre, l'ensemble des preuves indique que le 1,4dioxane n'est pas génotoxique. Ainsi, même si le mode d'induction de tumeurs n'a pas été élucidé entièrement, on ne considère pas que les tumeurs observées sont causées par une interaction directe avec le matériel génétique (NICNAS, 1998; EURAR, 2002; ATSDR, 2007; VCCEP, 2007). Certains ont laissé entendre que la formation de tumeurs dans les fosses nasales de rats exposés au 1,4-dioxane dans l’eau potable est causée par l’inspiration d’eau dans les fosses nasales lorsqu’ils prennent de l’eau de leur bouteille, causant l’exposition directe des fosses nasales à des doses élevées, puis la cytotoxité (Reitz et al., 1990; Goldsworthy et al, 1991; Stickney et al., 2003; Sweeney et al., 2008), les causes étant liées à l'anatomie nasale du rat et à la méthodologie expérimentale. Toutefois, une étude récente de deux ans sur les rats (Kasai et al., 2009) a permis de constater des lésions prénéoplasiques et néoplasiques dans les fosses nasales des rats par inhalation; par conséquent, la pertinence pour les humains des tumeurs nasales provoquées par le 1,4-dioxane ne peut pas être exclue. Par ailleurs, le 1,4-dioxane n’est pas un carcinogène complet car il n’a présenté qu’une activité de promotion des tumeurs, et non pas une activité d’initiation des tumeurs (Pereira et al., 1982; Bull et al., 1986; Stoner et al., 1986; Lundberg et al., 1987).
Plusieurs études ont indiqué que le 1,4dioxane était absorbé rapidement et complètement après une exposition orale ou une exposition par inhalation chez les humains et les rats, alors qu'une incidence d'absorption beaucoup moins grande (3,4 % en général) s'est produite lors de l'exposition par voie cutanée chez les singes et sur la peau humaine in vitro (Young et al., 1976, 1977, 1978; Marzulli et al., 1981; Bronaugh, 1982). Après une injection intrapéritonéale, le 1,4-dioxane a été réparti rapidement et décelé dans tous les tissus examinés (Woo et al., 1977; Mikheev et al., 1990). Le métabolite primaire du 1,4dioxane, l'acide ß-hydroxyéthoxyacétique (HEAA), a été décelé dans l'urine de rats et d'humains (Young et al., 1976, 1977, 1978; Braun et Young, 1977). Le 1,4-dioxan-2-one a également été décelé dans l'urine de rats, selon le pH et la température des conditions analytiques. À un pH élevé, le HEAA est décelé, et à un pH faible, le HEAA est converti au 1,4-dioxan-2-one (Braun et Young, 1977; Woo et al., 1977, 1978). À des doses plus faibles, l'élimination rapide (demivie d'environ une heure) du 1,4dioxane a été observée chez des humains exposés à 50 ppm (180 mg/m3) de 1,4dioxane par inhalation. Une demivie semblable a été observée chez des rats ayant reçu des doses orales ou intraveineuses du 1,4-dioxane (moins de 10 mg/kg-p.c.). Cependant, la toxicocinétique non linéaire du 1,4dioxane a été démontrée chez des rats lorsque l'oxydation du 1,4dioxane à ses métabolites primaires, le HEAA et le 1,4-dioxan-2-one, a atteint un point de saturation à des doses supérieures à 50 ppm (180 mg/m3) dans l'air ou à 10 mg/kg-p.c. administrées oralement et l'accumulation du 1,4dioxane a été observée (Young et al., 1976, 1977, 1978; Stickney et al., 2003). En outre, le métabolisme amélioré dans le foie n'a pas eu pour effet d'accroître l'hépatotoxicité du 1,4dioxane mesurée par le contenu en glutathione hépatique ou en enzymes sériques de l'alanine transaminase, ce qui révèle que les métabolites n'ont pas joué un rôle majeur dans l'hépatotoxicité du 1,4-dioxane (Nannelli et al., 2005). Dans l'ensemble, les preuves suggèrent qu'il peut exister un seuil de toxicité et de cancérogénicité à des doses où le métabolisme du 1,4-dioxane devient saturé (VCCEP, 2007).
Plusieurs modèles pharmacocinétiques et pharmacodynamiques à base physiologique (MPBP) ont été créés pour prévoir l'absorption, la répartition, le métabolisme et l'élimination du 1,4dioxane chez les rongeurs et les humains (Young et al., 1977, 1978; Leung et Paustenbach, 1990; Reitz et al., 1990; Fisher et al., 1997; Sweeney et al., 2008). Le modèle de Fisher et al. (1997) indique que le 1,4-dioxane peut aussi être éliminé dans le lait maternel humain, comme il est indiqué dans la partie d’évaluation de l’exposition. Toutefois, cette élimination du 1,4-dioxane dans le lait maternel n’a été ni évaluée ni prévue par d’autres modèles pharmacocinétiques à base physiologique (MPBP). Comme il est décrit dans la partie d’évaluation de l’exposition, l’exposition au 1,4-dioxane dans le lait maternel n’est pas envisagée.
Les effets primaires non néoplastiques induits par le 1,4dioxane sont les dommages au foie et aux reins, lesquels sont généralement associés à une exposition à de fortes doses du 1,4dioxane et à la citotoxicité, qui ont été observés par tous les mécanismes d'exposition faisant objet de l'étude chez les humains et les animaux de laboratoire. Parmi les autres effets nocifs induits par le 1,4dioxane, on compte des effets sur le système nerveux central, les systèmes respiratoires et sanguins ainsi que l'estomac.
La dose minimale avec effet nocif observé (DMENO) reçue oralement pour les effets non néoplastiques fondés sur des lésions au foie a été observée à 16 mg/kg-p.c. par jour chez des rats exposés au 1,4-dioxane par l'eau potable pendant deux ans (Yamazaki et al., 1994; JBRC, 1998c). De plus, les DME(N)O reçues oralement qui ont été décelées dans le cadre d'études subchroniques, de courte durée et aiguës sont de 130 mg/kg-p.c. par jour (Kano et al., 2008), de 400 mg/kg-p.c. par jour (la seule dose faisant objet de l'essai; Nannelli et al., 2005) et de 1 050 mg/kg-p.c. par jour (Kanada et al., 1994), respectivement (annexe 4). Une donnée pratique, la dose sans effet nocif observé (DSENO) pour les effets chroniques et la plus faible dose dans les études disponibles où des tumeurs n'ont pas été observées chez les rats est de 0,01 % dans l'eau potable (équivalent à 9,6 et à 19 mg/kg-p.c. par jour pour les mâles et les femelles, respectivement), selon l'étude de deux ans qui a déjà été mentionnée (Kociba et al., 1974).
Des effets non néoplasiques induits à la vapeur du 1,4-dioxane comme des changements histopathologiques dans les fosses nasales et le foie ont été observés chez des rats à des concentrations de 100 ppm (360 mg/m3) et supérieur dans une étude de 13 semaines (Kasai et al., 2008) et à 50 ppm (180 mg/m3) et supérieur dans une étude de deux ans (Kasai et al., 2009), même si dans d’autres études sur l’inhalation, aucun effet lié à un traitement n’a été observé chez des rats à des concentrations de vapeur du 1,4-dioxane de 111 ppm (400 mg/m3) sur deux ans (Torkelson et al., 1974). En outre, on a observé l'activation de la glutathione-peroxydase dans le cerveau et les ovaires des rats femelles observées qui ont été exposées à une concentration de vapeur de 1,4dioxane de 100 mg/m3pendant un mois (Burmistrov et al., 2001). On a également observé l'irritation des yeux et du système respiratoire après une exposition par inhalation aiguë chez des humains et des animaux de laboratoire. La dépression du système nerveux central et des lésions sur le foie et les reins ont été observées chez les animaux exposés à de fortes concentrations de vapeur du 1,4-dioxane. En matière d’exposition aiguë, une concentration sans effet nocif observé (CSENO) de 20 ppm (72 mg/m3) a été déterminée chez les humains (Ernstgård et al., 2006), tandis que de faibles effets, tels qu’une modification de l’activité des enzymes sériques, ont été observés chez les rats exposés à des concentrations de vapeur du 1,4-dioxane de 1 000 ppm (3 600 mg/m3, concentration minimale avec effet observé [CMEO] aiguë la plus faible) sur quatre heures (Drew et al., 1978).
En ce qui a trait à l'exposition par contact cutané, même si des lésions importantes n'ont pas été observées chez les souris ayant été exposées par voie cutanée à des concentrations du 1,4dioxane de 0,2 mL trois fois par semaine pendant 60 semaines ou de 0,05 mL trois fois par semaine pendant 78 semaines (King et al., 1973; Perone et al., 1976), ces données ne sont pas considérées comme adéquates pour dériver une DSENO car il se peut que l'application par contact cutané dans ces études n'ait pas eu lieu dans des conditions d'occlusion, et par conséquent, les doses appliquées par contact cutané peuvent avoir été réduites considérablement par l'évaporation rapide du 1,4dioxane.
Les effets induits du 1,4-dioxane sur la reproductivité et le développement ont été observés seulement à des doses élevées, d'après le peu de données qui sont disponibles. Les effets sur les organes reproducteurs mâles, par exemple, la réduction du taux de minéralisation des testicules, ont été observés chez des souris exposées au 1,4dioxane à des concentrations de 2 000 mg/L dans l'eau potable (250 mg/kg-p.c. par jour) pendant deux ans, mais non chez les rats qui ont été exposés oralement au 1,4dioxane à des doses de jusqu'à 1 015 mg/kg-p.c. par jour ou à 400 mg/m3 dans l'air pendant deux ans (Kociba et al., 1974; Torkelson et al., 1974; Yamazaki et al., 1994; JBRC, 1998c). On a également observé une baisse considérable du poids corporel moyen de fœtus vivants et un retard de l'ossification des sternèbres chez des rats exposés à une dose du 1,4dioxane de 1 035 mg/kg-p.c. par jour durant la période d'organogenèse (Giavini et al., 1985). En outre, des effets immunologiques comme la suppression de la production de lymphocytes T et l'augmentation de la production de cellules B ont été observés en réaction au 1,4dioxane dans des lymphocytes murins et humains in vitro, et une réaction des lymphocytes un peu plus faible aux mitogènes a été observée chez des souris exposées au 1,4dioxane par injection intrapéritonéale (1 670 mg/kg-p.c. par jour pendant 7 jours) (Thurman et al., 1978).
Le niveau de confiance accordé à la base de données sur la toxicité est élevé car on dispose de données sur la toxicité aiguë, la cancérogénicité, la toxicité par doses répétées, la génotoxicité et la toxicité pour le développement, mais les données liées aux effets sur la peau et la reproductivité sont limitées et il demeure une incertitude quant au mode d’induction de tumeurs..
Caractérisation du risque pour la santé humaine
En s’appuyant principalement sur des évaluations fondées sur le poids de la preuve de plusieurs organismes internationaux (Centre international de recherche sur le cancer, Union européenne, U.S. Environmental Protection Agency et National Toxicology Program des États-Unis) et sur les données disponibles, les effets critiques associés à l’exposition au 1,4-dioxane suivant une exposition orale à la substance et par inhalation, sont des tumorigenèses ainsi que d’autres effets systémiques, principalement des dommages aux reins et au foie, et ce, par toutes les voies d’exposition (orale, cutanée et inhalation). L'ensemble des preuves indique que le 1,4-dioxane n'est pas une substance mutagène et qu'elle présentait, dans certains essais, une faible clastogénicité à des niveaux d'exposition élevés, et non dans d'autres essais souvent associés à la cytotoxicité. Une considération des données disponibles concernant la génotoxicité et les conclusions d'autres organismes indiquent que le 1,4dioxane n'est probablement pas génotoxique. La toxicocinétique non linéaire du 1,4dioxane a été observée chez des rats, et on a suggéré l'existence d'un seuil de toxicité et de cancérogénicité où le métabolisme du 1,4dioxane devient saturé. Des voies métaboliques semblables pour le 1,4-dioxane ont été observées chez des humains et des animaux de laboratoire, quoique les données épidémiologiques disponibles n’aient pas fourni de preuves suffisantes sur la cancérogénicité du 1,4-dioxane chez les humains et la pertinence pour les humains de la cancérogénicité du 1,4-dioxane, notamment l’induction des tumeurs du foie. Ainsi, même si le mode d’induction de tumeurs n’a pas été clairement établi, les chercheurs n’estiment pas que les tumeurs observées soient le résultat d’un contact direct avec un matériel génétique. Un seuil d'exposition a donc été utilisé pour caractériser le risque pour la santé humaine. En conséquence, les marges d’exposition sont dérivées entre le niveau auquel aucune tumeur ou aucun effet nocif n’a été observé dans le cadre d’études expérimentales, la plus faible dose d’exposition associée aux effets nocifs induits par le 1,4-dioxane et les estimations prudentes de l’exposition de la population générale au 1,4-dioxane (annexe 5).
On estime que les principales voies d'exposition de la population générale au 1,4dioxane sont leur environnement (c.àd., l'air ambiant, l'air intérieur et l'eau potable), leur nourriture et leur utilisation de produits de consommation contenant la substance. La comparaison des limites supérieures de l'absorption quotidienne totale de l'environnement à la dose à laquelle aucune tumeur et aucun effet nocif n'a été observé et à la DMENO pour les effets non cancéreux a permis de créer la marge d'exposition variant de 7 000 à 84 000. Par ailleurs, en matière d’exposition par inhalation, une comparaison de la concentration la plus élevée de 1,4-dioxane dans l’air intérieur mesurée dans la région du Grand Toronto pendant trois mois en 1996 avec la concentration minimale avec effet nocif observé (CMENO) pour les effets non cancéreux sur les rats ou l’irritation chez les humains, conduit à des marges d’exposition de cinq ordres d’importance. Ces marges d’exposition sont considérées comme adéquates pour tenir compte des incertitudes dans l’ensemble de données sur l’évaluation des risques pour la santé humaine des effets cancéreux et non cancéreux.
En outre, une série de produits de soins personnels contenant le 1,4dioxane comme sousproduit de fabrication ont été identifiés. L'inhalation et le contact cutané par l'utilisation de ces produits contribuerait à l'exposition au 1,4dioxane. Pour les produits pouvant être utilisés tous les jours par les consommateurs collectivement, les estimations globales des limites supérieures de l’exposition au 1,4-dioxane de divers produits de soins personnels (p. ex., le shampooing, le revitalisant, le gel de douche et la lotion hydratante) par inhalation et par contact cutané sont comparées à la concentration à laquelle aucune tumeur et aucun effet nocif n’a été observé et à la DMENO pour les effets non cancéreux. Cette approche est considérée comme prudente car les données disponibles sur le contact cutané ne sont pas suffisantes pour dériver une DMENO cutanée, et le faible taux d’absorption cutanée a été considéré dans les estimations d’exposition cutanée. Les marges d'exposition résultantes se situent entre 8 000 et 13 300. L'utilisation d'un seul produit de soins personnels, de savon liquide pour lavevaisselle ou de produits pour enfants (tableau 7c) génère des doses d'exposition plus faibles et entraînerait même de plus grandes marges d'exposition. Pour les produits utilisés moins fréquemment comme le colorant capillaire, les estimations supérieures d’exposition par contact cutané et par inhalation sont comparées à la concentration minimale avec effet observé (CMEO) par voie orale aiguë, d’après les effets sur le système nerveux central observés chez des rats (Kanada et al., 1994), ce qui donne une marge d’exposition de 15 630 à 52 000. Par conséquent, la marge d’exposition pour l’absorption par inhalation et par contact cutané lors de l’utilisation de produits de consommation est considérée comme suffisamment protectrice.
En matière d’exposition par inhalation des produits, une comparaison de la somme prudente des estimations supérieures de l’exposition par inhalation lors de l’utilisation quotidienne de produits de soins personnels, qui pourrait être utilisée successivement avec la CMENO, d’après les effets sur les fosses nasales de rats, permet de créer une marge d’exposition de 15 250. L’estimation de la limite supérieure de la concentration moyenne liée à l’utilisation de colorant capillaire est comparée à la CMEO aiguë, d’après la modification des enzymes sériques chez des rats et avec l’irritation des yeux chez les humains permet de créer une marge d’exposition d’environ 40 (irritation chez les humains) à 780 (rats). Étant donné que ces estimations sont pour une limite supérieure très prudente (c.-à-d. de 100 % pour le sulfate d’alkyle éthoxylé dans le produit final, ce qui représente assurément une surestimation), la marge d’exposition par l’utilisation de produits de consommation est considérée comme étant suffisamment protectrice.
Incertitudes de l'évaluation des risques pour la santé humaine
Une grande confiance sévit à l'égard des concentrations du 1,4-dioxane dans les milieux environnementaux au Canada. Toutes les données sur le sol, l'air et l'eau proviennent du Canada et sont considérées comme adéquates pour permettre la quantification de l'exposition au 1,4dioxane. Des incertitudes existent concernant l’estimation de l’absorption de sources alimentaires car les données canadiennes sur le contrôle des doses du 1,4-dioxane dans les aliments n’étaient pas disponibles et par conséquent, elles n’ont pas été incluses dans les estimations de l’absorption. Les expositions à certains additifs alimentaires sont considérées comme étant surestimées, les niveaux réels dans les aliments devant être très faibles (communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée). Même s'il existe un certain degré d'incertitude en raison des renseignements limités sur la présence ou les concentrations de la substance dans les produits de consommation disponibles au Canada, les estimations d'exposition par l'utilisation de produits contenant du 1,4dioxane sont fondées sur des hypothèses prudentes.
Il existe une incertitude autour du niveau à laquelle le 1,4-dioxane, présent dans les produits de santé (pharmaceutiques, médicaments vétérinaires et produits de santé naturels), sous forme de résidus de solvants puisse contribuer à l’exposition de la population en générale (voir la section Utilisations)
Les chercheurs sont incertains à l'égard du mécanisme de la tumorigenèse induite par le 1,4dioxane car les données sur la réaction à la dose et le progrès de la réaction en fonction du temps permettant de caractériser et d'identifier les événements clés dans la formation de différents types de tumeurs induites par le 1,4dioxane, ainsi que d'appuyer tout mécanisme hypothétique de cancérogenèse sont insuffisantes, incohérentes ou non disponibles. Cependant, l’ensemble des preuves indique que cette substance peut ne pas avoir un lien direct avec le matériel génétique, et par conséquent, il est considéré comme justifiable d’utiliser une marge d’exposition dans l’évaluation préalable pour caractériser les risques. De plus, il existe un certain degré d’incertitude concernant la pertinence pour les humains de la cancérogénicité du 1,4-dioxane car les études épidémiologiques n’ont pas fourni de preuves concluantes. Toutefois, la pertinence éventuelle n’a pas été éliminée de l’évaluation. Quant aux effets non néoplasiques, certaines incertitudes demeurent à l’égard des concentrations d’exposition critiques associées à ces effets par exposition par contact cutané au 1,4-dioxane, étant donné que l’ensemble de données sur le contact cutané est limité De plus, les données sur la toxicité pour la reproduction associées à l'exposition au 1,4dioxane sont limitées car il n'existe aucune étude multigénérationnelle.
D’après les renseignements contenus dans la présente évaluation préalable finale, le 1,4-dioxane ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions qui ont pu ou peuvent avoir un effet nuisible immédiat ou à long terme sur l’environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
Compte tenu de l’adéquation des marges d’exposition entre les estimations prudentes de l’exposition au 1,4-dioxane et des doses à effet critique, il est conclu que le 1,4-dioxane est considéré comme une substance ne pénétrant pas dans l’environnement en quantités, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un danger pour la vie ou la santé humaine au Canada.
Il est conclu que le 1,4-dioxane ne répond à aucun des critères énoncés à l’article 64 de la LCPE(1999). Même si le 1,4dioxane répond aux critères de la persistance, il ne répond pas aux critères du potentiel de bioaccumulation tels qu'ils sont énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Cette substance sera considérée pour inclusion dans la prochaine initiative de mise à jour de l'inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
Abe, A. 1999. Distribution of 1,4-dioxane in relation to possible sources in the water environment. Sci. Total. Environ. 227:41-47.
Adams, R.M. 1983. Solvents and plasticizers. In : Adams, R.M. (éd.) Occupational skin disease. New York (NY) : Grune & Stratton USA. p. 279-297. [cité dans NICNAS, 1998].
[AIES] Artificial Intelligence Expert System. 2003-2005. Version 1.25. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Disponible auprès de la Division des substances nouvelles, Division des substances existantes, Environnement Canada
Ailamazian, E.K. 1990. Effect of ecological factors on the course of pregnancy. Vestn. Akad. Med. Nauk. SSSR 7:23-25 (en russe). [cité dans NICNAS, 1998].
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Argus, M.F., Arcos, J.C., Hoch-Ligeti, C. 1965. Studies on the carcinogenic activity of the protein-denaturing agents: hepatocarcinogenicity of dioxane. J. Natl. Cancer Inst.35:949-958.
Argus, M.F., Sohal, R.S., Bryant, G.M., Hoch-Ligeti, C., Arcos, J.C. 1973. Dose–response and ultrastructural alterations in dioxane carcinogenesis. Influence of methylcholanthrene on acute toxicity. Eur. J. Cancer 9:237-243.
Arnot, J.A., Gobas, F.A. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. [en ligne] 22(3):337-345. Accès : http://www3.interscience.wiley.com/journal/104557877/home[réserve de consultation]
[ASTER] Assessment Tools for the Evaluation of Risk [en ligne]. 1999. Duluth (MN) : U.S. Environmental Protection Agency, Mid-Continent Ecology Division. Accès : http:www.epa.gov/med/Prods_Pubs/aster.htm. [réserve de consultation]
Atkinson, R. 1989. Kinetics and mechanisms of the gas-phase reactions of the hydroxyl radical with organic compounds.J. Phys. Chem. Ref. Data. Monogr. 1:1-246.
[ATSDR] Agency for Toxic Substances and Disease Registry. 2007. Draft toxicological profile for 1,4-dioxane. Washington (DC) : U.S. Department of Health and Human Services, Public Health Service, ATSDR. [consulté le 3 mai 2009]. Accès : http://www.atsdr.cdc.gov/toxprofiles/tp187.pdf
Barber, H. 1934. Hemorrhagic nephritis and necrosis of the liver from dioxane poisoning. Guy’s Hosp. Rep. 84:267-280. [cité dans NICNAS, 1998].
BASF. 1973. Rapport inédit daté du 4 mai 1973. [cité dans EURAR, 2002].
BASF. 1977. Bericht über die Prüfung von 1,4-Dioxan auf mutagene Wirkung an männlichen Mäusen nach einmaliger intraperitonealer Applikation. Dominanter Letaltest. Rapport inédit de BASF Medizinisch-Biologische Forschunglaboratorien, Gewerbehygiene und Toxikologie, daté du 21 mars 1977. [cité dans EURAR, 2002].
BASF. 1979a. Bericht über die Prüfung von 1,4-Dioxan (stabilisiert mit 25 ppm 2,6-Di-tert.-butyl-p-kresol) im Ames-Test. Rapport inédit (79/135) de BASF, Gewerbehygiene und Toxikologie, daté du 2 avril 1979. [cité dans EURAR, 2002].
BASF. 1979b. Bericht über die Prüfung von 1,4-Dioxan (Peroxid-haltig) im Ames-Test. Rapport inédit (79/133) de BASF, Gewerbehygiene und Toxikologie, daté du 2 avril 1979. [consulté par l'EURAR, 2002].
BASF. 1979c. Bericht über die Prüfung von 1,4-Dioxan (Peroxid-frei) im Ames-Test. Rapport inédit (79/134) de BASF, Gewerbehygiene und Toxikologie, daté du 3 avril 1979. [consulté par l'EURAR, 2002].
BASF. 1980. Prüfung auf ein akutes Inhalationsrisiko (Ratte). Inhalationsrisikotest. Rapport inédit de BASF, Gewerbehygiene und Toxikologie, daté du 29 décembre 1980. [cité dans lEURAR, 2002].
BASF. 1991. Report on a point mutation test carried out on CHO cells (HGPRT locus) with the test substance 1,4-dioxane (substance no. 79/471). Rapport inédit. Ludwigshafen/Rhein (Allemagne) : BASF Aktiengesellschaft, Département de toxicologie. [cité dans EURAR, 2002].
BASF. 1993. Report on the maximization test for the sensitizing potential of 1,4-dioxane in guinea pigs. Projet no 30H0066/922030. Rapport inédit. Ludwigshafen/Rhein (Allemagne) : BASF Aktiengesellschaft, Département de toxicologie [cité dans EURAR, 2002].
[BCFWIN] BioConcentration Factor Program for Windows [modèle d'estimation]. 2000. Version 2.15. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BESC] Bureau européen des substances chimiques. 2000. IUCLID dataset for 1,4-dioxane (no CAS123-91-1). Accès : http://ecb.jrc.it/esis/
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ. Sci. Technol.34(4):699-703.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Black, R.E., Hurley, F.J., Havery, D.C. 2001. Occurrence of 1,4-dioxane in cosmetic raw materials and finished cosmetic products. J. AOAC. Int. 84(3):666-670.
Blount, B., Chambers, D., McElprang, D., Skinner, C., Wang, R. 2008. Measuring 1,4 dioxane in blood as a biomarker of exposure. Proceedings from Society of Toxicology meeting. Centre for Disease Control and Prevention.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere. 30(4):741-752.
Braun, W.H., Young, J.D. 1977. Identification of beta-hydroxyethoxyacetic acid as the major urinary metabolite of 1,4-dioxane in the rat. Toxicol. Appl. Pharmacol.39:33-38.
Bringmann, G., Kühn, R. 1976. Befunde der Schadwirkung wassergefahrdender Stoffe gegen Daphnia magna. Z Wasser Abwasser Forschung 10:161-166. [cité dans EURAR, 2002].
Bronaugh, R. 1982. Percutaneous absorption of cosmetic ingredients. In : Frost P, éd. Principles of cosmetics for the dermatologist. Minneapolis (MN) : University of Minnesota Press. p. 277284.
Brooke, L. 1987. Report of the flow-through and static acute test comparisons with fathead minnows and acute tests with an amphipod and a cladoceran. Superior (WI) : University of Wisconsin-Superior, Center for Lake Superior Environmental Studies. p. 24. [cité dans HSDB, 2009].
Brown, S.K., Sim, M.R., Abramson, M.J., Gray, C.N. 1994. Concentration of volatile organic compounds in indoor air – A review. Indoor Air 4:123-134.
[BUA] German Chemical Society Advisory Committee on Existing Chemicals of Environmental Relevance. 1991. 1,4-Dioxane. BUA Report 80. [Traduction par R. Brown.] Stuttgart (Allemagne) : BUA.
Buffler, P.A., Wood, S.M., Suarez, L., Kilian, D.J. 1978. Mortality follow-up of workers exposed to 1,4-dioxane. J. Occup. Med. 20:255-259.
Bull, R.J., Robinson, M., Laurie, R.D. 1986. Association of carcinoma yield with early papilloma development in SENCAR mice. Environ. Health Perspect. 68:11-17.
Burmistrov, S.O., Arutyunyan, A.V., Stepanov, M.G., Oparina, T.I., Prokopenko, V.M. 2001. Effect of chronic inhalation of toluene and dioxane on activity of free radical processes in rat ovaries and brain. Bull. Exp. Biol. Med. 132:832-836.
Canada. [1978]. Règlement sur les aliments et drogues, C.R.C., c. 870, a. C.01.040.2. Accès : http://laws.justice.gc.ca/PDF/Regulation/C/C.R.C.,_c._870.pdf??
Canada. 1998. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur les substances appauvrissant la couche d'ozone (1998), C.P. 1998-2251, le 16 décembre 1998, DORS/99-7. Accès : http://www.ec.gc.ca/NOPP/DIVISION/FR/detail.cfm
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, c. 33. Accès : http://canadagazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement : Règlement sur la persistence et la bioaccumulation. C.P. 2000-348, le 23 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l'Environnement, Ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures de gestion et d’évaluation des risques que certaines substances présentent pour la santé des Canadiens et leur environnement.Gazette du Canada. Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://canadagazette.gc.ca/partI/2006/20061209/pdf/g1-14049.pdf
Canada, Ministère de l'Environnement, Ministère de la Santé. 2008. Loi canadienne sur la protection de l'environnement (1999) : Avis de septième divulgation d'information technique concernant les substances identifiées dans le Défi.Gazette du Canada. Partie I, vol. 142, no 35, p. 2501-2517. Accès : http://www.gazette.gc.ca/rp-pr/p1/2008/2008-08-30/pdf/g1-14235.pdf
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
[CCME] Conseil canadien des ministres de l'environnement. 2008. Recommandations pour la qualité de l'eau en vue de la protection de la vie aquatique : 1,4-dioxane. In : Recommandations canadiennes pour la qualité des eaux. Winnipeg (MB) : Environnement Canada, CCME.
Chung, T., Hayase, F., Kato, H. 1983. Volatile components of ripe tomatoes and their juices, purees and pastes. Agric. Biol. Chem. 47(2):343.
Commission européenne. 2000. Summary Record. Commission Meeting of the Commission Working Group on the Classification and Labelling of Dangerous Substances. Rencontre au Bureau européen des substances chimiques à Ispra, du 19 au 21 janvier 2000. Direction générale du CCR de la Commission européenne, Centre commun de recherche, Institute for Health and Consumer Protection. Bureau européen des substances chimiques. ECBI/19/00 – Rev. 1. Accès : http://ecb.jrc.it/documents/Classification-Labelling/ADOPTED_SUMMARY_RECORDS/1900r1_cmr0100.pdf
[ConsExpo] Consumer Exposure Model [en ligne]. 2006. Version 4.1, Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais de la santé publique et de l'environnement). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
[CSC] Campaign for Safe Cosmetics. 2009. No more toxic tub: Getting contaminants out of children’s bath and personal care products. Safe Cosmetics Action Network (États-Unis). [consulté en mars 2009]. Accès : http://www.safecosmetics.org/
[CSFII] Continuing Survey of Food Intakes by Individuals 1994-96, 1998 and Diet and Health Knowledge Survey 1994-96. 1994-1996, 98. U.S. Department of Agriculture, Agricultural Research Service, Beltsville Human Nutrition Research Center, Food Surveys Research Group. Beltsville (MD). Accès : http://www.ars.usda.gov/
Daubert, T.E., Danner, R.P. 1989. Physical and thermodynamic properties of pure chemicals data compilation. Washington (DC) : Taylor and Francis. [cité dans HSDB, 2009]
DeRosa, C.T., Wilbur, S., Holler, J., Richter, P., Stevens, Y.W. 1996. Health evaluation of 1,4dioxane. Toxicol. Ind. Health 12:1-43.
Dow. 1995. Toxicity and environmental references for 1,4-dioxane. Communication personnelle. [Cité dans NICNAS, 1998].
Drew, R.T., Patel, J.M., Lin, F.N. 1978. Changes in serum enzymes in rats after inhalation of organic solvents singly and in combination. Toxicol. Appl. Pharmacol. 45:809-819.
[ECOSAR] Ecological Structure Activity Relationships [en ligne]. 2004. Version 0.99h. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[ECOTOX] ECOTOXicology database [base de données en ligne]. 2006. Version 4. Washington (DC) : U.S. Environmental Protection Agency, Office ofResearch and Development; National Health and Environmental Effects Research Laboratory, Mid-Continent Ecology Division. [consulté en avril 2007]. Accès : http://cfpub.epa.gov/ecotox
Environnement Canada. 2007. Review of the limitations and uncertainties associated with use for molecular size information when assessing bioaccumulation potential. Rapport final inédit. Gatineau (Qc) : Environnement Canada, Division des substances existantes. Disponible sur demande.
Environnement Canada. 2008. Données sur les substances du lot 7 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du lot 7 du Défi. Données préparées par Environnement Canada, Santé Canada, Programme des substances existantes.
Environnement Canada. 2009g. Rapport IGETA : 1,4-Dioxane. Avril 2009. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques..
Environnement Canada. 2009b. Mega Flush report : 1,4-Dioxane. Avril 2009. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry (consulté en avril 2009). Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
Ernstgård, L., Iregren, A., Sjögren, B., Johanson, G. 2006. Acute effects of exposure to vapours of dioxane in humans. Hum. Exp. Toxicol. 25:723-729.
[ESIS] European Chemical Substances Information System [base de données en ligne]. 2009. Base de données préparée par le Bureau européen des substances chimiques [consultée en mai 2009]. Accès : http://ecb.jrc.it/esis/
[EURAR] European Union risk assessment report. No CAS: 123-91-1: 1,4-dioxane [Internet]. 2002. Luxembourg : Office des publications officielles des Communautés européennes. Rapport final, le 16 octobre 2002. En page couverture : Centre commun de recherche de l'Union européenne [consulté en mars 2009]. Accès : http://ecb.jrc.ec.europa.eu/DOCUMENTS/ExistingChemicals/RISK_ASSESSMENT/
REPORT/dioxanereport038.pdf
Fairley, A., Linton, E.C., Ford-Moore, A.H. 1934. The toxicity to animals of 1:4 dioxan. J. Hyg. 34:486-501.
[FCC] Food Chemicals Codex. 2008. Food Chemicals Codex 6e édition, U.S. Pharmacopeia. The United States Pharmacopeial Convention, 12601, Twinbrook Parkway, Rockville (MD) 20852.
Fellin, P., Otson, R. 1997. Emissions of VPOC from residences in the metropolitan Toronto area. In : Proceedings of the Air and Waste Management Association’s 90th Annual Meeting. Pittsburgh (PA) : AWMA.
Fisher, J., Mahle, D., Bankston, L., Greene, R., Gearhart, J. 1997. Lactational transfer of volatile chemicals in breast milk. Am. Ind. Hyg. Assoc. J. 58:425-431.
Frantík, E., Hornychová, M., Horváth, M. 1994. Relative acute neurotoxicity of solvents: isoeffective air concentrations of 48 compounds evaluated in rats and mice. Environ. Res.66:173185.
Fuh, C., Lai, M., Tsai, H.Y., Chang, C.M. 2005. Impurity analysis of 1,4-dioxane in nonionic surfactants and cosmetics using headspace solid phase microextraction coupled with gas. J. Chromatogr. A 1071(1-2):141.
Galloway, S.M., Armstrong, M.J., Reuben, C., Colman, S., Brown, B., Cannon, C., Bloom, A.D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, B.H., Resnick, M.A., Anderson, B., Zeiger, E. 1987. Chromosome aberrations and sister chromatid exchanges in Chinese hamster ovary cells: evaluations of 108 chemicals. Environ. Mol. Mutagen. 10(Suppl. 10):1-37.
Geiger, D.L., Brooke, L.T., Call, D.J. 1990. Acute toxicities of organic chemicals to fathead minnows (Pimephales promelas), vol. 5. Superior (WI) : University of Wisconsin-Superior, Center for Lake Superior Environmental Studies. 332 p.
Giavini, E., Vismara, C., Broccia, M.L. 1985. Teratogenesis study of dioxane in rats. Toxicol. Lett. 26:85-88.
Gingell, R., Boatman, R.J., Bus, J.S., Cawley, T.J., Knack, J.B., Krasavage, W.J., Skoulis, H.P., Stack, C.R., Tyler, T.R. 1994. Glycol ethers and other selected glycol derivatives. In : Clayton, G.D., Clayton, F.E. (éd.) Patty’s industrial hygiene and toxicology, vol. 2 (Part D). 4e éd. New York (NY) : John Wiley & Sons Inc. p. 2761-2966.
Goldberg, M.E., Johnson, H.E., Pozzani, U.C., Smyth, H.F. 1964. Effect of repeated inhalation of vapors of industrial solvents on animal behavior. I. Evaluation of nine solvent vapors on poleclimb performance in rats. Am. Ind.Hyg. Assoc. J. 25:369-375.
Golder Associates. 1987. Testing of specific organic compounds in soils in background in urban areas. Oakville (Ont.) : Golder Associates.
Goldsworthy, T.L., Monticello, T.M., Morgan, K.T., Bermudez, E., Wilson, D.M., Jäckh, R., Butterworth, B.E. 1991. Examination of potential mechanisms of carcinogenicity of 1,4-dioxane in rat nasal epithelial cells and hepatocytes. Arch. Toxicol.65:1-9.
Gouvernement du Japon. 2004. Chemicals in the environment [en ligne]. Tokyo (Japon) : Gouvernement du Japon, ministère de l'Environnement, Département de la santé environnementale. [consulté en mars 2009].
Gross, E. 1938. The individual solvents: dioxane (diethylene dioxide). In : Lehmann, K.B., Flury, F. (éd.) Toxicology and hygiene of industrial solvents. [traduction par King, E., Smyth, H.F. Jr]. Berlin (Allemagne) : Springer. p. 263-307.
Hansch, C., Leo, A., Hoekman, D. 1995. Exploring QSAR – Hydrophobic, electronic, and steric constants. Washington (DC) : American Chemical Society. [cité dans HSDB, 2009].
Hansen, J. 1993. The industrial use of selected chemicals and risk of cancer 1970-1984. Copenhagen (Danemark) : At-salg (en danois). [cité dans NICNAS, 1998].
Hansen, J., Schneider, T., Olsen, J.H., Laursen, B. 1993. Availability of data on humans potentially exposed to suspected carcinogens in the working environment. Pharmacol. Toxicol. 72(Suppl.):77-85.
Harkov, R., Kebbekus, B., Bozzelli, J.W., Lioy, P.J. 1984. Measurement of selected volatile organic compounds at three locations in New Jersey during the summer season. J. Air Pollut. Control Assoc. 33:1177-1183.
Hartung, R. 1989. Health and environmental effects assessment for 1,4-dioxane. Ann Arbor (MI) : Gelman Sciences Inc.
Haworth, S., Lawlor, T., Mortelmans, K., Speck, W., Zeiger, E. 1983. Salmonella mutagenicity test results for 250 chemicals. Environ. Mutagen. Supp. 1:1-10.
Heidelberger, C., Freeman, A.E., Pienta, R.J., Sivak, A., Bertram, J.S., Casto, B.C., Dunkel, V.C., Francis, M.W., Kakunaga, T., Little, J.B., Schechtman, L.M. 1983. Cell transformation by chemical agents – a review and analysis of the literature. Mutat. Res. 114:283-385.
Heil, J., Reifferscheid, G. 1992. Detection of mammalian carcinogens with an immunological DNA synthesis-inhibition test.
Hellmer, L., Bolcsfoldi, G. 1992. An evaluation of the E. coli K-12 uvrB/recA DNA repair host-mediated assay. I. In vitro sensitivity of the bacteria to 61 compounds. Mutat. Res. 272:145-160.
Hoch-Ligeti, C., Argus, M.F. 1970. Effect of carcinogens on the lung of guinea pigs. In : Nettesheim, P., Hanna, M.G. Jr, Deatherage, J.W. Jr (éd.) Morphology of experimental respiratory carcinogenesis. AEC Symposium Series No. 21 (CONF-700501). Springfield (VA) : National Technical Information Service. p. 267-279.
Hoch-Ligeti, C., Argus, M.F., Arcos, J.C. 1970. Induction of carcinomas in the nasal cavity of rats by dioxane. Br. J. Cancer 24:164-167.
[HSDB] Hazardous Substances Data Bank [base de données en ligne]. 1983. Bethesda (MD) : National Library of Medicine (US). [mise à jour en 1998; consultée en février 2009]. Accès : http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?HSDB
[IARC] International Agency for Cancer Research. 1999. 1,4-Dioxane. IARC Monogr. Eval. Carcinog. Risks. Hum.71:589-602.
Igarashi, H., Northover, A.N. 1987. Increases in opacity and thickness induced by surfactants and other chemicals in the bovine isolated cornea. Toxicol. Lett. 39:249-254.
[JBRC] Japan Bioassay Research Center. 1998a. Two-week studies of 1,4-dioxane in F344 rats and BDF1 mice (drinking water studies). Kanagawa (Japon) : JBRC. [cité dans EURAR, 2002].
[JBRC] Japan Bioassay Research Center. 1998b. Thirteen-week studies of 1,4-dioxane in F344 rats and BDF1 mice (drinking water studies). Kanagawa (Japon) : JBRC. [cité dans EURAR, 2002].
[JBRC] Japan Bioassay Research Center. 1998c. Two-year studies of 1,4-dioxane in F344 rats and BDF1 mice (drinking water studies). Kanagawa (Japon) : JBRC. [addendum dans Yamazaki et al.publié 1994]. [cité dans EURAR, 2002].
Johnson, R., Tietge, J., Stokes, G., Lothenbach, D. 1993. The Medaka Carcinogenesis Model. In: Tech. Rep. 9306, Compendium of the FY1988 & FY1989 Res. Ft. Frederick (MD) : Rev. for the Res. Methods Branch, US Army Biomedical Res. & Dev. Lab, p. 147-172 (US NTIS AD-A272667). [Cité dans ECOTOX, 2007]
Johnstone, R.T. 1959. Death due to dioxane? AMA Arch. Ind. Health. 20:445-447.
Kanada, M., Miyagawa, M., Sato, M., Hasegawa, H., Honma, T. 1994. Neurochemical profile of effects of 28 neurotoxic chemicals on the central nervous system in rats. (1) Effects of oral administration on brain contents of biogenic amines and metabolites. Ind. Health 32:145-164.
Kano, H., Umeda, Y., Saito, M., Senoh, H., Ohbayashi, H., Aiso, S., Yamazaki, K., Nagano, K., Fukushima, S. 2008. Thirteen-week oral toxicity of 1,4-dioxane in rats and mice. J. Toxicol. Sci. 33:141-153.
Kasai, T., Saito, M., Senoh, H., Umeda, Y., Aiso, S., Ohbayashi, H., Nishizawa, T., Nagano, K., Fukushima, S. 2008. Thirteen-week inhalation toxicity of 1,4-dioxane in rats. Inhal. Toxicol. 20:961-971.
Kasai, T., Kano, H., Umeda, Y., Sasaki, T., Ikawa, N., Nishizawa, T., Nagano, K., Arito, H., Nagashima, H., Fukushima, S. 2009. Two-year inhalation study of carcinogenicity and chronic toxicity of 1,4-dioxane in male rats. Inhal. Toxicol.21:889-897.
Kawata, K., Ibaraki, T., Tanabe, A., Yasuhara, A. 2003. Distribution of 1,4-dioxane and N,N-dimethylformamide in river water from Niigata, Japan. Environ. Contam. Toxicol.70:876-882.
Khudoley, V.V., Mizgireuv, I., Pliss, G.B. 1987. The study of mutagenic activity of carcinogens and other chemical agents with Salmonella typhimurium assays: testing of 126 compounds. Arch. Geschwulstforsch 57:453-462.
King, M.E., Shefner, A.M., Bates, R.R. 1973. Carcinogenesis bioassay of chlorinated dibenzodioxins and related chemicals. Environ. Health Perspect. 5:163-170.
Kitchin, K.T., Brown, J.L. 1990. Is 1,4-dioxane a genotoxic carcinogen? Cancer Lett. 53:67-71.
Kociba, R.J., McCollister, S.B., Park, C., Torkelson, T.R., Gehring, P.J. 1974. 1,4-Dioxane. I. Results of a 2-year ingestion study in rats. Toxicol. Appl. Pharmacol. 30:275-286.
Kramer, C.G., Ott, M.G., Fulkerson, J.E., Hicks, N., Imbus, H.R. 1978. Health of workers exposed to 1,1,1-trichloroethane: a matched-pair study. Arch. Environ. Health 33:331-342.
Kurl, R.N., Poellinger, L., Lund, J., Gustafsson, J.A. 1981. Effects of dioxane on RNA synthesis in the rat liver. Arch. Toxicol. 49:29-33.
Kwan, K.K., Dutka, B.J., Rao, S.S., Liu, D. 1990. Mutatox test: a new test for monitoring environmental genotoxic agents. Environ. Pollut. 65:323-332.
Lane, R.W., Riddle, B.L., Borzelleca, J.F. 1982. Effects of 1,2-dichloroethane and 1,1,1-trichloroethane in drinking water on reproduction and development in mice. Toxicol. Appl. Pharmacol. 63:409-421.
Leung, H., Paustenbach, D.J. 1990. Cancer risk assessment for dioxane based upon a physiologically-based pharmacokinetic approach. Toxicol. Lett. 51:147-162.
Lundberg, I., Högberg, J., Kronevi, T., Holmberg, B. 1987. Three industrial solvents investigated for tumor promoting activity in the rat liver. Cancer Lett. 36:29-33.
Makino, R., Kawasaki, H., Gamo, M., Nakanishi, J. 2006. Estimating health risk from exposure to 1,4-dioxane in Japan. Environ. Sci. 13:43-58.
Maronpot, R.R., Shimkin, M.B., Witschi, H.P., Smith, L.H., Cline, J.M. 1986. Strain A mouse pulmonary tumor test results for chemicals previously tested in the National Cancer Institute carcinogenicity tests. J. Natl. Cancer Inst.6:1101-1112.
Marzulli, F.N., Anjo, D.M., Maibach, H.I. 1981. In vivoskin penetration of 2,4-toluenediamine, 2,4-diaminoanisole, 2-nitro-p-phenylenediamine, p-dioxane and n-nitrosodiethanolamine in cosmetics. Cosmet. Toxicol. 19:743-747.
McFee, A.F., Abbott, M.G., Gulati, D.K., Shelby, M.D. 1994. Results of mouse bone marrow micronucleus studies on 1,4-dioxane. Mutat. Res. 322:145-148.
McGregor, D.B., Brown, A.G., Howgate, S., McBride, D., Riach, C., Caspary, W.J. 1991. Responses of the L5178Y mouse lymphoma cell forward mutation assay. V: 27 coded chemicals. Environ. Mol. Mutagen. 17:196-219.
Mikheev, M.I., Minkina, N.A., et al. 1979. Occupational health questions in the electronics industry. In : Proceedings from the Erisman Institute of Hygiene. p. 33-38 (en russe). [cité dans NICNAS, 1998].
Mikheev, M.I., Gorlinskaya, Y.E.P., Solovyova, T.V. 1990. The body distribution and biological action of xenobiotics. J. Hyg. Epidemiol. Microbiol. Immunol. 34:329-336.
Mirkova, E.T. 1994. Activity of the rodent carcinogen 1,4-dioxane in the mouse bone marrow micronucleus assay. Mutat. Res. 322:142-144.
[MITI] Ministry of International Trade & Industry (JP). 1992. Biodegradation and bioaccumulation: data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Ministry of International Trade & Industry, Basic Industries Bureau, Chemical Products Safety Division, Chemicals Inspection & Testing Institute.
Miyagawa, M., Shirotori, T., Tsuchitani, M., Yoshikawa, K. 1999. Repeat-assessment of 1,4-dioxane in a rat hepatocyte replicative DNA synthesis (RDS) test: evidence for stimulus of hepatocyte proliferation. Exp. Toxicol. Pathol. 51:555-558.
Morita, T., Hayashi, M. 1998. 1,4-Dioxane is not mutagenic in five in vitro assays and mouse peripheral blood micronucleus assay, but is in mouse liver micronucleus assay. Environ. Mol. Mutagen. 32:269-280.
Mungikar, A.M., Pawar, S.S. 1978. Induction of the hepatic microsomal mixed function oxidase system in mice by p-dioxane. Bull. Environ. Contam. Toxicol.20:797-804.
Muñoz, E.R., Barnett, B.M. 2002. The rodent carcinogens 1,4-dioxane and thiourea induce meiotic nondisjunction in Drosophila melanogaster females. Mutat. Res.517:231-238.
Nannelli, A., De Rubertis, A., Longo, V., Gervasi, P.G. 2005. Effects of dioxane on cytochrome P450 enzymes in liver, kidney, lung and nasal mucosa of rat. Arch. Toxicol.79(2):74-82.
National Cancer Institute (États-Unis). 1978. Bioassay of 1,4-dioxane for possible carcinogenicity. NCI-CG-TR-80 (PB 285 711). Rockville (MD) : U.S. Department of Health, Education and Welfare, Public Health Service, National Institutes of Health, National Cancer Institute.
[NCI] National Chemical Inventories (base de données sur cédérom). 2006. Columbus (OH) : American Chemical Society. Accès : http://www.cas.org/products/cd/nci/index.html
Nestmann, E.R., Otson, R., Kowbel, D.J., Bothwell, P.D., Harrington, T.R. 1984. Mutagenicity in a modified Salmonella assay of fabric protecting products containing 1,1,1-trichloroethane. Environ. Mutagen. 6:71-80.
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 1998. 1,4-Dioxane. Priority Existing Chemical No. 7. Full public report [en ligne]. Australie. [consulté en mars 2009]. Accès : http://www.nicnas.gov.au/Publications/CAR/PEC/PEC7/PEC7_Full_Report_PDF.pdf
[NIOSH] National Institute for Occupational Safety and Health. 1977. Occupational exposure to dioxane: criteria for an occupational standard. DHEW Publication No. 77-226. Cincinnati (OH) : NIOSH. p. 193. [cité dansNICNAS, 1998].
Nishimura, T., Iizuka, S., Kibune, N., Ando, M. 2004. Study of 1,4-dioxane intake in the total diet using the market-basket method. J. Health Sci. 50(1):101-107.
Nishimura, T., Iizuka, S., Kibune, N., Ando, M., Magara, Y. 2005. Study of 1,4-dioxane intake in the total diet. J. Health Sci. 51:514-517.
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2006. Gatineau (Qc) : Environnement Canada. [consulté le 20 avril 2009]. Accès : http://www.ec.gc.ca/inrp-npri/
[NTP] National Toxicology Program (États-Unis). 2005. Substance profile for chromium hexavalent compounds. In : Report on carcinogens. 11e éd. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Accès : http://ntp.niehs.nih.gov/index.cfm?objectid=32BA9724-F1F6-975E-7FCE50709CB4C932
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software
[OCA] Organic Consumer Association. 2009. Results of testing for 1,4-dioxane by gas chromatography/mass spectrometry. [consulté en mars 2009]. Accès : http://www.organicconsumers.org/bodycare/DioxaneResults09.pdf
O’Neil, M.J., Smith, A., Heckelman, P.E., Budavari, S. (éd.) 2001. The Merck index: an encyclopedia of chemicals, drugs, and biologicals. 13e éd. Hoboken (NJ) : John Wiley & Sons. [cité dans HSDB, 2009].
Otson, R. 1987. Purgeable organics in Great Lakes raw and exposed water. Int. J. Environ. Anal. Chem. 31(1):41.
Park, J.H., Abul, H., Pascal, C., David, F., Carr, P.W. 1987. Experimental reexamination of selected partition coefficients from Rohrschneider’s data set. Anal. Chem. 59:1970-1976. [cité dans HSDB, 2009].
Pawar, S.S., Mungikar, A.M. 1978. Dioxane toxicity & hepatic mixed function oxidase enzymes in mice. Ind. J. Exp. Biol. 16:54-56.
Pereira, M.A., Herren, S.L., Britt, A.L., Khourg, M.M. 1982. Initiation/promotion bioassay in rat liver: use of gamma glutamyltranspeptidase-positive foci to indicate carcinogenic activity. Toxicol. Pathol. 10:11-18. [cité dans ATSDR, 2007].
Perone, V.B., Scheel, L.D., Tolos, W.P. 1976. Dioxane toxicity. Rapport inédit. Cincinnati (OH) : National Institute for Occupational Safety and Health. [cité dans NICNAS, 1998].
Perrin, D.D. 1965. Dissociation constants of organic bases in aqueous solution. London (Royaume-Uni) : Butterworths.
[PhysProp] Interactive PhysProp Database [base de données en ligne]. 2006. Syracuse (NY) : Syracuse Research Corporation [consultée en avril 2009]. Accès : http://www.syrres.com/what-we-do/databaseforms.aspx?id=386
Reitz, R.H., McCroskey, P.S., Park, C.N., Andersen, M.E., Gargas, M.L. 1990. Development of a physiologically based pharmacokinetic model for risk assessment with 1,4-dioxane. Toxicol. Appl. Pharmacol. 105:37-54.
Riddick, J.A., Bunger, W.B., Sakano, T.K. 1986. Techniques of chemistry. Vol. II, Organic solvents. 4th ed. New York (NY) : John Wiley and Sons. [cité dans HSDB, 2009].
Robinson, J., Ciurczak, E. 1980. Direct gas chromatographic determination of 1,4-dioxane in ethoxylated surfactants. J. Soc. Cosmetic. Chem. 31:329-337.
Roy, S.K., Thilagar, A.K., Eastmond, D.A. 2005. Chromosome breakage is primarily responsible for the micronuclei induced by 1,4-dioxane in the bone marrow and liver of young CD-1 mice. Mutat. Res. 586:28-37.
Sai, K., Takagi, A., Umemura, T., Kurokawa, Y., Kasai, H. 1989. Detection of 8-hydroxydeoxyguanosine in rat kidneys exposed with renal carcinogens. Mutat. Res. 216:373.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada. 2007. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques – mars 2007 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation [consulté en 2009]. Accès : http://www.hc-sc.gc.ca/cps-spc/person/cosmet/info-ind-prof/_hot-list-critique/hotlist-liste-fra.php
Santé et Bien-être social Canada. 1990. L'allaitement maternel au Canada : pratiques et tendances. Ottawa (Ont.) : chez l'auteur. No de catalogue H39-199/1990F. [consulté dans Santé Canada, 1998].
Sasaki, Y.F., Sekihashi, K., Izumiyama, F., Nishidate, E., Saga, A., Ishida, K., Tsuda, S. 2000. The comet assay with multiple mouse organs: comparison of comet assay results and carcinogenicity with 208 chemicals selected from the IARC monographs and U.S. NTP Carcinogenicity Database. Crit. Rev. Toxicol.30:629-799.
Scalia, S. 1991. Assay of 1,4-dioxane in commercial cosmetic products by HPLC. Farmaco 46(11):1365-1670.
Scalia, S., Testoni, F., Frisina, G., Guarneri, M. 1992. Assay of 1,4-dioxane in cosmetic products by solid-phase extraction and GC-MS. J. Soc. Cosmet. Chem. 43(4):207-213. [cité dans VCCEP, 2007].
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2009. Disponible auprès de Santé Canada, Division des cosmétiques.
Sekizawa, J., Yasuhara, K., Suyama, Y., Yamanaka, S., Tobe, M., Nishimura, M. 1994. A simple method for screening assessment of skin and eye irritation. J. Toxicol. Sci. 19:25-35.
Sheu, C.W., Moreland, F.M., Lee, J.K., Dunkel, V.C. 1988. In vitro BALB/3T3 cell transformation assay of nonoxynol-9 and 1,4-dioxane. Environ. Mol. Mutagen. 11:41-48.
Silverman, L., Schulte, H.F., First, M.W. 1946. Further studies of sensory response to certain industrial solvent vapors. J. Ind. Hyg. Toxicol. 28:262-266.
Simazaki, D., Asami, M., Nishimura, T., Kunikane, S., Aizawa, T., Magara, Y. 2006. Occurrence of 1,4-dioxane and MTBE in drinking water sources in Japan. Water Supply 6(2):47-53.
Sina, J.F., Bean, C.L., Dysart, G.R., Taylor, V.L., Bradley, M.O. 1983. Evaluation of the alkaline elution/rat hepatocyte assay as a predictor of carcinogenic/ mutagenic potential. Mutat. Res. 113:357-391.
Singhvi, R., Magriples, N., Schuetz, S., McGuire, N. 1999. Indoor air monitoring in homes built on a former wood treating facility. Proceeding of the 8th International Conference on Indoor air Quality and Climate. Du 8 au 13 août 1999. Edinburgh (Écosse) : Construction Research Communications, Inc.
Sonneck, H.J. 1964. Kontaktekzem durch Dioxan in überwiegender lineärer Anordnung. Dermatol. Wochenschr 1:24-27. [cité dans EURAR, 2002].
Springborn Laboratories Inc. 1989. 1,4-Dioxane – Chronic toxicity to Ceriodaphnia dubia under static renewal conditions. SLI Report 89-9-3089. Le 15 septembre 1989. Wareham (MA) : Springborn Laboratories Inc. [cité dans EURAR, 2002].
Steffan, R.J. 2007. Biodegradation of 1,4-Dioxane. Shaw Environmental, Inc.. Accès : http://stinet.dtic.mil/cgi-bin/GetTRDoc? AD=ADA479704&Location=U2&doc=GetTRDoc.pdf
Stickney, J.A., Sager, S.L., Clarkson, J.R., Smith, L.A., Locey, B.J., Bock, M.J., Hartung, R., Olp, S.F. 2003. An updated evaluation of the carcinogenic potential of 1,4-dioxane. Regul. Toxicol. Pharmacol. 38:183-195.
Stoner, G.D., Conran, P.B., Greisiger, E.A., Stober, J., Morgan, M., Pereira, M.A. 1986. Comparison of two routes of chemical administration on the lung adenoma response in strain A/J mice. Toxicol. Appl. Pharmacol. 82:19-31.
Stott, W.T., Quast, J.F., Watanabe, P.G. 1981. Differentiation of the mechanisms of oncogenicity of 1,4-dioxane and 1,3-hexachlorobutadiene in the rat. Toxicol. Appl. Pharmacol. 60:287-300.
Sullivan, L.J. 1994. Construction fatality: application of a concrete sealant. Appl. Occup. Environ. Hyg.9:681-682.
Sweeney, L.M., Thrall, K.D., Poet, T.S., Corley, R.A., Weber, T.J., Locey, B.J., Clarkson, J., Sager, S., Gargas, M.L. 2008. Physiologically based pharmacokinetic modeling of 1,4-dioxane in rats, mice and humans. Toxicol. Sci. 101:32-50.
Tanabe, A., Kawata, K. 2008. Determination of 1,4-dioxane in household detergents and cleaners. J. AOAC Int.91(2):439-444.
[TaPL3] Long Range Transport and Persistence Level III model [en ligne]. 2000. Version 2.10. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/TaPL3.html
Thiess, A.M., Tress, E., Fleig, I. 1976. Arbeitsmedizinische Untersuchungsergebnisse von Dioxan-exponierten Mitarbeitern. Arbeitsmed. Sozialmed. Präventivmed. 11:36-46. [cité dans EURAR, 2002].
Thiess, A.M., Schwegler, H., Fleig, I., Stocker, W.G. 1981. Mutagenicity study of workers exposed to alkylene oxides (ethylene oxide/propylene oxide) and derivatives. J. Occup. Med.23:343-347.
Thurman, G.B., Simms, B.G., Goldstein, A.L., Kilian, D.J. 1978. The effects of organic compounds used in the manufacture of plastics on the responsivity of murine and human lymphocytes. Toxicol. Appl. Pharmacol. 44:617-641.
Tinwell, H., Ashby, J. 1994. Activity of 1,4-dioxane in mouse bone marrow micronucleus assays. Mutat. Res. 322:148-150.
[TOPKAT] Toxicity Prediction Program by Komputer Assisted Technology. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. Accès : http://www.accelrys.com/products/topkat/index.html
Torkelson, T.R., Leong, B.K.J., Kociba, R.J., Richter, W.A., Gehring, P.J. 1974. 1,4-Dioxane. II. Results of a 2-year inhalation study in rats. Toxicol. Appl. Pharmacol. 30:287-298.
[TRI] Toxics Release Inventory Program [en ligne]. 2006. Washington (DC) : U.S. Environmental Protection Agency. [consulté en mars 2009]. Accès : http://www.epa.gov/triexplorer/
[TSCATS] Toxic Substances Control Act Test Submission. 1989. OTS0000719. No d'ID du nouveau document FYI-OTS-1089-0719, le 17 octobre 1989, Dow Chemical Co., D004057, 0158-0179. [cité dans EURAR, 2002].
Uno, Y., Takasawa, H., Miyagawa, M., Inoue, Y., Murata, T., Yoshikawa, K. 1994. An in vivo-in vitro replicative DNA synthesis (RDS) test using rat hepatocytes as an early prediction assay for nongenotoxic hepatocarcinogens screening of 22 known positives and 25 noncarcinogens. Mutat. Res.320:189-205.
[US EPA] US Environmental Protection Agency. 1990. 1,4-Dioxane (CAS RN 123-91-1). Washington (DC) : US EPA, Integrated Risk Information System (IRIS). [consulté en mai 2009]. Accès : http://www.epa.gov/ncea/iris/subst/0326.htm
[VCCEP] Voluntary Children’s Chemical Evaluation Program. 2007. Tiers 1, 2, and 3 pilot submission for 1,4-dioxane (no CAS 123-91-1) [en ligne]. Washington (DC) : U.S. Environmental Protection Agency. [consulté en mars 2009]. Accès : http://www.tera.org/peer/VCCEP/p-Dioxane/p-Dioxane%20Submission.pdf
Verschueren, K. 1983. Handbook of environmental data on organic chemicals. 2e éd. New York (NY) : Van Nostrand Reinhold Co.
Wirth, W., Klimmer, O. 1937. On the toxicology of organic solvents. 1,4-Dioxane (diethylene dioxide). Arch. Gewerbepathol. Gewerbehyg. 17:192-206. [cité dans EURAR, 2002].
Woo, Y., Arcos, J.C., Argus, M.F. 1977. Metabolism in vivo of dioxane: identification of p-dioxane-2-one as the major urinary metabolite. Biochem. Pharmacol.26:1535-1538.
Woo, Y., Argus, M.F., Arcos, J.C. 1978. Effect of mixed-function oxidase modifiers on metabolism and toxicity of the oncogen dioxane. Cancer Res. 38:1621-1625.
Yamazaki, K., Ohno, H., Asakura, M., Narumi, A., Ohbayashi, H., Fujita, H., Ohnishi, M., Katagiri, T., Senoh, H., Yamanouchi, K., Nakayama, E., Yamamoto, S., Noguchi, T., Nagano, K., Enomoto, M., Sakabe, H. 1994. Two-year toxicological and carcinogenesis studies of 1,4-dioxane in F344 rats and BDF1 mice – drinking studies. In : Sumino, K., Sato, S. (éd) Proceedings of the Second Asia-Pacific Symposium on Environmental and Occupational Health, du 22 au 24 juillet 1993, Kobe. Kobe (Japon) : University School of Medicine, International Center for Medical Research. p. 193-198.
Yant, W.P., Schrenk, H.H., Waite, C.P., Patty, F.A. 1930. Acute response of guinea pigs to vapors of some new commercial organic compounds. VI. Dioxan. Public Health Rep. 45:2023-2032. [cité dans EURAR, 2002].
Yoon, J.S., Mason, J.M., Valencia, R., Woodruff, R.C., Zimmering, S. 1985. Chemical mutagenesis testing in Drosophila. IV. Results of 45 coded compounds tested for the National Toxicology Program. Environ. Mutagen.7:349-367.
Young, J.D., Braun, W.H., Gehring, P.J., Horvath, B.S., Daniel, R.L. 1976. Short communication. 1,4-Dioxane and ß-hydroxyethoxyacetic acid excretion in urine of humans exposed to dioxane vapors. Toxicol. Appl. Pharmacol. 38:643-646.
Young, J.D., Braun, W.H., Rampy, L.W., Chenoweth, M.B., Blau, G.E. 1977. Pharmacokinetics of 1,4-dioxane in humans. J. Toxicol. Environ. Health 3:507-520.
Young, J.D., Braun, W.H., Gehring, P.J. 1978. The dose-dependent fate of 1,4-dioxane in rats. J. Environ. Pathol. Toxicol.2:263-282.
Zimmermann, F.K., Mayer, V.W., Scheel, I., Resnick, M.A. 1985. Acetone, methyl ethyl ketone, ethyl acetate, acetonitrile and other polar aprotic solvents are strong inducers of aneuploidy in Saccharomyces cerevisiae. Mutat. Res. 149:339-351.
Annexe 1 : Limites supérieures des estimations de l'absorption quotidienne de 1,4dioxane par la population générale du Canada
| Voie d'exposition | Absorption estimée (µg/kg-p.c. par jour) de 1,4dioxane par divers groupes d'âge | |||||||
|---|---|---|---|---|---|---|---|---|
| 0 à 6 mois1 | 0,5 à 4 ans4 | 5 à 11 ans5 | 12 à 19 ans6 | 20 à 59 ans7 | Plus de 60 ans8 | |||
| Lait maternel2 | Lait maternisé3 | Pas nourris au lait maternisé | ||||||
| 1 Par hypothèse, poids de 7,5 kg, absorption de l'air de 2,1 m3 par jour, absorption d'eau de 0,8 L par jour (lait maternisé) ou de 0,3 L par jour (autres que lait maternisé), ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998). 2 Aucune donnée n'a été signalée sur les doses de 1,4-dioxane dans le lait maternel. 3 Pour les poupons nourris au lait maternisé, l'absorption d'eau est la quantité exigée pour reconstituer le lait maternisé. Aucune donnée n'a été signalée sur les doses de 1,4dioxane dans le lait maternisé, mais la limite de détection pour le 1,4dioxane dans l'eau potable a été utilisée dans ce modèle (Otson, 1987). Environ 50 % des enfants non nourris au lait maternisé ont commencé à manger des aliments solides à 4 mois, et 90 % ont commencé à 6 mois (SNBS, 1990). 4 Par hypothèse, poids de 15,5 kg, absorption de l'air de 9,3 m3 par jour, absorption d'eau de 0,7 L par jour et ingestion de 100 mg de particules de sol par jour (Santé Canada, 1998). 5 Par hypothèse, poids de 31 kg, absorption de l'air de 14,5 m3 par jour, absorption d'eau de 1,1 L par jour et ingestion de 65 mg de particules de sol par jour (Santé Canada, 1998). 6 Par hypothèse, poids de 59,4 kg, absorption de l'air de 15,8 m3 par jour, absorption d'eau de 1,2 L par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998). 7 Par hypothèse, poids de 70,9 kg, absorption de l'air de 16,2 m3 par jour, absorption d'eau de 1,5 L par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998). 8 Par hypothèse, poids de 72,0 kg, absorption de l'air de 14,3 m3 par jour, absorption d'eau de 1,6 L par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998). 9 Le 1,4-dioxane a été mesuré dans l'air ambiant au Canada et aux ÉtatsUnis à proximité de sources ponctuelles. La concentration la plus élevée mesurée ailleurs qu'à proximité d'une source ponctuelle, soit de 0,646 µg/m3 dans la région du Grand Toronto sur une période de trois mois, a été utilisée pour mesurer la dose de 1,4dioxane dans l'air ambiant (Fellin et Otson, 1997). L'hypothèse selon laquelle les Canadiens passent 3 heures par jour à l'extérieur a été utilisée (Santé Canada, 1998). 10 Le 1,4-dioxane a été mesuré dans les habitations au Canada et aux ÉtatsUnis. En 1996, il a été décelé dans 44 habitations dans la région du Grand Toronto au cours d'une période de trois mois. La concentration maximale mesurée de 1,4-dioxane était de 0,685 µg/m3 (Fellin et Otson, 1997). L'hypothèse selon laquelle les Canadiens passent 21 heures par jour à l'intérieur a été utilisée (Santé Canada, 1998). 11 Le 1,4-dioxane a été décelé dans des sources d'eau potable de dix communautés différentes dans la région des Grands Lacs au Canada. Les concentrations de 1,4dioxane mesurées dans des échantillons d'eau potable prélevés de 42 sources d'eau potable municipale non traitée et de 42 sources d'eau potable municipale exposée étaient inférieures à la limite de détection de 10 µg/L, selon l'approche la plus prudente employée (Otson, 1987). 12 Aucune concentration de 1,4dioxane n'a été décelée dans les aliments au Canada. Des études japonaises avaient signalé des doses de 1,4-dioxane dans les aliments, mais on a estimé que l’inclusion de ces données était inutile en raison des différences entre les absorptions alimentaires au Canada et au Japon, des différences d’utilisation d’additifs alimentaires au moment de ces études et des concentrations éventuelles de 1,4-dioxane dans l’eau, ainsi que des limites de ces études. Le 1,4-dioxane peut exister dans certains produits alimentaires comme impuretés issues des additifs alimentaires (voir l’annexe 2), mais le présent rapport n’inclut pas une telle donnée dans son calcul d’absorption de 1,4-dioxane. 13 Des traces de 1,4-dioxane ont été mesurées dans le sol au Canada et au Japon. Des concentrations de 30 échantillons prélevés au sudest de l'Ontario étaient inférieures à la limite de détection, donc la limite de détection de 100 µg/kg a été utilisée pour calculer l'absorption de la substance à partir du sol (Golder Associates, 1987). |
||||||||
| Air ambiant9 | 0,2 | 0,05 | 0,04 | 0,02 | 0,02 | 0,02 | ||
| Air intérieur10 | 0,17 | 0,36 | 0,28 | 0,16 | 0,14 | 0,12 | ||
| Eau potable11 | 0,00 | 1,07 | 0,40 | 0,45 | 0,35 | 0,20 | 0,21 | 0,22 |
| Nourriture et beuvrages12 | – | – | – | – | – | – | – | – |
| Sol13 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | ||
| Absorption totale | 0,19 | 1,26 | 0,59 | 0,86 | 0,67 | 0,38 | 0,37 | 0,36 |
| Groupe d'âge (ans) | Sexe | Estimation de l'absorption moyenne de 1,4-dioxane par personne (µg/kg-p.c. par jour)3, 4, 5, 6 |
|---|---|---|
| 1 Communication personnelle, Direction des aliments, Santé Canada, 2009, source non citée. 2 L’estimation de l’absorption est pour le 1,4-dioxane comme impureté dans les additifs alimentaires autorisés (polysorbates 80, 65 et 60 et polyéthylène glycol) pour lesquels il existe actuellement une disposition dans le Règlement sur les aliments et drogues(Canada, 1978), selon la limite maximale de résidus (maximum de 10 mg/kg) de 1,4-dioxane dans ces additifs alimentaires établie dans le Food Chemicals Codex (FCC, 6e éd., 2008) et les données sur la consommation des aliments de la Continuing Survey of Food Intakes by Individuals (CSFII, 1994-1996, 1998). Les données du CSFII ont été utilisées car les catégories d’aliments correspondant aux aliments dans lesquels les polysorbates et le polyéthylène glycol sont permis comme additifs alimentaires conformément au Règlement sur les aliments et droguesétaient facilement accessibles, permettant ainsi d’estimer l’exposition éventuelle au 1,4-dioxane en raison de sa rémanence possible dans les aliments causée par sa présence à l’état d’impureté dans ces additifs alimentaires. Ces données sont considérées comme pertinentes pour estimer l'absorption selon le régime canadien. 3 Le secteur industriel n'a pas été consulté pour déterminer les concentrations actuelles de polysorbates ou de polyéthylène glycol dans les aliments pour lesquels il existe une disposition dans le Règlement sur les aliments et drogues. Par conséquent, toutes les estimations sont basées sur la dose maximale autorisée pour l'utilisation de polysorbates et de polyéthylène glycol dans chaque produit alimentaire et chaque catégorie d'aliments, selon le Règlement sur les aliments et drogues. 4 Le Règlement sur les aliments et droguesdresse la liste des additifs alimentaires de rechange (stabilisants) pouvant être utilisés dans certains aliments pour lesquels il existe une disposition pour l’utilisation de polysorbates. Par ailleurs, les additifs alimentaires, tels que les polysorbates et le polyéthylène glycol ne seront pas toujours utilisés dans les aliments pour lesquels ils sont autorisés (c’est-à-dire en cas de besoin technologique et de discrétion du fabricant). 5 Les polysorbates peuvent être utilisés dans des applications liées aux agents antimousses pouvant servir aux additifs alimentaires ou aux auxiliaires technologiques. Cependant, leur contribution à l’absorption de 1,4-dioxane à partir d’aliments dans ces utilisations est considérée comme beaucoup plus faible, même presque négligeable, relativement à celle de l’estimation d’absorption prudente faite pour les utilisations de polysorbates énumérées au titre 16 du Règlement sur les aliments et drogues. 6 Les estimations de l'absorption du 1,4-dioxane dans les aliments ne tiennent pas compte des pertes par volatilisation et du faible point d'ébullition du 1,4dioxane. Certains aliments transformés, par exemple, sont exposés à des températures plus élevées lors de la transformation des aliments, donc les doses résiduelles du 1,4dioxane devraient être inférieures dans ces conditions. |
||
| 1 à 4 | – | 0,335 |
| 5 à 11 | – | 0,287 |
| 12 à 18 | Hommes | 0,162 |
| 12 à 18 | Femmes | 0,125 |
| 31 à 50 | Mâles | 0,105 |
| 31 à 50 | Femmes | 0,088 |
Scénarios relatifs aux produits d'hygiène personnelle pour femmes
| Scénario basé sur des produits de consommation | Hypothèses | Estimation de l'exposition |
|---|---|---|
| Revitalisant capillaire | Inhalation (débit constant)
|
Concentration moyenne par événement = 1,68 × 10-5mg/m3 Dose chronique = 6,90 x 10-9 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 7,87 × 10-8 mg/kg-p.c. par jour | |
| Shampooing pour les cheveux | Inhalation (débit constant)
|
Concentration moyenne par événement = 0,00782 mg/m3 Dose chronique = 8,01 x 10-6 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 9,14 × 10-5 mg/kg-p.c. par jour | |
| Lotion hydratante pour la peau (crème pour le corps) | Inhalation (débit constant)
|
Concentration moyenne par événement = 2,25 × 10-3 mg/m3 Dose chronique = 1,16 x 10-3 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 1,69 x 10-3 mg/kg-p.c. par jour | |
| Gel de douche | Inhalation (débit constant)
|
Concentration moyenne par événement = 1,72 × 10-3 mg/m3 Dose chronique = 2,23 x 10-6 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 2,54 × 10-6 mg/kg-p.c. par jour | |
| Colorant capillaire | Inhalation (débit constant)
|
Concentration moyenne par événement = 1,39 à 4,64 mg/m3 Dose aiguë = 2,00 × 10-2 – 6,67 × 10-2mg/kg-p.c. |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose aiguë = 4,65 × 10-3 – 1,55 × 10-2mg/kg-p.c. |
Scénarios relatifs aux produits ménagers
| Scénario basé sur des produits de consommation | Hypothèses | Estimation de l'exposition |
|---|---|---|
| 1 RIVM, 2006 2 D'après Bronaugh, 1982 |
||
| Savon liquide pour lave-vaisselle | Inhalation (exposition à la vapeur par évaporation)
|
Concentration moyenne par événement = 8,89 × 10-3 mg/m3 Dose chronique = 2,24 x 10-4 mg/kg-p.c. par jour |
Exposition cutanée issue d'un contact direct avec le produit, application instantanée
|
Dose chronique = 6,51 x 10-5 mg/kg-p.c. par jour | |
| Paramètre ultime | Doses minimales avec effet1/Résultats |
|---|---|
| 1 CL50 = concentration létale médiane; DL50 = dose létale médiane; CME(N)O = concentration minimale avec effet (nocif) observé; DME(N)O = dose minimale avec effet (nocif) observé; CSE(N)O = concentration sans effet (nocif) observé; DSE(N)O = dose sans effet (nocif) observé | |
| Essais sur des animaux de laboratoire et in vitro | |
| Toxicité aiguë | DL50 la plus faible, par voie orale(lapin, chat) = 2 000 mg/kg-p.c. (NICNAS, 1998). [études supplémentaires : Argus et al., 1973; Pawar et Mungikar, 1978; NICNAS, 1998; EURAR, 2002; ATSDR, 2007] DMEO par voie orale la plus faible (rat) = 1 050 mg/kg-p.c., d'après des effets subtils sur le système nerveux central par perturbation de certains neurotransmetteurs chez des rats mâles (Kanada et al., 1994). [études supplémentaires : Kitchin et Brown, 1990; DeRosa et al., 1996] DL50 par voie cutanée la plus faible (lapin) = 7 600 mg/kg-p.c. (NICNAS, 1998). [études supplémentaires : NICNAS, 1998] CL50 la plus faible par inhalation(souris, 2 h) = 37 000 mg/m3 (EURAR, 2002). [études supplémentaires : NICNAS, 1998; EURAR, 2002] CMEO la plus faible par inhalation (rat, 4 h) = 1 000 ppm (36 000 mg/m3), d'après un accroissement considérable de l'activité d'enzymes sériques comme la transaminase glutamique oxaloacétique, la transaminase glutamique/pyruvique et l'ornithine carbamyl transférase chez des rats mâles CD (Drew et al., 1978). [études supplémentaires : Frantík et al., 1994] |
| Dose toxique à court terme pour l'exposition répétée | DMEO orale la plus faible = 400 mg/kg-p.c. par jour (seule dose à l'essai); fondée sur un accroissement de l'activité enzymatique du cytochrome P450 dans le foie, les reins et la muqueuse nasale des rats mâles Sprague-Dawley (SD) ayant reçu du 1,4dioxane à une dose de 1,5 % (vol/vol) dans l'eau potable, ce qui correspond à 400 mg/kg-p.c. par jour pendant 10 jours (Nannelli et al., 2005). [études supplémentaires : Fairley et al., 1934; Mungikar et Pawar, 1978; Pawar et Mungikar, 1978; Lundberg et al., 1987; Goldsworthy et al., 1991; JBRC, 1998a; NICNAS, 1998; Roy et al., 2005] Au cours d'une étude limitée en temps sur l'exposition par voie cutanée, quatre lapins et quatre cobayes ont été exposés à des solutions de 1,4dioxane-eau appliquées sur la peau rasée de la nuque. Chaque lapin a reçu 10 gouttes et chaque cobaye a reçu 5 gouttes de la solution de 1,4dioxane 11 fois par semaine pendant 48, 65, 76 et 100 jours (un animal par groupe). Des lésions au cortex rénal, des hémorragies au médullaire rénal et la dégénérescence du foie ont été observés chez les deux espèces (Fairley et al., 1934). Une DMENO par voie cutanée ne peut pas être déterminée en raison des limites dans le plan de l'expérience et de présentation des données. [Aucune autre étude sur l'exposition par voie cutanée n'a été recensée.] CMEO la plus faible, par inhalation = 100 mg/m3 (rats femelles, 4 h/jour, 5 jours/semaine, 4 semaines), fondée sur un accroissement considérable de l'activité de la glutathion-peroxydase dans le cerveau et les ovaires; CSE(N)O = 10 mg/m3 (Burmistrov et al., 2001). [études supplémentaires : Fairley et al., 1934; Goldberg et al., 1964; NICNAS, 1998] |
| Toxicité subchronique | DMENO la plus faible, par voie orale (rats) = 1 600 mg/L dans l'eau potable (équivalent à 130 mg/kg-p.c. par jour), fondée sur un accroissement du poids relatif du foie et des reins et sur des modifications histopathologiques observées dans les fosses nasales (dilatation des noyaux de l'épithélium de type respiratoire) et le foie (inflammation centrilobulaire). Dans la présente étude, des rats F344/DuCrj et des souris Crj:BDF1, 10 par sexe par groupe, ont été exposés au 1,4-dioxane dans l'eau potable à des concentrations de 0, 640, 1600, 4000, 10 000 et 25 000 mg/L (soit de 0, 52, 130, 325, 813 et 2031 mg/kg-p.c. par jour pour les rats et de 0, 170, 425, 1063, 2656 et 6641 mg/kg-p.c. par jour pour les souris) pendant 13 semaines. Des lésions histopathologiques ont été observées dans les voies respiratoires supérieures et inférieures, le foie, les reins et le cerveau des rats exposés, alors que seulement les deux premiers organes mentionnés ont été endommagés chez les souris exposées. Les foyers modifiés au niveau du foie ont réagi positivement à l'anticorps glutathion-S-transférase de forme placentaire (lésion prénéoplastique) chez les rats exposés (les souris n'ont pas été examinées). Les poids relatifs des reins et des poumons des rats et des souris exposées ont augmenté en fonction de la dose, tandis que les poids relatifs du foie ont augmenté seulement chez les rats exposés. Des changements aux paramètres hématologiques ont été observés chez les rats et les souris exposés seulement à la dose plus élevée. On a déterminé une DSENO à 640 mg/L pour les rats et les souris (équivalent à 52 mg/kg-p.c. par jour chez les rats et à 170 mg/kg-p.c. par jour chez les souris) (JBRC, 1998b; Kano et al., 2008). [études supplémentaires : King et al., 1973; Scott et al., 1981; Stoner et al., 1986] Au cours de l'étude limitée en temps sur l'exposition par voie cutanée (sous le titre « Dose toxique à court terme pour l'exposition répétée »), des lésions au cortex rénal, des hémorragies au médullaire rénal et la dégénérescence du foie ont été observés chez des lapins et des cobayes exposés au 1,4dioxane par voie cutanée pendant jusqu'à 100 jours (Fairley et al., 1934). Une DMENO par voie cutanée ne peut pas être établie en raison des limites dans le plan de l'expérience et de présentation des données. [Aucune autre étude sur l'exposition par voie cutanée n'a été recensée.] CMENO la plus faible, par inhalation (rats) = 100 ppm (plus faible concentration à l'essai, équivalente à 360 mg/m3), fondée sur une dilatation du noyau des cellules épithéliales de type respiratoire dans les fosses nasales chez les rats mâles et femelles exposées au 1,4-dioxane sous forme de vapeur. Dans le cadre de cette étude, des rats F344 ont été exposés à une vapeur de 1,4dioxane aux concentrations de 0, 100, 200, 400, 800, 1 600, 3 200 et 6 400 ppm à raison de 6 h/j, 5 jours par semaine, pendant 13 semaines. La diminution du poids corporel et l'accroissement du poids relatif du foie, des reins et des poumons ont été observés aux concentrations de 200 ppm et plus. Des modifications aux paramètres hématologiques et des lésions au foie (nécrose de cellules isolées et inflammation centrilobulaire) et aux reins (changements hydropiques aux tubules proximaux du rein) ont été observées à la concentration de 3200 ppm de 1,4dioxane. La dilation des noyaux et des changements aux vacuoles ont été observés dans l'épithélium olfactif aux concentrations de 200 ppm et plus de même que dans les bronches aux concentrations de 1 600 ppm et plus chez les mâles et de 3 200 chez les femelles. La dilatation des noyaux dans les trachées s'est produite à 1 600 ppm et plus. Des foyers au niveau du foie ont réagi positivement au glutathion-S-transférase de forme placentaire aux concentrations de 1 600 ppm et plus chez les femelles exposées et de 3 200 ppm chez les mâles exposés. Tous les rats exposés à une vapeur de 1,4dioxane de 6 400 ppm sont décédés au cours de la première semaine d'exposition (Kasai et al., 2008). [études supplémentaires : Fairley et al., 1934; Torkelson et al., 1974] |
| Toxicité chronique et cancérogénicité | Essai de cancérogénicité par voie orale (eau potable) chez le rat Des rats mâles Wistar, 26 par groupe d'essai et 9 témoins, ont été exposés tous les jours à de l'eau potable contenant 1 % de 1,4-dioxane (équivalent à 860 mg/kg-p.c. par jour) pendant 63 semaines. Six des 26 animaux exposés ont développé des tumeurs au foie, dont un avait aussi des carcinomes dans le bassinet et les reins, et la leucémie myéloïde. Un animal témoin a développé des lymphosarcomes. On a également observé chez les animaux exposés de graves problèmes rénaux comme des effets à l'épithélium tubulaire et glomérulaire ainsi que des changements histopathologiques au foie comme des groupes de cellules ayant des noyaux hépatiques hyperchromatiques dilatés et des groupes de cellules larges ayant une basophilie cytoplasmique (Argus et al., 1965). Des rats Charles River CD, 30 mâles par groupe, ont été exposés à 0, 0,75, 1,0, 1,4 et 1,8 % de 1,4-dioxane par l'eau potable (équivalent à environ 0, 770, 1 000, 1 430 et 1 850 mg/kg-p.c. par jour) pendant 13 mois. Deux des animaux dans chaque groupe ayant reçu la substance aux doses de 1,4 % et 1,8 % ont développé des carcinomes hépatocellulaires. En fonction de la dose, on a observé une augmentation de l'incidence de nodules hépatiques (0 chez les témoins, et 4, 9, 13 et 11 nodules chez les groupes ayant reçu une dose de 0,75 %, 1,0 %, 1,4 % et 1,8 %, respectivement). Des cellules d'hépatomes ont été observées chez trois rats ayant reçu une dose 1,4 % de 1,4dioxane et 12 rats ayant reçu une dose de 1,8 % de 1,4-dioxane. Des tumeurs n'ont pas été observées dans les fosses nasales des 30 témoins, mais ils étaient présents chez 1/30, 1/30, 2/30 et 2/30 des rats ayant reçu des concentrations de 1,4dioxane de 0,75 %, 1,0 %, 1,4 % et 1,8 %, respectivement. Tous les animaux exposés ont présenté de graves problèmes rénaux (Hoch-Ligeti et al., 1970; Argus et al., 1973). Des rats Sherman, 60 par sexe par groupe, ont été exposés à 0 %, 0,01 %, 0,1% et 1,0 % de 1,4-dioxane dans l'eau potable (équivalent à 0, 9,6, 94 et 1 015 mg/kg-p.c. par jour chez les mâles et à 0, 19, 148 et 1 599 mg/kg-p.c. par jour chez les femelles) pendant 716 jours. Des carcinomes du foie (10/66) et des cholangiomes (2/66) ainsi que des carcinomes malpighiens dans les fosses nasales (3/66) ont été observés dans le groupe ayant la plus forte dose (mâles et femelles combinés). Des carcinomes hépatiques ont également été retrouvés chez les témoins (1/106) et dans les groupes ayant reçu 0,1 % de 1,4dioxane (1/106). La dégénérescence, la nécrose hépatiques et des problèmes rénaux ont été observés dans les groupes ayant reçu la plus forte dose. Une réduction considérable du taux de survie et du poids corporel, de même qu'une augmentation absolue et relative du poids du foie ont été observés dans le groupe ayant reçu la plus forte dose. Aucun effet sur l'hématologie et les organes reproducteurs n'a été observé chez les animaux exposés. À la concentration de 0,01 % de 1,4dioxane (équivalent à 9,6 et à 19 mg/kg-p.c. par jour pour les mâles et les femelles, respectivement), il n'y avait aucune indication de formation de tumeurs ni d'effets toxiques considérés comme étant liés à l'exposition (DSENO) (Kociba et al., 1974). Des rats Osborne-Mendel, 35 par sexe par groupe, ont été exposés au 1,4dioxane à des doses de 0 %, 0,5 % et 1,0 % dans l'eau potable pendant 110 semaines (équivalent aux doses de 0, 240 et 530 mg/kg-p.c. par jour pour les mâles et de 0, 350 et 640 mg/kg-p.c. par jour pour les femelles, respectivement). Le taux de survie des deux groupes a diminué considérablement, mais un nombre suffisant d'animaux de chaque sexe étaient vivants à la 52e semaine. On a observé une importante augmentation de l'incidence d'adénomes hépatocellulaires chez les femelles (0/31, 10/33 et 11/32 aux doses de 0 %, 0,5 % et 1,0 %, respectivement), et aucune incidence chez les mâles. Une augmentation considérable de l'incidence de carcinomes malpighiens a été observée dans les fosses nasales des rats des deux sexes (0/33, 12/33 et 16/34 chez les rats mâles ayant reçu des doses de 0 %, 0,5 % et 1,0 % ainsi que 0/34, 10/35 et 8/35 chez les rats femelles ayant reçu des doses de 0 %, 0,5 % et 1,0 %, respectivement). En outre, des mésothéliomes dans la région des testicules ont été observés plus souvent chez les animaux ayant reçu une dose (2/33, 4/33 et 5/34 chez les mâles ayant été exposés à des doses de 0 %, 0,5 % et 1,0 %, respectivement). Des effets non néoplastiques ont été observés dans les reins (dégénérescence des tubules), le foie (cytomégalie) et l'estomac (ulcération). En outre, une plus grande incidence de pneumonie a été observée chez les rats ayant reçu une dose (Institut national du cancer du Canada, 1978). Des rats F344/DuCrj, 50 par sexe par groupe, ont été exposés au 1,4dioxane à des concentrations de 0, 200, 1 000 et 5 000 mg/L (équivalent à 0, 16, 81 et 398 mg/kg-p.c. par jour pour les mâles et à 0, 21, 103 et 514 mg/kg-p.c. par jour pour les femelles, respectivement) dans l'eau potable pendant 104 semaines. On a observé une réduction considérable du taux de survie dans les deux sexes chez le groupe exposé aux plus fortes doses. Les incidences combinées d'adénomes et de carcinomes hépatocellulaires observées chez les mâles étaient de 0/50, 2/50, 4/50 et 38/50 pour les groupes ayant reçu des doses de 0, 200, 1 000 et 5 000 mg/L, respectivement. Les incidences correspondantes chez les femelles étaient de 1/50, 0/50, 5/50 et 48/50. Chez les deux sexes, les incidences de tumeurs au foie dans les groupes ayant été exposés à une concentration de 1,4dioxane de 5 000 mg/L ont augmenté considérablement. Des néoplasmes malins dans les cavités nasales se sont produites seulement dans le groupe exposé à 5 000 mg/L. Des carcinomes malpighiens (3/50 et 7/50 parmi les mâles et les femelles, respectivement), des sarcomes (2/50 parmi les mâles seulement), des esthésioneuroépithéliomes (1/50 parmi les mâles et les femelles) et des rhabdomyosarcomes (1/50 parmi les mâles seulement) ont été observés. En outre, chez le groupe exposé à une concentration de 5 000 mg/L de 1,4dioxane, les incidences de mésothéliomes péritonéaux, de fibromes de l'hypoderme et de fibroadénomes de la glande mammaire ont augmenté considérablement chez les mâles, et les incidences d'adénomes de la glande mammaire ont augmenté considérablement chez les femelles. Des lésions non néoplastiques ont été observées dans les fosses nasales (dilatation du noyau et atrophie de l'épithélium olfactif, métaplasie et hyperplasie des cellules malpighiennes de l'épithélium de type respiratoire, changements hydropiques et sclérose dans les protéines laminines, adhésion, inflammation et prolifération de la glande nasale), le foie (spongiose et hyperplasie) et les reins (dilatation du noyau des tubules proximaux) des rats mâles exposés à des concentrations de 1,4dioxane de 200 mg/L et plus ainsi que des rats femelles exposées à des concentrations de 1 000 mg/L et plus (Yamazaki et al., 1994; JBRC, 1998c). Essai de cancérogénicité par voie orale (eau potable) chez la souris Des souris B6C3F1, 50 par sexe par groupe, ont été exposées à des doses de 0 %, 0,5 % et 1,0 % de 1,4-dioxane dans l'eau potable (équivalent à 0, 720 et 830 mg/kg-p.c. par jour pour les mâles et à 0, 380 et 860 mg/kg-p.c. par jour pour les femelles, respectivement) pendant 90 semaines. Une augmentation considérable de l'incidence de carcinomes hépatocellulaires a été observée chez les deux sexes des animaux exposés (2/49, 18/50 et 24/47 pour les mâles ainsi que 0/50, 12/48 et 29/37 pour les femelles qui ont été exposés aux concentrations de 1,4dioxane de 0 %, 0,5 % et 1,0 %, respectivement). L'incidence combinée des adénomes et des carcinomes hépatocellulaires a aussi augmenté (8/49, 19/50 et 28/47 pour les mâles ainsi que 0/50, 21/48 et 35/37 pour les femelles exposées aux concentrations de 1,4dioxane de 0 %, 0,5 % et 1,0 %, respectivement). Parmi les lésions non néoplastiques, la hausse de l'incidence de pneumonie et de rhinite était considérable. Des inclusions cytomégaliques ont été observées couramment chez les animaux exposés (Institut national du cancer du Canada, 1978). Des souris Crj:BDF1, 50 par sexe par groupe, ont été exposées au 1,4dioxane à des concentrations de 0, 500, 2 000 et 8 000 mg/L dans l'eau potable (équivalent à 0, 66, 250 et 770 mg/kg-p.c. par jour pour les mâles ainsi qu'à 0, 77, 320 et 1 070 mg/kg-p.c. par jour pour les femelles, respectivement) pendant 104 semaines. Le taux de survie chez les femelles exposées au 1,4dioxane aux concentrations de 2 000 et de 8 000 mg/L et les mâles exposés à la concentration de 8 000 mg/L a diminué en raison de tumeurs au foie. Une augmentation considérable du nombre d'incidences de carcinomes hépatocellulaires a été observée chez les mâles exposés au 1,4dioxane à une concentration de 8 000 mg/L (15/50, 20/50, 23/50 et 36/50 pour les groupes exposés aux concentrations de 0, 500, 2 000 et 8 000 mg/L, respectivement) et chez toutes les femelles exposées (0/50, 6/50, 30/50 et 45/50 pour les groupes exposés aux concentrations de 0, 500, 2 000 et 8 000 mg/L, respectivement). Une importante augmentation de l'incidence d'adénomes hépatocellulaires a été observée chez les deux sexes aux concentrations de 500 et 2 000 mg/L (7/50, 16/50, 22/50 et 8/50 chez les mâles et 4/50, 30/50, 20/50 et 2/50 chez les femelles pour les groupes exposés aux concentrations de 0, 500, 2 000 et 8 000 mg/L, respectivement). Des lésions non néoplastiques ont été observées dans les fosses nasales, les trachées, les poumons et les reins aux concentrations de 2 000 mg/L et plus chez les deux sexes. Chez les mâles, des lésions ont également été observées dans le foie (angiectasie) à la concentration de 8 000 mg/L et sur les testicules (minéralisation réduite) aux concentrations de 2 000 mg/L et plus. On a observé les effets du 1,4dioxane aux concentrations de 2 000 mg/L et plus, soit la réduction du poids corporel ainsi que des effets sur les paramètres hématologiques et biochimiques et sur la composition de l'urine (Yamazaki et al., 1994; JBRC, 1998c). Essai de cancérogénicité par voie orale (eau potable) chez le cobaye Des cobayes mâles, 22 par groupe d'essai et 10 témoins, ont été exposés à des concentrations de 1,4dioxane de 0,5 à 2 % dans l'eau potable (1 200 à 4 800 mg/kg-p.c. par jour) pendant 23 mois. Chez les animaux exposés, trois ont développé des hépatomes, un a développé des adénomes rénaux et deux ont développé des carcinomes de la vésicule biliaire. De plus, 9/22 animaux exposés ont développé l'hyperplasie épithéliale bronchique (1/10 chez les témoins) et l'infiltration de cellules mononucléaire dans les poumons (4/10 chez les témoins) (Hoch-Ligeti et Argus, 1970). Essai de cancérogénicité par inhalation chez le rat Des rats Wistar, 288 par sexe dans le groupe d'essai et 192 par sexe dans le groupe témoin, ont été exposés par inhalation à 400 mg/m3 (111 ppm) de 1,4dioxane (pureté de 99,9 %) à raison de 7 h/j, 5 jours par semaine, pendant 2 ans. Le groupe témoin a été exposé à de l'air filtrée dans une salle. La moitié des animaux ont survécu pendant une période de 20 à 24 mois. Aucune augmentation statistiquement considérable n'a été observée dans l'incidence de tumeurs chez les 525 rats exposés qui ont été examinés, comparativement aux 347 témoins. On n'a observé aucun effet lié à l'exposition sur les valeurs hématologiques et les valeurs de chimie clinique, la croissance, le taux de mortalité, le comportement, aucun changement de poids des organes, notamment le foie, les reins et la rate, et aucun changement histopathologique dans les organes comme le foie, les reins, la rate, les poumons, la trachée, les ganglions lymphatiques thoraciques, le cœur, le pancréas, l'estomac, les intestins, la glande thryroïde, les ganglions lymphatiques mésentériques, la vessie, l'hypophyse, les glandes surrénales, les testicules, les ovaires, l'oviducte, l'utérus, les glandes mammaires, les glandes lacrymales, les ganglions lymphatiques, le cerveau, le vagin et la moelle osseuse (Torkelson et al., 1974). Des rats F344/DuCrj mâles, 50 par sexe par groupe, ont été exposés au 1,4dioxane à des concentrations de 0, 50, 250 et 1 250 ppm (équivalent à 0, 180, 900 et 4 500 mg/m3) 6 heures par jour et 5 jours par semaine, pendant 104 semaines. Une augmentation attribuable à la dose et significative de l’incidence de carcinomes malphigiens et d’adénomes hépatocellulaires a été constatée principalement sur les rats exposés à 1 250 ppm. Une augmentation significative de l’incidence de mésothéliomes péritonéaux a été observée sur les groupes exposés à 250 et 1 250 ppm. L’incidence d’hypernéphromes, de fibroadénomes mammaires et d’adénomes dans la glande de Zymbal a également augmenté avec la dose, mais ne s’est pas révélée statistiquement significative. Des lésions prénéoplasiques sont apparues dans les fosses nasales et sur le foie des groupes exposés au 1,4-dioxane. L’augmentation significative de l’incidence de l’élargissement nucléaire, une atrophie et des métaplasies respiratoires ont été constatées dans les fosses nasales à 50 ppm et supérieur. Par ailleurs, un décrément statistiquement important mais marginal des poids corporels finaux, une large augmentation de la concentration de SGOT, de GPT, de PhoA et de gGTP, une baisse importante du niveau d’hémoglobine, un volume corpusculaire moyen et une hémoglobine corpusculaire moyenne, ainsi qu’une augmentation importante du poids relatif du foie, ont été décelés chez le groupe exposé à 1 250 ppm. Bien que des augmentations importantes du poids relatif des poumons aient été constatées chez le groupe exposé à 1 250 ppm, les auteurs ont indiqué que cette modification n’était pas biologiquement importante en raison de l’absence de lien entre la dose et la réponse pour le poids relatif des poumons. Un CMENO non cancéreux a été établi à 50 ppm (180 mg/m3) pour ses effets sur les fosses nasales (Kasai et al., 2009). Essai de cancérogénicité par voie cutanée et essai de production de tumeurs chez la souris Le 1,4-dioxane dissout dans l’acétone (0,2 mL, concentration non précisée) a été appliqué au dos rasé de souris Swiss-Webster, 30 par sexe par groupe, 3 fois par semaine, pendant 60 semaines. L'une parmi les 25 souris femelles exposées a développé des carcinomes cutanés, et l'une parmi les 22 souris mâles a développé des tumeurs souscutanées. Aucune lésion significative n'a été observée. Aucune tumeur n'a été observée chez les animaux ayant reçu un traitement à l'acétone. Un essai visant à produire des tumeurs a aussi été exécuté, où 50 µg de diméthylbenzanthracène a été administré aux souris une semaine avant d'être exposées au 1,4dioxane. Parmi les mâles exposés, 2/4, 3/4 et 2/4 ont développé des papillomes cutanés, des carcinomes et des tumeurs souscutanées, respectivement. Parmi les femelles exposées, 2/5 et 3/5 ont développé des papillomes cutanés et des carcinomes, respectivement. Des carcinomes malpighiens de la cloison nasale ont été observés chez un animal qui affichait des papillomes cutanés. Neuf parmi les animaux exposés ont développé des tumeurs pulmonaires. Des tumeurs aux reins, à la rate et au foie ainsi que des lésions non néoplastiques sur le foie et la peau ont été observées chez les animaux exposés (King et al., 1973). Le 1,4-dioxane (0,05 mL; quatre doses dans quatre groupes, respectivement) a été administré par voie cutanée à des souris C3h/HeJAgouti, 30 mâles par groupe, à raison de 3 fois par semaine, pendant 78 semaines. Les témoins ont été exposés à l'éthanol. Cinq néoplasmes hépatiques et un néoplasme pulmonaire ont été observés chez les animaux exposés; ces néoplasmes ont été signalés comme étant dans les limites normales. Aucun effet clinique n'a été observé. Parmi les animaux faisant objet de l'essai, seulement 40/120 ont survécu jusqu'à la fin de l'étude. Les chercheurs n'ont pas mentionné s'il s'agissait d'une application cutanée dans des conditions d'occlusion (Perone et al., 1976). Autres essais de cancérogénicité IInduction de tumeurs par injection intrapéritonéale Le 1,4dioxane (pureté non précisée) a été administré à des souris A/J, 30 mâles par groupe, par injection intrapéritonéale 3 fois par semaine, pendant 8 semaines, à des concentrations totales de 0, 400, 1 000 et 2 000 mg/kg-p.c. Les concentrations élevées ont accru la multiplicité des tumeurs pulmonaires à 0,97 par souris (p < 0,05) comparativement à 0,28 par souris chez les témoins traités avec l'excipient seulement (Maronpot et al., 1986). Dans le cadre d'un essai sur des adénomes pulmonaires chez des souris A/J, 16 par sexe par groupe d'essai, le 1,4-dioxane a induit une importante augmentation de l'incidence de tumeurs pulmonaires chez les mâles ayant reçu une concentration intrapéritonéale intermédiaire (dose totale de 12 000 mg/kg-p.c., huit injections au cours de 24 semaines). Une telle augmentation n'a pas été observée chez les mâles ayant reçu une dose intrapéritonéale inférieure ou supérieure (dose totale de 4 800 ou de 24 000 mg/kg-p.c., respectivement, huit injections au cours de 24 semaines) chez les femelles ayant reçu les mêmes doses intrapéritonéales ou chez les mâles et les femelles ayant reçu le 1,4dioxane par voie orale (dose totale de 24 000 mg/kg-p.c., 8 fois au cours de 24 semaines) (Stoner et al., 1986). Essai de promotion de tumeurs par voie orale (gavage) Des rats SD, de 8 à 11 mâles par groupe et 19 témoins, ont été partiellement hépatectomisés et ont reçu une injection intrapéritonale avec une seule dose de 30 mg/kg-p.c. de N-Nitrosodiéthylamine (NDEA) afin d'initier l'hépatocancérogenèse. Cinq jours plus tard, ces animaux ont été exposés par gavage au 1,4dioxane (pureté de 99,5 %) à des concentrations de 0, 100 et 1 000 mg/kg-p.c. une fois par jour, 5 jours par semaine, pendant 7 semaines. La concentration de 1,4dioxane de 1 000 mg/kg-p.c. a augmenté considérablement le nombre et le volume total de foyers qui réagissent positivement au ?glutamyltranspeptidase (GGT) au niveau du foie. Chez les deux autres groupes de rats n'étant pas été exposés au NDEA, l'administration de seulement le 1,4dioxane aux concentrations de 100 et 1 000 mg/kg-p.c. par jour n'a pas induit la réaction positive de foyers au GGT (Lundberg et al., 1987). Essai d'initiation de tumeurs Des souris femelles SENCAR, de 20 à 40 par groupe, ont été exposées au 1,4dioxane à une concentration de 1 000 mg/kg-p.c. par voie orale, souscutanée et cutanée comme initiateur de tumeurs, puis au 12-O-tétradécanoylphorbol-13acétate (TPA) à une concentration de 1 µg par voie cutanée comme promoteur de tumeurs, 3 fois par semaine, pendant 20 semaines. L'expérience a pris fin après 52 semaines. Aucune augmentation significative de formation de papillomes n'a été observée comparativement aux témoins exposés à l'acétone comme initiateur et au TPA comme promoteur de tumeurs (Bull et al., 1986). Des rats mâle SD, 10 par groupe, ont reçu une dose intrapéritonéale de 881 mg/kg-p.c. de 1,4-dioxane, après l'administration de 500 mg/L de phénobarbital de sodium dans l'eau potable pendant 49 jours. Aucune augmentation du nombre de foyers qui réagissent positivement au GGT n'a été observée au niveau du foie, ce qui indique un manque d'initiation (Pereira et al., 1982). Paramètres non néoplastiques DMENO la plus faible, par voie orale, pour les effets non néoplastiques = 200 mg/L (16 mg/kg-p.c. par jour), d'après un effet sur le foie (spongiose) chez les rats mâles exposés à 200 mg/L de 1,4dioxane dans l'eau potable pendant deux ans (Yamazaki et al., 1994; JBRC, 1998c). EURAR a déclaré que, même si l'accroissement de l'incidence de spongiose du foie n'était pas statistiquement significatif à la dose de 200 ppm, on a observé une croissance dans la tendance liée à la dose qui était associée à cet effet et par conséquent, on peut établir que 200 ppm est la DMENO (EURAR, 2002). La DSENO par voie orale est de 9,6 mg/kg-p.c. par jour chez les rats mâles et de 19 mg/kg-p.c. par jour chez les rats femelles exposées au 1,4dioxane à une concentration de 0,01 % dans l'eau potable pendant deux jours (Kociba et al., 1974). CSENO par inhalation = 50 ppm (180 mg/m3) (rats mâles F344/DuCrj (SPF) exposés à des doses de 0, 50, 250 ou 1 250 ppm de 1,4-dioxane (équivalent à 0, 180, 900 et 4 500 mg/m3) 7 heures par jour et 5 jours par semaine, pendant 104 semaines), pour constater les effets sur les fosses nasales (Kasai et al., 2009) (voir ci-dessus pour de plus amples renseignements). CSENO par inhalation = 400 mg/m3(rats exposés au 1,4-dioxane 7 h/j, 5 jours/semaine, pendant 2 ans), aucun effet non néoplastique lié à l'exposition n'a été observé (Torkelson et al., 1974). Application par voie cutanée de 0,05 mL de 1,4dioxane, équivalent à 700 à 1 000 mg/kg-p.c. par jour (souris exposées au 1,4-dioxane 3 fois par semaine pendant 78 semaines), aucun effet non néoplastique lié à l'exposition n'a été observé (Perone et al., 1976). |
| Toxicité pour la reproduction | DMENO la plus faible, par voie orale (souris exposées au 1,4-dioxane dans l'eau potable pendant deux ans) = 2 000 mg/L (250 mg/kg-p.c. par jour), fondée sur la minéralisation réduite des testicules observée au cours de l'étude à long terme mentionnée cidessus (JBRC, 1998c). Cependant, cet effet n'a pas été signalé par Yamazaki et al. (1994). [étude supplémentaire : Lane et al., 1982 (il s'agit d'une étude menée sur trois générations où des souris ont été exposées au 1,1,1-trichloroéthane aux concentrations de 0,58 à 5,83 mg/mL contenant le 1,4dioxane à une concentration de 3 % dans l'eau potable, un groupe témoin a été exposé au 1,4dioxane et à l'Emulphor; aucun effet n'a été observé sur les paramètres de reproductivité des adultes, le taux de survie, la croissance, le développement et la pathologie en général.] Aucune étude sur la reproductivité par voie cutanée ou par inhalation n'a été observée. Autre voie d'exposition Aucun effet sur le taux de conception, le nombre moyen d'implantations, le pourcentage de fœtus vivants ou l'indice de mutagénicité n'a été observé chez les souris mâles après une seule injection intrapéritonéale de 2 500 mg/kg-p.c. (BASF, 1977). |
| Toxicité pour le développement | DMENO la plus faible, par voie orale (gavage)(rats femelles SD gravides, 17 à 20 par groupe, exposées au 1,4dioxane aux concentrations de 0, 0,25, 0,5 et 1,0 mL/kg-p.c. par jour par gavage du jour 6 au jour 15 de la gestation) = 1,0 mL/kg-p.c. par jour (1 035 mg/kg-p.c. par jour), d'après la réduction considérable du poids moyen des fœtus vivants et le retard de l'ossification fœtale des sternèbres. On a également observé une réduction considérable du poids maternel à la concentration de 1,4dioxane de 1,0 mL/kg-p.c. par jour. DSENO = 0,5 mL/kg-p.c. par jour (517 mg/kg-p.c. par jour) (Giavini et al., 1985). [Aucune autre étude sur la toxicité par voie orale n'a été recensée.] Aucune étude sur le développement dans le cadre de l'exposition par voie cutanée ou par inhalation n'a été recensée. Autre voie d'exposition Aucun effet sur le taux de conception, le nombre moyen d'implantations, le pourcentage de fœtus vivants ou l'indice de mutagénicité n'a été observé chez les souris mâles après une seule injection intrapéritonéale de 2 500 mg/kg-p.c. (BASF, 1977). |
| Génotoxicté et paramètres connexes : in vivo | Essai de létalité dominante Résultats négatifs : Aucun effet sur le taux de conception, le nombre moyen d'implantations, le pourcentage de fœtus vivants ou l'indice de mutagénicité n'a été observé chez les souris mâles après une seule injection intrapéritonéale de 2 500 mg/kg-p.c. (BASF, 1977). Essai de létalité récessive liée au sexe Résultats négatifs : Le Drosophila melanogaster exposé au 1,4-dioxane par alimentation (35 000 ppm) ou par injection (50 000 ppm) (Yoon et al., 1985). Induction de micronoyaux Résultats positifs : Des augmentations significatives au taux d'induction de micronoyaux liées à la dose ont été observées dans la moelle osseuse et le foie de jeunes souris CD-1 après une administration par voie orale (gavage) de 1,4dioxane de 1 500, 2 500 et 3 500 mg/kg-p.c. par jour pendant 5 jours; les micronoyaux étaient issus principalement de bris chromosomiques (Roy et al., 2005). Des preuves d'augmentations du taux d'induction de micronoyaux liées à l'exposition au 1,4dioxane ont été observées chez des souris mâles et femelles C57BL/6 après une seule administration par voie orale (gavage) de 1,4dioxane aux concentrations de 900 mg/kg-p.c. et plus (Mirkova, 1994). Une augmentation significative du nombre de micronoyaux a été observée chez des hépatocytes de souris mâles CD-1 après une seule administration par gavage aux concentrations de 2 000 mg/kg-p.c. et plus (Morita et Hayashi, 1998). Résultats négatifs : Aucune preuve d'augmentation de micronoyaux liée à l'exposition au 1,4dioxane n'a été observée dans la moelle osseuse de souris mâles BALB/c après une seule administration par voie orale (gavage) de 5 000 mg/kg-p.c. (Mirkova, 1994). Aucune augmentation considérable en fonction de la dose n'a été observée dans le nombre de micronoyaux dans la moelle osseuse de souris mâles B6C3F1 après une seule injection intrapéritonéale ou après trois injections quotidiennes intrapéritonéales de 1,4dioxane (jusqu'à 4 000 mg/kg-p.c.) (McFee et al., 1994). Aucune augmentation considérable du nombre de micronoyaux n'a été observée dans la moelle osseuse de souris CBA (1 800 mg/kg-p.c.) ou de souris C57BL/6 (jusqu'à 3 600 mg/kg-p.c.) après une seule administration par voie orale (Tinwell et Ashby, 1994). Aucune augmentation considérable du nombre de micronoyaux n'a été observée dans les cellules rouges périphériques de souris mâles CD-1 après des doses par gavage uniques de jusqu'à 3 000 mg/kg-p.c. (Morita et Hayashi, 1998). Essai de réparation de l'ADN (synthèse non programmée d'ADN) Résultats positifs : Une hausse significative de la synthèse de l'ADN hépatique a été observée chez des rats mâles SD exposés au 1,4dioxane à une concentration de 1 000 mg/kg-p.c. par jour dans l'eau potable pendant 11 semaines, ainsi qu'une augmentation considérable du poids relatif du foie (Stott et al., 1981). Résultats négatifs : Aucune augmentation significative de la réparation de l'ADN n'a été observée dans les hépatocytes de rats mâles F344 après une seule administration par voie orale de 1,4-dioxane de 1 000 mg/kg-p.c. par gavage pendant 2 et 12 heures ou après une exposition au 1,4dioxane à une concentration de 1 % ou 2 % dans l'eau potable pendant une semaine (Goldsworthy et al., 1991). Aucune synthèse non programmée d'ADN n'a été observée dans les cellules épithéliales des fosses nasales des rats mâles F344 exposés à une concentration de 1 % de 1,4dioxane dans l'eau potable pendant 8 jours après une seule dose par gavage de jusqu'à 1 000 mg/kg-p.c. (Goldsworthy et al., 1991). Aucune augmentation significative de la réparation de l'ADN hépatique n'a été observée chez des rats mâles Sprague-Dawley (SD) auxquels on a administré une seule dose de 1,4dioxane à une concentration de 1 000 mg/kg-p.c. par gavage (Stott et al., 1981). Essai de prolifération de cellules (synthèse réplicative de l'ADN) Résultats positifs : Une hausse significative de la prolifération des cellules hépatiques (mesurée comme étant l'indice de marquage hépatique) a été observée chez des rats mâles F344 exposés au 1,4dioxane à une concentration de 1 % dans l'eau potable pendant 2 semaines (Goldsworthy et al., 1991). Une augmentation importante de la synthèse réplicative de l'ADN a été observée chez des rats mâles F344 24 heures après avoir été exposés à une seule dose de 2 000 mg/kg-p.c. de 1,4-dioxane; aucun changement histopathologique n'a été observé (la voie d'exposition n'a pas été déclarée) (Miyagawa et al., 1999). Résultats équivoques : Une induction de la synthèse réplicative de l'ADN a été observée chez les hépatocytes de rats mâles F344 24 heures après avoir été exposés par gavage à une seule dose de 2 000 mg/kg-p.c. de 1,4-dioxane, mais non 39 ou 48 heures après l'administration; on n'a pas réussi à reproduire les résultats après les 24 heures au cours de la même étude; par conséquent, on a déclaré que dans l'ensemble, les résultats étaient négatifs (Uno et al., 1994). Résultats négatifs : L'indice de marquage hépatique a augmenté ni aux 24 heures ni aux 48 heures après une seule dose de 1 000 mg/kg-p.c. de 1,4-dioxane chez les rats mâles F344 (Goldsworthy et al., 1991). Aucune augmentation de la prolifération des cellules n'a été observée dans les cellules épithéliales des fosses nasales (mesurée comme l'indice de marquage de la longueur par unité) des rats mâles F344 exposés au 1,4dioxane à une concentration de 1 % dans l'eau potable pendant 2 semaines (Goldsworthy et al., 1991). Essai de dommages à l'ADN Résultats positifs : Une augmentation liée à la dose des dommages à l'ADN hépatique a été observée chez des rats femelles SD après l'administration par voie orale de 1,4-dioxane (168 à 4 200 mg/kg-p.c.) 21 heures et 4 heures avant le sacrifice. Les résultats étaient significatifs aux concentrations de 2 550 mg/kg-p.c. et plus (Kitchin et Brown, 1990). Résultats négatifs : Aucune indication de dommages à l'ADN (essai de Comet) n'a été observée dans l'estomac, le côlon, le foie, les reins, la vessie, les poumons, le cerveau ou la moelle osseuse chez les souris mâles ddY après une seule dose par gavage de jusqu'à 3 200 mg/kg-p.c. (Sasaki et al., 2000). Aucune hausse des concentrations de 8-hydroxydésoxyguanosine n'a été observée dans l'ADN de rats F344 ayant reçu une seule dose de 1,4dioxane par gavage à la moitié de la DL50 (Sai et al., 1989). Essai d'alkylation de l'ADN Résultats négatifs : Aucune hausse significative de l'alkylation de l'ADN hépatique n'a été observée chez des rats mâles SpragueDawley (SD) ayant reçu une seule dose de 1 000 mg/kg-p.c. de 1,4-dioxane par gavage (Stott et al., 1981). Essai d'aneuploïdie Résultats positifs : Une induction considérable de non-disjonction méiotique a été observée dans les ovocytes matures de Drosophila melanogaster femelles ayant reçu une dose orale de 1,4-dioxane à une concentration de 2 % et plus, et dans les ovocytes immatures à une concentration de 1 % et plus, avant l'accouplement (Muñoz et Barnett, 2002). Essai de synthèse de l'acide ribonucléique (ARN) Une diminution de l'activité de l'ARN polymérase A et B a été observée chez des rats mâles SD exposés au 1,4dioxane à une concentration de 10 mg par rat (29 mg/kg-p.c.) et plus (Kurl et al., 1981). |
| Génotoxicté et paramètres connexes : in vitro | Essai de mutagénicité Résultats négatifs : Tests Ames chez des souches de Salmonella typhimuriumTA98, TA100, TA102, TA1530, TA1535, TA15337 et TA1538, avec et sans activation métabolique (BASF, 1979a, b, c; Stott et al., 1981; Haworth et al., 1983; Nestmann et al., 1984; Khudoley et al., 1987). Essais de mutation ponctuelle observés chez le Saccharomyces cerevisiae D61M (Zimmermann et al., 1985); chez le Photobacterium phosphoreum, sans activation métabolique (Kwan et al., 1990); dans les cellules ovariennes de hamsters chinois (CHO), avec et sans activation métabolique (BASF, 1991); et dans les cellules de lymphomes chez des souris, avec et sans activation métabolique (McGregor et al., 1991; Morita et Hayashi, 1998). Essai d'aberration chromosomique Résultats négatifs : CHCellules CHO W-B1 (Galloway et al., 1987) et cellules CHO K1 (Morita et Hayashi, 1998), avec et sans activation métabolique. Essai d'induction de micronoyaux Résultats négatifs : Cellules CHO K1, avec et sans activation métabolique (Morita et Hayashi, 1998). Essai d'échange de chromatides sœurs Résultats négatifs : Cellules CHO W-B1, avec activation métabolique (Galloway et al., 1987), et cellules CHO K1, avec et sans activation métabolique (Morita et Hayashi, 1998). Résultats faiblement positifs : Cellules CHO W-B1, sans activation métabolique (Galloway et al., 1987). Essai d'aneuploïdie Résultats négatifs : Saccharomyces cerevisiae D61M (Zimmermann et al., 1985) Essai de dommages à l'ADN Résultats positifs : Induction de ruptures des brins simples de l'ADN dans les hépatocytes de rats; une cytotoxicité a été observée (Sina et al., 1983). Résultats négatifs : Essai de réparation de l'ADN différentiel chez l'Escherichia coli K-12, avec et sans activation métabolique (Hellmer et Bolcsfoldi, 1992). Réparation de l'ADN dans les principaux hépatocytes fraîchement isolés de rats mâles F344 avec ou sans activation du métabolisme du 1,4-dioxane. Pour être en mesure d'activer le métabolisme du 1,4-dioxane, certains rats ont été exposés au 1,4dioxane à une concentration de 1 % dans l'eau potable pendant une semaine avant l'isolement des cellules (Goldsworthy et al., 1991). Essai de liaison covalente de l'ADN Aucune liaison par microsomes entre le 1,4-dioxane et l'ADN n'a été décelée dans l'essai in vitro (Woo et al., 1977). Transformation cellulaire Résultats positifs : Transformation par le 1,4-dioxane des cellules BALB/3T3; une cytotoxicité a été observée (Sheu et al., 1988). Résultats négatifs : Le 1,4-dioxane n'a pas augmenté la transformation induite par l'adénovirus SA7 des cellules embryonnaires de hamsters syriens (SHE) (Heidelberger et al., 1983). Essai d'inhibition de la synthèse d'ADN Résultats positifs : Cellules HeLaS3 (de nombreuses autres substances chimiques non génotoxiques ont donné des résultats positifs dans le cadre de cet essai) (Heil et Reifferscheid, 1992). |
| Immunotoxicité | Une inhibition de la réaction des lymphocytes T par le 1,4dioxane (sur les lymphocytes) en augmentant la réaction des cellules B (dans les cellules de la rate et des ganglions lymphatiques) a été observée dans les lymphocytes murins et humains in vitro et une réaction un peu plus faible des lymphocytes aux mitogènes a été observée chez des souris CBA/J exposées au 1,4-dioxane par injection intrapéritonéale (1670 mg/kg-p.c. par jour). Des souris CBA/J ont reçu 0,5 mL de 1,4dioxane à des concentrations de 0,1 à 10 % par injection intrapéritonéale pendant 7 jours (Thurman et al., 1978). |
| Sensibilisation | Négative pour la peau des cobayes (BASF, 1993). |
| Irritation | Irritation cutanée Une solution non diluée de 1,4-dioxane a été appliquée au dos rasé de lapins (une dose par sexe par groupe) pour des périodes de 1, 5 et 15 minutes et de 20 heures ainsi qu'à l'oreille pendant 20 heures dans des conditions d'occlusion. On a observé un érythème très léger 24 heures après des applications de 1 à 15 minutes, et un peu d'écailles après 8 jours. Un érythème très léger et des œdèmes ont été observés sur le dos d'un animal 24 heures après l'application sur 20 heures. Un érythème très léger a été observé sur l'oreille 24 heures après l'application sur 20 heures (BASF, 1973). Une irritation de la peau a été observée chez des rats Wister (trois par sexe par groupe), des souris ddY (trois par sexe par groupe) et des cobayes Hartley (trois femelles) dans des conditions de non-occlusion une semaine après l'application de 20 mg/kg-p.c. et plus de 1,4dioxane (Sekizawa et al., 1994). |
Irritation oculaire Deux lapins mâles White Vienna ont reçu une instillation de 0,05 mL de 1,4dioxane non dilué. Une légère opacification de la cornée, une conjonctive rouge et un léger chémosis ont été observés après 24 heures, et des dépôts de taches ont été observés après une application pendant 8 jours (BASF, 1973). On a observé une augmentation significative de l'opacité et de l'épaisseur de la cornée bovine et du stroma isolés après une incubation avec le 1,4dioxane à des concentrations de 5 à 10 % (vol/vol) pendant 30 minutes et 4,5 heures (Igarashi et Northover, 1987). |
|
Voie respiratoire Une irritation de la voie respiratoire a été observée chez des rats, des souris, des cobayes et des lapins exposés au 1,4-dioxane sous forme de vapeur (Yant et al., 1930; Gross, 1938; BASF, 1980). |
|
| Humains | |
| Toxicité aiguë | Dans le cadre d'une étude d'inhalation aiguë, six femelles et six mâles, tous des bénévoles en santé, ont été exposés au 1,4dioxane aux concentrations de 0 (témoin) et 20 ppm (72 mg/m3) pendant 2 heures au repos. Aucune différence significative n'a été observée dans la catégorisation des symptômes sur une échelle analogique visuelle, la fréquence de clignotement, le fonctionnement pulmonaire, l'inflammation des fosses nasales et les marqueurs d'inflammation dans le plasma entre les bénévoles exposés et les témoins. Les auteurs ont suggéré que 20 ppm est une CSENO, quoiqu'ils ont déclaré qu'à cette concentration, on ne peut pas exclure la possibilité d'effets souscliniques sur le système nerveux central (Ernstgård et al., 2006). |
| Toxicité chronique et cancérogénicité | Plusieurs études de cas ont révélé des décès parmi des travailleurs exposés au 1,4dioxane dans le milieu de travail. Les indications cliniques de toxicité sont de graves douleurs au niveau de l'épigastre, des convulsions et le coma. Une étude histologique a révélé des lésions hépatiques et rénales. On a également observé la néphrite hémorragique ainsi que la démyélination et la perte de fibres nerveuses dans le système nerveux central (Barber, 1934; Johnstone, 1959; Sullivan, 1994). Les niveaux d'exposition ne pouvaient pas être déterminés précisément et il se peut que la coexposition à d'autres substances chimiques et la consommation d'alcool étaient des facteurs de confusion. Dans le cadre d'une étude transversale, 74 travailleurs ont été exposés au 1,4dioxane à des concentrations estimées de 0,02 à 48 mg/m3 pendant environ 25 ans. Douze décès ont été signalés, y compris deux en raison du cancer. Le groupe n'a affiché aucune indication de dommages hépatiques et rénaux et il n'a pas présenté une incidence plus élevée de décès dus au cancer comparativement à la population en général. Chez six travailleurs actifs, aucune hausse de l'incidence d'aberrations chromosomiques dans les lymphocytes n'a été observée (Thiess et al., 1976). Dans le cadre d'une autre étude, une augmentation significative de la fréquence moyenne d'aberrations chromosomiques dans les lymphocytes a été observée chez 11 travailleurs exposés à des oxydes d'alkylène, y compris le 1,4dioxane, pendant plus de 20 ans. L'exposition aux mutagènes connus comme l'oxyde d'éthylène et l'oxyde de propylène rend difficile la tâche donner une conclusion sur les causes des effets observés (Thiess et al., 1981). Dans le cadre d'une étude de cohorte, 80 travailleurs peuvent avoir été exposés au 1,4dioxane à des concentrations de 0,18 à 184 mg/m3. Quatre cancers ont été signalés : cancer du colon, carcinomes pulmonaires, lymphosarcomes et glioblastomes. Les décès observés n'ont pas révélé une différence significative relativement à l'incidence attendue de décès dus au cancer (NIOSH, 1977). Lors d'une étude de cohorte rétrospective, 165 travailleurs (Texas) ont été exposés au 1,4dioxane (< 25 ppm, équivalent à 90 mg/m3) de 1954 à 1975 pendant des périodes d'un mois à 10 ans et plus. Trois décès dus au cancer ont été déclarés : carcinomes de l'estomac et des cellules alvéolaires. Aucune différence significative n'a été décelée entre le taux de mortalité totale observé et les décès dus à des tumeurs malignes et le taux de mortalité attendu chez les hommes du Texas. Cependant, les auteurs ont affirmé que la cohorte était peu nombreuse, et que tous les auraient été exposés à de faibles doses de 1,4-dioxane pendant des durées relativement courtes; les résultats n'étaient pas concluants (Buffler et al., 1978). Dans le cadre d'une étude de paires appariées sur 151 travailleurs exposés pendant 1 à 6 ans à des concentrations atmosphériques de jusqu'à 1,4 mg/L de 1,1,1trichloroéthane mélangé avec le stabiliseur 1,4dioxane à une concentration de 4 %, aucun effet nocif sur le foie et le cœur n'a été signalé (Kramer et al., 1978). Dans le cadre d'une étude comparative du taux de mortalité de plus de 19 000 cas dans le Danish Cancer Registry, un ratio standardisé d'incidence proportionnelle (RISP) de 1,64 a été déterminé pour le cancer hépatique chez des travailleurs mâles dans une compagnie qui a utilisé le 1,4dioxane de 1970 à 1984. Le RISP était beaucoup plus élevé que le taux attendu (p = 0,04), et les facteurs de confusion, en particulier la consommation d'alcool, ne pouvaient pas causer cette hausse. Cependant, lorsqu'une période de latence (minimum de 10 ans) est intégrée dans l'analyse des données, le RISP est réduit à 1,15. Du point de vue statistique, l'intervalle de confiance (1,03 à 2,48) indique la possibilité d'un effet réel. Par contre, des facteurs ne pouvant pas être contrôlés comme la possibilité d'exposition à d'autres produits chimiques cancérogènes, en particulier le 1,1,1trichloroéthane, et le manque de données d'exposition quantitatives pour le 1,4dioxane, rendent difficile la tâche de donner une conclusion sur une association de cause du cancer du foie dans le cadre de cette étude. Une augmentation de 50 % de l'incidence du cancer du foie a été signalée dans un milieu de travail où seulement le 1,4-dioxane était utilisé. La consommation d'alcool ne pouvait pas causer cette hausse. Les mêmes auteurs ont mené une enquête sur l'exposition dans le milieu de travail (1983 à 1991) et ont déclaré que la majorité des concentrations de 1,4dioxane mesurées étaient inférieures à 10 mg/m3. Cependant, ces données n'étaient pas suffisantes pour permettre aux auteurs de spéculer sur les concentrations d'exposition dans le milieu de travail dans le cadre de l'étude comparative sur le taux de mortalité (Hansen, 1993; Hansen et al., 1993). |
| Génotoxicité et paramètres connexes | Dans le cadre de l'étude transversale mentionnée cidessus, 74 travailleurs ont été exposés à des concentrations estimées de 0,02 à 48 mg/m3 de 1,4dioxane sur une période moyenne de presque 25 ans. Chez six travailleurs actifs, aucune augmentation du taux d'aberrations chromosomiques dans les lymphocytes n'a été signalée (Thiess et al., 1976). Dans une étude plus poussée, une augmentation importante de la fréquence moyenne d'aberration chromosomique des lymphocytes a été observée chez 11 travailleurs exposés à des oxydes d'alkylène, y compris le 1,4dioxane, pendant une période de plus de 20 ans. Les travailleurs ont également été exposés à d'autres mutagènes connus comme l'oxyde d'éthylène et l'oxyde de propylène (Thiess et al., 1981). |
| Toxicité pour la reproduction et le développement | Dans l'industrie électronique, une augmentation de l'incidence des fausses couches, des naissances prématurées, de toxicose, d'ossification fœtale et de réduction du poids de naissance ainsi que des effets gonadotoxiques sur la progéniture ont été observés chez les femmes travailleuses exposées à des produits chimiques, y compris le 1,4-dioxane dans le milieu de travail (Mikheev et al., 1979; Ailamazian, 1990). |
| Irritation | L'irritation des yeux, du nez et de la gorge a été signalée chez les bénévoles exposés au 1,4-dioxane sous forme de vapeur à une concentration de 50 ppm (180 mg/m3) pendant 6 heures et à des concentrations plus élevées pendant de plus courtes périodes (Yant et al., 1930; Wirth et Klimmer, 1937; Silverman et al., 1946; Young et al., 1977; Gingell et al., 1994). En outre, le 1,4dioxane est un solvant de graisses. L'irritation de la peau a été observée après des expositions répétées et de longue durée (Sonneck, 1964; Adams, 1983). La Commission européenne a conclu que le 1,4-dioxane irrite les yeux et les voies respiratoires, mais non la peau (EURAR, 2002). |
| Scénario d'exposition | Concentration ou dose | Dose avec effet critique | Effet critique | Marge d'exposition |
|---|---|---|---|---|
| 1 Voir l'annexe 1 pour obtenir les détails sur les concentrations environnementales. 2 Voir le tableau 7b pour obtenir les détails sur les estimations actuelles d'exposition à partir de produits de soins personnels et les estimations d'exposition à partir des produits dérivés du SDC. |
||||
| Milieu environnemental | ||||
| Dose quotidienne estimée provenant du milieu environnemental1 | 0,19 à 1,26 µg/kg-p.c. par jour | 9,6 mg/kg-p.c. par jour | Dose d'exposition orale à laquelle aucune formation de tumeurs n'a été observée et DSENO orale pour les effets non néoplastiques (toxicité hépatique) chez les animaux de laboratoire (Kociba et al., 1974) | 7 620 à 50 530 |
| 16 mg/kg-p.c. par jour | DMENO orale pour les lésions hépatiques chez les animaux de laboratoire (Yamazaki et al., 1994; JBRC, 1998c) | 12 700 à 84 200 | ||
| Estimation d’exposition par inhalation à partir de l’air intérieur | 0,685 µg/m3 (Fellin et Otson, 1997) | 180 mg/m3 | Toxicité nasale chronique chez les rats (2 ans) (Kasai et al., 2009) | 262 770 |
| 180 mg/m3 | Irritation des yeux, du nez et de la gorge (6 heures, humains) (Young et al., 1977). | |||
| Dose estimée issue de l'utilisation quotidienne de produits de soins personnels | ||||
| Données actuelles sur le produit fini : Estimation globale de la plage d'exposition à partir des produits utilisés quotidiennement (dose de l'exposition cutanée et par inhalation)2 | 0,0012 mg/kg-p.c. par jour | 9,6 mg/kg-p.c. par jour | Dose d'exposition orale à laquelle aucune formation de tumeurs n'a été observée et DSENO orale pour les effets non néoplastiques (toxicité hépatique) chez les animaux de laboratoire (Kociba et al., 1974) | 8 000 |
| 16 mg/kg-p.c. par jour | DMENO orale pour les lésions hépatiques chez les animaux de laboratoire (Yamazaki et al., 1994; JBRC, 1998c) | 13 300 | ||
| Estimation d'exposition par inhalation issue de l'utilisation quotidienne des produits de soins personnels | ||||
| Données actuelle sur le produit fini : Estimation moyenne globale des concentrations atmosphériques issues de l'utilisation quotidienne de produits2 | 0,0118 mg/m3 | 180 mg/m3 | Toxicité nasale chronique chez les rats (2 ans) (Kasai et al., 2009). | 15 250 |
| Estimation d'exposition issue de l'utilisation aiguë de produits de soins personnels | ||||
| Colorant capillaire : Plage d'estimations d'exposition issues des données tirées du SDC (absorption par exposition cutanée et par inhalation)2 | 0,0202 à 0,0672 mg/kg-p.c. | 1 050 mg/kg-p.c. | DMEO orale aiguë fondée sur les effets subtils sur le système nerveux central (neurotransmetteurs) chez les rats (Kanada et al., 1994) | 15 630 à 52 000 |
| Colorant capillaire : Estimations de la concentration atmosphérique moyenne tirée du SDC2 | 1,39 à 4,64 mg/m3 | 180 mg/m3 | Irritation des yeux, du nez et de la gorge (6 heures, humains) (Young et al., 1977) | 40 à 130 |
| 3 600 mg/m3 | CMEO aiguë fondée sur des modifications aux activités des enzymes sériques (4 heures, rats) (Drew et al., 1978) | 780 à 2 590 | ||