Évaluation préalable pour le Défi concernant le
Archivée
2-butanone, oxime
(butanone-oxime)
Numéro de registre du Chemical Abstracts Service
96-29-7
Environnement Canada
Santé Canada
Mars 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Estimations de la limite supérieure de l'exposition au butanone-oxime dans les produits de consommation
- Annexe 2 : Résumé des renseignements disponibles relatifs aux effets du butanone-oxime sur la santé
En application de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE(1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du butanone-oxime, dont le numéro de registre du Chemical Abstracts Service est 96-29-7. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance durant la catégorisation visant la Liste intérieure dans le cadre du Défi. Le butanone-oxime a été jugé hautement prioritaire, car il a été reconnu comme une substance présentant le plus fort risque d’exposition pour la population du Canada et il a été classé par la Commission européenne en fonction de sa cancérogénicité. Bien que le butanone-oxime répondait au critère environnemental de la catégorisation relatif à la persistance, il ne réponde pas aux critères liés au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation sur le butanone-oxime est donc principalement axée sur les risques pour la santé humaine.
Le butanone-oxime est largement utilisé comme agent antipeau dans la préparation des peintures alkydes, des vernis, des teintures et des revêtements destinés à l’utilisation par l’industrie et les consommateurs. Au Canada, cette substance est contenue dans plusieurs pesticides, notamment dans les produits de préservation du bois et les peintures marines antisalissures ainsi que dans certains adhésifs, agents d’étanchéité à base de silicone et encres d’imprimerie. De plus, le butanone-oxime est utilisé comme inhibiteur de corrosion dans les chaudières industrielles et les systèmes de traitement de l’eau et comme agent de blocage dans le processus de fabrication des polymères d’uréthane.
Selon les renseignements obtenus en application de l’article 71 de la LCPE(1999), aucune entreprise au Canada n’a fabriqué de butanone-oxime au cours de l’année civile 2006. Toutefois, environ 500 000 kg de cette substance ont été importés en 2006 et la quantité utilisée a atteint près de 120 000 kg au cours de l’année visée. Il existe très peu de données sur le rejet et le devenir du butanone-oxime dans les milieux naturels au Canada ou ailleurs. Il n’est pas présent naturellement dans l’environnement et ses rejets dans l’environnement devraient donc provenir directement des activités anthropiques. Étant donné la quantité de butanone-oxime commercialisée au Canada et son utilisation dans divers produits de consommation, l’exposition de la population générale à cette substance devrait être modérée.
Comme le butanone-oxime a été classé par la Commission européenne en fonction de sa cancérogénicité, la présente évaluation préalable porte principalement sur cette capacité de la substance. Dans le cadre d’une étude longitudinale menée chez les rats et les souris, on a observé une augmentation de l’incidence des tumeurs hépatiques ainsi qu’une augmentation de l’incidence des tumeurs des glandes mammaires chez les rats femelles; toutefois, ces tumeurs n’ont été observées qu’à une exposition à des concentrations moyennes à élevées. Les résultats des essais de génotoxicité in vivo et in vitro indiquent l’absence de mutagénicité. Il semble que l’exposition chronique au butanone-oxime provoque l’apparition de tumeurs par un mécanisme ne comportant aucune interaction directe avec le matériel génétique.
Des effets non néoplasiques ont également été observés dans les fosses nasales des rats et des souris à partir d’études sur l’exposition (de courte durée à chronique) au butanone-oxime par inhalation. De plus, des effets hématologiques chez les rats et les lapins ainsi que des effets sur le foie, la rate et les reins des rats ont été notés à la suite d’une exposition orale dans le cadre d’études à doses répétées. D’après la comparaison de l’exposition estimative au butanone-oxime au Canada et de la concentration associée à un effet critique pour les effets autres que le cancer, et compte tenu des incertitudes inhérentes aux bases de données sur l’exposition et les effets, on considère que les marges d’exposition, notamment l’exposition des consommateurs aux produits contenant la substance, pourraient ne pas être suffisamment protectrices de la santé humaine.
Compte tenu du manque de fiabilité possible entre l’exposition estimée au butanone-oxime et les concentrations associées à un effet critique, il en ressort que le butanone-oxime est une substance qui peut pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D'après le danger écologique que présentent le butanone-oxime et ses rejets estimés, il est conclu que cette substance ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ni à mettre en danger l'environnement essentiel pour la vie. Le butanone-oxime répond aux critères de la persistance, mais il ne répond pas aux critères du potentiel de bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation.
Cette substance sera considérée pour inclusion dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles déterminées à l’étape de la gestion des risques.
La Loi canadienne sur la protection de l'environnement (1999) [LCPE(1999)] (Canada, 1999) impose aux ministres de l'Environnement et de la Santé de procéder à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque (Ti) pour les organismes aquatiques et que l'on estime commercialisées;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
Une priorité élevée a été donnée à l'évaluation des risques que comporte le butanone-oxime pour la santé humaine étant donné le risque d'exposition des Canadiens, qui a été jugé le plus fort (PFRE), et la classification de la substance par un autre organisme en ce qui a trait à la cancérogénicité.
Le volet du Défi portant sur le butanone-oxime a été publié dans la Gazette du Canada le 30 août 2008 (Canada, 2008). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements sur la substance ont été communiqués en réponse au Défi.
Même s'il a été jugé hautement prioritaire d'évaluer les risques que présente le butanone-oxime pour la santé humaine et que cette substance répond aux critères environnementaux de la catégorisation applicables à la persistance, celle-ci ne répond pas aux critères définissant la bioaccumulation ou la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables visent à étudier les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les risques, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l'évaluation préalable de cette substance sont tirées de publications originales, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et d'autres documents consultés au cours de recherches documentaires menées récemment, jusqu’en novembre 2008 (sections concernant la santé humaine) et jusqu'en mai 2009 (sections concernant l’environnement). Les études les plus importantes ont fait l'objet d'une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition (non professionnelle) de la population générale et de l'information sur les dangers et les risques pour la santé (principalement d’après les évaluations s’appuyant sur la méthode du poids de la preuve effectuées par d'autres organismes, lesquelles ont servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur la marge entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, et ce, dans le contexte d'une évaluation préalable. La présente évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion.
L’évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes de ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'environnement ont fait l'objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment Mme Joan Strawson (TERA), M. Micheal Jayjock, Ph. D. (The LifeLine Group) et M. Glenn Talaska, Ph. D (Université de Cincinnati). Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l’évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Le butanone-oxime est appelé méthyléthylcétoxime (MECO). Cependant, aux fins de la présente évaluation, la substance est appelée butanone-oxime selon le nom utilisé dans l'Inventaire européen des substances chimiques commercialisées existantes (EINECS). Le tableau 1 résume l’identité de la substance.
Tableau 1. Identité de la substance – butanone-oxime
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 96-29-7 |
| Nom dans la LIS | Butanone-oxime |
| Noms relevés dans les NCI | Butanone-oxime (EINECS, PICCS) 2-Butanone-oxime (AICS, ASIA-PAC, PICCS, SWISS, TSCA) Butan-2-one oxime (ENCS, PICCS) 2-Butanonoxime (PICCS) Methyl ethyl ketoxime (PICCS) Methyl ethyl ketone oxime (PICCS)Oxime 2-butanone (ECL) |
| Autres noms | Aron M 1, 2-Butoxime, Ethyl methyl ketone oxime, Ethyl methyl ketoxime, Exkin 2, Exkin II, Hiaron M 1, MEK-oxime, MEKO, Mekor 70, NSC 442, NSC 65465, Troykyd AntiSkin B |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Oximes |
| Principale sous-classe chimique | Cétoximes (chaîne courte) |
| Formule chimique | C4H9NO |
| Structure chimique |  |
| SMILES | N(O)=C(CC)C |
| Masse moléculaire | 87,12 g/mol |
| Abréviations : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique); ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des produits et substances chimiques existantes et nouvelles du Japon); LIS (Liste intérieure des substances); National Chemical Inventories (NCI); n° CAS(numéro de registre du Chemical Abstracts Service); PICCS (inventaire des produits et substances chimiques des Philippines); SMILES (simplified molecular input line entry); SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). Source : NCI, 2006. |
|
Le tableau 2 présente les données physiques et chimiques (valeurs expérimentales et modélisées) du butanone-oxime qui se rapportent à son devenir dans l'environnement. Lorsque les données expérimentales n'étaient pas disponibles, la propriété a été estimée à l'aide de modèles, comme l'indique le tableau 2. Bien que le butanone-oxime soit un acide faible et qu'il se dissociera, cela ne survient qu'à un pH très élevé (> 12). Par conséquent, cette substance se trouve sous une forme neutre à des valeurs de pH pertinentes du point de vue de l'environnement (6 à 9) et la forme neutre du butanoneoxime a été utilisée pour l'estimation à l’aide des modèles.
Tableau 2. Propriétés physiques et chimiques du butanone-oxime
| Propriété | Type | Valeur1 | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Kco, coefficient de partage carbone organique-eau; Koa, coefficient de partage octanol-air; Koe, coefficient de partage octanol-eau; pKa, constante de dissociation acide. 1 Les valeurs entre parenthèses représentent les valeurs originales signalées par les auteurs. 2 Valeurs utilisées pour la modélisation. 3 La décomposition se produit à des températures supérieures à 100 °C (BESC, 2000). |
||||
| Point de fusion (°C) | Expérimental | -29,52 | Lide, 2005 | |
| Point d'ébullition (°C) | Expérimental | 152,52,3 | Lide, 2005 | |
| Masse volumique (kg/m3) | Expérimental | 923,2 | 20 | Lide, 2005 |
| Expérimental | 915 | BESC, 2000 | ||
| Expérimental | ~ 920 | 20 | ||
| Pression de vapeur (Pa) | Expérimental | ~ 3502 (~ 3,5 hPa) | 20 | BESC, 2000 |
| Expérimental | 440 (4,4 hPa) | 20 | ||
| Expérimental | 141 (1,06 mm Hg) | 20 | Kurita, 1967 | |
| Constante de la loi de Henry (Pa·m3/mol) | Calculé | 0,302 | 20 | |
| Log Koe (sans dimension) | Expérimental | 0,63 | MITI, 1992 | |
| Expérimental | 0,652 | 25 | BESC, 2000 | |
| Expérimental | 0,59 | 20 | ||
| Log Kco (sans dimension) | Modélisé | 0,56 | KOCWIN, 2008 | |
| Modélisé | 0,262 | EQC, 2003 | ||
| Log Koa (sans dimension) | Modélisé | 4,3 | 25 | KOAWIN, 2008 |
| Solubilité dans l'eau (mg/L) | Expérimental | 100 000 | Verschueren, 1977 | |
| pKa (sans dimension) | Expérimental | 12,45 | 25 | King et Marion, 1944 |
Alors que deux isomères géométriques sont possibles pour le butanone-oxime, l'isomère trans prédomine (> 99 %) (OCDE, 2003).
Le butanone-oxime est une substance anthropique et elle est considérée être une substance chimique produite en grande quantité dans les pays de l'Organisation de coopération et de développement économiques (OCDE, 2004), par l'Agence de protection de l’environnement des États-Unis (US EPA, 2006) et par la Commission européenne (ESIS, 2006). La production mondiale de butanone-oxime est estimée être entre 10 000 et 20 000 tonnes par année (OCDE, 2003). Selon les renseignements fournis en application de l'article 71 de la LCPE(1999), aucune entreprise au Canada n'a fabriqué de butanone-oxime au cours de l'année civile 2006. Pourtant, les importations de cette substance au Canada en une quantité supérieure au seuil de déclaration de 100 kg se sont chiffrées à environ 500 000 kg durant cette même année (Environnement Canada, 2009a).
Le butanone-oxime est largement utilisé comme agent antipeau dans la préparation des peintures alkydes, des apprêts, des vernis et des teintures destinés à empêcher le séchage par oxydation et la formation de pellicules dures et gélatineuses sur la préparation de peinture à l'intérieur du contenant. Selon les renseignements transmis en application de l'article 71 de la LCPE(1999), le Canada a, en 2006, utilisé près de 120 000 kg de butanone-oxime (Environnement Canada, 2009a). La majorité de ces utilisations étaient destinées à la fabrication de préparations de peinture alkyde à des fins d'applications industrielles et de consommation. Selon les renseignements disponibles, la concentration de butanone-oxime présente dans les préparations de peinture alkyde au Canada est d’au plus 1 % en poids (p/p), alors qu'une gamme de concentrations courantes varie de 0,02 à 0,5 % p/p (communication personnelle du groupe de travail de l'Association canadienne de l'industrie de la peinture et du revêtement adressée à Environnement Canada, 2009; source non citée dans les références). Selon les renseignements déclarés en application de l'article 71, le butanone-oxime est également présent dans les colorants ou les pigments utilisés dans les peintures alkydes ou les encres d'impression à des concentrations respectives de 0,1 % et 0,2 % p/p (Environnement Canada, 2009a).
Cette substance est également présente comme formulant dans plusieurs pesticides, notamment dans les produits de préservation du bois et les peintures marines antisalissures qui sont utilisés au Canada (communication personnelle de l'Agence de réglementation de la lutte antiparasitaire de Santé Canada adressée au Bureau de la gestion du risque de Santé Canada, 2009; source non citée dans les références). De plus, cette substance est un composant mineur de certains scellants et adhésifs fabriqués au Canada et, dans une moindre mesure, de certains bouche-pores et peintures et matériaux d'impression pour les artistes (Environnement Canada, 2009a).
Le butanone-oxime est également utilisé comme inhibiteur de corrosion dans les chaudières industrielles (Rumpf, 1993) et les systèmes de traitement de l'eau (Derelanko, 2003; Newton et al., 2001) et comme agent de blocage dans le processus de fabrication des polymères d'uréthane (Subramani et al., 2004). Selon les renseignements obtenus en application de l'article 71 de la LCPE(1999), le butanone-oxime sert d'inhibiteur de corrosion et d'agent de blocage dans la fabrication de polymères d'uréthane au Canada (Environnement Canada, 2009a).
Aucune utilisation actuelle du butanone-oxime dans les cosmétiques n'a été déclarée au Canada. Sur le plan international, une telle utilisation est interdite au Danemark (Ministère danois de l'environnement, 2004) et au Royaume-Uni (Secrétariat d'état britannique, 2008) conformément à une modification de la Directive 76/768/CEE de la Commission européenne (Commission européenne, 2004). Le butanone-oxime est présent dans certaines encres d'impression qui servent à fabriquer des matières constituant l'emballage alimentaire, mais il n'entre pas directement en contact avec les aliments.
Selon les renseignements communiqués en application de l'article 71 de la LCPE(1999), aucune entreprise au Canada n'a fabriqué de butanone-oxime au cours de l'année civile 2006. De plus, aucun rejet industriel important de cette substance n'a été déclaré dans les renseignements obtenus en exécution de l'article 71 durant cette même année (Environnement Canada, 2009a). L'Association canadienne des fabricants de produits chimiques (ACFPC, 2009) a indiqué un rejet de 356 kg de butanone-oxime dans l'environnement en 2007. La déclaration des rejets industriels de butanone-oxime à l'Inventaire national des rejets de polluants (INRP, 2007) n'est pas obligatoire. Le total des rejets industriels devrait être faible et les rejets les plus importants devraient être observés à l'étape de l'utilisation par les consommateurs.
D'après les propriétés physiques et chimiques du butanone-oxime (tableau 2), cette substance se caractérise par une hydrosolubilité élevée (100 000 mg/L), une pression de vapeur modérée (350 Pa), un faible log Koe (0,65) et une constante de la loi de Henry (0,30 Pa·m3/mol) faible. Les valeurs de demi-vie dans l'air (valeur modélisée de 7,21 jours; voir le tableau 4b) et dans l'eau (valeur mesurée de 18 jours en fonction du taux d'hydrolyse; voir le tableau 4a) servent à modéliser la fugacité de niveau III. D'après les résultats résumés dans le tableau 3, le butanone-oxime devrait demeurer en grande partie ou principalement dans le milieu où il est rejeté. On note une certaine répartition modérée dans l'eau et le sol lorsque la substance est rejetée dans l'air ainsi qu'une répartition modérée dans l'eau si la substance est rejetée dans le sol.
Tableau 3. Résultats de la modélisation de la fugacité de niveau III (EQC, 2003)
| Substance rejetée à 100 % dans : | Fraction de la substance se répartissant dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air | 61,1 | 18,9 | 20,0 | = 0,01 |
| l'eau | 0,2 | 99,6 | 0,1 | 0,2 |
| le sol | 0,7 | 21,6 | 77,6 | = 0,2 |
Le butanone-oxime est considéré être un composé non ionisant en raison de la valeur élevée de sa constante de dissociation (pKa > 12); il se trouvera donc sous sa forme neutre à des valeurs de pH normalement observées dans l'environnement (6 à 9).
Persistance dans l'environnement
Le tableau 4a présente les données empiriques sur la biodégradation et l'hydrolyse du butanone-oxime dans l’eau. Cette substance peut s'hydrolyser en fonction du pH. En effet, lorsque la température s’élève à 20 °C, l'hydrolyse est instable à pH 4, alors qu'aucune hydrolyse ne se produit à pH 9. À pH 7, 14 % de la substance est hydrolysée après quatre jours (Environnement Canada, 2009b), ce qui se traduit par une demie-vie de 18 jours en fonction du taux d'hydrolyse dans le milieu aquatique. Par conséquent, à des conditions environnementales neutres à acides, l'hydrolyse peut constituer une voie de dégradation importante pour cette substance. Les produits d'hydrolyse sont le 2-butanone (no CAS 78 93-3) et l'hydroxylamine (no CAS 7803-49-8) (BESC, 2000a; id., 2000b).
L'étude de la biodégradation intrinsèque (MITI, 1992) semble indiquer que le butanone-oxime subit une biodégradation primaire, mais que la biodégradation ultime est, au mieux, lente (tableau 4a).
Tableau 4a. Données empiriques sur la dégradation du butanone-oxime
| Milieu | Processus du devenir | Valeur pour la dégradation (%) | Paramètre de la dégradation | Référence |
|---|---|---|---|---|
| 1 Lignes directrices de l'OCDE pour les essais. Essai n° 302C : biodégradabilité dite intrinsèque : Essai MITI modifié (II). | ||||
| Eau | Biodégradation aérobie1 | 24,7 | Biodégradation intrinsèque en 28 jours | MITI, 1992 |
| Eau | Hydrolyse | 14 | Hydrolyse (4 jours, pH 7, 20 °C) | Environnement Canada, 2009b |
Le Bureau Européen des Substances Chimiques (BESC) a publié une fiche technique sur le butanone-oxime où il est question des études de dégradation et des autres essais approuvés de l'Organisation de coopération et de développement économiques (OCDE), qui concluent à une biodégradabilité intrinsèque, primaire et ultime (2000a). Les études révèlent une dégradation de 70 % relative au carbone organique dissous sur une période de 14 jours et une dégradation d'environ 25 % seulement relative à la demande biochimique d'oxygène.
En plus des données expérimentales susmentionnées sur la dégradation du butanone-oxime, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) (Environnement Canada, 2007) a été utilisée avec les modèles de dégradation présentés au tableau 4b.
Tableau 4b. Données modélisées sur la dégradation du butanone-oxime
| Processus du devenir | Modèle et fondement du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2008 | t1/2 = 7,21 jours1 | > 2 |
| Réaction avec l'ozone | AOPWIN, 2008 | s.o.2 | s.o. |
| Eau | |||
| Hydrolyse | HYDROWIN, 2008 | s.o.2 | s.o. |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 3 : enquête d'expert (biodégradation ultime) | 3,013 « se biodégrade rapidement » | < 182 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 4 : enquête d'expert (biodégradation primaire) | 3,723 « se biodégrade rapidement » | < 182 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 5 : MITI, probabilité linéaire (biodégradation ultime) | 0,504 « se biodégrade rapidement » | < 182 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 6 : MITI, probabilité non linéaire (biodégradation ultime) | 0,624 « se biodégrade rapidement » | < 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 probabilité | 0,03 « se biodégrade très lentement » | > 182 |
| Biodégradation (aérobie) | CATABOL, c2000-2008 DBO, % (demande biochimique en oxygène) | % DBO = 20,1 « se biodégrade lentement » | > 182 |
Les modèles de biodégradation aérobie (sous-modèles BIOWIN 3, 4, 5 et 6) semblent indiquer que le butanone-oxime se dégrade rapidement. Les résultats des modèles de probabilité (sous-modèles BIOWIN 5 et 6) sont supérieurs à 0,3, le seuil suggéré par Aronson et al. (2006) pour définir les substances comme ayant une demi-vie inférieure à 60 jours (selon les modèles de probabilité du MITI). Toutefois, le modèle TOPKAT prédit que la substance peut ne pas se biodégrader rapidement dans l'eau, alors que le modèle CATABOL indique que la substance se situe entre les valeurs limites définissant une biodégradation lente (DBO < 20 %) et une biodégradation rapide (DBO > 21 %). Vu l'existence des données expérimentales, on a accordé davantage d’importance aux mesures empiriques; les résultats des sous-modèles BIOWIN 3, 4, 5 et 6 ayant trait à la biodégradation aérobie viennent aussi appuyer ces données. Les données expérimentales, conjuguées avec les prévisions du modèle BIOWIN, sont assez fiables pour qu'on s’attende à une biodégradation importante avec une demi-vie vraisemblablement bien inférieure à 182 jours.
On s'attend à ce que le butanone-oxime se dépose dans une faible mesure dans les sédiments; toutefois, il pourra demeurer dans le sol s'il est rejeté dans ce milieu environnemental (voir le tableau 3). Étant donné la biodégradation rapide prévue par les sous-modèles BIOWIN (2008), de même que le potentiel modéré d'hydrolyse, la demi-vie de dégradation dans l'eau est probablement inférieure ou égale à 90 jours. Par conséquent, la demi-vie de dégradation dans le sol et les sédiments, laquelle est extrapolée à l'aide des facteurs de Boethling et al., (1995) (t½ eau : t½ sol : t½ sédiments = 1 : 1 :4), est inférieure ou égale à 180 jours et à 365 jours, respectivement.
D'après les données empiriques et modélisées (voir les tableaux 4a et 4b ci-dessus), il est conclu que le butanone-oxime satisfait au critère de la persistance dans l'air (demi-vie dans l'air = 2 jours), mais ne satisfait pas aux critères de la persistance dans l'eau, le sol ou les sédiments (demi-vie dans le sol et l'eau = 182 jours et demi-vie dans les sédiments = 365 jours) prévus dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Le potentiel de transport à grande distance de cette substance a été prévu à l'aide de deux modèles : le modèle de transport et de persistance de niveau III (TaPL3, v. 3.00) et l'outil de dépistage du potentiel de transport à grande distance et de persistance générale dans l'environnement de l'OCDE. Les résultats sont présentés au tableau 4c.
Tableau 4c. Prévisions des modèles et niveau de préoccupation pour le potentiel de transport à grande distance du butanone-oxime
| Modèles de prévision | Pge1 (jour) | DTC2 (km) | ET3 (%) | Niveau de préoccupation | ||
|---|---|---|---|---|---|---|
| Faible | Moyen | Élevé | ||||
| 1 Pge = Persistance générale dans l'environnement 2 DTC = Distance de transport caractéristique 3 ET = Efficacité du transfert |
||||||
| TaPL3, v. 3.00 | s.o.4 | 1 376 | s.o. | DTC < 700 km | DTC = de 700 à 2 000 km | DTC > 2 000 km |
| Outil de l'OCDE | 23,5 | 3 581 | 2,1 × 10-2 | 1) Pge < 195 jours et 2) DTC < 5 098 km et ET < 6,5 × 10-4 % | toute combinaison de Pge, DTC et ET autre que « faible » ou « élevé » | 1) Pge > 195 jours et 2) DTC > 5 098 km ou ET > 6,5 × 10-4 % |
Le modèle TaPL3 fournit une estimation de la distance de transport caractéristique seulement pour la substance, définie comme la distance maximale parcourue par 63 % de la substance sur 1 376 km. Beyer et al. (2000) ont proposé de considérer le potentiel de transport à grande distance comme étant élevé si la distance de transport caractéristique est supérieure à 2 000 km, moyen si elle est de 700 à 2 000 km et faible si elle est inférieure à 700 km. Selon le résultat du modèle TaPL3, cette substance devrait avoir un potentiel moyen de transport à grande distance.
Le potentiel de transport à grande distance du butanone-oxime a aussi été évalué à l'aide de l’outil de l'OCDE, en fonction d'une combinaison de la persistance générale dans l'environnement et de la distance de transport caractéristique ou de l'efficacité du transfert. La persistance générale dans l'environnement a été présentée comme un concept pour considérer les valeurs de demi-vie d'après le comportement de répartition et elle représente la moyenne de l'ensemble de ces valeurs dans l'air, l'eau, les sédiments et le sol (Mackay, 2006). Ce paramètre est étroitement lié au potentiel de transport à grande distance; toutefois, il n'est pas actuellement utilisé dans le processus décisionnel lié à l'évaluation des dangers puisque les organismes de réglementation privilégient la méthode faisant appel aux valeurs de demi-vie dans un même milieu. L'efficacité du transfert est une mesure, exprimée en pourcentage, de la portée du dépôt d'une substance sur les milieux en surface dans une région cible après avoir été transportée à partir de la région de rejet (Klasmeier et al., 2006). D'après le système d'évaluation du niveau de préoccupation (Scheringer et al., 2006), le potentiel de transport à grande distance du butanone-oxime devrait également être moyen.
Potentiel de bioaccumulation
Les valeurs expérimentales du log Koe (entre 0,59 et 0,65) du butanone-oxime (voir le tableau 2 ci-dessus) suggèrent que cette substance est peu bioaccumulable dans le biote. Les facteurs de bioconcentration (FBC) obtenus expérimentalement de 0,5 à 5,8 chez la carpe (Cyprinus carpio) et le medaka japonais (Oryzias latipes) (MITI, 1992; BESC, 2000a) indiquent que le butanone-oxime n'est pas bioaccumulable. Cette conclusion est également appuyée par les valeurs modélisées du FBC et du facteur de bioaccumulation (FBA) (tableau 5) sans métabolisme, lesquelles ont été utilisées dans la méthode du poids de la preuve (Environnement Canada, 2007) pour l'évaluation du potentiel de bioaccumulation de cette substance.
Tableau 5. FBA et FBC du butanoneoxime prévus chez les poissons sans métabolisme
| Organisme d'essai | Paramètre | Valeur en poids humide (L/kg) | Référence |
|---|---|---|---|
| 1 La très faible valeur de 3,2 assignée au FBC est une valeur par défaut recommandée par le modèle BCFBAF pour les substances dont le log Koe est inférieur à 1; ce résultat n'est donc pas une valeur de FBC issue du modèle qui a été calculée expressément pour le butanone-oxime. 2 Estimation maximale. |
|||
| Poissons | FBA | 1,2 | Modèle du FBA de Gobas pour le niveau trophique intermédiaire (BCFBAF, 2008) |
| Poissons | FBC | 1,2 | Modèle du FBC de Gobas pour le niveau trophique intermédiaire (BCFBAF, 2008) |
| Poissons | FBC | 3,21 | BCFBAF, 2008 |
| Poissons | FBC2 | 27,5 | CPOPs, 2008 |
De plus, les valeurs du log Koe pour les produits d'hydrolyse du butanone-oxime et de l'hydroxylamine sont très faibles (BESC, 2000; OCDE, 2008), ce qui indique que ces substances hydrolytiques du butanone-oxime présentent un faible potentiel de bioaccumulation.
D'après les valeurs empiriques et celles obtenues par modélisation cinétique, il est conclu que le butanone-oxime ne satisfait pas aux critères de la bioaccumulation (FBA ou FBC = 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La démarche suivie dans cette évaluation consistait à examiner les renseignements scientifiques disponibles et à tirer des conclusions en appliquant la méthode du poids de la preuve et en tenant compte du principe de prudence requis par la LCPE(1999). Les éléments de preuve pris en compte comprenaient les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Comme il a été décrit précédemment, le butanone-oxime est persistant dans l'air, mais il ne l'est pas dans l'eau, le sol ou les sédiments. Il devrait également présenter un faible potentiel de bioaccumulation. Les données expérimentales sur les effets écologiques les plus sensibles pour plusieurs espèces, de même que les données modélisées, sont résumées dans le tableau 6. Des sommaires de rigueur d'études n'ont pas été préparés pour les études empiriques, car celles-ci n'étaient pas disponibles. Cependant, la valeur la plus faible de toutes les données recueillies sur l'écotoxicité (6,1 mg/L) a été utilisée en tant qu'estimation prudente de la valeur critique de toxicité (VCT) pour caractériser le potentiel d’effets sur les espèces sensibles. Les données modélisées appuient généralement les résultats empiriques.
Tableau 6. Données empiriques et modélisées sur la toxicité en milieu aquatique du butanone-oxime
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence | ||
|---|---|---|---|---|---|---|
| Abréviations : CE50, concentration d'une substance qu'on estime susceptible de causer un effet toxique sublétal chez 50 % des organismes d'essai; CL50, concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai; CSEO, concentration sans effet observé. 1 Anciennement Selenastrum capricornutum. 2 Valeur critique de toxicité (VCT). 3 Essai biologique de toxicité sur Photobacterium phosphoreum. 4 Fondé sur un modèle RQSA pour la toxicité de référence. |
||||||
| Données empiriques | ||||||
| Poisson (Pimephales promelas) | Toxicité aiguë | CL50 sur 96 h | 843 | Brooke et al., 1984 | ||
| Poisson (Oryzias latipes) | Toxicité subchronique | CL50 sur 14 j CSEO sur 14 j | > 100 50 | CHRIP, c2002 | ||
| Invertébré(Daphnia magna) | Toxicité aiguë | CE50 sur 48 h | 200 | CHRIP, c2002 | ||
| Invertébré(Daphnia magna) | Toxicité chronique | CE50 (reproduction)sur 21 j | > 100 | CHRIP, c2002 | ||
| Algue (Pseudo-kircheneriella subcapitata)1 | Toxicité chronique | CE50 (croissance) sur 72 h) | 6,12 | CHRIP, c2002 | ||
| Microbe3 | Toxicité aiguë | CE50 en 5 min | 950 | Curtis et al., 1982 | ||
| Données modélisées | ||||||
| Poisson | Toxicité aiguë | CL50 sur 96 h | 932 | ECOSAR, 20084 | ||
| Poisson | Toxicité chronique | Valeur chronique | 91 | ECOSAR, 2008 | ||
| Poisson (Pimephales promelas) | Toxicité aiguë | CL50 sur 96 h | 1 482 | AIEPS, 2003-2007 | ||
| Invertébré (Daphnia) | Toxicité aiguë | CE50 sur 48 h | 457 | ECOSAR, 2008 | ||
| Invertébré (Daphnia) | Toxicité chronique | Valeur chronique | 33 | ECOSAR, 2008 | ||
| Invertébré (Daphnia) | CE50 | 1 600 | TOPKAT, 2004 | |||
| Invertébré (Daphnia) | Toxicité aiguë | CE50 sur 48 h | 290 | AIEPS, 2003-2007 | ||
| Algue verte | Toxicité chronique | CE50 sur 96 h | 113 | ECOSAR, 2008 | ||
| Algue verte | Toxicité chronique | Valeur chronique | 32 | ECOSAR, 2008 | ||
| Algue (Pseudo-kirchneriella subcapitata) | Toxicité chronique | CE50 sur 72 h | 31 | AIEPS, 2003-2007 | ||
Les données sur la toxicité indiquent que le butanone-oxime présente un potentiel modéré d'être toxique pour les algues et un potentiel faible pour la majorité des autres organismes aquatiques. De plus, en tenant compte de la toxicité des produits d'hydrolyse (2-butanone et hydroxylamine) pour les espèces aquatiques sensibles, de même que du faible taux comparable d'hydrolyse (14 % en 4 jours) dans les conditions environnementales, le risque découlant des produits d'hydrolyse du butanone-oxime ne devrait pas être significativement supérieur à celui du composé (BESC, 2000b; OCDE, 2008).
Aucune donnée sur la toxicité n'a été trouvée pour les organismes vivant dans le sol ou les sédiments.
Le grand volume d'importation de butanone-oxime au Canada, ainsi que les renseignements sur les utilisations de cette substance, indique une possibilité de rejet généralisé de cette substance dans l'environnement au pays. S'il est rejeté dans l'eau, le butanone-oxime devrait y rester (> 99 %; voir le tableau 3). Dans la présente évaluation préalable, des scénarios d'exposition du milieu aquatique propres au site ont été élaborés en vue d'estimer les rejets des exploitations industrielles dans le milieu aquatique ainsi que les concentrations de ces rejets dans le milieu aquatique.
Deux sites (usines de traitement des eaux usées) ont été identifiés comme ayant les rejets les plus importants de butanone-oxime, tel qu'établis à partir des renseignements obtenus dans le cadre de l'enquête menée en vertu de l'article 71 (Environnement Canada, 2009a). Chaque site comprend des rejets d'un certain nombre d'utilisateurs industriels de butanone-oxime. Un site rejette ses eaux usées dans un milieu récepteur relativement important, alors que l'autre les rejette dans un milieu récepteur considérablement plus petit. Les concentrations environnementales estimées (CEE) pour les deux sites étaient calculées en fonction de la quantité de butanone-oxime utilisée par toutes les installations desservies par chacune des usines de traitement des eaux usées, la fraction estimée du rejet vers l'usine de traitement des eaux usées, le taux d'élimination et le débit de l'effluent de cette usine ainsi que la capacité de dilution du milieu récepteur. La fraction de la substance rejetée vers l'usine de traitement des eaux usées constitue la valeur clé dans l'estimation de la CEE. Cette fraction de 0,3 %, qui est présumée par défaut, provient du nettoyage des conteneurs semi-vrac ou des boîtes de manutention utilisés pour le transport de la substance (Great Western Containers, 2005). La CEE calculée la plus élevée des deux sites était de 0,010 mg/L.
Une concentration estimée sans effet (CESE) a été déterminée à partir de la valeur de la toxicité chronique de 6,1 mg/L mesurée chez les algues, soit chez Pseudokirchneriella subcapitata (voir le tableau 6). Pour ce faire, un facteur d'évaluation de 100 a été appliqué pour tenir compte des incertitudes liées à la variabilité interspécifique et intraspécifique de la sensibilité et de l'extrapolation d'une valeur sans effet mesurée sur le terrain à partir d'une CE50 mesurée en laboratoire. La CESE ainsi obtenue était de 0,06 mg/L. Le quotient de risque dérivé le plus élevé, calculé comme étant le rapport de la CEE sur la CESE était de 0,17, ce qui indique que la substance ne devrait pas être nocive pour les organismes aquatiques.
Il est donc peu probable que le butanone-oxime cause des effets écologiques nocifs au Canada. Étant donné le faible taux d’hydrolyse comparable du butanone-oxime, les produits d'hydrolyse ne devraient pas non plus représenter une menace.
Il importe de souligner que cette conclusion a été formulée malgré les hypothèses prudentes qui ont été émises en réponse aux incertitudes découlant de la présente évaluation. Une incertitude clé est liée au manque de données empiriques sur les concentrations environnementales au Canada, auquel on a remédié en prédisant des concentrations réalistes pour la pire éventualité dans l'eau à l'aide d'un modèle d'exposition industrielle. Il y a aussi une incertitude associée à la CESE utilisée dans le calcul du quotient de risque puisque les détails de l'étude n'étaient pas disponibles. Cependant, la VCT qui a été utilisée est jugée prudente comme il s'agit de la valeur empirique la plus faible observée et qu'elle est au moins un ordre de grandeur inférieur à la deuxième plus faible VCT. De plus, un facteur d'évaluation de 100 a été appliqué à la VCT afin d'obtenir la CESE.
De plus, en ce qui concerne l'écotoxicité, le comportement de répartition prévu de cette substance montre que les données disponibles sur les effets ne permettent pas d'évaluer comme il se doit l'importance du sol et des sédiments comme milieux d'exposition. Toutefois, les expositions à proximité de sources ponctuelles industrielles devraient être les plus élevées dans le milieu aquatique.
Des incertitudes existent également au sujet de la conclusion relative à la persistance. Très peu de données empiriques étaient disponibles et certains résultats des modèles étaient contradictoires. Ces données ont néanmoins servi à estimer la demi-vie pour l'eau, le sol et les sédiments. Cependant, selon les données disponibles, y compris les données empiriques et modélisées, cette substance ne répond pas aux critères de la persistance pour l'eau, le sol ou les sédiments.
Évaluation de l'exposition
Milieux naturels et nourriture
Aucune concentration mesurée de butanone-oxime dans les milieux naturels n'a été recensée au Canada ou ailleurs. En raison de sa pression de vapeur élevée et de sa demivie dans l'air, le butanone-oxime devrait être surtout présent sous forme de vapeur et persister dans l'air ambiant. Toutefois, étant donné qu'aucun rejet industriel important de butanone-oxime n'a été signalé en 2006, la concentration de cette substance dans l'air ambiant devrait être faible. Les estimations modélisées fondées sur les renseignements actuels prédisent également que la concentration de butanoneoxime dans l'air est faible, soit environ 1,79 ng/m3 (ChemCAN, 2003). De même, les concentrations prévues pour l'eau et le sol sont très faibles (0,550 ng/L et 7,08 × 10-4 ng/g, respectivement).
Aucune concentration mesurée de butanone-oxime dans la nourriture n'a été recensée au Canada ou ailleurs. D'après les utilisations du butanone-oxime au Canada, il est très peu probable que la nourriture représente une source d'exposition. Étant donné que les valeurs expérimentales et modélisées du log Koe pour le butanone-oxime sont faibles, cette substance ne devrait pas se bioaccumuler dans le biote et son accumulation dans la chaîne alimentaire est très improbable.
En raison du manque de données empiriques sur les concentrations dans les milieux naturels et la nourriture, les estimations des limites supérieures de l'absorption quotidienne pour la population générale n'ont pas été calculées.
Produits de consommation
En ce qui concerne les produits de consommation, le butanone-oxime est largement utilisé dans les peintures alkydes, les teintures, les vernis et les revêtements selon les renseignements présentés en application de l'article 71 de la LCPE(1999). Le butanoneoxime est également présent dans quelques scellants, adhésifs et bouche-pores qui sont principalement utilisés par l'industrie, mais qui peuvent également être accessibles à la population générale pour l'entretien de la maison et les applications destinées aux bricoleurs. En consequence, l’utilisation des peintures alkyd contenant du butanone-oxime a été le principal scenario utilisé pour charactériser l’exposition aux produits. Un nombre limité d’études a relevé les concentrations de butanone-oxime pendant la fabrication et l’utilisation des produits tels que les peintures alkyd.
Selon une étude américaine récente de l'exposition des consommateurs au butanoneoxime (Chang, 1998), la concentration maximale de butanone-oxime présente dans l'air intérieur est de 18 mg/m3 et elle est fondée sur l'utilisation de peinture alkyde contenant 0,293 % p/p de butanone-oxime, la plus grande quantité de cette substance présente dans les produits mis à l'essai. Dans un nombre réduit d’études non-publiées la concentration de butanone-oxime a été mesuré jusqu’à 9.9 ppm (30 mg/m3) lors d’une simulation utilisant un scenario de peiture interne d’alkyd contenant environ 0,2% butanone-oxime (étude non-publiée présentée à Environnement Canada, 2009b; source non citée dans les références)
En effet, le contenu en butanone-oxime des peintures alkydes utilisées au Canada peut être supérieur, soit jusqu'à 1 % (communication personnelle du groupe de travail de l’Association canadienne de l’industrie de la peinture et du revêtement adressée à Environnement Canada, 2009; source non citée dans les références) le risque d’exposition à ce niveau-ci a été modellisé.
Les estimations de l'exposition ont donc été obtenues à l'aide de la version 4.1 du logiciel ConsExpo (ConsExpo, 2007). Les concentrations estimées en air obtenues et l’exposition cutanée (externe) sont résumées dans le tableau 7. Les intrants et les hypothèses utilisés pour la modélisation à l'aide de la version 4.1 de ConsExpo pour chaque scénario touchant un produit de consommation sont présentées de façon détaillée à l'annexe 1, où les estimations de l'exposition à l'extérieur et à l'intérieur pendant l'utilisation de ces produits sont présentées Aucune donnée sur l'absorption n'a été relevée pour le butanone-oxime à la suite de l'exposition par inhalation. Cependant, les absorptions cutanées ont été enrégistrées et varient entre 13 et 29 % dans une étude réalisée avec des rats, ont été déclarés (Burka et al, 1998). Les estimations de l’exposition interne ont été obtenues en utilisant une absorption de 100 % pour inhalation et une absorption de 29 % pour l'exposition cutanée.
Tableau 7. Sommaire des concentrations estimées en air et des doses cutanées appliquées (externe) de butanone-oxime lors d’utilisation de produits de consommation.
| Produit de consommation | Concentration maximale de butanone-oxime (%) | Estimations de l'exposition | ||
|---|---|---|---|---|
| Concentration moyenne par événement pour l'inhalation (mg/m3) | Dose cutanée aiguë (interne) (mg/kg p.c.) | Dose externe totale intégrée (mg/kg p.c.) | ||
| Abréviation : kg p.c. = kilogramme de poids corporel. | ||||
| Revêtement alkyde | 1 | 223 | 0,0102 | 2,16 |
| Peinture alkyde (à haut extrait sec) | 1 | 113 | 0,147 | 2,87 |
| Peinture alkyde (peinture à forte teneur en solvants) | 1 | 72,7 | 0,147 | 2,03 |
| Peinture alkyde (aérosol) | 1 | 3,75 | 0,0614 | 0,235 |
| Produit d'étanchéité à base de silicone (joint) | 5 | 150 | 0,307 | 2,13 |
| Adhésif (joint d'étanchéité) | 2 | 3,39 | 0,00654 | 0,152 |
Les estimations de l'exposition calculées à l'aide de la version 3.2 du Wall Paint Exposure Assessment Model (modèle d'évaluation de l'exposition à la peinture pour les murs) de l'Agence de protection de l’environnement des États-Unis (US EPA, 2001) prévoient une concentration intérieure maximale de 227 mg/m3 pour les peintures alkydes et une exposition moyenne pendant 8 heures de 195 mg/m3.
Selon l'information disponible, la voie d'exposition la plus probable au butanone-oxime pour la population générale est, si l'on se fie à la concentration moyenne maximale par événement, l'inhalation pendant l'utilisation de peintures et de revêtements alkydes. Toutefois, à la lumière du peu de données disponibles sur les concentrations de la substance dans les milieux naturels, la confiance dans cette estimation est très faible.
Évaluation des effets sur la santé
L'annexe 2 comporte un résumé des renseignements disponibles relatifs aux effets du butanone-oxime sur la santé.
La Commission européenne a classé le butanone-oxime dans la catégorie 3 pour la cancérogénicité (substances préoccupantes pour l'homme en raison d'effets cancérogènes possibles) (Commission européenne, 2000; id., 2001). Dans le cadre d'une étude longitudinale chronique menée chez les rats et les souris exposés par inhalation au butanone-oxime, on a observé une augmentation du nombre de tumeurs hépatiques (adénomes et carcinomes) chez les deux espèces à toutes les concentrations d'exposition mises à l'essai. Cependant, des augmentations importantes du nombre sur le plan statistique ont été observées uniquement à 267 et 1 333 mg/m3 pour les adénomes hépatiques chez les rats mâles et à 1 333 mg/m3 pour les carcinomes hépatiques chez les rats mâles et les souris. Une augmentation importante du nombre sur le plan statistique des fibroadénomes mammaires a également été observée chez les rats femelles à 1 333 mg/m3. Les effets non néoplasiques observés chez les rats incluent les effets histopathologiques dans la rate (congestion, pigmentation accrue dans les cellules réticuloendothéliales et l'hématopoïèse extramédullaire) et dans les cornets nasaux (dégénérescence de l'épithélium olfactif) à toutes les concentrations d'exposition, dans le foie (nombre accru de foyers basophiles et de vacuoles hépatiques) à 267 et à 1 333 mg/m3, des changements dans les paramètres sanguins à 1 333 mg/m3 et des testicules élargis à 267 et à 1 333 mg/m3. Les effets non néoplasiques observés chez les souris incluent les augmentations liées à la dose de l'hypertrophie et de la nécrose du foie, de même que la dégénérescence de l'épithélium olfactif dans les cornets nasaux à toutes les concentrations d'exposition, les changements dans les paramètres sanguins à 267 et 1 333 mg/m3 et les changements dans les paramètres de la chimie sérique à 1 333 mg/m3. La concentration minimale avec effet nocif observé (CMENO) pour les effets non néoplasiques était de 53 mg/m3 (15 ppm) d'après les effets dans la rate et les cornets nasaux chez les rats et d'après les effets dans le foie et les cornets nasaux chez les souris (Newton et al., 2001). Aucune étude par voie orale ou cutanée à long terme à l'aide de butanone-oxime n'a été recensée.
Le butanone-oxime n'était pas mutagène dans la majorité des essais de mutation bactériologiques à l'aide de Salmonella typhimurium, mais il s'est avéré mutagène dans un essai de mutation cellulaire dans un lymphome chez une souris avant et sans activation (Allied Corporation, 1983b; Rogers-Back et al., 1988; JETOC, 1999; NTP, 1999). Des essais in vitro pour déceler une aberration chromosomique dans les cellules ovariennes et pulmonaires chez les hamsters chinois, l'échange de chromatides sœurs dans les cellules ovariennes chez les hamsters chinois et la synthèse imprévue d'acide désoxyribonucléique (ADN) dans les hépatocytes chez les rats ont tous démontré des réponses négatives (Allied Corporation, 1983a; IHF Inc., 1995; JETOC, 1999; NTP, 1999). Les essais in vivo relatifs aux micronoyaux étaient négatifs pour les cellules de moelle osseuse chez les rats et du sang périphérique chez les souris; les rats et les souris ont été exposés oralement (Microbiological Associates Inc., 1990; NTP, 1999). Dans un essai in vivo chez les rats exposés par inhalation, le butanone-oxime était négatif pour les adduits à l'ADN, mais positif pour les adduits à l'acide ribonucléique (ARN) dans les cellules hépatiques chez les rats (Honeywell International Inc., 2000).
Aucune analyse de mode d'action pleinement élucidé pour l'induction des tumeurs observées n'a été relevé. La Commission européenne (2000) a estimé qu'un mécanisme pouvant peut-être intervenir dans l’augmentation du nombre de tumeurs hépatiques chez les rats et les souris mâles était le métabolisme transformant le butanone-oxime en un agent cancérogène, médié par la sulfotransférase. Le sexe et la spécificité de l'organe pour la formation d'une tumeur sont corrélés à l'activité généralement supérieure de cette enzyme chez les rongeurs mâles. Völkel et al., (1999) ont démontré que l'incubation des microsomes du foie chez les souris, les rats et les humains avec du butanone-oxime a donné lieu à la formation de nitronates, mais que le taux de formation n'est pas corrélé au sexe et aux différences entre les espèces pour la réponse d'une tumeur hépatique; ils ont conclu que [Traduction] « d'autres mécanismes tumorigènes non liés à la mutagénicité du nitronate et aux dommages à l'ADN peuvent être opérationnels. » La Commission européenne (2000) n'a pas indiqué si le mode d'action dans les tumeurs hépatiques chez les rats était dû à des mécanismes associés au seuil d'exposition. Cependant, les résultats de la génotoxicité in vitro et in vivo pour le butanone-oxime ont été principalement négatifs, incluant une étude in vivo qui a utilisé l'exposition par inhalation et qui s'est avérée négative pour les adduits à l'ADN dans les cellules hépatiques des rats. Par conséquent, selon les données disponibles, le butanone-oxime semble ne pas avoir un potentiel mutagène. Cette absence de potentiel mutagène peut également expliquer pourquoi la Commission européenne (2000) n'a pas précisé si le mode d'action dans les tumeurs mammaires chez les rats était dû à des mécanismes associés au seuil d'exposition.
Lors d'une étude d'exposition par inhalation au butanone-oxime menée chez les souris pendant 1, 2 ou 4 semaines, la dégénérescence de l'épithélium olfactif dans la cavité nasale a été observée chez les mâles à des concentrations de 107 et 356 mg/m3 (nombre et gravité augmentant en fonction de la concentration d'exposition) (Newton et al., 2002). Au cours d'une étude d'exposition par inhalation d'une durée de 13 semaines, la dégénérescence de l'épithélium olfactif dans la cavité nasale a été observée chez les souris mâles à des concentrations de 36 à 356 mg/m3 (le nombre et la gravité augmentant en fonction de la concentration d'exposition), alors que l'augmentation du poids relatif du foie chez les rats mâles a été observée à 267 et 1 333 mg/m3 (Newton et al., 2001; id., 2002). La CMENO pour une exposition subchronique était de 36 mg/m3 en raison de la dégénérescence de l'épithélium olfactif dans la cavité nasale des souris.
Lors d'une étude de 4 semaines chez les rats par administration orale, des changements dans les paramètres hématologiques (augmentation des réticulocytes, des plaquettes et des globules rouges) et une augmentation du poids relatif de la rate accompagnée d'anomalies histopathologiques (augmentation de la congestion, de l'hématopoïèse extramédullaire et de la présence de granules d'hémosidérine) ont été observés chez les deux sexes à des concentrations de 20 et 100 mg/kg de poids corporel par jour (p.c./j), alors que la présence de granules d'hémosidérine dans le foie a été observée chez les femelles aux mêmes doses (Japan MHW, 1996; JETOC, 1999). Durant une étude de 13 semaines sur l'exposition des rats au butanone-oxime, cette substance a été ajoutée à leur eau. Le poids relatif du foie des mâles a augmenté à des doses de 25 à 280 mg/kg p.c./j (NTP, 1999). Lors d'une autre étude de 13 semaines chez les rats, pendant laquelle du butanone-oxime a été administré par gavage, des changements du poids du foie et de la rate, l'hémosidérose de la rate et des effets hématologiques ont été observés chez les deux sexes à des doses de 25 à 225 mg/kg p.c./j (Allied Signal Inc., 1977). La dose minimale avec effet nocif observé (DMENO) pour l'exposition à court terme et subchronique par voie orale était de 20 mg/kg p.c./j d'après les changements des paramètres hématologiques, l'augmentation du poids relatif de la rate accompagnée d'anomalies histopathologiques et la présence de granules d'hémosidérine dans le foie qui ont été observés lors d'une étude de 4 semaines chez les rats.
Dans une étude de l'exposition orale chez 1 génération de rats, la DMENO concernant la toxicité pour la reproduction était de 100 mg/kg p.c./j, la dose maximale, d'après la diminution importante sur le plan statistique de l'indice de mise bas par les femelles (%)[1] (Japan MHW, 1998), alors qu'aucun effet lié au traitement sur les paramètres de la reproduction n'a été observé dans une étude sur 2 générations au cours de laquelle les rats ont reçu une dose orale de 0 à 200 mg/kg p.c./j (Tyl et al., 1996). Dans les études sur 1 génération et sur 2 générations de rats, une DMENO parentale de 10 mg/kg p.c./j, la dose la plus faible mise à l'essai, a été établie d'après les effets histopathologiques dans la rate et le foie (et dans les reins lors de l'étude sur 1 génération).
Aucune tétragénocité n'a été observée chez les rates et les lapines enceintes ayant reçu des doses orales de butanone-oxime pendant la gestation (Springborn Laboratories, 1990a; id., 1990b; Mercieca et al., 1991; Derelanko et al., 2003). La DMENO par voie orale pour la toxicité fœtale était de 40 mg/kg p.c./j, la dose maximale, d'après les avortements de 3 femelles adultes sur 10 de lapines enceintes ayant reçu des doses par gavage pendant la gestation (Springborn Laboratories, 1990b; Derelanko et al., 2003). La DMENO par voie orale pour la toxicité maternelle était de 10 mg/kg p.c./j, d'après les symptômes d'anémie (réticulocytes accrus et méthémoglobine) chez les lapines ayant reçu des doses par voie orale à des concentrations de 0 à 80 mg/kg p.c./j lors d'une étude de détermination des doses ayant des effets sur le développement (Springborn Laboratories, 1990b; Derelanko et al., 2003).
Les études mises au point pour déterminer les valeurs de la dose ou de la concentration létale médiane (DL50 ou CL50) ont également permis de déterminer les doses les plus faibles entraînant un effet d'après l'exposition ponctuelle. La CMENO pour l'exposition par inhalation était de 190 mg/m3, d'après la diminution du gain en poids corporel dans la période d'observation de 7 ou 14 jours, après une exposition par inhalation de 4 heures chez les rats (Allied Corporation, 1984b). La DMENO pour l'exposition cutanée était de 180 mg/mg p.c. d'après la production de méthémoglobine et l'érythrophagocytose de la rate dans une étude de 24 heures de l'exposition cutanée des lapins (Allied Corporation, 1984a; US EPA, 1986).
Les études toxicocinétiques du butanone-oxime chez les souris et les rats ont démontré que cette substance est rapidement absorbée du tractus gastrointestinal, qu'elle subit une absorption généralisée, qu'elle est distribuée partout dans le corps, qu'elle est métabolisée en profondeur et qu'elle ne s'accumule pas dans les tissus. L'excrétion du butanone-oxime et de ses métabolites s'effectue dans l'urine et dans la bile, ou en tant que composé volatil dans l'air expiré (ICCA MEKO, 2003). Lors des études à dose unique chez les rats, des quantités significativement plus grandes de composés volatils ont été sécrétées à la suite d'une administration par voie cutanée qu'après le gavage ou l'administration par intraveineuse (NTP, 1999). Toutefois, aucune donnée toxicocinétique d'après les expositions répétées par voie orale ou cutanée ou par inhalation n'a été extraite. Les études toxicocinétiques du butanone-oxime ont démontré l'existence de deux voies métaboliques et la possibilité d'une troisième (selon des doses aiguës administrées par intraveineuse, par voie cutanée et par voie orale seulement). La principale voie est l'hydrolyse du butanone-oxime en 2-butanone (éthyl méthyl cétone) et la deuxième, l'oxydation du butanone-oxime en butane 2nitronate par les monooxygénases microsomales, mais cela survient à de très faibles taux (ICCA MEKO, 2003). ICCA MEKO (2003) a déclaré : [Traduction] « À l'égard des trois voies [métaboliques], il n'y avait aucune différence quantitative dans l'étendue du métabolisme du MECO [butanone-oxime] entre les rats mâles et femelles. »
La confiance dans la base de données sur la toxicité du butanone-oxime est faible à modérée, puisqu'il existe de l'information pertinente pour corriger les effets qui peuvent être préoccupants et déterminer les paramètres critiques d'après les expositions, ponctuelle à long terme, à doses par inhalation. Cependant, il y avait un manque d'études sur la toxicité pour la reproduction et le développement en fonction de l'exposition par inhalation, un manque d'études sur la toxicité chronique et la cancérogénicité d'après l'exposition par voie orale, peu de données sur la génotoxicité in vivo et un manque d'études sur l'exposition cutanée pour plusieurs paramètres, à l'exception des expositions aiguës. Cependant, il y avait un manque d'études sur la toxicité reproductive et développementale basée sur l'exposition d'inhalation; et peu d’études sur la toxicité par voie cutanée.
Caractérisation des risques pour la santé humaine
La cancérogénicité a été incluse dans l'évaluation des effets sur la santé du butanone-oxime, puisque cette substance a été classée comme étant cancérogène par la Commission européenne (2002; id., 2001). Comme il est indiqué à la section « Évaluation des effets sur la santé », un nombre accru de tumeurs hépatiques a été observé lors d'études longitudinales chez le rat et la souris, ainsi qu'un nombre accru de tumeurs des glandes mammaires chez les rats femelles. Toutefois, celles-ci n'ont été observées qu'à une exposition à des concentrations moyennes ou élevées de butanone-oxime. La prise en considération de l'information disponible à l'égard de la génotoxicité indique que le butanone-oxime n'est pas susceptible d'être génotoxique. Par conséquent, bien que le mode d'induction des tumeurs ne soit pas été complètement élucidé, il n'est pas envisagé que les tumeurs observées résultent d'une interaction directe avec le matériel génétique. Donc, une approche fondée sur le seuil d'innocuité a été utilisée pour évaluer les risques pour la santé humaine.
En ce qui concerne les effets autres que le cancer observés pendant une étude longitudinale chez le rat et la souris, la CMENO pour les expositions chroniques était de 53 mg/m3, d'après la dégénérescence de l'épithélium olfactif dans les cavités nasales des souris et des rats, l'hypertrophie et la nécrose des cellules hépatiques des souris et les effets histopathologiques dans la rate des rats. Pour les expositions subchroniques observées lors d'une étude de 13 semaines de l'exposition par inhalation, la CMENO pour une exposition par inhalation était de 36 mg/m3, d'après la dégénérescence de l'épithélium olfactif dans la cavité nasale des souris. De même, pour les expositions à court terme, la CMENO pour une exposition par inhalation était des 107 mg/m3, d'après la dégénérescence de l'épithélium olfactif de la cavité nasale des souris soumises à un régime d'exposition au butanone-oxime de 6 heures par jour, 5 jours par semaine pour 1, 2 ou 4 semaines. L'occurrence de séquelles toxicologiques après 5 expositions (total de 30 heures d'exposition) est pertinente pour l'évaluation des risques de l'exposition aiguë. Pour les expositions aiguës, une CMENO de 190 mg/m3 pour une exposition par inhalation a été calculée d'après la diminution du gain en poids chez les rats pendant une étude de 4 heures de l'exposition par inhalation. Les changements de gain en poids n'ont pas été notés pour les concentrations associées à un effet critique dans les études d'exposition par inhalation à court terme. Toutefois, une analyse du changement de la courbe dose-réponse au fil du temps (190 mg/m3 au moment de l'exposition, 107 mg/m3 après 5 jours et 36 mg/m3après une exposition subchronique) suggère que les manques à l'égard du gain en poids surviennent dans la gamme de doses appropriée après une exposition aiguë.
La DMENO la plus faible par voie orale pour l'exposition à court terme et subchronique était de 10 mg de butanone-oxime/kg p.c./j, d'après les effets histopathologiques observés sur la rate et le foie de rats adultes pendant l'étude des effets sur la reproduction sur 1 génération et sur 2 générations de rats (et sur les reins dans l'étude sur 1 génération) (Tyl et al., 1996; Japan MHW, 1998) et d'après les symptômes d'anémie observés chez les lapins femelles adultes lors d'une étude de détermination des doses ayant des effets sur le développement (Springborn Laboratories, 1990b; Derelanko et al., 2003). Pour les expositions aiguës, une dose minimale avec effet nocif observé par voie orale de 300 mg/kg p.c. a été calculée d'après les effets neurotoxiques transitoires chez les rats (Schulze et Derelanko, 1993) et une dose minimale avec effet nocif observé pour l'exposition cutanée de 180 mg/kg p.c. a été calculée d'après la production de méthémoglobine et l'érythrophagocytose de la rate dans une étude de 24 heures de l'exposition cutanée des lapins (Allied Corporation, 1984b; US EPA, 1986).
Comme il est indiqué à la section « Évaluation de l'exposition », le manque de données empiriques sur les concentrations dans plusieurs milieux n'a pas permis de calculer l'absorption quotidienne pour la population générale. Donc, les marges d'exposition n'ont pas pu être calculées aux fins de comparaison entre les concentrations associées à un effet critique d'après les expositions quotidiennes répétées au butanone-oxime et les limites supérieures estimatives de l'absorption quotidienne.
L'exposition au butanone-oxime se produit généralement durant l'utilisation de produits de consommation. D'après la modélisation de l'utilisation de ces produits à l'aide de ConsExpo, la plus grande concentration en air découlant de l’inhalation pendant l'utilisation de peintures et revêtements alkydes, allant de 73 à 223 mg/m3. à l'aide du modèle d'évaluation de l'exposition à la peinture pour les murs (WPEM), une concentration moyenne en air de 195 mg/m3d’une durée de 8 heures a été obtenue pour les peintures alkydes. La comparaison de ces concentration prudentes en air avec les concentrations associées à un effet critique pour l'exposition aigüe (ou à court terme) par inhalation (107 à 190 mg/m3) a permis de calculer les marges d'exposition de 0,5 à 2,6.
Un nombre limité d’études a mésuré des concentrations en air allant de 6.0 to 18 mg/m3 sous divers scénario simulés de peinture utilisant des produits à faible concentration de butanone-oxime (0.2 – 0,6%). Les valeurs obtenues de ces scénario d’exposition vont de 6 à 30.
Les expositions cutanées aiguës estimées pendant l'utilisation de peintures et revêtements alkydes ont donné lieu à des valeurs de 0,0226 à 1,06 mg/kg p.c. Ces estimations ont été comparées à un effet critique de 180 mg/kg p.c. ce qui a abouti à des marges d'exposition allant de 170 à 8000.
Compte tenu des incertitudes liées aux bases de données sur l'exposition et les effets, on considère que les marges d'exposition obtenues pour ces scénarios concernant les produits de consommation (toutes les marges d'exposition sont fondées sur l'exposition par inhalation; les marges d'exposition inférieures, sur l'exposition cutanée) pourraient ne pas être suffisamment protectrices de la santé humaine pour les effets autres que le cancer.
Incertitudes de l'évaluation des risques pour la santé humaine
La présente évaluation préalable ne présente pas d'analyse complète du mode d'induction des effets, y compris cancéreux, du butanone-oxime. De plus, il n'y a que très peu d'information disponible sur la toxicité potentielle du butanone-oxime à la suite d'une exposition par voie orale et cutanée, de même que sur les études portant sur la toxicité pour la reproduction et le développement et sur la génotoxicité fondées sur les expositions par inhalation. Donc, les concentrations associées à un effet critique calculées dans cette évaluation préalable sont limitées par la base de données sur la toxicité et par les incertitudes liées à l'interprétation de l'importance biologique des effets, incluant les incertitudes relatives à l'interprétation de la variation intraspécifique et interspécifique.
L'incertitude liée à l'exposition au butanone-oxime provenant du milieu naturel et de la nourriture au Canada est grande en raison de l’absence de données empiriques pour estimer l'exposition. Alors en absence de données empiriques, la nourriture ne saurait être considérée comme une source d’exposition au butanone-oxime. Alors qu'il est attendu que la source d'exposition la plus probable au butanone-oxime pour la population générale soit des préparations de peinture alkyde, l'incertitude est associée à l'utilisation d'hypothèses par défaut. Toutefois, les concentrations de butanone-oxime présentes dans les produits retenus pour les scénarios de modélisation de l'exposition aux produits de consommation sont basées sur des renseignements spécifiques au Canada.
D'après les renseignements contenus dans la présente évaluation préalable, il est conclu que le butanone-oxime ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
Compte tenu du manque de fiabilité possible des marges entre les expositions estimatives au butanone-oxime et les concentrations associées à un effet critique, il est conclu que le butanone-oxime est considéré comme une substance pouvant pénétrer dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est conclu que le butanone-oxime répond à au moins un des critères prévus à l’article 64 de la LCPE(1999). De plus, le butanone-oxime remplit les critères de la persistance, mais il ne remplit pas ceux de la bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Cette substance sera considérée pour inclusion dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles déterminées à l’étape de la gestion des risques.
[ACFPC] Association canadienne des fabricants de produits chimiques. 2009. Réduction des émissions 16 : inventaire des émissions en 2007 et prévisions quinquennales. Accès : http://www.ccpa.ca/files/Library/Documents/Environment/Reducing_Emissions_16_FINAL_-_FR.pdf
[AIEPS] Artificial Intelligence Expert Predictive System. 2003-2007. Version 2.05. Ottawa (Ont.) : Environnement Canada, Division des substances existantes, Division des substances nouvelles. Modèle élaboré par Stephen Niculescu. Disponible chez l'auteur.
Allied Corporation. 1983a. Evaluation of methyl ethyl ketoxime (MEKO) in the sister chromatid exchange (SCE) test: in vitro results in Chinese hamster ovary (CHO) cells. No de rapport : MA22482-6 [cité dans ICCA MEKO, 2003].
Allied Corporation. 1983b. Evaluation of methyl ethyl ketoxime for enzyme mediated mutagenicity in Salmonella typhimurium. No de rapport : MA-224-82-3 [cité dans ICCA MEKO, 2003].
Allied Corporation. 1984a. Acute dermal toxicity study of methylethylketoxime (MEKO). No de rapport : MA-224-82-9. [cité dans ICCA MEKO, 2003].
Allied Corporation. 1984b. Acute inhalation toxicity study of MEKO. No de rapport : MA-224-82-7 [cité dans ICCA MEKO, 2003].
Allied Signal Inc. 1977. Final report: 13-week toxicity study in rats. Hazleton Laboratories America, Inc. Project No. 165-161. [cité dans ICCA MEKO, 2003].
Allied Signal Inc. 1995. A 4-week peroxisome proliferation study of MEKO in the rat via oral gavage administration. Pharmaco-LSR Study No. 94-2368 [cité dans ICCA MEKO, 2003].
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2008. Version 1.92a. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Aronson D, Boethling B, Howard P, Stiteler W. 2006. Estimating biodegradation half-lives for use in chemical screening. Chemosphere 63: 1953-1960.
[BCFBAF] BioConcentration Factor Program for Windows [modèle d'estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BESC] Bureau européen des substances chimiques. 2000a. IUCLID dataset: Butanone oxime, CASNo. 96-29-7 [en ligne]. Year 2000 CD-ROM edition. [conçu le 19 février 2000; consulté le 14 janvier 2009]. Accès : http://ecb.jrc.ec.europa.eu/iuclid-datasheet/96297.pdf
[BESC] Bureau européen des substances chimiques. 2000b. IUCLID dataset: Butanote, CAS No. 78-93-3 [en ligne]. Year 2000 CD-ROM edition. [conçu le 19 février 2000; consulté le 14 janvier 2009]. Accès : http://ecb.jrc.ec.europa.eu/iuclid-datasheet/78933.pdf
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ. Sci. Technol.34(4):699-703.
Bio/Dynamics Inc. 1990. A four week inhalation study of MEKO in the rat and mouse. USA project 90-8249. Étude fournie par les producteurs et les importateurs américains de MEKO dans le cadre du règlement concernant les essais définitifs de l'EPA en vertu de la TSCA (Loi américaine réglementant les substances toxiques). [citée dans ICCA MEKO, 2003].
Biosearch Inc. 1982. Summary of results of acute toxicity study on 2-butanone oxime; study report 81-2870A, conducted for Mooney Chemicals, Inc.; TSCA OTS0513319, no de document : 86870000134 [cité dans ICCA MEKO, 2003].
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2008. Version 4.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté le 1er mai 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Brooke, L.T., Call, D.J., Geiger, D.L., Northcott, C.E. (éd.) 1984. Acute toxicities of organic chemicals to fathead minnows (Pimephales promelas). Volume 1. Superior (WI): University of Wisconsin-Superior, Center for Lake Superior Environmental Studies. p. 105-106.
Burka, L.T., Black, S.R., Mathews, J.M. 1998. Disposition of methyl ethyl ketoxime in the rat after oral, intravenous and dermal administration. Xenobiotica. 28(10):1005-1015.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33. Accès : http://www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l’environnement : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf.
Canada. Ministère de l’Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie 1, vol. 140, no 49, p. 4109-4117. Accès : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2008. Loi canadienne sur la protection de l'environnement, 1999 : Avis concernant les substances du groupe du Défis. Gazette du Canada, Partie I, vol. 142, no 35,. Accès : http://www.gazette.gc.ca/rp-pr/p1/2008/2008-08-30/pdf/g1-14235.pdf
CATABOL [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [consulté le 3 mars 2009]. Accès : http://oasis-lmc.org/?section=software&swid=1
Chang, J.C.S. 1998. Exposure and emission evaluations of methyl ethyl ketoxime (MEKO) in alkyd paints. Indoor air.8(4):295-300.
ChemCAN [Level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. [consulté le 11 mai 2009]. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/CC600.html
[CHRIP] Chemical Risk Information Platform. Total Search System for Chemical Substances [base de données en ligne]. c2002. Butanone oxime, CAS RN 96-29-7. Tokyo (Japon) : National Institute of Technology and Evaluation. [mise à jour le 27 avril 2009; consultée le 1er mai 2009]. Accès : http://www.safe.nite.go.jp/english/db.html
[ConsExpo] Consumer Exposure Model [en ligne]. 2007. Version 4.1. Bilthoven (Pays-Bas): Rijksinstituut voor Volksgezondheid en Milieu (National Institute for Public Health and the Environment). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
Commission européenne. 2000. Summary Record: Meeting of the Commission Working Group on the Classification and Labelling of Dangerous Substances. ECB Ispra, 19–21 January 2000. Commission européenne, Direction générale du Centre commun de recherche, Institut pour la santé et la protection des consommateurs, Bureau Européen des Substances Chimiques, ECBI/19/00 – Rev. 1, Accès : http://ecb.jrc.it/documents/Classification-Labelling/ADOPTED_SUMMARY_RECORDS/1900r1_cmr0100.pdf
Commission européenne. 2001. 2-butanone-oxime. Directive de la Commission 2001/59/CE du 6 août 2001. Annexe 1B. Journal officiel des Communautés européennes. 21.08.2001. L 225/36. Commission européenne. 28e APT [adaptation au progrès technique]. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2001:225:0001:0333:FR:PDF
Commission européenne. 2004. Directive 2004/93/CE de la Commission du 21 septembre 2004 portant modification de la directive 76/768/CEE du Conseil en vue de l'adaptation au progrès technique de ses annexes II et III (Texte présentant de l'intérêt pour l'EEE). Journal officiel de l’Union européenne. 25/09/2004. L 300/13–4. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2004:300:0013:0041:FR:PDF
[CPOPs] Canadian POPs Model. 2008. Gatineau (Qc) : Environnement Canada, Division des substances existantes; Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [modèle élaboré à partir de celui de Mekenyan et al., 2005]. Disponible sur demande.
Curtis, C., Lima, A., Lozano, S.J., Veith, G.D. 1982. Evaluation of a bacterial luminescent bioassay as a method for predicting acute toxicity of organic chemicals to fish. In : Pearson, J.G., Foster, R.B., Bishop, W.E. (éd.) Aquatic toxicology and hazard assessment: fith conference. Philadelphie (PA) : American Society for Testing and Materials. ASTM Special Technical Publication 766. p. 170-178. [cité dans Kaiser et Ribo, 1988].
Derelanko, M.J., Rinehart, W.E., Rodwell, D.E. 2003. Developmental toxicity studies of methyl ethyl ketoxime (MEKO) in rats and rabbits. Drug Chem Toxicol 26(3):147-168.
Dow Corning Corporation. 1983. A 28-day vapor inhalation toxicity study of methyl ethyl ketoxime (MEKO) with the rat. No de référence : TX-82-4160-01 [cité dans ICCA MEKO, 2003].
[ECOSAR] Ecological Structure Activity Relationships [en ligne]. 2008. Version 1.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Environnement Canada. 2007. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series: draft module on QSARs. Document de travail provisoire révisé. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environnement Canada. 2009a. Données sur les substances du lot 7 recueillies conformément à l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant les substances du groupe 7 du Défi. Données préparées par : Environnement Canada, Programme des substances existantes.
Environnement Canada. 2009b. Étude confidentielle inédite présentée à la Division des substances existantes d’Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Disponible sous la forme de sommaire de rigueur d’étude, no d’identification : 3450Challenge001.
[EQC] Equilibrium Criterion Model 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre [consulté le 1er mai 2009]. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2new.html
[ESIS] European Chemical Substances Information System [base de données en ligne]. 2006. Result for CASNo. 96-29-7. Butanone oxime. ESIS Version 4.50. Base de données élaborée par le Bureau européen des substances chimiques. Accès : http://ecb.jrc.ec.europa.eu/esis/
Friedewald, M., Filser, J., Janku, S., Derelanko, M., Dekant, W. 2001. RNA-modifications after inhalation of methyl ethyl ketoxime in rats. Toxicologist 1:93 [résumé].
Great Western Containers. 2005. Great Western Containers, Inc., Edmonton South, Operations Manual: Standard for return of empty IBC [en ligne]. Edmonton (Alb.) : Great Western Containers Inc. [publié le 2 mai 2005; consulté le 12 mai 2009]. Accès : http://www.gwcontainers.com/Portals/0/Return%20Standards.pdf
Haskell Laboratory. 1966. Rapport de laboratoire sur le méthyléthylcétoxime avec page couverture datée du 10 février 1987. Rapport d'étude 53-66 réalisé par la société Du Pont; no d'identification du document : 86870000199.
Henkel Technologies. 2007. Fiche signalétique : Ready Gasket Loctite, agent d'étanchéité en caoutchouc silicone. Mississauga (Ont.) : Henkel Canada, Inc. [consultée le 20 mai 2009]. Accès : http://henkelconsumerinfo.com/products/henkel.datasheets.Search.pdf?BUSAREA=0006&
DOCTYPE=MSDS&LANG=FR&COUNTRY=CA&MATNR=743914&VKORG=3400
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d'estimation]. 2008. Version 3.20. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : htwww.epa.gov/oppt/exposure/pubs/episuite.htm
Honeywell International Inc. 2000. Biotransformation, toxicokinetics and DNA-binding of methyl ethyl ketoxime and its metabolites. Travaux menés par W. Dekant et J.G. Filser. No de rapport : MA-RR-00-2602 [cité dans ICCA MEKO, 2003].
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
ICCA MEKO (ICCA Methyl Ethyl Ketoxime Consortium). 2003. Unpublished draft (23 July 2003) SIDS [Screening Information Data Set] initial assessment report on 2-butanoneoxime, CAS# 96-29-7. Préparé pour la Rencontre initiale d'évaluation des SIDS (SIAM 17) par le consortium de l'ICCA MEKO. Parrainé par le Conseil international des associations chimiques (ICCA) des États-Unis et du Japon.
[IHF Inc.] Industrial Health Foundation, Inc. 1995. Unscheduled DNA synthesis assay in rat primary hepatocytes. Rockville (MD) : Microbiological Associates, Inc. No de projet : G94BA66.380 [cité dans ICCA MEKO, 2003].
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2007. Gatineau (QC) : Environnement Canada. [consultée le 18 mars 2008]. Accès : http://www.ec.gc.ca/inrp-npri/
[Japan MHW] Ministry of Health and Welfare (Japon). 1996. Ministry of Health and Welfare, Japan. Toxicity Testing Reports of Environmental Chemicals 4. p. 199-221 [cité dans ICCA MEKO, 2003].
[Japan MHW] Ministry of Health and Welfare (Japon). 1998. Ministry of Health and Welfare, Japan. Toxicity Testing Reports of Environmental Chemicals 6. p. 63-75 [cité dans ICCA MEKO, 2003].
[JETOC] Japan Chemical Industry Ecology-Toxicology and Information Centre. 1999. JETOC Information Sheet 37, Special Issue No. 4.
Kaiser, K.L.E., Ribo, J.M. 1988. Photobacterium phosphoreum toxicity bioassay. II. Toxicity data compilation. Toxic. Assess. 3(2):195-237.
King, C.V., Marion, A.P. 1944. The ionization constants of very weak acids. Acetoxime, methyl ethyl and diethyl ketoximes. J. Am. Chem. Soc. 66(6):977-980.
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, C., McKone, T., van de Meent, D., Wania, F. 2006. Application of multimedia models for screening assessment of long-range transport potential and overall persistence. Environ. Sci. Technol. 40(1):53-60.
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : http: //www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOCWIN] Soil Adsorption Coefficient Program for Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : http: //www.epa.gov/oppt/exposure/pubs/episuite.htm
Kurita, H. 1967. Experimental studies on methyl-ethyl-ketoxime toxicity. Nagoya J Med Sci 29:393-418 [cité dans US EPA, 1986].
Lide, D.R. (éd.) 2005. CRC handbook of chemistry and physics. 86e éd. Boca Raton (FL) : CRC Press/Taylor and Francis.
Mackay, D. 2006. The OECD Persistence and Long Range Transport Potential Screening Tool. Document préparé en vue de sa diffusion au cours d'un atelier de l'OCDE tenu à Ottawa, au Canada, du 31 mai au 2 juin 2006.
Mercieca, M.D., Rinehart, W.E., Hodgson, J.R., Derelanko, M.J. 1991. Developmental toxicity study of methyl ethyl ketoxime (MEKO) in two species. Teratology 43:454-455.
Microbiological Associates Inc. 1990. Acute in-vivo cytogenetics assay in rats. MBA study T9293.105009. Bethesda (MD) : Microbiological Associates Inc. Étude fournie par les producteurs et les importateurs américains de MEKO dans le cadre du règlement définitif sur les essais de l'US EPA en vertu de la TSCA [cité dans ICCA MEKO, 2003].
Ministère danois de l'environnement. 2004. List of undesirable substances 2004. Copenhague (Danemark) : Danish Ministry of the Environment, Environment Protection Agency. Environmental Review Report No. 15. p. 24.
[MITI] Ministry of International Trade & Industry (Japon), Basic Industries Bureau, Chemical Products Safety Division. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Japan Chemical Industry Ecology-Toxicology & Information Center.
[NCI] National Chemical Inventories [base de données sur cédérom]. 2006, Columbus (OH) : American Chemical Society. Accès : http://www.cas.org/products/cd/nci/index.html
Newton, P.E., Wooding, W.L., Bolte, H.F., Derelanko, M.J., Hardisty, J.F., Rinehart, W.E. 2001. A chronic inhalation toxicity/oncogenicity study of methylethylketoxime in rats and mice. Inhal Toxicol 13 (12):1093-1116.
Newton, P.E., Bolte, H.F., Derelanko, M.J., Hardisty, J.F., Rinehart, W.E. 2002. An evaluation of changes and recovery in the olfactory epithelium in mice after inhalation exposure to methylethylketoxime. Inhal Toxicol 14(12):1249-1260.
[NTP] National Toxicology Program (États-Unis). 1999. NTP technical report on the toxicity studies of methyl ethyl ketoxime (CAS No. 96-29-7) administered in drinking water to F344/N rats and B6C3F1 mice. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program, Toxicity Report Series No. 51, NIH Publication 99-3947.
[OCDE] Organisation de coopération et de développement économiques. 2003. SIDS [Screening Information Data Set] Initial Assessment Profile for 2-Butanone oxime (MEKO). (CASNo. 96-29-7). SIAM [SIDS Initial Assessment Meeting] 17, 11-14 November 2003. Accès : http://cs3-hq.oecd.org/scripts/hpv/index.asp
[OCDE] Organisation de coopération et de développement économiques. 2004. The 2004 OECD list of high production volume chemicals. Accès : http://www.oecd.org/dataoecd/55/38/33883530.pdf
[OCDE] Organisation de coopération et de développement économiques. 2008. SIDS [Screening Information Data Set] Initial Assessment Profile for Bis(hydroxylammonium)sulphate. SIAM [SIDS Initial Assessment Meeting] 27, 14-16 October 2008. Accès : http://cs3-hq.oecd.org/scripts/hpv/index.asp
Permatex Canada. 2009. Fiche signalétique : Ultra Black Gasket Maker. Milton (Ont.) : Permatex Canada, Inc. [consultée le 20 mai 2009]. Accès : http://www.permatex.com/documents/msds/04_Canada-French/82080_04.pdf
Rogers-Back, A.M., Lawlor, T.E., Cameron, T.P., Dunkel, V.C. 1988. Genotoxicity of 6 oxime compounds in the Salmonella/mammalian-microsome assay and mouse lymphoma TK +/- assay. Mutat. Res. 204(2):149-162.
[RTECS] Registry of Toxic Effects of Chemical Substances. 2006. Fichier concernant le 2butanone, oxime (29 juillet 1996). [dernière mise à jour en août 2006; consulté le 16 mars 2009]. Cincinnati (OH) : U.S. Department of Health and Human Services, National Institute for Occupational Safety and Health.
Rumpf, R.R., Gonzalez, W. 1993. No single answer controls corrosion. Power Eng. 97(1):33-35
Scheringer, M. MacLeod, M., Wegmann, F. 2006. The OECD POV and LRTP Screening Tool. Version 2.0
Schulze, G.E., Derelanko, M.J. 1993. Assessing the neurotoxic potential of methyl ethyl ketoxime in rats.Fundam Appl Toxicol 21:476-485 [cité dans ICCA MEKO, 2003).
Secrétariat d'état britannique. 2008. The Cosmetic Products (Safety) Regulations 2008. Statutory Instruments, 2008 No. 1284, Consumer Protection. 144 p. Accès : http://www.opsi.gov.uk/si/si2008/uksi_20081284_en_1
Springborn Laboratories. 1990a. Teratology studies in rats with MEKO. Study SLS 3224.6. Test performed by Springborn Laboratories, Inc. (SLS) Spencerville, USA [cited dans ICCA MEKO, 2003].
Springborn Laboratories. 1990b. Teratology studies in rabbits with MEKO. Study SLS 3224.5. Springborn Laboratories, Inc. [cité dans ICCA MEKO, 2003].
Subramani, S., Cheong, I.W., Kim, J.H. 2004. Synthesis and characterizations of silylated polyurethane from methyl ethyl ketoxime-blocked polyurethane dispersion. Eur Polymer J40(12):2745-2755.
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. [consulté le 3 mars 2009]. Accès : http://www.accelrys.com/products/topkat/index.html
Tyl, R.W., Gerhart, J.M., Marr, M.C., Brine, D.R., Gilliam, A.F., Seely, J.C., Derelanko, M.J., Rinehart, W.E. 1996. Reproductive toxicity evaluation of methylethyl ketoxime by gavage in CD rats. Fundam Appl Toxicol 31:149-161.
[US EPA] U.S. Environmental Protection Agency. 1986. Nineteenth report of the Interagency Testing Committee to the Administrator; receipt and request for comments regarding priority list of chemicals. Federal Register. Vol. 51, no 220, p. 41417-41432. Accès : http://tsca-itc.syrres.com/itcrep/docs/19.pdf
[US EPA] U.S. Environmental Protection Agency. 2006. High production volume (HPV) challenge program: the 1990 HPV voluntary challenge chemical list. Revised January 20, 2006. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics. Accès : http://www.epa.gov/chemrtk/pubs/update/hpv_1990.pdf
Verschueren, K. 1977. Handbook of environmental data on organic chemicals. New York (NY) : Van Nostrand Reinhold Company.
Völkel, W., Wolf, N., Derelanko, M., Dekant, W. 1999. Slow oxidation of acetoxime and methylethyl ketoxime to the corresponding nitronates and hydroxy nitronates by liver microsomes from rats, mice and humans. Toxicol. Sci. 47:144-150.
[WPEM] Wall Paint Exposure Assessment Model. 2001. Version 3.2 (élaboré par GEOMET Technologies Inc., une division de Versar, Inc., Germantown, MD). Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; National Paint and Coatings Association. Accès : http://www.epa.gov/oppt/exposure/pubs/wpem.htm
Annexe 1 : Estimations de la limite supérieure de l'exposition au butanone-oxime dans les produits de consommation
| Type de produit | Hypothèses1 | Estimations de l'exposition2 |
|---|---|---|
| 1 Pour tous les calculs, un poids corporel d'un adulte de 70,9 kg et un taux d'inhalation de 16,2 m3/j sont utilisés. 2 L'estimation de l'exposition a été calculée « par événement » : exposition aiguë pendant l'utilisation du produit. 3 Concentrations maximales obtenues [communication personnelle du groupe de travail de l’Association canadienne de la peinture et du revêtement à Environnement Canada, 2009; source non citée dans les références]. 4 Les hypothèses suivantes ont été utilisées : le modèle d'inhalation est fondé sur « l'exposition à la vapeur par évaporation » avec les paramètres par défaut suivants : durée de l'exposition : 132 min; volume de la pièce : 20 m3; taux de renouvellement de l'air : 0,6/h; durée de l'application : 120 min; fraction absorbée : 100 %. 5 Henkel Technologies, 2007. 6 Permatex Canada, 2009. 7 Burka et al., 1998. |
||
| Peinture alkyde (à haut extrait sec) |
Concentration maximale de butanone-oxime : 1 % p/p3 Exposition par inhalation4 : fréquence d'exposition : 1/an; quantité de produit utilisée : 1 300 g; superficie de rejet : 1,0 × 105 cm2; matrice d'une masse moléculaire : 550 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : contact direct avec le produit à un taux constant : surface exposée : 0,367 m2; taux de contact : 30 mg/min; durée de rejet : 120 min; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 113 mg/m3 Dose d'inhalation aiguë (interne) : 2,36 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,006 46 mg/kg/j Charge cutanée : 0,009 81 mg/cm2 Dose cutanée externe : 0,508 mg/kg p.c. Dose cutanée aiguë (interne) : 0,147 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 403 mg/kg p.c./j Dose externe totale intégrée : 2,87 mg/kg p.c. Dose aiguë totale intégrée : 2,51 mg/kg p.c. Dose chronique totale intégrée : 0,006 87 mg/kg p.c./j |
| Peinture alkyde (à forte teneur en solvants) |
Concentration maximale de butanone-oxime : 1 % p/p3 Exposition par inhalation4 : fréquence d'exposition : 1/an; quantité de produit utilisée : 1 300 g; superficie de rejet : 1,0 × 105 cm2; matrice d'une masse moléculaire : 300 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : contact direct avec le produit à un taux constant : surface exposée : 0,367 m2; taux de contact : 30 mg/min; durée de rejet : 120 min; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 72,7 mg/m3 Dose d'inhalation aiguë (interne) : 1,52 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,004 17 mg/kg p.c./j Charge cutanée : 98,1 mg/cm2 Dose cutanée externe : 0,508 mg/kg p.c. Dose cutanée aiguë (interne) : 0,147 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 403 mg/kg p.c./j Dose externe totale intégrée : 2,03 mg/kg p.c. Dose aiguë totale intégrée : 1,67 mg/kg p.c. Dose chronique totale intégrée : 0,004 57 mg/kg p.c./j |
| Peinture alkyde (en aérosol) |
Concentration maximale de butanone-oxime : 1 % p/p3 Inhalation : exposition à la pulvérisation lorsque le produit est vaporisé loin de la personne : fréquence d'exposition : 2/an; durée d'exposition : 20 min; volume de la pièce : 34 m3; taux de renouvellement de l'air : 1,5/h; taux de production massique : 0,33 g/s; durée de la vaporisation : 15 min; fraction atmosphérique : 1; fraction massique non volatile : 0,3; densité de la fraction non volatile : 1,5 g/cm3; hauteur de la pièce : 2,25 m; fraction absorbée non respirable : 100 %; diamètre minimum d'inhalation : 15 mm. Exposition cutanée : contact direct avec le produit à un taux constant : surface exposée : 0,367 m2; taux de contact : 100 mg/min; durée de rejet : 15 min; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 3,75 mg/m3 Dose d'inhalation aiguë (interne) : 0,0119 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,000 0652 mg/kg p.c./j Charge cutanée : 40,9 mg/cm2 Dose cutanée externe : 0,212 mg/kg p.c. Dose cutanée aiguë (interne) : 0,0614 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 336 mg/kg p.c./j Dose orale non respirable (externe) : 0,0112 mg/kg p.c. Dose orale aiguë (interne) : 0,0112 mg/kg p.c. Dose orale chronique (interne) : 0,000 061 1 mg/kg p.c./j Dose externe totale intégrée : 0,235 mg/kg p.c. Dose aiguë totale intégrée : 0,0844 mg/kg p.c. Dose chronique totale intégrée : 0,000 462 mg/kg p.c./j |
| Revêtement alkyde | Concentration maximale de butanone-oxime : 1 % p/p3 Inhalation : durée d'exposition : 60 min; volume de la pièce : 34 m2; taux de renouvellement de l'air : 1,5/h4; fréquence d'exposition : 0,33/an; quantité de produit utilisée : 3 000 g; superficie de rejet : 15 m2; matrice d'une masse moléculaire : 3 000 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : application instantanée : surface exposée : 108 cm2; quantité de produit utilisée : 0,25 g; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 223 mg/m3 Dose d'inhalation aiguë (interne) : 2,12 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,001 92 mg/kg p.c./j Charge cutanée : 0,0231 mg/cm2 Dose cutanée externe : 0,0353 mg/kg p.c. Dose cutanée aiguë (interne) : 0,0102 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 009 24 mg/kg p.c./j Dose externe totale intégrée : 2,16 mg/kg p.c. Dose aiguë totale intégrée : 2,13 mg/kg p.c. Dose chronique totale intégrée : 0,001 93 mg/kg p.c./j |
| Produit d'étanchéité à base de silicone – joint | Concentration maximale de butanone-oxime : 5 % p/p6 Inhalation : exposition à la vapeur : évaporation : fréquence d'exposition : 3/an; quantité de produit utilisée : 75 g; superficie de rejet : 250 cm2; matrice d'une masse moléculaire : 3 000 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : contact direct avec le produit à un taux constant : surface exposée : 2 cm2; taux de contact : 50 mg/min; durée de rejet : 30 min; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 150 mg/m3 Dose d'inhalation aiguë (interne) : 1,07 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,008 81 mg/kg p.c./j Charge cutanée : 37,5 mg/cm2 Dose cutanée externe : 1,06 mg/kg p.c. Dose cutanée aiguë (interne) : 0,307 mg/kg p.c. Dose cutanée chronique (interne) : 0,002 52 mg/kg p.c./j Dose externe totale intégrée : 2,13 mg/kg p.c. Dose aiguë totale intégrée : 1,38 mg/kg p.c. Dose chronique totale intégrée : 0,0113 mg/kg p.c./j |
| Adhésif (joint d'étanchéité) | Concentration maximale de butanone-oxime : 2 % p/p7 Inhalation : exposition à la pulvérisation lorsque le produit est vaporisé loin de la personne : fréquence d'exposition : 52/an; quantité de produit utilisée : 9 g; superficie de rejet : 200 cm2; matrice d'une masse moléculaire : 3 000 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : application instantanée : surface exposée : 2 cm2; quantité de produit utilisée : 0,08 g; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 3,39 mg/m3 Dose d'inhalation aiguë (interne) : 0,129 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,0184 mg/kg p.c./j Charge cutanée : 0,8 mg/cm2 Dose cutanée externe : 0,0226 mg/kg p.c. Dose cutanée aiguë (interne) : 0,006 54 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 932 mg/kg p.c./j Dose externe totale intégrée : 0,152 mg/kg p.c. Dose aiguë totale intégrée : 0,136 mg/kg p.c. Dose chronique totale intégrée : 0,0193 mg/kg p.c./j |
| Paramètres | Doses ou concentrations minimales avec effet1/Résultats |
|---|---|
| 1 CL50, concentration létale médiane; DL50, dose létale médiane; DMENO/CMENO, dose/concentration minimale avec effet nocif observé; DMEO/CMEO, dose/concentration minimale avec effet observé; DSENO/CSENO, dose/concentration sans effet nocif observé. | |
| Toxicité aiguë | DL50 la plus faible, par voie orale(rats) = 930 mg/kg p.c. (Biosearch Inc., 1982). Autres DL50 par voie orale= > 900 à 2 528 mg/kg p.c. dans trois études (ICCA MEKO, 2003). DMEO = 300 mg/kg p.c. d'après les effets neurotoxiques transitoires observés chez les rats; 10 rats par sexe par groupe ont reçu une dose de 0, 100, 300 ou 900 mg/kg p.c. pendant une période d'observation de 14 jours (aucun autre effet n'a été observé) (Schulze et Derelanko, 1993). CL50 la plus faible, par inhalation(rats, 4 h) = > 4 800 mg/m3. CMENO = 190 mg/m3 d'après la diminution importante observée sur le plan statistique du gain en poids corporel chez les femelles, durant la période d'observation de 7 à 14 jours après l'exposition; 5 rats par sexe par groupe ont reçu une dose de 0, 190, 1 450 ou 4 800 mg/m3. D'autres effets incluent la formation de méthémoglobine à des concentrations moyennes et élevées et la preuve d'anesthésie à une concentration élevée (Allied Corporation, 1984b). Autre CL50 par inhalation (rats, 2 h) = > 10 500 mg/m3(OCDE, 2003). DL50 la plus faible, par voie cutanée (lapin) = 184 mg/kg p.c. (RTECS, 2006). Autres DL50, par voie cutanée = 1 000 et entre 180 et 1 800 mg/kg p.c. dans deux études (ICCA MEKO, 2003). DMENO = 180 mg/kg p.c. d'après la production de méthémoglobine et l'érythrophagocytose de la rate chez les lapins (DMEO = 18 mg/kg p.c. d'après les effets narcotiques réversibles; exposition de 24 h). Cinq lapins par sexe par groupe ont reçu une dose de 0, 18, 180 ou 1 800 mg/kg p.c. pendant 24 h par une application occlusive sur la peau (aucun autre effet n'a été observé) (Allied Corporation, 1984a; US EPA, 1986). |
| Toxicité à court terme en doses répétées | CMENO la plus faible, par inhalation = 107 mg/m3 (30 ppm) d'après la dégénérescence de l'épithélium olfactif dans la cavité nasale (nombre et gravité augmentant en fonction de la concentration d'exposition) chez les souris mâles CD-1 dont le corps entier a été exposé à 0, 3, 10, 30 ou 100 ppm (0, 11, 36, 107 ou 356 mg/m3), 6 h/j, 5 jours/semaine, pendant 1, 2 ou 4 semaines (10 mâles par concentration par moment désigné) (Newton et al., 2002). Autres CME(N)O par inhalation = 356 à 1 899 mg/m3 chez les rats ou les souris (Haskell Laboratory, 1966; Dow Corning Corporation, 1983; Bio/Dynamics Inc., 1990). DME(N)O la plus faible, par voie orale= 20 mg/kg p.c./j, d'après les changements hématologiques observés (augmentation des réticulocytes, des plaquettes et des globules rouges) et l'augmentation du poids relatif de la rate accompagnée d'anomalies histologiques (augmentation de la congestion, de l'hématopoïèse extramédullaire et de la présence de granules d'hémosidérine) chez les deux sexes et de la présence de granules d'hémosidérine dans le foie des femelles chez les rats Crj:CD (SD) ayant reçu une dose par gavage (dans l'huile d'olive) à 0, 4, 20 ou 100 mg/kg p.c./j pendant 28 jours (Japan MHW, 1996; JETOC, 1999) Autre DME(N)O par voie orale = 250 mg/kg p.c./j d'après l'hypertrophie du foie chez les rats mâles Fischer 344 ayant reçu une dose par gavage (15 mâles par dose) à 0, 250 ou 500 mg/kg p.c./j pendant 28 jours (Allied Signal Inc., 1995). Aucune étude concernant l'absorption cutanée n'a été recensée. |
| Toxicité subchronique | CMENO la plus faible, par inhalation = 36 mg/m3 d'après la dégénérescence de l'épithélium olfactif dans la cavité nasale (nombre et gravité augmentant en fonction de la concentration d'exposition) chez les souris mâles CD-1 exposés par inhalation (corps entier) à 0, 3, 10, 30 ou 100 ppm (0, 11, 36, 107 ou 356 mg/m3), 6 h/j, 5 jours/semaine, pendant 13 semaines (10 mâles par concentration par moment désigné) (Newton et al., 2002). Autre CME(N)O par inhalation = 267 mg/m3 d'après l'augmentation du poids relatif du foie chez les mâles des rats F344 (10 par sexe par concentration) exposés à 0, 15, 75 ou 374 ppm (0, 53, 267 ou 1 333 mg/m3) 6 h/j, 5 jours/semaine, pendant 3 mois (Newton et al., 2001). DME(N)O la plus faible, par voie orale = 25 mg/kg p.c./j d'après l'augmentation du poids relatif du foie chez les mâles observée dans une étude de 13 semaines chez les rats (NTP, 1999: rats F344/N mâles et femelles ayant reçu une dose de 0, 312, 625, 1 250, 2 500 ou 5 000 ppm dans l'eau potable pendant 13 semaines, c’est-à-dire 0, 25, 50, 100, 175 ou 280 mg/kg p.c./j chez les mâles et 0, 30, 65, 120, 215 ou 335 mg/kg p.c./j chez les femelles) et les changements du poids du foie et de la rate, l'hémosidérose de la rate et les effets hématologiques dans une autre étude de 13 semaines avec des rats (Allied Signal Inc., 1977: rats mâles et femelles Sprague-Dawley ayant reçu une dose de 0, 25, 75 ou 225 mg/kg p.c./j par gavage; 5 jours/semaine pendant 13 semaines). Autres DME(N)O par voie orale = 40 mg/kg p.c./j pendant une étude de 13 semaines avec des rats (Schulze et Derelanko, 1993) et 200 mg/kg p.c./j pendant une étude de même durée avec des souris (NTP, 1999). Aucune étude concernant l'absorption cutanée n'a été recensée. |
| Toxicité chronique et cancérogénicité | Étude d'exposition par inhalation chez les rats : des groupes de 50 rats F-344 par sexe ont été exposés au butanone-oxime par inhalation (corps entier) à 0, 15, 75 ou 37 ppm (0, 53, 267 ou 1 333 mg/m3) 6 h/j, 5 jours/semaine, pendant 26 mois. On a observé un nombre accru de tumeurs hépatiques chez les deux sexes à 75 et 374 ppm (mâles : carcinomes hépatiques 0/50, 0/50, 1/50 et 12/50 à 0, 15, 75 et 374 ppm, respectivement; important sur le plan statistique à 374 ppm; adénomes hépatiques 0/50, 2/50, 5/50 et 18/50, respectivement; important sur le plan statistique à 75 et 374 ppm; femelles : adénomes hépatiques 0/50, 0/50, 2/50 et 4/50, respectivement; pas important sur le plan statistique) et de fibroadénomes des glandes mammaires chez les femelles à la dose la plus élevée (2/50, 2/50, 4/50 et 9/50 à 0, 15, 75 et 37 ppm, respectivement; important sur le plan statistique à 374 ppm). CMENO pour les effets non néoplasiques = 53 mg/m3 (15 ppm) d'après les effets sur la rate (congestion, pigmentation accrue dans les cellules réticuloendothéliales et hématopoïèse extramédullaire) observés pour la première fois après 12 mois et dans les cornets nasaux (dégénérescence de l'épithélium olfactif) observés après 18 mois. On a noté d'autres effets non néoplasiques, notamment un nombre accru de foyers basophiles et de vacuoles hépatiques dans le foie des mâles à 75 et 374 ppm et des femelles à 374 ppm, des testicules élargis à 75 et 374 ppm et des effets sanguins (diminution de l'hémoglobine et des globules rouges, et augmentation de la méthémoglobine, des plaquettes et des globules blancs) chez les deux sexes à 374 ppm (Newton et al., 2001). Autres études d'exposition par inhalation :des groupes de 50 souris CD-1 par sexe ont été exposés au butanone-oxime par inhalation (corps entier) à 0, 15, 75 ou 374 ppm (0, 53, 267 ou 1 333 mg/m3) 6 h/j, 5 jours/semaine, pendant 18 mois. On a observé un nombre accru de tumeurs hépatiques chez les mâles à toutes les doses et chez les femelles à 75 et 374 ppm (mâles : carcinomes hépatiques 2/50, 2/50, 1/50 et 10/50 dans les groupes témoins et dans ceux exposés à une dose faible, moyenne et élevée, respectivement, important sur le plan statistique à 374 ppm; adénomes hépatiques 4/50, 11/50, 10/50 et 11/50, respectivement, mais dans la plage des valeurs historiques; femelles : adénomes hépatiques 0/50, 0/50, 1/50, 3/50 dans les groupes témoins et dans ceux exposés à une dose faible, moyenne et élevée, respectivement, aucun n'était important sur le plan statistique). CMENO pour les effets non néoplasiques = 53 mg/m3 (15 ppm) d'après les effets sur le foie en fonction de la dose (hypertrophie et nécrose) et dans les cornets nasaux (dégénérescence de l'épithélium olfactif) observés après 12 mois et 18 mois. On a noté d'autres effets non néoplasiques, notamment des changements sanguins (une augmentation de la méthémoglobine en fonction de la dose chez les mâles, une faible diminution de l'hémoglobine à 75 et 374 ppm chez les femelles et une augmentation des plaquettes à 374 ppm chez les deux sexes) et des paramètres chimiques du sérum (diminution du chlorure et augmentation de la créatinine, de la protéine totale et de l'albumine à 374 ppm chez les mâles; une augmentation des niveaux d'enzymes hépatiques à 374 ppm chez les femelles) observés après 12 mois (Newton et al., 2001). Aucune étude par voie orale ou cutanée n'a été recensée. |
| Toxicité pour la reproduction | DMENO la plus faible concernant la toxicité pour la reproduction : 100 mg/kg p.c./j d'après une diminution importante sur le plan statistique de l'indice de mise bas par les femelles (%) ([nombre de ratons nés/nombre d'implantations] × 100) chez les rats mâles et femelles Crj: CD (Sprague-Dawley) exposés par gavage à 0, 10, 30 ou 100 mg/kg p.c./j dans le cadre d’une étude sur 1 génération (les mâles ont reçu un traitement 48 heures avant l'accouplement; les femelles ont reçu un traitement commençant 14 jours avant l'accouplement et prenant fin au 3e jour de lactation). DMENO pour la toxicité générale = 10 mg/kg p.c./j d'après les anomalies histopathologiques observées dans la rate, le foie et les reins chez les deux sexes (Japan MHW, 1998). Autre étude d'exposition par voie orale : des rats mâles et femelles CD (Sprague-Dawley) ont été exposés par gavage à 0, 10, 100 ou 200 mg/kg p.c./j dans une étude sur 2 générations (mâles et femelles F0 et F1traités quotidiennement de 10 à 11 semaines avant l'accouplement, pendant une période d'accouplement de 3 semaines et par la suite, pendant la durée de la grossesse et jusqu'au 21e jour de lactation). Aucun effet lié au traitement sur les paramètres de la reproduction n'a été observé. DMENO pour la toxicité générale = 10 mg/kg p.c./j d'après les effets sur la rate (prolifération de cellules hématopoïétiques, pigmentation et congestion) et le foie (hématopoïèse et pigmentation) chez les adultes F0 et F1 des deux sexes (Tyl et al., 1996). Aucune étude d'exposition par inhalation ou par voie cutanée n'a été recensée. |
| Toxicité pour le développement | DMENO la plus faible, par voie orale = 40 mg/kg p.c./j d'après les avortements de 3 femelles adultes sur 10 de lapins néo-zélandais blancs enceintes ayant reçu une dose par gavage de 0, 8, 14, 24 ou 40 mg/kg p.c./j (la dose la plus élevée « ne semblait pas être tératogène » pendant 6 à 18 jours de gestation, bien qu'une évaluation complète de la toxicité pour le développement n'était pas possible). DMENO pour la toxicité maternelle = 40 mg/kg p.c./j d'après 8 morts sur 18 sujets (Derelanko et al., 2003; Springborn Laboratories, 1990b). Autres études d’exposition par voie orale :l'étude de détermination des doses ayant des effets chez les lapins néo-zélandais blancs (ayant reçu une dose pendant les jours 6 à 18 de la gestation) n'a pas permis de prouver la toxicité pour le développement à des doses de 0 à 80 mg/kg p.c./j, bien que la DMENO pour la toxicité maternelle = 10 mg/kg p.c./j d'après les symptômes d'anémie observés chez les mères rates à toutes les doses. À 10 mg/kg p.c./j, une augmentation de méthémoglobine et de réticulocytes a été observée au 13e jour de gestation et a augmenté graduellement en fonction du temps jusqu'au 19e jour de gestion (3 jours après la dernière exposition) (Springborn Laboratories, 1990b; Derelanko et al., 2003). Deux études chez des rats Sprague-Dawley (ayant reçu des doses pendant les jours de gestation 6 à 15) a permis d'obtenir des DSENO de 400 et 600 mg/kg p.c./j concernant la toxicité pour le développement et des DMENO de 25 mg/kg p.c./j pour la toxicité maternelle, d'après les symptômes d'anémie, et de 60 mg/kg p.c./j, d'après l'élargissement de la rate (Springborn Laboratories, 1990a; Mercieca et al., 1991; Derelanko et al., 2003). Aucune étude d'exposition par inhalation ou par voie cutanée n'a été recensée. |
| Génotoxicité et paramètres connexes : in vivo | Micronoyaux Résultats négatifs :cellules de la moelle osseuse, rats Sprague-Dawley exposés par voie orale (300, 600 ou 1 200 mg/kg) (Microbiological Associates, 1990). Résultats négatifs : cellules du sang périphérique, souris B6C3F1 exposées par voie orale (0, 625, 1 250, 5 000 ou 10 000 ppm dans l'eau potable, c’est-à-dire 0, 128, 270, 573, 883 ou 2 250 mg/kg p.c./j; essai effectué sur des souris dans le cadre d’unevétude de 13 semaines) (NTP, 1999). Formation d'adduits de l'ADN et de l'ARN Résultats négatifs pour les adduits de l'ADN; résultats positifs pour les adduits de l'ARN : cellules hépatiques, rats (souche non mentionnée), inhalation (0, 375 ou 1 000 ppm [0, 1 336 ou 3 563 mg/m3]) (Honeywell International Inc., 2000; Friedewald et al., 2001). |
| Génotoxicité et paramètres connexes : in vitro | Mutagénicité chez les bactéries Résultats négatifs : Salmonella typhimurium, souches TA97, TA98, TA100, TA1537 et TA1538 avec et sans activation de la fraction S9 (Allied Corporation, 1983b; NTP, 1999; Rogers-Back et al., 1988; JETOC, 1999). Résultats équivoques : S. typhimurium, souche TA1535 positive en présence de la fraction S9 du foie des hamsters, mais pas en présence de la fraction S9 du foie des rats; négative sans la fraction S9 (NTP, 1999). Résultats négatifs : S. typhimurium, souches TA98 et TA100 avec et sans activation de la fraction S9; mises à l'essai sous forme de vapeur en plaçant des plaques dans un dessiccateur (NTP, 1999). Essai de mutation de cellules de mammifères Résultats positifs : cellules de lymphomes chez des souris L5178 Y TK+/-, avec et sans la fraction S9 (Rogers-Back et al., 1988). Essai d'aberrations chromosomiques Résultats négatifs : cellules ovariennes de hamsters chinois, avec et sans la fraction S9 (NTP, 1999). Résultats négatifs : cellules pulmonaires de hamsters chinois, avec et sans la fraction S9 (JETOC, 1999). Essai d'échange de chromatides sœurs Résultats négatifs : cellules ovariennes de hamsters chinois, avec et sans la fraction S9 (Allied Corporation, 1983a; NTP, 1999) Essai de synthèse de l'ADN non programmée Résultats négatifs : hépatocytes des rats (IHF Inc., 1995). |
| Études sur les humains | Aucune étude pertinente sur les humains n'a été recensée. |
Note de bas de page
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
2-butanone, oxime
(butanone-oxime)
Numéro de registre du Chemical Abstracts Service
96-29-7
Environnement Canada
Santé Canada
Mars 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Estimations de la limite supérieure de l'exposition au butanone-oxime dans les produits de consommation
- Annexe 2 : Résumé des renseignements disponibles relatifs aux effets du butanone-oxime sur la santé
En application de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE(1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du butanone-oxime, dont le numéro de registre du Chemical Abstracts Service est 96-29-7. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance durant la catégorisation visant la Liste intérieure dans le cadre du Défi. Le butanone-oxime a été jugé hautement prioritaire, car il a été reconnu comme une substance présentant le plus fort risque d’exposition pour la population du Canada et il a été classé par la Commission européenne en fonction de sa cancérogénicité. Bien que le butanone-oxime répondait au critère environnemental de la catégorisation relatif à la persistance, il ne réponde pas aux critères liés au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation sur le butanone-oxime est donc principalement axée sur les risques pour la santé humaine.
Le butanone-oxime est largement utilisé comme agent antipeau dans la préparation des peintures alkydes, des vernis, des teintures et des revêtements destinés à l’utilisation par l’industrie et les consommateurs. Au Canada, cette substance est contenue dans plusieurs pesticides, notamment dans les produits de préservation du bois et les peintures marines antisalissures ainsi que dans certains adhésifs, agents d’étanchéité à base de silicone et encres d’imprimerie. De plus, le butanone-oxime est utilisé comme inhibiteur de corrosion dans les chaudières industrielles et les systèmes de traitement de l’eau et comme agent de blocage dans le processus de fabrication des polymères d’uréthane.
Selon les renseignements obtenus en application de l’article 71 de la LCPE(1999), aucune entreprise au Canada n’a fabriqué de butanone-oxime au cours de l’année civile 2006. Toutefois, environ 500 000 kg de cette substance ont été importés en 2006 et la quantité utilisée a atteint près de 120 000 kg au cours de l’année visée. Il existe très peu de données sur le rejet et le devenir du butanone-oxime dans les milieux naturels au Canada ou ailleurs. Il n’est pas présent naturellement dans l’environnement et ses rejets dans l’environnement devraient donc provenir directement des activités anthropiques. Étant donné la quantité de butanone-oxime commercialisée au Canada et son utilisation dans divers produits de consommation, l’exposition de la population générale à cette substance devrait être modérée.
Comme le butanone-oxime a été classé par la Commission européenne en fonction de sa cancérogénicité, la présente évaluation préalable porte principalement sur cette capacité de la substance. Dans le cadre d’une étude longitudinale menée chez les rats et les souris, on a observé une augmentation de l’incidence des tumeurs hépatiques ainsi qu’une augmentation de l’incidence des tumeurs des glandes mammaires chez les rats femelles; toutefois, ces tumeurs n’ont été observées qu’à une exposition à des concentrations moyennes à élevées. Les résultats des essais de génotoxicité in vivo et in vitro indiquent l’absence de mutagénicité. Il semble que l’exposition chronique au butanone-oxime provoque l’apparition de tumeurs par un mécanisme ne comportant aucune interaction directe avec le matériel génétique.
Des effets non néoplasiques ont également été observés dans les fosses nasales des rats et des souris à partir d’études sur l’exposition (de courte durée à chronique) au butanone-oxime par inhalation. De plus, des effets hématologiques chez les rats et les lapins ainsi que des effets sur le foie, la rate et les reins des rats ont été notés à la suite d’une exposition orale dans le cadre d’études à doses répétées. D’après la comparaison de l’exposition estimative au butanone-oxime au Canada et de la concentration associée à un effet critique pour les effets autres que le cancer, et compte tenu des incertitudes inhérentes aux bases de données sur l’exposition et les effets, on considère que les marges d’exposition, notamment l’exposition des consommateurs aux produits contenant la substance, pourraient ne pas être suffisamment protectrices de la santé humaine.
Compte tenu du manque de fiabilité possible entre l’exposition estimée au butanone-oxime et les concentrations associées à un effet critique, il en ressort que le butanone-oxime est une substance qui peut pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D'après le danger écologique que présentent le butanone-oxime et ses rejets estimés, il est conclu que cette substance ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ni à mettre en danger l'environnement essentiel pour la vie. Le butanone-oxime répond aux critères de la persistance, mais il ne répond pas aux critères du potentiel de bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation.
Cette substance sera considérée pour inclusion dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles déterminées à l’étape de la gestion des risques.
La Loi canadienne sur la protection de l'environnement (1999) [LCPE(1999)] (Canada, 1999) impose aux ministres de l'Environnement et de la Santé de procéder à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque (Ti) pour les organismes aquatiques et que l'on estime commercialisées;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
Une priorité élevée a été donnée à l'évaluation des risques que comporte le butanone-oxime pour la santé humaine étant donné le risque d'exposition des Canadiens, qui a été jugé le plus fort (PFRE), et la classification de la substance par un autre organisme en ce qui a trait à la cancérogénicité.
Le volet du Défi portant sur le butanone-oxime a été publié dans la Gazette du Canada le 30 août 2008 (Canada, 2008). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements sur la substance ont été communiqués en réponse au Défi.
Même s'il a été jugé hautement prioritaire d'évaluer les risques que présente le butanone-oxime pour la santé humaine et que cette substance répond aux critères environnementaux de la catégorisation applicables à la persistance, celle-ci ne répond pas aux critères définissant la bioaccumulation ou la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables visent à étudier les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les risques, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l'évaluation préalable de cette substance sont tirées de publications originales, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et d'autres documents consultés au cours de recherches documentaires menées récemment, jusqu’en novembre 2008 (sections concernant la santé humaine) et jusqu'en mai 2009 (sections concernant l’environnement). Les études les plus importantes ont fait l'objet d'une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition (non professionnelle) de la population générale et de l'information sur les dangers et les risques pour la santé (principalement d’après les évaluations s’appuyant sur la méthode du poids de la preuve effectuées par d'autres organismes, lesquelles ont servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur la marge entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, et ce, dans le contexte d'une évaluation préalable. La présente évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion.
L’évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes de ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'environnement ont fait l'objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment Mme Joan Strawson (TERA), M. Micheal Jayjock, Ph. D. (The LifeLine Group) et M. Glenn Talaska, Ph. D (Université de Cincinnati). Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l’évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Le butanone-oxime est appelé méthyléthylcétoxime (MECO). Cependant, aux fins de la présente évaluation, la substance est appelée butanone-oxime selon le nom utilisé dans l'Inventaire européen des substances chimiques commercialisées existantes (EINECS). Le tableau 1 résume l’identité de la substance.
Tableau 1. Identité de la substance – butanone-oxime
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 96-29-7 |
| Nom dans la LIS | Butanone-oxime |
| Noms relevés dans les NCI | Butanone-oxime (EINECS, PICCS) 2-Butanone-oxime (AICS, ASIA-PAC, PICCS, SWISS, TSCA) Butan-2-one oxime (ENCS, PICCS) 2-Butanonoxime (PICCS) Methyl ethyl ketoxime (PICCS) Methyl ethyl ketone oxime (PICCS)Oxime 2-butanone (ECL) |
| Autres noms | Aron M 1, 2-Butoxime, Ethyl methyl ketone oxime, Ethyl methyl ketoxime, Exkin 2, Exkin II, Hiaron M 1, MEK-oxime, MEKO, Mekor 70, NSC 442, NSC 65465, Troykyd AntiSkin B |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Oximes |
| Principale sous-classe chimique | Cétoximes (chaîne courte) |
| Formule chimique | C4H9NO |
| Structure chimique | 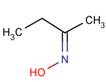 |
| SMILES | N(O)=C(CC)C |
| Masse moléculaire | 87,12 g/mol |
| Abréviations : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique); ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des produits et substances chimiques existantes et nouvelles du Japon); LIS (Liste intérieure des substances); National Chemical Inventories (NCI); n° CAS(numéro de registre du Chemical Abstracts Service); PICCS (inventaire des produits et substances chimiques des Philippines); SMILES (simplified molecular input line entry); SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). Source : NCI, 2006. |
|
Le tableau 2 présente les données physiques et chimiques (valeurs expérimentales et modélisées) du butanone-oxime qui se rapportent à son devenir dans l'environnement. Lorsque les données expérimentales n'étaient pas disponibles, la propriété a été estimée à l'aide de modèles, comme l'indique le tableau 2. Bien que le butanone-oxime soit un acide faible et qu'il se dissociera, cela ne survient qu'à un pH très élevé (> 12). Par conséquent, cette substance se trouve sous une forme neutre à des valeurs de pH pertinentes du point de vue de l'environnement (6 à 9) et la forme neutre du butanoneoxime a été utilisée pour l'estimation à l’aide des modèles.
Tableau 2. Propriétés physiques et chimiques du butanone-oxime
| Propriété | Type | Valeur1 | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Kco, coefficient de partage carbone organique-eau; Koa, coefficient de partage octanol-air; Koe, coefficient de partage octanol-eau; pKa, constante de dissociation acide. 1 Les valeurs entre parenthèses représentent les valeurs originales signalées par les auteurs. 2 Valeurs utilisées pour la modélisation. 3 La décomposition se produit à des températures supérieures à 100 °C (BESC, 2000). |
||||
| Point de fusion (°C) | Expérimental | -29,52 | Lide, 2005 | |
| Point d'ébullition (°C) | Expérimental | 152,52,3 | Lide, 2005 | |
| Masse volumique (kg/m3) | Expérimental | 923,2 | 20 | Lide, 2005 |
| Expérimental | 915 | BESC, 2000 | ||
| Expérimental | ~ 920 | 20 | ||
| Pression de vapeur (Pa) | Expérimental | ~ 3502 (~ 3,5 hPa) | 20 | BESC, 2000 |
| Expérimental | 440 (4,4 hPa) | 20 | ||
| Expérimental | 141 (1,06 mm Hg) | 20 | Kurita, 1967 | |
| Constante de la loi de Henry (Pa·m3/mol) | Calculé | 0,302 | 20 | |
| Log Koe (sans dimension) | Expérimental | 0,63 | MITI, 1992 | |
| Expérimental | 0,652 | 25 | BESC, 2000 | |
| Expérimental | 0,59 | 20 | ||
| Log Kco (sans dimension) | Modélisé | 0,56 | KOCWIN, 2008 | |
| Modélisé | 0,262 | EQC, 2003 | ||
| Log Koa (sans dimension) | Modélisé | 4,3 | 25 | KOAWIN, 2008 |
| Solubilité dans l'eau (mg/L) | Expérimental | 100 000 | Verschueren, 1977 | |
| pKa (sans dimension) | Expérimental | 12,45 | 25 | King et Marion, 1944 |
Alors que deux isomères géométriques sont possibles pour le butanone-oxime, l'isomère trans prédomine (> 99 %) (OCDE, 2003).
Le butanone-oxime est une substance anthropique et elle est considérée être une substance chimique produite en grande quantité dans les pays de l'Organisation de coopération et de développement économiques (OCDE, 2004), par l'Agence de protection de l’environnement des États-Unis (US EPA, 2006) et par la Commission européenne (ESIS, 2006). La production mondiale de butanone-oxime est estimée être entre 10 000 et 20 000 tonnes par année (OCDE, 2003). Selon les renseignements fournis en application de l'article 71 de la LCPE(1999), aucune entreprise au Canada n'a fabriqué de butanone-oxime au cours de l'année civile 2006. Pourtant, les importations de cette substance au Canada en une quantité supérieure au seuil de déclaration de 100 kg se sont chiffrées à environ 500 000 kg durant cette même année (Environnement Canada, 2009a).
Le butanone-oxime est largement utilisé comme agent antipeau dans la préparation des peintures alkydes, des apprêts, des vernis et des teintures destinés à empêcher le séchage par oxydation et la formation de pellicules dures et gélatineuses sur la préparation de peinture à l'intérieur du contenant. Selon les renseignements transmis en application de l'article 71 de la LCPE(1999), le Canada a, en 2006, utilisé près de 120 000 kg de butanone-oxime (Environnement Canada, 2009a). La majorité de ces utilisations étaient destinées à la fabrication de préparations de peinture alkyde à des fins d'applications industrielles et de consommation. Selon les renseignements disponibles, la concentration de butanone-oxime présente dans les préparations de peinture alkyde au Canada est d’au plus 1 % en poids (p/p), alors qu'une gamme de concentrations courantes varie de 0,02 à 0,5 % p/p (communication personnelle du groupe de travail de l'Association canadienne de l'industrie de la peinture et du revêtement adressée à Environnement Canada, 2009; source non citée dans les références). Selon les renseignements déclarés en application de l'article 71, le butanone-oxime est également présent dans les colorants ou les pigments utilisés dans les peintures alkydes ou les encres d'impression à des concentrations respectives de 0,1 % et 0,2 % p/p (Environnement Canada, 2009a).
Cette substance est également présente comme formulant dans plusieurs pesticides, notamment dans les produits de préservation du bois et les peintures marines antisalissures qui sont utilisés au Canada (communication personnelle de l'Agence de réglementation de la lutte antiparasitaire de Santé Canada adressée au Bureau de la gestion du risque de Santé Canada, 2009; source non citée dans les références). De plus, cette substance est un composant mineur de certains scellants et adhésifs fabriqués au Canada et, dans une moindre mesure, de certains bouche-pores et peintures et matériaux d'impression pour les artistes (Environnement Canada, 2009a).
Le butanone-oxime est également utilisé comme inhibiteur de corrosion dans les chaudières industrielles (Rumpf, 1993) et les systèmes de traitement de l'eau (Derelanko, 2003; Newton et al., 2001) et comme agent de blocage dans le processus de fabrication des polymères d'uréthane (Subramani et al., 2004). Selon les renseignements obtenus en application de l'article 71 de la LCPE(1999), le butanone-oxime sert d'inhibiteur de corrosion et d'agent de blocage dans la fabrication de polymères d'uréthane au Canada (Environnement Canada, 2009a).
Aucune utilisation actuelle du butanone-oxime dans les cosmétiques n'a été déclarée au Canada. Sur le plan international, une telle utilisation est interdite au Danemark (Ministère danois de l'environnement, 2004) et au Royaume-Uni (Secrétariat d'état britannique, 2008) conformément à une modification de la Directive 76/768/CEE de la Commission européenne (Commission européenne, 2004). Le butanone-oxime est présent dans certaines encres d'impression qui servent à fabriquer des matières constituant l'emballage alimentaire, mais il n'entre pas directement en contact avec les aliments.
Selon les renseignements communiqués en application de l'article 71 de la LCPE(1999), aucune entreprise au Canada n'a fabriqué de butanone-oxime au cours de l'année civile 2006. De plus, aucun rejet industriel important de cette substance n'a été déclaré dans les renseignements obtenus en exécution de l'article 71 durant cette même année (Environnement Canada, 2009a). L'Association canadienne des fabricants de produits chimiques (ACFPC, 2009) a indiqué un rejet de 356 kg de butanone-oxime dans l'environnement en 2007. La déclaration des rejets industriels de butanone-oxime à l'Inventaire national des rejets de polluants (INRP, 2007) n'est pas obligatoire. Le total des rejets industriels devrait être faible et les rejets les plus importants devraient être observés à l'étape de l'utilisation par les consommateurs.
D'après les propriétés physiques et chimiques du butanone-oxime (tableau 2), cette substance se caractérise par une hydrosolubilité élevée (100 000 mg/L), une pression de vapeur modérée (350 Pa), un faible log Koe (0,65) et une constante de la loi de Henry (0,30 Pa·m3/mol) faible. Les valeurs de demi-vie dans l'air (valeur modélisée de 7,21 jours; voir le tableau 4b) et dans l'eau (valeur mesurée de 18 jours en fonction du taux d'hydrolyse; voir le tableau 4a) servent à modéliser la fugacité de niveau III. D'après les résultats résumés dans le tableau 3, le butanone-oxime devrait demeurer en grande partie ou principalement dans le milieu où il est rejeté. On note une certaine répartition modérée dans l'eau et le sol lorsque la substance est rejetée dans l'air ainsi qu'une répartition modérée dans l'eau si la substance est rejetée dans le sol.
Tableau 3. Résultats de la modélisation de la fugacité de niveau III (EQC, 2003)
| Substance rejetée à 100 % dans : | Fraction de la substance se répartissant dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air | 61,1 | 18,9 | 20,0 | = 0,01 |
| l'eau | 0,2 | 99,6 | 0,1 | 0,2 |
| le sol | 0,7 | 21,6 | 77,6 | = 0,2 |
Le butanone-oxime est considéré être un composé non ionisant en raison de la valeur élevée de sa constante de dissociation (pKa > 12); il se trouvera donc sous sa forme neutre à des valeurs de pH normalement observées dans l'environnement (6 à 9).
Persistance dans l'environnement
Le tableau 4a présente les données empiriques sur la biodégradation et l'hydrolyse du butanone-oxime dans l’eau. Cette substance peut s'hydrolyser en fonction du pH. En effet, lorsque la température s’élève à 20 °C, l'hydrolyse est instable à pH 4, alors qu'aucune hydrolyse ne se produit à pH 9. À pH 7, 14 % de la substance est hydrolysée après quatre jours (Environnement Canada, 2009b), ce qui se traduit par une demie-vie de 18 jours en fonction du taux d'hydrolyse dans le milieu aquatique. Par conséquent, à des conditions environnementales neutres à acides, l'hydrolyse peut constituer une voie de dégradation importante pour cette substance. Les produits d'hydrolyse sont le 2-butanone (no CAS 78 93-3) et l'hydroxylamine (no CAS 7803-49-8) (BESC, 2000a; id., 2000b).
L'étude de la biodégradation intrinsèque (MITI, 1992) semble indiquer que le butanone-oxime subit une biodégradation primaire, mais que la biodégradation ultime est, au mieux, lente (tableau 4a).
Tableau 4a. Données empiriques sur la dégradation du butanone-oxime
| Milieu | Processus du devenir | Valeur pour la dégradation (%) | Paramètre de la dégradation | Référence |
|---|---|---|---|---|
| 1 Lignes directrices de l'OCDE pour les essais. Essai n° 302C : biodégradabilité dite intrinsèque : Essai MITI modifié (II). | ||||
| Eau | Biodégradation aérobie1 | 24,7 | Biodégradation intrinsèque en 28 jours | MITI, 1992 |
| Eau | Hydrolyse | 14 | Hydrolyse (4 jours, pH 7, 20 °C) | Environnement Canada, 2009b |
Le Bureau Européen des Substances Chimiques (BESC) a publié une fiche technique sur le butanone-oxime où il est question des études de dégradation et des autres essais approuvés de l'Organisation de coopération et de développement économiques (OCDE), qui concluent à une biodégradabilité intrinsèque, primaire et ultime (2000a). Les études révèlent une dégradation de 70 % relative au carbone organique dissous sur une période de 14 jours et une dégradation d'environ 25 % seulement relative à la demande biochimique d'oxygène.
En plus des données expérimentales susmentionnées sur la dégradation du butanone-oxime, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) (Environnement Canada, 2007) a été utilisée avec les modèles de dégradation présentés au tableau 4b.
Tableau 4b. Données modélisées sur la dégradation du butanone-oxime
| Processus du devenir | Modèle et fondement du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2008 | t1/2 = 7,21 jours1 | > 2 |
| Réaction avec l'ozone | AOPWIN, 2008 | s.o.2 | s.o. |
| Eau | |||
| Hydrolyse | HYDROWIN, 2008 | s.o.2 | s.o. |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 3 : enquête d'expert (biodégradation ultime) | 3,013 « se biodégrade rapidement » | < 182 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 4 : enquête d'expert (biodégradation primaire) | 3,723 « se biodégrade rapidement » | < 182 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 5 : MITI, probabilité linéaire (biodégradation ultime) | 0,504 « se biodégrade rapidement » | < 182 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 6 : MITI, probabilité non linéaire (biodégradation ultime) | 0,624 « se biodégrade rapidement » | < 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 probabilité | 0,03 « se biodégrade très lentement » | > 182 |
| Biodégradation (aérobie) | CATABOL, c2000-2008 DBO, % (demande biochimique en oxygène) | % DBO = 20,1 « se biodégrade lentement » | > 182 |
Les modèles de biodégradation aérobie (sous-modèles BIOWIN 3, 4, 5 et 6) semblent indiquer que le butanone-oxime se dégrade rapidement. Les résultats des modèles de probabilité (sous-modèles BIOWIN 5 et 6) sont supérieurs à 0,3, le seuil suggéré par Aronson et al. (2006) pour définir les substances comme ayant une demi-vie inférieure à 60 jours (selon les modèles de probabilité du MITI). Toutefois, le modèle TOPKAT prédit que la substance peut ne pas se biodégrader rapidement dans l'eau, alors que le modèle CATABOL indique que la substance se situe entre les valeurs limites définissant une biodégradation lente (DBO < 20 %) et une biodégradation rapide (DBO > 21 %). Vu l'existence des données expérimentales, on a accordé davantage d’importance aux mesures empiriques; les résultats des sous-modèles BIOWIN 3, 4, 5 et 6 ayant trait à la biodégradation aérobie viennent aussi appuyer ces données. Les données expérimentales, conjuguées avec les prévisions du modèle BIOWIN, sont assez fiables pour qu'on s’attende à une biodégradation importante avec une demi-vie vraisemblablement bien inférieure à 182 jours.
On s'attend à ce que le butanone-oxime se dépose dans une faible mesure dans les sédiments; toutefois, il pourra demeurer dans le sol s'il est rejeté dans ce milieu environnemental (voir le tableau 3). Étant donné la biodégradation rapide prévue par les sous-modèles BIOWIN (2008), de même que le potentiel modéré d'hydrolyse, la demi-vie de dégradation dans l'eau est probablement inférieure ou égale à 90 jours. Par conséquent, la demi-vie de dégradation dans le sol et les sédiments, laquelle est extrapolée à l'aide des facteurs de Boethling et al., (1995) (t½ eau : t½ sol : t½ sédiments = 1 : 1 :4), est inférieure ou égale à 180 jours et à 365 jours, respectivement.
D'après les données empiriques et modélisées (voir les tableaux 4a et 4b ci-dessus), il est conclu que le butanone-oxime satisfait au critère de la persistance dans l'air (demi-vie dans l'air = 2 jours), mais ne satisfait pas aux critères de la persistance dans l'eau, le sol ou les sédiments (demi-vie dans le sol et l'eau = 182 jours et demi-vie dans les sédiments = 365 jours) prévus dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Le potentiel de transport à grande distance de cette substance a été prévu à l'aide de deux modèles : le modèle de transport et de persistance de niveau III (TaPL3, v. 3.00) et l'outil de dépistage du potentiel de transport à grande distance et de persistance générale dans l'environnement de l'OCDE. Les résultats sont présentés au tableau 4c.
Tableau 4c. Prévisions des modèles et niveau de préoccupation pour le potentiel de transport à grande distance du butanone-oxime
| Modèles de prévision | Pge1 (jour) | DTC2 (km) | ET3 (%) | Niveau de préoccupation | ||
|---|---|---|---|---|---|---|
| Faible | Moyen | Élevé | ||||
| 1 Pge = Persistance générale dans l'environnement 2 DTC = Distance de transport caractéristique 3 ET = Efficacité du transfert |
||||||
| TaPL3, v. 3.00 | s.o.4 | 1 376 | s.o. | DTC < 700 km | DTC = de 700 à 2 000 km | DTC > 2 000 km |
| Outil de l'OCDE | 23,5 | 3 581 | 2,1 × 10-2 | 1) Pge < 195 jours et 2) DTC < 5 098 km et ET < 6,5 × 10-4 % | toute combinaison de Pge, DTC et ET autre que « faible » ou « élevé » | 1) Pge > 195 jours et 2) DTC > 5 098 km ou ET > 6,5 × 10-4 % |
Le modèle TaPL3 fournit une estimation de la distance de transport caractéristique seulement pour la substance, définie comme la distance maximale parcourue par 63 % de la substance sur 1 376 km. Beyer et al. (2000) ont proposé de considérer le potentiel de transport à grande distance comme étant élevé si la distance de transport caractéristique est supérieure à 2 000 km, moyen si elle est de 700 à 2 000 km et faible si elle est inférieure à 700 km. Selon le résultat du modèle TaPL3, cette substance devrait avoir un potentiel moyen de transport à grande distance.
Le potentiel de transport à grande distance du butanone-oxime a aussi été évalué à l'aide de l’outil de l'OCDE, en fonction d'une combinaison de la persistance générale dans l'environnement et de la distance de transport caractéristique ou de l'efficacité du transfert. La persistance générale dans l'environnement a été présentée comme un concept pour considérer les valeurs de demi-vie d'après le comportement de répartition et elle représente la moyenne de l'ensemble de ces valeurs dans l'air, l'eau, les sédiments et le sol (Mackay, 2006). Ce paramètre est étroitement lié au potentiel de transport à grande distance; toutefois, il n'est pas actuellement utilisé dans le processus décisionnel lié à l'évaluation des dangers puisque les organismes de réglementation privilégient la méthode faisant appel aux valeurs de demi-vie dans un même milieu. L'efficacité du transfert est une mesure, exprimée en pourcentage, de la portée du dépôt d'une substance sur les milieux en surface dans une région cible après avoir été transportée à partir de la région de rejet (Klasmeier et al., 2006). D'après le système d'évaluation du niveau de préoccupation (Scheringer et al., 2006), le potentiel de transport à grande distance du butanone-oxime devrait également être moyen.
Potentiel de bioaccumulation
Les valeurs expérimentales du log Koe (entre 0,59 et 0,65) du butanone-oxime (voir le tableau 2 ci-dessus) suggèrent que cette substance est peu bioaccumulable dans le biote. Les facteurs de bioconcentration (FBC) obtenus expérimentalement de 0,5 à 5,8 chez la carpe (Cyprinus carpio) et le medaka japonais (Oryzias latipes) (MITI, 1992; BESC, 2000a) indiquent que le butanone-oxime n'est pas bioaccumulable. Cette conclusion est également appuyée par les valeurs modélisées du FBC et du facteur de bioaccumulation (FBA) (tableau 5) sans métabolisme, lesquelles ont été utilisées dans la méthode du poids de la preuve (Environnement Canada, 2007) pour l'évaluation du potentiel de bioaccumulation de cette substance.
Tableau 5. FBA et FBC du butanoneoxime prévus chez les poissons sans métabolisme
| Organisme d'essai | Paramètre | Valeur en poids humide (L/kg) | Référence |
|---|---|---|---|
| 1 La très faible valeur de 3,2 assignée au FBC est une valeur par défaut recommandée par le modèle BCFBAF pour les substances dont le log Koe est inférieur à 1; ce résultat n'est donc pas une valeur de FBC issue du modèle qui a été calculée expressément pour le butanone-oxime. 2 Estimation maximale. |
|||
| Poissons | FBA | 1,2 | Modèle du FBA de Gobas pour le niveau trophique intermédiaire (BCFBAF, 2008) |
| Poissons | FBC | 1,2 | Modèle du FBC de Gobas pour le niveau trophique intermédiaire (BCFBAF, 2008) |
| Poissons | FBC | 3,21 | BCFBAF, 2008 |
| Poissons | FBC2 | 27,5 | CPOPs, 2008 |
De plus, les valeurs du log Koe pour les produits d'hydrolyse du butanone-oxime et de l'hydroxylamine sont très faibles (BESC, 2000; OCDE, 2008), ce qui indique que ces substances hydrolytiques du butanone-oxime présentent un faible potentiel de bioaccumulation.
D'après les valeurs empiriques et celles obtenues par modélisation cinétique, il est conclu que le butanone-oxime ne satisfait pas aux critères de la bioaccumulation (FBA ou FBC = 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La démarche suivie dans cette évaluation consistait à examiner les renseignements scientifiques disponibles et à tirer des conclusions en appliquant la méthode du poids de la preuve et en tenant compte du principe de prudence requis par la LCPE(1999). Les éléments de preuve pris en compte comprenaient les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Comme il a été décrit précédemment, le butanone-oxime est persistant dans l'air, mais il ne l'est pas dans l'eau, le sol ou les sédiments. Il devrait également présenter un faible potentiel de bioaccumulation. Les données expérimentales sur les effets écologiques les plus sensibles pour plusieurs espèces, de même que les données modélisées, sont résumées dans le tableau 6. Des sommaires de rigueur d'études n'ont pas été préparés pour les études empiriques, car celles-ci n'étaient pas disponibles. Cependant, la valeur la plus faible de toutes les données recueillies sur l'écotoxicité (6,1 mg/L) a été utilisée en tant qu'estimation prudente de la valeur critique de toxicité (VCT) pour caractériser le potentiel d’effets sur les espèces sensibles. Les données modélisées appuient généralement les résultats empiriques.
Tableau 6. Données empiriques et modélisées sur la toxicité en milieu aquatique du butanone-oxime
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence | ||
|---|---|---|---|---|---|---|
| Abréviations : CE50, concentration d'une substance qu'on estime susceptible de causer un effet toxique sublétal chez 50 % des organismes d'essai; CL50, concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai; CSEO, concentration sans effet observé. 1 Anciennement Selenastrum capricornutum. 2 Valeur critique de toxicité (VCT). 3 Essai biologique de toxicité sur Photobacterium phosphoreum. 4 Fondé sur un modèle RQSA pour la toxicité de référence. |
||||||
| Données empiriques | ||||||
| Poisson (Pimephales promelas) | Toxicité aiguë | CL50 sur 96 h | 843 | Brooke et al., 1984 | ||
| Poisson (Oryzias latipes) | Toxicité subchronique | CL50 sur 14 j CSEO sur 14 j | > 100 50 | CHRIP, c2002 | ||
| Invertébré(Daphnia magna) | Toxicité aiguë | CE50 sur 48 h | 200 | CHRIP, c2002 | ||
| Invertébré(Daphnia magna) | Toxicité chronique | CE50 (reproduction)sur 21 j | > 100 | CHRIP, c2002 | ||
| Algue (Pseudo-kircheneriella subcapitata)1 | Toxicité chronique | CE50 (croissance) sur 72 h) | 6,12 | CHRIP, c2002 | ||
| Microbe3 | Toxicité aiguë | CE50 en 5 min | 950 | Curtis et al., 1982 | ||
| Données modélisées | ||||||
| Poisson | Toxicité aiguë | CL50 sur 96 h | 932 | ECOSAR, 20084 | ||
| Poisson | Toxicité chronique | Valeur chronique | 91 | ECOSAR, 2008 | ||
| Poisson (Pimephales promelas) | Toxicité aiguë | CL50 sur 96 h | 1 482 | AIEPS, 2003-2007 | ||
| Invertébré (Daphnia) | Toxicité aiguë | CE50 sur 48 h | 457 | ECOSAR, 2008 | ||
| Invertébré (Daphnia) | Toxicité chronique | Valeur chronique | 33 | ECOSAR, 2008 | ||
| Invertébré (Daphnia) | CE50 | 1 600 | TOPKAT, 2004 | |||
| Invertébré (Daphnia) | Toxicité aiguë | CE50 sur 48 h | 290 | AIEPS, 2003-2007 | ||
| Algue verte | Toxicité chronique | CE50 sur 96 h | 113 | ECOSAR, 2008 | ||
| Algue verte | Toxicité chronique | Valeur chronique | 32 | ECOSAR, 2008 | ||
| Algue (Pseudo-kirchneriella subcapitata) | Toxicité chronique | CE50 sur 72 h | 31 | AIEPS, 2003-2007 | ||
Les données sur la toxicité indiquent que le butanone-oxime présente un potentiel modéré d'être toxique pour les algues et un potentiel faible pour la majorité des autres organismes aquatiques. De plus, en tenant compte de la toxicité des produits d'hydrolyse (2-butanone et hydroxylamine) pour les espèces aquatiques sensibles, de même que du faible taux comparable d'hydrolyse (14 % en 4 jours) dans les conditions environnementales, le risque découlant des produits d'hydrolyse du butanone-oxime ne devrait pas être significativement supérieur à celui du composé (BESC, 2000b; OCDE, 2008).
Aucune donnée sur la toxicité n'a été trouvée pour les organismes vivant dans le sol ou les sédiments.
Le grand volume d'importation de butanone-oxime au Canada, ainsi que les renseignements sur les utilisations de cette substance, indique une possibilité de rejet généralisé de cette substance dans l'environnement au pays. S'il est rejeté dans l'eau, le butanone-oxime devrait y rester (> 99 %; voir le tableau 3). Dans la présente évaluation préalable, des scénarios d'exposition du milieu aquatique propres au site ont été élaborés en vue d'estimer les rejets des exploitations industrielles dans le milieu aquatique ainsi que les concentrations de ces rejets dans le milieu aquatique.
Deux sites (usines de traitement des eaux usées) ont été identifiés comme ayant les rejets les plus importants de butanone-oxime, tel qu'établis à partir des renseignements obtenus dans le cadre de l'enquête menée en vertu de l'article 71 (Environnement Canada, 2009a). Chaque site comprend des rejets d'un certain nombre d'utilisateurs industriels de butanone-oxime. Un site rejette ses eaux usées dans un milieu récepteur relativement important, alors que l'autre les rejette dans un milieu récepteur considérablement plus petit. Les concentrations environnementales estimées (CEE) pour les deux sites étaient calculées en fonction de la quantité de butanone-oxime utilisée par toutes les installations desservies par chacune des usines de traitement des eaux usées, la fraction estimée du rejet vers l'usine de traitement des eaux usées, le taux d'élimination et le débit de l'effluent de cette usine ainsi que la capacité de dilution du milieu récepteur. La fraction de la substance rejetée vers l'usine de traitement des eaux usées constitue la valeur clé dans l'estimation de la CEE. Cette fraction de 0,3 %, qui est présumée par défaut, provient du nettoyage des conteneurs semi-vrac ou des boîtes de manutention utilisés pour le transport de la substance (Great Western Containers, 2005). La CEE calculée la plus élevée des deux sites était de 0,010 mg/L.
Une concentration estimée sans effet (CESE) a été déterminée à partir de la valeur de la toxicité chronique de 6,1 mg/L mesurée chez les algues, soit chez Pseudokirchneriella subcapitata (voir le tableau 6). Pour ce faire, un facteur d'évaluation de 100 a été appliqué pour tenir compte des incertitudes liées à la variabilité interspécifique et intraspécifique de la sensibilité et de l'extrapolation d'une valeur sans effet mesurée sur le terrain à partir d'une CE50 mesurée en laboratoire. La CESE ainsi obtenue était de 0,06 mg/L. Le quotient de risque dérivé le plus élevé, calculé comme étant le rapport de la CEE sur la CESE était de 0,17, ce qui indique que la substance ne devrait pas être nocive pour les organismes aquatiques.
Il est donc peu probable que le butanone-oxime cause des effets écologiques nocifs au Canada. Étant donné le faible taux d’hydrolyse comparable du butanone-oxime, les produits d'hydrolyse ne devraient pas non plus représenter une menace.
Il importe de souligner que cette conclusion a été formulée malgré les hypothèses prudentes qui ont été émises en réponse aux incertitudes découlant de la présente évaluation. Une incertitude clé est liée au manque de données empiriques sur les concentrations environnementales au Canada, auquel on a remédié en prédisant des concentrations réalistes pour la pire éventualité dans l'eau à l'aide d'un modèle d'exposition industrielle. Il y a aussi une incertitude associée à la CESE utilisée dans le calcul du quotient de risque puisque les détails de l'étude n'étaient pas disponibles. Cependant, la VCT qui a été utilisée est jugée prudente comme il s'agit de la valeur empirique la plus faible observée et qu'elle est au moins un ordre de grandeur inférieur à la deuxième plus faible VCT. De plus, un facteur d'évaluation de 100 a été appliqué à la VCT afin d'obtenir la CESE.
De plus, en ce qui concerne l'écotoxicité, le comportement de répartition prévu de cette substance montre que les données disponibles sur les effets ne permettent pas d'évaluer comme il se doit l'importance du sol et des sédiments comme milieux d'exposition. Toutefois, les expositions à proximité de sources ponctuelles industrielles devraient être les plus élevées dans le milieu aquatique.
Des incertitudes existent également au sujet de la conclusion relative à la persistance. Très peu de données empiriques étaient disponibles et certains résultats des modèles étaient contradictoires. Ces données ont néanmoins servi à estimer la demi-vie pour l'eau, le sol et les sédiments. Cependant, selon les données disponibles, y compris les données empiriques et modélisées, cette substance ne répond pas aux critères de la persistance pour l'eau, le sol ou les sédiments.
Évaluation de l'exposition
Milieux naturels et nourriture
Aucune concentration mesurée de butanone-oxime dans les milieux naturels n'a été recensée au Canada ou ailleurs. En raison de sa pression de vapeur élevée et de sa demivie dans l'air, le butanone-oxime devrait être surtout présent sous forme de vapeur et persister dans l'air ambiant. Toutefois, étant donné qu'aucun rejet industriel important de butanone-oxime n'a été signalé en 2006, la concentration de cette substance dans l'air ambiant devrait être faible. Les estimations modélisées fondées sur les renseignements actuels prédisent également que la concentration de butanoneoxime dans l'air est faible, soit environ 1,79 ng/m3 (ChemCAN, 2003). De même, les concentrations prévues pour l'eau et le sol sont très faibles (0,550 ng/L et 7,08 × 10-4 ng/g, respectivement).
Aucune concentration mesurée de butanone-oxime dans la nourriture n'a été recensée au Canada ou ailleurs. D'après les utilisations du butanone-oxime au Canada, il est très peu probable que la nourriture représente une source d'exposition. Étant donné que les valeurs expérimentales et modélisées du log Koe pour le butanone-oxime sont faibles, cette substance ne devrait pas se bioaccumuler dans le biote et son accumulation dans la chaîne alimentaire est très improbable.
En raison du manque de données empiriques sur les concentrations dans les milieux naturels et la nourriture, les estimations des limites supérieures de l'absorption quotidienne pour la population générale n'ont pas été calculées.
Produits de consommation
En ce qui concerne les produits de consommation, le butanone-oxime est largement utilisé dans les peintures alkydes, les teintures, les vernis et les revêtements selon les renseignements présentés en application de l'article 71 de la LCPE(1999). Le butanoneoxime est également présent dans quelques scellants, adhésifs et bouche-pores qui sont principalement utilisés par l'industrie, mais qui peuvent également être accessibles à la population générale pour l'entretien de la maison et les applications destinées aux bricoleurs. En consequence, l’utilisation des peintures alkyd contenant du butanone-oxime a été le principal scenario utilisé pour charactériser l’exposition aux produits. Un nombre limité d’études a relevé les concentrations de butanone-oxime pendant la fabrication et l’utilisation des produits tels que les peintures alkyd.
Selon une étude américaine récente de l'exposition des consommateurs au butanoneoxime (Chang, 1998), la concentration maximale de butanone-oxime présente dans l'air intérieur est de 18 mg/m3 et elle est fondée sur l'utilisation de peinture alkyde contenant 0,293 % p/p de butanone-oxime, la plus grande quantité de cette substance présente dans les produits mis à l'essai. Dans un nombre réduit d’études non-publiées la concentration de butanone-oxime a été mesuré jusqu’à 9.9 ppm (30 mg/m3) lors d’une simulation utilisant un scenario de peiture interne d’alkyd contenant environ 0,2% butanone-oxime (étude non-publiée présentée à Environnement Canada, 2009b; source non citée dans les références)
En effet, le contenu en butanone-oxime des peintures alkydes utilisées au Canada peut être supérieur, soit jusqu'à 1 % (communication personnelle du groupe de travail de l’Association canadienne de l’industrie de la peinture et du revêtement adressée à Environnement Canada, 2009; source non citée dans les références) le risque d’exposition à ce niveau-ci a été modellisé.
Les estimations de l'exposition ont donc été obtenues à l'aide de la version 4.1 du logiciel ConsExpo (ConsExpo, 2007). Les concentrations estimées en air obtenues et l’exposition cutanée (externe) sont résumées dans le tableau 7. Les intrants et les hypothèses utilisés pour la modélisation à l'aide de la version 4.1 de ConsExpo pour chaque scénario touchant un produit de consommation sont présentées de façon détaillée à l'annexe 1, où les estimations de l'exposition à l'extérieur et à l'intérieur pendant l'utilisation de ces produits sont présentées Aucune donnée sur l'absorption n'a été relevée pour le butanone-oxime à la suite de l'exposition par inhalation. Cependant, les absorptions cutanées ont été enrégistrées et varient entre 13 et 29 % dans une étude réalisée avec des rats, ont été déclarés (Burka et al, 1998). Les estimations de l’exposition interne ont été obtenues en utilisant une absorption de 100 % pour inhalation et une absorption de 29 % pour l'exposition cutanée.
Tableau 7. Sommaire des concentrations estimées en air et des doses cutanées appliquées (externe) de butanone-oxime lors d’utilisation de produits de consommation.
| Produit de consommation | Concentration maximale de butanone-oxime (%) | Estimations de l'exposition | ||
|---|---|---|---|---|
| Concentration moyenne par événement pour l'inhalation (mg/m3) | Dose cutanée aiguë (interne) (mg/kg p.c.) | Dose externe totale intégrée (mg/kg p.c.) | ||
| Abréviation : kg p.c. = kilogramme de poids corporel. | ||||
| Revêtement alkyde | 1 | 223 | 0,0102 | 2,16 |
| Peinture alkyde (à haut extrait sec) | 1 | 113 | 0,147 | 2,87 |
| Peinture alkyde (peinture à forte teneur en solvants) | 1 | 72,7 | 0,147 | 2,03 |
| Peinture alkyde (aérosol) | 1 | 3,75 | 0,0614 | 0,235 |
| Produit d'étanchéité à base de silicone (joint) | 5 | 150 | 0,307 | 2,13 |
| Adhésif (joint d'étanchéité) | 2 | 3,39 | 0,00654 | 0,152 |
Les estimations de l'exposition calculées à l'aide de la version 3.2 du Wall Paint Exposure Assessment Model (modèle d'évaluation de l'exposition à la peinture pour les murs) de l'Agence de protection de l’environnement des États-Unis (US EPA, 2001) prévoient une concentration intérieure maximale de 227 mg/m3 pour les peintures alkydes et une exposition moyenne pendant 8 heures de 195 mg/m3.
Selon l'information disponible, la voie d'exposition la plus probable au butanone-oxime pour la population générale est, si l'on se fie à la concentration moyenne maximale par événement, l'inhalation pendant l'utilisation de peintures et de revêtements alkydes. Toutefois, à la lumière du peu de données disponibles sur les concentrations de la substance dans les milieux naturels, la confiance dans cette estimation est très faible.
Évaluation des effets sur la santé
L'annexe 2 comporte un résumé des renseignements disponibles relatifs aux effets du butanone-oxime sur la santé.
La Commission européenne a classé le butanone-oxime dans la catégorie 3 pour la cancérogénicité (substances préoccupantes pour l'homme en raison d'effets cancérogènes possibles) (Commission européenne, 2000; id., 2001). Dans le cadre d'une étude longitudinale chronique menée chez les rats et les souris exposés par inhalation au butanone-oxime, on a observé une augmentation du nombre de tumeurs hépatiques (adénomes et carcinomes) chez les deux espèces à toutes les concentrations d'exposition mises à l'essai. Cependant, des augmentations importantes du nombre sur le plan statistique ont été observées uniquement à 267 et 1 333 mg/m3 pour les adénomes hépatiques chez les rats mâles et à 1 333 mg/m3 pour les carcinomes hépatiques chez les rats mâles et les souris. Une augmentation importante du nombre sur le plan statistique des fibroadénomes mammaires a également été observée chez les rats femelles à 1 333 mg/m3. Les effets non néoplasiques observés chez les rats incluent les effets histopathologiques dans la rate (congestion, pigmentation accrue dans les cellules réticuloendothéliales et l'hématopoïèse extramédullaire) et dans les cornets nasaux (dégénérescence de l'épithélium olfactif) à toutes les concentrations d'exposition, dans le foie (nombre accru de foyers basophiles et de vacuoles hépatiques) à 267 et à 1 333 mg/m3, des changements dans les paramètres sanguins à 1 333 mg/m3 et des testicules élargis à 267 et à 1 333 mg/m3. Les effets non néoplasiques observés chez les souris incluent les augmentations liées à la dose de l'hypertrophie et de la nécrose du foie, de même que la dégénérescence de l'épithélium olfactif dans les cornets nasaux à toutes les concentrations d'exposition, les changements dans les paramètres sanguins à 267 et 1 333 mg/m3 et les changements dans les paramètres de la chimie sérique à 1 333 mg/m3. La concentration minimale avec effet nocif observé (CMENO) pour les effets non néoplasiques était de 53 mg/m3 (15 ppm) d'après les effets dans la rate et les cornets nasaux chez les rats et d'après les effets dans le foie et les cornets nasaux chez les souris (Newton et al., 2001). Aucune étude par voie orale ou cutanée à long terme à l'aide de butanone-oxime n'a été recensée.
Le butanone-oxime n'était pas mutagène dans la majorité des essais de mutation bactériologiques à l'aide de Salmonella typhimurium, mais il s'est avéré mutagène dans un essai de mutation cellulaire dans un lymphome chez une souris avant et sans activation (Allied Corporation, 1983b; Rogers-Back et al., 1988; JETOC, 1999; NTP, 1999). Des essais in vitro pour déceler une aberration chromosomique dans les cellules ovariennes et pulmonaires chez les hamsters chinois, l'échange de chromatides sœurs dans les cellules ovariennes chez les hamsters chinois et la synthèse imprévue d'acide désoxyribonucléique (ADN) dans les hépatocytes chez les rats ont tous démontré des réponses négatives (Allied Corporation, 1983a; IHF Inc., 1995; JETOC, 1999; NTP, 1999). Les essais in vivo relatifs aux micronoyaux étaient négatifs pour les cellules de moelle osseuse chez les rats et du sang périphérique chez les souris; les rats et les souris ont été exposés oralement (Microbiological Associates Inc., 1990; NTP, 1999). Dans un essai in vivo chez les rats exposés par inhalation, le butanone-oxime était négatif pour les adduits à l'ADN, mais positif pour les adduits à l'acide ribonucléique (ARN) dans les cellules hépatiques chez les rats (Honeywell International Inc., 2000).
Aucune analyse de mode d'action pleinement élucidé pour l'induction des tumeurs observées n'a été relevé. La Commission européenne (2000) a estimé qu'un mécanisme pouvant peut-être intervenir dans l’augmentation du nombre de tumeurs hépatiques chez les rats et les souris mâles était le métabolisme transformant le butanone-oxime en un agent cancérogène, médié par la sulfotransférase. Le sexe et la spécificité de l'organe pour la formation d'une tumeur sont corrélés à l'activité généralement supérieure de cette enzyme chez les rongeurs mâles. Völkel et al., (1999) ont démontré que l'incubation des microsomes du foie chez les souris, les rats et les humains avec du butanone-oxime a donné lieu à la formation de nitronates, mais que le taux de formation n'est pas corrélé au sexe et aux différences entre les espèces pour la réponse d'une tumeur hépatique; ils ont conclu que [Traduction] « d'autres mécanismes tumorigènes non liés à la mutagénicité du nitronate et aux dommages à l'ADN peuvent être opérationnels. » La Commission européenne (2000) n'a pas indiqué si le mode d'action dans les tumeurs hépatiques chez les rats était dû à des mécanismes associés au seuil d'exposition. Cependant, les résultats de la génotoxicité in vitro et in vivo pour le butanone-oxime ont été principalement négatifs, incluant une étude in vivo qui a utilisé l'exposition par inhalation et qui s'est avérée négative pour les adduits à l'ADN dans les cellules hépatiques des rats. Par conséquent, selon les données disponibles, le butanone-oxime semble ne pas avoir un potentiel mutagène. Cette absence de potentiel mutagène peut également expliquer pourquoi la Commission européenne (2000) n'a pas précisé si le mode d'action dans les tumeurs mammaires chez les rats était dû à des mécanismes associés au seuil d'exposition.
Lors d'une étude d'exposition par inhalation au butanone-oxime menée chez les souris pendant 1, 2 ou 4 semaines, la dégénérescence de l'épithélium olfactif dans la cavité nasale a été observée chez les mâles à des concentrations de 107 et 356 mg/m3 (nombre et gravité augmentant en fonction de la concentration d'exposition) (Newton et al., 2002). Au cours d'une étude d'exposition par inhalation d'une durée de 13 semaines, la dégénérescence de l'épithélium olfactif dans la cavité nasale a été observée chez les souris mâles à des concentrations de 36 à 356 mg/m3 (le nombre et la gravité augmentant en fonction de la concentration d'exposition), alors que l'augmentation du poids relatif du foie chez les rats mâles a été observée à 267 et 1 333 mg/m3 (Newton et al., 2001; id., 2002). La CMENO pour une exposition subchronique était de 36 mg/m3 en raison de la dégénérescence de l'épithélium olfactif dans la cavité nasale des souris.
Lors d'une étude de 4 semaines chez les rats par administration orale, des changements dans les paramètres hématologiques (augmentation des réticulocytes, des plaquettes et des globules rouges) et une augmentation du poids relatif de la rate accompagnée d'anomalies histopathologiques (augmentation de la congestion, de l'hématopoïèse extramédullaire et de la présence de granules d'hémosidérine) ont été observés chez les deux sexes à des concentrations de 20 et 100 mg/kg de poids corporel par jour (p.c./j), alors que la présence de granules d'hémosidérine dans le foie a été observée chez les femelles aux mêmes doses (Japan MHW, 1996; JETOC, 1999). Durant une étude de 13 semaines sur l'exposition des rats au butanone-oxime, cette substance a été ajoutée à leur eau. Le poids relatif du foie des mâles a augmenté à des doses de 25 à 280 mg/kg p.c./j (NTP, 1999). Lors d'une autre étude de 13 semaines chez les rats, pendant laquelle du butanone-oxime a été administré par gavage, des changements du poids du foie et de la rate, l'hémosidérose de la rate et des effets hématologiques ont été observés chez les deux sexes à des doses de 25 à 225 mg/kg p.c./j (Allied Signal Inc., 1977). La dose minimale avec effet nocif observé (DMENO) pour l'exposition à court terme et subchronique par voie orale était de 20 mg/kg p.c./j d'après les changements des paramètres hématologiques, l'augmentation du poids relatif de la rate accompagnée d'anomalies histopathologiques et la présence de granules d'hémosidérine dans le foie qui ont été observés lors d'une étude de 4 semaines chez les rats.
Dans une étude de l'exposition orale chez 1 génération de rats, la DMENO concernant la toxicité pour la reproduction était de 100 mg/kg p.c./j, la dose maximale, d'après la diminution importante sur le plan statistique de l'indice de mise bas par les femelles (%)[1] (Japan MHW, 1998), alors qu'aucun effet lié au traitement sur les paramètres de la reproduction n'a été observé dans une étude sur 2 générations au cours de laquelle les rats ont reçu une dose orale de 0 à 200 mg/kg p.c./j (Tyl et al., 1996). Dans les études sur 1 génération et sur 2 générations de rats, une DMENO parentale de 10 mg/kg p.c./j, la dose la plus faible mise à l'essai, a été établie d'après les effets histopathologiques dans la rate et le foie (et dans les reins lors de l'étude sur 1 génération).
Aucune tétragénocité n'a été observée chez les rates et les lapines enceintes ayant reçu des doses orales de butanone-oxime pendant la gestation (Springborn Laboratories, 1990a; id., 1990b; Mercieca et al., 1991; Derelanko et al., 2003). La DMENO par voie orale pour la toxicité fœtale était de 40 mg/kg p.c./j, la dose maximale, d'après les avortements de 3 femelles adultes sur 10 de lapines enceintes ayant reçu des doses par gavage pendant la gestation (Springborn Laboratories, 1990b; Derelanko et al., 2003). La DMENO par voie orale pour la toxicité maternelle était de 10 mg/kg p.c./j, d'après les symptômes d'anémie (réticulocytes accrus et méthémoglobine) chez les lapines ayant reçu des doses par voie orale à des concentrations de 0 à 80 mg/kg p.c./j lors d'une étude de détermination des doses ayant des effets sur le développement (Springborn Laboratories, 1990b; Derelanko et al., 2003).
Les études mises au point pour déterminer les valeurs de la dose ou de la concentration létale médiane (DL50 ou CL50) ont également permis de déterminer les doses les plus faibles entraînant un effet d'après l'exposition ponctuelle. La CMENO pour l'exposition par inhalation était de 190 mg/m3, d'après la diminution du gain en poids corporel dans la période d'observation de 7 ou 14 jours, après une exposition par inhalation de 4 heures chez les rats (Allied Corporation, 1984b). La DMENO pour l'exposition cutanée était de 180 mg/mg p.c. d'après la production de méthémoglobine et l'érythrophagocytose de la rate dans une étude de 24 heures de l'exposition cutanée des lapins (Allied Corporation, 1984a; US EPA, 1986).
Les études toxicocinétiques du butanone-oxime chez les souris et les rats ont démontré que cette substance est rapidement absorbée du tractus gastrointestinal, qu'elle subit une absorption généralisée, qu'elle est distribuée partout dans le corps, qu'elle est métabolisée en profondeur et qu'elle ne s'accumule pas dans les tissus. L'excrétion du butanone-oxime et de ses métabolites s'effectue dans l'urine et dans la bile, ou en tant que composé volatil dans l'air expiré (ICCA MEKO, 2003). Lors des études à dose unique chez les rats, des quantités significativement plus grandes de composés volatils ont été sécrétées à la suite d'une administration par voie cutanée qu'après le gavage ou l'administration par intraveineuse (NTP, 1999). Toutefois, aucune donnée toxicocinétique d'après les expositions répétées par voie orale ou cutanée ou par inhalation n'a été extraite. Les études toxicocinétiques du butanone-oxime ont démontré l'existence de deux voies métaboliques et la possibilité d'une troisième (selon des doses aiguës administrées par intraveineuse, par voie cutanée et par voie orale seulement). La principale voie est l'hydrolyse du butanone-oxime en 2-butanone (éthyl méthyl cétone) et la deuxième, l'oxydation du butanone-oxime en butane 2nitronate par les monooxygénases microsomales, mais cela survient à de très faibles taux (ICCA MEKO, 2003). ICCA MEKO (2003) a déclaré : [Traduction] « À l'égard des trois voies [métaboliques], il n'y avait aucune différence quantitative dans l'étendue du métabolisme du MECO [butanone-oxime] entre les rats mâles et femelles. »
La confiance dans la base de données sur la toxicité du butanone-oxime est faible à modérée, puisqu'il existe de l'information pertinente pour corriger les effets qui peuvent être préoccupants et déterminer les paramètres critiques d'après les expositions, ponctuelle à long terme, à doses par inhalation. Cependant, il y avait un manque d'études sur la toxicité pour la reproduction et le développement en fonction de l'exposition par inhalation, un manque d'études sur la toxicité chronique et la cancérogénicité d'après l'exposition par voie orale, peu de données sur la génotoxicité in vivo et un manque d'études sur l'exposition cutanée pour plusieurs paramètres, à l'exception des expositions aiguës. Cependant, il y avait un manque d'études sur la toxicité reproductive et développementale basée sur l'exposition d'inhalation; et peu d’études sur la toxicité par voie cutanée.
Caractérisation des risques pour la santé humaine
La cancérogénicité a été incluse dans l'évaluation des effets sur la santé du butanone-oxime, puisque cette substance a été classée comme étant cancérogène par la Commission européenne (2002; id., 2001). Comme il est indiqué à la section « Évaluation des effets sur la santé », un nombre accru de tumeurs hépatiques a été observé lors d'études longitudinales chez le rat et la souris, ainsi qu'un nombre accru de tumeurs des glandes mammaires chez les rats femelles. Toutefois, celles-ci n'ont été observées qu'à une exposition à des concentrations moyennes ou élevées de butanone-oxime. La prise en considération de l'information disponible à l'égard de la génotoxicité indique que le butanone-oxime n'est pas susceptible d'être génotoxique. Par conséquent, bien que le mode d'induction des tumeurs ne soit pas été complètement élucidé, il n'est pas envisagé que les tumeurs observées résultent d'une interaction directe avec le matériel génétique. Donc, une approche fondée sur le seuil d'innocuité a été utilisée pour évaluer les risques pour la santé humaine.
En ce qui concerne les effets autres que le cancer observés pendant une étude longitudinale chez le rat et la souris, la CMENO pour les expositions chroniques était de 53 mg/m3, d'après la dégénérescence de l'épithélium olfactif dans les cavités nasales des souris et des rats, l'hypertrophie et la nécrose des cellules hépatiques des souris et les effets histopathologiques dans la rate des rats. Pour les expositions subchroniques observées lors d'une étude de 13 semaines de l'exposition par inhalation, la CMENO pour une exposition par inhalation était de 36 mg/m3, d'après la dégénérescence de l'épithélium olfactif dans la cavité nasale des souris. De même, pour les expositions à court terme, la CMENO pour une exposition par inhalation était des 107 mg/m3, d'après la dégénérescence de l'épithélium olfactif de la cavité nasale des souris soumises à un régime d'exposition au butanone-oxime de 6 heures par jour, 5 jours par semaine pour 1, 2 ou 4 semaines. L'occurrence de séquelles toxicologiques après 5 expositions (total de 30 heures d'exposition) est pertinente pour l'évaluation des risques de l'exposition aiguë. Pour les expositions aiguës, une CMENO de 190 mg/m3 pour une exposition par inhalation a été calculée d'après la diminution du gain en poids chez les rats pendant une étude de 4 heures de l'exposition par inhalation. Les changements de gain en poids n'ont pas été notés pour les concentrations associées à un effet critique dans les études d'exposition par inhalation à court terme. Toutefois, une analyse du changement de la courbe dose-réponse au fil du temps (190 mg/m3 au moment de l'exposition, 107 mg/m3 après 5 jours et 36 mg/m3après une exposition subchronique) suggère que les manques à l'égard du gain en poids surviennent dans la gamme de doses appropriée après une exposition aiguë.
La DMENO la plus faible par voie orale pour l'exposition à court terme et subchronique était de 10 mg de butanone-oxime/kg p.c./j, d'après les effets histopathologiques observés sur la rate et le foie de rats adultes pendant l'étude des effets sur la reproduction sur 1 génération et sur 2 générations de rats (et sur les reins dans l'étude sur 1 génération) (Tyl et al., 1996; Japan MHW, 1998) et d'après les symptômes d'anémie observés chez les lapins femelles adultes lors d'une étude de détermination des doses ayant des effets sur le développement (Springborn Laboratories, 1990b; Derelanko et al., 2003). Pour les expositions aiguës, une dose minimale avec effet nocif observé par voie orale de 300 mg/kg p.c. a été calculée d'après les effets neurotoxiques transitoires chez les rats (Schulze et Derelanko, 1993) et une dose minimale avec effet nocif observé pour l'exposition cutanée de 180 mg/kg p.c. a été calculée d'après la production de méthémoglobine et l'érythrophagocytose de la rate dans une étude de 24 heures de l'exposition cutanée des lapins (Allied Corporation, 1984b; US EPA, 1986).
Comme il est indiqué à la section « Évaluation de l'exposition », le manque de données empiriques sur les concentrations dans plusieurs milieux n'a pas permis de calculer l'absorption quotidienne pour la population générale. Donc, les marges d'exposition n'ont pas pu être calculées aux fins de comparaison entre les concentrations associées à un effet critique d'après les expositions quotidiennes répétées au butanone-oxime et les limites supérieures estimatives de l'absorption quotidienne.
L'exposition au butanone-oxime se produit généralement durant l'utilisation de produits de consommation. D'après la modélisation de l'utilisation de ces produits à l'aide de ConsExpo, la plus grande concentration en air découlant de l’inhalation pendant l'utilisation de peintures et revêtements alkydes, allant de 73 à 223 mg/m3. à l'aide du modèle d'évaluation de l'exposition à la peinture pour les murs (WPEM), une concentration moyenne en air de 195 mg/m3d’une durée de 8 heures a été obtenue pour les peintures alkydes. La comparaison de ces concentration prudentes en air avec les concentrations associées à un effet critique pour l'exposition aigüe (ou à court terme) par inhalation (107 à 190 mg/m3) a permis de calculer les marges d'exposition de 0,5 à 2,6.
Un nombre limité d’études a mésuré des concentrations en air allant de 6.0 to 18 mg/m3 sous divers scénario simulés de peinture utilisant des produits à faible concentration de butanone-oxime (0.2 – 0,6%). Les valeurs obtenues de ces scénario d’exposition vont de 6 à 30.
Les expositions cutanées aiguës estimées pendant l'utilisation de peintures et revêtements alkydes ont donné lieu à des valeurs de 0,0226 à 1,06 mg/kg p.c. Ces estimations ont été comparées à un effet critique de 180 mg/kg p.c. ce qui a abouti à des marges d'exposition allant de 170 à 8000.
Compte tenu des incertitudes liées aux bases de données sur l'exposition et les effets, on considère que les marges d'exposition obtenues pour ces scénarios concernant les produits de consommation (toutes les marges d'exposition sont fondées sur l'exposition par inhalation; les marges d'exposition inférieures, sur l'exposition cutanée) pourraient ne pas être suffisamment protectrices de la santé humaine pour les effets autres que le cancer.
Incertitudes de l'évaluation des risques pour la santé humaine
La présente évaluation préalable ne présente pas d'analyse complète du mode d'induction des effets, y compris cancéreux, du butanone-oxime. De plus, il n'y a que très peu d'information disponible sur la toxicité potentielle du butanone-oxime à la suite d'une exposition par voie orale et cutanée, de même que sur les études portant sur la toxicité pour la reproduction et le développement et sur la génotoxicité fondées sur les expositions par inhalation. Donc, les concentrations associées à un effet critique calculées dans cette évaluation préalable sont limitées par la base de données sur la toxicité et par les incertitudes liées à l'interprétation de l'importance biologique des effets, incluant les incertitudes relatives à l'interprétation de la variation intraspécifique et interspécifique.
L'incertitude liée à l'exposition au butanone-oxime provenant du milieu naturel et de la nourriture au Canada est grande en raison de l’absence de données empiriques pour estimer l'exposition. Alors en absence de données empiriques, la nourriture ne saurait être considérée comme une source d’exposition au butanone-oxime. Alors qu'il est attendu que la source d'exposition la plus probable au butanone-oxime pour la population générale soit des préparations de peinture alkyde, l'incertitude est associée à l'utilisation d'hypothèses par défaut. Toutefois, les concentrations de butanone-oxime présentes dans les produits retenus pour les scénarios de modélisation de l'exposition aux produits de consommation sont basées sur des renseignements spécifiques au Canada.
D'après les renseignements contenus dans la présente évaluation préalable, il est conclu que le butanone-oxime ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
Compte tenu du manque de fiabilité possible des marges entre les expositions estimatives au butanone-oxime et les concentrations associées à un effet critique, il est conclu que le butanone-oxime est considéré comme une substance pouvant pénétrer dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est conclu que le butanone-oxime répond à au moins un des critères prévus à l’article 64 de la LCPE(1999). De plus, le butanone-oxime remplit les critères de la persistance, mais il ne remplit pas ceux de la bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Cette substance sera considérée pour inclusion dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles déterminées à l’étape de la gestion des risques.
[ACFPC] Association canadienne des fabricants de produits chimiques. 2009. Réduction des émissions 16 : inventaire des émissions en 2007 et prévisions quinquennales. Accès : http://www.ccpa.ca/files/Library/Documents/Environment/Reducing_Emissions_16_FINAL_-_FR.pdf
[AIEPS] Artificial Intelligence Expert Predictive System. 2003-2007. Version 2.05. Ottawa (Ont.) : Environnement Canada, Division des substances existantes, Division des substances nouvelles. Modèle élaboré par Stephen Niculescu. Disponible chez l'auteur.
Allied Corporation. 1983a. Evaluation of methyl ethyl ketoxime (MEKO) in the sister chromatid exchange (SCE) test: in vitro results in Chinese hamster ovary (CHO) cells. No de rapport : MA22482-6 [cité dans ICCA MEKO, 2003].
Allied Corporation. 1983b. Evaluation of methyl ethyl ketoxime for enzyme mediated mutagenicity in Salmonella typhimurium. No de rapport : MA-224-82-3 [cité dans ICCA MEKO, 2003].
Allied Corporation. 1984a. Acute dermal toxicity study of methylethylketoxime (MEKO). No de rapport : MA-224-82-9. [cité dans ICCA MEKO, 2003].
Allied Corporation. 1984b. Acute inhalation toxicity study of MEKO. No de rapport : MA-224-82-7 [cité dans ICCA MEKO, 2003].
Allied Signal Inc. 1977. Final report: 13-week toxicity study in rats. Hazleton Laboratories America, Inc. Project No. 165-161. [cité dans ICCA MEKO, 2003].
Allied Signal Inc. 1995. A 4-week peroxisome proliferation study of MEKO in the rat via oral gavage administration. Pharmaco-LSR Study No. 94-2368 [cité dans ICCA MEKO, 2003].
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2008. Version 1.92a. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Aronson D, Boethling B, Howard P, Stiteler W. 2006. Estimating biodegradation half-lives for use in chemical screening. Chemosphere 63: 1953-1960.
[BCFBAF] BioConcentration Factor Program for Windows [modèle d'estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BESC] Bureau européen des substances chimiques. 2000a. IUCLID dataset: Butanone oxime, CASNo. 96-29-7 [en ligne]. Year 2000 CD-ROM edition. [conçu le 19 février 2000; consulté le 14 janvier 2009]. Accès : http://ecb.jrc.ec.europa.eu/iuclid-datasheet/96297.pdf
[BESC] Bureau européen des substances chimiques. 2000b. IUCLID dataset: Butanote, CAS No. 78-93-3 [en ligne]. Year 2000 CD-ROM edition. [conçu le 19 février 2000; consulté le 14 janvier 2009]. Accès : http://ecb.jrc.ec.europa.eu/iuclid-datasheet/78933.pdf
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ. Sci. Technol.34(4):699-703.
Bio/Dynamics Inc. 1990. A four week inhalation study of MEKO in the rat and mouse. USA project 90-8249. Étude fournie par les producteurs et les importateurs américains de MEKO dans le cadre du règlement concernant les essais définitifs de l'EPA en vertu de la TSCA (Loi américaine réglementant les substances toxiques). [citée dans ICCA MEKO, 2003].
Biosearch Inc. 1982. Summary of results of acute toxicity study on 2-butanone oxime; study report 81-2870A, conducted for Mooney Chemicals, Inc.; TSCA OTS0513319, no de document : 86870000134 [cité dans ICCA MEKO, 2003].
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2008. Version 4.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté le 1er mai 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Brooke, L.T., Call, D.J., Geiger, D.L., Northcott, C.E. (éd.) 1984. Acute toxicities of organic chemicals to fathead minnows (Pimephales promelas). Volume 1. Superior (WI): University of Wisconsin-Superior, Center for Lake Superior Environmental Studies. p. 105-106.
Burka, L.T., Black, S.R., Mathews, J.M. 1998. Disposition of methyl ethyl ketoxime in the rat after oral, intravenous and dermal administration. Xenobiotica. 28(10):1005-1015.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33. Accès : http://www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l’environnement : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf.
Canada. Ministère de l’Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie 1, vol. 140, no 49, p. 4109-4117. Accès : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2008. Loi canadienne sur la protection de l'environnement, 1999 : Avis concernant les substances du groupe du Défis. Gazette du Canada, Partie I, vol. 142, no 35,. Accès : http://www.gazette.gc.ca/rp-pr/p1/2008/2008-08-30/pdf/g1-14235.pdf
CATABOL [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [consulté le 3 mars 2009]. Accès : http://oasis-lmc.org/?section=software&swid=1
Chang, J.C.S. 1998. Exposure and emission evaluations of methyl ethyl ketoxime (MEKO) in alkyd paints. Indoor air.8(4):295-300.
ChemCAN [Level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. [consulté le 11 mai 2009]. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/CC600.html
[CHRIP] Chemical Risk Information Platform. Total Search System for Chemical Substances [base de données en ligne]. c2002. Butanone oxime, CAS RN 96-29-7. Tokyo (Japon) : National Institute of Technology and Evaluation. [mise à jour le 27 avril 2009; consultée le 1er mai 2009]. Accès : http://www.safe.nite.go.jp/english/db.html
[ConsExpo] Consumer Exposure Model [en ligne]. 2007. Version 4.1. Bilthoven (Pays-Bas): Rijksinstituut voor Volksgezondheid en Milieu (National Institute for Public Health and the Environment). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
Commission européenne. 2000. Summary Record: Meeting of the Commission Working Group on the Classification and Labelling of Dangerous Substances. ECB Ispra, 19–21 January 2000. Commission européenne, Direction générale du Centre commun de recherche, Institut pour la santé et la protection des consommateurs, Bureau Européen des Substances Chimiques, ECBI/19/00 – Rev. 1, Accès : http://ecb.jrc.it/documents/Classification-Labelling/ADOPTED_SUMMARY_RECORDS/1900r1_cmr0100.pdf
Commission européenne. 2001. 2-butanone-oxime. Directive de la Commission 2001/59/CE du 6 août 2001. Annexe 1B. Journal officiel des Communautés européennes. 21.08.2001. L 225/36. Commission européenne. 28e APT [adaptation au progrès technique]. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2001:225:0001:0333:FR:PDF
Commission européenne. 2004. Directive 2004/93/CE de la Commission du 21 septembre 2004 portant modification de la directive 76/768/CEE du Conseil en vue de l'adaptation au progrès technique de ses annexes II et III (Texte présentant de l'intérêt pour l'EEE). Journal officiel de l’Union européenne. 25/09/2004. L 300/13–4. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2004:300:0013:0041:FR:PDF
[CPOPs] Canadian POPs Model. 2008. Gatineau (Qc) : Environnement Canada, Division des substances existantes; Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [modèle élaboré à partir de celui de Mekenyan et al., 2005]. Disponible sur demande.
Curtis, C., Lima, A., Lozano, S.J., Veith, G.D. 1982. Evaluation of a bacterial luminescent bioassay as a method for predicting acute toxicity of organic chemicals to fish. In : Pearson, J.G., Foster, R.B., Bishop, W.E. (éd.) Aquatic toxicology and hazard assessment: fith conference. Philadelphie (PA) : American Society for Testing and Materials. ASTM Special Technical Publication 766. p. 170-178. [cité dans Kaiser et Ribo, 1988].
Derelanko, M.J., Rinehart, W.E., Rodwell, D.E. 2003. Developmental toxicity studies of methyl ethyl ketoxime (MEKO) in rats and rabbits. Drug Chem Toxicol 26(3):147-168.
Dow Corning Corporation. 1983. A 28-day vapor inhalation toxicity study of methyl ethyl ketoxime (MEKO) with the rat. No de référence : TX-82-4160-01 [cité dans ICCA MEKO, 2003].
[ECOSAR] Ecological Structure Activity Relationships [en ligne]. 2008. Version 1.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Environnement Canada. 2007. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series: draft module on QSARs. Document de travail provisoire révisé. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environnement Canada. 2009a. Données sur les substances du lot 7 recueillies conformément à l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant les substances du groupe 7 du Défi. Données préparées par : Environnement Canada, Programme des substances existantes.
Environnement Canada. 2009b. Étude confidentielle inédite présentée à la Division des substances existantes d’Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Disponible sous la forme de sommaire de rigueur d’étude, no d’identification : 3450Challenge001.
[EQC] Equilibrium Criterion Model 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre [consulté le 1er mai 2009]. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2new.html
[ESIS] European Chemical Substances Information System [base de données en ligne]. 2006. Result for CASNo. 96-29-7. Butanone oxime. ESIS Version 4.50. Base de données élaborée par le Bureau européen des substances chimiques. Accès : http://ecb.jrc.ec.europa.eu/esis/
Friedewald, M., Filser, J., Janku, S., Derelanko, M., Dekant, W. 2001. RNA-modifications after inhalation of methyl ethyl ketoxime in rats. Toxicologist 1:93 [résumé].
Great Western Containers. 2005. Great Western Containers, Inc., Edmonton South, Operations Manual: Standard for return of empty IBC [en ligne]. Edmonton (Alb.) : Great Western Containers Inc. [publié le 2 mai 2005; consulté le 12 mai 2009]. Accès : http://www.gwcontainers.com/Portals/0/Return%20Standards.pdf
Haskell Laboratory. 1966. Rapport de laboratoire sur le méthyléthylcétoxime avec page couverture datée du 10 février 1987. Rapport d'étude 53-66 réalisé par la société Du Pont; no d'identification du document : 86870000199.
Henkel Technologies. 2007. Fiche signalétique : Ready Gasket Loctite, agent d'étanchéité en caoutchouc silicone. Mississauga (Ont.) : Henkel Canada, Inc. [consultée le 20 mai 2009]. Accès : http://henkelconsumerinfo.com/products/henkel.datasheets.Search.pdf?BUSAREA=0006&
DOCTYPE=MSDS&LANG=FR&COUNTRY=CA&MATNR=743914&VKORG=3400
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d'estimation]. 2008. Version 3.20. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : htwww.epa.gov/oppt/exposure/pubs/episuite.htm
Honeywell International Inc. 2000. Biotransformation, toxicokinetics and DNA-binding of methyl ethyl ketoxime and its metabolites. Travaux menés par W. Dekant et J.G. Filser. No de rapport : MA-RR-00-2602 [cité dans ICCA MEKO, 2003].
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
ICCA MEKO (ICCA Methyl Ethyl Ketoxime Consortium). 2003. Unpublished draft (23 July 2003) SIDS [Screening Information Data Set] initial assessment report on 2-butanoneoxime, CAS# 96-29-7. Préparé pour la Rencontre initiale d'évaluation des SIDS (SIAM 17) par le consortium de l'ICCA MEKO. Parrainé par le Conseil international des associations chimiques (ICCA) des États-Unis et du Japon.
[IHF Inc.] Industrial Health Foundation, Inc. 1995. Unscheduled DNA synthesis assay in rat primary hepatocytes. Rockville (MD) : Microbiological Associates, Inc. No de projet : G94BA66.380 [cité dans ICCA MEKO, 2003].
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2007. Gatineau (QC) : Environnement Canada. [consultée le 18 mars 2008]. Accès : http://www.ec.gc.ca/inrp-npri/
[Japan MHW] Ministry of Health and Welfare (Japon). 1996. Ministry of Health and Welfare, Japan. Toxicity Testing Reports of Environmental Chemicals 4. p. 199-221 [cité dans ICCA MEKO, 2003].
[Japan MHW] Ministry of Health and Welfare (Japon). 1998. Ministry of Health and Welfare, Japan. Toxicity Testing Reports of Environmental Chemicals 6. p. 63-75 [cité dans ICCA MEKO, 2003].
[JETOC] Japan Chemical Industry Ecology-Toxicology and Information Centre. 1999. JETOC Information Sheet 37, Special Issue No. 4.
Kaiser, K.L.E., Ribo, J.M. 1988. Photobacterium phosphoreum toxicity bioassay. II. Toxicity data compilation. Toxic. Assess. 3(2):195-237.
King, C.V., Marion, A.P. 1944. The ionization constants of very weak acids. Acetoxime, methyl ethyl and diethyl ketoximes. J. Am. Chem. Soc. 66(6):977-980.
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, C., McKone, T., van de Meent, D., Wania, F. 2006. Application of multimedia models for screening assessment of long-range transport potential and overall persistence. Environ. Sci. Technol. 40(1):53-60.
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : http: //www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOCWIN] Soil Adsorption Coefficient Program for Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 1er mai 2009]. Accès : http: //www.epa.gov/oppt/exposure/pubs/episuite.htm
Kurita, H. 1967. Experimental studies on methyl-ethyl-ketoxime toxicity. Nagoya J Med Sci 29:393-418 [cité dans US EPA, 1986].
Lide, D.R. (éd.) 2005. CRC handbook of chemistry and physics. 86e éd. Boca Raton (FL) : CRC Press/Taylor and Francis.
Mackay, D. 2006. The OECD Persistence and Long Range Transport Potential Screening Tool. Document préparé en vue de sa diffusion au cours d'un atelier de l'OCDE tenu à Ottawa, au Canada, du 31 mai au 2 juin 2006.
Mercieca, M.D., Rinehart, W.E., Hodgson, J.R., Derelanko, M.J. 1991. Developmental toxicity study of methyl ethyl ketoxime (MEKO) in two species. Teratology 43:454-455.
Microbiological Associates Inc. 1990. Acute in-vivo cytogenetics assay in rats. MBA study T9293.105009. Bethesda (MD) : Microbiological Associates Inc. Étude fournie par les producteurs et les importateurs américains de MEKO dans le cadre du règlement définitif sur les essais de l'US EPA en vertu de la TSCA [cité dans ICCA MEKO, 2003].
Ministère danois de l'environnement. 2004. List of undesirable substances 2004. Copenhague (Danemark) : Danish Ministry of the Environment, Environment Protection Agency. Environmental Review Report No. 15. p. 24.
[MITI] Ministry of International Trade & Industry (Japon), Basic Industries Bureau, Chemical Products Safety Division. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Japan Chemical Industry Ecology-Toxicology & Information Center.
[NCI] National Chemical Inventories [base de données sur cédérom]. 2006, Columbus (OH) : American Chemical Society. Accès : http://www.cas.org/products/cd/nci/index.html
Newton, P.E., Wooding, W.L., Bolte, H.F., Derelanko, M.J., Hardisty, J.F., Rinehart, W.E. 2001. A chronic inhalation toxicity/oncogenicity study of methylethylketoxime in rats and mice. Inhal Toxicol 13 (12):1093-1116.
Newton, P.E., Bolte, H.F., Derelanko, M.J., Hardisty, J.F., Rinehart, W.E. 2002. An evaluation of changes and recovery in the olfactory epithelium in mice after inhalation exposure to methylethylketoxime. Inhal Toxicol 14(12):1249-1260.
[NTP] National Toxicology Program (États-Unis). 1999. NTP technical report on the toxicity studies of methyl ethyl ketoxime (CAS No. 96-29-7) administered in drinking water to F344/N rats and B6C3F1 mice. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program, Toxicity Report Series No. 51, NIH Publication 99-3947.
[OCDE] Organisation de coopération et de développement économiques. 2003. SIDS [Screening Information Data Set] Initial Assessment Profile for 2-Butanone oxime (MEKO). (CASNo. 96-29-7). SIAM [SIDS Initial Assessment Meeting] 17, 11-14 November 2003. Accès : http://cs3-hq.oecd.org/scripts/hpv/index.asp
[OCDE] Organisation de coopération et de développement économiques. 2004. The 2004 OECD list of high production volume chemicals. Accès : http://www.oecd.org/dataoecd/55/38/33883530.pdf
[OCDE] Organisation de coopération et de développement économiques. 2008. SIDS [Screening Information Data Set] Initial Assessment Profile for Bis(hydroxylammonium)sulphate. SIAM [SIDS Initial Assessment Meeting] 27, 14-16 October 2008. Accès : http://cs3-hq.oecd.org/scripts/hpv/index.asp
Permatex Canada. 2009. Fiche signalétique : Ultra Black Gasket Maker. Milton (Ont.) : Permatex Canada, Inc. [consultée le 20 mai 2009]. Accès : http://www.permatex.com/documents/msds/04_Canada-French/82080_04.pdf
Rogers-Back, A.M., Lawlor, T.E., Cameron, T.P., Dunkel, V.C. 1988. Genotoxicity of 6 oxime compounds in the Salmonella/mammalian-microsome assay and mouse lymphoma TK +/- assay. Mutat. Res. 204(2):149-162.
[RTECS] Registry of Toxic Effects of Chemical Substances. 2006. Fichier concernant le 2butanone, oxime (29 juillet 1996). [dernière mise à jour en août 2006; consulté le 16 mars 2009]. Cincinnati (OH) : U.S. Department of Health and Human Services, National Institute for Occupational Safety and Health.
Rumpf, R.R., Gonzalez, W. 1993. No single answer controls corrosion. Power Eng. 97(1):33-35
Scheringer, M. MacLeod, M., Wegmann, F. 2006. The OECD POV and LRTP Screening Tool. Version 2.0
Schulze, G.E., Derelanko, M.J. 1993. Assessing the neurotoxic potential of methyl ethyl ketoxime in rats.Fundam Appl Toxicol 21:476-485 [cité dans ICCA MEKO, 2003).
Secrétariat d'état britannique. 2008. The Cosmetic Products (Safety) Regulations 2008. Statutory Instruments, 2008 No. 1284, Consumer Protection. 144 p. Accès : http://www.opsi.gov.uk/si/si2008/uksi_20081284_en_1
Springborn Laboratories. 1990a. Teratology studies in rats with MEKO. Study SLS 3224.6. Test performed by Springborn Laboratories, Inc. (SLS) Spencerville, USA [cited dans ICCA MEKO, 2003].
Springborn Laboratories. 1990b. Teratology studies in rabbits with MEKO. Study SLS 3224.5. Springborn Laboratories, Inc. [cité dans ICCA MEKO, 2003].
Subramani, S., Cheong, I.W., Kim, J.H. 2004. Synthesis and characterizations of silylated polyurethane from methyl ethyl ketoxime-blocked polyurethane dispersion. Eur Polymer J40(12):2745-2755.
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. [consulté le 3 mars 2009]. Accès : http://www.accelrys.com/products/topkat/index.html
Tyl, R.W., Gerhart, J.M., Marr, M.C., Brine, D.R., Gilliam, A.F., Seely, J.C., Derelanko, M.J., Rinehart, W.E. 1996. Reproductive toxicity evaluation of methylethyl ketoxime by gavage in CD rats. Fundam Appl Toxicol 31:149-161.
[US EPA] U.S. Environmental Protection Agency. 1986. Nineteenth report of the Interagency Testing Committee to the Administrator; receipt and request for comments regarding priority list of chemicals. Federal Register. Vol. 51, no 220, p. 41417-41432. Accès : http://tsca-itc.syrres.com/itcrep/docs/19.pdf
[US EPA] U.S. Environmental Protection Agency. 2006. High production volume (HPV) challenge program: the 1990 HPV voluntary challenge chemical list. Revised January 20, 2006. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics. Accès : http://www.epa.gov/chemrtk/pubs/update/hpv_1990.pdf
Verschueren, K. 1977. Handbook of environmental data on organic chemicals. New York (NY) : Van Nostrand Reinhold Company.
Völkel, W., Wolf, N., Derelanko, M., Dekant, W. 1999. Slow oxidation of acetoxime and methylethyl ketoxime to the corresponding nitronates and hydroxy nitronates by liver microsomes from rats, mice and humans. Toxicol. Sci. 47:144-150.
[WPEM] Wall Paint Exposure Assessment Model. 2001. Version 3.2 (élaboré par GEOMET Technologies Inc., une division de Versar, Inc., Germantown, MD). Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; National Paint and Coatings Association. Accès : http://www.epa.gov/oppt/exposure/pubs/wpem.htm
Annexe 1 : Estimations de la limite supérieure de l'exposition au butanone-oxime dans les produits de consommation
| Type de produit | Hypothèses1 | Estimations de l'exposition2 |
|---|---|---|
| 1 Pour tous les calculs, un poids corporel d'un adulte de 70,9 kg et un taux d'inhalation de 16,2 m3/j sont utilisés. 2 L'estimation de l'exposition a été calculée « par événement » : exposition aiguë pendant l'utilisation du produit. 3 Concentrations maximales obtenues [communication personnelle du groupe de travail de l’Association canadienne de la peinture et du revêtement à Environnement Canada, 2009; source non citée dans les références]. 4 Les hypothèses suivantes ont été utilisées : le modèle d'inhalation est fondé sur « l'exposition à la vapeur par évaporation » avec les paramètres par défaut suivants : durée de l'exposition : 132 min; volume de la pièce : 20 m3; taux de renouvellement de l'air : 0,6/h; durée de l'application : 120 min; fraction absorbée : 100 %. 5 Henkel Technologies, 2007. 6 Permatex Canada, 2009. 7 Burka et al., 1998. |
||
| Peinture alkyde (à haut extrait sec) |
Concentration maximale de butanone-oxime : 1 % p/p3 Exposition par inhalation4 : fréquence d'exposition : 1/an; quantité de produit utilisée : 1 300 g; superficie de rejet : 1,0 × 105 cm2; matrice d'une masse moléculaire : 550 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : contact direct avec le produit à un taux constant : surface exposée : 0,367 m2; taux de contact : 30 mg/min; durée de rejet : 120 min; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 113 mg/m3 Dose d'inhalation aiguë (interne) : 2,36 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,006 46 mg/kg/j Charge cutanée : 0,009 81 mg/cm2 Dose cutanée externe : 0,508 mg/kg p.c. Dose cutanée aiguë (interne) : 0,147 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 403 mg/kg p.c./j Dose externe totale intégrée : 2,87 mg/kg p.c. Dose aiguë totale intégrée : 2,51 mg/kg p.c. Dose chronique totale intégrée : 0,006 87 mg/kg p.c./j |
| Peinture alkyde (à forte teneur en solvants) |
Concentration maximale de butanone-oxime : 1 % p/p3 Exposition par inhalation4 : fréquence d'exposition : 1/an; quantité de produit utilisée : 1 300 g; superficie de rejet : 1,0 × 105 cm2; matrice d'une masse moléculaire : 300 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : contact direct avec le produit à un taux constant : surface exposée : 0,367 m2; taux de contact : 30 mg/min; durée de rejet : 120 min; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 72,7 mg/m3 Dose d'inhalation aiguë (interne) : 1,52 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,004 17 mg/kg p.c./j Charge cutanée : 98,1 mg/cm2 Dose cutanée externe : 0,508 mg/kg p.c. Dose cutanée aiguë (interne) : 0,147 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 403 mg/kg p.c./j Dose externe totale intégrée : 2,03 mg/kg p.c. Dose aiguë totale intégrée : 1,67 mg/kg p.c. Dose chronique totale intégrée : 0,004 57 mg/kg p.c./j |
| Peinture alkyde (en aérosol) |
Concentration maximale de butanone-oxime : 1 % p/p3 Inhalation : exposition à la pulvérisation lorsque le produit est vaporisé loin de la personne : fréquence d'exposition : 2/an; durée d'exposition : 20 min; volume de la pièce : 34 m3; taux de renouvellement de l'air : 1,5/h; taux de production massique : 0,33 g/s; durée de la vaporisation : 15 min; fraction atmosphérique : 1; fraction massique non volatile : 0,3; densité de la fraction non volatile : 1,5 g/cm3; hauteur de la pièce : 2,25 m; fraction absorbée non respirable : 100 %; diamètre minimum d'inhalation : 15 mm. Exposition cutanée : contact direct avec le produit à un taux constant : surface exposée : 0,367 m2; taux de contact : 100 mg/min; durée de rejet : 15 min; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 3,75 mg/m3 Dose d'inhalation aiguë (interne) : 0,0119 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,000 0652 mg/kg p.c./j Charge cutanée : 40,9 mg/cm2 Dose cutanée externe : 0,212 mg/kg p.c. Dose cutanée aiguë (interne) : 0,0614 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 336 mg/kg p.c./j Dose orale non respirable (externe) : 0,0112 mg/kg p.c. Dose orale aiguë (interne) : 0,0112 mg/kg p.c. Dose orale chronique (interne) : 0,000 061 1 mg/kg p.c./j Dose externe totale intégrée : 0,235 mg/kg p.c. Dose aiguë totale intégrée : 0,0844 mg/kg p.c. Dose chronique totale intégrée : 0,000 462 mg/kg p.c./j |
| Revêtement alkyde | Concentration maximale de butanone-oxime : 1 % p/p3 Inhalation : durée d'exposition : 60 min; volume de la pièce : 34 m2; taux de renouvellement de l'air : 1,5/h4; fréquence d'exposition : 0,33/an; quantité de produit utilisée : 3 000 g; superficie de rejet : 15 m2; matrice d'une masse moléculaire : 3 000 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : application instantanée : surface exposée : 108 cm2; quantité de produit utilisée : 0,25 g; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 223 mg/m3 Dose d'inhalation aiguë (interne) : 2,12 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,001 92 mg/kg p.c./j Charge cutanée : 0,0231 mg/cm2 Dose cutanée externe : 0,0353 mg/kg p.c. Dose cutanée aiguë (interne) : 0,0102 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 009 24 mg/kg p.c./j Dose externe totale intégrée : 2,16 mg/kg p.c. Dose aiguë totale intégrée : 2,13 mg/kg p.c. Dose chronique totale intégrée : 0,001 93 mg/kg p.c./j |
| Produit d'étanchéité à base de silicone – joint | Concentration maximale de butanone-oxime : 5 % p/p6 Inhalation : exposition à la vapeur : évaporation : fréquence d'exposition : 3/an; quantité de produit utilisée : 75 g; superficie de rejet : 250 cm2; matrice d'une masse moléculaire : 3 000 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : contact direct avec le produit à un taux constant : surface exposée : 2 cm2; taux de contact : 50 mg/min; durée de rejet : 30 min; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 150 mg/m3 Dose d'inhalation aiguë (interne) : 1,07 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,008 81 mg/kg p.c./j Charge cutanée : 37,5 mg/cm2 Dose cutanée externe : 1,06 mg/kg p.c. Dose cutanée aiguë (interne) : 0,307 mg/kg p.c. Dose cutanée chronique (interne) : 0,002 52 mg/kg p.c./j Dose externe totale intégrée : 2,13 mg/kg p.c. Dose aiguë totale intégrée : 1,38 mg/kg p.c. Dose chronique totale intégrée : 0,0113 mg/kg p.c./j |
| Adhésif (joint d'étanchéité) | Concentration maximale de butanone-oxime : 2 % p/p7 Inhalation : exposition à la pulvérisation lorsque le produit est vaporisé loin de la personne : fréquence d'exposition : 52/an; quantité de produit utilisée : 9 g; superficie de rejet : 200 cm2; matrice d'une masse moléculaire : 3 000 g/mol; coefficient de transfert de masse : 4 000 m/min. Exposition cutanée : application instantanée : surface exposée : 2 cm2; quantité de produit utilisée : 0,08 g; fraction absorbée : 29 %5. |
Concentration moyenne par événement pour l'inhalation : 3,39 mg/m3 Dose d'inhalation aiguë (interne) : 0,129 mg/kg p.c. Dose d'inhalation chronique (interne) : 0,0184 mg/kg p.c./j Charge cutanée : 0,8 mg/cm2 Dose cutanée externe : 0,0226 mg/kg p.c. Dose cutanée aiguë (interne) : 0,006 54 mg/kg p.c. Dose cutanée chronique (interne) : 0,000 932 mg/kg p.c./j Dose externe totale intégrée : 0,152 mg/kg p.c. Dose aiguë totale intégrée : 0,136 mg/kg p.c. Dose chronique totale intégrée : 0,0193 mg/kg p.c./j |
| Paramètres | Doses ou concentrations minimales avec effet1/Résultats |
|---|---|
| 1 CL50, concentration létale médiane; DL50, dose létale médiane; DMENO/CMENO, dose/concentration minimale avec effet nocif observé; DMEO/CMEO, dose/concentration minimale avec effet observé; DSENO/CSENO, dose/concentration sans effet nocif observé. | |
| Toxicité aiguë | DL50 la plus faible, par voie orale(rats) = 930 mg/kg p.c. (Biosearch Inc., 1982). Autres DL50 par voie orale= > 900 à 2 528 mg/kg p.c. dans trois études (ICCA MEKO, 2003). DMEO = 300 mg/kg p.c. d'après les effets neurotoxiques transitoires observés chez les rats; 10 rats par sexe par groupe ont reçu une dose de 0, 100, 300 ou 900 mg/kg p.c. pendant une période d'observation de 14 jours (aucun autre effet n'a été observé) (Schulze et Derelanko, 1993). CL50 la plus faible, par inhalation(rats, 4 h) = > 4 800 mg/m3. CMENO = 190 mg/m3 d'après la diminution importante observée sur le plan statistique du gain en poids corporel chez les femelles, durant la période d'observation de 7 à 14 jours après l'exposition; 5 rats par sexe par groupe ont reçu une dose de 0, 190, 1 450 ou 4 800 mg/m3. D'autres effets incluent la formation de méthémoglobine à des concentrations moyennes et élevées et la preuve d'anesthésie à une concentration élevée (Allied Corporation, 1984b). Autre CL50 par inhalation (rats, 2 h) = > 10 500 mg/m3(OCDE, 2003). DL50 la plus faible, par voie cutanée (lapin) = 184 mg/kg p.c. (RTECS, 2006). Autres DL50, par voie cutanée = 1 000 et entre 180 et 1 800 mg/kg p.c. dans deux études (ICCA MEKO, 2003). DMENO = 180 mg/kg p.c. d'après la production de méthémoglobine et l'érythrophagocytose de la rate chez les lapins (DMEO = 18 mg/kg p.c. d'après les effets narcotiques réversibles; exposition de 24 h). Cinq lapins par sexe par groupe ont reçu une dose de 0, 18, 180 ou 1 800 mg/kg p.c. pendant 24 h par une application occlusive sur la peau (aucun autre effet n'a été observé) (Allied Corporation, 1984a; US EPA, 1986). |
| Toxicité à court terme en doses répétées | CMENO la plus faible, par inhalation = 107 mg/m3 (30 ppm) d'après la dégénérescence de l'épithélium olfactif dans la cavité nasale (nombre et gravité augmentant en fonction de la concentration d'exposition) chez les souris mâles CD-1 dont le corps entier a été exposé à 0, 3, 10, 30 ou 100 ppm (0, 11, 36, 107 ou 356 mg/m3), 6 h/j, 5 jours/semaine, pendant 1, 2 ou 4 semaines (10 mâles par concentration par moment désigné) (Newton et al., 2002). Autres CME(N)O par inhalation = 356 à 1 899 mg/m3 chez les rats ou les souris (Haskell Laboratory, 1966; Dow Corning Corporation, 1983; Bio/Dynamics Inc., 1990). DME(N)O la plus faible, par voie orale= 20 mg/kg p.c./j, d'après les changements hématologiques observés (augmentation des réticulocytes, des plaquettes et des globules rouges) et l'augmentation du poids relatif de la rate accompagnée d'anomalies histologiques (augmentation de la congestion, de l'hématopoïèse extramédullaire et de la présence de granules d'hémosidérine) chez les deux sexes et de la présence de granules d'hémosidérine dans le foie des femelles chez les rats Crj:CD (SD) ayant reçu une dose par gavage (dans l'huile d'olive) à 0, 4, 20 ou 100 mg/kg p.c./j pendant 28 jours (Japan MHW, 1996; JETOC, 1999) Autre DME(N)O par voie orale = 250 mg/kg p.c./j d'après l'hypertrophie du foie chez les rats mâles Fischer 344 ayant reçu une dose par gavage (15 mâles par dose) à 0, 250 ou 500 mg/kg p.c./j pendant 28 jours (Allied Signal Inc., 1995). Aucune étude concernant l'absorption cutanée n'a été recensée. |
| Toxicité subchronique | CMENO la plus faible, par inhalation = 36 mg/m3 d'après la dégénérescence de l'épithélium olfactif dans la cavité nasale (nombre et gravité augmentant en fonction de la concentration d'exposition) chez les souris mâles CD-1 exposés par inhalation (corps entier) à 0, 3, 10, 30 ou 100 ppm (0, 11, 36, 107 ou 356 mg/m3), 6 h/j, 5 jours/semaine, pendant 13 semaines (10 mâles par concentration par moment désigné) (Newton et al., 2002). Autre CME(N)O par inhalation = 267 mg/m3 d'après l'augmentation du poids relatif du foie chez les mâles des rats F344 (10 par sexe par concentration) exposés à 0, 15, 75 ou 374 ppm (0, 53, 267 ou 1 333 mg/m3) 6 h/j, 5 jours/semaine, pendant 3 mois (Newton et al., 2001). DME(N)O la plus faible, par voie orale = 25 mg/kg p.c./j d'après l'augmentation du poids relatif du foie chez les mâles observée dans une étude de 13 semaines chez les rats (NTP, 1999: rats F344/N mâles et femelles ayant reçu une dose de 0, 312, 625, 1 250, 2 500 ou 5 000 ppm dans l'eau potable pendant 13 semaines, c’est-à-dire 0, 25, 50, 100, 175 ou 280 mg/kg p.c./j chez les mâles et 0, 30, 65, 120, 215 ou 335 mg/kg p.c./j chez les femelles) et les changements du poids du foie et de la rate, l'hémosidérose de la rate et les effets hématologiques dans une autre étude de 13 semaines avec des rats (Allied Signal Inc., 1977: rats mâles et femelles Sprague-Dawley ayant reçu une dose de 0, 25, 75 ou 225 mg/kg p.c./j par gavage; 5 jours/semaine pendant 13 semaines). Autres DME(N)O par voie orale = 40 mg/kg p.c./j pendant une étude de 13 semaines avec des rats (Schulze et Derelanko, 1993) et 200 mg/kg p.c./j pendant une étude de même durée avec des souris (NTP, 1999). Aucune étude concernant l'absorption cutanée n'a été recensée. |
| Toxicité chronique et cancérogénicité | Étude d'exposition par inhalation chez les rats : des groupes de 50 rats F-344 par sexe ont été exposés au butanone-oxime par inhalation (corps entier) à 0, 15, 75 ou 37 ppm (0, 53, 267 ou 1 333 mg/m3) 6 h/j, 5 jours/semaine, pendant 26 mois. On a observé un nombre accru de tumeurs hépatiques chez les deux sexes à 75 et 374 ppm (mâles : carcinomes hépatiques 0/50, 0/50, 1/50 et 12/50 à 0, 15, 75 et 374 ppm, respectivement; important sur le plan statistique à 374 ppm; adénomes hépatiques 0/50, 2/50, 5/50 et 18/50, respectivement; important sur le plan statistique à 75 et 374 ppm; femelles : adénomes hépatiques 0/50, 0/50, 2/50 et 4/50, respectivement; pas important sur le plan statistique) et de fibroadénomes des glandes mammaires chez les femelles à la dose la plus élevée (2/50, 2/50, 4/50 et 9/50 à 0, 15, 75 et 37 ppm, respectivement; important sur le plan statistique à 374 ppm). CMENO pour les effets non néoplasiques = 53 mg/m3 (15 ppm) d'après les effets sur la rate (congestion, pigmentation accrue dans les cellules réticuloendothéliales et hématopoïèse extramédullaire) observés pour la première fois après 12 mois et dans les cornets nasaux (dégénérescence de l'épithélium olfactif) observés après 18 mois. On a noté d'autres effets non néoplasiques, notamment un nombre accru de foyers basophiles et de vacuoles hépatiques dans le foie des mâles à 75 et 374 ppm et des femelles à 374 ppm, des testicules élargis à 75 et 374 ppm et des effets sanguins (diminution de l'hémoglobine et des globules rouges, et augmentation de la méthémoglobine, des plaquettes et des globules blancs) chez les deux sexes à 374 ppm (Newton et al., 2001). Autres études d'exposition par inhalation :des groupes de 50 souris CD-1 par sexe ont été exposés au butanone-oxime par inhalation (corps entier) à 0, 15, 75 ou 374 ppm (0, 53, 267 ou 1 333 mg/m3) 6 h/j, 5 jours/semaine, pendant 18 mois. On a observé un nombre accru de tumeurs hépatiques chez les mâles à toutes les doses et chez les femelles à 75 et 374 ppm (mâles : carcinomes hépatiques 2/50, 2/50, 1/50 et 10/50 dans les groupes témoins et dans ceux exposés à une dose faible, moyenne et élevée, respectivement, important sur le plan statistique à 374 ppm; adénomes hépatiques 4/50, 11/50, 10/50 et 11/50, respectivement, mais dans la plage des valeurs historiques; femelles : adénomes hépatiques 0/50, 0/50, 1/50, 3/50 dans les groupes témoins et dans ceux exposés à une dose faible, moyenne et élevée, respectivement, aucun n'était important sur le plan statistique). CMENO pour les effets non néoplasiques = 53 mg/m3 (15 ppm) d'après les effets sur le foie en fonction de la dose (hypertrophie et nécrose) et dans les cornets nasaux (dégénérescence de l'épithélium olfactif) observés après 12 mois et 18 mois. On a noté d'autres effets non néoplasiques, notamment des changements sanguins (une augmentation de la méthémoglobine en fonction de la dose chez les mâles, une faible diminution de l'hémoglobine à 75 et 374 ppm chez les femelles et une augmentation des plaquettes à 374 ppm chez les deux sexes) et des paramètres chimiques du sérum (diminution du chlorure et augmentation de la créatinine, de la protéine totale et de l'albumine à 374 ppm chez les mâles; une augmentation des niveaux d'enzymes hépatiques à 374 ppm chez les femelles) observés après 12 mois (Newton et al., 2001). Aucune étude par voie orale ou cutanée n'a été recensée. |
| Toxicité pour la reproduction | DMENO la plus faible concernant la toxicité pour la reproduction : 100 mg/kg p.c./j d'après une diminution importante sur le plan statistique de l'indice de mise bas par les femelles (%) ([nombre de ratons nés/nombre d'implantations] × 100) chez les rats mâles et femelles Crj: CD (Sprague-Dawley) exposés par gavage à 0, 10, 30 ou 100 mg/kg p.c./j dans le cadre d’une étude sur 1 génération (les mâles ont reçu un traitement 48 heures avant l'accouplement; les femelles ont reçu un traitement commençant 14 jours avant l'accouplement et prenant fin au 3e jour de lactation). DMENO pour la toxicité générale = 10 mg/kg p.c./j d'après les anomalies histopathologiques observées dans la rate, le foie et les reins chez les deux sexes (Japan MHW, 1998). Autre étude d'exposition par voie orale : des rats mâles et femelles CD (Sprague-Dawley) ont été exposés par gavage à 0, 10, 100 ou 200 mg/kg p.c./j dans une étude sur 2 générations (mâles et femelles F0 et F1traités quotidiennement de 10 à 11 semaines avant l'accouplement, pendant une période d'accouplement de 3 semaines et par la suite, pendant la durée de la grossesse et jusqu'au 21e jour de lactation). Aucun effet lié au traitement sur les paramètres de la reproduction n'a été observé. DMENO pour la toxicité générale = 10 mg/kg p.c./j d'après les effets sur la rate (prolifération de cellules hématopoïétiques, pigmentation et congestion) et le foie (hématopoïèse et pigmentation) chez les adultes F0 et F1 des deux sexes (Tyl et al., 1996). Aucune étude d'exposition par inhalation ou par voie cutanée n'a été recensée. |
| Toxicité pour le développement | DMENO la plus faible, par voie orale = 40 mg/kg p.c./j d'après les avortements de 3 femelles adultes sur 10 de lapins néo-zélandais blancs enceintes ayant reçu une dose par gavage de 0, 8, 14, 24 ou 40 mg/kg p.c./j (la dose la plus élevée « ne semblait pas être tératogène » pendant 6 à 18 jours de gestation, bien qu'une évaluation complète de la toxicité pour le développement n'était pas possible). DMENO pour la toxicité maternelle = 40 mg/kg p.c./j d'après 8 morts sur 18 sujets (Derelanko et al., 2003; Springborn Laboratories, 1990b). Autres études d’exposition par voie orale :l'étude de détermination des doses ayant des effets chez les lapins néo-zélandais blancs (ayant reçu une dose pendant les jours 6 à 18 de la gestation) n'a pas permis de prouver la toxicité pour le développement à des doses de 0 à 80 mg/kg p.c./j, bien que la DMENO pour la toxicité maternelle = 10 mg/kg p.c./j d'après les symptômes d'anémie observés chez les mères rates à toutes les doses. À 10 mg/kg p.c./j, une augmentation de méthémoglobine et de réticulocytes a été observée au 13e jour de gestation et a augmenté graduellement en fonction du temps jusqu'au 19e jour de gestion (3 jours après la dernière exposition) (Springborn Laboratories, 1990b; Derelanko et al., 2003). Deux études chez des rats Sprague-Dawley (ayant reçu des doses pendant les jours de gestation 6 à 15) a permis d'obtenir des DSENO de 400 et 600 mg/kg p.c./j concernant la toxicité pour le développement et des DMENO de 25 mg/kg p.c./j pour la toxicité maternelle, d'après les symptômes d'anémie, et de 60 mg/kg p.c./j, d'après l'élargissement de la rate (Springborn Laboratories, 1990a; Mercieca et al., 1991; Derelanko et al., 2003). Aucune étude d'exposition par inhalation ou par voie cutanée n'a été recensée. |
| Génotoxicité et paramètres connexes : in vivo | Micronoyaux Résultats négatifs :cellules de la moelle osseuse, rats Sprague-Dawley exposés par voie orale (300, 600 ou 1 200 mg/kg) (Microbiological Associates, 1990). Résultats négatifs : cellules du sang périphérique, souris B6C3F1 exposées par voie orale (0, 625, 1 250, 5 000 ou 10 000 ppm dans l'eau potable, c’est-à-dire 0, 128, 270, 573, 883 ou 2 250 mg/kg p.c./j; essai effectué sur des souris dans le cadre d’unevétude de 13 semaines) (NTP, 1999). Formation d'adduits de l'ADN et de l'ARN Résultats négatifs pour les adduits de l'ADN; résultats positifs pour les adduits de l'ARN : cellules hépatiques, rats (souche non mentionnée), inhalation (0, 375 ou 1 000 ppm [0, 1 336 ou 3 563 mg/m3]) (Honeywell International Inc., 2000; Friedewald et al., 2001). |
| Génotoxicité et paramètres connexes : in vitro | Mutagénicité chez les bactéries Résultats négatifs : Salmonella typhimurium, souches TA97, TA98, TA100, TA1537 et TA1538 avec et sans activation de la fraction S9 (Allied Corporation, 1983b; NTP, 1999; Rogers-Back et al., 1988; JETOC, 1999). Résultats équivoques : S. typhimurium, souche TA1535 positive en présence de la fraction S9 du foie des hamsters, mais pas en présence de la fraction S9 du foie des rats; négative sans la fraction S9 (NTP, 1999). Résultats négatifs : S. typhimurium, souches TA98 et TA100 avec et sans activation de la fraction S9; mises à l'essai sous forme de vapeur en plaçant des plaques dans un dessiccateur (NTP, 1999). Essai de mutation de cellules de mammifères Résultats positifs : cellules de lymphomes chez des souris L5178 Y TK+/-, avec et sans la fraction S9 (Rogers-Back et al., 1988). Essai d'aberrations chromosomiques Résultats négatifs : cellules ovariennes de hamsters chinois, avec et sans la fraction S9 (NTP, 1999). Résultats négatifs : cellules pulmonaires de hamsters chinois, avec et sans la fraction S9 (JETOC, 1999). Essai d'échange de chromatides sœurs Résultats négatifs : cellules ovariennes de hamsters chinois, avec et sans la fraction S9 (Allied Corporation, 1983a; NTP, 1999) Essai de synthèse de l'ADN non programmée Résultats négatifs : hépatocytes des rats (IHF Inc., 1995). |
| Études sur les humains | Aucune étude pertinente sur les humains n'a été recensée. |