Évaluation préalable pour le Défi concernant le
Archivée
tert-butyl-4-méthoxyphénol
(hydroxyanisole butylé)
Numéro de registre du Chemical Abstracts Service
25013-16-5
Environnement Canada
Santé Canada
Juillet 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Estimation de l'exposition alimentaire à l'hydroxyanisole butylé liée à l'utilisation d'additifs alimentaires
- Annexe 2 : Limites supérieures de l'exposition à l'hydroxyanisole butylé présent dans les produits de soins personnels, estimées à l'aide de la version 4.1 du modèle ConsExpo (ConsExpo, 2006)
- Annexe 3 : Résumé des effets de l'hydroxyanisole butylé sur la santé indiqués dans les études sur les animaux
Les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du tert-butyl-4-méthoxyphénol (hydroxyanisole butylé), dont le numéro de registre du Chemical Abstracts Service est 25013-16-5. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance durant la catégorisation visant la Listeintérieure dans le cadre du Défi, car elle présente un risque d’exposition intermédiaire pour les particuliers au Canada et que le risque qu’il représente pour la santé humaine est considéré comme élevé, en fonction de sa classification par d’autres organismes sur la base de sa cancérogénicité. La substance ne répond pas aux critères environnementaux relatifs à la persistance, à la bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée principalement sur les renseignements utiles à l’évaluation des risques pour la santé humaine.
Selon les renseignements déclarés en réponse à l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], l’hydroxyanisole butylé n’a pas été fabriqué au Canada en 2006 en une quantité égale ou supérieure au seuil de déclaration de 100 kg. Par contre, une quantité de 100 à 1 000 kg d’hydroxyanisole butylé a été importée au pays et une quantité de 1 000 à 10 000 kg de cette substance y a été utilisée sous sa forme pure ou comme composant d’un produit, d’un mélange ou d’un article fabriqué. L’utilisation de l’hydroxyanisole butylé comme antioxydant dans les aliments est permise au Canada. Cette substance retarde la détérioration des saveurs et des odeurs et accroît considérablement la durée de conservation des matières grasses et des aliments qui en contiennent. Elle peut être utilisée dans les aliments cuits au four ou frits dans des huiles animales en raison de stabilité à haute température et de sa capacité à demeurer active après ces types de cuisson. En outre, l’hydroxyanisole butylé est un antioxydant très utilisé dans les aliments pour animaux puisqu’il retarde l’oxydation des vitamines A et E, du carotène, des xanthophylles, des gras fondus et des huiles végétales. Il est un ingrédient non médicinal utilisé comme antioxydant et agent antimicrobien dans les produits pharmaceutiques finaux, les produits de santé naturelle et les produits pour animaux manufacturés au Canada. Il y est aussi un composant des produits de soins personnels comme les désodorisants, les shampoings et les lotions corporelles. L’hydroxyanisole butylé est également utilisé comme produit de formulation dans les pesticides au Canada. Il agit comme agent stabilisant ou parfum dans les rodenticides, les insecticides (jardins particuliers), les fongicides, les bactéricides (pâtes et papiers), les shampooings insecticides (chats et chiens), les insectifuges (lotions, lingettes) et les nettoyants antibactériens pour surfaces et vitres. Au Canada, la population générale est exposée à l’hydroxyanisole butylé puisque son utilisation comme antioxydant est autorisée dans les aliments et qu’il est présent dans les produits de soins personnels comme les shampooings et les hydratants pour la peau.
D’après la comparaison de l’exposition estimative à l’hydroxyanisole butylé au Canada et de la concentration associée à un effet critique, et compte tenu des incertitudes inhérentes aux données sur l’exposition et les effets, on considère que les marges d’exposition ainsi obtenues sont adéquates pour protéger la santé humaine en ce qui a trait aux effets autres que le cancer. Les marges d’exposition pour les effets cancérogènes sont également jugées adéquates pour protéger la santé humaine. Les marges entre ces niveaux d’exposition et les estimations de l’absorption découlant de l’utilisation de produits de soins personnels sont considérées comme adéquates pour protéger la santé humaine.
À la lumière des renseignements disponibles sur le potentiel d’effets nocifs de l’hydroxyanisole butylé sur la santé humaine, il est conclu que cette substance ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D’après les données empiriques pour une substance analogue (4-tert-butylphénol), ainsi que les données modélisées, il est conclu que l’hydroxyanisole butylé va se dégrader rapidement dans l’air, l’eau et le sol, mais pas dans les sédiments. De plus, d’après les données expérimentales sur une substance analogue (4-tert-butylphénol) ainsi que les données modélisées, il est conclu que l’hydroxyanisole butylé ne rencontre pas les critères pour la bioaccumulation.
Comme l’hydroxyanisole butylé est présent dans les produits de consommations et que la substance est rejetée dans l’eau, un scénario a été développé afin de calculer le quotient de risque en ce basant sur une comparaison entre la concentration la plus élevée connue dans les eaux résiduaires municipale et la concentration estimée sans effet. Deuxièmement, un scénario basé sur les rejets à travers le drain par les utilisations par les consommateurs a été utilisé afin d’estimer la concentration potentielle d’hydroxyanisole butylé dans plusieurs étendues des effluents des stations d’épuration des eaux usées. Troisièmement, un scénario d’exposition site-spécifique pour cinq sites a été développé en ce basant sur l’information sur les utilisations commerciales afin d’estimé prudemment les rejets dans l’environnement aquatique provenant des opérations industrielles et les concentrations résultantes. Les concentrations on été estimée comme étant sous le seuil ayant le potentiel d’être nocif pour les organismes aquatiques sensibles. Ces trois scénarios indiquent que la substance ne devrait pas avoir le potentiel d’être nocive pour l’environnement aquatique.
Selon les renseignements disponibles, incluant les résultats de l’analyse conservatrice du quotient de risque, ainsi que l’information sur la persistense, bioaccumulation et toxicité de la substance, il est conclu que l’hydroxyanisole butylé ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ni à mettre en danger l’environnement essentiel pour la vie. L’hydroxyanisole butylé répond aux critères de la persistance, mais ne répond pas à ceux du potentiel de bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation.
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
D’après les renseignements disponibles, il est conclu que le tert-Butyl-4-méthoxyphénol ne satisfait à aucun des critères prévus à l’article 64 de la Loi.
Conformément à la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999), les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui ont été jugées prioritaires dans le cadre de la catégorisation des substances figurant sur la Liste intérieure des substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada(Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
Une priorité élevée a été donnée à l'évaluation du risque que comporte le tert-butyl-4-méthoxyphénol pour la santé humaine étant donné qu'on a déterminé que la substance présente un risque d'exposition intermédiaire (REI) pour les Canadiens et qu'elle a été classée par d'autres organismes en fonction de sa cancérogénicité. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 31 janvier 2009 (Canada, 2009). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements techniques sur la substance ont été reçus en réponse au Défi.
Même si l'évaluation des risques du tert-butyl-4-méthoxyphénol pour la santé humaine était jugée hautement prioritaire, cette substance ne répondait pas aux critères relatifs à la persistance et au potentiel de bioaccumulation ou aux critères de toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l'accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères au sens de l'article 64 de la Loi. Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.[1]
La présente évaluation préalable finale prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable du tert-butyl-4-méthoxyphénol sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu'en juillet 2009 (sections du document concernant la santé humaine) et jusqu'en octobre 2009 (sections concernant la nature écologique). Les études les plus importantes ont fait l'objet d'une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers et les risques pour la santé (principalement d’après les évaluations s’appuyant sur la méthode du poids de la preuve effectuées par d’autres organismes, lesquelles qui ont servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur la marge entre les valeurs prudentes de concentration donnant lieu à des effets et les estimations de l’exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, et ce, dans le contexte d’une évaluation préalable. L’ébauche d’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s'agit plutôt d'un sommaire des renseignements essentiels qui appuient la conclusion proposée.
La présente évaluation préalable finale a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes de ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'écologie ont fait l’objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment John Christopher, Ph. D. (California Office of Environmental Health Assessment), Michael Jayjock, Ph. D. (The LifeLine Group) et Mme Joan Strawson (TERA). Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable. Les méthodes utilisées dans les évaluations préalables du Défi ont été examinées par un Groupe consultatif du Défi indépendant.
Les principales données et considérations sur lesquelles repose la présente évaluation préalable finale sont résumées ci-après.
Aux fins du présent document, la substance est appelée hydroxyanisole butylé. Les renseignements liés à l'hydroxyanisole butylé sont repris dans le tableau 1.
| No CAS | 25013-16-5 |
| Nom dans la LIS | tert-butyl-4-méthoxyphénol |
| Noms relevés dans les NCI1 | t-Butyl-p-hydroxyanisole (ENCS) tert-Butyl-4-methoxyphenol (EINECS) 1,1-(Dimethylethyl)-4-methoxyphenol (ECL) Phenol, (1,1-dimethylethyl)-4-methoxy- (AICS, ASIA-PAC, LIS, NZIoC, PICCS, SWISS, TSCA) |
| Autres noms | Antioxyne B BHA BHA (antioxidant) BOA BOA (antioxidant) 2(3)-tert-Butyl-4-hydroxyanisole tert-Butyl-4-hydroxyanisole Butylated hydroxyanisole Butylhydroxyanisole tert-Butylhydroxyanisole Phenol, tert-butyl-4-methoxy- |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Phénols |
| Principale sous-classe chimique | hydroxyanisoles; tert-butyles |
| Formule chimique | C11H16O2 |
| Structure chimique |  |
| SMILES2 | COc1ccc(O)c(c1)C(C)(C)C |
| Masse moléculaire | 180,25 g/mol |
| 1 National Chemical Inventories (NCI), 2007 : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique; LIS (Liste intérieure des substances); ECL (liste des substances chimiques existantes de la Corée); EINECS (inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); NCI (National Chemical Inventories); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); SWISS (liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse) et TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). 2 SMILES signifie « Simplified Molecular Line Input Entry System ». |
|
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et prévues) de l'hydroxyanisole butylé qui se rapportent à son devenir dans l'environnement. Le tableau 2 présente également les propriétés chimiques et physiques expérimentales d'un analogue structural, le 4-tert-butylphénol. Une comparaison des structures chimiques de l'hydroxyanisole butylé et du 4-tert-butylphénol se trouve dans le tableau 3.
| Propriété | Type | Valeur1 | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Koa, coefficient de partage octanol-air; Kco, coefficient de partage carbone organique-eau; Koe, coefficient de partage octanol-eau; pKa, constante de dissociation acide. 1 Les valeurs et les unités entre parenthèses représentent les valeurs originales estimées à l'aide des modèles. * Les données présentées dans le tableau 2 s’appliquent à l’hydroxianisole butylé s’il n’est pas indiqué autrement |
||||
| Point de fusion (°C) | Expérimental | 51 | PhysProp, 2006 | |
| Modélisé | 66,21 | MPBPWIN, 2000 | ||
| Point d'ébullition (°C) | Expérimental | 268 | PhysProp, 2006 | |
| Modélisé | 265,53 | MPBPWIN, 2000 | ||
| Masse volumique (kg/m3) | n.d. | |||
| Pression de vapeur (Pa) | Modélisé | 0,312 | MPBPWIN, 2000 | |
| Constante de la loi de Henry (Pa·m3/mol) | Modélisé | 8,675 × 10-3 0,119 |
25 | HENRYWIN, 2000 |
| Log Koe (sans dimension) |
Modélisé | 3,5 | 25 | KOWWIN, 2000 |
| Expérimental (4-tert-butylphénol) | 3,29 | OCDE, 2000 | ||
| Log Kco (sans dimension) |
Modélisé | 3,143 | PCKOCWIN, 2000 | |
| Solubilité dans l'eau (mg/L) |
Modélisé | 212,8 | 25 | WSKOWWIN, 2000 |
| Expérimental (4-tert-butylphénol) | 610 | OCDE, 2000 | ||
| pKa | Modélisé | 11,83 | ACD/pKaDB, 2005 | |
No CAS |
Nom commun | Masse moléculaire (g/mol) | Nom dans la LIS | Structure chimique | Données expérimentales disponibles |
|---|---|---|---|---|---|
| 25013-16-5 | Hydroxyanisole butylé | 180,25 | tert-butyl-4-méthoxyphénol |  |
Point de fusion, point d'ébullition, toxicité aquatique, bioaccumulation |
| 98-54-4 | 4-tert-butylphénol | 150 | 4-tert-butylphénol |  |
Log koe, solubilité dans l'eau, biodégradation, bioaccumulation |
Des modèles fondés sur les relations quantitatives structure-activité (RQSA) ont été utilisés pour générer des données pour certaines des propriétés physiques et chimiques de l'hydroxyanisole butylé. Bon nombre de ces modèles sont fondés sur des méthodes d'addition de fragments; autrement dit, ils s'appuient sur la structure d'un produit chimique donné. Seules les formes neutres d'un produit chimique peuvent être fournies comme données d'entrée à ces modèles (forme SMILES); par conséquent, les valeurs modélisées figurant au tableau 2 concernent la forme neutre de la substance. De plus, la valeur élevée du pKa de 11,83 indique que le composé ne devrait pas s'ioniser à l'intervalle de pH pertinent du point de vue de l'environnement (6 à 9). Comme les substances chimiques relativement simples, tel l’hydrozyanisole butylé, sont bien traduites par les ensembles d’étalonnage des modèles, on accorde un degré de confiance raisonnablement élevé aux prévisions modélisées.
Le 4-tert-butylphénol a été choisi comme analogue afin de fournir des données expérimentales déduites à partir d'analogues supplémentaires en raison de sa structure très semblable à l'hydroxyanisole butylé et parce qu'il appartient à la même classe chimique des butylphénols tertiaires (Remberger et al., 2003). Il existe des différences structurales entre les deux substances. L'hydroxyanisole butylé contient un atome d'oxygène supplémentaire ainsi qu'un groupe méthyle lié à l'anneau phénolique, et le groupe hydroxy est situé à un endroit différent sur l'anneau.
En 2006, l'hydroxyanisole butylé n'a pas été fabriqué au Canada en une quantité égale ou supérieure au seuil de déclaration de 100 kg. Par contre, une quantité de 100 à 1 000 kg d'hydroxyanisole butylé a été importée au Canada et une quantité de 1 000 à 10 000 kg de cette substance sous sa forme pure ou comme composant d'un produit, d'un mélange ou d'un article fabriqué a été utilisée (Environnement Canada, 2009a).
La US Environmental Protection Agency a inscrit l'hydroxyanisole butylé sur la liste des substances chimiques produites en grande quantité (NCBI, 2008). En 1998, la US Geological Survey a déclaré que 11 % des 126 échantillons d'eaux usées provenant de diverses sources contenaient de l'hydroxyanisole butylé (Brown et al., non daté).
D’après l’information soumise lors de l’inscription de la Liste intérieure des substances (LIS) (1984-1986), la quantité d’hydroxyanisole butylé déclarée comme ayant été fabriquée, importée ou commercialisée au Canada au cours de l'année civile 1986 se situait entre 100 000 et 1 000 000 kg (Environnement Canada, 1988).
Selon le titre 16, tableau XI, du Règlement sur les aliments et drogues, l'hydroxyanisole butylé est un antioxydant qui peut être utilisé dans de nombreux aliments. L'hydroxyanisole butylé peut être ajouté à certains aliments jusqu'à des concentrations maximales précisées dans le Règlement sur les aliments et drogues ou peut être utilisé en association avec l'hydroxytoluène butylé, le gallate de propyle ou l'hydroquinone de butyle tertiaire (TBHQ) jusqu'à une concentration maximale totale, pour tous les antioxidants combinés, équivalant à la concentration maximale de l'hydroxyanisole butylé utilisé seul (Canada, 1978). Aux États-Unis, l'hydroxyanisole butylé est un produit chimique qui est généralement reconnu inoffensif (GRAS) lorsque sa concentration ne dépasse pas 0,02 % en poids de la teneur en huile ou en gras totale des aliments (NTP, 2005).
La propriété antioxydante de l'hydroxyanisole butylé retarde la détérioration des saveurs et des odeurs et accroît considérablement la durée de conservation des matières grasses et des aliments qui en contiennent (NTP, 2005). Cette substance peut être utilisée dans les aliments cuits au four ou frits dans des huiles animales en raison de stabilité à haute température et de sa capacité à demeurer actif après ces types de cuisson (NTP, 2005). En 2006, l'hydroxyanisole butylé était utilisé au Canada comme antioxydant dans les produits alimentaires (Environnement Canada, 2009a) et pouvait se trouver dans une large gamme d'aliments, tels que les huiles et les graisses, les sauces pour salade, les céréales prêtes à consommer, les aliments cuits au four, les produits de pommes de terre déshydratées, les mélanges pour boissons et mets, les grignotines, les sucreries, la gomme à mâcher ainsi que les crèmes-desserts et les sauces prêtes à consommer.
Au Canada, l'hydroxyanisole butylé est utilisé comme stabilisateur dans certains plastiques destinés à être utilisés en contact direct avec les aliments. Toutefois, la contribution de cette source d'hydroxyanisole butylé à l'absorption totale d'hydroxyanisole butylé est négligeable (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée).
De plus, l'hydroxyanisole butylé est employé comme antioxydant et comme agent de préservation dans les aliments pour animaux, les cosmétiques ainsi que les produits de caoutchouc et de pétrole. Il est également un antioxydant très utilisé dans les aliments pour animaux puisqu'il retarde l'oxydation des vitamines A et E, du carotène, des xanthophylles, des gras fondus et des huiles végétales. C'est un stabilisateur efficace dans les huiles essentielles, la paraffine et les polyéthylènes (NTP, 2005).
L'hydroxyanisole butylé est employé comme antioxydant et agent de préservation dans les préparations pharmaceutiques (NTP, 2005). Il est inscrit dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) et dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu'ingrédient non médicinal utilisé comme antioxydant et agent antimicrobien dans les produits pharmaceutiques finaux, les produits de santé naturels et les médicaments vétérinaires fabriqués au Canada (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée). Dans les produits de santé naturels, l'apport quotidien acceptable (AQA) de l'hydroxyanisole butylé est de 0,5 mg/kg de poids corporel (kg p.c.) (BDIPSN, 2009).
Au Canada, l'hydroxyanisole butylé est une composante des produits de soins personnels, comme les déodorants, les shampooings et les lotions pour le corps (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée). En outre, aux États-Unis, l'hydroxyanisole butylé figure parmi les ingrédients les plus utilisés dans les cosmétiques (US FDA, 2009).
Au Canada, l'hydroxyanisole butylé est inscrit sur la liste 2 des produits de formulation dans les pesticides, à des concentrations allant de 0,000 04 % à 1 % (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée). Il agit comme agent stabilisant ou fragrance dans les rodenticides, les insecticides (jardins privés), les fongicides, les bactéricides (pâtes et papiers), les shampooings insecticides (chats et chiens), les insectifuges (lotions, lingettes) et les nettoyants antibactériens pour surfaces et vitres. L'hydroxyanisole butylé est également répertorié en tant qu'ingrédient inerte dans des pesticides aux États-Unis (US EPA, 2004).
L'hydroxyanisole butylé figure sur la Liste de divulgation des ingrédients (concentration par poids de 1 %) de la Loi sur les produits dangereux (Canada, 1988).
L'hydroxyanisole butylé ne figure pas dans l'Inventaire national des rejets de polluants (INRP, 2009). De même, il n'a pas été relevé dans le Toxic Release Inventory des ÉtatsUnis en 2006, soit l'année de déclaration la plus récente (TRI, 2006).
D'après les propriétés physiques et chimiques de l'hydroxyanisole butylé (tableau 2), les résultats de la modélisation de fugacité de niveau III (tableau 4) semblent indiquer que cette substance devrait demeurer principalement dans le sol et l'eau, selon le milieu où elle est rejetée.
| Substance rejetée dans | Pourcentage de la substance se répartissant dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 24,6 | 10,8 | 63,8 | 0,78 |
| l'eau (100 %) | 0,02 | 93,2 | 0,06 | 6,72 |
| le sol (100 %) | 0,00 | 0,58 | 99,4 | 0,04 |
La constante de dissociation acide relativement élevée (pKa) de 11,83 pour le groupe fonctionnel acide indique que la moitié du produit chimique sera dissociée à un pH de 11,83. Dans les plans d'eau ayant des pH pertinents du point de vue de l'environnement (entre 6 et 9), 100 % de l'hydroxyanisole butylé sera non dissocié, ce qui indique qu'il y aura une exposition biotique au produit sous forme neutre. La proportion relativement faible de la substance chimique dissociée indique également qu'il est approprié de prévoir le comportement de répartition à l'aide des logarithmes Koe et Kco.
Persistance dans l'environnement
Aucune donnée expérimentale sur la dégradation de l'hydroxyanisole butylé n'a été trouvée. Il existe toutefois des données expérimentales sur la biodégradation de l'analogue 4-tert-butylphénol.
Le tableau 5a présente les données empiriques sur la biodégradation qui indiquent la biodégradation de 98 % du 4-tert-butylphénol en 28 jours dans un essai de biodégradation rapide (OCDE, 2000). La demi-vie dans l'eau serait donc bien inférieure à 182 jours (6 mois), par conséquent, la substance ne devrait pas persister dans ce milieu.
| Milieu | Processus du devenir |
Valeur pour la dégradation | Paramètre et unités de la dégradation | Référence |
|---|---|---|---|---|
| Eau | Biodégradation | 98 | Biodégradation (%) | OCDE, 2000 |
Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et que l'hydroxyanisole butylé devrait être libéré dans ce milieu, la persistance dans l'eau a été examinée essentiellement à l'aide de modèles prévisionnels RQSA sur la biodégradation. Le tableau 5b résume les résultats des modèles de prévision RQSA disponibles sur la dégradation dans divers milieux naturels.
Processus du devenir |
Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade and Industry, Japon; s.o., sans objet; t½, demi-vie. 1 Le modèle ne précise pas d'estimation pour ce type de structure. 2 Le résultat s'exprime par une valeur numérique de 0 à 5. 3 Le résultat s'exprime par un taux de probabilité. |
|||
Air |
|||
| Oxydation atmosphérique | AOPWIN, 2000 | t½ = 0,297 jour | < 2 |
| Réaction avec l'ozone | AOPWIN, 2000 | s.o.1 | s.o. |
Eau |
|||
| Hydrolyse | HYDROWIN, 2000 | s.o.1 | s.o. |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 3 : enquête d'expert (biodégradation ultime) |
2,582 «se biodégrade lentement » |
> 1823 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 4 : enquête d'expert (biodégradation primaire) |
3,552 « se biodégrade rapidement » |
< 182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 5 : MITI probabilité linéaire |
0,533 « se biodégrade rapidement » |
< 182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 6 : MITI, probabilité non linéaire |
0,493 « se biodégrade rapidement » |
< 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 Probabilité |
0,293 « peut se biodégrader lentement » |
= 182 incertain |
| Biodégradation (aérobie) | CATABOL ©2004-2008 % DBO |
% DBO = 27,3 « peut se biodégrader lentement » |
= 182 incertain |
Une demi-vie d'oxydation atmosphérique dans l'air de 0,3 jour (tableau 5b) démontre que cette substance est susceptible de s'oxyder rapidement. La substance ne devrait pas réagir de façon appréciable avec d'autres espèces, comme l'ozone, par photooxydation dans l'atmosphère et elle n'est pas susceptible de se dégrader par photolyse directe. Des réactions avec des radicaux hydroxyles devraient donc constituer le plus important processus régissant son devenir dans l'atmosphère. Sa demi-vie de 0,3 jour, résultant des réactions avec ces radicaux, permet d'affirmer que l'hydroxyanisole butylé n'est pas persistant dans l'air.
Comme la substance ne comprend aucun groupement hydrolysable (tableau 5b), il était impossible de prévoir la demi-vie par hydrolyse dans l'eau ni pertinent de le faire.
Les résultats des modèles de biodégradation sont contradictoires. Le résultat du sous-modèle BIOWIN (2000) 4 (modèle d'enquête sur la biodégradation primaire) révèlent que la substance se biodégrade rapidement et a une demi-vie primaire inférieure à 182 jours. L'identité des produits de dégradation est toutefois inconnue. Les résultats des sous-modèles BIOWIN (2000) 5 et 6 semblent indiquer que l'hydroxyanisole butylé subit une dégradation ultime relativement rapide, alors que le sous-modèle 3 suggère que ce composé ce biodégrade lentement. Le résultat du modèle CATABOL (©2004-2008) semble indiquer que ce composé peut présenter un taux de dégradation ultime plus lent et que sa demi-vie pourrait être supérieure ou égale à 182 jours. Toutefois, le DBO de 27 % prévu à l'aide du modèle CATABOL (©2004-2008) n'est pas inférieur à 20 %, ce qui est associé à des substances très persistantes. Les prévisions du modèle TOPKAT (2004) indiquent que l'hydroxyanisole butylé se biodégrade relativement lentement, mais la marge entre cette prévision et la prévision selon laquelle il pourrait se biodégrader rapidement n'est pas marquée (0,07). Par conséquent, les modèles indiquent que cette substance devrait subir une biodégradation primaire importante sur une période de 182 jours, et la majorité des modèles semble indiquer qu'elle subirait une dégradation ultime importante en 182 jours. Les données expérimentales sur la biodégradation pour l'analogue structural 4-tert-butylphénol (tableau 5a) font également état d'une biodégradation immédiate. Ainsi, compte tenu des résultats de tous les modèles, des données expérimentales sur la biodégradation pour l'analogue et des caractéristiques structurales, la plupart des preuves tangibles indiquent que la demi-vie de la biodégradation de l'hydroxyanisole butylé est supérieure à 182 jours dans l'eau.
D'après les données expérimentales sur des analogues et les données prévues (tableaux 5a et 5b), l'hydroxyanisole butylé ne répond pas aux critères de persistance dans l'air, dans l'eau et dans le sol (demi-vie dans l'air > 2 jours, demi-vies dans le sol et dans l'eau = 182 jours), mais il répond aux critères de la persistance dans les sédiments (demi-vie dans les sédiments = 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Une étude expérimentale sur le taux de rétention de l'hydroxyanisole butylé chez le saumon de l'Atlantique (Salmo salar) a été commandée par la National Institute of Nutrition and Seafood Research de Norvège (NIFES, 2007). Les saumons ont été exposés à une alimentation contenant de l'hydroxyanisole butylé durant 84 jours et ont ensuite été soumis à une période de dépuration de 14 jours. Les résultats de cette étude ont montré que les concentrations d'hydroxyanisole butylé dans les filets de saumon étaient fonction de la dose tout au long de la période d'exposition, la concentration la plus élevée étant de 0,183 mg/kg chez les poissons exposés à la dose la plus élevée de 225 mg/kg nourriture. Les concentrations de la substance n'ont toutefois pas augmenté de façon significative durant l'étude, ce qui indique qu'une élimination ou un catabolisme rapide permet de prévenir l'accumulation. De plus, la concentration d'hydroxyanisole butylé dans les filets de saumon était inférieure au seuil de détection (7 µg/kg) après la période de dépuration de 2 semaines. Étant donné que cette étude n'a pas été conçue de manière standard, on y accorde une moins grande importance dans les éléments de preuve. Les résultats expérimentaux fournissent cependant de l'information qui indique un faible potentiel de bioaccumulation, puisque l'hydroxyanisole butylé semble être éliminé rapidement suivant son ingestion.
Le tableau 6a présente une valeur empirique pour le facteur de biocentration (FBC) pour l’analogue structural 4-tert-butylphénol chez le poisson.
| Organisme d’essai | Paramètre | Valeur (en poids humide en L/kg) | Référence |
|---|---|---|---|
| Poisson | FBC | 120 | OECD, 2000 |
Puisque aucune donnée expérimentale standard sur le facteur de bioaccumulation (FBA) et sur le FBC n'était disponible pour l'hydroxyanisole butylé, une méthode prédictive a été appliquée au moyen de modèles des facteurs de bioaccumulation et de bioconcentration (tableau 6b). Selon le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si son FBC ou son FBA s'avère supérieur ou égal à 5 000; toutefois, le calcul des facteurs de bioaccumulation est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances. En effet, le facteur de bioconcentration ne prend pas en compte de manière adéquate le potentiel de bioaccumulation des substances par l'alimentation, lequel est un facteur majeur pour les substances dont le log Koe est supérieur à ~4,0 (Arnot et Gobas, 2003). La modélisation cinétique du bilan massique devrait constituer la méthode de prévision la plus fiable pour déterminer le potentiel de bioaccumulation de l'hydroxyanisole butylé, car elle permet une correction du métabolisme dans la mesure où le log Koe de la substance se trouve dans le domaine du log Koe du modèle.
| Organisme d'essai | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|
| Poisson | FBA | 110,5 | Arnot et Gobas, 2003 (FBC niveaux trophiques intermédiaires) |
| Poisson | FBC | 110,6 | Arnot et Gobas, 2003 (FBC niveaux trophiques intermédiaires) |
| Poisson | FBC | 705 | OASIS Forecast, 2005 |
| Poisson | FBC | 57 | BCFBAF, 2008 |
Les prévisions pour le FBA et le FBC aux niveaux trophiques intermédiaires par Arnot et Gobas comprends des estimés du taux de transformation (km = 1.8 j-1 pour 10g de poisson). Ceci est en accord avec une étude sur le saumon de l’atlantique (NIFES, 2007) qui suggère une élimination rapide ainsi qu’avec le FBC empirique pour l’analogue structural 4-tert-butylphénol chez le poisson.
Les preuves disponibles indiquent que l'hydroxyanisole butylé devrait présenter un faible potentiel de bioaccumulation en raison de ses propriétés physiques et chimiques (c.-à-d. valeurs relativement faibles des Koe modélisés et de l'analogue, l'hydrosolubilité modérée modélisée et de l'analogue), de son élimination rapidse et de ses faibles valeurs modélisées du FBC et du FBA. Par conséquent, l'hydroxyanisole butylé ne répond pas aux critères de bioaccumulation (FBC ou FBA = 5 000) du Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Évaluation des effets sur l'environnement
Un résumé des données expérimentales sur les effets écologiques est présenté au tableau 7.
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50 (concentration efficace moyenne), concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50 (concentration létale médiane), concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai. | ||||
| Chlorella vulgaris (algue) | Toxicité chronique (48 h) | CE50 | 7,6 (42 µM) | Jos et al., 20051 |
| Allium cepa (plante) | Toxicité chronique (inhibition de la croissance, 72 h) | CE50 | 35 (194 µM) | Jos et al., 20051 |
| Vibrio fischeri (bactérie) | Toxicité aiguë (5, 15, 60 min) | CE50 | 0,21 (1,17 µM) | Jos et al., 2005 |
| Daphnia magna | Toxicité aiguë (48 h) | CE50 | 3,6 (20 µM) | Jos et al., 2005 |
| Moule zébrée (Dreissena polymorpha) |
Toxicité aiguë (48 h) | CL50 | 34,2 (moyenne de deux échantillons : 3,4 et 65) |
Cope et al., 1997 |
| Truite arc-en-ciel (Oncorhynchus mykiss) |
Toxicité aiguë (48 h) | CL50 | 1 | Cope et al., 1997 |
| Barbue de rivière (Ictalurus punctatus) |
Toxicité aiguë (48 h) | CL50 | 1,5 | Cope et al., 1997 |
| Crapet arlequin (Lepomis macrochirus) | Toxicité aiguë (48 h) | CL50 | 4,8 | Cope et al., 1997 |
| Medaka (Oryzias latipes) | Toxicité aiguë (48 h) | CL50 | 4,3 (moyenne de trois valeurs variant de 2,5 à 5,3) |
Tsuji et al., 1986 |
L'algue Chlorella vulgaris était l'organisme le plus sensible dans l'ensemble de données sur la toxicité chronique, la CE50 après 48 h pour l'inhibition de la croissance cellulaire étant de 7,6 mg/L.
Vibrio fischeri était l'espèce la plus sensible dans l'ensemble de données sur la toxicité aiguë, la valeur moyenne de la CE50 après 5, 15 et 60 minutes d'exposition pour l'inhibition de la bioluminescence étant de 0,21 mg/L. On a émis l'hypothèse que l'hydroxyanisole butylé serait toxique pour V. fischeri en raison d'un découplage de la phosphorylation oxydative et de l'inhibition de la respiration suivant une interaction directe avec la chaîne de transport des électrons (Cope et al., 1997). Dans l'ensemble de données sur la toxicité aiguë, la truite arc-en-ciel était au deuxième rang des espèces les plus sensibles, la CL50après 48 h étant de 1 mg/L (Cope et al., 1997). Les données relatives à la CL50 pour les poissons étaient assez uniformes, variant légèrement entre 1 et 4,8 mg/L.
La gamme de données sur la toxicité aquatique expérimentale prise en compte indique que la substance présente un risque modéré à élevé pour les organismes aquatiques, les valeurs de la CL50 et de la CE50 variant de 0,21 mg/L à 35 mg/L (tableau 7).
Outre sa toxicité modérée à élevée, l'hydroxyanisole butylé a été décrit dans la littérature scientifique comme étant un composé qui dérègle légèrement le système endocrinien (Goo Kang et al., 2005; Jobling et al., 1995; Jos et al., 2005; PAN, 2009 et Scippo, 2004). Toutefois, il y a des données contradictoires en ce qui a trait au degré de dérèglement du système endocrinien ainsi qu’en ce qui a trait à savoir si la substance est oestrogènique ou anti-oestrogènique. Donc, l’interprétation de cette information dans un contexte environnemental n’est pas claire.
Parce-qu’un haut degré d’incertitude est associé avec l’importance écologique des études sur le dérèglement du système endocrinien par l’hydroxyanisole butylé ainsi que parce-qu’il y a des résultats contradictoires sur les effets oestrogénique de la substance, la présente évaluation uttilise des paramètres toxicologiques d’intérêts conventionels (p.e. inhibition de la croissance et mortalité; Tableau 7) avec des facteurs d’évaluation qui permettent de tenir compte des effets potentiels subtiles d’une exposition à long terme afin de caractériser le risque écologique.
Évaluation de l'exposition de l'environnement
L'hydroxyanisole butylé a été décelé dans des échantillons prélevés dans différents cours d'eau aux États-Unis à une concentration maximale de 2 × 10-4 mg/L (Kolpin et al., 2002). L'un des trois échantillons d'eau de surface fluviale recueilli en Illinois et au Minnesota en 1998 contenait de l'hydroxyanisole butylé (0,3 µg/L) (Brown et al., non daté). Dans le cadre de la même étude, les huit échantillons prélevés dans l'effluent des usines de traitement des eaux usées (Illinois, Minnesota, Michigan et Wisconsin) contenaient de l'hydroxyanisole butylé (0,2 à 1,3 µg/L). Une étude réalisée par Soliman et al. (2004) a permis de constater que tous les échantillons provenant d'effluents traités à trois usines de traitement des eaux usées en Californie contenaient de l'hydroxyanisole butylé, en concentrations allant de 0,02 à 0,13 µg/L. Cette substance a été détectée dans l'effluent de trois usines de traitement des eaux usées en Suède à des concentrations de 0,5, 0,5 et 1 µg/L (Paxéus, 1996).
Rudel et al. (1998) ont analysé les boues et les eaux usées à Cape Cod, au Massachusetts. L'hydroxyanisole butylé a été détecté dans les cinq échantillons de boues non traitées (0,13 à 0,53 µg/L), dans deux des quatre échantillons d'eaux usées non traitées (0,025 et 0,05 µg/L) et dans aucun des trois échantillons de boues et d'eaux usées traitées. Des échantillons ont également été prélevés dans des puits de surveillance des eaux souterraines situés dans trois sites d'enfouissement municipaux ou à proximité de ceux-ci. L'hydroxyanisole butylé n'a pas été détecté (seuil de détection de 0,0066 µg/L) dans quatre échantillons d'eaux souterraines contaminées par des lixiviats de décharge, et l'un des cinq échantillons recueillis dans un site d'enfouissement/lagune contenait de l'hydroxyanisole butylé en une quantité inférieure à la limite de quantification (0,002 µg/L).
Des échantillons d'eaux usées brutes et d'effluents finaux traités ont été prélevés à six usines de traitement des eaux usées situées dans trois États dans l'Ouest américain en 2005 (Drewes et Snyder, 2009). Une analyse par chromatographie en phase liquide et spectrométrie de masse en tandem a permis de déceler des concentrations moyennes dans six échantillons de chacun des effluents finaux et d'eaux usées brutes de 70 ng/L et de 160 ng/L, respectivement. Une analyse par chromatographie en phase gazeuse et spectrométrie de masse en tandem a permis de déceler des concentrations moyennes de 190 ng/L et de 90 ng/L pour les eaux usées brutes et les effluents finaux, respectivement.
Ces études sur l'exposition mettent en lumière l'importance de l'eau en tant que milieu récepteur de l'hydroxyanisole butylé dans l'environnement. Les concentrations les plus élevées recensées dans les publications concernaient des échantillons prélevés en 1998 par Brown et al. (non daté) dans les rivières et les eaux usées des Etats-Unis et variaient de 0,2 × 10-3 à 1,3 × 10-3 mg/L, la valeur la plus haute provenant des eaux usées d’une usine de traitement des eaux usées municipale.
Caractérisation des risques pour l'environnement
La démarche suivie dans cette évaluation écologique préalable consistait à examiner les divers renseignements à l'appui et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprenaient les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Tel qu'il a été décrit précédemment, l'hydroxyanisole butylé répond aux critères de la persistance dans les sédiments énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000). L'hydroxyanisole butylé n'est pas persistant dans l'eau, le sol ou l'air, et devrait avoir un faible potentiel de bioaccumulation.
Rejets par les consommateurs
Étant donné que l'on trouve de l'hydroxyanisole butylé dans les produits de consommation et qu'on a signalé des rejets de cette substance dans l'eau, un scénario précis a été élaboré afin de calculer s'il existe un quotient de risque d'effets nocifs chez les organismes aquatiques. La concentration environnementale estimée (CEE) prudente est fondée sur la concentration la plus élevée connue mesurée dans un échantillon d'effluent municipal tirée de l'étude de Brown et al. (non daté), soit 1,3 × 10-3 mg/L.
On a déterminé une valeur prudente de la concentration estimée sans effet (CESE) à partir de la deuxième valeur de la toxicité la plus faible relevée, soit une valeur de toxicité aiguë pour la truite arc-en-ciel de 1 mg/L (Cope et al., 1997). Les paramètres de la truite arc-en-ciel ont été préférés à ceux des bactéries, car on considère qu'ils sont plus représentatifs des autres paramètres aquatiques, tout en étant des valeurs prudentes. De plus, V. fischeri vit dans un milieu marin, alors que le scénario d'exposition vise l'eau douce. Cette valeur de toxicité aiguë de 1 mg/L pour la truite arc-en-ciel a été divisée par un facteur d'évaluation de 100 afin de tenir compte des incertitudes liées à l'extrapolation de la toxicité aiguë à la toxicité chronique et de l'extrapolation de la valeur de la CL50 constatée en laboratoire à une valeur sans effet sur le terrain. La CESE obtenue était de 0,01 mg/L.
Le quotient de risque prudent (CEE/CESE : 0,0013/0,01) de 0,13 pour les espèces pélagiques sensibles est inférieur à 1, ce qui indique qu'il est peu probable que les expositions soient suffisamment élevées pour être nocives aux organismes aquatiques.
De plus, Mega Flush, outil d'Environnement Canada qui sert à estimer les rejets à l'égout issus d'utilisations par les consommateurs, a été utilisé pour estimer la concentration possible de l'hydroxyanisole butylé dans différents cours d'eau récepteurs d'effluents issus des usines de traitement des eaux usées dans lesquelles ont été rejetés par les consommateurs des produits contenant cette substance (Environnement Canada, 2009b). Ce modèle est conçu de manière à fournir des estimations sur la base d'hypothèses prudentes en ce qui concerne la quantité de produit chimique utilisé et rejeté par les consommateurs.
Par défaut, on suppose des pertes de 100 % associées à l'utilisation, une utilisation de la substance par les consommateurs de plus de 365 jours par année ainsi qu'un débit des effluents sur tous les sites au 10e centile de la valeur. Ces estimations sont réalisées pour 1 000 sites de rejet environ dans tout le Canada, prenant donc en compte les usines de traitement des eaux usées les plus importantes du pays.
L'équation et les entrées utilisées pour calculer la CEE de l'hydroxyanisole butylé dans les eaux réceptrices sont décrites dans le rapport d'Environnement Canada (2009c). Un scénario a été exécuté en utilisant la valeur déclarée pour le volume total de la substance à être utilisé au Canada en 2006. De plus, dans ce scénario, certaines valeurs des paramètres par défaut ont été modifiées d'après les données disponibles, afin d'être plus réaliste. En particulier, des taux d'élimination provenant des usines de traitement des eaux usées primaires de 11,9 % a été obtenue à partir du modèle SimpleTreat (SimpleTreat, 1997) et un taux d’élimination provenant des usines de traitement des eaux usées secondaires de 52,3% a été obtenue à partir du modèle ASTreat (ASTreat, 2006) et un taux d’élimination provenant des usines de traitement des eaux usées primaires et secondaires de 72%. Les conséquences induites globalement par les valeurs des paramètres choisis font que ce scénario est modérément prudent.
Selon ce scénario, l'outil a calculé que la CEE dans les cours d'eau récepteurs variait de 3,2 x 10-6 à 4,3 x 10-3 mg/L. La gamme de quotients de risques résultante (CEE/CESE) est de 3,2 x 10-4à 0,43 (3,2 x 10-6 / 0,01 à 4,3 x 10-3 / 0,01) pour les espèces pélagiques sensibles – toutes les valeurs étant inférieure à 1. Étant donnée la nature conservatrice de ce scénario – et particulièrement l’assomption que 100% de la substance uttilisée par les consommateurs est perdue par les égouts - ceci indique qu'il est peu probable que les expositions soient suffisamment élevées pour être nocives aux organismes aquatiques.
Rejets industriels
Étant donné que l'hydroxyanisole butylé est utilisé dans un cadre industriel et qu'une partie importante de cette substance pourrait être rejetée dans l'eau, des scénarios propres aux sites ont été utilisés pour estimer la concentration de la substance résultant des rejets industriels à cinq sites où l'utilisation de cette substance est connue. Le scénario pour chaque site est prudent, c'est-à-dire qu'il suppose que la quantité maximale pour chaque déclarant, d’après les quantitées déclarées en 2006, de la substance est employée et que les pertes dans les égouts sont élevées et qu'elles représentent 5 % de la quantité totale provenant du nettoyage de contenants de produits chimiques et d'équipement de traitement. Les cinq scénarios présument en outre que les rejets se produisent 250 jours par an, habituellement pour les petites et moyennes installations, et qu'ils sont acheminés vers une usine de traitement des eaux usées avec un taux d'élimination propre au site allant de 12 % (traitements primaires) à 72 % (traitements primaires et secondaires). D'après les hypothèses formulées ci-dessus, et en appliquant des facteurs de dilutions propres aux sites de (à un facteur maximal de 10) aux concentrations résultantes dans les effluents, les cinq scénarios de rejets industriels donnent une gamme de concentration en milieu aquatique de 5,3 x 10-5 à 2,8 × 10-4 mg/L.
La gamme de quotient de risque prudent résultante (CEE/CESE) de 5,3 x 10-3 (5,3 x 10-5 / 0,01) à 0,028 (2,8 x 10-3 / 0,01) pour les espèces pélagiques sensibles est inférieure à 1, ce qui indique qu'il est peu probable que les expositions soient suffisamment élevées pour être nocives aux organismes aquatiques.
Étant donné que la majorité des rejets d'hydroxyanisole butylé serait issue d'utilisations par les consommateurs et comme les résultats de la modélisation de la fugacité montrent que la majeure partie de la substance rejetée dans l'eau restera dans ce milieu, il est peu probable que des organismes d'autres sites ou d'autres milieux y soient exposés.
Les renseignements disponibles révèlent que l'hydroxyanisole butylé n'a pas le potentiel de causer des effets écologiques nocifs au Canada.
Incertitudes dans l'évaluation des risques pour l'environnement
Malgré certaines incertitudes liées à l'utilisation de modèles RQSA pour l'estimation de la persistance et de la bioaccumulation, l'hydroxyanisole butylé est une molécule organique relativement simple, ce qui permet d'accorder un degré de confiance raisonnablement élevé aux prévisions modélisées. En outre, les modèles RQSA étaient fondés sur les valeurs estimées de certaines propriétés physiques et chimiques clés (notamment la pression de vapeur, la solubilité dans l'eau et le log Koe). Il y a aussi de l’incertitude en ce qui à trait au potentiel de dérèglement du système endocrinien de l’hydroxyanisole butylé et son importance écologique, ce qui a été adressé en partie a l’aide de facteurs d’évaluation qui extrapolent les données conventionnelles sur les effets aiguë jusqu'à une valeur chronique sans effets sur le terrain qui devrait tenir compte des effets potentiels subtiles d’une exposition à long terme.
Évaluation de l'exposition
Milieu naturel et nourriture
Au Canada, on a décelé aucune concentration d'hydroxyanisole butylé dans l'eau potable (courriel du Bureau de l'eau, de l'air et des changements climatiques de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée).
Aux États-Unis, l'hydroxyanisole butylé est inscrit sur la liste des « substances pouvant contaminer l'eau potable » (US EPA, 2008). L'hydroxyanisole butylé a été « identifié provisoirement » dans des échantillons d'eau brute et d'eau traitée dans le cadre d'un examen attentif des services d'eau publics au New Jersey (NJDEP, 2003). Stiles et al. (2008) ont recueilli de l'eau brute et de l'eau traitée à des installations de traitement de l'eau dans le nord du New Jersey; de l'hydroxyanisole butylé a été décelé, mais non quantifié, à la fois dans l'eau brute et l'eau traitée. En 1999-2000, la US Geological Survey a recueilli des échantillons d'eau dans plus de 139 cours d'eau situés dans 30 États, à des sites en aval de zones d'intense urbanisation ou d'élevage de bétail; l'hydroxyanisole butylé a été détecté dans 2 des 85 échantillons (concentration maximale de 0,2 µg/L) (Kolpin et al., 2002). L'hydroxyanisole butylé a été détecté dans l'eau de surface de la rivière Colorado (24 ng/L) mais non dans les échantillons prélevés dans le delta des rivières Sacramento et San Joaquin (Soliman et al., 2007).
En Allemagne, on a détecté de l'hydroxyanisole butylé dans l'eau de surface de cours d'eau et de rivières (concentration maximale de 35 ng/L) (Boltz et al., 2001). Cette substance a été détectée invariablement (concentration non précisée) dans des échantillons de la rivière Po (Italie) au cours de la période 1994-1996 (Davi et Gnudi, 1999). En Espagne, l'hydroxyanisole butylé a été décelé dans 6 des 20 échantillons prélevés à l'effluent d'usines de traitement des eaux usées municipales et dans 3 des 30 échantillons d'eau fluviale (Gomez et al., 2009).
L'absorption d'hydroxyanisole butylé provenant de l'eau potable a été calculée en utilisant la concentration maximale de 0,2 µg/L établie dans l'étude de 1999-2000 de la US Geological Survey (Kolpin et al., 2002). L'absorption estimée maximale (nourrissons nourris au lait maternisé) était de 0,02 µg/kg p.c. par jour, ce qui est négligeable en comparaison avec l'absorption estimée provenant des aliments et des produits de soins personnels (voir les sections suivantes).
Nourriture
Selon le titre 16, tableau XI, du Règlement sur les aliments et drogues, l'hydroxyanisole butylé est un antioxydant qui peut être utilisé dans de nombreux aliments. L'hydroxyanisole butylé peut être ajouté à certains aliments jusqu'à des concentrations maximales précisées dans le Règlement sur les aliments et drogues ou peut être utilisé en association avec l'hydroxytoluène butylé, le gallate de propyle ou le TBHQ jusqu'à une concentration maximale totale, pour tous les antioxydants combinés, équivalant à la concentration maximale de l'hydroxyanisole butylé utilisé seul. Les concentrations maximales sont fondées soit sur un pourcentage de la teneur totale en lipide d'un aliment donné soit sur le poids total de l'aliment (Canada, 1978). Les concentrations réelles d'hydroxyanisole butylé ont été trouvées pour certains aliments qui ont été pris en compte dans l'évaluation de l'exposition. Pour les autres aliments, on a supposé qu'ils contenaient toujours la concentration maximale permise d'hydroxyanisole butylé, sauf lorsque la substance pouvait être utilisée en association avec d'autres antioxydants. Dans ce cas, on a supposé que la concentration d'hydroxyanisole butylé dans les aliments était une fraction (moitié, tiers ou quart, selon le nombre d'antioxydants permis) de la concentration maximale permise dans le mélange d'antioxydants. Certains aliments peuvent également contenir de l'hydroxyanisole butylé lorsque de la vitamine A ou D y est ajouté, car l'utilisation d'hydroxyanisole butylé est autorisée dans ces vitamines.
L'évaluation de l'exposition comprenait, parmi les aliments autorisés à contenir de l'hydroxyanisole butylé, ceux qui contribuent de façon significative à l'alimentation ou qui sont populaires auprès des enfants et non ceux qui ne contribuent pas de façon significative à l'exposition. De plus, tous les aliments (à l'exception du lait de vache) auxquels les vitamines A et D doivent être ajoutées ont été exclus de l'évaluation, car la contribution de l'hydroxyanisole butylé comme ingrédient dans les préparations de vitamines A et D est très faible. L'exposition à l'hydroxyanisole butylé découlant de l'ajout des vitamines A et D dans le lait de vache a été incluse dans l'évaluation, car les enfants consomment couramment du lait. Cependant, l'exposition à l'hydroxyanisole butylé provenant du lait a également été jugée négligeable. Environ 40 catégories d'aliments, telles que les sauces pour salade, notamment les sauces à base de mayonnaise et celles à base d'huile et vinaigre, ont également été incluses dans l'évaluation de l'exposition.
Les données sur l'apport alimentaire sont tirées de l'Enquête sur la santé dans les collectivités canadiennes (ESCC) – Cycle 2.2, Nutrition (2004) de Statistique Canada. L'apport pour toutes personnes confondues sur une journée qui a été mentionné par les répondants a été utilisé, et aucun rajustement n'a été effectué pour tenir compte de l'apport quotidien habituel, rajustement statistique servant à estimer la distribution de l'exposition quotidienne moyenne à long terme. Les données sur l'exposition ont été rajustées en fonction du poids corporel (données autodéclarées et données mesurées) de façon à ce qu'elles soient représentatives de la population canadienne. Comme l'ESCC ne mentionne pas les poids corporels des enfants de moins de 2 ans, des valeurs tirées de Continuing Survey of Food Intakes by Individuals (CSFII, 1994-1996, 1998) ont été utilisées.
Une évaluation probabiliste de l'exposition a été menée. Les apports quotidiens moyens d'hydroxyanisole butylé estimés toutes personnes confondues provenant de l'alimentation pour tous les groupes d'âge des consommateurs sont présentés à l'annexe 1. Les valeurs de l'apport moyen variaient de 0,023 à 0,095 mg/kg p.c. par jour, selon le groupe d'âge.
Plusieurs aliments sont une source d'exposition à l'hydroxyanisole butylé chez les nourrissons de moins d'un an. Parmi les aliments qui représentent plus de 10 % de l'exposition totale à l'hydroxyanisole butylé dans ce groupe d'âge, notons les mélanges en poudre pour desserts, les céréales prêtes à consommer, les craquelins et le pain. Les graisses et les huiles sont des sources d'exposition pour les consommateurs de tous les groupes d'âge, sauf chez les nourrissons de moins d'un an, représentant entre 16 et 24 % de l'exposition totale à l'hydroxyanisole butylé chez les consommateurs âgés de plus d'un an. D'autres aliments qui représentent chacun plus de 10 % de l'exposition totale à l'hydroxyanisole butylé chez les sujets âgés de plus d'un an sont la margarine, les sauces pour salade, les mélanges secs pour desserts, le pain, les céréales prêtes à consommer et les mélanges en poudre pour boissons.
Bien que certaines catégories d'aliments qui pourraient constituer des sources mineures d'exposition à l'hydroxyanisole butylé n'aient pas été incluses dans l'évaluation, il se peut que l'exposition à cette substance ait été surestimée en raison du peu de données quantitatives trouvées pour tenir compte des facteurs suivants : les concentrations réelles d'hydroxyanisole butylé par rapport aux concentrations maximales autorisées dans le Règlement sur les aliments et drogues; les concentrations réelles d'hydroxyanisole butylé en association avec d'autres antioxydants; le fait que des fabricants puissent avoir abandonné l'utilisation de l'hydroxyanisole butylé dans certains des aliments pour lesquels l'utilisation de la substance est autorisée; les pertes possibles d'hydroxyanisole butylé dans les aliments pendant le traitement, le transport et l'entreposage.
Produits de soins personnels
L'hydroxyanisole butylé est une composante des produits de soins personnels, comme les déodorants, les shampooings et les lotions pour le corps (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée). Aucune étude n'a été relevée portant sur l'absorption in vivo de l'hydroxyanisole butylé chez les humaines ou des animaux de laboratoire. Schumann (1991) a fait état de l'absorption in vivo de l'hydroxyanisole butylé par la peau humaine. Dans le cadre de trois essais en parallèle portant sur l'absorption cutanée (abdomen) chez des femmes de 24 ans, l'hydroxyanisole butylé a été appliqué sous forme d'onguent eau dans l'huile pendant 16 heures. La concentration la plus élevée dans le liquide de cuve était de 5,34 % de la dose appliquée, après l'avulsion cutanée complète. Par conséquent, un taux d'absorption de 5 % a été appliqué dans la modélisation à l'aide de ConsExpo (2006) pour les produits de soins personnels. L'absence de toxicité notée dans les études sur l'exposition cutanée (vois la section « Évaluation des effets sur la santé » ci-après) est conforme avec la faible valeur d'absorption cutanée estimée.
L'exposition estimée par l'utilisation de produits de soins personnels est présentée à l'annexe 2. Les estimations varient, selon la concentration d'hydroxyanisole butylé dans le produit, la surface corporelle sur laquelle le produit a été appliqué ainsi que la durée de l'exposition. Les données disponibles sur la concentration d'hydroxyanisole butylé sont présentées sous forme d'intervalle. L'intervalle le moins élevé était de 0 % à 0,1 %. L'intervalle de 0,3 % à 1 % a été choisi pour calculer l'absorption maximale (prudente), car parmi les quelques milliers de produits de soins personnels qui contiennent de l'hydroxyanisole butylé que l'on trouve au Canada, presque tous contiennent de l'hydroxyanisole butylé à des concentrations allant jusqu'à 1 %, le plupart ne contenant qu'un maximum de 0,1 % d'hydroxyanisole butylé. Bien que quelques produits contiennent des concentrations supérieures à 1 %, ils ont été jugés non représentatifs de l'ensemble de la base de données. Les produits qui sont utilisés plus souvent et qui couvrent de grandes surfaces corporelles (shampooings, lotion pour le corps) contribuaient le plus à l'absorption combinée des produits les plus fréquemment utilisés. Pour ces produits, la concentration d'hydroxyanisole butylé correspondant au 95e centile a été utilisée pour estimer l'absorption, afin de refléter l'exposition de façon plus prudente.
Les intervalles d'absorption combinée d'hydroxyanisole butylé contenu dans les produits de soins personnels fréquemment utilisés sont présentés au tableau 8. Le groupe présentant l'absorption estimée maximale d'hydroxyanisole butylé, de 0,07 mg/kg p.c. par jour, est les enfants âgés de 6 mois à 5 ans, suivi de près par le groupe des enfants âgés de 5 à 12 ans (0,06 mg/kg p.c. par jour) et les femmes (0,06 mg/kg p.c. par jour).
| Produit | Absorption (mg/kg p.c. par jour)1 | |
|---|---|---|
| Moyenne | Maximale | |
| 1 L'absorption moyenne est fondée sur l'hypothèse que la concentration d'hydroxyanisole butylé est de 0,1 %. La plupart des produits faisaient partie de cette catégorie. L'absorption maximale est fondée sur l'hypothèse que la concentration d'hydroxyanisole butylé est de 0,1 %, sauf indication contraire. L'absorption cutanée est de 5 % (Schumann, 1991). 2 On suppose que le shampooing est utilisé tous les deux jours. 3 Parmi les autres produits utilisés quotidiennement, notons le fard à paupières, le fard à cils et le crayon pour les yeux. Leur apport à l'absorption totale est négligeable. L'exposition orale provenant du rouge à lèvres est négligeable comparativement à l'exposition par les aliments (annexe 1). |
||
| Nourrissons | ||
| Crème pour bébés | 0,004 | 0,04 |
| Total | 0,004 | 0,04 |
| Enfants de 6 mois à 5 ans | ||
| Shampooing2 | 0,0023 | 0,00989 (hydroxyanisole butylé 0,43 %, 95ecentile) |
| Lotion pour le corps, appliquée deux fois par jour | 0,0177 | 0,0583 (hydroxyanisole butylé 0,33 %, 95ecentile) |
| Total | 0,02 | 0,07 |
| Enfants de 5 à 12 ans | ||
| Shampooing | 0,0015 | 0,00646 (hydroxyanisole butylé 0,43 %, 95ecentile) |
| Lotion pour le corps, appliquée deux fois par jour | 0,0148 | 0,0489 (hydroxyanisole butylé 0,33 %, 95ecentile) |
| Total | 0,02 | 0,06 |
| Hommes | ||
| Crème à raser | 0,000 141 | 0,000 141 (tous les produits de rasage se situent dans l'intervalle 0 à 0,1 %) |
| Lotion après rasage | 0,000 846 | 0,000 846 (tous les produits de rasage se situent dans l'intervalle 0 à 0,1 %) |
| Gel capillaire | 0,000 207 | 0,00207 |
| Déodorant en aérosol | 0,00366 | 0,00366 (tous les déodorants se situent dans l'intervalle 0 à 0,1 %) |
| Shampooing | 0,001 | 0,00432 (hydroxyanisole butylé 0,43 %, 95ecentile) |
| Total | 0,006 | 0,01 |
| Femmes3 | ||
| Déodorant en aérosol | 0,00366 | 0,00366 (tous les déodorants se situent dans l'intervalle 0 à 0,1 %) |
| Maquillage pour le visage | 0,000 564 | 0,005 64 |
| Eau de toilette | 0,00128 | 28 (aucun parfum dans cet intervalle; valeur utilisée pour l'intervalle de 0 à 0,1 %) |
| Fixatif pour cheveux | 0,000 507 | 0,00507 |
| Nettoyant pour le visage | 0,000 352 | 0,00352 |
| Crème pour le visage, appliquée deux fois par jour | 0,00113 | 0,00372 (hydroxyanisole butylé 0,33 %, 95ecentile) |
| Lotion pour le corps, appliquée deux fois par jour | 0,0113 | 0,0372 (hydroxyanisole butylé 0,33 %, 95ecentile) |
| Shampooing | 0,001 | 0,00432 (hydroxyanisole butylé 0,43 %, 95ecentile) |
| Total | 0,02 | 0,06 |
Le degré de confiance associé à la base de données sur l'exposition à l'hydroxyanisole butylé est élevé. Des renseignements ont été relevés sur les concentrations d'hydroxyanisole butylé contenues dans de nombreux produits de soins personnels vendus au Canada. Ces produits pourraient être la principale source d'exposition à l'hydroxyanisole butylé.
Évaluation des effets sur la santé
L'annexe 3 présente un aperçu des effets déclarés de l'hydroxyanisole butylé sur la santé des animaux de laboratoire.
L'hydroxyanisole butylé a été classifié comme étant probablement cancérogène pour l'homme (2B), selon des preuves insuffisantes chez l'homme et des preuves concluantes chez les animaux de laboratoire (CIRC, 1986, 1987). Il a également été classé, dans le US National Toxicology Program Report on Carcinogens, parmi les substances dont on peut raisonnablement présumer qu'elles sont cancérogènes, à partir du sixième rapport annuel en 1991 jusqu'au onzième rapport en 2005 (NTP, 2005). Le CIRC (2003) a conclu que le mode d'action expliquant la cancérogénicité provoquée par l'hydroxyanisole butylé chez les animaux de laboratoire mécanisme n'était pas transposable chez l'humain. La Food and Drug Administration des États-Unis classe l'hydroxyanisole butylé comme un produit chimique qui est généralement reconnu inoffensif (GRAS) lorsque sa concentration total en antioxydant ne dépasse pas 0,02 % en poids de la teneur en huile ou en gras des aliments (NTP, 2005). De plus, lors de sa 33e réunion de 1989, le comité conjoint d'experts FAO/OMS sur les additifs alimentaires (JECFA) ont alloué un apport quotidien admissible (AQA) pour les humains de 0 à 0,5 mg/kg p.c. (OMS, 1989). Au Canada, l'utilisation de cette substance dans les aliments est autorisée en vertu du titre 16 du Règlement sur les aliments et les drogues) (Canada, 1978).
Chez les rats, une grande partie de l'hydroxyanisole butylé administré par voie orale est excrétée rapidement par l'urine, dans les matières fécales et par l'air expiré (revu dans Ito et Hirose, 1987). Les principaux métabolites sont des O-glucuronides et des O-sulfate conjugués, ainsi que du TBHQ, produits par l'O-déméthylation. Le TBHQ peut ensuite se conjuguer avec le glucuronide ou le sulfate et également participer au cycle redox avec la quinone correspondante, TBQ (tert-butylquinone), pour produire des espèces réactives à l'oxygène (évalué par l'OMS, 1998). On a noté la présence de composés conjugués de TBHQ dans l'urine ainsi que des variations dans les espèces produites en fonction de la proportion de la dose éliminée dans l'urine et les matières fécales et de l'importance des glucuronides ou des sulfates conjugués (Conning et Phillips, 1986), le mode d'élimination des humains étant plus semblable à celui des rats qu'à celui des chiens.
L'administration d'hydroxyanisole butylé à une concentration de 0,75 % dans le régime alimentaire des rats Sprague-Dawley mâles sur une période de 3 jours a entraîné des concentrations d'ARNm hépatique 40 fois plus élevées pour l'isoenzyme uridine 5'-diphosphate (UDP) glucuronyltransférase (UGT1*06), alors qu'elle a eu très peu d'effet sur les concentrations d'ARNm pour les enzymes du cytochrome P450 (Buetler et al., 1995). L'administration d'hydroxyanisole butylé à une concentration de 0,75 % dans le régime alimentaire des souris CD-1 femelles sur une période de 3 semaines a entraîné une glucuronidation d'œstradiol et d'œstrone par les microsomes hépatiques 2 et 3 fois plus élevée, respectivement (Zhu et al., 1997). La capacité de glucuronidation des cellules du petit intestin a également augmenté chez les souris Swiss Webster femelles, lorsqu'on leur administrait de l'hydroxyanisole butylé à une concentration de 1 % dans leur régime pendant 10 jours (Hjelle et al., 1985).
Le profil toxicologique de l'hydroxyanisole butylé administré par ingestion établi avant 1982 n'a soulevé aucune inquiétude relativement à la génotoxicité ou à la toxicité à court et à long terme de la substance. Aucune des études à long terme n'a été menée après le milieu des années 1960 et seulement une étude à court terme a été menée au cours de cette période; par conséquent, ces études ont été réalisées avant l'entrée en vigueur, une décennie plus tard, des bonnes pratiques en laboratoire et des protocoles d'étude normalisés. Certaines des études à long terme comptaient des sections sur la reproduction dans leur protocole. La plupart de ces études ne mettaient pas la substance à l'essai jusqu'à la dose maximale admissible, et peu d'observations histopathologiques étaient effectuées dans le cadre des études des effets de la substance administrée avec les aliments. Notons, comme exception, l'établissement de la dose maximale admissible à une concentration de 2 % pour l'hydroxyanisole butylé administré dans le régime alimentaire des rats (Wilder et Kraybill, 1948) ainsi que la découverte de la dégénérescence des cellules hépatiques chez les chiens sevrés, auxquels on administrait 250 mg/kg p.c. par jour d'hydroxyanisole butylé dans leur régime sur une période de 15 mois (Wilder et al., 1960).
La première étude à avoir signalé l'action cancérogène de l'hydroxyanisole butylé (Ito et al., 1982, 1983a) a été menée auprès de rats F344 mâles et femelles nourris au granulé, auquel on a incorporé la substance à des concentrations de 0 %, de 0,5 % et de 2 %. Une analyse a indiqué qu'en fait, le traitement avait réduit les concentrations de la substance à près de 0,25 % et de 1 %. Toutefois, une étude ultérieure a montré qu'il n'y avait aucune perte de la substance pendant le traitement (déclaré par l'OMS, 1983). Outre une baisse du gain de poids corporel à la dose élevée, cette étude a fait état d'une hausse très importante de l'incidence de la néoplasie et de l'hyperplasie du pré-estomac (papillomes et carcinomes malpighiens) chez les animaux traités, ce qui indique une relation dose-réponse claire. On n'a noté aucune différence significative dans l'incidence des tumeurs dans les autres organes. La prolifération des voies biliaires, présente dans tous les groupes, a diminué de manière proportionnelle à la dose administrée au sein des groupes recevant l'hydroxyanisole butylé. Selon une analyse subséquente des lames d'anatomopathologie, les néoplasmes n'étaient présents que dans le pré-estomac des animaux recevant la dose élevée de la substance.
Il existe trois études publiées sur la cancérogénicité qui évaluent les effets de l'hydroxyanisole butylé chez les rats F344 mâles (Ito et al., 1986; Masui et al., 1986; Williams et al., 1990b). L'ensemble de ces études faisait état d'augmentations statistiquement significatives des papillomes du pré-estomac à des concentrations de 1 % ou plus d'hydroxyanisole butylé dans leur régime alimentaire ainsi que des carcinomes malphigiens du pré-estomac à des concentrations de 2 %. L'étude menée par Ito et al. (1986) a établi une concentration sans effet observé (CSEO) d'hydroxyanisole butylé de 0,125 % dans le régime alimentaire (mesurée à 0,11 %, équivalant à 55 mg/kg p.c. par jour) pour l'hyperplasie du pré-estomac et une dose sans effet nocif observé (DSENO) d'hydroxyanisole butylé de 0,5 % (mesurée à 0,47 %, équivalant à 230 mg/kg p.c. par jour) pour l'induction des papillomes du pré-estomac.
Dans le cadre d'études sur d'autres rongeurs d'une durée de deux ans, des carcinomes malphigiens et des papillomes du pré-estomac ont été induits chez des souris B6C3F1 mâles à des concentrations de 0,5 % et de 1 % de la substance administrée dans leur régime alimentaire et chez des hamsters dorés de Syrie mâles à des concentrations de 1 % et de 2 % de la substance administrée dans leur régime (Masui et al., 1986). Ito et al. (1983b) ont montré qu'une concentration de 1 % ou de 2 % d'hydroxyanisole butylé administré dans le régime alimentaire des hamsters dorés de Syrie mâles a induit la totalité des papillomes du pré-estomac sur une période de 24 semaines (5,5 mois).
Aucune tumeur dans les tissus de l'estomac glandulaire ou les tissus de l'œsophage analogues n'a été observée dans les études sur la cancérogénicité menée chez des espèces sans pré-estomac. On n'a observé aucun changement macroscopique dans l'estomac des cochons d'Inde exposés à l'hydroxyanisole butylé à une concentration de 1 % dans leur régime alimentaire sur une période de 20 mois (Ito et Hirose, 1987).
Après la publication de la première étude sur la cancérogénicité chez les rats mentionnant le pré-estomac des rats comme principal organe cible de l'hydroxyanisole butylé, de nombreuses études à court terme ont été réalisées sur des souris, des rats et des hamsters afin de caractériser cet effet cancérigène de l'hydroxyanisole butylé. Des observations sur le développement et les caractéristiques des lésions prénéoplasiques, l'indice de marquagehépatique des cellules du pré-estomac ainsi que la durée et la réversibilité des lésions prolifératives du pré-estomac ont été signalées (OMS, 1987, 1989). Des études menées par Altmann et al. (1985) ont permis de conclure que la toxicité associée à l'hydroxyanisole butylé ciblant le pré-estomac était liée à une irritation locale et n'était pas un effet systémique. Chez les animaux auxquels on a administré de l'hydroxyanisole butylé par gavage, on a observé des modifications hyperplasiques à l'apex du pré-estomac, alors que l'administration de la substance dans le régime alimentaire entraînait une hyperplasie dans la région de la crête de séparation. Cette preuve appuie l'hypothèse selon laquelle les lésions du pré-estomac induites par la substance découlent d'un renouvellement des cellules, d'un dommage ou d'une irritation locale du tissu et laisse supposer que cette substance a une toxicité propre à la voie visée.
Des études à court terme ont également été menées sur des espèces sans pré-estomac (chiens, porcs, singes). Aucune de ces études n'a démontré une réponse proliférative provoquée par l'hydroxyanisole butylé aussi importante que celle observée dans les tissus analogues du pré-estomac des rongeurs.
Dans différentes études, des chiens Beagle des deux sexes recevaient des doses d'hydroxyanisole butylé de 0 %, 1,0 % et 1,3 % (doses réelles non calculées; Ikeda et al., 1986) ou de 0 %, 0,25 %, 0,5 % et 1 % (équivalant à 0, 54, 111 et 219 mg/kg p.c. par jour chez les mâles et à 0, 62, 112 et 231 mg/kg p.c. par jour chez les femelles) (Tobe et al., 1986) dans leur régime alimentaire sur une période de 180 jours (26 semaines). On a noté une baisse du poids corporel par rapport aux témoins à toutes les doses, indiquant une signification statistique à la dose la plus élevée seulement (1,3 % du régime). Les deux études ont signalé des augmentations importantes du poids du foie en fonction de la dose administrée chez les chiens mâles et femelles de tous les groupes de traitement, accompagnées de changements histologiques décrits comme une altération du tissu adipeux, une enflure ou une hypertrophie, ainsi que la prolifération du réticulum endoplasmique lisse, observée par microscopie électronique (Ikeda et al., 1986). Ces résultats concordent avec l'activité accrue des enzymes hépatiques (aminopyrine déméthylase, UDP-glucuronyltransférase, glutathion S-transférase et époxyde-hydratase) et l'augmentation des concentrations du cytochrome P450, de la cytochrome c réductase et du cytochrome b qui ont également été observés dans cette étude. Le poids de la thyroïde a également augmenté de façon statistiquement significative par rapport aux témoins aux deux doses de traitement, sauf à la dose élevée administrée aux femelles (Ikeda et al., 1986). Aucune modification histologique de la thyroïde n'a été observée (Tobe et al., 1986). Aucune étude n'a indiqué de lésions hyperplasiques ou prolifératives de l'œsophage inférieur ou de l'épithélium de l'estomac. Selon l'index mitotique de la couche basale de l'épithélium de l'œsophage, il n'y eu aucun effet par rapport aux témoins (Tobe et al., 1986). La dose minimale avec effet observé (DMEO) chez le chien, établie en fonction de l'augmentation du poids du foie et des changements histopathologiques, était de 0,25 %, soit l'équivalent de 54 mg/kg p.c. par jour.
Étant donné l'intérêt porté à l'effet de l'hydroxyanisole butylé sur le pré-estomac des rongeurs, des échantillons de tissus gastriques ayant été préservés à la suite d'une étude de 16 semaines sur l'embryotoxicité de l'hydroxyanisole butylé chez les truies Landrace danoise (Hansen et al., 1982) ont été évalués après coup (Olsen, 1983; Würtzen et Olsen, 1986). Au cours de cette étude, l'hydroxyanisole butylé a été intégré à l'alimentation de groupes comptant de 9 à 13 truies à des doses de 0, 50, 200 et 400 mg/kg p.c. par jour (équivalant à des concentrations de 0 %, 0,5 %, 1,9 % et 3,7 % dans l'alimentation) à partir du premier accouplement jusqu'au 110e jour de gestation. On a observé une baisse importante du gain de poids corporel chez les mères du groupe recevant la dose élevée (400 mg/kg p.c. par jour) ainsi que des augmentations statistiquement significatives des poids relatifs et absolus du foie et de la thyroïde proportionnellement à la dose administrée dans tous les groupes de traitement. Aucun changement histopathologique n'a été signalé dans le foie, tandis que d'importants follicules avec épithélium pavimenteux dans la thyroïde ont été notés chez certains animaux, plus particulièrement dans le groupe traité à la dose élevée. On a noté des modifications épithéliales dans la portion œsophagienne de l'estomac chez les témoins et les porcs traités, qui sont des lésions spontanées courantes chez cette espèce. De plus, un sillon d'épithélium jaune brun rugueux a été observé le long de l'œsophage chez quelques porcs des groupes d'exposition moyenne et élevée. Un examen microscopique a permis de confirmer les changements parakératosiques et la prolifération de l'épithélium de l'œsophage chez les animaux traités. Le traitement par hydroxyanisole butylé n'a eu aucun effet sur les paramètres de la reproduction et il n'y a eu aucun signe probant d'un effet tératologique attribuable à cette substance. D'après les poids relatifs et absolus élevés de la thyroïde et du foie et les changements histopathologiques dans la glande thyroïde à toutes les doses de traitement, la DMEO établie dans le cadre de cette étude était de 50 mg/kg p.c. par jour (Hansen et al., 1982; Olsen, 1983; Würtzen et Olsen, 1986).
On a administré par gavage de l'hydroxyanisole butylé dissous dans l'huile de maïs à des singes cynomolgus femelles 5 jours par semaine pendant 12 semaines à des doses initiales de 0, 125 et 500 mg/kg p.c. par jour (Iverson et al., 1986). Les vomissements fréquents dans le groupe traité à la dose élevée suivant le gavage a entraîné la diminution de la dose à 250 mg/kg p.c. par jour après 20 jours. Aucune lésion attribuable au traitement par hydroxyanisole butylé n'a été observée par gastroscopie durant l'étude ni à l'autopsie. Plus précisément, l'examen histologique du tissu épithélial gastrique n'a montré aucune prolifération ou hyperplasie des couches épithéliales inhabituelle ni aucun épaississement des couches épithéliales. Cependant, l'index mitotique de 5 000 cellules analysées à partir de la couche basale de l'épithélium pavimenteux simple prélevées dans des régions de l'œsophage à 5 mm du cardia était environ deux fois plus élevé dans le groupe traité à la dose élevée. Le poids du foie, tant la valeur absolue que la valeur relative au poids corporel, avait augmenté proportionnellement à la dose administrée aux deux doses de traitement, et une microscopie électronique des échantillons du foie a indiqué une cytomégalie, mais aucun développement accru du réticulum endoplasmique lisse. Le traitement par hydroxyanisole butylé n'a eu aucun effet sur l'activité de l'aminopyrine-N-déméthylase des monooxygénases microsomales hépatiques, de l'acétanilide hydroxylase ou de l'éthoxycoumarine-dééthylase, sur l'activité de la glutathion transférase cytosolique vis-à-vis de l'aryle ou les substrats d'époxy, ou sur la concentration du cytochrome P450 du foie. Une baisse de l'activité de l'éthoxyrésorufine-dééthylase a été observée chez les animaux traités à la dose élevée. L'activité de l'UDP-glucuronyltransférase n'a pas été évaluée. Dans le cadre de cette étude, la DMEO était de 125 mg/kg p.c. par jour, établie en fonction de l'augmentation du poids du foie.
Il a été démontré que l'hydroxyanisole butylé cause l'apparition de tumeurs dans le pré-estomac chez les rongeurs après administration par voie orale. Aucun signe de cancérogénicité n'a toutefois été observé lorsque la substance était administrée aux souris par injection sous-cutanée, injection intrapéritonéale ou application topique (Busch, 1984; NTP, 2005). Au cours d'une étude réalisée par Stoner et al. (1973), une dose totale de 6 000 mg/kg p.c. a été administrée par injection intrapéritonéale à des groupes de souris A/He sur une période de 8 semaines. La dose quotidienne calculée était de 107 mg/kg p.c. par jour. Les chercheurs ont effectué un examen macroscopique du foie, de la rate, du thymus, de l'intestin ainsi que des glandes endocrines et salivaires, de même qu'un examen microscopique des poumons. Les lésions macroscopiques dans ces tissus ont également fait l'objet d'un examen microscopique. Bien que la durée de cette étude et les paramètres examinés fût limités, on n'a signalé aucune lésion macroscopique ou histopathologique chez les animaux traités par hydroxyanisole butylé. Dans le cadre d'un essai sur les agents promoteurs de tumeurs (Berry et al., 1978), des groupes de 30 souris CD-1 ont été exposés par voie cutanée à l'hydroxyanisole butylé deux fois par semaine pendant 30 semaines. Il a été calculé que l'application de la substance à des doses de 1 mg/événement représentait un taux d'application quotidien de 10 à 15 mg/kg p.c. par jour. Au départ, les animaux recevaient une substance initiatrice (7,12-diméthylbenz[a]anthracène), et l'essai était conçu de façon à mettre à l'essai la capacité de l'hydroxyanisole butylé à agir comme agent promoteur de tumeurs. Après 30 semaines, les examens histopathologiques n'ont montré aucun signe de pathologie chez les animaux traités par hydroxyanisole butylé.
La toxicité observée dans le pré-estomac des rongeurs après administration par voie orale n'a pas été observée chez les souris C3H/Anf après une exposition à vie par voie cutanée. Des groupes de 50 souris ont été traités par voie cutanée à des doses de 0, 10 ou 10 mg d'hydroxyanisole butylé une fois par semaine tout au long de leur vie (Hodge et al., 1966). Comme les poids corporels n'étaient pas fournis dans le rapport de cette étude, une plage de doses a été calculée par l'évaluateur afin de représenter le dosage appliqué aux animaux ayant un poids corporel à l'âge adulte qui se situe dans une fourchette type. Il a été déterminé que la dose de 10 mg équivalait à des valeurs allant de 48 à 100 mg/kg p.c. par jour pour les mâles et de 57 à 133 mg/kg p.c. par jour (CSEO) pour les femelles. Les paramètres mesurés étaient le poids corporel, la survie, les observations macroscopiques à l'autopsie de chaque souris après une période de conservation dans le formol ainsi qu'un examen histopathologique de la peau si l'autolyse ne s'était pas produite. Les observations macroscopiques à l'autopsie et l'examen histopathologique de la peau n'ont indiqué aucune lésion attribuable au traitement, mais des cas isolés de lésions cutanées (attribuées au rasage hebdomadaire de la fourrure) ont été observés. Bien que la portée des examens des animaux était limitée, cette étude (Hodge et al., 1966) démontre une absence de toxicité générale après une exposition à long terme par voie cutanée des rongeurs à l'hydroxyanisole butylé. La conception limitée des études pourrait être à l'origine de l'absence de lésions signalées dans le cadre des études sur la toxicité de l'hydroxyanisole butylé administré par voies cutanée, sous-cutanée et intrapéritonéale. On a toutefois laissé entendre que les lésions observées au cours des études d'exposition à l'hydroxyanisole butylé par voie alimentaire pouvaient être une toxicité locale propre au tissu et non un effet systémique (Altmann et al., 1985).
De nombreux essais de mutagénicité in vitro sur l'hydroxyanisole butylé ont été menés (révisés dans Williams et al., 1999) et comptaient des essais de mutation inverse sur des souches de Salmonella typhimurium, la mutation au locus HGPRT sur des cellules de mammifères, ainsi que des essais d'aberrations chromosomiques et des essais d'échange de chromatides sœurs dans diverses cultures cellulaires de hamsters chinois. Seules les études d'aberrations chromosomiques in vitro avec activation métabolique ont donné constamment des résultats positifs, alors que les résultats de la grande majorité des autres études étaient négatifs. Aucune étude sur le potentiel clastogène menée in vivo n'a été relevée pour l'hydroxyanisole butylé. Toutefois, des résultats négatifs ont été trouvés pour d'autres paramètres relatifs à l'interaction de l'acide désoxyribonucléique (ADN) in vivo dans des cellules hépatiques et le pré-estomac de rats F344, y compris la formation d'adduits de l'ADN, la majorité des études portant sur la rupture et la réparation de brins d'ADN et une étude portant sur l'induction de la synthèse non programmée de l'ADN. Un seul essai de Comet mené sur les souris a donné des résultats positifs dans l'estomac et le colon (Sasaki et al., 2002). En outre, les résultats de l'évaluation sur le potentiel clastogène du TBHQ, métabolite oxydatif de l'hydroxyanisole butylé, sont pertinents et intéressants. Les résultats des essais d'aberrations chromosomiques in vitro étaient également uniformément positifs, avec ou sans activation métabolique. Toutefois, dans les études in vivo, le TBHQ n'a pas induit d'aberrations chromosomiques ni la formation de micronoyaux (évalué par l'OMS, 1998).
De nombreuses études ont été menées sur les effets de l'hydroxyanisole butylé sur la potentialisation ou l'inhibition de la cancérogénicité au niveau du colon, du pré-estomac, de la vessie, de l'estomac, du foie, des poumons, des glandes mammaires et du pancréas, ainsi que la cancérogénicité associée à une exposition périnatale, induite par divers composés clairement cancérogènes. L'ensemble de la preuve semble indiquer que l'hydroxyanisole butylé pourrait potentialiser ou inhiber l'action des composés cancérogènes ou n'avoir aucun effet sur ceux-ci, selon la substance chimique précise mise à l'essai et les circonstances dans lesquelles l'essai a été mené (OMS, 1987, 1989).
Le comité conjoint d'experts FAO/OMS sur les additifs alimentaires (JECFA) avait demandé à plusieurs reprises qu'une étude multigénérationnelle de la toxicité de l'hydroxyanisole butylé sur le plan de la reproduction soit menée et, au cours de sa dernière évaluation de la substance (33e réunion; OMS, 1989), il a indiqué qu'une telle étude était en cours. Toutefois, lors de cette réunion, vu l'absence de cette étude, une AQA de 0 à 0,5 mg/kg p.c., établie en fonction des données tirées d'une étude de la toxicité chronique chez le rat, a été allouée. La seule nouvelle étude de reproduction, soit une étude de reproduction sur une génération de rats (Jeong et al., 2005) publiée 16 ans plus tard, n'était sûrement pas l'étude à laquelle on faisait référence. Outre l'étude menée par Jeong et al. (2005), quatre études portaient sur la toxicité de l'hydroxyanisole butylé pour le développement chez la souris (Stokes et Scudder, 1974), le rat (Vorhees et al., 1981), le lapin (Hansen et Meyer, 1978) et le porc (Hansen et al., 1982).
Jeong et al. (2005) ont mené une étude de reproduction sur une génération de rats Sprague-Dawley auxquels on administrait par gavage des doses d'hydroxyanisole butylé de 0, 10, 100 et 500 mg/kg p.c. dissous dans l'huile de maïs. Outre le fait d'avoir mis fin à l'étude lorsque la génération F1 a atteint l'âge de 13 semaines, plutôt que de produire une génération F2, les autres écarts par rapport au protocole standard d'une étude de toxicité pour la reproduction comprenaient une période de 2 semaines plutôt que de 10 semaines avant l'accouplement ainsi que l'examen de la morphologie des spermatozoïdes fondé sur la mesure des têtes des spermatozoïdes dans des préparations sèches, soit 10 des spermatozoïdes par animal, plutôt que d'examiner les anomalies des spermatozoïdes dans des préparations humides, soit un minimum de 200 spermatozoïdes par animal. De petites différences, mais statistiquement significatives, par rapport aux groupes témoins ont été signalées pour de nombreux paramètres à la dose d'hydroxyanisole butylé la plus élevée, soit 500 mg/kg p.c. par jour. Ces différences sont notamment une diminution du rapport d'accouplement et une augmentation de la durée de cohabitation avant l'accouplement chez les rats de la génération F0; une diminution du taux de testostérone et de thyroxine sérique chez les rats mâles de la génération F0 après 7 semaines de traitement; des variations des poids des organes exprimées sous forme de poids absolus et relatifs du foie, des glandes surrénales et thyroïde (augmentation), de la rate, de la prostate ventrale, des testicules et du vagin (diminution) chez de nombreux adultes des générations F0 et F1; une baisse du gain de poids corporel postnatal chez les ratons mâles et femelles de la génération F1; un retard dans l'apparition de la perméabilité vaginale et la séparation du prépuce; une diminution des poids absolu et relatif du foie chez les rats femelles sevrées de la génération F1; une diminution du nombre de spermatozoïdes dans la queue de l'épididyme chez les rats de la génération F1 exposés à la substance sur une période de 13 semaines ainsi qu'une baisse de plusieurs paramètres de motilité des spermatozoïdes et une diminution du taux de la testostérone sérique chez les sujets de ce groupe. Peu d'observations ont été effectuées sur les effets associés au traitement à des doses plus faibles, certaines portant sur les différences de poids des organes, sans observations histopathologiques connexes ou sur la mesure des têtes de spermatozoïdes réalisées à l'aide de techniques douteuses. Dans le cadre de cette étude, les changements histopathologiques des cellules épithéliales des follicules thyroïdiens observés chez les rats mâles et femelles F1 des groupes de traitement recevant des doses de 100 et 500 mg/kg p.c. par jour ainsi que la diminution des taux de testostérone sérique chez les mâles de la génération F0 après 7 semaines de traitement indiquent qu'une dose de 100 mg/kg p.c. par jour serait la DMEO pour les effets endocriniens. Les auteurs de l'étude ont cité des observations tirées d'autres études, selon lesquelles l'hypothyroïdie induite au début de la période néonatale jusqu'au sevrage entraîne des retards de la maturation sexuelle, une atrophie testiculaire, une perturbation du développement des organes accessoires de l'appareil reproducteur, une diminution du taux de gonadostimulines et une inhibition de la stéroïdogénèse.
Vorhees et al. (1981) ont réalisé une étude sur des rats Sprague-Dawley reposant sur un protocole semblable à celui de l'étude menée par Jeong et al. (2005), sauf que l'hydroxyanisole butylé était administré dans l'alimentation plutôt que par gavage et l'étude était davantage orientée sur les essais comportementaux que sur les paramètres relatifs à la pathologie ou aux systèmes reproducteur et endocrinien. La plage de doses administrées dans l'alimentation chez les rats adultes avant la reproduction et pendant la lactation était semblable à celle utilisée dans les groupes recevant les deux doses les plus élevées dans l'étude de Jeong et al. (2005) : 0 %, 0,125 %, 0,25 % et 0,5 %, représentant une moyenne de 0, 100, 200 et 400 mg/kg p.c. par jour, respectivement; toutefois, les rates en lactation recevaient des doses doubles (mentionné par les auteurs), et les rats sevrés recevaient également des doses plus élevées. Le traitement par hydroxyanisole butylé n'a eu aucun effet sur les paramètres de reproduction et des effets minimaux ont été observés dans de nombreux essais comportementaux. Un retard du développement du réflexe de tressaillement a été observé aux deux concentrations les plus élevées; le développement de la perméabilité vaginale n'a pas été touché à aucune concentration de la substance dans l'alimentation. Un retard de croissance a été noté chez les ratons aux jours 14 et 21 de la période de lactation à la concentration la plus élevée dans l'alimentation (0,5 %). En outre, dans ce groupe, le taux de mortalité a augmenté jusqu'au 30e jour de la période postnatale et exceptionnellement à la concentration de 0,25 %. Dans le cadre de cette étude, la CSEO pour la toxicité sur le plan de la reproduction était de 0,125 % d'hydroxyanisole butylé dans l'alimentation, équivalant à 100 mg/kg p.c. par jour.
Aucun effet nocif n'a été observé dans l'étude de toxicité pour le développement sur des lapins auxquels on a administré par gavage des doses d'hydroxyanisole butylé de 0, 50, 200 et 400 mg/kg p.c. par jour de la 7e à la 18ejournée de gestation (Hansen et Meyer, 1978). Il convient de noter que la période d'administration de la substance ne respecte pas les exigences actuelles (jours 6 à 29 de la période de gestation chez les lapins).
Le même groupe de recherche (Hansen et al., 1982) a mené une étude sur l'embryotoxicité de l'hydroxyanisole butylé chez les porcs Landrace danois qui recevaient des doses de 0, 50, 200 et 400 mg/kg p.c. par jour dans leur alimentation à partir du jour de leur insémination artificielle jusqu'au 110ejour de gestation. Aucun effet sur les paramètres de la reproduction et du développement n'a été constaté. Les résultats concernant la détermination du poids des organes et l'histopathologie sont décrits plus haut.
Une seule étude épidémiologique menée dans le cadre de l'étude de cohortes réalisée aux Pays-Bas n'a pas établi de corrélation entre l'absorption d'une faible concentration d'hydroxyanisole butylé dans la nourriture (environ 100 µg/jour) et le cancer de l'estomac (Botterweck et al., 2000). Au contraire, une tendance inverse a été constatée en ce qui concerne le risque relatif par rapport à une absorption plus élevée de la substance, ce qui n'était pas statistiquement significatif.
La confiance à l'égard de la base de données sur la toxicité de l''hydroxyanisole butylé est modérée. Bien que de nombreuses études de toxicité chronique, de toxicité pour la reproduction et de génotoxicité aient été recensées, il existe certaines incertitudes quant à la pertinence de la base de données actuelle pour caractériser entièrement la toxicité de la substance selon toutes les voies d'exposition et la durée de l'exposition.
Caractérisation du risque pour la santé humaine
D'après les renseignements fournis dans les études sur l'hydroxyanisole butylé tirées des publications et les évaluations du JECFA, deux effets critiques ont été recensés pour la caractérisation des risques pour la santé humaine après administration de la substance par voie orale. Le premier effet était la cancérogénèse sur l'épithélium pavimenteux simple du pré-estomac chez les rongeurs après une exposition à vie dans l'alimentation et le deuxième, une variation des mesures des fonctions endocriniennes suivant l'induction enzymatique par l'hydroxyanisole butylé. Les effets secondaires visaient principalement la glande thyroïde, mais également les hormones sexuelles et les glandes surrénales à des doses élevées après une exposition subchronique par voie orale.
Deux études de toxicité par voie cutanée dont le rapport et le protocole étaient limités ont été recensées pour l'hydroxyanisole butylé. Toutefois, au cours de l'étude de toxicité résultant de l'exposition à vie (Hodge et al., 1966), l'hydroxyanisole butylé n'a pas entraîné de toxicité générale notable chez les souris. De la même manière, la toxicité cutanée se limitait à des signes d'ulcération isolés, attribués à des blessures liées au rasage. On n'a relevé aucun signe d'hyperplasie ou d'autres lésions prénéoplasiques dans le derme, ce qui indique que le point de contact de l'exposition par voie cutanée n'était pas vulnérable à la cytotoxicité ou au renouvellement des cellules à la dose testée. L'absence de toxicité générale dans ces études limitées en temps sur l'exposition par voie cutanée a également été constaté dans le cadre d'une étude à court terme (8 semaines) sur l'exposition par voie intrapéritonéale chez des animaux auxquels on administrait des doses allant jusqu'à 107 mg/kg p.c. par jour (Stoner et al., 1973). Certains auteurs laissent entendre que les lésions observées au cours des études d'exposition par voie alimentaire étaient des effets locaux et non systémiques, et les études d'exposition par voies cutanée, sous-cutanée et intrapéritonéale, bien que peu détaillées, corroborent cette conclusion (Altmann et al., 1985).
L'hydroxyanisole butylé ajouté à l'alimentation des rats, des souris et des hamsters provoquait une hyperplasie et une néoplasie de l'épithélium pavimenteux simple du préestomac. Toutefois, dans le cadre des études à court terme, aucun signe de réponse proliférative importante dans les tissus analogues d'espèces sans pré-estomac (chiens, porcs et singes) ni de tumeurs dans les tissus de l'œsophage analogues ou les tissus de l'estomac glandulaire dans les études à long terme sur les cochons d'Inde. Selon l'étude menée par Ito et al. (1986) la CSEO pour l'hyperplasie de l'épithélium du pré-estomac chez le rat, lésion réversible, était de 0,125 % du régime alimentaire (équivalant à 55 mg/kg p.c. par jour) et la DSENO pour la néoplasie était de 0,5 % du régime alimentaire (équivalant à 230 mg/kg p.c. par jour).
Le poids de la preuve issu des données disponibles indique que cette substance n'est pas génotoxique. Les résultats des essais d'aberrations chromosomiques in vitro montrent des résultats positifs de façon constante, mais la grande majorité des portant sur les mutations ponctuelles in vitro et la formation d'adduits à l'ADN in vivo, sur l'induction de la synthèse non programmée de l'ADN et sur la rupture et la réparation de brins d'ADN dans les cellules hépatiques et le pré-estomac des rats étaient négatifs. Aucune étude portant sur le potentiel d'induction des aberrations chromosomiques in vivo n'a été trouvée pour l'hydroxyanisole butylé, mais plusieurs tests du micronoyau sur des souris ont été réalisés comme mesure du potentiel clastogène avec le TBHQ, principal métabolite oxydatif de l'hydroxyanisole butylé et un autre additif alimentaire antioxydant. En ce qui a trait à l'hydroxyanisole butylé, les résultats des études d'aberrations chromosomiques in vitro menées avec le TBHQ étaient positifs, alors que les résultats des tests du micronoyau bien menés sur des souris comme mesure in vivo du potentiel clastogène étaient négatifs (évalué par l'OMS, 1998).
La base de données indique que l'hydroxyanisole butylé provoque des dommages cellulaires, le renouvellement des cellules ainsi que le développement de tumeurs à long terme dans le pré-estomac (structure anatomique pour laquelle il n'existe aucun organe analogue chez les humains ou les autres mammifères autres que les rongeurs) chez les rongeurs après exposition par voie orale. La présence de lésions se limitait au point de contact initial sur l'estomac, telle que constatée dans les études d'exposition par différentes voies orales menées sur des animaux (régime alimentaire ou gavage). Le poids de la preuve semble indiquer que l'hydroxyanisole butylé n'est pas directement génotoxique, étant donné qu'il ne forme pas d'adduits à l'ADN dans le foie et le tissu du pré-estomac et qu'il n'y a pas de corrélation significative entre la faible absorption de la substance découlant de l'utilisation d'additifs alimentaires et le cancer de l'estomac dans une cohorte de 3 500 sujets humains. La comparaison de la DSENO pour la formation de tumeurs (230 mg/kg p.c. par jour) avec la valeur moyenne de l'exposition la plus élevée de 0,095 mg/kg p.c. par jour chez des enfants âgés entre 4 et 8 ans a permis d'obtenir une marge d'exposition adéquate supérieure à 2 400. Bien qu'une réaction d'irritation semblable limitée au site puisse se produire chez les humains, les doses requises pour provoquer une telle réaction locale seraient trop élevées. Les séquelles toxicologiques initiales (hyperplasie, inflammation) sont décrites dans la base de données sur les animaux comme des séquelles entièrement réversibles.
Il a été démontré que l'hydroxyanisole butylé déclenchait l'activité de l'UDP-glucuronyltransférase du foie et des intestines, ce qui catalyse la conjugaison de l'l'hydroxyanisole butylé et de son métabolite, TBHQ, avec le glucuronide. Cette capacité de glucuronidation accrue contribue probablement à son effet anticancérigène au moyen d'une inactivation accrue des composés cancérogènes par conjugaison. En outre, les effets sur divers organes peuvent être attribués à une clairance des hormones plus élevée résultant d'une activité accrue des enzymes hépatiques. La DMEO pour les effets autres que le cancer a été établie à 50 mg/kg p.c. par jour chez le porc, la plus faible dose testée, en fonction de l'augmentation du poids du foie et de la thyroïde sans effet sur les paramètres de la reproduction et du développement (Hansen et al., 1982).
Une comparaison entre la concentration à effet critique non néoplasique la plus faible associée à l'induction de l'UDP-glucuronyltransférase dans le foie et le petit intestin (50 mg/kg p.c. par jour) et la valeur moyenne de l'exposition à l'hydroxyanisole butylé la plus élevée de 0,095 mg/kg p.c. par jour chez des enfants âgés entre 4 et 8 ans a permis d'obtenir une marge d'exposition supérieure à 500. Comme la DMEO est fondée sur un seuils pour l’induction d’une enzyme compensatoire dans le foie, cette marge d'exposition serait considérée comme adéquate pour protéger la santé humaine.
Une étude de toxicité par voie cutanée résultant de l'exposition à vie réalisée sur les souris (Hodge et al., 1966) a démontré que l'hydroxyanisole butylé n'avait aucun effet nocif général pour l'intervalle de doses estimées de 48 à 100 mg/kg p.c. par jour chez les mâles et de 57 à 133 mg/kg p.c. par jour chez les femelles (CSEO). Malgré que la portée de l'examen fût limitée, aucune toxicité locale n'a été observée. Bien que les autopsies pratiquées sur ces animaux ne fussent pas approfondies, aucun signe de toxicité systémique n'a été signalé chez les souris traitées, et les taux de survie n'ont pas subi de baisse. En outre, une deuxième étude de toxicité par voie cutanée a également indiqué l'absence de toxicité jusqu'à des doses allant de 10 à 15 mg/kg p.c. par jour pendant 30 semaines (Berry et al. 1978). Une absence de toxicité a également été notée dans le cadre d'un essai d'exposition par injection intrapéritonéale de 8 semaines chez les souris jusqu'à une dose de 107 mg/kg p.c. par jour (Stoner et al., 1973). Cet essai, qui visait à examiner différents organes, n'a révélé aucun signe de toxicité systémique. Toutefois, comme les études d'exposition par voies cutanées et intrapéritonéale ne comptaient pas d'examens histopathologiques approfondis, on ne sait pas avec certitude si les effets observés après une exposition orale pourraient se produire après une exposition par voie cutanée. Par conséquent, les paramètres observés dans la base de données sur la toxicité orale étaient considérés comme appropriés pour la caractérisation des risques associés à une exposition par voie cutanée.
L'absorption par voie cutanée combinée d'hydroxyanisole butylé contenu dans les produits de soins personnels fréquemment utilisés a été estimée pour plusieurs groupes d'âge de la population. L'absorption « moyenne » prévue (voir le tableau 8) variait de 0,004 mg/kg p.c. par jour (chez les nourrissons) à 0,02 mg/kg p.c. par jour (chez les femmes et les enfants âgés entre 6 mois et 12 ans). Une comparaison entre ces absorptions et la DSENO pour la formation de tumeurs (230 mg/kg p.c. par jour) permet d'obtenir des marges d'expositions de 57 500 et de 11 500, respectivement. Les valeurs d'absorption les plus élevées prévues allaient de 0,01 mg/kg p.c. par jour (chez les hommes) à 0,07 mg/kg p.c. par jour (chez les enfants âgés entre 6 mois et 5 ans). Une comparaison entre ces absorptions et la DSENO pour la formation de tumeurs permet d'obtenir des marges d'exposition de 23 000 et de 3 300, respectivement.
Le niveau d'effet critique le plus faible pour les paramètres des effets autres que le cancer était de 50 mg/kg p.c. par jour, établi en fonction de l'augmentation du poids du foie et de la thyroïde. La comparaison de cette valeur avec les estimations allant de 0,004 mg/kg p.c. par jour (chez les nourrissons) à 0,02 mg/kg p.c. par jour (chez les femmes et les enfants âgés entre 6 mois et 12 ans) permet d'obtenir des marges de 12 500 et de 2 500, respectivement. De même, la comparaison entre les valeurs maximales estimées de l'absorption de 0,01 mg/kg p.c. par jour (chez les hommes) et de 0,07 mg/kg p.c. par jour (chez les enfants âgés entre 6 mois et 5 ans) et le niveau d'effet critique le plus faible pour les paramètres des effets autres que le cancer permet d'obtenir des marges d'exposition de 5 000 et de 700, respectivement.
L'absence de toxicité systémique constatée dans les études limitées en temps sur l'exposition par voie cutanée a également été notée dans les études d'exposition par voies sous-cutanée et intrapéritonéale. Bien que ces études fussent de qualité limitée, prises ensemble, elles indiquent une absence de toxicité systémique après une exposition par voie non orale. Étant donné qu'aucune toxicité n'a été observée après une exposition à long terme par voie cutanée, l'utilisation de paramètres de toxicité orale est considérée comme très prudente, et les marges d'exposition qui en découlent sont considérées comme adéquates pour protéger la santé humaine.
Incertitudes de l'évaluation des risques pour la santé humaine
Bien que certaines catégories d'aliments qui pourraient constituer des sources minimes d'exposition à l'hydroxyanisole butylé n'aient pas été incluses dans l'évaluation, il se peut que l'exposition à cette substance ait été surestimée en raison du peu de données quantitatives trouvées pour tenir compte des facteurs suivants : les concentrations réelles d'hydroxyanisole butylé par rapport aux concentrations maximales autorisées dans le Règlement sur les aliments et drogues; les concentrations réelles d'hydroxyanisole butylé en association avec d'autres antioxydants; le fait que des fabricants puissent avoir abandonné l'utilisation de l'hydroxyanisole butylé dans certains des aliments pour lesquels l'utilisation de la substance est autorisée; les pertes possibles d'hydroxyanisole butylé dans les aliments pendant le traitement, le transport et l'entreposage.
On ne dispose que de données limitées pour estimer l'absorption d'hydroxyanisole butylé par voie cutanée chez les humains. Une caractérisation plus adéquate de l'absorption permettrait d'atténuer l'incertitude liée aux estimations de l'absorption résultant de l'utilisation de produits de soins personnels. Il existe une certaine incertitude en ce qui a trait à la caractérisation de la toxicité après une exposition par voie cutanée. En ce qui concerne les études menées à long terme sur l'administration par voie cutanée, on n'a trouvé que des rapports qui datent présentant une évaluation limitée des paramètres. Cependant, l'absence d'observation d'effets nocifs après une administration par voies cutanée, sous-cutanée ou intrapéritonéale était constante. L'utilisation des paramètres de toxicité orale pour la caractérisation des risques après une exposition par voie cutanée est considérée comme très prudente. Des études supplémentaires pour poursuivre la caractérisation de la toxicité par voie cutanée permettraient de réduire les incertitudes dans cette évaluation.
D'après les renseignements contenus dans le rapport d'évaluation préalable, il est conclu que l'hydroxyanisole butylé ne pénètrent pas dans l'environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nuisible immédiat ou à long terme sur l'environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l'environnement essentiel pour la vie. De plus, l’hydroxyanisole butylé répond aux critères de la persistance mais ne répond pas aux critères de la bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
À la lumière des renseignements disponibles sur le potentiel de l'hydroxyanisole butylé d'avoir des effets néfastes sur la santé humaine, il est conclu que cette substance ne pénètre pas dans l'environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un risque pour la vie ou la santé humaine.
Par conséquent, il est conclu que l'hydroxyanisole butylé ne satisfait à aucun des critères énoncés dans l'article 64 de la LCPE (1999).
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
Abe, S., Sasaki, M. 1977. Chromosome aberrations and sister chromatid exchanges in Chinese hamster cells exposed to various chemicals. J. Natl. Cancer Inst. 58:1635-1641.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. Accès : http://www.acdlabs.com/products/phys_chem_lab/pka/
Altmann, H.J., Wiester, P.W., Mattiaschuk, G., Grunow, W., van der Heuden, C.A. 1985. Induction of early lesions in the forestomach of rats by 3-tert-butyl-4-hydroxyanisole (BHA). Food Chem. Toxicol. 23:723-731.
Altmann, H.-J., Grunow, W., Mohr, U., Richter-Reichhelm, H.B., Wester, P.W. 1986. Effects of BHA and related phenols on the forestomach of rats. Food. Chem. Toxicol.24:1183-1188.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs [en ligne]. QSAR Comb. Sci. 22(3):337-345. Accès : http://www3.interscience.wiley.com/journal/104557877/home[réserve de consultation]
Astill, B.D., Mills, J., Fassett, D.W., Roudabush, R.L., Terhaar, C.J. 1962. Fate of butylated hydroxyanisole in man and dog. J. Agric. Food Chem. 10:315-319.
ASTreat Model [modèle de l’élimination par les usines de traitement des eaux usées]. 2006. Version 1.0. Cincinnati (US): Procter & Gamble Company. Disponible chez: Procter & Gamble Company, P.O. Box 538707, Cincinnati, OH 45253-8707, U.S.
[BCFBAF] BioConcentration Factor Program for Windows [modèle d'estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [base de données sur Internet]. 2009. Ottawa (Ont.) : Santé Canada. Accès : http://webprod.hc-sc.gc.ca/nhpid-bdipsn/search-rechercheReq.do?lang=fra
Benford, D.J., Price, S.C., Lawrence, J.N., Grasso, P., Bremmer, J.N. 1994. Investigations of the genotoxicity and cell proliferative activity of dichlorvos in mouse forestomach. Toxicology 92:203-215.
Berry, D., DiGiovanni, J., Juchau, M., Bracken, W., Gleason, G., Slaga, T. 1978. Lack of tumor-promoting ability of certain environmental chemicals in a two-stage mouse skin tumorigenesis assay. Res. Commun. Chem. Pathol. Pharmacol.20(1):101-108.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Boltz, U., Hagenmaier, H., Korner, W. 2001. Phenolic xenoestrogens in surface water, sediments, and sewage sludge from Baden-Wurttemberg, south-west Germany. Environ. Pollut.115(2):291-301.
Bonin, A.M., Baker, R.S.U. 1980. Mutagenicity testing of some approved food additives with the Salmonella microsome assay. Food Technol. Aust. 32:608-611.
Botterweck, A.A.M., Verhagen, H., Goldbohm, R.A., Kleinjans, J., van den Brandt, P.A. 2000. Intake of butylated hydroxyanisole and butylated hydroxytoluene and stomach cancer risk: results from analyses in the Netherlands Cohort Study. Food Chem. Toxicol. 38:599-605.
Brown, G.K,. Zaugg, S.D., Barber, L.B. Document non daté. Wastewater analysis by gas chromatography/mass spectrometry. [consulté le 28 juillet 2009]. Reston (VA) : US Department of the Interior, US Geological Survey. Accès : http://toxics.usgs.gov/pubs/wri99-4018/Volume2/sectionD/2506_Brown/pdf/2506_Brown.pdf
Buetler, T.M., Gallagher, E.P., Wang, C.H., Stahl, D.L., Hayes, J.D., Eaton, D.L. 1995. Induction of phase I and phase II drug-metabolizing enzyme mRNA, protein, and activity by BHA, ethoxyquin and oltipraz. Toxicol. Pharmacol.135:45-57.
Bunnell, R.H., Matterson, L.D., Singsen, E.P., Potter, L.M., Kozeff, A., Jungherr, E.L. 1955. Studies on encephalomalacia in the chick. III. The influence of feeding or injection of various tocopherols and other antioxidants on the incidence of encephalomalacia. Poult. Sci. 34:1068-1075.
Busch, J. 1984. Final report on the safety assessment of butylated hydroxyanisole. J. Am. Coll. Toxicol.3(5):83-146.
Canada. 1978. Règlement sur les aliments et drogues, C.R.C., c. 870. Accès : http://laws.justice.gc.ca/fra/C.R.C.-ch.870/index.html
Canada. 1988. Liste de divulgation des ingrédients [en ligne]. DORS/88-64. [consultée le 8 juin 2009]. Accès : http://www.canlii.org/ca/regu/sor88-64/part274942.html
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, c. 33. Accès : http://www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 29 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l'Environnement, ministère de la santé. 2006.Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement, Canada Gazette. Partie I, vol. 140, no 49, p. 4109–4117. Accès : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la santé. 2009. Loi canadienne sur la protection de l’environnement (1999) : Avis de huitième divulgation d'information technique concernant les substances identifiées dans le Défi, Gazette du Canada. Partie I, vol. 143, no 5, p. 192-196. Accès : http://www.gazette.gc.ca/rp-pr/p1/2009/2009-01-31/pdf/g1-14305.pdf
Cantoreggi, S., Dietrich, D.R., Lutz, W.K. 1993. Induction of cell proliferation in the forestomach of F344 rats following subchronic administration of styrene 7,8-oxide and butylated hydroxyanisole. Cancer Res. 53:3505-3508.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. ©2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
Chu, W., Lau, T.K. 2007. Ozonation of endocrine disrupting chemical BHA under the suppression effect by salt additive–with and without H2O2. J. Hazard. Mater. 144(1-2):249-254.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1986. Some naturally occurring and synthetic food components, furocoumarins and ultraviolet radiation. IARC Monogr. Eval. Carcinog. Risks Chem. Hum. 40:123-206.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1987. Overall evaluations of carcinogenicity: an updating of IARC Monographs Volumes 1-42. IARC Monogr. Eval. Carcinog. Risks Chem. Hum. Suppl. 7:59.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 2003. Predictive value of rodent forestomach and gastric neuroendocrine tumours in evaluating carcinogenic risks to humans. Lyon (France) : Centre International de Recherche sur le Cancer. Publication technique du CIRC no 39.
Clayson, D.B., Iverson, F., Nera, E., Lok, E., Rogers, C., Rodrigues, C., Page, D., Karpinski, K. 1986. Histopathological and radioautographical studies on the forestomach of F344 rats treated with butylated hydroxyanisole and related chemicals. Food Chem. Toxicol. 24:1171-1182.
Conning, D.M., Phillips, J.C. 1986. Comparative metabolism of BHA, BHT and other phenolic antioxidants and its toxicological relevance. Food Chem. Toxicol. 24:1145-1148.
[ConsExpo] Consumer Exposure Model [en ligne]. 2006. Version 4.1, Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais de la santé publique et de l'environnement). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
Cope, W.G., Bartsch, W.R., Marking, L.L. 1997. Efficacy of candidate chemicals for preventing attachment of zebra mussels (Dreissena polymorpha). Environ. Toxicol. Chem.16(9):1930-1934.
US Department of Agriculture. Continuing Survey of Food Intakes by Individuals (CSFII 1994-96, 1998) and Diet and Health Knowledge Survey (DHKS 1994-96). Beltsville (MD) : US Department of Agriculture, Agricultural Research Service, Beltsville Human Nutrition Research Center, Food Surveys Research Group. Accès : http://www.ars.usda.gov/SP2UserFiles/Place/12355000/pdf/Facts1.pdf
Daniel, J.W., Gage, J.C., Jones, D.I., Stevens, M.A. 1967. Excretion of butylated hydroxytoluene (BHT) and butylated hydroxyanisole (BHA) by man. Food Cosmet. Toxicol.5:475-479.
Davi, M., Gnudi, F. 1999. Phenolic compounds in surface water. Water Res. 33(14):3213-3219.
Degre, R., Saheb, S.A. 1982. Butylated hydroxyanisole as a possible mutagenic agent. FEMS Microbiol. Lett.14:183-186.
Drewes, J.E., Snyder, S. 2009. Contributions of household chemicals to sewage and their relevance to municipal wastewater systems and the environment. [consulté le 28 juillet 2009]. London (Royaume-Uni) : IWA Publishing pour le compte de la Water Environment Research Foundation. WERF Report 03-CTS-21UR. Accès : http://www.iwaponline.com/wio/2009/03/werf_pdf/wio200903WF03CTS21UR.pdf[réserve de consultation]
El-Rashidy, R., Niazi, S. 1979. GLC determination of butylated hydroxyanisole in human plasma and urine.J. Pharm. Sci.68:103-104.
Environnement Canada. 1988. Données en relation à la Liste Intérieure des Substances (LIS) 1984-1986, récoltées sous la LCPE, 1988, s. 25(1). D’après les déclarations pour la Liste Intérieure des Substances [guide] 1988. Données préparées par : Environnement Canada.
Environnement Canada. 2009a. Données sur les substances du lot 8 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le huitième lot du Défi.Données préparées par le Programme des substances existantes d'Environment Canada.
Environnement Canada. 2009b. Guidance for conducting ecological assessments under CEPA, 1999, science resource technical series, technical guidance module: Mega Flush consumer release scenario. Document de travail. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada. 2009c. Mega Flush report: CAS RN 25013-16-5. Rapport inédit. [consulté le 13 novembre 2009]. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
Fabrizio, D.P.A. 1974. Mutagenic evaluation of compound FDA 71-24: butylated hydroxyanisole. Kensington (MD) : Litton Bionetics, Inc. Rapport inédit présenté à l'Organisation mondiale de la santé par la US Food and Drug Administration. [cité dans OMS, 1980].
Go Kang H, Hee Jeong S, Hyoung Cho J, Gyu Kim D, Myung Park J. 2005. Evaluation of estrogenic and androgenic activity of butylated hydroxyanisole in immature female and castrated rats. Toxicology 213(1-2): 147-156.
Gomez, M., Gomez-Ramos, M., Aguera, A., Mezcua, M., Herrera, S., Fernandez-Alba, A. 2009. A new gas chromatography/mass spectrometry method for the simultaneous analysis of target and non-target organic contaminants in waters. J. Chromatogr. A1216(18):4071-4082.
Hageman, G.J., Verhagen, H., Kleinjans, J.C.S. 1988. Butylated hydroxyanisole, butylated hydroxytoluene and tert-butylhydroquinone are not mutagenic in the Salmonella/microsome assay using new tester strains. Mutat. Res. 208:207-211.
Hansen, E., Meyer, O. 1978. A study of the teratogenicity of butylated hydroxyanisole on rabbits. Toxicology10:195-201.
Hansen, E.V., Meyer, O., Olsen, P. 1982. Study on toxicity of butylated hydroxyanisole (BHA) in pregnant gilts and their foetuses. Toxicology 23:79-83.
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d'estimation]. 2000. Version 3.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Hirose, M., Masuda, A., Imaida, K., Kagawa, M., Tsuda, H., Ito, N. 1987a. Induction of forestomach lesions in rats by oral administrations of naturally occurring antioxidants for 4 weeks. Jpn. J. Cancer. Res. 78:317-321.
Hirose, M., Asamoto, M., Hagiwara, A., Ito, N., Kaneko, H., Saito, K., Takamatsu, Y., Yoshitake, A., Miyamoto, J. 1987b. Metabolism of 2- and 3-tert-butyl-4-hydroxyanisole (2- and 3-BHA) in the rat (II): metabolism in forestomach and covalent bonding to tissue macromolecules. Toxicology 45:13-24.
Hjelle, J.J., Hazleton, G.A., Klaassen, C.D. 1985. Increased UDP-glucuronosyl transferase activity and UDP-glucuronic acid concentration in the small intestine of butylated hydroxyanisole-treated mice. Drug Metab. Dispos. 13:68-70.
Hodge, H.C., Fassett, D.W., Maynard, E.A., Downs, W.L., Coye, R.D. 1966. Tests on mice for evaluating carcinogenicity. Toxicol. Appl. Pharmacol. 9:583-596.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Ikeda, G.J., Stewart, J.E., Sapienza, P.P., Peggins, J.O., Michel, T.C., Olivito, V., Alam, H.Z., O’Donnell, M.W. 1986. Effect of subchronic dietary administration of butylated hydroxyanisole on canine stomach and hepatic tissue. Food Chem. Toxicol. 24:1201-1221.
[INRP] Inventaire national des rejets de polluants [base de données sur Internet]. 2009. Gatineau (Qc) : Environnement Canada. [consultée le 4 juin 2009]. Accès : http://www.ec.gc.ca/inrp-npri/
Ishidate, M., Odashima, S. 1977. Chromosome tests with 134 compounds on Chinese hamster cells in vitro - a screening for chemical carcinogens. Mutat. Res. 48:337-354.
Ito, N., Hirose, M. 1987. The role of antioxidants in chemical carcinogenesis. Jpn. J. Cancer Res. (Gann)78:1011-1026.
Ito, N., Hagiwara, A., Shibata, M., Ogiso, T., Fukushima, S. 1982. Induction of squamous cell carcinoma in the forestomach of F344 rats treated with butylated hydroxyanisole. Gann73:332-334.
Ito, N., Fukushima, S., Hagiwara, A., Shibata, M., Ogiso, T. 1983a. Carcinogenicity of butylated hydroxyanisole in F344 rats. J. Natl. Cancer Inst. 70:343-352.
Ito, N., Fukushima, S., Imaida, K., Sakata, T., Masui, T. 1983b. Induction of papilloma in the forestomach of hamsters by butylated hydroxyanisole. Gann 74:459-461.
Ito, N., Hirose, M., Kurata, Y., Ikawa, E., Mera, Y., Fukushima, S. 1984. Induction of forestomach hyperplasia by crude butylated hydroxyanisole, a mixture of 3-tert and 2-tertisomers, in Syrian golden hamsters is due to 3-tert-butylated hydroxyanisole. Gann75:471-474.
Ito, N., Fukushima, S., Tamano, S., Hirose, M., Hagiwara, A. 1986. Dose response in butylated hydroxyanisole induction of forestomach carcinogenesis in F344 rats. J. Natl Cancer Inst. 77:1261-1265.
Ito, N., Hirose, M,. Takahashi, S. 1991. Cellular proliferation and stomach carcinogenesis induced by anti-oxidants. In : Butterworth, B., Slaga, T.J., Farland, W., McClain, M. (éditeurs). Chemically induced cell proliferation: implication for risk assessment. New York (NY) : Wiley-Liss. p. 43-52.
Iverson, F., Lok, E., Nera, E., Karpinski, K., Clayson, D.B. 1985. A 13-week feeding study of butylated hydroxyanisole: the subsequent regression of the induced lesions in male Fischer 344 rat forestomach epithelium. Toxicology 35:1-11.
Iverson, F., Truelove, J., Nera, E., Lok, E., Clayson, D.B., Wong, J. 1986. A 12-week study of BHA in the cynomolgus monkey. Food Chem. Toxicol. 24:1197-1200.
Jeong, S.-H., Kim, B.-Y., Kang, H.-G., Ku, H.-O., Cho, J.-H. 2005. Effects of butylated hydroxyanisole on the development and functions of reproductive system in rats. Toxicology208:49-62.
Jobling, S., Reynolds, T., White, R., Parker, M.G., Sumpter, J.P. 1995. A variety of environmentally persistent chemicals, including some phthalate plasticizers, are weakly estrogenic. Environ. Health Perspect. 103:582-587.
Joner, P.E. 1977. Butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT) and ethoxyquin (EMQ) tested for mutagenicity. Acta. Vet. Scand. 18:187-193.
Jos, A., Repetto, G., Rios, J.C,. del Peso, A., Salguero, M., Hazen, M.J., Molero, M.L., Fernandez-Freire, P., Perez-Martin, J.M., Labrador, V., Camean, A. 2005. Ecotoxicological evaluation of the additive butylated hydroxyanisole using a battery with six model systems and eighteen endpoints. Aquat. Toxicol.71:183-192.
Kang, H.G., Jeong, S.H., Cho, J.H., Kim, D.G., Park, J.M., Cho, M.H. 2005. Evaluation of estrogenic and androgenic activity of butylated hydroxyanisole in immature female and castrated rats. Toxicology 213:147-156.
Kawachi, T., Komatsu, T., Kada, T., Ishidate, M., Sasaki, M., Sugiyama, T., Tazima, Y. 1980. Results of recent studies on the relevance of various short-term screening tests in Japan. In: Williams, G.M., Kroes, R., Waaijers, H.W., van de Poll, K.W. (éditeurs). The predictive value of short-term screening tests in carcinogenicity evaluation. Amsterdam (Pays-Bas) : Elsevier. p. 253-267.
Kolpin, D., Furlong, E., Meyer, M., Thurman, E., Zaugg, S., Barber, L., Buxton, H. 2002. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: a national reconnaissance. Environ. Sci. Technol. 36(6):1202-1211.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Lehman, A.J., Fitzhugh, O.G., Nelson, A.A., Woodard, G. 1951. The pharmacological evaluation of antioxidants. Adv. Food Res. 3:197-208.
Masui, T., Hirose, M., Imaida, K., Fukushima, S., Tamano, S., Ito, N. 1986. Sequential changes of the forestomach of F344 rats, Syrian golden hamsters and B6C3F1 mice treated with butylated hydroxyanisole. Jpn. J. Cancer Res. 77:1083-1090.
Matsuoka, A., Matsui, M., Miyata, N., Sofuni, T., Ishidate, M. 1990. Mutagenicity of 3-tert-butyl-4-hydroxyanisole (BHA) and its metabolites in short-term tests in vitro. Mutat. Res. 241:125-132.
Miyagi, M.P., Goodheart, C.R. 1976. Effects of butylated hydroxyanisole in Drosophila melanogaster. Mutat. Res. 40:37-42.
Morimoto, K., Tsuji, K., Ito, T., Miyata, N., Uchida, A., Osawa, R., Kitsutaka, H., Takahashi, A. 1991. DNA damage in forestomach epithelium from male F344 rats following oral administration of tert-butylquinone, one of the forestomach metabolites of 3-BHA. Carcinogenesis 12:703-708.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Murli, H., Brusick, D. 1992. Induction of chromosomal aberrations by high concentrations of butylated hydroxyanisole (BHA) in Chinese hamster ovary (CHO) cells in the presence of washed microsomes. In Vitro Toxicol. 5:93-101.
[NCBI] National Center for Biotechnology Information. 2008. Butylated hydroxyanisole--substance summary (SID 48419723). Bethesda (MD) : National Institutes of Health, National Library of Medicine. [consulté le 8 juin 2009]. Accès : http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=48419723
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Columbus (OH) : American Chemical Society. Accès : http://www.cas.org/products/cd/nci/index.html
Nera, E.A., Lok, E., Iverson, F., Ormsby, E., Karpinsky, K.F., Clayson, D.B. 1984. Short-term pathological and proliferative effects of BHA and other phenolic antioxidants in the forestomach of Fischer 344 rats. Toxicology 32:197-213.
Newberne, P.M., Charnley, G., Adams, K., Cantor, M., Roth, D., Supharkarn, V. 1986. Gastric and esophageal carcinogenesis: models for the identification of risk and protective factors. Food Chem. Toxicol. 24:1111-1119.
[NIFES] Norwegian National Institute of Nutrition and Seafood Research. 2007. Limited BHA accumulation in salmon fillets [en ligne]. Bergen (Norvège) : National Institute of Nutrition and Seafood Research. [consulté le 8 sept. 2009]. Accès : http://www.nifes.no/index.php?page_id=320&article_id=2199&lang_id=2
[NJDEP] New Jersey Department of Environmental Protection. 2003. The characterization of tentatively identified compounds (TICs) in samples from public water systems in New Jersey. Trenton (NJ) : New Jersey Department of Environmental Protection, Division of Science, Research & Technology. [consulté le 12 juin 2009]. Accès : http://www.state.nj.us/dep/dsr/TIC-report.pdf
[NTP] National Toxicology Program (US). 1991. Butylated hydroxyanisole (BHA) CAS No. 25013-16-5. In : Sixth annual report on carcinogens. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program.
[NTP] National Toxicology Program (US). 2005. Butylated hydroxyanisole (BHA) CAS No. 25013-16-5. In : 11th report on carcinogens. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. [consulté le 22 juin 2009]. Accès : http://ntp.niehs.nih.gov/?objectid=72016262-BDB7-CEBA-FA60E922B18C2540
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software
[OCDE] Organisation de coopération et de développement économiques. 2000. p-tert-Butyl phenol CAS no. 98-54-4. SIDS [Screening Information Dataset] initial assessment report for SIAM [SIDS initial assessment meeting] 10 [en ligne]. Geneva (Suisse) : Publications du PNUE. [consulté le 18 nov. 2009]. Accès : http://www.chem.unep.ch/irptc/sids/OECDSIDS/98544.pdf
Olsen, P. 1983. The carcinogenic effect of butylated hydroxyanisole on the stratified epithelium of the stomach in rat versus pig. Cancer Lett. 21:115-116.
[OMS] Organisation mondiale de la santé. 1980. Butyl hydroxyanisole. In : Toxicological evaluation of certain food additives and contaminants. Rapport préparé par la vingt-quatrième session du Comité mixte FAO/OMS d'experts des additifs alimentaires, Genève (Suisse) : Organisation mondiale de la santé. WHO Food Additives Series 15. Accès : http://www.inchem.org/pages/jecfa.html
[OMS] Organisation mondiale de la santé. 1983. Butyl hydroxyanisole. In : Toxicological evaluation of certain food additives and contaminants. Rapport préparé par la vingt-septième session du Comité mixte FAO/OMS d'experts des additifs alimentaires, Genève (Suisse) : Organisation mondiale de la santé. WHO Food Additives Series 18. Accès : http://www.inchem.org/documents/jecfa/jecmono/v18je05.htm
[OMS] Organisation mondiale de la santé. 1987. Butyl hydroxyanisole. In : Toxicological evaluation of certain food additives and contaminants. Rapport préparé par la trentième session du Comité mixte FAO/OMS d'experts des additifs alimentaires. Cambridge (Royaume-Uni) : Cambridge University Press. WHO Food Additives Series 21. Accès : http://www.inchem.org/pages/jecfa.html
[OMS] Organisation mondiale de la santé. 1989. Butyl hydroxyanisole. In : Toxicological evaluation of certain food additives and contaminants. Rapport préparé par la trente-troisième session du Comité mixte FAO/OMS d'experts des additifs alimentaires, Genève (Suisse) : Organisation mondiale de la santé. WHO Food Additives Series 24. Accès : http://www.inchem.org/documents/jecfa/jecmono/v024je02.htm
[OMS] Organisation mondiale de la santé. 1998. tert-Butylhydroquinone (TBHQ). In : Safety evaluation of certain food additives and contaminants. Rapport préparé par la quarante-neuvième session du Comité mixte FAO/OMS d'experts des additifs alimentaires. Geneve (Suisse) : Organisation mondiale de la santé. WHO Food Additives Series 40. Accès : http://www.inchem.org/documents/jecfa/jecmono/v040je02.htm
[PAN] PAN Pesticide Database [base de données sur Internet]. 2009. BHA--Identification, toxicity, use, water pollution potential, ecological toxicity and regulatory information. San Francisco (CA) : Pesticide Action Network, North America. Accès : http://www.pesticideinfo.org/Detail_Chemical.jsp?Rec_Id=PC33764#Ecotoxicity
Paxéus, N. 1996. Organic pollutants in the effluents of large wastewater treatment plants in Sweden. Water Res.30(5):1115-1122.
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d'estimation]. 2000. Version 1.66. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Phillips, B.J., Carroll, P.A., Tee, A.C., Anderson, D. 1989. Microsome-mediated clastogenicity of butylated hydroxyanisole (BHA) in cultured Chinese hamster ovary cells: the possible role of reactive oxygen species. Mutat. Res. 214:105-114.
[PhysProp] Interactive PhysProp Database [base de données sur Internet]. 2006. Syracuse (NY) : Syracuse Research Corporation. Accès : http://srcinc.com/what-we-do/product.aspx?id=133
Prasad, O., Kamra, O.P. 1974. Radiosensitization of Drosophila sperm by commonly used food additives--butylated hydroxyanisole and butylated hydroxytoluene. Int. J. Radiat. Biol. 25:67-72.
Remberger, M., Kaj, L., Palm, A., Sternbeck, J., Kvernes, E., Brorström-Lundén, E. 2003. Screening tertiary butylphenols, methylphenols, and long-chain alkylphenols in the Swedish environment. Stockholm (Suède) : IVL Swedish Environmental Research Institute. IVL report. Accès : http://www3.ivl.se/rapporter/pdf/B1594.pdf
Riley, P.A., Seal, P. 1968. Microinvasion of epidermis caused by substituted anisoles. Nature 220:922-923.
Rogers, C.G., Nayak, B.N., Heroux-Metcalf, C. 1985. Lack of induction of sister chromatid exchanges and of mutation to 6-thioguanine resistance in V70 cells by butylated hydroxyanisole with and without activation by rat or hamster heptocytes. Cancer Lett. 27:61-69.
Rogers, C.G., Boyes, B.G., Matula, T.I., Stapley, R. 1992. Evaluation of genotoxicity of tert-butylhydroquinone in an hepatocyte-mediated assay with V79 Chinese hamster lung cells and in strain D7 of Saccharomyces cerevisiae. Mutat. Res. 280:17-27.
Rudel, R., Melly, S., Geno, P., Sun, G., Brody, J. 1998. Identification of alkylphenols and other estrogenic phenolic compounds in wastewater, septage, and groundwater on Cape Cod, Massachusetts. Environ. Sci. Technol. 32(7):861-869.
Saito, K., Nakagawa, S., Yoshitake, A., Miyamoto, J., Hirose, M., Ito, N. 1989. DNA-adduct formation in the forestomach of rats treated with 3-tert-butyl-4-hydroxyanisole and its metabolites as assessed by an enzymatic 32P-postlabeling method. Cancer Lett. 48:189-195.
Santé Canada. 1995. Enquête sur l'exposition des êtres humains aux contaminants dans le milieu : Un guide pour les calculs de l'exposition. Ottawa (Ont.) : Ministre desApprovisionnements et Services Canada.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Sasaki, Y.F., Kawaguchi, S., Kamaya, A., Ohshita, M., Kabasawa, K., Iwama, K., Taniguchi, K., Tsuda, S. 2002. The comet assay with 8 mouse organs: results with 39 currently used food additives. Mutat. Res. 519:103-119.
Schumann, R. 1991. In vitro absorption of butylated hydroxyanisole through human skin. J. Soc. Cosmet. Chem.42:335-340.
Scippo M-L, Argiris C, Van De Weerdt C, Muller M, Willemsen P, Martial J, Maghuin-Rogister G. 2004. Recombinant human estrogen, androgen and progesterone receptors for detection of potential endocrine disruptors. Anal Bioanal Chem 378 : 664–669.
[SDA] The Soap and Detergent Association. 2005. Exposure and risk screening methods for consumer product ingredients. Washington (DC) : The Soap and Detergent Association. Accès : http://www.sdascience.org/docs/Exposure_and_Risk_Screening_Methods.pdf
SimpleTreat [modèle sur l'élimination des usines de traitement des eaux usées]. 1997. Version 3.0. Bilthoven (Pays-Bas) : Institut national néérlandais de la santé publique et de l'environnement (RIVM), Laboratory for Ecological Risk Assessment.
Soliman, M.A., Pedersen, J.A., Suffet, I.H. 2004. Rapid gas chromatography–mass spectrometry screening method for human pharmaceuticals, hormones, antioxidants and plasticizers in water. J. Chromatogr. A 1029:223-237.
Soliman, M., Pedersen, J., Park, H., Castaneda-Jimenez, A., Stenstrom, M., Suffet, I. 2007. Human pharmaceuticals, antioxidants, and plasticizers in wastewater treatment plant and water reclamation plant effluents. Water Environ. Res.79(2):156-167.
Statistique Canada. 2004. Enquête sur la santé dans les collectivités canadiennes--Nutrition (ESSC). Renseignements détaillés pour 2004 (Cycle 2.2). Ottawa (Ont.) : Statistique Canada. Accès : http://www.statcan.gc.ca/cgi-bin/imdb/p2SV_f.pl?Function=getSurvey&SDDS=5049&lang=en&db=imdb&adm=8&dis=2
Stiles, R., Yang, I., Lippincott, R., Murphy, E., Buckley, B. 2008. Measurement of drinking water contaminants by solid phase microextraction initially quantified in source water samples by the USGS. Environ. Sci. Technol. 42(8):2976-2981.
Stokes, J.D., Scudder, C.L. 1974. The effect of butylated hydroxyanisole and butylated hydroxytoluene on behavioural development of mice. Dev. Psychobiol. 7:343-350.
Stoner, G., Shimkin, M., Kniazeff, A., Weisburger, J., Weisburger, E., Gori, G. 1973. Test for carcinogenicity of food additives and chemotherapeutic agents by the pulmonary tumor response in strain A mice. Cancer Res. 33:3069-3085.
Telford, I.R., Woodruff, C.S., Linford, R.H. 1962. Fetal resorption in the rat as influenced by certain antioxidants. Am. J. Anat. 110:29-36.
Tobe, M., Furuya, T., Kawasake, Y., Naito, K., Sekita, K., Matsumoto, K., Ochiai, T., Usui, A., Kokubo, T., Kanno, J., Hayashi, Y. 1986. Six-month toxicity study of butylated hydroxyanisole in beagle dogs. Food Chem. Toxicol.24:1223-1228.
Tomii, S., Aoki, Y. 1977. Chronic toxicity study of BHA. Rapport inédit préparé pour la Division de chimie alimentaire [traduction] du Ministère de la santé et du bien-être [traduction] du Japon en mars 1977. [cité dans OMS, 1983].
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. Accès : http://www.accelrys.com/products/topkat/index.html
TRI [Toxics Release Inventory]. 2006. 2006 reporting year list of TRI chemicals. Table II. EPCRA Section 313 chemical list for reporting year 2006 (including toxic chemical categories). [consulté le 4 juin 2009]. Washington (DC) : US Environmental Protection Agency. Accès : http://www.epa.gov/TRI/trichemicals/chemical%20lists/RY2006ChemicalList.pdf
Tsuji, S., Tonogai, Y., Ito, Y., Kanoh, S. 1986. The influence of rearing temperatures on the toxicity of various environmental pollutants for killifish (Oryzias latipes). J. Hyg. Chem. (Eisei Kagaku) 32(1):46-53.
[US EPA] US Environmental Protection Agency. 2004. Inert ingredients ordered by CAS number. [consulté le 8 juin 2009]. Washington (DC) : US Environmental Protection Agency. Accès : http://www.epa.gov/opprd001/inerts/completelist_inerts.pdf
[US EPA] US Environmental Protection Agency. 2008. Drinking water Contaminant Candidate List 3--draft, Federal Register. 73(35):9628-9654. [consulté le 8 juin 2009]. Washington (DC) : US Environmental Protection Agency. Accès : http://edocket.access.gpo.gov/2008/pdf/E8-3114.pdf
[US FDA] US Food and Drug Administration. 2009. FDA VCRP Cosmetic Ingredient Listing.[consulté le 17 juin 2009]. Silver Spring (MD) : US Department of Health and Human Services, Food and Drug Administration, Voluntary Cosmetic Registration Program. Accès : http://www.fda.gov/Cosmetics/GuidanceComplianceRegulatoryInformation/
VoluntaryCosmeticsRegistrationProgramVCRP/PaperSubmissions/ReferenceMaterialsYouWillNeed/ucm111317.htm
Verhagen, H., Mass, L.M., Beckers, R.H.G., Thijssen, H.H.W., Ten Hoor, F., Henderson, T.P., Kleinjans, J.C.S. 1989. Effect of subacute oral intake of the food antioxidant butylated hydroxyanisole on clinical parameters and phase-I and -II biotransformation capacity in man. Hum. Toxicol.8:451-459.
Vorhees, C.V., Butcher, R.E., Brunner, R.L., Wootten, V., Sobotka, T.J. 1981. Developmental neurobehavioral toxicity of butylated hydroxyanisole (BHA) in rats. Neurobehav. Toxicol. Teratol. 3:321-329.
Wilder, O.H.M., Kraybill, H.R. 1948. Toxicity studies on antioxidants--butylated hydroxyanisole and hydroquinone. Fed. Proc. 8:165.
Wilder, O.H.M., Ostby, P.C., Gregory, B.A. 1960. Effect of feeding butylated hydroxyanisole to dogs. J. Agric. Food Chem. 8:504-506.
Williams, G.M., McQueen, C.A., Tong, C. 1990a. Toxicity studies of butylated hydroxyanisole and butylated hydroxytoluene. I. Genetic and cellular effects. Food Chem. Toxicol. 28:793-798.
Williams, G.M., Wang, C.X., Iatropoulos, M.J. 1990b. Toxicity studies of butylated hydroxyanisole and butylated hydroxytoluene. II. Chronic feeding studies. Food Chem. Toxicol. 28:799-806.
Williams, G.M., Iatropoulos, M.J., Whysner, J. 1999. Safety assessment of butylated hydroxyanisole and butylated hydroxytoluene as antioxidant food additives. Food Chem. Toxicol. 37:1027-1038.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Würtzen, G., Olsen, P. 1986. BHA study in pigs. Food Chem. Toxicol. 24:1229-1233.
Zhu, B.T., Lech, J., Rosen, R.T., Conney, A.H. 1997. Effect of dietary 2(3)-tert-butyl-4-hydroxyanisole on the metabolism and action of estradiol and estrone in female CD-1 mice. Cancer Res. 57:2419-2427.
Note de bas de page
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
tert-butyl-4-méthoxyphénol
(hydroxyanisole butylé)
Numéro de registre du Chemical Abstracts Service
25013-16-5
Environnement Canada
Santé Canada
Juillet 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Estimation de l'exposition alimentaire à l'hydroxyanisole butylé liée à l'utilisation d'additifs alimentaires
- Annexe 2 : Limites supérieures de l'exposition à l'hydroxyanisole butylé présent dans les produits de soins personnels, estimées à l'aide de la version 4.1 du modèle ConsExpo (ConsExpo, 2006)
- Annexe 3 : Résumé des effets de l'hydroxyanisole butylé sur la santé indiqués dans les études sur les animaux
Les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du tert-butyl-4-méthoxyphénol (hydroxyanisole butylé), dont le numéro de registre du Chemical Abstracts Service est 25013-16-5. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance durant la catégorisation visant la Listeintérieure dans le cadre du Défi, car elle présente un risque d’exposition intermédiaire pour les particuliers au Canada et que le risque qu’il représente pour la santé humaine est considéré comme élevé, en fonction de sa classification par d’autres organismes sur la base de sa cancérogénicité. La substance ne répond pas aux critères environnementaux relatifs à la persistance, à la bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée principalement sur les renseignements utiles à l’évaluation des risques pour la santé humaine.
Selon les renseignements déclarés en réponse à l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], l’hydroxyanisole butylé n’a pas été fabriqué au Canada en 2006 en une quantité égale ou supérieure au seuil de déclaration de 100 kg. Par contre, une quantité de 100 à 1 000 kg d’hydroxyanisole butylé a été importée au pays et une quantité de 1 000 à 10 000 kg de cette substance y a été utilisée sous sa forme pure ou comme composant d’un produit, d’un mélange ou d’un article fabriqué. L’utilisation de l’hydroxyanisole butylé comme antioxydant dans les aliments est permise au Canada. Cette substance retarde la détérioration des saveurs et des odeurs et accroît considérablement la durée de conservation des matières grasses et des aliments qui en contiennent. Elle peut être utilisée dans les aliments cuits au four ou frits dans des huiles animales en raison de stabilité à haute température et de sa capacité à demeurer active après ces types de cuisson. En outre, l’hydroxyanisole butylé est un antioxydant très utilisé dans les aliments pour animaux puisqu’il retarde l’oxydation des vitamines A et E, du carotène, des xanthophylles, des gras fondus et des huiles végétales. Il est un ingrédient non médicinal utilisé comme antioxydant et agent antimicrobien dans les produits pharmaceutiques finaux, les produits de santé naturelle et les produits pour animaux manufacturés au Canada. Il y est aussi un composant des produits de soins personnels comme les désodorisants, les shampoings et les lotions corporelles. L’hydroxyanisole butylé est également utilisé comme produit de formulation dans les pesticides au Canada. Il agit comme agent stabilisant ou parfum dans les rodenticides, les insecticides (jardins particuliers), les fongicides, les bactéricides (pâtes et papiers), les shampooings insecticides (chats et chiens), les insectifuges (lotions, lingettes) et les nettoyants antibactériens pour surfaces et vitres. Au Canada, la population générale est exposée à l’hydroxyanisole butylé puisque son utilisation comme antioxydant est autorisée dans les aliments et qu’il est présent dans les produits de soins personnels comme les shampooings et les hydratants pour la peau.
D’après la comparaison de l’exposition estimative à l’hydroxyanisole butylé au Canada et de la concentration associée à un effet critique, et compte tenu des incertitudes inhérentes aux données sur l’exposition et les effets, on considère que les marges d’exposition ainsi obtenues sont adéquates pour protéger la santé humaine en ce qui a trait aux effets autres que le cancer. Les marges d’exposition pour les effets cancérogènes sont également jugées adéquates pour protéger la santé humaine. Les marges entre ces niveaux d’exposition et les estimations de l’absorption découlant de l’utilisation de produits de soins personnels sont considérées comme adéquates pour protéger la santé humaine.
À la lumière des renseignements disponibles sur le potentiel d’effets nocifs de l’hydroxyanisole butylé sur la santé humaine, il est conclu que cette substance ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D’après les données empiriques pour une substance analogue (4-tert-butylphénol), ainsi que les données modélisées, il est conclu que l’hydroxyanisole butylé va se dégrader rapidement dans l’air, l’eau et le sol, mais pas dans les sédiments. De plus, d’après les données expérimentales sur une substance analogue (4-tert-butylphénol) ainsi que les données modélisées, il est conclu que l’hydroxyanisole butylé ne rencontre pas les critères pour la bioaccumulation.
Comme l’hydroxyanisole butylé est présent dans les produits de consommations et que la substance est rejetée dans l’eau, un scénario a été développé afin de calculer le quotient de risque en ce basant sur une comparaison entre la concentration la plus élevée connue dans les eaux résiduaires municipale et la concentration estimée sans effet. Deuxièmement, un scénario basé sur les rejets à travers le drain par les utilisations par les consommateurs a été utilisé afin d’estimer la concentration potentielle d’hydroxyanisole butylé dans plusieurs étendues des effluents des stations d’épuration des eaux usées. Troisièmement, un scénario d’exposition site-spécifique pour cinq sites a été développé en ce basant sur l’information sur les utilisations commerciales afin d’estimé prudemment les rejets dans l’environnement aquatique provenant des opérations industrielles et les concentrations résultantes. Les concentrations on été estimée comme étant sous le seuil ayant le potentiel d’être nocif pour les organismes aquatiques sensibles. Ces trois scénarios indiquent que la substance ne devrait pas avoir le potentiel d’être nocive pour l’environnement aquatique.
Selon les renseignements disponibles, incluant les résultats de l’analyse conservatrice du quotient de risque, ainsi que l’information sur la persistense, bioaccumulation et toxicité de la substance, il est conclu que l’hydroxyanisole butylé ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ni à mettre en danger l’environnement essentiel pour la vie. L’hydroxyanisole butylé répond aux critères de la persistance, mais ne répond pas à ceux du potentiel de bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation.
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
D’après les renseignements disponibles, il est conclu que le tert-Butyl-4-méthoxyphénol ne satisfait à aucun des critères prévus à l’article 64 de la Loi.
Conformément à la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999), les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui ont été jugées prioritaires dans le cadre de la catégorisation des substances figurant sur la Liste intérieure des substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada(Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
Une priorité élevée a été donnée à l'évaluation du risque que comporte le tert-butyl-4-méthoxyphénol pour la santé humaine étant donné qu'on a déterminé que la substance présente un risque d'exposition intermédiaire (REI) pour les Canadiens et qu'elle a été classée par d'autres organismes en fonction de sa cancérogénicité. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 31 janvier 2009 (Canada, 2009). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements techniques sur la substance ont été reçus en réponse au Défi.
Même si l'évaluation des risques du tert-butyl-4-méthoxyphénol pour la santé humaine était jugée hautement prioritaire, cette substance ne répondait pas aux critères relatifs à la persistance et au potentiel de bioaccumulation ou aux critères de toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l'accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères au sens de l'article 64 de la Loi. Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.[1]
La présente évaluation préalable finale prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable du tert-butyl-4-méthoxyphénol sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu'en juillet 2009 (sections du document concernant la santé humaine) et jusqu'en octobre 2009 (sections concernant la nature écologique). Les études les plus importantes ont fait l'objet d'une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers et les risques pour la santé (principalement d’après les évaluations s’appuyant sur la méthode du poids de la preuve effectuées par d’autres organismes, lesquelles qui ont servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur la marge entre les valeurs prudentes de concentration donnant lieu à des effets et les estimations de l’exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, et ce, dans le contexte d’une évaluation préalable. L’ébauche d’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s'agit plutôt d'un sommaire des renseignements essentiels qui appuient la conclusion proposée.
La présente évaluation préalable finale a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes de ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'écologie ont fait l’objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment John Christopher, Ph. D. (California Office of Environmental Health Assessment), Michael Jayjock, Ph. D. (The LifeLine Group) et Mme Joan Strawson (TERA). Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable. Les méthodes utilisées dans les évaluations préalables du Défi ont été examinées par un Groupe consultatif du Défi indépendant.
Les principales données et considérations sur lesquelles repose la présente évaluation préalable finale sont résumées ci-après.
Aux fins du présent document, la substance est appelée hydroxyanisole butylé. Les renseignements liés à l'hydroxyanisole butylé sont repris dans le tableau 1.
| No CAS | 25013-16-5 |
| Nom dans la LIS | tert-butyl-4-méthoxyphénol |
| Noms relevés dans les NCI1 | t-Butyl-p-hydroxyanisole (ENCS) tert-Butyl-4-methoxyphenol (EINECS) 1,1-(Dimethylethyl)-4-methoxyphenol (ECL) Phenol, (1,1-dimethylethyl)-4-methoxy- (AICS, ASIA-PAC, LIS, NZIoC, PICCS, SWISS, TSCA) |
| Autres noms | Antioxyne B BHA BHA (antioxidant) BOA BOA (antioxidant) 2(3)-tert-Butyl-4-hydroxyanisole tert-Butyl-4-hydroxyanisole Butylated hydroxyanisole Butylhydroxyanisole tert-Butylhydroxyanisole Phenol, tert-butyl-4-methoxy- |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Phénols |
| Principale sous-classe chimique | hydroxyanisoles; tert-butyles |
| Formule chimique | C11H16O2 |
| Structure chimique | 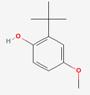 |
| SMILES2 | COc1ccc(O)c(c1)C(C)(C)C |
| Masse moléculaire | 180,25 g/mol |
| 1 National Chemical Inventories (NCI), 2007 : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique; LIS (Liste intérieure des substances); ECL (liste des substances chimiques existantes de la Corée); EINECS (inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); NCI (National Chemical Inventories); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); SWISS (liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse) et TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). 2 SMILES signifie « Simplified Molecular Line Input Entry System ». |
|
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et prévues) de l'hydroxyanisole butylé qui se rapportent à son devenir dans l'environnement. Le tableau 2 présente également les propriétés chimiques et physiques expérimentales d'un analogue structural, le 4-tert-butylphénol. Une comparaison des structures chimiques de l'hydroxyanisole butylé et du 4-tert-butylphénol se trouve dans le tableau 3.
| Propriété | Type | Valeur1 | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Koa, coefficient de partage octanol-air; Kco, coefficient de partage carbone organique-eau; Koe, coefficient de partage octanol-eau; pKa, constante de dissociation acide. 1 Les valeurs et les unités entre parenthèses représentent les valeurs originales estimées à l'aide des modèles. * Les données présentées dans le tableau 2 s’appliquent à l’hydroxianisole butylé s’il n’est pas indiqué autrement |
||||
| Point de fusion (°C) | Expérimental | 51 | PhysProp, 2006 | |
| Modélisé | 66,21 | MPBPWIN, 2000 | ||
| Point d'ébullition (°C) | Expérimental | 268 | PhysProp, 2006 | |
| Modélisé | 265,53 | MPBPWIN, 2000 | ||
| Masse volumique (kg/m3) | n.d. | |||
| Pression de vapeur (Pa) | Modélisé | 0,312 | MPBPWIN, 2000 | |
| Constante de la loi de Henry (Pa·m3/mol) | Modélisé | 8,675 × 10-3 0,119 |
25 | HENRYWIN, 2000 |
| Log Koe (sans dimension) |
Modélisé | 3,5 | 25 | KOWWIN, 2000 |
| Expérimental (4-tert-butylphénol) | 3,29 | OCDE, 2000 | ||
| Log Kco (sans dimension) |
Modélisé | 3,143 | PCKOCWIN, 2000 | |
| Solubilité dans l'eau (mg/L) |
Modélisé | 212,8 | 25 | WSKOWWIN, 2000 |
| Expérimental (4-tert-butylphénol) | 610 | OCDE, 2000 | ||
| pKa | Modélisé | 11,83 | ACD/pKaDB, 2005 | |
No CAS |
Nom commun | Masse moléculaire (g/mol) | Nom dans la LIS | Structure chimique | Données expérimentales disponibles |
|---|---|---|---|---|---|
| 25013-16-5 | Hydroxyanisole butylé | 180,25 | tert-butyl-4-méthoxyphénol | 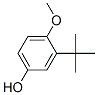 |
Point de fusion, point d'ébullition, toxicité aquatique, bioaccumulation |
| 98-54-4 | 4-tert-butylphénol | 150 | 4-tert-butylphénol | 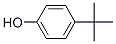 |
Log koe, solubilité dans l'eau, biodégradation, bioaccumulation |
Des modèles fondés sur les relations quantitatives structure-activité (RQSA) ont été utilisés pour générer des données pour certaines des propriétés physiques et chimiques de l'hydroxyanisole butylé. Bon nombre de ces modèles sont fondés sur des méthodes d'addition de fragments; autrement dit, ils s'appuient sur la structure d'un produit chimique donné. Seules les formes neutres d'un produit chimique peuvent être fournies comme données d'entrée à ces modèles (forme SMILES); par conséquent, les valeurs modélisées figurant au tableau 2 concernent la forme neutre de la substance. De plus, la valeur élevée du pKa de 11,83 indique que le composé ne devrait pas s'ioniser à l'intervalle de pH pertinent du point de vue de l'environnement (6 à 9). Comme les substances chimiques relativement simples, tel l’hydrozyanisole butylé, sont bien traduites par les ensembles d’étalonnage des modèles, on accorde un degré de confiance raisonnablement élevé aux prévisions modélisées.
Le 4-tert-butylphénol a été choisi comme analogue afin de fournir des données expérimentales déduites à partir d'analogues supplémentaires en raison de sa structure très semblable à l'hydroxyanisole butylé et parce qu'il appartient à la même classe chimique des butylphénols tertiaires (Remberger et al., 2003). Il existe des différences structurales entre les deux substances. L'hydroxyanisole butylé contient un atome d'oxygène supplémentaire ainsi qu'un groupe méthyle lié à l'anneau phénolique, et le groupe hydroxy est situé à un endroit différent sur l'anneau.
En 2006, l'hydroxyanisole butylé n'a pas été fabriqué au Canada en une quantité égale ou supérieure au seuil de déclaration de 100 kg. Par contre, une quantité de 100 à 1 000 kg d'hydroxyanisole butylé a été importée au Canada et une quantité de 1 000 à 10 000 kg de cette substance sous sa forme pure ou comme composant d'un produit, d'un mélange ou d'un article fabriqué a été utilisée (Environnement Canada, 2009a).
La US Environmental Protection Agency a inscrit l'hydroxyanisole butylé sur la liste des substances chimiques produites en grande quantité (NCBI, 2008). En 1998, la US Geological Survey a déclaré que 11 % des 126 échantillons d'eaux usées provenant de diverses sources contenaient de l'hydroxyanisole butylé (Brown et al., non daté).
D’après l’information soumise lors de l’inscription de la Liste intérieure des substances (LIS) (1984-1986), la quantité d’hydroxyanisole butylé déclarée comme ayant été fabriquée, importée ou commercialisée au Canada au cours de l'année civile 1986 se situait entre 100 000 et 1 000 000 kg (Environnement Canada, 1988).
Selon le titre 16, tableau XI, du Règlement sur les aliments et drogues, l'hydroxyanisole butylé est un antioxydant qui peut être utilisé dans de nombreux aliments. L'hydroxyanisole butylé peut être ajouté à certains aliments jusqu'à des concentrations maximales précisées dans le Règlement sur les aliments et drogues ou peut être utilisé en association avec l'hydroxytoluène butylé, le gallate de propyle ou l'hydroquinone de butyle tertiaire (TBHQ) jusqu'à une concentration maximale totale, pour tous les antioxidants combinés, équivalant à la concentration maximale de l'hydroxyanisole butylé utilisé seul (Canada, 1978). Aux États-Unis, l'hydroxyanisole butylé est un produit chimique qui est généralement reconnu inoffensif (GRAS) lorsque sa concentration ne dépasse pas 0,02 % en poids de la teneur en huile ou en gras totale des aliments (NTP, 2005).
La propriété antioxydante de l'hydroxyanisole butylé retarde la détérioration des saveurs et des odeurs et accroît considérablement la durée de conservation des matières grasses et des aliments qui en contiennent (NTP, 2005). Cette substance peut être utilisée dans les aliments cuits au four ou frits dans des huiles animales en raison de stabilité à haute température et de sa capacité à demeurer actif après ces types de cuisson (NTP, 2005). En 2006, l'hydroxyanisole butylé était utilisé au Canada comme antioxydant dans les produits alimentaires (Environnement Canada, 2009a) et pouvait se trouver dans une large gamme d'aliments, tels que les huiles et les graisses, les sauces pour salade, les céréales prêtes à consommer, les aliments cuits au four, les produits de pommes de terre déshydratées, les mélanges pour boissons et mets, les grignotines, les sucreries, la gomme à mâcher ainsi que les crèmes-desserts et les sauces prêtes à consommer.
Au Canada, l'hydroxyanisole butylé est utilisé comme stabilisateur dans certains plastiques destinés à être utilisés en contact direct avec les aliments. Toutefois, la contribution de cette source d'hydroxyanisole butylé à l'absorption totale d'hydroxyanisole butylé est négligeable (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée).
De plus, l'hydroxyanisole butylé est employé comme antioxydant et comme agent de préservation dans les aliments pour animaux, les cosmétiques ainsi que les produits de caoutchouc et de pétrole. Il est également un antioxydant très utilisé dans les aliments pour animaux puisqu'il retarde l'oxydation des vitamines A et E, du carotène, des xanthophylles, des gras fondus et des huiles végétales. C'est un stabilisateur efficace dans les huiles essentielles, la paraffine et les polyéthylènes (NTP, 2005).
L'hydroxyanisole butylé est employé comme antioxydant et agent de préservation dans les préparations pharmaceutiques (NTP, 2005). Il est inscrit dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) et dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu'ingrédient non médicinal utilisé comme antioxydant et agent antimicrobien dans les produits pharmaceutiques finaux, les produits de santé naturels et les médicaments vétérinaires fabriqués au Canada (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée). Dans les produits de santé naturels, l'apport quotidien acceptable (AQA) de l'hydroxyanisole butylé est de 0,5 mg/kg de poids corporel (kg p.c.) (BDIPSN, 2009).
Au Canada, l'hydroxyanisole butylé est une composante des produits de soins personnels, comme les déodorants, les shampooings et les lotions pour le corps (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée). En outre, aux États-Unis, l'hydroxyanisole butylé figure parmi les ingrédients les plus utilisés dans les cosmétiques (US FDA, 2009).
Au Canada, l'hydroxyanisole butylé est inscrit sur la liste 2 des produits de formulation dans les pesticides, à des concentrations allant de 0,000 04 % à 1 % (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée). Il agit comme agent stabilisant ou fragrance dans les rodenticides, les insecticides (jardins privés), les fongicides, les bactéricides (pâtes et papiers), les shampooings insecticides (chats et chiens), les insectifuges (lotions, lingettes) et les nettoyants antibactériens pour surfaces et vitres. L'hydroxyanisole butylé est également répertorié en tant qu'ingrédient inerte dans des pesticides aux États-Unis (US EPA, 2004).
L'hydroxyanisole butylé figure sur la Liste de divulgation des ingrédients (concentration par poids de 1 %) de la Loi sur les produits dangereux (Canada, 1988).
L'hydroxyanisole butylé ne figure pas dans l'Inventaire national des rejets de polluants (INRP, 2009). De même, il n'a pas été relevé dans le Toxic Release Inventory des ÉtatsUnis en 2006, soit l'année de déclaration la plus récente (TRI, 2006).
D'après les propriétés physiques et chimiques de l'hydroxyanisole butylé (tableau 2), les résultats de la modélisation de fugacité de niveau III (tableau 4) semblent indiquer que cette substance devrait demeurer principalement dans le sol et l'eau, selon le milieu où elle est rejetée.
| Substance rejetée dans | Pourcentage de la substance se répartissant dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 24,6 | 10,8 | 63,8 | 0,78 |
| l'eau (100 %) | 0,02 | 93,2 | 0,06 | 6,72 |
| le sol (100 %) | 0,00 | 0,58 | 99,4 | 0,04 |
La constante de dissociation acide relativement élevée (pKa) de 11,83 pour le groupe fonctionnel acide indique que la moitié du produit chimique sera dissociée à un pH de 11,83. Dans les plans d'eau ayant des pH pertinents du point de vue de l'environnement (entre 6 et 9), 100 % de l'hydroxyanisole butylé sera non dissocié, ce qui indique qu'il y aura une exposition biotique au produit sous forme neutre. La proportion relativement faible de la substance chimique dissociée indique également qu'il est approprié de prévoir le comportement de répartition à l'aide des logarithmes Koe et Kco.
Persistance dans l'environnement
Aucune donnée expérimentale sur la dégradation de l'hydroxyanisole butylé n'a été trouvée. Il existe toutefois des données expérimentales sur la biodégradation de l'analogue 4-tert-butylphénol.
Le tableau 5a présente les données empiriques sur la biodégradation qui indiquent la biodégradation de 98 % du 4-tert-butylphénol en 28 jours dans un essai de biodégradation rapide (OCDE, 2000). La demi-vie dans l'eau serait donc bien inférieure à 182 jours (6 mois), par conséquent, la substance ne devrait pas persister dans ce milieu.
| Milieu | Processus du devenir |
Valeur pour la dégradation | Paramètre et unités de la dégradation | Référence |
|---|---|---|---|---|
| Eau | Biodégradation | 98 | Biodégradation (%) | OCDE, 2000 |
Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et que l'hydroxyanisole butylé devrait être libéré dans ce milieu, la persistance dans l'eau a été examinée essentiellement à l'aide de modèles prévisionnels RQSA sur la biodégradation. Le tableau 5b résume les résultats des modèles de prévision RQSA disponibles sur la dégradation dans divers milieux naturels.
Processus du devenir |
Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade and Industry, Japon; s.o., sans objet; t½, demi-vie. 1 Le modèle ne précise pas d'estimation pour ce type de structure. 2 Le résultat s'exprime par une valeur numérique de 0 à 5. 3 Le résultat s'exprime par un taux de probabilité. |
|||
Air |
|||
| Oxydation atmosphérique | AOPWIN, 2000 | t½ = 0,297 jour | < 2 |
| Réaction avec l'ozone | AOPWIN, 2000 | s.o.1 | s.o. |
Eau |
|||
| Hydrolyse | HYDROWIN, 2000 | s.o.1 | s.o. |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 3 : enquête d'expert (biodégradation ultime) |
2,582 «se biodégrade lentement » |
> 1823 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 4 : enquête d'expert (biodégradation primaire) |
3,552 « se biodégrade rapidement » |
< 182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 5 : MITI probabilité linéaire |
0,533 « se biodégrade rapidement » |
< 182 |
| Biodégradation (aérobie) | BIOWIN, 2000 Sous-modèle 6 : MITI, probabilité non linéaire |
0,493 « se biodégrade rapidement » |
< 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 Probabilité |
0,293 « peut se biodégrader lentement » |
= 182 incertain |
| Biodégradation (aérobie) | CATABOL ©2004-2008 % DBO |
% DBO = 27,3 « peut se biodégrader lentement » |
= 182 incertain |
Une demi-vie d'oxydation atmosphérique dans l'air de 0,3 jour (tableau 5b) démontre que cette substance est susceptible de s'oxyder rapidement. La substance ne devrait pas réagir de façon appréciable avec d'autres espèces, comme l'ozone, par photooxydation dans l'atmosphère et elle n'est pas susceptible de se dégrader par photolyse directe. Des réactions avec des radicaux hydroxyles devraient donc constituer le plus important processus régissant son devenir dans l'atmosphère. Sa demi-vie de 0,3 jour, résultant des réactions avec ces radicaux, permet d'affirmer que l'hydroxyanisole butylé n'est pas persistant dans l'air.
Comme la substance ne comprend aucun groupement hydrolysable (tableau 5b), il était impossible de prévoir la demi-vie par hydrolyse dans l'eau ni pertinent de le faire.
Les résultats des modèles de biodégradation sont contradictoires. Le résultat du sous-modèle BIOWIN (2000) 4 (modèle d'enquête sur la biodégradation primaire) révèlent que la substance se biodégrade rapidement et a une demi-vie primaire inférieure à 182 jours. L'identité des produits de dégradation est toutefois inconnue. Les résultats des sous-modèles BIOWIN (2000) 5 et 6 semblent indiquer que l'hydroxyanisole butylé subit une dégradation ultime relativement rapide, alors que le sous-modèle 3 suggère que ce composé ce biodégrade lentement. Le résultat du modèle CATABOL (©2004-2008) semble indiquer que ce composé peut présenter un taux de dégradation ultime plus lent et que sa demi-vie pourrait être supérieure ou égale à 182 jours. Toutefois, le DBO de 27 % prévu à l'aide du modèle CATABOL (©2004-2008) n'est pas inférieur à 20 %, ce qui est associé à des substances très persistantes. Les prévisions du modèle TOPKAT (2004) indiquent que l'hydroxyanisole butylé se biodégrade relativement lentement, mais la marge entre cette prévision et la prévision selon laquelle il pourrait se biodégrader rapidement n'est pas marquée (0,07). Par conséquent, les modèles indiquent que cette substance devrait subir une biodégradation primaire importante sur une période de 182 jours, et la majorité des modèles semble indiquer qu'elle subirait une dégradation ultime importante en 182 jours. Les données expérimentales sur la biodégradation pour l'analogue structural 4-tert-butylphénol (tableau 5a) font également état d'une biodégradation immédiate. Ainsi, compte tenu des résultats de tous les modèles, des données expérimentales sur la biodégradation pour l'analogue et des caractéristiques structurales, la plupart des preuves tangibles indiquent que la demi-vie de la biodégradation de l'hydroxyanisole butylé est supérieure à 182 jours dans l'eau.
D'après les données expérimentales sur des analogues et les données prévues (tableaux 5a et 5b), l'hydroxyanisole butylé ne répond pas aux critères de persistance dans l'air, dans l'eau et dans le sol (demi-vie dans l'air > 2 jours, demi-vies dans le sol et dans l'eau = 182 jours), mais il répond aux critères de la persistance dans les sédiments (demi-vie dans les sédiments = 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Une étude expérimentale sur le taux de rétention de l'hydroxyanisole butylé chez le saumon de l'Atlantique (Salmo salar) a été commandée par la National Institute of Nutrition and Seafood Research de Norvège (NIFES, 2007). Les saumons ont été exposés à une alimentation contenant de l'hydroxyanisole butylé durant 84 jours et ont ensuite été soumis à une période de dépuration de 14 jours. Les résultats de cette étude ont montré que les concentrations d'hydroxyanisole butylé dans les filets de saumon étaient fonction de la dose tout au long de la période d'exposition, la concentration la plus élevée étant de 0,183 mg/kg chez les poissons exposés à la dose la plus élevée de 225 mg/kg nourriture. Les concentrations de la substance n'ont toutefois pas augmenté de façon significative durant l'étude, ce qui indique qu'une élimination ou un catabolisme rapide permet de prévenir l'accumulation. De plus, la concentration d'hydroxyanisole butylé dans les filets de saumon était inférieure au seuil de détection (7 µg/kg) après la période de dépuration de 2 semaines. Étant donné que cette étude n'a pas été conçue de manière standard, on y accorde une moins grande importance dans les éléments de preuve. Les résultats expérimentaux fournissent cependant de l'information qui indique un faible potentiel de bioaccumulation, puisque l'hydroxyanisole butylé semble être éliminé rapidement suivant son ingestion.
Le tableau 6a présente une valeur empirique pour le facteur de biocentration (FBC) pour l’analogue structural 4-tert-butylphénol chez le poisson.
| Organisme d’essai | Paramètre | Valeur (en poids humide en L/kg) | Référence |
|---|---|---|---|
| Poisson | FBC | 120 | OECD, 2000 |
Puisque aucune donnée expérimentale standard sur le facteur de bioaccumulation (FBA) et sur le FBC n'était disponible pour l'hydroxyanisole butylé, une méthode prédictive a été appliquée au moyen de modèles des facteurs de bioaccumulation et de bioconcentration (tableau 6b). Selon le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si son FBC ou son FBA s'avère supérieur ou égal à 5 000; toutefois, le calcul des facteurs de bioaccumulation est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances. En effet, le facteur de bioconcentration ne prend pas en compte de manière adéquate le potentiel de bioaccumulation des substances par l'alimentation, lequel est un facteur majeur pour les substances dont le log Koe est supérieur à ~4,0 (Arnot et Gobas, 2003). La modélisation cinétique du bilan massique devrait constituer la méthode de prévision la plus fiable pour déterminer le potentiel de bioaccumulation de l'hydroxyanisole butylé, car elle permet une correction du métabolisme dans la mesure où le log Koe de la substance se trouve dans le domaine du log Koe du modèle.
| Organisme d'essai | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|
| Poisson | FBA | 110,5 | Arnot et Gobas, 2003 (FBC niveaux trophiques intermédiaires) |
| Poisson | FBC | 110,6 | Arnot et Gobas, 2003 (FBC niveaux trophiques intermédiaires) |
| Poisson | FBC | 705 | OASIS Forecast, 2005 |
| Poisson | FBC | 57 | BCFBAF, 2008 |
Les prévisions pour le FBA et le FBC aux niveaux trophiques intermédiaires par Arnot et Gobas comprends des estimés du taux de transformation (km = 1.8 j-1 pour 10g de poisson). Ceci est en accord avec une étude sur le saumon de l’atlantique (NIFES, 2007) qui suggère une élimination rapide ainsi qu’avec le FBC empirique pour l’analogue structural 4-tert-butylphénol chez le poisson.
Les preuves disponibles indiquent que l'hydroxyanisole butylé devrait présenter un faible potentiel de bioaccumulation en raison de ses propriétés physiques et chimiques (c.-à-d. valeurs relativement faibles des Koe modélisés et de l'analogue, l'hydrosolubilité modérée modélisée et de l'analogue), de son élimination rapidse et de ses faibles valeurs modélisées du FBC et du FBA. Par conséquent, l'hydroxyanisole butylé ne répond pas aux critères de bioaccumulation (FBC ou FBA = 5 000) du Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Évaluation des effets sur l'environnement
Un résumé des données expérimentales sur les effets écologiques est présenté au tableau 7.
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50 (concentration efficace moyenne), concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50 (concentration létale médiane), concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai. | ||||
| Chlorella vulgaris (algue) | Toxicité chronique (48 h) | CE50 | 7,6 (42 µM) | Jos et al., 20051 |
| Allium cepa (plante) | Toxicité chronique (inhibition de la croissance, 72 h) | CE50 | 35 (194 µM) | Jos et al., 20051 |
| Vibrio fischeri (bactérie) | Toxicité aiguë (5, 15, 60 min) | CE50 | 0,21 (1,17 µM) | Jos et al., 2005 |
| Daphnia magna | Toxicité aiguë (48 h) | CE50 | 3,6 (20 µM) | Jos et al., 2005 |
| Moule zébrée (Dreissena polymorpha) |
Toxicité aiguë (48 h) | CL50 | 34,2 (moyenne de deux échantillons : 3,4 et 65) |
Cope et al., 1997 |
| Truite arc-en-ciel (Oncorhynchus mykiss) |
Toxicité aiguë (48 h) | CL50 | 1 | Cope et al., 1997 |
| Barbue de rivière (Ictalurus punctatus) |
Toxicité aiguë (48 h) | CL50 | 1,5 | Cope et al., 1997 |
| Crapet arlequin (Lepomis macrochirus) | Toxicité aiguë (48 h) | CL50 | 4,8 | Cope et al., 1997 |
| Medaka (Oryzias latipes) | Toxicité aiguë (48 h) | CL50 | 4,3 (moyenne de trois valeurs variant de 2,5 à 5,3) |
Tsuji et al., 1986 |
L'algue Chlorella vulgaris était l'organisme le plus sensible dans l'ensemble de données sur la toxicité chronique, la CE50 après 48 h pour l'inhibition de la croissance cellulaire étant de 7,6 mg/L.
Vibrio fischeri était l'espèce la plus sensible dans l'ensemble de données sur la toxicité aiguë, la valeur moyenne de la CE50 après 5, 15 et 60 minutes d'exposition pour l'inhibition de la bioluminescence étant de 0,21 mg/L. On a émis l'hypothèse que l'hydroxyanisole butylé serait toxique pour V. fischeri en raison d'un découplage de la phosphorylation oxydative et de l'inhibition de la respiration suivant une interaction directe avec la chaîne de transport des électrons (Cope et al., 1997). Dans l'ensemble de données sur la toxicité aiguë, la truite arc-en-ciel était au deuxième rang des espèces les plus sensibles, la CL50après 48 h étant de 1 mg/L (Cope et al., 1997). Les données relatives à la CL50 pour les poissons étaient assez uniformes, variant légèrement entre 1 et 4,8 mg/L.
La gamme de données sur la toxicité aquatique expérimentale prise en compte indique que la substance présente un risque modéré à élevé pour les organismes aquatiques, les valeurs de la CL50 et de la CE50 variant de 0,21 mg/L à 35 mg/L (tableau 7).
Outre sa toxicité modérée à élevée, l'hydroxyanisole butylé a été décrit dans la littérature scientifique comme étant un composé qui dérègle légèrement le système endocrinien (Goo Kang et al., 2005; Jobling et al., 1995; Jos et al., 2005; PAN, 2009 et Scippo, 2004). Toutefois, il y a des données contradictoires en ce qui a trait au degré de dérèglement du système endocrinien ainsi qu’en ce qui a trait à savoir si la substance est oestrogènique ou anti-oestrogènique. Donc, l’interprétation de cette information dans un contexte environnemental n’est pas claire.
Parce-qu’un haut degré d’incertitude est associé avec l’importance écologique des études sur le dérèglement du système endocrinien par l’hydroxyanisole butylé ainsi que parce-qu’il y a des résultats contradictoires sur les effets oestrogénique de la substance, la présente évaluation uttilise des paramètres toxicologiques d’intérêts conventionels (p.e. inhibition de la croissance et mortalité; Tableau 7) avec des facteurs d’évaluation qui permettent de tenir compte des effets potentiels subtiles d’une exposition à long terme afin de caractériser le risque écologique.
Évaluation de l'exposition de l'environnement
L'hydroxyanisole butylé a été décelé dans des échantillons prélevés dans différents cours d'eau aux États-Unis à une concentration maximale de 2 × 10-4 mg/L (Kolpin et al., 2002). L'un des trois échantillons d'eau de surface fluviale recueilli en Illinois et au Minnesota en 1998 contenait de l'hydroxyanisole butylé (0,3 µg/L) (Brown et al., non daté). Dans le cadre de la même étude, les huit échantillons prélevés dans l'effluent des usines de traitement des eaux usées (Illinois, Minnesota, Michigan et Wisconsin) contenaient de l'hydroxyanisole butylé (0,2 à 1,3 µg/L). Une étude réalisée par Soliman et al. (2004) a permis de constater que tous les échantillons provenant d'effluents traités à trois usines de traitement des eaux usées en Californie contenaient de l'hydroxyanisole butylé, en concentrations allant de 0,02 à 0,13 µg/L. Cette substance a été détectée dans l'effluent de trois usines de traitement des eaux usées en Suède à des concentrations de 0,5, 0,5 et 1 µg/L (Paxéus, 1996).
Rudel et al. (1998) ont analysé les boues et les eaux usées à Cape Cod, au Massachusetts. L'hydroxyanisole butylé a été détecté dans les cinq échantillons de boues non traitées (0,13 à 0,53 µg/L), dans deux des quatre échantillons d'eaux usées non traitées (0,025 et 0,05 µg/L) et dans aucun des trois échantillons de boues et d'eaux usées traitées. Des échantillons ont également été prélevés dans des puits de surveillance des eaux souterraines situés dans trois sites d'enfouissement municipaux ou à proximité de ceux-ci. L'hydroxyanisole butylé n'a pas été détecté (seuil de détection de 0,0066 µg/L) dans quatre échantillons d'eaux souterraines contaminées par des lixiviats de décharge, et l'un des cinq échantillons recueillis dans un site d'enfouissement/lagune contenait de l'hydroxyanisole butylé en une quantité inférieure à la limite de quantification (0,002 µg/L).
Des échantillons d'eaux usées brutes et d'effluents finaux traités ont été prélevés à six usines de traitement des eaux usées situées dans trois États dans l'Ouest américain en 2005 (Drewes et Snyder, 2009). Une analyse par chromatographie en phase liquide et spectrométrie de masse en tandem a permis de déceler des concentrations moyennes dans six échantillons de chacun des effluents finaux et d'eaux usées brutes de 70 ng/L et de 160 ng/L, respectivement. Une analyse par chromatographie en phase gazeuse et spectrométrie de masse en tandem a permis de déceler des concentrations moyennes de 190 ng/L et de 90 ng/L pour les eaux usées brutes et les effluents finaux, respectivement.
Ces études sur l'exposition mettent en lumière l'importance de l'eau en tant que milieu récepteur de l'hydroxyanisole butylé dans l'environnement. Les concentrations les plus élevées recensées dans les publications concernaient des échantillons prélevés en 1998 par Brown et al. (non daté) dans les rivières et les eaux usées des Etats-Unis et variaient de 0,2 × 10-3 à 1,3 × 10-3 mg/L, la valeur la plus haute provenant des eaux usées d’une usine de traitement des eaux usées municipale.
Caractérisation des risques pour l'environnement
La démarche suivie dans cette évaluation écologique préalable consistait à examiner les divers renseignements à l'appui et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprenaient les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Tel qu'il a été décrit précédemment, l'hydroxyanisole butylé répond aux critères de la persistance dans les sédiments énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000). L'hydroxyanisole butylé n'est pas persistant dans l'eau, le sol ou l'air, et devrait avoir un faible potentiel de bioaccumulation.
Rejets par les consommateurs
Étant donné que l'on trouve de l'hydroxyanisole butylé dans les produits de consommation et qu'on a signalé des rejets de cette substance dans l'eau, un scénario précis a été élaboré afin de calculer s'il existe un quotient de risque d'effets nocifs chez les organismes aquatiques. La concentration environnementale estimée (CEE) prudente est fondée sur la concentration la plus élevée connue mesurée dans un échantillon d'effluent municipal tirée de l'étude de Brown et al. (non daté), soit 1,3 × 10-3 mg/L.
On a déterminé une valeur prudente de la concentration estimée sans effet (CESE) à partir de la deuxième valeur de la toxicité la plus faible relevée, soit une valeur de toxicité aiguë pour la truite arc-en-ciel de 1 mg/L (Cope et al., 1997). Les paramètres de la truite arc-en-ciel ont été préférés à ceux des bactéries, car on considère qu'ils sont plus représentatifs des autres paramètres aquatiques, tout en étant des valeurs prudentes. De plus, V. fischeri vit dans un milieu marin, alors que le scénario d'exposition vise l'eau douce. Cette valeur de toxicité aiguë de 1 mg/L pour la truite arc-en-ciel a été divisée par un facteur d'évaluation de 100 afin de tenir compte des incertitudes liées à l'extrapolation de la toxicité aiguë à la toxicité chronique et de l'extrapolation de la valeur de la CL50 constatée en laboratoire à une valeur sans effet sur le terrain. La CESE obtenue était de 0,01 mg/L.
Le quotient de risque prudent (CEE/CESE : 0,0013/0,01) de 0,13 pour les espèces pélagiques sensibles est inférieur à 1, ce qui indique qu'il est peu probable que les expositions soient suffisamment élevées pour être nocives aux organismes aquatiques.
De plus, Mega Flush, outil d'Environnement Canada qui sert à estimer les rejets à l'égout issus d'utilisations par les consommateurs, a été utilisé pour estimer la concentration possible de l'hydroxyanisole butylé dans différents cours d'eau récepteurs d'effluents issus des usines de traitement des eaux usées dans lesquelles ont été rejetés par les consommateurs des produits contenant cette substance (Environnement Canada, 2009b). Ce modèle est conçu de manière à fournir des estimations sur la base d'hypothèses prudentes en ce qui concerne la quantité de produit chimique utilisé et rejeté par les consommateurs.
Par défaut, on suppose des pertes de 100 % associées à l'utilisation, une utilisation de la substance par les consommateurs de plus de 365 jours par année ainsi qu'un débit des effluents sur tous les sites au 10e centile de la valeur. Ces estimations sont réalisées pour 1 000 sites de rejet environ dans tout le Canada, prenant donc en compte les usines de traitement des eaux usées les plus importantes du pays.
L'équation et les entrées utilisées pour calculer la CEE de l'hydroxyanisole butylé dans les eaux réceptrices sont décrites dans le rapport d'Environnement Canada (2009c). Un scénario a été exécuté en utilisant la valeur déclarée pour le volume total de la substance à être utilisé au Canada en 2006. De plus, dans ce scénario, certaines valeurs des paramètres par défaut ont été modifiées d'après les données disponibles, afin d'être plus réaliste. En particulier, des taux d'élimination provenant des usines de traitement des eaux usées primaires de 11,9 % a été obtenue à partir du modèle SimpleTreat (SimpleTreat, 1997) et un taux d’élimination provenant des usines de traitement des eaux usées secondaires de 52,3% a été obtenue à partir du modèle ASTreat (ASTreat, 2006) et un taux d’élimination provenant des usines de traitement des eaux usées primaires et secondaires de 72%. Les conséquences induites globalement par les valeurs des paramètres choisis font que ce scénario est modérément prudent.
Selon ce scénario, l'outil a calculé que la CEE dans les cours d'eau récepteurs variait de 3,2 x 10-6 à 4,3 x 10-3 mg/L. La gamme de quotients de risques résultante (CEE/CESE) est de 3,2 x 10-4à 0,43 (3,2 x 10-6 / 0,01 à 4,3 x 10-3 / 0,01) pour les espèces pélagiques sensibles – toutes les valeurs étant inférieure à 1. Étant donnée la nature conservatrice de ce scénario – et particulièrement l’assomption que 100% de la substance uttilisée par les consommateurs est perdue par les égouts - ceci indique qu'il est peu probable que les expositions soient suffisamment élevées pour être nocives aux organismes aquatiques.
Rejets industriels
Étant donné que l'hydroxyanisole butylé est utilisé dans un cadre industriel et qu'une partie importante de cette substance pourrait être rejetée dans l'eau, des scénarios propres aux sites ont été utilisés pour estimer la concentration de la substance résultant des rejets industriels à cinq sites où l'utilisation de cette substance est connue. Le scénario pour chaque site est prudent, c'est-à-dire qu'il suppose que la quantité maximale pour chaque déclarant, d’après les quantitées déclarées en 2006, de la substance est employée et que les pertes dans les égouts sont élevées et qu'elles représentent 5 % de la quantité totale provenant du nettoyage de contenants de produits chimiques et d'équipement de traitement. Les cinq scénarios présument en outre que les rejets se produisent 250 jours par an, habituellement pour les petites et moyennes installations, et qu'ils sont acheminés vers une usine de traitement des eaux usées avec un taux d'élimination propre au site allant de 12 % (traitements primaires) à 72 % (traitements primaires et secondaires). D'après les hypothèses formulées ci-dessus, et en appliquant des facteurs de dilutions propres aux sites de (à un facteur maximal de 10) aux concentrations résultantes dans les effluents, les cinq scénarios de rejets industriels donnent une gamme de concentration en milieu aquatique de 5,3 x 10-5 à 2,8 × 10-4 mg/L.
La gamme de quotient de risque prudent résultante (CEE/CESE) de 5,3 x 10-3 (5,3 x 10-5 / 0,01) à 0,028 (2,8 x 10-3 / 0,01) pour les espèces pélagiques sensibles est inférieure à 1, ce qui indique qu'il est peu probable que les expositions soient suffisamment élevées pour être nocives aux organismes aquatiques.
Étant donné que la majorité des rejets d'hydroxyanisole butylé serait issue d'utilisations par les consommateurs et comme les résultats de la modélisation de la fugacité montrent que la majeure partie de la substance rejetée dans l'eau restera dans ce milieu, il est peu probable que des organismes d'autres sites ou d'autres milieux y soient exposés.
Les renseignements disponibles révèlent que l'hydroxyanisole butylé n'a pas le potentiel de causer des effets écologiques nocifs au Canada.
Incertitudes dans l'évaluation des risques pour l'environnement
Malgré certaines incertitudes liées à l'utilisation de modèles RQSA pour l'estimation de la persistance et de la bioaccumulation, l'hydroxyanisole butylé est une molécule organique relativement simple, ce qui permet d'accorder un degré de confiance raisonnablement élevé aux prévisions modélisées. En outre, les modèles RQSA étaient fondés sur les valeurs estimées de certaines propriétés physiques et chimiques clés (notamment la pression de vapeur, la solubilité dans l'eau et le log Koe). Il y a aussi de l’incertitude en ce qui à trait au potentiel de dérèglement du système endocrinien de l’hydroxyanisole butylé et son importance écologique, ce qui a été adressé en partie a l’aide de facteurs d’évaluation qui extrapolent les données conventionnelles sur les effets aiguë jusqu'à une valeur chronique sans effets sur le terrain qui devrait tenir compte des effets potentiels subtiles d’une exposition à long terme.
Évaluation de l'exposition
Milieu naturel et nourriture
Au Canada, on a décelé aucune concentration d'hydroxyanisole butylé dans l'eau potable (courriel du Bureau de l'eau, de l'air et des changements climatiques de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée).
Aux États-Unis, l'hydroxyanisole butylé est inscrit sur la liste des « substances pouvant contaminer l'eau potable » (US EPA, 2008). L'hydroxyanisole butylé a été « identifié provisoirement » dans des échantillons d'eau brute et d'eau traitée dans le cadre d'un examen attentif des services d'eau publics au New Jersey (NJDEP, 2003). Stiles et al. (2008) ont recueilli de l'eau brute et de l'eau traitée à des installations de traitement de l'eau dans le nord du New Jersey; de l'hydroxyanisole butylé a été décelé, mais non quantifié, à la fois dans l'eau brute et l'eau traitée. En 1999-2000, la US Geological Survey a recueilli des échantillons d'eau dans plus de 139 cours d'eau situés dans 30 États, à des sites en aval de zones d'intense urbanisation ou d'élevage de bétail; l'hydroxyanisole butylé a été détecté dans 2 des 85 échantillons (concentration maximale de 0,2 µg/L) (Kolpin et al., 2002). L'hydroxyanisole butylé a été détecté dans l'eau de surface de la rivière Colorado (24 ng/L) mais non dans les échantillons prélevés dans le delta des rivières Sacramento et San Joaquin (Soliman et al., 2007).
En Allemagne, on a détecté de l'hydroxyanisole butylé dans l'eau de surface de cours d'eau et de rivières (concentration maximale de 35 ng/L) (Boltz et al., 2001). Cette substance a été détectée invariablement (concentration non précisée) dans des échantillons de la rivière Po (Italie) au cours de la période 1994-1996 (Davi et Gnudi, 1999). En Espagne, l'hydroxyanisole butylé a été décelé dans 6 des 20 échantillons prélevés à l'effluent d'usines de traitement des eaux usées municipales et dans 3 des 30 échantillons d'eau fluviale (Gomez et al., 2009).
L'absorption d'hydroxyanisole butylé provenant de l'eau potable a été calculée en utilisant la concentration maximale de 0,2 µg/L établie dans l'étude de 1999-2000 de la US Geological Survey (Kolpin et al., 2002). L'absorption estimée maximale (nourrissons nourris au lait maternisé) était de 0,02 µg/kg p.c. par jour, ce qui est négligeable en comparaison avec l'absorption estimée provenant des aliments et des produits de soins personnels (voir les sections suivantes).
Nourriture
Selon le titre 16, tableau XI, du Règlement sur les aliments et drogues, l'hydroxyanisole butylé est un antioxydant qui peut être utilisé dans de nombreux aliments. L'hydroxyanisole butylé peut être ajouté à certains aliments jusqu'à des concentrations maximales précisées dans le Règlement sur les aliments et drogues ou peut être utilisé en association avec l'hydroxytoluène butylé, le gallate de propyle ou le TBHQ jusqu'à une concentration maximale totale, pour tous les antioxydants combinés, équivalant à la concentration maximale de l'hydroxyanisole butylé utilisé seul. Les concentrations maximales sont fondées soit sur un pourcentage de la teneur totale en lipide d'un aliment donné soit sur le poids total de l'aliment (Canada, 1978). Les concentrations réelles d'hydroxyanisole butylé ont été trouvées pour certains aliments qui ont été pris en compte dans l'évaluation de l'exposition. Pour les autres aliments, on a supposé qu'ils contenaient toujours la concentration maximale permise d'hydroxyanisole butylé, sauf lorsque la substance pouvait être utilisée en association avec d'autres antioxydants. Dans ce cas, on a supposé que la concentration d'hydroxyanisole butylé dans les aliments était une fraction (moitié, tiers ou quart, selon le nombre d'antioxydants permis) de la concentration maximale permise dans le mélange d'antioxydants. Certains aliments peuvent également contenir de l'hydroxyanisole butylé lorsque de la vitamine A ou D y est ajouté, car l'utilisation d'hydroxyanisole butylé est autorisée dans ces vitamines.
L'évaluation de l'exposition comprenait, parmi les aliments autorisés à contenir de l'hydroxyanisole butylé, ceux qui contribuent de façon significative à l'alimentation ou qui sont populaires auprès des enfants et non ceux qui ne contribuent pas de façon significative à l'exposition. De plus, tous les aliments (à l'exception du lait de vache) auxquels les vitamines A et D doivent être ajoutées ont été exclus de l'évaluation, car la contribution de l'hydroxyanisole butylé comme ingrédient dans les préparations de vitamines A et D est très faible. L'exposition à l'hydroxyanisole butylé découlant de l'ajout des vitamines A et D dans le lait de vache a été incluse dans l'évaluation, car les enfants consomment couramment du lait. Cependant, l'exposition à l'hydroxyanisole butylé provenant du lait a également été jugée négligeable. Environ 40 catégories d'aliments, telles que les sauces pour salade, notamment les sauces à base de mayonnaise et celles à base d'huile et vinaigre, ont également été incluses dans l'évaluation de l'exposition.
Les données sur l'apport alimentaire sont tirées de l'Enquête sur la santé dans les collectivités canadiennes (ESCC) – Cycle 2.2, Nutrition (2004) de Statistique Canada. L'apport pour toutes personnes confondues sur une journée qui a été mentionné par les répondants a été utilisé, et aucun rajustement n'a été effectué pour tenir compte de l'apport quotidien habituel, rajustement statistique servant à estimer la distribution de l'exposition quotidienne moyenne à long terme. Les données sur l'exposition ont été rajustées en fonction du poids corporel (données autodéclarées et données mesurées) de façon à ce qu'elles soient représentatives de la population canadienne. Comme l'ESCC ne mentionne pas les poids corporels des enfants de moins de 2 ans, des valeurs tirées de Continuing Survey of Food Intakes by Individuals (CSFII, 1994-1996, 1998) ont été utilisées.
Une évaluation probabiliste de l'exposition a été menée. Les apports quotidiens moyens d'hydroxyanisole butylé estimés toutes personnes confondues provenant de l'alimentation pour tous les groupes d'âge des consommateurs sont présentés à l'annexe 1. Les valeurs de l'apport moyen variaient de 0,023 à 0,095 mg/kg p.c. par jour, selon le groupe d'âge.
Plusieurs aliments sont une source d'exposition à l'hydroxyanisole butylé chez les nourrissons de moins d'un an. Parmi les aliments qui représentent plus de 10 % de l'exposition totale à l'hydroxyanisole butylé dans ce groupe d'âge, notons les mélanges en poudre pour desserts, les céréales prêtes à consommer, les craquelins et le pain. Les graisses et les huiles sont des sources d'exposition pour les consommateurs de tous les groupes d'âge, sauf chez les nourrissons de moins d'un an, représentant entre 16 et 24 % de l'exposition totale à l'hydroxyanisole butylé chez les consommateurs âgés de plus d'un an. D'autres aliments qui représentent chacun plus de 10 % de l'exposition totale à l'hydroxyanisole butylé chez les sujets âgés de plus d'un an sont la margarine, les sauces pour salade, les mélanges secs pour desserts, le pain, les céréales prêtes à consommer et les mélanges en poudre pour boissons.
Bien que certaines catégories d'aliments qui pourraient constituer des sources mineures d'exposition à l'hydroxyanisole butylé n'aient pas été incluses dans l'évaluation, il se peut que l'exposition à cette substance ait été surestimée en raison du peu de données quantitatives trouvées pour tenir compte des facteurs suivants : les concentrations réelles d'hydroxyanisole butylé par rapport aux concentrations maximales autorisées dans le Règlement sur les aliments et drogues; les concentrations réelles d'hydroxyanisole butylé en association avec d'autres antioxydants; le fait que des fabricants puissent avoir abandonné l'utilisation de l'hydroxyanisole butylé dans certains des aliments pour lesquels l'utilisation de la substance est autorisée; les pertes possibles d'hydroxyanisole butylé dans les aliments pendant le traitement, le transport et l'entreposage.
Produits de soins personnels
L'hydroxyanisole butylé est une composante des produits de soins personnels, comme les déodorants, les shampooings et les lotions pour le corps (courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée). Aucune étude n'a été relevée portant sur l'absorption in vivo de l'hydroxyanisole butylé chez les humaines ou des animaux de laboratoire. Schumann (1991) a fait état de l'absorption in vivo de l'hydroxyanisole butylé par la peau humaine. Dans le cadre de trois essais en parallèle portant sur l'absorption cutanée (abdomen) chez des femmes de 24 ans, l'hydroxyanisole butylé a été appliqué sous forme d'onguent eau dans l'huile pendant 16 heures. La concentration la plus élevée dans le liquide de cuve était de 5,34 % de la dose appliquée, après l'avulsion cutanée complète. Par conséquent, un taux d'absorption de 5 % a été appliqué dans la modélisation à l'aide de ConsExpo (2006) pour les produits de soins personnels. L'absence de toxicité notée dans les études sur l'exposition cutanée (vois la section « Évaluation des effets sur la santé » ci-après) est conforme avec la faible valeur d'absorption cutanée estimée.
L'exposition estimée par l'utilisation de produits de soins personnels est présentée à l'annexe 2. Les estimations varient, selon la concentration d'hydroxyanisole butylé dans le produit, la surface corporelle sur laquelle le produit a été appliqué ainsi que la durée de l'exposition. Les données disponibles sur la concentration d'hydroxyanisole butylé sont présentées sous forme d'intervalle. L'intervalle le moins élevé était de 0 % à 0,1 %. L'intervalle de 0,3 % à 1 % a été choisi pour calculer l'absorption maximale (prudente), car parmi les quelques milliers de produits de soins personnels qui contiennent de l'hydroxyanisole butylé que l'on trouve au Canada, presque tous contiennent de l'hydroxyanisole butylé à des concentrations allant jusqu'à 1 %, le plupart ne contenant qu'un maximum de 0,1 % d'hydroxyanisole butylé. Bien que quelques produits contiennent des concentrations supérieures à 1 %, ils ont été jugés non représentatifs de l'ensemble de la base de données. Les produits qui sont utilisés plus souvent et qui couvrent de grandes surfaces corporelles (shampooings, lotion pour le corps) contribuaient le plus à l'absorption combinée des produits les plus fréquemment utilisés. Pour ces produits, la concentration d'hydroxyanisole butylé correspondant au 95e centile a été utilisée pour estimer l'absorption, afin de refléter l'exposition de façon plus prudente.
Les intervalles d'absorption combinée d'hydroxyanisole butylé contenu dans les produits de soins personnels fréquemment utilisés sont présentés au tableau 8. Le groupe présentant l'absorption estimée maximale d'hydroxyanisole butylé, de 0,07 mg/kg p.c. par jour, est les enfants âgés de 6 mois à 5 ans, suivi de près par le groupe des enfants âgés de 5 à 12 ans (0,06 mg/kg p.c. par jour) et les femmes (0,06 mg/kg p.c. par jour).
| Produit | Absorption (mg/kg p.c. par jour)1 | |
|---|---|---|
| Moyenne | Maximale | |
| 1 L'absorption moyenne est fondée sur l'hypothèse que la concentration d'hydroxyanisole butylé est de 0,1 %. La plupart des produits faisaient partie de cette catégorie. L'absorption maximale est fondée sur l'hypothèse que la concentration d'hydroxyanisole butylé est de 0,1 %, sauf indication contraire. L'absorption cutanée est de 5 % (Schumann, 1991). 2 On suppose que le shampooing est utilisé tous les deux jours. 3 Parmi les autres produits utilisés quotidiennement, notons le fard à paupières, le fard à cils et le crayon pour les yeux. Leur apport à l'absorption totale est négligeable. L'exposition orale provenant du rouge à lèvres est négligeable comparativement à l'exposition par les aliments (annexe 1). |
||
| Nourrissons | ||
| Crème pour bébés | 0,004 | 0,04 |
| Total | 0,004 | 0,04 |
| Enfants de 6 mois à 5 ans | ||
| Shampooing2 | 0,0023 | 0,00989 (hydroxyanisole butylé 0,43 %, 95ecentile) |
| Lotion pour le corps, appliquée deux fois par jour | 0,0177 | 0,0583 (hydroxyanisole butylé 0,33 %, 95ecentile) |
| Total | 0,02 | 0,07 |
| Enfants de 5 à 12 ans | ||
| Shampooing | 0,0015 | 0,00646 (hydroxyanisole butylé 0,43 %, 95ecentile) |
| Lotion pour le corps, appliquée deux fois par jour | 0,0148 | 0,0489 (hydroxyanisole butylé 0,33 %, 95ecentile) |
| Total | 0,02 | 0,06 |
| Hommes | ||
| Crème à raser | 0,000 141 | 0,000 141 (tous les produits de rasage se situent dans l'intervalle 0 à 0,1 %) |
| Lotion après rasage | 0,000 846 | 0,000 846 (tous les produits de rasage se situent dans l'intervalle 0 à 0,1 %) |
| Gel capillaire | 0,000 207 | 0,00207 |
| Déodorant en aérosol | 0,00366 | 0,00366 (tous les déodorants se situent dans l'intervalle 0 à 0,1 %) |
| Shampooing | 0,001 | 0,00432 (hydroxyanisole butylé 0,43 %, 95ecentile) |
| Total | 0,006 | 0,01 |
| Femmes3 | ||
| Déodorant en aérosol | 0,00366 | 0,00366 (tous les déodorants se situent dans l'intervalle 0 à 0,1 %) |
| Maquillage pour le visage | 0,000 564 | 0,005 64 |
| Eau de toilette | 0,00128 | 28 (aucun parfum dans cet intervalle; valeur utilisée pour l'intervalle de 0 à 0,1 %) |
| Fixatif pour cheveux | 0,000 507 | 0,00507 |
| Nettoyant pour le visage | 0,000 352 | 0,00352 |
| Crème pour le visage, appliquée deux fois par jour | 0,00113 | 0,00372 (hydroxyanisole butylé 0,33 %, 95ecentile) |
| Lotion pour le corps, appliquée deux fois par jour | 0,0113 | 0,0372 (hydroxyanisole butylé 0,33 %, 95ecentile) |
| Shampooing | 0,001 | 0,00432 (hydroxyanisole butylé 0,43 %, 95ecentile) |
| Total | 0,02 | 0,06 |
Le degré de confiance associé à la base de données sur l'exposition à l'hydroxyanisole butylé est élevé. Des renseignements ont été relevés sur les concentrations d'hydroxyanisole butylé contenues dans de nombreux produits de soins personnels vendus au Canada. Ces produits pourraient être la principale source d'exposition à l'hydroxyanisole butylé.
Évaluation des effets sur la santé
L'annexe 3 présente un aperçu des effets déclarés de l'hydroxyanisole butylé sur la santé des animaux de laboratoire.
L'hydroxyanisole butylé a été classifié comme étant probablement cancérogène pour l'homme (2B), selon des preuves insuffisantes chez l'homme et des preuves concluantes chez les animaux de laboratoire (CIRC, 1986, 1987). Il a également été classé, dans le US National Toxicology Program Report on Carcinogens, parmi les substances dont on peut raisonnablement présumer qu'elles sont cancérogènes, à partir du sixième rapport annuel en 1991 jusqu'au onzième rapport en 2005 (NTP, 2005). Le CIRC (2003) a conclu que le mode d'action expliquant la cancérogénicité provoquée par l'hydroxyanisole butylé chez les animaux de laboratoire mécanisme n'était pas transposable chez l'humain. La Food and Drug Administration des États-Unis classe l'hydroxyanisole butylé comme un produit chimique qui est généralement reconnu inoffensif (GRAS) lorsque sa concentration total en antioxydant ne dépasse pas 0,02 % en poids de la teneur en huile ou en gras des aliments (NTP, 2005). De plus, lors de sa 33e réunion de 1989, le comité conjoint d'experts FAO/OMS sur les additifs alimentaires (JECFA) ont alloué un apport quotidien admissible (AQA) pour les humains de 0 à 0,5 mg/kg p.c. (OMS, 1989). Au Canada, l'utilisation de cette substance dans les aliments est autorisée en vertu du titre 16 du Règlement sur les aliments et les drogues) (Canada, 1978).
Chez les rats, une grande partie de l'hydroxyanisole butylé administré par voie orale est excrétée rapidement par l'urine, dans les matières fécales et par l'air expiré (revu dans Ito et Hirose, 1987). Les principaux métabolites sont des O-glucuronides et des O-sulfate conjugués, ainsi que du TBHQ, produits par l'O-déméthylation. Le TBHQ peut ensuite se conjuguer avec le glucuronide ou le sulfate et également participer au cycle redox avec la quinone correspondante, TBQ (tert-butylquinone), pour produire des espèces réactives à l'oxygène (évalué par l'OMS, 1998). On a noté la présence de composés conjugués de TBHQ dans l'urine ainsi que des variations dans les espèces produites en fonction de la proportion de la dose éliminée dans l'urine et les matières fécales et de l'importance des glucuronides ou des sulfates conjugués (Conning et Phillips, 1986), le mode d'élimination des humains étant plus semblable à celui des rats qu'à celui des chiens.
L'administration d'hydroxyanisole butylé à une concentration de 0,75 % dans le régime alimentaire des rats Sprague-Dawley mâles sur une période de 3 jours a entraîné des concentrations d'ARNm hépatique 40 fois plus élevées pour l'isoenzyme uridine 5'-diphosphate (UDP) glucuronyltransférase (UGT1*06), alors qu'elle a eu très peu d'effet sur les concentrations d'ARNm pour les enzymes du cytochrome P450 (Buetler et al., 1995). L'administration d'hydroxyanisole butylé à une concentration de 0,75 % dans le régime alimentaire des souris CD-1 femelles sur une période de 3 semaines a entraîné une glucuronidation d'œstradiol et d'œstrone par les microsomes hépatiques 2 et 3 fois plus élevée, respectivement (Zhu et al., 1997). La capacité de glucuronidation des cellules du petit intestin a également augmenté chez les souris Swiss Webster femelles, lorsqu'on leur administrait de l'hydroxyanisole butylé à une concentration de 1 % dans leur régime pendant 10 jours (Hjelle et al., 1985).
Le profil toxicologique de l'hydroxyanisole butylé administré par ingestion établi avant 1982 n'a soulevé aucune inquiétude relativement à la génotoxicité ou à la toxicité à court et à long terme de la substance. Aucune des études à long terme n'a été menée après le milieu des années 1960 et seulement une étude à court terme a été menée au cours de cette période; par conséquent, ces études ont été réalisées avant l'entrée en vigueur, une décennie plus tard, des bonnes pratiques en laboratoire et des protocoles d'étude normalisés. Certaines des études à long terme comptaient des sections sur la reproduction dans leur protocole. La plupart de ces études ne mettaient pas la substance à l'essai jusqu'à la dose maximale admissible, et peu d'observations histopathologiques étaient effectuées dans le cadre des études des effets de la substance administrée avec les aliments. Notons, comme exception, l'établissement de la dose maximale admissible à une concentration de 2 % pour l'hydroxyanisole butylé administré dans le régime alimentaire des rats (Wilder et Kraybill, 1948) ainsi que la découverte de la dégénérescence des cellules hépatiques chez les chiens sevrés, auxquels on administrait 250 mg/kg p.c. par jour d'hydroxyanisole butylé dans leur régime sur une période de 15 mois (Wilder et al., 1960).
La première étude à avoir signalé l'action cancérogène de l'hydroxyanisole butylé (Ito et al., 1982, 1983a) a été menée auprès de rats F344 mâles et femelles nourris au granulé, auquel on a incorporé la substance à des concentrations de 0 %, de 0,5 % et de 2 %. Une analyse a indiqué qu'en fait, le traitement avait réduit les concentrations de la substance à près de 0,25 % et de 1 %. Toutefois, une étude ultérieure a montré qu'il n'y avait aucune perte de la substance pendant le traitement (déclaré par l'OMS, 1983). Outre une baisse du gain de poids corporel à la dose élevée, cette étude a fait état d'une hausse très importante de l'incidence de la néoplasie et de l'hyperplasie du pré-estomac (papillomes et carcinomes malpighiens) chez les animaux traités, ce qui indique une relation dose-réponse claire. On n'a noté aucune différence significative dans l'incidence des tumeurs dans les autres organes. La prolifération des voies biliaires, présente dans tous les groupes, a diminué de manière proportionnelle à la dose administrée au sein des groupes recevant l'hydroxyanisole butylé. Selon une analyse subséquente des lames d'anatomopathologie, les néoplasmes n'étaient présents que dans le pré-estomac des animaux recevant la dose élevée de la substance.
Il existe trois études publiées sur la cancérogénicité qui évaluent les effets de l'hydroxyanisole butylé chez les rats F344 mâles (Ito et al., 1986; Masui et al., 1986; Williams et al., 1990b). L'ensemble de ces études faisait état d'augmentations statistiquement significatives des papillomes du pré-estomac à des concentrations de 1 % ou plus d'hydroxyanisole butylé dans leur régime alimentaire ainsi que des carcinomes malphigiens du pré-estomac à des concentrations de 2 %. L'étude menée par Ito et al. (1986) a établi une concentration sans effet observé (CSEO) d'hydroxyanisole butylé de 0,125 % dans le régime alimentaire (mesurée à 0,11 %, équivalant à 55 mg/kg p.c. par jour) pour l'hyperplasie du pré-estomac et une dose sans effet nocif observé (DSENO) d'hydroxyanisole butylé de 0,5 % (mesurée à 0,47 %, équivalant à 230 mg/kg p.c. par jour) pour l'induction des papillomes du pré-estomac.
Dans le cadre d'études sur d'autres rongeurs d'une durée de deux ans, des carcinomes malphigiens et des papillomes du pré-estomac ont été induits chez des souris B6C3F1 mâles à des concentrations de 0,5 % et de 1 % de la substance administrée dans leur régime alimentaire et chez des hamsters dorés de Syrie mâles à des concentrations de 1 % et de 2 % de la substance administrée dans leur régime (Masui et al., 1986). Ito et al. (1983b) ont montré qu'une concentration de 1 % ou de 2 % d'hydroxyanisole butylé administré dans le régime alimentaire des hamsters dorés de Syrie mâles a induit la totalité des papillomes du pré-estomac sur une période de 24 semaines (5,5 mois).
Aucune tumeur dans les tissus de l'estomac glandulaire ou les tissus de l'œsophage analogues n'a été observée dans les études sur la cancérogénicité menée chez des espèces sans pré-estomac. On n'a observé aucun changement macroscopique dans l'estomac des cochons d'Inde exposés à l'hydroxyanisole butylé à une concentration de 1 % dans leur régime alimentaire sur une période de 20 mois (Ito et Hirose, 1987).
Après la publication de la première étude sur la cancérogénicité chez les rats mentionnant le pré-estomac des rats comme principal organe cible de l'hydroxyanisole butylé, de nombreuses études à court terme ont été réalisées sur des souris, des rats et des hamsters afin de caractériser cet effet cancérigène de l'hydroxyanisole butylé. Des observations sur le développement et les caractéristiques des lésions prénéoplasiques, l'indice de marquagehépatique des cellules du pré-estomac ainsi que la durée et la réversibilité des lésions prolifératives du pré-estomac ont été signalées (OMS, 1987, 1989). Des études menées par Altmann et al. (1985) ont permis de conclure que la toxicité associée à l'hydroxyanisole butylé ciblant le pré-estomac était liée à une irritation locale et n'était pas un effet systémique. Chez les animaux auxquels on a administré de l'hydroxyanisole butylé par gavage, on a observé des modifications hyperplasiques à l'apex du pré-estomac, alors que l'administration de la substance dans le régime alimentaire entraînait une hyperplasie dans la région de la crête de séparation. Cette preuve appuie l'hypothèse selon laquelle les lésions du pré-estomac induites par la substance découlent d'un renouvellement des cellules, d'un dommage ou d'une irritation locale du tissu et laisse supposer que cette substance a une toxicité propre à la voie visée.
Des études à court terme ont également été menées sur des espèces sans pré-estomac (chiens, porcs, singes). Aucune de ces études n'a démontré une réponse proliférative provoquée par l'hydroxyanisole butylé aussi importante que celle observée dans les tissus analogues du pré-estomac des rongeurs.
Dans différentes études, des chiens Beagle des deux sexes recevaient des doses d'hydroxyanisole butylé de 0 %, 1,0 % et 1,3 % (doses réelles non calculées; Ikeda et al., 1986) ou de 0 %, 0,25 %, 0,5 % et 1 % (équivalant à 0, 54, 111 et 219 mg/kg p.c. par jour chez les mâles et à 0, 62, 112 et 231 mg/kg p.c. par jour chez les femelles) (Tobe et al., 1986) dans leur régime alimentaire sur une période de 180 jours (26 semaines). On a noté une baisse du poids corporel par rapport aux témoins à toutes les doses, indiquant une signification statistique à la dose la plus élevée seulement (1,3 % du régime). Les deux études ont signalé des augmentations importantes du poids du foie en fonction de la dose administrée chez les chiens mâles et femelles de tous les groupes de traitement, accompagnées de changements histologiques décrits comme une altération du tissu adipeux, une enflure ou une hypertrophie, ainsi que la prolifération du réticulum endoplasmique lisse, observée par microscopie électronique (Ikeda et al., 1986). Ces résultats concordent avec l'activité accrue des enzymes hépatiques (aminopyrine déméthylase, UDP-glucuronyltransférase, glutathion S-transférase et époxyde-hydratase) et l'augmentation des concentrations du cytochrome P450, de la cytochrome c réductase et du cytochrome b qui ont également été observés dans cette étude. Le poids de la thyroïde a également augmenté de façon statistiquement significative par rapport aux témoins aux deux doses de traitement, sauf à la dose élevée administrée aux femelles (Ikeda et al., 1986). Aucune modification histologique de la thyroïde n'a été observée (Tobe et al., 1986). Aucune étude n'a indiqué de lésions hyperplasiques ou prolifératives de l'œsophage inférieur ou de l'épithélium de l'estomac. Selon l'index mitotique de la couche basale de l'épithélium de l'œsophage, il n'y eu aucun effet par rapport aux témoins (Tobe et al., 1986). La dose minimale avec effet observé (DMEO) chez le chien, établie en fonction de l'augmentation du poids du foie et des changements histopathologiques, était de 0,25 %, soit l'équivalent de 54 mg/kg p.c. par jour.
Étant donné l'intérêt porté à l'effet de l'hydroxyanisole butylé sur le pré-estomac des rongeurs, des échantillons de tissus gastriques ayant été préservés à la suite d'une étude de 16 semaines sur l'embryotoxicité de l'hydroxyanisole butylé chez les truies Landrace danoise (Hansen et al., 1982) ont été évalués après coup (Olsen, 1983; Würtzen et Olsen, 1986). Au cours de cette étude, l'hydroxyanisole butylé a été intégré à l'alimentation de groupes comptant de 9 à 13 truies à des doses de 0, 50, 200 et 400 mg/kg p.c. par jour (équivalant à des concentrations de 0 %, 0,5 %, 1,9 % et 3,7 % dans l'alimentation) à partir du premier accouplement jusqu'au 110e jour de gestation. On a observé une baisse importante du gain de poids corporel chez les mères du groupe recevant la dose élevée (400 mg/kg p.c. par jour) ainsi que des augmentations statistiquement significatives des poids relatifs et absolus du foie et de la thyroïde proportionnellement à la dose administrée dans tous les groupes de traitement. Aucun changement histopathologique n'a été signalé dans le foie, tandis que d'importants follicules avec épithélium pavimenteux dans la thyroïde ont été notés chez certains animaux, plus particulièrement dans le groupe traité à la dose élevée. On a noté des modifications épithéliales dans la portion œsophagienne de l'estomac chez les témoins et les porcs traités, qui sont des lésions spontanées courantes chez cette espèce. De plus, un sillon d'épithélium jaune brun rugueux a été observé le long de l'œsophage chez quelques porcs des groupes d'exposition moyenne et élevée. Un examen microscopique a permis de confirmer les changements parakératosiques et la prolifération de l'épithélium de l'œsophage chez les animaux traités. Le traitement par hydroxyanisole butylé n'a eu aucun effet sur les paramètres de la reproduction et il n'y a eu aucun signe probant d'un effet tératologique attribuable à cette substance. D'après les poids relatifs et absolus élevés de la thyroïde et du foie et les changements histopathologiques dans la glande thyroïde à toutes les doses de traitement, la DMEO établie dans le cadre de cette étude était de 50 mg/kg p.c. par jour (Hansen et al., 1982; Olsen, 1983; Würtzen et Olsen, 1986).
On a administré par gavage de l'hydroxyanisole butylé dissous dans l'huile de maïs à des singes cynomolgus femelles 5 jours par semaine pendant 12 semaines à des doses initiales de 0, 125 et 500 mg/kg p.c. par jour (Iverson et al., 1986). Les vomissements fréquents dans le groupe traité à la dose élevée suivant le gavage a entraîné la diminution de la dose à 250 mg/kg p.c. par jour après 20 jours. Aucune lésion attribuable au traitement par hydroxyanisole butylé n'a été observée par gastroscopie durant l'étude ni à l'autopsie. Plus précisément, l'examen histologique du tissu épithélial gastrique n'a montré aucune prolifération ou hyperplasie des couches épithéliales inhabituelle ni aucun épaississement des couches épithéliales. Cependant, l'index mitotique de 5 000 cellules analysées à partir de la couche basale de l'épithélium pavimenteux simple prélevées dans des régions de l'œsophage à 5 mm du cardia était environ deux fois plus élevé dans le groupe traité à la dose élevée. Le poids du foie, tant la valeur absolue que la valeur relative au poids corporel, avait augmenté proportionnellement à la dose administrée aux deux doses de traitement, et une microscopie électronique des échantillons du foie a indiqué une cytomégalie, mais aucun développement accru du réticulum endoplasmique lisse. Le traitement par hydroxyanisole butylé n'a eu aucun effet sur l'activité de l'aminopyrine-N-déméthylase des monooxygénases microsomales hépatiques, de l'acétanilide hydroxylase ou de l'éthoxycoumarine-dééthylase, sur l'activité de la glutathion transférase cytosolique vis-à-vis de l'aryle ou les substrats d'époxy, ou sur la concentration du cytochrome P450 du foie. Une baisse de l'activité de l'éthoxyrésorufine-dééthylase a été observée chez les animaux traités à la dose élevée. L'activité de l'UDP-glucuronyltransférase n'a pas été évaluée. Dans le cadre de cette étude, la DMEO était de 125 mg/kg p.c. par jour, établie en fonction de l'augmentation du poids du foie.
Il a été démontré que l'hydroxyanisole butylé cause l'apparition de tumeurs dans le pré-estomac chez les rongeurs après administration par voie orale. Aucun signe de cancérogénicité n'a toutefois été observé lorsque la substance était administrée aux souris par injection sous-cutanée, injection intrapéritonéale ou application topique (Busch, 1984; NTP, 2005). Au cours d'une étude réalisée par Stoner et al. (1973), une dose totale de 6 000 mg/kg p.c. a été administrée par injection intrapéritonéale à des groupes de souris A/He sur une période de 8 semaines. La dose quotidienne calculée était de 107 mg/kg p.c. par jour. Les chercheurs ont effectué un examen macroscopique du foie, de la rate, du thymus, de l'intestin ainsi que des glandes endocrines et salivaires, de même qu'un examen microscopique des poumons. Les lésions macroscopiques dans ces tissus ont également fait l'objet d'un examen microscopique. Bien que la durée de cette étude et les paramètres examinés fût limités, on n'a signalé aucune lésion macroscopique ou histopathologique chez les animaux traités par hydroxyanisole butylé. Dans le cadre d'un essai sur les agents promoteurs de tumeurs (Berry et al., 1978), des groupes de 30 souris CD-1 ont été exposés par voie cutanée à l'hydroxyanisole butylé deux fois par semaine pendant 30 semaines. Il a été calculé que l'application de la substance à des doses de 1 mg/événement représentait un taux d'application quotidien de 10 à 15 mg/kg p.c. par jour. Au départ, les animaux recevaient une substance initiatrice (7,12-diméthylbenz[a]anthracène), et l'essai était conçu de façon à mettre à l'essai la capacité de l'hydroxyanisole butylé à agir comme agent promoteur de tumeurs. Après 30 semaines, les examens histopathologiques n'ont montré aucun signe de pathologie chez les animaux traités par hydroxyanisole butylé.
La toxicité observée dans le pré-estomac des rongeurs après administration par voie orale n'a pas été observée chez les souris C3H/Anf après une exposition à vie par voie cutanée. Des groupes de 50 souris ont été traités par voie cutanée à des doses de 0, 10 ou 10 mg d'hydroxyanisole butylé une fois par semaine tout au long de leur vie (Hodge et al., 1966). Comme les poids corporels n'étaient pas fournis dans le rapport de cette étude, une plage de doses a été calculée par l'évaluateur afin de représenter le dosage appliqué aux animaux ayant un poids corporel à l'âge adulte qui se situe dans une fourchette type. Il a été déterminé que la dose de 10 mg équivalait à des valeurs allant de 48 à 100 mg/kg p.c. par jour pour les mâles et de 57 à 133 mg/kg p.c. par jour (CSEO) pour les femelles. Les paramètres mesurés étaient le poids corporel, la survie, les observations macroscopiques à l'autopsie de chaque souris après une période de conservation dans le formol ainsi qu'un examen histopathologique de la peau si l'autolyse ne s'était pas produite. Les observations macroscopiques à l'autopsie et l'examen histopathologique de la peau n'ont indiqué aucune lésion attribuable au traitement, mais des cas isolés de lésions cutanées (attribuées au rasage hebdomadaire de la fourrure) ont été observés. Bien que la portée des examens des animaux était limitée, cette étude (Hodge et al., 1966) démontre une absence de toxicité générale après une exposition à long terme par voie cutanée des rongeurs à l'hydroxyanisole butylé. La conception limitée des études pourrait être à l'origine de l'absence de lésions signalées dans le cadre des études sur la toxicité de l'hydroxyanisole butylé administré par voies cutanée, sous-cutanée et intrapéritonéale. On a toutefois laissé entendre que les lésions observées au cours des études d'exposition à l'hydroxyanisole butylé par voie alimentaire pouvaient être une toxicité locale propre au tissu et non un effet systémique (Altmann et al., 1985).
De nombreux essais de mutagénicité in vitro sur l'hydroxyanisole butylé ont été menés (révisés dans Williams et al., 1999) et comptaient des essais de mutation inverse sur des souches de Salmonella typhimurium, la mutation au locus HGPRT sur des cellules de mammifères, ainsi que des essais d'aberrations chromosomiques et des essais d'échange de chromatides sœurs dans diverses cultures cellulaires de hamsters chinois. Seules les études d'aberrations chromosomiques in vitro avec activation métabolique ont donné constamment des résultats positifs, alors que les résultats de la grande majorité des autres études étaient négatifs. Aucune étude sur le potentiel clastogène menée in vivo n'a été relevée pour l'hydroxyanisole butylé. Toutefois, des résultats négatifs ont été trouvés pour d'autres paramètres relatifs à l'interaction de l'acide désoxyribonucléique (ADN) in vivo dans des cellules hépatiques et le pré-estomac de rats F344, y compris la formation d'adduits de l'ADN, la majorité des études portant sur la rupture et la réparation de brins d'ADN et une étude portant sur l'induction de la synthèse non programmée de l'ADN. Un seul essai de Comet mené sur les souris a donné des résultats positifs dans l'estomac et le colon (Sasaki et al., 2002). En outre, les résultats de l'évaluation sur le potentiel clastogène du TBHQ, métabolite oxydatif de l'hydroxyanisole butylé, sont pertinents et intéressants. Les résultats des essais d'aberrations chromosomiques in vitro étaient également uniformément positifs, avec ou sans activation métabolique. Toutefois, dans les études in vivo, le TBHQ n'a pas induit d'aberrations chromosomiques ni la formation de micronoyaux (évalué par l'OMS, 1998).
De nombreuses études ont été menées sur les effets de l'hydroxyanisole butylé sur la potentialisation ou l'inhibition de la cancérogénicité au niveau du colon, du pré-estomac, de la vessie, de l'estomac, du foie, des poumons, des glandes mammaires et du pancréas, ainsi que la cancérogénicité associée à une exposition périnatale, induite par divers composés clairement cancérogènes. L'ensemble de la preuve semble indiquer que l'hydroxyanisole butylé pourrait potentialiser ou inhiber l'action des composés cancérogènes ou n'avoir aucun effet sur ceux-ci, selon la substance chimique précise mise à l'essai et les circonstances dans lesquelles l'essai a été mené (OMS, 1987, 1989).
Le comité conjoint d'experts FAO/OMS sur les additifs alimentaires (JECFA) avait demandé à plusieurs reprises qu'une étude multigénérationnelle de la toxicité de l'hydroxyanisole butylé sur le plan de la reproduction soit menée et, au cours de sa dernière évaluation de la substance (33e réunion; OMS, 1989), il a indiqué qu'une telle étude était en cours. Toutefois, lors de cette réunion, vu l'absence de cette étude, une AQA de 0 à 0,5 mg/kg p.c., établie en fonction des données tirées d'une étude de la toxicité chronique chez le rat, a été allouée. La seule nouvelle étude de reproduction, soit une étude de reproduction sur une génération de rats (Jeong et al., 2005) publiée 16 ans plus tard, n'était sûrement pas l'étude à laquelle on faisait référence. Outre l'étude menée par Jeong et al. (2005), quatre études portaient sur la toxicité de l'hydroxyanisole butylé pour le développement chez la souris (Stokes et Scudder, 1974), le rat (Vorhees et al., 1981), le lapin (Hansen et Meyer, 1978) et le porc (Hansen et al., 1982).
Jeong et al. (2005) ont mené une étude de reproduction sur une génération de rats Sprague-Dawley auxquels on administrait par gavage des doses d'hydroxyanisole butylé de 0, 10, 100 et 500 mg/kg p.c. dissous dans l'huile de maïs. Outre le fait d'avoir mis fin à l'étude lorsque la génération F1 a atteint l'âge de 13 semaines, plutôt que de produire une génération F2, les autres écarts par rapport au protocole standard d'une étude de toxicité pour la reproduction comprenaient une période de 2 semaines plutôt que de 10 semaines avant l'accouplement ainsi que l'examen de la morphologie des spermatozoïdes fondé sur la mesure des têtes des spermatozoïdes dans des préparations sèches, soit 10 des spermatozoïdes par animal, plutôt que d'examiner les anomalies des spermatozoïdes dans des préparations humides, soit un minimum de 200 spermatozoïdes par animal. De petites différences, mais statistiquement significatives, par rapport aux groupes témoins ont été signalées pour de nombreux paramètres à la dose d'hydroxyanisole butylé la plus élevée, soit 500 mg/kg p.c. par jour. Ces différences sont notamment une diminution du rapport d'accouplement et une augmentation de la durée de cohabitation avant l'accouplement chez les rats de la génération F0; une diminution du taux de testostérone et de thyroxine sérique chez les rats mâles de la génération F0 après 7 semaines de traitement; des variations des poids des organes exprimées sous forme de poids absolus et relatifs du foie, des glandes surrénales et thyroïde (augmentation), de la rate, de la prostate ventrale, des testicules et du vagin (diminution) chez de nombreux adultes des générations F0 et F1; une baisse du gain de poids corporel postnatal chez les ratons mâles et femelles de la génération F1; un retard dans l'apparition de la perméabilité vaginale et la séparation du prépuce; une diminution des poids absolu et relatif du foie chez les rats femelles sevrées de la génération F1; une diminution du nombre de spermatozoïdes dans la queue de l'épididyme chez les rats de la génération F1 exposés à la substance sur une période de 13 semaines ainsi qu'une baisse de plusieurs paramètres de motilité des spermatozoïdes et une diminution du taux de la testostérone sérique chez les sujets de ce groupe. Peu d'observations ont été effectuées sur les effets associés au traitement à des doses plus faibles, certaines portant sur les différences de poids des organes, sans observations histopathologiques connexes ou sur la mesure des têtes de spermatozoïdes réalisées à l'aide de techniques douteuses. Dans le cadre de cette étude, les changements histopathologiques des cellules épithéliales des follicules thyroïdiens observés chez les rats mâles et femelles F1 des groupes de traitement recevant des doses de 100 et 500 mg/kg p.c. par jour ainsi que la diminution des taux de testostérone sérique chez les mâles de la génération F0 après 7 semaines de traitement indiquent qu'une dose de 100 mg/kg p.c. par jour serait la DMEO pour les effets endocriniens. Les auteurs de l'étude ont cité des observations tirées d'autres études, selon lesquelles l'hypothyroïdie induite au début de la période néonatale jusqu'au sevrage entraîne des retards de la maturation sexuelle, une atrophie testiculaire, une perturbation du développement des organes accessoires de l'appareil reproducteur, une diminution du taux de gonadostimulines et une inhibition de la stéroïdogénèse.
Vorhees et al. (1981) ont réalisé une étude sur des rats Sprague-Dawley reposant sur un protocole semblable à celui de l'étude menée par Jeong et al. (2005), sauf que l'hydroxyanisole butylé était administré dans l'alimentation plutôt que par gavage et l'étude était davantage orientée sur les essais comportementaux que sur les paramètres relatifs à la pathologie ou aux systèmes reproducteur et endocrinien. La plage de doses administrées dans l'alimentation chez les rats adultes avant la reproduction et pendant la lactation était semblable à celle utilisée dans les groupes recevant les deux doses les plus élevées dans l'étude de Jeong et al. (2005) : 0 %, 0,125 %, 0,25 % et 0,5 %, représentant une moyenne de 0, 100, 200 et 400 mg/kg p.c. par jour, respectivement; toutefois, les rates en lactation recevaient des doses doubles (mentionné par les auteurs), et les rats sevrés recevaient également des doses plus élevées. Le traitement par hydroxyanisole butylé n'a eu aucun effet sur les paramètres de reproduction et des effets minimaux ont été observés dans de nombreux essais comportementaux. Un retard du développement du réflexe de tressaillement a été observé aux deux concentrations les plus élevées; le développement de la perméabilité vaginale n'a pas été touché à aucune concentration de la substance dans l'alimentation. Un retard de croissance a été noté chez les ratons aux jours 14 et 21 de la période de lactation à la concentration la plus élevée dans l'alimentation (0,5 %). En outre, dans ce groupe, le taux de mortalité a augmenté jusqu'au 30e jour de la période postnatale et exceptionnellement à la concentration de 0,25 %. Dans le cadre de cette étude, la CSEO pour la toxicité sur le plan de la reproduction était de 0,125 % d'hydroxyanisole butylé dans l'alimentation, équivalant à 100 mg/kg p.c. par jour.
Aucun effet nocif n'a été observé dans l'étude de toxicité pour le développement sur des lapins auxquels on a administré par gavage des doses d'hydroxyanisole butylé de 0, 50, 200 et 400 mg/kg p.c. par jour de la 7e à la 18ejournée de gestation (Hansen et Meyer, 1978). Il convient de noter que la période d'administration de la substance ne respecte pas les exigences actuelles (jours 6 à 29 de la période de gestation chez les lapins).
Le même groupe de recherche (Hansen et al., 1982) a mené une étude sur l'embryotoxicité de l'hydroxyanisole butylé chez les porcs Landrace danois qui recevaient des doses de 0, 50, 200 et 400 mg/kg p.c. par jour dans leur alimentation à partir du jour de leur insémination artificielle jusqu'au 110ejour de gestation. Aucun effet sur les paramètres de la reproduction et du développement n'a été constaté. Les résultats concernant la détermination du poids des organes et l'histopathologie sont décrits plus haut.
Une seule étude épidémiologique menée dans le cadre de l'étude de cohortes réalisée aux Pays-Bas n'a pas établi de corrélation entre l'absorption d'une faible concentration d'hydroxyanisole butylé dans la nourriture (environ 100 µg/jour) et le cancer de l'estomac (Botterweck et al., 2000). Au contraire, une tendance inverse a été constatée en ce qui concerne le risque relatif par rapport à une absorption plus élevée de la substance, ce qui n'était pas statistiquement significatif.
La confiance à l'égard de la base de données sur la toxicité de l''hydroxyanisole butylé est modérée. Bien que de nombreuses études de toxicité chronique, de toxicité pour la reproduction et de génotoxicité aient été recensées, il existe certaines incertitudes quant à la pertinence de la base de données actuelle pour caractériser entièrement la toxicité de la substance selon toutes les voies d'exposition et la durée de l'exposition.
Caractérisation du risque pour la santé humaine
D'après les renseignements fournis dans les études sur l'hydroxyanisole butylé tirées des publications et les évaluations du JECFA, deux effets critiques ont été recensés pour la caractérisation des risques pour la santé humaine après administration de la substance par voie orale. Le premier effet était la cancérogénèse sur l'épithélium pavimenteux simple du pré-estomac chez les rongeurs après une exposition à vie dans l'alimentation et le deuxième, une variation des mesures des fonctions endocriniennes suivant l'induction enzymatique par l'hydroxyanisole butylé. Les effets secondaires visaient principalement la glande thyroïde, mais également les hormones sexuelles et les glandes surrénales à des doses élevées après une exposition subchronique par voie orale.
Deux études de toxicité par voie cutanée dont le rapport et le protocole étaient limités ont été recensées pour l'hydroxyanisole butylé. Toutefois, au cours de l'étude de toxicité résultant de l'exposition à vie (Hodge et al., 1966), l'hydroxyanisole butylé n'a pas entraîné de toxicité générale notable chez les souris. De la même manière, la toxicité cutanée se limitait à des signes d'ulcération isolés, attribués à des blessures liées au rasage. On n'a relevé aucun signe d'hyperplasie ou d'autres lésions prénéoplasiques dans le derme, ce qui indique que le point de contact de l'exposition par voie cutanée n'était pas vulnérable à la cytotoxicité ou au renouvellement des cellules à la dose testée. L'absence de toxicité générale dans ces études limitées en temps sur l'exposition par voie cutanée a également été constaté dans le cadre d'une étude à court terme (8 semaines) sur l'exposition par voie intrapéritonéale chez des animaux auxquels on administrait des doses allant jusqu'à 107 mg/kg p.c. par jour (Stoner et al., 1973). Certains auteurs laissent entendre que les lésions observées au cours des études d'exposition par voie alimentaire étaient des effets locaux et non systémiques, et les études d'exposition par voies cutanée, sous-cutanée et intrapéritonéale, bien que peu détaillées, corroborent cette conclusion (Altmann et al., 1985).
L'hydroxyanisole butylé ajouté à l'alimentation des rats, des souris et des hamsters provoquait une hyperplasie et une néoplasie de l'épithélium pavimenteux simple du préestomac. Toutefois, dans le cadre des études à court terme, aucun signe de réponse proliférative importante dans les tissus analogues d'espèces sans pré-estomac (chiens, porcs et singes) ni de tumeurs dans les tissus de l'œsophage analogues ou les tissus de l'estomac glandulaire dans les études à long terme sur les cochons d'Inde. Selon l'étude menée par Ito et al. (1986) la CSEO pour l'hyperplasie de l'épithélium du pré-estomac chez le rat, lésion réversible, était de 0,125 % du régime alimentaire (équivalant à 55 mg/kg p.c. par jour) et la DSENO pour la néoplasie était de 0,5 % du régime alimentaire (équivalant à 230 mg/kg p.c. par jour).
Le poids de la preuve issu des données disponibles indique que cette substance n'est pas génotoxique. Les résultats des essais d'aberrations chromosomiques in vitro montrent des résultats positifs de façon constante, mais la grande majorité des portant sur les mutations ponctuelles in vitro et la formation d'adduits à l'ADN in vivo, sur l'induction de la synthèse non programmée de l'ADN et sur la rupture et la réparation de brins d'ADN dans les cellules hépatiques et le pré-estomac des rats étaient négatifs. Aucune étude portant sur le potentiel d'induction des aberrations chromosomiques in vivo n'a été trouvée pour l'hydroxyanisole butylé, mais plusieurs tests du micronoyau sur des souris ont été réalisés comme mesure du potentiel clastogène avec le TBHQ, principal métabolite oxydatif de l'hydroxyanisole butylé et un autre additif alimentaire antioxydant. En ce qui a trait à l'hydroxyanisole butylé, les résultats des études d'aberrations chromosomiques in vitro menées avec le TBHQ étaient positifs, alors que les résultats des tests du micronoyau bien menés sur des souris comme mesure in vivo du potentiel clastogène étaient négatifs (évalué par l'OMS, 1998).
La base de données indique que l'hydroxyanisole butylé provoque des dommages cellulaires, le renouvellement des cellules ainsi que le développement de tumeurs à long terme dans le pré-estomac (structure anatomique pour laquelle il n'existe aucun organe analogue chez les humains ou les autres mammifères autres que les rongeurs) chez les rongeurs après exposition par voie orale. La présence de lésions se limitait au point de contact initial sur l'estomac, telle que constatée dans les études d'exposition par différentes voies orales menées sur des animaux (régime alimentaire ou gavage). Le poids de la preuve semble indiquer que l'hydroxyanisole butylé n'est pas directement génotoxique, étant donné qu'il ne forme pas d'adduits à l'ADN dans le foie et le tissu du pré-estomac et qu'il n'y a pas de corrélation significative entre la faible absorption de la substance découlant de l'utilisation d'additifs alimentaires et le cancer de l'estomac dans une cohorte de 3 500 sujets humains. La comparaison de la DSENO pour la formation de tumeurs (230 mg/kg p.c. par jour) avec la valeur moyenne de l'exposition la plus élevée de 0,095 mg/kg p.c. par jour chez des enfants âgés entre 4 et 8 ans a permis d'obtenir une marge d'exposition adéquate supérieure à 2 400. Bien qu'une réaction d'irritation semblable limitée au site puisse se produire chez les humains, les doses requises pour provoquer une telle réaction locale seraient trop élevées. Les séquelles toxicologiques initiales (hyperplasie, inflammation) sont décrites dans la base de données sur les animaux comme des séquelles entièrement réversibles.
Il a été démontré que l'hydroxyanisole butylé déclenchait l'activité de l'UDP-glucuronyltransférase du foie et des intestines, ce qui catalyse la conjugaison de l'l'hydroxyanisole butylé et de son métabolite, TBHQ, avec le glucuronide. Cette capacité de glucuronidation accrue contribue probablement à son effet anticancérigène au moyen d'une inactivation accrue des composés cancérogènes par conjugaison. En outre, les effets sur divers organes peuvent être attribués à une clairance des hormones plus élevée résultant d'une activité accrue des enzymes hépatiques. La DMEO pour les effets autres que le cancer a été établie à 50 mg/kg p.c. par jour chez le porc, la plus faible dose testée, en fonction de l'augmentation du poids du foie et de la thyroïde sans effet sur les paramètres de la reproduction et du développement (Hansen et al., 1982).
Une comparaison entre la concentration à effet critique non néoplasique la plus faible associée à l'induction de l'UDP-glucuronyltransférase dans le foie et le petit intestin (50 mg/kg p.c. par jour) et la valeur moyenne de l'exposition à l'hydroxyanisole butylé la plus élevée de 0,095 mg/kg p.c. par jour chez des enfants âgés entre 4 et 8 ans a permis d'obtenir une marge d'exposition supérieure à 500. Comme la DMEO est fondée sur un seuils pour l’induction d’une enzyme compensatoire dans le foie, cette marge d'exposition serait considérée comme adéquate pour protéger la santé humaine.
Une étude de toxicité par voie cutanée résultant de l'exposition à vie réalisée sur les souris (Hodge et al., 1966) a démontré que l'hydroxyanisole butylé n'avait aucun effet nocif général pour l'intervalle de doses estimées de 48 à 100 mg/kg p.c. par jour chez les mâles et de 57 à 133 mg/kg p.c. par jour chez les femelles (CSEO). Malgré que la portée de l'examen fût limitée, aucune toxicité locale n'a été observée. Bien que les autopsies pratiquées sur ces animaux ne fussent pas approfondies, aucun signe de toxicité systémique n'a été signalé chez les souris traitées, et les taux de survie n'ont pas subi de baisse. En outre, une deuxième étude de toxicité par voie cutanée a également indiqué l'absence de toxicité jusqu'à des doses allant de 10 à 15 mg/kg p.c. par jour pendant 30 semaines (Berry et al. 1978). Une absence de toxicité a également été notée dans le cadre d'un essai d'exposition par injection intrapéritonéale de 8 semaines chez les souris jusqu'à une dose de 107 mg/kg p.c. par jour (Stoner et al., 1973). Cet essai, qui visait à examiner différents organes, n'a révélé aucun signe de toxicité systémique. Toutefois, comme les études d'exposition par voies cutanées et intrapéritonéale ne comptaient pas d'examens histopathologiques approfondis, on ne sait pas avec certitude si les effets observés après une exposition orale pourraient se produire après une exposition par voie cutanée. Par conséquent, les paramètres observés dans la base de données sur la toxicité orale étaient considérés comme appropriés pour la caractérisation des risques associés à une exposition par voie cutanée.
L'absorption par voie cutanée combinée d'hydroxyanisole butylé contenu dans les produits de soins personnels fréquemment utilisés a été estimée pour plusieurs groupes d'âge de la population. L'absorption « moyenne » prévue (voir le tableau 8) variait de 0,004 mg/kg p.c. par jour (chez les nourrissons) à 0,02 mg/kg p.c. par jour (chez les femmes et les enfants âgés entre 6 mois et 12 ans). Une comparaison entre ces absorptions et la DSENO pour la formation de tumeurs (230 mg/kg p.c. par jour) permet d'obtenir des marges d'expositions de 57 500 et de 11 500, respectivement. Les valeurs d'absorption les plus élevées prévues allaient de 0,01 mg/kg p.c. par jour (chez les hommes) à 0,07 mg/kg p.c. par jour (chez les enfants âgés entre 6 mois et 5 ans). Une comparaison entre ces absorptions et la DSENO pour la formation de tumeurs permet d'obtenir des marges d'exposition de 23 000 et de 3 300, respectivement.
Le niveau d'effet critique le plus faible pour les paramètres des effets autres que le cancer était de 50 mg/kg p.c. par jour, établi en fonction de l'augmentation du poids du foie et de la thyroïde. La comparaison de cette valeur avec les estimations allant de 0,004 mg/kg p.c. par jour (chez les nourrissons) à 0,02 mg/kg p.c. par jour (chez les femmes et les enfants âgés entre 6 mois et 12 ans) permet d'obtenir des marges de 12 500 et de 2 500, respectivement. De même, la comparaison entre les valeurs maximales estimées de l'absorption de 0,01 mg/kg p.c. par jour (chez les hommes) et de 0,07 mg/kg p.c. par jour (chez les enfants âgés entre 6 mois et 5 ans) et le niveau d'effet critique le plus faible pour les paramètres des effets autres que le cancer permet d'obtenir des marges d'exposition de 5 000 et de 700, respectivement.
L'absence de toxicité systémique constatée dans les études limitées en temps sur l'exposition par voie cutanée a également été notée dans les études d'exposition par voies sous-cutanée et intrapéritonéale. Bien que ces études fussent de qualité limitée, prises ensemble, elles indiquent une absence de toxicité systémique après une exposition par voie non orale. Étant donné qu'aucune toxicité n'a été observée après une exposition à long terme par voie cutanée, l'utilisation de paramètres de toxicité orale est considérée comme très prudente, et les marges d'exposition qui en découlent sont considérées comme adéquates pour protéger la santé humaine.
Incertitudes de l'évaluation des risques pour la santé humaine
Bien que certaines catégories d'aliments qui pourraient constituer des sources minimes d'exposition à l'hydroxyanisole butylé n'aient pas été incluses dans l'évaluation, il se peut que l'exposition à cette substance ait été surestimée en raison du peu de données quantitatives trouvées pour tenir compte des facteurs suivants : les concentrations réelles d'hydroxyanisole butylé par rapport aux concentrations maximales autorisées dans le Règlement sur les aliments et drogues; les concentrations réelles d'hydroxyanisole butylé en association avec d'autres antioxydants; le fait que des fabricants puissent avoir abandonné l'utilisation de l'hydroxyanisole butylé dans certains des aliments pour lesquels l'utilisation de la substance est autorisée; les pertes possibles d'hydroxyanisole butylé dans les aliments pendant le traitement, le transport et l'entreposage.
On ne dispose que de données limitées pour estimer l'absorption d'hydroxyanisole butylé par voie cutanée chez les humains. Une caractérisation plus adéquate de l'absorption permettrait d'atténuer l'incertitude liée aux estimations de l'absorption résultant de l'utilisation de produits de soins personnels. Il existe une certaine incertitude en ce qui a trait à la caractérisation de la toxicité après une exposition par voie cutanée. En ce qui concerne les études menées à long terme sur l'administration par voie cutanée, on n'a trouvé que des rapports qui datent présentant une évaluation limitée des paramètres. Cependant, l'absence d'observation d'effets nocifs après une administration par voies cutanée, sous-cutanée ou intrapéritonéale était constante. L'utilisation des paramètres de toxicité orale pour la caractérisation des risques après une exposition par voie cutanée est considérée comme très prudente. Des études supplémentaires pour poursuivre la caractérisation de la toxicité par voie cutanée permettraient de réduire les incertitudes dans cette évaluation.
D'après les renseignements contenus dans le rapport d'évaluation préalable, il est conclu que l'hydroxyanisole butylé ne pénètrent pas dans l'environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nuisible immédiat ou à long terme sur l'environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l'environnement essentiel pour la vie. De plus, l’hydroxyanisole butylé répond aux critères de la persistance mais ne répond pas aux critères de la bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
À la lumière des renseignements disponibles sur le potentiel de l'hydroxyanisole butylé d'avoir des effets néfastes sur la santé humaine, il est conclu que cette substance ne pénètre pas dans l'environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un risque pour la vie ou la santé humaine.
Par conséquent, il est conclu que l'hydroxyanisole butylé ne satisfait à aucun des critères énoncés dans l'article 64 de la LCPE (1999).
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
Abe, S., Sasaki, M. 1977. Chromosome aberrations and sister chromatid exchanges in Chinese hamster cells exposed to various chemicals. J. Natl. Cancer Inst. 58:1635-1641.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. Accès : http://www.acdlabs.com/products/phys_chem_lab/pka/
Altmann, H.J., Wiester, P.W., Mattiaschuk, G., Grunow, W., van der Heuden, C.A. 1985. Induction of early lesions in the forestomach of rats by 3-tert-butyl-4-hydroxyanisole (BHA). Food Chem. Toxicol. 23:723-731.
Altmann, H.-J., Grunow, W., Mohr, U., Richter-Reichhelm, H.B., Wester, P.W. 1986. Effects of BHA and related phenols on the forestomach of rats. Food. Chem. Toxicol.24:1183-1188.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs [en ligne]. QSAR Comb. Sci. 22(3):337-345. Accès : http://www3.interscience.wiley.com/journal/104557877/home[réserve de consultation]
Astill, B.D., Mills, J., Fassett, D.W., Roudabush, R.L., Terhaar, C.J. 1962. Fate of butylated hydroxyanisole in man and dog. J. Agric. Food Chem. 10:315-319.
ASTreat Model [modèle de l’élimination par les usines de traitement des eaux usées]. 2006. Version 1.0. Cincinnati (US): Procter & Gamble Company. Disponible chez: Procter & Gamble Company, P.O. Box 538707, Cincinnati, OH 45253-8707, U.S.
[BCFBAF] BioConcentration Factor Program for Windows [modèle d'estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [base de données sur Internet]. 2009. Ottawa (Ont.) : Santé Canada. Accès : http://webprod.hc-sc.gc.ca/nhpid-bdipsn/search-rechercheReq.do?lang=fra
Benford, D.J., Price, S.C., Lawrence, J.N., Grasso, P., Bremmer, J.N. 1994. Investigations of the genotoxicity and cell proliferative activity of dichlorvos in mouse forestomach. Toxicology 92:203-215.
Berry, D., DiGiovanni, J., Juchau, M., Bracken, W., Gleason, G., Slaga, T. 1978. Lack of tumor-promoting ability of certain environmental chemicals in a two-stage mouse skin tumorigenesis assay. Res. Commun. Chem. Pathol. Pharmacol.20(1):101-108.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Boltz, U., Hagenmaier, H., Korner, W. 2001. Phenolic xenoestrogens in surface water, sediments, and sewage sludge from Baden-Wurttemberg, south-west Germany. Environ. Pollut.115(2):291-301.
Bonin, A.M., Baker, R.S.U. 1980. Mutagenicity testing of some approved food additives with the Salmonella microsome assay. Food Technol. Aust. 32:608-611.
Botterweck, A.A.M., Verhagen, H., Goldbohm, R.A., Kleinjans, J., van den Brandt, P.A. 2000. Intake of butylated hydroxyanisole and butylated hydroxytoluene and stomach cancer risk: results from analyses in the Netherlands Cohort Study. Food Chem. Toxicol. 38:599-605.
Brown, G.K,. Zaugg, S.D., Barber, L.B. Document non daté. Wastewater analysis by gas chromatography/mass spectrometry. [consulté le 28 juillet 2009]. Reston (VA) : US Department of the Interior, US Geological Survey. Accès : http://toxics.usgs.gov/pubs/wri99-4018/Volume2/sectionD/2506_Brown/pdf/2506_Brown.pdf
Buetler, T.M., Gallagher, E.P., Wang, C.H., Stahl, D.L., Hayes, J.D., Eaton, D.L. 1995. Induction of phase I and phase II drug-metabolizing enzyme mRNA, protein, and activity by BHA, ethoxyquin and oltipraz. Toxicol. Pharmacol.135:45-57.
Bunnell, R.H., Matterson, L.D., Singsen, E.P., Potter, L.M., Kozeff, A., Jungherr, E.L. 1955. Studies on encephalomalacia in the chick. III. The influence of feeding or injection of various tocopherols and other antioxidants on the incidence of encephalomalacia. Poult. Sci. 34:1068-1075.
Busch, J. 1984. Final report on the safety assessment of butylated hydroxyanisole. J. Am. Coll. Toxicol.3(5):83-146.
Canada. 1978. Règlement sur les aliments et drogues, C.R.C., c. 870. Accès : http://laws.justice.gc.ca/fra/C.R.C.-ch.870/index.html
Canada. 1988. Liste de divulgation des ingrédients [en ligne]. DORS/88-64. [consultée le 8 juin 2009]. Accès : http://www.canlii.org/ca/regu/sor88-64/part274942.html
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, c. 33. Accès : http://www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 29 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l'Environnement, ministère de la santé. 2006.Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement, Canada Gazette. Partie I, vol. 140, no 49, p. 4109–4117. Accès : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la santé. 2009. Loi canadienne sur la protection de l’environnement (1999) : Avis de huitième divulgation d'information technique concernant les substances identifiées dans le Défi, Gazette du Canada. Partie I, vol. 143, no 5, p. 192-196. Accès : http://www.gazette.gc.ca/rp-pr/p1/2009/2009-01-31/pdf/g1-14305.pdf
Cantoreggi, S., Dietrich, D.R., Lutz, W.K. 1993. Induction of cell proliferation in the forestomach of F344 rats following subchronic administration of styrene 7,8-oxide and butylated hydroxyanisole. Cancer Res. 53:3505-3508.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. ©2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
Chu, W., Lau, T.K. 2007. Ozonation of endocrine disrupting chemical BHA under the suppression effect by salt additive–with and without H2O2. J. Hazard. Mater. 144(1-2):249-254.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1986. Some naturally occurring and synthetic food components, furocoumarins and ultraviolet radiation. IARC Monogr. Eval. Carcinog. Risks Chem. Hum. 40:123-206.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1987. Overall evaluations of carcinogenicity: an updating of IARC Monographs Volumes 1-42. IARC Monogr. Eval. Carcinog. Risks Chem. Hum. Suppl. 7:59.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 2003. Predictive value of rodent forestomach and gastric neuroendocrine tumours in evaluating carcinogenic risks to humans. Lyon (France) : Centre International de Recherche sur le Cancer. Publication technique du CIRC no 39.
Clayson, D.B., Iverson, F., Nera, E., Lok, E., Rogers, C., Rodrigues, C., Page, D., Karpinski, K. 1986. Histopathological and radioautographical studies on the forestomach of F344 rats treated with butylated hydroxyanisole and related chemicals. Food Chem. Toxicol. 24:1171-1182.
Conning, D.M., Phillips, J.C. 1986. Comparative metabolism of BHA, BHT and other phenolic antioxidants and its toxicological relevance. Food Chem. Toxicol. 24:1145-1148.
[ConsExpo] Consumer Exposure Model [en ligne]. 2006. Version 4.1, Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais de la santé publique et de l'environnement). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
Cope, W.G., Bartsch, W.R., Marking, L.L. 1997. Efficacy of candidate chemicals for preventing attachment of zebra mussels (Dreissena polymorpha). Environ. Toxicol. Chem.16(9):1930-1934.
US Department of Agriculture. Continuing Survey of Food Intakes by Individuals (CSFII 1994-96, 1998) and Diet and Health Knowledge Survey (DHKS 1994-96). Beltsville (MD) : US Department of Agriculture, Agricultural Research Service, Beltsville Human Nutrition Research Center, Food Surveys Research Group. Accès : http://www.ars.usda.gov/SP2UserFiles/Place/12355000/pdf/Facts1.pdf
Daniel, J.W., Gage, J.C., Jones, D.I., Stevens, M.A. 1967. Excretion of butylated hydroxytoluene (BHT) and butylated hydroxyanisole (BHA) by man. Food Cosmet. Toxicol.5:475-479.
Davi, M., Gnudi, F. 1999. Phenolic compounds in surface water. Water Res. 33(14):3213-3219.
Degre, R., Saheb, S.A. 1982. Butylated hydroxyanisole as a possible mutagenic agent. FEMS Microbiol. Lett.14:183-186.
Drewes, J.E., Snyder, S. 2009. Contributions of household chemicals to sewage and their relevance to municipal wastewater systems and the environment. [consulté le 28 juillet 2009]. London (Royaume-Uni) : IWA Publishing pour le compte de la Water Environment Research Foundation. WERF Report 03-CTS-21UR. Accès : http://www.iwaponline.com/wio/2009/03/werf_pdf/wio200903WF03CTS21UR.pdf[réserve de consultation]
El-Rashidy, R., Niazi, S. 1979. GLC determination of butylated hydroxyanisole in human plasma and urine.J. Pharm. Sci.68:103-104.
Environnement Canada. 1988. Données en relation à la Liste Intérieure des Substances (LIS) 1984-1986, récoltées sous la LCPE, 1988, s. 25(1). D’après les déclarations pour la Liste Intérieure des Substances [guide] 1988. Données préparées par : Environnement Canada.
Environnement Canada. 2009a. Données sur les substances du lot 8 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le huitième lot du Défi.Données préparées par le Programme des substances existantes d'Environment Canada.
Environnement Canada. 2009b. Guidance for conducting ecological assessments under CEPA, 1999, science resource technical series, technical guidance module: Mega Flush consumer release scenario. Document de travail. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada. 2009c. Mega Flush report: CAS RN 25013-16-5. Rapport inédit. [consulté le 13 novembre 2009]. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
Fabrizio, D.P.A. 1974. Mutagenic evaluation of compound FDA 71-24: butylated hydroxyanisole. Kensington (MD) : Litton Bionetics, Inc. Rapport inédit présenté à l'Organisation mondiale de la santé par la US Food and Drug Administration. [cité dans OMS, 1980].
Go Kang H, Hee Jeong S, Hyoung Cho J, Gyu Kim D, Myung Park J. 2005. Evaluation of estrogenic and androgenic activity of butylated hydroxyanisole in immature female and castrated rats. Toxicology 213(1-2): 147-156.
Gomez, M., Gomez-Ramos, M., Aguera, A., Mezcua, M., Herrera, S., Fernandez-Alba, A. 2009. A new gas chromatography/mass spectrometry method for the simultaneous analysis of target and non-target organic contaminants in waters. J. Chromatogr. A1216(18):4071-4082.
Hageman, G.J., Verhagen, H., Kleinjans, J.C.S. 1988. Butylated hydroxyanisole, butylated hydroxytoluene and tert-butylhydroquinone are not mutagenic in the Salmonella/microsome assay using new tester strains. Mutat. Res. 208:207-211.
Hansen, E., Meyer, O. 1978. A study of the teratogenicity of butylated hydroxyanisole on rabbits. Toxicology10:195-201.
Hansen, E.V., Meyer, O., Olsen, P. 1982. Study on toxicity of butylated hydroxyanisole (BHA) in pregnant gilts and their foetuses. Toxicology 23:79-83.
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d'estimation]. 2000. Version 3.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Hirose, M., Masuda, A., Imaida, K., Kagawa, M., Tsuda, H., Ito, N. 1987a. Induction of forestomach lesions in rats by oral administrations of naturally occurring antioxidants for 4 weeks. Jpn. J. Cancer. Res. 78:317-321.
Hirose, M., Asamoto, M., Hagiwara, A., Ito, N., Kaneko, H., Saito, K., Takamatsu, Y., Yoshitake, A., Miyamoto, J. 1987b. Metabolism of 2- and 3-tert-butyl-4-hydroxyanisole (2- and 3-BHA) in the rat (II): metabolism in forestomach and covalent bonding to tissue macromolecules. Toxicology 45:13-24.
Hjelle, J.J., Hazleton, G.A., Klaassen, C.D. 1985. Increased UDP-glucuronosyl transferase activity and UDP-glucuronic acid concentration in the small intestine of butylated hydroxyanisole-treated mice. Drug Metab. Dispos. 13:68-70.
Hodge, H.C., Fassett, D.W., Maynard, E.A., Downs, W.L., Coye, R.D. 1966. Tests on mice for evaluating carcinogenicity. Toxicol. Appl. Pharmacol. 9:583-596.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Ikeda, G.J., Stewart, J.E., Sapienza, P.P., Peggins, J.O., Michel, T.C., Olivito, V., Alam, H.Z., O’Donnell, M.W. 1986. Effect of subchronic dietary administration of butylated hydroxyanisole on canine stomach and hepatic tissue. Food Chem. Toxicol. 24:1201-1221.
[INRP] Inventaire national des rejets de polluants [base de données sur Internet]. 2009. Gatineau (Qc) : Environnement Canada. [consultée le 4 juin 2009]. Accès : http://www.ec.gc.ca/inrp-npri/
Ishidate, M., Odashima, S. 1977. Chromosome tests with 134 compounds on Chinese hamster cells in vitro - a screening for chemical carcinogens. Mutat. Res. 48:337-354.
Ito, N., Hirose, M. 1987. The role of antioxidants in chemical carcinogenesis. Jpn. J. Cancer Res. (Gann)78:1011-1026.
Ito, N., Hagiwara, A., Shibata, M., Ogiso, T., Fukushima, S. 1982. Induction of squamous cell carcinoma in the forestomach of F344 rats treated with butylated hydroxyanisole. Gann73:332-334.
Ito, N., Fukushima, S., Hagiwara, A., Shibata, M., Ogiso, T. 1983a. Carcinogenicity of butylated hydroxyanisole in F344 rats. J. Natl. Cancer Inst. 70:343-352.
Ito, N., Fukushima, S., Imaida, K., Sakata, T., Masui, T. 1983b. Induction of papilloma in the forestomach of hamsters by butylated hydroxyanisole. Gann 74:459-461.
Ito, N., Hirose, M., Kurata, Y., Ikawa, E., Mera, Y., Fukushima, S. 1984. Induction of forestomach hyperplasia by crude butylated hydroxyanisole, a mixture of 3-tert and 2-tertisomers, in Syrian golden hamsters is due to 3-tert-butylated hydroxyanisole. Gann75:471-474.
Ito, N., Fukushima, S., Tamano, S., Hirose, M., Hagiwara, A. 1986. Dose response in butylated hydroxyanisole induction of forestomach carcinogenesis in F344 rats. J. Natl Cancer Inst. 77:1261-1265.
Ito, N., Hirose, M,. Takahashi, S. 1991. Cellular proliferation and stomach carcinogenesis induced by anti-oxidants. In : Butterworth, B., Slaga, T.J., Farland, W., McClain, M. (éditeurs). Chemically induced cell proliferation: implication for risk assessment. New York (NY) : Wiley-Liss. p. 43-52.
Iverson, F., Lok, E., Nera, E., Karpinski, K., Clayson, D.B. 1985. A 13-week feeding study of butylated hydroxyanisole: the subsequent regression of the induced lesions in male Fischer 344 rat forestomach epithelium. Toxicology 35:1-11.
Iverson, F., Truelove, J., Nera, E., Lok, E., Clayson, D.B., Wong, J. 1986. A 12-week study of BHA in the cynomolgus monkey. Food Chem. Toxicol. 24:1197-1200.
Jeong, S.-H., Kim, B.-Y., Kang, H.-G., Ku, H.-O., Cho, J.-H. 2005. Effects of butylated hydroxyanisole on the development and functions of reproductive system in rats. Toxicology208:49-62.
Jobling, S., Reynolds, T., White, R., Parker, M.G., Sumpter, J.P. 1995. A variety of environmentally persistent chemicals, including some phthalate plasticizers, are weakly estrogenic. Environ. Health Perspect. 103:582-587.
Joner, P.E. 1977. Butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT) and ethoxyquin (EMQ) tested for mutagenicity. Acta. Vet. Scand. 18:187-193.
Jos, A., Repetto, G., Rios, J.C,. del Peso, A., Salguero, M., Hazen, M.J., Molero, M.L., Fernandez-Freire, P., Perez-Martin, J.M., Labrador, V., Camean, A. 2005. Ecotoxicological evaluation of the additive butylated hydroxyanisole using a battery with six model systems and eighteen endpoints. Aquat. Toxicol.71:183-192.
Kang, H.G., Jeong, S.H., Cho, J.H., Kim, D.G., Park, J.M., Cho, M.H. 2005. Evaluation of estrogenic and androgenic activity of butylated hydroxyanisole in immature female and castrated rats. Toxicology 213:147-156.
Kawachi, T., Komatsu, T., Kada, T., Ishidate, M., Sasaki, M., Sugiyama, T., Tazima, Y. 1980. Results of recent studies on the relevance of various short-term screening tests in Japan. In: Williams, G.M., Kroes, R., Waaijers, H.W., van de Poll, K.W. (éditeurs). The predictive value of short-term screening tests in carcinogenicity evaluation. Amsterdam (Pays-Bas) : Elsevier. p. 253-267.
Kolpin, D., Furlong, E., Meyer, M., Thurman, E., Zaugg, S., Barber, L., Buxton, H. 2002. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: a national reconnaissance. Environ. Sci. Technol. 36(6):1202-1211.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Lehman, A.J., Fitzhugh, O.G., Nelson, A.A., Woodard, G. 1951. The pharmacological evaluation of antioxidants. Adv. Food Res. 3:197-208.
Masui, T., Hirose, M., Imaida, K., Fukushima, S., Tamano, S., Ito, N. 1986. Sequential changes of the forestomach of F344 rats, Syrian golden hamsters and B6C3F1 mice treated with butylated hydroxyanisole. Jpn. J. Cancer Res. 77:1083-1090.
Matsuoka, A., Matsui, M., Miyata, N., Sofuni, T., Ishidate, M. 1990. Mutagenicity of 3-tert-butyl-4-hydroxyanisole (BHA) and its metabolites in short-term tests in vitro. Mutat. Res. 241:125-132.
Miyagi, M.P., Goodheart, C.R. 1976. Effects of butylated hydroxyanisole in Drosophila melanogaster. Mutat. Res. 40:37-42.
Morimoto, K., Tsuji, K., Ito, T., Miyata, N., Uchida, A., Osawa, R., Kitsutaka, H., Takahashi, A. 1991. DNA damage in forestomach epithelium from male F344 rats following oral administration of tert-butylquinone, one of the forestomach metabolites of 3-BHA. Carcinogenesis 12:703-708.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Murli, H., Brusick, D. 1992. Induction of chromosomal aberrations by high concentrations of butylated hydroxyanisole (BHA) in Chinese hamster ovary (CHO) cells in the presence of washed microsomes. In Vitro Toxicol. 5:93-101.
[NCBI] National Center for Biotechnology Information. 2008. Butylated hydroxyanisole--substance summary (SID 48419723). Bethesda (MD) : National Institutes of Health, National Library of Medicine. [consulté le 8 juin 2009]. Accès : http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?sid=48419723
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Columbus (OH) : American Chemical Society. Accès : http://www.cas.org/products/cd/nci/index.html
Nera, E.A., Lok, E., Iverson, F., Ormsby, E., Karpinsky, K.F., Clayson, D.B. 1984. Short-term pathological and proliferative effects of BHA and other phenolic antioxidants in the forestomach of Fischer 344 rats. Toxicology 32:197-213.
Newberne, P.M., Charnley, G., Adams, K., Cantor, M., Roth, D., Supharkarn, V. 1986. Gastric and esophageal carcinogenesis: models for the identification of risk and protective factors. Food Chem. Toxicol. 24:1111-1119.
[NIFES] Norwegian National Institute of Nutrition and Seafood Research. 2007. Limited BHA accumulation in salmon fillets [en ligne]. Bergen (Norvège) : National Institute of Nutrition and Seafood Research. [consulté le 8 sept. 2009]. Accès : http://www.nifes.no/index.php?page_id=320&article_id=2199&lang_id=2
[NJDEP] New Jersey Department of Environmental Protection. 2003. The characterization of tentatively identified compounds (TICs) in samples from public water systems in New Jersey. Trenton (NJ) : New Jersey Department of Environmental Protection, Division of Science, Research & Technology. [consulté le 12 juin 2009]. Accès : http://www.state.nj.us/dep/dsr/TIC-report.pdf
[NTP] National Toxicology Program (US). 1991. Butylated hydroxyanisole (BHA) CAS No. 25013-16-5. In : Sixth annual report on carcinogens. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program.
[NTP] National Toxicology Program (US). 2005. Butylated hydroxyanisole (BHA) CAS No. 25013-16-5. In : 11th report on carcinogens. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. [consulté le 22 juin 2009]. Accès : http://ntp.niehs.nih.gov/?objectid=72016262-BDB7-CEBA-FA60E922B18C2540
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software
[OCDE] Organisation de coopération et de développement économiques. 2000. p-tert-Butyl phenol CAS no. 98-54-4. SIDS [Screening Information Dataset] initial assessment report for SIAM [SIDS initial assessment meeting] 10 [en ligne]. Geneva (Suisse) : Publications du PNUE. [consulté le 18 nov. 2009]. Accès : http://www.chem.unep.ch/irptc/sids/OECDSIDS/98544.pdf
Olsen, P. 1983. The carcinogenic effect of butylated hydroxyanisole on the stratified epithelium of the stomach in rat versus pig. Cancer Lett. 21:115-116.
[OMS] Organisation mondiale de la santé. 1980. Butyl hydroxyanisole. In : Toxicological evaluation of certain food additives and contaminants. Rapport préparé par la vingt-quatrième session du Comité mixte FAO/OMS d'experts des additifs alimentaires, Genève (Suisse) : Organisation mondiale de la santé. WHO Food Additives Series 15. Accès : http://www.inchem.org/pages/jecfa.html
[OMS] Organisation mondiale de la santé. 1983. Butyl hydroxyanisole. In : Toxicological evaluation of certain food additives and contaminants. Rapport préparé par la vingt-septième session du Comité mixte FAO/OMS d'experts des additifs alimentaires, Genève (Suisse) : Organisation mondiale de la santé. WHO Food Additives Series 18. Accès : http://www.inchem.org/documents/jecfa/jecmono/v18je05.htm
[OMS] Organisation mondiale de la santé. 1987. Butyl hydroxyanisole. In : Toxicological evaluation of certain food additives and contaminants. Rapport préparé par la trentième session du Comité mixte FAO/OMS d'experts des additifs alimentaires. Cambridge (Royaume-Uni) : Cambridge University Press. WHO Food Additives Series 21. Accès : http://www.inchem.org/pages/jecfa.html
[OMS] Organisation mondiale de la santé. 1989. Butyl hydroxyanisole. In : Toxicological evaluation of certain food additives and contaminants. Rapport préparé par la trente-troisième session du Comité mixte FAO/OMS d'experts des additifs alimentaires, Genève (Suisse) : Organisation mondiale de la santé. WHO Food Additives Series 24. Accès : http://www.inchem.org/documents/jecfa/jecmono/v024je02.htm
[OMS] Organisation mondiale de la santé. 1998. tert-Butylhydroquinone (TBHQ). In : Safety evaluation of certain food additives and contaminants. Rapport préparé par la quarante-neuvième session du Comité mixte FAO/OMS d'experts des additifs alimentaires. Geneve (Suisse) : Organisation mondiale de la santé. WHO Food Additives Series 40. Accès : http://www.inchem.org/documents/jecfa/jecmono/v040je02.htm
[PAN] PAN Pesticide Database [base de données sur Internet]. 2009. BHA--Identification, toxicity, use, water pollution potential, ecological toxicity and regulatory information. San Francisco (CA) : Pesticide Action Network, North America. Accès : http://www.pesticideinfo.org/Detail_Chemical.jsp?Rec_Id=PC33764#Ecotoxicity
Paxéus, N. 1996. Organic pollutants in the effluents of large wastewater treatment plants in Sweden. Water Res.30(5):1115-1122.
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d'estimation]. 2000. Version 1.66. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Phillips, B.J., Carroll, P.A., Tee, A.C., Anderson, D. 1989. Microsome-mediated clastogenicity of butylated hydroxyanisole (BHA) in cultured Chinese hamster ovary cells: the possible role of reactive oxygen species. Mutat. Res. 214:105-114.
[PhysProp] Interactive PhysProp Database [base de données sur Internet]. 2006. Syracuse (NY) : Syracuse Research Corporation. Accès : http://srcinc.com/what-we-do/product.aspx?id=133
Prasad, O., Kamra, O.P. 1974. Radiosensitization of Drosophila sperm by commonly used food additives--butylated hydroxyanisole and butylated hydroxytoluene. Int. J. Radiat. Biol. 25:67-72.
Remberger, M., Kaj, L., Palm, A., Sternbeck, J., Kvernes, E., Brorström-Lundén, E. 2003. Screening tertiary butylphenols, methylphenols, and long-chain alkylphenols in the Swedish environment. Stockholm (Suède) : IVL Swedish Environmental Research Institute. IVL report. Accès : http://www3.ivl.se/rapporter/pdf/B1594.pdf
Riley, P.A., Seal, P. 1968. Microinvasion of epidermis caused by substituted anisoles. Nature 220:922-923.
Rogers, C.G., Nayak, B.N., Heroux-Metcalf, C. 1985. Lack of induction of sister chromatid exchanges and of mutation to 6-thioguanine resistance in V70 cells by butylated hydroxyanisole with and without activation by rat or hamster heptocytes. Cancer Lett. 27:61-69.
Rogers, C.G., Boyes, B.G., Matula, T.I., Stapley, R. 1992. Evaluation of genotoxicity of tert-butylhydroquinone in an hepatocyte-mediated assay with V79 Chinese hamster lung cells and in strain D7 of Saccharomyces cerevisiae. Mutat. Res. 280:17-27.
Rudel, R., Melly, S., Geno, P., Sun, G., Brody, J. 1998. Identification of alkylphenols and other estrogenic phenolic compounds in wastewater, septage, and groundwater on Cape Cod, Massachusetts. Environ. Sci. Technol. 32(7):861-869.
Saito, K., Nakagawa, S., Yoshitake, A., Miyamoto, J., Hirose, M., Ito, N. 1989. DNA-adduct formation in the forestomach of rats treated with 3-tert-butyl-4-hydroxyanisole and its metabolites as assessed by an enzymatic 32P-postlabeling method. Cancer Lett. 48:189-195.
Santé Canada. 1995. Enquête sur l'exposition des êtres humains aux contaminants dans le milieu : Un guide pour les calculs de l'exposition. Ottawa (Ont.) : Ministre desApprovisionnements et Services Canada.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Sasaki, Y.F., Kawaguchi, S., Kamaya, A., Ohshita, M., Kabasawa, K., Iwama, K., Taniguchi, K., Tsuda, S. 2002. The comet assay with 8 mouse organs: results with 39 currently used food additives. Mutat. Res. 519:103-119.
Schumann, R. 1991. In vitro absorption of butylated hydroxyanisole through human skin. J. Soc. Cosmet. Chem.42:335-340.
Scippo M-L, Argiris C, Van De Weerdt C, Muller M, Willemsen P, Martial J, Maghuin-Rogister G. 2004. Recombinant human estrogen, androgen and progesterone receptors for detection of potential endocrine disruptors. Anal Bioanal Chem 378 : 664–669.
[SDA] The Soap and Detergent Association. 2005. Exposure and risk screening methods for consumer product ingredients. Washington (DC) : The Soap and Detergent Association. Accès : http://www.sdascience.org/docs/Exposure_and_Risk_Screening_Methods.pdf
SimpleTreat [modèle sur l'élimination des usines de traitement des eaux usées]. 1997. Version 3.0. Bilthoven (Pays-Bas) : Institut national néérlandais de la santé publique et de l'environnement (RIVM), Laboratory for Ecological Risk Assessment.
Soliman, M.A., Pedersen, J.A., Suffet, I.H. 2004. Rapid gas chromatography–mass spectrometry screening method for human pharmaceuticals, hormones, antioxidants and plasticizers in water. J. Chromatogr. A 1029:223-237.
Soliman, M., Pedersen, J., Park, H., Castaneda-Jimenez, A., Stenstrom, M., Suffet, I. 2007. Human pharmaceuticals, antioxidants, and plasticizers in wastewater treatment plant and water reclamation plant effluents. Water Environ. Res.79(2):156-167.
Statistique Canada. 2004. Enquête sur la santé dans les collectivités canadiennes--Nutrition (ESSC). Renseignements détaillés pour 2004 (Cycle 2.2). Ottawa (Ont.) : Statistique Canada. Accès : http://www.statcan.gc.ca/cgi-bin/imdb/p2SV_f.pl?Function=getSurvey&SDDS=5049&lang=en&db=imdb&adm=8&dis=2
Stiles, R., Yang, I., Lippincott, R., Murphy, E., Buckley, B. 2008. Measurement of drinking water contaminants by solid phase microextraction initially quantified in source water samples by the USGS. Environ. Sci. Technol. 42(8):2976-2981.
Stokes, J.D., Scudder, C.L. 1974. The effect of butylated hydroxyanisole and butylated hydroxytoluene on behavioural development of mice. Dev. Psychobiol. 7:343-350.
Stoner, G., Shimkin, M., Kniazeff, A., Weisburger, J., Weisburger, E., Gori, G. 1973. Test for carcinogenicity of food additives and chemotherapeutic agents by the pulmonary tumor response in strain A mice. Cancer Res. 33:3069-3085.
Telford, I.R., Woodruff, C.S., Linford, R.H. 1962. Fetal resorption in the rat as influenced by certain antioxidants. Am. J. Anat. 110:29-36.
Tobe, M., Furuya, T., Kawasake, Y., Naito, K., Sekita, K., Matsumoto, K., Ochiai, T., Usui, A., Kokubo, T., Kanno, J., Hayashi, Y. 1986. Six-month toxicity study of butylated hydroxyanisole in beagle dogs. Food Chem. Toxicol.24:1223-1228.
Tomii, S., Aoki, Y. 1977. Chronic toxicity study of BHA. Rapport inédit préparé pour la Division de chimie alimentaire [traduction] du Ministère de la santé et du bien-être [traduction] du Japon en mars 1977. [cité dans OMS, 1983].
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. Accès : http://www.accelrys.com/products/topkat/index.html
TRI [Toxics Release Inventory]. 2006. 2006 reporting year list of TRI chemicals. Table II. EPCRA Section 313 chemical list for reporting year 2006 (including toxic chemical categories). [consulté le 4 juin 2009]. Washington (DC) : US Environmental Protection Agency. Accès : http://www.epa.gov/TRI/trichemicals/chemical%20lists/RY2006ChemicalList.pdf
Tsuji, S., Tonogai, Y., Ito, Y., Kanoh, S. 1986. The influence of rearing temperatures on the toxicity of various environmental pollutants for killifish (Oryzias latipes). J. Hyg. Chem. (Eisei Kagaku) 32(1):46-53.
[US EPA] US Environmental Protection Agency. 2004. Inert ingredients ordered by CAS number. [consulté le 8 juin 2009]. Washington (DC) : US Environmental Protection Agency. Accès : http://www.epa.gov/opprd001/inerts/completelist_inerts.pdf
[US EPA] US Environmental Protection Agency. 2008. Drinking water Contaminant Candidate List 3--draft, Federal Register. 73(35):9628-9654. [consulté le 8 juin 2009]. Washington (DC) : US Environmental Protection Agency. Accès : http://edocket.access.gpo.gov/2008/pdf/E8-3114.pdf
[US FDA] US Food and Drug Administration. 2009. FDA VCRP Cosmetic Ingredient Listing.[consulté le 17 juin 2009]. Silver Spring (MD) : US Department of Health and Human Services, Food and Drug Administration, Voluntary Cosmetic Registration Program. Accès : http://www.fda.gov/Cosmetics/GuidanceComplianceRegulatoryInformation/
VoluntaryCosmeticsRegistrationProgramVCRP/PaperSubmissions/ReferenceMaterialsYouWillNeed/ucm111317.htm
Verhagen, H., Mass, L.M., Beckers, R.H.G., Thijssen, H.H.W., Ten Hoor, F., Henderson, T.P., Kleinjans, J.C.S. 1989. Effect of subacute oral intake of the food antioxidant butylated hydroxyanisole on clinical parameters and phase-I and -II biotransformation capacity in man. Hum. Toxicol.8:451-459.
Vorhees, C.V., Butcher, R.E., Brunner, R.L., Wootten, V., Sobotka, T.J. 1981. Developmental neurobehavioral toxicity of butylated hydroxyanisole (BHA) in rats. Neurobehav. Toxicol. Teratol. 3:321-329.
Wilder, O.H.M., Kraybill, H.R. 1948. Toxicity studies on antioxidants--butylated hydroxyanisole and hydroquinone. Fed. Proc. 8:165.
Wilder, O.H.M., Ostby, P.C., Gregory, B.A. 1960. Effect of feeding butylated hydroxyanisole to dogs. J. Agric. Food Chem. 8:504-506.
Williams, G.M., McQueen, C.A., Tong, C. 1990a. Toxicity studies of butylated hydroxyanisole and butylated hydroxytoluene. I. Genetic and cellular effects. Food Chem. Toxicol. 28:793-798.
Williams, G.M., Wang, C.X., Iatropoulos, M.J. 1990b. Toxicity studies of butylated hydroxyanisole and butylated hydroxytoluene. II. Chronic feeding studies. Food Chem. Toxicol. 28:799-806.
Williams, G.M., Iatropoulos, M.J., Whysner, J. 1999. Safety assessment of butylated hydroxyanisole and butylated hydroxytoluene as antioxidant food additives. Food Chem. Toxicol. 37:1027-1038.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Würtzen, G., Olsen, P. 1986. BHA study in pigs. Food Chem. Toxicol. 24:1229-1233.
Zhu, B.T., Lech, J., Rosen, R.T., Conney, A.H. 1997. Effect of dietary 2(3)-tert-butyl-4-hydroxyanisole on the metabolism and action of estradiol and estrone in female CD-1 mice. Cancer Res. 57:2419-2427.